遺伝子治療による骨形成
【課題】本発明は、効率的な骨の再生を導くことによって、骨の欠損部位において、骨形成を行うような治療用のタンパク質の発現を持続する組成物を提供する
【解決手段】本発明は、低骨量患者の骨欠損部位において骨を形成するための治療用組成物を開示する。そして、それは、機能するようにプロモーターを結合した骨再生機能を持つタンパク質をコードする遺伝子を軟骨細胞へ挿入すること、および、哺乳動物細胞を骨欠損部位へ移植し、骨欠損部位において骨を形成させることを含むものである。
【解決手段】本発明は、低骨量患者の骨欠損部位において骨を形成するための治療用組成物を開示する。そして、それは、機能するようにプロモーターを結合した骨再生機能を持つタンパク質をコードする遺伝子を軟骨細胞へ挿入すること、および、哺乳動物細胞を骨欠損部位へ移植し、骨欠損部位において骨を形成させることを含むものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、骨を発生あるいは再生、特に、骨粗鬆症の骨折の修復あるいは、哺乳動物宿主における脊椎固定術を行うために、少なくとも一つの哺乳動物結合組織細胞に形質転換成長因子-βスーパーファミリーのメンバーをコードする遺伝子の少なくとも1つを導入する方法に関するものである。
【背景技術】
【0002】
生きている骨組織のホメオスタシスは、ホルモン、成長因子、分化因子などの調節シグナルによって、動的な過程で調節されている。骨の細胞の増殖を刺激することが知られている成長因子は、骨形成タンパク質(BMPs)、形質転換成長因子-βタンパク質(TGF-β)、インシュリン様成長因子(IGFs)、塩基性繊維芽細胞成長因子(bFGFs)などがある。
【0003】
骨粗鬆症(低骨量や骨折による骨の構造の微細構造上の劣化を特徴とする)は、加齢に伴う共通した健康問題である。骨粗鬆症の条件も、例えば、閉経のみならず、カルシウム欠乏食、卵巣除去、グルココルチコイド誘導性骨粗鬆症、甲状腺機能亢進症、ヘパリン誘導あるいは免疫抑制的誘導などの様々な因子によって引き起こされうる。
【0004】
骨折治癒は、複雑な過程であり、未だ良く理解されていない。骨粗鬆症を持った患者をシミュレートするために卵巣切除術および低カルシウム食によって産生されたラットモデルでは、骨折した骨粗鬆症の骨が適切に治癒しなかった(非特許文献1、非特許文献2)。したがって、骨再生を含む治療は、骨粗鬆症の骨折の治療をさらに改善するだろう。
【0005】
整形外科分野において、いくつかのサイトカインは、整形外科の疾病の治療の候補となりうると考えられている。骨形成タンパク質(BMP)は、効果的な骨形成のスティミュレーター(刺激因子)であり(非特許文献3、非特許文献4)、TGF-βは骨形成および軟骨形成のスティミュレーター(刺激因子)であることが報告されている(非特許文献5)。形質転換成長因子-βタンパク質(TGF-β)は、多機能なサイトカインであると考えられており(非特許文献6)、細胞内での成長、分化、そして細胞外マトリックスタンパク質の合成において、調節的な役割を担っている(非特許文献7)。TGF-βは、in vitroにおける上皮細胞や破骨細胞様細胞の成長を阻害する(非特許文献8)。しかし、in vivoにおいては、軟骨内骨化を刺激し、ついには骨形成までも刺激する(非特許文献9、非特許文献10、非特許文献11)。TGF-β誘導性の骨形成は、骨膜下の多分化能を持つ細胞による媒介によって最終的に軟骨形成細胞へと分化する(非特許文献12、非特許文献13)。
【0006】
整形外科におけるTGF-βの生物学的な効果が報告されている(非特許文献14、非特許文献15、非特許文献16、非特許文献17、非特許文献18)。マウスの胎児において、TGF-βは間葉系由来の組織、たとえば結合組織、軟骨、骨などと密接に関連していることが染色によって示されている。さらに、発生学的な発見として、TGF-βは、骨形成や軟骨形成の部位に存在していることがわかっている。そして、TGF-βは、ウサギの脛骨の骨折の治癒を増進させることもわかっている。近年、TGF-βの治療的価値についての報告がされている (非特許文献19、非特許文献20)。しかし、その効果が短期間であることやコストが高いことが、広汎な臨床応用を制限している。
【0007】
過度に損傷が著しい多くの骨の欠損は、完全に回復するには至らず、自家移植や保存されている骨を移植するなどの治療介入が必要となってくる。これらの従来の治療方法は、高い確率で治療が失敗に終わる可能性がある。また、近年の多くの代替アプローチは、損傷した部位に骨誘導性のタンパク質を注入した生分解性の担体の移植を利用するものである。例として、特許文献1が挙げられる。特許文献2や特許文献3などが開示する、骨の再生を促す機械装置を用いるものを含むアプローチがある。これらの方法の一つの大きな欠点は、in vivoにおいて治療に用いるタンパク質の作用に関して短期で効果的な治療を達成するために、大量の組換えタンパク質を必要とすることである。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許第5656598号
【特許文献2】米国特許第6077076号
【特許文献3】米国特許第6022349号
【非特許文献】
【0009】
【非特許文献1】Kubo et al., Steroid Biochemistry & Molecular Biology, 68:197-202, 1999
【非特許文献2】Namkung-Matthai et al., Bone, 28:80-86, 2001
【非特許文献3】Ozkaynak et al., EMBO J, 9:2085-2093, 1990
【非特許文献4】Sampath and Rueger, Complications in Ortho, 101-107, 1994
【非特許文献5】Joyce et al., J Cell Biology, 110:2195-2207, 1990
【非特許文献6】Sporn and Roberts, Nature (London), 332: 217-219, 1988
【非特許文献7】Madri et al., J Cell Biology, 106: 1375-1384, 1988
【非特許文献8】Chenu et al., Proc Natl Acad Sci, 85: 5683-5687, 1988
【非特許文献9】Critchlow et al., Bone, 521-527, 1995
【非特許文献10】Lind et al., A Orthop Scand, 64(5): 553-556, 1993
【非特許文献11】Matsumoto et al., In vivo, 8: 215-220, 1994
【非特許文献12】Joyce et al., J Cell Biology, 110: 2195-2207, 1990
【非特許文献13】Miettinen et al., J Cell Biology, 127-6: 2021-2036, 1994
【非特許文献14】Andrew et al., Calcif Tissue In. 52: 74-78, 1993
【非特許文献15】Borque et al., Int J Dev Biol., 37:573-579, 1993
【非特許文献16】Carrington et al., J Cell Biology, 107:1969-1975, 1988
【非特許文献17】Lind et al., A Orthop Scand. 64(5):553-556, 1993
【非特許文献18】Matsumoto et al., In vivo, 8:215-220, 1994
【非特許文献19】Critchlow et al., Bone, 521-527, 1995
【非特許文献20】Lind et al., A Orthop Scand, 64(5): 553-556, 1993
【発明の概要】
【発明が解決しようとする課題】
【0010】
脊椎における椎骨の骨劣化は、一方で椎骨の虚脱により腰痛に苦しむ患者を救う椎骨固定術を行うための、骨を産生する場所でもある。したがって、骨形成タンパク質の放出時間を長くするような改良が治療的な適用技術に必要とされている。本発明の記載にあるとおり、本発明は、効率的な骨の再生を導くことによって、骨の欠損部位において、骨形成を行うような治療用のタンパク質の発現を持続する方法を提供する。
【課題を解決するための手段】
【0011】
本発明は前述の記載要件を満たすものである。哺乳動物宿主を治療するのに用いる哺乳動物結合組織細胞の少なくとも一つの細胞に、ある産物をコードする少なくとも一つの遺伝子を導入する方法が、本発明によって供給される。この方法は、その産物をコードする遺伝子を含むDNAベクター分子の作製、その産物をコードする遺伝子を含むDNAベクター分子を結合組織細胞に導入することを含む。DNAベクター分子は、どのようなDNA分子をも運搬することが可能であり、標的細胞あるいは組織内で興味がある遺伝子産物をコードする遺伝子が安定して発現されるように維持されるものである。本発明で使用されるDNAベクター分子は、好ましくは、ウィルスあるいはプラスミドDNAベクター分子である。本発明の方法は、好ましくは、治療を目的として哺乳動物結合組織細胞に産物をコードした遺伝子を導入することを含むものである。
【0012】
本発明は、低骨量患者の骨欠損部位に、骨を形成させるための治療用組成物に関するもので、以下のことを含む:
【0013】
a) 骨を再生する機能をもつタンパク質をコードする遺伝子が作用するようにプロモーターに結合してベクターに挿入すること、及び
【0014】
b) in vitroにおいて、結合組織細胞群へ該組換えベクターでトランスフェクションあるいは形質導入すること、及び
【0015】
c) 哺乳動物細胞を骨欠損部位に移植し、骨欠損部位に骨を形成させるようにすること。
【0016】
この方法において、ベクターはレトロウィルスベクターあるいはプラスミドベクターに限定されるものでない。遺伝子はTGF-βスーパーファミリーのメンバーでよいが、特に、骨形成タンパク質(BMP)がよい。さらに好ましいくは、BMPはBMP-2がよい。加えて、結合組織細胞は、繊維芽細胞あるいは骨の前駆細胞でよい。
【0017】
上記の方法において、初期あるいは後期を通して骨は産生される。
【0018】
本発明は、脊椎固定用組成物に関するもので、以下のことを含む。
【0019】
a) 骨を産生する機能をもつタンパク質をコードする遺伝子をベクターに挿入すること、及び
【0020】
b) in vitroにおいて、結合組織細胞群へ組換えベクターでトランスフェクションあるいは形質導入すること、及び
【0021】
c)トランスフェクションあるいは形質導入された結合組織細胞群を骨形成を行うのに十分な量及び薬剤的に容認された担体を脊椎と接触させ、該脊椎で遺伝子をコードするDNA配列の発現により骨の産出が起こり、結果として脊椎の固定がされること。
【0022】
この方法において、ベクターはレトロウィルスベクターあるいはプラスミドベクターに限定されるものでない。遺伝子はTGF-βスーパーファミリーのメンバーでよいが、特に骨形成タンパク質(BMP)がよい。さらに好ましくは、BMPはBMP-2で良い。加えて、結合組織細胞は、繊維芽細胞あるいは、骨の前駆細胞で良い。
【0023】
上記の方法において、骨は初期あるいは後期を通して産生される。
【0024】
さらに、本発明は骨粗鬆症による骨折の治療用組成物に関するものであり、以下のことを含む。
【0025】
a) 骨を再生する機能をもつタンパク質をコードする遺伝子をベクターに挿入すること、及び
【0026】
b) in vitroにおいて、結合組織細胞群を組換えベクターでトランスフェクションあるいは形質導入すること、及び
【0027】
c) 骨折部位へ結合組織細胞を導入し、骨折を治癒すること。
【0028】
この方法において、ベクターはレトロウィルスベクターあるいはプラスミドベクターに限定されるものでない。遺伝子はTGF-βスーパーファミリーのメンバーでよいが、特に骨形成タンパク質(BMP)がよい。さらに好ましくは、BMPはBMP-2がよい。また、結合組織細胞は、繊維芽細胞あるいは骨の前駆細胞がよい。
【0029】
上記の方法において、骨は初期あるいは後期を通して産生される。
【0030】
発明のこれらおよび他の対象は、後述の発明の記載、参照に付された図面、および請求項から、より完全に理解されるだろう。
【図面の簡単な説明】
【0031】
本発明は、以上に示す詳細な記述および添付された図面に示される説明によってより理解が深まるものになるものであり、しかしながらここに示されたものに限定されるものではない。
【0032】
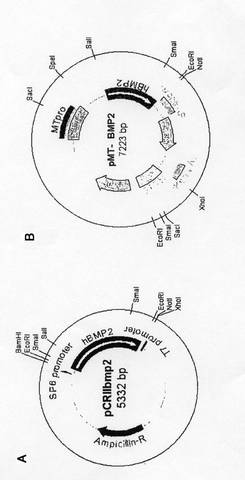
【図1】図1Aおよび1BはヒトBMP2遺伝子を組み込んだpMT-BMP2のコンストラクトを示す。
【図2】図2A-2Fは、NIH3T3-BMP-2繊維芽細胞による骨の再生を示す。図2Aおよび2BはコントロールのNIH3T3繊維芽細胞(A)およびNIH3T3-BMP-2繊維芽細胞(B)を注射して8週間後の足の骨の写真をそれぞれ示したものである。図2C-2Fは、実験動物を屠殺する前のコントロール(CおよびD)、実験をおこなった(EおよびF)足の骨のX線写真を示すものである。BMP-2タンパク質を発現している細胞で処理した骨の欠損は注射後8週間で治癒した。
【図3】図3A-3Dは、再生した骨組織の組織学的な実験を示すものである。再生した骨組織のパラフィン切片を作製し、マッソン・トリクローム染色をした。その結果、再生した骨の組織(RB)の構造は、正常な骨の組織(NB)とほぼ同質であることが示された。図3Aおよび図3Bは低倍率(40x)、図3Cおよび3Dは高倍率(100x)で示すものである。点線は再生した骨と正常な骨との境界線を示すものである。
【図4】図4A-4Iは、NIH3T3-hBMP-2繊維芽細胞による骨の再生を示すものである。NIH3T3-BMP-2細胞(2x106 cell/mlを2ml)を縫合後の脛骨における欠損部位に注射した。(AからG)細胞を注射してから1、2、3、4、5、6、そして7週間目において、X線写真による解析を行った。(H)検体は、注射後7週間で回収し写真を撮影した。(I)組織学的な解析は回収後に行った。マッソン・トリクローム染色の結果を示す。
【図5】図5A-5Iは、コントロールであるDMEM培養液による骨再生を示すものである。コントロールDMEM培養液(2ml)を縫合後の脛骨における欠損部位に注射した。(AからG)培養液を注射してから1日、1、2、3、4、5、そして6週間目において、X線写真による解析を行った。(H)検体は、注射後6週間で回収し写真を撮影した。(I)組織学的な解析は回収後に行った。マッソン・トリクローム染色の結果を示す。
【図6】図6Aおよび6Bは、吸収性のコラーゲンスポンジ(ACS)担体を用いて後方侵入椎体間固定術により細胞を移植した後の、4週目と6週目のラットTG001のX線写真を示す。X線写真の左側のつながった骨は、後方侵入椎体間固定術により5x106のBMP-2のcDNAが導入された(マウス)繊維芽細胞であり、円く囲まれている。右側よりも細胞数が少なく、骨形成が少ないことを強調する。
【発明を実施するための形態】
【0033】
本発明において、単数形を用いているものは単数あるいは複数の両方を対象とするものである。
【0034】
ここに使用される一つあるいはさらに多くの治療のための薬剤を「併用して」投与するとあるのは、どのような順序においても、併用(同時に)あるいは継続した投与を含む。
【0035】
ここに使用される核酸、タンパク質、タンパク質断片あるいはそれらの誘導体に関する「生物学的活性」という用語は、核酸又はタンパク質の野生型フォームによって導きだされる公知の生物活性を模倣した核酸又はアミノ酸の機能により定義される。
【0036】
ここに使用される「骨成長」という用語は、骨量と関連する。TGF-βタンパク質は、全身での骨量を増加させるものと考えられている。このことは、骨芽細胞の数や大きさの増大によって、また全身性の投与によって骨様ライニング骨表面の沈着が増加することから示唆されている。
【0037】
ここに使用される「担体」は、使用された投与量および濃度によって、それにさらされた細胞あるいは哺乳動物にとって無毒な薬学的に容認される担体、補形薬あるいは安定剤を含む。多くの場合、薬学的に容認される担体は水溶性のpHバッファーである。薬学的に容認される担体の例として、ここにいくつかあげるが、これらに限定されるものではない。バッファーは、リン酸バッファー、クエン酸バッファー、その他の有機酸のバッファー。低分子量ポリペプチドは、10残基以下のもの。抗酸化剤は、アスコルビン酸を含むようなもの。タンパク質は、血清アルブミンや、ゼラチン、免疫グロブリンなど。親水性ポリマーは、ポリビニルピロリドンなど。アミノ酸は、グリシン、グルタミン、アスパラギン、アルギニン、リジンなど。単糖類、二糖類、その他の糖質は、グルコース、マンノース、デキストリンなどを含むもの。キレート剤としてEDTAなど。糖アルコールとしてマンニトールやソルビトールなど。塩形成対イオンとしてナトリウム。非イオン性界面活性剤としてTWEENR、ポリエチレングリコール(PEG)、PLURONICSRなど。
【0038】
ここに使用される「結合組織」は、その他の組織あるいは器官で、これらに限定するわけではないが、哺乳動物宿主の靭帯、軟骨、腱、骨、滑膜を含み、結合及び支持するあらゆる組織である。
【0039】
ここに使用される「結合組織細胞」又は「結合組織の細胞」は、繊維芽細胞、軟骨細胞(chondrocyte)、骨細胞(osteoblast/ osteocyte)そして脂肪細胞(adipocyte)、平滑筋細胞をも含む、結合組織において見られる細胞である。好ましくは、結合組織細胞は、繊維芽細胞、軟骨細胞、骨細胞である。さらに好ましくは、結合組織細胞は繊維芽細胞である。もしくは、結合組織細胞は、骨芽細胞あるいは骨細胞である。単一のタイプの細胞でも結合組織細胞の混合培養でも、本発明は実行することができることが認識されるだろう。また、組織細胞は、化学物質あるいは放射線照射によって細胞が興味のある遺伝子を安定して発現するような処理がなされる可能性があることも認識されるだろう。好ましくは、結合組織細胞は宿主に導入されたときに、ネガティブな免疫反応を引き起こさないのがよい。この同種間の細胞が、細胞を介した遺伝子治療又は体細胞治療のための自己由来細胞と同様に使用される点は理解されるものである。
【0040】
ここに使用される「結合組織細胞系」は、その多くが共通の親細胞に由来する結合組織細胞からなるものである。
【0041】
ここに使用される「宿主細胞」は、個々の細胞あるいは本発明におけるベクターの宿主あるいは導入された細胞培養を含むものである。宿主細胞は、単一の宿主細胞に由来するものであり、その孫細胞は自然に、偶然にあるいは計画的な突然変異の導入及び/又は変化によりオリジナルの親細胞と完全に同一(形態的にあるいは総DNA配列的に)であることは必ずしも必要とされない。宿主細胞は、in vivoにおいてTGF-βスーパーファミリーのメンバーをコードするポリヌクレオチドを含むベクターでトランスフェクションされたあるいは、感染させられた細胞を含む。
【0042】
ここに使用される「低骨量」という用語は、骨量の段階が世界保健機関(WHO)の"Assessment of Fracture Risk and its Application to Screening for Postmenopausal Osteoporosis (1994)によるスタンダードによって定義される年齢の平均よりも低い値を意味する。Report of a World Health Organization Study Group. World Health Organization Technical Series 843"は、正常および骨粗鬆症の骨量の段階の参照は本参照として組み込まれる。さらに、「骨量」とは、時には骨ミネラル濃度としての参照である、ある範囲における骨量として参照される。
【0043】
ここに使用される「維持」という用語は、リポソームの輸送に関連して用いられた場合、細胞中に現存している導入されたDNAの能力を意味する。その他に関連して用いられた場合、治療効果を与える標的細胞あるいは標的組織における標的DNAの保存能力を意味する。
【0044】
ここに使用される「哺乳動物宿主」は、ヒトに限定されるものではなく、広く動物界のメンバーを含む。
【0045】
ここに使用される「成熟した骨」という用語は、石灰化してない骨様の骨とは対照的に、石灰化している骨に関するものである。
【0046】
ここに使用される「骨形成の効果」という用語は、成熟した骨の形成および発生をもたらす量を意味する。
【0047】
ここに使用される「骨芽前駆細胞」又は「骨の前駆細胞」という用語は、骨細胞になる能力を持ち、骨膜や骨髄に存在する細胞を意味する。骨芽前駆細胞は、組織(筋肉)の周辺にも存在する結合組織前駆細胞にも由来するものである。
【0048】
ここに使用される「患者」という用語は、ヒトに限定されるものではなく、広く動物界のメンバーを含むものである。
【0049】
ここに使用される「薬理学的にあるいは生理学的に容認された」という用語は、その投与がレシピエント動物によって耐えられうるものであり、さもなければ、動物への投与が適合するものであることをいう。そのような薬剤がもし生理学的に意味のある投与量である場合に「治療的に効果のある量」といわれる。薬剤があることによって、レシピエントとなる患者の生理学的な効果において検出可能な変化に帰する場合、その薬剤は生理学的に意味があるとされる。
【0050】
ここに使用される「薬剤的に容認される担体及び/又は希釈液」という用語は、懸濁液、被覆剤、抗生物質、抗真菌剤、等張性及び吸収遅延剤などあらゆる溶剤を含むものである。薬剤的に活性のある物質のためにそのような溶媒や薬剤の使用することは、技術的によく知られている。活性成分として不適合な従来の溶媒又は試薬であるものを除く限り、治療組成中にそれらを使用できることを意図する。補助的な活性成分もその組成に組み込まれることもできる。
【0051】
ここに使用される「プロモーター」という用語は、真核細胞中においてDNA配列の活性化および転写制御にかかるものである。プロモーターは真核生物と原核生物の一方もしくは両方の活性化に関わることができる。好ましくは、プロモーターは哺乳動物細胞において転写を活性化するものである。プロモーターは、恒常的に発現あるいは誘導される可能性がある。好ましくは、そのプロモーターは、誘導されるものである。さらに好ましくは、外的刺激により誘導されるものである。より好ましくは、そのプロモーターは、ホルモンや金属によって誘導されるものである。転写を制御する「エンハンサー因子」のように、DNAベクターのコンストラクトに挿入されることも可能であり、興味のある遺伝子の発現を増大させるように本発明のコンストラクトと一緒に使用されうる。
【0052】
ここで使用する"選択可能なマーカー"とは、導入したDNAを安定に維持する細胞によって発現された遺伝子生成物などであり、その細胞に、形態学的転移または酵素活性など、変化した表現型を発現させる。形質移入された遺伝子を発現する細胞の単離は、選択可能なマーカーをコード化する二番目の遺伝子を、同じ細胞中に導入することによって達成される。そのマーカーには、例えば、抗菌薬あるいは他の薬物に耐性を与える酵素活性を有するマーカーが含まれる。選択可能なマーカーには、チミジンキナーゼ、ジハイドロ葉酸還元酵素、カナマイシン、ネオマイシン、ゲンチシンなどのアミノ配糖体抗生物質に耐性を示すアミノ配糖体転移酵素、ハイグロマイシンBリン酸転移酵素、キサンチン-グアニンホスホリボシル基転移酵素、CAD酵素 (de novo ウリジン-カルバミルリン酸合成酵素、アスパラギン酸トランスカルバモイラーゼおよびジハイドロオロターゼの3つの酵素活性有する1つのタンパク質)、アデニン脱アミノ酵素、およびアスパラギン合成酵素(Sambrook et al. Molecular Cloning, Chapter 16. 1989)が含まれるが、これだけに限定されない。本明細書の参考文献としてその全文が添付されている。
【0053】
ここに使用される「対象」は、脊椎動物であり、好ましくは、哺乳動物、より好ましくはヒトである。
【0054】
ここに使用される「治療」は、有益なあるいは望まれている臨床上の結果を得るために取り組むものである。本発明の目的として、有益なあるいは望まれている臨床上の結果には次のものが含まれるが、これに限定されるものではない。検出可能であろうがなかろうが、症状の軽減、病気の存在の減少、病気の状態の安定化(たとえば、悪化しないようにする)、病気の進行を遅らせるあるいはゆっくりとさせる、病気の状態の回復あるいは緩和、そして一部あるいは全部の寛解。「治療」は、治療を受けない場合の期待される生存と比較して、延長されうる生存をも意味する。「治療」は、治療的処置並びに予防又は予防学的な測定を含む。治療を必要とするものには、障害を既に持つものも、その障害が予防されうるものも含む。病気の「緩和」とは、治療をしない場合と比較したときの程度またあるいは臨床上好ましくない病状の徴候の緩和及び/又は進行の時間経過の遅滞あるいは延長を意味する。
【0055】
ここに使用される「TGF-βタンパク質」は、TGF-βスーパーファミリーのメンバーに関するものである。
【0056】
ここに使用される「ベクター」、「ポリヌクレオチドベクター」、「コンストラクト」及び「ポリヌクレオチドコンストラクト」は、ここにおいて相互交換されるものである。本発明のポリヌクレオチドベクターは、いくつかの形態を持つことが可能である。限定されるわけではないが、以下のものを含む。RNA、DNA、レトロウィルスの外被で包まれたRNA、アデノウィルスの外被で包まれたDNA、他のウィルスあるいはウィルス様の形態(ヘルペスシンプレックスやアデノ関連ウィルス(AAV)など)で包まれたDNA、リポソームで包まれたDNA、ポリリジン、合成されたポリカチオニック分子、免疫学的に「マスク」された分子によるポリエチレングリコール(PEG)、及び/又は半減期の増加するもの、あるいは非ウィルス性のタンパク質結合複合体DNA。好ましくは、ポリヌクレオチドはDNAを指す。ここで用いられている「DNA」は、A,T,G,Cだけでなく、例えば、メチル化されたヌクレオチドのような塩基の類似体又は修飾形式、無電荷結合(uncharged linkages)、チオアート(thioates)、糖類似体使用などの内部ヌクレオチド修飾、並びにポリアミドなどの修飾又は代替骨格構造も含む。
【0057】
形質転換成長因子-β(TGF-β)スーパーファミリー
【0058】
本明細書で使用する"形質転換成長因子β(TGF-β)スーパーファミリー"とは、構造的に関連するタンパク質のグループなどであり、胚発生中、広範囲に分化プロセスに影響を与える。ファミリーには、正常な男性性器発生に必要な(Behringer, et al., Nature, 345:167, 1990)ミュラー管抑制物質(MIS)、背腹軸形成と成虫盤の形態発生に必要な(Padgett, et al., Nature, 325:81-84, 1987)ショウジョウバエのDPP(TGF-β/BMPホモログ)遺伝子生成物、卵の植物性極に局在する(Weeks, et al., Cell, 51:861-867, 1987)Xenopus Vg-1 遺伝子生成物、ゼノパス胚中で中胚葉と前部構造の形成を誘導する(Thomsen, et al., Cell, 63:485, 1990)アクチビン(Mason, et al., Biochem, Biophys. Res. Commun., 135:957-964, 1986)、およびde novo 軟骨と骨形成を誘導する(Sampath, et al., J. Biol. Chem., 265:13198, 1990)骨形態形成タンパク質(BMP-2-15のようなBMP's)などが含まれる。TGF-β 遺伝子生成物は、脂肪生成、筋形成、軟骨形成、造血形成、上皮細胞分化など、様々な分化プロセスに影響を与える可能性がある(Massague, Cell 49:437, 1987を参照)。本明細書に参考文献として全文を添付してある。
【0059】
TGF-β ファミリーのタンパク質は、まず大型の先駆体タンパク質として合成され、続いて、C末端から約110-140 個の基本アミノ酸残基クラスターでタンパク質開裂が起こる。タンパク質のC末端領域は、すべて構造的に関連しており、異なるファミリーメンバーは、それらの相同性の大きさに基づいて別々のサブグループに分類することができる。特定のサブグループの相同性は、アミノ酸配列の同一性が70% 〜90% の範囲であるが、サブグループ間の相同性は有意に低く、一般的に20% 〜50%の範囲である。いづれの場合も、活性種は、C末端フラグメントのジスルフィド結合二量体であるように思われる。試験した殆どのファミリーメンバーに対し、ホモダイマー種は生体活性であることが認められたが、インヒビン(Ung, et al., Nature, 321:779, 1986)やTGF-β'S(Cheifetz, et al., Cell, 48:409, 1987)のような他のファミリーメンバーでは、ヘテロダイマーも検出され、相当するホモダイマーと生物学的特性が異なるように思われる。
【0060】
TGF-β 遺伝子のスーパーファミリーメンバーには、TGF-β3、TGF-β2、 TGF-β4 (チキン)、TGF-β1、TGF-β5 (アフリカツメガエル)、BMP-2、BMP-4、ショウジョウバエ DPP、BMP-5、BMP-6、Vgr1、OP-1/BMP-7、ショウジョウバエ 60A、GDF-1、アフリカツメガエルVgf、BMP-3、インヒビン-βA、インヒビン-βB、インヒビン-α、および MISなどが含まれる。これらの遺伝子はMassague, Ann. Rev. Biochem. 67:753-791, 1998において考察されており、本明細書の参考文献として全文を添付してある。
【0061】
好ましくは、TGF-β 遺伝子のスーパーファミリーメンバーはBMPである。さらに好ましくは、メンバーは、TGF-β1、TGF-β2、TGF-β3、BMP-2、BMP-3、BMP-4、BMP-5、BMP-6、or BMP-7がよい。さらになお好ましくは、メンバーは、ヒトBMPである。また、さらになお好ましくは、メンバーは、ヒトのBMP-2である。
【0062】
BMP
【0063】
BMPタンパク質は、骨形成が始まる前に間葉系の細胞から軟骨細胞および骨芽細胞へ分化を誘導する働きを持つ。BMPは、骨折した部位の近辺しかし異所的な場所で軟骨および骨の形成における分化を促進する。タンパク質のいくつかには、骨芽細胞においてアルカリフォスファターゼおよびコラーゲンの合成を誘導するものがある。あるBMPの中には、筋分化を抑制すると同時に、直接骨芽細胞に働きかけて骨芽細胞の成熟を促進するものがある。その他のBMPは、典型的な繊維芽細胞から軟骨細胞への転換を促進するものがあり、非骨形成型の細胞において、骨芽細胞の表現型を発現するように誘導することができるものもある。BMPファミリーはTGFβスーパーファミリーに属し、以下のものが含まれる:
【0064】
BMP-2AあるいはBMP-2α(114アミノ酸)は、BMP-2と名称変更された。ヒト、マウス、ラットのタンパク質はそのアミノ酸配列上同一である。このタンパク質は、ショウジョウバエと68%の相同性を示す。
【0065】
BMP-2BあるいはBMP-2β(116アミノ酸)は、BMP-4と名称変更された。マウス、ラットのタンパク質はそのタンパク質配列と同一である。
【0066】
BMP-3(110アミノ酸)は糖タンパク質であり、オステオゲニンと同一である。ヒトおよびラットの成熟タンパク質は98%同一である。
【0067】
BMP-3b(110アミノ酸)は、BMP-3(82%同一)と関連する。ヒトおよびマウスのタンパク質は、97%の同一性(3アミノ酸が相違)を示す。ヒトおよびラットのタンパク質の配列は、2アミノ酸相違する。そのファクターは、GDF-10と同一である。
【0068】
BMP-4は、BMP-2BおよびDVR-4と同一である。ショウジョウバエと72%の相同性を示す。
【0069】
BMP-5(138アミノ酸)は、ヒトとマウスにおいて、アミノ酸レベルで96%の同一性を示す。
【0070】
BMP-6(139アミノ酸)は、DVR-6やvegetal-specific-related-1と同一である。
【0071】
BMP-7(139アミノ酸)は、OP-1(osteogenic protein 1)と同一である。マウスとヒトのタンパク質は98%の同一性を持つ。BMP-5、BMP-6、BMP-7の成熟したフォームと75%の同一性を示す。
【0072】
BMP-8(139アミノ酸)は、OP-2と同一である。そのファクターは、BMP-8aと関連づけられる。
【0073】
BMP-8b(139アミノ酸)はOP-3と同一であり、マウスのみで見つかっている。そのファクターは、OP-3としても知られている。
【0074】
BMP-9(110アミノ酸)は、GDF-5とも関連づけられる。
【0075】
BMP-10(108アミノ酸)は、ウシから単離されたものである。ウシおよびヒトが同一である。
【0076】
BMP-11(109アミノ酸)は、ウシから単離された。ヒトとウシの配列は同一である。タンパク質は、GDF-11とも関連づけられる。
【0077】
BMP-12(104アミノ酸)は、GDF-7あるいはCDMP-3としても知られている。
【0078】
BMP-13(120アミノ酸)は、GDF-6およびCDMP-2と同じである。
【0079】
BMP-14(120アミノ酸)は、GDF-5およびCDMP-1と同じである。
【0080】
BMP-15(125アミノ酸)は、卵母細胞特異的に発現する。このマウスタンパク質は、マウスGDF-9と最も近いものとして関連づけられる。
【0081】
これらのタンパク質のうちのいくつかは、ヘテロダイマーで存在する。例えば、OP-1は、BMP-2Aと結合する。
【0082】
およそ90パーセントもの高いアミノ酸配列の相同性が見られるため、BMP-5、BMP-6及びBMP-7は、BMPの特別なサブファミリーとして認識されている。BMP-5、BMP-6をコードする遺伝子は、ヒトの6番染色体にマップされている。BMP-7をコードする遺伝子は、ヒトの20番染色体にマップされている。BMPは脱石灰化した骨および骨肉腫から単離することが可能である。BMPは、胚において様々な上皮組織および間葉系の組織でも発現が見られる。いくつかのBMPs(例としてBMP-2およびBMP-4)は、同質の効果(軟骨形成および骨形成)を引き起こし、一つを別のものに置き換えても同じ効果を示すことがわかっている。
【0083】
オステオゲニンおよび関連するBMPsは、循環する単球に対して強力な走化性因子として機能し、単球によってTGF-β1の合成および分泌がなされ、互いを誘導することにより、軟骨内の骨形成のカスケードにおけるさらなる連続した段階へと促進する。TGF-βによって刺激された単球は、多くの走化性および分裂促進をもたらすサイトカインを内皮細胞および間葉系細胞を補充している条件培地へ分泌し、コラーゲンの合成を促進し、マトリックス構成物と結合させる。
【0084】
骨再生治療
【0085】
本発明は、興味あるDNA配列を哺乳動物宿主の結合組織細胞へ導入するex vivoおよびin vivoの技術を開示する。ex vivo技術は、標的結合組織細胞の培養、in vitroにおける興味のあるDNA配列、DNAベクター若しくは他の輸送ベシクルを結合組織細胞へ導入し、続いて興味ある遺伝子産物のin vivoでの発現の効果を得るために哺乳動物細胞の標的骨欠損領域への修飾した結合組織細胞の移植を行うことを含むものである。外来の組織、生体適合性担体及び補助剤と同様に、足場のフレームワークとなるような材料、マトリックス又はバフィーコートのような生体付着性若しくは化学性接着剤のような物質も、本発明の遺伝的改良された細胞といっしょに移植できることは理解できる。もう一つの側面において、本発明は、遺伝学的に改良された結合組織細胞と骨の欠損部位若しくはその周辺間の接触が促進されるような治療組成物である生体付着物質を含むでもよい。一方で、本発明の投与体系における構成からそのような物質は除外される可能性もある。
【0086】
ヒトの患者の治療に用いる適切な供与源からの細胞は、自己の繊維芽細胞あるいは骨芽前駆細胞、骨細胞、骨芽細胞、あるいは破骨細胞のような患者自身の結合組織細胞であるが、しかし同種間の細胞もまた用いられることができることは、通常の技術を持つ当業者には理解されるものである。
【0087】
具体的には、この方法は形質転換成長因子-βスーパーファミリーのメンバーあるいは生物学的に活性のある誘導体あるいはそれらの断片のような遺伝子産物を使用することも含む。
【0088】
本発明の別の実施例として、治療上効果的な量を患者に非経口投与する化合物には、TGF-βスーパーファミリーのタンパク質および適切な薬剤の担体を含むものが提供される。
【0089】
本発明の別の実施例は、TGF-βスーパーファミリーのタンパク質および適切な薬剤の担体を含む予防的に効果のある量を患者に非経口投与する化合物を提供するものである。
【0090】
本発明において、BMP-2およびTGF-β1、2、3(これに限定されないが)を含む形質転換成長因子-β(TGF-β)スーパーファミリーのメンバーをコードする遺伝子をトランスフェクションあるいは形質導入した適切な哺乳動物細胞の注射によって骨の産生あるいは再生の方法を提供するものである。BMP-2が例証されている。
【0091】
本発明の実施例において、細胞は、外来性の細胞あるいは生体適合性のある担体などのような足場となる物質あるいはその他の補助的な物質を伴ってあるいは伴わないで骨が産生されるあるいは再生される場所に注射されうることが理解される。つまり、改良された細胞は付加的な構造あるいは枠組みの補助なしに再生されうる骨の領域に注射されうる。本発明のひとつの実施例において、そのような付加的な物質は例えば米国特許第5842477号において開示されており、本発明の構成からは除外されてもよい。
【0092】
本発明における方法は、体の全てのタイプの骨に適応される可能性がある。以下のものを含むがこれに限定されるものではない。非癒合骨折(骨折の治癒がうまくいかなかったもの)、頭蓋顔面の再構築、腫瘍除去によるセグメントの欠損、臀部の移植片の修正による周囲の骨の増大(例えば、臀部の移植片の25%が移植片に置き換わるとき、その臀部移植片の寿命はたった10年以内である)、歯科の目的での顎の骨の再構築。さらにその他の標的となる骨は、脊椎固定術のための脊椎における椎骨、大きな骨などをも含む。
【0093】
改良される細胞は、骨の形成を助けるあらゆる適当な哺乳動物の結合組織細胞を含み、これらに限定されるものではないが、以下のものを含む。繊維芽細胞、骨芽前駆細胞、骨芽細胞、骨細胞、破骨細胞、さらには軟骨細胞をも含むでもよい。しかしながら、その他の遺伝学的な改良を受けていない細胞、例えば、骨芽細胞、骨細胞、破骨細胞、軟骨細胞などが骨欠損部位に接触するように用いられる組成をも含まれる可能性があることは理解されるものである。
【0094】
宿主細胞のin vitroにおける操作に代わるものとして、興味のある産物をコードする遺伝子をリポソームに導入して、直接に骨折あるいは欠損している部位やその周辺に直接注射し、その部位において結合組織細胞とリポソームの融合が起こり、その結果TGF-βスーパーファミリーに属する遺伝子産物のin vivo 遺伝子発現が起こる。
【0095】
「骨欠損」又は「欠損した骨」に言及すると、そのような欠損は骨折、破壊、及び/又は怪我や病気による場合を含む骨の分解、さらには脊椎の椎骨の欠損および、またさらには、脊椎間椎間板の分解も含まれる可能性があることが理解されるものである。本発明の一態様として、脊椎間椎間板の分解によって引き起こされる痛みが、分解された椎間板の周囲の脊椎固定により治療されることである。
【0096】
さらに結合組織細胞のin vitroにおける操作に代わる方法として、興味のある産物をコードする遺伝子を裸のDNAとして骨欠損領域に導入するものがある。裸のDNAは、結合組織細胞に入り込み、TGF-βスーパーファミリーに属する遺伝子産物のin vivoにおける遺伝子発現に帰着する。
【0097】
この明細書を通して開示された骨折や骨の欠損のex vivoにおける治療方法の一つとしては、タンパク質あるいは生物学的に活性のある断片をコードしているDNA配列を含む初期に産生する組換えウィルスあるいはプラスミドベクターを含む。この組換えベクターはin vitroで培養された結合組織細胞群への感染あるいは導入に用いられるものであり、結果として、ベクターが含まれる結合組織細胞群になる。これらの結合組織細胞は、哺乳動物宿主の骨の欠損領域を標的として移植され、続いて欠損部位内でタンパク質又はタンパク質フラグメントの効果的な発現が起こる。この興味のあるDNA配列の発現は、骨折あるいは骨の欠損の修復に大いに有用である。
【0098】
具体的に、この方法は、形質転換成長因子-βスーパーファミリーのメンバーあるいは生物学的に活性のある誘導体若しくはその断片、選択可能なマーカーあるいは生物学的に活性のある誘導体若しくはその断片をコードすることができる遺伝子を使用することを含む。
【0099】
さらに本発明の実施例は、少なくとも一つの形質転換成長因子-βスーパーファミリーのメンバーあるいは生物学的に活性のある誘導体若しくはその断片をコードできる遺伝子の使用、そしてどのようなDNAプラスミドベクターも本方法の導入方法が利用できることは言うまでもないが、導入された標的細胞あるいは組織を安定して維持する能力を持つ、通常の技術をもつ当業者に公知のいかなるDNAプラスミドベクターを使用することを含む。
【0100】
本発明のもうひとつの実施例は、哺乳動物宿主の治療に用いることを目的として、産物をコードする少なくとも一つの遺伝子を結合組織細胞の少なくとも一つの細胞に導入する方法についても提供するものである。この方法は、ある産物をコードする遺伝子を結合組織細胞へ導入するのに非ウィルスによる手段を用いた方法の使用を含むものである。具体的には、本方法は以下のものを含む。リポソームの封入、リン酸カルシウムによる共沈、電気穿孔法、DEAE-デキストランによる媒介、そして形質転換成長因子-βスーパーファミリーのメンバーあるいは生物学的な活性をもつその誘導体又はその断片、そして選択可能なマーカーあるいは生物学的な活性をもつその誘導体又はその断片などをコードすることが可能な遺伝子を使用することを含む。
【0101】
本発明のもうひとつの実施例は、哺乳動物宿主の治療に用いられために産物をコードする少なくとも一つの遺伝子を、結合組織細胞の少なくとも一つの細胞へ導入する付加的な方法を提供するものである。この付加的な方法は、標的細胞あるいは組織へDNAベクター分子を輸送するためのウイルスを利用する生物学的な手法を含む。好ましくは、そのウィルスは偽ウィルス、つまり自身の複製能力はなく輸送する能力のみをもち、標的細胞内で安定して維持できるようなものにゲノムを置き換えたものである。その置き換えられたウィルスのゲノムは、興味のある異種の遺伝子を標的細胞内あるいは組織内で発現しうるものを含むDNAベクター分子として機能するように、ウィルスゲノムを組換えDNA技術によってさらに操作したものである。
【0102】
本発明の具体的な実施例は、この明細書の中で開示されたex vivo技術によるレトロウィルスベクターを通して哺乳動物宿主の結合組織にTGF-β遺伝子を郵送することによってTGF-βタンパク質を標的欠損領域に輸送することである。言い換えると、機能的なTGF- βタンパク質あるいはタンパク質の断片をコードする興味のあるDNA配列は、選ばれたレトロウィルスベクターにサブクローニングされ、その組換えウィルスベクターは、適当なタイターで増殖し、in vitroで培養された結合組織細胞に感染するのに用いられる。そして導入された結合組織細胞は、好ましくは自家移植細胞とであり、骨欠損領域あるいは治療的に効果があるその近辺に移植する。
【0103】
発明で他に用いられる方法は、アデノウィルスベクター、アデノ随伴ウィルス(AAV)ベクター、ヘルペスシンプレックスウィルス(HSV)のいずれかを用いて哺乳動物宿主の結合組織細胞へTGF-βスーパーファミリーの遺伝子を直接in vivoで導入する方法を含むものである。言い換えると、機能的なTGF-βタンパク質あるいはタンパク質断片をコードする興味あるDNA配列をそれぞれのウィルスベクターにサブクローニングする。それからウィルスベクターを含むTGF-βを、適当なタイターで増殖させ、骨欠損領域あるいは骨形成に効果のある領域の近辺に導入することである。
【0104】
関節の標的結合組織へDNA分子を存在させる方法は、これに限定されるものではないが、カチオンリポソームへのDNA分子封入、興味のあるDNA配列をレトロウィルスあるいはプラスミドベクターへサブクローニングすること、あるいはDNA分子そのものを直接骨欠損領域あるいは骨形成に効果のある領域の近辺に導入するものを含む。DNA分子はDNAベクター分子つまり、組換えウィルスDNAベクター分子あるいは組換えDNAプラスミドベクター分子として存在することが望ましい。興味ある異種遺伝子の発現は、異種遺伝子のコード領域の上流に真核生物でのプロモーター活性のある断片を挿入することにより確実にできる。DNA分子を結合組織に導入により連続的な発現レベルを適切に確実にするためのベクターのコンストラクトは、公知の戦略及び技術であり、当業者の通常の技術のひとつである。
【0105】
レトロウイルスが効果的に結合組織細胞へ感染および導入されるのに必要とされる細胞分裂によってリポソームの使用が限定されないことは、当業者に理解されるものである。上述に記載された非ウィルスの使用は、TGF-βスーパーファミリーに属している遺伝子および抗生物質耐性遺伝子のような選択マーカー遺伝子をコードする可能な遺伝子を使用することを含むものである。
【0106】
本発明の別の実施例としては、細胞への導入前の結合組織細胞の保存が含まれる。結合組織細胞は液体窒素中において10%DMSOで凍結保存されうることは当業者に理解されるものである。
【0107】
発明者はBMP-2を発現するコンストラクトを導入した安定した繊維芽細胞系統を作製した。これらのBMP-2産生細胞は長期に渡って、in vivoで高濃度の活性のあるBMP-2を保持できる。
【0108】
骨粗鬆症による骨折の治療
【0109】
骨粗鬆症は骨量低下による骨格構造の劣化である。それは、骨形成と骨吸収のバランスが崩れることにより引き起こされる。例えば、骨形成期に吸収が支配的になることによって、骨の荷重負担能力が減少する影響がでる。健康な成人において、骨の形成と吸収の割合は、骨新生の維持のためにしっかりと協調して行われている。しかし骨粗鬆症において、骨の再形成のサイクルにおけるバランスが失われていることにより、骨量の低下および骨の連続した微細構造上の欠損が形成される。一連の骨の再構成の混乱により、これらの骨の欠損が蓄積し、骨の構造的な整合性が著しく損なわれ、骨折が起こりそうな最終段階に到達する。このバランスが失われることは、個人レベルの多くにおいて年齢に伴って次第に起こるものであるが(老人性骨粗鬆症)、女性の閉経後において、それよりもっと重篤で、急速な進行がみられる。さらに、骨粗鬆症は栄養上および内分泌のバランス上、遺伝性疾患および多くの悪性腫瘍の結果生じる可能性もある。
【0110】
本発明の目的は、骨折に苦しむ、例えば骨格骨量の減少により苦しむ病気、特に骨のリモデリングのアンバランスが引き起こす病気の患者の骨再生のための方法及び組成物を開発することである。もう一つは、骨代謝の疾病を含むような、骨の病気に苦しむ子供の骨折を修復するために、骨成長を増強するのが目的ある。また別の目的としては、閉経後の女性、老人、糖尿病を患っている患者を含む、骨量の低下の危険におかれている人の骨折の修復である。さらに別の目的は、骨折の修復を含む骨の微細構造上の欠損によって、骨が構造上損なわれており、それを修復するための方法及び組成物を提供するものである。このことは、本発明が骨形成を刺激し、骨量を増加させることを目的とするもので、それに伴って発症時期を遅らせるものであり、特に骨の構造上の劣化によって生じた新たな骨折の出現を減少させるものである。
【0111】
ラットの骨粗鬆症モデルでの骨折後初期の段階での骨の修復が研究されており、Namkung-Matthai et al., Bone, 28:80-86 (2001)で開示されている。初期は、骨折後3から6週間以内と示されている。同様に、ラットの骨粗鬆症モデルでの骨折後後期の骨の修復が研究されており、Kubo et al., Steroid Biochemistry & Molecular Biology, 68:197-202 (1999)で開示されている。後期は、骨折後およそ12週と示されている。これらの公開されている骨粗鬆症のラットモデルおよび骨粗鬆症の骨折の参照データなどは本発明の参照として全体に組み込まれる。
【0112】
本発明のもう一つの特徴として、本発明に従って骨折あるいは切断部位あるいはその周囲へ遺伝学的に改良した細胞を投与することにより、脊椎動物(例えば哺乳動物)における骨の移植を強化する方法を意図している
【0113】
骨折治癒アッセイ(fracture healing assay)は、骨折技術、組織学的解析、生体力学的解析を含んでおり、当業者に知られている。そしてそれは例えば、米国特許第 6,521,750号に記述があり、骨折の引き起こし方および骨折の伸展の測定方法および修復の過程、とりわけ骨粗鬆症を対象とするものにおいて実験手順で明らかにされているものは、その全体が参照に組み込まれるものとする。
【0114】
活性成分つまりTGF-βタンパク質は、賦形剤の希釈剤のような担体と一般的に組み合わせられる。賦形剤は、充填剤(fillers)、伸展剤(extenders)、つなぎ(bindings)、湿潤剤(wetting agents)、崩壊剤(disintegrants)、界面活性剤(surface active agents)、生分解性ポリマー(erodable polymers)あるいは潤滑剤(lubricants)を含む可能性があり、投与様式および剤形の性質に依存する。典型的な剤形は、粉、液体製剤(懸濁液を含む)、エマルジョン、糖、カプセルを含む。
【0115】
薬剤的に許容される担体のその他の例には、種々の陽イオン脂質があり、N-(1-2,3-dioleyloxy)propyl)-n,n,n-trimethylammonium chloride (DOTMA) やdioleoylphophotidyl ethanolamine (DOPE)を含むが、これらに限定されるものではない。リポソームは、本発明のTGFタンパク質分子にとっても適合する担体である。別の適合する担体には、スローリリースゲル(slow-release gel)あるいは、TGF-βタンパク質分子を含むポリマーがある。
【0116】
TGF-βタンパク質は、生理的食塩水やその他の適合する液体のような生理学的に容認される担体又は希釈剤の量と混合する。TGF-βタンパク質分子は、TGF-βタンパク質および生物学的に活性のある形態をその標的となる場所へ到達するまで、及び/又は組織の障壁を乗り越えてTGF-βタンパク質あるいは生物学的に活性のある形態になるまで、分解から保護する目的でその他の担体と組み合わせられることもある。
【0117】
脊椎固定術のための遺伝子治療
【0118】
本発明は、椎骨が固定されることが望まれる脊椎の領域へ本発明の組成物を投与することにより、標的となる脊椎のある椎骨を固定する方法を意図する。骨形成に効果的な量を、形質転換あるいはトランスフェクションした結合組織細胞(例えば、繊維芽細胞あるいは骨芽前駆細胞)を欠損領域あるいは骨形成に効果的な領域に接触させる。そしてその一回の注射あるいは複数回の注射(これは実施者に最適化されるものである)によって、標的の椎骨の固定に帰結するものである。
【0119】
脊椎は円柱状の骨(椎骨)が互いにその上に積み重なっているものであり、クッションとなる円盤(椎間板)がそれらの間に挟まっている。この脊柱の中央部には、脊髄がある。脊髄神経は、脊髄から生じ、椎体の間の空間を通って脊椎を出る。 隆起板又は椎間板ヘルニアは外部へのびている脊椎神経を圧迫する可能性がある。不安定な脊柱は骨を互いに滑らせ擦らせるので、腰痛および神経損傷の可能性の原因となる。怪我や変性疾患による脊柱の骨および板の変化は、腰痛や時には神経損傷の原因となりうる。
【0120】
脊椎固定手術は、重度の脊椎の不安定性を持つ人(異常な移動性)、過剰な移動を伴う重度の椎間板の変性疾患、脊椎すべり症(別の脊椎の上でもう一つの脊椎のすべり)、他の治療法では反応しなかった椎間関節突起(関節)の疾患、または骨折あるいは腫瘍の人に対して一般に行われる。脊椎固定治療に最も候補は、板がとても異常であり椎骨間のスペースが50%以上崩壊している、又は周囲に刺激を与えるように崩壊している患者である。
【0121】
骨の接ぎ木および移植片は脊椎固定手術の間、安定性を増大させるために用いられる。椎間板の一部が取り除かれた後、脊椎骨は削られ、移植を受け入れるように形づくられる。時間が経過するにつれ、移植片は脊椎骨の互いに隣接した面において融合する。骨が融合すると、椎骨はもはや別々に動かない。このことにより、脊柱はより安定化する。典型的なものとして、スクリュー、プレート、ケージ、メタルロッド、およびその他の脊椎固定術における移植片は、安定性を増大させるためにも用いられる。
【0122】
治療用組成物
【0123】
本発明のもう一つの実施例として、予防的にあるいは治療上効果のある量において患者に非経口投与される化合物は、TGF-βスーパーファミリー遺伝子を収納した結合組織細胞および適切な薬理的担体を含むものである。
【0124】
治療への応用において、TGF-βスーパーファミリーのメンバーをコードする遺伝子を収納した結合組織細胞は、局所への投与のために製剤化される可能性がある。本発明において、結合組織細胞は一般的に以下のような賦形剤の希釈液のような担体と組み合わされる可能性がある。充填剤(fillers)、伸展剤(extenders)、つなぎ(bindings)、湿潤剤(wetting agents)、崩壊剤(disintegrants)、界面活性剤(surface active agents)、生分解性ポリマー(erodable polymers)あるいは潤滑剤(lubricants)、これらは、投与様式および剤形の性質に依存する。
【0125】
注入使用に適切な薬剤形には、滅菌水溶液(水溶性)または分散液、および滅菌注射液または分散媒の用時調製用の滅菌粉末が含まれる。常に剤形は滅菌され、容易に注入できる範囲の液体でなければならない。剤形は、製造および保存条件下で安定であり、細菌や真菌類のような微生物による汚染作用から保護しなければならない。キャリアは、溶媒または分散媒で、例えば、水、エタノール、ポリオール(例:グレセロール、プロピレングリコール、および液体ポリエチレングリコール、および類似物)、それらの適当な混合液、および植物油を含むものであってよい。適切な流動性は、例えば、レシチンによる被覆、分散液に必要な粒子サイズの維持、および界面活性剤の使用により維持することができる。様々な抗菌剤および抗真菌剤、例えば、クロロブタノール、フェノール、ソルビン酸、theomersalおよび類似物によって、微生物の作用を防ぐことができる。多くの場合、糖または塩化ナトリウムのような等張剤を含むことが好ましい。注入可能な組成は、モノステアリン酸アルミニウムおよびゼラチンなど吸収遅延成分の使用により、長期間吸収させることができる。
【0126】
服用の容易性および投与量の均一性を考慮して、投与ユニット剤型に非経口組成を処方することは特に有益である。本発明で使用する投与ユニット剤型とは、治療する哺乳動物の単位投与量として適切な物理的に個別のユニットを示す。つまり、各ユニットには、前もって定量した有効成分量を含んでおり、その量は、必要な薬剤的キャリアに関連して必要な治療作用を生み出すように計算されている。本発明の投与ユニット剤型の明細は、(a) 有効成分と得られる特有な治療作用の特有な性質、(b) 疾病状態にある、つまり健康障害を持つ被験生体の治療に有効な成分を混合する当分野の技術の限界、によって決定され、直接依存する。
【0127】
活性のある主成分は、簡便かつ効果的な投与にとって、投薬単位形式において薬理的に適合した担体で効果的な投与量が調合される。補助的な活性成分を含んでいる組成物の場合には、投与量は前述の成分の投与の様式および通常の投与量を参照して決定される。
【0128】
導入システム
【0129】
色々なデリバリーシステムが知られており、本発明の組成を投与するのに用いることができる。例えば、リポソームによるカプセル化、微粒子、微カプセル、化合物の発現可能な組換え細胞、受容体介在エンドサイトーシス、レトロウイルスまたは他のベクターの一部として核酸の構築などである、また他の生物学的に活性のある薬剤と共に投与される可能性がある。投与は全身的かもしれないしあるいは局所的かもしれない。
【0130】
特定な実施形態において、治療を要する領域に局所的に、本発明の薬剤物質または組成を投与することが望ましい。この局所投与は、例えば、手術中の局所輸注、座薬、または移植(すなわちsialastic 膜あるいはファイバーなどの膜を含む、多孔、非多孔、またはゼラチン材質の当該インプラント)によって達成することができる。
【0131】
本発明は、ここで説明する特定な実施形態の範囲だけに限定されない。事実、ここの説明に追加された本発明の色々な変更は、前述の説明と添付の図から、これらの当技術分野の専門家には明確になるであろう。このような変更は、付録の請求範囲内に含むことが意図されている。以下の実施例は、本発明を図解することによって提供されるが、それだけに限定されない。
【実施例1】
【0132】
骨再生の実験の手順
【0133】
ヒトBMP-2遺伝子はヒトの胎児の脳のcDNAから二つのプライマーを用いてPCR(ポリメラーゼ連鎖反応)によってクローン化されたものであった。5' プライマーは 5'-TCCCAGCGTGAAAAGAGAGACTGC-3' (SEQ ID NO:1) そして 3' プライマーは 5'-TTTTGCTGTACTAGCGACACCCACAACC-3' (SEQ ID NO:2)であった。GC-rich PCR system(Roche社)によるPCRの後、TOPO TA cloning kit (Invitrogen社) を用いてpCRII-TOPO ベクターにクローニングを行った(図 1A)。レトロウィルスベクターにクローニングを行う際、pCRIIbmp2DNAは、Sal I および Not Iで切断を行った。ヒトBMP-2cDNAの挿入断片(-1.2kb)は、Sal I および Not I 突出があるpMTMLVにライゲーションした(図 1B)。トランスフェクションの前、パッケージング細胞系統であるGP-293細胞(5 x 105 cells/p60mm培養皿)を一日培養した。pMTMLV あるいは pMT-BMP2 は、Fugene (Roche社)を用いてGP-293 細胞へのトランフェクションを行った。トランスフェクション後、48時間において、ネオマイシン耐性細胞を選別するために培養液にネオマイシンを加えた。選別は10日継続して行った。選別された293MT および 293MTBMP2 細胞 (5 x 105 cells/p60mm培養皿)は、エンベロープコードプラスミドpVSVGを翌日トランスフェクションするために培養された。トランスフェクション後、24時間で、標的の細胞であるNIH3T3に感染させるため、プレートに播かれた(1 x 105 cells/p60mm培養皿)。トランスフェクションした細胞の上清は、トランスフェクション後48時間で、低タンパク質結合フィルター(0.45mm)を通して、同量のDMEMで希釈した。NIH3T3の培養液は取り除かれ、フィルターを通した上清で置き換えられた。ポリブレンは終濃度が8μg/mlとなるように加えられた。感染後、二日目にNIH3T3-neo および NIH3T3-BMP-2 細胞の安定化した細胞系統を得るために、ネオマイシンによる選別を行った。選別は10日間継続して行った。産生したBMP2の量は24時間後におよそ150 ng/105 cellsであると決定された。
【実施例2】
【0134】
ラビットへのNIH3T3-BMP-2細胞の注射
【0135】
動物実験に使用する体重2.0 - 2.5 kg のニュージーランドホワイトラビットを選別した。整形外科用の器具で脛骨を露出し、長さ2cm深さ0.5cmの損傷を与えた。コントロールNIH3T3-neo又は NIH3T3-BMP-2 細胞 (2ml of 2 x 106 cells/ml) のいずれかを縫合後の欠損領域に注射した。細胞注射後8週間目において、X線撮影による解析および組織学的な検査を行った。
【実施例3】
【0136】
週ごとのX線撮影検査
【0137】
動物実験に使用する体重2.0 - 2.5 kg のニュージーランドホワイトラビットを選別した。整形外科用の器具で脛骨を露出し、長さ2cm深さ0.5cmの損傷を与えた。NIH3T3-BMP-2 細胞 (2ml of 2 x 106 cells/ml) のを縫合後の欠損領域に注射した。それから、細胞を注射後1、2、3、4、5、6、7週目にX線撮影による解析を行った。注射後7週間目に検体を回収し、写真撮影を行った。組織学的な検査は回収後に行った。
【0138】
図2A-2Fは、NIH3T3-BMP-2 繊維芽細胞での骨の再生を示す。図 1A および1B は、コントロール NIH3T3 繊維芽細胞 (A)およびNIH3T3-BMP-2 細胞 (B)を注射後8週間目の足の骨の写真を示す。図 2C-2F は、実験動物を屠殺する前のコントロール (C と D) および 実験を行った (E と F) の足の骨のX線写真撮影検査を示したものである。BMP-2タンパク質を発現している細胞で処理した欠損領域の骨は、注射後8週間目で治癒した。一方、コントロールの繊維芽細胞を注射した欠損領域では、治癒は見られず、骨の再生は起こらなかった。
【0139】
図3A-3Dは、再生した骨組織の組織学的な実験を示すものである。再生した骨組織のパラフィン切片を作製し、マッソン・トリクローム染色をした。その結果、再生した骨の組織(RB)の構造は、正常な骨の組織(NB)とほぼ同質であることが示された。図3Aおよび図3Bは低倍率(40x)、図3Cおよび3Dは高倍率(100x)で示すものである。点線は再生した骨と正常な骨の境界線を示すものである。これらの結果は、再生した骨は正常な骨と同質のものであることを示唆する。
【0140】
図4A-4Iは、NIH3T3-hBMP-2繊維芽細胞による骨の再生を示すものである。NIH3T3-BMP-2細胞(2x106 cell/mlを2ml)を縫合後の脛骨における欠損部位に注射した。(AからG)細胞を注射してから1、2、3、4、5、6、そして7週間目において、X線写真による解析を行った。この結果は、細胞の注射後3週間で、欠損した骨は新たに産生された骨組織で満たされ始め、注射後6週間目で完全に満たされたことを示す。(H)検体は、注射後7週間で回収し写真を撮影した。この写真は、また再生骨細胞組織で欠損部位が満たされていることを示す。(I)組織学的な解析は回収後に行った。そのマッソン・トリクローム染色の結果を示す。修復された骨組織は正常な骨組織と同じ特徴を持つものであることが染色の結果から示唆される。
【0141】
図5A-5Iは、コントロールDMEM培養液による骨再生を示すものである。コントロールDMEM培養液(2ml)を縫合後の脛骨における欠損部位に注射した。(AからG)培養液を注射してから1日、1、2、3、4、5、そして6週間目において、X線写真による解析を行った。この結果、NIH3T3-hBMP-2繊維芽細胞のデータとは対照的に、細胞注射後6週間であっても欠損が完全に満たされないことが示されている。(H)検体は、注射後6週間で回収し、写真を撮影した。この写真は欠損が完全に満たされていないことをも示す。(I)組織学的な解析は回収後に行った。そのマッソン・トリクローム染色の結果を示す。
【実施例4】
【0142】
骨粗鬆症ラットへのNIH3T3-BMP-2 細胞の注射
【0143】
骨粗鬆症モデルラットは、"Kubo et al., Steroid Biochemistry & Molecular Biology, 68:197-202, 1999; and Namkung-Matthai et al., Bone, 28:80-86, 2001 "で明らかにされているものを用いた。整形外科用の器具で脛骨を露出し、欠損部位(長さ2cm深さ0.5cm)を与えた。コントロールNIH3T3-neo あるいはNIH3T3-BMP-2 細胞 (2ml of 2 x 106 cells/ml) のいずれかを縫合後の欠損領域に注射した。数週間の間隔をあけて、特に細胞注射後およそ8週間目で、X線写真撮影解析および組織学的な検査を行った。
【実施例5】
【0144】
脊椎固定術の実験手順
【0145】
ヒトBMP-2は実施例1で記載したとおり、NIH3T3にクローン化し、トランスフェクションを行ったものである。ヒト由来の接着性の繊維芽細胞(第1段階にある細胞系統由来の包皮繊維芽細胞)、マウス(第1段階のNIH3T3)、ラット(第2段階の繊維芽細胞由来のルイスラット偽関節繊維性組織(Lewis rat pseudarthrosis fibrous tissue))及びヒト(第2段階の繊維芽細胞由来の偽関節繊維性/瘢痕組織(pseudarthrosis fibrous/scar tissue))は、別々に培養し、レトロウィルスを介してBMP-2をトランスフェクションした。細胞は熱ショックで非働化した10%胎児ウシ血清 (Gibco BRL社, Grand Island, New York)、ペニシリンおよびストレプトマイシン(CellGro社, Herndon, Virginia)を加えたDulbecco´s Modified Eagle´s Medium (Cellgro社, Herndon, Virginia)を用いて、60mm培養皿で成長させた。レトロウィルスーBMP2あるいはレトロウィルスーlacZ(ネガティブコントロール)を一日あたり4時間で二日間繊維芽細胞に感染させた。ELISAは発現したタンパク質の濃度(ng/ml)を決定するのに用いられた。それぞれの種において、5 x 106, 10 x 106, 20 x 106 の量のBMP-2 産生細胞は、1 x 0.5 cm のコラーゲン止血スポンジ(collagen hemostatic sponge) (ACS, Helistat, Integra LifeSciences, Plainsboro, NJ)の上に吸収された。0.16-0.18 mg/mlのrhBMP-2 (Genetics Institute, Cambridge, MA) は 1 x 0.5 cm ACS (positive control)の上に吸収された。細片化した腸骨稜の骨は固定部位に置いた。
【実施例6】
【0146】
ラットの脊椎への細胞の注射
【0147】
48匹の成体(3-4ヶ月)の雌で無胸腺のrnu/rnuラットが利用された(24匹:第1段階、24匹:第2段階)。ラットを麻酔した。後方の正中線(posterior midline)へのアプローチにはL4およびL5の横突起(transverse process)を露出して用いた。高速のバー(burr)は、横突起(transverse process)を切断するときにのみ用いた。その部位は洗浄(抗生物質を含んだリンゲル液)した。細胞/ACSはL4とL5の横突起間に移植された。その後、切開部は閉じた。X線撮影は屠殺するまで週2回行った。L4-L5の部分は手での触診を行った。横突起(transverse process)の間の移動を感じたら、固定に失敗したと考えた。組織学的な解析には非脱灰標本を用いた。
【0148】
図6Aおよび6Bは、吸収性のコラーゲンスポンジ(ACS)担体を用いて後方侵入椎体間固定術により細胞を移植した後の、4週目と6週目のラットTG001のX線写真を示す。X線写真の左側のつながった骨は、後方侵入椎体間固定術により5x106のBMP-2のcDNAが導入されたマウス繊維芽細胞であり、円く囲まれている。右側よりも細胞数が少なく、骨形成が少ないことを強調する。示したとおり、骨は産生され、脊椎固定が起こっている。
【0149】
ここで引用された全ての参照は、全体として参照に組み込まれる。
【0150】
本発明の特別の実施例は説明の目的のために上述したものであり、添付した請求項の中で定義されるような発明から外れないように、本発明の詳細の多くのバリエーションが作られるかもしれないことは、当業者にとって明らかである。
【技術分野】
【0001】
本発明は、骨を発生あるいは再生、特に、骨粗鬆症の骨折の修復あるいは、哺乳動物宿主における脊椎固定術を行うために、少なくとも一つの哺乳動物結合組織細胞に形質転換成長因子-βスーパーファミリーのメンバーをコードする遺伝子の少なくとも1つを導入する方法に関するものである。
【背景技術】
【0002】
生きている骨組織のホメオスタシスは、ホルモン、成長因子、分化因子などの調節シグナルによって、動的な過程で調節されている。骨の細胞の増殖を刺激することが知られている成長因子は、骨形成タンパク質(BMPs)、形質転換成長因子-βタンパク質(TGF-β)、インシュリン様成長因子(IGFs)、塩基性繊維芽細胞成長因子(bFGFs)などがある。
【0003】
骨粗鬆症(低骨量や骨折による骨の構造の微細構造上の劣化を特徴とする)は、加齢に伴う共通した健康問題である。骨粗鬆症の条件も、例えば、閉経のみならず、カルシウム欠乏食、卵巣除去、グルココルチコイド誘導性骨粗鬆症、甲状腺機能亢進症、ヘパリン誘導あるいは免疫抑制的誘導などの様々な因子によって引き起こされうる。
【0004】
骨折治癒は、複雑な過程であり、未だ良く理解されていない。骨粗鬆症を持った患者をシミュレートするために卵巣切除術および低カルシウム食によって産生されたラットモデルでは、骨折した骨粗鬆症の骨が適切に治癒しなかった(非特許文献1、非特許文献2)。したがって、骨再生を含む治療は、骨粗鬆症の骨折の治療をさらに改善するだろう。
【0005】
整形外科分野において、いくつかのサイトカインは、整形外科の疾病の治療の候補となりうると考えられている。骨形成タンパク質(BMP)は、効果的な骨形成のスティミュレーター(刺激因子)であり(非特許文献3、非特許文献4)、TGF-βは骨形成および軟骨形成のスティミュレーター(刺激因子)であることが報告されている(非特許文献5)。形質転換成長因子-βタンパク質(TGF-β)は、多機能なサイトカインであると考えられており(非特許文献6)、細胞内での成長、分化、そして細胞外マトリックスタンパク質の合成において、調節的な役割を担っている(非特許文献7)。TGF-βは、in vitroにおける上皮細胞や破骨細胞様細胞の成長を阻害する(非特許文献8)。しかし、in vivoにおいては、軟骨内骨化を刺激し、ついには骨形成までも刺激する(非特許文献9、非特許文献10、非特許文献11)。TGF-β誘導性の骨形成は、骨膜下の多分化能を持つ細胞による媒介によって最終的に軟骨形成細胞へと分化する(非特許文献12、非特許文献13)。
【0006】
整形外科におけるTGF-βの生物学的な効果が報告されている(非特許文献14、非特許文献15、非特許文献16、非特許文献17、非特許文献18)。マウスの胎児において、TGF-βは間葉系由来の組織、たとえば結合組織、軟骨、骨などと密接に関連していることが染色によって示されている。さらに、発生学的な発見として、TGF-βは、骨形成や軟骨形成の部位に存在していることがわかっている。そして、TGF-βは、ウサギの脛骨の骨折の治癒を増進させることもわかっている。近年、TGF-βの治療的価値についての報告がされている (非特許文献19、非特許文献20)。しかし、その効果が短期間であることやコストが高いことが、広汎な臨床応用を制限している。
【0007】
過度に損傷が著しい多くの骨の欠損は、完全に回復するには至らず、自家移植や保存されている骨を移植するなどの治療介入が必要となってくる。これらの従来の治療方法は、高い確率で治療が失敗に終わる可能性がある。また、近年の多くの代替アプローチは、損傷した部位に骨誘導性のタンパク質を注入した生分解性の担体の移植を利用するものである。例として、特許文献1が挙げられる。特許文献2や特許文献3などが開示する、骨の再生を促す機械装置を用いるものを含むアプローチがある。これらの方法の一つの大きな欠点は、in vivoにおいて治療に用いるタンパク質の作用に関して短期で効果的な治療を達成するために、大量の組換えタンパク質を必要とすることである。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】米国特許第5656598号
【特許文献2】米国特許第6077076号
【特許文献3】米国特許第6022349号
【非特許文献】
【0009】
【非特許文献1】Kubo et al., Steroid Biochemistry & Molecular Biology, 68:197-202, 1999
【非特許文献2】Namkung-Matthai et al., Bone, 28:80-86, 2001
【非特許文献3】Ozkaynak et al., EMBO J, 9:2085-2093, 1990
【非特許文献4】Sampath and Rueger, Complications in Ortho, 101-107, 1994
【非特許文献5】Joyce et al., J Cell Biology, 110:2195-2207, 1990
【非特許文献6】Sporn and Roberts, Nature (London), 332: 217-219, 1988
【非特許文献7】Madri et al., J Cell Biology, 106: 1375-1384, 1988
【非特許文献8】Chenu et al., Proc Natl Acad Sci, 85: 5683-5687, 1988
【非特許文献9】Critchlow et al., Bone, 521-527, 1995
【非特許文献10】Lind et al., A Orthop Scand, 64(5): 553-556, 1993
【非特許文献11】Matsumoto et al., In vivo, 8: 215-220, 1994
【非特許文献12】Joyce et al., J Cell Biology, 110: 2195-2207, 1990
【非特許文献13】Miettinen et al., J Cell Biology, 127-6: 2021-2036, 1994
【非特許文献14】Andrew et al., Calcif Tissue In. 52: 74-78, 1993
【非特許文献15】Borque et al., Int J Dev Biol., 37:573-579, 1993
【非特許文献16】Carrington et al., J Cell Biology, 107:1969-1975, 1988
【非特許文献17】Lind et al., A Orthop Scand. 64(5):553-556, 1993
【非特許文献18】Matsumoto et al., In vivo, 8:215-220, 1994
【非特許文献19】Critchlow et al., Bone, 521-527, 1995
【非特許文献20】Lind et al., A Orthop Scand, 64(5): 553-556, 1993
【発明の概要】
【発明が解決しようとする課題】
【0010】
脊椎における椎骨の骨劣化は、一方で椎骨の虚脱により腰痛に苦しむ患者を救う椎骨固定術を行うための、骨を産生する場所でもある。したがって、骨形成タンパク質の放出時間を長くするような改良が治療的な適用技術に必要とされている。本発明の記載にあるとおり、本発明は、効率的な骨の再生を導くことによって、骨の欠損部位において、骨形成を行うような治療用のタンパク質の発現を持続する方法を提供する。
【課題を解決するための手段】
【0011】
本発明は前述の記載要件を満たすものである。哺乳動物宿主を治療するのに用いる哺乳動物結合組織細胞の少なくとも一つの細胞に、ある産物をコードする少なくとも一つの遺伝子を導入する方法が、本発明によって供給される。この方法は、その産物をコードする遺伝子を含むDNAベクター分子の作製、その産物をコードする遺伝子を含むDNAベクター分子を結合組織細胞に導入することを含む。DNAベクター分子は、どのようなDNA分子をも運搬することが可能であり、標的細胞あるいは組織内で興味がある遺伝子産物をコードする遺伝子が安定して発現されるように維持されるものである。本発明で使用されるDNAベクター分子は、好ましくは、ウィルスあるいはプラスミドDNAベクター分子である。本発明の方法は、好ましくは、治療を目的として哺乳動物結合組織細胞に産物をコードした遺伝子を導入することを含むものである。
【0012】
本発明は、低骨量患者の骨欠損部位に、骨を形成させるための治療用組成物に関するもので、以下のことを含む:
【0013】
a) 骨を再生する機能をもつタンパク質をコードする遺伝子が作用するようにプロモーターに結合してベクターに挿入すること、及び
【0014】
b) in vitroにおいて、結合組織細胞群へ該組換えベクターでトランスフェクションあるいは形質導入すること、及び
【0015】
c) 哺乳動物細胞を骨欠損部位に移植し、骨欠損部位に骨を形成させるようにすること。
【0016】
この方法において、ベクターはレトロウィルスベクターあるいはプラスミドベクターに限定されるものでない。遺伝子はTGF-βスーパーファミリーのメンバーでよいが、特に、骨形成タンパク質(BMP)がよい。さらに好ましいくは、BMPはBMP-2がよい。加えて、結合組織細胞は、繊維芽細胞あるいは骨の前駆細胞でよい。
【0017】
上記の方法において、初期あるいは後期を通して骨は産生される。
【0018】
本発明は、脊椎固定用組成物に関するもので、以下のことを含む。
【0019】
a) 骨を産生する機能をもつタンパク質をコードする遺伝子をベクターに挿入すること、及び
【0020】
b) in vitroにおいて、結合組織細胞群へ組換えベクターでトランスフェクションあるいは形質導入すること、及び
【0021】
c)トランスフェクションあるいは形質導入された結合組織細胞群を骨形成を行うのに十分な量及び薬剤的に容認された担体を脊椎と接触させ、該脊椎で遺伝子をコードするDNA配列の発現により骨の産出が起こり、結果として脊椎の固定がされること。
【0022】
この方法において、ベクターはレトロウィルスベクターあるいはプラスミドベクターに限定されるものでない。遺伝子はTGF-βスーパーファミリーのメンバーでよいが、特に骨形成タンパク質(BMP)がよい。さらに好ましくは、BMPはBMP-2で良い。加えて、結合組織細胞は、繊維芽細胞あるいは、骨の前駆細胞で良い。
【0023】
上記の方法において、骨は初期あるいは後期を通して産生される。
【0024】
さらに、本発明は骨粗鬆症による骨折の治療用組成物に関するものであり、以下のことを含む。
【0025】
a) 骨を再生する機能をもつタンパク質をコードする遺伝子をベクターに挿入すること、及び
【0026】
b) in vitroにおいて、結合組織細胞群を組換えベクターでトランスフェクションあるいは形質導入すること、及び
【0027】
c) 骨折部位へ結合組織細胞を導入し、骨折を治癒すること。
【0028】
この方法において、ベクターはレトロウィルスベクターあるいはプラスミドベクターに限定されるものでない。遺伝子はTGF-βスーパーファミリーのメンバーでよいが、特に骨形成タンパク質(BMP)がよい。さらに好ましくは、BMPはBMP-2がよい。また、結合組織細胞は、繊維芽細胞あるいは骨の前駆細胞がよい。
【0029】
上記の方法において、骨は初期あるいは後期を通して産生される。
【0030】
発明のこれらおよび他の対象は、後述の発明の記載、参照に付された図面、および請求項から、より完全に理解されるだろう。
【図面の簡単な説明】
【0031】
本発明は、以上に示す詳細な記述および添付された図面に示される説明によってより理解が深まるものになるものであり、しかしながらここに示されたものに限定されるものではない。
【0032】
【図1】図1Aおよび1BはヒトBMP2遺伝子を組み込んだpMT-BMP2のコンストラクトを示す。
【図2】図2A-2Fは、NIH3T3-BMP-2繊維芽細胞による骨の再生を示す。図2Aおよび2BはコントロールのNIH3T3繊維芽細胞(A)およびNIH3T3-BMP-2繊維芽細胞(B)を注射して8週間後の足の骨の写真をそれぞれ示したものである。図2C-2Fは、実験動物を屠殺する前のコントロール(CおよびD)、実験をおこなった(EおよびF)足の骨のX線写真を示すものである。BMP-2タンパク質を発現している細胞で処理した骨の欠損は注射後8週間で治癒した。
【図3】図3A-3Dは、再生した骨組織の組織学的な実験を示すものである。再生した骨組織のパラフィン切片を作製し、マッソン・トリクローム染色をした。その結果、再生した骨の組織(RB)の構造は、正常な骨の組織(NB)とほぼ同質であることが示された。図3Aおよび図3Bは低倍率(40x)、図3Cおよび3Dは高倍率(100x)で示すものである。点線は再生した骨と正常な骨との境界線を示すものである。
【図4】図4A-4Iは、NIH3T3-hBMP-2繊維芽細胞による骨の再生を示すものである。NIH3T3-BMP-2細胞(2x106 cell/mlを2ml)を縫合後の脛骨における欠損部位に注射した。(AからG)細胞を注射してから1、2、3、4、5、6、そして7週間目において、X線写真による解析を行った。(H)検体は、注射後7週間で回収し写真を撮影した。(I)組織学的な解析は回収後に行った。マッソン・トリクローム染色の結果を示す。
【図5】図5A-5Iは、コントロールであるDMEM培養液による骨再生を示すものである。コントロールDMEM培養液(2ml)を縫合後の脛骨における欠損部位に注射した。(AからG)培養液を注射してから1日、1、2、3、4、5、そして6週間目において、X線写真による解析を行った。(H)検体は、注射後6週間で回収し写真を撮影した。(I)組織学的な解析は回収後に行った。マッソン・トリクローム染色の結果を示す。
【図6】図6Aおよび6Bは、吸収性のコラーゲンスポンジ(ACS)担体を用いて後方侵入椎体間固定術により細胞を移植した後の、4週目と6週目のラットTG001のX線写真を示す。X線写真の左側のつながった骨は、後方侵入椎体間固定術により5x106のBMP-2のcDNAが導入された(マウス)繊維芽細胞であり、円く囲まれている。右側よりも細胞数が少なく、骨形成が少ないことを強調する。
【発明を実施するための形態】
【0033】
本発明において、単数形を用いているものは単数あるいは複数の両方を対象とするものである。
【0034】
ここに使用される一つあるいはさらに多くの治療のための薬剤を「併用して」投与するとあるのは、どのような順序においても、併用(同時に)あるいは継続した投与を含む。
【0035】
ここに使用される核酸、タンパク質、タンパク質断片あるいはそれらの誘導体に関する「生物学的活性」という用語は、核酸又はタンパク質の野生型フォームによって導きだされる公知の生物活性を模倣した核酸又はアミノ酸の機能により定義される。
【0036】
ここに使用される「骨成長」という用語は、骨量と関連する。TGF-βタンパク質は、全身での骨量を増加させるものと考えられている。このことは、骨芽細胞の数や大きさの増大によって、また全身性の投与によって骨様ライニング骨表面の沈着が増加することから示唆されている。
【0037】
ここに使用される「担体」は、使用された投与量および濃度によって、それにさらされた細胞あるいは哺乳動物にとって無毒な薬学的に容認される担体、補形薬あるいは安定剤を含む。多くの場合、薬学的に容認される担体は水溶性のpHバッファーである。薬学的に容認される担体の例として、ここにいくつかあげるが、これらに限定されるものではない。バッファーは、リン酸バッファー、クエン酸バッファー、その他の有機酸のバッファー。低分子量ポリペプチドは、10残基以下のもの。抗酸化剤は、アスコルビン酸を含むようなもの。タンパク質は、血清アルブミンや、ゼラチン、免疫グロブリンなど。親水性ポリマーは、ポリビニルピロリドンなど。アミノ酸は、グリシン、グルタミン、アスパラギン、アルギニン、リジンなど。単糖類、二糖類、その他の糖質は、グルコース、マンノース、デキストリンなどを含むもの。キレート剤としてEDTAなど。糖アルコールとしてマンニトールやソルビトールなど。塩形成対イオンとしてナトリウム。非イオン性界面活性剤としてTWEENR、ポリエチレングリコール(PEG)、PLURONICSRなど。
【0038】
ここに使用される「結合組織」は、その他の組織あるいは器官で、これらに限定するわけではないが、哺乳動物宿主の靭帯、軟骨、腱、骨、滑膜を含み、結合及び支持するあらゆる組織である。
【0039】
ここに使用される「結合組織細胞」又は「結合組織の細胞」は、繊維芽細胞、軟骨細胞(chondrocyte)、骨細胞(osteoblast/ osteocyte)そして脂肪細胞(adipocyte)、平滑筋細胞をも含む、結合組織において見られる細胞である。好ましくは、結合組織細胞は、繊維芽細胞、軟骨細胞、骨細胞である。さらに好ましくは、結合組織細胞は繊維芽細胞である。もしくは、結合組織細胞は、骨芽細胞あるいは骨細胞である。単一のタイプの細胞でも結合組織細胞の混合培養でも、本発明は実行することができることが認識されるだろう。また、組織細胞は、化学物質あるいは放射線照射によって細胞が興味のある遺伝子を安定して発現するような処理がなされる可能性があることも認識されるだろう。好ましくは、結合組織細胞は宿主に導入されたときに、ネガティブな免疫反応を引き起こさないのがよい。この同種間の細胞が、細胞を介した遺伝子治療又は体細胞治療のための自己由来細胞と同様に使用される点は理解されるものである。
【0040】
ここに使用される「結合組織細胞系」は、その多くが共通の親細胞に由来する結合組織細胞からなるものである。
【0041】
ここに使用される「宿主細胞」は、個々の細胞あるいは本発明におけるベクターの宿主あるいは導入された細胞培養を含むものである。宿主細胞は、単一の宿主細胞に由来するものであり、その孫細胞は自然に、偶然にあるいは計画的な突然変異の導入及び/又は変化によりオリジナルの親細胞と完全に同一(形態的にあるいは総DNA配列的に)であることは必ずしも必要とされない。宿主細胞は、in vivoにおいてTGF-βスーパーファミリーのメンバーをコードするポリヌクレオチドを含むベクターでトランスフェクションされたあるいは、感染させられた細胞を含む。
【0042】
ここに使用される「低骨量」という用語は、骨量の段階が世界保健機関(WHO)の"Assessment of Fracture Risk and its Application to Screening for Postmenopausal Osteoporosis (1994)によるスタンダードによって定義される年齢の平均よりも低い値を意味する。Report of a World Health Organization Study Group. World Health Organization Technical Series 843"は、正常および骨粗鬆症の骨量の段階の参照は本参照として組み込まれる。さらに、「骨量」とは、時には骨ミネラル濃度としての参照である、ある範囲における骨量として参照される。
【0043】
ここに使用される「維持」という用語は、リポソームの輸送に関連して用いられた場合、細胞中に現存している導入されたDNAの能力を意味する。その他に関連して用いられた場合、治療効果を与える標的細胞あるいは標的組織における標的DNAの保存能力を意味する。
【0044】
ここに使用される「哺乳動物宿主」は、ヒトに限定されるものではなく、広く動物界のメンバーを含む。
【0045】
ここに使用される「成熟した骨」という用語は、石灰化してない骨様の骨とは対照的に、石灰化している骨に関するものである。
【0046】
ここに使用される「骨形成の効果」という用語は、成熟した骨の形成および発生をもたらす量を意味する。
【0047】
ここに使用される「骨芽前駆細胞」又は「骨の前駆細胞」という用語は、骨細胞になる能力を持ち、骨膜や骨髄に存在する細胞を意味する。骨芽前駆細胞は、組織(筋肉)の周辺にも存在する結合組織前駆細胞にも由来するものである。
【0048】
ここに使用される「患者」という用語は、ヒトに限定されるものではなく、広く動物界のメンバーを含むものである。
【0049】
ここに使用される「薬理学的にあるいは生理学的に容認された」という用語は、その投与がレシピエント動物によって耐えられうるものであり、さもなければ、動物への投与が適合するものであることをいう。そのような薬剤がもし生理学的に意味のある投与量である場合に「治療的に効果のある量」といわれる。薬剤があることによって、レシピエントとなる患者の生理学的な効果において検出可能な変化に帰する場合、その薬剤は生理学的に意味があるとされる。
【0050】
ここに使用される「薬剤的に容認される担体及び/又は希釈液」という用語は、懸濁液、被覆剤、抗生物質、抗真菌剤、等張性及び吸収遅延剤などあらゆる溶剤を含むものである。薬剤的に活性のある物質のためにそのような溶媒や薬剤の使用することは、技術的によく知られている。活性成分として不適合な従来の溶媒又は試薬であるものを除く限り、治療組成中にそれらを使用できることを意図する。補助的な活性成分もその組成に組み込まれることもできる。
【0051】
ここに使用される「プロモーター」という用語は、真核細胞中においてDNA配列の活性化および転写制御にかかるものである。プロモーターは真核生物と原核生物の一方もしくは両方の活性化に関わることができる。好ましくは、プロモーターは哺乳動物細胞において転写を活性化するものである。プロモーターは、恒常的に発現あるいは誘導される可能性がある。好ましくは、そのプロモーターは、誘導されるものである。さらに好ましくは、外的刺激により誘導されるものである。より好ましくは、そのプロモーターは、ホルモンや金属によって誘導されるものである。転写を制御する「エンハンサー因子」のように、DNAベクターのコンストラクトに挿入されることも可能であり、興味のある遺伝子の発現を増大させるように本発明のコンストラクトと一緒に使用されうる。
【0052】
ここで使用する"選択可能なマーカー"とは、導入したDNAを安定に維持する細胞によって発現された遺伝子生成物などであり、その細胞に、形態学的転移または酵素活性など、変化した表現型を発現させる。形質移入された遺伝子を発現する細胞の単離は、選択可能なマーカーをコード化する二番目の遺伝子を、同じ細胞中に導入することによって達成される。そのマーカーには、例えば、抗菌薬あるいは他の薬物に耐性を与える酵素活性を有するマーカーが含まれる。選択可能なマーカーには、チミジンキナーゼ、ジハイドロ葉酸還元酵素、カナマイシン、ネオマイシン、ゲンチシンなどのアミノ配糖体抗生物質に耐性を示すアミノ配糖体転移酵素、ハイグロマイシンBリン酸転移酵素、キサンチン-グアニンホスホリボシル基転移酵素、CAD酵素 (de novo ウリジン-カルバミルリン酸合成酵素、アスパラギン酸トランスカルバモイラーゼおよびジハイドロオロターゼの3つの酵素活性有する1つのタンパク質)、アデニン脱アミノ酵素、およびアスパラギン合成酵素(Sambrook et al. Molecular Cloning, Chapter 16. 1989)が含まれるが、これだけに限定されない。本明細書の参考文献としてその全文が添付されている。
【0053】
ここに使用される「対象」は、脊椎動物であり、好ましくは、哺乳動物、より好ましくはヒトである。
【0054】
ここに使用される「治療」は、有益なあるいは望まれている臨床上の結果を得るために取り組むものである。本発明の目的として、有益なあるいは望まれている臨床上の結果には次のものが含まれるが、これに限定されるものではない。検出可能であろうがなかろうが、症状の軽減、病気の存在の減少、病気の状態の安定化(たとえば、悪化しないようにする)、病気の進行を遅らせるあるいはゆっくりとさせる、病気の状態の回復あるいは緩和、そして一部あるいは全部の寛解。「治療」は、治療を受けない場合の期待される生存と比較して、延長されうる生存をも意味する。「治療」は、治療的処置並びに予防又は予防学的な測定を含む。治療を必要とするものには、障害を既に持つものも、その障害が予防されうるものも含む。病気の「緩和」とは、治療をしない場合と比較したときの程度またあるいは臨床上好ましくない病状の徴候の緩和及び/又は進行の時間経過の遅滞あるいは延長を意味する。
【0055】
ここに使用される「TGF-βタンパク質」は、TGF-βスーパーファミリーのメンバーに関するものである。
【0056】
ここに使用される「ベクター」、「ポリヌクレオチドベクター」、「コンストラクト」及び「ポリヌクレオチドコンストラクト」は、ここにおいて相互交換されるものである。本発明のポリヌクレオチドベクターは、いくつかの形態を持つことが可能である。限定されるわけではないが、以下のものを含む。RNA、DNA、レトロウィルスの外被で包まれたRNA、アデノウィルスの外被で包まれたDNA、他のウィルスあるいはウィルス様の形態(ヘルペスシンプレックスやアデノ関連ウィルス(AAV)など)で包まれたDNA、リポソームで包まれたDNA、ポリリジン、合成されたポリカチオニック分子、免疫学的に「マスク」された分子によるポリエチレングリコール(PEG)、及び/又は半減期の増加するもの、あるいは非ウィルス性のタンパク質結合複合体DNA。好ましくは、ポリヌクレオチドはDNAを指す。ここで用いられている「DNA」は、A,T,G,Cだけでなく、例えば、メチル化されたヌクレオチドのような塩基の類似体又は修飾形式、無電荷結合(uncharged linkages)、チオアート(thioates)、糖類似体使用などの内部ヌクレオチド修飾、並びにポリアミドなどの修飾又は代替骨格構造も含む。
【0057】
形質転換成長因子-β(TGF-β)スーパーファミリー
【0058】
本明細書で使用する"形質転換成長因子β(TGF-β)スーパーファミリー"とは、構造的に関連するタンパク質のグループなどであり、胚発生中、広範囲に分化プロセスに影響を与える。ファミリーには、正常な男性性器発生に必要な(Behringer, et al., Nature, 345:167, 1990)ミュラー管抑制物質(MIS)、背腹軸形成と成虫盤の形態発生に必要な(Padgett, et al., Nature, 325:81-84, 1987)ショウジョウバエのDPP(TGF-β/BMPホモログ)遺伝子生成物、卵の植物性極に局在する(Weeks, et al., Cell, 51:861-867, 1987)Xenopus Vg-1 遺伝子生成物、ゼノパス胚中で中胚葉と前部構造の形成を誘導する(Thomsen, et al., Cell, 63:485, 1990)アクチビン(Mason, et al., Biochem, Biophys. Res. Commun., 135:957-964, 1986)、およびde novo 軟骨と骨形成を誘導する(Sampath, et al., J. Biol. Chem., 265:13198, 1990)骨形態形成タンパク質(BMP-2-15のようなBMP's)などが含まれる。TGF-β 遺伝子生成物は、脂肪生成、筋形成、軟骨形成、造血形成、上皮細胞分化など、様々な分化プロセスに影響を与える可能性がある(Massague, Cell 49:437, 1987を参照)。本明細書に参考文献として全文を添付してある。
【0059】
TGF-β ファミリーのタンパク質は、まず大型の先駆体タンパク質として合成され、続いて、C末端から約110-140 個の基本アミノ酸残基クラスターでタンパク質開裂が起こる。タンパク質のC末端領域は、すべて構造的に関連しており、異なるファミリーメンバーは、それらの相同性の大きさに基づいて別々のサブグループに分類することができる。特定のサブグループの相同性は、アミノ酸配列の同一性が70% 〜90% の範囲であるが、サブグループ間の相同性は有意に低く、一般的に20% 〜50%の範囲である。いづれの場合も、活性種は、C末端フラグメントのジスルフィド結合二量体であるように思われる。試験した殆どのファミリーメンバーに対し、ホモダイマー種は生体活性であることが認められたが、インヒビン(Ung, et al., Nature, 321:779, 1986)やTGF-β'S(Cheifetz, et al., Cell, 48:409, 1987)のような他のファミリーメンバーでは、ヘテロダイマーも検出され、相当するホモダイマーと生物学的特性が異なるように思われる。
【0060】
TGF-β 遺伝子のスーパーファミリーメンバーには、TGF-β3、TGF-β2、 TGF-β4 (チキン)、TGF-β1、TGF-β5 (アフリカツメガエル)、BMP-2、BMP-4、ショウジョウバエ DPP、BMP-5、BMP-6、Vgr1、OP-1/BMP-7、ショウジョウバエ 60A、GDF-1、アフリカツメガエルVgf、BMP-3、インヒビン-βA、インヒビン-βB、インヒビン-α、および MISなどが含まれる。これらの遺伝子はMassague, Ann. Rev. Biochem. 67:753-791, 1998において考察されており、本明細書の参考文献として全文を添付してある。
【0061】
好ましくは、TGF-β 遺伝子のスーパーファミリーメンバーはBMPである。さらに好ましくは、メンバーは、TGF-β1、TGF-β2、TGF-β3、BMP-2、BMP-3、BMP-4、BMP-5、BMP-6、or BMP-7がよい。さらになお好ましくは、メンバーは、ヒトBMPである。また、さらになお好ましくは、メンバーは、ヒトのBMP-2である。
【0062】
BMP
【0063】
BMPタンパク質は、骨形成が始まる前に間葉系の細胞から軟骨細胞および骨芽細胞へ分化を誘導する働きを持つ。BMPは、骨折した部位の近辺しかし異所的な場所で軟骨および骨の形成における分化を促進する。タンパク質のいくつかには、骨芽細胞においてアルカリフォスファターゼおよびコラーゲンの合成を誘導するものがある。あるBMPの中には、筋分化を抑制すると同時に、直接骨芽細胞に働きかけて骨芽細胞の成熟を促進するものがある。その他のBMPは、典型的な繊維芽細胞から軟骨細胞への転換を促進するものがあり、非骨形成型の細胞において、骨芽細胞の表現型を発現するように誘導することができるものもある。BMPファミリーはTGFβスーパーファミリーに属し、以下のものが含まれる:
【0064】
BMP-2AあるいはBMP-2α(114アミノ酸)は、BMP-2と名称変更された。ヒト、マウス、ラットのタンパク質はそのアミノ酸配列上同一である。このタンパク質は、ショウジョウバエと68%の相同性を示す。
【0065】
BMP-2BあるいはBMP-2β(116アミノ酸)は、BMP-4と名称変更された。マウス、ラットのタンパク質はそのタンパク質配列と同一である。
【0066】
BMP-3(110アミノ酸)は糖タンパク質であり、オステオゲニンと同一である。ヒトおよびラットの成熟タンパク質は98%同一である。
【0067】
BMP-3b(110アミノ酸)は、BMP-3(82%同一)と関連する。ヒトおよびマウスのタンパク質は、97%の同一性(3アミノ酸が相違)を示す。ヒトおよびラットのタンパク質の配列は、2アミノ酸相違する。そのファクターは、GDF-10と同一である。
【0068】
BMP-4は、BMP-2BおよびDVR-4と同一である。ショウジョウバエと72%の相同性を示す。
【0069】
BMP-5(138アミノ酸)は、ヒトとマウスにおいて、アミノ酸レベルで96%の同一性を示す。
【0070】
BMP-6(139アミノ酸)は、DVR-6やvegetal-specific-related-1と同一である。
【0071】
BMP-7(139アミノ酸)は、OP-1(osteogenic protein 1)と同一である。マウスとヒトのタンパク質は98%の同一性を持つ。BMP-5、BMP-6、BMP-7の成熟したフォームと75%の同一性を示す。
【0072】
BMP-8(139アミノ酸)は、OP-2と同一である。そのファクターは、BMP-8aと関連づけられる。
【0073】
BMP-8b(139アミノ酸)はOP-3と同一であり、マウスのみで見つかっている。そのファクターは、OP-3としても知られている。
【0074】
BMP-9(110アミノ酸)は、GDF-5とも関連づけられる。
【0075】
BMP-10(108アミノ酸)は、ウシから単離されたものである。ウシおよびヒトが同一である。
【0076】
BMP-11(109アミノ酸)は、ウシから単離された。ヒトとウシの配列は同一である。タンパク質は、GDF-11とも関連づけられる。
【0077】
BMP-12(104アミノ酸)は、GDF-7あるいはCDMP-3としても知られている。
【0078】
BMP-13(120アミノ酸)は、GDF-6およびCDMP-2と同じである。
【0079】
BMP-14(120アミノ酸)は、GDF-5およびCDMP-1と同じである。
【0080】
BMP-15(125アミノ酸)は、卵母細胞特異的に発現する。このマウスタンパク質は、マウスGDF-9と最も近いものとして関連づけられる。
【0081】
これらのタンパク質のうちのいくつかは、ヘテロダイマーで存在する。例えば、OP-1は、BMP-2Aと結合する。
【0082】
およそ90パーセントもの高いアミノ酸配列の相同性が見られるため、BMP-5、BMP-6及びBMP-7は、BMPの特別なサブファミリーとして認識されている。BMP-5、BMP-6をコードする遺伝子は、ヒトの6番染色体にマップされている。BMP-7をコードする遺伝子は、ヒトの20番染色体にマップされている。BMPは脱石灰化した骨および骨肉腫から単離することが可能である。BMPは、胚において様々な上皮組織および間葉系の組織でも発現が見られる。いくつかのBMPs(例としてBMP-2およびBMP-4)は、同質の効果(軟骨形成および骨形成)を引き起こし、一つを別のものに置き換えても同じ効果を示すことがわかっている。
【0083】
オステオゲニンおよび関連するBMPsは、循環する単球に対して強力な走化性因子として機能し、単球によってTGF-β1の合成および分泌がなされ、互いを誘導することにより、軟骨内の骨形成のカスケードにおけるさらなる連続した段階へと促進する。TGF-βによって刺激された単球は、多くの走化性および分裂促進をもたらすサイトカインを内皮細胞および間葉系細胞を補充している条件培地へ分泌し、コラーゲンの合成を促進し、マトリックス構成物と結合させる。
【0084】
骨再生治療
【0085】
本発明は、興味あるDNA配列を哺乳動物宿主の結合組織細胞へ導入するex vivoおよびin vivoの技術を開示する。ex vivo技術は、標的結合組織細胞の培養、in vitroにおける興味のあるDNA配列、DNAベクター若しくは他の輸送ベシクルを結合組織細胞へ導入し、続いて興味ある遺伝子産物のin vivoでの発現の効果を得るために哺乳動物細胞の標的骨欠損領域への修飾した結合組織細胞の移植を行うことを含むものである。外来の組織、生体適合性担体及び補助剤と同様に、足場のフレームワークとなるような材料、マトリックス又はバフィーコートのような生体付着性若しくは化学性接着剤のような物質も、本発明の遺伝的改良された細胞といっしょに移植できることは理解できる。もう一つの側面において、本発明は、遺伝学的に改良された結合組織細胞と骨の欠損部位若しくはその周辺間の接触が促進されるような治療組成物である生体付着物質を含むでもよい。一方で、本発明の投与体系における構成からそのような物質は除外される可能性もある。
【0086】
ヒトの患者の治療に用いる適切な供与源からの細胞は、自己の繊維芽細胞あるいは骨芽前駆細胞、骨細胞、骨芽細胞、あるいは破骨細胞のような患者自身の結合組織細胞であるが、しかし同種間の細胞もまた用いられることができることは、通常の技術を持つ当業者には理解されるものである。
【0087】
具体的には、この方法は形質転換成長因子-βスーパーファミリーのメンバーあるいは生物学的に活性のある誘導体あるいはそれらの断片のような遺伝子産物を使用することも含む。
【0088】
本発明の別の実施例として、治療上効果的な量を患者に非経口投与する化合物には、TGF-βスーパーファミリーのタンパク質および適切な薬剤の担体を含むものが提供される。
【0089】
本発明の別の実施例は、TGF-βスーパーファミリーのタンパク質および適切な薬剤の担体を含む予防的に効果のある量を患者に非経口投与する化合物を提供するものである。
【0090】
本発明において、BMP-2およびTGF-β1、2、3(これに限定されないが)を含む形質転換成長因子-β(TGF-β)スーパーファミリーのメンバーをコードする遺伝子をトランスフェクションあるいは形質導入した適切な哺乳動物細胞の注射によって骨の産生あるいは再生の方法を提供するものである。BMP-2が例証されている。
【0091】
本発明の実施例において、細胞は、外来性の細胞あるいは生体適合性のある担体などのような足場となる物質あるいはその他の補助的な物質を伴ってあるいは伴わないで骨が産生されるあるいは再生される場所に注射されうることが理解される。つまり、改良された細胞は付加的な構造あるいは枠組みの補助なしに再生されうる骨の領域に注射されうる。本発明のひとつの実施例において、そのような付加的な物質は例えば米国特許第5842477号において開示されており、本発明の構成からは除外されてもよい。
【0092】
本発明における方法は、体の全てのタイプの骨に適応される可能性がある。以下のものを含むがこれに限定されるものではない。非癒合骨折(骨折の治癒がうまくいかなかったもの)、頭蓋顔面の再構築、腫瘍除去によるセグメントの欠損、臀部の移植片の修正による周囲の骨の増大(例えば、臀部の移植片の25%が移植片に置き換わるとき、その臀部移植片の寿命はたった10年以内である)、歯科の目的での顎の骨の再構築。さらにその他の標的となる骨は、脊椎固定術のための脊椎における椎骨、大きな骨などをも含む。
【0093】
改良される細胞は、骨の形成を助けるあらゆる適当な哺乳動物の結合組織細胞を含み、これらに限定されるものではないが、以下のものを含む。繊維芽細胞、骨芽前駆細胞、骨芽細胞、骨細胞、破骨細胞、さらには軟骨細胞をも含むでもよい。しかしながら、その他の遺伝学的な改良を受けていない細胞、例えば、骨芽細胞、骨細胞、破骨細胞、軟骨細胞などが骨欠損部位に接触するように用いられる組成をも含まれる可能性があることは理解されるものである。
【0094】
宿主細胞のin vitroにおける操作に代わるものとして、興味のある産物をコードする遺伝子をリポソームに導入して、直接に骨折あるいは欠損している部位やその周辺に直接注射し、その部位において結合組織細胞とリポソームの融合が起こり、その結果TGF-βスーパーファミリーに属する遺伝子産物のin vivo 遺伝子発現が起こる。
【0095】
「骨欠損」又は「欠損した骨」に言及すると、そのような欠損は骨折、破壊、及び/又は怪我や病気による場合を含む骨の分解、さらには脊椎の椎骨の欠損および、またさらには、脊椎間椎間板の分解も含まれる可能性があることが理解されるものである。本発明の一態様として、脊椎間椎間板の分解によって引き起こされる痛みが、分解された椎間板の周囲の脊椎固定により治療されることである。
【0096】
さらに結合組織細胞のin vitroにおける操作に代わる方法として、興味のある産物をコードする遺伝子を裸のDNAとして骨欠損領域に導入するものがある。裸のDNAは、結合組織細胞に入り込み、TGF-βスーパーファミリーに属する遺伝子産物のin vivoにおける遺伝子発現に帰着する。
【0097】
この明細書を通して開示された骨折や骨の欠損のex vivoにおける治療方法の一つとしては、タンパク質あるいは生物学的に活性のある断片をコードしているDNA配列を含む初期に産生する組換えウィルスあるいはプラスミドベクターを含む。この組換えベクターはin vitroで培養された結合組織細胞群への感染あるいは導入に用いられるものであり、結果として、ベクターが含まれる結合組織細胞群になる。これらの結合組織細胞は、哺乳動物宿主の骨の欠損領域を標的として移植され、続いて欠損部位内でタンパク質又はタンパク質フラグメントの効果的な発現が起こる。この興味のあるDNA配列の発現は、骨折あるいは骨の欠損の修復に大いに有用である。
【0098】
具体的に、この方法は、形質転換成長因子-βスーパーファミリーのメンバーあるいは生物学的に活性のある誘導体若しくはその断片、選択可能なマーカーあるいは生物学的に活性のある誘導体若しくはその断片をコードすることができる遺伝子を使用することを含む。
【0099】
さらに本発明の実施例は、少なくとも一つの形質転換成長因子-βスーパーファミリーのメンバーあるいは生物学的に活性のある誘導体若しくはその断片をコードできる遺伝子の使用、そしてどのようなDNAプラスミドベクターも本方法の導入方法が利用できることは言うまでもないが、導入された標的細胞あるいは組織を安定して維持する能力を持つ、通常の技術をもつ当業者に公知のいかなるDNAプラスミドベクターを使用することを含む。
【0100】
本発明のもうひとつの実施例は、哺乳動物宿主の治療に用いることを目的として、産物をコードする少なくとも一つの遺伝子を結合組織細胞の少なくとも一つの細胞に導入する方法についても提供するものである。この方法は、ある産物をコードする遺伝子を結合組織細胞へ導入するのに非ウィルスによる手段を用いた方法の使用を含むものである。具体的には、本方法は以下のものを含む。リポソームの封入、リン酸カルシウムによる共沈、電気穿孔法、DEAE-デキストランによる媒介、そして形質転換成長因子-βスーパーファミリーのメンバーあるいは生物学的な活性をもつその誘導体又はその断片、そして選択可能なマーカーあるいは生物学的な活性をもつその誘導体又はその断片などをコードすることが可能な遺伝子を使用することを含む。
【0101】
本発明のもうひとつの実施例は、哺乳動物宿主の治療に用いられために産物をコードする少なくとも一つの遺伝子を、結合組織細胞の少なくとも一つの細胞へ導入する付加的な方法を提供するものである。この付加的な方法は、標的細胞あるいは組織へDNAベクター分子を輸送するためのウイルスを利用する生物学的な手法を含む。好ましくは、そのウィルスは偽ウィルス、つまり自身の複製能力はなく輸送する能力のみをもち、標的細胞内で安定して維持できるようなものにゲノムを置き換えたものである。その置き換えられたウィルスのゲノムは、興味のある異種の遺伝子を標的細胞内あるいは組織内で発現しうるものを含むDNAベクター分子として機能するように、ウィルスゲノムを組換えDNA技術によってさらに操作したものである。
【0102】
本発明の具体的な実施例は、この明細書の中で開示されたex vivo技術によるレトロウィルスベクターを通して哺乳動物宿主の結合組織にTGF-β遺伝子を郵送することによってTGF-βタンパク質を標的欠損領域に輸送することである。言い換えると、機能的なTGF- βタンパク質あるいはタンパク質の断片をコードする興味のあるDNA配列は、選ばれたレトロウィルスベクターにサブクローニングされ、その組換えウィルスベクターは、適当なタイターで増殖し、in vitroで培養された結合組織細胞に感染するのに用いられる。そして導入された結合組織細胞は、好ましくは自家移植細胞とであり、骨欠損領域あるいは治療的に効果があるその近辺に移植する。
【0103】
発明で他に用いられる方法は、アデノウィルスベクター、アデノ随伴ウィルス(AAV)ベクター、ヘルペスシンプレックスウィルス(HSV)のいずれかを用いて哺乳動物宿主の結合組織細胞へTGF-βスーパーファミリーの遺伝子を直接in vivoで導入する方法を含むものである。言い換えると、機能的なTGF-βタンパク質あるいはタンパク質断片をコードする興味あるDNA配列をそれぞれのウィルスベクターにサブクローニングする。それからウィルスベクターを含むTGF-βを、適当なタイターで増殖させ、骨欠損領域あるいは骨形成に効果のある領域の近辺に導入することである。
【0104】
関節の標的結合組織へDNA分子を存在させる方法は、これに限定されるものではないが、カチオンリポソームへのDNA分子封入、興味のあるDNA配列をレトロウィルスあるいはプラスミドベクターへサブクローニングすること、あるいはDNA分子そのものを直接骨欠損領域あるいは骨形成に効果のある領域の近辺に導入するものを含む。DNA分子はDNAベクター分子つまり、組換えウィルスDNAベクター分子あるいは組換えDNAプラスミドベクター分子として存在することが望ましい。興味ある異種遺伝子の発現は、異種遺伝子のコード領域の上流に真核生物でのプロモーター活性のある断片を挿入することにより確実にできる。DNA分子を結合組織に導入により連続的な発現レベルを適切に確実にするためのベクターのコンストラクトは、公知の戦略及び技術であり、当業者の通常の技術のひとつである。
【0105】
レトロウイルスが効果的に結合組織細胞へ感染および導入されるのに必要とされる細胞分裂によってリポソームの使用が限定されないことは、当業者に理解されるものである。上述に記載された非ウィルスの使用は、TGF-βスーパーファミリーに属している遺伝子および抗生物質耐性遺伝子のような選択マーカー遺伝子をコードする可能な遺伝子を使用することを含むものである。
【0106】
本発明の別の実施例としては、細胞への導入前の結合組織細胞の保存が含まれる。結合組織細胞は液体窒素中において10%DMSOで凍結保存されうることは当業者に理解されるものである。
【0107】
発明者はBMP-2を発現するコンストラクトを導入した安定した繊維芽細胞系統を作製した。これらのBMP-2産生細胞は長期に渡って、in vivoで高濃度の活性のあるBMP-2を保持できる。
【0108】
骨粗鬆症による骨折の治療
【0109】
骨粗鬆症は骨量低下による骨格構造の劣化である。それは、骨形成と骨吸収のバランスが崩れることにより引き起こされる。例えば、骨形成期に吸収が支配的になることによって、骨の荷重負担能力が減少する影響がでる。健康な成人において、骨の形成と吸収の割合は、骨新生の維持のためにしっかりと協調して行われている。しかし骨粗鬆症において、骨の再形成のサイクルにおけるバランスが失われていることにより、骨量の低下および骨の連続した微細構造上の欠損が形成される。一連の骨の再構成の混乱により、これらの骨の欠損が蓄積し、骨の構造的な整合性が著しく損なわれ、骨折が起こりそうな最終段階に到達する。このバランスが失われることは、個人レベルの多くにおいて年齢に伴って次第に起こるものであるが(老人性骨粗鬆症)、女性の閉経後において、それよりもっと重篤で、急速な進行がみられる。さらに、骨粗鬆症は栄養上および内分泌のバランス上、遺伝性疾患および多くの悪性腫瘍の結果生じる可能性もある。
【0110】
本発明の目的は、骨折に苦しむ、例えば骨格骨量の減少により苦しむ病気、特に骨のリモデリングのアンバランスが引き起こす病気の患者の骨再生のための方法及び組成物を開発することである。もう一つは、骨代謝の疾病を含むような、骨の病気に苦しむ子供の骨折を修復するために、骨成長を増強するのが目的ある。また別の目的としては、閉経後の女性、老人、糖尿病を患っている患者を含む、骨量の低下の危険におかれている人の骨折の修復である。さらに別の目的は、骨折の修復を含む骨の微細構造上の欠損によって、骨が構造上損なわれており、それを修復するための方法及び組成物を提供するものである。このことは、本発明が骨形成を刺激し、骨量を増加させることを目的とするもので、それに伴って発症時期を遅らせるものであり、特に骨の構造上の劣化によって生じた新たな骨折の出現を減少させるものである。
【0111】
ラットの骨粗鬆症モデルでの骨折後初期の段階での骨の修復が研究されており、Namkung-Matthai et al., Bone, 28:80-86 (2001)で開示されている。初期は、骨折後3から6週間以内と示されている。同様に、ラットの骨粗鬆症モデルでの骨折後後期の骨の修復が研究されており、Kubo et al., Steroid Biochemistry & Molecular Biology, 68:197-202 (1999)で開示されている。後期は、骨折後およそ12週と示されている。これらの公開されている骨粗鬆症のラットモデルおよび骨粗鬆症の骨折の参照データなどは本発明の参照として全体に組み込まれる。
【0112】
本発明のもう一つの特徴として、本発明に従って骨折あるいは切断部位あるいはその周囲へ遺伝学的に改良した細胞を投与することにより、脊椎動物(例えば哺乳動物)における骨の移植を強化する方法を意図している
【0113】
骨折治癒アッセイ(fracture healing assay)は、骨折技術、組織学的解析、生体力学的解析を含んでおり、当業者に知られている。そしてそれは例えば、米国特許第 6,521,750号に記述があり、骨折の引き起こし方および骨折の伸展の測定方法および修復の過程、とりわけ骨粗鬆症を対象とするものにおいて実験手順で明らかにされているものは、その全体が参照に組み込まれるものとする。
【0114】
活性成分つまりTGF-βタンパク質は、賦形剤の希釈剤のような担体と一般的に組み合わせられる。賦形剤は、充填剤(fillers)、伸展剤(extenders)、つなぎ(bindings)、湿潤剤(wetting agents)、崩壊剤(disintegrants)、界面活性剤(surface active agents)、生分解性ポリマー(erodable polymers)あるいは潤滑剤(lubricants)を含む可能性があり、投与様式および剤形の性質に依存する。典型的な剤形は、粉、液体製剤(懸濁液を含む)、エマルジョン、糖、カプセルを含む。
【0115】
薬剤的に許容される担体のその他の例には、種々の陽イオン脂質があり、N-(1-2,3-dioleyloxy)propyl)-n,n,n-trimethylammonium chloride (DOTMA) やdioleoylphophotidyl ethanolamine (DOPE)を含むが、これらに限定されるものではない。リポソームは、本発明のTGFタンパク質分子にとっても適合する担体である。別の適合する担体には、スローリリースゲル(slow-release gel)あるいは、TGF-βタンパク質分子を含むポリマーがある。
【0116】
TGF-βタンパク質は、生理的食塩水やその他の適合する液体のような生理学的に容認される担体又は希釈剤の量と混合する。TGF-βタンパク質分子は、TGF-βタンパク質および生物学的に活性のある形態をその標的となる場所へ到達するまで、及び/又は組織の障壁を乗り越えてTGF-βタンパク質あるいは生物学的に活性のある形態になるまで、分解から保護する目的でその他の担体と組み合わせられることもある。
【0117】
脊椎固定術のための遺伝子治療
【0118】
本発明は、椎骨が固定されることが望まれる脊椎の領域へ本発明の組成物を投与することにより、標的となる脊椎のある椎骨を固定する方法を意図する。骨形成に効果的な量を、形質転換あるいはトランスフェクションした結合組織細胞(例えば、繊維芽細胞あるいは骨芽前駆細胞)を欠損領域あるいは骨形成に効果的な領域に接触させる。そしてその一回の注射あるいは複数回の注射(これは実施者に最適化されるものである)によって、標的の椎骨の固定に帰結するものである。
【0119】
脊椎は円柱状の骨(椎骨)が互いにその上に積み重なっているものであり、クッションとなる円盤(椎間板)がそれらの間に挟まっている。この脊柱の中央部には、脊髄がある。脊髄神経は、脊髄から生じ、椎体の間の空間を通って脊椎を出る。 隆起板又は椎間板ヘルニアは外部へのびている脊椎神経を圧迫する可能性がある。不安定な脊柱は骨を互いに滑らせ擦らせるので、腰痛および神経損傷の可能性の原因となる。怪我や変性疾患による脊柱の骨および板の変化は、腰痛や時には神経損傷の原因となりうる。
【0120】
脊椎固定手術は、重度の脊椎の不安定性を持つ人(異常な移動性)、過剰な移動を伴う重度の椎間板の変性疾患、脊椎すべり症(別の脊椎の上でもう一つの脊椎のすべり)、他の治療法では反応しなかった椎間関節突起(関節)の疾患、または骨折あるいは腫瘍の人に対して一般に行われる。脊椎固定治療に最も候補は、板がとても異常であり椎骨間のスペースが50%以上崩壊している、又は周囲に刺激を与えるように崩壊している患者である。
【0121】
骨の接ぎ木および移植片は脊椎固定手術の間、安定性を増大させるために用いられる。椎間板の一部が取り除かれた後、脊椎骨は削られ、移植を受け入れるように形づくられる。時間が経過するにつれ、移植片は脊椎骨の互いに隣接した面において融合する。骨が融合すると、椎骨はもはや別々に動かない。このことにより、脊柱はより安定化する。典型的なものとして、スクリュー、プレート、ケージ、メタルロッド、およびその他の脊椎固定術における移植片は、安定性を増大させるためにも用いられる。
【0122】
治療用組成物
【0123】
本発明のもう一つの実施例として、予防的にあるいは治療上効果のある量において患者に非経口投与される化合物は、TGF-βスーパーファミリー遺伝子を収納した結合組織細胞および適切な薬理的担体を含むものである。
【0124】
治療への応用において、TGF-βスーパーファミリーのメンバーをコードする遺伝子を収納した結合組織細胞は、局所への投与のために製剤化される可能性がある。本発明において、結合組織細胞は一般的に以下のような賦形剤の希釈液のような担体と組み合わされる可能性がある。充填剤(fillers)、伸展剤(extenders)、つなぎ(bindings)、湿潤剤(wetting agents)、崩壊剤(disintegrants)、界面活性剤(surface active agents)、生分解性ポリマー(erodable polymers)あるいは潤滑剤(lubricants)、これらは、投与様式および剤形の性質に依存する。
【0125】
注入使用に適切な薬剤形には、滅菌水溶液(水溶性)または分散液、および滅菌注射液または分散媒の用時調製用の滅菌粉末が含まれる。常に剤形は滅菌され、容易に注入できる範囲の液体でなければならない。剤形は、製造および保存条件下で安定であり、細菌や真菌類のような微生物による汚染作用から保護しなければならない。キャリアは、溶媒または分散媒で、例えば、水、エタノール、ポリオール(例:グレセロール、プロピレングリコール、および液体ポリエチレングリコール、および類似物)、それらの適当な混合液、および植物油を含むものであってよい。適切な流動性は、例えば、レシチンによる被覆、分散液に必要な粒子サイズの維持、および界面活性剤の使用により維持することができる。様々な抗菌剤および抗真菌剤、例えば、クロロブタノール、フェノール、ソルビン酸、theomersalおよび類似物によって、微生物の作用を防ぐことができる。多くの場合、糖または塩化ナトリウムのような等張剤を含むことが好ましい。注入可能な組成は、モノステアリン酸アルミニウムおよびゼラチンなど吸収遅延成分の使用により、長期間吸収させることができる。
【0126】
服用の容易性および投与量の均一性を考慮して、投与ユニット剤型に非経口組成を処方することは特に有益である。本発明で使用する投与ユニット剤型とは、治療する哺乳動物の単位投与量として適切な物理的に個別のユニットを示す。つまり、各ユニットには、前もって定量した有効成分量を含んでおり、その量は、必要な薬剤的キャリアに関連して必要な治療作用を生み出すように計算されている。本発明の投与ユニット剤型の明細は、(a) 有効成分と得られる特有な治療作用の特有な性質、(b) 疾病状態にある、つまり健康障害を持つ被験生体の治療に有効な成分を混合する当分野の技術の限界、によって決定され、直接依存する。
【0127】
活性のある主成分は、簡便かつ効果的な投与にとって、投薬単位形式において薬理的に適合した担体で効果的な投与量が調合される。補助的な活性成分を含んでいる組成物の場合には、投与量は前述の成分の投与の様式および通常の投与量を参照して決定される。
【0128】
導入システム
【0129】
色々なデリバリーシステムが知られており、本発明の組成を投与するのに用いることができる。例えば、リポソームによるカプセル化、微粒子、微カプセル、化合物の発現可能な組換え細胞、受容体介在エンドサイトーシス、レトロウイルスまたは他のベクターの一部として核酸の構築などである、また他の生物学的に活性のある薬剤と共に投与される可能性がある。投与は全身的かもしれないしあるいは局所的かもしれない。
【0130】
特定な実施形態において、治療を要する領域に局所的に、本発明の薬剤物質または組成を投与することが望ましい。この局所投与は、例えば、手術中の局所輸注、座薬、または移植(すなわちsialastic 膜あるいはファイバーなどの膜を含む、多孔、非多孔、またはゼラチン材質の当該インプラント)によって達成することができる。
【0131】
本発明は、ここで説明する特定な実施形態の範囲だけに限定されない。事実、ここの説明に追加された本発明の色々な変更は、前述の説明と添付の図から、これらの当技術分野の専門家には明確になるであろう。このような変更は、付録の請求範囲内に含むことが意図されている。以下の実施例は、本発明を図解することによって提供されるが、それだけに限定されない。
【実施例1】
【0132】
骨再生の実験の手順
【0133】
ヒトBMP-2遺伝子はヒトの胎児の脳のcDNAから二つのプライマーを用いてPCR(ポリメラーゼ連鎖反応)によってクローン化されたものであった。5' プライマーは 5'-TCCCAGCGTGAAAAGAGAGACTGC-3' (SEQ ID NO:1) そして 3' プライマーは 5'-TTTTGCTGTACTAGCGACACCCACAACC-3' (SEQ ID NO:2)であった。GC-rich PCR system(Roche社)によるPCRの後、TOPO TA cloning kit (Invitrogen社) を用いてpCRII-TOPO ベクターにクローニングを行った(図 1A)。レトロウィルスベクターにクローニングを行う際、pCRIIbmp2DNAは、Sal I および Not Iで切断を行った。ヒトBMP-2cDNAの挿入断片(-1.2kb)は、Sal I および Not I 突出があるpMTMLVにライゲーションした(図 1B)。トランスフェクションの前、パッケージング細胞系統であるGP-293細胞(5 x 105 cells/p60mm培養皿)を一日培養した。pMTMLV あるいは pMT-BMP2 は、Fugene (Roche社)を用いてGP-293 細胞へのトランフェクションを行った。トランスフェクション後、48時間において、ネオマイシン耐性細胞を選別するために培養液にネオマイシンを加えた。選別は10日継続して行った。選別された293MT および 293MTBMP2 細胞 (5 x 105 cells/p60mm培養皿)は、エンベロープコードプラスミドpVSVGを翌日トランスフェクションするために培養された。トランスフェクション後、24時間で、標的の細胞であるNIH3T3に感染させるため、プレートに播かれた(1 x 105 cells/p60mm培養皿)。トランスフェクションした細胞の上清は、トランスフェクション後48時間で、低タンパク質結合フィルター(0.45mm)を通して、同量のDMEMで希釈した。NIH3T3の培養液は取り除かれ、フィルターを通した上清で置き換えられた。ポリブレンは終濃度が8μg/mlとなるように加えられた。感染後、二日目にNIH3T3-neo および NIH3T3-BMP-2 細胞の安定化した細胞系統を得るために、ネオマイシンによる選別を行った。選別は10日間継続して行った。産生したBMP2の量は24時間後におよそ150 ng/105 cellsであると決定された。
【実施例2】
【0134】
ラビットへのNIH3T3-BMP-2細胞の注射
【0135】
動物実験に使用する体重2.0 - 2.5 kg のニュージーランドホワイトラビットを選別した。整形外科用の器具で脛骨を露出し、長さ2cm深さ0.5cmの損傷を与えた。コントロールNIH3T3-neo又は NIH3T3-BMP-2 細胞 (2ml of 2 x 106 cells/ml) のいずれかを縫合後の欠損領域に注射した。細胞注射後8週間目において、X線撮影による解析および組織学的な検査を行った。
【実施例3】
【0136】
週ごとのX線撮影検査
【0137】
動物実験に使用する体重2.0 - 2.5 kg のニュージーランドホワイトラビットを選別した。整形外科用の器具で脛骨を露出し、長さ2cm深さ0.5cmの損傷を与えた。NIH3T3-BMP-2 細胞 (2ml of 2 x 106 cells/ml) のを縫合後の欠損領域に注射した。それから、細胞を注射後1、2、3、4、5、6、7週目にX線撮影による解析を行った。注射後7週間目に検体を回収し、写真撮影を行った。組織学的な検査は回収後に行った。
【0138】
図2A-2Fは、NIH3T3-BMP-2 繊維芽細胞での骨の再生を示す。図 1A および1B は、コントロール NIH3T3 繊維芽細胞 (A)およびNIH3T3-BMP-2 細胞 (B)を注射後8週間目の足の骨の写真を示す。図 2C-2F は、実験動物を屠殺する前のコントロール (C と D) および 実験を行った (E と F) の足の骨のX線写真撮影検査を示したものである。BMP-2タンパク質を発現している細胞で処理した欠損領域の骨は、注射後8週間目で治癒した。一方、コントロールの繊維芽細胞を注射した欠損領域では、治癒は見られず、骨の再生は起こらなかった。
【0139】
図3A-3Dは、再生した骨組織の組織学的な実験を示すものである。再生した骨組織のパラフィン切片を作製し、マッソン・トリクローム染色をした。その結果、再生した骨の組織(RB)の構造は、正常な骨の組織(NB)とほぼ同質であることが示された。図3Aおよび図3Bは低倍率(40x)、図3Cおよび3Dは高倍率(100x)で示すものである。点線は再生した骨と正常な骨の境界線を示すものである。これらの結果は、再生した骨は正常な骨と同質のものであることを示唆する。
【0140】
図4A-4Iは、NIH3T3-hBMP-2繊維芽細胞による骨の再生を示すものである。NIH3T3-BMP-2細胞(2x106 cell/mlを2ml)を縫合後の脛骨における欠損部位に注射した。(AからG)細胞を注射してから1、2、3、4、5、6、そして7週間目において、X線写真による解析を行った。この結果は、細胞の注射後3週間で、欠損した骨は新たに産生された骨組織で満たされ始め、注射後6週間目で完全に満たされたことを示す。(H)検体は、注射後7週間で回収し写真を撮影した。この写真は、また再生骨細胞組織で欠損部位が満たされていることを示す。(I)組織学的な解析は回収後に行った。そのマッソン・トリクローム染色の結果を示す。修復された骨組織は正常な骨組織と同じ特徴を持つものであることが染色の結果から示唆される。
【0141】
図5A-5Iは、コントロールDMEM培養液による骨再生を示すものである。コントロールDMEM培養液(2ml)を縫合後の脛骨における欠損部位に注射した。(AからG)培養液を注射してから1日、1、2、3、4、5、そして6週間目において、X線写真による解析を行った。この結果、NIH3T3-hBMP-2繊維芽細胞のデータとは対照的に、細胞注射後6週間であっても欠損が完全に満たされないことが示されている。(H)検体は、注射後6週間で回収し、写真を撮影した。この写真は欠損が完全に満たされていないことをも示す。(I)組織学的な解析は回収後に行った。そのマッソン・トリクローム染色の結果を示す。
【実施例4】
【0142】
骨粗鬆症ラットへのNIH3T3-BMP-2 細胞の注射
【0143】
骨粗鬆症モデルラットは、"Kubo et al., Steroid Biochemistry & Molecular Biology, 68:197-202, 1999; and Namkung-Matthai et al., Bone, 28:80-86, 2001 "で明らかにされているものを用いた。整形外科用の器具で脛骨を露出し、欠損部位(長さ2cm深さ0.5cm)を与えた。コントロールNIH3T3-neo あるいはNIH3T3-BMP-2 細胞 (2ml of 2 x 106 cells/ml) のいずれかを縫合後の欠損領域に注射した。数週間の間隔をあけて、特に細胞注射後およそ8週間目で、X線写真撮影解析および組織学的な検査を行った。
【実施例5】
【0144】
脊椎固定術の実験手順
【0145】
ヒトBMP-2は実施例1で記載したとおり、NIH3T3にクローン化し、トランスフェクションを行ったものである。ヒト由来の接着性の繊維芽細胞(第1段階にある細胞系統由来の包皮繊維芽細胞)、マウス(第1段階のNIH3T3)、ラット(第2段階の繊維芽細胞由来のルイスラット偽関節繊維性組織(Lewis rat pseudarthrosis fibrous tissue))及びヒト(第2段階の繊維芽細胞由来の偽関節繊維性/瘢痕組織(pseudarthrosis fibrous/scar tissue))は、別々に培養し、レトロウィルスを介してBMP-2をトランスフェクションした。細胞は熱ショックで非働化した10%胎児ウシ血清 (Gibco BRL社, Grand Island, New York)、ペニシリンおよびストレプトマイシン(CellGro社, Herndon, Virginia)を加えたDulbecco´s Modified Eagle´s Medium (Cellgro社, Herndon, Virginia)を用いて、60mm培養皿で成長させた。レトロウィルスーBMP2あるいはレトロウィルスーlacZ(ネガティブコントロール)を一日あたり4時間で二日間繊維芽細胞に感染させた。ELISAは発現したタンパク質の濃度(ng/ml)を決定するのに用いられた。それぞれの種において、5 x 106, 10 x 106, 20 x 106 の量のBMP-2 産生細胞は、1 x 0.5 cm のコラーゲン止血スポンジ(collagen hemostatic sponge) (ACS, Helistat, Integra LifeSciences, Plainsboro, NJ)の上に吸収された。0.16-0.18 mg/mlのrhBMP-2 (Genetics Institute, Cambridge, MA) は 1 x 0.5 cm ACS (positive control)の上に吸収された。細片化した腸骨稜の骨は固定部位に置いた。
【実施例6】
【0146】
ラットの脊椎への細胞の注射
【0147】
48匹の成体(3-4ヶ月)の雌で無胸腺のrnu/rnuラットが利用された(24匹:第1段階、24匹:第2段階)。ラットを麻酔した。後方の正中線(posterior midline)へのアプローチにはL4およびL5の横突起(transverse process)を露出して用いた。高速のバー(burr)は、横突起(transverse process)を切断するときにのみ用いた。その部位は洗浄(抗生物質を含んだリンゲル液)した。細胞/ACSはL4とL5の横突起間に移植された。その後、切開部は閉じた。X線撮影は屠殺するまで週2回行った。L4-L5の部分は手での触診を行った。横突起(transverse process)の間の移動を感じたら、固定に失敗したと考えた。組織学的な解析には非脱灰標本を用いた。
【0148】
図6Aおよび6Bは、吸収性のコラーゲンスポンジ(ACS)担体を用いて後方侵入椎体間固定術により細胞を移植した後の、4週目と6週目のラットTG001のX線写真を示す。X線写真の左側のつながった骨は、後方侵入椎体間固定術により5x106のBMP-2のcDNAが導入されたマウス繊維芽細胞であり、円く囲まれている。右側よりも細胞数が少なく、骨形成が少ないことを強調する。示したとおり、骨は産生され、脊椎固定が起こっている。
【0149】
ここで引用された全ての参照は、全体として参照に組み込まれる。
【0150】
本発明の特別の実施例は説明の目的のために上述したものであり、添付した請求項の中で定義されるような発明から外れないように、本発明の詳細の多くのバリエーションが作られるかもしれないことは、当業者にとって明らかである。
【特許請求の範囲】
【請求項1】
TGF-βスーパーファミリータンパク質をコードする遺伝子が挿入された組換えベクターで、トランスフェクションあるいは形質導入された軟骨細胞を有効成分として含み、該細胞を低骨量の骨欠損部位に移植することを特徴とする骨を形成するための治療用組成物。
【請求項2】
ベクターがレトロウィルスベクター又はプラスミドベクターである請求項1に記載の組成物。
【請求項3】
TGF-βスーパーファミリータンパク質がBMPである請求項1又は2に記載の組成物。
【請求項4】
BMPがBMP-2である請求項3に記載の組成物。
【請求項5】
骨が初期又は後期に産生される骨である請求項1〜4のいずれか一に記載の組成物。
【請求項6】
TGF-βスーパーファミリータンパク質をコードする遺伝子が挿入された組換えベクターで、トランスフェクションあるいは形質導入された軟骨細胞並びに薬剤的に容認された担体を含む、脊椎固定用組成物。
【請求項7】
ベクターがレトロウィルスベクター又はプラスミドベクターである請求項6に記載の組成物。
【請求項8】
TGF-βスーパーファミリータンパク質がBMPである請求項6又は7に記載の組成物。
【請求項9】
BMPがBMP-2である請求項8に記載の組成物。
【請求項10】
TGF-βスーパーファミリータンパク質をコードする遺伝子が挿入された組換えベクターで、トランスフェクションあるいは形質導入された軟骨細胞を有効成分として含み、該細胞を骨折部位に導入することを特徴とする骨粗鬆症の骨折治療用組成物。
【請求項11】
ベクターがレトロウィルスベクター又はプラスミドベクターである請求項10に記載の組成物。
【請求項12】
TGF-βスーパーファミリータンパク質がBMPである請求項10又は11に記載の組成物。
【請求項13】
BMPがBMP-2である請求項12に記載の組成物。
【請求項14】
骨が初期又は後期に産生される骨である請求項10〜13のいずれか一に記載の組成物。
【請求項1】
TGF-βスーパーファミリータンパク質をコードする遺伝子が挿入された組換えベクターで、トランスフェクションあるいは形質導入された軟骨細胞を有効成分として含み、該細胞を低骨量の骨欠損部位に移植することを特徴とする骨を形成するための治療用組成物。
【請求項2】
ベクターがレトロウィルスベクター又はプラスミドベクターである請求項1に記載の組成物。
【請求項3】
TGF-βスーパーファミリータンパク質がBMPである請求項1又は2に記載の組成物。
【請求項4】
BMPがBMP-2である請求項3に記載の組成物。
【請求項5】
骨が初期又は後期に産生される骨である請求項1〜4のいずれか一に記載の組成物。
【請求項6】
TGF-βスーパーファミリータンパク質をコードする遺伝子が挿入された組換えベクターで、トランスフェクションあるいは形質導入された軟骨細胞並びに薬剤的に容認された担体を含む、脊椎固定用組成物。
【請求項7】
ベクターがレトロウィルスベクター又はプラスミドベクターである請求項6に記載の組成物。
【請求項8】
TGF-βスーパーファミリータンパク質がBMPである請求項6又は7に記載の組成物。
【請求項9】
BMPがBMP-2である請求項8に記載の組成物。
【請求項10】
TGF-βスーパーファミリータンパク質をコードする遺伝子が挿入された組換えベクターで、トランスフェクションあるいは形質導入された軟骨細胞を有効成分として含み、該細胞を骨折部位に導入することを特徴とする骨粗鬆症の骨折治療用組成物。
【請求項11】
ベクターがレトロウィルスベクター又はプラスミドベクターである請求項10に記載の組成物。
【請求項12】
TGF-βスーパーファミリータンパク質がBMPである請求項10又は11に記載の組成物。
【請求項13】
BMPがBMP-2である請求項12に記載の組成物。
【請求項14】
骨が初期又は後期に産生される骨である請求項10〜13のいずれか一に記載の組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−69327(P2010−69327A)
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願番号】特願2009−298034(P2009−298034)
【出願日】平成21年12月28日(2009.12.28)
【分割の表示】特願2003−580515(P2003−580515)の分割
【原出願日】平成15年3月28日(2003.3.28)
【出願人】(504346352)ティシュージーン,インク (6)
【Fターム(参考)】
【公開日】平成22年4月2日(2010.4.2)
【国際特許分類】
【出願日】平成21年12月28日(2009.12.28)
【分割の表示】特願2003−580515(P2003−580515)の分割
【原出願日】平成15年3月28日(2003.3.28)
【出願人】(504346352)ティシュージーン,インク (6)
【Fターム(参考)】
[ Back to top ]

