遺伝子治療ベクターおよびシトシンデアミナーゼ
本開示は、改変されたシトシンデアミナーゼ(CD)を提供する。本開示は、さらに、該改変されたCDを発現するかまたはそれを含む細胞およびベクターに関し、かつ疾患および障害の治療で該改変されたCDを使用する方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願への相互参照
本出願は、2008年9月26日出願の米国仮出願第61/100,666号、2008年12月8日出願の米国仮出願第61/120,618号、および2009年6月13日出願の米国仮出願第61/186,823号への優先権を主張する。該文献の開示内容は参照によりここに組み入れられる。
【0002】
技術分野
本開示は、改変されたシトシンデアミナーゼ(CD)に関する。該開示は、さらに、該改変されたCDを発現する細胞、および疾患および障害の治療で該改変されたCDを使用する方法に関する。
【背景技術】
【0003】
背景
酵母、または細菌、のシトシンデアミナーゼは、無害の抗生物質プロドラッグ5-FCを細胞傷害性化学療法剤5-フルオロウラシル(5-FU)に変換する。ヒト(および哺乳類一般)が、顕著なシトシンデアミナーゼ活性を有する酵素をコードする天然に存在する遺伝子を有することは知られていない。酵母および細菌のシトシンデアミナーゼは、酵素の送達およびその後の、該酵素によって細胞傷害性薬物に変換される5-FCでの治療のための遺伝子送達およびウイルスベクターを使用する癌の治療において評価を得ている(Miller et al., Can Res 62:773-780 2002; Kievit et al., Can Res 59:1417-1421 1999)。
【発明の概要】
【課題を解決するための手段】
【0004】
要旨
本発明では、5-FCを5-FUに変換するポリペプチドを提供する。また、該ポリペプチドをコードする核酸分子、該ポリペプチドを発現する細胞、該ポリヌクレオチドを含むベクター、およびポリペプチド、ならびに該ポリペプチドの好適な使用から5-FUまたはその誘導体を合成する方法を提供する。したがって、種々の実施形態では、配列番号2に記載の配列を有するシトシンデアミナーゼを含む、単離された、または組換えポリペプチドを提供する。他の実施形態では、該ポリペプチドは、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含む。さらに別の実施形態では、該ポリペプチドは、配列番号4に記載の配列を含み、残基: (a) 23、108および140を除いて、50、25、10、または5個までの保存的アミノ酸置換を含む。一般に、本明細書中で提供されるポリペプチドは、5-FCを5-FUに変換するために有用なシトシンデアミナーゼ活性を示す。
【0005】
本開示はまた、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含むポリペプチドであって、23位のロイシン、108位のイソロイシン、および140位のロイシンを有し、かつシトシンデアミナーゼ活性を有するポリペプチドを提供する。さらに別の実施形態では、該ポリペプチドは、配列番号4に記載の配列を含む。
【0006】
本開示は、さらに、ウラシルホスホリボシルトランスフェラーゼ(UPRT)またはオロト酸ホスホリボシルトランスフェラーゼ(OPRT)に作動可能に連結された前記ポリペプチドのいずれか1つを含む融合構築物を提供する。一実施形態では、該融合構築物は、UPRTまたはOPRT活性を有する第2のポリペプチドに連結された、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含む第1のポリペプチドを含む。さらに別の実施形態では、融合構築物は、配列番号4に記載の配列を有する第1のポリペプチドを含み、かつ残基: 23、108および140を除く、50、25、10、または5個までの保存的アミノ酸置換を含み、ここに該第1のポリペプチドは、UPRTまたはOPRT活性を有する第2のポリペプチドに連結されている。本開示はまた、シトシンデアミナーゼ活性を有しかつ、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含む第1のポリペプチドを含み、ここに該ポリペプチドは、23位のロイシン、108位のイソロイシンおよび140位のロイシンを有し、かつ該第1のポリペプチドは、UPRTまたはOPRT活性を含む第2のポリペプチドに連結されている、融合構築物を提供する。一実施形態では、UPRTまたはOPRT活性を有するポリペプチドは、それぞれ、配列番号8および10に記載の配列またはそれらの変異体を含む。さらに別の実施形態では、シトシンデアミナーゼ活性を含む第1のポリペプチドは、UPRTまたはOPRT活性を有するポリペプチドに連結され、ここに該ポリペプチドはペプチドリンカーによって分離されている。別の実施形態では、該融合構築物は、配列番号12、14、16または18からなる群から選択される配列を含む。
本開示は、さらに、前記ポリペプチドのいずれかをコードするポリヌクレオチドを提供する。例えば、本開示は、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含むポリペプチドをコードするポリヌクレオチドを提供する。さらに別の実施形態では、該ポリヌクレオチドは、配列番号4に記載の配列を含みかつ残基: (a) 23、108および140を除いて、50、25、10、または5個までの保存的アミノ酸置換を含むポリペプチドをコードする。さらなる実施形態では、本開示は、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含むポリペプチドであって、23位のロイシン、108位のイソロイシン、および140位のロイシンを有し、かつシトシンデアミナーゼ活性を有するポリペプチドをコードするポリヌクレオチドを提供する。さらに別の実施形態では、該ポリヌクレオチドは、配列番号4を含むポリペプチドをコードする。さらなる実施形態では、該ポリヌクレオチドは、配列番号4、6、8、10、11、12、または13に記載の配列を含むポリペプチドをコードする。
【0007】
本開示は、シトシンデアミナーゼをコードするヒトコドン最適化ポリヌクレオチドを提供する。一実施形態では、該ヒトコドン最適化ポリヌクレオチドは、配列番号3に記載の配列を含む。さらに別の実施形態では、該ポリヌクレオチドは、配列番号5、7、または9に記載の配列を含む。
【0008】
他の実施形態では、本開示のシトシンデアミナーゼまたは融合構築物は、遺伝子送達システム(GDS)を使用して送達される。別の態様では、シトシンデアミナーゼをコードするポリヌクレオチドを、ウイルスベクターまたはウイルス派生ベクターであるGDSで送達する。該ウイルスベクターは複製可能または複製不能であってよく、アデノウイルスベクター、麻疹ベクター、ヘルペスベクター、レトロウイルスベクター(レンチウイルスベクターを含む)、ラブドウイルスベクター、例えば水疱性口内炎ウイルスベクター、レオウイルスベクター、セネカバレーウイルス(Seneca Valley Virus)ベクター、ポックスウイルスベクター(動物痘またはワクシニア由来ベクターを含む)、パルボウイルスベクター(AAVベクターを含む)、アルファウイルスベクターまたは当業者に公知の他のウイルスベクターであってよい。一実施形態では、ウイルスベクターは、複製中の哺乳類細胞に感染可能な複製適合性(competent)レトロウイルスベクターであってよい。複製適合性レトロウイルスベクターは、オルソレトロウイルスまたは、より典型的には、ガンマレトロウイルスベクターを含んでよい。一態様では、複製適合性レトロウイルスベクターは、本開示のシトシンデアミナーゼをコードするポリヌクレオチドの5’側に内部リボソーム侵入部位(IRES)を含む。一実施形態では、シトシンデアミナーゼをコードするポリヌクレオチドはレトロウイルスベクターのENVポリヌクレオチドの3'側にある。
【0009】
他の実施形態では、本開示のシトシンデアミナーゼまたは融合構築物、または本開示のポリヌクレオチドまたは融合構築物を含むベクターでトランスフェクトされた宿主細胞を提供する。宿主細胞には、真核細胞、例えば酵母細胞、昆虫細胞、または動物細胞が含まれる。宿主細胞にはまた、原核細胞、例えば細菌細胞も含まれる。
【0010】
本開示はまた、癌を含む細胞増殖性障害を治療する方法であって、本開示のポリヌクレオチドまたはポリペプチドを被験体に投与するステップ、および5-フルオロシトシン(5-FC)を含む細胞傷害性薬物と被験体を接触させるステップを含む方法を提供する。
【0011】
本開示は、レトロウイルスGAGタンパク質; レトロウイルスPOLタンパク質; レトロウイルスエンベロープ; レトロウイルスポリヌクレオチド配列の3'末端の長末端反復(LTR)配列、哺乳類細胞での発現に好適な、レトロウイルスポリヌクレオチドの5'末端のプロモーター配列、gag核酸ドメイン、pol核酸ドメインおよびenv核酸ドメインを含むレトロウイルスポリヌクレオチド; 異種ポリヌクレオチドに作動可能に連結された内部リボソーム結合部位(IRES)を含む、3' LTRの5'側でかつレトロウイルスエンベロープをコードするenv核酸ドメインの3'側に位置するカセット; および逆転写、パッケージングおよび標的細胞への組み込みに必要なシス作用配列、を含む組み換え複製適合性レトロウイルス(RCR)を提供し、ここで該RCRは、6回の継代後に、pACEベクター(配列番号21)と比較して高い複製能を維持する。一実施形態では、該レトロウイルスポリヌクレオチド配列は、マウス白血病ウイルス(MLV)、モロニーマウス白血病ウイルス(MoMLV)、ネコ白血病ウイルスまたはテナガザル(Gibbon ape)白血病ウイルス(GALV)由来である。別の実施形態では、MLVは両種性MLVである。さらに別の実施形態では、レトロウイルスはオンコレトロウイルスである。さらに別の実施形態では、標的細胞は、細胞増殖性障害を有する細胞である。細胞増殖性障害は、非限定的に、肺癌、結腸直腸癌、乳癌、前立腺癌、尿路癌、子宮癌、脳腫瘍、頭頸部癌、膵癌、黒色腫、胃癌および卵巣癌、関節リウマチおよび他の自己免疫疾患からなる群から選択することができる。一実施形態では、プロモーターは、配列番号19、20、または22のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を有するCMVプロモーターを含み、1個以上の核酸塩基に対する改変を含んでよく、それは転写を誘導し開始させることが可能である。さらに別の実施形態では、プロモーターは配列番号19、20、または22のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を含む。さらなる実施形態では、プロモーターはCMV-R-U5ドメインポリヌクレオチドを含む。一実施形態では、CMV-R-U5ドメインは、MLV R-U5領域に連結されたヒトサイトメガロウイルス由来の前初期プロモーターを含む。さらに別の実施形態では、CMV-R-U5ドメインポリヌクレオチドは、配列番号19、20、または22のヌクレオチド約1位〜ヌクレオチド約1202位に記載の配列または、配列番号19、20、または22に記載の配列と少なくとも95%同一の配列を含み、ここで該ポリヌクレオチドはそれに作動可能に連結された核酸分子の転写を促進する。別の実施形態では、該ポリヌクレオチドのgagおよびpolはオンコレトロウイルス由来である。gag核酸ドメインは、配列番号19のヌクレオチド番号約1203〜ヌクレオチド約2819位の配列またはそれに対して少なくとも95%、98%、99%または99.8%の同一性を有する配列を含んでよい。polドメインは、配列番号19のヌクレオチド番号約2820位〜ヌクレオチド約6358位の配列またはそれに対して少なくとも95%、98%、99%または99.9%の同一性を有する配列を含んでよい。一実施形態では、envドメインは両性envタンパク質(amphoteric env protein)をコードする。そのenvドメインは、配列番号19のヌクレオチド番号約6359位〜ヌクレオチド約8323位の配列またはそれに対して少なくとも95%、98%、99%または99.8%の同一性を有する配列を含んでよい。該ベクターのIRESドメインは任意のIRESであってよいが、一実施形態では、IRESは脳心筋炎ウイルス由来である。さらなる実施形態では、IRESは、配列番号19のヌクレオチド番号約8327位〜ヌクレオチド約8876位の配列またはそれに対して少なくとも95%、98%、または99%の同一性を有する配列を含む。さらに別の実施形態では、異種ポリヌクレオチドは、配列番号3、5、11、13、15または17に記載の配列を有するポリヌクレオチドを含む。さらなる実施形態では、異種配列は、配列番号4に記載の配列を含むポリペプチドをコードする。異種核酸はヒトコドン最適化され、配列番号4に記載のポリペプチドをコードする。さらなる実施形態では、異種核酸は配列番号19のヌクレオチド番号約8877位〜約9353位に記載の配列を含む。一実施形態では、3' LTRはオンコレトロウイルス由来である。さらなる実施形態では、3' LTRはU3-R-U5ドメインを含む。さらに別の実施形態では、3' LTRは、配列番号19のヌクレオチド約9405位〜約9998位に記載の配列またはそれと少なくとも95%、98%または99.5%同一の配列を含む。
【0012】
本開示は、配列番号19、20、または22に記載の配列を含むポリヌクレオチドを提供する。
【0013】
本開示は、5'から3'方向に: ヒトサイトメガロウイルス由来の前初期プロモーターとMLV R-U5領域とのCMV-R-U5融合物; 逆転写酵素のためのプライマー結合部位PBS; 5'スプライス部位; Ψパッケージングシグナル; MLV群特異的抗原のgagコード配列; MLVポリメラーゼポリプロテインのpolコード配列; 3'スプライス部位; MLV 4070A株のエンベロープタンパク質の4070A envコード配列; 脳心筋炎ウイルス由来の内部リボソーム侵入部位(IRES); 改変されたシトシンデアミナーゼコード配列; ポリプリントラクト(polypurine tract); およびU3-R-U5 MLV長末端反復配列を含む、単離されたポリヌクレオチドを提供する。
【0014】
本開示は、細胞増殖性障害を有する被験体を治療する方法であって、被験体を、シトシンデアミナーゼ活性を有する本開示のポリペプチドをコードするポリヌクレオチドと、該ポリヌクレオチドが発現されるような条件下で接触させるステップおよび被験体を5-フルオロシトシンと接触させるステップを含む方法を提供する。
【0015】
本開示はまた、被験体の細胞増殖性障害を治療する方法であって、被験体を本開示のレトロウイルスと接触させるステップを含み、ここで前記異種核酸配列は、新生物細胞の増殖を阻害する治療的タンパク質をコードする、方法を提供する。一実施形態では、該レトロウイルスは、配列番号4、12、14、16、または18に記載の配列を有するポリペプチドをコードするポリヌクレオチドを含む。
【0016】
本開示の1以上の実施形態の詳細は、添付の図面および下記説明に記載される。他の特徴、目的、および利点は、説明および図面、ならびに特許請求の範囲から明らかになる。
【図面の簡単な説明】
【0017】
【図1−1】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−2】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−3】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−4】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−5】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−6】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−7】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−8】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−9】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−10】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−11】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−12】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−13】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−14】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−15】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−16】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−17】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−18】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−19】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−20】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−21】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−22】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−23】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−24】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−25】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図2−1】図2A〜Dは、CD、OPRTおよびUPRT活性を有するポリペプチドを含む本開示の種々の実施形態の作製のための模式図を示す。
【図2−2】図2A〜Dは、CD、OPRTおよびUPRT活性を有するポリペプチドを含む本開示の種々の実施形態の作製のための模式図を示す。
【図2−3】図2A〜Dは、CD、OPRTおよびUPRT活性を有するポリペプチドを含む本開示の種々の実施形態の作製のための模式図を示す。
【図3】図3は、感染U-87細胞で野生型yCDタンパク質と比較して高レベルのyCD2タンパク質が観察されることを示す。
【図4】図4は、本開示のCDポリペプチドを含むベクターの安定性および本開示の他のベクターとの比較を示す。
【図5】図5A〜Bは、本開示のシトシンデアミナーゼ活性およびベクターは、感染細胞が漸増レベルの5-FCに曝露された場合に、野生型yCD活性(T5.0007)と比較して、感染ラットRG2(5A)またはU87細胞(5B)の同等またはより良好な発現、およびゆえにその死滅を提供することを示す。
【図6】図6は、T5.0002 (yCD2)の感染U87細胞の比活性は、T5.0001 (部分的に最適化されたyCD)より高く、T5.0001はT5.0007 (wt yCD)より大きいことを示す。
【発明を実施するための形態】
【0018】
種々の図面中の参照記号類は要素類を示す。
【0019】
詳細な説明
本明細書および特許請求の範囲中で使用される、単数形「a」、「and」、および「the」は、文脈によって明らかに他の様式で決定されない限り、複数の指示対象を含む。ゆえに、例えば、「a cell」への言及には、複数の該細胞が含まれ、「the agent」への言及には、当業者に公知の1種以上の物質への言及が含まれる、などである。
【0020】
また、「または」の使用は、特に指定されない限り、「および/または」を意味する。同様に、「comprise」、「comprises」、「comprising」「include」、「includes」、および「including」は交換可能であり、限定的でないものとする。
【0021】
種々の実施形態の説明が用語「含む(comprising)」を使用する場合、当業者は、一部の具体的事例では、ある実施形態は、その代わりに用語「から本質的に構成される(consisting essentially of)」または「からなる(consisting of)」を使用して記載できると理解するであろうことは、さらに理解されよう。
【0022】
特に規定されない限り、本明細書中で使用されるすべての技術用語および科学用語は、本開示が属する技術分野の当業者に一般に理解される意義と同一の意義を有する。本明細書中に記載のものと類似または等価の方法および材料を、開示される方法および組成物の実施に使用できるが、典型的な方法、デバイスおよび材料をここに記載する。
【0023】
上およびテキストの全体を通して考察される刊行物は、単に、本出願の提出日前のその開示内容に関して提供される。本明細書中のいかなるものも、発明者らが、以前の開示内容に基づいてそのような開示内容を予測することができないことの承認として解釈されないものとする。
【0024】
シトシンデアミナーゼ(EC 3.5.4.1)は、以下の化学反応:
シトシン+ H2O → ウラシル+ NH3
を触媒する酵素である。ゆえに、この酵素の2つの基質はシトシンおよびH2Oであり、その2つの生成物はウラシルおよびNH3である。この酵素は加水分解酵素のファミリーに属し、それらは、特に環状アミジン中の、ペプチド結合以外の炭素-窒素結合に作用する。この酵素クラスの分類名はシトシンアミノヒドロラーゼである。この酵素はイソシトシンデアミナーゼとも称される。この酵素はピリミジン代謝に関与する。
【0025】
より具体的には、シトシンデアミナーゼは、外因性シトシンが加水分解による脱アミノ化を介してウラシルに変換される、ピリミジンの代謝経路に関与する酵素である。シトシンデアミナーゼ(CDアーゼまたはCD)活性は原核生物および下等真核生物で実証されているが、それらは哺乳類で不存在である(Koechlin et al., 1966, Biochem. Pharmacol. 15, 435-446; Polak et al., 1976, Chemotherapy 22, 137-153)。Saccharomyces cerevisiae (S. cerevisiae)のFCY1遺伝子およびE. coliのcoda遺伝子は、それぞれ、前記2種の生物のCDアーゼをコードするが、該遺伝子は公知であり、その配列は公開されている(EP 402 108; Erbs et al., 1997, Curr. Genet. 31, 1-6; WO 93/01281)。CDアーゼはまた、シトシンアナログである5-フルオロシトシン(5-FC)を脱アミノ化して、5-フルオロウラシル(5-FU)にする。5-フルオロウラシルは、特に5-フルオロ-UMP (5-FUMP)に変換された場合に高度に細胞傷害性の化合物である。該酵素をコードする遺伝子の不活性化突然変異またはこの酵素についてのその天然の欠損(例えば哺乳類細胞に関して)のせいでCDアーゼ活性を欠く細胞は5-FCに耐性である(Jund and Lacroute, 1970, J. Bacteriol. 102, 607-615; Kilstrup et al., 1989, J. Bacteriol., 171, 2124-2127)。一方、5-FC感受性を、CDアーゼ活性をコードする配列が導入されている哺乳類細胞に伝達することが可能であると示されている(Huber et al., 1993, Cancer Res. 53, 4619-4626; Mullen et al., 1992, Proc. Natl. Acad. Sci. USA 89, 33-37; WO 93/01281)。したがって、CDの使用は遺伝子治療、特に抗癌性遺伝子治療の場面で有益である。
【0026】
しかし、5-FC感受性はセルラインに応じて大きく変動する。例えば、E. coliのcoda遺伝子を発現するレトロウイルスで形質導入されたヒト腫瘍系統、PANC-1 (膵臓の癌腫)およびSK-BR-3 (乳腺癌)で低感受性が観察される(Harris et al., 1994, Gene Therapy 1, 170-175)。この現象は、CDアーゼの酵素作用によって形成される5-FUの不存在またはその細胞傷害性5-FUMPへの不十分な内因性変換によって説明される。このステップは、哺乳類細胞でオロト酸ホスホリボシルトランスフェラーゼ(OPRTアーゼ)によって通常実行されるが、特定の腫瘍では不存在であってゆえにCDアーゼに基づく遺伝子治療は無効になる。原核生物および下等真核生物では、ウラシルホスホリボシルトランスフェラーゼの作用(UPRTアーゼ活性)によってウラシルはUMPに変換される。この酵素もまた、5-FUを5-FUMPに変換する。重要なことに、細菌のウラシルホスホリボシルトランスフェラーゼ(UPRT)は哺乳類細胞のオロト酸ホスホリボシルトランスフェラーゼ(OPRT)またはウリジン-5'-一リン酸シンターゼと機能的に等価である。これらの酵素は、5-フルオロウラシル(5-FU)(ウラシルのフッ化アナログ)から5-フルオロウリジン5'一リン酸(5-FUMP)への変換を媒介する。5-フルオロウリジン5'一リン酸は、次いで、哺乳類のde novoピリミジン経路を介して5-FdUDPおよびFdUTPに変換される。各5-FdUTPはチミジル酸シンターゼ(Thy-A)の不可逆的インヒビターであり、dTTP飢餓を生じさせる。この変換は、5-フルオロウラシルの細胞傷害性作用を達成するための必須経路の1つであること、および細菌起源の細菌性ウラシルホスホリボシルトランスフェラーゼは、5-フルオロウラシルを、哺乳類のオロト酸ホスホリボシルトランスフェラーゼと同一の活性代謝産物に変換できることは広く受け入れられている。UPRTアーゼ活性またはOPRTアーゼ活性の不存在下では、CDアーゼによる5-FCの脱アミノ化に起因する5-FUは細胞傷害性5-FUMPに変換されない(Jund and Lacroute, 1970, J. Bacteriol. 102, 607-615)。
【0027】
本明細書中に記載のように、本開示は、シトシンデアミナーゼ活性を有する第1のポリペプチドとUPRTまたはOPRT活性を含む第2のポリペプチドとの融合物を含むポリペプチドをコードするポリヌクレオチドおよび該ポリペプチドを提供する。そのような融合構築物は、ウラシル、またはその誘導体を一リン酸アナログに変換し、特に5-FUを5-FUMPに変換するために有用である。
【0028】
以下でさらに詳細に説明されるように、本開示は、5-FCから5-FUへの変換を触媒する新規ポリペプチドの作製および発現に少なくとも部分的に基づく。一実施形態では、5-FCから5-FUへの変換に関する、改良した触媒特性を有するように改変されている新規ポリペプチドを提供する。そのようなポリペプチドには、指定残基でアミノ酸置換を含むように改変されている変異体が含まれる。これらの変異体は以下でさらに詳細に説明されるが、本開示のポリペプチドは1つ以上の改変されたアミノ酸を含んでよいことが理解されよう。改変されたアミノ酸の存在は、例えば、(a) ポリペプチドin vivo半減期の増加、(b) ポリペプチド抗原性の減少または増加、および(c) ポリペプチド保存安定性の増加に有益である。アミノ酸(群)を、組み換え生産中に、例えば、翻訳と同時にまたは翻訳後に改変(例えば、哺乳類細胞での発現中のN--X--S/TモチーフでのN結合グリコシル化)するか、または合成手段によって改変する。したがって、「突然変異体」、「変異体」または「改変された」タンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞とは、親タンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞から改変または誘導されているか、または何らかの様式で異なるかまたは変化したタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞を意味する。突然変異体または改変されたタンパク質または酵素は、必ずではないが通常は、突然変異体ポリヌクレオチドまたは遺伝子から発現される。
【0029】
「突然変異」とは、突然変異体タンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞を生じさせる任意のプロセスまたは機構を意味する。これには、タンパク質、酵素、ポリヌクレオチド、または遺伝子配列が改変される任意の突然変異、および該突然変異に起因する細胞中の任意の検出可能な変化が含まれる。典型的に、突然変異は、単一または複数のヌクレオチド残基のポイントミューテーション、欠失、または挿入によってポリヌクレオチドまたは遺伝子配列中で生じる。突然変異には、遺伝子のタンパク質コード領域内で生じるポリヌクレオチド変化ならびに非限定的に調節配列またはプロモーター配列などの、タンパク質コード配列の外側の領域の変化が含まれる。遺伝子の突然変異は「サイレント」であってよく、すなわち、発現時のアミノ酸変化に反映されず、該遺伝子の「配列保存的」変異体を生じさせる。これは、一般に、1アミノ酸が2以上のコドンに対応する場合に生じる。
【0030】
改変されたアミノ酸の非限定的な例には、グリコシル化アミノ酸、硫酸化アミノ酸、プレニル化(例えば、ファルネシル化、ゲラニルゲラニル化)アミノ酸、アセチル化アミノ酸、アシル化アミノ酸、ペグ化アミノ酸、ビオチニル化アミノ酸、カルボキシル化アミノ酸、リン酸化アミノ酸、などが含まれる。アミノ酸の改変に関して当業者をガイドするために適切な参考文献は文献中に豊富である。プロトコールの例はWalker (1998) Protein Protocols on CD-ROM (Humana Press, Towata, N.J.)に見出せる。
【0031】
本開示の改変されたCDポリペプチドおよびポリヌクレオチドを製造、単離、および使用するための組み換え方法が本明細書中に記載される。組み換え生産に加えて、固相技術を使用する直接ペプチド合成によって該ポリペプチドを製造することができる(例えば、Stewart et al. (1969) Solid-Phase Peptide Synthesis (WH Freeman Co, San Francisco); およびMerrifield (1963) J. Am. Chem. Soc. 85: 2149-2154)。ペプチド合成は、マニュアル技術を使用するかまたは自動化によって実施することができる。自動合成は、例えば、Applied Biosystems 431A Peptide Synthesizer (Perkin Elmer, Foster City, Calif.)を、製造元によって提供される指示書にしたがって使用して達成することができる。
【0032】
例として、E. coli (Anderson et al., 1992, Eur. J. Biochem 204, 51-56)、Lactococcus lactis (Martinussen and Hammer, 1994, J. Bacteriol. 176, 6457-6463)、Mycobacterium bovis (Kim et al., 1997, Biochem Mol. Biol. Int 41, 1117-1124)およびBacillus subtilis (Martinussen et al., 1995, J. Bacteriol. 177, 271-274)のUPRTアーゼをコードする核酸配列を本開示の内容で使用することができる。しかし、酵母UPRTアーゼ、および特に、その配列がKern et al. (1990, Gene 88, 149-157)に開示されるS. cerevisiaeのFUR1遺伝子によってコードされるものの使用が参照的にここに組み入れられる。指摘として、該遺伝子の配列および対応するUPRTアーゼの配列は文献および専門データバンク(SWISSPROT, EMBL, Genbank Medline, など)に見出せる。
【0033】
本明細書中で互換的に使用される用語「タンパク質」または「ポリペプチド」は、ペプチド結合と称される化学結合によって1つに連結されるアミノ酸と称される化学構成単位の1以上の鎖を含む。「酵素」とは、1以上の化学反応または生化学反応を、多かれ少なかれ特異的に、触媒または促進する、好ましくは完全にまたは大部分がタンパク質から構成される任意の物質を意味する。用語「酵素」とは、触媒性のポリヌクレオチド(例えばRNAまたはDNA)を呼んでもよい。「天然(native)」または「野生型」のタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞とは、天然に存在するタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞を意味する。
【0034】
したがって、種々の実施形態では、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含む、単離された、または組み換えポリペプチドを提供する。さらに別の実施形態では、該ポリペプチドは、配列番号4に記載の配列を含み、残基: (a) 23、108および140を除いて、50、25、10、または5個までの保存的アミノ酸置換を含む。一般に、本明細書中で提供されるポリペプチドは、5-FCを5-FUに変換するために有用なシトシンデアミナーゼ活性を示す。
【0035】
本開示はまた、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含むポリペプチドであって、23位のロイシン、108位のイソロイシン、および140位のロイシンを有し、かつシトシンデアミナーゼ活性を有するポリペプチドを提供する。さらに別の実施形態では、該ポリペプチドは、配列番号4に記載の配列を含む。
【0036】
本開示は、さらに、ウラシルホスホリボシルトランスフェラーゼ(UPRT)またはオロト酸(oratate)ホスホリボシルトランスフェラーゼ(OPRT)に作動可能に連結された前記ポリペプチドのいずれか1つを含む融合構築物を提供する。一実施形態では、該融合構築物は、UPRTまたはOPRT活性を有する第2のポリペプチドに連結された、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含む第1のポリペプチドを含む。さらに別の実施形態では、融合構築物は、配列番号4に記載の配列を有しかつ残基: 23、108および140を除く、50、25、10、または5個までの保存的アミノ酸置換を含む第1のポリペプチドを含み、ここで該第1のポリペプチドは、UPRTまたはOPRT活性を有する第2のポリペプチドに連結されている。本開示はまた、シトシンデアミナーゼ活性を有しかつ、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含む第1のポリペプチドを含み、該ポリペプチドは、23位のロイシン、108位のイソロイシンおよび140位のロイシンを有し、かつ該第1のポリペプチドは、UPRTまたはOPRT活性を含む第2のポリペプチドに連結されている、融合構築物を提供する。一実施形態では、UPRTまたはOPRT活性を有するポリペプチドは、それぞれ、配列番号8および10に記載の配列またはそれらの変異体を含む。さらに別の実施形態では、シトシンデアミナーゼ活性を含む第1のポリペプチドは、UPRTまたはOPRT活性を有するポリペプチドに連結され、該ポリペプチドはペプチドリンカーによって分離されている。別の実施形態では、該融合構築物は、配列番号11、12または13からなる群から選択される配列を含む。
【0037】
用語「作動可能に連結(operably linked)」または「作動可能に結合(operably associated)」とは、調節配列と該調節配列によって調節されるポリヌクレオチドとの間の、または2種の別のポリペプチドまたはそのようなポリペプチドをコードするポリヌクレオチドの間の機能的連結または結合を表す。
【0038】
CD活性を有するポリペプチドおよびUPRTまたはOPRT活性を含むポリペプチドを含む融合構築物を、タンパク質回収を支援するための切断部位または他のリンカー部分を含むように改変することができる。典型的にリンカーはペプチドリンカー部分である。リンカー部分の長さは、CDポリペプチドおよびUPRTまたはOPRTポリペプチドの生物学的活性を最適化するように選択され、過度の実験を行なわずに経験的に決定することができる。該リンカー部分は、基質がCDポリペプチドと相互作用しかつ基質がUPRTまたはOPRTポリペプチドと相互作用することを可能にするように十分に長く、十分にフレキシブルであるべきである。リンカー部分は、約1〜30アミノ酸残基長の範囲、典型的に約2〜15アミノ酸残基の範囲のペプチドである。リンカー部分の例は、--Gly--Gly--、GGGGS (配列番号22)、(GGGGS)N (配列番号23)、(SGGGG)N (配列番号24)、GKSSGSGSESKS (配列番号25)、GSTSGSGKSSEGKG (配列番号26)、GSTSGSGKSSEGSGSTKG (配列番号27)、GSTSGSGKPGSGEGSTKG (配列番号28)、またはEGKSSGSGSESKEF (配列番号29)である。連結部分は、例えば、Huston et al., Proc. Nat'l Acad. Sci 85:5879, 1988; Whitlow et al., Protein Engineering 6:989, 1993; およびNewton et al., Biochemistry 35:545, 1996に記載されている。他の好適なペプチドリンカーは、U.S. Pat. Nos. 4,751,180および4,935,233に記載されるものがある。該文献は参照によりここに組み入れられる。所望のペプチドリンカーをコードするDNA配列を、任意の好適な慣用技術を使用して、CDポリペプチドおよびその後のUPRTまたはOPRTポリペプチドをコードするポリヌクレオチドの間にかつ、該ポリヌクレオチドと同じ読み枠で挿入することができる。例えば、リンカーをコードする化学合成されたオリゴヌクレオチドを、2つのコードポリヌクレオチド間にライゲートすることができる。特定の実施形態では、融合ポリペプチドは、2〜4つの別々のドメイン(例えば、CDドメインおよびUPRTまたはOPRT)を含み、該ドメインはペプチドリンカーによって分離されている。
【0039】
特定の配列の「保存的アミノ酸置換」または単に「保存的変異」とは、1アミノ酸、または一続きのアミノ酸の、本質的に同一のアミノ酸配列による置換を表す。コード化配列中の単一アミノ酸またはあるパーセンテージのアミノ酸を変更、付加または除去する個別の置換、欠失または付加は、該変化がアミノ酸の欠失、アミノ酸の付加、または化学的に類似のアミノ酸とのアミノ酸の置換を生じさせる場合に「保存的変異」を生じさせることを当業者は認識する。
【0040】
機能的に類似のアミノ酸を提供する保存的置換テーブルは当技術分野で周知である。例えば、1保存的置換群は、アラニン(A)、セリン(S)、およびスレオニン(T)を含む。別の保存的置換群はアスパラギン酸(D)およびグルタミン酸(E)を含む。別の保存的置換群はアスパラギン(N)およびグルタミン(Q)を含む。さらに別の保存的置換群はアルギニン(R)およびリシン(K)を含む。別の保存的置換群は、イソロイシン、(I) ロイシン(L)、メチオニン(M)、およびバリン(V)を含む。別の保存的置換群は、フェニルアラニン(F)、チロシン(Y)、およびトリプトファン(W)を含む。
【0041】
ゆえに、列挙されるポリペプチド配列(例えば、配列番号2、4、6、8、10、11、12、13など)の「保存的アミノ酸置換」は、当該ポリペプチド配列のあるパーセンテージ、典型的に10%未満、のアミノ酸と、同一保存的置換群の保存的に選択されるアミノ酸との置換を含む。したがって、本開示のポリペプチドの保存的に置換された変異は、同一保存的置換群の保存的に置換される変異での100、75、50、25、または10個の置換を含んでよい。
【0042】
酵素の「活性」は、反応を触媒する、すなわち「機能」する、その能力の基準であり、反応の産物が生産される割合として表記することができる。例えば、酵素活性は、単位時間あたりまたは単位酵素(例えば濃度または重量)あたりに生産される産物の量として、または親和性もしくは解離定数の観点で表すことができる。本明細書中で互換的に使用される「シトシンデアミナーゼ活性」、「シトシンデアミナーゼの生物学的活性」または「シトシンデアミナーゼの機能的活性」とは、標準的技術にしたがってin vivo、またはin vitro、で測定された場合に、シトシンデアミナーゼ基質に対して本開示のシトシンデアミナーゼタンパク質、またはポリペプチドによって発揮される活性を表す。シトシンデアミナーゼ活性を測定するためのアッセイは当技術分野で公知である。例えば、シトシンデアミナーゼ活性は、5-FCから5-FUまたはシトシンからウラシルへの変換速度を測定することによって測定することができる。5-FC、5-FU、シトシンおよびウラシルの検出は、クロマトグラフィーおよび当技術分野で公知の他の方法によって実施することができる。
【0043】
開示される核酸構築物の多数の保存的変異が機能的に同一の構築物を生じさせることを当業者は認識するであろう。例えば、上で考察されるように、遺伝暗号の縮重のせいで、「サイレント置換」(すなわち、コード化ポリペプチドの変化を生じさせない、核酸配列中の置換)は、アミノ酸をコードするすべての核酸配列についての暗黙的に含まれる特徴である。遺伝暗号の縮重のため、本開示の改変されたシトシンデアミナーゼポリペプチドをコードする多数のヌクレオチド配列を製造することができ、その一部は、本明細書中で明示的に開示される核酸配列との実質的同一性を保持するものもあることは当業者に理解されよう。例えば、コドンAGA、AGG、CGA、CGC、CGG、およびCGUはすべて、アミノ酸アルギニンをコードする。ゆえに、コード化ポリペプチドを変更することなしに、コドンによってアルギニンが指定される本開示の核酸中のすべての位置で、該コドンを、対応する上記コドンのいずれかに改変することができる。RNA配列中のUはDNA配列中のTに対応することが理解される。
【0044】
同様に、アミノ酸配列中の1個または少数のアミノ酸での「保存的アミノ酸置換」は、非常に類似の特性を有する異なるアミノ酸で置換され、また、開示対象の構築物と非常に類似であると容易に特定することができる。開示された各配列のそのような保存的変異は、本明細書中で提供されるポリペプチドの特徴である。
【0045】
「保存的変異体」は、非限定的に、アミノ酸と、極性または無極性、サイズ、形状および電荷を含む類似の特性を有するものとの置換を含む、タンパク質または酵素の全体のコンフォメーションおよび機能を変化させることなく、所定のアミノ酸残基が変化しているタンパク質または酵素である。保存されていると指定されるアミノ酸以外のアミノ酸は、類似の機能の任意の2タンパク質間のタンパク質またはアミノ酸配列類似性パーセントがさまざまであり、例えば、アライメントスキームにしたがって測定された場合に、少なくとも30%、少なくとも50%、少なくとも70%、少なくとも80%、または少なくとも90%でありうるように、タンパク質または酵素中で異なってよい。本明細書中で言及される「配列類似性」とは、ヌクレオチドまたはタンパク質配列が関連する程度を意味する。2配列間の類似性の程度は配列同一性および/または保存パーセントに基づいてよい。本明細書中の「配列同一性」は、2ヌクレオチドまたはアミノ酸配列が不変である程度を意味する。「配列アライメント」とは、類似性の程度を評価する目的で、最大レベルの同一性(および、アミノ酸配列の場合は、保存)を達成するように2以上の配列を並べるプロセスを意味する。配列をアライメントして類似性/同一性を評価するための多数の方法が当技術分野で公知であり、例えば、類似性がMEGALIGNアルゴリズムに基づくCluster Method、ならびにBLASTN、BLASTP、およびFASTAである(Lipman and Pearson, 1985; Pearson and Lipman, 1988)。すべてのこれらのプログラムを使用する場合、好ましい設定は最高の配列類似性を生じさせる設定である。例えば、特定ペアのアライメントされたアミノ酸配列に関する「同一性」または「同一性パーセント」とは、アライメント中の同一適合の数をカウントし、該同一適合の数を、(i) アライメントされた配列の長さ、および(ii) 96の大きい方で除算し、低速/精密ペアワイズアライメントを達成するために以下のデフォルトClustalWパラメータ--Gap Open Penalty: 10; Gap Extension Penalty: 0.10; Proteinウエイトマトリックス: Gonnetシリーズ; DNAウエイトマトリックス: IUB; Toggle Slow/Fastペアワイズアライメント=SLOWまたはFULL Alignmentを使用する、ClustalW解析(European Bioinformatics Institute, Cambridge, UKから入手可能のバージョンW 1.8)によって得られるアミノ酸配列同一性パーセントを表してよい。
【0046】
2配列は、それらが、該配列ペアに関してできるだけ最高のスコアに到達するように、規定されたアミノ酸置換マトリックス(例えばBLOSUM62)、ギャップ存在ペナルティおよびギャップ伸長ペナルティを使用して類似性スコアリングに関してアライメントされた場合に、「最適にアライメント」される。アミノ酸置換マトリックスおよび2配列間の類似性の定量化でのその使用は当技術分野で周知であり、例えばDayhoff et al. (1978) "A model of evolutionary change in proteins" in "Atlas of Protein Sequence and Structure," Vol. 5, Suppl. 3 (ed. M. O. Dayhoff), pp. 345-352. Natl. Biomed. Res. Found., Washington, D.C. およびHenikoffet al. (1992) Proc. Nat'l. Acad. Sci. USA 89: 10915-10919に記載される。BLOSUM62マトリックス(図10)は、しばしば、Gapped BLAST 2.0などの配列アライメントプロトコールにおいてデフォルトスコア置換マトリックスとして使用される。ギャップ存在ペナルティは、アライメントされた配列の一方での単一アミノ酸ギャップの導入に課せられ、ギャップ伸長ペナルティは、すでに開いたギャップ中へ挿入される追加の空の各アミノ酸位置に課せられる。アライメントは、該アライメントが開始または終了する、各配列のアミノ酸位置によって規定され、場合により、できるだけ最高のスコアに到達するような一方または両方の配列でのギャップまたは複数のギャップの挿入によって規定される。最適なアライメントおよびスコアリングは手作業で達成することができるが、コンピュータ実装アライメントアルゴリズム、例えば、Altschul et al. (1997) Nucl. Acids Res. 25: 3389-3402に記載されかつNational Center for Biotechnology Information (NCBI) Website (www.ncbi.nlm.nih.gov)で公に入手可能にされているギャップBLAST 2.0の使用によってプロセスは容易になる。マルチプルアライメントを含む最適なアライメントは、例えば、NCB1ウェブサイトを通して入手可能でかつAltschul et al. (1997) Nucl. Acids Res. 25:3389-3402に記載されるPSI-BLASTを使用して作製することができる。
【0047】
参照配列と最適にアライメントされたアミノ酸配列では、アミノ酸残基は、アライメント中で残基がペアを構成している参照配列中の位置に「対応する」。該「位置」は、参照配列中の各アミノ酸をN末端に対するその位置に基づいて連続して特定する番号によって示される。最適なアライメントを決定する場合に考慮に入れる必要がある欠失、挿入、切断、融合、などのせいで、一般に、N末端からの単純なカウントよって決定される試験配列中のアミノ酸残基番号は、必ずしも、参照配列中のその対応する位置の番号と同じではない。例えば、アライメントされた試験配列中に欠失が存在する場合、該欠失部位の、参照配列中の位置に対応するアミノ酸は存在しない。アライメントされた参照配列中に挿入が存在する場合、該挿入は参照配列中のいかなるアミノ酸位置にも対応しない。切断または融合の場合、対応する配列中のいかなるアミノ酸にも対応しない、参照配列またはアライメントされた配列中にアミノ酸のストレッチが存在しうる。
【0048】
特定のポリペプチドの非保存的改変は、保存的置換と特徴付けられていない任意のアミノ酸を置換するものである。例えば、上記6群の境界を横断する任意の置換である。これらには、中性アミノ酸の代わりの塩基性または酸性アミノ酸の置換(例えば、Val、Ile、LeuまたはMetの代わりのAsp、Glu、Asn、またはGln)、塩基性または酸性アミノ酸の代わりの芳香族アミノ酸の置換(例えば、Asp、Asn、GluまたはGlnの代わりのPhe、TyrまたはTrp)またはアミノ酸を類似のアミノ酸で置換しない任意の他の置換が含まれる。塩基性側鎖には、リシン(K)、アルギニン(R)、ヒスチジン(H)が含まれ; 酸性側鎖には、アスパラギン酸(D)、グルタミン酸(E)が含まれ; 無電荷極性側鎖には、グリシン(G)、アスパラギン(N)、グルタミン(Q)、セリン(S)、スレオニン(T)、チロシン(Y)、システイン(C)が含まれ; 無極性側鎖には、アラニン(A)、バリン(V)、ロイシン(L)、イソロイシン(I)、プロリン(P)、フェニルアラニン(F)、メチオニン(M)、トリプトファン(W)が含まれ; ベータ分岐側鎖には、スレオニン(T)、バリン(V)、イソロイシン(I)が含まれ; 芳香族側鎖には、チロシン(Y)、フェニルアラニン(F)、トリプトファン(W)、ヒスチジン(H)が含まれる。
【0049】
状況に応じて、ポリペプチド中の特定の位置の一部のアミノ酸残基は保存的アミノ酸置換から「除外」される。例えば、本開示は、配列番号4に記載の配列を含むポリペプチドを提供する。一部の実施形態では、該ポリペプチドは上記のように保存的アミノ酸置換で改変することができるが、23位、108位、および140位の残基などの特定の残基は、望ましくは非置換のままにする。
【0050】
「親」タンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞は、任意の他のタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞が、任意の方法、ツールまたは技術を使用して得られるまたは作製される元となった任意のタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞であり、親自身が天然(native)のものであるか、または突然変異体であるかには無関係である。親ポリヌクレオチドまたは遺伝子は親タンパク質または酵素をコードする。
【0051】
ポリヌクレオチド、ポリペプチド、または他の成分は、それが通常伴う成分(他のタンパク質、核酸、細胞、合成試薬、など)から部分的にまたは完全に分離されている場合に、「単離され」ている。核酸またはポリペプチドは、人工物であるかもしくは遺伝子工学的に操作されているか、または人工物のもしくは遺伝子工学的に操作されたタンパク質もしくは核酸に由来する場合に、「組み換え」られている。例えば、ポリヌクレオチドが、それが天然に見出される場合に該ポリヌクレオチドに通常隣接するヌクレオチド配列を伴わないように、ベクターまたは任意の他の異種部位、例えば組み換え生物のゲノム中の部位に挿入されたポリヌクレオチドは組み換えポリヌクレオチドである。組み換えポリヌクレオチドからin vitroまたはin vivoで発現されるタンパク質は組み換えポリペプチドの例である。同様に、天然に出現しないポリヌクレオチド配列、例えば天然に存在する遺伝子の変異体は組み換え物である。
【0052】
他の実施形態では、本開示のシトシンデアミナーゼポリペプチドまたは融合構築物をコードする、単離されたポリヌクレオチドを提供する。一態様では、本開示は、本明細書中で「CD最適化ポリヌクレオチド」、「CDポリヌクレオチド」または「CD融合ポリヌクレオチド」と称される、単離されたまたは組み換えポリヌクレオチドを提供する。用語「ポリヌクレオチド」、「ヌクレオチド配列」、および「核酸分子」は、関連の状況に応じて、ヌクレオチド(A、C、T、U、G、など、または天然に存在するかもしくは人工のヌクレオチドアナログ)のポリマー、例えばDNAまたはRNA、またはそれらの表示、例えば文字列、などを表すために使用される。所定のポリヌクレオチドまたは相補ポリヌクレオチドは、任意の指定のヌクレオチド配列から決定することができる。
【0053】
本開示の一実施形態は、シトシンデアミンまたは突然変異体シトシンデアミナーゼポリペプチドまたはその生物活性部分をコードする、単離されたポリヌクレオチドに関連する。本明細書中で使用される用語「核酸分子」または「ポリヌクレオチド」は、DNA分子(例えばcDNAまたはゲノムDNA)およびRNA分子(例えばmRNA)、ならびにヌクレオチドアナログを使用して作製されたDNAまたはRNAのアナログを含むものとする。核酸分子は一本鎖または二本鎖であってよい。
【0054】
一実施形態では、CD最適化ポリヌクレオチドまたはCDポリヌクレオチドは、生物、例えば、細菌または酵母株から単離された天然に存在する核酸の、組み換え形態、遺伝子操作形態、または単離形態を含む。典型的なCDポリヌクレオチドには、配列番号2に記載の野生型ポリペプチドをコードするものが含まれる。本開示の別の実施形態では、CDポリヌクレオチドを、1種以上の天然に存在する、単離された、または組み換えCDポリヌクレオチドを多様化する、例えば組み換え、かつ/または突然変異させることによって製造する。本明細書中の他の箇所でさらに詳細に記載されるように、多様化プロセスで基質または親として使用されるCDポリヌクレオチドより優れた機能的属性、例えば、増加した触媒機能、増加した安定性、または高い発現レベルを有するCDポリペプチドをコードする、多様化されたCDポリヌクレオチドを作製することが可能である。典型的なポリヌクレオチドには、配列番号3および5ならびに本開示のCD変異体ポリペプチドをコードするものが含まれる。
【0055】
本開示のポリヌクレオチドは、例えば、本開示のCDポリペプチドの組み換え生産(すなわち発現)における、また、さらなる多様性生成、例えば、新規および/または改良CDホモログを作製するための組み換え反応または突然変異反応の基質として、などの種々の用途を有する。
【0056】
CDポリヌクレオチドの特定の具体的、実質的および確実な有用性は該ポリヌクレオチドが実質的CD活性、または変異CD活性さえも有するポリペプチドをコードすることを必要としないことに留意することが重要である。例えば、活性な酵素をコードしないCDポリヌクレオチドは、望ましい機能的特性(例えば、高いkcatまたはkcat/Km、低いKm、熱または他の環境要因に対する高い安定性、高い転写または翻訳速度、タンパク質分解切断に対する抵抗性、など)を有するCDポリヌクレオチド変異体、または非CDポリヌクレオチド、に到達するために多様化手順で使用するための親ポリヌクレオチドの有用な供給源でありうる。
【0057】
CDポリペプチドおよびその変異体、CDポリペプチドの断片、関連融合タンパク質、またはその機能的等価物をコードするヌクレオチド配列を含むCDポリヌクレオチドを、適切な宿主細胞、例えば細菌細胞での該CDポリペプチドの発現を誘導する組み換えDNA分子中で使用する。遺伝暗号の本来的な縮重のために実質的に同一または機能的に等価のアミノ酸配列をコードする他の核酸配列を使用して、CDポリヌクレオチドをクローニングし、発現させることもできる。本明細書中で使用される用語「宿主細胞」には、核酸構築物での形質転換に感受性の任意の細胞種が含まれる。用語「形質転換」とは、宿主細胞が導入遺伝子または配列を発現して、導入遺伝子または配列によってコードされる所望の物質、典型的にタンパク質または酵素を生産するような、宿主細胞への外来性(すなわち外因性または細胞外)遺伝子、DNAまたはRNA配列の導入を意味する。導入遺伝子または配列は、調節配列または制御配列、例えば開始、終止、プロモーター、シグナル、分泌、または細胞の遺伝的機構によって使用される他の配列を含んでよい。導入DNAまたはRNAを収容しかつ発現する宿主細胞は「形質転換され」ていて、「形質転換体」または「クローン」である。宿主細胞に導入されるDNAまたはRNAは、宿主細胞と同じ属または種の細胞、または異なる属または種の細胞を含む任意の供給源由来であってよい。
【0058】
当業者に理解されるように、コード配列を改変して、特定の宿主でのその発現を増強することが有益である。遺伝暗号は縮重し、64のコドン候補があるが、ほとんどの生物はこれらのコドンのサブセットを優先的に使用する。ある種で最もよく利用されるコドンは最適コドンと称され、あまりよく利用されないコドンはまれなコドンまたは低使用コドンとして分類される(例えばZhang et al. (1991) Gene 105:61-72を参照のこと)。宿主の優先コドン使用を反映するようにコドンを置換することができ、「コドン最適化」または「種コドンバイアスのコントロール」と称されることもあるプロセスである。
【0059】
特定の原核生物または真核生物宿主によって好まれるコドンを含む最適化されたコード配列(Murray et al. (1989) Nucl. Acids Res. 17:477-508も参照のこと)は、例えば、翻訳の割合を増加させるか、または非最適化配列から生産される転写物と比較して長い半減期などの所望の特性を有する組み換えRNA転写物を生産するように調製することができる。宿主優先度を反映するように翻訳終止コドンを改変することもできる。例えば、S. cerevisiaeおよび哺乳類の好ましい終止コドンは、それぞれ、UAAおよびUGAである。単子葉植物の好ましい終止コドンはUGAであり、昆虫およびE. coliは終止コドンとしてUAAの使用を好む(Dalphin et al. (1996) Nucl. Acids Res. 24: 216-218)。
【0060】
コドン使用バイアスとは、タンパク質をコードするDNA配列(遺伝子)中のコドンの出現頻度の生物間での差異を表す。コドンは、ポリペプチド鎖中の特定のアミノ酸残基をコードする一連の3個のヌクレオチド(トリプレット)である。DNA中には4種のヌクレオチド、アデニン(A)、グアニン(G)、シトシン(C)およびチミン(T)が存在するため、20種のアミノ酸、および3種の翻訳終結(ナンセンス)コドンをコードする64種のトリプレット候補が存在する。この縮重のために、2種のアミノ酸を除くすべてのアミノ酸が2以上のトリプレットによってコードされる。異なる生物は、同一アミノ酸をコードする数個のコドンのうちの1つに特定の優先度を示すことがよくある。これらの優先がどのように生じるかは、盛んに議論される、分子進化の分野である。
【0061】
コドン優先度は、突然変異バイアスと翻訳最適化の自然選択との間のバランスを反映することが一般に認められる。急成長する微生物、例えばEscherichia coliまたはSaccharomyces cerevisiae (パン酵母)での最適コドンは、それらのそれぞれのゲノムtRNAプールの組成を反映する。最適コドンは高速の翻訳速度および高い精度の達成を支援すると考えられる。これらの要因の結果として、高度に発現される遺伝子で翻訳選択が強いと予測され、それが前述の生物での実状である。高い成長速度を示さないかまたは小さいゲノムを示す他の生物では、コドン使用最適化は、通常、不存在であり、コドン優先度は該特定のゲノムで観察される特徴的突然変異バイアスによって決定される。この例はHomo sapiens (ヒト)およびHelicobacter pyloriである。中間レベルのコドン使用最適化を示す生物には、Drosophila melanogaster (ショウジョウバエ)、Caenorhabditis elegans (線虫)またはArabidopsis thaliana (カベバシリ)が含まれる。
【0062】
用語「コドン最適化配列」とは、一般に、約20%未満の使用頻度しか有さないすべてのコドンを置換することによって特定の宿主種に最適化されているヌクレオチド配列を表す。コドン最適化に加えて、スプリアスポリアデニル化配列(spurious polyadenylation sequences)の除去、エキソン/イントロンスプライシングシグナルの除去、トランスポゾン様反復の除去および/またはGC含量の最適化によって所定の宿主種での発現に最適化されているヌクレオチド配列は、本明細書中で、「発現増強配列」と称される。
【表1】

【0063】
したがって、本開示の一部の実施形態では、ポリヌクレオチドはヒト細胞での翻訳のためにコドン最適化された分子を含む。例えば、配列番号3および5は、ヒト宿主細胞でのシトシンデアミナーゼの生産に最適化されている配列を含む。
【0064】
ゆえに、本開示は、シトシンデアミナーゼ活性を有するポリペプチドをコードするヒトコドン最適化ポリヌクレオチドを提供する。本開示のヒトコドン最適化ポリヌクレオチド(例えば配列番号5)は、さらに、コード化ポリペプチドの保存的アミノ酸置換およびまたは改良された活性もしくは安定性を生じさせる追加の突然変異を含んでよい。例えば、配列番号6を含むポリペプチドの23、108および140位での突然変異は、増加した熱安定性をもたらす。したがって、本開示は、シトシンデアミナーゼ活性および増加した熱安定性を有するポリペプチドをコードするヒトコドン最適化ポリヌクレオチドを提供する。一実施形態では、ヒトコドン最適化ポリヌクレオチドは、配列番号4のポリペプチドをコードする配列を含み、該ポリペプチドのアミノ酸をコードするコドンはヒト細胞での発現に最適化されている。別の実施形態では、本開示のポリヌクレオチドは配列番号3または5を含む。
【0065】
一実施形態では、本開示は、UPRTまたはOPRT活性を有するポリペプチドをコードする異種ポリヌクレオチドに連結されたシトシンデアミナーゼポリヌクレオチドまたはコドン最適化ポリヌクレオチドもしくは突然変異体を含むポリヌクレオチドを提供する。
【0066】
例えば、配列番号4、8、10、12、14、16、または18のポリペプチドをコードする配列; または配列番号3、5、7、9、11、13、15、または17のいずれかに記載のヌクレオチド配列、またはその一部分を有する配列を含む本開示のポリヌクレオチドを、標準的分子生物学技術および本明細書中で提供される配列情報を使用して、単離し、作製することができる。
【0067】
本開示のポリヌクレオチドは、標準的PCR増幅技術にしたがって、鋳型としてcDNA、mRNAまたは、あるいは、ゲノムDNAを使用し、かつ適切なオリゴヌクレオチドプライマーを使用して増幅することができる。そのように増幅された核酸を、適切なベクターにクローニングし、DNA配列分析によって特徴付けることができる。さらに、標準的合成技術によって、例えば自動DNA合成機を使用して、ヌクレオチド配列に対応するオリゴヌクレオチドを作製することができる。一部の実施形態では、本開示の単離された核酸分子は、配列番号2、4、6、8、10、12、14、16、または18のいずれかに記載のポリペプチドをコードするか、または配列番号1、3、5、7、9、11、13、15、または17のいずれかに記載のヌクレオチド配列を有するヌクレオチド配列の相補配列である核酸分子を含む。
【0068】
別の実施形態では、本開示の単離されたポリヌクレオチドは、配列番号4、12、14、16または18のいずれかに記載のポリペプチドをコードするヌクレオチド配列からなるか、または配列番号3、5、11、13、15、または17のいずれかに記載のヌクレオチド配列からなる核酸分子に、ストリンジェントな条件下でハイブリダイズする核酸分子を含む。他の実施形態では、該核酸は、少なくとも30、50、100、150、200、250、300、350、400、450、500、550、または600ヌクレオチド長である。核酸分子は、一方のポリヌクレオチドの少なくとも一方の鎖が規定のストリンジェンシー条件下で別のポリヌクレオチドにアニールできる場合に互いに「ハイブリダイズ可能」である。ハイブリダイゼーションのストリンジェンシーは、例えば、(a) ハイブリダイゼーションおよび/または洗浄が実施される温度、および(b) ハイブリダイゼーションおよび洗浄溶液のイオン強度および極性(例えばホルムアミド)、ならびに他のパラメータによって決定される。ハイブリダイゼーションは、2つのポリヌクレオチドが実質的に相補的な配列を含むことを必要とする; しかし、ハイブリダイゼーションのストリンジェンシーに応じて、ミスマッチが許容される。典型的に、高ストリンジェンシー(例えば、65℃の0.5 X SSCの水性溶液中)での2つの配列のハイブリダイゼーションは、配列がそれらの配列全体にわたってかなり高い程度の相補性を示すことを必要とする。中ストリンジェンシー(例えば、65℃の2 X SSCの水性溶液)および低ストリンジェンシー(例えば、55℃の2 X SSCの水性溶液)の条件は、ハイブリダイゼーション配列間で相応に低い全体的相補性しか必要としない(1 X SSCは0.15 M NaCl、0.015 Mクエン酸Naである)。ハイブリダイズする核酸分子には、好適なストリンジェンシー条件下でアニールしかつ本開示の、5-フルオロシトシン(5-FC)から5-フルオロウラシル(5-flurouracil)(5-FU)への変換を触媒する能力などの同機能を有するポリペプチドまたは酵素をコードするものが含まれる。さらに、用語「ストリンジェントな条件下でハイブリダイズ」する、とは、互いに少なくとも30%、40%、50%、または60%相同なヌクレオチド配列が、典型的に、互いにハイブリダイズしたままである、ハイブリダイゼーションおよび洗浄条件を記載するものとする。好ましくは、該条件は、互いに少なくとも約70%、より好ましくは少なくとも約80%、さらにより好ましくは少なくとも約85%または90%相同な配列が、典型的に、互いにハイブリダイズしたままであるような条件である。一部の場合、本開示の単離された核酸分子は、配列番号4、12、14、16、または18のいずれかに記載のポリペプチドをコードするか、または配列番号3、5、11、13、15、または17のいずれかに記載のヌクレオチド配列を有する核酸配列に、ストリンジェントな条件下でハイブリダイズする。本明細書中で使用される「天然に存在する」核酸分子とは、天然に存在する(例えば天然タンパク質をコードする)ヌクレオチド配列を有するRNAまたはDNA分子を表す。
【0069】
配列番号2、4、6、8、10、12、14、16、または18のいずれかに記載のポリペプチドをコードするか、または配列番号1、3、5、7、9、11、13、15、または17のいずれかに記載のヌクレオチド配列を有する、任意のポリヌクレオチドのヌクレオチド配列内に突然変異によって変化を導入し、それによりコード化タンパク質のアミノ酸配列の変化を生じさせることができることを当業者は認識しているであろう。一部の場合、該変化はポリペプチドの機能の変化を生じさせる。他の場合、該変化は、コード化ポリペプチドの機能的能力を変化させない。一般に、ポリペプチドの機能を変化させない置換には、「非必須」アミノ酸残基においてアミノ酸置換を生じさせるヌクレオチド置換が含まれる。「非必須」アミノ酸残基は、例えば5-FCから5-FUへの変換を触媒する、得られるポリペプチドの生物学的活性を変化させることなく、親配列から改変できる残基である。
【0070】
また、親ポリペプチドの活性を、該ポリペプチドが特定の基質に対する新規または増加した活性、または増加した安定性または減少した分解を有するように変化させることが望ましい状況が想定される。これらのアミノ酸置換は、一般に、「保存的」置換を構成しないことが理解される。代わりに、これらの置換は、新規または改良した活性を取得するために配列に導入された非保存的置換を構成する。例えば、配列番号1はS. cervisaeシトシンデアミナーゼの親核酸配列を提供する(配列番号2は対応するポリペプチドを提供する)。配列番号3は、該ポリペプチドに、増加した安定性を付与するアミノ酸置換を含む突然変異体配列の核酸配列を提供する。したがって、配列番号2のアミノ酸配列をコードする核酸分子は「親」核酸分子を提供し、該親核酸分子から、突然変異を施して、アミノ酸置換を含む改変されたポリペプチドをコードする核酸分子を取得することができる。
【0071】
また、改変されたポリペプチドが「親」ポリペプチドを構成でき、該親ポリペプチドから、追加の置換を施すことができることが理解される。したがって、親ポリペプチド、および親ポリペプチドをコードする核酸分子には、改変されたポリペプチドが含まれ、「野生型」配列だけではない。例えば、配列番号5のポリヌクレオチドは、配列番号1(すなわち「親」ポリヌクレオチド)に対して改変されたポリヌクレオチドである。同様に、配列番号3のポリヌクレオチドは、配列番号5に対して改変されたポリヌクレオチドである。したがって、配列番号5は配列番号3の親配列である。
【0072】
多様性を生じさせる突然変異の方法には、例えば、部位特異的突然変異誘発(Ling et al. (1997) "Approaches to DNA mutagenesis: an overview" Anal Biochem. 254(2): 157-178; Dale et al. (1996) "Oligonucleotide-directed random mutagenesis using the phosphorothioate method" Methods Mol. Biol. 57:369-374; Smith (1985) "In vitro mutagenesis" Ann. Rev. Genet. 19:423-462; Botstein & Shortle (1985) "Strategies and applications of in vitro mutagenesis" Science 229:1193-1201; Carter (1986) "Site-directed mutagenesis" Biochem. J. 237:1-7; およびKunkel (1987) "The efficiency of oligonucleotide directed mutagenesis" in Nucleic Acids & Molecular Biology (Eckstein, F. and Lilley, D. M. J. eds., Springer Verlag, Berlin)); ウラシル含有鋳型を使用する突然変異誘発(Kunkel (1985) "Rapid and efficient site-specific mutagenesis without phenotypic selection" Proc. Natl. Acad. Sci. USA 82:488-492; Kunkel et al. (1987) "Rapid and efficient site-specific mutagenesis without phenotypic selection" Methods in Enzymol. 154, 367-382; およびBass et al. (1988) "Mutant Trp repressors with new DNA-binding specificities" Science 242:240-245); オリゴヌクレオチド特異的突然変異誘発(oligonucleotide-directed mutagenesis)(Methods in Enzymol. 100: 468-500 (1983); Methods in Enzymol. 154: 329-350 (1987); Zoller & Smith (1982) "Oligonucleotide-directed mutagenesis using M13-derived vectors: an efficient and general procedure for the production of point mutations in any DNA fragment" Nucleic Acids Res. 10:6487-6500; Zoller & Smith (1983) "Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13 vectors" Methods in Enzymol. 100:468-500; およびZoller & Smith (1987) "Oligonucleotide-directed mutagenesis: a simple method using two oligonucleotide primers and a single-stranded DNA template" Methods in Enzymol. 154:329-350); ホスホロチオアート修飾DNA突然変異誘発(Taylor et al. (1985) "The use of phosphorothioate-modified DNA in restriction enzyme reactions to prepare nicked DNA" Nucl. Acids Res. 13: 8749-8764; Taylor et al. (1985) "The rapid generation of oligonucleotide-directed mutations at high frequency using phosphorothioate-modified DNA" Nucl. Acids Res. 13: 8765-8787; Nakamaye & Eckstein (1986) "Inhibition of restriction endonuclease Nci I cleavage by phosphorothioate groups and its application to oligonucleotide-directed mutagenesis" Nucl. Acids Res. 14: 9679-9698; Sayers et al. (1988) "Y-T Exonucleases in phosphorothioate-based oligonucleotide-directed mutagenesis" Nucl. Acids Res. 16:791-802; およびSayers et al. (1988) "Strand specific cleavage of phosphorothioate-containing DNA by reaction with restriction endonucleases in the presence of ethidium bromide" Nucl. Acids Res. 16: 803-814); ギャップ二重鎖DNAを使用する突然変異誘発 (Kramer et al. (1984) "The gapped duplex DNA approach to oligonucleotide-directed mutation construction" Nucl. Acids Res. 12: 9441-9456; Kramer & Fritz (1987) Methods in Enzymol. "Oligonucleotide-directed construction of mutations via gapped duplex DNA" 154:350-367; Kramer et al. (1988) "Improved enzymatic in vitro reactions in the gapped duplex DNA approach to oligonucleotide-directed construction of mutations" Nucl. Acids Res. 16: 7207; およびFritz et al. (1988) "Oligonucleotide-directed construction of mutations: a gapped duplex DNA procedure without enzymatic reactions in vitro" Nucl. Acids Res. 16: 6987-6999)が含まれる。
【0073】
追加の好適な方法には、点ミスマッチ修復(Kramer et al. (1984) "Point Mismatch Repair" Cell 38:879-887)、修復欠損宿主株を使用する突然変異誘発(Carter et al. (1985) "Improved oligonucleotide site-directed mutagenesis using M13 vectors" Nucl. Acids Res. 13: 4431-4443; およびCarter (1987) "Improved oligonucleotide-directed mutagenesis using M13 vectors" Methods in Enzymol. 154: 382-403)、欠失突然変異誘発(Eghtedarzadeh & Henikoff (1986) "Use of oligonucleotides to generate large deletions" Nucl. Acids Res. 14: 5115)、制限選択および制限精製(Wells et al. (1986) "Importance of hydrogen-bond formation in stabilizing the transition state of subtilisin" Phil. Trans. R. Soc. Lond. A 317: 415-423)、トータル遺伝子合成による突然変異誘発(Nambiar et al. (1984) "Total synthesis and cloning of a gene coding for the ribonuclease S protein" Science 223: 1299-1301; Sakamar and Khorana (1988) "Total synthesis and expression of a gene for the a-subunit of bovine rod outer segment guanine nucleotide-binding protein (transducin)" Nucl. Acids Res. 14: 6361-6372; Wells et al. (1985) "Cassette mutagenesis: an efficient method for generation of multiple mutations at defined sites" Gene 34:315-323; およびGrundstrom et al. (1985) "Oligonucleotide-directed mutagenesis by microscale 'shot-gun' gene synthesis" Nucl. Acids Res. 13: 3305-3316); 二本鎖切断修復(Mandecki (1986); Arnold (1993) "Protein engineering for unusual environments" Current Opinion in Biotechnology 4:450-455; および"Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis" Proc. Natl. Acad. Sci. USA, 83:7177-7181)が含まれる。多数の上記方法に関する追加の詳細はMethods in Enzymology Volume 154に見出せる。該文献は、また、種々の突然変異誘発方法に伴う問題のトラブルシューティングに有用な制御を記載する。
【0074】
種々の多様性作製方法に関する追加の詳細は、以下のU.S.特許、PCT公開、およびEPO公開に見出せる: U.S. Pat. No. 5,605,793 to Stemmer (Feb. 25, 1997), "Methods for In vitro Recombination;" U.S. Pat. No. 5,811,238 to Stemmer et al. (Sep. 22, 1998) "Methods for Generating Polynucleotides having Desired Characteristics by Iterative Selection and Recombination;" U.S. Pat. No. 5,830,721 to Stemmer et al. (Nov. 3, 1998), "DNA Mutagenesis by Random Fragmentation and Reassembly;" U.S. Pat. No. 5,834,252 to Stemmer, et al. (Nov. 10, 1998) "End-Complementary Polymerase Reaction;" U.S. Pat. No. 5,837,458 to Minshull, et al. (Nov. 17, 1998), "Methods and Compositions for Cellular and Metabolic Engineering;" WO 95/22625, Stemmer and Crameri, "Mutagenesis by Random Fragmentation and Reassembly;" WO 96/33207 by Stemmer and Lipschutz "End Complementary Polymerase Chain Reaction;" WO 97/20078 by Stemmer and Crameri "Methods for Generating Polynucleotides having Desired Characteristics by Iterative Selection and Recombination;" WO 97/35966 by Minshull and Stemmer, "Methods and Compositions for Cellular and Metabolic Engineering;" WO 99/41402 by Punnonen et al. "Targeting of Genetic Vaccine Vectors;" WO 99/41383 by Punnonen et al. "Antigen Library Immunization;" WO 99/41369 by Punnonen et al. "Genetic Vaccine Vector Engineering;" WO 99/41368 by Punnonen et al. "Optimization of Immunomodulatory Properties of Genetic Vaccines;" EP 752008 by Stemmer and Crameri, "DNA Mutagenesis by Random Fragmentation and Reassembly;" EP 0932670 by Stemmer "Evolving Cellular DNA Uptake by Recursive Sequence Recombination;" WO 99/23107 by Stemmer et al., "Modification of Virus Tropism and Host Range by Viral Genome Shuffling;" WO 99/21979 by Apt et al., "Human Papillomavirus Vectors;" WO 98/31837 by del Cardayre et al. "Evolution of Whole Cells and Organisms by Recursive Sequence Recombination;" WO 98/27230 by Patten and Stemmer, "Methods and Compositions for Polypeptide Engineering;" WO 98/13487 by Stemmer et al., "Methods for Optimization of Gene Therapy by Recursive Sequence Shuffling and Selection;" WO 00/00632, "Methods for Generating Highly Diverse Libraries;" WO 00/09679, "Methods for Obtaining in vitro Recombined Polynucleotide Sequence Banks and Resulting Sequences;" WO 98/42832 by Arnold et al., "Recombination of Polynucleotide Sequences Using Random or Defined Primers;" WO 99/29902 by Arnold et al., "Method for Creating Polynucleotide and Polypeptide Sequences;" WO 98/41653 by Vind, "An in vitro Method for Construction of a DNA Library;" WO 98/41622 by Borchert et al., "Method for Constructing a Library Using DNA Shuffling;" WO 98/42727 by Pati and Zarling, "Sequence Alterations using Homologous Recombination;" WO 00/18906 by Patten et al., "Shuffling of Codon-Altered Genes;" WO 00/04190 by del Cardayre et al. "Evolution of Whole Cells and Organisms by Recursive Recombination;" WO 00/42561 by Crameri et al., "Oligonucleotide Mediated Nucleic Acid Recombination;" WO 00/42559 by Selifonov and Stemmer "Methods of Populating Data Structures for Use in Evolutionary Simulations;" WO 00/42560 by Selifonov et al., "Methods for Making Character Strings, Polynucleotides & Polypeptides Having Desired Characteristics;" WO 01/23401 by Welch et al., "Use of Codon-Varied Oligonucleotide Synthesis for Synthetic Shuffling;" およびWO 01/64864 "Single-Stranded Nucleic Acid Template-Mediated Recombination and Nucleic Acid Fragment Isolation" by Affholter。
【0075】
また、上で広く記載される1種以上の核酸配列を含む組み換え構築物を提供する。該構築物は、本開示のポリヌクレオチドがフォワードまたはリバース方向で挿入されているベクター、例えば、プラスミド、コスミド、ファージ、ウイルス、細菌性人工染色体(BAC)、酵母人工染色体(YAC)、ウイルスベクターなどを含む。多数の好適なベクターおよびプロモーターが当業者に公知であり、市販されている。一実施形態では、該ウイルスベクターはレトロウイルスベクターである。
【0076】
用語「ベクター」、「ベクター構築物」および「発現ベクター」とは、該宿主を形質転換し、導入配列の発現(例えば転写および翻訳)を促進するために、DNAまたはRNA配列(例えば外来遺伝子)を宿主細胞内に導入するのに用いられる運搬体を意味する。ベクターは、典型的に、制限酵素技術によってタンパク質をコードする外来DNAがその中に挿入される伝播性物質のDNAを含む。一般的なタイプのベクターは「プラスミド」であり、プラスミドは、概して、追加の(外来) DNAを容易に受容しかつ好適な宿主細胞に容易に導入できる二本鎖DNAの自己完結的分子である。プラスミドおよび真菌ベクターを含む多数のベクターが、種々の真核生物および原核生物宿主での複製および/または発現に関して報告されている。非限定的な例には、pKKプラスミド(Clonetech)、pUCプラスミド、pETプラスミド(Novagen, Inc., Madison, Wis.)、pRSETまたはpREPプラスミド(Invitrogen, San Diego, Calif.)、またはpMALプラスミド(New England Biolabs, Beverly, Mass.)、および、本明細書中で開示されるかもしくは引用されるかまたは他の様式で関連技術分野の当業者に公知である方法を使用する、多数の適切な宿主細胞が含まれる。組み換えクローニングベクターは、クローニングまたは発現のための1以上の複製系、宿主での選択のための1以上のマーカー、例えば抗生物質耐性、および1以上の発現カセットを含むことがよくある。
【0077】
用語「発現する」および「発現」とは、遺伝子またはDNA配列中の情報が顕在化するようにさせるかまたは引き起こすこと、例えば対応する遺伝子またはDNA配列の転写および翻訳に関与する細胞機能を活性化することによるタンパク質の生産、を意味する。DNA配列は、細胞中でまたは細胞によって発現されて、タンパク質などの「発現産物」を形成する。発現産物自体、例えば得られたタンパク質が、該細胞によって「発現された」と言ってもよい。ポリヌクレオチドまたはポリペプチドは、例えば、外来性宿主細胞中で外来性もしくは天然(native)プロモーターの制御下で、または天然(native)宿主細胞中で外来性プロモーターの制御下で発現または生産された場合に、組み換え的に発現される。
【0078】
本明細書中で提供されるポリヌクレオチドは、ポリペプチドの発現に好適な種々の発現ベクターのいずれかに組み込むことができる。好適なベクターには、染色体、非染色体および合成DNA配列、例えばSV40の誘導体; 細菌プラスミド; ファージDNA; バキュロウイルス; 酵母プラスミド; プラスミドおよびファージDNAの組み合わせに由来するベクター、ウイルスDNA、例えばワクシニア、アデノウイルス、鶏痘ウイルス、偽性狂犬病、アデノウイルス、アデノ随伴ウイルス、レトロウイルスおよび多数の他のものが含まれる。細胞内に遺伝物質を伝達し、かつ、複製が所望であれば、関連宿主中で複製適合性でかつ生存可能な任意のベクターを使用することができる。これらの核酸ベクターは、P.Midoux et al. Brit J Pharm 157: 166-178 2009またはKamimura & Liu J AAPS 10:589-595 (2008)に記載されるような非ウイルス性送達系または下記のようなウイルス系を使用して送達することができる。
【0079】
別の態様では、ウイルスまたはウイルス由来ベクターである遺伝子送達系によりシトシンデアミナーゼまたはその突然変異体をコードするポリヌクレオチドを送達する。ウイルスベクターは複製可能または複製不能であってよく、アデノウイルスベクター、麻疹ベクター、ヘルペスベクター、レトロウイルスベクター(レンチウイルスベクターを含む)、ラブドウイルスベクター、例えば水疱性口内炎ウイルスベクター、レオウイルスベクター、セネカバレーウイルスベクター、ポックスウイルスベクター(動物痘またはワクシニア由来ベクターを含む)、パルボウイルスベクター(AAVベクターを含む)、アルファウイルスベクターまたは当業者に公知の他のウイルスベクターであってよい(例えばConcepts in Genetic Medicine, ed. Boro Dropulic and Barrie Carter, Wiley, 2008, Hoboken, NJ.; The Development of Human Gene Therapy, ed. Theodore Friedmann, Cold Springs Harbor Laboratory Press, Cold springs Harbor, New York, 1999; Gene and Cell Therapy, ed. Nancy Smyth Templeton, Marcel Dekker Inc., New York, New York, 2000およびGene Therapy: Therapeutic Mechanism and Strategies, ed. Nancy Smyth Templetone and Danilo D Lasic, Marcel Dekker, Inc., New York, New York, 2000も参照のこと; 該文献の開示内容は参照によりここに組み入れられる)。
【0080】
一実施形態では、ウイルスベクターは、複製哺乳類細胞にのみ感染可能な複製適合性レトロウイルスベクターであってよい。レトロウイルスは種々の方法で分類されているが、命名法は過去10年間で標準化されてきた(ICTVdB - The Universal Virus Database, v 4 on the World Wide Web (www) at ncbi.nlm.nih.gov/ICTVdb/ICTVdB/ および教科書"Retroviruses" Eds Coffin, Hughs and Varmus, Cold Spring Harbor Press 1997を参照のこと; 該文献の開示内容は参照によりここに組み入れられる)。複製適合性レトロウイルスベクターは、オルソレトロウイルスまたは、より典型的には、ガンマレトロウイルスベクターを含んでよい。一態様では、複製適合性レトロウイルスベクターは、シトシンデアミナーゼをコードするポリヌクレオチドの5’側の内部リボソーム侵入部位(IRES)を含む。一実施形態では、シトシンデアミナーゼをコードするポリヌクレオチドはレトロウイルスベクターのENVポリヌクレオチドの3'側である。
【0081】
したがって、他の実施形態では、本開示のポリヌクレオチドを含むベクターを提供する。他の実施形態では、本開示の核酸分子、または本開示のポリヌクレオチドを含むベクターでトランスフェクトされた宿主細胞を提供する。宿主細胞には、真核細胞、例えば酵母細胞、昆虫細胞、または動物細胞が含まれる。宿主細胞にはまた、原核細胞、例えば細菌細胞も含まれる。
【0082】
以前に考察されるように、ベクター、プロモーターの使用および多数の他の関連トピックスを含む本明細書中で有用な分子生物学技術を記載する一般的テキストには、Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology Volume 152, (Academic Press, Inc., San Diego, Calif.) ("Berger"); Sambrook et al., Molecular Cloning--A Laboratory Manual, 2d ed., Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989 ("Sambrook")およびCurrent Protocols in Molecular Biology, F. M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., (supplemented through 1999) ("Ausubel")が含まれる。例えば本開示の相同的核酸の製造のための、ポリメラーゼ連鎖反応(PCR)、リガーゼ連鎖反応(LCR)、Qβ-レプリカーゼ増幅および他のRNAポリメラーゼ媒介性技術(例えばNASBA)を含むin vitro増幅法の全体にわたって当業者を導くために十分なプロトコールの例は、Berger, Sambrook, およびAusubel, ならびにMullis et al. (1987) U.S. Pat. No. 4,683,202; Innis et al., eds. (1990) PCR Protocols: A Guide to Methods and Applications (Academic Press Inc. San Diego, Calif.) ("Innis"); Arnheim & Levinson (Oct. 1, 1990) C&EN 36-47; The Journal Of NIH
Research (1991) 3: 81-94; Kwoh et al. (1989) Proc. Natl. Acad. Sci. USA 86: 1173; Guatelli et al. (1990) Proc. Nat'l. Acad. Sci. USA 87: 1874; Lomell et al. (1989) J. Clin. Chem 35: 1826; Landegren et al. (1988) Science 241: 1077-1080; Van Brunt (1990) Biotechnology 8: 291-294; Wu and Wallace (1989) Gene 4:560; Barringer et al. (1990) Gene 89:117; およびSooknanan and Malek (1995) Biotechnology 13: 563-564に見出せる。in vitro増幅核酸のクローニングのための改良された方法は、Wallace et al., U.S. Pat. No. 5,426,039に記載される。PCRによって大きい核酸を増幅するための改良された方法は、Cheng et al. (1994) Nature 369: 684-685および該文献中で引用される参考文献にまとめられ、該文献では、40 kbまでのPCRアンプリコンが作製される。逆転写酵素およびポリメラーゼを使用して、本質的に任意のRNAを、制限消化、PCRエクスパンションおよびシークエンシングに好適な二本鎖DNAに変換できることを当業者は認識するであろう。例えば、Ausubel、SambrookおよびBerger (すべて上記)を参照のこと。
【0083】
また、本明細書中で提供されるベクター(例えばクローニングベクターまたは発現ベクター)で形質導入(形質転換またはトランスフェクト)された、遺伝子工学的に操作された宿主細胞、ならびに組み換え技術による本開示のポリペプチドの製造を提供する。該ベクターは、例えば、プラスミド、ウイルス粒子、ファージ、などであってよい。該操作された宿主細胞は、プロモーターの活性化、形質転換体の選択、またはコードポリヌクレオチドの増幅のために必要に応じて改変された慣用の栄養培地で培養することができる。培養条件、例えば温度、pHなどは、発現のために選択された宿主細胞とともに以前に使用された培養条件であり、当業者には明らかであり、本明細書中に引用される参考文献、例えばSambrook、AusubelおよびBerger、ならびに例えばFreshney (1994) Culture of Animal Cells: A Manual of Basic Technique, 3rd ed. (Wiley-Liss, New York)および該文献中で引用される参考文献中で明らかである。
【0084】
ベクターを使用して、適切な宿主を形質転換し、宿主にタンパク質またはポリペプチドを発現させることができる。適切な発現宿主の例には、細菌細胞、例えば、E. coli、B. subtilis、ストレプトマイセス、およびSalmonella typhimurium; 真菌細胞、例えばSaccharomyces cerevisiae、Pichia pastoris、およびNeurospora crassa; 昆虫細胞、例えばショウジョウバエおよびSpodoptera frugiperda; 哺乳類細胞、例えばCHO、COS、BHK、HEK 293またはBowes黒色腫; または植物細胞または外植片、などが含まれる。
【0085】
細菌系では、シトシンデアミナーゼポリペプチドの意図される用途に応じて、いくつかの発現ベクターを選択することができる。例えば、商業的生産または抗体の誘導のために大量のCDポリペプチドまたはその断片が必要である場合、容易に精製できる融合タンパク質の高レベル発現を導くベクターが望ましい。そのようなベクターには、非限定的に、多機能性E. coliクローニングおよび発現ベクター、例えばBLUESCRIPT (Stratagene)、該ベクターでは、CDポリペプチドコード配列がアミノ末端Metおよびそれに続く7残基のベータ-ガラクトシダーゼの配列とインフレームでベクターにライゲートされ、ハイブリッドタンパク質が生産されるようにされる; pINベクター(Van Heeke & Schuster (1989) J. Biol. Chem. 264: 5503-5509); pETベクター(Novagen, Madison Wis.); などが含まれる。
【0086】
同様に、酵母Saccharomyces cerevisiaeでは、構成的または誘導性プロモーター、例えばアルファ因子、アルコールオキシダーゼおよびPGHを含むいくつかのベクターを本開示のCDポリペプチドの生産に使用することができる。レビューに関しては、Ausubel (上記)およびGrant et al. (1987) Methods in Enzymology 153:516-544を参照のこと。
【0087】
本開示はまた、以前のレトロウイルスベクターと比較して増加した安定性を有する複製適合性レトロウイルスベクターを提供する。感染および複製中のそのような増加した安定性は細胞増殖性障害の治療のために重要である。形質導入効率、導入遺伝子の安定性および標的選択性の組み合わせが複製適合性レトロウイルスによって提供される。該組成物および方法は挿入安定性を提供し、導入遺伝子の転写活性およびコード化ポリペプチドの翻訳生存性を維持する。
【0088】
レトロウイルスは水平伝播および垂直伝播することができる。レトロウイルスの効率的感染伝播は、ウイルスエンベロープタンパク質を特異的に認識する受容体の、標的細胞上での発現を必要とするが、ウイルスは、受容体非依存的、非特異的侵入経路を低い効率で使用することができる。さらに、標的細胞種は、ウイルスが結合および侵入した後に複製サイクルのすべての段階を支持することができなければならない。垂直伝播は、ウイルスゲノムが宿主の生殖系列中に組み込まれた場合に生じる。そしてプロウイルスは、細胞の遺伝子であるかのように、世代から世代へ継代する。ゆえに内因性プロウイルスは確立されて潜伏していることが多いが、宿主が適切な作用物質に曝露されると活性化される。
【0089】
上記のように、組み込まれたDNA中間体はプロウイルスと称される。先の遺伝子治療または遺伝子送達系では、混入ヘルパーウイルスの同時生産を伴わない、適切なヘルパーウイルスの存在下またはカプシド形成を可能にする適切な配列を含むセルライン中で、プロウイルスの転写および感染性ウイルスへの組み立てを必要とする方法およびレトロウイルスを使用する。下記のように、ヘルパーウイルスは、本開示の組み換えレトロウイルスの生産に必要とされないが、その理由は、カプシド形成のための配列がゲノム中で提供され、それによって遺伝子送達または治療のための複製適合性レトロウイルスベクターが提供されるからである。
【0090】
本開示の方法および組成物で有用なレトロウイルスゲノムは、少なくとも3つの遺伝子:gag、pol、およびenvを有するプロウイルスDNAを含み、これらの遺伝子には1または2つの長末端(LTR)反復配列が隣接するか、またはプロウイルス中で、2つの長末端反復配列(LTR)およびシス作用配列、例えばpsiを含む配列が該遺伝子に隣接している。gag遺伝子は内部構造(基質、カプシド、およびヌクレオカプシド)タンパク質をコードし; pol遺伝子は、RNA指向性DNAポリメラーゼ(逆転写酵素)、プロテアーゼおよびインテグラーゼをコードし; およびenv遺伝子はウイルスエンベロープ糖タンパク質をコードする。5'および/または3' LTRはビリオンRNAの転写およびポリアデニル化を促進する役目を果たす。該LTRはウイルス複製に必要なすべての他のシス作用配列を含む。レンチウイルスは追加の遺伝子を有し、それには、vif、vpr、tat、rev、vpu、nef、およびvpx (HIV-1、HIV-2および/またはSIV中)が含まれる。
【0091】
5' LTRに隣接して、ゲノムの逆転写に必要な配列(tRNAプライマー結合部位)およびウイルスRNAの粒子への効率的カプシド形成に必要な配列(Psi部位)がある。カプシド形成(または感染性ビリオンへのレトロウイルスRNAのパッケージング)に必要な配列がウイルスゲノムから失われていると、その結果は、ゲノムウイルスRNAのカプシド形成を妨げるシス欠損となる。このタイプの改変ベクターは、以前の遺伝子送達系(すなわち、ビリオンのカプシド形成に必要とされる要素を欠く系)で典型的に使用されているものである。
【0092】
一実施形態では、本開示は、非分裂細胞、分裂細胞、または細胞増殖性障害を有する細胞に感染可能な組み換えレトロウイルスを提供する。本開示の組み換え複製適合性レトロウイルスは、ビリオン内にカプセル封入されたウイルスGAG、ウイルスPOL、ウイルスENV、内部リボソーム侵入部位(IRES)に続く異種ポリヌクレオチドをコードするポリヌクレオチド配列を含む。
【0093】
異種核酸配列はIRESに作動可能に連結されている。本明細書中で使用される用語「異種」核酸配列または導入遺伝子とは、(i) 野生型レトロウイルスに通常存在しない配列、(ii) 他の生物種に由来する配列、または(iii) 同種由来である場合、その元の形態から実質的に改変されている可能性がある配列、を表す。あるいは、細胞で通常発現されない不変の核酸配列は異種核酸配列である。特定の実施形態では、異種ポリヌクレオチドは、シトシンデアミナーゼ活性を有する本開示のポリペプチドである。
【0094】
用語「非分裂」細胞とは、有糸分裂を経験しない細胞を表す。非分裂細胞は、細胞が活発に分裂していない限り、細胞周期の任意の時点(例えば、G0/G1、G1/S、G2/M)でブロックされる。ex vivo感染では、照射、アフィドコリン(aphidocolin)処理、血清飢餓、および接触阻害を含む、当業者によって使用される標準的技術によって分裂細胞を処理して、細胞分裂をブロックすることができる。しかし、ex vivo感染は、多数の細胞がすでに静止している(例えば幹細胞)ために、細胞をブロックすることなく実施されることがよくあることが理解されるべきである。例えば、組み換えレンチウイルスベクターは、細胞分裂をブロックするために使用される機構または細胞がブロックされる細胞周期の時点にかかわらず、任意の非分裂細胞に感染可能である。身体中の既存の非分裂細胞の例には、神経、筋肉、肝臓、皮膚、心臓、肺、および骨髄細胞、およびそれらの誘導体が含まれる。分裂細胞では、オンコレトロウイルスベクターを使用することができる。
【0095】
「分裂」細胞とは、活発な有糸分裂、または減数分裂を経験する細胞を意味する。そのような分裂細胞には、幹細胞、皮膚細胞(例えば、線維芽細胞およびケラチノサイト)、配偶子、および当技術分野で公知の他の分裂細胞が含まれる。細胞増殖性障害を有する細胞、例えば新生物細胞は特に興味深く、分裂細胞という用語に包含される。用語「細胞増殖性障害」とは、異常な数の細胞によって特徴付けられる状態を表す。該状態には、肥大性(組織内の細胞集団の過成長を生じさせる絶え間のない細胞増殖)および発育不全性(hypotrophic)(組織内の細胞の欠乏または欠損)細胞増殖の両者または、ある身体領域への過剰の細胞流入または遊走が含まれる。該細胞集団は、必ずしも、形質転換、腫瘍化または悪性細胞ではなく、正常細胞も同様に含まれる。細胞増殖性障害には、種々の線維性状態、例えば強皮症、関節炎および肝硬変などの結合組織の過成長に関連する障害が含まれる。細胞増殖性障害には、新生物障害、例えば頭頸部の癌腫が含まれる。頭部および頸部の癌腫には、例えば、口、食道、咽頭、喉頭、甲状腺、舌、唇、唾液腺、鼻、副鼻腔、上咽頭の癌腫、上鼻蓋(superior nasal vault)および洞の腫瘍、鼻腔神経芽細胞腫、扁平上皮癌(squamous call cancer)、悪性黒色腫、副鼻腔未分化癌(SNUC)、脳(グリア芽細胞腫を含む)または血液異常増殖が含まれる。また、頸部リンパ節、喉頭前リンパ節、肺食道傍リンパ節および顎下リンパ節を含む局所のリンパ節の癌腫が含まれる(Harrison's Principles of Internal Medicine (eds., Isselbacher, et al., McGraw-Hill, Inc., 13th Edition, ppl850-1853, 1994)。他の癌タイプには、非限定的に、肺癌、結腸-直腸癌、乳癌、前立腺癌、尿路癌、子宮癌リンパ腫、口腔癌、膵癌、白血病、黒色腫、胃癌、皮膚癌および卵巣癌が含まれる。
【0096】
一実施形態では、該ベクター内の異種ポリヌクレオチドは、ヒト細胞での発現に最適化されているシトシンデアミナーゼを含む。さらなる実施形態では、該シトシンデアミナーゼは、ヒトコドン最適化されていて、かつ、野生型シトシンデアミナーゼと比較して、シトシンデアミナーゼの安定性を増加(例えば分解の減少または熱安定性の増加)させる突然変異を含む配列を含む。さらに別の実施形態では、該異種ポリヌクレオチドは、UPRTまたはOPRT活性を有するポリペプチドをコードするポリヌクレオチドに作動可能に連結されたシトシンデアミナーゼ(ヒトコドン最適化型または非最適化型、突然変異型または非突然変異型)を含む融合構築物をコードする。別の実施形態では、該異種ポリヌクレオチドは、本開示のCDポリヌクレオチドまたは融合構築物(例えば、配列番号3、5、11、13、15、または17)を含む。
【0097】
別の実施形態では、複製適合性レトロウイルスベクターは、シトシンデアミナーゼを含むポリペプチドをコードする異種ポリヌクレオチド(本明細書中に記載される)を含むことができ、かつ細胞種または組織特異的プロモーターに連結されたmiRNAまたはsiRNA分子を含むポリヌクレオチドをさらに含んでよい。
【0098】
用語「調節性核酸配列」とは、レシピエント細胞でのコード配列の複製、転写および翻訳を包括的に提供する、プロモーター配列、ポリアデニル化シグナル、転写終結配列、上流調節ドメイン、複製起点、エンハンサーなどを包括的に表す。選択されたコード配列が適切な宿主細胞中で複製、転写、および翻訳可能である限り、これらの制御配列のすべてが常に存在する必要はない。当業者は公的データベースおよび材料から調節性核酸配列を容易に特定することができる。さらにまた、当業者は、例えば、in vivo、ex vivo、またはin vitroでの目的の用途に適用可能な調節配列を特定することができる。
【0099】
用語「プロモーター領域」は、DNA調節配列を含むヌクレオチド領域を表すために、その通常の意義で本明細書中で使用され、該調節配列は、遺伝子由来であり、RNAポリメラーゼと結合しかつ下流(3'方向)のコード配列の転写を開始させることが可能である。該調節配列は所望の遺伝子配列と同種または異種由来であってよい。例えば、広範囲のプロモーターを利用することができ、それには、上記のようなウイルスプロモーターまたは哺乳類プロモーターが含まれる。
【0100】
内部リボソーム侵入部位(「IRES」)とは、通常IRESの3'側のコード配列の翻訳中のリボソームの侵入または保持を促進する、核酸のセグメントを表す。一部の実施形態では、IRESはスプライスアクセプター/ドナー部位を含んでよいが、好ましいIRESはスプライスアクセプター/ドナー部位を欠く。通常、メッセンジャーRNAへのリボソームの侵入は、すべての真核生物mRNAの5'末端に位置するキャップを介して生じる。しかし、この汎用ルールの例外が存在する。一部のウイルスmRNAでキャップが不存在であることは、これらのRNAの内部部位でのリボソームの侵入を可能にする代替構造の存在を示唆する。現在までに、その機能によってIRESと称されるいくつかの前記構造が、特に、ポリオウイルス(Pelletier et al., 1988, Mol. Cell. Biol., 8, 1103-1112)およびEMCVウイルス(脳心筋炎ウイルス(Jang et al., J. Virol., 1988, 62, 2636-2643)などのピコルナウイルスのものなどの、キャップされていない(uncapped)ウイルスmRNAの5'非翻訳領域で特定されている。本開示は、複製適合性レトロウイルスベクターの関連でのIRESの使用を提供する。
【0101】
異種核酸配列は、典型的に、ウイルスLTRプロモーター・エンハンサーシグナルまたは内部プロモーターの制御下にあり、レトロウイルスLTR内の保持されたシグナルは宿主細胞ゲノムへのベクターの効率的組み込みを依然として生じさせることができる。したがって、本開示の組み換えレトロウイルスベクター、所望の配列、遺伝子および/または遺伝子断片を数個の部位で異なる調節配列の下で挿入することができる。例えば、挿入部位は、ウイルスエンハンサー/プロモーター近接部位(すなわち5' LTRによって駆動される遺伝子座)であってよい。あるいは、所望の配列を遠位部位(例えば、env遺伝子の3'側のIRES配列)に挿入することができ、または2以上の異種配列が存在する場合、1異種配列は第1の調節領域の制御下であり、かつ第2の異種配列は第2の調節領域の制御下であってよい。他の遠位部位には、ウイルスプロモーター配列が含まれ、所望の配列または配列群の発現がプロモーター近接シストロンのスプライシングによるものである場合、SV40またはCMVなどの内部異種プロモーター、または内部リボソーム侵入部位(IRES)を使用することができる。
【0102】
一実施形態では、本開示のレトロウイルスゲノムは、所望のポリヌクレオチド配列の挿入のためのクローニング部位を含むIRESを含む。一実施形態では、該IRESはレトロウイルスベクター中のenv遺伝子の3'側であるが、所望の異種核酸の5'側に位置する。状況に応じて、所望のポリペプチドをコードする異種ポリヌクレオチド配列はIRESに作動可能に連結することができる。
【0103】
別の実施形態では、ターゲティングポリヌクレオチド配列が、本開示の組み換えレトロウイルスベクターの部分として含まれる。該ターゲティングポリヌクレオチド配列は、ターゲティングリガンド(例えば、ペプチドホルモン、例えばヘレグリン、単鎖抗体、受容体または受容体リガンド)、組織特異的または細胞種特異的調節要素(例えば、組織特異的または細胞種特異的プロモーターまたはエンハンサー)、またはターゲティングリガンドと組織特異的/細胞種特異的調節要素の組み合わせである。好ましくは、ターゲティングリガンドは該レトロウイルスのenvタンパク質に作動可能に連結されて、キメラレトロウイルスenvタンパク質を創出する。ウイルスGAG、ウイルスPOLおよびウイルスENVタンパク質は、任意の好適なレトロウイルス由来(例えば、MLVまたはレンチウイルス由来)であってよい。別の実施形態では、該ウイルスENVタンパク質は非レトロウイルス由来(例えば、CMVまたはVSV)である。
【0104】
本開示の組み換えレトロウイルスは、したがって、該ウイルスが特定の細胞種(例えば、平滑筋細胞、肝細胞、腎細胞、線維芽細胞、ケラチノサイト、間葉系幹細胞、骨髄細胞、軟骨細胞、上皮細胞、腸細胞、新生物細胞、神経膠腫細胞、神経細胞および当技術分野で公知の他のもの)に向けられ、該核酸ゲノムが標的非分裂、標的分裂細胞、または細胞増殖性障害を有する標的細胞に送達されるように遺伝子改変される。ターゲティングは2つの方法で達成することができる。第1の方法は、ある分子を細胞の外面に有する細胞への結合によってレトロウイルスを標的細胞に導く。レトロウイルスをターゲティングするこの方法は、レトロウイルスの表面のターゲティングリガンドと相互作用する受容体または結合分子を有する細胞または組織へのウイルスのターゲティングを支援するためにレトロウイルスの被膜上のターゲティングリガンドの発現を利用する。ウイルスによる細胞への感染後、ウイルスはその核酸を細胞内に注入し、レトロウイルス遺伝物質が宿主細胞ゲノムに組み込まれる。第2のターゲティング方法は、以下でより完全に記載されるように、細胞特異的または組織特異的調節要素を使用して、該調節要素を活発に利用する標的にされた細胞中のウイルスゲノムの発現および転写を促進する。導入されたレトロウイルス遺伝物質は該宿主細胞内で転写され、タンパク質に翻訳される。該ターゲティング調節要素は、典型的に5'および/または3' LTRに連結され、キメラLTRを創出する。
【0105】
例えば特定の標的細胞上の受容体のリガンドをコードする別の遺伝子とともに、目的の異種核酸配列を本開示のウイルスベクターに挿入することによって、該ベクターは標的特異的になる。ウイルスベクターは、例えば、糖、糖脂質、またはタンパク質を取り付けることによって標的特異的にすることができる。ターゲティングは、抗体を使用してウイルスベクターをターゲティングすることによって達成することができる。目的の核酸配列を含むウイルスベクターの標的特異的送達を可能にするためにウイルスゲノムに挿入できる特定のポリヌクレオチド配列またはウイルスエンベロープに取り付けることができるタンパク質を当業者は承知するか、または容易に突きとめることができる。
【0106】
ゆえに、本開示は、一実施形態では、ターゲティングポリペプチドに作動可能に連結されたレトロウイルスenvタンパク質を含むキメラenvタンパク質を含む。該ターゲティングポリペプチドは、細胞特異的受容体分子、細胞特異的受容体のリガンド、細胞特異的抗原性エピトープに対する抗体もしくは抗体断片または、当技術分野で容易に特定できる、標的細胞と結合または相互作用可能な任意の他のリガンドであってよい。ターゲティングポリペプチドまたは分子の例には、ビオチン-ストレプトアビジンをリンカーとして使用する二価抗体(Etienne-Julan et al., J. Of General Virol., 73, 3251-3255 (1992); Roux et al., Proc. Natl. Acad. Sci USA 86, 9079-9083 (1989))、ハプテンに対する単鎖抗体可変領域をコードする配列を、そのエンベロープ中に含む組み換えウイルス(Russell et al., Nucleic Acids Research, 21, 1081-1085 (1993))、ペプチドホルモンリガンドのレトロウイルスエンベロープへのクローニング(Kasahara et al., Science, 266, 1373-1376 (1994))、キメラEPO/env構築物(Kasahara et al., 1994)、LDL受容体を発現するHeLa細胞の特異的感染を生じさせる、エコトロピックMLVエンベロープ中の低密度リポタンパク質(LDL)受容体に対する単鎖抗体(Somia et al., Proc. Natl. Acad. Sci USA, 92, 7570-7574 (1995))が含まれ、同様に、ALVの宿主クラスを、インテグリンリガンドを組み入れることによって改変して、該ウイルスが種を横断し、特にラットグリア芽細胞腫細胞に感染することを可能にすることができ(Valsesia-Wittmann et al., J. Virol. 68, 4609-4619 (1994))、ならびに、Dornberg and co-workers (Chu and Dornburg, J. Virol 69, 2659-2663 (1995))は、腫瘍マーカーを標的にする単鎖抗体を含むエンベロープを使用する、トリレトロウイルスである脾臓壊死ウイルス(SNV)の組織特異的ターゲティングを報告している。
【0107】
本開示は、標的細胞に感染可能な組み換えレトロウイルスの製造方法であって、ウイルスgag、ウイルスpolおよびウイルスenvをコードするポリヌクレオチド配列を含むベクター(このベクターは、調節性核酸配列に作動可能に連結された、異種遺伝子の導入のためのクローニング部位を含む)で好適な宿主細胞をトランスフェクトするステップ、および組み換えウイルスを回収するステップを含む、方法を提供する。
【0108】
本開示のレトロウイルスおよび方法は、増殖しかつビリオンを生産するためにヘルパーウイルスまたは追加の核酸配列またはタンパク質を必要としない複製適合性レトロウイルスを提供する。例えば、本開示のレトロウイルスの核酸配列は、例えば、上で考察されるように、グループ特異的抗原および逆転写酵素、(およびインテグラーゼおよびプロテアーゼ -成熟および逆転写に必要な酵素)をそれぞれコードする。ウイルスgagおよびpolは、レンチウイルス、例えばHIVまたはオンコウイルス、例えばMoMLV由来であってよい。さらに、本開示のレトロウイルスの核酸ゲノムは、ウイルスエンベロープ(ENV)タンパク質をコードする配列を含む。env遺伝子は任意のレトロウイルス由来であってよい。envは、ヒトおよび他の種の細胞の形質導入を可能にする両種性(amphotropic)エンベロープタンパク質であるか、またはマウスおよびラット細胞にのみ形質導入することができる同種性(ecotropic)エンベロープタンパク質であってよい。さらに、エンベロープタンパク質と抗体または、特定の細胞種の受容体へのターゲティングのための特定のリガンドとを連結することによって、組み換えウイルスをターゲティングにすることが望ましい。上記のように、レトロウイルスベクターは、例えば、糖脂質、またはタンパク質を挿入することによって標的特異的にすることができる。ターゲティングは、抗体を使用して、レトロウイルスベクターを特定の細胞種(例えば、特定の組織で見出される細胞種、または癌細胞種)上の抗原に向けることによって達成されることがよくある。特定の標的へのレトロウイルスベクターの送達を達成するための具体的方法を当業者は承知するか、または過度の実験を行うことなく容易に突きとめることができる。一実施形態では、env遺伝子は非レトロウイルス(例えば、CMVまたはVSV)由来である。レトロウイルス由来env遺伝子の例には、非限定的に: モロニーマウス白血病ウイルス(MoMuLV)、ハーベイマウス肉腫ウイルス(HaMuSV)、マウス乳癌ウイルス(MuMTV)、テナガザル白血病ウイルス(GaLV)、ヒト免疫不全ウイルス(HIV)およびラウス肉腫ウイルス(Rous Sarcoma Virus)(RSV)が含まれる。他のenv遺伝子、例えば水疱性口炎ウイルス(VSV)(プロテインG)、サイトメガロウイルスエンベロープ(CMV)、またはインフルエンザウイルス赤血球凝集素(HA)を使用することもできる。
【0109】
一実施形態では、レトロウイルスゲノムは、オンコレトロウイルスまたはガンマレトロウイルス、およびさらに具体的には哺乳類オンコレトロウイルスまたはガンマレトロウイルス由来である。「由来(派生)(derived)」は、親ポリヌクレオチド配列が野生型オンコウイルスであり、それが、天然に存在する配列の挿入または除去(例えば、IRESの挿入、例えば本開示のシトシンデアミナーゼ活性を有するポリペプチドをコードする異種ポリヌクレオチドの挿入、など)によって改変されていることを意味する。
【0110】
別の実施形態では、本開示は、調節配列を使用して標的化されたレトロウイルスベクターを提供する。細胞特異的または組織特異的調節配列(例えばプロモーター)を利用して、特定の細胞集団での遺伝子配列の発現を標的化することができる。本開示に好適な哺乳類プロモーターおよびウイルスプロモーターは本明細書中の他の箇所で記載される。したがって、一実施形態では、本開示は、レトロウイルスゲノムの5'末端に組織特異的プロモーター要素を有するレトロウイルスを提供する。好ましくは、該組織特異的調節要素/配列は、レトロウイルスゲノムのLTRのU3領域中であり、例えば新生物細胞に対する細胞特異的または組織特異的プロモーターおよびエンハンサー(例えば、腫瘍細胞特異的エンハンサーおよびプロモーター)、および誘導性プロモーター(例えばテトラサイクリン)を含む。
【0111】
一部の状況では、発現を調節することが望ましい。例えば、所望の発現レベルに応じて、種々の強度の活性を有する異なるウイルスプロモーターを利用することができる。哺乳類細胞では、CMV前初期プロモーターを使用して強力な転写活性化を提供することがよくある。あまり強力でないCMVプロモーターの改変バージョンも、導入遺伝子の低レベルの発現が所望である場合に使用されている。造血細胞での導入遺伝子の発現が所望である場合、レトロウイルスプロモーター、例えばMLVまたはMMTV由来のLTRを使用することができる。使用できる他のウイルスプロモーターには、SV40、RSV LTR、HIV-1およびHIV-2 LTR、アデノウイルスプロモーター、例えばE1A、E2A、またはMLP領域由来のプロモーター、AAV LTR、カリフラワーモザイクウイルス、HSV-TK、およびトリ肉腫ウイルスが含まれる。
【0112】
同様に、組織特異的または選択的プロモーターを使用して、非標的組織に対する潜在的な毒性または望ましくない影響を減少させるために、特定の組織または細胞で転写を達成することができる。例えば、PSA、プロバシン、前立腺酸性ホスファターゼまたは前立腺特異的腺性カリクレイン(hK2)などのプロモーターを使用して、前立腺での遺伝子発現を標的化することができる。使用できる他のプロモーター/調節ドメインは表1に記載される。
【0113】
特定の適応では、遺伝子治療ベクターの投与後の特定の時点で転写を活性化することが望ましい。これは、ホルモンまたはサイトカイン調節可能なプロモーターなどのプロモーターを用いて行うことができる。例えば、適応が、特定のステロイドが生産されるかまたは送られる生殖腺組織である治療用途では、アンドロゲンまたはエストロゲン調節プロモーターの使用が有益である。そのようなホルモン調節可能なプロモーターには、MMTV、MT-1、エクジソンおよびRuBiscoが含まれる。甲状腺、下垂体および副腎ホルモンに応答するプロモーターなどの他のホルモン調節プロモーターを使用してもよい。使用できるサイトカインおよび炎症性タンパク質応答性プロモーターには、KおよびTキニノゲン(Kageyama et al., 1987)、c-fos、TNF-アルファ、C-反応性タンパク質(Arcone et al., 1988)、ハプトグロビン(Oliviero et al., 1987)、血清アミロイドA2、C/EBPアルファ、IL-1、IL-6 (Poli and Cortese, 1989)、補体C3 (Wilson et al., 1990)、IL-8、アルファ-1酸糖タンパク質(Prowse and Baumann, 1988)、アルファ-1アンチチプシン(alpha-1 antitypsin)、リポタンパク質リパーゼ(Zechner et al., 1988)、アンギオテンシノゲン(Ron et al., 1990)、フィブリノーゲン、c-jun (ホルボールエステル、TNF-アルファ、UV照射、レチノイン酸、および過酸化水素によって誘導可能)、コラゲナーゼ(ホルボールエステルおよびレチノイン酸によって誘導される)、メタロチオネイン(重金属および糖質コルチコイド誘導性)、ストロメライシン(ホルボールエステル、インターロイキン-1およびEGFによって誘導可能)、アルファ-2マクログロブリンおよびアルファ-1アンチキモトリプシンが含まれる。腫瘍特異的プロモーター、例えばオステオカルシン、低酸素応答要素(HRE)、MAGE-4、CEA、アルファ-フェトプロテイン、GRP78/BiPおよびチロシナーゼを使用して、腫瘍細胞での遺伝子発現を調節してもよい。
【0114】
さらに、このプロモーターのリストは、網羅的または限定的であると解釈されるべきではなく、本明細書中で開示されるプロモーターおよび方法とともに使用してよい他のプロモーターを当業者は承知する。
【0115】
表1 組織特異的プロモーター
組織 プロモーター
膵臓 インスリン エラスチン アミラーゼ
pdr-1 pdx-1 グルコキナーゼ
肝臓 アルブミン PEPCK HBVエンハンサー
αフェトプロテイン アポリポタンパク質C α-1
アンチトリプシン ビテロゲニン, NF-AB
トランスチレチン
骨格筋 ミオシンH鎖 筋クレアチンキナーゼ
ジストロフィン カルパインp94 骨格
アルファ-アクチン 速筋トロポニン1 (fast troponin 1)
皮膚 ケラチンK6 ケラチンK1
肺 CFTRヒトサイトケラチン18 (K18)
肺サーファクタントタンパク質A, BおよびC CC-10 P1
平滑筋 sm22 α SM-アルファ-アクチン
内皮 エンドセリン-1 E-セレクチン フォン
ウィルブランド因子 TIE, KDR/flk-1
メラノサイト チロシナーゼ
脂肪組織 リポタンパク質リパーゼ(Zechner et al., 1988)
アジプシン(Spiegelman et al., 1989)
アセチル-CoAカルボキシラーゼ(Pape and Kim, 1989)
グリセロリン酸デヒドロゲナーゼ(Dani et al., 1989)
脂肪細胞P2 (Hunt et al., 1986)
乳房 乳清酸性タンパク質(WAP)(Andres et al. PNAS 84:1299-1303 1987
血液 β-グロビン
【0116】
「組織特異的調節要素」は、一組織において遺伝子の転写を駆動可能であり、他の組織タイプでは大部分は「サイレント」のままである調節要素(例えばプロモーター)である。しかし、組織特異的プロモーターは、それらがサイレントである組織において検出可能な量の「バックグラウンド」または「基底」活性を有することが理解される。プロモーターが標的組織で選択的に活性化される程度は、選択比(標的組織での活性/コントロール組織での活性)として表記することができる。この関連で、本開示の実施で有用な組織特異的プロモーターは、典型的に、約5より大きい選択比を有する。好ましくは、該選択比は約15より大きい。
【0117】
さらに、単一組織タイプに活性が制限されない特定のプロモーターは、それにもかかわらず、それらが一群の組織で活性であり、かつ別の群であまり活性でないかまたはサイレントである点で選択性を示すことが理解される。そのようなプロモーターもまた、「組織特異的」と称され、本開示とともに使用することが想定される。したがって、本開示で使用される組織特異的調節要素は、本開示のシトシンデアミナーゼ活性を有するポリペプチドなどの異種タンパク質の調節への適用可能性ならびにレトロウイルスベクター中のターゲティングポリヌクレオチド配列としての適用可能性を有する。
【0118】
本開示のレトロウイルスベクターおよびCDポリヌクレオチドおよびポリペプチドを使用して、多数の細胞増殖性疾患および障害を含む広範囲の疾患および障害を治療することができる(例えばU.S. Pat. Nos. 4,405,712および4,650,764; Friedmann, 1989, Science, 244:1275-1281; Mulligan, 1993, Science, 260:926-932, R. Crystal, 1995, Science 270:404-410 (各文献は参照によりその全体がここに組み入れられる)を参照のこと; さらにThe Development of Human Gene Therapy, Theodore Friedmann, Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1999. ISBN 0-87969-528-5 (該文献は参照によりその全体がここに組み入れられる)を参照のこと)。
【0119】
本開示はまた、細胞増殖性障害の治療のための遺伝子治療を提供する。そのような治療は、適切な治療用ポリヌクレオチド配列(例えば、シトシンデアミナーゼ活性を有する本開示のポリペプチド)を、増殖性障害を有する被験体の細胞に導入することによってその治療効果を達成する。ポリヌクレオチド構築物の送達は、本開示の組み換えレトロウイルスベクターを使用して達成することができる。
【0120】
さらに、本明細書中に記載の治療方法(例えば、遺伝子治療または遺伝子送達方法)はin vivoまたはex vivoで実施することができる。例えば、細胞増殖性疾患または障害の治療のための方法では、例えば外科的にまたは照射によって遺伝子治療前に大多数の腫瘍を除去することが有用である。一部の実施形態では、レトロウイルス療法の前またはその後に化学療法を実施する。
【0121】
ゆえに、本開示は、非分裂細胞、分裂細胞または新生物細胞に感染可能な組み換えレトロウイルスであって、ウイルスGAG; ウイルスPOL; ウイルスENV; IRESに作動可能に連結された異種核酸(例えば、シトシンデアミナーゼ活性を有する本開示のポリペプチドを含む); およびパッケージング、逆転写および組み込みに必要なシス作用性核酸配列を含む、組み換えレトロウイルスを提供する。該組み換えレトロウイルスはHIVなどのレンチウイルスであるか、またはオンコウイルスであってよい。組み換えレトロウイルスの製造方法に関して上記のように、本開示の組み換えレトロウイルスは、さらに、VPR、VIF、NEF、VPX、TAT、REV、およびVPUタンパク質の少なくとも1つを含んでよい。特定の理論によって拘束されることを望まないが、1種以上のこれらの遺伝子/タンパク質産物は、生産される組み換えレトロウイルスのウイルス力価を増加させるために重要である(例えばNEF)か、またはビリオンの感染およびパッケージングに必要であると考えられる。
【0122】
本開示はまた、特定の核酸(例えば、シトシンデアミナーゼ活性を有するポリペプチドをコードするポリヌクレオチドなどの異種配列)の発現を提供するための標的細胞への核酸導入方法を提供する。したがって、別の実施形態では、本開示は、標的細胞での異種核酸の導入および発現のための方法であって、本開示の組み換えウイルスを標的細胞に感染させるステップおよび標的細胞で異種核酸を発現させるステップを含む、方法を提供する。上記のように、該標的細胞は、それらにレトロウイルスが感染可能である限り、分裂、非分裂、新生物、不死化、改変および、当業者によって認識される他の細胞種を含む任意の細胞種であってよい。
【0123】
本開示はまた、細胞増殖性または免疫性障害の治療のための遺伝子治療を提供する。一実施形態では、本開示のCDポリヌクレオチドを導入し、ポリヌクレオチドを発現させてシトシンデアミナーゼ活性を含むポリペプチドを生産させ、かつ細胞を、細胞傷害量の5-FUを生産するための量および期間で5-フルオロシトシンと接触させることによって細胞増殖性障害を治療する。
【0124】
さらに、本開示は、本開示の組み換えレトロウイルスベクターをコードするポリヌクレオチド配列を提供する。該ポリヌクレオチド配列を種々のウイルス粒子に組み入れることができる。例えば、遺伝子治療に利用できる種々のウイルスベクターには、アデノウイルス、ヘルペスウイルス、ワクシニア、または、好ましくは、RNAウイルス、例えばレトロウイルスおよび、さらに具体的には、哺乳類オンコウイルスが含まれる。レトロウイルスベクターはマウス、サルまたはヒトレトロウイルスの誘導体であってよい。外来遺伝子(例えば異種ポリヌクレオチド配列)を挿入できるレトロウイルスベクターの例には、非限定的に、モロニーマウス白血病ウイルス(MoMuLV)、ハーベイマウス肉腫ウイルス(HaMuSV)、マウス乳癌ウイルス(MuMTV)、およびラウス肉腫ウイルス(RSV)の誘導体が含まれる。すべてのこれらのベクターは、選択マーカー遺伝子を導入または組み入れて、形質導入された細胞が特定および作製できるようにすることができる。さらに別の実施形態では、本開示は、組み換えレトロウイルス派生構築物を含むプラスミドを提供する。該プラスミドは、標的細胞または細胞培養物、例えばNIH 3T3、HT1080 (ヒト)、CF2 (イヌ)または他の組織培養細胞に直接導入することができる。得られた細胞はレトロウイルスベクターを培養培地に放出する。
【0125】
本開示は、5'から3'方向に、転写の開始に有用なプロモーターまたは調節領域; psiパッケージングシグナル; gagコード核酸配列、polコード核酸配列; envコード核酸配列; 内部リボソーム侵入部位核酸配列; マーカー、治療用(例えばシトシンデアミナーゼ活性を有するポリペプチド)または診断用ポリペプチドをコードする異種ポリヌクレオチド; およびLTR核酸配列を含むポリヌクレオチド構築物を提供する。特定の実施形態では、シトシンデアミナーゼ活性を有するポリペプチドをコードする異種ポリヌクレオチドは、さらに、UPRTまたはOPRT活性を含むポリペプチドをコードするドメインを含んでよい。
【0126】
本明細書中の他の箇所で記載されかつ以下のように、本開示のポリヌクレオチド構築物(例えば組み換え複製適合性レトロウイルスポリヌクレオチド)の種々のセグメントを、所望の宿主細胞、発現タイミングまたは量、および該異種ポリヌクレオチドに部分的に応じて操作する。本開示の複製適合性レトロウイルス構築物はいくつかのドメインに分けることができ、該ドメインを当業者は個別に改変することができる。
【0127】
例えば、該プロモーターは、配列番号19、20、または22のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を有するCMVプロモーターを含んでよく、改変されたプロモーターが転写を誘導し開始させることが可能である限り、1以上(例えば、2〜5、5〜10、10〜20、20〜30、30〜50、50〜100またはそれ以上の核酸塩基)に対する改変を含んでよい。一実施形態では、該プロモーターまたは調節領域はCMV-R-U5ドメインポリヌクレオチドを含む。CMV-R-U5ドメインは、MLV R-U5領域に対して、ヒトサイトメガロウイルス由来の前初期プロモーターを含む。一実施形態では、CMV-R-U5ドメインポリヌクレオチドは、配列番号19、20、または22のヌクレオチド約1位〜ヌクレオチド約1202位に記載の配列または、配列番号19、20、または22に記載の配列と少なくとも95%同一の配列を含み、ここで該ポリヌクレオチドはそれに作動可能に連結された核酸分子の転写を促進する。該ポリヌクレオチドのgagドメインは任意の数のレトロウイルス由来であってよいが、典型的に、オンコレトロウイルス由来であり、さらに具体的には、哺乳類オンコレトロウイルス由来である。一実施形態では、該gagドメインはヌクレオチド番号約1203位〜ヌクレオチド約2819位の配列または、それに対して少なくとも95%、98%、99%または99.8% (最も近い10thに端数を丸めている)の同一性を有する配列を含む。該ポリヌクレオチドのpolドメインは任意の数のレトロウイルス由来であってよいが、典型的に、オンコレトロウイルス由来であり、さらに具体的には、哺乳類オンコレトロウイルス由来である。一実施形態では、該polドメインはヌクレオチド番号約2820位〜ヌクレオチド約6358位の配列または、それに対して少なくとも95%、98%、99%または99.9% (最も近い10thに端数を丸めている)の同一性を有する配列を含む。該ポリヌクレオチドのenvドメインは任意の数のレトロウイルス由来であってよいが、典型的に、オンコレトロウイルス由来であり、さらに具体的には、哺乳類オンコレトロウイルス由来である。一部の実施形態では、該envコードドメインは両種性envドメインを含む。一実施形態では、該envドメインはヌクレオチド番号約6359位〜ヌクレオチド約8323位の配列または、それに対して少なくとも95%、98%、99%または99.8% (最も近い10thに端数を丸めている)の同一性を有する配列を含む。該ポリヌクレオチドのIRESドメインは、任意の数の内部リボソーム侵入部位から取得することができる。一実施形態では、IRESは脳心筋炎ウイルス由来である。一実施形態では、該IRESドメインは、ドメインがリボソームの侵入を可能にする限り、ヌクレオチド番号約8327位〜ヌクレオチド約8876位の配列または、それに対して少なくとも95%、98%、または99% (最も近い10thに端数を丸めている)の同一性を有する配列を含む。該異種ドメインは本開示のシトシンデアミナーゼを含んでよい。一実施形態では、該CDポリヌクレオチドはヒトコドン最適化配列を含む。さらに別の実施形態では、該CDポリヌクレオチドは、シトシンデアミナーゼを有する突然変異体ポリペプチドをコードし、ここに該突然変異は、広い温度範囲にわたって持続した動力学的活性を可能にする、融解温度(Tm)を10℃高める熱安定化の増加およびタンパク質の蓄積レベルの増加を付与する。一実施形態では、該シトシンデアミナーゼは、配列番号19のヌクレオチド番号約8877位〜約9353位に記載の配列を含む。ポリプリンリッチドメインが該異種ドメインに続いてもよい。3' LTRは、任意の数のレトロウイルス、典型的にオンコレトロウイルスおよび好ましくは哺乳類オンコレトロウイルス由来であってよい。一実施形態では、該3' LTRはU3-R-U5ドメインを含む。さらに別の実施形態では、該LTRは、配列番号19のヌクレオチド約9405位〜約9998位に記載の配列または、それに対して少なくとも95%、98%または99.5% (最も近い10thに端数を丸めている)同一の配列を含む。
【0128】
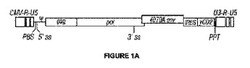
本開示はまた、5'から3'方向に、CMV-R-U5、ヒトサイトメガロウイルス由来の前初期プロモーターとMLV R-U5領域との融合物; PBS、逆転写酵素のためのプライマー結合部位; 5'スプライス部位; Ψパッケージングシグナル; gag、MLV群特異的抗原のORF; pol、MLVポリメラーゼポリプロテインのORF; 3'スプライス部位; 4070A env、MLV 4070A系統のエンベロープタンパク質のORF; IRES、脳心筋炎ウイルスの内部リボソーム侵入部位; 改変されたシトシンデアミナーゼ(熱安定化およびコドン最適化); PPT、ポリプリントラクト; およびU3-R-U5、MLV長末端反復配列を含む組み換えレトロウイルスベクターを提供する。この構造を図1にさらに示す。
【0129】
本開示はまた、配列番号19、20、または22に記載の配列を含むレトロウイルスベクターを提供する。
【0130】
別の実施形態では、本開示は、細胞増殖性障害を有する被験体の治療方法を提供する。該被験体は任意の哺乳類であってよく、好ましくはヒトである。該被験体を、本開示の組み換え複製適合性レトロウイルスベクターと接触させる。該接触はin vivoまたはex vivoであってよい。本開示のレトロウイルスベクターを投与する方法は当技術分野で公知であり、それには、例えば、全身投与、局所投与、腹腔内投与、筋肉内投与、頭蓋内、脳脊髄、ならびに腫瘍または細胞増殖性障害の部位での直接投与が含まれる。他の投与経路は当技術分野で公知である。
【0131】
ゆえに、本開示は、細胞増殖性障害を治療するために有用な種々の医薬組成物を含む。本開示の医薬組成物は、担体、賦形剤および添加物または補助物質を使用して、本開示に基づく細胞増殖性障害の治療または調節に有用な異種ポリヌクレオチド配列を含むレトロウイルスベクターを、被験体への投与に好適な形態にすることによって製造される。頻繁に使用される担体または補助物質には、炭酸マグネシウム、二酸化チタン、ラクトース、マンニトールおよび他の糖、タルク、乳タンパク質、ゼラチン、デンプン、ビタミン、セルロースおよびその誘導体、動物油および植物油、ポリエチレングリコールおよび溶媒、例えば滅菌水、アルコール、グリセロールおよび多価アルコールが含まれる。静脈内ビヒクルには、液体および栄養分補充液(nutrient replenishers)が含まれる。保存剤には、抗菌剤、抗酸化剤、キレート剤および不活性ガスが含まれる。他の製薬的に許容される担体には、例えばRemington's Pharmaceutical Sciences, 15th ed. Easton: Mack Publishing Co., 1405-1412, 1461-1487 (1975)およびThe National Formulary XIV., 14th ed. Washington: American Pharmaceutical Association (1975)(該文献の内容は参照によりここに組み入れられる)に記載のように、水性溶液、無毒の賦形剤、例えば、塩、保存剤、バッファーなどが含まれる。医薬組成物のpHおよび種々の成分の正確な濃度は、当技術分野の慣用的技術にしたがって調節される。Goodman and Gilman's The Pharmacological Basis for Therapeutics (7th ed.)を参照のこと。
【0132】
例えば、限定目的でなく、細胞増殖性障害の治療に有用なレトロウイルスベクターは、両種性ENVタンパク質、GAG、およびPOLタンパク質、U3領域レトロウイルスゲノム中のプロモーター配列、およびレトロウイルスのゲノムの複製、パッケージングおよび標的細胞への組み込みに必要なすべてのシス作用配列を含む。
【0133】
以下の実施例は本開示を説明するためのものであり、限定するためのものではない。そのような実施例は、使用することができる実施例の典型であり、当業者に公知の他の手順を代わりに利用してもよい。
【0134】
実施例
【実施例1】
【0135】
実施例1 改変されたCD遺伝子の構築およびプラスミドベクターへの挿入
野生型酵母シトシンデアミナーゼ遺伝子に対する遺伝子強化は、(1) 3つのアミノ酸を変化させて(A23L、I140LおよびV108I)、酵母シトシンデアミナーゼタンパク質の熱安定性を増加させる、3つの位置の突然変異、および(2) アミノ酸配列をさらに変化させることなくヒト細胞でのタンパク質翻訳効率を向上させるヒトコドン使用配列を強化するための追加の遺伝子配列改変を含むように施された。
【0136】
CDの配列設計は、最適化CD、CD-UPRT (+/-リンカー)およびCD-OPRTアーゼ(+/-リンカー)を含んだ。最終シトシンデアミナーゼコード配列は、PSI1/Not1カセットに基づくストラテジーのため、5'末端にPSI1部位(全長)ならびに3'末端にNot1部位およびポリA尾部を含みうる。
【0137】
酵母シトシンデアミナーゼを含む以下の配列を、クローニング、最適化および突然変異に使用した(ボックスで囲まれた核酸は、後の方法でクローニングに使用される制限部位を含む)。

【0138】
以下の表は、作製された遺伝子および得られたプラスミドベクターならびにそれらの名称をまとめる。
【表2】

【0139】
Kasahara et al.によって報告された複製適合性レトロウイルスベクター、pACE-CD (米国特許第6,899,871号、該文献の開示内容はここに組み入れられる)を追加の改変の基礎として使用した。本明細書中に記載の改変された酵母シトシンデアミナーゼ遺伝子を発現するようにベクター(pAC3-yCD)を改変し、構築物中で使用した。最初にトランスフェクトした複製適合性レトロウイルスのためのベクター構築物の図に関しては、下記の1Aを参照のこと。CMVはヒトCMV前初期プロモーターであり、U3、RおよびU5は、ウイルス長末端反復配列(LTR)の対応する領域である。gag、polおよびenvはウイルスタンパク質コード領域である。1Bおよび1Dは本開示のプラスミド構造および配列を示す。受託業者(Bio Basic Inc., Markham, Ontario, Canada)で遺伝子が合成された後、それらをpAC3ベクター主鎖のPsi1-Not1部位に挿入した(図1)。該プラスミド主鎖は、プラスミドpAC3-eGFPをPsi1およびNot1で切断し、プラスミドおよびレトロウイルスの主鎖をコードする大きい(約11kb)断片を精製することによって通常通り作製された。
【0140】
A. ヒト化コドン最適化CD遺伝子(CDopt,aka CD1, T5.0001)
Conrad et al.およびPCT WO 99/60008のヒトコドン最適化シトシンデアミナーゼの比較は、両者で、最適化された合計91個のコドンを示し、36個のコドンは同一であり、47個のコドンは3番目の塩基対の変化を有し(すべて同一のアミノ酸をコードする)、および9個のコドンは異なった(しかし、それらは同一のアミノ酸をコードした)。異なっていた9個のコドンは:
AGC (Ser) から TCC (Ser)へ
CGT (Arg) から AGG (Arg)へ
CCA (Pro) から CCT (Pro)への変化であった。
【0141】
すべて同等のGC含量を有し、かつ同一アミノ酸をコードする。
【0142】
上記天然(native)酵母遺伝子配列を別途コドン最適化して以下のCD遺伝子(CD1)を得て、IRESを有する複製適合性レトロウイルス(RCR)をコードするプラスミドベクターpAC3に挿入された場合にT5.0001と称した。
【0143】

【0144】
B. 熱安定化CD遺伝子
追加の改変を施してシトシンデアミナーゼの安定性を高めた。3つのアミノ酸を変化させて(A23L、I140LおよびV108I)酵母シトシンデアミナーゼタンパク質の熱安定性を増加させる3つの位置の突然変異を含むように野生型酵母シトシンデアミナーゼ遺伝子に対する遺伝子強化を施した。
【0145】
本開示のシトシンデアミナーゼポリペプチドの遺伝子の作製に以下のプライマーペアを使用した。
センス: 5'-tcgaggatatcggcgagtgaaacccgttattctttttggc-3' (配列番号25)
アンチセンス: 5'-gccaaaaagaataacgggtttcactcgccgatatcctcga-3'(配列番号26)
センス: 5'tcggcgagtgatccggcggcggcgcctccggcggcggcgcctccggcggcggcgcctccggcggcggcgccaacccgttatt-3'(配列番号27)
アンチセンス:5'-aataacgggttggcgccgccgccggaggcgccgccgccggaggcgccgccgccggaggcgccgccgccggatcactcgccga-3'(配列番号28)。
【0146】
天然(native)酵母CDの安定性を増加させるために、3つのアミノ酸置換をタンパク質中に組み込んだ。これらの置換は単独で、またはヒトコドン最適化と組み合わせた。
【0147】
該3つのアミノ酸置換は、A23L、V108I、I140Lである。これらの置換をコードする配列を以下に示す。

【0148】
そのコード化ポリペプチドは、以下の配列(置換アミノ酸は太字で下線が付されている)を含む。

【0149】
最終構築物設計は優先コドンを利用する3つのアミノ酸置換A23L/V108I/I140Lを組み込みかつ配列全体について優先ヒトコドン使用を用いる(この遺伝子はCDopt+3pt [別名CD2]と称され、IRESを有するRCRをコードするプラスミドベクターpAC3に挿入された場合T5.0002と称される)(配列番号34)。
1 ATGGTGACCGGCGGCATGGCCTCCAAGTGGGATCAAAAGGGCATGGATATCGCTTACGAG
61 GAGGCCCTGCTGGGCTACAAGGAGGGCGGCGTGCCTATCGGCGGCTGTCTGATCAACAAC
121 AAGGACGGCAGTGTGCTGGGCAGGGGCCACAACATGAGGTTCCAGAAGGGCTCCGCCACC
181 CTGCACGGCGAGATCTCCACCCTGGAGAACTGTGGCAGGCTGGAGGGCAAGGTGTACAAG
241 GACACCACCCTGTACACCACCCTGTCCCCTTGTGACATGTGTACCGGCGCTATCATCATG
301 TACGGCATCCCTAGGTGTGTGATCGGCGAGAACGTGAACTTCAAGTCCAAGGGCGAGAAG
361 TACCTGCAAACCAGGGGCCACGAGGTGGTGGTTGTTGACGATGAGAGGTGTAAGAAGCTG
421 ATGAAGCAGTTCATCGACGAGAGGCCTCAGGACTGGTTCGAGGATATCGGCGAGTGATAA
下線が付されたコドンはアミノ酸置換に関して優先コドンを示す。
【0150】
CD最適化配列設計(ヒトコドン優先+ 3つのアミノ酸置換)

【0151】
C. CD-UPRT融合遺伝子(CDopt+3pt-UPRT, [別名 CDopt-UPRTおよびCD2-UPRT], pAC3プラスミドRCRベクター中でT5.0003)の構築
また、図2Aに記載のスキームIを使用して最適化CD-UPRT配列を作製するためにUPRTポリペプチドに連結された上記CDポリペプチドを含む融合構築物を開発した。以下のプライマーを使用して、CDとUPRTとの間の終止-開始を除去した。
【表3】

【0152】
得られた融合ポリヌクレオチドは1296 bpを有し、直下に記載の配列を含む:

【0153】
D. CD-リンカーUPRT融合遺伝子(CDopt+3pt-LINK-UPRT [別名 CDopt-LINKER-UPRTおよびCD2-L-UPRT])の構築。
また、2Bに記載のスキームIIを使用して最適化CD-リンカー-UPRT配列を作製するために、CDポリペプチドとUPRTポリペプチドとの間にインフレームでリンカー(Ser-Gly-Gly-Gly-Gly)4ドメインをクローニングすることによって融合構築物を開発した。以下のプライマーを使用してリンカーを挿入した。
【表4】

【0154】
得られた構築物は1356 bpのサイズおよび直下の配列を有する:

【0155】
E. CD-OPRT融合遺伝子(CDopt+3pt-OPRT [別名 CDopt-OPRTおよびCD2-OPRT], pAC3プラスミドRCRベクターに挿入された場合T5.0004)の構築
また、図2Cに示されるスキームIIIを使用して最適化CD-OPRTアーゼ(ヒト化CD+3pt突然変異+OPRTアーゼヒト機能性ドメイン)を作製するために、OPRTポリペプチドに連結された上記CDポリペプチドを含む融合構築物を開発した。
【0156】
得られた構築物は1269 bpのサイズおよび直下の配列を含む:

【0157】
F. CD-リンカー-OPRT融合遺伝子(CDopt+3pt-LINK-OPRT, [別名 CDopt-リンカー-OPRTおよびCD2-L-OPRT], pAC3プラスミドRCRベクター中でT5.0005)の構築
また、図2Dに示されるスキームIVを使用して最適化CD-リンカー-OPRT配列を作製するために、CDポリペプチドとOPRTポリペプチドとの間にインフレームでリンカー(Ser-Gly-Gly-Gly-Gly)4ドメインをクローニングすることによって融合構築物を開発した。
【0158】
得られた構築物は1329 bpのサイズおよび直下の配列を含む:

【実施例2】
【0159】
実施例2 感染性ベクターの製造
いくつかの方法でベクターを製造することができるが、第1のステップは、プラスミドDNAベクターを細胞に導入して感染性粒子を生産させることであり、そして該粒子は細胞上清から回収することができる。いったん感染性粒子が作製されれば、当業者は他の製造方法を実施することができる。293T細胞の一時的トランスフェクションによってベクター粒子を作製した(Pear et al. Proc Natl Acad Sci U S A. 90:8392-8396 1993)。該293T細胞を解凍し、培養し、次いで、DMEM High Glucose培地(Hyclone# 30081, 500 mL)をFBS (Hyclone# SH30070, 50 mL)、L-グルタミン(Cellgro# 25-005-CI, 5 mL)、NEAA (Hyclone #SH30238, 5 mL)、およびPenicillin-strep (Cellgro# 30-002-CI, 5 mL)と混合することによって製造された15 mLのDMEM培地を含むT-75フラスコ中で2回継代した。フラスコを37℃、5% CO2でインキュベートした。3回目の継代後、各5 mLの培地を含む6個のT-25に1.8 x 106細胞/T-25 (または7.2 x 104細胞/cm2)の細胞密度で細胞を播種した。T-25への播種の1日後、PromegaのCalcium Phosphate Transfection Kit (Cat# E1200)を使用して、ウイルスベクターを発現するT5.0002プラスミドで細胞をトランスフェクトした。トランスフェクションの18時間後、1セットのフラスコ(各セット3フラスコ)中の培地を、10 mM NaBを含む新鮮な培地で置換した。第2のセットのフラスコ中の培地は置換せず、該培地はコントロール(NaBゼロ)としての役割を果たした。NaB処理の8時間後、すべてのフラスコ中の培地を、NaBを含まない新鮮な培地で置換した。両セットのフラスコで翌日まで(22時間の期間)発現を継続させた。両セットのフラスコ由来の上清を回収し、形質導入単位(TU)/mlで表されるqPCRによるそれらの力価についてアッセイした(実施例3を参照のこと)。
【0160】
力価の結果を以下の表に示す。
【表5】

【0161】
続いてベクター調製物をこの様式で製造したが、酪酸ナトリウムを用いなかった。他のベクタープラスミドを同じ方法で使用して、10e5 TU/ml〜10e7 TU/mlの範囲の力価を有するベクター調製物を作製した。所望であれば、下記のように、前記材料をさらに精製し、濃縮することができる。US 5792643; T. Rodriguez et al. J Gene Med 9:233 2007; US出願61218063も参照のこと。本開示の特定の実施形態では、脳重量のグラム数によって用量を算出した。そのような実施形態では、治療方法で有用な本開示の複製適合性レトロウイルスベクターの用量は脳重量1グラムあたり103〜107TUの範囲でありうる。
【実施例3】
【0162】
実施例3 定量的PCR力価決定アッセイ
機能的ベクター濃度、または力価を、定量的PCR(qPCR)に基づく方法を使用して決定する。この方法では、形質導入可能な宿主セルライン(例えばPC-3ヒト前立腺癌細胞, ATCC Cat# CRL-1435)に標準量のベクターを感染させ、形質導入後に該宿主細胞内に存在するプロウイルスの生成量を測定することによってベクターの力価を決定する。標準培養条件(37℃、5% CO2)下で24時間、細胞とベクターをインキュベートして完全に感染させた後、抗レトロウイルスAZTを加えてベクター複製を停止させる。
【0163】
次いで、培養皿から細胞を回収し、Invitrogen Purelink gDNA精製キットを使用してゲノムDNA (gDNA)を精製し、RNアーゼ-/DNアーゼ-フリーの滅菌水で精製カラムから溶出させる。分光光度計でA260/A280吸光度比を測定して、サンプルの濃度および相対純度を決定する。追加のRNアーゼ-/DNアーゼ-フリーの水でgDNA濃度を任意の所定のgDNA調製物セットの最低濃度に標準化して、qPCRの入力DNAがすべての分析サンプルで一定であるようにする。
【0164】
臭化エチジウム染色された0.8%アガロースゲルでの各サンプルのアリコートの電気泳動によってゲノムDNA純度をさらに評価する。サンプルが1.8〜2.0のA260/A280吸光度範囲を超え、かつ単一バンドのgDNAを示せば、該サンプルはベクターのプロウイルスコピー数についてのqPCR分析の準備が整っている。プロウイルス(逆転写されたベクターDNAおよび宿主gDNAに組み込まれているベクターDNA)のLTR領域を調べるプライマーを使用してqPCRを実施し、既知の数の細胞に形質導入するために既知の量のベクターが使用された場合に生じた形質導入イベントの総数を評価する。1E7〜1E1コピーで連続希釈されかつサンプルと同一のqPCR条件下で測定された既知のコピー数の標的保持プラスミドを利用する標準曲線から反応あたりの形質導入イベントの数を算出する。各qPCR反応に使用されたゲノム等価物の数(あらかじめ測定された濃度から)および反応あたりに生じた形質導入イベントの数を知って、形質導入の時点で存在した細胞の総数に基づいて生じた形質導入イベントの総数を決定する。この値は、初期形質導入中の細胞を含む培地中への希釈後のベクターの力価である。補正力価の値を算出するために、培養物の量と滴定量を掛け合わせて滴定量で除算することによって希釈を補正する。重複培養物でこれらの実験を実施し、各条件に関して3回の測定を用いるqPCRによって分析して、平均力価を、その関連する標準偏差および変異係数とともに決定する。
【実施例4】
【0165】
実施例4 ウエスタンブロットによって測定される発現レベル
図3は、野生型(ACE-yCD)または完全に最適化された(AC3-yCD2)シトシンデアミナーゼ遺伝子をコードするウイルスに感染させたU-87細胞のウエスタンブロット分析において、野生型yCDタンパク質と比較して、高い安定性のための3つの突然変異で最適化されたヒトコドンについて高レベルが観察されることを示す。
【実施例5】
【0166】
実施例5 ウイルスベクターの遺伝子安定性。
逆転写および、処理細胞への最初の組み込みイベントの後に、DNAプロウイルスおよび任意の後の子孫レトロウイルスはMLV由来の従来型のLTR構造を両端に有することが認識される。この配置は複数サイクルの感染後に安定であることが示されている(以下の図4を参照のこと)。
【0167】
約106個のナイーブU-87細胞をMOI 0.01のウイルスベクターで最初に感染させ、完全に感染して1回の感染サイクルが完了するまで培養した。そして上清を未感染細胞に対して再び通過させ、サイクルを繰り返した。導入遺伝子挿入部位に隣接するMLV特異的プライマーを使用する、感染細胞由来の組み込みプロウイルスのPCR増幅によって、yCD2配列のゲノム安定性を評価した。各セットの感染で、ベクタープラスミド(pAC3-yCD2およびKasahara et al.ベクターpACE-CD)の増幅をさらに実施して、ゲル上の全長アンプリコンサイズ分類を追跡した。全長アンプリコンより小さい任意のバンドの出現は、ベクターの不安定性の指標となる。該実験では、本開示のベクター(T5.0002 - 改変されたベクターおよびCDopt+3pt (CD2)異種ポリヌクレオチドを含む)が、ともに野生型酵母を保持するpACE-CDまたはT5.007より多数の継代中に安定性を維持することが示された。
【実施例6】
【0168】
実施例6 細胞死滅実験
in vitro細胞培養実験では、実験は、pAC3-yCD2/T5.0002 [AC3-yCD2(V)]から、pAC3-yCD/T5.0007 [AC3-yCD(V)]から、または他のベクターから作製されたウイルスを感染させたRG2ラット細胞(図5A)またはU-87細胞(図5B)に対する5-FC滴定を実施することによって、yCD2タンパク質を発現する細胞中のシトシンデアミナーゼが、野生型yCDタンパク質を発現する細胞由来のものと少なくとも同程度に活性であることを示す。簡潔に言えば、U-87細胞では、AC3-yCD (野生型CD)ベクターまたはAC3-yCD2 (熱安定化&コドン最適化)ベクターでの感染多重度0.1 (すなわち100%感染)での感染の5日後に、漸増量の5-FCまたはポジティブコントロールとしての0.1 mMの5-FUに8日間付した。5-FC処理の8日目に、MTSアッセイ(Promega CellTiter 96 AQUEOUS One Solution Proliferation Assay)を使用して生存度について細胞培養物を評価した。データは、漸増量の5-FC処理での2種のレトロウイルスベクター間で同等の死滅を示す。RG2培養物を同様に処理すると、やはり、むしろT5.0002CD発現アッセイ由来のウイルスに関して低濃度の5-FCへの、死滅曲線のわずかなシフトを示す。U87細胞に、感染多重度(MOI) 0.1で形質導入し、5日間培養してウイルスを伝播させ、形質導入後5日目由来の細胞を回収した。そして、該細胞を800 x gで5分間の遠心分離によって収集した。細胞ペレットから上清を吸引除去し、5 mLのリン酸緩衝食塩水(PBS)で洗浄し、800 x gで5分間、再び遠心分離した。得られた細胞ペレットを1.5 mLのPBSにとり、ピペットチップの通過によって再懸濁し、-20℃のフリーザーに入れた。細胞を凍結解凍法によって溶解させた。以前に再懸濁された細胞を室温で解凍し、ピペットチップに通過させ、プロテアーゼインヒビター反応混液と混合し、-20℃で再凍結した。酵素アッセイの前に、サンプルを室温で再び解凍し、ピペットチップに通過させた。次いで懸濁液を卓上遠心分離機で5分間14,000 rpmで遠心分離した。上清をペレットからデカントして除き、新しいエッペンドルフチューブに入れ、氷上に置いた。HPLCアッセイを使用することによってyCD酵素活性を評価した。
【0169】
フォトアレイ検出器(photoarray detector)およびオートインジェクターと連続して連結されたShimadzu LC20ATユニットでHPLCアッセイを実施した。固相は5 umスフェアサイズ(sphere size)および4.0 x 250 mmカラム寸法を有するHypersil BDS C18 HPLCカラムであった。移動相は、0.01%過塩素酸tert-ブチルアンモニウムおよび5%メタノールを含む50 mMリン酸アンモニウム、pH 2.1であり、該システムを22℃で平衡化した。すべての試薬はACSグレードであり、溶媒はHPLCグレードであった。PBS中の0.125 mg/mL 5FC (1 mM)の終濃度を有する800μLからなる反応混合物を作製し、1.5 mLオートサンプラーバイアルに入れた。200uLの各細胞ライセートを加えることによって反応を開始させた。反応/オートサンプラーバイアルをオートサンプラーに設置し、5uLの反応混合物を注入した。各反応バイアルから5 uLアリコートを回収し、HPLCカラムで分析することによって、タイムポイントを周期的に取得した。以前に作製された5FU標準曲線から得られる既知の量とピーク面積を比較することによって5FCから5FUへの変換速度を算出した。生成された5FUの量(nmol単位)をその対応する時間間隔に対してプロットすることによって5FCから5FUへの変換速度を導き出した。細胞サンプルのタンパク質濃度を導き出し、変換速度(nmol/分)を、mg単位の、アッセイで使用されたタンパク質の量によって除算することによって細胞ライセートサンプルの比活性を算出した。図6は、MOI 0.1での形質導入の5日後の種々のベクターの比活性を示す。該データは、組織培養細胞中のシトシンデアミナーゼの比活性の観点で、pACE-yCD (T5.0000) < pAC3-yCD1(T5.0001) <pAC3-CD2 (T5.0002)であることを示す。
【実施例7】
【0170】
実施例7. 完全に改変されたCD遺伝子(yCD2)で処置された腫瘍は、未改変の酵母CD遺伝子で処置された腫瘍より効率的に排除され、かつ再発しない(PR-01-08-001)。
どのベクター構築物が皮下マウス/ヒト異種移植モデルで最も有効なベクターを生じさせるかを決定する。3つの異なる構築物: T5.0001 (部分的に改変されたCD); T5.0007 (未改変酵母CD遺伝子); T5.0002 (完全に改変されたyCD2遺伝子)を評価した。5-FCプロドラッグ投与後の腫瘍増殖、生存および腫瘍退縮を免疫不全マウスでのヒト神経膠腫(U87)の皮下モデルで評価した。2つの異なる5-FC濃度を評価して、5-FCと腫瘍-ベクター構築物との間で観察される用量反応を決定した。
【0171】
群あたり9〜11匹の雌性マウスからなる合計12群を研究した。すべてのマウスは、0日目に、未感染U-87腫瘍セルラインの98%混合物および、3つのTOCA 511ベクター構築物、T5.0002、T5.0001、T5.0007のうちの1つが感染しているU-87セルラインの2%混合物; または未感染コントロールU-87セルライン(100%)のいずれかでの右背側の側腹部移植を受けた。2x106細胞/マウスをマウスに接種した。群1〜3のマウスは未感染U87細胞を有し、群4〜6は、形質導入されたT5.0002 U87を含むU87細胞混合物を有し、群7〜9は、T5.0001で形質導入されたものを含むU87細胞混合物を有し、群10〜12は、T5.0007で形質導入されたものを含むU87細胞混合物を有した。腫瘍サイズが約100mm3になるまで、6日間、腫瘍を増殖させた。6日目に開始される1回のIP注射として投与された5-FCの2つの用量(200または500 mg/kg/日)の一方を投与するか、または5-FCを投与しないように、各ベクター投与群のマウスをランダム化した。5-FC投与を28日間連続で毎日継続した。29日目の後、生存マウスの腫瘍サイズを評価し、次いで種々の日に犠牲にし、存在すれば、腫瘍を分析のために抽出した。29日目に、群4〜12のマウスを再びランダム化し、マウスを2つの亜群に細分した(腫瘍退縮をモニターするために5-FCを継続した群または腫瘍再増殖をモニターするために5-FC処置を中止した群)。
【0172】
結果: T5.0002、T5.0000およびT5.0007で処置された腫瘍はすべて、29日目に200および500 mg/kg用量で検出不可能になるまでの腫瘍退縮を示した。すべてのT5.0002処置動物は、5FC処置を中止した場合に、終了までの39日間に、腫瘍を再形成しなかった。対照的に、T5.0001およびT5.0007で処置された一部の腫瘍は39日の時点までに再発した。実験は39日目に終了した。
【0173】
結論: T5.0002プラス5-FCは、T5.0001またはT5.0007プラス5-FCよりも有効な抗腫瘍療法である。
【0174】
本開示の多数の実施形態を記載してきた。それにもかかわらず、本開示の思想および範囲から逸脱することなく、種々の改変を施すことができることが理解される。したがって、他の実施形態は特許請求の範囲の範囲内である。
【技術分野】
【0001】
関連出願への相互参照
本出願は、2008年9月26日出願の米国仮出願第61/100,666号、2008年12月8日出願の米国仮出願第61/120,618号、および2009年6月13日出願の米国仮出願第61/186,823号への優先権を主張する。該文献の開示内容は参照によりここに組み入れられる。
【0002】
技術分野
本開示は、改変されたシトシンデアミナーゼ(CD)に関する。該開示は、さらに、該改変されたCDを発現する細胞、および疾患および障害の治療で該改変されたCDを使用する方法に関する。
【背景技術】
【0003】
背景
酵母、または細菌、のシトシンデアミナーゼは、無害の抗生物質プロドラッグ5-FCを細胞傷害性化学療法剤5-フルオロウラシル(5-FU)に変換する。ヒト(および哺乳類一般)が、顕著なシトシンデアミナーゼ活性を有する酵素をコードする天然に存在する遺伝子を有することは知られていない。酵母および細菌のシトシンデアミナーゼは、酵素の送達およびその後の、該酵素によって細胞傷害性薬物に変換される5-FCでの治療のための遺伝子送達およびウイルスベクターを使用する癌の治療において評価を得ている(Miller et al., Can Res 62:773-780 2002; Kievit et al., Can Res 59:1417-1421 1999)。
【発明の概要】
【課題を解決するための手段】
【0004】
要旨
本発明では、5-FCを5-FUに変換するポリペプチドを提供する。また、該ポリペプチドをコードする核酸分子、該ポリペプチドを発現する細胞、該ポリヌクレオチドを含むベクター、およびポリペプチド、ならびに該ポリペプチドの好適な使用から5-FUまたはその誘導体を合成する方法を提供する。したがって、種々の実施形態では、配列番号2に記載の配列を有するシトシンデアミナーゼを含む、単離された、または組換えポリペプチドを提供する。他の実施形態では、該ポリペプチドは、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含む。さらに別の実施形態では、該ポリペプチドは、配列番号4に記載の配列を含み、残基: (a) 23、108および140を除いて、50、25、10、または5個までの保存的アミノ酸置換を含む。一般に、本明細書中で提供されるポリペプチドは、5-FCを5-FUに変換するために有用なシトシンデアミナーゼ活性を示す。
【0005】
本開示はまた、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含むポリペプチドであって、23位のロイシン、108位のイソロイシン、および140位のロイシンを有し、かつシトシンデアミナーゼ活性を有するポリペプチドを提供する。さらに別の実施形態では、該ポリペプチドは、配列番号4に記載の配列を含む。
【0006】
本開示は、さらに、ウラシルホスホリボシルトランスフェラーゼ(UPRT)またはオロト酸ホスホリボシルトランスフェラーゼ(OPRT)に作動可能に連結された前記ポリペプチドのいずれか1つを含む融合構築物を提供する。一実施形態では、該融合構築物は、UPRTまたはOPRT活性を有する第2のポリペプチドに連結された、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含む第1のポリペプチドを含む。さらに別の実施形態では、融合構築物は、配列番号4に記載の配列を有する第1のポリペプチドを含み、かつ残基: 23、108および140を除く、50、25、10、または5個までの保存的アミノ酸置換を含み、ここに該第1のポリペプチドは、UPRTまたはOPRT活性を有する第2のポリペプチドに連結されている。本開示はまた、シトシンデアミナーゼ活性を有しかつ、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含む第1のポリペプチドを含み、ここに該ポリペプチドは、23位のロイシン、108位のイソロイシンおよび140位のロイシンを有し、かつ該第1のポリペプチドは、UPRTまたはOPRT活性を含む第2のポリペプチドに連結されている、融合構築物を提供する。一実施形態では、UPRTまたはOPRT活性を有するポリペプチドは、それぞれ、配列番号8および10に記載の配列またはそれらの変異体を含む。さらに別の実施形態では、シトシンデアミナーゼ活性を含む第1のポリペプチドは、UPRTまたはOPRT活性を有するポリペプチドに連結され、ここに該ポリペプチドはペプチドリンカーによって分離されている。別の実施形態では、該融合構築物は、配列番号12、14、16または18からなる群から選択される配列を含む。
本開示は、さらに、前記ポリペプチドのいずれかをコードするポリヌクレオチドを提供する。例えば、本開示は、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含むポリペプチドをコードするポリヌクレオチドを提供する。さらに別の実施形態では、該ポリヌクレオチドは、配列番号4に記載の配列を含みかつ残基: (a) 23、108および140を除いて、50、25、10、または5個までの保存的アミノ酸置換を含むポリペプチドをコードする。さらなる実施形態では、本開示は、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含むポリペプチドであって、23位のロイシン、108位のイソロイシン、および140位のロイシンを有し、かつシトシンデアミナーゼ活性を有するポリペプチドをコードするポリヌクレオチドを提供する。さらに別の実施形態では、該ポリヌクレオチドは、配列番号4を含むポリペプチドをコードする。さらなる実施形態では、該ポリヌクレオチドは、配列番号4、6、8、10、11、12、または13に記載の配列を含むポリペプチドをコードする。
【0007】
本開示は、シトシンデアミナーゼをコードするヒトコドン最適化ポリヌクレオチドを提供する。一実施形態では、該ヒトコドン最適化ポリヌクレオチドは、配列番号3に記載の配列を含む。さらに別の実施形態では、該ポリヌクレオチドは、配列番号5、7、または9に記載の配列を含む。
【0008】
他の実施形態では、本開示のシトシンデアミナーゼまたは融合構築物は、遺伝子送達システム(GDS)を使用して送達される。別の態様では、シトシンデアミナーゼをコードするポリヌクレオチドを、ウイルスベクターまたはウイルス派生ベクターであるGDSで送達する。該ウイルスベクターは複製可能または複製不能であってよく、アデノウイルスベクター、麻疹ベクター、ヘルペスベクター、レトロウイルスベクター(レンチウイルスベクターを含む)、ラブドウイルスベクター、例えば水疱性口内炎ウイルスベクター、レオウイルスベクター、セネカバレーウイルス(Seneca Valley Virus)ベクター、ポックスウイルスベクター(動物痘またはワクシニア由来ベクターを含む)、パルボウイルスベクター(AAVベクターを含む)、アルファウイルスベクターまたは当業者に公知の他のウイルスベクターであってよい。一実施形態では、ウイルスベクターは、複製中の哺乳類細胞に感染可能な複製適合性(competent)レトロウイルスベクターであってよい。複製適合性レトロウイルスベクターは、オルソレトロウイルスまたは、より典型的には、ガンマレトロウイルスベクターを含んでよい。一態様では、複製適合性レトロウイルスベクターは、本開示のシトシンデアミナーゼをコードするポリヌクレオチドの5’側に内部リボソーム侵入部位(IRES)を含む。一実施形態では、シトシンデアミナーゼをコードするポリヌクレオチドはレトロウイルスベクターのENVポリヌクレオチドの3'側にある。
【0009】
他の実施形態では、本開示のシトシンデアミナーゼまたは融合構築物、または本開示のポリヌクレオチドまたは融合構築物を含むベクターでトランスフェクトされた宿主細胞を提供する。宿主細胞には、真核細胞、例えば酵母細胞、昆虫細胞、または動物細胞が含まれる。宿主細胞にはまた、原核細胞、例えば細菌細胞も含まれる。
【0010】
本開示はまた、癌を含む細胞増殖性障害を治療する方法であって、本開示のポリヌクレオチドまたはポリペプチドを被験体に投与するステップ、および5-フルオロシトシン(5-FC)を含む細胞傷害性薬物と被験体を接触させるステップを含む方法を提供する。
【0011】
本開示は、レトロウイルスGAGタンパク質; レトロウイルスPOLタンパク質; レトロウイルスエンベロープ; レトロウイルスポリヌクレオチド配列の3'末端の長末端反復(LTR)配列、哺乳類細胞での発現に好適な、レトロウイルスポリヌクレオチドの5'末端のプロモーター配列、gag核酸ドメイン、pol核酸ドメインおよびenv核酸ドメインを含むレトロウイルスポリヌクレオチド; 異種ポリヌクレオチドに作動可能に連結された内部リボソーム結合部位(IRES)を含む、3' LTRの5'側でかつレトロウイルスエンベロープをコードするenv核酸ドメインの3'側に位置するカセット; および逆転写、パッケージングおよび標的細胞への組み込みに必要なシス作用配列、を含む組み換え複製適合性レトロウイルス(RCR)を提供し、ここで該RCRは、6回の継代後に、pACEベクター(配列番号21)と比較して高い複製能を維持する。一実施形態では、該レトロウイルスポリヌクレオチド配列は、マウス白血病ウイルス(MLV)、モロニーマウス白血病ウイルス(MoMLV)、ネコ白血病ウイルスまたはテナガザル(Gibbon ape)白血病ウイルス(GALV)由来である。別の実施形態では、MLVは両種性MLVである。さらに別の実施形態では、レトロウイルスはオンコレトロウイルスである。さらに別の実施形態では、標的細胞は、細胞増殖性障害を有する細胞である。細胞増殖性障害は、非限定的に、肺癌、結腸直腸癌、乳癌、前立腺癌、尿路癌、子宮癌、脳腫瘍、頭頸部癌、膵癌、黒色腫、胃癌および卵巣癌、関節リウマチおよび他の自己免疫疾患からなる群から選択することができる。一実施形態では、プロモーターは、配列番号19、20、または22のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を有するCMVプロモーターを含み、1個以上の核酸塩基に対する改変を含んでよく、それは転写を誘導し開始させることが可能である。さらに別の実施形態では、プロモーターは配列番号19、20、または22のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を含む。さらなる実施形態では、プロモーターはCMV-R-U5ドメインポリヌクレオチドを含む。一実施形態では、CMV-R-U5ドメインは、MLV R-U5領域に連結されたヒトサイトメガロウイルス由来の前初期プロモーターを含む。さらに別の実施形態では、CMV-R-U5ドメインポリヌクレオチドは、配列番号19、20、または22のヌクレオチド約1位〜ヌクレオチド約1202位に記載の配列または、配列番号19、20、または22に記載の配列と少なくとも95%同一の配列を含み、ここで該ポリヌクレオチドはそれに作動可能に連結された核酸分子の転写を促進する。別の実施形態では、該ポリヌクレオチドのgagおよびpolはオンコレトロウイルス由来である。gag核酸ドメインは、配列番号19のヌクレオチド番号約1203〜ヌクレオチド約2819位の配列またはそれに対して少なくとも95%、98%、99%または99.8%の同一性を有する配列を含んでよい。polドメインは、配列番号19のヌクレオチド番号約2820位〜ヌクレオチド約6358位の配列またはそれに対して少なくとも95%、98%、99%または99.9%の同一性を有する配列を含んでよい。一実施形態では、envドメインは両性envタンパク質(amphoteric env protein)をコードする。そのenvドメインは、配列番号19のヌクレオチド番号約6359位〜ヌクレオチド約8323位の配列またはそれに対して少なくとも95%、98%、99%または99.8%の同一性を有する配列を含んでよい。該ベクターのIRESドメインは任意のIRESであってよいが、一実施形態では、IRESは脳心筋炎ウイルス由来である。さらなる実施形態では、IRESは、配列番号19のヌクレオチド番号約8327位〜ヌクレオチド約8876位の配列またはそれに対して少なくとも95%、98%、または99%の同一性を有する配列を含む。さらに別の実施形態では、異種ポリヌクレオチドは、配列番号3、5、11、13、15または17に記載の配列を有するポリヌクレオチドを含む。さらなる実施形態では、異種配列は、配列番号4に記載の配列を含むポリペプチドをコードする。異種核酸はヒトコドン最適化され、配列番号4に記載のポリペプチドをコードする。さらなる実施形態では、異種核酸は配列番号19のヌクレオチド番号約8877位〜約9353位に記載の配列を含む。一実施形態では、3' LTRはオンコレトロウイルス由来である。さらなる実施形態では、3' LTRはU3-R-U5ドメインを含む。さらに別の実施形態では、3' LTRは、配列番号19のヌクレオチド約9405位〜約9998位に記載の配列またはそれと少なくとも95%、98%または99.5%同一の配列を含む。
【0012】
本開示は、配列番号19、20、または22に記載の配列を含むポリヌクレオチドを提供する。
【0013】
本開示は、5'から3'方向に: ヒトサイトメガロウイルス由来の前初期プロモーターとMLV R-U5領域とのCMV-R-U5融合物; 逆転写酵素のためのプライマー結合部位PBS; 5'スプライス部位; Ψパッケージングシグナル; MLV群特異的抗原のgagコード配列; MLVポリメラーゼポリプロテインのpolコード配列; 3'スプライス部位; MLV 4070A株のエンベロープタンパク質の4070A envコード配列; 脳心筋炎ウイルス由来の内部リボソーム侵入部位(IRES); 改変されたシトシンデアミナーゼコード配列; ポリプリントラクト(polypurine tract); およびU3-R-U5 MLV長末端反復配列を含む、単離されたポリヌクレオチドを提供する。
【0014】
本開示は、細胞増殖性障害を有する被験体を治療する方法であって、被験体を、シトシンデアミナーゼ活性を有する本開示のポリペプチドをコードするポリヌクレオチドと、該ポリヌクレオチドが発現されるような条件下で接触させるステップおよび被験体を5-フルオロシトシンと接触させるステップを含む方法を提供する。
【0015】
本開示はまた、被験体の細胞増殖性障害を治療する方法であって、被験体を本開示のレトロウイルスと接触させるステップを含み、ここで前記異種核酸配列は、新生物細胞の増殖を阻害する治療的タンパク質をコードする、方法を提供する。一実施形態では、該レトロウイルスは、配列番号4、12、14、16、または18に記載の配列を有するポリペプチドをコードするポリヌクレオチドを含む。
【0016】
本開示の1以上の実施形態の詳細は、添付の図面および下記説明に記載される。他の特徴、目的、および利点は、説明および図面、ならびに特許請求の範囲から明らかになる。
【図面の簡単な説明】
【0017】
【図1−1】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−2】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−3】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−4】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−5】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−6】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−7】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−8】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−9】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−10】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−11】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−12】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−13】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−14】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−15】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−16】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−17】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−18】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−19】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−20】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−21】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−22】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−23】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−24】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図1−25】図1A〜Dは、(a) 本開示の組み換えレトロウイルスベクターの模式図; (b) 本開示のポリヌクレオチドのプラスミド地図; (cおよびd) 本開示のポリヌクレオチドの配列(配列番号19)を示す。
【図2−1】図2A〜Dは、CD、OPRTおよびUPRT活性を有するポリペプチドを含む本開示の種々の実施形態の作製のための模式図を示す。
【図2−2】図2A〜Dは、CD、OPRTおよびUPRT活性を有するポリペプチドを含む本開示の種々の実施形態の作製のための模式図を示す。
【図2−3】図2A〜Dは、CD、OPRTおよびUPRT活性を有するポリペプチドを含む本開示の種々の実施形態の作製のための模式図を示す。
【図3】図3は、感染U-87細胞で野生型yCDタンパク質と比較して高レベルのyCD2タンパク質が観察されることを示す。
【図4】図4は、本開示のCDポリペプチドを含むベクターの安定性および本開示の他のベクターとの比較を示す。
【図5】図5A〜Bは、本開示のシトシンデアミナーゼ活性およびベクターは、感染細胞が漸増レベルの5-FCに曝露された場合に、野生型yCD活性(T5.0007)と比較して、感染ラットRG2(5A)またはU87細胞(5B)の同等またはより良好な発現、およびゆえにその死滅を提供することを示す。
【図6】図6は、T5.0002 (yCD2)の感染U87細胞の比活性は、T5.0001 (部分的に最適化されたyCD)より高く、T5.0001はT5.0007 (wt yCD)より大きいことを示す。
【発明を実施するための形態】
【0018】
種々の図面中の参照記号類は要素類を示す。
【0019】
詳細な説明
本明細書および特許請求の範囲中で使用される、単数形「a」、「and」、および「the」は、文脈によって明らかに他の様式で決定されない限り、複数の指示対象を含む。ゆえに、例えば、「a cell」への言及には、複数の該細胞が含まれ、「the agent」への言及には、当業者に公知の1種以上の物質への言及が含まれる、などである。
【0020】
また、「または」の使用は、特に指定されない限り、「および/または」を意味する。同様に、「comprise」、「comprises」、「comprising」「include」、「includes」、および「including」は交換可能であり、限定的でないものとする。
【0021】
種々の実施形態の説明が用語「含む(comprising)」を使用する場合、当業者は、一部の具体的事例では、ある実施形態は、その代わりに用語「から本質的に構成される(consisting essentially of)」または「からなる(consisting of)」を使用して記載できると理解するであろうことは、さらに理解されよう。
【0022】
特に規定されない限り、本明細書中で使用されるすべての技術用語および科学用語は、本開示が属する技術分野の当業者に一般に理解される意義と同一の意義を有する。本明細書中に記載のものと類似または等価の方法および材料を、開示される方法および組成物の実施に使用できるが、典型的な方法、デバイスおよび材料をここに記載する。
【0023】
上およびテキストの全体を通して考察される刊行物は、単に、本出願の提出日前のその開示内容に関して提供される。本明細書中のいかなるものも、発明者らが、以前の開示内容に基づいてそのような開示内容を予測することができないことの承認として解釈されないものとする。
【0024】
シトシンデアミナーゼ(EC 3.5.4.1)は、以下の化学反応:
シトシン+ H2O → ウラシル+ NH3
を触媒する酵素である。ゆえに、この酵素の2つの基質はシトシンおよびH2Oであり、その2つの生成物はウラシルおよびNH3である。この酵素は加水分解酵素のファミリーに属し、それらは、特に環状アミジン中の、ペプチド結合以外の炭素-窒素結合に作用する。この酵素クラスの分類名はシトシンアミノヒドロラーゼである。この酵素はイソシトシンデアミナーゼとも称される。この酵素はピリミジン代謝に関与する。
【0025】
より具体的には、シトシンデアミナーゼは、外因性シトシンが加水分解による脱アミノ化を介してウラシルに変換される、ピリミジンの代謝経路に関与する酵素である。シトシンデアミナーゼ(CDアーゼまたはCD)活性は原核生物および下等真核生物で実証されているが、それらは哺乳類で不存在である(Koechlin et al., 1966, Biochem. Pharmacol. 15, 435-446; Polak et al., 1976, Chemotherapy 22, 137-153)。Saccharomyces cerevisiae (S. cerevisiae)のFCY1遺伝子およびE. coliのcoda遺伝子は、それぞれ、前記2種の生物のCDアーゼをコードするが、該遺伝子は公知であり、その配列は公開されている(EP 402 108; Erbs et al., 1997, Curr. Genet. 31, 1-6; WO 93/01281)。CDアーゼはまた、シトシンアナログである5-フルオロシトシン(5-FC)を脱アミノ化して、5-フルオロウラシル(5-FU)にする。5-フルオロウラシルは、特に5-フルオロ-UMP (5-FUMP)に変換された場合に高度に細胞傷害性の化合物である。該酵素をコードする遺伝子の不活性化突然変異またはこの酵素についてのその天然の欠損(例えば哺乳類細胞に関して)のせいでCDアーゼ活性を欠く細胞は5-FCに耐性である(Jund and Lacroute, 1970, J. Bacteriol. 102, 607-615; Kilstrup et al., 1989, J. Bacteriol., 171, 2124-2127)。一方、5-FC感受性を、CDアーゼ活性をコードする配列が導入されている哺乳類細胞に伝達することが可能であると示されている(Huber et al., 1993, Cancer Res. 53, 4619-4626; Mullen et al., 1992, Proc. Natl. Acad. Sci. USA 89, 33-37; WO 93/01281)。したがって、CDの使用は遺伝子治療、特に抗癌性遺伝子治療の場面で有益である。
【0026】
しかし、5-FC感受性はセルラインに応じて大きく変動する。例えば、E. coliのcoda遺伝子を発現するレトロウイルスで形質導入されたヒト腫瘍系統、PANC-1 (膵臓の癌腫)およびSK-BR-3 (乳腺癌)で低感受性が観察される(Harris et al., 1994, Gene Therapy 1, 170-175)。この現象は、CDアーゼの酵素作用によって形成される5-FUの不存在またはその細胞傷害性5-FUMPへの不十分な内因性変換によって説明される。このステップは、哺乳類細胞でオロト酸ホスホリボシルトランスフェラーゼ(OPRTアーゼ)によって通常実行されるが、特定の腫瘍では不存在であってゆえにCDアーゼに基づく遺伝子治療は無効になる。原核生物および下等真核生物では、ウラシルホスホリボシルトランスフェラーゼの作用(UPRTアーゼ活性)によってウラシルはUMPに変換される。この酵素もまた、5-FUを5-FUMPに変換する。重要なことに、細菌のウラシルホスホリボシルトランスフェラーゼ(UPRT)は哺乳類細胞のオロト酸ホスホリボシルトランスフェラーゼ(OPRT)またはウリジン-5'-一リン酸シンターゼと機能的に等価である。これらの酵素は、5-フルオロウラシル(5-FU)(ウラシルのフッ化アナログ)から5-フルオロウリジン5'一リン酸(5-FUMP)への変換を媒介する。5-フルオロウリジン5'一リン酸は、次いで、哺乳類のde novoピリミジン経路を介して5-FdUDPおよびFdUTPに変換される。各5-FdUTPはチミジル酸シンターゼ(Thy-A)の不可逆的インヒビターであり、dTTP飢餓を生じさせる。この変換は、5-フルオロウラシルの細胞傷害性作用を達成するための必須経路の1つであること、および細菌起源の細菌性ウラシルホスホリボシルトランスフェラーゼは、5-フルオロウラシルを、哺乳類のオロト酸ホスホリボシルトランスフェラーゼと同一の活性代謝産物に変換できることは広く受け入れられている。UPRTアーゼ活性またはOPRTアーゼ活性の不存在下では、CDアーゼによる5-FCの脱アミノ化に起因する5-FUは細胞傷害性5-FUMPに変換されない(Jund and Lacroute, 1970, J. Bacteriol. 102, 607-615)。
【0027】
本明細書中に記載のように、本開示は、シトシンデアミナーゼ活性を有する第1のポリペプチドとUPRTまたはOPRT活性を含む第2のポリペプチドとの融合物を含むポリペプチドをコードするポリヌクレオチドおよび該ポリペプチドを提供する。そのような融合構築物は、ウラシル、またはその誘導体を一リン酸アナログに変換し、特に5-FUを5-FUMPに変換するために有用である。
【0028】
以下でさらに詳細に説明されるように、本開示は、5-FCから5-FUへの変換を触媒する新規ポリペプチドの作製および発現に少なくとも部分的に基づく。一実施形態では、5-FCから5-FUへの変換に関する、改良した触媒特性を有するように改変されている新規ポリペプチドを提供する。そのようなポリペプチドには、指定残基でアミノ酸置換を含むように改変されている変異体が含まれる。これらの変異体は以下でさらに詳細に説明されるが、本開示のポリペプチドは1つ以上の改変されたアミノ酸を含んでよいことが理解されよう。改変されたアミノ酸の存在は、例えば、(a) ポリペプチドin vivo半減期の増加、(b) ポリペプチド抗原性の減少または増加、および(c) ポリペプチド保存安定性の増加に有益である。アミノ酸(群)を、組み換え生産中に、例えば、翻訳と同時にまたは翻訳後に改変(例えば、哺乳類細胞での発現中のN--X--S/TモチーフでのN結合グリコシル化)するか、または合成手段によって改変する。したがって、「突然変異体」、「変異体」または「改変された」タンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞とは、親タンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞から改変または誘導されているか、または何らかの様式で異なるかまたは変化したタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞を意味する。突然変異体または改変されたタンパク質または酵素は、必ずではないが通常は、突然変異体ポリヌクレオチドまたは遺伝子から発現される。
【0029】
「突然変異」とは、突然変異体タンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞を生じさせる任意のプロセスまたは機構を意味する。これには、タンパク質、酵素、ポリヌクレオチド、または遺伝子配列が改変される任意の突然変異、および該突然変異に起因する細胞中の任意の検出可能な変化が含まれる。典型的に、突然変異は、単一または複数のヌクレオチド残基のポイントミューテーション、欠失、または挿入によってポリヌクレオチドまたは遺伝子配列中で生じる。突然変異には、遺伝子のタンパク質コード領域内で生じるポリヌクレオチド変化ならびに非限定的に調節配列またはプロモーター配列などの、タンパク質コード配列の外側の領域の変化が含まれる。遺伝子の突然変異は「サイレント」であってよく、すなわち、発現時のアミノ酸変化に反映されず、該遺伝子の「配列保存的」変異体を生じさせる。これは、一般に、1アミノ酸が2以上のコドンに対応する場合に生じる。
【0030】
改変されたアミノ酸の非限定的な例には、グリコシル化アミノ酸、硫酸化アミノ酸、プレニル化(例えば、ファルネシル化、ゲラニルゲラニル化)アミノ酸、アセチル化アミノ酸、アシル化アミノ酸、ペグ化アミノ酸、ビオチニル化アミノ酸、カルボキシル化アミノ酸、リン酸化アミノ酸、などが含まれる。アミノ酸の改変に関して当業者をガイドするために適切な参考文献は文献中に豊富である。プロトコールの例はWalker (1998) Protein Protocols on CD-ROM (Humana Press, Towata, N.J.)に見出せる。
【0031】
本開示の改変されたCDポリペプチドおよびポリヌクレオチドを製造、単離、および使用するための組み換え方法が本明細書中に記載される。組み換え生産に加えて、固相技術を使用する直接ペプチド合成によって該ポリペプチドを製造することができる(例えば、Stewart et al. (1969) Solid-Phase Peptide Synthesis (WH Freeman Co, San Francisco); およびMerrifield (1963) J. Am. Chem. Soc. 85: 2149-2154)。ペプチド合成は、マニュアル技術を使用するかまたは自動化によって実施することができる。自動合成は、例えば、Applied Biosystems 431A Peptide Synthesizer (Perkin Elmer, Foster City, Calif.)を、製造元によって提供される指示書にしたがって使用して達成することができる。
【0032】
例として、E. coli (Anderson et al., 1992, Eur. J. Biochem 204, 51-56)、Lactococcus lactis (Martinussen and Hammer, 1994, J. Bacteriol. 176, 6457-6463)、Mycobacterium bovis (Kim et al., 1997, Biochem Mol. Biol. Int 41, 1117-1124)およびBacillus subtilis (Martinussen et al., 1995, J. Bacteriol. 177, 271-274)のUPRTアーゼをコードする核酸配列を本開示の内容で使用することができる。しかし、酵母UPRTアーゼ、および特に、その配列がKern et al. (1990, Gene 88, 149-157)に開示されるS. cerevisiaeのFUR1遺伝子によってコードされるものの使用が参照的にここに組み入れられる。指摘として、該遺伝子の配列および対応するUPRTアーゼの配列は文献および専門データバンク(SWISSPROT, EMBL, Genbank Medline, など)に見出せる。
【0033】
本明細書中で互換的に使用される用語「タンパク質」または「ポリペプチド」は、ペプチド結合と称される化学結合によって1つに連結されるアミノ酸と称される化学構成単位の1以上の鎖を含む。「酵素」とは、1以上の化学反応または生化学反応を、多かれ少なかれ特異的に、触媒または促進する、好ましくは完全にまたは大部分がタンパク質から構成される任意の物質を意味する。用語「酵素」とは、触媒性のポリヌクレオチド(例えばRNAまたはDNA)を呼んでもよい。「天然(native)」または「野生型」のタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞とは、天然に存在するタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞を意味する。
【0034】
したがって、種々の実施形態では、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含む、単離された、または組み換えポリペプチドを提供する。さらに別の実施形態では、該ポリペプチドは、配列番号4に記載の配列を含み、残基: (a) 23、108および140を除いて、50、25、10、または5個までの保存的アミノ酸置換を含む。一般に、本明細書中で提供されるポリペプチドは、5-FCを5-FUに変換するために有用なシトシンデアミナーゼ活性を示す。
【0035】
本開示はまた、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含むポリペプチドであって、23位のロイシン、108位のイソロイシン、および140位のロイシンを有し、かつシトシンデアミナーゼ活性を有するポリペプチドを提供する。さらに別の実施形態では、該ポリペプチドは、配列番号4に記載の配列を含む。
【0036】
本開示は、さらに、ウラシルホスホリボシルトランスフェラーゼ(UPRT)またはオロト酸(oratate)ホスホリボシルトランスフェラーゼ(OPRT)に作動可能に連結された前記ポリペプチドのいずれか1つを含む融合構築物を提供する。一実施形態では、該融合構築物は、UPRTまたはOPRT活性を有する第2のポリペプチドに連結された、A23L、V108I、I140Lおよびそれらの任意の組み合わせからなる群から選択される突然変異を有する配列番号2を含む第1のポリペプチドを含む。さらに別の実施形態では、融合構築物は、配列番号4に記載の配列を有しかつ残基: 23、108および140を除く、50、25、10、または5個までの保存的アミノ酸置換を含む第1のポリペプチドを含み、ここで該第1のポリペプチドは、UPRTまたはOPRT活性を有する第2のポリペプチドに連結されている。本開示はまた、シトシンデアミナーゼ活性を有しかつ、配列番号4と少なくとも80%、90%、95%、98%または99%同一の配列を含む第1のポリペプチドを含み、該ポリペプチドは、23位のロイシン、108位のイソロイシンおよび140位のロイシンを有し、かつ該第1のポリペプチドは、UPRTまたはOPRT活性を含む第2のポリペプチドに連結されている、融合構築物を提供する。一実施形態では、UPRTまたはOPRT活性を有するポリペプチドは、それぞれ、配列番号8および10に記載の配列またはそれらの変異体を含む。さらに別の実施形態では、シトシンデアミナーゼ活性を含む第1のポリペプチドは、UPRTまたはOPRT活性を有するポリペプチドに連結され、該ポリペプチドはペプチドリンカーによって分離されている。別の実施形態では、該融合構築物は、配列番号11、12または13からなる群から選択される配列を含む。
【0037】
用語「作動可能に連結(operably linked)」または「作動可能に結合(operably associated)」とは、調節配列と該調節配列によって調節されるポリヌクレオチドとの間の、または2種の別のポリペプチドまたはそのようなポリペプチドをコードするポリヌクレオチドの間の機能的連結または結合を表す。
【0038】
CD活性を有するポリペプチドおよびUPRTまたはOPRT活性を含むポリペプチドを含む融合構築物を、タンパク質回収を支援するための切断部位または他のリンカー部分を含むように改変することができる。典型的にリンカーはペプチドリンカー部分である。リンカー部分の長さは、CDポリペプチドおよびUPRTまたはOPRTポリペプチドの生物学的活性を最適化するように選択され、過度の実験を行なわずに経験的に決定することができる。該リンカー部分は、基質がCDポリペプチドと相互作用しかつ基質がUPRTまたはOPRTポリペプチドと相互作用することを可能にするように十分に長く、十分にフレキシブルであるべきである。リンカー部分は、約1〜30アミノ酸残基長の範囲、典型的に約2〜15アミノ酸残基の範囲のペプチドである。リンカー部分の例は、--Gly--Gly--、GGGGS (配列番号22)、(GGGGS)N (配列番号23)、(SGGGG)N (配列番号24)、GKSSGSGSESKS (配列番号25)、GSTSGSGKSSEGKG (配列番号26)、GSTSGSGKSSEGSGSTKG (配列番号27)、GSTSGSGKPGSGEGSTKG (配列番号28)、またはEGKSSGSGSESKEF (配列番号29)である。連結部分は、例えば、Huston et al., Proc. Nat'l Acad. Sci 85:5879, 1988; Whitlow et al., Protein Engineering 6:989, 1993; およびNewton et al., Biochemistry 35:545, 1996に記載されている。他の好適なペプチドリンカーは、U.S. Pat. Nos. 4,751,180および4,935,233に記載されるものがある。該文献は参照によりここに組み入れられる。所望のペプチドリンカーをコードするDNA配列を、任意の好適な慣用技術を使用して、CDポリペプチドおよびその後のUPRTまたはOPRTポリペプチドをコードするポリヌクレオチドの間にかつ、該ポリヌクレオチドと同じ読み枠で挿入することができる。例えば、リンカーをコードする化学合成されたオリゴヌクレオチドを、2つのコードポリヌクレオチド間にライゲートすることができる。特定の実施形態では、融合ポリペプチドは、2〜4つの別々のドメイン(例えば、CDドメインおよびUPRTまたはOPRT)を含み、該ドメインはペプチドリンカーによって分離されている。
【0039】
特定の配列の「保存的アミノ酸置換」または単に「保存的変異」とは、1アミノ酸、または一続きのアミノ酸の、本質的に同一のアミノ酸配列による置換を表す。コード化配列中の単一アミノ酸またはあるパーセンテージのアミノ酸を変更、付加または除去する個別の置換、欠失または付加は、該変化がアミノ酸の欠失、アミノ酸の付加、または化学的に類似のアミノ酸とのアミノ酸の置換を生じさせる場合に「保存的変異」を生じさせることを当業者は認識する。
【0040】
機能的に類似のアミノ酸を提供する保存的置換テーブルは当技術分野で周知である。例えば、1保存的置換群は、アラニン(A)、セリン(S)、およびスレオニン(T)を含む。別の保存的置換群はアスパラギン酸(D)およびグルタミン酸(E)を含む。別の保存的置換群はアスパラギン(N)およびグルタミン(Q)を含む。さらに別の保存的置換群はアルギニン(R)およびリシン(K)を含む。別の保存的置換群は、イソロイシン、(I) ロイシン(L)、メチオニン(M)、およびバリン(V)を含む。別の保存的置換群は、フェニルアラニン(F)、チロシン(Y)、およびトリプトファン(W)を含む。
【0041】
ゆえに、列挙されるポリペプチド配列(例えば、配列番号2、4、6、8、10、11、12、13など)の「保存的アミノ酸置換」は、当該ポリペプチド配列のあるパーセンテージ、典型的に10%未満、のアミノ酸と、同一保存的置換群の保存的に選択されるアミノ酸との置換を含む。したがって、本開示のポリペプチドの保存的に置換された変異は、同一保存的置換群の保存的に置換される変異での100、75、50、25、または10個の置換を含んでよい。
【0042】
酵素の「活性」は、反応を触媒する、すなわち「機能」する、その能力の基準であり、反応の産物が生産される割合として表記することができる。例えば、酵素活性は、単位時間あたりまたは単位酵素(例えば濃度または重量)あたりに生産される産物の量として、または親和性もしくは解離定数の観点で表すことができる。本明細書中で互換的に使用される「シトシンデアミナーゼ活性」、「シトシンデアミナーゼの生物学的活性」または「シトシンデアミナーゼの機能的活性」とは、標準的技術にしたがってin vivo、またはin vitro、で測定された場合に、シトシンデアミナーゼ基質に対して本開示のシトシンデアミナーゼタンパク質、またはポリペプチドによって発揮される活性を表す。シトシンデアミナーゼ活性を測定するためのアッセイは当技術分野で公知である。例えば、シトシンデアミナーゼ活性は、5-FCから5-FUまたはシトシンからウラシルへの変換速度を測定することによって測定することができる。5-FC、5-FU、シトシンおよびウラシルの検出は、クロマトグラフィーおよび当技術分野で公知の他の方法によって実施することができる。
【0043】
開示される核酸構築物の多数の保存的変異が機能的に同一の構築物を生じさせることを当業者は認識するであろう。例えば、上で考察されるように、遺伝暗号の縮重のせいで、「サイレント置換」(すなわち、コード化ポリペプチドの変化を生じさせない、核酸配列中の置換)は、アミノ酸をコードするすべての核酸配列についての暗黙的に含まれる特徴である。遺伝暗号の縮重のため、本開示の改変されたシトシンデアミナーゼポリペプチドをコードする多数のヌクレオチド配列を製造することができ、その一部は、本明細書中で明示的に開示される核酸配列との実質的同一性を保持するものもあることは当業者に理解されよう。例えば、コドンAGA、AGG、CGA、CGC、CGG、およびCGUはすべて、アミノ酸アルギニンをコードする。ゆえに、コード化ポリペプチドを変更することなしに、コドンによってアルギニンが指定される本開示の核酸中のすべての位置で、該コドンを、対応する上記コドンのいずれかに改変することができる。RNA配列中のUはDNA配列中のTに対応することが理解される。
【0044】
同様に、アミノ酸配列中の1個または少数のアミノ酸での「保存的アミノ酸置換」は、非常に類似の特性を有する異なるアミノ酸で置換され、また、開示対象の構築物と非常に類似であると容易に特定することができる。開示された各配列のそのような保存的変異は、本明細書中で提供されるポリペプチドの特徴である。
【0045】
「保存的変異体」は、非限定的に、アミノ酸と、極性または無極性、サイズ、形状および電荷を含む類似の特性を有するものとの置換を含む、タンパク質または酵素の全体のコンフォメーションおよび機能を変化させることなく、所定のアミノ酸残基が変化しているタンパク質または酵素である。保存されていると指定されるアミノ酸以外のアミノ酸は、類似の機能の任意の2タンパク質間のタンパク質またはアミノ酸配列類似性パーセントがさまざまであり、例えば、アライメントスキームにしたがって測定された場合に、少なくとも30%、少なくとも50%、少なくとも70%、少なくとも80%、または少なくとも90%でありうるように、タンパク質または酵素中で異なってよい。本明細書中で言及される「配列類似性」とは、ヌクレオチドまたはタンパク質配列が関連する程度を意味する。2配列間の類似性の程度は配列同一性および/または保存パーセントに基づいてよい。本明細書中の「配列同一性」は、2ヌクレオチドまたはアミノ酸配列が不変である程度を意味する。「配列アライメント」とは、類似性の程度を評価する目的で、最大レベルの同一性(および、アミノ酸配列の場合は、保存)を達成するように2以上の配列を並べるプロセスを意味する。配列をアライメントして類似性/同一性を評価するための多数の方法が当技術分野で公知であり、例えば、類似性がMEGALIGNアルゴリズムに基づくCluster Method、ならびにBLASTN、BLASTP、およびFASTAである(Lipman and Pearson, 1985; Pearson and Lipman, 1988)。すべてのこれらのプログラムを使用する場合、好ましい設定は最高の配列類似性を生じさせる設定である。例えば、特定ペアのアライメントされたアミノ酸配列に関する「同一性」または「同一性パーセント」とは、アライメント中の同一適合の数をカウントし、該同一適合の数を、(i) アライメントされた配列の長さ、および(ii) 96の大きい方で除算し、低速/精密ペアワイズアライメントを達成するために以下のデフォルトClustalWパラメータ--Gap Open Penalty: 10; Gap Extension Penalty: 0.10; Proteinウエイトマトリックス: Gonnetシリーズ; DNAウエイトマトリックス: IUB; Toggle Slow/Fastペアワイズアライメント=SLOWまたはFULL Alignmentを使用する、ClustalW解析(European Bioinformatics Institute, Cambridge, UKから入手可能のバージョンW 1.8)によって得られるアミノ酸配列同一性パーセントを表してよい。
【0046】
2配列は、それらが、該配列ペアに関してできるだけ最高のスコアに到達するように、規定されたアミノ酸置換マトリックス(例えばBLOSUM62)、ギャップ存在ペナルティおよびギャップ伸長ペナルティを使用して類似性スコアリングに関してアライメントされた場合に、「最適にアライメント」される。アミノ酸置換マトリックスおよび2配列間の類似性の定量化でのその使用は当技術分野で周知であり、例えばDayhoff et al. (1978) "A model of evolutionary change in proteins" in "Atlas of Protein Sequence and Structure," Vol. 5, Suppl. 3 (ed. M. O. Dayhoff), pp. 345-352. Natl. Biomed. Res. Found., Washington, D.C. およびHenikoffet al. (1992) Proc. Nat'l. Acad. Sci. USA 89: 10915-10919に記載される。BLOSUM62マトリックス(図10)は、しばしば、Gapped BLAST 2.0などの配列アライメントプロトコールにおいてデフォルトスコア置換マトリックスとして使用される。ギャップ存在ペナルティは、アライメントされた配列の一方での単一アミノ酸ギャップの導入に課せられ、ギャップ伸長ペナルティは、すでに開いたギャップ中へ挿入される追加の空の各アミノ酸位置に課せられる。アライメントは、該アライメントが開始または終了する、各配列のアミノ酸位置によって規定され、場合により、できるだけ最高のスコアに到達するような一方または両方の配列でのギャップまたは複数のギャップの挿入によって規定される。最適なアライメントおよびスコアリングは手作業で達成することができるが、コンピュータ実装アライメントアルゴリズム、例えば、Altschul et al. (1997) Nucl. Acids Res. 25: 3389-3402に記載されかつNational Center for Biotechnology Information (NCBI) Website (www.ncbi.nlm.nih.gov)で公に入手可能にされているギャップBLAST 2.0の使用によってプロセスは容易になる。マルチプルアライメントを含む最適なアライメントは、例えば、NCB1ウェブサイトを通して入手可能でかつAltschul et al. (1997) Nucl. Acids Res. 25:3389-3402に記載されるPSI-BLASTを使用して作製することができる。
【0047】
参照配列と最適にアライメントされたアミノ酸配列では、アミノ酸残基は、アライメント中で残基がペアを構成している参照配列中の位置に「対応する」。該「位置」は、参照配列中の各アミノ酸をN末端に対するその位置に基づいて連続して特定する番号によって示される。最適なアライメントを決定する場合に考慮に入れる必要がある欠失、挿入、切断、融合、などのせいで、一般に、N末端からの単純なカウントよって決定される試験配列中のアミノ酸残基番号は、必ずしも、参照配列中のその対応する位置の番号と同じではない。例えば、アライメントされた試験配列中に欠失が存在する場合、該欠失部位の、参照配列中の位置に対応するアミノ酸は存在しない。アライメントされた参照配列中に挿入が存在する場合、該挿入は参照配列中のいかなるアミノ酸位置にも対応しない。切断または融合の場合、対応する配列中のいかなるアミノ酸にも対応しない、参照配列またはアライメントされた配列中にアミノ酸のストレッチが存在しうる。
【0048】
特定のポリペプチドの非保存的改変は、保存的置換と特徴付けられていない任意のアミノ酸を置換するものである。例えば、上記6群の境界を横断する任意の置換である。これらには、中性アミノ酸の代わりの塩基性または酸性アミノ酸の置換(例えば、Val、Ile、LeuまたはMetの代わりのAsp、Glu、Asn、またはGln)、塩基性または酸性アミノ酸の代わりの芳香族アミノ酸の置換(例えば、Asp、Asn、GluまたはGlnの代わりのPhe、TyrまたはTrp)またはアミノ酸を類似のアミノ酸で置換しない任意の他の置換が含まれる。塩基性側鎖には、リシン(K)、アルギニン(R)、ヒスチジン(H)が含まれ; 酸性側鎖には、アスパラギン酸(D)、グルタミン酸(E)が含まれ; 無電荷極性側鎖には、グリシン(G)、アスパラギン(N)、グルタミン(Q)、セリン(S)、スレオニン(T)、チロシン(Y)、システイン(C)が含まれ; 無極性側鎖には、アラニン(A)、バリン(V)、ロイシン(L)、イソロイシン(I)、プロリン(P)、フェニルアラニン(F)、メチオニン(M)、トリプトファン(W)が含まれ; ベータ分岐側鎖には、スレオニン(T)、バリン(V)、イソロイシン(I)が含まれ; 芳香族側鎖には、チロシン(Y)、フェニルアラニン(F)、トリプトファン(W)、ヒスチジン(H)が含まれる。
【0049】
状況に応じて、ポリペプチド中の特定の位置の一部のアミノ酸残基は保存的アミノ酸置換から「除外」される。例えば、本開示は、配列番号4に記載の配列を含むポリペプチドを提供する。一部の実施形態では、該ポリペプチドは上記のように保存的アミノ酸置換で改変することができるが、23位、108位、および140位の残基などの特定の残基は、望ましくは非置換のままにする。
【0050】
「親」タンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞は、任意の他のタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞が、任意の方法、ツールまたは技術を使用して得られるまたは作製される元となった任意のタンパク質、酵素、ポリヌクレオチド、遺伝子、または細胞であり、親自身が天然(native)のものであるか、または突然変異体であるかには無関係である。親ポリヌクレオチドまたは遺伝子は親タンパク質または酵素をコードする。
【0051】
ポリヌクレオチド、ポリペプチド、または他の成分は、それが通常伴う成分(他のタンパク質、核酸、細胞、合成試薬、など)から部分的にまたは完全に分離されている場合に、「単離され」ている。核酸またはポリペプチドは、人工物であるかもしくは遺伝子工学的に操作されているか、または人工物のもしくは遺伝子工学的に操作されたタンパク質もしくは核酸に由来する場合に、「組み換え」られている。例えば、ポリヌクレオチドが、それが天然に見出される場合に該ポリヌクレオチドに通常隣接するヌクレオチド配列を伴わないように、ベクターまたは任意の他の異種部位、例えば組み換え生物のゲノム中の部位に挿入されたポリヌクレオチドは組み換えポリヌクレオチドである。組み換えポリヌクレオチドからin vitroまたはin vivoで発現されるタンパク質は組み換えポリペプチドの例である。同様に、天然に出現しないポリヌクレオチド配列、例えば天然に存在する遺伝子の変異体は組み換え物である。
【0052】
他の実施形態では、本開示のシトシンデアミナーゼポリペプチドまたは融合構築物をコードする、単離されたポリヌクレオチドを提供する。一態様では、本開示は、本明細書中で「CD最適化ポリヌクレオチド」、「CDポリヌクレオチド」または「CD融合ポリヌクレオチド」と称される、単離されたまたは組み換えポリヌクレオチドを提供する。用語「ポリヌクレオチド」、「ヌクレオチド配列」、および「核酸分子」は、関連の状況に応じて、ヌクレオチド(A、C、T、U、G、など、または天然に存在するかもしくは人工のヌクレオチドアナログ)のポリマー、例えばDNAまたはRNA、またはそれらの表示、例えば文字列、などを表すために使用される。所定のポリヌクレオチドまたは相補ポリヌクレオチドは、任意の指定のヌクレオチド配列から決定することができる。
【0053】
本開示の一実施形態は、シトシンデアミンまたは突然変異体シトシンデアミナーゼポリペプチドまたはその生物活性部分をコードする、単離されたポリヌクレオチドに関連する。本明細書中で使用される用語「核酸分子」または「ポリヌクレオチド」は、DNA分子(例えばcDNAまたはゲノムDNA)およびRNA分子(例えばmRNA)、ならびにヌクレオチドアナログを使用して作製されたDNAまたはRNAのアナログを含むものとする。核酸分子は一本鎖または二本鎖であってよい。
【0054】
一実施形態では、CD最適化ポリヌクレオチドまたはCDポリヌクレオチドは、生物、例えば、細菌または酵母株から単離された天然に存在する核酸の、組み換え形態、遺伝子操作形態、または単離形態を含む。典型的なCDポリヌクレオチドには、配列番号2に記載の野生型ポリペプチドをコードするものが含まれる。本開示の別の実施形態では、CDポリヌクレオチドを、1種以上の天然に存在する、単離された、または組み換えCDポリヌクレオチドを多様化する、例えば組み換え、かつ/または突然変異させることによって製造する。本明細書中の他の箇所でさらに詳細に記載されるように、多様化プロセスで基質または親として使用されるCDポリヌクレオチドより優れた機能的属性、例えば、増加した触媒機能、増加した安定性、または高い発現レベルを有するCDポリペプチドをコードする、多様化されたCDポリヌクレオチドを作製することが可能である。典型的なポリヌクレオチドには、配列番号3および5ならびに本開示のCD変異体ポリペプチドをコードするものが含まれる。
【0055】
本開示のポリヌクレオチドは、例えば、本開示のCDポリペプチドの組み換え生産(すなわち発現)における、また、さらなる多様性生成、例えば、新規および/または改良CDホモログを作製するための組み換え反応または突然変異反応の基質として、などの種々の用途を有する。
【0056】
CDポリヌクレオチドの特定の具体的、実質的および確実な有用性は該ポリヌクレオチドが実質的CD活性、または変異CD活性さえも有するポリペプチドをコードすることを必要としないことに留意することが重要である。例えば、活性な酵素をコードしないCDポリヌクレオチドは、望ましい機能的特性(例えば、高いkcatまたはkcat/Km、低いKm、熱または他の環境要因に対する高い安定性、高い転写または翻訳速度、タンパク質分解切断に対する抵抗性、など)を有するCDポリヌクレオチド変異体、または非CDポリヌクレオチド、に到達するために多様化手順で使用するための親ポリヌクレオチドの有用な供給源でありうる。
【0057】
CDポリペプチドおよびその変異体、CDポリペプチドの断片、関連融合タンパク質、またはその機能的等価物をコードするヌクレオチド配列を含むCDポリヌクレオチドを、適切な宿主細胞、例えば細菌細胞での該CDポリペプチドの発現を誘導する組み換えDNA分子中で使用する。遺伝暗号の本来的な縮重のために実質的に同一または機能的に等価のアミノ酸配列をコードする他の核酸配列を使用して、CDポリヌクレオチドをクローニングし、発現させることもできる。本明細書中で使用される用語「宿主細胞」には、核酸構築物での形質転換に感受性の任意の細胞種が含まれる。用語「形質転換」とは、宿主細胞が導入遺伝子または配列を発現して、導入遺伝子または配列によってコードされる所望の物質、典型的にタンパク質または酵素を生産するような、宿主細胞への外来性(すなわち外因性または細胞外)遺伝子、DNAまたはRNA配列の導入を意味する。導入遺伝子または配列は、調節配列または制御配列、例えば開始、終止、プロモーター、シグナル、分泌、または細胞の遺伝的機構によって使用される他の配列を含んでよい。導入DNAまたはRNAを収容しかつ発現する宿主細胞は「形質転換され」ていて、「形質転換体」または「クローン」である。宿主細胞に導入されるDNAまたはRNAは、宿主細胞と同じ属または種の細胞、または異なる属または種の細胞を含む任意の供給源由来であってよい。
【0058】
当業者に理解されるように、コード配列を改変して、特定の宿主でのその発現を増強することが有益である。遺伝暗号は縮重し、64のコドン候補があるが、ほとんどの生物はこれらのコドンのサブセットを優先的に使用する。ある種で最もよく利用されるコドンは最適コドンと称され、あまりよく利用されないコドンはまれなコドンまたは低使用コドンとして分類される(例えばZhang et al. (1991) Gene 105:61-72を参照のこと)。宿主の優先コドン使用を反映するようにコドンを置換することができ、「コドン最適化」または「種コドンバイアスのコントロール」と称されることもあるプロセスである。
【0059】
特定の原核生物または真核生物宿主によって好まれるコドンを含む最適化されたコード配列(Murray et al. (1989) Nucl. Acids Res. 17:477-508も参照のこと)は、例えば、翻訳の割合を増加させるか、または非最適化配列から生産される転写物と比較して長い半減期などの所望の特性を有する組み換えRNA転写物を生産するように調製することができる。宿主優先度を反映するように翻訳終止コドンを改変することもできる。例えば、S. cerevisiaeおよび哺乳類の好ましい終止コドンは、それぞれ、UAAおよびUGAである。単子葉植物の好ましい終止コドンはUGAであり、昆虫およびE. coliは終止コドンとしてUAAの使用を好む(Dalphin et al. (1996) Nucl. Acids Res. 24: 216-218)。
【0060】
コドン使用バイアスとは、タンパク質をコードするDNA配列(遺伝子)中のコドンの出現頻度の生物間での差異を表す。コドンは、ポリペプチド鎖中の特定のアミノ酸残基をコードする一連の3個のヌクレオチド(トリプレット)である。DNA中には4種のヌクレオチド、アデニン(A)、グアニン(G)、シトシン(C)およびチミン(T)が存在するため、20種のアミノ酸、および3種の翻訳終結(ナンセンス)コドンをコードする64種のトリプレット候補が存在する。この縮重のために、2種のアミノ酸を除くすべてのアミノ酸が2以上のトリプレットによってコードされる。異なる生物は、同一アミノ酸をコードする数個のコドンのうちの1つに特定の優先度を示すことがよくある。これらの優先がどのように生じるかは、盛んに議論される、分子進化の分野である。
【0061】
コドン優先度は、突然変異バイアスと翻訳最適化の自然選択との間のバランスを反映することが一般に認められる。急成長する微生物、例えばEscherichia coliまたはSaccharomyces cerevisiae (パン酵母)での最適コドンは、それらのそれぞれのゲノムtRNAプールの組成を反映する。最適コドンは高速の翻訳速度および高い精度の達成を支援すると考えられる。これらの要因の結果として、高度に発現される遺伝子で翻訳選択が強いと予測され、それが前述の生物での実状である。高い成長速度を示さないかまたは小さいゲノムを示す他の生物では、コドン使用最適化は、通常、不存在であり、コドン優先度は該特定のゲノムで観察される特徴的突然変異バイアスによって決定される。この例はHomo sapiens (ヒト)およびHelicobacter pyloriである。中間レベルのコドン使用最適化を示す生物には、Drosophila melanogaster (ショウジョウバエ)、Caenorhabditis elegans (線虫)またはArabidopsis thaliana (カベバシリ)が含まれる。
【0062】
用語「コドン最適化配列」とは、一般に、約20%未満の使用頻度しか有さないすべてのコドンを置換することによって特定の宿主種に最適化されているヌクレオチド配列を表す。コドン最適化に加えて、スプリアスポリアデニル化配列(spurious polyadenylation sequences)の除去、エキソン/イントロンスプライシングシグナルの除去、トランスポゾン様反復の除去および/またはGC含量の最適化によって所定の宿主種での発現に最適化されているヌクレオチド配列は、本明細書中で、「発現増強配列」と称される。
【表1】

【0063】
したがって、本開示の一部の実施形態では、ポリヌクレオチドはヒト細胞での翻訳のためにコドン最適化された分子を含む。例えば、配列番号3および5は、ヒト宿主細胞でのシトシンデアミナーゼの生産に最適化されている配列を含む。
【0064】
ゆえに、本開示は、シトシンデアミナーゼ活性を有するポリペプチドをコードするヒトコドン最適化ポリヌクレオチドを提供する。本開示のヒトコドン最適化ポリヌクレオチド(例えば配列番号5)は、さらに、コード化ポリペプチドの保存的アミノ酸置換およびまたは改良された活性もしくは安定性を生じさせる追加の突然変異を含んでよい。例えば、配列番号6を含むポリペプチドの23、108および140位での突然変異は、増加した熱安定性をもたらす。したがって、本開示は、シトシンデアミナーゼ活性および増加した熱安定性を有するポリペプチドをコードするヒトコドン最適化ポリヌクレオチドを提供する。一実施形態では、ヒトコドン最適化ポリヌクレオチドは、配列番号4のポリペプチドをコードする配列を含み、該ポリペプチドのアミノ酸をコードするコドンはヒト細胞での発現に最適化されている。別の実施形態では、本開示のポリヌクレオチドは配列番号3または5を含む。
【0065】
一実施形態では、本開示は、UPRTまたはOPRT活性を有するポリペプチドをコードする異種ポリヌクレオチドに連結されたシトシンデアミナーゼポリヌクレオチドまたはコドン最適化ポリヌクレオチドもしくは突然変異体を含むポリヌクレオチドを提供する。
【0066】
例えば、配列番号4、8、10、12、14、16、または18のポリペプチドをコードする配列; または配列番号3、5、7、9、11、13、15、または17のいずれかに記載のヌクレオチド配列、またはその一部分を有する配列を含む本開示のポリヌクレオチドを、標準的分子生物学技術および本明細書中で提供される配列情報を使用して、単離し、作製することができる。
【0067】
本開示のポリヌクレオチドは、標準的PCR増幅技術にしたがって、鋳型としてcDNA、mRNAまたは、あるいは、ゲノムDNAを使用し、かつ適切なオリゴヌクレオチドプライマーを使用して増幅することができる。そのように増幅された核酸を、適切なベクターにクローニングし、DNA配列分析によって特徴付けることができる。さらに、標準的合成技術によって、例えば自動DNA合成機を使用して、ヌクレオチド配列に対応するオリゴヌクレオチドを作製することができる。一部の実施形態では、本開示の単離された核酸分子は、配列番号2、4、6、8、10、12、14、16、または18のいずれかに記載のポリペプチドをコードするか、または配列番号1、3、5、7、9、11、13、15、または17のいずれかに記載のヌクレオチド配列を有するヌクレオチド配列の相補配列である核酸分子を含む。
【0068】
別の実施形態では、本開示の単離されたポリヌクレオチドは、配列番号4、12、14、16または18のいずれかに記載のポリペプチドをコードするヌクレオチド配列からなるか、または配列番号3、5、11、13、15、または17のいずれかに記載のヌクレオチド配列からなる核酸分子に、ストリンジェントな条件下でハイブリダイズする核酸分子を含む。他の実施形態では、該核酸は、少なくとも30、50、100、150、200、250、300、350、400、450、500、550、または600ヌクレオチド長である。核酸分子は、一方のポリヌクレオチドの少なくとも一方の鎖が規定のストリンジェンシー条件下で別のポリヌクレオチドにアニールできる場合に互いに「ハイブリダイズ可能」である。ハイブリダイゼーションのストリンジェンシーは、例えば、(a) ハイブリダイゼーションおよび/または洗浄が実施される温度、および(b) ハイブリダイゼーションおよび洗浄溶液のイオン強度および極性(例えばホルムアミド)、ならびに他のパラメータによって決定される。ハイブリダイゼーションは、2つのポリヌクレオチドが実質的に相補的な配列を含むことを必要とする; しかし、ハイブリダイゼーションのストリンジェンシーに応じて、ミスマッチが許容される。典型的に、高ストリンジェンシー(例えば、65℃の0.5 X SSCの水性溶液中)での2つの配列のハイブリダイゼーションは、配列がそれらの配列全体にわたってかなり高い程度の相補性を示すことを必要とする。中ストリンジェンシー(例えば、65℃の2 X SSCの水性溶液)および低ストリンジェンシー(例えば、55℃の2 X SSCの水性溶液)の条件は、ハイブリダイゼーション配列間で相応に低い全体的相補性しか必要としない(1 X SSCは0.15 M NaCl、0.015 Mクエン酸Naである)。ハイブリダイズする核酸分子には、好適なストリンジェンシー条件下でアニールしかつ本開示の、5-フルオロシトシン(5-FC)から5-フルオロウラシル(5-flurouracil)(5-FU)への変換を触媒する能力などの同機能を有するポリペプチドまたは酵素をコードするものが含まれる。さらに、用語「ストリンジェントな条件下でハイブリダイズ」する、とは、互いに少なくとも30%、40%、50%、または60%相同なヌクレオチド配列が、典型的に、互いにハイブリダイズしたままである、ハイブリダイゼーションおよび洗浄条件を記載するものとする。好ましくは、該条件は、互いに少なくとも約70%、より好ましくは少なくとも約80%、さらにより好ましくは少なくとも約85%または90%相同な配列が、典型的に、互いにハイブリダイズしたままであるような条件である。一部の場合、本開示の単離された核酸分子は、配列番号4、12、14、16、または18のいずれかに記載のポリペプチドをコードするか、または配列番号3、5、11、13、15、または17のいずれかに記載のヌクレオチド配列を有する核酸配列に、ストリンジェントな条件下でハイブリダイズする。本明細書中で使用される「天然に存在する」核酸分子とは、天然に存在する(例えば天然タンパク質をコードする)ヌクレオチド配列を有するRNAまたはDNA分子を表す。
【0069】
配列番号2、4、6、8、10、12、14、16、または18のいずれかに記載のポリペプチドをコードするか、または配列番号1、3、5、7、9、11、13、15、または17のいずれかに記載のヌクレオチド配列を有する、任意のポリヌクレオチドのヌクレオチド配列内に突然変異によって変化を導入し、それによりコード化タンパク質のアミノ酸配列の変化を生じさせることができることを当業者は認識しているであろう。一部の場合、該変化はポリペプチドの機能の変化を生じさせる。他の場合、該変化は、コード化ポリペプチドの機能的能力を変化させない。一般に、ポリペプチドの機能を変化させない置換には、「非必須」アミノ酸残基においてアミノ酸置換を生じさせるヌクレオチド置換が含まれる。「非必須」アミノ酸残基は、例えば5-FCから5-FUへの変換を触媒する、得られるポリペプチドの生物学的活性を変化させることなく、親配列から改変できる残基である。
【0070】
また、親ポリペプチドの活性を、該ポリペプチドが特定の基質に対する新規または増加した活性、または増加した安定性または減少した分解を有するように変化させることが望ましい状況が想定される。これらのアミノ酸置換は、一般に、「保存的」置換を構成しないことが理解される。代わりに、これらの置換は、新規または改良した活性を取得するために配列に導入された非保存的置換を構成する。例えば、配列番号1はS. cervisaeシトシンデアミナーゼの親核酸配列を提供する(配列番号2は対応するポリペプチドを提供する)。配列番号3は、該ポリペプチドに、増加した安定性を付与するアミノ酸置換を含む突然変異体配列の核酸配列を提供する。したがって、配列番号2のアミノ酸配列をコードする核酸分子は「親」核酸分子を提供し、該親核酸分子から、突然変異を施して、アミノ酸置換を含む改変されたポリペプチドをコードする核酸分子を取得することができる。
【0071】
また、改変されたポリペプチドが「親」ポリペプチドを構成でき、該親ポリペプチドから、追加の置換を施すことができることが理解される。したがって、親ポリペプチド、および親ポリペプチドをコードする核酸分子には、改変されたポリペプチドが含まれ、「野生型」配列だけではない。例えば、配列番号5のポリヌクレオチドは、配列番号1(すなわち「親」ポリヌクレオチド)に対して改変されたポリヌクレオチドである。同様に、配列番号3のポリヌクレオチドは、配列番号5に対して改変されたポリヌクレオチドである。したがって、配列番号5は配列番号3の親配列である。
【0072】
多様性を生じさせる突然変異の方法には、例えば、部位特異的突然変異誘発(Ling et al. (1997) "Approaches to DNA mutagenesis: an overview" Anal Biochem. 254(2): 157-178; Dale et al. (1996) "Oligonucleotide-directed random mutagenesis using the phosphorothioate method" Methods Mol. Biol. 57:369-374; Smith (1985) "In vitro mutagenesis" Ann. Rev. Genet. 19:423-462; Botstein & Shortle (1985) "Strategies and applications of in vitro mutagenesis" Science 229:1193-1201; Carter (1986) "Site-directed mutagenesis" Biochem. J. 237:1-7; およびKunkel (1987) "The efficiency of oligonucleotide directed mutagenesis" in Nucleic Acids & Molecular Biology (Eckstein, F. and Lilley, D. M. J. eds., Springer Verlag, Berlin)); ウラシル含有鋳型を使用する突然変異誘発(Kunkel (1985) "Rapid and efficient site-specific mutagenesis without phenotypic selection" Proc. Natl. Acad. Sci. USA 82:488-492; Kunkel et al. (1987) "Rapid and efficient site-specific mutagenesis without phenotypic selection" Methods in Enzymol. 154, 367-382; およびBass et al. (1988) "Mutant Trp repressors with new DNA-binding specificities" Science 242:240-245); オリゴヌクレオチド特異的突然変異誘発(oligonucleotide-directed mutagenesis)(Methods in Enzymol. 100: 468-500 (1983); Methods in Enzymol. 154: 329-350 (1987); Zoller & Smith (1982) "Oligonucleotide-directed mutagenesis using M13-derived vectors: an efficient and general procedure for the production of point mutations in any DNA fragment" Nucleic Acids Res. 10:6487-6500; Zoller & Smith (1983) "Oligonucleotide-directed mutagenesis of DNA fragments cloned into M13 vectors" Methods in Enzymol. 100:468-500; およびZoller & Smith (1987) "Oligonucleotide-directed mutagenesis: a simple method using two oligonucleotide primers and a single-stranded DNA template" Methods in Enzymol. 154:329-350); ホスホロチオアート修飾DNA突然変異誘発(Taylor et al. (1985) "The use of phosphorothioate-modified DNA in restriction enzyme reactions to prepare nicked DNA" Nucl. Acids Res. 13: 8749-8764; Taylor et al. (1985) "The rapid generation of oligonucleotide-directed mutations at high frequency using phosphorothioate-modified DNA" Nucl. Acids Res. 13: 8765-8787; Nakamaye & Eckstein (1986) "Inhibition of restriction endonuclease Nci I cleavage by phosphorothioate groups and its application to oligonucleotide-directed mutagenesis" Nucl. Acids Res. 14: 9679-9698; Sayers et al. (1988) "Y-T Exonucleases in phosphorothioate-based oligonucleotide-directed mutagenesis" Nucl. Acids Res. 16:791-802; およびSayers et al. (1988) "Strand specific cleavage of phosphorothioate-containing DNA by reaction with restriction endonucleases in the presence of ethidium bromide" Nucl. Acids Res. 16: 803-814); ギャップ二重鎖DNAを使用する突然変異誘発 (Kramer et al. (1984) "The gapped duplex DNA approach to oligonucleotide-directed mutation construction" Nucl. Acids Res. 12: 9441-9456; Kramer & Fritz (1987) Methods in Enzymol. "Oligonucleotide-directed construction of mutations via gapped duplex DNA" 154:350-367; Kramer et al. (1988) "Improved enzymatic in vitro reactions in the gapped duplex DNA approach to oligonucleotide-directed construction of mutations" Nucl. Acids Res. 16: 7207; およびFritz et al. (1988) "Oligonucleotide-directed construction of mutations: a gapped duplex DNA procedure without enzymatic reactions in vitro" Nucl. Acids Res. 16: 6987-6999)が含まれる。
【0073】
追加の好適な方法には、点ミスマッチ修復(Kramer et al. (1984) "Point Mismatch Repair" Cell 38:879-887)、修復欠損宿主株を使用する突然変異誘発(Carter et al. (1985) "Improved oligonucleotide site-directed mutagenesis using M13 vectors" Nucl. Acids Res. 13: 4431-4443; およびCarter (1987) "Improved oligonucleotide-directed mutagenesis using M13 vectors" Methods in Enzymol. 154: 382-403)、欠失突然変異誘発(Eghtedarzadeh & Henikoff (1986) "Use of oligonucleotides to generate large deletions" Nucl. Acids Res. 14: 5115)、制限選択および制限精製(Wells et al. (1986) "Importance of hydrogen-bond formation in stabilizing the transition state of subtilisin" Phil. Trans. R. Soc. Lond. A 317: 415-423)、トータル遺伝子合成による突然変異誘発(Nambiar et al. (1984) "Total synthesis and cloning of a gene coding for the ribonuclease S protein" Science 223: 1299-1301; Sakamar and Khorana (1988) "Total synthesis and expression of a gene for the a-subunit of bovine rod outer segment guanine nucleotide-binding protein (transducin)" Nucl. Acids Res. 14: 6361-6372; Wells et al. (1985) "Cassette mutagenesis: an efficient method for generation of multiple mutations at defined sites" Gene 34:315-323; およびGrundstrom et al. (1985) "Oligonucleotide-directed mutagenesis by microscale 'shot-gun' gene synthesis" Nucl. Acids Res. 13: 3305-3316); 二本鎖切断修復(Mandecki (1986); Arnold (1993) "Protein engineering for unusual environments" Current Opinion in Biotechnology 4:450-455; および"Oligonucleotide-directed double-strand break repair in plasmids of Escherichia coli: a method for site-specific mutagenesis" Proc. Natl. Acad. Sci. USA, 83:7177-7181)が含まれる。多数の上記方法に関する追加の詳細はMethods in Enzymology Volume 154に見出せる。該文献は、また、種々の突然変異誘発方法に伴う問題のトラブルシューティングに有用な制御を記載する。
【0074】
種々の多様性作製方法に関する追加の詳細は、以下のU.S.特許、PCT公開、およびEPO公開に見出せる: U.S. Pat. No. 5,605,793 to Stemmer (Feb. 25, 1997), "Methods for In vitro Recombination;" U.S. Pat. No. 5,811,238 to Stemmer et al. (Sep. 22, 1998) "Methods for Generating Polynucleotides having Desired Characteristics by Iterative Selection and Recombination;" U.S. Pat. No. 5,830,721 to Stemmer et al. (Nov. 3, 1998), "DNA Mutagenesis by Random Fragmentation and Reassembly;" U.S. Pat. No. 5,834,252 to Stemmer, et al. (Nov. 10, 1998) "End-Complementary Polymerase Reaction;" U.S. Pat. No. 5,837,458 to Minshull, et al. (Nov. 17, 1998), "Methods and Compositions for Cellular and Metabolic Engineering;" WO 95/22625, Stemmer and Crameri, "Mutagenesis by Random Fragmentation and Reassembly;" WO 96/33207 by Stemmer and Lipschutz "End Complementary Polymerase Chain Reaction;" WO 97/20078 by Stemmer and Crameri "Methods for Generating Polynucleotides having Desired Characteristics by Iterative Selection and Recombination;" WO 97/35966 by Minshull and Stemmer, "Methods and Compositions for Cellular and Metabolic Engineering;" WO 99/41402 by Punnonen et al. "Targeting of Genetic Vaccine Vectors;" WO 99/41383 by Punnonen et al. "Antigen Library Immunization;" WO 99/41369 by Punnonen et al. "Genetic Vaccine Vector Engineering;" WO 99/41368 by Punnonen et al. "Optimization of Immunomodulatory Properties of Genetic Vaccines;" EP 752008 by Stemmer and Crameri, "DNA Mutagenesis by Random Fragmentation and Reassembly;" EP 0932670 by Stemmer "Evolving Cellular DNA Uptake by Recursive Sequence Recombination;" WO 99/23107 by Stemmer et al., "Modification of Virus Tropism and Host Range by Viral Genome Shuffling;" WO 99/21979 by Apt et al., "Human Papillomavirus Vectors;" WO 98/31837 by del Cardayre et al. "Evolution of Whole Cells and Organisms by Recursive Sequence Recombination;" WO 98/27230 by Patten and Stemmer, "Methods and Compositions for Polypeptide Engineering;" WO 98/13487 by Stemmer et al., "Methods for Optimization of Gene Therapy by Recursive Sequence Shuffling and Selection;" WO 00/00632, "Methods for Generating Highly Diverse Libraries;" WO 00/09679, "Methods for Obtaining in vitro Recombined Polynucleotide Sequence Banks and Resulting Sequences;" WO 98/42832 by Arnold et al., "Recombination of Polynucleotide Sequences Using Random or Defined Primers;" WO 99/29902 by Arnold et al., "Method for Creating Polynucleotide and Polypeptide Sequences;" WO 98/41653 by Vind, "An in vitro Method for Construction of a DNA Library;" WO 98/41622 by Borchert et al., "Method for Constructing a Library Using DNA Shuffling;" WO 98/42727 by Pati and Zarling, "Sequence Alterations using Homologous Recombination;" WO 00/18906 by Patten et al., "Shuffling of Codon-Altered Genes;" WO 00/04190 by del Cardayre et al. "Evolution of Whole Cells and Organisms by Recursive Recombination;" WO 00/42561 by Crameri et al., "Oligonucleotide Mediated Nucleic Acid Recombination;" WO 00/42559 by Selifonov and Stemmer "Methods of Populating Data Structures for Use in Evolutionary Simulations;" WO 00/42560 by Selifonov et al., "Methods for Making Character Strings, Polynucleotides & Polypeptides Having Desired Characteristics;" WO 01/23401 by Welch et al., "Use of Codon-Varied Oligonucleotide Synthesis for Synthetic Shuffling;" およびWO 01/64864 "Single-Stranded Nucleic Acid Template-Mediated Recombination and Nucleic Acid Fragment Isolation" by Affholter。
【0075】
また、上で広く記載される1種以上の核酸配列を含む組み換え構築物を提供する。該構築物は、本開示のポリヌクレオチドがフォワードまたはリバース方向で挿入されているベクター、例えば、プラスミド、コスミド、ファージ、ウイルス、細菌性人工染色体(BAC)、酵母人工染色体(YAC)、ウイルスベクターなどを含む。多数の好適なベクターおよびプロモーターが当業者に公知であり、市販されている。一実施形態では、該ウイルスベクターはレトロウイルスベクターである。
【0076】
用語「ベクター」、「ベクター構築物」および「発現ベクター」とは、該宿主を形質転換し、導入配列の発現(例えば転写および翻訳)を促進するために、DNAまたはRNA配列(例えば外来遺伝子)を宿主細胞内に導入するのに用いられる運搬体を意味する。ベクターは、典型的に、制限酵素技術によってタンパク質をコードする外来DNAがその中に挿入される伝播性物質のDNAを含む。一般的なタイプのベクターは「プラスミド」であり、プラスミドは、概して、追加の(外来) DNAを容易に受容しかつ好適な宿主細胞に容易に導入できる二本鎖DNAの自己完結的分子である。プラスミドおよび真菌ベクターを含む多数のベクターが、種々の真核生物および原核生物宿主での複製および/または発現に関して報告されている。非限定的な例には、pKKプラスミド(Clonetech)、pUCプラスミド、pETプラスミド(Novagen, Inc., Madison, Wis.)、pRSETまたはpREPプラスミド(Invitrogen, San Diego, Calif.)、またはpMALプラスミド(New England Biolabs, Beverly, Mass.)、および、本明細書中で開示されるかもしくは引用されるかまたは他の様式で関連技術分野の当業者に公知である方法を使用する、多数の適切な宿主細胞が含まれる。組み換えクローニングベクターは、クローニングまたは発現のための1以上の複製系、宿主での選択のための1以上のマーカー、例えば抗生物質耐性、および1以上の発現カセットを含むことがよくある。
【0077】
用語「発現する」および「発現」とは、遺伝子またはDNA配列中の情報が顕在化するようにさせるかまたは引き起こすこと、例えば対応する遺伝子またはDNA配列の転写および翻訳に関与する細胞機能を活性化することによるタンパク質の生産、を意味する。DNA配列は、細胞中でまたは細胞によって発現されて、タンパク質などの「発現産物」を形成する。発現産物自体、例えば得られたタンパク質が、該細胞によって「発現された」と言ってもよい。ポリヌクレオチドまたはポリペプチドは、例えば、外来性宿主細胞中で外来性もしくは天然(native)プロモーターの制御下で、または天然(native)宿主細胞中で外来性プロモーターの制御下で発現または生産された場合に、組み換え的に発現される。
【0078】
本明細書中で提供されるポリヌクレオチドは、ポリペプチドの発現に好適な種々の発現ベクターのいずれかに組み込むことができる。好適なベクターには、染色体、非染色体および合成DNA配列、例えばSV40の誘導体; 細菌プラスミド; ファージDNA; バキュロウイルス; 酵母プラスミド; プラスミドおよびファージDNAの組み合わせに由来するベクター、ウイルスDNA、例えばワクシニア、アデノウイルス、鶏痘ウイルス、偽性狂犬病、アデノウイルス、アデノ随伴ウイルス、レトロウイルスおよび多数の他のものが含まれる。細胞内に遺伝物質を伝達し、かつ、複製が所望であれば、関連宿主中で複製適合性でかつ生存可能な任意のベクターを使用することができる。これらの核酸ベクターは、P.Midoux et al. Brit J Pharm 157: 166-178 2009またはKamimura & Liu J AAPS 10:589-595 (2008)に記載されるような非ウイルス性送達系または下記のようなウイルス系を使用して送達することができる。
【0079】
別の態様では、ウイルスまたはウイルス由来ベクターである遺伝子送達系によりシトシンデアミナーゼまたはその突然変異体をコードするポリヌクレオチドを送達する。ウイルスベクターは複製可能または複製不能であってよく、アデノウイルスベクター、麻疹ベクター、ヘルペスベクター、レトロウイルスベクター(レンチウイルスベクターを含む)、ラブドウイルスベクター、例えば水疱性口内炎ウイルスベクター、レオウイルスベクター、セネカバレーウイルスベクター、ポックスウイルスベクター(動物痘またはワクシニア由来ベクターを含む)、パルボウイルスベクター(AAVベクターを含む)、アルファウイルスベクターまたは当業者に公知の他のウイルスベクターであってよい(例えばConcepts in Genetic Medicine, ed. Boro Dropulic and Barrie Carter, Wiley, 2008, Hoboken, NJ.; The Development of Human Gene Therapy, ed. Theodore Friedmann, Cold Springs Harbor Laboratory Press, Cold springs Harbor, New York, 1999; Gene and Cell Therapy, ed. Nancy Smyth Templeton, Marcel Dekker Inc., New York, New York, 2000およびGene Therapy: Therapeutic Mechanism and Strategies, ed. Nancy Smyth Templetone and Danilo D Lasic, Marcel Dekker, Inc., New York, New York, 2000も参照のこと; 該文献の開示内容は参照によりここに組み入れられる)。
【0080】
一実施形態では、ウイルスベクターは、複製哺乳類細胞にのみ感染可能な複製適合性レトロウイルスベクターであってよい。レトロウイルスは種々の方法で分類されているが、命名法は過去10年間で標準化されてきた(ICTVdB - The Universal Virus Database, v 4 on the World Wide Web (www) at ncbi.nlm.nih.gov/ICTVdb/ICTVdB/ および教科書"Retroviruses" Eds Coffin, Hughs and Varmus, Cold Spring Harbor Press 1997を参照のこと; 該文献の開示内容は参照によりここに組み入れられる)。複製適合性レトロウイルスベクターは、オルソレトロウイルスまたは、より典型的には、ガンマレトロウイルスベクターを含んでよい。一態様では、複製適合性レトロウイルスベクターは、シトシンデアミナーゼをコードするポリヌクレオチドの5’側の内部リボソーム侵入部位(IRES)を含む。一実施形態では、シトシンデアミナーゼをコードするポリヌクレオチドはレトロウイルスベクターのENVポリヌクレオチドの3'側である。
【0081】
したがって、他の実施形態では、本開示のポリヌクレオチドを含むベクターを提供する。他の実施形態では、本開示の核酸分子、または本開示のポリヌクレオチドを含むベクターでトランスフェクトされた宿主細胞を提供する。宿主細胞には、真核細胞、例えば酵母細胞、昆虫細胞、または動物細胞が含まれる。宿主細胞にはまた、原核細胞、例えば細菌細胞も含まれる。
【0082】
以前に考察されるように、ベクター、プロモーターの使用および多数の他の関連トピックスを含む本明細書中で有用な分子生物学技術を記載する一般的テキストには、Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology Volume 152, (Academic Press, Inc., San Diego, Calif.) ("Berger"); Sambrook et al., Molecular Cloning--A Laboratory Manual, 2d ed., Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989 ("Sambrook")およびCurrent Protocols in Molecular Biology, F. M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., (supplemented through 1999) ("Ausubel")が含まれる。例えば本開示の相同的核酸の製造のための、ポリメラーゼ連鎖反応(PCR)、リガーゼ連鎖反応(LCR)、Qβ-レプリカーゼ増幅および他のRNAポリメラーゼ媒介性技術(例えばNASBA)を含むin vitro増幅法の全体にわたって当業者を導くために十分なプロトコールの例は、Berger, Sambrook, およびAusubel, ならびにMullis et al. (1987) U.S. Pat. No. 4,683,202; Innis et al., eds. (1990) PCR Protocols: A Guide to Methods and Applications (Academic Press Inc. San Diego, Calif.) ("Innis"); Arnheim & Levinson (Oct. 1, 1990) C&EN 36-47; The Journal Of NIH
Research (1991) 3: 81-94; Kwoh et al. (1989) Proc. Natl. Acad. Sci. USA 86: 1173; Guatelli et al. (1990) Proc. Nat'l. Acad. Sci. USA 87: 1874; Lomell et al. (1989) J. Clin. Chem 35: 1826; Landegren et al. (1988) Science 241: 1077-1080; Van Brunt (1990) Biotechnology 8: 291-294; Wu and Wallace (1989) Gene 4:560; Barringer et al. (1990) Gene 89:117; およびSooknanan and Malek (1995) Biotechnology 13: 563-564に見出せる。in vitro増幅核酸のクローニングのための改良された方法は、Wallace et al., U.S. Pat. No. 5,426,039に記載される。PCRによって大きい核酸を増幅するための改良された方法は、Cheng et al. (1994) Nature 369: 684-685および該文献中で引用される参考文献にまとめられ、該文献では、40 kbまでのPCRアンプリコンが作製される。逆転写酵素およびポリメラーゼを使用して、本質的に任意のRNAを、制限消化、PCRエクスパンションおよびシークエンシングに好適な二本鎖DNAに変換できることを当業者は認識するであろう。例えば、Ausubel、SambrookおよびBerger (すべて上記)を参照のこと。
【0083】
また、本明細書中で提供されるベクター(例えばクローニングベクターまたは発現ベクター)で形質導入(形質転換またはトランスフェクト)された、遺伝子工学的に操作された宿主細胞、ならびに組み換え技術による本開示のポリペプチドの製造を提供する。該ベクターは、例えば、プラスミド、ウイルス粒子、ファージ、などであってよい。該操作された宿主細胞は、プロモーターの活性化、形質転換体の選択、またはコードポリヌクレオチドの増幅のために必要に応じて改変された慣用の栄養培地で培養することができる。培養条件、例えば温度、pHなどは、発現のために選択された宿主細胞とともに以前に使用された培養条件であり、当業者には明らかであり、本明細書中に引用される参考文献、例えばSambrook、AusubelおよびBerger、ならびに例えばFreshney (1994) Culture of Animal Cells: A Manual of Basic Technique, 3rd ed. (Wiley-Liss, New York)および該文献中で引用される参考文献中で明らかである。
【0084】
ベクターを使用して、適切な宿主を形質転換し、宿主にタンパク質またはポリペプチドを発現させることができる。適切な発現宿主の例には、細菌細胞、例えば、E. coli、B. subtilis、ストレプトマイセス、およびSalmonella typhimurium; 真菌細胞、例えばSaccharomyces cerevisiae、Pichia pastoris、およびNeurospora crassa; 昆虫細胞、例えばショウジョウバエおよびSpodoptera frugiperda; 哺乳類細胞、例えばCHO、COS、BHK、HEK 293またはBowes黒色腫; または植物細胞または外植片、などが含まれる。
【0085】
細菌系では、シトシンデアミナーゼポリペプチドの意図される用途に応じて、いくつかの発現ベクターを選択することができる。例えば、商業的生産または抗体の誘導のために大量のCDポリペプチドまたはその断片が必要である場合、容易に精製できる融合タンパク質の高レベル発現を導くベクターが望ましい。そのようなベクターには、非限定的に、多機能性E. coliクローニングおよび発現ベクター、例えばBLUESCRIPT (Stratagene)、該ベクターでは、CDポリペプチドコード配列がアミノ末端Metおよびそれに続く7残基のベータ-ガラクトシダーゼの配列とインフレームでベクターにライゲートされ、ハイブリッドタンパク質が生産されるようにされる; pINベクター(Van Heeke & Schuster (1989) J. Biol. Chem. 264: 5503-5509); pETベクター(Novagen, Madison Wis.); などが含まれる。
【0086】
同様に、酵母Saccharomyces cerevisiaeでは、構成的または誘導性プロモーター、例えばアルファ因子、アルコールオキシダーゼおよびPGHを含むいくつかのベクターを本開示のCDポリペプチドの生産に使用することができる。レビューに関しては、Ausubel (上記)およびGrant et al. (1987) Methods in Enzymology 153:516-544を参照のこと。
【0087】
本開示はまた、以前のレトロウイルスベクターと比較して増加した安定性を有する複製適合性レトロウイルスベクターを提供する。感染および複製中のそのような増加した安定性は細胞増殖性障害の治療のために重要である。形質導入効率、導入遺伝子の安定性および標的選択性の組み合わせが複製適合性レトロウイルスによって提供される。該組成物および方法は挿入安定性を提供し、導入遺伝子の転写活性およびコード化ポリペプチドの翻訳生存性を維持する。
【0088】
レトロウイルスは水平伝播および垂直伝播することができる。レトロウイルスの効率的感染伝播は、ウイルスエンベロープタンパク質を特異的に認識する受容体の、標的細胞上での発現を必要とするが、ウイルスは、受容体非依存的、非特異的侵入経路を低い効率で使用することができる。さらに、標的細胞種は、ウイルスが結合および侵入した後に複製サイクルのすべての段階を支持することができなければならない。垂直伝播は、ウイルスゲノムが宿主の生殖系列中に組み込まれた場合に生じる。そしてプロウイルスは、細胞の遺伝子であるかのように、世代から世代へ継代する。ゆえに内因性プロウイルスは確立されて潜伏していることが多いが、宿主が適切な作用物質に曝露されると活性化される。
【0089】
上記のように、組み込まれたDNA中間体はプロウイルスと称される。先の遺伝子治療または遺伝子送達系では、混入ヘルパーウイルスの同時生産を伴わない、適切なヘルパーウイルスの存在下またはカプシド形成を可能にする適切な配列を含むセルライン中で、プロウイルスの転写および感染性ウイルスへの組み立てを必要とする方法およびレトロウイルスを使用する。下記のように、ヘルパーウイルスは、本開示の組み換えレトロウイルスの生産に必要とされないが、その理由は、カプシド形成のための配列がゲノム中で提供され、それによって遺伝子送達または治療のための複製適合性レトロウイルスベクターが提供されるからである。
【0090】
本開示の方法および組成物で有用なレトロウイルスゲノムは、少なくとも3つの遺伝子:gag、pol、およびenvを有するプロウイルスDNAを含み、これらの遺伝子には1または2つの長末端(LTR)反復配列が隣接するか、またはプロウイルス中で、2つの長末端反復配列(LTR)およびシス作用配列、例えばpsiを含む配列が該遺伝子に隣接している。gag遺伝子は内部構造(基質、カプシド、およびヌクレオカプシド)タンパク質をコードし; pol遺伝子は、RNA指向性DNAポリメラーゼ(逆転写酵素)、プロテアーゼおよびインテグラーゼをコードし; およびenv遺伝子はウイルスエンベロープ糖タンパク質をコードする。5'および/または3' LTRはビリオンRNAの転写およびポリアデニル化を促進する役目を果たす。該LTRはウイルス複製に必要なすべての他のシス作用配列を含む。レンチウイルスは追加の遺伝子を有し、それには、vif、vpr、tat、rev、vpu、nef、およびvpx (HIV-1、HIV-2および/またはSIV中)が含まれる。
【0091】
5' LTRに隣接して、ゲノムの逆転写に必要な配列(tRNAプライマー結合部位)およびウイルスRNAの粒子への効率的カプシド形成に必要な配列(Psi部位)がある。カプシド形成(または感染性ビリオンへのレトロウイルスRNAのパッケージング)に必要な配列がウイルスゲノムから失われていると、その結果は、ゲノムウイルスRNAのカプシド形成を妨げるシス欠損となる。このタイプの改変ベクターは、以前の遺伝子送達系(すなわち、ビリオンのカプシド形成に必要とされる要素を欠く系)で典型的に使用されているものである。
【0092】
一実施形態では、本開示は、非分裂細胞、分裂細胞、または細胞増殖性障害を有する細胞に感染可能な組み換えレトロウイルスを提供する。本開示の組み換え複製適合性レトロウイルスは、ビリオン内にカプセル封入されたウイルスGAG、ウイルスPOL、ウイルスENV、内部リボソーム侵入部位(IRES)に続く異種ポリヌクレオチドをコードするポリヌクレオチド配列を含む。
【0093】
異種核酸配列はIRESに作動可能に連結されている。本明細書中で使用される用語「異種」核酸配列または導入遺伝子とは、(i) 野生型レトロウイルスに通常存在しない配列、(ii) 他の生物種に由来する配列、または(iii) 同種由来である場合、その元の形態から実質的に改変されている可能性がある配列、を表す。あるいは、細胞で通常発現されない不変の核酸配列は異種核酸配列である。特定の実施形態では、異種ポリヌクレオチドは、シトシンデアミナーゼ活性を有する本開示のポリペプチドである。
【0094】
用語「非分裂」細胞とは、有糸分裂を経験しない細胞を表す。非分裂細胞は、細胞が活発に分裂していない限り、細胞周期の任意の時点(例えば、G0/G1、G1/S、G2/M)でブロックされる。ex vivo感染では、照射、アフィドコリン(aphidocolin)処理、血清飢餓、および接触阻害を含む、当業者によって使用される標準的技術によって分裂細胞を処理して、細胞分裂をブロックすることができる。しかし、ex vivo感染は、多数の細胞がすでに静止している(例えば幹細胞)ために、細胞をブロックすることなく実施されることがよくあることが理解されるべきである。例えば、組み換えレンチウイルスベクターは、細胞分裂をブロックするために使用される機構または細胞がブロックされる細胞周期の時点にかかわらず、任意の非分裂細胞に感染可能である。身体中の既存の非分裂細胞の例には、神経、筋肉、肝臓、皮膚、心臓、肺、および骨髄細胞、およびそれらの誘導体が含まれる。分裂細胞では、オンコレトロウイルスベクターを使用することができる。
【0095】
「分裂」細胞とは、活発な有糸分裂、または減数分裂を経験する細胞を意味する。そのような分裂細胞には、幹細胞、皮膚細胞(例えば、線維芽細胞およびケラチノサイト)、配偶子、および当技術分野で公知の他の分裂細胞が含まれる。細胞増殖性障害を有する細胞、例えば新生物細胞は特に興味深く、分裂細胞という用語に包含される。用語「細胞増殖性障害」とは、異常な数の細胞によって特徴付けられる状態を表す。該状態には、肥大性(組織内の細胞集団の過成長を生じさせる絶え間のない細胞増殖)および発育不全性(hypotrophic)(組織内の細胞の欠乏または欠損)細胞増殖の両者または、ある身体領域への過剰の細胞流入または遊走が含まれる。該細胞集団は、必ずしも、形質転換、腫瘍化または悪性細胞ではなく、正常細胞も同様に含まれる。細胞増殖性障害には、種々の線維性状態、例えば強皮症、関節炎および肝硬変などの結合組織の過成長に関連する障害が含まれる。細胞増殖性障害には、新生物障害、例えば頭頸部の癌腫が含まれる。頭部および頸部の癌腫には、例えば、口、食道、咽頭、喉頭、甲状腺、舌、唇、唾液腺、鼻、副鼻腔、上咽頭の癌腫、上鼻蓋(superior nasal vault)および洞の腫瘍、鼻腔神経芽細胞腫、扁平上皮癌(squamous call cancer)、悪性黒色腫、副鼻腔未分化癌(SNUC)、脳(グリア芽細胞腫を含む)または血液異常増殖が含まれる。また、頸部リンパ節、喉頭前リンパ節、肺食道傍リンパ節および顎下リンパ節を含む局所のリンパ節の癌腫が含まれる(Harrison's Principles of Internal Medicine (eds., Isselbacher, et al., McGraw-Hill, Inc., 13th Edition, ppl850-1853, 1994)。他の癌タイプには、非限定的に、肺癌、結腸-直腸癌、乳癌、前立腺癌、尿路癌、子宮癌リンパ腫、口腔癌、膵癌、白血病、黒色腫、胃癌、皮膚癌および卵巣癌が含まれる。
【0096】
一実施形態では、該ベクター内の異種ポリヌクレオチドは、ヒト細胞での発現に最適化されているシトシンデアミナーゼを含む。さらなる実施形態では、該シトシンデアミナーゼは、ヒトコドン最適化されていて、かつ、野生型シトシンデアミナーゼと比較して、シトシンデアミナーゼの安定性を増加(例えば分解の減少または熱安定性の増加)させる突然変異を含む配列を含む。さらに別の実施形態では、該異種ポリヌクレオチドは、UPRTまたはOPRT活性を有するポリペプチドをコードするポリヌクレオチドに作動可能に連結されたシトシンデアミナーゼ(ヒトコドン最適化型または非最適化型、突然変異型または非突然変異型)を含む融合構築物をコードする。別の実施形態では、該異種ポリヌクレオチドは、本開示のCDポリヌクレオチドまたは融合構築物(例えば、配列番号3、5、11、13、15、または17)を含む。
【0097】
別の実施形態では、複製適合性レトロウイルスベクターは、シトシンデアミナーゼを含むポリペプチドをコードする異種ポリヌクレオチド(本明細書中に記載される)を含むことができ、かつ細胞種または組織特異的プロモーターに連結されたmiRNAまたはsiRNA分子を含むポリヌクレオチドをさらに含んでよい。
【0098】
用語「調節性核酸配列」とは、レシピエント細胞でのコード配列の複製、転写および翻訳を包括的に提供する、プロモーター配列、ポリアデニル化シグナル、転写終結配列、上流調節ドメイン、複製起点、エンハンサーなどを包括的に表す。選択されたコード配列が適切な宿主細胞中で複製、転写、および翻訳可能である限り、これらの制御配列のすべてが常に存在する必要はない。当業者は公的データベースおよび材料から調節性核酸配列を容易に特定することができる。さらにまた、当業者は、例えば、in vivo、ex vivo、またはin vitroでの目的の用途に適用可能な調節配列を特定することができる。
【0099】
用語「プロモーター領域」は、DNA調節配列を含むヌクレオチド領域を表すために、その通常の意義で本明細書中で使用され、該調節配列は、遺伝子由来であり、RNAポリメラーゼと結合しかつ下流(3'方向)のコード配列の転写を開始させることが可能である。該調節配列は所望の遺伝子配列と同種または異種由来であってよい。例えば、広範囲のプロモーターを利用することができ、それには、上記のようなウイルスプロモーターまたは哺乳類プロモーターが含まれる。
【0100】
内部リボソーム侵入部位(「IRES」)とは、通常IRESの3'側のコード配列の翻訳中のリボソームの侵入または保持を促進する、核酸のセグメントを表す。一部の実施形態では、IRESはスプライスアクセプター/ドナー部位を含んでよいが、好ましいIRESはスプライスアクセプター/ドナー部位を欠く。通常、メッセンジャーRNAへのリボソームの侵入は、すべての真核生物mRNAの5'末端に位置するキャップを介して生じる。しかし、この汎用ルールの例外が存在する。一部のウイルスmRNAでキャップが不存在であることは、これらのRNAの内部部位でのリボソームの侵入を可能にする代替構造の存在を示唆する。現在までに、その機能によってIRESと称されるいくつかの前記構造が、特に、ポリオウイルス(Pelletier et al., 1988, Mol. Cell. Biol., 8, 1103-1112)およびEMCVウイルス(脳心筋炎ウイルス(Jang et al., J. Virol., 1988, 62, 2636-2643)などのピコルナウイルスのものなどの、キャップされていない(uncapped)ウイルスmRNAの5'非翻訳領域で特定されている。本開示は、複製適合性レトロウイルスベクターの関連でのIRESの使用を提供する。
【0101】
異種核酸配列は、典型的に、ウイルスLTRプロモーター・エンハンサーシグナルまたは内部プロモーターの制御下にあり、レトロウイルスLTR内の保持されたシグナルは宿主細胞ゲノムへのベクターの効率的組み込みを依然として生じさせることができる。したがって、本開示の組み換えレトロウイルスベクター、所望の配列、遺伝子および/または遺伝子断片を数個の部位で異なる調節配列の下で挿入することができる。例えば、挿入部位は、ウイルスエンハンサー/プロモーター近接部位(すなわち5' LTRによって駆動される遺伝子座)であってよい。あるいは、所望の配列を遠位部位(例えば、env遺伝子の3'側のIRES配列)に挿入することができ、または2以上の異種配列が存在する場合、1異種配列は第1の調節領域の制御下であり、かつ第2の異種配列は第2の調節領域の制御下であってよい。他の遠位部位には、ウイルスプロモーター配列が含まれ、所望の配列または配列群の発現がプロモーター近接シストロンのスプライシングによるものである場合、SV40またはCMVなどの内部異種プロモーター、または内部リボソーム侵入部位(IRES)を使用することができる。
【0102】
一実施形態では、本開示のレトロウイルスゲノムは、所望のポリヌクレオチド配列の挿入のためのクローニング部位を含むIRESを含む。一実施形態では、該IRESはレトロウイルスベクター中のenv遺伝子の3'側であるが、所望の異種核酸の5'側に位置する。状況に応じて、所望のポリペプチドをコードする異種ポリヌクレオチド配列はIRESに作動可能に連結することができる。
【0103】
別の実施形態では、ターゲティングポリヌクレオチド配列が、本開示の組み換えレトロウイルスベクターの部分として含まれる。該ターゲティングポリヌクレオチド配列は、ターゲティングリガンド(例えば、ペプチドホルモン、例えばヘレグリン、単鎖抗体、受容体または受容体リガンド)、組織特異的または細胞種特異的調節要素(例えば、組織特異的または細胞種特異的プロモーターまたはエンハンサー)、またはターゲティングリガンドと組織特異的/細胞種特異的調節要素の組み合わせである。好ましくは、ターゲティングリガンドは該レトロウイルスのenvタンパク質に作動可能に連結されて、キメラレトロウイルスenvタンパク質を創出する。ウイルスGAG、ウイルスPOLおよびウイルスENVタンパク質は、任意の好適なレトロウイルス由来(例えば、MLVまたはレンチウイルス由来)であってよい。別の実施形態では、該ウイルスENVタンパク質は非レトロウイルス由来(例えば、CMVまたはVSV)である。
【0104】
本開示の組み換えレトロウイルスは、したがって、該ウイルスが特定の細胞種(例えば、平滑筋細胞、肝細胞、腎細胞、線維芽細胞、ケラチノサイト、間葉系幹細胞、骨髄細胞、軟骨細胞、上皮細胞、腸細胞、新生物細胞、神経膠腫細胞、神経細胞および当技術分野で公知の他のもの)に向けられ、該核酸ゲノムが標的非分裂、標的分裂細胞、または細胞増殖性障害を有する標的細胞に送達されるように遺伝子改変される。ターゲティングは2つの方法で達成することができる。第1の方法は、ある分子を細胞の外面に有する細胞への結合によってレトロウイルスを標的細胞に導く。レトロウイルスをターゲティングするこの方法は、レトロウイルスの表面のターゲティングリガンドと相互作用する受容体または結合分子を有する細胞または組織へのウイルスのターゲティングを支援するためにレトロウイルスの被膜上のターゲティングリガンドの発現を利用する。ウイルスによる細胞への感染後、ウイルスはその核酸を細胞内に注入し、レトロウイルス遺伝物質が宿主細胞ゲノムに組み込まれる。第2のターゲティング方法は、以下でより完全に記載されるように、細胞特異的または組織特異的調節要素を使用して、該調節要素を活発に利用する標的にされた細胞中のウイルスゲノムの発現および転写を促進する。導入されたレトロウイルス遺伝物質は該宿主細胞内で転写され、タンパク質に翻訳される。該ターゲティング調節要素は、典型的に5'および/または3' LTRに連結され、キメラLTRを創出する。
【0105】
例えば特定の標的細胞上の受容体のリガンドをコードする別の遺伝子とともに、目的の異種核酸配列を本開示のウイルスベクターに挿入することによって、該ベクターは標的特異的になる。ウイルスベクターは、例えば、糖、糖脂質、またはタンパク質を取り付けることによって標的特異的にすることができる。ターゲティングは、抗体を使用してウイルスベクターをターゲティングすることによって達成することができる。目的の核酸配列を含むウイルスベクターの標的特異的送達を可能にするためにウイルスゲノムに挿入できる特定のポリヌクレオチド配列またはウイルスエンベロープに取り付けることができるタンパク質を当業者は承知するか、または容易に突きとめることができる。
【0106】
ゆえに、本開示は、一実施形態では、ターゲティングポリペプチドに作動可能に連結されたレトロウイルスenvタンパク質を含むキメラenvタンパク質を含む。該ターゲティングポリペプチドは、細胞特異的受容体分子、細胞特異的受容体のリガンド、細胞特異的抗原性エピトープに対する抗体もしくは抗体断片または、当技術分野で容易に特定できる、標的細胞と結合または相互作用可能な任意の他のリガンドであってよい。ターゲティングポリペプチドまたは分子の例には、ビオチン-ストレプトアビジンをリンカーとして使用する二価抗体(Etienne-Julan et al., J. Of General Virol., 73, 3251-3255 (1992); Roux et al., Proc. Natl. Acad. Sci USA 86, 9079-9083 (1989))、ハプテンに対する単鎖抗体可変領域をコードする配列を、そのエンベロープ中に含む組み換えウイルス(Russell et al., Nucleic Acids Research, 21, 1081-1085 (1993))、ペプチドホルモンリガンドのレトロウイルスエンベロープへのクローニング(Kasahara et al., Science, 266, 1373-1376 (1994))、キメラEPO/env構築物(Kasahara et al., 1994)、LDL受容体を発現するHeLa細胞の特異的感染を生じさせる、エコトロピックMLVエンベロープ中の低密度リポタンパク質(LDL)受容体に対する単鎖抗体(Somia et al., Proc. Natl. Acad. Sci USA, 92, 7570-7574 (1995))が含まれ、同様に、ALVの宿主クラスを、インテグリンリガンドを組み入れることによって改変して、該ウイルスが種を横断し、特にラットグリア芽細胞腫細胞に感染することを可能にすることができ(Valsesia-Wittmann et al., J. Virol. 68, 4609-4619 (1994))、ならびに、Dornberg and co-workers (Chu and Dornburg, J. Virol 69, 2659-2663 (1995))は、腫瘍マーカーを標的にする単鎖抗体を含むエンベロープを使用する、トリレトロウイルスである脾臓壊死ウイルス(SNV)の組織特異的ターゲティングを報告している。
【0107】
本開示は、標的細胞に感染可能な組み換えレトロウイルスの製造方法であって、ウイルスgag、ウイルスpolおよびウイルスenvをコードするポリヌクレオチド配列を含むベクター(このベクターは、調節性核酸配列に作動可能に連結された、異種遺伝子の導入のためのクローニング部位を含む)で好適な宿主細胞をトランスフェクトするステップ、および組み換えウイルスを回収するステップを含む、方法を提供する。
【0108】
本開示のレトロウイルスおよび方法は、増殖しかつビリオンを生産するためにヘルパーウイルスまたは追加の核酸配列またはタンパク質を必要としない複製適合性レトロウイルスを提供する。例えば、本開示のレトロウイルスの核酸配列は、例えば、上で考察されるように、グループ特異的抗原および逆転写酵素、(およびインテグラーゼおよびプロテアーゼ -成熟および逆転写に必要な酵素)をそれぞれコードする。ウイルスgagおよびpolは、レンチウイルス、例えばHIVまたはオンコウイルス、例えばMoMLV由来であってよい。さらに、本開示のレトロウイルスの核酸ゲノムは、ウイルスエンベロープ(ENV)タンパク質をコードする配列を含む。env遺伝子は任意のレトロウイルス由来であってよい。envは、ヒトおよび他の種の細胞の形質導入を可能にする両種性(amphotropic)エンベロープタンパク質であるか、またはマウスおよびラット細胞にのみ形質導入することができる同種性(ecotropic)エンベロープタンパク質であってよい。さらに、エンベロープタンパク質と抗体または、特定の細胞種の受容体へのターゲティングのための特定のリガンドとを連結することによって、組み換えウイルスをターゲティングにすることが望ましい。上記のように、レトロウイルスベクターは、例えば、糖脂質、またはタンパク質を挿入することによって標的特異的にすることができる。ターゲティングは、抗体を使用して、レトロウイルスベクターを特定の細胞種(例えば、特定の組織で見出される細胞種、または癌細胞種)上の抗原に向けることによって達成されることがよくある。特定の標的へのレトロウイルスベクターの送達を達成するための具体的方法を当業者は承知するか、または過度の実験を行うことなく容易に突きとめることができる。一実施形態では、env遺伝子は非レトロウイルス(例えば、CMVまたはVSV)由来である。レトロウイルス由来env遺伝子の例には、非限定的に: モロニーマウス白血病ウイルス(MoMuLV)、ハーベイマウス肉腫ウイルス(HaMuSV)、マウス乳癌ウイルス(MuMTV)、テナガザル白血病ウイルス(GaLV)、ヒト免疫不全ウイルス(HIV)およびラウス肉腫ウイルス(Rous Sarcoma Virus)(RSV)が含まれる。他のenv遺伝子、例えば水疱性口炎ウイルス(VSV)(プロテインG)、サイトメガロウイルスエンベロープ(CMV)、またはインフルエンザウイルス赤血球凝集素(HA)を使用することもできる。
【0109】
一実施形態では、レトロウイルスゲノムは、オンコレトロウイルスまたはガンマレトロウイルス、およびさらに具体的には哺乳類オンコレトロウイルスまたはガンマレトロウイルス由来である。「由来(派生)(derived)」は、親ポリヌクレオチド配列が野生型オンコウイルスであり、それが、天然に存在する配列の挿入または除去(例えば、IRESの挿入、例えば本開示のシトシンデアミナーゼ活性を有するポリペプチドをコードする異種ポリヌクレオチドの挿入、など)によって改変されていることを意味する。
【0110】
別の実施形態では、本開示は、調節配列を使用して標的化されたレトロウイルスベクターを提供する。細胞特異的または組織特異的調節配列(例えばプロモーター)を利用して、特定の細胞集団での遺伝子配列の発現を標的化することができる。本開示に好適な哺乳類プロモーターおよびウイルスプロモーターは本明細書中の他の箇所で記載される。したがって、一実施形態では、本開示は、レトロウイルスゲノムの5'末端に組織特異的プロモーター要素を有するレトロウイルスを提供する。好ましくは、該組織特異的調節要素/配列は、レトロウイルスゲノムのLTRのU3領域中であり、例えば新生物細胞に対する細胞特異的または組織特異的プロモーターおよびエンハンサー(例えば、腫瘍細胞特異的エンハンサーおよびプロモーター)、および誘導性プロモーター(例えばテトラサイクリン)を含む。
【0111】
一部の状況では、発現を調節することが望ましい。例えば、所望の発現レベルに応じて、種々の強度の活性を有する異なるウイルスプロモーターを利用することができる。哺乳類細胞では、CMV前初期プロモーターを使用して強力な転写活性化を提供することがよくある。あまり強力でないCMVプロモーターの改変バージョンも、導入遺伝子の低レベルの発現が所望である場合に使用されている。造血細胞での導入遺伝子の発現が所望である場合、レトロウイルスプロモーター、例えばMLVまたはMMTV由来のLTRを使用することができる。使用できる他のウイルスプロモーターには、SV40、RSV LTR、HIV-1およびHIV-2 LTR、アデノウイルスプロモーター、例えばE1A、E2A、またはMLP領域由来のプロモーター、AAV LTR、カリフラワーモザイクウイルス、HSV-TK、およびトリ肉腫ウイルスが含まれる。
【0112】
同様に、組織特異的または選択的プロモーターを使用して、非標的組織に対する潜在的な毒性または望ましくない影響を減少させるために、特定の組織または細胞で転写を達成することができる。例えば、PSA、プロバシン、前立腺酸性ホスファターゼまたは前立腺特異的腺性カリクレイン(hK2)などのプロモーターを使用して、前立腺での遺伝子発現を標的化することができる。使用できる他のプロモーター/調節ドメインは表1に記載される。
【0113】
特定の適応では、遺伝子治療ベクターの投与後の特定の時点で転写を活性化することが望ましい。これは、ホルモンまたはサイトカイン調節可能なプロモーターなどのプロモーターを用いて行うことができる。例えば、適応が、特定のステロイドが生産されるかまたは送られる生殖腺組織である治療用途では、アンドロゲンまたはエストロゲン調節プロモーターの使用が有益である。そのようなホルモン調節可能なプロモーターには、MMTV、MT-1、エクジソンおよびRuBiscoが含まれる。甲状腺、下垂体および副腎ホルモンに応答するプロモーターなどの他のホルモン調節プロモーターを使用してもよい。使用できるサイトカインおよび炎症性タンパク質応答性プロモーターには、KおよびTキニノゲン(Kageyama et al., 1987)、c-fos、TNF-アルファ、C-反応性タンパク質(Arcone et al., 1988)、ハプトグロビン(Oliviero et al., 1987)、血清アミロイドA2、C/EBPアルファ、IL-1、IL-6 (Poli and Cortese, 1989)、補体C3 (Wilson et al., 1990)、IL-8、アルファ-1酸糖タンパク質(Prowse and Baumann, 1988)、アルファ-1アンチチプシン(alpha-1 antitypsin)、リポタンパク質リパーゼ(Zechner et al., 1988)、アンギオテンシノゲン(Ron et al., 1990)、フィブリノーゲン、c-jun (ホルボールエステル、TNF-アルファ、UV照射、レチノイン酸、および過酸化水素によって誘導可能)、コラゲナーゼ(ホルボールエステルおよびレチノイン酸によって誘導される)、メタロチオネイン(重金属および糖質コルチコイド誘導性)、ストロメライシン(ホルボールエステル、インターロイキン-1およびEGFによって誘導可能)、アルファ-2マクログロブリンおよびアルファ-1アンチキモトリプシンが含まれる。腫瘍特異的プロモーター、例えばオステオカルシン、低酸素応答要素(HRE)、MAGE-4、CEA、アルファ-フェトプロテイン、GRP78/BiPおよびチロシナーゼを使用して、腫瘍細胞での遺伝子発現を調節してもよい。
【0114】
さらに、このプロモーターのリストは、網羅的または限定的であると解釈されるべきではなく、本明細書中で開示されるプロモーターおよび方法とともに使用してよい他のプロモーターを当業者は承知する。
【0115】
表1 組織特異的プロモーター
組織 プロモーター
膵臓 インスリン エラスチン アミラーゼ
pdr-1 pdx-1 グルコキナーゼ
肝臓 アルブミン PEPCK HBVエンハンサー
αフェトプロテイン アポリポタンパク質C α-1
アンチトリプシン ビテロゲニン, NF-AB
トランスチレチン
骨格筋 ミオシンH鎖 筋クレアチンキナーゼ
ジストロフィン カルパインp94 骨格
アルファ-アクチン 速筋トロポニン1 (fast troponin 1)
皮膚 ケラチンK6 ケラチンK1
肺 CFTRヒトサイトケラチン18 (K18)
肺サーファクタントタンパク質A, BおよびC CC-10 P1
平滑筋 sm22 α SM-アルファ-アクチン
内皮 エンドセリン-1 E-セレクチン フォン
ウィルブランド因子 TIE, KDR/flk-1
メラノサイト チロシナーゼ
脂肪組織 リポタンパク質リパーゼ(Zechner et al., 1988)
アジプシン(Spiegelman et al., 1989)
アセチル-CoAカルボキシラーゼ(Pape and Kim, 1989)
グリセロリン酸デヒドロゲナーゼ(Dani et al., 1989)
脂肪細胞P2 (Hunt et al., 1986)
乳房 乳清酸性タンパク質(WAP)(Andres et al. PNAS 84:1299-1303 1987
血液 β-グロビン
【0116】
「組織特異的調節要素」は、一組織において遺伝子の転写を駆動可能であり、他の組織タイプでは大部分は「サイレント」のままである調節要素(例えばプロモーター)である。しかし、組織特異的プロモーターは、それらがサイレントである組織において検出可能な量の「バックグラウンド」または「基底」活性を有することが理解される。プロモーターが標的組織で選択的に活性化される程度は、選択比(標的組織での活性/コントロール組織での活性)として表記することができる。この関連で、本開示の実施で有用な組織特異的プロモーターは、典型的に、約5より大きい選択比を有する。好ましくは、該選択比は約15より大きい。
【0117】
さらに、単一組織タイプに活性が制限されない特定のプロモーターは、それにもかかわらず、それらが一群の組織で活性であり、かつ別の群であまり活性でないかまたはサイレントである点で選択性を示すことが理解される。そのようなプロモーターもまた、「組織特異的」と称され、本開示とともに使用することが想定される。したがって、本開示で使用される組織特異的調節要素は、本開示のシトシンデアミナーゼ活性を有するポリペプチドなどの異種タンパク質の調節への適用可能性ならびにレトロウイルスベクター中のターゲティングポリヌクレオチド配列としての適用可能性を有する。
【0118】
本開示のレトロウイルスベクターおよびCDポリヌクレオチドおよびポリペプチドを使用して、多数の細胞増殖性疾患および障害を含む広範囲の疾患および障害を治療することができる(例えばU.S. Pat. Nos. 4,405,712および4,650,764; Friedmann, 1989, Science, 244:1275-1281; Mulligan, 1993, Science, 260:926-932, R. Crystal, 1995, Science 270:404-410 (各文献は参照によりその全体がここに組み入れられる)を参照のこと; さらにThe Development of Human Gene Therapy, Theodore Friedmann, Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1999. ISBN 0-87969-528-5 (該文献は参照によりその全体がここに組み入れられる)を参照のこと)。
【0119】
本開示はまた、細胞増殖性障害の治療のための遺伝子治療を提供する。そのような治療は、適切な治療用ポリヌクレオチド配列(例えば、シトシンデアミナーゼ活性を有する本開示のポリペプチド)を、増殖性障害を有する被験体の細胞に導入することによってその治療効果を達成する。ポリヌクレオチド構築物の送達は、本開示の組み換えレトロウイルスベクターを使用して達成することができる。
【0120】
さらに、本明細書中に記載の治療方法(例えば、遺伝子治療または遺伝子送達方法)はin vivoまたはex vivoで実施することができる。例えば、細胞増殖性疾患または障害の治療のための方法では、例えば外科的にまたは照射によって遺伝子治療前に大多数の腫瘍を除去することが有用である。一部の実施形態では、レトロウイルス療法の前またはその後に化学療法を実施する。
【0121】
ゆえに、本開示は、非分裂細胞、分裂細胞または新生物細胞に感染可能な組み換えレトロウイルスであって、ウイルスGAG; ウイルスPOL; ウイルスENV; IRESに作動可能に連結された異種核酸(例えば、シトシンデアミナーゼ活性を有する本開示のポリペプチドを含む); およびパッケージング、逆転写および組み込みに必要なシス作用性核酸配列を含む、組み換えレトロウイルスを提供する。該組み換えレトロウイルスはHIVなどのレンチウイルスであるか、またはオンコウイルスであってよい。組み換えレトロウイルスの製造方法に関して上記のように、本開示の組み換えレトロウイルスは、さらに、VPR、VIF、NEF、VPX、TAT、REV、およびVPUタンパク質の少なくとも1つを含んでよい。特定の理論によって拘束されることを望まないが、1種以上のこれらの遺伝子/タンパク質産物は、生産される組み換えレトロウイルスのウイルス力価を増加させるために重要である(例えばNEF)か、またはビリオンの感染およびパッケージングに必要であると考えられる。
【0122】
本開示はまた、特定の核酸(例えば、シトシンデアミナーゼ活性を有するポリペプチドをコードするポリヌクレオチドなどの異種配列)の発現を提供するための標的細胞への核酸導入方法を提供する。したがって、別の実施形態では、本開示は、標的細胞での異種核酸の導入および発現のための方法であって、本開示の組み換えウイルスを標的細胞に感染させるステップおよび標的細胞で異種核酸を発現させるステップを含む、方法を提供する。上記のように、該標的細胞は、それらにレトロウイルスが感染可能である限り、分裂、非分裂、新生物、不死化、改変および、当業者によって認識される他の細胞種を含む任意の細胞種であってよい。
【0123】
本開示はまた、細胞増殖性または免疫性障害の治療のための遺伝子治療を提供する。一実施形態では、本開示のCDポリヌクレオチドを導入し、ポリヌクレオチドを発現させてシトシンデアミナーゼ活性を含むポリペプチドを生産させ、かつ細胞を、細胞傷害量の5-FUを生産するための量および期間で5-フルオロシトシンと接触させることによって細胞増殖性障害を治療する。
【0124】
さらに、本開示は、本開示の組み換えレトロウイルスベクターをコードするポリヌクレオチド配列を提供する。該ポリヌクレオチド配列を種々のウイルス粒子に組み入れることができる。例えば、遺伝子治療に利用できる種々のウイルスベクターには、アデノウイルス、ヘルペスウイルス、ワクシニア、または、好ましくは、RNAウイルス、例えばレトロウイルスおよび、さらに具体的には、哺乳類オンコウイルスが含まれる。レトロウイルスベクターはマウス、サルまたはヒトレトロウイルスの誘導体であってよい。外来遺伝子(例えば異種ポリヌクレオチド配列)を挿入できるレトロウイルスベクターの例には、非限定的に、モロニーマウス白血病ウイルス(MoMuLV)、ハーベイマウス肉腫ウイルス(HaMuSV)、マウス乳癌ウイルス(MuMTV)、およびラウス肉腫ウイルス(RSV)の誘導体が含まれる。すべてのこれらのベクターは、選択マーカー遺伝子を導入または組み入れて、形質導入された細胞が特定および作製できるようにすることができる。さらに別の実施形態では、本開示は、組み換えレトロウイルス派生構築物を含むプラスミドを提供する。該プラスミドは、標的細胞または細胞培養物、例えばNIH 3T3、HT1080 (ヒト)、CF2 (イヌ)または他の組織培養細胞に直接導入することができる。得られた細胞はレトロウイルスベクターを培養培地に放出する。
【0125】
本開示は、5'から3'方向に、転写の開始に有用なプロモーターまたは調節領域; psiパッケージングシグナル; gagコード核酸配列、polコード核酸配列; envコード核酸配列; 内部リボソーム侵入部位核酸配列; マーカー、治療用(例えばシトシンデアミナーゼ活性を有するポリペプチド)または診断用ポリペプチドをコードする異種ポリヌクレオチド; およびLTR核酸配列を含むポリヌクレオチド構築物を提供する。特定の実施形態では、シトシンデアミナーゼ活性を有するポリペプチドをコードする異種ポリヌクレオチドは、さらに、UPRTまたはOPRT活性を含むポリペプチドをコードするドメインを含んでよい。
【0126】
本明細書中の他の箇所で記載されかつ以下のように、本開示のポリヌクレオチド構築物(例えば組み換え複製適合性レトロウイルスポリヌクレオチド)の種々のセグメントを、所望の宿主細胞、発現タイミングまたは量、および該異種ポリヌクレオチドに部分的に応じて操作する。本開示の複製適合性レトロウイルス構築物はいくつかのドメインに分けることができ、該ドメインを当業者は個別に改変することができる。
【0127】
例えば、該プロモーターは、配列番号19、20、または22のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を有するCMVプロモーターを含んでよく、改変されたプロモーターが転写を誘導し開始させることが可能である限り、1以上(例えば、2〜5、5〜10、10〜20、20〜30、30〜50、50〜100またはそれ以上の核酸塩基)に対する改変を含んでよい。一実施形態では、該プロモーターまたは調節領域はCMV-R-U5ドメインポリヌクレオチドを含む。CMV-R-U5ドメインは、MLV R-U5領域に対して、ヒトサイトメガロウイルス由来の前初期プロモーターを含む。一実施形態では、CMV-R-U5ドメインポリヌクレオチドは、配列番号19、20、または22のヌクレオチド約1位〜ヌクレオチド約1202位に記載の配列または、配列番号19、20、または22に記載の配列と少なくとも95%同一の配列を含み、ここで該ポリヌクレオチドはそれに作動可能に連結された核酸分子の転写を促進する。該ポリヌクレオチドのgagドメインは任意の数のレトロウイルス由来であってよいが、典型的に、オンコレトロウイルス由来であり、さらに具体的には、哺乳類オンコレトロウイルス由来である。一実施形態では、該gagドメインはヌクレオチド番号約1203位〜ヌクレオチド約2819位の配列または、それに対して少なくとも95%、98%、99%または99.8% (最も近い10thに端数を丸めている)の同一性を有する配列を含む。該ポリヌクレオチドのpolドメインは任意の数のレトロウイルス由来であってよいが、典型的に、オンコレトロウイルス由来であり、さらに具体的には、哺乳類オンコレトロウイルス由来である。一実施形態では、該polドメインはヌクレオチド番号約2820位〜ヌクレオチド約6358位の配列または、それに対して少なくとも95%、98%、99%または99.9% (最も近い10thに端数を丸めている)の同一性を有する配列を含む。該ポリヌクレオチドのenvドメインは任意の数のレトロウイルス由来であってよいが、典型的に、オンコレトロウイルス由来であり、さらに具体的には、哺乳類オンコレトロウイルス由来である。一部の実施形態では、該envコードドメインは両種性envドメインを含む。一実施形態では、該envドメインはヌクレオチド番号約6359位〜ヌクレオチド約8323位の配列または、それに対して少なくとも95%、98%、99%または99.8% (最も近い10thに端数を丸めている)の同一性を有する配列を含む。該ポリヌクレオチドのIRESドメインは、任意の数の内部リボソーム侵入部位から取得することができる。一実施形態では、IRESは脳心筋炎ウイルス由来である。一実施形態では、該IRESドメインは、ドメインがリボソームの侵入を可能にする限り、ヌクレオチド番号約8327位〜ヌクレオチド約8876位の配列または、それに対して少なくとも95%、98%、または99% (最も近い10thに端数を丸めている)の同一性を有する配列を含む。該異種ドメインは本開示のシトシンデアミナーゼを含んでよい。一実施形態では、該CDポリヌクレオチドはヒトコドン最適化配列を含む。さらに別の実施形態では、該CDポリヌクレオチドは、シトシンデアミナーゼを有する突然変異体ポリペプチドをコードし、ここに該突然変異は、広い温度範囲にわたって持続した動力学的活性を可能にする、融解温度(Tm)を10℃高める熱安定化の増加およびタンパク質の蓄積レベルの増加を付与する。一実施形態では、該シトシンデアミナーゼは、配列番号19のヌクレオチド番号約8877位〜約9353位に記載の配列を含む。ポリプリンリッチドメインが該異種ドメインに続いてもよい。3' LTRは、任意の数のレトロウイルス、典型的にオンコレトロウイルスおよび好ましくは哺乳類オンコレトロウイルス由来であってよい。一実施形態では、該3' LTRはU3-R-U5ドメインを含む。さらに別の実施形態では、該LTRは、配列番号19のヌクレオチド約9405位〜約9998位に記載の配列または、それに対して少なくとも95%、98%または99.5% (最も近い10thに端数を丸めている)同一の配列を含む。
【0128】
本開示はまた、5'から3'方向に、CMV-R-U5、ヒトサイトメガロウイルス由来の前初期プロモーターとMLV R-U5領域との融合物; PBS、逆転写酵素のためのプライマー結合部位; 5'スプライス部位; Ψパッケージングシグナル; gag、MLV群特異的抗原のORF; pol、MLVポリメラーゼポリプロテインのORF; 3'スプライス部位; 4070A env、MLV 4070A系統のエンベロープタンパク質のORF; IRES、脳心筋炎ウイルスの内部リボソーム侵入部位; 改変されたシトシンデアミナーゼ(熱安定化およびコドン最適化); PPT、ポリプリントラクト; およびU3-R-U5、MLV長末端反復配列を含む組み換えレトロウイルスベクターを提供する。この構造を図1にさらに示す。
【0129】
本開示はまた、配列番号19、20、または22に記載の配列を含むレトロウイルスベクターを提供する。
【0130】
別の実施形態では、本開示は、細胞増殖性障害を有する被験体の治療方法を提供する。該被験体は任意の哺乳類であってよく、好ましくはヒトである。該被験体を、本開示の組み換え複製適合性レトロウイルスベクターと接触させる。該接触はin vivoまたはex vivoであってよい。本開示のレトロウイルスベクターを投与する方法は当技術分野で公知であり、それには、例えば、全身投与、局所投与、腹腔内投与、筋肉内投与、頭蓋内、脳脊髄、ならびに腫瘍または細胞増殖性障害の部位での直接投与が含まれる。他の投与経路は当技術分野で公知である。
【0131】
ゆえに、本開示は、細胞増殖性障害を治療するために有用な種々の医薬組成物を含む。本開示の医薬組成物は、担体、賦形剤および添加物または補助物質を使用して、本開示に基づく細胞増殖性障害の治療または調節に有用な異種ポリヌクレオチド配列を含むレトロウイルスベクターを、被験体への投与に好適な形態にすることによって製造される。頻繁に使用される担体または補助物質には、炭酸マグネシウム、二酸化チタン、ラクトース、マンニトールおよび他の糖、タルク、乳タンパク質、ゼラチン、デンプン、ビタミン、セルロースおよびその誘導体、動物油および植物油、ポリエチレングリコールおよび溶媒、例えば滅菌水、アルコール、グリセロールおよび多価アルコールが含まれる。静脈内ビヒクルには、液体および栄養分補充液(nutrient replenishers)が含まれる。保存剤には、抗菌剤、抗酸化剤、キレート剤および不活性ガスが含まれる。他の製薬的に許容される担体には、例えばRemington's Pharmaceutical Sciences, 15th ed. Easton: Mack Publishing Co., 1405-1412, 1461-1487 (1975)およびThe National Formulary XIV., 14th ed. Washington: American Pharmaceutical Association (1975)(該文献の内容は参照によりここに組み入れられる)に記載のように、水性溶液、無毒の賦形剤、例えば、塩、保存剤、バッファーなどが含まれる。医薬組成物のpHおよび種々の成分の正確な濃度は、当技術分野の慣用的技術にしたがって調節される。Goodman and Gilman's The Pharmacological Basis for Therapeutics (7th ed.)を参照のこと。
【0132】
例えば、限定目的でなく、細胞増殖性障害の治療に有用なレトロウイルスベクターは、両種性ENVタンパク質、GAG、およびPOLタンパク質、U3領域レトロウイルスゲノム中のプロモーター配列、およびレトロウイルスのゲノムの複製、パッケージングおよび標的細胞への組み込みに必要なすべてのシス作用配列を含む。
【0133】
以下の実施例は本開示を説明するためのものであり、限定するためのものではない。そのような実施例は、使用することができる実施例の典型であり、当業者に公知の他の手順を代わりに利用してもよい。
【0134】
実施例
【実施例1】
【0135】
実施例1 改変されたCD遺伝子の構築およびプラスミドベクターへの挿入
野生型酵母シトシンデアミナーゼ遺伝子に対する遺伝子強化は、(1) 3つのアミノ酸を変化させて(A23L、I140LおよびV108I)、酵母シトシンデアミナーゼタンパク質の熱安定性を増加させる、3つの位置の突然変異、および(2) アミノ酸配列をさらに変化させることなくヒト細胞でのタンパク質翻訳効率を向上させるヒトコドン使用配列を強化するための追加の遺伝子配列改変を含むように施された。
【0136】
CDの配列設計は、最適化CD、CD-UPRT (+/-リンカー)およびCD-OPRTアーゼ(+/-リンカー)を含んだ。最終シトシンデアミナーゼコード配列は、PSI1/Not1カセットに基づくストラテジーのため、5'末端にPSI1部位(全長)ならびに3'末端にNot1部位およびポリA尾部を含みうる。
【0137】
酵母シトシンデアミナーゼを含む以下の配列を、クローニング、最適化および突然変異に使用した(ボックスで囲まれた核酸は、後の方法でクローニングに使用される制限部位を含む)。

【0138】
以下の表は、作製された遺伝子および得られたプラスミドベクターならびにそれらの名称をまとめる。
【表2】

【0139】
Kasahara et al.によって報告された複製適合性レトロウイルスベクター、pACE-CD (米国特許第6,899,871号、該文献の開示内容はここに組み入れられる)を追加の改変の基礎として使用した。本明細書中に記載の改変された酵母シトシンデアミナーゼ遺伝子を発現するようにベクター(pAC3-yCD)を改変し、構築物中で使用した。最初にトランスフェクトした複製適合性レトロウイルスのためのベクター構築物の図に関しては、下記の1Aを参照のこと。CMVはヒトCMV前初期プロモーターであり、U3、RおよびU5は、ウイルス長末端反復配列(LTR)の対応する領域である。gag、polおよびenvはウイルスタンパク質コード領域である。1Bおよび1Dは本開示のプラスミド構造および配列を示す。受託業者(Bio Basic Inc., Markham, Ontario, Canada)で遺伝子が合成された後、それらをpAC3ベクター主鎖のPsi1-Not1部位に挿入した(図1)。該プラスミド主鎖は、プラスミドpAC3-eGFPをPsi1およびNot1で切断し、プラスミドおよびレトロウイルスの主鎖をコードする大きい(約11kb)断片を精製することによって通常通り作製された。
【0140】
A. ヒト化コドン最適化CD遺伝子(CDopt,aka CD1, T5.0001)
Conrad et al.およびPCT WO 99/60008のヒトコドン最適化シトシンデアミナーゼの比較は、両者で、最適化された合計91個のコドンを示し、36個のコドンは同一であり、47個のコドンは3番目の塩基対の変化を有し(すべて同一のアミノ酸をコードする)、および9個のコドンは異なった(しかし、それらは同一のアミノ酸をコードした)。異なっていた9個のコドンは:
AGC (Ser) から TCC (Ser)へ
CGT (Arg) から AGG (Arg)へ
CCA (Pro) から CCT (Pro)への変化であった。
【0141】
すべて同等のGC含量を有し、かつ同一アミノ酸をコードする。
【0142】
上記天然(native)酵母遺伝子配列を別途コドン最適化して以下のCD遺伝子(CD1)を得て、IRESを有する複製適合性レトロウイルス(RCR)をコードするプラスミドベクターpAC3に挿入された場合にT5.0001と称した。
【0143】

【0144】
B. 熱安定化CD遺伝子
追加の改変を施してシトシンデアミナーゼの安定性を高めた。3つのアミノ酸を変化させて(A23L、I140LおよびV108I)酵母シトシンデアミナーゼタンパク質の熱安定性を増加させる3つの位置の突然変異を含むように野生型酵母シトシンデアミナーゼ遺伝子に対する遺伝子強化を施した。
【0145】
本開示のシトシンデアミナーゼポリペプチドの遺伝子の作製に以下のプライマーペアを使用した。
センス: 5'-tcgaggatatcggcgagtgaaacccgttattctttttggc-3' (配列番号25)
アンチセンス: 5'-gccaaaaagaataacgggtttcactcgccgatatcctcga-3'(配列番号26)
センス: 5'tcggcgagtgatccggcggcggcgcctccggcggcggcgcctccggcggcggcgcctccggcggcggcgccaacccgttatt-3'(配列番号27)
アンチセンス:5'-aataacgggttggcgccgccgccggaggcgccgccgccggaggcgccgccgccggaggcgccgccgccggatcactcgccga-3'(配列番号28)。
【0146】
天然(native)酵母CDの安定性を増加させるために、3つのアミノ酸置換をタンパク質中に組み込んだ。これらの置換は単独で、またはヒトコドン最適化と組み合わせた。
【0147】
該3つのアミノ酸置換は、A23L、V108I、I140Lである。これらの置換をコードする配列を以下に示す。

【0148】
そのコード化ポリペプチドは、以下の配列(置換アミノ酸は太字で下線が付されている)を含む。

【0149】
最終構築物設計は優先コドンを利用する3つのアミノ酸置換A23L/V108I/I140Lを組み込みかつ配列全体について優先ヒトコドン使用を用いる(この遺伝子はCDopt+3pt [別名CD2]と称され、IRESを有するRCRをコードするプラスミドベクターpAC3に挿入された場合T5.0002と称される)(配列番号34)。
1 ATGGTGACCGGCGGCATGGCCTCCAAGTGGGATCAAAAGGGCATGGATATCGCTTACGAG
61 GAGGCCCTGCTGGGCTACAAGGAGGGCGGCGTGCCTATCGGCGGCTGTCTGATCAACAAC
121 AAGGACGGCAGTGTGCTGGGCAGGGGCCACAACATGAGGTTCCAGAAGGGCTCCGCCACC
181 CTGCACGGCGAGATCTCCACCCTGGAGAACTGTGGCAGGCTGGAGGGCAAGGTGTACAAG
241 GACACCACCCTGTACACCACCCTGTCCCCTTGTGACATGTGTACCGGCGCTATCATCATG
301 TACGGCATCCCTAGGTGTGTGATCGGCGAGAACGTGAACTTCAAGTCCAAGGGCGAGAAG
361 TACCTGCAAACCAGGGGCCACGAGGTGGTGGTTGTTGACGATGAGAGGTGTAAGAAGCTG
421 ATGAAGCAGTTCATCGACGAGAGGCCTCAGGACTGGTTCGAGGATATCGGCGAGTGATAA
下線が付されたコドンはアミノ酸置換に関して優先コドンを示す。
【0150】
CD最適化配列設計(ヒトコドン優先+ 3つのアミノ酸置換)

【0151】
C. CD-UPRT融合遺伝子(CDopt+3pt-UPRT, [別名 CDopt-UPRTおよびCD2-UPRT], pAC3プラスミドRCRベクター中でT5.0003)の構築
また、図2Aに記載のスキームIを使用して最適化CD-UPRT配列を作製するためにUPRTポリペプチドに連結された上記CDポリペプチドを含む融合構築物を開発した。以下のプライマーを使用して、CDとUPRTとの間の終止-開始を除去した。
【表3】

【0152】
得られた融合ポリヌクレオチドは1296 bpを有し、直下に記載の配列を含む:

【0153】
D. CD-リンカーUPRT融合遺伝子(CDopt+3pt-LINK-UPRT [別名 CDopt-LINKER-UPRTおよびCD2-L-UPRT])の構築。
また、2Bに記載のスキームIIを使用して最適化CD-リンカー-UPRT配列を作製するために、CDポリペプチドとUPRTポリペプチドとの間にインフレームでリンカー(Ser-Gly-Gly-Gly-Gly)4ドメインをクローニングすることによって融合構築物を開発した。以下のプライマーを使用してリンカーを挿入した。
【表4】

【0154】
得られた構築物は1356 bpのサイズおよび直下の配列を有する:

【0155】
E. CD-OPRT融合遺伝子(CDopt+3pt-OPRT [別名 CDopt-OPRTおよびCD2-OPRT], pAC3プラスミドRCRベクターに挿入された場合T5.0004)の構築
また、図2Cに示されるスキームIIIを使用して最適化CD-OPRTアーゼ(ヒト化CD+3pt突然変異+OPRTアーゼヒト機能性ドメイン)を作製するために、OPRTポリペプチドに連結された上記CDポリペプチドを含む融合構築物を開発した。
【0156】
得られた構築物は1269 bpのサイズおよび直下の配列を含む:

【0157】
F. CD-リンカー-OPRT融合遺伝子(CDopt+3pt-LINK-OPRT, [別名 CDopt-リンカー-OPRTおよびCD2-L-OPRT], pAC3プラスミドRCRベクター中でT5.0005)の構築
また、図2Dに示されるスキームIVを使用して最適化CD-リンカー-OPRT配列を作製するために、CDポリペプチドとOPRTポリペプチドとの間にインフレームでリンカー(Ser-Gly-Gly-Gly-Gly)4ドメインをクローニングすることによって融合構築物を開発した。
【0158】
得られた構築物は1329 bpのサイズおよび直下の配列を含む:

【実施例2】
【0159】
実施例2 感染性ベクターの製造
いくつかの方法でベクターを製造することができるが、第1のステップは、プラスミドDNAベクターを細胞に導入して感染性粒子を生産させることであり、そして該粒子は細胞上清から回収することができる。いったん感染性粒子が作製されれば、当業者は他の製造方法を実施することができる。293T細胞の一時的トランスフェクションによってベクター粒子を作製した(Pear et al. Proc Natl Acad Sci U S A. 90:8392-8396 1993)。該293T細胞を解凍し、培養し、次いで、DMEM High Glucose培地(Hyclone# 30081, 500 mL)をFBS (Hyclone# SH30070, 50 mL)、L-グルタミン(Cellgro# 25-005-CI, 5 mL)、NEAA (Hyclone #SH30238, 5 mL)、およびPenicillin-strep (Cellgro# 30-002-CI, 5 mL)と混合することによって製造された15 mLのDMEM培地を含むT-75フラスコ中で2回継代した。フラスコを37℃、5% CO2でインキュベートした。3回目の継代後、各5 mLの培地を含む6個のT-25に1.8 x 106細胞/T-25 (または7.2 x 104細胞/cm2)の細胞密度で細胞を播種した。T-25への播種の1日後、PromegaのCalcium Phosphate Transfection Kit (Cat# E1200)を使用して、ウイルスベクターを発現するT5.0002プラスミドで細胞をトランスフェクトした。トランスフェクションの18時間後、1セットのフラスコ(各セット3フラスコ)中の培地を、10 mM NaBを含む新鮮な培地で置換した。第2のセットのフラスコ中の培地は置換せず、該培地はコントロール(NaBゼロ)としての役割を果たした。NaB処理の8時間後、すべてのフラスコ中の培地を、NaBを含まない新鮮な培地で置換した。両セットのフラスコで翌日まで(22時間の期間)発現を継続させた。両セットのフラスコ由来の上清を回収し、形質導入単位(TU)/mlで表されるqPCRによるそれらの力価についてアッセイした(実施例3を参照のこと)。
【0160】
力価の結果を以下の表に示す。
【表5】

【0161】
続いてベクター調製物をこの様式で製造したが、酪酸ナトリウムを用いなかった。他のベクタープラスミドを同じ方法で使用して、10e5 TU/ml〜10e7 TU/mlの範囲の力価を有するベクター調製物を作製した。所望であれば、下記のように、前記材料をさらに精製し、濃縮することができる。US 5792643; T. Rodriguez et al. J Gene Med 9:233 2007; US出願61218063も参照のこと。本開示の特定の実施形態では、脳重量のグラム数によって用量を算出した。そのような実施形態では、治療方法で有用な本開示の複製適合性レトロウイルスベクターの用量は脳重量1グラムあたり103〜107TUの範囲でありうる。
【実施例3】
【0162】
実施例3 定量的PCR力価決定アッセイ
機能的ベクター濃度、または力価を、定量的PCR(qPCR)に基づく方法を使用して決定する。この方法では、形質導入可能な宿主セルライン(例えばPC-3ヒト前立腺癌細胞, ATCC Cat# CRL-1435)に標準量のベクターを感染させ、形質導入後に該宿主細胞内に存在するプロウイルスの生成量を測定することによってベクターの力価を決定する。標準培養条件(37℃、5% CO2)下で24時間、細胞とベクターをインキュベートして完全に感染させた後、抗レトロウイルスAZTを加えてベクター複製を停止させる。
【0163】
次いで、培養皿から細胞を回収し、Invitrogen Purelink gDNA精製キットを使用してゲノムDNA (gDNA)を精製し、RNアーゼ-/DNアーゼ-フリーの滅菌水で精製カラムから溶出させる。分光光度計でA260/A280吸光度比を測定して、サンプルの濃度および相対純度を決定する。追加のRNアーゼ-/DNアーゼ-フリーの水でgDNA濃度を任意の所定のgDNA調製物セットの最低濃度に標準化して、qPCRの入力DNAがすべての分析サンプルで一定であるようにする。
【0164】
臭化エチジウム染色された0.8%アガロースゲルでの各サンプルのアリコートの電気泳動によってゲノムDNA純度をさらに評価する。サンプルが1.8〜2.0のA260/A280吸光度範囲を超え、かつ単一バンドのgDNAを示せば、該サンプルはベクターのプロウイルスコピー数についてのqPCR分析の準備が整っている。プロウイルス(逆転写されたベクターDNAおよび宿主gDNAに組み込まれているベクターDNA)のLTR領域を調べるプライマーを使用してqPCRを実施し、既知の数の細胞に形質導入するために既知の量のベクターが使用された場合に生じた形質導入イベントの総数を評価する。1E7〜1E1コピーで連続希釈されかつサンプルと同一のqPCR条件下で測定された既知のコピー数の標的保持プラスミドを利用する標準曲線から反応あたりの形質導入イベントの数を算出する。各qPCR反応に使用されたゲノム等価物の数(あらかじめ測定された濃度から)および反応あたりに生じた形質導入イベントの数を知って、形質導入の時点で存在した細胞の総数に基づいて生じた形質導入イベントの総数を決定する。この値は、初期形質導入中の細胞を含む培地中への希釈後のベクターの力価である。補正力価の値を算出するために、培養物の量と滴定量を掛け合わせて滴定量で除算することによって希釈を補正する。重複培養物でこれらの実験を実施し、各条件に関して3回の測定を用いるqPCRによって分析して、平均力価を、その関連する標準偏差および変異係数とともに決定する。
【実施例4】
【0165】
実施例4 ウエスタンブロットによって測定される発現レベル
図3は、野生型(ACE-yCD)または完全に最適化された(AC3-yCD2)シトシンデアミナーゼ遺伝子をコードするウイルスに感染させたU-87細胞のウエスタンブロット分析において、野生型yCDタンパク質と比較して、高い安定性のための3つの突然変異で最適化されたヒトコドンについて高レベルが観察されることを示す。
【実施例5】
【0166】
実施例5 ウイルスベクターの遺伝子安定性。
逆転写および、処理細胞への最初の組み込みイベントの後に、DNAプロウイルスおよび任意の後の子孫レトロウイルスはMLV由来の従来型のLTR構造を両端に有することが認識される。この配置は複数サイクルの感染後に安定であることが示されている(以下の図4を参照のこと)。
【0167】
約106個のナイーブU-87細胞をMOI 0.01のウイルスベクターで最初に感染させ、完全に感染して1回の感染サイクルが完了するまで培養した。そして上清を未感染細胞に対して再び通過させ、サイクルを繰り返した。導入遺伝子挿入部位に隣接するMLV特異的プライマーを使用する、感染細胞由来の組み込みプロウイルスのPCR増幅によって、yCD2配列のゲノム安定性を評価した。各セットの感染で、ベクタープラスミド(pAC3-yCD2およびKasahara et al.ベクターpACE-CD)の増幅をさらに実施して、ゲル上の全長アンプリコンサイズ分類を追跡した。全長アンプリコンより小さい任意のバンドの出現は、ベクターの不安定性の指標となる。該実験では、本開示のベクター(T5.0002 - 改変されたベクターおよびCDopt+3pt (CD2)異種ポリヌクレオチドを含む)が、ともに野生型酵母を保持するpACE-CDまたはT5.007より多数の継代中に安定性を維持することが示された。
【実施例6】
【0168】
実施例6 細胞死滅実験
in vitro細胞培養実験では、実験は、pAC3-yCD2/T5.0002 [AC3-yCD2(V)]から、pAC3-yCD/T5.0007 [AC3-yCD(V)]から、または他のベクターから作製されたウイルスを感染させたRG2ラット細胞(図5A)またはU-87細胞(図5B)に対する5-FC滴定を実施することによって、yCD2タンパク質を発現する細胞中のシトシンデアミナーゼが、野生型yCDタンパク質を発現する細胞由来のものと少なくとも同程度に活性であることを示す。簡潔に言えば、U-87細胞では、AC3-yCD (野生型CD)ベクターまたはAC3-yCD2 (熱安定化&コドン最適化)ベクターでの感染多重度0.1 (すなわち100%感染)での感染の5日後に、漸増量の5-FCまたはポジティブコントロールとしての0.1 mMの5-FUに8日間付した。5-FC処理の8日目に、MTSアッセイ(Promega CellTiter 96 AQUEOUS One Solution Proliferation Assay)を使用して生存度について細胞培養物を評価した。データは、漸増量の5-FC処理での2種のレトロウイルスベクター間で同等の死滅を示す。RG2培養物を同様に処理すると、やはり、むしろT5.0002CD発現アッセイ由来のウイルスに関して低濃度の5-FCへの、死滅曲線のわずかなシフトを示す。U87細胞に、感染多重度(MOI) 0.1で形質導入し、5日間培養してウイルスを伝播させ、形質導入後5日目由来の細胞を回収した。そして、該細胞を800 x gで5分間の遠心分離によって収集した。細胞ペレットから上清を吸引除去し、5 mLのリン酸緩衝食塩水(PBS)で洗浄し、800 x gで5分間、再び遠心分離した。得られた細胞ペレットを1.5 mLのPBSにとり、ピペットチップの通過によって再懸濁し、-20℃のフリーザーに入れた。細胞を凍結解凍法によって溶解させた。以前に再懸濁された細胞を室温で解凍し、ピペットチップに通過させ、プロテアーゼインヒビター反応混液と混合し、-20℃で再凍結した。酵素アッセイの前に、サンプルを室温で再び解凍し、ピペットチップに通過させた。次いで懸濁液を卓上遠心分離機で5分間14,000 rpmで遠心分離した。上清をペレットからデカントして除き、新しいエッペンドルフチューブに入れ、氷上に置いた。HPLCアッセイを使用することによってyCD酵素活性を評価した。
【0169】
フォトアレイ検出器(photoarray detector)およびオートインジェクターと連続して連結されたShimadzu LC20ATユニットでHPLCアッセイを実施した。固相は5 umスフェアサイズ(sphere size)および4.0 x 250 mmカラム寸法を有するHypersil BDS C18 HPLCカラムであった。移動相は、0.01%過塩素酸tert-ブチルアンモニウムおよび5%メタノールを含む50 mMリン酸アンモニウム、pH 2.1であり、該システムを22℃で平衡化した。すべての試薬はACSグレードであり、溶媒はHPLCグレードであった。PBS中の0.125 mg/mL 5FC (1 mM)の終濃度を有する800μLからなる反応混合物を作製し、1.5 mLオートサンプラーバイアルに入れた。200uLの各細胞ライセートを加えることによって反応を開始させた。反応/オートサンプラーバイアルをオートサンプラーに設置し、5uLの反応混合物を注入した。各反応バイアルから5 uLアリコートを回収し、HPLCカラムで分析することによって、タイムポイントを周期的に取得した。以前に作製された5FU標準曲線から得られる既知の量とピーク面積を比較することによって5FCから5FUへの変換速度を算出した。生成された5FUの量(nmol単位)をその対応する時間間隔に対してプロットすることによって5FCから5FUへの変換速度を導き出した。細胞サンプルのタンパク質濃度を導き出し、変換速度(nmol/分)を、mg単位の、アッセイで使用されたタンパク質の量によって除算することによって細胞ライセートサンプルの比活性を算出した。図6は、MOI 0.1での形質導入の5日後の種々のベクターの比活性を示す。該データは、組織培養細胞中のシトシンデアミナーゼの比活性の観点で、pACE-yCD (T5.0000) < pAC3-yCD1(T5.0001) <pAC3-CD2 (T5.0002)であることを示す。
【実施例7】
【0170】
実施例7. 完全に改変されたCD遺伝子(yCD2)で処置された腫瘍は、未改変の酵母CD遺伝子で処置された腫瘍より効率的に排除され、かつ再発しない(PR-01-08-001)。
どのベクター構築物が皮下マウス/ヒト異種移植モデルで最も有効なベクターを生じさせるかを決定する。3つの異なる構築物: T5.0001 (部分的に改変されたCD); T5.0007 (未改変酵母CD遺伝子); T5.0002 (完全に改変されたyCD2遺伝子)を評価した。5-FCプロドラッグ投与後の腫瘍増殖、生存および腫瘍退縮を免疫不全マウスでのヒト神経膠腫(U87)の皮下モデルで評価した。2つの異なる5-FC濃度を評価して、5-FCと腫瘍-ベクター構築物との間で観察される用量反応を決定した。
【0171】
群あたり9〜11匹の雌性マウスからなる合計12群を研究した。すべてのマウスは、0日目に、未感染U-87腫瘍セルラインの98%混合物および、3つのTOCA 511ベクター構築物、T5.0002、T5.0001、T5.0007のうちの1つが感染しているU-87セルラインの2%混合物; または未感染コントロールU-87セルライン(100%)のいずれかでの右背側の側腹部移植を受けた。2x106細胞/マウスをマウスに接種した。群1〜3のマウスは未感染U87細胞を有し、群4〜6は、形質導入されたT5.0002 U87を含むU87細胞混合物を有し、群7〜9は、T5.0001で形質導入されたものを含むU87細胞混合物を有し、群10〜12は、T5.0007で形質導入されたものを含むU87細胞混合物を有した。腫瘍サイズが約100mm3になるまで、6日間、腫瘍を増殖させた。6日目に開始される1回のIP注射として投与された5-FCの2つの用量(200または500 mg/kg/日)の一方を投与するか、または5-FCを投与しないように、各ベクター投与群のマウスをランダム化した。5-FC投与を28日間連続で毎日継続した。29日目の後、生存マウスの腫瘍サイズを評価し、次いで種々の日に犠牲にし、存在すれば、腫瘍を分析のために抽出した。29日目に、群4〜12のマウスを再びランダム化し、マウスを2つの亜群に細分した(腫瘍退縮をモニターするために5-FCを継続した群または腫瘍再増殖をモニターするために5-FC処置を中止した群)。
【0172】
結果: T5.0002、T5.0000およびT5.0007で処置された腫瘍はすべて、29日目に200および500 mg/kg用量で検出不可能になるまでの腫瘍退縮を示した。すべてのT5.0002処置動物は、5FC処置を中止した場合に、終了までの39日間に、腫瘍を再形成しなかった。対照的に、T5.0001およびT5.0007で処置された一部の腫瘍は39日の時点までに再発した。実験は39日目に終了した。
【0173】
結論: T5.0002プラス5-FCは、T5.0001またはT5.0007プラス5-FCよりも有効な抗腫瘍療法である。
【0174】
本開示の多数の実施形態を記載してきた。それにもかかわらず、本開示の思想および範囲から逸脱することなく、種々の改変を施すことができることが理解される。したがって、他の実施形態は特許請求の範囲の範囲内である。
【特許請求の範囲】
【請求項1】
配列番号4のポリペプチドをコードするヒトコドン最適化ポリヌクレオチドを含み、該ポリペプチドがシトシンデアミナーゼ(CD)活性を含む、単離されたポリヌクレオチド。
【請求項2】
ポリヌクレオチドが、配列番号3に記載の配列を含みかつ1〜50個のサイレント突然変異を含む、請求項1の単離されたポリヌクレオチド。
【請求項3】
ポリヌクレオチドが配列番号3を含む、請求項1または2の単離されたポリヌクレオチド。
【請求項4】
CD活性を有するポリペプチドに作動可能に連結されたUPRTまたはOPRT活性を有するポリペプチドをコードするUPRTまたはOPRTポリヌクレオチドをさらに含む、請求項1の単離されたポリヌクレオチド。
【請求項5】
UPRTまたはOPRTポリヌクレオチドがコドン最適化されている、請求項4の単離されたポリヌクレオチド。
【請求項6】
UPRTまたはOPRTポリヌクレオチドが、リンカーによって、CD活性を有するポリペプチドをコードするポリヌクレオチドから分離されている、請求項4の単離されたポリヌクレオチド。
【請求項7】
シトシンデアミナーゼ活性を有するポリペプチドをコードする第1のコード配列; および
URPTまたはOPRT活性を有するポリペプチドをコードする第2のコード配列
を含み、該第1のコード配列が該第2のコード配列に作動可能に連結されている、単離されたポリヌクレオチド。
【請求項8】
第1および第2のコード配列が、ペプチドリンカーをコードする配列によって分離されている、請求項7の単離されたポリヌクレオチド。
【請求項9】
ポリヌクレオチドが、配列番号12、14、または16に記載の配列を含むポリペプチドをコードする、請求項7の単離されたポリヌクレオチド。
【請求項10】
請求項1、2、4または7のポリヌクレオチドの発現によって製造される、実質的に精製されたポリペプチド。
【請求項11】
請求項1、2、4または7のポリヌクレオチドを含むベクター。
【請求項12】
プラスミドである、請求項11のベクター。
【請求項13】
発現ベクターである、請求項11のベクター。
【請求項14】
ウイルスベクターを含む、請求項11のベクター。
【請求項15】
ウイルスベクターが複製適合性レトロウイルスを含む、請求項14のベクター。
【請求項16】
請求項12、13、14、または15のベクターを含む宿主細胞。
【請求項17】
請求項1、4または7のポリヌクレオチドを含む宿主細胞。
【請求項18】
ヒト細胞を含む、請求項17の宿主細胞。
【請求項19】
細胞増殖性障害を含む細胞を含む、請求項18の宿主細胞。
【請求項20】
安定に形質転換されたヒト細胞を含む、請求項17の宿主細胞。
【請求項21】
細胞増殖性障害を含む、請求項20の宿主細胞。
【請求項22】
多形性グリア芽細胞腫を含む、請求項19または21の宿主細胞。
【請求項23】
in vivoで形質転換される、請求項17の宿主細胞。
【請求項24】
以下のもの:
レトロウイルスGAGタンパク質;
レトロウイルスPOLタンパク質;
レトロウイルスエンベロープ;
レトロウイルスポリヌクレオチドであって、該レトロウイルスポリヌクレオチド配列の3'末端の長末端反復(LTR)配列、該レトロウイルスポリヌクレオチドの5'末端の哺乳類細胞での発現に好適なプロモーター配列、gag核酸ドメイン、pol核酸ドメインおよびenv核酸ドメインを含むレトロウイルスポリヌクレオチド;
請求項1のポリヌクレオチドを含む異種核酸に作動可能に連結されている内部リボソーム侵入部位(IRES)を含むカセットであって、3' LTRの5'側でかつ、レトロウイルスエンベロープをコードするenv核酸ドメインの3'側に位置する、カセット; および
標的細胞での逆転写、パッケージングおよび組み込みに必要なシス作用配列
を含む、組み換え複製適合性レトロウイルス(RCR)。
【請求項25】
レトロウイルスポリヌクレオチド配列が、マウス白血病ウイルス(MLV)、モロニーマウス白血病ウイルス(MoMLV)、ネコ白血病ウイルスまたはテナガザル白血病ウイルス(GALV)由来である、請求項24のレトロウイルス。
【請求項26】
MLVが両種性MLVである、請求項24または25のレトロウイルス。
【請求項27】
ガンマレトロウイルスである、請求項24のレトロウイルス。
【請求項28】
標的細胞が、細胞増殖性障害を有する細胞である、請求項24のレトロウイルス。
【請求項29】
標的細胞が新生物細胞である、請求項24のレトロウイルス。
【請求項30】
細胞増殖性障害が、肺癌、結腸直腸癌、乳癌、前立腺癌、尿路癌、子宮癌、脳腫瘍、頭頸部癌、膵癌、黒色腫、胃癌および卵巣癌、関節リウマチまたは他の自己免疫疾患からなる群から選択される、請求項28のレトロウイルス。
【請求項31】
プロモーター配列が増殖調節遺伝子と関連している、請求項24のレトロウイルス。
【請求項32】
プロモーター配列が組織特異的プロモーター配列を含む、請求項24に記載のレトロウイルス。
【請求項33】
組織特異的プロモーター配列が少なくとも1つのアンドロゲン応答要素(ARE)を含む、請求項32に記載のレトロウイルス。
【請求項34】
アンドロゲン応答要素がプロバシンプロモーター由来である、請求項33に記載のレトロウイルス。
【請求項35】
組織特異的プロモーター配列がプロバシンプロモーターを含む、請求項32に記載のレトロウイルス。
【請求項36】
プロモーターが、配列番号19、20、または22のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を有するCMVプロモーターを含み、かつ1以上の核酸塩基に対する改変を含んでよく、かつ転写を誘導し開始させることができる、請求項24に記載のレトロウイルス。
【請求項37】
プロモーターが、配列番号19または20のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を含む、請求項24のレトロウイルス。
【請求項38】
プロモーターがCMV-R-U5ドメインポリヌクレオチドを含む、請求項24のレトロウイルス。
【請求項39】
CMV-R-U5ドメインが、MLV R-U5領域に連結されているヒトサイトメガロウイルス由来の前初期プロモーターを含む、請求項38のレトロウイルス。
【請求項40】
CMV-R-U5ドメインポリヌクレオチドが、配列番号19、20、または22のヌクレオチド約1位〜ヌクレオチド約1202位に記載の配列、または配列番号19、20、または22に記載の配列と少なくとも95%同一である配列を含み、ここで該ポリヌクレオチドが、それに作動可能に連結されている核酸分子の転写を促進する、請求項39のレトロウイルス。
【請求項41】
ポリヌクレオチドのgagがガンマレトロウイルス由来である、請求項24のレトロウイルス。
【請求項42】
gag核酸ドメインが、配列番号19のヌクレオチド番号約1203位〜ヌクレオチド約2819位の配列、またはそれに対して少なくとも95%、98%、99%または99.8%の同一性を有する配列を含む、請求項41のレトロウイルス。
【請求項43】
ポリヌクレオチドのpolドメインがガンマレトロウイルス由来である、請求項24のレトロウイルス。
【請求項44】
polドメインが、配列番号19のヌクレオチド番号約2820位〜ヌクレオチド約6358位の配列、またはそれに対して少なくとも95%、98%、99%または99.9%の同一性を有する配列を含む、請求項43のレトロウイルス。
【請求項45】
envドメインが、配列番号19のヌクレオチド番号約6359位〜ヌクレオチド約8323位の配列、またはそれに対して少なくとも95%、98%、99%または99.8%の同一性を有する配列を含む、請求項24のレトロウイルス。
【請求項46】
IRESが脳心筋炎ウイルス由来である、請求項24のレトロウイルス。
【請求項47】
IRESが、配列番号19のヌクレオチド番号約8327位〜ヌクレオチド約8876位の配列、またはそれに対して少なくとも95%、98%、または99%の同一性を有する配列を含む、請求項46のレトロウイルス。
【請求項48】
異種核酸が、配列番号3、5、11、13、15または17に記載の配列を有するポリヌクレオチドを含む、請求項24のレトロウイルス。
【請求項49】
異種核酸が、配列番号4に記載の配列を含むポリペプチドをコードする、請求項24のレトロウイルス。
【請求項50】
異種核酸がヒトコドン最適化されていて、かつ配列番号4に記載のポリペプチドをコードする、請求項24のレトロウイルス。
【請求項51】
異種核酸が、配列番号19のヌクレオチド番号約8877位〜約9353位に記載の配列を含む、請求項24のレトロウイルス。
【請求項52】
3' LTRがガンマレトロウイルス由来である、請求項51のレトロウイルス。
【請求項53】
3' LTRがU3-R-U5ドメインを含む、請求項52のレトロウイルス。
【請求項54】
3' LTRが、配列番号19のヌクレオチド約9405位〜約9998位に記載の配列、またはそれに対して少なくとも95%、98%または99.5%同一の配列を含む、請求項52のレトロウイルス。
【請求項55】
レトロウイルスポリヌクレオチドが、配列番号19、20、または22に記載の配列を含む、請求項24のレトロウイルス。
【請求項56】
5'から3'方向に以下のもの:
ヒトサイトメガロウイルス由来の前初期プロモーターとMLV R-U5領域のCMV-R-U5融合物;
逆転写酵素のPBS(プライマー結合部位);
5'スプライス部位;
Ψパッケージングシグナル;
MLV群特異的抗原に関するgagコード配列;
MLVポリメラーゼポリプロテインに関するpolコード配列;
3'スプライス部位;
MLV 4070A系統のエンベロープタンパク質に関する4070A envコード配列;
脳心筋炎ウイルス由来の内部リボソーム侵入部位(IRES);
改変シトシンデアミナーゼコード配列;
ポリプリントラクト; および
U3-R-U5 MLV長末端反復配列
を含む、単離されたポリヌクレオチド。
【請求項57】
レトロウイルスポリヌクレオチドが、配列番号19、20、または22に記載の配列を含む、請求項56のポリヌクレオチド。
【請求項58】
レトロウイルスポリヌクレオチド配列が、マウス白血病ウイルス(MLV)、モロニーマウス白血病ウイルス(MoMLV)、ネコ白血病ウイルスまたはテナガザル白血病ウイルス(GALV)由来である、請求項56のポリヌクレオチド。
【請求項59】
MoMLVが両種性MoMLVである、請求項58のポリヌクレオチド。
【請求項60】
細胞増殖性障害を有する被験体の治療方法であって、被験体を請求項1、7または56のポリヌクレオチドと該ポリヌクレオチドが発現されるような条件下で接触させるステップおよび該被験体を5-フルオロシトシンと接触させるステップを含む、方法。
【請求項61】
前記ポリヌクレオチドが被験体の細胞に組み込まれる、請求項60の方法。
【請求項62】
前記ポリヌクレオチドがレトロウイルスベクターによって送達される、請求項60の方法。
【請求項63】
レトロウイルスベクターが、配列番号19、20、または22に記載の配列を含む、請求項62の方法。
【請求項64】
細胞増殖性障害が多形性グリア芽細胞腫である、請求項60の方法。
【請求項65】
細胞増殖性障害が、肺癌、結腸直腸癌、乳癌、前立腺癌、尿路癌、子宮癌、脳腫瘍、頭頸部癌、膵癌、黒色腫、胃癌および卵巣癌、関節リウマチまたは他の自己免疫疾患からなる群から選択される、請求項60の方法。
【請求項66】
被験体の細胞増殖性障害の治療方法であって、被験体を請求項24のレトロウイルスと接触させるステップ、および該被験体を5-フルオロシトシンと接触させるステップを含む、方法。
【請求項67】
異種核酸が、配列番号4、12、14、16、または18に記載の配列を含むポリペプチドをコードする、請求項66の方法。
【請求項68】
レトロウイルスポリヌクレオチドが、配列番号19、20、または22に記載の配列を含む、請求項66の方法。
【請求項1】
配列番号4のポリペプチドをコードするヒトコドン最適化ポリヌクレオチドを含み、該ポリペプチドがシトシンデアミナーゼ(CD)活性を含む、単離されたポリヌクレオチド。
【請求項2】
ポリヌクレオチドが、配列番号3に記載の配列を含みかつ1〜50個のサイレント突然変異を含む、請求項1の単離されたポリヌクレオチド。
【請求項3】
ポリヌクレオチドが配列番号3を含む、請求項1または2の単離されたポリヌクレオチド。
【請求項4】
CD活性を有するポリペプチドに作動可能に連結されたUPRTまたはOPRT活性を有するポリペプチドをコードするUPRTまたはOPRTポリヌクレオチドをさらに含む、請求項1の単離されたポリヌクレオチド。
【請求項5】
UPRTまたはOPRTポリヌクレオチドがコドン最適化されている、請求項4の単離されたポリヌクレオチド。
【請求項6】
UPRTまたはOPRTポリヌクレオチドが、リンカーによって、CD活性を有するポリペプチドをコードするポリヌクレオチドから分離されている、請求項4の単離されたポリヌクレオチド。
【請求項7】
シトシンデアミナーゼ活性を有するポリペプチドをコードする第1のコード配列; および
URPTまたはOPRT活性を有するポリペプチドをコードする第2のコード配列
を含み、該第1のコード配列が該第2のコード配列に作動可能に連結されている、単離されたポリヌクレオチド。
【請求項8】
第1および第2のコード配列が、ペプチドリンカーをコードする配列によって分離されている、請求項7の単離されたポリヌクレオチド。
【請求項9】
ポリヌクレオチドが、配列番号12、14、または16に記載の配列を含むポリペプチドをコードする、請求項7の単離されたポリヌクレオチド。
【請求項10】
請求項1、2、4または7のポリヌクレオチドの発現によって製造される、実質的に精製されたポリペプチド。
【請求項11】
請求項1、2、4または7のポリヌクレオチドを含むベクター。
【請求項12】
プラスミドである、請求項11のベクター。
【請求項13】
発現ベクターである、請求項11のベクター。
【請求項14】
ウイルスベクターを含む、請求項11のベクター。
【請求項15】
ウイルスベクターが複製適合性レトロウイルスを含む、請求項14のベクター。
【請求項16】
請求項12、13、14、または15のベクターを含む宿主細胞。
【請求項17】
請求項1、4または7のポリヌクレオチドを含む宿主細胞。
【請求項18】
ヒト細胞を含む、請求項17の宿主細胞。
【請求項19】
細胞増殖性障害を含む細胞を含む、請求項18の宿主細胞。
【請求項20】
安定に形質転換されたヒト細胞を含む、請求項17の宿主細胞。
【請求項21】
細胞増殖性障害を含む、請求項20の宿主細胞。
【請求項22】
多形性グリア芽細胞腫を含む、請求項19または21の宿主細胞。
【請求項23】
in vivoで形質転換される、請求項17の宿主細胞。
【請求項24】
以下のもの:
レトロウイルスGAGタンパク質;
レトロウイルスPOLタンパク質;
レトロウイルスエンベロープ;
レトロウイルスポリヌクレオチドであって、該レトロウイルスポリヌクレオチド配列の3'末端の長末端反復(LTR)配列、該レトロウイルスポリヌクレオチドの5'末端の哺乳類細胞での発現に好適なプロモーター配列、gag核酸ドメイン、pol核酸ドメインおよびenv核酸ドメインを含むレトロウイルスポリヌクレオチド;
請求項1のポリヌクレオチドを含む異種核酸に作動可能に連結されている内部リボソーム侵入部位(IRES)を含むカセットであって、3' LTRの5'側でかつ、レトロウイルスエンベロープをコードするenv核酸ドメインの3'側に位置する、カセット; および
標的細胞での逆転写、パッケージングおよび組み込みに必要なシス作用配列
を含む、組み換え複製適合性レトロウイルス(RCR)。
【請求項25】
レトロウイルスポリヌクレオチド配列が、マウス白血病ウイルス(MLV)、モロニーマウス白血病ウイルス(MoMLV)、ネコ白血病ウイルスまたはテナガザル白血病ウイルス(GALV)由来である、請求項24のレトロウイルス。
【請求項26】
MLVが両種性MLVである、請求項24または25のレトロウイルス。
【請求項27】
ガンマレトロウイルスである、請求項24のレトロウイルス。
【請求項28】
標的細胞が、細胞増殖性障害を有する細胞である、請求項24のレトロウイルス。
【請求項29】
標的細胞が新生物細胞である、請求項24のレトロウイルス。
【請求項30】
細胞増殖性障害が、肺癌、結腸直腸癌、乳癌、前立腺癌、尿路癌、子宮癌、脳腫瘍、頭頸部癌、膵癌、黒色腫、胃癌および卵巣癌、関節リウマチまたは他の自己免疫疾患からなる群から選択される、請求項28のレトロウイルス。
【請求項31】
プロモーター配列が増殖調節遺伝子と関連している、請求項24のレトロウイルス。
【請求項32】
プロモーター配列が組織特異的プロモーター配列を含む、請求項24に記載のレトロウイルス。
【請求項33】
組織特異的プロモーター配列が少なくとも1つのアンドロゲン応答要素(ARE)を含む、請求項32に記載のレトロウイルス。
【請求項34】
アンドロゲン応答要素がプロバシンプロモーター由来である、請求項33に記載のレトロウイルス。
【請求項35】
組織特異的プロモーター配列がプロバシンプロモーターを含む、請求項32に記載のレトロウイルス。
【請求項36】
プロモーターが、配列番号19、20、または22のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を有するCMVプロモーターを含み、かつ1以上の核酸塩基に対する改変を含んでよく、かつ転写を誘導し開始させることができる、請求項24に記載のレトロウイルス。
【請求項37】
プロモーターが、配列番号19または20のヌクレオチド1位〜ヌクレオチド約582位に記載の配列を含む、請求項24のレトロウイルス。
【請求項38】
プロモーターがCMV-R-U5ドメインポリヌクレオチドを含む、請求項24のレトロウイルス。
【請求項39】
CMV-R-U5ドメインが、MLV R-U5領域に連結されているヒトサイトメガロウイルス由来の前初期プロモーターを含む、請求項38のレトロウイルス。
【請求項40】
CMV-R-U5ドメインポリヌクレオチドが、配列番号19、20、または22のヌクレオチド約1位〜ヌクレオチド約1202位に記載の配列、または配列番号19、20、または22に記載の配列と少なくとも95%同一である配列を含み、ここで該ポリヌクレオチドが、それに作動可能に連結されている核酸分子の転写を促進する、請求項39のレトロウイルス。
【請求項41】
ポリヌクレオチドのgagがガンマレトロウイルス由来である、請求項24のレトロウイルス。
【請求項42】
gag核酸ドメインが、配列番号19のヌクレオチド番号約1203位〜ヌクレオチド約2819位の配列、またはそれに対して少なくとも95%、98%、99%または99.8%の同一性を有する配列を含む、請求項41のレトロウイルス。
【請求項43】
ポリヌクレオチドのpolドメインがガンマレトロウイルス由来である、請求項24のレトロウイルス。
【請求項44】
polドメインが、配列番号19のヌクレオチド番号約2820位〜ヌクレオチド約6358位の配列、またはそれに対して少なくとも95%、98%、99%または99.9%の同一性を有する配列を含む、請求項43のレトロウイルス。
【請求項45】
envドメインが、配列番号19のヌクレオチド番号約6359位〜ヌクレオチド約8323位の配列、またはそれに対して少なくとも95%、98%、99%または99.8%の同一性を有する配列を含む、請求項24のレトロウイルス。
【請求項46】
IRESが脳心筋炎ウイルス由来である、請求項24のレトロウイルス。
【請求項47】
IRESが、配列番号19のヌクレオチド番号約8327位〜ヌクレオチド約8876位の配列、またはそれに対して少なくとも95%、98%、または99%の同一性を有する配列を含む、請求項46のレトロウイルス。
【請求項48】
異種核酸が、配列番号3、5、11、13、15または17に記載の配列を有するポリヌクレオチドを含む、請求項24のレトロウイルス。
【請求項49】
異種核酸が、配列番号4に記載の配列を含むポリペプチドをコードする、請求項24のレトロウイルス。
【請求項50】
異種核酸がヒトコドン最適化されていて、かつ配列番号4に記載のポリペプチドをコードする、請求項24のレトロウイルス。
【請求項51】
異種核酸が、配列番号19のヌクレオチド番号約8877位〜約9353位に記載の配列を含む、請求項24のレトロウイルス。
【請求項52】
3' LTRがガンマレトロウイルス由来である、請求項51のレトロウイルス。
【請求項53】
3' LTRがU3-R-U5ドメインを含む、請求項52のレトロウイルス。
【請求項54】
3' LTRが、配列番号19のヌクレオチド約9405位〜約9998位に記載の配列、またはそれに対して少なくとも95%、98%または99.5%同一の配列を含む、請求項52のレトロウイルス。
【請求項55】
レトロウイルスポリヌクレオチドが、配列番号19、20、または22に記載の配列を含む、請求項24のレトロウイルス。
【請求項56】
5'から3'方向に以下のもの:
ヒトサイトメガロウイルス由来の前初期プロモーターとMLV R-U5領域のCMV-R-U5融合物;
逆転写酵素のPBS(プライマー結合部位);
5'スプライス部位;
Ψパッケージングシグナル;
MLV群特異的抗原に関するgagコード配列;
MLVポリメラーゼポリプロテインに関するpolコード配列;
3'スプライス部位;
MLV 4070A系統のエンベロープタンパク質に関する4070A envコード配列;
脳心筋炎ウイルス由来の内部リボソーム侵入部位(IRES);
改変シトシンデアミナーゼコード配列;
ポリプリントラクト; および
U3-R-U5 MLV長末端反復配列
を含む、単離されたポリヌクレオチド。
【請求項57】
レトロウイルスポリヌクレオチドが、配列番号19、20、または22に記載の配列を含む、請求項56のポリヌクレオチド。
【請求項58】
レトロウイルスポリヌクレオチド配列が、マウス白血病ウイルス(MLV)、モロニーマウス白血病ウイルス(MoMLV)、ネコ白血病ウイルスまたはテナガザル白血病ウイルス(GALV)由来である、請求項56のポリヌクレオチド。
【請求項59】
MoMLVが両種性MoMLVである、請求項58のポリヌクレオチド。
【請求項60】
細胞増殖性障害を有する被験体の治療方法であって、被験体を請求項1、7または56のポリヌクレオチドと該ポリヌクレオチドが発現されるような条件下で接触させるステップおよび該被験体を5-フルオロシトシンと接触させるステップを含む、方法。
【請求項61】
前記ポリヌクレオチドが被験体の細胞に組み込まれる、請求項60の方法。
【請求項62】
前記ポリヌクレオチドがレトロウイルスベクターによって送達される、請求項60の方法。
【請求項63】
レトロウイルスベクターが、配列番号19、20、または22に記載の配列を含む、請求項62の方法。
【請求項64】
細胞増殖性障害が多形性グリア芽細胞腫である、請求項60の方法。
【請求項65】
細胞増殖性障害が、肺癌、結腸直腸癌、乳癌、前立腺癌、尿路癌、子宮癌、脳腫瘍、頭頸部癌、膵癌、黒色腫、胃癌および卵巣癌、関節リウマチまたは他の自己免疫疾患からなる群から選択される、請求項60の方法。
【請求項66】
被験体の細胞増殖性障害の治療方法であって、被験体を請求項24のレトロウイルスと接触させるステップ、および該被験体を5-フルオロシトシンと接触させるステップを含む、方法。
【請求項67】
異種核酸が、配列番号4、12、14、16、または18に記載の配列を含むポリペプチドをコードする、請求項66の方法。
【請求項68】
レトロウイルスポリヌクレオチドが、配列番号19、20、または22に記載の配列を含む、請求項66の方法。
【図1−1】


【図1−2】


【図1−3】


【図1−4】


【図1−5】


【図1−6】


【図1−7】


【図1−8】


【図1−9】


【図1−10】


【図1−11】


【図1−12】


【図1−13】


【図1−14】


【図1−15】


【図1−16】


【図1−17】


【図1−18】


【図1−19】


【図1−20】


【図1−21】


【図1−22】


【図1−23】


【図1−24】


【図1−25】


【図2−1】


【図2−2】


【図2−3】


【図3】


【図4】


【図5】


【図6】




【図1−2】


【図1−3】


【図1−4】


【図1−5】


【図1−6】


【図1−7】


【図1−8】


【図1−9】


【図1−10】


【図1−11】


【図1−12】


【図1−13】


【図1−14】


【図1−15】


【図1−16】


【図1−17】


【図1−18】


【図1−19】


【図1−20】


【図1−21】


【図1−22】


【図1−23】


【図1−24】


【図1−25】


【図2−1】


【図2−2】


【図2−3】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2012−503986(P2012−503986A)
【公表日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願番号】特願2011−529291(P2011−529291)
【出願日】平成21年9月26日(2009.9.26)
【国際出願番号】PCT/US2009/058510
【国際公開番号】WO2010/045002
【国際公開日】平成22年4月22日(2010.4.22)
【出願人】(510337436)トカジェン インコーポレーテッド (5)
【Fターム(参考)】
【公表日】平成24年2月16日(2012.2.16)
【国際特許分類】
【出願日】平成21年9月26日(2009.9.26)
【国際出願番号】PCT/US2009/058510
【国際公開番号】WO2010/045002
【国際公開日】平成22年4月22日(2010.4.22)
【出願人】(510337436)トカジェン インコーポレーテッド (5)
【Fターム(参考)】
[ Back to top ]

