遺伝子組換え抗体の製造方法
【課題】 親和性が高い特徴を有するウサギモノクローナル抗体を、ウサギミエローマ細胞を使用することなく製造すること。
【解決の手段】 抗原を免疫したウサギから抗体産生細胞を単離後、目的とする抗体遺伝子を保有する細胞を増殖させてから選別し、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離、増幅し、発現ベクターに導入後、ホスト細胞に導入することで遺伝子組換えウサギモノクローナル抗体を発現させる遺伝子組換え抗体の製造を可能にした。
【解決の手段】 抗原を免疫したウサギから抗体産生細胞を単離後、目的とする抗体遺伝子を保有する細胞を増殖させてから選別し、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離、増幅し、発現ベクターに導入後、ホスト細胞に導入することで遺伝子組換えウサギモノクローナル抗体を発現させる遺伝子組換え抗体の製造を可能にした。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、遺伝子組換えウサギモノクローナル抗体の製造方法に関するものである。
【背景技術】
【0002】
モノクローナル抗体はその特異性と親和性の高さから、ある特定の物質を検出するための実験用試薬としてだけではなく、がん治療用医薬品、免疫診断薬の中核材料として広く利用されている。
【0003】
モノクローナル抗体といえば、マウス由来のモノクローナル抗体が一般には認知されている。通常の実験で使用する抗体あるいは免疫測定試薬であればマウス由来のモノクローナル抗体が有する親和性の程度で十分な場合が多い。しかし、免疫診断薬のような、測定感度の高感度化が近年ますます要求されている領域では、マウス由来モノクローナル抗体では親和性が足りない場合がある。たとえば競合法においては、抗体の親和性が高くなるほど検出感度が高くなることは、理論的に証明することができ、高感度競合法を構築するためには、親和性の高い抗体が必要となる。また、サンドイッチ法でも、親和性の高い抗体により、微量の抗原を検出できるようになり、高感度測定系が構築できる。
【0004】
たとえば、ステロイドは低分子であるため、競合法で測定されている。特にステロイド類の中でもエストラジオール(E2)は、高感度測定系が要求されており、親和性の高い抗体の要求が強い。
【0005】
マウス以外の種々のモノクローナル抗体も報告されており、非特許文献1で紹介されているように、体の大きい動物種から抗体をとれば親和性の高い抗体が単離される傾向にある。しかしながら、同じ動物種に同じ抗原を免疫しても、個体差の影響が大きく、得られる抗血清も異なるため、親和性の高い抗体を単離するためには、少なくとも数匹以上の個体に抗原を免疫し、免疫応答の高い個体からモノクローナル抗体を単離する必要がある。そのため、現実的には免疫動物としてウサギが選ばれる。また、ウサギは免疫診断薬用の抗血清にウサギの血清がよく利用されていることからも、免疫動物種としては適していると考えられる。
【0006】
マウスモノクローナル抗体の製造方法は確立されており、以下に示す方法で製造している。まず、抗原を免疫したマウスの脾臓細胞(抗体産生細胞)をマウスミエローマ細胞(骨髄腫細胞)と細胞融合させ、無限増殖能を持ち、かつ、目的抗体を産生するハイブリドーマを作製する。その後、当該細胞を培養し産生された抗体を精製して、マウスモノクローナル抗体を製造する。
【0007】
ウサギモノクローナル抗体も理論上はマウスモノクローナル抗体の製造方法と同様な方法で生産できる。しかしながら、抗体産生細胞と細胞融合させるのに用いるウサギミエローマ細胞(非特許文献2)が、マウスミエローマ細胞とは異なり、一般には流通していないため、マウスモノクローナル抗体の製造方法と同様な方法で生産できる施設は限られており、通常の実験室レベルでは当該方法によりウサギモノクローナル抗体を製造することは出来ない。このため、ウサギミエローマ細胞を用いずに、ウサギモノクローナル抗体を生産する方法について、これまでいくつか検討されている。
【0008】
まず、ウサギ抗体産生細胞をマウスミエローマ細胞と融合する方法がある。しかしながら、当該方法は異種動物間の融合であり、融合効率が低いため、得られるハイブリドーマ数は少なく、また得られたハイブリドーマも、短期間のうちに抗体生産能力が消失する(非特許文献3、4)。さらに、ウサギ血清の存在下で当該融合細胞を培養することで抗体生産能力を維持可能との報告もあるが、生産されたモノクローナル抗体の精製が困難であり、長期間の抗体生産性についての報告もない(非特許文献5)。
【0009】
次に、抗原を免疫したウサギ脾臓から重鎖(H鎖)および軽鎖(L鎖)の抗体遺伝子を単離、増幅後、ウサギ抗体ライブラリーを作製し、ファージディスプレイ法などにより、ウサギ抗体を単離する方法が報告されている(非特許文献6から8)。しかし本方法によると、ライブラリーから抗体を選別する過程において「パニング」という操作が必須となる。当該操作を簡単に述べると、抗原が固定化された水不溶性担体をライブラリーに接触させ、抗原に結合した抗体を回収する。その後抗原に結合した抗体を何らかの方法で増幅させ新たなライブラリーを作製し、さらに抗原を固定化した水不溶性担体と反応させる操作を繰り返す。当該操作により、抗原と結合する抗体は濃縮され、最終的に抗原に結合する抗体を単離することができる。しかしながら、抗原抗体反応が平衡反応である以上、抗原と抗体の結合には濃度の影響をうける。例えばライブラリーの中に微量しか存在しない親和性の高い抗体を選択的に濃縮してくることは原理上不可能である。また、一般的に親和性の高い抗体を得るためには、抗体が本来ウサギの作製したH鎖とL鎖の組み合わせである必要があるが、当該操作によって得られる抗体は、本来ウサギの作製したH鎖とL鎖の組み合わせが再現される可能性が極めて低いため、当該操作で親和性が向上した抗体を回収するのは極めて困難である。
【0010】
上記方法以外には、ウサギ抗体産生細胞を軟寒天培地中で保持した後、赤血球溶血法により目的抗体を発現している抗体産生細胞を探し、一個の抗体産生細胞から抗体遺伝子を単離し、遺伝子組換え抗体として作製する方法がある(非特許文献9)。当該方法を用いることで本来ウサギの作製したH鎖とL鎖の組み合わせを再現できるが、極めて高い抗体性能(親和性、特異性、保存安定性、生産性など)が要求される免疫診断薬で使用するような抗体は簡単に得られるものではない。つまり、単に抗原に結合するウサギモノクローナル抗体を単離するのであれば非特許文献9の方法でも良いが、免疫診断薬で使用可能な性能の高いモノクローナル抗体を単離しようと、数千から数万クローンの遺伝子組換え抗体を作製しても、目的とする抗体を単離できる保障はない。さらに、上記作業を行なうには、膨大な実験工数を必要とするため、現実的に実施は困難である。また、一個の細胞から遺伝子を単離するため、抗体を発現している細胞を見つけても抗体遺伝子の増幅効率は低く、非特許文献9で報告されている抗体遺伝子の増幅確率はH鎖で27%、L鎖で55%程度である。
【0011】
以上より、ウサギモノクローナル抗体の性能が高いことは報告されているものの、ウサギモノクローナル抗体自体はウサギミエローマ細胞を有する一部の施設でしか生産できないため、当該抗体の工業的な利用を困難にしていた。
【0012】
【特許文献1】特開平10−262657号
【非特許文献1】Hybridoma、19、201;2000
【非特許文献2】Proc.Natl.Acad.Sci.USA、92,9348;1995
【非特許文献3】Proc.Natl.Acad.Sci.USA、58、1104;1967
【非特許文献4】Genetics,54,1095;1966
【非特許文献5】Science、240、1788;1988
【非特許文献6】J.Biol.Chem.、275、13668;2000
【非特許文献7】Gene、172、295;1996
【非特許文献8】J.Immunol.Method.、213、201;1998
【非特許文献9】Proc.Natl.Acad.Sci.USA、93、7843;1996
【非特許文献10】Cole et al.,”The EBV−Hybridoma Technique and Its Application to Human Lung Cancer” Monoclonal Antibodies and Cancer Therapy,Reisfeld et al.,New York:Alan R. Liss Inc.77−96;1985
【非特許文献11】J.Immunol.、152、3935;1994
【非特許文献12】J.Mol.Biol.、325、325;2003
【非特許文献13】Biotechnol.、13、6171;1995
【非特許文献14】Nucl.Acids Res.、15、6171;1987
【非特許文献15】Nucl.Acids Res.、10、1535;1982
【非特許文献16】J.Biochem.、108、673;1990
【非特許文献17】Biotechnol.Lett.、17、135;1995
【非特許文献18】J.Ferm.Bioeng.、79、405;1995
【発明の開示】
【発明が解決しようとする課題】
【0013】
本発明が解決しようとする課題は、ウサギミエローマ細胞を有する特定の機関でのみ作製可能であったウサギモノクローナル抗体を、通常の実験施設と分子生物学の知識があれば製造できる技術を提供することである。
【課題を解決するための手段】
【0014】
上記課題を鑑みてなされた本発明は、以下の発明を包含する。
【0015】
第一の発明は、抗原を免疫したウサギから抗体産生細胞を単離し、目的とする抗体遺伝子を保有する細胞を選別し、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離、増幅し、発現ベクターに導入後、ホスト細胞に導入することで遺伝子組換えウサギモノクローナル抗体を発現させる遺伝子組換え抗体の製造方法において、目的とする抗体遺伝子を保有する細胞を選別するにあたり、抗体産生細胞を増殖させてから選別することを特徴とする、遺伝子組換え抗体の製造方法である。
【0016】
第二の発明は、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離する操作を、選別した細胞から抗体遺伝子の脱落が起きない期間内で実施することを特徴とする、第一の発明に記載の遺伝子組換え抗体の製造方法である。
【0017】
第三の発明は、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離する操作を、抗体産生細胞増殖開始後14日以内に実施することを特徴とする、第一の発明に記載の遺伝子組換え抗体の製造方法である。
【0018】
第四の発明は、抗体産生細胞が、抗原を免疫したウサギの脾臓細胞、リンパ節細胞、末梢血細胞のいずれかであることを特徴とする、第一から第三の発明に記載の遺伝子組換え抗体の製造方法である。
【0019】
第五の発明は、抗体産生細胞を増殖させる方法が、抗体産生細胞を培地中で培養する方法であることを特徴とする、第一から第四の発明に記載の遺伝子組換え抗体の製造方法である。
【0020】
第六の発明は、抗体産生細胞を増殖させる方法が、不死化能を与えることのできる細胞を融合させて培養する方法であることを特徴とする、第一から第四の発明に記載の遺伝子組換え抗体の製造方法である。
【0021】
第七の発明は、ウサギに免疫する抗原が、ハプテンまたはペプチドであることを特徴とする、第一から第六の発明に記載の遺伝子組換え抗体の製造方法である。
【0022】
第八の発明は、ホスト細胞が動物細胞であることを特徴とする、第一から第七の発明に記載の遺伝子組換え抗体の製造方法である。
【0023】
以下、本発明について詳細に説明する。
【0024】
(1)抗原の種類
ウサギに免疫する抗原は、特に限定されず、ハプテン、ペプチド、タンパク質、核酸、細胞、脂質、糖鎖、細菌、蛍光物質、ビタミン類の中から任意に選択することができるが、特に、親和性および特異性などにおいて高い抗体性能が要求される抗原に対して本発明を適用するのが好ましい。具体的には、測定原理上高感度測定系を構築するために高い親和性が要求される競合法用の抗原、例えば、エストロン(E1)、エストラジオール(E2)、エストリオール(E3)、プロゲステロン、コルチゾールなどのステロイドホルモン類、サイロニン、サイロキシン、トリヨードサイロニンなどの甲状腺ホルモン類といったハプテンがあげられる。また、競合法用の抗原以外でも、例えば、Cペプチド、および脳性ナトリウム利尿ペプチド(BNP)といった、高感度が要求されるペプチドへの適用も好ましい一例である。
【0025】
(2)抗原免疫方法
抗原を免疫するウサギは、抗原の種類によって免疫応答は異なるため、できるだけ多くの系統と匹数に免疫するのが好ましい。ウサギの系統としては、一般に入手可能な日本白色種、およびニュージーランドホワイトが例示されるが、当該系統に限定されるものではない。また、同じ系統のウサギを用いても個体差があるため数匹から10匹程度の個体に免疫することで、免疫応答の高いウサギ由来の抗体産生細胞を入手するのが好ましい。
【0026】
ウサギへの免疫方法は特に限定されるものではなく、通常一般的に行なわれている方法で免疫すればよい。例えば、アジュバントとエマルジョンを作製し免疫する方法やタンパク質あるいはペプチドをコードしているDNAを免疫する方法があげられる。
【0027】
免疫場所も特に限定されない。皮下、腹腔、フットパットといった通常行なわれている場所でウサギに免疫すればよい。
【0028】
免疫回数は、抗原の種類およびウサギへの応答性によって変動があるため、ELISA法あるいはBIAcore(商品名)(ビアコア社製)で測定することで血清の抗体価を解析し、当該血清の経過を観察して決定するのが好ましい。通常は4回程度の免疫で良いが、場合によってはさらに複数回(期間にして数ヶ月から1年間程度)の免疫が必要な場合もある。
【0029】
(3)抗体産生細胞の単離
単離の対象となる抗体産生細胞は、抗体を産生する細胞であれば特に限定はされないが、脾臓由来の細胞、リンパ節由来の細胞、末梢血由来の細胞のいずれかを使うのが好ましい。また、抗体産生細胞の単離は通常実施されている方法で実施すればよい。単離した細胞はすぐに使用するのが好ましいが、一般的に入手できる細胞保存溶液中に分散させた状態で、液体窒素あるいはディープフリーザー中で保存することが可能であり、必要に応じて使用することが出来る。
【0030】
(4)抗体産生細胞の選別
上記(3)で単離した抗体産生細胞から目的とする抗体遺伝子を保有する細胞を選別する必要がある。選別方法としては、非特許文献9にあるように、抗体を産生している細胞から一個の細胞を選別し、選別した細胞から抗体遺伝子を単離、増幅させる方法があるが、当該選別方法では抗原結合能しか評価ができないため、目的の性能を有した抗体を取得するのは困難である。そのため、本発明では、(3)で単離した抗体産生細胞を増殖させ、培養上清中に発現した抗体の有する競合特性、特異性、反応性といった性能を評価し、当該性能が高い抗体を発現している細胞を選別後、抗体遺伝子を単離することを特徴としている。
【0031】
本発明の製造方法における、抗体産生細胞の増殖方法としては以下の方法が例示できる。
【0032】
a)マイクロウエルプレート中にて、抗体産生細胞を増殖用培地で培養上清中の抗体
性能が評価できるまで培養する方法。
【0033】
b)通常のハイブリドーマを得る方法のように、抗体産生細胞に不死化能を与えるよ
うな細胞と融合させることで、培養上清中の抗体性能を評価する方法。
【0034】
c)エプスタイン−バーウイルス(EBV)などのウイルスにより抗体産生細胞を不
死化し培養することで、抗体遺伝子を単離する細胞を選別する方法。
このうち、a)またはb)の方法を用いて増殖させる方法が好ましい。
【0035】
a)の増殖方法で用いる培地としては、通常用いられる動物細胞用の培地、あるいはIL−4やLPSといった通常よく知られているサイトカイン類を添加した培地が使用できる。
【0036】
b)の増殖方法で用いる不死化能を与える細胞としては、融合後に抗体を分泌できる融合細胞が得られる細胞であり、かつ、増殖後、抗体の性能を評価した時点で融合細胞中に抗体遺伝子が残存している細胞であれば限定はされないが、抗体産生能を長期間維持できる融合細胞が得られる細胞が特に好ましい。不死化能を与える細胞としては、P3−X63−Ag8(ATCC TIB9)、P3−NS1−1−Ag4−1(JCRB 0009)、P3−X63−Ag8−U1(JCRB 9085)、P3−X63−Ag8、653(JCRB 0028)、SP2/O−Ag−14(JCRB 0029)、NSO/U(RCB 0213)、S194/5XXO、BU1(ATCC CRL−8837)、FO(ATCC CRL−1646)といったマウスミエローマ関連の細胞や、SK0−007、HO−323といったヒト骨髄腫細胞株、GM1500 6GT−Al2といったヒトB細胞株、Y3−Ag1・2・3といったラット骨髄腫細胞株、TP−3のウサギ形質転換細胞株、VX−2といったウサギがん細胞を例示することができる。また、マウスミエローマ細胞株を出発とした細胞株(たとえば特許文献1に記載の2−3A)も、本発明における、好ましい不死化能を与える細胞の一例である。
【0037】
b)の増殖方法で用いる細胞融合方法は、通常用いられる方法で実施すればよく、例えば、ポリエチレングリコール法、電気融合法、センダイウイルスを用いる方法をあげることができる。
【0038】
c)の増殖方法は、当業者によく知られている、ヒトリンパ球にEBVなどのウイルスを感染させて増殖させる(非特許文献10)のと同様な手法で、抗体生産能を有するウサギB細胞にEBVなどのウイルスを感染させ、一時的に不死化させる方法である。なお、ウサギB細胞に感染させるウイルスとしては前記目的を達成できるものであれば良く、特にEBVに限定されるものではない。
【0039】
(5)抗体性能の評価方法
抗体遺伝子を保有する細胞を選別するための抗体性能の評価方法は、対象抗体の評価内容に応じて適宜選択すればよい。例えば、評価内容としては、抗原結合能、競合特性、特異性、抗体生産性があげられ、評価方法としてはELISA法、RIA法、蛍光偏光法をあげることができる。
【0040】
(6)抗体遺伝子の単離時期
上記(4)で選別した細胞から重鎖(H鎖)および軽鎖(L鎖)の抗体遺伝子を単離する時期としては、抗原およびウサギの系統によって最適時期が異なるため、培養上清中に評価するための十分な抗体量が確保でき、かつ、抗体遺伝子の脱落が起きない期間であれば特に限定されないが、実施例12にあるように抗体産生細胞増殖開始後16日後で抗体遺伝子を単離すると、抗体遺伝子の増幅効率、および抗原結合活性を持った発現ベクターの取得率が低下していることから、抗体遺伝子の単離は抗体産生細胞増殖開始後14日以内に実施するのが好ましい。
【0041】
(7)抗体遺伝子の増幅方法
抗体遺伝子の増幅方法としては通常用いられるRT−PCR法が使用できる。また、RT−PCR反応の際に用いる逆転写酵素およびDNAポリメラーゼは通常市販の酵素が使用できるが、特にDNAポリメラーゼはDNA増幅の際、変異が導入されるのを避けるため、Phusion High−Fidelity DNA polymerase(商品名)(第一化学薬品社製)やPrimeSTAR HS DNA polymerase(商品名)(タカラバイオ社製)といったフィデリティーの高い酵素を使用するのが好ましい。
【0042】
抗体遺伝子を増幅するためのプライマーは、抗体の可変領域をコードする領域が増幅されるような位置に設計してあれば、特に場所は限定されない。抗体遺伝子を増幅するために用いるプライマーの組み合わせとしては、抗体遺伝子の全長を増幅することを目的とした開始コドンより上流と終始コドンより下流の非翻訳領域に設計したプライマーの組み合わせ、抗体遺伝子の可変領域を増幅することを目的とした抗体遺伝子内部に設計したプライマーの組み合わせ、あるいは上記プライマーを適宜組み合わせた系を例示することができる。なお、一回のPCR反応で抗体遺伝子の増幅効率が低い場合には、1回目のPCR反応産物を鋳型とし、2回目のPCR反応を行うことで効率よく抗体遺伝子を増幅することが出来る。この際1回目の増幅領域の少し内側に新たなプライマーを作製するほうが効率よく遺伝子を増幅することが出来る場合が多いが、それに限定されるものではない。
【0043】
また、ウサギH鎖は8割以上でVH1を使用していること(非特許文献11)、およびL鎖は8割以上がκ鎖であることが報告されていること(非特許文献12)から、それぞれの遺伝子に特異的なプライマーセットを用いて増幅するのが好ましい。さらに、抗体遺伝子を増幅するためのプライマーの一態様として、非特許文献10及び13から15に記載のプライマー配列、およびGenBankを参考に設計したプライマー配列(配列番号1から11)を開示するが、上記目的を達成できるものであれば、他の配列を用いてもかまわない。
【0044】
(8)発現ベクター
発現用ベクターについては、一般的に報告されているベクターであれば限定されないが、特にpECEdhfr(非特許文献16、図4)を発現ベクターとして使用するのが好ましい。また、発現させる抗体の領域も、抗体の可変領域を含むように発現させればよく、発現の形としてはIgG、F(ab’)2、Fab、FV、scFVが例示できる。また、単離した抗体遺伝子を出発材料として、種々のアミノ酸変異を加えることで抗体の性能を変化させることは、当業者であれば容易に想到可能である。
【0045】
(9)ホスト細胞
発現ベクターは適切なホスト細胞に導入することにより、遺伝子組換え抗体を産生させることができる。一過的に遺伝子組換え抗体を高発現させるためには、SV40 large T抗原タンパク質発現細胞をホスト細胞として用いるのが好ましく、その一例として、実施例7、13、14で使用のCOS1細胞(非特許文献17、18)や、293T細胞、COS7細胞をあげることができる。
【0046】
また、安定的に遺伝子組換え抗体を発現させるためには、遺伝子組み換え動物/昆虫/植物を用いて発現させることも可能であるが、動物細胞、および酵母や大腸菌に代表される微生物をホスト細胞として用いるのが好ましく、特に動物細胞、その中でもCHO細胞を用いるのが好ましい。さらに好ましい安定生産株は、抗体遺伝子を増幅することができるdhfr遺伝子増幅系を組み込んだベクターをCHO細胞に導入したホストベクター系である。
【発明の効果】
【0047】
本発明のウサギモノクローナル抗体の製造方法は、一般に流通していないウサギミエローマ細胞を使用することなく、抗原を免疫したウサギから単離した抗体産生細胞を増殖させてから、抗体遺伝子を保有する細胞を選別し、選別した細胞から抗体遺伝子を単離、増幅することを特徴としており、通常の実験施設と分子生物学の知識があればウサギモノクローナル抗体の製造を可能にする方法である。また、本発明の製造方法は従来技術では困難であった、本来ウサギが作製した重鎖と軽鎖の組み合わせを有するモノクローナル抗体を容易に製造することができるため、これまで限られた施設でしか取り扱うことができない、高い親和性を有したウサギモノクローナル抗体を通常の実験室レベルで容易に取り扱うことが可能となる。
【実施例】
【0048】
以下、実施例を用いて本発明をさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0049】
実施例1 免疫抗原およびスクリーニング抗原の作製
免疫抗原としてはE2−BSA(商品名)(Sigma社製)を使用した。またELISAでのスクリーニング用抗原は、下記の方法で作製した。
(1)BCP(Blue Carrier Protein:Pierce社製)100mgを10mg/mLになるようにPBSを加え、6位をN−ヒドロキシスクシイミドで活性化したエストラジオール(E2) 1.25mgをDMF 1mLに溶解したものと混合した。
(2)室温で2時間撹拌後、PBSで透析(1L×3回)することでE2−BCPを得た。
【0050】
実施例2 動物と抗原免疫方法
免疫動物はウサギ(日本白色種)の12週齢メスを使用した。初回免疫はフロイント完全アジュバント、2次免疫以降はフロイントの不完全アジュバントを用い、抗原溶液(500μg/mL)と等量のアジュバントを混合後、エマルジョンを作製した後に2週間間隔で免疫した。免疫抗抗原量は、初回500μgで2次免疫以降は250μgである。
【0051】
次に、以下に示すELISA(Enzyme Linked Immunosorbent Assay)で、十分な抗体価の上昇を確認した。
(1)E2−BCP(0.5μg/mL)をELISAプレートに固定化後、1%スキムミルクでブロッキングした。
(2)ウサギから採血した血清と反応させた。E2に結合した抗E2ウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0052】
実施例3 脾臓細胞を用いた抗体産生細胞の増殖(培地での培養)
十分に抗体価が上昇したウサギの脾臓を摘出し、定法に従い脾臓細胞を単離した。脾臓細胞を10%FCSを含むGIT培地(日水製薬社製)に懸濁し、マイクロプレートにまいて培養した。一週間後に培養上清を実施例2に記載の方法で、192クローンの培養上清中の抗体を評価した結果を図1に示した。このように、マイクロウエルプレートの上清中に抗体の産生を確認することができた。
【0053】
実施例4 末梢血細胞由来のリンパ球を用いた抗体産生細胞の増殖(細胞融合を用いた培養)
以下に示す方法で、末梢血細胞由来のリンパ球と不死化能を与える細胞とを融合させた。
(1)十分に抗体価が上昇したウサギ末梢血から採取したリンパ球と、マウスミエローマ細胞の遺伝子にウサギの染色体が一部組み込まれている細胞(2−3A、特許文献1)を融合した。なお、本細胞(2−3A)は、栄研化学株式会社により樹立されたもので、栄研化学株式会社の好意により譲渡して頂いたものである。
(2)定法(PEG法)に従い、2−3A細胞と末梢血細胞由来のリンパ球とを融合させた。
(3)融合後の細胞浮遊液を10%FCS、1×HATを含むGIT培地(日水製薬社製)で懸濁し、マイクロタイタープレートにまいた。
【0054】
384クローンの培養上清中の抗体を実施例2に記載の方法で評価した結果を図2に示した。このように、マイクロウエルプレートの上清中に抗体の産生を確認することができた。
【0055】
実施例5 脾臓細胞を用いた抗体産生細胞の増殖(細胞融合を用いた培養)
以下に示す方法で、脾臓細胞と不死化能を与える細胞とを融合させた。
(1)十分に抗体価が上昇したウサギの脾臓を摘出し、定法に従って脾臓細胞を調製した。なお、ウサギ脾臓細胞と細胞融合する細胞は、実施例4で使用した細胞(2−3A、特許文献1)を使用した。
(2)定法(PEG法)に従い、2−3A細胞とウサギ脾臓細胞を融合させた。
(3)融合後の細胞浮遊液を10%FCS、1×HATを含むGIT培地(日水製薬社製)で懸濁し、マイクロタイタープレートにまいた。
(4)培養上清中の抗E2抗体の性能を下記の3つのELISAにより評価した。
(4−1)反応性:E2−BCP(0.5μg/mL)をELISAプレートに固定化した後、1%スキムミルクでブロッキングした。その後、細胞融合後の培養上清を反応させた。E2に結合した抗E2ウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4−メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
(4−2)競合特性:反応性を評価する実験系に、E2(500pg/mL)を共存させる実験を行なった。ここで得られた値(B)を、反応性で得られた値(B0)で割ることで、競合特性(B/B0値)を算出した。
(4−3)特異性:反応性を評価する実験系に、各種ステロイド(エストロン:E1、エストリオール:E3、エチニルエストラジオール:EtE2、テストステロン:TS、各500 pg/mL)を共存させる実験をおこなった。ここで得られた値(B)を、反応性で得られた値(B0)で割ることで、特異性(B/B0値)を算出した。
【0056】
以上得られた3つのデータをグラフ化した(図3)。横軸に特異性(B/B0値)を、縦軸に競合特性(B/B0値)を、反応性は円の大きさでプロットした。このグラフの中で、黒丸で塗りつぶしたクローンは、競合特性が高く、特異性も高く、かつ、反応性も高いクローンである。
【0057】
実施例6 抗体遺伝子の単離・増幅と発現ベクターの作製
実施例5の結果、図3で黒丸で塗りつぶしたクローンを選別後、当該クローンから以下の方法で抗体遺伝子を単離、増幅後、発現ベクターを作製した。
(1)MagMaxTM−96 Total RNA Isolation kit(商品名)(Ambion社製)を用い、添付されているプロトコルに従って細胞からのRNAの単離を行なった。
(2)単離したRNAを鋳型とし、Ready−To−Go You−Prime First−Strand Beads(商品名)(GE Healthcare社製)を用いて、逆転写反応を行ないcDNAを合成した。
(3)ウサギ抗体遺伝子に特異的なプライマー(重鎖(H鎖)および軽鎖(L鎖)に特異的なプライマー、配列番号1から4、なお配列1と2はH鎖、配列3と4はL鎖にそれぞれ特異的なプライマーである)を用いPhusion High−Fidelity DNA polymerase(商品名)(第一化学薬品社製)で、抗体遺伝子をPCR反応で増幅させた。条件を以下に示す。
【0058】
(試薬組成)
キットに添付の緩衝液で、dNTP 0.2μM、プライマーはそれぞれ0.5
μMで行なった。
【0059】
(反応条件)
98℃で30秒保持後、98℃で10秒、72℃で50秒のサイクルを35サイ
クル繰り返し、その後72℃で10分間保持した。
(4)電気泳動で遺伝子の増幅を確認した。
(5)得られたH鎖及びL鎖のPCRフラグメントを、BglIIとXbaIで制限酵素処理した後、動物細胞用発現ベクター(pECEdhfr:図4)のBglII/XbaIサイトに導入し、H鎖、L鎖用の発現ベクターを調製した。
【0060】
実施例7 遺伝子組換え抗体の発現(COS細胞による一過性発現)と精製
実施例6で得られたH鎖、L鎖用の発現ベクターからCOS1細胞(非特許文献17、18)での遺伝子組換え抗体の生産を行なった。なお、実施例6における抗体遺伝子の単離操作は細胞融合後8日目に実施した。
(1)96ウエルプレート上で対数増殖期にあるCOS細胞に、H鎖発現ベクターとL鎖発現ベクター各200ngを、リポフェクトアミン2000(商品名)(インビトロジェン社製)で導入した。遺伝子導入時の培地は、Opti−MEM(商品名)(インビトロジェン社製)を使用した。
(2)遺伝子導入から3日後に培養上清を回収し、ELISAで抗体の存在を確認した。
(3)抗原結合能が確認された抗体遺伝子ペアを有するCOS細胞を、培養スケールを上昇させて培養し、抗体の一過性発現を行なった。
(4)定法に従い培養上清からProtein Gカラム(GE Healthcare社製)で抗E2抗体を精製した。抗体の性能を評価し、競合特性、特異性、生産性などの点から性能が高かった抗体を選定した。
【0061】
実施例8 ウサギモノクローナル抗体安定産生株の作製
実施例7で選定した抗体の発現ベクターをCHO細胞に導入することで、抗体安定産生株を作製した。
【0062】
対数増殖期にある、CHO細胞(DXB11:dhfr欠損株)に実施例7と同じ条件で遺伝子を導入し、アルファーMEM(−)に10%透析血清を添加した培地で、細胞を培養した。その後、MTX(メソトレキセート)の濃度を5nMから500nMまで段階的に上昇させ、ウサギモノクローナル抗体U−1発現CHO細胞を得た。
【0063】
実施例9 発現抗体の親和性測定
BIAcore T−100(商品名)(ビアコア社製)を用いて、以下に示す3種類のモノクローナル抗体の親和性を測定した。
【0064】
(a)東ソー株式会社で単離したマウスモノクローナル抗体Ma−1
(b)東ソー株式会社で単離したラットモノクローナル抗体Ra−1
(c)本発明で製造したウサギモノクローナル抗体U−1
親和性は以下に示す方法で測定した。
(1)E2誘導体(6位にアミノ基が導入されたもの)をアミンカップリング法で、センサーチップ(CM5)上に結合させたものを使用した。
(2)緩衝液:HBS−EP、温度:25℃、流速30μL/min、結合時間:1分、解離時間:10分、の条件で解析を行なった。
(3)得られたデータを、解析ソフト(Biacore T100 Evaluation Software、version 1.1)を用い、bivalentモデルで解析し、Kd(M)の値を算出した。
【0065】
解離定数(Kd)を横軸に、縦軸に競合特性(1000pg/mLのE2が共存したときの値をE2が存在しないときの値で割った値。東ソー株式会社製のAIA−600IIを用いて測定した結果)を測定すると、親和性の高い抗体ほど競合特性も高く、高感度な測定系を構築できることがわかる(図5)。マウスモノクローナル抗体Ma−1(Kd=8.1×10−10M)、ラットモノクローナル抗体Ra−1(Kd=5.2×10−11M)はそれぞれ一般的には親和性の高い抗体に分類されるが、本発明で製造したウサギモノクローナル抗体U−1(Kd=3.3×10−13M)はMa−1よりも約2500倍、Ra−1よりも約160倍、それぞれ親和性が向上していた。
【0066】
実施例10 単離した抗体の蛍光偏光解消法による評価
単離した抗体を蛍光偏光解消法で結合性を評価した(図6)。テトラメチルローダミンで標識したE2を使用し、横軸に抗体濃度を、縦軸に蛍光偏光度(mP)をプロットしたものである。テトラメチルローダミン標識E2のmP値を20としたとき、抗体濃度を増加させた場合の偏光度の変化を示している。抗体濃度が高くなるにつれ、テトラメチルローダミンで標識されたE2が抗体と結合するため、大きい偏光度を得るようになる。本発明で製造したウサギモノクローナル抗体U−1は、マウスモノクローナル抗体Ma−1、ラットモノクローナル抗体Ra−1と比較して100倍以上低い濃度で偏光度が増加している。このことは、U−1が、Ma−1およびRa−1より親和性が極めて高いことを示している。
【0067】
実施例11 AIA試薬形態でのモノクローナル抗体の評価
本発明で製造したウサギモノクローナル抗体U−1を使用した免疫反応試薬を、ポリクローナル抗体を使用した免疫反応試薬(Eテスト「TOSOH」II E2、東ソー社製)と性能を比較した。両免疫反応試薬の検量線を図7に示す。E2の検出限界はポリクローナル抗体を使用した免疫反応試薬が25.2pg/mLであるのに対し、U−1を使用した免疫反応試薬は22.4pg/mLと、ポリクローナル抗体を使用した免疫反応試薬より高感度な測定系が構築できることが明らかとなった。
【0068】
また、エストロン(E1)およびエストリオール(E3)といった、類似ステロイドへの交差反応性(10ng/mL)を測定したところ、E1の場合(市販のAIA試薬:4.77%、ウサギモノクローナル抗体U−1を用いたAIA試薬:0.92%)、E3の場合(市販のAIA試薬:4.19%、ウサギモノクローナル抗体U−1を用いたAIA試薬:0.28%)、いずれもステロイド類に対する交差反応性が大幅に改善された。
【0069】
次に、40例の実検体を用いて両測定系の相関性を見た結果を図8に示した。回帰係数0.924、y切片−2.387pg/mL、相関係数r=0.998というきわめて高い相関性を示した。
【0070】
実施例12 遺伝子単離時期と単離される遺伝子の割合
ヘテロハイブリドーマは遺伝子が脱落しやすいとの情報はあるが、それがどの程度の時間で消失してしまうかなどの詳細な解析は報告されていなかった。本発明者らも、細胞融合後の培養上清をELISAで評価し、抗体が培養上清に発現していることを確認した後、その細胞から抗体遺伝子の増幅を試みても、抗体遺伝子が増幅できないという問題に直面した。PCRの条件、プライマーの配列などの種々の観点から遺伝子が増幅できない理由を検討した結果、細胞融合後に得られたヘテロハイブリドーマを経代培養する際、通常のマウスモノクローナル抗体を取り扱うのと同じ感覚で取り扱うと、抗体を発現しなくなる時期の特定が難しいことを見出した。通常、細胞を継代培養する際は、細胞懸濁液を約10倍量程度の新しい培地に移して培養を継続するため、はじめの培養上清中は、新しい培地に移すことで希釈されてゆく。つまり、細胞が安定に抗体を発現していない場合は、培養上清が希釈されるため、継代培養後の培養上清のシグナルは激減する。しかし、ウサギモノクローナル抗体の場合はこの理論は当てはまらなかった。ウサギモノクローナル抗体はマウスモノクローナル抗体と比較して、極端に親和性が高く、継代培養により培養上清が10倍あるいは100倍程度希釈されてもELISAでは十分なシグナルが得られるため、すでにヘテロハイブリドーマから抗体遺伝子は脱落し、抗体は発現していないにもかかわらず、ELISAでは陽性判定となってしまう。このことは、実施例10において、本特許で単離したウサギモノクローナル抗体とマウスモノクローナル抗体の結合性の比較を行なった結果、ウサギモノクローナル抗体はマウスモノクローナル抗体より100倍以上低い濃度でも抗原結合能が観察されていることからも裏づけできる。
【0071】
そこで、実施例6において、細胞融合後に抗体遺伝子を単離する時期を変更し、最適な単離時期について検討した。結果を表1に示す。
【0072】
【表1】

細胞融合後8日目で遺伝子を増幅すると、3回の実験の平均で、H鎖遺伝子は86.1%、L鎖遺伝子は94.4%の確率で増幅できた。そして、増幅した遺伝子から発現ベクターを作製しCOS細胞で発現させた抗体を評価したところ、75.0%の抗体は抗原結合能を有していた。また、3回の実験を通じ、安定した増幅率および抗体取得率を示したことから、当該期間で増幅すると抗体結合活性を持ったベクターを安定的に取得できることがわかる。
【0073】
一方、細胞融合後16日目で遺伝子を単離すると、それぞれの数値は、25.0%、88.9%、9.52%と低下した。このことから、単離する時期が遅いと特にH鎖遺伝子で急速な抗体遺伝子の脱落が起きていることがわかる。
【0074】
実施例13 抗トリヨードサイロニン(T3)抗体の単離
抗トリヨードサイロニン(T3)ウサギモノクローナル抗体を以下の方法で単離した。
【0075】
(1)免疫抗原の作製
BSA(Sigma社製)25mgを10mg/mLになるように、ホウ酸バッファー(0.05M、pH8.5)を加え、カルボン酸をメチルエステルとして保護した後、アミノ基からリンカーを伸ばした。次に、前記溶液と、N−ヒドロキシスクシイミドで活性化したT3 7mgをDMSO 100μLに溶解した液とを混合した。室温で30分撹拌後、PBSで透析(500mL×3回)することで、免疫抗原であるT3−BSAを得た。
【0076】
(2)スクリーニング抗原の作製
BCP(Blue Carrier Protein:Pierce社製)を用いて(1)と同様の方法で作製した。BCP 25mgを10mg/mLになるように、ホウ酸バッファー(0.05M、pH8.5)を加えた。前記溶液に、N−ヒドロキシスクシイミドで活性化したT3 7mgをDMSO 100μLに溶解した液とを混合した。室温で30分撹拌後、PBSで透析(500mL×3回)することで、ELISAでのスクリーニング抗原であるT3−BCPを得た。
【0077】
(3)動物と抗原免疫方法
免疫動物はウサギ(日本白色種)の12週齢メスを使用した。初回免疫はフロイント完全アジュバント、2次免疫以降はフロイントの不完全アジュバントを用い、抗原溶液(500μg/mL)と等量のアジュバントを混合後、エマルジョンを作製した後に2週間間隔で免疫した。免疫抗抗原量は、初回1mgで2次免疫以降は500μgである。
【0078】
次に、以下に示すELISAで十分な抗体価の上昇を確認した。
(3−1)T3−BCP(0.5μg/mL)をELISAプレートに固定化後、1%スキムミルクでブロッキングした。
(3−2)ウサギから採血した血清と反応させた。T3に結合した抗T3ウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0079】
(4)抗体産生細胞の増殖(培地での培養)
十分に抗体価が上昇したウサギの脾臓を摘出し、細胞凍結保存液(セルバンカー1(商品名)、日本全薬工業社製)中に分散させた状態で、ディープフリーザー中(−80℃)で保存した。保存細胞は定法に従って解凍し、GIT培地(日水製薬社製)で懸濁し、マイクロタイタープレートにまいた。5日間培養後の培養上清中にある抗T3抗体の性能は下記の3つのELISAにより評価した。
(4−1)反応性:Anti−Rabbit IgG(0.5μg/mL)をELISAプレートに固定化した後、1%スキムミルクでブロッキングした。その後、培養上清とアルカリホスファターゼ標識T3を同時に反応させた。ウサギモノクローナル抗体に未反応の酵素標識T3をB/F分離後、酵素基質である4−メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
(4−2)競合特性:反応性を評価する実験系に、T3(2nM)を共存させる実験を行なった。ここで得られた値(B)を、反応性で得られた値(B0)で割ることで、競合特性(B/B0値)を算出した。
(4−3)競合特性:反応性を評価する実験系に、T4(20nM)を共存させる実験を行なった。ここで得られた値(B)を、反応性で得られた値(B0)で割ることで、特異性(B/B0値)を算出した。
【0080】
以上得られた3つのデータをグラフ化した(図9)。横軸に特異性(B/B0値)を、縦軸に競合特性(B/B0値)を、反応性は円の大きさでプロットした。このグラフの中で、黒丸で塗りつぶしたクローンは、競合性能が高く、特異性も高く、かつ反応性も高いクローンである。
【0081】
(5)抗体遺伝子の単離・増幅と発現ベクターの作製
(4)の結果、図9で黒丸で塗りつぶしたクローンを選別後、選別した次の日に以下の方法で抗体遺伝子の単離を行なった。
(5−1)RNeasy Plus Micro kit(商品名)(QIAGEN社製)を用い、添付されているプロトコルに従って、細胞からのRNAの抽出を行なった。
(5−2)(5−1)で得られたRNAを鋳型とし、Sensiscript RT Kit(商品名)(QIAGEN社製)を用いて逆転写反応を行ない、cDNAを合成した。
(5−3)ウサギ抗体遺伝子に特異的なプライマー(H鎖およびL鎖に特異的なプライマー。配列番号1から3、5から7)を用いPhusion High−Fidelity DNA polymerase(商品名)(第一化学薬品社製)で、抗体遺伝子を増幅させた。条件は以下に示す。なお、H鎖を増幅させる際の二回目のPCRは、一回目のPCR産物(2μL)を鋳型とした他は、一回目のPCRと同じ試薬組成/反応条件で行なっている。
【0082】
(試薬組成)
キットに添付の緩衝液で、dNTP 0.2μM、プライマーはそれぞれ0.5
μMで行なった。
【0083】
(反応条件)
98℃で30秒保持後、98℃で10秒、72℃で50秒のサイクルを35サイ
クル繰り返し、その後72℃で10分間保持した。
【0084】
(プライマー)
H鎖:一回目のPCRでは配列2及び5、二回目のPCRでは配列1及び6
L鎖:配列番号3及び7
(5−4)電気泳動で遺伝子の増幅を確認した。
(5−5)得られたH鎖及びL鎖のPCRフラグメントを、BglIIとXbaIで制限酵素処理した後、動物細胞用発現ベクター(pECEdhfr:図4)のBglII/XbaIサイトに導入し、H鎖、L鎖用の発現ベクターを調製した。
【0085】
(6)遺伝子組み換え抗体の発現(COS細胞による一過性発現)
(5)で得られたH鎖、L鎖用発現ベクターからCOS1細胞(非特許文献17、18)での遺伝子組み換え抗体の生産を行なった。
(6−1)96ウエルプレート上で対数増殖期にあるCOS細胞に、H鎖発現ベクターを16.6ng、及びL鎖発現ベクターを8.3ngを、リポフェクトアミン2000(商品名)(インビトロジェン社)で導入した。遺伝子導入時の培地は、Opti−MEM(商品名)(インビトロジェン社)を使用した。
(6−2)遺伝子導入から3日後に培養上清を回収し、ELISAで抗体の存在を確認した。
(6−3)抗原結合能が確認された抗体遺伝子ペアを有するCOS細胞を、培養スケールを上昇させて培養し、抗体の一過性発現を行なった。
【0086】
(7)AIA試薬形態でのモノクローナル抗体の評価
(6)で作製した、ウサギ由来抗T3モノクローナル抗体(UT1D−5)を用いて、AIA用テストカップを作製した。AIAは東ソー株式会社で販売している全自動免疫診断システムであり、今回作製した抗体を使用してAIA用の免疫反応試薬を作製し評価を行なった。
【0087】
今回単離したウサギモノクローナル抗体UT1D−5を用いた免疫反応試薬、及びマウス由来抗T3モノクローナル抗体を用いた免疫反応試薬の検量線を図10に示した。図10に示すように、今回単離した抗体を用いることで、マウス由来の試薬より高感度な測定系を構築できることが明らかとなった。
【0088】
今回作製したUT1D−5を用いた免疫反応試薬を用いて交差反応性を評価した結果を図11に示す。図11より、今回単離した抗体はT3の類似化合物のサイロキシン(T4)には全く交差反応性を有しておらず、T3に対して非常に高い特異性を有していることがわかる。
【0089】
実施例14 抗脳性ナトリウム利尿ペプチド(BNP)抗体の単離
抗脳性ナトリウム利尿ペプチド(BNP)ウサギモノクローナル抗体を以下の方法で単離した。
【0090】
(1)免疫抗原の作製
BNPのC末端側7アミノ酸に相当するペプチド(CKVLRRH、配列番号12)を合成した。合成したペプチドのN末端にあるシステインを利用して、マレイミド−KLH(PIERCE社製)と反応させ、これを免疫抗原として使用した。反応方法は添付されたプロトコルに従い、ペプチド1mgに対して、マレイミド−KLHを1mg反応させた。
【0091】
(2)スクリーニング抗原の作製
BNPのC末端の7アミノ酸に相当するペプチド(CKVLRRH、配列番号12)のN末端に、リンカー配列(GGGSGGGS、配列番号13)を付加し、さらにN末端をビオチン化したペプチド(biotin−GGGSGGGSCKVLRRH、配列番号14、以降Bio−BNCと表記)を作成し、これをELISAでのスクリーニング抗原として使用した。
【0092】
(3)動物と抗原免疫方法
免疫動物はウサギ(日本白色種)の12週齢メスを使用した。初回免疫はフロイント完全アジュバント、2次免疫以降はフロイントの不完全アジュバントを用い、抗原溶液(500μg/mL)と等量のアジュバントを混合後、エマルジョンを作製した後に2週間間隔で免疫した。免疫抗抗原量は、初回500μgで2次免疫以降は250μgである。
【0093】
次に、以下に示すELISAで、十分な抗体価の上昇を確認した。
(3−1)ストレプトアビジン(0.5μg/mL)をELISAプレートに固定化後、1%スキムミルクでブロッキングした。
(3−2)Bio−BNC(0.5μg/mL)を反応させたELISAプレートを作製した。その後、抗原を免疫したウサギの血清を反応させた。Bio−BNCに結合した抗BNPウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0094】
(4)抗体産生細胞の増殖(培地での培養)
十分に抗体価が上昇したウサギの脾臓を摘出し、細胞凍結保存液(セルバンカー1(商品名)、日本全薬工業社製)中に分散させた状態で、ディープフリーザー中(−80℃)で保存した。保存細胞は定法に従って解凍し、GIT培地(日水製薬社製)で懸濁し、マイクロタイタープレートにまいた。5日間培養後の培養上清中にある抗BNP抗体の性能は下記のELISAにより評価した。
(4−1)ストレプトアビジン(0.5μg/mL)をELISAプレートに固定化後、1%スキムミルクでブロッキングし、その後、Bio−BNC(0.5μg/mL)を反応させたELISAプレートを作製した。
(4−2)培養上清と反応させた。Bio−BNCに結合した抗BNPウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0095】
得られた結果を図12に示す。図12の結果よりシグナルが強いクローンを選別し、抗体遺伝子を単離した。
【0096】
(5)抗体遺伝子の単離と発現ベクターの作製
(4)で選別したクローンから以下の方法で抗体遺伝子の単離を行なった。
(5−1)RNeasy Plus Micro kit(商品名)(QIAGEN社製)を用い、添付されているプロトコルに従い、細胞からのRNAの抽出を行なった。
(5−2)得られたRNAを鋳型とし、Sensiscript RT Kit(商品名)(QIAGEN社製)を用い、逆転写反応を行ないcDNAを合成した。
(5−3)ウサギ抗体遺伝子に特異的なプライマー(H鎖およびL鎖に特異的なプライマー。配列番号2、3、6から11参照)を用いPhusion High−Fidelity DNA polymerase(第一化学薬品社製)で、抗体遺伝子を増幅させた。条件は以下に示す。なお、二回目のPCR(反応液量50μL)を行なう際、H鎖を増幅させる場合は、一回目のPCR産物(2μL)を鋳型とした他は、一回目のPCRと同じ試薬組成/反応条件で行なっており、L鎖を増幅させる場合は、一回目のPCR産物をTEで1000倍希釈した液(2μL)を鋳型とした他は、一回目のPCRと同じ試薬組成/反応条件で行なっている。
【0097】
(試薬組成)
キットに添付の緩衝液で、dNTP 0.2μM、プライマーはそれぞれ0.5
μLで行なった。
【0098】
(反応条件)
98℃で30秒保持後、98℃で10秒、72℃で50秒のサイクルを35サイ
クル繰り返し、その後72℃で10分間保持した。
【0099】
(プライマー)
H鎖:一回目のPCRでは配列2及び6、二回目のPCRでは配列8及び9
L鎖:一回目のPCRでは配列3及び7、二回目のPCRでは配列10及び11
(5−4)電気泳動で遺伝子の増幅を確認した。
(5−5)得られたH鎖及びL鎖のPCRフラグメントは、BglII/XbaIで制限酵素処理した後、動物細胞用発現ベクター(pECEdhfr:図4)のBglII/XbaIサイトにInfusion Cloning kit(商品名)(Clontech社製)を用いて導入し、H鎖、L鎖用の発現ベクターを調製した。
【0100】
(6)遺伝子組み換え抗体の発現(COS細胞による一過性発現)
(5)で得られたH鎖、L鎖用発現ベクターからCOS1細胞(非特許文献17、18)での遺伝子組み換え抗体の生産を行なった。
(6−1)96ウエルプレート上で対数増殖期にあるCOS細胞に、H鎖発現ベクターを20ng、及びL鎖発現ベクターを20ngを、リポフェクトアミン2000(商品名)(インビトロジェン社製)で導入した。遺伝子導入時の培地は、Opti−MEM(商品名)(インビトロジェン社製)を使用した。
(6−2)遺伝子導入から3日後に培養上清を回収し、ELISAで抗体の存在を確認した。抗原結合能が確認された2つのクローン(27、45)を取得した。
【0101】
(7)サンドイッチアッセイ系でのモノクローナル抗体の評価
(6)で取得したクローンより得られたウサギ由来抗BNPモノクローナル抗体(27、45)を、以下の方法でELISAにより評価した。
(7−1)抗ウサギ抗体(10μg/mL)を固定化したELISAプレートに、(6)で取得したクローンから抗体を一過性発現させた後の培養上清を反応させ、その後BNP(0.1μg/mL)を反応させた。
(7−2)さらに、アルカリフォスファターゼで標識されたBNPの環状部位を認識する抗体(タンパク質濃度として、A280nm=0.003)を反応させた。
(7−3)未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0102】
得られた結果を図13に示した。図13の結果より、BNPの有無で、反応性に明確な差が見られたことから、BNPのC末端を認識するウサギモノクローナル抗体が単離されたことが確認できた。
【0103】
実施例15 細胞融合後のELISAのシグナル値の変化
E2−BSAを免疫したウサギ凍結脾臓細胞を使用して以下に示す実験を行なった。
(1)実施例5に示す方法に従い、細胞融合を行ない、マイクロタイタープレートに融合細胞をまいた。
(2)培養1、2、3、4、7、11日目に培養上清を同量とった。なお、培養上清をとる際に、同量の同じ組成の培地を加えることで培地の量を維持している。
(3)得られた培養上清を、実施例2に示すELISAで評価した。
【0104】
結果を図14に示す。細胞融合後1日目から7日目まではシグナル強度が上昇していたが、7日目以降はシグナルの強度にほとんど変化がなかった。以上の結果より、抗体遺伝子を単離する際、細胞融合した後、7日前後培養した培養上清から単離するのが好ましいことがわかる。
【産業上の利用可能性】
【0105】
本発明の製造方法により、親和性が高い特徴を有するウサギモノクローナル抗体を、通常の実験施設と分子生物学の知識があれば製造することができる。また、本発明の方法で製造したウサギモノクローナル抗体を免疫診断薬に用いることで、高感度で夾雑物の影響を受けない測定系を構築できる。
【図面の簡単な説明】
【0106】
【図1】脾臓由来の細胞を培養し、192クローンの培養上清の抗原結合能力を評価した結果。
【図2】末梢血由来のリンパ球を使った細胞融合後の培養上清中の抗体をELISAで評価した結果。
【図3】3840クローンの培養上清のスクリーニングの結果。縦軸は競合特性を、横軸は特異性を、各プロットの大きさは反応性を、それぞれ示す。また、図中の黒丸のプロットで示す抗体は、競合性能が高く、特異性も高く、かつ、反応性も高いクローンであり、当該クローンから、抗体遺伝子を単離した。
【図4】発現ベクターpECEdhfrの構造。図中のSV40PはSV40のプロモーターを、dhfrはジヒドロフォレート・リダクターゼ遺伝子を、polyAはポリアデニレートアタッチメントシグナルを、Ampはアンピシリン耐性遺伝子を、MCSはマルチクローニングサイトを、それぞれ示す。
【図5】マウスモノクローナル抗体、ラットモノクローナル抗体、および本発明で製造したウサギモノクローナル抗体を用いて、競合特性を比較した結果。縦軸は1000pg/mLの濃度のE2を測定した際のB/B0値を、横軸は解離定数を、それぞれ示す。
【図6】各抗体の性能を蛍光偏光解消法で評価した結果。縦軸は偏光度を、横軸は抗体の濃度を、それぞれ示す。抗原として使用した蛍光物質標識E2の偏光度は20とした。図中の黒丸はマウスモノクローナル抗体Ma−1を、白丸はラットモノクローナル抗体Ra−1を、黒四角は本発明で製造したウサギモノクローナル抗体U−1を、それぞれ使用したときの結果である。
【図7】東ソー社製の全自動免疫診断システム用の試薬を作製し、検量線を描いた結果。図中の白丸はポリクローナル抗体を使用した免疫反応試薬(Eテスト「TOSOH」II E2、東ソー社製)を、黒丸は本発明で製造したウサギモノクローナル抗体U−1を使用した免疫反応試薬を、それぞれ使用したときの結果である。
【図8】ポリクローナル抗体を使用した免疫反応試薬(Eテスト「TOSOH」II E2)と、本発明で製造したウサギモノクローナル抗体U−1を使用した免疫反応試薬にて、実検体を測定し相関をとった結果。
【図9】3840クローンの培養上清のスクリーニングの結果。縦軸は競合特性を、横軸は特異性を、各プロットの大きさは反応性を、それぞれ示す。また、図中の黒丸のプロットで示す抗体は、競合性能が高く、特異性も高く、かつ反応性も高いクローンであり、当該クローンから、抗体遺伝子を単離した。
【図10】東ソー社製の全自動免疫診断システム用の試薬を作製し、検量線を描いた結果。図中の黒丸は本発明で製造したウサギモノクローナル抗体UT1D−5を用いた免疫反応試薬を、白四角はマウスモノクロナール抗体を用いた免疫反応試薬を、それぞれ使用したときの結果である。
【図11】交差反応性を評価した結果。横軸にT3またはT4の濃度を示し,縦軸はB/B0値を示す。
【図12】3840クローンの培養上清のスクリーニングの結果。縦軸は蛍光強度を示し横軸はクローンを示す。
【図13】一過性発現で得られた抗BNP抗体(C末端認識)とBNPの環状部位を認識する抗体によるBNPのサンドイッチアッセイ結果。
【図14】細胞融合後の培養上清中の抗体量の推移をELISAで評価した結果。
【技術分野】
【0001】
本発明は、遺伝子組換えウサギモノクローナル抗体の製造方法に関するものである。
【背景技術】
【0002】
モノクローナル抗体はその特異性と親和性の高さから、ある特定の物質を検出するための実験用試薬としてだけではなく、がん治療用医薬品、免疫診断薬の中核材料として広く利用されている。
【0003】
モノクローナル抗体といえば、マウス由来のモノクローナル抗体が一般には認知されている。通常の実験で使用する抗体あるいは免疫測定試薬であればマウス由来のモノクローナル抗体が有する親和性の程度で十分な場合が多い。しかし、免疫診断薬のような、測定感度の高感度化が近年ますます要求されている領域では、マウス由来モノクローナル抗体では親和性が足りない場合がある。たとえば競合法においては、抗体の親和性が高くなるほど検出感度が高くなることは、理論的に証明することができ、高感度競合法を構築するためには、親和性の高い抗体が必要となる。また、サンドイッチ法でも、親和性の高い抗体により、微量の抗原を検出できるようになり、高感度測定系が構築できる。
【0004】
たとえば、ステロイドは低分子であるため、競合法で測定されている。特にステロイド類の中でもエストラジオール(E2)は、高感度測定系が要求されており、親和性の高い抗体の要求が強い。
【0005】
マウス以外の種々のモノクローナル抗体も報告されており、非特許文献1で紹介されているように、体の大きい動物種から抗体をとれば親和性の高い抗体が単離される傾向にある。しかしながら、同じ動物種に同じ抗原を免疫しても、個体差の影響が大きく、得られる抗血清も異なるため、親和性の高い抗体を単離するためには、少なくとも数匹以上の個体に抗原を免疫し、免疫応答の高い個体からモノクローナル抗体を単離する必要がある。そのため、現実的には免疫動物としてウサギが選ばれる。また、ウサギは免疫診断薬用の抗血清にウサギの血清がよく利用されていることからも、免疫動物種としては適していると考えられる。
【0006】
マウスモノクローナル抗体の製造方法は確立されており、以下に示す方法で製造している。まず、抗原を免疫したマウスの脾臓細胞(抗体産生細胞)をマウスミエローマ細胞(骨髄腫細胞)と細胞融合させ、無限増殖能を持ち、かつ、目的抗体を産生するハイブリドーマを作製する。その後、当該細胞を培養し産生された抗体を精製して、マウスモノクローナル抗体を製造する。
【0007】
ウサギモノクローナル抗体も理論上はマウスモノクローナル抗体の製造方法と同様な方法で生産できる。しかしながら、抗体産生細胞と細胞融合させるのに用いるウサギミエローマ細胞(非特許文献2)が、マウスミエローマ細胞とは異なり、一般には流通していないため、マウスモノクローナル抗体の製造方法と同様な方法で生産できる施設は限られており、通常の実験室レベルでは当該方法によりウサギモノクローナル抗体を製造することは出来ない。このため、ウサギミエローマ細胞を用いずに、ウサギモノクローナル抗体を生産する方法について、これまでいくつか検討されている。
【0008】
まず、ウサギ抗体産生細胞をマウスミエローマ細胞と融合する方法がある。しかしながら、当該方法は異種動物間の融合であり、融合効率が低いため、得られるハイブリドーマ数は少なく、また得られたハイブリドーマも、短期間のうちに抗体生産能力が消失する(非特許文献3、4)。さらに、ウサギ血清の存在下で当該融合細胞を培養することで抗体生産能力を維持可能との報告もあるが、生産されたモノクローナル抗体の精製が困難であり、長期間の抗体生産性についての報告もない(非特許文献5)。
【0009】
次に、抗原を免疫したウサギ脾臓から重鎖(H鎖)および軽鎖(L鎖)の抗体遺伝子を単離、増幅後、ウサギ抗体ライブラリーを作製し、ファージディスプレイ法などにより、ウサギ抗体を単離する方法が報告されている(非特許文献6から8)。しかし本方法によると、ライブラリーから抗体を選別する過程において「パニング」という操作が必須となる。当該操作を簡単に述べると、抗原が固定化された水不溶性担体をライブラリーに接触させ、抗原に結合した抗体を回収する。その後抗原に結合した抗体を何らかの方法で増幅させ新たなライブラリーを作製し、さらに抗原を固定化した水不溶性担体と反応させる操作を繰り返す。当該操作により、抗原と結合する抗体は濃縮され、最終的に抗原に結合する抗体を単離することができる。しかしながら、抗原抗体反応が平衡反応である以上、抗原と抗体の結合には濃度の影響をうける。例えばライブラリーの中に微量しか存在しない親和性の高い抗体を選択的に濃縮してくることは原理上不可能である。また、一般的に親和性の高い抗体を得るためには、抗体が本来ウサギの作製したH鎖とL鎖の組み合わせである必要があるが、当該操作によって得られる抗体は、本来ウサギの作製したH鎖とL鎖の組み合わせが再現される可能性が極めて低いため、当該操作で親和性が向上した抗体を回収するのは極めて困難である。
【0010】
上記方法以外には、ウサギ抗体産生細胞を軟寒天培地中で保持した後、赤血球溶血法により目的抗体を発現している抗体産生細胞を探し、一個の抗体産生細胞から抗体遺伝子を単離し、遺伝子組換え抗体として作製する方法がある(非特許文献9)。当該方法を用いることで本来ウサギの作製したH鎖とL鎖の組み合わせを再現できるが、極めて高い抗体性能(親和性、特異性、保存安定性、生産性など)が要求される免疫診断薬で使用するような抗体は簡単に得られるものではない。つまり、単に抗原に結合するウサギモノクローナル抗体を単離するのであれば非特許文献9の方法でも良いが、免疫診断薬で使用可能な性能の高いモノクローナル抗体を単離しようと、数千から数万クローンの遺伝子組換え抗体を作製しても、目的とする抗体を単離できる保障はない。さらに、上記作業を行なうには、膨大な実験工数を必要とするため、現実的に実施は困難である。また、一個の細胞から遺伝子を単離するため、抗体を発現している細胞を見つけても抗体遺伝子の増幅効率は低く、非特許文献9で報告されている抗体遺伝子の増幅確率はH鎖で27%、L鎖で55%程度である。
【0011】
以上より、ウサギモノクローナル抗体の性能が高いことは報告されているものの、ウサギモノクローナル抗体自体はウサギミエローマ細胞を有する一部の施設でしか生産できないため、当該抗体の工業的な利用を困難にしていた。
【0012】
【特許文献1】特開平10−262657号
【非特許文献1】Hybridoma、19、201;2000
【非特許文献2】Proc.Natl.Acad.Sci.USA、92,9348;1995
【非特許文献3】Proc.Natl.Acad.Sci.USA、58、1104;1967
【非特許文献4】Genetics,54,1095;1966
【非特許文献5】Science、240、1788;1988
【非特許文献6】J.Biol.Chem.、275、13668;2000
【非特許文献7】Gene、172、295;1996
【非特許文献8】J.Immunol.Method.、213、201;1998
【非特許文献9】Proc.Natl.Acad.Sci.USA、93、7843;1996
【非特許文献10】Cole et al.,”The EBV−Hybridoma Technique and Its Application to Human Lung Cancer” Monoclonal Antibodies and Cancer Therapy,Reisfeld et al.,New York:Alan R. Liss Inc.77−96;1985
【非特許文献11】J.Immunol.、152、3935;1994
【非特許文献12】J.Mol.Biol.、325、325;2003
【非特許文献13】Biotechnol.、13、6171;1995
【非特許文献14】Nucl.Acids Res.、15、6171;1987
【非特許文献15】Nucl.Acids Res.、10、1535;1982
【非特許文献16】J.Biochem.、108、673;1990
【非特許文献17】Biotechnol.Lett.、17、135;1995
【非特許文献18】J.Ferm.Bioeng.、79、405;1995
【発明の開示】
【発明が解決しようとする課題】
【0013】
本発明が解決しようとする課題は、ウサギミエローマ細胞を有する特定の機関でのみ作製可能であったウサギモノクローナル抗体を、通常の実験施設と分子生物学の知識があれば製造できる技術を提供することである。
【課題を解決するための手段】
【0014】
上記課題を鑑みてなされた本発明は、以下の発明を包含する。
【0015】
第一の発明は、抗原を免疫したウサギから抗体産生細胞を単離し、目的とする抗体遺伝子を保有する細胞を選別し、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離、増幅し、発現ベクターに導入後、ホスト細胞に導入することで遺伝子組換えウサギモノクローナル抗体を発現させる遺伝子組換え抗体の製造方法において、目的とする抗体遺伝子を保有する細胞を選別するにあたり、抗体産生細胞を増殖させてから選別することを特徴とする、遺伝子組換え抗体の製造方法である。
【0016】
第二の発明は、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離する操作を、選別した細胞から抗体遺伝子の脱落が起きない期間内で実施することを特徴とする、第一の発明に記載の遺伝子組換え抗体の製造方法である。
【0017】
第三の発明は、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離する操作を、抗体産生細胞増殖開始後14日以内に実施することを特徴とする、第一の発明に記載の遺伝子組換え抗体の製造方法である。
【0018】
第四の発明は、抗体産生細胞が、抗原を免疫したウサギの脾臓細胞、リンパ節細胞、末梢血細胞のいずれかであることを特徴とする、第一から第三の発明に記載の遺伝子組換え抗体の製造方法である。
【0019】
第五の発明は、抗体産生細胞を増殖させる方法が、抗体産生細胞を培地中で培養する方法であることを特徴とする、第一から第四の発明に記載の遺伝子組換え抗体の製造方法である。
【0020】
第六の発明は、抗体産生細胞を増殖させる方法が、不死化能を与えることのできる細胞を融合させて培養する方法であることを特徴とする、第一から第四の発明に記載の遺伝子組換え抗体の製造方法である。
【0021】
第七の発明は、ウサギに免疫する抗原が、ハプテンまたはペプチドであることを特徴とする、第一から第六の発明に記載の遺伝子組換え抗体の製造方法である。
【0022】
第八の発明は、ホスト細胞が動物細胞であることを特徴とする、第一から第七の発明に記載の遺伝子組換え抗体の製造方法である。
【0023】
以下、本発明について詳細に説明する。
【0024】
(1)抗原の種類
ウサギに免疫する抗原は、特に限定されず、ハプテン、ペプチド、タンパク質、核酸、細胞、脂質、糖鎖、細菌、蛍光物質、ビタミン類の中から任意に選択することができるが、特に、親和性および特異性などにおいて高い抗体性能が要求される抗原に対して本発明を適用するのが好ましい。具体的には、測定原理上高感度測定系を構築するために高い親和性が要求される競合法用の抗原、例えば、エストロン(E1)、エストラジオール(E2)、エストリオール(E3)、プロゲステロン、コルチゾールなどのステロイドホルモン類、サイロニン、サイロキシン、トリヨードサイロニンなどの甲状腺ホルモン類といったハプテンがあげられる。また、競合法用の抗原以外でも、例えば、Cペプチド、および脳性ナトリウム利尿ペプチド(BNP)といった、高感度が要求されるペプチドへの適用も好ましい一例である。
【0025】
(2)抗原免疫方法
抗原を免疫するウサギは、抗原の種類によって免疫応答は異なるため、できるだけ多くの系統と匹数に免疫するのが好ましい。ウサギの系統としては、一般に入手可能な日本白色種、およびニュージーランドホワイトが例示されるが、当該系統に限定されるものではない。また、同じ系統のウサギを用いても個体差があるため数匹から10匹程度の個体に免疫することで、免疫応答の高いウサギ由来の抗体産生細胞を入手するのが好ましい。
【0026】
ウサギへの免疫方法は特に限定されるものではなく、通常一般的に行なわれている方法で免疫すればよい。例えば、アジュバントとエマルジョンを作製し免疫する方法やタンパク質あるいはペプチドをコードしているDNAを免疫する方法があげられる。
【0027】
免疫場所も特に限定されない。皮下、腹腔、フットパットといった通常行なわれている場所でウサギに免疫すればよい。
【0028】
免疫回数は、抗原の種類およびウサギへの応答性によって変動があるため、ELISA法あるいはBIAcore(商品名)(ビアコア社製)で測定することで血清の抗体価を解析し、当該血清の経過を観察して決定するのが好ましい。通常は4回程度の免疫で良いが、場合によってはさらに複数回(期間にして数ヶ月から1年間程度)の免疫が必要な場合もある。
【0029】
(3)抗体産生細胞の単離
単離の対象となる抗体産生細胞は、抗体を産生する細胞であれば特に限定はされないが、脾臓由来の細胞、リンパ節由来の細胞、末梢血由来の細胞のいずれかを使うのが好ましい。また、抗体産生細胞の単離は通常実施されている方法で実施すればよい。単離した細胞はすぐに使用するのが好ましいが、一般的に入手できる細胞保存溶液中に分散させた状態で、液体窒素あるいはディープフリーザー中で保存することが可能であり、必要に応じて使用することが出来る。
【0030】
(4)抗体産生細胞の選別
上記(3)で単離した抗体産生細胞から目的とする抗体遺伝子を保有する細胞を選別する必要がある。選別方法としては、非特許文献9にあるように、抗体を産生している細胞から一個の細胞を選別し、選別した細胞から抗体遺伝子を単離、増幅させる方法があるが、当該選別方法では抗原結合能しか評価ができないため、目的の性能を有した抗体を取得するのは困難である。そのため、本発明では、(3)で単離した抗体産生細胞を増殖させ、培養上清中に発現した抗体の有する競合特性、特異性、反応性といった性能を評価し、当該性能が高い抗体を発現している細胞を選別後、抗体遺伝子を単離することを特徴としている。
【0031】
本発明の製造方法における、抗体産生細胞の増殖方法としては以下の方法が例示できる。
【0032】
a)マイクロウエルプレート中にて、抗体産生細胞を増殖用培地で培養上清中の抗体
性能が評価できるまで培養する方法。
【0033】
b)通常のハイブリドーマを得る方法のように、抗体産生細胞に不死化能を与えるよ
うな細胞と融合させることで、培養上清中の抗体性能を評価する方法。
【0034】
c)エプスタイン−バーウイルス(EBV)などのウイルスにより抗体産生細胞を不
死化し培養することで、抗体遺伝子を単離する細胞を選別する方法。
このうち、a)またはb)の方法を用いて増殖させる方法が好ましい。
【0035】
a)の増殖方法で用いる培地としては、通常用いられる動物細胞用の培地、あるいはIL−4やLPSといった通常よく知られているサイトカイン類を添加した培地が使用できる。
【0036】
b)の増殖方法で用いる不死化能を与える細胞としては、融合後に抗体を分泌できる融合細胞が得られる細胞であり、かつ、増殖後、抗体の性能を評価した時点で融合細胞中に抗体遺伝子が残存している細胞であれば限定はされないが、抗体産生能を長期間維持できる融合細胞が得られる細胞が特に好ましい。不死化能を与える細胞としては、P3−X63−Ag8(ATCC TIB9)、P3−NS1−1−Ag4−1(JCRB 0009)、P3−X63−Ag8−U1(JCRB 9085)、P3−X63−Ag8、653(JCRB 0028)、SP2/O−Ag−14(JCRB 0029)、NSO/U(RCB 0213)、S194/5XXO、BU1(ATCC CRL−8837)、FO(ATCC CRL−1646)といったマウスミエローマ関連の細胞や、SK0−007、HO−323といったヒト骨髄腫細胞株、GM1500 6GT−Al2といったヒトB細胞株、Y3−Ag1・2・3といったラット骨髄腫細胞株、TP−3のウサギ形質転換細胞株、VX−2といったウサギがん細胞を例示することができる。また、マウスミエローマ細胞株を出発とした細胞株(たとえば特許文献1に記載の2−3A)も、本発明における、好ましい不死化能を与える細胞の一例である。
【0037】
b)の増殖方法で用いる細胞融合方法は、通常用いられる方法で実施すればよく、例えば、ポリエチレングリコール法、電気融合法、センダイウイルスを用いる方法をあげることができる。
【0038】
c)の増殖方法は、当業者によく知られている、ヒトリンパ球にEBVなどのウイルスを感染させて増殖させる(非特許文献10)のと同様な手法で、抗体生産能を有するウサギB細胞にEBVなどのウイルスを感染させ、一時的に不死化させる方法である。なお、ウサギB細胞に感染させるウイルスとしては前記目的を達成できるものであれば良く、特にEBVに限定されるものではない。
【0039】
(5)抗体性能の評価方法
抗体遺伝子を保有する細胞を選別するための抗体性能の評価方法は、対象抗体の評価内容に応じて適宜選択すればよい。例えば、評価内容としては、抗原結合能、競合特性、特異性、抗体生産性があげられ、評価方法としてはELISA法、RIA法、蛍光偏光法をあげることができる。
【0040】
(6)抗体遺伝子の単離時期
上記(4)で選別した細胞から重鎖(H鎖)および軽鎖(L鎖)の抗体遺伝子を単離する時期としては、抗原およびウサギの系統によって最適時期が異なるため、培養上清中に評価するための十分な抗体量が確保でき、かつ、抗体遺伝子の脱落が起きない期間であれば特に限定されないが、実施例12にあるように抗体産生細胞増殖開始後16日後で抗体遺伝子を単離すると、抗体遺伝子の増幅効率、および抗原結合活性を持った発現ベクターの取得率が低下していることから、抗体遺伝子の単離は抗体産生細胞増殖開始後14日以内に実施するのが好ましい。
【0041】
(7)抗体遺伝子の増幅方法
抗体遺伝子の増幅方法としては通常用いられるRT−PCR法が使用できる。また、RT−PCR反応の際に用いる逆転写酵素およびDNAポリメラーゼは通常市販の酵素が使用できるが、特にDNAポリメラーゼはDNA増幅の際、変異が導入されるのを避けるため、Phusion High−Fidelity DNA polymerase(商品名)(第一化学薬品社製)やPrimeSTAR HS DNA polymerase(商品名)(タカラバイオ社製)といったフィデリティーの高い酵素を使用するのが好ましい。
【0042】
抗体遺伝子を増幅するためのプライマーは、抗体の可変領域をコードする領域が増幅されるような位置に設計してあれば、特に場所は限定されない。抗体遺伝子を増幅するために用いるプライマーの組み合わせとしては、抗体遺伝子の全長を増幅することを目的とした開始コドンより上流と終始コドンより下流の非翻訳領域に設計したプライマーの組み合わせ、抗体遺伝子の可変領域を増幅することを目的とした抗体遺伝子内部に設計したプライマーの組み合わせ、あるいは上記プライマーを適宜組み合わせた系を例示することができる。なお、一回のPCR反応で抗体遺伝子の増幅効率が低い場合には、1回目のPCR反応産物を鋳型とし、2回目のPCR反応を行うことで効率よく抗体遺伝子を増幅することが出来る。この際1回目の増幅領域の少し内側に新たなプライマーを作製するほうが効率よく遺伝子を増幅することが出来る場合が多いが、それに限定されるものではない。
【0043】
また、ウサギH鎖は8割以上でVH1を使用していること(非特許文献11)、およびL鎖は8割以上がκ鎖であることが報告されていること(非特許文献12)から、それぞれの遺伝子に特異的なプライマーセットを用いて増幅するのが好ましい。さらに、抗体遺伝子を増幅するためのプライマーの一態様として、非特許文献10及び13から15に記載のプライマー配列、およびGenBankを参考に設計したプライマー配列(配列番号1から11)を開示するが、上記目的を達成できるものであれば、他の配列を用いてもかまわない。
【0044】
(8)発現ベクター
発現用ベクターについては、一般的に報告されているベクターであれば限定されないが、特にpECEdhfr(非特許文献16、図4)を発現ベクターとして使用するのが好ましい。また、発現させる抗体の領域も、抗体の可変領域を含むように発現させればよく、発現の形としてはIgG、F(ab’)2、Fab、FV、scFVが例示できる。また、単離した抗体遺伝子を出発材料として、種々のアミノ酸変異を加えることで抗体の性能を変化させることは、当業者であれば容易に想到可能である。
【0045】
(9)ホスト細胞
発現ベクターは適切なホスト細胞に導入することにより、遺伝子組換え抗体を産生させることができる。一過的に遺伝子組換え抗体を高発現させるためには、SV40 large T抗原タンパク質発現細胞をホスト細胞として用いるのが好ましく、その一例として、実施例7、13、14で使用のCOS1細胞(非特許文献17、18)や、293T細胞、COS7細胞をあげることができる。
【0046】
また、安定的に遺伝子組換え抗体を発現させるためには、遺伝子組み換え動物/昆虫/植物を用いて発現させることも可能であるが、動物細胞、および酵母や大腸菌に代表される微生物をホスト細胞として用いるのが好ましく、特に動物細胞、その中でもCHO細胞を用いるのが好ましい。さらに好ましい安定生産株は、抗体遺伝子を増幅することができるdhfr遺伝子増幅系を組み込んだベクターをCHO細胞に導入したホストベクター系である。
【発明の効果】
【0047】
本発明のウサギモノクローナル抗体の製造方法は、一般に流通していないウサギミエローマ細胞を使用することなく、抗原を免疫したウサギから単離した抗体産生細胞を増殖させてから、抗体遺伝子を保有する細胞を選別し、選別した細胞から抗体遺伝子を単離、増幅することを特徴としており、通常の実験施設と分子生物学の知識があればウサギモノクローナル抗体の製造を可能にする方法である。また、本発明の製造方法は従来技術では困難であった、本来ウサギが作製した重鎖と軽鎖の組み合わせを有するモノクローナル抗体を容易に製造することができるため、これまで限られた施設でしか取り扱うことができない、高い親和性を有したウサギモノクローナル抗体を通常の実験室レベルで容易に取り扱うことが可能となる。
【実施例】
【0048】
以下、実施例を用いて本発明をさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0049】
実施例1 免疫抗原およびスクリーニング抗原の作製
免疫抗原としてはE2−BSA(商品名)(Sigma社製)を使用した。またELISAでのスクリーニング用抗原は、下記の方法で作製した。
(1)BCP(Blue Carrier Protein:Pierce社製)100mgを10mg/mLになるようにPBSを加え、6位をN−ヒドロキシスクシイミドで活性化したエストラジオール(E2) 1.25mgをDMF 1mLに溶解したものと混合した。
(2)室温で2時間撹拌後、PBSで透析(1L×3回)することでE2−BCPを得た。
【0050】
実施例2 動物と抗原免疫方法
免疫動物はウサギ(日本白色種)の12週齢メスを使用した。初回免疫はフロイント完全アジュバント、2次免疫以降はフロイントの不完全アジュバントを用い、抗原溶液(500μg/mL)と等量のアジュバントを混合後、エマルジョンを作製した後に2週間間隔で免疫した。免疫抗抗原量は、初回500μgで2次免疫以降は250μgである。
【0051】
次に、以下に示すELISA(Enzyme Linked Immunosorbent Assay)で、十分な抗体価の上昇を確認した。
(1)E2−BCP(0.5μg/mL)をELISAプレートに固定化後、1%スキムミルクでブロッキングした。
(2)ウサギから採血した血清と反応させた。E2に結合した抗E2ウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0052】
実施例3 脾臓細胞を用いた抗体産生細胞の増殖(培地での培養)
十分に抗体価が上昇したウサギの脾臓を摘出し、定法に従い脾臓細胞を単離した。脾臓細胞を10%FCSを含むGIT培地(日水製薬社製)に懸濁し、マイクロプレートにまいて培養した。一週間後に培養上清を実施例2に記載の方法で、192クローンの培養上清中の抗体を評価した結果を図1に示した。このように、マイクロウエルプレートの上清中に抗体の産生を確認することができた。
【0053】
実施例4 末梢血細胞由来のリンパ球を用いた抗体産生細胞の増殖(細胞融合を用いた培養)
以下に示す方法で、末梢血細胞由来のリンパ球と不死化能を与える細胞とを融合させた。
(1)十分に抗体価が上昇したウサギ末梢血から採取したリンパ球と、マウスミエローマ細胞の遺伝子にウサギの染色体が一部組み込まれている細胞(2−3A、特許文献1)を融合した。なお、本細胞(2−3A)は、栄研化学株式会社により樹立されたもので、栄研化学株式会社の好意により譲渡して頂いたものである。
(2)定法(PEG法)に従い、2−3A細胞と末梢血細胞由来のリンパ球とを融合させた。
(3)融合後の細胞浮遊液を10%FCS、1×HATを含むGIT培地(日水製薬社製)で懸濁し、マイクロタイタープレートにまいた。
【0054】
384クローンの培養上清中の抗体を実施例2に記載の方法で評価した結果を図2に示した。このように、マイクロウエルプレートの上清中に抗体の産生を確認することができた。
【0055】
実施例5 脾臓細胞を用いた抗体産生細胞の増殖(細胞融合を用いた培養)
以下に示す方法で、脾臓細胞と不死化能を与える細胞とを融合させた。
(1)十分に抗体価が上昇したウサギの脾臓を摘出し、定法に従って脾臓細胞を調製した。なお、ウサギ脾臓細胞と細胞融合する細胞は、実施例4で使用した細胞(2−3A、特許文献1)を使用した。
(2)定法(PEG法)に従い、2−3A細胞とウサギ脾臓細胞を融合させた。
(3)融合後の細胞浮遊液を10%FCS、1×HATを含むGIT培地(日水製薬社製)で懸濁し、マイクロタイタープレートにまいた。
(4)培養上清中の抗E2抗体の性能を下記の3つのELISAにより評価した。
(4−1)反応性:E2−BCP(0.5μg/mL)をELISAプレートに固定化した後、1%スキムミルクでブロッキングした。その後、細胞融合後の培養上清を反応させた。E2に結合した抗E2ウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4−メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
(4−2)競合特性:反応性を評価する実験系に、E2(500pg/mL)を共存させる実験を行なった。ここで得られた値(B)を、反応性で得られた値(B0)で割ることで、競合特性(B/B0値)を算出した。
(4−3)特異性:反応性を評価する実験系に、各種ステロイド(エストロン:E1、エストリオール:E3、エチニルエストラジオール:EtE2、テストステロン:TS、各500 pg/mL)を共存させる実験をおこなった。ここで得られた値(B)を、反応性で得られた値(B0)で割ることで、特異性(B/B0値)を算出した。
【0056】
以上得られた3つのデータをグラフ化した(図3)。横軸に特異性(B/B0値)を、縦軸に競合特性(B/B0値)を、反応性は円の大きさでプロットした。このグラフの中で、黒丸で塗りつぶしたクローンは、競合特性が高く、特異性も高く、かつ、反応性も高いクローンである。
【0057】
実施例6 抗体遺伝子の単離・増幅と発現ベクターの作製
実施例5の結果、図3で黒丸で塗りつぶしたクローンを選別後、当該クローンから以下の方法で抗体遺伝子を単離、増幅後、発現ベクターを作製した。
(1)MagMaxTM−96 Total RNA Isolation kit(商品名)(Ambion社製)を用い、添付されているプロトコルに従って細胞からのRNAの単離を行なった。
(2)単離したRNAを鋳型とし、Ready−To−Go You−Prime First−Strand Beads(商品名)(GE Healthcare社製)を用いて、逆転写反応を行ないcDNAを合成した。
(3)ウサギ抗体遺伝子に特異的なプライマー(重鎖(H鎖)および軽鎖(L鎖)に特異的なプライマー、配列番号1から4、なお配列1と2はH鎖、配列3と4はL鎖にそれぞれ特異的なプライマーである)を用いPhusion High−Fidelity DNA polymerase(商品名)(第一化学薬品社製)で、抗体遺伝子をPCR反応で増幅させた。条件を以下に示す。
【0058】
(試薬組成)
キットに添付の緩衝液で、dNTP 0.2μM、プライマーはそれぞれ0.5
μMで行なった。
【0059】
(反応条件)
98℃で30秒保持後、98℃で10秒、72℃で50秒のサイクルを35サイ
クル繰り返し、その後72℃で10分間保持した。
(4)電気泳動で遺伝子の増幅を確認した。
(5)得られたH鎖及びL鎖のPCRフラグメントを、BglIIとXbaIで制限酵素処理した後、動物細胞用発現ベクター(pECEdhfr:図4)のBglII/XbaIサイトに導入し、H鎖、L鎖用の発現ベクターを調製した。
【0060】
実施例7 遺伝子組換え抗体の発現(COS細胞による一過性発現)と精製
実施例6で得られたH鎖、L鎖用の発現ベクターからCOS1細胞(非特許文献17、18)での遺伝子組換え抗体の生産を行なった。なお、実施例6における抗体遺伝子の単離操作は細胞融合後8日目に実施した。
(1)96ウエルプレート上で対数増殖期にあるCOS細胞に、H鎖発現ベクターとL鎖発現ベクター各200ngを、リポフェクトアミン2000(商品名)(インビトロジェン社製)で導入した。遺伝子導入時の培地は、Opti−MEM(商品名)(インビトロジェン社製)を使用した。
(2)遺伝子導入から3日後に培養上清を回収し、ELISAで抗体の存在を確認した。
(3)抗原結合能が確認された抗体遺伝子ペアを有するCOS細胞を、培養スケールを上昇させて培養し、抗体の一過性発現を行なった。
(4)定法に従い培養上清からProtein Gカラム(GE Healthcare社製)で抗E2抗体を精製した。抗体の性能を評価し、競合特性、特異性、生産性などの点から性能が高かった抗体を選定した。
【0061】
実施例8 ウサギモノクローナル抗体安定産生株の作製
実施例7で選定した抗体の発現ベクターをCHO細胞に導入することで、抗体安定産生株を作製した。
【0062】
対数増殖期にある、CHO細胞(DXB11:dhfr欠損株)に実施例7と同じ条件で遺伝子を導入し、アルファーMEM(−)に10%透析血清を添加した培地で、細胞を培養した。その後、MTX(メソトレキセート)の濃度を5nMから500nMまで段階的に上昇させ、ウサギモノクローナル抗体U−1発現CHO細胞を得た。
【0063】
実施例9 発現抗体の親和性測定
BIAcore T−100(商品名)(ビアコア社製)を用いて、以下に示す3種類のモノクローナル抗体の親和性を測定した。
【0064】
(a)東ソー株式会社で単離したマウスモノクローナル抗体Ma−1
(b)東ソー株式会社で単離したラットモノクローナル抗体Ra−1
(c)本発明で製造したウサギモノクローナル抗体U−1
親和性は以下に示す方法で測定した。
(1)E2誘導体(6位にアミノ基が導入されたもの)をアミンカップリング法で、センサーチップ(CM5)上に結合させたものを使用した。
(2)緩衝液:HBS−EP、温度:25℃、流速30μL/min、結合時間:1分、解離時間:10分、の条件で解析を行なった。
(3)得られたデータを、解析ソフト(Biacore T100 Evaluation Software、version 1.1)を用い、bivalentモデルで解析し、Kd(M)の値を算出した。
【0065】
解離定数(Kd)を横軸に、縦軸に競合特性(1000pg/mLのE2が共存したときの値をE2が存在しないときの値で割った値。東ソー株式会社製のAIA−600IIを用いて測定した結果)を測定すると、親和性の高い抗体ほど競合特性も高く、高感度な測定系を構築できることがわかる(図5)。マウスモノクローナル抗体Ma−1(Kd=8.1×10−10M)、ラットモノクローナル抗体Ra−1(Kd=5.2×10−11M)はそれぞれ一般的には親和性の高い抗体に分類されるが、本発明で製造したウサギモノクローナル抗体U−1(Kd=3.3×10−13M)はMa−1よりも約2500倍、Ra−1よりも約160倍、それぞれ親和性が向上していた。
【0066】
実施例10 単離した抗体の蛍光偏光解消法による評価
単離した抗体を蛍光偏光解消法で結合性を評価した(図6)。テトラメチルローダミンで標識したE2を使用し、横軸に抗体濃度を、縦軸に蛍光偏光度(mP)をプロットしたものである。テトラメチルローダミン標識E2のmP値を20としたとき、抗体濃度を増加させた場合の偏光度の変化を示している。抗体濃度が高くなるにつれ、テトラメチルローダミンで標識されたE2が抗体と結合するため、大きい偏光度を得るようになる。本発明で製造したウサギモノクローナル抗体U−1は、マウスモノクローナル抗体Ma−1、ラットモノクローナル抗体Ra−1と比較して100倍以上低い濃度で偏光度が増加している。このことは、U−1が、Ma−1およびRa−1より親和性が極めて高いことを示している。
【0067】
実施例11 AIA試薬形態でのモノクローナル抗体の評価
本発明で製造したウサギモノクローナル抗体U−1を使用した免疫反応試薬を、ポリクローナル抗体を使用した免疫反応試薬(Eテスト「TOSOH」II E2、東ソー社製)と性能を比較した。両免疫反応試薬の検量線を図7に示す。E2の検出限界はポリクローナル抗体を使用した免疫反応試薬が25.2pg/mLであるのに対し、U−1を使用した免疫反応試薬は22.4pg/mLと、ポリクローナル抗体を使用した免疫反応試薬より高感度な測定系が構築できることが明らかとなった。
【0068】
また、エストロン(E1)およびエストリオール(E3)といった、類似ステロイドへの交差反応性(10ng/mL)を測定したところ、E1の場合(市販のAIA試薬:4.77%、ウサギモノクローナル抗体U−1を用いたAIA試薬:0.92%)、E3の場合(市販のAIA試薬:4.19%、ウサギモノクローナル抗体U−1を用いたAIA試薬:0.28%)、いずれもステロイド類に対する交差反応性が大幅に改善された。
【0069】
次に、40例の実検体を用いて両測定系の相関性を見た結果を図8に示した。回帰係数0.924、y切片−2.387pg/mL、相関係数r=0.998というきわめて高い相関性を示した。
【0070】
実施例12 遺伝子単離時期と単離される遺伝子の割合
ヘテロハイブリドーマは遺伝子が脱落しやすいとの情報はあるが、それがどの程度の時間で消失してしまうかなどの詳細な解析は報告されていなかった。本発明者らも、細胞融合後の培養上清をELISAで評価し、抗体が培養上清に発現していることを確認した後、その細胞から抗体遺伝子の増幅を試みても、抗体遺伝子が増幅できないという問題に直面した。PCRの条件、プライマーの配列などの種々の観点から遺伝子が増幅できない理由を検討した結果、細胞融合後に得られたヘテロハイブリドーマを経代培養する際、通常のマウスモノクローナル抗体を取り扱うのと同じ感覚で取り扱うと、抗体を発現しなくなる時期の特定が難しいことを見出した。通常、細胞を継代培養する際は、細胞懸濁液を約10倍量程度の新しい培地に移して培養を継続するため、はじめの培養上清中は、新しい培地に移すことで希釈されてゆく。つまり、細胞が安定に抗体を発現していない場合は、培養上清が希釈されるため、継代培養後の培養上清のシグナルは激減する。しかし、ウサギモノクローナル抗体の場合はこの理論は当てはまらなかった。ウサギモノクローナル抗体はマウスモノクローナル抗体と比較して、極端に親和性が高く、継代培養により培養上清が10倍あるいは100倍程度希釈されてもELISAでは十分なシグナルが得られるため、すでにヘテロハイブリドーマから抗体遺伝子は脱落し、抗体は発現していないにもかかわらず、ELISAでは陽性判定となってしまう。このことは、実施例10において、本特許で単離したウサギモノクローナル抗体とマウスモノクローナル抗体の結合性の比較を行なった結果、ウサギモノクローナル抗体はマウスモノクローナル抗体より100倍以上低い濃度でも抗原結合能が観察されていることからも裏づけできる。
【0071】
そこで、実施例6において、細胞融合後に抗体遺伝子を単離する時期を変更し、最適な単離時期について検討した。結果を表1に示す。
【0072】
【表1】

細胞融合後8日目で遺伝子を増幅すると、3回の実験の平均で、H鎖遺伝子は86.1%、L鎖遺伝子は94.4%の確率で増幅できた。そして、増幅した遺伝子から発現ベクターを作製しCOS細胞で発現させた抗体を評価したところ、75.0%の抗体は抗原結合能を有していた。また、3回の実験を通じ、安定した増幅率および抗体取得率を示したことから、当該期間で増幅すると抗体結合活性を持ったベクターを安定的に取得できることがわかる。
【0073】
一方、細胞融合後16日目で遺伝子を単離すると、それぞれの数値は、25.0%、88.9%、9.52%と低下した。このことから、単離する時期が遅いと特にH鎖遺伝子で急速な抗体遺伝子の脱落が起きていることがわかる。
【0074】
実施例13 抗トリヨードサイロニン(T3)抗体の単離
抗トリヨードサイロニン(T3)ウサギモノクローナル抗体を以下の方法で単離した。
【0075】
(1)免疫抗原の作製
BSA(Sigma社製)25mgを10mg/mLになるように、ホウ酸バッファー(0.05M、pH8.5)を加え、カルボン酸をメチルエステルとして保護した後、アミノ基からリンカーを伸ばした。次に、前記溶液と、N−ヒドロキシスクシイミドで活性化したT3 7mgをDMSO 100μLに溶解した液とを混合した。室温で30分撹拌後、PBSで透析(500mL×3回)することで、免疫抗原であるT3−BSAを得た。
【0076】
(2)スクリーニング抗原の作製
BCP(Blue Carrier Protein:Pierce社製)を用いて(1)と同様の方法で作製した。BCP 25mgを10mg/mLになるように、ホウ酸バッファー(0.05M、pH8.5)を加えた。前記溶液に、N−ヒドロキシスクシイミドで活性化したT3 7mgをDMSO 100μLに溶解した液とを混合した。室温で30分撹拌後、PBSで透析(500mL×3回)することで、ELISAでのスクリーニング抗原であるT3−BCPを得た。
【0077】
(3)動物と抗原免疫方法
免疫動物はウサギ(日本白色種)の12週齢メスを使用した。初回免疫はフロイント完全アジュバント、2次免疫以降はフロイントの不完全アジュバントを用い、抗原溶液(500μg/mL)と等量のアジュバントを混合後、エマルジョンを作製した後に2週間間隔で免疫した。免疫抗抗原量は、初回1mgで2次免疫以降は500μgである。
【0078】
次に、以下に示すELISAで十分な抗体価の上昇を確認した。
(3−1)T3−BCP(0.5μg/mL)をELISAプレートに固定化後、1%スキムミルクでブロッキングした。
(3−2)ウサギから採血した血清と反応させた。T3に結合した抗T3ウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0079】
(4)抗体産生細胞の増殖(培地での培養)
十分に抗体価が上昇したウサギの脾臓を摘出し、細胞凍結保存液(セルバンカー1(商品名)、日本全薬工業社製)中に分散させた状態で、ディープフリーザー中(−80℃)で保存した。保存細胞は定法に従って解凍し、GIT培地(日水製薬社製)で懸濁し、マイクロタイタープレートにまいた。5日間培養後の培養上清中にある抗T3抗体の性能は下記の3つのELISAにより評価した。
(4−1)反応性:Anti−Rabbit IgG(0.5μg/mL)をELISAプレートに固定化した後、1%スキムミルクでブロッキングした。その後、培養上清とアルカリホスファターゼ標識T3を同時に反応させた。ウサギモノクローナル抗体に未反応の酵素標識T3をB/F分離後、酵素基質である4−メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
(4−2)競合特性:反応性を評価する実験系に、T3(2nM)を共存させる実験を行なった。ここで得られた値(B)を、反応性で得られた値(B0)で割ることで、競合特性(B/B0値)を算出した。
(4−3)競合特性:反応性を評価する実験系に、T4(20nM)を共存させる実験を行なった。ここで得られた値(B)を、反応性で得られた値(B0)で割ることで、特異性(B/B0値)を算出した。
【0080】
以上得られた3つのデータをグラフ化した(図9)。横軸に特異性(B/B0値)を、縦軸に競合特性(B/B0値)を、反応性は円の大きさでプロットした。このグラフの中で、黒丸で塗りつぶしたクローンは、競合性能が高く、特異性も高く、かつ反応性も高いクローンである。
【0081】
(5)抗体遺伝子の単離・増幅と発現ベクターの作製
(4)の結果、図9で黒丸で塗りつぶしたクローンを選別後、選別した次の日に以下の方法で抗体遺伝子の単離を行なった。
(5−1)RNeasy Plus Micro kit(商品名)(QIAGEN社製)を用い、添付されているプロトコルに従って、細胞からのRNAの抽出を行なった。
(5−2)(5−1)で得られたRNAを鋳型とし、Sensiscript RT Kit(商品名)(QIAGEN社製)を用いて逆転写反応を行ない、cDNAを合成した。
(5−3)ウサギ抗体遺伝子に特異的なプライマー(H鎖およびL鎖に特異的なプライマー。配列番号1から3、5から7)を用いPhusion High−Fidelity DNA polymerase(商品名)(第一化学薬品社製)で、抗体遺伝子を増幅させた。条件は以下に示す。なお、H鎖を増幅させる際の二回目のPCRは、一回目のPCR産物(2μL)を鋳型とした他は、一回目のPCRと同じ試薬組成/反応条件で行なっている。
【0082】
(試薬組成)
キットに添付の緩衝液で、dNTP 0.2μM、プライマーはそれぞれ0.5
μMで行なった。
【0083】
(反応条件)
98℃で30秒保持後、98℃で10秒、72℃で50秒のサイクルを35サイ
クル繰り返し、その後72℃で10分間保持した。
【0084】
(プライマー)
H鎖:一回目のPCRでは配列2及び5、二回目のPCRでは配列1及び6
L鎖:配列番号3及び7
(5−4)電気泳動で遺伝子の増幅を確認した。
(5−5)得られたH鎖及びL鎖のPCRフラグメントを、BglIIとXbaIで制限酵素処理した後、動物細胞用発現ベクター(pECEdhfr:図4)のBglII/XbaIサイトに導入し、H鎖、L鎖用の発現ベクターを調製した。
【0085】
(6)遺伝子組み換え抗体の発現(COS細胞による一過性発現)
(5)で得られたH鎖、L鎖用発現ベクターからCOS1細胞(非特許文献17、18)での遺伝子組み換え抗体の生産を行なった。
(6−1)96ウエルプレート上で対数増殖期にあるCOS細胞に、H鎖発現ベクターを16.6ng、及びL鎖発現ベクターを8.3ngを、リポフェクトアミン2000(商品名)(インビトロジェン社)で導入した。遺伝子導入時の培地は、Opti−MEM(商品名)(インビトロジェン社)を使用した。
(6−2)遺伝子導入から3日後に培養上清を回収し、ELISAで抗体の存在を確認した。
(6−3)抗原結合能が確認された抗体遺伝子ペアを有するCOS細胞を、培養スケールを上昇させて培養し、抗体の一過性発現を行なった。
【0086】
(7)AIA試薬形態でのモノクローナル抗体の評価
(6)で作製した、ウサギ由来抗T3モノクローナル抗体(UT1D−5)を用いて、AIA用テストカップを作製した。AIAは東ソー株式会社で販売している全自動免疫診断システムであり、今回作製した抗体を使用してAIA用の免疫反応試薬を作製し評価を行なった。
【0087】
今回単離したウサギモノクローナル抗体UT1D−5を用いた免疫反応試薬、及びマウス由来抗T3モノクローナル抗体を用いた免疫反応試薬の検量線を図10に示した。図10に示すように、今回単離した抗体を用いることで、マウス由来の試薬より高感度な測定系を構築できることが明らかとなった。
【0088】
今回作製したUT1D−5を用いた免疫反応試薬を用いて交差反応性を評価した結果を図11に示す。図11より、今回単離した抗体はT3の類似化合物のサイロキシン(T4)には全く交差反応性を有しておらず、T3に対して非常に高い特異性を有していることがわかる。
【0089】
実施例14 抗脳性ナトリウム利尿ペプチド(BNP)抗体の単離
抗脳性ナトリウム利尿ペプチド(BNP)ウサギモノクローナル抗体を以下の方法で単離した。
【0090】
(1)免疫抗原の作製
BNPのC末端側7アミノ酸に相当するペプチド(CKVLRRH、配列番号12)を合成した。合成したペプチドのN末端にあるシステインを利用して、マレイミド−KLH(PIERCE社製)と反応させ、これを免疫抗原として使用した。反応方法は添付されたプロトコルに従い、ペプチド1mgに対して、マレイミド−KLHを1mg反応させた。
【0091】
(2)スクリーニング抗原の作製
BNPのC末端の7アミノ酸に相当するペプチド(CKVLRRH、配列番号12)のN末端に、リンカー配列(GGGSGGGS、配列番号13)を付加し、さらにN末端をビオチン化したペプチド(biotin−GGGSGGGSCKVLRRH、配列番号14、以降Bio−BNCと表記)を作成し、これをELISAでのスクリーニング抗原として使用した。
【0092】
(3)動物と抗原免疫方法
免疫動物はウサギ(日本白色種)の12週齢メスを使用した。初回免疫はフロイント完全アジュバント、2次免疫以降はフロイントの不完全アジュバントを用い、抗原溶液(500μg/mL)と等量のアジュバントを混合後、エマルジョンを作製した後に2週間間隔で免疫した。免疫抗抗原量は、初回500μgで2次免疫以降は250μgである。
【0093】
次に、以下に示すELISAで、十分な抗体価の上昇を確認した。
(3−1)ストレプトアビジン(0.5μg/mL)をELISAプレートに固定化後、1%スキムミルクでブロッキングした。
(3−2)Bio−BNC(0.5μg/mL)を反応させたELISAプレートを作製した。その後、抗原を免疫したウサギの血清を反応させた。Bio−BNCに結合した抗BNPウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0094】
(4)抗体産生細胞の増殖(培地での培養)
十分に抗体価が上昇したウサギの脾臓を摘出し、細胞凍結保存液(セルバンカー1(商品名)、日本全薬工業社製)中に分散させた状態で、ディープフリーザー中(−80℃)で保存した。保存細胞は定法に従って解凍し、GIT培地(日水製薬社製)で懸濁し、マイクロタイタープレートにまいた。5日間培養後の培養上清中にある抗BNP抗体の性能は下記のELISAにより評価した。
(4−1)ストレプトアビジン(0.5μg/mL)をELISAプレートに固定化後、1%スキムミルクでブロッキングし、その後、Bio−BNC(0.5μg/mL)を反応させたELISAプレートを作製した。
(4−2)培養上清と反応させた。Bio−BNCに結合した抗BNPウサギモノクローナル抗体は、アルカリホスファターゼ標識抗ウサギIgG抗体を結合させ、未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0095】
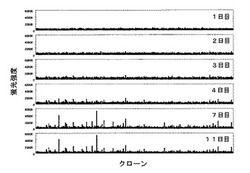
得られた結果を図12に示す。図12の結果よりシグナルが強いクローンを選別し、抗体遺伝子を単離した。
【0096】
(5)抗体遺伝子の単離と発現ベクターの作製
(4)で選別したクローンから以下の方法で抗体遺伝子の単離を行なった。
(5−1)RNeasy Plus Micro kit(商品名)(QIAGEN社製)を用い、添付されているプロトコルに従い、細胞からのRNAの抽出を行なった。
(5−2)得られたRNAを鋳型とし、Sensiscript RT Kit(商品名)(QIAGEN社製)を用い、逆転写反応を行ないcDNAを合成した。
(5−3)ウサギ抗体遺伝子に特異的なプライマー(H鎖およびL鎖に特異的なプライマー。配列番号2、3、6から11参照)を用いPhusion High−Fidelity DNA polymerase(第一化学薬品社製)で、抗体遺伝子を増幅させた。条件は以下に示す。なお、二回目のPCR(反応液量50μL)を行なう際、H鎖を増幅させる場合は、一回目のPCR産物(2μL)を鋳型とした他は、一回目のPCRと同じ試薬組成/反応条件で行なっており、L鎖を増幅させる場合は、一回目のPCR産物をTEで1000倍希釈した液(2μL)を鋳型とした他は、一回目のPCRと同じ試薬組成/反応条件で行なっている。
【0097】
(試薬組成)
キットに添付の緩衝液で、dNTP 0.2μM、プライマーはそれぞれ0.5
μLで行なった。
【0098】
(反応条件)
98℃で30秒保持後、98℃で10秒、72℃で50秒のサイクルを35サイ
クル繰り返し、その後72℃で10分間保持した。
【0099】
(プライマー)
H鎖:一回目のPCRでは配列2及び6、二回目のPCRでは配列8及び9
L鎖:一回目のPCRでは配列3及び7、二回目のPCRでは配列10及び11
(5−4)電気泳動で遺伝子の増幅を確認した。
(5−5)得られたH鎖及びL鎖のPCRフラグメントは、BglII/XbaIで制限酵素処理した後、動物細胞用発現ベクター(pECEdhfr:図4)のBglII/XbaIサイトにInfusion Cloning kit(商品名)(Clontech社製)を用いて導入し、H鎖、L鎖用の発現ベクターを調製した。
【0100】
(6)遺伝子組み換え抗体の発現(COS細胞による一過性発現)
(5)で得られたH鎖、L鎖用発現ベクターからCOS1細胞(非特許文献17、18)での遺伝子組み換え抗体の生産を行なった。
(6−1)96ウエルプレート上で対数増殖期にあるCOS細胞に、H鎖発現ベクターを20ng、及びL鎖発現ベクターを20ngを、リポフェクトアミン2000(商品名)(インビトロジェン社製)で導入した。遺伝子導入時の培地は、Opti−MEM(商品名)(インビトロジェン社製)を使用した。
(6−2)遺伝子導入から3日後に培養上清を回収し、ELISAで抗体の存在を確認した。抗原結合能が確認された2つのクローン(27、45)を取得した。
【0101】
(7)サンドイッチアッセイ系でのモノクローナル抗体の評価
(6)で取得したクローンより得られたウサギ由来抗BNPモノクローナル抗体(27、45)を、以下の方法でELISAにより評価した。
(7−1)抗ウサギ抗体(10μg/mL)を固定化したELISAプレートに、(6)で取得したクローンから抗体を一過性発現させた後の培養上清を反応させ、その後BNP(0.1μg/mL)を反応させた。
(7−2)さらに、アルカリフォスファターゼで標識されたBNPの環状部位を認識する抗体(タンパク質濃度として、A280nm=0.003)を反応させた。
(7−3)未反応の酵素標識抗体をB/F分離後、酵素基質である4―メチルウンベリフェリルリン酸(4−MUP)を分注し、蛍光強度を測定することで検出した。
【0102】
得られた結果を図13に示した。図13の結果より、BNPの有無で、反応性に明確な差が見られたことから、BNPのC末端を認識するウサギモノクローナル抗体が単離されたことが確認できた。
【0103】
実施例15 細胞融合後のELISAのシグナル値の変化
E2−BSAを免疫したウサギ凍結脾臓細胞を使用して以下に示す実験を行なった。
(1)実施例5に示す方法に従い、細胞融合を行ない、マイクロタイタープレートに融合細胞をまいた。
(2)培養1、2、3、4、7、11日目に培養上清を同量とった。なお、培養上清をとる際に、同量の同じ組成の培地を加えることで培地の量を維持している。
(3)得られた培養上清を、実施例2に示すELISAで評価した。
【0104】
結果を図14に示す。細胞融合後1日目から7日目まではシグナル強度が上昇していたが、7日目以降はシグナルの強度にほとんど変化がなかった。以上の結果より、抗体遺伝子を単離する際、細胞融合した後、7日前後培養した培養上清から単離するのが好ましいことがわかる。
【産業上の利用可能性】
【0105】
本発明の製造方法により、親和性が高い特徴を有するウサギモノクローナル抗体を、通常の実験施設と分子生物学の知識があれば製造することができる。また、本発明の方法で製造したウサギモノクローナル抗体を免疫診断薬に用いることで、高感度で夾雑物の影響を受けない測定系を構築できる。
【図面の簡単な説明】
【0106】
【図1】脾臓由来の細胞を培養し、192クローンの培養上清の抗原結合能力を評価した結果。
【図2】末梢血由来のリンパ球を使った細胞融合後の培養上清中の抗体をELISAで評価した結果。
【図3】3840クローンの培養上清のスクリーニングの結果。縦軸は競合特性を、横軸は特異性を、各プロットの大きさは反応性を、それぞれ示す。また、図中の黒丸のプロットで示す抗体は、競合性能が高く、特異性も高く、かつ、反応性も高いクローンであり、当該クローンから、抗体遺伝子を単離した。
【図4】発現ベクターpECEdhfrの構造。図中のSV40PはSV40のプロモーターを、dhfrはジヒドロフォレート・リダクターゼ遺伝子を、polyAはポリアデニレートアタッチメントシグナルを、Ampはアンピシリン耐性遺伝子を、MCSはマルチクローニングサイトを、それぞれ示す。
【図5】マウスモノクローナル抗体、ラットモノクローナル抗体、および本発明で製造したウサギモノクローナル抗体を用いて、競合特性を比較した結果。縦軸は1000pg/mLの濃度のE2を測定した際のB/B0値を、横軸は解離定数を、それぞれ示す。
【図6】各抗体の性能を蛍光偏光解消法で評価した結果。縦軸は偏光度を、横軸は抗体の濃度を、それぞれ示す。抗原として使用した蛍光物質標識E2の偏光度は20とした。図中の黒丸はマウスモノクローナル抗体Ma−1を、白丸はラットモノクローナル抗体Ra−1を、黒四角は本発明で製造したウサギモノクローナル抗体U−1を、それぞれ使用したときの結果である。
【図7】東ソー社製の全自動免疫診断システム用の試薬を作製し、検量線を描いた結果。図中の白丸はポリクローナル抗体を使用した免疫反応試薬(Eテスト「TOSOH」II E2、東ソー社製)を、黒丸は本発明で製造したウサギモノクローナル抗体U−1を使用した免疫反応試薬を、それぞれ使用したときの結果である。
【図8】ポリクローナル抗体を使用した免疫反応試薬(Eテスト「TOSOH」II E2)と、本発明で製造したウサギモノクローナル抗体U−1を使用した免疫反応試薬にて、実検体を測定し相関をとった結果。
【図9】3840クローンの培養上清のスクリーニングの結果。縦軸は競合特性を、横軸は特異性を、各プロットの大きさは反応性を、それぞれ示す。また、図中の黒丸のプロットで示す抗体は、競合性能が高く、特異性も高く、かつ反応性も高いクローンであり、当該クローンから、抗体遺伝子を単離した。
【図10】東ソー社製の全自動免疫診断システム用の試薬を作製し、検量線を描いた結果。図中の黒丸は本発明で製造したウサギモノクローナル抗体UT1D−5を用いた免疫反応試薬を、白四角はマウスモノクロナール抗体を用いた免疫反応試薬を、それぞれ使用したときの結果である。
【図11】交差反応性を評価した結果。横軸にT3またはT4の濃度を示し,縦軸はB/B0値を示す。
【図12】3840クローンの培養上清のスクリーニングの結果。縦軸は蛍光強度を示し横軸はクローンを示す。
【図13】一過性発現で得られた抗BNP抗体(C末端認識)とBNPの環状部位を認識する抗体によるBNPのサンドイッチアッセイ結果。
【図14】細胞融合後の培養上清中の抗体量の推移をELISAで評価した結果。
【特許請求の範囲】
【請求項1】
抗原を免疫したウサギから抗体産生細胞を単離し、目的とする抗体遺伝子を保有する細胞を選別し、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離、増幅し、発現ベクターに導入後、ホスト細胞に導入することで遺伝子組換えウサギモノクローナル抗体を発現させる遺伝子組換え抗体の製造方法において、目的とする抗体遺伝子を保有する細胞を選別するにあたり、抗体産生細胞を増殖させてから選別することを特徴とする、遺伝子組換え抗体の製造方法。
【請求項2】
選別した細胞から重鎖および軽鎖の抗体遺伝子を単離する操作を、選別した細胞から抗体遺伝子の脱落が起きない期間内で実施することを特徴とする、請求項1に記載の遺伝子組換え抗体の製造方法。
【請求項3】
選別した細胞から重鎖および軽鎖の抗体遺伝子を単離する操作を、抗体産生細胞増殖開始後14日以内に実施することを特徴とする、請求項1に記載の遺伝子組換え抗体の製造方法。
【請求項4】
抗体産生細胞が、抗原を免疫したウサギの脾臓細胞、リンパ節細胞、末梢血細胞のいずれかであることを特徴とする、請求項1から3に記載の遺伝子組換え抗体の製造方法。
【請求項5】
抗体産生細胞を増殖させる方法が、抗体産生細胞を培地中で培養する方法であることを特徴とする、請求項1から4に記載の遺伝子組換え抗体の製造方法。
【請求項6】
抗体産生細胞を増殖させる方法が、不死化能を与えることのできる細胞を融合させて培養する方法であることを特徴とする、請求項1から4に記載の遺伝子組換え抗体の製造方法。
【請求項7】
ウサギに免疫する抗原が、ハプテンまたはペプチドであることを特徴とする、請求項1から6に記載の遺伝子組換え抗体の製造方法。
【請求項8】
ホスト細胞が動物細胞であることを特徴とする、請求項1から7に記載の遺伝子組換え抗体の製造方法。
【請求項1】
抗原を免疫したウサギから抗体産生細胞を単離し、目的とする抗体遺伝子を保有する細胞を選別し、選別した細胞から重鎖および軽鎖の抗体遺伝子を単離、増幅し、発現ベクターに導入後、ホスト細胞に導入することで遺伝子組換えウサギモノクローナル抗体を発現させる遺伝子組換え抗体の製造方法において、目的とする抗体遺伝子を保有する細胞を選別するにあたり、抗体産生細胞を増殖させてから選別することを特徴とする、遺伝子組換え抗体の製造方法。
【請求項2】
選別した細胞から重鎖および軽鎖の抗体遺伝子を単離する操作を、選別した細胞から抗体遺伝子の脱落が起きない期間内で実施することを特徴とする、請求項1に記載の遺伝子組換え抗体の製造方法。
【請求項3】
選別した細胞から重鎖および軽鎖の抗体遺伝子を単離する操作を、抗体産生細胞増殖開始後14日以内に実施することを特徴とする、請求項1に記載の遺伝子組換え抗体の製造方法。
【請求項4】
抗体産生細胞が、抗原を免疫したウサギの脾臓細胞、リンパ節細胞、末梢血細胞のいずれかであることを特徴とする、請求項1から3に記載の遺伝子組換え抗体の製造方法。
【請求項5】
抗体産生細胞を増殖させる方法が、抗体産生細胞を培地中で培養する方法であることを特徴とする、請求項1から4に記載の遺伝子組換え抗体の製造方法。
【請求項6】
抗体産生細胞を増殖させる方法が、不死化能を与えることのできる細胞を融合させて培養する方法であることを特徴とする、請求項1から4に記載の遺伝子組換え抗体の製造方法。
【請求項7】
ウサギに免疫する抗原が、ハプテンまたはペプチドであることを特徴とする、請求項1から6に記載の遺伝子組換え抗体の製造方法。
【請求項8】
ホスト細胞が動物細胞であることを特徴とする、請求項1から7に記載の遺伝子組換え抗体の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2009−240300(P2009−240300A)
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願番号】特願2008−306713(P2008−306713)
【出願日】平成20年12月1日(2008.12.1)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願日】平成20年12月1日(2008.12.1)
【出願人】(000003300)東ソー株式会社 (1,901)
【Fターム(参考)】
[ Back to top ]

