還元性物質を用いるタンパク質又はペプチドのジスルフィドマッピング法
【課題】 質量分析において、タンパク質又はペプチドのジスルフィド結合の数及び位置の決定を迅速且つ容易に行うことができる方法を提供する。
【解決手段】 MSの2乗以上が可能なLI質量分析装置により、ジスルフィド結合に対して還元性を示す物質を用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て;イオンAとイオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し;イオンAとイオンBとをそれぞれプリカーサーイオンとして選択してMSnを行い、イオンAからプロダクトイオンaを、イオンBからプロダクトイオンbを得て;プロダクトイオンaからアミノ酸配列情報を得て;プロダクトイオンaとプロダクトイオンbとの質量数差を求めることによって、ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【解決手段】 MSの2乗以上が可能なLI質量分析装置により、ジスルフィド結合に対して還元性を示す物質を用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て;イオンAとイオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し;イオンAとイオンBとをそれぞれプリカーサーイオンとして選択してMSnを行い、イオンAからプロダクトイオンaを、イオンBからプロダクトイオンbを得て;プロダクトイオンaからアミノ酸配列情報を得て;プロダクトイオンaとプロダクトイオンbとの質量数差を求めることによって、ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、プロテオミクスに関し、より詳しくは、MSの2乗以上の分析が可能な質量分析装置を用いたタンパク質又はペプチドのジスルフィドマッピング法(すなわちタンパク質又はペプチド中のジスルフィド結合の数及び位置を決定する方法)に関する。
【背景技術】
【0002】
従来、ジスルフィド結合を持つタンパク質又はペプチドについて、質量分析装置を用いたジスルフィドマッピングを行う場合、質量分析装置による計測を行う前に前処理が必要であった。
【0003】
例えば、従来のジスルフィドマッピング法の例として、以下のような手順を踏む手法が挙げられる。
まず、精製されたタンパク質又はペプチドをトリプシンなどを用いてジスルフィド結合が維持される条件下(例えばpH 7)で酵素消化する。続いて、得られた消化断片を、高速液体クロマトグラフィー(HPLC)で分離し、質量分析計で計測する。
【0004】
計測結果から、システインを含む2つのペプチドの質量を合計した理論値、すなわち2つのペプチドがジスルフィド結合で架橋されていると想定して算出した理論値、と一致するペプチド断片を確認する。
【0005】
これらの確認されたペプチド断片を、ジスルフィド結合の交換が起こらないよう低pH下(例えばpH 4.5〜5.5)で、鎖間ジスルフィド結合からシステイン残基を遊離させ、遊離したシステイン残基に対して、4-vinilpyridine(4-VP)を用いてS-ピリジルエチル化を行い、S-ピリジルエチル化ペプチドを得る。
【0006】
その後、S-ピリジルエチル化ペプチドを適当な条件下でジチオスレイトール(DTT)などを用いて鎖内ジスルフィド結合を還元し、還元部位をS-カルボメチル化などにより保護し、還元アルキル化ペプチド断片を得る。
【0007】
得られた還元アルキル化ペプチド断片を、質量分析装置で計測する。質量分析により得られたアミノ酸配列情報から、ペプチド断片のシステイン残基の位置を確認し、ジスルフィド結合を特定する。
【0008】
また、従来のジスルフィドマッピング法の他の例として、以下のような手法もある。 タンパク質を、過剰の2-ニトロ-5-シアノ安息香酸(NTCB)を用いて室温でアルカリ条件下15分間反応させることによりシアニル化し、1 M水酸化アンモニウムを加えて1時間インキュベートすることによりシステイン部位で切断する。
【0009】
その後、トリス(2-カルボキシエチル)ホスフィン(TCEP)のような還元剤を5〜10倍量加えて、37℃、30分で還元反応を行う。得られた還元断片を質量分析装置で計測し、これらの断片のアミノ酸配列情報を得ると共に、遊離のチオール基を持つシステイン残基を同定する。
【0010】
一方で、タンパク質を、まずTCEPを用いて37℃、30分間で還元し、還元されたタンパク質を、NTCBを用いてシステイン部位で切断する。得られた断片を質量分析装置で計測し、これらの断片のアミノ酸配列情報を得ると共に、全てのシステイン残基を同定する。
【0011】
シアニル化したタンパク質を断片化し、その後還元した前者の分析結果と、シアニル化していないタンパク質を還元し、その後断片化した後者の分析結果とを比較することで、ジスルフィド結合の数と位置を決定する。
【0012】
このように従来から行われてきたジスルフィドマッピング法に関しては、例えば、Wu, J., Gage, D.A., Watson, J.T., Anal.Biochem., vol. 235, p. 161-174 (1996)、Wu, J., Watson, J.T., Anal. Biochem., vol. 258, p. 268-276 (1998)、及び、Christoph Spiess, H. Peter Happersberger, Michael O. Glocker, Eberhard Spiess, Karsten Rippe, and Michael Ehrmann., J.Biol.Chem., vol. 272, p. 22125-22133 (1997)に詳細に記載されている。
【0013】
【非特許文献1】ウー・J(Wu, J.)、ゲイジ・D・A(Gage, D.A.)、及びワトソン・J・T(Watson, J.T.)、「アナリティカル・バイオケミストリー(ANALYTICAL BIOCHEMISTRY)」、1996年、第235巻、p.161−174
【非特許文献2】ウー・J(Wu, J.)、ゲイジ・D・A(Gage, D.A.)、及びワトソン・J・T(Watson, J.T.)、「アナリティカル・バイオケミストリー(ANALYTICAL BIOCHEMISTRY)」、1998年、第258巻、p.268−276
【非特許文献3】クリストフ・スピース(Christoph Spiess)、H・ピーター・ハッパスベーガー(H. Peter Happersberger)・ミヒャエル・O・グロッカー(Michael O. Glocker)、エベラール・スピース(Eberhard Spiess)、カーステン・リペ(Karsten Rippe)、及びミヒャエル・アーマン(Michael Ehrmann)、「ザ・ジャーナル・オブ・バイオロジカル・ケミストリー(The Journal of Biological Chemistry)」、1997年、第272巻、p.22125−22133
【発明の開示】
【発明が解決しようとする課題】
【0014】
上に述べた従来のジスルフィドマッピング法は、以下の点で不都合である。
・前処理に手間と時間がかかる。
・タンパク質について、還元前及び還元後(すなわちジスルフィド結合が有る場合及び無い場合)の分析結果を比較するため、2種類の試料を用意する必要がある。
・試料分子の他の部位に影響を与えないように、ジスルフィド結合のみを還元し保護することが要求されるため、pHなどの反応条件の制約が厳しい。
・前処理において用いられる過剰の試薬が除去されきれないため、残留試薬の質量分析に対する影響が危惧される。
【0015】
そこで本発明の目的は、質量分析において、タンパク質又はペプチドのジスルフィド結合の数及び位置の決定を迅速且つ容易に行うことができる方法を提供することにある。
【課題を解決するための手段】
【0016】
本発明者は、LI質量分析装置により、ジスルフィド結合に対して還元性を示す物質を用いることによって、上記本発明の目的が達成されることを見出し、本発明を完成するに至った。
【0017】
本発明は、以下の<1>〜<8>の発明を含む。
<1>
(i)MSの2乗以上が可能なLI(レーザーイオン化)質量分析装置により、ジスルフィド結合に対して還元性を示す物質を用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て、
(ii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し、
(iii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行い、前記分子量関連イオンAから複数のプロダクトイオンaを、前記分子量関連イオンBから複数のプロダクトイオンbを得て、
(iv)前記複数のプロダクトイオンaから前記タンパク質又はペプチドのアミノ酸配列情報を得て、
(v)前記複数のプロダクトイオンaの各々の質量数と、前記各々のプロダクトイオンaと同じ配列であり且つ同じ系列のプロダクトイオンbの質量数との差を求めることによって、前記タンパク質又はペプチドにおける前記ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【0018】
前記<1>においては、分子量関連イオンAは、還元性を示す物質によって還元されたことによって生成し、分子量関連イオンBは、還元性を示す物質によって還元されなかったことによって生成する。
【0019】
<2>
前記LI質量分析装置が、MALDI(マトリックス支援レーザー脱離イオン化型)質量分析装置である、<1>に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0020】
<3>
前記ジスルフィド結合に対して還元性を示す物質が、ジスルフィド結合に対して還元性を示すマトリックスである、<2>に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0021】
<4>
(i)MSの2乗以上が可能なMALDI質量分析装置により、ジスルフィド結合に対して還元性を示す物質、及び、前記物質が示す還元性より強い還元性を示さないマトリックスを用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て、
(ii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し、
(iii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行い、前記分子量関連イオンAから複数のプロダクトイオンaを、前記分子量関連イオンBから複数のプロダクトイオンbを得て、
(iv)前記複数のプロダクトイオンaから前記タンパク質又はペプチドのアミノ酸配列情報を得て、
(v)前記複数のプロダクトイオンaの各々の質量数と、前記各々のプロダクトイオンaと同じ配列であり且つ同じ系列のプロダクトイオンbの質量数との差を求めることによって、前記タンパク質又はペプチドにおける前記ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【0022】
上記<4>においては、分子量関連イオンAは、還元性を示す物質によって還元されたことによって生成し、分子量関連イオンBは、還元性を示す物質によって還元されなかったことによって生成する。
【0023】
<5>
前記ジスルフィド結合に対して還元性を示す物質が、ジスルフィド結合に対して還元性を示すマトリックスである、<4>に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0024】
<6>
前記ジスルフィド結合に対して還元性を示す物質が、ジアミノナフタレンの位置異性体から選ばれる、<1>〜<5>のいずれかに記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0025】
上記<6>に記載のジアミノナフタレンは、MALDI法において、マトリックスとしての性質とともに還元性を有する物質、すなわち還元性を示すマトリックスとして使用されることがある。また、上記<6>に記載のジアミノナフタレンは、マトリックスを用いないLI法において、気相中で還元性を示す物質として使用されることがある。
【0026】
<7>
前記ジスルフィド結合に対して還元性を示す物質が、1,5−ジアミノナフタレン、2,3−ジアミノナフタレン、及び1,8−ジアミノナフタレンからなる群から選ばれる、<1>〜<6>のいずれかに記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0027】
<8>
前記MALDI質量分析装置が、MALDI−QIT−TOF(マトリックス支援レーザー脱離イオン化四重極イオントラップ飛行時間型)質量分析装置である、<2>〜<7>のいずれかに記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0028】
<9>
前記タンパク質又はペプチドのアミノ酸配列情報を、de novo Sequencingの自動解析を行うことによって得る、<1>〜<8>のいずれかに記載のタンパク質又はペプチドのジスルフィドマッピング法。
【発明の効果】
【0029】
本発明によると、質量分析において、タンパク質又はペプチドのジスルフィド結合の数及び位置の決定を迅速且つ容易に行うことができる方法を提供することができる。
【発明を実施するための最良の形態】
【0030】
本発明においては、ジスルフィド結合に対して還元性を示す物質を用い、MSの2乗以上が可能なLI質量分析装置によって、タンパク質又はペプチドの質量分析を行い、ジスルフィドマッピングを行う。
【0031】
本明細書においては、質量分析装置によって行われる分析において、測定試料の1回目の分析をMSとし、MSにおいて得られたスペクトルのイオンピークから特定のイオンを選択し、選択された特定のイオンをプリカーサイオンとして2回目の分析を行うことをMS/MS又はMS2と表記する。同様に、MSn-1において得られたスペクトルのイオンピークから特定のイオンを選択し、選択された特定のイオンをプリカーサイオンとしてn回目の分析を行うことをMSnと表記し、MSのn乗と呼称する。
【0032】
本発明では、LI(レーザーイオン化)質量分析装置が用いられる。LI法は、固相または液相の試料に対しては、適切な波長のレーザー光を照射して試料を気相中に脱離した後イオン化し(レーザー脱離イオン化;LDI)、気相の試料に対しては、気相の状態を保ったままで適切な波長のレーザー光を照射して、試料をイオン化する方法である。気相試料のLIには、LS(レーザースプレー;液体を噴霧させ、赤外レーザーを照射して、試料を気相中でイオン化する方法)などがある。固相または液相試料のLIには、LDI(レーザー脱離イオン化)質量分析装置などがある。
【0033】
LDI法は、レーザー光を吸収する固体又は液体に試料を混合または搭載し、適切なレーザー光を照射し、気相中に試料をイオン化する方法である。ここで、レーザー光を吸収する固体または液体が試料そのものである場合もある。LDIには、MALDI(マトリックス支援レーザー脱離イオン化)やSELDI(表面増強レーザー脱離イオン化)、DIOS (desorption/ionization on silicon)などがある。
【0034】
MALDI質量分析装置としては、MALDI−QIT−TOF(マトリックス支援レーザー脱離イオン化四重極イオントラップ型飛行時間型)質量分析装置が好ましい。MALDI−QIT−TOF質量分析装置としては、島津製作所AXIMA−QITなどが挙げられる。
【0035】
本発明のジスルフィドマッピング法は、以下の工程を含む。
(i)タンパク質又はペプチドのMSを行う。
(ii)MSの結果から、ジスルフィド結合の数を推定する。
(iii)MSnを行う。
(iv)MSnの結果から、タンパク質又はペプチドのアミノ酸配列情報を得る。
(v)MSnの結果から、ジスルフィド結合の位置を推定する。
なお、これらの工程は、上記の順番に限定されるものではない。以下、これらの工程について詳しく説明する。
【0036】
(i)MS
本工程では、ジスルフィド結合に対して還元性を示す物質を用いて、タンパク質又はペプチドのMSを行う。本工程によって、ジスルフィド結合が還元された分子量関連イオンAと、ジスルフィド結合が還元されていない分子量関連イオンBとを得る。
【0037】
本発明における、ジスルフィド結合に対して還元性を示す物質としては、質量分析に用いるレーザーの波長を吸収し、ジスルフィド結合を還元的に開裂する能力を有するものであれば特に限定されない。ジスルフィド結合に対して還元性を示す物質の一例として、本発明の条件下で、タンパク質試料又はペプチド試料中のジスルフィド結合の、例えば20%以上、好ましくは50%以上を還元的に開裂させる能力を有する物質が挙げられる。
【0038】
ジスルフィド結合に対して還元性を示す物質は、1種又は複数種を組み合わせて用いることができる。そして、ジスルフィド結合に対して還元性を示す物質は、このような還元性の強さを考慮して適宜用いることができる。ジスルフィド結合に対して還元性を示す物質の中でも比較的還元性が強くないものを用いれば、ジスルフィド結合が還元されていない分子量関連イオンBが相対的に多く得られる。
【0039】
具体的には、ジスルフィド結合に対して還元性を示す物質の構造としては、質量分析に用いるレーザーの波長に吸収帯を有する分子骨格と、ジスルフィド結合を還元的に開裂させることができる官能基とを有するものであれば特に限定されない。例えば、ジアミノナフタレン類が挙げられる。ここでいうジアミノナフタレン類には、ジアミノナフタレンの存在しうる位置異性体が全て含まれる。この中でも、1,5−ジアミノナフタレン(1,5−DAN;下記式(I))、1,8−ジアミノナフタレン(1,8−DAN;下記式(II))、2,3−ジアミノナフタレン(2,3−DAN;下記式(III))が特に好ましく用いられる。
【0040】
【化1】

【0041】
【化2】

【0042】
【化3】

【0043】
これら位置異性体は、測定試料に応じて適宜使い分けることができる。この中では、1,5−DANは、もっとも強いS/N比を示し、2,3−DANは、もっとも強い還元性を持つ。従って、これら位置異性体は、このように感度や還元性などの各々の能力を考慮しながら、適宜使い分けると良い。
【0044】
本発明の還元性を示す物質は、気相中で還元するために用いることができる。よって、DIOS(desorption/ionization on silicon)などマトリックスを用いないLIにおける還元に使用することもできる。例えば、ジアミノナフタレンは気相にて還元作用を示す。さらにジアミノナフタレンは、後述するように、マトリックスとしても働くため、還元性を示すマトリックスとしてMALDI質量分析装置にて用いることができる。
【0045】
ジスルフィド結合に対して還元性を示す物質は、上記の強さの還元性を損なわない程度の十分な量で用いると良い。
【0046】
MSでは、主に分子量関連イオンが得られる。ここで分子量関連イオンとは、分子量情報の獲得に直接役立つイオン種をいう。ジスルフィド結合に対して還元性を示す物質によって、タンパク質又はペプチドから、分子量関連イオンをジスルフィド結合が還元的に開裂された状態で生じさせることができる。また、このようにジスルフィド結合が還元された分子量関連イオンAとともに、ジスルフィド結合が還元されなかった分子量関連イオンBも生成する。
【0047】
また、タンパク質又はペプチドがジスルフィド結合をm個有している場合は、分子量関連イオンAとして、ジスルフィド結合が1個還元された分子量関連イオンA1、ジスルフィド結合が2個還元された分子量関連イオンA2、・・・ジスルフィド結合がm個還元された分子量関連イオンAmが得られる。
【0048】
以下に、本発明においてMALDI質量分析装置を用いる場合を挙げて、ジスルフィド結合を有する物質、及び測定試料をMALDI質量分析装置に導入する手順について説明する。
【0049】
本発明においてMALDI質量分析装置を用いる場合、タンパク質試料又はペプチド試料は、ジスルフィド結合に対して還元性を示す物質と混合され、MALDI測定用試料混合物に調製される。この測定用試料混合物は、MALDI質量分析装置を用いる一般の測定用試料混合物と同様に、マトリックス物質を含んでいる。従って本発明では、測定用試料混合物中の還元性を示す物質として、ジスルフィド結合を還元する働きとともにマトリックスとしての働きを有する物質(すなわち、還元性を示すマトリックス)が用いられることがある。この場合は、還元性を示すマトリックスを単独で用いても良いし、そのような強い還元性を示さないマトリックス(例えば従来から用いられてきたマトリックスなど)とともに用いても良い。さらに、前記の還元性を示す物質として、ジスルフィド結合に作用する働きを有するがマトリックスとしての働きは有しない物質を選択し、このような物質を、前記の強い還元性を示さないマトリックスとともに用いても良い。
【0050】
測定用試料混合物において、還元性を示すマトリックス、強い還元性を示さないマトリックス、還元性を示し且つマトリックスでない物質は、それぞれ1種又は複数種を選択して用いることができる。すなわち、タンパク質試料又はペプチド試料と混合させる物質の還元性の強弱やマトリックスの有無などを考慮することによって、測定用試料混合物に含まれる物質の種類と数とを制限なく組み合わせることができる。
【0051】
例えば、測定用試料混合物としては、以下の混合物などが挙げられる。
タンパク質試料又はペプチド試料と、ジスルフィド結合に対して還元性を示すマトリックスとの混合物;タンパク質試料又はペプチド試料と、還元性を示すマトリックスと、強い還元性を示さないマトリックスとの混合物;又は、タンパク質試料又はペプチド試料と、還元性を示し且つマトリックスでない物質と、強い還元性を示さないマトリックスとの混合物など。
【0052】
なお、「強い還元性を示さないマトリックス」としては、「還元性を示す物質」が有する還元性よりも強い還元性を有しないマトリックスであれば特に限定されない。強い還元性を示さないマトリックスの例としては、タンパク質試料又はペプチド試料中のジスルフィド結合を全く還元する能力を有しないものや、還元する能力があっても、本発明の条件下で、タンパク質試料又はペプチド試料中のジスルフィド結合の、例えば50%未満、好ましくは20%未満、より好ましくはせいぜい5%を還元することができる程度のものが挙げられる。
【0053】
強い還元性を示さないマトリックスは、イオン化能力に優れたもの(例えば従来から用いられてきたマトリックスなど)から選択することができる。強い還元性を示さないマトリックスを用いることによって、より効率的にイオン化を行うことが可能になる。
【0054】
本発明においてMALDI質量分析装置を用いる場合、ジスルフィド結合に対しての還元性を示す物質としては、MALDI質量分析に用いられるレーザーの波長に吸収帯を有する分子骨格と、ジスルフィド結合を還元的に開裂する能力を有する官能基とを有するものが挙げられる。すでに挙げたジアミノナフタレン類は、マトリックスとしての働きを有するため、還元性を示す物質として還元性を示すマトリックスを用いる場合に、このようなジアミノナフタレン類が特に有用に用いられる。
【0055】
還元性を示すマトリックスを単独で用いる場合、MALDI質量分析においてマトリックスとして用いるという目的において通常用いられる量を、当業者が適宜決定すれば良い。すなわち、測定試料に対してマトリックスが過剰量となるような適当な濃度、例えば1mg/ml〜飽和濃度の溶液として用いると良い。溶媒としては、有機溶媒水溶液、トリフルオロ酢酸(TFA)水溶液、有機溶媒−TFA水溶液などを用いることができる。有機溶媒としては、アセトニトリル、エタノール、メタノールなどを用いることができる。
【0056】
測定試料をMALDI質量分析装置に導入する手順としては特に限定されない。例えば、還元性を示すマトリックスを単独で用いる場合、以下のような方法が挙げられる。
すなわち、MALDI質量分析用のプレートに、測定試料の溶液とマトリックスの溶液とを、同一の位置に微量滴下し、乾燥させる。測定試料の溶液は、測定試料のタンパク質又はペプチドを、TFA水溶液に適当な濃度で溶解することによって調製すると良い。マトリックスの溶液は、上記の溶媒に、上記の濃度で溶解することによって調製すると良い。滴下する量としては、特に限定されず、当業者が適宜決定すればよい。例えば、試料にして数fmol〜数pmol程度となるような量とすることができる。
【0057】
乾燥させたプレートは、MALDI質量分析装置内に導入される。プレート上の試料とマトリックスとの混合結晶にレーザー光が照射されると、そのレーザー波長を吸収してマトリックスが励起し、そのとき試料も同時にイオン化される。すなわち、マトリックスは、質量分析装置のレーザー波長を吸収して励起する際に、マトリックスとともにプレート上に搭載された試料を同時にイオン化する働きをする。マトリックスと共にイオン化した試料は、電位差によりイオン源を飛び出し、高真空である分離部を飛行し、質量による飛行速度の違いによって分離される。その後、検出器においてそれぞれのイオンの質量値を示すイオンピークとして検出される。
【0058】
MALDI質量分析装置を用いた場合は、ジスルフィド結合に対して還元性を示す物質(すなわち還元性を示すマトリックスや還元性を示し且つマトリックスでない物質)によって、タンパク質又はペプチドから、分子量関連イオンをジスルフィド結合が還元的に開裂された状態で生じさせることができる。また、ジスルフィド結合に対して還元性を示す物質によって、このようにジスルフィド結合が還元された分子量関連イオンとともに、ジスルフィド結合が還元されなかった分子量関連イオンも生成する。
【0059】
MALDI質量分析装置以外のLI質量分析装置により質量分析測定を行う場合は、ジスルフィド結合に対して還元性を示す物質を用いて試料を調製すること以外は、それぞれの分析装置にて通常用いられる手順に従って、試料調製及び分析を行うことができる。
【0060】
このようにMALDI質量分析装置をはじめ、LI質量分析装置により質量分析測定にかけられた測定試料は、ジスルフィド結合が還元的開裂された状態で検出することができる。従って本発明の方法では、ジスルフィド結合の開裂のために従来必ず行われてきたような、煩雑な前処理を行う必要がない。すなわち、そのような前処理に必要とされていた時間、手間、試薬類、より具体的には、pHなどの反応条件の調整、チオール基の保護、試薬等の塩類の除去等という作業が不要になる。そして、そのような前処理によって危惧されていた残留試薬のスペクトルへの影響もなくなる。
【0061】
このように、本発明の方法を用いると、ジスルフィド結合の還元反応を、迅速且つ容易に行うことが可能になる。MALDI質量分析装置を用いた場合は、ジスルフィド結合の還元反応を、オンターゲットで、すなわちMALDIプレート上で行うことが可能になるため、迅速且つ容易な処理が可能になる。
【0062】
(ii)ジスルフィド結合の数の推定
従来法において、還元性を持つ物質を
用いない場合や、強い還元性を持たないマトリックスのみを用いた場合に得られるMSスペクトルにおいては、測定試料がジスルフィド結合を有する場合も、分子量関連イオンのピークは、通常[M+H]+(ポジティブモードでの測定の場合でプロトン付加分子として検出された場合(金属イオン付加分子として検出される場合もある。))又は[M−H]−(ネガティブモードでの測定の場合)として帰属される。すなわち、分子量関連イオンはジスルフィド結合を維持した状態のものとして得られる。
【0063】
一方、本発明のようにジスルフィド結合に対して還元性を持つ物質を用いて得られるMSスペクトルにおいて、ジスルフィド結合が還元された分子量関連イオンについては、分子量関連イオンのピークを、理論上、[M+2m+H]+(ポジティブモードでの測定の場合でプロトン付加分子として検出された場合(金属イオン付加分子として検出される場合もある。))又は[M+2m−H]−(ネガティブモードでの測定の場合)として帰属する。従来のマトリックスを用いた場合と比べて質量数が2mDa大きいとするのは、ジスルフィド結合(−S−S−)が還元的に開裂を受けることによって、1個のジスルフィド結合につき2個のチオール基(−SH,HS−)へと変換されて質量が2Da大きくなるためである。
【0064】
従って、測定試料がジスルフィド結合を1個有するものである場合、MSスペクトルにおけるジスルフィド結合が還元された分子量関連イオンのピークは、[M+2+H]+(プロトン付加分子の場合)又は[M+2−H]−として帰属する。同様に、測定試料がジスルフィド結合を2個有するものである場合は、MSスペクトルにおけるジスルフィド結合が還元された分子量関連イオンのピークは、[M+4+H]+(プロトン付加分子の場合)又は[M+4−H]−として、測定試料がジスルフィド結合を3個有するものである場合は、MSスペクトルにおけるジスルフィド結合が還元された分子量関連イオンのピークは、[M+6+H]+(プロトン付加分子の場合)又は[M+6−H]−として帰属する。
【0065】
測定試料のタンパク質又はペプチドが有するジスルフィド結合の数が未知である場合、以下のようにしてジスルフィド結合の数を決定する。
ジスルフィド結合の数をm個として仮定する。そして、上述の工程(i)によって、ジスルフィド結合が還元された分子量関連イオンAと、ジスルフィド結合が維持された分子量関連イオンBとを得る。
【0066】
次に、分子量関連イオンAの質量数MAと、分子量関連イオンBの質量数MBとの差(MA−MB)を求める。
ジスルフィド結合の数m(個)に対して、双方の分子量関連イオンの差が2m(Da)で表される、すなわち、2m=MA−MBという関係に基づき、実際に求められた差(MA−MB)からジスルフィド結合の数mを算出する。
【0067】
例えば、双方の分子量関連イオンの差が2であれば、測定試料のタンパク質又はペプチドが有するジスルフィド結合の数は1個であると決定することができる。同様に、当該差が4であればジスルフィド結合の数は2個、当該差が6であればジスルフィド結合の数は3個であると決定することができる。また、双方の分子量関連イオンの差がなければ、測定試料のタンパク質又はペプチドはジスルフィド結合を有しないと決定することができる。このように、ジスルフィド結合の有無及び数を確認することが可能になる。
【0068】
(iii)MSn
本工程では、分子量関連イオンAと分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行う。前記工程(i)で、ジスルフィド結合をm個有するタンパク質又はペプチドから、複数の分子量関連イオンA(分子量関連イオンA1、A2・・・Am)が得られた場合は、それぞれの分子量関連イオンをプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行うことができる。
【0069】
本工程により、分子量関連イオンAから、複数のプロダクトイオンa(プロダクトイオンa群)を、分子量関連イオンBから、複数のプロダクトイオンb(プロダクトイオンb群)を得る。
【0070】
(iv)アミノ酸配列情報の取得
本工程では、MSnの結果から、ジスルフィド結合が還元されたタンパク質又はペプチドのアミノ酸配列情報を得る。このときに関わるプロダクトイオンaについて、以下に説明する。
【0071】
従来法において、還元性を示す物質を用いない場合や、強い還元性を示さないマトリックスを用いた場合は、プリカーサイオンがジスルフィド結合を有するため、MS/MSで得られるプロダクトイオンは、さまざまな種類のプロダクトイオン種が入り混じる。このようなプロダクトイオン種としては、例えば、ジスルフィド結合を維持したもの、ジスルフィド結合に由来し且つシステイン残基のチオール基「−SH」のHが外れた「−S」に相当する基を生成するフラグメンテーションが起こったもの、ジスルフィド結合に由来し且つシステイン残基のチオール基に相当する「−SH」を生成するフラグメンテーションが起こったものなどが含まれる。さらに、ジスルフィド結合を維持した内部断片なども相対的に多く検出され得る。
【0072】
このような多種類のプロダクトイオンのピークが混在した複雑なスペクトルは、その解析が非常に困難である。例えば、de novo Sequencing(すなわち数学的演算によりアミノ酸配列を算出する方法)による自動解析を試みたとしても、配列のほとんどを解析することができない。これは、自動解析に用いられるソフトウェアが、通常はジスルフィド結合が維持されている条件に対応していないことが原因に挙げられる。このようなソフトウェアによる計算は、ジスルフィド結合を持たない状態か、或いはジスルフィド結合が還元されてカルボアミドメチル化などの修飾を受けた状態としてのみ行われると考えられるため、誤った配列情報を与えてしまう。
【0073】
マニュアルでde novo Sequencingを行う場合は、プロダクトイオンの構造、すなわちジスルフィド結合の有無やジスルフィド結合に由来する官能基(あるいは基)を考慮しながら、一つ一つのプロダクトイオンピークに関して質量の理論値を計算する必要があり、大変な手間がかかる上に困難を極める。しかも、得られたプロダクトイオンの多くは解析できない結果に終わってしまう。
【0074】
一方、本発明で還元性を示す物質を用いた場合は、プリカーサイオンがジスルフィド結合を有しないため、プロダクトイオンaとしては、通常の規則性を持ったフラグメンテーションにより生じるイオン(x−、y−、z−系列、a−、b−、c−系列及びそれに関連するプロダクトイオン)が得られる。すなわち、質量分析の前処理としてジスルフィド結合の還元・アルキル化を行った測定試料を解析するときと同様に、シンプルなスペクトルが得られる。従って、アミノ酸残基の質量のみを考慮するだけの、容易な解析が可能となる。
【0075】
ここで、ペプチド内の1箇所でフラグメンテーションが起こった結果、N末端側のフラグメントに電荷が保持される場合、そのプロダクトイオンは、a−、b−、c−系列イオンとして分類される。また、C末端側のフラグメントに電荷が保持される場合、そのプロダクトイオンは、x−、y−、z−系列として分類される。そして、下記式に例示されているように、これらのプロダクトイオンは、ペプチドのアミノ酸残基の番号を付して表記する。
【0076】
【化4】

【0077】
具体的には、自動又はマニュアルによるde novoSequencingによりジスルフィド結合が還元されたタンパク質又はペプチドのアミノ酸配列情報を得る。これによりシステイン残基の位置も確認する。
【0078】
本発明では、還元・アルキル化の前処理を行っていないにもかかわらず、還元・アルキル化の前処理を行ったときと同様の簡便さでアミノ酸配列の解析を行うことが可能になる。そして、従来からのアミノ酸配列解析用のソフトウェアが適応できるスペクトルを与えるため、たとえば市販のde novo Sequencing用ソフトウェアをそのまま使用することが可能になる。市販のde novo Sequencing用ソフトウェアとして、PEAKSTMなどが挙げられる。
【0079】
(v)ジスルフィド結合の位置の推定
本工程では、プロダクトイオンaとプロダクトイオンbとの質量差を利用して、ジスルフィド結合の位置を推定する。
【0080】
ここで、プロダクトイオンa群は、すでに述べたように、通常の規則性を持ったフラグメンテーションにより生じるイオン(x−、y−、z−系列、a−、b−、c−系列及びそれに関連するプロダクトイオン)が得られる。これらイオンは、y−/b−系列のイオンを中心として得られる。
【0081】
一方、プロダクトイオンb群は、従来法において、還元性を示す物質を用いない場合や、強い還元性を示さないマトリックスを用いた場合と同様に、さまざまな種類のプロダクトイオン種が入り混じる。すなわち、b群には、(1b)ジスルフィド結合を維持したもの、(2b)ジスルフィド結合に由来し且つシステイン残基のチオール基「−SH」のHが外れた「−S」に相当する基を生成するフラグメンテーションが起こったもの、(3b)ジスルフィド結合に由来し且つシステイン残基のチオール基に相当する「−SH」を生成するフラグメンテーションが起こったものなどが含まれる。さらに、ジスルフィド結合を維持した内部断片なども相対的に多く含まれ得る。
【0082】
このようなさまざまな種類のプロダクトイオンが含まれるプロダクトイオンb群から、例えば上記の(1b)、(2b)及び(3b)の形式を有するプロダクトイオンbのみを考慮する。(1b)、(2b)及び(3b)の形式を有するプロダクトイオンbについて、それらを生じたフラグメンテーションと、ジスルフィド結合の位置との関係を考慮すると、以下のように説明できる。なお、以下の説明では、ジスルフィド結合を1個有するタンパク質又はペプチドにおいて1箇所でフラグメンテーションが起こる、最もシンプルな場合を想定している。
【0083】
(1b)の形式のプロダクトイオンbは、プリカーサーイオンとして用いた分子量関連イオンBにおいて、ジスルフィド結合のN末端側のシステイン残基よりもN末端側でフラグメンテーションが起こった場合の、C末端側のイオン(例えばy−系列イオン)として生じる。また、(1b)の形式のプロダクトイオンbは、プリカーサーイオンとして用いた分子量関連イオンBにおいて、ジスルフィド結合のC末端側のシステイン残基よりもC末端側でフラグメンテーションが起こった場合の、N末端側のイオン(例えばb−系列イオン)としても生じる。
【0084】
(2b)及び(3b)の形式を有するプロダクトイオンbはいずれも、プリカーサーイオンとして用いた分子量関連イオンBにおいて、1個のジスルフィド結合を形成する2個のシステイン残基の間でフラグメンテーションが起こった場合の、C末端側/N末端側のイオン(例えばy−/b−系列イオン)として生じる。
【0085】
プロダクトイオンa群にも、上記(1b)、(2b)及び(3b)の形式のプロダクトイオンbにそれぞれ対応する、(1a)、(2a)及び(3a)の形式のプロダクトイオンaが含まれる。
【0086】
すなわち、(1a)の形式のプロダクトイオンaは、プリカーサーイオンとして用いた分子量関連イオンAにおいて、ジスルフィド結合のN末端側のシステイン残基よりもN末端側でフラグメンテーションが起こった場合の、C末端側のイオン(例えばy−系列イオン)として生じる。また、(1a)の形式のプロダクトイオンaは、プリカーサーイオンとして用いた分子量関連イオンAにおいて、ジスルフィド結合のC末端側のシステイン残基よりもC末端側でフラグメンテーションが起こった場合の、N末端側のイオン(例えばb−系列イオン)としても生じる。
それぞれの場合において、(1b)の形式のプロダクトイオンbとそれに対応する(1a)の形式のプロダクトイオンaとは、ジスルフィド結合が還元されているか否かという違いがあることを除いては、互いに同系列、同配列である。
【0087】
そして、(2a)の形式を有するプロダクトイオンaは、プリカーサーイオンとして用いた分子量関連イオンAにおいて、1個のジスルフィド結合を形成する2個のシステイン残基の間でフラグメンテーションが起こった場合の、C末端側/N末端側のイオン(例えばy−/b−系列イオン)として生じる。
この場合において、(2b)の形式のプロダクトイオンbとそれに対応する(2a)の形式のプロダクトイオンaとは、切断されたジスルフィド結合がさらに還元されているか否かという違いがあることを除いては、互いに同系列、同配列である。
【0088】
さらに、 (3a)の形式を有するプロダクトイオンaは、プリカーサーイオンとして用いた分子量関連イオンAにおいて、1個のジスルフィド結合を形成する2個のシステイン残基の間でフラグメンテーションが起こった場合の、C末端側/N末端側のイオン(例えばy−/b−系列イオン)として生じる。
この場合において、(3b)の形式のプロダクトイオンbとそれに対応する(3a)の形式のプロダクトイオンaとは、ジスルフィド結合が同じ形に切断されており、互いに同系列、同配列である。
【0089】
ここで、(1a)の形式のプロダクトイオンaと(1b)の形式のプロダクトイオンbとにおいて、両者が同系列のイオンの場合、双方の質量差は、理論的に2となる。
また、(2a)の形式のプロダクトイオンaと(2b)の形式のプロダクトイオンbとにおいて、両者が同系列のイオンの場合、双方の質量差は、理論的に1となる。
さらに、(3a)の形式のプロダクトイオンaと(3b)の形式のプロダクトイオンbとにおいて、両者が同系列のイオンの場合、双方の質量差は、理論的に0となる。
【0090】
上述のプロダクトイオン、すなわちジスルフィド結合に関与するシステイン残基を有するプロダクトイオンの他に、ジスルフィド結合に関与するシステイン残基を有しないプロダクトイオンについては、プロダクトイオンa及びbを、対応するもの同士で(すなわち同配列、同系列のもの同士で)比較すると、双方の質量差は、理論的に0となる。なお、ジスルフィド結合に関与するシステイン残基を有しないプロダクトイオンは具体的には以下のものが挙げられる。
【0091】
すなわち、プロダクトイオンaについては、プリカーサーイオンとして用いた分子量関連イオンAにおいて、ジスルフィド結合のN末端側のシステイン残基よりもN末端側でフラグメンテーションが起こった場合の、N末端側のイオン(例えばb−系列イオン)や;プリカーサーイオンとして用いた分子量関連イオンAにおいて、ジスルフィド結合のC末端側のシステイン残基よりもC末端側でフラグメンテーションが起こった場合の、C末端側のイオン(例えばy−系列イオン)。
【0092】
一方、プロダクトイオンbについては、プリカーサーイオンとして用いた分子量関連イオンBにおいて、ジスルフィド結合のN末端側のシステイン残基よりもN末端側でフラグメンテーションが起こった場合の、N末端側のイオン(例えばb−系列イオン)や;プリカーサーイオンとして用いた分子量関連イオンBにおいて、ジスルフィド結合のC末端側のシステイン残基よりもC末端側でフラグメンテーションが起こった場合の、C末端側のイオン(例えばy−系列イオン)。
【0093】
このような原理を利用し、互いに対応するプロダクトイオンaとプロダクトイオンbとの質量差を次々に算出していくと、ジスルフィド結合の位置を確認することができる。タンパク質又はペプチドは、プロダクトイオンとしてy系列及びb系列のものを中心に得られるため、y系列イオン及びb系列イオンの両方について質量差を算出していくと良い。
【0094】
本工程では、MS2測定で得られたプロダクトイオンから特定のイオンをプリカーサイオンとして選択してMS3測定を行うことで、より詳細な構造情報を得ることができる。同様に、MSn-1測定で得られたプロダクトイオンから特定のイオンをプリカーサイオンとして選択してMSn測定を行うことで、さらに詳細な構造情報を得ることができる。MSn測定を行うことで、より詳細な構造情報を得ることができる。MSn測定で得られるプロダクトイオンは、特定のプリカーサイオンに帰属できるので、分子量関連イオンピークについてのより正確な構造解析が可能となる。
【0095】
本発明によって、以下の効果が得られる。
・前処理の手間と時間が大幅に縮小される。
・前処理における調整の難しさや残留試薬の問題が軽減される。
・基本的に通常の質量分析と手順が同じであるため、操作が容易である。
・使用する試料の量が少なくてすむ。
【実施例】
【0096】
<実験例1>
測定試料として、図1に示すように、A鎖((A-chain:GIVEQCCASVCSLYQLENYCN(配列表の配列番号1),ジスルフィド結合CysA6-CysA11)とB鎖(B-chain:FVNQHLCGSHLVEALYLVCGERGFFYTPKA(配列表の配列番号2))とがジスルフィド結合CysA7-CysB7及びCysA20-CysB19で架橋した構造を有するInsulinを用い、還元性を示すマトリックスとして、ジアミノナフタレンの位置異性体3種、及び比較用として強い還元性を示さない2,5-dihydroxybenzoic acid(DHBA)をそれぞれ用いて、AXIMA−QIT(島津製作所)によりポジティブモード及びネガティブモードで質量分析を行った。本実験例で用いたジアミノナフタレンの位置異性体は、1,5-diaminonaphthalene(1,5−DAN)、1,8-diaminonaphthalene(1,8−DAN)、及び2,3-diaminonaphthalene(2,3−DAN)である。また、DHBAを用いた場合においては、還元性を有する物質は用いなかった。
【0097】
図1の(a−1)は、比較用のDHBAを用いた、ポジティブ(positive)モードでのMSスペクトル、(a−2)は、比較用のDHBAを用いた、ネガティブ(negative)モードでのMSスペクトル、(b−1)は、1,5−DANを用いた、ポジティブモードでのMSスペクトル、(b−2)は、1,5−DANを用いた、ネガティブモードでのMSスペクトル、(c−1)は、1,8−DANを用いた、ポジティブモードでのMSスペクトル、(c−2)は、1,8−DANを用いた、ネガティブモードでのMSスペクトル、(d−1)は、2,3−DANを用いた、ポジティブモードでのMSスペクトル、及び、(d−2)は、2,3−DANを用いた、ネガティブモードでのMSスペクトルである。なお、本明細書における全てのスペクトルにおいて、横軸は(質量/電荷)(m/z)、縦軸は相対強度(% Int.)を表す。
【0098】
DHBAを用いた結果によると、図1(a−1)及び(a−2)が示すように、主にInsulinの分子量関連イオンが検出された。これに対し、1,5−DANを用いた結果によると図1(b−1)及び(b−2)が示すように、主にA鎖及びB鎖の分子量関連イオンが検出された。これは、Insulin分子の架橋構造を形成していたジスルフィド結合が還元的に切断された結果、A鎖とB鎖とに分解されたことを示す。同じ結果が、1,8−DANを用いた場合(図1(c−1)及び(c−2))、及び、2,3−DANを用いた場合(図1(d−1)及び(d−2))においても得られた。
【0099】
さらに、この3種類のジアミノナフタレンを用いた結果を比較すると、1,5−DANが最も強いS/N比を示し、2,3−DANが最も強い還元性を持つことが確かめられた。なお、還元性については、Insulinの分子量関連イオンと、A鎖及びB鎖の分子量関連イオンとのピーク強度比を比較することにより行った。
【0100】
<実施例1>
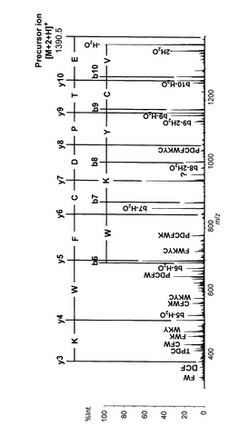
測定試料として、ペプチドUrotensin II (human由来; アミノ酸配列:ETPDCFWKYCV(配列表の配列番号3), ジスルフィド結合:Cys5-Cys10, 分子式:C64H86N13O18, 分子量:1388.6, 最小質量による精密質量: 1387.6)を用いて、MALDI−TOF(マトリックス支援レーザー脱離イオン化飛行時間型)質量分析装置によりMSを、MALDI−QIT−TOF(マトリックス支援レーザー脱離イオン化四重極イオントラップ飛行時間型)質量分析装置(AXIMA−QIT(島津製作所))によって、MSと、MSで得られた分子量関連イオンをプリカーサイオンとしたMS/MSとを行った。マトリックスにDHBAを用いた場合と、1,5−DANを用いた場合とを、得られた結果について比較した。
【0101】
DHBAをマトリックスとして用いたMSスペクトルでは、分子量関連イオンBとして[M+H]+が主に得られた。一方、1,5−DANをマトリックスとして用いたMSスペクトルでは、分子量関連イオンAとして[M+H]+と共にそれ以上の強度で[M+2+H]+が主に得られた。分子量関連イオンA[M+2+H]+は、1,5−DANがジスルフィド結合を還元することにより生じた2つのチオール基の存在によるものと考えられる。ジスルフィド結合が還元されるごとに2つのチオール基を生じることから、m個のジスルフィド結合をもつタンパク質あるいはペプチドのジスルフィド結合が全て還元された場合、分子量関連イオンAは、プロトン化分子として生じる場合は[M+2m+H]+、金属イオンMetalが付加した分子として生じる場合は[M+2m+Metal]+として示すことができる。今回の試料Urotensin IIに対しては、m=1であるため、ジスルフィド結合は1個と推定できる。
【0102】
DHBAによる、[M+H]+をプレカーサイオン(Precursor ion)としたMS/MSスペクトルを図2に、1,5−DANによる、[M+2+H]+をプレカーサイオン(Precursor ion)MS/MSスペクトルを図3に示す。続いて、1,5−DANをマトリックスとして用いたMSで得られた分子量関連イオンA[M+2+H]+をプリカーサイオンとして行ったMS/MSで、得られたMS/MSスペクトルから、y/b−系列を中心とした多くの規則的な開裂を示すプロダクトイオンa(x−、y−、z−系列、及びa−、b−、c−系列及びそれに関連するイオン)を効率良く確認した。これにより、ペプチドUrotensin IIの全アミノ酸配列情報を得、同時にシステイン残基の位置を確認した。尚、このアミノ酸配列の解析は、de novo Sequencingによるマニュアル解析だけでなく、自動解析でも可能であった。
【0103】
さらに、1,5−DANによるMS/MSスペクトルで得られたプロダクトイオンaのうち、特にy−/b−系列イオン群と、DHBAによるMS/MSスペクトルで得られたプロダクトイオンbのうち、プロダクトイオンaのy−/b−系列イオンに対応するプロダクトイオン群とを比較すると、ジスルフィド結合の位置に特徴的な質量差を示した。具体的に、DHBA及び1,5−DANによって得られたそれぞれのy−系列イオンの質量数と、両質量数の差を以下の表に示した。
【0104】
【表1】

【0105】
また、DHBA及び1,5−DANによって得られたそれぞれのb−系列イオンの質量数と、両質量数の差を以下の表に示した。
【0106】
【表2】

【0107】
さらに、DHBA及び1,5−DANによって得られたそれぞれのy−H2O−系列イオンの質量数と、両質量数の差を以下の表に示した。
【0108】
【表3】

【0109】
そこで、本実施例で得られたこれらのプロダクトイオン(y−、b−、及びb−H2O−系列イオン)及びそれから導かれた質量差について、具体的にジスルフィド結合の位置と関連付けて示したものを以下の表に示す。なお、以下の表においては、b−H2O−系列イオンを、y6’、y7’・・・のように、「’」を付して表している。
【0110】
【表4】

【0111】
このように、ジスルフィド結合の位置に応じて、特徴的な質量差が示される。このように特徴的な質量差が示されることについて、以下に説明する。
【0112】
1,5−DANをマトリックスとして用いた場合は、プロダクトイオンaは、ジスルフィド結合が還元されて2つのシステイン残基上それぞれにチオール基(−SH)が存在する状態の質量数を与えて検出された。
【0113】
一方、DHBAをマトリックスとして用いた場合は、プロダクトイオンbは、(1b)ジスルフィド結合を含む形式、(2b)ジスルフィド結合が切断されチオール基の硫黄原子Sを1つ含む形式、(3b)ジスルフィド結合が切断されチオール基(−SH)が1つ存在する形式などを含め、複数の形式で検出された。本実施例では特に、DHBAによるプロダクトイオンbのうち、上記(1b)、(2b)及び(3b)の形式のもののみを考慮している。
【0114】
ここで、プロダクトイオンaのうち、(1b)の形式のプロダクトイオンbに対応するものを、(1a)の形式のプロダクトイオンaとし;(2b)の形式のプロダクトイオンbに対応するものを、(2a)の形式のプロダクトイオンaとし;(3b)の形式のプロダクトイオンbに対応するものを、(3a)の形式のプロダクトイオンaとする。
【0115】
1,5−DANによるMS/MSスペクトルで得られたプロダクトイオンaのうち、y−/b−系列イオン群と、DHBAによるMS/MSスペクトルで得られたプロダクトイオンbのうち、プロダクトイオンaのy−/b−系列イオンに対応するプロダクトイオン群とにおいて、対応するプロダクトイオン同士の質量差は、理論的には次の通りである。すなわち、(1b)の形式のプロダクトイオンbと、(1a)の形式のプロダクトイオンaとの間では、両者の質量差は2;(2b)の形式のプロダクトイオンbと、(2a)の形式のプロダクトイオンaとの間では、両者の質量差は1;(3b)の形式のプロダクトイオンbと、(3a)の形式のプロダクトイオンaとの間では、両者の質量差は0となると考えられる。
【0116】
これらの質量差を、ジスルフィド結合の位置と関連付けて説明すると、以下の通りである。
ジスルフィド結合を含むペプチドで1箇所切断が生じる場合、y−系列イオンは、ジスルフィド結合に関係するシステイン残基のうちN末端側残基までのペプチド骨格が開裂して生じるイオンであれば質量差2、ジスルフィド結合に関する2つのシステイン残基間のペプチド骨格が開裂して生じるイオンであれば質量差1か0となる。
【0117】
またこの場合、b−系列イオン及びb−H2O系列イオンは、ジスルフィド結合に関係するシステイン残基のうちC末端側の残基までのペプチド骨格が開裂して生じるイオンであれば質量差2、ジスルフィド結合に関する2つのシステイン残基間のペプチド骨格が開裂して生じるイオンであれば質量差1か0となる。
【0118】
本実施例で得られた各系列のイオンにおける質量差と、ジスルフィド結合の位置とについて、より簡潔に示したものを以下の表及び式に示す。
【0119】
【表5】

【0120】
【化5】

【0121】
このように、本実施例の試料Urotensin IIの場合、y系列イオンは、y4〜y6において質量差0か1、y7〜y11において質量差2である。このように、0又は1の質量差から2の質量差に切り替わったy7のC末端側に、ジスルフィド結合に関わるシステイン残基のうちN末端側の残基が位置することを確認した。また、b−系列イオンは、b7〜b9において質量差0か1、b10〜b11において質量差2である。このように、0又は1の質量差から2の質量差に切り替わったb10のN末端側に、ジスルフィド結合に関わるシステイン残基のうちC末端側の残基が位置することを確認した。これは、b−H2O−系列イオンがb6−H2O〜b9−H2Oにおいて質量差0、b10−H2O〜b11−H2Oにおいて質量差2であることからも確認できる。
【0122】
以上のように、ジスルフィド結合の数及び位置を解析することができた。
【0123】
<比較例1>
実施例1で得られたデータのうち、マトリックスとしてDHBAを用いて得られた図2のデータのみから、de novo Sequencingによるマニュアル解析と自動解析とのそれぞれの方法によって行った。de novo Sequencingによるマニュアル解析により得られた結果を図2中に示す。
【0124】
(de novo Sequencingによるマニュアル解析)
マトリックスとしてDHBAを用いると、MSによる分子量関連イオンが、ジスルフィド結合が維持された分子として得られる。このため、MS/MSによるプロダクトイオンは、ジスルフィド結合及びそれに由来するシステイン残基のチオール基の状態を考慮して質量の理論値を計算する必要がある。さまざまなプロダクトイオン種が入り混じっているため、de novo Sequencingによるマニュアル解析は大変困難な作業となった。
【0125】
図2中のy/b系列表示上に付された“*”は、そのイオンが、ジスルフィド結合(−S−S−)を含むプロダクトイオンであることを示す。また“**”は、そのイオンが、ジスルフィド結合に由来し且つシステイン残基のチオール基「−SH」のHが外れた硫黄原子「−S」に相当する官能基を1個有するプロダクトイオンであることを示す。さらに“***”は、そのイオンが、ジスルフィド結合に由来し且つシステイン残基のチオール基「−SH」に相当する官能基を1個有するプロダクトイオンであることを示す。図2中“?”を付したピークは、そのイオンが、解析できなかったプロダクトイオンであることを示す。このように比較例1ではプロダクトイオンの多くは解析できなかった。解析できなかったプロダクトイオンとしては、ジスルフィド結合が維持されたまま複数の部位で開裂したことにより生じたプロダクトイオン、或いは一般の開裂様式のプロダクトイオン(すなわちx−、y−、z−系列、a−、b−、c−系列及びそれに関連するプロダクトイオン群)に当てはまらないプロダクトイオンなどが考えられる。
【0126】
(de novo Sequencingによる自動解析)
一方、de novo Sequencingによる自動解析を行った場合は、配列のほとんどを解析することができなかった。例えば最高の結果でも、Urotensin IIのN末端側のETPという配列と、C末端側のアミノ酸Vとが解析された程度である。これは、ソフトウェアが、ジスルフィド結合が保持されている条件に対応していないため、ジスルフィド結合を持たない状態か、或いはジスルフィド結合が還元されてカルボアミドメチル化などの修飾を受けた状態としてのみ計算するためだと考えられる。しかも実際には、この結果においては、解析されたアミノ酸の情報さえも、間違ったイオンピークを選んで解析されていたことが判明した。
【図面の簡単な説明】
【0127】
【図1】実験例1で用いられた測定試料の構造、及び本発明のマトリックス3種を用いて得られたMSスペクトルである。
【図2】実施例1において、DBHAを用いることによって得られたMS/MSスペクトルである。
【図3】実験例1において、1,5−DANを用いることによって得られたMS/MSスペクトルである。
【技術分野】
【0001】
本発明は、プロテオミクスに関し、より詳しくは、MSの2乗以上の分析が可能な質量分析装置を用いたタンパク質又はペプチドのジスルフィドマッピング法(すなわちタンパク質又はペプチド中のジスルフィド結合の数及び位置を決定する方法)に関する。
【背景技術】
【0002】
従来、ジスルフィド結合を持つタンパク質又はペプチドについて、質量分析装置を用いたジスルフィドマッピングを行う場合、質量分析装置による計測を行う前に前処理が必要であった。
【0003】
例えば、従来のジスルフィドマッピング法の例として、以下のような手順を踏む手法が挙げられる。
まず、精製されたタンパク質又はペプチドをトリプシンなどを用いてジスルフィド結合が維持される条件下(例えばpH 7)で酵素消化する。続いて、得られた消化断片を、高速液体クロマトグラフィー(HPLC)で分離し、質量分析計で計測する。
【0004】
計測結果から、システインを含む2つのペプチドの質量を合計した理論値、すなわち2つのペプチドがジスルフィド結合で架橋されていると想定して算出した理論値、と一致するペプチド断片を確認する。
【0005】
これらの確認されたペプチド断片を、ジスルフィド結合の交換が起こらないよう低pH下(例えばpH 4.5〜5.5)で、鎖間ジスルフィド結合からシステイン残基を遊離させ、遊離したシステイン残基に対して、4-vinilpyridine(4-VP)を用いてS-ピリジルエチル化を行い、S-ピリジルエチル化ペプチドを得る。
【0006】
その後、S-ピリジルエチル化ペプチドを適当な条件下でジチオスレイトール(DTT)などを用いて鎖内ジスルフィド結合を還元し、還元部位をS-カルボメチル化などにより保護し、還元アルキル化ペプチド断片を得る。
【0007】
得られた還元アルキル化ペプチド断片を、質量分析装置で計測する。質量分析により得られたアミノ酸配列情報から、ペプチド断片のシステイン残基の位置を確認し、ジスルフィド結合を特定する。
【0008】
また、従来のジスルフィドマッピング法の他の例として、以下のような手法もある。 タンパク質を、過剰の2-ニトロ-5-シアノ安息香酸(NTCB)を用いて室温でアルカリ条件下15分間反応させることによりシアニル化し、1 M水酸化アンモニウムを加えて1時間インキュベートすることによりシステイン部位で切断する。
【0009】
その後、トリス(2-カルボキシエチル)ホスフィン(TCEP)のような還元剤を5〜10倍量加えて、37℃、30分で還元反応を行う。得られた還元断片を質量分析装置で計測し、これらの断片のアミノ酸配列情報を得ると共に、遊離のチオール基を持つシステイン残基を同定する。
【0010】
一方で、タンパク質を、まずTCEPを用いて37℃、30分間で還元し、還元されたタンパク質を、NTCBを用いてシステイン部位で切断する。得られた断片を質量分析装置で計測し、これらの断片のアミノ酸配列情報を得ると共に、全てのシステイン残基を同定する。
【0011】
シアニル化したタンパク質を断片化し、その後還元した前者の分析結果と、シアニル化していないタンパク質を還元し、その後断片化した後者の分析結果とを比較することで、ジスルフィド結合の数と位置を決定する。
【0012】
このように従来から行われてきたジスルフィドマッピング法に関しては、例えば、Wu, J., Gage, D.A., Watson, J.T., Anal.Biochem., vol. 235, p. 161-174 (1996)、Wu, J., Watson, J.T., Anal. Biochem., vol. 258, p. 268-276 (1998)、及び、Christoph Spiess, H. Peter Happersberger, Michael O. Glocker, Eberhard Spiess, Karsten Rippe, and Michael Ehrmann., J.Biol.Chem., vol. 272, p. 22125-22133 (1997)に詳細に記載されている。
【0013】
【非特許文献1】ウー・J(Wu, J.)、ゲイジ・D・A(Gage, D.A.)、及びワトソン・J・T(Watson, J.T.)、「アナリティカル・バイオケミストリー(ANALYTICAL BIOCHEMISTRY)」、1996年、第235巻、p.161−174
【非特許文献2】ウー・J(Wu, J.)、ゲイジ・D・A(Gage, D.A.)、及びワトソン・J・T(Watson, J.T.)、「アナリティカル・バイオケミストリー(ANALYTICAL BIOCHEMISTRY)」、1998年、第258巻、p.268−276
【非特許文献3】クリストフ・スピース(Christoph Spiess)、H・ピーター・ハッパスベーガー(H. Peter Happersberger)・ミヒャエル・O・グロッカー(Michael O. Glocker)、エベラール・スピース(Eberhard Spiess)、カーステン・リペ(Karsten Rippe)、及びミヒャエル・アーマン(Michael Ehrmann)、「ザ・ジャーナル・オブ・バイオロジカル・ケミストリー(The Journal of Biological Chemistry)」、1997年、第272巻、p.22125−22133
【発明の開示】
【発明が解決しようとする課題】
【0014】
上に述べた従来のジスルフィドマッピング法は、以下の点で不都合である。
・前処理に手間と時間がかかる。
・タンパク質について、還元前及び還元後(すなわちジスルフィド結合が有る場合及び無い場合)の分析結果を比較するため、2種類の試料を用意する必要がある。
・試料分子の他の部位に影響を与えないように、ジスルフィド結合のみを還元し保護することが要求されるため、pHなどの反応条件の制約が厳しい。
・前処理において用いられる過剰の試薬が除去されきれないため、残留試薬の質量分析に対する影響が危惧される。
【0015】
そこで本発明の目的は、質量分析において、タンパク質又はペプチドのジスルフィド結合の数及び位置の決定を迅速且つ容易に行うことができる方法を提供することにある。
【課題を解決するための手段】
【0016】
本発明者は、LI質量分析装置により、ジスルフィド結合に対して還元性を示す物質を用いることによって、上記本発明の目的が達成されることを見出し、本発明を完成するに至った。
【0017】
本発明は、以下の<1>〜<8>の発明を含む。
<1>
(i)MSの2乗以上が可能なLI(レーザーイオン化)質量分析装置により、ジスルフィド結合に対して還元性を示す物質を用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て、
(ii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し、
(iii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行い、前記分子量関連イオンAから複数のプロダクトイオンaを、前記分子量関連イオンBから複数のプロダクトイオンbを得て、
(iv)前記複数のプロダクトイオンaから前記タンパク質又はペプチドのアミノ酸配列情報を得て、
(v)前記複数のプロダクトイオンaの各々の質量数と、前記各々のプロダクトイオンaと同じ配列であり且つ同じ系列のプロダクトイオンbの質量数との差を求めることによって、前記タンパク質又はペプチドにおける前記ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【0018】
前記<1>においては、分子量関連イオンAは、還元性を示す物質によって還元されたことによって生成し、分子量関連イオンBは、還元性を示す物質によって還元されなかったことによって生成する。
【0019】
<2>
前記LI質量分析装置が、MALDI(マトリックス支援レーザー脱離イオン化型)質量分析装置である、<1>に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0020】
<3>
前記ジスルフィド結合に対して還元性を示す物質が、ジスルフィド結合に対して還元性を示すマトリックスである、<2>に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0021】
<4>
(i)MSの2乗以上が可能なMALDI質量分析装置により、ジスルフィド結合に対して還元性を示す物質、及び、前記物質が示す還元性より強い還元性を示さないマトリックスを用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て、
(ii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し、
(iii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行い、前記分子量関連イオンAから複数のプロダクトイオンaを、前記分子量関連イオンBから複数のプロダクトイオンbを得て、
(iv)前記複数のプロダクトイオンaから前記タンパク質又はペプチドのアミノ酸配列情報を得て、
(v)前記複数のプロダクトイオンaの各々の質量数と、前記各々のプロダクトイオンaと同じ配列であり且つ同じ系列のプロダクトイオンbの質量数との差を求めることによって、前記タンパク質又はペプチドにおける前記ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【0022】
上記<4>においては、分子量関連イオンAは、還元性を示す物質によって還元されたことによって生成し、分子量関連イオンBは、還元性を示す物質によって還元されなかったことによって生成する。
【0023】
<5>
前記ジスルフィド結合に対して還元性を示す物質が、ジスルフィド結合に対して還元性を示すマトリックスである、<4>に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0024】
<6>
前記ジスルフィド結合に対して還元性を示す物質が、ジアミノナフタレンの位置異性体から選ばれる、<1>〜<5>のいずれかに記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0025】
上記<6>に記載のジアミノナフタレンは、MALDI法において、マトリックスとしての性質とともに還元性を有する物質、すなわち還元性を示すマトリックスとして使用されることがある。また、上記<6>に記載のジアミノナフタレンは、マトリックスを用いないLI法において、気相中で還元性を示す物質として使用されることがある。
【0026】
<7>
前記ジスルフィド結合に対して還元性を示す物質が、1,5−ジアミノナフタレン、2,3−ジアミノナフタレン、及び1,8−ジアミノナフタレンからなる群から選ばれる、<1>〜<6>のいずれかに記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0027】
<8>
前記MALDI質量分析装置が、MALDI−QIT−TOF(マトリックス支援レーザー脱離イオン化四重極イオントラップ飛行時間型)質量分析装置である、<2>〜<7>のいずれかに記載のタンパク質又はペプチドのジスルフィドマッピング法。
【0028】
<9>
前記タンパク質又はペプチドのアミノ酸配列情報を、de novo Sequencingの自動解析を行うことによって得る、<1>〜<8>のいずれかに記載のタンパク質又はペプチドのジスルフィドマッピング法。
【発明の効果】
【0029】
本発明によると、質量分析において、タンパク質又はペプチドのジスルフィド結合の数及び位置の決定を迅速且つ容易に行うことができる方法を提供することができる。
【発明を実施するための最良の形態】
【0030】
本発明においては、ジスルフィド結合に対して還元性を示す物質を用い、MSの2乗以上が可能なLI質量分析装置によって、タンパク質又はペプチドの質量分析を行い、ジスルフィドマッピングを行う。
【0031】
本明細書においては、質量分析装置によって行われる分析において、測定試料の1回目の分析をMSとし、MSにおいて得られたスペクトルのイオンピークから特定のイオンを選択し、選択された特定のイオンをプリカーサイオンとして2回目の分析を行うことをMS/MS又はMS2と表記する。同様に、MSn-1において得られたスペクトルのイオンピークから特定のイオンを選択し、選択された特定のイオンをプリカーサイオンとしてn回目の分析を行うことをMSnと表記し、MSのn乗と呼称する。
【0032】
本発明では、LI(レーザーイオン化)質量分析装置が用いられる。LI法は、固相または液相の試料に対しては、適切な波長のレーザー光を照射して試料を気相中に脱離した後イオン化し(レーザー脱離イオン化;LDI)、気相の試料に対しては、気相の状態を保ったままで適切な波長のレーザー光を照射して、試料をイオン化する方法である。気相試料のLIには、LS(レーザースプレー;液体を噴霧させ、赤外レーザーを照射して、試料を気相中でイオン化する方法)などがある。固相または液相試料のLIには、LDI(レーザー脱離イオン化)質量分析装置などがある。
【0033】
LDI法は、レーザー光を吸収する固体又は液体に試料を混合または搭載し、適切なレーザー光を照射し、気相中に試料をイオン化する方法である。ここで、レーザー光を吸収する固体または液体が試料そのものである場合もある。LDIには、MALDI(マトリックス支援レーザー脱離イオン化)やSELDI(表面増強レーザー脱離イオン化)、DIOS (desorption/ionization on silicon)などがある。
【0034】
MALDI質量分析装置としては、MALDI−QIT−TOF(マトリックス支援レーザー脱離イオン化四重極イオントラップ型飛行時間型)質量分析装置が好ましい。MALDI−QIT−TOF質量分析装置としては、島津製作所AXIMA−QITなどが挙げられる。
【0035】
本発明のジスルフィドマッピング法は、以下の工程を含む。
(i)タンパク質又はペプチドのMSを行う。
(ii)MSの結果から、ジスルフィド結合の数を推定する。
(iii)MSnを行う。
(iv)MSnの結果から、タンパク質又はペプチドのアミノ酸配列情報を得る。
(v)MSnの結果から、ジスルフィド結合の位置を推定する。
なお、これらの工程は、上記の順番に限定されるものではない。以下、これらの工程について詳しく説明する。
【0036】
(i)MS
本工程では、ジスルフィド結合に対して還元性を示す物質を用いて、タンパク質又はペプチドのMSを行う。本工程によって、ジスルフィド結合が還元された分子量関連イオンAと、ジスルフィド結合が還元されていない分子量関連イオンBとを得る。
【0037】
本発明における、ジスルフィド結合に対して還元性を示す物質としては、質量分析に用いるレーザーの波長を吸収し、ジスルフィド結合を還元的に開裂する能力を有するものであれば特に限定されない。ジスルフィド結合に対して還元性を示す物質の一例として、本発明の条件下で、タンパク質試料又はペプチド試料中のジスルフィド結合の、例えば20%以上、好ましくは50%以上を還元的に開裂させる能力を有する物質が挙げられる。
【0038】
ジスルフィド結合に対して還元性を示す物質は、1種又は複数種を組み合わせて用いることができる。そして、ジスルフィド結合に対して還元性を示す物質は、このような還元性の強さを考慮して適宜用いることができる。ジスルフィド結合に対して還元性を示す物質の中でも比較的還元性が強くないものを用いれば、ジスルフィド結合が還元されていない分子量関連イオンBが相対的に多く得られる。
【0039】
具体的には、ジスルフィド結合に対して還元性を示す物質の構造としては、質量分析に用いるレーザーの波長に吸収帯を有する分子骨格と、ジスルフィド結合を還元的に開裂させることができる官能基とを有するものであれば特に限定されない。例えば、ジアミノナフタレン類が挙げられる。ここでいうジアミノナフタレン類には、ジアミノナフタレンの存在しうる位置異性体が全て含まれる。この中でも、1,5−ジアミノナフタレン(1,5−DAN;下記式(I))、1,8−ジアミノナフタレン(1,8−DAN;下記式(II))、2,3−ジアミノナフタレン(2,3−DAN;下記式(III))が特に好ましく用いられる。
【0040】
【化1】

【0041】
【化2】

【0042】
【化3】

【0043】
これら位置異性体は、測定試料に応じて適宜使い分けることができる。この中では、1,5−DANは、もっとも強いS/N比を示し、2,3−DANは、もっとも強い還元性を持つ。従って、これら位置異性体は、このように感度や還元性などの各々の能力を考慮しながら、適宜使い分けると良い。
【0044】
本発明の還元性を示す物質は、気相中で還元するために用いることができる。よって、DIOS(desorption/ionization on silicon)などマトリックスを用いないLIにおける還元に使用することもできる。例えば、ジアミノナフタレンは気相にて還元作用を示す。さらにジアミノナフタレンは、後述するように、マトリックスとしても働くため、還元性を示すマトリックスとしてMALDI質量分析装置にて用いることができる。
【0045】
ジスルフィド結合に対して還元性を示す物質は、上記の強さの還元性を損なわない程度の十分な量で用いると良い。
【0046】
MSでは、主に分子量関連イオンが得られる。ここで分子量関連イオンとは、分子量情報の獲得に直接役立つイオン種をいう。ジスルフィド結合に対して還元性を示す物質によって、タンパク質又はペプチドから、分子量関連イオンをジスルフィド結合が還元的に開裂された状態で生じさせることができる。また、このようにジスルフィド結合が還元された分子量関連イオンAとともに、ジスルフィド結合が還元されなかった分子量関連イオンBも生成する。
【0047】
また、タンパク質又はペプチドがジスルフィド結合をm個有している場合は、分子量関連イオンAとして、ジスルフィド結合が1個還元された分子量関連イオンA1、ジスルフィド結合が2個還元された分子量関連イオンA2、・・・ジスルフィド結合がm個還元された分子量関連イオンAmが得られる。
【0048】
以下に、本発明においてMALDI質量分析装置を用いる場合を挙げて、ジスルフィド結合を有する物質、及び測定試料をMALDI質量分析装置に導入する手順について説明する。
【0049】
本発明においてMALDI質量分析装置を用いる場合、タンパク質試料又はペプチド試料は、ジスルフィド結合に対して還元性を示す物質と混合され、MALDI測定用試料混合物に調製される。この測定用試料混合物は、MALDI質量分析装置を用いる一般の測定用試料混合物と同様に、マトリックス物質を含んでいる。従って本発明では、測定用試料混合物中の還元性を示す物質として、ジスルフィド結合を還元する働きとともにマトリックスとしての働きを有する物質(すなわち、還元性を示すマトリックス)が用いられることがある。この場合は、還元性を示すマトリックスを単独で用いても良いし、そのような強い還元性を示さないマトリックス(例えば従来から用いられてきたマトリックスなど)とともに用いても良い。さらに、前記の還元性を示す物質として、ジスルフィド結合に作用する働きを有するがマトリックスとしての働きは有しない物質を選択し、このような物質を、前記の強い還元性を示さないマトリックスとともに用いても良い。
【0050】
測定用試料混合物において、還元性を示すマトリックス、強い還元性を示さないマトリックス、還元性を示し且つマトリックスでない物質は、それぞれ1種又は複数種を選択して用いることができる。すなわち、タンパク質試料又はペプチド試料と混合させる物質の還元性の強弱やマトリックスの有無などを考慮することによって、測定用試料混合物に含まれる物質の種類と数とを制限なく組み合わせることができる。
【0051】
例えば、測定用試料混合物としては、以下の混合物などが挙げられる。
タンパク質試料又はペプチド試料と、ジスルフィド結合に対して還元性を示すマトリックスとの混合物;タンパク質試料又はペプチド試料と、還元性を示すマトリックスと、強い還元性を示さないマトリックスとの混合物;又は、タンパク質試料又はペプチド試料と、還元性を示し且つマトリックスでない物質と、強い還元性を示さないマトリックスとの混合物など。
【0052】
なお、「強い還元性を示さないマトリックス」としては、「還元性を示す物質」が有する還元性よりも強い還元性を有しないマトリックスであれば特に限定されない。強い還元性を示さないマトリックスの例としては、タンパク質試料又はペプチド試料中のジスルフィド結合を全く還元する能力を有しないものや、還元する能力があっても、本発明の条件下で、タンパク質試料又はペプチド試料中のジスルフィド結合の、例えば50%未満、好ましくは20%未満、より好ましくはせいぜい5%を還元することができる程度のものが挙げられる。
【0053】
強い還元性を示さないマトリックスは、イオン化能力に優れたもの(例えば従来から用いられてきたマトリックスなど)から選択することができる。強い還元性を示さないマトリックスを用いることによって、より効率的にイオン化を行うことが可能になる。
【0054】
本発明においてMALDI質量分析装置を用いる場合、ジスルフィド結合に対しての還元性を示す物質としては、MALDI質量分析に用いられるレーザーの波長に吸収帯を有する分子骨格と、ジスルフィド結合を還元的に開裂する能力を有する官能基とを有するものが挙げられる。すでに挙げたジアミノナフタレン類は、マトリックスとしての働きを有するため、還元性を示す物質として還元性を示すマトリックスを用いる場合に、このようなジアミノナフタレン類が特に有用に用いられる。
【0055】
還元性を示すマトリックスを単独で用いる場合、MALDI質量分析においてマトリックスとして用いるという目的において通常用いられる量を、当業者が適宜決定すれば良い。すなわち、測定試料に対してマトリックスが過剰量となるような適当な濃度、例えば1mg/ml〜飽和濃度の溶液として用いると良い。溶媒としては、有機溶媒水溶液、トリフルオロ酢酸(TFA)水溶液、有機溶媒−TFA水溶液などを用いることができる。有機溶媒としては、アセトニトリル、エタノール、メタノールなどを用いることができる。
【0056】
測定試料をMALDI質量分析装置に導入する手順としては特に限定されない。例えば、還元性を示すマトリックスを単独で用いる場合、以下のような方法が挙げられる。
すなわち、MALDI質量分析用のプレートに、測定試料の溶液とマトリックスの溶液とを、同一の位置に微量滴下し、乾燥させる。測定試料の溶液は、測定試料のタンパク質又はペプチドを、TFA水溶液に適当な濃度で溶解することによって調製すると良い。マトリックスの溶液は、上記の溶媒に、上記の濃度で溶解することによって調製すると良い。滴下する量としては、特に限定されず、当業者が適宜決定すればよい。例えば、試料にして数fmol〜数pmol程度となるような量とすることができる。
【0057】
乾燥させたプレートは、MALDI質量分析装置内に導入される。プレート上の試料とマトリックスとの混合結晶にレーザー光が照射されると、そのレーザー波長を吸収してマトリックスが励起し、そのとき試料も同時にイオン化される。すなわち、マトリックスは、質量分析装置のレーザー波長を吸収して励起する際に、マトリックスとともにプレート上に搭載された試料を同時にイオン化する働きをする。マトリックスと共にイオン化した試料は、電位差によりイオン源を飛び出し、高真空である分離部を飛行し、質量による飛行速度の違いによって分離される。その後、検出器においてそれぞれのイオンの質量値を示すイオンピークとして検出される。
【0058】
MALDI質量分析装置を用いた場合は、ジスルフィド結合に対して還元性を示す物質(すなわち還元性を示すマトリックスや還元性を示し且つマトリックスでない物質)によって、タンパク質又はペプチドから、分子量関連イオンをジスルフィド結合が還元的に開裂された状態で生じさせることができる。また、ジスルフィド結合に対して還元性を示す物質によって、このようにジスルフィド結合が還元された分子量関連イオンとともに、ジスルフィド結合が還元されなかった分子量関連イオンも生成する。
【0059】
MALDI質量分析装置以外のLI質量分析装置により質量分析測定を行う場合は、ジスルフィド結合に対して還元性を示す物質を用いて試料を調製すること以外は、それぞれの分析装置にて通常用いられる手順に従って、試料調製及び分析を行うことができる。
【0060】
このようにMALDI質量分析装置をはじめ、LI質量分析装置により質量分析測定にかけられた測定試料は、ジスルフィド結合が還元的開裂された状態で検出することができる。従って本発明の方法では、ジスルフィド結合の開裂のために従来必ず行われてきたような、煩雑な前処理を行う必要がない。すなわち、そのような前処理に必要とされていた時間、手間、試薬類、より具体的には、pHなどの反応条件の調整、チオール基の保護、試薬等の塩類の除去等という作業が不要になる。そして、そのような前処理によって危惧されていた残留試薬のスペクトルへの影響もなくなる。
【0061】
このように、本発明の方法を用いると、ジスルフィド結合の還元反応を、迅速且つ容易に行うことが可能になる。MALDI質量分析装置を用いた場合は、ジスルフィド結合の還元反応を、オンターゲットで、すなわちMALDIプレート上で行うことが可能になるため、迅速且つ容易な処理が可能になる。
【0062】
(ii)ジスルフィド結合の数の推定
従来法において、還元性を持つ物質を
用いない場合や、強い還元性を持たないマトリックスのみを用いた場合に得られるMSスペクトルにおいては、測定試料がジスルフィド結合を有する場合も、分子量関連イオンのピークは、通常[M+H]+(ポジティブモードでの測定の場合でプロトン付加分子として検出された場合(金属イオン付加分子として検出される場合もある。))又は[M−H]−(ネガティブモードでの測定の場合)として帰属される。すなわち、分子量関連イオンはジスルフィド結合を維持した状態のものとして得られる。
【0063】
一方、本発明のようにジスルフィド結合に対して還元性を持つ物質を用いて得られるMSスペクトルにおいて、ジスルフィド結合が還元された分子量関連イオンについては、分子量関連イオンのピークを、理論上、[M+2m+H]+(ポジティブモードでの測定の場合でプロトン付加分子として検出された場合(金属イオン付加分子として検出される場合もある。))又は[M+2m−H]−(ネガティブモードでの測定の場合)として帰属する。従来のマトリックスを用いた場合と比べて質量数が2mDa大きいとするのは、ジスルフィド結合(−S−S−)が還元的に開裂を受けることによって、1個のジスルフィド結合につき2個のチオール基(−SH,HS−)へと変換されて質量が2Da大きくなるためである。
【0064】
従って、測定試料がジスルフィド結合を1個有するものである場合、MSスペクトルにおけるジスルフィド結合が還元された分子量関連イオンのピークは、[M+2+H]+(プロトン付加分子の場合)又は[M+2−H]−として帰属する。同様に、測定試料がジスルフィド結合を2個有するものである場合は、MSスペクトルにおけるジスルフィド結合が還元された分子量関連イオンのピークは、[M+4+H]+(プロトン付加分子の場合)又は[M+4−H]−として、測定試料がジスルフィド結合を3個有するものである場合は、MSスペクトルにおけるジスルフィド結合が還元された分子量関連イオンのピークは、[M+6+H]+(プロトン付加分子の場合)又は[M+6−H]−として帰属する。
【0065】
測定試料のタンパク質又はペプチドが有するジスルフィド結合の数が未知である場合、以下のようにしてジスルフィド結合の数を決定する。
ジスルフィド結合の数をm個として仮定する。そして、上述の工程(i)によって、ジスルフィド結合が還元された分子量関連イオンAと、ジスルフィド結合が維持された分子量関連イオンBとを得る。
【0066】
次に、分子量関連イオンAの質量数MAと、分子量関連イオンBの質量数MBとの差(MA−MB)を求める。
ジスルフィド結合の数m(個)に対して、双方の分子量関連イオンの差が2m(Da)で表される、すなわち、2m=MA−MBという関係に基づき、実際に求められた差(MA−MB)からジスルフィド結合の数mを算出する。
【0067】
例えば、双方の分子量関連イオンの差が2であれば、測定試料のタンパク質又はペプチドが有するジスルフィド結合の数は1個であると決定することができる。同様に、当該差が4であればジスルフィド結合の数は2個、当該差が6であればジスルフィド結合の数は3個であると決定することができる。また、双方の分子量関連イオンの差がなければ、測定試料のタンパク質又はペプチドはジスルフィド結合を有しないと決定することができる。このように、ジスルフィド結合の有無及び数を確認することが可能になる。
【0068】
(iii)MSn
本工程では、分子量関連イオンAと分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行う。前記工程(i)で、ジスルフィド結合をm個有するタンパク質又はペプチドから、複数の分子量関連イオンA(分子量関連イオンA1、A2・・・Am)が得られた場合は、それぞれの分子量関連イオンをプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行うことができる。
【0069】
本工程により、分子量関連イオンAから、複数のプロダクトイオンa(プロダクトイオンa群)を、分子量関連イオンBから、複数のプロダクトイオンb(プロダクトイオンb群)を得る。
【0070】
(iv)アミノ酸配列情報の取得
本工程では、MSnの結果から、ジスルフィド結合が還元されたタンパク質又はペプチドのアミノ酸配列情報を得る。このときに関わるプロダクトイオンaについて、以下に説明する。
【0071】
従来法において、還元性を示す物質を用いない場合や、強い還元性を示さないマトリックスを用いた場合は、プリカーサイオンがジスルフィド結合を有するため、MS/MSで得られるプロダクトイオンは、さまざまな種類のプロダクトイオン種が入り混じる。このようなプロダクトイオン種としては、例えば、ジスルフィド結合を維持したもの、ジスルフィド結合に由来し且つシステイン残基のチオール基「−SH」のHが外れた「−S」に相当する基を生成するフラグメンテーションが起こったもの、ジスルフィド結合に由来し且つシステイン残基のチオール基に相当する「−SH」を生成するフラグメンテーションが起こったものなどが含まれる。さらに、ジスルフィド結合を維持した内部断片なども相対的に多く検出され得る。
【0072】
このような多種類のプロダクトイオンのピークが混在した複雑なスペクトルは、その解析が非常に困難である。例えば、de novo Sequencing(すなわち数学的演算によりアミノ酸配列を算出する方法)による自動解析を試みたとしても、配列のほとんどを解析することができない。これは、自動解析に用いられるソフトウェアが、通常はジスルフィド結合が維持されている条件に対応していないことが原因に挙げられる。このようなソフトウェアによる計算は、ジスルフィド結合を持たない状態か、或いはジスルフィド結合が還元されてカルボアミドメチル化などの修飾を受けた状態としてのみ行われると考えられるため、誤った配列情報を与えてしまう。
【0073】
マニュアルでde novo Sequencingを行う場合は、プロダクトイオンの構造、すなわちジスルフィド結合の有無やジスルフィド結合に由来する官能基(あるいは基)を考慮しながら、一つ一つのプロダクトイオンピークに関して質量の理論値を計算する必要があり、大変な手間がかかる上に困難を極める。しかも、得られたプロダクトイオンの多くは解析できない結果に終わってしまう。
【0074】
一方、本発明で還元性を示す物質を用いた場合は、プリカーサイオンがジスルフィド結合を有しないため、プロダクトイオンaとしては、通常の規則性を持ったフラグメンテーションにより生じるイオン(x−、y−、z−系列、a−、b−、c−系列及びそれに関連するプロダクトイオン)が得られる。すなわち、質量分析の前処理としてジスルフィド結合の還元・アルキル化を行った測定試料を解析するときと同様に、シンプルなスペクトルが得られる。従って、アミノ酸残基の質量のみを考慮するだけの、容易な解析が可能となる。
【0075】
ここで、ペプチド内の1箇所でフラグメンテーションが起こった結果、N末端側のフラグメントに電荷が保持される場合、そのプロダクトイオンは、a−、b−、c−系列イオンとして分類される。また、C末端側のフラグメントに電荷が保持される場合、そのプロダクトイオンは、x−、y−、z−系列として分類される。そして、下記式に例示されているように、これらのプロダクトイオンは、ペプチドのアミノ酸残基の番号を付して表記する。
【0076】
【化4】

【0077】
具体的には、自動又はマニュアルによるde novoSequencingによりジスルフィド結合が還元されたタンパク質又はペプチドのアミノ酸配列情報を得る。これによりシステイン残基の位置も確認する。
【0078】
本発明では、還元・アルキル化の前処理を行っていないにもかかわらず、還元・アルキル化の前処理を行ったときと同様の簡便さでアミノ酸配列の解析を行うことが可能になる。そして、従来からのアミノ酸配列解析用のソフトウェアが適応できるスペクトルを与えるため、たとえば市販のde novo Sequencing用ソフトウェアをそのまま使用することが可能になる。市販のde novo Sequencing用ソフトウェアとして、PEAKSTMなどが挙げられる。
【0079】
(v)ジスルフィド結合の位置の推定
本工程では、プロダクトイオンaとプロダクトイオンbとの質量差を利用して、ジスルフィド結合の位置を推定する。
【0080】
ここで、プロダクトイオンa群は、すでに述べたように、通常の規則性を持ったフラグメンテーションにより生じるイオン(x−、y−、z−系列、a−、b−、c−系列及びそれに関連するプロダクトイオン)が得られる。これらイオンは、y−/b−系列のイオンを中心として得られる。
【0081】
一方、プロダクトイオンb群は、従来法において、還元性を示す物質を用いない場合や、強い還元性を示さないマトリックスを用いた場合と同様に、さまざまな種類のプロダクトイオン種が入り混じる。すなわち、b群には、(1b)ジスルフィド結合を維持したもの、(2b)ジスルフィド結合に由来し且つシステイン残基のチオール基「−SH」のHが外れた「−S」に相当する基を生成するフラグメンテーションが起こったもの、(3b)ジスルフィド結合に由来し且つシステイン残基のチオール基に相当する「−SH」を生成するフラグメンテーションが起こったものなどが含まれる。さらに、ジスルフィド結合を維持した内部断片なども相対的に多く含まれ得る。
【0082】
このようなさまざまな種類のプロダクトイオンが含まれるプロダクトイオンb群から、例えば上記の(1b)、(2b)及び(3b)の形式を有するプロダクトイオンbのみを考慮する。(1b)、(2b)及び(3b)の形式を有するプロダクトイオンbについて、それらを生じたフラグメンテーションと、ジスルフィド結合の位置との関係を考慮すると、以下のように説明できる。なお、以下の説明では、ジスルフィド結合を1個有するタンパク質又はペプチドにおいて1箇所でフラグメンテーションが起こる、最もシンプルな場合を想定している。
【0083】
(1b)の形式のプロダクトイオンbは、プリカーサーイオンとして用いた分子量関連イオンBにおいて、ジスルフィド結合のN末端側のシステイン残基よりもN末端側でフラグメンテーションが起こった場合の、C末端側のイオン(例えばy−系列イオン)として生じる。また、(1b)の形式のプロダクトイオンbは、プリカーサーイオンとして用いた分子量関連イオンBにおいて、ジスルフィド結合のC末端側のシステイン残基よりもC末端側でフラグメンテーションが起こった場合の、N末端側のイオン(例えばb−系列イオン)としても生じる。
【0084】
(2b)及び(3b)の形式を有するプロダクトイオンbはいずれも、プリカーサーイオンとして用いた分子量関連イオンBにおいて、1個のジスルフィド結合を形成する2個のシステイン残基の間でフラグメンテーションが起こった場合の、C末端側/N末端側のイオン(例えばy−/b−系列イオン)として生じる。
【0085】
プロダクトイオンa群にも、上記(1b)、(2b)及び(3b)の形式のプロダクトイオンbにそれぞれ対応する、(1a)、(2a)及び(3a)の形式のプロダクトイオンaが含まれる。
【0086】
すなわち、(1a)の形式のプロダクトイオンaは、プリカーサーイオンとして用いた分子量関連イオンAにおいて、ジスルフィド結合のN末端側のシステイン残基よりもN末端側でフラグメンテーションが起こった場合の、C末端側のイオン(例えばy−系列イオン)として生じる。また、(1a)の形式のプロダクトイオンaは、プリカーサーイオンとして用いた分子量関連イオンAにおいて、ジスルフィド結合のC末端側のシステイン残基よりもC末端側でフラグメンテーションが起こった場合の、N末端側のイオン(例えばb−系列イオン)としても生じる。
それぞれの場合において、(1b)の形式のプロダクトイオンbとそれに対応する(1a)の形式のプロダクトイオンaとは、ジスルフィド結合が還元されているか否かという違いがあることを除いては、互いに同系列、同配列である。
【0087】
そして、(2a)の形式を有するプロダクトイオンaは、プリカーサーイオンとして用いた分子量関連イオンAにおいて、1個のジスルフィド結合を形成する2個のシステイン残基の間でフラグメンテーションが起こった場合の、C末端側/N末端側のイオン(例えばy−/b−系列イオン)として生じる。
この場合において、(2b)の形式のプロダクトイオンbとそれに対応する(2a)の形式のプロダクトイオンaとは、切断されたジスルフィド結合がさらに還元されているか否かという違いがあることを除いては、互いに同系列、同配列である。
【0088】
さらに、 (3a)の形式を有するプロダクトイオンaは、プリカーサーイオンとして用いた分子量関連イオンAにおいて、1個のジスルフィド結合を形成する2個のシステイン残基の間でフラグメンテーションが起こった場合の、C末端側/N末端側のイオン(例えばy−/b−系列イオン)として生じる。
この場合において、(3b)の形式のプロダクトイオンbとそれに対応する(3a)の形式のプロダクトイオンaとは、ジスルフィド結合が同じ形に切断されており、互いに同系列、同配列である。
【0089】
ここで、(1a)の形式のプロダクトイオンaと(1b)の形式のプロダクトイオンbとにおいて、両者が同系列のイオンの場合、双方の質量差は、理論的に2となる。
また、(2a)の形式のプロダクトイオンaと(2b)の形式のプロダクトイオンbとにおいて、両者が同系列のイオンの場合、双方の質量差は、理論的に1となる。
さらに、(3a)の形式のプロダクトイオンaと(3b)の形式のプロダクトイオンbとにおいて、両者が同系列のイオンの場合、双方の質量差は、理論的に0となる。
【0090】
上述のプロダクトイオン、すなわちジスルフィド結合に関与するシステイン残基を有するプロダクトイオンの他に、ジスルフィド結合に関与するシステイン残基を有しないプロダクトイオンについては、プロダクトイオンa及びbを、対応するもの同士で(すなわち同配列、同系列のもの同士で)比較すると、双方の質量差は、理論的に0となる。なお、ジスルフィド結合に関与するシステイン残基を有しないプロダクトイオンは具体的には以下のものが挙げられる。
【0091】
すなわち、プロダクトイオンaについては、プリカーサーイオンとして用いた分子量関連イオンAにおいて、ジスルフィド結合のN末端側のシステイン残基よりもN末端側でフラグメンテーションが起こった場合の、N末端側のイオン(例えばb−系列イオン)や;プリカーサーイオンとして用いた分子量関連イオンAにおいて、ジスルフィド結合のC末端側のシステイン残基よりもC末端側でフラグメンテーションが起こった場合の、C末端側のイオン(例えばy−系列イオン)。
【0092】
一方、プロダクトイオンbについては、プリカーサーイオンとして用いた分子量関連イオンBにおいて、ジスルフィド結合のN末端側のシステイン残基よりもN末端側でフラグメンテーションが起こった場合の、N末端側のイオン(例えばb−系列イオン)や;プリカーサーイオンとして用いた分子量関連イオンBにおいて、ジスルフィド結合のC末端側のシステイン残基よりもC末端側でフラグメンテーションが起こった場合の、C末端側のイオン(例えばy−系列イオン)。
【0093】
このような原理を利用し、互いに対応するプロダクトイオンaとプロダクトイオンbとの質量差を次々に算出していくと、ジスルフィド結合の位置を確認することができる。タンパク質又はペプチドは、プロダクトイオンとしてy系列及びb系列のものを中心に得られるため、y系列イオン及びb系列イオンの両方について質量差を算出していくと良い。
【0094】
本工程では、MS2測定で得られたプロダクトイオンから特定のイオンをプリカーサイオンとして選択してMS3測定を行うことで、より詳細な構造情報を得ることができる。同様に、MSn-1測定で得られたプロダクトイオンから特定のイオンをプリカーサイオンとして選択してMSn測定を行うことで、さらに詳細な構造情報を得ることができる。MSn測定を行うことで、より詳細な構造情報を得ることができる。MSn測定で得られるプロダクトイオンは、特定のプリカーサイオンに帰属できるので、分子量関連イオンピークについてのより正確な構造解析が可能となる。
【0095】
本発明によって、以下の効果が得られる。
・前処理の手間と時間が大幅に縮小される。
・前処理における調整の難しさや残留試薬の問題が軽減される。
・基本的に通常の質量分析と手順が同じであるため、操作が容易である。
・使用する試料の量が少なくてすむ。
【実施例】
【0096】
<実験例1>
測定試料として、図1に示すように、A鎖((A-chain:GIVEQCCASVCSLYQLENYCN(配列表の配列番号1),ジスルフィド結合CysA6-CysA11)とB鎖(B-chain:FVNQHLCGSHLVEALYLVCGERGFFYTPKA(配列表の配列番号2))とがジスルフィド結合CysA7-CysB7及びCysA20-CysB19で架橋した構造を有するInsulinを用い、還元性を示すマトリックスとして、ジアミノナフタレンの位置異性体3種、及び比較用として強い還元性を示さない2,5-dihydroxybenzoic acid(DHBA)をそれぞれ用いて、AXIMA−QIT(島津製作所)によりポジティブモード及びネガティブモードで質量分析を行った。本実験例で用いたジアミノナフタレンの位置異性体は、1,5-diaminonaphthalene(1,5−DAN)、1,8-diaminonaphthalene(1,8−DAN)、及び2,3-diaminonaphthalene(2,3−DAN)である。また、DHBAを用いた場合においては、還元性を有する物質は用いなかった。
【0097】
図1の(a−1)は、比較用のDHBAを用いた、ポジティブ(positive)モードでのMSスペクトル、(a−2)は、比較用のDHBAを用いた、ネガティブ(negative)モードでのMSスペクトル、(b−1)は、1,5−DANを用いた、ポジティブモードでのMSスペクトル、(b−2)は、1,5−DANを用いた、ネガティブモードでのMSスペクトル、(c−1)は、1,8−DANを用いた、ポジティブモードでのMSスペクトル、(c−2)は、1,8−DANを用いた、ネガティブモードでのMSスペクトル、(d−1)は、2,3−DANを用いた、ポジティブモードでのMSスペクトル、及び、(d−2)は、2,3−DANを用いた、ネガティブモードでのMSスペクトルである。なお、本明細書における全てのスペクトルにおいて、横軸は(質量/電荷)(m/z)、縦軸は相対強度(% Int.)を表す。
【0098】
DHBAを用いた結果によると、図1(a−1)及び(a−2)が示すように、主にInsulinの分子量関連イオンが検出された。これに対し、1,5−DANを用いた結果によると図1(b−1)及び(b−2)が示すように、主にA鎖及びB鎖の分子量関連イオンが検出された。これは、Insulin分子の架橋構造を形成していたジスルフィド結合が還元的に切断された結果、A鎖とB鎖とに分解されたことを示す。同じ結果が、1,8−DANを用いた場合(図1(c−1)及び(c−2))、及び、2,3−DANを用いた場合(図1(d−1)及び(d−2))においても得られた。
【0099】
さらに、この3種類のジアミノナフタレンを用いた結果を比較すると、1,5−DANが最も強いS/N比を示し、2,3−DANが最も強い還元性を持つことが確かめられた。なお、還元性については、Insulinの分子量関連イオンと、A鎖及びB鎖の分子量関連イオンとのピーク強度比を比較することにより行った。
【0100】
<実施例1>
測定試料として、ペプチドUrotensin II (human由来; アミノ酸配列:ETPDCFWKYCV(配列表の配列番号3), ジスルフィド結合:Cys5-Cys10, 分子式:C64H86N13O18, 分子量:1388.6, 最小質量による精密質量: 1387.6)を用いて、MALDI−TOF(マトリックス支援レーザー脱離イオン化飛行時間型)質量分析装置によりMSを、MALDI−QIT−TOF(マトリックス支援レーザー脱離イオン化四重極イオントラップ飛行時間型)質量分析装置(AXIMA−QIT(島津製作所))によって、MSと、MSで得られた分子量関連イオンをプリカーサイオンとしたMS/MSとを行った。マトリックスにDHBAを用いた場合と、1,5−DANを用いた場合とを、得られた結果について比較した。
【0101】
DHBAをマトリックスとして用いたMSスペクトルでは、分子量関連イオンBとして[M+H]+が主に得られた。一方、1,5−DANをマトリックスとして用いたMSスペクトルでは、分子量関連イオンAとして[M+H]+と共にそれ以上の強度で[M+2+H]+が主に得られた。分子量関連イオンA[M+2+H]+は、1,5−DANがジスルフィド結合を還元することにより生じた2つのチオール基の存在によるものと考えられる。ジスルフィド結合が還元されるごとに2つのチオール基を生じることから、m個のジスルフィド結合をもつタンパク質あるいはペプチドのジスルフィド結合が全て還元された場合、分子量関連イオンAは、プロトン化分子として生じる場合は[M+2m+H]+、金属イオンMetalが付加した分子として生じる場合は[M+2m+Metal]+として示すことができる。今回の試料Urotensin IIに対しては、m=1であるため、ジスルフィド結合は1個と推定できる。
【0102】
DHBAによる、[M+H]+をプレカーサイオン(Precursor ion)としたMS/MSスペクトルを図2に、1,5−DANによる、[M+2+H]+をプレカーサイオン(Precursor ion)MS/MSスペクトルを図3に示す。続いて、1,5−DANをマトリックスとして用いたMSで得られた分子量関連イオンA[M+2+H]+をプリカーサイオンとして行ったMS/MSで、得られたMS/MSスペクトルから、y/b−系列を中心とした多くの規則的な開裂を示すプロダクトイオンa(x−、y−、z−系列、及びa−、b−、c−系列及びそれに関連するイオン)を効率良く確認した。これにより、ペプチドUrotensin IIの全アミノ酸配列情報を得、同時にシステイン残基の位置を確認した。尚、このアミノ酸配列の解析は、de novo Sequencingによるマニュアル解析だけでなく、自動解析でも可能であった。
【0103】
さらに、1,5−DANによるMS/MSスペクトルで得られたプロダクトイオンaのうち、特にy−/b−系列イオン群と、DHBAによるMS/MSスペクトルで得られたプロダクトイオンbのうち、プロダクトイオンaのy−/b−系列イオンに対応するプロダクトイオン群とを比較すると、ジスルフィド結合の位置に特徴的な質量差を示した。具体的に、DHBA及び1,5−DANによって得られたそれぞれのy−系列イオンの質量数と、両質量数の差を以下の表に示した。
【0104】
【表1】

【0105】
また、DHBA及び1,5−DANによって得られたそれぞれのb−系列イオンの質量数と、両質量数の差を以下の表に示した。
【0106】
【表2】

【0107】
さらに、DHBA及び1,5−DANによって得られたそれぞれのy−H2O−系列イオンの質量数と、両質量数の差を以下の表に示した。
【0108】
【表3】

【0109】
そこで、本実施例で得られたこれらのプロダクトイオン(y−、b−、及びb−H2O−系列イオン)及びそれから導かれた質量差について、具体的にジスルフィド結合の位置と関連付けて示したものを以下の表に示す。なお、以下の表においては、b−H2O−系列イオンを、y6’、y7’・・・のように、「’」を付して表している。
【0110】
【表4】

【0111】
このように、ジスルフィド結合の位置に応じて、特徴的な質量差が示される。このように特徴的な質量差が示されることについて、以下に説明する。
【0112】
1,5−DANをマトリックスとして用いた場合は、プロダクトイオンaは、ジスルフィド結合が還元されて2つのシステイン残基上それぞれにチオール基(−SH)が存在する状態の質量数を与えて検出された。
【0113】
一方、DHBAをマトリックスとして用いた場合は、プロダクトイオンbは、(1b)ジスルフィド結合を含む形式、(2b)ジスルフィド結合が切断されチオール基の硫黄原子Sを1つ含む形式、(3b)ジスルフィド結合が切断されチオール基(−SH)が1つ存在する形式などを含め、複数の形式で検出された。本実施例では特に、DHBAによるプロダクトイオンbのうち、上記(1b)、(2b)及び(3b)の形式のもののみを考慮している。
【0114】
ここで、プロダクトイオンaのうち、(1b)の形式のプロダクトイオンbに対応するものを、(1a)の形式のプロダクトイオンaとし;(2b)の形式のプロダクトイオンbに対応するものを、(2a)の形式のプロダクトイオンaとし;(3b)の形式のプロダクトイオンbに対応するものを、(3a)の形式のプロダクトイオンaとする。
【0115】
1,5−DANによるMS/MSスペクトルで得られたプロダクトイオンaのうち、y−/b−系列イオン群と、DHBAによるMS/MSスペクトルで得られたプロダクトイオンbのうち、プロダクトイオンaのy−/b−系列イオンに対応するプロダクトイオン群とにおいて、対応するプロダクトイオン同士の質量差は、理論的には次の通りである。すなわち、(1b)の形式のプロダクトイオンbと、(1a)の形式のプロダクトイオンaとの間では、両者の質量差は2;(2b)の形式のプロダクトイオンbと、(2a)の形式のプロダクトイオンaとの間では、両者の質量差は1;(3b)の形式のプロダクトイオンbと、(3a)の形式のプロダクトイオンaとの間では、両者の質量差は0となると考えられる。
【0116】
これらの質量差を、ジスルフィド結合の位置と関連付けて説明すると、以下の通りである。
ジスルフィド結合を含むペプチドで1箇所切断が生じる場合、y−系列イオンは、ジスルフィド結合に関係するシステイン残基のうちN末端側残基までのペプチド骨格が開裂して生じるイオンであれば質量差2、ジスルフィド結合に関する2つのシステイン残基間のペプチド骨格が開裂して生じるイオンであれば質量差1か0となる。
【0117】
またこの場合、b−系列イオン及びb−H2O系列イオンは、ジスルフィド結合に関係するシステイン残基のうちC末端側の残基までのペプチド骨格が開裂して生じるイオンであれば質量差2、ジスルフィド結合に関する2つのシステイン残基間のペプチド骨格が開裂して生じるイオンであれば質量差1か0となる。
【0118】
本実施例で得られた各系列のイオンにおける質量差と、ジスルフィド結合の位置とについて、より簡潔に示したものを以下の表及び式に示す。
【0119】
【表5】

【0120】
【化5】

【0121】
このように、本実施例の試料Urotensin IIの場合、y系列イオンは、y4〜y6において質量差0か1、y7〜y11において質量差2である。このように、0又は1の質量差から2の質量差に切り替わったy7のC末端側に、ジスルフィド結合に関わるシステイン残基のうちN末端側の残基が位置することを確認した。また、b−系列イオンは、b7〜b9において質量差0か1、b10〜b11において質量差2である。このように、0又は1の質量差から2の質量差に切り替わったb10のN末端側に、ジスルフィド結合に関わるシステイン残基のうちC末端側の残基が位置することを確認した。これは、b−H2O−系列イオンがb6−H2O〜b9−H2Oにおいて質量差0、b10−H2O〜b11−H2Oにおいて質量差2であることからも確認できる。
【0122】
以上のように、ジスルフィド結合の数及び位置を解析することができた。
【0123】
<比較例1>
実施例1で得られたデータのうち、マトリックスとしてDHBAを用いて得られた図2のデータのみから、de novo Sequencingによるマニュアル解析と自動解析とのそれぞれの方法によって行った。de novo Sequencingによるマニュアル解析により得られた結果を図2中に示す。
【0124】
(de novo Sequencingによるマニュアル解析)
マトリックスとしてDHBAを用いると、MSによる分子量関連イオンが、ジスルフィド結合が維持された分子として得られる。このため、MS/MSによるプロダクトイオンは、ジスルフィド結合及びそれに由来するシステイン残基のチオール基の状態を考慮して質量の理論値を計算する必要がある。さまざまなプロダクトイオン種が入り混じっているため、de novo Sequencingによるマニュアル解析は大変困難な作業となった。
【0125】
図2中のy/b系列表示上に付された“*”は、そのイオンが、ジスルフィド結合(−S−S−)を含むプロダクトイオンであることを示す。また“**”は、そのイオンが、ジスルフィド結合に由来し且つシステイン残基のチオール基「−SH」のHが外れた硫黄原子「−S」に相当する官能基を1個有するプロダクトイオンであることを示す。さらに“***”は、そのイオンが、ジスルフィド結合に由来し且つシステイン残基のチオール基「−SH」に相当する官能基を1個有するプロダクトイオンであることを示す。図2中“?”を付したピークは、そのイオンが、解析できなかったプロダクトイオンであることを示す。このように比較例1ではプロダクトイオンの多くは解析できなかった。解析できなかったプロダクトイオンとしては、ジスルフィド結合が維持されたまま複数の部位で開裂したことにより生じたプロダクトイオン、或いは一般の開裂様式のプロダクトイオン(すなわちx−、y−、z−系列、a−、b−、c−系列及びそれに関連するプロダクトイオン群)に当てはまらないプロダクトイオンなどが考えられる。
【0126】
(de novo Sequencingによる自動解析)
一方、de novo Sequencingによる自動解析を行った場合は、配列のほとんどを解析することができなかった。例えば最高の結果でも、Urotensin IIのN末端側のETPという配列と、C末端側のアミノ酸Vとが解析された程度である。これは、ソフトウェアが、ジスルフィド結合が保持されている条件に対応していないため、ジスルフィド結合を持たない状態か、或いはジスルフィド結合が還元されてカルボアミドメチル化などの修飾を受けた状態としてのみ計算するためだと考えられる。しかも実際には、この結果においては、解析されたアミノ酸の情報さえも、間違ったイオンピークを選んで解析されていたことが判明した。
【図面の簡単な説明】
【0127】
【図1】実験例1で用いられた測定試料の構造、及び本発明のマトリックス3種を用いて得られたMSスペクトルである。
【図2】実施例1において、DBHAを用いることによって得られたMS/MSスペクトルである。
【図3】実験例1において、1,5−DANを用いることによって得られたMS/MSスペクトルである。
【特許請求の範囲】
【請求項1】
(i)MSの2乗以上が可能なLI(レーザーイオン化)質量分析装置により、ジスルフィド結合に対して還元性を示す物質を用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て、
(ii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し、
(iii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行い、前記分子量関連イオンAから複数のプロダクトイオンaを、前記分子量関連イオンBから複数のプロダクトイオンbを得て、
(iv)前記複数のプロダクトイオンaから前記タンパク質又はペプチドのアミノ酸配列情報を得て、
(v)前記複数のプロダクトイオンaの各々の質量数と、前記各々のプロダクトイオンaと同じ配列であり且つ同じ系列のプロダクトイオンbの質量数との差を求めることによって、前記タンパク質又はペプチドにおける前記ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【請求項2】
前記LI質量分析装置が、MALDI(マトリックス支援レーザー脱離イオン化型)質量分析装置である、請求項1に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項3】
前記ジスルフィド結合に対して還元性を示す物質が、ジスルフィド結合に対して還元性を示すマトリックスである、請求項2に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項4】
(i)MSの2乗以上が可能なMALDI質量分析装置により、ジスルフィド結合に対して還元性を示す物質、及び、前記物質が示す還元性より強い還元性を示さないマトリックスを用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て、
(ii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し、
(iii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行い、前記分子量関連イオンAから複数のプロダクトイオンaを、前記分子量関連イオンBから複数のプロダクトイオンbを得て、
(iv)前記複数のプロダクトイオンaから前記タンパク質又はペプチドのアミノ酸配列情報を得て、
(v)前記複数のプロダクトイオンaの各々の質量数と、前記各々のプロダクトイオンaと同じ配列であり且つ同じ系列のプロダクトイオンbの質量数との差を求めることによって、前記タンパク質又はペプチドにおける前記ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【請求項5】
前記ジスルフィド結合に対して還元性を示す物質が、ジスルフィド結合に対して還元性を示すマトリックスである、請求項4に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項6】
前記ジスルフィド結合に対して還元性を示す物質が、ジアミノナフタレンの位置異性体から選ばれる、請求項1〜5のいずれか1項に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項7】
前記ジスルフィド結合に対して還元性を示す物質が、1,5−ジアミノナフタレン、2,3−ジアミノナフタレン、及び1,8−ジアミノナフタレンからなる群から選ばれる、請求項1〜6のいずれか1項に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項8】
前記MALDI質量分析装置が、MALDI−QIT−TOF(マトリックス支援レーザー脱離イオン化四重極イオントラップ飛行時間型)質量分析装置である、請求項2〜7のいずれか1項に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項9】
前記タンパク質又はペプチドのアミノ酸配列情報を、de novo Sequencingの自動解析を行うことによって得る、請求項1〜8のいずれか1項に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項1】
(i)MSの2乗以上が可能なLI(レーザーイオン化)質量分析装置により、ジスルフィド結合に対して還元性を示す物質を用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て、
(ii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し、
(iii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行い、前記分子量関連イオンAから複数のプロダクトイオンaを、前記分子量関連イオンBから複数のプロダクトイオンbを得て、
(iv)前記複数のプロダクトイオンaから前記タンパク質又はペプチドのアミノ酸配列情報を得て、
(v)前記複数のプロダクトイオンaの各々の質量数と、前記各々のプロダクトイオンaと同じ配列であり且つ同じ系列のプロダクトイオンbの質量数との差を求めることによって、前記タンパク質又はペプチドにおける前記ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【請求項2】
前記LI質量分析装置が、MALDI(マトリックス支援レーザー脱離イオン化型)質量分析装置である、請求項1に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項3】
前記ジスルフィド結合に対して還元性を示す物質が、ジスルフィド結合に対して還元性を示すマトリックスである、請求項2に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項4】
(i)MSの2乗以上が可能なMALDI質量分析装置により、ジスルフィド結合に対して還元性を示す物質、及び、前記物質が示す還元性より強い還元性を示さないマトリックスを用いてタンパク質又はペプチドのMSを行い、ジスルフィド結合が還元された分子量関連イオンAとジスルフィド結合が還元されていない分子量関連イオンBとを得て、
(ii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとの質量差を算出し、算出された質量差からジスルフィド結合の数を推定し、
(iii)前記ジスルフィド結合が還元された分子量関連イオンAと、前記ジスルフィド結合が還元されていない分子量関連イオンBとをそれぞれプリカーサーイオンとして選択し、選択されたプリカーサーイオンについてそれぞれMSnを行い、前記分子量関連イオンAから複数のプロダクトイオンaを、前記分子量関連イオンBから複数のプロダクトイオンbを得て、
(iv)前記複数のプロダクトイオンaから前記タンパク質又はペプチドのアミノ酸配列情報を得て、
(v)前記複数のプロダクトイオンaの各々の質量数と、前記各々のプロダクトイオンaと同じ配列であり且つ同じ系列のプロダクトイオンbの質量数との差を求めることによって、前記タンパク質又はペプチドにおける前記ジスルフィド結合の位置を推定する、タンパク質又はペプチドのジスルフィドマッピング法。
【請求項5】
前記ジスルフィド結合に対して還元性を示す物質が、ジスルフィド結合に対して還元性を示すマトリックスである、請求項4に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項6】
前記ジスルフィド結合に対して還元性を示す物質が、ジアミノナフタレンの位置異性体から選ばれる、請求項1〜5のいずれか1項に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項7】
前記ジスルフィド結合に対して還元性を示す物質が、1,5−ジアミノナフタレン、2,3−ジアミノナフタレン、及び1,8−ジアミノナフタレンからなる群から選ばれる、請求項1〜6のいずれか1項に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項8】
前記MALDI質量分析装置が、MALDI−QIT−TOF(マトリックス支援レーザー脱離イオン化四重極イオントラップ飛行時間型)質量分析装置である、請求項2〜7のいずれか1項に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【請求項9】
前記タンパク質又はペプチドのアミノ酸配列情報を、de novo Sequencingの自動解析を行うことによって得る、請求項1〜8のいずれか1項に記載のタンパク質又はペプチドのジスルフィドマッピング法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2006−292603(P2006−292603A)
【公開日】平成18年10月26日(2006.10.26)
【国際特許分類】
【出願番号】特願2005−115345(P2005−115345)
【出願日】平成17年4月13日(2005.4.13)
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
【公開日】平成18年10月26日(2006.10.26)
【国際特許分類】
【出願日】平成17年4月13日(2005.4.13)
【出願人】(000001993)株式会社島津製作所 (3,708)
【Fターム(参考)】
[ Back to top ]

