酢酸バゼドキシフェンの多形フォームD及びその製造方法
【課題】 酢酸バゼドキシフェンの製造のし易さ、安定性、溶解性、貯蔵安定性、製剤化のし易さ、及びin vivo薬理学のいずれかにおける改善をもたらす結晶を提供することを目的とする。
【解決手段】 本開示は、特定の粉末X線回折パターンを有する酢酸バゼドキシフェンの多形フォームD、それを用いた医薬組成物及び治療方法、並びにその製造方法に関する。
【解決手段】 本開示は、特定の粉末X線回折パターンを有する酢酸バゼドキシフェンの多形フォームD、それを用いた医薬組成物及び治療方法、並びにその製造方法に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本開示は、酢酸バゼドキシフェンの新規な多形フォーム、多形フォームの製造方法、及び多形フォームを用いる組成物及び治療方法に関する。
【背景技術】
【0002】
酢酸バゼドキシフェンは、(1−[4−(2−アゼパン−1−イル−エトキシ)−ベンジル]−2−(4−ヒドロキシ−フェニル)−3−メチル−1H−インドール−5−オール・酢酸塩)の化学名を有し、そしてその化学構造は下記の通りである。
【化1】

【0003】
酢酸バゼドキシフェンは、一般的に選択的エストロゲン受容体調節剤(SERM)と呼ばれる薬剤の種類に属する。その分類通り、バゼドキシフェンはエストロゲン受容体(ER)に対して親和性を呈し、しかも組織選択性エストロゲン効果を示す。例えば、酢酸バゼドキシフェンは、子宮刺激の前臨床モデルにおいて子宮反応の刺激をほとんど又は全然示さない。逆に、酢酸バゼドキシフェンは、骨減少症の卵巣切除ラットモデルにおける骨量減少予防及びコレステロール低減にエストロゲンアゴニスト様効果を示す。MCF‐7細胞系(ヒト乳がん細胞系)では、酢酸バゼドキシフェンはエストロゲンアンタゴニストとして作用する。これらのデータは、酢酸バゼドキシフェンが骨及び心血管の脂質パラメータに対してはエストロゲン性であり、子宮及び乳房組織に対しては抗エストロゲン性であり、従って、エストロゲン受容体が関与する多数の疾患又は疾患様病態を治療する可能性を有することを実証する。酢酸バゼドキシフェンの生物活性の更に詳細な説明については、例えば、特許文献1及び2、並びに非特許文献1を参照されたい。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】米国特許第5998402号
【特許文献2】米国特許第6479535号
【非特許文献】
【0005】
【非特許文献1】Miller, et al., Drugs of the Future, 2002, 27(2), 117-121
【発明の概要】
【発明が解決しようとする課題】
【0006】
特定の薬剤の結晶多形フォームが、薬剤の製造し易さ、安定性、溶解性、貯蔵安定性、製剤化のし易さ、及びin vivo薬理学の重要な決定因子になることは周知である。多形フォームは、同じ物質の組成物が異なる格子配列で結晶化し、特定の多形フォームに特異的な異なる熱力学特性及び安定性をもたらす場合に生じる。所定の化合物の種々の多形は、溶解度及び解離、真の密度、結晶形状、圧密挙動、流動性、及び/又は固体状態安定性などの1つ又はそれ以上の物理的性質に関して互いに異なってもよい。2つ又はそれ以上の多形性物質が製造し得る場合には、各多形を純品にする方法を有することが望ましい。どの多形が所定の状態で好ましいかを決定するに当って、多形の多数の性質を比較し、そして好ましい多形が多くの物理特性変数に基づいて選択されるべきである。製造し易さ、安定性などの特定の側面が重視される特定の状況では、1つの多形同が好ましくなり得ることは全く可能である。他の状況では、例えば、より大きい溶解度及び/又はより優れた薬物動力学のために異なる多形が優先されてもよい。しかしながら、どの多形フォームが特定の条件下で結晶化するかを予測するのは困難なだけでなく、1つの多形フォームから別の多形フォームへの変換を防ぐ条件を見出すのは困難であることから、薬剤の多形フォームを製造することは多くの課題を伴う。
【0007】
特に明記しない限り、本明細書で使用されるすべての技術的及び科学的用語は、本開示が属する分野の当業者によって一般的に理解されるのと同じ意味を有する。本明細書に記載のものと類似の又は同等の方法及び物質は、本開示の実施又は試験において使用することができるが、好適な方法及び物質は下記のとおりである。本明細書に記載のすべての刊行物、特許出願、特許、及び他の参考文献は、参照することによりその全文が本明細書に組み入れられている。加えて、物質、方法、及び実施例は説明のためだけのものであり、限定することを意図するものではない。
【課題を解決するための手段】
【0008】
多形が実質的に純粋なフォームDの多形である、酢酸バゼドキシフェンの多形が本明細書に開示されている。フォームDを、1つ又はそれ以上の他の多形結晶フォーム又は非晶相、例えば、酢酸バゼドキシフェンのフォームA〜Cと組み合わせて含む組成物をも意図している。また、酢酸バゼドキシフェンの多形フォームDの製造方法、フォームDを含む医薬組成物、及びそれを用いる治療方法が提供される。
【0009】
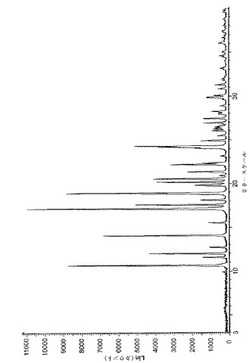
1つの態様では、本開示は、2θを単位として約10.6°、14.0°、17.1°、17.5°及び24.2°において特徴的なピークを含むX線粉末回折(XRPD)パターンを有するフォームDの結晶多形を提供する。少なくとも幾つかの実施態様では、多形は実質的に図1に示すようなXRPDパターンを有する。幾つかの実施態様では、多形は実質的に図2に示すようなラマンスペクトルを有する。少なくとも幾つかの実施態様では、多形は実質的に図3に示すような示差走査熱量測定(DSC)トレースを有する。少なくとも複数の実施態様では、多形は約166℃及び168℃の間のガラス転移温度を有する。
【0010】
本開示は、更に、酢酸バゼドキシフェンの多形フォームD及び薬学的に許容される担体を含む組成物を提供する。幾つかの実施態様では、薬学的に許容される担体は経口投与に適しており、そして組成物は経口投与形態を含む。幾つかの実施態様では、組成物中の総酢酸バゼドキシフェンの少なくとも約50〜90質量%は、多形フォームDとして存在する。更なる実施態様では、組成物中の総酢酸バゼドキシフェンの少なくとも約70質量%、少なくとも約80質量%、又は少なくとも約90質量%は、多形として存在する。また、少なくとも約97〜99質量%の酢酸バゼドキシフェンが多形フォームDとして組成物中に存在する、本質的に酢酸バゼドキシフェンから成る組成物が本開示によって提供される。
【0011】
他の態様では、本開示は、酢酸バゼドキシフェンのフォームDを含有する組成物の有効量を投与することを含む、それを必要とする動物におけるエストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害を治療する方法を提供する。幾つかの実施態様では、エストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害は、骨粗鬆症、前立腺肥大、男性型禿頭症、膣及び皮膚萎縮、アクネ、不正子宮出血、子宮内膜ポリープ、良性乳房疾患、子宮平滑筋腫、腺筋症、卵巣がん、不妊症、乳がん、子宮内膜症、子宮内膜がん、多嚢胞性卵巣症候群、心血管疾患、避妊、アルツハイマー病、認知低下、メラノーマ、前立腺がん、結腸がん、及びCNSがんから成る群から選択される。
【0012】
別の態様では、本開示は、酢酸バゼドキシフェンのフォームDを含有する組成物の有効量を投与することを含む、それを必要とする動物における子宮内膜組織の増殖又は発達異常に関連する疾患又は障害を治療する方法を提供する。幾つかの実施態様では、子宮内膜組織の増殖又は発達異常に関連する疾患又は障害は、子宮内膜ポリープ、子宮内膜症、及び子宮内膜がんから成る群から選択される。
【0013】
別の実施態様では、本開示は、酢酸バゼドキシフェンのフォームDを含有する組成物の有効量を投与することを含む、それを必要とする動物において、コレステロールを低下させ、骨量減少を抑制し、又は乳がんを治療する方法を提供する。幾つかの実施態様では、骨量減少は、骨粗鬆症、骨減少症、変形性関節症、低カルシウム血症、高カルシウム血症、パジェット病、骨軟化症、骨石灰脱失症、多発性骨髄腫及びがんから成る群から選択される疾患又は障害に起因する。
【0014】
尚別の実施態様では、本開示は、酢酸バゼドキシフェンのフォームDを含有する組成物の有効量を投与することを含む、それを必要とする動物における、周閉経期の、閉経期の、又は閉経期後の症状を治療する方法を提供する。幾つかの実施態様では、周閉経期の、閉経期の、又は閉経期後の症状は顔面潮紅などの血管運動障害である。
【0015】
本開示は、また、酢酸バゼドキシフェンの多形フォームDを製造する方法であって、
(a)ヘキサメチレンイミノベンジルオキシインドールを、エタノールを含む溶媒中で、触媒の存在下、高温下に水素と接触させ、遊離塩基のバゼドキシフェンを含む第1の反応混合物を得、ここで、第1の反応混合物は、実施的にヘキサメチレンイミノベンジルオキシインドールを含まず;
(b)該第1の反応混合物を抗酸化剤で処理して第2の反応混合物を得;
(c)該第2の反応混合物を濾過して、遊離塩基のバゼドキシフェンを含む溶液を得;そして
(d)該溶液を酢酸で処理して、酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む方法を提供する。
【0016】
更なる態様において、本開示は、本明細書に記載した方法に従って製造された酢酸バゼドキシフェンの多形フォームDに関する。
【0017】
本開示のその他の特徴及び利点は、詳細な明細書、図面及び特許請求範囲から明白であろう。
【図面の簡単な説明】
【0018】
【図1】酢酸バゼドキシフェンの多形フォームDのX線粉末回折(XRPD)のパターンを示す。
【図2−1】酢酸バゼドキシフェンの多形フォームDの特徴的なラマン・スペクトルを示す。
【図2−2】図2−1の続きである。
【図3】酢酸バゼドキシフェンの多形フォームDの特徴的なDSCサーモグラムを示す。
【図4】結晶化混合溶媒中での酢酸バゼドキシフェンの溶解度を示す。
【図5】スラリーテスト溶媒中での酢酸バゼドキシフェンの溶解度を示す。
【図6】酢酸バゼドキシフェンのフォームA、B及びDのXRPD回折図形を示す。
【発明を実施するための形態】
【0019】
本発明は、新規な1−[4−(2−アゼパン−1−イル−エトキシ)−ベンジル]−2−(4−ヒドロキシ−フェニル)−3−メチル−1H−インドール−5−オール・酢酸(酢酸バゼドキシフェン)化合物の多形フォームDを提供し、それは以下の式を有する。
【化2】

【0020】
本開示の多形フォームDに加えて、酢酸バゼドキシフェンのその他の公知の多形としては、結晶性多形フォームA及びB、並びに非晶性のフォームCが挙げられる。
【0021】
本明細書で用いる「多形」とは、同一化合物の異なる結晶形態を意味し、そして同一化合物の水和物及び溶媒和物を含むその他の固体状態の分子形態をも含むが、しかしそれらに限定されない。与えられた化合物の異なる多形は、溶解度、解離、真の密度、結晶形状、圧密挙動、流動特性、及び/又は固体状態の安定性などの1つ又はそれ以上の物理的性質に関して互いに異なるものである。不安定な多形は、一般的には、与えられた温度で、十分な時間が過ぎた後、より熱力学的に安定なフォームに変換する。準安定なフォームは、ゆっくりと安定なフォームに変換する不安定な多形である。一般的に、安定なフォームは、最も高い融点と、最も高い化学的安定性を示すが、しかし準安定なフォームは、また、薬学的に許容可能な状態にするための十分な化学的、物理的安定性を有する。本明細書で使用される「化学的安定性」とは、熱安定性、光安定性及び湿気に対する安定性を含むが、それらに限定されないある特定の化学的性質の安定性を意味する。
【0022】
酢酸バゼドキシフェンの多形フォームDは、幾つかの実施態様においては、実質的に純粋であり、その多形フォームが、その他の多形フォームの酢酸バゼドキシフェンを含む不純物を、約15質量%未満、約10質量%未満、約5質量%未満、又は約1質量%未満含むことを意味する。
【0023】
多形フォームDは、また、混合物として存在し得る。幾つかの実施態様において、多形フォームDは、その他の多形フォームA、及び/又はB、及び/又は非晶性の酢酸バゼドキシフェン(フォームC)との混合物として存在し得る。複数の多形フォームを含む組成物は、いかなる好適な方法によっても製造可能であり、本明細書で記載されるように製造されるフォームDと、例えば、国際公開第2005/100316号、国際公開第2005/100314号、及び米国特許仮出願第61/027,725号においてこれまでに記載されたいずれかの方法に従って作られる、実質的に純粋なフォームA及び/又はBとの混合物を含む。ここで、これらの各開示は、参照することによりそれらの全文が本明細書に取り込まれている。組成物中の酢酸バゼドキシフェンの多形フォームのそれぞれの量は、X線粉末回折、又は示差走査熱量測定分析などのいかなる好適なスペクトル分析法によっても分析可能である。
【0024】
多形フォームDは、1つ又はそれ以上の固相分析方法で同定可能である。例えば、フォームDは、図1に実質的に示されるような粉末X線回折パターンにより同定可能である。フォームDに一致する粉末X線回折データは、下記の表1に提供される。当業者には当然のことながら、ピークの相対強度は、試料の調製技術、試料の取り付け手順及び採用した特別な機器に依存して変わり得る。その上、機器のばらつき及びその他の因子は、2θ値にある程度影響を与え得る。
【0025】
【表1】

【0026】
【表2】

【0027】
多形フォームDは、また、図2に実質的に示すようなその特徴的なラマン・スペクトルによっても同定可能である。幾つかの実施態様において、フォームDは、約1,561cm-1、約1,589cm-1及び約1,613cm-1から選択される1つ又はそれ以上の特徴的ピークを有するラマンスペクトルによって特徴付けられる。
【0028】
多形フォームDは、また、図3に実質的に示すようなその特徴的なDSCトレースによっても同定可能である。少なくとも幾つかの実施態様において、フォームDは、約166℃と約168℃の間のガラス転移温度によって特徴付けられる。当業者には当然のことであるが、加熱速度、即ち、DSC分析が行われる走査速度、用いられる較正標準、機器較正、相対湿度、及び相対純度に依存して、多形の吸熱は、約0.01〜10℃又は約0〜5℃だけ、測定される吸熱の高温側か又は低温側に変化する。観察される吸熱は、また、いずれの与えられた試料に対しても、機器間である程度は異なる可能性がある。
【0029】
投与の目的ために、酢酸バゼドキシフェンの多形フォームDは、実質的に純品で製剤化するか、又は医薬組成物として酢酸バゼドキシフェンの他の多形性結晶又は非晶形と混合してもよい。特定の実施態様における医薬組成物は、1つ又はそれ以上の多形の酢酸バゼドキシフェン及び薬学的に許容される担体を含み、ここで、酢酸バゼドキシフェンは、関係する病態、疾患又は障害を治療するのに有効な量で組成物中に存在する。本明細書で使用される病態の「治療」は、症状及び/又は病状の部分的な又は完全な予防及び/又は改善を含む。治療用組成物における本明細書に記載の化合物の濃度は、投与する薬剤の用量及び投与経路を含む多数の因子に応じて変動してもよい。適切な濃度及び用量は当業者によって容易に決定し得る。
【0030】
少なくとも幾つかの実施態様では、酢酸バゼドキシフェンは、2日毎に1回から週1回の範囲で拡大投与計画に従って投与してもよい。所定の投与計画での用量は、一度に又は同日に複数回投与することができる。個々の患者のニーズによって、酢酸バゼドキシフェンは2日毎に、3日毎に、4日毎に、5日毎に、6日毎に、又は7日毎(週1回)に投与してもよい。投与期間は患者のニーズによって調整してもよく、そして拡大投与計画に従って投与することも考えられる。
【0031】
例えば、用量は隔日に1回投与してもよく、次いで医学的フォローアップ後3日毎、そして最終的には週1回投与するように調整してもよい。拡大投与計画では週1回投与してもよく、その場合に週用量は、単回投与として1日に投与するか、又は同日中に2回又はそれ以上の回数に分割して投与してもよい。
【0032】
少なくとも幾つかの実施態様では、ヒトでの酢酸バゼドキシフェンの1日投与量は、約5〜80mgの間である。酢酸バゼドキシフェンを週1回投与する場合、少なくとも幾つかの実施態様における週1回投与の用量は、1日投与量の約3〜15倍量からである。従って、少なくとも幾つかの実施態様では、週1回の経口投与量は、約15及び1,200mgの間で週1回投与されてよい;その投薬量は、投与日中に1回又はそれ以上の回数で投与される。
【0033】
幾つかの実施態様では、組成物中の総酢酸バゼドキシフェンの少なくとも約50〜99質量%は、本明細書に記載のように調製された多形フォームDの酢酸バゼドキシフェンとして存在する。更なる実施態様では、組成物中の総酢酸バゼドキシフェンの少なくとも約70質量%、少なくとも約80質量%、少なくとも約90質量%、少なくとも約95質量%、少なくとも約97質量%、少なくとも約98質量%、少なくとも約99質量%、少なくとも約99.5質量%、又は少なくとも約99.9質量%は、多形フォームDとして存在する。また、少なくとも約97〜99質量%の酢酸バゼドキシフェンが多形フォームDとして組成物中に存在する、本質的に酢酸バゼドキシフェンから成る組成物が、本開示によって提供される。
【0034】
本開示の方法は、本明細書に記載の多形での、例えば、医薬組成物の形態での全身投与を含む。これらの方法は、酢酸バゼドキシフェンの多形及び薬学的に許容される担体を含む医薬組成物の有効量を、それを必要とする動物に投与する工程を含む。当業者は、適切な方法で、そしてRemington's Pharmaceutical Sciences (Gennaro, Ed., Mack Publishing Co., Pa. 1990)に記載の慣例に従って、組成物を製剤化してもよい。酢酸バゼドキシフェンの好適な製剤の例は、国際公開公報第0203987号、国際公開公報第03105834号、及び国際公開公報第07024961号に記載の例を含み、各開示内容は参照することによりその全文が本明細書に組み入れられている。
【0035】
本開示の活性化合物を含む経口製剤は、錠剤、カプセル剤、バッカル剤、トローチ剤及びロゼンジを含む、通常使用されているいずれの経口剤形を含んでもよい。カプセル剤は、薬学的に許容される澱粉(例えば、トウモロコシ、ジャガイモ又はタピオカ澱粉)、砂糖、人工甘味剤、結晶及び微結晶セルロースなどの粉末セルロース、小麦粉、ゼラチン、ガムなどの不活性充填剤及び/又は賦形剤と1つ又は複数の活性化合物との混合物を含むことができる。有用な錠剤製剤は、従来型圧縮法、湿式造粒法又は乾式造粒法によって作られ、そしてステアリン酸マグネシウム、ステアリン酸、タルク、ラウリル硫酸ナトリウム、微結晶セルロース、30カルボキシメチルセルロースカルシウム、ポリビニルピロリドン、ゼラチン、アルギン酸、アカシアガム、キサンタンガム、クエン酸ナトリウム、複合珪酸塩、炭酸カルシウム、グリシン、デキストリン、蔗糖、ソルビトール、第二リン酸カルシウム、硫酸カルシウム、乳糖、カオリン、マンニトール、塩化ナトリウム、乾燥澱粉及び粉末砂糖を含む、薬学的に許容される賦形剤、結合剤、滑沢剤、崩壊剤、懸濁化又は安定化剤を使用してもよいが、それらに限定されない。本明細書に記載の経口製剤は、1つ又は複数の活性化合物の吸収を変えるために、標準的な徐放性又は持続放出製剤を用いてもよい。坐剤製剤は、坐剤の融点を変えるためにろうの添加有り/無しのカカオバター、及びグリセリンを含む、伝統的材料から作ることができる。種々の分子量のポリエチレングリコールなどの水溶性坐剤基剤を使用してもよい。
【0036】
米国特許第5998402号に記載のように、バゼドキシフェン及びその塩は、エストロゲン受容体に親和性を有する選択的エストロゲン・アゴニストである。他のタイプのエストロゲン・アゴニストと異なり、バゼドキシフェン及びその塩は子宮において抗エストロゲン性であり、子宮組織においてエストロゲン・アゴニストの栄養作用に拮抗することができる。従って、酢酸バゼドキシフェンの多形及びそれを含む組成物は、エストロゲン欠乏又はエストロゲン過剰に関連する症状又は症候の治療に関連する、多くの使用法を見出すことができる。幾つかの態様では、本開示は、エストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害を治療する方法を提供する。エストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害は、骨量減少、骨粗鬆症、前立腺肥大、男性型禿頭症、膣及び皮膚萎縮、アクネ、不正子宮出血、子宮内膜ポリープ、良性乳房疾患、子宮平滑筋腫、腺筋症、卵巣がん、不妊症、乳がん、子宮内膜症、子宮内膜がん、多嚢胞性卵巣症候群、心血管疾患、避妊、アルツハイマー病、認知低下及び他のCNS障害、並びにメラノーマ、前立腺がん、結腸がん、及びCNSがんなどを含む特定のがんを含む。
【0037】
酢酸バゼドキシフェンの多形は、子宮内膜若しくは子宮内膜様組織の増殖又は発達、作用若しくは成長の異常に起因する疾患又は障害の治療方法にも使用することができる。幾つかの実施態様では、本開示は、子宮内膜組織の増殖又は発達異常に関連する疾患又は障害を治療する方法を提供する。子宮内膜組織の増殖又は発達異常に関連する疾患又は障害は、子宮内膜ポリープ、子宮内膜症、及び子宮内膜がんを含む。
【0038】
本開示の多形は、骨量減少を抑制する方法に使用することもできる。骨量減少は、しばしば新しい骨組織の個人の形成不均衡及び老齢組織の吸収に起因し、純骨減少をもたらす。当該骨枯渇は個人の範囲で、例えば、閉経後女性(例えば、閉経後骨粗鬆症又は骨減少症を経験している女性)、両側卵巣摘出を受けている女性、長期コルチコイド療法を受けている又は受けた女性、性腺発育障害を経験している女性、及びクッシング症候群を患っている女性に起こり得る。歯及び口腔骨置換を含む骨の特別なニーズについては、骨折、骨構造欠損を有する個人、及び骨関連手術及び/又は補綴物移植を受けているヒトでは、多形を用いて処置を施すことができる。上記の問題に加えて、幾つかの実施態様では、多形は、骨粗鬆症、骨減少症、変形性関節症、低カルシウム血症、高カルシウム血症、パジェット病、骨軟化症、骨石灰脱失症、多発性骨髄腫及び骨組織に対して有害作用を有する他のがんの治療に使用することができる。
【0039】
酢酸バゼドキシフェンの多形フォームは、コレステロールを低下させ、そして乳がんを治療する方法にも使用することができる。加えて、多形は、周閉経期の、閉経期の、又は閉経期後の症状を治療するために使用することができる。幾つかの実施態様では、多形は、閉経前女性の避妊、並びに閉経後女性(顔面潮紅などの血管運動障害の治療など)又はエストロゲン補充が有益な他のエストロゲン欠乏状態におけるホルモン補充療法に使用することができる。多形は、白血病、子宮内膜剥離、慢性腎臓若しくは肝臓疾患、又は凝固疾患若しくは障害などの、無月経が有利な病状においても使用することができる。
【0040】
1つの態様において、本開示は、酢酸バゼドキシフェンの多形フォームDを製造する方法であって:
(a)酢酸バゼドキシフェンの多形フォームAを、酢酸エチルを含む溶媒中に高温下で溶解して溶液を生成させ;そして
(b)溶液を冷却して、酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む方法を提供する。
【0041】
ある実施態様において、本明細書に記載された方法の工程(a)における上記高温は、約30℃又はそれ以上である。ある別の実施態様において、高温は、約40℃又はそれ以上である。ある別の実施態様において、高温は、約50℃又はそれ以上である。ある別の実施態様において、高温は、約60℃又はそれ以上である。
【0042】
ある別の実施態様において、本明細書に記載された方法の工程(a)は、抗酸化剤の存在下で実施される。幾つかの実施態様において、抗酸化剤はアスコルビン酸である。
【0043】
ある別の実施態様において、本明細書に記載された方法の工程(b)における溶液は、約40℃以下に冷却される。幾つかの実施態様において、溶液は約30℃以下に冷却される。ある別の実施態様において、溶液は約0℃〜約30℃の間に冷却される。
【0044】
ある実施態様において、本明細書に記載された方法の工程(b)における結晶化は、酢酸バゼドキシフェンの多形フォームDの種結晶添加により促進される。
【0045】
1つの態様において、本開示は、酢酸バゼドキシフェンの多形フォームDの製造方法であって:
(a)ヘキサメチレンイミノベンジルオキシインドールを、エタノールを含む溶媒中で、触媒の存在下、高温下で水素と接触させ、遊離塩基のバゼドキシフェンを含む第1の反応混合物を得、ここで、第1の反応混合物は、実質的にヘキサメチレンイミノベンジルオキシインドールを含まず;
(b)該第1の反応混合物を抗酸化剤で処理して第2の反応混合物を得;
(c)該第2の反応混合物を濾過して、遊離塩基のバゼドキシフェンを含む溶液(即ち、酢酸を含まないバゼドキシフェン)を得;そして
(d)該溶液を酢酸で処理して酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む方法を提供する。
【0046】
ある実施態様において、上記の本明細書に記載された方法の工程(a)における溶媒は、エタノールに加えて、酢酸エチル、アセトン、シクロヘキサン及びメタノールから成る群から選択される少なくとも1つの溶媒、例えば、エタノール−酢酸エチル、エタノール−アセトン−シクロヘキサン及びエタノール−メタノール−シクロヘキサンを更に含む。1つの実施態様において、溶媒はエタノール及び酢酸エチルを含む。
【0047】
ある実施態様において、上記の本明細書に記載された方法の工程(a)は、約10時間未満で完了する。ある別の実施態様において、工程(a)は、約6時間未満で完了する。更なる実施態様において、工程(a)は、約4時間未満、例えば、約3時間又は約2時間未満で完了する。
【0048】
ある実施態様において、上記の本明細書に記載された方法の工程(a)における水素分圧は、少なくとも約4バールである。ある別の実施態様において、工程(a)における水素分圧は、少なくとも約5バールである。
【0049】
ある実施態様において、上記の本明細書に記載された方法の工程(a)における触媒は、Pd/C触媒である。1つの実施態様において、使用されるPd/C触媒は、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約12mmol未満の量である。別の実施態様において、使用されるPd/C触媒は、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約6mmol未満の量である。別の実施態様において、使用されるPd/C触媒は、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約3mmol未満の量である。
【0050】
更なる実施態様において、Pd/C触媒は、約1、100m2/g以上の全表面積(B.E.T法)を有する。1つの実施態様において、Pd/C触媒は、約1,500m2/gを超える全表面積(B.E.T法)を有する。「B.E.T」は、 Brunauer-Emmett-Tellerを意味し、1〜20m2/gの大きい表面積の物質に適用される表面積測定技法であり、圧力の関数(単分子層被覆)として吸着される気体(例えば、低温でのN2)に基づく(例えば:G.A.Somorjai, Principles of Surface Chemistry, Prentice-Hall, Englewood Cliffs, NJ, 1972, p.216を参照)。
【0051】
1つの実施態様において、Pd/Cは、湿潤性炭素上の非還元性Pdであり、例えば、BASFの触媒、5%Pd/Carbon Powder DeLink、コード番号:57494652である。別の実施態様において、Pd/C触媒は、5%Pd/Carbon Powder DeLink、コード番号:57489193である。両方の触媒は、BASF Catalysts LLC, Iselin, NJから購入可能である。
【0052】
これら2つの典型的な触媒は、異なった物理−化学的特性を示す。下記の表2は2つの触媒の主要な特性値を示す。
【表3】

【0053】
ある実施態様において、上記の本明細書に記載された方法の工程(a)は、約20℃以上の温度で行なわれる。ある別の実施態様において、上記の本明細書に記載された方法の工程(a)は、約30℃以上の温度で行なわれる。ある別の実施態様において、上記の本明細書に記載された方法の工程(a)は、約40℃以上の温度で行なわれる。ある実施態様において、上記の本明細書に記載された方法の工程(a)は、約50℃の温度で行なわれる。
【0054】
ある実施態様において、上記の本明細書に記載された方法の工程(b)における該酸化剤はアスコルビン酸である、
【0055】
ある実施態様において、上記の本明細書に記載された方法の工程(d)は、酢酸バゼドキシフェンの多形フォームAの種結晶を添加することにより促進される。ある実施態様において、工程(d)は、約40℃の温度で行なわれる。ある実施態様において、工程(d)は、約30℃以下の温度で行なわれる。ある実施態様において、工程(d)は、約20℃〜約35℃の温度範囲で行なわれる。ある実施態様において、工程(d)は、約25℃〜約30℃の温度範囲で行なわれる。ある別の実施態様において、工程(d)は、約28℃〜約30℃の温度範囲で行なわれる。
【0056】
ある実施態様において、上記の本明細書に記載された方法の工程(d)は、約4時間未満で完了する。ある実施態様において、工程(d)は、約3時間未満で完了する。ある実施態様において、工程(d)は、約2時間未満で完了する。ある実施態様において、工程(d)は、約0.1時間〜約3時間で完了する。ある実施態様において、工程(d)は、約0.5時間〜約3時間で完了する。
【0057】
ある実施態様において、上記の本明細書に記載された方法の工程(a)〜(d)は、不活性気体の雰囲気下で実施される。不活性気体の非限定的な例としては、窒素、アルゴンなどが挙げられる。
【0058】
ある実施態様において、上記の本明細書に記載された方法の工程(d)において得られる該酢酸バゼドキシフェンの多形フォームDの純度は、約90質量%超であり、約95質量%超であり、約99質量%超であり、又は約99.9質量%超である。
【0059】
上記の本明細書に記載された方法のある実施態様は、1回又はそれ以上の濾過、洗浄及び乾燥工程により、酢酸バゼドキシフェンの多形フォームDを単離することを更に含む。
【0060】
ある実施態様において、多形フォームDの単離における乾燥工程は、撹拌したフィルタードライヤー内で実施される。撹拌したフィルタードライヤーは、単一容器内で、液体から固体を分離するのに有用である。一旦ドライヤーにスラリーを投入すると、窒素などの気体を用いてフィルタードライヤーの最上部から圧力を負荷するか、又はフィルター媒体の下から真空で吸引し、それにより、液体を布又は網を通して押し出すか又は吸引する。ケーキが圧縮されて結晶が一緒に融解しない様に、低圧力(例えば、約1バール)が一般的に用いられる。液体は容器の底から排出される。結晶をフィルター媒体上に集めながら、撹拌器の滑らかな端がケーキの表面を滑らかにするように作動し、ケーキの表面に裂け目が生じないようにする。両方向に回転できる撹拌器のもう一方の端は、ケーキの中へ掘り進み、それを破壊し、フィルター媒体からそれを除去するのを助けるための歯を有することができる。ケーキを破壊し、そして数回洗浄して微量の溶媒又は不純物を除去することができる。ドライヤーに熱を適用して乾燥過程を促進してもよい。好適なフィルタードライヤーは、種々の販売会社から、例えば、OMCA Plants、Italyから購入することができる。
【0061】
当業者には当然のことであるが、撹拌の頻度、1回当たりの撹拌継続時間、合計の撹拌継続時間、及びドライヤーの乾燥時間は、乾燥すべき製品の負荷に依存して変えてよい。1つの実施態様において、撹拌の頻度は約120分間隔であり、1回当たりの撹拌継続時間は約2分、合計の撹拌継続時間は約18分、そして乾燥時間は約18時間である。別の実施態様において、撹拌の頻度は約30分間隔であり、1回当たりの撹拌継続時間は約1分、合計の撹拌継続時間は約38分、そして乾燥時間は約19時間である。尚また別の実施態様において、撹拌の頻度は約60分間隔であり、1回当たりの撹拌継続時間は約1分、合計の撹拌継続時間は約18分、そして乾燥時間は約18時間である。ある実施態様において、湿潤した製品は 低温(例えば、約0℃)で、窒素気流下、撹拌なしで、短時間(例えば、約1時間)放置し、乾燥過程を開始する前に、製品の湿度レベルを低下させる。
【0062】
ある別の実施態様において、多形フォームDの単離における乾燥工程は、タンブルドライヤーで実施される。乾燥は、窒素雰囲気下及び/又は真空条件下でタンブルドライヤーで実施される。好適なタンブルドライヤーは、種々の販売会社から、例えば、Italvacuum
CRIOX, Italyから購入することができる。
【0063】
ある実施態様において、多形フォームDの単離における乾燥工程は、約20℃〜約50℃の間で実施される。ある実施態様において、乾燥工程は、少なくとも約20℃で実施される。ある実施態様において、乾燥工程は、少なくとも約30℃で実施される。ある実施態様において、乾燥工程は、少なくとも約40℃で実施される。ある実施態様において、乾燥工程は、少なくとも約50℃で実施される
【0064】
1つの実施態様において、本開示は、本明細書に記載された方法に従って製造される酢酸バゼドキシフェンの多形フォームDに関する。ある実施態様において、酢酸バゼドキシフェンの多形フォームDの純度は、約90%超であり、約95%超であり、約99%超であり、又は約99.9%超である。本開示全体を通して、酢酸バゼドキシフェンの多形フォームDの純度は、多形フォームの純度を意味する。
【0065】
本開示を、以下の実施例により更に説明する。実施例は説明目的のみのために提供される。それらは、決して、本開示の範囲又は内容を限定するものとして解釈すべきではない。
【実施例】
【0066】
〔実施例1〕
酢酸バゼドキシフェンのフォームDの製造
【化3】

酢酸エチル/エタノール=2.5:1の混合物(190g)中の、ヘキサメチレンイミノベンジルオキシインドール(35.7g)(J. Med. Chem., 2001, 44, 1654-1657、及び欧州特許出願第00802183号、1997年10月22日出願、に記載のように得られた)のスラリーを、Pd/C(0.46g)、Delinkの存在下、5バールの水素雰囲気中で、50℃で24時間水素化した。その後、反応混合物にアスコルビン酸(0.27g)を加え、Celite(登録商標)パッドを通して濾過し、酢酸(1.5g)を加え、そして撹拌しながら30℃に保った。2時間後、自己核形成が起こり、追加の酢酸(3.3g)を加えた。30℃で2時間撹拌した後、沈殿を濾過し、オーブン中減圧下50℃で乾燥し、純粋な酢酸バゼドキシフェンのフォームDを得た。
【0067】
〔実施例2〕
酢酸バゼドキシフェンのフォームDの製造
【化4】

酢酸エチル/エタノール=2.5:1の混合物(30g)中の、ヘキサメチレンイミノベンジルオキシインドール(5.6g)のスラリーを、Pd/C(0.1g)、Delinkの存在下、5バールの水素雰囲気中で、50℃で24時間水素化した。その後、反応混合物にアスコルビン酸(0.04g)を加え、Celite(登録商標)パッドを通して濾過し、酢酸(0.17g)を加え、酢酸バゼドキシフェンのフォームA(7.6mg:例えば、国際公開第05/100316号に記載されたように製造した。この公報の開示内容は、参照によりその全文が本明細書に組み込まれる)の種結晶を添加し、撹拌下に30℃で30分間保った。生成した沈殿を濾過し、母液を30℃に保ってフォームDを生成させた。18時間後、得られた沈殿を濾過し、オーブン中で乾燥して、純粋な酢酸バゼドキシフェンのフォームD(1g)を得た。
【0068】
〔実施例3〕
酢酸バゼドキシフェンのフォームDのフォームAからの製造
酢酸エチル/水=3:1の混合物(14.5Kg)中の酢酸バゼドキシフェンのフォームA(1,500g)をアスコルビン酸(14.2g)及び重炭酸ナトリウム(250g)と合わせて、そして撹拌しつつ約60℃で1時間加熱した。その温度を約1時間維持した。溶液を約40℃に冷却し、そして30分間放置した。有機相を分離し、水(1,000g)を加えた。撹拌後、有機相を分離し、アスコルビン酸(14.2g)及びCelite(43g)と混ぜ合わせた。混合物を約50℃で減圧蒸留し、30℃に冷却し、そして、エタノール/トルエン=13:1の混合物(7Kg)を加えた。反応混合物を撹拌しつつ50℃に加熱し、その温度を約30分間維持した後、40℃に冷却した。懸濁液を濾過し、得られた濾液を30℃に冷却した後、酢酸(57.1g)、酢酸バゼドキシフェンのフォームD(2.8g)及び酢酸(197.1g)を段階的に投入した。反応混合物を0℃に冷却し、そして結晶生成物を濾過し、オーブン中、減圧下約50℃で乾燥し、純度約99.9%の酢酸バゼドキシフェンのフォームD(約1,340g)を得た。
【0069】
〔実施例4〕
粉末X線回折(XRPD)
XRPD分析をBrukerの回折計を用い、以下の条件下で行なった。
スキャン:3〜40°;ステップサイズ:0.01°;
線源:Cu;50mA、35KV;
照射:K(α1)、K(α2);
検出器モデル:Lynx eye、Bruker;
収集時間:1.5sec/ステップ。
酢酸バゼドキシフェンのフォームDについてのXRPDの結果を図1に示す。
【0070】
〔実施例5〕
ラマン分光法
FT-Raman Thermofisherを用い、分解能4cm-1で操作し、250〜4,000cm-1の範囲を走査して、ラマンスペクトルを得た。酢酸バゼドキシフェンのフォームDについて得られたラマンスペクトルの結果を図2に示す。
【0071】
〔実施例6〕
示差走査熱量測定(DSC)
DSC測定は、型式ULSP90のイントラクーラーを備えたPerkin Elmer Diamond装置で行なった。試料(3〜5mg)をアルミニウム製の密閉したパン中に置いた。加熱を、5℃min-1で、60〜200℃の温度範囲で行った。酢酸バゼドキシフェンのフォームDのDSCの結果を図3に示す。
【0072】
〔実施例7〕
固相キャラクタリゼーション
1.酢酸バゼドキシフェンの固相キャラクタリゼーション
多形フォームの特性を評価するために、示差走査熱量測定法(DSC)を用いた熱分析、水性及び有機溶媒中での溶解度測定、及び懸濁液相互変換の検討を行った。
フォームDは、これまで公知の結晶フォームA及びBとは、特徴のある粉末X線回折パターン、ラマンスペクトル、及び熱的性質により区別される。酢酸バゼドキシフェンの公知の固体形態の熱的性質を、表3にリストアップする。
【表4】

【0073】
2.溶解度
酢酸バゼドキシフェンの溶解度は、Crystal-16(Avantium Technologies,BV, Netherland)を用いる動的溶解法(dynamic dissolution method)により測定した。この装置は、4列に配列した16バイアルを収容することができ、結晶化及び溶解度の研究を1mLスケールで行うための中処理量ツールである。各列の温度プロファイル及び磁気撹拌スピードは、独立に調整することができる。各バイアルの濁度をモニターし、そして温度プロファイルと共にプロットして、固体の溶解及び沈殿点を測定した。あらかじめ秤量した固体及び溶媒を透明なガラスバイアル内で混合し、そして徐々に(0.2℃/minで)加熱した。溶解温度を記録した。溶液の濃度(固体と溶媒の質量に基づいて計算した)を、記録した温度での飽和濃度として処理し、溶解度をこの濃度に基づいて計算した。
【0074】
酢酸バゼドキシフェンの溶解度も、また、HPLC法を用いて測定し、この場合、過剰量の固体の酢酸バゼドキシフェンを溶媒中で撹拌して、懸濁液を得た。懸濁液を30分間撹拌した後濾過し、溶液の濃度をHPLCで分析した。2つの方法で測定した溶解度データを、図4及び5にプロットする。
【0075】
2つの溶媒混合物をこの研究に用いた:
1)結晶化溶媒(質量基準):エタノール:66.53%、アセトン:4.02%、シクロヘキサン:2.56%、酢酸エチル:22.26%、トルエン:4.32%、水:0.3%、アスコルビン酸:0.1%;
2)スラリー試験用溶媒(質量基準):エタノール:72.6%(アセトン−NMT:5.5%、及びシクロヘキサン−NMT:3.5%で変性した)、酢酸エチル:22.1%、酢酸:0.7%、トルエン:4.2%、水:0.3%、及びアスコルビン酸:0.1%。
【0076】
フォームAの溶解度は、フォームB及びDより、検討した全ての条件で高いことが判明した。結晶化溶媒中でのフォームDの溶解度は、約30℃未満の温度ではフォームBの溶解度に非常に近似していた。この温度以上では、フォームDの溶解度は、フォームBのそれより若干高かった。
【0077】
3.溶媒懸濁液中での多形混合物の安定性
溶媒が介在するフォーム変換を理解するため、酢酸バゼドキシフェン結晶多形の懸濁液の研究を行った。0.5、25及び70℃での熱力学的に安定なフォームを決定するための実験は、3つの公知の結晶フォームA、B及びD(表4を参照)を用いて行った。3つのフォームの混合物を、所定の温度で、フォームAの飽和溶液中に懸濁し、そして数日間平衡化した。濾過後、固体をXRPDで分析した。
【表5】

【0078】
この研究から、フォームDは、0.5℃において現在までに知られている最も安定な非溶媒和物である。フォームBは、70℃において現在までに知られている最も安定な非溶媒和物であり、そして25℃において、恐らく最も安定な非溶媒和物である。
【0079】
多形変化の動力学を確立するための更なる実験を、工業的結晶化溶媒システムを用いて行った。フォームA及びフォームDを含む試料を、工程の結晶化条件を再現する混合溶媒(シクロヘキサン/アセトン、酢酸エチル、トルエン及び酢酸で変性したエタノール)中、25℃でスラリー化した。2時間後、フォームAからフォームDへの完全な転移が観察された(表5を参照)。以下の表で報告されるデータは、吸熱ピークの比率を取り入れたDSCを用いた定性的評価である。
【表6】

【0080】
多形フォームBの試料を、25℃で、工程の結晶化条件を再現する混合溶媒中でスラリー化し、多形フォームD(5質量%)の種結晶を添加した(表6)。
【表7】

【0081】
多形フォームDの試料を、25℃で、工程の結晶化条件を再現する混合溶媒中でスラリー化し、多形フォームB(5質量%)の種結晶を添加した(表7)。
【表8】

【0082】
これらの相互変換実験から、フォームAのフォームDへの変換速度が、結晶化溶媒中では迅速であることが示されている。フォームDのフォームBへの変換速度、及びその逆もまた、結晶化溶媒混合物中では、前記に示された溶解度データと一致して非常に遅い。
【0083】
4.多形スクリーニング及び安定性研究の要約
広範囲に及ぶ多形のスクリーニングから、酢酸バゼドキシフェンが、複数の結晶フォーム及び非晶質状態で存在し得ることが示された。フォームBは最も高い融点を持つ酢酸バゼドキシフェンの多形である。溶解度及びフォームの安定性研究から、フォームBは、単変的にフォームAと関連していることが示される。フォームDはフォームAより融点が低いが、0〜60℃において、フォームAより溶解性が低い。従って、フォームAは、酢酸バゼドキシフェンの製造工程で遭遇する条件下では、フォームB及びフォームDと比較して準安定である。
【0084】
〔実施例8〕
酢酸バゼドキシフェンのフォームDの検出
1.粉末X線回折
粉末X線回折(XRPD)により、フォームA、B及びD間を識別することが示されている。図6に示されるように、XRPDパターンは、3つの全てのフォームについての識別ピークを有する。フォームDは、回折角(2θ)10.6°の特性ピークにより同定される。
【0085】
フォームDに特有の10.6°のピークの強度(面積)は、フォームAの薬学的活性成分(API)試料中のフォームDの量と直接比例する。フォームDの定量は、試料中のフォームDのピーク面積をフォームDの既知の含量を有する試料(即ち、標準試料)のそれと比較して、較正曲線を作成することにより達成した。この定量方法は、良好な直線性(R2=0.9996)及び良好な感度を有し、約0.5%の検出限界が確立されている。X'Celerator line detectorを備えた、Philips X'Pert MPD 粉末X線回折計を用いた。
【0086】
XRPDは、フォームAに対しては16.1°、フォームDに対しては10.6°の特異的な孤立したピークを示す。相対的ピーク面積方法を、多形定量のばらつきを低減するために用いた。フォームDの相対的ピーク面積は、10.6°におけるフォームDのピーク面積と16.1°におけるフォームAのピーク面積の合計値に対する、10.6°におけるフォームDのピーク面積の比率である。ピーク面積はTopasのソフトウエアを用い、プロファイル・フィッティング(profile fitting)を通して計算された。
【0087】
フォームDの含量とフォームDの相対的ピーク面積間の直線の検量線が、既知量のフォームDを加えた標準試料から、相関係数R2=0.9986で確立された。0.5%〜5%の範囲の含量のフォームDを加えた6個の標準試料を用いた。直線の検量線の信頼性を確実にするため、各添加標準試料について複数回のXRPD測定とピークのフィッティングを行った。
【0088】
次いで、この直線の検量線を用いて、検出されたフォームDを有する所定の酢酸バゼドキシフェン試料中のフォームDの含量を計算した。フォームDが存在するか又は検出されたかを決定するために、3以上(SNR≧3)のシグナル/ノイズ比が用いられた。
【0089】
類似のラインデテクター(line detector)を備えたBrukerX線回折計を用いた同様の方法を用いて、同様に酢酸バゼドキシフェンAPI中のフォームDの含量を、検出限界0.5%で、定量化することができた。
【0090】
2.スラリー増幅試験
分光学的又はX線技術上での検出限界以下で、バルク薬物試料中の多形フォームを検出するために、スラリー増幅法を用いた。多形の安定性に関する研究により、フォームDはフォームAより熱力学的により安定であることが示されている。フォームDの種結晶を有する工業的結晶化溶媒中でのフォームAの飽和懸濁液は、フォームDの溶解度が低いため、不可逆的にフォームDに変換することが示される。これがスラリー増幅試験の基礎であり、この試験は、フォームAの試料中のフォームDのような、100〜1,000ppm(0.01〜0.1質量%)の他の多形フォームを、XRPDによる検出が可能となるまでフォームDの量を増加させることにより、検出するように設計された。
【0091】
25℃でのAPIの懸濁液によるスラリー増幅を、ガラス製プロベラ撹拌器を備えたガラス反応器(100mL)に、結晶化溶媒混合物(30g)(アセトンとシクロヘキサンで変質させたEtOH(エタノールアッセイNLT:91.0質量%;アセトン含量NMT:5.5質量%;シクロヘキサン含量NMT:3.5質量%):72.6質量%;酢酸エチル:22.1質量%;酢酸:0.7質量%;トルエン:4.2質量%;水:0.3質量%;アスコルビン酸:0.1質量%)及び酢酸バゼドキシフェン(4.0g)を、N2雰囲気下で加えて行なった。酢酸バゼドキシフェンの濃度(133mg/g溶媒)は、試験条件における溶媒系での酢酸バゼドキシフェンの溶解度(表3を参照)より有意に高かった。懸濁液を25℃で24時間撹拌(200rpm)した。濾過し、45℃で終夜乾燥した後、固体試料の多形性をXRPDにより調べた。
【0092】
〔実施例9〕
フォームD生成に及ぼす単離、乾燥、及び微粒子化の影響
酢酸バゼドキシフェンのフォームAの製造過程におけるフォームDの発生を理解するために、結晶化中の種々の工程でサンプリングした結果、フォームDが主として、表8(表8におけるパーセンテージの値は、DSCの測定から推測され、それは近似値のみである)で分かるように、結晶化操作中に生成することが明らかになった。結晶化の間に行ったフォームDの種結晶の添加により、フォームDの量は単離及び乾燥操作を通じて増加し続けた。
【表9】

【0093】
更にモニターした結果、結晶化の最後にフォームDが生成しない場合、フォームDを含まない乾燥した酢酸バゼドキシフェンが残ることが示され、そして微粒子化した酢酸バゼドキシフェンも、また、検出できる含量のフォームDを含んでいないことがXRPDにより示された(表9)。
【表10】

【0094】
潜在的なフォームDの成長に及ぼす濾過、乾燥、及び微粒子化の影響を更に研究するために、実験室スケールでの実験を行った。
【0095】
本明細書で特に記載したそれらの実施態様に加えて、本開示の様々な変更は、これまでの記述から当業者には明白であろう。その様な変更も、また、添付の特許請求の範囲の属するものとする。本願において引用された各参考資料は、参照によりその全文が本明細書に組み込まれる。
【技術分野】
【0001】
本開示は、酢酸バゼドキシフェンの新規な多形フォーム、多形フォームの製造方法、及び多形フォームを用いる組成物及び治療方法に関する。
【背景技術】
【0002】
酢酸バゼドキシフェンは、(1−[4−(2−アゼパン−1−イル−エトキシ)−ベンジル]−2−(4−ヒドロキシ−フェニル)−3−メチル−1H−インドール−5−オール・酢酸塩)の化学名を有し、そしてその化学構造は下記の通りである。
【化1】

【0003】
酢酸バゼドキシフェンは、一般的に選択的エストロゲン受容体調節剤(SERM)と呼ばれる薬剤の種類に属する。その分類通り、バゼドキシフェンはエストロゲン受容体(ER)に対して親和性を呈し、しかも組織選択性エストロゲン効果を示す。例えば、酢酸バゼドキシフェンは、子宮刺激の前臨床モデルにおいて子宮反応の刺激をほとんど又は全然示さない。逆に、酢酸バゼドキシフェンは、骨減少症の卵巣切除ラットモデルにおける骨量減少予防及びコレステロール低減にエストロゲンアゴニスト様効果を示す。MCF‐7細胞系(ヒト乳がん細胞系)では、酢酸バゼドキシフェンはエストロゲンアンタゴニストとして作用する。これらのデータは、酢酸バゼドキシフェンが骨及び心血管の脂質パラメータに対してはエストロゲン性であり、子宮及び乳房組織に対しては抗エストロゲン性であり、従って、エストロゲン受容体が関与する多数の疾患又は疾患様病態を治療する可能性を有することを実証する。酢酸バゼドキシフェンの生物活性の更に詳細な説明については、例えば、特許文献1及び2、並びに非特許文献1を参照されたい。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】米国特許第5998402号
【特許文献2】米国特許第6479535号
【非特許文献】
【0005】
【非特許文献1】Miller, et al., Drugs of the Future, 2002, 27(2), 117-121
【発明の概要】
【発明が解決しようとする課題】
【0006】
特定の薬剤の結晶多形フォームが、薬剤の製造し易さ、安定性、溶解性、貯蔵安定性、製剤化のし易さ、及びin vivo薬理学の重要な決定因子になることは周知である。多形フォームは、同じ物質の組成物が異なる格子配列で結晶化し、特定の多形フォームに特異的な異なる熱力学特性及び安定性をもたらす場合に生じる。所定の化合物の種々の多形は、溶解度及び解離、真の密度、結晶形状、圧密挙動、流動性、及び/又は固体状態安定性などの1つ又はそれ以上の物理的性質に関して互いに異なってもよい。2つ又はそれ以上の多形性物質が製造し得る場合には、各多形を純品にする方法を有することが望ましい。どの多形が所定の状態で好ましいかを決定するに当って、多形の多数の性質を比較し、そして好ましい多形が多くの物理特性変数に基づいて選択されるべきである。製造し易さ、安定性などの特定の側面が重視される特定の状況では、1つの多形同が好ましくなり得ることは全く可能である。他の状況では、例えば、より大きい溶解度及び/又はより優れた薬物動力学のために異なる多形が優先されてもよい。しかしながら、どの多形フォームが特定の条件下で結晶化するかを予測するのは困難なだけでなく、1つの多形フォームから別の多形フォームへの変換を防ぐ条件を見出すのは困難であることから、薬剤の多形フォームを製造することは多くの課題を伴う。
【0007】
特に明記しない限り、本明細書で使用されるすべての技術的及び科学的用語は、本開示が属する分野の当業者によって一般的に理解されるのと同じ意味を有する。本明細書に記載のものと類似の又は同等の方法及び物質は、本開示の実施又は試験において使用することができるが、好適な方法及び物質は下記のとおりである。本明細書に記載のすべての刊行物、特許出願、特許、及び他の参考文献は、参照することによりその全文が本明細書に組み入れられている。加えて、物質、方法、及び実施例は説明のためだけのものであり、限定することを意図するものではない。
【課題を解決するための手段】
【0008】
多形が実質的に純粋なフォームDの多形である、酢酸バゼドキシフェンの多形が本明細書に開示されている。フォームDを、1つ又はそれ以上の他の多形結晶フォーム又は非晶相、例えば、酢酸バゼドキシフェンのフォームA〜Cと組み合わせて含む組成物をも意図している。また、酢酸バゼドキシフェンの多形フォームDの製造方法、フォームDを含む医薬組成物、及びそれを用いる治療方法が提供される。
【0009】
1つの態様では、本開示は、2θを単位として約10.6°、14.0°、17.1°、17.5°及び24.2°において特徴的なピークを含むX線粉末回折(XRPD)パターンを有するフォームDの結晶多形を提供する。少なくとも幾つかの実施態様では、多形は実質的に図1に示すようなXRPDパターンを有する。幾つかの実施態様では、多形は実質的に図2に示すようなラマンスペクトルを有する。少なくとも幾つかの実施態様では、多形は実質的に図3に示すような示差走査熱量測定(DSC)トレースを有する。少なくとも複数の実施態様では、多形は約166℃及び168℃の間のガラス転移温度を有する。
【0010】
本開示は、更に、酢酸バゼドキシフェンの多形フォームD及び薬学的に許容される担体を含む組成物を提供する。幾つかの実施態様では、薬学的に許容される担体は経口投与に適しており、そして組成物は経口投与形態を含む。幾つかの実施態様では、組成物中の総酢酸バゼドキシフェンの少なくとも約50〜90質量%は、多形フォームDとして存在する。更なる実施態様では、組成物中の総酢酸バゼドキシフェンの少なくとも約70質量%、少なくとも約80質量%、又は少なくとも約90質量%は、多形として存在する。また、少なくとも約97〜99質量%の酢酸バゼドキシフェンが多形フォームDとして組成物中に存在する、本質的に酢酸バゼドキシフェンから成る組成物が本開示によって提供される。
【0011】
他の態様では、本開示は、酢酸バゼドキシフェンのフォームDを含有する組成物の有効量を投与することを含む、それを必要とする動物におけるエストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害を治療する方法を提供する。幾つかの実施態様では、エストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害は、骨粗鬆症、前立腺肥大、男性型禿頭症、膣及び皮膚萎縮、アクネ、不正子宮出血、子宮内膜ポリープ、良性乳房疾患、子宮平滑筋腫、腺筋症、卵巣がん、不妊症、乳がん、子宮内膜症、子宮内膜がん、多嚢胞性卵巣症候群、心血管疾患、避妊、アルツハイマー病、認知低下、メラノーマ、前立腺がん、結腸がん、及びCNSがんから成る群から選択される。
【0012】
別の態様では、本開示は、酢酸バゼドキシフェンのフォームDを含有する組成物の有効量を投与することを含む、それを必要とする動物における子宮内膜組織の増殖又は発達異常に関連する疾患又は障害を治療する方法を提供する。幾つかの実施態様では、子宮内膜組織の増殖又は発達異常に関連する疾患又は障害は、子宮内膜ポリープ、子宮内膜症、及び子宮内膜がんから成る群から選択される。
【0013】
別の実施態様では、本開示は、酢酸バゼドキシフェンのフォームDを含有する組成物の有効量を投与することを含む、それを必要とする動物において、コレステロールを低下させ、骨量減少を抑制し、又は乳がんを治療する方法を提供する。幾つかの実施態様では、骨量減少は、骨粗鬆症、骨減少症、変形性関節症、低カルシウム血症、高カルシウム血症、パジェット病、骨軟化症、骨石灰脱失症、多発性骨髄腫及びがんから成る群から選択される疾患又は障害に起因する。
【0014】
尚別の実施態様では、本開示は、酢酸バゼドキシフェンのフォームDを含有する組成物の有効量を投与することを含む、それを必要とする動物における、周閉経期の、閉経期の、又は閉経期後の症状を治療する方法を提供する。幾つかの実施態様では、周閉経期の、閉経期の、又は閉経期後の症状は顔面潮紅などの血管運動障害である。
【0015】
本開示は、また、酢酸バゼドキシフェンの多形フォームDを製造する方法であって、
(a)ヘキサメチレンイミノベンジルオキシインドールを、エタノールを含む溶媒中で、触媒の存在下、高温下に水素と接触させ、遊離塩基のバゼドキシフェンを含む第1の反応混合物を得、ここで、第1の反応混合物は、実施的にヘキサメチレンイミノベンジルオキシインドールを含まず;
(b)該第1の反応混合物を抗酸化剤で処理して第2の反応混合物を得;
(c)該第2の反応混合物を濾過して、遊離塩基のバゼドキシフェンを含む溶液を得;そして
(d)該溶液を酢酸で処理して、酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む方法を提供する。
【0016】
更なる態様において、本開示は、本明細書に記載した方法に従って製造された酢酸バゼドキシフェンの多形フォームDに関する。
【0017】
本開示のその他の特徴及び利点は、詳細な明細書、図面及び特許請求範囲から明白であろう。
【図面の簡単な説明】
【0018】
【図1】酢酸バゼドキシフェンの多形フォームDのX線粉末回折(XRPD)のパターンを示す。
【図2−1】酢酸バゼドキシフェンの多形フォームDの特徴的なラマン・スペクトルを示す。
【図2−2】図2−1の続きである。
【図3】酢酸バゼドキシフェンの多形フォームDの特徴的なDSCサーモグラムを示す。
【図4】結晶化混合溶媒中での酢酸バゼドキシフェンの溶解度を示す。
【図5】スラリーテスト溶媒中での酢酸バゼドキシフェンの溶解度を示す。
【図6】酢酸バゼドキシフェンのフォームA、B及びDのXRPD回折図形を示す。
【発明を実施するための形態】
【0019】
本発明は、新規な1−[4−(2−アゼパン−1−イル−エトキシ)−ベンジル]−2−(4−ヒドロキシ−フェニル)−3−メチル−1H−インドール−5−オール・酢酸(酢酸バゼドキシフェン)化合物の多形フォームDを提供し、それは以下の式を有する。
【化2】

【0020】
本開示の多形フォームDに加えて、酢酸バゼドキシフェンのその他の公知の多形としては、結晶性多形フォームA及びB、並びに非晶性のフォームCが挙げられる。
【0021】
本明細書で用いる「多形」とは、同一化合物の異なる結晶形態を意味し、そして同一化合物の水和物及び溶媒和物を含むその他の固体状態の分子形態をも含むが、しかしそれらに限定されない。与えられた化合物の異なる多形は、溶解度、解離、真の密度、結晶形状、圧密挙動、流動特性、及び/又は固体状態の安定性などの1つ又はそれ以上の物理的性質に関して互いに異なるものである。不安定な多形は、一般的には、与えられた温度で、十分な時間が過ぎた後、より熱力学的に安定なフォームに変換する。準安定なフォームは、ゆっくりと安定なフォームに変換する不安定な多形である。一般的に、安定なフォームは、最も高い融点と、最も高い化学的安定性を示すが、しかし準安定なフォームは、また、薬学的に許容可能な状態にするための十分な化学的、物理的安定性を有する。本明細書で使用される「化学的安定性」とは、熱安定性、光安定性及び湿気に対する安定性を含むが、それらに限定されないある特定の化学的性質の安定性を意味する。
【0022】
酢酸バゼドキシフェンの多形フォームDは、幾つかの実施態様においては、実質的に純粋であり、その多形フォームが、その他の多形フォームの酢酸バゼドキシフェンを含む不純物を、約15質量%未満、約10質量%未満、約5質量%未満、又は約1質量%未満含むことを意味する。
【0023】
多形フォームDは、また、混合物として存在し得る。幾つかの実施態様において、多形フォームDは、その他の多形フォームA、及び/又はB、及び/又は非晶性の酢酸バゼドキシフェン(フォームC)との混合物として存在し得る。複数の多形フォームを含む組成物は、いかなる好適な方法によっても製造可能であり、本明細書で記載されるように製造されるフォームDと、例えば、国際公開第2005/100316号、国際公開第2005/100314号、及び米国特許仮出願第61/027,725号においてこれまでに記載されたいずれかの方法に従って作られる、実質的に純粋なフォームA及び/又はBとの混合物を含む。ここで、これらの各開示は、参照することによりそれらの全文が本明細書に取り込まれている。組成物中の酢酸バゼドキシフェンの多形フォームのそれぞれの量は、X線粉末回折、又は示差走査熱量測定分析などのいかなる好適なスペクトル分析法によっても分析可能である。
【0024】
多形フォームDは、1つ又はそれ以上の固相分析方法で同定可能である。例えば、フォームDは、図1に実質的に示されるような粉末X線回折パターンにより同定可能である。フォームDに一致する粉末X線回折データは、下記の表1に提供される。当業者には当然のことながら、ピークの相対強度は、試料の調製技術、試料の取り付け手順及び採用した特別な機器に依存して変わり得る。その上、機器のばらつき及びその他の因子は、2θ値にある程度影響を与え得る。
【0025】
【表1】

【0026】
【表2】

【0027】
多形フォームDは、また、図2に実質的に示すようなその特徴的なラマン・スペクトルによっても同定可能である。幾つかの実施態様において、フォームDは、約1,561cm-1、約1,589cm-1及び約1,613cm-1から選択される1つ又はそれ以上の特徴的ピークを有するラマンスペクトルによって特徴付けられる。
【0028】
多形フォームDは、また、図3に実質的に示すようなその特徴的なDSCトレースによっても同定可能である。少なくとも幾つかの実施態様において、フォームDは、約166℃と約168℃の間のガラス転移温度によって特徴付けられる。当業者には当然のことであるが、加熱速度、即ち、DSC分析が行われる走査速度、用いられる較正標準、機器較正、相対湿度、及び相対純度に依存して、多形の吸熱は、約0.01〜10℃又は約0〜5℃だけ、測定される吸熱の高温側か又は低温側に変化する。観察される吸熱は、また、いずれの与えられた試料に対しても、機器間である程度は異なる可能性がある。
【0029】
投与の目的ために、酢酸バゼドキシフェンの多形フォームDは、実質的に純品で製剤化するか、又は医薬組成物として酢酸バゼドキシフェンの他の多形性結晶又は非晶形と混合してもよい。特定の実施態様における医薬組成物は、1つ又はそれ以上の多形の酢酸バゼドキシフェン及び薬学的に許容される担体を含み、ここで、酢酸バゼドキシフェンは、関係する病態、疾患又は障害を治療するのに有効な量で組成物中に存在する。本明細書で使用される病態の「治療」は、症状及び/又は病状の部分的な又は完全な予防及び/又は改善を含む。治療用組成物における本明細書に記載の化合物の濃度は、投与する薬剤の用量及び投与経路を含む多数の因子に応じて変動してもよい。適切な濃度及び用量は当業者によって容易に決定し得る。
【0030】
少なくとも幾つかの実施態様では、酢酸バゼドキシフェンは、2日毎に1回から週1回の範囲で拡大投与計画に従って投与してもよい。所定の投与計画での用量は、一度に又は同日に複数回投与することができる。個々の患者のニーズによって、酢酸バゼドキシフェンは2日毎に、3日毎に、4日毎に、5日毎に、6日毎に、又は7日毎(週1回)に投与してもよい。投与期間は患者のニーズによって調整してもよく、そして拡大投与計画に従って投与することも考えられる。
【0031】
例えば、用量は隔日に1回投与してもよく、次いで医学的フォローアップ後3日毎、そして最終的には週1回投与するように調整してもよい。拡大投与計画では週1回投与してもよく、その場合に週用量は、単回投与として1日に投与するか、又は同日中に2回又はそれ以上の回数に分割して投与してもよい。
【0032】
少なくとも幾つかの実施態様では、ヒトでの酢酸バゼドキシフェンの1日投与量は、約5〜80mgの間である。酢酸バゼドキシフェンを週1回投与する場合、少なくとも幾つかの実施態様における週1回投与の用量は、1日投与量の約3〜15倍量からである。従って、少なくとも幾つかの実施態様では、週1回の経口投与量は、約15及び1,200mgの間で週1回投与されてよい;その投薬量は、投与日中に1回又はそれ以上の回数で投与される。
【0033】
幾つかの実施態様では、組成物中の総酢酸バゼドキシフェンの少なくとも約50〜99質量%は、本明細書に記載のように調製された多形フォームDの酢酸バゼドキシフェンとして存在する。更なる実施態様では、組成物中の総酢酸バゼドキシフェンの少なくとも約70質量%、少なくとも約80質量%、少なくとも約90質量%、少なくとも約95質量%、少なくとも約97質量%、少なくとも約98質量%、少なくとも約99質量%、少なくとも約99.5質量%、又は少なくとも約99.9質量%は、多形フォームDとして存在する。また、少なくとも約97〜99質量%の酢酸バゼドキシフェンが多形フォームDとして組成物中に存在する、本質的に酢酸バゼドキシフェンから成る組成物が、本開示によって提供される。
【0034】
本開示の方法は、本明細書に記載の多形での、例えば、医薬組成物の形態での全身投与を含む。これらの方法は、酢酸バゼドキシフェンの多形及び薬学的に許容される担体を含む医薬組成物の有効量を、それを必要とする動物に投与する工程を含む。当業者は、適切な方法で、そしてRemington's Pharmaceutical Sciences (Gennaro, Ed., Mack Publishing Co., Pa. 1990)に記載の慣例に従って、組成物を製剤化してもよい。酢酸バゼドキシフェンの好適な製剤の例は、国際公開公報第0203987号、国際公開公報第03105834号、及び国際公開公報第07024961号に記載の例を含み、各開示内容は参照することによりその全文が本明細書に組み入れられている。
【0035】
本開示の活性化合物を含む経口製剤は、錠剤、カプセル剤、バッカル剤、トローチ剤及びロゼンジを含む、通常使用されているいずれの経口剤形を含んでもよい。カプセル剤は、薬学的に許容される澱粉(例えば、トウモロコシ、ジャガイモ又はタピオカ澱粉)、砂糖、人工甘味剤、結晶及び微結晶セルロースなどの粉末セルロース、小麦粉、ゼラチン、ガムなどの不活性充填剤及び/又は賦形剤と1つ又は複数の活性化合物との混合物を含むことができる。有用な錠剤製剤は、従来型圧縮法、湿式造粒法又は乾式造粒法によって作られ、そしてステアリン酸マグネシウム、ステアリン酸、タルク、ラウリル硫酸ナトリウム、微結晶セルロース、30カルボキシメチルセルロースカルシウム、ポリビニルピロリドン、ゼラチン、アルギン酸、アカシアガム、キサンタンガム、クエン酸ナトリウム、複合珪酸塩、炭酸カルシウム、グリシン、デキストリン、蔗糖、ソルビトール、第二リン酸カルシウム、硫酸カルシウム、乳糖、カオリン、マンニトール、塩化ナトリウム、乾燥澱粉及び粉末砂糖を含む、薬学的に許容される賦形剤、結合剤、滑沢剤、崩壊剤、懸濁化又は安定化剤を使用してもよいが、それらに限定されない。本明細書に記載の経口製剤は、1つ又は複数の活性化合物の吸収を変えるために、標準的な徐放性又は持続放出製剤を用いてもよい。坐剤製剤は、坐剤の融点を変えるためにろうの添加有り/無しのカカオバター、及びグリセリンを含む、伝統的材料から作ることができる。種々の分子量のポリエチレングリコールなどの水溶性坐剤基剤を使用してもよい。
【0036】
米国特許第5998402号に記載のように、バゼドキシフェン及びその塩は、エストロゲン受容体に親和性を有する選択的エストロゲン・アゴニストである。他のタイプのエストロゲン・アゴニストと異なり、バゼドキシフェン及びその塩は子宮において抗エストロゲン性であり、子宮組織においてエストロゲン・アゴニストの栄養作用に拮抗することができる。従って、酢酸バゼドキシフェンの多形及びそれを含む組成物は、エストロゲン欠乏又はエストロゲン過剰に関連する症状又は症候の治療に関連する、多くの使用法を見出すことができる。幾つかの態様では、本開示は、エストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害を治療する方法を提供する。エストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害は、骨量減少、骨粗鬆症、前立腺肥大、男性型禿頭症、膣及び皮膚萎縮、アクネ、不正子宮出血、子宮内膜ポリープ、良性乳房疾患、子宮平滑筋腫、腺筋症、卵巣がん、不妊症、乳がん、子宮内膜症、子宮内膜がん、多嚢胞性卵巣症候群、心血管疾患、避妊、アルツハイマー病、認知低下及び他のCNS障害、並びにメラノーマ、前立腺がん、結腸がん、及びCNSがんなどを含む特定のがんを含む。
【0037】
酢酸バゼドキシフェンの多形は、子宮内膜若しくは子宮内膜様組織の増殖又は発達、作用若しくは成長の異常に起因する疾患又は障害の治療方法にも使用することができる。幾つかの実施態様では、本開示は、子宮内膜組織の増殖又は発達異常に関連する疾患又は障害を治療する方法を提供する。子宮内膜組織の増殖又は発達異常に関連する疾患又は障害は、子宮内膜ポリープ、子宮内膜症、及び子宮内膜がんを含む。
【0038】
本開示の多形は、骨量減少を抑制する方法に使用することもできる。骨量減少は、しばしば新しい骨組織の個人の形成不均衡及び老齢組織の吸収に起因し、純骨減少をもたらす。当該骨枯渇は個人の範囲で、例えば、閉経後女性(例えば、閉経後骨粗鬆症又は骨減少症を経験している女性)、両側卵巣摘出を受けている女性、長期コルチコイド療法を受けている又は受けた女性、性腺発育障害を経験している女性、及びクッシング症候群を患っている女性に起こり得る。歯及び口腔骨置換を含む骨の特別なニーズについては、骨折、骨構造欠損を有する個人、及び骨関連手術及び/又は補綴物移植を受けているヒトでは、多形を用いて処置を施すことができる。上記の問題に加えて、幾つかの実施態様では、多形は、骨粗鬆症、骨減少症、変形性関節症、低カルシウム血症、高カルシウム血症、パジェット病、骨軟化症、骨石灰脱失症、多発性骨髄腫及び骨組織に対して有害作用を有する他のがんの治療に使用することができる。
【0039】
酢酸バゼドキシフェンの多形フォームは、コレステロールを低下させ、そして乳がんを治療する方法にも使用することができる。加えて、多形は、周閉経期の、閉経期の、又は閉経期後の症状を治療するために使用することができる。幾つかの実施態様では、多形は、閉経前女性の避妊、並びに閉経後女性(顔面潮紅などの血管運動障害の治療など)又はエストロゲン補充が有益な他のエストロゲン欠乏状態におけるホルモン補充療法に使用することができる。多形は、白血病、子宮内膜剥離、慢性腎臓若しくは肝臓疾患、又は凝固疾患若しくは障害などの、無月経が有利な病状においても使用することができる。
【0040】
1つの態様において、本開示は、酢酸バゼドキシフェンの多形フォームDを製造する方法であって:
(a)酢酸バゼドキシフェンの多形フォームAを、酢酸エチルを含む溶媒中に高温下で溶解して溶液を生成させ;そして
(b)溶液を冷却して、酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む方法を提供する。
【0041】
ある実施態様において、本明細書に記載された方法の工程(a)における上記高温は、約30℃又はそれ以上である。ある別の実施態様において、高温は、約40℃又はそれ以上である。ある別の実施態様において、高温は、約50℃又はそれ以上である。ある別の実施態様において、高温は、約60℃又はそれ以上である。
【0042】
ある別の実施態様において、本明細書に記載された方法の工程(a)は、抗酸化剤の存在下で実施される。幾つかの実施態様において、抗酸化剤はアスコルビン酸である。
【0043】
ある別の実施態様において、本明細書に記載された方法の工程(b)における溶液は、約40℃以下に冷却される。幾つかの実施態様において、溶液は約30℃以下に冷却される。ある別の実施態様において、溶液は約0℃〜約30℃の間に冷却される。
【0044】
ある実施態様において、本明細書に記載された方法の工程(b)における結晶化は、酢酸バゼドキシフェンの多形フォームDの種結晶添加により促進される。
【0045】
1つの態様において、本開示は、酢酸バゼドキシフェンの多形フォームDの製造方法であって:
(a)ヘキサメチレンイミノベンジルオキシインドールを、エタノールを含む溶媒中で、触媒の存在下、高温下で水素と接触させ、遊離塩基のバゼドキシフェンを含む第1の反応混合物を得、ここで、第1の反応混合物は、実質的にヘキサメチレンイミノベンジルオキシインドールを含まず;
(b)該第1の反応混合物を抗酸化剤で処理して第2の反応混合物を得;
(c)該第2の反応混合物を濾過して、遊離塩基のバゼドキシフェンを含む溶液(即ち、酢酸を含まないバゼドキシフェン)を得;そして
(d)該溶液を酢酸で処理して酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む方法を提供する。
【0046】
ある実施態様において、上記の本明細書に記載された方法の工程(a)における溶媒は、エタノールに加えて、酢酸エチル、アセトン、シクロヘキサン及びメタノールから成る群から選択される少なくとも1つの溶媒、例えば、エタノール−酢酸エチル、エタノール−アセトン−シクロヘキサン及びエタノール−メタノール−シクロヘキサンを更に含む。1つの実施態様において、溶媒はエタノール及び酢酸エチルを含む。
【0047】
ある実施態様において、上記の本明細書に記載された方法の工程(a)は、約10時間未満で完了する。ある別の実施態様において、工程(a)は、約6時間未満で完了する。更なる実施態様において、工程(a)は、約4時間未満、例えば、約3時間又は約2時間未満で完了する。
【0048】
ある実施態様において、上記の本明細書に記載された方法の工程(a)における水素分圧は、少なくとも約4バールである。ある別の実施態様において、工程(a)における水素分圧は、少なくとも約5バールである。
【0049】
ある実施態様において、上記の本明細書に記載された方法の工程(a)における触媒は、Pd/C触媒である。1つの実施態様において、使用されるPd/C触媒は、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約12mmol未満の量である。別の実施態様において、使用されるPd/C触媒は、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約6mmol未満の量である。別の実施態様において、使用されるPd/C触媒は、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約3mmol未満の量である。
【0050】
更なる実施態様において、Pd/C触媒は、約1、100m2/g以上の全表面積(B.E.T法)を有する。1つの実施態様において、Pd/C触媒は、約1,500m2/gを超える全表面積(B.E.T法)を有する。「B.E.T」は、 Brunauer-Emmett-Tellerを意味し、1〜20m2/gの大きい表面積の物質に適用される表面積測定技法であり、圧力の関数(単分子層被覆)として吸着される気体(例えば、低温でのN2)に基づく(例えば:G.A.Somorjai, Principles of Surface Chemistry, Prentice-Hall, Englewood Cliffs, NJ, 1972, p.216を参照)。
【0051】
1つの実施態様において、Pd/Cは、湿潤性炭素上の非還元性Pdであり、例えば、BASFの触媒、5%Pd/Carbon Powder DeLink、コード番号:57494652である。別の実施態様において、Pd/C触媒は、5%Pd/Carbon Powder DeLink、コード番号:57489193である。両方の触媒は、BASF Catalysts LLC, Iselin, NJから購入可能である。
【0052】
これら2つの典型的な触媒は、異なった物理−化学的特性を示す。下記の表2は2つの触媒の主要な特性値を示す。
【表3】

【0053】
ある実施態様において、上記の本明細書に記載された方法の工程(a)は、約20℃以上の温度で行なわれる。ある別の実施態様において、上記の本明細書に記載された方法の工程(a)は、約30℃以上の温度で行なわれる。ある別の実施態様において、上記の本明細書に記載された方法の工程(a)は、約40℃以上の温度で行なわれる。ある実施態様において、上記の本明細書に記載された方法の工程(a)は、約50℃の温度で行なわれる。
【0054】
ある実施態様において、上記の本明細書に記載された方法の工程(b)における該酸化剤はアスコルビン酸である、
【0055】
ある実施態様において、上記の本明細書に記載された方法の工程(d)は、酢酸バゼドキシフェンの多形フォームAの種結晶を添加することにより促進される。ある実施態様において、工程(d)は、約40℃の温度で行なわれる。ある実施態様において、工程(d)は、約30℃以下の温度で行なわれる。ある実施態様において、工程(d)は、約20℃〜約35℃の温度範囲で行なわれる。ある実施態様において、工程(d)は、約25℃〜約30℃の温度範囲で行なわれる。ある別の実施態様において、工程(d)は、約28℃〜約30℃の温度範囲で行なわれる。
【0056】
ある実施態様において、上記の本明細書に記載された方法の工程(d)は、約4時間未満で完了する。ある実施態様において、工程(d)は、約3時間未満で完了する。ある実施態様において、工程(d)は、約2時間未満で完了する。ある実施態様において、工程(d)は、約0.1時間〜約3時間で完了する。ある実施態様において、工程(d)は、約0.5時間〜約3時間で完了する。
【0057】
ある実施態様において、上記の本明細書に記載された方法の工程(a)〜(d)は、不活性気体の雰囲気下で実施される。不活性気体の非限定的な例としては、窒素、アルゴンなどが挙げられる。
【0058】
ある実施態様において、上記の本明細書に記載された方法の工程(d)において得られる該酢酸バゼドキシフェンの多形フォームDの純度は、約90質量%超であり、約95質量%超であり、約99質量%超であり、又は約99.9質量%超である。
【0059】
上記の本明細書に記載された方法のある実施態様は、1回又はそれ以上の濾過、洗浄及び乾燥工程により、酢酸バゼドキシフェンの多形フォームDを単離することを更に含む。
【0060】
ある実施態様において、多形フォームDの単離における乾燥工程は、撹拌したフィルタードライヤー内で実施される。撹拌したフィルタードライヤーは、単一容器内で、液体から固体を分離するのに有用である。一旦ドライヤーにスラリーを投入すると、窒素などの気体を用いてフィルタードライヤーの最上部から圧力を負荷するか、又はフィルター媒体の下から真空で吸引し、それにより、液体を布又は網を通して押し出すか又は吸引する。ケーキが圧縮されて結晶が一緒に融解しない様に、低圧力(例えば、約1バール)が一般的に用いられる。液体は容器の底から排出される。結晶をフィルター媒体上に集めながら、撹拌器の滑らかな端がケーキの表面を滑らかにするように作動し、ケーキの表面に裂け目が生じないようにする。両方向に回転できる撹拌器のもう一方の端は、ケーキの中へ掘り進み、それを破壊し、フィルター媒体からそれを除去するのを助けるための歯を有することができる。ケーキを破壊し、そして数回洗浄して微量の溶媒又は不純物を除去することができる。ドライヤーに熱を適用して乾燥過程を促進してもよい。好適なフィルタードライヤーは、種々の販売会社から、例えば、OMCA Plants、Italyから購入することができる。
【0061】
当業者には当然のことであるが、撹拌の頻度、1回当たりの撹拌継続時間、合計の撹拌継続時間、及びドライヤーの乾燥時間は、乾燥すべき製品の負荷に依存して変えてよい。1つの実施態様において、撹拌の頻度は約120分間隔であり、1回当たりの撹拌継続時間は約2分、合計の撹拌継続時間は約18分、そして乾燥時間は約18時間である。別の実施態様において、撹拌の頻度は約30分間隔であり、1回当たりの撹拌継続時間は約1分、合計の撹拌継続時間は約38分、そして乾燥時間は約19時間である。尚また別の実施態様において、撹拌の頻度は約60分間隔であり、1回当たりの撹拌継続時間は約1分、合計の撹拌継続時間は約18分、そして乾燥時間は約18時間である。ある実施態様において、湿潤した製品は 低温(例えば、約0℃)で、窒素気流下、撹拌なしで、短時間(例えば、約1時間)放置し、乾燥過程を開始する前に、製品の湿度レベルを低下させる。
【0062】
ある別の実施態様において、多形フォームDの単離における乾燥工程は、タンブルドライヤーで実施される。乾燥は、窒素雰囲気下及び/又は真空条件下でタンブルドライヤーで実施される。好適なタンブルドライヤーは、種々の販売会社から、例えば、Italvacuum
CRIOX, Italyから購入することができる。
【0063】
ある実施態様において、多形フォームDの単離における乾燥工程は、約20℃〜約50℃の間で実施される。ある実施態様において、乾燥工程は、少なくとも約20℃で実施される。ある実施態様において、乾燥工程は、少なくとも約30℃で実施される。ある実施態様において、乾燥工程は、少なくとも約40℃で実施される。ある実施態様において、乾燥工程は、少なくとも約50℃で実施される
【0064】
1つの実施態様において、本開示は、本明細書に記載された方法に従って製造される酢酸バゼドキシフェンの多形フォームDに関する。ある実施態様において、酢酸バゼドキシフェンの多形フォームDの純度は、約90%超であり、約95%超であり、約99%超であり、又は約99.9%超である。本開示全体を通して、酢酸バゼドキシフェンの多形フォームDの純度は、多形フォームの純度を意味する。
【0065】
本開示を、以下の実施例により更に説明する。実施例は説明目的のみのために提供される。それらは、決して、本開示の範囲又は内容を限定するものとして解釈すべきではない。
【実施例】
【0066】
〔実施例1〕
酢酸バゼドキシフェンのフォームDの製造
【化3】

酢酸エチル/エタノール=2.5:1の混合物(190g)中の、ヘキサメチレンイミノベンジルオキシインドール(35.7g)(J. Med. Chem., 2001, 44, 1654-1657、及び欧州特許出願第00802183号、1997年10月22日出願、に記載のように得られた)のスラリーを、Pd/C(0.46g)、Delinkの存在下、5バールの水素雰囲気中で、50℃で24時間水素化した。その後、反応混合物にアスコルビン酸(0.27g)を加え、Celite(登録商標)パッドを通して濾過し、酢酸(1.5g)を加え、そして撹拌しながら30℃に保った。2時間後、自己核形成が起こり、追加の酢酸(3.3g)を加えた。30℃で2時間撹拌した後、沈殿を濾過し、オーブン中減圧下50℃で乾燥し、純粋な酢酸バゼドキシフェンのフォームDを得た。
【0067】
〔実施例2〕
酢酸バゼドキシフェンのフォームDの製造
【化4】

酢酸エチル/エタノール=2.5:1の混合物(30g)中の、ヘキサメチレンイミノベンジルオキシインドール(5.6g)のスラリーを、Pd/C(0.1g)、Delinkの存在下、5バールの水素雰囲気中で、50℃で24時間水素化した。その後、反応混合物にアスコルビン酸(0.04g)を加え、Celite(登録商標)パッドを通して濾過し、酢酸(0.17g)を加え、酢酸バゼドキシフェンのフォームA(7.6mg:例えば、国際公開第05/100316号に記載されたように製造した。この公報の開示内容は、参照によりその全文が本明細書に組み込まれる)の種結晶を添加し、撹拌下に30℃で30分間保った。生成した沈殿を濾過し、母液を30℃に保ってフォームDを生成させた。18時間後、得られた沈殿を濾過し、オーブン中で乾燥して、純粋な酢酸バゼドキシフェンのフォームD(1g)を得た。
【0068】
〔実施例3〕
酢酸バゼドキシフェンのフォームDのフォームAからの製造
酢酸エチル/水=3:1の混合物(14.5Kg)中の酢酸バゼドキシフェンのフォームA(1,500g)をアスコルビン酸(14.2g)及び重炭酸ナトリウム(250g)と合わせて、そして撹拌しつつ約60℃で1時間加熱した。その温度を約1時間維持した。溶液を約40℃に冷却し、そして30分間放置した。有機相を分離し、水(1,000g)を加えた。撹拌後、有機相を分離し、アスコルビン酸(14.2g)及びCelite(43g)と混ぜ合わせた。混合物を約50℃で減圧蒸留し、30℃に冷却し、そして、エタノール/トルエン=13:1の混合物(7Kg)を加えた。反応混合物を撹拌しつつ50℃に加熱し、その温度を約30分間維持した後、40℃に冷却した。懸濁液を濾過し、得られた濾液を30℃に冷却した後、酢酸(57.1g)、酢酸バゼドキシフェンのフォームD(2.8g)及び酢酸(197.1g)を段階的に投入した。反応混合物を0℃に冷却し、そして結晶生成物を濾過し、オーブン中、減圧下約50℃で乾燥し、純度約99.9%の酢酸バゼドキシフェンのフォームD(約1,340g)を得た。
【0069】
〔実施例4〕
粉末X線回折(XRPD)
XRPD分析をBrukerの回折計を用い、以下の条件下で行なった。
スキャン:3〜40°;ステップサイズ:0.01°;
線源:Cu;50mA、35KV;
照射:K(α1)、K(α2);
検出器モデル:Lynx eye、Bruker;
収集時間:1.5sec/ステップ。
酢酸バゼドキシフェンのフォームDについてのXRPDの結果を図1に示す。
【0070】
〔実施例5〕
ラマン分光法
FT-Raman Thermofisherを用い、分解能4cm-1で操作し、250〜4,000cm-1の範囲を走査して、ラマンスペクトルを得た。酢酸バゼドキシフェンのフォームDについて得られたラマンスペクトルの結果を図2に示す。
【0071】
〔実施例6〕
示差走査熱量測定(DSC)
DSC測定は、型式ULSP90のイントラクーラーを備えたPerkin Elmer Diamond装置で行なった。試料(3〜5mg)をアルミニウム製の密閉したパン中に置いた。加熱を、5℃min-1で、60〜200℃の温度範囲で行った。酢酸バゼドキシフェンのフォームDのDSCの結果を図3に示す。
【0072】
〔実施例7〕
固相キャラクタリゼーション
1.酢酸バゼドキシフェンの固相キャラクタリゼーション
多形フォームの特性を評価するために、示差走査熱量測定法(DSC)を用いた熱分析、水性及び有機溶媒中での溶解度測定、及び懸濁液相互変換の検討を行った。
フォームDは、これまで公知の結晶フォームA及びBとは、特徴のある粉末X線回折パターン、ラマンスペクトル、及び熱的性質により区別される。酢酸バゼドキシフェンの公知の固体形態の熱的性質を、表3にリストアップする。
【表4】

【0073】
2.溶解度
酢酸バゼドキシフェンの溶解度は、Crystal-16(Avantium Technologies,BV, Netherland)を用いる動的溶解法(dynamic dissolution method)により測定した。この装置は、4列に配列した16バイアルを収容することができ、結晶化及び溶解度の研究を1mLスケールで行うための中処理量ツールである。各列の温度プロファイル及び磁気撹拌スピードは、独立に調整することができる。各バイアルの濁度をモニターし、そして温度プロファイルと共にプロットして、固体の溶解及び沈殿点を測定した。あらかじめ秤量した固体及び溶媒を透明なガラスバイアル内で混合し、そして徐々に(0.2℃/minで)加熱した。溶解温度を記録した。溶液の濃度(固体と溶媒の質量に基づいて計算した)を、記録した温度での飽和濃度として処理し、溶解度をこの濃度に基づいて計算した。
【0074】
酢酸バゼドキシフェンの溶解度も、また、HPLC法を用いて測定し、この場合、過剰量の固体の酢酸バゼドキシフェンを溶媒中で撹拌して、懸濁液を得た。懸濁液を30分間撹拌した後濾過し、溶液の濃度をHPLCで分析した。2つの方法で測定した溶解度データを、図4及び5にプロットする。
【0075】
2つの溶媒混合物をこの研究に用いた:
1)結晶化溶媒(質量基準):エタノール:66.53%、アセトン:4.02%、シクロヘキサン:2.56%、酢酸エチル:22.26%、トルエン:4.32%、水:0.3%、アスコルビン酸:0.1%;
2)スラリー試験用溶媒(質量基準):エタノール:72.6%(アセトン−NMT:5.5%、及びシクロヘキサン−NMT:3.5%で変性した)、酢酸エチル:22.1%、酢酸:0.7%、トルエン:4.2%、水:0.3%、及びアスコルビン酸:0.1%。
【0076】
フォームAの溶解度は、フォームB及びDより、検討した全ての条件で高いことが判明した。結晶化溶媒中でのフォームDの溶解度は、約30℃未満の温度ではフォームBの溶解度に非常に近似していた。この温度以上では、フォームDの溶解度は、フォームBのそれより若干高かった。
【0077】
3.溶媒懸濁液中での多形混合物の安定性
溶媒が介在するフォーム変換を理解するため、酢酸バゼドキシフェン結晶多形の懸濁液の研究を行った。0.5、25及び70℃での熱力学的に安定なフォームを決定するための実験は、3つの公知の結晶フォームA、B及びD(表4を参照)を用いて行った。3つのフォームの混合物を、所定の温度で、フォームAの飽和溶液中に懸濁し、そして数日間平衡化した。濾過後、固体をXRPDで分析した。
【表5】

【0078】
この研究から、フォームDは、0.5℃において現在までに知られている最も安定な非溶媒和物である。フォームBは、70℃において現在までに知られている最も安定な非溶媒和物であり、そして25℃において、恐らく最も安定な非溶媒和物である。
【0079】
多形変化の動力学を確立するための更なる実験を、工業的結晶化溶媒システムを用いて行った。フォームA及びフォームDを含む試料を、工程の結晶化条件を再現する混合溶媒(シクロヘキサン/アセトン、酢酸エチル、トルエン及び酢酸で変性したエタノール)中、25℃でスラリー化した。2時間後、フォームAからフォームDへの完全な転移が観察された(表5を参照)。以下の表で報告されるデータは、吸熱ピークの比率を取り入れたDSCを用いた定性的評価である。
【表6】

【0080】
多形フォームBの試料を、25℃で、工程の結晶化条件を再現する混合溶媒中でスラリー化し、多形フォームD(5質量%)の種結晶を添加した(表6)。
【表7】

【0081】
多形フォームDの試料を、25℃で、工程の結晶化条件を再現する混合溶媒中でスラリー化し、多形フォームB(5質量%)の種結晶を添加した(表7)。
【表8】

【0082】
これらの相互変換実験から、フォームAのフォームDへの変換速度が、結晶化溶媒中では迅速であることが示されている。フォームDのフォームBへの変換速度、及びその逆もまた、結晶化溶媒混合物中では、前記に示された溶解度データと一致して非常に遅い。
【0083】
4.多形スクリーニング及び安定性研究の要約
広範囲に及ぶ多形のスクリーニングから、酢酸バゼドキシフェンが、複数の結晶フォーム及び非晶質状態で存在し得ることが示された。フォームBは最も高い融点を持つ酢酸バゼドキシフェンの多形である。溶解度及びフォームの安定性研究から、フォームBは、単変的にフォームAと関連していることが示される。フォームDはフォームAより融点が低いが、0〜60℃において、フォームAより溶解性が低い。従って、フォームAは、酢酸バゼドキシフェンの製造工程で遭遇する条件下では、フォームB及びフォームDと比較して準安定である。
【0084】
〔実施例8〕
酢酸バゼドキシフェンのフォームDの検出
1.粉末X線回折
粉末X線回折(XRPD)により、フォームA、B及びD間を識別することが示されている。図6に示されるように、XRPDパターンは、3つの全てのフォームについての識別ピークを有する。フォームDは、回折角(2θ)10.6°の特性ピークにより同定される。
【0085】
フォームDに特有の10.6°のピークの強度(面積)は、フォームAの薬学的活性成分(API)試料中のフォームDの量と直接比例する。フォームDの定量は、試料中のフォームDのピーク面積をフォームDの既知の含量を有する試料(即ち、標準試料)のそれと比較して、較正曲線を作成することにより達成した。この定量方法は、良好な直線性(R2=0.9996)及び良好な感度を有し、約0.5%の検出限界が確立されている。X'Celerator line detectorを備えた、Philips X'Pert MPD 粉末X線回折計を用いた。
【0086】
XRPDは、フォームAに対しては16.1°、フォームDに対しては10.6°の特異的な孤立したピークを示す。相対的ピーク面積方法を、多形定量のばらつきを低減するために用いた。フォームDの相対的ピーク面積は、10.6°におけるフォームDのピーク面積と16.1°におけるフォームAのピーク面積の合計値に対する、10.6°におけるフォームDのピーク面積の比率である。ピーク面積はTopasのソフトウエアを用い、プロファイル・フィッティング(profile fitting)を通して計算された。
【0087】
フォームDの含量とフォームDの相対的ピーク面積間の直線の検量線が、既知量のフォームDを加えた標準試料から、相関係数R2=0.9986で確立された。0.5%〜5%の範囲の含量のフォームDを加えた6個の標準試料を用いた。直線の検量線の信頼性を確実にするため、各添加標準試料について複数回のXRPD測定とピークのフィッティングを行った。
【0088】
次いで、この直線の検量線を用いて、検出されたフォームDを有する所定の酢酸バゼドキシフェン試料中のフォームDの含量を計算した。フォームDが存在するか又は検出されたかを決定するために、3以上(SNR≧3)のシグナル/ノイズ比が用いられた。
【0089】
類似のラインデテクター(line detector)を備えたBrukerX線回折計を用いた同様の方法を用いて、同様に酢酸バゼドキシフェンAPI中のフォームDの含量を、検出限界0.5%で、定量化することができた。
【0090】
2.スラリー増幅試験
分光学的又はX線技術上での検出限界以下で、バルク薬物試料中の多形フォームを検出するために、スラリー増幅法を用いた。多形の安定性に関する研究により、フォームDはフォームAより熱力学的により安定であることが示されている。フォームDの種結晶を有する工業的結晶化溶媒中でのフォームAの飽和懸濁液は、フォームDの溶解度が低いため、不可逆的にフォームDに変換することが示される。これがスラリー増幅試験の基礎であり、この試験は、フォームAの試料中のフォームDのような、100〜1,000ppm(0.01〜0.1質量%)の他の多形フォームを、XRPDによる検出が可能となるまでフォームDの量を増加させることにより、検出するように設計された。
【0091】
25℃でのAPIの懸濁液によるスラリー増幅を、ガラス製プロベラ撹拌器を備えたガラス反応器(100mL)に、結晶化溶媒混合物(30g)(アセトンとシクロヘキサンで変質させたEtOH(エタノールアッセイNLT:91.0質量%;アセトン含量NMT:5.5質量%;シクロヘキサン含量NMT:3.5質量%):72.6質量%;酢酸エチル:22.1質量%;酢酸:0.7質量%;トルエン:4.2質量%;水:0.3質量%;アスコルビン酸:0.1質量%)及び酢酸バゼドキシフェン(4.0g)を、N2雰囲気下で加えて行なった。酢酸バゼドキシフェンの濃度(133mg/g溶媒)は、試験条件における溶媒系での酢酸バゼドキシフェンの溶解度(表3を参照)より有意に高かった。懸濁液を25℃で24時間撹拌(200rpm)した。濾過し、45℃で終夜乾燥した後、固体試料の多形性をXRPDにより調べた。
【0092】
〔実施例9〕
フォームD生成に及ぼす単離、乾燥、及び微粒子化の影響
酢酸バゼドキシフェンのフォームAの製造過程におけるフォームDの発生を理解するために、結晶化中の種々の工程でサンプリングした結果、フォームDが主として、表8(表8におけるパーセンテージの値は、DSCの測定から推測され、それは近似値のみである)で分かるように、結晶化操作中に生成することが明らかになった。結晶化の間に行ったフォームDの種結晶の添加により、フォームDの量は単離及び乾燥操作を通じて増加し続けた。
【表9】

【0093】
更にモニターした結果、結晶化の最後にフォームDが生成しない場合、フォームDを含まない乾燥した酢酸バゼドキシフェンが残ることが示され、そして微粒子化した酢酸バゼドキシフェンも、また、検出できる含量のフォームDを含んでいないことがXRPDにより示された(表9)。
【表10】

【0094】
潜在的なフォームDの成長に及ぼす濾過、乾燥、及び微粒子化の影響を更に研究するために、実験室スケールでの実験を行った。
【0095】
本明細書で特に記載したそれらの実施態様に加えて、本開示の様々な変更は、これまでの記述から当業者には明白であろう。その様な変更も、また、添付の特許請求の範囲の属するものとする。本願において引用された各参考資料は、参照によりその全文が本明細書に組み込まれる。
【特許請求の範囲】
【請求項1】
2θを単位として、約10.6°、14.0°、17.1°、17.5°及び24.2°に特性ピークを含む粉末X線回折パターンを有する、酢酸バゼドキシフェンの結晶多形(フォームD)。
【請求項2】
多形が約166℃〜約168℃のガラス転移温度を有する、請求項1に記載の多形。
【請求項3】
実質的に図2に示されるようなラマンスペクトルを有する、請求項1に記載の多形。
【請求項4】
約1,561cm-1、約1,589cm-1及び約1,613cm-1から選択される1つ又はそれ以上の特性ピークを有するラマンスペクトルを有する、請求項1に記載の多形。
【請求項5】
実質的に図3に示されるような示差走査熱量測定トレースを有する、請求項1に記載の多形。
【請求項6】
請求項1に記載の多形、又は薬学的に許容されるその塩若しくはその水和物、及び薬学的に許容される担体を含む組成物。
【請求項7】
薬学的に許容される担体が経口投与に適しており、そして組成物が経口投与形態を有する、請求項6に記載の組成物。
【請求項8】
組成物中の酢酸バゼドキシフェンの全量の少なくとも約50〜99質量%が多形として存在する、請求項6に記載の組成物。
【請求項9】
組成物中の酢酸バゼドキシフェンの全量の少なくとも約70質量%が多形として存在する、請求項6に記載の組成物。
【請求項10】
組成物中の酢酸バゼドキシフェンの全量の少なくとも約80質量%が多形として存在する、請求項6に記載の組成物。
【請求項11】
組成物中の酢酸バゼドキシフェンの全量の少なくとも約90質量%が多形として存在する、請求項6に記載の組成物。
【請求項12】
本質的に酢酸バゼドキシフェンから成る組成物であって、該酢酸バゼドキシフェンの少なくとも約97〜99質量%が、請求項1に記載の多形として該組成物中に存在する、上記組成物。
【請求項13】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物におけるエストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害を治療する方法。
【請求項14】
請求項13に記載の方法であって、エストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害が、骨粗鬆症、前立腺肥大、男性型禿頭症、膣及び皮膚萎縮、アクネ、不正子宮出血、子宮内膜ポリープ、良性乳房疾患、子宮平滑筋腫、腺筋症、卵巣がん、不妊症、乳がん、子宮内膜症、子宮内膜がん、多嚢胞性卵巣症候群、心血管疾患、避妊、アルツハイマー病、認知低下、メラノーマ、前立腺がん、結腸がん、及びCNSがんから成る群から選択される、上記方法。
【請求項15】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物における子宮内膜組織の増殖又は発達異常に関連する疾患又は障害を治療する方法。
【請求項16】
請求項15に記載の方法であって、子宮内膜組織の増殖又は発達異常に関連する疾患又は障害が、子宮内膜ポリープ、子宮内膜症、及び子宮内膜がんから成る群から選択される、上記方法。
【請求項17】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物におけるコレステロールを低下させる方法。
【請求項18】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物における骨量減少を抑制する方法。
【請求項19】
請求項18に記載の方法であって、骨量減少が、骨粗鬆症、骨減少症、変形性関節症、低カルシウム血症、高カルシウム血症、パジェット病、骨軟化症、骨石灰脱失症、多発性骨髄腫及びがんから成る群から選択される疾患又は障害に起因する、上記方法。
【請求項20】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物における乳がんを治療する方法。
【請求項21】
請求項6に記載の組成物、又はその薬学的に許容される塩若しくは水和物の有効用量を投与することを含む、その動物における閉経期、更年期、又は閉経後の症状を治療する方法。
【請求項22】
請求項21に記載の方法であって、周閉経期の、閉経期の、又は閉経期後の症状が血管運動障害である、上記方法。
【請求項23】
請求項22に記載の方法であって、血管運動障害が顔面潮紅である、上記方法。
【請求項24】
酢酸バゼドキシフェンの多形フォームDの製造方法であって、
(a)酢酸バゼドキシフェンの多形フォームAを、酢酸エチルを含む溶媒に、高温下で溶解して溶液を生成させ;そして
(b)溶液を冷却して、酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む方法。
【請求項25】
工程(a)において、高温が約60℃以上である、請求項24に記載の方法。
【請求項26】
工程(a)が抗酸化剤の存在下で実行される、請求項24に記載の方法。
【請求項27】
工程(b)において、溶液が約30℃以下に冷却される、請求項24に記載の方法。
【請求項28】
酢酸バゼドキシフェンの多形フォームDの製造方法であって、
(a)ヘキサメチレンイミノベンジルオキシインドールを、エタノールを含む溶媒中、触媒の存在下、高温下で水素と接触させ、遊離塩基のバゼドキシフェンを含む第1の反応混合物を得、ここで、第1の反応混合物は実質的にヘキサメチレンイミノベンジルオキシインドールを含まず;
(b)該第1の反応混合物を抗酸化剤で処理して、第2の反応混合物を得;
(c)該第2の反応混合物を濾過して、遊離塩基のバゼドキシフェンを含む溶液を得;そして
(d)該溶液を酢酸で処理して、酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む、上記方法。
【請求項29】
工程(a)において、溶媒が、酢酸エチル、アセトン及びシクロヘキサンから成るグループから選択される少なくとも1つの溶媒を更に含む、請求項28に記載の方法。
【請求項30】
工程(a)が約10時間未満で完了する、請求項28に記載の方法。
【請求項31】
工程(a)が約6時間未満で完了する、請求項28に記載の方法。
【請求項32】
工程(a)が約4時間未満で完了する、請求項28に記載の方法。
【請求項33】
工程(a)において、水素の分圧が少なくとも約4バールである、請求項28に記載の方法。
【請求項34】
工程(a)において、水素の分圧が少なくとも約5バールである、請求項28に記載の方法。
【請求項35】
工程(a)において、触媒がPd/C触媒である、請求項28に記載の方法。
【請求項36】
使用されるPd/C触媒が、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約12mmol未満の量である、請求項28に記載の方法。
【請求項37】
使用されるPd/C触媒が、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約6mmol未満の量である、請求項28に記載の方法。
【請求項38】
Pd/C触媒が約1,100m2/gを超える全表面積(B.E.T)を有する、請求項28に記載の方法。
【請求項39】
Pd/C触媒が約1,500m2/gを超える全表面積(B.E.T)を有する、請求項28に記載の方法。
【請求項40】
Pd/C触媒が湿潤炭素上の非還元Pdであり、そしてここでPd/C触媒がBASF触媒:5%Pd /炭素粉末(DeLink code 57494652)である、請求項28に記載の方法。
【請求項41】
Pd/C触媒がBASF触媒:5%Pd /炭素粉末(catalyst code 57489193)である、請求項28に記載の方法。
【請求項42】
工程(a)が約30℃以上の温度で行なわれる、請求項28に記載の方法。
【請求項43】
工程(a)が約40℃以上の温度で行なわれる、請求項28に記載の方法。
【請求項44】
工程(a)が約50℃の温度で行なわれる、請求項28に記載の方法。
【請求項45】
工程(b)において、抗酸化剤がアスコルビン酸である、請求項28に記載の方法。
【請求項46】
工程(d)が酢酸バゼドキシフェンの多形フォームAの種結晶添加により促進される、請求項28に記載の方法。
【請求項47】
工程(d)が約40℃以下の温度で行なわれる、請求項28に記載の方法。
【請求項48】
工程(d)が約30℃以下の温度で行なわれる、請求項28に記載の方法。
【請求項49】
工程(d)が約20℃〜約35℃の範囲の温度で行なわれる、請求項28に記載の方法。
【請求項50】
工程(d)が約25℃〜約30℃の範囲の温度で行なわれる、請求項28に記載の方法。
【請求項51】
工程(d)が約28℃〜約30℃の範囲の温度で行なわれる、請求項28に記載の方法。
【請求項52】
工程(d)が約4時間未満で完了する、請求項28に記載の方法。
【請求項53】
工程(d)が約3時間未満で完了する、請求項28に記載の方法。
【請求項54】
工程(d)が約2時間未満で完了する、請求項28に記載の方法。
【請求項55】
工程(d)が約0.1時間〜約3時間で完了する、請求項28に記載の方法。
【請求項56】
工程(d)が約0.5時間〜約3時間で完了する、請求項28に記載の方法。
【請求項57】
工程(a)から(d)の工程が不活性雰囲気下で実行される、請求項28に記載の方法。
【請求項58】
工程(d)において、酢酸バゼドキシフェンの多形フォームDの純度が約99%を超える、請求項28に記載の方法。
【請求項59】
酢酸バゼドキシフェンの多形フォームDを、濾過、洗浄及び乾燥の1つ又はそれ以上の工程により単離することを更に含む、請求項28に記載の方法。
【請求項60】
乾燥が撹拌を伴うフィルタードライヤーで実行される、請求項59に記載の方法。
【請求項61】
乾燥がタンブルドライヤーで実行される、請求項59に記載の方法。
【請求項62】
乾燥が約20℃〜約50℃の間で実行される、請求項59に記載の方法。
【請求項63】
乾燥が少なくとも約20℃で実行される、請求項59に記載の方法。
【請求項64】
乾燥が少なくとも約30℃で実行される、請求項59に記載の方法。
【請求項65】
乾燥が少なくとも約40℃で実行される、請求項59に記載の方法。
【請求項66】
乾燥が約50℃で実行される、請求項59に記載の方法。
【請求項67】
請求項28に記載の方法に従って製造される酢酸バゼドキシフェンの多形フォームD。
【請求項68】
酢酸バゼドキシフェンの多形フォームDの純度が約99%を超える、請求項67に記載の酢酸バゼドキシフェンの多形フォームD。
【請求項1】
2θを単位として、約10.6°、14.0°、17.1°、17.5°及び24.2°に特性ピークを含む粉末X線回折パターンを有する、酢酸バゼドキシフェンの結晶多形(フォームD)。
【請求項2】
多形が約166℃〜約168℃のガラス転移温度を有する、請求項1に記載の多形。
【請求項3】
実質的に図2に示されるようなラマンスペクトルを有する、請求項1に記載の多形。
【請求項4】
約1,561cm-1、約1,589cm-1及び約1,613cm-1から選択される1つ又はそれ以上の特性ピークを有するラマンスペクトルを有する、請求項1に記載の多形。
【請求項5】
実質的に図3に示されるような示差走査熱量測定トレースを有する、請求項1に記載の多形。
【請求項6】
請求項1に記載の多形、又は薬学的に許容されるその塩若しくはその水和物、及び薬学的に許容される担体を含む組成物。
【請求項7】
薬学的に許容される担体が経口投与に適しており、そして組成物が経口投与形態を有する、請求項6に記載の組成物。
【請求項8】
組成物中の酢酸バゼドキシフェンの全量の少なくとも約50〜99質量%が多形として存在する、請求項6に記載の組成物。
【請求項9】
組成物中の酢酸バゼドキシフェンの全量の少なくとも約70質量%が多形として存在する、請求項6に記載の組成物。
【請求項10】
組成物中の酢酸バゼドキシフェンの全量の少なくとも約80質量%が多形として存在する、請求項6に記載の組成物。
【請求項11】
組成物中の酢酸バゼドキシフェンの全量の少なくとも約90質量%が多形として存在する、請求項6に記載の組成物。
【請求項12】
本質的に酢酸バゼドキシフェンから成る組成物であって、該酢酸バゼドキシフェンの少なくとも約97〜99質量%が、請求項1に記載の多形として該組成物中に存在する、上記組成物。
【請求項13】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物におけるエストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害を治療する方法。
【請求項14】
請求項13に記載の方法であって、エストロゲン欠乏又はエストロゲン過剰に関連する疾患又は障害が、骨粗鬆症、前立腺肥大、男性型禿頭症、膣及び皮膚萎縮、アクネ、不正子宮出血、子宮内膜ポリープ、良性乳房疾患、子宮平滑筋腫、腺筋症、卵巣がん、不妊症、乳がん、子宮内膜症、子宮内膜がん、多嚢胞性卵巣症候群、心血管疾患、避妊、アルツハイマー病、認知低下、メラノーマ、前立腺がん、結腸がん、及びCNSがんから成る群から選択される、上記方法。
【請求項15】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物における子宮内膜組織の増殖又は発達異常に関連する疾患又は障害を治療する方法。
【請求項16】
請求項15に記載の方法であって、子宮内膜組織の増殖又は発達異常に関連する疾患又は障害が、子宮内膜ポリープ、子宮内膜症、及び子宮内膜がんから成る群から選択される、上記方法。
【請求項17】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物におけるコレステロールを低下させる方法。
【請求項18】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物における骨量減少を抑制する方法。
【請求項19】
請求項18に記載の方法であって、骨量減少が、骨粗鬆症、骨減少症、変形性関節症、低カルシウム血症、高カルシウム血症、パジェット病、骨軟化症、骨石灰脱失症、多発性骨髄腫及びがんから成る群から選択される疾患又は障害に起因する、上記方法。
【請求項20】
請求項6に記載の組成物の有効用量を投与することを含む、それを必要とする動物における乳がんを治療する方法。
【請求項21】
請求項6に記載の組成物、又はその薬学的に許容される塩若しくは水和物の有効用量を投与することを含む、その動物における閉経期、更年期、又は閉経後の症状を治療する方法。
【請求項22】
請求項21に記載の方法であって、周閉経期の、閉経期の、又は閉経期後の症状が血管運動障害である、上記方法。
【請求項23】
請求項22に記載の方法であって、血管運動障害が顔面潮紅である、上記方法。
【請求項24】
酢酸バゼドキシフェンの多形フォームDの製造方法であって、
(a)酢酸バゼドキシフェンの多形フォームAを、酢酸エチルを含む溶媒に、高温下で溶解して溶液を生成させ;そして
(b)溶液を冷却して、酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む方法。
【請求項25】
工程(a)において、高温が約60℃以上である、請求項24に記載の方法。
【請求項26】
工程(a)が抗酸化剤の存在下で実行される、請求項24に記載の方法。
【請求項27】
工程(b)において、溶液が約30℃以下に冷却される、請求項24に記載の方法。
【請求項28】
酢酸バゼドキシフェンの多形フォームDの製造方法であって、
(a)ヘキサメチレンイミノベンジルオキシインドールを、エタノールを含む溶媒中、触媒の存在下、高温下で水素と接触させ、遊離塩基のバゼドキシフェンを含む第1の反応混合物を得、ここで、第1の反応混合物は実質的にヘキサメチレンイミノベンジルオキシインドールを含まず;
(b)該第1の反応混合物を抗酸化剤で処理して、第2の反応混合物を得;
(c)該第2の反応混合物を濾過して、遊離塩基のバゼドキシフェンを含む溶液を得;そして
(d)該溶液を酢酸で処理して、酢酸バゼドキシフェンの多形フォームDを結晶化させる;
ことを含む、上記方法。
【請求項29】
工程(a)において、溶媒が、酢酸エチル、アセトン及びシクロヘキサンから成るグループから選択される少なくとも1つの溶媒を更に含む、請求項28に記載の方法。
【請求項30】
工程(a)が約10時間未満で完了する、請求項28に記載の方法。
【請求項31】
工程(a)が約6時間未満で完了する、請求項28に記載の方法。
【請求項32】
工程(a)が約4時間未満で完了する、請求項28に記載の方法。
【請求項33】
工程(a)において、水素の分圧が少なくとも約4バールである、請求項28に記載の方法。
【請求項34】
工程(a)において、水素の分圧が少なくとも約5バールである、請求項28に記載の方法。
【請求項35】
工程(a)において、触媒がPd/C触媒である、請求項28に記載の方法。
【請求項36】
使用されるPd/C触媒が、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約12mmol未満の量である、請求項28に記載の方法。
【請求項37】
使用されるPd/C触媒が、使用されるヘキサメチレンイミノベンジルオキシインドール1mol当たり約6mmol未満の量である、請求項28に記載の方法。
【請求項38】
Pd/C触媒が約1,100m2/gを超える全表面積(B.E.T)を有する、請求項28に記載の方法。
【請求項39】
Pd/C触媒が約1,500m2/gを超える全表面積(B.E.T)を有する、請求項28に記載の方法。
【請求項40】
Pd/C触媒が湿潤炭素上の非還元Pdであり、そしてここでPd/C触媒がBASF触媒:5%Pd /炭素粉末(DeLink code 57494652)である、請求項28に記載の方法。
【請求項41】
Pd/C触媒がBASF触媒:5%Pd /炭素粉末(catalyst code 57489193)である、請求項28に記載の方法。
【請求項42】
工程(a)が約30℃以上の温度で行なわれる、請求項28に記載の方法。
【請求項43】
工程(a)が約40℃以上の温度で行なわれる、請求項28に記載の方法。
【請求項44】
工程(a)が約50℃の温度で行なわれる、請求項28に記載の方法。
【請求項45】
工程(b)において、抗酸化剤がアスコルビン酸である、請求項28に記載の方法。
【請求項46】
工程(d)が酢酸バゼドキシフェンの多形フォームAの種結晶添加により促進される、請求項28に記載の方法。
【請求項47】
工程(d)が約40℃以下の温度で行なわれる、請求項28に記載の方法。
【請求項48】
工程(d)が約30℃以下の温度で行なわれる、請求項28に記載の方法。
【請求項49】
工程(d)が約20℃〜約35℃の範囲の温度で行なわれる、請求項28に記載の方法。
【請求項50】
工程(d)が約25℃〜約30℃の範囲の温度で行なわれる、請求項28に記載の方法。
【請求項51】
工程(d)が約28℃〜約30℃の範囲の温度で行なわれる、請求項28に記載の方法。
【請求項52】
工程(d)が約4時間未満で完了する、請求項28に記載の方法。
【請求項53】
工程(d)が約3時間未満で完了する、請求項28に記載の方法。
【請求項54】
工程(d)が約2時間未満で完了する、請求項28に記載の方法。
【請求項55】
工程(d)が約0.1時間〜約3時間で完了する、請求項28に記載の方法。
【請求項56】
工程(d)が約0.5時間〜約3時間で完了する、請求項28に記載の方法。
【請求項57】
工程(a)から(d)の工程が不活性雰囲気下で実行される、請求項28に記載の方法。
【請求項58】
工程(d)において、酢酸バゼドキシフェンの多形フォームDの純度が約99%を超える、請求項28に記載の方法。
【請求項59】
酢酸バゼドキシフェンの多形フォームDを、濾過、洗浄及び乾燥の1つ又はそれ以上の工程により単離することを更に含む、請求項28に記載の方法。
【請求項60】
乾燥が撹拌を伴うフィルタードライヤーで実行される、請求項59に記載の方法。
【請求項61】
乾燥がタンブルドライヤーで実行される、請求項59に記載の方法。
【請求項62】
乾燥が約20℃〜約50℃の間で実行される、請求項59に記載の方法。
【請求項63】
乾燥が少なくとも約20℃で実行される、請求項59に記載の方法。
【請求項64】
乾燥が少なくとも約30℃で実行される、請求項59に記載の方法。
【請求項65】
乾燥が少なくとも約40℃で実行される、請求項59に記載の方法。
【請求項66】
乾燥が約50℃で実行される、請求項59に記載の方法。
【請求項67】
請求項28に記載の方法に従って製造される酢酸バゼドキシフェンの多形フォームD。
【請求項68】
酢酸バゼドキシフェンの多形フォームDの純度が約99%を超える、請求項67に記載の酢酸バゼドキシフェンの多形フォームD。
【図1】


【図2−1】


【図2−2】


【図3】


【図4】


【図5】


【図6】




【図2−1】


【図2−2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−37832(P2011−37832A)
【公開日】平成23年2月24日(2011.2.24)
【国際特許分類】
【外国語出願】
【出願番号】特願2010−141370(P2010−141370)
【出願日】平成22年6月22日(2010.6.22)
【出願人】(309040701)ワイス・エルエルシー (181)
【Fターム(参考)】
【公開日】平成23年2月24日(2011.2.24)
【国際特許分類】
【出願番号】特願2010−141370(P2010−141370)
【出願日】平成22年6月22日(2010.6.22)
【出願人】(309040701)ワイス・エルエルシー (181)
【Fターム(参考)】
[ Back to top ]

