酢酸耐性付与方法、酢酸耐性酵母の製造方法、酢酸耐性酵母を用いたエタノールの製造方法
【課題】エタノール発酵能を有する酵母おける酢酸耐性を向上させる。
【解決手段】エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる。
【解決手段】エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エタノール発酵に利用される酵母に対する酢酸耐性付与方法、酢酸耐性酵母の製造方法及び酢酸耐性酵母を用いたエタノールの製造方法に関する。
【背景技術】
【0002】
酵母によるエタノール発酵は、古くからの醸造のみならず、近年においてはバイオマスを利用した反応系にまで応用されている。従来、酵母のエタノール発酵能を向上させる試みが検討されている。一例として、酵母の酢酸耐性を向上させることで、培養環境中に存在する酢酸による酵母の増殖阻害を防止するといった技術が知られている(非特許文献1)。この非特許文献1に開示された方法は、可溶性低分子を細胞内に取り込む機能を有するFPS1遺伝子を破壊するといった方法である。FPS1遺伝子を破壊した酵母は、細胞内に酢酸を取り込みにくくなるため、酢酸を含有する培地において増殖できる。
【0003】
このように、遺伝子破壊により酵母に酢酸耐性を付与することはできるものの、酢酸耐性の程度としては未だ十分とは言えない。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Molecular and Cellular Biology, 2007, Vol. 27, p. 6446-6456
【発明の概要】
【発明が解決しようとする課題】
【0005】
そこで、本発明は、上述した実情に鑑み、特に、エタノール発酵能を有する酵母における酢酸耐性を向上させる酢酸耐性能付与方法、酢酸耐性酵母の製造方法及び酢酸耐性酵母を用いたエタノールの製造方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
上記目的を達成するため、本発明者らが鋭意検討した結果、エタノール発酵能を有する酵母に、機能未知の所定の遺伝子を導入する又は当該遺伝子の発現量を向上させることで当該酵母の酢酸耐性を向上できることを見いだし、本発明を完成するに至った。
【0007】
すなわち、本発明に係る酵母における酢酸耐性向上方法は、エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる方法である。
【0008】
また、本発明に係る酢酸耐性酵母の製造方法は、エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる方法である。
【0009】
さらに、本発明に係る酢酸耐性酵母を用いたエタノールの製造方法は、エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させた酵母を培地に培養し、培地からエタノールを回収する方法である。
【0010】
本発明において、 YOL046C遺伝子及び当該YOL046C遺伝子に機能的に等価な遺伝子は、以下の(a)〜(c)のいずれかの遺伝子であることが好ましい。
(a)配列番号2に示すアミノ酸配列に対して80%以上の一致度を有するアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(b)配列番号2に示すアミノ酸配列に対して1又は複数個のアミノ酸が欠失、置換、不可又は挿入されたアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(c)配列番号1に示す塩基配列に対する相補的な塩基配列からなるポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズすることができ、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
また、本発明においてエタノール発酵能を有する酵母としてはSaccharomyces cerevisiaeを使用することができる。
【発明の効果】
【0011】
本発明によれば、エタノール発酵能を有する酵母における酢酸耐性を付与又は向上させることができる。すなわち、本発明によれば、酢酸耐性に優れた酵母を作出することができ、酢酸存在下におけるエタノール収率を向上させることができる。したがって、本発明を適用することによって、例えば、バイオマスを利用した酵母によるエタノール発酵を効率化することができ、その結果、エタノールの生産性を改善することができる。
【図面の簡単な説明】
【0012】
【図1】各種濃度の酢酸存在下における、コントロール株のOD600を測定した結果を示す特性図である。
【図2】各種濃度の酢酸存在下における、OC-2Δfps1株のOD600を測定した結果を示す特性図である。
【図3】各種濃度の酢酸存在下における、ORF過剰発現酵母ライブラリについてOD600を測定した結果を示す特性図である。
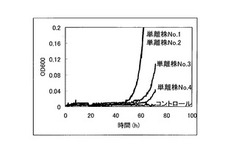
【図4】120mMの酢酸存在下における、単離株No.1〜No.4及びコントロール酵母のOD600を測定した結果を示す特性図である。
【発明を実施するための形態】
【0013】
以下、本発明を図面及び実施例を用いてより詳細に説明する。
本発明に係る酢酸耐性付与方法は、エタノール発酵能を有する酵母に所定の遺伝子を導入する又は当該遺伝子の発現量を向上させるといった特徴を有する。換言すると、エタノール発酵能を有する酵母に対して当該遺伝子を導入する又は当該遺伝子の発現量を向上させることで酢酸耐性に優れた酵母を製造できる。ここで、上記所定の遺伝子とは、Saccharomyces cerevisiaeにおけるYOL046C遺伝子及びYOL046C遺伝子に機能的に等価な遺伝子である。また、遺伝子の発現量を向上させるには、一例として、当該遺伝子の発現制御領域を改変する手法を挙げることができる。発現制御領域とは、RNAポリメラーゼが結合するプロモーター領域及びその他の転写因子が結合する領域を含む意味である。転写制御領域の改変としては、内在する転写制御領域のうち例えばプロモーター領域を、より高発現が可能なプロモーター領域に置換することが好ましい。
【0014】
<YOL046C遺伝子>
YOL046C遺伝子とは、Saccharomyces cerevisiaeにおいて機能未知の遺伝子として同定されている遺伝子である。YOL046C遺伝子に関する文献としてはMolecular Biology of the Cell, Vol. 19, 284-296, January 2008が挙げられる。当該文献は、菌糸成長について調査するために、菌糸を伸ばすSaccharomyces cerevisiae Σ1278b株の遺伝子破壊もしくはORF過剰発現株のライブラリを作製し、評価している。そして、YOL046C遺伝子の過剰発現株では、菌糸の成長が野生型と比較して促進するといった表現型を示すことが明らかになっている。しかし、当該文献やその他の知見から、YOL046C遺伝子が酵母における酢酸の取り込みや代謝など酢酸耐性に関与することは示唆されていない。
【0015】
YOL046C遺伝子におけるコーディング領域の塩基配列を配列番号1に示す。また、YOL046C遺伝子がコードするタンパク質のアミノ酸配列を配列番号2に示す。ただし、これら具体的な塩基配列及びアミノ酸配列は、Saccharomyces cerevisiaeにおける標準株にて同定されたものであり、他のSaccharomyces cerevisiaeのYOL046C遺伝子は、配列番号1の塩基配列とは異なる塩基配列を有するか、配列番号2のアミノ酸配列とは異なるアミノ酸配列のタンパク質をコードすることもある。すなわち、Saccharomyces cerevisiaeのYOL046C遺伝子という場合でも、配列番号1の塩基配列からなるコーディング領域を有するもの、或いは配列番号2のアミノ酸配列からなるタンパク質をコードするものに限定されない。
【0016】
YOL046C遺伝子としては、配列番号2のアミノ酸配列に対して高い類似性を有するアミノ酸配列を有し、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードする遺伝子であってもよい。ここで、高い類似性とは、例えば80%以上の一致度を意味し、好ましくは90%以上の一致度、より好ましくは95%以上の一致度、最も好ましくは97%以上の一致度を意味する。なお、一致度の値は、配列類似性を検索するプログラム(相同性検索プログラムと称される場合もある)を用いて、配列番号2のアミノ酸配列と他のアミノ酸配列とをアライメントした際に、当該他のアミノ酸配列における、配列番号2のアミノ酸配列に対して一致したアミノ酸残基の割合として算出される値である。
【0017】
また、YOL046C遺伝子としては、配列番号2のアミノ酸配列における1又は複数個のアミノ酸が置換、欠失、付加又は挿入されたアミノ酸配列を有するタンパク質であって、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードする遺伝子であってもよい。ここで、複数個のアミノ酸とは、例えば2〜30個のアミノ酸を意味し、好ましくは2〜20個、より好ましくは2〜10個、最も好ましくは2〜5個のアミノ酸を意味する。
【0018】
さらに、YOL046C遺伝子としては、配列番号1の塩基配列に対して相補的な塩基配列を含むポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズするポリヌクレオチドであって、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードするポリヌクレオチドであってもよい。ここで、ストリンジェントな条件下でハイブリダイズするとは、60℃で2×SSC洗浄条件下で結合を維持することを意味する。ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。
【0019】
上述したような、配列番号1の塩基配列とは異なる塩基配列、配列番号2のアミノ酸配列とは異なるアミノ酸配列を有するタンパク質をコードするYOL046C遺伝子は、Saccharomyces cerevisiaeに分類される各種の株から単離することができる。或いは、配列番号1の塩基配列とは異なる塩基配列、配列番号2のアミノ酸配列とは異なるアミノ酸配列を有するタンパク質をコードするYOL046C遺伝子は、例えば、配列番号1の塩基配列を含むポリヌクレオチドを、当該技術分野で公知の手法によって人為的に改変することによって取得することもできる。塩基配列に変異を導入するには、Kunkel法またはGapped duplex法等の公知手法又はこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-KやMutant-G(何れも商品名、TAKARA社製))等を用いて、あるいはLA PCR in vitro Mutagenesisシリーズキット(商品名、TAKARA社製)を用いて変異が導入される。
【0020】
配列番号1の塩基配列とは異なる塩基配列を含むポリヌクレオチド、配列番号2のアミノ酸配列とは異なるアミノ酸配列を有するタンパク質をコードするポリヌクレオチドについては、当該ポリヌクレオチドを宿主酵母に導入して過剰発現させ、酢酸含有培地における増殖能を検証することで、当該ポリヌクレオチド導入酵母における酢酸耐性を評価できる。このように評価できる酢酸耐性が宿主酵母より有意に向上している場合、宿主酵母に導入したポリヌクレオチドをYOL046C遺伝子であると判断することができる。
【0021】
また、YOL046C遺伝子に機能的に等価な遺伝子とは、Saccharomyces cerevisiae以外の生物由来であって、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードする遺伝子を意味する。すなわち、YOL046C遺伝子に機能的に等価な遺伝子とは、Saccharomyces cerevisiaeにおけるYOL046C遺伝子に対する広義のホモログの関係にある遺伝子又はオルソログの関係にある遺伝子を意味する。
【0022】
このようなYOL046C遺伝子に機能的に等価な遺伝子は、Saccharomyces cerevisiae以外の生物由来に関するゲノムDNAの配列情報を格納したデータベースを検索することによって特定することができる。ここで、データベースとしては、MBGD、GenBank、DDBJ及びEMBL等のデータベースを挙げることができる。ただし、YOL046C遺伝子に機能的に等価な遺伝子を検索するに際して、使用するデータベースには何ら制限はない。特に、データベースとしては、1つの種について1つのゲノム情報を検索対象としたシステムを実装しているMBGDを使用することが好ましい。データベースを用いたYOL046C遺伝子に機能的に等価な遺伝子の検索は、配列番号1の塩基配列及び/又は配列番号2のアミノ酸配列をクエリー配列として上述した配列類似性の値に基づいて実行できる。このような検索においては、上述した配列類似性は相同性と同義となる。このような検索において、例えば、配列番号2のアミノ酸配列に対して、好ましくは80%以上、より好ましくは85%以上、更に好ましくは90%以上、最も好ましくは95%以上の相同性(配列類似性)を有するアミノ酸配列を有するタンパク質をコードする遺伝子をYOL046C遺伝子に機能的に等価な遺伝子として特定できる。
【0023】
また、YOL046C遺伝子に機能的に等価な遺伝子は、例えば、配列番号2のアミノ酸配列に対して、1又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列を有し、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードするものでも良い。ここで、数個とは、例えば、2〜30個、好ましくは2〜20個、より好ましくは2〜10個、最も好ましくは2〜5個である。
【0024】
さらにまた、YOL046C遺伝子に機能的に等価な遺伝子、例えば、配列番号1の塩基配列からなるDNAの相補鎖の全部又は一部に対して、ストリンジェントな条件下でハイブリダイズし、かつ宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードするものでもよい。ここでいう「ストリンジェントな条件」とはいわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件を意味し、例えばMolecular Cloning: A Laboratory Manual(Third Edition)を参照して適宜決定することができる。具体的には、サザンハイブリダイゼーションの際の温度や溶液に含まれる塩濃度、及びサザンハイブリダイゼーションの洗浄工程の際の温度や溶液に含まれる塩濃度によりストリンジェンシーを設定することができる。
【0025】
<エタノール発酵能を有する酵母>
上述したYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子を導入する又は当該遺伝子の発現量を向上させる対象としては、エタノール発酵能を有する酵母を挙げることができる。このような酵母としては、特に限定されないが、Candida Shehatae、Pichia stipitis、Pachysolen tannophilus、Saccharomyces cerevisiae及びSchizosaccaromyces pombeなどの酵母が挙げられ、特にSaccharomyces cerevisiaeが好ましい。また、酵母としては、実験面での利便性のために使われる実験株でも良いし、実用面での有用性のために使われている工業株(実用株)でも良い。工業株としては、例えば、ワイン、清酒や焼酎作りに用いられる酵母株を挙げることができる。
【0026】
なかでも、Saccharomyces cerevisiae OC-2株は、従来ワイン醸造の場面で利用されてきた安全性を確認されている菌株であるため好ましい。また、Saccharomyces cerevisiae OC-2株は、後述する実施例で示したように、高糖濃度の条件下におけるプロモーター活性が優れた菌株であるため好ましい。特にSaccharomyces cerevisiae OC-2株は、高糖濃度条件においてピルビン酸脱炭酸酵素遺伝子(PDC1)のプロモーター活性が優れているため好ましい。
【0027】
また、導入する遺伝子のプロモーターとしては、特に限定されないが、例えばグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子(TDH3)のプロモーター、3-ホスホグリセレートキナーゼ遺伝子(PGK1)のプロモーター、高浸透圧応答7遺伝子(HOR7)のプロモーターなどが利用可能である。なかでもピルビン酸脱炭酸酵素遺伝子(PDC1)のプロモーターが下流の目的遺伝子を高発現させる能力が高いために好ましい。その他にも、TEF1遺伝子プロモーター、ADH1遺伝子プロモーター、TPI1遺伝子プロモーター、HXT7遺伝子プロモーター及びPYK1遺伝子プロモーターを使用することができる。
【0028】
すなわち、上述した遺伝子は、発現を制御するプロモーターやその他の発現制御領域とともに酵母のゲノムに導入してもよい。または、上述した遺伝子は、宿主となる酵母のゲノムに本来的に存在する遺伝子のプロモーターやその他の発現制御領域により発現制御されるように導入してもよい。
【0029】
また、上述した遺伝子を導入する方法としては、酵母の形質転換方法として知られている従来公知のいかなる手法をも適用することができる。具体的には、例えば、例えば、エレクトロポレーション法“Meth. Enzym., 194, p182 (1990)”、スフェロプラスト法“Proc. Natl. Acad. Sci. USA, 75 p1929(1978)”、酢酸リチウム法“J.Bacteriology, 153, p163(1983)”、Proc. Natl. Acad. Sci. USA, 75 p1929 (1978)、Methods in yeast genetics, 2000 Edition : A Cold Spring Harbor Laboratory Course Manualなどに記載の方法で実施可能であるが、これに限定されない。
【0030】
一方、エタノール発酵能を有する酵母に内在するYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子について、その発現制御領域を改変する方法により遺伝子の発現量を向上させることもできる。すなわち、YOL046C遺伝子や、当該YOL046C遺伝子に機能的に等価な遺伝子の発現制御領域(例えばプロモーター)を、より高発現可能なものに置換する方法、所定の遺伝子の発現を上昇させるようなレギュレーターを導入する方法などを使用することができる。高発現可能なプロモーターとしては、特に限定されず、上記で列挙したプロモーターを適宜使用することができる。また、内在する発現制御領域に突然変異を導入し、より高発現できるものに改変することも可能である。
【0031】
なお、酵母に内在するYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子の発現量を向上させるには、当該遺伝子が転写されてなるmRNAの生存時間を延長させることや、輸送タンパク質の細胞内での分解を防ぐことによっても達成可能である。
【0032】
<エタノール製造>
以上で説明した組換え酵母を使用してエタノールを製造する際には、グルコース等の炭素源を含む培地にてエタノール発酵培養を行い、培地からエタノールを回収する方法である。また、培地としては、SD培地、YPD培地、YPAD培地、YM培地といった酵母用の培地を適宜使用することもできる。さらに、バイオマスを糖化した後の処理物を培地として使用することもできる。バイオマスは、セルロースやヘミセルロース、キシランをといった多糖類を含んでおり、これら多糖類を構成単糖又はオリゴ糖にまで加水分解(糖化)する。このようにして得られた糖類は酵母によりエタノール発酵の基質として使用される。一般に、この糖化処理には、セルラーゼ等の糖化酵素が利用される。なお、糖化方法としては、特に限定されないが、セルラーゼやヘミセルラーゼ等のセルラーゼ製剤を利用する酵素法等を挙げることができる。セルラーゼ製剤は、セルロース鎖及びヘミセルロース鎖の分解に関与する複数の酵素を含んでおり、エンドグルカナーゼ活性、エンドキシラナーゼ活性、セロビオヒドロラーゼ活性、グルコシダーゼ活性及びキシロシダーゼ活性等の複数の活性を示す。セルラーゼ製剤としては、特に限定されないが、例えば、Trichoderma reeseiや、Acremonium cellulolyticusなどが生産するセルラーゼを挙げることができる。セルラーゼ製剤としては、市販されているものを使用しても良い。
【0033】
バイオマスに含まれる多糖類を構成単糖にまで分解する割合、すなわち糖化率を向上させるため、一般的には糖化処理に先立ってバイオマスに対する前処理が施されてもよい。前処理工程としては、例えば、粉砕したセルロース系バイオマスを希硫酸溶液やアルカリ溶液、イオン液体に浸漬する処理、水熱処理、微粉砕処理といった処理が挙げられる。これら前処理により、バイオマスの糖化率を向上させることができる。
【0034】
このようにバイオマスに由来する糖を利用してエタノールを製造する場合、上述した前処理や糖化処理において酢酸やフルフラールといった発酵阻害物質が生産される場合がある。特に酢酸については、酵母の生育・増殖を阻害するため、エタノールの生産性を低下させる一因として知られている。
【0035】
しかしながら、エタノール発酵能を有する酵母において、上述したYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子を導入する又は当該遺伝子の発現量を向上させるように改変することで、酢酸による生育・増殖阻害を低減又は防止できる。よって、上述したYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子を導入する又は当該遺伝子の発現量を向上させるように改変した酵母を用いてエタノール発酵を行うことで、酢酸存在下においても優れた生産性でエタノールを製造できる。特に、上述した前処理や糖化処理を行った後の処理物に含まれる糖を利用してエタノール発酵を行う場合であっても、当該処理物に含まれる酢酸による生育・増殖阻害を防止でき、優れたエタノール生産性を達成できる。
【0036】
なお、エタノール発酵に利用する培地としてはバイオマスを含む培地であっても良い。この場合、エタノール発酵は、いわゆる同時糖化発酵処理となる。同時糖化発酵処理とは、バイオマス糖化工程とエタノール発酵工程とを区別せずに同時に実施する処理を意味する。なお、同時糖化発酵処理に先立って、バイオマスに対して従来公知の前処理を施しても良い。前処理としては、特に限定されないが、例えば、リグニンを微生物によって分解する処理や、セルロース系バイオマスの粉砕処理等を挙げることができる。
【0037】
同時糖化発酵処理では、セルロース系バイオマス(前処理後であってもよい)を含む培地にセルラーゼ製剤と上述した組換え微生物とを加え、所定の温度範囲で当該組換え酵母を培養する。培養温度としては特に限定されないが、エタノール発酵の効率を考慮して25〜45℃とすることができ、30〜40℃とすることが好ましい。また、培養液のpHを4〜6とすることが好ましい。また、培養に際して、攪拌や振とうしてもよい。
【0038】
本発明を利用したエタノールの製造方法では、エタノール発酵の後、培地からエタノールを回収する。エタノールの回収方法は、特に限定されず、従来公知のいかなる方法も適用することができる。例えば、上述したエタノール発酵が終了した後、固液分離操作によってエタノールを含む液層と、組換え酵母や固形成分を含有する固層とを分離する。その後、液層に含まれるエタノールを蒸留法によって分離・精製することで、純度の高いエタノールを回収することができる。なお、エタノールの精製度は、エタノールの使用目的にあわせて適宜調整することができる。
【実施例】
【0039】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の技術的範囲は以下の実施例に限定されるものではない。
〔実施例1〕
本実施例では、酵母ゲノムにおけるオープンリーディングフレーム(ORF)をGAL1プロモーターの制御下で過剰発現する酵母ライブラリを以下のように作製した。先ず、Saccharomyces cerevisiaeのORFをGAL1プロモーターの下流に挿入した酵母発現ベクターのコレクションであるYeast ORF clone collection (Open Biosystems社製)を入手し、当該ベクターを宿主である大腸菌より抽出した。次に、抽出したベクターを用いて酵母S. cerevisiae OC-2Δura3株を酢酸リチウム法により形質転換した。なお、S. cerevisiae OC-2Δura3株は、UV変異によりOC-2株のURA3遺伝子を破壊した株である。
【0040】
得られた形質転換体を5mlのSDCA(0.67% yeast nitrogen base w/o amino acids、2% D-glucose、2% Casamino acid)培地で培養することでORF過剰発現酵母ライブラリを作製した。なお、このとき、培養温度を30℃とし、120rpmで攪拌しながら1日間培養した。
【0041】
また、比較のために、酢酸含有培地において増殖可能であることが知られている、FPS1遺伝子破壊酵母を作製した。FPS1遺伝子を破壊するための遺伝子断片を以下のように作製した。先ず、S. cerevisiae OC-2株のゲノムDNAを基にプライマーI、IIを用いてPCRを行い、FPS1遺伝子の部分配列(1番目から500番目)を500残基増幅した。同様に、プライマーV、VIを用いてPCRを行い、FPS1遺伝子の部分配列(1511番目から2011番目)を500残基増幅した。また、次に、プラスミドpRS406 (Stratagene社製)を基にプライマーIII、IVを用いて5’末端及び3’末端にFPS1遺伝子の一部(5’末端側:FPS1の471番目から500番目を付加、3’末端側:FPS1の1511番目から1540番目を付加)を含むURA3遺伝子を増幅した。
【0042】
以上のようにPCRで増幅した3断片とプライマーI、VIを用いたPCRにより、FPS1遺伝子を破壊するための遺伝子断片を作製した。作製した遺伝子断片を用いてS. cerevisiae OC-2Δura3株を酢酸リチウム法で形質転換した。S. cerevisiae OC-2Δura3株はホモタリズム酵母であるため、得られた形質転換体を胞子形成させ、再度、選択培地にて培養することで、FPS1遺伝子をホモに破壊した二倍体酵母OC-2Δfps1を作製した。
【0043】
以下に使用したプライマーを纏めて示す。
プライマーI:ATGAGTAATCCTCAAAAAGCTCTAAACGACTTTCTGTCCA(配列番号3)
プライマーII:ATGAGTAATCCTCAAAAAGCTCTAAACGACTTTCTGTCCA(complementary) (配列番号4)
プライマーIII:AGATTTTTACAAAAATGCAGACGATGCGCAtcaattcatcattttttttttattcttttt(配列番号5)
プライマーIV:CCATGGGAACCCAAAAGAAATGATGATGATgggtaataactgatataattaaattgaagc (complementary) (配列番号6)
プライマーV:ATCATCATCATTTCTTTTGGGTTCCCATGGTAGGCCCATT(配列番号7)
プライマーVI:TCATGTTACCTTCTTAGCATTACCATAATGCGAATCTTCT(complementary) (配列番号8)
なお、FPS1遺伝子の塩基配列を配列番号9に示し、URA3遺伝子の塩基配列を配列番号10に示した。
【0044】
以上のように作製した、ORF過剰発現酵母ライブラリ、OC-2Δfps1株、ORFを生産していないコントロール株について酢酸耐性を比較検討した。先ず、これらORF過剰発現酵母ライブラリ、OC-2Δfps1株、ORFを生産していないコントロール株を5mlのSGCA (0.67% yeast nitrogen base w/o amino acids、2% galactose、2% Casamino acid)培地にOD=0.03となるように植菌し、30℃で120rpmで撹拌しながら1日間培養した。次に、培養した酵母をOD=0.03になるように酢酸を含むSGCA+酢酸培地(酢酸0〜130mM、0.67% yeast nitrogen base w/o amino acids、2% galactose、2% Casamino acid)に植菌し、経時的にOD600を測定した。コントロール株についてOD600を測定した結果を図1に示す。OC-2Δfps1株についてOD600を測定した結果を図2に示す。ORF過剰発現酵母ライブラリについてOD600を測定した結果を図3に示す。
【0045】
次に、ORF過剰発現酵母ライブラリについては、120mMの酢酸を含むSGCA培地で約70時間培養した培養液をSGCA寒天培地にプレーティングを行い、生育したシングルコロニーからランダムに4株を選抜した。シングルコロニー4株からプラスミドを抽出し、シークエンス用プライマー(GAATAAGAA GTAATACAAA CCGAAAATG:配列番号11)を用いてプラスミドの配列を決定した。抽出したプラスミドを用いて酵母S. cerevisiae OC-2Δura3株を酢酸リチウム法により形質転換し、単離株No.1〜No.4を獲得した。
【0046】
次に、コントロール酵母と単離株No.1〜No.4を5mlのSGCA培地にOD=0.03となるように植菌し、30℃で120rpmで撹拌しながら1日間培養した。培養した酵母をOD=0.03になるように120mM酢酸を含むSGCA+酢酸培地に植菌し、経時的にOD600を測定した。これら単離株No.1〜No.4及びコントロール酵母についてOD600を測定した結果を図4に示す。
【0047】
図1に示すように、コントロール酵母においては、50mMの酢酸存在下で生育・増殖阻害の傾向が見られ、100mM以上の酢酸存在下では殆ど死滅していることが判る。一方、図2に示すように、FPS1遺伝子を欠損したOC-2Δfps1株では、生育・増殖が若干阻害されるものの100mの酢酸存在下でも生育・増殖できている。ただし、OC-2Δfps1株は、130mMの酢酸存在下では全く殆ど死滅していることが判る。
【0048】
これに対して、図3に示すような優れた酢酸耐性を示したORF過剰発現酵母ライブラリから単離した単離株No.1〜No.4については、図4に示すように、120mMといった酢酸存在下においても優れた生育・増殖特性を示していた。この結果から、単離株No.1〜No.4において高発現している遺伝子は、酵母に対して酢酸耐性を付与するものであることが示された。
【0049】
シークエンス用プライマー(GAATAAGAA GTAATACAAA CCGAAAATG:配列番号11)を用いてプラスミドの配列を決定した結果、単離株No.1〜No.4において高発現している遺伝子は、全てYOL046C遺伝子であることが判明した。以上の結果より、所定の酵母についてYOL046C遺伝子を導入する又は当該YOL046C遺伝子の発現量を向上させることで、当該酵母に対して酢酸耐性を付与できることが明らかになった。
【技術分野】
【0001】
本発明は、エタノール発酵に利用される酵母に対する酢酸耐性付与方法、酢酸耐性酵母の製造方法及び酢酸耐性酵母を用いたエタノールの製造方法に関する。
【背景技術】
【0002】
酵母によるエタノール発酵は、古くからの醸造のみならず、近年においてはバイオマスを利用した反応系にまで応用されている。従来、酵母のエタノール発酵能を向上させる試みが検討されている。一例として、酵母の酢酸耐性を向上させることで、培養環境中に存在する酢酸による酵母の増殖阻害を防止するといった技術が知られている(非特許文献1)。この非特許文献1に開示された方法は、可溶性低分子を細胞内に取り込む機能を有するFPS1遺伝子を破壊するといった方法である。FPS1遺伝子を破壊した酵母は、細胞内に酢酸を取り込みにくくなるため、酢酸を含有する培地において増殖できる。
【0003】
このように、遺伝子破壊により酵母に酢酸耐性を付与することはできるものの、酢酸耐性の程度としては未だ十分とは言えない。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Molecular and Cellular Biology, 2007, Vol. 27, p. 6446-6456
【発明の概要】
【発明が解決しようとする課題】
【0005】
そこで、本発明は、上述した実情に鑑み、特に、エタノール発酵能を有する酵母における酢酸耐性を向上させる酢酸耐性能付与方法、酢酸耐性酵母の製造方法及び酢酸耐性酵母を用いたエタノールの製造方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
上記目的を達成するため、本発明者らが鋭意検討した結果、エタノール発酵能を有する酵母に、機能未知の所定の遺伝子を導入する又は当該遺伝子の発現量を向上させることで当該酵母の酢酸耐性を向上できることを見いだし、本発明を完成するに至った。
【0007】
すなわち、本発明に係る酵母における酢酸耐性向上方法は、エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる方法である。
【0008】
また、本発明に係る酢酸耐性酵母の製造方法は、エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる方法である。
【0009】
さらに、本発明に係る酢酸耐性酵母を用いたエタノールの製造方法は、エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させた酵母を培地に培養し、培地からエタノールを回収する方法である。
【0010】
本発明において、 YOL046C遺伝子及び当該YOL046C遺伝子に機能的に等価な遺伝子は、以下の(a)〜(c)のいずれかの遺伝子であることが好ましい。
(a)配列番号2に示すアミノ酸配列に対して80%以上の一致度を有するアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(b)配列番号2に示すアミノ酸配列に対して1又は複数個のアミノ酸が欠失、置換、不可又は挿入されたアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(c)配列番号1に示す塩基配列に対する相補的な塩基配列からなるポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズすることができ、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
また、本発明においてエタノール発酵能を有する酵母としてはSaccharomyces cerevisiaeを使用することができる。
【発明の効果】
【0011】
本発明によれば、エタノール発酵能を有する酵母における酢酸耐性を付与又は向上させることができる。すなわち、本発明によれば、酢酸耐性に優れた酵母を作出することができ、酢酸存在下におけるエタノール収率を向上させることができる。したがって、本発明を適用することによって、例えば、バイオマスを利用した酵母によるエタノール発酵を効率化することができ、その結果、エタノールの生産性を改善することができる。
【図面の簡単な説明】
【0012】
【図1】各種濃度の酢酸存在下における、コントロール株のOD600を測定した結果を示す特性図である。
【図2】各種濃度の酢酸存在下における、OC-2Δfps1株のOD600を測定した結果を示す特性図である。
【図3】各種濃度の酢酸存在下における、ORF過剰発現酵母ライブラリについてOD600を測定した結果を示す特性図である。
【図4】120mMの酢酸存在下における、単離株No.1〜No.4及びコントロール酵母のOD600を測定した結果を示す特性図である。
【発明を実施するための形態】
【0013】
以下、本発明を図面及び実施例を用いてより詳細に説明する。
本発明に係る酢酸耐性付与方法は、エタノール発酵能を有する酵母に所定の遺伝子を導入する又は当該遺伝子の発現量を向上させるといった特徴を有する。換言すると、エタノール発酵能を有する酵母に対して当該遺伝子を導入する又は当該遺伝子の発現量を向上させることで酢酸耐性に優れた酵母を製造できる。ここで、上記所定の遺伝子とは、Saccharomyces cerevisiaeにおけるYOL046C遺伝子及びYOL046C遺伝子に機能的に等価な遺伝子である。また、遺伝子の発現量を向上させるには、一例として、当該遺伝子の発現制御領域を改変する手法を挙げることができる。発現制御領域とは、RNAポリメラーゼが結合するプロモーター領域及びその他の転写因子が結合する領域を含む意味である。転写制御領域の改変としては、内在する転写制御領域のうち例えばプロモーター領域を、より高発現が可能なプロモーター領域に置換することが好ましい。
【0014】
<YOL046C遺伝子>
YOL046C遺伝子とは、Saccharomyces cerevisiaeにおいて機能未知の遺伝子として同定されている遺伝子である。YOL046C遺伝子に関する文献としてはMolecular Biology of the Cell, Vol. 19, 284-296, January 2008が挙げられる。当該文献は、菌糸成長について調査するために、菌糸を伸ばすSaccharomyces cerevisiae Σ1278b株の遺伝子破壊もしくはORF過剰発現株のライブラリを作製し、評価している。そして、YOL046C遺伝子の過剰発現株では、菌糸の成長が野生型と比較して促進するといった表現型を示すことが明らかになっている。しかし、当該文献やその他の知見から、YOL046C遺伝子が酵母における酢酸の取り込みや代謝など酢酸耐性に関与することは示唆されていない。
【0015】
YOL046C遺伝子におけるコーディング領域の塩基配列を配列番号1に示す。また、YOL046C遺伝子がコードするタンパク質のアミノ酸配列を配列番号2に示す。ただし、これら具体的な塩基配列及びアミノ酸配列は、Saccharomyces cerevisiaeにおける標準株にて同定されたものであり、他のSaccharomyces cerevisiaeのYOL046C遺伝子は、配列番号1の塩基配列とは異なる塩基配列を有するか、配列番号2のアミノ酸配列とは異なるアミノ酸配列のタンパク質をコードすることもある。すなわち、Saccharomyces cerevisiaeのYOL046C遺伝子という場合でも、配列番号1の塩基配列からなるコーディング領域を有するもの、或いは配列番号2のアミノ酸配列からなるタンパク質をコードするものに限定されない。
【0016】
YOL046C遺伝子としては、配列番号2のアミノ酸配列に対して高い類似性を有するアミノ酸配列を有し、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードする遺伝子であってもよい。ここで、高い類似性とは、例えば80%以上の一致度を意味し、好ましくは90%以上の一致度、より好ましくは95%以上の一致度、最も好ましくは97%以上の一致度を意味する。なお、一致度の値は、配列類似性を検索するプログラム(相同性検索プログラムと称される場合もある)を用いて、配列番号2のアミノ酸配列と他のアミノ酸配列とをアライメントした際に、当該他のアミノ酸配列における、配列番号2のアミノ酸配列に対して一致したアミノ酸残基の割合として算出される値である。
【0017】
また、YOL046C遺伝子としては、配列番号2のアミノ酸配列における1又は複数個のアミノ酸が置換、欠失、付加又は挿入されたアミノ酸配列を有するタンパク質であって、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードする遺伝子であってもよい。ここで、複数個のアミノ酸とは、例えば2〜30個のアミノ酸を意味し、好ましくは2〜20個、より好ましくは2〜10個、最も好ましくは2〜5個のアミノ酸を意味する。
【0018】
さらに、YOL046C遺伝子としては、配列番号1の塩基配列に対して相補的な塩基配列を含むポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズするポリヌクレオチドであって、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードするポリヌクレオチドであってもよい。ここで、ストリンジェントな条件下でハイブリダイズするとは、60℃で2×SSC洗浄条件下で結合を維持することを意味する。ハイブリダイゼーションは、J. Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory(1989)に記載されている方法等、従来公知の方法で行うことができる。
【0019】
上述したような、配列番号1の塩基配列とは異なる塩基配列、配列番号2のアミノ酸配列とは異なるアミノ酸配列を有するタンパク質をコードするYOL046C遺伝子は、Saccharomyces cerevisiaeに分類される各種の株から単離することができる。或いは、配列番号1の塩基配列とは異なる塩基配列、配列番号2のアミノ酸配列とは異なるアミノ酸配列を有するタンパク質をコードするYOL046C遺伝子は、例えば、配列番号1の塩基配列を含むポリヌクレオチドを、当該技術分野で公知の手法によって人為的に改変することによって取得することもできる。塩基配列に変異を導入するには、Kunkel法またはGapped duplex法等の公知手法又はこれに準ずる方法により行うことができ、例えば部位特異的突然変異誘発法を利用した変異導入用キット(例えばMutant-KやMutant-G(何れも商品名、TAKARA社製))等を用いて、あるいはLA PCR in vitro Mutagenesisシリーズキット(商品名、TAKARA社製)を用いて変異が導入される。
【0020】
配列番号1の塩基配列とは異なる塩基配列を含むポリヌクレオチド、配列番号2のアミノ酸配列とは異なるアミノ酸配列を有するタンパク質をコードするポリヌクレオチドについては、当該ポリヌクレオチドを宿主酵母に導入して過剰発現させ、酢酸含有培地における増殖能を検証することで、当該ポリヌクレオチド導入酵母における酢酸耐性を評価できる。このように評価できる酢酸耐性が宿主酵母より有意に向上している場合、宿主酵母に導入したポリヌクレオチドをYOL046C遺伝子であると判断することができる。
【0021】
また、YOL046C遺伝子に機能的に等価な遺伝子とは、Saccharomyces cerevisiae以外の生物由来であって、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードする遺伝子を意味する。すなわち、YOL046C遺伝子に機能的に等価な遺伝子とは、Saccharomyces cerevisiaeにおけるYOL046C遺伝子に対する広義のホモログの関係にある遺伝子又はオルソログの関係にある遺伝子を意味する。
【0022】
このようなYOL046C遺伝子に機能的に等価な遺伝子は、Saccharomyces cerevisiae以外の生物由来に関するゲノムDNAの配列情報を格納したデータベースを検索することによって特定することができる。ここで、データベースとしては、MBGD、GenBank、DDBJ及びEMBL等のデータベースを挙げることができる。ただし、YOL046C遺伝子に機能的に等価な遺伝子を検索するに際して、使用するデータベースには何ら制限はない。特に、データベースとしては、1つの種について1つのゲノム情報を検索対象としたシステムを実装しているMBGDを使用することが好ましい。データベースを用いたYOL046C遺伝子に機能的に等価な遺伝子の検索は、配列番号1の塩基配列及び/又は配列番号2のアミノ酸配列をクエリー配列として上述した配列類似性の値に基づいて実行できる。このような検索においては、上述した配列類似性は相同性と同義となる。このような検索において、例えば、配列番号2のアミノ酸配列に対して、好ましくは80%以上、より好ましくは85%以上、更に好ましくは90%以上、最も好ましくは95%以上の相同性(配列類似性)を有するアミノ酸配列を有するタンパク質をコードする遺伝子をYOL046C遺伝子に機能的に等価な遺伝子として特定できる。
【0023】
また、YOL046C遺伝子に機能的に等価な遺伝子は、例えば、配列番号2のアミノ酸配列に対して、1又は数個のアミノ酸が置換、欠失、挿入又は付加されたアミノ酸配列を有し、宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードするものでも良い。ここで、数個とは、例えば、2〜30個、好ましくは2〜20個、より好ましくは2〜10個、最も好ましくは2〜5個である。
【0024】
さらにまた、YOL046C遺伝子に機能的に等価な遺伝子、例えば、配列番号1の塩基配列からなるDNAの相補鎖の全部又は一部に対して、ストリンジェントな条件下でハイブリダイズし、かつ宿主酵母において過剰発現させたときに酢酸耐性を向上させる機能を有するタンパク質をコードするものでもよい。ここでいう「ストリンジェントな条件」とはいわゆる特異的なハイブリッドが形成され、非特異的なハイブリッドが形成されない条件を意味し、例えばMolecular Cloning: A Laboratory Manual(Third Edition)を参照して適宜決定することができる。具体的には、サザンハイブリダイゼーションの際の温度や溶液に含まれる塩濃度、及びサザンハイブリダイゼーションの洗浄工程の際の温度や溶液に含まれる塩濃度によりストリンジェンシーを設定することができる。
【0025】
<エタノール発酵能を有する酵母>
上述したYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子を導入する又は当該遺伝子の発現量を向上させる対象としては、エタノール発酵能を有する酵母を挙げることができる。このような酵母としては、特に限定されないが、Candida Shehatae、Pichia stipitis、Pachysolen tannophilus、Saccharomyces cerevisiae及びSchizosaccaromyces pombeなどの酵母が挙げられ、特にSaccharomyces cerevisiaeが好ましい。また、酵母としては、実験面での利便性のために使われる実験株でも良いし、実用面での有用性のために使われている工業株(実用株)でも良い。工業株としては、例えば、ワイン、清酒や焼酎作りに用いられる酵母株を挙げることができる。
【0026】
なかでも、Saccharomyces cerevisiae OC-2株は、従来ワイン醸造の場面で利用されてきた安全性を確認されている菌株であるため好ましい。また、Saccharomyces cerevisiae OC-2株は、後述する実施例で示したように、高糖濃度の条件下におけるプロモーター活性が優れた菌株であるため好ましい。特にSaccharomyces cerevisiae OC-2株は、高糖濃度条件においてピルビン酸脱炭酸酵素遺伝子(PDC1)のプロモーター活性が優れているため好ましい。
【0027】
また、導入する遺伝子のプロモーターとしては、特に限定されないが、例えばグリセルアルデヒド3リン酸デヒドロゲナーゼ遺伝子(TDH3)のプロモーター、3-ホスホグリセレートキナーゼ遺伝子(PGK1)のプロモーター、高浸透圧応答7遺伝子(HOR7)のプロモーターなどが利用可能である。なかでもピルビン酸脱炭酸酵素遺伝子(PDC1)のプロモーターが下流の目的遺伝子を高発現させる能力が高いために好ましい。その他にも、TEF1遺伝子プロモーター、ADH1遺伝子プロモーター、TPI1遺伝子プロモーター、HXT7遺伝子プロモーター及びPYK1遺伝子プロモーターを使用することができる。
【0028】
すなわち、上述した遺伝子は、発現を制御するプロモーターやその他の発現制御領域とともに酵母のゲノムに導入してもよい。または、上述した遺伝子は、宿主となる酵母のゲノムに本来的に存在する遺伝子のプロモーターやその他の発現制御領域により発現制御されるように導入してもよい。
【0029】
また、上述した遺伝子を導入する方法としては、酵母の形質転換方法として知られている従来公知のいかなる手法をも適用することができる。具体的には、例えば、例えば、エレクトロポレーション法“Meth. Enzym., 194, p182 (1990)”、スフェロプラスト法“Proc. Natl. Acad. Sci. USA, 75 p1929(1978)”、酢酸リチウム法“J.Bacteriology, 153, p163(1983)”、Proc. Natl. Acad. Sci. USA, 75 p1929 (1978)、Methods in yeast genetics, 2000 Edition : A Cold Spring Harbor Laboratory Course Manualなどに記載の方法で実施可能であるが、これに限定されない。
【0030】
一方、エタノール発酵能を有する酵母に内在するYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子について、その発現制御領域を改変する方法により遺伝子の発現量を向上させることもできる。すなわち、YOL046C遺伝子や、当該YOL046C遺伝子に機能的に等価な遺伝子の発現制御領域(例えばプロモーター)を、より高発現可能なものに置換する方法、所定の遺伝子の発現を上昇させるようなレギュレーターを導入する方法などを使用することができる。高発現可能なプロモーターとしては、特に限定されず、上記で列挙したプロモーターを適宜使用することができる。また、内在する発現制御領域に突然変異を導入し、より高発現できるものに改変することも可能である。
【0031】
なお、酵母に内在するYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子の発現量を向上させるには、当該遺伝子が転写されてなるmRNAの生存時間を延長させることや、輸送タンパク質の細胞内での分解を防ぐことによっても達成可能である。
【0032】
<エタノール製造>
以上で説明した組換え酵母を使用してエタノールを製造する際には、グルコース等の炭素源を含む培地にてエタノール発酵培養を行い、培地からエタノールを回収する方法である。また、培地としては、SD培地、YPD培地、YPAD培地、YM培地といった酵母用の培地を適宜使用することもできる。さらに、バイオマスを糖化した後の処理物を培地として使用することもできる。バイオマスは、セルロースやヘミセルロース、キシランをといった多糖類を含んでおり、これら多糖類を構成単糖又はオリゴ糖にまで加水分解(糖化)する。このようにして得られた糖類は酵母によりエタノール発酵の基質として使用される。一般に、この糖化処理には、セルラーゼ等の糖化酵素が利用される。なお、糖化方法としては、特に限定されないが、セルラーゼやヘミセルラーゼ等のセルラーゼ製剤を利用する酵素法等を挙げることができる。セルラーゼ製剤は、セルロース鎖及びヘミセルロース鎖の分解に関与する複数の酵素を含んでおり、エンドグルカナーゼ活性、エンドキシラナーゼ活性、セロビオヒドロラーゼ活性、グルコシダーゼ活性及びキシロシダーゼ活性等の複数の活性を示す。セルラーゼ製剤としては、特に限定されないが、例えば、Trichoderma reeseiや、Acremonium cellulolyticusなどが生産するセルラーゼを挙げることができる。セルラーゼ製剤としては、市販されているものを使用しても良い。
【0033】
バイオマスに含まれる多糖類を構成単糖にまで分解する割合、すなわち糖化率を向上させるため、一般的には糖化処理に先立ってバイオマスに対する前処理が施されてもよい。前処理工程としては、例えば、粉砕したセルロース系バイオマスを希硫酸溶液やアルカリ溶液、イオン液体に浸漬する処理、水熱処理、微粉砕処理といった処理が挙げられる。これら前処理により、バイオマスの糖化率を向上させることができる。
【0034】
このようにバイオマスに由来する糖を利用してエタノールを製造する場合、上述した前処理や糖化処理において酢酸やフルフラールといった発酵阻害物質が生産される場合がある。特に酢酸については、酵母の生育・増殖を阻害するため、エタノールの生産性を低下させる一因として知られている。
【0035】
しかしながら、エタノール発酵能を有する酵母において、上述したYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子を導入する又は当該遺伝子の発現量を向上させるように改変することで、酢酸による生育・増殖阻害を低減又は防止できる。よって、上述したYOL046C遺伝子及び/又はYOL046C遺伝子に機能的に等価な遺伝子を導入する又は当該遺伝子の発現量を向上させるように改変した酵母を用いてエタノール発酵を行うことで、酢酸存在下においても優れた生産性でエタノールを製造できる。特に、上述した前処理や糖化処理を行った後の処理物に含まれる糖を利用してエタノール発酵を行う場合であっても、当該処理物に含まれる酢酸による生育・増殖阻害を防止でき、優れたエタノール生産性を達成できる。
【0036】
なお、エタノール発酵に利用する培地としてはバイオマスを含む培地であっても良い。この場合、エタノール発酵は、いわゆる同時糖化発酵処理となる。同時糖化発酵処理とは、バイオマス糖化工程とエタノール発酵工程とを区別せずに同時に実施する処理を意味する。なお、同時糖化発酵処理に先立って、バイオマスに対して従来公知の前処理を施しても良い。前処理としては、特に限定されないが、例えば、リグニンを微生物によって分解する処理や、セルロース系バイオマスの粉砕処理等を挙げることができる。
【0037】
同時糖化発酵処理では、セルロース系バイオマス(前処理後であってもよい)を含む培地にセルラーゼ製剤と上述した組換え微生物とを加え、所定の温度範囲で当該組換え酵母を培養する。培養温度としては特に限定されないが、エタノール発酵の効率を考慮して25〜45℃とすることができ、30〜40℃とすることが好ましい。また、培養液のpHを4〜6とすることが好ましい。また、培養に際して、攪拌や振とうしてもよい。
【0038】
本発明を利用したエタノールの製造方法では、エタノール発酵の後、培地からエタノールを回収する。エタノールの回収方法は、特に限定されず、従来公知のいかなる方法も適用することができる。例えば、上述したエタノール発酵が終了した後、固液分離操作によってエタノールを含む液層と、組換え酵母や固形成分を含有する固層とを分離する。その後、液層に含まれるエタノールを蒸留法によって分離・精製することで、純度の高いエタノールを回収することができる。なお、エタノールの精製度は、エタノールの使用目的にあわせて適宜調整することができる。
【実施例】
【0039】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の技術的範囲は以下の実施例に限定されるものではない。
〔実施例1〕
本実施例では、酵母ゲノムにおけるオープンリーディングフレーム(ORF)をGAL1プロモーターの制御下で過剰発現する酵母ライブラリを以下のように作製した。先ず、Saccharomyces cerevisiaeのORFをGAL1プロモーターの下流に挿入した酵母発現ベクターのコレクションであるYeast ORF clone collection (Open Biosystems社製)を入手し、当該ベクターを宿主である大腸菌より抽出した。次に、抽出したベクターを用いて酵母S. cerevisiae OC-2Δura3株を酢酸リチウム法により形質転換した。なお、S. cerevisiae OC-2Δura3株は、UV変異によりOC-2株のURA3遺伝子を破壊した株である。
【0040】
得られた形質転換体を5mlのSDCA(0.67% yeast nitrogen base w/o amino acids、2% D-glucose、2% Casamino acid)培地で培養することでORF過剰発現酵母ライブラリを作製した。なお、このとき、培養温度を30℃とし、120rpmで攪拌しながら1日間培養した。
【0041】
また、比較のために、酢酸含有培地において増殖可能であることが知られている、FPS1遺伝子破壊酵母を作製した。FPS1遺伝子を破壊するための遺伝子断片を以下のように作製した。先ず、S. cerevisiae OC-2株のゲノムDNAを基にプライマーI、IIを用いてPCRを行い、FPS1遺伝子の部分配列(1番目から500番目)を500残基増幅した。同様に、プライマーV、VIを用いてPCRを行い、FPS1遺伝子の部分配列(1511番目から2011番目)を500残基増幅した。また、次に、プラスミドpRS406 (Stratagene社製)を基にプライマーIII、IVを用いて5’末端及び3’末端にFPS1遺伝子の一部(5’末端側:FPS1の471番目から500番目を付加、3’末端側:FPS1の1511番目から1540番目を付加)を含むURA3遺伝子を増幅した。
【0042】
以上のようにPCRで増幅した3断片とプライマーI、VIを用いたPCRにより、FPS1遺伝子を破壊するための遺伝子断片を作製した。作製した遺伝子断片を用いてS. cerevisiae OC-2Δura3株を酢酸リチウム法で形質転換した。S. cerevisiae OC-2Δura3株はホモタリズム酵母であるため、得られた形質転換体を胞子形成させ、再度、選択培地にて培養することで、FPS1遺伝子をホモに破壊した二倍体酵母OC-2Δfps1を作製した。
【0043】
以下に使用したプライマーを纏めて示す。
プライマーI:ATGAGTAATCCTCAAAAAGCTCTAAACGACTTTCTGTCCA(配列番号3)
プライマーII:ATGAGTAATCCTCAAAAAGCTCTAAACGACTTTCTGTCCA(complementary) (配列番号4)
プライマーIII:AGATTTTTACAAAAATGCAGACGATGCGCAtcaattcatcattttttttttattcttttt(配列番号5)
プライマーIV:CCATGGGAACCCAAAAGAAATGATGATGATgggtaataactgatataattaaattgaagc (complementary) (配列番号6)
プライマーV:ATCATCATCATTTCTTTTGGGTTCCCATGGTAGGCCCATT(配列番号7)
プライマーVI:TCATGTTACCTTCTTAGCATTACCATAATGCGAATCTTCT(complementary) (配列番号8)
なお、FPS1遺伝子の塩基配列を配列番号9に示し、URA3遺伝子の塩基配列を配列番号10に示した。
【0044】
以上のように作製した、ORF過剰発現酵母ライブラリ、OC-2Δfps1株、ORFを生産していないコントロール株について酢酸耐性を比較検討した。先ず、これらORF過剰発現酵母ライブラリ、OC-2Δfps1株、ORFを生産していないコントロール株を5mlのSGCA (0.67% yeast nitrogen base w/o amino acids、2% galactose、2% Casamino acid)培地にOD=0.03となるように植菌し、30℃で120rpmで撹拌しながら1日間培養した。次に、培養した酵母をOD=0.03になるように酢酸を含むSGCA+酢酸培地(酢酸0〜130mM、0.67% yeast nitrogen base w/o amino acids、2% galactose、2% Casamino acid)に植菌し、経時的にOD600を測定した。コントロール株についてOD600を測定した結果を図1に示す。OC-2Δfps1株についてOD600を測定した結果を図2に示す。ORF過剰発現酵母ライブラリについてOD600を測定した結果を図3に示す。
【0045】
次に、ORF過剰発現酵母ライブラリについては、120mMの酢酸を含むSGCA培地で約70時間培養した培養液をSGCA寒天培地にプレーティングを行い、生育したシングルコロニーからランダムに4株を選抜した。シングルコロニー4株からプラスミドを抽出し、シークエンス用プライマー(GAATAAGAA GTAATACAAA CCGAAAATG:配列番号11)を用いてプラスミドの配列を決定した。抽出したプラスミドを用いて酵母S. cerevisiae OC-2Δura3株を酢酸リチウム法により形質転換し、単離株No.1〜No.4を獲得した。
【0046】
次に、コントロール酵母と単離株No.1〜No.4を5mlのSGCA培地にOD=0.03となるように植菌し、30℃で120rpmで撹拌しながら1日間培養した。培養した酵母をOD=0.03になるように120mM酢酸を含むSGCA+酢酸培地に植菌し、経時的にOD600を測定した。これら単離株No.1〜No.4及びコントロール酵母についてOD600を測定した結果を図4に示す。
【0047】
図1に示すように、コントロール酵母においては、50mMの酢酸存在下で生育・増殖阻害の傾向が見られ、100mM以上の酢酸存在下では殆ど死滅していることが判る。一方、図2に示すように、FPS1遺伝子を欠損したOC-2Δfps1株では、生育・増殖が若干阻害されるものの100mの酢酸存在下でも生育・増殖できている。ただし、OC-2Δfps1株は、130mMの酢酸存在下では全く殆ど死滅していることが判る。
【0048】
これに対して、図3に示すような優れた酢酸耐性を示したORF過剰発現酵母ライブラリから単離した単離株No.1〜No.4については、図4に示すように、120mMといった酢酸存在下においても優れた生育・増殖特性を示していた。この結果から、単離株No.1〜No.4において高発現している遺伝子は、酵母に対して酢酸耐性を付与するものであることが示された。
【0049】
シークエンス用プライマー(GAATAAGAA GTAATACAAA CCGAAAATG:配列番号11)を用いてプラスミドの配列を決定した結果、単離株No.1〜No.4において高発現している遺伝子は、全てYOL046C遺伝子であることが判明した。以上の結果より、所定の酵母についてYOL046C遺伝子を導入する又は当該YOL046C遺伝子の発現量を向上させることで、当該酵母に対して酢酸耐性を付与できることが明らかになった。
【特許請求の範囲】
【請求項1】
エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる、酵母における酢酸耐性向上方法。
【請求項2】
YOL046C遺伝子及び当該YOL046C遺伝子に機能的に等価な遺伝子は、以下の(a)〜(c)のいずれかの遺伝子であることを特徴とする請求項1記載の酢酸耐性向上方法。
(a)配列番号2に示すアミノ酸配列に対して80%以上の一致度を有するアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(b)配列番号2に示すアミノ酸配列に対して1又は複数個のアミノ酸が欠失、置換、不可又は挿入されたアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(c)配列番号1に示す塩基配列に対する相補的な塩基配列からなるポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズすることができ、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
【請求項3】
上記エタノール発酵能を有する酵母はSaccharomyces cerevisiae であることを特徴とする請求項1記載の酢酸耐性向上方法。
【請求項4】
エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる、酢酸耐性酵母の製造方法。
【請求項5】
YOL046C遺伝子及び当該YOL046C遺伝子に機能的に等価な遺伝子は、以下の(a)〜(c)のいずれかの遺伝子であることを特徴とする請求項4記載の酢酸耐性酵母の製造方法。
(a)配列番号2に示すアミノ酸配列に対して80%以上の一致度を有するアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(b)配列番号2に示すアミノ酸配列に対して1又は複数個のアミノ酸が欠失、置換、不可又は挿入されたアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(c)配列番号1に示す塩基配列に対する相補的な塩基配列からなるポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズすることができ、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
【請求項6】
上記エタノール発酵能を有する酵母はSaccharomyces cerevisiae であることを特徴とする請求項4記載の酢酸耐性酵母の製造方法。
【請求項7】
エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させた酵母を培地に培養し、培地からエタノールを回収するエタノールの製造方法。
【請求項8】
YOL046C遺伝子及び当該YOL046C遺伝子に機能的に等価な遺伝子は、以下の(a)〜(c)のいずれかの遺伝子であることを特徴とする請求項7記載のエタノールの製造方法。
(a)配列番号2に示すアミノ酸配列に対して80%以上の一致度を有するアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(b)配列番号2に示すアミノ酸配列に対して1又は複数個のアミノ酸が欠失、置換、不可又は挿入されたアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(c)配列番号1に示す塩基配列に対する相補的な塩基配列からなるポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズすることができ、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
【請求項9】
上記エタノール発酵能を有する酵母はSaccharomyces cerevisiae であることを特徴とする請求項7記載のエタノールの製造方法。
【請求項10】
上記培地は、120mM以上の酢酸を含有することを特徴とする請求項7記載のエタノールの製造方法。
【請求項1】
エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる、酵母における酢酸耐性向上方法。
【請求項2】
YOL046C遺伝子及び当該YOL046C遺伝子に機能的に等価な遺伝子は、以下の(a)〜(c)のいずれかの遺伝子であることを特徴とする請求項1記載の酢酸耐性向上方法。
(a)配列番号2に示すアミノ酸配列に対して80%以上の一致度を有するアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(b)配列番号2に示すアミノ酸配列に対して1又は複数個のアミノ酸が欠失、置換、不可又は挿入されたアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(c)配列番号1に示す塩基配列に対する相補的な塩基配列からなるポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズすることができ、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
【請求項3】
上記エタノール発酵能を有する酵母はSaccharomyces cerevisiae であることを特徴とする請求項1記載の酢酸耐性向上方法。
【請求項4】
エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させる、酢酸耐性酵母の製造方法。
【請求項5】
YOL046C遺伝子及び当該YOL046C遺伝子に機能的に等価な遺伝子は、以下の(a)〜(c)のいずれかの遺伝子であることを特徴とする請求項4記載の酢酸耐性酵母の製造方法。
(a)配列番号2に示すアミノ酸配列に対して80%以上の一致度を有するアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(b)配列番号2に示すアミノ酸配列に対して1又は複数個のアミノ酸が欠失、置換、不可又は挿入されたアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(c)配列番号1に示す塩基配列に対する相補的な塩基配列からなるポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズすることができ、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
【請求項6】
上記エタノール発酵能を有する酵母はSaccharomyces cerevisiae であることを特徴とする請求項4記載の酢酸耐性酵母の製造方法。
【請求項7】
エタノール発酵能を有する酵母に対して、YOL046C遺伝子及び/又は当該YOL046C遺伝子に機能的に等価な遺伝子を導入する、又は当該酵母に対して当該遺伝子の発現量を向上させた酵母を培地に培養し、培地からエタノールを回収するエタノールの製造方法。
【請求項8】
YOL046C遺伝子及び当該YOL046C遺伝子に機能的に等価な遺伝子は、以下の(a)〜(c)のいずれかの遺伝子であることを特徴とする請求項7記載のエタノールの製造方法。
(a)配列番号2に示すアミノ酸配列に対して80%以上の一致度を有するアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(b)配列番号2に示すアミノ酸配列に対して1又は複数個のアミノ酸が欠失、置換、不可又は挿入されたアミノ酸配列を含むタンパク質をコードし、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
(c)配列番号1に示す塩基配列に対する相補的な塩基配列からなるポリヌクレオチドの一部又は全部に対してストリンジェントな条件下でハイブリダイズすることができ、宿主酵母に導入することで酢酸耐性を向上する機能を有する遺伝子
【請求項9】
上記エタノール発酵能を有する酵母はSaccharomyces cerevisiae であることを特徴とする請求項7記載のエタノールの製造方法。
【請求項10】
上記培地は、120mM以上の酢酸を含有することを特徴とする請求項7記載のエタノールの製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−34448(P2013−34448A)
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願番号】特願2011−174815(P2011−174815)
【出願日】平成23年8月10日(2011.8.10)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【Fターム(参考)】
【公開日】平成25年2月21日(2013.2.21)
【国際特許分類】
【出願日】平成23年8月10日(2011.8.10)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【出願人】(000003609)株式会社豊田中央研究所 (4,200)
【Fターム(参考)】
[ Back to top ]

