酸化チタン機能性分子複合体粒子
【課題】 水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子に対して、水溶性高分子を変質させることなく機能性分子を酸化チタン表面に結合させた酸化チタン機能性分子複合体粒子の提供。
【解決手段】 本発明では、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子の酸化チタン表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を介して機能性分子を結合させることにより、前記水溶性高分子を変質させることなく、新たな機能性付与を実現できる。この酸化チタン機能性分子複合体粒子は、体内に投与後に体内動態を確認するためのトレーサー実験用材料や、患部に超音波や光を照射することにより行われる診断および治療のための医療用材料として利用できる。
【解決手段】 本発明では、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子の酸化チタン表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を介して機能性分子を結合させることにより、前記水溶性高分子を変質させることなく、新たな機能性付与を実現できる。この酸化チタン機能性分子複合体粒子は、体内に投与後に体内動態を確認するためのトレーサー実験用材料や、患部に超音波や光を照射することにより行われる診断および治療のための医療用材料として利用できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子に対して、水溶性高分子を変質させることなく機能性分子を酸化チタン表面に結合させた酸化チタン機能性分子複合体粒子に関する。
【背景技術】
【0002】
酸化チタンはpH6前後に等電点を有すると言われている。このため、酸化チタン粒子は中性付近の水系溶媒中では凝集を生じてしまい、これを均一に分散させることは極めて難しい。そのため、酸化チタン粒子を水系の分散媒に均一に分散させるため、今まで種々の試みがなされてきた。
【0003】
PEG(ポリエチレングリコール)を分散剤として添加して、分散媒中における酸化チタン粒子の分散性を向上させることが知られている(特許文献1(特開平2−307524号公報)および特許文献2(特開2002−60651号公報)参照)。
【0004】
あるいは酸化チタン微粒子に、ポリアクリル酸等の親水性高分子を、カルボキシル基を介して結合させた、表面改質酸化チタン微粒子も知られている(特許文献3(WO2004/087577)参照)。この技術は、ポリアクリル酸等といったアニオン性ポリマーの使用を念頭としたものである。アニオン性ポリマーのもつカルボキシル基等の官能基により表面電荷を与え、それにより生体内環境に近い中性の生理食塩水においても安定した分散性を示し、かつ光触媒活性機能を有するものである。
【0005】
更に、酸化チタンに機能性を付与する検討がなされている。例えば、前記表面改質酸化チタン微粒子に対して、前記親水性高分子の結合に関与していないカルボキシル残基に、目的分子に対して特異的な結合能を有する分子を固定化した、分子識別能を有する二酸化チタン複合体が提案されている(特許文献4(特許第3835700号)参照)。この技術は、アニオン性ポリマーのもつカルボキシル基等の官能基により、分子が固定化されていても表面電荷を与え、安定した分散性を示すものである。一方で、官能基によって与えられる表面電荷は分散性に直接寄与しており、結合に関与していない残基に分子を固定化することで表面電荷は減少する。このことが固定化される分子の量等に対して制限を与える。
【0006】
【特許文献1】特開平2−307524号公報
【特許文献2】特開2002−60651号公報
【特許文献3】WO2004/087577号パンフレット
【特許文献4】特許第3835700号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子において、前記水溶性高分子を変質させることなく高い分散性を保持し、かつ、酸化チタン表面に結合した機能性分子により、酸化チタン表面付近での新たな機能性付与を実現した酸化チタン機能性分子複合体粒子およびその分散体の提供をその目的としている。
【課題を解決するための手段】
【0008】
本発明者らは、今般、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子の酸化チタン表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を介して機能性分子を結合させることにより、前記水溶性高分子を変質させることなく、新たな機能性付与を実現できるとの知見を得た。
【0009】
すなわち、本発明の酸化チタン機能性分子複合体粒子によれば、水溶性高分子を変質させることなく酸化チタン表面に対し機能性分子を結合させることにより、水溶性高分子による高い分散性を保持できる。このため、機能性分子の結合に際して自由度の高い分子設計が可能である。また、機能性分子を酸化チタン表面に結合することにより、酸化チタン表面付近において超音波や紫外線照射によって発生したラジカル種と機能性分子との反応性が高い。このため、機能性分子および機能性分子と相互作用を有する対象物との反応性を著しく向上することができる。前記対象物が癌細胞の場合にあっては、超音波や紫外線による癌の治療効果を著しく向上することができる。そのため、本発明の酸化チタン機能性分子複合体粒子は、患部に超音波を照射することにより行われる超音波癌治療を促進するための超音波癌治療促進剤としても利用可能である。
【0010】
そして、本発明の酸化チタン機能性分子複合体粒子は、
酸化チタン粒子と、
該酸化チタン粒子の表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を介して結合されてなる水溶性高分子を含んでなる、酸化チタン複合体粒子と、
該酸化チタン複合体粒子の表面に、さらに結合されてなる機能性分子を含んでなり、
前記機能性分子は、
(1)カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくとも一つの官能基を有し、
(2)a)炭素数6〜40よりなる飽和又は不飽和の鎖状炭化水素基、b)置換基を有するか有しない飽和又は不飽和の5〜6員環複素環式基、又はc)置換基を有するか有しない飽和又は不飽和の5〜6員環環状炭化水素水素基を含んでなる化合物であって、
前記官能基を介して前記酸化チタンと結合されてなる、酸化チタン機能性分子複合体粒子であることを特徴とするものである。
【0011】
また、本発明による分散液は、酸化チタン機能性分子複合体粒子と、該粒子が分散される溶媒とを含んでなるものである。
【発明の効果】
【0012】
本発明によれば、水溶性高分子を変質させることなく高い分散性を保持し、かつ、酸化チタン表面に結合した機能性分子により、酸化チタン表面付近での新たな機能性付与を実現した酸化チタン機能性分子複合体粒子およびその分散体を提供できる。
【発明を実施するための最良の形態】
【0013】
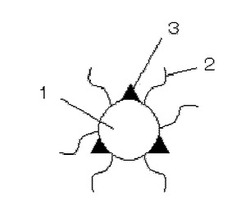
本発明による酸化チタン機能性分子複合体粒子は、酸化チタン粒子と、水溶性高分子と、機能性分子を含む。図1に、酸化チタン機能性分子複合体粒子の一例を示す。図1に示されるように、酸化チタン機能性分子複合体粒子は、酸化チタン粒子1の表面に水溶性高分子2および機能性分子3が結合されたものである。酸化チタン粒子1と、水溶性高分子2および機能性分子3との結合は、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基から選択される少なくとも1種の官能基を介して形成される。
【0014】
すなわち、これらの官能基は酸化チタンとの間で強固な結合を形成するため、酸化チタン粒子の高い触媒活性に関わらず分散性を保持できる。これらの官能基は酸化チタンとの間で強固な結合を形成するため、酸化チタン粒子の高い触媒活性にかかわらず水溶性高分子および機能性分子の結合を保持することが可能である。なお、本発明における結合形態は、体内における安全性の観点から、体内への投与後24〜72時間後に分散性が確保されている程度の結合形態であればよい。生理条件での分散が安定しており、かつ超音波や紫外線照射後も水溶性高分子の遊離が無く、正常細胞へのダメージが少ない点で、共有結合であるのが望ましい。
【0015】
カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基は、3官能シラノール基のような相互に三次元的に縮合重合して重合物で酸化チタン粒子の表面を覆い尽くしてしまう官能基とは異なり、官能基同士で重合することが無いため、図1に示されるように酸化チタン粒子の表面に剥き出しの部分を確保することができると考えられる。その結果、表面が重合体で覆われることによって起こりうる失活を抑制しつつ、酸化チタン粒子の触媒活性を十分に発揮させることができる。
【0016】
そして、酸化チタン粒子の表面に結合した水溶性高分子は、電荷あるいは水和の作用によって、酸化チタン粒子の分散が困難とされる中性付近の水系溶媒中であって酸化チタン機能性分子複合体粒子を高度に分散させることができる。機能性分子を、酸化チタン粒子の表面に結合した水溶性高分子に対して導入する方法については公知である。このような場合は、水溶性高分子と機能性分子を化学結合するために、水溶性高分子は反応性の高い極性基を含んでなることが必要である。この水溶性高分子に含まれる極性基は、機能性分子が結合されると失われる。このことにより、水溶性高分子の極性自体に変化が生じる。つまり、酸化チタン粒子の表面に結合した水溶性高分子のもつ電荷あるいは水和の作用によって分散しているバランスが、機能性分子の結合前後において変化すると考えられる。この酸化チタン粒子の表面に結合した水溶性高分子の変質に伴う電荷あるいは水和のバランスをうまくコントロールすることでのみ達成しうる。一方、本発明における酸化チタン粒子の表面に結合した機能性分子については、水溶性高分子を変質させることなく結合させることにより、水溶性高分子による高い分散性を保持できる。このため、水溶性高分子の変質によって生じる分散性の変化を考慮することなく、機能性分子の結合に際して自由度の高い分子設計が可能である。
【0017】
本発明の酸化チタン機能性分子複合体粒子によれば、前記機能性分子として酸化チタン表面に対し、疎水性や細胞認識性の分子を導入することで、水溶性高分子を変質させることなく高い分散性を保持することができる。さらに、酸化チタン表面付近におけるこれら分子と細胞との高い相互作用を発揮できる。細胞認識性の分子を酸化チタン粒子の表面に結合しているので、酸化チタン表面付近において超音波や紫外線照射によって発生したラジカル種との反応速度を向上させ、殺対象が癌細胞の場合にあっては、超音波や紫外線による癌の治療効果を著しく向上することができる。そのため、本発明の酸化チタン機能性分子複合体粒子は、投与後に選択的に患部に取り込まれ、その後に患部に超音波を照射することにより行われる超音波癌治療を促進するための、細胞認識性を有する超音波癌治療促進剤としても利用可能である。
【0018】
また、本発明の酸化チタン機能性分子複合体粒子によれば、前記機能性分子として酸化チタン表面に対し、光応答性の分子や放射性物質を導入することで、水溶性高分子を変質させることなく高い分散性を保持することができる。さらに、酸化チタン表面を直接的にこれらの分子を標識することができる。特に、放射性物質に関しては、安全性の観点から取り扱いに注意が必要であるが、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子に対して、酸化チタン表面に放射性物質を結合した後に、未結合の放射性物質を適当な方法で分離除去するだけの、簡易でかつ少ない工程によって粒子の標識ができる。このため、放射性物質が外部に広がる機会が少なく、安全性の面において優れる。また、これを適当な機器により測定することで粒子のイメージングや定量の測定が可能である。そのため、本発明の酸化チタン機能性分子複合体粒子は、体内に投与後に体内動態を確認するためのトレーサー実験用材料や、患部に超音波や光を照射することにより行われる診断および治療のための医療用材料としても利用可能である。
【0019】
さらに、本発明の酸化チタン機能性分子複合体粒子によれば、前記機能性分子として酸化チタン表面に対し、ラジカル応答性の分子を導入することで、水溶性高分子を変質させることなく高い分散性を保持することができる。さらに、酸化チタン表面付近において超音波や紫外線照射によって発生したラジカル種との反応速度を向上させ、高い反応性を発揮することができる。前記ラジカル応答性の分子が、ラジカル種との反応により蛍光性や発光性を示すものを用いれば、これを適当な機器により測定することで粒子のイメージングやラジカル種発生量の測定が可能である。そのため、本発明の酸化チタン機能性分子複合体粒子は、患部に超音波や光を照射することにより行われる診断および治療のための医療用材料としても利用可能である。
【0020】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、酸化チタン粒子の表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を介して結合されてなることが好ましい。これによって、酸化チタン粒子の表面に強固に結合することが可能であり、また、3官能シラノール基のような相互に三次元的に縮合重合して重合物で酸化チタン粒子の表面を覆い尽くしてしまう官能基とは異なり、官能基同士で重合することが無いため、図1に示されるように酸化チタン粒子の表面に剥き出しの部分を多く確保することができると考えられる。その結果、表面が重合体で覆われることによって起こりうる失活を抑制しつつ、酸化チタン粒子の触媒活性を十分に発揮させることができる。
【0021】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、酸化チタン機能性分子複合体粒子を水系溶媒中で分散させることができれば特に限定されないが、電荷を有するものとしては、アニオン性またはカチオン性を有する水溶性高分子、また、電荷を有さずに水和によって分散性を与えるものとしてはノニオン性を有する水溶性高分子が挙げられ、これらの少なくとも一種を含んでなる。
【0022】
本発明の好ましい態様によれば、前記水溶性高分子は重量平均分子量2000〜100000である。水溶性高分子の重量平均分子量はサイズ排除クロマトグラフィーを用いて求めた値である。前記分子量をこの範囲とすることで、水溶性高分子のもつ電荷あるいは水和の作用によって、酸化チタン粒子の分散が困難とされる中性付近の水系溶媒中であって酸化チタン機能性分子複合体粒子を高度に分散させることができる。
より好ましい範囲は5000〜100000であり、さらに好ましくは5000〜40000である。
【0023】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、アニオン性を有する水溶性高分子として酸化チタン機能性分子複合体粒子を水系溶媒中で分散させることができればいずれも使用可能であるが、複数のカルボキシル基を有するものとしては、例えばカルボキシメチルデンプン、カルボキシメチルデキストラン、カルボキシメチルセルロース、ポリカルボン酸類、およびカルボキシル基単位を有する共重合体(コポリマー)などが挙げられる。具体的には、水溶性高分子の加水分解性および溶解度の観点から、ポリアクリル酸、ポリマレイン酸等のポリカルボン酸類、およびアクリル酸/マレイン酸やアクリル酸/スルフォン酸系モノマーの共重合体(コポリマー)がより好適に使用され、さらに好ましくはポリアクリル酸である。
【0024】
アニオン性を有する水溶性高分子として、ポリアクリル酸を用いる場合、分散性の観点からポリアクリル酸の重量平均分子量は2000〜100000であるのが好ましく、より好ましくは5000〜40000であり、さらに好ましくは5000〜20000である。
【0025】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、カチオン性を有する水溶性高分子として酸化チタン機能性分子複合体粒子を水系溶媒中で分散させることができればいずれも使用可能であるが、複数のアミノ基を有するものとしては、例えばポリアミノ酸、ポリペプチド、ポリアミン類、およびアミン単位を有する共重合体(コポリマー)などが挙げられる。具体的には、水溶性高分子の加水分解性および溶解度の観点から、ポリエチレンイミン、ポリビニルアミン、ポリアリルアミン等のポリアミン類がより好適に使用され、さらに好ましくはポリエチレンイミンである。
【0026】
カチオン性を有する水溶性高分子として、ポリエチレンイミンを用いる場合、分散性の観点からポリエチレンイミンの重量平均分子量は2000〜100000であるのが好ましく、より好ましくは5000〜40000であり、さらに好ましくは5000〜20000である。
【0027】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、ノニオン性を有する水溶性高分子として酸化チタン機能性分子複合体粒子を水系溶媒中で分散させることができればいずれも使用可能であるが、好ましくは水酸基および/またはポリオキシアルキレン基を有する高分子が挙げられる。そのような水溶性高分子の好ましい例としては、ポリエチレングリコール(PEG)、ポリビニルアルコール、ポリエチレンオキシド、デキストランあるいはそれらを含有するコポリマーが挙げられ、より好ましくはポリエチレングリコール(PEG)およびデキストランであり、さらに好ましくはポリエチレングリコールである。
【0028】
ノニオン性を有する水溶性高分子として、ポリエチレングリコールを用いる場合、分散性の観点からポリエチレングリコールの重量平均分子量は2000〜100000であるのが好ましく、より好ましくは5000〜40000である
【0029】
本発明の好ましい態様によれば、本発明に用いる機能性分子は、酸化チタン粒子表面に結合してなるが、該機能性分子はカルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を有する。
【0030】
本発明の好ましい態様によれば、本発明に用いる機能性分子は、a)炭素数6〜40よりなる飽和又は不飽和の鎖状炭化水素基、b)置換基を有するか有しない飽和又は不飽和の5〜6員環複素環式基、又はc)置換基を有するか有しない飽和又は不飽和の5〜6員環環状炭化水素基を含んでなる化合物である。
【0031】
上記炭素数よりなる機能性分子は、前記水溶性高分子と比べて分子の大きさが小さい。また、機能性分子は酸化チタン表面に結合してなる。このため、本発明の酸化チタン機能性分子複合体粒子において、外殻に水溶性高分子が位置するのに対し、より内部の位置に機能性分子を有する構造をとる。該外殻は酸化チタン機能性分子複合体粒子の分散性に対する影響が最も大きい。すなわち外殻に位置する水溶性高分子に対して、内部に位置する機能性分子が分散性に与える影響は小さくなり、好適に用いることが出来る。
【0032】
また、上記炭素数よりなる機能性分子は、機能性分子は酸化チタン粒子表面に結合してなるため、酸化チタン表面付近において超音波や紫外線照射によって発生したラジカル種と機能性分子との反応性が高く、機能性分子および機能性分子と相互作用を有する対象物との反応性を著しく向上することができ、好適に用いることが出来る。
【0033】
本発明の好ましい態様によれば、本発明に用いる機能性分子は、特にその機能は限定されないが、疎水性、細胞認識性、光応答性、放射性、ラジカル応答性、および医薬の他、抗体等の生体分子や他の機能性分子等とのリンカー、などが挙げられる。
【0034】
前記酸化チタン機能性分子複合体粒子に結合された機能性分子の量は、前記酸化チタン粒子の質量あたり、1.0×10−1〜1.0×10−5 質量部/酸化チタン粒子の質量部であり、好ましくは1.0×10−2〜1.0×10−5 質量部/酸化チタン粒子の質量部であることが好ましい。この範囲であると、酸化チタン機能性分子複合体粒子は生体内環境に近い、10%タンパク質溶液を溶媒としても分散することができるため、好適に用いることができる。
【0035】
そのような機能性分子の例としては、芳香族化合物やアルキル構造をもつ分子等が考えられ、より具体的には、ベンゼン環をもつ分子として、カテコール、メチルカテコール、ターシャリーブチルカテコールドーパ、ドーパミン、ジヒドロキシフェニルエタノール、ジヒドロキシフェニルプロピオン酸、ジヒドロキシフェニル酢酸等の、分子内にカテコールの構造を有する、カテコール類などがあげられる。また、他の環状分子として、フェロセン、フェロセンカルボン酸、アスコルビン酸、ジハイドロキシシクロブテンジエン、アリザリン、ビナフタレンジオール等が好適に使用できる。さらに、アルキル構造をもつ分子としては、ヘキシル基、オクチル基、ラウリル基、パルミチル基、ステアリル基などのアルキル基を有する分子があげられる。あるいは、ヘキセニル基、オクテニル基、オレイル基などのアルケニル基、または、シクロアルキル基などの飽和又は不飽和脂肪族炭化水素基をもつものなどがあげられる。
【0036】
また、機能性分子の他の例としては、細胞認識性においては結合活性部位を含むペプチドやアミノ酸配列であってもよい。より具体的には5−アミノレブリン酸、メチオニン、システイン、グリシン等があげられる。あるいは、糖鎖を含んでもよい。さらに、結合性を有する核酸を含んでいても良い。核酸としては、特に制限はなく、DNA、RNAの他、アプタマー等の核酸塩基、PNA等のペプチド核酸を用いることもできる。
【0037】
また、機能性分子の他の例としては、光応答性においては蛍光性分子を含んでなるものを用いることが出来る。
【0038】
また、機能性分子の他の例としては、放射性においては同位体元素を含む化合物が挙げられ、例えば14Cを有する14C標識カテコールなどが好適に用いられる。
【0039】
また、機能性分子の他の例としては、ラジカル応答性においてはラジカルと特異的な反応性を示す化学発光性分子や蛍光性分子、またはスピントラップ剤を含んでなることが挙げられる。より具体的には、化学発光性分子や蛍光性分子として、ルミノール、海ホタルルシフェリン類縁体、シュウ酸エステル、アクリジニウム、パラヒドロキシフェニルフルオレセイン、パラアミノフェニルフルオレセイン、ジヒドロローダミン123、ジヒドロローダミン6G、トランス‐1‐(2’‐メトキシビニル)ピレン、ジヒドロキシエチジウム、葉酸、(2’,7’−dichlorodihydrofluorescein diacetate,succinimidyl ester(インビトロジェン)、)、5−or6−(N−Succinimidyloxycarbonyl)−3’,6’−O,O’−diacetylfluorescein、Cy色素(アマシャムバイオサイエンス社製)、プテリンなどであり、スピントラップ剤としては、4,6−Tri−tert−butylnitrosobenzene、2−Methyl−2−nitrosopropane、3,3,5,5−Tetramethyl−1−pyrroline N−Oxide、5,5−Dimethyl−1−pyrroline N−Oxide、5−(Diethylphosphono)−5−methyl−1−pyrroline N−Oxide、N−tert−Butyl−alpha−(4−pyridyl−1−oxide)nitrone、N−tert−Butyl−alpha−phenylnitrone、Nitrosobenzene、5,5−Dimethyl−1−pyrroline N−oxide、4−Hydroxy−2,2,6,6−tetramethylpiperidinyloxy, free radical、2−(5,5−Dimethyl−2−oxo−2λ5−[1,3,2]dioxaphosphinan−2−yl)−2−methyl−3,4−dihydro−2H−pyrrole 1−oxide、5−Diethoxyphosphoryl−5−methyl−1−pyrroline−N−oxideなどである。
【0040】
また、機能性分子の他の例としては、抗がん剤を用いる場合は、フルオロウラシル、ゲムシタビン、メソトレキセート、シクロホスファミド、塩酸ダウノルビシン、アドリアマイシン、塩酸イダルビシン、ブレオマイシン、マイトマイシン、アクチノマイシン、ビンクリスチン、シスプラチン、カルボプラチン、エトポシド、ネダプラチン、パクリタキセル、ドセタキセル、塩酸イリノテカン等から少なくとも一つが利用できる。また、ペニシリン系、マクロライド系、ニューキノロン系、テトラサイクリン系等の抗菌剤や、ラミブジン、ネルフィナビル、インジナビ、サキナビル、インターフェロン、アマンタジン、アシクロビル等のウイルス治療薬、そして、ニュープロレリン、ブセレリン、ゴセレリン、トリプトレリン、ナファレリン等のホルモン疾患治療薬、イブプロフェン等の鎮痛薬等を含んでなるものが挙げられる。
【0041】
本発明の好ましい態様によれば、本発明に用いる機能性分子は、上記機能を与える分子と酸化チタン表面に結合する官能基がリンカーを介して結合してなる分子であってもなんら問題はない。
【0042】
本発明の好ましい態様によれば、前記リンカーは、例えば生体分子同士を異なる官能基同士で結合する際に用いられるヘテロバイファンクショナルなクロスリンカーなどが考えられる。リンカーの具体例としては、N−ヒドロキシスクシンイミド、N−[α−マレイミドアセトキシ]スクシンイミドエステル、N−[β−マレイミドプロピルオキシ]スクシンイミドエステル、N−β−マレイミドプロピオン酸、N−[β−マレイミドプロピオン酸]ヒドラジド・TFA、1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミドヒドロクロリド、N−ε−マレイミドカプロン酸、N−[ε−マレイミドカプロン酸]ヒドラジド、N−[ε−マレイミドカプロイルオキシ]スクシンイミドエステル、N−[γ−マレイミドブチリルオキシ]スクシンイミドエステル、N−κ−マレイミドウンデカン酸、N−[κ−マレイミドウンデカン酸]ヒドラジド、スクシンイミジル−4−[N−マレイミドメチル]−シクロヘキサン−1−カルボキシ−[6−アミドカプロエート]、スクシンイミジル6−[3−(2−ピリジルジチオ)−プロピオンアミド]ヘキサノエート、m−マレイミドベンゾイル−N−ヒドロキシスクシンイミドエステル、4−[4−N−マレイミドフェニル]酪酸ヒドラジド・HCl、3−[2−ピリジルジチオ]プロピオニルヒドラジド、N−[p−マレイミドフェニル]イソシアネート、N−スクシンイミジル[4−アジドフェニル]−1,3’−ジチオプロピオネート、N−スクシンイミジル S−アセチルチオアセテート、N−スクシンイミジルS−アセチルチオプロピオネート、スクシンイミジル 3−[ブロモアセトアミド]プロピオネート、N−スクシンイミジル ヨードアセテート、N−スクシンイミジル[4−イオドアセチル]アミノベンゾエート、スクシンイミジル4−[N−マレイミドメチル]−シクロヘキサン−1−カルボキシレート、スクシンイミジル4−[p−マレイミドフェニル]ブチレート、スクシンイミジル6−[(β−マレイミドプロピオンアミド)ヘキサノネート]、4−スクシンイミジルオキシカルボニル−メチル−α[2−ピリジルジチオ]トルエン、N−スクシンイミジル3−[2−ピリジルジチオ]プロピオネート、N−[ε−マレイミドカプロイルオキシ]スルホスクシンイミドエステル、N−[γ−マレイミドブチリルオキシ]スルホスクシンイミドエステル、N−[κ−マレイミドウンデカノイルオキシ]−スルホスクシンイミドエステル、スルホスクシンイミジル−6−[α−メチル−α−(2−ピリジルジチオ)トルアミド]ヘキサノネート、スルホスクシンイミジル6−[3’−(2−ピリジルチチオ)−プロピオンアミド]ヘキサノネート、m−マレイミドベンゾイル−N−ヒドロキシスルホ−スクシンイミドエステル、スルホスクシンイミジル[4−ヨードアセチル]アミノベンゾエート、スルホスクシンイミジル4−[N−マレイミドメチル]−シクロヘキサン−1−カルボキシレート、スルホスクシンイミジル4−[p−マレイミドフェニル]ブチレート,N−[ε−トリフルオロアセチルカプロイルオキシ]スクシンイミドエステル、クロロトリアジン、ジクロロトリアジン、トリクロロトリアジン等が挙げられる。また、リンカーはさらに他のリンカー同士が結合されるような複数種類のリンカーから構成されてもよい。
【0043】
本発明の好ましい態様によれば、酸化チタン粒子と水溶性高分子およびまたは機能性分子との結合に用いられるジオール基としては、エンジオール基であることが好ましく、より好ましくはα−ジオール基である。これらの官能基を用いることで、優れた酸化チタン粒子への結合を実現することができる。
【0044】
本発明の好ましい態様によれば、酸化チタン粒子が、アナターゼ型酸化チタンまたはルチル型酸化チタンであるのが好ましい。紫外線や超音波の照射による触媒活性を利用する場合にはアナターゼ型酸化チタンが好ましく、化粧料のように高い屈折率等の性質を利用する場合にはルチル型酸化チタンが好ましい。
【0045】
本発明の好ましい態様によれば、本発明に用いる酸化チタン機能性分子複合体粒子は20〜200nmの粒子径を有し、より好ましくは50〜200nmであり、さらに好ましくは50〜150nmである。この粒径範囲であると、癌腫瘍への到達を目的として患者の体内に投与されると、ドラッグデリバリーシステムのように、Enhanced Permeability and Retention Effect(EPR効果)により癌組織に効率的に到達して蓄積される。そして、上述の通り、400kHz〜20MHzの超音波や紫外線の照射によりラジカル種の特異的生成が起こる。したがって、超音波や紫外線の照射により高い効率で癌組織を殺傷することができる。
【0046】
本発明の別の好ましい態様によれば、酸化チタン機能性分子複合体粒子が50nm未満(例えば数nm)の粒子径を有する場合、見かけ上のサイズを大きくしてEPR効果を得ることもできる。すなわち、50〜150nmの粒子径を有する二次粒子の形態を有するように半導体粒子同士を多官能リンカーで連結する等の方法にて結合されることで、EPR効果により高い癌治療効果を実現することができる。本発明のさらに別の好ましい態様によれば、EPR効果を利用するため、リポソームのような薬剤封入体の中に、酸化チタン機能性分子複合体粒子を包摂させることもできる。
【0047】
本発明において半導体粒子の粒子径は、動的光散乱法により測定することができる。具体的には、粒径分布測定装置(ゼータサイザーナノ、マルバーンインスツルメント社製)を用いて、キュミュラント解析で得られる、Z−average sizeで示される値として得ることができる。
【0048】
本発明に使用可能な酸化チタン機能性分子複合体粒子は、単一種類の酸化チタン複合体粒子のみならず、複数種類の半導体粒子の混合物あるいは複合物も包含する。具体例としては、酸化チタン粒子と酸化鉄ナノ粒子との複合物、酸化チタン粒子と白金との複合物、およびシリカ被覆された酸化チタン等が挙げられる。
【0049】
本発明の好ましい態様によれば、酸化チタン機能性分子複合体粒子が、溶媒に分散されて分散液の形態とされてなるのが好ましい。これにより、酸化チタン機能性分子複合体粒子を、点滴、注射、塗布等の種々の方法により、患者の体内に効率的に投与することができる。分散液の液性は限定されず、pH3〜10の広範囲にわたって高い分散性を実現可能である。なお、体内投与における安全性の観点から、分散液は、pH5〜9であるのが好ましく、より好ましくは5〜8、特に中性の液性を有するのが好ましい。また、本発明の好ましい態様によれば、溶媒は水系溶媒であるのが好ましく、さらに好ましくはpH緩衝液または生理食塩水である。水系溶媒の好ましい塩濃度は2M以下であり、体内投与における安全性の観点から200mM以下がより好ましい。酸化チタン機能性分子複合体粒子は分散体に対して、0.001〜1質量%以下含有されることが好ましく、より好ましくは0.001〜0.1質量%である。この範囲内であれば、投与後、24〜72時間後に患部(腫瘍)に効果的に粒子を蓄積させることが可能となる。すなわち、患部(腫瘍)に粒子濃度が蓄積しやすくなるとともに、血中での粒子の分散性も確保されて凝集隗が形成しにくくなるため、投与後に血管の閉塞などの二次的弊害を招くおそれも無い。
【0050】
本発明の酸化チタン機能性分子複合体粒子は、点滴、注射、塗布等の種々の方法により、患者の体内に投与することができる。特に静脈または皮下による投与経路で用いられる場合は、粒子の大きさによるEPR効果と、血中の滞留性を利用して、所謂DDS的な治療により、患者の負担を軽減する観点から好ましい。そして、体内に投与された酸化チタン機能性分子複合体粒子は、ドラッグデリバリーシステムのように、癌組織に到達して蓄積される。
【0051】
本発明の酸化チタン機能性分子複合体粒子は、超音波あるいは紫外線の照射を受け、該照射により細胞毒となることができる。この酸化チタン機能性分子複合体粒子は、体内に投与され、超音波照射を受け、該照射により細胞毒となることで、細胞を殺傷することができるが、体内に限らず、試験管内においても殺対象である細胞を殺傷することができる。本発明において、殺対象は特に限定されないが、癌細胞であるのが好ましい。すなわち、本発明による酸化チタン機能性分子複合体粒子によれば、超音波や紫外線の照射により活性化して癌細胞を殺傷することができる。
【0052】
本発明の好ましい態様によれば、酸化チタン機能性分子複合体粒子が蓄積された癌組織に超音波処理が行われる。使用する超音波の周波数は、400kHz〜20MHzが好ましく、より好ましくは600kHz〜10MHz、さらに好ましくは1MHz〜10MHzである。超音波の照射時間は治療対象である癌組織の位置および大きさを考慮して適宜決定されるべきであり、特に限定されない。こうして、患者の癌組織を超音波により高い効率で殺傷して、高い癌治療効果を実現することができる。超音波は生体内の深部に外部より到達させることが可能で、本発明の酸化チタン機能性分子複合体粒子と併せて用いることにより、非侵襲の状態で生体内深部に存在するような患部やターゲット部位の治療が実現できる。さらに、患部やターゲット部位に本発明の酸化チタン複合体粒子が集積することにより、周辺の正常細胞に悪影響を及ぼさない程度の微弱な超音波で本発明の酸化チタン複合体粒子を集積させた局所のみに作用させることができる。
【0053】
ところで、これらの半導体粒子が超音波の照射により活性化して細胞を殺傷する効果は、超音波照射によりラジカル種を生成させることにより得ることができる。すなわち、これらの半導体粒子が与える生物的殺傷効果はラジカル種の質的・量的な増加にあると考えられる。その理由は以下の通り推察されるが、以下の理由はあくまで仮説であって、本発明は何ら下記説明に限定されるものではない。すなわち、超音波照射のみでは系中には過酸化水素とヒドロキシルラジカルが発生するが、本発明者らの知見によれば、酸化チタンなどの半導体粒子の存在下では、過酸化水素及びヒドロキシルラジカルの生成が促進される。また、これら半導体粒子の存在下、特に酸化チタンの存在下では、スーパーオキサイドアニオンと一重項酸素の生成が促進されるように見受けられる。これらラジカル種の特異的生成は、ナノメートルオーダーの微粒子を用いた場合、超音波照射時の周波数が400kHz〜20MHzの範囲、好ましくは600kHz〜10MHzの範囲、より好ましくは1MHz〜10MHzの範囲で顕著に観察される現象であると考えられる。
【実施例】
【0054】
以下に実施例を示す。特に断りのない限り、「%」は質量%を意味する。
【0055】
例1:ポリエチレングリコール結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(アマシャム・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、分散液0.1mlを石英測定セルに仕込み、ゼータサイザーナノZS(シスメックス社製)を用いて、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は20.2nmであった。蒸発皿を用いて、50℃下で酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0056】
次に、ポリオキシエチレン−モノアリル−モノメチルエーテルと無水マレイン酸の共重合体(平均分子量;33659−日本油脂製)1gに水5mlを添加し加水分解後得られた溶液と1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(同仁化学製)を、超純水を用いてそれぞれ濃度が50mg/mlおよび50mMとなるように混合に調整した。調整した溶液に4−アミノサリチル酸(分子量Mn=153.14:MP Biomedicals,Inc.)を濃度50mMになるよう混合して4mlの溶液を得た。この溶液を室温にて72時間振とう撹拌して反応させた。反応後、得られた溶液を透析膜であるスペクトラ/ポア CE 透析用チューブ(分画分子量=3500、Spectrum Laboratories,Inc.)に移して超純水4lに対して室温にて24時間で透析を行った。透析後にすべてナスフラスコに移し替えて一晩凍結乾燥し、得られた粉末に4mlのジメチルホルムアミド(DMF:和光純薬工業)を添加して混合し、4−アミノサリチル酸結合ポリエチレングリコール溶液とした。
【0057】
次にDMFを用いて4−アミノサリチル酸結合ポリエチレングリコール溶液が終濃度20(vol/vol)%、先に得られたアナタ−ゼ型二酸化チタンゾルが終濃度で固形成分0.25%となるよう調整し、2.5mlの反応溶液とした。この反応溶液を水熱反応容器のHU−50(三愛科学製)に溶液を移し変え、80℃で6時間加熱反応を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水1mlを添加して酸化チタン複合体粒子であるポリエチレングリコール結合二酸化チタン微粒子の分散液とした。さらに、HPLC:AKTA purifier(GEヘルスケアバイオサイエンス製)、カラム:HiPrep 16/60 Sephacryl S−300HR(GEヘルスケアバイオサイエンス製)、移動相:リン酸塩緩衝溶液(pH7.4)、流速:0.3ml/min]に付したところ、素通り画分にUV吸収のピークが確認され、この画分を回収した。この分散液を蒸留水で0.05(wt/vol)%水溶液に希釈して72時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合二酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は32.7nmであった。
【0058】
例2:ポリアクリル酸結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(アマシャム・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸化チタンゾルを100ml容のバイアル瓶に入れ、200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、ゼータサイザーナノZS(シスメックス社製)を用いて、石英測定セルに分散液0.1mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は20.2nmであった。蒸発皿を用いて、50℃下で酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0059】
この酸性酸化チタンゾル0.6mlをジメチルホルムアミド(DMF)で20mlとなるよう調整して分散させ、平均分子量5000のポリアクリル酸(和光純薬社製)0.3gを溶解したDMF10mlを添加後、攪拌して混合した。水熱反応容器のHU−50(三愛科学社製)に溶液を移し変え、150℃で5時間反応を行った。反応終了後、反応容器温度が50℃以下になるまで反応液を冷却し、反応液に対して2倍量のイソプロパノールを添加した。室温で30分間静置後、2000gにて15min遠心分離により沈殿を回収した。回収した沈殿表面をエタノールで洗浄後、1.5mlの水を加えて酸化チタン複合体粒子であるポリアクリル酸結合酸化チタン微粒子の分散液を得た。この分散液を蒸留水で100倍に希釈し、分散粒径およびゼータ電位を動的光散乱法により測定した。この測定は、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリアクリル酸結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は53.6nm、ゼータ電位は−45.08mVであった。
【0060】
例3:ポリエチレンイミン結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(アマシャム・ファルマシア・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸化チタンゾルを100ml容のバイアル瓶に入れ、200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、12Nの硝酸で1000倍に希釈した後、ゼータサイザーナノZS(シスメックス社製)を用いて、石英測定セルに分散液0.1mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は20.2nmであった。
【0061】
得られた酸化チタンゾル3mlを20mlのジメチルホルムアミド(DMF)に分散させ、平均分子量10000のポリエチレンイミン(和光純薬社製)450mgを溶解したDMF10mlを添加後、攪拌して混合した。水熱反応容器のHU−50(三愛科学社製)に溶液を移し変え、150℃で5時間反応を行った。反応終了後、反応容器温度が50℃以下になるまで反応液を冷却し、反応液に対して2倍量のアセトンを添加した。室温で30分間静置後、2000gにて15min遠心分離により沈殿を回収した。回収した沈殿表面をエタノールで洗浄後、1.5mlの水を加えて酸化チタン複合体粒子であるポリエチレンイミン結合酸化チタン微粒子の分散液を得た。この分散液を蒸留水で100倍に希釈し、分散粒径およびゼータ電位を動的光散乱法により測定した。この測定は、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレンイミン結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は57.5nm、ゼータ電位は47.5mVであった。
【0062】
例4:酸化チタン複合体粒子へのカテコール結合
例1〜3で得られた、それぞれの酸化チタン複合体粒子を超純水にて固形成分1%とした。次に、カテコールを超純水にて、モル濃度で100mM、10mM、1mM、0.1mMに調整した。酸化チタン複合体粒子1%溶液に対してそれぞれのカテコール溶液を等量ずつ混合し、リン酸緩衝生理食塩水(PBS;pH7.4)で最終的に酸化チタン複合体粒子とカテコール溶液がそれぞれ終濃度で10倍希釈になるように調整した。調整した溶液をそれぞれ恒温器に移して40℃に設定し、3時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、それぞれの溶液について増大が認められたため、カテコールが結合したと考えられた。また、反応前と反応後の溶液をキャピラリ電気泳動にて以下の条件で付したところ、フォトダイオードアレイ検出器によって吸収波長214nmのピークを確認することによりカテコールの変化量を求めた。
・装置:P/ACE MDQ(ベックマンコールター製)
・キャピラリ:フューズドシリカキャピラリ 50μm i.d × 67cm(effective length 50cm)(ベックマンコールター製)
・移動相:50mM 酢酸ナトリウム緩衝溶液(pH4.8)
・電圧:25kV
・温度:20℃
求めた変化量よりカテコールは酸化チタン粒子の質量あたり5.0×10−3〜1.0×10−4 カテコール−g/酸化チタン粒子−gであった。
さらに、この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケアバイオサイエンス製)を用いて水3.5mlで回収して未反応のカテコールを除去した。カテコールの除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのカテコールがないことを確認した。これらからカテコール結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0063】
例5:酸化チタン複合体粒子への14C標識カテコール結合
例4において、カテコールの代わりに14C標識カテコール(14C標識カテコール終濃度1mM)を使い、酸化チタン複合体粒子として例1において得られたポリエチレングリコール結合酸化チタン微粒子のみを用いた以外は、まったく同じ手順で酸化チタン複合体粒子への14C標識カテコール結合を行った。その結果、14C標識カテコールの結合と、フリー14C標識カテコールの除去を確認した。また、それぞれの溶液を超純水を用いて、固形成分0.01%に希釈した後、ゼータサイザーナノZS(シスメックス社製)を用いて、例1と同様に平均分散粒径の測定を行った。その結果、分散粒径は35.7nmであった。これらから、14C標識カテコール結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0064】
例6:カテコール結合酸化チタン機能性分子複合体粒子の分散性
例4において得られたポリエチレングリコール結合酸化チタン微粒子を用いたカテコール結合酸化チタン機能性分子複合体粒子を、それぞれ10%血清を含むRPMI1640培地(GIBCO製)に対して、固形成分0.01%になるように添加し、96時間、室温にて静置した。その後、ゼータサイザーナノZSにて例1と同様に平均分散粒径の測定を行った。結果を表1に示す。表1より、それぞれのカテコール結合酸化チタン機能性分子複合体粒子は20〜200nmの範囲における粒径をもつことが確認された。
【0065】
【表1】

【0066】
例7:カテコール結合酸化チタン機能性分子複合体粒子の疎水性
例1〜例4において得られた酸化チタン複合体粒子およびカテコール結合酸化チタン機能性分子複合体粒子の分散液を、それぞれよく攪拌して混合した。1分後、各溶液の液面における気泡の状態を目視にて確認したところ、酸化チタン複合体粒子の分散液に比べて、カテコール結合酸化チタン機能性分子複合体粒子の分散液は気泡の形成が有意に多いことが確認され、このことから、カテコール結合によってカテコール結合酸化チタン機能性分子複合体粒子は疎水性が強まっているものと考えられた。
【0067】
例8:ポリエチレングリコール結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(GEヘルスケア バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸性酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸性酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、分散液0.1mlを石英測定セルに仕込み、ゼータサイザーナノZS(シスメックス社製)を用いて、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は38.4nmであった。蒸発皿を用いて、50℃下で酸性酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0068】
次に、ポリオキシエチレン−モノアリル−モノメチルエーテルと無水マレイン酸の共重合体(平均分子量15000;AM1510K−日本油脂製)0.5gに超純水4.5mlを添加しポリエチレングリコール溶液とした。次に、超純水を用いて1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC;同仁化学製)を濃度400mMになるよう調製し、EDC溶液とした。ポリエチレングリコール溶液1mlに超純水0.25mlと0.75N水酸化ナトリウム水溶液0.1ml、およびEDC溶液0.5mlを混合調製した。調製した溶液にドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を濃度15mMになるよう混合して2mlの溶液を得た。この溶液を40℃にて2時間振とう撹拌して反応させた。反応後、得られた溶液を透析膜であるスペクトラ/ポア CE 透析用チューブ(分画分子量=3500、Spectrum Laboratories,Inc.)に移して超純水4lに対して室温にて24時間で透析を行った。透析後にすべてナスフラスコに移し替えて一晩凍結乾燥し、得られた粉末に4mlのジメチルホルムアミド(DMF:和光純薬工業)を添加して混合し、ドーパミン結合ポリエチレングリコール溶液とした。
【0069】
次にDMFを用いてドーパミン結合ポリエチレングリコール溶液が終濃度20(vol/vol)%、先に得られた酸性酸化チタンゾルが終濃度で固形成分0.25%となるよう調製し、5mlの反応溶液とした。この反応溶液を水熱反応容器のHU−50(三愛科学製)に溶液を移し替え、150℃で6時間加熱反応を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水1.25mlを添加してポリエチレングリコール結合酸化チタン微粒子の分散液とした。この分散液を蒸留水で0.05(wt/vol)%水溶液に希釈して24時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は57.3nm、ゼータ電位は3.41mVであった。
【0070】
例9:ポリエチレングリコール結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(GEヘルスケア バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸性酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸性酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、分散液0.1mlを石英測定セルに仕込み、ゼータサイザーナノZS(シスメックス社製)を用いて、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は38.4nmであった。蒸発皿を用いて、50℃下で酸性酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0071】
次に、ポリオキシエチレン−モノアリル−モノメチルエーテルと無水マレイン酸の共重合体(平均分子量30000;AM2090P−日本油脂製)0.5gに超純水4.5mlを添加しポリエチレングリコール溶液とした。次に、超純水を用いて1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC;同仁化学製)を濃度400mMになるよう調製し、EDC溶液とした。ポリエチレングリコール溶液1mlに超純水0.25mlと0.75N水酸化ナトリウム水溶液0.1ml、およびEDC溶液0.5mlを混合調製した。調製した溶液にドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を濃度15mMになるよう混合して2mlの溶液を得た。この溶液を40℃にて2時間振とう撹拌して反応させた。反応後、得られた溶液を透析膜であるスペクトラ/ポア CE 透析用チューブ(分画分子量=3500、Spectrum Laboratories,Inc.)に移して超純水4lに対して室温にて24時間で透析を行った。透析後にすべてナスフラスコに移し替えて一晩凍結乾燥し、得られた粉末に4mlのジメチルホルムアミド(DMF:和光純薬工業)を添加して混合し、ドーパミン結合ポリエチレングリコール溶液とした。
【0072】
次にDMFを用いてドーパミン結合ポリエチレングリコール溶液が終濃度20(vol/vol)%、実施例1で得られた酸性酸化チタンゾルが終濃度で固形成分0.25%となるよう調製し、5mlの反応溶液とした。この反応溶液を水熱反応容器のHU−50(三愛科学製)に溶液を移し替え、150℃で6時間加熱反応を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水1.25mlを添加してポリエチレングリコール結合酸化チタン微粒子の分散液とした。この分散液を蒸留水で0.05(wt/vol)%水溶液に希釈して24時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は60.3nm、ゼータ電位は3.05mVであった。
【0073】
例10:ポリエチレングリコール結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(GEヘルスケア バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸性酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸性酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、分散液0.1mlを石英測定セルに仕込み、ゼータサイザーナノZS(シスメックス社製)を用いて、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は38.4nmであった。蒸発皿を用いて、50℃下で酸性酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0074】
次に、2,4−bis(O−methoxypolyethyleneglycol)−6−chloro−s−triazine(平均分子量10000;PEG2−生化学工業製)0.5gに超純水4.5mlを添加しポリエチレングリコール溶液とした。ポリエチレングリコール溶液4mlに50mMの2−[4−(2−ヒドロキシエチル)−1−ピペラジニル]エタンスルホン酸緩衝液(pH7.0)2mlとドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を濃度2.5mMになるよう混合して8mlの溶液を得た。この溶液を室温にて24時間振とう撹拌して反応させた。反応後、得られた溶液を透析膜であるスペクトラ/ポア CE 透析用チューブ(分画分子量=3500、Spectrum Laboratories,Inc.)に移して超純水4lに対して室温にて24時間で透析を行った。透析後にすべてナスフラスコに移し替えて一晩凍結乾燥し、得られた粉末に4mlのジメチルホルムアミド(DMF:和光純薬工業)を添加して混合し、ドーパミン結合ポリエチレングリコール溶液とした。
【0075】
次にDMFを用いてドーパミン結合ポリエチレングリコール溶液が終濃度40(vol/vol)%、実施例1で得られた酸性酸化チタンゾルが終濃度で固形成分0.25%となるよう調製し、5mlの反応溶液とした。この反応溶液を水熱反応容器のHU−50(三愛科学製)に溶液を移し替え、150℃で6時間加熱反応を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水1.25mlを添加してポリエチレングリコール結合酸化チタン微粒子の分散液とした。この分散液を蒸留水で0.05(wt/vol)%水溶液に希釈して24時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は123nm、ゼータ電位は13.1mVであった。
【0076】
例11:酸化チタン複合体粒子への蛍光分子の結合
例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%の分散液とした。次に、ドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を200mMとなるよう調整した。調整した溶液と分散液を1:9で混合して1mlとし、室温で1時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、それぞれの溶液について増大が認められたため、ドーパミンが結合したと考えられた。また、反応前と反応後の溶液をキャピラリ電気泳動にて以下の条件で付したところ、フォトダイオードアレイ検出器によって吸収波長214nmのピークを確認することによりドーパミンの変化量を求めた。
・装置:P/ACE MDQ(ベックマンコールター製)
・キャピラリ:フューズドシリカキャピラリ 50μm i.d×67cm(effective length 50cm)(ベックマンコールター製)
・移動相:50mM 酢酸ナトリウム緩衝溶液(pH4.8)
・電圧:25kV
・温度:20℃
求めた変化量よりドーパミンは酸化チタン粒子の質量あたり5.2×10−2 ドーパミン−g/酸化チタン粒子−gであった。
さらに、この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応のドーパミンを除去した。ドーパミンの除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのドーパミンがないことを確認した。これらからドーパミン結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0077】
次にこのドーパミン結合酸化チタン機能性分子複合体粒子を終濃度で0.3%、またNHS−Rhodamine(ピアース製)を終濃度で1mMとなるように20mMホウ酸緩衝液中で混合調整した。この溶液を4℃、遮光下で24時間静置した。この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応のNHS−Rhodamineを除去した。NHS−Rhodamineの除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのNHS−Rhodamineがないことを確認した。得られた溶液を蛍光分光光度計にてスペクトル解析を行い、励起波長555nm、蛍光波長575nmであることを確認した。これらのことから、酸化チタン複合体粒子へ蛍光分子を結合した、蛍光分子結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0078】
例12:酸化チタン複合体粒子へのドーパミンの結合
例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%の分散液とした。次に、ドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を200mMとなるよう調整した。調整した溶液と分散液を1:9で混合して1mlとし、室温で1時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、それぞれの溶液について増大が認められたため、ドーパミンが結合したと考えられた。また、反応前と反応後の溶液をキャピラリ電気泳動にて以下の条件で付したところ、フォトダイオードアレイ検出器によって吸収波長214nmのピークを確認することによりドーパミンの変化量を求めた。
・装置:P/ACE MDQ(ベックマンコールター製)
・キャピラリ:フューズドシリカキャピラリ 50μm i.d×67cm(effective length 50cm)(ベックマンコールター製)
・移動相:50mM 酢酸ナトリウム緩衝溶液(pH4.8)
・電圧:25kV
・温度:20℃
求めた変化量よりドーパミンは酸化チタン粒子の質量あたり5.2×10−2 ドーパミン−g/酸化チタン粒子−gであった。
さらに、この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応のドーパミンを除去した。ドーパミンの除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのドーパミンがないことを確認した。これらからドーパミン結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0079】
例13:酸化チタン複合体粒子へのジヒドロキシフェニルプロピオン酸の結合
例1で得られた、酸化チタン複合体粒子を超純水にて固形成分3%とした。次に、ジヒドロキシフェニルプロピオン酸(和光純薬工業製)を超純水にて、モル濃度で500mMに調整した。酸化チタン複合体粒子3%溶液に対してジヒドロキシフェニルプロピオン酸溶液を1/10量混合し、全量で1ml調整した。調整した溶液を室温で2.5時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、吸光度の増大が認められたため、ジヒドロキシフェニルプロピオン酸が結合したと考えられた。また、反応前と反応後の溶液をキャピラリ電気泳動にて以下の条件で、フォトダイオードアレイ検出器の吸収波長214nmのピークを確認することによりジヒドロキシフェニルプロピオン酸の変化量を求めた。
・装置:P/ACE MDQ(ベックマンコールター製)
・キャピラリ:フューズドシリカキャピラリ 50μm i.d × 67cm(effective length 50cm)(ベックマンコールター製)
・移動相:50mM ホウ酸緩衝溶液(pH9.0)
・電圧:25kV
・温度:20℃
求めた変化量より結合したジヒドロキシフェニルプロピオン酸は酸化チタン粒子の質量あたり4.8×10−2 ジヒドロキシフェニルプロピオン酸−g/酸化チタン−gであった。さらに、この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケアバイオサイエンス製)を用いて水3.5mlで回収して未反応のジヒドロキシフェニルプロピオン酸を除去した。ジヒドロキシフェニルプロピオン酸の除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのジヒドロキシフェニルプロピオン酸がないことを確認した。これらからジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0080】
例14:ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子へのエタノールアミンの結合
例9で得られた、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子の溶液と1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(同仁化学製)を、50mM ホウ酸緩衝溶液(pH9.0)を用いてそれぞれ濃度が15mg/mlおよび80mMとなるように混合して調整した。調整した溶液にエタノールアミン(和光純薬工業製)を濃度10mMになるよう混合して0.2mlの溶液を得た。この溶液を室温にて24時間振とう撹拌して反応させた。反応した溶液から50μlを超純水にて1000倍希釈に調整し、これを50mM ホウ酸緩衝液に対して1/10量添加して、440μlとした。さらにアセトンに溶解した0.3mg/mlのフルオレスカミン(東京化成工業社製)を20μl添加して溶液を攪拌後、蛍光光度計(島津製作所製 :RF−5300)により蛍光値を以下の測定条件で測定した。(波長:Ex=395nm/Em=495nm、バンド幅:Ex=5nm/Em=10nm、感度:High、レスポンス:Auto)。事前に作成した検量線を用いて未結合のエタノールアミンを算出して初期濃度からの濃度変化の割合、すなわち結合した割合を算出した。その結果、63.16%であった。以上のことから、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子のジヒドロキシフェニルプロピオン酸を介して、エタノールアミンが結合することを確認した。
【0081】
例15:ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子への抗体の結合
例13で得られた、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子の溶液と1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(同仁化学製)を、超純水を用いてそれぞれ濃度が20mg/mlおよび80mMとなるように混合した。混合した溶液を室温にて10分間反応した。脱塩カラムPD−10(GEヘルスケア バイオサイエンス社製)を用いて20mM HEPES緩衝溶液(pH7.4)に溶液交換し、酸化チタン濃度にして20mg/mlの粒子の溶液を得た。これと同一の緩衝液で調製した抗ヒト血清アルブミン(抗HSA)モノクローナル抗体(マウスIgG:MSU−304、コスモバイオ社)を3mg/mlになるように添加し、全量で1mlの溶液とした。4℃で24時間反応後、終濃度が0.5Mとなるようエタノールアミンを添加して、さらに4℃で1時間反応した。この溶液を酸化チタン濃度にして1mg/mlに調製し、HPLC:AKTA purifier(GEヘルスケアバイオサイエンス製)、カラム:HiPrep 16/60 Sephacryl S−500HR(GEヘルスケアバイオサイエンス製)、移動相:リン酸緩衝生理食塩水(pH7.4)、流速:0.3ml/min]に1ml付したところ、素通り画分および結合に用いた抗HSAモノクローナル抗体が単体で確認される画分にUV吸収のピークが確認され、これらの画分を回収した。素通り画分について、蒸留水で0.05(wt/vol)%水溶液に希釈して24時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は50.3nm、ゼータ電位は−3.0mVであった。また、抗HSAモノクローナル抗体が単体で確認される画分については、ブラッドフォード法でタンパク質濃度を測定した結果、反応前後で抗体濃度の減少が確認された。以上のことから、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子のジヒドロキシフェニルプロピオン酸を介して、抗体分子が結合することを確認した。
【0082】
例16:酸化チタン複合体粒子へのアミノレブリン酸およびジヒドロキシフェニルエタノールの結合
3,4−ジヒドロキシフェニルエタノール(和光純薬工業製)300mgをジメチルホルムアミド(DMF;和光純薬工業製)0.5mlに溶解した。この溶液に塩化チオニル(和光純薬工業製)を0.1ml加えて攪拌後、トルエン(和光純薬工業製)を7ml混合した。さらに、5−アミノレブリン酸塩酸塩(和光純薬工業製)を250mg加え、攪拌しながら80℃で1時間反応させた。反応後、二層に分かれた上層部および下層部をそれぞれ回収した。この回収液の一部と3,4−ジヒドロキシフェニルエタノールおよび5−アミノレブリン酸塩酸塩のDMF溶液を薄層クロマトグラフィ(TLC)を用いて、アセトン(和光純薬工業製):メタノール(和光純薬工業製)=2:3の溶液を用いて展開した後、乾燥したTLC板にニンヒドリンスプレー(和光純薬工業)を噴霧して加熱後、スポットの観察を行った。その結果、回収液のうち下層部の展開スポットが3,4−ジヒドロキシフェニルエタノールおよび5−アミノレブリン酸塩酸塩とは異なる位置にあり、ニンヒドリン反応によって呈色したことから、3,4−ジヒドロキシフェニルエタノールと5−アミノレブリン酸塩酸塩の複合体が生成したと考えられた。回収液のうち下層部を減圧下で10倍に濃縮し、反応濃縮溶液とした。例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%に調整し、そこに反応濃縮溶液を1/10量混合して、全量で1mlとした。この混合溶液を緩やかに攪拌しながら、室温で1時間反応を行った。反応後、沈殿成分を遠心分離(1500g、10min)して上澄みを回収し、この溶液1mlに対してバッファー交換用自然落下型カラムNAP−10(GEヘルスケアバイオサイエンス製)を用いて水1.5mlで回収して未反応の3,4−ジヒドロキシフェニルエタノールと5−アミノレブリン酸塩酸塩の複合体がおよびDMFを除去した。この溶液について可視光域(400nm)における波長の吸収スペクトルを紫外−可視光分光光度計(UV1600;島津製作所製)により確認したところ増大が認められたため、3,4−ジヒドロキシフェニルエタノールと5−アミノレブリン酸塩酸塩の複合体が結合したと考えられた。これらから3,4−ジヒドロキシフェニルエタノールと5−アミノレブリン酸塩酸塩の複合体結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0083】
例17:酸化チタン複合体粒子への葉酸およびドーパミンの結合
葉酸(和光純薬工業製)および塩酸ドーパミン(和光純薬工業製)を1mMとなるようジメチルホルムアミド(DMF;和光純薬工業製)に溶解した。また、同様にDMFを用いて200mM Benzotriazole−1−yl−oxy−trispyrrolidinophosphonium hexafluorophosphate(PyBop;メルク製)、200mM 1−ヒドロキシベンゾトリアゾール(HoBt;同仁化学製)、20mM N,N−ジイソプロピルエチルアミン(DIEA;和光純薬工業製)をそれぞれ調製した。これらのうち、葉酸と塩酸ドーパミンは元濃度の1/4、またその他は元濃度の1/10となるよう混合してDMFで20mlに溶液調整した。この混合溶液を緩やかに攪拌しながら、室温で20時間反応を行った。反応溶液の一部を超純水で10倍に希釈し、この溶液を逆相クロマトグラフィ(HPLCシステム:Prominence(島津製作所製)、カラム:Chromolith RP−18e 100−3mm(メルク製)、移動相:A メタノール(和光純薬工業製)B 0.1%トリフルオロ酢酸水溶液(和光純薬工業製)、流速:2ml/min)を用いて解析した。紫外線検出器で波長210nmに設定し、インジェクション(0.02ml)後、1〜10minにおいてメタノールが100%となるようグラジエント溶出を行った結果、9min付近に葉酸と塩酸ドーパミンの複合体と考えられるピークを確認した。また、葉酸および塩酸ドーパミンそれぞれ単独のピークは検出限界以下であった。これらのことから、葉酸と塩酸ドーパミンの複合体の生成を確認した。次に、反応溶液の残りを減圧下で10倍に濃縮し、反応濃縮溶液とした。例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%に調整し、そこに反応濃縮溶液を1/10量混合して、全量で1mlとした。この混合溶液を緩やかに攪拌しながら、室温で1時間反応を行った。反応後、沈殿成分を遠心分離(1500g、10min)して上澄みを回収し、この溶液1mlに対してバッファー交換用自然落下型カラムNAP−10(GEヘルスケアバイオサイエンス製)を用いて水1.5mlで回収して未反応の葉酸と塩酸ドーパミンの複合体およびDMFを除去した。葉酸と塩酸ドーパミンの複合体およびDMFの除去は逆相クロマトグラフィにて上記と同様に確認し、フリーの葉酸と塩酸ドーパミンの複合体がないことを確認した。これらから葉酸と塩酸ドーパミンの複合体結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0084】
例18:葉酸と塩酸ドーパミンの複合体結合酸化チタン機能性分子複合体粒子への紫外線照射と蛍光の確認
例17で得られた葉酸と塩酸ドーパミンの複合体結合酸化チタン機能性分子複合体粒子の溶液を、リン酸緩衝生理食塩水を用いて酸化チタン濃度がそれぞれ0.05、0.01、0.005%となるよう3mlに調製した。これらの溶液を攪拌しながら、波長352nmの紫外線ランプ(FL20S・BLB−A;東芝ライテック製)を用いて紫外線強度0.9mW/cm2で照射し、照射開始後0、3、6、9minにおける溶液の蛍光強度を、蛍光分光光度計(RF−5300PC;島津製作所製)を用いて励起波長360nmおよび蛍光波長450nmに設定し、それぞれ測定を行った。結果を図2に示す。照射時間および酸化チタン濃度の増加に伴い、蛍光強度が大きくなることが確認された。これは、この溶液への紫外線照射によって生じたラジカルとの反応に伴い、葉酸から遊離したプテリン化合物由来の蛍光であると考えられた。
【0085】
例19:ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子へのメチオニンの結合
例13で得られた、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子の溶液と1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(同仁化学製)を、50mM ホウ酸緩衝溶液(pH9.0)を用いてそれぞれ濃度が15mg/mlおよび80mMとなるように混合に調整した。調整した溶液にメチオニン(和光純薬工業製)を濃度10mMになるよう混合して0.2mlの溶液を得た。この溶液を室温にて24時間振とう撹拌して反応させた。反応した溶液から50μlを超純水にて1000倍希釈に調整し、これを50mM ホウ酸緩衝液に対して1/10量添加して、440μlとした。さらにアセトンに溶解した0.3mg/mlのフルオレスカミン(東京化成工業社製)を20μl添加して溶液を攪拌後、蛍光光度計(島津製作所製 :RF−5300)により蛍光値を以下の測定条件で測定した。(波長:Ex=395nm/Em=495nm、バンド幅:Ex=5nm/Em=10nm、感度:High、レスポンス:Auto)。事前に作成した検量線を用いて未結合のメチオニンを算出して初期濃度からの濃度変化の割合、すなわち結合した割合を算出した。その結果、40.2%であった。以上のことから、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子のジヒドロキシフェニルプロピオン酸を介して、メチオニンが結合することを確認した。
【0086】
例20:ドーパミン結合酸化チタン機能性分子複合体粒子へのラジカル応答性分子の結合
例12で得られたドーパミン結合酸化チタン機能性分子複合体粒子を終濃度で0.3%、また2,3−dihydro−6−isothiocyanato−1,4−phthalazinedione(同仁化学製)を終濃度で1mMとなるように20mMリン酸緩衝液中(pH7.0)で混合し、3mlに調整した。この溶液を4℃、遮光下で24時間静置し、結合反応を行った。この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応物の除去を行った。これらのことから、酸化チタン複合体粒子へラジカル応答性分子である2,3−dihydro−6−isothiocyanato−1,4−phthalazinedioneを結合した、ラジカル応答性分子結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0087】
例21:ドーパミン結合酸化チタン機能性分子複合体粒子へのラジカル応答性分子の結合2
例12で得られたドーパミン結合酸化チタン機能性分子複合体粒子を終濃度で0.3%、また2’,7’−dichlorodihydrofluorescein diacetate,succinimidyl ester(Invitrogen製)を終濃度で1mMとなるように20mMリン酸緩衝液中(pH7.0)で混合し、3mlに調整した。この溶液を4℃、遮光下で24時間静置し、結合反応を行った。この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応物を除去した。これらのことから、酸化チタン複合体粒子へラジカル応答性分子である2’,7’−dichlorodihydrofluorescein diacetate,succinimidyl esterを結合した、蛍光分子結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0088】
例22:酸化チタン複合体粒子へのフェロセンカルボン酸およびドーパミンの結合
フェロセンカルボン酸(和光純薬工業製)および塩酸ドーパミン(和光純薬工業製)を1mMとなるようジメチルホルムアミド(DMF;和光純薬工業製)に溶解した。また、同様にDMFを用いて200mM Benzotriazole−1−yl−oxy−trispyrrolidinophosphonium hexafluorophosphate(PyBop;メルク製)、200mM 1−ヒドロキシベンゾトリアゾール(HoBt;同仁化学製)、20mM N,N−ジイソプロピルエチルアミン(DIEA;和光純薬工業製)をそれぞれ調製した。これらのうち、フェロセンカルボン酸と塩酸ドーパミンは元濃度の1/4、またその他は元濃度の1/10となるよう混合してDMFで20mlに溶液調整した。この混合溶液を緩やかに攪拌しながら、室温で20時間反応を行った。反応溶液の一部を超純水で10倍に希釈し、この溶液を逆相クロマトグラフィ(HPLCシステム:Prominence(島津製作所製)、カラム:Chromolith RP−18e 100−3mm(メルク製)、移動相:A メタノール(和光純薬工業製)B 0.1%トリフルオロ酢酸水溶液(和光純薬工業製)、流速:2ml/min)を用いて解析した。紫外線検出器で波長210nmに設定し、インジェクション(0.02ml)後、1〜10minにおいてメタノールが100%となるようグラジエント溶出を行った結果、フェロセンカルボン酸と塩酸ドーパミンの複合体と考えられるピークを確認した。また、フェロセンカルボン酸および塩酸ドーパミンそれぞれ単独のピークは検出限界以下であった。これらのことから、フェロセンカルボン酸と塩酸ドーパミンの複合体の生成を確認した。
【0089】
反応溶液の残りを減圧下で10倍に濃縮し、反応濃縮溶液とした。例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%に調整し、そこに反応濃縮溶液を1/10量混合して、全量で1mlとした。この混合溶液を緩やかに攪拌しながら、室温で1時間反応を行った。反応後、沈殿成分を遠心分離(1500g、10min)して上澄みを回収し、この溶液1mlに対してバッファー交換用自然落下型カラムNAP−10(GEヘルスケアバイオサイエンス製)を用いて水1.5mlで回収して未反応のフェロセンカルボン酸と塩酸ドーパミンの複合体およびDMFを除去した。この溶液について可視光域(400nm)における波長の吸収スペクトルを紫外−可視光分光光度計(UV1600;島津製作所製)により確認したところ増大が認められたため、フェロセンカルボン酸と塩酸ドーパミンの複合体が結合したと考えられた。これらからフェロセンカルボン酸と塩酸ドーパミンの複合体結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0090】
例23:ドーパミン結合酸化チタン機能性分子複合体粒子への蛍光分子の結合2
例12で得られたドーパミン結合酸化チタン機能性分子複合体粒子を終濃度で0.3%、またCy7−NHS ester(GEヘルスケア バイオサイエンス製)を終濃度で1mMとなるように20mMリン酸緩衝液中(pH7.0)で混合し、3mlに調整した。この溶液を4℃、遮光下で24時間静置し、結合反応を行った。この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応物を除去した。この溶液について蛍光強度を、蛍光分光光度計(RF−5300PC;島津製作所製)を用いて励起波長743nmおよび蛍光波長767nmに設定して測定を行った結果、蛍光を示すことが確認された。これらのことから、酸化チタン複合体粒子へ蛍光分子であるCy7−NHS esterを結合した、蛍光分子結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0091】
例24:酸化チタン複合体粒子へのカテコール結合2
例8〜10で得られた、それぞれの酸化チタン複合体粒子を超純水にて固形成分1%とした。次に、カテコールを超純水にて、モル濃度で100mM、10mM、1mM、0.1mMに調整した。酸化チタン複合体粒子1%溶液に対してそれぞれのカテコール溶液を等量ずつ混合し、リン酸緩衝生理食塩水(PBS;pH7.4)で最終的に酸化チタン複合体粒子とカテコール溶液がそれぞれ終濃度で10倍希釈になるように調整した。調整した溶液をそれぞれ恒温器に移して40℃に設定し、3時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、それぞれの溶液について増大が認められたため、カテコールが結合したと考えられた。
【図面の簡単な説明】
【0092】
【図1】本発明の酸化チタン機能性分子複合体粒子の一例を示す図である。
【図2】例18において測定された、例17で得られた酸化チタン機能性分子複合体粒子の紫外線照射時間と、蛍光強度との関係を示す図である。
【符号の説明】
【0093】
1…酸化チタン粒子
2…水溶性高分子
3…機能性分子
【技術分野】
【0001】
本発明は、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子に対して、水溶性高分子を変質させることなく機能性分子を酸化チタン表面に結合させた酸化チタン機能性分子複合体粒子に関する。
【背景技術】
【0002】
酸化チタンはpH6前後に等電点を有すると言われている。このため、酸化チタン粒子は中性付近の水系溶媒中では凝集を生じてしまい、これを均一に分散させることは極めて難しい。そのため、酸化チタン粒子を水系の分散媒に均一に分散させるため、今まで種々の試みがなされてきた。
【0003】
PEG(ポリエチレングリコール)を分散剤として添加して、分散媒中における酸化チタン粒子の分散性を向上させることが知られている(特許文献1(特開平2−307524号公報)および特許文献2(特開2002−60651号公報)参照)。
【0004】
あるいは酸化チタン微粒子に、ポリアクリル酸等の親水性高分子を、カルボキシル基を介して結合させた、表面改質酸化チタン微粒子も知られている(特許文献3(WO2004/087577)参照)。この技術は、ポリアクリル酸等といったアニオン性ポリマーの使用を念頭としたものである。アニオン性ポリマーのもつカルボキシル基等の官能基により表面電荷を与え、それにより生体内環境に近い中性の生理食塩水においても安定した分散性を示し、かつ光触媒活性機能を有するものである。
【0005】
更に、酸化チタンに機能性を付与する検討がなされている。例えば、前記表面改質酸化チタン微粒子に対して、前記親水性高分子の結合に関与していないカルボキシル残基に、目的分子に対して特異的な結合能を有する分子を固定化した、分子識別能を有する二酸化チタン複合体が提案されている(特許文献4(特許第3835700号)参照)。この技術は、アニオン性ポリマーのもつカルボキシル基等の官能基により、分子が固定化されていても表面電荷を与え、安定した分散性を示すものである。一方で、官能基によって与えられる表面電荷は分散性に直接寄与しており、結合に関与していない残基に分子を固定化することで表面電荷は減少する。このことが固定化される分子の量等に対して制限を与える。
【0006】
【特許文献1】特開平2−307524号公報
【特許文献2】特開2002−60651号公報
【特許文献3】WO2004/087577号パンフレット
【特許文献4】特許第3835700号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明は、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子において、前記水溶性高分子を変質させることなく高い分散性を保持し、かつ、酸化チタン表面に結合した機能性分子により、酸化チタン表面付近での新たな機能性付与を実現した酸化チタン機能性分子複合体粒子およびその分散体の提供をその目的としている。
【課題を解決するための手段】
【0008】
本発明者らは、今般、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子の酸化チタン表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を介して機能性分子を結合させることにより、前記水溶性高分子を変質させることなく、新たな機能性付与を実現できるとの知見を得た。
【0009】
すなわち、本発明の酸化チタン機能性分子複合体粒子によれば、水溶性高分子を変質させることなく酸化チタン表面に対し機能性分子を結合させることにより、水溶性高分子による高い分散性を保持できる。このため、機能性分子の結合に際して自由度の高い分子設計が可能である。また、機能性分子を酸化チタン表面に結合することにより、酸化チタン表面付近において超音波や紫外線照射によって発生したラジカル種と機能性分子との反応性が高い。このため、機能性分子および機能性分子と相互作用を有する対象物との反応性を著しく向上することができる。前記対象物が癌細胞の場合にあっては、超音波や紫外線による癌の治療効果を著しく向上することができる。そのため、本発明の酸化チタン機能性分子複合体粒子は、患部に超音波を照射することにより行われる超音波癌治療を促進するための超音波癌治療促進剤としても利用可能である。
【0010】
そして、本発明の酸化チタン機能性分子複合体粒子は、
酸化チタン粒子と、
該酸化チタン粒子の表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を介して結合されてなる水溶性高分子を含んでなる、酸化チタン複合体粒子と、
該酸化チタン複合体粒子の表面に、さらに結合されてなる機能性分子を含んでなり、
前記機能性分子は、
(1)カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくとも一つの官能基を有し、
(2)a)炭素数6〜40よりなる飽和又は不飽和の鎖状炭化水素基、b)置換基を有するか有しない飽和又は不飽和の5〜6員環複素環式基、又はc)置換基を有するか有しない飽和又は不飽和の5〜6員環環状炭化水素水素基を含んでなる化合物であって、
前記官能基を介して前記酸化チタンと結合されてなる、酸化チタン機能性分子複合体粒子であることを特徴とするものである。
【0011】
また、本発明による分散液は、酸化チタン機能性分子複合体粒子と、該粒子が分散される溶媒とを含んでなるものである。
【発明の効果】
【0012】
本発明によれば、水溶性高分子を変質させることなく高い分散性を保持し、かつ、酸化チタン表面に結合した機能性分子により、酸化チタン表面付近での新たな機能性付与を実現した酸化チタン機能性分子複合体粒子およびその分散体を提供できる。
【発明を実施するための最良の形態】
【0013】
本発明による酸化チタン機能性分子複合体粒子は、酸化チタン粒子と、水溶性高分子と、機能性分子を含む。図1に、酸化チタン機能性分子複合体粒子の一例を示す。図1に示されるように、酸化チタン機能性分子複合体粒子は、酸化チタン粒子1の表面に水溶性高分子2および機能性分子3が結合されたものである。酸化チタン粒子1と、水溶性高分子2および機能性分子3との結合は、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基から選択される少なくとも1種の官能基を介して形成される。
【0014】
すなわち、これらの官能基は酸化チタンとの間で強固な結合を形成するため、酸化チタン粒子の高い触媒活性に関わらず分散性を保持できる。これらの官能基は酸化チタンとの間で強固な結合を形成するため、酸化チタン粒子の高い触媒活性にかかわらず水溶性高分子および機能性分子の結合を保持することが可能である。なお、本発明における結合形態は、体内における安全性の観点から、体内への投与後24〜72時間後に分散性が確保されている程度の結合形態であればよい。生理条件での分散が安定しており、かつ超音波や紫外線照射後も水溶性高分子の遊離が無く、正常細胞へのダメージが少ない点で、共有結合であるのが望ましい。
【0015】
カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基は、3官能シラノール基のような相互に三次元的に縮合重合して重合物で酸化チタン粒子の表面を覆い尽くしてしまう官能基とは異なり、官能基同士で重合することが無いため、図1に示されるように酸化チタン粒子の表面に剥き出しの部分を確保することができると考えられる。その結果、表面が重合体で覆われることによって起こりうる失活を抑制しつつ、酸化チタン粒子の触媒活性を十分に発揮させることができる。
【0016】
そして、酸化チタン粒子の表面に結合した水溶性高分子は、電荷あるいは水和の作用によって、酸化チタン粒子の分散が困難とされる中性付近の水系溶媒中であって酸化チタン機能性分子複合体粒子を高度に分散させることができる。機能性分子を、酸化チタン粒子の表面に結合した水溶性高分子に対して導入する方法については公知である。このような場合は、水溶性高分子と機能性分子を化学結合するために、水溶性高分子は反応性の高い極性基を含んでなることが必要である。この水溶性高分子に含まれる極性基は、機能性分子が結合されると失われる。このことにより、水溶性高分子の極性自体に変化が生じる。つまり、酸化チタン粒子の表面に結合した水溶性高分子のもつ電荷あるいは水和の作用によって分散しているバランスが、機能性分子の結合前後において変化すると考えられる。この酸化チタン粒子の表面に結合した水溶性高分子の変質に伴う電荷あるいは水和のバランスをうまくコントロールすることでのみ達成しうる。一方、本発明における酸化チタン粒子の表面に結合した機能性分子については、水溶性高分子を変質させることなく結合させることにより、水溶性高分子による高い分散性を保持できる。このため、水溶性高分子の変質によって生じる分散性の変化を考慮することなく、機能性分子の結合に際して自由度の高い分子設計が可能である。
【0017】
本発明の酸化チタン機能性分子複合体粒子によれば、前記機能性分子として酸化チタン表面に対し、疎水性や細胞認識性の分子を導入することで、水溶性高分子を変質させることなく高い分散性を保持することができる。さらに、酸化チタン表面付近におけるこれら分子と細胞との高い相互作用を発揮できる。細胞認識性の分子を酸化チタン粒子の表面に結合しているので、酸化チタン表面付近において超音波や紫外線照射によって発生したラジカル種との反応速度を向上させ、殺対象が癌細胞の場合にあっては、超音波や紫外線による癌の治療効果を著しく向上することができる。そのため、本発明の酸化チタン機能性分子複合体粒子は、投与後に選択的に患部に取り込まれ、その後に患部に超音波を照射することにより行われる超音波癌治療を促進するための、細胞認識性を有する超音波癌治療促進剤としても利用可能である。
【0018】
また、本発明の酸化チタン機能性分子複合体粒子によれば、前記機能性分子として酸化チタン表面に対し、光応答性の分子や放射性物質を導入することで、水溶性高分子を変質させることなく高い分散性を保持することができる。さらに、酸化チタン表面を直接的にこれらの分子を標識することができる。特に、放射性物質に関しては、安全性の観点から取り扱いに注意が必要であるが、水溶性高分子により水系溶媒中で分散させた酸化チタン複合体粒子に対して、酸化チタン表面に放射性物質を結合した後に、未結合の放射性物質を適当な方法で分離除去するだけの、簡易でかつ少ない工程によって粒子の標識ができる。このため、放射性物質が外部に広がる機会が少なく、安全性の面において優れる。また、これを適当な機器により測定することで粒子のイメージングや定量の測定が可能である。そのため、本発明の酸化チタン機能性分子複合体粒子は、体内に投与後に体内動態を確認するためのトレーサー実験用材料や、患部に超音波や光を照射することにより行われる診断および治療のための医療用材料としても利用可能である。
【0019】
さらに、本発明の酸化チタン機能性分子複合体粒子によれば、前記機能性分子として酸化チタン表面に対し、ラジカル応答性の分子を導入することで、水溶性高分子を変質させることなく高い分散性を保持することができる。さらに、酸化チタン表面付近において超音波や紫外線照射によって発生したラジカル種との反応速度を向上させ、高い反応性を発揮することができる。前記ラジカル応答性の分子が、ラジカル種との反応により蛍光性や発光性を示すものを用いれば、これを適当な機器により測定することで粒子のイメージングやラジカル種発生量の測定が可能である。そのため、本発明の酸化チタン機能性分子複合体粒子は、患部に超音波や光を照射することにより行われる診断および治療のための医療用材料としても利用可能である。
【0020】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、酸化チタン粒子の表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を介して結合されてなることが好ましい。これによって、酸化チタン粒子の表面に強固に結合することが可能であり、また、3官能シラノール基のような相互に三次元的に縮合重合して重合物で酸化チタン粒子の表面を覆い尽くしてしまう官能基とは異なり、官能基同士で重合することが無いため、図1に示されるように酸化チタン粒子の表面に剥き出しの部分を多く確保することができると考えられる。その結果、表面が重合体で覆われることによって起こりうる失活を抑制しつつ、酸化チタン粒子の触媒活性を十分に発揮させることができる。
【0021】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、酸化チタン機能性分子複合体粒子を水系溶媒中で分散させることができれば特に限定されないが、電荷を有するものとしては、アニオン性またはカチオン性を有する水溶性高分子、また、電荷を有さずに水和によって分散性を与えるものとしてはノニオン性を有する水溶性高分子が挙げられ、これらの少なくとも一種を含んでなる。
【0022】
本発明の好ましい態様によれば、前記水溶性高分子は重量平均分子量2000〜100000である。水溶性高分子の重量平均分子量はサイズ排除クロマトグラフィーを用いて求めた値である。前記分子量をこの範囲とすることで、水溶性高分子のもつ電荷あるいは水和の作用によって、酸化チタン粒子の分散が困難とされる中性付近の水系溶媒中であって酸化チタン機能性分子複合体粒子を高度に分散させることができる。
より好ましい範囲は5000〜100000であり、さらに好ましくは5000〜40000である。
【0023】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、アニオン性を有する水溶性高分子として酸化チタン機能性分子複合体粒子を水系溶媒中で分散させることができればいずれも使用可能であるが、複数のカルボキシル基を有するものとしては、例えばカルボキシメチルデンプン、カルボキシメチルデキストラン、カルボキシメチルセルロース、ポリカルボン酸類、およびカルボキシル基単位を有する共重合体(コポリマー)などが挙げられる。具体的には、水溶性高分子の加水分解性および溶解度の観点から、ポリアクリル酸、ポリマレイン酸等のポリカルボン酸類、およびアクリル酸/マレイン酸やアクリル酸/スルフォン酸系モノマーの共重合体(コポリマー)がより好適に使用され、さらに好ましくはポリアクリル酸である。
【0024】
アニオン性を有する水溶性高分子として、ポリアクリル酸を用いる場合、分散性の観点からポリアクリル酸の重量平均分子量は2000〜100000であるのが好ましく、より好ましくは5000〜40000であり、さらに好ましくは5000〜20000である。
【0025】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、カチオン性を有する水溶性高分子として酸化チタン機能性分子複合体粒子を水系溶媒中で分散させることができればいずれも使用可能であるが、複数のアミノ基を有するものとしては、例えばポリアミノ酸、ポリペプチド、ポリアミン類、およびアミン単位を有する共重合体(コポリマー)などが挙げられる。具体的には、水溶性高分子の加水分解性および溶解度の観点から、ポリエチレンイミン、ポリビニルアミン、ポリアリルアミン等のポリアミン類がより好適に使用され、さらに好ましくはポリエチレンイミンである。
【0026】
カチオン性を有する水溶性高分子として、ポリエチレンイミンを用いる場合、分散性の観点からポリエチレンイミンの重量平均分子量は2000〜100000であるのが好ましく、より好ましくは5000〜40000であり、さらに好ましくは5000〜20000である。
【0027】
本発明の好ましい態様によれば、本発明に用いる水溶性高分子は、ノニオン性を有する水溶性高分子として酸化チタン機能性分子複合体粒子を水系溶媒中で分散させることができればいずれも使用可能であるが、好ましくは水酸基および/またはポリオキシアルキレン基を有する高分子が挙げられる。そのような水溶性高分子の好ましい例としては、ポリエチレングリコール(PEG)、ポリビニルアルコール、ポリエチレンオキシド、デキストランあるいはそれらを含有するコポリマーが挙げられ、より好ましくはポリエチレングリコール(PEG)およびデキストランであり、さらに好ましくはポリエチレングリコールである。
【0028】
ノニオン性を有する水溶性高分子として、ポリエチレングリコールを用いる場合、分散性の観点からポリエチレングリコールの重量平均分子量は2000〜100000であるのが好ましく、より好ましくは5000〜40000である
【0029】
本発明の好ましい態様によれば、本発明に用いる機能性分子は、酸化チタン粒子表面に結合してなるが、該機能性分子はカルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくともひとつの官能基を有する。
【0030】
本発明の好ましい態様によれば、本発明に用いる機能性分子は、a)炭素数6〜40よりなる飽和又は不飽和の鎖状炭化水素基、b)置換基を有するか有しない飽和又は不飽和の5〜6員環複素環式基、又はc)置換基を有するか有しない飽和又は不飽和の5〜6員環環状炭化水素基を含んでなる化合物である。
【0031】
上記炭素数よりなる機能性分子は、前記水溶性高分子と比べて分子の大きさが小さい。また、機能性分子は酸化チタン表面に結合してなる。このため、本発明の酸化チタン機能性分子複合体粒子において、外殻に水溶性高分子が位置するのに対し、より内部の位置に機能性分子を有する構造をとる。該外殻は酸化チタン機能性分子複合体粒子の分散性に対する影響が最も大きい。すなわち外殻に位置する水溶性高分子に対して、内部に位置する機能性分子が分散性に与える影響は小さくなり、好適に用いることが出来る。
【0032】
また、上記炭素数よりなる機能性分子は、機能性分子は酸化チタン粒子表面に結合してなるため、酸化チタン表面付近において超音波や紫外線照射によって発生したラジカル種と機能性分子との反応性が高く、機能性分子および機能性分子と相互作用を有する対象物との反応性を著しく向上することができ、好適に用いることが出来る。
【0033】
本発明の好ましい態様によれば、本発明に用いる機能性分子は、特にその機能は限定されないが、疎水性、細胞認識性、光応答性、放射性、ラジカル応答性、および医薬の他、抗体等の生体分子や他の機能性分子等とのリンカー、などが挙げられる。
【0034】
前記酸化チタン機能性分子複合体粒子に結合された機能性分子の量は、前記酸化チタン粒子の質量あたり、1.0×10−1〜1.0×10−5 質量部/酸化チタン粒子の質量部であり、好ましくは1.0×10−2〜1.0×10−5 質量部/酸化チタン粒子の質量部であることが好ましい。この範囲であると、酸化チタン機能性分子複合体粒子は生体内環境に近い、10%タンパク質溶液を溶媒としても分散することができるため、好適に用いることができる。
【0035】
そのような機能性分子の例としては、芳香族化合物やアルキル構造をもつ分子等が考えられ、より具体的には、ベンゼン環をもつ分子として、カテコール、メチルカテコール、ターシャリーブチルカテコールドーパ、ドーパミン、ジヒドロキシフェニルエタノール、ジヒドロキシフェニルプロピオン酸、ジヒドロキシフェニル酢酸等の、分子内にカテコールの構造を有する、カテコール類などがあげられる。また、他の環状分子として、フェロセン、フェロセンカルボン酸、アスコルビン酸、ジハイドロキシシクロブテンジエン、アリザリン、ビナフタレンジオール等が好適に使用できる。さらに、アルキル構造をもつ分子としては、ヘキシル基、オクチル基、ラウリル基、パルミチル基、ステアリル基などのアルキル基を有する分子があげられる。あるいは、ヘキセニル基、オクテニル基、オレイル基などのアルケニル基、または、シクロアルキル基などの飽和又は不飽和脂肪族炭化水素基をもつものなどがあげられる。
【0036】
また、機能性分子の他の例としては、細胞認識性においては結合活性部位を含むペプチドやアミノ酸配列であってもよい。より具体的には5−アミノレブリン酸、メチオニン、システイン、グリシン等があげられる。あるいは、糖鎖を含んでもよい。さらに、結合性を有する核酸を含んでいても良い。核酸としては、特に制限はなく、DNA、RNAの他、アプタマー等の核酸塩基、PNA等のペプチド核酸を用いることもできる。
【0037】
また、機能性分子の他の例としては、光応答性においては蛍光性分子を含んでなるものを用いることが出来る。
【0038】
また、機能性分子の他の例としては、放射性においては同位体元素を含む化合物が挙げられ、例えば14Cを有する14C標識カテコールなどが好適に用いられる。
【0039】
また、機能性分子の他の例としては、ラジカル応答性においてはラジカルと特異的な反応性を示す化学発光性分子や蛍光性分子、またはスピントラップ剤を含んでなることが挙げられる。より具体的には、化学発光性分子や蛍光性分子として、ルミノール、海ホタルルシフェリン類縁体、シュウ酸エステル、アクリジニウム、パラヒドロキシフェニルフルオレセイン、パラアミノフェニルフルオレセイン、ジヒドロローダミン123、ジヒドロローダミン6G、トランス‐1‐(2’‐メトキシビニル)ピレン、ジヒドロキシエチジウム、葉酸、(2’,7’−dichlorodihydrofluorescein diacetate,succinimidyl ester(インビトロジェン)、)、5−or6−(N−Succinimidyloxycarbonyl)−3’,6’−O,O’−diacetylfluorescein、Cy色素(アマシャムバイオサイエンス社製)、プテリンなどであり、スピントラップ剤としては、4,6−Tri−tert−butylnitrosobenzene、2−Methyl−2−nitrosopropane、3,3,5,5−Tetramethyl−1−pyrroline N−Oxide、5,5−Dimethyl−1−pyrroline N−Oxide、5−(Diethylphosphono)−5−methyl−1−pyrroline N−Oxide、N−tert−Butyl−alpha−(4−pyridyl−1−oxide)nitrone、N−tert−Butyl−alpha−phenylnitrone、Nitrosobenzene、5,5−Dimethyl−1−pyrroline N−oxide、4−Hydroxy−2,2,6,6−tetramethylpiperidinyloxy, free radical、2−(5,5−Dimethyl−2−oxo−2λ5−[1,3,2]dioxaphosphinan−2−yl)−2−methyl−3,4−dihydro−2H−pyrrole 1−oxide、5−Diethoxyphosphoryl−5−methyl−1−pyrroline−N−oxideなどである。
【0040】
また、機能性分子の他の例としては、抗がん剤を用いる場合は、フルオロウラシル、ゲムシタビン、メソトレキセート、シクロホスファミド、塩酸ダウノルビシン、アドリアマイシン、塩酸イダルビシン、ブレオマイシン、マイトマイシン、アクチノマイシン、ビンクリスチン、シスプラチン、カルボプラチン、エトポシド、ネダプラチン、パクリタキセル、ドセタキセル、塩酸イリノテカン等から少なくとも一つが利用できる。また、ペニシリン系、マクロライド系、ニューキノロン系、テトラサイクリン系等の抗菌剤や、ラミブジン、ネルフィナビル、インジナビ、サキナビル、インターフェロン、アマンタジン、アシクロビル等のウイルス治療薬、そして、ニュープロレリン、ブセレリン、ゴセレリン、トリプトレリン、ナファレリン等のホルモン疾患治療薬、イブプロフェン等の鎮痛薬等を含んでなるものが挙げられる。
【0041】
本発明の好ましい態様によれば、本発明に用いる機能性分子は、上記機能を与える分子と酸化チタン表面に結合する官能基がリンカーを介して結合してなる分子であってもなんら問題はない。
【0042】
本発明の好ましい態様によれば、前記リンカーは、例えば生体分子同士を異なる官能基同士で結合する際に用いられるヘテロバイファンクショナルなクロスリンカーなどが考えられる。リンカーの具体例としては、N−ヒドロキシスクシンイミド、N−[α−マレイミドアセトキシ]スクシンイミドエステル、N−[β−マレイミドプロピルオキシ]スクシンイミドエステル、N−β−マレイミドプロピオン酸、N−[β−マレイミドプロピオン酸]ヒドラジド・TFA、1−エチル−3−[3−ジメチルアミノプロピル]カルボジイミドヒドロクロリド、N−ε−マレイミドカプロン酸、N−[ε−マレイミドカプロン酸]ヒドラジド、N−[ε−マレイミドカプロイルオキシ]スクシンイミドエステル、N−[γ−マレイミドブチリルオキシ]スクシンイミドエステル、N−κ−マレイミドウンデカン酸、N−[κ−マレイミドウンデカン酸]ヒドラジド、スクシンイミジル−4−[N−マレイミドメチル]−シクロヘキサン−1−カルボキシ−[6−アミドカプロエート]、スクシンイミジル6−[3−(2−ピリジルジチオ)−プロピオンアミド]ヘキサノエート、m−マレイミドベンゾイル−N−ヒドロキシスクシンイミドエステル、4−[4−N−マレイミドフェニル]酪酸ヒドラジド・HCl、3−[2−ピリジルジチオ]プロピオニルヒドラジド、N−[p−マレイミドフェニル]イソシアネート、N−スクシンイミジル[4−アジドフェニル]−1,3’−ジチオプロピオネート、N−スクシンイミジル S−アセチルチオアセテート、N−スクシンイミジルS−アセチルチオプロピオネート、スクシンイミジル 3−[ブロモアセトアミド]プロピオネート、N−スクシンイミジル ヨードアセテート、N−スクシンイミジル[4−イオドアセチル]アミノベンゾエート、スクシンイミジル4−[N−マレイミドメチル]−シクロヘキサン−1−カルボキシレート、スクシンイミジル4−[p−マレイミドフェニル]ブチレート、スクシンイミジル6−[(β−マレイミドプロピオンアミド)ヘキサノネート]、4−スクシンイミジルオキシカルボニル−メチル−α[2−ピリジルジチオ]トルエン、N−スクシンイミジル3−[2−ピリジルジチオ]プロピオネート、N−[ε−マレイミドカプロイルオキシ]スルホスクシンイミドエステル、N−[γ−マレイミドブチリルオキシ]スルホスクシンイミドエステル、N−[κ−マレイミドウンデカノイルオキシ]−スルホスクシンイミドエステル、スルホスクシンイミジル−6−[α−メチル−α−(2−ピリジルジチオ)トルアミド]ヘキサノネート、スルホスクシンイミジル6−[3’−(2−ピリジルチチオ)−プロピオンアミド]ヘキサノネート、m−マレイミドベンゾイル−N−ヒドロキシスルホ−スクシンイミドエステル、スルホスクシンイミジル[4−ヨードアセチル]アミノベンゾエート、スルホスクシンイミジル4−[N−マレイミドメチル]−シクロヘキサン−1−カルボキシレート、スルホスクシンイミジル4−[p−マレイミドフェニル]ブチレート,N−[ε−トリフルオロアセチルカプロイルオキシ]スクシンイミドエステル、クロロトリアジン、ジクロロトリアジン、トリクロロトリアジン等が挙げられる。また、リンカーはさらに他のリンカー同士が結合されるような複数種類のリンカーから構成されてもよい。
【0043】
本発明の好ましい態様によれば、酸化チタン粒子と水溶性高分子およびまたは機能性分子との結合に用いられるジオール基としては、エンジオール基であることが好ましく、より好ましくはα−ジオール基である。これらの官能基を用いることで、優れた酸化チタン粒子への結合を実現することができる。
【0044】
本発明の好ましい態様によれば、酸化チタン粒子が、アナターゼ型酸化チタンまたはルチル型酸化チタンであるのが好ましい。紫外線や超音波の照射による触媒活性を利用する場合にはアナターゼ型酸化チタンが好ましく、化粧料のように高い屈折率等の性質を利用する場合にはルチル型酸化チタンが好ましい。
【0045】
本発明の好ましい態様によれば、本発明に用いる酸化チタン機能性分子複合体粒子は20〜200nmの粒子径を有し、より好ましくは50〜200nmであり、さらに好ましくは50〜150nmである。この粒径範囲であると、癌腫瘍への到達を目的として患者の体内に投与されると、ドラッグデリバリーシステムのように、Enhanced Permeability and Retention Effect(EPR効果)により癌組織に効率的に到達して蓄積される。そして、上述の通り、400kHz〜20MHzの超音波や紫外線の照射によりラジカル種の特異的生成が起こる。したがって、超音波や紫外線の照射により高い効率で癌組織を殺傷することができる。
【0046】
本発明の別の好ましい態様によれば、酸化チタン機能性分子複合体粒子が50nm未満(例えば数nm)の粒子径を有する場合、見かけ上のサイズを大きくしてEPR効果を得ることもできる。すなわち、50〜150nmの粒子径を有する二次粒子の形態を有するように半導体粒子同士を多官能リンカーで連結する等の方法にて結合されることで、EPR効果により高い癌治療効果を実現することができる。本発明のさらに別の好ましい態様によれば、EPR効果を利用するため、リポソームのような薬剤封入体の中に、酸化チタン機能性分子複合体粒子を包摂させることもできる。
【0047】
本発明において半導体粒子の粒子径は、動的光散乱法により測定することができる。具体的には、粒径分布測定装置(ゼータサイザーナノ、マルバーンインスツルメント社製)を用いて、キュミュラント解析で得られる、Z−average sizeで示される値として得ることができる。
【0048】
本発明に使用可能な酸化チタン機能性分子複合体粒子は、単一種類の酸化チタン複合体粒子のみならず、複数種類の半導体粒子の混合物あるいは複合物も包含する。具体例としては、酸化チタン粒子と酸化鉄ナノ粒子との複合物、酸化チタン粒子と白金との複合物、およびシリカ被覆された酸化チタン等が挙げられる。
【0049】
本発明の好ましい態様によれば、酸化チタン機能性分子複合体粒子が、溶媒に分散されて分散液の形態とされてなるのが好ましい。これにより、酸化チタン機能性分子複合体粒子を、点滴、注射、塗布等の種々の方法により、患者の体内に効率的に投与することができる。分散液の液性は限定されず、pH3〜10の広範囲にわたって高い分散性を実現可能である。なお、体内投与における安全性の観点から、分散液は、pH5〜9であるのが好ましく、より好ましくは5〜8、特に中性の液性を有するのが好ましい。また、本発明の好ましい態様によれば、溶媒は水系溶媒であるのが好ましく、さらに好ましくはpH緩衝液または生理食塩水である。水系溶媒の好ましい塩濃度は2M以下であり、体内投与における安全性の観点から200mM以下がより好ましい。酸化チタン機能性分子複合体粒子は分散体に対して、0.001〜1質量%以下含有されることが好ましく、より好ましくは0.001〜0.1質量%である。この範囲内であれば、投与後、24〜72時間後に患部(腫瘍)に効果的に粒子を蓄積させることが可能となる。すなわち、患部(腫瘍)に粒子濃度が蓄積しやすくなるとともに、血中での粒子の分散性も確保されて凝集隗が形成しにくくなるため、投与後に血管の閉塞などの二次的弊害を招くおそれも無い。
【0050】
本発明の酸化チタン機能性分子複合体粒子は、点滴、注射、塗布等の種々の方法により、患者の体内に投与することができる。特に静脈または皮下による投与経路で用いられる場合は、粒子の大きさによるEPR効果と、血中の滞留性を利用して、所謂DDS的な治療により、患者の負担を軽減する観点から好ましい。そして、体内に投与された酸化チタン機能性分子複合体粒子は、ドラッグデリバリーシステムのように、癌組織に到達して蓄積される。
【0051】
本発明の酸化チタン機能性分子複合体粒子は、超音波あるいは紫外線の照射を受け、該照射により細胞毒となることができる。この酸化チタン機能性分子複合体粒子は、体内に投与され、超音波照射を受け、該照射により細胞毒となることで、細胞を殺傷することができるが、体内に限らず、試験管内においても殺対象である細胞を殺傷することができる。本発明において、殺対象は特に限定されないが、癌細胞であるのが好ましい。すなわち、本発明による酸化チタン機能性分子複合体粒子によれば、超音波や紫外線の照射により活性化して癌細胞を殺傷することができる。
【0052】
本発明の好ましい態様によれば、酸化チタン機能性分子複合体粒子が蓄積された癌組織に超音波処理が行われる。使用する超音波の周波数は、400kHz〜20MHzが好ましく、より好ましくは600kHz〜10MHz、さらに好ましくは1MHz〜10MHzである。超音波の照射時間は治療対象である癌組織の位置および大きさを考慮して適宜決定されるべきであり、特に限定されない。こうして、患者の癌組織を超音波により高い効率で殺傷して、高い癌治療効果を実現することができる。超音波は生体内の深部に外部より到達させることが可能で、本発明の酸化チタン機能性分子複合体粒子と併せて用いることにより、非侵襲の状態で生体内深部に存在するような患部やターゲット部位の治療が実現できる。さらに、患部やターゲット部位に本発明の酸化チタン複合体粒子が集積することにより、周辺の正常細胞に悪影響を及ぼさない程度の微弱な超音波で本発明の酸化チタン複合体粒子を集積させた局所のみに作用させることができる。
【0053】
ところで、これらの半導体粒子が超音波の照射により活性化して細胞を殺傷する効果は、超音波照射によりラジカル種を生成させることにより得ることができる。すなわち、これらの半導体粒子が与える生物的殺傷効果はラジカル種の質的・量的な増加にあると考えられる。その理由は以下の通り推察されるが、以下の理由はあくまで仮説であって、本発明は何ら下記説明に限定されるものではない。すなわち、超音波照射のみでは系中には過酸化水素とヒドロキシルラジカルが発生するが、本発明者らの知見によれば、酸化チタンなどの半導体粒子の存在下では、過酸化水素及びヒドロキシルラジカルの生成が促進される。また、これら半導体粒子の存在下、特に酸化チタンの存在下では、スーパーオキサイドアニオンと一重項酸素の生成が促進されるように見受けられる。これらラジカル種の特異的生成は、ナノメートルオーダーの微粒子を用いた場合、超音波照射時の周波数が400kHz〜20MHzの範囲、好ましくは600kHz〜10MHzの範囲、より好ましくは1MHz〜10MHzの範囲で顕著に観察される現象であると考えられる。
【実施例】
【0054】
以下に実施例を示す。特に断りのない限り、「%」は質量%を意味する。
【0055】
例1:ポリエチレングリコール結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(アマシャム・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、分散液0.1mlを石英測定セルに仕込み、ゼータサイザーナノZS(シスメックス社製)を用いて、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は20.2nmであった。蒸発皿を用いて、50℃下で酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0056】
次に、ポリオキシエチレン−モノアリル−モノメチルエーテルと無水マレイン酸の共重合体(平均分子量;33659−日本油脂製)1gに水5mlを添加し加水分解後得られた溶液と1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(同仁化学製)を、超純水を用いてそれぞれ濃度が50mg/mlおよび50mMとなるように混合に調整した。調整した溶液に4−アミノサリチル酸(分子量Mn=153.14:MP Biomedicals,Inc.)を濃度50mMになるよう混合して4mlの溶液を得た。この溶液を室温にて72時間振とう撹拌して反応させた。反応後、得られた溶液を透析膜であるスペクトラ/ポア CE 透析用チューブ(分画分子量=3500、Spectrum Laboratories,Inc.)に移して超純水4lに対して室温にて24時間で透析を行った。透析後にすべてナスフラスコに移し替えて一晩凍結乾燥し、得られた粉末に4mlのジメチルホルムアミド(DMF:和光純薬工業)を添加して混合し、4−アミノサリチル酸結合ポリエチレングリコール溶液とした。
【0057】
次にDMFを用いて4−アミノサリチル酸結合ポリエチレングリコール溶液が終濃度20(vol/vol)%、先に得られたアナタ−ゼ型二酸化チタンゾルが終濃度で固形成分0.25%となるよう調整し、2.5mlの反応溶液とした。この反応溶液を水熱反応容器のHU−50(三愛科学製)に溶液を移し変え、80℃で6時間加熱反応を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水1mlを添加して酸化チタン複合体粒子であるポリエチレングリコール結合二酸化チタン微粒子の分散液とした。さらに、HPLC:AKTA purifier(GEヘルスケアバイオサイエンス製)、カラム:HiPrep 16/60 Sephacryl S−300HR(GEヘルスケアバイオサイエンス製)、移動相:リン酸塩緩衝溶液(pH7.4)、流速:0.3ml/min]に付したところ、素通り画分にUV吸収のピークが確認され、この画分を回収した。この分散液を蒸留水で0.05(wt/vol)%水溶液に希釈して72時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合二酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は32.7nmであった。
【0058】
例2:ポリアクリル酸結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(アマシャム・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸化チタンゾルを100ml容のバイアル瓶に入れ、200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、ゼータサイザーナノZS(シスメックス社製)を用いて、石英測定セルに分散液0.1mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は20.2nmであった。蒸発皿を用いて、50℃下で酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0059】
この酸性酸化チタンゾル0.6mlをジメチルホルムアミド(DMF)で20mlとなるよう調整して分散させ、平均分子量5000のポリアクリル酸(和光純薬社製)0.3gを溶解したDMF10mlを添加後、攪拌して混合した。水熱反応容器のHU−50(三愛科学社製)に溶液を移し変え、150℃で5時間反応を行った。反応終了後、反応容器温度が50℃以下になるまで反応液を冷却し、反応液に対して2倍量のイソプロパノールを添加した。室温で30分間静置後、2000gにて15min遠心分離により沈殿を回収した。回収した沈殿表面をエタノールで洗浄後、1.5mlの水を加えて酸化チタン複合体粒子であるポリアクリル酸結合酸化チタン微粒子の分散液を得た。この分散液を蒸留水で100倍に希釈し、分散粒径およびゼータ電位を動的光散乱法により測定した。この測定は、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリアクリル酸結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は53.6nm、ゼータ電位は−45.08mVであった。
【0060】
例3:ポリエチレンイミン結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(アマシャム・ファルマシア・バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸化チタンゾルを100ml容のバイアル瓶に入れ、200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、12Nの硝酸で1000倍に希釈した後、ゼータサイザーナノZS(シスメックス社製)を用いて、石英測定セルに分散液0.1mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は20.2nmであった。
【0061】
得られた酸化チタンゾル3mlを20mlのジメチルホルムアミド(DMF)に分散させ、平均分子量10000のポリエチレンイミン(和光純薬社製)450mgを溶解したDMF10mlを添加後、攪拌して混合した。水熱反応容器のHU−50(三愛科学社製)に溶液を移し変え、150℃で5時間反応を行った。反応終了後、反応容器温度が50℃以下になるまで反応液を冷却し、反応液に対して2倍量のアセトンを添加した。室温で30分間静置後、2000gにて15min遠心分離により沈殿を回収した。回収した沈殿表面をエタノールで洗浄後、1.5mlの水を加えて酸化チタン複合体粒子であるポリエチレンイミン結合酸化チタン微粒子の分散液を得た。この分散液を蒸留水で100倍に希釈し、分散粒径およびゼータ電位を動的光散乱法により測定した。この測定は、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレンイミン結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は57.5nm、ゼータ電位は47.5mVであった。
【0062】
例4:酸化チタン複合体粒子へのカテコール結合
例1〜3で得られた、それぞれの酸化チタン複合体粒子を超純水にて固形成分1%とした。次に、カテコールを超純水にて、モル濃度で100mM、10mM、1mM、0.1mMに調整した。酸化チタン複合体粒子1%溶液に対してそれぞれのカテコール溶液を等量ずつ混合し、リン酸緩衝生理食塩水(PBS;pH7.4)で最終的に酸化チタン複合体粒子とカテコール溶液がそれぞれ終濃度で10倍希釈になるように調整した。調整した溶液をそれぞれ恒温器に移して40℃に設定し、3時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、それぞれの溶液について増大が認められたため、カテコールが結合したと考えられた。また、反応前と反応後の溶液をキャピラリ電気泳動にて以下の条件で付したところ、フォトダイオードアレイ検出器によって吸収波長214nmのピークを確認することによりカテコールの変化量を求めた。
・装置:P/ACE MDQ(ベックマンコールター製)
・キャピラリ:フューズドシリカキャピラリ 50μm i.d × 67cm(effective length 50cm)(ベックマンコールター製)
・移動相:50mM 酢酸ナトリウム緩衝溶液(pH4.8)
・電圧:25kV
・温度:20℃
求めた変化量よりカテコールは酸化チタン粒子の質量あたり5.0×10−3〜1.0×10−4 カテコール−g/酸化チタン粒子−gであった。
さらに、この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケアバイオサイエンス製)を用いて水3.5mlで回収して未反応のカテコールを除去した。カテコールの除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのカテコールがないことを確認した。これらからカテコール結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0063】
例5:酸化チタン複合体粒子への14C標識カテコール結合
例4において、カテコールの代わりに14C標識カテコール(14C標識カテコール終濃度1mM)を使い、酸化チタン複合体粒子として例1において得られたポリエチレングリコール結合酸化チタン微粒子のみを用いた以外は、まったく同じ手順で酸化チタン複合体粒子への14C標識カテコール結合を行った。その結果、14C標識カテコールの結合と、フリー14C標識カテコールの除去を確認した。また、それぞれの溶液を超純水を用いて、固形成分0.01%に希釈した後、ゼータサイザーナノZS(シスメックス社製)を用いて、例1と同様に平均分散粒径の測定を行った。その結果、分散粒径は35.7nmであった。これらから、14C標識カテコール結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0064】
例6:カテコール結合酸化チタン機能性分子複合体粒子の分散性
例4において得られたポリエチレングリコール結合酸化チタン微粒子を用いたカテコール結合酸化チタン機能性分子複合体粒子を、それぞれ10%血清を含むRPMI1640培地(GIBCO製)に対して、固形成分0.01%になるように添加し、96時間、室温にて静置した。その後、ゼータサイザーナノZSにて例1と同様に平均分散粒径の測定を行った。結果を表1に示す。表1より、それぞれのカテコール結合酸化チタン機能性分子複合体粒子は20〜200nmの範囲における粒径をもつことが確認された。
【0065】
【表1】

【0066】
例7:カテコール結合酸化チタン機能性分子複合体粒子の疎水性
例1〜例4において得られた酸化チタン複合体粒子およびカテコール結合酸化チタン機能性分子複合体粒子の分散液を、それぞれよく攪拌して混合した。1分後、各溶液の液面における気泡の状態を目視にて確認したところ、酸化チタン複合体粒子の分散液に比べて、カテコール結合酸化チタン機能性分子複合体粒子の分散液は気泡の形成が有意に多いことが確認され、このことから、カテコール結合によってカテコール結合酸化チタン機能性分子複合体粒子は疎水性が強まっているものと考えられた。
【0067】
例8:ポリエチレングリコール結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(GEヘルスケア バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸性酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸性酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、分散液0.1mlを石英測定セルに仕込み、ゼータサイザーナノZS(シスメックス社製)を用いて、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は38.4nmであった。蒸発皿を用いて、50℃下で酸性酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0068】
次に、ポリオキシエチレン−モノアリル−モノメチルエーテルと無水マレイン酸の共重合体(平均分子量15000;AM1510K−日本油脂製)0.5gに超純水4.5mlを添加しポリエチレングリコール溶液とした。次に、超純水を用いて1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC;同仁化学製)を濃度400mMになるよう調製し、EDC溶液とした。ポリエチレングリコール溶液1mlに超純水0.25mlと0.75N水酸化ナトリウム水溶液0.1ml、およびEDC溶液0.5mlを混合調製した。調製した溶液にドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を濃度15mMになるよう混合して2mlの溶液を得た。この溶液を40℃にて2時間振とう撹拌して反応させた。反応後、得られた溶液を透析膜であるスペクトラ/ポア CE 透析用チューブ(分画分子量=3500、Spectrum Laboratories,Inc.)に移して超純水4lに対して室温にて24時間で透析を行った。透析後にすべてナスフラスコに移し替えて一晩凍結乾燥し、得られた粉末に4mlのジメチルホルムアミド(DMF:和光純薬工業)を添加して混合し、ドーパミン結合ポリエチレングリコール溶液とした。
【0069】
次にDMFを用いてドーパミン結合ポリエチレングリコール溶液が終濃度20(vol/vol)%、先に得られた酸性酸化チタンゾルが終濃度で固形成分0.25%となるよう調製し、5mlの反応溶液とした。この反応溶液を水熱反応容器のHU−50(三愛科学製)に溶液を移し替え、150℃で6時間加熱反応を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水1.25mlを添加してポリエチレングリコール結合酸化チタン微粒子の分散液とした。この分散液を蒸留水で0.05(wt/vol)%水溶液に希釈して24時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は57.3nm、ゼータ電位は3.41mVであった。
【0070】
例9:ポリエチレングリコール結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(GEヘルスケア バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸性酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸性酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、分散液0.1mlを石英測定セルに仕込み、ゼータサイザーナノZS(シスメックス社製)を用いて、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は38.4nmであった。蒸発皿を用いて、50℃下で酸性酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0071】
次に、ポリオキシエチレン−モノアリル−モノメチルエーテルと無水マレイン酸の共重合体(平均分子量30000;AM2090P−日本油脂製)0.5gに超純水4.5mlを添加しポリエチレングリコール溶液とした。次に、超純水を用いて1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC;同仁化学製)を濃度400mMになるよう調製し、EDC溶液とした。ポリエチレングリコール溶液1mlに超純水0.25mlと0.75N水酸化ナトリウム水溶液0.1ml、およびEDC溶液0.5mlを混合調製した。調製した溶液にドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を濃度15mMになるよう混合して2mlの溶液を得た。この溶液を40℃にて2時間振とう撹拌して反応させた。反応後、得られた溶液を透析膜であるスペクトラ/ポア CE 透析用チューブ(分画分子量=3500、Spectrum Laboratories,Inc.)に移して超純水4lに対して室温にて24時間で透析を行った。透析後にすべてナスフラスコに移し替えて一晩凍結乾燥し、得られた粉末に4mlのジメチルホルムアミド(DMF:和光純薬工業)を添加して混合し、ドーパミン結合ポリエチレングリコール溶液とした。
【0072】
次にDMFを用いてドーパミン結合ポリエチレングリコール溶液が終濃度20(vol/vol)%、実施例1で得られた酸性酸化チタンゾルが終濃度で固形成分0.25%となるよう調製し、5mlの反応溶液とした。この反応溶液を水熱反応容器のHU−50(三愛科学製)に溶液を移し替え、150℃で6時間加熱反応を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水1.25mlを添加してポリエチレングリコール結合酸化チタン微粒子の分散液とした。この分散液を蒸留水で0.05(wt/vol)%水溶液に希釈して24時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は60.3nm、ゼータ電位は3.05mVであった。
【0073】
例10:ポリエチレングリコール結合酸化チタン微粒子の作製
チタンテトライソプロポキシド3.6gとイソプロパノール3.6gを混合し、氷冷下で60mlの超純水に滴下して加水分解を行った。滴下後に室温で30分間攪拌した。攪拌後、12N硝酸1mlを滴下して80℃で8時間攪拌を行い、ペプチゼーションした。ペプチゼーション終了後0.45μmのフィルターで濾過し、さらに脱塩カラムPD−10(GEヘルスケア バイオサイエンス社製)を用いて溶液交換して固形成分1%の酸性酸化チタンゾルを調製した。この酸性酸化チタンゾルを100ml容のバイアル瓶に入れ、超音波発生器MIDSONIC200(カイジョー社製)を用いて200kHzで30分間超音波処理を行った。超音波処理を行った後の平均分散粒経を動的光散乱法により測定した。この測定は、超音波処理を行った後の酸性酸化チタンゾルを12Nの硝酸で1000倍に希釈した後、分散液0.1mlを石英測定セルに仕込み、ゼータサイザーナノZS(シスメックス社製)を用いて、溶媒の各種パラメーターを水と同値に設定し、25℃にて行った。その結果、分散粒径は38.4nmであった。蒸発皿を用いて、50℃下で酸性酸化チタンゾル溶液の濃縮を行い、最終的に固形成分20%の酸性酸化チタンゾルを調製した。
【0074】
次に、2,4−bis(O−methoxypolyethyleneglycol)−6−chloro−s−triazine(平均分子量10000;PEG2−生化学工業製)0.5gに超純水4.5mlを添加しポリエチレングリコール溶液とした。ポリエチレングリコール溶液4mlに50mMの2−[4−(2−ヒドロキシエチル)−1−ピペラジニル]エタンスルホン酸緩衝液(pH7.0)2mlとドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を濃度2.5mMになるよう混合して8mlの溶液を得た。この溶液を室温にて24時間振とう撹拌して反応させた。反応後、得られた溶液を透析膜であるスペクトラ/ポア CE 透析用チューブ(分画分子量=3500、Spectrum Laboratories,Inc.)に移して超純水4lに対して室温にて24時間で透析を行った。透析後にすべてナスフラスコに移し替えて一晩凍結乾燥し、得られた粉末に4mlのジメチルホルムアミド(DMF:和光純薬工業)を添加して混合し、ドーパミン結合ポリエチレングリコール溶液とした。
【0075】
次にDMFを用いてドーパミン結合ポリエチレングリコール溶液が終濃度40(vol/vol)%、実施例1で得られた酸性酸化チタンゾルが終濃度で固形成分0.25%となるよう調製し、5mlの反応溶液とした。この反応溶液を水熱反応容器のHU−50(三愛科学製)に溶液を移し替え、150℃で6時間加熱反応を行った。反応終了後、反応容器温度が50℃以下になるまで冷却し、エバポレータでDMFを除去した後に、蒸留水1.25mlを添加してポリエチレングリコール結合酸化チタン微粒子の分散液とした。この分散液を蒸留水で0.05(wt/vol)%水溶液に希釈して24時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は123nm、ゼータ電位は13.1mVであった。
【0076】
例11:酸化チタン複合体粒子への蛍光分子の結合
例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%の分散液とした。次に、ドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を200mMとなるよう調整した。調整した溶液と分散液を1:9で混合して1mlとし、室温で1時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、それぞれの溶液について増大が認められたため、ドーパミンが結合したと考えられた。また、反応前と反応後の溶液をキャピラリ電気泳動にて以下の条件で付したところ、フォトダイオードアレイ検出器によって吸収波長214nmのピークを確認することによりドーパミンの変化量を求めた。
・装置:P/ACE MDQ(ベックマンコールター製)
・キャピラリ:フューズドシリカキャピラリ 50μm i.d×67cm(effective length 50cm)(ベックマンコールター製)
・移動相:50mM 酢酸ナトリウム緩衝溶液(pH4.8)
・電圧:25kV
・温度:20℃
求めた変化量よりドーパミンは酸化チタン粒子の質量あたり5.2×10−2 ドーパミン−g/酸化チタン粒子−gであった。
さらに、この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応のドーパミンを除去した。ドーパミンの除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのドーパミンがないことを確認した。これらからドーパミン結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0077】
次にこのドーパミン結合酸化チタン機能性分子複合体粒子を終濃度で0.3%、またNHS−Rhodamine(ピアース製)を終濃度で1mMとなるように20mMホウ酸緩衝液中で混合調整した。この溶液を4℃、遮光下で24時間静置した。この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応のNHS−Rhodamineを除去した。NHS−Rhodamineの除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのNHS−Rhodamineがないことを確認した。得られた溶液を蛍光分光光度計にてスペクトル解析を行い、励起波長555nm、蛍光波長575nmであることを確認した。これらのことから、酸化チタン複合体粒子へ蛍光分子を結合した、蛍光分子結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0078】
例12:酸化チタン複合体粒子へのドーパミンの結合
例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%の分散液とした。次に、ドーパミン塩酸塩(分子量Mn=153.178:和光純薬工業製)を200mMとなるよう調整した。調整した溶液と分散液を1:9で混合して1mlとし、室温で1時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、それぞれの溶液について増大が認められたため、ドーパミンが結合したと考えられた。また、反応前と反応後の溶液をキャピラリ電気泳動にて以下の条件で付したところ、フォトダイオードアレイ検出器によって吸収波長214nmのピークを確認することによりドーパミンの変化量を求めた。
・装置:P/ACE MDQ(ベックマンコールター製)
・キャピラリ:フューズドシリカキャピラリ 50μm i.d×67cm(effective length 50cm)(ベックマンコールター製)
・移動相:50mM 酢酸ナトリウム緩衝溶液(pH4.8)
・電圧:25kV
・温度:20℃
求めた変化量よりドーパミンは酸化チタン粒子の質量あたり5.2×10−2 ドーパミン−g/酸化チタン粒子−gであった。
さらに、この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応のドーパミンを除去した。ドーパミンの除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのドーパミンがないことを確認した。これらからドーパミン結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0079】
例13:酸化チタン複合体粒子へのジヒドロキシフェニルプロピオン酸の結合
例1で得られた、酸化チタン複合体粒子を超純水にて固形成分3%とした。次に、ジヒドロキシフェニルプロピオン酸(和光純薬工業製)を超純水にて、モル濃度で500mMに調整した。酸化チタン複合体粒子3%溶液に対してジヒドロキシフェニルプロピオン酸溶液を1/10量混合し、全量で1ml調整した。調整した溶液を室温で2.5時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、吸光度の増大が認められたため、ジヒドロキシフェニルプロピオン酸が結合したと考えられた。また、反応前と反応後の溶液をキャピラリ電気泳動にて以下の条件で、フォトダイオードアレイ検出器の吸収波長214nmのピークを確認することによりジヒドロキシフェニルプロピオン酸の変化量を求めた。
・装置:P/ACE MDQ(ベックマンコールター製)
・キャピラリ:フューズドシリカキャピラリ 50μm i.d × 67cm(effective length 50cm)(ベックマンコールター製)
・移動相:50mM ホウ酸緩衝溶液(pH9.0)
・電圧:25kV
・温度:20℃
求めた変化量より結合したジヒドロキシフェニルプロピオン酸は酸化チタン粒子の質量あたり4.8×10−2 ジヒドロキシフェニルプロピオン酸−g/酸化チタン−gであった。さらに、この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケアバイオサイエンス製)を用いて水3.5mlで回収して未反応のジヒドロキシフェニルプロピオン酸を除去した。ジヒドロキシフェニルプロピオン酸の除去はキャピラリ電気泳動にて上記と同様に確認し、フリーのジヒドロキシフェニルプロピオン酸がないことを確認した。これらからジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0080】
例14:ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子へのエタノールアミンの結合
例9で得られた、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子の溶液と1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(同仁化学製)を、50mM ホウ酸緩衝溶液(pH9.0)を用いてそれぞれ濃度が15mg/mlおよび80mMとなるように混合して調整した。調整した溶液にエタノールアミン(和光純薬工業製)を濃度10mMになるよう混合して0.2mlの溶液を得た。この溶液を室温にて24時間振とう撹拌して反応させた。反応した溶液から50μlを超純水にて1000倍希釈に調整し、これを50mM ホウ酸緩衝液に対して1/10量添加して、440μlとした。さらにアセトンに溶解した0.3mg/mlのフルオレスカミン(東京化成工業社製)を20μl添加して溶液を攪拌後、蛍光光度計(島津製作所製 :RF−5300)により蛍光値を以下の測定条件で測定した。(波長:Ex=395nm/Em=495nm、バンド幅:Ex=5nm/Em=10nm、感度:High、レスポンス:Auto)。事前に作成した検量線を用いて未結合のエタノールアミンを算出して初期濃度からの濃度変化の割合、すなわち結合した割合を算出した。その結果、63.16%であった。以上のことから、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子のジヒドロキシフェニルプロピオン酸を介して、エタノールアミンが結合することを確認した。
【0081】
例15:ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子への抗体の結合
例13で得られた、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子の溶液と1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(同仁化学製)を、超純水を用いてそれぞれ濃度が20mg/mlおよび80mMとなるように混合した。混合した溶液を室温にて10分間反応した。脱塩カラムPD−10(GEヘルスケア バイオサイエンス社製)を用いて20mM HEPES緩衝溶液(pH7.4)に溶液交換し、酸化チタン濃度にして20mg/mlの粒子の溶液を得た。これと同一の緩衝液で調製した抗ヒト血清アルブミン(抗HSA)モノクローナル抗体(マウスIgG:MSU−304、コスモバイオ社)を3mg/mlになるように添加し、全量で1mlの溶液とした。4℃で24時間反応後、終濃度が0.5Mとなるようエタノールアミンを添加して、さらに4℃で1時間反応した。この溶液を酸化チタン濃度にして1mg/mlに調製し、HPLC:AKTA purifier(GEヘルスケアバイオサイエンス製)、カラム:HiPrep 16/60 Sephacryl S−500HR(GEヘルスケアバイオサイエンス製)、移動相:リン酸緩衝生理食塩水(pH7.4)、流速:0.3ml/min]に1ml付したところ、素通り画分および結合に用いた抗HSAモノクローナル抗体が単体で確認される画分にUV吸収のピークが確認され、これらの画分を回収した。素通り画分について、蒸留水で0.05(wt/vol)%水溶液に希釈して24時間静置後、動的光散乱法による分散粒径およびゼータ電位の確認を、ゼータサイザーナノZSを用いて、ゼータ電位測定セルにポリエチレングリコール結合酸化チタン微粒子の分散液0.75mlを仕込み、溶媒の各種パラメーターを水と同値に設定し、25℃にて測定した。キュミュラント解析の結果、分散粒径は50.3nm、ゼータ電位は−3.0mVであった。また、抗HSAモノクローナル抗体が単体で確認される画分については、ブラッドフォード法でタンパク質濃度を測定した結果、反応前後で抗体濃度の減少が確認された。以上のことから、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子のジヒドロキシフェニルプロピオン酸を介して、抗体分子が結合することを確認した。
【0082】
例16:酸化チタン複合体粒子へのアミノレブリン酸およびジヒドロキシフェニルエタノールの結合
3,4−ジヒドロキシフェニルエタノール(和光純薬工業製)300mgをジメチルホルムアミド(DMF;和光純薬工業製)0.5mlに溶解した。この溶液に塩化チオニル(和光純薬工業製)を0.1ml加えて攪拌後、トルエン(和光純薬工業製)を7ml混合した。さらに、5−アミノレブリン酸塩酸塩(和光純薬工業製)を250mg加え、攪拌しながら80℃で1時間反応させた。反応後、二層に分かれた上層部および下層部をそれぞれ回収した。この回収液の一部と3,4−ジヒドロキシフェニルエタノールおよび5−アミノレブリン酸塩酸塩のDMF溶液を薄層クロマトグラフィ(TLC)を用いて、アセトン(和光純薬工業製):メタノール(和光純薬工業製)=2:3の溶液を用いて展開した後、乾燥したTLC板にニンヒドリンスプレー(和光純薬工業)を噴霧して加熱後、スポットの観察を行った。その結果、回収液のうち下層部の展開スポットが3,4−ジヒドロキシフェニルエタノールおよび5−アミノレブリン酸塩酸塩とは異なる位置にあり、ニンヒドリン反応によって呈色したことから、3,4−ジヒドロキシフェニルエタノールと5−アミノレブリン酸塩酸塩の複合体が生成したと考えられた。回収液のうち下層部を減圧下で10倍に濃縮し、反応濃縮溶液とした。例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%に調整し、そこに反応濃縮溶液を1/10量混合して、全量で1mlとした。この混合溶液を緩やかに攪拌しながら、室温で1時間反応を行った。反応後、沈殿成分を遠心分離(1500g、10min)して上澄みを回収し、この溶液1mlに対してバッファー交換用自然落下型カラムNAP−10(GEヘルスケアバイオサイエンス製)を用いて水1.5mlで回収して未反応の3,4−ジヒドロキシフェニルエタノールと5−アミノレブリン酸塩酸塩の複合体がおよびDMFを除去した。この溶液について可視光域(400nm)における波長の吸収スペクトルを紫外−可視光分光光度計(UV1600;島津製作所製)により確認したところ増大が認められたため、3,4−ジヒドロキシフェニルエタノールと5−アミノレブリン酸塩酸塩の複合体が結合したと考えられた。これらから3,4−ジヒドロキシフェニルエタノールと5−アミノレブリン酸塩酸塩の複合体結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0083】
例17:酸化チタン複合体粒子への葉酸およびドーパミンの結合
葉酸(和光純薬工業製)および塩酸ドーパミン(和光純薬工業製)を1mMとなるようジメチルホルムアミド(DMF;和光純薬工業製)に溶解した。また、同様にDMFを用いて200mM Benzotriazole−1−yl−oxy−trispyrrolidinophosphonium hexafluorophosphate(PyBop;メルク製)、200mM 1−ヒドロキシベンゾトリアゾール(HoBt;同仁化学製)、20mM N,N−ジイソプロピルエチルアミン(DIEA;和光純薬工業製)をそれぞれ調製した。これらのうち、葉酸と塩酸ドーパミンは元濃度の1/4、またその他は元濃度の1/10となるよう混合してDMFで20mlに溶液調整した。この混合溶液を緩やかに攪拌しながら、室温で20時間反応を行った。反応溶液の一部を超純水で10倍に希釈し、この溶液を逆相クロマトグラフィ(HPLCシステム:Prominence(島津製作所製)、カラム:Chromolith RP−18e 100−3mm(メルク製)、移動相:A メタノール(和光純薬工業製)B 0.1%トリフルオロ酢酸水溶液(和光純薬工業製)、流速:2ml/min)を用いて解析した。紫外線検出器で波長210nmに設定し、インジェクション(0.02ml)後、1〜10minにおいてメタノールが100%となるようグラジエント溶出を行った結果、9min付近に葉酸と塩酸ドーパミンの複合体と考えられるピークを確認した。また、葉酸および塩酸ドーパミンそれぞれ単独のピークは検出限界以下であった。これらのことから、葉酸と塩酸ドーパミンの複合体の生成を確認した。次に、反応溶液の残りを減圧下で10倍に濃縮し、反応濃縮溶液とした。例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%に調整し、そこに反応濃縮溶液を1/10量混合して、全量で1mlとした。この混合溶液を緩やかに攪拌しながら、室温で1時間反応を行った。反応後、沈殿成分を遠心分離(1500g、10min)して上澄みを回収し、この溶液1mlに対してバッファー交換用自然落下型カラムNAP−10(GEヘルスケアバイオサイエンス製)を用いて水1.5mlで回収して未反応の葉酸と塩酸ドーパミンの複合体およびDMFを除去した。葉酸と塩酸ドーパミンの複合体およびDMFの除去は逆相クロマトグラフィにて上記と同様に確認し、フリーの葉酸と塩酸ドーパミンの複合体がないことを確認した。これらから葉酸と塩酸ドーパミンの複合体結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0084】
例18:葉酸と塩酸ドーパミンの複合体結合酸化チタン機能性分子複合体粒子への紫外線照射と蛍光の確認
例17で得られた葉酸と塩酸ドーパミンの複合体結合酸化チタン機能性分子複合体粒子の溶液を、リン酸緩衝生理食塩水を用いて酸化チタン濃度がそれぞれ0.05、0.01、0.005%となるよう3mlに調製した。これらの溶液を攪拌しながら、波長352nmの紫外線ランプ(FL20S・BLB−A;東芝ライテック製)を用いて紫外線強度0.9mW/cm2で照射し、照射開始後0、3、6、9minにおける溶液の蛍光強度を、蛍光分光光度計(RF−5300PC;島津製作所製)を用いて励起波長360nmおよび蛍光波長450nmに設定し、それぞれ測定を行った。結果を図2に示す。照射時間および酸化チタン濃度の増加に伴い、蛍光強度が大きくなることが確認された。これは、この溶液への紫外線照射によって生じたラジカルとの反応に伴い、葉酸から遊離したプテリン化合物由来の蛍光であると考えられた。
【0085】
例19:ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子へのメチオニンの結合
例13で得られた、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子の溶液と1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(同仁化学製)を、50mM ホウ酸緩衝溶液(pH9.0)を用いてそれぞれ濃度が15mg/mlおよび80mMとなるように混合に調整した。調整した溶液にメチオニン(和光純薬工業製)を濃度10mMになるよう混合して0.2mlの溶液を得た。この溶液を室温にて24時間振とう撹拌して反応させた。反応した溶液から50μlを超純水にて1000倍希釈に調整し、これを50mM ホウ酸緩衝液に対して1/10量添加して、440μlとした。さらにアセトンに溶解した0.3mg/mlのフルオレスカミン(東京化成工業社製)を20μl添加して溶液を攪拌後、蛍光光度計(島津製作所製 :RF−5300)により蛍光値を以下の測定条件で測定した。(波長:Ex=395nm/Em=495nm、バンド幅:Ex=5nm/Em=10nm、感度:High、レスポンス:Auto)。事前に作成した検量線を用いて未結合のメチオニンを算出して初期濃度からの濃度変化の割合、すなわち結合した割合を算出した。その結果、40.2%であった。以上のことから、ジヒドロキシフェニルプロピオン酸結合酸化チタン機能性分子複合体粒子のジヒドロキシフェニルプロピオン酸を介して、メチオニンが結合することを確認した。
【0086】
例20:ドーパミン結合酸化チタン機能性分子複合体粒子へのラジカル応答性分子の結合
例12で得られたドーパミン結合酸化チタン機能性分子複合体粒子を終濃度で0.3%、また2,3−dihydro−6−isothiocyanato−1,4−phthalazinedione(同仁化学製)を終濃度で1mMとなるように20mMリン酸緩衝液中(pH7.0)で混合し、3mlに調整した。この溶液を4℃、遮光下で24時間静置し、結合反応を行った。この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応物の除去を行った。これらのことから、酸化チタン複合体粒子へラジカル応答性分子である2,3−dihydro−6−isothiocyanato−1,4−phthalazinedioneを結合した、ラジカル応答性分子結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0087】
例21:ドーパミン結合酸化チタン機能性分子複合体粒子へのラジカル応答性分子の結合2
例12で得られたドーパミン結合酸化チタン機能性分子複合体粒子を終濃度で0.3%、また2’,7’−dichlorodihydrofluorescein diacetate,succinimidyl ester(Invitrogen製)を終濃度で1mMとなるように20mMリン酸緩衝液中(pH7.0)で混合し、3mlに調整した。この溶液を4℃、遮光下で24時間静置し、結合反応を行った。この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応物を除去した。これらのことから、酸化チタン複合体粒子へラジカル応答性分子である2’,7’−dichlorodihydrofluorescein diacetate,succinimidyl esterを結合した、蛍光分子結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0088】
例22:酸化チタン複合体粒子へのフェロセンカルボン酸およびドーパミンの結合
フェロセンカルボン酸(和光純薬工業製)および塩酸ドーパミン(和光純薬工業製)を1mMとなるようジメチルホルムアミド(DMF;和光純薬工業製)に溶解した。また、同様にDMFを用いて200mM Benzotriazole−1−yl−oxy−trispyrrolidinophosphonium hexafluorophosphate(PyBop;メルク製)、200mM 1−ヒドロキシベンゾトリアゾール(HoBt;同仁化学製)、20mM N,N−ジイソプロピルエチルアミン(DIEA;和光純薬工業製)をそれぞれ調製した。これらのうち、フェロセンカルボン酸と塩酸ドーパミンは元濃度の1/4、またその他は元濃度の1/10となるよう混合してDMFで20mlに溶液調整した。この混合溶液を緩やかに攪拌しながら、室温で20時間反応を行った。反応溶液の一部を超純水で10倍に希釈し、この溶液を逆相クロマトグラフィ(HPLCシステム:Prominence(島津製作所製)、カラム:Chromolith RP−18e 100−3mm(メルク製)、移動相:A メタノール(和光純薬工業製)B 0.1%トリフルオロ酢酸水溶液(和光純薬工業製)、流速:2ml/min)を用いて解析した。紫外線検出器で波長210nmに設定し、インジェクション(0.02ml)後、1〜10minにおいてメタノールが100%となるようグラジエント溶出を行った結果、フェロセンカルボン酸と塩酸ドーパミンの複合体と考えられるピークを確認した。また、フェロセンカルボン酸および塩酸ドーパミンそれぞれ単独のピークは検出限界以下であった。これらのことから、フェロセンカルボン酸と塩酸ドーパミンの複合体の生成を確認した。
【0089】
反応溶液の残りを減圧下で10倍に濃縮し、反応濃縮溶液とした。例1で得られた、酸化チタン複合体粒子を超純水にて固形成分1%に調整し、そこに反応濃縮溶液を1/10量混合して、全量で1mlとした。この混合溶液を緩やかに攪拌しながら、室温で1時間反応を行った。反応後、沈殿成分を遠心分離(1500g、10min)して上澄みを回収し、この溶液1mlに対してバッファー交換用自然落下型カラムNAP−10(GEヘルスケアバイオサイエンス製)を用いて水1.5mlで回収して未反応のフェロセンカルボン酸と塩酸ドーパミンの複合体およびDMFを除去した。この溶液について可視光域(400nm)における波長の吸収スペクトルを紫外−可視光分光光度計(UV1600;島津製作所製)により確認したところ増大が認められたため、フェロセンカルボン酸と塩酸ドーパミンの複合体が結合したと考えられた。これらからフェロセンカルボン酸と塩酸ドーパミンの複合体結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0090】
例23:ドーパミン結合酸化チタン機能性分子複合体粒子への蛍光分子の結合2
例12で得られたドーパミン結合酸化チタン機能性分子複合体粒子を終濃度で0.3%、またCy7−NHS ester(GEヘルスケア バイオサイエンス製)を終濃度で1mMとなるように20mMリン酸緩衝液中(pH7.0)で混合し、3mlに調整した。この溶液を4℃、遮光下で24時間静置し、結合反応を行った。この溶液2.5mlに対してバッファー交換用自然落下型カラムPD−10(GEヘルスケア バイオサイエンス製)を用いて水3.5mlで回収して未反応物を除去した。この溶液について蛍光強度を、蛍光分光光度計(RF−5300PC;島津製作所製)を用いて励起波長743nmおよび蛍光波長767nmに設定して測定を行った結果、蛍光を示すことが確認された。これらのことから、酸化チタン複合体粒子へ蛍光分子であるCy7−NHS esterを結合した、蛍光分子結合酸化チタン機能性分子複合体粒子の作製を確認した。
【0091】
例24:酸化チタン複合体粒子へのカテコール結合2
例8〜10で得られた、それぞれの酸化チタン複合体粒子を超純水にて固形成分1%とした。次に、カテコールを超純水にて、モル濃度で100mM、10mM、1mM、0.1mMに調整した。酸化チタン複合体粒子1%溶液に対してそれぞれのカテコール溶液を等量ずつ混合し、リン酸緩衝生理食塩水(PBS;pH7.4)で最終的に酸化チタン複合体粒子とカテコール溶液がそれぞれ終濃度で10倍希釈になるように調整した。調整した溶液をそれぞれ恒温器に移して40℃に設定し、3時間結合反応を行った。反応後の溶液について可視光域における波長の吸収スペクトルを紫外−可視光分光光度計により確認したところ、それぞれの溶液について増大が認められたため、カテコールが結合したと考えられた。
【図面の簡単な説明】
【0092】
【図1】本発明の酸化チタン機能性分子複合体粒子の一例を示す図である。
【図2】例18において測定された、例17で得られた酸化チタン機能性分子複合体粒子の紫外線照射時間と、蛍光強度との関係を示す図である。
【符号の説明】
【0093】
1…酸化チタン粒子
2…水溶性高分子
3…機能性分子
【特許請求の範囲】
【請求項1】
酸化チタン粒子と、
該酸化チタン粒子の表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくとも一つの官能基を介して結合されてなる水溶性高分子を含んでなる、酸化チタン複合体粒子と、
該酸化チタン複合体粒子の表面に、さらに結合されてなる機能性分子を含んでなり、
前記前記機能性分子は、
(1)カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくとも一つの官能基を有し、
(2)a)炭素数6〜40よりなる飽和又は不飽和の鎖状炭化水素基、b)置換基を有するか有しない飽和又は不飽和の5〜6員環複素環式基、又はc)置換基を有するか有しない飽和又は不飽和の5〜6員環環状炭化水素基を含んでなる化合物であって、
前記官能基を介して前記酸化チタンと結合されてなる、酸化チタン機能性分子複合体粒子。
【請求項2】
前記機能性分子の結合量は前記酸化チタン粒子の質量あたり、1.0×10−1〜1.0×10−5 質量部/酸化チタン粒子の質量部であることを特徴とする、請求項1に記載の酸化チタン機能性分子複合体粒子。
【請求項3】
前記機能性分子はカテコール類であることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項4】
前記機能性分子は、カテコール、ドーパミン、ジヒドロキシフェニルプロピオン酸からなる群から選択される少なくとも一種である、請求項3に記載の酸化チタン機能性分子複合体粒子。
【請求項5】
前記機能性分子は放射性物質であることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項6】
前記放射性物質は14C標識カテコールであることを特徴とする、請求項5に記載の酸化チタン機能性分子複合体粒子。
【請求項7】
前記機能性分子はラジカル応答性分子を含んでなることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項8】
前記機能性分子は蛍光性分子を含んでなることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項9】
前記機能性分子はアミノレブリン酸を含んでなることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項10】
前記機能性分子はフェロセンを含んでなることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項11】
前記水溶性高分子は重量平均分子量5000〜40000であることを特徴とする、請求項1〜10のいずれか1項に記載の酸化チタン機能性分子複合体粒子。
【請求項12】
前記水溶性高分子は、ポリエチレングリコール、ポリアクリル酸、ポリエチレンイミンの群から選択される少なくとも一種を含んでなることを特徴とする、請求項1〜11のいずれか一項に記載の酸化チタン機能性分子複合体粒子。
【請求項13】
20〜200nmの粒子径を有する、請求項1〜12のいずれか一項に記載の酸化チタン機能性分子複合体粒子。
【請求項14】
請求項1〜13のいずれか一項に記載の酸化チタン機能性分子複合体粒子と、該粒子が分散される溶媒とを含んでなる、分散液。
【請求項15】
前記溶媒が、水系溶媒である、請求項14に記載の分散液。
【請求項16】
前記溶媒のpHが5〜8である、請求項14または15に記載の分散液。
【請求項17】
前記溶媒が、生理食塩水である、請求項14〜16のいずれか一項に記載の分散液。
【請求項18】
前記酸化チタン機能性分子複合体粒子が、0.001〜1質量%含有される、請求項14〜17のいずれか一項に記載の分散液。
【請求項1】
酸化チタン粒子と、
該酸化チタン粒子の表面に、カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくとも一つの官能基を介して結合されてなる水溶性高分子を含んでなる、酸化チタン複合体粒子と、
該酸化チタン複合体粒子の表面に、さらに結合されてなる機能性分子を含んでなり、
前記前記機能性分子は、
(1)カルボキシル基、アミノ基、ジオール基、サリチル酸基、およびリン酸基の群から選択される少なくとも一つの官能基を有し、
(2)a)炭素数6〜40よりなる飽和又は不飽和の鎖状炭化水素基、b)置換基を有するか有しない飽和又は不飽和の5〜6員環複素環式基、又はc)置換基を有するか有しない飽和又は不飽和の5〜6員環環状炭化水素基を含んでなる化合物であって、
前記官能基を介して前記酸化チタンと結合されてなる、酸化チタン機能性分子複合体粒子。
【請求項2】
前記機能性分子の結合量は前記酸化チタン粒子の質量あたり、1.0×10−1〜1.0×10−5 質量部/酸化チタン粒子の質量部であることを特徴とする、請求項1に記載の酸化チタン機能性分子複合体粒子。
【請求項3】
前記機能性分子はカテコール類であることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項4】
前記機能性分子は、カテコール、ドーパミン、ジヒドロキシフェニルプロピオン酸からなる群から選択される少なくとも一種である、請求項3に記載の酸化チタン機能性分子複合体粒子。
【請求項5】
前記機能性分子は放射性物質であることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項6】
前記放射性物質は14C標識カテコールであることを特徴とする、請求項5に記載の酸化チタン機能性分子複合体粒子。
【請求項7】
前記機能性分子はラジカル応答性分子を含んでなることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項8】
前記機能性分子は蛍光性分子を含んでなることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項9】
前記機能性分子はアミノレブリン酸を含んでなることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項10】
前記機能性分子はフェロセンを含んでなることを特徴とする、請求項1または2に記載の酸化チタン機能性分子複合体粒子。
【請求項11】
前記水溶性高分子は重量平均分子量5000〜40000であることを特徴とする、請求項1〜10のいずれか1項に記載の酸化チタン機能性分子複合体粒子。
【請求項12】
前記水溶性高分子は、ポリエチレングリコール、ポリアクリル酸、ポリエチレンイミンの群から選択される少なくとも一種を含んでなることを特徴とする、請求項1〜11のいずれか一項に記載の酸化チタン機能性分子複合体粒子。
【請求項13】
20〜200nmの粒子径を有する、請求項1〜12のいずれか一項に記載の酸化チタン機能性分子複合体粒子。
【請求項14】
請求項1〜13のいずれか一項に記載の酸化チタン機能性分子複合体粒子と、該粒子が分散される溶媒とを含んでなる、分散液。
【請求項15】
前記溶媒が、水系溶媒である、請求項14に記載の分散液。
【請求項16】
前記溶媒のpHが5〜8である、請求項14または15に記載の分散液。
【請求項17】
前記溶媒が、生理食塩水である、請求項14〜16のいずれか一項に記載の分散液。
【請求項18】
前記酸化チタン機能性分子複合体粒子が、0.001〜1質量%含有される、請求項14〜17のいずれか一項に記載の分散液。
【図1】


【図2】




【図2】


【公開番号】特開2009−91345(P2009−91345A)
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願番号】特願2008−29466(P2008−29466)
【出願日】平成20年2月8日(2008.2.8)
【出願人】(000010087)TOTO株式会社 (3,889)
【Fターム(参考)】
【公開日】平成21年4月30日(2009.4.30)
【国際特許分類】
【出願日】平成20年2月8日(2008.2.8)
【出願人】(000010087)TOTO株式会社 (3,889)
【Fターム(参考)】
[ Back to top ]

