重水素化(メタ)アクリル酸エステル、その製造法、その重合体、及び光学部材
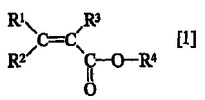
【解決手段】 下記一般式[1](式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は各々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である)で表される新規な化合物、及び該化合物を含有する重合性組成物を重合してなる新規な重合体である。
一般式[1]
【化1】

一般式[1]
【化1】

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規な重水素化(メタ)アクリル酸エステル化合物、特に耐熱性や透明性に優れた光ファイバ用ポリマーの原料として有用な、重水素化(メタ)アクリル酸エステル化合物及びこれを用いて得られるポリマーに関する。
【背景技術】
【0002】
従来、一般的な光ファイバ用ポリマーとして、重水素化メタクリル酸メチルと種々の重水素化(メタ)アクリル酸エステルとの共重合体が用いられているが、実用上多くの問題が残されている。例えば、重水素化率の低い重水素化(メタ)アクリル酸エステルと重水素化メタクリル酸メチルとを共重合させて得られるポリマー(特開昭63−130563号公報)は、重水素化(メタ)アクリル酸エステル中にC−H結合が依然多く存在しており、該化合物を用いて得られるポリマーの透明性が悪く、また光伝送損失が大きくなる。従って、この様なポリマーは大容量高速伝送システムに使用される光ファイバ原料として好ましいものとはいえない。
【0003】
また、例えば、重水素化(メタ)アクリル酸ノルボルニルと重水素化メタクリル酸メチルとを共重合させて得られるポリマー(特開昭63−130563号公報)は、自動車エンジン等に使用する等の過酷な条件下で使用する光ファイバの原料としては、耐熱性が不充分である。
【0004】
一方、重水素化されていないメタクリル酸エステル化合物と重水素化メタクリル酸メチルとの共重合体を主体とするポリマーを、光ファイバの原料として使用することも試みられている。中でも、例えば、メタクリル酸シクロヘキシル系化合物、メタクリル酸ボルニル、メタクリル酸フェンチル、メタクリル酸メンチル等の脂環式炭化水素基を有するメタクリル酸エステルを、重水素化メタクリル酸メチルと共重合させて得られるポリマー(特開昭60−098407号公報及び特開昭60−125807号公報)は、上記と同様、脂環式炭化水素基を有するメタクリル酸エステル中にC−H結合が多く存在しているため、該化合物を用いて得られるポリマーは使用に適した光源波長が限定されるため大容量高速伝送システムに使用される光ファイバ原料として好ましいものとはいえない。
【0005】
また、重水素化されているまたは重水素化されていない(メタ)アクリル酸アダマンチル或いはその誘導体を、重水素化メタクリル酸メチルと共重合させて得られるポリマー(特開昭60−125807号公報及び特開平9−235322号公報)は、ある程度の耐熱性があるといえるが、その原料モノマーである(メタ)アクリル酸アダマンチル或いはその誘導体の合成に必要なアダマンチル骨格を有する化合物が極めて高価なものであることから、工業的生産にこれを使用することは不利であり、このような原料モノマーを用いて得られるポリマーはコスト面で実用的でないという問題を有している。
【0006】
このような状況から、重水素化メタクリル酸メチルと共重合することにより、高温環境等の過酷な条件下でも使用し得る耐熱性を有し、且つ透明性に優れ、光伝送損失の少ない大容量高速伝送システム用光ファイバの原料ポリマーとなる、工業的により安価で実用的な重水素化モノマー化合物の創製が望まれている。
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明の目的は、工業的に安価に製造可能で、且つ重水素化率の高い重水素化(メタ)アクリル酸エステル及びこれを用いて得られるポリマーを提供することである。また、本発明の他の目的は、高温環境下等の過酷な条件下でも使用し得る、耐熱性及び透明性に優れた光ファイバ用の原料として使用可能な、重水素化モノマー化合物及びポリマーを提供することである。
【課題を解決するための手段】
【0008】
本発明は、前記目的を達成する、下記一般式[1]
【0009】
【化1】

【0010】
(式中、R1及びR2は夫々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は夫々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である。)で表される化合物を提供する。
【0011】
前記炭素数5〜7の炭化水素環が飽和炭化水素環であっても、不飽和炭化水素環であってもよく、飽和炭化水素環としては、シクロペンタン環、シクロヘキサン環及びノルボルナン環からなる群より選ばれる環;不飽和炭化水素環としては、シクロペンテン環、シクロヘキセン環及びノルボルネン環からなる群より選ばれる環が挙げられる。また、前記一般式[1]で表される化合物が有する水素原子の20%以上(より好ましくは40%以上)が重水素原子であるのが好ましい。また、本発明の態様として、前記一般式[1]で表される化合物が有する軽水素原子が15個以下である前記化合物;R4で表される基が有する水素原子の10%以上が重水素原子である前記化合物;R4で表される基が有する軽水素原子が12個以下である前記化合物;前記一般式[1]におけるR4で表される基が、トリシクロ[5.2.1.02,6]デシル基であって、当該基中の水素原子の少なくとも1つが重水素原子である前記化合物;が提供される。
【0012】
また、別の観点から、本発明によって、前記一般式[1]で表される化合物を含有する重合性組成物を重合させてなる重合体;重合体が有する水素原子の50%以上が重水素原子である前記重合体;前記重合体を含む領域を少なくとも有する光学部材;および全水素原子が軽水素であること以外は同一構造の重合体と比較して910nmにおける吸光度が50%以下である前記光学部材;が提供される。
【0013】
なお、本明細書において、「水素原子」とは軽水素原子及び重水素原子を総称するものであり、重水素原子とはジュウテリウム(D)又はトリチウム(T)を意味する。
さらに、本明細書において、「重水素原子比率」とは、化合物中又は基中の全水素原子の総数に対する重水素原子の数の比を意味する。
【発明の実施の形態】
【0014】
以下、本発明の実施形態について以下詳細に説明する。
本発明は、下記一般式[1]で表される化合物に関する。
【0015】
【化2】

【0016】
式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は各々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である。
【0017】
前記式中、R1及びR2は、いずれか一方が重水素原子であるのが好ましく、R1及びR2の両方が重水素原子であるのがより好ましい。
【0018】
前記式中、R3が水素原子を表す場合には、それが重水素原子であるが好ましく、R3がメチル基を表す場合には、該メチル基の3つの水素原子のうち、少なくとも1つが重水素原子であるのが好ましく、少なくとも2つが重水素原子であるのがより好ましく、3つの水素原子全てが重水素原子であるのがさらに好ましい。尚、R3は、3つ全ての水素原子が重水素化されたメチル基であることが最も好ましい。
【0019】
前記式中、ノルボルナン環と縮合してR4で表される基を形成する、炭素数5〜7の炭化水素環としては、例えば飽和炭化水素環、不飽和炭化水素環等が挙げられ、それらは架橋されていてもよい。
前記飽和炭化水素環の具体例としては、例えばシクロペンタン環、シクロヘキサン環、シクロヘプタン環、ノルボルナン環、トリシクロ[2.2.1.0]ヘプタン環等が挙げられ、中でもシクロペンタン環、シクロヘキサン環、ノルボルナン環が好ましく、特にシクロペンタン環が好ましい。
また、前記不飽和炭化水素環の具体例としては、例えばシクロペンテン環、シクロペンタジエン環、シクロヘキセン環、1,4−シクロヘキサジエン環、1,3−シクロヘキサジエン環、ノルボルネン環、2,5−ノルボルナンジエン環等が挙げられ、中でもシクロペンテン環、シクロヘキセン環、ノルボルネン環が好ましく、特にシクロペンテン環が好ましい。
【0020】
R4で表される基としては、ノルボルナン環と飽和炭化水素環が縮合されて得られる基が好ましく、中でもトリシクロ[5.2.1.02,6]デシル基、トリシクロ[6.2.1.02,7]ウンデシル基、テトラシクロ[6.2.1.13,6.02,7]ドデシル基がより好ましく、その中でもトリシクロ[5.2.1.02,6]デシル基が特に好ましい。
【0021】
上記した如きR4で表される基において、当該基が有する水素原子のうちの少なくとも1つが重水素原子であればよいが、当該基が重水素原子をより多く有していることが好ましい。R4で表される基が有する水素原子のうちの重水素原子の割合は、好ましくは10%以上、より好ましくは20%以上、さらに好ましくは40%以上であり、また、当該基が有する軽水素原子は、好ましくは12個以下、より好ましくは10個以下、さらに好ましくは9個以下である。
【0022】
また、一般式[1]で表される化合物が有する水素原子のうちの重水素原子の割合は、好ましくは20%以上、より好ましくは40%以上、さらに好ましくは50%、さらにより好ましくは60%以上、特に好ましくは65%以上であり、また、当該化合物が有する軽水素原子は、好ましくは15個以下、より好ましくは13個以下、さらに好ましくは11個以下、さらにより好ましくは9個以下である。
【0023】
本発明の前記一般式[1]で表される化合物は、例えば下記一般式[2]
【0024】
【化3】

(式中、Xはハロゲン原子、ヒドロキシル基又はアルコキシ基を表し、R1、R2及びR3は前記一般式[1]中のそれぞれと同義である)で表される化合物と、例えば下記一般式[3]
【0025】
【化4】

(式中、R4は前記一般式[1]中と同義である)で表される化合物とを反応させることにより合成することができる。
【0026】
上記一般式[2]において、Xで表されるハロゲン原子としては、例えば塩素原子、臭素原子、フッ素原子、ヨウ素原子等が挙げられ、中でも塩素原子、臭素原子が好ましく、特に塩素原子が好ましい。
【0027】
また、Xで表されるアルコキシ基としては、直鎖状でも分枝状でも或いは環状でもよく、好ましくは炭素数1〜4、より好ましくは1〜2、さらに好ましくは1のものが挙げられ、具体的には、例えばメトキシ基、エトキシ基、プロピルオキシ基、イソプロピルオキシ基、ブトキシ基、イソブチルオキシ基、sec−ブチルオキシ基、tert−ブチルオキシ基、シクロプロピル基等が挙げられる。
【0028】
上記一般式[2]で表される化合物としては、R1、R2及びR3で表される基が有する水素原子のうち、重水素原子の割合が大きい程好ましく、全ての水素原子が重水素原子であることが最も好ましい。尚、Xがヒドロキシル基又はアルコキシ基である場合、これらの基が有する水素原子は軽水素原子であっても重水素原子であってもよい。
【0029】
上記一般式[2]で表される化合物は、例えば特開昭63−130563号公報等に記載の公知の方法に従って得ることができる。即ち、一般式[2]で表される化合物が有する水素原子の全て或いは一部が軽水素原子である化合物を、アルカリ土類金属塩及び重合禁止剤(重合防止剤)の存在下、重水中で反応させればよい。
【0030】
また、水素原子が軽水素原子であるアクリル酸或いはその酸ハロゲン化物が有する炭素−炭素二重結合が、炭素−炭素三重結合に置き換わった化合物を、水酸化カルシウムの存在下、重水等の重水素化された溶媒中で反応させて、該三重結合を形成する炭素原子に直結した水素原子を重水素化し、さらにこれをリンドラー触媒の存在下で重水素ガスと反応させて三重結合を二重結合に還元すると同時に、得られる二重結合を形成する炭素原子に直結する水素原子を全て重水素化するという方法を用いて、一般式[2]で表される化合物を合成することもできる。尚、この方法により得られる化合物は、一般式[2]で表される化合物のうちのR1、R2及びR3が全て重水素原子であるものである。
【0031】
一般式[3]で表される化合物は、例えば一般式[3]中のR4で表される基が有する水素原子が全部又は一部軽水素原子である化合物を、軽水素ガス雰囲気下、パラジウム触媒を用いて重水と反応させることによって得ることができる。
【0032】
本発明の一般式[1]で表される化合物のうち、R4がノルボルナン環と炭素数5〜7の飽和炭化水素環との縮合環からなる基であるものを得るには、一般式[3]で表される化合物のうち、R4がノルボルナン環と炭素数5〜7の飽和炭化水素環との縮合環からなる基であるものと、一般式[2]で表される化合物とを反応させればよい。
また、本発明の一般式[1]で表される化合物のうち、R4がノルボルナン環と炭素数5〜7の飽和炭化水素環との縮合環からなる基であるものを得るには、一般式[3]で表される化合物のうち、R4が前記飽和炭化水素環に対応する不飽和炭化水素環とノルボルナン環との縮合環である化合物を原料として用い、一旦該化合物が有する不飽和炭化水素環の不飽和結合を還元してから、一般式[2]で表される化合物と反応させて製造してもよい。尚、不飽和炭化水素環の不飽和結合を還元する際、重水素ガスを用いて還元を行えば、R4で表される基の軽水素原子の重水素化と不飽和結合の還元とを同時に行うことができる。
【0033】
本発明の一般式[1]で表される化合物を得る際、一般式[2]中のXがハロゲン原子である化合物を用いる場合には、適当な塩基を用い、所望により適当な溶媒中で、前記一般式[3]で表される化合物と反応させてもよい(以下、「第一の態様」という)。
第一の態様において、一般式[3]で表される化合物の使用量は、一般式[2]で表される化合物に対して、好ましくは0.8〜1000倍モル、より好ましくは0.8〜100倍モル、さらに好ましくは0.8〜50倍モル、さらにより好ましくは0.8〜10倍モルである。
【0034】
第一の態様において使用される塩基としては、酸ハロゲン化物とアルコールとの一般的なエステル化反応に使用できるものが挙げられ、具体的には、例えばトリエチルアミン、N,N−ジメチルアニリン、ピペリジン、ピリジン、4−ジメチルアミノピリジン、N−メチルモルホリン、1,5−ジアザビシクロ[4.3.0]ノナ−5−エン、1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン、トリ−n−ブチルアミン等の有機アミン類;例えば水素化ナトリウム、n−ブチルリチウム等のアルカリ金属化合物類;等が挙げられる。
第一の態様において、塩基の使用量は、使用する一般式[2]で表される化合物に対して、好ましくは1〜50倍モル、より好ましくは1〜20倍モル、さらに好ましくは1〜5倍モルである。
【0035】
第一の態様において、所望により用いられる反応溶媒としては、例えばジエチルエーテル、ジイソプロピルエーテル、エチルメチルエーテル、テトラヒドロフラン、1,4−ジオキサン、ジメトキシエタン等のエーテル類;例えばクロロメタン、塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、トリクロロエタン、クロロベンゼン等のハロゲン化炭化水素類;例えばn−ヘキサン、ベンゼン、トルエン、キシレン等の炭化水素類;例えば酢酸エチル、酢酸ブチル、プロピオン酸メチル等のエステル類;例えばアセトニトリル等のニトリル類;例えばN,N−ジメチルホルムアミド等のアミド類;等が挙げられ、これらはそれぞれ単独でも或いは二種以上適宜組み合わせて用いてもよい。
第一の態様において、反応溶媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0〜100倍体積、より好ましくは0〜50倍体積、さらに好ましくは0〜20倍体積となる量である。
【0036】
第一の態様において、反応温度は、好ましくは−20〜200℃、より好ましくは−20〜100℃、さらに好ましくは−10〜70℃である。また、反応時間は、好ましくは0.5〜200時間、より好ましくは0.5〜36時間、さらに好ましくは0.5〜12時間である。
【0037】
また、本発明の一般式[1]で表される化合物を得る際、一般式[2]におけるXがヒドロキシル基である化合物を用いる場合には、これを適当な脱水縮合剤を用いるかまたは適当な酸触媒を用いて、所望により適当な溶媒中で一般式[3]で表される化合物と反応させてもよい(以下、前者を「第二の態様」、後者を「第三の態様」という)。
【0038】
前記第二および第三の態様において、一般式[3]で表される化合物の使用量は、一般式[2]で表される化合物に対して、好ましくは0.8〜1000倍モル、より好ましくは0.8〜100倍モル、さらに好ましくは0.8〜50倍モル、よりさらに好ましくは0.8〜10倍モルである。
【0039】
前記第二の態様において、使用可能な脱水縮合剤としては、例えば一般に脱水縮合剤として使用されるものであればよく、例えば五酸化二リン、無水塩化亜鉛等の無機脱水剤類;例えばジシクロヘキシルカルボジイミド、ジイソプロピルカルボジイミド、1−エチル−3−(3−ジメチルアミノプロピルカルボジイミド)塩酸塩等のカルボジイミド類;例えばポリリン酸、無水酢酸、カルボニルジイミダゾ−ル、p−トルエンスルホニルクロライド;等が挙げられ、その使用量は、一般式[3]で表される化合物に対して好ましくは1〜50倍モル、より好ましくは1〜30倍モル、さらに好ましくは1〜10倍モルである。
【0040】
前記第二の態様において、所望により用いられる反応溶媒としては、例えばジエチルエーテル、ジイソプロピルエーテル、エチルメチルエーテル、テトラヒドロフラン、1,4−ジオキサン、ジメトキシエタン等のエーテル類;例えばアセトン、ジメチルケトン、メチルエチルケトン、ジエチルケトン、2−ヘキサノン、t−ブチルメチルケトン、シクロペンタノン、シクロヘキサノン等のケトン類;例えばクロロメタン、塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、トリクロロエタン、クロロベンゼン等のハロゲン化炭化水素類;例えばn−ヘキサン、ベンゼン、トルエン、キシレン等の炭化水素類;例えば酢酸エチル、酢酸ブチル、プロピオン酸メチル等のエステル類;例えばアセトニトリル等のニトリル類;例えばN,N−ジメチルホルムアミド等のアミド類;等が挙げられ、これらは夫々単独でも或いは二種以上適宜組み合わせて用いてもよい。
第二の態様において、反応溶媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0〜100倍体積、より好ましくは0〜50倍体積、さらに好ましくは0〜20倍体積である。
【0041】
第二の態様において、反応温度は、好ましくは−20〜100℃、より好ましくは−20〜80℃、さらに好ましくは−10〜50℃である。また、反応時間は、好ましくは0.5〜200時間、より好ましくは0.5〜36時間、さらに好ましくは0.5〜12時間である。
【0042】
第三の態様において、酸触媒としては、例えば塩酸、硫酸、無水リン酸等の鉱酸類、p−トルエンスルホン酸、エタンスルホン酸等の有機酸類;例えば三フッ化ホウ素エーテラート等のルイス酸;等が挙げられる。
第三の態様において、酸触媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0.01〜0.5倍モル、より好ましくは0.01〜0.2倍モル、さらに好ましくは0.01〜0.1倍モルである。
【0043】
第三の態様において、所望により用いられる反応溶媒としては、例えばジエチルエーテル、ジイソプロピルエーテル、エチルメチルエーテル、テトラヒドロフラン、1,4−ジオキサン、ジメトキシエタン等のエーテル類;例えばクロロメタン、塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、トリクロロエタン、クロロベンゼン等のハロゲン化炭化水素類;例えばn−ヘキサン、ベンゼン、トルエン、キシレン等の炭化水素類;等が挙げられ、これらはそれぞれ単独でも或いは二種以上適宜組み合わせて用いてもよい。
第三の態様において、反応溶媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0〜100倍体積、より好ましくは0〜50体積、さらに好ましくは0〜20体積である。
【0044】
第三の態様において、反応温度は、好ましくは0〜200℃、より好ましくは20〜200℃、さらに好ましくは20〜150℃である。また、反応時間は、好ましくは0.5〜200時間、より好ましくは0.5〜36時間、さらに好ましくは0.5〜12時間である。
【0045】
さらにまた、本発明の一般式[1]で表される化合物を得る際、一般式[2]中のXがアルコキシ基である化合物を用いる場合には、これを適当な酸又は塩基触媒を用い、所望により適当な溶媒中で一般式[3]で表される化合物とエステル交換反応させてもよい(以下、「第四の態様」という)。
【0046】
第四の態様において、一般式[3]で表される化合物の使用量は、一般式[2]で表される化合物に対して、好ましくは0.8〜1000倍モル、より好ましくは0.8〜100倍モル、さらに好ましくは0.8〜50倍モル、さらにより好ましくは0.8〜10倍モルである。
【0047】
第四の態様において使用可能な酸又は塩基触媒としては、エステルとアルコールの一般的なエステル交換に使用されるものが挙げられ、酸触媒の具体例としては、例えば硫酸、p−トルエンスルホン酸等が挙げられる、塩基触媒の具体例としては、例えばカリウムt−ブトキシド、ナトリウムメトキシド等が挙げられる。
【0048】
第四の態様において、所望により用いられる反応溶媒としては、例えばジエチルエーテル、ジイソプロピルエーテル、エチルメチルエーテル、テトラヒドロフラン、1,4−ジオキサン、ジメトキシエタン等のエーテル類;例えばクロロメタン、塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、トリクロロエタン、クロロベンゼン等のハロゲン化炭化水素類;例えばn−ヘキサン、ベンゼン、トルエン、キシレン等の炭化水素類;例えばアセトニトリル等のニトリル類;例えばN,N−ジメチルホルムアミド等のアミド類;等が挙げられ、これらは夫々単独でも或いは二種以上適宜組み合わせて用いてもよい。
第四の態様において、反応溶媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0〜100倍体積、より好ましくは0〜50倍体積、さらに好ましくは0〜20倍体積である。
【0049】
第四の態様において、反応温度は、好ましくは0〜200℃、より好ましくは20〜200℃、さらに好ましくは20〜150℃である。また、反応時間は、通常0.5〜200時間であるのが好ましく、0.5〜36時間であるのがより好ましく、0.5〜12時間であるのがさらに好ましい。
【0050】
尚、上記した如き、一般式[2]で表される化合物と一般式[3]で表される化合物の種々の反応(上記第一〜第四の態様を含む)において、反応液から本発明の一般式[1]で表される化合物を精製する際には、一般式[1]で表される化合物がその分子中に重合性二重結合を有していることから、重合禁止剤を使用して該化合物が重合しないようにすることが好ましい。
【0051】
重合禁止剤としては、一般的に重合禁止剤(重合防止剤)として使用されるものであればよく、具体的には、例えばp−メトキシフェノール、t−ブチルカテコール、ブチルヒドロキシトルエン、テトラキス[メチレン3−(3,5−ジ−tert−ブチル−4−ヒドロキシフェニル)プロピオネート]メタン(商品名:イルガノックス1010)等のフェノール系化合物、例えばハイドロキノン、2,5−ビス(1,1,3,3−テトラメチルブチル)ハイドロキノン、2,5−ビス(1,1−ジメチルブチル)ハイドロキノン等のハイドロキノン系化合物、例えばN−ニトロソフェニルヒドロキシルアミン、N−ニトロソフェニルヒドロキシルアミンのアルミニウム塩等のニトロソアミン系化合物、無機塩として臭化リチウム等が挙げられる。尚、重合禁止剤の使用量は、一般式[1]で表される化合物の重量に対して好ましくは10〜10000ppm、より好ましくは100〜500ppmとなる量である。本発明の化合物を光ファイバ用途とする場合、残留する重合禁止剤は、損失悪化、特に高温時の着色に伴う損実悪化が懸念される。そのため、蒸留やカラムによる吸着などの既知の方法で除くことができる。重合禁止剤、例えばテトラキス[メチレン3−(3,5−ジ−tert−ブチル−4−ヒドロキシフェニル)プロピオネート]メタン等を好ましく用いることができる。また、その除去の目安としては、残留量がモノマーに対する質量換算で50ppm以下、好ましくは10ppm以下、より好ましくは5ppm以下である。
【0052】
本発明の一般式[1]で表される化合物は、分子中に重合性二重結合を有していることから、それを単独で或いは種々のモノマーと共に重合反応に付すことにより、容易にホモポリマー或いは種々のコポリマーが得られる。具体的には、本発明の前記一般式[1]で表される化合物とともに、該化合物が硬化可能な範囲で種々の添加剤を含有する重合性組成物を調製し、該組成物を重合することによって、種々の組成の重合体を得ることができる。重合条件や得られる重合体の物性を調整するために、重合開始剤および連鎖移動剤をはじめとする各種添加剤を任意に添加してもよい。本明細書において、一般式[1]で表される化合物それ自体、又は該化合物と添加剤との混合物を重合性組成物という。
【0053】
本発明の一般式[1]で表される化合物は、R1、R2及びR3で表される基が有する水素原子の一部または全部を重水素化するだけでなく、R4で表される基が有する水素原子をも重水素化されていることから、これを重合して得られたポリマーは、R4で表される基が有する水素原子が全て軽水素原子である化合物に比べ特定波長領域における透明性に優れている。尚、一般式[1]で表される化合物が有する水素原子のうちの重水素原子の割合(重水素化率)が高くなるにつれ、該化合物を重合して得られるポリマーの特定波長領域における透明性は向上する。なお、本明細書において、前記一般式[1]で表される化合物もしくは該化合物を重合させてなる重合体が有する水素原子のうち重水素原子に置換された比率を重水素化率とする。また、重水素化率0%とは、化合物もしくは重合体の有する水素原子がすべて軽水素からなることを意味する。なお、重水素の天然存在比は0.015%のため重水素置換を行わない化合物の重水素化率は0%と見なすことができる。
【0054】
本発明の一般式[1]で表される化合物の一種或いは二種以上を重合して得られるポリマーのガラス転移温度(以下、Tgと略記する場合がある。)は、耐熱性を要求される用途の場合には150〜180℃となる様に調整することが好ましく、より好ましくは170〜180℃である。
【0055】
本発明の一般式[1]で表される化合物(以下、「本発明の化合物」という場合がある)は、従来用いられていた、重水素化されたアダマンチル基を有するメタクリル酸エステル化合物と同等あるいはそれ以上のガラス転移温度(Tg値)を有しているものの、従来の重水素化されたアダマンチル基を有するメタクリル酸エステル化合物に比べ、その原料が安価であるため、極めて低コストでの製造が可能となることから、工業的に有利に使用し得る化合物であるといえる。
【0056】
上記した如き本発明の化合物は、反応機構や物質代謝などを調査する際の標識化合物として有用であり、またこれを重合あるいは他のモノマーと共重合して得られるポリマーは、例えば、光学部材、レジスト材料、光データ記録媒体などに有用であり、その優れた透明性を生かした透明性製品等にも利用可能である。本発明の化合物を用いることによって得られる光学部材には、例えば、光導性素子類、スチールカメラ用、ビデオカメラ用、望遠鏡用、眼鏡用、プラスチックコンタクトレンズ用、太陽光集光用等のレンズ類、凹面鏡等が挙げられる。光導性素子類、レンズ類に用いられるのが好ましい。
【0057】
以下は、本発明の化合物の実施態様の一つである光学部材について光ファイバを例として説明する。本実施の形態は、本発明の化合物を重合性モノマーとして使用した重合体を含む領域を有する光ファイバに関する。本実施の形態には、前記重合体を含む領域の屈折率が均一である態様と、分布を持つ態様とがある。その分布構造に応じて、ステップインデックス型プラスチック光ファイバ(SI型POF)、マルチステップインデックス型プラスチック光ファイバ(MSI型POF)、グレーデッドインデックス型プラスチック光ファイバ(GI型POF)と称され、分類されるが、本発明の化合物はいずれの態様のファイバであってもよい。この中でも、GI型POFへの適用が帯域の観点から最も好ましい。MSIやGIにおいて、屈折率を付与する方法として、ドーパントを加える、或いは、屈折率の異なるポリマーを組み合わせる方法が知られている。
【0058】
本発明の重合体を光学部材、特に光ファイバに用いる場合には重合体は透明ポリマーであることが好ましい。なお、本明細書において、「透明ポリマー」とは、利用する波長においてその光線透過率が50%以上、好ましくは70%以上、特に好ましくは90%以上であるポリマーをいうものとする。なお、専ら特定波長域において用いる場合は、全波長領域において光線透過率が高いことは必要ではない。
【0059】
特に、前記一般式[1]で表される化合物を単独重合させた、または他の重合性モノマーと共重合させたポリマーを、光ファイバとして用いると、C−H4倍音に帰属される約910nmの吸収を顕著に減少させることができる。市販されている光源である850nmの光源(VCSEL)用の光ファイバでは、該光ファイバの910nmの吸収の裾が伝送損失に影響を与える場合がある。前記ポリマーからなる光ファイバは、約910nmの吸収が顕著に小さいので、その影響も少なく、伝送損失を格段に軽減させることができる。前記ポリマーの波長910nmの吸収の吸光度は、同一構造を有する非重水素化、言い換えれば重水素化率0%、の重合体と比較して、50%以下であるのが好ましい。
【0060】
本発明の化合物の単独重合、もしくは本発明の化合物と不飽和エチレン性モノマーとの共重合することによって、光ファイバの材料として使用可能な透明性ポリマーを製造することができる。本発明の化合物と共重合可能な不飽和エチレン性モノマーとしては、例えば、アクリル酸エステル類、メタクリル酸エステル類、アクリルアミド類、メタクリルアミド類、マレイミド類、ビニルエステル類、ビニルケトン類、アリル化合物、オレフィン酸、ビニルエーテル類、N−ビニルアミド類、ビニル異節環化合物、マレイン酸エステル類、イタコン酸エステル類、フマル酸エステル類、クロトン酸エステル類などがある。中でも、(メタ)アクリル酸エステル類が好ましく、メタクリル酸エステル類がより好ましく、メチルメタクリレートが特に好ましい。また、ポリマーの透明性の観点から、これらの不飽和エチレン性モノマーは重水素化されているのが好ましい。特に、本発明の化合物と重水素化メチルメタクリレートとを共重合することによって得られるコポリマーは、光ファイバ用のポリマーとして非常に有用である。なお、共重合比は目的とする特性値、用いる共重合モノマーの種類に応じて、適切な値に調整することができる。
【0061】
該透明性ポリマーを調製する際には、目的とする光学部材に合わせて、公知の重合開始剤、連鎖移動剤を用いて適当な分子量に調整することが可能である。好ましい開始剤、連鎖移動剤は国際公開WO03/19252号公報に記載のパーオキサイド系化合物や、2,2’−アゾビスイソブチロニトリル、2,2’−アゾビス(2−メチルブチロニトリル)、1,1’−アゾビス(シクロヘキサン−1−カルボニトリル)、2,2’−アゾビス(2−メチルプロパン)、2,2’−アゾビス(2−メチルブタン)、2,2’−アゾビス(2−メチルペンタン)、2,2’−アゾビス(2,3−ジメチルブタン)、2,2’−アゾビス(2−メチルヘキサン)、2,2’−アゾビス(2,4−ジメチルペンタン)、2,2’−アゾビス(2,3,3−トリメチルブタン)、2,2’−アゾビス(2,4,4−トリメチルペンタン)、3,3’−アゾビス(3−メチルペンタン)、3,3’−アゾビス(3−メチルヘキサン)、3,3’−アゾビス(3,4−ジメチルペンタン)、3,3’−アゾビス(3−エチルペンタン)、ジメチル−2,2’−アゾビス(2−メチルプロピオネート)、ジエチル−2,2’−アゾビス(2−メチルプロピオネート)、ジ−tert−ブチル−2,2’−アゾビス(2−メチルプロピオネート)などのアゾ系化合物が挙げられる。なお、重合開始剤は勿論これらに限定されるものではなく、2種類以上を併用して用いることができる。重合体の分子量としては、機械特性や透明性などの各物性をバランスよく満足させるために重量平均分子量で10000〜1000000の範囲とすることが好ましい。重合法も溶液重合、懸濁重合、塊状重合、乳化重合などを公知の重合法を採用でき、透明性の観点からは塊状重合が好ましい。さらに、屈折率調整成分を添加して屈折率を調整することも可能であり、界面ゲル重合法を利用すれば、所望の方向に沿って屈折率分布を付与することも可能である。
【0062】
屈折率調整成分は、これを添加することにより重合性組成物のみからなる重合体に、それが元々有する屈折率と異なる屈折率を付与する成分であり、低分子化合物であっても高分子化合物であってもよい。その屈折率差(屈折率調整成分を添加することによって生じる屈折率差)は、0.005以上であるのが好ましい。屈折率調整成分は、これを含有する重合体が無添加の重合体と比較して、屈折率が高くなる性質を有するものを用いるのが好ましい。また、屈折率調整成分は重合性化合物であってもよく、重合性化合物が屈折率調整成分の場合は、これを共重合成分として含む共重合体がこれを含まない重合体と比較して、屈折率が上昇する性質を有するものを用いるのが好ましい。上記性質を有し、重合体と安定して共存可能で、且つ前述の原料である本発明の化合物の重合条件(加熱及び加圧等の重合条件)下において安定であるものを、屈折率調整成分として用いることができる。この屈折率調整成分をポリマー中に添加することにより、用途や目的に応じて屈折率の値や分布の形態を所望の値に調整することができる。例えば、国際公開WO03/19252号公報、特開2003−75656号公報、特開2003−149463号公報に記載の方法によれば、コア部の屈折率が分布する様に形成することができ、得られる光学部材は広い伝送帯域を有する屈折率分布型プラスチック光学部材となる。
【0063】
前記屈折率調整成分としては、低分子化合物として、例えば、安息香酸ベンジル(BEN)、硫化ジフェニル(DPS)、リン酸トリフェニル(TPP)、フタル酸ベンジルn−ブチル(BBP)、フタル酸ジフェニル(DPP)、ビフェニル(DP)、ジフェニルメタン(DPM)、リン酸トリクレジル(TCP)、ジフェニルスルホキシド(DPSO)などが挙げられる。中でも、BEN、DPS、TPP、及びDPSOが好ましい。前記屈折率調整成分としては、一般式[1]で表される化合物と共重合可能なモノマーとして、例えば、ベンジルメタクリレート、フェニルメタクリレート、ブロモフェニルメタクリレートなどが挙げられる。なお、本発明に用いられる態様においては特にこれらの化合物中に存在する水素原子を重水素原子に置換するのが好ましく、例えば重水素化ブロモベンゼンなども広い波長域での透明性を向上させる目的で用いることが出来る。
【0064】
これらの屈折率調整成分の濃度及び分布を調整することによって、屈折率を所望の値に変化させることができるが、その種類や添加量は、用途に応じて適宜選ばれる。屈折率調整成分は、複数種類添加してもよい。
【0065】
本発明の光学材料、部品の製造方法としては、射出成形法、圧縮成形法、マイクロモールド法、フローティングモールド法、インジェクションコンプレッション成形法、キャスト成形法等の公知の成形法を利用することができる。さらに、上記のような成形法により得られた成形品表面に、各種のコーティングを施すことにより、耐湿性、光学特性、耐薬品性、耐磨耗性、曇り止めなどを向上させてもよい。
【実施例】
【0066】
以下に実施例を挙げて本発明をさらに具体的に説明する。以下の実施例に示す材料、試薬、割合、操作等は、本発明の精神から逸脱しない限り適宜変更することができる。したがって、本発明の範囲は以下に示す実施例に制限されるものではない。
【0067】
(参考例1:トリシクロ[5.2.1.02,6]デカン−3−エン−8−オールの重水素化)
トリシクロ[5.2.1.02,6]デカン−3−エン−8−オール 45g及びパラジウムカーボン(Pd 10%)22.5gを重水(D2O)765mLに懸濁させ、反応系を水素置換した後、油浴中180℃で約48時間反応させた。反応終了後、反応液にn−ヘキサンを加え、触媒を濾去した後、濾液を分液した。得られた有機層の溶媒を減圧留去して、重水素化トリシクロ[5.2.1.02,6]デカン−3−エン−8−オールを40.7g得た(収率90%)。得られた重水素化物の1H−NMR及び2H−NMRを測定して構造解析を行ったところ、得られた重水素化物の平均重水素化率は45%であった。
【0068】
(参考例2:トリシクロ[5.2.1.02,6]デカン−3−エン−8−オールの重水素化)
窒素気流下、パラジウムカーボン(Pd 5%)2gをメタノール200mLに懸濁させ、そこに参考例1で得られたトリシクロ[5.2.1.02,6]デカン−3−エン−8−オール 39.1gをメタノール200mLに溶解させた溶液を加えた。反応系を重水素で置換した後、室温で24時間重水素を導入して反応させた。反応終了後、反応液を濾過し、濾液を減圧留去して、重水素化トリシクロ[5.2.1.02,6]デカン−8−オール38.8gを得た(収率98%)。得られた重水素化物の1H−NMR及び2H−NMRを測定して構造解析を行ったところ、得られた重水素化物の平均重水素化率は52%であった。
【0069】
(参考例3.トリシクロ[5.2.1.02,6]デカン−8−オールの重水素化)
トリシクロ[5.2.1.02,6]デカン−8−オール 20g及びパラジウムカーボン(Pd 10%)4.0gを重水(D2O)340mLに懸濁させ、反応系を水素置換した後、油浴中180℃で約24時間反応させた。反応終了後、反応液にn−ヘキサンを加え、触媒を濾去した後、濾液を分液した。得られた有機層の溶媒を減圧留去して、重水素化トリシクロ[5.2.1.02,6]デカン−8−オール 12.1gを得た(収率61%)。得られた重水素化物の1H−NMR及び2H−NMRを測定して構造解析を行ったところ、得られた重水素化物の平均重水素化率は56%であった。
【0070】
(実施例1:本発明の化合物の合成)
参考例2で得られた重水素化トリシクロ[5.2.1.02,6]デカン−8−オール 38.1g及びトリエチルアミン25.3gをジクロロメタン120mLに溶解し、氷冷下、全ての水素原子が重水素化されている塩化メタクリロイル28.8gを滴下し、室温で2時間反応させた。反応終了後、析出した結晶を濾去し、濾液にp−メトキシフェノールを加えたものを減圧蒸留して、沸点が103〜108℃/2Torrの重水素化された無色油状トリシクロ[5.2.1.02,6]デカンメタクリレート 37.8gを得た(収率67%)。得られた重水素化物の1H−NMR及び2H−NMRを測定して構造解析を行ったところ、化合物全体の重水素化率は65.7%であった。この化合物を以下、「WDM−6」という。
【0071】
(実施例2:ホモポリマーの合成)
実施例1で得られたWDM−6 1.0gにジメチル2,2’−アゾビス(2−メチルプロピオネート)[和光純薬工業社製、商品名V−601]1mgを添加した後、真空下、70℃で6時間重合反応させた。重合反応終了後、得られた反応液にアセトニトリルを注入して沈殿させ、析出した固体を濾取し、これを減圧乾燥して白色粉末状の重水素化ポリ(トリシクロ[5.2.1.02,6]デカンメタクリレート)0.7gを得た。得られたポリマーのガラス転移温度は約175℃であった。
【0072】
(実施例3:コポリマーの合成)
実施例1で得られたWDM−6 1.0gと、重水素化メチルメタクリレート(MMA−d8)5.0gとを混合し、ジメチル2,2’−アゾビス(2−メチルプロピオネート)[和光純薬工業社製、商品名V−601]1mg、ラウリルメルカプタン 1.5mgを添加した後、真空下70℃で、6時間重合反応させた。重合反応終了後、得られた反応液にメタノールを注入して沈殿させ、析出した固体を濾取し、これを減圧乾燥して白色粉末状の重水素化ポリ(トリシクロ[5.2.1.02,6]デカンメタクリレート/メチルメタクリレート)5.6gを得た。得られたポリマーの重量平均分子量は、9.5万、分子量分布は2.1であった。ガラス転移温度は約125℃であった。
【0073】
(実施例4〜6)
実施例1で得られたWDM−6(全重水素化率65.7%、側鎖重水素化率56%)を単独で、またはWDM−6と重水素化メチルメタクリレート(MMA−d8)とを重量比にして、25/75と50/50の2種類のモノマー混合溶液をそれぞれ調製し、重合開始剤としてジメチル−2,2’−アゾビス(2−メチルプロピオネート)をモノマー混合液に対して0.14重量%、連鎖移動剤としてn−ラウリルメルカプタンをモノマー混合液に対して0.2重量%配合して重合性組成物をそれぞれ調製した。該重合性組成物を窒素にて5分間脱気した後、密閉して、70℃で24時間、90℃で24時間、さらに105℃で3時間重合させてポリマーロッドをそれぞれ作製した。
こうして得られた各ポリマーロッドの両末端をダイヤモンドカッターで切断し、さらに切断表面を光学的な研磨を施し、それぞれ実施例4〜6とした。実施例5および6について、近赤外吸収スペクトル測定した。結果を図1に示す。
【0074】
(比較例1)
トリシクロ[5.2.1.02,6]デカンメタクリレート(全重水素化率0%;以下「TCDMA」という)、重合開始剤としてジメチル−2,2’−アゾビス(2−メチルプロピオネート)をモノマーに対して0.14重量%、連鎖移動剤としてn−ラウリルメルカプタンをモノマー混合液に対して0.2重量%配合して重合性組成物を調製した。該重合性組成物を窒素にて5分間脱気した後、密閉して、70℃で24時間、90℃で24時間、さらに105℃で3時間重合させてポリマーロッドを得た。
こうして得られたポリマーロッドの両末端をダイヤモンドカッターで切断し、さらに切断表面を光学的な研磨を施し、比較例1とした。近赤外吸収スペクトルを測定した。その結果を図1にあわせて示す。
【0075】
図1に示す近赤外吸収スペクトルの結果より、本発明の化合物WDM−6と重水素化メチルメタクリレートとの共重合体からなるポリマーロッドは、重水素化率0%の化合物を重合して得られたポリマーロッドと比較して、約730nmや約910nmのC−H4倍音の吸収が顕著に小さいことがわかる。このことにより、例えば、WDM−6のと重水素化メチルメタクリレートとの共重合体を、市販の850nmの光源(VCSEL)用の光ファイバの材料として用いた場合、910nmの吸収の裾が伝送損失に影響をほとんど与えず、透明で、伝送損失が小さい光ファイバとなることがわかる。さらにガラス転移温度が高いため、良好な耐熱性も有している。従って、前記ポリマーを、例えば、国際公開WO03/019252号公報に記載の方法で延伸し、ファイバ化することで耐熱性が高くC−H高調波振動吸収の非常に小さい、透明な光ファイバを得ることができる。
【産業上の利用可能性】
【0076】
本発明によれば、重水素化率が高く、且つその原料が安価であり、したがってコスト面で工業的に有利に使用し得る、重水素化化合物を提供することができる。また、各種モノマーと共重合させることにより、高温環境等の過酷な条件下でも使用し得る耐熱性を有し、透明性に優れ光伝送損失の少ない、大容量高速伝送システム等に使用可能な光ファイバ用の原料ポリマーを得ることが可能となる。
【図面の簡単な説明】
【0077】
【図1】実施例5及び6ならびに比較例1で測定されたポリマーロッドの近赤外吸収スペクトルの測定結果である。
【技術分野】
【0001】
本発明は、新規な重水素化(メタ)アクリル酸エステル化合物、特に耐熱性や透明性に優れた光ファイバ用ポリマーの原料として有用な、重水素化(メタ)アクリル酸エステル化合物及びこれを用いて得られるポリマーに関する。
【背景技術】
【0002】
従来、一般的な光ファイバ用ポリマーとして、重水素化メタクリル酸メチルと種々の重水素化(メタ)アクリル酸エステルとの共重合体が用いられているが、実用上多くの問題が残されている。例えば、重水素化率の低い重水素化(メタ)アクリル酸エステルと重水素化メタクリル酸メチルとを共重合させて得られるポリマー(特開昭63−130563号公報)は、重水素化(メタ)アクリル酸エステル中にC−H結合が依然多く存在しており、該化合物を用いて得られるポリマーの透明性が悪く、また光伝送損失が大きくなる。従って、この様なポリマーは大容量高速伝送システムに使用される光ファイバ原料として好ましいものとはいえない。
【0003】
また、例えば、重水素化(メタ)アクリル酸ノルボルニルと重水素化メタクリル酸メチルとを共重合させて得られるポリマー(特開昭63−130563号公報)は、自動車エンジン等に使用する等の過酷な条件下で使用する光ファイバの原料としては、耐熱性が不充分である。
【0004】
一方、重水素化されていないメタクリル酸エステル化合物と重水素化メタクリル酸メチルとの共重合体を主体とするポリマーを、光ファイバの原料として使用することも試みられている。中でも、例えば、メタクリル酸シクロヘキシル系化合物、メタクリル酸ボルニル、メタクリル酸フェンチル、メタクリル酸メンチル等の脂環式炭化水素基を有するメタクリル酸エステルを、重水素化メタクリル酸メチルと共重合させて得られるポリマー(特開昭60−098407号公報及び特開昭60−125807号公報)は、上記と同様、脂環式炭化水素基を有するメタクリル酸エステル中にC−H結合が多く存在しているため、該化合物を用いて得られるポリマーは使用に適した光源波長が限定されるため大容量高速伝送システムに使用される光ファイバ原料として好ましいものとはいえない。
【0005】
また、重水素化されているまたは重水素化されていない(メタ)アクリル酸アダマンチル或いはその誘導体を、重水素化メタクリル酸メチルと共重合させて得られるポリマー(特開昭60−125807号公報及び特開平9−235322号公報)は、ある程度の耐熱性があるといえるが、その原料モノマーである(メタ)アクリル酸アダマンチル或いはその誘導体の合成に必要なアダマンチル骨格を有する化合物が極めて高価なものであることから、工業的生産にこれを使用することは不利であり、このような原料モノマーを用いて得られるポリマーはコスト面で実用的でないという問題を有している。
【0006】
このような状況から、重水素化メタクリル酸メチルと共重合することにより、高温環境等の過酷な条件下でも使用し得る耐熱性を有し、且つ透明性に優れ、光伝送損失の少ない大容量高速伝送システム用光ファイバの原料ポリマーとなる、工業的により安価で実用的な重水素化モノマー化合物の創製が望まれている。
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明の目的は、工業的に安価に製造可能で、且つ重水素化率の高い重水素化(メタ)アクリル酸エステル及びこれを用いて得られるポリマーを提供することである。また、本発明の他の目的は、高温環境下等の過酷な条件下でも使用し得る、耐熱性及び透明性に優れた光ファイバ用の原料として使用可能な、重水素化モノマー化合物及びポリマーを提供することである。
【課題を解決するための手段】
【0008】
本発明は、前記目的を達成する、下記一般式[1]
【0009】
【化1】

【0010】
(式中、R1及びR2は夫々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は夫々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である。)で表される化合物を提供する。
【0011】
前記炭素数5〜7の炭化水素環が飽和炭化水素環であっても、不飽和炭化水素環であってもよく、飽和炭化水素環としては、シクロペンタン環、シクロヘキサン環及びノルボルナン環からなる群より選ばれる環;不飽和炭化水素環としては、シクロペンテン環、シクロヘキセン環及びノルボルネン環からなる群より選ばれる環が挙げられる。また、前記一般式[1]で表される化合物が有する水素原子の20%以上(より好ましくは40%以上)が重水素原子であるのが好ましい。また、本発明の態様として、前記一般式[1]で表される化合物が有する軽水素原子が15個以下である前記化合物;R4で表される基が有する水素原子の10%以上が重水素原子である前記化合物;R4で表される基が有する軽水素原子が12個以下である前記化合物;前記一般式[1]におけるR4で表される基が、トリシクロ[5.2.1.02,6]デシル基であって、当該基中の水素原子の少なくとも1つが重水素原子である前記化合物;が提供される。
【0012】
また、別の観点から、本発明によって、前記一般式[1]で表される化合物を含有する重合性組成物を重合させてなる重合体;重合体が有する水素原子の50%以上が重水素原子である前記重合体;前記重合体を含む領域を少なくとも有する光学部材;および全水素原子が軽水素であること以外は同一構造の重合体と比較して910nmにおける吸光度が50%以下である前記光学部材;が提供される。
【0013】
なお、本明細書において、「水素原子」とは軽水素原子及び重水素原子を総称するものであり、重水素原子とはジュウテリウム(D)又はトリチウム(T)を意味する。
さらに、本明細書において、「重水素原子比率」とは、化合物中又は基中の全水素原子の総数に対する重水素原子の数の比を意味する。
【発明の実施の形態】
【0014】
以下、本発明の実施形態について以下詳細に説明する。
本発明は、下記一般式[1]で表される化合物に関する。
【0015】
【化2】

【0016】
式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は各々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である。
【0017】
前記式中、R1及びR2は、いずれか一方が重水素原子であるのが好ましく、R1及びR2の両方が重水素原子であるのがより好ましい。
【0018】
前記式中、R3が水素原子を表す場合には、それが重水素原子であるが好ましく、R3がメチル基を表す場合には、該メチル基の3つの水素原子のうち、少なくとも1つが重水素原子であるのが好ましく、少なくとも2つが重水素原子であるのがより好ましく、3つの水素原子全てが重水素原子であるのがさらに好ましい。尚、R3は、3つ全ての水素原子が重水素化されたメチル基であることが最も好ましい。
【0019】
前記式中、ノルボルナン環と縮合してR4で表される基を形成する、炭素数5〜7の炭化水素環としては、例えば飽和炭化水素環、不飽和炭化水素環等が挙げられ、それらは架橋されていてもよい。
前記飽和炭化水素環の具体例としては、例えばシクロペンタン環、シクロヘキサン環、シクロヘプタン環、ノルボルナン環、トリシクロ[2.2.1.0]ヘプタン環等が挙げられ、中でもシクロペンタン環、シクロヘキサン環、ノルボルナン環が好ましく、特にシクロペンタン環が好ましい。
また、前記不飽和炭化水素環の具体例としては、例えばシクロペンテン環、シクロペンタジエン環、シクロヘキセン環、1,4−シクロヘキサジエン環、1,3−シクロヘキサジエン環、ノルボルネン環、2,5−ノルボルナンジエン環等が挙げられ、中でもシクロペンテン環、シクロヘキセン環、ノルボルネン環が好ましく、特にシクロペンテン環が好ましい。
【0020】
R4で表される基としては、ノルボルナン環と飽和炭化水素環が縮合されて得られる基が好ましく、中でもトリシクロ[5.2.1.02,6]デシル基、トリシクロ[6.2.1.02,7]ウンデシル基、テトラシクロ[6.2.1.13,6.02,7]ドデシル基がより好ましく、その中でもトリシクロ[5.2.1.02,6]デシル基が特に好ましい。
【0021】
上記した如きR4で表される基において、当該基が有する水素原子のうちの少なくとも1つが重水素原子であればよいが、当該基が重水素原子をより多く有していることが好ましい。R4で表される基が有する水素原子のうちの重水素原子の割合は、好ましくは10%以上、より好ましくは20%以上、さらに好ましくは40%以上であり、また、当該基が有する軽水素原子は、好ましくは12個以下、より好ましくは10個以下、さらに好ましくは9個以下である。
【0022】
また、一般式[1]で表される化合物が有する水素原子のうちの重水素原子の割合は、好ましくは20%以上、より好ましくは40%以上、さらに好ましくは50%、さらにより好ましくは60%以上、特に好ましくは65%以上であり、また、当該化合物が有する軽水素原子は、好ましくは15個以下、より好ましくは13個以下、さらに好ましくは11個以下、さらにより好ましくは9個以下である。
【0023】
本発明の前記一般式[1]で表される化合物は、例えば下記一般式[2]
【0024】
【化3】

(式中、Xはハロゲン原子、ヒドロキシル基又はアルコキシ基を表し、R1、R2及びR3は前記一般式[1]中のそれぞれと同義である)で表される化合物と、例えば下記一般式[3]
【0025】
【化4】

(式中、R4は前記一般式[1]中と同義である)で表される化合物とを反応させることにより合成することができる。
【0026】
上記一般式[2]において、Xで表されるハロゲン原子としては、例えば塩素原子、臭素原子、フッ素原子、ヨウ素原子等が挙げられ、中でも塩素原子、臭素原子が好ましく、特に塩素原子が好ましい。
【0027】
また、Xで表されるアルコキシ基としては、直鎖状でも分枝状でも或いは環状でもよく、好ましくは炭素数1〜4、より好ましくは1〜2、さらに好ましくは1のものが挙げられ、具体的には、例えばメトキシ基、エトキシ基、プロピルオキシ基、イソプロピルオキシ基、ブトキシ基、イソブチルオキシ基、sec−ブチルオキシ基、tert−ブチルオキシ基、シクロプロピル基等が挙げられる。
【0028】
上記一般式[2]で表される化合物としては、R1、R2及びR3で表される基が有する水素原子のうち、重水素原子の割合が大きい程好ましく、全ての水素原子が重水素原子であることが最も好ましい。尚、Xがヒドロキシル基又はアルコキシ基である場合、これらの基が有する水素原子は軽水素原子であっても重水素原子であってもよい。
【0029】
上記一般式[2]で表される化合物は、例えば特開昭63−130563号公報等に記載の公知の方法に従って得ることができる。即ち、一般式[2]で表される化合物が有する水素原子の全て或いは一部が軽水素原子である化合物を、アルカリ土類金属塩及び重合禁止剤(重合防止剤)の存在下、重水中で反応させればよい。
【0030】
また、水素原子が軽水素原子であるアクリル酸或いはその酸ハロゲン化物が有する炭素−炭素二重結合が、炭素−炭素三重結合に置き換わった化合物を、水酸化カルシウムの存在下、重水等の重水素化された溶媒中で反応させて、該三重結合を形成する炭素原子に直結した水素原子を重水素化し、さらにこれをリンドラー触媒の存在下で重水素ガスと反応させて三重結合を二重結合に還元すると同時に、得られる二重結合を形成する炭素原子に直結する水素原子を全て重水素化するという方法を用いて、一般式[2]で表される化合物を合成することもできる。尚、この方法により得られる化合物は、一般式[2]で表される化合物のうちのR1、R2及びR3が全て重水素原子であるものである。
【0031】
一般式[3]で表される化合物は、例えば一般式[3]中のR4で表される基が有する水素原子が全部又は一部軽水素原子である化合物を、軽水素ガス雰囲気下、パラジウム触媒を用いて重水と反応させることによって得ることができる。
【0032】
本発明の一般式[1]で表される化合物のうち、R4がノルボルナン環と炭素数5〜7の飽和炭化水素環との縮合環からなる基であるものを得るには、一般式[3]で表される化合物のうち、R4がノルボルナン環と炭素数5〜7の飽和炭化水素環との縮合環からなる基であるものと、一般式[2]で表される化合物とを反応させればよい。
また、本発明の一般式[1]で表される化合物のうち、R4がノルボルナン環と炭素数5〜7の飽和炭化水素環との縮合環からなる基であるものを得るには、一般式[3]で表される化合物のうち、R4が前記飽和炭化水素環に対応する不飽和炭化水素環とノルボルナン環との縮合環である化合物を原料として用い、一旦該化合物が有する不飽和炭化水素環の不飽和結合を還元してから、一般式[2]で表される化合物と反応させて製造してもよい。尚、不飽和炭化水素環の不飽和結合を還元する際、重水素ガスを用いて還元を行えば、R4で表される基の軽水素原子の重水素化と不飽和結合の還元とを同時に行うことができる。
【0033】
本発明の一般式[1]で表される化合物を得る際、一般式[2]中のXがハロゲン原子である化合物を用いる場合には、適当な塩基を用い、所望により適当な溶媒中で、前記一般式[3]で表される化合物と反応させてもよい(以下、「第一の態様」という)。
第一の態様において、一般式[3]で表される化合物の使用量は、一般式[2]で表される化合物に対して、好ましくは0.8〜1000倍モル、より好ましくは0.8〜100倍モル、さらに好ましくは0.8〜50倍モル、さらにより好ましくは0.8〜10倍モルである。
【0034】
第一の態様において使用される塩基としては、酸ハロゲン化物とアルコールとの一般的なエステル化反応に使用できるものが挙げられ、具体的には、例えばトリエチルアミン、N,N−ジメチルアニリン、ピペリジン、ピリジン、4−ジメチルアミノピリジン、N−メチルモルホリン、1,5−ジアザビシクロ[4.3.0]ノナ−5−エン、1,8−ジアザビシクロ[5.4.0]ウンデカ−7−エン、トリ−n−ブチルアミン等の有機アミン類;例えば水素化ナトリウム、n−ブチルリチウム等のアルカリ金属化合物類;等が挙げられる。
第一の態様において、塩基の使用量は、使用する一般式[2]で表される化合物に対して、好ましくは1〜50倍モル、より好ましくは1〜20倍モル、さらに好ましくは1〜5倍モルである。
【0035】
第一の態様において、所望により用いられる反応溶媒としては、例えばジエチルエーテル、ジイソプロピルエーテル、エチルメチルエーテル、テトラヒドロフラン、1,4−ジオキサン、ジメトキシエタン等のエーテル類;例えばクロロメタン、塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、トリクロロエタン、クロロベンゼン等のハロゲン化炭化水素類;例えばn−ヘキサン、ベンゼン、トルエン、キシレン等の炭化水素類;例えば酢酸エチル、酢酸ブチル、プロピオン酸メチル等のエステル類;例えばアセトニトリル等のニトリル類;例えばN,N−ジメチルホルムアミド等のアミド類;等が挙げられ、これらはそれぞれ単独でも或いは二種以上適宜組み合わせて用いてもよい。
第一の態様において、反応溶媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0〜100倍体積、より好ましくは0〜50倍体積、さらに好ましくは0〜20倍体積となる量である。
【0036】
第一の態様において、反応温度は、好ましくは−20〜200℃、より好ましくは−20〜100℃、さらに好ましくは−10〜70℃である。また、反応時間は、好ましくは0.5〜200時間、より好ましくは0.5〜36時間、さらに好ましくは0.5〜12時間である。
【0037】
また、本発明の一般式[1]で表される化合物を得る際、一般式[2]におけるXがヒドロキシル基である化合物を用いる場合には、これを適当な脱水縮合剤を用いるかまたは適当な酸触媒を用いて、所望により適当な溶媒中で一般式[3]で表される化合物と反応させてもよい(以下、前者を「第二の態様」、後者を「第三の態様」という)。
【0038】
前記第二および第三の態様において、一般式[3]で表される化合物の使用量は、一般式[2]で表される化合物に対して、好ましくは0.8〜1000倍モル、より好ましくは0.8〜100倍モル、さらに好ましくは0.8〜50倍モル、よりさらに好ましくは0.8〜10倍モルである。
【0039】
前記第二の態様において、使用可能な脱水縮合剤としては、例えば一般に脱水縮合剤として使用されるものであればよく、例えば五酸化二リン、無水塩化亜鉛等の無機脱水剤類;例えばジシクロヘキシルカルボジイミド、ジイソプロピルカルボジイミド、1−エチル−3−(3−ジメチルアミノプロピルカルボジイミド)塩酸塩等のカルボジイミド類;例えばポリリン酸、無水酢酸、カルボニルジイミダゾ−ル、p−トルエンスルホニルクロライド;等が挙げられ、その使用量は、一般式[3]で表される化合物に対して好ましくは1〜50倍モル、より好ましくは1〜30倍モル、さらに好ましくは1〜10倍モルである。
【0040】
前記第二の態様において、所望により用いられる反応溶媒としては、例えばジエチルエーテル、ジイソプロピルエーテル、エチルメチルエーテル、テトラヒドロフラン、1,4−ジオキサン、ジメトキシエタン等のエーテル類;例えばアセトン、ジメチルケトン、メチルエチルケトン、ジエチルケトン、2−ヘキサノン、t−ブチルメチルケトン、シクロペンタノン、シクロヘキサノン等のケトン類;例えばクロロメタン、塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、トリクロロエタン、クロロベンゼン等のハロゲン化炭化水素類;例えばn−ヘキサン、ベンゼン、トルエン、キシレン等の炭化水素類;例えば酢酸エチル、酢酸ブチル、プロピオン酸メチル等のエステル類;例えばアセトニトリル等のニトリル類;例えばN,N−ジメチルホルムアミド等のアミド類;等が挙げられ、これらは夫々単独でも或いは二種以上適宜組み合わせて用いてもよい。
第二の態様において、反応溶媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0〜100倍体積、より好ましくは0〜50倍体積、さらに好ましくは0〜20倍体積である。
【0041】
第二の態様において、反応温度は、好ましくは−20〜100℃、より好ましくは−20〜80℃、さらに好ましくは−10〜50℃である。また、反応時間は、好ましくは0.5〜200時間、より好ましくは0.5〜36時間、さらに好ましくは0.5〜12時間である。
【0042】
第三の態様において、酸触媒としては、例えば塩酸、硫酸、無水リン酸等の鉱酸類、p−トルエンスルホン酸、エタンスルホン酸等の有機酸類;例えば三フッ化ホウ素エーテラート等のルイス酸;等が挙げられる。
第三の態様において、酸触媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0.01〜0.5倍モル、より好ましくは0.01〜0.2倍モル、さらに好ましくは0.01〜0.1倍モルである。
【0043】
第三の態様において、所望により用いられる反応溶媒としては、例えばジエチルエーテル、ジイソプロピルエーテル、エチルメチルエーテル、テトラヒドロフラン、1,4−ジオキサン、ジメトキシエタン等のエーテル類;例えばクロロメタン、塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、トリクロロエタン、クロロベンゼン等のハロゲン化炭化水素類;例えばn−ヘキサン、ベンゼン、トルエン、キシレン等の炭化水素類;等が挙げられ、これらはそれぞれ単独でも或いは二種以上適宜組み合わせて用いてもよい。
第三の態様において、反応溶媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0〜100倍体積、より好ましくは0〜50体積、さらに好ましくは0〜20体積である。
【0044】
第三の態様において、反応温度は、好ましくは0〜200℃、より好ましくは20〜200℃、さらに好ましくは20〜150℃である。また、反応時間は、好ましくは0.5〜200時間、より好ましくは0.5〜36時間、さらに好ましくは0.5〜12時間である。
【0045】
さらにまた、本発明の一般式[1]で表される化合物を得る際、一般式[2]中のXがアルコキシ基である化合物を用いる場合には、これを適当な酸又は塩基触媒を用い、所望により適当な溶媒中で一般式[3]で表される化合物とエステル交換反応させてもよい(以下、「第四の態様」という)。
【0046】
第四の態様において、一般式[3]で表される化合物の使用量は、一般式[2]で表される化合物に対して、好ましくは0.8〜1000倍モル、より好ましくは0.8〜100倍モル、さらに好ましくは0.8〜50倍モル、さらにより好ましくは0.8〜10倍モルである。
【0047】
第四の態様において使用可能な酸又は塩基触媒としては、エステルとアルコールの一般的なエステル交換に使用されるものが挙げられ、酸触媒の具体例としては、例えば硫酸、p−トルエンスルホン酸等が挙げられる、塩基触媒の具体例としては、例えばカリウムt−ブトキシド、ナトリウムメトキシド等が挙げられる。
【0048】
第四の態様において、所望により用いられる反応溶媒としては、例えばジエチルエーテル、ジイソプロピルエーテル、エチルメチルエーテル、テトラヒドロフラン、1,4−ジオキサン、ジメトキシエタン等のエーテル類;例えばクロロメタン、塩化メチレン、クロロホルム、四塩化炭素、ジクロロエタン、トリクロロエタン、クロロベンゼン等のハロゲン化炭化水素類;例えばn−ヘキサン、ベンゼン、トルエン、キシレン等の炭化水素類;例えばアセトニトリル等のニトリル類;例えばN,N−ジメチルホルムアミド等のアミド類;等が挙げられ、これらは夫々単独でも或いは二種以上適宜組み合わせて用いてもよい。
第四の態様において、反応溶媒の使用量は、一般式[2]で表される化合物に対して、好ましくは0〜100倍体積、より好ましくは0〜50倍体積、さらに好ましくは0〜20倍体積である。
【0049】
第四の態様において、反応温度は、好ましくは0〜200℃、より好ましくは20〜200℃、さらに好ましくは20〜150℃である。また、反応時間は、通常0.5〜200時間であるのが好ましく、0.5〜36時間であるのがより好ましく、0.5〜12時間であるのがさらに好ましい。
【0050】
尚、上記した如き、一般式[2]で表される化合物と一般式[3]で表される化合物の種々の反応(上記第一〜第四の態様を含む)において、反応液から本発明の一般式[1]で表される化合物を精製する際には、一般式[1]で表される化合物がその分子中に重合性二重結合を有していることから、重合禁止剤を使用して該化合物が重合しないようにすることが好ましい。
【0051】
重合禁止剤としては、一般的に重合禁止剤(重合防止剤)として使用されるものであればよく、具体的には、例えばp−メトキシフェノール、t−ブチルカテコール、ブチルヒドロキシトルエン、テトラキス[メチレン3−(3,5−ジ−tert−ブチル−4−ヒドロキシフェニル)プロピオネート]メタン(商品名:イルガノックス1010)等のフェノール系化合物、例えばハイドロキノン、2,5−ビス(1,1,3,3−テトラメチルブチル)ハイドロキノン、2,5−ビス(1,1−ジメチルブチル)ハイドロキノン等のハイドロキノン系化合物、例えばN−ニトロソフェニルヒドロキシルアミン、N−ニトロソフェニルヒドロキシルアミンのアルミニウム塩等のニトロソアミン系化合物、無機塩として臭化リチウム等が挙げられる。尚、重合禁止剤の使用量は、一般式[1]で表される化合物の重量に対して好ましくは10〜10000ppm、より好ましくは100〜500ppmとなる量である。本発明の化合物を光ファイバ用途とする場合、残留する重合禁止剤は、損失悪化、特に高温時の着色に伴う損実悪化が懸念される。そのため、蒸留やカラムによる吸着などの既知の方法で除くことができる。重合禁止剤、例えばテトラキス[メチレン3−(3,5−ジ−tert−ブチル−4−ヒドロキシフェニル)プロピオネート]メタン等を好ましく用いることができる。また、その除去の目安としては、残留量がモノマーに対する質量換算で50ppm以下、好ましくは10ppm以下、より好ましくは5ppm以下である。
【0052】
本発明の一般式[1]で表される化合物は、分子中に重合性二重結合を有していることから、それを単独で或いは種々のモノマーと共に重合反応に付すことにより、容易にホモポリマー或いは種々のコポリマーが得られる。具体的には、本発明の前記一般式[1]で表される化合物とともに、該化合物が硬化可能な範囲で種々の添加剤を含有する重合性組成物を調製し、該組成物を重合することによって、種々の組成の重合体を得ることができる。重合条件や得られる重合体の物性を調整するために、重合開始剤および連鎖移動剤をはじめとする各種添加剤を任意に添加してもよい。本明細書において、一般式[1]で表される化合物それ自体、又は該化合物と添加剤との混合物を重合性組成物という。
【0053】
本発明の一般式[1]で表される化合物は、R1、R2及びR3で表される基が有する水素原子の一部または全部を重水素化するだけでなく、R4で表される基が有する水素原子をも重水素化されていることから、これを重合して得られたポリマーは、R4で表される基が有する水素原子が全て軽水素原子である化合物に比べ特定波長領域における透明性に優れている。尚、一般式[1]で表される化合物が有する水素原子のうちの重水素原子の割合(重水素化率)が高くなるにつれ、該化合物を重合して得られるポリマーの特定波長領域における透明性は向上する。なお、本明細書において、前記一般式[1]で表される化合物もしくは該化合物を重合させてなる重合体が有する水素原子のうち重水素原子に置換された比率を重水素化率とする。また、重水素化率0%とは、化合物もしくは重合体の有する水素原子がすべて軽水素からなることを意味する。なお、重水素の天然存在比は0.015%のため重水素置換を行わない化合物の重水素化率は0%と見なすことができる。
【0054】
本発明の一般式[1]で表される化合物の一種或いは二種以上を重合して得られるポリマーのガラス転移温度(以下、Tgと略記する場合がある。)は、耐熱性を要求される用途の場合には150〜180℃となる様に調整することが好ましく、より好ましくは170〜180℃である。
【0055】
本発明の一般式[1]で表される化合物(以下、「本発明の化合物」という場合がある)は、従来用いられていた、重水素化されたアダマンチル基を有するメタクリル酸エステル化合物と同等あるいはそれ以上のガラス転移温度(Tg値)を有しているものの、従来の重水素化されたアダマンチル基を有するメタクリル酸エステル化合物に比べ、その原料が安価であるため、極めて低コストでの製造が可能となることから、工業的に有利に使用し得る化合物であるといえる。
【0056】
上記した如き本発明の化合物は、反応機構や物質代謝などを調査する際の標識化合物として有用であり、またこれを重合あるいは他のモノマーと共重合して得られるポリマーは、例えば、光学部材、レジスト材料、光データ記録媒体などに有用であり、その優れた透明性を生かした透明性製品等にも利用可能である。本発明の化合物を用いることによって得られる光学部材には、例えば、光導性素子類、スチールカメラ用、ビデオカメラ用、望遠鏡用、眼鏡用、プラスチックコンタクトレンズ用、太陽光集光用等のレンズ類、凹面鏡等が挙げられる。光導性素子類、レンズ類に用いられるのが好ましい。
【0057】
以下は、本発明の化合物の実施態様の一つである光学部材について光ファイバを例として説明する。本実施の形態は、本発明の化合物を重合性モノマーとして使用した重合体を含む領域を有する光ファイバに関する。本実施の形態には、前記重合体を含む領域の屈折率が均一である態様と、分布を持つ態様とがある。その分布構造に応じて、ステップインデックス型プラスチック光ファイバ(SI型POF)、マルチステップインデックス型プラスチック光ファイバ(MSI型POF)、グレーデッドインデックス型プラスチック光ファイバ(GI型POF)と称され、分類されるが、本発明の化合物はいずれの態様のファイバであってもよい。この中でも、GI型POFへの適用が帯域の観点から最も好ましい。MSIやGIにおいて、屈折率を付与する方法として、ドーパントを加える、或いは、屈折率の異なるポリマーを組み合わせる方法が知られている。
【0058】
本発明の重合体を光学部材、特に光ファイバに用いる場合には重合体は透明ポリマーであることが好ましい。なお、本明細書において、「透明ポリマー」とは、利用する波長においてその光線透過率が50%以上、好ましくは70%以上、特に好ましくは90%以上であるポリマーをいうものとする。なお、専ら特定波長域において用いる場合は、全波長領域において光線透過率が高いことは必要ではない。
【0059】
特に、前記一般式[1]で表される化合物を単独重合させた、または他の重合性モノマーと共重合させたポリマーを、光ファイバとして用いると、C−H4倍音に帰属される約910nmの吸収を顕著に減少させることができる。市販されている光源である850nmの光源(VCSEL)用の光ファイバでは、該光ファイバの910nmの吸収の裾が伝送損失に影響を与える場合がある。前記ポリマーからなる光ファイバは、約910nmの吸収が顕著に小さいので、その影響も少なく、伝送損失を格段に軽減させることができる。前記ポリマーの波長910nmの吸収の吸光度は、同一構造を有する非重水素化、言い換えれば重水素化率0%、の重合体と比較して、50%以下であるのが好ましい。
【0060】
本発明の化合物の単独重合、もしくは本発明の化合物と不飽和エチレン性モノマーとの共重合することによって、光ファイバの材料として使用可能な透明性ポリマーを製造することができる。本発明の化合物と共重合可能な不飽和エチレン性モノマーとしては、例えば、アクリル酸エステル類、メタクリル酸エステル類、アクリルアミド類、メタクリルアミド類、マレイミド類、ビニルエステル類、ビニルケトン類、アリル化合物、オレフィン酸、ビニルエーテル類、N−ビニルアミド類、ビニル異節環化合物、マレイン酸エステル類、イタコン酸エステル類、フマル酸エステル類、クロトン酸エステル類などがある。中でも、(メタ)アクリル酸エステル類が好ましく、メタクリル酸エステル類がより好ましく、メチルメタクリレートが特に好ましい。また、ポリマーの透明性の観点から、これらの不飽和エチレン性モノマーは重水素化されているのが好ましい。特に、本発明の化合物と重水素化メチルメタクリレートとを共重合することによって得られるコポリマーは、光ファイバ用のポリマーとして非常に有用である。なお、共重合比は目的とする特性値、用いる共重合モノマーの種類に応じて、適切な値に調整することができる。
【0061】
該透明性ポリマーを調製する際には、目的とする光学部材に合わせて、公知の重合開始剤、連鎖移動剤を用いて適当な分子量に調整することが可能である。好ましい開始剤、連鎖移動剤は国際公開WO03/19252号公報に記載のパーオキサイド系化合物や、2,2’−アゾビスイソブチロニトリル、2,2’−アゾビス(2−メチルブチロニトリル)、1,1’−アゾビス(シクロヘキサン−1−カルボニトリル)、2,2’−アゾビス(2−メチルプロパン)、2,2’−アゾビス(2−メチルブタン)、2,2’−アゾビス(2−メチルペンタン)、2,2’−アゾビス(2,3−ジメチルブタン)、2,2’−アゾビス(2−メチルヘキサン)、2,2’−アゾビス(2,4−ジメチルペンタン)、2,2’−アゾビス(2,3,3−トリメチルブタン)、2,2’−アゾビス(2,4,4−トリメチルペンタン)、3,3’−アゾビス(3−メチルペンタン)、3,3’−アゾビス(3−メチルヘキサン)、3,3’−アゾビス(3,4−ジメチルペンタン)、3,3’−アゾビス(3−エチルペンタン)、ジメチル−2,2’−アゾビス(2−メチルプロピオネート)、ジエチル−2,2’−アゾビス(2−メチルプロピオネート)、ジ−tert−ブチル−2,2’−アゾビス(2−メチルプロピオネート)などのアゾ系化合物が挙げられる。なお、重合開始剤は勿論これらに限定されるものではなく、2種類以上を併用して用いることができる。重合体の分子量としては、機械特性や透明性などの各物性をバランスよく満足させるために重量平均分子量で10000〜1000000の範囲とすることが好ましい。重合法も溶液重合、懸濁重合、塊状重合、乳化重合などを公知の重合法を採用でき、透明性の観点からは塊状重合が好ましい。さらに、屈折率調整成分を添加して屈折率を調整することも可能であり、界面ゲル重合法を利用すれば、所望の方向に沿って屈折率分布を付与することも可能である。
【0062】
屈折率調整成分は、これを添加することにより重合性組成物のみからなる重合体に、それが元々有する屈折率と異なる屈折率を付与する成分であり、低分子化合物であっても高分子化合物であってもよい。その屈折率差(屈折率調整成分を添加することによって生じる屈折率差)は、0.005以上であるのが好ましい。屈折率調整成分は、これを含有する重合体が無添加の重合体と比較して、屈折率が高くなる性質を有するものを用いるのが好ましい。また、屈折率調整成分は重合性化合物であってもよく、重合性化合物が屈折率調整成分の場合は、これを共重合成分として含む共重合体がこれを含まない重合体と比較して、屈折率が上昇する性質を有するものを用いるのが好ましい。上記性質を有し、重合体と安定して共存可能で、且つ前述の原料である本発明の化合物の重合条件(加熱及び加圧等の重合条件)下において安定であるものを、屈折率調整成分として用いることができる。この屈折率調整成分をポリマー中に添加することにより、用途や目的に応じて屈折率の値や分布の形態を所望の値に調整することができる。例えば、国際公開WO03/19252号公報、特開2003−75656号公報、特開2003−149463号公報に記載の方法によれば、コア部の屈折率が分布する様に形成することができ、得られる光学部材は広い伝送帯域を有する屈折率分布型プラスチック光学部材となる。
【0063】
前記屈折率調整成分としては、低分子化合物として、例えば、安息香酸ベンジル(BEN)、硫化ジフェニル(DPS)、リン酸トリフェニル(TPP)、フタル酸ベンジルn−ブチル(BBP)、フタル酸ジフェニル(DPP)、ビフェニル(DP)、ジフェニルメタン(DPM)、リン酸トリクレジル(TCP)、ジフェニルスルホキシド(DPSO)などが挙げられる。中でも、BEN、DPS、TPP、及びDPSOが好ましい。前記屈折率調整成分としては、一般式[1]で表される化合物と共重合可能なモノマーとして、例えば、ベンジルメタクリレート、フェニルメタクリレート、ブロモフェニルメタクリレートなどが挙げられる。なお、本発明に用いられる態様においては特にこれらの化合物中に存在する水素原子を重水素原子に置換するのが好ましく、例えば重水素化ブロモベンゼンなども広い波長域での透明性を向上させる目的で用いることが出来る。
【0064】
これらの屈折率調整成分の濃度及び分布を調整することによって、屈折率を所望の値に変化させることができるが、その種類や添加量は、用途に応じて適宜選ばれる。屈折率調整成分は、複数種類添加してもよい。
【0065】
本発明の光学材料、部品の製造方法としては、射出成形法、圧縮成形法、マイクロモールド法、フローティングモールド法、インジェクションコンプレッション成形法、キャスト成形法等の公知の成形法を利用することができる。さらに、上記のような成形法により得られた成形品表面に、各種のコーティングを施すことにより、耐湿性、光学特性、耐薬品性、耐磨耗性、曇り止めなどを向上させてもよい。
【実施例】
【0066】
以下に実施例を挙げて本発明をさらに具体的に説明する。以下の実施例に示す材料、試薬、割合、操作等は、本発明の精神から逸脱しない限り適宜変更することができる。したがって、本発明の範囲は以下に示す実施例に制限されるものではない。
【0067】
(参考例1:トリシクロ[5.2.1.02,6]デカン−3−エン−8−オールの重水素化)
トリシクロ[5.2.1.02,6]デカン−3−エン−8−オール 45g及びパラジウムカーボン(Pd 10%)22.5gを重水(D2O)765mLに懸濁させ、反応系を水素置換した後、油浴中180℃で約48時間反応させた。反応終了後、反応液にn−ヘキサンを加え、触媒を濾去した後、濾液を分液した。得られた有機層の溶媒を減圧留去して、重水素化トリシクロ[5.2.1.02,6]デカン−3−エン−8−オールを40.7g得た(収率90%)。得られた重水素化物の1H−NMR及び2H−NMRを測定して構造解析を行ったところ、得られた重水素化物の平均重水素化率は45%であった。
【0068】
(参考例2:トリシクロ[5.2.1.02,6]デカン−3−エン−8−オールの重水素化)
窒素気流下、パラジウムカーボン(Pd 5%)2gをメタノール200mLに懸濁させ、そこに参考例1で得られたトリシクロ[5.2.1.02,6]デカン−3−エン−8−オール 39.1gをメタノール200mLに溶解させた溶液を加えた。反応系を重水素で置換した後、室温で24時間重水素を導入して反応させた。反応終了後、反応液を濾過し、濾液を減圧留去して、重水素化トリシクロ[5.2.1.02,6]デカン−8−オール38.8gを得た(収率98%)。得られた重水素化物の1H−NMR及び2H−NMRを測定して構造解析を行ったところ、得られた重水素化物の平均重水素化率は52%であった。
【0069】
(参考例3.トリシクロ[5.2.1.02,6]デカン−8−オールの重水素化)
トリシクロ[5.2.1.02,6]デカン−8−オール 20g及びパラジウムカーボン(Pd 10%)4.0gを重水(D2O)340mLに懸濁させ、反応系を水素置換した後、油浴中180℃で約24時間反応させた。反応終了後、反応液にn−ヘキサンを加え、触媒を濾去した後、濾液を分液した。得られた有機層の溶媒を減圧留去して、重水素化トリシクロ[5.2.1.02,6]デカン−8−オール 12.1gを得た(収率61%)。得られた重水素化物の1H−NMR及び2H−NMRを測定して構造解析を行ったところ、得られた重水素化物の平均重水素化率は56%であった。
【0070】
(実施例1:本発明の化合物の合成)
参考例2で得られた重水素化トリシクロ[5.2.1.02,6]デカン−8−オール 38.1g及びトリエチルアミン25.3gをジクロロメタン120mLに溶解し、氷冷下、全ての水素原子が重水素化されている塩化メタクリロイル28.8gを滴下し、室温で2時間反応させた。反応終了後、析出した結晶を濾去し、濾液にp−メトキシフェノールを加えたものを減圧蒸留して、沸点が103〜108℃/2Torrの重水素化された無色油状トリシクロ[5.2.1.02,6]デカンメタクリレート 37.8gを得た(収率67%)。得られた重水素化物の1H−NMR及び2H−NMRを測定して構造解析を行ったところ、化合物全体の重水素化率は65.7%であった。この化合物を以下、「WDM−6」という。
【0071】
(実施例2:ホモポリマーの合成)
実施例1で得られたWDM−6 1.0gにジメチル2,2’−アゾビス(2−メチルプロピオネート)[和光純薬工業社製、商品名V−601]1mgを添加した後、真空下、70℃で6時間重合反応させた。重合反応終了後、得られた反応液にアセトニトリルを注入して沈殿させ、析出した固体を濾取し、これを減圧乾燥して白色粉末状の重水素化ポリ(トリシクロ[5.2.1.02,6]デカンメタクリレート)0.7gを得た。得られたポリマーのガラス転移温度は約175℃であった。
【0072】
(実施例3:コポリマーの合成)
実施例1で得られたWDM−6 1.0gと、重水素化メチルメタクリレート(MMA−d8)5.0gとを混合し、ジメチル2,2’−アゾビス(2−メチルプロピオネート)[和光純薬工業社製、商品名V−601]1mg、ラウリルメルカプタン 1.5mgを添加した後、真空下70℃で、6時間重合反応させた。重合反応終了後、得られた反応液にメタノールを注入して沈殿させ、析出した固体を濾取し、これを減圧乾燥して白色粉末状の重水素化ポリ(トリシクロ[5.2.1.02,6]デカンメタクリレート/メチルメタクリレート)5.6gを得た。得られたポリマーの重量平均分子量は、9.5万、分子量分布は2.1であった。ガラス転移温度は約125℃であった。
【0073】
(実施例4〜6)
実施例1で得られたWDM−6(全重水素化率65.7%、側鎖重水素化率56%)を単独で、またはWDM−6と重水素化メチルメタクリレート(MMA−d8)とを重量比にして、25/75と50/50の2種類のモノマー混合溶液をそれぞれ調製し、重合開始剤としてジメチル−2,2’−アゾビス(2−メチルプロピオネート)をモノマー混合液に対して0.14重量%、連鎖移動剤としてn−ラウリルメルカプタンをモノマー混合液に対して0.2重量%配合して重合性組成物をそれぞれ調製した。該重合性組成物を窒素にて5分間脱気した後、密閉して、70℃で24時間、90℃で24時間、さらに105℃で3時間重合させてポリマーロッドをそれぞれ作製した。
こうして得られた各ポリマーロッドの両末端をダイヤモンドカッターで切断し、さらに切断表面を光学的な研磨を施し、それぞれ実施例4〜6とした。実施例5および6について、近赤外吸収スペクトル測定した。結果を図1に示す。
【0074】
(比較例1)
トリシクロ[5.2.1.02,6]デカンメタクリレート(全重水素化率0%;以下「TCDMA」という)、重合開始剤としてジメチル−2,2’−アゾビス(2−メチルプロピオネート)をモノマーに対して0.14重量%、連鎖移動剤としてn−ラウリルメルカプタンをモノマー混合液に対して0.2重量%配合して重合性組成物を調製した。該重合性組成物を窒素にて5分間脱気した後、密閉して、70℃で24時間、90℃で24時間、さらに105℃で3時間重合させてポリマーロッドを得た。
こうして得られたポリマーロッドの両末端をダイヤモンドカッターで切断し、さらに切断表面を光学的な研磨を施し、比較例1とした。近赤外吸収スペクトルを測定した。その結果を図1にあわせて示す。
【0075】
図1に示す近赤外吸収スペクトルの結果より、本発明の化合物WDM−6と重水素化メチルメタクリレートとの共重合体からなるポリマーロッドは、重水素化率0%の化合物を重合して得られたポリマーロッドと比較して、約730nmや約910nmのC−H4倍音の吸収が顕著に小さいことがわかる。このことにより、例えば、WDM−6のと重水素化メチルメタクリレートとの共重合体を、市販の850nmの光源(VCSEL)用の光ファイバの材料として用いた場合、910nmの吸収の裾が伝送損失に影響をほとんど与えず、透明で、伝送損失が小さい光ファイバとなることがわかる。さらにガラス転移温度が高いため、良好な耐熱性も有している。従って、前記ポリマーを、例えば、国際公開WO03/019252号公報に記載の方法で延伸し、ファイバ化することで耐熱性が高くC−H高調波振動吸収の非常に小さい、透明な光ファイバを得ることができる。
【産業上の利用可能性】
【0076】
本発明によれば、重水素化率が高く、且つその原料が安価であり、したがってコスト面で工業的に有利に使用し得る、重水素化化合物を提供することができる。また、各種モノマーと共重合させることにより、高温環境等の過酷な条件下でも使用し得る耐熱性を有し、透明性に優れ光伝送損失の少ない、大容量高速伝送システム等に使用可能な光ファイバ用の原料ポリマーを得ることが可能となる。
【図面の簡単な説明】
【0077】
【図1】実施例5及び6ならびに比較例1で測定されたポリマーロッドの近赤外吸収スペクトルの測定結果である。
【特許請求の範囲】
【請求項1】
下記一般式[1]で表される化合物:
【化5】

式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は各々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である。
【請求項2】
前記炭素数5〜7の炭化水素環が飽和炭化水素環である請求項1の化合物。
【請求項3】
前記炭素数5〜7の炭化水素環が不飽和炭化水素環である請求項1の化合物。
【請求項4】
前記飽和炭化水素環が、シクロペンタン環、シクロヘキサン環及びノルボルナン環からなる群より選ばれる環である請求項2の化合物。
【請求項5】
前記不飽和炭化水素環が、シクロペンテン環、シクロヘキセン環及びノルボルネン環からなる群より選ばれる環である請求項3の化合物。
【請求項6】
前記一般式[1]で表される化合物が有する水素原子の20%以上が重水素原子である請求項1〜5のいずれか1項の化合物。
【請求項7】
前記一般式[1]で表される化合物が有する水素原子の40%以上が重水素原子である請求項1〜5のいずれか1項の化合物。
【請求項8】
前記一般式[1]で表される化合物が有する軽水素原子が15個以下である請求項1〜7のいずれか1項の化合物。
【請求項9】
R4で表される基が有する水素原子の10%以上が重水素原子である請求項1〜8のいずれか1項の化合物。
【請求項10】
R4で表される基が有する軽水素原子が12個以下である請求項1〜9のいずれか1項の化合物。
【請求項11】
前記一般式[1]におけるR4で表される基が、トリシクロ[5.2.1.02,6]デシル基であって、当該基中の水素原子の少なくとも1つが重水素原子である請求項1〜10のいずれか1項の化合物。
【請求項12】
下記一般式[1]で表される化合物:
【化5】

式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は各々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である;の製造方法であって、
有する水素原子の少なくとも1つが重水素原子であるノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなるアルコールと、下記一般式[2]:
【化6】

式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子はそれぞれ独立して軽水素原子又は重水素原子である}を表し、Xはハロゲン原子、ヒドロキシル基又はアルコキシ基を表す)で表される化合物と、を反応させることを含む前記一般式[1]で表される化合物の製造方法。
【請求項13】
請求項1〜11のいずれか1項の化合物を含有する重合性組成物を重合させてなる重合体。
【請求項14】
重合体が有する水素原子の50%以上が重水素原子である請求項13の重合体。
【請求項15】
請求項13または14の重合体を含む領域を有する光学部材。
【請求項16】
全水素原子が軽水素であること以外は同一構造を有する重合体と比較して910nmにおける吸光度が50%以下である請求項15の光学部材。
【請求項1】
下記一般式[1]で表される化合物:
【化5】

式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は各々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である。
【請求項2】
前記炭素数5〜7の炭化水素環が飽和炭化水素環である請求項1の化合物。
【請求項3】
前記炭素数5〜7の炭化水素環が不飽和炭化水素環である請求項1の化合物。
【請求項4】
前記飽和炭化水素環が、シクロペンタン環、シクロヘキサン環及びノルボルナン環からなる群より選ばれる環である請求項2の化合物。
【請求項5】
前記不飽和炭化水素環が、シクロペンテン環、シクロヘキセン環及びノルボルネン環からなる群より選ばれる環である請求項3の化合物。
【請求項6】
前記一般式[1]で表される化合物が有する水素原子の20%以上が重水素原子である請求項1〜5のいずれか1項の化合物。
【請求項7】
前記一般式[1]で表される化合物が有する水素原子の40%以上が重水素原子である請求項1〜5のいずれか1項の化合物。
【請求項8】
前記一般式[1]で表される化合物が有する軽水素原子が15個以下である請求項1〜7のいずれか1項の化合物。
【請求項9】
R4で表される基が有する水素原子の10%以上が重水素原子である請求項1〜8のいずれか1項の化合物。
【請求項10】
R4で表される基が有する軽水素原子が12個以下である請求項1〜9のいずれか1項の化合物。
【請求項11】
前記一般式[1]におけるR4で表される基が、トリシクロ[5.2.1.02,6]デシル基であって、当該基中の水素原子の少なくとも1つが重水素原子である請求項1〜10のいずれか1項の化合物。
【請求項12】
下記一般式[1]で表される化合物:
【化5】

式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子は各々独立して軽水素原子又は重水素原子である}を表し、R4はノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなる基であり、当該基が有する水素原子の少なくとも1つが重水素原子である;の製造方法であって、
有する水素原子の少なくとも1つが重水素原子であるノルボルナン環と炭素数5〜7の炭化水素環との縮合環からなるアルコールと、下記一般式[2]:
【化6】

式中、R1及びR2は各々独立して軽水素原子又は重水素原子を表し、R3は軽水素原子、重水素原子又はメチル基{但し、該メチル基の3つの水素原子はそれぞれ独立して軽水素原子又は重水素原子である}を表し、Xはハロゲン原子、ヒドロキシル基又はアルコキシ基を表す)で表される化合物と、を反応させることを含む前記一般式[1]で表される化合物の製造方法。
【請求項13】
請求項1〜11のいずれか1項の化合物を含有する重合性組成物を重合させてなる重合体。
【請求項14】
重合体が有する水素原子の50%以上が重水素原子である請求項13の重合体。
【請求項15】
請求項13または14の重合体を含む領域を有する光学部材。
【請求項16】
全水素原子が軽水素であること以外は同一構造を有する重合体と比較して910nmにおける吸光度が50%以下である請求項15の光学部材。
【図1】




【公表番号】特表2007−528913(P2007−528913A)
【公表日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願番号】特願2006−519241(P2006−519241)
【出願日】平成16年7月23日(2004.7.23)
【国際出願番号】PCT/JP2004/010868
【国際公開番号】WO2005/010060
【国際公開日】平成17年2月3日(2005.2.3)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【出願人】(000252300)和光純薬工業株式会社 (105)
【Fターム(参考)】
【公表日】平成19年10月18日(2007.10.18)
【国際特許分類】
【出願日】平成16年7月23日(2004.7.23)
【国際出願番号】PCT/JP2004/010868
【国際公開番号】WO2005/010060
【国際公開日】平成17年2月3日(2005.2.3)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【出願人】(000252300)和光純薬工業株式会社 (105)
【Fターム(参考)】
[ Back to top ]

