金ナノ粒子組成物、DNAチップ、近赤外線吸収材、ドラッグデリバリーシステム(DDS)用薬物保持体、着色剤、バイオセンサー、化粧品、生体内診断用組成物および治療用組成物。
【課題】本発明の課題は、医療用途あるいは工業用途において、自己発熱性のエネルギー受容体あるいは近赤外線吸収材などに利用できる金ナノ粒子組成物を提供することにある。
【解決手段】本発明に係る金ナノ粒子組成物は、球状の金ナノ粒子および有機リガンド分子を含有する。有機リガンド分子は、金ナノ粒子に結合している。そして、この金ナノ粒子組成物は、少なくとも1つの吸収ピークの波長(プラズモン吸収波長)が600nmから1000nmまでの領域内に存在する。このため、この金ナノ粒子組成物は、600nmから1000nmまでの電磁波が照射されると、自己発熱する。
【解決手段】本発明に係る金ナノ粒子組成物は、球状の金ナノ粒子および有機リガンド分子を含有する。有機リガンド分子は、金ナノ粒子に結合している。そして、この金ナノ粒子組成物は、少なくとも1つの吸収ピークの波長(プラズモン吸収波長)が600nmから1000nmまでの領域内に存在する。このため、この金ナノ粒子組成物は、600nmから1000nmまでの電磁波が照射されると、自己発熱する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えば、バイオセンサー、DNAチップ、腫瘍などの診断剤や治療薬などに利用し得る金ナノ粒子組成物に関する。
【背景技術】
【0002】
現在、医薬品や、化粧品、食品、配線材料、偏光材料、電極材料、近赤外線吸収材、偽造防止インク、電磁波シールド材、表面増強蛍光センサー、生体マーカー、ナノ導波路、記録材料、記録素子、ドラッグデリバリーシステム(DDS)用薬物保持体、バイオセンサー、DNAチップ、検査薬など、幅広い産業分野において、金ナノ粒子が利用されている(例えば、特許文献1及び2参照)。
【0003】
この金ナノ粒子は電磁波が照射されるとプラズモン吸収と呼ばれる光の吸収現象を引き起こし自己発熱することが知られている。そして、この金ナノ粒子は形状や大きさが異なると、その吸収波長も異なる。例えば、一般的な金ナノ粒子は530nm付近に吸収域を有するが、アスペクト比が1.1〜8.0のロッド状の金ナノ粒子はロッドの短軸に起因する530nm付近の吸収域の他に、ロッドの長軸に起因する長波長側の吸収域(400nm〜1200nm)を有する(例えば、特許文献1及び2参照)。
【0004】
また、この金ナノ粒子は、人体に対する毒性の低さから医療分野、特に、腫瘍等の診断・治療分野でも注目を集めている。ところで、悪性腫瘍すなわち癌細胞は、例えば、43度C以上の温度にさらされることにより不可逆的なダメージを追うことが知られている。そこで、生体内の悪性腫瘍などに金ナノ粒子のようなエネルギー受容体を搬送した後、体外からそのエネルギー受容体に対してエネルギーを供給することによりそのエネルギー受容体を発熱させ、悪性腫瘍などを殺滅あるいは不活性化することが考案されている(例えば、特許文献3参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2005−320616号公報
【特許文献2】特開2005−255582号公報
【特許文献3】特開2007−521109号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、一般に、生体は、600nm以下の波長の電磁波(紫外線領域および可視光線領域)や、1000nm以上の波長の電磁波(赤外線領域)を吸収する。なお、具体的には、前者の電磁波は主に体内の色素やヘモグロビンなどに吸収され、後者の電磁波は主に体内の水分に吸収される。このため、金ナノ粒子組成物が600nm以下の波長の電磁波や、1000nm以上の波長の電磁波を吸収して発熱する性質があるとしても、その金ナノ粒子組成物は、生体内において発熱することがない。
【0007】
また、上述のようなロッド状の金ナノ粒子は、プラズモン吸収波長が550nmから1200nmまでの領域に存在し、外部からそのような電磁波が照射されれば、生体内でも自己発熱することができる。しかし、生体内の非常に小さな孔を通して金ナノ粒子を疾患部まで搬送する必要がある場合、例えば、悪性腫瘍が形成する新しい血管と、既存血管との接合部分に形成される100nm程度の孔を通して金ナノ粒子を悪性腫瘍まで搬送する必要がある場合、ロッド状の金ナノ粒子は、その形状から疾患部への到達が困難である。
【0008】
本発明の課題は、ロッド状の金ナノ粒子よりも生体内の小さな孔を通りやすく、自己発熱性のエネルギー受容体として利用することができる金ナノ粒子組成物を提供することにある。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を克服するために、金ナノ粒子の合成、有機リガンド分子の選定、金ナノ粒子組成物の吸収波長、発熱性などに関して多くの実験を行った結果、700nmから800nmまでの波長領域内に少なくとも1つの吸収ピーク(プラズモン吸収ピーク)を有する金ナノ粒子組成物を完成するに至った。
【0010】
本発明に係る金ナノ粒子組成物は、球状の金ナノ粒子および有機リガンド分子を含有する。有機リガンド分子は、金ナノ粒子に結合している。なお、ここにいう「結合」とは、例えば、配位結合や水素結合などである。そして、この金ナノ粒子組成物は、少なくとも1つの吸収ピーク(プラズモン吸収ピーク)の波長が600nmから1000nmまでの領域内に存在する。なお、少なくとも1つの吸収ピークの波長は650nmから900nmまでの領域内に存在するのがより好ましい。この波長領域の電磁波は生体内での吸収が小さく、金ナノ粒子組成物が生体内に存在していたとしても、エネルギー受容体がこの波長域の電磁波を効率よく吸収して発熱することができるからである。
【0011】
また、本発明において、金ナノ粒子は、塩化近酸溶液中において塩化近酸を還元することによって製造されるのが好ましい。なお、塩化金酸溶液中における塩化金酸の還元方法としては、例えば、還元剤を添加する方法や、紫外線を照射する方法、アルコールを添加する方法、超音波を照射する方法などが挙げられる。
【0012】
また、本発明において、有機リガンド分子は、金ナノ粒子と結合可能な官能基を少なくとも1つ有する有機化合物である。官能基としては、硫黄含有官能基、窒素含有官能基、リン含有官能基、酸素含有官能基が好ましい。なお、この有機リガンド分子は、金粒子の成長を抑制して金粒子をナノサイズにとどめる役割のみならず、金ナノ粒子組成物のプラズモン吸収波長を調整する役目をも担う。
【0013】
請求項1に記載の発明は、球状の金ナノ粒子と、前記金ナノ粒子に結合する有機リガンド分子とを含有し、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する金ナノ粒子組成物であって、前記有機リガンド分子は、下記一般式(I)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物である。
【化1】

(I)
(式中、R1〜R10はCH3、CF3、OH、H、COOHおよびハロゲン元素よりなる群から選択される置換基または連結基である。)
【0014】
また、請求項2に記載の発明は、請求項1に記載の発明において、前記有機リガンド分子は、下記化学構造式(II)で示されるジアミン、下記化学構造式(III)で示されるジアミン、および下記化学構造式(IV)で示されるジアミンよりなる群から選択されるジアミンである金ナノ粒子組成物である。
【化2】

(II)
【化3】

(III)
【化4】

(IV)
【0015】
また、請求項3に記載の発明は、球状の金ナノ粒子と、前記金ナノ粒子に結合する有機リガンド分子とを含有し、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する金ナノ粒子組成物であって、前記有機リガンド分子は、下記化学構造式(V)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物である。
【化5】

(V)
【0016】
なお、本発明に係る金ナノ粒子組成物は、DNAチップ、近赤外線吸収材、ドラッグデリバリーシステム(DDS)用薬物保持体、着色剤、バイオセンサー、化粧品、生体内診断用組成物、治療用組成物などに利用することができる。また、この金ナノ粒子組成物は、コーティング剤や充填材などとして種々の用途に使用することができる。
【0017】
また、本発明に係る金ナノ粒子組成物は、ナノプローブを利用して生体内に導入された後、600nm以上1000nm以下の波長の電磁波が照射されれば、そのナノプローブを加熱する。このため、本発明に係る金ナノ粒子組成物は、生体の診断や治療に利用することができる。このような診断や治療では、人体を切開する必要がなく、患者に対する精神的、肉体的負担が小さく好ましい。
【発明の効果】
【0018】
本発明に係る金ナノ粒子組成物は、生体が吸収することのない600nmから1000nmまでの領域内に少なくとも1つの吸収ピークの波長がある。このため、本発明に係る金ナノ粒子組成物は、生体内においても、体外から600nmから1000nmまでの領域内の波長の電磁波が照射されると自己発熱する。このため、この金ナノ粒子組成物は、癌などの悪性腫瘍に対する温熱治療に利用することができる。また、本発明に係る金ナノ粒子組成物は数nm〜数十nm程度の球状粒子である。このため、本発明に係る金ナノ粒子組成物は、ロッド状の金ナノ粒子よりも生体内の小さな孔を通りやすく、例えば、脳に存在するBBB(blood brain barrier)といわれる血液脳関門などの細部にまで投入することができる可能性があり、脳腫瘍等の診断や治療にも応用することができる。
【0019】
このため、本発明に係る金ナノ粒子組成物は、ロッド状の金ナノ粒子よりも生体内の小さな孔を通りやすく、自己発熱性のエネルギー受容体として利用すすることができる。
【0020】
また、有機リガンド分子が、化学構造式(V)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物は、他のジアミンを用いた場合と比較して、プラズモン吸収波長の吸収ピークが比較的強いため吸収効率が良い。また、同じく吸収ピークが比較的シャープであるため、波長幅の狭い光のエネルギーを吸収する場合に適している。また、化学構造式(V)で示されるジアミンは、少量の添加でも効果が発現し易い特徴があり、比較的安価であるため、工業用途に適していると考えられる。
【0021】
また、本発明に係る金ナノ粒子組成物は、上記用途以外に、DNAチップや、近赤外線吸収材、ドラッグデリバリーシステム(DDS)用薬物保持体、着色剤、バイオセンサー、化粧品、生体内診断用組成物、治療用組成物、体外診断薬、検査薬、生体マーカー、配線材料、電極材料、触媒、表面増強蛍光センサー、表面増強ラマンセンサー、近赤外光カットフィルム、近赤外光カットフィルター、光学フィルター材料、波長吸収材、電磁波遮断材料、塗料、塗膜、導電性フィルム、ナノ導波路、偽造防止インク、記録材料、記録素子などの基本材料としても利用することができる。
【図面の簡単な説明】
【0022】
【図1】実施例1で作製した球状金ナノ粒子組成物の透過型電子顕微鏡写真である。
【図2】実施例1で作製した球状金ナノ粒子組成物の吸光スペクトルである。
【図3】球状金ナノ粒子組成物の近赤外線照射による温度上昇特性を測定した測定装置の概略図である。
【図4】実施例2で作製した球状金ナノ粒子組成物の吸光スペクトルである。
【図5】実施例3で作製した球状金ナノ粒子組成物の吸光スペクトルである。
【図6】実施例4で作製した球状金ナノ粒子組成物の吸光スペクトルである。
【発明を実施するための形態】
【0023】
以下に本発明の実施の形態に係る球状金ナノ粒子組成物について説明する。本実施の形態に係る球状金ナノ粒子組成物中の金ナノ粒子は、図1に示されるように20nm程度の真球形状を呈する。なお、本願において、「球状」とは、図1の倍率の透過型電子顕微鏡写真において真円と確認できる程度の形状を意味する。
【0024】
また、本実施の形態に係る球状金ナノ粒子組成物は、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する。ちなみに、現在、この領域内にプラズモン吸収波長が存在する金ナノ粒子組成物は存在しない。
【0025】
なお、一般的な金ナノ粒子では530nm近傍でプラズモン吸収が生じるが、本発明に係る球状金ナノ粒子組成物ではそのプラズモン吸収が長波長側にシフトする。これは、おそらく、金ナノ粒子を修飾する有機リガンド分子の構造や、有機リガンド分子と金ナノとの結合状態に起因する推測される。なぜならば、球状の金ナノ粒子単体(有機リガンド分子なし)のプラズモン吸収波長は530nmであり、2,2−ビス(3−アミノフェニル)ヘキサフルオロプロパン)、2,2−ビス(3−アミノ−4−ヒドロキシフェニル)ヘキサフルオロプロパンおよび2,2−ビス(4−アミノフェニル)ヘキサフルオロプロパン単体では600nm以上の長波長側において光の吸収が認められないからである。
【0026】
また、本実施の形態の球状金ナノ粒子組成物には、必要に応じて蛍光色素や、生体適合性を向上させるための親水性高分子、分散剤、保存安定剤、界面活性剤などの機能性分子を添加することができる。なお、蛍光色素としては、例えば、フルオレセイン(FITC)や、フィコエリスリン、ローダミンなどが挙げられる。また、上記親水性高分子としては、例えば、ポリエチレングリコールや、タウリン、ポリグルタミン酸、ポリビニルアルコール、ポリビニルピロリドン、ポリアクリル酸、ポリアミノ酸などが挙げられる。
【0027】
以下、実施例を示して、本実施の形態に係る球状金ナノ粒子組成物についてさらに詳述する。
【実施例1】
【0028】
0.2mmolの塩化金酸水溶液(和光純薬株式会社製)に10mLのエタノールを添加し、さらに5mLのエタノールに0.2mmolの1,5−ジアミノナフタレン(以下[15ND」と称する)(東京化成株式会社製)を溶解させたものを添加した後、その混合液を室温で5分攪拌した。その後、その混合液に254nmの波長の紫外線を照射して、15NDを有機リガンド分子とする球状金ナノ粒子組成物分散液を得た。
【0029】
そして、この球状金ナノ粒子組成物分散液を乾燥させて球状金ナノ粒子組成物を得、この球状金ナノ粒子組成物の粒子径を透過型電子顕微鏡(TEM)(日立製作所製 H7100TE型)により測定した。図1の透過型電子顕微鏡写真に示されるように、球状金ナノ粒子組成物の最大粒子直径は20nm程度であることが明らかとなった。なお、図1の透過型電子顕微鏡写真において、金ナノ粒子組成物は、複数の黒い粒として写っている。
【0030】
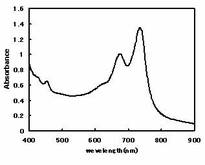
次に、球状の金ナノ粒子組成物のプラズモン吸収波長を分光光度計(Amersham Biosciences社製Ultraspec2100型)により測定した。本実施例の球状金ナノ粒子組成物の吸光スペクトルを図2に示す。図2から明らかなように、本実施例の球状金ナノ粒子組成物のプラズモン吸収波長は675nmと740nmであった。
【0031】
また、図3に示す測定装置を用いて球状金ナノ粒子組成物の温度上昇特性を確認した。測定方法は次の通りである。先ず、ガラス製のセル容器2にカンテン1を入れ、そのカンテン1に10mgの球状金ナノ粒子組成物を注入する。次いで、そのカンテン1にガラスファイバープローブ6を挿入した後、800nm〜1050nmの近赤外線をカンテン1に照射しながらガラスファイバープローブ6によりカンテン1の温度を測定した。なお、この温度測定は、近赤外線照射開始時点から30分間行われた。また、図3中、符号3は近赤外線フィルターであり、符号4は導光管であり、符号5は照明電源であり、符号7は温度計測器である。
【0032】
そして、この測定の結果、本実施例の球状金ナノ粒子組成物は、30分間の近赤外線照射により38℃まで昇温することが明らかとなった。なお、この発熱温度は、リファレンス(球状金ナノ粒子組成物が注入されていないカンテン)の約2倍である。
【実施例2】
【0033】
15NDを9,9−ビス(4−アミノフェニル)フルオレン(以下「BAFL」と称する)(JFEケミカル株式会社製)に代え、5mLのエタノールに溶解させる量を0.2mmolから2.0mmolに代えた以外は、実施例1と同様にしてBAFLを有機リガンド分子とする球状金ナノ粒子組成物分散液を得た。また、実施例1と同様にして、その球状金ナノ粒子組成物のプラズモン吸収波長の測定を行った。
【0034】
本実施例の球状金ナノ粒子組成物の吸光スペクトルを図5に示す。図5から明らかなように、本実施例の球状金ナノ粒子組成物のプラズモン吸収波長は570nmと710nmであった。
【実施例3】
【0035】
15NDを9,9−ビス(3−メチル−4アミノフェニル)フルオレン(以下「BTFL」と称する)(JFEケミカル株式会社製)に代え、5mLのエタノールに溶解させる量を0.2mmolから2.0mmolに代えた以外は、実施例1と同様にしてBTFLを有機リガンド分子とする球状金ナノ粒子組成物分散液を得た。また、実施例1と同様にして、その球状金ナノ粒子組成物のプラズモン吸収波長の測定を行った。
【0036】
本実施例の球状金ナノ粒子組成物の吸光スペクトルを図5に示す。図5から明らかなように、本実施例の球状金ナノ粒子組成物のプラズモン吸収波長は710nmであった。
【実施例4】
【0037】
15NDを9,9−ビス(3−フルオロ−4アミノフェニル)フルオレン(以下「BFAF」と称する)(JFEケミカル株式会社製)に代え、5mLのエタノールに溶解させる量を0.2mmolから2.0mmolに代えた以外は、実施例1と同様にしてBFAFを有機リガンド分子とする球状金ナノ粒子組成物分散液を得た。また、実施例1と同様にして、その球状金ナノ粒子組成物のプラズモン吸収波長の測定を行った。
【0038】
本実施例の球状金ナノ粒子組成物の吸光スペクトルを図5に示す。図5から明らかなように、本実施例の球状金ナノ粒子組成物のプラズモン吸収波長は700nmであった。
【産業上の利用可能性】
【0039】
本発明に係る球状金ナノ粒子組成物は、620nm付近や、720nm付近、760nm付近に大きなプラズモン吸収ピークがあり、近赤外線(600nm〜900nm)が照射されると発熱するので、癌細胞に対する診断や温熱治療に有用である。また、本発明に係る球状金ナノ粒子組成物は、DNAチップや、近赤外線吸収材、ドラッグデリバリーシステム(DDS)用薬物保持体、着色剤、バイオセンサー、化粧品、生体内診断用組成物、治療用組成物、体外診断薬、検査薬、生体マーカー、配線材料、電極材料、触媒、表面増強蛍光センサー、表面増強ラマンセンサー、近赤外光カットフィルム、近赤外光カットフィルター、近赤外光カットガラス、カラーフィルター、光学フィルター材料、波長吸収材、電磁波遮断材料、塗料、塗膜、電磁波シールド材、導電性ペースト、導電性塗料、導電性塗膜、導電性フィルム、ナノ導波路、偽造防止インク、記録材料、記録素子などにも好適に利用することができる。
【符号の説明】
【0040】
1 カンテン
2 セル容器
3 近赤外線フィルター
4 ライトガイド
5 ハロゲンランプ(光源)
6 ガラスファイバープローブ
7 温度計測器
【技術分野】
【0001】
本発明は、例えば、バイオセンサー、DNAチップ、腫瘍などの診断剤や治療薬などに利用し得る金ナノ粒子組成物に関する。
【背景技術】
【0002】
現在、医薬品や、化粧品、食品、配線材料、偏光材料、電極材料、近赤外線吸収材、偽造防止インク、電磁波シールド材、表面増強蛍光センサー、生体マーカー、ナノ導波路、記録材料、記録素子、ドラッグデリバリーシステム(DDS)用薬物保持体、バイオセンサー、DNAチップ、検査薬など、幅広い産業分野において、金ナノ粒子が利用されている(例えば、特許文献1及び2参照)。
【0003】
この金ナノ粒子は電磁波が照射されるとプラズモン吸収と呼ばれる光の吸収現象を引き起こし自己発熱することが知られている。そして、この金ナノ粒子は形状や大きさが異なると、その吸収波長も異なる。例えば、一般的な金ナノ粒子は530nm付近に吸収域を有するが、アスペクト比が1.1〜8.0のロッド状の金ナノ粒子はロッドの短軸に起因する530nm付近の吸収域の他に、ロッドの長軸に起因する長波長側の吸収域(400nm〜1200nm)を有する(例えば、特許文献1及び2参照)。
【0004】
また、この金ナノ粒子は、人体に対する毒性の低さから医療分野、特に、腫瘍等の診断・治療分野でも注目を集めている。ところで、悪性腫瘍すなわち癌細胞は、例えば、43度C以上の温度にさらされることにより不可逆的なダメージを追うことが知られている。そこで、生体内の悪性腫瘍などに金ナノ粒子のようなエネルギー受容体を搬送した後、体外からそのエネルギー受容体に対してエネルギーを供給することによりそのエネルギー受容体を発熱させ、悪性腫瘍などを殺滅あるいは不活性化することが考案されている(例えば、特許文献3参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2005−320616号公報
【特許文献2】特開2005−255582号公報
【特許文献3】特開2007−521109号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
ところで、一般に、生体は、600nm以下の波長の電磁波(紫外線領域および可視光線領域)や、1000nm以上の波長の電磁波(赤外線領域)を吸収する。なお、具体的には、前者の電磁波は主に体内の色素やヘモグロビンなどに吸収され、後者の電磁波は主に体内の水分に吸収される。このため、金ナノ粒子組成物が600nm以下の波長の電磁波や、1000nm以上の波長の電磁波を吸収して発熱する性質があるとしても、その金ナノ粒子組成物は、生体内において発熱することがない。
【0007】
また、上述のようなロッド状の金ナノ粒子は、プラズモン吸収波長が550nmから1200nmまでの領域に存在し、外部からそのような電磁波が照射されれば、生体内でも自己発熱することができる。しかし、生体内の非常に小さな孔を通して金ナノ粒子を疾患部まで搬送する必要がある場合、例えば、悪性腫瘍が形成する新しい血管と、既存血管との接合部分に形成される100nm程度の孔を通して金ナノ粒子を悪性腫瘍まで搬送する必要がある場合、ロッド状の金ナノ粒子は、その形状から疾患部への到達が困難である。
【0008】
本発明の課題は、ロッド状の金ナノ粒子よりも生体内の小さな孔を通りやすく、自己発熱性のエネルギー受容体として利用することができる金ナノ粒子組成物を提供することにある。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を克服するために、金ナノ粒子の合成、有機リガンド分子の選定、金ナノ粒子組成物の吸収波長、発熱性などに関して多くの実験を行った結果、700nmから800nmまでの波長領域内に少なくとも1つの吸収ピーク(プラズモン吸収ピーク)を有する金ナノ粒子組成物を完成するに至った。
【0010】
本発明に係る金ナノ粒子組成物は、球状の金ナノ粒子および有機リガンド分子を含有する。有機リガンド分子は、金ナノ粒子に結合している。なお、ここにいう「結合」とは、例えば、配位結合や水素結合などである。そして、この金ナノ粒子組成物は、少なくとも1つの吸収ピーク(プラズモン吸収ピーク)の波長が600nmから1000nmまでの領域内に存在する。なお、少なくとも1つの吸収ピークの波長は650nmから900nmまでの領域内に存在するのがより好ましい。この波長領域の電磁波は生体内での吸収が小さく、金ナノ粒子組成物が生体内に存在していたとしても、エネルギー受容体がこの波長域の電磁波を効率よく吸収して発熱することができるからである。
【0011】
また、本発明において、金ナノ粒子は、塩化近酸溶液中において塩化近酸を還元することによって製造されるのが好ましい。なお、塩化金酸溶液中における塩化金酸の還元方法としては、例えば、還元剤を添加する方法や、紫外線を照射する方法、アルコールを添加する方法、超音波を照射する方法などが挙げられる。
【0012】
また、本発明において、有機リガンド分子は、金ナノ粒子と結合可能な官能基を少なくとも1つ有する有機化合物である。官能基としては、硫黄含有官能基、窒素含有官能基、リン含有官能基、酸素含有官能基が好ましい。なお、この有機リガンド分子は、金粒子の成長を抑制して金粒子をナノサイズにとどめる役割のみならず、金ナノ粒子組成物のプラズモン吸収波長を調整する役目をも担う。
【0013】
請求項1に記載の発明は、球状の金ナノ粒子と、前記金ナノ粒子に結合する有機リガンド分子とを含有し、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する金ナノ粒子組成物であって、前記有機リガンド分子は、下記一般式(I)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物である。
【化1】

(I)
(式中、R1〜R10はCH3、CF3、OH、H、COOHおよびハロゲン元素よりなる群から選択される置換基または連結基である。)
【0014】
また、請求項2に記載の発明は、請求項1に記載の発明において、前記有機リガンド分子は、下記化学構造式(II)で示されるジアミン、下記化学構造式(III)で示されるジアミン、および下記化学構造式(IV)で示されるジアミンよりなる群から選択されるジアミンである金ナノ粒子組成物である。
【化2】

(II)
【化3】

(III)
【化4】

(IV)
【0015】
また、請求項3に記載の発明は、球状の金ナノ粒子と、前記金ナノ粒子に結合する有機リガンド分子とを含有し、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する金ナノ粒子組成物であって、前記有機リガンド分子は、下記化学構造式(V)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物である。
【化5】

(V)
【0016】
なお、本発明に係る金ナノ粒子組成物は、DNAチップ、近赤外線吸収材、ドラッグデリバリーシステム(DDS)用薬物保持体、着色剤、バイオセンサー、化粧品、生体内診断用組成物、治療用組成物などに利用することができる。また、この金ナノ粒子組成物は、コーティング剤や充填材などとして種々の用途に使用することができる。
【0017】
また、本発明に係る金ナノ粒子組成物は、ナノプローブを利用して生体内に導入された後、600nm以上1000nm以下の波長の電磁波が照射されれば、そのナノプローブを加熱する。このため、本発明に係る金ナノ粒子組成物は、生体の診断や治療に利用することができる。このような診断や治療では、人体を切開する必要がなく、患者に対する精神的、肉体的負担が小さく好ましい。
【発明の効果】
【0018】
本発明に係る金ナノ粒子組成物は、生体が吸収することのない600nmから1000nmまでの領域内に少なくとも1つの吸収ピークの波長がある。このため、本発明に係る金ナノ粒子組成物は、生体内においても、体外から600nmから1000nmまでの領域内の波長の電磁波が照射されると自己発熱する。このため、この金ナノ粒子組成物は、癌などの悪性腫瘍に対する温熱治療に利用することができる。また、本発明に係る金ナノ粒子組成物は数nm〜数十nm程度の球状粒子である。このため、本発明に係る金ナノ粒子組成物は、ロッド状の金ナノ粒子よりも生体内の小さな孔を通りやすく、例えば、脳に存在するBBB(blood brain barrier)といわれる血液脳関門などの細部にまで投入することができる可能性があり、脳腫瘍等の診断や治療にも応用することができる。
【0019】
このため、本発明に係る金ナノ粒子組成物は、ロッド状の金ナノ粒子よりも生体内の小さな孔を通りやすく、自己発熱性のエネルギー受容体として利用すすることができる。
【0020】
また、有機リガンド分子が、化学構造式(V)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物は、他のジアミンを用いた場合と比較して、プラズモン吸収波長の吸収ピークが比較的強いため吸収効率が良い。また、同じく吸収ピークが比較的シャープであるため、波長幅の狭い光のエネルギーを吸収する場合に適している。また、化学構造式(V)で示されるジアミンは、少量の添加でも効果が発現し易い特徴があり、比較的安価であるため、工業用途に適していると考えられる。
【0021】
また、本発明に係る金ナノ粒子組成物は、上記用途以外に、DNAチップや、近赤外線吸収材、ドラッグデリバリーシステム(DDS)用薬物保持体、着色剤、バイオセンサー、化粧品、生体内診断用組成物、治療用組成物、体外診断薬、検査薬、生体マーカー、配線材料、電極材料、触媒、表面増強蛍光センサー、表面増強ラマンセンサー、近赤外光カットフィルム、近赤外光カットフィルター、光学フィルター材料、波長吸収材、電磁波遮断材料、塗料、塗膜、導電性フィルム、ナノ導波路、偽造防止インク、記録材料、記録素子などの基本材料としても利用することができる。
【図面の簡単な説明】
【0022】
【図1】実施例1で作製した球状金ナノ粒子組成物の透過型電子顕微鏡写真である。
【図2】実施例1で作製した球状金ナノ粒子組成物の吸光スペクトルである。
【図3】球状金ナノ粒子組成物の近赤外線照射による温度上昇特性を測定した測定装置の概略図である。
【図4】実施例2で作製した球状金ナノ粒子組成物の吸光スペクトルである。
【図5】実施例3で作製した球状金ナノ粒子組成物の吸光スペクトルである。
【図6】実施例4で作製した球状金ナノ粒子組成物の吸光スペクトルである。
【発明を実施するための形態】
【0023】
以下に本発明の実施の形態に係る球状金ナノ粒子組成物について説明する。本実施の形態に係る球状金ナノ粒子組成物中の金ナノ粒子は、図1に示されるように20nm程度の真球形状を呈する。なお、本願において、「球状」とは、図1の倍率の透過型電子顕微鏡写真において真円と確認できる程度の形状を意味する。
【0024】
また、本実施の形態に係る球状金ナノ粒子組成物は、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する。ちなみに、現在、この領域内にプラズモン吸収波長が存在する金ナノ粒子組成物は存在しない。
【0025】
なお、一般的な金ナノ粒子では530nm近傍でプラズモン吸収が生じるが、本発明に係る球状金ナノ粒子組成物ではそのプラズモン吸収が長波長側にシフトする。これは、おそらく、金ナノ粒子を修飾する有機リガンド分子の構造や、有機リガンド分子と金ナノとの結合状態に起因する推測される。なぜならば、球状の金ナノ粒子単体(有機リガンド分子なし)のプラズモン吸収波長は530nmであり、2,2−ビス(3−アミノフェニル)ヘキサフルオロプロパン)、2,2−ビス(3−アミノ−4−ヒドロキシフェニル)ヘキサフルオロプロパンおよび2,2−ビス(4−アミノフェニル)ヘキサフルオロプロパン単体では600nm以上の長波長側において光の吸収が認められないからである。
【0026】
また、本実施の形態の球状金ナノ粒子組成物には、必要に応じて蛍光色素や、生体適合性を向上させるための親水性高分子、分散剤、保存安定剤、界面活性剤などの機能性分子を添加することができる。なお、蛍光色素としては、例えば、フルオレセイン(FITC)や、フィコエリスリン、ローダミンなどが挙げられる。また、上記親水性高分子としては、例えば、ポリエチレングリコールや、タウリン、ポリグルタミン酸、ポリビニルアルコール、ポリビニルピロリドン、ポリアクリル酸、ポリアミノ酸などが挙げられる。
【0027】
以下、実施例を示して、本実施の形態に係る球状金ナノ粒子組成物についてさらに詳述する。
【実施例1】
【0028】
0.2mmolの塩化金酸水溶液(和光純薬株式会社製)に10mLのエタノールを添加し、さらに5mLのエタノールに0.2mmolの1,5−ジアミノナフタレン(以下[15ND」と称する)(東京化成株式会社製)を溶解させたものを添加した後、その混合液を室温で5分攪拌した。その後、その混合液に254nmの波長の紫外線を照射して、15NDを有機リガンド分子とする球状金ナノ粒子組成物分散液を得た。
【0029】
そして、この球状金ナノ粒子組成物分散液を乾燥させて球状金ナノ粒子組成物を得、この球状金ナノ粒子組成物の粒子径を透過型電子顕微鏡(TEM)(日立製作所製 H7100TE型)により測定した。図1の透過型電子顕微鏡写真に示されるように、球状金ナノ粒子組成物の最大粒子直径は20nm程度であることが明らかとなった。なお、図1の透過型電子顕微鏡写真において、金ナノ粒子組成物は、複数の黒い粒として写っている。
【0030】
次に、球状の金ナノ粒子組成物のプラズモン吸収波長を分光光度計(Amersham Biosciences社製Ultraspec2100型)により測定した。本実施例の球状金ナノ粒子組成物の吸光スペクトルを図2に示す。図2から明らかなように、本実施例の球状金ナノ粒子組成物のプラズモン吸収波長は675nmと740nmであった。
【0031】
また、図3に示す測定装置を用いて球状金ナノ粒子組成物の温度上昇特性を確認した。測定方法は次の通りである。先ず、ガラス製のセル容器2にカンテン1を入れ、そのカンテン1に10mgの球状金ナノ粒子組成物を注入する。次いで、そのカンテン1にガラスファイバープローブ6を挿入した後、800nm〜1050nmの近赤外線をカンテン1に照射しながらガラスファイバープローブ6によりカンテン1の温度を測定した。なお、この温度測定は、近赤外線照射開始時点から30分間行われた。また、図3中、符号3は近赤外線フィルターであり、符号4は導光管であり、符号5は照明電源であり、符号7は温度計測器である。
【0032】
そして、この測定の結果、本実施例の球状金ナノ粒子組成物は、30分間の近赤外線照射により38℃まで昇温することが明らかとなった。なお、この発熱温度は、リファレンス(球状金ナノ粒子組成物が注入されていないカンテン)の約2倍である。
【実施例2】
【0033】
15NDを9,9−ビス(4−アミノフェニル)フルオレン(以下「BAFL」と称する)(JFEケミカル株式会社製)に代え、5mLのエタノールに溶解させる量を0.2mmolから2.0mmolに代えた以外は、実施例1と同様にしてBAFLを有機リガンド分子とする球状金ナノ粒子組成物分散液を得た。また、実施例1と同様にして、その球状金ナノ粒子組成物のプラズモン吸収波長の測定を行った。
【0034】
本実施例の球状金ナノ粒子組成物の吸光スペクトルを図5に示す。図5から明らかなように、本実施例の球状金ナノ粒子組成物のプラズモン吸収波長は570nmと710nmであった。
【実施例3】
【0035】
15NDを9,9−ビス(3−メチル−4アミノフェニル)フルオレン(以下「BTFL」と称する)(JFEケミカル株式会社製)に代え、5mLのエタノールに溶解させる量を0.2mmolから2.0mmolに代えた以外は、実施例1と同様にしてBTFLを有機リガンド分子とする球状金ナノ粒子組成物分散液を得た。また、実施例1と同様にして、その球状金ナノ粒子組成物のプラズモン吸収波長の測定を行った。
【0036】
本実施例の球状金ナノ粒子組成物の吸光スペクトルを図5に示す。図5から明らかなように、本実施例の球状金ナノ粒子組成物のプラズモン吸収波長は710nmであった。
【実施例4】
【0037】
15NDを9,9−ビス(3−フルオロ−4アミノフェニル)フルオレン(以下「BFAF」と称する)(JFEケミカル株式会社製)に代え、5mLのエタノールに溶解させる量を0.2mmolから2.0mmolに代えた以外は、実施例1と同様にしてBFAFを有機リガンド分子とする球状金ナノ粒子組成物分散液を得た。また、実施例1と同様にして、その球状金ナノ粒子組成物のプラズモン吸収波長の測定を行った。
【0038】
本実施例の球状金ナノ粒子組成物の吸光スペクトルを図5に示す。図5から明らかなように、本実施例の球状金ナノ粒子組成物のプラズモン吸収波長は700nmであった。
【産業上の利用可能性】
【0039】
本発明に係る球状金ナノ粒子組成物は、620nm付近や、720nm付近、760nm付近に大きなプラズモン吸収ピークがあり、近赤外線(600nm〜900nm)が照射されると発熱するので、癌細胞に対する診断や温熱治療に有用である。また、本発明に係る球状金ナノ粒子組成物は、DNAチップや、近赤外線吸収材、ドラッグデリバリーシステム(DDS)用薬物保持体、着色剤、バイオセンサー、化粧品、生体内診断用組成物、治療用組成物、体外診断薬、検査薬、生体マーカー、配線材料、電極材料、触媒、表面増強蛍光センサー、表面増強ラマンセンサー、近赤外光カットフィルム、近赤外光カットフィルター、近赤外光カットガラス、カラーフィルター、光学フィルター材料、波長吸収材、電磁波遮断材料、塗料、塗膜、電磁波シールド材、導電性ペースト、導電性塗料、導電性塗膜、導電性フィルム、ナノ導波路、偽造防止インク、記録材料、記録素子などにも好適に利用することができる。
【符号の説明】
【0040】
1 カンテン
2 セル容器
3 近赤外線フィルター
4 ライトガイド
5 ハロゲンランプ(光源)
6 ガラスファイバープローブ
7 温度計測器
【特許請求の範囲】
【請求項1】
球状の金ナノ粒子と、前記金ナノ粒子に結合する有機リガンド分子とを含有し、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する金ナノ粒子組成物であって、前記有機リガンド分子は、下記一般式(I)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物。
【化1】

(I)
(式中、R1〜R10はCH3、CF3、OH、H、COOH及びハロゲン元素よりなる群から選択される置換基または連結基である。)
【請求項2】
前記有機リガンド分子は、下記化学構造式(II)で示されるジアミン、下記化学構造式(III)で示されるジアミン、および下記化学構造式(IV)で示されるジアミンよりなる群から選択されるジアミンである請求項1に記載の金ナノ粒子組成物。
【化2】

(II)
【化3】

(III)
【化4】

(IV)
【請求項3】
球状の金ナノ粒子と、前記金ナノ粒子に結合する有機リガンド分子とを含有し、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する金ナノ粒子組成物であって、前記有機リガンド分子は、下記化学構造式(V)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物。
【化5】

(V)
【請求項4】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含むDNAチップ。
【請求項5】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む近赤外線吸収材。
【請求項6】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含むドラッグデリバリーシステム用薬物保持体。
【請求項7】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む着色剤。
【請求項8】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含むバイオセンサー。
【請求項9】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む化粧品。
【請求項10】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む生体内診断用組成物。
【請求項11】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む治療用組成物。
【請求項1】
球状の金ナノ粒子と、前記金ナノ粒子に結合する有機リガンド分子とを含有し、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する金ナノ粒子組成物であって、前記有機リガンド分子は、下記一般式(I)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物。
【化1】

(I)
(式中、R1〜R10はCH3、CF3、OH、H、COOH及びハロゲン元素よりなる群から選択される置換基または連結基である。)
【請求項2】
前記有機リガンド分子は、下記化学構造式(II)で示されるジアミン、下記化学構造式(III)で示されるジアミン、および下記化学構造式(IV)で示されるジアミンよりなる群から選択されるジアミンである請求項1に記載の金ナノ粒子組成物。
【化2】

(II)
【化3】

(III)
【化4】

(IV)
【請求項3】
球状の金ナノ粒子と、前記金ナノ粒子に結合する有機リガンド分子とを含有し、少なくとも1つの吸収ピークの波長が600nmから1000nmまでの領域内に存在する金ナノ粒子組成物であって、前記有機リガンド分子は、下記化学構造式(V)で示される少なくとも1種のジアミンを含む金ナノ粒子組成物。
【化5】

(V)
【請求項4】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含むDNAチップ。
【請求項5】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む近赤外線吸収材。
【請求項6】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含むドラッグデリバリーシステム用薬物保持体。
【請求項7】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む着色剤。
【請求項8】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含むバイオセンサー。
【請求項9】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む化粧品。
【請求項10】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む生体内診断用組成物。
【請求項11】
請求項1から3のいずれかに記載の金ナノ粒子組成物を含む治療用組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−16778(P2011−16778A)
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2009−164122(P2009−164122)
【出願日】平成21年7月10日(2009.7.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度、文部科学省、地域科学技術振興事業委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504177284)国立大学法人滋賀医科大学 (41)
【出願人】(391059399)株式会社アイ.エス.テイ (102)
【Fターム(参考)】
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成21年7月10日(2009.7.10)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度、文部科学省、地域科学技術振興事業委託事業、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504177284)国立大学法人滋賀医科大学 (41)
【出願人】(391059399)株式会社アイ.エス.テイ (102)
【Fターム(参考)】
[ Back to top ]

