金ナノ複合体
【課題】ドラッグデリバリーシステムや蛍光センサー等に用いられる新規な金ナノ複合体を提供する。
【解決手段】表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有することを特徴とする金ナノ粒子複合体によって、上記課題を解決する。この金ナノ複合体は、グルタチオン等チオール化合物の共存下においてのみ、熱刺激により薬剤を放出することから、ねらった部位で薬物を的確に放出できるドラッグデリバリーシステムを構築することができる。
【解決手段】表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有することを特徴とする金ナノ粒子複合体によって、上記課題を解決する。この金ナノ複合体は、グルタチオン等チオール化合物の共存下においてのみ、熱刺激により薬剤を放出することから、ねらった部位で薬物を的確に放出できるドラッグデリバリーシステムを構築することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ドラッグデリバリーシステムや蛍光センサー等に用いられる金ナノ複合体に関する。更に詳しくは、所定の条件下においてのみ、熱刺激により、包摂していた有機分子を放出する、金ナノ複合体及びこれを用いたドラッグデリバリーシステムに関する。
【背景技術】
【0002】
ドラッグデリバリーシステムは、理想的な薬物投与システムとして、また、種々の種類の担体等を対象として、盛んに研究されている。粒子径が100nm以下のナノ粒子材料は、その粒径が薬物運搬体のサイズに適しているのに加え、相互作用に利用できる単位質量あたりの表面積が大きいという特性を有する。そのため、機能性物質の内包や分析感度の向上等、その実用性への展望からバイオ分離や各種アッセイ、診断やドラッグデリバリーシステム等の幅広い領域での活用が期待されている。
【0003】
中でも、温度やpH等の外部刺激に応答して機能や物理的性質が不連続かつ可逆的に変化する刺激応答性高分子は、感知・判断・運動といった高度機能を兼ね備えた高機能材料として数多く研究されている。
【0004】
刺激応答性高分子とは、外部環境の様々な物理・化学情報(温度・熱、溶媒・組成、pH、電場、光等)を感知して応答する高分子であり,特に熱に感応するものが熱応答性高分子とばれる。現在、4種の基本的な相互作用(水素結合性、疎水性、ファンデルワールス力、静電的相互作用)と高分子の相転移が示されている。
【0005】
この相転移は、ゲル内の分子間相互作用(高分子鎖と溶媒分子間、高分子鎖と高分子鎖間)によって誘発されていることから、ゲルの相転移を構成高分子の物性変化と捉えることができる。従来からよく知られる熱応答性高分子には、ポリN−イソピルアクリルアミド等のポリ(アクリルアミンド)類縁体が挙げられる。
【0006】
このように、架橋型熱応答性高分子は、外部の熱刺激に応じて高分子鎖のコンフォメーションを変化させることができる。そのため、体温に近い温度で相転移する架橋型熱応答性高分子を利用して、体内の必要な部分に確実に薬を投与し、最適な温度で薬の投与のon‐offを制御することのできるドラッグデリバリー用の担体として研究されている。
【0007】
しかしながら、このような架橋型熱応答性高分子を用いたドラッグデリバリーシステムにおいては、当該高分子の熱による相転移によって、内包させた薬剤の放出が生じる(すなわち熱刺激によって薬剤の放出が起動されてしまう)ため、環境温度変化による当該高分子からの薬剤の遊離等による安定性の問題、また薬剤の自己拡散による漏出等の克服すべき課題が残されている。
【0008】
一方、金ナノ粒子は、バルクでは見られなかった新しい物性と構造を持っている古くから研究されているナノ粒子であり、ステンドグラスや陶器の無鉛赤色絵具や無機塗料顔料として利用されてきた。例えば、鮮やかなワインレッドの色は、液相で金ナノ粒子を調製して得ることができる。金ナノ粒子の発色は、表面プラズモン共鳴(SPR)によって生じるため、形状や粒径によって様々な色調を与える。粒径が十数nm程度で分散状態にある溶液は、520nm付近で極大吸収波長を示し、赤色を呈する。この粒子が凝集状態になると、ブルーシフトを起こして長波長側に新たな吸収帯が生じ、溶液は青色になる。金ナノ粒子は、一度凝集状態になると容易には分散状態に戻らない。
【0009】
このようなあざやかな色調の変化を利用して、近年では、バイオセンサや光スイッチ等の次世代のセンシング材料やフォトニクス材料として注目され、多くの研究が行われている。
【0010】
例えば、本発明者による特許文献1においては、グルタチオン又はシステイニルグリシン等のチオール基含有化合物を簡便、迅速、正確に計測することができる色彩色差計測方法として、金ナノ粒子に、特定の熱応答性高分子を複合化してなる金ナノ粒子複合体を用いる方法を提案している。この方法によれば、金ナノ粒子と特定の熱応答性高分子を複合化した金ナノ粒子複合体は溶液中で凝集状態となって青色を呈するが、金ナノ粒子複合体はポリマーが金ナノ粒子に化学吸着することにより溶液中で沈降しない。そして、この複合体溶液にグルタチオンやシステイニルグリシン等の特定のチオール基含有化合物を混合することにより、ポリマーが離脱する代わりにグルタチオンやシステイニルグリシン等が金ナノ粒子に吸着し、さらにそのグルタチオンやシステイニルグリシン等が有するカルボキシル基の作用により分散状態になって赤色に変化するというものである。
【0011】
また、同じく本発明者による特許文献2においては、粒径が1〜5μmの金ナノクラスターと熱応答性高分子(カルボキシル基等のアニオン基を含む熱応答性高分子を除く。)とを含む混合溶液を準備する工程と、混合溶液を加熱し、冷却する工程とを有することを特徴とする金ナノ粒子の製造方法が開示されている。この方法によれば、金(III)イオンを還元して粒径が50nmを超える金ナノ粒子やロッド状の金ナノ粒子を製造するのではなく、粒径1〜5μmの金ナノクラスターと熱応答性高分子との混合溶液を加熱、冷却するという簡単な操作で、粒径が50〜100nmの範囲の金ナノ粒子を得るという新しい方法を提案している。また、特許文献2においては、チオール化合物が、凝集体を構成する金ナノクラスターに吸着することで、金ナノクラスター同士の接触・融合が阻まれ、その結果、金ナノ粒子の製造が阻害され、吸光度での550nmの吸収ピークが小さくなり、赤みが弱くなるため、金ナノ粒子の製造用溶液を、チオール化合物の選択的な検出溶液として応用できることが提案されている。
【0012】
非特許文献1では、ナイルレッドを非共有的に吸着させた金ナノ粒子の水溶液をチオール類の検出に用いることが開示されている。これは、システアミンやホモシステイン等のようなチオール類の添加によって、当該ナイルレッドを非共有的に吸着させた金ナノ粒子の水溶液の蛍光が増加するというものであり、このような蛍光の増加は、アミン類、酸類、アルコール類、ウシ血清アルブミン、ヘモグロビン等の添加によっては生じないことが報告されている。
【0013】
非特許文献2においては、狭い多分散性を有する熱応答性ブロック共重合体を被覆した金ナノ粒子が、可逆性の熱応答性を示すことが開示されている。
【0014】
非特許文献3においては、1,10−フェナントロリンリガンドを有する4nmの金ナノ粒子が、選択的にリチウムイオンに結合し、2:1のリガンド−金属複合体を形成することで、当該リガンドがリチウムイオンに結合し、金ナノ粒子が凝集することを引き起こすことが示されており、この金ナノ粒子の凝集が、色変化を伴う励起スペクトルにおけるシフトを引き起こし、水溶液中のリチウムイオンの有用な光学的検出方法となることが開示されている。
【0015】
金ナノ粒子は、前記したようなナノ粒子材料の一種であり、ドラッグデリバリー用の担体としても研究されているが、薬剤は金ナノ粒子に吸着した状態で運ばれ、かつ一般的にその結合力が強いため、外部から薬剤の放出を制御することが困難であった。
【0016】
また、蛍光分子を金ナノ粒子に物理吸着させたナノ複合体が、ナノ粒子蛍光センサーとして研究されている。ナノ粒子蛍光センサー溶液に分析対象物質を添加すると、ナノ複合体に吸着していた蛍光分子が遊離するため、ナノ複合体による蛍光共鳴エネルギー移動(以下FRET)が解消し、蛍光強度が回復する。しかし、このナノ粒子蛍光センサーでは、分析対象物質の添加により凝集が生じることがあり、再現性低下の原因となっていた。
【0017】
このように、従来、金ナノ粒子、架橋型熱応答性高分子はともにドラッグデリバリー用の担体として研究されている。しかしながら、これまで熱応答性高分子を被覆した金ナノ粒子をドラッグデリバリー担体として実用化されているものはない。
【先行技術文献】
【特許文献】
【0018】
【特許文献1】特開2009−229147号公報
【特許文献2】特願2010−44792号明細書
【非特許文献】
【0019】
【非特許文献1】Analytical Chemistry, 76, 3727-3734(2004).
【非特許文献2】Colloids and Surfaces, A, 317, 764-767(2008).
【非特許文献2】Langmuir, 26, 6818-6825(2010).
【発明の概要】
【発明が解決しようとする課題】
【0020】
効果的なドラッグデリバリーシステムを構築するためには、ねらった部位で薬物を的確に放出できる担体の開発する必要がある。上述したように、架橋型熱応答性高分子を用いる場合には、外部からの熱刺激により内包している薬物の放出を制御することが可能ではある。しかしながら、薬物の自己拡散による漏出等が従来克服すべき課題であった。一方、金ナノ粒子を担体として用いる場合、薬剤は金ナノ粒子に吸着した状態で運ばれるが、この場合には、外部から薬剤の放出を制御することはできないという問題があった。
【0021】
本発明の目的は、ドラッグデリバリーシステムや蛍光センサー等に用いられる新規な金ナノ複合体を提供することにある。特に、本発明は、ねらった部位で薬物を的確に放出できる金ナノ複合体、及びこれを用いたドラッグデリバリーシステムを提供することにある。
【課題を解決するための手段】
【0022】
本発明者は、上記課題を解決するために鋭意研究及び検討を重ねた結果、金ナノ粒子に対しチオール類が強い吸着性を示すことに着目し、金ナノ粒子表面に薬剤(有機物)を吸着させ、熱応答性高分子を被覆してなる金ナノ複合体を調製した。この金ナノ複合体を、グルタチオン等チオール化合物と接触させると、チオール化合物により、金ナノ粒子表面で吸着分子の置換が起こるものの、薬剤は熱応答性高分子に覆われている金ナノ複合体の中に留まる。この状態で熱刺激を加えると熱応答性高分子の収縮により、薬剤は複合体から放出される。これによって、当該金ナノ複合体は、グルタチオン等チオール化合物の共存下においてのみ、熱刺激により薬剤を放出し、ねらった部位で薬物を的確に放出できるドラッグデリバリーシステムが確立されること、また、薬剤として蛍光物質を用いた場合に、再現性の良好な蛍光センサーとなることを見出し、本発明に到達した。
【0023】
すなわち、上記課題を解決するための本発明に係る金ナノ粒子複合体は、表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有することを特徴とする。
【0024】
この発明によれば、表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有するので、グルタチオン等のチオール化合物の共存下において、熱刺激により薬剤を効率的に放出することができる。こうした金ナノ複合体は、その核である金ナノ粒子の表面が薬剤を吸着していることから、自己拡散のおそれがない。なお、薬剤の放散のメカニズムは以下のステップで行われると考えられる。すなわち、チオール化合物により、金ナノ粒子の表面で吸着分子の置換が起こるものの、薬剤は熱応答性高分子に覆われている金ナノ複合体の中に留まる。この状態で熱刺激を加えると、熱応答性高分子の収縮により、薬剤が複合体から放出される。このように、金ナノ粒子に熱応答性高分子を被覆することで、これらが単独で用いられていたときには克服できなかった問題を克服するドラッグデリバリー担体やナノ粒子蛍光センサーを構築することができる。
【0025】
本発明に係る金ナノ複合体において、前記熱応答性高分子としては、下記化学式2で表されるポリマーが好ましい。式中、R1とR2はそれぞれ独立にアルキル基を表す。R3とR4はそれぞれ独立に水素又はメチル基を表す。また、x/yは95/5〜70/30であり、nは1〜4である。
【0026】
【化1】

【0027】
このうち特に、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルジエチレントリアミン)[poly(NIPAAm−co−(AC−DETA))]及びポリ(N−イソプロピルアクリルアミド−co−アクリロイルトリエチレンテトラミン)[poly(NIPAAm−co−(AC−TETA))が好ましい。
【0028】
本発明に係る金ナノ複合体において、前記薬剤としては、蛍光物質、生理活性物質又は医薬化合物を用いることができる。
【0029】
上記課題を解決するための本発明に係る金ナノ複合体の製造方法は、金ナノ粒子のコロイド溶液に対し、薬剤水溶液、熱応答性高分子溶液の順に添加し、金ナノ粒子に対して先に薬剤を吸着させてから、熱応答性高分子を被覆することを特徴とする。
【0030】
上記課題を解決するための本発明に係るドラッグデリバリーシステム薬剤は、上記した本発明に係る金ナノ複合体を、チオール類又はシスチンの存在下で加熱して使用することを特徴とする。
【発明の効果】
【0031】
本発明に係る金ナノ複合体によれば、表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有するので、グルタチオン等のチオール化合物の共存下において、熱刺激により薬剤を効率的に放出することができる。こうした金ナノ複合体は、その核である金ナノ粒子表面に薬剤が吸着していることから、自己拡散のおそれがない。
【図面の簡単な説明】
【0032】
【図1】金ナノ複合体からの薬剤放出のメカニズムを示す模式図である。
【図2】蛍光物質Nile Redの励起及び蛍光スペクトルを示す図面である。
【図3】金ナノ複合体において用いられた熱応答性高分子の相違による薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図4】金ナノ粒子を被覆する熱応答性高分子(NIP−DETA)の濃度による蛍光スペクトル強度の影響を示す図である。
【図5】金ナノ粒子を被覆する熱応答性高分子(NIP−TETA)の濃度による蛍光スペクトル強度の影響を示す図である。
【図6】pH環境変化による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図7】加熱温度の変化による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図8】実施例において使用した分子スイッチ化合物の構造式を示す図面である。
【図9】添加した分子スイッチ化合物の相違による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図10】分子スイッチ化合物の添加濃度変化による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図11】分子スイッチ化合物の添加濃度変化による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図12】分子スイッチ化合物の添加時における共存物質の存在による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【発明を実施するための形態】
【0033】
以下、本発明に係る金ナノ粒子複合体について、図面を参照しつつ説明する。
【0034】
[金ナノ粒子複合体]
本発明に係る金ナノ粒子複合体は、表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有することを特徴とする。先ず、本発明に係る金ナノ複合体を説明するに先立ち、本発明の重要な構成要素につき、個々に説明する。
【0035】
(金ナノ粒子)
金ナノ粒子としては、種々の形状のものを用いることが可能であるが、粒形状又は球形状であることが望ましい。なお、金ナノ粒子の粒径は、その調製方法に依存し、各種の粒径のものを得ることができる。本発明に使用可能な金ナノ粒子の粒径の範囲は特に限定されないが、粒径が小さすぎるものは作製が難しく、一方、粒径が大きすぎるものは沈降してしまう場合があるので、それらを考慮して選択する。一般的には、粒径10〜100nm程度のもの、特に10〜50nm程度のものが多く用いられる。なお、金ナノ粒子の粒径は、透過型電子顕微鏡(TEM)での観察結果から求めることができる。
【0036】
金ナノ粒子は、金ナノ粒子溶液として調製することができる。この金ナノ粒子溶液の調製は、クエン酸ナトリウム還元により行うことができ、具体的には、所定量のテトラクロロ金酸水溶液に、クエン酸三ナトリウム水溶液を添加して調製する例を挙げることができる。また、市販の所定の大きさからなる金ナノ粒子溶液を用いてもよい。
【0037】
金ナノ粒子を含む金ナノ粒子複合体は、特許文献1に記載されるように、粒径1〜5μmの金ナノクラスターと熱応答性高分子との混合溶液を加熱、冷却するという製造方法を応用して、調製することも可能である。この調製方法については下記に詳述する。
【0038】
ここで、金ナノクラスターは、透過型電子顕微鏡像(TEM像)で測定した粒径が1〜5μmの金粒子のことである。金ナノクラスターの形状は、粒形状又は球形状であることが望ましい。金ナノクラスターは各種の方法で製造でき、例えば、テトラヒドロホウ酸ナトリウム溶液を用いる方法等で製造することができる。具体的には、塩化金酸溶液にポリオキシエチレン溶液を添加した後に水を加え、pH調整した後にNaBH4(テトラヒドロホウ酸ナトリウム)溶液を添加し、その後反応させて合成することができる。なお、ポリオキシエチレン溶液としては、テトラエチレングリコール等を挙げることができる。こうした合成方法によって、粒径が1〜5μmの金ナノクラスターを得ることができる。
【0039】
(熱応答性高分子)
熱応答性高分子としては、少なくともN−イソプロピルアクリルアミド類を構成単位として含むポリマー、ポリ(メチルビニルエーテル)、又はヒドロキシプロピルセルロース等が挙げられる。
【0040】
熱応答性高分子のうち、N−イソプロピルアクリルアミド類を構成単位として含むポリマーの例としては、下記一般式1〜6に記載のものを例示することができる。
【0041】
【化2】

【0042】
上記化学式1のポリマーは、ポリ(N−イソプロピルアクリルアミド)類である。化学式1において、R1とR2はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。nは1000〜100000の整数である。R1とR2をメチル基とし、R3を水素としたポリ(N−イソプロピルアクリルアミド)は「P−NIP」で表す。
【0043】
【化3】

【0044】
上記化学式2のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)類である。化学式2において、R1とR2はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3とR4はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。また、x/yは95/5〜70/30であり、好ましくは90/10〜85/15の範囲である。nは1〜4である。R1とR2をメチル基とし、R3とR4を水素としたポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)は「pNIP−AC」で表す。
【0045】
化学式2のポリマーの右側の側鎖は、エチレンイミン鎖の繰り返し単位を含むアクリロイルアミン(以下、ACという。)である。より具体的には、右側の側鎖のエチレンイミン鎖の繰り返し単位であるn=0の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルエチレンジアミン)[以下、poly(NIPAAm−co−(AC−EDA))という。]となり、n=1の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルジエチレントリアミン)[以下、poly(NIPAAm−co−(AC−DETA))という。]となり、n=2の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルトリエチレンテトラミン)[以下、poly(NIPAAm−co−(AC−TETA))という。]となり、n=3の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルテトラエチレンペンタミン)[以下、poly(NIPAAm−co−(AC−TEPA))という。]、n=4の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルペンタエチレンヘキサミン)[以下、poly(NIPAAm−co−(AC−PEHA))という。]となる。
【0046】
【化4】

【0047】
上記化学式3のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−アクリロイル−シスタミン)類である。化学式3において、R1とR2及びR7とR8はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3とR4及びR5とR6はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。また、x/y/zは95/2.5/2.5〜80/10/10である。R1とR2及びR7とR8をメチル基とし、R3とR4及びR5とR6を水素としたポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)は「pNIP−Cys」で表す。
【0048】
【化5】

【0049】
上記化学式4のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アラニン)類である。化学式4において、R1とR2及びR5はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3とR4はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。また、x/yは90/10〜80/20である。R1とR2及びR5をメチル基とし、R3とR4を水素としたポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)は「pNIP−AC」で表す。
【0050】
【化6】

【0051】
上記化学式5のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−グリシジルメタクリル酸−乳酸)類である。化学式5において、R1とR2及びR5はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3とR4はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。また、x/yは95/5〜80/20である。R1とR2及びR5をメチル基とし、R3とR4を水素としたポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)は「pNIP−GMA−乳酸」で表す。
【0052】
【化7】

【0053】
上記化学式6のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−(メタ)アクリル酸)類である。化学式6において、R1とR2はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R4は水素又はメチル基を表す。また、x/yは95/5〜70/30であり、好ましくは90/10〜85/15の範囲である。R1とR2をメチル基とし、R4をメチル基としたポリ(N−イソプロピルアクリルアミド−co−メタクリル酸)は「pNIP−MA」で表す。
【0054】
なお、この化学式6で表されるポリマーのように、カルボキシル基等のアニオン基を含む熱応答性高分子は、前述の特許文献1に記載の金ナノクラスターと熱応答性高分子との混合溶液から金ナノ粒子を調製するという製法には用いることができない。
【0055】
また、熱応答性高分子ではないポリエチレングリコール(PEG)やポリアクリルアミドは、金ナノ粒子を製造できない。
【0056】
上記化学式1〜6のポリマーの分子量は、重量平均分子量で8000以上100000以下のものを用いることができ、10000以上20000以下のものが好ましい。また、各ポリマーは、通常それぞれ単独で用いられるが、2以上を併せて用いてもよい。また、本発明の趣旨の範囲内であれば、上記化学式1〜6のポリマーと同様の効果を奏する他の熱応答性高分子、例えば、ポリ(メチルビニルエーテル)、ヒドロキシプロピルセルロース等を用いてもよい。
【0057】
上記化学式1〜6のポリマーは、後述する実験例に示す方法で合成することができる。例えば、化学式1のポリマーは、モノマー成分であるN−イソプロピルアクリルアミド類を水に溶解し、重合開始剤と重合促進剤を加えて重合し、生成物を精製し、その後凍結乾燥して得ることができる。また、化学式2〜6のポリマーも、重合させるモノマー成分を溶媒に溶解し、重合開始剤と重合促進剤を加えて重合し、生成物を精製し、その後凍結乾燥して各ポリマーを得ることができる。
【0058】
特に限定されるものではないが、上記化学式1〜6のポリマーうち、化学式2のpNIP−AC、好ましくは、poly(NIPAAm−co−(AC−DETA)、poly(NIPAAm−co−(AC−TETA))、特に好ましくは、poly(NIPAAm−co−(AC−DETA)である。poly(NIPAAm−co−(AC−DETA)は、チオール類存在下における熱刺激による、金ナノ粒子に吸着していた薬剤の放出特性に優れ、チオール類不在下における熱刺激の状態又はチオール存在下の熱刺激のない状態においては、安定に薬剤を保持している特性を発揮することから、特に好ましいものである。
【0059】
なお、熱応答性高分子が、上記化学式2で表されるポリマーのうち、右側の側鎖のエチレンイミン鎖の繰り返し単位の数が大きいもの、具体的には、n=3のpoly(NIPAAm−co−(AC−TETA)よりもエチレンイミンユニットが多いものである場合には、NH基やNH2基が多く、熱刺激によって熱応答性高分子が熱収縮した際、そうした基が金ナノ粒子に吸着し、金ナノ粒子に吸着していた薬剤分子と置き換わることが生じると考えられるため、チオール類の不在下によっても、熱刺激によりある程度の薬剤が放出されるが、チオール類の存在下における熱刺激の場合と比較すると、放出の程度は有意に異なり、かつその放出の程度は後述する実施例において示すように、実験に用いた熱応答性高分子のうち最も高いものであったことから、好ましい熱応答性高分子として例示できるものである。
【0060】
(薬剤)
金ナノ粒子が吸着する薬剤としては、チオール類存在下における熱刺激によって、金ナノ複合体より良好に放出される一方、チオール類不在下における熱刺激の状態又はチオール存在下の熱刺激のない状態においては、安定に金ナノ複合体に保持され得るものであれば、特に制限なく各種のものを用いることができる。
【0061】
薬剤としては、担持又は付着されない状態において、特有の機能、例えば生理活性、薬物活性、触媒活性や光学分割性、抗酸化活性、界面活性、香料、又は、光学活性等の機能を有するものとして考慮される。中でも、生理活性物質又は医薬化合物が代表的なものとして例示される。
【0062】
生理活性物質又は医薬化合物としては、例えば、Goodman and Gilman’s “The Pharmacological of Basis of Therapeutics”の最新版、又はThe Merck Indexの最新版等に示された各種の薬剤類が挙げられる。例えば、中枢神経系に作用する薬剤;末梢シナプスに作用する薬剤;炎症応答に影響を及ぼす薬剤;体液の組成に影響を及ぼす薬剤;腎臓機能及び電解質代謝に影響を及ぼす薬剤;心臓血管剤、胃腸管機能に影響を及ぼす薬剤;子宮運動性に影響を及ぼす薬剤;寄生中感染症のための化学療法剤、微生物病のための化学療法剤;抗腫瘍性ないし抗癌剤;免疫抑制剤、血液及び血液形成器官に影響を及ぼす薬剤;ホルモン及びホルモンアンタゴニスト;皮膚剤;重金属アンタゴニスト、ビタミン及び栄養素、ワクチン、オリゴヌクレオチド及び遺伝子治療薬等が挙げられる。また、アミン系の薬剤、例えば塩酸アミトリプチリン、塩酸イミプラミン、塩酸クロミプラミン、マレイン酸トリミプラミン、塩酸ノルトリプチリン、アモキサピン、塩酸ドスレピン、塩酸ロフェプラミン)等を挙げることもできる。また、シスプラチン等の錯体系の薬剤であってもよい。
【0063】
また、光学特性の機能を有する薬剤として代表的な、蛍光物質としては、ナイルレッド等が好ましく例示できる。
【0064】
本発明に係る金ナノ複合体において、金ナノ粒子が吸着する薬剤は、後述するようなチオール類の存在下において、金ナノ粒子に対しチオール類が強い吸着性を示すために置換され、金ナノ粒子から遊離するものと考えられる。金ナノ粒子に対して、チオール化合物よりも強い吸着性を有する薬剤であると、チオール類存在下における熱刺激によっても、金ナノ複合体より放出されにくいものとなる。このため、使用するチオール類の種類によっても左右されるが、概して、金ナノ粒子に対してある程度の吸着性を示す一方で、チオール類の吸着性よりも低い吸着性を発揮する化合物が用いられる。こうした化合物としては、特にチオール化合物の有するチオール基よりも、金ナノ粒子表面に対し弱い相互作用を示す官能基ないし骨格構造を有する、例えばエチル基やメチル基のようなアルキル基、フェニル基、水酸基、カルボキシル基、アミノ基等を適度に有する化合物等が用いられる。
【0065】
また、金ナノ粒子に対して、いわゆる保護コロイドを形成するような高分子化合物、つまり1分子が多数の点で金ナノ粒子表面に吸着(多点吸着)する高分子化合物等は、チオール類の添加によっても脱着が生じにくいと考えられる。そのため、本発明に係るナノ複合体に使用する薬剤としては、概して適当ではないものが多い。
【0066】
[金ナノ複合体の製造方法1]
本発明に係る金ナノ複合体は、基本的には、金ナノ粒子のコロイド溶液に対し、薬剤水溶液、熱応答性高分子溶液の順に添加し、金ナノ粒子に対して先に薬剤を吸着させてから、熱応答性高分子を被覆することによって製造することができる。
【0067】
なお、上記とは異なり、金ナノ粒子のコロイド溶液に対し、先に熱応答性高分子溶液を添加した後、薬剤水溶液を添加する順序で金ナノ複合体を調製すると、金ナノ粒子に先に熱応答性高分子を被覆されてしまう。このことから、得られる金ナノ複合体において、薬剤分子は金ナノ粒子にはあまり直接吸着せず、金ナノ粒子を被覆している熱応答性高分子に取り込まれている状態になっていることが推測される。本発明者が確認したところによれば、この場合、後述するようなチオール類等の分子スイッチの添加有無ないしは添加する有機化合物分子のチオール基含有の有無にかかわらず、熱刺激によって薬剤分子の放出が見られる。このことから、本発明に係る金ナノ複合体の製造方法としては、上記したように、金ナノ粒子のコロイド溶液に対し、先に薬剤水溶液を接触させることが肝要であると考えられる。
【0068】
使用する熱応答性高分子は、通常、1種の熱応答性高分子であるが、金ナノ複合体を製造することが可能であれば2種以上の熱応答性高分子であってもよい。また、金ナノ複合体を製造する際の、混合溶液のpHは含有させる薬剤及び熱応答性高分子の種類にもよるが、通常、2.9〜10.0の範囲であることが好ましい。
【0069】
混合溶液には、金ナノ粒子が0.0018〜0.0090質量%の範囲で含まれることが好ましく、熱応答性高分子は、使用する熱応答性高分子の種類によっても左右されるが0.25〜2.0質量%の範囲で含まれることが好ましい。また、薬剤の濃度としては、使用する薬剤の種類によっても左右されるが、例えば、金1gに対し、0.2〜20×10-5M程度の濃度とすることができる。この程度の薬剤濃度であれば、添加した薬剤を効率よく金ナノ粒子に吸着させることができ、かつ後述するようなチオール類存在下における熱刺激による薬剤放出の作用機序に薬剤の濃度依存性による影響を及ぼすこともない。
【0070】
[金ナノ複合体の製造方法2]
本発明に係る金ナノ複合体の製造方法としては、特許文献1に記載の製造方法を応用したものを例示することが可能である。
【0071】
すなわち、金ナノ複合体は、上記した金ナノクラスターの溶液に、薬剤水溶液、熱応答性高分子(カルボキシル基等のアニオン基を含む熱応答性高分子を除く。)溶液を順に添加し、調製された混合溶液を加熱し、冷却することによって、金ナノ複合体が製造される。
【0072】
混合溶液には、金ナノクラスターが0.0018〜0.0090質量%の範囲で含まれることが好ましく、熱応答性高分子が0.25〜2.0質量%の範囲で含まれることが好ましい。また、金ナノクラスターと熱応答性高分子を質量比で表すと、金ナノクラスター/熱応答性高分子の質量比が9/10000〜36/1000の範囲であることが好ましい。また、薬剤の濃度としては、使用する薬剤の種類によっても左右されるが、例えば、金1gに対し、0.2〜20×10-5M程度の濃度とすることができる。この程度の薬剤濃度であれば、添加した薬剤を効率よく金ナノ粒子に吸着させることができ、かつ後述するようなチオール類存在下における熱刺激による薬剤放出の作用機序に薬剤の濃度依存性による影響を及ぼすこともない。
【0073】
混合溶液に含有させる熱応答性高分子は、通常、1種の熱応答性高分子であるが、金ナノ粒子を製造することが可能であれば2種以上の熱応答性高分子であってもよい。また、混合溶液のpHは含有させる熱応答性高分子の種類にもよるが、通常、2.9〜10.0の範囲であることが好ましい。
【0074】
金ナノ複合体は、調製された金ナノ複合体の製造用溶液(混合溶液)を加熱し、冷却することによって製造される。加熱は、熱応答性高分子に相転移を起こさせ、金ナノクラスターを融合させる操作である。加熱温度は、40〜95℃、好ましくは70〜95℃である。温度が高いほど大きな粒径の金ナノ粒子を得ることができる。加熱時間は、30分〜2時間が好ましい。なお、加熱時間が長くなると大きな粒子の個数が増えて平均粒径が見かけ上大きくなる。しかし、粒子が成長して大きい粒子になるわけではない。また、吸光度の変化は、30分以上ではあまり変わらない。
【0075】
冷却は、加熱されて熱応答性高分子が析出し濁った溶液を、再度透明にする操作である。冷却温度は、0〜30℃、好ましくは4〜10℃である。冷却温度が低くなるほど早く溶液は透明となる。冷却時間は、30分以上で十分であり、上限は特に限定されない(1時間又は2時間程度)。
【0076】
こうした加熱冷却手段により、混合溶液から金ナノ複合体を製造することができる。製造された金ナノ粒子は、TEM像から計測できる粒径が50〜100nmの範囲であり、動的光散乱法での測定で粒径100〜500nmにピークを示す。なお、TEM像からの計測は、TEM写真を撮影し、その写真から計測したものである。一方、動的光散乱法による粒径の測定は、動的光散乱測定装置で測定されたものである。
【0077】
[金ナノ複合体からの薬剤放出]
本発明に係る金ナノ複合体からの吸着薬剤分子の放出は、後述するようなグルタチオン等チオール類又はシスチンを添加し、熱刺激(加熱→冷却)を行うことによってなされる。
【0078】
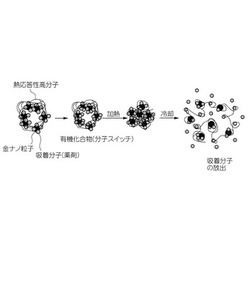
図1は、金ナノ複合体からの薬剤放出のメカニズムを示す模式図である。すなわち、図1に示すように、金ナノ粒子表面に薬剤分子を吸着させ、熱応答性高分子を被覆してなる金ナノ複合体に対して、チオール類等の分子スイッチとなる有機化合物を添加すると、当該有機化合物分子により、金ナノ粒子表面で吸着分子の置換が起こるものの、薬剤は熱応答性高分子に覆われている金ナノ複合体の中に留まる。この状態で熱刺激(加熱→冷却)を加えると熱応答性高分子が相移転を起こし一旦収縮することで、金ナノ複合体から遊離し放出されというものである。
【0079】
(チオール類)
次に、上記したような本発明に係る金ナノ複合体からの薬剤放出のために用いられるチオール類について説明する。
【0080】
金ナノ複合体へのチオール類の吸着によって、金ナノ粒子に吸着した薬剤分子が金ナノ粒子から脱離する。すなわち、凝集状態の金ナノ粒子複合体にチオール基を有するチオール類を加えると、金ナノ粒子の表面で、薬剤分子の官能基等と交換して、金ナノ粒子表面に対し強い結合性を有するチオール基が配位しチオール類が吸着する。
【0081】
チオール類の添加により、上記のような薬剤分子の脱離を効果的に生じさせるチオール類としては、(1)チオール基の存在、(2)分子サイズ及び構造、(3)カルボキシル基やアミノ基間の水素結合の存在といった要素が必要であると考えられる。
【0082】
(1)のチオール基は、金ナノ粒子の表面に吸着し、薬剤分子の官能基等との交換反応を起こすと考えられる。酸化型グルタチオンのようなジスルフィド結合を有する化合物、メチオニンのようなスルフィド結合を有する化合物では、チオール基を有する化合物とは異なり、薬剤分子の官能基等との交換反応は生じないように思われる。但し、本発明者の行った実験によれば、ジスルフィド結合を有する化合物であっても、シスチン(システインの2量体)の場合、当該化合物添加後に熱刺激を与えると、薬剤分子の高い放出効果が発揮されることが観察でき、例外的にシスチンは、本発明に係る金ナノ複合体に対し効果的に作用する化合物であるといえる。
【0083】
(2)の分子サイズ及び構造については、チオール類の金ナノ粒子表面への吸着による薬剤分子との置き換え反応が、概してチオール類が低分子量となる程速く生じるものと思われる。例えば、グルタチオンのように分子サイズが大きいと金ナノ粒子の保護効果が大きいものの、金ナノ複合体の表面に吸着した薬剤分子や熱応答性高分子との置換が遅い。L−システイン(L−Cys)、ホモシステイン(Hcys)等の低分子量のカルボキシル基を有するチオール基含有化合物では金ナノ粒子の保護効果はほとんどなく、反応は速い。グルタチオンとL−システインの中間のサイズにあるシステイニルグリシン、グルタミルシステイン等は、金ナノ粒子の保護効果を有し、薬剤分子や熱応答性高分子との置換の反応速度も比較的速いと考えられる。
【0084】
このため、L−システイン、Hcys等の低分子量チオール基含有化合物を用いた場合、当該化合物を添加したのみで、金ナノ複合体からかなりの量の薬剤が放出され、熱刺激によって薬剤を放出するという本発明に係る金ナノ複合体の起動作用が有効に働かないおそれが高い。このような化合物は分子サイズが小さいので、これを添加すると、熱刺激(加熱→冷却)による金ナノ粒子の再分散を阻害する為に薬剤分子の遊離が十分ではなくなり、熱刺激後において遊離薬剤分子量が低下するものと思われる。
【0085】
システイニルグリシン、グルタミルシステイン等の場合においても、このような傾向はある程度見られるものの、熱刺激を受けた後において金ナノ粒子の再分散が促進され、薬剤放出は、熱刺激を与える前よりも高い割合で生じるため、好ましい化合物といえる。グルタチオンの場合には、当該化合物を添加したのみでは、最も薬剤放出の程度が低く、かつ熱刺激を受けた後における薬剤放出の割合が極めて高いものとなるために、特に好ましい化合物といえる。
【0086】
(3)カルボキシル基の静電反発については、チオール基含有化合物の酸解離したカルボキシル基の静電反発が大きく関与すると考えられる。グルタチオンの二つのカルボキシル基のpKaはpKa1=2.16及びpKa2=3.55であり、主に検討している熱応答性高分子濃度0.2質量%における複合体溶液のpHが約8であるため、カルボキシル基はCOO−となっている。その一方、NH基、NH2基は一部水素イオンが付加して正に帯電している。はじめに金ナノ粒子はクエン酸によりアニオン性の状態であり、静電反発により分散している。この状態にNH基、NH2基を有するポリマーを添加することにより、金ナノ粒子表面の電荷が部分的に打ち消されるとともに、NH基、NH2基が金に吸着して、金ナノ粒子が凝集する。このとき、金ナノ粒子は、ポリマーで被覆され、凝集した粒子間にポリマーが入りこんだ状態になっている。この状態の金ナノ粒子にチオール基含有化合物であるグルタチオン等を添加すると、チオール基とNH基、NH2基とが交換し、チオール基含有化合物が金ナノ粒子の表面に結合する。このとき、金ナノ粒子の表面では官能基が非常に込み合っている状態となっているが、チオール基含有化合物や熱応答性高分子の極性基(官能基)がランダムな状態で存在することはエネルギー的に不利になる。極性基(官能基)が水素結合により配列することで、エネルギー的に不利な状態が解消される。結果として、金ナノ粒子間の距離を広がることになるものと考えられる。
【0087】
以上のチオール基の存在、分子サイズや構造、チオール基含有化合物のカルボキシル基の存在、NH基、NH2基を有するポリマーによる非共有結合的な保護効果が金ナノ粒子の再分散に影響するほかに、チオール基含有化合物の他の官能基の電荷や溶液中に存在する化合物の構造や各官能基の電荷等が、全体として金ナノ粒子の再分散に影響していると考えられる。
【0088】
以上の点から、本発明に係る金ナノ複合体による薬剤放出の分子スイッチとして用いられるチオール類としては、特に限定されるものではないが、グルタチオン(GSH)、システイニルグリシン(Cys−Gly)、グルタミン酸システイン(Glu−Cys)等が好ましいものとして例示でき、このうち特に好ましくは、グルタチオンである。また、前記したように薬剤放出の分子スイッチとしてシスチンも好ましい化合物として例示できる。
【0089】
また、このような薬剤放出の分子スイッチとして用いられるチオール類の添加濃度としては、一般的にチオール類の添加濃度が高い程、熱刺激を与えた後に放出される薬剤量が多くなる傾向があるが、一方で添加濃度が高くなる程、熱刺激を与えない状態において放出される薬剤量も多くなる傾向がある。また、ある程度以上の添加濃度とならないと、熱刺激前後における放出薬剤量の有意差が生じない。このため使用するチオール類の種類によっても左右されるため、一概には規定できないが、例えば、グルタチオンを使用する場合には、その濃度が4〜10×10−6M程度とすることが望ましい。
【0090】
なお、グルタチオン等の好ましいチオール類を薬剤放出の分子スイッチとして用いる場合、L−Cys、Hcys、グリシン、グルタミン酸等の共存物質が存在していても、当該グルタチオン(分子スイッチ)の添加後、熱刺激によって薬剤を放出するという本発明に係る金ナノ複合体の起動作用が有効に機能する。このことは、生体内においては、L−Cys、Hcys、グリシン、グルタミン酸等のアミノ酸、ペプチド等の存在が当然に想定されることから、本発明に係る金ナノ複合体を用いたドラッグデリバリーシステムが生体内において有効に機能するものであると思われる。
【0091】
(熱刺激)
本発明に係る金ナノ複合体に対し、分子スイッチであるチオール類の添加後、加熱し、冷却することによって、金ナノ複合体よりの薬剤放出が行われる。加熱は、熱応答性高分子に相転移を起こさせる操作である。加熱温度は、40〜95℃、好ましくは70〜95℃である。加熱時間は、30分〜2時間が好ましい。蛍光強度から見積もった薬物放出量の変化は、30分以上ではあまり変わらない。
【0092】
冷却は、加熱されて相転移を起こし収縮した熱応答性高分子を、再度分散させ金ナノ複合体からの薬剤の放出を行わせる操作である。冷却温度は、0〜30℃、好ましくは4〜10℃である。冷却時間は、30分以上で十分であり、上限は特に限定されない(1時間又は2時間程度)。
【0093】
金ナノ複合体が分子スイッチ添加及び熱刺激により吸着薬剤分子を放出する現象は、一般的なpH環境であるpH5〜9の範囲内においては、pH値にあまり依存することなく、ほぼ均一に生じ、熱刺激前において吸着薬剤分子は実質的に放出されないか又はごく微量の放出に留まり、熱刺激後において大きな放出が生じる。より望ましくは、pH5〜7.5程度の弱酸性ないし中性領域での使用が、熱刺激前の吸着薬剤分子の放出量を抑制しかつ熱刺激後において大きな放出を生じさせる上で好ましい。
【0094】
(ドラッグデリバリーシステム)
本発明に係る金ナノ複合体に対して、上記したようにチオール類又はシスチンの存在下で熱刺激を与えることで、吸着していた薬剤を放出することができることから、ねらった部位で薬物を的確に放出できるドラッグデリバリーシステムにおいて好適に用いられる。
【0095】
金ナノ複合体の生体内投与経路としては、特に限定されるものではなく、担持させる薬剤の種類及び薬剤を投与しようとする生体部位ないし組織に応じて、経口、経鼻、経膣、静脈内、皮下、腹腔内等の適当な投与経路を通して生体内に導入することが可能である。
【0096】
生体内においては、金ナノ複合体の分子スイッチであるチオール類、例えば、分子スイッチとして好適なグルタチオン、システイニルグリシン、グルタミン酸システイン等が本来存在しており、このようなグルタチオン等の濃度が高い生体部位ないし組織をターゲットとする薬剤投与の場合には、系外より別途チオール類を投与せずとも、熱刺激を与えることによって、本発明に係る金ナノ複合体を用いたドラッグデリバリーシステム薬剤を、ターゲット部位において的確に発動させることができる。もちろん、必要に応じて、このような分子スイッチとしてチオール類は、外部より生体内のターゲット部位ないし組織に導入することが可能である。
【0097】
生体に対し熱刺激(加熱)を行う手段としては、特に限定されるものではなく各種の手法を用いることが可能であるが、例えば、二方向(代表的には直交方向)からの遠赤外レーザー加熱を行えば、ターゲット部位を局所的に加熱することが可能である。
【0098】
(蛍光センサー)
本発明に係る金ナノ複合体に担持させる薬剤として、蛍光物質、例えば、上記したようなナイルレッド等を用いた場合、再現性の良いナノ蛍光センサーとして用いることがきる。
【0099】
ナノ粒子蛍光センサー溶液に、チオール化合物であるグルタチオン等の分析対象物質を添加し、熱刺激を加えると、熱応答性高分子の相転移に伴って蛍光物質が金ナノ複合体から遊離する。この結果、金ナノ複合体による蛍光共鳴エネルギー移動(以下FRET)が解消し、蛍光強度が回復する。回復した蛍光強度は添加する分析対象物質の濃度に比例するので、分析対象物質を定量できる。熱刺激を加えないと、蛍光物質が金ナノ複合体から遊離が実質的生じないため、分析対象物質の添加により遊離した蛍光物質が凝集することがなく、再現性良く定量分析が可能である。
【実施例】
【0100】
以下の実験によって、本発明をさらに詳しく説明するが、本発明は以下の実施例によって何ら限定されるものではない。特に、以下の実施例においては、吸着薬剤の放出の程度の確認を容易とするために、蛍光物質であるナイルレッドを吸着薬剤として使用した例を中心として記載するが、吸着薬剤としては何らこのような蛍光物質に限定されるものではなく、上述したような各種の薬剤が使用可能であることと、このような各種の薬剤においても以下の実施例に示す蛍光物質の場合と同様の有効な薬剤放出現象が生じることは、当業者であれば容易に理解できるものであると思われる。
【0101】
[装置及び試薬]
まず、本実施例において用いられた装置及び試薬としては、以下の通りであった。吸収スペクトルの測定には、光路長1cmプラスチックセルを装備した日本分光製V−560型 紫外可視分光光度計を使用した。蛍光スペクトル測定には、光路長1cm石英セルを装備した日本分光製FP−6300型分光蛍光光度計を使用した。
【0102】
合成した熱応答性高分子の限外濾過には、Millipore製の限外濾過膜を(排除限界分子量:5000)を装備したアドバンテック製のプラスチック製ウルトラフィルター用限外濾過器MODEL−UHP−Kを使用した。合成した熱応答性高分子の凍結乾燥には、アルバック機工製のOMT−050A型オイルミストトラップを備え付けたアルバック機工製の直結型油回転真空ポンプ、東京理科器械製のUT−1000型ユニトラップ、及び東京理科器械製のCMW−1型水分トラップを装備した東京理科器械製のFD−5N型凍結乾燥機を使用した。pHの測定には、HORIBA製pH−METER F−13を使用した。
【0103】
α,α’‐アゾビスイソブチロニトリル(AIBN、Fw:164.21)、水酸化カリウム(Fw:56.11)、水酸化ナトリウム(Fw:40.00)、ジエチルエーテル(Fw:74.12)、1,4‐ジオキサン(Fw:88.1)、ペルオキソ二硫酸カリウム(Fw:270.32)、ジエチレントリアミン(DETA、Fw:103.17)は関東化学製特級のものを使用した。ピロガロール(Fw:126.11)は関東化学製1級のものを使用した。メタクリル酸(MA、Fw:86.09)は関東化学製1級のものを凍結法により重合禁止剤を除去してから使用した。トリエチレンテトラミン(TETA、Fw:146.24)は関東化学製ものを使用した。N‐イソプロピルアクリルアミド(NIPAAm、Fw:113.16)は和光純薬製特級を関東化学製特級のヘキサン(Fw:86.18)を用いて再結晶してから使用した。N,N,N’,N’−テトラメチルエチレンジアミン(TEMED、Fw:116.21)は和光純薬特級を使用した。塩化アクリロイル(AC、Fw:90.51)は和光純薬1級を用いた。テトラクロロ金酸四水和物(Fw:411.85)、クエン酸三ナトリウム二水和物(Fw:294.1)、アセトン(Fw:58.08)は関東化学製特級のものを使用した。Nile Red(NR、Fw:318.57)は東京化成製1級のものを使用した。グリシン(Gly、Fw:75.07)、グルタミン酸(Fw:147.03)、L‐システイン(L-Cys、Fw:121.16)、1-ブタンチオール(Fw:90.19)、1-オクタンチオール(Fw:146.29)、2-メルカプトエタノール(Fw:78.13)、2,3-ジメルカプト-1-プロパノール (Fw:124.23)は関東化学製特級のものを、還元型グルタチオン(GSH、Fw:307.32)、3-メルカプト-1,2-プロパンジオール(Fw:108.16)は関東化学製1級のものを使用した。3-メルカプトプロピオン酸 (3-MPA、Fw:106.14)、1,2-エタンジチオール(Fw:94.2)は東京化成製特級のものを、酸化型グルタチオン(GSSG、Fw:612.63)、n-ドデシルメルカプタン(Fw:202.4)、3-メルカプトプロピオン酸エチル (Fw:134.2)は東京化成製1級のものをシスタミン硫酸塩(Fw:250.36)、Hcys(Fw:135.19)は東京化成製のものを使用した。グルタミルシステイン(Glu-Cys、Fw:250.27)、システイニルグリシン(Cys-Gly、Fw:178.2)、DL−ペニシラミン(Fw:149.2)はSigma製ものを使用した。
【0104】
実験における水は、蒸留、イオン交換した後、Millpore製のMilli−Q超純水製造システムで製造したものを使用した。メタノール(Fw:32.04)は関東化学製特級のものを蒸留してから使用した。
【0105】
[合成例1(金ナノ粒子の調製)]
金ナノ粒子溶液の調製は、クエン酸ナトリウム還元法により行った。使用した器具は、全て王水に30分間浸漬後、超純水で洗浄し、乾燥させたものを用いた。調製手順を以下に示す。500mL丸底フラスコに1mMテトラクロロ金酸塩水溶液、250mLを入れ、激しく攪拌しながら、沸騰直前まで加熱した。沸騰させたまま38.8mMクエン酸三ナトリウム水溶液、25mLを添加し、溶液の色が淡黄色から深赤色へと変化することを確認した。さらに攪拌しながら10分間加熱させた後、室温において15分間攪拌し続けた。溶液を孔径1μmメンブランフィルターを用いて吸引ろ過を行い、金ナノ粒子溶液をガラス試薬瓶に移し、冷暗所(4℃)に保管した(0.18g−Au/L金コロイド溶液)。
【0106】
[合成例2(化学式1/P−NIPの合成)]
500mL三つ口セパラブルフラスコにN−イソプロピルアクリルアミド(NIPAAm)30gを採り、水100mLで溶解した。氷浴を用いてフラスコを0℃に保ち、攪拌しながら、重合開始剤としてペルオキソ二硫酸カリウム1.0g及び重合促進剤としてN,N,N’,N’−テトラメチルエチレンジアミン(TEMED)1.5mLを添加し、4時間重合した。合成したP−NIPの構造式は、上記化学式1のR1とR2をメチル基としR3を水素原子としたものである。重合終了後、メタノール100mLを加えて沈殿したポリマーを取り出し、メタノール100mLに溶解した。この溶液に、水100mLを加え、沈殿したポリマー取り出して水100mLに溶解した。この操作を二回繰り返し行い、精製したP−NIPを水に溶解し、凍結乾燥を行った。さらに、得られたポリマーを水に溶解して凍結乾燥を行い、冷暗所に保存した。この熱応答性高分子の下限臨界溶液温度(LCST)は34.1℃であった。
【0107】
[合成例3(化学式2/ポリ(N−イソプロピルアクリルアミド−co−アクリロイルトリエチレンテトラミン)の合成)]
トリエチレンテトラミン(TETA)をモノマーとして用いる場合、あらかじめビニル基を導入する必要がある。そこでまずTETAと塩化アクリロイル(AC)よりアクリロイルトリエチレンテトラミン[以下、AC−TETA]の合成を行った。TETA29.73mL(0.2mol)と1,4−ジオキサン200mLの混合溶液に、AC1.625mL(0.02mol)と1,4−ジオキサン50mLの混合溶液を冷却、攪拌しながら一滴ずつ滴下して反応させた。滴下終了後、白色の沈殿を濾別し少量のメタノールに溶解した。これに水酸化カリウム−メタノール溶液(水酸化カリウム 1.18g(0.02mol))を含む100mLを加えて攪拌、濾別し得られた濾液をNIPAAmとの共重合に用いた。
【0108】
500mL三つ口セパラブルフラスコにモノマーの供給比(NIPAAmの物質量:TETAの物質量)がモル比で90:10(mol%)となるようにN−イソプロピルアクリルアミド(NIPAAm)20.37g(0.18mol)とAC−TETAを含むメタノール溶液を加えた。オイルバスを用いてフラスコを60℃に加温、攪拌しながら、重合促進剤として3−メルカプトプロピオン酸(3−MPA)(メタノール20mLに対して0.1mL)及び重合開始剤としてα,α’−アゾビスイソブチロニトリル(AIBN)0.8211g(0.005mol)を添加して、5w/v% ピロガロール−10w/v%アルカリ溶液(アルカリ:NaOH)100mLを用いた脱酸素ラインに通気した窒素雰囲気下で4時間重合を行った。
【0109】
得られたポリマーは以下の手順で精製した。まず、得られた重合反応物をエバポレーターにてポリマーの溶解液に含まれるメタノールを除去した後に、冷ジエチルエーテル1.0Lに注いだ。この上澄み液をデカンテーションして取り除き、メタノールで再度溶解した。この工程を2回繰り返した後、デカンテーション後に得られた沈殿物に水を加えて300mLとした。この溶液を分子量5000の限外濾過膜を用いて透析を6回行い、未反応モノマーを除去した。その後、得られたポリマー溶液に凍結乾燥を行い冷暗所で保存した。合成したポリ(N−イソプロピルアクリルアミド-co-アクリロイルトリエチレンテトラミン)[以下、NIP−TETA]の構造式は、上記化学式2のR1とR2をメチル基としR3とR4を水素原子、nを2としたものである。得られたNIP−TETAの下限臨界溶液温度(LCST)は38.3℃であった。
【0110】
[合成例4(化学式2/ポリ(N−イソプロピルアクリルアミド−co−アクリロイルジトリエチレンテトラミン)の合成)]
ジエチレントリアミン(DETA)をモノマーとして用いる場合、DETAにビニル基を導入する必要がある。そこで、まずDETAと塩化アクリロイル(AC)よりアクリロイルジエチレントリアミン[以下、AC−DETA]の合成を以下の手順で行った。DETAを含む1,4−ジオキサンの混合溶液(20.63g/200mL)に、ACと1,4−ジオキサンの混合溶液(1.625mL/50mL)を冷却、攪拌しながら一滴ずつ滴下して反応させた(DETAの物質量:ACの物質量=10:1)。滴下終了後、白色の沈殿を濾別し、少量のメタノールに溶解した。これにKOH−メタノール溶液を加えて攪拌、濾別し、得られた濾液をNIPAAmとの共重合に用いた。
【0111】
500mL三つ口セパラブルフラスコにモノマーの供給比(NIPAAmの物質量:DETAの物質量)がモル比で90:10(mol%)となるようにN−イソプロピルアクリルアミド(NIPAAm)とAC−DETAを含むメタノール溶液を加えた。重合促進剤として3−メルカプトプロピオン酸(3−MPA)(メタノール20mLに対して0.1mL)を、重合開始剤としてα,α’−アゾビスイソブチロニトリル(AIBN)0.3284g(0.005mol)を添加した。油浴中においてフラスコ内の溶液を攪拌しながら脱酸素ライン(5w/v%ピロガロール−10w/v%NaOH溶液100mL)に通気した窒素をフラスコ内に通気し、窒素雰囲気下で30分間脱酸素を行った。その後、窒素を通気しながら、60℃に加温し、窒素雰囲気下で4時間重合を行った。得られたポリマーは以下の手順で精製した。まず、得られた重合反応物をエバポレーターにてポリマーの溶解液に含まれるメタノールを可能な限り除去した後に、冷ジエチルエーテル1.0Lに注いだ。この上澄み液をデカンテーションして取り除き、メタノールで再度溶解した。この工程を2回繰り返した後、デカンテーション後に得られた沈殿物に水を加えて300mLとした。この溶液を分子量5000の限外濾過膜を用いて透析を6回行い、未反応ポリマーを除去した。その後、得られたポリマー溶液に凍結乾燥を行い冷暗所で保存した。合成したポリ(N−イソプロピルアクリルアミド−co−アクリロイルジトリエチレンテトラミン)[以下、NIP−DETA]の構造式は、上記化学式2のR1とR2をメチル基としR3とR4を水素原子、nを1としたものである。得られたNIP−DETAの下限臨界溶液温度(LCST)は38.4℃であった。
【0112】
[合成例5(化学式6/pNIP−MAの合成)]
500mL三つ口セパラブルフラスコに、モノマーの供給比(NIPAAmの物質量:MAの物質量)をモル比で(90:10)(mol%)となるようにNIPAAm20.37g(0.18mol)とメタクリル酸(MA)1.72g(0.02mol)を入れた。NIPAAmとMAの含量が両者の和として30質量%となるようにメタノール65.2mLを添加してモノマーを溶解した。オイルバスを用いてフラスコを60℃に加温し、攪拌しながら、重合促進剤として3−MPA(メタノール20mLに対して0.1mL)を、重合開始剤としてAIBN0.8211g(0.005mol)を添加して、脱酸素ライン(5w/v%ピロガロール−10w/v%水酸化ナトリウム溶液100mL)に通気した窒素をフラスコ内に通気し、窒素雰囲気下で4時間重合を行った。重合終了後、生成物を含むメタノール溶液を室温まで冷却する。メタノール100mLに対して2Lの冷ジエチルエーテルを用い、生成物を含むメタノール溶液を冷ジエチルエーテルに1滴ずつゆっくり滴下し、攪拌する。これにより析出したガム状の生成物を回収し、再びメタノール約50mLに溶解する。この精製を2回行った後、得られたポリマーを水に溶解し、溶液を凍結させた。溶液が完全に凍結した後、凍結乾燥を行い、冷暗所に保存した。合成したpNIP−MAの構造式は上記化学式6のR1とR2をメチル基としR3とR4を水素原子としたものである。得られたpNIP−MAの下限臨界溶液温度(LCST)は35.7℃であった。
【0113】
[参考例1(蛍光物質の特性)]
本発明に係る金ナノ複合体の薬剤放出特性を評価するための吸着薬剤として、蛍光物質Nile Redを使用した。そこでまず、Nile Redの蛍光スペクトル測定を行った。Nile Redを0.0159g(5.0×10−5mol)採り、少量のアセトンで溶解したのち、アセトンで20mLに定容した(2.5×10−3M)。この溶液0.04mLを10mLメスフラスコに採り、水で定容した(1.0×10−5M)。このNile Red水溶液を10mLメスフラスコに0〜0.100mLに採り、水で10mLに定要した(0〜1.0×10−7M)。これらの溶液の蛍光スペクトルを励起波長を580nm、蛍光波長を652nmに固定して測定した。その結果、Nile Redの濃度に応じて蛍光強度の増加が確認できた。
【0114】
Nile Redを熱応答性高分子及び、金ナノ粒子に混合することから、以下の実験では、Nile Redの最終濃度を、1.0×10−7Mとした。後に詳述するが、この濃度のNile Redは、再分散には全く影響を及ぼさない。なお、図2に、1.0×10−7Mの濃度におけるNile Redの励起及び蛍光スペクトルを示す。
【0115】
[実施例1〜4及び比較例1]
(金ナノ複合体の調製及び熱応答性高分子の相違による薬剤放出評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液3.0mLを添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、上記合成例2〜5で調製した各熱応答性高分子の2.0質量%溶液3.75mLを添加し、水で10mLに定容とした。
【0116】
調製した金ナノ複合体(実施例1〜4)からの薬剤放出を評価するため、励起波長を580nm、蛍光波長を652nmに固定して、蛍光スペクトル測定を行った。その後、90℃で30分間、加熱を行い、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0117】
また、調製した各金ナノ複合体溶液に、チオール類として、1.0×10−3Mグルタチオン(GSH)溶液250μLを添加した後、上記と同様の条件にて、蛍光スペクトル測定を行った。その後、90℃で30分間、加熱を行い、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0118】
また、比較のために、10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液0〜5.0mLを添加し、1.0×10−5M Nile Red溶液0.100mLを添加して水で10mLに定容した。
【0119】
得られた比較用金ナノ複合体(比較例1)に対し、実施例1〜4と同様に、GSH無添加の状態での加熱前後の蛍光スペクトル測定、GSH添加状態での加熱前後の蛍光スペクトル測定を行った。
【0120】
得られた結果を、図3に示す。図3中、Au+NRは、金ナノ粒子にNile Redを吸着させた比較例1の比較用金ナノ複合体を、「P−NIP」は、金ナノ粒子にNile Redを吸着させ合成例2のP−NIPを被覆した実施例1の金ナノ複合体を、「TETA」は、金ナノ粒子にNile Redを吸着させ合成例3のNIP−TETAを被覆した実施例2の金ナノ複合体を、「DETA」は、金ナノ粒子にNile Redを吸着させ合成例4のNIP−DETAを被覆した実施例3の金ナノ複合体を、「MA」は、金ナノ粒子にNile Redを吸着させ合成例5のpNIP−MAを被覆した実施例4の金ナノ複合体を、それぞれ示すものである。
【0121】
図3に示すように、実施例1〜4の金ナノ複合体はいずれもGSHを添加しない系に比較して、GSHを添加した系において、加熱後において高い蛍光強度を示し、GSHを添加し熱刺激を与えることによって、金ナノ複合体からNile Redが効果的に遊離することが明らかとなった。また、比較例1のものと比べて、GSHを添加した系における加熱後の蛍光強度は、いずれも大きな値であり、本発明に係る金ナノ複合体によるチオール類共存下における熱刺激による薬剤放出効果が優れたものであることが示された。
【0122】
なお、図3に示すように、NIP−TETAを被覆した際(実施例2)は、GSHを添加しない系においても、Nile Redが一部遊離していることが分かった。これは、TETA基が金ナノ粒子表面に吸着した際に、Nile Redを交換したために生じると思われる。これに対して、その他の熱応答性高分子を加えた場合にはNile Redの遊離は観測されなかった。
【0123】
一方、GSHを添加した系においては、GSHはチオール基を有することから金ナノ粒子と特異的に反応しかつ、加熱・冷却なしでも再分散を促進する効果があることが観察できる。このことから、熱刺激によって再分散を起こすNIP−TETA(実施例2)とNIP−DETA(実施例3)は、GSH添加によりNile Redが効果的に遊離するために蛍光強度が大幅に回復したと考えられる。再分散を起こさないNIP−MA(実施例4)とP−NIP(実施例1)においても、添加したGSHによってNile Redの遊離がある程度生じたものと思われ、熱刺激後において比較的高い蛍光強度を示したものと考えられる。
【0124】
[実施例5]
(金ナノ複合体の調製及び熱応答性高分子の濃度による薬剤放出評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、熱応答性高分子の最終濃度が0〜1.0質量%の時は、2.0質量%熱応答性高分子溶液を0〜5mL加え、ポリマーの最終濃度が1.25及び1.50質量%の時は5.0質量%熱応答性高分子溶液を2.5mL及び3mL加えて、水で最終体積が10mLとして、熱応答性高分子濃度の異なる金ナノ複合体を調製した。なお、使用した熱応答性高分子としては、合成例4のNIP−DETAを用いた。
【0125】
これらの各溶液について、実施例1〜4と同様の条件下に、GSH無添加の状態で測定を行った。得られた結果を、図4に示す。図4に示すように、GSHを添加しない系においては、被覆したNIP−DETAの量にかかわらす、熱刺激を加えてもNile Redの遊離はほどんど起こっておらず、一方GSHを添加している系においては、熱刺激後に大きなNile Redの遊離が起こることが示された。NIP−DETAの添加濃度が0.25質量%以上となると、NIP−DETAを添加しない場合と比較して、その熱刺激後のNile Redの遊離量に有意な差が見られ、特に、添加濃度約0.5〜約1.0質量%の範囲内において、大きな効果が得られた。
【0126】
[実施例6]
(金ナノ複合体の調製及び熱応答性高分子の濃度による薬剤放出評価)
使用する熱応答性高分子として、合成例4のNIP−DETAに代えて、合成例3のNIP−TETAを用いた以外は、実施例5と同様にして、熱応答性高分子濃度の異なる金ナノ複合体を調製し、これらの各溶液について、GSH添加状態での加熱前後の蛍光スペクトル測定を実施例5と同様にして行った。
【0127】
得られた結果を、図5に示す。図5に示すようにGSHを添加している系において、熱刺激後に大きなNile Redの遊離が起こることが示された。NIP−TETAの添加濃度が比較的低いところでも、NIP−TETAを添加しない場合と比較して、その熱刺激後のNile Redの遊離量に有意な差が見られたが、NIP−TETAの添加濃度が約1.0質量%を超えると、NIP−TETAを添加しない場合と比べて熱刺激前におけるNile Redの遊離量が大きくなってしまう傾向が見られた。熱刺激前後における蛍光強度差からみると、添加濃度としては、約0.25〜約1.25質量%、特に約0.25質量%前後の範囲内において、大きな効果が得られた。
【0128】
[実施例7]
(金ナノ複合体の調製及び環境pH条件の変動による薬剤放出評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、2質量%NIP−DETA溶液 3.73mLを加えて、水で最終体積が10mLとした。この溶液に1.0M NaOH水溶液及び、1M HCl水溶液を少量加えることによりpHを5.0〜9.0の間で調整した。各溶液に対し、1.0×10−3Mグルタチオン(GSH)溶液250μmμLを添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、90℃で30分間、加熱を行い、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0129】
得られた結果を図6に示す。図6に示すように、GSH添加系において熱刺激により吸着薬剤分子を放出する現象は、測定したpH5〜9の範囲内においては、pH値にあまり依存することなく、ほぼ均一に生じ、熱刺激前において吸着薬剤分子はごく微量の放出に留まり、熱刺激後において大きな放出が生じることが示された。特にpH5.5〜pH7.5の範囲において良好な結果が得られた。
【0130】
[実施例8]
(熱刺激温度の変動による薬剤放出評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、2質量%NIP−DETA溶液 3.73mLを加えて、水で最終体積が10mLとした。
【0131】
得られた金ナノ複合体溶液に対し、1.0×10−3Mグルタチオン(GSH)溶液250μLを添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、加熱温度を30、40、50、60、70、80、90℃に設定して30分間、加熱を行った後、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0132】
得られた結果を図7に示す。図7に示すように、加熱温度が約40℃以上、特に約70℃となると熱刺激による良好なNile Redの遊離が生じた。
【0133】
[実施例9〜12及び参考例2〜7]
(分子スイッチの評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、2質量%NIP−DETA溶液 3.73mLを加えて、水で最終体積が10mLとした。
【0134】
得られた金ナノ複合体溶液に対し、1.0×10−3Mの各化合物溶液を250μLを添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、加熱温度を90℃で30分間、加熱を行った後、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0135】
なお、添加した化合物は、グルタチオン(GSH)(実施例9)、システイニルグリシン(Cys−Gly)(実施例10)、シスチン(実施例10)、グルタミン酸システイン(Glu−Cys)(実施例11)、グリシン(Gly)(参考例2)、グルタミン酸(参考例3)、酸化型グルタチオン(GSSG)(参考例4)、L−システイン(L−Cys)(参考例5)、Hcys(参考例6)、メチオニン(参考例7)であった。使用した化合物の構造式を図8に示す。
【0136】
得られた結果を図9に示す。図9に示すように、GSH、Cly−Cys、Cys−Gly、L−Cys、Hcysのチオール化合物を用いた場合は、いずれもNile Redが遊離していることが確認できた。その中でも、GSH、Glu−Cys、Cys−Gly、が非常に大きな蛍光強度の回復が確認できた。GSH、Glu−Cys、Cys−Glyは分子サイズが大きいことから再分散を促進し、熱刺激を与えることで十分な再分散を行うことができ、これによって蛍光強度の回復が起こるものと考えられる。L−Cys、Hcysでは分子サイズが小さいので、L−Cys、Hcysを添加すると再分散を阻害する為にNile Redの遊離が十分ではなくなり、結果として加熱・冷却しても蛍光強度が十分には回復しなかったものと考えられる。
【0137】
Gly、グルタミン酸は、チオール基を含まない化合物であるため、金ナノ粒子と反応せず、加熱後においてもNile Redが遊離しておらず、分子スイッチとして不適であることが示された。また、ジスルフィド結合を有するGSSG、スルフィド結合を有するメチオニンに関しても、加熱後においてもNile Redが遊離していなかったが、ジスルフィド結合を有するシスチンに関しては、加熱・冷却後に蛍光強度が大きく回復しており、分子スイッチとして適用可能であることが示された。
【0138】
[実施例13〜16及び参考例8〜9]
(分子スイッチの評価)
実施例9〜12及び参考例2〜7における結果から、分子スイッチとして好適であると思われるGSH、Glu−Cys、Cys−Gly、シスチンに関し、その濃度の検討を行った。比較のために、併せてL−Cys、Hcysに関しても同様の検討を行った。
【0139】
実験は、実施例9〜12及び参考例2〜7におけるものと同様にして得られた金ナノ複合体溶液に対し、1.0×10−3Mの各化合物溶液を0〜250μLの範囲で添加量を変えてを添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、加熱温度を90℃で30分間、加熱を行った後、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0140】
得られた結果を図10に示す。図10に示すように、GSH、Glu−Cys、Cys−Gly、シスチンは測定した0.5〜2.5×10−5Mの濃度範囲において、分子スイッチとして有効に機能していることが確認できた。
【0141】
なお、GSHにおいては、比較的添加濃度が低いところにおいても有意な効果が見られたため、濃度0〜1×10−6Mの範囲内においてより細かな濃度変化を与え、濃度変動による効果の違いを調べた。得られた結果を図11に示す。図11に示すように、濃度が約4×10−6M以上となると、加熱・冷却後に蛍光強度が大きく回復していることが判った。
【0142】
[実施例17]
(共存物質の影響の検討)
実施例13〜16及び参考例8〜9の結果から、分子スイッチとしてGSHが適当なものの1つであることが判ったため、このGSHの分子スイッチの機能が、共存物質により影響を受けるかどうかについて検討を行った。
【0143】
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、2質量%NIP−DETA溶液 3.73mLを加えて、水で最終体積を10mLとした。
【0144】
得られた金ナノ複合体溶液に対し、1.0×10−3MのGSH溶液を50μL、共存物質としてL−Cys、Hcys、Gly、グルタミン酸のそれぞれ1.0×10−3M溶液を50μL添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、加熱温度を90℃で30分間、加熱を行った後、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。なお比較対照として、共存物質を添加せず1.0×10−3MのGSH溶液を50μLのみ添加した系も別途調製し、同様の測定を行った。
【0145】
得られた結果を図12に示す。図12に示すように、共存物質の存在下においても、GSHは分子スイッチとして有効に機能することが確認できた。
【技術分野】
【0001】
本発明は、ドラッグデリバリーシステムや蛍光センサー等に用いられる金ナノ複合体に関する。更に詳しくは、所定の条件下においてのみ、熱刺激により、包摂していた有機分子を放出する、金ナノ複合体及びこれを用いたドラッグデリバリーシステムに関する。
【背景技術】
【0002】
ドラッグデリバリーシステムは、理想的な薬物投与システムとして、また、種々の種類の担体等を対象として、盛んに研究されている。粒子径が100nm以下のナノ粒子材料は、その粒径が薬物運搬体のサイズに適しているのに加え、相互作用に利用できる単位質量あたりの表面積が大きいという特性を有する。そのため、機能性物質の内包や分析感度の向上等、その実用性への展望からバイオ分離や各種アッセイ、診断やドラッグデリバリーシステム等の幅広い領域での活用が期待されている。
【0003】
中でも、温度やpH等の外部刺激に応答して機能や物理的性質が不連続かつ可逆的に変化する刺激応答性高分子は、感知・判断・運動といった高度機能を兼ね備えた高機能材料として数多く研究されている。
【0004】
刺激応答性高分子とは、外部環境の様々な物理・化学情報(温度・熱、溶媒・組成、pH、電場、光等)を感知して応答する高分子であり,特に熱に感応するものが熱応答性高分子とばれる。現在、4種の基本的な相互作用(水素結合性、疎水性、ファンデルワールス力、静電的相互作用)と高分子の相転移が示されている。
【0005】
この相転移は、ゲル内の分子間相互作用(高分子鎖と溶媒分子間、高分子鎖と高分子鎖間)によって誘発されていることから、ゲルの相転移を構成高分子の物性変化と捉えることができる。従来からよく知られる熱応答性高分子には、ポリN−イソピルアクリルアミド等のポリ(アクリルアミンド)類縁体が挙げられる。
【0006】
このように、架橋型熱応答性高分子は、外部の熱刺激に応じて高分子鎖のコンフォメーションを変化させることができる。そのため、体温に近い温度で相転移する架橋型熱応答性高分子を利用して、体内の必要な部分に確実に薬を投与し、最適な温度で薬の投与のon‐offを制御することのできるドラッグデリバリー用の担体として研究されている。
【0007】
しかしながら、このような架橋型熱応答性高分子を用いたドラッグデリバリーシステムにおいては、当該高分子の熱による相転移によって、内包させた薬剤の放出が生じる(すなわち熱刺激によって薬剤の放出が起動されてしまう)ため、環境温度変化による当該高分子からの薬剤の遊離等による安定性の問題、また薬剤の自己拡散による漏出等の克服すべき課題が残されている。
【0008】
一方、金ナノ粒子は、バルクでは見られなかった新しい物性と構造を持っている古くから研究されているナノ粒子であり、ステンドグラスや陶器の無鉛赤色絵具や無機塗料顔料として利用されてきた。例えば、鮮やかなワインレッドの色は、液相で金ナノ粒子を調製して得ることができる。金ナノ粒子の発色は、表面プラズモン共鳴(SPR)によって生じるため、形状や粒径によって様々な色調を与える。粒径が十数nm程度で分散状態にある溶液は、520nm付近で極大吸収波長を示し、赤色を呈する。この粒子が凝集状態になると、ブルーシフトを起こして長波長側に新たな吸収帯が生じ、溶液は青色になる。金ナノ粒子は、一度凝集状態になると容易には分散状態に戻らない。
【0009】
このようなあざやかな色調の変化を利用して、近年では、バイオセンサや光スイッチ等の次世代のセンシング材料やフォトニクス材料として注目され、多くの研究が行われている。
【0010】
例えば、本発明者による特許文献1においては、グルタチオン又はシステイニルグリシン等のチオール基含有化合物を簡便、迅速、正確に計測することができる色彩色差計測方法として、金ナノ粒子に、特定の熱応答性高分子を複合化してなる金ナノ粒子複合体を用いる方法を提案している。この方法によれば、金ナノ粒子と特定の熱応答性高分子を複合化した金ナノ粒子複合体は溶液中で凝集状態となって青色を呈するが、金ナノ粒子複合体はポリマーが金ナノ粒子に化学吸着することにより溶液中で沈降しない。そして、この複合体溶液にグルタチオンやシステイニルグリシン等の特定のチオール基含有化合物を混合することにより、ポリマーが離脱する代わりにグルタチオンやシステイニルグリシン等が金ナノ粒子に吸着し、さらにそのグルタチオンやシステイニルグリシン等が有するカルボキシル基の作用により分散状態になって赤色に変化するというものである。
【0011】
また、同じく本発明者による特許文献2においては、粒径が1〜5μmの金ナノクラスターと熱応答性高分子(カルボキシル基等のアニオン基を含む熱応答性高分子を除く。)とを含む混合溶液を準備する工程と、混合溶液を加熱し、冷却する工程とを有することを特徴とする金ナノ粒子の製造方法が開示されている。この方法によれば、金(III)イオンを還元して粒径が50nmを超える金ナノ粒子やロッド状の金ナノ粒子を製造するのではなく、粒径1〜5μmの金ナノクラスターと熱応答性高分子との混合溶液を加熱、冷却するという簡単な操作で、粒径が50〜100nmの範囲の金ナノ粒子を得るという新しい方法を提案している。また、特許文献2においては、チオール化合物が、凝集体を構成する金ナノクラスターに吸着することで、金ナノクラスター同士の接触・融合が阻まれ、その結果、金ナノ粒子の製造が阻害され、吸光度での550nmの吸収ピークが小さくなり、赤みが弱くなるため、金ナノ粒子の製造用溶液を、チオール化合物の選択的な検出溶液として応用できることが提案されている。
【0012】
非特許文献1では、ナイルレッドを非共有的に吸着させた金ナノ粒子の水溶液をチオール類の検出に用いることが開示されている。これは、システアミンやホモシステイン等のようなチオール類の添加によって、当該ナイルレッドを非共有的に吸着させた金ナノ粒子の水溶液の蛍光が増加するというものであり、このような蛍光の増加は、アミン類、酸類、アルコール類、ウシ血清アルブミン、ヘモグロビン等の添加によっては生じないことが報告されている。
【0013】
非特許文献2においては、狭い多分散性を有する熱応答性ブロック共重合体を被覆した金ナノ粒子が、可逆性の熱応答性を示すことが開示されている。
【0014】
非特許文献3においては、1,10−フェナントロリンリガンドを有する4nmの金ナノ粒子が、選択的にリチウムイオンに結合し、2:1のリガンド−金属複合体を形成することで、当該リガンドがリチウムイオンに結合し、金ナノ粒子が凝集することを引き起こすことが示されており、この金ナノ粒子の凝集が、色変化を伴う励起スペクトルにおけるシフトを引き起こし、水溶液中のリチウムイオンの有用な光学的検出方法となることが開示されている。
【0015】
金ナノ粒子は、前記したようなナノ粒子材料の一種であり、ドラッグデリバリー用の担体としても研究されているが、薬剤は金ナノ粒子に吸着した状態で運ばれ、かつ一般的にその結合力が強いため、外部から薬剤の放出を制御することが困難であった。
【0016】
また、蛍光分子を金ナノ粒子に物理吸着させたナノ複合体が、ナノ粒子蛍光センサーとして研究されている。ナノ粒子蛍光センサー溶液に分析対象物質を添加すると、ナノ複合体に吸着していた蛍光分子が遊離するため、ナノ複合体による蛍光共鳴エネルギー移動(以下FRET)が解消し、蛍光強度が回復する。しかし、このナノ粒子蛍光センサーでは、分析対象物質の添加により凝集が生じることがあり、再現性低下の原因となっていた。
【0017】
このように、従来、金ナノ粒子、架橋型熱応答性高分子はともにドラッグデリバリー用の担体として研究されている。しかしながら、これまで熱応答性高分子を被覆した金ナノ粒子をドラッグデリバリー担体として実用化されているものはない。
【先行技術文献】
【特許文献】
【0018】
【特許文献1】特開2009−229147号公報
【特許文献2】特願2010−44792号明細書
【非特許文献】
【0019】
【非特許文献1】Analytical Chemistry, 76, 3727-3734(2004).
【非特許文献2】Colloids and Surfaces, A, 317, 764-767(2008).
【非特許文献2】Langmuir, 26, 6818-6825(2010).
【発明の概要】
【発明が解決しようとする課題】
【0020】
効果的なドラッグデリバリーシステムを構築するためには、ねらった部位で薬物を的確に放出できる担体の開発する必要がある。上述したように、架橋型熱応答性高分子を用いる場合には、外部からの熱刺激により内包している薬物の放出を制御することが可能ではある。しかしながら、薬物の自己拡散による漏出等が従来克服すべき課題であった。一方、金ナノ粒子を担体として用いる場合、薬剤は金ナノ粒子に吸着した状態で運ばれるが、この場合には、外部から薬剤の放出を制御することはできないという問題があった。
【0021】
本発明の目的は、ドラッグデリバリーシステムや蛍光センサー等に用いられる新規な金ナノ複合体を提供することにある。特に、本発明は、ねらった部位で薬物を的確に放出できる金ナノ複合体、及びこれを用いたドラッグデリバリーシステムを提供することにある。
【課題を解決するための手段】
【0022】
本発明者は、上記課題を解決するために鋭意研究及び検討を重ねた結果、金ナノ粒子に対しチオール類が強い吸着性を示すことに着目し、金ナノ粒子表面に薬剤(有機物)を吸着させ、熱応答性高分子を被覆してなる金ナノ複合体を調製した。この金ナノ複合体を、グルタチオン等チオール化合物と接触させると、チオール化合物により、金ナノ粒子表面で吸着分子の置換が起こるものの、薬剤は熱応答性高分子に覆われている金ナノ複合体の中に留まる。この状態で熱刺激を加えると熱応答性高分子の収縮により、薬剤は複合体から放出される。これによって、当該金ナノ複合体は、グルタチオン等チオール化合物の共存下においてのみ、熱刺激により薬剤を放出し、ねらった部位で薬物を的確に放出できるドラッグデリバリーシステムが確立されること、また、薬剤として蛍光物質を用いた場合に、再現性の良好な蛍光センサーとなることを見出し、本発明に到達した。
【0023】
すなわち、上記課題を解決するための本発明に係る金ナノ粒子複合体は、表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有することを特徴とする。
【0024】
この発明によれば、表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有するので、グルタチオン等のチオール化合物の共存下において、熱刺激により薬剤を効率的に放出することができる。こうした金ナノ複合体は、その核である金ナノ粒子の表面が薬剤を吸着していることから、自己拡散のおそれがない。なお、薬剤の放散のメカニズムは以下のステップで行われると考えられる。すなわち、チオール化合物により、金ナノ粒子の表面で吸着分子の置換が起こるものの、薬剤は熱応答性高分子に覆われている金ナノ複合体の中に留まる。この状態で熱刺激を加えると、熱応答性高分子の収縮により、薬剤が複合体から放出される。このように、金ナノ粒子に熱応答性高分子を被覆することで、これらが単独で用いられていたときには克服できなかった問題を克服するドラッグデリバリー担体やナノ粒子蛍光センサーを構築することができる。
【0025】
本発明に係る金ナノ複合体において、前記熱応答性高分子としては、下記化学式2で表されるポリマーが好ましい。式中、R1とR2はそれぞれ独立にアルキル基を表す。R3とR4はそれぞれ独立に水素又はメチル基を表す。また、x/yは95/5〜70/30であり、nは1〜4である。
【0026】
【化1】

【0027】
このうち特に、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルジエチレントリアミン)[poly(NIPAAm−co−(AC−DETA))]及びポリ(N−イソプロピルアクリルアミド−co−アクリロイルトリエチレンテトラミン)[poly(NIPAAm−co−(AC−TETA))が好ましい。
【0028】
本発明に係る金ナノ複合体において、前記薬剤としては、蛍光物質、生理活性物質又は医薬化合物を用いることができる。
【0029】
上記課題を解決するための本発明に係る金ナノ複合体の製造方法は、金ナノ粒子のコロイド溶液に対し、薬剤水溶液、熱応答性高分子溶液の順に添加し、金ナノ粒子に対して先に薬剤を吸着させてから、熱応答性高分子を被覆することを特徴とする。
【0030】
上記課題を解決するための本発明に係るドラッグデリバリーシステム薬剤は、上記した本発明に係る金ナノ複合体を、チオール類又はシスチンの存在下で加熱して使用することを特徴とする。
【発明の効果】
【0031】
本発明に係る金ナノ複合体によれば、表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有するので、グルタチオン等のチオール化合物の共存下において、熱刺激により薬剤を効率的に放出することができる。こうした金ナノ複合体は、その核である金ナノ粒子表面に薬剤が吸着していることから、自己拡散のおそれがない。
【図面の簡単な説明】
【0032】
【図1】金ナノ複合体からの薬剤放出のメカニズムを示す模式図である。
【図2】蛍光物質Nile Redの励起及び蛍光スペクトルを示す図面である。
【図3】金ナノ複合体において用いられた熱応答性高分子の相違による薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図4】金ナノ粒子を被覆する熱応答性高分子(NIP−DETA)の濃度による蛍光スペクトル強度の影響を示す図である。
【図5】金ナノ粒子を被覆する熱応答性高分子(NIP−TETA)の濃度による蛍光スペクトル強度の影響を示す図である。
【図6】pH環境変化による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図7】加熱温度の変化による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図8】実施例において使用した分子スイッチ化合物の構造式を示す図面である。
【図9】添加した分子スイッチ化合物の相違による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図10】分子スイッチ化合物の添加濃度変化による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図11】分子スイッチ化合物の添加濃度変化による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【図12】分子スイッチ化合物の添加時における共存物質の存在による金ナノ複合体の薬剤放出特性の影響を示す蛍光スペクトル強度を示す図面である。
【発明を実施するための形態】
【0033】
以下、本発明に係る金ナノ粒子複合体について、図面を参照しつつ説明する。
【0034】
[金ナノ粒子複合体]
本発明に係る金ナノ粒子複合体は、表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有することを特徴とする。先ず、本発明に係る金ナノ複合体を説明するに先立ち、本発明の重要な構成要素につき、個々に説明する。
【0035】
(金ナノ粒子)
金ナノ粒子としては、種々の形状のものを用いることが可能であるが、粒形状又は球形状であることが望ましい。なお、金ナノ粒子の粒径は、その調製方法に依存し、各種の粒径のものを得ることができる。本発明に使用可能な金ナノ粒子の粒径の範囲は特に限定されないが、粒径が小さすぎるものは作製が難しく、一方、粒径が大きすぎるものは沈降してしまう場合があるので、それらを考慮して選択する。一般的には、粒径10〜100nm程度のもの、特に10〜50nm程度のものが多く用いられる。なお、金ナノ粒子の粒径は、透過型電子顕微鏡(TEM)での観察結果から求めることができる。
【0036】
金ナノ粒子は、金ナノ粒子溶液として調製することができる。この金ナノ粒子溶液の調製は、クエン酸ナトリウム還元により行うことができ、具体的には、所定量のテトラクロロ金酸水溶液に、クエン酸三ナトリウム水溶液を添加して調製する例を挙げることができる。また、市販の所定の大きさからなる金ナノ粒子溶液を用いてもよい。
【0037】
金ナノ粒子を含む金ナノ粒子複合体は、特許文献1に記載されるように、粒径1〜5μmの金ナノクラスターと熱応答性高分子との混合溶液を加熱、冷却するという製造方法を応用して、調製することも可能である。この調製方法については下記に詳述する。
【0038】
ここで、金ナノクラスターは、透過型電子顕微鏡像(TEM像)で測定した粒径が1〜5μmの金粒子のことである。金ナノクラスターの形状は、粒形状又は球形状であることが望ましい。金ナノクラスターは各種の方法で製造でき、例えば、テトラヒドロホウ酸ナトリウム溶液を用いる方法等で製造することができる。具体的には、塩化金酸溶液にポリオキシエチレン溶液を添加した後に水を加え、pH調整した後にNaBH4(テトラヒドロホウ酸ナトリウム)溶液を添加し、その後反応させて合成することができる。なお、ポリオキシエチレン溶液としては、テトラエチレングリコール等を挙げることができる。こうした合成方法によって、粒径が1〜5μmの金ナノクラスターを得ることができる。
【0039】
(熱応答性高分子)
熱応答性高分子としては、少なくともN−イソプロピルアクリルアミド類を構成単位として含むポリマー、ポリ(メチルビニルエーテル)、又はヒドロキシプロピルセルロース等が挙げられる。
【0040】
熱応答性高分子のうち、N−イソプロピルアクリルアミド類を構成単位として含むポリマーの例としては、下記一般式1〜6に記載のものを例示することができる。
【0041】
【化2】

【0042】
上記化学式1のポリマーは、ポリ(N−イソプロピルアクリルアミド)類である。化学式1において、R1とR2はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。nは1000〜100000の整数である。R1とR2をメチル基とし、R3を水素としたポリ(N−イソプロピルアクリルアミド)は「P−NIP」で表す。
【0043】
【化3】

【0044】
上記化学式2のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)類である。化学式2において、R1とR2はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3とR4はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。また、x/yは95/5〜70/30であり、好ましくは90/10〜85/15の範囲である。nは1〜4である。R1とR2をメチル基とし、R3とR4を水素としたポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)は「pNIP−AC」で表す。
【0045】
化学式2のポリマーの右側の側鎖は、エチレンイミン鎖の繰り返し単位を含むアクリロイルアミン(以下、ACという。)である。より具体的には、右側の側鎖のエチレンイミン鎖の繰り返し単位であるn=0の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルエチレンジアミン)[以下、poly(NIPAAm−co−(AC−EDA))という。]となり、n=1の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルジエチレントリアミン)[以下、poly(NIPAAm−co−(AC−DETA))という。]となり、n=2の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルトリエチレンテトラミン)[以下、poly(NIPAAm−co−(AC−TETA))という。]となり、n=3の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルテトラエチレンペンタミン)[以下、poly(NIPAAm−co−(AC−TEPA))という。]、n=4の場合には、ポリ(N−イソプロピルアクリルアミド−co−アクリロイルペンタエチレンヘキサミン)[以下、poly(NIPAAm−co−(AC−PEHA))という。]となる。
【0046】
【化4】

【0047】
上記化学式3のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−アクリロイル−シスタミン)類である。化学式3において、R1とR2及びR7とR8はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3とR4及びR5とR6はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。また、x/y/zは95/2.5/2.5〜80/10/10である。R1とR2及びR7とR8をメチル基とし、R3とR4及びR5とR6を水素としたポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)は「pNIP−Cys」で表す。
【0048】
【化5】

【0049】
上記化学式4のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アラニン)類である。化学式4において、R1とR2及びR5はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3とR4はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。また、x/yは90/10〜80/20である。R1とR2及びR5をメチル基とし、R3とR4を水素としたポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)は「pNIP−AC」で表す。
【0050】
【化6】

【0051】
上記化学式5のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−グリシジルメタクリル酸−乳酸)類である。化学式5において、R1とR2及びR5はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R3とR4はそれぞれ独立に水素又はメチル基、好ましくは水素を表す。また、x/yは95/5〜80/20である。R1とR2及びR5をメチル基とし、R3とR4を水素としたポリ(N−イソプロピルアクリルアミド−co−アクリロイル−アミン)は「pNIP−GMA−乳酸」で表す。
【0052】
【化7】

【0053】
上記化学式6のポリマーは、ポリ(N−イソプロピルアクリルアミド−co−(メタ)アクリル酸)類である。化学式6において、R1とR2はそれぞれ独立にアルキル基、好ましくは炭素数1〜4程度の直鎖状のアルキル基、より好ましくはメチル基を表す。R4は水素又はメチル基を表す。また、x/yは95/5〜70/30であり、好ましくは90/10〜85/15の範囲である。R1とR2をメチル基とし、R4をメチル基としたポリ(N−イソプロピルアクリルアミド−co−メタクリル酸)は「pNIP−MA」で表す。
【0054】
なお、この化学式6で表されるポリマーのように、カルボキシル基等のアニオン基を含む熱応答性高分子は、前述の特許文献1に記載の金ナノクラスターと熱応答性高分子との混合溶液から金ナノ粒子を調製するという製法には用いることができない。
【0055】
また、熱応答性高分子ではないポリエチレングリコール(PEG)やポリアクリルアミドは、金ナノ粒子を製造できない。
【0056】
上記化学式1〜6のポリマーの分子量は、重量平均分子量で8000以上100000以下のものを用いることができ、10000以上20000以下のものが好ましい。また、各ポリマーは、通常それぞれ単独で用いられるが、2以上を併せて用いてもよい。また、本発明の趣旨の範囲内であれば、上記化学式1〜6のポリマーと同様の効果を奏する他の熱応答性高分子、例えば、ポリ(メチルビニルエーテル)、ヒドロキシプロピルセルロース等を用いてもよい。
【0057】
上記化学式1〜6のポリマーは、後述する実験例に示す方法で合成することができる。例えば、化学式1のポリマーは、モノマー成分であるN−イソプロピルアクリルアミド類を水に溶解し、重合開始剤と重合促進剤を加えて重合し、生成物を精製し、その後凍結乾燥して得ることができる。また、化学式2〜6のポリマーも、重合させるモノマー成分を溶媒に溶解し、重合開始剤と重合促進剤を加えて重合し、生成物を精製し、その後凍結乾燥して各ポリマーを得ることができる。
【0058】
特に限定されるものではないが、上記化学式1〜6のポリマーうち、化学式2のpNIP−AC、好ましくは、poly(NIPAAm−co−(AC−DETA)、poly(NIPAAm−co−(AC−TETA))、特に好ましくは、poly(NIPAAm−co−(AC−DETA)である。poly(NIPAAm−co−(AC−DETA)は、チオール類存在下における熱刺激による、金ナノ粒子に吸着していた薬剤の放出特性に優れ、チオール類不在下における熱刺激の状態又はチオール存在下の熱刺激のない状態においては、安定に薬剤を保持している特性を発揮することから、特に好ましいものである。
【0059】
なお、熱応答性高分子が、上記化学式2で表されるポリマーのうち、右側の側鎖のエチレンイミン鎖の繰り返し単位の数が大きいもの、具体的には、n=3のpoly(NIPAAm−co−(AC−TETA)よりもエチレンイミンユニットが多いものである場合には、NH基やNH2基が多く、熱刺激によって熱応答性高分子が熱収縮した際、そうした基が金ナノ粒子に吸着し、金ナノ粒子に吸着していた薬剤分子と置き換わることが生じると考えられるため、チオール類の不在下によっても、熱刺激によりある程度の薬剤が放出されるが、チオール類の存在下における熱刺激の場合と比較すると、放出の程度は有意に異なり、かつその放出の程度は後述する実施例において示すように、実験に用いた熱応答性高分子のうち最も高いものであったことから、好ましい熱応答性高分子として例示できるものである。
【0060】
(薬剤)
金ナノ粒子が吸着する薬剤としては、チオール類存在下における熱刺激によって、金ナノ複合体より良好に放出される一方、チオール類不在下における熱刺激の状態又はチオール存在下の熱刺激のない状態においては、安定に金ナノ複合体に保持され得るものであれば、特に制限なく各種のものを用いることができる。
【0061】
薬剤としては、担持又は付着されない状態において、特有の機能、例えば生理活性、薬物活性、触媒活性や光学分割性、抗酸化活性、界面活性、香料、又は、光学活性等の機能を有するものとして考慮される。中でも、生理活性物質又は医薬化合物が代表的なものとして例示される。
【0062】
生理活性物質又は医薬化合物としては、例えば、Goodman and Gilman’s “The Pharmacological of Basis of Therapeutics”の最新版、又はThe Merck Indexの最新版等に示された各種の薬剤類が挙げられる。例えば、中枢神経系に作用する薬剤;末梢シナプスに作用する薬剤;炎症応答に影響を及ぼす薬剤;体液の組成に影響を及ぼす薬剤;腎臓機能及び電解質代謝に影響を及ぼす薬剤;心臓血管剤、胃腸管機能に影響を及ぼす薬剤;子宮運動性に影響を及ぼす薬剤;寄生中感染症のための化学療法剤、微生物病のための化学療法剤;抗腫瘍性ないし抗癌剤;免疫抑制剤、血液及び血液形成器官に影響を及ぼす薬剤;ホルモン及びホルモンアンタゴニスト;皮膚剤;重金属アンタゴニスト、ビタミン及び栄養素、ワクチン、オリゴヌクレオチド及び遺伝子治療薬等が挙げられる。また、アミン系の薬剤、例えば塩酸アミトリプチリン、塩酸イミプラミン、塩酸クロミプラミン、マレイン酸トリミプラミン、塩酸ノルトリプチリン、アモキサピン、塩酸ドスレピン、塩酸ロフェプラミン)等を挙げることもできる。また、シスプラチン等の錯体系の薬剤であってもよい。
【0063】
また、光学特性の機能を有する薬剤として代表的な、蛍光物質としては、ナイルレッド等が好ましく例示できる。
【0064】
本発明に係る金ナノ複合体において、金ナノ粒子が吸着する薬剤は、後述するようなチオール類の存在下において、金ナノ粒子に対しチオール類が強い吸着性を示すために置換され、金ナノ粒子から遊離するものと考えられる。金ナノ粒子に対して、チオール化合物よりも強い吸着性を有する薬剤であると、チオール類存在下における熱刺激によっても、金ナノ複合体より放出されにくいものとなる。このため、使用するチオール類の種類によっても左右されるが、概して、金ナノ粒子に対してある程度の吸着性を示す一方で、チオール類の吸着性よりも低い吸着性を発揮する化合物が用いられる。こうした化合物としては、特にチオール化合物の有するチオール基よりも、金ナノ粒子表面に対し弱い相互作用を示す官能基ないし骨格構造を有する、例えばエチル基やメチル基のようなアルキル基、フェニル基、水酸基、カルボキシル基、アミノ基等を適度に有する化合物等が用いられる。
【0065】
また、金ナノ粒子に対して、いわゆる保護コロイドを形成するような高分子化合物、つまり1分子が多数の点で金ナノ粒子表面に吸着(多点吸着)する高分子化合物等は、チオール類の添加によっても脱着が生じにくいと考えられる。そのため、本発明に係るナノ複合体に使用する薬剤としては、概して適当ではないものが多い。
【0066】
[金ナノ複合体の製造方法1]
本発明に係る金ナノ複合体は、基本的には、金ナノ粒子のコロイド溶液に対し、薬剤水溶液、熱応答性高分子溶液の順に添加し、金ナノ粒子に対して先に薬剤を吸着させてから、熱応答性高分子を被覆することによって製造することができる。
【0067】
なお、上記とは異なり、金ナノ粒子のコロイド溶液に対し、先に熱応答性高分子溶液を添加した後、薬剤水溶液を添加する順序で金ナノ複合体を調製すると、金ナノ粒子に先に熱応答性高分子を被覆されてしまう。このことから、得られる金ナノ複合体において、薬剤分子は金ナノ粒子にはあまり直接吸着せず、金ナノ粒子を被覆している熱応答性高分子に取り込まれている状態になっていることが推測される。本発明者が確認したところによれば、この場合、後述するようなチオール類等の分子スイッチの添加有無ないしは添加する有機化合物分子のチオール基含有の有無にかかわらず、熱刺激によって薬剤分子の放出が見られる。このことから、本発明に係る金ナノ複合体の製造方法としては、上記したように、金ナノ粒子のコロイド溶液に対し、先に薬剤水溶液を接触させることが肝要であると考えられる。
【0068】
使用する熱応答性高分子は、通常、1種の熱応答性高分子であるが、金ナノ複合体を製造することが可能であれば2種以上の熱応答性高分子であってもよい。また、金ナノ複合体を製造する際の、混合溶液のpHは含有させる薬剤及び熱応答性高分子の種類にもよるが、通常、2.9〜10.0の範囲であることが好ましい。
【0069】
混合溶液には、金ナノ粒子が0.0018〜0.0090質量%の範囲で含まれることが好ましく、熱応答性高分子は、使用する熱応答性高分子の種類によっても左右されるが0.25〜2.0質量%の範囲で含まれることが好ましい。また、薬剤の濃度としては、使用する薬剤の種類によっても左右されるが、例えば、金1gに対し、0.2〜20×10-5M程度の濃度とすることができる。この程度の薬剤濃度であれば、添加した薬剤を効率よく金ナノ粒子に吸着させることができ、かつ後述するようなチオール類存在下における熱刺激による薬剤放出の作用機序に薬剤の濃度依存性による影響を及ぼすこともない。
【0070】
[金ナノ複合体の製造方法2]
本発明に係る金ナノ複合体の製造方法としては、特許文献1に記載の製造方法を応用したものを例示することが可能である。
【0071】
すなわち、金ナノ複合体は、上記した金ナノクラスターの溶液に、薬剤水溶液、熱応答性高分子(カルボキシル基等のアニオン基を含む熱応答性高分子を除く。)溶液を順に添加し、調製された混合溶液を加熱し、冷却することによって、金ナノ複合体が製造される。
【0072】
混合溶液には、金ナノクラスターが0.0018〜0.0090質量%の範囲で含まれることが好ましく、熱応答性高分子が0.25〜2.0質量%の範囲で含まれることが好ましい。また、金ナノクラスターと熱応答性高分子を質量比で表すと、金ナノクラスター/熱応答性高分子の質量比が9/10000〜36/1000の範囲であることが好ましい。また、薬剤の濃度としては、使用する薬剤の種類によっても左右されるが、例えば、金1gに対し、0.2〜20×10-5M程度の濃度とすることができる。この程度の薬剤濃度であれば、添加した薬剤を効率よく金ナノ粒子に吸着させることができ、かつ後述するようなチオール類存在下における熱刺激による薬剤放出の作用機序に薬剤の濃度依存性による影響を及ぼすこともない。
【0073】
混合溶液に含有させる熱応答性高分子は、通常、1種の熱応答性高分子であるが、金ナノ粒子を製造することが可能であれば2種以上の熱応答性高分子であってもよい。また、混合溶液のpHは含有させる熱応答性高分子の種類にもよるが、通常、2.9〜10.0の範囲であることが好ましい。
【0074】
金ナノ複合体は、調製された金ナノ複合体の製造用溶液(混合溶液)を加熱し、冷却することによって製造される。加熱は、熱応答性高分子に相転移を起こさせ、金ナノクラスターを融合させる操作である。加熱温度は、40〜95℃、好ましくは70〜95℃である。温度が高いほど大きな粒径の金ナノ粒子を得ることができる。加熱時間は、30分〜2時間が好ましい。なお、加熱時間が長くなると大きな粒子の個数が増えて平均粒径が見かけ上大きくなる。しかし、粒子が成長して大きい粒子になるわけではない。また、吸光度の変化は、30分以上ではあまり変わらない。
【0075】
冷却は、加熱されて熱応答性高分子が析出し濁った溶液を、再度透明にする操作である。冷却温度は、0〜30℃、好ましくは4〜10℃である。冷却温度が低くなるほど早く溶液は透明となる。冷却時間は、30分以上で十分であり、上限は特に限定されない(1時間又は2時間程度)。
【0076】
こうした加熱冷却手段により、混合溶液から金ナノ複合体を製造することができる。製造された金ナノ粒子は、TEM像から計測できる粒径が50〜100nmの範囲であり、動的光散乱法での測定で粒径100〜500nmにピークを示す。なお、TEM像からの計測は、TEM写真を撮影し、その写真から計測したものである。一方、動的光散乱法による粒径の測定は、動的光散乱測定装置で測定されたものである。
【0077】
[金ナノ複合体からの薬剤放出]
本発明に係る金ナノ複合体からの吸着薬剤分子の放出は、後述するようなグルタチオン等チオール類又はシスチンを添加し、熱刺激(加熱→冷却)を行うことによってなされる。
【0078】
図1は、金ナノ複合体からの薬剤放出のメカニズムを示す模式図である。すなわち、図1に示すように、金ナノ粒子表面に薬剤分子を吸着させ、熱応答性高分子を被覆してなる金ナノ複合体に対して、チオール類等の分子スイッチとなる有機化合物を添加すると、当該有機化合物分子により、金ナノ粒子表面で吸着分子の置換が起こるものの、薬剤は熱応答性高分子に覆われている金ナノ複合体の中に留まる。この状態で熱刺激(加熱→冷却)を加えると熱応答性高分子が相移転を起こし一旦収縮することで、金ナノ複合体から遊離し放出されというものである。
【0079】
(チオール類)
次に、上記したような本発明に係る金ナノ複合体からの薬剤放出のために用いられるチオール類について説明する。
【0080】
金ナノ複合体へのチオール類の吸着によって、金ナノ粒子に吸着した薬剤分子が金ナノ粒子から脱離する。すなわち、凝集状態の金ナノ粒子複合体にチオール基を有するチオール類を加えると、金ナノ粒子の表面で、薬剤分子の官能基等と交換して、金ナノ粒子表面に対し強い結合性を有するチオール基が配位しチオール類が吸着する。
【0081】
チオール類の添加により、上記のような薬剤分子の脱離を効果的に生じさせるチオール類としては、(1)チオール基の存在、(2)分子サイズ及び構造、(3)カルボキシル基やアミノ基間の水素結合の存在といった要素が必要であると考えられる。
【0082】
(1)のチオール基は、金ナノ粒子の表面に吸着し、薬剤分子の官能基等との交換反応を起こすと考えられる。酸化型グルタチオンのようなジスルフィド結合を有する化合物、メチオニンのようなスルフィド結合を有する化合物では、チオール基を有する化合物とは異なり、薬剤分子の官能基等との交換反応は生じないように思われる。但し、本発明者の行った実験によれば、ジスルフィド結合を有する化合物であっても、シスチン(システインの2量体)の場合、当該化合物添加後に熱刺激を与えると、薬剤分子の高い放出効果が発揮されることが観察でき、例外的にシスチンは、本発明に係る金ナノ複合体に対し効果的に作用する化合物であるといえる。
【0083】
(2)の分子サイズ及び構造については、チオール類の金ナノ粒子表面への吸着による薬剤分子との置き換え反応が、概してチオール類が低分子量となる程速く生じるものと思われる。例えば、グルタチオンのように分子サイズが大きいと金ナノ粒子の保護効果が大きいものの、金ナノ複合体の表面に吸着した薬剤分子や熱応答性高分子との置換が遅い。L−システイン(L−Cys)、ホモシステイン(Hcys)等の低分子量のカルボキシル基を有するチオール基含有化合物では金ナノ粒子の保護効果はほとんどなく、反応は速い。グルタチオンとL−システインの中間のサイズにあるシステイニルグリシン、グルタミルシステイン等は、金ナノ粒子の保護効果を有し、薬剤分子や熱応答性高分子との置換の反応速度も比較的速いと考えられる。
【0084】
このため、L−システイン、Hcys等の低分子量チオール基含有化合物を用いた場合、当該化合物を添加したのみで、金ナノ複合体からかなりの量の薬剤が放出され、熱刺激によって薬剤を放出するという本発明に係る金ナノ複合体の起動作用が有効に働かないおそれが高い。このような化合物は分子サイズが小さいので、これを添加すると、熱刺激(加熱→冷却)による金ナノ粒子の再分散を阻害する為に薬剤分子の遊離が十分ではなくなり、熱刺激後において遊離薬剤分子量が低下するものと思われる。
【0085】
システイニルグリシン、グルタミルシステイン等の場合においても、このような傾向はある程度見られるものの、熱刺激を受けた後において金ナノ粒子の再分散が促進され、薬剤放出は、熱刺激を与える前よりも高い割合で生じるため、好ましい化合物といえる。グルタチオンの場合には、当該化合物を添加したのみでは、最も薬剤放出の程度が低く、かつ熱刺激を受けた後における薬剤放出の割合が極めて高いものとなるために、特に好ましい化合物といえる。
【0086】
(3)カルボキシル基の静電反発については、チオール基含有化合物の酸解離したカルボキシル基の静電反発が大きく関与すると考えられる。グルタチオンの二つのカルボキシル基のpKaはpKa1=2.16及びpKa2=3.55であり、主に検討している熱応答性高分子濃度0.2質量%における複合体溶液のpHが約8であるため、カルボキシル基はCOO−となっている。その一方、NH基、NH2基は一部水素イオンが付加して正に帯電している。はじめに金ナノ粒子はクエン酸によりアニオン性の状態であり、静電反発により分散している。この状態にNH基、NH2基を有するポリマーを添加することにより、金ナノ粒子表面の電荷が部分的に打ち消されるとともに、NH基、NH2基が金に吸着して、金ナノ粒子が凝集する。このとき、金ナノ粒子は、ポリマーで被覆され、凝集した粒子間にポリマーが入りこんだ状態になっている。この状態の金ナノ粒子にチオール基含有化合物であるグルタチオン等を添加すると、チオール基とNH基、NH2基とが交換し、チオール基含有化合物が金ナノ粒子の表面に結合する。このとき、金ナノ粒子の表面では官能基が非常に込み合っている状態となっているが、チオール基含有化合物や熱応答性高分子の極性基(官能基)がランダムな状態で存在することはエネルギー的に不利になる。極性基(官能基)が水素結合により配列することで、エネルギー的に不利な状態が解消される。結果として、金ナノ粒子間の距離を広がることになるものと考えられる。
【0087】
以上のチオール基の存在、分子サイズや構造、チオール基含有化合物のカルボキシル基の存在、NH基、NH2基を有するポリマーによる非共有結合的な保護効果が金ナノ粒子の再分散に影響するほかに、チオール基含有化合物の他の官能基の電荷や溶液中に存在する化合物の構造や各官能基の電荷等が、全体として金ナノ粒子の再分散に影響していると考えられる。
【0088】
以上の点から、本発明に係る金ナノ複合体による薬剤放出の分子スイッチとして用いられるチオール類としては、特に限定されるものではないが、グルタチオン(GSH)、システイニルグリシン(Cys−Gly)、グルタミン酸システイン(Glu−Cys)等が好ましいものとして例示でき、このうち特に好ましくは、グルタチオンである。また、前記したように薬剤放出の分子スイッチとしてシスチンも好ましい化合物として例示できる。
【0089】
また、このような薬剤放出の分子スイッチとして用いられるチオール類の添加濃度としては、一般的にチオール類の添加濃度が高い程、熱刺激を与えた後に放出される薬剤量が多くなる傾向があるが、一方で添加濃度が高くなる程、熱刺激を与えない状態において放出される薬剤量も多くなる傾向がある。また、ある程度以上の添加濃度とならないと、熱刺激前後における放出薬剤量の有意差が生じない。このため使用するチオール類の種類によっても左右されるため、一概には規定できないが、例えば、グルタチオンを使用する場合には、その濃度が4〜10×10−6M程度とすることが望ましい。
【0090】
なお、グルタチオン等の好ましいチオール類を薬剤放出の分子スイッチとして用いる場合、L−Cys、Hcys、グリシン、グルタミン酸等の共存物質が存在していても、当該グルタチオン(分子スイッチ)の添加後、熱刺激によって薬剤を放出するという本発明に係る金ナノ複合体の起動作用が有効に機能する。このことは、生体内においては、L−Cys、Hcys、グリシン、グルタミン酸等のアミノ酸、ペプチド等の存在が当然に想定されることから、本発明に係る金ナノ複合体を用いたドラッグデリバリーシステムが生体内において有効に機能するものであると思われる。
【0091】
(熱刺激)
本発明に係る金ナノ複合体に対し、分子スイッチであるチオール類の添加後、加熱し、冷却することによって、金ナノ複合体よりの薬剤放出が行われる。加熱は、熱応答性高分子に相転移を起こさせる操作である。加熱温度は、40〜95℃、好ましくは70〜95℃である。加熱時間は、30分〜2時間が好ましい。蛍光強度から見積もった薬物放出量の変化は、30分以上ではあまり変わらない。
【0092】
冷却は、加熱されて相転移を起こし収縮した熱応答性高分子を、再度分散させ金ナノ複合体からの薬剤の放出を行わせる操作である。冷却温度は、0〜30℃、好ましくは4〜10℃である。冷却時間は、30分以上で十分であり、上限は特に限定されない(1時間又は2時間程度)。
【0093】
金ナノ複合体が分子スイッチ添加及び熱刺激により吸着薬剤分子を放出する現象は、一般的なpH環境であるpH5〜9の範囲内においては、pH値にあまり依存することなく、ほぼ均一に生じ、熱刺激前において吸着薬剤分子は実質的に放出されないか又はごく微量の放出に留まり、熱刺激後において大きな放出が生じる。より望ましくは、pH5〜7.5程度の弱酸性ないし中性領域での使用が、熱刺激前の吸着薬剤分子の放出量を抑制しかつ熱刺激後において大きな放出を生じさせる上で好ましい。
【0094】
(ドラッグデリバリーシステム)
本発明に係る金ナノ複合体に対して、上記したようにチオール類又はシスチンの存在下で熱刺激を与えることで、吸着していた薬剤を放出することができることから、ねらった部位で薬物を的確に放出できるドラッグデリバリーシステムにおいて好適に用いられる。
【0095】
金ナノ複合体の生体内投与経路としては、特に限定されるものではなく、担持させる薬剤の種類及び薬剤を投与しようとする生体部位ないし組織に応じて、経口、経鼻、経膣、静脈内、皮下、腹腔内等の適当な投与経路を通して生体内に導入することが可能である。
【0096】
生体内においては、金ナノ複合体の分子スイッチであるチオール類、例えば、分子スイッチとして好適なグルタチオン、システイニルグリシン、グルタミン酸システイン等が本来存在しており、このようなグルタチオン等の濃度が高い生体部位ないし組織をターゲットとする薬剤投与の場合には、系外より別途チオール類を投与せずとも、熱刺激を与えることによって、本発明に係る金ナノ複合体を用いたドラッグデリバリーシステム薬剤を、ターゲット部位において的確に発動させることができる。もちろん、必要に応じて、このような分子スイッチとしてチオール類は、外部より生体内のターゲット部位ないし組織に導入することが可能である。
【0097】
生体に対し熱刺激(加熱)を行う手段としては、特に限定されるものではなく各種の手法を用いることが可能であるが、例えば、二方向(代表的には直交方向)からの遠赤外レーザー加熱を行えば、ターゲット部位を局所的に加熱することが可能である。
【0098】
(蛍光センサー)
本発明に係る金ナノ複合体に担持させる薬剤として、蛍光物質、例えば、上記したようなナイルレッド等を用いた場合、再現性の良いナノ蛍光センサーとして用いることがきる。
【0099】
ナノ粒子蛍光センサー溶液に、チオール化合物であるグルタチオン等の分析対象物質を添加し、熱刺激を加えると、熱応答性高分子の相転移に伴って蛍光物質が金ナノ複合体から遊離する。この結果、金ナノ複合体による蛍光共鳴エネルギー移動(以下FRET)が解消し、蛍光強度が回復する。回復した蛍光強度は添加する分析対象物質の濃度に比例するので、分析対象物質を定量できる。熱刺激を加えないと、蛍光物質が金ナノ複合体から遊離が実質的生じないため、分析対象物質の添加により遊離した蛍光物質が凝集することがなく、再現性良く定量分析が可能である。
【実施例】
【0100】
以下の実験によって、本発明をさらに詳しく説明するが、本発明は以下の実施例によって何ら限定されるものではない。特に、以下の実施例においては、吸着薬剤の放出の程度の確認を容易とするために、蛍光物質であるナイルレッドを吸着薬剤として使用した例を中心として記載するが、吸着薬剤としては何らこのような蛍光物質に限定されるものではなく、上述したような各種の薬剤が使用可能であることと、このような各種の薬剤においても以下の実施例に示す蛍光物質の場合と同様の有効な薬剤放出現象が生じることは、当業者であれば容易に理解できるものであると思われる。
【0101】
[装置及び試薬]
まず、本実施例において用いられた装置及び試薬としては、以下の通りであった。吸収スペクトルの測定には、光路長1cmプラスチックセルを装備した日本分光製V−560型 紫外可視分光光度計を使用した。蛍光スペクトル測定には、光路長1cm石英セルを装備した日本分光製FP−6300型分光蛍光光度計を使用した。
【0102】
合成した熱応答性高分子の限外濾過には、Millipore製の限外濾過膜を(排除限界分子量:5000)を装備したアドバンテック製のプラスチック製ウルトラフィルター用限外濾過器MODEL−UHP−Kを使用した。合成した熱応答性高分子の凍結乾燥には、アルバック機工製のOMT−050A型オイルミストトラップを備え付けたアルバック機工製の直結型油回転真空ポンプ、東京理科器械製のUT−1000型ユニトラップ、及び東京理科器械製のCMW−1型水分トラップを装備した東京理科器械製のFD−5N型凍結乾燥機を使用した。pHの測定には、HORIBA製pH−METER F−13を使用した。
【0103】
α,α’‐アゾビスイソブチロニトリル(AIBN、Fw:164.21)、水酸化カリウム(Fw:56.11)、水酸化ナトリウム(Fw:40.00)、ジエチルエーテル(Fw:74.12)、1,4‐ジオキサン(Fw:88.1)、ペルオキソ二硫酸カリウム(Fw:270.32)、ジエチレントリアミン(DETA、Fw:103.17)は関東化学製特級のものを使用した。ピロガロール(Fw:126.11)は関東化学製1級のものを使用した。メタクリル酸(MA、Fw:86.09)は関東化学製1級のものを凍結法により重合禁止剤を除去してから使用した。トリエチレンテトラミン(TETA、Fw:146.24)は関東化学製ものを使用した。N‐イソプロピルアクリルアミド(NIPAAm、Fw:113.16)は和光純薬製特級を関東化学製特級のヘキサン(Fw:86.18)を用いて再結晶してから使用した。N,N,N’,N’−テトラメチルエチレンジアミン(TEMED、Fw:116.21)は和光純薬特級を使用した。塩化アクリロイル(AC、Fw:90.51)は和光純薬1級を用いた。テトラクロロ金酸四水和物(Fw:411.85)、クエン酸三ナトリウム二水和物(Fw:294.1)、アセトン(Fw:58.08)は関東化学製特級のものを使用した。Nile Red(NR、Fw:318.57)は東京化成製1級のものを使用した。グリシン(Gly、Fw:75.07)、グルタミン酸(Fw:147.03)、L‐システイン(L-Cys、Fw:121.16)、1-ブタンチオール(Fw:90.19)、1-オクタンチオール(Fw:146.29)、2-メルカプトエタノール(Fw:78.13)、2,3-ジメルカプト-1-プロパノール (Fw:124.23)は関東化学製特級のものを、還元型グルタチオン(GSH、Fw:307.32)、3-メルカプト-1,2-プロパンジオール(Fw:108.16)は関東化学製1級のものを使用した。3-メルカプトプロピオン酸 (3-MPA、Fw:106.14)、1,2-エタンジチオール(Fw:94.2)は東京化成製特級のものを、酸化型グルタチオン(GSSG、Fw:612.63)、n-ドデシルメルカプタン(Fw:202.4)、3-メルカプトプロピオン酸エチル (Fw:134.2)は東京化成製1級のものをシスタミン硫酸塩(Fw:250.36)、Hcys(Fw:135.19)は東京化成製のものを使用した。グルタミルシステイン(Glu-Cys、Fw:250.27)、システイニルグリシン(Cys-Gly、Fw:178.2)、DL−ペニシラミン(Fw:149.2)はSigma製ものを使用した。
【0104】
実験における水は、蒸留、イオン交換した後、Millpore製のMilli−Q超純水製造システムで製造したものを使用した。メタノール(Fw:32.04)は関東化学製特級のものを蒸留してから使用した。
【0105】
[合成例1(金ナノ粒子の調製)]
金ナノ粒子溶液の調製は、クエン酸ナトリウム還元法により行った。使用した器具は、全て王水に30分間浸漬後、超純水で洗浄し、乾燥させたものを用いた。調製手順を以下に示す。500mL丸底フラスコに1mMテトラクロロ金酸塩水溶液、250mLを入れ、激しく攪拌しながら、沸騰直前まで加熱した。沸騰させたまま38.8mMクエン酸三ナトリウム水溶液、25mLを添加し、溶液の色が淡黄色から深赤色へと変化することを確認した。さらに攪拌しながら10分間加熱させた後、室温において15分間攪拌し続けた。溶液を孔径1μmメンブランフィルターを用いて吸引ろ過を行い、金ナノ粒子溶液をガラス試薬瓶に移し、冷暗所(4℃)に保管した(0.18g−Au/L金コロイド溶液)。
【0106】
[合成例2(化学式1/P−NIPの合成)]
500mL三つ口セパラブルフラスコにN−イソプロピルアクリルアミド(NIPAAm)30gを採り、水100mLで溶解した。氷浴を用いてフラスコを0℃に保ち、攪拌しながら、重合開始剤としてペルオキソ二硫酸カリウム1.0g及び重合促進剤としてN,N,N’,N’−テトラメチルエチレンジアミン(TEMED)1.5mLを添加し、4時間重合した。合成したP−NIPの構造式は、上記化学式1のR1とR2をメチル基としR3を水素原子としたものである。重合終了後、メタノール100mLを加えて沈殿したポリマーを取り出し、メタノール100mLに溶解した。この溶液に、水100mLを加え、沈殿したポリマー取り出して水100mLに溶解した。この操作を二回繰り返し行い、精製したP−NIPを水に溶解し、凍結乾燥を行った。さらに、得られたポリマーを水に溶解して凍結乾燥を行い、冷暗所に保存した。この熱応答性高分子の下限臨界溶液温度(LCST)は34.1℃であった。
【0107】
[合成例3(化学式2/ポリ(N−イソプロピルアクリルアミド−co−アクリロイルトリエチレンテトラミン)の合成)]
トリエチレンテトラミン(TETA)をモノマーとして用いる場合、あらかじめビニル基を導入する必要がある。そこでまずTETAと塩化アクリロイル(AC)よりアクリロイルトリエチレンテトラミン[以下、AC−TETA]の合成を行った。TETA29.73mL(0.2mol)と1,4−ジオキサン200mLの混合溶液に、AC1.625mL(0.02mol)と1,4−ジオキサン50mLの混合溶液を冷却、攪拌しながら一滴ずつ滴下して反応させた。滴下終了後、白色の沈殿を濾別し少量のメタノールに溶解した。これに水酸化カリウム−メタノール溶液(水酸化カリウム 1.18g(0.02mol))を含む100mLを加えて攪拌、濾別し得られた濾液をNIPAAmとの共重合に用いた。
【0108】
500mL三つ口セパラブルフラスコにモノマーの供給比(NIPAAmの物質量:TETAの物質量)がモル比で90:10(mol%)となるようにN−イソプロピルアクリルアミド(NIPAAm)20.37g(0.18mol)とAC−TETAを含むメタノール溶液を加えた。オイルバスを用いてフラスコを60℃に加温、攪拌しながら、重合促進剤として3−メルカプトプロピオン酸(3−MPA)(メタノール20mLに対して0.1mL)及び重合開始剤としてα,α’−アゾビスイソブチロニトリル(AIBN)0.8211g(0.005mol)を添加して、5w/v% ピロガロール−10w/v%アルカリ溶液(アルカリ:NaOH)100mLを用いた脱酸素ラインに通気した窒素雰囲気下で4時間重合を行った。
【0109】
得られたポリマーは以下の手順で精製した。まず、得られた重合反応物をエバポレーターにてポリマーの溶解液に含まれるメタノールを除去した後に、冷ジエチルエーテル1.0Lに注いだ。この上澄み液をデカンテーションして取り除き、メタノールで再度溶解した。この工程を2回繰り返した後、デカンテーション後に得られた沈殿物に水を加えて300mLとした。この溶液を分子量5000の限外濾過膜を用いて透析を6回行い、未反応モノマーを除去した。その後、得られたポリマー溶液に凍結乾燥を行い冷暗所で保存した。合成したポリ(N−イソプロピルアクリルアミド-co-アクリロイルトリエチレンテトラミン)[以下、NIP−TETA]の構造式は、上記化学式2のR1とR2をメチル基としR3とR4を水素原子、nを2としたものである。得られたNIP−TETAの下限臨界溶液温度(LCST)は38.3℃であった。
【0110】
[合成例4(化学式2/ポリ(N−イソプロピルアクリルアミド−co−アクリロイルジトリエチレンテトラミン)の合成)]
ジエチレントリアミン(DETA)をモノマーとして用いる場合、DETAにビニル基を導入する必要がある。そこで、まずDETAと塩化アクリロイル(AC)よりアクリロイルジエチレントリアミン[以下、AC−DETA]の合成を以下の手順で行った。DETAを含む1,4−ジオキサンの混合溶液(20.63g/200mL)に、ACと1,4−ジオキサンの混合溶液(1.625mL/50mL)を冷却、攪拌しながら一滴ずつ滴下して反応させた(DETAの物質量:ACの物質量=10:1)。滴下終了後、白色の沈殿を濾別し、少量のメタノールに溶解した。これにKOH−メタノール溶液を加えて攪拌、濾別し、得られた濾液をNIPAAmとの共重合に用いた。
【0111】
500mL三つ口セパラブルフラスコにモノマーの供給比(NIPAAmの物質量:DETAの物質量)がモル比で90:10(mol%)となるようにN−イソプロピルアクリルアミド(NIPAAm)とAC−DETAを含むメタノール溶液を加えた。重合促進剤として3−メルカプトプロピオン酸(3−MPA)(メタノール20mLに対して0.1mL)を、重合開始剤としてα,α’−アゾビスイソブチロニトリル(AIBN)0.3284g(0.005mol)を添加した。油浴中においてフラスコ内の溶液を攪拌しながら脱酸素ライン(5w/v%ピロガロール−10w/v%NaOH溶液100mL)に通気した窒素をフラスコ内に通気し、窒素雰囲気下で30分間脱酸素を行った。その後、窒素を通気しながら、60℃に加温し、窒素雰囲気下で4時間重合を行った。得られたポリマーは以下の手順で精製した。まず、得られた重合反応物をエバポレーターにてポリマーの溶解液に含まれるメタノールを可能な限り除去した後に、冷ジエチルエーテル1.0Lに注いだ。この上澄み液をデカンテーションして取り除き、メタノールで再度溶解した。この工程を2回繰り返した後、デカンテーション後に得られた沈殿物に水を加えて300mLとした。この溶液を分子量5000の限外濾過膜を用いて透析を6回行い、未反応ポリマーを除去した。その後、得られたポリマー溶液に凍結乾燥を行い冷暗所で保存した。合成したポリ(N−イソプロピルアクリルアミド−co−アクリロイルジトリエチレンテトラミン)[以下、NIP−DETA]の構造式は、上記化学式2のR1とR2をメチル基としR3とR4を水素原子、nを1としたものである。得られたNIP−DETAの下限臨界溶液温度(LCST)は38.4℃であった。
【0112】
[合成例5(化学式6/pNIP−MAの合成)]
500mL三つ口セパラブルフラスコに、モノマーの供給比(NIPAAmの物質量:MAの物質量)をモル比で(90:10)(mol%)となるようにNIPAAm20.37g(0.18mol)とメタクリル酸(MA)1.72g(0.02mol)を入れた。NIPAAmとMAの含量が両者の和として30質量%となるようにメタノール65.2mLを添加してモノマーを溶解した。オイルバスを用いてフラスコを60℃に加温し、攪拌しながら、重合促進剤として3−MPA(メタノール20mLに対して0.1mL)を、重合開始剤としてAIBN0.8211g(0.005mol)を添加して、脱酸素ライン(5w/v%ピロガロール−10w/v%水酸化ナトリウム溶液100mL)に通気した窒素をフラスコ内に通気し、窒素雰囲気下で4時間重合を行った。重合終了後、生成物を含むメタノール溶液を室温まで冷却する。メタノール100mLに対して2Lの冷ジエチルエーテルを用い、生成物を含むメタノール溶液を冷ジエチルエーテルに1滴ずつゆっくり滴下し、攪拌する。これにより析出したガム状の生成物を回収し、再びメタノール約50mLに溶解する。この精製を2回行った後、得られたポリマーを水に溶解し、溶液を凍結させた。溶液が完全に凍結した後、凍結乾燥を行い、冷暗所に保存した。合成したpNIP−MAの構造式は上記化学式6のR1とR2をメチル基としR3とR4を水素原子としたものである。得られたpNIP−MAの下限臨界溶液温度(LCST)は35.7℃であった。
【0113】
[参考例1(蛍光物質の特性)]
本発明に係る金ナノ複合体の薬剤放出特性を評価するための吸着薬剤として、蛍光物質Nile Redを使用した。そこでまず、Nile Redの蛍光スペクトル測定を行った。Nile Redを0.0159g(5.0×10−5mol)採り、少量のアセトンで溶解したのち、アセトンで20mLに定容した(2.5×10−3M)。この溶液0.04mLを10mLメスフラスコに採り、水で定容した(1.0×10−5M)。このNile Red水溶液を10mLメスフラスコに0〜0.100mLに採り、水で10mLに定要した(0〜1.0×10−7M)。これらの溶液の蛍光スペクトルを励起波長を580nm、蛍光波長を652nmに固定して測定した。その結果、Nile Redの濃度に応じて蛍光強度の増加が確認できた。
【0114】
Nile Redを熱応答性高分子及び、金ナノ粒子に混合することから、以下の実験では、Nile Redの最終濃度を、1.0×10−7Mとした。後に詳述するが、この濃度のNile Redは、再分散には全く影響を及ぼさない。なお、図2に、1.0×10−7Mの濃度におけるNile Redの励起及び蛍光スペクトルを示す。
【0115】
[実施例1〜4及び比較例1]
(金ナノ複合体の調製及び熱応答性高分子の相違による薬剤放出評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液3.0mLを添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、上記合成例2〜5で調製した各熱応答性高分子の2.0質量%溶液3.75mLを添加し、水で10mLに定容とした。
【0116】
調製した金ナノ複合体(実施例1〜4)からの薬剤放出を評価するため、励起波長を580nm、蛍光波長を652nmに固定して、蛍光スペクトル測定を行った。その後、90℃で30分間、加熱を行い、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0117】
また、調製した各金ナノ複合体溶液に、チオール類として、1.0×10−3Mグルタチオン(GSH)溶液250μLを添加した後、上記と同様の条件にて、蛍光スペクトル測定を行った。その後、90℃で30分間、加熱を行い、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0118】
また、比較のために、10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液0〜5.0mLを添加し、1.0×10−5M Nile Red溶液0.100mLを添加して水で10mLに定容した。
【0119】
得られた比較用金ナノ複合体(比較例1)に対し、実施例1〜4と同様に、GSH無添加の状態での加熱前後の蛍光スペクトル測定、GSH添加状態での加熱前後の蛍光スペクトル測定を行った。
【0120】
得られた結果を、図3に示す。図3中、Au+NRは、金ナノ粒子にNile Redを吸着させた比較例1の比較用金ナノ複合体を、「P−NIP」は、金ナノ粒子にNile Redを吸着させ合成例2のP−NIPを被覆した実施例1の金ナノ複合体を、「TETA」は、金ナノ粒子にNile Redを吸着させ合成例3のNIP−TETAを被覆した実施例2の金ナノ複合体を、「DETA」は、金ナノ粒子にNile Redを吸着させ合成例4のNIP−DETAを被覆した実施例3の金ナノ複合体を、「MA」は、金ナノ粒子にNile Redを吸着させ合成例5のpNIP−MAを被覆した実施例4の金ナノ複合体を、それぞれ示すものである。
【0121】
図3に示すように、実施例1〜4の金ナノ複合体はいずれもGSHを添加しない系に比較して、GSHを添加した系において、加熱後において高い蛍光強度を示し、GSHを添加し熱刺激を与えることによって、金ナノ複合体からNile Redが効果的に遊離することが明らかとなった。また、比較例1のものと比べて、GSHを添加した系における加熱後の蛍光強度は、いずれも大きな値であり、本発明に係る金ナノ複合体によるチオール類共存下における熱刺激による薬剤放出効果が優れたものであることが示された。
【0122】
なお、図3に示すように、NIP−TETAを被覆した際(実施例2)は、GSHを添加しない系においても、Nile Redが一部遊離していることが分かった。これは、TETA基が金ナノ粒子表面に吸着した際に、Nile Redを交換したために生じると思われる。これに対して、その他の熱応答性高分子を加えた場合にはNile Redの遊離は観測されなかった。
【0123】
一方、GSHを添加した系においては、GSHはチオール基を有することから金ナノ粒子と特異的に反応しかつ、加熱・冷却なしでも再分散を促進する効果があることが観察できる。このことから、熱刺激によって再分散を起こすNIP−TETA(実施例2)とNIP−DETA(実施例3)は、GSH添加によりNile Redが効果的に遊離するために蛍光強度が大幅に回復したと考えられる。再分散を起こさないNIP−MA(実施例4)とP−NIP(実施例1)においても、添加したGSHによってNile Redの遊離がある程度生じたものと思われ、熱刺激後において比較的高い蛍光強度を示したものと考えられる。
【0124】
[実施例5]
(金ナノ複合体の調製及び熱応答性高分子の濃度による薬剤放出評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、熱応答性高分子の最終濃度が0〜1.0質量%の時は、2.0質量%熱応答性高分子溶液を0〜5mL加え、ポリマーの最終濃度が1.25及び1.50質量%の時は5.0質量%熱応答性高分子溶液を2.5mL及び3mL加えて、水で最終体積が10mLとして、熱応答性高分子濃度の異なる金ナノ複合体を調製した。なお、使用した熱応答性高分子としては、合成例4のNIP−DETAを用いた。
【0125】
これらの各溶液について、実施例1〜4と同様の条件下に、GSH無添加の状態で測定を行った。得られた結果を、図4に示す。図4に示すように、GSHを添加しない系においては、被覆したNIP−DETAの量にかかわらす、熱刺激を加えてもNile Redの遊離はほどんど起こっておらず、一方GSHを添加している系においては、熱刺激後に大きなNile Redの遊離が起こることが示された。NIP−DETAの添加濃度が0.25質量%以上となると、NIP−DETAを添加しない場合と比較して、その熱刺激後のNile Redの遊離量に有意な差が見られ、特に、添加濃度約0.5〜約1.0質量%の範囲内において、大きな効果が得られた。
【0126】
[実施例6]
(金ナノ複合体の調製及び熱応答性高分子の濃度による薬剤放出評価)
使用する熱応答性高分子として、合成例4のNIP−DETAに代えて、合成例3のNIP−TETAを用いた以外は、実施例5と同様にして、熱応答性高分子濃度の異なる金ナノ複合体を調製し、これらの各溶液について、GSH添加状態での加熱前後の蛍光スペクトル測定を実施例5と同様にして行った。
【0127】
得られた結果を、図5に示す。図5に示すようにGSHを添加している系において、熱刺激後に大きなNile Redの遊離が起こることが示された。NIP−TETAの添加濃度が比較的低いところでも、NIP−TETAを添加しない場合と比較して、その熱刺激後のNile Redの遊離量に有意な差が見られたが、NIP−TETAの添加濃度が約1.0質量%を超えると、NIP−TETAを添加しない場合と比べて熱刺激前におけるNile Redの遊離量が大きくなってしまう傾向が見られた。熱刺激前後における蛍光強度差からみると、添加濃度としては、約0.25〜約1.25質量%、特に約0.25質量%前後の範囲内において、大きな効果が得られた。
【0128】
[実施例7]
(金ナノ複合体の調製及び環境pH条件の変動による薬剤放出評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、2質量%NIP−DETA溶液 3.73mLを加えて、水で最終体積が10mLとした。この溶液に1.0M NaOH水溶液及び、1M HCl水溶液を少量加えることによりpHを5.0〜9.0の間で調整した。各溶液に対し、1.0×10−3Mグルタチオン(GSH)溶液250μmμLを添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、90℃で30分間、加熱を行い、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0129】
得られた結果を図6に示す。図6に示すように、GSH添加系において熱刺激により吸着薬剤分子を放出する現象は、測定したpH5〜9の範囲内においては、pH値にあまり依存することなく、ほぼ均一に生じ、熱刺激前において吸着薬剤分子はごく微量の放出に留まり、熱刺激後において大きな放出が生じることが示された。特にpH5.5〜pH7.5の範囲において良好な結果が得られた。
【0130】
[実施例8]
(熱刺激温度の変動による薬剤放出評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、2質量%NIP−DETA溶液 3.73mLを加えて、水で最終体積が10mLとした。
【0131】
得られた金ナノ複合体溶液に対し、1.0×10−3Mグルタチオン(GSH)溶液250μLを添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、加熱温度を30、40、50、60、70、80、90℃に設定して30分間、加熱を行った後、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0132】
得られた結果を図7に示す。図7に示すように、加熱温度が約40℃以上、特に約70℃となると熱刺激による良好なNile Redの遊離が生じた。
【0133】
[実施例9〜12及び参考例2〜7]
(分子スイッチの評価)
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、2質量%NIP−DETA溶液 3.73mLを加えて、水で最終体積が10mLとした。
【0134】
得られた金ナノ複合体溶液に対し、1.0×10−3Mの各化合物溶液を250μLを添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、加熱温度を90℃で30分間、加熱を行った後、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0135】
なお、添加した化合物は、グルタチオン(GSH)(実施例9)、システイニルグリシン(Cys−Gly)(実施例10)、シスチン(実施例10)、グルタミン酸システイン(Glu−Cys)(実施例11)、グリシン(Gly)(参考例2)、グルタミン酸(参考例3)、酸化型グルタチオン(GSSG)(参考例4)、L−システイン(L−Cys)(参考例5)、Hcys(参考例6)、メチオニン(参考例7)であった。使用した化合物の構造式を図8に示す。
【0136】
得られた結果を図9に示す。図9に示すように、GSH、Cly−Cys、Cys−Gly、L−Cys、Hcysのチオール化合物を用いた場合は、いずれもNile Redが遊離していることが確認できた。その中でも、GSH、Glu−Cys、Cys−Gly、が非常に大きな蛍光強度の回復が確認できた。GSH、Glu−Cys、Cys−Glyは分子サイズが大きいことから再分散を促進し、熱刺激を与えることで十分な再分散を行うことができ、これによって蛍光強度の回復が起こるものと考えられる。L−Cys、Hcysでは分子サイズが小さいので、L−Cys、Hcysを添加すると再分散を阻害する為にNile Redの遊離が十分ではなくなり、結果として加熱・冷却しても蛍光強度が十分には回復しなかったものと考えられる。
【0137】
Gly、グルタミン酸は、チオール基を含まない化合物であるため、金ナノ粒子と反応せず、加熱後においてもNile Redが遊離しておらず、分子スイッチとして不適であることが示された。また、ジスルフィド結合を有するGSSG、スルフィド結合を有するメチオニンに関しても、加熱後においてもNile Redが遊離していなかったが、ジスルフィド結合を有するシスチンに関しては、加熱・冷却後に蛍光強度が大きく回復しており、分子スイッチとして適用可能であることが示された。
【0138】
[実施例13〜16及び参考例8〜9]
(分子スイッチの評価)
実施例9〜12及び参考例2〜7における結果から、分子スイッチとして好適であると思われるGSH、Glu−Cys、Cys−Gly、シスチンに関し、その濃度の検討を行った。比較のために、併せてL−Cys、Hcysに関しても同様の検討を行った。
【0139】
実験は、実施例9〜12及び参考例2〜7におけるものと同様にして得られた金ナノ複合体溶液に対し、1.0×10−3Mの各化合物溶液を0〜250μLの範囲で添加量を変えてを添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、加熱温度を90℃で30分間、加熱を行った後、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。
【0140】
得られた結果を図10に示す。図10に示すように、GSH、Glu−Cys、Cys−Gly、シスチンは測定した0.5〜2.5×10−5Mの濃度範囲において、分子スイッチとして有効に機能していることが確認できた。
【0141】
なお、GSHにおいては、比較的添加濃度が低いところにおいても有意な効果が見られたため、濃度0〜1×10−6Mの範囲内においてより細かな濃度変化を与え、濃度変動による効果の違いを調べた。得られた結果を図11に示す。図11に示すように、濃度が約4×10−6M以上となると、加熱・冷却後に蛍光強度が大きく回復していることが判った。
【0142】
[実施例17]
(共存物質の影響の検討)
実施例13〜16及び参考例8〜9の結果から、分子スイッチとしてGSHが適当なものの1つであることが判ったため、このGSHの分子スイッチの機能が、共存物質により影響を受けるかどうかについて検討を行った。
【0143】
10mLメスフラスコに0.18g−Au/L金ナノ粒子溶液を添加し、1.0×10−5M Nile Red溶液0.100mLを添加し、2質量%NIP−DETA溶液 3.73mLを加えて、水で最終体積を10mLとした。
【0144】
得られた金ナノ複合体溶液に対し、1.0×10−3MのGSH溶液を50μL、共存物質としてL−Cys、Hcys、Gly、グルタミン酸のそれぞれ1.0×10−3M溶液を50μL添加した後、実施例1〜4におけるものと同様の条件にて、蛍光スペクトル測定を行った。その後、加熱温度を90℃で30分間、加熱を行った後、4℃で1時間冷却を行い、同様の条件で蛍光スペクトル測定を行った。なお比較対照として、共存物質を添加せず1.0×10−3MのGSH溶液を50μLのみ添加した系も別途調製し、同様の測定を行った。
【0145】
得られた結果を図12に示す。図12に示すように、共存物質の存在下においても、GSHは分子スイッチとして有効に機能することが確認できた。
【特許請求の範囲】
【請求項1】
表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有することを特徴とする金ナノ複合体。
【請求項2】
前記熱応答性高分子が、下記化学式2で表されるポリマーであることを特徴とする請求項1に記載の金ナノ複合体(式中、R1とR2はそれぞれ独立にアルキル基を表す。R3とR4はそれぞれ独立に水素又はメチル基を表す。また、x/yは95/5〜70/30であり、nは1〜4である。)。
【化1】

【請求項3】
前記薬剤が、蛍光物質、生理活性物質又は医薬化合物である、請求項1又は2に記載の金ナノ複合体。
【請求項4】
金ナノ粒子のコロイド溶液に対し、薬剤水溶液、熱応答性高分子溶液の順に添加し、金ナノ粒子に対して先に薬剤を吸着させてから、熱応答性高分子を被覆することを特徴とする金ナノ複合体の製造方法。
【請求項5】
上記請求項1〜3に記載の金ナノ複合体を、チオール類又はシスチンの存在下加熱して使用することを特徴とするドラッグデリバリーシステム薬剤。
【請求項1】
表面に薬剤を吸着した金ナノ粒子と、該金ナノ粒子を被覆してなる熱応答性高分子とを有することを特徴とする金ナノ複合体。
【請求項2】
前記熱応答性高分子が、下記化学式2で表されるポリマーであることを特徴とする請求項1に記載の金ナノ複合体(式中、R1とR2はそれぞれ独立にアルキル基を表す。R3とR4はそれぞれ独立に水素又はメチル基を表す。また、x/yは95/5〜70/30であり、nは1〜4である。)。
【化1】

【請求項3】
前記薬剤が、蛍光物質、生理活性物質又は医薬化合物である、請求項1又は2に記載の金ナノ複合体。
【請求項4】
金ナノ粒子のコロイド溶液に対し、薬剤水溶液、熱応答性高分子溶液の順に添加し、金ナノ粒子に対して先に薬剤を吸着させてから、熱応答性高分子を被覆することを特徴とする金ナノ複合体の製造方法。
【請求項5】
上記請求項1〜3に記載の金ナノ複合体を、チオール類又はシスチンの存在下加熱して使用することを特徴とするドラッグデリバリーシステム薬剤。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公開番号】特開2012−180301(P2012−180301A)
【公開日】平成24年9月20日(2012.9.20)
【国際特許分類】
【出願番号】特願2011−43346(P2011−43346)
【出願日】平成23年2月28日(2011.2.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 刊行物1 ・刊行物名 :東京コンファレンス2010 講演要旨集 ・巻号頁等 :294頁 ・発行年月日:2010年(平成22年)8月31日 ・発行者名 :社団法人 日本分析化学会 刊行物2 ・刊行物名 :日本分析化学会第59年会 講演要旨集 ・巻号頁等 :369頁 ・発行年月日:2010年(平成22年)9月1日 ・発行者名 :社団法人 日本分析化学会
【出願人】(304036743)国立大学法人宇都宮大学 (209)
【Fターム(参考)】
【公開日】平成24年9月20日(2012.9.20)
【国際特許分類】
【出願日】平成23年2月28日(2011.2.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 刊行物1 ・刊行物名 :東京コンファレンス2010 講演要旨集 ・巻号頁等 :294頁 ・発行年月日:2010年(平成22年)8月31日 ・発行者名 :社団法人 日本分析化学会 刊行物2 ・刊行物名 :日本分析化学会第59年会 講演要旨集 ・巻号頁等 :369頁 ・発行年月日:2010年(平成22年)9月1日 ・発行者名 :社団法人 日本分析化学会
【出願人】(304036743)国立大学法人宇都宮大学 (209)
【Fターム(参考)】
[ Back to top ]

