金属の浸出方法
【課題】より容易に低コストで希少金属が回収できるようにする。
【解決手段】作製した混合粉末を粉砕処理する。例えば、ボールミルを用いて粉砕処理を行えばよい。この粉砕処理により、混合粉末中の金属酸化物と還元剤とが、メカノケミカル反応により固相で反応し、金属酸化物が還元される。ボールミルによる粉砕用ボールを用いての回転運動による粉砕処理では、物理的な粉砕処理のみでなく、機械的エネルギーによる化学反応を起こすメカノケミカル反応を起こすことが知られている。この還元により、金属酸化物より金属などの還元体が生成される。
【解決手段】作製した混合粉末を粉砕処理する。例えば、ボールミルを用いて粉砕処理を行えばよい。この粉砕処理により、混合粉末中の金属酸化物と還元剤とが、メカノケミカル反応により固相で反応し、金属酸化物が還元される。ボールミルによる粉砕用ボールを用いての回転運動による粉砕処理では、物理的な粉砕処理のみでなく、機械的エネルギーによる化学反応を起こすメカノケミカル反応を起こすことが知られている。この還元により、金属酸化物より金属などの還元体が生成される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、廃棄された電池などより希少金属を回収する金属の浸出方法に関する。
【背景技術】
【0002】
リチウムイオン二次電池は、携帯電話をはじめとする小型電子機器の電源として急速に用途が広がっており、生産量が急増することが予想される。リチウムイオン二次電池には、リチウム(Li),コバルト(Co),ニッケル(Ni),マンガン(Mn)などの稀少金属が使用されている。しかしながら、これらの金属の回収方法は確立されているとは、言い難いのが現状である。Coは、乾式処理方法によって回収されているが、Liについては乾式処理による回収が困難であるため、再利用されることなく廃棄処理されている。また、Ni,Mnといった遷移金属に関しても、乾式処理では経済的に回収する手段がなく、再利用は、なされていない。
【0003】
リチウムイオン二次電池の生産量の増加に伴い、廃棄されるリチウムイオン二次電池の電極に含まれる稀少金属の、経済的な回収方法の確立が必要となっている。これらの稀少金属を回収する方法としては、溶液に金属を浸出させ、イオン交換樹脂などを用いて溶液中より金属を分離する湿式処理方法が有望視されている。湿式処理方法では、簡便に稀少金属酸化物を溶液に浸出させることが重要である。
【0004】
廃棄されたリチウムイオン二次電池に含まれる稀少金属酸化物には、リチウムイオン二次電池の電極材料であるコバルト酸リチウム(LiCoO2)がある。コバルト酸リチウムは、安定な層状岩塩型構造であるため、従来の湿式処理では、高濃度の塩酸、硫酸、硝酸などの酸に浸出させている。この方法では,高濃度の酸を使用し、更には、過酸化水素などを添加して長時間の加熱処理を行って稀少金属を浸出させた後、中和反応を行い目的に応じた稀少金属を回収している。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2001−115218号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、上述した高濃度の酸を用いた浸出には、長時間の加熱処理、酸の使用および多量の中和剤の使用によるコストの問題がある。このように、多量の薬剤の使用に加え、塩酸を使用した際には塩素ガス、硫酸を用いた際には硫化水素が発生することになり、安全・環境負荷対策としての操業コストも問題となる。また、コバルト酸リチウムの硫酸や硝酸に対する溶解度が小さい事から、これら従来の酸浸出では、Liは浸出できてもCoを十分に浸出させることができなかった。Coに限らず、Ni,Mnといった稀少金属も十分に浸出させることが困難であった。
【0007】
上述した問題に対し、コバルト酸リチウムなどのリチウム遷移金属含有酸化物に含まれている稀少金属を、加熱などの処理を行わず簡易に(十分に)浸出させる方法が種々検討されている。例えば、コバルト酸リチウムにセラミック粉末を加え、遊星ボールミルで粉砕処理することによって浸出率を向上させる技術が提案されている(特許文献1参照)。この技術では、セラミック粉末を添加することで、リチウム遷移金属含有酸化物の結晶構造を破壊し、溶解性を向上させることで浸出率を向上させている。しかしながら、セラミック粉末を加えることによって薬品コストが増加するのみならず、不純物を増やすことになるため、浸出後の工程で悪影響を及ぼすと考えられるなど、実用化し難いものであった。
【0008】
本発明は、以上のような問題点を解消するためになされたものであり、より容易に低コストで希少金属が回収できるようにすることを目的とする。
【課題を解決するための手段】
【0009】
本発明に係る金属の浸出方法は、金属酸化物を含む粉末と還元剤の粉末とを混合して混合粉末を作製する第1工程と、混合粉末をボールミルにより粉砕処理する第2工程と、粉砕処理した混合粉末と酸の水溶液とを混合して金属を水溶液に浸出する第3工程とを少なくとも備える。
【0010】
上記金属の浸出方法において、金属酸化物は、リチウム,コバルト,ニッケル,マンガン,クロム,およびチタンの少なくとも1つの金属から構成されているものであればよい。また、金属酸化物は、リチウムを含む2つ以上の金属から構成されているものであってもよい。例えば、金属酸化物は、コバルト酸リチウムである。
【0011】
上記金属の浸出方法において、酸の水溶液は、6mol/l以下の濃度の硫酸または硝酸であればよい。また、還元剤は、炭素であればよい。なお、還元剤は、電池の電極を構成する炭素であり、金属酸化物は、電池の電極を構成するコバルト酸リチウムとすることができる。この場合、混合粉末と水溶液とを混合して金属を水溶液に浸出した後、水溶液中の炭素を回収して還元剤として再利用することができる。
【発明の効果】
【0012】
以上説明したように、本発明によれば、金属酸化物を含む粉末と還元剤の粉末とを混合した混合粉末をボールミルにより粉砕処理するようにしたので、より容易に低コストで希少金属が回収できるようになるという優れた効果が得られる。
【図面の簡単な説明】
【0013】
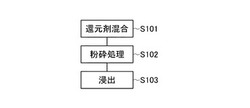
【図1】図1は、本発明の実施の形態における金属の浸出方法を説明するためのフローチャートである。
【図2】図2は、本発明の実施例において実施した実験の方法を説明するためのフローチャートである。
【図3】図3は、浸出結果を示す特性図である。
【発明を実施するための形態】
【0014】
以下、本発明の実施の形態について図を参照して説明する。図1は、本発明の実施の形態における金属の浸出方法を説明するためのフローチャートである。まず、ステップS101で、金属酸化物を含む粉末と還元剤の粉末とを混合して混合粉末を作製する。還元剤は、例えば、炭素であればよい。
【0015】
次に、ステップS102で、作製した混合粉末を粉砕処理する。例えば、ボールミルを用いて粉砕処理を行えばよい。粉砕処理において用いるボールは、ジルコニア製ボール,SUS製ボール,アルミナ製ボール,メノウ製ボールなどを用いればよく、特に制限はない。また、粉砕処理は、大気の雰囲気で行えばよい。例えば、遊星ボールミルを用いる場合、回転速度200〜1500rpm、粉砕処理時間4〜8時間で処理を行えばよい。また、還元剤として炭素を用いる場合、加える炭素粉末の量は、対象の金属酸化物との還元反応における化学量論式から求められる値の2〜10倍の量を加えるとよい。
【0016】
この粉砕処理により、混合粉末中の金属酸化物と還元剤とが、メカノケミカル反応により固相で反応し、金属酸化物が還元される。ボールミルによる粉砕用ボールを用いての回転運動による粉砕処理では、物理的な粉砕処理のみでなく、機械的エネルギーによる化学反応を起こすメカノケミカル反応を起こすことが知られている。この還元により、金属酸化物より金属などの還元体が生成される。
【0017】
次に、ステップS103で、粉砕処理した混合粉末と酸の水溶液とを混合して金属を水溶液中に浸出する。例えば、6mol/l程度の低濃度の硝酸(希硝酸)に、粉砕処理した混合粉末を混合する。上述した粉砕処理により、還元された金属酸化物の還元体は、希硝酸であっても容易に溶解するようになる。
【0018】
このように、本実施の形態によれば、大気中・室温(20〜25℃)程度の環境で、低濃度の酸を用いることで、金属酸化物を含む廃棄物より希少金属の浸出ができるようになる。従って、高濃度の塩酸や硫酸などを用いる必要がなく、中和剤などが不要となり、また、加熱処理も不要となる。この結果、操業コストを大幅に削減することが可能となる。このように、本実施の形態によれば、より容易に低コストで希少金属が回収できるようになる。
【0019】
例えば、本実施の形態により得られた溶液中の稀少金属は、溶媒抽出法、イオン交換法、電解採取法、沈澱法などといった公知の抽出手段を用いることによって、容易にかつ高効率に分離回収することが可能である。また不溶な物質が混入した際にも、ろ過を行うことによって簡易に溶液中の金属との分離回収が可能である。
【0020】
特に、無機還元剤として炭素を用いる場合、これは酸に溶解しないため、余剰の炭素は容易に回収できるため、無機還元剤として再度利用することが容易である。このため、無機還元剤の新規購入量を抑制できることになり、さらにコストを抑制することが可能となる。また、本実施の形態によれば、塩酸を用いる必要がなく、塩素ガスの発生がない状態とすることができる。
【0021】
[実施例]
以下、実施例を用いてより詳細に説明する。まず、実験の方法について、図2を用いて説明する。実験では、コバルト酸リチウムの粉末に3.75:1.25の割合で炭素粉末を混合して混合試料を作製する(ステップS201)。コバルト酸リチウムは、リチウムイオン二次電池の電極材料である。また、炭素粉末としては、よく知られたアセチレンブラックを用いた。上記混合比は、実際に用いられているリチウムイオン二次電池の電極材料の組成に合わせてある。
【0022】
次に、遊星ボールミル(フリッチュ社製premium line P-7)を用いて混合試料を粉砕処理する(ステップS202)。この遊星ボールミルは、2個のジルコニア製の密閉容器(内容量50ml)が、自転および公転することで、容器内の試料を粉砕する。粉砕処理では、ジルコニア製直径15mmの粉砕用ボールを7個用いた。また、ミルの回転速度は700rpm一定とした。
【0023】
次に、粉砕処理が終了したら、上記容器内より混合試料1.33gを採取し(ステップS203)、採取した混合試料を1mol/lの硝酸水溶液50mlに混合し、1時間撹拌する。この撹拌には、マグネチックスターラを用いた。次に、撹拌後の混合溶液を濾過する(ステップS205)。ろ過には、ポアサイズ0.1μmのメンブレンフィルターを用いた。次に、ろ液中のリチウムおよびコバルトの定量を行う(ステップS206)。この定量分析では、よく知られた誘導結合プラズマ質量分析装置(ICP−MS)を用い、浸出率を算出した。
【0024】
以上の実験方法により、ボールミルによる粉砕処理の時間を、60分とした試料1−1,120分とした試料1−2,240分とした試料1−3,480分とした試料1−4を作製し、各々の試料の浸出率を算出した。図3の白四角に示すように、試料1−1は、Coの浸出率が38.4%であり、Liの浸出率は100%であった。また、試料1−2は、Coの浸出率が50%であり、Liの浸出率は100%であった。また、試料1−3は、Coの浸出率が63.2%であり、Liの浸出率は100%であった。また、試料1−4は、Coの浸出率が100%であり、Liの浸出率は100%であった。図3には、Coの浸出率を示している。
【0025】
また、図3には、コバルト酸リチウム1gを1mol/l硝酸50mlに室温で混合し、1時間撹拌を行った後、ポアサイズ0.1μmのメンブレンフィルターでろ過したろ液中に溶解しているCoおよびLiの濃度より、上述同様に浸出率を求めた結果について2−1の黒四角で示している。
【0026】
また、図3には、炭素粉末を用いないCo酸リチウムの粉末からなる単独試料(比較試料:1g)を、上述同様に、ボールミルによる粉砕処理をし、同様の酸処理をしてからろ過したろ液中のリチウムおよびCoの浸出率の結果を黒四角で示している。この比核実験では、ボールミルによる粉砕処理の時間を、60分とした比較試料2−2,120分とした比較試料2−3,240分とした比較試料2−4,480分とした比較試料2−5を作製し、各々の比較試料の浸出率を算出した。
【0027】
図3の黒四角に示すように、比較試料2−1は、Coの浸出率が7.4%であり、Liの浸出率は33.8%であった。また、比較試料2−2は、Coの浸出率が31.8%であり、Liの浸出率は100%であった。また、比較試料2−3は、Coの浸出率が28.1%であり、Liの浸出率は100%であった。また、比較試料2−4は、Coの浸出率が29,6%であり、Liの浸出率は100%であった。また、比較試料2−5は、Coの浸出率が30.6%であり、Liの浸出率は100%であった。
【0028】
上述した実験の結果から明らかなように、炭素を無機還元剤として用いた実施例によれば、室温程度の温度条件で、低濃度の希硝酸に、CoおよびLiを浸出させることができるようになる。
【0029】
以上のように、本発明によれば、稀少金属をリサイクルするプロセスにおいて、高効率かつ低コストで、稀少金属酸化物から稀少金属を水溶液中に浸出させることができ、湿式処理による安全・安価な稀少金属の回収を可能にする。
【0030】
なお、本発明は以上に説明した実施の形態に限定されるものではなく、本発明の技術的思想内で、当分野において通常の知識を有する者により、多くの変形および組み合わせが実施可能であることは明白である。例えば、上述では、炭素を無機還元剤として用いたが、これに限るものではなく、対象となる金属より酸化しやすい物質の粉末を用いるようにしてもよい。例えば、鉄を無機還元剤として用い、鉄の粉末を対象となる金属酸化物を含む粉末と混合してもよい。
【0031】
上述では、硝酸を用いているが、これに限るものではなく、希硫酸を用いるようにしてもよい。いずれの酸の場合についても、濃度が6mol/l以下であれば、本発明による金属の浸出が可能である。また、上述では、主に、CoおよびLiを例に説明したが、これに限るものではなく、金属酸化物は、リチウム,コバルト,ニッケル,マンガン,クロム,およびチタンの少なくとも1つの金属から構成されているものであればよい。また、コバルト酸リチウムに限らず、リチウムを含む2つ以上の金属から構成されていればよい。このような金属酸化物であれば、金属が浸出できるようになる。また、上述した金属であれば、室温程度の温度条件で希硝酸および希硫酸に溶解する。
【技術分野】
【0001】
本発明は、廃棄された電池などより希少金属を回収する金属の浸出方法に関する。
【背景技術】
【0002】
リチウムイオン二次電池は、携帯電話をはじめとする小型電子機器の電源として急速に用途が広がっており、生産量が急増することが予想される。リチウムイオン二次電池には、リチウム(Li),コバルト(Co),ニッケル(Ni),マンガン(Mn)などの稀少金属が使用されている。しかしながら、これらの金属の回収方法は確立されているとは、言い難いのが現状である。Coは、乾式処理方法によって回収されているが、Liについては乾式処理による回収が困難であるため、再利用されることなく廃棄処理されている。また、Ni,Mnといった遷移金属に関しても、乾式処理では経済的に回収する手段がなく、再利用は、なされていない。
【0003】
リチウムイオン二次電池の生産量の増加に伴い、廃棄されるリチウムイオン二次電池の電極に含まれる稀少金属の、経済的な回収方法の確立が必要となっている。これらの稀少金属を回収する方法としては、溶液に金属を浸出させ、イオン交換樹脂などを用いて溶液中より金属を分離する湿式処理方法が有望視されている。湿式処理方法では、簡便に稀少金属酸化物を溶液に浸出させることが重要である。
【0004】
廃棄されたリチウムイオン二次電池に含まれる稀少金属酸化物には、リチウムイオン二次電池の電極材料であるコバルト酸リチウム(LiCoO2)がある。コバルト酸リチウムは、安定な層状岩塩型構造であるため、従来の湿式処理では、高濃度の塩酸、硫酸、硝酸などの酸に浸出させている。この方法では,高濃度の酸を使用し、更には、過酸化水素などを添加して長時間の加熱処理を行って稀少金属を浸出させた後、中和反応を行い目的に応じた稀少金属を回収している。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2001−115218号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、上述した高濃度の酸を用いた浸出には、長時間の加熱処理、酸の使用および多量の中和剤の使用によるコストの問題がある。このように、多量の薬剤の使用に加え、塩酸を使用した際には塩素ガス、硫酸を用いた際には硫化水素が発生することになり、安全・環境負荷対策としての操業コストも問題となる。また、コバルト酸リチウムの硫酸や硝酸に対する溶解度が小さい事から、これら従来の酸浸出では、Liは浸出できてもCoを十分に浸出させることができなかった。Coに限らず、Ni,Mnといった稀少金属も十分に浸出させることが困難であった。
【0007】
上述した問題に対し、コバルト酸リチウムなどのリチウム遷移金属含有酸化物に含まれている稀少金属を、加熱などの処理を行わず簡易に(十分に)浸出させる方法が種々検討されている。例えば、コバルト酸リチウムにセラミック粉末を加え、遊星ボールミルで粉砕処理することによって浸出率を向上させる技術が提案されている(特許文献1参照)。この技術では、セラミック粉末を添加することで、リチウム遷移金属含有酸化物の結晶構造を破壊し、溶解性を向上させることで浸出率を向上させている。しかしながら、セラミック粉末を加えることによって薬品コストが増加するのみならず、不純物を増やすことになるため、浸出後の工程で悪影響を及ぼすと考えられるなど、実用化し難いものであった。
【0008】
本発明は、以上のような問題点を解消するためになされたものであり、より容易に低コストで希少金属が回収できるようにすることを目的とする。
【課題を解決するための手段】
【0009】
本発明に係る金属の浸出方法は、金属酸化物を含む粉末と還元剤の粉末とを混合して混合粉末を作製する第1工程と、混合粉末をボールミルにより粉砕処理する第2工程と、粉砕処理した混合粉末と酸の水溶液とを混合して金属を水溶液に浸出する第3工程とを少なくとも備える。
【0010】
上記金属の浸出方法において、金属酸化物は、リチウム,コバルト,ニッケル,マンガン,クロム,およびチタンの少なくとも1つの金属から構成されているものであればよい。また、金属酸化物は、リチウムを含む2つ以上の金属から構成されているものであってもよい。例えば、金属酸化物は、コバルト酸リチウムである。
【0011】
上記金属の浸出方法において、酸の水溶液は、6mol/l以下の濃度の硫酸または硝酸であればよい。また、還元剤は、炭素であればよい。なお、還元剤は、電池の電極を構成する炭素であり、金属酸化物は、電池の電極を構成するコバルト酸リチウムとすることができる。この場合、混合粉末と水溶液とを混合して金属を水溶液に浸出した後、水溶液中の炭素を回収して還元剤として再利用することができる。
【発明の効果】
【0012】
以上説明したように、本発明によれば、金属酸化物を含む粉末と還元剤の粉末とを混合した混合粉末をボールミルにより粉砕処理するようにしたので、より容易に低コストで希少金属が回収できるようになるという優れた効果が得られる。
【図面の簡単な説明】
【0013】
【図1】図1は、本発明の実施の形態における金属の浸出方法を説明するためのフローチャートである。
【図2】図2は、本発明の実施例において実施した実験の方法を説明するためのフローチャートである。
【図3】図3は、浸出結果を示す特性図である。
【発明を実施するための形態】
【0014】
以下、本発明の実施の形態について図を参照して説明する。図1は、本発明の実施の形態における金属の浸出方法を説明するためのフローチャートである。まず、ステップS101で、金属酸化物を含む粉末と還元剤の粉末とを混合して混合粉末を作製する。還元剤は、例えば、炭素であればよい。
【0015】
次に、ステップS102で、作製した混合粉末を粉砕処理する。例えば、ボールミルを用いて粉砕処理を行えばよい。粉砕処理において用いるボールは、ジルコニア製ボール,SUS製ボール,アルミナ製ボール,メノウ製ボールなどを用いればよく、特に制限はない。また、粉砕処理は、大気の雰囲気で行えばよい。例えば、遊星ボールミルを用いる場合、回転速度200〜1500rpm、粉砕処理時間4〜8時間で処理を行えばよい。また、還元剤として炭素を用いる場合、加える炭素粉末の量は、対象の金属酸化物との還元反応における化学量論式から求められる値の2〜10倍の量を加えるとよい。
【0016】
この粉砕処理により、混合粉末中の金属酸化物と還元剤とが、メカノケミカル反応により固相で反応し、金属酸化物が還元される。ボールミルによる粉砕用ボールを用いての回転運動による粉砕処理では、物理的な粉砕処理のみでなく、機械的エネルギーによる化学反応を起こすメカノケミカル反応を起こすことが知られている。この還元により、金属酸化物より金属などの還元体が生成される。
【0017】
次に、ステップS103で、粉砕処理した混合粉末と酸の水溶液とを混合して金属を水溶液中に浸出する。例えば、6mol/l程度の低濃度の硝酸(希硝酸)に、粉砕処理した混合粉末を混合する。上述した粉砕処理により、還元された金属酸化物の還元体は、希硝酸であっても容易に溶解するようになる。
【0018】
このように、本実施の形態によれば、大気中・室温(20〜25℃)程度の環境で、低濃度の酸を用いることで、金属酸化物を含む廃棄物より希少金属の浸出ができるようになる。従って、高濃度の塩酸や硫酸などを用いる必要がなく、中和剤などが不要となり、また、加熱処理も不要となる。この結果、操業コストを大幅に削減することが可能となる。このように、本実施の形態によれば、より容易に低コストで希少金属が回収できるようになる。
【0019】
例えば、本実施の形態により得られた溶液中の稀少金属は、溶媒抽出法、イオン交換法、電解採取法、沈澱法などといった公知の抽出手段を用いることによって、容易にかつ高効率に分離回収することが可能である。また不溶な物質が混入した際にも、ろ過を行うことによって簡易に溶液中の金属との分離回収が可能である。
【0020】
特に、無機還元剤として炭素を用いる場合、これは酸に溶解しないため、余剰の炭素は容易に回収できるため、無機還元剤として再度利用することが容易である。このため、無機還元剤の新規購入量を抑制できることになり、さらにコストを抑制することが可能となる。また、本実施の形態によれば、塩酸を用いる必要がなく、塩素ガスの発生がない状態とすることができる。
【0021】
[実施例]
以下、実施例を用いてより詳細に説明する。まず、実験の方法について、図2を用いて説明する。実験では、コバルト酸リチウムの粉末に3.75:1.25の割合で炭素粉末を混合して混合試料を作製する(ステップS201)。コバルト酸リチウムは、リチウムイオン二次電池の電極材料である。また、炭素粉末としては、よく知られたアセチレンブラックを用いた。上記混合比は、実際に用いられているリチウムイオン二次電池の電極材料の組成に合わせてある。
【0022】
次に、遊星ボールミル(フリッチュ社製premium line P-7)を用いて混合試料を粉砕処理する(ステップS202)。この遊星ボールミルは、2個のジルコニア製の密閉容器(内容量50ml)が、自転および公転することで、容器内の試料を粉砕する。粉砕処理では、ジルコニア製直径15mmの粉砕用ボールを7個用いた。また、ミルの回転速度は700rpm一定とした。
【0023】
次に、粉砕処理が終了したら、上記容器内より混合試料1.33gを採取し(ステップS203)、採取した混合試料を1mol/lの硝酸水溶液50mlに混合し、1時間撹拌する。この撹拌には、マグネチックスターラを用いた。次に、撹拌後の混合溶液を濾過する(ステップS205)。ろ過には、ポアサイズ0.1μmのメンブレンフィルターを用いた。次に、ろ液中のリチウムおよびコバルトの定量を行う(ステップS206)。この定量分析では、よく知られた誘導結合プラズマ質量分析装置(ICP−MS)を用い、浸出率を算出した。
【0024】
以上の実験方法により、ボールミルによる粉砕処理の時間を、60分とした試料1−1,120分とした試料1−2,240分とした試料1−3,480分とした試料1−4を作製し、各々の試料の浸出率を算出した。図3の白四角に示すように、試料1−1は、Coの浸出率が38.4%であり、Liの浸出率は100%であった。また、試料1−2は、Coの浸出率が50%であり、Liの浸出率は100%であった。また、試料1−3は、Coの浸出率が63.2%であり、Liの浸出率は100%であった。また、試料1−4は、Coの浸出率が100%であり、Liの浸出率は100%であった。図3には、Coの浸出率を示している。
【0025】
また、図3には、コバルト酸リチウム1gを1mol/l硝酸50mlに室温で混合し、1時間撹拌を行った後、ポアサイズ0.1μmのメンブレンフィルターでろ過したろ液中に溶解しているCoおよびLiの濃度より、上述同様に浸出率を求めた結果について2−1の黒四角で示している。
【0026】
また、図3には、炭素粉末を用いないCo酸リチウムの粉末からなる単独試料(比較試料:1g)を、上述同様に、ボールミルによる粉砕処理をし、同様の酸処理をしてからろ過したろ液中のリチウムおよびCoの浸出率の結果を黒四角で示している。この比核実験では、ボールミルによる粉砕処理の時間を、60分とした比較試料2−2,120分とした比較試料2−3,240分とした比較試料2−4,480分とした比較試料2−5を作製し、各々の比較試料の浸出率を算出した。
【0027】
図3の黒四角に示すように、比較試料2−1は、Coの浸出率が7.4%であり、Liの浸出率は33.8%であった。また、比較試料2−2は、Coの浸出率が31.8%であり、Liの浸出率は100%であった。また、比較試料2−3は、Coの浸出率が28.1%であり、Liの浸出率は100%であった。また、比較試料2−4は、Coの浸出率が29,6%であり、Liの浸出率は100%であった。また、比較試料2−5は、Coの浸出率が30.6%であり、Liの浸出率は100%であった。
【0028】
上述した実験の結果から明らかなように、炭素を無機還元剤として用いた実施例によれば、室温程度の温度条件で、低濃度の希硝酸に、CoおよびLiを浸出させることができるようになる。
【0029】
以上のように、本発明によれば、稀少金属をリサイクルするプロセスにおいて、高効率かつ低コストで、稀少金属酸化物から稀少金属を水溶液中に浸出させることができ、湿式処理による安全・安価な稀少金属の回収を可能にする。
【0030】
なお、本発明は以上に説明した実施の形態に限定されるものではなく、本発明の技術的思想内で、当分野において通常の知識を有する者により、多くの変形および組み合わせが実施可能であることは明白である。例えば、上述では、炭素を無機還元剤として用いたが、これに限るものではなく、対象となる金属より酸化しやすい物質の粉末を用いるようにしてもよい。例えば、鉄を無機還元剤として用い、鉄の粉末を対象となる金属酸化物を含む粉末と混合してもよい。
【0031】
上述では、硝酸を用いているが、これに限るものではなく、希硫酸を用いるようにしてもよい。いずれの酸の場合についても、濃度が6mol/l以下であれば、本発明による金属の浸出が可能である。また、上述では、主に、CoおよびLiを例に説明したが、これに限るものではなく、金属酸化物は、リチウム,コバルト,ニッケル,マンガン,クロム,およびチタンの少なくとも1つの金属から構成されているものであればよい。また、コバルト酸リチウムに限らず、リチウムを含む2つ以上の金属から構成されていればよい。このような金属酸化物であれば、金属が浸出できるようになる。また、上述した金属であれば、室温程度の温度条件で希硝酸および希硫酸に溶解する。
【特許請求の範囲】
【請求項1】
金属酸化物を含む粉末と還元剤の粉末とを混合して混合粉末を作製する第1工程と、
前記混合粉末をボールミルにより粉砕処理する第2工程と、
粉砕処理した前記混合粉末と酸の水溶液とを混合して前記金属を前記水溶液に浸出する第3工程と
を少なくとも備えることを特徴とする金属の浸出方法。
【請求項2】
請求項1記載の金属の浸出方法において、
前記金属酸化物は、リチウム,コバルト,ニッケル,マンガン,クロム,およびチタンの少なくとも1つの金属から構成されていることを特徴とする金属の浸出方法。
【請求項3】
請求項2記載の金属の浸出方法において、
前記金属酸化物は、リチウムを含む2つ以上の金属から構成されていることを特徴とする金属の浸出方法。
【請求項4】
請求項3記載の金属の浸出方法において、
前記金属酸化物は、コバルト酸リチウムであることを特徴とする金属の浸出方法。
【請求項5】
請求項1〜4のいずれか1項に記載の金属の浸出方法において、
前記酸の水溶液は、6mol/l以下の濃度の硫酸または硝酸であることを特徴とする金属の浸出方法。
【請求項6】
請求項1〜5のいずれか1項に記載の金属の浸出方法において、
前記還元剤は、炭素であることを特徴とする金属の浸出方法。
【請求項7】
請求項6記載の金属の浸出方法において、
前記還元剤は、電池の電極を構成する炭素であり、前記金属酸化物は、前記電池の電極を構成するコバルト酸リチウムであることを特徴とする金属の浸出方法。
【請求項8】
請求項6または7記載の金属の浸出方法において、
前記混合粉末と前記水溶液とを混合して前記金属を前記水溶液に浸出した後、前記水溶液中の炭素を回収して前記還元剤として再利用することを特徴とする金属の浸出方法。
【請求項1】
金属酸化物を含む粉末と還元剤の粉末とを混合して混合粉末を作製する第1工程と、
前記混合粉末をボールミルにより粉砕処理する第2工程と、
粉砕処理した前記混合粉末と酸の水溶液とを混合して前記金属を前記水溶液に浸出する第3工程と
を少なくとも備えることを特徴とする金属の浸出方法。
【請求項2】
請求項1記載の金属の浸出方法において、
前記金属酸化物は、リチウム,コバルト,ニッケル,マンガン,クロム,およびチタンの少なくとも1つの金属から構成されていることを特徴とする金属の浸出方法。
【請求項3】
請求項2記載の金属の浸出方法において、
前記金属酸化物は、リチウムを含む2つ以上の金属から構成されていることを特徴とする金属の浸出方法。
【請求項4】
請求項3記載の金属の浸出方法において、
前記金属酸化物は、コバルト酸リチウムであることを特徴とする金属の浸出方法。
【請求項5】
請求項1〜4のいずれか1項に記載の金属の浸出方法において、
前記酸の水溶液は、6mol/l以下の濃度の硫酸または硝酸であることを特徴とする金属の浸出方法。
【請求項6】
請求項1〜5のいずれか1項に記載の金属の浸出方法において、
前記還元剤は、炭素であることを特徴とする金属の浸出方法。
【請求項7】
請求項6記載の金属の浸出方法において、
前記還元剤は、電池の電極を構成する炭素であり、前記金属酸化物は、前記電池の電極を構成するコバルト酸リチウムであることを特徴とする金属の浸出方法。
【請求項8】
請求項6または7記載の金属の浸出方法において、
前記混合粉末と前記水溶液とを混合して前記金属を前記水溶液に浸出した後、前記水溶液中の炭素を回収して前記還元剤として再利用することを特徴とする金属の浸出方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−246519(P2012−246519A)
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願番号】特願2011−117727(P2011−117727)
【出願日】平成23年5月26日(2011.5.26)
【出願人】(000004226)日本電信電話株式会社 (13,992)
【Fターム(参考)】
【公開日】平成24年12月13日(2012.12.13)
【国際特許分類】
【出願日】平成23年5月26日(2011.5.26)
【出願人】(000004226)日本電信電話株式会社 (13,992)
【Fターム(参考)】
[ Back to top ]

