金属イオン結合能およびナノチューブ形成能を有する環状ペプチドと、それを用いたペプチドで構成されるナノチューブ、並びにそれらの製造方法。
【課題】規則的な微細構造で中空構造を有するナノメートルスケールのナノチューブを形成する新規環状ペプチドの配列、当該配列を成す物質のナノチューブ形成条件を提供する。
【解決手段】環状ペプチドの環内部に金属イオンを配位させるため、3残基連続して同じ光学異性体が並んだ領域を2つ連続せずに配置し、それ以外のアミノ酸はL−体とD−体が交互に配された配列を持たせることにより、3残基の真ん中のアミノ酸は環内部を向き、その位置に金属イオンと配位結合するHis、Aspなどのアミノ酸を設定するように設計する。環状ペプチドは特定条件下で自己組織化的に会合し、金属イオンを環内部に配位させながらナノチューブを形成するため、ナノチューブ内に一次元的に金属イオンを配列化させることができることで、機能的なナノ素材、ナノ材料へ応用が可能である。
【解決手段】環状ペプチドの環内部に金属イオンを配位させるため、3残基連続して同じ光学異性体が並んだ領域を2つ連続せずに配置し、それ以外のアミノ酸はL−体とD−体が交互に配された配列を持たせることにより、3残基の真ん中のアミノ酸は環内部を向き、その位置に金属イオンと配位結合するHis、Aspなどのアミノ酸を設定するように設計する。環状ペプチドは特定条件下で自己組織化的に会合し、金属イオンを環内部に配位させながらナノチューブを形成するため、ナノチューブ内に一次元的に金属イオンを配列化させることができることで、機能的なナノ素材、ナノ材料へ応用が可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、金属イオンと結合する単位分子の環状ペプチドと、それらの環状ペプチドが連結することで形成されるナノスケールの中空繊維(本明細書中では、ナノチューブと称する)のナノ素材の技術に関するものである。
【背景技術】
【0002】
これまで大きな物質を削ってナノメートルスケールにまで微細化していく「トップダウン」型アプローチを用いて、半導体素子や大規模集積回路(LSI)を作製する技術開発が盛んに行われてきた。しかしながらその技術にも限界があり、20nm以下の微細構造を作ることが困難となっている。
そこで近年、分子の自己組織化を利用し、規則的な微細構造を作り上げる研究が急速に進展している。このような自己組織化を利用した「ボトムアップ」型アプローチを模倣する代表的な例として生物の細胞があり、これをモデルシステムとした生体分子による新規材料開発の研究が大変注目を集めている。
【0003】
生体を作るタンパク質や核酸などの生体分子で材料を作る利点としては、外部からエネルギーを加えることなく自己組織化的に材料が構築されることから無駄のない製造システムであること、そして物質自体が生分解性であることなどが挙げられ、地球環境や生物に対して負荷が少ないといえる。
特にタンパク質は、構成する天然アミノ酸(L−体アミノ酸)の種類が20種類存在するため、形成される構造や機能は多種多様である。
さらに化学合成法を利用した場合は、タンパク質配列中に非天然アミノ酸やL−体アミノ酸の鏡像異性体であるD−体アミノ酸を導入することも可能となり、タンパク質を利用したナノテクノロジーは、今後様々な分野において重要になってくると考えられる。
【0004】
生体高分子であるタンパク質は、20種類の天然アミノ酸(L−体アミノ酸、比較的単純な有機分子)から構成され、アミノ酸の中には金属イオンと配位結合するものが存在する。
金属イオンと配位することが可能なアミノ酸としては、ヒスチジン、システイン、アスパラギン酸、グルタミン酸などがそうであり、実際にある種のタンパク質はこれらのアミノ酸を利用し、種々の金属イオンと配位結合することで細胞内において機能を果たしている。
近年、有機材料と無機材料を組み合わせた機能性複合新素材の開発や応用の研究が盛んに行われているが、タンパク質と無機材料とのハイブリッド材料の構築には金属イオンと配位するアミノ酸を用いることが重要であり、タンパク質の構造や機能の多様性を考慮すると、これまでにない新しいハイブリッド材料の創出が期待される。
【0005】
またタンパク質の立体構造は、主に比較的規則的な二次構造から構成されており、その主なものはαヘリックス構造、及びβシート構造である。
αヘリックス構造は、配列中の連続した領域でアミノ酸残基nのCOとアミノ酸残基n+4のNHがそれぞれ水素結合(αヘリックス型水素結合)することで形成される。
またβシート構造は、隣り合うβストランドと呼ばれるほとんど伸びきった領域間で、αヘリックスと同様に向かい合ったアミノ酸残基のCO(NH)とNH(CO)が水素結合(平行、または逆平行βシート型水素結合)形成することにより、二次構造となり安定化している。
このような二次構造を基本ブロックとして、タンパク質分子同士が相互作用することが知られている。例えば、筋肉を構成するミオシン、狂牛病などの原因と思われるアミロイド線維など、ナノメートルスケールの規則的な繊維状超分子構造を形成することが知られている。
【0006】
これまでアミロイド線維を形成するタンパク質に、システイン残基を利用して金コロイドを化学修飾し、さらに金または銀でメッキすることで、導電性ナノワイヤーを作製する手法が知られている(例えば、非特許文献1。)。
また、連続したヒスチジン残基を有するペプチド様高分子から形成されるナノチューブに金属イオンを配位させ、還元剤で還元することでナノワイヤーを作製する手法が知られている(例えば、非特許文献2。)。
これらの手法は、どちらの手法も繊維状構造体の表面を金属で被覆するためにワイヤーの直径が数百ナノメートルと太くなり、従来の微細加工技術よりも優れた新技術とはいい難い。
【0007】
またDNAを構成するヌクレオチドの塩基部分を有機化学合成で金属イオンと配位可能な塩基に改良し、ニ本鎖DNA内部に最大5個の銅イオンを配列させた例が報告されている(例えば、非特許文献3。)。しかしながら、5個以上の金属イオンを一次元的に配列させることはできていない。
【0008】
昨今の半導体プロセス技術の動向をみると、半導体内機能素子間の配線において、その配線の幅はますます小さなものが要求されている。また金属錯体の性質をハイブリッドした新しい機能性物質の開発も盛んに行われているが、生体分子と無機材料を融合したハイブリッド材料の構築は、工業的または産業的利用が期待されるにもかかわらず、いまだ確立されていないのが現状である。
【0009】
【非特許文献1】Scheibel, T. et. al. (2003) Proc. Natl. Acad. Sci. USA 100, 4527-4532.
【非特許文献2】Banerjee, I. A. et. al. (2003) Proc. Natl. Acad. Sci. USA 100, 14678-14682.
【非特許文献3】Tanaka, K. et. al. (2003) Science 299, 1212-1213.
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明が解決しようとする課題は、規則的な微細構造で中空構造を有するナノメートルスケールのナノチューブを提供することである。また、当該ナノチューブに様々な特性・機能を持たせるために金属イオンをナノチューブ内部に配列化することである。
【0011】
そのために、ペプチドで構成されるナノチューブの内部に金属イオンを配列することが可能で、かつ、幅数ナノメートルから十数ナノメートル、さらには長さ数マイクロメートル規模のナノチューブを自己組織化的に形成させるための新規な環状ペプチドの配列を同定すること、また、当該配列を成す環状ペプチドのナノチューブ形成条件を確立すること、及び環状ペプチドの環内部に金属イオンを配位させることが可能なナノチューブの形成条件を確立させることが本発明の目的とするところである。
【課題を解決するための手段】
【0012】
本発明者らは、ペプチドに関して鋭意研究を行い、実験を繰り返し行った結果、12残基のアミノ酸で構成された環状ペプチドを常温常圧下で中性付近(pH6〜pH8)の水溶媒もしくは水/アルコール混合溶媒中で自己組織化させることにより、幅数ナノメートルから十数ナノメートル、長さ数マイクロメートルに至るナノチューブが形成されること、また環状ペプチドの環内部に向いている2つのアミノ酸側鎖に金属イオンが配位結合されること、かつ自己組織化的にナノチューブが形成されることの知見を得て、本発明を完成した。
【0013】
前述の課題を達成するために、本発明の第1の観点に係る環状ペプチドは、n残基(nは8,12,16,20,24)のアミノ酸から構成され、1残基目のN末端とn残基目のC末端がペプチド結合した環状ペプチドにおいて、
3残基のアミノ酸が連続してL−体もしくはD−体である連続領域が少なくとも2つ存在し、かつ、前記連続領域が隣接すること無く配された配列で、
それ以外のアミノ酸はL−体とD−体が交互に配された配列からなり、
3残基のアミノ酸が連続した前記連続領域では真ん中のアミノ酸残基の側鎖のみ環状ペプチドの環内部を向き、L−体とD−体が交互に配されたアミノ酸残基の側鎖は全て環状ペプチドの環外部を向く構造を形成していることを特徴とする。
【0014】
ここで、上記の本発明の第1の観点に係る12残基の環状ペプチドの配列において、1つ目の3残基のアミノ酸が連続した前記連続領域の最初のアミノ酸を1番目として、
X1-His(またはCys)-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11
と示される配列からなり、
(X2、X3、X4、X5)と(X8、X9、X10、Y11)の組合せで、
それぞれ側鎖に同じ電荷を有するアミノ酸(Asp、Glu、Lys、Arg)の中から選択されたもの)が配され、
かつ、互いの組合せが逆の電荷になるように配されていることが好ましい。
【0015】
また、上記の環状ペプチドにおいて、更に、 X1とX6のそれぞれに、Gln,Asn若しくはTyrが配され、
及び/又は、
X7にHis, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸が配されていることが好ましい。
【0016】
上記の12残基の環状ペプチドのアミノ酸配列は、具体的には、Gln(L体)-His(L体)-Glu(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Gln(L体)-Asp(L体)-Lys(L体)-Lys(D体)-Lys(L体)-Lys(D体)(配列番号1)で示される。
【0017】
本発明の第1の観点に係る12残基の環状ペプチドの配列において、1つ目の3残基のアミノ酸が連続した前記連続領域の最初のアミノ酸を1番目として、
Y1-Y2-Y3-Y4-Y5-Y6-Y7-His(またはCys)-Y8-Y9-Y10-Y11
と示される配列からなり、
(Y1、Y9、Y10、Y11)と(Y4、Y5、Y6、Y7)の組合せで、
それぞれ側鎖に同じ電荷を有するアミノ酸(Asp、Glu、Lys、Arg)の中から選択されたもの)が配され、
かつ、互いの組合せが逆の電荷になるように配されていることが好ましい。
【0018】
また、上記の環状ペプチドにおいて、さらに、
Y3とY8のそれぞれに、Gln,Asn若しくはTyrが配され、
及び/又は、
Y2にHis, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸が配されていることが好ましい。
【0019】
上記の12残基の環状ペプチドのアミノ酸配列は、具体的には、Lys(L体)-Asp(L体)-Gln(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Glu(L体)-His(L体)-Gln(L体)-Lys(D体)-Lys(L体)-Lys(D体)(配列番号2)で示される。
【0020】
また、本発明の第2の観点の環状ペプチドは、前述の第1の観点の環状ペプチドにおいて、金属イオンが環内部に向いているアミノ酸側鎖と配位結合されていることを特徴とする。
【0021】
ここで、金属イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることが好ましい。また、この金属イオンは、2価の銅イオンであることが更に好ましい。
【0022】
また、本発明の第3の観点からは、前述の第1の観点の環状ペプチドを用いて自己組織化によりナノスケールオーダの径を有する管状構造を形成させたことを特徴とするナノチューブが提供される。
【0023】
上述した如く、本発明に係る環状ペプチドは、n残基(nは8,12,16,20,24)のアミノ酸から構成され、1残基目のN末端と8残基目のC末端、または1残基目のN末端と12残基目のC末端がペプチド結合を形成し、直鎖状の構造ではなく、環状のペプチド構造となっていることが特徴である。また3残基が連続してL体またはD体アミノ酸である領域が2つ連続せずに存在し、それ以外のアミノ酸はL体及びD体アミノ酸が交互に配された配列からなることを特徴とする(図1を参照)。
このようにアミノ酸の光学異性体を上手く配置することで、同種の光学異性体が3残基連続した領域では真ん中のアミノ酸残基側鎖のみ環状ペプチドの環内部を向くことになり、また交互に光学異性体が配置している領域はアミノ酸残基側鎖が全て環外部を向くという特徴的な環状構造を形成する。
【0024】
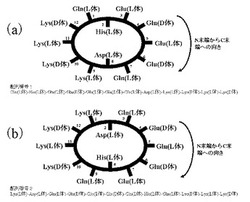
金属イオンを環状ペプチドの環内部に配位させるための、かつ環状ペプチドが自己組織化的にナノチューブを形成するような配列は、図2(a)に示すように、1つ目のL体またはD体アミノ酸が3残基連続した領域の最初のアミノ酸を1番目としてX1-His(またはCys)-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11と示される配列のうち、X2、X3、X4、X5とX8、X9、X10、X11の組み合わせで側鎖に同じ電荷をもつアミノ酸(Asp、Glu、Lys、Arg)で、かつ互いが逆の電荷になるように配置する。さらに溶解度を高めるためとペプチド濃度を吸光度により測定するためにX1とX6にGlnまたはAsnまたはTyrを配し、X7には金属イオンを配位するために、His, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸を配置させる。なお、好ましくは、X7には、AspまたはGluまたはHisを配置させるのがよい。
【0025】
また同様に図2(b)に示すように、1つ目のL体またはD体アミノ酸が3残基連続した領域の最初のアミノ酸を1番目としてY1-Y2-Y3-Y4-Y5-Y6-Y7-His(またはCys)-Y8-Y9-Y10-Y11と示される配列のうち、Y1、Y9、Y10、Y11とY4、Y5、Y6、Y7の組み合わせで側鎖に同じ電荷をもつアミノ酸(Asp、Glu、Lys、Arg)で、かつ互いが逆の電荷になるように配置する。さらに溶解度を高めるためとペプチド濃度を吸光度により測定するためにY3とY8にGlnまたはAsnまたはTyrを配し、Y2には金属イオンを配位するために、His, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸を配置させる。なお、好ましくは、Y2には、AspまたはGluまたはHisを配置させるのがよい。
【0026】
具体的には、図3(a)(b)に示すように、1つ目のL−体アミノ酸が3残基連続した領域の最初のアミノ酸を1番目として、以下の1),2)の配列番号の配列の環状ペプチドである。
1)配列番号1(以下、略称名:cyclic p-Aを用いる。)
Gln(L体)-His(L体)-Glu(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Gln(L体)-Asp(L体)-Lys(L体)-Lys(D体)-Lys(L体)-Lys(D体)
2)配列番号2(以下、略称名:cyclic p-Bを用いる。)
Lys(L体)-Asp(L体)-Gln(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Glu(L体)-His(L体)-Gln(L体)-Lys(D体)-Lys(L体)-Lys(D体)
【0027】
この環状ペプチドでは、L体アミノ酸が3残基連続する領域が2領域存在し、配列番号1ではAsp(L体)とHis(L体)が、配列番号2ではHis(L体)とAsp(L体)がそれぞれ環状ペプチドの環内部に側鎖が向いており、それ以外のアミノ酸側鎖は環外部に向いた構造をとっている。
それぞれの環状ペプチドの配列において、環内部に向いているアミノ酸残基はHis(L体)とAsp(L体)であるが、これらはL体やD体の光学異性体に限らず金属イオンと配位結合をすることが知られており、特にHis残基が強く特異的に金属イオンと配位結合することから、His残基側鎖を環内部に向けさせることが重要である。
このように設計された環状ペプチドは1個の金属イオン(特異的に2価の銅イオン)を配位結合で環内部にトラップすることが可能となる。実際に本発明に係る環状ペプチド配列は環内部に金属イオンを配位し、トラップしていることが確認されており、人工設計による環状ペプチドでは世界初である。
【0028】
また、配列番号1と配列番号2の環状ペプチドは、それぞれ単独でも、かつ互いを混合しても、ある特定の溶媒条件に静置しておくだけで自己組織化的にナノチューブを形成することが可能である。一般的にタンパク質の立体構造はαヘリックス構造やβシート構造を呼ばれる二次構造が組み合わされて形成しており、配列番号1単独でも、また配列番号2単独でも、さらに両配列を混合しても、平行型または逆平行型βシート構造の水素結合を形成し、ナノチューブを形成するように設計されていることが特徴である。
【0029】
しかし、配列番号1や配列番号2のアミノ酸配列では、アミノ酸側鎖の立体障害や静電相互作用を考慮すると、配列番号1単独または配列番号2単独でナノチューブを形成する場合は平行型βシート構造、両配列を混合した場合でナノチューブを形成する場合は逆平行型βシート構造がエネルギー的に安定であると考えられる。
【0030】
さらにナノチューブ形成条件下で金属イオンを共存させておくと、環状ペプチドは金属イオンを環内部に配位させ、かつナノチューブを形成することができる。こうすることで1個の金属イオンをナノチューブ内に約5Å間隔で一次元的に配列させることが可能となる。本発明は人工環状ペプチドが金属イオンと配位し、かつナノチューブを形成し、金属イオンをチューブ内に配列させた最初の報告例である。
【発明の効果】
【0031】
本発明に係るナノチューブを形成する環状ペプチドは、光学異性体であるL体及びD体アミノ酸の並びを設計することにより、金属イオンと配位結合する特定のアミノ酸を環内部に配向させ、特定の金属イオンを配位させることができるという効果を有する。
また、溶媒をある特定の条件にすることで、環状ペプチドが自己組織化的にナノチューブを形成すること、また金属イオンをナノチューブ内に一次元的に配列させることができるという特徴を有している。
これらのナノチューブを構成する環状ペプチドは、金属イオンと配位結合する特殊なアミノ酸を新たに開発・合成しなくても天然に存在するアミノ酸が利用でき、従来の固相合成により容易に高収率で得ることができるという特徴を有している。
【0032】
また、これらのナノチューブは、中性付近(pH6〜pH8)の水溶液と0%<濃度<90%のアルコール濃度の混合溶液中で、常温常圧下でペプチドの自己組織化能力を利用して製造されるため、エネルギーの添加が不要なことや環境負荷が少ないという効果を有する。
【0033】
さらに金属イオンをナノチューブ内に一次元的に配列化できることから、還元剤を用いて還元することによりペプチドという絶縁体にコートされた極細の導電性ワイヤーや、金属イオンの特性を利用した高分子磁性体などの分子デバイスを作ることができるという効果を有する。
【発明を実施するための最良の形態】
【0034】
以下、本発明のナノチューブを形成する環状ペプチドの作製方法、及び環状ペプチド内部への金属イオンの配位とナノチューブの形成について、図面を参照しつつ、最良の形態を詳細に説明する。ただし、本発明の技術的範囲は以下の実施例に示した具体的な用途や形状・寸法などには限定されるものではない。
【実施例1】
【0035】
[ペプチド合成]
配列番号1及び配列番号2の環状ペプチドの合成は、固相合成法に基づきペプチド合成機(peptide synthesis system, Pioneer ; Applied Biosystems)で行った。固相合成で用いた支持体レジンはPAL-PEG-PS樹脂(Applied Biosystems)で、Nα−アミノ基の保護に9-fluorenylmethoxycarbonyl(Fmoc)保護基が付加されており、ヒスチジン残基、(C末端でない)グルタミン残基の側鎖にtrityl(Trt)保護基、アスパラギン酸残基、グルタミン酸残基(L−体、D−体)の側鎖にt-butoxy(OtBu)保護基、リジン残基(L−体、D−体)側鎖にt-butoxycarbonyl(tBoc)保護基がそれぞれ付加されたアミノ酸を使用し、C末端のアミノ酸にglutamic acid 1-allyl esterを用いた。
【0036】
このグルタミン酸残基側鎖に支持体レジンがカップリングし、脱保護反応の際に支持体レジンが取り除かれてグルタミン残基となる。これらのアミノ酸(ペプチド研究所)がアミノ酸のカップリングに使用され、カップリング試薬としてN-[(Dimethylamino)-1H-1,2,3-triazole[4,5-6]pyridine-1-ylmethylene]-N-meth-ylmet-hanaminium hexafluorophosphate N-oxide(HATU)(Applied Biosystems)を用いた。
環状化にはAllyl基を脱保護するためTetrakis (triphenylphosphine) palladium(Fluka)を触媒に混合溶液(5% Acetic acid(nacalai tesque)、 2.5% 4-Methylmorpholine(NMM) (Fluka)、Chloroform(Fluka))を、また活性剤として7-Azobenzotriazol-1-yloxytris (pyrrolidino) phosphonium-hexafluorophosphate (PyAOP) (Applied Biosystems)を使用した。
【0037】
ペプチド保護基の脱保護反応は、混合溶液A(0.25ml エタンジチオール(EDT)、0.25ml 精製水、9.5ml トリフルオロ酢酸(TFA))中で1時間半かけて室温で行った。その後、脱保護されたペプチドはt-butyl methyl ether (MTBE)で抽出し、遠心回収後、真空乾燥により得た。
【0038】
ペプチドの精製はDevelosil ODS column (Nomura Chemical)を用いてreverse-phase high-pressure liquid chromatography(RP-HPLC,日立製作所製)によって行った。
流速は10ml/minで、溶出の際のグラジエントは溶離液Bの濃度を20分で5%から20%に変化させて行った。使用した溶離液Aは精製水(0.1% TFA)、溶離液Bはアセトニトリル(0.1% TFA)である。HPLCによって精製されたペプチドの確認は、マトリックス支援レーザー脱離イオン化(matrix-assisted laser desorption ionization ; MALDI)法を用いて飛行時間型質量分析機(AXIMA-CFR,島津製作所製)で行った。
【0039】
[環状ペプチドによるナノチューブ形成反応]
環状ペプチドを秤量し、精製水を加え溶かしてこれを1mMのペプチドストック溶液とし、またCuCl2・2H2Oを秤量し、精製水を加え溶かして1mMのCu2+ ストック溶液とする。さらに2-[4-(2-Hydroxy-ethyl)-1-piperazinyl]ethanesulfonic acid(HEPES)緩衝液(pH7.5)を調整する。ペプチドストック溶液からそれぞれ一定量分取し、HEPES緩衝液、Cu2+ストック溶液とMethanolを加えて、ペプチド濃度がそれぞれ50μM、Cu2+濃度が50μM、Methanol濃度が55%または75%になるよう調製し、ナノチューブ形成反応を開始した。
【0040】
[円ニ色性(CD)分光測定]
環状ペプチド溶液を約200ml分取し、それを光路長0.1cmの円筒型石英セルに入れ、250nm〜190nmの遠紫外領域のCD(Jasco J-720 spectropolarimeter、日本分光)測定を行った。
【0041】
[蛍光光度計を用いたチオフラビンT結合アッセイ]
13μlの各環状ペプチド試料、35μl の200μMチオフラビンTストック溶液、652μlの 50mMリン酸緩衝溶液(pH7.0)を素早く混合し、全溶液(700μl)を蛍光測定用石英セルに入れた後、蛍光光度計(Jasco FP-6500 spectrofluorometer,日本分光製)にセットして10秒間の蛍光強度の時間変化を測定した。測定時の励起光波長は450nm、蛍光波長は485nmである。
【0042】
[原子間力顕微鏡(AFM)による観察]
各試料から2μl分取し、それを雲母基板(約1cm四方)上へ滴下し、約1分間吸着させた。その後、基板洗浄のためにマイクロピペットを用いて50μl精製水を傾けた基板の上端から滴下し、これを2回行った後、室温にて完全に乾燥させ、AFM(SPM-9500J2,島津製作所製)観察を行った。
【0043】
[核磁気共鳴(NMR)測定]
測定に用いる溶媒として、90%H2O/10%D2O、100%D2O、および45%D2O/55%CD3ODの3種類を用意し、それぞれ5mM Tris-d11・HCl、0.173mM TSP-d4溶液となるように調整し、さらに、cyclic p-Aおよびcyclic p-Bが77μM、cyclic p-Aのみが154μM、またはcyclic p-Bのみが154μMとなるように調整した。測定試料として、調整溶液400μlまたは500μlをWILMAD社製標準試料管に挿入したものを用意した。測定はBruker社製NMR分光器、DMX-750を用いて25℃で行い、1Hの周波数が750.03MHzとなるようにチューニングした。各測定において、スペクトル幅を10000Hz、FID取り込み時間を1.64秒に設定し、積算を512回行った。90%H20/10%D2O溶液の場合は、FIDを取り込む直前にwatergateパルスシーケンスを用いて溶媒であるH2O由来のシグナルを抑えた。各スペクトルの化学シフトは、TSP-d4由来ピークのピークトップが0ppmとなるように補正した。
【実施例2】
【0044】
[cyclic p-Aとcyclic p-Bの混合によるナノチューブ形成条件の決定]
cyclic p-Aとcyclic p-Bを混合した時のナノチューブ形成条件をCDとチオフラビンT結合アッセイで評価した。これまでに報告されている環状ペプチドから成るナノチューブは、環状ペプチド同士の主鎖間でβシート型水素結合を形成していることが確認されていることから、CDスペクトルが時間経過とともに典型的なβシート構造のスペクトルに転移すると予想される。またナノチューブの構造がβシート構造だとすると、同様の構造を有するアミロイド線維と同じ性質を持つと考えられ、アミロイド線維に特異的に結合するチオフラビンTにも同様に結合し、ナノチューブ形成と同時に485nmのチオフラビンTの蛍光強度が増加することが予想される。
【0045】
図4(a)は、各時間における217nmのCD強度のメタノール濃度依存性を示したものである。一般的にβシート構造のCDスペクトルは、約217nmで負の極大を示す。図4(a)から、日にちが経つとともに40%〜65%の領域のメタノール濃度において217nmのCD強度が負に増加し、50%前後で極小値をとっていることが分かる。これは、40%〜65%メタノール濃度領域においてcyclic p-Aとcyclic p-Bはβシート構造へ構造転移していることを示している。
【0046】
また図4(b)は各時間におけるチオフラビンTの蛍光強度のメタノール濃度依存性を示したものであるが、一日後には40%〜90%メタノール濃度において485nmの蛍光強度が増加し、その後はほとんど蛍光強度の変化がないことが確認できる。また、75%前後のメタノール濃度でもっとも蛍光強度が増加している。これは、40%〜90%メタノール濃度領域においてアミロイド線維と同様のβシート構造を形成していることと、75%前後のメタノール濃度でもっとも多くのチオフラビンTが凝集体に結合していることを示している。しかしながら、CD測定から得られたもっともβシート構造に転移するメタノール濃度(50%前後)と蛍光測定から得られたメタノール濃度(75%前後)は、大きく異なっている。そこで溶液内にどのような凝集体形成されているか確認するため、7日後の試料溶液を全てAFMで観察した(図5を参照)。
【0047】
その結果、0%<濃度<40%のメタノール濃度領域ではごく小さな繊維状凝集体が確認でき、40%〜65%のメタノール濃度領域では長さが5μm前後の太い繊維、65%以上のメタノール濃度では長さが5μm前後の細い繊維が確認された。これらのことから、75%前後のメタノール濃度で形成した細い繊維は、さらに繊維同士でより合わさることがないため、その分チオフラビンTが結合可能な繊維表面が多く存在し、多くのチオフラビンTが結合する結果、蛍光強度を増加させたと考えられる。また、50%前後のメタノール濃度で形成した太い繊維は、細い繊維同士がより合わさって会合しやすく、すぐに太い繊維を形成するため、チオフラビンTの結合表面が減少し、CDの結果からもっとβシート構造をとっているにもかかわらず、蛍光強度が低く出ていると考えられる。以上のCD、蛍光、AFM測定の結果から、cyclic p-Aとcyclic p-Bを混合した時のナノチューブ形成条件は中性付近(pH6〜8)の水溶液と0%<濃度<90%のメタノールとの混合溶液であり、その中でも長く太いナノチューブは40%〜65%前後のメタノール濃度、長くて細いナノチューブは65%以上のメタノール濃度である。また、メタノール濃度0%では繊維状の凝集体は形成しないことが確認できた。
【0048】
[ナノチューブ形成におけるアルコール効果]
さらに、cyclic p-Aとcyclic p-Bを混合した時のナノチューブが、メタノール以外のアルコールでも形成されるかどうか、チオフラビンT結合アッセイで評価した。アルコールをプロパノールにし、各時間におけるチオフラビンTの蛍光強度のプロパノール濃度依存性を調べた結果を図6に示す。メタノールの時と同様に一日後には30%〜90%メタノール濃度において485nmの蛍光強度が増加し、その後はほとんど蛍光強度の変化がないことが確認できる。これはプロパノールでもアミロイド線維様の構造が形成されていることを示しており、βシート構造を形成しながらナノチューブが形成していると考えられる。AFMでもメタノールの時と同じような形態のナノチューブが観察されている。したがって、メタノールよりも比誘電率が低いプロパノールでも0%<濃度<90%の濃度範囲でナノチューブ形成が確認されていることから、メタノールとプロパノールの中間の比誘電率をもつエタノールでも同様のアルコール濃度範囲でナノチューブが形成されることは想定でき、ナノチューブ形成条件は常温常圧下で、中性付近(pH6〜pH8)の水溶液とアルコール(メタノール、エタノール、プロパノール)濃度が0%<濃度<90%の領域における混合溶液であると言える。
【0049】
[cyclic p-A、cyclic p-Bへの金属イオンの配位]
cyclic p-A、cyclic p-Bが各種遷移金属イオンと配結合をするかどうか、ナノチューブを形成しない条件(アルコール0%)で、金属イオンの滴定実験を行った。添加する遷移金属イオンは、Cu2+、Zn2+、Cd2+、Co2+、Ni2+である。cyclic p-A、cyclic p-BにはそれぞれHisとAspの2つの配位子しか存在せず、もし遷移金属イオンが環状ペプチドと配位結合するならば、cyclic p-A1分子とcyclic p-B1分子で金属イオンを挟み込んだ形になることがもっとも安定であると考えられる。
その結果、cyclic p-Aとcyclic p-Bは金属イオンを介してお互いが近くなり、βシート構造を形成すると考えられるため、CDで変化を追跡した。その結果を図7に示す。
【0050】
図7(a)はCu2+滴定実験の結果を示しており、Cu2+濃度が増加するとともにβシート構造のスペクトルに転移していることが分かる。
図7(b)は217nmのCD強度をCu2+濃度に対してプロットした滴定曲線であるが、Cu2+濃度〜50μM付近で変化がなくなっていることが確認できる。cyclic p-Aとcyclic p-Bの濃度は50μMずつなので、化学量論は大体cyclic p-A:cyclic p-B:Cu2+=1:1:1である。この結果からcyclic p-A、cyclic p-BはCu2+と配位結合していると考えられる。
【0051】
同様にZn2+で滴定した結果を図7(c)に示すが、Cu2+とは異なりZn2+濃度が増加してもβシート構造へは転移せず、ランダムコイル様のCDスペクトルで変化がないことが分かる。またCd2+(図7(d))、Co2+(図7(e))、Ni2+(図7(f))でもZn2+と同様の結果を得ているため、Cu2+以外の遷移金属はcyclic p-A、cyclic p-Bとは配位結合していないと考えられる。
【0052】
Cu2+は配位子と平面四配位をもっとも安定に形成し、Zn2+、Cd2+は正四面体配位、Co2+、Ni2+は正八面体配位(配位子によっては正四面体配位)を形成することが知られている。静電相互作用、立体障害、歪みの少ない主鎖の安定な水素結合により、cyclic p-Aとcyclic p-Bは逆平行βシート構造を形成すると考えられ、この構造を形成した場合、遷移金属イオンの配位子となりうる2つのHis、2つのAspは平面四角形のそれぞれ頂点に位置する。このことから、Cu2+がもっとも環状ペプチドに配位しやすいと考えられ、金属イオンの特異的選択性を生み出していると思われる。また逆にCu2+しかcyclic p-A、cyclic p-Bに配位しないことから、設計通りにcyclic p-Aとcyclic p-Bが金属イオンを介してお互いが近くなりβシート構造を形成していると推測できる。
【0053】
[Cu2+が配位する残基のNMRによる同定]
これまでの実験結果から、cyclic p-A、cyclic p-BとCu2+が配位結合していることが確認できたが、実際にHisとAspにCu2+が結合しているかどうか、NMRを用いてアミノ酸残基レベルで確認を行った。77μMのcyclic p-A、77μMのcyclic p-Bを混合し、Cu2+が0、3.5、7、30、70μMになるように調整した溶液の一次元NMRを図8に示す。低磁場領域で見られる6.87ppmと7.05ppmの2つの鋭いピークはcyclic p-A、cyclic p-BのHisのδH、7.75ppmと7.81ppm付近の2つの鋭いピークはcyclic p-A、cyclic p-BのHisのεHであるが、Cu2+が3.5μM入るとそれらのピークは著しく減少し、30μM以上ではHisのピークは消失している。また高磁場側で見られる2.45〜2.8ppmのピークはAspのβH 、3.05〜3.2ppmのピークはHisのβHであるが、これらのピークも同様にCu2+濃度の増加とともに各ピークは消失している。
【0054】
しかしながら7.6ppm付近のGln、Lysに由来するピーク、及び8.0〜8.8ppmのアミドプロトンのピークは、Cu2+濃度が増加してもCu2+によるピークの幅広化(ブロードニング)が起こっているだけでピークの消失はない。同様に高磁場側でも、1.6ppm〜2.4ppmのLysのβHやδH、Gln及びGluのβHやγHのピーク、そして3.0ppm付近のLysのεHのピークもブロードニングするだけでピークの消失はない。Cu2+は常磁性であるために環状ペプチドと相互作用していなくてもNMRスペクトルは著しくブロードニングを起こすが、ある残基と相互作用する場合は、その残基のピークが他の残基と比べて距離が近いために極度にブロードニングを起こし、ピークの消失を引き起こす。このことから、設計通りにCu2+は特異的にHisとAspに結合していることが分かる。またHisやAspが環状ペプチドの環の外を向いているとすると、同じように外を向いている他のアミノ酸ともCu2+との距離が近くなるため、他のアミノ酸のピークも消失するはずであるが、それが見られないため、HisとAspの側鎖は環状ペプチドの環内部を向いていると考えられる。
【0055】
次にcyclic p-A単独、cyclic p-B単独でもCu2+と配位結合するかどうか、同様に一次元NMR測定を行った。図9にcyclic p-A単独(図9(a))の時とcyclic p-B単独(図9(b))の時の結果を示す。cyclic p-A単独では2.6ppm〜2.8ppmのAspのβH、3.05ppm〜3.2ppmのHisのβH、6.85ppmのHisのδH、そして7.75ppmのHisのεHがそれぞれCu2+を等量添加するとピークが消失している。またcyclic p-B単独でも同様に2.4ppm〜2.8ppmのAspのβH、3.05ppm〜3.2ppmのHisのβH、7.05ppmのHisのδH、そして7.8ppmのHisのεHがCu2+を等量添加するとピークが消失している。これらのことから、cyclic p-A単独、cyclic p-B単独でもHisとAspの部位でCu2+と配位結合していることが確認された。
【0056】
さらにナノチューブを形成する条件(55%メタノール存在下)で、cyclic p-Aとcyclic p-Bを等量に混合し、実際にCu2+を環状ペプチドの環内部に配位させながらナノチューブを形成しているかどうか、NMRを用いて確認した。図10(a)に示すように、Cu2+がない場合はナノチューブ形成から2時間後と24時間後のスペクトルを比較すると、スペクトルの形は変化せず、強度が著しく減少していることがわかる。この強度の減少は高分子量凝集体形成によるもので、ナノチューブの形成を示しており、HisとAspの各ピークの消失は見られない。
【0057】
しかし、図10(b)に示すように、Cu2+が存在する場合は、ナノチューブ形成から2時間後のスペクトルではHisとAspの各ピークがすでに消失し、それ以外のアミノ酸のピークは残ったままである。さらに24時間後になると、2時間後のスペクトルの形のまま、強度が減少していることが確認された。これらの結果から、Cu2+は環状ペプチドの環内部のHisとAspに配位結合しながらナノチューブを形成していると考えられる。
【0058】
[Cu2+存在下でのcyclic p-A単独、cyclic p-B単独、cyclic p-Aとcyclic p-Bの混合のナノチューブ形成]
図11に各環状ペプチドのCu2+存在下での1日後のCDスペクトルとAFM画像を示す。図11(a)は各メタノール濃度におけるcyclic p-A単独のCDスペクトルを示しており、0%メタノール濃度ではランダムコイル様スペクトルを示しているが、55%、75%メタノール濃度では極小値が〜222nm付近を示した同じようなβシート構造様スペクトルを示している。AFMで形成されたナノチューブの形態を調べてみると、高さ6〜9nmで長さ5μm前後のナノチューブが観察された。また図11(b)は各メタノール濃度におけるcyclic p-B単独のCDスペクトルを示しており、0%メタノール濃度ではランダムコイル様スペクトルを示し、cyclic p-Aと同様に55%、75%メタノール濃度では極小値が〜222nm付近を示したβシート構造様スペクトルを示している。cyclic p-Bの場合も形成されたナノチューブの形態をAFMで調べてみると、高さ2〜3nmで長さ数百nm〜十数μmのナノチューブが観察された。これらの結果はcyclic p-Aとcyclic p-Bを混合した時のナノチューブ形成条件(40%〜65%前後では太いチューブ、65%以上では細いチューブ)でcyclic p-A単独でも、またcyclic p-B単独でもCu2+を環内部に配位させながら、ナノチューブを形成することを示している。
【0059】
図11(c)に示すようにcyclic p-Aとcyclic p-Bを混合した場合では、0%メタノール濃度ではランダムコイル様スペクトルを示し、55%、75%メタノール濃度では極小値が〜217nm付近を示したβシート構造スペクトルを示していることが分かる。またAFMでは、高さ10〜40nmで長さ十数μm前後のナノチューブが観察された。このナノチューブは、Cu2+が存在しない時に形成するナノチューブ(高さ10〜15nm、長さ5μm前後)よりも太く、長いナノチューブである。このことからCu2+と環状ペプチドとの相互作用がナノチューブ形成に影響を与え、ナノチューブ形成を促進したと考えられる。
【0060】
それぞれの環状ペプチドの静電相互作用や立体障害を考えると、cyclic p-A単独やcyclic p-B単独でのナノチューブはおそらく平行βシート構造を形成していると考えられるが、平行βシート構造で形成される水素結合は歪んでいるために、短い繊維や細い繊維のように比較的未熟な繊維しか形成できないのかもしれない。しかし、cyclic p-Aとcyclic p-Bを混合した場合では、静電相互作用や立体障害を考慮すると、おそらく逆平行βシート構造を形成していると考えられ、逆平行βシート構造で形成される水素結合は歪みが少なく、安定に太く、長い繊維が形成すると考えられる。
以上、本発明の好ましい実施形態を図示して説明してきたが、本発明の技術的範囲を逸脱することなく種々の変更が可能であることは理解されるであろう。
【産業上の利用可能性】
【0061】
本発明に係る環状ペプチドを用いて形成したナノチューブは、ナノチューブそのものをナノ材料やナノ素材をして利用できる。金属イオン、本発明では特にCu2、をナノチューブ内部に金属錯体として内包することが可能であり、イオンチャンネルなどの物質輸送材、また細胞膜へナノチューブが貫通する報告もあることから抗菌物質としての利用、また金属イオンを還元剤で還元することで絶縁体コートされた導電路としての利用、金属の磁性を利用した高分子磁性体などの分子デバイスへの応用などが考えられる。
【0062】
また、本発明に係る環状ペプチドは、その構成に天然アミノ酸を利用し、かつナノチューブ形成のために外部からのエネルギーを加えることがなく、自己組織化的に形成されることからも、環境調和材料としても利用可能である。
【0063】
さらに、金属イオンと配位するアミノ酸を環状ペプチド内部へ向ける数や配置を設計することは可能であり、種々の金属イオンや有用な物資をナノチューブ内部に内包、配列化することも可能となる。
【図面の簡単な説明】
【0064】
【図1】光学異性体アミノ酸を使用した8残基及び12残基環状ペプチドの設計模式図
【図2】金属イオンを環内部には良い結合させるための、12残基環状ペプチドの設計模式図
【図3】配列番号1Gln(L体)-His(L体)-Glu(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Gln(L体)-Asp(L体)-Lys(L体)-Lys(D体)-Lys(L体)-Lys(D体)と、配列番号2Lys(L体)-Asp(L体)-Gln(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Glu(L体)-His(L体)-Gln(L体)-Lys(D体)-Lys(L体)-Lys(D体)の配列をもつ環状ペプチドの説明図
【図4】cyclic p-Aとcyclic p-Aを混合した時の217nmにおけるCD強度のメタノール濃度依存性(a)と、チオフラビンTの蛍光強度のメタノール濃度依存性(b)
【図5】各メタノール濃度でのcyclic p-Aとcyclic p-Aの混合溶液のAFM画像
【図6】cyclic p-Aとcyclic p-Aを混合した時のチオフラビンTの蛍光強度のプロパノール濃度依存性
【図7】0%メタノールにおけるcyclic p-Aとcyclic p-Aの混合溶液への各種遷移金属イオン((a)Cu2+;スペクトル、(b)Cu2+;滴定曲線、(c)Zn2+、(d)Cd2+、(e)Co2+、(f)Ni2+)の滴定実験の結果
【図8】0%メタノールにおける各Cu2+濃度でのcyclic p-Aとcyclic p-Aの混合溶液の一次元NMRスペクトル
【図9】0%メタノールにおける各Cu2+濃度でのcyclic p-A単独溶液(a)とcyclic p-B単独溶液(b)の一次元NMRスペクトル
【図10】55%メタノールにおけるCu2+非存在下(a)とCu2+存在下(b)でのcyclic p-Aとcyclic p-Aの混合溶液の2時間後と24時間後の一次元NMRスペクトル
【図11】Cu2+存在下でのcyclic p-A単独(a)、cyclic p-B単独(b)、cyclic p-Aとcyclic p-Aの混合溶液(c)の各メタノール濃度におけるCDスペクトルとAFM画像
【技術分野】
【0001】
本発明は、金属イオンと結合する単位分子の環状ペプチドと、それらの環状ペプチドが連結することで形成されるナノスケールの中空繊維(本明細書中では、ナノチューブと称する)のナノ素材の技術に関するものである。
【背景技術】
【0002】
これまで大きな物質を削ってナノメートルスケールにまで微細化していく「トップダウン」型アプローチを用いて、半導体素子や大規模集積回路(LSI)を作製する技術開発が盛んに行われてきた。しかしながらその技術にも限界があり、20nm以下の微細構造を作ることが困難となっている。
そこで近年、分子の自己組織化を利用し、規則的な微細構造を作り上げる研究が急速に進展している。このような自己組織化を利用した「ボトムアップ」型アプローチを模倣する代表的な例として生物の細胞があり、これをモデルシステムとした生体分子による新規材料開発の研究が大変注目を集めている。
【0003】
生体を作るタンパク質や核酸などの生体分子で材料を作る利点としては、外部からエネルギーを加えることなく自己組織化的に材料が構築されることから無駄のない製造システムであること、そして物質自体が生分解性であることなどが挙げられ、地球環境や生物に対して負荷が少ないといえる。
特にタンパク質は、構成する天然アミノ酸(L−体アミノ酸)の種類が20種類存在するため、形成される構造や機能は多種多様である。
さらに化学合成法を利用した場合は、タンパク質配列中に非天然アミノ酸やL−体アミノ酸の鏡像異性体であるD−体アミノ酸を導入することも可能となり、タンパク質を利用したナノテクノロジーは、今後様々な分野において重要になってくると考えられる。
【0004】
生体高分子であるタンパク質は、20種類の天然アミノ酸(L−体アミノ酸、比較的単純な有機分子)から構成され、アミノ酸の中には金属イオンと配位結合するものが存在する。
金属イオンと配位することが可能なアミノ酸としては、ヒスチジン、システイン、アスパラギン酸、グルタミン酸などがそうであり、実際にある種のタンパク質はこれらのアミノ酸を利用し、種々の金属イオンと配位結合することで細胞内において機能を果たしている。
近年、有機材料と無機材料を組み合わせた機能性複合新素材の開発や応用の研究が盛んに行われているが、タンパク質と無機材料とのハイブリッド材料の構築には金属イオンと配位するアミノ酸を用いることが重要であり、タンパク質の構造や機能の多様性を考慮すると、これまでにない新しいハイブリッド材料の創出が期待される。
【0005】
またタンパク質の立体構造は、主に比較的規則的な二次構造から構成されており、その主なものはαヘリックス構造、及びβシート構造である。
αヘリックス構造は、配列中の連続した領域でアミノ酸残基nのCOとアミノ酸残基n+4のNHがそれぞれ水素結合(αヘリックス型水素結合)することで形成される。
またβシート構造は、隣り合うβストランドと呼ばれるほとんど伸びきった領域間で、αヘリックスと同様に向かい合ったアミノ酸残基のCO(NH)とNH(CO)が水素結合(平行、または逆平行βシート型水素結合)形成することにより、二次構造となり安定化している。
このような二次構造を基本ブロックとして、タンパク質分子同士が相互作用することが知られている。例えば、筋肉を構成するミオシン、狂牛病などの原因と思われるアミロイド線維など、ナノメートルスケールの規則的な繊維状超分子構造を形成することが知られている。
【0006】
これまでアミロイド線維を形成するタンパク質に、システイン残基を利用して金コロイドを化学修飾し、さらに金または銀でメッキすることで、導電性ナノワイヤーを作製する手法が知られている(例えば、非特許文献1。)。
また、連続したヒスチジン残基を有するペプチド様高分子から形成されるナノチューブに金属イオンを配位させ、還元剤で還元することでナノワイヤーを作製する手法が知られている(例えば、非特許文献2。)。
これらの手法は、どちらの手法も繊維状構造体の表面を金属で被覆するためにワイヤーの直径が数百ナノメートルと太くなり、従来の微細加工技術よりも優れた新技術とはいい難い。
【0007】
またDNAを構成するヌクレオチドの塩基部分を有機化学合成で金属イオンと配位可能な塩基に改良し、ニ本鎖DNA内部に最大5個の銅イオンを配列させた例が報告されている(例えば、非特許文献3。)。しかしながら、5個以上の金属イオンを一次元的に配列させることはできていない。
【0008】
昨今の半導体プロセス技術の動向をみると、半導体内機能素子間の配線において、その配線の幅はますます小さなものが要求されている。また金属錯体の性質をハイブリッドした新しい機能性物質の開発も盛んに行われているが、生体分子と無機材料を融合したハイブリッド材料の構築は、工業的または産業的利用が期待されるにもかかわらず、いまだ確立されていないのが現状である。
【0009】
【非特許文献1】Scheibel, T. et. al. (2003) Proc. Natl. Acad. Sci. USA 100, 4527-4532.
【非特許文献2】Banerjee, I. A. et. al. (2003) Proc. Natl. Acad. Sci. USA 100, 14678-14682.
【非特許文献3】Tanaka, K. et. al. (2003) Science 299, 1212-1213.
【発明の開示】
【発明が解決しようとする課題】
【0010】
本発明が解決しようとする課題は、規則的な微細構造で中空構造を有するナノメートルスケールのナノチューブを提供することである。また、当該ナノチューブに様々な特性・機能を持たせるために金属イオンをナノチューブ内部に配列化することである。
【0011】
そのために、ペプチドで構成されるナノチューブの内部に金属イオンを配列することが可能で、かつ、幅数ナノメートルから十数ナノメートル、さらには長さ数マイクロメートル規模のナノチューブを自己組織化的に形成させるための新規な環状ペプチドの配列を同定すること、また、当該配列を成す環状ペプチドのナノチューブ形成条件を確立すること、及び環状ペプチドの環内部に金属イオンを配位させることが可能なナノチューブの形成条件を確立させることが本発明の目的とするところである。
【課題を解決するための手段】
【0012】
本発明者らは、ペプチドに関して鋭意研究を行い、実験を繰り返し行った結果、12残基のアミノ酸で構成された環状ペプチドを常温常圧下で中性付近(pH6〜pH8)の水溶媒もしくは水/アルコール混合溶媒中で自己組織化させることにより、幅数ナノメートルから十数ナノメートル、長さ数マイクロメートルに至るナノチューブが形成されること、また環状ペプチドの環内部に向いている2つのアミノ酸側鎖に金属イオンが配位結合されること、かつ自己組織化的にナノチューブが形成されることの知見を得て、本発明を完成した。
【0013】
前述の課題を達成するために、本発明の第1の観点に係る環状ペプチドは、n残基(nは8,12,16,20,24)のアミノ酸から構成され、1残基目のN末端とn残基目のC末端がペプチド結合した環状ペプチドにおいて、
3残基のアミノ酸が連続してL−体もしくはD−体である連続領域が少なくとも2つ存在し、かつ、前記連続領域が隣接すること無く配された配列で、
それ以外のアミノ酸はL−体とD−体が交互に配された配列からなり、
3残基のアミノ酸が連続した前記連続領域では真ん中のアミノ酸残基の側鎖のみ環状ペプチドの環内部を向き、L−体とD−体が交互に配されたアミノ酸残基の側鎖は全て環状ペプチドの環外部を向く構造を形成していることを特徴とする。
【0014】
ここで、上記の本発明の第1の観点に係る12残基の環状ペプチドの配列において、1つ目の3残基のアミノ酸が連続した前記連続領域の最初のアミノ酸を1番目として、
X1-His(またはCys)-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11
と示される配列からなり、
(X2、X3、X4、X5)と(X8、X9、X10、Y11)の組合せで、
それぞれ側鎖に同じ電荷を有するアミノ酸(Asp、Glu、Lys、Arg)の中から選択されたもの)が配され、
かつ、互いの組合せが逆の電荷になるように配されていることが好ましい。
【0015】
また、上記の環状ペプチドにおいて、更に、 X1とX6のそれぞれに、Gln,Asn若しくはTyrが配され、
及び/又は、
X7にHis, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸が配されていることが好ましい。
【0016】
上記の12残基の環状ペプチドのアミノ酸配列は、具体的には、Gln(L体)-His(L体)-Glu(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Gln(L体)-Asp(L体)-Lys(L体)-Lys(D体)-Lys(L体)-Lys(D体)(配列番号1)で示される。
【0017】
本発明の第1の観点に係る12残基の環状ペプチドの配列において、1つ目の3残基のアミノ酸が連続した前記連続領域の最初のアミノ酸を1番目として、
Y1-Y2-Y3-Y4-Y5-Y6-Y7-His(またはCys)-Y8-Y9-Y10-Y11
と示される配列からなり、
(Y1、Y9、Y10、Y11)と(Y4、Y5、Y6、Y7)の組合せで、
それぞれ側鎖に同じ電荷を有するアミノ酸(Asp、Glu、Lys、Arg)の中から選択されたもの)が配され、
かつ、互いの組合せが逆の電荷になるように配されていることが好ましい。
【0018】
また、上記の環状ペプチドにおいて、さらに、
Y3とY8のそれぞれに、Gln,Asn若しくはTyrが配され、
及び/又は、
Y2にHis, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸が配されていることが好ましい。
【0019】
上記の12残基の環状ペプチドのアミノ酸配列は、具体的には、Lys(L体)-Asp(L体)-Gln(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Glu(L体)-His(L体)-Gln(L体)-Lys(D体)-Lys(L体)-Lys(D体)(配列番号2)で示される。
【0020】
また、本発明の第2の観点の環状ペプチドは、前述の第1の観点の環状ペプチドにおいて、金属イオンが環内部に向いているアミノ酸側鎖と配位結合されていることを特徴とする。
【0021】
ここで、金属イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることが好ましい。また、この金属イオンは、2価の銅イオンであることが更に好ましい。
【0022】
また、本発明の第3の観点からは、前述の第1の観点の環状ペプチドを用いて自己組織化によりナノスケールオーダの径を有する管状構造を形成させたことを特徴とするナノチューブが提供される。
【0023】
上述した如く、本発明に係る環状ペプチドは、n残基(nは8,12,16,20,24)のアミノ酸から構成され、1残基目のN末端と8残基目のC末端、または1残基目のN末端と12残基目のC末端がペプチド結合を形成し、直鎖状の構造ではなく、環状のペプチド構造となっていることが特徴である。また3残基が連続してL体またはD体アミノ酸である領域が2つ連続せずに存在し、それ以外のアミノ酸はL体及びD体アミノ酸が交互に配された配列からなることを特徴とする(図1を参照)。
このようにアミノ酸の光学異性体を上手く配置することで、同種の光学異性体が3残基連続した領域では真ん中のアミノ酸残基側鎖のみ環状ペプチドの環内部を向くことになり、また交互に光学異性体が配置している領域はアミノ酸残基側鎖が全て環外部を向くという特徴的な環状構造を形成する。
【0024】
金属イオンを環状ペプチドの環内部に配位させるための、かつ環状ペプチドが自己組織化的にナノチューブを形成するような配列は、図2(a)に示すように、1つ目のL体またはD体アミノ酸が3残基連続した領域の最初のアミノ酸を1番目としてX1-His(またはCys)-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11と示される配列のうち、X2、X3、X4、X5とX8、X9、X10、X11の組み合わせで側鎖に同じ電荷をもつアミノ酸(Asp、Glu、Lys、Arg)で、かつ互いが逆の電荷になるように配置する。さらに溶解度を高めるためとペプチド濃度を吸光度により測定するためにX1とX6にGlnまたはAsnまたはTyrを配し、X7には金属イオンを配位するために、His, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸を配置させる。なお、好ましくは、X7には、AspまたはGluまたはHisを配置させるのがよい。
【0025】
また同様に図2(b)に示すように、1つ目のL体またはD体アミノ酸が3残基連続した領域の最初のアミノ酸を1番目としてY1-Y2-Y3-Y4-Y5-Y6-Y7-His(またはCys)-Y8-Y9-Y10-Y11と示される配列のうち、Y1、Y9、Y10、Y11とY4、Y5、Y6、Y7の組み合わせで側鎖に同じ電荷をもつアミノ酸(Asp、Glu、Lys、Arg)で、かつ互いが逆の電荷になるように配置する。さらに溶解度を高めるためとペプチド濃度を吸光度により測定するためにY3とY8にGlnまたはAsnまたはTyrを配し、Y2には金属イオンを配位するために、His, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸を配置させる。なお、好ましくは、Y2には、AspまたはGluまたはHisを配置させるのがよい。
【0026】
具体的には、図3(a)(b)に示すように、1つ目のL−体アミノ酸が3残基連続した領域の最初のアミノ酸を1番目として、以下の1),2)の配列番号の配列の環状ペプチドである。
1)配列番号1(以下、略称名:cyclic p-Aを用いる。)
Gln(L体)-His(L体)-Glu(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Gln(L体)-Asp(L体)-Lys(L体)-Lys(D体)-Lys(L体)-Lys(D体)
2)配列番号2(以下、略称名:cyclic p-Bを用いる。)
Lys(L体)-Asp(L体)-Gln(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Glu(L体)-His(L体)-Gln(L体)-Lys(D体)-Lys(L体)-Lys(D体)
【0027】
この環状ペプチドでは、L体アミノ酸が3残基連続する領域が2領域存在し、配列番号1ではAsp(L体)とHis(L体)が、配列番号2ではHis(L体)とAsp(L体)がそれぞれ環状ペプチドの環内部に側鎖が向いており、それ以外のアミノ酸側鎖は環外部に向いた構造をとっている。
それぞれの環状ペプチドの配列において、環内部に向いているアミノ酸残基はHis(L体)とAsp(L体)であるが、これらはL体やD体の光学異性体に限らず金属イオンと配位結合をすることが知られており、特にHis残基が強く特異的に金属イオンと配位結合することから、His残基側鎖を環内部に向けさせることが重要である。
このように設計された環状ペプチドは1個の金属イオン(特異的に2価の銅イオン)を配位結合で環内部にトラップすることが可能となる。実際に本発明に係る環状ペプチド配列は環内部に金属イオンを配位し、トラップしていることが確認されており、人工設計による環状ペプチドでは世界初である。
【0028】
また、配列番号1と配列番号2の環状ペプチドは、それぞれ単独でも、かつ互いを混合しても、ある特定の溶媒条件に静置しておくだけで自己組織化的にナノチューブを形成することが可能である。一般的にタンパク質の立体構造はαヘリックス構造やβシート構造を呼ばれる二次構造が組み合わされて形成しており、配列番号1単独でも、また配列番号2単独でも、さらに両配列を混合しても、平行型または逆平行型βシート構造の水素結合を形成し、ナノチューブを形成するように設計されていることが特徴である。
【0029】
しかし、配列番号1や配列番号2のアミノ酸配列では、アミノ酸側鎖の立体障害や静電相互作用を考慮すると、配列番号1単独または配列番号2単独でナノチューブを形成する場合は平行型βシート構造、両配列を混合した場合でナノチューブを形成する場合は逆平行型βシート構造がエネルギー的に安定であると考えられる。
【0030】
さらにナノチューブ形成条件下で金属イオンを共存させておくと、環状ペプチドは金属イオンを環内部に配位させ、かつナノチューブを形成することができる。こうすることで1個の金属イオンをナノチューブ内に約5Å間隔で一次元的に配列させることが可能となる。本発明は人工環状ペプチドが金属イオンと配位し、かつナノチューブを形成し、金属イオンをチューブ内に配列させた最初の報告例である。
【発明の効果】
【0031】
本発明に係るナノチューブを形成する環状ペプチドは、光学異性体であるL体及びD体アミノ酸の並びを設計することにより、金属イオンと配位結合する特定のアミノ酸を環内部に配向させ、特定の金属イオンを配位させることができるという効果を有する。
また、溶媒をある特定の条件にすることで、環状ペプチドが自己組織化的にナノチューブを形成すること、また金属イオンをナノチューブ内に一次元的に配列させることができるという特徴を有している。
これらのナノチューブを構成する環状ペプチドは、金属イオンと配位結合する特殊なアミノ酸を新たに開発・合成しなくても天然に存在するアミノ酸が利用でき、従来の固相合成により容易に高収率で得ることができるという特徴を有している。
【0032】
また、これらのナノチューブは、中性付近(pH6〜pH8)の水溶液と0%<濃度<90%のアルコール濃度の混合溶液中で、常温常圧下でペプチドの自己組織化能力を利用して製造されるため、エネルギーの添加が不要なことや環境負荷が少ないという効果を有する。
【0033】
さらに金属イオンをナノチューブ内に一次元的に配列化できることから、還元剤を用いて還元することによりペプチドという絶縁体にコートされた極細の導電性ワイヤーや、金属イオンの特性を利用した高分子磁性体などの分子デバイスを作ることができるという効果を有する。
【発明を実施するための最良の形態】
【0034】
以下、本発明のナノチューブを形成する環状ペプチドの作製方法、及び環状ペプチド内部への金属イオンの配位とナノチューブの形成について、図面を参照しつつ、最良の形態を詳細に説明する。ただし、本発明の技術的範囲は以下の実施例に示した具体的な用途や形状・寸法などには限定されるものではない。
【実施例1】
【0035】
[ペプチド合成]
配列番号1及び配列番号2の環状ペプチドの合成は、固相合成法に基づきペプチド合成機(peptide synthesis system, Pioneer ; Applied Biosystems)で行った。固相合成で用いた支持体レジンはPAL-PEG-PS樹脂(Applied Biosystems)で、Nα−アミノ基の保護に9-fluorenylmethoxycarbonyl(Fmoc)保護基が付加されており、ヒスチジン残基、(C末端でない)グルタミン残基の側鎖にtrityl(Trt)保護基、アスパラギン酸残基、グルタミン酸残基(L−体、D−体)の側鎖にt-butoxy(OtBu)保護基、リジン残基(L−体、D−体)側鎖にt-butoxycarbonyl(tBoc)保護基がそれぞれ付加されたアミノ酸を使用し、C末端のアミノ酸にglutamic acid 1-allyl esterを用いた。
【0036】
このグルタミン酸残基側鎖に支持体レジンがカップリングし、脱保護反応の際に支持体レジンが取り除かれてグルタミン残基となる。これらのアミノ酸(ペプチド研究所)がアミノ酸のカップリングに使用され、カップリング試薬としてN-[(Dimethylamino)-1H-1,2,3-triazole[4,5-6]pyridine-1-ylmethylene]-N-meth-ylmet-hanaminium hexafluorophosphate N-oxide(HATU)(Applied Biosystems)を用いた。
環状化にはAllyl基を脱保護するためTetrakis (triphenylphosphine) palladium(Fluka)を触媒に混合溶液(5% Acetic acid(nacalai tesque)、 2.5% 4-Methylmorpholine(NMM) (Fluka)、Chloroform(Fluka))を、また活性剤として7-Azobenzotriazol-1-yloxytris (pyrrolidino) phosphonium-hexafluorophosphate (PyAOP) (Applied Biosystems)を使用した。
【0037】
ペプチド保護基の脱保護反応は、混合溶液A(0.25ml エタンジチオール(EDT)、0.25ml 精製水、9.5ml トリフルオロ酢酸(TFA))中で1時間半かけて室温で行った。その後、脱保護されたペプチドはt-butyl methyl ether (MTBE)で抽出し、遠心回収後、真空乾燥により得た。
【0038】
ペプチドの精製はDevelosil ODS column (Nomura Chemical)を用いてreverse-phase high-pressure liquid chromatography(RP-HPLC,日立製作所製)によって行った。
流速は10ml/minで、溶出の際のグラジエントは溶離液Bの濃度を20分で5%から20%に変化させて行った。使用した溶離液Aは精製水(0.1% TFA)、溶離液Bはアセトニトリル(0.1% TFA)である。HPLCによって精製されたペプチドの確認は、マトリックス支援レーザー脱離イオン化(matrix-assisted laser desorption ionization ; MALDI)法を用いて飛行時間型質量分析機(AXIMA-CFR,島津製作所製)で行った。
【0039】
[環状ペプチドによるナノチューブ形成反応]
環状ペプチドを秤量し、精製水を加え溶かしてこれを1mMのペプチドストック溶液とし、またCuCl2・2H2Oを秤量し、精製水を加え溶かして1mMのCu2+ ストック溶液とする。さらに2-[4-(2-Hydroxy-ethyl)-1-piperazinyl]ethanesulfonic acid(HEPES)緩衝液(pH7.5)を調整する。ペプチドストック溶液からそれぞれ一定量分取し、HEPES緩衝液、Cu2+ストック溶液とMethanolを加えて、ペプチド濃度がそれぞれ50μM、Cu2+濃度が50μM、Methanol濃度が55%または75%になるよう調製し、ナノチューブ形成反応を開始した。
【0040】
[円ニ色性(CD)分光測定]
環状ペプチド溶液を約200ml分取し、それを光路長0.1cmの円筒型石英セルに入れ、250nm〜190nmの遠紫外領域のCD(Jasco J-720 spectropolarimeter、日本分光)測定を行った。
【0041】
[蛍光光度計を用いたチオフラビンT結合アッセイ]
13μlの各環状ペプチド試料、35μl の200μMチオフラビンTストック溶液、652μlの 50mMリン酸緩衝溶液(pH7.0)を素早く混合し、全溶液(700μl)を蛍光測定用石英セルに入れた後、蛍光光度計(Jasco FP-6500 spectrofluorometer,日本分光製)にセットして10秒間の蛍光強度の時間変化を測定した。測定時の励起光波長は450nm、蛍光波長は485nmである。
【0042】
[原子間力顕微鏡(AFM)による観察]
各試料から2μl分取し、それを雲母基板(約1cm四方)上へ滴下し、約1分間吸着させた。その後、基板洗浄のためにマイクロピペットを用いて50μl精製水を傾けた基板の上端から滴下し、これを2回行った後、室温にて完全に乾燥させ、AFM(SPM-9500J2,島津製作所製)観察を行った。
【0043】
[核磁気共鳴(NMR)測定]
測定に用いる溶媒として、90%H2O/10%D2O、100%D2O、および45%D2O/55%CD3ODの3種類を用意し、それぞれ5mM Tris-d11・HCl、0.173mM TSP-d4溶液となるように調整し、さらに、cyclic p-Aおよびcyclic p-Bが77μM、cyclic p-Aのみが154μM、またはcyclic p-Bのみが154μMとなるように調整した。測定試料として、調整溶液400μlまたは500μlをWILMAD社製標準試料管に挿入したものを用意した。測定はBruker社製NMR分光器、DMX-750を用いて25℃で行い、1Hの周波数が750.03MHzとなるようにチューニングした。各測定において、スペクトル幅を10000Hz、FID取り込み時間を1.64秒に設定し、積算を512回行った。90%H20/10%D2O溶液の場合は、FIDを取り込む直前にwatergateパルスシーケンスを用いて溶媒であるH2O由来のシグナルを抑えた。各スペクトルの化学シフトは、TSP-d4由来ピークのピークトップが0ppmとなるように補正した。
【実施例2】
【0044】
[cyclic p-Aとcyclic p-Bの混合によるナノチューブ形成条件の決定]
cyclic p-Aとcyclic p-Bを混合した時のナノチューブ形成条件をCDとチオフラビンT結合アッセイで評価した。これまでに報告されている環状ペプチドから成るナノチューブは、環状ペプチド同士の主鎖間でβシート型水素結合を形成していることが確認されていることから、CDスペクトルが時間経過とともに典型的なβシート構造のスペクトルに転移すると予想される。またナノチューブの構造がβシート構造だとすると、同様の構造を有するアミロイド線維と同じ性質を持つと考えられ、アミロイド線維に特異的に結合するチオフラビンTにも同様に結合し、ナノチューブ形成と同時に485nmのチオフラビンTの蛍光強度が増加することが予想される。
【0045】
図4(a)は、各時間における217nmのCD強度のメタノール濃度依存性を示したものである。一般的にβシート構造のCDスペクトルは、約217nmで負の極大を示す。図4(a)から、日にちが経つとともに40%〜65%の領域のメタノール濃度において217nmのCD強度が負に増加し、50%前後で極小値をとっていることが分かる。これは、40%〜65%メタノール濃度領域においてcyclic p-Aとcyclic p-Bはβシート構造へ構造転移していることを示している。
【0046】
また図4(b)は各時間におけるチオフラビンTの蛍光強度のメタノール濃度依存性を示したものであるが、一日後には40%〜90%メタノール濃度において485nmの蛍光強度が増加し、その後はほとんど蛍光強度の変化がないことが確認できる。また、75%前後のメタノール濃度でもっとも蛍光強度が増加している。これは、40%〜90%メタノール濃度領域においてアミロイド線維と同様のβシート構造を形成していることと、75%前後のメタノール濃度でもっとも多くのチオフラビンTが凝集体に結合していることを示している。しかしながら、CD測定から得られたもっともβシート構造に転移するメタノール濃度(50%前後)と蛍光測定から得られたメタノール濃度(75%前後)は、大きく異なっている。そこで溶液内にどのような凝集体形成されているか確認するため、7日後の試料溶液を全てAFMで観察した(図5を参照)。
【0047】
その結果、0%<濃度<40%のメタノール濃度領域ではごく小さな繊維状凝集体が確認でき、40%〜65%のメタノール濃度領域では長さが5μm前後の太い繊維、65%以上のメタノール濃度では長さが5μm前後の細い繊維が確認された。これらのことから、75%前後のメタノール濃度で形成した細い繊維は、さらに繊維同士でより合わさることがないため、その分チオフラビンTが結合可能な繊維表面が多く存在し、多くのチオフラビンTが結合する結果、蛍光強度を増加させたと考えられる。また、50%前後のメタノール濃度で形成した太い繊維は、細い繊維同士がより合わさって会合しやすく、すぐに太い繊維を形成するため、チオフラビンTの結合表面が減少し、CDの結果からもっとβシート構造をとっているにもかかわらず、蛍光強度が低く出ていると考えられる。以上のCD、蛍光、AFM測定の結果から、cyclic p-Aとcyclic p-Bを混合した時のナノチューブ形成条件は中性付近(pH6〜8)の水溶液と0%<濃度<90%のメタノールとの混合溶液であり、その中でも長く太いナノチューブは40%〜65%前後のメタノール濃度、長くて細いナノチューブは65%以上のメタノール濃度である。また、メタノール濃度0%では繊維状の凝集体は形成しないことが確認できた。
【0048】
[ナノチューブ形成におけるアルコール効果]
さらに、cyclic p-Aとcyclic p-Bを混合した時のナノチューブが、メタノール以外のアルコールでも形成されるかどうか、チオフラビンT結合アッセイで評価した。アルコールをプロパノールにし、各時間におけるチオフラビンTの蛍光強度のプロパノール濃度依存性を調べた結果を図6に示す。メタノールの時と同様に一日後には30%〜90%メタノール濃度において485nmの蛍光強度が増加し、その後はほとんど蛍光強度の変化がないことが確認できる。これはプロパノールでもアミロイド線維様の構造が形成されていることを示しており、βシート構造を形成しながらナノチューブが形成していると考えられる。AFMでもメタノールの時と同じような形態のナノチューブが観察されている。したがって、メタノールよりも比誘電率が低いプロパノールでも0%<濃度<90%の濃度範囲でナノチューブ形成が確認されていることから、メタノールとプロパノールの中間の比誘電率をもつエタノールでも同様のアルコール濃度範囲でナノチューブが形成されることは想定でき、ナノチューブ形成条件は常温常圧下で、中性付近(pH6〜pH8)の水溶液とアルコール(メタノール、エタノール、プロパノール)濃度が0%<濃度<90%の領域における混合溶液であると言える。
【0049】
[cyclic p-A、cyclic p-Bへの金属イオンの配位]
cyclic p-A、cyclic p-Bが各種遷移金属イオンと配結合をするかどうか、ナノチューブを形成しない条件(アルコール0%)で、金属イオンの滴定実験を行った。添加する遷移金属イオンは、Cu2+、Zn2+、Cd2+、Co2+、Ni2+である。cyclic p-A、cyclic p-BにはそれぞれHisとAspの2つの配位子しか存在せず、もし遷移金属イオンが環状ペプチドと配位結合するならば、cyclic p-A1分子とcyclic p-B1分子で金属イオンを挟み込んだ形になることがもっとも安定であると考えられる。
その結果、cyclic p-Aとcyclic p-Bは金属イオンを介してお互いが近くなり、βシート構造を形成すると考えられるため、CDで変化を追跡した。その結果を図7に示す。
【0050】
図7(a)はCu2+滴定実験の結果を示しており、Cu2+濃度が増加するとともにβシート構造のスペクトルに転移していることが分かる。
図7(b)は217nmのCD強度をCu2+濃度に対してプロットした滴定曲線であるが、Cu2+濃度〜50μM付近で変化がなくなっていることが確認できる。cyclic p-Aとcyclic p-Bの濃度は50μMずつなので、化学量論は大体cyclic p-A:cyclic p-B:Cu2+=1:1:1である。この結果からcyclic p-A、cyclic p-BはCu2+と配位結合していると考えられる。
【0051】
同様にZn2+で滴定した結果を図7(c)に示すが、Cu2+とは異なりZn2+濃度が増加してもβシート構造へは転移せず、ランダムコイル様のCDスペクトルで変化がないことが分かる。またCd2+(図7(d))、Co2+(図7(e))、Ni2+(図7(f))でもZn2+と同様の結果を得ているため、Cu2+以外の遷移金属はcyclic p-A、cyclic p-Bとは配位結合していないと考えられる。
【0052】
Cu2+は配位子と平面四配位をもっとも安定に形成し、Zn2+、Cd2+は正四面体配位、Co2+、Ni2+は正八面体配位(配位子によっては正四面体配位)を形成することが知られている。静電相互作用、立体障害、歪みの少ない主鎖の安定な水素結合により、cyclic p-Aとcyclic p-Bは逆平行βシート構造を形成すると考えられ、この構造を形成した場合、遷移金属イオンの配位子となりうる2つのHis、2つのAspは平面四角形のそれぞれ頂点に位置する。このことから、Cu2+がもっとも環状ペプチドに配位しやすいと考えられ、金属イオンの特異的選択性を生み出していると思われる。また逆にCu2+しかcyclic p-A、cyclic p-Bに配位しないことから、設計通りにcyclic p-Aとcyclic p-Bが金属イオンを介してお互いが近くなりβシート構造を形成していると推測できる。
【0053】
[Cu2+が配位する残基のNMRによる同定]
これまでの実験結果から、cyclic p-A、cyclic p-BとCu2+が配位結合していることが確認できたが、実際にHisとAspにCu2+が結合しているかどうか、NMRを用いてアミノ酸残基レベルで確認を行った。77μMのcyclic p-A、77μMのcyclic p-Bを混合し、Cu2+が0、3.5、7、30、70μMになるように調整した溶液の一次元NMRを図8に示す。低磁場領域で見られる6.87ppmと7.05ppmの2つの鋭いピークはcyclic p-A、cyclic p-BのHisのδH、7.75ppmと7.81ppm付近の2つの鋭いピークはcyclic p-A、cyclic p-BのHisのεHであるが、Cu2+が3.5μM入るとそれらのピークは著しく減少し、30μM以上ではHisのピークは消失している。また高磁場側で見られる2.45〜2.8ppmのピークはAspのβH 、3.05〜3.2ppmのピークはHisのβHであるが、これらのピークも同様にCu2+濃度の増加とともに各ピークは消失している。
【0054】
しかしながら7.6ppm付近のGln、Lysに由来するピーク、及び8.0〜8.8ppmのアミドプロトンのピークは、Cu2+濃度が増加してもCu2+によるピークの幅広化(ブロードニング)が起こっているだけでピークの消失はない。同様に高磁場側でも、1.6ppm〜2.4ppmのLysのβHやδH、Gln及びGluのβHやγHのピーク、そして3.0ppm付近のLysのεHのピークもブロードニングするだけでピークの消失はない。Cu2+は常磁性であるために環状ペプチドと相互作用していなくてもNMRスペクトルは著しくブロードニングを起こすが、ある残基と相互作用する場合は、その残基のピークが他の残基と比べて距離が近いために極度にブロードニングを起こし、ピークの消失を引き起こす。このことから、設計通りにCu2+は特異的にHisとAspに結合していることが分かる。またHisやAspが環状ペプチドの環の外を向いているとすると、同じように外を向いている他のアミノ酸ともCu2+との距離が近くなるため、他のアミノ酸のピークも消失するはずであるが、それが見られないため、HisとAspの側鎖は環状ペプチドの環内部を向いていると考えられる。
【0055】
次にcyclic p-A単独、cyclic p-B単独でもCu2+と配位結合するかどうか、同様に一次元NMR測定を行った。図9にcyclic p-A単独(図9(a))の時とcyclic p-B単独(図9(b))の時の結果を示す。cyclic p-A単独では2.6ppm〜2.8ppmのAspのβH、3.05ppm〜3.2ppmのHisのβH、6.85ppmのHisのδH、そして7.75ppmのHisのεHがそれぞれCu2+を等量添加するとピークが消失している。またcyclic p-B単独でも同様に2.4ppm〜2.8ppmのAspのβH、3.05ppm〜3.2ppmのHisのβH、7.05ppmのHisのδH、そして7.8ppmのHisのεHがCu2+を等量添加するとピークが消失している。これらのことから、cyclic p-A単独、cyclic p-B単独でもHisとAspの部位でCu2+と配位結合していることが確認された。
【0056】
さらにナノチューブを形成する条件(55%メタノール存在下)で、cyclic p-Aとcyclic p-Bを等量に混合し、実際にCu2+を環状ペプチドの環内部に配位させながらナノチューブを形成しているかどうか、NMRを用いて確認した。図10(a)に示すように、Cu2+がない場合はナノチューブ形成から2時間後と24時間後のスペクトルを比較すると、スペクトルの形は変化せず、強度が著しく減少していることがわかる。この強度の減少は高分子量凝集体形成によるもので、ナノチューブの形成を示しており、HisとAspの各ピークの消失は見られない。
【0057】
しかし、図10(b)に示すように、Cu2+が存在する場合は、ナノチューブ形成から2時間後のスペクトルではHisとAspの各ピークがすでに消失し、それ以外のアミノ酸のピークは残ったままである。さらに24時間後になると、2時間後のスペクトルの形のまま、強度が減少していることが確認された。これらの結果から、Cu2+は環状ペプチドの環内部のHisとAspに配位結合しながらナノチューブを形成していると考えられる。
【0058】
[Cu2+存在下でのcyclic p-A単独、cyclic p-B単独、cyclic p-Aとcyclic p-Bの混合のナノチューブ形成]
図11に各環状ペプチドのCu2+存在下での1日後のCDスペクトルとAFM画像を示す。図11(a)は各メタノール濃度におけるcyclic p-A単独のCDスペクトルを示しており、0%メタノール濃度ではランダムコイル様スペクトルを示しているが、55%、75%メタノール濃度では極小値が〜222nm付近を示した同じようなβシート構造様スペクトルを示している。AFMで形成されたナノチューブの形態を調べてみると、高さ6〜9nmで長さ5μm前後のナノチューブが観察された。また図11(b)は各メタノール濃度におけるcyclic p-B単独のCDスペクトルを示しており、0%メタノール濃度ではランダムコイル様スペクトルを示し、cyclic p-Aと同様に55%、75%メタノール濃度では極小値が〜222nm付近を示したβシート構造様スペクトルを示している。cyclic p-Bの場合も形成されたナノチューブの形態をAFMで調べてみると、高さ2〜3nmで長さ数百nm〜十数μmのナノチューブが観察された。これらの結果はcyclic p-Aとcyclic p-Bを混合した時のナノチューブ形成条件(40%〜65%前後では太いチューブ、65%以上では細いチューブ)でcyclic p-A単独でも、またcyclic p-B単独でもCu2+を環内部に配位させながら、ナノチューブを形成することを示している。
【0059】
図11(c)に示すようにcyclic p-Aとcyclic p-Bを混合した場合では、0%メタノール濃度ではランダムコイル様スペクトルを示し、55%、75%メタノール濃度では極小値が〜217nm付近を示したβシート構造スペクトルを示していることが分かる。またAFMでは、高さ10〜40nmで長さ十数μm前後のナノチューブが観察された。このナノチューブは、Cu2+が存在しない時に形成するナノチューブ(高さ10〜15nm、長さ5μm前後)よりも太く、長いナノチューブである。このことからCu2+と環状ペプチドとの相互作用がナノチューブ形成に影響を与え、ナノチューブ形成を促進したと考えられる。
【0060】
それぞれの環状ペプチドの静電相互作用や立体障害を考えると、cyclic p-A単独やcyclic p-B単独でのナノチューブはおそらく平行βシート構造を形成していると考えられるが、平行βシート構造で形成される水素結合は歪んでいるために、短い繊維や細い繊維のように比較的未熟な繊維しか形成できないのかもしれない。しかし、cyclic p-Aとcyclic p-Bを混合した場合では、静電相互作用や立体障害を考慮すると、おそらく逆平行βシート構造を形成していると考えられ、逆平行βシート構造で形成される水素結合は歪みが少なく、安定に太く、長い繊維が形成すると考えられる。
以上、本発明の好ましい実施形態を図示して説明してきたが、本発明の技術的範囲を逸脱することなく種々の変更が可能であることは理解されるであろう。
【産業上の利用可能性】
【0061】
本発明に係る環状ペプチドを用いて形成したナノチューブは、ナノチューブそのものをナノ材料やナノ素材をして利用できる。金属イオン、本発明では特にCu2、をナノチューブ内部に金属錯体として内包することが可能であり、イオンチャンネルなどの物質輸送材、また細胞膜へナノチューブが貫通する報告もあることから抗菌物質としての利用、また金属イオンを還元剤で還元することで絶縁体コートされた導電路としての利用、金属の磁性を利用した高分子磁性体などの分子デバイスへの応用などが考えられる。
【0062】
また、本発明に係る環状ペプチドは、その構成に天然アミノ酸を利用し、かつナノチューブ形成のために外部からのエネルギーを加えることがなく、自己組織化的に形成されることからも、環境調和材料としても利用可能である。
【0063】
さらに、金属イオンと配位するアミノ酸を環状ペプチド内部へ向ける数や配置を設計することは可能であり、種々の金属イオンや有用な物資をナノチューブ内部に内包、配列化することも可能となる。
【図面の簡単な説明】
【0064】
【図1】光学異性体アミノ酸を使用した8残基及び12残基環状ペプチドの設計模式図
【図2】金属イオンを環内部には良い結合させるための、12残基環状ペプチドの設計模式図
【図3】配列番号1Gln(L体)-His(L体)-Glu(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Gln(L体)-Asp(L体)-Lys(L体)-Lys(D体)-Lys(L体)-Lys(D体)と、配列番号2Lys(L体)-Asp(L体)-Gln(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Glu(L体)-His(L体)-Gln(L体)-Lys(D体)-Lys(L体)-Lys(D体)の配列をもつ環状ペプチドの説明図
【図4】cyclic p-Aとcyclic p-Aを混合した時の217nmにおけるCD強度のメタノール濃度依存性(a)と、チオフラビンTの蛍光強度のメタノール濃度依存性(b)
【図5】各メタノール濃度でのcyclic p-Aとcyclic p-Aの混合溶液のAFM画像
【図6】cyclic p-Aとcyclic p-Aを混合した時のチオフラビンTの蛍光強度のプロパノール濃度依存性
【図7】0%メタノールにおけるcyclic p-Aとcyclic p-Aの混合溶液への各種遷移金属イオン((a)Cu2+;スペクトル、(b)Cu2+;滴定曲線、(c)Zn2+、(d)Cd2+、(e)Co2+、(f)Ni2+)の滴定実験の結果
【図8】0%メタノールにおける各Cu2+濃度でのcyclic p-Aとcyclic p-Aの混合溶液の一次元NMRスペクトル
【図9】0%メタノールにおける各Cu2+濃度でのcyclic p-A単独溶液(a)とcyclic p-B単独溶液(b)の一次元NMRスペクトル
【図10】55%メタノールにおけるCu2+非存在下(a)とCu2+存在下(b)でのcyclic p-Aとcyclic p-Aの混合溶液の2時間後と24時間後の一次元NMRスペクトル
【図11】Cu2+存在下でのcyclic p-A単独(a)、cyclic p-B単独(b)、cyclic p-Aとcyclic p-Aの混合溶液(c)の各メタノール濃度におけるCDスペクトルとAFM画像
【特許請求の範囲】
【請求項1】
n残基(nは8,12,16,20,24)のアミノ酸から構成され、1残基目のN末端とn残基目のC末端がペプチド結合した環状ペプチドにおいて、
3残基のアミノ酸が連続してL−体もしくはD−体である連続領域が少なくとも2つ存在し、かつ、前記連続領域が隣接すること無く配された配列で、
それ以外のアミノ酸はL−体とD−体が交互に配された配列からなり、
3残基のアミノ酸が連続した前記連続領域では真ん中のアミノ酸残基の側鎖のみ環状ペプチドの環内部を向き、L−体とD−体が交互に配されたアミノ酸残基の側鎖は全て環状ペプチドの環外部を向く構造を形成していることを特徴とする環状ペプチド。
【請求項2】
請求項1に記載の12残基の環状ペプチドの配列において、1つ目の3残基のアミノ酸が連続した前記連続領域の最初のアミノ酸を1番目として、
X1-His(またはCys)-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11
と示される配列からなり、
(X2、X3、X4、X5)と(X8、X9、X10、Y11)の組合せで、
それぞれ側鎖に同じ電荷を有するアミノ酸(Asp、Glu、Lys、Arg)の中から選択されたもの)が配され、
かつ、互いの組合せが逆の電荷になるように配されていることを特徴とする環状ペプチド。
【請求項3】
請求項2に記載の環状ペプチドにおいて、
X1とX6のそれぞれに、Gln,Asn若しくはTyrが配され、
及び/又は、
X7にHis, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸が配されていることを特徴とする環状ペプチド。
【請求項4】
請求項1に記載の12残基の環状ペプチドのアミノ酸配列が、Gln(L体)-His(L体)-Glu(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Gln(L体)-Asp(L体)-Lys(L体)-Lys(D体)-Lys(L体)-Lys(D体)(配列番号1)で示されることを特徴とする環状ペプチド。
【請求項5】
請求項1に記載の12残基の環状ペプチドの配列において、1つ目の3残基のアミノ酸が連続した前記連続領域の最初のアミノ酸を1番目として、
Y1-Y2-Y3-Y4-Y5-Y6-Y7-His(またはCys)-Y8-Y9-Y10-Y11
と示される配列からなり、
(Y1、Y9、Y10、Y11)と(Y4、Y5、Y6、Y7)の組合せで、
それぞれ側鎖に同じ電荷を有するアミノ酸(Asp、Glu、Lys、Arg)の中から選択されたもの)が配され、
かつ、互いの組合せが逆の電荷になるように配されていることを特徴とする環状ペプチド。
【請求項6】
請求項5に記載の環状ペプチドにおいて、
Y3とY8のそれぞれに、Gln,Asn若しくはTyrが配され、
及び/又は、
Y2にHis, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸が配されていることを特徴とする環状ペプチド。
【請求項7】
請求項1に記載の12残基の環状ペプチドのアミノ酸配列が、Lys(L体)-Asp(L体)-Gln(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Glu(L体)-His(L体)-Gln(L体)-Lys(D体)-Lys(L体)-Lys(D体)(配列番号2)で示されることを特徴とする環状ペプチド。
【請求項8】
金属イオンが環内部に向いているアミノ酸側鎖と配位結合されていることを特徴とする請求項1乃至7のいずれか1項に記載の環状ペプチド。
【請求項9】
金属イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることを特徴とする請求項4に記載の環状ペプチド。
【請求項10】
金属イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることを特徴とする請求項7に記載の環状ペプチド。
【請求項11】
2価の銅イオンが環内部に向いているアミノ酸側鎖と配位結合されていることを特徴とする請求項1乃至7のいずれか1項に記載の環状ペプチド。
【請求項12】
2価の銅イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることを特徴とする請求項4に記載の環状ペプチド。
【請求項13】
2価の銅イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることを特徴とする請求項7に記載の環状ペプチド。
【請求項14】
請求項1乃至7のいずれか1項に記載の環状ペプチドを用いて自己組織化によりナノスケールオーダの径を有する管状構造を形成させたことを特徴とするナノチューブ。
【請求項15】
請求項2乃至4のいずれか1項に記載の環状ペプチドと、請求項5乃至7のいずれか1項に記載の環状ペプチドとを混合して、自己組織化によりナノスケールオーダの径を有する管状構造を形成させたことを特徴とするナノチューブ。
【請求項16】
請求項8乃至13のいずれか1項に記載の環状ペプチドを用いて自己組織化によりナノスケールオーダの径の管状構造を形成し、かつ、管状構造内部に金属イオン若しくは銅イオンを配列化させたことを特徴とするナノチューブ。
【請求項17】
請求項9又は12に記載の環状ペプチドと、請求項10又は13に記載の環状ペプチドとを混合して、自己組織化によりナノスケールオーダの径を有する管状構造を形成し、かつ、管状構造内部に金属イオン若しくは銅イオンを配列化させたことを特徴とするナノチューブ。
【請求項18】
前記環状ペプチドが溶解した中性付近(pH6〜pH8)の水溶液に、所定の濃度の低級アルコールを加えた混合溶液を、常温常圧下に静置することにより作製することを特徴とする請求項14又は15に記載のナノチューブの製造方法。
【請求項19】
前記環状ペプチドが溶解した中性付近(pH6〜pH8)の水溶液に、前記環状ペプチドの全濃度に対して金属イオン若しくは銅イオンが0.5モル濃度存在する条件下で、所定の濃度の低級アルコールを加えた混合溶液を、常温常圧下に静置することにより作製することを特徴とする請求項16又は17に記載のナノチューブの製造方法。
【請求項20】
前記低級アルコールが、メタノール,エタノール,若しくはプロパノールでいずれかであることを特徴とする請求項18又は19に記載のナノチューブの製造方法。
【請求項21】
請求項16又は17に記載のナノチューブに対して、還元剤を用いて還元して作製される導電性ワイヤー。
【請求項1】
n残基(nは8,12,16,20,24)のアミノ酸から構成され、1残基目のN末端とn残基目のC末端がペプチド結合した環状ペプチドにおいて、
3残基のアミノ酸が連続してL−体もしくはD−体である連続領域が少なくとも2つ存在し、かつ、前記連続領域が隣接すること無く配された配列で、
それ以外のアミノ酸はL−体とD−体が交互に配された配列からなり、
3残基のアミノ酸が連続した前記連続領域では真ん中のアミノ酸残基の側鎖のみ環状ペプチドの環内部を向き、L−体とD−体が交互に配されたアミノ酸残基の側鎖は全て環状ペプチドの環外部を向く構造を形成していることを特徴とする環状ペプチド。
【請求項2】
請求項1に記載の12残基の環状ペプチドの配列において、1つ目の3残基のアミノ酸が連続した前記連続領域の最初のアミノ酸を1番目として、
X1-His(またはCys)-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11
と示される配列からなり、
(X2、X3、X4、X5)と(X8、X9、X10、Y11)の組合せで、
それぞれ側鎖に同じ電荷を有するアミノ酸(Asp、Glu、Lys、Arg)の中から選択されたもの)が配され、
かつ、互いの組合せが逆の電荷になるように配されていることを特徴とする環状ペプチド。
【請求項3】
請求項2に記載の環状ペプチドにおいて、
X1とX6のそれぞれに、Gln,Asn若しくはTyrが配され、
及び/又は、
X7にHis, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸が配されていることを特徴とする環状ペプチド。
【請求項4】
請求項1に記載の12残基の環状ペプチドのアミノ酸配列が、Gln(L体)-His(L体)-Glu(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Gln(L体)-Asp(L体)-Lys(L体)-Lys(D体)-Lys(L体)-Lys(D体)(配列番号1)で示されることを特徴とする環状ペプチド。
【請求項5】
請求項1に記載の12残基の環状ペプチドの配列において、1つ目の3残基のアミノ酸が連続した前記連続領域の最初のアミノ酸を1番目として、
Y1-Y2-Y3-Y4-Y5-Y6-Y7-His(またはCys)-Y8-Y9-Y10-Y11
と示される配列からなり、
(Y1、Y9、Y10、Y11)と(Y4、Y5、Y6、Y7)の組合せで、
それぞれ側鎖に同じ電荷を有するアミノ酸(Asp、Glu、Lys、Arg)の中から選択されたもの)が配され、
かつ、互いの組合せが逆の電荷になるように配されていることを特徴とする環状ペプチド。
【請求項6】
請求項5に記載の環状ペプチドにおいて、
Y3とY8のそれぞれに、Gln,Asn若しくはTyrが配され、
及び/又は、
Y2にHis, Cys, Arg, Lys, Glu, Gln, Asp, Asnの中から選択されたアミノ酸が配されていることを特徴とする環状ペプチド。
【請求項7】
請求項1に記載の12残基の環状ペプチドのアミノ酸配列が、Lys(L体)-Asp(L体)-Gln(L体)-Glu(D体)-Glu(L体)-Glu(D体)-Glu(L体)-His(L体)-Gln(L体)-Lys(D体)-Lys(L体)-Lys(D体)(配列番号2)で示されることを特徴とする環状ペプチド。
【請求項8】
金属イオンが環内部に向いているアミノ酸側鎖と配位結合されていることを特徴とする請求項1乃至7のいずれか1項に記載の環状ペプチド。
【請求項9】
金属イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることを特徴とする請求項4に記載の環状ペプチド。
【請求項10】
金属イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることを特徴とする請求項7に記載の環状ペプチド。
【請求項11】
2価の銅イオンが環内部に向いているアミノ酸側鎖と配位結合されていることを特徴とする請求項1乃至7のいずれか1項に記載の環状ペプチド。
【請求項12】
2価の銅イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることを特徴とする請求項4に記載の環状ペプチド。
【請求項13】
2価の銅イオンが環内部に向いているHis及びAspの2つのアミノ酸側鎖と配位結合されていることを特徴とする請求項7に記載の環状ペプチド。
【請求項14】
請求項1乃至7のいずれか1項に記載の環状ペプチドを用いて自己組織化によりナノスケールオーダの径を有する管状構造を形成させたことを特徴とするナノチューブ。
【請求項15】
請求項2乃至4のいずれか1項に記載の環状ペプチドと、請求項5乃至7のいずれか1項に記載の環状ペプチドとを混合して、自己組織化によりナノスケールオーダの径を有する管状構造を形成させたことを特徴とするナノチューブ。
【請求項16】
請求項8乃至13のいずれか1項に記載の環状ペプチドを用いて自己組織化によりナノスケールオーダの径の管状構造を形成し、かつ、管状構造内部に金属イオン若しくは銅イオンを配列化させたことを特徴とするナノチューブ。
【請求項17】
請求項9又は12に記載の環状ペプチドと、請求項10又は13に記載の環状ペプチドとを混合して、自己組織化によりナノスケールオーダの径を有する管状構造を形成し、かつ、管状構造内部に金属イオン若しくは銅イオンを配列化させたことを特徴とするナノチューブ。
【請求項18】
前記環状ペプチドが溶解した中性付近(pH6〜pH8)の水溶液に、所定の濃度の低級アルコールを加えた混合溶液を、常温常圧下に静置することにより作製することを特徴とする請求項14又は15に記載のナノチューブの製造方法。
【請求項19】
前記環状ペプチドが溶解した中性付近(pH6〜pH8)の水溶液に、前記環状ペプチドの全濃度に対して金属イオン若しくは銅イオンが0.5モル濃度存在する条件下で、所定の濃度の低級アルコールを加えた混合溶液を、常温常圧下に静置することにより作製することを特徴とする請求項16又は17に記載のナノチューブの製造方法。
【請求項20】
前記低級アルコールが、メタノール,エタノール,若しくはプロパノールでいずれかであることを特徴とする請求項18又は19に記載のナノチューブの製造方法。
【請求項21】
請求項16又は17に記載のナノチューブに対して、還元剤を用いて還元して作製される導電性ワイヤー。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2007−230901(P2007−230901A)
【公開日】平成19年9月13日(2007.9.13)
【国際特許分類】
【出願番号】特願2006−53253(P2006−53253)
【出願日】平成18年2月28日(2006.2.28)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
【公開日】平成19年9月13日(2007.9.13)
【国際特許分類】
【出願日】平成18年2月28日(2006.2.28)
【出願人】(504150450)国立大学法人神戸大学 (421)
【Fターム(参考)】
[ Back to top ]

