金属ポルフィリン誘導体、それを含むナノ粒子、及び光線力学的療法へのその使用
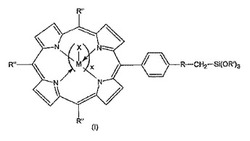
光線力学的療法を用いて癌細胞を同時に標的化、画像化及び治療することを可能にするナノベクターが開示される。ポルフィリンから誘導される新規の分子(I):

、それを含むシリカ系ナノ粒子、及び光線力学的療法におけるその使用も開示される。

、それを含むシリカ系ナノ粒子、及び光線力学的療法におけるその使用も開示される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明の主題は、光線力学的療法を用いて癌細胞を同時に標的化、画像化及び治療することを可能にするナノベクターである。特に、本発明は、ポルフィリンから誘導される新規の分子の使用、それを含有するシリカ質ナノ粒子、及び光線力学的療法におけるその使用に基づく。
【背景技術】
【0002】
光線力学的療法は、悪性組織に特異的に(preferentially)局在化し、可視範囲又は近赤外範囲の適切な波長の光源を用いて活性化されると、その過剰なエネルギーを周囲の分子状酸素へと伝達する或る特定の治療用分子(光増感剤と呼ばれる)の使用に基づく。この活性化によって、フリーラジカル及び一重項酸素等の活性酸素種が形成される。これらの活性酸素種、より具体的には一重項酸素は周囲の細胞にとって毒性であり、それらが近接する環境において悪性組織の破壊をもたらす(細胞膜を酸化し、それにより光増感剤を含有する細胞に対して不可逆的な損傷を引き起こす)。光線力学的療法は、第一に関連の組織の選択的照射、第二に標的組織に対する光増感剤の相対的選択性という二重の選択性に基づく。照射を行わない場合、光増感剤は細胞にとってあまり毒性ではないため、生物体におけるその拡散はごくわずかな障害しか引き起こさない。
【0003】
光増感剤は、in vivoで使用可能となるためには、幾つかの特質を有していなくてはならず、特に癌組織に容易に送達されることが可能でなくてはならない。光増感剤は水溶性であり、製造が容易であり、照射を行わない場合に無毒であり、循環酵素に対して安定でなくてはならず、腫瘍細胞に対して良好な指向性を有していなくてはならず、健常組織から急速に排除されるものでなくてはならない。しかしながら、光増感剤のカテゴリーに属する分子の大部分は疎水性であり、それを生物体へ、特に非経口的に導入するには、特定の剤型、特にコロイド懸濁液、リポソーム又はナノ粒子の形態の剤型を利用する必要がある。これらの剤型は、光増感剤を水性媒体中で安定化し、特に特異的な標的化分子を用いた標的組織へのその輸送を促進することを可能にするものである。これらの剤型の別の制約は、光増感剤の有効性、すなわち周囲の分子状酸素を活性酸素種へと変換するその能力を保持可能であることである。これは、一部の剤型は励起状態の光増感剤と相互作用し、その有効性を低減するためである。
【0004】
多孔性を制御したメソ多孔性ナノ粒子中の光増感剤の剤型は、光線力学的療法における用途のための有望な手法として登場した。かかる剤型は、特に特許文献1、特許文献2、非特許文献1に記載されている。
【0005】
しかしながら、これらの剤型は非常に多くの場合、光増感剤がその標的に到達する前に、生物体における該光増感剤の早過ぎる放出をもたらす。
【0006】
したがって、この早過ぎる放出を回避する手段を見つける必要があると考えられ、提案された解決策の一つは、光増感剤が共有結合したナノ粒子を開発することであった。
【0007】
非特許文献2は、有機修飾したシリカナノ粒子(ORMOSIL)に光増感剤を共有結合させた光線力学的療法用の光増感剤のナノ製剤(nanoformulations)を記載している。光増感剤はその分光学的特性及び機能的特性を保持しており、この小型の単分散ナノ粒子は癌細胞に対して良好な親和性を有し、高い細胞毒性効果を有する。使用される光増感剤は疎水性であるため、有機媒体中で合成を行うことが必要であるが、その溶媒は今日の産業では大規模使用を避けることが求められている。
【0008】
特許文献3は、ポルフィリンファミリーの光増感剤を結合させた発光ナノ粒子を記載している。この文献に記載されるナノ粒子は固体で非多孔性であり、CdS、CdSe又はZnO等の金属分子をベースとしており、光増感剤はこれらのナノ粒子の表面にシステインリンカーを介してグラフト化されている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第2004/067508号
【特許文献2】国際公開第2008/030624号
【特許文献3】米国特許出願公開第2007/0218049号
【非特許文献】
【0010】
【非特許文献1】I. Royet al., J. Am. Chem. Soc. 2003,125, 7860-7865
【非特許文献2】T.Y. Ohulchanskyy et al., Nanolett. 2007, 2835
【発明の概要】
【発明が解決しようとする課題】
【0011】
したがって、光増感剤を共有結合させた、多孔性を制御した新規のナノ粒子であって、該光増感剤がその分光学的特性及び機能的特性を保持し、これらのナノ粒子を毒性化合物及び/又は汚染化合物を使用しない単純な方法によって作製することが可能である、ナノ粒子が依然として必要とされている。
【課題を解決するための手段】
【0012】
下記式(I)に相当する新規の光増感剤の開発によって、かかるナノ粒子を作製することが可能であった。
【0013】
したがって、本発明の第1の主題は下記式(I)に相当する分子である:
【0014】
【化1】

【0015】
(式中、
xは0及び1から選択される整数を表し、
Mは遷移金属から選択される金属原子を表し、
Xはハロゲン化物、及び薬学的に許容されるカルボン酸のアニオンから選択される基を表し、
Rは以下のものから選択される基を表し:
任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖、
R’はC1〜C6アルキル、フェニル及びベンジルから選択される基を表し、
R’’は以下のものから選択される基を表し:
【0016】
【化2】

【0017】
Z+は薬学的に許容される有機又は無機カチオンを表し、
Y−は−COO−及び−SO3−から選択され得る基を表し、
A−はハロゲン化物、及び薬学的に許容されるカルボン酸のアニオンから選択され得るアニオンを表し、
R1はC1〜C10アルキルを表す)。
【0018】
C1〜C10アルキル基とは、1個〜10個の炭素原子を含有する直鎖、分岐又は環状炭化水素ベースの鎖である。
【0019】
xが0を表す場合、式(I)の化合物はポルフィリン誘導体であり、(M−X)基は2個の水素原子で置換される。
【0020】
xが1を表す場合、式(I)の化合物は金属ポルフィリン誘導体である。
【0021】
式(I)において、上記で規定した可変要素(variables)は、有利には以下の規則に従って独立して選択される:
好ましくは、MはZn、Pt、Pd、Mn、Gd、Ni、Cr及びRuから選択される金属原子を表す。
【0022】
好ましくは、XはCl−、Br−、I−、アセテート、プロピオネート、ブチレート、アスコルベート、ベンゾエート、シンナメート、シトレート、フマレート、グリコレート、マロネート、タートレート、マレート、マレエート、マンデレート及びトシレート、さらに好ましくはCl−、Br−、I−、アセテート及びトシレートから選択される基を表す。
【0023】
有利には、Rは、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C10アルキル鎖から選択される基を表し、
例えば、Rは以下のものから選択され得る:
【0024】
【化3】

【0025】
有利には、R’はC1〜C3アルキルから選択される基、例えばメチル、エチル、n−プロピル又はイソプロピル、好ましくはメチル又はエチルを表す。
【0026】
有利には、R1はC1〜C3アルキルから選択される基、例えばメチル、エチル、n−プロピル又はイソプロピル、さらに有利にはメチルを表す。
【0027】
好ましくは、Z+はK+、Li+、Na+及びNH4+から選択され得るカチオンを表す。
【0028】
好ましくは、A−はCl−、Br−、I−、アセテート、プロピオネート、ブチレート、アスコルベート、ベンゾエート、シンナメート、シトレート、フマレート、グリコレート(gycolate)、マロネート、タートレート、マレート、マレエート、マンデレート及びトシレート、さらに好ましくはCl−、Br−、I−、アセテート及びトシレートから選択され得るアニオンを表す。
【0029】
好ましいポルフィリン(I)は以下のリストに属する:
【0030】
【化4】

【0031】
式(I)に相当する分子は、周囲の分子状酸素を活性酸素種へと変換する良好な能力を有する水溶性光増感剤である。光増感剤は、その水溶性のために、それが共有結合したシリカ質ナノ粒子中に容易に配合することができる。また、これらのナノ粒子の合成は、本質的に水性の媒体中で行うことができる。
【0032】
Rが以下のものから選択され:
【0033】
【化5】

【0034】
R2が、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖から選択される基を表す場合、
式(I)の分子は、アミン官能基(function)を有するポルフィリン(II)をイソシアナトトリアルコキシシラン(又はRがNH−CS−NHR2を表す場合、イソチオシアナトアルコキシシラン)化合物と反応させる、下記スキーム1に記載されるプロセスを用いて調製することができる:
【0035】
【化6】

【0036】
イソシアネート官能基(又はRがNH−CS−NR2を表す場合、イソチオシアネート官能基)を有するポルフィリン(IV)をアミノアルキルトリアルコキシシラン化合物(V)と反応させる、スキーム2に従うプロセスを用いることも可能である:
【0037】
【化7】

【0038】
Rが−CO−NH−R2−基を表し、R2が、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖から選択される基を表す場合、
下記スキーム3に従ってカルボン酸基を有するポルフィリンから出発するカップリングを行うことが可能である:
【0039】
【化8】

【0040】
Rが−NH−R2−基又は−O−R2−基を表し、R2が、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖から選択される基を表す場合、
スキーム4及びスキーム5のそれぞれに示されるSN2型カップリングを行うことが可能である。
【0041】
【化9】

【0042】
Rが−O−CO−NH−R2−基を表し、R2が、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖から選択される基を表す場合、
スキーム6に示される方法に従ってカルバメートリンカーを形成することが可能である:
【0043】
【化10】

【0044】
式(I)のポルフィリンの調製については、以下の出発分子を使用してもよい:
フェニル−CO2H基を有するカチオン性ポルフィリンが、H. Yamaguchi et al, Chem. Eur. J., 2004, 10, 6179に記載されている。−CO2H基を有するアニオン性ポルフィリンが、米国特許第4783529号に記載されている。ヒドロキシフェニル基を有するアニオン性ポルフィリンが、欧州特許第891977号に記載されている。
【0045】
ピリジン基を有するポルフィリンの合成は、特に欧州特許第345171号に記載されている。かかる分子を、下記スキーム7に示される式(I)の分子を調製するために使用することができる:
【0046】
【化11】

【0047】
使用される出発製品(starting product)は、3個のピリジン基及び−R−CH2−リンカーの前駆体である適切な官能基Qを有するポルフィリン化合物(VI)である。次いで、ピリジン基を四級化して(VII)を得て、Q基を変換し、トリアルコキシシラン基をグラフト化させて、(I)を得る。
【0048】
本発明の主題はまた、上記式(I)に相当する少なくとも1つの光増感剤を含むナノ粒子の組成物である。これらのナノ粒子は、有利には組織的な(organized)多孔性を有する。
【0049】
「組織的な多孔性を有する(又は構造化された(structured)多孔性を有する)ナノ粒子」という用語は、細孔が三空間次元において規則的なスキームに従って幾何学的に分布したナノ粒子を意味することが意図される。組織的な多孔性の一例としては、ハニカム構造を挙げることができる。
【0050】
多孔性の構造的性質は以下のように種々の方法で観察することができる。
【0051】
組織的な多孔性を有するナノ粒子はX線回折スペクトルを有する。
【0052】
窒素吸着/脱着法(BET)によっても構造化された多孔性を特性化することが可能である。
【0053】
組織的な多孔性を有する構造を有するという事実によって、細胞における光増感剤から酸素へのエネルギー移動、及び一重項酸素を含む活性酸素種の放出が容易になる。また、金属カチオンMが反磁性であるか、又はx=0である場合、ポルフィリン(I)は蛍光を発するため、本発明のナノ粒子によって、癌組織が位置する領域を蛍光標識することが可能となる。また、一部の式(I)の分子は常磁性金属カチオン(ポルフィリン中のM)を含み、それにより生物体におけるナノ粒子の分布をNMR及びMRIによって追跡することが可能となる。これらの標識分子が多孔性を制御した組織的な構造中にあるという事実のために、画像分析が容易となる。
【0054】
有利には、本発明のナノ粒子はシリカ系である。これらのナノ粒子の製造は、光増感剤(I)の共有結合的グラフト化(covalent grafting)及び組織的な多孔性を有するネットワークの形成を可能にする条件下でシリカ質前駆体を重合する工程を含む。
【0055】
第1の変形形態(variant)によると、界面活性剤の存在下でのシリカ質前駆体の重合によって形成される、メソ多孔性シリカのナノ粒子を製造することが選択される。メソ多孔性シリカのナノ粒子は、高い比表面積、制御された容積及び細孔径を有するという利点を有する。本発明のナノ粒子は、有利には単分散性である。多孔性を制御した本発明のメソ多孔性シリカのナノ粒子は、直径80nm〜400nmの範囲の粒径、800m2/g〜1000m2/gの範囲の比表面積、及び2nm〜6nmの範囲の大きさの細孔を有する。これらのナノ粒子は、有利にはMCM41型である。
【0056】
シリカ系メソ多孔性ナノ粒子及びそれを合成するプロセスは、特にC.E. Fowler et al., Adv. Mater. 2001, 13, No. 9, 649-652に記載されている。同じ手順が本発明において用いられる。
【0057】
本発明のナノ粒子を製造するプロセスは、テトラエトキシシランを、臭化セチルトリメチルアンモニウム等の界面活性剤の存在下、式(I)の分子の存在下で塩基性水溶液中で重合することを特徴とする。
【0058】
第2の変形形態によると、微孔性シリカナノ粒子を製造することが選択される。本発明の微孔性ナノ粒子はシリカライト型であり、式(I)の分子、テトラエトキシシラン及び第四級アンモニウム型の構造化剤(例えば水酸化テトラプロピルアンモニウム)の存在下で、塩基性媒体中で合成される。本発明のナノ粒子は、有利には単分散性である。本発明のナノ粒子はさらに、微孔性であり、30nm〜80nmの直径、100m2/g〜450m2/gの範囲の比表面積、及び2Å〜20Åの範囲の細孔径を有する。
【0059】
シリカ系微孔性ナノ粒子及びそれを合成するプロセスは、特にT. Doussineau et al., Eur. J. Inorg. Chem. 2006, 2766-2772に記載されている。同じ手順が本発明において用いられる。
【0060】
これらのナノ粒子を製造するプロセスによって、式(I)の分子とナノ粒子との間に共有結合が形成され、それにより生物体における式(I)の分子の放出が回避され、その生物学的標的に特異的な式(I)の分子の輸送が促進される。
【0061】
好ましくは、本発明のナノ粒子の表面上に、新生物組織に特異的な標的化分子、すなわち受容体が癌細胞によって過剰発現されているか、又は癌細胞の表面にある生体分子をグラフト化させる。これらの標的化分子によって、生物学的標的へのナノ粒子の移動が容易になる。概して、これらの標的化分子は葉酸、ペプチド及び炭水化物から選択することができる。図4に示されるように、ポリマーリンカーを用いて標的化分子を本発明のナノ粒子にグラフト化させることができる。
【0062】
本発明のナノ粒子にグラフト化させることができる標的化分子の中でも、以下のものを挙げることができる:
ポリエチレンイミンリンカー又はポリエチレングリコール(PEG)リンカーを用いてシリカ質ナノ粒子にグラフト化させることができる、マンノース等の糖の誘導体。メソ多孔性シリカナノ粒子へのマンノースのグラフト化は、特にI. Young Park et al., International Journal of Pharmaceutics, 359, 2008, 280-287に記載されており、同じ手順を用いることができる。別の手法は、図5に示されるようにフェニルスクアレート−α−マンノースを使用することである;
ホルモン標的(LH−RH)を有するペプチド等のペプチド;
マンノース、マンノース−6−リン酸、グルコース、ガラクトース等の幾つかの単糖類誘導体又は二糖類誘導体を有する糖デンドリマー(glycodendrimers)。
【0063】
シリカ系微孔性ナノ粒子に生体分子をグラフト化させる方法は、特にT. Doussineau et al., Eur. J. Inorg. Chem. 2006, 2766-2722に記載されており、同じ手順を用いることができる。
【0064】
本発明の主題はまた、上記のナノ粒子製造工程を含む、腫瘍の治療及び/又は予防及び/又は検出を目的とする薬物を製造するプロセスである。
【0065】
一重項酸素の発生、したがって癌細胞の破壊は、光子励起によって誘発される。光源を用いてナノ粒子に照射した後、生成した一重項酸素によって腫瘍細胞を破壊することが可能となる。照射は630nm〜680nmの波長、2mW/cm2〜10mW/cm2の範囲の出力で行われる。得られる結果から、合成されるナノ粒子が、30%〜90%の量子収率で溶液中に一重項酸素を生成させるのに効果的であることが示される。これらのナノ粒子は、生体分子による表面官能基化の後に、活性成分のベクター化(vectorization)及び腫瘍細胞におけるそのエンドサイトーシスを可能にするものでなくてはならない。
【0066】
本発明のナノ粒子を用いて治療することが想定され得る様々な癌の中でも、網膜芽腫(Y−79細胞株)、大腸癌(HT29細胞株)、表皮癌(A 431)、肺癌(A 549)、乳癌(MDA−MB−231、MCF−7)、子宮頸癌(HeLa)、卵巣癌(PEO14)、さらに頭部癌及び頸部癌、消化管癌及び性器癌、並びに照射する(illuminated)ことができる任意の良性腫瘍又は癌性腫瘍を含むが、これらに限定されない全ての固形腫瘍を挙げることができる。
【0067】
エンドサイトーシスの後、細胞株を光増感剤の吸収帯の1つで照射し、ナノ粒子の有効性をMTTアッセイを用いて評価する。
【0068】
本発明のナノ粒子の組成物は、局所投与又は全身投与することができる。局所投与は、特にナノ粒子組成物を腫瘍領域の周辺に注射することによって行うことができる。表在性腫瘍の場合、ナノ粒子組成物を好適な剤型(galenical form)(溶液、懸濁液、ペースト、パッチ)で局所的に投与することができる。全身投与は静脈内、筋肉内、皮下、腹腔内又は直腸内に行うことができる。かかる剤型及びその用法は当業者に既知である。
【0069】
式(I)の活性剤に関する組成物の投与量は、患者の体重及び年齢、腫瘍の性質、位置及び発生段階、選択される投与経路並びに使用される照射線量に応じて調整される。
【0070】
組成物は、腫瘍及び/又はその症状の治療で知られる任意の他の活性成分を含んでいてもよい。組成物は、選択される投与方法に好適な製剤学(galenics)の従来の成分を含む。
【0071】
本発明の主題はまた、薬物として使用するための、特に腫瘍及び癌の予防及び/又は治療のための上記のナノ粒子である。
【図面の簡単な説明】
【0072】
【図1】アニオン性ポルフィリンを封入するシリカライトナノ粒子のX線回折図(diffractogram)である。
【図2】組織的な多孔性を有するメソ多孔性ナノ粒子のTEM写真である。
【図3】ナノ粒子DG015(NP−PS)、DB016(NP−マンノース)及びアリールスクアレート−α−マンノース(Sq−マンノース)のUVスペクトルを示す図である。
【図4】標的化分子をグラフト化させた本発明のナノ粒子を示す図である。
【図5】マンノース官能基化ナノ粒子の例を示す図である。
【図6】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図7】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図8】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図9】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図10】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図11】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図12】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図13】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図14】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【発明を実施するための形態】
【0073】
I 式(I)の分子の合成
A 水溶性カチオン性ポルフィリン8の合成
合成スキーム:
Diane L. Dick et al, J. Am. Chem. Soc. 1992, 114, 2664-2669によって記載される方法を用いて得られた化合物3(1当量)を、類似のメタ化合物に関してMartine Perree-Fauvet et al., Tetrahedron. 1996, 52, 13569-13588に記載されるように、標準的なアドラー法(Adler procedure)に従ってピリジンアルデヒド(3当量)及びピロール(4当量)と共に縮合すると、クロマトグラフィーの後、5.7%の収率でポルフィリン4が得られる。誘導体5は化合物4から、水中、還流下でヒドラジンで処理することによって定量的に得られる。ポルフィリン5とペプチド酸(peptidic acid)6とを、ジクロロメタン中、カップリング剤として1−ヒドロキシベンゾトリアゾール水和物(HOBt)、1−(3−ジメチルアミノプロピル)−3−エチルカルボジイミド塩酸塩(EDC)及びトリエチルアミンの存在下で反応させることによって、化合物7が得られる(収率:40%)(Daniel H. Rich, et al., J. Med. Chem. 1975, 18, 1004-1010)。化合物7を大過剰のヨウ化メチルで処理すると、水溶性ポルフィリン8が定量的に得られる。
【0074】
【化12】

【0075】
手順:
5−[p−(3−イソインドリン−1’,3’−ジオンプロポキシ)フェニル]−10,15,20−トリ−p−ピリジルポルフィリン4
ポルフィリン4は、沸騰プロピオン酸(400ml)中に溶解させたアルデヒド3(6.2g、20mmol)及び4−ピリジンカルボキサルデヒド(6.4g、60mmol)から調製する。次いで、ピロール(5.36g、80mmol)を滴下する。還流を2時間維持する。溶液を真空蒸発させる。CH2Cl2/EtOH混合物(100/5(v/v))で溶出を行うシリカゲルクロマトグラフィーによる1回目の精製を、最大量の不純物を除去するために行う。CH2Cl2、続いて漸増量のエタノール(0%から10%)で溶出を行う2回目の精製によって、6つのポルフィリンが分離される。5,10,15−トリピリジル−20−フェニルポルフィリン4は、CH2Cl2/EtOH混合物(94/6(v/v))によって溶出され(第3画分)、ジクロロメタン/メタノール混合物を用いて結晶化させると、青色の結晶の形態で得られる(収率:5.7%)。CH2Cl2中のUV−visスペクトル:λmax、nm(OD):418.5(1)、514.5(0.61)、549(0.31)、589(0.25)、646(0.16)。1H NMR(300MHz、CDCl3)δ9.05(m,6H,メタ−ピリジン)、8.95(d,J=4.7Hz,2H,ピロール)、8.85(s,4H,ピロール)、8.81(d,J=5Hz,2H,ピロール)、8.16(d,J=5.8Hz,6H,オルト−ピリジン)、8.07(d,J=8.4Hz,2H,メタ−フェニル)、7.93(dd,J=3.1,5.4Hz,2H,フタルイミド)、7.76(dd,J=3.0,5.4Hz,2H,フタルイミド)、7.12(d,J=8Hz,2H,オルト−フェニル)、4.35(t,8Hz,2H,O−CH2)、4.09(t,8Hz,2H,N−CH2)、2.40(m,2H,CH2)、−2.87(s,2H,NH)。
5−[p−(3−アミノプロポキシ)フェニル]−10,15,20−トリ−p−ピリジルポルフィリン5
ポルフィリン4(0.930g、1.13mmol)とヒドラジン一水和物(0.71ml、23mmol)との混合物を、16時間還流させた後、周囲温度で24時間攪拌する。HCl(10%溶液)を添加することによってフタルヒドラジドを沈殿させ、濾過する。NaOH(10%溶液)を添加することによって溶液を中和する。ポルフィリンをCH2Cl2/EtOH混合物(95/5(v/v))で水相から抽出する。硫酸ナトリウムで乾燥させて、濾過し、蒸発乾固すると、ポルフィリン5(0.760g)が純粋な青色の粉末の形態で得られる(収率:97%)。CH2Cl2中のUV−visスペクトル:λmax、nm(ε L.mmol−1.cm−1):418(224.9)、515(13.1)、550(6.5)、590(5.4)、647(4.1)。1H NMR(300MHz、CDCl3)δ9.05(m,6H,メタ−ピリジン)、8.95(d,J=4.7Hz,2H,ピロール)、8.85(s,4H,ピロール)、8.81(d,J=5Hz,2H,ピロール)、8.16(d,J=5.8Hz,6H,オルト−ピリジン)、8.10(d,J=8.4Hz,2H,メタ−フェニル),7.31(d,J=8Hz,2H,オルト−フェニル)、4.38(t,J=8Hz,2H,O−CH2)、3.09(t,J=8Hz,2H,N−CH2)、2.14(m,2H,CH2)、−2.87(s,2H,NH)。
5−{p−[3−(2’,5’−ジオキソ−2’,5’−ジヒドロ−1H−ピロール−1’−イル)−N−(3−フェノキシプロピル)プロパンアミド]フェニル}−10,15,20−トリ−p−ピリジルポルフィリン7
化合物5(160mg、0.23mmol)をCH2Cl2(40ml)中に溶解させる。HOBt(48mg、0.35mmol)、EDC(67mg、0.35mmol)、トリエチルアミン(48ml、0.35mmol)及び5−(2,5−ジオキソ−2,5−ジヒドロピロール−1−イル)プロピオン酸(80mg、0.46mmol)を添加する。混合物をアルゴン下、周囲温度で3時間攪拌する。CH2Cl2/エタノール混合物(90/10(v/v))で溶出を行うシリカゲル薄層クロマトグラフィー分析によって反応の終了を確認する。溶液をCH2Cl2/エタノール混合物(95/5(v/v))で希釈し、水で洗浄し(3回)、硫酸ナトリウムで乾燥させて、濾過した後、真空下で濃縮する。生成物を、CH2Cl2/メタノール混合物(9/1(v/v))で溶出を行う薄層クロマトグラフィー(Al2O3)によって精製する。CH2Cl2/エタノール/ヘプタン混合物から結晶化させると、化合物7が青色の粉末の形態で得られる(110mg、収率:57%)。CH2Cl2中のUV−visスペクトル:λmax、nm(ε L.mmol−1.cm−1):418(190.6)、516(13.7)、550(8.3)、591(7.1)、652(6.7)。エレクトロスプレー質量スペクトル:C51H39N9O4に対する計算値841.9、実測値842.66、M+1。1H NMR(300MHz、CDCl3)δ9.04(d,J=5.6Hz,6H,メタ−ピリジン)、8.92(d,J=5Hz,2H,ピロール)、8.83(s,4H,ピロール)、8.80(d,J=4.7Hz,2H,ピロール)、8.13(d,J=5.7Hz,6H,オルト−ピリジン)、8.10(d,J=8.5Hz,2H,メタ−フェニル)、7.30(d,J=8.6Hz,2H,オルト−フェニル)、4.32(t,8Hz,2H,O−CH2)、3.92(t,J=7.4Hz,2H,CH2−N)、3.63(t,J=7.8Hz,2H,CH2−NH−CO)、2.62(t,J=7Hz,2H,CH2−CO−NH)、2.19(t,2H,CH2)、−2.87(s,2H,NH)。13C NMR(300MHz、CDCl3)δ170.6(CON)、169.7(CO−NH)、158.8(パラ−フェニル)、150(ピリジン)、148.4(メタ−ピリジン)、135.7(オルト−フェニル)、134.3(エチレン)、134(フェニル)、131(ピロール)、129.4(オルト−ピリジン)、121.6(メソ−C)、117.4(メソ−C)、116.7(メソ−C)、112.8(メタ−フェニル)、66.6(C−O−)、37.5(C−NHCO)、34.9(C−N)、34.3(C−CONH)、29.2(C−C−O)。
5−{p−[3−(2’,5’−ジオキソ−2’,5’−ジヒドロ−1H−ピロール−1’−イル)−N−(3−フェノキシプロピル)プロパンアミド]フェニル]−10,15,20−トリ−p−ピリジニウムポルフィリントリクロリド8
ポルフィリン7(68mg、0.08mmol)及びヨウ化メチル(1ml)を、ジメチルホルムアミド(20ml)中に溶解させ、周囲温度で3時間攪拌する。溶液を真空下で濃縮した後、メタノール(10ml)で希釈する。IRA400樹脂(0.9g)を溶液に添加した後、懸濁液を1時間半穏やかに攪拌する。溶液を濾過した後、蒸発させる。メタノール/ジエチルエーテル混合物から結晶化させると、純粋な化合物が青色の粉末の形態で得られる(80mg、収率:100%)。MeOH中のUV−visスペクトル:λmax、nm(μL.mmol−1.cm−1):427(98.3)、518(12)、557(6.1)、593(4.1)、652(2.5)。MALDI−TOF質量スペクトル:C54H48N9O4Cl3に対する計算値993.38、実測値886.44、M−3Cl−、887.44、M+H−3Cl−。
B 水溶性アニオン性ポルフィリン9の合成
この化合物は、5,10,15,20−テトラフェニルポルフィリンから、Kruper et al., J. Org. Chem. 1989, 54, 2753-2756によって記載される方法を用いて全収率43%で調製される。
【0076】
【化13】

【0077】
II ナノ粒子の合成
A アニオン性ポルフィリンDB 003、DB 005ナノ粒子を封入するメソ多孔性ナノ粒子の合成
【0078】
【化14】

【0079】
DB 003:5mgのポルフィリン9(5.44×10−3mmol)を、15分間超音波をかけることによって、1mlのEtOH中に溶解させる。5当量(2.72×10−2mmol)のイソシアナトプロピルトリエトキシシランを、4当量(2.17×10−2mmol)のジイソプロピルエチルアミンと共に添加する。溶液を12時間周囲温度に維持する。
【0080】
686mg(1.8×10−3mol)の臭化セチルトリメチルアンモニウム(CTAB)を、40mlの0.2M水酸化ナトリウム中に25℃で溶解させる。先に調製した溶液を添加した後、テトラエトキシシラン(3.5ml、1.57×10−2mmol)を滴下する。40秒後、260mlの脱イオン水を添加する。溶液を6分間攪拌し続けた後、0.2M HCl(およそ50ml)を添加することによってpH7まで急速に中和する。ナノ粒子を遠心分離(20分間、20000rpm)によって回収し、超音波によってEtOH中に再懸濁して、遠心分離する。界面活性剤を、60℃で2時間、30mlのEtOH/12N HCl(4/1)溶液で処理することによって抽出する。遠心分離後、この操作を2回繰り返し、次いでナノ粒子を水中に再懸濁し、中性pHが得られるまで遠心分離する(5回)。
【0081】
代替的には、界面活性剤は硝酸アンモニウムでの処理によって除去することができる(Chem Mater, 2004, 10, 1961)。300mgのNH4NO3を150mlの95%EtOH中に溶解させる。500mgのナノ粒子をこの溶液中に懸濁し、超音波で15分間処理した後、溶液を60℃で15分間静置する(placed)。懸濁液を遠心分離によって回収し、超音波によってEtOH中に再分散させて、遠心分離する。この界面活性剤の抽出プロトコルを一度繰り返す。
【0082】
透過電子顕微鏡法(TEM)によって、約100nmのナノ粒子径を有するメソ細孔の六角形のネットワークの存在が示される。
【0083】
準弾性光散乱(DLS)によって、150nmの流体力学直径が確認される。
【0084】
BETによって、862m2/gの比表面積及び2nmの細孔径が示される。
【0085】
UV可視吸収分光分析(UV分析と称される)(EtOH)によって、共有結合的に封入されたポルフィリンの存在が確認される。ナノ粒子1g当たり3.3μmolのポルフィリン負荷量が得られる。
【0086】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に421nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は92%である。
【0087】
同じ手順を用いてDB 005ナノ粒子を合成するが、10mg(10.88×10−3mmol)のポルフィリン9、13.4μlのイソシアナトプロピルトリエトキシシラン及び7.4μlのジイソプロピルエチルアミンを使用する。
。
【0088】
透過電子顕微鏡法(TEM)によって、約100nmのナノ粒子径を有するメソ細孔の六角形のネットワークの存在が示される。
【0089】
準弾性光散乱(DLS)によって、200nmの流体力学直径が確認される。
【0090】
BETによって、891m2/gの比表面積及び2nmの細孔径が示される。
【0091】
UV可視吸収分光分析(UV分析と称される)(EtOH)によって、共有結合的に封入されたポルフィリンの存在が確認される。ナノ粒子1g当たり6.94μmolのポルフィリン負荷量が得られる。
【0092】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に421nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は32%である。
B ナノ粒子表面でのアミノプロピルトリエトキシシラン(APTS)のグラフト化−DB 015ナノ粒子、DB 019ナノ粒子
【0093】
【化15】

【0094】
DB 015:250mgのDB 003ナノ粒子を、30分間の超音波によって6mlの脱イオンH2O中に懸濁する。次いで、2.5mlのEtOH及び391μlのAPTSの溶液を滴下する。0.2M HClをpH=6となるまで添加する。反応混合物を20時間攪拌し、20000rpmで15分間遠心分離する。ナノ粒子をEtOHで洗浄し(超音波+遠心分離)、次いでソックスレー装置において20時間EtOHで洗浄する。得られた粒子の質量mは206mgである。
【0095】
アミン官能基を定性的ニンヒドリン試験によって特性化する。
【0096】
UV分析(EtOH)によって、ポルフィリンが依然として存在し、反応中に修飾されていないことが示される。
【0097】
BETによって、ナノ粒子の表面だけでなく、細孔中にもアミノプロピル基が存在するために比表面積が481m2/gまで減少したことが示される。
【0098】
APTSを固体の微量分析及び29Si NMRによって定量的に測定する。2.2mmol/gのアミノ負荷量が得られる。
【0099】
同じ手順を用いて、DB 005ナノ粒子からDB 019ナノ粒子を合成する。
【0100】
BETによって、ナノ粒子の表面だけでなく、細孔中にもアミノプロピル基が存在するために比表面積が545m2/gまで減少したことが示される。
C アニオン性ポルフィリンを封入するシリカライトナノ粒子の合成−DB 008ナノ粒子
【0101】
【化16】

【0102】
4mgのポルフィリン9(4.35×10−3mmol)を、15分間超音波をかけることによって、1mlのEtOH中に溶解させる。5当量(4.5μl)のイソシアナトプロピルトリエトキシシランを、4当量(3.04μl)のジイソプロピルエチルアミンと共に添加する。溶液を12時間周囲温度に維持した後、14mlの1M水酸化テトラプロピルアンモニウム水溶液、8.4mlのTEOS及び2mlの水を添加し、反応混合物を24時間周囲温度に維持する。次いで、溶液を攪拌せずに80℃のオーブンにおいて48時間静置する。冷却後、溶液を20000rpmで20分間遠心分離する(3回)。次いで、ナノ粒子を水中に再分散させ、遠心分離する。構造化剤の抽出を、EtOH/12N HCl(4/1)溶液を用いて60℃で2時間行う(2サイクル行う)。次いで、ナノ粒子を、3.5のpHが得られるまでH2Oで6回洗浄する(超音波による水中への分散及び遠心分離を6サイクル)。次いで、ナノ粒子をEtOHで2回洗浄する。
【0103】
ナノ粒子の粉末X線分析を行うが、この分析によってゼオライトの構造化されたネットワーク特性の存在が示される(図1)。
【0104】
DLSによって68nmの流体力学半径が得られる。
【0105】
BETによって300m2/gの比表面積が得られる。
【0106】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に421nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は31%である。
D カチオン性ポルフィリンを封入するシリカライトナノ粒子の合成−DB 011ナノ粒子
【0107】
【化17】

【0108】
4.9mgのポルフィリン10を、超音波によって1mlの無水EtOH中に溶解させる。2μlのアミノプロピルトリエトキシシランを添加し、反応混合物を一晩周囲温度に維持する。先の反応混合物を、ポリエチレンフラスコ中で、14mlの1M水酸化テトラプロピルアンモニウム水溶液、8.4mlのテトラエトキシシラン及び2mlのH2Oと共に激しく攪拌しながら溶解させる。溶液を周囲温度で24時間攪拌した後、80℃のオーブンにおいて攪拌せずに静置する。2日後、反応混合物を冷却し、次いで遠心分離する。ナノ粒子を超音波によって水中に再分散させた後、遠心分離する(3サイクル)。構造化剤を、EtOH/12N HCl(4/1)溶液を用いて60℃で2時間抽出する(2サイクル行う)。次いで、ナノ粒子を、3.5のpHが得られるまでH2Oで6回洗浄する(超音波による水中への分散−遠心分離を6サイクル)。次いで、ナノ粒子をEtOHで2回洗浄する。
X線回折:構造化されたネットワーク
DLS:92nm
BET:100m2/g。
E カチオン性ポルフィリンを封入するメソ多孔性ナノ粒子の合成−OH21ナノ粒子
【0109】
【化18】

【0110】
8mgのポルフィリン8(6.3×10−3mmol)を1mlのMeOH中に溶解させる。4.2mgのメルカプトプロピルトリメトキシシラン(21.78×10−3mmol)を添加し、反応混合物を周囲温度に一晩維持する。343mg(0.9×10−3mol)の臭化セチルトリメチルアンモニウム(CTAB)を、20mlの0.2M水酸化ナトリウム中に25℃で溶解させる。先に調製した溶液を、テトラエトキシシラン(1.75ml、0.8×10−2mmol)と共に添加する。40秒後、128mlの脱イオン水を添加する。溶液を6分間攪拌し続けた後、0.2M HCl(およそ25ml)を添加することによってpH7まで急速に中和する。ナノ粒子を遠心分離(20000rpmで20分間)によって回収し、超音波によってEtOH中に再懸濁して、遠心分離する。界面活性剤を、60℃で2時間、15mlのEtOH/12N HCl(4/1)溶液で処理することによって抽出する。遠心分離後、この操作を2回繰り返し、次いでナノ粒子を水中に再懸濁し、約6のpHが得られるまで遠心分離する(6回)。
【0111】
IR分析によって、界面活性剤の除去が確認される。
【0112】
TEMによって、約150nmのナノ粒子径を有するメソ細孔の六角形のネットワークの存在が示される。
【0113】
DLSによって311nmの流体力学直径が示される。
【0114】
UV分析(EtOH)によって、共有結合的に封入されたポルフィリンの存在が確認される。ナノ粒子1g当たり4.43μmolのポルフィリン負荷量が得られる。
【0115】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に431nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は58%である。
F カチオン性ポルフィリンを封入するメソ多孔性ナノ粒子の合成−OH22粒子
【0116】
【化19】

【0117】
12mgのポルフィリン10(1.1×10−2mmol)を1mlのMeOH中に溶解させる。4.88mgのアミノプロピルトリメトキシシラン(2.72×10−2mmol)を添加し、溶液を周囲温度に一晩維持する。343mg(0.9×10−3mol)の臭化セチルトリメチルアンモニウム(CTAB)を、20mlの0.2M水酸化ナトリウム中に25℃で溶解させる。テトラエトキシシラン(1.75ml、0.8×10−2mmol)を、先に調製した溶液と共に滴下する。40秒後、128mlの脱イオン水を添加する。溶液を6分間攪拌し続けた後、0.2M HCl(およそ25ml)を添加することによってpH7まで急速に中和する。ナノ粒子を遠心分離(20000rpmで20分間)によって回収し、超音波によってEtOH中に再懸濁して、遠心分離する。界面活性剤を、60℃で2時間、15mlのEtOH/12N HCl(4/1)溶液で処理することによって抽出する。遠心分離後、この操作を2回繰り返し、次いでナノ粒子を水中に再懸濁し、約6のpHが得られるまで遠心分離する(6回)。
【0118】
IR分析によって、界面活性剤の除去が確認される。
【0119】
TEM(図2)によって、約150nmのナノ粒子径を有するメソ細孔の六角形のネットワークの存在が示される。
【0120】
DLSによって153nmの流体力学直径が示される。
【0121】
UV分析(EtOH)によって、共有結合的に封入されたポルフィリンの存在が確認される。ナノ粒子1g当たり0.97μmolのポルフィリン負荷量が得られる。
【0122】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に431nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は60%である。
G ナノ粒子表面でのα−マンノースのグラフト化
DB016粒子:
【0123】
【化20】

【0124】
上記§Bで調製されるアミノ化DB 015ナノ粒子100mgを、10分間の超音波によって5mlのEtOH中に分散させる。59mg(0.15mmol)のα−マンノースアリールスクアレートを、5mlのEtOH/H2O混合物(50/50)中に溶解させる。この溶液を上記の溶液に滴下する。500μlのトリエチルアミンを添加し、懸濁液を18時間攪拌する。遠心分離後、ナノ粒子を水中に再分散させ、遠心分離する(3サイクル)。次いで、これをEtOH中に再分散させ、遠心分離する(2サイクル)。
【0125】
DLS分析によって173nmの流体力学直径が示される。
【0126】
UV分析によって、ポルフィリン及び芳香核−スクアレートの存在が確認される(図3)。
DB 021ナノ粒子:
【0127】
【化21】

【0128】
250mg(7.35×10−5mol)のH2N−PEG−CO2H(モル質量:3400)を、1.25mlの蒸留水中に溶解させる。2当量(0.0148mol)のトリエチルアミンを添加する。81mg(2.5当量)のフェニルスクアレート−マンノースを、1mlの水中に溶解させる。この溶液を先の溶液に滴下する。反応混合物を周囲温度に15時間維持する。DMFを蒸発させた後、PEGをエーテルから結晶化させ、これを蒸発させる。
【0129】
66mg(2×10−5mol)の先の生成物及び256mg(9×10−5mol)のHO2C−PEG−OHを10mlのDMF中に溶解させる。21μlのEt3N、15mgのNHS(N−ヒドロキシスクシンイミド)及び30mgのDCC(ジシクロヘキシルカルボジイミド)を添加する。反応混合物を周囲温度に一晩維持した後、200mgのDB 019ナノ粒子を添加する。20時間後、溶液を遠心分離し、ナノ粒子を超音波によってDMF中に再懸濁し、次いで溶液を再度遠心分離する。DMFでの洗浄を一度繰り返し、次いでナノ粒子を水で3回、EtOHで2回洗浄する。
【0130】
178mgのDB 021ナノ粒子が得られる。
H ナノ粒子表面でのα−マンノース−6−カルボキシレートのグラフト化(DB 054粒子)
【0131】
【化22】

【0132】
56mgのDB 015アミノ化ナノ粒子を、10分間の超音波によって5mlのEtOH中に再分散させる。25mg(0.055mmol)のα−マンノース−6−カルボキシレートスクアリン酸塩を、5mlのEtOH/H2O混合物(3/2)中に溶解させる。この溶液を上記の溶液に滴下する。400μlのトリエチルアミンを添加し、懸濁液を17時間攪拌する。遠心分離後、ナノ粒子を水中で再分散させて遠心分離し(3サイクル)、次いでEtOH中に再分散させて遠心分離する(3サイクル)。
【0133】
33mgのDB 054ナノ粒子が得られる。
III 生物活性:
生体分子によって官能基化されていないか、又は官能基化された様々なナノ粒子の光線力学的療法(PDT)における活性を、様々な細胞株において評価する。癌細胞中に内在化されたナノ粒子の細胞毒性効果を、封入されたポルフィリンの単一光子励起の後、試験する。PDTの効果は、非照射粒子の相対的無害性(innocuousness)によって示される。ナノ粒子の標的化及びエンドサイトーシスの特異性は、官能基化ナノ粒子と対応する生体分子との共インキュベーション(coincubation)によって示される。
【実施例】
【0134】
実施例1:MDA−MB−231乳癌細胞に対するOH21ナノ粒子のPDT活性(図6)
実験条件:37℃及び5%CO2の加湿雰囲気下で、10%のFCSを添加したダルベッコ変法イーグル培地中での培養下に維持したMDA−MB−231乳癌細胞を、100μlの培地中、1ウェル当たり30000個の細胞の密度で96ウェルプレートに播種する。食作用を行う能力を有するMDA−MB−231乳癌細胞を、20μg/mlのナノ粒子と共に24時間インキュベートし、650nmのレーザー(出力:2mW/cm2〜10mW/cm2)を用いて40分間照射する。照射の2日後、生細胞を、MTT(3−(4,5−ジメチルチアゾール−2−イル)−2,5−ジフェニルテトラゾリウムブロミド、Sigma)酵素アッセイを用いて定量化する。
結果:光線力学的療法の効果は、細胞増殖の92%の阻害に反映される。非照射ナノ粒子の毒性がないこと、及びナノ粒子の非存在下で照射の毒性がないことから、これらのナノ粒子を用いた光線力学的療法の特異性が実証される。細胞をDAPIによる核の蛍光標識によって可視化する。得られた画像から、本発明のナノ粒子を用いた光線力学的療法の特異性が示される。細胞死は、照射領域内及びナノ粒子の存在下において明らかであり、限定的である。
【0135】
実施例2:POE14卵巣癌細胞に対するOH21ナノ粒子のPDT活性(図7)
実験条件:実施例1に記載されるように培養下に維持したPOE14細胞を、10μg/mlに低下させたナノ粒子濃度で24時間インキュベートし、実施例1に記載されるように照射する。照射の2日後、培地にMTTを添加することによって、生細胞数を定量化することが可能となる。
結果:POE14細胞と共にインキュベートしたナノ粒子への照射によって、対照細胞又は照射のみを行った細胞と比較して82%の細胞死が誘発される。この細胞型では、非照射ナノ粒子は、生細胞数のおよそ30%の減少を誘発する。この毒性から、特異的標的化の必要性が実証される。
【0136】
実施例3:MDA−MB−231乳癌細胞に対するOH21及びOH22カチオン性ナノ粒子並びにDB003及びDB005アニオン性粒子のPDT活性(図8)
実験条件:実施例1と同一。
結果:得られる結果によって、アニオン性ポルフィリン又はカチオン性ポルフィリンのいずれかを含有するナノ粒子の効果を比較することが可能となる。図8は、試験した全ての照射ナノ粒子が、照射前の最初の細胞播種に相当するT0値と比較して、MDA−MB−231細胞の増殖を完全に阻害することを示す。また、カチオン性ポルフィリンを含有するOH21ナノ粒子及びOH22ナノ粒子への照射は、対照(非処理細胞)と比較してそれぞれ51.3%及び57.2%の細胞死を誘発する。アニオン性ポルフィリンを含有するDB003ナノ粒子及びDB005ナノ粒子は、照射後にそれぞれ37.1%及び54%の細胞死を誘発する。或る特定の非照射ナノ粒子の(低いが有意である)細胞毒性によって、マンノースによる特異的標的化の利点が実証される。
【0137】
実施例4:MDA−MB−231乳癌細胞に対するマンノース官能基化アニオン性ナノ粒子のPDT活性(図9)
実験条件:実施例1と同一。
結果:得られる結果によって、マンノースで被覆されていないか、又は被覆されたアニオン性ポルフィリンを含有するナノ粒子の効果を比較することが可能となる。表面にマンノース残基がグラフト化されたDB016ナノ粒子及びDB021ナノ粒子は、それぞれ100%及び99%の細胞死を誘発する。これらの結果から、マンノースによる標的化によるナノ粒子の細胞毒性効果の増大が実証される。
【0138】
実施例5:過剰のマンノースの存在下又は非存在下における、MDA−MB−231乳癌細胞に対するマンノース官能基化又は非官能基化アニオン性ナノ粒子のPDT活性の比較(図10)
実験条件:細胞を、20μg/mlのナノ粒子(DB021又はDB005)の存在下又は非存在下で、任意でマンノース(10−2M)を添加した培地中で6時間インキュベートする。6時間のインキュベーション後、培地中のナノ粒子を取り除き、細胞を2回すすいだ後、100μlの新鮮培地中で培養する。次いで、細胞を40分間、2mW/cm2〜10mW/cm2の出力で630nm〜680nmの波長でのレーザー照射に付す。照射の48時間後、生細胞をMTTによって明らかにし(A)、定量化する(B)。
結果:図10Aは、非処理細胞における対照レベルのMTT蓄積を示す。照射に付したDB021ナノ粒子と共に細胞をインキュベートすることによって、細胞死がもたらされる。この現象は、過剰のマンノースとのプレインキュベーションによって阻止される。照射DB005ナノ粒子は細胞死を誘発しない。生細胞の定量化(図10B)によって、これらの所見が確認される。6時間インキュベートしたDB021ナノ粒子による細胞毒性は、わずか2%〜10%であるが(±マンノース)、DB021ナノ粒子への照射によって、70%の細胞死が誘発される。過剰のマンノースの添加によって、この効果が大幅に妨げられ、それにより内在化の特異性が実証される。さらに、照射又は非照射DB005ナノ粒子はわずか5%〜10%の細胞死しか誘発しない。
【0139】
実施例6:MDA−MB−231乳癌細胞に対するDB008及びDB011シリカライトナノ粒子のPDT活性(図11)
実験条件:実施例1と同一。
結果:得られる結果から、DB008及びDB011シリカライトナノ粒子が、照射しなかった場合、8.3%及び5.3%という低い毒性を示すことが示される。これらのナノ粒子と共に(24時間)インキュベートした細胞への照射によっては、完全な増殖の阻害及びおよそ60%の細胞死が誘発される。
【0140】
実施例7:LNCaP前立腺癌細胞に対するDB054ナノ粒子のPDT活性:DB054内在化の特異性(図12)
実験条件:ヒト前立腺癌細胞(LNCaP)を、過剰のM6Pの存在下又は非存在下で、DB054ナノ粒子と共に無血清培地中、37℃で1時間インキュベートした後、レーザー照射に付す(660nm、6mW/cm2〜7mW/cm2、40分間)。生細胞の割合を、MTS試験(Promega)を用いて測定する。グラフ表示は3回の独立実験の平均に相当する。
結果:得られる結果から、DB054ナノ粒子が1時間の処理の後、47%の細胞死を誘発することが示される。この効果は、培地に10mM M6Pを過剰に添加することによって阻止され、それによりM6Pに対する膜受容体を介したDB054ナノ粒子の内在化が実証される。
【0141】
実施例8:LNCaP前立腺癌細胞に対するDB054ナノ粒子のPDT活性:DB054の経時的な効果の変動(図13)
実験条件:ヒト前立腺癌細胞(LNCaP)を、種々の期間(1時間、3時間、24時間)、DB054ナノ粒子と共にインキュベートした後、レーザー照射に付す(660nm、6mW/cm2〜7mW/cm2、40分間)。生細胞の割合を、MTS試験(Promega)を用いて測定する。グラフ表示は3回の独立実験の平均に相当する。
結果:得られる結果から、DB054ナノ粒子が1時間、3時間及び24時間の処理の後、それぞれ47%、96%及び100%の細胞毒性(cyttotoxicity)を誘発することが示される。これらの結果によって、ナノ粒子の急速な作用が実証される。
【0142】
実施例9:ヒト網膜芽腫細胞に対するDB016ナノ粒子及びDB054ナノ粒子のPDT活性(図14)
実験条件:ヒト網膜芽腫細胞(Y−79)を、DB054ナノ粒子及びDB016ナノ粒子と共に完全培地中、37℃で1時間インキュベートした後、レーザー照射に付す(660nm、6mW/cm2〜7mW/cm2、40分間)。生細胞の割合を、MTS試験(Promega)を用いて測定する。グラフ表示は3回の独立実験の平均に相当する。
結果:得られる結果から、DB054ナノ粒子及びDB016ナノ粒子が、それぞれ33%及び38%の細胞毒性(cell cytotoxicity)を誘発することが示される。このことから、マンノース−6−リン酸又はマンノースで官能基化されたナノ粒子が、Y−79細胞の表面に存在する様々なレクチンを介して効率的に内在化され得ることが実証される。
【技術分野】
【0001】
本発明の主題は、光線力学的療法を用いて癌細胞を同時に標的化、画像化及び治療することを可能にするナノベクターである。特に、本発明は、ポルフィリンから誘導される新規の分子の使用、それを含有するシリカ質ナノ粒子、及び光線力学的療法におけるその使用に基づく。
【背景技術】
【0002】
光線力学的療法は、悪性組織に特異的に(preferentially)局在化し、可視範囲又は近赤外範囲の適切な波長の光源を用いて活性化されると、その過剰なエネルギーを周囲の分子状酸素へと伝達する或る特定の治療用分子(光増感剤と呼ばれる)の使用に基づく。この活性化によって、フリーラジカル及び一重項酸素等の活性酸素種が形成される。これらの活性酸素種、より具体的には一重項酸素は周囲の細胞にとって毒性であり、それらが近接する環境において悪性組織の破壊をもたらす(細胞膜を酸化し、それにより光増感剤を含有する細胞に対して不可逆的な損傷を引き起こす)。光線力学的療法は、第一に関連の組織の選択的照射、第二に標的組織に対する光増感剤の相対的選択性という二重の選択性に基づく。照射を行わない場合、光増感剤は細胞にとってあまり毒性ではないため、生物体におけるその拡散はごくわずかな障害しか引き起こさない。
【0003】
光増感剤は、in vivoで使用可能となるためには、幾つかの特質を有していなくてはならず、特に癌組織に容易に送達されることが可能でなくてはならない。光増感剤は水溶性であり、製造が容易であり、照射を行わない場合に無毒であり、循環酵素に対して安定でなくてはならず、腫瘍細胞に対して良好な指向性を有していなくてはならず、健常組織から急速に排除されるものでなくてはならない。しかしながら、光増感剤のカテゴリーに属する分子の大部分は疎水性であり、それを生物体へ、特に非経口的に導入するには、特定の剤型、特にコロイド懸濁液、リポソーム又はナノ粒子の形態の剤型を利用する必要がある。これらの剤型は、光増感剤を水性媒体中で安定化し、特に特異的な標的化分子を用いた標的組織へのその輸送を促進することを可能にするものである。これらの剤型の別の制約は、光増感剤の有効性、すなわち周囲の分子状酸素を活性酸素種へと変換するその能力を保持可能であることである。これは、一部の剤型は励起状態の光増感剤と相互作用し、その有効性を低減するためである。
【0004】
多孔性を制御したメソ多孔性ナノ粒子中の光増感剤の剤型は、光線力学的療法における用途のための有望な手法として登場した。かかる剤型は、特に特許文献1、特許文献2、非特許文献1に記載されている。
【0005】
しかしながら、これらの剤型は非常に多くの場合、光増感剤がその標的に到達する前に、生物体における該光増感剤の早過ぎる放出をもたらす。
【0006】
したがって、この早過ぎる放出を回避する手段を見つける必要があると考えられ、提案された解決策の一つは、光増感剤が共有結合したナノ粒子を開発することであった。
【0007】
非特許文献2は、有機修飾したシリカナノ粒子(ORMOSIL)に光増感剤を共有結合させた光線力学的療法用の光増感剤のナノ製剤(nanoformulations)を記載している。光増感剤はその分光学的特性及び機能的特性を保持しており、この小型の単分散ナノ粒子は癌細胞に対して良好な親和性を有し、高い細胞毒性効果を有する。使用される光増感剤は疎水性であるため、有機媒体中で合成を行うことが必要であるが、その溶媒は今日の産業では大規模使用を避けることが求められている。
【0008】
特許文献3は、ポルフィリンファミリーの光増感剤を結合させた発光ナノ粒子を記載している。この文献に記載されるナノ粒子は固体で非多孔性であり、CdS、CdSe又はZnO等の金属分子をベースとしており、光増感剤はこれらのナノ粒子の表面にシステインリンカーを介してグラフト化されている。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第2004/067508号
【特許文献2】国際公開第2008/030624号
【特許文献3】米国特許出願公開第2007/0218049号
【非特許文献】
【0010】
【非特許文献1】I. Royet al., J. Am. Chem. Soc. 2003,125, 7860-7865
【非特許文献2】T.Y. Ohulchanskyy et al., Nanolett. 2007, 2835
【発明の概要】
【発明が解決しようとする課題】
【0011】
したがって、光増感剤を共有結合させた、多孔性を制御した新規のナノ粒子であって、該光増感剤がその分光学的特性及び機能的特性を保持し、これらのナノ粒子を毒性化合物及び/又は汚染化合物を使用しない単純な方法によって作製することが可能である、ナノ粒子が依然として必要とされている。
【課題を解決するための手段】
【0012】
下記式(I)に相当する新規の光増感剤の開発によって、かかるナノ粒子を作製することが可能であった。
【0013】
したがって、本発明の第1の主題は下記式(I)に相当する分子である:
【0014】
【化1】

【0015】
(式中、
xは0及び1から選択される整数を表し、
Mは遷移金属から選択される金属原子を表し、
Xはハロゲン化物、及び薬学的に許容されるカルボン酸のアニオンから選択される基を表し、
Rは以下のものから選択される基を表し:
任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖、
R’はC1〜C6アルキル、フェニル及びベンジルから選択される基を表し、
R’’は以下のものから選択される基を表し:
【0016】
【化2】

【0017】
Z+は薬学的に許容される有機又は無機カチオンを表し、
Y−は−COO−及び−SO3−から選択され得る基を表し、
A−はハロゲン化物、及び薬学的に許容されるカルボン酸のアニオンから選択され得るアニオンを表し、
R1はC1〜C10アルキルを表す)。
【0018】
C1〜C10アルキル基とは、1個〜10個の炭素原子を含有する直鎖、分岐又は環状炭化水素ベースの鎖である。
【0019】
xが0を表す場合、式(I)の化合物はポルフィリン誘導体であり、(M−X)基は2個の水素原子で置換される。
【0020】
xが1を表す場合、式(I)の化合物は金属ポルフィリン誘導体である。
【0021】
式(I)において、上記で規定した可変要素(variables)は、有利には以下の規則に従って独立して選択される:
好ましくは、MはZn、Pt、Pd、Mn、Gd、Ni、Cr及びRuから選択される金属原子を表す。
【0022】
好ましくは、XはCl−、Br−、I−、アセテート、プロピオネート、ブチレート、アスコルベート、ベンゾエート、シンナメート、シトレート、フマレート、グリコレート、マロネート、タートレート、マレート、マレエート、マンデレート及びトシレート、さらに好ましくはCl−、Br−、I−、アセテート及びトシレートから選択される基を表す。
【0023】
有利には、Rは、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C10アルキル鎖から選択される基を表し、
例えば、Rは以下のものから選択され得る:
【0024】
【化3】

【0025】
有利には、R’はC1〜C3アルキルから選択される基、例えばメチル、エチル、n−プロピル又はイソプロピル、好ましくはメチル又はエチルを表す。
【0026】
有利には、R1はC1〜C3アルキルから選択される基、例えばメチル、エチル、n−プロピル又はイソプロピル、さらに有利にはメチルを表す。
【0027】
好ましくは、Z+はK+、Li+、Na+及びNH4+から選択され得るカチオンを表す。
【0028】
好ましくは、A−はCl−、Br−、I−、アセテート、プロピオネート、ブチレート、アスコルベート、ベンゾエート、シンナメート、シトレート、フマレート、グリコレート(gycolate)、マロネート、タートレート、マレート、マレエート、マンデレート及びトシレート、さらに好ましくはCl−、Br−、I−、アセテート及びトシレートから選択され得るアニオンを表す。
【0029】
好ましいポルフィリン(I)は以下のリストに属する:
【0030】
【化4】

【0031】
式(I)に相当する分子は、周囲の分子状酸素を活性酸素種へと変換する良好な能力を有する水溶性光増感剤である。光増感剤は、その水溶性のために、それが共有結合したシリカ質ナノ粒子中に容易に配合することができる。また、これらのナノ粒子の合成は、本質的に水性の媒体中で行うことができる。
【0032】
Rが以下のものから選択され:
【0033】
【化5】

【0034】
R2が、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖から選択される基を表す場合、
式(I)の分子は、アミン官能基(function)を有するポルフィリン(II)をイソシアナトトリアルコキシシラン(又はRがNH−CS−NHR2を表す場合、イソチオシアナトアルコキシシラン)化合物と反応させる、下記スキーム1に記載されるプロセスを用いて調製することができる:
【0035】
【化6】

【0036】
イソシアネート官能基(又はRがNH−CS−NR2を表す場合、イソチオシアネート官能基)を有するポルフィリン(IV)をアミノアルキルトリアルコキシシラン化合物(V)と反応させる、スキーム2に従うプロセスを用いることも可能である:
【0037】
【化7】

【0038】
Rが−CO−NH−R2−基を表し、R2が、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖から選択される基を表す場合、
下記スキーム3に従ってカルボン酸基を有するポルフィリンから出発するカップリングを行うことが可能である:
【0039】
【化8】

【0040】
Rが−NH−R2−基又は−O−R2−基を表し、R2が、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖から選択される基を表す場合、
スキーム4及びスキーム5のそれぞれに示されるSN2型カップリングを行うことが可能である。
【0041】
【化9】

【0042】
Rが−O−CO−NH−R2−基を表し、R2が、任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖から選択される基を表す場合、
スキーム6に示される方法に従ってカルバメートリンカーを形成することが可能である:
【0043】
【化10】

【0044】
式(I)のポルフィリンの調製については、以下の出発分子を使用してもよい:
フェニル−CO2H基を有するカチオン性ポルフィリンが、H. Yamaguchi et al, Chem. Eur. J., 2004, 10, 6179に記載されている。−CO2H基を有するアニオン性ポルフィリンが、米国特許第4783529号に記載されている。ヒドロキシフェニル基を有するアニオン性ポルフィリンが、欧州特許第891977号に記載されている。
【0045】
ピリジン基を有するポルフィリンの合成は、特に欧州特許第345171号に記載されている。かかる分子を、下記スキーム7に示される式(I)の分子を調製するために使用することができる:
【0046】
【化11】

【0047】
使用される出発製品(starting product)は、3個のピリジン基及び−R−CH2−リンカーの前駆体である適切な官能基Qを有するポルフィリン化合物(VI)である。次いで、ピリジン基を四級化して(VII)を得て、Q基を変換し、トリアルコキシシラン基をグラフト化させて、(I)を得る。
【0048】
本発明の主題はまた、上記式(I)に相当する少なくとも1つの光増感剤を含むナノ粒子の組成物である。これらのナノ粒子は、有利には組織的な(organized)多孔性を有する。
【0049】
「組織的な多孔性を有する(又は構造化された(structured)多孔性を有する)ナノ粒子」という用語は、細孔が三空間次元において規則的なスキームに従って幾何学的に分布したナノ粒子を意味することが意図される。組織的な多孔性の一例としては、ハニカム構造を挙げることができる。
【0050】
多孔性の構造的性質は以下のように種々の方法で観察することができる。
【0051】
組織的な多孔性を有するナノ粒子はX線回折スペクトルを有する。
【0052】
窒素吸着/脱着法(BET)によっても構造化された多孔性を特性化することが可能である。
【0053】
組織的な多孔性を有する構造を有するという事実によって、細胞における光増感剤から酸素へのエネルギー移動、及び一重項酸素を含む活性酸素種の放出が容易になる。また、金属カチオンMが反磁性であるか、又はx=0である場合、ポルフィリン(I)は蛍光を発するため、本発明のナノ粒子によって、癌組織が位置する領域を蛍光標識することが可能となる。また、一部の式(I)の分子は常磁性金属カチオン(ポルフィリン中のM)を含み、それにより生物体におけるナノ粒子の分布をNMR及びMRIによって追跡することが可能となる。これらの標識分子が多孔性を制御した組織的な構造中にあるという事実のために、画像分析が容易となる。
【0054】
有利には、本発明のナノ粒子はシリカ系である。これらのナノ粒子の製造は、光増感剤(I)の共有結合的グラフト化(covalent grafting)及び組織的な多孔性を有するネットワークの形成を可能にする条件下でシリカ質前駆体を重合する工程を含む。
【0055】
第1の変形形態(variant)によると、界面活性剤の存在下でのシリカ質前駆体の重合によって形成される、メソ多孔性シリカのナノ粒子を製造することが選択される。メソ多孔性シリカのナノ粒子は、高い比表面積、制御された容積及び細孔径を有するという利点を有する。本発明のナノ粒子は、有利には単分散性である。多孔性を制御した本発明のメソ多孔性シリカのナノ粒子は、直径80nm〜400nmの範囲の粒径、800m2/g〜1000m2/gの範囲の比表面積、及び2nm〜6nmの範囲の大きさの細孔を有する。これらのナノ粒子は、有利にはMCM41型である。
【0056】
シリカ系メソ多孔性ナノ粒子及びそれを合成するプロセスは、特にC.E. Fowler et al., Adv. Mater. 2001, 13, No. 9, 649-652に記載されている。同じ手順が本発明において用いられる。
【0057】
本発明のナノ粒子を製造するプロセスは、テトラエトキシシランを、臭化セチルトリメチルアンモニウム等の界面活性剤の存在下、式(I)の分子の存在下で塩基性水溶液中で重合することを特徴とする。
【0058】
第2の変形形態によると、微孔性シリカナノ粒子を製造することが選択される。本発明の微孔性ナノ粒子はシリカライト型であり、式(I)の分子、テトラエトキシシラン及び第四級アンモニウム型の構造化剤(例えば水酸化テトラプロピルアンモニウム)の存在下で、塩基性媒体中で合成される。本発明のナノ粒子は、有利には単分散性である。本発明のナノ粒子はさらに、微孔性であり、30nm〜80nmの直径、100m2/g〜450m2/gの範囲の比表面積、及び2Å〜20Åの範囲の細孔径を有する。
【0059】
シリカ系微孔性ナノ粒子及びそれを合成するプロセスは、特にT. Doussineau et al., Eur. J. Inorg. Chem. 2006, 2766-2772に記載されている。同じ手順が本発明において用いられる。
【0060】
これらのナノ粒子を製造するプロセスによって、式(I)の分子とナノ粒子との間に共有結合が形成され、それにより生物体における式(I)の分子の放出が回避され、その生物学的標的に特異的な式(I)の分子の輸送が促進される。
【0061】
好ましくは、本発明のナノ粒子の表面上に、新生物組織に特異的な標的化分子、すなわち受容体が癌細胞によって過剰発現されているか、又は癌細胞の表面にある生体分子をグラフト化させる。これらの標的化分子によって、生物学的標的へのナノ粒子の移動が容易になる。概して、これらの標的化分子は葉酸、ペプチド及び炭水化物から選択することができる。図4に示されるように、ポリマーリンカーを用いて標的化分子を本発明のナノ粒子にグラフト化させることができる。
【0062】
本発明のナノ粒子にグラフト化させることができる標的化分子の中でも、以下のものを挙げることができる:
ポリエチレンイミンリンカー又はポリエチレングリコール(PEG)リンカーを用いてシリカ質ナノ粒子にグラフト化させることができる、マンノース等の糖の誘導体。メソ多孔性シリカナノ粒子へのマンノースのグラフト化は、特にI. Young Park et al., International Journal of Pharmaceutics, 359, 2008, 280-287に記載されており、同じ手順を用いることができる。別の手法は、図5に示されるようにフェニルスクアレート−α−マンノースを使用することである;
ホルモン標的(LH−RH)を有するペプチド等のペプチド;
マンノース、マンノース−6−リン酸、グルコース、ガラクトース等の幾つかの単糖類誘導体又は二糖類誘導体を有する糖デンドリマー(glycodendrimers)。
【0063】
シリカ系微孔性ナノ粒子に生体分子をグラフト化させる方法は、特にT. Doussineau et al., Eur. J. Inorg. Chem. 2006, 2766-2722に記載されており、同じ手順を用いることができる。
【0064】
本発明の主題はまた、上記のナノ粒子製造工程を含む、腫瘍の治療及び/又は予防及び/又は検出を目的とする薬物を製造するプロセスである。
【0065】
一重項酸素の発生、したがって癌細胞の破壊は、光子励起によって誘発される。光源を用いてナノ粒子に照射した後、生成した一重項酸素によって腫瘍細胞を破壊することが可能となる。照射は630nm〜680nmの波長、2mW/cm2〜10mW/cm2の範囲の出力で行われる。得られる結果から、合成されるナノ粒子が、30%〜90%の量子収率で溶液中に一重項酸素を生成させるのに効果的であることが示される。これらのナノ粒子は、生体分子による表面官能基化の後に、活性成分のベクター化(vectorization)及び腫瘍細胞におけるそのエンドサイトーシスを可能にするものでなくてはならない。
【0066】
本発明のナノ粒子を用いて治療することが想定され得る様々な癌の中でも、網膜芽腫(Y−79細胞株)、大腸癌(HT29細胞株)、表皮癌(A 431)、肺癌(A 549)、乳癌(MDA−MB−231、MCF−7)、子宮頸癌(HeLa)、卵巣癌(PEO14)、さらに頭部癌及び頸部癌、消化管癌及び性器癌、並びに照射する(illuminated)ことができる任意の良性腫瘍又は癌性腫瘍を含むが、これらに限定されない全ての固形腫瘍を挙げることができる。
【0067】
エンドサイトーシスの後、細胞株を光増感剤の吸収帯の1つで照射し、ナノ粒子の有効性をMTTアッセイを用いて評価する。
【0068】
本発明のナノ粒子の組成物は、局所投与又は全身投与することができる。局所投与は、特にナノ粒子組成物を腫瘍領域の周辺に注射することによって行うことができる。表在性腫瘍の場合、ナノ粒子組成物を好適な剤型(galenical form)(溶液、懸濁液、ペースト、パッチ)で局所的に投与することができる。全身投与は静脈内、筋肉内、皮下、腹腔内又は直腸内に行うことができる。かかる剤型及びその用法は当業者に既知である。
【0069】
式(I)の活性剤に関する組成物の投与量は、患者の体重及び年齢、腫瘍の性質、位置及び発生段階、選択される投与経路並びに使用される照射線量に応じて調整される。
【0070】
組成物は、腫瘍及び/又はその症状の治療で知られる任意の他の活性成分を含んでいてもよい。組成物は、選択される投与方法に好適な製剤学(galenics)の従来の成分を含む。
【0071】
本発明の主題はまた、薬物として使用するための、特に腫瘍及び癌の予防及び/又は治療のための上記のナノ粒子である。
【図面の簡単な説明】
【0072】
【図1】アニオン性ポルフィリンを封入するシリカライトナノ粒子のX線回折図(diffractogram)である。
【図2】組織的な多孔性を有するメソ多孔性ナノ粒子のTEM写真である。
【図3】ナノ粒子DG015(NP−PS)、DB016(NP−マンノース)及びアリールスクアレート−α−マンノース(Sq−マンノース)のUVスペクトルを示す図である。
【図4】標的化分子をグラフト化させた本発明のナノ粒子を示す図である。
【図5】マンノース官能基化ナノ粒子の例を示す図である。
【図6】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図7】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図8】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図9】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図10】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図11】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図12】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図13】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【図14】単一光子励起後の光増感剤を封入する様々なナノ粒子の乳癌細胞株(MDA−MB−231)、卵巣癌細胞株(POE14)、前立腺癌細胞株(LNCaP)及び網膜芽腫細胞株(Y−79)に対する細胞毒性効果に関する生物学的結果を示す図である。
【発明を実施するための形態】
【0073】
I 式(I)の分子の合成
A 水溶性カチオン性ポルフィリン8の合成
合成スキーム:
Diane L. Dick et al, J. Am. Chem. Soc. 1992, 114, 2664-2669によって記載される方法を用いて得られた化合物3(1当量)を、類似のメタ化合物に関してMartine Perree-Fauvet et al., Tetrahedron. 1996, 52, 13569-13588に記載されるように、標準的なアドラー法(Adler procedure)に従ってピリジンアルデヒド(3当量)及びピロール(4当量)と共に縮合すると、クロマトグラフィーの後、5.7%の収率でポルフィリン4が得られる。誘導体5は化合物4から、水中、還流下でヒドラジンで処理することによって定量的に得られる。ポルフィリン5とペプチド酸(peptidic acid)6とを、ジクロロメタン中、カップリング剤として1−ヒドロキシベンゾトリアゾール水和物(HOBt)、1−(3−ジメチルアミノプロピル)−3−エチルカルボジイミド塩酸塩(EDC)及びトリエチルアミンの存在下で反応させることによって、化合物7が得られる(収率:40%)(Daniel H. Rich, et al., J. Med. Chem. 1975, 18, 1004-1010)。化合物7を大過剰のヨウ化メチルで処理すると、水溶性ポルフィリン8が定量的に得られる。
【0074】
【化12】

【0075】
手順:
5−[p−(3−イソインドリン−1’,3’−ジオンプロポキシ)フェニル]−10,15,20−トリ−p−ピリジルポルフィリン4
ポルフィリン4は、沸騰プロピオン酸(400ml)中に溶解させたアルデヒド3(6.2g、20mmol)及び4−ピリジンカルボキサルデヒド(6.4g、60mmol)から調製する。次いで、ピロール(5.36g、80mmol)を滴下する。還流を2時間維持する。溶液を真空蒸発させる。CH2Cl2/EtOH混合物(100/5(v/v))で溶出を行うシリカゲルクロマトグラフィーによる1回目の精製を、最大量の不純物を除去するために行う。CH2Cl2、続いて漸増量のエタノール(0%から10%)で溶出を行う2回目の精製によって、6つのポルフィリンが分離される。5,10,15−トリピリジル−20−フェニルポルフィリン4は、CH2Cl2/EtOH混合物(94/6(v/v))によって溶出され(第3画分)、ジクロロメタン/メタノール混合物を用いて結晶化させると、青色の結晶の形態で得られる(収率:5.7%)。CH2Cl2中のUV−visスペクトル:λmax、nm(OD):418.5(1)、514.5(0.61)、549(0.31)、589(0.25)、646(0.16)。1H NMR(300MHz、CDCl3)δ9.05(m,6H,メタ−ピリジン)、8.95(d,J=4.7Hz,2H,ピロール)、8.85(s,4H,ピロール)、8.81(d,J=5Hz,2H,ピロール)、8.16(d,J=5.8Hz,6H,オルト−ピリジン)、8.07(d,J=8.4Hz,2H,メタ−フェニル)、7.93(dd,J=3.1,5.4Hz,2H,フタルイミド)、7.76(dd,J=3.0,5.4Hz,2H,フタルイミド)、7.12(d,J=8Hz,2H,オルト−フェニル)、4.35(t,8Hz,2H,O−CH2)、4.09(t,8Hz,2H,N−CH2)、2.40(m,2H,CH2)、−2.87(s,2H,NH)。
5−[p−(3−アミノプロポキシ)フェニル]−10,15,20−トリ−p−ピリジルポルフィリン5
ポルフィリン4(0.930g、1.13mmol)とヒドラジン一水和物(0.71ml、23mmol)との混合物を、16時間還流させた後、周囲温度で24時間攪拌する。HCl(10%溶液)を添加することによってフタルヒドラジドを沈殿させ、濾過する。NaOH(10%溶液)を添加することによって溶液を中和する。ポルフィリンをCH2Cl2/EtOH混合物(95/5(v/v))で水相から抽出する。硫酸ナトリウムで乾燥させて、濾過し、蒸発乾固すると、ポルフィリン5(0.760g)が純粋な青色の粉末の形態で得られる(収率:97%)。CH2Cl2中のUV−visスペクトル:λmax、nm(ε L.mmol−1.cm−1):418(224.9)、515(13.1)、550(6.5)、590(5.4)、647(4.1)。1H NMR(300MHz、CDCl3)δ9.05(m,6H,メタ−ピリジン)、8.95(d,J=4.7Hz,2H,ピロール)、8.85(s,4H,ピロール)、8.81(d,J=5Hz,2H,ピロール)、8.16(d,J=5.8Hz,6H,オルト−ピリジン)、8.10(d,J=8.4Hz,2H,メタ−フェニル),7.31(d,J=8Hz,2H,オルト−フェニル)、4.38(t,J=8Hz,2H,O−CH2)、3.09(t,J=8Hz,2H,N−CH2)、2.14(m,2H,CH2)、−2.87(s,2H,NH)。
5−{p−[3−(2’,5’−ジオキソ−2’,5’−ジヒドロ−1H−ピロール−1’−イル)−N−(3−フェノキシプロピル)プロパンアミド]フェニル}−10,15,20−トリ−p−ピリジルポルフィリン7
化合物5(160mg、0.23mmol)をCH2Cl2(40ml)中に溶解させる。HOBt(48mg、0.35mmol)、EDC(67mg、0.35mmol)、トリエチルアミン(48ml、0.35mmol)及び5−(2,5−ジオキソ−2,5−ジヒドロピロール−1−イル)プロピオン酸(80mg、0.46mmol)を添加する。混合物をアルゴン下、周囲温度で3時間攪拌する。CH2Cl2/エタノール混合物(90/10(v/v))で溶出を行うシリカゲル薄層クロマトグラフィー分析によって反応の終了を確認する。溶液をCH2Cl2/エタノール混合物(95/5(v/v))で希釈し、水で洗浄し(3回)、硫酸ナトリウムで乾燥させて、濾過した後、真空下で濃縮する。生成物を、CH2Cl2/メタノール混合物(9/1(v/v))で溶出を行う薄層クロマトグラフィー(Al2O3)によって精製する。CH2Cl2/エタノール/ヘプタン混合物から結晶化させると、化合物7が青色の粉末の形態で得られる(110mg、収率:57%)。CH2Cl2中のUV−visスペクトル:λmax、nm(ε L.mmol−1.cm−1):418(190.6)、516(13.7)、550(8.3)、591(7.1)、652(6.7)。エレクトロスプレー質量スペクトル:C51H39N9O4に対する計算値841.9、実測値842.66、M+1。1H NMR(300MHz、CDCl3)δ9.04(d,J=5.6Hz,6H,メタ−ピリジン)、8.92(d,J=5Hz,2H,ピロール)、8.83(s,4H,ピロール)、8.80(d,J=4.7Hz,2H,ピロール)、8.13(d,J=5.7Hz,6H,オルト−ピリジン)、8.10(d,J=8.5Hz,2H,メタ−フェニル)、7.30(d,J=8.6Hz,2H,オルト−フェニル)、4.32(t,8Hz,2H,O−CH2)、3.92(t,J=7.4Hz,2H,CH2−N)、3.63(t,J=7.8Hz,2H,CH2−NH−CO)、2.62(t,J=7Hz,2H,CH2−CO−NH)、2.19(t,2H,CH2)、−2.87(s,2H,NH)。13C NMR(300MHz、CDCl3)δ170.6(CON)、169.7(CO−NH)、158.8(パラ−フェニル)、150(ピリジン)、148.4(メタ−ピリジン)、135.7(オルト−フェニル)、134.3(エチレン)、134(フェニル)、131(ピロール)、129.4(オルト−ピリジン)、121.6(メソ−C)、117.4(メソ−C)、116.7(メソ−C)、112.8(メタ−フェニル)、66.6(C−O−)、37.5(C−NHCO)、34.9(C−N)、34.3(C−CONH)、29.2(C−C−O)。
5−{p−[3−(2’,5’−ジオキソ−2’,5’−ジヒドロ−1H−ピロール−1’−イル)−N−(3−フェノキシプロピル)プロパンアミド]フェニル]−10,15,20−トリ−p−ピリジニウムポルフィリントリクロリド8
ポルフィリン7(68mg、0.08mmol)及びヨウ化メチル(1ml)を、ジメチルホルムアミド(20ml)中に溶解させ、周囲温度で3時間攪拌する。溶液を真空下で濃縮した後、メタノール(10ml)で希釈する。IRA400樹脂(0.9g)を溶液に添加した後、懸濁液を1時間半穏やかに攪拌する。溶液を濾過した後、蒸発させる。メタノール/ジエチルエーテル混合物から結晶化させると、純粋な化合物が青色の粉末の形態で得られる(80mg、収率:100%)。MeOH中のUV−visスペクトル:λmax、nm(μL.mmol−1.cm−1):427(98.3)、518(12)、557(6.1)、593(4.1)、652(2.5)。MALDI−TOF質量スペクトル:C54H48N9O4Cl3に対する計算値993.38、実測値886.44、M−3Cl−、887.44、M+H−3Cl−。
B 水溶性アニオン性ポルフィリン9の合成
この化合物は、5,10,15,20−テトラフェニルポルフィリンから、Kruper et al., J. Org. Chem. 1989, 54, 2753-2756によって記載される方法を用いて全収率43%で調製される。
【0076】
【化13】

【0077】
II ナノ粒子の合成
A アニオン性ポルフィリンDB 003、DB 005ナノ粒子を封入するメソ多孔性ナノ粒子の合成
【0078】
【化14】

【0079】
DB 003:5mgのポルフィリン9(5.44×10−3mmol)を、15分間超音波をかけることによって、1mlのEtOH中に溶解させる。5当量(2.72×10−2mmol)のイソシアナトプロピルトリエトキシシランを、4当量(2.17×10−2mmol)のジイソプロピルエチルアミンと共に添加する。溶液を12時間周囲温度に維持する。
【0080】
686mg(1.8×10−3mol)の臭化セチルトリメチルアンモニウム(CTAB)を、40mlの0.2M水酸化ナトリウム中に25℃で溶解させる。先に調製した溶液を添加した後、テトラエトキシシラン(3.5ml、1.57×10−2mmol)を滴下する。40秒後、260mlの脱イオン水を添加する。溶液を6分間攪拌し続けた後、0.2M HCl(およそ50ml)を添加することによってpH7まで急速に中和する。ナノ粒子を遠心分離(20分間、20000rpm)によって回収し、超音波によってEtOH中に再懸濁して、遠心分離する。界面活性剤を、60℃で2時間、30mlのEtOH/12N HCl(4/1)溶液で処理することによって抽出する。遠心分離後、この操作を2回繰り返し、次いでナノ粒子を水中に再懸濁し、中性pHが得られるまで遠心分離する(5回)。
【0081】
代替的には、界面活性剤は硝酸アンモニウムでの処理によって除去することができる(Chem Mater, 2004, 10, 1961)。300mgのNH4NO3を150mlの95%EtOH中に溶解させる。500mgのナノ粒子をこの溶液中に懸濁し、超音波で15分間処理した後、溶液を60℃で15分間静置する(placed)。懸濁液を遠心分離によって回収し、超音波によってEtOH中に再分散させて、遠心分離する。この界面活性剤の抽出プロトコルを一度繰り返す。
【0082】
透過電子顕微鏡法(TEM)によって、約100nmのナノ粒子径を有するメソ細孔の六角形のネットワークの存在が示される。
【0083】
準弾性光散乱(DLS)によって、150nmの流体力学直径が確認される。
【0084】
BETによって、862m2/gの比表面積及び2nmの細孔径が示される。
【0085】
UV可視吸収分光分析(UV分析と称される)(EtOH)によって、共有結合的に封入されたポルフィリンの存在が確認される。ナノ粒子1g当たり3.3μmolのポルフィリン負荷量が得られる。
【0086】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に421nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は92%である。
【0087】
同じ手順を用いてDB 005ナノ粒子を合成するが、10mg(10.88×10−3mmol)のポルフィリン9、13.4μlのイソシアナトプロピルトリエトキシシラン及び7.4μlのジイソプロピルエチルアミンを使用する。
。
【0088】
透過電子顕微鏡法(TEM)によって、約100nmのナノ粒子径を有するメソ細孔の六角形のネットワークの存在が示される。
【0089】
準弾性光散乱(DLS)によって、200nmの流体力学直径が確認される。
【0090】
BETによって、891m2/gの比表面積及び2nmの細孔径が示される。
【0091】
UV可視吸収分光分析(UV分析と称される)(EtOH)によって、共有結合的に封入されたポルフィリンの存在が確認される。ナノ粒子1g当たり6.94μmolのポルフィリン負荷量が得られる。
【0092】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に421nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は32%である。
B ナノ粒子表面でのアミノプロピルトリエトキシシラン(APTS)のグラフト化−DB 015ナノ粒子、DB 019ナノ粒子
【0093】
【化15】

【0094】
DB 015:250mgのDB 003ナノ粒子を、30分間の超音波によって6mlの脱イオンH2O中に懸濁する。次いで、2.5mlのEtOH及び391μlのAPTSの溶液を滴下する。0.2M HClをpH=6となるまで添加する。反応混合物を20時間攪拌し、20000rpmで15分間遠心分離する。ナノ粒子をEtOHで洗浄し(超音波+遠心分離)、次いでソックスレー装置において20時間EtOHで洗浄する。得られた粒子の質量mは206mgである。
【0095】
アミン官能基を定性的ニンヒドリン試験によって特性化する。
【0096】
UV分析(EtOH)によって、ポルフィリンが依然として存在し、反応中に修飾されていないことが示される。
【0097】
BETによって、ナノ粒子の表面だけでなく、細孔中にもアミノプロピル基が存在するために比表面積が481m2/gまで減少したことが示される。
【0098】
APTSを固体の微量分析及び29Si NMRによって定量的に測定する。2.2mmol/gのアミノ負荷量が得られる。
【0099】
同じ手順を用いて、DB 005ナノ粒子からDB 019ナノ粒子を合成する。
【0100】
BETによって、ナノ粒子の表面だけでなく、細孔中にもアミノプロピル基が存在するために比表面積が545m2/gまで減少したことが示される。
C アニオン性ポルフィリンを封入するシリカライトナノ粒子の合成−DB 008ナノ粒子
【0101】
【化16】

【0102】
4mgのポルフィリン9(4.35×10−3mmol)を、15分間超音波をかけることによって、1mlのEtOH中に溶解させる。5当量(4.5μl)のイソシアナトプロピルトリエトキシシランを、4当量(3.04μl)のジイソプロピルエチルアミンと共に添加する。溶液を12時間周囲温度に維持した後、14mlの1M水酸化テトラプロピルアンモニウム水溶液、8.4mlのTEOS及び2mlの水を添加し、反応混合物を24時間周囲温度に維持する。次いで、溶液を攪拌せずに80℃のオーブンにおいて48時間静置する。冷却後、溶液を20000rpmで20分間遠心分離する(3回)。次いで、ナノ粒子を水中に再分散させ、遠心分離する。構造化剤の抽出を、EtOH/12N HCl(4/1)溶液を用いて60℃で2時間行う(2サイクル行う)。次いで、ナノ粒子を、3.5のpHが得られるまでH2Oで6回洗浄する(超音波による水中への分散及び遠心分離を6サイクル)。次いで、ナノ粒子をEtOHで2回洗浄する。
【0103】
ナノ粒子の粉末X線分析を行うが、この分析によってゼオライトの構造化されたネットワーク特性の存在が示される(図1)。
【0104】
DLSによって68nmの流体力学半径が得られる。
【0105】
BETによって300m2/gの比表面積が得られる。
【0106】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に421nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は31%である。
D カチオン性ポルフィリンを封入するシリカライトナノ粒子の合成−DB 011ナノ粒子
【0107】
【化17】

【0108】
4.9mgのポルフィリン10を、超音波によって1mlの無水EtOH中に溶解させる。2μlのアミノプロピルトリエトキシシランを添加し、反応混合物を一晩周囲温度に維持する。先の反応混合物を、ポリエチレンフラスコ中で、14mlの1M水酸化テトラプロピルアンモニウム水溶液、8.4mlのテトラエトキシシラン及び2mlのH2Oと共に激しく攪拌しながら溶解させる。溶液を周囲温度で24時間攪拌した後、80℃のオーブンにおいて攪拌せずに静置する。2日後、反応混合物を冷却し、次いで遠心分離する。ナノ粒子を超音波によって水中に再分散させた後、遠心分離する(3サイクル)。構造化剤を、EtOH/12N HCl(4/1)溶液を用いて60℃で2時間抽出する(2サイクル行う)。次いで、ナノ粒子を、3.5のpHが得られるまでH2Oで6回洗浄する(超音波による水中への分散−遠心分離を6サイクル)。次いで、ナノ粒子をEtOHで2回洗浄する。
X線回折:構造化されたネットワーク
DLS:92nm
BET:100m2/g。
E カチオン性ポルフィリンを封入するメソ多孔性ナノ粒子の合成−OH21ナノ粒子
【0109】
【化18】

【0110】
8mgのポルフィリン8(6.3×10−3mmol)を1mlのMeOH中に溶解させる。4.2mgのメルカプトプロピルトリメトキシシラン(21.78×10−3mmol)を添加し、反応混合物を周囲温度に一晩維持する。343mg(0.9×10−3mol)の臭化セチルトリメチルアンモニウム(CTAB)を、20mlの0.2M水酸化ナトリウム中に25℃で溶解させる。先に調製した溶液を、テトラエトキシシラン(1.75ml、0.8×10−2mmol)と共に添加する。40秒後、128mlの脱イオン水を添加する。溶液を6分間攪拌し続けた後、0.2M HCl(およそ25ml)を添加することによってpH7まで急速に中和する。ナノ粒子を遠心分離(20000rpmで20分間)によって回収し、超音波によってEtOH中に再懸濁して、遠心分離する。界面活性剤を、60℃で2時間、15mlのEtOH/12N HCl(4/1)溶液で処理することによって抽出する。遠心分離後、この操作を2回繰り返し、次いでナノ粒子を水中に再懸濁し、約6のpHが得られるまで遠心分離する(6回)。
【0111】
IR分析によって、界面活性剤の除去が確認される。
【0112】
TEMによって、約150nmのナノ粒子径を有するメソ細孔の六角形のネットワークの存在が示される。
【0113】
DLSによって311nmの流体力学直径が示される。
【0114】
UV分析(EtOH)によって、共有結合的に封入されたポルフィリンの存在が確認される。ナノ粒子1g当たり4.43μmolのポルフィリン負荷量が得られる。
【0115】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に431nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は58%である。
F カチオン性ポルフィリンを封入するメソ多孔性ナノ粒子の合成−OH22粒子
【0116】
【化19】

【0117】
12mgのポルフィリン10(1.1×10−2mmol)を1mlのMeOH中に溶解させる。4.88mgのアミノプロピルトリメトキシシラン(2.72×10−2mmol)を添加し、溶液を周囲温度に一晩維持する。343mg(0.9×10−3mol)の臭化セチルトリメチルアンモニウム(CTAB)を、20mlの0.2M水酸化ナトリウム中に25℃で溶解させる。テトラエトキシシラン(1.75ml、0.8×10−2mmol)を、先に調製した溶液と共に滴下する。40秒後、128mlの脱イオン水を添加する。溶液を6分間攪拌し続けた後、0.2M HCl(およそ25ml)を添加することによってpH7まで急速に中和する。ナノ粒子を遠心分離(20000rpmで20分間)によって回収し、超音波によってEtOH中に再懸濁して、遠心分離する。界面活性剤を、60℃で2時間、15mlのEtOH/12N HCl(4/1)溶液で処理することによって抽出する。遠心分離後、この操作を2回繰り返し、次いでナノ粒子を水中に再懸濁し、約6のpHが得られるまで遠心分離する(6回)。
【0118】
IR分析によって、界面活性剤の除去が確認される。
【0119】
TEM(図2)によって、約150nmのナノ粒子径を有するメソ細孔の六角形のネットワークの存在が示される。
【0120】
DLSによって153nmの流体力学直径が示される。
【0121】
UV分析(EtOH)によって、共有結合的に封入されたポルフィリンの存在が確認される。ナノ粒子1g当たり0.97μmolのポルフィリン負荷量が得られる。
【0122】
一重項酸素を生成させるナノ粒子の能力を、5mlの無水EtOH中3mgのナノ粒子に、光増感剤の吸収帯の1つ、特に431nmで照射した後のそのリン光によって評価する。一重項酸素形成に対する量子収率は60%である。
G ナノ粒子表面でのα−マンノースのグラフト化
DB016粒子:
【0123】
【化20】

【0124】
上記§Bで調製されるアミノ化DB 015ナノ粒子100mgを、10分間の超音波によって5mlのEtOH中に分散させる。59mg(0.15mmol)のα−マンノースアリールスクアレートを、5mlのEtOH/H2O混合物(50/50)中に溶解させる。この溶液を上記の溶液に滴下する。500μlのトリエチルアミンを添加し、懸濁液を18時間攪拌する。遠心分離後、ナノ粒子を水中に再分散させ、遠心分離する(3サイクル)。次いで、これをEtOH中に再分散させ、遠心分離する(2サイクル)。
【0125】
DLS分析によって173nmの流体力学直径が示される。
【0126】
UV分析によって、ポルフィリン及び芳香核−スクアレートの存在が確認される(図3)。
DB 021ナノ粒子:
【0127】
【化21】

【0128】
250mg(7.35×10−5mol)のH2N−PEG−CO2H(モル質量:3400)を、1.25mlの蒸留水中に溶解させる。2当量(0.0148mol)のトリエチルアミンを添加する。81mg(2.5当量)のフェニルスクアレート−マンノースを、1mlの水中に溶解させる。この溶液を先の溶液に滴下する。反応混合物を周囲温度に15時間維持する。DMFを蒸発させた後、PEGをエーテルから結晶化させ、これを蒸発させる。
【0129】
66mg(2×10−5mol)の先の生成物及び256mg(9×10−5mol)のHO2C−PEG−OHを10mlのDMF中に溶解させる。21μlのEt3N、15mgのNHS(N−ヒドロキシスクシンイミド)及び30mgのDCC(ジシクロヘキシルカルボジイミド)を添加する。反応混合物を周囲温度に一晩維持した後、200mgのDB 019ナノ粒子を添加する。20時間後、溶液を遠心分離し、ナノ粒子を超音波によってDMF中に再懸濁し、次いで溶液を再度遠心分離する。DMFでの洗浄を一度繰り返し、次いでナノ粒子を水で3回、EtOHで2回洗浄する。
【0130】
178mgのDB 021ナノ粒子が得られる。
H ナノ粒子表面でのα−マンノース−6−カルボキシレートのグラフト化(DB 054粒子)
【0131】
【化22】

【0132】
56mgのDB 015アミノ化ナノ粒子を、10分間の超音波によって5mlのEtOH中に再分散させる。25mg(0.055mmol)のα−マンノース−6−カルボキシレートスクアリン酸塩を、5mlのEtOH/H2O混合物(3/2)中に溶解させる。この溶液を上記の溶液に滴下する。400μlのトリエチルアミンを添加し、懸濁液を17時間攪拌する。遠心分離後、ナノ粒子を水中で再分散させて遠心分離し(3サイクル)、次いでEtOH中に再分散させて遠心分離する(3サイクル)。
【0133】
33mgのDB 054ナノ粒子が得られる。
III 生物活性:
生体分子によって官能基化されていないか、又は官能基化された様々なナノ粒子の光線力学的療法(PDT)における活性を、様々な細胞株において評価する。癌細胞中に内在化されたナノ粒子の細胞毒性効果を、封入されたポルフィリンの単一光子励起の後、試験する。PDTの効果は、非照射粒子の相対的無害性(innocuousness)によって示される。ナノ粒子の標的化及びエンドサイトーシスの特異性は、官能基化ナノ粒子と対応する生体分子との共インキュベーション(coincubation)によって示される。
【実施例】
【0134】
実施例1:MDA−MB−231乳癌細胞に対するOH21ナノ粒子のPDT活性(図6)
実験条件:37℃及び5%CO2の加湿雰囲気下で、10%のFCSを添加したダルベッコ変法イーグル培地中での培養下に維持したMDA−MB−231乳癌細胞を、100μlの培地中、1ウェル当たり30000個の細胞の密度で96ウェルプレートに播種する。食作用を行う能力を有するMDA−MB−231乳癌細胞を、20μg/mlのナノ粒子と共に24時間インキュベートし、650nmのレーザー(出力:2mW/cm2〜10mW/cm2)を用いて40分間照射する。照射の2日後、生細胞を、MTT(3−(4,5−ジメチルチアゾール−2−イル)−2,5−ジフェニルテトラゾリウムブロミド、Sigma)酵素アッセイを用いて定量化する。
結果:光線力学的療法の効果は、細胞増殖の92%の阻害に反映される。非照射ナノ粒子の毒性がないこと、及びナノ粒子の非存在下で照射の毒性がないことから、これらのナノ粒子を用いた光線力学的療法の特異性が実証される。細胞をDAPIによる核の蛍光標識によって可視化する。得られた画像から、本発明のナノ粒子を用いた光線力学的療法の特異性が示される。細胞死は、照射領域内及びナノ粒子の存在下において明らかであり、限定的である。
【0135】
実施例2:POE14卵巣癌細胞に対するOH21ナノ粒子のPDT活性(図7)
実験条件:実施例1に記載されるように培養下に維持したPOE14細胞を、10μg/mlに低下させたナノ粒子濃度で24時間インキュベートし、実施例1に記載されるように照射する。照射の2日後、培地にMTTを添加することによって、生細胞数を定量化することが可能となる。
結果:POE14細胞と共にインキュベートしたナノ粒子への照射によって、対照細胞又は照射のみを行った細胞と比較して82%の細胞死が誘発される。この細胞型では、非照射ナノ粒子は、生細胞数のおよそ30%の減少を誘発する。この毒性から、特異的標的化の必要性が実証される。
【0136】
実施例3:MDA−MB−231乳癌細胞に対するOH21及びOH22カチオン性ナノ粒子並びにDB003及びDB005アニオン性粒子のPDT活性(図8)
実験条件:実施例1と同一。
結果:得られる結果によって、アニオン性ポルフィリン又はカチオン性ポルフィリンのいずれかを含有するナノ粒子の効果を比較することが可能となる。図8は、試験した全ての照射ナノ粒子が、照射前の最初の細胞播種に相当するT0値と比較して、MDA−MB−231細胞の増殖を完全に阻害することを示す。また、カチオン性ポルフィリンを含有するOH21ナノ粒子及びOH22ナノ粒子への照射は、対照(非処理細胞)と比較してそれぞれ51.3%及び57.2%の細胞死を誘発する。アニオン性ポルフィリンを含有するDB003ナノ粒子及びDB005ナノ粒子は、照射後にそれぞれ37.1%及び54%の細胞死を誘発する。或る特定の非照射ナノ粒子の(低いが有意である)細胞毒性によって、マンノースによる特異的標的化の利点が実証される。
【0137】
実施例4:MDA−MB−231乳癌細胞に対するマンノース官能基化アニオン性ナノ粒子のPDT活性(図9)
実験条件:実施例1と同一。
結果:得られる結果によって、マンノースで被覆されていないか、又は被覆されたアニオン性ポルフィリンを含有するナノ粒子の効果を比較することが可能となる。表面にマンノース残基がグラフト化されたDB016ナノ粒子及びDB021ナノ粒子は、それぞれ100%及び99%の細胞死を誘発する。これらの結果から、マンノースによる標的化によるナノ粒子の細胞毒性効果の増大が実証される。
【0138】
実施例5:過剰のマンノースの存在下又は非存在下における、MDA−MB−231乳癌細胞に対するマンノース官能基化又は非官能基化アニオン性ナノ粒子のPDT活性の比較(図10)
実験条件:細胞を、20μg/mlのナノ粒子(DB021又はDB005)の存在下又は非存在下で、任意でマンノース(10−2M)を添加した培地中で6時間インキュベートする。6時間のインキュベーション後、培地中のナノ粒子を取り除き、細胞を2回すすいだ後、100μlの新鮮培地中で培養する。次いで、細胞を40分間、2mW/cm2〜10mW/cm2の出力で630nm〜680nmの波長でのレーザー照射に付す。照射の48時間後、生細胞をMTTによって明らかにし(A)、定量化する(B)。
結果:図10Aは、非処理細胞における対照レベルのMTT蓄積を示す。照射に付したDB021ナノ粒子と共に細胞をインキュベートすることによって、細胞死がもたらされる。この現象は、過剰のマンノースとのプレインキュベーションによって阻止される。照射DB005ナノ粒子は細胞死を誘発しない。生細胞の定量化(図10B)によって、これらの所見が確認される。6時間インキュベートしたDB021ナノ粒子による細胞毒性は、わずか2%〜10%であるが(±マンノース)、DB021ナノ粒子への照射によって、70%の細胞死が誘発される。過剰のマンノースの添加によって、この効果が大幅に妨げられ、それにより内在化の特異性が実証される。さらに、照射又は非照射DB005ナノ粒子はわずか5%〜10%の細胞死しか誘発しない。
【0139】
実施例6:MDA−MB−231乳癌細胞に対するDB008及びDB011シリカライトナノ粒子のPDT活性(図11)
実験条件:実施例1と同一。
結果:得られる結果から、DB008及びDB011シリカライトナノ粒子が、照射しなかった場合、8.3%及び5.3%という低い毒性を示すことが示される。これらのナノ粒子と共に(24時間)インキュベートした細胞への照射によっては、完全な増殖の阻害及びおよそ60%の細胞死が誘発される。
【0140】
実施例7:LNCaP前立腺癌細胞に対するDB054ナノ粒子のPDT活性:DB054内在化の特異性(図12)
実験条件:ヒト前立腺癌細胞(LNCaP)を、過剰のM6Pの存在下又は非存在下で、DB054ナノ粒子と共に無血清培地中、37℃で1時間インキュベートした後、レーザー照射に付す(660nm、6mW/cm2〜7mW/cm2、40分間)。生細胞の割合を、MTS試験(Promega)を用いて測定する。グラフ表示は3回の独立実験の平均に相当する。
結果:得られる結果から、DB054ナノ粒子が1時間の処理の後、47%の細胞死を誘発することが示される。この効果は、培地に10mM M6Pを過剰に添加することによって阻止され、それによりM6Pに対する膜受容体を介したDB054ナノ粒子の内在化が実証される。
【0141】
実施例8:LNCaP前立腺癌細胞に対するDB054ナノ粒子のPDT活性:DB054の経時的な効果の変動(図13)
実験条件:ヒト前立腺癌細胞(LNCaP)を、種々の期間(1時間、3時間、24時間)、DB054ナノ粒子と共にインキュベートした後、レーザー照射に付す(660nm、6mW/cm2〜7mW/cm2、40分間)。生細胞の割合を、MTS試験(Promega)を用いて測定する。グラフ表示は3回の独立実験の平均に相当する。
結果:得られる結果から、DB054ナノ粒子が1時間、3時間及び24時間の処理の後、それぞれ47%、96%及び100%の細胞毒性(cyttotoxicity)を誘発することが示される。これらの結果によって、ナノ粒子の急速な作用が実証される。
【0142】
実施例9:ヒト網膜芽腫細胞に対するDB016ナノ粒子及びDB054ナノ粒子のPDT活性(図14)
実験条件:ヒト網膜芽腫細胞(Y−79)を、DB054ナノ粒子及びDB016ナノ粒子と共に完全培地中、37℃で1時間インキュベートした後、レーザー照射に付す(660nm、6mW/cm2〜7mW/cm2、40分間)。生細胞の割合を、MTS試験(Promega)を用いて測定する。グラフ表示は3回の独立実験の平均に相当する。
結果:得られる結果から、DB054ナノ粒子及びDB016ナノ粒子が、それぞれ33%及び38%の細胞毒性(cell cytotoxicity)を誘発することが示される。このことから、マンノース−6−リン酸又はマンノースで官能基化されたナノ粒子が、Y−79細胞の表面に存在する様々なレクチンを介して効率的に内在化され得ることが実証される。
【特許請求の範囲】
【請求項1】
下記式(I)に相当する分子:
【化1】

(式中、
xは0及び1から選択される整数を表し、
Mは遷移金属から選択される金属原子を表し、
Xが0を表す場合、(M−X)は2個の水素原子で置換され、
Xはハロゲン化物、及び薬学的に許容されるカルボン酸のアニオンから選択される基を表し、
Rは以下のものから選択される基を表し:
任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖、
R’はC1〜C6アルキル、フェニル及びベンジルから選択される基を表し、
R’’は以下のものから選択される基を表し:
【化2】

Z+は薬学的に許容される有機又は無機カチオンを表し、
Y−は−COO−及び−SO3−から選択され得る基を表し、
A−はハロゲン化物、及び薬学的に許容されるカルボン酸のアニオンから選択され得るアニオンを表し、
R1はC1〜C10アルキルを表す)。
【請求項2】
MがZn、Pt、Pd、Mn、Gd、Ni、Cr及びRuから選択される金属原子を表し、
XがCl−、Br−、I−、アセテート、プロピオネート、ブチレート、アスコルベート、ベンゾエート、シンナメート、シトレート、フマレート、グリコレート、マロネート、タートレート、マレート、マレエート、マンデレート及びトシレートから選択される基を表し、
Rが以下のものから選択される基を表し:
任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C10アルキル鎖、
R’がC1〜C3アルキルから選択される基を表し、
R1がC1〜C3アルキルから選択される基を表し、
Z+がK+、Li+、Na+及びNH4+から選択され得るカチオンを表し、
A−がCl−、Br−、I−、アセテート、プロピオネート、ブチレート、アスコルベート、ベンゾエート、シンナメート、シトレート、フマレート、グリコレート、マロネート、タートレート、マレート、マレエート、マンデレート及びトシレートから選択され得るアニオンを表す、請求項1に記載の分子。
【請求項3】
XがCl−、Br−、I−、アセテート及びトシレートから選択される基を表し、
Rが以下のものから選択され:
【化3】

R’がメチル及びエチルから選択される基を表し、
R1がメチルを表し、
A−がCl−、Br−、I−、アセテート及びトシレートから選択され得るアニオンを表す、請求項2に記載の分子。
【請求項4】
以下のものから選択される、請求項1〜3のいずれか一項に記載の分子:
【化4】

【請求項5】
請求項1〜4のいずれか一項に記載の式(I)に相当する少なくとも1つの光増感剤を含むシリカ系ナノ粒子の組成物。
【請求項6】
前記ナノ粒子が組織的な多孔性を有する、請求項5に記載の組成物。
【請求項7】
前記シリカナノ粒子がメソ多孔性である、請求項6に記載の組成物。
【請求項8】
前記メソ多孔性シリカナノ粒子が、直径80nm〜400nmの範囲の粒径、800m2/g〜1000m2/gの範囲の比表面積、及び2nm〜6nmの範囲の細孔径を有する、請求項7に記載の組成物。
【請求項9】
前記シリカナノ粒子が微孔性である、請求項6に記載の組成物。
【請求項10】
前記ナノ粒子が40nm〜80nmの直径、100m2/g〜450m2/gの範囲の比表面積、及び2Å〜20Åの範囲の細孔径を有する、請求項9に記載の組成物。
【請求項11】
前記ナノ粒子の表面上に新生物組織に特異的な標的化分子がグラフト化されている、請求項5〜10のいずれか一項に記載の組成物。
【請求項12】
前記標的化分子が糖、特にマンノースの誘導体から選択される、請求項11に記載の組成物。
【請求項13】
薬物として使用される、請求項5〜12のいずれか一項に記載の組成物。
【請求項14】
癌の治療及び/又は予防及び/又は検出において使用される、請求項13に記載の組成物。
【請求項1】
下記式(I)に相当する分子:
【化1】

(式中、
xは0及び1から選択される整数を表し、
Mは遷移金属から選択される金属原子を表し、
Xが0を表す場合、(M−X)は2個の水素原子で置換され、
Xはハロゲン化物、及び薬学的に許容されるカルボン酸のアニオンから選択される基を表し、
Rは以下のものから選択される基を表し:
任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C15アルキル鎖、
R’はC1〜C6アルキル、フェニル及びベンジルから選択される基を表し、
R’’は以下のものから選択される基を表し:
【化2】

Z+は薬学的に許容される有機又は無機カチオンを表し、
Y−は−COO−及び−SO3−から選択され得る基を表し、
A−はハロゲン化物、及び薬学的に許容されるカルボン酸のアニオンから選択され得るアニオンを表し、
R1はC1〜C10アルキルを表す)。
【請求項2】
MがZn、Pt、Pd、Mn、Gd、Ni、Cr及びRuから選択される金属原子を表し、
XがCl−、Br−、I−、アセテート、プロピオネート、ブチレート、アスコルベート、ベンゾエート、シンナメート、シトレート、フマレート、グリコレート、マロネート、タートレート、マレート、マレエート、マンデレート及びトシレートから選択される基を表し、
Rが以下のものから選択される基を表し:
任意でエーテル(−O−)、アミン(−NH−)、チオエーテル(−S−)、ケトン(−CO−)、エステル(−CO−O−)、アミド(−CO−NH−)、尿素(−NH−CO−NH−)、チオ尿素(−NH−CS−NH−)、オキシカルボニル(−O−CO−O−)及びカルバメート(−NH−CO−O−)から選択される1つ又は複数の基で中断されたC1〜C10アルキル鎖、
R’がC1〜C3アルキルから選択される基を表し、
R1がC1〜C3アルキルから選択される基を表し、
Z+がK+、Li+、Na+及びNH4+から選択され得るカチオンを表し、
A−がCl−、Br−、I−、アセテート、プロピオネート、ブチレート、アスコルベート、ベンゾエート、シンナメート、シトレート、フマレート、グリコレート、マロネート、タートレート、マレート、マレエート、マンデレート及びトシレートから選択され得るアニオンを表す、請求項1に記載の分子。
【請求項3】
XがCl−、Br−、I−、アセテート及びトシレートから選択される基を表し、
Rが以下のものから選択され:
【化3】

R’がメチル及びエチルから選択される基を表し、
R1がメチルを表し、
A−がCl−、Br−、I−、アセテート及びトシレートから選択され得るアニオンを表す、請求項2に記載の分子。
【請求項4】
以下のものから選択される、請求項1〜3のいずれか一項に記載の分子:
【化4】

【請求項5】
請求項1〜4のいずれか一項に記載の式(I)に相当する少なくとも1つの光増感剤を含むシリカ系ナノ粒子の組成物。
【請求項6】
前記ナノ粒子が組織的な多孔性を有する、請求項5に記載の組成物。
【請求項7】
前記シリカナノ粒子がメソ多孔性である、請求項6に記載の組成物。
【請求項8】
前記メソ多孔性シリカナノ粒子が、直径80nm〜400nmの範囲の粒径、800m2/g〜1000m2/gの範囲の比表面積、及び2nm〜6nmの範囲の細孔径を有する、請求項7に記載の組成物。
【請求項9】
前記シリカナノ粒子が微孔性である、請求項6に記載の組成物。
【請求項10】
前記ナノ粒子が40nm〜80nmの直径、100m2/g〜450m2/gの範囲の比表面積、及び2Å〜20Åの範囲の細孔径を有する、請求項9に記載の組成物。
【請求項11】
前記ナノ粒子の表面上に新生物組織に特異的な標的化分子がグラフト化されている、請求項5〜10のいずれか一項に記載の組成物。
【請求項12】
前記標的化分子が糖、特にマンノースの誘導体から選択される、請求項11に記載の組成物。
【請求項13】
薬物として使用される、請求項5〜12のいずれか一項に記載の組成物。
【請求項14】
癌の治療及び/又は予防及び/又は検出において使用される、請求項13に記載の組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公表番号】特表2012−502892(P2012−502892A)
【公表日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願番号】特願2011−526529(P2011−526529)
【出願日】平成21年9月14日(2009.9.14)
【国際出願番号】PCT/FR2009/001090
【国際公開番号】WO2010/029232
【国際公開日】平成22年3月18日(2010.3.18)
【出願人】(502205846)サントル ナショナル ドゥ ラ ルシェルシュ シアンティフィク (154)
【出願人】(500056471)
【出願人】(511066746)
【出願人】(504223868)
【Fターム(参考)】
【公表日】平成24年2月2日(2012.2.2)
【国際特許分類】
【出願日】平成21年9月14日(2009.9.14)
【国際出願番号】PCT/FR2009/001090
【国際公開番号】WO2010/029232
【国際公開日】平成22年3月18日(2010.3.18)
【出願人】(502205846)サントル ナショナル ドゥ ラ ルシェルシュ シアンティフィク (154)
【出願人】(500056471)

【出願人】(511066746)

【出願人】(504223868)

【Fターム(参考)】
[ Back to top ]

