金属硫化物の塩素浸出方法、並びに金属の湿式製錬方法
【課題】金属の湿式製錬のプロセス系内に保有する銅量を低減させた状態でも、金属硫化物からの金属成分の浸出反応を促進させることができる金属硫化物の塩素浸出方法、並びにその塩素浸出方法を利用した金属の湿式製錬方法を提供する。
【解決手段】金属硫化物を原料として銅イオンを含む塩化物溶液中で塩素浸出する金属硫化物の塩素浸出方法であって、塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して塩素浸出する。
【解決手段】金属硫化物を原料として銅イオンを含む塩化物溶液中で塩素浸出する金属硫化物の塩素浸出方法であって、塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して塩素浸出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、例えばニッケルやコバルトなどを含む金属硫化物から塩素ガスによりニッケルやコバルトなどの金属成分を浸出させる金属硫化物の塩素浸出方法、並びにその塩素浸出方法を利用した金属の湿式製錬方法に関する。
【背景技術】
【0002】
ニッケル、コバルトなどを含む金属硫化物からニッケル、コバルトなどの金属を回収する湿式製錬方法としては、ニッケル、コバルト、銅及び硫黄を含む金属硫化物から、金属を浸出させ、得られた浸出液から不純物を除去した後、電解採取により金属を回収する方法が実用化されている。
【0003】
金属硫化物から金属を浸出させる方法としては、例えば特許文献1に記載の技術のように、1価銅イオンを含む塩化物浴中にて、金属硫化物を含むスラリーに塩素ガスなどの酸化性ガスを吹き込んで金属を酸化浸出させる方法がある。この方法は、下記反応式(1)に示すように、銅が塩素ガスを吸収して1価の銅イオンから2価の銅イオンに酸化される反応と、下記反応式(2)に示すように、2価の銅イオンが硫化物中に含まれる金属を酸化し、金属が浴中へ浸出される反応が起こることを利用している。
Cl2+2CuCl → 2CuCl2 ・・・(1)
2CuCl2+MS → MCl2+2CuCl+S ・・・(2)
(なお、式(2)中のMは、NiやCoなどの金属である。)
【0004】
このことから、酸化浸出反応においては、塩化物浴中における銅イオン濃度が低いと反応の進行速度が遅く、浸出反応が進行し難いことが知られている。そのため、この方法を用いた金属の製錬操業においては、従来、プロセス内に保有する銅量を多く保つような操業が実施されていた。
【0005】
具体的には、従来の塩素ガスによる酸化浸出では、ニッケルが220g/L、Cuが50〜60g/L、Cl濃度が350g/Lより低い濃度の条件において、主としてさらにCu濃度を可能な限り増加させて反応確率の増加させることによって浸出反応を促進させるようにしていた。
【0006】
一方で、銅イオンは、ニッケル、コバルトなどの金属の電解採取工程においては不純物として働くため、上述した浸出処理工程以降において、その銅イオンを塩化物浴の浸出液中から除去する処理が必要となる。
【0007】
塩化物浴から銅イオンを除去する方法としては、硫化物などの還元剤添加による硫化銅生成反応を利用する方法や、電解により銅を選択的に除去する方法、溶媒抽出により銅を選択的に除去する方法などが一般的に用いられる。しかしながら、いずれの方法においても、プロセス系内に保有される銅量の増加に伴い、硫化物、電力、溶媒などの必要資材量が増大するため、操業コストが増加することが懸念されている。したがって、不純物除去工程の観点から見れば、プロセス系内の銅量を低減させることが望ましいとされていた。
【0008】
しかしながら、上述のように金属の浸出工程においては、銅イオンが塩素を吸収する働きをしているため、プロセス内に保有する銅量を極端に低減させると、浸出工程における浸出反応を維持並びに促進させることができなくなる。そのため、増産などによりプロセス内で浸出するニッケル、コバルトなどの電解採取する金属が増加した場合には、それに伴って銅量も増加させる必要が生じ、結果として不純物除去工程における操業コスト増加につながっていた。
【0009】
このような状況を鑑み、ニッケルやコバルトなどの金属硫化物からの金属の湿式製錬において、プロセス内に保持する銅量を低減させ、かつ、効率よく金属の浸出反応を促進させられる操業方法が望まれている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特公平07−91599号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
そこで、本発明は、このような実情に鑑みて提案されたものであり、金属の湿式製錬のプロセス系内に保有する銅量を低減させた状態でも、金属硫化物からの金属成分の浸出反応を促進させることができる金属硫化物の塩素浸出方法、並びにその塩素浸出方法を利用した金属の湿式製錬方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、上述した目的を達成するために鋭意検討を重ねた結果、銅イオンを塩化物溶液中における金属硫化物の塩素浸出において、塩化物イオン濃度を高くすることにより金属の浸出反応が促進されることを見出し、本発明を完成させた。
【0013】
すなわち、本発明に係る金属硫化物の塩素浸出方法は、金属硫化物を原料として銅イオンを含む塩化物溶液中で塩素浸出する金属硫化物の塩素浸出方法であって、上記塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して塩素浸出することを特徴とする。
【0014】
また、本発明に係る金属の湿式製錬方法は、金属硫化物を原料として銅イオンを含む塩化物溶液中で該金属硫化物に含まれる金属成分を浸出し、得られた浸出液から金属を回収する金属の湿式製錬方法であって、上記塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して上記金属硫化物を塩素浸出する工程を含むことを特徴とする。
【発明の効果】
【0015】
本発明によれば、塩素浸出処理における塩化物溶液中の塩化物イオン濃度を所定の濃度以上に調整して塩素浸出を行うようにしているので、金属の湿式精錬プロセス系内に保有する銅量を増加させなくても、金属の浸出反応を促進させることができる。そしてこれにより、金属精錬プロセス系内において、浸出反応においては不可欠であるが浸出処理後に不純物となってしまう銅の含有量を低減させることができるため、その工業的価値は極めて大きい。
【図面の簡単な説明】
【0016】
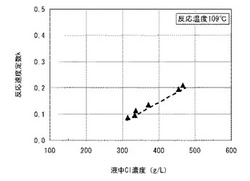
【図1】塩化物溶液中の塩化物イオン濃度に対する塩素浸出反応の反応速度定数の関係を示すグラフである。
【発明を実施するための形態】
【0017】
以下、本発明に係る金属硫化物の塩素浸出方法の具体的な実施形態(以下、本実施の形態という)について、図面を参考にして詳細に説明する。なお、本発明は、以下の実施形態に限定されるものではなく、要旨を変更しない範囲において適宜変更することができる。
【0018】
本実施の形態に係る金属硫化物の塩素浸出方法は、銅イオンを含む塩化物溶液中で金属硫化物を塩素浸出する方法であって、その塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して塩化物溶液中の銅の酸化力を高めることによって塩素浸出することを特徴とする。
【0019】
金属硫化物とは、ニッケルやコバルト、銅などの金属混合物を含有する硫化物であり、例えば、低品位ラテライト鉱石などのニッケル酸化鉱から、高温高圧下で硫酸浸出することによって産出されたニッケル混合硫化物などが挙げられる。このニッケル混合硫化物など金属硫化物は、例えば硫酸浸出などによって産出された後、塩化物溶液中にてレパルプ処理されてスラリーとなる。塩素浸出処理においては、このスラリーとなった金属硫化物を原料として浸出処理が行われる。なお、以下では、主として、金属硫化物としてニッケル混合硫化物を用いる場合を例示して説明する。
【0020】
ここで、例えばニッケルやコバルトなどの非鉄金属の湿式精錬法では、ニッケル混合硫化物を原料として、ニッケル、コバルト、銅などの金属の大部分を塩素浸出し、浸出して得られた溶液から金属不純物を除去した後に、電解採取によって電気ニッケルや電気コバルトを製造する。具体的に、これらの金属の湿式精錬プロセスは、原料であるニッケル混合硫化物から金属成分を塩素で浸出する塩素浸出工程と、浸出液に含まれる銅を固定除去するセメンテーション工程と、銅が除去された溶液から不純物成分を除去する浄液工程と、不純物を除去した溶液を用いてニッケルやコバルトなどの金属を電解採取する電解工程とを有している。
【0021】
金属を電解採取する精錬プロセスにおいて、ニッケル混合硫化物を塩素浸出する塩素浸出工程では、上述したように、ニッケル混合硫化物を原料として、その原料を含有する塩化物溶液(スラリー)中に塩素ガスを吹き込み、ニッケルや銅などの金属成分を銅イオンを含む塩化物溶液中で酸化浸出する。そして、塩素浸出工程では、塩素浸出液としての銅を含有する塩化ニッケル溶液(以下、含銅塩化ニッケル溶液ともいう)を生成する。
【0022】
具体的に、塩素浸出工程におけるニッケル混合硫化物の浸出処理では、例えば下記の(1)、(2)式に示す反応が生じる。
Cl2+2CuCl → 2CuCl2 ・・・(1)
(Cl2+2Cu+→2Cl−+2Cu2+)
2CuCl2+MS → MCl2+2CuCl+S ・・・(2)
(なお、式(2)中のMは、NiやCoなどの金属である。)
【0023】
すなわち、上記式に示されるように、塩素浸出処理においては、原料としてのニッケル混合硫化物のスラリーが送液されると、ニッケル混合硫化物中に含まれる硫化ニッケル及び硫化銅などの金属成分を、塩素ガスにより酸化された2価銅イオンによって酸化浸出し、塩素浸出液としての含銅塩化ニッケル溶液を生成する。このようにして塩素浸出処理によって生成した塩素浸出液は、セメンテーション工程において浸出液中の銅が固定除去される。一方で、塩素浸出処理では、硫黄を主成分とした塩素浸出残渣が固相に残存する。
【0024】
このように、例えば電気ニッケルの製造プロセスでは、塩素浸出工程におけるニッケル混合硫化物を原料とした塩素浸出によって含銅塩化ニッケルを生成し、その含銅塩化ニッケルから電気ニッケルを製造することになる。このとき、品質の良い電気ニッケルを製造するためには、含銅塩化ニッケル溶液中の銅を効果的に除去することが重要となる。
【0025】
塩素浸出工程にて生成した含銅塩化ニッケル溶液中の銅は、上述のように、セメンテーション工程において含銅塩化ニッケル溶液から固定除去され、再び塩素浸出工程に戻されることになる。そして、塩素浸出工程においては、戻された銅と新たなニッケル混合硫化物中の銅とを塩素ガスによって2価銅イオンとし、ニッケルやコバルトなどの金属成分を浸出することとなる。つまり、塩素浸出工程とセメンテーション工程では、ある所定の濃度を保った状態で銅が循環することになる。したがって、電気ニッケルの増産を目的として、例えば湿式製錬から産出されたニッケル混合硫化物の処理量を増加させた場合、必然的に電気ニッケル製造プロセス系内に循環される銅量も増加することになる。
【0026】
ところが、電気ニッケルの電解採取においては、プロセス系内の銅は不純物となるため、電気ニッケルの増産に伴って循環される銅量が増加すると、不純物としての銅も増加することになる。したがって、この不純物としての銅を除去するという観点から見れば、プロセス系内の銅量を低減させることが望ましい。しかしながら、上述のように、塩素浸出工程における浸出処理では、原料中の金属成分が、塩素ガスによって酸化された2価銅イオンによって塩化物溶液中で酸化浸出されることになる。そのため、銅イオン濃度が低いと浸出反応の進行速度が遅くなり、金属が浸出し難くなる。
【0027】
ここで、上記反応式(1)及び(2)に示したように、金属の塩素浸出反応は、2価の銅イオンが金属を酸化して1価の銅イオンに還元されることによって進行する。したがって、この銅イオンの還元反応を促進させることによって、プロセス系内の銅量を低減させた場合でも、金属の浸出反応をより進行させることが可能となることが分かる。
【0028】
そこで、本実施の形態においては、金属硫化物であるニッケル混合硫化物の塩素浸出処理において、塩化物溶液中の塩化物イオン濃度に着目し、その塩化物イオン濃度を所定濃度以上の高い濃度に維持して塩素浸出反応を行うようにする。具体的には、塩化物イオン濃度を350g/L以上に調整して塩素浸出反応を行う。このように、塩化物溶液中の塩化物イオンの濃度を考慮し、その濃度を高めることにで、プロセス系内の銅量が少なくても、金属の浸出反応を進行させることができる。
【0029】
図1に、ニッケル混合硫化物(ニッケル:48%、硫黄:32%、コバルト:3%、銅:8%)の塩素浸出反応(反応温度109℃)において、塩化物溶液中の塩化物イオン濃度に対する塩素浸出反応の反応速度定数kの関係を示す。図1のグラフに示されるように、塩化物イオン濃度が高まるにつれて反応速度定数が大きくなる正の直線関係が成立し、塩化物イオン濃度を高くするほど金属の浸出反応が促進されることが分かる。特に、塩化物溶液中の塩化物イオン濃度が350g/L以上の場合では、反応速度定数が0.1以上となり、効果的に浸出反応を進行させることができることが分かる。
【0030】
このことは以下のメカニズムによるものと推測される。つまり、塩化物溶液中において、1価の銅イオンは多様な錯体を形成するが、2価の銅イオンは錯体を形成しない。そのため、塩化物溶液中の塩化物イオン濃度を増加させていくことにより、1価の銅イオンが塩化物イオンと錯体を形成し易くなり、1価銅の安定性が増大するものと考えられる。具体的には、1価の銅イオンが安定形態であるクロロ錯体となるものと考えられる。
【0031】
すると、塩素の吹き込みにより酸化された2価の塩化銅イオンが安定形態である1価のクロロ錯体に還元される力が駆動力となり、これによって上記反応式(2)において金属を酸化する力が増大するため、塩素浸出(酸化)反応が促進されるものと推測される。
【0032】
塩化物溶液中の塩化物イオン濃度として、上述のように350g/L以上に調整する。濃度が350g/L未満の場合には、2価の銅イオンが安定形態である1価のクロロ錯体に還元される力が十分に生じず、塩素浸出反応が促進されない。一方で、塩化物イオン濃度の上限値としては、特に限定されないが、500g/L以下とすることが好ましい。塩化物イオン濃度が500g/Lより多い場合には、塩化物溶液が過飽和状態となり、反応槽内に塩化物が析出して配管詰まりが発生し、安定した操業が行えなくなる可能性がある。また、後述するように、塩化物イオン濃度を高めるためのコストが増加し、経済性の観点からも好ましくない。したがって、塩化物溶液中の塩化物イオン濃度としては、350g/L以上となるように調整し、好ましくは350g/L以上500g/L以下となるように調整して塩素浸出反応を行う。
【0033】
また、その塩化物イオンの濃度調整方法としては、特に限定されるものではないが、例えば食塩などの銅以外の金属塩化物を添加する方法や、目的とする電解採取の金属を含有する金属塩化物を添加する方法、または、濃塩酸を添加する方法などにより調整することができる。
【0034】
以上詳細に説明したように、本実施の形態に係る金属硫化物の塩素浸出方法は、塩化物溶液中の塩化物イオン濃度を350g/L以上となるように調整して塩化物溶液中の銅の酸化力を高めることによって、この塩化物溶液中の金属硫化物の塩素浸出を行う。
【0035】
このような塩素浸出方法、並びにこの塩素浸出方法を適用した金属の湿式製錬方法によれば、プロセス系内の銅量を多くすることなく、金属の浸出反応を効果的に促進させることができる。そして、このように銅量に依存することなく浸出反応を効果的に進行させることができるので、プロセス系内の不純物となる銅量を効果的に低減させることができ、高価な設備などを用いた不純物除去処理などを行うことなく、質の高い電気ニッケルや電気コバルトなどを効率的に製造することができる。
【実施例】
【0036】
以下に、本発明の実施例を説明するが、本発明は下記の実施例に何ら限定されるものではない。
【0037】
[参照例1]
容量3Lのセパラブルフラスコに、銅を含む塩化ニッケル溶液(ニッケル:210g/L、銅:35g/L、Na:15g/L、塩化物イオン:310g/L)を2.7L入れ、回転数380rpmで攪拌しながら、マントルヒーターにて液温109℃まで昇温した。
【0038】
その後、液温を109℃に保持したまま、溶液の酸化還元電位が650mV(vs Ag/AgCl)以上になるまで溶液中に塩素ガスを吹込み、溶液中の銅イオンを酸化して全て2価の銅イオンとして始液とした。そして、この溶液に、金属混合硫化物(ニッケル:58%、硫黄:34%、コバルト:4%)を投入し、液温を109℃に保持したまま攪拌し、塩素浸出反応(上記反応式(2))を行った。
【0039】
反応開始後15分毎にスラリーをサンプリングし、溶液中の2価の銅イオン濃度を一般的なヨウ素滴定法により測定した。そして、測定した2価銅イオン濃度から、浸出反応の反応率を算出した。なお、反応率は、(2価銅イオン濃度の減少量)÷(始液の2価銅イオン濃度)により求め、浸出反応を界面反応速度律速として一般的なShrinking core modelで仮定し、算出した反応率を用いて反応速度定数を算定した。
【0040】
その結果、反応速度定数は0.09(Hr−1)であった。本参照例1におけるニッケル濃度210g/Lは、商業用途で用いられている一般的な浸出反応の条件であることから、当該反応速度定数は浸出速度の基準といえる。
【0041】
[実施例1]
容量3Lのセパラブルフラスコに、銅を含む塩化ニッケル溶液(ニッケル:270g/L、銅:35g/L、Na:15g/L、塩化物イオン:370g/L)を2.7L入れ、回転数380rpmで攪拌しながら、マントルヒーターにて液温109℃まで昇温した。
【0042】
その後、参照例1と同様にして、液温を109℃に保持したまま溶液中に塩素ガスを吹き込み、溶液中の銅イオンを酸化して全て2価の銅イオンとした溶液に金属混合硫化物を投入して塩素浸出反応を行った。そして、同様にして、反応率を算出して反応速度定数を求めた。
【0043】
その結果、実施例1における反応速度定数は、0.13(Hr−1)となり、参照例1に比べて大幅に増加した。
【0044】
[実施例2]
容量3Lのセパラブルフラスコに、銅を含む塩化ニッケル溶液(ニッケル:350g/L、銅:35g/L、Na:15g/L、塩化物イオン:440g/L)を2.7L入れ、回転数380rpmで攪拌しながら、マントルヒーターにて液温109℃まで昇温した。
【0045】
その後、参照例1及び実施例1と同様にして、液温を109℃に保持したまま溶液中に塩素ガスを吹込み、溶液中の銅イオンを酸化して全て2価の銅イオンとした溶液に金属混合硫化物を投入して塩素浸出反応を行った。そして、同様にして、反応率を算出して反応速度定数を求めた。
【0046】
その結果、反応速度定数は0.19(Hr−1)となり、参照例1に比べて2倍以上に増加した。
【0047】
以上の実施例の結果に示されるように、塩化物溶液中の塩化物イオン濃度を350g/L以上とすることにより、銅イオン濃度を高めなくても、浸出反応の反応速度定数を大幅に高めることができ、浸出反応を効果的に進行させることができることが分かった。
【産業上の利用可能性】
【0048】
以上より明らかなように、本発明のように塩素浸出反応において塩化物溶液中の塩化物イオン濃度を上昇させることにより、浸出反応速度を大きく増加させることができる。これは、本発明に係る塩素浸出方法を用いることにより、銅濃度が高い場合はもとより、銅濃度が低い場合においても浸出反応を促進させることができることを意味する。また、この塩素浸出方法を適用した電解製錬プロセスにおいては、不純物となる銅量を低減させることができ、不純物の除去コストを抑制することができるとともに、良質な電気ニッケルや電気コバルトなどを製造することができる。
【技術分野】
【0001】
本発明は、例えばニッケルやコバルトなどを含む金属硫化物から塩素ガスによりニッケルやコバルトなどの金属成分を浸出させる金属硫化物の塩素浸出方法、並びにその塩素浸出方法を利用した金属の湿式製錬方法に関する。
【背景技術】
【0002】
ニッケル、コバルトなどを含む金属硫化物からニッケル、コバルトなどの金属を回収する湿式製錬方法としては、ニッケル、コバルト、銅及び硫黄を含む金属硫化物から、金属を浸出させ、得られた浸出液から不純物を除去した後、電解採取により金属を回収する方法が実用化されている。
【0003】
金属硫化物から金属を浸出させる方法としては、例えば特許文献1に記載の技術のように、1価銅イオンを含む塩化物浴中にて、金属硫化物を含むスラリーに塩素ガスなどの酸化性ガスを吹き込んで金属を酸化浸出させる方法がある。この方法は、下記反応式(1)に示すように、銅が塩素ガスを吸収して1価の銅イオンから2価の銅イオンに酸化される反応と、下記反応式(2)に示すように、2価の銅イオンが硫化物中に含まれる金属を酸化し、金属が浴中へ浸出される反応が起こることを利用している。
Cl2+2CuCl → 2CuCl2 ・・・(1)
2CuCl2+MS → MCl2+2CuCl+S ・・・(2)
(なお、式(2)中のMは、NiやCoなどの金属である。)
【0004】
このことから、酸化浸出反応においては、塩化物浴中における銅イオン濃度が低いと反応の進行速度が遅く、浸出反応が進行し難いことが知られている。そのため、この方法を用いた金属の製錬操業においては、従来、プロセス内に保有する銅量を多く保つような操業が実施されていた。
【0005】
具体的には、従来の塩素ガスによる酸化浸出では、ニッケルが220g/L、Cuが50〜60g/L、Cl濃度が350g/Lより低い濃度の条件において、主としてさらにCu濃度を可能な限り増加させて反応確率の増加させることによって浸出反応を促進させるようにしていた。
【0006】
一方で、銅イオンは、ニッケル、コバルトなどの金属の電解採取工程においては不純物として働くため、上述した浸出処理工程以降において、その銅イオンを塩化物浴の浸出液中から除去する処理が必要となる。
【0007】
塩化物浴から銅イオンを除去する方法としては、硫化物などの還元剤添加による硫化銅生成反応を利用する方法や、電解により銅を選択的に除去する方法、溶媒抽出により銅を選択的に除去する方法などが一般的に用いられる。しかしながら、いずれの方法においても、プロセス系内に保有される銅量の増加に伴い、硫化物、電力、溶媒などの必要資材量が増大するため、操業コストが増加することが懸念されている。したがって、不純物除去工程の観点から見れば、プロセス系内の銅量を低減させることが望ましいとされていた。
【0008】
しかしながら、上述のように金属の浸出工程においては、銅イオンが塩素を吸収する働きをしているため、プロセス内に保有する銅量を極端に低減させると、浸出工程における浸出反応を維持並びに促進させることができなくなる。そのため、増産などによりプロセス内で浸出するニッケル、コバルトなどの電解採取する金属が増加した場合には、それに伴って銅量も増加させる必要が生じ、結果として不純物除去工程における操業コスト増加につながっていた。
【0009】
このような状況を鑑み、ニッケルやコバルトなどの金属硫化物からの金属の湿式製錬において、プロセス内に保持する銅量を低減させ、かつ、効率よく金属の浸出反応を促進させられる操業方法が望まれている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特公平07−91599号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
そこで、本発明は、このような実情に鑑みて提案されたものであり、金属の湿式製錬のプロセス系内に保有する銅量を低減させた状態でも、金属硫化物からの金属成分の浸出反応を促進させることができる金属硫化物の塩素浸出方法、並びにその塩素浸出方法を利用した金属の湿式製錬方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、上述した目的を達成するために鋭意検討を重ねた結果、銅イオンを塩化物溶液中における金属硫化物の塩素浸出において、塩化物イオン濃度を高くすることにより金属の浸出反応が促進されることを見出し、本発明を完成させた。
【0013】
すなわち、本発明に係る金属硫化物の塩素浸出方法は、金属硫化物を原料として銅イオンを含む塩化物溶液中で塩素浸出する金属硫化物の塩素浸出方法であって、上記塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して塩素浸出することを特徴とする。
【0014】
また、本発明に係る金属の湿式製錬方法は、金属硫化物を原料として銅イオンを含む塩化物溶液中で該金属硫化物に含まれる金属成分を浸出し、得られた浸出液から金属を回収する金属の湿式製錬方法であって、上記塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して上記金属硫化物を塩素浸出する工程を含むことを特徴とする。
【発明の効果】
【0015】
本発明によれば、塩素浸出処理における塩化物溶液中の塩化物イオン濃度を所定の濃度以上に調整して塩素浸出を行うようにしているので、金属の湿式精錬プロセス系内に保有する銅量を増加させなくても、金属の浸出反応を促進させることができる。そしてこれにより、金属精錬プロセス系内において、浸出反応においては不可欠であるが浸出処理後に不純物となってしまう銅の含有量を低減させることができるため、その工業的価値は極めて大きい。
【図面の簡単な説明】
【0016】
【図1】塩化物溶液中の塩化物イオン濃度に対する塩素浸出反応の反応速度定数の関係を示すグラフである。
【発明を実施するための形態】
【0017】
以下、本発明に係る金属硫化物の塩素浸出方法の具体的な実施形態(以下、本実施の形態という)について、図面を参考にして詳細に説明する。なお、本発明は、以下の実施形態に限定されるものではなく、要旨を変更しない範囲において適宜変更することができる。
【0018】
本実施の形態に係る金属硫化物の塩素浸出方法は、銅イオンを含む塩化物溶液中で金属硫化物を塩素浸出する方法であって、その塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して塩化物溶液中の銅の酸化力を高めることによって塩素浸出することを特徴とする。
【0019】
金属硫化物とは、ニッケルやコバルト、銅などの金属混合物を含有する硫化物であり、例えば、低品位ラテライト鉱石などのニッケル酸化鉱から、高温高圧下で硫酸浸出することによって産出されたニッケル混合硫化物などが挙げられる。このニッケル混合硫化物など金属硫化物は、例えば硫酸浸出などによって産出された後、塩化物溶液中にてレパルプ処理されてスラリーとなる。塩素浸出処理においては、このスラリーとなった金属硫化物を原料として浸出処理が行われる。なお、以下では、主として、金属硫化物としてニッケル混合硫化物を用いる場合を例示して説明する。
【0020】
ここで、例えばニッケルやコバルトなどの非鉄金属の湿式精錬法では、ニッケル混合硫化物を原料として、ニッケル、コバルト、銅などの金属の大部分を塩素浸出し、浸出して得られた溶液から金属不純物を除去した後に、電解採取によって電気ニッケルや電気コバルトを製造する。具体的に、これらの金属の湿式精錬プロセスは、原料であるニッケル混合硫化物から金属成分を塩素で浸出する塩素浸出工程と、浸出液に含まれる銅を固定除去するセメンテーション工程と、銅が除去された溶液から不純物成分を除去する浄液工程と、不純物を除去した溶液を用いてニッケルやコバルトなどの金属を電解採取する電解工程とを有している。
【0021】
金属を電解採取する精錬プロセスにおいて、ニッケル混合硫化物を塩素浸出する塩素浸出工程では、上述したように、ニッケル混合硫化物を原料として、その原料を含有する塩化物溶液(スラリー)中に塩素ガスを吹き込み、ニッケルや銅などの金属成分を銅イオンを含む塩化物溶液中で酸化浸出する。そして、塩素浸出工程では、塩素浸出液としての銅を含有する塩化ニッケル溶液(以下、含銅塩化ニッケル溶液ともいう)を生成する。
【0022】
具体的に、塩素浸出工程におけるニッケル混合硫化物の浸出処理では、例えば下記の(1)、(2)式に示す反応が生じる。
Cl2+2CuCl → 2CuCl2 ・・・(1)
(Cl2+2Cu+→2Cl−+2Cu2+)
2CuCl2+MS → MCl2+2CuCl+S ・・・(2)
(なお、式(2)中のMは、NiやCoなどの金属である。)
【0023】
すなわち、上記式に示されるように、塩素浸出処理においては、原料としてのニッケル混合硫化物のスラリーが送液されると、ニッケル混合硫化物中に含まれる硫化ニッケル及び硫化銅などの金属成分を、塩素ガスにより酸化された2価銅イオンによって酸化浸出し、塩素浸出液としての含銅塩化ニッケル溶液を生成する。このようにして塩素浸出処理によって生成した塩素浸出液は、セメンテーション工程において浸出液中の銅が固定除去される。一方で、塩素浸出処理では、硫黄を主成分とした塩素浸出残渣が固相に残存する。
【0024】
このように、例えば電気ニッケルの製造プロセスでは、塩素浸出工程におけるニッケル混合硫化物を原料とした塩素浸出によって含銅塩化ニッケルを生成し、その含銅塩化ニッケルから電気ニッケルを製造することになる。このとき、品質の良い電気ニッケルを製造するためには、含銅塩化ニッケル溶液中の銅を効果的に除去することが重要となる。
【0025】
塩素浸出工程にて生成した含銅塩化ニッケル溶液中の銅は、上述のように、セメンテーション工程において含銅塩化ニッケル溶液から固定除去され、再び塩素浸出工程に戻されることになる。そして、塩素浸出工程においては、戻された銅と新たなニッケル混合硫化物中の銅とを塩素ガスによって2価銅イオンとし、ニッケルやコバルトなどの金属成分を浸出することとなる。つまり、塩素浸出工程とセメンテーション工程では、ある所定の濃度を保った状態で銅が循環することになる。したがって、電気ニッケルの増産を目的として、例えば湿式製錬から産出されたニッケル混合硫化物の処理量を増加させた場合、必然的に電気ニッケル製造プロセス系内に循環される銅量も増加することになる。
【0026】
ところが、電気ニッケルの電解採取においては、プロセス系内の銅は不純物となるため、電気ニッケルの増産に伴って循環される銅量が増加すると、不純物としての銅も増加することになる。したがって、この不純物としての銅を除去するという観点から見れば、プロセス系内の銅量を低減させることが望ましい。しかしながら、上述のように、塩素浸出工程における浸出処理では、原料中の金属成分が、塩素ガスによって酸化された2価銅イオンによって塩化物溶液中で酸化浸出されることになる。そのため、銅イオン濃度が低いと浸出反応の進行速度が遅くなり、金属が浸出し難くなる。
【0027】
ここで、上記反応式(1)及び(2)に示したように、金属の塩素浸出反応は、2価の銅イオンが金属を酸化して1価の銅イオンに還元されることによって進行する。したがって、この銅イオンの還元反応を促進させることによって、プロセス系内の銅量を低減させた場合でも、金属の浸出反応をより進行させることが可能となることが分かる。
【0028】
そこで、本実施の形態においては、金属硫化物であるニッケル混合硫化物の塩素浸出処理において、塩化物溶液中の塩化物イオン濃度に着目し、その塩化物イオン濃度を所定濃度以上の高い濃度に維持して塩素浸出反応を行うようにする。具体的には、塩化物イオン濃度を350g/L以上に調整して塩素浸出反応を行う。このように、塩化物溶液中の塩化物イオンの濃度を考慮し、その濃度を高めることにで、プロセス系内の銅量が少なくても、金属の浸出反応を進行させることができる。
【0029】
図1に、ニッケル混合硫化物(ニッケル:48%、硫黄:32%、コバルト:3%、銅:8%)の塩素浸出反応(反応温度109℃)において、塩化物溶液中の塩化物イオン濃度に対する塩素浸出反応の反応速度定数kの関係を示す。図1のグラフに示されるように、塩化物イオン濃度が高まるにつれて反応速度定数が大きくなる正の直線関係が成立し、塩化物イオン濃度を高くするほど金属の浸出反応が促進されることが分かる。特に、塩化物溶液中の塩化物イオン濃度が350g/L以上の場合では、反応速度定数が0.1以上となり、効果的に浸出反応を進行させることができることが分かる。
【0030】
このことは以下のメカニズムによるものと推測される。つまり、塩化物溶液中において、1価の銅イオンは多様な錯体を形成するが、2価の銅イオンは錯体を形成しない。そのため、塩化物溶液中の塩化物イオン濃度を増加させていくことにより、1価の銅イオンが塩化物イオンと錯体を形成し易くなり、1価銅の安定性が増大するものと考えられる。具体的には、1価の銅イオンが安定形態であるクロロ錯体となるものと考えられる。
【0031】
すると、塩素の吹き込みにより酸化された2価の塩化銅イオンが安定形態である1価のクロロ錯体に還元される力が駆動力となり、これによって上記反応式(2)において金属を酸化する力が増大するため、塩素浸出(酸化)反応が促進されるものと推測される。
【0032】
塩化物溶液中の塩化物イオン濃度として、上述のように350g/L以上に調整する。濃度が350g/L未満の場合には、2価の銅イオンが安定形態である1価のクロロ錯体に還元される力が十分に生じず、塩素浸出反応が促進されない。一方で、塩化物イオン濃度の上限値としては、特に限定されないが、500g/L以下とすることが好ましい。塩化物イオン濃度が500g/Lより多い場合には、塩化物溶液が過飽和状態となり、反応槽内に塩化物が析出して配管詰まりが発生し、安定した操業が行えなくなる可能性がある。また、後述するように、塩化物イオン濃度を高めるためのコストが増加し、経済性の観点からも好ましくない。したがって、塩化物溶液中の塩化物イオン濃度としては、350g/L以上となるように調整し、好ましくは350g/L以上500g/L以下となるように調整して塩素浸出反応を行う。
【0033】
また、その塩化物イオンの濃度調整方法としては、特に限定されるものではないが、例えば食塩などの銅以外の金属塩化物を添加する方法や、目的とする電解採取の金属を含有する金属塩化物を添加する方法、または、濃塩酸を添加する方法などにより調整することができる。
【0034】
以上詳細に説明したように、本実施の形態に係る金属硫化物の塩素浸出方法は、塩化物溶液中の塩化物イオン濃度を350g/L以上となるように調整して塩化物溶液中の銅の酸化力を高めることによって、この塩化物溶液中の金属硫化物の塩素浸出を行う。
【0035】
このような塩素浸出方法、並びにこの塩素浸出方法を適用した金属の湿式製錬方法によれば、プロセス系内の銅量を多くすることなく、金属の浸出反応を効果的に促進させることができる。そして、このように銅量に依存することなく浸出反応を効果的に進行させることができるので、プロセス系内の不純物となる銅量を効果的に低減させることができ、高価な設備などを用いた不純物除去処理などを行うことなく、質の高い電気ニッケルや電気コバルトなどを効率的に製造することができる。
【実施例】
【0036】
以下に、本発明の実施例を説明するが、本発明は下記の実施例に何ら限定されるものではない。
【0037】
[参照例1]
容量3Lのセパラブルフラスコに、銅を含む塩化ニッケル溶液(ニッケル:210g/L、銅:35g/L、Na:15g/L、塩化物イオン:310g/L)を2.7L入れ、回転数380rpmで攪拌しながら、マントルヒーターにて液温109℃まで昇温した。
【0038】
その後、液温を109℃に保持したまま、溶液の酸化還元電位が650mV(vs Ag/AgCl)以上になるまで溶液中に塩素ガスを吹込み、溶液中の銅イオンを酸化して全て2価の銅イオンとして始液とした。そして、この溶液に、金属混合硫化物(ニッケル:58%、硫黄:34%、コバルト:4%)を投入し、液温を109℃に保持したまま攪拌し、塩素浸出反応(上記反応式(2))を行った。
【0039】
反応開始後15分毎にスラリーをサンプリングし、溶液中の2価の銅イオン濃度を一般的なヨウ素滴定法により測定した。そして、測定した2価銅イオン濃度から、浸出反応の反応率を算出した。なお、反応率は、(2価銅イオン濃度の減少量)÷(始液の2価銅イオン濃度)により求め、浸出反応を界面反応速度律速として一般的なShrinking core modelで仮定し、算出した反応率を用いて反応速度定数を算定した。
【0040】
その結果、反応速度定数は0.09(Hr−1)であった。本参照例1におけるニッケル濃度210g/Lは、商業用途で用いられている一般的な浸出反応の条件であることから、当該反応速度定数は浸出速度の基準といえる。
【0041】
[実施例1]
容量3Lのセパラブルフラスコに、銅を含む塩化ニッケル溶液(ニッケル:270g/L、銅:35g/L、Na:15g/L、塩化物イオン:370g/L)を2.7L入れ、回転数380rpmで攪拌しながら、マントルヒーターにて液温109℃まで昇温した。
【0042】
その後、参照例1と同様にして、液温を109℃に保持したまま溶液中に塩素ガスを吹き込み、溶液中の銅イオンを酸化して全て2価の銅イオンとした溶液に金属混合硫化物を投入して塩素浸出反応を行った。そして、同様にして、反応率を算出して反応速度定数を求めた。
【0043】
その結果、実施例1における反応速度定数は、0.13(Hr−1)となり、参照例1に比べて大幅に増加した。
【0044】
[実施例2]
容量3Lのセパラブルフラスコに、銅を含む塩化ニッケル溶液(ニッケル:350g/L、銅:35g/L、Na:15g/L、塩化物イオン:440g/L)を2.7L入れ、回転数380rpmで攪拌しながら、マントルヒーターにて液温109℃まで昇温した。
【0045】
その後、参照例1及び実施例1と同様にして、液温を109℃に保持したまま溶液中に塩素ガスを吹込み、溶液中の銅イオンを酸化して全て2価の銅イオンとした溶液に金属混合硫化物を投入して塩素浸出反応を行った。そして、同様にして、反応率を算出して反応速度定数を求めた。
【0046】
その結果、反応速度定数は0.19(Hr−1)となり、参照例1に比べて2倍以上に増加した。
【0047】
以上の実施例の結果に示されるように、塩化物溶液中の塩化物イオン濃度を350g/L以上とすることにより、銅イオン濃度を高めなくても、浸出反応の反応速度定数を大幅に高めることができ、浸出反応を効果的に進行させることができることが分かった。
【産業上の利用可能性】
【0048】
以上より明らかなように、本発明のように塩素浸出反応において塩化物溶液中の塩化物イオン濃度を上昇させることにより、浸出反応速度を大きく増加させることができる。これは、本発明に係る塩素浸出方法を用いることにより、銅濃度が高い場合はもとより、銅濃度が低い場合においても浸出反応を促進させることができることを意味する。また、この塩素浸出方法を適用した電解製錬プロセスにおいては、不純物となる銅量を低減させることができ、不純物の除去コストを抑制することができるとともに、良質な電気ニッケルや電気コバルトなどを製造することができる。
【特許請求の範囲】
【請求項1】
金属硫化物を原料として銅イオンを含む塩化物溶液中で塩素浸出する金属硫化物の塩素浸出方法であって、
上記塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して塩素浸出することを特徴とする金属硫化物の塩素浸出方法。
【請求項2】
上記塩化物イオン濃度を350g/L以上500g/L以下とすることを特徴とする請求項1記載の金属硫化物の塩素浸出方法。
【請求項3】
上記金属硫化物は、ニッケル酸化鉱の湿式製錬法により得られたニッケル混合硫化物であることを特徴とする請求項1又は2記載の金属硫化物の塩素浸出方法。
【請求項4】
金属硫化物を原料として銅イオンを含む塩化物溶液中で該金属硫化物に含まれる金属成分を浸出し、得られた浸出液から金属を回収する金属の湿式製錬方法であって、
上記塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して上記金属硫化物を塩素浸出する工程を含むことを特徴とする金属の湿式製錬方法。
【請求項5】
上記金属硫化物は、ニッケル酸化鉱の湿式製錬法により得られたニッケル混合硫化物であり、上記塩素浸出する工程を経て得られた浸出液からニッケルを回収することを特徴とする請求項4記載の金属の湿式製錬方法。
【請求項1】
金属硫化物を原料として銅イオンを含む塩化物溶液中で塩素浸出する金属硫化物の塩素浸出方法であって、
上記塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して塩素浸出することを特徴とする金属硫化物の塩素浸出方法。
【請求項2】
上記塩化物イオン濃度を350g/L以上500g/L以下とすることを特徴とする請求項1記載の金属硫化物の塩素浸出方法。
【請求項3】
上記金属硫化物は、ニッケル酸化鉱の湿式製錬法により得られたニッケル混合硫化物であることを特徴とする請求項1又は2記載の金属硫化物の塩素浸出方法。
【請求項4】
金属硫化物を原料として銅イオンを含む塩化物溶液中で該金属硫化物に含まれる金属成分を浸出し、得られた浸出液から金属を回収する金属の湿式製錬方法であって、
上記塩化物溶液中の塩化物イオン濃度を350g/L以上に調整して上記金属硫化物を塩素浸出する工程を含むことを特徴とする金属の湿式製錬方法。
【請求項5】
上記金属硫化物は、ニッケル酸化鉱の湿式製錬法により得られたニッケル混合硫化物であり、上記塩素浸出する工程を経て得られた浸出液からニッケルを回収することを特徴とする請求項4記載の金属の湿式製錬方法。
【図1】




【公開番号】特開2013−67839(P2013−67839A)
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願番号】特願2011−207756(P2011−207756)
【出願日】平成23年9月22日(2011.9.22)
【出願人】(000183303)住友金属鉱山株式会社 (2,015)
【Fターム(参考)】
【公開日】平成25年4月18日(2013.4.18)
【国際特許分類】
【出願日】平成23年9月22日(2011.9.22)
【出願人】(000183303)住友金属鉱山株式会社 (2,015)
【Fターム(参考)】
[ Back to top ]

