金属触媒の製造方法
【課題】高効率な金属触媒の製造方法を提供する。
【解決手段】下記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導されるヒドラゾン高分子化合物と、金属化合物とを混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する金属錯体形成工程、及び、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体とを高温処理する高温処理工程を有することを特徴とする、金属触媒の製造方法。

(上記式(1)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
【解決手段】下記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導されるヒドラゾン高分子化合物と、金属化合物とを混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する金属錯体形成工程、及び、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体とを高温処理する高温処理工程を有することを特徴とする、金属触媒の製造方法。

(上記式(1)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、高効率な金属触媒の製造方法に関する。
【背景技術】
【0002】
燃料電池における電極触媒としては、例えば、白金、コバルト、ニッケル、鉄、及び、白金−ルテニウム合金のような合金等が知られている。燃料電池の発電性能を高めるには、これら触媒金属の触媒作用を高めることが重要であり、例えば、触媒金属の微粒子化等による触媒利用率の向上が図られている。しかしながら、微細な粒子は非常に凝集しやすいため、従来、長期間にわたってその分散状態を保持することが困難であり、触媒利用率は充分に高められていない。触媒金属の安定した微細分散を実現すべく、触媒金属微粒子を炭素粒子や金属粒子等の導電性粒子に担持させることも行われているが、その効果は充分ではない。
また、従来の電極触媒や該電極触媒を分散させた電極の製造方法は、煩雑な操作や工程を要するため、より簡便な操作又は工程で製造可能な電極触媒原料化合物の開発が望まれている。
【0003】
一方、ある種のヒドラゾン化合物を原料として製造される合成高分子に金属を配位させ
て錯体化した後、この合成高分子金属錯体を焼成することにより、燃料電池用触媒を製造
しうることが知られている(特許文献1参照)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開公報WO2004/036674号
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明者らは、燃料電池用金属触媒について鋭意検討した結果、合成高分子原料や金属触媒担体原料などとして有用な新規ヒドラゾン化合物を見出し、既に特許出願を行っている(特願2007−225268)。前記新規ヒドラゾン化合物は、触媒金属の微細分散を可能とする電極触媒原料化合物として特に有用である。
【0006】
本発明者らは、さらに上記新規ヒドラゾン化合物を用いた金属触媒について研究を進め、高効率で金属触媒を得る製造方法を見出した。すなわち、本発明は、上記研究の経緯を経て成し遂げられたものであり、金属触媒の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の金属触媒の製造方法は、下記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを、特定のpH条件下で混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する金属錯体形成工程、並びに、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方と、導電性粒子とを混合して高温処理する高温処理工程を有することを特徴とする。なお、前記pH条件は、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を、前記金属化合物と混合した溶液の、波長が400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件である。
【0008】
【化1】

(上記式(1)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
【0009】
このような構成の金属触媒の製造方法は、前記式(1)に示すヒドラゾン化合物が異なるpH条件下において異なる化学構造を有することにより、金属原子への配位能がpH条件に依存して変化することから、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来する金属イオンが有する吸光度が一定以上の値になるようなpH条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記金属イオンとの、安定した金属錯体形成を行わせることができる。また、このような構成の金属触媒の製造方法は、高温処理工程を行うことによって、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方を導電性粒子に担持した金属触媒を得ることができる。
【0010】
本発明の金属触媒の製造方法は、前記ヒドラゾン化合物から誘導される構成単位を含有する前記ヒドラゾン高分子化合物を合成する第1のポリマー合成工程を有することが好ましい。
【0011】
このような構成の金属触媒の製造方法は、前記第1のポリマー合成工程において予めヒドラゾン高分子化合物を準備することによって、前記金属錯体形成工程において、前記ヒドラゾン金属錯体よりも触媒活性の高い前記ヒドラゾン高分子金属錯体を合成することができる。
【0012】
本発明の金属触媒の製造方法は、前記ヒドラゾン金属錯体から誘導される構成単位を含有するヒドラゾン高分子金属錯体を合成する第2のポリマー合成工程を有することが好ましい。
【0013】
このような構成の金属触媒の製造方法は、前記金属錯体形成工程において得られた前記ヒドラゾン金属錯体を用いて、当該ヒドラゾン金属錯体よりも触媒活性の高い前記ヒドラゾン高分子金属錯体を合成することができる。
【0014】
本発明の金属触媒の製造方法は、前記ヒドラゾン化合物を合成するモノマー合成工程を有することが好ましい。
【0015】
このような構成の金属触媒の製造方法は、前記モノマー合成工程において原料を適宜選択することにより、所望の金属触媒を合成するために最適な前記ヒドラゾン化合物を得ることができる。
【0016】
本発明の金属触媒の製造方法は、前記金属錯体形成工程において、前記金属化合物がニッケル元素を有し、且つ、前記pH条件が10.5〜13.5であることが好ましい。
【0017】
このような構成の金属触媒の製造方法は、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来するニッケルイオンが有する吸光度が一定以上の値になるようなpH=10.5〜13.5の条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記ニッケルイオンとの、安定した金属錯体形成を行わせることができる。
【0018】
本発明の金属触媒の製造方法は、前記金属錯体形成工程において、前記金属化合物が鉄元素を有し、且つ、前記pH条件が5〜12であることが好ましい。
【0019】
このような構成の金属触媒の製造方法は、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来する鉄イオンが有する吸光度が一定以上の値になるようなpH=5〜12の条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記鉄イオンとの、安定した金属錯体形成を行わせることができる。
【0020】
本発明の金属触媒の製造方法は、前記金属錯体形成工程において、前記金属化合物がコバルト元素を有し、且つ、前記pH条件が6〜13であることが好ましい。
【0021】
このような構成の金属触媒の製造方法は、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来するコバルトイオンが有する吸光度が一定以上の値になるようなpH=6〜13の条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記コバルトイオンとの、安定した金属錯体形成を行わせることができる。
【0022】
本発明の第1のヒドラゾン金属錯体は、下記一般式(2)で表されることを特徴とする。
【0023】
【化2】

(上記式(2)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0024】
このような構成の第1のヒドラゾン金属錯体は、金属触媒及び金属触媒前駆体の少なくともいずれか一方として用いることができる。
【0025】
本発明の第2のヒドラゾン金属錯体は、下記一般式(3)で表されることを特徴とする。
【0026】
【化3】

(上記式(3)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0027】
このような構成の第2のヒドラゾン金属錯体は、金属触媒及び金属触媒前駆体の少なくともいずれか一方として用いることができる。
【0028】
本発明の第1のヒドラゾン高分子金属錯体は、下記一般式(4)で表される繰り返し単位を有するポリマーであることを特徴とする。
【0029】
【化4】

(上記式(4)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0030】
このような構成の第1のヒドラゾン高分子金属錯体は、金属触媒及び金属触媒前駆体の少なくともいずれか一方として用いることができる。
【0031】
本発明の第2のヒドラゾン高分子金属錯体は、下記一般式(5)で表される繰り返し単位を有するポリマーであることを特徴とする。
【0032】
【化5】

(上記式(5)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0033】
このような構成の第2のヒドラゾン高分子金属錯体は、金属触媒及び金属触媒前駆体の少なくともいずれか一方として用いることができる。
【発明の効果】
【0034】
本発明によれば、前記式(1)に示すヒドラゾン化合物が異なるpH条件下において異なる化学構造を有することにより、金属原子への配位能がpH条件に依存して変化することから、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来する金属イオンが有する吸光度が一定以上の値になるようなpH条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記金属イオンとの、安定した金属錯体形成を行わせることができる。また、本発明によれば、高温処理工程を行うことによって、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方を導電性粒子に担持した金属触媒を得ることができる。
【図面の簡単な説明】
【0035】
【図1】アルカリ燃料電池用セルの概略を説明する断面図である。
【図2】実施例の触媒製造において用いた熱処理装置の概略図である。
【図3】実施例におけるアノード用触媒(a)の評価結果を示すグラフである。
【図4】実施例におけるアノード用触媒(A)の評価結果を示すグラフである。
【図5】各pH(pH=4〜13)における実施例1の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。
【図6】各pH(pH=10〜14)における実施例1の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。
【図7】各pH(pH=4〜13)における実施例2の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。
【図8】各pH(pH=4〜13)における実施例3の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。
【図9】各pH(pH=1〜10)におけるヒドラゾン化合物水溶液(参考例の測定用水溶液)のUV−visスペクトル測定結果を示すグラフである。
【発明を実施するための形態】
【0036】
本発明の金属触媒の製造方法は、下記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを、特定のpH条件下で混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する金属錯体形成工程、並びに、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方と、導電性粒子とを混合して高温処理する高温処理工程を有することを特徴とする。なお、前記pH条件は、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を、前記金属化合物と混合した溶液の、波長が400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件である。
【0037】
【化6】

(上記式(1)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
【0038】
本発明の金属触媒の製造方法は、少なくとも、金属錯体形成工程と、高温処理工程とからなる。また、本発明に係る第1及び第2のヒドラゾン金属錯体、並びに、第1及び第2のヒドラゾン高分子金属錯体は、上記金属錯体形成工程において得られるヒドラゾン金属錯体又はヒドラゾン高分子金属錯体の典型例である。
本明細書においては、まず、本発明の金属触媒の製造方法について、金属錯体形成工程、高温処理工程と順を追って説明した後、必要に応じて行われるその他の工程(第1及び第2のポリマー合成工程、モノマー合成工程等)について説明する。さらにその後に、本発明に係る第1及び第2のヒドラゾン金属錯体、並びに、第1及び第2のヒドラゾン高分子金属錯体について説明する。
【0039】
1.金属錯体形成工程
本発明において、金属錯体形成工程とは、上記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを、特定のpH条件下で混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する工程のことである。なお、特定の前記pH条件とは、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を、前記金属化合物と混合した溶液の、波長が400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件である。
【0040】
本発明において「吸光度」とは、強度I0の単色光が物質層を透過して強度Iとなったときの、その波長における物質層の吸光度(A=log10(I0/I))のことである(ランベルト‐ベールの法則)。
【0041】
本発明において使用されるヒドラゾン化合物において、Pyで表される基は、2−ピリジル基、3−ピリジル基、及び4−ピリジル基のいずれであってもよいが、分子内で三座配位を形成しうると考えられる点からは2−ピリジル基が好ましい。本発明において使用されるヒドラゾン化合物には、E(Entgegen)体、Z(Zusammen)体の異性体が存在し、E体の純粋物、Z体の純粋物、又は両異性体を任意の割合で含む混合物として得られるが、代表して一般式(1)で表記する。
また、上記一般式(1)で表されるヒドラゾン化合物のうち、例えば、4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオールには、下記式(1a)に表されるような互変異性体(tautomer)が存在するが、このような互変異性体が存在する場合においても、本明細書においては、代表して一般式(1)で表記する。
【0042】
【化7】

【0043】
一般式(1)で表されるヒドラゾン化合物の具体例としては、例えば、4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオール、4−{1−[(3−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオール、4−{1−[(4−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオールが挙げられる。
【0044】
上記一般式(1)で表される、本発明において使用されるヒドラゾン化合物は、ヒドラゾン窒素、ピリジン窒素及び/又はフェノール類のヒドロキシル基が配位性を有しており、当該分子が配位子として機能し、錯体を形成することができる。しかも、本発明において使用されるヒドラゾン化合物が配位して得られる錯体は安定性に優れる。得られる錯体の安定性は、本発明において使用されるヒドラゾン化合物の配位性部位の構造に起因すると考えられる。すなわち、上記式(1)のヒドラゾン化合物の配位部位であるヒドラゾノ基の窒素(=N−)が、該窒素に隣接する炭素と、該ヒドラゾノ基が結合するフェノール類の4位と3位の炭素と、該フェノール類のベンゼン環の3位に結合する酸素(ヒドロキシル基)と共に、C字型構造を形成しており、該ヒドラゾン窒素(=N−)と金属、さらにはフェノール類のヒドロキシル基と金属が配位結合を形成することによって、該中心金属と、上記C字型構造を形成している該ヒドラゾン窒素(=N−)、該ヒドラゾン窒素に隣接する炭素、該ヒドラゾノ基が結合するフェノール類の4位と3位の炭素、及び、該フェノール類のベンゼン環の3位に結合する酸素とによって、六角形構造が形成されるためと推測される(下記式(6)参照)。
【0045】
【化8】

【0046】
さらには、本発明において使用されるヒドラゾン化合物においては、ヒドラゾノ基に結合するピリジン環の窒素(ピリジン窒素)も配位能を有しており、金属錯体の形成に関与することが推測される。その配位については、当該ピリジン窒素がピリジン環の3位又は4位に存する場合には、複数のヒドラゾン化合物分子の関与により金属錯体を形成することも推測され、また一方、当該窒素がピリジン環の2位に存するものにおいては、いわゆる三座配位を分子内で形成することにより金属錯体を形成することも推測される。
上記式(6)に示した構造は、本発明に係るヒドラゾン金属錯体の構造の典型例である。なお、本明細書においては、本発明に係るヒドラゾン金属錯体の構造を式(6)のごとき表記で代表させるが、該金属錯体の構造としては式(6)に示した構造の他にも、例えば、「窒素原子とともに金属錯体形成に寄与している水酸基以外のもう1つの水酸基を用いて、2以上のヒドラゾン化合物分子と金属との間で配位結合あるいはイオン結合を形成した構造」等を挙げることができる。
【0047】
錯体を形成することによって、金属種(金属原子、金属イオン)は凝集が抑制されており、その分散性を高めることができる。上述したように、本発明において使用されるヒドラゾン化合物を配位子とする錯体は、錯体の安定性が高いため、金属種の分散性をさらに高めることが可能であり、しかも、その分散性を長期間にわたって維持することができる。
ゆえに、本発明において使用されるヒドラゾン化合物を配位子(金属錯体形成用配位子)とし、触媒金属種に配位させて錯体を形成することによって、触媒金属の微細分散が可能となり、その結果、触媒金属の利用率を向上させることができる。従って、本発明によれば、触媒金属微粒子の製造工程や使用中において生じる粒成長が抑制されており、少量の触媒金属で優れた触媒作用を発現する触媒を得ることが可能である。そして、このように本発明において使用されるヒドラゾン化合物と触媒金属を用いて得られる金属錯体を、電極触媒の原料化合物として用いることにより、発電性能に優れた燃料電池を得ることも可能である。しかも、本発明において使用されるヒドラゾン化合物と触媒金属とを配位結合させてなる錯体は、従来の一般的な方法に準じて製造することが可能であり、非常に簡便な操作、工程で得られ、生産性に優れるものである。
【0048】
また、上記式(1)で表されるヒドラゾン化合物は、合成高分子化合物の原料、すなわち、高分子化合物製造用単量体としても利用することができ、他の化合物と重合してヒドラゾン高分子化合物を形成したり、さらには、金属種に配位させてヒドラゾン金属錯体を形成したのち、該ヒドラゾン金属錯体をモノマーとしてヒドラゾン高分子金属錯体を形成したりすることも可能である。
このようにヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物を触媒金属に配位させたり、或いは、ヒドラゾン金属錯体を他のモノマーと重合させたりして得られるヒドラゾン高分子金属錯体においては、上記ヒドラゾン金属錯体(モノマー)と比較して、触媒金属の分散性のさらなる向上が可能である。
【0049】
以上のように、本発明において使用されるヒドラゾン化合物は、錯体や高分子材料、その他化合物の原料化合物として非常に有用であり、金属錯体形成用配位子及び高分子化合物製造用単量体として利用できるほか、様々な分野における利用、応用が期待できる。中でも、金属錯体形成における配位安定性の観点から、少なくとも1種の金属種に配位して金属錯体を形成する金属錯体形成用ヒドラゾン化合物として非常に適するものであり、該金属種を微細分散させる担体として優れた性能を発揮しうる。
【0050】
上記式(1)のヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物としては、具体的には、少なくとも、本発明において使用されるヒドラゾン化合物、フェノール類、及びアルデヒド類を重合させることにより得られる下記式(7)に示すポリマーを挙げることができるが、必ずしもこれのみに限定されるものではない。
【0051】
【化9】

【0052】
上記式(7)中、n、mはそれぞれ1以上の整数である。また、lは2以上の整数である。
なお、ヒドラゾン高分子を構成する繰り返し単位の連結の順番に関しては、上記式(7)に示されるような、ヒドラゾン化合物から誘導される繰り返し単位、及びフェノールとホルムアルデヒド由来の繰り返し単位のそれぞれが、どのような順番で何回ずつ連結されていても構わない。たとえば、一定数同じ繰り返し単位が連結されたブロックが、互いに共重合するブロック共重合体であってもよいし、あるいは異なる繰り返し単位が交互に重合する交互共重合体であってもよい。また、繰り返し単位の配列に全く秩序が無いランダム共重合体であってもよい。
【0053】
上述したように、本発明において使用されるヒドラゾン化合物は、金属種(金属原子、金属イオン)に配位結合し、金属錯体を形成する(上記式(6)参照)。
配位する金属種としては、特に限定されず、例えば、遷移金属、具体的には8〜10族(第VIIIA族)遷移金属、より具体的には、鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム、白金を例示することができる。中でも、鉄、コバルト、ニッケルを好適に用いることができる。本発明において使用されるヒドラゾン化合物を金属種に配位させてなるヒドラゾン金属錯体は、配位する金属種を選択し、必要に応じて金属種を還元することによって、特定の化学反応に対して触媒活性を示しうる(例えばオレフィン重合用触媒などが考えられる)。
なお、金属錯体形成においては、1種類のみの金属種を単独で用いてもよいし、2種類以上の金属種を併用(混用)して用いてもよい。
【0054】
本発明における金属錯体形成工程において、ヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを混合して錯体を形成する際に、特定のpH条件下で混合することが、本発明の主な特徴のうちの1つである。
上述した発明者らによる特許出願(特願2007−225268)においては、触媒の合成に成功はしているものの、出願後にXRD(X−ray diffraction:X線回折法)等の分析を行った結果、ヒドラゾン化合物の金属への錯体形成に未だ課題が残されていることが明らかとなった。以下、本発明に用いられるヒドラゾン化合物のうち、4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオールを例として、詳細に説明する。
発明者らは、分子軌道計算を行った結果、本発明で用いられるヒドラゾン化合物は、pHによって化学構造が変化することを下記式(8)のように推定した。すなわち、pH≦1の強酸性下においては、ヒドラゾン化合物はジカチオン構造(8a)をとる。このようなジカチオン構造は、pH=2〜4の酸性下においては、ヒドラゾン窒素(=N−)とフェノール類のヒドロキシル基とが分子内水素結合を起こすため、モノカチオン構造(8b)へと変化する。さらに、pH=5〜8の弱酸性〜弱塩基性下においては、ヒドラゾン化合物は中性の分子構造(8c)をとる。なお、このときピリジン環上の窒素原子は、ヒドロキシル基上の水素原子に水素結合しないことが、分子軌道計算結果により明らかとなっている。そして、pH≧9の弱塩基性〜強塩基性下においては、ヒドロキシル基が脱プロトン化することによって、ヒドラゾン化合物はアニオン構造(8d)をとる。なお、このとき、ベンゼン環上の1位のヒドロキシル基上のプロトン(H+)は、カリウムイオン(K+)に置換される場合がある。
【0055】
【化10】

【0056】
これらの分子構造は、後述する実施例において測定した、各pHにおけるヒドラゾン化合物水溶液のUV−visスペクトル測定結果(図9)からも説明することができる。
実施例において後述するように、UV−visスペクトル測定において、中性領域(pH=5〜7.5)では、構造(8c)の互変異性体(tautomer)のπ‐π*遷移による吸収が確認された。
また、酸性領域(pH=1〜4)では、構造(8a)又は(8b)のように、ピリジン環上の窒素原子、及び/又はヒドラゾン窒素のプロトン化により、前記π‐π*遷移による吸収が長波長シフトしたものが確認された。
さらに、アルカリ性領域(pH=9〜10)では、構造(8d)のような錯体形成による吸収が確認された。
【0057】
後述する参考例の結果及び図9から分かるように、ヒドラゾン化合物は、溶液中のpHを変動させても波長400nm以上の長波長領域にはほとんど吸収を持たない。それとは対照的に、ヒドラゾン金属錯体は、長波長領域、特に波長400nm以上の領域に金属イオン由来の吸収を有する。したがって、十分な吸光強度を有しており、かつ、錯体を形成していない上記式(1)のヒドラゾン化合物に由来する波長400nm以下の光の吸収とも重ならないため測定/解析に有用な波長である、波長400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件を予め設定することで、本発明における金属錯体形成工程においては、安定してヒドラゾン化合物と金属イオンとが金属錯体形成を起こし、ヒドラゾン金属錯体が生成しているとみなすことができる。なお、pH条件は、金属化合物が有する金属種(金属原子、金属イオン)の種類によってそれぞれ異なる。
【0058】
金属錯体形成工程において、前記金属化合物がニッケル元素を有し、且つ、pH条件が10.5〜13.5であることが好ましい。これは、金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来するニッケルイオンが有する吸光度が一定以上の値になるようなpH=10.5〜13.5の条件下で、ヒドラゾン化合物又はヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、ヒドラゾン化合物又はヒドラゾン高分子化合物とニッケルイオンとの、安定した金属錯体形成を行わせることができるからである。なお、前記pH条件が10.5〜12.5であることが特に好ましい。
【0059】
金属錯体形成工程において、前記金属化合物が鉄元素を有し、且つ、pH条件が5〜12であることが好ましい。これは、金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来する鉄イオンが有する吸光度が一定以上の値になるようなpH=5〜12の条件下で、ヒドラゾン化合物又はヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、ヒドラゾン化合物又はヒドラゾン高分子化合物と鉄イオンとの、安定した金属錯体形成を行わせることができるからである。なお、前記pH条件が10〜12であることが特に好ましい。
【0060】
金属錯体形成工程において、前記金属化合物がコバルト元素を有し、且つ、pH条件が6〜13であることが好ましい。これは、金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来するコバルトイオンが有する吸光度が一定以上の値になるようなpH=6〜13の条件下で、ヒドラゾン化合物又はヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、ヒドラゾン化合物又はヒドラゾン高分子化合物とコバルトイオンとの、安定した金属錯体形成を行わせることができるからである。なお、前記pH条件が10〜13であることが特に好ましい。
【0061】
本発明において使用されるヒドラゾン化合物を金属種に配位させてなるヒドラゾン金属錯体を得る方法は、上記pH条件下であれば、特に限定されず、一般的な方法に準じることができる。例えば、まず、ヒドラゾン化合物を、ヒドラゾン化合物及び生成した金属錯体に対しての溶解性が小なる極性溶媒、具体的には水、アセトンに代表されるケトン類、メタノール、エタノールに代表されるアルコール類等の適当な溶媒もしくはその混合溶媒に分散させ、該溶液中に金属種の原料となる金属塩を加え混合し、pH調節剤を加え、さらに混合することでヒドラゾン金属錯体が得られる。上記溶媒としては、さらにはアセトニトリルに代表されるアルキルニトリルや、クロロホルム、ジクロロメタンに代表されるハロゲン化脂肪族炭化水素、酢酸エチルに代表されるカルボン酸エステル等の溶媒も使用可能である。
該ヒドラゾン金属錯体の製造は、通常、20〜60℃の温度範囲で行うことが好ましい。得られたヒドラゾン金属錯体は、ろ過等により分離し、必要に応じて、生成した金属錯体に対しての溶解性が小なる極性溶媒、具体的には水、アセトンに代表されるケトン類、メタノール、エタノールに代表されるアルコール類等の適当な溶媒により洗浄、乾燥することで、単離することができる。
【0062】
金属錯体形成に用いる金属塩としては、例えば、硝酸塩;硫酸塩;リン酸塩;ハロゲン化物、具体的には塩素化物、臭素化物、ヨウ素化物;過ハロゲン酸塩、具体的には過塩素酸塩、過臭素酸塩、過ヨウ素酸塩;スルホン酸塩、具体的にはメタンスルホン酸塩、トリフルオロメタンスルホン酸塩、p−トルエンスルホン酸塩、ベンゼンスルホン酸塩;カルボン酸塩、具体的には、ギ酸塩、酢酸塩、プロピオン酸塩、酪酸塩、吉草酸塩、カプロン酸塩、ハロ置換酢酸塩、より具体的にはモノクロロ酢酸塩、ジクロロ酢酸塩、トリクロロ酢酸塩、モノフルオロ酢酸塩、ジフルオロ酢酸塩、トリフルオロ酢酸塩等を用いることができる。用途に応じて、これら金属塩は1種のみでも或いは複数種を組み合わせてもよい。複数種の金属塩を用いる場合、各金属塩の仕込み比(金属原子換算)を反映した比率で、各金属種に配位したヒドラゾン金属錯体が混在した混合物を得ることができる。
金属塩としては、具体的には、酢酸鉄(II)、酢酸コバルト(II)に代表されるカルボン酸塩、塩化鉄(II)、塩化コバルト(II)、塩化ニッケル(II)、臭化鉄(II)、臭化コバルト(II)、臭化ニッケル(II)、ヨウ化鉄(II)、ヨウ化コバルト(II)、ヨウ化ニッケル(II)等に代表されるハロゲン化物を例示でき、これらは水和物であっても差し支えない。
また、pH調節剤としては、例えば有機酸塩、有機酸、無機酸塩、無機酸を包含する一般的な塩基及び/又は酸であればよく、具体的には、トリチルアミン等の三級アミン類、及びピリジン類等を包含する有機塩基;メタンスルホン酸、p−トルエンスルホン酸等のスルホン酸類、及び酢酸等のカルボン酸類を包含する有機酸;水酸化ナトリウム、水酸化カリウム等の水酸化金属類、炭酸ナトリウム、炭酸カリウム等の金属炭酸塩類、炭酸水素ナトリウム、及び炭酸水素カリウム等の金属炭酸水素塩類を包含する無機塩基;塩酸等のハロゲン化水素酸類、硫酸、リン酸、及び硝酸等を包含する無機酸が挙げられ、NaOH、KOH、Na2CO3、NaHCO3、HCl、H2SO4、HNO3、KHSO4、CH3COOH等を例示できる。
【0063】
ヒドラゾン化合物同様、当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物も、当該構成単位に由来するヒドラゾン窒素、ピリジン窒素及び/又はフェノール類のヒドロキシル基において金属種に配位してヒドラゾン高分子金属錯体を形成することができる(下記式(9)参照)。ヒドラゾン高分子化合物を金属種に配位させる方法は、ヒドラゾン化合物からヒドラゾン金属錯体を製造する方法と同様である。
ヒドラゾン高分子化合物に、複数種の金属塩を用いる場合、各金属塩の仕込み比(金属原子換算)を反映した比率で、各金属種を含有するヒドラゾン高分子金属錯体が得られる。合成した高分子により各金属に対する親和性に違いが見られるのが一般的であり、これを利用して分子の構造により金属含有量をコントロールすることができる。
なお、ヒドラゾン高分子金属錯体を構成する繰り返し単位の連結の順番に関しては、下記式(9)に示されるような、ヒドラゾンに金属が配位した繰り返し単位、及びフェノールとホルムアルデヒド由来の繰り返し単位のそれぞれが、どのような順番で何回ずつ連結されていても構わない。たとえば、一定数同じ繰り返し単位が連結されたブロックが、互いに共重合するブロック共重合体であってもよいし、あるいは異なる繰り返し単位が交互に重合する交互共重合体であってもよい。また、繰り返し単位の配列に全く秩序が無いランダム共重合体であってもよい。
下記式(9)に示した構造は、本発明に係るヒドラゾン高分子金属錯体の構造の典型例である。なお、本明細書においては、本発明に係るヒドラゾン高分子金属錯体の構造を式(9)のごとき表記で代表させるが、該金属錯体の構造としては式(9)に示した構造の他にも、例えば、「窒素原子とともに金属錯体形成に寄与している水酸基以外のもう1つの水酸基を用いて、2以上のヒドラゾン部位と金属との間で配位結合あるいはイオン結合を形成した構造」や、「ポリマー製造において、ヒドラゾン化合物と共に用いられるフェノール原料由来の2以上のフェノール性水酸基と金属との間で、配位結合あるいはイオン結合を形成した構造」等を挙げることができる。
【0064】
【化11】

【0065】
2.高温処理工程
本発明において、高温処理工程とは、ヒドラゾン金属錯体及びヒドラゾン高分子金属錯体の少なくともいずれか一方と、導電性粒子とを混合して高温処理を行う工程のことである。
高温処理工程を行うことによって、ヒドラゾン金属錯体及びヒドラゾン高分子金属錯体の少なくともいずれか一方を導電性粒子に担持した金属触媒を得ることができる。
【0066】
本発明の高温処理工程において、高温処理とは、例えば焼成を挙げることができる。以下、高温処理として焼成を行った例について詳細に述べる。
具体的には、Pt、Ni、Fe、Co、Ag、Pd、Cu、Mn、Mo、Ru、Rh、Cr等の金属触媒種にヒドラゾン化合物から誘導される構成単位が配位したヒドラゾン高分子金属錯体と、活性炭等の炭素質導電性担持材料と、を焼成することにより、ヒドラゾンと炭素質導電性担持材料に部分的な結合が生じ、ヒドラゾン高分子金属錯体が炭素質導電性担持材料表面に固定化される。これにより生成するヒドラゾン高分子金属錯体・炭素質導電性担持材料複合体は、触媒金属の導電性担体として機能し得るようになり、該複合体に担持された触媒金属が電気化学反応に対して触媒活性を発現できるようになる。
【0067】
上記金属錯体の焼成は、不活性ガス雰囲気下、或いは、水素ガス雰囲気等の還元条件下で行うことが好ましい。不活性雰囲気又は還元条件下で行うことによって、触媒金属に配位するヒドラゾン高分子化合物を酸化させることなく、電気化学反応に対する触媒活性の付与、及び、触媒金属とヒドラゾン高分子化合物との配位構造の維持が可能となる。
焼成温度及び焼成時間等の焼成条件は、ヒドラゾン高分子金属錯体を構成するヒドラゾン高分子化合物、並びに金属触媒の種類、さらに、触媒の使用用途等を考慮して適宜決定すればよい。但し、焼成温度及び焼成時間は、電気化学反応に対する触媒活性の付与と共に、焼成後も触媒金属とヒドラゾン高分子化合物の由来の窒素との配位部位の構造が保持されるように、それぞれ設定することが重要である。焼成温度が高すぎたり、或いは焼成時間が長すぎると、触媒金属の配位状態が保持されず、ヒドラゾン高分子化合物の焼成体に金属触媒が担持されず、触媒金属の微細分散状態の保持が困難となる。
【0068】
また、上記ヒドラゾン高分子金属錯体の焼成を、該焼成により得られる触媒を担持しうる導電性担持材料の存在下行う場合、上記したような強い触媒活性の発現の他、これら金属錯体の触媒化と同時に、得られる触媒を該導電性担持材料に担持させることができるという利点もある。ヒドラゾン高分子金属錯体を焼成して得られる触媒を導電性担持材料に担持させることで、金属触媒のさらなる微細分散を実現することが可能となる。
導電性担持材料としては、触媒金属を担持させる担体として一般的に使用されている導電性材料、例えば、活性炭(具体的には、Vulcan XC−72R(商品名)、Ketjen black(商品名)等)のようなカーボン粒子、Al2O3、SiO2、CeO2のような多孔質酸化物のような金属粒子、等が挙げられる。また、これら導電性材料をシート状等に成型したものでもよい。
尚、ヒドラゾン高分子金属錯体は、触媒の用途に応じて、上記焼成の前に、配位金属を還元する還元処理を施してもよい。還元処理方法としては、一般的な方法が挙げられ、例えば、水素ガスや水素化ホウ素アルカリ金属塩、水素化ホウ素第四級アンモニウム塩、ジボラン、ヒドラジン、アルコール、アルコールアミン等の還元剤を用いる方法等が挙げられる。
【0069】
具体的な焼成条件として、例えば、燃料電池のアノード触媒(燃料の酸化反応用触媒)を得るためには、まず、水素ガス雰囲気又はNaBH4、KBH4、LiBH4、テトラアルキルアンモニウム(NR4+)等をカチオンとするテトラハイドロボレート塩(XBH4)、NaH2PO2等の化学的還元剤の存在下、250〜450℃で1〜10時間半焼成し、ヒドラゾン高分子化合物に配位した金属種を還元する。その後、還元条件(具体的には水素ガス雰囲気下)、350〜400℃で1〜2時間焼成する。このとき、上述したように、導電性担持材料と混合した状態で焼成を行うことによって、焼成により得られる触媒を導電性担持材料に担持させること、より強い触媒活性を示す触媒を作製することが可能である。
一方、燃料電池のカソード触媒(酸化剤の還元用触媒)を得るためには、窒素ガス雰囲気やアルゴンガス雰囲気等の不活性ガス雰囲気下、250〜1000℃、好ましくは500〜1000℃、特に好ましくは700〜900℃、最も好ましくは800℃で1〜2時間焼成する。このとき、アノード触媒同様、上述したように、導電性担持材料と混合した状態で焼成を行うことによって、焼成により得られる触媒を導電性担持材料に担持させること、より強い触媒活性を示す触媒を作製することが可能である。
【0070】
3.第1のポリマー合成工程
予めヒドラゾン高分子化合物を準備することによって、上述した金属錯体形成工程において、ヒドラゾン金属錯体よりも触媒活性の高いヒドラゾン高分子金属錯体を合成することができるという観点から、本発明の金属触媒の製造方法は、ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物を合成する第1のポリマー合成工程を有することが好ましい。
【0071】
第1のポリマー合成工程においては、具体的には、例えば、少なくとも、本発明において使用されるヒドラゾン化合物、フェノール類、及びアルデヒド類を重合させることにより、ヒドラゾン高分子化合物を得ることができる。さらに具体的には、本発明において使用されるヒドラゾン化合物と、フェノールと、ホルムアルデヒドとを、塩基又は酸触媒存在下、重合することによって、上記式(7)で表されるヒドラゾン高分子化合物が得られる。
【0072】
ここでフェノール類としては、フェノールの他、フェノールに1つ又は2つ以上の置換基が結合しているものが挙げられる。フェノールに導入される置換基としては、例えば、−OH、−OR、−NR’R”、炭素数1〜15のアリール基又はアルキル基(分岐構造を有していてもよい)が挙げられ、高い重合反応性が期待できることから、電子供与性を有しているものが好ましい。尚、Rは、アルキル置換基又はアリール置換基であれば特に限定されないが、炭素数1〜10のアルキル基又はアリール基が好ましい。また、R’及びR”は一価の有機基であれば特に限定されないが、好ましくは、それぞれ独立して、水素、炭素数1〜10のアルキル基又はアリール基のいずれかであることが好ましい。
【0073】
アルデヒド類としては、例えば、ホルムアルデヒド、パラホルムアルデヒドが好適である。
【0074】
上記式(7)で表されるヒドラゾン高分子化合物の具体的な製造方法としては、本発明において使用されるヒドラゾン化合物、フェノール類、アルデヒド類を適当な溶媒(例えば、水、アセトンに代表されるケトン類、メタノール、エタノールに代表されるアルコール類等の適当な溶媒又はこれらの混合物)中に溶解又は分散させ、NaOH等の塩基又はHCl等の酸存在下、所定の温度条件(例えば、20℃〜150℃)とすることで、ヒドラゾン化合物とアルデヒド類及びフェノール類とアルデヒド類を縮合させる方法が挙げられる。
【0075】
上記式(7)で表されるヒドラゾン高分子化合物において、ヒドラゾン化合物から誘導される構成単位とフェノール類から誘導される構成単位の割合は特に限定されず、適宜選択することができる。
【0076】
尚、本発明において使用されるヒドラゾン化合物は、上記構造のヒドラゾン高分子化合物に限定されず、その他の化合物と重合することによって、高分子化が可能である。
具体的には、塩基触媒存在下において合成したレゾール樹脂を酸化条件下にて加熱・攪拌を行うこと、もしくは酸性条件下において合成したノボラック樹脂に、ヘキサメチレンテトラミン等の架橋剤を添加することにより、より高分子化された配位性高分子を合成することが可能である。
【0077】
4.第2のポリマー合成工程
金属錯体形成工程において得られたヒドラゾン金属錯体を用いて、当該ヒドラゾン金属錯体よりも触媒活性の高いヒドラゾン高分子金属錯体を合成することができるという観点から、本発明の金属触媒の製造方法は、ヒドラゾン金属錯体から誘導される構成単位を含有するヒドラゾン高分子金属錯体を合成する第2のポリマー合成工程を有することが好ましい。
【0078】
第2のポリマー合成工程としては、具体的には、ヒドラゾン金属錯体と、フェノール類、アルデヒド類と重合させることによって上記式(9)と同様の構造を有するヒドラゾン高分子金属錯体を製造することができる。
ヒドラゾン金属錯体と、フェノール類と、アルデヒド類との重合は、上述したヒドラゾン化合物とフェノール類とアルデヒド類との重合反応と同様の条件において行うことができる。
【0079】
5.モノマー合成工程
ヒドラゾン化合物を合成するための原料を適宜選択することにより、所望の金属触媒を合成するために最適なヒドラゾン化合物を得ることができるという観点から、本発明の金属触媒の製造方法は、ヒドラゾン化合物を合成するモノマー合成工程を有することが好ましい。
【0080】
上記式(1)で表されるヒドラゾン化合物を合成するモノマー合成工程において、その具体的なモノマーの合成方法は特に限定されないが、例えば、下記に示す反応スキームに従って製造することができる。
【0081】
【化12】

(式中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
【0082】
一般式(1)で表される本発明において使用されるヒドラゾン化合物は、適当な溶媒中又は無溶媒で、縮合剤の存在下又は非存在下で、一般式(10)で表されるケトン化合物(2,4−ジヒドロキシアセトフェノン)と一般式(11)で表されるヒドラジン化合物(ヒドラジノピリジン)とを反応させることにより製造することができる。
一般式(10)で表されるケトン化合物及び一般式(11)で表されるヒドラジン化合物は、共に公知であり、市販品として入手又は一般的な方法に準じて合成することができる。
上記反応における各化合物の使用量としては、一般式(10)で表されるケトン化合物1モルに対して、一般式(11)で表されるヒドラジン化合物を、通常、0.8〜10モル、好ましくは、1.0〜5.0モル、より好ましくは1.0〜2.0モルの範囲とする。
【0083】
上記反応は、酸触媒の存在下で進行するが、反応を促進するために縮合剤を用いることが好ましい。酸触媒の具体例としては、例えば、塩化水素、濃硫酸、リン酸、酢酸、等のプロトン酸を用いることができ、また、縮合剤の具体例としては、例えば、DCC(ジシクロヘキシルカルボジイミド)等の一般的なもの用いることができる。酸触媒、縮合剤の使用量としては、一般式(10)で表されるケトン化合物1モルに対して、酸触媒、縮合剤それぞれを、通常、0.0001〜10モル、好ましくは0.0001〜5モル、より好ましくは0.0001〜2モルの範囲とする。
【0084】
また、上記反応は、無溶媒でも進行するが、より円滑に反応を進行させるために溶媒を用いることが好ましい。該反応に用いうる溶媒としては、反応を阻害せず安定なものであれば良く、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;フェニルエーテル、アニソール等のエーテル類;トルエン、キシレン、メシチレン、テトラリン等の芳香族炭化水素類;デカリンその他脂環式炭化水素類;N,N−ジメチルホルムアミド(DMF)、N,N−ジメチルアセトアミド(DMAC)、N,N−ジメチルイミダゾリジノン(DMI)、N−メチルピロリドン(NMP)、ジメチルスルホキシド(DMSO)、スルホラン(TMSO2)等の非プロトン性極性溶媒類;ニトロベンゼン、p−ニトロトルエン等の芳香族系ニトロ化合物;クロロベンゼン、o−ジクロロベンゼン、トリクロロベンゼン等の芳香族系ハロゲン化合物等を例示できる。溶媒の使用量としては、一般式(10)で表されるケトン化合物1モルに対して、通常、0〜3.0L、好ましくは0.05〜1.5Lの範囲である。
【0085】
上記反応の反応温度は、反応が進行する限りにおいて、特に制限はないが、通常、−20℃〜150℃、好ましくは10℃〜120℃、より好ましくは20〜100℃の範囲である。
また、反応時間は特に制限されないが、副生成物抑制の観点等から、好ましくは0.5〜40時間である。
反応後は、析出した結晶をろ過等により分離し、必要に応じてメタノール等の有機溶媒や水、これらの混合物等を用いて洗浄し、乾燥すればよい。乾燥温度は特に限定されず、本発明において使用されるヒドラゾン化合物の融点又は分解点未満であれば差し支えないが、通常、20〜200℃、好ましくは30〜180℃、さらに好ましくは40〜150℃の範囲を例示できる。
【0086】
6.金属触媒の用途
以上のような、本発明において使用されるヒドラゾン化合物を用いて得られる触媒は、白金に代表される希少な金属を用いる場合には、その使用量を低減することが可能であり、また、白金等の希少な金属を用いずとも、優れた触媒作用を示すという点で、産業上の利用価値が高い。
触媒の用途としては、例えば、燃料電池の電極触媒、自動車等の排ガスの浄化触媒、アンモニアの分解触媒等の様々な分野において使用可能である。燃料電池としては、電荷キャリアが水酸化物イオン(OH−)であるアルカリ燃料電池の他、電荷キャリアがプロトン(H+)である固体高分子電解質型燃料電池、固体酸化物型燃料電池、リン酸型燃料電池等が挙げられる。本発明において使用されるヒドラゾン化合物を用いて得られる上記触媒を用いることによって、触媒金属の分散性に優れた電極を容易に製造することが可能である。中でも、電荷キャリアが水酸化物イオンであり、Ni、Fe、Co等の卑金属(非貴金属)を電極触媒として好適に用いることが可能なアルカリ燃料電池において好ましく用いられる。
アルカリ燃料電池用触媒として利用する場合には、8族の遷移金属、9族の遷移金属、10族の遷移金属及び11族の遷移金属を中心金属とするヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を用いることが好ましい。特に、8族遷移金属に配位してなるヒドラゾン金属錯体、9族遷移金属に配位してなるヒドラゾン金属錯体、10族遷移金属に配位してなるヒドラゾン金属錯体、及び、11族遷移金属に配位してなるヒドラゾン金属錯体のうち、少なくとも2種以上又は3種以上を組み合わせた混合物や、8族遷移金属、9族遷移金属、10族遷移金属及び11族遷移金属から選ばれる2種以上又は3種以上の遷移金属に配位したヒドラゾン高分子金属錯体等、多元系とすることが好ましい。
【0087】
具体的には、アルカリ型直接エタノール燃料電池のアノード用触媒としては、触媒金属として、Ni、Co、Feが好ましく、特にこれらの触媒金属を2種以上用いた多元系、中でもNi、Co及びFeの三元系であることが好ましい。一方、アルカリ燃料電池のカソード用触媒としては、触媒金属として、Ni、Co、Fe、Mnが好ましく、特にこれらの触媒金属を2種以上用いた多元系、中でもNi及びCoの二元系であることが好ましい。
【0088】
ここで、アルカリ燃料電池の一形態例について図1を用いて説明する。尚、アルカリ燃料電池は、以下に示す構造に限定されるものではない。
アルカリ燃料電池は、電解質1として水酸化カリウム水溶液やアニオン交換樹脂膜等を用い、酸化剤極3において、酸素と水との反応(1/2O2+H2O→2OH−)により生成した水酸化物イオンが、電解質1を通って燃料極2へと移動し、燃料極2において燃料(水素ガス等)と反応することにより水と電子を生じる(H2+2OH−→2H2O+2e−)。燃料極2で生成した水は、電解質1を経て酸化剤極へと移動し、酸化剤極3の電極反応原料となる。
アニオン交換膜としては、酸化剤極で生成した水酸化物イオンを燃料極へと移動させることができるものであれば、特に限定されないが、例えば、第四級アンモニウム基、ピリジニウム基などのアニオン交換基を有するアニオン交換樹脂を含有する固体高分子膜が挙げられる。
【0089】
燃料極は、上記水素と水酸化物イオンから水を生成させる触媒作用を有する電極触媒を含み、酸化剤極は、上記酸素と水から水酸化物イオンを生成させる触媒作用を有する電極触媒を含む。各電極の構成としては、これら電極触媒を、該電極触媒へ燃料又は酸化物を供給できる多孔質構造及び電子伝導性を有する多孔質導電体上に配置した構成が挙げられる。多孔質導電体としては、例えば、カーボンペーパー、カーボンシート等の導電性炭素質の他、Ni、Ti等の金属メッシュ、金属発泡体等が挙げられる。各電極は、電極触媒が固定されれば、上記のような多孔質導電体がなくてもよい。
燃料極の外側には、燃料不透過性且つ導電性を有する燃料極側セパレータ4、酸化剤の外側には、酸化剤不透過性且つ導電性を有する酸化剤極側セパレータ5が配置され、燃料電池用単セルが構成される。
そして、燃料極には燃料極側セパレータを介して水素を含有又は水素発生化合物を含有する燃料が供給され、酸化剤極には酸化剤極側セパレータを介して空気を含有又は空気発生化合物を含有する酸化剤が供給され、発電する。
【0090】
本発明によれば、前記式(1)に示すヒドラゾン化合物が異なるpH条件下において異なる化学構造を有することにより、金属原子への配位能がpH条件に依存して変化することから、金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、金属化合物に由来する金属イオンが有する吸光度が一定以上の値になるようなpH条件下で、ヒドラゾン化合物又はヒドラゾン高分子化合物のいずれか一方を金属化合物と混合することにより、ヒドラゾン化合物又はヒドラゾン高分子化合物と金属イオンとの、安定した金属錯体形成を行わせることができる。また、本発明によれば、金属錯体形成工程とポリマー合成工程のどちらを先に行っても金属触媒が得られることから、ヒドラゾン化合物や金属化合物の種類によって、より効率のよい触媒の製造方法を選択することができる。また、本発明によれば、高温処理工程を行うことによって、ヒドラゾン金属錯体及びヒドラゾン高分子金属錯体の少なくともいずれか一方を導電性粒子に担持した金属触媒を得ることができる。
【0091】
7.本発明に係るヒドラゾン金属錯体及びヒドラゾン高分子金属錯体
本発明の第1のヒドラゾン金属錯体は、下記一般式(2)で表されることを特徴とする
【0092】
【化13】

(上記式(2)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0093】
本発明の第2のヒドラゾン金属錯体は、下記一般式(3)で表されることを特徴とする
【0094】
【化14】

(上記式(3)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0095】
本発明の第1のヒドラゾン高分子金属錯体は、下記一般式(4)で表される繰り返し単位を有するポリマーであることを特徴とする
【0096】
【化15】

(上記式(4)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0097】
本発明の第2のヒドラゾン高分子金属錯体は、下記一般式(5)で表される繰り返し単位を有するポリマーであることを特徴とする。
【0098】
【化16】

(上記式(5)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0099】
上記第1及び第2のヒドラゾン金属錯体、並びに第1及び第2のヒドラゾン高分子金属錯体(以下、「本発明に係る金属錯体」ということがある。)は、上述した本発明に係る金属触媒の製造方法における、金属錯体形成工程において合成される、金属錯体の典型例である。なお、上述した金属錯体形成工程において合成される金属錯体は、必ずしもこれら4種類の錯体のみに限定されるものではない。
本発明に係る金属錯体は、例えば、上述した金属触媒の製造方法における、高温処理工程において、金属触媒へと変換するための前駆体として用いることができる。また、本発明に係る金属錯体は、それぞれ金属触媒そのものとしても使用が可能である。
なお、本発明に係る金属錯体を合成する方法は、必ずしも上述した金属錯体形成工程のみに限定されるものではない。
【0100】
本発明に係る金属錯体はいずれも、ヒドラゾン窒素(=N−)及び置換基X(Xは−O−又は−O(H)−)と、金属元素由来の原子又はイオンMとの間に、それぞれ結合を形成している。当該結合は、イオン結合であっても、配位結合であってもよい。すなわち、上記式(2)を例にとると、Xが−O−である場合には、酸素原子上の負電荷により、結合O−Mはイオン結合となり、Xが−O(H)−である場合には、酸素原子上の非共有電子対により、結合O−Mは配位結合となる。なお、ヒドラゾン窒素(=N−)とMとの結合は、窒素原子上の非共有電子対により、常に配位結合となる。
【0101】
第1のヒドラゾン金属錯体と第2のヒドラゾン金属錯体との相違点は、第1のヒドラゾン金属錯体が2配位の金属錯体であるのに対し、第2のヒドラゾン金属錯体が3配位の金属錯体である点である。すなわち、第1のヒドラゾン金属錯体が、上述したようなヒドラゾン窒素及び置換基Xと、金属元素由来の原子又はイオンMとの間にそれぞれ結合を1つずつ有しているのに対し、第2のヒドラゾン金属錯体は、これらの2つの結合に加えて、さらに、2−ピリジル基上のピリジン窒素とMとの間に配位結合を有している点で異なる。
第1のヒドラゾン高分子金属錯体と第2のヒドラゾン高分子金属錯体との相違点についても、同様である。
【0102】
第1又は第2のヒドラゾン高分子金属錯体は、上記式(4)又は(5)の繰り返し単位を有する他に、異なる繰り返し単位を有していてもよい。すなわち、上記式(9)に示すように、例えば、フェノール由来の繰り返し単位及び/又はホルムアルデヒド由来の繰り返し単位等を含んでいてもよい。
【実施例】
【0103】
(ヒドラゾン化合物の製造)
還流冷却管、温度計、攪拌機を備えた3Lの4つ口フラスコに、2−ヒドラジノピリジン33.8g(0.309mol)及びメタノール2Lを仕込み、攪拌下、室温で濃硫酸1mLを滴下した。その後、2,4−ジヒドロキシアセトフェノン44.0g(0.289mol)を仕込み、40℃で8時間攪拌して反応させた。
析出した結晶をろ過で取り出し、メタノール及び水で洗浄し、60℃で乾燥後、淡黄色の結晶として33.0gの4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン1,3−ジオールを得た。収率は50%だった。
得られた結晶について、GC/MS、1H−NMR、IR測定を行った。結果を以下に示す。
【0104】
・融点 : 230℃
・GC/MS(EI) : M/Z=243(M+)、228(M+−CH3)
・1H−NMR(300MHz、DMSO−d6) : δ=2.33(s,3H),6.26(d,1H,J=2.4Hz),6.31(dd,1H,J=2.4Hz,J=8.7Hz),6.80(ddd,1H,J=0.7Hz,J=5.1Hz,J=7.2Hz),6.89(d,1H,J=8.4Hz),7.36(d,1H,J=8.7Hz),7.64(ddd,1H,J=1.8Hz,J=7.2Hz,J=8.4Hz),8.18(ddd,1H,J=0.7Hz,J=1.8Hz,J=5.1Hz),δ=9.65(s,1H),δ=9.93(s,1H),δ=13.36(s,1H),
・IR(KBr、cm−1) : 3440、3372,1630,1598,1578,1506,1454,1255,767
【0105】
(ヒドラゾン高分子化合物の製造)
200mLフラスコで上記にて得られたヒドラゾン化合物8gをエタノール水溶液(水:エタノール=1:2)100mLに懸濁させ、ヒドラゾン溶液を調製した。次に、該ヒドラゾン溶液に、フェノール4.0g、ホルムアルデヒド(37wt%)4.0mL、NaOH0.25gを加え、110℃にて加熱還流を行い、6時間反応させた。
反応後、HCl水溶液にてpH2〜3に調整し、さらに1時間反応を継続した。得られた懸濁液をNaOH水溶液にて中和した後、濾過し、濾物をアセトン水溶液[アセトン:水=1:1]で3回洗浄した。得られた固形物(ヒドラゾン高分子化合物)を65℃で3日間乾燥させた。
【0106】
(ヒドラゾン金属錯体(1)の製造)
まず、上記にて得られたヒドラゾン化合物0.5gを100mLのアセトンと混合し、攪拌した。続いて、0.08gのCo(AcO)2・4H2O、0.13gのNi(AcO)2・4H2O、0.08gのFe(AcO)2・4H2Oを加え、攪拌した。さらに、1MのNaOH水溶液約100mLを加え、pH9付近に調整した。
10時間攪拌した後、ろ過し、得られた濾物を数回水で洗浄した。得られた固形物(ヒドラゾン金属錯体(1))を、65℃で真空乾燥した。
【0107】
(ヒドラゾン高分子金属錯体(1)の製造)
まず、上記にて得られたヒドラゾン高分子化合物1.0gを20mLのアセトンと混合し、攪拌した。続いて、0.5gのCo(AcO)2・4H2O、0.5gのNi(AcO)2・4H2O、0.5gのFe(AcO)2・4H2O、及び、アセトン15mLを加え、攪拌した。さらに、1MのNaOH水溶液約20mLを加え、pH9付近に調整した。
10時間攪拌した後、ろ過し、得られた濾物を数回水で洗浄した。得られた固形物(ヒドラゾン高分子金属錯体(1))を、65℃で真空乾燥した。
【0108】
(アノード用触媒(a)の製造)
上記にて得られたヒドラゾン金属錯体(1)0.10gとカーボン粒子(Valkan XC−72R)1.00gとを混合した。該混合物を石英ガラス管内に設置し、石英ガラス管内に水素ガスを導入(250mL/min)して昇温速度6.5℃で360℃まで昇温した(図2に示す熱処理装置参照)。360℃を2時間保持し、ヒドラゾン金属錯体(1)の酢酸塩を還元すると共に、該金属錯体を焼成した。その後、室温まで降温させ、水素ガスを停止し、アノード用触媒(a)を得た。
尚、図2に示す熱処理装置において、石英ガラス管内の温度は熱電対によりモニターし、温調のマントルヒーターによりコントールした。また、石英ガラス管に導入されるガスの流量はフローメーターにより調節した。ガラスウールは、管内の試料がガス流で移動しないようにするために用いた。
【0109】
(アノード用触媒(A)の製造)
上記にて得られたヒドラゾン高分子金属錯体(1)0.10gとカーボン粒子(Valkan XC−72R)1.00gとを混合した。該混合物を石英ガラス管内に設置し、石英ガラス管内に水素ガスを導入(250mL/min)して昇温速度6.5℃で360℃まで昇温した(図2参照)。360℃を2時間保持し、ヒドラゾン高分子金属錯体(1)の酢酸塩を還元すると共に、該高分子金属錯体を焼成した。その後、室温まで降温させ、水素ガスを停止し、アノード用触媒(A)を得た。
【0110】
[触媒の評価]
(アノード用触媒(a)の評価)
上記にて得られたアノード用触媒(a)0.5gを、約10mLの水に分散させ、該触媒分散液をニッケル製の多孔体シート(ニッケルフォーム、厚さ約1mm)に塗布し(36mm角、0.3mm)、乾燥してアノード電極(厚さ0.3mm)とした。一方、カソード用触媒(上記アノード用触媒(a)と同じもの)0.5gを、テトラフルオロエチレン0.05gと共に、超音波分散により約10mLの水に分散させ、該触媒分散液をカーボン製の多孔体シート(カーボンシート、厚さ約1mm)にスプレー塗布し(36mm角、0.2mm)、乾燥してカソード電極とした。
アニオン交換膜(炭化水素系膜、膜厚40μm、65mm角)を、アノード電極及びカソード電極の触媒分散液塗布面と接するように、アノード電極及びカソード電極で挟み込み、さらに、セル治具に設置して評価用燃料電池セル1を作製した。
評価用燃料電池セル1について、以下の条件下、ガルバノスタットによりI−V特性を測定した。結果を図3に示す。
【0111】
<I−V特性測定条件>
・アノード燃料:KOHエタノール水溶液(エタノール10wt%、KOH 1M)
・アノード燃料流量:約600mL/min
・カソードガス:空気
・カソードガス流量:130mL/min
・温度(恒温槽温度):50℃
【0112】
(アノード用触媒(A)の評価)
上記アノード用触媒(a)の評価において、アノード用触媒(a)の代わりにアノード用触媒(A)を用いる(アノード用触媒及びカソード用触媒共に)以外は、同様にして、評価用燃料電池セル2を作製し、I−V特性を測定した。結果を図4に示す。
【0113】
(結果)
図3に示すように、本発明において使用されるヒドラゾン化合物を原料とするアノード用触媒(a)を用いた燃料電池セル1は、OCV約0.65V、最高出力密度約0.88mW/cm2(電流密度3.8mA/cm2の時)という良好な発電性能を示した。
また、図4に示すように、本発明において使用されるヒドラゾン化合物を原料とするアノード用触媒(A)を用いた燃料電池セル2は、OCV約0.58V、最高出力密度約1.4mW/cm2(電流密度6.4mA/cm2の時)という良好な発電性能を示した。
これらの結果から、ヒドラゾン高分子金属錯体を焼成して得られたアノード用触媒Aの方が、ヒドラゾン金属錯体を焼成して得られたアノード用触媒aよりも、大幅に高い出力密度が得られることがわかる。これは、ヒドラゾン金属錯体を用いる場合と比較して、ヒドラゾン高分子金属錯体を用いることによって、電極における触媒金属の分散性が向上したためと推測される。
【0114】
(金属イオンを含有したヒドラゾン化合物水溶液の、各pHにおけるUV−visスペクトル測定)
本発明の金属触媒の製造方法に用いられるヒドラゾン化合物の、pHに依存した構造変化を確かめるために、当該化合物水溶液のUV−visスペクトル測定を行った。なお、本測定においては、ヒドラゾン化合物として、4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオールを用いた。
なお、pH測定には、pHメーター(型番:HM−20P、東亜ディーケーケー株式会社製)を用いた。また、UV−visスペクトル測定には、紫外可視近赤外分光光度計(型番:V−670、日本分光株式会社製)を用いた。
【0115】
[実施例1]
まず、イオン交換水50mL中に、0.1質量%アスコルビン酸水溶液5mL、0.5mM塩化ニッケル(II)水溶液5mL、0.5mMヒドラゾン化合物/アセトニトリル溶液5mLを加え、仮水溶液とした。続いて、10mM水酸化カリウム水溶液、1M水酸化カリウム水溶液、10mM塩酸又は1M塩酸を用いて、仮水溶液を目的とする各pHに調整した。なお、目的とする各pHは、pH=4〜10の範囲において1刻みで、pH=10〜14の範囲において0.2刻みで設定した。
次に、仮水溶液に、イオン交換溶液を加えて、全体が100mLとなるように希釈した。これによって、目的とするpH別に調整された、0.025mMヒドラゾン化合物・ニッケル(II)イオン水溶液(以下、測定用水溶液という。)100mLがそれぞれ得られた。この測定用水溶液を室温で30分間静置した後、波長410、415、420、425nmの単色光を用いて、UV−visスペクトル測定を行った。
【0116】
[実施例2]
まず、イオン交換水50mL中に、0.1質量%アスコルビン酸水溶液5mL、0.5mM塩化鉄(II)水溶液5mL、0.5mMヒドラゾン化合物/アセトニトリル溶液5mLを加え、仮水溶液とした。続いて、10mM水酸化カリウム水溶液、1M水酸化カリウム水溶液、10mM塩酸又は1M塩酸を用いて、仮水溶液を目的とする各pHに調整した。なお、目的とする各pHは、pH=4〜13の範囲において1刻みで設定した。
次に、仮水溶液に、イオン交換溶液を加えて、全体が100mLとなるように希釈した。これによって、目的とするpH別に調整された、0.025mMヒドラゾン化合物・鉄(II)イオン水溶液(以下、測定用水溶液という。)100mLがそれぞれ得られた。この測定用水溶液を室温で30分間静置した後、波長410、415、420、425nmの単色光を用いて、UV−visスペクトル測定を行った。
【0117】
[実施例3]
まず、イオン交換水50mL中に、0.1質量%アスコルビン酸水溶液5mL、0.5mM塩化コバルト(II)水溶液5mL、0.5mMヒドラゾン化合物/アセトニトリル溶液5mLを加え、仮水溶液とした。続いて、10mM水酸化カリウム水溶液、1M水酸化カリウム水溶液、10mM塩酸又は1M塩酸を用いて、仮水溶液を目的とする各pHに調整した。なお、目的とする各pHは、pH=4〜13の範囲において1刻みで設定した。
次に、仮水溶液に、イオン交換溶液を加えて、全体が100mLとなるように希釈した。これによって、目的とするpH別に調整された、0.025mMヒドラゾン化合物・コバルト(II)イオン水溶液(以下、測定用水溶液という。)100mLがそれぞれ得られた。この測定用水溶液を室温で30分間静置した後、波長410、415、420、425nmの単色光を用いて、UV−visスペクトル測定を行った。
【0118】
[参考例]
実施例1〜3とは別に、本発明の金属触媒の製造方法に用いられるヒドラゾン化合物の、pHに依存した構造変化を確かめるために、当該化合物水溶液のUV−visスペクトル測定を行った。
まず、イオン交換水50mL中に、0.1質量%アスコルビン酸水溶液5mL、0.5mMヒドラゾン化合物/アセトニトリル溶液5mLを加え、仮水溶液とした。続いて、10mM水酸化カリウム水溶液、1M水酸化カリウム水溶液、10mM塩酸又は1M塩酸を用いて、仮水溶液を目的とする各pHに調整した。なお、目的とする各pHは、pH=1〜10の範囲で、pH=1、2、3、4、5、6、6.5、7.5、8、9、10となるようにそれぞれ設定した。
次に、仮水溶液に、イオン交換溶液を加えて、全体が100mLとなるように希釈した。これによって、目的とするpH別に調整された、0.025mMヒドラゾン化合物水溶液(以下、測定用水溶液という。)100mLがそれぞれ得られた。この各測定用水溶液を室温で30分間静置した後、各pHの当該測定用水溶液を用いて、波長250〜800nmの領域の吸光度について、UV−visスペクトル測定を行った。
【0119】
実施例1〜3、及び参考例の測定用水溶液のUV−visスペクトル測定の結果をそれぞれ示したグラフが、図5〜図9である。なお、図9には、得られたスペクトラムの250〜450nmの範囲を示した。
図9は、各pH(pH=1〜10)におけるヒドラゾン化合物水溶液(参考例の測定用水溶液)のUV−visスペクトル測定結果を示すグラフである。
図9において、中性領域(pH=5〜7.5)では、波長330nm付近に極大吸収が確認された。この吸収は、上述した構造(1c)の互変異性体(tautomer)のπ‐π*遷移による吸収と考えられる。
また、酸性領域(pH=1〜4)では、波長350nm付近に極大吸収が確認された。この吸収は、上述した構造(1a)又は(1b)のように、ピリジン環上の窒素原子、及び/又はヒドラゾン窒素のプロトン化により、前記π‐π*遷移による吸収が長波長シフトしたと考えられる。
さらに、アルカリ性領域(pH=9〜10)では、波長340nm付近に極大吸収が確認された。この吸収は、上述した構造(1d)のような錯体形成による吸収と考えられる。
また、図9より、ヒドラゾン化合物は、溶液中のpHを変動させても400nm以上の長波長領域にはほとんど吸収を持たないことが分かる。したがって、ヒドラゾン化合物が金属イオンに配位してヒドラゾン金属錯体が生成しているか否かは、400nm以上に吸収を有するかどうかで判断することが可能であることが分かる。
【0120】
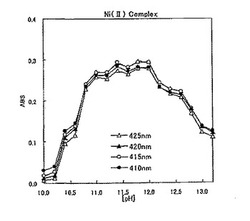
図5は各pH(pH=4〜13)における、図6は各pH(pH=10〜13)における、実施例1の測定用水溶液のUV−visスペクトル測定結果をそれぞれ示すグラフである。図5及び図6から分かるように、波長410、415、420、425nmのいずれの単色光を用いて測定した場合でも、pH=10.5〜13.5の範囲において吸光度が0.1以上となっていることから、この範囲のpH条件において、ニッケルイオンとヒドラゾン化合物とが安定して錯体形成していることが分かる。
図7は各pH(pH=4〜13)における、実施例2の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。図7から分かるように、波長410、415、420、425nmのいずれの単色光を用いて測定した場合でも、pH=5〜12の範囲において吸光度が0.1以上となっていることから、この範囲のpH条件において、鉄イオンとヒドラゾン化合物とが安定して錯体形成していることが分かる。
図8は各pH(pH=4〜13)における、実施例3の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。図8から分かるように、波長410、415、420、425nmのいずれの単色光を用いて測定した場合でも、pH=6〜13の範囲において吸光度が0.1以上となっていることから、この範囲のpH条件において、コバルトイオンとヒドラゾン化合物とが安定して錯体形成していることが分かる。
【符号の説明】
【0121】
1…電解質
2…燃料極
3…酸化剤極
4…燃料極側セパレータ
4a…燃料流路
5…酸化剤極側セパレータ
5a…酸化剤流路
【技術分野】
【0001】
本発明は、高効率な金属触媒の製造方法に関する。
【背景技術】
【0002】
燃料電池における電極触媒としては、例えば、白金、コバルト、ニッケル、鉄、及び、白金−ルテニウム合金のような合金等が知られている。燃料電池の発電性能を高めるには、これら触媒金属の触媒作用を高めることが重要であり、例えば、触媒金属の微粒子化等による触媒利用率の向上が図られている。しかしながら、微細な粒子は非常に凝集しやすいため、従来、長期間にわたってその分散状態を保持することが困難であり、触媒利用率は充分に高められていない。触媒金属の安定した微細分散を実現すべく、触媒金属微粒子を炭素粒子や金属粒子等の導電性粒子に担持させることも行われているが、その効果は充分ではない。
また、従来の電極触媒や該電極触媒を分散させた電極の製造方法は、煩雑な操作や工程を要するため、より簡便な操作又は工程で製造可能な電極触媒原料化合物の開発が望まれている。
【0003】
一方、ある種のヒドラゾン化合物を原料として製造される合成高分子に金属を配位させ
て錯体化した後、この合成高分子金属錯体を焼成することにより、燃料電池用触媒を製造
しうることが知られている(特許文献1参照)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】国際公開公報WO2004/036674号
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明者らは、燃料電池用金属触媒について鋭意検討した結果、合成高分子原料や金属触媒担体原料などとして有用な新規ヒドラゾン化合物を見出し、既に特許出願を行っている(特願2007−225268)。前記新規ヒドラゾン化合物は、触媒金属の微細分散を可能とする電極触媒原料化合物として特に有用である。
【0006】
本発明者らは、さらに上記新規ヒドラゾン化合物を用いた金属触媒について研究を進め、高効率で金属触媒を得る製造方法を見出した。すなわち、本発明は、上記研究の経緯を経て成し遂げられたものであり、金属触媒の製造方法を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の金属触媒の製造方法は、下記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを、特定のpH条件下で混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する金属錯体形成工程、並びに、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方と、導電性粒子とを混合して高温処理する高温処理工程を有することを特徴とする。なお、前記pH条件は、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を、前記金属化合物と混合した溶液の、波長が400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件である。
【0008】
【化1】

(上記式(1)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
【0009】
このような構成の金属触媒の製造方法は、前記式(1)に示すヒドラゾン化合物が異なるpH条件下において異なる化学構造を有することにより、金属原子への配位能がpH条件に依存して変化することから、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来する金属イオンが有する吸光度が一定以上の値になるようなpH条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記金属イオンとの、安定した金属錯体形成を行わせることができる。また、このような構成の金属触媒の製造方法は、高温処理工程を行うことによって、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方を導電性粒子に担持した金属触媒を得ることができる。
【0010】
本発明の金属触媒の製造方法は、前記ヒドラゾン化合物から誘導される構成単位を含有する前記ヒドラゾン高分子化合物を合成する第1のポリマー合成工程を有することが好ましい。
【0011】
このような構成の金属触媒の製造方法は、前記第1のポリマー合成工程において予めヒドラゾン高分子化合物を準備することによって、前記金属錯体形成工程において、前記ヒドラゾン金属錯体よりも触媒活性の高い前記ヒドラゾン高分子金属錯体を合成することができる。
【0012】
本発明の金属触媒の製造方法は、前記ヒドラゾン金属錯体から誘導される構成単位を含有するヒドラゾン高分子金属錯体を合成する第2のポリマー合成工程を有することが好ましい。
【0013】
このような構成の金属触媒の製造方法は、前記金属錯体形成工程において得られた前記ヒドラゾン金属錯体を用いて、当該ヒドラゾン金属錯体よりも触媒活性の高い前記ヒドラゾン高分子金属錯体を合成することができる。
【0014】
本発明の金属触媒の製造方法は、前記ヒドラゾン化合物を合成するモノマー合成工程を有することが好ましい。
【0015】
このような構成の金属触媒の製造方法は、前記モノマー合成工程において原料を適宜選択することにより、所望の金属触媒を合成するために最適な前記ヒドラゾン化合物を得ることができる。
【0016】
本発明の金属触媒の製造方法は、前記金属錯体形成工程において、前記金属化合物がニッケル元素を有し、且つ、前記pH条件が10.5〜13.5であることが好ましい。
【0017】
このような構成の金属触媒の製造方法は、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来するニッケルイオンが有する吸光度が一定以上の値になるようなpH=10.5〜13.5の条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記ニッケルイオンとの、安定した金属錯体形成を行わせることができる。
【0018】
本発明の金属触媒の製造方法は、前記金属錯体形成工程において、前記金属化合物が鉄元素を有し、且つ、前記pH条件が5〜12であることが好ましい。
【0019】
このような構成の金属触媒の製造方法は、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来する鉄イオンが有する吸光度が一定以上の値になるようなpH=5〜12の条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記鉄イオンとの、安定した金属錯体形成を行わせることができる。
【0020】
本発明の金属触媒の製造方法は、前記金属錯体形成工程において、前記金属化合物がコバルト元素を有し、且つ、前記pH条件が6〜13であることが好ましい。
【0021】
このような構成の金属触媒の製造方法は、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来するコバルトイオンが有する吸光度が一定以上の値になるようなpH=6〜13の条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記コバルトイオンとの、安定した金属錯体形成を行わせることができる。
【0022】
本発明の第1のヒドラゾン金属錯体は、下記一般式(2)で表されることを特徴とする。
【0023】
【化2】

(上記式(2)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0024】
このような構成の第1のヒドラゾン金属錯体は、金属触媒及び金属触媒前駆体の少なくともいずれか一方として用いることができる。
【0025】
本発明の第2のヒドラゾン金属錯体は、下記一般式(3)で表されることを特徴とする。
【0026】
【化3】

(上記式(3)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0027】
このような構成の第2のヒドラゾン金属錯体は、金属触媒及び金属触媒前駆体の少なくともいずれか一方として用いることができる。
【0028】
本発明の第1のヒドラゾン高分子金属錯体は、下記一般式(4)で表される繰り返し単位を有するポリマーであることを特徴とする。
【0029】
【化4】

(上記式(4)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0030】
このような構成の第1のヒドラゾン高分子金属錯体は、金属触媒及び金属触媒前駆体の少なくともいずれか一方として用いることができる。
【0031】
本発明の第2のヒドラゾン高分子金属錯体は、下記一般式(5)で表される繰り返し単位を有するポリマーであることを特徴とする。
【0032】
【化5】

(上記式(5)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0033】
このような構成の第2のヒドラゾン高分子金属錯体は、金属触媒及び金属触媒前駆体の少なくともいずれか一方として用いることができる。
【発明の効果】
【0034】
本発明によれば、前記式(1)に示すヒドラゾン化合物が異なるpH条件下において異なる化学構造を有することにより、金属原子への配位能がpH条件に依存して変化することから、前記金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来する金属イオンが有する吸光度が一定以上の値になるようなpH条件下で、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物と前記金属イオンとの、安定した金属錯体形成を行わせることができる。また、本発明によれば、高温処理工程を行うことによって、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方を導電性粒子に担持した金属触媒を得ることができる。
【図面の簡単な説明】
【0035】
【図1】アルカリ燃料電池用セルの概略を説明する断面図である。
【図2】実施例の触媒製造において用いた熱処理装置の概略図である。
【図3】実施例におけるアノード用触媒(a)の評価結果を示すグラフである。
【図4】実施例におけるアノード用触媒(A)の評価結果を示すグラフである。
【図5】各pH(pH=4〜13)における実施例1の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。
【図6】各pH(pH=10〜14)における実施例1の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。
【図7】各pH(pH=4〜13)における実施例2の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。
【図8】各pH(pH=4〜13)における実施例3の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。
【図9】各pH(pH=1〜10)におけるヒドラゾン化合物水溶液(参考例の測定用水溶液)のUV−visスペクトル測定結果を示すグラフである。
【発明を実施するための形態】
【0036】
本発明の金属触媒の製造方法は、下記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを、特定のpH条件下で混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する金属錯体形成工程、並びに、前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方と、導電性粒子とを混合して高温処理する高温処理工程を有することを特徴とする。なお、前記pH条件は、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を、前記金属化合物と混合した溶液の、波長が400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件である。
【0037】
【化6】

(上記式(1)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
【0038】
本発明の金属触媒の製造方法は、少なくとも、金属錯体形成工程と、高温処理工程とからなる。また、本発明に係る第1及び第2のヒドラゾン金属錯体、並びに、第1及び第2のヒドラゾン高分子金属錯体は、上記金属錯体形成工程において得られるヒドラゾン金属錯体又はヒドラゾン高分子金属錯体の典型例である。
本明細書においては、まず、本発明の金属触媒の製造方法について、金属錯体形成工程、高温処理工程と順を追って説明した後、必要に応じて行われるその他の工程(第1及び第2のポリマー合成工程、モノマー合成工程等)について説明する。さらにその後に、本発明に係る第1及び第2のヒドラゾン金属錯体、並びに、第1及び第2のヒドラゾン高分子金属錯体について説明する。
【0039】
1.金属錯体形成工程
本発明において、金属錯体形成工程とは、上記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを、特定のpH条件下で混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する工程のことである。なお、特定の前記pH条件とは、前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を、前記金属化合物と混合した溶液の、波長が400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件である。
【0040】
本発明において「吸光度」とは、強度I0の単色光が物質層を透過して強度Iとなったときの、その波長における物質層の吸光度(A=log10(I0/I))のことである(ランベルト‐ベールの法則)。
【0041】
本発明において使用されるヒドラゾン化合物において、Pyで表される基は、2−ピリジル基、3−ピリジル基、及び4−ピリジル基のいずれであってもよいが、分子内で三座配位を形成しうると考えられる点からは2−ピリジル基が好ましい。本発明において使用されるヒドラゾン化合物には、E(Entgegen)体、Z(Zusammen)体の異性体が存在し、E体の純粋物、Z体の純粋物、又は両異性体を任意の割合で含む混合物として得られるが、代表して一般式(1)で表記する。
また、上記一般式(1)で表されるヒドラゾン化合物のうち、例えば、4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオールには、下記式(1a)に表されるような互変異性体(tautomer)が存在するが、このような互変異性体が存在する場合においても、本明細書においては、代表して一般式(1)で表記する。
【0042】
【化7】

【0043】
一般式(1)で表されるヒドラゾン化合物の具体例としては、例えば、4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオール、4−{1−[(3−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオール、4−{1−[(4−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオールが挙げられる。
【0044】
上記一般式(1)で表される、本発明において使用されるヒドラゾン化合物は、ヒドラゾン窒素、ピリジン窒素及び/又はフェノール類のヒドロキシル基が配位性を有しており、当該分子が配位子として機能し、錯体を形成することができる。しかも、本発明において使用されるヒドラゾン化合物が配位して得られる錯体は安定性に優れる。得られる錯体の安定性は、本発明において使用されるヒドラゾン化合物の配位性部位の構造に起因すると考えられる。すなわち、上記式(1)のヒドラゾン化合物の配位部位であるヒドラゾノ基の窒素(=N−)が、該窒素に隣接する炭素と、該ヒドラゾノ基が結合するフェノール類の4位と3位の炭素と、該フェノール類のベンゼン環の3位に結合する酸素(ヒドロキシル基)と共に、C字型構造を形成しており、該ヒドラゾン窒素(=N−)と金属、さらにはフェノール類のヒドロキシル基と金属が配位結合を形成することによって、該中心金属と、上記C字型構造を形成している該ヒドラゾン窒素(=N−)、該ヒドラゾン窒素に隣接する炭素、該ヒドラゾノ基が結合するフェノール類の4位と3位の炭素、及び、該フェノール類のベンゼン環の3位に結合する酸素とによって、六角形構造が形成されるためと推測される(下記式(6)参照)。
【0045】
【化8】

【0046】
さらには、本発明において使用されるヒドラゾン化合物においては、ヒドラゾノ基に結合するピリジン環の窒素(ピリジン窒素)も配位能を有しており、金属錯体の形成に関与することが推測される。その配位については、当該ピリジン窒素がピリジン環の3位又は4位に存する場合には、複数のヒドラゾン化合物分子の関与により金属錯体を形成することも推測され、また一方、当該窒素がピリジン環の2位に存するものにおいては、いわゆる三座配位を分子内で形成することにより金属錯体を形成することも推測される。
上記式(6)に示した構造は、本発明に係るヒドラゾン金属錯体の構造の典型例である。なお、本明細書においては、本発明に係るヒドラゾン金属錯体の構造を式(6)のごとき表記で代表させるが、該金属錯体の構造としては式(6)に示した構造の他にも、例えば、「窒素原子とともに金属錯体形成に寄与している水酸基以外のもう1つの水酸基を用いて、2以上のヒドラゾン化合物分子と金属との間で配位結合あるいはイオン結合を形成した構造」等を挙げることができる。
【0047】
錯体を形成することによって、金属種(金属原子、金属イオン)は凝集が抑制されており、その分散性を高めることができる。上述したように、本発明において使用されるヒドラゾン化合物を配位子とする錯体は、錯体の安定性が高いため、金属種の分散性をさらに高めることが可能であり、しかも、その分散性を長期間にわたって維持することができる。
ゆえに、本発明において使用されるヒドラゾン化合物を配位子(金属錯体形成用配位子)とし、触媒金属種に配位させて錯体を形成することによって、触媒金属の微細分散が可能となり、その結果、触媒金属の利用率を向上させることができる。従って、本発明によれば、触媒金属微粒子の製造工程や使用中において生じる粒成長が抑制されており、少量の触媒金属で優れた触媒作用を発現する触媒を得ることが可能である。そして、このように本発明において使用されるヒドラゾン化合物と触媒金属を用いて得られる金属錯体を、電極触媒の原料化合物として用いることにより、発電性能に優れた燃料電池を得ることも可能である。しかも、本発明において使用されるヒドラゾン化合物と触媒金属とを配位結合させてなる錯体は、従来の一般的な方法に準じて製造することが可能であり、非常に簡便な操作、工程で得られ、生産性に優れるものである。
【0048】
また、上記式(1)で表されるヒドラゾン化合物は、合成高分子化合物の原料、すなわち、高分子化合物製造用単量体としても利用することができ、他の化合物と重合してヒドラゾン高分子化合物を形成したり、さらには、金属種に配位させてヒドラゾン金属錯体を形成したのち、該ヒドラゾン金属錯体をモノマーとしてヒドラゾン高分子金属錯体を形成したりすることも可能である。
このようにヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物を触媒金属に配位させたり、或いは、ヒドラゾン金属錯体を他のモノマーと重合させたりして得られるヒドラゾン高分子金属錯体においては、上記ヒドラゾン金属錯体(モノマー)と比較して、触媒金属の分散性のさらなる向上が可能である。
【0049】
以上のように、本発明において使用されるヒドラゾン化合物は、錯体や高分子材料、その他化合物の原料化合物として非常に有用であり、金属錯体形成用配位子及び高分子化合物製造用単量体として利用できるほか、様々な分野における利用、応用が期待できる。中でも、金属錯体形成における配位安定性の観点から、少なくとも1種の金属種に配位して金属錯体を形成する金属錯体形成用ヒドラゾン化合物として非常に適するものであり、該金属種を微細分散させる担体として優れた性能を発揮しうる。
【0050】
上記式(1)のヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物としては、具体的には、少なくとも、本発明において使用されるヒドラゾン化合物、フェノール類、及びアルデヒド類を重合させることにより得られる下記式(7)に示すポリマーを挙げることができるが、必ずしもこれのみに限定されるものではない。
【0051】
【化9】

【0052】
上記式(7)中、n、mはそれぞれ1以上の整数である。また、lは2以上の整数である。
なお、ヒドラゾン高分子を構成する繰り返し単位の連結の順番に関しては、上記式(7)に示されるような、ヒドラゾン化合物から誘導される繰り返し単位、及びフェノールとホルムアルデヒド由来の繰り返し単位のそれぞれが、どのような順番で何回ずつ連結されていても構わない。たとえば、一定数同じ繰り返し単位が連結されたブロックが、互いに共重合するブロック共重合体であってもよいし、あるいは異なる繰り返し単位が交互に重合する交互共重合体であってもよい。また、繰り返し単位の配列に全く秩序が無いランダム共重合体であってもよい。
【0053】
上述したように、本発明において使用されるヒドラゾン化合物は、金属種(金属原子、金属イオン)に配位結合し、金属錯体を形成する(上記式(6)参照)。
配位する金属種としては、特に限定されず、例えば、遷移金属、具体的には8〜10族(第VIIIA族)遷移金属、より具体的には、鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム、白金を例示することができる。中でも、鉄、コバルト、ニッケルを好適に用いることができる。本発明において使用されるヒドラゾン化合物を金属種に配位させてなるヒドラゾン金属錯体は、配位する金属種を選択し、必要に応じて金属種を還元することによって、特定の化学反応に対して触媒活性を示しうる(例えばオレフィン重合用触媒などが考えられる)。
なお、金属錯体形成においては、1種類のみの金属種を単独で用いてもよいし、2種類以上の金属種を併用(混用)して用いてもよい。
【0054】
本発明における金属錯体形成工程において、ヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを混合して錯体を形成する際に、特定のpH条件下で混合することが、本発明の主な特徴のうちの1つである。
上述した発明者らによる特許出願(特願2007−225268)においては、触媒の合成に成功はしているものの、出願後にXRD(X−ray diffraction:X線回折法)等の分析を行った結果、ヒドラゾン化合物の金属への錯体形成に未だ課題が残されていることが明らかとなった。以下、本発明に用いられるヒドラゾン化合物のうち、4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオールを例として、詳細に説明する。
発明者らは、分子軌道計算を行った結果、本発明で用いられるヒドラゾン化合物は、pHによって化学構造が変化することを下記式(8)のように推定した。すなわち、pH≦1の強酸性下においては、ヒドラゾン化合物はジカチオン構造(8a)をとる。このようなジカチオン構造は、pH=2〜4の酸性下においては、ヒドラゾン窒素(=N−)とフェノール類のヒドロキシル基とが分子内水素結合を起こすため、モノカチオン構造(8b)へと変化する。さらに、pH=5〜8の弱酸性〜弱塩基性下においては、ヒドラゾン化合物は中性の分子構造(8c)をとる。なお、このときピリジン環上の窒素原子は、ヒドロキシル基上の水素原子に水素結合しないことが、分子軌道計算結果により明らかとなっている。そして、pH≧9の弱塩基性〜強塩基性下においては、ヒドロキシル基が脱プロトン化することによって、ヒドラゾン化合物はアニオン構造(8d)をとる。なお、このとき、ベンゼン環上の1位のヒドロキシル基上のプロトン(H+)は、カリウムイオン(K+)に置換される場合がある。
【0055】
【化10】

【0056】
これらの分子構造は、後述する実施例において測定した、各pHにおけるヒドラゾン化合物水溶液のUV−visスペクトル測定結果(図9)からも説明することができる。
実施例において後述するように、UV−visスペクトル測定において、中性領域(pH=5〜7.5)では、構造(8c)の互変異性体(tautomer)のπ‐π*遷移による吸収が確認された。
また、酸性領域(pH=1〜4)では、構造(8a)又は(8b)のように、ピリジン環上の窒素原子、及び/又はヒドラゾン窒素のプロトン化により、前記π‐π*遷移による吸収が長波長シフトしたものが確認された。
さらに、アルカリ性領域(pH=9〜10)では、構造(8d)のような錯体形成による吸収が確認された。
【0057】
後述する参考例の結果及び図9から分かるように、ヒドラゾン化合物は、溶液中のpHを変動させても波長400nm以上の長波長領域にはほとんど吸収を持たない。それとは対照的に、ヒドラゾン金属錯体は、長波長領域、特に波長400nm以上の領域に金属イオン由来の吸収を有する。したがって、十分な吸光強度を有しており、かつ、錯体を形成していない上記式(1)のヒドラゾン化合物に由来する波長400nm以下の光の吸収とも重ならないため測定/解析に有用な波長である、波長400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件を予め設定することで、本発明における金属錯体形成工程においては、安定してヒドラゾン化合物と金属イオンとが金属錯体形成を起こし、ヒドラゾン金属錯体が生成しているとみなすことができる。なお、pH条件は、金属化合物が有する金属種(金属原子、金属イオン)の種類によってそれぞれ異なる。
【0058】
金属錯体形成工程において、前記金属化合物がニッケル元素を有し、且つ、pH条件が10.5〜13.5であることが好ましい。これは、金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来するニッケルイオンが有する吸光度が一定以上の値になるようなpH=10.5〜13.5の条件下で、ヒドラゾン化合物又はヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、ヒドラゾン化合物又はヒドラゾン高分子化合物とニッケルイオンとの、安定した金属錯体形成を行わせることができるからである。なお、前記pH条件が10.5〜12.5であることが特に好ましい。
【0059】
金属錯体形成工程において、前記金属化合物が鉄元素を有し、且つ、pH条件が5〜12であることが好ましい。これは、金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来する鉄イオンが有する吸光度が一定以上の値になるようなpH=5〜12の条件下で、ヒドラゾン化合物又はヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、ヒドラゾン化合物又はヒドラゾン高分子化合物と鉄イオンとの、安定した金属錯体形成を行わせることができるからである。なお、前記pH条件が10〜12であることが特に好ましい。
【0060】
金属錯体形成工程において、前記金属化合物がコバルト元素を有し、且つ、pH条件が6〜13であることが好ましい。これは、金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、前記金属化合物に由来するコバルトイオンが有する吸光度が一定以上の値になるようなpH=6〜13の条件下で、ヒドラゾン化合物又はヒドラゾン高分子化合物のいずれか一方を前記金属化合物と混合することにより、ヒドラゾン化合物又はヒドラゾン高分子化合物とコバルトイオンとの、安定した金属錯体形成を行わせることができるからである。なお、前記pH条件が10〜13であることが特に好ましい。
【0061】
本発明において使用されるヒドラゾン化合物を金属種に配位させてなるヒドラゾン金属錯体を得る方法は、上記pH条件下であれば、特に限定されず、一般的な方法に準じることができる。例えば、まず、ヒドラゾン化合物を、ヒドラゾン化合物及び生成した金属錯体に対しての溶解性が小なる極性溶媒、具体的には水、アセトンに代表されるケトン類、メタノール、エタノールに代表されるアルコール類等の適当な溶媒もしくはその混合溶媒に分散させ、該溶液中に金属種の原料となる金属塩を加え混合し、pH調節剤を加え、さらに混合することでヒドラゾン金属錯体が得られる。上記溶媒としては、さらにはアセトニトリルに代表されるアルキルニトリルや、クロロホルム、ジクロロメタンに代表されるハロゲン化脂肪族炭化水素、酢酸エチルに代表されるカルボン酸エステル等の溶媒も使用可能である。
該ヒドラゾン金属錯体の製造は、通常、20〜60℃の温度範囲で行うことが好ましい。得られたヒドラゾン金属錯体は、ろ過等により分離し、必要に応じて、生成した金属錯体に対しての溶解性が小なる極性溶媒、具体的には水、アセトンに代表されるケトン類、メタノール、エタノールに代表されるアルコール類等の適当な溶媒により洗浄、乾燥することで、単離することができる。
【0062】
金属錯体形成に用いる金属塩としては、例えば、硝酸塩;硫酸塩;リン酸塩;ハロゲン化物、具体的には塩素化物、臭素化物、ヨウ素化物;過ハロゲン酸塩、具体的には過塩素酸塩、過臭素酸塩、過ヨウ素酸塩;スルホン酸塩、具体的にはメタンスルホン酸塩、トリフルオロメタンスルホン酸塩、p−トルエンスルホン酸塩、ベンゼンスルホン酸塩;カルボン酸塩、具体的には、ギ酸塩、酢酸塩、プロピオン酸塩、酪酸塩、吉草酸塩、カプロン酸塩、ハロ置換酢酸塩、より具体的にはモノクロロ酢酸塩、ジクロロ酢酸塩、トリクロロ酢酸塩、モノフルオロ酢酸塩、ジフルオロ酢酸塩、トリフルオロ酢酸塩等を用いることができる。用途に応じて、これら金属塩は1種のみでも或いは複数種を組み合わせてもよい。複数種の金属塩を用いる場合、各金属塩の仕込み比(金属原子換算)を反映した比率で、各金属種に配位したヒドラゾン金属錯体が混在した混合物を得ることができる。
金属塩としては、具体的には、酢酸鉄(II)、酢酸コバルト(II)に代表されるカルボン酸塩、塩化鉄(II)、塩化コバルト(II)、塩化ニッケル(II)、臭化鉄(II)、臭化コバルト(II)、臭化ニッケル(II)、ヨウ化鉄(II)、ヨウ化コバルト(II)、ヨウ化ニッケル(II)等に代表されるハロゲン化物を例示でき、これらは水和物であっても差し支えない。
また、pH調節剤としては、例えば有機酸塩、有機酸、無機酸塩、無機酸を包含する一般的な塩基及び/又は酸であればよく、具体的には、トリチルアミン等の三級アミン類、及びピリジン類等を包含する有機塩基;メタンスルホン酸、p−トルエンスルホン酸等のスルホン酸類、及び酢酸等のカルボン酸類を包含する有機酸;水酸化ナトリウム、水酸化カリウム等の水酸化金属類、炭酸ナトリウム、炭酸カリウム等の金属炭酸塩類、炭酸水素ナトリウム、及び炭酸水素カリウム等の金属炭酸水素塩類を包含する無機塩基;塩酸等のハロゲン化水素酸類、硫酸、リン酸、及び硝酸等を包含する無機酸が挙げられ、NaOH、KOH、Na2CO3、NaHCO3、HCl、H2SO4、HNO3、KHSO4、CH3COOH等を例示できる。
【0063】
ヒドラゾン化合物同様、当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物も、当該構成単位に由来するヒドラゾン窒素、ピリジン窒素及び/又はフェノール類のヒドロキシル基において金属種に配位してヒドラゾン高分子金属錯体を形成することができる(下記式(9)参照)。ヒドラゾン高分子化合物を金属種に配位させる方法は、ヒドラゾン化合物からヒドラゾン金属錯体を製造する方法と同様である。
ヒドラゾン高分子化合物に、複数種の金属塩を用いる場合、各金属塩の仕込み比(金属原子換算)を反映した比率で、各金属種を含有するヒドラゾン高分子金属錯体が得られる。合成した高分子により各金属に対する親和性に違いが見られるのが一般的であり、これを利用して分子の構造により金属含有量をコントロールすることができる。
なお、ヒドラゾン高分子金属錯体を構成する繰り返し単位の連結の順番に関しては、下記式(9)に示されるような、ヒドラゾンに金属が配位した繰り返し単位、及びフェノールとホルムアルデヒド由来の繰り返し単位のそれぞれが、どのような順番で何回ずつ連結されていても構わない。たとえば、一定数同じ繰り返し単位が連結されたブロックが、互いに共重合するブロック共重合体であってもよいし、あるいは異なる繰り返し単位が交互に重合する交互共重合体であってもよい。また、繰り返し単位の配列に全く秩序が無いランダム共重合体であってもよい。
下記式(9)に示した構造は、本発明に係るヒドラゾン高分子金属錯体の構造の典型例である。なお、本明細書においては、本発明に係るヒドラゾン高分子金属錯体の構造を式(9)のごとき表記で代表させるが、該金属錯体の構造としては式(9)に示した構造の他にも、例えば、「窒素原子とともに金属錯体形成に寄与している水酸基以外のもう1つの水酸基を用いて、2以上のヒドラゾン部位と金属との間で配位結合あるいはイオン結合を形成した構造」や、「ポリマー製造において、ヒドラゾン化合物と共に用いられるフェノール原料由来の2以上のフェノール性水酸基と金属との間で、配位結合あるいはイオン結合を形成した構造」等を挙げることができる。
【0064】
【化11】

【0065】
2.高温処理工程
本発明において、高温処理工程とは、ヒドラゾン金属錯体及びヒドラゾン高分子金属錯体の少なくともいずれか一方と、導電性粒子とを混合して高温処理を行う工程のことである。
高温処理工程を行うことによって、ヒドラゾン金属錯体及びヒドラゾン高分子金属錯体の少なくともいずれか一方を導電性粒子に担持した金属触媒を得ることができる。
【0066】
本発明の高温処理工程において、高温処理とは、例えば焼成を挙げることができる。以下、高温処理として焼成を行った例について詳細に述べる。
具体的には、Pt、Ni、Fe、Co、Ag、Pd、Cu、Mn、Mo、Ru、Rh、Cr等の金属触媒種にヒドラゾン化合物から誘導される構成単位が配位したヒドラゾン高分子金属錯体と、活性炭等の炭素質導電性担持材料と、を焼成することにより、ヒドラゾンと炭素質導電性担持材料に部分的な結合が生じ、ヒドラゾン高分子金属錯体が炭素質導電性担持材料表面に固定化される。これにより生成するヒドラゾン高分子金属錯体・炭素質導電性担持材料複合体は、触媒金属の導電性担体として機能し得るようになり、該複合体に担持された触媒金属が電気化学反応に対して触媒活性を発現できるようになる。
【0067】
上記金属錯体の焼成は、不活性ガス雰囲気下、或いは、水素ガス雰囲気等の還元条件下で行うことが好ましい。不活性雰囲気又は還元条件下で行うことによって、触媒金属に配位するヒドラゾン高分子化合物を酸化させることなく、電気化学反応に対する触媒活性の付与、及び、触媒金属とヒドラゾン高分子化合物との配位構造の維持が可能となる。
焼成温度及び焼成時間等の焼成条件は、ヒドラゾン高分子金属錯体を構成するヒドラゾン高分子化合物、並びに金属触媒の種類、さらに、触媒の使用用途等を考慮して適宜決定すればよい。但し、焼成温度及び焼成時間は、電気化学反応に対する触媒活性の付与と共に、焼成後も触媒金属とヒドラゾン高分子化合物の由来の窒素との配位部位の構造が保持されるように、それぞれ設定することが重要である。焼成温度が高すぎたり、或いは焼成時間が長すぎると、触媒金属の配位状態が保持されず、ヒドラゾン高分子化合物の焼成体に金属触媒が担持されず、触媒金属の微細分散状態の保持が困難となる。
【0068】
また、上記ヒドラゾン高分子金属錯体の焼成を、該焼成により得られる触媒を担持しうる導電性担持材料の存在下行う場合、上記したような強い触媒活性の発現の他、これら金属錯体の触媒化と同時に、得られる触媒を該導電性担持材料に担持させることができるという利点もある。ヒドラゾン高分子金属錯体を焼成して得られる触媒を導電性担持材料に担持させることで、金属触媒のさらなる微細分散を実現することが可能となる。
導電性担持材料としては、触媒金属を担持させる担体として一般的に使用されている導電性材料、例えば、活性炭(具体的には、Vulcan XC−72R(商品名)、Ketjen black(商品名)等)のようなカーボン粒子、Al2O3、SiO2、CeO2のような多孔質酸化物のような金属粒子、等が挙げられる。また、これら導電性材料をシート状等に成型したものでもよい。
尚、ヒドラゾン高分子金属錯体は、触媒の用途に応じて、上記焼成の前に、配位金属を還元する還元処理を施してもよい。還元処理方法としては、一般的な方法が挙げられ、例えば、水素ガスや水素化ホウ素アルカリ金属塩、水素化ホウ素第四級アンモニウム塩、ジボラン、ヒドラジン、アルコール、アルコールアミン等の還元剤を用いる方法等が挙げられる。
【0069】
具体的な焼成条件として、例えば、燃料電池のアノード触媒(燃料の酸化反応用触媒)を得るためには、まず、水素ガス雰囲気又はNaBH4、KBH4、LiBH4、テトラアルキルアンモニウム(NR4+)等をカチオンとするテトラハイドロボレート塩(XBH4)、NaH2PO2等の化学的還元剤の存在下、250〜450℃で1〜10時間半焼成し、ヒドラゾン高分子化合物に配位した金属種を還元する。その後、還元条件(具体的には水素ガス雰囲気下)、350〜400℃で1〜2時間焼成する。このとき、上述したように、導電性担持材料と混合した状態で焼成を行うことによって、焼成により得られる触媒を導電性担持材料に担持させること、より強い触媒活性を示す触媒を作製することが可能である。
一方、燃料電池のカソード触媒(酸化剤の還元用触媒)を得るためには、窒素ガス雰囲気やアルゴンガス雰囲気等の不活性ガス雰囲気下、250〜1000℃、好ましくは500〜1000℃、特に好ましくは700〜900℃、最も好ましくは800℃で1〜2時間焼成する。このとき、アノード触媒同様、上述したように、導電性担持材料と混合した状態で焼成を行うことによって、焼成により得られる触媒を導電性担持材料に担持させること、より強い触媒活性を示す触媒を作製することが可能である。
【0070】
3.第1のポリマー合成工程
予めヒドラゾン高分子化合物を準備することによって、上述した金属錯体形成工程において、ヒドラゾン金属錯体よりも触媒活性の高いヒドラゾン高分子金属錯体を合成することができるという観点から、本発明の金属触媒の製造方法は、ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物を合成する第1のポリマー合成工程を有することが好ましい。
【0071】
第1のポリマー合成工程においては、具体的には、例えば、少なくとも、本発明において使用されるヒドラゾン化合物、フェノール類、及びアルデヒド類を重合させることにより、ヒドラゾン高分子化合物を得ることができる。さらに具体的には、本発明において使用されるヒドラゾン化合物と、フェノールと、ホルムアルデヒドとを、塩基又は酸触媒存在下、重合することによって、上記式(7)で表されるヒドラゾン高分子化合物が得られる。
【0072】
ここでフェノール類としては、フェノールの他、フェノールに1つ又は2つ以上の置換基が結合しているものが挙げられる。フェノールに導入される置換基としては、例えば、−OH、−OR、−NR’R”、炭素数1〜15のアリール基又はアルキル基(分岐構造を有していてもよい)が挙げられ、高い重合反応性が期待できることから、電子供与性を有しているものが好ましい。尚、Rは、アルキル置換基又はアリール置換基であれば特に限定されないが、炭素数1〜10のアルキル基又はアリール基が好ましい。また、R’及びR”は一価の有機基であれば特に限定されないが、好ましくは、それぞれ独立して、水素、炭素数1〜10のアルキル基又はアリール基のいずれかであることが好ましい。
【0073】
アルデヒド類としては、例えば、ホルムアルデヒド、パラホルムアルデヒドが好適である。
【0074】
上記式(7)で表されるヒドラゾン高分子化合物の具体的な製造方法としては、本発明において使用されるヒドラゾン化合物、フェノール類、アルデヒド類を適当な溶媒(例えば、水、アセトンに代表されるケトン類、メタノール、エタノールに代表されるアルコール類等の適当な溶媒又はこれらの混合物)中に溶解又は分散させ、NaOH等の塩基又はHCl等の酸存在下、所定の温度条件(例えば、20℃〜150℃)とすることで、ヒドラゾン化合物とアルデヒド類及びフェノール類とアルデヒド類を縮合させる方法が挙げられる。
【0075】
上記式(7)で表されるヒドラゾン高分子化合物において、ヒドラゾン化合物から誘導される構成単位とフェノール類から誘導される構成単位の割合は特に限定されず、適宜選択することができる。
【0076】
尚、本発明において使用されるヒドラゾン化合物は、上記構造のヒドラゾン高分子化合物に限定されず、その他の化合物と重合することによって、高分子化が可能である。
具体的には、塩基触媒存在下において合成したレゾール樹脂を酸化条件下にて加熱・攪拌を行うこと、もしくは酸性条件下において合成したノボラック樹脂に、ヘキサメチレンテトラミン等の架橋剤を添加することにより、より高分子化された配位性高分子を合成することが可能である。
【0077】
4.第2のポリマー合成工程
金属錯体形成工程において得られたヒドラゾン金属錯体を用いて、当該ヒドラゾン金属錯体よりも触媒活性の高いヒドラゾン高分子金属錯体を合成することができるという観点から、本発明の金属触媒の製造方法は、ヒドラゾン金属錯体から誘導される構成単位を含有するヒドラゾン高分子金属錯体を合成する第2のポリマー合成工程を有することが好ましい。
【0078】
第2のポリマー合成工程としては、具体的には、ヒドラゾン金属錯体と、フェノール類、アルデヒド類と重合させることによって上記式(9)と同様の構造を有するヒドラゾン高分子金属錯体を製造することができる。
ヒドラゾン金属錯体と、フェノール類と、アルデヒド類との重合は、上述したヒドラゾン化合物とフェノール類とアルデヒド類との重合反応と同様の条件において行うことができる。
【0079】
5.モノマー合成工程
ヒドラゾン化合物を合成するための原料を適宜選択することにより、所望の金属触媒を合成するために最適なヒドラゾン化合物を得ることができるという観点から、本発明の金属触媒の製造方法は、ヒドラゾン化合物を合成するモノマー合成工程を有することが好ましい。
【0080】
上記式(1)で表されるヒドラゾン化合物を合成するモノマー合成工程において、その具体的なモノマーの合成方法は特に限定されないが、例えば、下記に示す反応スキームに従って製造することができる。
【0081】
【化12】

(式中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
【0082】
一般式(1)で表される本発明において使用されるヒドラゾン化合物は、適当な溶媒中又は無溶媒で、縮合剤の存在下又は非存在下で、一般式(10)で表されるケトン化合物(2,4−ジヒドロキシアセトフェノン)と一般式(11)で表されるヒドラジン化合物(ヒドラジノピリジン)とを反応させることにより製造することができる。
一般式(10)で表されるケトン化合物及び一般式(11)で表されるヒドラジン化合物は、共に公知であり、市販品として入手又は一般的な方法に準じて合成することができる。
上記反応における各化合物の使用量としては、一般式(10)で表されるケトン化合物1モルに対して、一般式(11)で表されるヒドラジン化合物を、通常、0.8〜10モル、好ましくは、1.0〜5.0モル、より好ましくは1.0〜2.0モルの範囲とする。
【0083】
上記反応は、酸触媒の存在下で進行するが、反応を促進するために縮合剤を用いることが好ましい。酸触媒の具体例としては、例えば、塩化水素、濃硫酸、リン酸、酢酸、等のプロトン酸を用いることができ、また、縮合剤の具体例としては、例えば、DCC(ジシクロヘキシルカルボジイミド)等の一般的なもの用いることができる。酸触媒、縮合剤の使用量としては、一般式(10)で表されるケトン化合物1モルに対して、酸触媒、縮合剤それぞれを、通常、0.0001〜10モル、好ましくは0.0001〜5モル、より好ましくは0.0001〜2モルの範囲とする。
【0084】
また、上記反応は、無溶媒でも進行するが、より円滑に反応を進行させるために溶媒を用いることが好ましい。該反応に用いうる溶媒としては、反応を阻害せず安定なものであれば良く、例えば、メタノール、エタノール、イソプロパノール等のアルコール類;フェニルエーテル、アニソール等のエーテル類;トルエン、キシレン、メシチレン、テトラリン等の芳香族炭化水素類;デカリンその他脂環式炭化水素類;N,N−ジメチルホルムアミド(DMF)、N,N−ジメチルアセトアミド(DMAC)、N,N−ジメチルイミダゾリジノン(DMI)、N−メチルピロリドン(NMP)、ジメチルスルホキシド(DMSO)、スルホラン(TMSO2)等の非プロトン性極性溶媒類;ニトロベンゼン、p−ニトロトルエン等の芳香族系ニトロ化合物;クロロベンゼン、o−ジクロロベンゼン、トリクロロベンゼン等の芳香族系ハロゲン化合物等を例示できる。溶媒の使用量としては、一般式(10)で表されるケトン化合物1モルに対して、通常、0〜3.0L、好ましくは0.05〜1.5Lの範囲である。
【0085】
上記反応の反応温度は、反応が進行する限りにおいて、特に制限はないが、通常、−20℃〜150℃、好ましくは10℃〜120℃、より好ましくは20〜100℃の範囲である。
また、反応時間は特に制限されないが、副生成物抑制の観点等から、好ましくは0.5〜40時間である。
反応後は、析出した結晶をろ過等により分離し、必要に応じてメタノール等の有機溶媒や水、これらの混合物等を用いて洗浄し、乾燥すればよい。乾燥温度は特に限定されず、本発明において使用されるヒドラゾン化合物の融点又は分解点未満であれば差し支えないが、通常、20〜200℃、好ましくは30〜180℃、さらに好ましくは40〜150℃の範囲を例示できる。
【0086】
6.金属触媒の用途
以上のような、本発明において使用されるヒドラゾン化合物を用いて得られる触媒は、白金に代表される希少な金属を用いる場合には、その使用量を低減することが可能であり、また、白金等の希少な金属を用いずとも、優れた触媒作用を示すという点で、産業上の利用価値が高い。
触媒の用途としては、例えば、燃料電池の電極触媒、自動車等の排ガスの浄化触媒、アンモニアの分解触媒等の様々な分野において使用可能である。燃料電池としては、電荷キャリアが水酸化物イオン(OH−)であるアルカリ燃料電池の他、電荷キャリアがプロトン(H+)である固体高分子電解質型燃料電池、固体酸化物型燃料電池、リン酸型燃料電池等が挙げられる。本発明において使用されるヒドラゾン化合物を用いて得られる上記触媒を用いることによって、触媒金属の分散性に優れた電極を容易に製造することが可能である。中でも、電荷キャリアが水酸化物イオンであり、Ni、Fe、Co等の卑金属(非貴金属)を電極触媒として好適に用いることが可能なアルカリ燃料電池において好ましく用いられる。
アルカリ燃料電池用触媒として利用する場合には、8族の遷移金属、9族の遷移金属、10族の遷移金属及び11族の遷移金属を中心金属とするヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を用いることが好ましい。特に、8族遷移金属に配位してなるヒドラゾン金属錯体、9族遷移金属に配位してなるヒドラゾン金属錯体、10族遷移金属に配位してなるヒドラゾン金属錯体、及び、11族遷移金属に配位してなるヒドラゾン金属錯体のうち、少なくとも2種以上又は3種以上を組み合わせた混合物や、8族遷移金属、9族遷移金属、10族遷移金属及び11族遷移金属から選ばれる2種以上又は3種以上の遷移金属に配位したヒドラゾン高分子金属錯体等、多元系とすることが好ましい。
【0087】
具体的には、アルカリ型直接エタノール燃料電池のアノード用触媒としては、触媒金属として、Ni、Co、Feが好ましく、特にこれらの触媒金属を2種以上用いた多元系、中でもNi、Co及びFeの三元系であることが好ましい。一方、アルカリ燃料電池のカソード用触媒としては、触媒金属として、Ni、Co、Fe、Mnが好ましく、特にこれらの触媒金属を2種以上用いた多元系、中でもNi及びCoの二元系であることが好ましい。
【0088】
ここで、アルカリ燃料電池の一形態例について図1を用いて説明する。尚、アルカリ燃料電池は、以下に示す構造に限定されるものではない。
アルカリ燃料電池は、電解質1として水酸化カリウム水溶液やアニオン交換樹脂膜等を用い、酸化剤極3において、酸素と水との反応(1/2O2+H2O→2OH−)により生成した水酸化物イオンが、電解質1を通って燃料極2へと移動し、燃料極2において燃料(水素ガス等)と反応することにより水と電子を生じる(H2+2OH−→2H2O+2e−)。燃料極2で生成した水は、電解質1を経て酸化剤極へと移動し、酸化剤極3の電極反応原料となる。
アニオン交換膜としては、酸化剤極で生成した水酸化物イオンを燃料極へと移動させることができるものであれば、特に限定されないが、例えば、第四級アンモニウム基、ピリジニウム基などのアニオン交換基を有するアニオン交換樹脂を含有する固体高分子膜が挙げられる。
【0089】
燃料極は、上記水素と水酸化物イオンから水を生成させる触媒作用を有する電極触媒を含み、酸化剤極は、上記酸素と水から水酸化物イオンを生成させる触媒作用を有する電極触媒を含む。各電極の構成としては、これら電極触媒を、該電極触媒へ燃料又は酸化物を供給できる多孔質構造及び電子伝導性を有する多孔質導電体上に配置した構成が挙げられる。多孔質導電体としては、例えば、カーボンペーパー、カーボンシート等の導電性炭素質の他、Ni、Ti等の金属メッシュ、金属発泡体等が挙げられる。各電極は、電極触媒が固定されれば、上記のような多孔質導電体がなくてもよい。
燃料極の外側には、燃料不透過性且つ導電性を有する燃料極側セパレータ4、酸化剤の外側には、酸化剤不透過性且つ導電性を有する酸化剤極側セパレータ5が配置され、燃料電池用単セルが構成される。
そして、燃料極には燃料極側セパレータを介して水素を含有又は水素発生化合物を含有する燃料が供給され、酸化剤極には酸化剤極側セパレータを介して空気を含有又は空気発生化合物を含有する酸化剤が供給され、発電する。
【0090】
本発明によれば、前記式(1)に示すヒドラゾン化合物が異なるpH条件下において異なる化学構造を有することにより、金属原子への配位能がpH条件に依存して変化することから、金属錯体形成工程において、波長が400〜450nmの単色光に対する吸光度、すなわち、金属化合物に由来する金属イオンが有する吸光度が一定以上の値になるようなpH条件下で、ヒドラゾン化合物又はヒドラゾン高分子化合物のいずれか一方を金属化合物と混合することにより、ヒドラゾン化合物又はヒドラゾン高分子化合物と金属イオンとの、安定した金属錯体形成を行わせることができる。また、本発明によれば、金属錯体形成工程とポリマー合成工程のどちらを先に行っても金属触媒が得られることから、ヒドラゾン化合物や金属化合物の種類によって、より効率のよい触媒の製造方法を選択することができる。また、本発明によれば、高温処理工程を行うことによって、ヒドラゾン金属錯体及びヒドラゾン高分子金属錯体の少なくともいずれか一方を導電性粒子に担持した金属触媒を得ることができる。
【0091】
7.本発明に係るヒドラゾン金属錯体及びヒドラゾン高分子金属錯体
本発明の第1のヒドラゾン金属錯体は、下記一般式(2)で表されることを特徴とする
【0092】
【化13】

(上記式(2)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0093】
本発明の第2のヒドラゾン金属錯体は、下記一般式(3)で表されることを特徴とする
【0094】
【化14】

(上記式(3)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0095】
本発明の第1のヒドラゾン高分子金属錯体は、下記一般式(4)で表される繰り返し単位を有するポリマーであることを特徴とする
【0096】
【化15】

(上記式(4)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0097】
本発明の第2のヒドラゾン高分子金属錯体は、下記一般式(5)で表される繰り返し単位を有するポリマーであることを特徴とする。
【0098】
【化16】

(上記式(5)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【0099】
上記第1及び第2のヒドラゾン金属錯体、並びに第1及び第2のヒドラゾン高分子金属錯体(以下、「本発明に係る金属錯体」ということがある。)は、上述した本発明に係る金属触媒の製造方法における、金属錯体形成工程において合成される、金属錯体の典型例である。なお、上述した金属錯体形成工程において合成される金属錯体は、必ずしもこれら4種類の錯体のみに限定されるものではない。
本発明に係る金属錯体は、例えば、上述した金属触媒の製造方法における、高温処理工程において、金属触媒へと変換するための前駆体として用いることができる。また、本発明に係る金属錯体は、それぞれ金属触媒そのものとしても使用が可能である。
なお、本発明に係る金属錯体を合成する方法は、必ずしも上述した金属錯体形成工程のみに限定されるものではない。
【0100】
本発明に係る金属錯体はいずれも、ヒドラゾン窒素(=N−)及び置換基X(Xは−O−又は−O(H)−)と、金属元素由来の原子又はイオンMとの間に、それぞれ結合を形成している。当該結合は、イオン結合であっても、配位結合であってもよい。すなわち、上記式(2)を例にとると、Xが−O−である場合には、酸素原子上の負電荷により、結合O−Mはイオン結合となり、Xが−O(H)−である場合には、酸素原子上の非共有電子対により、結合O−Mは配位結合となる。なお、ヒドラゾン窒素(=N−)とMとの結合は、窒素原子上の非共有電子対により、常に配位結合となる。
【0101】
第1のヒドラゾン金属錯体と第2のヒドラゾン金属錯体との相違点は、第1のヒドラゾン金属錯体が2配位の金属錯体であるのに対し、第2のヒドラゾン金属錯体が3配位の金属錯体である点である。すなわち、第1のヒドラゾン金属錯体が、上述したようなヒドラゾン窒素及び置換基Xと、金属元素由来の原子又はイオンMとの間にそれぞれ結合を1つずつ有しているのに対し、第2のヒドラゾン金属錯体は、これらの2つの結合に加えて、さらに、2−ピリジル基上のピリジン窒素とMとの間に配位結合を有している点で異なる。
第1のヒドラゾン高分子金属錯体と第2のヒドラゾン高分子金属錯体との相違点についても、同様である。
【0102】
第1又は第2のヒドラゾン高分子金属錯体は、上記式(4)又は(5)の繰り返し単位を有する他に、異なる繰り返し単位を有していてもよい。すなわち、上記式(9)に示すように、例えば、フェノール由来の繰り返し単位及び/又はホルムアルデヒド由来の繰り返し単位等を含んでいてもよい。
【実施例】
【0103】
(ヒドラゾン化合物の製造)
還流冷却管、温度計、攪拌機を備えた3Lの4つ口フラスコに、2−ヒドラジノピリジン33.8g(0.309mol)及びメタノール2Lを仕込み、攪拌下、室温で濃硫酸1mLを滴下した。その後、2,4−ジヒドロキシアセトフェノン44.0g(0.289mol)を仕込み、40℃で8時間攪拌して反応させた。
析出した結晶をろ過で取り出し、メタノール及び水で洗浄し、60℃で乾燥後、淡黄色の結晶として33.0gの4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン1,3−ジオールを得た。収率は50%だった。
得られた結晶について、GC/MS、1H−NMR、IR測定を行った。結果を以下に示す。
【0104】
・融点 : 230℃
・GC/MS(EI) : M/Z=243(M+)、228(M+−CH3)
・1H−NMR(300MHz、DMSO−d6) : δ=2.33(s,3H),6.26(d,1H,J=2.4Hz),6.31(dd,1H,J=2.4Hz,J=8.7Hz),6.80(ddd,1H,J=0.7Hz,J=5.1Hz,J=7.2Hz),6.89(d,1H,J=8.4Hz),7.36(d,1H,J=8.7Hz),7.64(ddd,1H,J=1.8Hz,J=7.2Hz,J=8.4Hz),8.18(ddd,1H,J=0.7Hz,J=1.8Hz,J=5.1Hz),δ=9.65(s,1H),δ=9.93(s,1H),δ=13.36(s,1H),
・IR(KBr、cm−1) : 3440、3372,1630,1598,1578,1506,1454,1255,767
【0105】
(ヒドラゾン高分子化合物の製造)
200mLフラスコで上記にて得られたヒドラゾン化合物8gをエタノール水溶液(水:エタノール=1:2)100mLに懸濁させ、ヒドラゾン溶液を調製した。次に、該ヒドラゾン溶液に、フェノール4.0g、ホルムアルデヒド(37wt%)4.0mL、NaOH0.25gを加え、110℃にて加熱還流を行い、6時間反応させた。
反応後、HCl水溶液にてpH2〜3に調整し、さらに1時間反応を継続した。得られた懸濁液をNaOH水溶液にて中和した後、濾過し、濾物をアセトン水溶液[アセトン:水=1:1]で3回洗浄した。得られた固形物(ヒドラゾン高分子化合物)を65℃で3日間乾燥させた。
【0106】
(ヒドラゾン金属錯体(1)の製造)
まず、上記にて得られたヒドラゾン化合物0.5gを100mLのアセトンと混合し、攪拌した。続いて、0.08gのCo(AcO)2・4H2O、0.13gのNi(AcO)2・4H2O、0.08gのFe(AcO)2・4H2Oを加え、攪拌した。さらに、1MのNaOH水溶液約100mLを加え、pH9付近に調整した。
10時間攪拌した後、ろ過し、得られた濾物を数回水で洗浄した。得られた固形物(ヒドラゾン金属錯体(1))を、65℃で真空乾燥した。
【0107】
(ヒドラゾン高分子金属錯体(1)の製造)
まず、上記にて得られたヒドラゾン高分子化合物1.0gを20mLのアセトンと混合し、攪拌した。続いて、0.5gのCo(AcO)2・4H2O、0.5gのNi(AcO)2・4H2O、0.5gのFe(AcO)2・4H2O、及び、アセトン15mLを加え、攪拌した。さらに、1MのNaOH水溶液約20mLを加え、pH9付近に調整した。
10時間攪拌した後、ろ過し、得られた濾物を数回水で洗浄した。得られた固形物(ヒドラゾン高分子金属錯体(1))を、65℃で真空乾燥した。
【0108】
(アノード用触媒(a)の製造)
上記にて得られたヒドラゾン金属錯体(1)0.10gとカーボン粒子(Valkan XC−72R)1.00gとを混合した。該混合物を石英ガラス管内に設置し、石英ガラス管内に水素ガスを導入(250mL/min)して昇温速度6.5℃で360℃まで昇温した(図2に示す熱処理装置参照)。360℃を2時間保持し、ヒドラゾン金属錯体(1)の酢酸塩を還元すると共に、該金属錯体を焼成した。その後、室温まで降温させ、水素ガスを停止し、アノード用触媒(a)を得た。
尚、図2に示す熱処理装置において、石英ガラス管内の温度は熱電対によりモニターし、温調のマントルヒーターによりコントールした。また、石英ガラス管に導入されるガスの流量はフローメーターにより調節した。ガラスウールは、管内の試料がガス流で移動しないようにするために用いた。
【0109】
(アノード用触媒(A)の製造)
上記にて得られたヒドラゾン高分子金属錯体(1)0.10gとカーボン粒子(Valkan XC−72R)1.00gとを混合した。該混合物を石英ガラス管内に設置し、石英ガラス管内に水素ガスを導入(250mL/min)して昇温速度6.5℃で360℃まで昇温した(図2参照)。360℃を2時間保持し、ヒドラゾン高分子金属錯体(1)の酢酸塩を還元すると共に、該高分子金属錯体を焼成した。その後、室温まで降温させ、水素ガスを停止し、アノード用触媒(A)を得た。
【0110】
[触媒の評価]
(アノード用触媒(a)の評価)
上記にて得られたアノード用触媒(a)0.5gを、約10mLの水に分散させ、該触媒分散液をニッケル製の多孔体シート(ニッケルフォーム、厚さ約1mm)に塗布し(36mm角、0.3mm)、乾燥してアノード電極(厚さ0.3mm)とした。一方、カソード用触媒(上記アノード用触媒(a)と同じもの)0.5gを、テトラフルオロエチレン0.05gと共に、超音波分散により約10mLの水に分散させ、該触媒分散液をカーボン製の多孔体シート(カーボンシート、厚さ約1mm)にスプレー塗布し(36mm角、0.2mm)、乾燥してカソード電極とした。
アニオン交換膜(炭化水素系膜、膜厚40μm、65mm角)を、アノード電極及びカソード電極の触媒分散液塗布面と接するように、アノード電極及びカソード電極で挟み込み、さらに、セル治具に設置して評価用燃料電池セル1を作製した。
評価用燃料電池セル1について、以下の条件下、ガルバノスタットによりI−V特性を測定した。結果を図3に示す。
【0111】
<I−V特性測定条件>
・アノード燃料:KOHエタノール水溶液(エタノール10wt%、KOH 1M)
・アノード燃料流量:約600mL/min
・カソードガス:空気
・カソードガス流量:130mL/min
・温度(恒温槽温度):50℃
【0112】
(アノード用触媒(A)の評価)
上記アノード用触媒(a)の評価において、アノード用触媒(a)の代わりにアノード用触媒(A)を用いる(アノード用触媒及びカソード用触媒共に)以外は、同様にして、評価用燃料電池セル2を作製し、I−V特性を測定した。結果を図4に示す。
【0113】
(結果)
図3に示すように、本発明において使用されるヒドラゾン化合物を原料とするアノード用触媒(a)を用いた燃料電池セル1は、OCV約0.65V、最高出力密度約0.88mW/cm2(電流密度3.8mA/cm2の時)という良好な発電性能を示した。
また、図4に示すように、本発明において使用されるヒドラゾン化合物を原料とするアノード用触媒(A)を用いた燃料電池セル2は、OCV約0.58V、最高出力密度約1.4mW/cm2(電流密度6.4mA/cm2の時)という良好な発電性能を示した。
これらの結果から、ヒドラゾン高分子金属錯体を焼成して得られたアノード用触媒Aの方が、ヒドラゾン金属錯体を焼成して得られたアノード用触媒aよりも、大幅に高い出力密度が得られることがわかる。これは、ヒドラゾン金属錯体を用いる場合と比較して、ヒドラゾン高分子金属錯体を用いることによって、電極における触媒金属の分散性が向上したためと推測される。
【0114】
(金属イオンを含有したヒドラゾン化合物水溶液の、各pHにおけるUV−visスペクトル測定)
本発明の金属触媒の製造方法に用いられるヒドラゾン化合物の、pHに依存した構造変化を確かめるために、当該化合物水溶液のUV−visスペクトル測定を行った。なお、本測定においては、ヒドラゾン化合物として、4−{1−[(2−ピリジン−2−イル)ヒドラゾノ]エチル}ベンゼン−1,3−ジオールを用いた。
なお、pH測定には、pHメーター(型番:HM−20P、東亜ディーケーケー株式会社製)を用いた。また、UV−visスペクトル測定には、紫外可視近赤外分光光度計(型番:V−670、日本分光株式会社製)を用いた。
【0115】
[実施例1]
まず、イオン交換水50mL中に、0.1質量%アスコルビン酸水溶液5mL、0.5mM塩化ニッケル(II)水溶液5mL、0.5mMヒドラゾン化合物/アセトニトリル溶液5mLを加え、仮水溶液とした。続いて、10mM水酸化カリウム水溶液、1M水酸化カリウム水溶液、10mM塩酸又は1M塩酸を用いて、仮水溶液を目的とする各pHに調整した。なお、目的とする各pHは、pH=4〜10の範囲において1刻みで、pH=10〜14の範囲において0.2刻みで設定した。
次に、仮水溶液に、イオン交換溶液を加えて、全体が100mLとなるように希釈した。これによって、目的とするpH別に調整された、0.025mMヒドラゾン化合物・ニッケル(II)イオン水溶液(以下、測定用水溶液という。)100mLがそれぞれ得られた。この測定用水溶液を室温で30分間静置した後、波長410、415、420、425nmの単色光を用いて、UV−visスペクトル測定を行った。
【0116】
[実施例2]
まず、イオン交換水50mL中に、0.1質量%アスコルビン酸水溶液5mL、0.5mM塩化鉄(II)水溶液5mL、0.5mMヒドラゾン化合物/アセトニトリル溶液5mLを加え、仮水溶液とした。続いて、10mM水酸化カリウム水溶液、1M水酸化カリウム水溶液、10mM塩酸又は1M塩酸を用いて、仮水溶液を目的とする各pHに調整した。なお、目的とする各pHは、pH=4〜13の範囲において1刻みで設定した。
次に、仮水溶液に、イオン交換溶液を加えて、全体が100mLとなるように希釈した。これによって、目的とするpH別に調整された、0.025mMヒドラゾン化合物・鉄(II)イオン水溶液(以下、測定用水溶液という。)100mLがそれぞれ得られた。この測定用水溶液を室温で30分間静置した後、波長410、415、420、425nmの単色光を用いて、UV−visスペクトル測定を行った。
【0117】
[実施例3]
まず、イオン交換水50mL中に、0.1質量%アスコルビン酸水溶液5mL、0.5mM塩化コバルト(II)水溶液5mL、0.5mMヒドラゾン化合物/アセトニトリル溶液5mLを加え、仮水溶液とした。続いて、10mM水酸化カリウム水溶液、1M水酸化カリウム水溶液、10mM塩酸又は1M塩酸を用いて、仮水溶液を目的とする各pHに調整した。なお、目的とする各pHは、pH=4〜13の範囲において1刻みで設定した。
次に、仮水溶液に、イオン交換溶液を加えて、全体が100mLとなるように希釈した。これによって、目的とするpH別に調整された、0.025mMヒドラゾン化合物・コバルト(II)イオン水溶液(以下、測定用水溶液という。)100mLがそれぞれ得られた。この測定用水溶液を室温で30分間静置した後、波長410、415、420、425nmの単色光を用いて、UV−visスペクトル測定を行った。
【0118】
[参考例]
実施例1〜3とは別に、本発明の金属触媒の製造方法に用いられるヒドラゾン化合物の、pHに依存した構造変化を確かめるために、当該化合物水溶液のUV−visスペクトル測定を行った。
まず、イオン交換水50mL中に、0.1質量%アスコルビン酸水溶液5mL、0.5mMヒドラゾン化合物/アセトニトリル溶液5mLを加え、仮水溶液とした。続いて、10mM水酸化カリウム水溶液、1M水酸化カリウム水溶液、10mM塩酸又は1M塩酸を用いて、仮水溶液を目的とする各pHに調整した。なお、目的とする各pHは、pH=1〜10の範囲で、pH=1、2、3、4、5、6、6.5、7.5、8、9、10となるようにそれぞれ設定した。
次に、仮水溶液に、イオン交換溶液を加えて、全体が100mLとなるように希釈した。これによって、目的とするpH別に調整された、0.025mMヒドラゾン化合物水溶液(以下、測定用水溶液という。)100mLがそれぞれ得られた。この各測定用水溶液を室温で30分間静置した後、各pHの当該測定用水溶液を用いて、波長250〜800nmの領域の吸光度について、UV−visスペクトル測定を行った。
【0119】
実施例1〜3、及び参考例の測定用水溶液のUV−visスペクトル測定の結果をそれぞれ示したグラフが、図5〜図9である。なお、図9には、得られたスペクトラムの250〜450nmの範囲を示した。
図9は、各pH(pH=1〜10)におけるヒドラゾン化合物水溶液(参考例の測定用水溶液)のUV−visスペクトル測定結果を示すグラフである。
図9において、中性領域(pH=5〜7.5)では、波長330nm付近に極大吸収が確認された。この吸収は、上述した構造(1c)の互変異性体(tautomer)のπ‐π*遷移による吸収と考えられる。
また、酸性領域(pH=1〜4)では、波長350nm付近に極大吸収が確認された。この吸収は、上述した構造(1a)又は(1b)のように、ピリジン環上の窒素原子、及び/又はヒドラゾン窒素のプロトン化により、前記π‐π*遷移による吸収が長波長シフトしたと考えられる。
さらに、アルカリ性領域(pH=9〜10)では、波長340nm付近に極大吸収が確認された。この吸収は、上述した構造(1d)のような錯体形成による吸収と考えられる。
また、図9より、ヒドラゾン化合物は、溶液中のpHを変動させても400nm以上の長波長領域にはほとんど吸収を持たないことが分かる。したがって、ヒドラゾン化合物が金属イオンに配位してヒドラゾン金属錯体が生成しているか否かは、400nm以上に吸収を有するかどうかで判断することが可能であることが分かる。
【0120】
図5は各pH(pH=4〜13)における、図6は各pH(pH=10〜13)における、実施例1の測定用水溶液のUV−visスペクトル測定結果をそれぞれ示すグラフである。図5及び図6から分かるように、波長410、415、420、425nmのいずれの単色光を用いて測定した場合でも、pH=10.5〜13.5の範囲において吸光度が0.1以上となっていることから、この範囲のpH条件において、ニッケルイオンとヒドラゾン化合物とが安定して錯体形成していることが分かる。
図7は各pH(pH=4〜13)における、実施例2の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。図7から分かるように、波長410、415、420、425nmのいずれの単色光を用いて測定した場合でも、pH=5〜12の範囲において吸光度が0.1以上となっていることから、この範囲のpH条件において、鉄イオンとヒドラゾン化合物とが安定して錯体形成していることが分かる。
図8は各pH(pH=4〜13)における、実施例3の測定用水溶液のUV−visスペクトル測定結果を示すグラフである。図8から分かるように、波長410、415、420、425nmのいずれの単色光を用いて測定した場合でも、pH=6〜13の範囲において吸光度が0.1以上となっていることから、この範囲のpH条件において、コバルトイオンとヒドラゾン化合物とが安定して錯体形成していることが分かる。
【符号の説明】
【0121】
1…電解質
2…燃料極
3…酸化剤極
4…燃料極側セパレータ
4a…燃料流路
5…酸化剤極側セパレータ
5a…酸化剤流路
【特許請求の範囲】
【請求項1】
下記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを、下記pH条件下で混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する金属錯体形成工程、並びに、
前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方と、導電性粒子とを混合して高温処理する高温処理工程を有することを特徴とする、金属触媒の製造方法。
【化1】

(上記式(1)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
pH条件:前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を、前記金属化合物と混合した溶液の、波長が400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件。
【請求項2】
前記ヒドラゾン化合物から誘導される構成単位を含有する前記ヒドラゾン高分子化合物を合成する第1のポリマー合成工程を有する、請求項1に記載の金属触媒の製造方法。
【請求項3】
前記ヒドラゾン金属錯体から誘導される構成単位を含有する前記ヒドラゾン高分子金属錯体を合成する第2のポリマー合成工程を有する、請求項1又は2に記載の金属触媒の製造方法。
【請求項4】
前記ヒドラゾン化合物を合成するモノマー合成工程を有する、請求項1乃至3のいずれか一項に記載の金属触媒の製造方法。
【請求項5】
前記金属錯体形成工程において、前記金属化合物がニッケル元素を有し、且つ、前記pH条件が10.5〜13.5である、請求項1乃至4のいずれか一項に記載の金属触媒の製造方法。
【請求項6】
前記金属錯体形成工程において、前記金属化合物が鉄元素を有し、且つ、前記pH条件が5〜12である、請求項1乃至4のいずれか一項に記載の金属触媒の製造方法。
【請求項7】
前記金属錯体形成工程において、前記金属化合物がコバルト元素を有し、且つ、前記pH条件が6〜13である、請求項1乃至4のいずれか一項に記載の金属触媒の製造方法。
【請求項8】
下記一般式(2)で表されることを特徴とする、第1のヒドラゾン金属錯体。
【化2】

(上記式(2)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【請求項9】
下記一般式(3)で表されることを特徴とする、第2のヒドラゾン金属錯体。
【化3】

(上記式(3)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【請求項10】
下記一般式(4)で表される繰り返し単位を有するポリマーであることを特徴とする、第1のヒドラゾン高分子金属錯体。
【化4】

(上記式(4)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【請求項11】
下記一般式(5)で表される繰り返し単位を有するポリマーであることを特徴とする、第2のヒドラゾン高分子金属錯体。
【化5】

(上記式(5)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【請求項1】
下記一般式(1)で表されるヒドラゾン化合物、又は当該ヒドラゾン化合物から誘導される構成単位を含有するヒドラゾン高分子化合物のいずれか一方と、金属化合物とを、下記pH条件下で混合し、ヒドラゾン金属錯体又はヒドラゾン高分子金属錯体を合成する金属錯体形成工程、並びに、
前記ヒドラゾン金属錯体及び前記ヒドラゾン高分子金属錯体の少なくともいずれか一方と、導電性粒子とを混合して高温処理する高温処理工程を有することを特徴とする、金属触媒の製造方法。
【化1】

(上記式(1)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を示す。)
pH条件:前記ヒドラゾン化合物又は前記ヒドラゾン高分子化合物のいずれか一方を、前記金属化合物と混合した溶液の、波長が400〜450nmの単色光に対する吸光度が0.1〜1となるpH条件。
【請求項2】
前記ヒドラゾン化合物から誘導される構成単位を含有する前記ヒドラゾン高分子化合物を合成する第1のポリマー合成工程を有する、請求項1に記載の金属触媒の製造方法。
【請求項3】
前記ヒドラゾン金属錯体から誘導される構成単位を含有する前記ヒドラゾン高分子金属錯体を合成する第2のポリマー合成工程を有する、請求項1又は2に記載の金属触媒の製造方法。
【請求項4】
前記ヒドラゾン化合物を合成するモノマー合成工程を有する、請求項1乃至3のいずれか一項に記載の金属触媒の製造方法。
【請求項5】
前記金属錯体形成工程において、前記金属化合物がニッケル元素を有し、且つ、前記pH条件が10.5〜13.5である、請求項1乃至4のいずれか一項に記載の金属触媒の製造方法。
【請求項6】
前記金属錯体形成工程において、前記金属化合物が鉄元素を有し、且つ、前記pH条件が5〜12である、請求項1乃至4のいずれか一項に記載の金属触媒の製造方法。
【請求項7】
前記金属錯体形成工程において、前記金属化合物がコバルト元素を有し、且つ、前記pH条件が6〜13である、請求項1乃至4のいずれか一項に記載の金属触媒の製造方法。
【請求項8】
下記一般式(2)で表されることを特徴とする、第1のヒドラゾン金属錯体。
【化2】

(上記式(2)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【請求項9】
下記一般式(3)で表されることを特徴とする、第2のヒドラゾン金属錯体。
【化3】

(上記式(3)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【請求項10】
下記一般式(4)で表される繰り返し単位を有するポリマーであることを特徴とする、第1のヒドラゾン高分子金属錯体。
【化4】

(上記式(4)中、Pyは2−ピリジル基、3−ピリジル基又は4−ピリジル基を、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【請求項11】
下記一般式(5)で表される繰り返し単位を有するポリマーであることを特徴とする、第2のヒドラゾン高分子金属錯体。
【化5】

(上記式(5)中、Xは−O−又は−O(H)−を、Mは鉄、コバルト、ニッケル、ルテニウム、ロジウム、パラジウム、オスミウム、イリジウム又は白金のうちいずれか1つの元素由来の原子又はイオンを示す。)
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2010−194513(P2010−194513A)
【公開日】平成22年9月9日(2010.9.9)
【国際特許分類】
【出願番号】特願2009−45347(P2009−45347)
【出願日】平成21年2月27日(2009.2.27)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【出願人】(000102049)イハラケミカル工業株式会社 (48)
【Fターム(参考)】
【公開日】平成22年9月9日(2010.9.9)
【国際特許分類】
【出願日】平成21年2月27日(2009.2.27)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【出願人】(000102049)イハラケミカル工業株式会社 (48)
【Fターム(参考)】
[ Back to top ]

