金属錯体、該金属錯体の製造方法および分離材
【課題】従来材料よりも二酸化炭素を選択的に吸着する金属錯体を提供する。
【解決手段】亜鉛等から選択される少なくとも1種の金属のイオンと、下記(I)で表されるジカルボン酸化合物と、

(式中、R1、R2、R3及びXはそれぞれ水素原子等を表す)下記(II)で表される、前記金属イオンに二座配位可能な有機配位子とからなる擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体。

(式中、R4、R5、R6、R7、R8、R9、R10およびR11はそれぞれ水素原子等を表す)
【解決手段】亜鉛等から選択される少なくとも1種の金属のイオンと、下記(I)で表されるジカルボン酸化合物と、

(式中、R1、R2、R3及びXはそれぞれ水素原子等を表す)下記(II)で表される、前記金属イオンに二座配位可能な有機配位子とからなる擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体。

(式中、R4、R5、R6、R7、R8、R9、R10およびR11はそれぞれ水素原子等を表す)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は種々の気体中から特定の成分を選択的に吸着、脱着を行う為の分離材として使用可能な金属錯体およびその製造方法に関する。
【背景技術】
【0002】
酸化反応プロセスを用いた製品製造において、原料の燃焼による炭酸ガス(二酸化炭素)の副生は避けられない。副生した炭酸ガスを反応系中から除去する方法として、熱炭酸カリ法、アミン法などの吸収法が用いられている。しかし、これら吸収法は、再生の際に多量の熱エネルギーを必要とするため、非効率である。
【0003】
吸収法の代わりに、高効率の圧力スイング吸着法(PSA法)プロセスを導入すれば、炭酸ガス除去剤の再生に必要な熱エネルギーを削減することが可能となり、プロセスのさらなる省エネルギー化が期待される。しかしながら、ゼオライトに代表される既存の吸着剤では、炭酸ガスと炭化水素の分離係数が小さく、PSA法に用いる吸着剤としては不十分である。
【0004】
一方、より優れた分離性能を与える多孔性材料として、外部刺激により動的構造変化を生じる多孔性金属錯体が開発されている(非特許文献1、非特許文献2参照)。この新規な構造変化しうる多孔性金属錯体をガス分離材として使用した場合、既存の分離材よりも優れた分離性能を発現し、高効率な炭酸ガス除去システムの構築が可能となる。
【0005】
動的構造変化高分子金属錯体を吸蔵材や分離材に適用した例として、インターデジテイト型(二次元シート型)の集積構造を有する金属錯体(特許文献1、特許文献2参照)などが報告されている。しかしながら、インターデジテイト型の集積構造を有する金属錯体について、本発明者らが室温付近における各ガスの平衡吸着量を測定したところ、二酸化炭素、エチレン、エタンの吸着量に大きな差はなく、エチレン、エタンと二酸化炭素との分離は困難であることが判明した。
【0006】
また、5−ブロモイソフタル酸と亜鉛イオンと1,2−ジ(4−ピリジル)エチレンからなる高分子金属錯体が構造とともに報告されている(非特許文献3参照)。しかしながら、ガスの吸着挙動については何ら言及されていない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2010−158617公報
【特許文献2】特開2010−180202公報
【非特許文献】
【0008】
【非特許文献1】植村一広、北川進、未来材料、第2巻、44〜51頁(2002年)
【非特許文献2】松田亮太郎、北川進、ペトロテック、第26巻、97〜104頁(2003年)
【非特許文献3】Lu-Fang Ma, Xiu-Qin Li, Qing-Lei Meng, Li-Ya Wang, Miao Du, andHong-Wei Hou、Crystal Growth and Design、第11巻、175〜184頁(2011年)
【発明の概要】
【発明が解決しようとする課題】
【0009】
したがって、本発明の目的は、従来材料よりも二酸化炭素を選択的に吸着する金属錯体を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは鋭意検討し、構造式内でカルボキシル基が互いに120°の位置にあるジカルボン酸化合物と、マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属と、該金属に二座配位可能な有機配位子とを、水を含む溶媒中で反応させることによって合成される、擬ダイヤモンド骨格が相互貫入した構造を持つ金属錯体により、上記目的を達成することができることを見出し、本発明に至った。即ち本発明は以下の[1]〜[12]に関する。
[1]下記一般式(I);
【0011】
【化1】

【0012】
(式中、R1、R2およびR3はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基およびハロゲン原子のいずれかを示し、Xは水素原子、置換基を有してもよい炭素数1〜4のアルキル基、炭素数2〜4のアルケニル基、炭素数1〜4のアルコキシ基、水酸基およびアミノ基のいずれかを示す)で表されるジカルボン酸化合物(I)と、
マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属のイオンと、
下記一般式(II);
【0013】
【化2】

【0014】
(式中、R4、R5、R6、R7、R8、R9、R10およびR11はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基、炭素数1〜4のアルコキシ基、ホルミル基、アシロキシ基、炭素数1〜4のアルコキシカルボニル基、ニトロ基、シアノ基、アミノ基、炭素数1〜4のモノアルキルアミノ基、炭素数1〜4のジアルキルアミノ基、炭素数1〜4のアシルアミノ基またはハロゲン原子のいずれかである。)で表される、前記金属イオンに二座配位可能な有機配位子(II)とからなる擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体。
[2]擬ダイヤモンド骨格の相互貫入が三重である[1]に記載の金属錯体。
[3]前記金属のイオンが亜鉛イオン、マンガンイオン、ニッケルイオンのいずれかである[1]または[2]に記載の金属錯体。
[4]一般式(I)で示されるジカルボン酸化合物(I)が、R1、R2、R3およびXのすべてが水素原子であるイソフタル酸である[1]〜[3]のいずれかに記載の金属錯体。
[5]一般式(II)で示される有機配位子(II)が、R4、R5、R6、R7、R8、R9、R10およびR11のすべてが水素原子である1,2−ジ(4−ピリジル)エチレンである[1]〜[4]のいずれかに記載の金属錯体。
[6]ジカルボン酸化合物(I)と、周期表の2族および7〜13族に属する金属の塩から選択される少なくとも1種の金属塩と、該金属イオンに二座配位可能な有機配位子(II)とを、水を20〜80質量%含む混合溶媒中で反応させ、析出させることを特徴とする[1]〜[5]のいずれかに記載の金属錯体の製造方法。
[7]前記混合溶媒が非プロトン性極性溶媒と水との混合溶媒である[6]に記載の金属錯体の製造方法。
[8]前記非プロトン性極性溶媒がN,N−ジメチルホルムアミドである[7]に記載の金属錯体の製造方法。
[9] [1]〜[5]のいずれかに記載の金属錯体からなる分離材。
[10]水素ガス、一酸化炭素、酸素ガス、窒素ガス、炭素数1〜4の炭化水素、希ガス、硫化水素、アンモニア、硫黄酸化物、窒素酸化物、シロキサン、水蒸気または有機蒸気中から二酸化炭素を選択的に吸着する[9]に記載の分離材。
[11]該分離材が、エチレンまたはエタンの中から二酸化炭素を選択的に吸着するための分離材である[10]に記載の分離材。
[12] [9]に記載の分離材を用いることを特徴とするエチレンまたはエタンの中からの二酸化炭素の分離方法。
【発明の効果】
【0015】
本発明により、擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体を提供することができる。
【0016】
本発明の金属錯体は、各種ガスの分離性能に優れているので、水素ガス、一酸化炭素、酸素ガス、窒素ガス、炭素数1〜4の炭化水素、希ガス、硫化水素、アンモニア、硫黄酸化物、窒素酸化物、シロキサン、水蒸気などから二酸化炭素を分離・除去するための分離材として使用することができる。
【図面の簡単な説明】
【0017】
【図1】擬ダイヤモンド型骨格の構造を示す図である。
【図2】擬ダイヤモンド骨格が三重に相互貫入した三次元構造の模式図である。
【図3】単結晶X線構造解析に基づく、実施例1で得られた金属錯体の結晶のORTEP図である。
【図4】単結晶X線構造解析に基づく、実施例1で得られた金属錯体の結晶の構造図である。
【図5】実施例1の結果から想定される金属錯体の粉末X線回折パターンシミュレーションと実施例2の金属錯体の粉末X線回折パターンの比較図である。
【図6】比較例1および実施例2の金属錯体の粉末X線回折パターンの比較図である。
【図7】比較例2の金属錯体の粉末X線回折パターンとシミュレーションとの比較図である。
【図8】比較例3の金属錯体の粉末X線回折パターンとシミュレーションとの比較図である。
【図9】実施例2の金属錯体の、40℃における二酸化炭素およびエチレンの吸脱着等温線である。
【図10】比較例2の金属錯体の、0℃における二酸化炭素およびエチレンの吸脱着等温線である。
【図11】比較例3の金属錯体の、0℃における二酸化炭素およびエチレンの吸脱着等温線である。
【図12】実施例1の金属錯体の、40℃における二酸化炭素およびエタンの吸脱着等温線である。
【図13】比較例2の金属錯体の、0℃における二酸化炭素およびエタンの吸脱着等温線である。
【図14】比較例3の金属錯体の、0℃における二酸化炭素およびエタンの吸脱着等温線である。
【発明を実施するための形態】
【0018】
<金属錯体>
本発明の金属錯体は、ジカルボン酸化合物(I)と、特定の金属イオンと、該金属イオンに二座配位可能な有機配位子(II)とからなる。
【0019】
金属錯体は、ジカルボン酸化合物(I)と、マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属の塩から選択される少なくとも1種の金属塩と、該金属イオンに二座配位可能な有機配位子(II)とを、常圧下、溶媒中で数時間から数日間反応させ、析出させて製造することができる。例えば、前記金属塩の水溶液または水を含む有機溶媒溶液と、ジカルボン酸化合物(I)および二座配位可能な有機配位子(II)を含有する有機溶媒溶液とを、常圧下で混合して反応させることにより本発明の金属錯体を得ることができる。
【0020】
<ジカルボン酸化合物(I)>
本発明に用いられるジカルボン酸化合物(I)は下記一般式(I);
【0021】
【化3】

【0022】
(式中、R1、R2およびR3はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基およびハロゲン原子のいずれかを示し、Xは水素原子、置換基を有してもよい炭素数1〜4のアルキル基、炭素数2〜4のアルケニル基、炭素数1〜4のアルコキシ基、水酸基およびアミノ基のいずれかを示す)で表される。
【0023】
R1、R2およびR3はそれぞれ独立に水素原子、置換基を有していてもよい炭素数1〜4のアルキル基およびハロゲン原子のいずれかを示す。
【0024】
炭素数1〜4のアルキル基としてはメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基などの直鎖または分岐を有するアルキル基が挙げられる。
【0025】
該アルキル基等が有していてもよい置換基の例としては、アルコキシ基(メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基など)、アミノ基、モノアルキルアミノ基(メチルアミノ基など)、ジアルキルアミノ基(ジメチルアミノ基など)、ホルミル基、エポキシ基、アシロキシ基(アセトキシ基、n−プロパノイルオキシ基、n−ブタノイルオキシ基、ピバロイルオキシ基、ベンゾイルオキシ基など)、アルコキシカルボニル基(メトキシカルボニル基、エトキシカルボニル基、n−ブトキシカルボニル基など)、カルボン酸無水物基(−CO−O−CO−R基)(Rは炭素数1〜4のアルキル基である)などが挙げられる。アルキル基の置換基の数は、1〜3個が好ましく、1個がより好ましい。
【0026】
ハロゲン原子としてはフッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられる。
【0027】
R1、R2およびR3は水素原子または置換基のない炭素数1〜4のアルキル基が好ましく、すべて水素原子であることがより好ましい。
【0028】
Xは水素原子、置換基を有してもよい炭素数1〜4のアルキル基、炭素数2〜4のアルケニル基、炭素数1〜4のアルコキシ基、水酸基およびアミノ基のいずれかである。本発明の金属錯体が擬ダイヤモンド骨格が相互貫入した構造を有し、かつ二酸化炭素を選択的に吸着する分離材として機能するためにはXがハロゲン原子であってはならない。Xとしては水素原子、置換基のない炭素数1〜4のアルキル基が好ましい。
【0029】
炭素数1〜4のアルキル基としてはメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基などの直鎖または分岐を有するアルキル基が挙げられる。
【0030】
該アルキル基等が有していてもよい置換基の例としては、アルコキシ基(メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基など)、アミノ基、モノアルキルアミノ基(メチルアミノ基など)、ジアルキルアミノ基(ジメチルアミノ基など)、ホルミル基、エポキシ基、アシロキシ基(アセトキシ基、n−プロパノイルオキシ基、n−ブタノイルオキシ基、ピバロイルオキシ基、ベンゾイルオキシ基など)、アルコキシカルボニル基(メトキシカルボニル基、エトキシカルボニル基、n−ブトキシカルボニル基など)、カルボン酸無水物基(−CO−O−CO−R基)(Rは炭素数1〜4のアルキル基である)などが挙げられる。アルキル基の置換基の数は、1〜3個が好ましく、1個がより好ましい。
【0031】
炭素数2〜4のアルケニル基としてはビニル基、アリル基、1−プロペニル基、ブテニル基が挙げられる。
【0032】
炭素数1〜4のアルコキシ基としてはメトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基が挙げられる。
【0033】
ジカルボン酸化合物(I)としては、R1、R2、R3およびXのすべてが水素原子であるイソフタル酸が好ましい。
【0034】
<金属イオン>
本発明の金属錯体を構成する金属のイオンはマグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属のイオンである。これらの中でもガス吸着性能の面から亜鉛イオン、マンガンイオン、ニッケルイオンが好ましく、亜鉛イオンがより好ましい。
【0035】
本発明金属錯体を製造する際には前記金属の塩を用いることができる。金属塩は単一の金属塩を使用することが好ましいが、2種以上の金属塩を混合して用いてもよい。これらの金属塩としては、酢酸塩、ギ酸塩などの有機酸塩、塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、炭酸塩などの無機酸塩を使用することができる。
【0036】
<二座配位可能な有機配位子(II)>
本発明に用いられる金属イオンに二座配位可能な有機配位子(II)は下記一般式(II)で表される。
【0037】
【化4】

【0038】
(式中、R4、R5、R6、R7、R8、R9、R10およびR11はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基、炭素数1〜4のアルコキシ基、ホルミル基、アシロキシ基、炭素数1〜4のアルコキシカルボニル基、ニトロ基、シアノ基、アミノ基、炭素数1〜4のモノアルキルアミノ基、炭素数1〜4のジアルキルアミノ基、炭素数1〜4のアシルアミノ基またはハロゲン原子のいずれかである。)
【0039】
炭素数1〜4のアルキル基の例としては、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基などの直鎖または分岐を有するアルキル基が挙げられる。また、該アルキル基が有していてもよい置換基の例としては、アルコキシ基(メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基など)、アミノ基、モノアルキルアミノ基(メチルアミノ基など)、ジアルキルアミノ基(ジメチルアミノ基など)、ホルミル基、エポキシ基、アシロキシ基(アセトキシ基、n−プロパノイルオキシ基、n−ブタノイルオキシ基、ピバロイルオキシ基、ベンゾイルオキシ基など)、アルコキシカルボニル基(メトキシカルボニル基、エトキシカルボニル基、n−ブトキシカルボニル基など)、カルボン酸無水物基(−CO−O−CO−R基)(Rは炭素数1〜4のアルキル基である)などが挙げられる。アルキル基の置換基の数は、1〜3個が好ましく、1個がより好ましい。
【0040】
炭素数1〜4のアルコキシ基の例としては、メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基が挙げられる。
【0041】
アシロキシ基の例としては、アセトキシ基、n−プロパノイルオキシ基、n−ブタノイルオキシ基、ピバロイルオキシ基、ベンゾイルオキシ基が挙げられる。
【0042】
炭素数1〜4のアルコキシカルボニル基の例としては、メトキシカルボニル基、エトキシカルボニル基、n−ブトキシカルボニル基が挙げられる。
【0043】
炭素数1〜4のモノアルキルアミノ基の例としてはメチルアミノ基が挙げられる。炭素数1〜4のジアルキルアミノ基の例としては、ジメチルアミノ基が挙げられる。炭素数1〜4のアシルアミノ基の例としては、アセチルアミノ基が挙げられる。
【0044】
ハロゲン原子としてはフッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられる。
【0045】
R4、R5、R6、R7、R8、R9、R10およびR11としては水素原子、置換基のない炭素数1〜4のアルキル基がガス吸着量の面で好ましく、すべてが水素原子であることがより好ましい。
【0046】
二座配位可能な有機配位子(II)としては、1,2−ジ(4−ピリジル)エチレンが好ましい。ここで、二座配位可能な有機配位子とは非共有電子対で金属に対して配位する部位を2箇所持つ配位子を意味する。
【0047】
<製造方法>
本発明の擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体は、ジカルボン酸化合物(I)と、マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属の塩から選択される少なくとも1種の金属塩と、該金属イオンに二座配位可能な有機配位子(II)とを、常圧下、溶媒中で数時間から数日間反応させ、結晶を析出させて製造することができる。
【0048】
金属錯体を製造するときのジカルボン酸化合物(I)と二座配位可能な有機配位子(II)との混合比率は、ジカルボン酸化合物(I):二座配位可能な有機配位子(II)=1:5〜8:1のモル比の範囲内が好ましく、1:3〜6:1のモル比の範囲内がより好ましい。これ以外の範囲で反応を行っても目的とする金属錯体は得られるが、収率が低下し、副反応も増えるために好ましくない。
【0049】
金属錯体を製造するときの金属塩と二座配位可能な有機配位子(II)の混合比率は、金属塩:二座配位可能な有機配位子(II)=3:1〜1:3のモル比の範囲内が好ましく、2:1〜1:2のモル比の範囲内がより好ましい。これ以外の範囲では目的とする金属錯体の収率が低下し、また、未反応の原料が残留して得られた金属錯体の精製が困難になる。
【0050】
金属錯体を製造するための溶液におけるジカルボン酸化合物(I)のモル濃度は、0.005〜5.0mol/Lが好ましく、0.01〜2.0mol/Lがより好ましい。これより低い濃度で反応を行っても目的とする金属錯体は得られるが、収率が低下するため好ましくない。また、これより高い濃度では溶解性が低下し、反応が円滑に進行しない。
【0051】
金属錯体を製造するための溶液における金属塩のモル濃度は、0.005〜5.0mol/Lが好ましく、0.01〜2.0mol/Lがより好ましい。これより低い濃度で反応を行っても目的とする金属錯体は得られるが、収率が低下するため好ましくない。また、これより高い濃度では未反応の金属塩が残留し、得られた金属錯体の精製が困難になる。
【0052】
金属錯体を製造するための溶液における二座配位可能な有機配位子(II)のモル濃度は、0.001〜5.0mol/Lが好ましく、0.005〜2.0mol/Lがより好ましい。これより低い濃度で反応を行っても目的とする金属錯体は得られるが、収率が低下するため好ましくない。また、これより高い濃度では溶解性が低下し、反応が円滑に進行しない。
【0053】
<溶媒>
金属錯体の製造に用いる溶媒としては、有機溶媒、水またはそれらの混合溶媒を使用することができる。具体的には、メタノール、エタノール、プロパノール、ジエチルエーテル、ジメトキシエタン、テトラヒドロフラン、ヘキサン、シクロヘキサン、ヘプタン、ベンゼン、トルエン、塩化メチレン、クロロホルム、アセトン、酢酸エチル、アセトニトリル、N,N−ジメチルホルムアミド、ジメチルスルホオキシド、水またはこれらの混合溶媒を使用することができる。混合溶媒としては水20〜80質量%と有機溶媒との混合溶媒が好ましい。水との混合溶媒に用いる有機溶媒としてはテトラヒドロフラン、アセトン、アセトニトリル、N,N−ジメチルホルムアミド、N,N−ジエチルホルムアミド、ジメチルスルホオキシドなどの非プロトン性極性溶媒が好ましく、なかでも、N,N−ジメチルホルムアミドと水の混合溶媒が好ましい。
【0054】
混合溶媒中の水の濃度は粒子サイズの観点からで20〜80質量%が好ましく、30〜60質量%がより好ましく、40〜55質量%が最も好ましい。反応温度は、−20〜150℃が好ましく、50〜100℃がより好ましい。反応時間は1〜24hrが好ましく、2〜6hrがより好ましい。
【0055】
反応が終了したことはガスクロマトグラフィーまたは高速液体クロマトグラフィーにより原料の残存量を定量することにより確認することができる。反応終了後、得られた混合液を吸引濾過に付して沈殿物を集め、有機溶媒による洗浄後、100℃程度で数時間真空乾燥することにより、本発明の金属錯体を得ることができる。結晶性の高い金属錯体は、純度が高くて吸着性能が良い。結晶性を高めるには、酸または塩基を用いて適切なpHに調整すればよい。
【0056】
<金属錯体の構造>
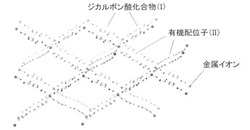
以上のようにして得られる本発明の金属錯体は、1つ金属イオンあたり2つのジカルボン酸化合物(I)のカルボキシラートイオンと2つの二座配位可能な有機配位子(II)が配位して形成される擬ダイヤモンド型骨格が三重に相互貫入した三次元構造を有する。擬ダイヤモンド型骨格の構造を図1に、擬ダイヤモンド骨格が三重に相互貫入した三次元構造の模式図を図2に示す。
【0057】
本発明の金属錯体は、金属イオン:ジカルボン酸化合物(I):有機配位子(II)=1モル:1モル:1モルの比率で存在する。
【0058】
本明細書において、「擬ダイヤモンド骨格」とは、1つ金属イオンあたり2つのジカルボン酸化合物(I)のカルボキシラートイオンと2つの二座配位可能な有機配位子(II)が配位して形成されるダイヤモンド構造に似た三次元構造と定義する。
【0059】
本明細書において、「擬ダイヤモンド骨格が多重に相互貫入した構造」とは、複数の擬ダイヤモンド骨格が互いの細孔を埋める形で貫入し合った三次元集積構造と定義する。金属錯体が「擬ダイヤモンド骨格が多重に相互貫入した構造を有する」ことは、例えば結晶X線解析、粉末X線結晶構造解析などにより確認できる。
【0060】
本発明の金属錯体における三次元構造は、合成後においても変化できる。その変化に伴って、細孔の構造や大きさも変化する。この構造の変化は、吸着される物質の種類、吸着圧力、吸着温度に依存すると推定される。すなわち、細孔表面と物質の相互作用の差に加え(相互作用の強さは物質のLennard−Jonesポテンシャルの大きさに比例)、吸着する物質により構造変化の程度が異なるため、高い選択性が発現する。本発明では、一般式(I)で表されるジカルボン酸化合物を用いて細孔表面と吸着されるガス分子の相互作用、および相互貫入した擬ダイヤモンド骨格同士の相互作用の強さを制御することで、高いガス分離性能が発現する。吸着された物質が脱着した後は、元の構造に戻るので、細孔の構造も元に戻ると考えられる。
【0061】
本発明の金属錯体は、各種ガスの分離性能に優れているので、二酸化炭素、水素、一酸化炭素、酸素、窒素、硫化水素、アンモニア、硫黄酸化物、窒素酸化物、炭素数1〜4の炭化水素(メタン、エタン、エチレン、アセチレンなど)、希ガス(ヘリウム、ネオン、アルゴン、クリプトン、キセノンなど)、シロキサン(ヘキサメチルシクロトリシロキサン、オクタメチルシクロテトラシロキサンなど)、水蒸気または有機蒸気などを分離するための分離材としても好ましく、特に、エチレン中の二酸化炭素、エタン中の二酸化炭素を、圧力スイング吸着法や温度スイング吸着法により分離するのに適している。ここで有機蒸気とは、常温、常圧で液体状の有機物質の気化ガスを意味する。このような有機物質としては、メタノール、エタノールなどのアルコール類;トリメチルアミンなどのアミン類;アセトアルデヒドなどのアルデヒド類;炭素数5〜16の脂肪族炭化水素;ベンゼン、トルエンなどの芳香族炭化水素;アセトン、メチルエチルケトンなどのケトン類;塩化メチル、クロロホルムなどのハロゲン化炭化水素などが挙げられる。
【実施例】
【0062】
以下、本発明を実施例によって具体的に説明するが、本発明はこれらに限定されるものではない。実施例および比較例における分析および評価は次のようにして行った。
【0063】
(1)単結晶X線結晶構造解析
得られた単結晶をゴニオヘッドにマウントし、単結晶X線回折装置(ブルカー・エイエックスエス株式会社製SMART APEX II Ultra)を用いて測定した。X線としてはMoのKα線(λ=0.71073)を用い、2θ=52°までの反射を用いた。反射強度はSADABSプログラムを用いて補正した。構造は プログラム:SHELXS−97による直接法により決定し、プログラム:SHELXL−97により最適化した。水素以外の原子は異方的に最適化し、水素原子はAFIX Instructionを用いて配置した。
【0064】
(2)粉末X線回折パターンの測定
株式会社リガク製のX線回折装置:マルチフレックスおよびブルカー・エイエックスエス株式会社製のX線回折装置:NEW D8 ADVANCEを用いて、回折角(2θ)=3〜50°の範囲を走査速度3°/分で走査し、対称反射法で測定した。
【0065】
(3)吸脱着等温線の測定
ガス吸着量測定装置(日本ベル株式会社製BELSORP−HP)を用いて容量法(平衡待ち時間:500秒)で測定を行った。このとき、測定に先立って試料を150℃、50Paで6時間以上乾燥し、吸着水などを除去した。
【0066】
<実施例1>
[Zn(ip)(dpe)]の単結晶合成:
1.5mlのバイアル瓶に硝酸亜鉛六水和物のN,N−ジメチルホルムアミド(DMF)溶液(0.1M、0.2ml)、イソフタル酸(「ip」と略すことがある)のDMF溶液(0.1M、0.2ml)、1,2−ジ(4−ピリジル)エチレン(「dpe」と略すことがある)のDMF溶液(0.1M、0.2ml)、水0.5mlを加えた。得られた溶液を80℃のオイルバスで72時間加熱した。室温まで冷却した後、析出した結晶を取り出し、0℃において、単結晶X線構造解析を実施した。単結晶X線構造解析を行った結果を図3、図4および表1に示す。構造解析の結果、本金属錯体が、亜鉛イオン:イソフタル酸:1,2−ジ(4−ピリジル)エチレン=1:1:1の組成であり、かつ、擬ダイヤモンド骨格が三重に相互貫入した構造を有することがわかった。
【0067】
【表1】

【0068】
<実施例2>
[Zn(ip)(dpe)]の合成:
300mLナスフラスコに硝酸亜鉛六水和物0.581 g(1.95 mmol)、イソフタル酸0.333 g(2.00 mmol)、1,2−ジ(4−ピリジル)エチレン0.368 g(2.00 mmol)、DMF60ml、水50 ml(=水53質量%)を加えた。得られた溶液を80℃で16時間加熱攪拌した。室温まで冷却した後、析出した固体を吸引ろ過し、DMF、メタノールで洗浄し、80℃で真空乾燥した。目的の金属錯体0.1870g(収率:23%)を得た。実施例1の単結晶構造解析の結果から推測される粉末X線回折パターンと、得られた金属錯体の粉末X線回折パターンとの比較を図5に示す。図5より、得られた固体が実施例1で示した擬ダイヤモンド骨格が三重に相互貫入した構造を有する金属錯体であることがわかる。
【0069】
<比較例1>
[Zn(ip)(dpe)]の合成:
100mLナスフラスコに硝酸亜鉛六水和物1.48g(4.98 mmol)、イソフタル酸0.839g(5.05 mmol)、1,2−ジ(4−ピリジル)エチレン0.922g(5.06mmol)、DMF100 mlを加えた。得られた溶液を120℃のオイルバスで6時間加熱攪拌した。室温まで冷却した後、析出した固体を吸引ろ過し、DMF、メタノールで洗浄した。金属錯体を2.0g(収率:90%)得た。比較例1と実施例2で得られた金属錯体の粉末X線回折パターンを図6に示す。
図6より、実施例2と比較例1の回折パターンが一致しないことから、実施例1の錯体の合成には、溶媒中に水が必要であることがわかる。
【0070】
<比較例2>
[Zn(ip)(bpy)]の合成:
100mLナスフラスコに硝酸亜鉛六水和物0.297g(1.00 mmol)、イソフタル酸0.160g(0.96 mmol)、4,4’−ビピリジン(「bpy」と略す)0.160g(1.02mmol)、DMF20 mlを加えた。得られた溶液を120℃のオイルバスで6時間加熱攪拌した。室温まで冷却した後、析出した固体を吸引ろ過し、DMF、メタノールで洗浄した。金属錯体を0.326 g(収率:75%)得た。インターデジテイト型の単結晶構造を仮定して、シミュレーションした粉末X線回折パターンと、得られた金属錯体の粉末X線回折パターンとの比較を図7に示す。図7より、得られた固体が特許文献1に記載されているインターデジテイト型の集積構造を有する金属錯体であることがわかる。
【0071】
<比較例3>
[Zn(Brip)(dpe)]の合成:
100ml水熱容器に5−ブロモイソフタル酸0.1479g(0.60mmol)、01M水酸化カリウム水溶液6mlを入れ、配位子を溶解させた。さらに、酢酸亜鉛二水和物0.1324g(0.60mmol)の水溶液10ml、1,2−ジ(4−ピリジル)エチレン0.0546g(0.30mmol)、水29mlを加えた。150℃で72時間加熱した後、毎時5℃の冷却速度で室温まで冷却した。得られた白色固体を桐山漏斗を用いてろ過し、エタノールで洗浄し、目的とする化合物を0.1323g(収率:90%)得た。擬ダイヤモンド骨格が三重に相互貫入した構造をとると仮定した単結晶構造から予測される粉末X線回折パターンと、得られた金属錯体の粉末X線回折パターンとの比較を図8に示す。図8より、得られた固体が特許文献1に記載されている擬ダイヤモンド骨格が三重に相互貫入した構造を有する金属錯体であることがわかる。
【0072】
<吸着等温線>
実施例2で得た金属錯体について、40℃における二酸化炭素およびエチレンの吸脱着等温線を測定した。結果を図9に示す。
【0073】
比較例2で得た金属錯体について、0℃における二酸化炭素およびエチレンの吸脱着等温線を測定した。結果を図10に示す。
【0074】
比較例3で得た金属錯体について、0℃における二酸化炭素およびエチレンの吸脱着等温線を測定した。結果を図11に示す。
【0075】
図9、図10および図11の比較より、本発明の擬ダイヤモンド骨格をもつ金属錯体はエチレンに対して二酸化炭素を選択的に吸着するので、二酸化炭素とエチレンの分離材として優れていることは明らかである。
【0076】
実施例2で得た金属錯体について、40℃における二酸化炭素およびエタンの吸脱着等温線を測定した。結果を図12に示す。
【0077】
比較例2で得た金属錯体について、0℃における二酸化炭素およびエタンの吸脱着等温線を測定した。結果を図13に示す。
【0078】
比較例3で得た金属錯体について、0℃における二酸化炭素およびエタンの吸脱着等温線を測定した。結果を図14に示す。
【0079】
図12、図13および図14の比較より、擬ダイヤモンド骨格をもつ本発明の金属錯体はエタンに対して二酸化炭素を選択的に吸着するので、二酸化炭素とエタンの分離材として優れていることが明らかである。
【技術分野】
【0001】
本発明は種々の気体中から特定の成分を選択的に吸着、脱着を行う為の分離材として使用可能な金属錯体およびその製造方法に関する。
【背景技術】
【0002】
酸化反応プロセスを用いた製品製造において、原料の燃焼による炭酸ガス(二酸化炭素)の副生は避けられない。副生した炭酸ガスを反応系中から除去する方法として、熱炭酸カリ法、アミン法などの吸収法が用いられている。しかし、これら吸収法は、再生の際に多量の熱エネルギーを必要とするため、非効率である。
【0003】
吸収法の代わりに、高効率の圧力スイング吸着法(PSA法)プロセスを導入すれば、炭酸ガス除去剤の再生に必要な熱エネルギーを削減することが可能となり、プロセスのさらなる省エネルギー化が期待される。しかしながら、ゼオライトに代表される既存の吸着剤では、炭酸ガスと炭化水素の分離係数が小さく、PSA法に用いる吸着剤としては不十分である。
【0004】
一方、より優れた分離性能を与える多孔性材料として、外部刺激により動的構造変化を生じる多孔性金属錯体が開発されている(非特許文献1、非特許文献2参照)。この新規な構造変化しうる多孔性金属錯体をガス分離材として使用した場合、既存の分離材よりも優れた分離性能を発現し、高効率な炭酸ガス除去システムの構築が可能となる。
【0005】
動的構造変化高分子金属錯体を吸蔵材や分離材に適用した例として、インターデジテイト型(二次元シート型)の集積構造を有する金属錯体(特許文献1、特許文献2参照)などが報告されている。しかしながら、インターデジテイト型の集積構造を有する金属錯体について、本発明者らが室温付近における各ガスの平衡吸着量を測定したところ、二酸化炭素、エチレン、エタンの吸着量に大きな差はなく、エチレン、エタンと二酸化炭素との分離は困難であることが判明した。
【0006】
また、5−ブロモイソフタル酸と亜鉛イオンと1,2−ジ(4−ピリジル)エチレンからなる高分子金属錯体が構造とともに報告されている(非特許文献3参照)。しかしながら、ガスの吸着挙動については何ら言及されていない。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2010−158617公報
【特許文献2】特開2010−180202公報
【非特許文献】
【0008】
【非特許文献1】植村一広、北川進、未来材料、第2巻、44〜51頁(2002年)
【非特許文献2】松田亮太郎、北川進、ペトロテック、第26巻、97〜104頁(2003年)
【非特許文献3】Lu-Fang Ma, Xiu-Qin Li, Qing-Lei Meng, Li-Ya Wang, Miao Du, andHong-Wei Hou、Crystal Growth and Design、第11巻、175〜184頁(2011年)
【発明の概要】
【発明が解決しようとする課題】
【0009】
したがって、本発明の目的は、従来材料よりも二酸化炭素を選択的に吸着する金属錯体を提供することにある。
【課題を解決するための手段】
【0010】
本発明者らは鋭意検討し、構造式内でカルボキシル基が互いに120°の位置にあるジカルボン酸化合物と、マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属と、該金属に二座配位可能な有機配位子とを、水を含む溶媒中で反応させることによって合成される、擬ダイヤモンド骨格が相互貫入した構造を持つ金属錯体により、上記目的を達成することができることを見出し、本発明に至った。即ち本発明は以下の[1]〜[12]に関する。
[1]下記一般式(I);
【0011】
【化1】

【0012】
(式中、R1、R2およびR3はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基およびハロゲン原子のいずれかを示し、Xは水素原子、置換基を有してもよい炭素数1〜4のアルキル基、炭素数2〜4のアルケニル基、炭素数1〜4のアルコキシ基、水酸基およびアミノ基のいずれかを示す)で表されるジカルボン酸化合物(I)と、
マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属のイオンと、
下記一般式(II);
【0013】
【化2】

【0014】
(式中、R4、R5、R6、R7、R8、R9、R10およびR11はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基、炭素数1〜4のアルコキシ基、ホルミル基、アシロキシ基、炭素数1〜4のアルコキシカルボニル基、ニトロ基、シアノ基、アミノ基、炭素数1〜4のモノアルキルアミノ基、炭素数1〜4のジアルキルアミノ基、炭素数1〜4のアシルアミノ基またはハロゲン原子のいずれかである。)で表される、前記金属イオンに二座配位可能な有機配位子(II)とからなる擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体。
[2]擬ダイヤモンド骨格の相互貫入が三重である[1]に記載の金属錯体。
[3]前記金属のイオンが亜鉛イオン、マンガンイオン、ニッケルイオンのいずれかである[1]または[2]に記載の金属錯体。
[4]一般式(I)で示されるジカルボン酸化合物(I)が、R1、R2、R3およびXのすべてが水素原子であるイソフタル酸である[1]〜[3]のいずれかに記載の金属錯体。
[5]一般式(II)で示される有機配位子(II)が、R4、R5、R6、R7、R8、R9、R10およびR11のすべてが水素原子である1,2−ジ(4−ピリジル)エチレンである[1]〜[4]のいずれかに記載の金属錯体。
[6]ジカルボン酸化合物(I)と、周期表の2族および7〜13族に属する金属の塩から選択される少なくとも1種の金属塩と、該金属イオンに二座配位可能な有機配位子(II)とを、水を20〜80質量%含む混合溶媒中で反応させ、析出させることを特徴とする[1]〜[5]のいずれかに記載の金属錯体の製造方法。
[7]前記混合溶媒が非プロトン性極性溶媒と水との混合溶媒である[6]に記載の金属錯体の製造方法。
[8]前記非プロトン性極性溶媒がN,N−ジメチルホルムアミドである[7]に記載の金属錯体の製造方法。
[9] [1]〜[5]のいずれかに記載の金属錯体からなる分離材。
[10]水素ガス、一酸化炭素、酸素ガス、窒素ガス、炭素数1〜4の炭化水素、希ガス、硫化水素、アンモニア、硫黄酸化物、窒素酸化物、シロキサン、水蒸気または有機蒸気中から二酸化炭素を選択的に吸着する[9]に記載の分離材。
[11]該分離材が、エチレンまたはエタンの中から二酸化炭素を選択的に吸着するための分離材である[10]に記載の分離材。
[12] [9]に記載の分離材を用いることを特徴とするエチレンまたはエタンの中からの二酸化炭素の分離方法。
【発明の効果】
【0015】
本発明により、擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体を提供することができる。
【0016】
本発明の金属錯体は、各種ガスの分離性能に優れているので、水素ガス、一酸化炭素、酸素ガス、窒素ガス、炭素数1〜4の炭化水素、希ガス、硫化水素、アンモニア、硫黄酸化物、窒素酸化物、シロキサン、水蒸気などから二酸化炭素を分離・除去するための分離材として使用することができる。
【図面の簡単な説明】
【0017】
【図1】擬ダイヤモンド型骨格の構造を示す図である。
【図2】擬ダイヤモンド骨格が三重に相互貫入した三次元構造の模式図である。
【図3】単結晶X線構造解析に基づく、実施例1で得られた金属錯体の結晶のORTEP図である。
【図4】単結晶X線構造解析に基づく、実施例1で得られた金属錯体の結晶の構造図である。
【図5】実施例1の結果から想定される金属錯体の粉末X線回折パターンシミュレーションと実施例2の金属錯体の粉末X線回折パターンの比較図である。
【図6】比較例1および実施例2の金属錯体の粉末X線回折パターンの比較図である。
【図7】比較例2の金属錯体の粉末X線回折パターンとシミュレーションとの比較図である。
【図8】比較例3の金属錯体の粉末X線回折パターンとシミュレーションとの比較図である。
【図9】実施例2の金属錯体の、40℃における二酸化炭素およびエチレンの吸脱着等温線である。
【図10】比較例2の金属錯体の、0℃における二酸化炭素およびエチレンの吸脱着等温線である。
【図11】比較例3の金属錯体の、0℃における二酸化炭素およびエチレンの吸脱着等温線である。
【図12】実施例1の金属錯体の、40℃における二酸化炭素およびエタンの吸脱着等温線である。
【図13】比較例2の金属錯体の、0℃における二酸化炭素およびエタンの吸脱着等温線である。
【図14】比較例3の金属錯体の、0℃における二酸化炭素およびエタンの吸脱着等温線である。
【発明を実施するための形態】
【0018】
<金属錯体>
本発明の金属錯体は、ジカルボン酸化合物(I)と、特定の金属イオンと、該金属イオンに二座配位可能な有機配位子(II)とからなる。
【0019】
金属錯体は、ジカルボン酸化合物(I)と、マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属の塩から選択される少なくとも1種の金属塩と、該金属イオンに二座配位可能な有機配位子(II)とを、常圧下、溶媒中で数時間から数日間反応させ、析出させて製造することができる。例えば、前記金属塩の水溶液または水を含む有機溶媒溶液と、ジカルボン酸化合物(I)および二座配位可能な有機配位子(II)を含有する有機溶媒溶液とを、常圧下で混合して反応させることにより本発明の金属錯体を得ることができる。
【0020】
<ジカルボン酸化合物(I)>
本発明に用いられるジカルボン酸化合物(I)は下記一般式(I);
【0021】
【化3】

【0022】
(式中、R1、R2およびR3はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基およびハロゲン原子のいずれかを示し、Xは水素原子、置換基を有してもよい炭素数1〜4のアルキル基、炭素数2〜4のアルケニル基、炭素数1〜4のアルコキシ基、水酸基およびアミノ基のいずれかを示す)で表される。
【0023】
R1、R2およびR3はそれぞれ独立に水素原子、置換基を有していてもよい炭素数1〜4のアルキル基およびハロゲン原子のいずれかを示す。
【0024】
炭素数1〜4のアルキル基としてはメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基などの直鎖または分岐を有するアルキル基が挙げられる。
【0025】
該アルキル基等が有していてもよい置換基の例としては、アルコキシ基(メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基など)、アミノ基、モノアルキルアミノ基(メチルアミノ基など)、ジアルキルアミノ基(ジメチルアミノ基など)、ホルミル基、エポキシ基、アシロキシ基(アセトキシ基、n−プロパノイルオキシ基、n−ブタノイルオキシ基、ピバロイルオキシ基、ベンゾイルオキシ基など)、アルコキシカルボニル基(メトキシカルボニル基、エトキシカルボニル基、n−ブトキシカルボニル基など)、カルボン酸無水物基(−CO−O−CO−R基)(Rは炭素数1〜4のアルキル基である)などが挙げられる。アルキル基の置換基の数は、1〜3個が好ましく、1個がより好ましい。
【0026】
ハロゲン原子としてはフッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられる。
【0027】
R1、R2およびR3は水素原子または置換基のない炭素数1〜4のアルキル基が好ましく、すべて水素原子であることがより好ましい。
【0028】
Xは水素原子、置換基を有してもよい炭素数1〜4のアルキル基、炭素数2〜4のアルケニル基、炭素数1〜4のアルコキシ基、水酸基およびアミノ基のいずれかである。本発明の金属錯体が擬ダイヤモンド骨格が相互貫入した構造を有し、かつ二酸化炭素を選択的に吸着する分離材として機能するためにはXがハロゲン原子であってはならない。Xとしては水素原子、置換基のない炭素数1〜4のアルキル基が好ましい。
【0029】
炭素数1〜4のアルキル基としてはメチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基などの直鎖または分岐を有するアルキル基が挙げられる。
【0030】
該アルキル基等が有していてもよい置換基の例としては、アルコキシ基(メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基など)、アミノ基、モノアルキルアミノ基(メチルアミノ基など)、ジアルキルアミノ基(ジメチルアミノ基など)、ホルミル基、エポキシ基、アシロキシ基(アセトキシ基、n−プロパノイルオキシ基、n−ブタノイルオキシ基、ピバロイルオキシ基、ベンゾイルオキシ基など)、アルコキシカルボニル基(メトキシカルボニル基、エトキシカルボニル基、n−ブトキシカルボニル基など)、カルボン酸無水物基(−CO−O−CO−R基)(Rは炭素数1〜4のアルキル基である)などが挙げられる。アルキル基の置換基の数は、1〜3個が好ましく、1個がより好ましい。
【0031】
炭素数2〜4のアルケニル基としてはビニル基、アリル基、1−プロペニル基、ブテニル基が挙げられる。
【0032】
炭素数1〜4のアルコキシ基としてはメトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基が挙げられる。
【0033】
ジカルボン酸化合物(I)としては、R1、R2、R3およびXのすべてが水素原子であるイソフタル酸が好ましい。
【0034】
<金属イオン>
本発明の金属錯体を構成する金属のイオンはマグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属のイオンである。これらの中でもガス吸着性能の面から亜鉛イオン、マンガンイオン、ニッケルイオンが好ましく、亜鉛イオンがより好ましい。
【0035】
本発明金属錯体を製造する際には前記金属の塩を用いることができる。金属塩は単一の金属塩を使用することが好ましいが、2種以上の金属塩を混合して用いてもよい。これらの金属塩としては、酢酸塩、ギ酸塩などの有機酸塩、塩酸塩、臭化水素酸塩、硫酸塩、硝酸塩、炭酸塩などの無機酸塩を使用することができる。
【0036】
<二座配位可能な有機配位子(II)>
本発明に用いられる金属イオンに二座配位可能な有機配位子(II)は下記一般式(II)で表される。
【0037】
【化4】

【0038】
(式中、R4、R5、R6、R7、R8、R9、R10およびR11はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基、炭素数1〜4のアルコキシ基、ホルミル基、アシロキシ基、炭素数1〜4のアルコキシカルボニル基、ニトロ基、シアノ基、アミノ基、炭素数1〜4のモノアルキルアミノ基、炭素数1〜4のジアルキルアミノ基、炭素数1〜4のアシルアミノ基またはハロゲン原子のいずれかである。)
【0039】
炭素数1〜4のアルキル基の例としては、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、tert−ブチル基などの直鎖または分岐を有するアルキル基が挙げられる。また、該アルキル基が有していてもよい置換基の例としては、アルコキシ基(メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基など)、アミノ基、モノアルキルアミノ基(メチルアミノ基など)、ジアルキルアミノ基(ジメチルアミノ基など)、ホルミル基、エポキシ基、アシロキシ基(アセトキシ基、n−プロパノイルオキシ基、n−ブタノイルオキシ基、ピバロイルオキシ基、ベンゾイルオキシ基など)、アルコキシカルボニル基(メトキシカルボニル基、エトキシカルボニル基、n−ブトキシカルボニル基など)、カルボン酸無水物基(−CO−O−CO−R基)(Rは炭素数1〜4のアルキル基である)などが挙げられる。アルキル基の置換基の数は、1〜3個が好ましく、1個がより好ましい。
【0040】
炭素数1〜4のアルコキシ基の例としては、メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基,n−ブトキシ基、イソブトキシ基、tert−ブトキシ基が挙げられる。
【0041】
アシロキシ基の例としては、アセトキシ基、n−プロパノイルオキシ基、n−ブタノイルオキシ基、ピバロイルオキシ基、ベンゾイルオキシ基が挙げられる。
【0042】
炭素数1〜4のアルコキシカルボニル基の例としては、メトキシカルボニル基、エトキシカルボニル基、n−ブトキシカルボニル基が挙げられる。
【0043】
炭素数1〜4のモノアルキルアミノ基の例としてはメチルアミノ基が挙げられる。炭素数1〜4のジアルキルアミノ基の例としては、ジメチルアミノ基が挙げられる。炭素数1〜4のアシルアミノ基の例としては、アセチルアミノ基が挙げられる。
【0044】
ハロゲン原子としてはフッ素原子、塩素原子、臭素原子、ヨウ素原子が挙げられる。
【0045】
R4、R5、R6、R7、R8、R9、R10およびR11としては水素原子、置換基のない炭素数1〜4のアルキル基がガス吸着量の面で好ましく、すべてが水素原子であることがより好ましい。
【0046】
二座配位可能な有機配位子(II)としては、1,2−ジ(4−ピリジル)エチレンが好ましい。ここで、二座配位可能な有機配位子とは非共有電子対で金属に対して配位する部位を2箇所持つ配位子を意味する。
【0047】
<製造方法>
本発明の擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体は、ジカルボン酸化合物(I)と、マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属の塩から選択される少なくとも1種の金属塩と、該金属イオンに二座配位可能な有機配位子(II)とを、常圧下、溶媒中で数時間から数日間反応させ、結晶を析出させて製造することができる。
【0048】
金属錯体を製造するときのジカルボン酸化合物(I)と二座配位可能な有機配位子(II)との混合比率は、ジカルボン酸化合物(I):二座配位可能な有機配位子(II)=1:5〜8:1のモル比の範囲内が好ましく、1:3〜6:1のモル比の範囲内がより好ましい。これ以外の範囲で反応を行っても目的とする金属錯体は得られるが、収率が低下し、副反応も増えるために好ましくない。
【0049】
金属錯体を製造するときの金属塩と二座配位可能な有機配位子(II)の混合比率は、金属塩:二座配位可能な有機配位子(II)=3:1〜1:3のモル比の範囲内が好ましく、2:1〜1:2のモル比の範囲内がより好ましい。これ以外の範囲では目的とする金属錯体の収率が低下し、また、未反応の原料が残留して得られた金属錯体の精製が困難になる。
【0050】
金属錯体を製造するための溶液におけるジカルボン酸化合物(I)のモル濃度は、0.005〜5.0mol/Lが好ましく、0.01〜2.0mol/Lがより好ましい。これより低い濃度で反応を行っても目的とする金属錯体は得られるが、収率が低下するため好ましくない。また、これより高い濃度では溶解性が低下し、反応が円滑に進行しない。
【0051】
金属錯体を製造するための溶液における金属塩のモル濃度は、0.005〜5.0mol/Lが好ましく、0.01〜2.0mol/Lがより好ましい。これより低い濃度で反応を行っても目的とする金属錯体は得られるが、収率が低下するため好ましくない。また、これより高い濃度では未反応の金属塩が残留し、得られた金属錯体の精製が困難になる。
【0052】
金属錯体を製造するための溶液における二座配位可能な有機配位子(II)のモル濃度は、0.001〜5.0mol/Lが好ましく、0.005〜2.0mol/Lがより好ましい。これより低い濃度で反応を行っても目的とする金属錯体は得られるが、収率が低下するため好ましくない。また、これより高い濃度では溶解性が低下し、反応が円滑に進行しない。
【0053】
<溶媒>
金属錯体の製造に用いる溶媒としては、有機溶媒、水またはそれらの混合溶媒を使用することができる。具体的には、メタノール、エタノール、プロパノール、ジエチルエーテル、ジメトキシエタン、テトラヒドロフラン、ヘキサン、シクロヘキサン、ヘプタン、ベンゼン、トルエン、塩化メチレン、クロロホルム、アセトン、酢酸エチル、アセトニトリル、N,N−ジメチルホルムアミド、ジメチルスルホオキシド、水またはこれらの混合溶媒を使用することができる。混合溶媒としては水20〜80質量%と有機溶媒との混合溶媒が好ましい。水との混合溶媒に用いる有機溶媒としてはテトラヒドロフラン、アセトン、アセトニトリル、N,N−ジメチルホルムアミド、N,N−ジエチルホルムアミド、ジメチルスルホオキシドなどの非プロトン性極性溶媒が好ましく、なかでも、N,N−ジメチルホルムアミドと水の混合溶媒が好ましい。
【0054】
混合溶媒中の水の濃度は粒子サイズの観点からで20〜80質量%が好ましく、30〜60質量%がより好ましく、40〜55質量%が最も好ましい。反応温度は、−20〜150℃が好ましく、50〜100℃がより好ましい。反応時間は1〜24hrが好ましく、2〜6hrがより好ましい。
【0055】
反応が終了したことはガスクロマトグラフィーまたは高速液体クロマトグラフィーにより原料の残存量を定量することにより確認することができる。反応終了後、得られた混合液を吸引濾過に付して沈殿物を集め、有機溶媒による洗浄後、100℃程度で数時間真空乾燥することにより、本発明の金属錯体を得ることができる。結晶性の高い金属錯体は、純度が高くて吸着性能が良い。結晶性を高めるには、酸または塩基を用いて適切なpHに調整すればよい。
【0056】
<金属錯体の構造>
以上のようにして得られる本発明の金属錯体は、1つ金属イオンあたり2つのジカルボン酸化合物(I)のカルボキシラートイオンと2つの二座配位可能な有機配位子(II)が配位して形成される擬ダイヤモンド型骨格が三重に相互貫入した三次元構造を有する。擬ダイヤモンド型骨格の構造を図1に、擬ダイヤモンド骨格が三重に相互貫入した三次元構造の模式図を図2に示す。
【0057】
本発明の金属錯体は、金属イオン:ジカルボン酸化合物(I):有機配位子(II)=1モル:1モル:1モルの比率で存在する。
【0058】
本明細書において、「擬ダイヤモンド骨格」とは、1つ金属イオンあたり2つのジカルボン酸化合物(I)のカルボキシラートイオンと2つの二座配位可能な有機配位子(II)が配位して形成されるダイヤモンド構造に似た三次元構造と定義する。
【0059】
本明細書において、「擬ダイヤモンド骨格が多重に相互貫入した構造」とは、複数の擬ダイヤモンド骨格が互いの細孔を埋める形で貫入し合った三次元集積構造と定義する。金属錯体が「擬ダイヤモンド骨格が多重に相互貫入した構造を有する」ことは、例えば結晶X線解析、粉末X線結晶構造解析などにより確認できる。
【0060】
本発明の金属錯体における三次元構造は、合成後においても変化できる。その変化に伴って、細孔の構造や大きさも変化する。この構造の変化は、吸着される物質の種類、吸着圧力、吸着温度に依存すると推定される。すなわち、細孔表面と物質の相互作用の差に加え(相互作用の強さは物質のLennard−Jonesポテンシャルの大きさに比例)、吸着する物質により構造変化の程度が異なるため、高い選択性が発現する。本発明では、一般式(I)で表されるジカルボン酸化合物を用いて細孔表面と吸着されるガス分子の相互作用、および相互貫入した擬ダイヤモンド骨格同士の相互作用の強さを制御することで、高いガス分離性能が発現する。吸着された物質が脱着した後は、元の構造に戻るので、細孔の構造も元に戻ると考えられる。
【0061】
本発明の金属錯体は、各種ガスの分離性能に優れているので、二酸化炭素、水素、一酸化炭素、酸素、窒素、硫化水素、アンモニア、硫黄酸化物、窒素酸化物、炭素数1〜4の炭化水素(メタン、エタン、エチレン、アセチレンなど)、希ガス(ヘリウム、ネオン、アルゴン、クリプトン、キセノンなど)、シロキサン(ヘキサメチルシクロトリシロキサン、オクタメチルシクロテトラシロキサンなど)、水蒸気または有機蒸気などを分離するための分離材としても好ましく、特に、エチレン中の二酸化炭素、エタン中の二酸化炭素を、圧力スイング吸着法や温度スイング吸着法により分離するのに適している。ここで有機蒸気とは、常温、常圧で液体状の有機物質の気化ガスを意味する。このような有機物質としては、メタノール、エタノールなどのアルコール類;トリメチルアミンなどのアミン類;アセトアルデヒドなどのアルデヒド類;炭素数5〜16の脂肪族炭化水素;ベンゼン、トルエンなどの芳香族炭化水素;アセトン、メチルエチルケトンなどのケトン類;塩化メチル、クロロホルムなどのハロゲン化炭化水素などが挙げられる。
【実施例】
【0062】
以下、本発明を実施例によって具体的に説明するが、本発明はこれらに限定されるものではない。実施例および比較例における分析および評価は次のようにして行った。
【0063】
(1)単結晶X線結晶構造解析
得られた単結晶をゴニオヘッドにマウントし、単結晶X線回折装置(ブルカー・エイエックスエス株式会社製SMART APEX II Ultra)を用いて測定した。X線としてはMoのKα線(λ=0.71073)を用い、2θ=52°までの反射を用いた。反射強度はSADABSプログラムを用いて補正した。構造は プログラム:SHELXS−97による直接法により決定し、プログラム:SHELXL−97により最適化した。水素以外の原子は異方的に最適化し、水素原子はAFIX Instructionを用いて配置した。
【0064】
(2)粉末X線回折パターンの測定
株式会社リガク製のX線回折装置:マルチフレックスおよびブルカー・エイエックスエス株式会社製のX線回折装置:NEW D8 ADVANCEを用いて、回折角(2θ)=3〜50°の範囲を走査速度3°/分で走査し、対称反射法で測定した。
【0065】
(3)吸脱着等温線の測定
ガス吸着量測定装置(日本ベル株式会社製BELSORP−HP)を用いて容量法(平衡待ち時間:500秒)で測定を行った。このとき、測定に先立って試料を150℃、50Paで6時間以上乾燥し、吸着水などを除去した。
【0066】
<実施例1>
[Zn(ip)(dpe)]の単結晶合成:
1.5mlのバイアル瓶に硝酸亜鉛六水和物のN,N−ジメチルホルムアミド(DMF)溶液(0.1M、0.2ml)、イソフタル酸(「ip」と略すことがある)のDMF溶液(0.1M、0.2ml)、1,2−ジ(4−ピリジル)エチレン(「dpe」と略すことがある)のDMF溶液(0.1M、0.2ml)、水0.5mlを加えた。得られた溶液を80℃のオイルバスで72時間加熱した。室温まで冷却した後、析出した結晶を取り出し、0℃において、単結晶X線構造解析を実施した。単結晶X線構造解析を行った結果を図3、図4および表1に示す。構造解析の結果、本金属錯体が、亜鉛イオン:イソフタル酸:1,2−ジ(4−ピリジル)エチレン=1:1:1の組成であり、かつ、擬ダイヤモンド骨格が三重に相互貫入した構造を有することがわかった。
【0067】
【表1】

【0068】
<実施例2>
[Zn(ip)(dpe)]の合成:
300mLナスフラスコに硝酸亜鉛六水和物0.581 g(1.95 mmol)、イソフタル酸0.333 g(2.00 mmol)、1,2−ジ(4−ピリジル)エチレン0.368 g(2.00 mmol)、DMF60ml、水50 ml(=水53質量%)を加えた。得られた溶液を80℃で16時間加熱攪拌した。室温まで冷却した後、析出した固体を吸引ろ過し、DMF、メタノールで洗浄し、80℃で真空乾燥した。目的の金属錯体0.1870g(収率:23%)を得た。実施例1の単結晶構造解析の結果から推測される粉末X線回折パターンと、得られた金属錯体の粉末X線回折パターンとの比較を図5に示す。図5より、得られた固体が実施例1で示した擬ダイヤモンド骨格が三重に相互貫入した構造を有する金属錯体であることがわかる。
【0069】
<比較例1>
[Zn(ip)(dpe)]の合成:
100mLナスフラスコに硝酸亜鉛六水和物1.48g(4.98 mmol)、イソフタル酸0.839g(5.05 mmol)、1,2−ジ(4−ピリジル)エチレン0.922g(5.06mmol)、DMF100 mlを加えた。得られた溶液を120℃のオイルバスで6時間加熱攪拌した。室温まで冷却した後、析出した固体を吸引ろ過し、DMF、メタノールで洗浄した。金属錯体を2.0g(収率:90%)得た。比較例1と実施例2で得られた金属錯体の粉末X線回折パターンを図6に示す。
図6より、実施例2と比較例1の回折パターンが一致しないことから、実施例1の錯体の合成には、溶媒中に水が必要であることがわかる。
【0070】
<比較例2>
[Zn(ip)(bpy)]の合成:
100mLナスフラスコに硝酸亜鉛六水和物0.297g(1.00 mmol)、イソフタル酸0.160g(0.96 mmol)、4,4’−ビピリジン(「bpy」と略す)0.160g(1.02mmol)、DMF20 mlを加えた。得られた溶液を120℃のオイルバスで6時間加熱攪拌した。室温まで冷却した後、析出した固体を吸引ろ過し、DMF、メタノールで洗浄した。金属錯体を0.326 g(収率:75%)得た。インターデジテイト型の単結晶構造を仮定して、シミュレーションした粉末X線回折パターンと、得られた金属錯体の粉末X線回折パターンとの比較を図7に示す。図7より、得られた固体が特許文献1に記載されているインターデジテイト型の集積構造を有する金属錯体であることがわかる。
【0071】
<比較例3>
[Zn(Brip)(dpe)]の合成:
100ml水熱容器に5−ブロモイソフタル酸0.1479g(0.60mmol)、01M水酸化カリウム水溶液6mlを入れ、配位子を溶解させた。さらに、酢酸亜鉛二水和物0.1324g(0.60mmol)の水溶液10ml、1,2−ジ(4−ピリジル)エチレン0.0546g(0.30mmol)、水29mlを加えた。150℃で72時間加熱した後、毎時5℃の冷却速度で室温まで冷却した。得られた白色固体を桐山漏斗を用いてろ過し、エタノールで洗浄し、目的とする化合物を0.1323g(収率:90%)得た。擬ダイヤモンド骨格が三重に相互貫入した構造をとると仮定した単結晶構造から予測される粉末X線回折パターンと、得られた金属錯体の粉末X線回折パターンとの比較を図8に示す。図8より、得られた固体が特許文献1に記載されている擬ダイヤモンド骨格が三重に相互貫入した構造を有する金属錯体であることがわかる。
【0072】
<吸着等温線>
実施例2で得た金属錯体について、40℃における二酸化炭素およびエチレンの吸脱着等温線を測定した。結果を図9に示す。
【0073】
比較例2で得た金属錯体について、0℃における二酸化炭素およびエチレンの吸脱着等温線を測定した。結果を図10に示す。
【0074】
比較例3で得た金属錯体について、0℃における二酸化炭素およびエチレンの吸脱着等温線を測定した。結果を図11に示す。
【0075】
図9、図10および図11の比較より、本発明の擬ダイヤモンド骨格をもつ金属錯体はエチレンに対して二酸化炭素を選択的に吸着するので、二酸化炭素とエチレンの分離材として優れていることは明らかである。
【0076】
実施例2で得た金属錯体について、40℃における二酸化炭素およびエタンの吸脱着等温線を測定した。結果を図12に示す。
【0077】
比較例2で得た金属錯体について、0℃における二酸化炭素およびエタンの吸脱着等温線を測定した。結果を図13に示す。
【0078】
比較例3で得た金属錯体について、0℃における二酸化炭素およびエタンの吸脱着等温線を測定した。結果を図14に示す。
【0079】
図12、図13および図14の比較より、擬ダイヤモンド骨格をもつ本発明の金属錯体はエタンに対して二酸化炭素を選択的に吸着するので、二酸化炭素とエタンの分離材として優れていることが明らかである。
【特許請求の範囲】
【請求項1】
下記一般式(I);
【化1】

(式中、R1、R2およびR3はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基およびハロゲン原子のいずれかを示し、Xは水素原子、置換基を有してもよい炭素数1〜4のアルキル基、炭素数2〜4のアルケニル基、炭素数1〜4のアルコキシ基、水酸基およびアミノ基のいずれかを示す)で表されるジカルボン酸化合物(I)と、
マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属のイオンと、
下記一般式(II);
【化2】

(式中、R4、R5、R6、R7、R8、R9、R10およびR11はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基、炭素数1〜4のアルコキシ基、ホルミル基、アシロキシ基、炭素数1〜4のアルコキシカルボニル基、ニトロ基、シアノ基、アミノ基、炭素数1〜4のモノアルキルアミノ基、炭素数1〜4のジアルキルアミノ基、炭素数1〜4のアシルアミノ基またはハロゲン原子のいずれかである。)で表される、前記金属イオンに二座配位可能な有機配位子(II)とからなる擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体。
【請求項2】
擬ダイヤモンド骨格の相互貫入が三重である請求項1に記載の金属錯体。
【請求項3】
前記金属のイオンが亜鉛イオン、マンガンイオン、ニッケルイオンのいずれかである請求項1または2に記載の金属錯体。
【請求項4】
一般式(I)で示されるジカルボン酸化合物(I)が、R1、R2、R3およびXのすべてが水素原子であるイソフタル酸である請求項1〜3のいずれかに記載の金属錯体。
【請求項5】
一般式(II)で示される有機配位子(II)が、R4、R5、R6、R7、R8、R9、R10およびR11のすべてが水素原子である1,2−ジ(4−ピリジル)エチレンである請求項1〜4のいずれかに記載の金属錯体。
【請求項6】
ジカルボン酸化合物(I)と、周期表の2族および7〜13族に属する金属の塩から選択される少なくとも1種の金属塩と、該金属イオンに二座配位可能な有機配位子(II)とを、水を20〜80%含む混合溶媒中で反応させ、析出させることを特徴とする請求項1〜5のいずれかに記載の金属錯体の製造方法。
【請求項7】
前記混合溶媒が非プロトン性極性溶媒と水との混合溶媒である請求項6に記載の金属錯体の製造方法。
【請求項8】
前記非プロトン性極性溶媒がN,N−ジメチルホルムアミドである請求項7に記載の金属錯体の製造方法。
【請求項9】
請求項1〜5のいずれかに記載の金属錯体からなる分離材。
【請求項10】
水素ガス、一酸化炭素、酸素ガス、窒素ガス、炭素数1〜4の炭化水素、希ガス、硫化水素、アンモニア、硫黄酸化物、窒素酸化物、シロキサン、水蒸気または有機蒸気中から二酸化炭素を選択的に吸着する請求項9に記載の分離材。
【請求項11】
該分離材が、エチレンまたはエタンの中から二酸化炭素を選択的に吸着するための分離材である請求項10に記載の分離材。
【請求項12】
請求項9に記載の分離材を用いることを特徴とするエチレンまたはエタンの中からの二酸化炭素の分離方法。
【請求項1】
下記一般式(I);
【化1】

(式中、R1、R2およびR3はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基およびハロゲン原子のいずれかを示し、Xは水素原子、置換基を有してもよい炭素数1〜4のアルキル基、炭素数2〜4のアルケニル基、炭素数1〜4のアルコキシ基、水酸基およびアミノ基のいずれかを示す)で表されるジカルボン酸化合物(I)と、
マグネシウム、カルシウム、クロム、モリブデン、タングステン、マンガン、鉄、ルテニウム、コバルト、ロジウム、ニッケル、パラジウム、銅、亜鉛およびカドミウムから選択される少なくとも1種の金属のイオンと、
下記一般式(II);
【化2】

(式中、R4、R5、R6、R7、R8、R9、R10およびR11はそれぞれ同一または異なっていてもよい、水素原子、置換基を有していてもよい炭素数1〜4のアルキル基、炭素数1〜4のアルコキシ基、ホルミル基、アシロキシ基、炭素数1〜4のアルコキシカルボニル基、ニトロ基、シアノ基、アミノ基、炭素数1〜4のモノアルキルアミノ基、炭素数1〜4のジアルキルアミノ基、炭素数1〜4のアシルアミノ基またはハロゲン原子のいずれかである。)で表される、前記金属イオンに二座配位可能な有機配位子(II)とからなる擬ダイヤモンド骨格が相互貫入した構造を有する金属錯体。
【請求項2】
擬ダイヤモンド骨格の相互貫入が三重である請求項1に記載の金属錯体。
【請求項3】
前記金属のイオンが亜鉛イオン、マンガンイオン、ニッケルイオンのいずれかである請求項1または2に記載の金属錯体。
【請求項4】
一般式(I)で示されるジカルボン酸化合物(I)が、R1、R2、R3およびXのすべてが水素原子であるイソフタル酸である請求項1〜3のいずれかに記載の金属錯体。
【請求項5】
一般式(II)で示される有機配位子(II)が、R4、R5、R6、R7、R8、R9、R10およびR11のすべてが水素原子である1,2−ジ(4−ピリジル)エチレンである請求項1〜4のいずれかに記載の金属錯体。
【請求項6】
ジカルボン酸化合物(I)と、周期表の2族および7〜13族に属する金属の塩から選択される少なくとも1種の金属塩と、該金属イオンに二座配位可能な有機配位子(II)とを、水を20〜80%含む混合溶媒中で反応させ、析出させることを特徴とする請求項1〜5のいずれかに記載の金属錯体の製造方法。
【請求項7】
前記混合溶媒が非プロトン性極性溶媒と水との混合溶媒である請求項6に記載の金属錯体の製造方法。
【請求項8】
前記非プロトン性極性溶媒がN,N−ジメチルホルムアミドである請求項7に記載の金属錯体の製造方法。
【請求項9】
請求項1〜5のいずれかに記載の金属錯体からなる分離材。
【請求項10】
水素ガス、一酸化炭素、酸素ガス、窒素ガス、炭素数1〜4の炭化水素、希ガス、硫化水素、アンモニア、硫黄酸化物、窒素酸化物、シロキサン、水蒸気または有機蒸気中から二酸化炭素を選択的に吸着する請求項9に記載の分離材。
【請求項11】
該分離材が、エチレンまたはエタンの中から二酸化炭素を選択的に吸着するための分離材である請求項10に記載の分離材。
【請求項12】
請求項9に記載の分離材を用いることを特徴とするエチレンまたはエタンの中からの二酸化炭素の分離方法。
【図1】


【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図4】




【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図4】


【公開番号】特開2013−107826(P2013−107826A)
【公開日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願番号】特願2011−251395(P2011−251395)
【出願日】平成23年11月17日(2011.11.17)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成23年度独立行政法人新エネルギー・産業技術総合開発機構『グリーン・サステイナブルケミカルプロセス基盤技術開発』「副生ガス高効率分離・精製プロセス基盤技術開発」に係る委託研究、産業技術力強化法第19条の適用を受ける特許出願)
【出願人】(000002004)昭和電工株式会社 (3,251)
【出願人】(000001085)株式会社クラレ (1,607)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
【公開日】平成25年6月6日(2013.6.6)
【国際特許分類】
【出願日】平成23年11月17日(2011.11.17)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成23年度独立行政法人新エネルギー・産業技術総合開発機構『グリーン・サステイナブルケミカルプロセス基盤技術開発』「副生ガス高効率分離・精製プロセス基盤技術開発」に係る委託研究、産業技術力強化法第19条の適用を受ける特許出願)
【出願人】(000002004)昭和電工株式会社 (3,251)
【出願人】(000001085)株式会社クラレ (1,607)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
[ Back to top ]

