針腎生検検体から糸球体を単離する方法
【課題】針腎生検検体から効率的に糸球体を単離する方法の提供。
【解決手段】針腎生検検体から糸球体を単離する方法であって、(1)針腎生検検体を、針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュで濾す工程、(2)第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す工程、(3)第2のメッシュ上の画分を染色する工程、(4)第2のメッシュから糸球体を回収する工程を含む、方法。
【解決手段】針腎生検検体から糸球体を単離する方法であって、(1)針腎生検検体を、針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュで濾す工程、(2)第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す工程、(3)第2のメッシュ上の画分を染色する工程、(4)第2のメッシュから糸球体を回収する工程を含む、方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、腎臓の糸球体を単離する方法などに関する。
【背景技術】
【0002】
現在日本の維持透析患者は29万人存在し、毎年患者数は1万人ずつ増加している。透析導入原疾患に慢性糸球体腎炎の占める割合は高く、透析導入を防ぐためには腎炎の病因・病態を解明し、それに応じた治療を行うことが重要であると考えられる。
【0003】
糸球体腎炎(Glomerulonephritis、GN)(例、IgA腎症(非特許文献1、[1])、膜性腎症(非特許文献2、3、[2、3])および膜性増殖性GN(非特許文献4、[4])は、腎臓学の主要な疾患カテゴリーの1つである。GNの識別診断のためには、針腎生検は重要な検査法である。しかしながら、腎生検の重要性は診断の場面に限定されない。針腎生検検体は、診断のための情報だけではなく、GNの病因・病態を解明するのに多くの情報を提供し得る。
【0004】
現在、針腎生検検体の糸球体タンパク質はほとんどが免疫組織化学的に調査されており、生化学的には調査されていない。針腎生検検体は、糸球体の他にも尿細管や結合組織(例、赤血球)などの様々な構成成分を含むので、糸球体タンパク質の生化学的解析には針腎生検検体から糸球体を単離する必要がある。しかしながら、小さい針腎生検検体から糸球体を単離するのは困難であるという問題がある。
【0005】
針腎生検検体をスライスした組織切片から糸球体を回収する最近の技術であるレーザーマイクロダイセクション(laser microdissection、LMD)法(非特許文献5、[5])は、部分的に上述の問題を解決する。しかしながら、LMD法を行うにはレーザー照射装置など高価な器具が必要である。また、糸球体タンパク質の生化学的分析を行うには100スライス以上の組織切片が必要であるところ、100スライス以上の組織切片を作製するには長時間かかることに加え、1本の針腎生検検体から得られる組織切片はせいぜい30スライス程度であり、1本の針腎生検検体から生化学的分析には不十分な極めて少量の糸球体タンパク質しか得ることはできない。また、組織切片は、凍結した針腎生検検体をスライスすることで作製するので、凍結による糸球体タンパク質の変性の可能性も否定できない。さらに、レーザー照射によるタンパク質変性を無視することができない。したがって、針腎生検検体から効率的に糸球体を得る方法を、GNを患っている患者における糸球体タンパク質の生化学的解析のために確立することが望まれる。
【0006】
ここで、外科的腎切除検体から糸球体を単離する方法として、古典的なシービング法(非特許文献6、7、[6、7])が知られている。古典的なシービング法では外科的腎切除検体を、425μmメッシュ、250μmメッシュ、および150μmメッシュで順番に濾し、最後に150μmのメッシュ上に残った糸球体を回収する方法である。この古典的なシービング法は、金属シーブなどの安価な材料しか必要とせず、糸球体の単離作業に約1時間しか要しないが、約1g以上の外科的腎切除検体のブロックを必要とする。古典的なシービング法で用いる外科的腎切除検体は、癌の手術などにおいて腎臓の病変部およびその周囲組織を摘出した場合などに得られるものであるが、腎炎患者から外科的腎切除検体を入手することは極めて困難である。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Tumlin JA, Madaio MP, Hennigar R: Idiopathic IgA nephropathy: pathogenesis, histopathology, and therapeutic options. Clin J Am Soc Nephrol 2007;2: 1054-1061.
【非特許文献2】Ponticelli C: Membranous nephropathy. J Nephrol 2007;20:268-287.
【非特許文献3】Beck LH Jr, Bonegio RG, Lambeau G, Beck DM, Powell DW, Cummins TD, JB Klein, DJ Salant: M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med 2009;361:11-21.
【非特許文献4】Alchi B, Jayne D: Membranoproliferative glomerulonephritis. Pediatr Nephrol 2010;25:1409-1418
【非特許文献5】Craven RA, Totty N, Harnden P, PJ Selby, RE Banks: Laser capture microdissection and two-dimensional polyacrylamide gel electrophoresis: evaluation of tissue preparation and sample limitations. Am J Pathol 2002;160:815-822.
【非特許文献6】Nagi AH, Kirkwood W: A quick method for the isolation of glomeruli from human kidney. J Clin Pathol 1972;25:361.
【非特許文献7】Yoshida Y, Miyazaki K, Kamiie J, Sato M, Okuizumi S, Kenmochi A, Kamijo K, NabetaniT, Tsugita A, Xu B, Zhang Y, Yaoita E, Osawa T, Yamamoto T: Two-dimensional electrophoretic profiling of normal human kidney glomerulus proteome and construction of an extensible markup language (XML)-based database. Proteomics 2005;5:1083-1096.
【発明の概要】
【発明が解決しようとする課題】
【0008】
上記状況において、針腎生検検体から効率的に糸球体を単離する方法などが求められていた。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために鋭意研究を重ねた結果、摘出腎臓検体から糸球体を単離する古典的なシービング法を改良することにより針腎生検検体から糸球体を単離することができることに想到し、本発明を完成するに至った。
【0010】
すなわち、本発明は、以下に示す、針腎生検検体から糸球体を単離する方法などを提供する。
[1] 針腎生検検体から糸球体を単離する方法であって、
(1)針腎生検検体を、針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュで濾す工程、
(2)第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す工程、
(3)第2のメッシュ上の画分を染色する工程、
(4)第2のメッシュから糸球体を回収する工程
を含む、前記方法。
[2] 前記第2のメッシュ上の画分の染色をトリパンブルーで行う、上記[1]に記載の方法。
[3] 前記第1のメッシュが、180μmのメッシュサイズである、上記[1]または[2]に記載の方法。
[4] 前記第2のメッシュが、75μmのメッシュサイズである、上記[1]〜[3]のいずれか1項に記載の方法。
[5] 前記針腎生検検体を第1のメッシュで濾す工程は、針腎生検検体を第1のメッシュ上でこすり、針腎生検検体の形を崩して行うものである、上記[1]〜[4]のいずれか1項に記載の方法。
[6] 前記針腎生検検体から糸球体を単離する全ての工程を4℃で行う、上記[1]〜[5]のいずれか1項に記載の方法。
[7] 前記針腎生検検体は未凍結のものである、上記[1]〜[6]のいずれか1項に記載の方法。
[8] 針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュと、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュと、糸球体を染色する染色材料とを含む、糸球体単離用キット。
[9] 上記[1]〜[7]のいずれか1項に記載の方法で単離した糸球体を用いることを含む、腎疾患の生化学的検査方法。
[10] 上記[1]〜[7]のいずれか1項に記載の方法で単離した糸球体を用いることを含む、腎疾患予防または治療薬のスクリーニング方法。
【発明の効果】
【0011】
本発明は、針腎生検検体から糸球体を単離する方法を提供する。本発明の方法によれば、針腎生検検体から効率よく糸球体を単離することができる。
【図面の簡単な説明】
【0012】
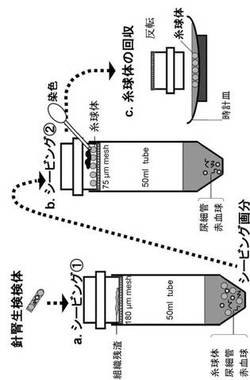
【図1】針腎生検検体から糸球体を単離する方法を示す概略図である。針腎生検検体を180μmメッシュで濾した(a)。糸球体は180μmメッシュを通過し、シービング画分に回収された。その後、シービング画分を75μmメッシュで再び濾した(b)。糸球体をメッシュ上の画分に回収した。メッシュ上の糸球体をトリパンブルーで染色し、メッシュを時計皿の上で反転させることで、染色した糸球体を時計皿上に集めた。
【図2】単離した糸球体の顕微鏡図である。マイクロシービング法により1本の針腎生検検体から単離した糸球体(a)、および古典的なシービング法により外科的腎切除検体から単離した糸球体(b)を0.5%(w/v)トリパンブルーで染色し、顕微鏡下(x100)で見た。横棒は200μmを表わす。
【図3】Cy3標識糸球体タンパク質の2次元電気泳動法(2−DE)像。Cy3標識糸球体タンパク質(2.5μg)を初めに等電点電気泳動、続いてSDS−PAGEを用いて展開した。マイクロシービング法により1本の針腎生検検体から(a)、また古典的なシービング法により外科的腎切除検体から(b)、糸球体タンパク質を単離した。
【発明を実施するための形態】
【0013】
以下、本発明について詳細に説明する。
本明細書に記載した全ての文献及び刊行物は、その目的にかかわらず参照によりその全体を本明細書に組み込むものとする。
【0014】
1.本発明の概要
針腎生検検体は糸球体腎炎の診断のためだけでなく、その病因・病態の調査のために重要である。針腎生検検体から糸球体を単離する方法として、マクロダイセクション法が知られているが、マイクロダイセクション法には、次のような問題がある。すなわち、器具が高価であり、組織切片の作製に長時間かかり、1本の針生検検体から生化学的分析に十分な量の糸球体を得ることができず、レーザー照射による糸球体タンパク質の変性の可能性がある。
【0015】
本発明者らは、これらの問題を克服するために、外科的切除腎検体から糸球体を単離する古典的なシービング法を改良し、針腎生検検体から糸球体を単離する本発明の方法を開発した。本発明の方法を、本明細書中ではマイクロシービング(micro−sieving)法と呼ぶ場合がある。
【0016】
マイクロシービング法は、針腎生検検体から糸球体を単離する方法であって、次の工程を含む(図1)。
(1)針腎生検検体を、針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュで濾す工程、
(2)第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す工程、
(3)第2のメッシュ上の画分を染色する工程、
(4)第2のメッシュから糸球体を回収する工程。
【0017】
後述の実施例では、マイクロシービング法により、構造を損なわずに糸球体を回収することが可能であった(図2(a))。また、1本の針腎生検検体から平均で55個の糸球体を1時間で単離することができた(表1)。針腎生検検体1本あたりの糸球体タンパク質の量(1検体から得られた糸球体数x1つの糸球体に含まれるタンパク質量)は平均で23μgであり(表1)、生化学的分析を行うのに十分な量の糸球体タンパク質を得ることができた。
【0018】
マイクロシービング法により単離した糸球体を用いて、本発明者らは、蛍光2次元電気泳動法(2−DE)により、糸球体腎炎を患っている各患者の糸球体タンパク質プロファイルを得ることができた(図3(a))。個々の患者の糸球体プロテオームを個別に決定することが可能であることが分かった。
【0019】
マイクロシービング法は針腎生検検体中の糸球体を解析する基本的な技術として広く用いることができる。
【0020】
2.針腎生検検体
針腎生検検体は、腎臓に中空の針を刺して採取した腎臓組織である。本発明で用いる針腎生検検体は、採取した腎臓組織の全部であってもよいし、あるいは、採取した腎臓組織のさらに一部でもよい。針腎生検検体は、糸球体腎炎などの腎疾患の診断のために採取することがあり、外科的腎切除検体と比較して、容易に入手することができる。本発明では、針腎生検検体として、腎疾患の診断を目的として採取した検体であって、診断後の余りの部分を用いるようにしてもよい。
【0021】
針腎生検検体は、ヒト由来のものや、ヒト以外の生物由来のもの、例えばウシ、サル、トリ、ネコ、マウス、ラット、モルモット、ハムスター、ブタ、イヌ、ウサギ、ヒツジ、ウマなどの非ヒト哺乳動物等由来のものであってよい。針腎生検検体は、好ましくは、ヒト由来のものである。
【0022】
針腎生検検体は、当分野で公知の方法で採取することができ、市販のキットを用いて採取してもよい。市販のキットとしては、Tru・CoreII(Medical Device Technology Inc.、Gainesville、Fla.、USA)、エースカット(TSK LABORATORY、 Tochigi、Japan)、ツルーカット スタンダード(CareFusion Co.、LTD.、Tokyo、Japan)などが例示される。採取に用いる針は、例えば、太さが16ゲージ〜18ゲージのものであり、好ましくは、16ゲージのものである。
【0023】
本発明では、針腎生検検体として、未凍結のものを用いるのが好ましい。未凍結の針生検検体を用いることで、凍結による糸球体タンパク質の変性の可能性を排除することができる。
【0024】
3.マイクロシービング法
3.1.第1のシービング
第1のシービングでは、針腎生検検体を、針腎生検検体中の尿細管、赤血球、糸球体を通す、第1のメッシュで濾す(図1(a))。
【0025】
第1のシービングで用いる針腎生検検体は、少なくとも1本(例えば、10本〜1本、5本〜1本、4本〜1本、3本〜1本、2本〜1本、1本)の針腎生検検体であり、好ましくは1本の針腎生検検体である。
【0026】
第1のメッシュは、針腎生検検体中の尿細管、赤血球、糸球体を通すものであればよい。糸球体は、ヒトの場合、直径が平均180〜200μmであり、針腎生検検体中の尿細管、赤血球は、それよりもさらに小さい。したがって、メッシュサイズは、例えば、300μm〜180μm、好ましくは、250μm〜180μm、さらに好ましくは、180μmとする。メッシュの材質としては、金属(例、ステンレス、鉄、硬鋼線)、合成繊維(例、ナイロン、ポリエステル、ポリエチレン、フッ素繊維、ポリプロピレン)などが挙げられる。第1のメッシュとして、市販のものを用いてもよい。
【0027】
ヒト以外の動物の針腎生検検体を用いる場合にも、その動物の尿細管、赤血球、および糸球体のサイズから、これらを通すメッシュサイズを適宜選択することができる。
【0028】
針腎生検検体を、第1のメッシュで濾す工程を、針腎生検検体を第1のメッシュ上でこすり、針腎生検検体の形を崩して行うのが好ましい。こする道具としては、例えば、薬さじ、ガラス棒などが挙げられる。
【0029】
第1のメッシュで濾した後、リン酸緩衝食塩水(PBS)などで第1のメッシュを洗浄するのが好ましい。
【0030】
第1のシービングにより第1のメッシュを通過したシービング画分には、尿細管、赤血球および糸球体が少なくとも含まれる。
【0031】
3.2.第2のシービング
第2のシービングでは、第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す(図1(b))。
【0032】
第2のメッシュは、尿細管および赤血球を通し、糸球体を通さないものであれよい。糸球体は、ヒトの場合、直径が平均180〜200μmであり、第1のシービングによるシービング画分中の尿細管および赤血球は、大きさが、おおよそ60μm〜8μmと考えられるので、メッシュサイズは、例えば、150μm〜65μm、好ましくは、100μ〜70μm、さらに好ましくは75μmとする。メッシュの材質としては、前記第1のメッシュで説明したものと同様のものが挙げられる。第2のメッシュとして、市販のものを用いてもよい。
尚、ヒトの尿細管は、直径が最大60μmで、全長が約50mmである。しかしながら、腎生検によって、尿細管の長さは分断され、更に第1のシービングによって更に細かく分断されるため、第1のシービングによるシービング画分中では、尿細管は、糸球体よりも小さく、例えば、おおよそ60μm以下の大きさになると考えられる。
【0033】
ヒト以外の動物の針腎生検検体を用いる場合にも、その動物の尿細管、赤血球、および糸球体のサイズから、尿細管および赤血球を通すが、糸球体を通さないメッシュサイズを適宜選択することができる。
【0034】
第2のメッシュで濾した後、リン酸緩衝食塩水(PBS)などで第2のメッシュを洗浄するのが好ましい。
【0035】
第2のシービングにより第2のメッシュを通過したシービング画分には、尿細管および赤血球が少なくとも含まれる。一方、第2のメッシュ上の画分には、糸球体が少なくとも含まれる。
【0036】
3.3.染色
本発明では、第2のメッシュ上の画分を染色する(図1(b))。染色により第2のメッシュ上の糸球体の視認性を高めることができることなどから、糸球体の回収効率が上がる。
【0037】
染色は、糸球体を染色することができる公知の染色材料を用いて行う。染色材料として、糸球体タンパク質の生化学的分析に影響が少ない材料を用いるのが好ましい。そのような染色材料としては、例えば、トリパンブルー;チュルク液;例えばナショナルファストブルー、アルシアンブルー8GX、アルシアンブルー8GS、アストラブルー等のフタロシアニン系色素を用いる染色液;例えばピロニンB、ピロニンG等のキサンテン系色素を用いる染色液;例えばクリスタルバイオレット、ゲンチアナバイオレット等のパラロサニリン色素を用いる染色液;例えばサフラニン、フクシン、メチレンブルー、メチルバイオレット、エオジン、ビスマルクブラウン、クリソイジン、ヘマトキシリン、アニリンブルー、オレンジG、ビクトリアブルー、ライトグリーン、ベルリンブルー、クレシルバイオレット等の色素を用いる染色液;パパニコロウ染色法用染色液;ギムザ染色法用染色液;ヘマトキシリン・エオジン重染色法用染色液;PAS(periodic acid Schiff)染色法用染色液;Sternheimer−Malbin法用染色液;Sternheimer法用染色液;Sudan III染色法用染色液;Prescott-Brodie染色法用染色液;Berlin Blue染色法用染色液;などが挙げられ、好ましくは、トリパンブルーが挙げられる。トリパンブルーで染色した場合、続く工程で、例えば、第2のメッシュを反転させて糸球体を回収するときなどに糸球体のメッシュ離れがよくなり、糸球体の回収効率がより一層高くなるという利点がある。
【0038】
染色により、第2のメッシュ上には、染色した糸球体を含む画分が生成する。
【0039】
3.4.回収・単離
本発明では、第2のメッシュから糸球体を回収する(図1(c))。
【0040】
このとき、第2のメッシュを反転させて、染色した糸球体を含む第2のメッシュ上の画分を回収し、染色した糸球体を単離するのが好ましい。第2のメッシュを反転させたときに、第2のメッシュ上の画分を受ける容器として、例えば、時計皿、シャーレ、ファルコンチューブなどを用いてよい。好ましくは、時計皿を用いる。時計皿により、第2のメッシュから落ちてきた糸球体を時計皿の中央に集めることができる。
【0041】
本工程により、染色した糸球体が回収・単離される。
【0042】
マイクロシービング法では、針腎生検検体から糸球体を単離する全ての工程を、針腎生検検体のプロテアーゼの影響を最小限に抑えて糸球体タンパク質の分解を防ぐことのできる温度下で行うのが好ましい。具体的には、例えば、8℃〜2℃、好ましくは、5℃〜3℃、より好ましくは、4℃で行う。マイクロシービング法で用いる、試薬、器具等も、予め氷冷したり、上記温度に冷却しておくのが好ましい。
【0043】
上記マイクロシービング法によれば、腎生検検体から糸球体を、比較的短時間(例えば、約1時間)で効率よく単離することができる。
【0044】
このように単離した糸球体は、生化学的分析、例えば、プロテオーム解析やRNA解析による糸球体腎炎の病因・病態解析などに用いることができる。また、単離した糸球体は、腎疾患の生化学的検査方法、および腎疾患予防または治療薬のスクリーニング方法にて用いることもできる。
【0045】
4.糸球体単離用キット
本発明は、糸球体単離用キットを提供する。本発明の糸球体単離用キットは、上記マイクロシービング法で用いることができる。
本発明の糸球体単離用キットには、(i)針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュと、(ii)第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュと、(iii)糸球体を染色する染色材料とが含まれる。第1のメッシュ、第2のメッシュ、および染色材料は、上記説明したのと同様である。
【0046】
本発明のキットには、さらに、マイクロシービング法についての実験操作説明書が含まれていてよい。また、上記マイクロシービング法で説明した、緩衝液、各種容器、などが含まれていてよい。
【0047】
5.腎疾患の生化学的検査方法
本発明は、上記マイクロシービング法で単離した糸球体を用いることを含む、腎疾患の生化学的検査方法を提供する。
本発明の生化学的検査方法において「単離した糸球体を用いる」ことには、腎疾患の病因・病態と関連がある糸球体内の物質(例、ペプチド、タンパク質、DNA、RNAなど)を検出することなどが含まれる。「腎疾患の病因・病態と関連がある糸球体内の物質」としては、塩基性繊維芽細胞増殖因子(bFGF)、繊維芽細胞成長因子(FGF)、腫瘍壊死因子(TNF-α)、血小板由来増殖因子(PDGF)、血管内皮細胞接着分子(ICAM-1)、インスリン様成長因子(IGF-1 )、フィブロネクチン、インテグリンα5、各種コラーゲン(I、III、IV、VI)、結合組織成長因子(CTGF)などの組織繊維化因子、例えばp53、p21などの細胞周期関連因子、例えば組織因子 (TF)、メタロプロテアーゼなどの血栓関連因子等が挙げられる。これらの物質は、公知の方法にて検出することができる。
そして、腎疾患の病因・病態と関連がある糸球体内の物質が、正常値と比較して増減したとき、例えば、正常値と比較して、10%以上、好ましくは30%以上、より好ましくは50%以上、増減したとき、腎疾患である、と判断することができる。
【0048】
6.腎疾患予防または治療薬のスクリーニング方法
本発明は、上記マイクロシービング法で単離した糸球体を用いることを含む、腎疾患の予防または治療薬のスクリーニング方法を提供する。
本発明のスクリーニング方法において「単離した糸球体を用いる」ことには、例えば、単離した糸球体に被検物質を接触させて、該接触により糸球体内で発現量又は活性が増減する物質を検出することなどが含まれる。ここで、「被検物質」は、ペプチド、タンパク質、合成化合物(低分子化合物等)などのいずれであってもよい。「接触」とは、糸球体と被検物質とを、同一の培養系に存在させることなどを意味する。
より具体的には、腎疾患を患っている対象由来の糸球体と被検物質とを接触させた場合の糸球体内の所定物質の発現量又は活性を測定し、腎疾患を患っている対象の糸球体と被検物質とを接触させない場合の糸球体内の前記所定物質の発現量又は活性を測定し、両者を比較する。ここで、「対象」は、ヒトや、ヒト以外の生物、例えばウシ、サル、トリ、ネコ、マウス、ラット、モルモット、ハムスター、ブタ、イヌ、ウサギ、ヒツジ、ウマなどの非ヒト哺乳動物等である。「所定物質」は、腎疾患の病因・病態と関連がある糸球体内の物質(例、ペプチド、タンパク質、DNA、RNAなど)である。「腎疾患の病因・病態と関連がある糸球体内の物質」は、より具体的には、前記したものが挙げられる。
比較の結果、糸球体内で所定物質の発現量又は活性が増減する物質を、腎疾患の予防または治療薬の候補薬として選択する。より具体的には、糸球体内で所定物質の発現量又は活性が、10%以上、好ましくは30%以上、より好ましくは50%以上、増減する物質を、腎疾患の予防または治療薬の候補薬として選択する。
当該候補薬については、さらに、腎疾患病態モデル等において腎疾患の予防または治療効果を確認するようにしてもよい。そして、腎疾患病態モデル等において腎疾患の予防または治療効果が確認できた候補薬を、腎疾患予防または治療薬として選択するようにしてよい。
【0049】
以下、本発明を下記の実施例を参照してより詳細に説明するが、本発明はこの実施例に限定されない。
【実施例】
【0050】
方法
ヒト針腎生検検体および切除検体
4本の針腎生検検体を4人の腎臓病患者から得た(IgA沈着、軽鎖沈着、膜性増殖性GN、および膜性腎症)。針腎生検を、16ゲージの針を有する自動生検装置Tru・CoreII(Medical Device Technology Inc.、Gainesville、Fla.、USA)を用いて行った。古典的なシービング法に関して、通常の腎皮質を腎細胞癌を有する2人の患者から外科的に切除して、2つの外科的切除腎検体を得た。本研究は、聖マリアンナ医科大学の学内の生命倫理委員会の承認を得た。インフォームドコンセントを各患者から文書で得た。
【0051】
ヒト針腎生検検体からの糸球体の単離
針腎生検検体を得た直後から糸球体の単離を開始した。針腎生検検体を180μmメッシュ(Tokyo Screen Co.Ltd.、Tokyo、Japan)上に置き、薬さじの先端でこすり、針腎生検検体の形をくずした後、10mlの氷冷リン酸緩衝食塩水(PBS)で洗浄した。シービング画分を75μmメッシュ(Tokyo Screen Co.Ltd.、Tokyo、Japan)で再び濾した後、20mlの氷冷PBSで洗浄した。糸球体を75μmメッシュで回収した。メッシュ上で、糸球体を0.5%(w/v) トリパンブルー(Boehringer Mannheim GmbH、Mannheim、Germany)で染色し、その後、20mlの氷冷PBSで洗浄した。その後、75μmメッシュを時計皿上で反転させた。糸球体を時計皿上で10ml氷冷PBSを用いて洗浄し、時計皿の中心に集めた。混入したプロテアーゼの影響を最小限に抑えるため全ての作業を4℃で行った。シービングメッシュ、薬さじ、時計皿およびパスツールピペットを含む全ての道具を使用直前に4℃で冷却した。糸球体の数は顕微鏡下でカウントした。染色した糸球体を1.5ml試験管に移してから、パスツールピペットで1つずつ取り出した。単離した糸球体を遠心分離(2,500g、5分、4℃)で集め、30mM Tris−HCl(pH8.0)、4%(v/v) 3−((3−Cholamidopropyl)dimetylammonio)propanesulfonate(CHAPS)、7M ureaおよび2M thioureaを含む溶解緩衝液(lysis buffer)中に溶解した。ライセートを遠心分離(20,000g、30分、4℃)し、得られた上澄み画分を使用までの間、−80℃で保管した。
【0052】
糸球体タンパク質の2次元電気泳動(2−DE)
2−DE解析のために、2.5μgのタンパク質を、以前に記載されている通りに4pmolの蛍光シアニン染色(Cy3)で標識した[8]。IPGphor(GE Healthcare UK Ltd、UK)を用いての等電点電気泳動(IEF)のために、標識したタンパク質をpH3〜11の範囲のpHの24cm Immobine Dry−Strip(GE Healthcare UK Ltd、UK)に添加した。IEF後、そのImmobine Dry−Stripを以前に記載されている通りに[8]、12.5% SDS−PAGEスラブゲルの上に置いた。分離した標識タンパク質を画像分析機(Typoon9400Imager、GE Healthcare UK Ltd、UK)を用いて100μmの解像度でスキャンした。得られたゲルイメージをProgenesis software(Perkin Elmer、Wellesley、Mass.、USA)を用いて解析した。
【0053】
ブタ針腎生検検体からの糸球体の単離
ブタ針腎生検検体を、16ゲージの針を有する自動生検装置Tru・CoreII(Medical Device Technology Inc.,Gainesville、Fla.、USA)を用いて採取した。
【0054】
ブタ針腎生検検体を1度に2本使用したことを除いて上記ヒト針腎生検検体からの糸球体の単離と同様の手順にてトリパンブルーで染色した糸球体を単離した。時計皿の中心に集めた染色糸球体の数を顕微鏡下でカウントした。
【0055】
一方、ブタ針腎生検検体を1度に2本使用し、かつトリパンブルー染色を行わなかったことを除いて上記ヒト針腎生検検体からの糸球体の単離と同様の手順にてトリパンブルーで染色しない糸球体も単離した。時計皿の中心に集めた未染色糸球体の数を顕微鏡下でカウントした。
【0056】
結果および考察
マイクロシービング法は針腎生検検体から糸球体を単離する方法であり、外科的切除腎検体から糸球体を単離する古典的なシービング法を基にして開発した。マイクロシービング法の手順のスキーマを図1に示す。図1では、1本の針腎生検検体をメッシュサイズ180μmのメッシュ上に置いた。ヒト糸球体の直径は180〜200μmであるので[9]、糸球体は、針腎生検検体を優しくこすってその形を崩し、メッシュを洗浄することにより腎尿細管や赤血球のような小さな構成成分とともに濾した分画に移動した。一方、メッシュ上には、メッシュを通過しない組織残渣が残った。次いで、シービング画分を75μmメッシュ上に置いた。その後、PBSでよく洗浄することによって小さな構成成分をシービング画分へと回収した。糸球体を75μmメッシュ上に回収した。回収した糸球体を、0.5%(w/v)トリパンブルーで染色し、時計皿に集め、カウントし、1.5ml試験管に回収した。この手順には1時間を要した。外科的切除腎検体から糸球体を単離する古典的なシービング法では、3つのメッシュ(425μmメッシュ、250μmメッシュ、および150μmメッシュ)を用いる。しかしながら、本発明者らは、針腎生検検体から糸球体を単離するには、2種類のメッシュを使用すれば十分であることを見出した。トリパンブルー染色糸球体を確認し、顕微鏡でその外観をチェックした。図2(a)に示すように、糸球体は直径約200μmの球状に見え、目に見える破損は観察されなかった。これと同時に、外科的切除腎検体から糸球体を単離する古典的なシービング法を行った(図2(b))。マイクロシービング法により針腎生検検体から単離した糸球体は古典的なシービング法により外科的切除腎検体から単離したものと区別できなかった(図2)。さらに、マイクロシービング法により単離した糸球体では、古典的なシービング法により得たものと比較して混入したデブリが少ないようであった(図2)。顕微鏡観察下でパスツールピペットを用いて無傷の糸球体のみを回収したので、尿細管の混入を無視することができた。このことは、針腎生検検体から糸球体を首尾よく回収したことを示している。本発明者らはマイクロシービング法を合計で4つの針腎生検検体に適用した。ここで、表1に、マイクロシービング法と古典的なシービング法により単離した糸球体の数を示す。表1に示したように、マイクロシービング法により平均で55個の糸球体を1つの針腎生検検体から回収した。この数の糸球体を2−DE解析によるタンパク質解析のために溶解バッファーに溶解し、平均23μgのタンパク質を各糸球体検体から抽出した。マイクロシービング法により単離した糸球体1つあたりに含まれるタンパク質量は、0.4μg前後であり、古典的なシービング法により単離した糸球体1つあたりのタンパク質量と同程度であった。
【0057】
【表1】

【0058】
マイクロシービング法を用いて、本発明者らはGNの4患者の各々から2−DEにより糸球体タンパク質プロファイルを得ようとした。これは、2−DEによるタンパク質プロファイルがタンパク質を解析する最も有用な方法の1つであるからである。針腎生検検体由来の糸球体から抽出したタンパク質(2.5μg)をCy3で標識し、2−DEにより分離した。代表的な結果を図3(a)に示す。本発明者らは、1本の針腎生検検体由来の糸球体タンパク質から鮮明な2−DEイメージを首尾よく得た。各患者の1本の針腎生検検体から大きな労力を使うことなくタンパク質プロファイルを得ることを、本発明者らの知る限りでは、マイクロシービング法により初めて可能とした。加えて、同時に、本発明者らは、古典的なシービング法により外科的切除腎検体から単離した糸球体由来のタンパク質を用いて2−DEを行った。マイクロシービング法により得たタンパク質の2−DEイメージは古典的なシービング法によるものと似ていた(図3(b))。ここで、表2に、マイクロシービング法および古典的なシービング法により得られた糸球体タンパク質の2−DE上のスポットの数を示す。表2に示したように、1本の生検検体由来の糸球体と外科的切除腎臓検体由来の糸球体との間で似たような数のタンパク質スポット(約1000個)を2−DEイメージで検出した。
【0059】
【表2】

【0060】
2本のブタ針腎生検検体から、マイクロシービング法により糸球体を単離した。このマイクロシービング法には、トリパンブルーによる染色工程が含まれているため、糸球体は、トリパンブルーにより染色された。染色した糸球体を92〜96個回収できた(表3)。一方、マイクロシービング法から染色工程のみを省いた方法にて、2本のブタ針腎生検検体から未染色の糸球体を単離したところ、未染色糸球体は8〜9個しか回収できなかった(表3)。すなわち、回収できた未染色糸球体の量は、染色糸球体の量の約10分の1であった(表3)。この結果から、針腎生検検体からの糸球体の回収率を上げるには、マイクロシービング法において染色工程が重要であることが分かる。
【0061】
【表3】

【0062】
ここで、針腎生検検体をレーザーマイクロダイセクション(LMD)法を用いて単離することができる。局所的な糸球体疾患の所定の病理変化を有する糸球体をLMDにより隔離すること、例えば、局所的な糸球体硬化症における硬化した糸球体を避けることができる。さらに、通常行う病理学的評価の後に残された針腎生検検体の糸球体をLMD法を用いて解析することができ、したがって、針腎生検で追加の組織検体を入手する必要がない。しかしながら、LMDには克服すべき致命的な問題、すなわち、得られるタンパク質の量とレーザー照射によるタンパク質の変性の点に問題がある。例えば、Yoshidaら[10]は、10μmの厚さの凍結切片からLMDにより得られた1つの糸球体切片のタンパク質量が53.2±5ngであると計算したことを報告した。高感度2−DE解析でさえ2.5〜5.0μgの糸球体タンパク質が必要であるので、生化学的解析には1本の生検検体につき100個以上のスライスが必要となる。後者の問題を考慮すると、現在、レーザーによる糸球体タンパク質の変性を避けることはできないようである。これに対して、本発明の方法では、針腎生検検体から糸球体を糸球体にほとんどダメージを与えることなく短時間(例、1時間)で得ることができる。さらに、入手可能なタンパク質の量は2−DE解析の約10回分である。まとめると、ここに記載したマイクロシービング法は、例えば、GNなどの腎疾患を患っている各患者の糸球体タンパク質の調査(例、糸球体プロテオーム解析)のための標準的な方法になり得る。
【0063】
[参考文献]
1. Tumlin JA, Madaio MP, Hennigar R: Idiopathic IgA nephropathy: pathogenesis, histopathology, and therapeutic options. Clin J Am Soc Nephrol 2007;2: 1054-1061.
2. Ponticelli C: Membranous nephropathy. J Nephrol 2007;20:268-287.
3. Beck LH Jr, Bonegio RG, Lambeau G, Beck DM, Powell DW, Cummins TD, JB Klein, DJ Salant: M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med 2009;361:11-21.
4. Alchi B, Jayne D: Membranoproliferative glomerulonephritis. Pediatr Nephrol 2010;25:1409-1418
5. Craven RA, Totty N, Harnden P, PJ Selby, RE Banks: Laser capture microdissection and two-dimensional polyacrylamide gel electrophoresis: evaluation of tissue preparation and sample limitations. Am J Pathol 2002;160:815-822.
6. Nagi AH, Kirkwood W: A quick method for the isolation of glomeruli from human kidney. J Clin Pathol 1972;25:361.
7. Yoshida Y, Miyazaki K, Kamiie J, Sato M, Okuizumi S, Kenmochi A, Kamijo K, Nabetani T, Tsugita A, Xu B, Zhang Y, Yaoita E, Osawa T, Yamamoto T: Two-dimensional electrophoretic profiling of normal human kidney glomerulus proteome and construction of an extensible markup language (XML)-based database. Proteomics 2005;5:1083-1096.
8. Katano M, Okamoto K, Arito M, Kawakami Y, Manae S Kurokawa MS, Suematsu N, Shimada S, Nakamura H, Yang X, Masuko K, Nishioka K, Yudoh K, Kato T: Implication of granulocyte-macrophage colony-stimulating factor induced neutrophil gelatinase-associated lipocalin in pathogenesis of rheumatoid arthritis revealed by proteome analysis. Arthritis Res Ther 2009;11:R3
9. J Charles, Jennette, Heptinstall, Robert H (eds.): Heptinstall`s pathology of the kidney. -6th ed. LIPPINCOTT WILLIAMS & WILKINS: Philadelphia, 2007.
10. Yoshida Y, Miyamoto M, Taguchi I, Xu Bo, Zhang Ying, Yaoita E, Fujinaka H, Ymamoto T: Human kidney glomerulus proteome and biomarker discovery of kidney diseases. Proteomics Clin 2008;2:420-427.
【技術分野】
【0001】
本発明は、腎臓の糸球体を単離する方法などに関する。
【背景技術】
【0002】
現在日本の維持透析患者は29万人存在し、毎年患者数は1万人ずつ増加している。透析導入原疾患に慢性糸球体腎炎の占める割合は高く、透析導入を防ぐためには腎炎の病因・病態を解明し、それに応じた治療を行うことが重要であると考えられる。
【0003】
糸球体腎炎(Glomerulonephritis、GN)(例、IgA腎症(非特許文献1、[1])、膜性腎症(非特許文献2、3、[2、3])および膜性増殖性GN(非特許文献4、[4])は、腎臓学の主要な疾患カテゴリーの1つである。GNの識別診断のためには、針腎生検は重要な検査法である。しかしながら、腎生検の重要性は診断の場面に限定されない。針腎生検検体は、診断のための情報だけではなく、GNの病因・病態を解明するのに多くの情報を提供し得る。
【0004】
現在、針腎生検検体の糸球体タンパク質はほとんどが免疫組織化学的に調査されており、生化学的には調査されていない。針腎生検検体は、糸球体の他にも尿細管や結合組織(例、赤血球)などの様々な構成成分を含むので、糸球体タンパク質の生化学的解析には針腎生検検体から糸球体を単離する必要がある。しかしながら、小さい針腎生検検体から糸球体を単離するのは困難であるという問題がある。
【0005】
針腎生検検体をスライスした組織切片から糸球体を回収する最近の技術であるレーザーマイクロダイセクション(laser microdissection、LMD)法(非特許文献5、[5])は、部分的に上述の問題を解決する。しかしながら、LMD法を行うにはレーザー照射装置など高価な器具が必要である。また、糸球体タンパク質の生化学的分析を行うには100スライス以上の組織切片が必要であるところ、100スライス以上の組織切片を作製するには長時間かかることに加え、1本の針腎生検検体から得られる組織切片はせいぜい30スライス程度であり、1本の針腎生検検体から生化学的分析には不十分な極めて少量の糸球体タンパク質しか得ることはできない。また、組織切片は、凍結した針腎生検検体をスライスすることで作製するので、凍結による糸球体タンパク質の変性の可能性も否定できない。さらに、レーザー照射によるタンパク質変性を無視することができない。したがって、針腎生検検体から効率的に糸球体を得る方法を、GNを患っている患者における糸球体タンパク質の生化学的解析のために確立することが望まれる。
【0006】
ここで、外科的腎切除検体から糸球体を単離する方法として、古典的なシービング法(非特許文献6、7、[6、7])が知られている。古典的なシービング法では外科的腎切除検体を、425μmメッシュ、250μmメッシュ、および150μmメッシュで順番に濾し、最後に150μmのメッシュ上に残った糸球体を回収する方法である。この古典的なシービング法は、金属シーブなどの安価な材料しか必要とせず、糸球体の単離作業に約1時間しか要しないが、約1g以上の外科的腎切除検体のブロックを必要とする。古典的なシービング法で用いる外科的腎切除検体は、癌の手術などにおいて腎臓の病変部およびその周囲組織を摘出した場合などに得られるものであるが、腎炎患者から外科的腎切除検体を入手することは極めて困難である。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Tumlin JA, Madaio MP, Hennigar R: Idiopathic IgA nephropathy: pathogenesis, histopathology, and therapeutic options. Clin J Am Soc Nephrol 2007;2: 1054-1061.
【非特許文献2】Ponticelli C: Membranous nephropathy. J Nephrol 2007;20:268-287.
【非特許文献3】Beck LH Jr, Bonegio RG, Lambeau G, Beck DM, Powell DW, Cummins TD, JB Klein, DJ Salant: M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med 2009;361:11-21.
【非特許文献4】Alchi B, Jayne D: Membranoproliferative glomerulonephritis. Pediatr Nephrol 2010;25:1409-1418
【非特許文献5】Craven RA, Totty N, Harnden P, PJ Selby, RE Banks: Laser capture microdissection and two-dimensional polyacrylamide gel electrophoresis: evaluation of tissue preparation and sample limitations. Am J Pathol 2002;160:815-822.
【非特許文献6】Nagi AH, Kirkwood W: A quick method for the isolation of glomeruli from human kidney. J Clin Pathol 1972;25:361.
【非特許文献7】Yoshida Y, Miyazaki K, Kamiie J, Sato M, Okuizumi S, Kenmochi A, Kamijo K, NabetaniT, Tsugita A, Xu B, Zhang Y, Yaoita E, Osawa T, Yamamoto T: Two-dimensional electrophoretic profiling of normal human kidney glomerulus proteome and construction of an extensible markup language (XML)-based database. Proteomics 2005;5:1083-1096.
【発明の概要】
【発明が解決しようとする課題】
【0008】
上記状況において、針腎生検検体から効率的に糸球体を単離する方法などが求められていた。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題を解決するために鋭意研究を重ねた結果、摘出腎臓検体から糸球体を単離する古典的なシービング法を改良することにより針腎生検検体から糸球体を単離することができることに想到し、本発明を完成するに至った。
【0010】
すなわち、本発明は、以下に示す、針腎生検検体から糸球体を単離する方法などを提供する。
[1] 針腎生検検体から糸球体を単離する方法であって、
(1)針腎生検検体を、針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュで濾す工程、
(2)第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す工程、
(3)第2のメッシュ上の画分を染色する工程、
(4)第2のメッシュから糸球体を回収する工程
を含む、前記方法。
[2] 前記第2のメッシュ上の画分の染色をトリパンブルーで行う、上記[1]に記載の方法。
[3] 前記第1のメッシュが、180μmのメッシュサイズである、上記[1]または[2]に記載の方法。
[4] 前記第2のメッシュが、75μmのメッシュサイズである、上記[1]〜[3]のいずれか1項に記載の方法。
[5] 前記針腎生検検体を第1のメッシュで濾す工程は、針腎生検検体を第1のメッシュ上でこすり、針腎生検検体の形を崩して行うものである、上記[1]〜[4]のいずれか1項に記載の方法。
[6] 前記針腎生検検体から糸球体を単離する全ての工程を4℃で行う、上記[1]〜[5]のいずれか1項に記載の方法。
[7] 前記針腎生検検体は未凍結のものである、上記[1]〜[6]のいずれか1項に記載の方法。
[8] 針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュと、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュと、糸球体を染色する染色材料とを含む、糸球体単離用キット。
[9] 上記[1]〜[7]のいずれか1項に記載の方法で単離した糸球体を用いることを含む、腎疾患の生化学的検査方法。
[10] 上記[1]〜[7]のいずれか1項に記載の方法で単離した糸球体を用いることを含む、腎疾患予防または治療薬のスクリーニング方法。
【発明の効果】
【0011】
本発明は、針腎生検検体から糸球体を単離する方法を提供する。本発明の方法によれば、針腎生検検体から効率よく糸球体を単離することができる。
【図面の簡単な説明】
【0012】
【図1】針腎生検検体から糸球体を単離する方法を示す概略図である。針腎生検検体を180μmメッシュで濾した(a)。糸球体は180μmメッシュを通過し、シービング画分に回収された。その後、シービング画分を75μmメッシュで再び濾した(b)。糸球体をメッシュ上の画分に回収した。メッシュ上の糸球体をトリパンブルーで染色し、メッシュを時計皿の上で反転させることで、染色した糸球体を時計皿上に集めた。
【図2】単離した糸球体の顕微鏡図である。マイクロシービング法により1本の針腎生検検体から単離した糸球体(a)、および古典的なシービング法により外科的腎切除検体から単離した糸球体(b)を0.5%(w/v)トリパンブルーで染色し、顕微鏡下(x100)で見た。横棒は200μmを表わす。
【図3】Cy3標識糸球体タンパク質の2次元電気泳動法(2−DE)像。Cy3標識糸球体タンパク質(2.5μg)を初めに等電点電気泳動、続いてSDS−PAGEを用いて展開した。マイクロシービング法により1本の針腎生検検体から(a)、また古典的なシービング法により外科的腎切除検体から(b)、糸球体タンパク質を単離した。
【発明を実施するための形態】
【0013】
以下、本発明について詳細に説明する。
本明細書に記載した全ての文献及び刊行物は、その目的にかかわらず参照によりその全体を本明細書に組み込むものとする。
【0014】
1.本発明の概要
針腎生検検体は糸球体腎炎の診断のためだけでなく、その病因・病態の調査のために重要である。針腎生検検体から糸球体を単離する方法として、マクロダイセクション法が知られているが、マイクロダイセクション法には、次のような問題がある。すなわち、器具が高価であり、組織切片の作製に長時間かかり、1本の針生検検体から生化学的分析に十分な量の糸球体を得ることができず、レーザー照射による糸球体タンパク質の変性の可能性がある。
【0015】
本発明者らは、これらの問題を克服するために、外科的切除腎検体から糸球体を単離する古典的なシービング法を改良し、針腎生検検体から糸球体を単離する本発明の方法を開発した。本発明の方法を、本明細書中ではマイクロシービング(micro−sieving)法と呼ぶ場合がある。
【0016】
マイクロシービング法は、針腎生検検体から糸球体を単離する方法であって、次の工程を含む(図1)。
(1)針腎生検検体を、針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュで濾す工程、
(2)第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す工程、
(3)第2のメッシュ上の画分を染色する工程、
(4)第2のメッシュから糸球体を回収する工程。
【0017】
後述の実施例では、マイクロシービング法により、構造を損なわずに糸球体を回収することが可能であった(図2(a))。また、1本の針腎生検検体から平均で55個の糸球体を1時間で単離することができた(表1)。針腎生検検体1本あたりの糸球体タンパク質の量(1検体から得られた糸球体数x1つの糸球体に含まれるタンパク質量)は平均で23μgであり(表1)、生化学的分析を行うのに十分な量の糸球体タンパク質を得ることができた。
【0018】
マイクロシービング法により単離した糸球体を用いて、本発明者らは、蛍光2次元電気泳動法(2−DE)により、糸球体腎炎を患っている各患者の糸球体タンパク質プロファイルを得ることができた(図3(a))。個々の患者の糸球体プロテオームを個別に決定することが可能であることが分かった。
【0019】
マイクロシービング法は針腎生検検体中の糸球体を解析する基本的な技術として広く用いることができる。
【0020】
2.針腎生検検体
針腎生検検体は、腎臓に中空の針を刺して採取した腎臓組織である。本発明で用いる針腎生検検体は、採取した腎臓組織の全部であってもよいし、あるいは、採取した腎臓組織のさらに一部でもよい。針腎生検検体は、糸球体腎炎などの腎疾患の診断のために採取することがあり、外科的腎切除検体と比較して、容易に入手することができる。本発明では、針腎生検検体として、腎疾患の診断を目的として採取した検体であって、診断後の余りの部分を用いるようにしてもよい。
【0021】
針腎生検検体は、ヒト由来のものや、ヒト以外の生物由来のもの、例えばウシ、サル、トリ、ネコ、マウス、ラット、モルモット、ハムスター、ブタ、イヌ、ウサギ、ヒツジ、ウマなどの非ヒト哺乳動物等由来のものであってよい。針腎生検検体は、好ましくは、ヒト由来のものである。
【0022】
針腎生検検体は、当分野で公知の方法で採取することができ、市販のキットを用いて採取してもよい。市販のキットとしては、Tru・CoreII(Medical Device Technology Inc.、Gainesville、Fla.、USA)、エースカット(TSK LABORATORY、 Tochigi、Japan)、ツルーカット スタンダード(CareFusion Co.、LTD.、Tokyo、Japan)などが例示される。採取に用いる針は、例えば、太さが16ゲージ〜18ゲージのものであり、好ましくは、16ゲージのものである。
【0023】
本発明では、針腎生検検体として、未凍結のものを用いるのが好ましい。未凍結の針生検検体を用いることで、凍結による糸球体タンパク質の変性の可能性を排除することができる。
【0024】
3.マイクロシービング法
3.1.第1のシービング
第1のシービングでは、針腎生検検体を、針腎生検検体中の尿細管、赤血球、糸球体を通す、第1のメッシュで濾す(図1(a))。
【0025】
第1のシービングで用いる針腎生検検体は、少なくとも1本(例えば、10本〜1本、5本〜1本、4本〜1本、3本〜1本、2本〜1本、1本)の針腎生検検体であり、好ましくは1本の針腎生検検体である。
【0026】
第1のメッシュは、針腎生検検体中の尿細管、赤血球、糸球体を通すものであればよい。糸球体は、ヒトの場合、直径が平均180〜200μmであり、針腎生検検体中の尿細管、赤血球は、それよりもさらに小さい。したがって、メッシュサイズは、例えば、300μm〜180μm、好ましくは、250μm〜180μm、さらに好ましくは、180μmとする。メッシュの材質としては、金属(例、ステンレス、鉄、硬鋼線)、合成繊維(例、ナイロン、ポリエステル、ポリエチレン、フッ素繊維、ポリプロピレン)などが挙げられる。第1のメッシュとして、市販のものを用いてもよい。
【0027】
ヒト以外の動物の針腎生検検体を用いる場合にも、その動物の尿細管、赤血球、および糸球体のサイズから、これらを通すメッシュサイズを適宜選択することができる。
【0028】
針腎生検検体を、第1のメッシュで濾す工程を、針腎生検検体を第1のメッシュ上でこすり、針腎生検検体の形を崩して行うのが好ましい。こする道具としては、例えば、薬さじ、ガラス棒などが挙げられる。
【0029】
第1のメッシュで濾した後、リン酸緩衝食塩水(PBS)などで第1のメッシュを洗浄するのが好ましい。
【0030】
第1のシービングにより第1のメッシュを通過したシービング画分には、尿細管、赤血球および糸球体が少なくとも含まれる。
【0031】
3.2.第2のシービング
第2のシービングでは、第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す(図1(b))。
【0032】
第2のメッシュは、尿細管および赤血球を通し、糸球体を通さないものであれよい。糸球体は、ヒトの場合、直径が平均180〜200μmであり、第1のシービングによるシービング画分中の尿細管および赤血球は、大きさが、おおよそ60μm〜8μmと考えられるので、メッシュサイズは、例えば、150μm〜65μm、好ましくは、100μ〜70μm、さらに好ましくは75μmとする。メッシュの材質としては、前記第1のメッシュで説明したものと同様のものが挙げられる。第2のメッシュとして、市販のものを用いてもよい。
尚、ヒトの尿細管は、直径が最大60μmで、全長が約50mmである。しかしながら、腎生検によって、尿細管の長さは分断され、更に第1のシービングによって更に細かく分断されるため、第1のシービングによるシービング画分中では、尿細管は、糸球体よりも小さく、例えば、おおよそ60μm以下の大きさになると考えられる。
【0033】
ヒト以外の動物の針腎生検検体を用いる場合にも、その動物の尿細管、赤血球、および糸球体のサイズから、尿細管および赤血球を通すが、糸球体を通さないメッシュサイズを適宜選択することができる。
【0034】
第2のメッシュで濾した後、リン酸緩衝食塩水(PBS)などで第2のメッシュを洗浄するのが好ましい。
【0035】
第2のシービングにより第2のメッシュを通過したシービング画分には、尿細管および赤血球が少なくとも含まれる。一方、第2のメッシュ上の画分には、糸球体が少なくとも含まれる。
【0036】
3.3.染色
本発明では、第2のメッシュ上の画分を染色する(図1(b))。染色により第2のメッシュ上の糸球体の視認性を高めることができることなどから、糸球体の回収効率が上がる。
【0037】
染色は、糸球体を染色することができる公知の染色材料を用いて行う。染色材料として、糸球体タンパク質の生化学的分析に影響が少ない材料を用いるのが好ましい。そのような染色材料としては、例えば、トリパンブルー;チュルク液;例えばナショナルファストブルー、アルシアンブルー8GX、アルシアンブルー8GS、アストラブルー等のフタロシアニン系色素を用いる染色液;例えばピロニンB、ピロニンG等のキサンテン系色素を用いる染色液;例えばクリスタルバイオレット、ゲンチアナバイオレット等のパラロサニリン色素を用いる染色液;例えばサフラニン、フクシン、メチレンブルー、メチルバイオレット、エオジン、ビスマルクブラウン、クリソイジン、ヘマトキシリン、アニリンブルー、オレンジG、ビクトリアブルー、ライトグリーン、ベルリンブルー、クレシルバイオレット等の色素を用いる染色液;パパニコロウ染色法用染色液;ギムザ染色法用染色液;ヘマトキシリン・エオジン重染色法用染色液;PAS(periodic acid Schiff)染色法用染色液;Sternheimer−Malbin法用染色液;Sternheimer法用染色液;Sudan III染色法用染色液;Prescott-Brodie染色法用染色液;Berlin Blue染色法用染色液;などが挙げられ、好ましくは、トリパンブルーが挙げられる。トリパンブルーで染色した場合、続く工程で、例えば、第2のメッシュを反転させて糸球体を回収するときなどに糸球体のメッシュ離れがよくなり、糸球体の回収効率がより一層高くなるという利点がある。
【0038】
染色により、第2のメッシュ上には、染色した糸球体を含む画分が生成する。
【0039】
3.4.回収・単離
本発明では、第2のメッシュから糸球体を回収する(図1(c))。
【0040】
このとき、第2のメッシュを反転させて、染色した糸球体を含む第2のメッシュ上の画分を回収し、染色した糸球体を単離するのが好ましい。第2のメッシュを反転させたときに、第2のメッシュ上の画分を受ける容器として、例えば、時計皿、シャーレ、ファルコンチューブなどを用いてよい。好ましくは、時計皿を用いる。時計皿により、第2のメッシュから落ちてきた糸球体を時計皿の中央に集めることができる。
【0041】
本工程により、染色した糸球体が回収・単離される。
【0042】
マイクロシービング法では、針腎生検検体から糸球体を単離する全ての工程を、針腎生検検体のプロテアーゼの影響を最小限に抑えて糸球体タンパク質の分解を防ぐことのできる温度下で行うのが好ましい。具体的には、例えば、8℃〜2℃、好ましくは、5℃〜3℃、より好ましくは、4℃で行う。マイクロシービング法で用いる、試薬、器具等も、予め氷冷したり、上記温度に冷却しておくのが好ましい。
【0043】
上記マイクロシービング法によれば、腎生検検体から糸球体を、比較的短時間(例えば、約1時間)で効率よく単離することができる。
【0044】
このように単離した糸球体は、生化学的分析、例えば、プロテオーム解析やRNA解析による糸球体腎炎の病因・病態解析などに用いることができる。また、単離した糸球体は、腎疾患の生化学的検査方法、および腎疾患予防または治療薬のスクリーニング方法にて用いることもできる。
【0045】
4.糸球体単離用キット
本発明は、糸球体単離用キットを提供する。本発明の糸球体単離用キットは、上記マイクロシービング法で用いることができる。
本発明の糸球体単離用キットには、(i)針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュと、(ii)第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュと、(iii)糸球体を染色する染色材料とが含まれる。第1のメッシュ、第2のメッシュ、および染色材料は、上記説明したのと同様である。
【0046】
本発明のキットには、さらに、マイクロシービング法についての実験操作説明書が含まれていてよい。また、上記マイクロシービング法で説明した、緩衝液、各種容器、などが含まれていてよい。
【0047】
5.腎疾患の生化学的検査方法
本発明は、上記マイクロシービング法で単離した糸球体を用いることを含む、腎疾患の生化学的検査方法を提供する。
本発明の生化学的検査方法において「単離した糸球体を用いる」ことには、腎疾患の病因・病態と関連がある糸球体内の物質(例、ペプチド、タンパク質、DNA、RNAなど)を検出することなどが含まれる。「腎疾患の病因・病態と関連がある糸球体内の物質」としては、塩基性繊維芽細胞増殖因子(bFGF)、繊維芽細胞成長因子(FGF)、腫瘍壊死因子(TNF-α)、血小板由来増殖因子(PDGF)、血管内皮細胞接着分子(ICAM-1)、インスリン様成長因子(IGF-1 )、フィブロネクチン、インテグリンα5、各種コラーゲン(I、III、IV、VI)、結合組織成長因子(CTGF)などの組織繊維化因子、例えばp53、p21などの細胞周期関連因子、例えば組織因子 (TF)、メタロプロテアーゼなどの血栓関連因子等が挙げられる。これらの物質は、公知の方法にて検出することができる。
そして、腎疾患の病因・病態と関連がある糸球体内の物質が、正常値と比較して増減したとき、例えば、正常値と比較して、10%以上、好ましくは30%以上、より好ましくは50%以上、増減したとき、腎疾患である、と判断することができる。
【0048】
6.腎疾患予防または治療薬のスクリーニング方法
本発明は、上記マイクロシービング法で単離した糸球体を用いることを含む、腎疾患の予防または治療薬のスクリーニング方法を提供する。
本発明のスクリーニング方法において「単離した糸球体を用いる」ことには、例えば、単離した糸球体に被検物質を接触させて、該接触により糸球体内で発現量又は活性が増減する物質を検出することなどが含まれる。ここで、「被検物質」は、ペプチド、タンパク質、合成化合物(低分子化合物等)などのいずれであってもよい。「接触」とは、糸球体と被検物質とを、同一の培養系に存在させることなどを意味する。
より具体的には、腎疾患を患っている対象由来の糸球体と被検物質とを接触させた場合の糸球体内の所定物質の発現量又は活性を測定し、腎疾患を患っている対象の糸球体と被検物質とを接触させない場合の糸球体内の前記所定物質の発現量又は活性を測定し、両者を比較する。ここで、「対象」は、ヒトや、ヒト以外の生物、例えばウシ、サル、トリ、ネコ、マウス、ラット、モルモット、ハムスター、ブタ、イヌ、ウサギ、ヒツジ、ウマなどの非ヒト哺乳動物等である。「所定物質」は、腎疾患の病因・病態と関連がある糸球体内の物質(例、ペプチド、タンパク質、DNA、RNAなど)である。「腎疾患の病因・病態と関連がある糸球体内の物質」は、より具体的には、前記したものが挙げられる。
比較の結果、糸球体内で所定物質の発現量又は活性が増減する物質を、腎疾患の予防または治療薬の候補薬として選択する。より具体的には、糸球体内で所定物質の発現量又は活性が、10%以上、好ましくは30%以上、より好ましくは50%以上、増減する物質を、腎疾患の予防または治療薬の候補薬として選択する。
当該候補薬については、さらに、腎疾患病態モデル等において腎疾患の予防または治療効果を確認するようにしてもよい。そして、腎疾患病態モデル等において腎疾患の予防または治療効果が確認できた候補薬を、腎疾患予防または治療薬として選択するようにしてよい。
【0049】
以下、本発明を下記の実施例を参照してより詳細に説明するが、本発明はこの実施例に限定されない。
【実施例】
【0050】
方法
ヒト針腎生検検体および切除検体
4本の針腎生検検体を4人の腎臓病患者から得た(IgA沈着、軽鎖沈着、膜性増殖性GN、および膜性腎症)。針腎生検を、16ゲージの針を有する自動生検装置Tru・CoreII(Medical Device Technology Inc.、Gainesville、Fla.、USA)を用いて行った。古典的なシービング法に関して、通常の腎皮質を腎細胞癌を有する2人の患者から外科的に切除して、2つの外科的切除腎検体を得た。本研究は、聖マリアンナ医科大学の学内の生命倫理委員会の承認を得た。インフォームドコンセントを各患者から文書で得た。
【0051】
ヒト針腎生検検体からの糸球体の単離
針腎生検検体を得た直後から糸球体の単離を開始した。針腎生検検体を180μmメッシュ(Tokyo Screen Co.Ltd.、Tokyo、Japan)上に置き、薬さじの先端でこすり、針腎生検検体の形をくずした後、10mlの氷冷リン酸緩衝食塩水(PBS)で洗浄した。シービング画分を75μmメッシュ(Tokyo Screen Co.Ltd.、Tokyo、Japan)で再び濾した後、20mlの氷冷PBSで洗浄した。糸球体を75μmメッシュで回収した。メッシュ上で、糸球体を0.5%(w/v) トリパンブルー(Boehringer Mannheim GmbH、Mannheim、Germany)で染色し、その後、20mlの氷冷PBSで洗浄した。その後、75μmメッシュを時計皿上で反転させた。糸球体を時計皿上で10ml氷冷PBSを用いて洗浄し、時計皿の中心に集めた。混入したプロテアーゼの影響を最小限に抑えるため全ての作業を4℃で行った。シービングメッシュ、薬さじ、時計皿およびパスツールピペットを含む全ての道具を使用直前に4℃で冷却した。糸球体の数は顕微鏡下でカウントした。染色した糸球体を1.5ml試験管に移してから、パスツールピペットで1つずつ取り出した。単離した糸球体を遠心分離(2,500g、5分、4℃)で集め、30mM Tris−HCl(pH8.0)、4%(v/v) 3−((3−Cholamidopropyl)dimetylammonio)propanesulfonate(CHAPS)、7M ureaおよび2M thioureaを含む溶解緩衝液(lysis buffer)中に溶解した。ライセートを遠心分離(20,000g、30分、4℃)し、得られた上澄み画分を使用までの間、−80℃で保管した。
【0052】
糸球体タンパク質の2次元電気泳動(2−DE)
2−DE解析のために、2.5μgのタンパク質を、以前に記載されている通りに4pmolの蛍光シアニン染色(Cy3)で標識した[8]。IPGphor(GE Healthcare UK Ltd、UK)を用いての等電点電気泳動(IEF)のために、標識したタンパク質をpH3〜11の範囲のpHの24cm Immobine Dry−Strip(GE Healthcare UK Ltd、UK)に添加した。IEF後、そのImmobine Dry−Stripを以前に記載されている通りに[8]、12.5% SDS−PAGEスラブゲルの上に置いた。分離した標識タンパク質を画像分析機(Typoon9400Imager、GE Healthcare UK Ltd、UK)を用いて100μmの解像度でスキャンした。得られたゲルイメージをProgenesis software(Perkin Elmer、Wellesley、Mass.、USA)を用いて解析した。
【0053】
ブタ針腎生検検体からの糸球体の単離
ブタ針腎生検検体を、16ゲージの針を有する自動生検装置Tru・CoreII(Medical Device Technology Inc.,Gainesville、Fla.、USA)を用いて採取した。
【0054】
ブタ針腎生検検体を1度に2本使用したことを除いて上記ヒト針腎生検検体からの糸球体の単離と同様の手順にてトリパンブルーで染色した糸球体を単離した。時計皿の中心に集めた染色糸球体の数を顕微鏡下でカウントした。
【0055】
一方、ブタ針腎生検検体を1度に2本使用し、かつトリパンブルー染色を行わなかったことを除いて上記ヒト針腎生検検体からの糸球体の単離と同様の手順にてトリパンブルーで染色しない糸球体も単離した。時計皿の中心に集めた未染色糸球体の数を顕微鏡下でカウントした。
【0056】
結果および考察
マイクロシービング法は針腎生検検体から糸球体を単離する方法であり、外科的切除腎検体から糸球体を単離する古典的なシービング法を基にして開発した。マイクロシービング法の手順のスキーマを図1に示す。図1では、1本の針腎生検検体をメッシュサイズ180μmのメッシュ上に置いた。ヒト糸球体の直径は180〜200μmであるので[9]、糸球体は、針腎生検検体を優しくこすってその形を崩し、メッシュを洗浄することにより腎尿細管や赤血球のような小さな構成成分とともに濾した分画に移動した。一方、メッシュ上には、メッシュを通過しない組織残渣が残った。次いで、シービング画分を75μmメッシュ上に置いた。その後、PBSでよく洗浄することによって小さな構成成分をシービング画分へと回収した。糸球体を75μmメッシュ上に回収した。回収した糸球体を、0.5%(w/v)トリパンブルーで染色し、時計皿に集め、カウントし、1.5ml試験管に回収した。この手順には1時間を要した。外科的切除腎検体から糸球体を単離する古典的なシービング法では、3つのメッシュ(425μmメッシュ、250μmメッシュ、および150μmメッシュ)を用いる。しかしながら、本発明者らは、針腎生検検体から糸球体を単離するには、2種類のメッシュを使用すれば十分であることを見出した。トリパンブルー染色糸球体を確認し、顕微鏡でその外観をチェックした。図2(a)に示すように、糸球体は直径約200μmの球状に見え、目に見える破損は観察されなかった。これと同時に、外科的切除腎検体から糸球体を単離する古典的なシービング法を行った(図2(b))。マイクロシービング法により針腎生検検体から単離した糸球体は古典的なシービング法により外科的切除腎検体から単離したものと区別できなかった(図2)。さらに、マイクロシービング法により単離した糸球体では、古典的なシービング法により得たものと比較して混入したデブリが少ないようであった(図2)。顕微鏡観察下でパスツールピペットを用いて無傷の糸球体のみを回収したので、尿細管の混入を無視することができた。このことは、針腎生検検体から糸球体を首尾よく回収したことを示している。本発明者らはマイクロシービング法を合計で4つの針腎生検検体に適用した。ここで、表1に、マイクロシービング法と古典的なシービング法により単離した糸球体の数を示す。表1に示したように、マイクロシービング法により平均で55個の糸球体を1つの針腎生検検体から回収した。この数の糸球体を2−DE解析によるタンパク質解析のために溶解バッファーに溶解し、平均23μgのタンパク質を各糸球体検体から抽出した。マイクロシービング法により単離した糸球体1つあたりに含まれるタンパク質量は、0.4μg前後であり、古典的なシービング法により単離した糸球体1つあたりのタンパク質量と同程度であった。
【0057】
【表1】

【0058】
マイクロシービング法を用いて、本発明者らはGNの4患者の各々から2−DEにより糸球体タンパク質プロファイルを得ようとした。これは、2−DEによるタンパク質プロファイルがタンパク質を解析する最も有用な方法の1つであるからである。針腎生検検体由来の糸球体から抽出したタンパク質(2.5μg)をCy3で標識し、2−DEにより分離した。代表的な結果を図3(a)に示す。本発明者らは、1本の針腎生検検体由来の糸球体タンパク質から鮮明な2−DEイメージを首尾よく得た。各患者の1本の針腎生検検体から大きな労力を使うことなくタンパク質プロファイルを得ることを、本発明者らの知る限りでは、マイクロシービング法により初めて可能とした。加えて、同時に、本発明者らは、古典的なシービング法により外科的切除腎検体から単離した糸球体由来のタンパク質を用いて2−DEを行った。マイクロシービング法により得たタンパク質の2−DEイメージは古典的なシービング法によるものと似ていた(図3(b))。ここで、表2に、マイクロシービング法および古典的なシービング法により得られた糸球体タンパク質の2−DE上のスポットの数を示す。表2に示したように、1本の生検検体由来の糸球体と外科的切除腎臓検体由来の糸球体との間で似たような数のタンパク質スポット(約1000個)を2−DEイメージで検出した。
【0059】
【表2】

【0060】
2本のブタ針腎生検検体から、マイクロシービング法により糸球体を単離した。このマイクロシービング法には、トリパンブルーによる染色工程が含まれているため、糸球体は、トリパンブルーにより染色された。染色した糸球体を92〜96個回収できた(表3)。一方、マイクロシービング法から染色工程のみを省いた方法にて、2本のブタ針腎生検検体から未染色の糸球体を単離したところ、未染色糸球体は8〜9個しか回収できなかった(表3)。すなわち、回収できた未染色糸球体の量は、染色糸球体の量の約10分の1であった(表3)。この結果から、針腎生検検体からの糸球体の回収率を上げるには、マイクロシービング法において染色工程が重要であることが分かる。
【0061】
【表3】

【0062】
ここで、針腎生検検体をレーザーマイクロダイセクション(LMD)法を用いて単離することができる。局所的な糸球体疾患の所定の病理変化を有する糸球体をLMDにより隔離すること、例えば、局所的な糸球体硬化症における硬化した糸球体を避けることができる。さらに、通常行う病理学的評価の後に残された針腎生検検体の糸球体をLMD法を用いて解析することができ、したがって、針腎生検で追加の組織検体を入手する必要がない。しかしながら、LMDには克服すべき致命的な問題、すなわち、得られるタンパク質の量とレーザー照射によるタンパク質の変性の点に問題がある。例えば、Yoshidaら[10]は、10μmの厚さの凍結切片からLMDにより得られた1つの糸球体切片のタンパク質量が53.2±5ngであると計算したことを報告した。高感度2−DE解析でさえ2.5〜5.0μgの糸球体タンパク質が必要であるので、生化学的解析には1本の生検検体につき100個以上のスライスが必要となる。後者の問題を考慮すると、現在、レーザーによる糸球体タンパク質の変性を避けることはできないようである。これに対して、本発明の方法では、針腎生検検体から糸球体を糸球体にほとんどダメージを与えることなく短時間(例、1時間)で得ることができる。さらに、入手可能なタンパク質の量は2−DE解析の約10回分である。まとめると、ここに記載したマイクロシービング法は、例えば、GNなどの腎疾患を患っている各患者の糸球体タンパク質の調査(例、糸球体プロテオーム解析)のための標準的な方法になり得る。
【0063】
[参考文献]
1. Tumlin JA, Madaio MP, Hennigar R: Idiopathic IgA nephropathy: pathogenesis, histopathology, and therapeutic options. Clin J Am Soc Nephrol 2007;2: 1054-1061.
2. Ponticelli C: Membranous nephropathy. J Nephrol 2007;20:268-287.
3. Beck LH Jr, Bonegio RG, Lambeau G, Beck DM, Powell DW, Cummins TD, JB Klein, DJ Salant: M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med 2009;361:11-21.
4. Alchi B, Jayne D: Membranoproliferative glomerulonephritis. Pediatr Nephrol 2010;25:1409-1418
5. Craven RA, Totty N, Harnden P, PJ Selby, RE Banks: Laser capture microdissection and two-dimensional polyacrylamide gel electrophoresis: evaluation of tissue preparation and sample limitations. Am J Pathol 2002;160:815-822.
6. Nagi AH, Kirkwood W: A quick method for the isolation of glomeruli from human kidney. J Clin Pathol 1972;25:361.
7. Yoshida Y, Miyazaki K, Kamiie J, Sato M, Okuizumi S, Kenmochi A, Kamijo K, Nabetani T, Tsugita A, Xu B, Zhang Y, Yaoita E, Osawa T, Yamamoto T: Two-dimensional electrophoretic profiling of normal human kidney glomerulus proteome and construction of an extensible markup language (XML)-based database. Proteomics 2005;5:1083-1096.
8. Katano M, Okamoto K, Arito M, Kawakami Y, Manae S Kurokawa MS, Suematsu N, Shimada S, Nakamura H, Yang X, Masuko K, Nishioka K, Yudoh K, Kato T: Implication of granulocyte-macrophage colony-stimulating factor induced neutrophil gelatinase-associated lipocalin in pathogenesis of rheumatoid arthritis revealed by proteome analysis. Arthritis Res Ther 2009;11:R3
9. J Charles, Jennette, Heptinstall, Robert H (eds.): Heptinstall`s pathology of the kidney. -6th ed. LIPPINCOTT WILLIAMS & WILKINS: Philadelphia, 2007.
10. Yoshida Y, Miyamoto M, Taguchi I, Xu Bo, Zhang Ying, Yaoita E, Fujinaka H, Ymamoto T: Human kidney glomerulus proteome and biomarker discovery of kidney diseases. Proteomics Clin 2008;2:420-427.
【特許請求の範囲】
【請求項1】
針腎生検検体から糸球体を単離する方法であって、
(1)針腎生検検体を、針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュで濾す工程、
(2)第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す工程、
(3)第2のメッシュ上の画分を染色する工程、
(4)第2のメッシュから糸球体を回収する工程
を含む、前記方法。
【請求項2】
前記第2のメッシュ上の画分の染色をトリパンブルーで行う、請求項1に記載の方法。
【請求項3】
前記第1のメッシュが、180μmのメッシュサイズである、請求項1または2に記載の方法。
【請求項4】
前記第2のメッシュが、75μmのメッシュサイズである、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記針腎生検検体を第1のメッシュで濾す工程は、針腎生検検体を第1のメッシュ上でこすり、針腎生検検体の形を崩して行うものである、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記針腎生検検体から糸球体を単離する全ての工程を4℃で行う、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記針腎生検検体は未凍結のものである、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュと、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュと、糸球体を染色する染色材料とを含む、糸球体単離用キット。
【請求項9】
請求項1〜7のいずれか1項に記載の方法で単離した糸球体を用いることを含む、腎疾患の生化学的検査方法。
【請求項10】
請求項1〜7のいずれか1項に記載の方法で単離した糸球体を用いることを含む、腎疾患予防または治療薬のスクリーニング方法。
【請求項1】
針腎生検検体から糸球体を単離する方法であって、
(1)針腎生検検体を、針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュで濾す工程、
(2)第1のメッシュを通過したシービング画分を、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュで濾す工程、
(3)第2のメッシュ上の画分を染色する工程、
(4)第2のメッシュから糸球体を回収する工程
を含む、前記方法。
【請求項2】
前記第2のメッシュ上の画分の染色をトリパンブルーで行う、請求項1に記載の方法。
【請求項3】
前記第1のメッシュが、180μmのメッシュサイズである、請求項1または2に記載の方法。
【請求項4】
前記第2のメッシュが、75μmのメッシュサイズである、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記針腎生検検体を第1のメッシュで濾す工程は、針腎生検検体を第1のメッシュ上でこすり、針腎生検検体の形を崩して行うものである、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記針腎生検検体から糸球体を単離する全ての工程を4℃で行う、請求項1〜5のいずれか1項に記載の方法。
【請求項7】
前記針腎生検検体は未凍結のものである、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
針腎生検検体中の尿細管、赤血球および糸球体を少なくとも通す第1のメッシュと、第1のメッシュよりも細かい目開きで、尿細管および赤血球を少なくとも通すが糸球体を通さない第2のメッシュと、糸球体を染色する染色材料とを含む、糸球体単離用キット。
【請求項9】
請求項1〜7のいずれか1項に記載の方法で単離した糸球体を用いることを含む、腎疾患の生化学的検査方法。
【請求項10】
請求項1〜7のいずれか1項に記載の方法で単離した糸球体を用いることを含む、腎疾患予防または治療薬のスクリーニング方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−50358(P2012−50358A)
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願番号】特願2010−193841(P2010−193841)
【出願日】平成22年8月31日(2010.8.31)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 日本ヒトプロテオーム機構 第8回大会 (日本プロテオーム学会2010年会) 第6回日本臨床プロテオーム研究会 連合大会 プログラム・抄録集、日本腎臓学会誌 第52巻・第3号 学術総会号、ネフロン クリニカル プラクティス(Nephron Clinical Practice) 2011;117:c225−c229
【出願人】(596165589)学校法人 聖マリアンナ医科大学 (53)
【Fターム(参考)】
【公開日】平成24年3月15日(2012.3.15)
【国際特許分類】
【出願日】平成22年8月31日(2010.8.31)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 日本ヒトプロテオーム機構 第8回大会 (日本プロテオーム学会2010年会) 第6回日本臨床プロテオーム研究会 連合大会 プログラム・抄録集、日本腎臓学会誌 第52巻・第3号 学術総会号、ネフロン クリニカル プラクティス(Nephron Clinical Practice) 2011;117:c225−c229
【出願人】(596165589)学校法人 聖マリアンナ医科大学 (53)
【Fターム(参考)】
[ Back to top ]

