銀イオン化植物抽出液およびその用途
本発明は、銀イオン化植物抽出液およびその用途を開示する。具体的に、本発明は、電解液としての植物抽出液で電気分解によって銀をイオン化させて得られる銀イオン化植物抽出液、および前記銀イオン化植物抽出液を含む抗微生物性組成物を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、銀イオン化植物抽出液およびその用途に係り、より詳しくは、電解液としての植物抽出液で電気分解によって銀をイオン化させて得られる銀イオン化植物抽出液およびこれを含む抗微生物性組成物に関する。
【背景技術】
【0002】
銀は、様々な古典文献に言及されているとおり、広範囲な抗微生物効果を持つものと古来から知られてきた金属である。よって、銀は、実生活において、例えばさじなどの食器の製作にも用いられてきた。
【0003】
銀が抗微生物効果を持つとすれば、実際、抗微生物作用をするものは銀から発せられる銀イオン(Ag+)であるから、銀イオン水をより容易且つ大量に製造するための多くの方法が提案されてきた。例えば、韓国公開特許第10−2003−0090466号(発明の名称:銀イオン水製造機)や韓国公開特許第10−2005−0001240号(発明の名称:銀イオン水製造装置)などが、銀イオン水の製造に関連した技術である。
【0004】
一方、植物抽出物は、その植物の種類および抽出方法を問わず、一般に強弱の程度差異はあるが、ある程度の抗微生物性を持つと知られている[Hori Y, Sato S, Hatai A. Antibacterial activity of plant extracts from azuki beans (Vigna angularis) in vitro. Phytother Res. 2006 Jan 27;20(2):162-164; Ravikumar S, Nazar S, Nuralshiefa A, Abideen S. Antibacterial activity of traditional therapeutic coastal medicinal plants against some pathogens. J Environ Biol. 2005 Jun;26(2 Suppl):383-6; Bandyopadhyay D, Chatterjee TK, Dasgupta A, Lourduraja J, Dastidar SG. In vitro and in vivo antimicrobial action of tea: the commonest beverage of Asia. Biol Pharm Bull. 2005 Nov;28(11):2125-7]。
【0005】
本発明者らは、銀の抗微生物効果と植物抽出物の一般的な抗微生物効果に着眼し、銀を液状の植物抽出物(植物抽出液)で電気分解によってイオン化させたところ、その結果物である銀イオン化植物抽出液が非常に高い抗微生物効果を持つという事実を確認することにより、本発明を完成するに至った。
【発明の開示】
【発明が解決しようとする課題】
【0006】
そこで、本発明の目的は、銀を植物抽出液で電気分解させて得られる銀イオン化植物抽出液を提供することにある。
本発明の他の目的は、前記銀イオン化植物抽出液を含む抗微生物性組成物を提供することにある。
本発明のその他の目的および具体的な様態などは、以下に提示される。
【課題を解決するための手段】
【0007】
本発明のある観点によれば、銀イオン化植物抽出液を提供する。本発明の銀イオン化植物抽出液とは、電解液(電気分解するとき、電解槽に入れてイオン伝導の媒体の役割をする溶液)である植物抽出液で銀を電気分解によってイオン化させて得られたものをいう。
【0008】
本発明者らは、下記実施例および実験例から確認されるように、電解槽に電解液としての植物抽出液(具体的には竹抽出液、木草液(オーク抽出液)、松抽出液、コノテガシワ抽出液、海藻類抽出液)を入れて2本の銀電極棒に電源を連結して銀イオン化を誘導し、その得られた結果物に対する抗微生物効果を実験したところ、その結果物が電解液として用いられた植物抽出液または銀イオン水(植物抽出液の代わりに3次蒸留水を用いて銀を電気分解させて得られた結果物)に比べて相乗的な抗微生物効果を示すことを確認することができた。
したがって、本発明の銀イオン化植物抽出液は、より具体的には、電解液としての植物抽出液で銀を電気分解によってイオン化させて得られたものであって、抗微生物性を持つものと説明できる。
【0009】
ここで、前記「抗微生物性」の意味、「微生物」の意味およびその「微生物の範囲」については、下記本発明の抗微生物性組成物に関連して後述する内容がそのまま適用できる。
【0010】
一方、本発明の銀イオン化植物抽出液は、2本の銀電極棒に電源を連結して電気分解によって電解液としての植物抽出液で銀をイオン化させて得られたものであって、電気分解は、植物抽出液を電解液として銀がイオン化できるように行われるだけでよい。
よって、銀イオン化が発生する(+)電極は、銀を含有する導体でなければならないが、(−)電極は、必ずしも銀を含有する導体である必要はなく、金属や黒鉛などの導体であるだけでよい。
【0011】
また、(+)電極が銀含有導体であれば、それが銀を含有する程度、すなわち銀の純度は特に問題とならない。それは、銀の純度が低くても、電気分解の際に高電圧をかけると、容易に銀イオン化を誘導することができるというのが当業界に公知になっているためである。但し、得られる銀イオン化植物抽出液が持つ抗微生物活性の側面からみては、銀の純度が高いほど好ましいであろう。
【0012】
また、電気分解時の電圧または電気分解時間は、銀イオン化が誘導される程度であれば、いずれの電圧でもいずれの時間でも構わないが、下記実験例は、電圧が高いほど且つ電気分解時間が長いほど、全般的に抗微生物効果が高くなる結果を示すという点において、前記電気分解時の電圧が高いほど且つ電気分解時間が長いほど好ましい(下記実験例1−4、実験例2−4、表5および表8参照)。
【0013】
一方、本発明の銀イオン化植物抽出液において、電解液としての植物抽出液は液体状の植物抽出物であればよい。植物抽出物の最初得られた形態が液体状であれば、その状態そのままを電解液として使用できるが、固体状であれば、蒸留水、水、アルコールなど電解液として使用できる任意の適切な溶媒で希釈して使用することができる。液体状の植物抽出物も植物抽出液の種類に応じて適切な溶媒で希釈して使用することが好ましい。
【0014】
一方、本発明者らによって選定された全ての植物抽出液が銀イオン化されたときに高い抗微生物性を持つという点において、前記植物抽出液は、それが得られる植物の種類を問わないものと理解できる。よって、分類学上「植物」に分類されるものであれば、それから得られる全ての抽出液が前記本発明の銀イオン化植物抽出液の製造において電解液として使用できる。
【0015】
分類学上「植物」に分類されるものとは、細胞膜の外側に細胞壁があり、光合成能力があって独立栄養生活能力を備えるものをいうが、例えば、藻類(藍藻類(Cyanophyta)、クリプト藻類(Cryptophyta)、黄金色藻類(Chrysophyta)、珪藻類(Bacillariophyta)、褐藻類(Phaeophyta)、紅藻類(Rholophyta)、緑藻類(Chlorophyta)、車軸藻類(Charophyta)、蘚苔植物(Bryophyta)、羊歯(Pteridophyta)、種子植物(Spermatophyta)(被子植物(Angiospermae)と裸子植物(Gymnospermae))などが含まれる。
【0016】
一方、松抽出液の場合、本発明者らによって選定されたいずれの微生物に対しても抗微生物性を示していないが、それを電解液として用いて得られた銀イオン化松抽出液の場合は、本発明者らによって選定された全ての微生物に対して非常に高い抗微生物性を示した(下記実験例3および表9参照)。そして、コノテガシワまたは海藻類抽出液の場合も、本発明者らによって選定された微生物のうち特定の幾つかの微生物に対してのみ弱い抗微生物性を示したが、前記抽出液を電解液として用いて銀イオン化させたときは、その結果物が、本発明者らによって選定された全ての微生物に対して非常に高い抗微生物性を示した(下記実験例4、実験例5、表10および表11参照)。
したがって、本発明の銀イオン化植物抽出液の製造において、電解液として用いる植物抽出液はそれがもともと抗微生物効果を持つかを問わないものと理解されるべきである。
【0017】
一方、植物抽出液は、植物を抽出対象とする限りはその抽出方法を問わないものと理解されるべきである。
一般に、植物抽出液を得る方法は4つに分類できるが、一つ目は植物に直・間接的に熱を加え、エキスタイプの植物抽出液を得る第1方法であり、二つ目は生きている植物の上部を切り、流れてくるエキスを得る第2方法であり、三つ目は植物を抽出溶媒(例えば、メタノール、蒸留水、エタノール、アセトン、酢酸エチル、飽和n−ブタノール、クロロホルム、塩化メチレン、水、またはこれらの混合溶媒)で抽出して得る第3方法であり、四つ目は植物を乾燥させた後、乾燥した植物を燃焼させ、燃焼の際に発生する気体を冷却させて得る第4方法である。
通常、前記第1方法、第2方法および第4方法は木質部(Xylem)を持つ植物への適用に適する方法であり、第3方法は全ての植物に対して適用できる方法である。
【0018】
本発明の下記参考例から得られた植物抽出液は、前記第1方法、第2方法(海藻類抽出液)および第4方法によって得られたものであるが、前記第3方法も本発明の銀イオン化植物抽出液の製造に電解液として使用でき、下記実験例では開示されていないが、実際、本発明者らが鋸屑状の竹を70%エタノールで抽出した後、凍結乾燥した粉末状の抽出物を3次蒸留水に溶解させ、それを電解液として用いて銀イオン化させたところ、その結果物が高い抗微生物性効果を持つことを確認することができた。
したがって、本発明の銀イオン化植物抽出液の製造において、電解液として用いられる植物抽出液は、それが得られる抽出方法を問わないものと理解されるべきである。
【0019】
一方、前述したように、植物抽出液は、それが得られる植物の種類と抽出方法を問わないが、好ましくは下記参考例に使用された植物、すなわち竹、オーク、松、コノテガシワ、海藻類を有し、前述した4つの抽出方法のうち任意の抽出方法を用いて得られる抽出液を意味し、さらに好ましくは前述した4つの抽出方法のうち第1、第2または第4の方法を用いて得られた抽出液を意味する。
ここで、海藻類とは、海で棲息する藻類(褐藻類、緑藻類、紅藻類などを含む)を意味し、竹、オーク、松、コノテガシワとは、その具体的な種類を問わず、分類学上それぞれ竹、オーク、松、コノテガシワに分類される植物を意味する。
【0020】
本発明の他の観点によれば、銀イオン化植物抽出液の製造方法を提供する。前記本発明の銀イオン化植物抽出液の製造方法は、電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする。
【0021】
本発明の別の観点によれば、抗微生物性を持つ植物抽出液の抗微生物性を高める方法を提供する。前記本発明の抗微生物性を持つ植物抽出液の抗微生物性を高める方法は、電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする。
【0022】
本発明の別の観点によれば、抗微生物性のない植物抽出液に抗微生物性を付加する方法を提供する。前記本発明の抗微生物性のない植物抽出液に抗微生物性を付加する方法は、電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする。
【0023】
前記本発明の銀イオン化植物抽出液の製造方法、抗微生物性を持つ植物抽出液の抗微生物性を高める方法、および抗微生物性のない植物抽出液に抗微生物性を付加する方法において、銀イオン化植物抽出液、抗微生物性の意味、微生物の意味、微生物の範囲、植物抽出液の意味、好適な観点における電気分解時の電圧または電気分解の時間、並びに銀の純度などに対しては、前述および後述したとおりの説明がそのまま有効である。
【0024】
本発明の別の観点によれば、有効成分として、前述したところの銀イオン化植物抽出液を含む抗微生物性組成物を提供する。
請求の範囲を含む本明細書において、前記「抗微生物性」とは、微生物の生長または増殖を抑制し、或いは微生物を死滅させる性質を意味する。
【0025】
また、請求の範囲を含む本明細書において、前記「微生物」とは、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液が抗微生物効果を示す全ての細菌、真菌、酵母、藻類を含む概念である。
【0026】
下記実験例から確認できるように、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液は、その植物抽出液が得られた植物の種類を問わず、本発明者らによって選定された全ての微生物に対して抗微生物活性を示した。
【0027】
当業者であれば、その通常の能力範囲内で下記実験例に基づく限りは、下記実験例から確認された微生物以外にも、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液が抗微生物効果を示すその他の微生物を確認、選別し得ると期待される。
したがって、前記「微生物」の意味には、下記実施例で直接確認された微生物以外にも、当業者の通常の能力範囲内で、本明細書が開示するところに基づき、本発明の銀イオン化植物抽出液がその抗微生物活性を示すものと予想されるその他の全ての微生物が含まれると理解されるべきである。
【0028】
少なくとも、前記「微生物」の意味には、植物抽出液が抗微生物活性を示す微生物、および銀イオン水が抗微生物活性を示す微生物が含まれると理解されるべきである。それは、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液が、下記実験例に示すように、植物抽出液自体が抗微生物活性を示す(場合によっては、活性を示さない)全ての微生物、および銀イオン水自体が抗微生物活性を示す(場合によっては、活性を示さない)全ての微生物に対して相乗的な抗微生物活性を示すという点において、本発明の抗微生物性組成物に有効成分として含まられる銀イオン化植物抽出液は、少なくとも植物抽出液または銀イオン水が抗微生物活性を示す微生物に対しては抗微生物活性を示すことが明白だからである。ここで、銀イオン水は、水や蒸留水、アルコールなどその他の電解液として利用できる溶媒で電気分解によって銀がイオン化されたものであると理解される。
【0029】
それにも拘わらず、前記「微生物」は、下記実験例で直接抗微生物性が確認された細菌、真菌または酵母を意味するものと理解されることが好ましく、特に細菌の中ではエシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、ラクトバシラス(Lactobacillus sp.) を意味すると理解されることが好ましく、真菌の中ではアスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.) を意味すると理解されることが好ましく、酵母の中ではカンジダ(Candida sp.)を意味すると理解されることが好ましい。最も好ましくは、下記実験例で抗微生物活性が直接確認されたそれぞれの微生物を意味する。
【0030】
前記本発明の抗微生物性組成物は、好適な様態を含んで前記定義された微生物が直・間接的に原因となって発生する有害な現象の改善または予防に単独でまたは他の抗微生物剤などと一緒に使用できる。
【0031】
前記「有害な現象」とは、それが改善または予防されるならばヒトに有益な現象と定義できるが、例えばヒト、動物または植物に発生する疾病、食品の腐敗、水質または土壌の汚染、繊維の腐敗などを挙げることができる。
【0032】
また、前記「微生物が直接的に原因となって発生する有害な現象」とは、当該微生物の生長または増殖を抑制し、或いは当該微生物を死滅させると、それにより改善または予防効果がある現象と定義できるが、例えば、サルモネラが引き起こすチフス性疾患または食中毒[下記参照文献30]、スタフィロコッカスが引き起こす蜂窩織炎、リンパ管炎、中耳炎[下記参照文献20〜25参照]、バシラスが引き起こす動物または植物の炭疽病[下記参照文献34〜35参照]、フサリウムが引き起こす作物伝染病[下記参照文献37〜40参照]、カンジダまたはラクトバシラスが引き起こす膣炎、アエロモナスやクロモバクテリウムなどが関与する皮膚外傷、ストレプトコッカスが引き起こす虫歯、トリコフィトンまたはマイクロスポルムが引き起こす白癬などを挙げることができる。この場合においては、本発明の抗微生物性組成物を単独で使用しても、意図するところの改善または予防効果を挙げることができる。
【0033】
また、前記において「微生物が間接的に原因となって発生する有害な現象」とは、そのような現象を改善または予防するために、当該微生物の生長または増殖を抑制し、或いは当該微生物を死滅させることが好ましい(すなわち、共に要求される)現象と定義できる。微生物が間接的に原因となって発生する有害な現象の例としては、ビブリオが引き起こす敗血症[下記参照文献32および33参照]、大腸菌0157が引き起こす腎臓組織損傷[下記参照文献26〜29参照]などを挙げることができる。
【0034】
前記微生物が間接的に原因となって発生する、ヒトに有害な現象は、他の抗微生物剤または前記現象の改善または予防剤と共に本発明の抗微生物性組成物を使用すると、より容易に改善または予防することができる。例えば、敗血症の場合、敗血症に治療または予防効果のある薬物(例えば、Lilly Co.社のXigrisなどと共に本発明の抗微生物性組成物が使用される場合を挙げることができる。
【0035】
一方、本発明の抗微生物性組成物において、銀イオン化植物抽出液は、抗微生物効果を示すことができる限りは、その適用様態または抗微生物性が要求される程度(すなわち、有害な現象の有害な程度)などに応じて適切な任意の量で本発明の抗微生物性組成物に含まれ得る。十分な抗微生物効果を得るためには、その適用様態または抗微生物性が要求される程度を問わず、通常、銀イオン化植物抽出液は、本発明の抗微生物性組成物にその組成物の全体重量を基準としたとき、0.1重量%以上、好ましくは3重量%以上含まれればよい。
【0036】
一方、本発明の抗微生物性組成物は、有効成分である銀イオン化植物抽出液の抗微生物効果を阻害しない限りは、銀イオン化植物抽出液以外にも、分散剤、担体、およびその他の抗微生物剤などを含んで製造できる。
【0037】
そのような分散剤として、水、アルコール(例えば、メチルアルコール、エチルアルコール、エチレングリコール、プロピレングリコール、ジエチレングリコール、グリセリンなど)、ケトン(例えば、アセトン、メチルエチルケトンなど)、エーテル(例えば、ジオクサン、テトラヒドロフラン、セロソルブ、ジエチレングリコールジメチルエーテルなど)、脂肪族炭化水素(例えば、ヘキサン、ケロセンなど)、芳香族炭化水素(例えば、ベンゼン、トルエン、キシレン、ナフタレン、メチルナフタレンなど)、ハロゲン化炭化水素(例えば、クロロホルム、四塩化炭素など)、酸アミド(例えば、ジメチルホルムアミドなど)、エステル(例えば、酢酸メチルエステル、酢酸エチルエステル、酢酸ブチルエステル、脂肪酸グリセリンエステルなど)、ニトリル(例えば、アセトニトリルなど)、界面活性剤(高級硫酸アルコールエステル、アルキルスルホン酸、アルキルアリールスルホン酸、4級アンモニウム塩、オキシアルキルアミン、脂肪酸エステル、ポリアルキレンオキシド化合物、アンヒドロソルビトール化合物)などが例示できる。前記分散剤は、単独でまたは2種以上の混合物として本発明の抗微生物性組成物に含まれ得る。
【0038】
担体として、粘土(例えば、カオリン、ベントナイト、酸粘土など)、滑石(例えば、滑石粉末、蝋石粉末など)、シリカ(例えば、珪藻土、珪酸無水物、雲母粉末など)、アルミナ、硫黄粉末、活性炭などが例示できる。これらの担体も、単独でまたは2種以上の混合物として本発明の抗微生物性組成物に含まれ得る。
【0039】
抗微生物剤として、カルバクロール(carvacrol)、チモール(thymol)、シトラール(citral)(韓国特許第438209号)、イソユージノール、メチルユージノール(韓国特許第427584号)、竹エキス(WO2003/105878)、ガノダーマシネンス(Ganoderma sinense)抽出液(韓国特許第445405号)、イソチアノゾロン(isothiazolone)化合物、アミノカルボン酸(WO2000/13510)などが例示できる。これらの抗微生物剤も、単独でまたは2種以上の混合物として本発明の抗微生物性組成物に含まれ得る。
【0040】
一方、本発明の抗微生物性組成物は、液体状、固体状および気体状のいずれの形に製造されてもよい。また、本発明の抗微生物性組成物は、経口、非経口など任意の方式で投与できるが、局所投与方式が好ましい。経口投与方式の剤形は、錠剤、丸薬、粉剤、液剤、食品の形などを例示することができ、非経口投与方式の剤形は、注射剤、局所投与剤(クリーム、軟膏など)、座薬、撒布剤(植物に適用する場合)などを例示することができる。特に、局所投与方式の剤形は、本発明の抗微生物性組成物を、天然繊維または合成繊維からなる担体に含浸させたもの、化粧品や石鹸などに含有させたものなどを含む。
【0041】
本発明の抗微生物性組成物は、前述したとおりのヒトに有害な現象を改善または予防することができれば、ヒトだけでなく、愛玩動物や家畜、養殖魚類などを含んだ動物または植物にも投与/撒布でき、防腐剤用として食品に添加されることも可能であり、ひいてはヒトが使用する繊維製品などにもその製品の保存性を延長させるために繊維製品の製造の際に添加される、または製造の後に塗布されることが可能である。
【0042】
前記において、本発明の抗微生物性組成物がヒトに投与されるための様態、すなわち薬学的組成物に対しては、本発明の抗微生物性組成物が主に薬学的組成物として利用されるだろうと期待されるという点において、以下で特に詳述する。
本発明の抗微生物性組成物が薬学的組成物として利用される場合、その薬理効果は、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液が抗微生物効果を示す微生物が引き起こす疾病に対する改善または予防効果と把握できるであろう。
【0043】
前記薬理効果は、好ましくは下記実験例で銀イオン化植物抽出液が直接的に抗微生物効果を示すものと確認された細菌、真菌、酵母が引き起こす疾病に対する改善または予防効果と把握でき、さらに好ましくは前記細菌、真菌または酵母の中でもエシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、カンジダ(Candida sp.)、ラクトバシラス(Lactobacillus sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.)などが引き起こす疾病に対する改善または予防効果と把握できるであろう。
【0044】
具体的に、本発明の抗微生物性薬学的組成物は、大腸菌、特に大腸菌0157が引き起こす腎臓組織損傷[下記参照文献26〜29]、サルモネラが引き起こすチフス性疾患、食中毒[下記参照文献30]、ビブリオが引き起こすコレラ、敗血症、腸炎[下記参照文献31〜32]、スタフィロコッカスが引き起こすフルンケル、蜂窩織炎、リンパ管炎、ひょう疽(felon)、中耳炎、肺炎、食中毒、敗血症[下記参照文献20〜25参照]、カンジダが引き起こす淋疾、結核、梅毒、ジフテリア、腸チフス、はしか、口内と陰部の粘膜の炎症(膣炎を含む)、掻痒症または痛症[下記参照文献1〜18]、アスペルギルスが引き起こす敗血症[下記参照文献36および37参照]、ラクトバシラスが引き起こす膣炎、アエロモナスやクロモバクテリウムなどが引き起こす皮膚外傷、ストレプトコッカスが引き起こす虫歯や歯周炎、トリコフィトンまたはマイクロスポルムが引き起こす白癬などに対する改善または予防効果を持つ。
【0045】
前記において本発明の抗微生物性薬学的組成物に有効成分として含まれる銀イオン化植物抽出液が前記微生物に対して抗微生物効果を持つという点において、本発明の抗微生物性薬学的組成物は、前記微生物が引き起こす疾病に対して薬理効果を持つことは自明なので、本発明の薬学的組成物が薬理効果を持つと予想される前記疾病はあくまでも例示に過ぎないと理解されるべきである。よって、本発明の薬学的組成物の薬理効果が前記例示された疾病に対する薬理効果に限定されると理解されてはならない。
【0046】
少なくとも、本発明の抗微生物性薬学的組成物は、前述した微生物が引き起こす、下記に引用された参照文献上に開示された疾病に対しては改善または予防の薬理効果を持つと理解されるべきである。
【0047】
一方、本発明の薬学的組成物は、有効成分として、銀イオン化植物抽出液以外に、薬学的に許容される担体を含むことができるが、このような薬学的に許容される担体は、薬品製剤の際に通常利用されるものであって、ラクトース、デキストロース、スクロース、ソルビトール、マンニトール、澱粉、アカシアゴム、リン酸カルシウム、アルギン酸塩、ゼラチン、珪酸カルシウム、微細結晶性セルロース、ポリビニルピロリドン、セルロース、水、シロップ、メチルセルロース、メチルヒドロキシベンゾエート、プロピルヒドロキシベンゾエート、滑石、ステアリン酸マグネシウム、ミネラルオイルなどを含む。
【0048】
本発明の薬学的組成物は、また、添加剤として、当業界に知られている潤滑剤、湿潤剤、甘味剤、香味剤、乳化剤、懸濁剤、保存剤などをさらに含むことができる。
【0049】
前記担体は、本発明の薬学的組成物に、それの全体重量に対して約0.1重量%〜約99.9重量%、好ましくは約0.1重量〜約97重量%で含まれることができ、前記添加剤は、約0.1重量%〜約20重量%で含まれることができる。
【0050】
一方、本発明の薬学的組成物は、経口または非経口で投与でき、好ましくは局所投与方式で当該部位に直接投与できる。
本発明の薬学的組成物は、薬学的に許容される担体を用いて製剤化することにより、単位用量の形で、或いは多用量の容器内に入れて製造できる。この際、剤形は溶液、懸濁液、乳化液、エリキシル剤、エキス剤、粉末剤、顆粒剤、錠剤、軟膏などを含むことができる。
【0051】
本発明の薬学的組成物は、その1日投与量が通常0.001〜150mL/kg体重の範囲であり、1回または数回に分けて投与することができる。ところが、本発明の薬学的組成物の投与量は投与経路、患者の年齢、性別、体重、患者の重症度、使用期間などのいろんな関連因子に鑑みて定められるものなので、前記投与量はどんな側面からも本発明の範囲を制限するものと理解されてはならない。
【発明の効果】
【0052】
前述したように、本発明は、銀イオン化植物抽出液とその銀イオン化植物抽出液の抗微生物剤としての用途を開示する。
本発明の銀イオン化植物抽出液は、様々な微生物に対して抗微生物効果を示すことにより、その微生物が原因となって発生する有害な現象の改善または予防に有用に使用できる。
【発明を実施するための最良の形態】
【0053】
以下、本発明を参考例、実施例および実験例を参照して説明する。ところが、本発明の範囲はこのような参考例、実施例および実験例によって制限されるものではない。
【0054】
<参考例>植物抽出液の製造または購入
【0055】
<参考例1>竹抽出液の製造
【0056】
竹を約30cm程度に細切し、細切された竹の中央部分に約400℃程度の熱を加え、細切された竹の両端から出るエキスを採取して竹抽出液を製造した。製造された竹抽出液の酸度を測定したところ、酸度がpH267であった。
【0057】
<参考例2>木草液(オーク抽出液)の購入
【0058】
木草液は韓国ソウル市中浪区所在の(株)Life−Chamsoot社から購入して使用した。
【0059】
<参考例3>松抽出液の製造
【0060】
松を約30cm程度に細切し、細切された松の中央部分に約300℃の熱を加え、細切された松の両端から出るエキスを採取して松抽出液を製造した。
【0061】
<参考例4>コノテガシワ抽出液の製造
【0062】
コノテガシワを約30cm程度に細切し、細切されたコノテガシワの中央部分に約400℃の熱を加え、細切されたコノテガシワの両端から出るエキスを採取してコノテガシワ抽出液を製造した。
【0063】
<参考例5>海藻類抽出液の購入
【0064】
海藻類抽出液(海藻類を圧搾して得られるエキスタイプの抽出液である)は、Harveson社(Freegrow、Harveson Inc.Philippine)(液体状であり、pHは14である)から購入した。
【0065】
<実施例>銀イオン化植物抽出液の製造
【0066】
<実施例1〜10>電気分解を利用した銀イオン化竹抽出液の製造
【0067】
非導電性の電解槽に、前記<参考例1>で得られた竹抽出液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、下記<表1>の電圧と時間で銀イオン化を誘導して、銀イオンと前記竹抽出液とが反応するようにした。その結果、濃い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化竹抽出液を製造した。
【0068】
【表1】

【0069】
<実施例11〜20>電気分解を利用した銀イオン化木草液の製造
【0070】
非導電性の電解槽に前記<参考例2>の木草液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、下記<表2>の電圧と時間で銀イオン化を誘導して、銀イオンと前記木草液とが反応するようにした。その結果、濃い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化木草液を製造した。
【0071】
【表2】

【0072】
<実施例21>電気分解を利用した銀イオン化松抽出液の製造
【0073】
非導電性の電解槽に、前記<参考例3>で得られた松抽出液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、9Vの電圧をかけて約4分間銀イオン化を誘導して、銀イオンと前記松抽出液とが反応するようにした。その結果、薄い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化松抽出液を製造した。
【0074】
<実施例22>電気分解を利用した銀イオン化コノテガシワ抽出液の製造
【0075】
非導電性の電解槽に、前記<参考例4>で得られたコノテガシワ抽出液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、9Vの電圧をかけて約4分間銀イオン化を誘導して、銀イオンと前記コノテガシワ抽出液とが反応するようにした。その結果、薄い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化コノテガシワ抽出液を製造した。
【0076】
<実施例23>電気分解を利用した銀イオン化海藻類抽出液の製造
【0077】
まず、電解液としては、前記<参考例5>の海藻類抽出液に3次蒸留水を添加して2倍に希釈させた後、得られる上澄み原液を使用した。
非導電性の電解槽に前記上澄み原液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、9Vの電圧をかけて約4分間銀イオン化を誘導して、銀イオンと前記2倍希釈された海藻類抽出液の上澄み原液とが反応するようにした。その結果、濃い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化海藻類抽出液を製造した。
【0078】
<実験例>銀イオン化植物抽出液の抗微生物効果実験
【0079】
<実験例1>銀イオン化竹抽出液の抗微生物効果実験
<実験例1−1>カンジダ(Candida sp.)に対する抗微生物効果実験
【0080】
本実験で使用されたカンジダ(Candida sp.)は、カンジダクルセイ(Candida krusei)ATCC6258、カンジダパラプシロシス(Candida parapsilosis)ATCC22019、カンジダグラブラータ(Candida glabrata)ATCC90030である。
【0081】
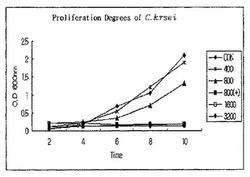
まず、滅菌した培養液(Sabouraud Dextrose Broth、10mL)に<参考例1>の竹抽出液を無処理または400μL、800μL、1600μL、3200μLの量でそれぞれ処理し、また800μLの<実施例10>の銀イオン化竹抽出液を処理した後、十分に成長した100μLのカンジダクルセイATCC6258、カンジダパラプシロシスATCC22019、カンジダグラブラータATCC90030をそれぞれ接種して30℃で培養した。
【0082】
培養中に2時間間隔でO.D(600nm)値を測定し、その結果を図1〜図3に示した。図1〜図3はそれぞれカンジダクルセイATCC6258、カンジダパラプシロシスATCC22019、カンジダグラブラータATCC90030に対する菌株の増殖程度を調べた結果である。
【0083】
カンジダクルセイの場合は、<参考例1>の竹抽出液を400μL添加したときに特別な抗微生物効果を示しておらず、800μL以上を添加したときには抗微生物効果を示し始め、1600μLを添加したときにはカンジダクルセイの増殖が完全に抑制されたが、これに対し、銀イオン化竹抽出液を800μL添加したときにはカンジダクルセイの増殖が完全に抑制された。このような結果より、<参考例1>の竹抽出液の場合は最小発育阻止濃度(Minimum Inhibitory concentration;以下「MIC」という)が少なくとも80μL/mL以上であるが、銀イオン化竹抽出液の場合はMICが80μL/mL以下であることが分かる。
【0084】
カンジダパラプシロシスの場合は、<参考例1>の竹抽出液と銀イオン化竹抽出液の両方とも800μLを添加したときに菌の増殖が完全に抑制されたが、カンジダグラブラータの場合は、前記カンジダクルセイに対する抗微生物効果と同様に、<参考例1>の竹抽出液は1600μLを添加したときに菌の増殖が抑制され、銀イオン化竹抽出液は800μLを添加したときに菌の増殖が抑制された。
【0085】
<実験例1−2>細菌および酵母に対する抗微生物効果実験
【0086】
バクテリアのうち、大腸菌0157(KCCM40406)、Bacillus therengenesis(KCTC1034)、Staphylococcus warneri(KACC 10785)、Staphylococcus aureus(KACC 10778)、Staphylococus aureus(KACC 10778)およびVibrio sp.(全南大病院)は、LB Brothで初期培養(37℃、12時間)し、Aeromonas hydrophila subsp. Hydrophila(KCCM32586)とChromobacterium violaceum(KCCM11748)はNutrient Broth培地で初期培養し(26℃、18時間)、Streptococcus pyogenes(KCCM11856)およびStreptococcus mutants(KCCM 40105)はBHI(Brain Heart Infusion) Broth培地で初期培養し(37℃、18時間)、Lactobacillus crispatus(KCCM41620)はLactobacilli MRS Broth培地で初期培養した(37℃、18時間)。そして、カンジダ(Candida sp.)はSD(Sabouraud Dextrose)Brothで初期培養(30℃、12時間)した。
【0087】
初期培養の後、微生物培地(LB寒天)入りのそれぞれのペトリ皿に前記初期培養された100μLのそれぞれの菌株を十分塗抹した後、<参考例1>の竹抽出液、銀イオン水、<実施例10>の銀イオン化竹抽出液12μLを前記微生物の塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育をクリアゾーン(clear zone)で判断して下記<表2>に示した。
ここで、前記銀イオン水は、前記<実施例10>と同様の方法および条件で、<参考例1>の竹抽出液の代わりに3次蒸留水を用いて製造されたものである。
【0088】
【表3】

【0089】
前記<表3>は、<実施例10>の銀イオン化竹抽出液のバクテリアと酵母に対する抗微生物効果が<参考例1>の竹抽出液または銀イオン水の抗微生物効果よりも相乗的な効果であることを示す。前記において一般に抗微生物効果を持つと知られている銀イオン水が抗微生物効果を示していないのは、電気分解の電圧が低く、時間が短くて十分な量の銀イオンが発生していないためであると推測される。
【0090】
<実験例1−3>真菌に対する抗微生物効果実験
【0091】
Aspergillus ocnraceus(KACC4007)、Trichoderma harzianum(KCTC6426)、Fusarium solani(KCTC6328)、およびFusarium oxysporum(KACC40037)はPDA(ポテトデキストロース寒天培地、Duchefa)培地、Aspergillus ochraceus(KACC40077)、Fusarium solani(KACC40384)およびFusarium graminearum(KACC40532)はMEA(Malt Extraction liquid Agar)培地、Trichophyton rubrum(KCTC6345)、Microsporum audouinii(KCTC6346)およびTrichophyton ferrugineum(KCTC6351)はSDA(Sabouraud Dextrose Agar)培地の中心部に菌を移植し、菌が栄養繁殖を始めて円形に確定されるとき(約7日間培養する)、一定の距離をおいてペーパーディスク(paper disk)に適量(約30μL)の試料、すなわち<参考例1>の竹抽出液、銀イオン水、<実施例10>の銀イオン化竹抽出液を吸収させた後、12時間後に菌が前記試料処理地域へ増殖されるか否かを観察し、その結果を下記<表3>に示した。
ここで、前記銀イオン水は、前記<実施例10>と同様の方法と条件で、<参考例1>の竹抽出液の代わりに3次蒸留水を用いて製造されたものである。
【0092】
【表4】

【0093】
前記<表4>より、前記<実験例1−2>の<表3>と同様に、<実施例10>の銀イオン化竹抽出液の真菌に対する抗微生物効果が<参考例1>の竹抽出液または銀イオン水の抗微生物効果よりも相乗的な効果であることが分かる。銀イオン水が真菌に対する抗微生物効果を示していないのは、前記<表3>で説明したような理由であると推測される。
【0094】
<実験例1−4>電気分解の電圧と時間による抗微生物効果実験
【0095】
前記<実施例1〜10>の銀イオン化竹抽出液を用いて、銀イオン化竹抽出液の製造の際に電気分解の電圧と時間が抗微生物活性に対してどんな影響を及ぼすかを調べた。
実験方法は前記<実験例1−2>と同様であり、その結果は下記<表5>に示した。
【0096】
【表5】

【0097】
前記<表5>によれば、銀イオン化竹抽出液は、全般的に電気分解時の電圧が高いほど、且つ電気分解時間が長いほどさらに高い抗微生物効果を持つ。
【0098】
<実験例2>銀イオン化木草液の抗微生物効果実験
【0099】
<実験例2−1>カンジダ(Candida sp.)に対する抗微生物効果実験
【0100】
前記<実験例1−1>と同様の方法によってカンジダ(Candida sp.)に対する抗微生物効果を調べた。
本実験に使用されたカンジダ(Candida sp.)は、カンジダクルセイ(Candida krusei)ATCC6258、カンジダパラプシロシス(Candida parapsilosis)ATCC22019、カンジダグラブラータ(Candida glabrata)ATCC90030、カンジダアルビカンス(Candida albicans)ATCC64550およびカンジダアルビカンス(Candida albicans)ATCC90028である。
【0101】
まず、滅菌した培養液(Sabouraud Dextrose Broth)10mLに<参考例2>の木草液を無処理(CON)または100μL、200μL、400μL、800μL、1600μLの量でそれぞれ処理し、また200μL、400μLの<実施例20>の銀イオン化木草液を処理した後、十分成長した100μLのカンジダクルセイATCC6258、カンジダパラプシロシスATCC22019、カンジダグラブラータATCC90030、カンジダアルビカンスATCC64550(C. albicans 1)およびカンジダアルビカンスATCC90028(C. albicans 2)をそれぞれ接種して30℃で培養した。
【0102】
培養中2に時間間隔でO.D(600nm)値を測定し、その結果を図4〜図8に示した。図4〜図8はそれぞれカンジダクルセイATCC6258、カンジダパラプシロシスATCC22019、カンジダクラブラータATCC90030、カンジダアルビカンスATCC64550、およびカンジダアルビカンスATCC90028に対する菌株の増殖程度を調べた結果である。
【0103】
カンジダクルセイと2種のカンジダアルビカンスの場合は、木草液を100μL添加したときには特別な抗微生物効果を示しておらず、木草液を200μL以上添加したときに抗微生物効果が現われ始め、木草液を400μL添加したときには完全にその増殖が抑制された。これに対し、銀イオン化木草液の場合は、木草液を200μLを添加したときにその増殖が完全に抑制された。このような結果より、カンジダクルセイと2種のカンジダアルビカンスにおいて、木草液の場合は最小発育阻止濃度(Minimum Inhibitiry Concentration;以下「MIC」という)が少なくとも20μL/mL以上であるが、銀イオン化木草液の場合はMICが20μL/mL以下であることが分かる。
【0104】
カンジダパラプシロシスの場合は、木草液と銀イオン化木草液の両方とも200μLを添加したときに菌の増殖が完全に抑制されたが、カンジダグラブラータの場合は、前記カンジダクルセイに対する抗微生物効果と同様に、木草液は800μLを添加したときに菌の増殖が完全に抑制され、銀イオン化木草液は400μLを添加したときに菌の増殖が完全に抑制された。
【0105】
<実験例2−2>細菌および酵母に対する抗微生物効果実験
【0106】
前記<実験例1−2>と同様の方法で、細菌と酵母に対する抗微生物効果を調べた。
バクテリアは、LB Brothで初期培養(37℃、12時間)し、カンジダ(Candida sp.)は、SD(Sabouraud Dextrose) Brothで初期培養(30℃、12時間)した後、微生物培地(LB寒天)入りのペトリ皿に、初期培養された100μLの菌株を十分塗抹した後、<参考例2>の木草液、銀イオン水、<実施例20>の銀イオン化木草液12μLを、前記バクテリアが塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育有無をクリアゾーンで判断して下記<表6>に示した。
ここで、前記銀イオン水は、前記<実施例20>と同様の方法および条件で、<参考例2>の木草液の代わりに3次蒸留水を用いて製造されたものである。
【0107】
【表6】

【0108】
前記<表6>は、<実施例20>の銀イオン化木草液のバクテリアと酵母に対する抗微生物効果が<参考例2>の木草液または銀イオン水の抗微生物効果よりも相乗的な効果であることを示す。前記において一般に抗微生物効果を持つと知られている銀イオン水が抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0109】
<実験例2−3>真菌に対する抗微生物効果実験
【0110】
前記<実験例1−3>と同様の方法で、真菌(カビ菌)に対する抗微生物効果を調べた。
培地(ポテトデキストロース寒天培地、Duchefa)の中心部に菌を移植し、菌が栄養繁殖を始めて円形に確定されるとき、一定の距離をおいてペーパーディスクに25μLの試料、すなわち<参考例2>の木草液、銀イオン水、<実施例10>の銀イオン化木草液を吸収させた後、12時間後に菌が前記試料処理地域へ増殖するか否かを観察し、その結果を下記<表7>に示した。
ここで、前記銀イオン水は、前記<実施例20>と同様の方法と条件で、<参考例2>の木草液の代わりに3次蒸留水を用いて製造されたものである。
【0111】
【表7】

【0112】
前記<表7>からも分かるように、前記実験例と同様に、<実施例20>の銀イオン化木草液の真菌に対する抗微生物効果が<参考例2>の木草液または銀イオン水の抗微生物効果よりも相乗的な効果である。銀イオン水が真菌に対する抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0113】
<実験例2−4>電気分解の電圧と時間による抗微生物効果実験
【0114】
前記<実施例11〜20>の銀イオン化木草液を用いて、銀イオン化木草液の製造時の電気分解の電圧と時間が抗微生物活性に対してどんな影響を及ぼすかを調べた。
実験方法は前記<実験例2−2>と同様であり、その結果は下記<表8>に示した。
【0115】
【表8】

【0116】
前記<表8>は、銀イオン化木草液が全般的に電気分解時の電圧が高いほど、且つ電気分解時間が長いほど、さらに高い抗微生物効果を持つことを示している。
【0117】
<実験例3>銀イオン化松抽出液の抗微生物効果実験
【0118】
前記<実験例1−2>と同様の方法で、細菌と酵母に対する抗微生物効果を調べた。
バクテリアは、MH(Mueller Hinton) Brothで初期培養(37℃、12時間)し、カンジダ(Candida sp.)はSD(Sabouraud Dextrose) Brothで初期培養(30℃、12時間)した後、微生物培地(MH寒天)入りのペトリ皿に、初期培養された100μLの菌株を十分塗抹した後、<参考例3>の松抽出液、銀イオン水、<実施例21>の銀イオン松抽出液15μLを、前記バクテリアの塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育有無を形成されたクリアゾーンで判断して下記<表9>に示した。
ここで、前記銀イオン水は、前記<実施例21>と同様の方法と条件で、<参考例3>の松抽出液の代わりに3次蒸留水を用いて製造された。
【0119】
【表9】

【0120】
前記<表9>より分かるように、<参考例3>の松抽出液または銀イオン水は抗微生物効果を示していないが、<実施例21>の銀イオン化松抽出液はバクテリアおよび酵母に対して抗微生物効果がある。前記で銀イオン水が抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0121】
<実験例4>銀イオン化コノテガシワ抽出液の抗微生物効果実験
【0122】
前記<実験例1−2>と同様の方法で、細菌と酵母に対する抗微生物効果を調べた。
バクテリアはMH(Mueller Hinton) Brothで初期培養(37℃、12時間)し、カンジダ(Candida sp.)はSD(Sabouraud Dextrose) Brothで初期培養(30℃、12時間)した後、微生物培地(MH寒天)入りのペトリ皿に、初期培養された100μLの菌株を十分塗抹した後、<参考例4>のコノテガシワ抽出液、銀イオン水、<実施例22>の銀イオンコノテガシワ抽出液15μLを、前記バクテリアの塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育有無を形成されたクリアゾーンで判断して下記<表10>に示した。
ここで、前記銀イオン水は、前記<実施例22>と同様の方法と条件で、<参考例4>の松抽出液の代わりに3次蒸留水を用いて製造された。
【0123】
【表10】

【0124】
前記<表10>は、<実施例22>の銀イオン化コノテガシワ抽出液のバクテリアおよび酵母に対する抗微生物効果が<参考例4>のコノテガシワ抽出液または銀イオン水の抗微生物効果よりも相乗的な効果であることを示す。前記において銀イオン水が抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0125】
<実験例5>銀イオン化海藻類抽出液の抗微生物効果実験
前記<実験例1−2>と同様の方法で、細菌と酵母に対する抗微生物効果を調べた。
バクテリアはMH(Mueller Hinton) Brothで初期培養(37℃、12時間)し、カンジダ(Candida sp.)はSD(Sabouraud Dextrose) Brothで初期培養(30℃、12時間)した後、微生物培地(MH寒天)入りのペトリ皿に、初期培養された100μLの菌株を十分塗抹した後、蒸留水で2倍希釈された<参考例5>の海藻類抽出液の上澄み原液(<実施例23>参照)、銀イオン水、<実施例23>の銀イオン化海藻類抽出液15μLを、前記バクテリアの塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育有無を形成されたクリアゾーンで判断して下記<表11>に示した。
ここで、前記銀イオン水は、前記<実施例23>と同様の方法と条件で、蒸留水で2倍希釈された<参考例5>の海藻類抽出液の上澄み原液の代わりに3次蒸留水を用いて製造された。
【0126】
【表11】

【0127】
前記<表11>は、<実施例23>の銀イオン化海藻類抽出液のバクテリアおよび酵母に対する抗微生物効果が<参考例5>の海藻類抽出液または銀イオン水の抗微生物効果よりも相乗的な効果であることを示す。前記において銀イオン水が抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0128】
本発明者らは、電気分解によって生成された銀イオンが竹抽出液または木草液などの植物抽出液に存在する未知の物質と反応して新規物質を生成することにより、その物質が抗微生物効果を高める、と推測している。
【0129】
一方、前記実験例には示されていないが、本発明者らが前記<実験例1−2>と同様の方法で実験した結果によれば、銀イオン化竹抽出液または木草液はバシラスアントラシス(Bacillus anthracis)、大腸菌DH5α、スタフィロコッカススクレイフェリ(Staphylococcus schleiferi)に対しても抗微生物効果があった。
【0130】
[参照文献]
下記参照文献は、本明細書の一部を成す。
1. Ripeau JS, Aumont F, Belhumeur P, Ostrosky-Zeichner L, Rex JH, de Repentigny L. Effect of the echinocandin caspofungin on expression of Candida albicans secretory aspartyl proteinases and phospholipase in vitro. Antimicrob Agents Chemother. 2002 Sep;46(9):3096-100
2. Barousse, M. M., C. Steele, K. Dunlap, T. Espinosa, D. Boikov, J. D. Sobel,and P. L. Fidel, Jr. 2001. Growth inhibition of Candida albicans by human vaginal epithelial cells. J. Infect. Dis. 184:1489-1493.
3. Brassart, D., A. Woltz, M. Golliard, and J. R. Neeser. 1991. In vitro inhibition of adhesion of Candida albicans clinical isolates to human buccal epithelial cells by Fuc 132Gal-bearing complex carbohydrates. Infect. Immun.59:1605-1613.
4. Cameron, B. J., and L. J. Douglas. 1996. Blood group glycolipids as epithelial cell receptors for Candida albicans. Infect. Immun. 64:891-896.
5. Chaim, W., B. Foxman, and J. D. Sobel. 1997. Association of recurrent vaginal candidiasis and secretory ABO and Lewis phenotype. J. Infect. Dis.176:828-830.
6. Critchley, I. A., and L. J. Douglas. 1987. Role of glycosides as epithelial cell receptors for Candida albicans. J. Gen. Microbiol. 133:637-643.
7. Fidel, P. L., Jr. 2002. Immunity to Candida. Oral Dis. 8(Suppl. 2):69-75.
8. Fidel, P. L., Jr., J. Cutright, and C. Steele. 2000. Effects of reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68:651-657.
9. Fidel, P. L., Jr., M. E. Lynch, and J. D. Sobel. 1993. Candida-specific cellmediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61:1990-1995.
10. Han, Y., R. P. Morrison, and J. E. Cutler. 1998. A vaccine and monoclonal antibodies that enhance mouse resistance to Candida albicans vaginal infection. Infect. Immun. 66:5771-5776.
11. Kelly, R. J., S. Rouquier, D. Giorgi, G. G. Lennon, and J. B. Lowe. 1995. Sequence and expression of a candidate for the human secretor blood group (1,2)fucosyltransferase gene (FUT2). Homozygosity for an enzyme-inactivating nonsense mutation commonly correlates with the non-secretor phenotype. J. Biol. Chem. 270:4640-4649.
12. Kirkpatrick WR, Lopez-Ribot JL, McAtee RK, Patterson TF Growth competition between Candida dubliniensis and Candida albicans under broth and biofilm growing conditions. Clin Microbiol. 2000 Feb;38(2):902-4.
13. Schaeffer, A. J., N. Rajan, Q. Cao, B. E. Anderson, D. L. Pruden, J. Sensibar, and J. L. Duncan. 2001. Host pathogenesis in urinary tract infections. Int. J. Antimicrob. Agents 17:245-251.
14. Sobel, J. D. 1988. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544:547-557.
15. Sobel, J. D. 1992. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14(Suppl. 1):S148-S153.
16. Steele, C., J. Leigh, R. Swoboda, H. Ozenci, and P. L. Fidel, Jr. 2001. Potential role for a carbohydrate moiety in anti-Candida activity of human oral epithelial cells. Infect. Immun. 69:7091-7099.
17. Vardar-Unlu, G., C. McSharry, and L. J. Douglas. 1998. Fucose-specific adhesins on germ tubes of Candida albicans. FEMS Immunol. Med. Microbiol. 20:55-67.
18. Kirkpatrick WR, Lopez-Ribot JL, McAtee RK, Patterson TF Growth competition between Candida dubliniensis and Candida albicans under broth and biofilm growing conditions. Clin Microbiol. 2000 Feb;38(2):902-4.
19. Saadi, A. T., D. M. Weir, I. R. Poxton, J. Stewart, S. D. Essery, C. C. Blackwell, M. W. Raza, and A. Busuttil. 1994. Isolation of an adhesin from Staphylococcus aureus that binds Lewis a blood group antigen and its relevance to sudden infant death syndrome. FEMS Immunol. Med. Microbiol.8:315-320.
20. Steinberg, J.P., Clark, C.C., and Hackman, B.O. 1996. Nosocomial and community-acquired Staphylococcus aureus bacteremias from 1980 to 1993: impact of intravascular devices and methicillin resistance. Clin. Infect. Dis. 23:255.259.
21. Staphylococcus Laboratory, Statens Serum Institut. 2003. Annual report on Staphylococcus aureus bacteraemia cases 2001. StaphylococcusLaboratory, National Center for Antimicrobials and Infection Control, Statens Serum Institut. Copenhagen, Denmark. 9 pp.
22. Luzar, M.A., et al. 1990. Staphylococcus aureus nasal carriage and infection in patients on continuous ambulatory peritoneal dialysis. N. Engl. J. Med. 322:505.509.
23. Yu, V.L., et al. 1986. Staphylococcus aureus nasal carriage and infection in patients on hemodialysis. Efficacy of antibiotic prophylaxis. N. Engl. J. Med.315:91.96.
24. Nguyen, M.H., et al. 1999. Nasal carriage of and infection with Staphylococcus aureus in HIV-infected patients. Ann. Intern. Med. 130:221.225.
25. Moss, B., Squire, J.R., and Topley, E. 1948. Nose and skin carriage of Staphylococcus aureus in patients receiving penicillin. Lancet. 1:320.325.
26. Sherman P, Drumm B, Karmali M & Cutz E. Adherence of bacteria to the intestine in sporadic cases of Enteropathogenic Escherichia coli-associated diarrhea in infants and young children: a prospective study.Gastroenterol, 1989;96:86:-94
27. Cravioto A, Gross RJ, Scotland SM, Rowe B. An adhesive factor found in strains of escherichia coli belonging to the traditional infantile enteropathogenic serotypes. Current Microbiology,1979;3:95-9.
28. Scaletsky ICA, Silva MLM, Trabulsi LR. Distinctive patterns of adherence of enteropathogenic Escherichia coli to HelLa cells. Infct. Immun., 1984;45:534-6.
29. Nataro JP, Baldini MM, Kaper JB, Black RE, Bravo N, Levine M.M. Detection of an adherence factor of enteropathogenic Escherichia coli with a DNA probe. Infect. Dis. 1985;152:560-5
30. TAVECHIO, A.T.; GHILARDI, A.C.R.; PERESI, J.T. et al. Salmonella serotypes isolated from nonhuman sources in S Paulo, Brazil, from 1996 through 2000. J. Food protect., 65: 1041-1044, 2002.
31. THEOPHILO, G.N.D. & VIEIRA, R.H.S.F. Pesquisa de Vibrio parahaemolyticus em caranguejos crus e cozidos comercializados na Praia do Futuro (Fortaleza, CE). Bol.SBCTA, 28: 134-142, 1994.
32. VIEIRA, R.H.S.F. & IARIA, S.T. - Vibrio parahaemolyticus in lobster Panulirus laevicauda (Latreille). Rev. Microbiol. (S. Paulo), 24: 16-21,1993.
33. Puglielli L, Cattrini C, Garces Resa JJ, Velasques M, Leon Garcia LM Symptomless carriage of Vibrio cholerae in Peru. Lancet. 1992 Apr 25;339(8800):1056-7
34. Parkinson R, Rajic A, Jenson C. Investigation of an anthrax outbreak in Alberta in 1999 using a geographic information system. Agriculture and Agri-Food Canada, 600, 138-4th Avenue Southeast, Calgary, Alberta T2G 4Z6.
35. Watson J, Koya V, Leppla SH, Daniell H Expression of Bacillus anthracis protective antigen in transgenic chloroplasts of tobacco, a non-food/feed crop.Vaccine. 2004 Oct 22;22(31-32):4374-84 Department of Molecular Biology and Microbiology, University of Central Florida, Biomolecular Science Building #20, Room 336, Orlando, FL 32816-2364, USA.
36. Jarque I, Andreu R, Salavert M, Gomez D, Peman J, Gobernado M, Sanz MA.[Value of Aspergillus galactomannan antigen detection in the diagnosis and follow-up of invasive aspergillosis in hematological patients]
37. Jimenez-Gasco MM, Navas-Cortes JA, Jimenez-Diaz RM.The Fusarium oxysporum f. sp. ciceris/Cicer arietinum pathosystem: a case study of the evolution of plant-pathogenic fungi into races and pathotypes. Int Microbiol. 2004 Jun;7(2):95-104
38. Lievens B, Brouwer M, Vanachter AC, Cammue BP, Thomma BP Rapid detection and identification of tomato vascular wilt pathogens using a DNA array. Commun Agric Appl Biol Sci. 2003;68(4 Pt B):569-81
39. Okhovvat SM, Zakeri Z Identification of fungal diseases associated with imported wheat in Iranian silos. Commun Agric Appl Biol Sci. 2003;68(4 Pt B):533-5
40. Lievens B, Brouwer M, Vanachter AC, Levesque CA, Cammue BP, Thomma BPDesign and development of a DNA array for rapid detection and identification of multiple tomato vascular wilt pathogens. FEMS Microbiol Lett. 2003 Jun 6;223(1):113-22
【図面の簡単な説明】
【0131】
【図1】図1は竹抽出液と銀イオン化竹抽出液をそれぞれカンジダクルセイATCC6258培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図1において、CONは竹抽出液を無処理した場合であり、400、800、1600および3200は竹抽出液をそれぞれ400μL、800μL、1600μLおよび3200μLで処理した場合であり、800(+)は銀イオン化竹抽出液を800μLで処理した場合である。
【図2】図2は竹抽出液と銀イオン化竹抽出液をそれぞれカンジダパラプシロシスATCC22019培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図2において、CONは竹抽出液を無処理した場合であり、400、800、1600および3200は竹抽出液をそれぞれ400μL、800μL、1600μLおよび3200μLで処理した場合であり、800(+)は銀イオン化竹抽出液を800μLで処理した場合である。
【図3】図3は竹抽出液と銀イオン化竹抽出液をそれぞれカンジダグラブラータATCC90030培養液に処理した場合における前記微生物の増殖程度をフラグで示す。図3において、CONは竹抽出液を無処理した場合であり、400、800、1600および3200は竹抽出液をそれぞれ400μL、800μL、1600μLおよび3200μLで処理した場合であり、800(+)は銀イオン化竹抽出液を800μで処理した場合である。
【図4】図4は木草液と銀イオン化木草液をそれぞれカンジダクルセイATCC6258培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図4において、CONは木草液を無処理した場合であり、100、200、400、800および1600は木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【図5】図5は木草液と銀イオン化木草液をそれぞれカンジダパラプシロシスATCC22019培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図5において、CONは木草液を無処理した場合であり、100、200、400、800および1600は、木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【図6】図6は木草液と銀イオン化木草液をそれぞれカンジダグラブラータATCC90030培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図6において、CONは木草液を無処理した場合であり、100、200、400、800および1600は木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【図7】図7は木草液と銀イオン化木草液をそれぞれカンジダアルビカンスATCC64550(C. albians 1)培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図7において、CONは木草液を無処理した場合であり、100、200、400、800および1600は木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【図8】図8は木草液と銀イオン化木草液をそれぞれカンジダアルビカンスATCC90028(C. albicans 2)培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図8において、CONは木草液を無処理した場合であり、100、200、400、800および1600は木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【技術分野】
【0001】
本発明は、銀イオン化植物抽出液およびその用途に係り、より詳しくは、電解液としての植物抽出液で電気分解によって銀をイオン化させて得られる銀イオン化植物抽出液およびこれを含む抗微生物性組成物に関する。
【背景技術】
【0002】
銀は、様々な古典文献に言及されているとおり、広範囲な抗微生物効果を持つものと古来から知られてきた金属である。よって、銀は、実生活において、例えばさじなどの食器の製作にも用いられてきた。
【0003】
銀が抗微生物効果を持つとすれば、実際、抗微生物作用をするものは銀から発せられる銀イオン(Ag+)であるから、銀イオン水をより容易且つ大量に製造するための多くの方法が提案されてきた。例えば、韓国公開特許第10−2003−0090466号(発明の名称:銀イオン水製造機)や韓国公開特許第10−2005−0001240号(発明の名称:銀イオン水製造装置)などが、銀イオン水の製造に関連した技術である。
【0004】
一方、植物抽出物は、その植物の種類および抽出方法を問わず、一般に強弱の程度差異はあるが、ある程度の抗微生物性を持つと知られている[Hori Y, Sato S, Hatai A. Antibacterial activity of plant extracts from azuki beans (Vigna angularis) in vitro. Phytother Res. 2006 Jan 27;20(2):162-164; Ravikumar S, Nazar S, Nuralshiefa A, Abideen S. Antibacterial activity of traditional therapeutic coastal medicinal plants against some pathogens. J Environ Biol. 2005 Jun;26(2 Suppl):383-6; Bandyopadhyay D, Chatterjee TK, Dasgupta A, Lourduraja J, Dastidar SG. In vitro and in vivo antimicrobial action of tea: the commonest beverage of Asia. Biol Pharm Bull. 2005 Nov;28(11):2125-7]。
【0005】
本発明者らは、銀の抗微生物効果と植物抽出物の一般的な抗微生物効果に着眼し、銀を液状の植物抽出物(植物抽出液)で電気分解によってイオン化させたところ、その結果物である銀イオン化植物抽出液が非常に高い抗微生物効果を持つという事実を確認することにより、本発明を完成するに至った。
【発明の開示】
【発明が解決しようとする課題】
【0006】
そこで、本発明の目的は、銀を植物抽出液で電気分解させて得られる銀イオン化植物抽出液を提供することにある。
本発明の他の目的は、前記銀イオン化植物抽出液を含む抗微生物性組成物を提供することにある。
本発明のその他の目的および具体的な様態などは、以下に提示される。
【課題を解決するための手段】
【0007】
本発明のある観点によれば、銀イオン化植物抽出液を提供する。本発明の銀イオン化植物抽出液とは、電解液(電気分解するとき、電解槽に入れてイオン伝導の媒体の役割をする溶液)である植物抽出液で銀を電気分解によってイオン化させて得られたものをいう。
【0008】
本発明者らは、下記実施例および実験例から確認されるように、電解槽に電解液としての植物抽出液(具体的には竹抽出液、木草液(オーク抽出液)、松抽出液、コノテガシワ抽出液、海藻類抽出液)を入れて2本の銀電極棒に電源を連結して銀イオン化を誘導し、その得られた結果物に対する抗微生物効果を実験したところ、その結果物が電解液として用いられた植物抽出液または銀イオン水(植物抽出液の代わりに3次蒸留水を用いて銀を電気分解させて得られた結果物)に比べて相乗的な抗微生物効果を示すことを確認することができた。
したがって、本発明の銀イオン化植物抽出液は、より具体的には、電解液としての植物抽出液で銀を電気分解によってイオン化させて得られたものであって、抗微生物性を持つものと説明できる。
【0009】
ここで、前記「抗微生物性」の意味、「微生物」の意味およびその「微生物の範囲」については、下記本発明の抗微生物性組成物に関連して後述する内容がそのまま適用できる。
【0010】
一方、本発明の銀イオン化植物抽出液は、2本の銀電極棒に電源を連結して電気分解によって電解液としての植物抽出液で銀をイオン化させて得られたものであって、電気分解は、植物抽出液を電解液として銀がイオン化できるように行われるだけでよい。
よって、銀イオン化が発生する(+)電極は、銀を含有する導体でなければならないが、(−)電極は、必ずしも銀を含有する導体である必要はなく、金属や黒鉛などの導体であるだけでよい。
【0011】
また、(+)電極が銀含有導体であれば、それが銀を含有する程度、すなわち銀の純度は特に問題とならない。それは、銀の純度が低くても、電気分解の際に高電圧をかけると、容易に銀イオン化を誘導することができるというのが当業界に公知になっているためである。但し、得られる銀イオン化植物抽出液が持つ抗微生物活性の側面からみては、銀の純度が高いほど好ましいであろう。
【0012】
また、電気分解時の電圧または電気分解時間は、銀イオン化が誘導される程度であれば、いずれの電圧でもいずれの時間でも構わないが、下記実験例は、電圧が高いほど且つ電気分解時間が長いほど、全般的に抗微生物効果が高くなる結果を示すという点において、前記電気分解時の電圧が高いほど且つ電気分解時間が長いほど好ましい(下記実験例1−4、実験例2−4、表5および表8参照)。
【0013】
一方、本発明の銀イオン化植物抽出液において、電解液としての植物抽出液は液体状の植物抽出物であればよい。植物抽出物の最初得られた形態が液体状であれば、その状態そのままを電解液として使用できるが、固体状であれば、蒸留水、水、アルコールなど電解液として使用できる任意の適切な溶媒で希釈して使用することができる。液体状の植物抽出物も植物抽出液の種類に応じて適切な溶媒で希釈して使用することが好ましい。
【0014】
一方、本発明者らによって選定された全ての植物抽出液が銀イオン化されたときに高い抗微生物性を持つという点において、前記植物抽出液は、それが得られる植物の種類を問わないものと理解できる。よって、分類学上「植物」に分類されるものであれば、それから得られる全ての抽出液が前記本発明の銀イオン化植物抽出液の製造において電解液として使用できる。
【0015】
分類学上「植物」に分類されるものとは、細胞膜の外側に細胞壁があり、光合成能力があって独立栄養生活能力を備えるものをいうが、例えば、藻類(藍藻類(Cyanophyta)、クリプト藻類(Cryptophyta)、黄金色藻類(Chrysophyta)、珪藻類(Bacillariophyta)、褐藻類(Phaeophyta)、紅藻類(Rholophyta)、緑藻類(Chlorophyta)、車軸藻類(Charophyta)、蘚苔植物(Bryophyta)、羊歯(Pteridophyta)、種子植物(Spermatophyta)(被子植物(Angiospermae)と裸子植物(Gymnospermae))などが含まれる。
【0016】
一方、松抽出液の場合、本発明者らによって選定されたいずれの微生物に対しても抗微生物性を示していないが、それを電解液として用いて得られた銀イオン化松抽出液の場合は、本発明者らによって選定された全ての微生物に対して非常に高い抗微生物性を示した(下記実験例3および表9参照)。そして、コノテガシワまたは海藻類抽出液の場合も、本発明者らによって選定された微生物のうち特定の幾つかの微生物に対してのみ弱い抗微生物性を示したが、前記抽出液を電解液として用いて銀イオン化させたときは、その結果物が、本発明者らによって選定された全ての微生物に対して非常に高い抗微生物性を示した(下記実験例4、実験例5、表10および表11参照)。
したがって、本発明の銀イオン化植物抽出液の製造において、電解液として用いる植物抽出液はそれがもともと抗微生物効果を持つかを問わないものと理解されるべきである。
【0017】
一方、植物抽出液は、植物を抽出対象とする限りはその抽出方法を問わないものと理解されるべきである。
一般に、植物抽出液を得る方法は4つに分類できるが、一つ目は植物に直・間接的に熱を加え、エキスタイプの植物抽出液を得る第1方法であり、二つ目は生きている植物の上部を切り、流れてくるエキスを得る第2方法であり、三つ目は植物を抽出溶媒(例えば、メタノール、蒸留水、エタノール、アセトン、酢酸エチル、飽和n−ブタノール、クロロホルム、塩化メチレン、水、またはこれらの混合溶媒)で抽出して得る第3方法であり、四つ目は植物を乾燥させた後、乾燥した植物を燃焼させ、燃焼の際に発生する気体を冷却させて得る第4方法である。
通常、前記第1方法、第2方法および第4方法は木質部(Xylem)を持つ植物への適用に適する方法であり、第3方法は全ての植物に対して適用できる方法である。
【0018】
本発明の下記参考例から得られた植物抽出液は、前記第1方法、第2方法(海藻類抽出液)および第4方法によって得られたものであるが、前記第3方法も本発明の銀イオン化植物抽出液の製造に電解液として使用でき、下記実験例では開示されていないが、実際、本発明者らが鋸屑状の竹を70%エタノールで抽出した後、凍結乾燥した粉末状の抽出物を3次蒸留水に溶解させ、それを電解液として用いて銀イオン化させたところ、その結果物が高い抗微生物性効果を持つことを確認することができた。
したがって、本発明の銀イオン化植物抽出液の製造において、電解液として用いられる植物抽出液は、それが得られる抽出方法を問わないものと理解されるべきである。
【0019】
一方、前述したように、植物抽出液は、それが得られる植物の種類と抽出方法を問わないが、好ましくは下記参考例に使用された植物、すなわち竹、オーク、松、コノテガシワ、海藻類を有し、前述した4つの抽出方法のうち任意の抽出方法を用いて得られる抽出液を意味し、さらに好ましくは前述した4つの抽出方法のうち第1、第2または第4の方法を用いて得られた抽出液を意味する。
ここで、海藻類とは、海で棲息する藻類(褐藻類、緑藻類、紅藻類などを含む)を意味し、竹、オーク、松、コノテガシワとは、その具体的な種類を問わず、分類学上それぞれ竹、オーク、松、コノテガシワに分類される植物を意味する。
【0020】
本発明の他の観点によれば、銀イオン化植物抽出液の製造方法を提供する。前記本発明の銀イオン化植物抽出液の製造方法は、電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする。
【0021】
本発明の別の観点によれば、抗微生物性を持つ植物抽出液の抗微生物性を高める方法を提供する。前記本発明の抗微生物性を持つ植物抽出液の抗微生物性を高める方法は、電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする。
【0022】
本発明の別の観点によれば、抗微生物性のない植物抽出液に抗微生物性を付加する方法を提供する。前記本発明の抗微生物性のない植物抽出液に抗微生物性を付加する方法は、電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする。
【0023】
前記本発明の銀イオン化植物抽出液の製造方法、抗微生物性を持つ植物抽出液の抗微生物性を高める方法、および抗微生物性のない植物抽出液に抗微生物性を付加する方法において、銀イオン化植物抽出液、抗微生物性の意味、微生物の意味、微生物の範囲、植物抽出液の意味、好適な観点における電気分解時の電圧または電気分解の時間、並びに銀の純度などに対しては、前述および後述したとおりの説明がそのまま有効である。
【0024】
本発明の別の観点によれば、有効成分として、前述したところの銀イオン化植物抽出液を含む抗微生物性組成物を提供する。
請求の範囲を含む本明細書において、前記「抗微生物性」とは、微生物の生長または増殖を抑制し、或いは微生物を死滅させる性質を意味する。
【0025】
また、請求の範囲を含む本明細書において、前記「微生物」とは、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液が抗微生物効果を示す全ての細菌、真菌、酵母、藻類を含む概念である。
【0026】
下記実験例から確認できるように、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液は、その植物抽出液が得られた植物の種類を問わず、本発明者らによって選定された全ての微生物に対して抗微生物活性を示した。
【0027】
当業者であれば、その通常の能力範囲内で下記実験例に基づく限りは、下記実験例から確認された微生物以外にも、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液が抗微生物効果を示すその他の微生物を確認、選別し得ると期待される。
したがって、前記「微生物」の意味には、下記実施例で直接確認された微生物以外にも、当業者の通常の能力範囲内で、本明細書が開示するところに基づき、本発明の銀イオン化植物抽出液がその抗微生物活性を示すものと予想されるその他の全ての微生物が含まれると理解されるべきである。
【0028】
少なくとも、前記「微生物」の意味には、植物抽出液が抗微生物活性を示す微生物、および銀イオン水が抗微生物活性を示す微生物が含まれると理解されるべきである。それは、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液が、下記実験例に示すように、植物抽出液自体が抗微生物活性を示す(場合によっては、活性を示さない)全ての微生物、および銀イオン水自体が抗微生物活性を示す(場合によっては、活性を示さない)全ての微生物に対して相乗的な抗微生物活性を示すという点において、本発明の抗微生物性組成物に有効成分として含まられる銀イオン化植物抽出液は、少なくとも植物抽出液または銀イオン水が抗微生物活性を示す微生物に対しては抗微生物活性を示すことが明白だからである。ここで、銀イオン水は、水や蒸留水、アルコールなどその他の電解液として利用できる溶媒で電気分解によって銀がイオン化されたものであると理解される。
【0029】
それにも拘わらず、前記「微生物」は、下記実験例で直接抗微生物性が確認された細菌、真菌または酵母を意味するものと理解されることが好ましく、特に細菌の中ではエシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、ラクトバシラス(Lactobacillus sp.) を意味すると理解されることが好ましく、真菌の中ではアスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.) を意味すると理解されることが好ましく、酵母の中ではカンジダ(Candida sp.)を意味すると理解されることが好ましい。最も好ましくは、下記実験例で抗微生物活性が直接確認されたそれぞれの微生物を意味する。
【0030】
前記本発明の抗微生物性組成物は、好適な様態を含んで前記定義された微生物が直・間接的に原因となって発生する有害な現象の改善または予防に単独でまたは他の抗微生物剤などと一緒に使用できる。
【0031】
前記「有害な現象」とは、それが改善または予防されるならばヒトに有益な現象と定義できるが、例えばヒト、動物または植物に発生する疾病、食品の腐敗、水質または土壌の汚染、繊維の腐敗などを挙げることができる。
【0032】
また、前記「微生物が直接的に原因となって発生する有害な現象」とは、当該微生物の生長または増殖を抑制し、或いは当該微生物を死滅させると、それにより改善または予防効果がある現象と定義できるが、例えば、サルモネラが引き起こすチフス性疾患または食中毒[下記参照文献30]、スタフィロコッカスが引き起こす蜂窩織炎、リンパ管炎、中耳炎[下記参照文献20〜25参照]、バシラスが引き起こす動物または植物の炭疽病[下記参照文献34〜35参照]、フサリウムが引き起こす作物伝染病[下記参照文献37〜40参照]、カンジダまたはラクトバシラスが引き起こす膣炎、アエロモナスやクロモバクテリウムなどが関与する皮膚外傷、ストレプトコッカスが引き起こす虫歯、トリコフィトンまたはマイクロスポルムが引き起こす白癬などを挙げることができる。この場合においては、本発明の抗微生物性組成物を単独で使用しても、意図するところの改善または予防効果を挙げることができる。
【0033】
また、前記において「微生物が間接的に原因となって発生する有害な現象」とは、そのような現象を改善または予防するために、当該微生物の生長または増殖を抑制し、或いは当該微生物を死滅させることが好ましい(すなわち、共に要求される)現象と定義できる。微生物が間接的に原因となって発生する有害な現象の例としては、ビブリオが引き起こす敗血症[下記参照文献32および33参照]、大腸菌0157が引き起こす腎臓組織損傷[下記参照文献26〜29参照]などを挙げることができる。
【0034】
前記微生物が間接的に原因となって発生する、ヒトに有害な現象は、他の抗微生物剤または前記現象の改善または予防剤と共に本発明の抗微生物性組成物を使用すると、より容易に改善または予防することができる。例えば、敗血症の場合、敗血症に治療または予防効果のある薬物(例えば、Lilly Co.社のXigrisなどと共に本発明の抗微生物性組成物が使用される場合を挙げることができる。
【0035】
一方、本発明の抗微生物性組成物において、銀イオン化植物抽出液は、抗微生物効果を示すことができる限りは、その適用様態または抗微生物性が要求される程度(すなわち、有害な現象の有害な程度)などに応じて適切な任意の量で本発明の抗微生物性組成物に含まれ得る。十分な抗微生物効果を得るためには、その適用様態または抗微生物性が要求される程度を問わず、通常、銀イオン化植物抽出液は、本発明の抗微生物性組成物にその組成物の全体重量を基準としたとき、0.1重量%以上、好ましくは3重量%以上含まれればよい。
【0036】
一方、本発明の抗微生物性組成物は、有効成分である銀イオン化植物抽出液の抗微生物効果を阻害しない限りは、銀イオン化植物抽出液以外にも、分散剤、担体、およびその他の抗微生物剤などを含んで製造できる。
【0037】
そのような分散剤として、水、アルコール(例えば、メチルアルコール、エチルアルコール、エチレングリコール、プロピレングリコール、ジエチレングリコール、グリセリンなど)、ケトン(例えば、アセトン、メチルエチルケトンなど)、エーテル(例えば、ジオクサン、テトラヒドロフラン、セロソルブ、ジエチレングリコールジメチルエーテルなど)、脂肪族炭化水素(例えば、ヘキサン、ケロセンなど)、芳香族炭化水素(例えば、ベンゼン、トルエン、キシレン、ナフタレン、メチルナフタレンなど)、ハロゲン化炭化水素(例えば、クロロホルム、四塩化炭素など)、酸アミド(例えば、ジメチルホルムアミドなど)、エステル(例えば、酢酸メチルエステル、酢酸エチルエステル、酢酸ブチルエステル、脂肪酸グリセリンエステルなど)、ニトリル(例えば、アセトニトリルなど)、界面活性剤(高級硫酸アルコールエステル、アルキルスルホン酸、アルキルアリールスルホン酸、4級アンモニウム塩、オキシアルキルアミン、脂肪酸エステル、ポリアルキレンオキシド化合物、アンヒドロソルビトール化合物)などが例示できる。前記分散剤は、単独でまたは2種以上の混合物として本発明の抗微生物性組成物に含まれ得る。
【0038】
担体として、粘土(例えば、カオリン、ベントナイト、酸粘土など)、滑石(例えば、滑石粉末、蝋石粉末など)、シリカ(例えば、珪藻土、珪酸無水物、雲母粉末など)、アルミナ、硫黄粉末、活性炭などが例示できる。これらの担体も、単独でまたは2種以上の混合物として本発明の抗微生物性組成物に含まれ得る。
【0039】
抗微生物剤として、カルバクロール(carvacrol)、チモール(thymol)、シトラール(citral)(韓国特許第438209号)、イソユージノール、メチルユージノール(韓国特許第427584号)、竹エキス(WO2003/105878)、ガノダーマシネンス(Ganoderma sinense)抽出液(韓国特許第445405号)、イソチアノゾロン(isothiazolone)化合物、アミノカルボン酸(WO2000/13510)などが例示できる。これらの抗微生物剤も、単独でまたは2種以上の混合物として本発明の抗微生物性組成物に含まれ得る。
【0040】
一方、本発明の抗微生物性組成物は、液体状、固体状および気体状のいずれの形に製造されてもよい。また、本発明の抗微生物性組成物は、経口、非経口など任意の方式で投与できるが、局所投与方式が好ましい。経口投与方式の剤形は、錠剤、丸薬、粉剤、液剤、食品の形などを例示することができ、非経口投与方式の剤形は、注射剤、局所投与剤(クリーム、軟膏など)、座薬、撒布剤(植物に適用する場合)などを例示することができる。特に、局所投与方式の剤形は、本発明の抗微生物性組成物を、天然繊維または合成繊維からなる担体に含浸させたもの、化粧品や石鹸などに含有させたものなどを含む。
【0041】
本発明の抗微生物性組成物は、前述したとおりのヒトに有害な現象を改善または予防することができれば、ヒトだけでなく、愛玩動物や家畜、養殖魚類などを含んだ動物または植物にも投与/撒布でき、防腐剤用として食品に添加されることも可能であり、ひいてはヒトが使用する繊維製品などにもその製品の保存性を延長させるために繊維製品の製造の際に添加される、または製造の後に塗布されることが可能である。
【0042】
前記において、本発明の抗微生物性組成物がヒトに投与されるための様態、すなわち薬学的組成物に対しては、本発明の抗微生物性組成物が主に薬学的組成物として利用されるだろうと期待されるという点において、以下で特に詳述する。
本発明の抗微生物性組成物が薬学的組成物として利用される場合、その薬理効果は、本発明の抗微生物性組成物に有効成分として含まれる銀イオン化植物抽出液が抗微生物効果を示す微生物が引き起こす疾病に対する改善または予防効果と把握できるであろう。
【0043】
前記薬理効果は、好ましくは下記実験例で銀イオン化植物抽出液が直接的に抗微生物効果を示すものと確認された細菌、真菌、酵母が引き起こす疾病に対する改善または予防効果と把握でき、さらに好ましくは前記細菌、真菌または酵母の中でもエシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、カンジダ(Candida sp.)、ラクトバシラス(Lactobacillus sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.)などが引き起こす疾病に対する改善または予防効果と把握できるであろう。
【0044】
具体的に、本発明の抗微生物性薬学的組成物は、大腸菌、特に大腸菌0157が引き起こす腎臓組織損傷[下記参照文献26〜29]、サルモネラが引き起こすチフス性疾患、食中毒[下記参照文献30]、ビブリオが引き起こすコレラ、敗血症、腸炎[下記参照文献31〜32]、スタフィロコッカスが引き起こすフルンケル、蜂窩織炎、リンパ管炎、ひょう疽(felon)、中耳炎、肺炎、食中毒、敗血症[下記参照文献20〜25参照]、カンジダが引き起こす淋疾、結核、梅毒、ジフテリア、腸チフス、はしか、口内と陰部の粘膜の炎症(膣炎を含む)、掻痒症または痛症[下記参照文献1〜18]、アスペルギルスが引き起こす敗血症[下記参照文献36および37参照]、ラクトバシラスが引き起こす膣炎、アエロモナスやクロモバクテリウムなどが引き起こす皮膚外傷、ストレプトコッカスが引き起こす虫歯や歯周炎、トリコフィトンまたはマイクロスポルムが引き起こす白癬などに対する改善または予防効果を持つ。
【0045】
前記において本発明の抗微生物性薬学的組成物に有効成分として含まれる銀イオン化植物抽出液が前記微生物に対して抗微生物効果を持つという点において、本発明の抗微生物性薬学的組成物は、前記微生物が引き起こす疾病に対して薬理効果を持つことは自明なので、本発明の薬学的組成物が薬理効果を持つと予想される前記疾病はあくまでも例示に過ぎないと理解されるべきである。よって、本発明の薬学的組成物の薬理効果が前記例示された疾病に対する薬理効果に限定されると理解されてはならない。
【0046】
少なくとも、本発明の抗微生物性薬学的組成物は、前述した微生物が引き起こす、下記に引用された参照文献上に開示された疾病に対しては改善または予防の薬理効果を持つと理解されるべきである。
【0047】
一方、本発明の薬学的組成物は、有効成分として、銀イオン化植物抽出液以外に、薬学的に許容される担体を含むことができるが、このような薬学的に許容される担体は、薬品製剤の際に通常利用されるものであって、ラクトース、デキストロース、スクロース、ソルビトール、マンニトール、澱粉、アカシアゴム、リン酸カルシウム、アルギン酸塩、ゼラチン、珪酸カルシウム、微細結晶性セルロース、ポリビニルピロリドン、セルロース、水、シロップ、メチルセルロース、メチルヒドロキシベンゾエート、プロピルヒドロキシベンゾエート、滑石、ステアリン酸マグネシウム、ミネラルオイルなどを含む。
【0048】
本発明の薬学的組成物は、また、添加剤として、当業界に知られている潤滑剤、湿潤剤、甘味剤、香味剤、乳化剤、懸濁剤、保存剤などをさらに含むことができる。
【0049】
前記担体は、本発明の薬学的組成物に、それの全体重量に対して約0.1重量%〜約99.9重量%、好ましくは約0.1重量〜約97重量%で含まれることができ、前記添加剤は、約0.1重量%〜約20重量%で含まれることができる。
【0050】
一方、本発明の薬学的組成物は、経口または非経口で投与でき、好ましくは局所投与方式で当該部位に直接投与できる。
本発明の薬学的組成物は、薬学的に許容される担体を用いて製剤化することにより、単位用量の形で、或いは多用量の容器内に入れて製造できる。この際、剤形は溶液、懸濁液、乳化液、エリキシル剤、エキス剤、粉末剤、顆粒剤、錠剤、軟膏などを含むことができる。
【0051】
本発明の薬学的組成物は、その1日投与量が通常0.001〜150mL/kg体重の範囲であり、1回または数回に分けて投与することができる。ところが、本発明の薬学的組成物の投与量は投与経路、患者の年齢、性別、体重、患者の重症度、使用期間などのいろんな関連因子に鑑みて定められるものなので、前記投与量はどんな側面からも本発明の範囲を制限するものと理解されてはならない。
【発明の効果】
【0052】
前述したように、本発明は、銀イオン化植物抽出液とその銀イオン化植物抽出液の抗微生物剤としての用途を開示する。
本発明の銀イオン化植物抽出液は、様々な微生物に対して抗微生物効果を示すことにより、その微生物が原因となって発生する有害な現象の改善または予防に有用に使用できる。
【発明を実施するための最良の形態】
【0053】
以下、本発明を参考例、実施例および実験例を参照して説明する。ところが、本発明の範囲はこのような参考例、実施例および実験例によって制限されるものではない。
【0054】
<参考例>植物抽出液の製造または購入
【0055】
<参考例1>竹抽出液の製造
【0056】
竹を約30cm程度に細切し、細切された竹の中央部分に約400℃程度の熱を加え、細切された竹の両端から出るエキスを採取して竹抽出液を製造した。製造された竹抽出液の酸度を測定したところ、酸度がpH267であった。
【0057】
<参考例2>木草液(オーク抽出液)の購入
【0058】
木草液は韓国ソウル市中浪区所在の(株)Life−Chamsoot社から購入して使用した。
【0059】
<参考例3>松抽出液の製造
【0060】
松を約30cm程度に細切し、細切された松の中央部分に約300℃の熱を加え、細切された松の両端から出るエキスを採取して松抽出液を製造した。
【0061】
<参考例4>コノテガシワ抽出液の製造
【0062】
コノテガシワを約30cm程度に細切し、細切されたコノテガシワの中央部分に約400℃の熱を加え、細切されたコノテガシワの両端から出るエキスを採取してコノテガシワ抽出液を製造した。
【0063】
<参考例5>海藻類抽出液の購入
【0064】
海藻類抽出液(海藻類を圧搾して得られるエキスタイプの抽出液である)は、Harveson社(Freegrow、Harveson Inc.Philippine)(液体状であり、pHは14である)から購入した。
【0065】
<実施例>銀イオン化植物抽出液の製造
【0066】
<実施例1〜10>電気分解を利用した銀イオン化竹抽出液の製造
【0067】
非導電性の電解槽に、前記<参考例1>で得られた竹抽出液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、下記<表1>の電圧と時間で銀イオン化を誘導して、銀イオンと前記竹抽出液とが反応するようにした。その結果、濃い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化竹抽出液を製造した。
【0068】
【表1】

【0069】
<実施例11〜20>電気分解を利用した銀イオン化木草液の製造
【0070】
非導電性の電解槽に前記<参考例2>の木草液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、下記<表2>の電圧と時間で銀イオン化を誘導して、銀イオンと前記木草液とが反応するようにした。その結果、濃い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化木草液を製造した。
【0071】
【表2】

【0072】
<実施例21>電気分解を利用した銀イオン化松抽出液の製造
【0073】
非導電性の電解槽に、前記<参考例3>で得られた松抽出液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、9Vの電圧をかけて約4分間銀イオン化を誘導して、銀イオンと前記松抽出液とが反応するようにした。その結果、薄い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化松抽出液を製造した。
【0074】
<実施例22>電気分解を利用した銀イオン化コノテガシワ抽出液の製造
【0075】
非導電性の電解槽に、前記<参考例4>で得られたコノテガシワ抽出液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、9Vの電圧をかけて約4分間銀イオン化を誘導して、銀イオンと前記コノテガシワ抽出液とが反応するようにした。その結果、薄い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化コノテガシワ抽出液を製造した。
【0076】
<実施例23>電気分解を利用した銀イオン化海藻類抽出液の製造
【0077】
まず、電解液としては、前記<参考例5>の海藻類抽出液に3次蒸留水を添加して2倍に希釈させた後、得られる上澄み原液を使用した。
非導電性の電解槽に前記上澄み原液を入れた後、高純度(99.9%以上)の2本の銀棒に(+)電極と(−)電極を連結し、9Vの電圧をかけて約4分間銀イオン化を誘導して、銀イオンと前記2倍希釈された海藻類抽出液の上澄み原液とが反応するようにした。その結果、濃い褐色の沈殿物が形成されたが、前記電気分解した溶液を遠心分離した後、膜濾過(Pall Corporation;Acrodisc Syringe Filter、0.2μm)させて沈殿物を完全に除去し、最終的に銀イオン化海藻類抽出液を製造した。
【0078】
<実験例>銀イオン化植物抽出液の抗微生物効果実験
【0079】
<実験例1>銀イオン化竹抽出液の抗微生物効果実験
<実験例1−1>カンジダ(Candida sp.)に対する抗微生物効果実験
【0080】
本実験で使用されたカンジダ(Candida sp.)は、カンジダクルセイ(Candida krusei)ATCC6258、カンジダパラプシロシス(Candida parapsilosis)ATCC22019、カンジダグラブラータ(Candida glabrata)ATCC90030である。
【0081】
まず、滅菌した培養液(Sabouraud Dextrose Broth、10mL)に<参考例1>の竹抽出液を無処理または400μL、800μL、1600μL、3200μLの量でそれぞれ処理し、また800μLの<実施例10>の銀イオン化竹抽出液を処理した後、十分に成長した100μLのカンジダクルセイATCC6258、カンジダパラプシロシスATCC22019、カンジダグラブラータATCC90030をそれぞれ接種して30℃で培養した。
【0082】
培養中に2時間間隔でO.D(600nm)値を測定し、その結果を図1〜図3に示した。図1〜図3はそれぞれカンジダクルセイATCC6258、カンジダパラプシロシスATCC22019、カンジダグラブラータATCC90030に対する菌株の増殖程度を調べた結果である。
【0083】
カンジダクルセイの場合は、<参考例1>の竹抽出液を400μL添加したときに特別な抗微生物効果を示しておらず、800μL以上を添加したときには抗微生物効果を示し始め、1600μLを添加したときにはカンジダクルセイの増殖が完全に抑制されたが、これに対し、銀イオン化竹抽出液を800μL添加したときにはカンジダクルセイの増殖が完全に抑制された。このような結果より、<参考例1>の竹抽出液の場合は最小発育阻止濃度(Minimum Inhibitory concentration;以下「MIC」という)が少なくとも80μL/mL以上であるが、銀イオン化竹抽出液の場合はMICが80μL/mL以下であることが分かる。
【0084】
カンジダパラプシロシスの場合は、<参考例1>の竹抽出液と銀イオン化竹抽出液の両方とも800μLを添加したときに菌の増殖が完全に抑制されたが、カンジダグラブラータの場合は、前記カンジダクルセイに対する抗微生物効果と同様に、<参考例1>の竹抽出液は1600μLを添加したときに菌の増殖が抑制され、銀イオン化竹抽出液は800μLを添加したときに菌の増殖が抑制された。
【0085】
<実験例1−2>細菌および酵母に対する抗微生物効果実験
【0086】
バクテリアのうち、大腸菌0157(KCCM40406)、Bacillus therengenesis(KCTC1034)、Staphylococcus warneri(KACC 10785)、Staphylococcus aureus(KACC 10778)、Staphylococus aureus(KACC 10778)およびVibrio sp.(全南大病院)は、LB Brothで初期培養(37℃、12時間)し、Aeromonas hydrophila subsp. Hydrophila(KCCM32586)とChromobacterium violaceum(KCCM11748)はNutrient Broth培地で初期培養し(26℃、18時間)、Streptococcus pyogenes(KCCM11856)およびStreptococcus mutants(KCCM 40105)はBHI(Brain Heart Infusion) Broth培地で初期培養し(37℃、18時間)、Lactobacillus crispatus(KCCM41620)はLactobacilli MRS Broth培地で初期培養した(37℃、18時間)。そして、カンジダ(Candida sp.)はSD(Sabouraud Dextrose)Brothで初期培養(30℃、12時間)した。
【0087】
初期培養の後、微生物培地(LB寒天)入りのそれぞれのペトリ皿に前記初期培養された100μLのそれぞれの菌株を十分塗抹した後、<参考例1>の竹抽出液、銀イオン水、<実施例10>の銀イオン化竹抽出液12μLを前記微生物の塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育をクリアゾーン(clear zone)で判断して下記<表2>に示した。
ここで、前記銀イオン水は、前記<実施例10>と同様の方法および条件で、<参考例1>の竹抽出液の代わりに3次蒸留水を用いて製造されたものである。
【0088】
【表3】

【0089】
前記<表3>は、<実施例10>の銀イオン化竹抽出液のバクテリアと酵母に対する抗微生物効果が<参考例1>の竹抽出液または銀イオン水の抗微生物効果よりも相乗的な効果であることを示す。前記において一般に抗微生物効果を持つと知られている銀イオン水が抗微生物効果を示していないのは、電気分解の電圧が低く、時間が短くて十分な量の銀イオンが発生していないためであると推測される。
【0090】
<実験例1−3>真菌に対する抗微生物効果実験
【0091】
Aspergillus ocnraceus(KACC4007)、Trichoderma harzianum(KCTC6426)、Fusarium solani(KCTC6328)、およびFusarium oxysporum(KACC40037)はPDA(ポテトデキストロース寒天培地、Duchefa)培地、Aspergillus ochraceus(KACC40077)、Fusarium solani(KACC40384)およびFusarium graminearum(KACC40532)はMEA(Malt Extraction liquid Agar)培地、Trichophyton rubrum(KCTC6345)、Microsporum audouinii(KCTC6346)およびTrichophyton ferrugineum(KCTC6351)はSDA(Sabouraud Dextrose Agar)培地の中心部に菌を移植し、菌が栄養繁殖を始めて円形に確定されるとき(約7日間培養する)、一定の距離をおいてペーパーディスク(paper disk)に適量(約30μL)の試料、すなわち<参考例1>の竹抽出液、銀イオン水、<実施例10>の銀イオン化竹抽出液を吸収させた後、12時間後に菌が前記試料処理地域へ増殖されるか否かを観察し、その結果を下記<表3>に示した。
ここで、前記銀イオン水は、前記<実施例10>と同様の方法と条件で、<参考例1>の竹抽出液の代わりに3次蒸留水を用いて製造されたものである。
【0092】
【表4】

【0093】
前記<表4>より、前記<実験例1−2>の<表3>と同様に、<実施例10>の銀イオン化竹抽出液の真菌に対する抗微生物効果が<参考例1>の竹抽出液または銀イオン水の抗微生物効果よりも相乗的な効果であることが分かる。銀イオン水が真菌に対する抗微生物効果を示していないのは、前記<表3>で説明したような理由であると推測される。
【0094】
<実験例1−4>電気分解の電圧と時間による抗微生物効果実験
【0095】
前記<実施例1〜10>の銀イオン化竹抽出液を用いて、銀イオン化竹抽出液の製造の際に電気分解の電圧と時間が抗微生物活性に対してどんな影響を及ぼすかを調べた。
実験方法は前記<実験例1−2>と同様であり、その結果は下記<表5>に示した。
【0096】
【表5】

【0097】
前記<表5>によれば、銀イオン化竹抽出液は、全般的に電気分解時の電圧が高いほど、且つ電気分解時間が長いほどさらに高い抗微生物効果を持つ。
【0098】
<実験例2>銀イオン化木草液の抗微生物効果実験
【0099】
<実験例2−1>カンジダ(Candida sp.)に対する抗微生物効果実験
【0100】
前記<実験例1−1>と同様の方法によってカンジダ(Candida sp.)に対する抗微生物効果を調べた。
本実験に使用されたカンジダ(Candida sp.)は、カンジダクルセイ(Candida krusei)ATCC6258、カンジダパラプシロシス(Candida parapsilosis)ATCC22019、カンジダグラブラータ(Candida glabrata)ATCC90030、カンジダアルビカンス(Candida albicans)ATCC64550およびカンジダアルビカンス(Candida albicans)ATCC90028である。
【0101】
まず、滅菌した培養液(Sabouraud Dextrose Broth)10mLに<参考例2>の木草液を無処理(CON)または100μL、200μL、400μL、800μL、1600μLの量でそれぞれ処理し、また200μL、400μLの<実施例20>の銀イオン化木草液を処理した後、十分成長した100μLのカンジダクルセイATCC6258、カンジダパラプシロシスATCC22019、カンジダグラブラータATCC90030、カンジダアルビカンスATCC64550(C. albicans 1)およびカンジダアルビカンスATCC90028(C. albicans 2)をそれぞれ接種して30℃で培養した。
【0102】
培養中2に時間間隔でO.D(600nm)値を測定し、その結果を図4〜図8に示した。図4〜図8はそれぞれカンジダクルセイATCC6258、カンジダパラプシロシスATCC22019、カンジダクラブラータATCC90030、カンジダアルビカンスATCC64550、およびカンジダアルビカンスATCC90028に対する菌株の増殖程度を調べた結果である。
【0103】
カンジダクルセイと2種のカンジダアルビカンスの場合は、木草液を100μL添加したときには特別な抗微生物効果を示しておらず、木草液を200μL以上添加したときに抗微生物効果が現われ始め、木草液を400μL添加したときには完全にその増殖が抑制された。これに対し、銀イオン化木草液の場合は、木草液を200μLを添加したときにその増殖が完全に抑制された。このような結果より、カンジダクルセイと2種のカンジダアルビカンスにおいて、木草液の場合は最小発育阻止濃度(Minimum Inhibitiry Concentration;以下「MIC」という)が少なくとも20μL/mL以上であるが、銀イオン化木草液の場合はMICが20μL/mL以下であることが分かる。
【0104】
カンジダパラプシロシスの場合は、木草液と銀イオン化木草液の両方とも200μLを添加したときに菌の増殖が完全に抑制されたが、カンジダグラブラータの場合は、前記カンジダクルセイに対する抗微生物効果と同様に、木草液は800μLを添加したときに菌の増殖が完全に抑制され、銀イオン化木草液は400μLを添加したときに菌の増殖が完全に抑制された。
【0105】
<実験例2−2>細菌および酵母に対する抗微生物効果実験
【0106】
前記<実験例1−2>と同様の方法で、細菌と酵母に対する抗微生物効果を調べた。
バクテリアは、LB Brothで初期培養(37℃、12時間)し、カンジダ(Candida sp.)は、SD(Sabouraud Dextrose) Brothで初期培養(30℃、12時間)した後、微生物培地(LB寒天)入りのペトリ皿に、初期培養された100μLの菌株を十分塗抹した後、<参考例2>の木草液、銀イオン水、<実施例20>の銀イオン化木草液12μLを、前記バクテリアが塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育有無をクリアゾーンで判断して下記<表6>に示した。
ここで、前記銀イオン水は、前記<実施例20>と同様の方法および条件で、<参考例2>の木草液の代わりに3次蒸留水を用いて製造されたものである。
【0107】
【表6】

【0108】
前記<表6>は、<実施例20>の銀イオン化木草液のバクテリアと酵母に対する抗微生物効果が<参考例2>の木草液または銀イオン水の抗微生物効果よりも相乗的な効果であることを示す。前記において一般に抗微生物効果を持つと知られている銀イオン水が抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0109】
<実験例2−3>真菌に対する抗微生物効果実験
【0110】
前記<実験例1−3>と同様の方法で、真菌(カビ菌)に対する抗微生物効果を調べた。
培地(ポテトデキストロース寒天培地、Duchefa)の中心部に菌を移植し、菌が栄養繁殖を始めて円形に確定されるとき、一定の距離をおいてペーパーディスクに25μLの試料、すなわち<参考例2>の木草液、銀イオン水、<実施例10>の銀イオン化木草液を吸収させた後、12時間後に菌が前記試料処理地域へ増殖するか否かを観察し、その結果を下記<表7>に示した。
ここで、前記銀イオン水は、前記<実施例20>と同様の方法と条件で、<参考例2>の木草液の代わりに3次蒸留水を用いて製造されたものである。
【0111】
【表7】

【0112】
前記<表7>からも分かるように、前記実験例と同様に、<実施例20>の銀イオン化木草液の真菌に対する抗微生物効果が<参考例2>の木草液または銀イオン水の抗微生物効果よりも相乗的な効果である。銀イオン水が真菌に対する抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0113】
<実験例2−4>電気分解の電圧と時間による抗微生物効果実験
【0114】
前記<実施例11〜20>の銀イオン化木草液を用いて、銀イオン化木草液の製造時の電気分解の電圧と時間が抗微生物活性に対してどんな影響を及ぼすかを調べた。
実験方法は前記<実験例2−2>と同様であり、その結果は下記<表8>に示した。
【0115】
【表8】

【0116】
前記<表8>は、銀イオン化木草液が全般的に電気分解時の電圧が高いほど、且つ電気分解時間が長いほど、さらに高い抗微生物効果を持つことを示している。
【0117】
<実験例3>銀イオン化松抽出液の抗微生物効果実験
【0118】
前記<実験例1−2>と同様の方法で、細菌と酵母に対する抗微生物効果を調べた。
バクテリアは、MH(Mueller Hinton) Brothで初期培養(37℃、12時間)し、カンジダ(Candida sp.)はSD(Sabouraud Dextrose) Brothで初期培養(30℃、12時間)した後、微生物培地(MH寒天)入りのペトリ皿に、初期培養された100μLの菌株を十分塗抹した後、<参考例3>の松抽出液、銀イオン水、<実施例21>の銀イオン松抽出液15μLを、前記バクテリアの塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育有無を形成されたクリアゾーンで判断して下記<表9>に示した。
ここで、前記銀イオン水は、前記<実施例21>と同様の方法と条件で、<参考例3>の松抽出液の代わりに3次蒸留水を用いて製造された。
【0119】
【表9】

【0120】
前記<表9>より分かるように、<参考例3>の松抽出液または銀イオン水は抗微生物効果を示していないが、<実施例21>の銀イオン化松抽出液はバクテリアおよび酵母に対して抗微生物効果がある。前記で銀イオン水が抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0121】
<実験例4>銀イオン化コノテガシワ抽出液の抗微生物効果実験
【0122】
前記<実験例1−2>と同様の方法で、細菌と酵母に対する抗微生物効果を調べた。
バクテリアはMH(Mueller Hinton) Brothで初期培養(37℃、12時間)し、カンジダ(Candida sp.)はSD(Sabouraud Dextrose) Brothで初期培養(30℃、12時間)した後、微生物培地(MH寒天)入りのペトリ皿に、初期培養された100μLの菌株を十分塗抹した後、<参考例4>のコノテガシワ抽出液、銀イオン水、<実施例22>の銀イオンコノテガシワ抽出液15μLを、前記バクテリアの塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育有無を形成されたクリアゾーンで判断して下記<表10>に示した。
ここで、前記銀イオン水は、前記<実施例22>と同様の方法と条件で、<参考例4>の松抽出液の代わりに3次蒸留水を用いて製造された。
【0123】
【表10】

【0124】
前記<表10>は、<実施例22>の銀イオン化コノテガシワ抽出液のバクテリアおよび酵母に対する抗微生物効果が<参考例4>のコノテガシワ抽出液または銀イオン水の抗微生物効果よりも相乗的な効果であることを示す。前記において銀イオン水が抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0125】
<実験例5>銀イオン化海藻類抽出液の抗微生物効果実験
前記<実験例1−2>と同様の方法で、細菌と酵母に対する抗微生物効果を調べた。
バクテリアはMH(Mueller Hinton) Brothで初期培養(37℃、12時間)し、カンジダ(Candida sp.)はSD(Sabouraud Dextrose) Brothで初期培養(30℃、12時間)した後、微生物培地(MH寒天)入りのペトリ皿に、初期培養された100μLの菌株を十分塗抹した後、蒸留水で2倍希釈された<参考例5>の海藻類抽出液の上澄み原液(<実施例23>参照)、銀イオン水、<実施例23>の銀イオン化海藻類抽出液15μLを、前記バクテリアの塗抹された微生物培地上に添加した。そして、恒温器で12時間培養した後、バクテリアの生育有無を形成されたクリアゾーンで判断して下記<表11>に示した。
ここで、前記銀イオン水は、前記<実施例23>と同様の方法と条件で、蒸留水で2倍希釈された<参考例5>の海藻類抽出液の上澄み原液の代わりに3次蒸留水を用いて製造された。
【0126】
【表11】

【0127】
前記<表11>は、<実施例23>の銀イオン化海藻類抽出液のバクテリアおよび酵母に対する抗微生物効果が<参考例5>の海藻類抽出液または銀イオン水の抗微生物効果よりも相乗的な効果であることを示す。前記において銀イオン水が抗微生物効果を示していないのは前記<表3>での説明と同じ理由であろう、と推測される。
【0128】
本発明者らは、電気分解によって生成された銀イオンが竹抽出液または木草液などの植物抽出液に存在する未知の物質と反応して新規物質を生成することにより、その物質が抗微生物効果を高める、と推測している。
【0129】
一方、前記実験例には示されていないが、本発明者らが前記<実験例1−2>と同様の方法で実験した結果によれば、銀イオン化竹抽出液または木草液はバシラスアントラシス(Bacillus anthracis)、大腸菌DH5α、スタフィロコッカススクレイフェリ(Staphylococcus schleiferi)に対しても抗微生物効果があった。
【0130】
[参照文献]
下記参照文献は、本明細書の一部を成す。
1. Ripeau JS, Aumont F, Belhumeur P, Ostrosky-Zeichner L, Rex JH, de Repentigny L. Effect of the echinocandin caspofungin on expression of Candida albicans secretory aspartyl proteinases and phospholipase in vitro. Antimicrob Agents Chemother. 2002 Sep;46(9):3096-100
2. Barousse, M. M., C. Steele, K. Dunlap, T. Espinosa, D. Boikov, J. D. Sobel,and P. L. Fidel, Jr. 2001. Growth inhibition of Candida albicans by human vaginal epithelial cells. J. Infect. Dis. 184:1489-1493.
3. Brassart, D., A. Woltz, M. Golliard, and J. R. Neeser. 1991. In vitro inhibition of adhesion of Candida albicans clinical isolates to human buccal epithelial cells by Fuc 132Gal-bearing complex carbohydrates. Infect. Immun.59:1605-1613.
4. Cameron, B. J., and L. J. Douglas. 1996. Blood group glycolipids as epithelial cell receptors for Candida albicans. Infect. Immun. 64:891-896.
5. Chaim, W., B. Foxman, and J. D. Sobel. 1997. Association of recurrent vaginal candidiasis and secretory ABO and Lewis phenotype. J. Infect. Dis.176:828-830.
6. Critchley, I. A., and L. J. Douglas. 1987. Role of glycosides as epithelial cell receptors for Candida albicans. J. Gen. Microbiol. 133:637-643.
7. Fidel, P. L., Jr. 2002. Immunity to Candida. Oral Dis. 8(Suppl. 2):69-75.
8. Fidel, P. L., Jr., J. Cutright, and C. Steele. 2000. Effects of reproductive hormones on experimental vaginal candidiasis. Infect. Immun. 68:651-657.
9. Fidel, P. L., Jr., M. E. Lynch, and J. D. Sobel. 1993. Candida-specific cellmediated immunity is demonstrable in mice with experimental vaginal candidiasis. Infect. Immun. 61:1990-1995.
10. Han, Y., R. P. Morrison, and J. E. Cutler. 1998. A vaccine and monoclonal antibodies that enhance mouse resistance to Candida albicans vaginal infection. Infect. Immun. 66:5771-5776.
11. Kelly, R. J., S. Rouquier, D. Giorgi, G. G. Lennon, and J. B. Lowe. 1995. Sequence and expression of a candidate for the human secretor blood group (1,2)fucosyltransferase gene (FUT2). Homozygosity for an enzyme-inactivating nonsense mutation commonly correlates with the non-secretor phenotype. J. Biol. Chem. 270:4640-4649.
12. Kirkpatrick WR, Lopez-Ribot JL, McAtee RK, Patterson TF Growth competition between Candida dubliniensis and Candida albicans under broth and biofilm growing conditions. Clin Microbiol. 2000 Feb;38(2):902-4.
13. Schaeffer, A. J., N. Rajan, Q. Cao, B. E. Anderson, D. L. Pruden, J. Sensibar, and J. L. Duncan. 2001. Host pathogenesis in urinary tract infections. Int. J. Antimicrob. Agents 17:245-251.
14. Sobel, J. D. 1988. Pathogenesis and epidemiology of vulvovaginal candidiasis. Ann. N. Y. Acad. Sci. 544:547-557.
15. Sobel, J. D. 1992. Pathogenesis and treatment of recurrent vulvovaginal candidiasis. Clin. Infect. Dis. 14(Suppl. 1):S148-S153.
16. Steele, C., J. Leigh, R. Swoboda, H. Ozenci, and P. L. Fidel, Jr. 2001. Potential role for a carbohydrate moiety in anti-Candida activity of human oral epithelial cells. Infect. Immun. 69:7091-7099.
17. Vardar-Unlu, G., C. McSharry, and L. J. Douglas. 1998. Fucose-specific adhesins on germ tubes of Candida albicans. FEMS Immunol. Med. Microbiol. 20:55-67.
18. Kirkpatrick WR, Lopez-Ribot JL, McAtee RK, Patterson TF Growth competition between Candida dubliniensis and Candida albicans under broth and biofilm growing conditions. Clin Microbiol. 2000 Feb;38(2):902-4.
19. Saadi, A. T., D. M. Weir, I. R. Poxton, J. Stewart, S. D. Essery, C. C. Blackwell, M. W. Raza, and A. Busuttil. 1994. Isolation of an adhesin from Staphylococcus aureus that binds Lewis a blood group antigen and its relevance to sudden infant death syndrome. FEMS Immunol. Med. Microbiol.8:315-320.
20. Steinberg, J.P., Clark, C.C., and Hackman, B.O. 1996. Nosocomial and community-acquired Staphylococcus aureus bacteremias from 1980 to 1993: impact of intravascular devices and methicillin resistance. Clin. Infect. Dis. 23:255.259.
21. Staphylococcus Laboratory, Statens Serum Institut. 2003. Annual report on Staphylococcus aureus bacteraemia cases 2001. StaphylococcusLaboratory, National Center for Antimicrobials and Infection Control, Statens Serum Institut. Copenhagen, Denmark. 9 pp.
22. Luzar, M.A., et al. 1990. Staphylococcus aureus nasal carriage and infection in patients on continuous ambulatory peritoneal dialysis. N. Engl. J. Med. 322:505.509.
23. Yu, V.L., et al. 1986. Staphylococcus aureus nasal carriage and infection in patients on hemodialysis. Efficacy of antibiotic prophylaxis. N. Engl. J. Med.315:91.96.
24. Nguyen, M.H., et al. 1999. Nasal carriage of and infection with Staphylococcus aureus in HIV-infected patients. Ann. Intern. Med. 130:221.225.
25. Moss, B., Squire, J.R., and Topley, E. 1948. Nose and skin carriage of Staphylococcus aureus in patients receiving penicillin. Lancet. 1:320.325.
26. Sherman P, Drumm B, Karmali M & Cutz E. Adherence of bacteria to the intestine in sporadic cases of Enteropathogenic Escherichia coli-associated diarrhea in infants and young children: a prospective study.Gastroenterol, 1989;96:86:-94
27. Cravioto A, Gross RJ, Scotland SM, Rowe B. An adhesive factor found in strains of escherichia coli belonging to the traditional infantile enteropathogenic serotypes. Current Microbiology,1979;3:95-9.
28. Scaletsky ICA, Silva MLM, Trabulsi LR. Distinctive patterns of adherence of enteropathogenic Escherichia coli to HelLa cells. Infct. Immun., 1984;45:534-6.
29. Nataro JP, Baldini MM, Kaper JB, Black RE, Bravo N, Levine M.M. Detection of an adherence factor of enteropathogenic Escherichia coli with a DNA probe. Infect. Dis. 1985;152:560-5
30. TAVECHIO, A.T.; GHILARDI, A.C.R.; PERESI, J.T. et al. Salmonella serotypes isolated from nonhuman sources in S Paulo, Brazil, from 1996 through 2000. J. Food protect., 65: 1041-1044, 2002.
31. THEOPHILO, G.N.D. & VIEIRA, R.H.S.F. Pesquisa de Vibrio parahaemolyticus em caranguejos crus e cozidos comercializados na Praia do Futuro (Fortaleza, CE). Bol.SBCTA, 28: 134-142, 1994.
32. VIEIRA, R.H.S.F. & IARIA, S.T. - Vibrio parahaemolyticus in lobster Panulirus laevicauda (Latreille). Rev. Microbiol. (S. Paulo), 24: 16-21,1993.
33. Puglielli L, Cattrini C, Garces Resa JJ, Velasques M, Leon Garcia LM Symptomless carriage of Vibrio cholerae in Peru. Lancet. 1992 Apr 25;339(8800):1056-7
34. Parkinson R, Rajic A, Jenson C. Investigation of an anthrax outbreak in Alberta in 1999 using a geographic information system. Agriculture and Agri-Food Canada, 600, 138-4th Avenue Southeast, Calgary, Alberta T2G 4Z6.
35. Watson J, Koya V, Leppla SH, Daniell H Expression of Bacillus anthracis protective antigen in transgenic chloroplasts of tobacco, a non-food/feed crop.Vaccine. 2004 Oct 22;22(31-32):4374-84 Department of Molecular Biology and Microbiology, University of Central Florida, Biomolecular Science Building #20, Room 336, Orlando, FL 32816-2364, USA.
36. Jarque I, Andreu R, Salavert M, Gomez D, Peman J, Gobernado M, Sanz MA.[Value of Aspergillus galactomannan antigen detection in the diagnosis and follow-up of invasive aspergillosis in hematological patients]
37. Jimenez-Gasco MM, Navas-Cortes JA, Jimenez-Diaz RM.The Fusarium oxysporum f. sp. ciceris/Cicer arietinum pathosystem: a case study of the evolution of plant-pathogenic fungi into races and pathotypes. Int Microbiol. 2004 Jun;7(2):95-104
38. Lievens B, Brouwer M, Vanachter AC, Cammue BP, Thomma BP Rapid detection and identification of tomato vascular wilt pathogens using a DNA array. Commun Agric Appl Biol Sci. 2003;68(4 Pt B):569-81
39. Okhovvat SM, Zakeri Z Identification of fungal diseases associated with imported wheat in Iranian silos. Commun Agric Appl Biol Sci. 2003;68(4 Pt B):533-5
40. Lievens B, Brouwer M, Vanachter AC, Levesque CA, Cammue BP, Thomma BPDesign and development of a DNA array for rapid detection and identification of multiple tomato vascular wilt pathogens. FEMS Microbiol Lett. 2003 Jun 6;223(1):113-22
【図面の簡単な説明】
【0131】
【図1】図1は竹抽出液と銀イオン化竹抽出液をそれぞれカンジダクルセイATCC6258培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図1において、CONは竹抽出液を無処理した場合であり、400、800、1600および3200は竹抽出液をそれぞれ400μL、800μL、1600μLおよび3200μLで処理した場合であり、800(+)は銀イオン化竹抽出液を800μLで処理した場合である。
【図2】図2は竹抽出液と銀イオン化竹抽出液をそれぞれカンジダパラプシロシスATCC22019培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図2において、CONは竹抽出液を無処理した場合であり、400、800、1600および3200は竹抽出液をそれぞれ400μL、800μL、1600μLおよび3200μLで処理した場合であり、800(+)は銀イオン化竹抽出液を800μLで処理した場合である。
【図3】図3は竹抽出液と銀イオン化竹抽出液をそれぞれカンジダグラブラータATCC90030培養液に処理した場合における前記微生物の増殖程度をフラグで示す。図3において、CONは竹抽出液を無処理した場合であり、400、800、1600および3200は竹抽出液をそれぞれ400μL、800μL、1600μLおよび3200μLで処理した場合であり、800(+)は銀イオン化竹抽出液を800μで処理した場合である。
【図4】図4は木草液と銀イオン化木草液をそれぞれカンジダクルセイATCC6258培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図4において、CONは木草液を無処理した場合であり、100、200、400、800および1600は木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【図5】図5は木草液と銀イオン化木草液をそれぞれカンジダパラプシロシスATCC22019培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図5において、CONは木草液を無処理した場合であり、100、200、400、800および1600は、木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【図6】図6は木草液と銀イオン化木草液をそれぞれカンジダグラブラータATCC90030培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図6において、CONは木草液を無処理した場合であり、100、200、400、800および1600は木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【図7】図7は木草液と銀イオン化木草液をそれぞれカンジダアルビカンスATCC64550(C. albians 1)培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図7において、CONは木草液を無処理した場合であり、100、200、400、800および1600は木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【図8】図8は木草液と銀イオン化木草液をそれぞれカンジダアルビカンスATCC90028(C. albicans 2)培養液に処理した場合における前記微生物の増殖程度をグラフで示す。図8において、CONは木草液を無処理した場合であり、100、200、400、800および1600は木草液をそれぞれ100μL、200μL、400μL、800μLおよび1600μLで処理した場合であり、200(+)および400(+)は銀イオン化木草液をそれぞれ200μLおよび400μLで処理した場合である。
【特許請求の範囲】
【請求項1】
電解液としての植物抽出液で電気分解によって銀をイオン化させて得られることを特徴とする、銀イオン化植物抽出液。
【請求項2】
前記銀イオン化植物抽出液は抗微生物性を持つことを特徴とする、請求項1に記載の銀イオン化植物抽出液。
【請求項3】
前記抗微生物性は、植物抽出液または銀イオン水が抗微生物性を示す微生物に対する抗体微生物性であることを特徴とする、請求項2に記載の銀イオン化植物抽出液。
【請求項4】
前記抗微生物性は、細菌、真菌、酵母および藻類よりなる群から選択される微生物に対する抗微生物性であることを特徴とする、請求項2に記載の銀イオン化植物抽出液。
【請求項5】
前記抗微生物性は、エシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、ラクトバシラス(Lactobacillus sp.)、アスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.)、およびカンジダ(Candida sp.)よりなる群から選択される微生物に対する抗微生物性であることを特徴とする、請求項2に記載の銀イオン化植物抽出液。
【請求項6】
前記植物は、竹、オーク、松、コノテガシワおよび海藻類よりなる群から選択されることを特徴とする、請求項1に記載の銀イオン化植物抽出液。
【請求項7】
電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含む、銀イオン化植物抽出液の製造方法。
【請求項8】
電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする、抗微生物性を有する植物抽出液の抗微生物性を高める方法。
【請求項9】
電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする、抗微生物性のない植物抽出液に抗微生物性を付加する方法。
【請求項10】
請求項1に記載の銀イオン化植物抽出液を含むことを特徴とする、抗微生物性組成物。
【請求項11】
前記抗微生物性は、植物抽出液または銀イオン水が抗微生物性を示す微生物に対する抗微生物性であることを特徴とする、請求項10に記載の抗微生物性組成物。
【請求項12】
前記抗微生物性は、細菌、真菌、酵母および藻類よりなる群から選択される微生物に対する抗微生物性であることを特徴とする、請求項10に記載の抗微生物性組成物。
【請求項13】
前記抗微生物性は、エシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、ラクトバシラス(Lactobacillus sp.)、アスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.)、およびカンジダ(Candida sp.)よりなる群から選択される微生物に対する抗微生物性であることを特徴とする、請求項10に記載の抗微生物性組成物。
【請求項14】
前記組成物は薬学的組成物であることを特徴とする、請求項10に記載の抗微生物性組成物。
【請求項15】
前記薬学的組成物は、細菌、真菌、酵母および藻類よりなる群から選択される微生物が引き起こす疾病に対する改善または予防効果を持つことを特徴とする、請求項14に記載の抗微生物性組成物。
【請求項16】
前記薬学的組成物は、エシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、ラクトバシラス(Lactobacillus sp.)、アスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.)、およびカンジダ(Candida sp.)よりなる群から選択される微生物が引き起こす疾病に対する改善または予防効果を持つことを特徴とする、請求項14に記載の抗微生物性組成物。
【請求項17】
前記薬学的組成物は、腎臓組織損傷、チフス性疾患、食中毒、コレラ、腸炎、
フルンケル、蜂窩織炎、リンパ管炎、ひょう疽(felon)、中耳炎、肺炎、敗血症、炭疽病、淋疾、結核、梅毒、ジフテリア、腸チフス、はしか、口内と陰部の粘膜の炎症、口内と陰部の粘膜の掻痒症、口内と陰部の粘膜の痛症、膣炎、皮膚外傷、虫歯、歯周炎、および白癬よりなる群から選択される疾病に対する改善または予防効果を持つことを特徴とする、請求項14に記載の抗微生物性組成物。
【請求項18】
請求項10〜13に記載の抗微生物性組成物を含むことを特徴とする、微生物が原因となって発生する有害な現象の改善または予防用組成物。
【請求項1】
電解液としての植物抽出液で電気分解によって銀をイオン化させて得られることを特徴とする、銀イオン化植物抽出液。
【請求項2】
前記銀イオン化植物抽出液は抗微生物性を持つことを特徴とする、請求項1に記載の銀イオン化植物抽出液。
【請求項3】
前記抗微生物性は、植物抽出液または銀イオン水が抗微生物性を示す微生物に対する抗体微生物性であることを特徴とする、請求項2に記載の銀イオン化植物抽出液。
【請求項4】
前記抗微生物性は、細菌、真菌、酵母および藻類よりなる群から選択される微生物に対する抗微生物性であることを特徴とする、請求項2に記載の銀イオン化植物抽出液。
【請求項5】
前記抗微生物性は、エシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、ラクトバシラス(Lactobacillus sp.)、アスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.)、およびカンジダ(Candida sp.)よりなる群から選択される微生物に対する抗微生物性であることを特徴とする、請求項2に記載の銀イオン化植物抽出液。
【請求項6】
前記植物は、竹、オーク、松、コノテガシワおよび海藻類よりなる群から選択されることを特徴とする、請求項1に記載の銀イオン化植物抽出液。
【請求項7】
電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含む、銀イオン化植物抽出液の製造方法。
【請求項8】
電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする、抗微生物性を有する植物抽出液の抗微生物性を高める方法。
【請求項9】
電解液としての植物抽出液で電気分解によって銀をイオン化させる段階を含むことを特徴とする、抗微生物性のない植物抽出液に抗微生物性を付加する方法。
【請求項10】
請求項1に記載の銀イオン化植物抽出液を含むことを特徴とする、抗微生物性組成物。
【請求項11】
前記抗微生物性は、植物抽出液または銀イオン水が抗微生物性を示す微生物に対する抗微生物性であることを特徴とする、請求項10に記載の抗微生物性組成物。
【請求項12】
前記抗微生物性は、細菌、真菌、酵母および藻類よりなる群から選択される微生物に対する抗微生物性であることを特徴とする、請求項10に記載の抗微生物性組成物。
【請求項13】
前記抗微生物性は、エシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、ラクトバシラス(Lactobacillus sp.)、アスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.)、およびカンジダ(Candida sp.)よりなる群から選択される微生物に対する抗微生物性であることを特徴とする、請求項10に記載の抗微生物性組成物。
【請求項14】
前記組成物は薬学的組成物であることを特徴とする、請求項10に記載の抗微生物性組成物。
【請求項15】
前記薬学的組成物は、細菌、真菌、酵母および藻類よりなる群から選択される微生物が引き起こす疾病に対する改善または予防効果を持つことを特徴とする、請求項14に記載の抗微生物性組成物。
【請求項16】
前記薬学的組成物は、エシェリキア(Escherichia sp.)、サルモネラ(Salmonella sp.)、バシラス(Bacillus sp.)、スタフィロコッカス(Staphylococuus sp.)、ビブリオ(Vibrio sp.)、アエロモナス(Aeromonas sp.)、クロモバクテリウム(Chromobacterium sp.)、ストレプトコッカス(Streptococcus sp.)、ラクトバシラス(Lactobacillus sp.)、アスベルギルス(Aspergillus sp.)、フサリウム(Fusarium sp.)、トリコデルマ(Trichoderma sp.)、トリコフィトン(Trichophyton sp.)、マイクロスポルム(Microsporum sp.)、およびカンジダ(Candida sp.)よりなる群から選択される微生物が引き起こす疾病に対する改善または予防効果を持つことを特徴とする、請求項14に記載の抗微生物性組成物。
【請求項17】
前記薬学的組成物は、腎臓組織損傷、チフス性疾患、食中毒、コレラ、腸炎、
フルンケル、蜂窩織炎、リンパ管炎、ひょう疽(felon)、中耳炎、肺炎、敗血症、炭疽病、淋疾、結核、梅毒、ジフテリア、腸チフス、はしか、口内と陰部の粘膜の炎症、口内と陰部の粘膜の掻痒症、口内と陰部の粘膜の痛症、膣炎、皮膚外傷、虫歯、歯周炎、および白癬よりなる群から選択される疾病に対する改善または予防効果を持つことを特徴とする、請求項14に記載の抗微生物性組成物。
【請求項18】
請求項10〜13に記載の抗微生物性組成物を含むことを特徴とする、微生物が原因となって発生する有害な現象の改善または予防用組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2008−526958(P2008−526958A)
【公表日】平成20年7月24日(2008.7.24)
【国際特許分類】
【出願番号】特願2007−551207(P2007−551207)
【出願日】平成18年2月8日(2006.2.8)
【国際出願番号】PCT/KR2006/000456
【国際公開番号】WO2006/088297
【国際公開日】平成18年8月24日(2006.8.24)
【出願人】(507234036)
【出願人】(507362579)
【Fターム(参考)】
【公表日】平成20年7月24日(2008.7.24)
【国際特許分類】
【出願日】平成18年2月8日(2006.2.8)
【国際出願番号】PCT/KR2006/000456
【国際公開番号】WO2006/088297
【国際公開日】平成18年8月24日(2006.8.24)
【出願人】(507234036)

【出願人】(507362579)

【Fターム(参考)】
[ Back to top ]

