長期作用性凝固因子およびそれを製造する方法
凝固因子のカルボキシ末端に結合した少なくとも1個の絨毛性ゴナドトロピンのカルボキシ末端ペプチド(CTP)を含むポリペプチド、およびそれをコードするポリヌクレオチド。本発明のポリペプチドおよびポリヌクレオチドを含む医薬組成物、ならびにそれらを用いる方法も、開示される。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の相互参照)
本願は、米国特許仮出願番号第61/224,366号からの優先権を主張するものである。
【0002】
(技術分野)
凝固因子のC−末端(カルボキシ末端)に結合した少なくとも1個の絨毛性ゴナドトロピンのカルボキシ末端ペプチド(CTP)を含むポリペプチドおよびそれをコードするポリヌクレオチドが、開示される。本発明のポリペプチドおよびポリヌクレオチドを含む医薬組成物、ならびにそれらを使用する方法も、開示される。
【背景技術】
【0003】
ポリペプチドは、血液、肝臓または腎臓において変性または酵素分解を受け易い。したがってポリペプチドは、典型的には数時間という短い循環半減期を有する。安定性が低いので、ペプチド薬は通常、頻繁な送達を持続することで、活性ペプチドの効果的血漿濃度を保持する。その上、ペプチド薬は通常、点滴により投与されるため、ペプチド薬の頻繁な注射により、対象に少なからぬ不快感を誘発させる。つまり、治療的ポリペプチドの高い薬理学的有効性を保持しながら、その半減期を延長させる技術が求められている。そのような所望のペプチド薬は、対象に注射した場合に、血清安定性が高く、活性が高く、不適当な免疫反応誘導の確率が低い、という要件にも適合していなければならない。
【0004】
好ましくない薬物動態性、例えば、血清半減期が短いことが、他の多くの有望な薬物候補の医薬品開発を妨害する可能性がある。血清半減期は、分子の経験的特性であり、それぞれの新規な潜在的薬物で実験的に決定しなければならない。例えば、低分子量ポリペプチド薬では、必要となる投与レジメンの経費または頻度が原因で、生理学的なクリアランスメカニズム、例えば、腎臓によるろ過により、薬物の治療レベルの維持が実行できない可能性がある。それとは逆に、薬物またはその代謝産物が毒性副作用を有する場合には、血清半減期が長いことは不適当である。
【発明の概要】
【課題を解決するための手段】
【0005】
一実施形態において、本発明は、凝固因子と、凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端(CTP)ペプチドとからなるポリペプチドを提供する。
【0006】
別の実施形態において、本発明は更に、凝固因子と、凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端(CTP)ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。
【0007】
別の実施形態において、本発明は更に、1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドを、凝固因子のカルボキシ末端に結合させ、それにより凝固因子の生物学的半減期を向上させる(延長させる)ステップを含む、凝固因子の生物学的半減期を延長させる方法を提供する。
【0008】
別の実施形態において、本発明は更に、1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドを、凝固因子のカルボキシ末端に結合させ、それにより凝固因子の曲線下面積(AUC)を向上させる(増大させる)ステップを含む、凝固因子の曲線下面積(AUC)を増大させる方法を提供する。
【0009】
別の実施形態において、本発明は更に、1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドを、凝固因子のカルボキシ末端に結合させ、それにより凝固因子の投与頻度を低減するステップを含む、凝固因子の投与頻度を低減する方法を提供する。
【0010】
別の実施形態において、本発明は更に、凝固因子と、凝固因子のカルボキシ末端に結合した1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、必要とする対象に提供し、それにより凝固因子療法の利用における服薬遵守を向上させることを含む、凝固因子療法の利用における服薬遵守を向上させる方法を提供する。
【図面の簡単な説明】
【0011】
【図1】rFVII−CTP構造体(A)、rFVII−CTP−CTP構造体(B)、rFIX−CTP構造体(C)、およびrFIX−CTP−CTP構造体(D)を示す図である。
【図2A】ビタミンK3 5μg/mlの存在下、FVII−CTPバリアントを用いて限定、および希釈され、クローンをトランスフェクトされ、選別された細胞のハーベストを示す棒グラフである。FVIIのレベルは、FVII ELISA(アッセイプロ(AssayPro))を用いて定量した。
【図2B】ビタミンK3活性 5μgの存在下、FVII−CTPバリアントを用いて限定、希釈、トランスフェクトおよび選別された細胞のハーベストを示す棒グラフである。FVII活性は、FVIIの色素生成活性アッセイ(アッセイプロ)を用いて定量した。
【図2C】ビタミンK3 5μgの存在下、FVII−CTPバリアントを用いて限定、希釈、トランスフェクトおよび選別された細胞のハーベストを示す棒グラフである。FVIIの特異的活性は、各バージョン(version)ごとに、活性値をハーベストのFVIIの濃度で割って計算した。
【図2D】プール(poll)ヒト正常血漿凝固活性に比較した、FVII、FVII−CTPおよびFVII−(CTP)2凝固活性を有する、限定、希釈、トランスフェクトおよび選別された細胞のハーベストを示すグラフである。
【図2E】FVII、FVII−CTP−CTP、およびFVII−CTPハーベストのPKプロファイルを示すグラフである。
【図3A】ビタミンK3 5μg/mlの存在下、FIX−CTPおよびFIX−CTP−CTPバリアントを用いて限定、希釈、トランスフェクトおよび選別された細胞のハーベストを示す棒グラフである。FIXのレベルは、ヒトFIX ELISAキット(アフィニティー・バイオロジカルズ(Affinity Biologicals)、カタログ番号 FIX−AG RUO)を用いて定量したが、計算されたタンパク質濃度(μg/ml)は、2回の独立した実験の平均値である。
【図3B】FIX抗体認識のSDS−PAGEゲル顕微鏡写真を示し、顕微鏡写真Aは、ウエスタンブロットでの抗FIX抗体の認識を示し;顕微鏡写真Bは、ウエスタンブロットでの抗γ−カルボキシル化抗体の認識を示す。A〜Bのレーン1には、組換えFIXを含有する試料を負荷し、A〜Bのレーン2には、FIX−CTPハーベストを含有する試料を負荷した。A〜Bのレーン3には、FIX−(CTP)2ハーベストを含有する試料を負荷した。
【図4】rhFIX(アメリカアン・ダイアグノスティックス(American Diagnostics))に比較した、FIX−CTPおよびFIX−(CTP)2ハーベストの色素生成活性の比較(EC50濃度により測定)を示すグラフである。
【図5】rhFIX(アメリカアン・ダイアグノスティックス)凝固活性に比較した、FIX−CTPおよびFIX−(CTP)2ハーベストの凝固活性を示すグラフである。
【図6】rhFIX、FIX−CTP−CTPのハーベスト、およびFIX−CTPのハーベストのPKプロファイルを示すグラフである。
【図7】ヒトFIX−ELISAキット(アフィニティー・バイオロジカルズ カタログ番号FIX−AG RUO)を用いて測定された、FIX−CTPおよびFIX−CTP−CTPのハーベスト、つまりそれぞれMOD−3011およびMOD−3012のハーベスト、ならびにMOD−3012精製タンパク質のFIX抗原レベルを示す棒グラフであるが、計算されたタンパク質濃度(μg/ml)は、2回の独立した実験の平均値である。
【図8】FIX抗体認識のSDS−PAGEゲル顕微鏡写真を示す。顕微鏡写真Aは、クーマシーブルー染色を示し;顕微鏡写真Bは、ウエスタンブロットでの抗FIX抗体の認識を示し;顕微鏡写真Cは、抗FIX抗体のウエスタンブロットでの抗γ−カルボキシル化抗体の認識を示す。A〜Cのレーン1には、FIX−(CTP)2(MOD−3012)を含有する試料を負荷した。A〜Cのレーン2には、非結合FIX−(CTP)2を含有する試料を負荷した。A〜Cのレーン3には、FIX−(CTP)2(MOD−3012)の濃縮された溶離液を含有する試料を負荷した。
【図9】プールヒト正常血漿およびrhFIX(アメリカン・ダイアグノスチックス)に比較した、MOD3012色素生成活性(試料濃度/O.D.)の比較を示すグラフである。
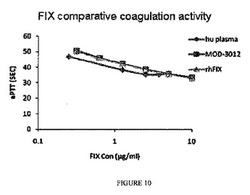
【図10】プールヒト正常血漿およびrhFIXに比較した、MOD3012凝固活性の比較を示すグラフである。
【図11】精製MOD3012、rhFIX、FIX−CTP−CTPのハーベスト、およびFIX−CTPのハーベストのPKプロファイルを示すグラフである。
【発明を実施するための形態】
【0012】
一実施形態において、本発明は、長期作用性凝固因子、ならびにそれを製造および使用する方法を提供する。別の実施形態において、長期作用性凝固因子は、カルボキシ末端ペプチド(CTP、CTP単位とも呼ばれる)を含む。別の実施形態において、凝固因子を含む長期作用性ポリペプチドは更に、ヒト絨毛性ゴナドトロピン(hCG)のカルボキシ末端ペプチド(CTP)を含む。別の実施形態において、CTPは、凝固因子の分解の防御剤として作用する。別の実施形態において、CTPは、凝固因子のCmaxを高める。別の実施形態において、CTPは、凝固因子のTmaxを増大する。別の実施形態において、CTPは、凝固因子の循環半減期を延長する。幾つかの実施形態において、CTPは、凝固因子の効能を高める。
【0013】
別の実施形態において、1〜10個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の生物学的半減期を向上させる(延長させる)ステップを含む、凝固因子の生物学的半減期を延長させる方法が、本明細書において提供される。別の実施形態において、1〜5個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の生物学的半減期を向上させる(延長させる)ステップを含む、凝固因子の生物学的半減期を延長させる方法が、本明細書において提供される。
【0014】
別の実施形態において、1〜10個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の曲線下面積(AUC)を向上させる(増大させる)ステップを含む、凝固因子の曲線下面積(AUC)を増大させる方法が、本明細書において提供される。別の実施形態において、1〜5個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の曲線下面積(AUC)を向上させる(増大させる)ステップを含む、凝固因子の曲線下面積(AUC)を増大させる方法が、本明細書において提供される。
【0015】
別の実施形態において、本発明の凝固因子は、タンパク質である。別の実施形態において、本発明の凝固因子は、ペプチドである。別の実施形態において、本発明の凝固因子は、ポリペプチドである。別の実施形態において、凝固因子は、酵素である。別の実施形態において、凝固因子は、セリンプロテアーゼである。別の実施形態において、凝固因子は、糖タンパク質である。別の実施形態において、凝固因子は、トランスグルタミナーゼである。別の実施形態において、凝固因子は、不活性チモーゲンである。別の実施形態において、凝固因子は、当業者に公知の任意の凝固因子である。別の実施形態において、凝固因子は、FVIIIである。別の実施形態において、凝固因子は、FVである。別の実施形態において、凝固因子は、第XIII因子である。別の実施形態において、凝固因子は、第X因子である。別の実施形態において、凝固因子は、トロンビンである。別の実施形態において、凝固因子は、フィブリンである。別の実施形態において、凝固因子は、FVIIaである。別の実施形態において、凝固因子は、FVIIである。別の実施形態において、凝固因子は、FIXである。別の実施形態において、凝固因子は、FXである。別の実施形態において、凝固因子は、FXIaである。別の実施形態において、凝固因子は、FXIIである。別の実施形態において、凝固因子は、FXaである。別の実施形態において、凝固因子は、FVaである。別の実施形態において、凝固因子は、プロトロンビンである。別の実施形態において、凝固因子は、トロンビンである。別の実施形態において、凝固因子は、FVである。別の実施形態において、凝固因子は、FXIである。別の実施形態において、凝固因子は、vWFである。別の実施形態において、凝固因子は、FVIIIaである。別の実施形態において、凝固因子は、B−ドメイン欠失FVIII(FVIIIBDD)である。別の実施形態において、凝固因子は、FIXaである。別の実施形態において、凝固因子は、プレカリクレインである。別の実施形態において、凝固因子は、カリクレインである。別の実施形態において、凝固因子は、FXIIaである。別の実施形態において、凝固因子は、フィブリノーゲンである。別の実施形態において、凝固因子は、トロンボモジュリンである。別の実施形態において、凝固因子は、FIIである。
【0016】
別の実施形態において、凝固因子は、糖タンパク質である。別の実施形態において、凝固因子は、ビタミンK依存性糖タンパク質である。別の実施形態において、凝固因子は、ビタミンK非依存性糖タンパク質である。別の実施形態において、凝固因子は、組換えタンパク質である。別の実施形態において、凝固因子は、組換え糖タンパク質である。別の実施形態において、凝固因子は、組換え糖タンパク質FVである。別の実施形態において、凝固因子は、組換えFVIである。別の実施形態において、凝固因子は、組換えFVIIである。別の実施形態において、凝固因子は、FVIIIである。別の実施形態において、凝固因子は、組換えFIXである。別の実施形態において、凝固因子は、組換えFXである。別の実施形態において、凝固因子は、組換えFXIである。別の実施形態において、凝固因子は、組換えFXIIである。別の実施形態において、凝固因子は、組換えFvWである。別の実施形態において、凝固因子は、組換えFIIである。別の実施形態において、凝固因子は、組換えFIXaである。別の実施形態において、凝固因子は、組換えFXIaである。別の実施形態において、凝固因子は、組換えフィブリンである。別の実施形態において、凝固因子は、組換えFVIIaである。別の実施形態において、凝固因子は、組換えFXaである。別の実施形態において、凝固因子は、組換えFVaである。別の実施形態において、凝固因子は、組換えプロトロンビンである。別の実施形態において、凝固因子は、組換えトロンビンである。別の実施形態において、凝固因子は、組換えFVIIIaである。別の実施形態において、凝固因子は、組換えプレカリクレインである。別の実施形態において、凝固因子は、組換えカリクレインである。別の実施形態において、凝固因子は、組換えFXIIaである。別の実施形態において、凝固因子は、任意の公知組換え凝固因子である。別の実施形態において、シグナルペプチドを含む凝固因子が、任意の公知組換え凝固因子である。別の実施形態において、凝固因子は、C末端に結合した1〜10個のCTPリピートを含み、N−末端に結合したCTPは含まない。別の実施形態において、シグナルペプチドを含む凝固因子は、任意の公知組換え凝固因子である。別の実施形態において、凝固因子は、C末端に結合した少なくとも1個のCTPを含み、N−末端に結合したCTPは含まない。別の実施形態において、C末端に結合した1〜10個のCTPリピートを含み、N−末端に結合したCTPを含まない凝固因子が、加工(engineered)凝固因子である。別の実施形態において、C末端に結合した少なくとも1個のCTPを含み、N−末端に結合したCTPを含まない凝固因子が、加工凝固因子である。別の実施形態において、C末端に結合した1〜10個のCTPリピートを含み、N−末端に結合したCTPを含まない凝固因子が、コンジュゲート化凝固因子である。別の実施形態において、C末端に結合した少なくとも1個のCTPを含み、N−末端に結合したCTPを含まない凝固因子が、コンジュゲート化凝固因子である。
【0017】
別の実施形態において、FIX、FVII、第X因子、プロテインCおよびプロトロンビンのドメイン構成と類似または同一のドメイン構成を含む凝固因子。別の実施形態において、凝固因子は、N−末端プロペプチドを含む前駆体として合成される。別の実施形態において、本明細書で用いられる凝固因子は、不活性プロ酵素形態である。別の実施形態において、凝固因子は、肝細胞中で産生される。別の実施形態において、凝固因子は、グルタミン酸(Glu)をγ−カルボキシグルタミン酸(Gla)に変換するγ−カルボキシラーゼのドッキング部位を含む。別の実施形態において、本明細書で用いられる凝固因子は、市販の凝固因子である。
【0018】
別の実施形態において、第VII因子のアミノ酸配列は、以下のアミノ酸配列を含む:
【0019】
【化1】

【0020】
別の実施形態において、第VII因子のアミノ酸配列は、以下のアミノ酸配列を含む:
【0021】
【化2】

【0022】
別の実施形態において、第VII因子をコードする核酸配列は、以下の核酸配列を含む:
【0023】
【化3】

【0024】
別の実施形態において、第VII因子−CTP(カルボキシ末端に結合)をコードする核酸配列は、以下の核酸配列を含む:
【0025】
【化4】

【0026】
別の実施形態において、第VII因子−CTP(カルボキシ末端に結合)のアミノ酸配列は、以下のアミノ酸配列を含む:
【0027】
【化5】

【0028】
別の実施形態において、第VII因子−CTP−CTP(カルボキシ末端に結合)をコードする核酸配列は、以下の核酸配列を含む:
【0029】
【化6】

【0030】
別の実施形態において、第VII因子−CTP−CTP(カルボキシ末端に結合)のアミノ酸配列は、以下のアミノ酸配列を含む:
【0031】
【化7】

【0032】
別の実施形態において、第IX因子をコードする核酸配列は、以下の核酸配列を含む:
【0033】
【化8】

【0034】
別の実施形態において、第IX因子のアミノ酸配列は、以下のアミノ酸配列を含む:
【0035】
【化9】

【0036】
別の実施形態において、第IX因子−CTP(カルボキシ末端に結合)をコードする核酸配列は、以下の核酸配列を含む:
【0037】
【化10】

【0038】
別の実施形態において、第IX因子−CTP(カルボキシ末端に結合)のアミノ酸配列は、以下のアミノ酸配列を含む:
【0039】
【化11】

【0040】
別の実施形態において、第IX因子−CTP−CTP(カルボキシ末端に結合)をコードする核酸配列は、以下の核酸配列を含む:
【0041】
【化12】

【0042】
別の実施形態において、第IX因子−CTP−CTP(カルボキシ末端に結合)のアミノ酸配列は、以下のアミノ酸配列を含む:
【0043】
【化13】

【0044】
別の実施形態において、フリンが、本発明の凝固因子−CTPを発現する細胞に添加される。別の実施形態において、フリンは、細胞内で本発明の凝固因子−CTPの産生効率を上昇させる。別の実施形態において、フリンは、本発明の凝固因子−CTPのコーディング配列を含むベクターとコトランスフェクトされる。別の実施形態において、フリンは、別個のベクターによりコードされる。別の実施形態において、フリンおよび凝固因子−CTPは、1つのベクターによりコードされる。別の実施形態において、フリンのコーディング配列が、pCI−DHFRに挿入される。別の実施形態において、フリンのコーディング配列は、pCI−dhfr/smaI+NotI、フリン/AsisI F.I.+NotI内で加工される。
【0045】
別の実施形態において、フリンをコードする核酸配列は、以下の核酸配列を含む:
【0046】
【化14】

【0047】
【化15】

【0048】
別の実施形態において、フリンのアミノ酸配列は、以下のアミノ酸配列を含む:
【0049】
【化16】

【0050】
幾つかの実施形態において、用語、凝固因子は更に、凝固活性を有する公知の凝固因子の相同物を包含する。幾つかの実施形態において、本発明による相同性は、そのアミノ酸置換をはじめとする欠失、挿入、または置換バリアント、およびその生物活性ポリペプチドフラグメントも包含する。
【0051】
別の実施形態において、本発明は、凝固活性を有する凝固因子の相同物を包含する。別の実施形態において、本発明は、凝固活性を有する本発明に記載された凝固因子の相同物を包含する。別の実施形態において、相同物、例えば、デフォルトパラメータを用いる、米国立生物工学情報センター(National Center of Biotechnology Information)(NCBI)のBlastPソフトウェアを用いて測定すると、凝固因子と少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも87%、少なくとも89%、少なくとも91%、少なくとも93%、少なくとも95%、または更に言えば99%の相同性を有するポリペプチド。
【0052】
別の実施形態において、本発明は、フリンの相同物を包含する。別の実施形態において、相同物、例えば、デフォルトパラメータを用いる、米国立生物工学情報センター(NCBI)のBlastPソフトウェアを用いて測定すると、フリンと少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも87%、少なくとも89%、少なくとも91%、少なくとも93%、少なくとも95%、または更に言えば99%の相同性を有するポリペプチド。
【0053】
別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜10個のゴナドトロピンカルボキシ末端(CTP)ペプチドとを含むポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した2〜8個のゴナドトロピンカルボキシ末端(CTP)ペプチドとを含むポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜3個のゴナドトロピンカルボキシ末端(CTP)ペプチドとを含むポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端(CTP)ペプチドとを含むポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端(CTP)ペプチドとからなるポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜5個のCTPとを含むポリペプチドが、本明細書において提供される。別の実施形態において、アミノ末端にCTPを有さない凝固因子を含むポリペプチドが、本明細書において提供される。別の実施形態において、カルボキシ末端に少なくとも1個のCTPを有する凝固因子を含むポリペプチドが、本明細書において提供される。別の実施形態において、カルボキシ末端に少なくとも1個のCTPを有し、アミノ末端にCTPを有さない凝固因子を含むポリペプチドが、本明細書において提供される。
【0054】
別の実施形態において、加工凝固因子が、カルボキシ末端に少なくとも1個のCTPを有する凝固因子を含むポリペプチドである。別の実施形態において、加工凝固因子は、カルボキシ末端に1個のCTPを有する凝固因子を含むポリペプチドである。別の実施形態において、加工凝固因子は、カルボキシ末端に1個のCTPを有する凝固因子からなるポリペプチドである。別の実施形態において、加工凝固因子は、カルボキシ末端にタンデムに結合した2個のCTPペプチドを含む。別の実施形態において、本明細書に記載の加工凝固因子は、生物活性に関して、非CTP修飾凝固因子と同等である。別の実施形態において、本明細書に記載の加工凝固因子は、薬理学的測定、例えば薬物動態および/または薬力学に関して、非CTP修飾凝固因子と少なくとも同等である。
【0055】
別の実施形態において、加工凝固因子は、血友病B患者の処置のための使用に向けられる。別の実施形態において、カルボキシ末端にタンデムにつながった2個のCTPを含む第IX凝固因子(MOD−3012)は、血友病B患者の処置のための使用に向けられる。別の実施形態において、カルボキシ末端に1個のCTPリピートを含む第IX凝固因子(MOD−3011)は、血友病B患者の処置のための使用に向けられる。別の実施形態において、加工凝固因子は、点滴の速度を低下させるか、必要な用量を低減するか、またはその両方を行うことが可能である。
【0056】
別の実施形態において、カルボキシ末端にタンデムにつながった2個のCTPを含む第IX凝固因子(MOD−3012)は、凝固活性とFIX−CTPハーベストまたはrhFIXとの対比を維持しながら、改善されたPKプロファイルを示す。別の実施形態において、カルボキシ末端にタンデムにつながった2個のCTPを含む第IX凝固因子(MOD−3012)は、rhFIXに比較して、半減期の3倍増加およびAUCの4.5倍増加を示す。
【0057】
別の実施形態において、用語「CTPペプチド」、「カルボキシ末端ペプチド」および「CTP配列」は、本明細書において互換的に用いられる。別の実施形態において、カルボキシ末端ペプチドは、完全長CTPである。別の実施形態において、カルボキシ末端ペプチドは、トランケートされたCTPである。各可能性により、本発明の別個の実施形態が表わされる。
【0058】
別の実施形態において、用語、加工凝固因子は、成熟された凝固因子のアミノ酸配列を含む。別の実施形態において、用語、加工凝固因子は、シグナル配列またはシグナルペプチドをはじめとする凝固因子のアミノ酸配列を含む。
【0059】
別の実施形態において、「シグナル配列」および「シグナルペプチド」は、本明細書において互換的に用いられる。別の実施形態において、ポリヌクレオチド分子に関係する場合の「配列」は、コーディング部分を指すことができる。各可能性により、本発明の別個の実施形態が表わされる。
【0060】
別の実施形態において、本明細書に記載された少なくとも1個のCTPを含む加工凝固因子は、少なくとも1個のCTPを含まない同様の凝固因子に比較して、高いインビボ生物活性を有する。
【0061】
幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列が、凝固因子の分解に対する高い防御性を提供する。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、クリアランスに対する高い防御性を提供する。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、長いクリアランス時間を提供する。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、Cmaxを高める。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、Tmaxの増加に対する高い防御性を提供する。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、T1/2を延長する。
【0062】
別の実施形態において、本発明のコンジュゲート化凝固因子が、修飾されていないコンジュゲート化凝固因子と同様の手法で用いられる。別の実施形態において、本発明のコンジュゲート化凝固因子は、インビボで、循環半減期および血漿滞留時間を増加させ、クリアランスを低減し、そして臨床活性を上昇させる。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子の改善された性質により、このコンジュゲートは、同じ凝固因子の修飾されていない形態よりも少ない頻度で投与される。
【0063】
別の実施形態において、少ない頻度での投与が、患者の服薬遵守の改善をもたらし、処置成果の改善および患者の生活の質の改善へと導く。別の実施形態において、本発明のコンジュゲートの分子量およびリンカー構造を有するコンジュゲートが、従来の凝固因子のコンジュゲートに比較して、改善された効能、改善された安定性、高いAUCレベル、および長い循環半減期を有することが見出された。
【0064】
別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子を含む組成物が、本明細書において提供される。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子を含む医薬組成物が、本明細書において提供される。別の実施形態において、コンジュゲート化凝固因子の治療上の有効量は、処置される状態の厳密な型、処置される患者の状態、および組成物の他の成分などの因子により決定される。別の実施形態において、コンジュゲート化凝固因子の治療上の有効量は、1日1回〜月1回の投与で、50〜500IU/kg体重である。別の実施形態において、コンジュゲート化凝固因子の治療上の有効量は、1日1回の投与で、150〜250IU/kg体重である。別の実施形態において、コンジュゲート化凝固因子を含む医薬組成物は、様々な手法によるヒト患者への投与に効果的な強度で、配合される。
【0065】
別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病に苦しむ対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病の予防的治療に有用であり、つまり出血および関連の合併症の危険性を低下させる。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、外部から投与された凝固因子への阻害抗体を生成するリスクを低下させながら、血友病に苦しむ対象の処置に有用となる。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病に苦しむ対象の処置に有用であり、つまり止血を導入する。
【0066】
別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、過剰な出血もしくは打撲傷を受けた対象、または長いプロトロンビン時間(PT)もしくは部分トロンボプラスチン時間(PTT)を有する対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、出血を起こす後天的状態、例えば、ビタミンK欠乏症または肝臓疾患を有する対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、後天性(他の疾患による)または遺伝性、軽度または重度、永久または一過性である、凝固因子の欠損を有する対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病Aに苦しむ対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病Bに苦しむ対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、慢性疾患、例えば肝臓疾患もしくは癌による;急速に凝血因子を使い果たす急性状態、例えば播種性血管内凝固(DIC)による;またはビタミンK欠乏症もしくはワルファリンのようなビタミンKアンタゴニストでの処置による後天的欠損を有する対象の処置に有用である(第II、VII、IX、およびX因子の産生には、ビタミンKが必要となる)。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、凝血の不均衡を起こす疾患、例えば非限定的に、肝臓疾患、尿毒症、癌、骨髄障害、ヘビ毒への暴露、ビタミンK欠乏症、抗凝固療法、抗凝固ワルファリンの誤飲、複数回の輸血(血液の貯蔵単位は、凝血因子の一部が欠乏する)などに苦しむ対象の処置に有用である。
【0067】
別の実施形態において、本明細書で用いられる対象は、ヒト対象である。別の実施形態において、対象は、ペットである。別の実施形態において、対象は、哺乳類である。別の実施形態において、対象は、家畜である。別の実施形態において、対象は、サルである。別の実施形態において、対象は、ウマである。別の実施形態において、対象は、ウシである。別の実施形態において、対象は、マウスである。別の実施形態において、対象は、ラットである。
【0068】
別の実施形態において、本明細書に記載された[(CTP)n>1−凝固因子]は、カルボキシ末端のペプチド結合を介して少なくとも1個のCTP単位につながり、アミノ末端にはCTPを有さない、完全長凝固因子またはその活性フラグメントを含む。別の実施形態において、本明細書に記載された[(CTP)n>1−凝固因子]は、ペプチド結合を介して少なくとも1個のCTP単位につながり、ペプチド結合を介して更なるCTP単位につながり、アミノ末端にはCTPを有さない、凝固因子またはその活性フラグメントを含む。別の実施形態において、1つの核酸分子が、C−末端に結合した少なくとも1個のCTPを含み、アミノ末端にはCTPを含まない加工凝固因子をコードする。
【0069】
別の実施形態において、CTPは、リンカーを介して凝固因子に結合する。別の実施形態において、CTP配列を凝固因子につなぐリンカーは、共有結合である。別の実施形態において、CTP配列を凝固因子につなぐリンカーは、ペプチド結合である。別の実施形態において、CTP配列を凝固因子につなぐリンカーは、置換されたペプチド結合である。別の実施形態において、CTP配列は、配列番号1および配列番号2に示された配列組から選択されるアミノ酸配列を含む。
【0070】
別の実施形態において、配列番号1は、以下のアミノ酸(AA)配列を含む:DPRFQDSSSSKAPPPSLPSPSRLPGPSDTPIL(配列番号1)。別の実施形態において、配列番号2は、以下のアミノ酸(AA)配列を含む:SSSSKAPPPSLPSPSRLPGPSDTPILPQ(配列番号2)。
【0071】
別の実施形態において、本発明のカルボキシ末端ペプチド(CTP)ペプチドは、ヒト絨毛性ゴナドトロピンのアミノ酸位置112〜145に、配列番号1で示されるアミノ酸配列を含む。別の実施形態において、本発明のCTP配列は、ヒト絨毛性ゴナドトロピンのアミノ酸位置118〜145に、配列番号2で示されるアミノ酸配列を含む。別の実施形態において、同じくCTP配列は、ヒト絨毛性ゴナドトロピンのアミノ酸位置112〜118の任意の位置から開始して、アミノ酸位置145で終結している。幾つかの実施形態において、CTP配列ペプチドは、28、29、30、31、32、33または34のアミノ酸長であり、CTPアミノ酸配列のアミノ酸位置112、113、114、115、116、117または118で開始している。
【0072】
別の実施形態において、CTPペプチドは、本明細書に参照により組み込まれた米国特許第5,712,122号に記載された通り、1〜5個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、1個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、2個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、3個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、4個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、5個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、本発明のCTPペプチドのアミノ酸配列は、天然型CTPのアミノ酸配列またはそのペプチドと少なくとも70%の相同性を有する。別の実施形態において、本発明のCTPペプチドのアミノ酸配列は、天然型CTPのアミノ酸配列またはそのペプチドと少なくとも80%の相同性を有する。別の実施形態において、本発明のCTPペプチドのアミノ酸配列は、天然型CTPのアミノ酸配列またはそのペプチドと少なくとも90%の相同性を有する。別の実施形態において、本発明のCTPペプチドのアミノ酸配列は、天然型CTPのアミノ酸配列またはそのペプチドと少なくとも95%の相同性を有する。
【0073】
別の実施形態において、本発明のCTPペプチドのDNA配列は、天然型ヒトCTPのDNA配列またはそのペプチドと少なくとも70%の相同性を有する。別の実施形態において、本発明のCTPペプチドのDNA配列は、天然型ヒトCTPのDNA配列またはそのペプチドと少なくとも80%の相同性を有する。別の実施形態において、本発明のCTPペプチドのDNA配列は、天然型CTPのDNA配列またはそのペプチドと少なくとも90%の相同性を有する。別の実施形態において、本発明のCTPペプチドのDNA配列は、天然型CTPのDNA配列またはそのペプチドと少なくとも95%の相同性を有する。
【0074】
一実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の少なくとも1個が、トランケートされている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の両方が、トランケートされている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の2個が、トランケートされている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の2個以上が、トランケートされている。別の実施形態において、全ての絨毛性ゴナドトロピンCTPのアミノ酸配列が、トランケートされている。一実施形態において、トランケートされたCTPは、配列番号3の最初の10個のアミノ酸を含む。別の実施形態において、配列番号3は、以下のアミノ酸(AA)配列を含む:SSSSKAPPPSLP。
【0075】
一実施形態において、トランケートされたCTPは、配列番号4の最初の10個のアミノ酸を含む。別の実施形態において、配列番号4は、以下のアミノ酸(AA)配列を含む:SSSSKAPPPSLPSPSRLPGPSDTPILPQ。
【0076】
一実施形態において、トランケートされたCTPは、配列番号4の最初の11個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4の最初の12個のアミノ酸配列を含む。一実施形態において、トランケートされたCTPは、配列番号4または配列番号3の最初の8個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4の最初の13個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4の最初の14個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4または配列番号3の最初の6個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4または配列番号3の最初の5個のアミノ酸を含む。
【0077】
一実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の少なくとも1個が、グリコシル化されている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の両方が、グリコシル化されている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の2個が、グリコシル化されている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の2個以上が、グリコシル化されている。別の実施形態において、全ての絨毛性ゴナドトロピンCTPのアミノ酸配列が、グリコシル化されている。一実施形態において、本発明のCTP配列は、グリコシル化部位を少なくとも1個含む。一実施形態において、本発明のCTP配列は、グリコシル化部位を2個含む。一実施形態において、本発明のCTP配列は、グリコシル化部位を3個含む。一実施形態において、本発明のCTP配列は、グリコシル化部位を4個含む。
【0078】
幾つかの実施形態において、CTP配列の修飾は、より低用量の使用が可能になる点で有利である。幾つかの実施形態において、CTP配列の修飾は、より少ない頻度での投与が可能になる点で有利である。幾つかの実施形態において、CTP配列の修飾は、安全な長期作用効果が可能になる点で有利である。
【0079】
幾つかの実施形態において、本明細書で用いられる「ポリペプチド」、「加工凝固因子」、または「タンパク質」は、天然型ポリペプチド(分解生成物、合成的に合成されたポリペプチド、または組換えポリペプチドのいずれか)およびペプチド模倣薬(典型的には、合成的に合成されたポリペプチド)と、幾つかの実施形態において、凝固因子を含むポリペプチドを、体内でより安定させるか、または細胞への浸透をより可能にする修飾を有する、ポリペプチド類似体であるペプトイドおよびセミペプトイドとを包含する。
【0080】
幾つかの実施形態において、修飾としては、非限定的に、C末端修飾、ポリペプチド結合修飾、例えば、非限定的にCH2−NH、CH2−S、CH2−S=O、O=C−NH、CH2−O、CH2−CH2、S=C−NH、CH=CH、またはCF−CHなど、骨格修飾、および残基修飾が挙げられる。ペプチド模倣薬化合物を調製する方法は、当該技術分野で周知であり、例えば、本明細書に完全に示され、参照により組み込まれる、「Quantitative Drug Design, C.A. Ramsden Gd., Chapter 17.2, F. Choplin Pergamon Press (1992)」に明記されている。これに関する更なる詳細を、本明細書の以下に示す。
【0081】
幾つかの実施形態において、ポリペプチド内のポリペプチド結合(−CO−NH−)が、置換されている。幾つかの実施形態において、ポリペプチド結合は、N−メチル化結合(−N(CH3)−CO−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、エステル結合(−C(R)H−C−O−O−C(R)−N−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、ケトメチレン化結合(−CO−CH2−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、α−アザ結合(−NH−N(R)−CO−)(ここでRは、任意のアルキル、例えばメチルである)、カルバ結合(−CH2−NH−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、ヒドロキシエチレン結合(−CH(OH)−CH2−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、チオアミド結合(−CS−NH−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、オレフィン二重結合(−CH=CH−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、レトロアミド結合(−NH−CO−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、ポリペプチド誘導体(−N(R)−CH2−CO−)(ここでRは、炭素原子上に自然に存在する「ノルマルの」側鎖である)により置換されている。幾つかの実施形態において、これらの修飾は、ポリペプチド鎖に沿った結合のいずれか、および複数の部位(結合2〜3個)で同時に生じる。
【0082】
幾つかの実施形態において、ポリペプチドの天然型芳香族アミノ酸、例えば、Trp、TyrおよびPheが、合成の非天然型の酸、例えばフェニルグリシン、TIC、ナフチルアラニン(Nol)、Pheの環式メチル化誘導体、Pheのハロゲン化誘導体またはO−メチル−Tyrで置換されている。幾つかの実施形態において、本発明のポリペプチドは、修飾アミノ酸を1個以上または非アミノ酸モノマー(例えば、脂肪酸、複合炭水化物)を1個以上含む。
【0083】
一実施形態において、「アミノ酸」または「アミノ酸配列」は、天然由来アミノ酸20種;例えば、ヒドロキシプロリン、ホスホセリンおよびホスホトレオニンをはじめとする、多くはインビボで翻訳後修飾されたそれらのアミノ酸;ならびに非限定的に2−アミノアジピン酸、ヒドロキシルリシン、イソデスモシン、ノルバリン、ノルロイシンおよびオルイニチンをはじめとする他の異常アミノ酸を包含すると理解されたい。一実施形態において、「アミノ酸」は、D−およびL−アミノ酸の両者を包含する。
【0084】
幾つかの実施形態において、本発明のポリペプチドは、可溶性形態である凝固因子を含むポリペプチドを必要とする治療に用いられる。幾つかの実施形態において、本発明のポリペプチドは、ヒドロキシル含有側鎖によりポリペプチドの溶解度を上昇させることが可能な、非限定的にセリンおよびトレオニンをはじめとする非天然または天然型極性アミノ酸を1種以上包含する。
【0085】
幾つかの実施形態において、本発明の加工凝固因子は、直鎖状形態で使用されるが、環化が加工凝固因子の特徴を大きく妨害しない場合には、加工凝固因子の環状形態を使用できることは、当業者に理解されるであろう。
【0086】
幾つかの実施形態において、本発明の加工凝固因子は、例えば、標準の固相技術を用いることにより、生化学的に合成される。幾つかの実施形態において、これらの生化学的方法としては、排他的固相合成(exclusive solid phase synthesis)、部分固相合成、フラグメント縮合、または伝統的な溶液合成が挙げられる。
【0087】
幾つかの実施形態において、組換えタンパク質技術を用いて、本発明の加工凝固因子を生成させる。幾つかの実施形態において、組換えタンパク質技術は、比較的長いポリペプチド(例えば、アミノ酸18〜25個よりも長い)の生成に用いられる。幾つかの実施形態において、組換えタンパク質技術は、本発明の加工凝固因子を多量に生成させるのに用いられる。幾つかの実施形態において、組換え技術は、「Bitter et al., (1987) Methods in Enzymol. 153:516-544」、「Studier et al. (1990) Methods in Enzymol. 185:60-89」、「Brisson et al. (1984) Nature 310:511-514」、「Takamatsu et al. (1987) EMBO J. 6:307-311」、「Coruzzi et al., (1984) EMBO J. 3:1671-1680」、「Brogli et al., (1984) Science 224:838-843」、「Gurley et al. (1986) Mol. Cell. Biol. 6:559-565」および「Weissbach & Weissbach, 1988, Methods for Plant Molecular Biology, Academic Press, NY, Section VIII, pp421-463」に記載されている。
【0088】
別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜10個のゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜10個のゴナドトロピンカルボキシ末端ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜7個のゴナドトロピンカルボキシ末端ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した2〜8個のゴナドトロピンカルボキシ末端ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。
【0089】
別の実施形態において、本発明は、本明細書に記載されたポリヌクレオチド分子を含む発現ベクターを提供する。別の実施形態において、本発明は、本明細書に記載された発現ベクターを含む細胞を提供する。別の実施形態において、本発明は、本明細書に記載された発現ベクターを含む組成物を提供する。別の実施形態において、本発明は、本明細書に記載された細胞を含む組成物を提供する。別の実施形態において、細胞は、真核細胞である。別の実施形態において、細胞は、原核細胞である。
【0090】
別の実施形態において、本発明の加工凝固因子は、本発明のポリペプチドをコードするポリヌクレオチド分子を用いて合成される。幾つかの実施形態において、本発明の加工凝固因子をコードするポリヌクレオチド分子は、シス調節配列(例えば、プロモーター配列)の転写制御を含む発現ベクターに連結されている。幾つかの実施形態において、シス調節配列は、本発明の加工凝固因子の構成的発現を指導するのに適している。幾つかの実施形態において、シス調節配列は、本発明の加工凝固因子の組織特異的発現を指導するのに適している。幾つかの実施形態において、シス調節配列は、本発明の加工凝固因子の誘導性発現を指導するのに適している。
【0091】
幾つかの実施形態において、本発明の使用に適した組織特異性プロモーターは、特異的細胞集団内で機能的な配列を含み、例としては、非限定的に、肝臓特異性のあるアルブミンなどのプロモーター(Pinkert et al., (1987) Genes Dev. 1:268-277)、リンパ球特異性プロモーター(Calame et al., (1988) Adv. Immunol. 43:235-275);詳細にはT細胞受容体のプロモーター(Winoto et al., (1989) EMBO J. 8:729-733)および免疫グロブリンのプロモーター(Banerji et al. (1983) Cell 33729-740);ニューロフィラメントプロモーターなどのニューロン特異性プロモーター(Byrne et al. (1989) Proc. Natl. Sci. USA 86:5473-5477)、膵臓特異性プロモーター(Edlunch et al. (1985) Science 230:912-916)または乳腺特異性プロモーター、例えば、乳清プロモーター(米国特許第4,873,316号および欧州特許出願公開第264,166号)が挙げられる。本発明の使用に適した誘導性プロモーターとしては、例えば、テトラサイクリン誘導性プロモーター(Srour, M. A., et al., 2003. Thromb. Haemost. 90:398-405)が挙げられる。
【0092】
一実施形態において、語句「ポリヌクレオチド分子」は、RNA配列、相補的ポリヌクレオチド配列(cDNA)、ゲノムポリヌクレオチド配列および/または複合ポリヌクレオチド配列(例えば、上記の組合せ)の形態で単離および提供される一本鎖または二本鎖核酸配列を指す。
【0093】
一実施形態において、「相補的ポリヌクレオチド配列」は、逆転写酵素または他の任意のRNA依存性DNAポリメラーゼを用いたメッセンジャーRNAの逆転写から得られる配列を指す。一実施形態において、その配列は、引き続き、インビボまたはインビトロで、DNAポリメラーゼを用いて増幅することができる。
【0094】
一実施形態において、「ゲノムポリヌクレオチド配列」は、染色体から誘導(単離)された配列を指し、つまりそれは、染色体の隣接部分を表す。
【0095】
一実施形態において、「複合ポリペプチド配列」は、少なくとも部分的に相補性があり少なくとも部分的にゲノムである配列を指す。一実施形態において、複合配列は、本発明のポリペプチドをコードするのに必要となる幾つかのエキソン配列と、それらの間に挿入された幾つかのイントロン配列とを含むことができる。一実施形態において、イントロン配列は、他の遺伝子をはじめとする任意の供給源のものであってもよく、典型的には、保存されたスプライシングシグナル配列を含む。一実施形態において、イントロン配列は、シス作用性発現調節エレメントを含む。
【0096】
一実施形態において、シグナルペプチドは、発現および分泌に続いて、前駆体である加工凝固因子から開裂されて、成熟の加工凝固因子を生じる。
【0097】
幾つかの実施形態において、本発明のポリペプチドは、PCR技術、または当業者に公知の他の任意の方法もしくは手順を用いて調製される。幾つかの実施形態において、その手順は、2つの異なるDNA配列のライゲーションを含む(例えば、「Current Protocols in Molecular Biology, eds. Ausubel et al., John Wiley & Sons, 1992」参照)。
【0098】
一実施形態において、加工凝固因子をコードする本発明のポリペプチドが、発現ベクター(即ち、核酸構造体)に挿入されると、組換えポリペプチドの発現が可能になる。一実施形態において、本発明の発現ベクターは、このベクターを原核生物における複製および統合に適合させる更なる配列を含む。一実施形態において、本発明の発現ベクターは、このベクターを真核生物における複製および統合に適合させる更なる配列を含む。一実施形態において、本発明の発現ベクターは、このベクターを原核生物および真核生物の両方における複製および統合に適合させるシャトルベクターを含む。幾つかの実施形態において、凝血ベクターは、転写および翻訳開始配列(例えば、プロモーター、エンハンサー)ならびに転写および翻訳ターミネーター(例えば、ポリアデニル化シグナル)を含む。
【0099】
一実施形態において、様々な原核または真核細胞が、宿主発現系として用いられて、本発明の凝固因子を発現することができる。幾つかの実施形態において、これらには、非限定的に、微生物、例えば、ポリペプチドコーディング配列を含む組換えバクテリオファージDNA、プラスミドDNAまたはコスミドDNAの発現ベクターで形質転換された細菌;ポリペプチドコーディング配列を含む組換え酵母発現ベクターで形質転換された酵母;組換えウイルス発現ベクター(例えば、カリフラワーモザイクウイルス、CaMV;タバコモザイクウイルス、TMV)に感染した、またはポリペプチドコーディング配列を含む組換えプラスミド発現ベクター、例えば、Tiプラスミドで形質転換された植物細胞系が挙げられる。
【0100】
幾つかの実施形態において、非細菌発現系(例えば、哺乳類発現系、例えばCHO細胞)を用いて、本発明の凝固因子を発現させる。一実施形態において、哺乳類細胞における本発明のポリヌクレオチドの発現に用いられる発現ベクターが、CMVプロモーターおよびネオマイシン耐性遺伝子を含むpCI−DHFRベクターである。pCI−dhfrベクターの構築は、実施例1の一実施形態により記載される。
【0101】
幾つかの実施形態において、本発明の細菌系では、有利には多数の発現ベクターを、発現されたポリペプチドに向けた用途に応じて選択することができる。一実施形態において、多量のポリペプチドが望ましい。一実施形態において、可能な限り疎水性シグナル配列との融合体としての、高レベルのタンパク質生成物の発現を指導し、発現された生成物を、タンパク質生成物が容易に精製される細菌または培地のペリプラズム中に指向するベクターが望ましい。一実施形態において、特定の融合タンパク質は、特異的開裂部位を含むように加工されていて、ポリペプチドの回収の助力となる。一実施形態において、そのような操作に適合可能なベクターとしては、非限定的に、大腸菌発現ベクターのpET類が挙げられる(Studier et al., Methods in Enzymol. 185:60-89 (1990))。
【0102】
一実施形態において、酵母発現システムが用いられる。一実施形態において、構造的または誘導性プロモーターを含む多数のベクターを、米国特許出願第5,932,447号に開示された通り、酵母内で用いることができる。別の実施形態において、外来DNA配列の、酵母染色体への統合を促進するベクターが用いられる。
【0103】
一実施形態において、本発明の発現ベクターは更に、例えば単一のmRNAから複数のタンパク質を翻訳させる追加的ポリヌクレオチド配列、例えば内部リボソーム進入部位(IRES)、およびプロモーター−キメラポリペプチドをゲノムへ取込むための配列を含むことができる。
【0104】
幾つかの実施形態において、哺乳類発現ベクターとしては、非限定的に、インビトロジェン(Invitrogen)から入手できる、pcDNA3、pcDNA3.1(+/−)、pGL3、pZeoSV2(+/−)、pSecTag2、pDisplay、pEF/myc/cyto、pCMV/myc/cyto、pCR3.1、pSinRep5、DH26S、DHBB、pNMT1、pNMT41、pNMT81、プロメガ(Promega)から入手できるpCI、ストラタジーン(Stratagene)から入手できる、pMbac、pPbac、pBK−RSVおよびpBK−CMV、クロンテック(Clontech)から入手できるpTRES、ならびにそれらの誘導体が挙げられる。
【0105】
幾つかの実施形態において、真核性ウイルス、例えばレトロウイルスからの調節エレメントを含む発現ベクターが、本発明により用いられる。SV40ベクターとしては、pSVT7およびpMT2が挙げられる。幾つかの実施形態において、ウシパピローマウイルスから誘導されたベクターとしては、pBV−1MTHAが挙げられ、エプスタイン・バー・ウイルスから誘導されたベクターとしては、pHEBOおよびp205が挙げられる。他の実例的ベクターとしては、真核細胞内での発現に効果的であることが示されている、SV−40初期プロモーター、SV−40後期プロモーター、メタロチオネインプロモーター、マウス哺乳類腫瘍ウイルスプロモーター、ラウス肉腫ウイルスプロモーター、ポリヘドリンプロモーター、または他のプロモーターの指導の下でタンパク質の発現が可能な、pMSG、pAV009/A+、pMTO10/A+、pMAMneo−5、バキュロウイルスpDSVE、および任意の他のベクターが挙げられる。
【0106】
幾つかの実施形態において、組換えウイルスベクターは、水平感染(lateral infection)および標的特異性などの利点を提供することから、本発明の凝固因子のインビボ発現に有用である。一実施形態において、水平感染は、例えばレトロウイルスでは、生命周期に本来備わっているものであり、1個の感染細胞が多数の子孫ビリオンを産生し、それらが分離して隣接する細胞に感染する工程である。一実施形態において、その結果、最初は領域のほとんどで元のウイルス粒子には感染しなかった大きな領域が、急激に感染するようになる。一実施形態において、水平に伝搬することができないウイルスベクターが、生成される。一実施形態において、所望の目的が特定遺伝子を限定数の標的細胞のみに導入することならば、この特徴は有用となりうる。
【0107】
一実施形態において、様々な方法を用いて、本発明の発現ベクターを細胞に導入することができる。そのような方法は一般に、「Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992)」、「Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1989)」、「Chang et al., Somatic Gene Therapy, CRC Press, Ann Arbor, Mich. (1995)」、「Vega et al., Gene Targeting, CRC Press, Ann Arbor Mich. (1995)」、「Vectors: A Survey of Molecular Cloning Vectors and Their Uses, Butterworths, Boston Mass. (1988)」、および「Gilboa et at., Biotechniques 4 (6): 504-512, (1986)」に記載されており、例えば、安定または一過性トランスフェクション、リポフェクション、電気穿孔法、および組換えウイルスベクターの感染が挙げられる。加えて、ポジティブ/ネガティブ選別法に関しては、米国特許第5,464,764号および第5,487,992号を参照されたい。
【0108】
幾つかの実施形態において、ウイルス感染による核酸の導入は、ウイルスの感染的性質により、より高度のトランスフェクション効率を得ることができるため、他の方法、例えばリポフェクションおよび電気穿孔法を超える複数の利点を提供する。
【0109】
一実施形態において、本発明の加工凝固因子が、本明細書の先に記載された任意の適切な投与様式を利用して、個体に投与された核酸構造体から発現しうることは、理解されよう(即ち、インビボ遺伝子療法)。一実施形態において、核酸構造体は、適切な遺伝子送達ビヒクル/方法(トランスフェクション、トランスダクション、相同組換えなど)および必要となる発現系を介して適切な細胞に導入され、その後、修飾された細胞を培養で増殖させて、個体に戻す(即ち、エクスビボ遺伝子療法)。
【0110】
一実施形態において、植物発現ベクターが用いられる。一実施形態において、ポリペプチドコーディング配列の発現が、多数のプロモーターにより指導される。幾つかの実施形態において、ウイルスプロモーター、例えば、CaMVの35S RNAおよび19S RNAプロモーター(Brisson et al., Nature 310:511-514 (1984))、またはTMVへのコートタンパク質プロモーター(Takamatsu et al., EMBO J. 6:307-311 (1987))が用いられる。別の実施形態において、植物プロモーター、例えば、RUBISCOの小サブユニット(「Coruzzi et al., EMBO J. 3:1671-1680 (1984)」および「Brogli et al., Science 224:838-843 (1984)」)または熱ショックプロモーター、例えば、大豆hsp17.5−Eもしくはhsp17.3−B(Gurley et al., Mol. Cell. Biol. 6:559-565 (1986))が用いられる。一実施形態において、構造体は、Tiプラスミド、Riプラスミド、植物ウイルスベクターを用いて植物細胞に導入され、DNA形質転換、マイクロインジェクション、電気穿孔法および当業者に周知の他の技術を指導する。例えば、「Weissbach & Weissbach, Methods for Plant Molecular Biology, Academic Press, NY, Section VIII, pp 421-463 (1988)」を参照されたい。当該技術分野で周知の他の発現系、例えば、昆虫および哺乳類宿主細胞系を、本発明により用いることもできる。
【0111】
本発明の発現構造体が、挿入されたコーティング配列(ポリペプチドをコードする)の転写および翻訳に必要な要素を含む以外に、発現されたポリペプチドの安定性、産生、精製、収率、または活性を最適化するように加工された配列も含みうることは理解されよう。
【0112】
幾つかの実施形態において、様々な方法を用いて、本発明の発現ベクターを宿主細胞系に導入することができる。幾つかの実施形態において、そのような方法は一般に、「Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992)」、「Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1989)」、「Chang et al., Somatic Gene Therapy, CRC Press, Ann Arbor, Mich. (1995)」、「Vega et al., Gene Targeting, CRC Press, Ann Arbor Mich. (1995)」、「Vectors: A Survey of Molecular Cloning Vectors and Their Uses, Butterworths, Boston Mass. (1988)」、および「Gilboa et at., Biotechniques 4 (6): 504-512, (1986)」に記載されており、例えば、安定または一過性トランスフェクション、リポフェクション、電気穿孔法、および組換えウイルスベクターの感染が挙げられる。加えて、ポジティブ/ネガティブ選別法に関しては、米国特許第5,464,764号および第5,487,992号を参照されたい。
【0113】
幾つかの実施形態において、形質転換細胞を、効果的条件下で培養して、多量の組換え加工凝固因子を発現させることができる。幾つかの実施形態において、効果的培養条件としては、非限定的に、タンパク質生成を可能にする、効果的培地、バイオリアクター、温度、pHおよび酸素条件が挙げられる。一実施形態において、効果的培地は、細胞を培養して本発明の組換えポリペプチドを生成する任意の培地を指す。幾つかの実施形態において、培地は、典型的には、同化性炭素、窒素およびリン酸供給源、ならびに適切な塩、金属、および他の栄養素、例えばビタミンを有する水溶液を含む。幾つかの実施形態において、本発明の細胞は、従来の発酵バイオリアクター、振とうフラスコ、試験管、ミクロタイターディッシュ、およびペトリ皿で培養することができる。幾つかの実施形態において、培養は、組換え細胞に適した温度、pHおよび酸素含量で実施される。幾つかの実施形態において、培養条件は、当業者の専門技術の範囲内である。
【0114】
幾つかの実施形態において、生成に用いられるベクターおよび宿主系に応じて、得られた本発明の加工凝固因子は、組換え細胞内に残存するか、発酵培地に分泌されるか、2つの細胞膜間の空間、例えば大腸菌のペリプラズム空間に分泌されるか、または細胞もしくはウイルス膜の外表面に保持される。
【0115】
一実施形態において、所定の時間の培養に続いて、組換え加工凝固因子の回収が実行される。
【0116】
一実施形態において、本明細書で用いられる語句「組換え加工凝固因子を回収すること」は、ポリペプチドを含む発酵培地全体を回収することを指しており、分離または精製の追加的ステップを伴う必要はない。
【0117】
一実施形態において、本発明の加工凝固因子は、様々な標準的タンパク質精製技術、例えば非限定的に、アフィニティークロマトグラフィー、イオン交換クロマトグラフィー、ろ過、電気泳動法、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、逆相クロマトグラフィー、コンカナバリンAクロマトグラフィー、クロマトフォーカシングおよび分別可溶化、を用いて精製される。
【0118】
一実施形態において、回収を促進するために、発現されたコーディング配列を、本発明の加工凝固因子をコードするように加工して、開裂可能な部分を融合させることができる。一実施形態において、ポリペプチドがアフィニティークロマトグラフィーにより、例えば、開裂可能な部分に特異的なカラムへの固定化により、容易に単離できるように、融合タンパク質を設計することができる。一実施形態において、開裂部位は、加工凝固因子と開裂可能な部分の間で加工され、融合タンパク質をこの部位で特異的に開裂する適切な酵素または薬剤で処理することにより、ポリペプチドをクロマトグラフィーカラムから遊離させることができる(例えば、「Booth et al., Immunol. Lett. 19:65-70 (1988)」および「Gardella et al., J. Biol. Chem. 265:15854-15859 (1990)」参照)。
【0119】
一実施形態において、本発明の加工凝固因子は、「実質的に純粋な」形態で回収される。
【0120】
一実施形態において、語句「実質的に純粋な」は、本明細書に記載された適用例においてタンパク質の効果的使用が可能な純度を指す。
【0121】
一実施形態において、本発明の加工凝固因子は、インビトロ発現系を用いて合成することもできる。一実施形態において、インビトロ合成法は、当該技術分野で周知であり、系の成分は市販されている。
【0122】
幾つかの実施形態において、組換え加工凝固因子は、合成および精製され;それらの治療有効性を、インビボまたはインビトロのいずれかでアッセイすることができる。一実施形態において、本発明の組換え加工凝固因子の結合活性は、当業者に公知の様々なアッセイを用いて確認することができる。
【0123】
別の実施形態において、本発明の加工凝固因子は、それ自体を個体に提供することができる。一実施形態において、本発明の加工凝固因子は、薬学的に許容しうる担体と混合された医薬組成物の一部として、個体に提供することができる。
【0124】
別の実施形態において、「医薬組成物」は、本明細書に記載された有効成分1種以上と、他の化学成分、例えば、生理学的に適した担体および賦形剤との調製物を指す。医薬組成物の目的は、生物体への化合物投与を促進することである。
【0125】
別の実施形態において、「有効成分」は、生物学的効果を担う、該当するポリペプチド配列を指す。
【0126】
別の実施形態において、本発明の組成物のいずれも、任意の形態の、該当する加工凝固因子が、カルボキシ末端のみに結合したCTP配列を少なくとも1個含む。一実施形態において、本発明は、複合調製物(combined preparation)を提供する。一実施形態において、「複合調製物」は、先に定義された複合パートナーが、独立して投与されうる、または異なる一定の複合物を識別された量の複合パートナーと共に使用して、即ち、同時に、一度に、別個にまたは逐次、投与されうるという意味において、特に「成分のキット」を定義する。幾つかの実施形態において、成分のキットの中の成分は、その場合、例えば、成分のキットの中の任意の成分に関して、異なる時点で、そして同一または異なる時間間隔で、同時に投与されるか、または経時的にずらして投与することができる。幾つかの実施形態において、複合調製物では、複合パートナーの総量の比で投与することができる。一実施形態において、複合調製物は、例えば、処置される患者の部分集合の要件、または一人の患者の要件に対処するために、変動することができ、その異なる要件は、当業者が容易に作成することができるよう、特定の疾患、疾患の重症度、年齢、性別、または体重によるものであってもよい。
【0127】
別の実施形態において、互換可能に用いられる「生理学的に許容しうる担体」および「薬学的に許容しうる担体」は、生物体に顕著な刺激を起こさず、投与化合物の生物活性および性質を抑制しない担体または希釈剤を指す。これらの語句の下では、アジュバントが含まれる。一実施形態において、薬学的に許容しうる担体に含まれる成分の1つは、例えば、有機および水性媒体中で広範囲の溶解度を有する生体適合性ポリマーであるポリエチレングリコール(PEG)であってもよい(Mutter et al.(1979))。
【0128】
別の実施形態において、「賦形剤」は、医薬組成物に添加されて、有効成分の投与を更に促進する不活性物質を指す。一実施形態において、賦形剤としては、炭酸カルシウム、リン酸カルシウム、様々な糖類および複数の型のデンプン、セルロース誘導体、ゼラチン、植物油およびポリエチレングリコールが挙げられる。
【0129】
薬物の配合および投与の技術は、本明細書に参照により組み込まれた「Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA」の最新版に見出される。
【0130】
別の実施形態において、適切な投与経路としては、例えば、経口、経直腸、経粘膜、経鼻、腸内または非経口送達、例えば、筋肉内、皮下および髄内注射など、ならびに髄腔内、直接脳室内、静脈内、腹腔内、鼻腔、または眼内注射が挙げられる。
【0131】
別の実施形態において、調製物は、全身的手法よりむしろ局所的に、例えば、患者の身体の特定領域へ調製物を直接注射することにより、投与される。
【0132】
投与量の範囲の様々な実施形態が、本発明により企図される。一実施形態において、本発明の加工凝固因子の投与量は、0.005〜100mg/日の範囲内である。別の実施形態において、投与量は、0.05〜5mg/日の範囲内である。別の実施形態において、投与量は、0.01〜50mg/日の範囲内である。別の実施形態において、投与量は、0.1〜20mg/日の範囲内である。別の実施形態において、投与量は、0.1〜10mg/日の範囲内である。別の実施形態において、投与量は、0.01〜5mg/日の範囲内である。別の実施形態において、投与量は、0.001〜0.01mg/日の範囲内である。別の実施形態において、投与量は、0.001〜0.1mg/日の範囲内である。別の実施形態において、投与量は、0.1〜5mg/日の範囲内である。別の実施形態において、投与量は、0.5〜50mg/日の範囲内である。別の実施形態において、投与量は、0.2〜15mg/日の範囲内である。別の実施形態において、投与量は、0.8〜65mg/日の範囲内である。別の実施形態において、投与量は、1〜50mg/日の範囲内である。別の実施形態において、投与量は、5〜10mg/日の範囲内である。別の実施形態において、投与量は、8〜15mg/日の範囲内である。別の実施形態において、投与量は、10〜20mg/日の範囲内である。別の実施形態において、投与量は、20〜40mg/日の範囲内である。別の実施形態において、投与量は、60〜120mg/日の範囲内である。別の実施形態において、投与量は、12〜40mg/日の範囲内である。別の実施形態において、投与量は、40〜60mg/日の範囲内である。別の実施形態において、投与量は、50〜100mg/日の範囲内である。別の実施形態において、投与量は、1〜60mg/日の範囲内である。別の実施形態において、投与量は、15〜25mg/日の範囲内である。別の実施形態において、投与量は、5〜10mg/日の範囲内である。別の実施形態において、投与量は、55〜65mg/日の範囲内である。
【0133】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、鼻腔投与形態で配合される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、注射投与形態で配合される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.0001mg〜0.6mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.001mg〜0.005mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.005mg〜0.01mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.01mg〜0.3mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.2mg〜0.6mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子は、アミノ末端にCTPを含まない。
【0134】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、1〜100μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、10〜80μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、20〜60μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、10〜50μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、40〜80μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、10〜30μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、30〜60μgの範囲内の用量で対象に投与される。
【0135】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.2mg〜2mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、2mg〜6mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、4mg〜10mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、5mg〜15mgの範囲内の用量で対象に投与される。
【0136】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、筋肉内に注射される(筋肉内注射)。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、皮膚の下に注射される(皮下注射)。別の実施形態において、IFNタンパク質およびCTP単位を含むポリペプチドは、筋肉内に注射される。別の実施形態において、IFNタンパク質およびCTP単位を含むポリペプチドは、皮膚の下に注射される。
【0137】
別の実施形態において、本発明の方法は、凝固因子と、その凝固因子のアミノ末端に結合した1個の絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)と、その凝固因子のカルボキシ末端に結合した2個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、必要とする対象に提供し、それにより凝固因子療法の利用において服薬遵守を向上させることを含む、凝固因子療法の利用において服薬遵守を向上させることを含む。
【0138】
別の実施形態において、本発明の方法は、凝固因子療法が必要な慢性疾患に苦しむ患者の服薬遵守を向上させることを含む。別の実施形態において、本発明の方法は、本明細書の先に記載された通り凝固因子をCTPで修飾することにより、凝固因子の投与頻度を低減する。別の実施形態において、用語、服薬遵守は、アドヒアランスを含む。別の実施形態において、本発明の方法は、凝固因子の投与頻度を低減することにより、凝固因子療法が必要な患者の服薬遵守を向上させることを含む。別の実施形態において、凝固因子の投与頻度の低減は、CTP修飾凝固因子をより安定化させるCTP修飾により実現される。別の実施形態において、凝固因子の投与頻度の低減は、凝固因子のT1/2を増加させた結果、実現される。別の実施形態において、凝固因子の投与頻度の低減は、凝固因子のクリアランス時間を増加させた結果、実現される。別の実施形態において、凝固因子の投与頻度の低減は、凝固因子のAUC測定値を増加させた結果、実現される。
【0139】
別の実施形態において、1〜10個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の投与頻度を低減するステップを含む、凝固因子の投与頻度を低減する方法が提供される。別の実施形態において、1〜5個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の投与頻度を低減するステップを含む、凝固因子の投与頻度を低減する方法が提供される。
【0140】
別の実施形態において、凝固因子と、凝固因子のカルボキシ末端に結合した1〜10個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、必要とする対象に提供し、それにより凝固因子療法の利用において服薬遵守を向上させることを含む、凝固因子療法の利用における服薬遵守を向上させる方法が提供される。別の実施形態において、凝固因子と、凝固因子のカルボキシ末端に結合した1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、必要とする対象に提供し、それにより凝固因子療法の利用において服薬遵守を向上させることを含む、凝固因子療法の利用における服薬遵守を向上させる方法が提供される。
【0141】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に1日1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に2日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に3日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に4日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に5日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に6日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に週に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に7〜14日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に10〜20日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に5〜15日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に15〜30日に1回投与される。
【0142】
別の実施形態において、投与量は、50〜500mg/日の範囲内である。別の実施形態において、投与量は、50〜150mg/日の範囲内である。別の実施形態において、投与量は、100〜200mg/日の範囲内である。別の実施形態において、投与量は、150〜250mg/日の範囲内である。別の実施形態において、投与量は、200〜300mg/日の範囲内である。別の実施形態において、投与量は、250〜400mg/日の範囲内である。別の実施形態において、投与量は、300〜500mg/日の範囲内である。別の実施形態において、投与量は、350〜500mg/日の範囲内である。
【0143】
一実施形態において、投与量は、20mg/日である。一実施形態において、投与量は、30mg/日である。一実施形態において、投与量は、40mg/日である。一実施形態において、投与量は、50mg/日である。一実施形態において、投与量は、0.01mg/日である。別の実施形態において、投与量は、0.1mg/日である。別の実施形態において、投与量は、1mg/日である。別の実施形態において、投与量は、0.530mg/日である。別の実施形態において、投与量は、0.05mg/日である。別の実施形態において、投与量は、50mg/日である。別の実施形態において、投与量は、10mg/日である。別の実施形態において、投与量は、20〜70mg/日である。別の実施形態において、投与量は、5mg/日である。
【0144】
別の実施形態において、投与量は、1〜90mg/日である。別の実施形態において、投与量は、1〜90mg/2日である。別の実施形態において、投与量は、1〜90mg/3日である。別の実施形態において、投与量は、1〜90mg/4日である。別の実施形態において、投与量は、1〜90mg/5日である。別の実施形態において、投与量は、1〜90mg/6日である。別の実施形態において、投与量は、1〜90mg/週である。別の実施形態において、投与量は、1〜90mg/9日である。別の実施形態において、投与量は、1〜90mg/11日である。別の実施形態において、投与量は、1〜90mg/14日である。
【0145】
別の実施形態において、凝固因子の投与量は、10〜50mg/日である。別の実施形態において、投与量は、10〜50mg/2日である。別の実施形態において、投与量は、10〜50mg/3日である。別の実施形態において、投与量は、10〜50mg/4日である。別の実施形態において、投与量は、10〜50mg/5日である。別の実施形態において、投与量は、10〜50mg/6日である。別の実施形態において、投与量は、10〜50mg/週である。別の実施形態において、投与量は、10〜50mg/9日である。別の実施形態において、投与量は、10〜50mg/11日である。別の実施形態において、投与量は、10〜50mg/14日である。
【0146】
一実施形態において、経口投与は、錠剤、カプセル、トローチ剤、チュワブル錠、懸濁物、エマルジョンなどを含む単位用量形態を含む。そのような単位用量形態は、本発明の所望の凝固因子を安全で効果的な量含み、それぞれは、一実施形態において、0.7もしくは3.5mg〜約280mg/70kg、または別の実施形態において、0.5もしくは10mg〜約210mg/70kgである。経口投与のための単位用量形態の調製に適した、薬学的に許容しうる担体は、当該技術分野で周知である。幾つかの実施形態において、錠剤は、典型的には、不活性希釈剤、例えば、炭酸カルシウム、炭酸ナトリウム、マンニトール、ラクトースおよびセルロース;結合剤、例えば、デンプン、ゼラチンおよびスクロース;崩壊剤、例えば、デンプン、アルギン酸およびクロスカルメロース;潤滑剤、例えば、ステアリン酸マグネシウム、ステアリン酸およびタルク、のような従来の薬学的に適合しうるアジュバントを含む。一実施形態において、滑剤、例えば、二酸化ケイ素を用いて、粉末混合物の流動性を向上させることができる。一実施形態において、着色剤、例えば、FD&C着色剤を、外観のために添加することができる。甘味剤および着香剤、例えば、アスパルテーム、サッカリン、メントール、ペパーミント、および果実香料は、チュワブル錠に有用なアジュバントである。カプセルは、典型的には、先に開示された固体希釈剤を1種以上含む。幾つかの実施形態において、担体成分の選択は、香味、経費、および貯蔵安定性などの第二の判断材料に依存し、本発明の目的としては不可欠ではなく、当業者により容易に実施することができる。
【0147】
一実施形態において、経口投与形態は、あらかじめ定義された放出プロファイルを含む。一実施形態において、本発明の経口投与形態は、長期放出性の錠剤、カプセル、トローチ剤またはチュワブル錠を含む。一実施形態において、本発明の経口投与形態は、徐放性の錠剤、カプセル、トローチ剤またはチュワブル錠を含む。一実施形態において、本発明の経口投与形態は、即放性の錠剤、カプセル、トローチ剤またはチュワブル錠を含む。一実施形態において、経口投与形態は、当業者に公知の薬学的有効成分の所望の放出プロファイルに従って配合される。
【0148】
幾つかの実施形態において、経口組成物は、溶液、エマルジョン、懸濁物などを含む。幾つかの実施形態において、そのような組成物の調製に適した薬学的に許容しうる担体は、当該技術分野で周知である。幾つかの実施形態において、液体経口組成物は、所望の化合物を約0.001%〜約0.933%を含み、別の実施形態において、約0.01%〜約10%含む。
【0149】
幾つかの実施形態において、本発明の方法で用いられる組成物は、溶液またはエマルジョンを含み、幾つかの実施形態において、それは、本発明の化合物、および場合により局所鼻腔投与に向けた他の化合物を、安全で効果的な量含む水溶液またはエマルジョンである。幾つかの実施形態において、その組成物は、表題化合物を約0.001%〜約10.0%w/v、より好ましくは約0.01%〜約2.0%w/v含み、化合物を鼻腔経路により全身に送達するのに用いられる。
【0150】
別の実施形態において、医薬組成物は、液体調製物の静脈内、動脈内、または筋肉内注射により投与される。幾つかの実施形態において、液体配合剤としては、溶液、懸濁物、分散物、エマルジョン、オイルなどが挙げられる。一実施形態において、医薬組成物は、静脈内に投与され、つまり静脈内投与に適した形態で配合される。別の実施形態において、医薬組成物は、動脈内に投与され、つまり動脈内投与に適した形態で配合される。別の実施形態において、医薬組成物は、筋肉内に投与され、つまり筋肉内投与に適した形態で配合される。
【0151】
更に、別の実施形態において、医薬組成物は、体表に局所的に投与され、つまり局所投与に適した形態で配合される。適切な局所配合剤としては、ゲル、軟膏、クリーム、ローション、滴薬などが挙げられる。局所投与では、本発明の化合物は、更なる適切な治療薬1種または複数種と混和され、薬学的担体を含み、または含まずに、生理学的に許容しうる希釈剤中の溶液、懸濁物またはエマルジョンとして調製および適用される。
【0152】
一実施形態において、本発明の医薬組成物は、当該技術分野で周知の工程により、例えば、従来の混合、溶解、造粒、糖衣錠製造、研和、乳化、カプセル化、封入または凍結乾燥工程を用いて製造される。
【0153】
一実施形態において、本発明により使用される医薬組成物は、有効成分の、薬学的に用いうる調製物への加工を促進する、賦形剤および補助剤を含む生理学的に許容しうる担体1種以上を用いて、従来の手法で配合される。一実施形態において、配合は、選択された投与経路に依存する。
【0154】
一実施形態において、本発明の注射薬は、水溶液中で配合される。一実施形態において、本発明の注射薬は、生理学的に適合しうる緩衝剤、例えばハンクス液、リンガー液、または生理学的塩緩衝剤中で配合される。幾つかの実施形態において、経粘膜投与では、透過されるバリアに適した浸透薬が、配合剤中で用いられる。そのような浸透薬は、一般に、当該技術分野で公知である。
【0155】
一実施形態において、本明細書に記載された調製物は、非経口投与用に、例えば、ボーラス注射または連続点滴用に配合される。幾つかの実施形態において、注射用の配合剤は、単位用量形態で、例えばアンプル中に存在するか、または場合により追加の防腐剤と共に、反復投与容器中に存在する。幾つかの実施形態において、組成物は、油性または水性ビヒクル中の懸濁物、溶液またはエマルジョンであり、配合剤、例えば、懸濁剤、安定化剤および/または分散剤を含有する。
【0156】
組成物は、幾つかの実施形態において、必要に応じて、防腐剤、例えば、塩化ベンザルコニウムおよびチメロサールなど;キレート化剤、例えば、エデト酸ナトリウムなど;緩衝剤、例えばリン酸塩、クエン酸塩および酢酸塩;等張剤、例えば、塩化ナトリウム、塩化カリウム、グリセリン、マンニトールなど;抗酸化剤、例えば、アスコルビン酸、アセチルシスチン、ピロ亜硫酸ナトリウムなど;芳香剤;粘度調整剤、例えば、セルロースおよびその誘導体をはじめとするポリマー;およびポリビニルアルコール;ならびにこれらの水性組成物のpHを調整するための酸および塩基も含む。組成物は、幾つかの実施形態において、部分麻酔または他の活性剤も含む。組成物は、スプレー、ミスト、滴薬などとして用いることができる。
【0157】
幾つかの実施形態において、非経口投与用の医薬組成物は、活性調製物の水溶液を水溶性形態で含む。加えて、幾つかの実施形態において、有効成分の懸濁物は、オイルまたは水を基剤とする注射用懸濁物として調製される。幾つかの実施形態において、適切な親油性溶媒またはビヒクルとしては、脂肪油、例えば、ゴマ油、または合成脂肪酸エステル、例えば、オレイン酸エチル、トリグリセリドまたはリポソームが挙げられる。水性注射用懸濁物は、幾つかの実施形態において、懸濁物の粘度を上昇させる物質、例えば、カルボキシメチルセルロースナトリウム、ソルビトールまたはデキストランを含有する。別の実施形態において、懸濁物は、有効成分の溶解度を上昇させて、高濃縮溶液の調製を可能にする適切な安定化剤または薬剤も含有する。
【0158】
別の実施形態において、活性化合物は、小胞、詳細にはリポソーム中に送達することができる(「Langer, Science 249:1527-1533 (1990)」;「Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez- Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989)」;「Lopez-Berestein, ibid., pp. 317-327」を参照;一般には同書を参照)。
【0159】
別の実施形態において、制御放出系で送達される医薬組成物は、静脈内注射、移植可能な浸透圧ポンプ、経皮パッチ、リポソームまたは他の投与様式用に配合される。一実施形態において、ポンプが用いられる(「Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987)」及び「Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989)」を参照)。別の実施形態において、ポリマー材料を用いることができる。更に別の実施形態において、制御放出系は、治療ターゲット、即ち、脳の付近に設置することができ、つまり全身用量のほんのわずかしか必要とならない(例えば、「Goodson, Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984)」参照)。他の制御放出系は、Langerによるレビュー(Science 249:1527-1533 (1990))に議論されている。
【0160】
幾つかの実施形態において、有効成分は、使用前に、適切なビヒクル、例えば、滅菌パイロジェンフリー水を基にした溶液で再構成される粉末形態である。組成物は、幾つかの実施形態において、噴霧および吸入投与用に配合される。別の実施形態において、組成物は、噴霧手段が取付けられた容器に含有されている。
【0161】
一実施形態において、本発明の調製物は、例えば従来の坐剤ベース、例えばココアバターまたは他のグリセリドを用いて、直腸組成物、例えば、坐剤または停留浣腸中に配合されている。
【0162】
幾つかの実施形態において、本発明の関連での使用に適した医薬組成物は、有効成分が意図する目的を実現するのに効果的な量で含有されている組成物を包含する。幾つかの実施形態において、治療上効果的な量は、処置される対象の疾患の症状を予防、緩和もしくは寛解するか、または生存を延長するのに効果的な有効成分の量を意味する。
【0163】
一実施形態において、治療上効果的な量の決定は、当業者の能力の範囲内で十分に行われる。
【0164】
薬学的に許容しうる担体またはその成分として作用しうる物質の幾つかの例は、糖、例えば、ラクトース、グルコースおよびスクロース;デンプン、例えばコーンスターチおよびジャガイモデンプン;セルロースおよびその誘導体、例えば、カルボキシメチルセルロースナトリウム、エチルセルロース、およびメチルセルロース;粉末トラガカント;麦芽;ゼラチン;タルク;固形潤滑剤、例えば、ステアリン酸およびステアリン酸マグネシウム;硫酸カルシウム;植物油、例えば、ピーナッツ油、綿実油、ゴマ油、オリーブ油、コーン油およびカカオ油;ポリオール、例えば、プロピレングリコール、グリセリン、ソルビトール、マンニトール、およびポリエチレングリコール;アルギン酸;乳化剤、例えば、ツイーン(Tween)(商標)ブランドの乳化剤;湿潤剤、例えば、ラウリル硫酸ナトリウム;着色剤;着香剤;錠剤成形剤(tableting agents);安定化剤;抗酸化剤;防腐剤;パイロジェンフリー水;等張性生理食塩水;ならびにリン酸緩衝溶液である。化合物と一体となって用いられる、薬学的に許容しうる担体の選択は、基本的に、化合物を投与する方法により決定される。表題化合物が注射されるものである場合、一実施形態において、薬学的に許容しうる担体は、血液と適合性のある懸濁剤を有し、pHが約7.4に調整された滅菌生理食塩水である。
【0165】
加えて、組成物は更に、結合剤(例えば、アカシア、コーンスターチ、ゼラチン、カルボマー、エチルセルロース、グアーガム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポビドン)、崩壊剤(例えば、コーンスターチ、トウモロコシデンプン、アルギン酸、二酸化ケイ素、クロスカルメロースナトリウム、クロスポビドン、グアーガム、デンプングリコール酸ナトリウム)、様々なpHおよびイオン強度の緩衝剤(例えば、トリスHCl、酢酸塩、リン酸塩)、表面への吸収を予防する添加剤、例えば、アルブミンまたはゼラチン、崩壊剤(例えば、ツイーン20、ツイーン80、プルロニック(Pluronic)F68、胆汁酸塩)、プロテアーゼ阻害剤、界面活性剤(例えば、ラウリル硫酸ナトリウム)、浸透増強剤、可溶化剤(例えば、グリセロール、ポリエチレングリセロール)、抗酸化剤(例えば、アスコルビン酸、メタ重亜硫酸ナトリウム、ブチルヒドロキシアニソール)、安定化剤(例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース)、粘度上昇剤(例えば、カルボマー、コロイド状二酸化ケイ素、エチルセルロース、グアーガム)、甘味剤(例えば、アスパルテーム、クエン酸)、防腐剤(例えば、チメロサール、ベンジルアルコール、パラベン)、潤滑剤(例えば、ステアリン酸、ステアリン酸マグネシウム、ポリエチレングリコール、ラウリル硫酸ナトリウム)、流動助剤(例えば、コロイド状二酸化ケイ素)、可塑剤(例えば、ジエチルフタル酸、トリエチルクエン酸)、乳化剤(例えば、カルボマー、ヒドロキシプロピルセルロース、ラウリル硫酸ナトリウム)、ポリマーコーティング(例えば、ポロキサマーまたはポロキサアミン)、コーティングおよびフィルム形成剤(例えば、エチルセルロース、アクリラート、ポリメタクリラート)ならびに/またはアジュバントを含む。
【0166】
シロップ、エリキシル、エマルジョンおよび懸濁物のための担体の典型的な成分としては、エタノール、グリセロール、プロピレングリコール、ポリエチレングリコール、液体スクロース、ソルビトールおよび水が挙げられる。懸濁物では、典型的な懸濁剤として、メチルセルロース、カルボキシメチルセルロースナトリウム、セルロース(例えば、アビセル(Avicel)(商標)、RC−591)、トラガカントおよびアルギン酸ナトリウムが挙げられ;典型的な湿潤剤としては、レシチンおよびポリエチレンオキシドソルビタン(例えば、ポリソルベート80)が挙げられる。典型的な防腐剤としては、メチルパラベンおよび安息香酸ナトリウムが挙げられる。別の実施形態において、経口液体組成物は、先に開示された成分、例えば、甘味剤、着色剤および着色剤も1種以上含有する。
【0167】
組成物は、ポリマー化合物、例えば、ポリ乳酸、ポリグリコール酸、ハイドロゲルなどの粒子状調製物の内部もしくは表面に、あるいはリポソーム、マイクロエマルジョン、ミセル、ユニラメラもしくはマルチラメラベシクル、赤血球影、またはスフェロプラストなどの表面に、活性材料を組込んだものも包含する。そのような組成物は、物理的状態、溶解度、安定性、インビボ放出速度、およびインビボクリアランス速度に影響を及ぼす。
【0168】
同じく本発明により、ポリマー(例えば、ポロキサマーまたはポロキサミン)でコートされた特定の組成物、および組織特異性の受容体、リガンドもしくは抗原に対する抗体に結合した化合物、または組織特異性受容体のリガンドに結合した化合物も包含される。
【0169】
幾つかの実施形態において、水溶性ポリマー、例えばポリエチレングリコール、ポリエチレングリコールとポリプロピレングリコールとのコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニルアルコール、ポリビニルピロリドンまたはポリプロリンの共有結合により修飾された化合物。別の実施形態において、修飾された化合物は、静脈内注射後に、対応する非修飾化合物よりも実質的に長い血中半減期を示す。一実施形態において、修飾は、同じく、水溶液中の化合物溶解度を上昇させ、凝集を排除し、化合物の物理的および化学的安定性を上昇させて、化合物の免疫原性および反応性を大きく低下させる。別の実施形態において、そのようなポリマー−化合物・付加物(abduct)を、非修飾化合物よりも少ない頻度で、または低用量で投与することにより、所望のインビボ生物活性が実現される。
【0170】
幾つかの実施形態において、有効量または用量の調製は、最初はインビトロアッセイから推定することができる。一実施形態において、用量を動物モデルにおいて配合させることができ、そのような情報を用いて、ヒトにおける有用な用量をより正確に決定することができる。
【0171】
一実施形態において、本明細書に記載された有効成分の毒性および治療有効性は、インビトロ、細胞培養、または実験動物において、標準的医薬手順により決定することができる。一実施形態において、これらのインビトロおよび細胞培養アッセイおよび動物試験から得られたデータは、ヒトに使用される一定範囲の投与量を配合させるのに用いることができる。一実施形態において、投与量は、用いられる投与形態および利用される投与経路に応じて変動する。一実施形態において、厳密な配合、投与経路および投与量は、各医師により患者の状態を考慮して選択することができる(例えば、「Fingl, et al., The Pharmacological Basis of Therapeutics, Ch. 1 p.1, (1975)」参照)。
【0172】
一実施形態において、処置される状態の重症度および応答性に応じて、投与は、単回投与または反復投与であってもよく、数日から数週間、または治癒が果たされるまで、または疾患状態の縮小に至るまで、一連の処置が継続されてもよい。
【0173】
一実施形態において、投与される組成物の量は、もちろん、処置される対象、病気の重症度、投与の手法、処方する医師の判断などに依存する。
【0174】
一実施形態において、適合しうる医薬担体中で配合される本発明の調製物をはじめとする組成物が調製され、適切な容器に入れられて、適応症の処置に関してラベル表示される。
【0175】
別の実施形態において、本明細書に記載された凝固因子は、全身投与により投与される。別の実施形態において、本明細書に記載された凝固因子は、静脈内、筋肉内または皮下注射により投与される。別の実施形態において、本明細書に記載された凝固因子は、複合有機賦形剤および安定化剤、例えば、非イオン性表面活性剤(即ち、界面活性剤)、様々な糖類、有機ポリオールおよび/またはヒト血清アルブミンと混和された凍結乾燥(即ち、フリーズドライ)調製物である。別の実施形態において、医薬組成物は、注射用滅菌水中の、凍結乾燥された上記凝固因子を含む。別の実施形態において、医薬組成物は、注射用滅菌PBS中の、凍結乾燥された上記凝固因子を含む。別の実施形態において、医薬組成物は、注射用滅菌0.9%NaCl中の、凍結乾燥された上記凝固因子を含む。
【0176】
別の実施形態において、医薬組成物は、本明細書に記載された凝固因子と、複合担体、例えば、ヒト血清アルブミン、ポリオール、糖類、および陰イオン性表面活性安定化剤とを含む。例えば、WO第89/10756号(Hara et al.、ポリオールおよびp−ヒドロキシ安息香酸を含有)を参照されたい。別の実施形態において、医薬組成物は、本明細書に記載された凝固因子と、ラクトビオン酸と、酢酸/グリシン緩衝剤とを含む。別の実施形態において、医薬組成物は、本明細書に記載された凝固因子と、水へのインターフェロン組成物の溶解度を上昇させるアミノ酸、例えば、アルギニンまたはグルタミン酸とを含む。別の実施形態において、医薬組成物は、凍結乾燥された、本明細書に記載された凝固因子と、グリシンまたはヒト血清アルブミン(HSA)、緩衝剤(例えば、酢酸塩)および等張剤(例えば、NaCl)とを含む。別の実施形態において、医薬組成物は、凍結乾燥された、本明細書に記載された凝固因子と、リン酸緩衝剤と、グリシンと、HSAとを含む。
【0177】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、約4〜7.2のpHを有する緩衝溶液中に添加されると安定化する。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、安定化剤としてのアミノ酸と、幾つかの例では、塩(アミノ酸が帯電した側鎖を含まない場合)とによって安定化される。
【0178】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、アミノ酸である安定化剤を約0.3重量%〜5重量%含む液体組成物である。
【0179】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、用量精度および製品安全性を提供する。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、注射可能な適用例に用いられる、生物活性のある安定した液体配合剤を提供する。別の実施形態において、医薬組成物は、凍結乾燥されていない、本明細書に記載された凝固因子を含む。
【0180】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、液体状態での長期貯蔵が可能であるために投与前の貯蔵および運搬が促進される液体配合剤を提供する。
【0181】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、固形脂質をマトリックス材料として含む。別の実施形態において、本明細書に記載された凝固因子を含む注射可能な医薬組成物は、固形脂質をマトリックス材料として含む。別の実施形態において、噴霧凝固法による液体微粒子の製造が、「Speiser(Speiser and al., Pharm. Res. 8 (1991) 47-54)」により記載されており、その後、経口投与のための液体ナノペレット(Speiser EP0167825(1990))を製造する。別の実施形態において、用いられる液体は、身体に十分に耐容される(例えば、非経口栄養素用のエマルジョン中に存在する脂肪酸で構成されたグリセリド)。
【0182】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、リポソームの形態である(J. E. Diederichs and al., Pharm./nd. 56 (1994) 267- 275)。
【0183】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、高分子微粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む注射可能な医薬組成物は、高分子微粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、ナノ粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、リポソームを含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、液体エマルジョンを含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、ミクロスフェアを含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、脂質ナノ粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、両親媒性脂質を含む脂質ナノ粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、薬物と、脂質マトリックスと、界面活性剤とを含む脂質ナノ粒子を含む。別の実施形態において、脂質マトリックスは、少なくとも50%w/wであるモノグリセリドを有する。
【0184】
一実施形態において、本発明の組成物は、有効成分を含有する単位用量形態を1種以上含有する、パックまたはディスペンサー装置、例えば、FDA認可のキットの中に存在する。一実施形態において、パックは、例えば、金属またはプラスチックのホイル、例えばブリスタパックを含む。一実施形態において、パックまたはディスペンサー装置は、投与用の器具を伴う。一実施形態において、パックまたはディスペンサーは、医薬品の製造、用法または安全性を管理する政府機関により規定された形態で、容器に添付された注意書きにより適応される、その注意書きは、組成物またはヒトもしくは家畜への投与の形態の、政府機関による認可を表している。一実施形態において、そのような注意書きは、処方薬に関する米国食品医薬品局の認可について、または認可製品のリストを、ラベル表示している。
【0185】
一実施形態において、本発明の凝固因子が、追加の活性剤と共に個体に提供されることで、各薬剤の単独での処置に比較して、改善された治療効果が実現しうることは、理解されよう。別の実施形態において、併用療法に関連する有害な副作用への方策(例えば、補助剤の投与および選択)が採られる。
【0186】
本発明の更なる目的、利益、および新規特徴は、以下の実施例の実験により当業者に明白となるが、それらは本発明の限定ではない。更に、本明細書の先に表示され、そして以下の特許請求の範囲の区分で請求される本発明の様々な実施形態および態様それぞれにより、以下の実施例の実験的サポートが見出される。
【0187】
実施例
【0188】
一般に、本明細書で用いられる命名法および本発明で用いられる検査手順は、分子学的、生化学的、微生物学的および組換えDANの技術を含む。そのような技術は、文献に完全に説明されている。例えば、「Molecular Cloning: A laboratory Manual, Sambrook et al., (1989)」;「Current Protocols in Molecular Biology, Volumes I-III Ausubel, R. M., 編 (1994)」;「Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Maryland (1989)」;「Perbal, A Practical Guide to Molecular Cloning, John Wiley & Sons, New York (1988)」;「Watson et al., Recombinant DNA, Scientific American Books, New York」;「Birren et al. (編) Genome Analysis: A Laboratory Manual Series, Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998)」、以下に示された方法論:米国特許第4,666,828号、第4,683,202号、第4,801,531号、第5,192,659号および第5,272,057号;「Cell Biology: A Laboratory Handbook, Volumes I-III Cellis, J. E., 編. (1994)」、「Culture of Animal Cells - A Manual of Basic Technique, by Freshney, Wiley-Liss, N. Y. (1994), Third Edition」、「Current Protocols in Immunology, Volumes I-III Coligan J. E.,編 (1994)」、「Stites et al. (編), Basic and Clinical Immunology (8th Edition), Appleton & Lange, Norwalk, CT (1994)」、「Mishell and Shiigi (編), Selected Methods in Cellular Immunology, W. H. Freeman and Co., New York (1980)」を参照されたく、利用可能な免疫アッセイは、特許および科学文献に広範に記載されており、例えば、米国特許第3,791,932号;第3,839,153号;第3,850,752号;第3,850,578号;第3,853,987号;第3,867,517号;第3,879,262号;第3,901,654号;第3,935,074号;第3,984,533号;第3,996,345号;第4,034,074号;第4,098,876号;第4,879,219号;第5,011,771号および第5,281,521号、「Oligonucleotide Synthesis, Gait, M. J.,編 (1984)」;「Nucleic Acid Hybridization, Hames, B. D., and Higgins S. J.,編 (1985)」;「Transcription and Translation, Hames, B. D., and Higgins S. J.,編. (1984)」;「Animal Cell Culture, Freshney, R. I., 編(1986)」;「Immobilized Cells and Enzymes, IRL Press, (1986)」;「A Practical Guide to Molecular Cloning, Perbal, B., (1984)」;「Methods in Enzymology, Vol. 1-317, Academic Press」;「PCR Protocols: A Guide To Methods And Applications, Academic Press, San Diego, CA (1990)」;「Marshak et al., Strategies for Protein Purification and Characterization - A Laboratory Course Manual, CSHL Press (1996)」を参照されたく、それらの全てが、本明細書に参考として組入れられている。他の一般的参考文献は、この文書全体に提供されている。
【0189】
実施例1
【0190】
[第IX凝固因子の生成および利用]
【0191】
第IX因子(FIX)は、415アミノ酸(55KDa)の糖タンパク質であり、凝固系に関連するビタミンK依存性糖タンパク質の群に属する。FIXは、N−末端プロペプチドと、それに続く成熟アミノ酸配列とを有する前駆体として合成される第FVII因子、第X因子、プロテインCおよびプロトロンビンと類似のドメイン構成を有する。
【0192】
FIXは、一本鎖分子として分泌され、複雑な翻訳後修飾を受けるが、その多くが生化学的および薬物動態的性質にとって不可欠である。全ての翻訳後修飾のうち、ビタミンK依存性γ−カルボキシラーゼによりγ−カルボキシル化されるFIXのアミノ末端付近の12個のグルタミン酸残基は、最も肝要なものである。カルボキシル化は、FIXとリン脂質表面との相互作用に、そして最適なFIX活性に必要である。アミノ末端プロペプチドは、γ−カルボキシラーゼの認識部位として作用し、つまりγ−カルボキシル化に続いて、塩基性アミノ酸残基対開裂酵素(Paired basic Amino acid Cleave Enzyme)(PACE/フリン)として知られるゴルジ装置セリンプロテアーゼにより開裂される。4種の更なる翻訳後修飾がゴルジ装置で起こり、チロシン155の硫酸化、セリン158のリン酸化、セリン63および61のO−グリコシル化、そして最後にAsn157および16のN−グリコシル化が起こる。
【0193】
FIXは、一本鎖の不活性チモーゲンとして、血漿内を循環する(平均濃度5μg/ml)。1種以上の生理学的アクチベータ、FVIIa−TF複合体またはFIXaのいずれかによる、2つのペプチド結合:Arg145およびArg180のタンパク質分解開裂の際に、活性化ペプチドが除去されて、FIXを、ジスルフィド単結合により結合した軽鎖および重鎖からなる完全に活性化された酵素に変換する。N−末端軽鎖は、非触媒γ−カルボキシグルタミン酸(Gla)および2個の上皮増殖因子様ドメインを含み、C−末端重鎖は、分子のトリプシン様触媒ドメインを含む。FIXaそのものは、わずかな触媒活性により特徴づけられる。しかし、FVIIIと複合体化すると、そのタンパク質分解活性が、天然基質FXより4〜5桁上昇する。
【0194】
血友病Bは、第IX因子(FIX)遺伝子の突然変異により引き起こされるX染色体関連の出血性疾患であり、FIXのプロコアグラント活性の欠乏をきたす。血友病B患者は、特発性軟部組織出血および再発性関節血症を有し、多くの場合、手足に障害が残る関節症を来す。これらの患者の現行の処置には、組換えFIXの静脈内投与がある。しかし、経費の問題、および循環からのFIXの比較的急速なクリアランスが、長期作用性FIXの開発を困難な課題にしている。
【0195】
CTPテクノロジーが、長期作用性FIXの開発に利用された。詳細には、少なくとも1種のヒトCPTをFIXに融合することにより、組換えrFIX分子の半減期延長が実施された。組換えFIX−CTPが、哺乳類細胞内で発現され、インビトロおよびインビボで特徴づけられた。rFIX−CTPのインビトロ活性が、rFIXと同等であることが実証された。ラットにおける薬物動態および有効性試験により、rFIX−CTPの改善された性質が実証された。この試験の結果、野生型酵素と類似の止血性を有する、半減期の長いrFIX分子の開発が実現可能であることが実証された。
【0196】
組換えFIX分子のクローニングおよび発現:Dg44細胞を100mm組織培養皿に添加して、50〜60%コンフルエンスになるまで増殖させた。無タンパク質培地(インビトロジェン CD Dg44)中のヒュージーン(FuGene)試薬(ロッシュ(Roche))を用いた100mmプレート1枚のでのトランスフェクションに、合計2μg(マイクログラム)のFIX cDNAを用いた。トランスフェクションの48時間後に培地を除去して、ヌクレオシドを含まず800μg/ml G418(ネオマイシン)が存在する無タンパク質培地(インビトロジェン CD Dg44)と交換した。14日後に、トランスフェクトされた細胞集団をT25組織培養フラスコに移して、細胞が安定したクローンとして増殖し始めるまで、更に10〜14日間、選別を継続した。高発現クローンを選別した。細胞 約2×107個を用いて、ビタミンK3 5ng/ml(メナジオン重硫酸ナトリウム;シグマ(Sigma))を補足した1700cm2丸底フラスコ(コーニング(Corning)、コーニングNY)内の増殖培地300mlに播種した。細胞生存性が約70%に急速低下した後、生成培地(ハーベスト)を回収した。生成培地を、最初は透明化させ、その後、約20倍に濃縮し、流動ろ過カセット(flow filtration cassette)(10KDa MWCO、ミリポア社(Millipore Corp))を用いてPBSで透析した。
【0197】
FIX抗原レベルの測定:FIX−CTPハーベストの抗原レベルを、アッセイマックス(AssayMax)ヒトFIX ELISAキット(アッセプロ−EF1009−1)を用いて測定したが、計算されたタンパク質濃度は、2回の独立した実験での3個の異なる希釈液の平均値である(図3A)。
【0198】
【表1】

【0199】
FIXのSDS−PAGE − 免疫ブロット:FIX−CTPハーベストまたは精製rhFIX(アメリカン・ダイアグノスティックス)のタンパク質100ngを、プレシジョン・プラス・デュアル・カラー・プロテイン・マーカー(Precision plus dual color protein marker)(バイオ・ラッド(Bio-Rad))を用いて、12%トリス−グリシンゲルに負荷した。抗ヒトFIXポリクローナル抗体および抗ヒトγ−カルボキシル化モノクローナル抗体(アメリカン・ダイアグノスティックス)を用いたウェスタン免疫ブロットにより、SDS−PAGE分析を実施した。過去に報告された通り、rhFIXは55KDaに移動し、2個のCTPに融合されたFIXは75KDaに移動した。FIX−CTPタンパク質のバリアントは両者とも、γ−カルボキシル化されていることが示された(図3B)。
【0200】
FIX色素生成活性の測定:市販の色素生成活性検査キット、バイオフェン(BIOPHEN)(ハイフン・バイオメド(Hyphen BioMed) 221802)を用いて、rhFIXタンパク質(アメリカン・ダイアグノスティックス)に対するFIX−CTPハーベストのインビトロ能力の比較評価を実施した。トロンビン、リン脂質、カルシウムの存在下では、過剰量のFXIaは、採取したFIXをFIXaに活性化させる。FIXaは、トロンビン、活性化FVIII:C(過剰量で補足)、リン脂質、およびカルシウムと酵素複合体を形成して、アッセイ系に存在する第X因子をFXaに活性化させる。その活性は、限定的ファクターであるFIXの量に直接相関する。その後、生成されたFXaを、FXa色素生成基質(pNA)での特異的活性により測定する。生成されたpNAの量は、FIXa活性に直接比例する。rhFIXおよびFIX−CTPハーベストを系列希釈して、FIXハーベストの用量反応曲線をrhFIXまたはヒト血漿からなる参照調製物に比較することにより、効能を評価した。FIXの平均EC50は21ng/mlであり、FIX−(CTP)2ハーベストの計算されたEC50は382ng/mlであり、FIX−CTPハーベストの計算されたEC50は1644ng/mlであった。FIX−(CTP)2ハーベストの酵素活性において、約15倍の低下が観察された(図4)。
【0201】
FIX凝血活性(aPTT):活性化部分トロンボプラスチン時間(aPTT)は、凝固カスケードの内因系および共通系経路の統合性の指標である。aPTTは、内因系経路活性化剤、リン脂質およびカルシウムの添加の後、血漿が凝血するまでの秒数の時間である。組織因子はリン脂質と一緒には含まれず、プロトロンビン時間(PT)試薬と一緒に含まれるため、aPTT試薬は部分トロンボプラスチンと呼ばれる。活性化剤がその系を開始させ、その後、内因系経路の残りのステップがリン脂質の存在下で起こる。参照aPTTの範囲は、検査室間で変動するが、通常、27〜34秒の範囲内である。
【0202】
アッセイの原理は、rhFIXの添加により、FIX欠失ヒト血漿の凝血活性を回復させるFIX−CTPハーベストの能力を定量することである。FIX欠失ヒト血漿300μlを、rhFIXまたはFIX−CTPハーベスト 100μlと混合して、系列希釈した。37℃で60秒間インキュベートした後、トロンボプラスチン、CaCl2、およびリン脂質を混合物に添加し、秒単位での凝血時間を測定した(アメリカン・メディカル・ラボラトリーズ(America Medical Laboratories)により実施)。FIXハーベストの用量反応曲線を、rhFIXまたはヒト血漿からなる参照調製物に比較することにより効能を評価したが、FIX活性の1単位は、ヒト正常血漿1mlの活性と等しい必要FIX濃度である。表示されたaPTT結果から、FIX−(CTP)2が、rhFIXに比較して特異的凝固活性の5.7倍低下を示すことが示された。その上、aPTTの結果をインビトロアッセイでの色素生成活性と合わせると、FIX−(CTP)2ハーベストが、FIX−CTPハーベストに対比して、向上した酵素活性を有することが示唆された(図5)。FIX−CTPタンパク質の向上した活性は、発現系の最適化(即ち、フリンでのコトランスフェクションおよびビタミンK3の培地中濃度の最適化)に続いて得られる。
【0203】
【表2】

【0204】
薬物動態試験:rhFIX(アメリカン・ダイアグノスティックス)およびFIX−CTPハーベストを、スプラグー・ドーリー・ラット(6匹/物質)に用量75μg/kg体重で、単回の静脈内注射により投与した。
【0205】
【表3】

【0206】
血液試料を、投与の0.083、0.5、1.5、4、8、24、48、72時間後に、3匹ずつ交替で後眼窩から採取した。採取後直ちに血漿を調製して、分析まで−20℃で貯蔵した。FIX ELISA特異的アッセイ(アッセイプロ)によりFIX濃度を定量し、各タンパク質ごとに薬物動態プロファイルを計算したが、それらは各時間での動物3匹の平均値であり(図6)、最終半減期(terminal half lives)を、PKソルーション2.0(PK solutions 2.0)ソフトウエアを用いて計算した。表4は、異なる採取時間で観察されたFIX濃度を要約している。PKプロファイルおよび最終半減期の要約を、表5にまとめる。
【0207】
【表4】

【0208】
FIX−CTPハーベストは、rhFIXに比較して、向上したT1/2β値を示す(それぞれ2および5倍上昇)。FIX投与では、24時間後に回収した動物血清濃度は、定量限界未満(BLQ)であり、更なるPKパラメータを計算しなかった。
【0209】
【表5】

【0210】
この試験では、治療的効能を保持しながらFIX半減期を延長させるための新規なアプローチを記載した。活性タンパク質へのCTPペプチド付加は、タンパク質の活性を妨害する点で有害な可能性を有しており、それ故、CTP配列をFIXのC−末端に付加することによる活性組換えFIX−CTPの生成は予測されない。
【0211】
[免疫アフィニティー精製FIX−CTP−CTP(MOD−3012)の特徴づけ]
【0212】
MOD3012の精製
【0213】
MOD3012は、カルボキシ末端にタンデムにつながったCTP単位2個で修飾されたFIXである。FIXのN−末端領域に存在するγ−カルボキシルグルタミル(Gla)残基に対するモノクローナル抗体に結合したマトリックス(アメリカン・ダイアグノスティックス カタログ番号 3570MX)を用いて、MOD3012を精製した。モノクローナル抗体を、セファロースCL−4Bに結合させた。88μg/mlの濃度のMOD3012ハーベストを、トリス20mM、NaCl 150mMおよびEDTA pH=7.4 10mMで透析した。負荷速度は0.5ml/分であり、20mMトリス−HCl、350mM NaClおよび50mM CaClを用いて溶出を実施し、非結合画分を5回リサイクルした。最後に、溶出画分をPBSで透析し、プールして濃縮した。
【0214】
FIX抗原レベルの測定
【0215】
FIX−CTPおよびFIX−(CTP)2、つまりそれぞれMOD−3011およびMOD−3012のハーベスト、ならびにMOD3012精製タンパク質のレベルを、ヒトFIX ELISAキット(アフィニティー・バイオロジカルズ カタログ番号FIX−AG RUO)を用いて測定したが、計算されたタンパク質濃度(μg/ml)は、2回の独立した実験の平均値である(図7)。
【0216】
【表6】

【0217】
加えて、MOD−3012は、ブラッドフォードアッセイにより定量した。計算濃度は202μg/mlであり、ヒトFIX ELISAにより得られた濃度と類似している。
【0218】
SDS−PAGEブロット
【0219】
プレシジョン・プラス・デュアル・カラー・プロテイン・マーカー(バイオ・ラッド)を用いて、MOD3012ハーベスト、非結合画分および精製タンパク質を、12%トリス−グリシンゲルに負荷した。クーマシーブルー試薬(タンパク質800ng)でゲルを染色することにより、SDS−PAGE・クーマシー分析を実施し、抗ヒトFIXポリクローナル抗体(Ab)および抗ヒトγ−カルボキシル化モノクローナルAb(アメリカン・ダイアグノスティックス カタログ番号499 3570)(タンパク質100ng)を用いてウエスタンブロットを実施した。免疫アフィニティー精製手順では、MOD3012部分が有意に高濃度であり、不純物が減少した(図8)。
【0220】
N−末端配列決定:
【0221】
MOD−3012精製タンパク質を、12%トリス−グリシンSDS−PAGEにより分離し、続いてPVDF膜にエレクトロブロットした。該当するバンドを切り出して、精製されたバイオブレーン(Biobrene)処理のガラス繊維フィルター上に載せた。140C HPLCマイクログラジエントシステムを具備したパルス液相プロテインシーケンサー(pulsed liquid protein sequencer)を用いて、エドマン分解によりN−末端配列分析を実施した。N−末端配列決定により、MOD3012が、不完全なプロペプチド開裂タンパク質と完全なプロペプチド開裂タンパク質との混合物であることが明らかとなった。不適切にプロペプチドが開裂すると、FIX凝固活性を低下させることが示された。フリンとのコトランスフェクションにより、改善されたプロペプチド開裂工程を得ることができた。
【0222】
FIX色素生成活性の測定
【0223】
市販の色素生成活性検査キット、バイオフェン(ハイフン・バイオメド 221802)を用いて、rhFIX(アメリカン・ダイアグノスティックス)およびヒト正常血漿のプールに対するMOD−3012精製タンパク質のインビトロでの効能の比較評価を実施した。トロンビン、リン脂質およびカルシウムの存在下、過剰量のFXIaが、FIXをFIXaに活性化した。FIXaが、トロンビン、リン脂質(過剰量で補足)およびカルシウムとの酵素複合体を形成し、アッセイ系に存在する第X因子をFXaに活性化する。その活性は、限定的ファクターであるFIXの量に直接相関した。生成されたFXaを、FXa色素生成基質(pNA)での特異的活性により測定した。生成されたpNAの量は、FIXa活性に直接比例する。rhFIX、ヒト血漿およびMOD−3012を系列希釈して用量反応曲線を比較することにより、効能を評価した(図9)。rhFIXの平均EC50は、68.74ng/mlであり、MOD−3012の計算されたEC50は、505ng/mlであった。MOD−3012の酵素活性は、組換えFIXに対比して約7倍の低下が観察され、プールヒト正常血漿に対比して16.5倍の低下が観察された。この低下した活性は、N−末端分析により同定されたN−末端プロペプチドの不適切な開裂により説明することができた。
【0224】
FIX凝血活性(aPTT)
【0225】
活性化部分トロンボプラスチン時間(aPTT)は、凝固カスケードの内因系および共通系経路の統合性の指標である。aPTTは、内因系経路活性化剤、リン脂質およびカルシウムの添加の後、血漿が凝血するまでの時間(秒単位)である。
【0226】
そのアッセイでは、rhFIXの添加により、FIX欠失ヒト血漿の凝血活性を回復させるMOD−3012タンパク質の能力を定量した。FIX欠損ヒト血漿300μlを、rhFIX、MOD−3012(FIX−CTP−CTP(CTPがC−末端にタンデムにつながっている))、またはプールヒト正常血漿100μlと混合して、更に希釈した。37℃で60秒間インキュベートした後、組織因子(TF)、CaCl2、およびリン脂質を混合物に添加した。秒単位の凝血時間を測定した。MOD3012の用量反応曲線を、rhFIXまたはヒト血漿からなる参照調製物に比較することにより、効能を評価した。FIX活性の1単位を、ヒト正常血漿1mlの活性と等しいFIX量として定義した。
【0227】
MOD3012の凝固活性が、プールヒト正常血漿よりもわずか1.4小さく、rhFIXと類似していることが、表示されたaPTT結果から示される(図10)。aPTTの結果をインビトロアッセイでの色素生成活性と合わせると、MOD−3012精製が、活性を損なわなかったことが示唆される。
【0228】
MOD3012の薬物動態活性
【0229】
精製MOD3012、rhFIX(アメリカン・ダイアグノスティックス)ならびにMOD3012およびMOD3011(FIX−CTP)を含むハーベストを、スプラグー・ドーリー・ラット(8匹/物質)に用量100μg/kg体重で、単回の静脈内注射で投与した。
【0230】
【表7】

【0231】
血液試料を、投与の0.083、0.5、2、4、7、10、24、48、および72時間後に、4匹ずつ交替で後眼窩から採取した。採取後直ちにクエン酸血漿(0.32%)を調製して、分析まで−20℃で貯蔵した。ヒトFIX Elisaキット(アフィニティー・バイオロジカルズ)を用いて、FIX濃度を定量した。各タンパク質ごとに薬物動態プロファイルを、各時間での動物4匹の平均値として計算した(図11)。最終半減期を、PKソルーション2.0ソフトウエアを用いて計算した。表3は、異なる採取時間で観察されたFIX濃度をまとめている。PKパラメータの要約を、表4にもまとめる。
【0232】
【表8】

【0233】
【表9】

【0234】
MOD−3012ハーベストは、MOD3011ハーベストに比較して、改善されたPKプロファイルを示した。更に、精製MOD−3012は、rhFIXに比較して、T1/2β値の3倍増加およびAUCの4.5倍増加を示した。
【0235】
1個のCTPの融合物に対比して、2個のCTP分子をタンデムに融合した分泌FIX量が低値であったのは、余分なCTPの付加によるものであり、ELISAによる検出量の低下のためではないと思われる。この仮説は、ブラッドフォードアッセイでの精製MOD−3012計算濃度が、得られたELISA計算濃度と類似していることに基づいている。
【0236】
MOD3012凝血活性は、プールヒト血漿と類似していたが、インビトロ色素生成活性は、rhFIXまたはプールヒト血漿に比較して有意に低かった。色素生成活性アッセイは、凝固アッセイに比較して、非常に感度の高いアッセイであると報告されている。MOD3012の活性低下の原因は、様々であろう。CTPの付加によりFIXaへの親和力が低下したか、または翻訳後修飾が低減した(例えば、12−10個のGLA残基およびプロペプチドの開裂)。N−末端分析により、MOD−3012プロペプチドのタンパク質分解開裂が、分泌前に完全に終了していないことが明らかとなった。この翻訳後修飾は、タンパク質の正常な酵素活性にとって重大であるため、フリン−PACEプラスミドとのコトランスフェクションは好適であり、MOD3012活性を向上させる可能性がある。
【0237】
最後に、ラットにおけるMOD−3012のPK比較試験で、FIXのC−末端への2個のタンデムなCTPの融合が、半減期の長いFIXを生成することを実証した。MOD−3012のPK特性をFIX−FCまたはFIX−FP(拮抗する組換えタンパク質;以下の表5)に比較すると、MOD3012が、FIX−FPに比較して向上したT1/2を有するが、FIX−FCに比較すると低いT1/2を有することが示される。
【0238】
【表10】

【0239】
FIX欠失マウスモデル
【0240】
インビボ活性モデルを評価するために、FIXノックアウトマウスを得て、繁殖コロニーを確立した。市販の組換えhFIX(ベネフィックス(Benefix))またはrFIX−(CTP)2(MOD−3012)のいずれか10μgを、麻酔を施したFIXノックアウトマウス(22〜28g)の尾静脈に注射した。注射されたタンパク質の量は、正常な血漿の必要なFIX濃度と等しい(5μg/ml)。血液試料を、特定の時間に、剃毛した尾からへパリン付加キャピラリーチューブに採取した。血漿試料を、ELISAによりFIXレベルについて評価し、有効性をaPTT凝固アッセイにより測定した。
【0241】
FIXプロペプチド開裂有効性の上昇:CTPペプチドのcDNAを、ヒトFIX cDNAの3’末端に融合した。対応するrFIXおよびフリン発現構造体を、Dg44細胞にコトランスフェクトして、ヒトrFIX cDNAも、対照としてフリンプラスミドとコトランスフェクトした。細胞内のフリンプロテアーゼ量が限定されているため、高レベルのFIXが分泌されると、前駆因子と成熟因子FIXとの混合物の分泌が誘導される。フリン発現ベクターと前駆因子発現ベクターとのコトランスフェクションにより、回収量が増加して、完全に処理されたFIXが培地に分泌されるようになる。
【0242】
FIX−(CTP)2とフリンとのコトランスフェクションに続いて、安定したクローンを生成させて、プロペプチドの開裂評価のためにハーベストを回収する。プレシジョン・プラス・デュアル・カラー・プロテイン・マーカー(バイオ・ラッド)を用いて、タンパク質100ngを、12%トリス−グリシンゲルに負荷した。抗ヒトFIXポリクローナル抗体(アメリカン・ダイアグノスティックス)および抗プロペプチドポリクローナル抗体を用いたウェスタン免疫ブロットにより、SDS−PAGE分析を実施した。過去に報告された通り、rhFIXは55KDaに移動し、2個のCTPに融合されたFIXは75KDaに移動した。FIX−タンパク質のバリアントは両者とも、適切で完全なプロペプチド開裂を受けたことが示される。
【0243】
適切なプロペプチド開裂が、FIX−(CTP)2酵素活性を向上させるか否かを決定するために、フリンとコトランスフェクトされたFIX−(CTP)2ハーベストの色素生成活性と凝固活性との比較評価を実施する。FIX−(CTP)2特異的活性の有意な向上が観察され、それがrhFIXと類似していることが観察された。
【0244】
結論として、本明細書に記載された結果から、MOD−3012が、血友病B患者の処置に効率的に用いられうることが示唆される。CTP構造体に融合されたFIXは、特定のインビトロ測定での欠点を克服する、インビボ薬理学的性能の向上により有益である。この提案された処置は、注入速度に関してこれまでの処置よりも有利であり、必要な用量が低減される。
【0245】
アルブミン融合分子の方策を用いてFIX半減期を向上させた(延長させた)場合に、組換えFIXが不活性になったことに留意することが重要である。本発明の新規アプローチを用いれば、向上させた長期持続性活性を示す新規な組換えFIX融合タンパク質の設計および精製がもたらされる。これまで、サイズの改変だけでは、注入FIXの薬物動態は向上しなかった。FIXに融合されたCTPが薬物動態パラメータを促進するという結果は、予期されなかった。高グリコシル化ペプチドのシアル酸残基の存在により、タンパク質が安定化し、FIX機能の重要な決定因子を抑制せずに、それと血管受容体と相互作用が予防された。
【0246】
FIX−CTPは、血友病B患者においてrFIXと類似の治療有効性を有し、必要な投与頻度を低減する。FIX−CTPの単回注射により、出血エピソードが十分に抑制されること、および血友病B患者の外科的介入の際に必要となる注射頻度が低減することも考えられる。
【0247】
実施例2
【0248】
[凝固因子FVIIの生成および使用]
【0249】
組換え第VIIa凝固因子(ノボセブン(NovoSeven))(FVIIa)は市販されており、血友病患者の出血エピソードを阻害剤で処置するために1996年に認可された。しかしrFVIIaは、重大な欠点を有しており、つまりrFVIIaは、最終半減期2,5時間で急速に消失された。その結果、患者は一般に、軽度〜中等度の出血の後、適切な止血を遂げるためには、複数回の頻繁な点滴を必要とした(2〜3時間間隔で2〜3回投与)。
【0250】
本明細書では、半減期の長い組換えFVIIa−CTP分子の生成は、記載された通り、ヒトCTPへのFVIIaの融合に基づいている。組換えFVIIa−CTPを哺乳類細胞で発現させて、インビトロおよびインビボで特徴づけた。rFVII−CTP活性がrFVIIと同等であることが実証され、ラットにおける薬物動態および有効性試験により、rFVIIa−CTPの改善された特性が実証された。この試験結果から、野生型酵素と非常に類似した止血性を有する半減期の長いrFVIIa分子の開発が実現可能であることが実証された。
【0251】
組換えFVII分子のクローニングおよび発現:複数の第VII因子のクローンを、我々の真核生物発現ベクター(pCI−dhfrr)内に構築した(図1)。ヒト第VII凝固因子の配列を含むヒトMGC検査済みFL cDNAクローン(IRCM)を、オープンバイオシステムズ(Open Biosystems)(OB−MHS4426)から取り寄せた。以下のプライマーは、以下の配列でシグマ・ジェノシス(Sigma-Genosys)により合成された;プライマー67:5’CTCGAGGACATGGTCTCCCAGGCCC3’(第VII因子DNAの5’末端およびXhoIの制限部位を含む)(配列番号5);プライマー68R:5’TCTAGAATAGGTATTTTTCCACATG3’(XbaIの制限部位を含む)(配列番号6);プライマー69:5’TCTAGAAAAAAGAAATGCCAGC3’(XbaIの制限部位を含む)(配列番号7);およびプライマー70R:5’GCGGCCGCATCCTCAGGGAAATGGGGCTCGCA3’(第VII因子DNAの3’末端およびNotIの制限部位を含む)(配列番号8)。
【0252】
2組のPCR反応において、クローニングを実施した。最初の反応は、プライマー67およびプライマー68Rを用いて実施し、第VII因子配列を含むcDNAプラスミド(OB−MHS4426)をテンプレートとして用い、PCR増幅の結果、約534bpの生成物が形成され、それを単離して、TAクローニングベクター(インビトロジェン、カタログ番号 K2000−01)に連結させた。第VII因子配列のアミノ末端を含むXhoI−XbaIフラグメントを単離した。第二の反応は、プライマー69およびプライマー70Rを用いて実施し、同じく第VII因子配列を含むcDNAプラスミド(OB−MHS4426)をテンプレートとして用い、PCR増幅の結果、約813bpの生成物が形成され、それをTAクローニングベクター(インビトロジェン、カタログ番号 K2000−01)に連結させた。第VII因子配列のカルボキシ末端を含むXbaI−NotIフラグメントを単離した。2個のフラグメントを我々の真核生物発現ベクターpCI−dhfrに挿入して(トリプルライゲーション)、501−0−p136−1クローンを生成させた。
【0253】
プラスミド501−p136−1(pCI−dhfrベクター内の第VII因子)を、制限酵素XhoIおよびKpnIで消化した。約1186bpのフラグメントを単離した。部分的な第VII因子クローン(1180bp〜1322bp)に続くCTP配列、末端配列、およびジーンアート(GeneArt)により合成されたNotI配列(0721543)を、制限酵素KpnIおよびNotIで消化した。約253bpのフラグメントを単離した。2個のフラグメントを我々の真核生物発現ベクターpCI−dhfrに挿入して(トリプルライゲーション)、501−1−p137−2クローンを生成させた。pCI−dhfr−701−2−p24−2を、制限酵素XhoIおよびApaIで消化して、大きなフラグメント(ベクター)を単離した。
【0254】
pCI−dhfr−501−2−p137−2(第VII因子−ctp×1)を、制限酵素XhoIおよびApaIで消化して、約1200bp挿入物を単離した。ベクターと挿入物とを連結させて、501−2−p139−2を生成させた。Dg44細胞を100mm組織培養皿に添加して、50〜60%コンフルエンスになるまで増殖させた。無タンパク質培地(インビトロジェン CD Dg44)中のヒュージーン試薬(ロッシュ)を用いた100mmプレート 1枚のトランスフェクションに、合計2μgのDANを用いた。トランスフェクションの48時間後に培地を除去して、ヌクレオシドを含まない無タンパク質培地(インビトロジェン CD Dg44)と交換した。14日後に、トランスフェクトされた細胞集団をT25組織培養フラスコに移して、細胞が安定したクローンとして十分に増殖し始めるまで、10〜14日間、選別を継続した。高発現クローンを選別し、細胞 約2×107個を用いて、ビタミンK3 5ng/ml(メナジオン重硫酸ナトリウム;シグマ)を補足した1700cm2丸底フラスコ(コーニング、コーニングNY)内の増殖培地300mlに播種した。細胞生存性が約70%に急速低下した後、生成培地(ハーベスト)を回収した。生成培地を、最初、透明化させ、その後、約20倍に濃縮し、流動ろ過カセット(10KDaMWCO、ミリポア社、マサチューセッツ州ビレリカ)を用いて、PBSで透析した。
【0255】
FVII抗原レベルの測定
【0256】
CTPペプチドをコードするcDNAを、ヒトFVIIをコードするcDNAの3’末端に融合した。対応するrFVII構造体を、Dg44細胞にトランスフェクトした。対照として、ヒトrFVII cDNAを用いた。生成培地(ハーベスト)を回収し、濃縮して、分泌された組換えFVIIを更に評価した。rFVII、rFVII−CTPおよびrFVII−CTP−CTPの抗原レベルを、アッセイマックスヒトFVII ELISAキット(アッセイプロ)により測定した(図2A)。rFVII−CTPおよびrFVII−(CTP)2の分泌レベルは、天然型rFVIIに比較して、有意差が存在しなかった。
【0257】
SDS−PAGEブロット
【0258】
ハーベスト、精製また活性化されたrFVIIタンパク質のいずれか50ngを負荷することにより、SDS−PAGE分析を実施した。プレシジョン・プラス・デュアル・カラー・プロテイン・マーカー(バイオ・ラッド)を用いて、試料を12%トリス−グリシンゲルに負荷した。抗ヒトFVIIモノクローナル抗体(R&Dシステムズ)またはウサギで生成された抗−CTPポリクローナル抗体を用いたウェスタン免疫ブロットを実施することにより、SDS−PAGE分析を実施した。
【0259】
rFVII抗原レベルは、抗FVIIAbを免疫ブロットされたSDS−PAGEで検出されたタンパク質レベルと相関した。rFVII−CTPは単一バンドとして移動し、FVII対照の対応する分子量は約52KDaであり、両者のタンパク質は免疫ブロットでFVIIに特異的な抗体と反応した。rFVII−CTPは、CTPに特異的な抗体とも反応した。rFVIIは、活性化タンパク質を全く含まないチモーゲン形態で分泌された。
【0260】
FVII色素生成活性:
【0261】
市販の色素生成キット(アッセイセンス・ヒトFVII色素生成活性アッセイキット(AssaySense Human FVII chromogenic Activity assay kit)(アッセイプロ))を用いて、rFVII、rFVII−CTPおよびrFVII−(CTP)2ハーベストの活性を測定した。rFVII−CTPおよび更に活性化された(FVIIa)の能力を機能的に特徴づけるために、第X因子を第Xa因子に活性化してFXa特異性基質の存在下で定量シグナル(アッセイプロ)を放出する、TF/FVIIaの能力を測定するための市販の色素生成検査キットに、濃縮されたrFVII−CTP(ハーベスト)を添加した。rFVIIタンパク質のC−末端にCTPペプチドを付加しても、セリンプロテアーゼ活性は損なわれなかった(図2B、C)。
【0262】
FVII凝血活性:
【0263】
プロトロンビン時間(PT)は、凝固の外因系経路を測定する。PTは、外因系経路の活性化剤、リン脂質およびカルシウムの添加後に血漿が凝結するまでにかかる時間(秒で測定)である。具体的にはワルファリン投与量、肝障害、およびビタミンK状態の指標として、血液の凝血傾向を測定するのに、それが用いられる。プロトロンビン時間の参照範囲は通常、約12〜15秒である。具体的には、そのアッセイでは、rhFVIIの添加により、FVII欠失ヒト血漿の凝血活性を回復させるFVII−CTPおよびFVII−(CTP)2ハーベストの能力を定量した。FVII欠損ヒト血漿300μlを、特定の濃度のFVII、FVII−CTPおよびFVII−(CTP)2ハーベスト、またはプールヒト正常血漿100μlと混合して、更に希釈した。37℃で60秒間インキュベートした後、組織因子(TF)、CaCl2、およびリン脂質を混合物に添加した。秒数の凝血時間を測定した。FVII−CTPおよびFVII−(CTP)2ハーベストの用量反応曲線を、rhFVIIまたはプールヒト血漿からなる参照調製物に比較することにより、効能を評価した。活性FVIIの1単位を、ヒト正常血漿1mlの活性と等しいFVIIの量と定義した。rFVIIおよびrFVII−CTPのPT凝血活性を、コアグロメータ(インストゥルメンテーション・ラボラトリー(Instrumentation Laboratory))で測定した。
【0264】
これまで示された通り、rFVIIタンパク質のC−末端でのCTPペプチドの付加は、セリンプロテアーゼ活性を損なわず、ヒト血漿中の天然型第X因子および第IX因子の始動および活性化を誘導した。C−末端の更なるCTPにより、セリンプロテアーゼの3倍低下が観察された(図2D)。
【0265】
薬物動態試験:rFVII、rFVII−CTP、およびrFVII−(CTP)2ハーベストを、スプラグー・ドーリー・ラット(6匹/物質)に用量100μg/kg体重で静脈内投与した。インビボ実験全てで、各タンパク質の量を、FVIIElisaキットに基づいて測定した。rFVII−CTPに対するrFVIIの分子量の差を考慮して異なるモル濃度を誘導することにより、各FVII被験物質ごとに注射量を計算した。
【0266】
試料採取手順により定量されるレベルが妨害されるのを最小限に抑えるために、交替での試料採取スキームを利用して、つまり30分後、90、2、6および48時間後にラット3匹から、そして15、60分後、および1.5、4、24時間後に残りの3匹から交替で、血液試料を後眼窩から採取した。試料採取後直ちに血漿を調製して、分析まで−20℃で貯蔵した。FVII濃度を、FVII Elisa特異性アッセイにより定量した。線形台形公式を用いて、半減期および曲線下面積(AUC)を計算した。これらのクリアランスパラメータの比較により、インビボ半減期およびrFVII−(CTP)2 AUCが、rFVIIのものよりも有意に高いことが明らかとなった(表8)。
【0267】
【表9】

【0268】
組換えFVIIa−CTPの特徴づけ:
【0269】
FVIIは、活性化の際にR152で開裂されて、1本のジスルフィド架橋により連結された重鎖および軽鎖ドメインを生じる。rFVIIa−(CTP)2を精製して、イオン交換カラム精製法により活性化させる。rFVIIa−(CTP)2を完全に評価するために、市販のFVIIa(ノボセブン(登録商標))へ換算する(reducing)条件下で、タンパク質をSDS−PAGEに負荷する。重鎖および軽鎖ドメインは分離して、分子量55KDaおよび25KDaの別個のバンドとして移動する。両方のタンパク質は、FVIIに特異的な抗体と反応するが、rFVIIa−CTPの重鎖は、抗CTP特異性抗体と反応するため、このバンドが、CTPに融合されたFVII重鎖を表すことが示される。軽鎖は、抗γ−カルボキシラーゼAbと特異的に反応する。FVIIa特異性Elisaキットにより、FVIIaタンパク質濃度を測定する。
【0270】
FVIIaのN−末端配列決定
【0271】
活性化またはチモーゲン精製されたタンパク質中のrFVIIa−CTP−CTPを、SDS−PAGE(12%トリス−グリシンで)により分離し、続いてPVDF膜にエレクトロブロットする。該当するバンドを切り出して、精製されたバイオブレーン処理のガラス繊維フィルター上に載せる。140C HPLCマイクログラジエントシステムを具備したパルス液相プロテインシーケンサーを用いて、エドマン分解によりN−末端配列分析を実施する。N−末端配列決定により、組換えタンパク質および適切なプロペプチド開裂の同定を、更に検証する。
【0272】
FVIIa凝血活性:
【0273】
rFVIIa−(CTP)2凝固活性を評価するために、活性化部分トロンボプラスチン時間アッセイ(aPTT)を実施する。FVIII欠損血漿試料に代えてrFVIIa(ノボセブン)またはrFVIIa−(CTP)2を用い、FVII欠損ヒト血漿300μlを、特定の濃度のFVIIaもしくはFVIIa−(CTP)2、またはプールヒト正常血漿 100μlと混合して、更に希釈した。37℃で60秒間インキュベートした後、組織因子(TF)、CaCl2、およびリン脂質を混合物に添加する。秒数の凝血時間を測定する。rFVIIa−(CTP)2の用量反応曲線を、rhFVIIaまたはプールヒト正常血漿からなる参照調製物に比較することにより、効能を評価する。FVIIaの1単位を、ヒト正常血漿1mlの活性と等しいFVIIaの量と定義した。rFVIIおよびrFVIIa−(CTP)2のaPTT凝血活性を、コアグロメータ(インストゥルメンテーション・ラボラトリー)で測定する。rFVIIaとrFVIIa−(CTP)2のaPTT凝血活性は、類似している。
【0274】
ラットにおける薬物動態試験:
【0275】
長期作用能力(longevity potential)に対する、rFVIIaへのCTP付加の影響を特徴づけるために、ラットにおける薬物動態の比較試験を実施する。TBS中のノボセブン(rFVIIa)およびrFVIIa−(CTP)2を、SDラット6匹にIV注射する。FVIIa Elisaキットを用いて、FVIIaの経時的レベルを検出する。半減期およびAUCを、各タンパク質ごとに計算する。これらのクリアランスパラメータの比較により、rFVIIa−(CTP)2の半減期、回収率、およびAUCのインビボ測定値が、ノボセブンのそれらよりも優れていることが明らかとなる。
【0276】
FVIIa−CTPのインビボ有効性モデル:
【0277】
rFVIIa−(CTP)2のインビボ活性を評価するため、凝固因子のGlaドメインのビタミンK依存性γ−カルボキシル化を阻害するためにSDラット6匹をフェンプロクモンで処置する。FVIIIの半減期は短いため、天然型FVIIIは、他のビタミンK依存性凝固因子よりも急速に枯渇される。16時間後に、FVIII活性が、ほぼ完全に枯渇されたことが示される。この時点で、FVIIaを外部から添加すれば、ラットにおける凝血時間の低減が修正される。ノボセブンとrFVIIa−(CTP)2とを比較するために、同じ用量の両タンパク質を、フェンプロクモン処置の16時間後にラットに注射する。ラット血液の凝血時間は、両方の組換えタンパク質により正常値に修正される。つまり、両タンパク質は、このモデルにおいて同等の効果を示す。
【0278】
別々の実験で、ノボセブンおよびrFVIIa−(CTP)2を、フェンプロクモン処置後直ちに注射するが、凝固パラメータは16時間後に測定する。ノボセブンは、半減期が短いため、凝固時間をこれらの条件下で修正しない。それとは逆に、rFVIIa−(CTP)2で処置された動物の凝血時間は、健常対照の値の近似値に修正される。これは、rFVIIa−(CTP)2が依然として存在し、より長期間経過した後も生物活性を保持することを示している。更に、CTP修飾rFVIIaを用いることの大きな利益が、このデータから確認される。FIX欠失マウスモデル(未だ実施していない):
【0279】
FVIII血友病マウスモデル:
【0280】
インビボ活性モデルを評価するために、FVIIノックアウトマウスを得て、繁殖コロニーを確立する。市販の組換えhFVIIa(ノボセブン)またはrFVIIa−(CTP)2のいずれか10μgを、麻酔を施したFVIIIノックアウトマウス(22〜28g)の尾静脈に注射する。注射されたタンパク質の量は、正常血漿の必要なFVIII濃度と等しい(5μg/ml)。血液試料を、特定の時間に、剃毛された尾からへパリン付加キャピラリーチューブに採取する。血漿試料を、ELISAによりFVIIaレベルについて評価し、有効性をaPTT凝固アッセイにより測定する。
【0281】
この試験では、FVIIとCTPとの融合構造体を生成させる。この組換えタンパク質は、長い半減期と適切で好ましい治療的効能の持続とを提供する処置の主薬である。
【0282】
これらの結果から、rFVIIa−(CTP)2が、血友病患者のrFVIIaと類似の治療有効性を有することが示唆される。その上、このテクノロジーは、必要とする投与頻度を低減する。rFVIIa−(CTP)2の単回注射が、出血エピソードを十分に制御し、外科的介入の際に必要となる注射の頻度を低減すると考えられる。この組換えタンパク質は、長期予防的処置として用いられる可能性がある。
【技術分野】
【0001】
(関連出願の相互参照)
本願は、米国特許仮出願番号第61/224,366号からの優先権を主張するものである。
【0002】
(技術分野)
凝固因子のC−末端(カルボキシ末端)に結合した少なくとも1個の絨毛性ゴナドトロピンのカルボキシ末端ペプチド(CTP)を含むポリペプチドおよびそれをコードするポリヌクレオチドが、開示される。本発明のポリペプチドおよびポリヌクレオチドを含む医薬組成物、ならびにそれらを使用する方法も、開示される。
【背景技術】
【0003】
ポリペプチドは、血液、肝臓または腎臓において変性または酵素分解を受け易い。したがってポリペプチドは、典型的には数時間という短い循環半減期を有する。安定性が低いので、ペプチド薬は通常、頻繁な送達を持続することで、活性ペプチドの効果的血漿濃度を保持する。その上、ペプチド薬は通常、点滴により投与されるため、ペプチド薬の頻繁な注射により、対象に少なからぬ不快感を誘発させる。つまり、治療的ポリペプチドの高い薬理学的有効性を保持しながら、その半減期を延長させる技術が求められている。そのような所望のペプチド薬は、対象に注射した場合に、血清安定性が高く、活性が高く、不適当な免疫反応誘導の確率が低い、という要件にも適合していなければならない。
【0004】
好ましくない薬物動態性、例えば、血清半減期が短いことが、他の多くの有望な薬物候補の医薬品開発を妨害する可能性がある。血清半減期は、分子の経験的特性であり、それぞれの新規な潜在的薬物で実験的に決定しなければならない。例えば、低分子量ポリペプチド薬では、必要となる投与レジメンの経費または頻度が原因で、生理学的なクリアランスメカニズム、例えば、腎臓によるろ過により、薬物の治療レベルの維持が実行できない可能性がある。それとは逆に、薬物またはその代謝産物が毒性副作用を有する場合には、血清半減期が長いことは不適当である。
【発明の概要】
【課題を解決するための手段】
【0005】
一実施形態において、本発明は、凝固因子と、凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端(CTP)ペプチドとからなるポリペプチドを提供する。
【0006】
別の実施形態において、本発明は更に、凝固因子と、凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端(CTP)ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。
【0007】
別の実施形態において、本発明は更に、1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドを、凝固因子のカルボキシ末端に結合させ、それにより凝固因子の生物学的半減期を向上させる(延長させる)ステップを含む、凝固因子の生物学的半減期を延長させる方法を提供する。
【0008】
別の実施形態において、本発明は更に、1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドを、凝固因子のカルボキシ末端に結合させ、それにより凝固因子の曲線下面積(AUC)を向上させる(増大させる)ステップを含む、凝固因子の曲線下面積(AUC)を増大させる方法を提供する。
【0009】
別の実施形態において、本発明は更に、1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドを、凝固因子のカルボキシ末端に結合させ、それにより凝固因子の投与頻度を低減するステップを含む、凝固因子の投与頻度を低減する方法を提供する。
【0010】
別の実施形態において、本発明は更に、凝固因子と、凝固因子のカルボキシ末端に結合した1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、必要とする対象に提供し、それにより凝固因子療法の利用における服薬遵守を向上させることを含む、凝固因子療法の利用における服薬遵守を向上させる方法を提供する。
【図面の簡単な説明】
【0011】
【図1】rFVII−CTP構造体(A)、rFVII−CTP−CTP構造体(B)、rFIX−CTP構造体(C)、およびrFIX−CTP−CTP構造体(D)を示す図である。
【図2A】ビタミンK3 5μg/mlの存在下、FVII−CTPバリアントを用いて限定、および希釈され、クローンをトランスフェクトされ、選別された細胞のハーベストを示す棒グラフである。FVIIのレベルは、FVII ELISA(アッセイプロ(AssayPro))を用いて定量した。
【図2B】ビタミンK3活性 5μgの存在下、FVII−CTPバリアントを用いて限定、希釈、トランスフェクトおよび選別された細胞のハーベストを示す棒グラフである。FVII活性は、FVIIの色素生成活性アッセイ(アッセイプロ)を用いて定量した。
【図2C】ビタミンK3 5μgの存在下、FVII−CTPバリアントを用いて限定、希釈、トランスフェクトおよび選別された細胞のハーベストを示す棒グラフである。FVIIの特異的活性は、各バージョン(version)ごとに、活性値をハーベストのFVIIの濃度で割って計算した。
【図2D】プール(poll)ヒト正常血漿凝固活性に比較した、FVII、FVII−CTPおよびFVII−(CTP)2凝固活性を有する、限定、希釈、トランスフェクトおよび選別された細胞のハーベストを示すグラフである。
【図2E】FVII、FVII−CTP−CTP、およびFVII−CTPハーベストのPKプロファイルを示すグラフである。
【図3A】ビタミンK3 5μg/mlの存在下、FIX−CTPおよびFIX−CTP−CTPバリアントを用いて限定、希釈、トランスフェクトおよび選別された細胞のハーベストを示す棒グラフである。FIXのレベルは、ヒトFIX ELISAキット(アフィニティー・バイオロジカルズ(Affinity Biologicals)、カタログ番号 FIX−AG RUO)を用いて定量したが、計算されたタンパク質濃度(μg/ml)は、2回の独立した実験の平均値である。
【図3B】FIX抗体認識のSDS−PAGEゲル顕微鏡写真を示し、顕微鏡写真Aは、ウエスタンブロットでの抗FIX抗体の認識を示し;顕微鏡写真Bは、ウエスタンブロットでの抗γ−カルボキシル化抗体の認識を示す。A〜Bのレーン1には、組換えFIXを含有する試料を負荷し、A〜Bのレーン2には、FIX−CTPハーベストを含有する試料を負荷した。A〜Bのレーン3には、FIX−(CTP)2ハーベストを含有する試料を負荷した。
【図4】rhFIX(アメリカアン・ダイアグノスティックス(American Diagnostics))に比較した、FIX−CTPおよびFIX−(CTP)2ハーベストの色素生成活性の比較(EC50濃度により測定)を示すグラフである。
【図5】rhFIX(アメリカアン・ダイアグノスティックス)凝固活性に比較した、FIX−CTPおよびFIX−(CTP)2ハーベストの凝固活性を示すグラフである。
【図6】rhFIX、FIX−CTP−CTPのハーベスト、およびFIX−CTPのハーベストのPKプロファイルを示すグラフである。
【図7】ヒトFIX−ELISAキット(アフィニティー・バイオロジカルズ カタログ番号FIX−AG RUO)を用いて測定された、FIX−CTPおよびFIX−CTP−CTPのハーベスト、つまりそれぞれMOD−3011およびMOD−3012のハーベスト、ならびにMOD−3012精製タンパク質のFIX抗原レベルを示す棒グラフであるが、計算されたタンパク質濃度(μg/ml)は、2回の独立した実験の平均値である。
【図8】FIX抗体認識のSDS−PAGEゲル顕微鏡写真を示す。顕微鏡写真Aは、クーマシーブルー染色を示し;顕微鏡写真Bは、ウエスタンブロットでの抗FIX抗体の認識を示し;顕微鏡写真Cは、抗FIX抗体のウエスタンブロットでの抗γ−カルボキシル化抗体の認識を示す。A〜Cのレーン1には、FIX−(CTP)2(MOD−3012)を含有する試料を負荷した。A〜Cのレーン2には、非結合FIX−(CTP)2を含有する試料を負荷した。A〜Cのレーン3には、FIX−(CTP)2(MOD−3012)の濃縮された溶離液を含有する試料を負荷した。
【図9】プールヒト正常血漿およびrhFIX(アメリカン・ダイアグノスチックス)に比較した、MOD3012色素生成活性(試料濃度/O.D.)の比較を示すグラフである。
【図10】プールヒト正常血漿およびrhFIXに比較した、MOD3012凝固活性の比較を示すグラフである。
【図11】精製MOD3012、rhFIX、FIX−CTP−CTPのハーベスト、およびFIX−CTPのハーベストのPKプロファイルを示すグラフである。
【発明を実施するための形態】
【0012】
一実施形態において、本発明は、長期作用性凝固因子、ならびにそれを製造および使用する方法を提供する。別の実施形態において、長期作用性凝固因子は、カルボキシ末端ペプチド(CTP、CTP単位とも呼ばれる)を含む。別の実施形態において、凝固因子を含む長期作用性ポリペプチドは更に、ヒト絨毛性ゴナドトロピン(hCG)のカルボキシ末端ペプチド(CTP)を含む。別の実施形態において、CTPは、凝固因子の分解の防御剤として作用する。別の実施形態において、CTPは、凝固因子のCmaxを高める。別の実施形態において、CTPは、凝固因子のTmaxを増大する。別の実施形態において、CTPは、凝固因子の循環半減期を延長する。幾つかの実施形態において、CTPは、凝固因子の効能を高める。
【0013】
別の実施形態において、1〜10個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の生物学的半減期を向上させる(延長させる)ステップを含む、凝固因子の生物学的半減期を延長させる方法が、本明細書において提供される。別の実施形態において、1〜5個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の生物学的半減期を向上させる(延長させる)ステップを含む、凝固因子の生物学的半減期を延長させる方法が、本明細書において提供される。
【0014】
別の実施形態において、1〜10個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の曲線下面積(AUC)を向上させる(増大させる)ステップを含む、凝固因子の曲線下面積(AUC)を増大させる方法が、本明細書において提供される。別の実施形態において、1〜5個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の曲線下面積(AUC)を向上させる(増大させる)ステップを含む、凝固因子の曲線下面積(AUC)を増大させる方法が、本明細書において提供される。
【0015】
別の実施形態において、本発明の凝固因子は、タンパク質である。別の実施形態において、本発明の凝固因子は、ペプチドである。別の実施形態において、本発明の凝固因子は、ポリペプチドである。別の実施形態において、凝固因子は、酵素である。別の実施形態において、凝固因子は、セリンプロテアーゼである。別の実施形態において、凝固因子は、糖タンパク質である。別の実施形態において、凝固因子は、トランスグルタミナーゼである。別の実施形態において、凝固因子は、不活性チモーゲンである。別の実施形態において、凝固因子は、当業者に公知の任意の凝固因子である。別の実施形態において、凝固因子は、FVIIIである。別の実施形態において、凝固因子は、FVである。別の実施形態において、凝固因子は、第XIII因子である。別の実施形態において、凝固因子は、第X因子である。別の実施形態において、凝固因子は、トロンビンである。別の実施形態において、凝固因子は、フィブリンである。別の実施形態において、凝固因子は、FVIIaである。別の実施形態において、凝固因子は、FVIIである。別の実施形態において、凝固因子は、FIXである。別の実施形態において、凝固因子は、FXである。別の実施形態において、凝固因子は、FXIaである。別の実施形態において、凝固因子は、FXIIである。別の実施形態において、凝固因子は、FXaである。別の実施形態において、凝固因子は、FVaである。別の実施形態において、凝固因子は、プロトロンビンである。別の実施形態において、凝固因子は、トロンビンである。別の実施形態において、凝固因子は、FVである。別の実施形態において、凝固因子は、FXIである。別の実施形態において、凝固因子は、vWFである。別の実施形態において、凝固因子は、FVIIIaである。別の実施形態において、凝固因子は、B−ドメイン欠失FVIII(FVIIIBDD)である。別の実施形態において、凝固因子は、FIXaである。別の実施形態において、凝固因子は、プレカリクレインである。別の実施形態において、凝固因子は、カリクレインである。別の実施形態において、凝固因子は、FXIIaである。別の実施形態において、凝固因子は、フィブリノーゲンである。別の実施形態において、凝固因子は、トロンボモジュリンである。別の実施形態において、凝固因子は、FIIである。
【0016】
別の実施形態において、凝固因子は、糖タンパク質である。別の実施形態において、凝固因子は、ビタミンK依存性糖タンパク質である。別の実施形態において、凝固因子は、ビタミンK非依存性糖タンパク質である。別の実施形態において、凝固因子は、組換えタンパク質である。別の実施形態において、凝固因子は、組換え糖タンパク質である。別の実施形態において、凝固因子は、組換え糖タンパク質FVである。別の実施形態において、凝固因子は、組換えFVIである。別の実施形態において、凝固因子は、組換えFVIIである。別の実施形態において、凝固因子は、FVIIIである。別の実施形態において、凝固因子は、組換えFIXである。別の実施形態において、凝固因子は、組換えFXである。別の実施形態において、凝固因子は、組換えFXIである。別の実施形態において、凝固因子は、組換えFXIIである。別の実施形態において、凝固因子は、組換えFvWである。別の実施形態において、凝固因子は、組換えFIIである。別の実施形態において、凝固因子は、組換えFIXaである。別の実施形態において、凝固因子は、組換えFXIaである。別の実施形態において、凝固因子は、組換えフィブリンである。別の実施形態において、凝固因子は、組換えFVIIaである。別の実施形態において、凝固因子は、組換えFXaである。別の実施形態において、凝固因子は、組換えFVaである。別の実施形態において、凝固因子は、組換えプロトロンビンである。別の実施形態において、凝固因子は、組換えトロンビンである。別の実施形態において、凝固因子は、組換えFVIIIaである。別の実施形態において、凝固因子は、組換えプレカリクレインである。別の実施形態において、凝固因子は、組換えカリクレインである。別の実施形態において、凝固因子は、組換えFXIIaである。別の実施形態において、凝固因子は、任意の公知組換え凝固因子である。別の実施形態において、シグナルペプチドを含む凝固因子が、任意の公知組換え凝固因子である。別の実施形態において、凝固因子は、C末端に結合した1〜10個のCTPリピートを含み、N−末端に結合したCTPは含まない。別の実施形態において、シグナルペプチドを含む凝固因子は、任意の公知組換え凝固因子である。別の実施形態において、凝固因子は、C末端に結合した少なくとも1個のCTPを含み、N−末端に結合したCTPは含まない。別の実施形態において、C末端に結合した1〜10個のCTPリピートを含み、N−末端に結合したCTPを含まない凝固因子が、加工(engineered)凝固因子である。別の実施形態において、C末端に結合した少なくとも1個のCTPを含み、N−末端に結合したCTPを含まない凝固因子が、加工凝固因子である。別の実施形態において、C末端に結合した1〜10個のCTPリピートを含み、N−末端に結合したCTPを含まない凝固因子が、コンジュゲート化凝固因子である。別の実施形態において、C末端に結合した少なくとも1個のCTPを含み、N−末端に結合したCTPを含まない凝固因子が、コンジュゲート化凝固因子である。
【0017】
別の実施形態において、FIX、FVII、第X因子、プロテインCおよびプロトロンビンのドメイン構成と類似または同一のドメイン構成を含む凝固因子。別の実施形態において、凝固因子は、N−末端プロペプチドを含む前駆体として合成される。別の実施形態において、本明細書で用いられる凝固因子は、不活性プロ酵素形態である。別の実施形態において、凝固因子は、肝細胞中で産生される。別の実施形態において、凝固因子は、グルタミン酸(Glu)をγ−カルボキシグルタミン酸(Gla)に変換するγ−カルボキシラーゼのドッキング部位を含む。別の実施形態において、本明細書で用いられる凝固因子は、市販の凝固因子である。
【0018】
別の実施形態において、第VII因子のアミノ酸配列は、以下のアミノ酸配列を含む:
【0019】
【化1】

【0020】
別の実施形態において、第VII因子のアミノ酸配列は、以下のアミノ酸配列を含む:
【0021】
【化2】

【0022】
別の実施形態において、第VII因子をコードする核酸配列は、以下の核酸配列を含む:
【0023】
【化3】

【0024】
別の実施形態において、第VII因子−CTP(カルボキシ末端に結合)をコードする核酸配列は、以下の核酸配列を含む:
【0025】
【化4】

【0026】
別の実施形態において、第VII因子−CTP(カルボキシ末端に結合)のアミノ酸配列は、以下のアミノ酸配列を含む:
【0027】
【化5】

【0028】
別の実施形態において、第VII因子−CTP−CTP(カルボキシ末端に結合)をコードする核酸配列は、以下の核酸配列を含む:
【0029】
【化6】

【0030】
別の実施形態において、第VII因子−CTP−CTP(カルボキシ末端に結合)のアミノ酸配列は、以下のアミノ酸配列を含む:
【0031】
【化7】

【0032】
別の実施形態において、第IX因子をコードする核酸配列は、以下の核酸配列を含む:
【0033】
【化8】

【0034】
別の実施形態において、第IX因子のアミノ酸配列は、以下のアミノ酸配列を含む:
【0035】
【化9】

【0036】
別の実施形態において、第IX因子−CTP(カルボキシ末端に結合)をコードする核酸配列は、以下の核酸配列を含む:
【0037】
【化10】

【0038】
別の実施形態において、第IX因子−CTP(カルボキシ末端に結合)のアミノ酸配列は、以下のアミノ酸配列を含む:
【0039】
【化11】

【0040】
別の実施形態において、第IX因子−CTP−CTP(カルボキシ末端に結合)をコードする核酸配列は、以下の核酸配列を含む:
【0041】
【化12】

【0042】
別の実施形態において、第IX因子−CTP−CTP(カルボキシ末端に結合)のアミノ酸配列は、以下のアミノ酸配列を含む:
【0043】
【化13】

【0044】
別の実施形態において、フリンが、本発明の凝固因子−CTPを発現する細胞に添加される。別の実施形態において、フリンは、細胞内で本発明の凝固因子−CTPの産生効率を上昇させる。別の実施形態において、フリンは、本発明の凝固因子−CTPのコーディング配列を含むベクターとコトランスフェクトされる。別の実施形態において、フリンは、別個のベクターによりコードされる。別の実施形態において、フリンおよび凝固因子−CTPは、1つのベクターによりコードされる。別の実施形態において、フリンのコーディング配列が、pCI−DHFRに挿入される。別の実施形態において、フリンのコーディング配列は、pCI−dhfr/smaI+NotI、フリン/AsisI F.I.+NotI内で加工される。
【0045】
別の実施形態において、フリンをコードする核酸配列は、以下の核酸配列を含む:
【0046】
【化14】

【0047】
【化15】

【0048】
別の実施形態において、フリンのアミノ酸配列は、以下のアミノ酸配列を含む:
【0049】
【化16】

【0050】
幾つかの実施形態において、用語、凝固因子は更に、凝固活性を有する公知の凝固因子の相同物を包含する。幾つかの実施形態において、本発明による相同性は、そのアミノ酸置換をはじめとする欠失、挿入、または置換バリアント、およびその生物活性ポリペプチドフラグメントも包含する。
【0051】
別の実施形態において、本発明は、凝固活性を有する凝固因子の相同物を包含する。別の実施形態において、本発明は、凝固活性を有する本発明に記載された凝固因子の相同物を包含する。別の実施形態において、相同物、例えば、デフォルトパラメータを用いる、米国立生物工学情報センター(National Center of Biotechnology Information)(NCBI)のBlastPソフトウェアを用いて測定すると、凝固因子と少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも87%、少なくとも89%、少なくとも91%、少なくとも93%、少なくとも95%、または更に言えば99%の相同性を有するポリペプチド。
【0052】
別の実施形態において、本発明は、フリンの相同物を包含する。別の実施形態において、相同物、例えば、デフォルトパラメータを用いる、米国立生物工学情報センター(NCBI)のBlastPソフトウェアを用いて測定すると、フリンと少なくとも50%、少なくとも55%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも87%、少なくとも89%、少なくとも91%、少なくとも93%、少なくとも95%、または更に言えば99%の相同性を有するポリペプチド。
【0053】
別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜10個のゴナドトロピンカルボキシ末端(CTP)ペプチドとを含むポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した2〜8個のゴナドトロピンカルボキシ末端(CTP)ペプチドとを含むポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜3個のゴナドトロピンカルボキシ末端(CTP)ペプチドとを含むポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端(CTP)ペプチドとを含むポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端(CTP)ペプチドとからなるポリペプチドが、本明細書において提供される。別の実施形態において、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜5個のCTPとを含むポリペプチドが、本明細書において提供される。別の実施形態において、アミノ末端にCTPを有さない凝固因子を含むポリペプチドが、本明細書において提供される。別の実施形態において、カルボキシ末端に少なくとも1個のCTPを有する凝固因子を含むポリペプチドが、本明細書において提供される。別の実施形態において、カルボキシ末端に少なくとも1個のCTPを有し、アミノ末端にCTPを有さない凝固因子を含むポリペプチドが、本明細書において提供される。
【0054】
別の実施形態において、加工凝固因子が、カルボキシ末端に少なくとも1個のCTPを有する凝固因子を含むポリペプチドである。別の実施形態において、加工凝固因子は、カルボキシ末端に1個のCTPを有する凝固因子を含むポリペプチドである。別の実施形態において、加工凝固因子は、カルボキシ末端に1個のCTPを有する凝固因子からなるポリペプチドである。別の実施形態において、加工凝固因子は、カルボキシ末端にタンデムに結合した2個のCTPペプチドを含む。別の実施形態において、本明細書に記載の加工凝固因子は、生物活性に関して、非CTP修飾凝固因子と同等である。別の実施形態において、本明細書に記載の加工凝固因子は、薬理学的測定、例えば薬物動態および/または薬力学に関して、非CTP修飾凝固因子と少なくとも同等である。
【0055】
別の実施形態において、加工凝固因子は、血友病B患者の処置のための使用に向けられる。別の実施形態において、カルボキシ末端にタンデムにつながった2個のCTPを含む第IX凝固因子(MOD−3012)は、血友病B患者の処置のための使用に向けられる。別の実施形態において、カルボキシ末端に1個のCTPリピートを含む第IX凝固因子(MOD−3011)は、血友病B患者の処置のための使用に向けられる。別の実施形態において、加工凝固因子は、点滴の速度を低下させるか、必要な用量を低減するか、またはその両方を行うことが可能である。
【0056】
別の実施形態において、カルボキシ末端にタンデムにつながった2個のCTPを含む第IX凝固因子(MOD−3012)は、凝固活性とFIX−CTPハーベストまたはrhFIXとの対比を維持しながら、改善されたPKプロファイルを示す。別の実施形態において、カルボキシ末端にタンデムにつながった2個のCTPを含む第IX凝固因子(MOD−3012)は、rhFIXに比較して、半減期の3倍増加およびAUCの4.5倍増加を示す。
【0057】
別の実施形態において、用語「CTPペプチド」、「カルボキシ末端ペプチド」および「CTP配列」は、本明細書において互換的に用いられる。別の実施形態において、カルボキシ末端ペプチドは、完全長CTPである。別の実施形態において、カルボキシ末端ペプチドは、トランケートされたCTPである。各可能性により、本発明の別個の実施形態が表わされる。
【0058】
別の実施形態において、用語、加工凝固因子は、成熟された凝固因子のアミノ酸配列を含む。別の実施形態において、用語、加工凝固因子は、シグナル配列またはシグナルペプチドをはじめとする凝固因子のアミノ酸配列を含む。
【0059】
別の実施形態において、「シグナル配列」および「シグナルペプチド」は、本明細書において互換的に用いられる。別の実施形態において、ポリヌクレオチド分子に関係する場合の「配列」は、コーディング部分を指すことができる。各可能性により、本発明の別個の実施形態が表わされる。
【0060】
別の実施形態において、本明細書に記載された少なくとも1個のCTPを含む加工凝固因子は、少なくとも1個のCTPを含まない同様の凝固因子に比較して、高いインビボ生物活性を有する。
【0061】
幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列が、凝固因子の分解に対する高い防御性を提供する。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、クリアランスに対する高い防御性を提供する。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、長いクリアランス時間を提供する。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、Cmaxを高める。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、Tmaxの増加に対する高い防御性を提供する。幾つかの実施形態において、凝固因子のカルボキシ末端にある少なくとも1個のCTP配列は、T1/2を延長する。
【0062】
別の実施形態において、本発明のコンジュゲート化凝固因子が、修飾されていないコンジュゲート化凝固因子と同様の手法で用いられる。別の実施形態において、本発明のコンジュゲート化凝固因子は、インビボで、循環半減期および血漿滞留時間を増加させ、クリアランスを低減し、そして臨床活性を上昇させる。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子の改善された性質により、このコンジュゲートは、同じ凝固因子の修飾されていない形態よりも少ない頻度で投与される。
【0063】
別の実施形態において、少ない頻度での投与が、患者の服薬遵守の改善をもたらし、処置成果の改善および患者の生活の質の改善へと導く。別の実施形態において、本発明のコンジュゲートの分子量およびリンカー構造を有するコンジュゲートが、従来の凝固因子のコンジュゲートに比較して、改善された効能、改善された安定性、高いAUCレベル、および長い循環半減期を有することが見出された。
【0064】
別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子を含む組成物が、本明細書において提供される。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子を含む医薬組成物が、本明細書において提供される。別の実施形態において、コンジュゲート化凝固因子の治療上の有効量は、処置される状態の厳密な型、処置される患者の状態、および組成物の他の成分などの因子により決定される。別の実施形態において、コンジュゲート化凝固因子の治療上の有効量は、1日1回〜月1回の投与で、50〜500IU/kg体重である。別の実施形態において、コンジュゲート化凝固因子の治療上の有効量は、1日1回の投与で、150〜250IU/kg体重である。別の実施形態において、コンジュゲート化凝固因子を含む医薬組成物は、様々な手法によるヒト患者への投与に効果的な強度で、配合される。
【0065】
別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病に苦しむ対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病の予防的治療に有用であり、つまり出血および関連の合併症の危険性を低下させる。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、外部から投与された凝固因子への阻害抗体を生成するリスクを低下させながら、血友病に苦しむ対象の処置に有用となる。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病に苦しむ対象の処置に有用であり、つまり止血を導入する。
【0066】
別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、過剰な出血もしくは打撲傷を受けた対象、または長いプロトロンビン時間(PT)もしくは部分トロンボプラスチン時間(PTT)を有する対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、出血を起こす後天的状態、例えば、ビタミンK欠乏症または肝臓疾患を有する対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、後天性(他の疾患による)または遺伝性、軽度または重度、永久または一過性である、凝固因子の欠損を有する対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病Aに苦しむ対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、血友病Bに苦しむ対象の処置に有用である。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、慢性疾患、例えば肝臓疾患もしくは癌による;急速に凝血因子を使い果たす急性状態、例えば播種性血管内凝固(DIC)による;またはビタミンK欠乏症もしくはワルファリンのようなビタミンKアンタゴニストでの処置による後天的欠損を有する対象の処置に有用である(第II、VII、IX、およびX因子の産生には、ビタミンKが必要となる)。別の実施形態において、本明細書に記載されたコンジュゲート化凝固因子は、凝血の不均衡を起こす疾患、例えば非限定的に、肝臓疾患、尿毒症、癌、骨髄障害、ヘビ毒への暴露、ビタミンK欠乏症、抗凝固療法、抗凝固ワルファリンの誤飲、複数回の輸血(血液の貯蔵単位は、凝血因子の一部が欠乏する)などに苦しむ対象の処置に有用である。
【0067】
別の実施形態において、本明細書で用いられる対象は、ヒト対象である。別の実施形態において、対象は、ペットである。別の実施形態において、対象は、哺乳類である。別の実施形態において、対象は、家畜である。別の実施形態において、対象は、サルである。別の実施形態において、対象は、ウマである。別の実施形態において、対象は、ウシである。別の実施形態において、対象は、マウスである。別の実施形態において、対象は、ラットである。
【0068】
別の実施形態において、本明細書に記載された[(CTP)n>1−凝固因子]は、カルボキシ末端のペプチド結合を介して少なくとも1個のCTP単位につながり、アミノ末端にはCTPを有さない、完全長凝固因子またはその活性フラグメントを含む。別の実施形態において、本明細書に記載された[(CTP)n>1−凝固因子]は、ペプチド結合を介して少なくとも1個のCTP単位につながり、ペプチド結合を介して更なるCTP単位につながり、アミノ末端にはCTPを有さない、凝固因子またはその活性フラグメントを含む。別の実施形態において、1つの核酸分子が、C−末端に結合した少なくとも1個のCTPを含み、アミノ末端にはCTPを含まない加工凝固因子をコードする。
【0069】
別の実施形態において、CTPは、リンカーを介して凝固因子に結合する。別の実施形態において、CTP配列を凝固因子につなぐリンカーは、共有結合である。別の実施形態において、CTP配列を凝固因子につなぐリンカーは、ペプチド結合である。別の実施形態において、CTP配列を凝固因子につなぐリンカーは、置換されたペプチド結合である。別の実施形態において、CTP配列は、配列番号1および配列番号2に示された配列組から選択されるアミノ酸配列を含む。
【0070】
別の実施形態において、配列番号1は、以下のアミノ酸(AA)配列を含む:DPRFQDSSSSKAPPPSLPSPSRLPGPSDTPIL(配列番号1)。別の実施形態において、配列番号2は、以下のアミノ酸(AA)配列を含む:SSSSKAPPPSLPSPSRLPGPSDTPILPQ(配列番号2)。
【0071】
別の実施形態において、本発明のカルボキシ末端ペプチド(CTP)ペプチドは、ヒト絨毛性ゴナドトロピンのアミノ酸位置112〜145に、配列番号1で示されるアミノ酸配列を含む。別の実施形態において、本発明のCTP配列は、ヒト絨毛性ゴナドトロピンのアミノ酸位置118〜145に、配列番号2で示されるアミノ酸配列を含む。別の実施形態において、同じくCTP配列は、ヒト絨毛性ゴナドトロピンのアミノ酸位置112〜118の任意の位置から開始して、アミノ酸位置145で終結している。幾つかの実施形態において、CTP配列ペプチドは、28、29、30、31、32、33または34のアミノ酸長であり、CTPアミノ酸配列のアミノ酸位置112、113、114、115、116、117または118で開始している。
【0072】
別の実施形態において、CTPペプチドは、本明細書に参照により組み込まれた米国特許第5,712,122号に記載された通り、1〜5個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、1個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、2個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、3個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、4個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、CTPペプチドは、5個の同類アミノ酸置換基が天然型CTPと異なる、絨毛性ゴナドトロピンのバリアントである。別の実施形態において、本発明のCTPペプチドのアミノ酸配列は、天然型CTPのアミノ酸配列またはそのペプチドと少なくとも70%の相同性を有する。別の実施形態において、本発明のCTPペプチドのアミノ酸配列は、天然型CTPのアミノ酸配列またはそのペプチドと少なくとも80%の相同性を有する。別の実施形態において、本発明のCTPペプチドのアミノ酸配列は、天然型CTPのアミノ酸配列またはそのペプチドと少なくとも90%の相同性を有する。別の実施形態において、本発明のCTPペプチドのアミノ酸配列は、天然型CTPのアミノ酸配列またはそのペプチドと少なくとも95%の相同性を有する。
【0073】
別の実施形態において、本発明のCTPペプチドのDNA配列は、天然型ヒトCTPのDNA配列またはそのペプチドと少なくとも70%の相同性を有する。別の実施形態において、本発明のCTPペプチドのDNA配列は、天然型ヒトCTPのDNA配列またはそのペプチドと少なくとも80%の相同性を有する。別の実施形態において、本発明のCTPペプチドのDNA配列は、天然型CTPのDNA配列またはそのペプチドと少なくとも90%の相同性を有する。別の実施形態において、本発明のCTPペプチドのDNA配列は、天然型CTPのDNA配列またはそのペプチドと少なくとも95%の相同性を有する。
【0074】
一実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の少なくとも1個が、トランケートされている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の両方が、トランケートされている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の2個が、トランケートされている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の2個以上が、トランケートされている。別の実施形態において、全ての絨毛性ゴナドトロピンCTPのアミノ酸配列が、トランケートされている。一実施形態において、トランケートされたCTPは、配列番号3の最初の10個のアミノ酸を含む。別の実施形態において、配列番号3は、以下のアミノ酸(AA)配列を含む:SSSSKAPPPSLP。
【0075】
一実施形態において、トランケートされたCTPは、配列番号4の最初の10個のアミノ酸を含む。別の実施形態において、配列番号4は、以下のアミノ酸(AA)配列を含む:SSSSKAPPPSLPSPSRLPGPSDTPILPQ。
【0076】
一実施形態において、トランケートされたCTPは、配列番号4の最初の11個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4の最初の12個のアミノ酸配列を含む。一実施形態において、トランケートされたCTPは、配列番号4または配列番号3の最初の8個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4の最初の13個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4の最初の14個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4または配列番号3の最初の6個のアミノ酸を含む。一実施形態において、トランケートされたCTPは、配列番号4または配列番号3の最初の5個のアミノ酸を含む。
【0077】
一実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の少なくとも1個が、グリコシル化されている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の両方が、グリコシル化されている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の2個が、グリコシル化されている。別の実施形態において、絨毛性ゴナドトロピンCTPのアミノ酸配列の2個以上が、グリコシル化されている。別の実施形態において、全ての絨毛性ゴナドトロピンCTPのアミノ酸配列が、グリコシル化されている。一実施形態において、本発明のCTP配列は、グリコシル化部位を少なくとも1個含む。一実施形態において、本発明のCTP配列は、グリコシル化部位を2個含む。一実施形態において、本発明のCTP配列は、グリコシル化部位を3個含む。一実施形態において、本発明のCTP配列は、グリコシル化部位を4個含む。
【0078】
幾つかの実施形態において、CTP配列の修飾は、より低用量の使用が可能になる点で有利である。幾つかの実施形態において、CTP配列の修飾は、より少ない頻度での投与が可能になる点で有利である。幾つかの実施形態において、CTP配列の修飾は、安全な長期作用効果が可能になる点で有利である。
【0079】
幾つかの実施形態において、本明細書で用いられる「ポリペプチド」、「加工凝固因子」、または「タンパク質」は、天然型ポリペプチド(分解生成物、合成的に合成されたポリペプチド、または組換えポリペプチドのいずれか)およびペプチド模倣薬(典型的には、合成的に合成されたポリペプチド)と、幾つかの実施形態において、凝固因子を含むポリペプチドを、体内でより安定させるか、または細胞への浸透をより可能にする修飾を有する、ポリペプチド類似体であるペプトイドおよびセミペプトイドとを包含する。
【0080】
幾つかの実施形態において、修飾としては、非限定的に、C末端修飾、ポリペプチド結合修飾、例えば、非限定的にCH2−NH、CH2−S、CH2−S=O、O=C−NH、CH2−O、CH2−CH2、S=C−NH、CH=CH、またはCF−CHなど、骨格修飾、および残基修飾が挙げられる。ペプチド模倣薬化合物を調製する方法は、当該技術分野で周知であり、例えば、本明細書に完全に示され、参照により組み込まれる、「Quantitative Drug Design, C.A. Ramsden Gd., Chapter 17.2, F. Choplin Pergamon Press (1992)」に明記されている。これに関する更なる詳細を、本明細書の以下に示す。
【0081】
幾つかの実施形態において、ポリペプチド内のポリペプチド結合(−CO−NH−)が、置換されている。幾つかの実施形態において、ポリペプチド結合は、N−メチル化結合(−N(CH3)−CO−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、エステル結合(−C(R)H−C−O−O−C(R)−N−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、ケトメチレン化結合(−CO−CH2−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、α−アザ結合(−NH−N(R)−CO−)(ここでRは、任意のアルキル、例えばメチルである)、カルバ結合(−CH2−NH−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、ヒドロキシエチレン結合(−CH(OH)−CH2−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、チオアミド結合(−CS−NH−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、オレフィン二重結合(−CH=CH−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、レトロアミド結合(−NH−CO−)により置換されている。幾つかの実施形態において、ポリペプチド結合は、ポリペプチド誘導体(−N(R)−CH2−CO−)(ここでRは、炭素原子上に自然に存在する「ノルマルの」側鎖である)により置換されている。幾つかの実施形態において、これらの修飾は、ポリペプチド鎖に沿った結合のいずれか、および複数の部位(結合2〜3個)で同時に生じる。
【0082】
幾つかの実施形態において、ポリペプチドの天然型芳香族アミノ酸、例えば、Trp、TyrおよびPheが、合成の非天然型の酸、例えばフェニルグリシン、TIC、ナフチルアラニン(Nol)、Pheの環式メチル化誘導体、Pheのハロゲン化誘導体またはO−メチル−Tyrで置換されている。幾つかの実施形態において、本発明のポリペプチドは、修飾アミノ酸を1個以上または非アミノ酸モノマー(例えば、脂肪酸、複合炭水化物)を1個以上含む。
【0083】
一実施形態において、「アミノ酸」または「アミノ酸配列」は、天然由来アミノ酸20種;例えば、ヒドロキシプロリン、ホスホセリンおよびホスホトレオニンをはじめとする、多くはインビボで翻訳後修飾されたそれらのアミノ酸;ならびに非限定的に2−アミノアジピン酸、ヒドロキシルリシン、イソデスモシン、ノルバリン、ノルロイシンおよびオルイニチンをはじめとする他の異常アミノ酸を包含すると理解されたい。一実施形態において、「アミノ酸」は、D−およびL−アミノ酸の両者を包含する。
【0084】
幾つかの実施形態において、本発明のポリペプチドは、可溶性形態である凝固因子を含むポリペプチドを必要とする治療に用いられる。幾つかの実施形態において、本発明のポリペプチドは、ヒドロキシル含有側鎖によりポリペプチドの溶解度を上昇させることが可能な、非限定的にセリンおよびトレオニンをはじめとする非天然または天然型極性アミノ酸を1種以上包含する。
【0085】
幾つかの実施形態において、本発明の加工凝固因子は、直鎖状形態で使用されるが、環化が加工凝固因子の特徴を大きく妨害しない場合には、加工凝固因子の環状形態を使用できることは、当業者に理解されるであろう。
【0086】
幾つかの実施形態において、本発明の加工凝固因子は、例えば、標準の固相技術を用いることにより、生化学的に合成される。幾つかの実施形態において、これらの生化学的方法としては、排他的固相合成(exclusive solid phase synthesis)、部分固相合成、フラグメント縮合、または伝統的な溶液合成が挙げられる。
【0087】
幾つかの実施形態において、組換えタンパク質技術を用いて、本発明の加工凝固因子を生成させる。幾つかの実施形態において、組換えタンパク質技術は、比較的長いポリペプチド(例えば、アミノ酸18〜25個よりも長い)の生成に用いられる。幾つかの実施形態において、組換えタンパク質技術は、本発明の加工凝固因子を多量に生成させるのに用いられる。幾つかの実施形態において、組換え技術は、「Bitter et al., (1987) Methods in Enzymol. 153:516-544」、「Studier et al. (1990) Methods in Enzymol. 185:60-89」、「Brisson et al. (1984) Nature 310:511-514」、「Takamatsu et al. (1987) EMBO J. 6:307-311」、「Coruzzi et al., (1984) EMBO J. 3:1671-1680」、「Brogli et al., (1984) Science 224:838-843」、「Gurley et al. (1986) Mol. Cell. Biol. 6:559-565」および「Weissbach & Weissbach, 1988, Methods for Plant Molecular Biology, Academic Press, NY, Section VIII, pp421-463」に記載されている。
【0088】
別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜10個のゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜10個のゴナドトロピンカルボキシ末端ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜7個のゴナドトロピンカルボキシ末端ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した2〜8個のゴナドトロピンカルボキシ末端ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。別の実施形態において、本発明は、凝固因子と、その凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端ペプチドとからなるポリペプチドをコードするコーディング部分を含むポリヌクレオチド分子を提供する。
【0089】
別の実施形態において、本発明は、本明細書に記載されたポリヌクレオチド分子を含む発現ベクターを提供する。別の実施形態において、本発明は、本明細書に記載された発現ベクターを含む細胞を提供する。別の実施形態において、本発明は、本明細書に記載された発現ベクターを含む組成物を提供する。別の実施形態において、本発明は、本明細書に記載された細胞を含む組成物を提供する。別の実施形態において、細胞は、真核細胞である。別の実施形態において、細胞は、原核細胞である。
【0090】
別の実施形態において、本発明の加工凝固因子は、本発明のポリペプチドをコードするポリヌクレオチド分子を用いて合成される。幾つかの実施形態において、本発明の加工凝固因子をコードするポリヌクレオチド分子は、シス調節配列(例えば、プロモーター配列)の転写制御を含む発現ベクターに連結されている。幾つかの実施形態において、シス調節配列は、本発明の加工凝固因子の構成的発現を指導するのに適している。幾つかの実施形態において、シス調節配列は、本発明の加工凝固因子の組織特異的発現を指導するのに適している。幾つかの実施形態において、シス調節配列は、本発明の加工凝固因子の誘導性発現を指導するのに適している。
【0091】
幾つかの実施形態において、本発明の使用に適した組織特異性プロモーターは、特異的細胞集団内で機能的な配列を含み、例としては、非限定的に、肝臓特異性のあるアルブミンなどのプロモーター(Pinkert et al., (1987) Genes Dev. 1:268-277)、リンパ球特異性プロモーター(Calame et al., (1988) Adv. Immunol. 43:235-275);詳細にはT細胞受容体のプロモーター(Winoto et al., (1989) EMBO J. 8:729-733)および免疫グロブリンのプロモーター(Banerji et al. (1983) Cell 33729-740);ニューロフィラメントプロモーターなどのニューロン特異性プロモーター(Byrne et al. (1989) Proc. Natl. Sci. USA 86:5473-5477)、膵臓特異性プロモーター(Edlunch et al. (1985) Science 230:912-916)または乳腺特異性プロモーター、例えば、乳清プロモーター(米国特許第4,873,316号および欧州特許出願公開第264,166号)が挙げられる。本発明の使用に適した誘導性プロモーターとしては、例えば、テトラサイクリン誘導性プロモーター(Srour, M. A., et al., 2003. Thromb. Haemost. 90:398-405)が挙げられる。
【0092】
一実施形態において、語句「ポリヌクレオチド分子」は、RNA配列、相補的ポリヌクレオチド配列(cDNA)、ゲノムポリヌクレオチド配列および/または複合ポリヌクレオチド配列(例えば、上記の組合せ)の形態で単離および提供される一本鎖または二本鎖核酸配列を指す。
【0093】
一実施形態において、「相補的ポリヌクレオチド配列」は、逆転写酵素または他の任意のRNA依存性DNAポリメラーゼを用いたメッセンジャーRNAの逆転写から得られる配列を指す。一実施形態において、その配列は、引き続き、インビボまたはインビトロで、DNAポリメラーゼを用いて増幅することができる。
【0094】
一実施形態において、「ゲノムポリヌクレオチド配列」は、染色体から誘導(単離)された配列を指し、つまりそれは、染色体の隣接部分を表す。
【0095】
一実施形態において、「複合ポリペプチド配列」は、少なくとも部分的に相補性があり少なくとも部分的にゲノムである配列を指す。一実施形態において、複合配列は、本発明のポリペプチドをコードするのに必要となる幾つかのエキソン配列と、それらの間に挿入された幾つかのイントロン配列とを含むことができる。一実施形態において、イントロン配列は、他の遺伝子をはじめとする任意の供給源のものであってもよく、典型的には、保存されたスプライシングシグナル配列を含む。一実施形態において、イントロン配列は、シス作用性発現調節エレメントを含む。
【0096】
一実施形態において、シグナルペプチドは、発現および分泌に続いて、前駆体である加工凝固因子から開裂されて、成熟の加工凝固因子を生じる。
【0097】
幾つかの実施形態において、本発明のポリペプチドは、PCR技術、または当業者に公知の他の任意の方法もしくは手順を用いて調製される。幾つかの実施形態において、その手順は、2つの異なるDNA配列のライゲーションを含む(例えば、「Current Protocols in Molecular Biology, eds. Ausubel et al., John Wiley & Sons, 1992」参照)。
【0098】
一実施形態において、加工凝固因子をコードする本発明のポリペプチドが、発現ベクター(即ち、核酸構造体)に挿入されると、組換えポリペプチドの発現が可能になる。一実施形態において、本発明の発現ベクターは、このベクターを原核生物における複製および統合に適合させる更なる配列を含む。一実施形態において、本発明の発現ベクターは、このベクターを真核生物における複製および統合に適合させる更なる配列を含む。一実施形態において、本発明の発現ベクターは、このベクターを原核生物および真核生物の両方における複製および統合に適合させるシャトルベクターを含む。幾つかの実施形態において、凝血ベクターは、転写および翻訳開始配列(例えば、プロモーター、エンハンサー)ならびに転写および翻訳ターミネーター(例えば、ポリアデニル化シグナル)を含む。
【0099】
一実施形態において、様々な原核または真核細胞が、宿主発現系として用いられて、本発明の凝固因子を発現することができる。幾つかの実施形態において、これらには、非限定的に、微生物、例えば、ポリペプチドコーディング配列を含む組換えバクテリオファージDNA、プラスミドDNAまたはコスミドDNAの発現ベクターで形質転換された細菌;ポリペプチドコーディング配列を含む組換え酵母発現ベクターで形質転換された酵母;組換えウイルス発現ベクター(例えば、カリフラワーモザイクウイルス、CaMV;タバコモザイクウイルス、TMV)に感染した、またはポリペプチドコーディング配列を含む組換えプラスミド発現ベクター、例えば、Tiプラスミドで形質転換された植物細胞系が挙げられる。
【0100】
幾つかの実施形態において、非細菌発現系(例えば、哺乳類発現系、例えばCHO細胞)を用いて、本発明の凝固因子を発現させる。一実施形態において、哺乳類細胞における本発明のポリヌクレオチドの発現に用いられる発現ベクターが、CMVプロモーターおよびネオマイシン耐性遺伝子を含むpCI−DHFRベクターである。pCI−dhfrベクターの構築は、実施例1の一実施形態により記載される。
【0101】
幾つかの実施形態において、本発明の細菌系では、有利には多数の発現ベクターを、発現されたポリペプチドに向けた用途に応じて選択することができる。一実施形態において、多量のポリペプチドが望ましい。一実施形態において、可能な限り疎水性シグナル配列との融合体としての、高レベルのタンパク質生成物の発現を指導し、発現された生成物を、タンパク質生成物が容易に精製される細菌または培地のペリプラズム中に指向するベクターが望ましい。一実施形態において、特定の融合タンパク質は、特異的開裂部位を含むように加工されていて、ポリペプチドの回収の助力となる。一実施形態において、そのような操作に適合可能なベクターとしては、非限定的に、大腸菌発現ベクターのpET類が挙げられる(Studier et al., Methods in Enzymol. 185:60-89 (1990))。
【0102】
一実施形態において、酵母発現システムが用いられる。一実施形態において、構造的または誘導性プロモーターを含む多数のベクターを、米国特許出願第5,932,447号に開示された通り、酵母内で用いることができる。別の実施形態において、外来DNA配列の、酵母染色体への統合を促進するベクターが用いられる。
【0103】
一実施形態において、本発明の発現ベクターは更に、例えば単一のmRNAから複数のタンパク質を翻訳させる追加的ポリヌクレオチド配列、例えば内部リボソーム進入部位(IRES)、およびプロモーター−キメラポリペプチドをゲノムへ取込むための配列を含むことができる。
【0104】
幾つかの実施形態において、哺乳類発現ベクターとしては、非限定的に、インビトロジェン(Invitrogen)から入手できる、pcDNA3、pcDNA3.1(+/−)、pGL3、pZeoSV2(+/−)、pSecTag2、pDisplay、pEF/myc/cyto、pCMV/myc/cyto、pCR3.1、pSinRep5、DH26S、DHBB、pNMT1、pNMT41、pNMT81、プロメガ(Promega)から入手できるpCI、ストラタジーン(Stratagene)から入手できる、pMbac、pPbac、pBK−RSVおよびpBK−CMV、クロンテック(Clontech)から入手できるpTRES、ならびにそれらの誘導体が挙げられる。
【0105】
幾つかの実施形態において、真核性ウイルス、例えばレトロウイルスからの調節エレメントを含む発現ベクターが、本発明により用いられる。SV40ベクターとしては、pSVT7およびpMT2が挙げられる。幾つかの実施形態において、ウシパピローマウイルスから誘導されたベクターとしては、pBV−1MTHAが挙げられ、エプスタイン・バー・ウイルスから誘導されたベクターとしては、pHEBOおよびp205が挙げられる。他の実例的ベクターとしては、真核細胞内での発現に効果的であることが示されている、SV−40初期プロモーター、SV−40後期プロモーター、メタロチオネインプロモーター、マウス哺乳類腫瘍ウイルスプロモーター、ラウス肉腫ウイルスプロモーター、ポリヘドリンプロモーター、または他のプロモーターの指導の下でタンパク質の発現が可能な、pMSG、pAV009/A+、pMTO10/A+、pMAMneo−5、バキュロウイルスpDSVE、および任意の他のベクターが挙げられる。
【0106】
幾つかの実施形態において、組換えウイルスベクターは、水平感染(lateral infection)および標的特異性などの利点を提供することから、本発明の凝固因子のインビボ発現に有用である。一実施形態において、水平感染は、例えばレトロウイルスでは、生命周期に本来備わっているものであり、1個の感染細胞が多数の子孫ビリオンを産生し、それらが分離して隣接する細胞に感染する工程である。一実施形態において、その結果、最初は領域のほとんどで元のウイルス粒子には感染しなかった大きな領域が、急激に感染するようになる。一実施形態において、水平に伝搬することができないウイルスベクターが、生成される。一実施形態において、所望の目的が特定遺伝子を限定数の標的細胞のみに導入することならば、この特徴は有用となりうる。
【0107】
一実施形態において、様々な方法を用いて、本発明の発現ベクターを細胞に導入することができる。そのような方法は一般に、「Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992)」、「Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1989)」、「Chang et al., Somatic Gene Therapy, CRC Press, Ann Arbor, Mich. (1995)」、「Vega et al., Gene Targeting, CRC Press, Ann Arbor Mich. (1995)」、「Vectors: A Survey of Molecular Cloning Vectors and Their Uses, Butterworths, Boston Mass. (1988)」、および「Gilboa et at., Biotechniques 4 (6): 504-512, (1986)」に記載されており、例えば、安定または一過性トランスフェクション、リポフェクション、電気穿孔法、および組換えウイルスベクターの感染が挙げられる。加えて、ポジティブ/ネガティブ選別法に関しては、米国特許第5,464,764号および第5,487,992号を参照されたい。
【0108】
幾つかの実施形態において、ウイルス感染による核酸の導入は、ウイルスの感染的性質により、より高度のトランスフェクション効率を得ることができるため、他の方法、例えばリポフェクションおよび電気穿孔法を超える複数の利点を提供する。
【0109】
一実施形態において、本発明の加工凝固因子が、本明細書の先に記載された任意の適切な投与様式を利用して、個体に投与された核酸構造体から発現しうることは、理解されよう(即ち、インビボ遺伝子療法)。一実施形態において、核酸構造体は、適切な遺伝子送達ビヒクル/方法(トランスフェクション、トランスダクション、相同組換えなど)および必要となる発現系を介して適切な細胞に導入され、その後、修飾された細胞を培養で増殖させて、個体に戻す(即ち、エクスビボ遺伝子療法)。
【0110】
一実施形態において、植物発現ベクターが用いられる。一実施形態において、ポリペプチドコーディング配列の発現が、多数のプロモーターにより指導される。幾つかの実施形態において、ウイルスプロモーター、例えば、CaMVの35S RNAおよび19S RNAプロモーター(Brisson et al., Nature 310:511-514 (1984))、またはTMVへのコートタンパク質プロモーター(Takamatsu et al., EMBO J. 6:307-311 (1987))が用いられる。別の実施形態において、植物プロモーター、例えば、RUBISCOの小サブユニット(「Coruzzi et al., EMBO J. 3:1671-1680 (1984)」および「Brogli et al., Science 224:838-843 (1984)」)または熱ショックプロモーター、例えば、大豆hsp17.5−Eもしくはhsp17.3−B(Gurley et al., Mol. Cell. Biol. 6:559-565 (1986))が用いられる。一実施形態において、構造体は、Tiプラスミド、Riプラスミド、植物ウイルスベクターを用いて植物細胞に導入され、DNA形質転換、マイクロインジェクション、電気穿孔法および当業者に周知の他の技術を指導する。例えば、「Weissbach & Weissbach, Methods for Plant Molecular Biology, Academic Press, NY, Section VIII, pp 421-463 (1988)」を参照されたい。当該技術分野で周知の他の発現系、例えば、昆虫および哺乳類宿主細胞系を、本発明により用いることもできる。
【0111】
本発明の発現構造体が、挿入されたコーティング配列(ポリペプチドをコードする)の転写および翻訳に必要な要素を含む以外に、発現されたポリペプチドの安定性、産生、精製、収率、または活性を最適化するように加工された配列も含みうることは理解されよう。
【0112】
幾つかの実施形態において、様々な方法を用いて、本発明の発現ベクターを宿主細胞系に導入することができる。幾つかの実施形態において、そのような方法は一般に、「Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Springs Harbor Laboratory, New York (1989, 1992)」、「Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Md. (1989)」、「Chang et al., Somatic Gene Therapy, CRC Press, Ann Arbor, Mich. (1995)」、「Vega et al., Gene Targeting, CRC Press, Ann Arbor Mich. (1995)」、「Vectors: A Survey of Molecular Cloning Vectors and Their Uses, Butterworths, Boston Mass. (1988)」、および「Gilboa et at., Biotechniques 4 (6): 504-512, (1986)」に記載されており、例えば、安定または一過性トランスフェクション、リポフェクション、電気穿孔法、および組換えウイルスベクターの感染が挙げられる。加えて、ポジティブ/ネガティブ選別法に関しては、米国特許第5,464,764号および第5,487,992号を参照されたい。
【0113】
幾つかの実施形態において、形質転換細胞を、効果的条件下で培養して、多量の組換え加工凝固因子を発現させることができる。幾つかの実施形態において、効果的培養条件としては、非限定的に、タンパク質生成を可能にする、効果的培地、バイオリアクター、温度、pHおよび酸素条件が挙げられる。一実施形態において、効果的培地は、細胞を培養して本発明の組換えポリペプチドを生成する任意の培地を指す。幾つかの実施形態において、培地は、典型的には、同化性炭素、窒素およびリン酸供給源、ならびに適切な塩、金属、および他の栄養素、例えばビタミンを有する水溶液を含む。幾つかの実施形態において、本発明の細胞は、従来の発酵バイオリアクター、振とうフラスコ、試験管、ミクロタイターディッシュ、およびペトリ皿で培養することができる。幾つかの実施形態において、培養は、組換え細胞に適した温度、pHおよび酸素含量で実施される。幾つかの実施形態において、培養条件は、当業者の専門技術の範囲内である。
【0114】
幾つかの実施形態において、生成に用いられるベクターおよび宿主系に応じて、得られた本発明の加工凝固因子は、組換え細胞内に残存するか、発酵培地に分泌されるか、2つの細胞膜間の空間、例えば大腸菌のペリプラズム空間に分泌されるか、または細胞もしくはウイルス膜の外表面に保持される。
【0115】
一実施形態において、所定の時間の培養に続いて、組換え加工凝固因子の回収が実行される。
【0116】
一実施形態において、本明細書で用いられる語句「組換え加工凝固因子を回収すること」は、ポリペプチドを含む発酵培地全体を回収することを指しており、分離または精製の追加的ステップを伴う必要はない。
【0117】
一実施形態において、本発明の加工凝固因子は、様々な標準的タンパク質精製技術、例えば非限定的に、アフィニティークロマトグラフィー、イオン交換クロマトグラフィー、ろ過、電気泳動法、疎水性相互作用クロマトグラフィー、ゲルろ過クロマトグラフィー、逆相クロマトグラフィー、コンカナバリンAクロマトグラフィー、クロマトフォーカシングおよび分別可溶化、を用いて精製される。
【0118】
一実施形態において、回収を促進するために、発現されたコーディング配列を、本発明の加工凝固因子をコードするように加工して、開裂可能な部分を融合させることができる。一実施形態において、ポリペプチドがアフィニティークロマトグラフィーにより、例えば、開裂可能な部分に特異的なカラムへの固定化により、容易に単離できるように、融合タンパク質を設計することができる。一実施形態において、開裂部位は、加工凝固因子と開裂可能な部分の間で加工され、融合タンパク質をこの部位で特異的に開裂する適切な酵素または薬剤で処理することにより、ポリペプチドをクロマトグラフィーカラムから遊離させることができる(例えば、「Booth et al., Immunol. Lett. 19:65-70 (1988)」および「Gardella et al., J. Biol. Chem. 265:15854-15859 (1990)」参照)。
【0119】
一実施形態において、本発明の加工凝固因子は、「実質的に純粋な」形態で回収される。
【0120】
一実施形態において、語句「実質的に純粋な」は、本明細書に記載された適用例においてタンパク質の効果的使用が可能な純度を指す。
【0121】
一実施形態において、本発明の加工凝固因子は、インビトロ発現系を用いて合成することもできる。一実施形態において、インビトロ合成法は、当該技術分野で周知であり、系の成分は市販されている。
【0122】
幾つかの実施形態において、組換え加工凝固因子は、合成および精製され;それらの治療有効性を、インビボまたはインビトロのいずれかでアッセイすることができる。一実施形態において、本発明の組換え加工凝固因子の結合活性は、当業者に公知の様々なアッセイを用いて確認することができる。
【0123】
別の実施形態において、本発明の加工凝固因子は、それ自体を個体に提供することができる。一実施形態において、本発明の加工凝固因子は、薬学的に許容しうる担体と混合された医薬組成物の一部として、個体に提供することができる。
【0124】
別の実施形態において、「医薬組成物」は、本明細書に記載された有効成分1種以上と、他の化学成分、例えば、生理学的に適した担体および賦形剤との調製物を指す。医薬組成物の目的は、生物体への化合物投与を促進することである。
【0125】
別の実施形態において、「有効成分」は、生物学的効果を担う、該当するポリペプチド配列を指す。
【0126】
別の実施形態において、本発明の組成物のいずれも、任意の形態の、該当する加工凝固因子が、カルボキシ末端のみに結合したCTP配列を少なくとも1個含む。一実施形態において、本発明は、複合調製物(combined preparation)を提供する。一実施形態において、「複合調製物」は、先に定義された複合パートナーが、独立して投与されうる、または異なる一定の複合物を識別された量の複合パートナーと共に使用して、即ち、同時に、一度に、別個にまたは逐次、投与されうるという意味において、特に「成分のキット」を定義する。幾つかの実施形態において、成分のキットの中の成分は、その場合、例えば、成分のキットの中の任意の成分に関して、異なる時点で、そして同一または異なる時間間隔で、同時に投与されるか、または経時的にずらして投与することができる。幾つかの実施形態において、複合調製物では、複合パートナーの総量の比で投与することができる。一実施形態において、複合調製物は、例えば、処置される患者の部分集合の要件、または一人の患者の要件に対処するために、変動することができ、その異なる要件は、当業者が容易に作成することができるよう、特定の疾患、疾患の重症度、年齢、性別、または体重によるものであってもよい。
【0127】
別の実施形態において、互換可能に用いられる「生理学的に許容しうる担体」および「薬学的に許容しうる担体」は、生物体に顕著な刺激を起こさず、投与化合物の生物活性および性質を抑制しない担体または希釈剤を指す。これらの語句の下では、アジュバントが含まれる。一実施形態において、薬学的に許容しうる担体に含まれる成分の1つは、例えば、有機および水性媒体中で広範囲の溶解度を有する生体適合性ポリマーであるポリエチレングリコール(PEG)であってもよい(Mutter et al.(1979))。
【0128】
別の実施形態において、「賦形剤」は、医薬組成物に添加されて、有効成分の投与を更に促進する不活性物質を指す。一実施形態において、賦形剤としては、炭酸カルシウム、リン酸カルシウム、様々な糖類および複数の型のデンプン、セルロース誘導体、ゼラチン、植物油およびポリエチレングリコールが挙げられる。
【0129】
薬物の配合および投与の技術は、本明細書に参照により組み込まれた「Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA」の最新版に見出される。
【0130】
別の実施形態において、適切な投与経路としては、例えば、経口、経直腸、経粘膜、経鼻、腸内または非経口送達、例えば、筋肉内、皮下および髄内注射など、ならびに髄腔内、直接脳室内、静脈内、腹腔内、鼻腔、または眼内注射が挙げられる。
【0131】
別の実施形態において、調製物は、全身的手法よりむしろ局所的に、例えば、患者の身体の特定領域へ調製物を直接注射することにより、投与される。
【0132】
投与量の範囲の様々な実施形態が、本発明により企図される。一実施形態において、本発明の加工凝固因子の投与量は、0.005〜100mg/日の範囲内である。別の実施形態において、投与量は、0.05〜5mg/日の範囲内である。別の実施形態において、投与量は、0.01〜50mg/日の範囲内である。別の実施形態において、投与量は、0.1〜20mg/日の範囲内である。別の実施形態において、投与量は、0.1〜10mg/日の範囲内である。別の実施形態において、投与量は、0.01〜5mg/日の範囲内である。別の実施形態において、投与量は、0.001〜0.01mg/日の範囲内である。別の実施形態において、投与量は、0.001〜0.1mg/日の範囲内である。別の実施形態において、投与量は、0.1〜5mg/日の範囲内である。別の実施形態において、投与量は、0.5〜50mg/日の範囲内である。別の実施形態において、投与量は、0.2〜15mg/日の範囲内である。別の実施形態において、投与量は、0.8〜65mg/日の範囲内である。別の実施形態において、投与量は、1〜50mg/日の範囲内である。別の実施形態において、投与量は、5〜10mg/日の範囲内である。別の実施形態において、投与量は、8〜15mg/日の範囲内である。別の実施形態において、投与量は、10〜20mg/日の範囲内である。別の実施形態において、投与量は、20〜40mg/日の範囲内である。別の実施形態において、投与量は、60〜120mg/日の範囲内である。別の実施形態において、投与量は、12〜40mg/日の範囲内である。別の実施形態において、投与量は、40〜60mg/日の範囲内である。別の実施形態において、投与量は、50〜100mg/日の範囲内である。別の実施形態において、投与量は、1〜60mg/日の範囲内である。別の実施形態において、投与量は、15〜25mg/日の範囲内である。別の実施形態において、投与量は、5〜10mg/日の範囲内である。別の実施形態において、投与量は、55〜65mg/日の範囲内である。
【0133】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、鼻腔投与形態で配合される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、注射投与形態で配合される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.0001mg〜0.6mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.001mg〜0.005mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.005mg〜0.01mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.01mg〜0.3mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.2mg〜0.6mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子は、アミノ末端にCTPを含まない。
【0134】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、1〜100μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、10〜80μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、20〜60μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、10〜50μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、40〜80μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、10〜30μgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、30〜60μgの範囲内の用量で対象に投与される。
【0135】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、0.2mg〜2mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、2mg〜6mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、4mg〜10mgの範囲内の用量で対象に投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、5mg〜15mgの範囲内の用量で対象に投与される。
【0136】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、筋肉内に注射される(筋肉内注射)。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、皮膚の下に注射される(皮下注射)。別の実施形態において、IFNタンパク質およびCTP単位を含むポリペプチドは、筋肉内に注射される。別の実施形態において、IFNタンパク質およびCTP単位を含むポリペプチドは、皮膚の下に注射される。
【0137】
別の実施形態において、本発明の方法は、凝固因子と、その凝固因子のアミノ末端に結合した1個の絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)と、その凝固因子のカルボキシ末端に結合した2個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、必要とする対象に提供し、それにより凝固因子療法の利用において服薬遵守を向上させることを含む、凝固因子療法の利用において服薬遵守を向上させることを含む。
【0138】
別の実施形態において、本発明の方法は、凝固因子療法が必要な慢性疾患に苦しむ患者の服薬遵守を向上させることを含む。別の実施形態において、本発明の方法は、本明細書の先に記載された通り凝固因子をCTPで修飾することにより、凝固因子の投与頻度を低減する。別の実施形態において、用語、服薬遵守は、アドヒアランスを含む。別の実施形態において、本発明の方法は、凝固因子の投与頻度を低減することにより、凝固因子療法が必要な患者の服薬遵守を向上させることを含む。別の実施形態において、凝固因子の投与頻度の低減は、CTP修飾凝固因子をより安定化させるCTP修飾により実現される。別の実施形態において、凝固因子の投与頻度の低減は、凝固因子のT1/2を増加させた結果、実現される。別の実施形態において、凝固因子の投与頻度の低減は、凝固因子のクリアランス時間を増加させた結果、実現される。別の実施形態において、凝固因子の投与頻度の低減は、凝固因子のAUC測定値を増加させた結果、実現される。
【0139】
別の実施形態において、1〜10個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の投与頻度を低減するステップを含む、凝固因子の投与頻度を低減する方法が提供される。別の実施形態において、1〜5個のCTPを凝固因子のカルボキシ末端に結合させ、それにより凝固因子の投与頻度を低減するステップを含む、凝固因子の投与頻度を低減する方法が提供される。
【0140】
別の実施形態において、凝固因子と、凝固因子のカルボキシ末端に結合した1〜10個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、必要とする対象に提供し、それにより凝固因子療法の利用において服薬遵守を向上させることを含む、凝固因子療法の利用における服薬遵守を向上させる方法が提供される。別の実施形態において、凝固因子と、凝固因子のカルボキシ末端に結合した1〜5個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、必要とする対象に提供し、それにより凝固因子療法の利用において服薬遵守を向上させることを含む、凝固因子療法の利用における服薬遵守を向上させる方法が提供される。
【0141】
別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に1日1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に2日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に3日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に4日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に5日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に6日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に週に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に7〜14日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に10〜20日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に5〜15日に1回投与される。別の実施形態において、凝固因子と、少なくとも1個のCTP単位とを含むポリペプチドは、対象に15〜30日に1回投与される。
【0142】
別の実施形態において、投与量は、50〜500mg/日の範囲内である。別の実施形態において、投与量は、50〜150mg/日の範囲内である。別の実施形態において、投与量は、100〜200mg/日の範囲内である。別の実施形態において、投与量は、150〜250mg/日の範囲内である。別の実施形態において、投与量は、200〜300mg/日の範囲内である。別の実施形態において、投与量は、250〜400mg/日の範囲内である。別の実施形態において、投与量は、300〜500mg/日の範囲内である。別の実施形態において、投与量は、350〜500mg/日の範囲内である。
【0143】
一実施形態において、投与量は、20mg/日である。一実施形態において、投与量は、30mg/日である。一実施形態において、投与量は、40mg/日である。一実施形態において、投与量は、50mg/日である。一実施形態において、投与量は、0.01mg/日である。別の実施形態において、投与量は、0.1mg/日である。別の実施形態において、投与量は、1mg/日である。別の実施形態において、投与量は、0.530mg/日である。別の実施形態において、投与量は、0.05mg/日である。別の実施形態において、投与量は、50mg/日である。別の実施形態において、投与量は、10mg/日である。別の実施形態において、投与量は、20〜70mg/日である。別の実施形態において、投与量は、5mg/日である。
【0144】
別の実施形態において、投与量は、1〜90mg/日である。別の実施形態において、投与量は、1〜90mg/2日である。別の実施形態において、投与量は、1〜90mg/3日である。別の実施形態において、投与量は、1〜90mg/4日である。別の実施形態において、投与量は、1〜90mg/5日である。別の実施形態において、投与量は、1〜90mg/6日である。別の実施形態において、投与量は、1〜90mg/週である。別の実施形態において、投与量は、1〜90mg/9日である。別の実施形態において、投与量は、1〜90mg/11日である。別の実施形態において、投与量は、1〜90mg/14日である。
【0145】
別の実施形態において、凝固因子の投与量は、10〜50mg/日である。別の実施形態において、投与量は、10〜50mg/2日である。別の実施形態において、投与量は、10〜50mg/3日である。別の実施形態において、投与量は、10〜50mg/4日である。別の実施形態において、投与量は、10〜50mg/5日である。別の実施形態において、投与量は、10〜50mg/6日である。別の実施形態において、投与量は、10〜50mg/週である。別の実施形態において、投与量は、10〜50mg/9日である。別の実施形態において、投与量は、10〜50mg/11日である。別の実施形態において、投与量は、10〜50mg/14日である。
【0146】
一実施形態において、経口投与は、錠剤、カプセル、トローチ剤、チュワブル錠、懸濁物、エマルジョンなどを含む単位用量形態を含む。そのような単位用量形態は、本発明の所望の凝固因子を安全で効果的な量含み、それぞれは、一実施形態において、0.7もしくは3.5mg〜約280mg/70kg、または別の実施形態において、0.5もしくは10mg〜約210mg/70kgである。経口投与のための単位用量形態の調製に適した、薬学的に許容しうる担体は、当該技術分野で周知である。幾つかの実施形態において、錠剤は、典型的には、不活性希釈剤、例えば、炭酸カルシウム、炭酸ナトリウム、マンニトール、ラクトースおよびセルロース;結合剤、例えば、デンプン、ゼラチンおよびスクロース;崩壊剤、例えば、デンプン、アルギン酸およびクロスカルメロース;潤滑剤、例えば、ステアリン酸マグネシウム、ステアリン酸およびタルク、のような従来の薬学的に適合しうるアジュバントを含む。一実施形態において、滑剤、例えば、二酸化ケイ素を用いて、粉末混合物の流動性を向上させることができる。一実施形態において、着色剤、例えば、FD&C着色剤を、外観のために添加することができる。甘味剤および着香剤、例えば、アスパルテーム、サッカリン、メントール、ペパーミント、および果実香料は、チュワブル錠に有用なアジュバントである。カプセルは、典型的には、先に開示された固体希釈剤を1種以上含む。幾つかの実施形態において、担体成分の選択は、香味、経費、および貯蔵安定性などの第二の判断材料に依存し、本発明の目的としては不可欠ではなく、当業者により容易に実施することができる。
【0147】
一実施形態において、経口投与形態は、あらかじめ定義された放出プロファイルを含む。一実施形態において、本発明の経口投与形態は、長期放出性の錠剤、カプセル、トローチ剤またはチュワブル錠を含む。一実施形態において、本発明の経口投与形態は、徐放性の錠剤、カプセル、トローチ剤またはチュワブル錠を含む。一実施形態において、本発明の経口投与形態は、即放性の錠剤、カプセル、トローチ剤またはチュワブル錠を含む。一実施形態において、経口投与形態は、当業者に公知の薬学的有効成分の所望の放出プロファイルに従って配合される。
【0148】
幾つかの実施形態において、経口組成物は、溶液、エマルジョン、懸濁物などを含む。幾つかの実施形態において、そのような組成物の調製に適した薬学的に許容しうる担体は、当該技術分野で周知である。幾つかの実施形態において、液体経口組成物は、所望の化合物を約0.001%〜約0.933%を含み、別の実施形態において、約0.01%〜約10%含む。
【0149】
幾つかの実施形態において、本発明の方法で用いられる組成物は、溶液またはエマルジョンを含み、幾つかの実施形態において、それは、本発明の化合物、および場合により局所鼻腔投与に向けた他の化合物を、安全で効果的な量含む水溶液またはエマルジョンである。幾つかの実施形態において、その組成物は、表題化合物を約0.001%〜約10.0%w/v、より好ましくは約0.01%〜約2.0%w/v含み、化合物を鼻腔経路により全身に送達するのに用いられる。
【0150】
別の実施形態において、医薬組成物は、液体調製物の静脈内、動脈内、または筋肉内注射により投与される。幾つかの実施形態において、液体配合剤としては、溶液、懸濁物、分散物、エマルジョン、オイルなどが挙げられる。一実施形態において、医薬組成物は、静脈内に投与され、つまり静脈内投与に適した形態で配合される。別の実施形態において、医薬組成物は、動脈内に投与され、つまり動脈内投与に適した形態で配合される。別の実施形態において、医薬組成物は、筋肉内に投与され、つまり筋肉内投与に適した形態で配合される。
【0151】
更に、別の実施形態において、医薬組成物は、体表に局所的に投与され、つまり局所投与に適した形態で配合される。適切な局所配合剤としては、ゲル、軟膏、クリーム、ローション、滴薬などが挙げられる。局所投与では、本発明の化合物は、更なる適切な治療薬1種または複数種と混和され、薬学的担体を含み、または含まずに、生理学的に許容しうる希釈剤中の溶液、懸濁物またはエマルジョンとして調製および適用される。
【0152】
一実施形態において、本発明の医薬組成物は、当該技術分野で周知の工程により、例えば、従来の混合、溶解、造粒、糖衣錠製造、研和、乳化、カプセル化、封入または凍結乾燥工程を用いて製造される。
【0153】
一実施形態において、本発明により使用される医薬組成物は、有効成分の、薬学的に用いうる調製物への加工を促進する、賦形剤および補助剤を含む生理学的に許容しうる担体1種以上を用いて、従来の手法で配合される。一実施形態において、配合は、選択された投与経路に依存する。
【0154】
一実施形態において、本発明の注射薬は、水溶液中で配合される。一実施形態において、本発明の注射薬は、生理学的に適合しうる緩衝剤、例えばハンクス液、リンガー液、または生理学的塩緩衝剤中で配合される。幾つかの実施形態において、経粘膜投与では、透過されるバリアに適した浸透薬が、配合剤中で用いられる。そのような浸透薬は、一般に、当該技術分野で公知である。
【0155】
一実施形態において、本明細書に記載された調製物は、非経口投与用に、例えば、ボーラス注射または連続点滴用に配合される。幾つかの実施形態において、注射用の配合剤は、単位用量形態で、例えばアンプル中に存在するか、または場合により追加の防腐剤と共に、反復投与容器中に存在する。幾つかの実施形態において、組成物は、油性または水性ビヒクル中の懸濁物、溶液またはエマルジョンであり、配合剤、例えば、懸濁剤、安定化剤および/または分散剤を含有する。
【0156】
組成物は、幾つかの実施形態において、必要に応じて、防腐剤、例えば、塩化ベンザルコニウムおよびチメロサールなど;キレート化剤、例えば、エデト酸ナトリウムなど;緩衝剤、例えばリン酸塩、クエン酸塩および酢酸塩;等張剤、例えば、塩化ナトリウム、塩化カリウム、グリセリン、マンニトールなど;抗酸化剤、例えば、アスコルビン酸、アセチルシスチン、ピロ亜硫酸ナトリウムなど;芳香剤;粘度調整剤、例えば、セルロースおよびその誘導体をはじめとするポリマー;およびポリビニルアルコール;ならびにこれらの水性組成物のpHを調整するための酸および塩基も含む。組成物は、幾つかの実施形態において、部分麻酔または他の活性剤も含む。組成物は、スプレー、ミスト、滴薬などとして用いることができる。
【0157】
幾つかの実施形態において、非経口投与用の医薬組成物は、活性調製物の水溶液を水溶性形態で含む。加えて、幾つかの実施形態において、有効成分の懸濁物は、オイルまたは水を基剤とする注射用懸濁物として調製される。幾つかの実施形態において、適切な親油性溶媒またはビヒクルとしては、脂肪油、例えば、ゴマ油、または合成脂肪酸エステル、例えば、オレイン酸エチル、トリグリセリドまたはリポソームが挙げられる。水性注射用懸濁物は、幾つかの実施形態において、懸濁物の粘度を上昇させる物質、例えば、カルボキシメチルセルロースナトリウム、ソルビトールまたはデキストランを含有する。別の実施形態において、懸濁物は、有効成分の溶解度を上昇させて、高濃縮溶液の調製を可能にする適切な安定化剤または薬剤も含有する。
【0158】
別の実施形態において、活性化合物は、小胞、詳細にはリポソーム中に送達することができる(「Langer, Science 249:1527-1533 (1990)」;「Treat et al., in Liposomes in the Therapy of Infectious Disease and Cancer, Lopez- Berestein and Fidler (eds.), Liss, New York, pp. 353-365 (1989)」;「Lopez-Berestein, ibid., pp. 317-327」を参照;一般には同書を参照)。
【0159】
別の実施形態において、制御放出系で送達される医薬組成物は、静脈内注射、移植可能な浸透圧ポンプ、経皮パッチ、リポソームまたは他の投与様式用に配合される。一実施形態において、ポンプが用いられる(「Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987)」及び「Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989)」を参照)。別の実施形態において、ポリマー材料を用いることができる。更に別の実施形態において、制御放出系は、治療ターゲット、即ち、脳の付近に設置することができ、つまり全身用量のほんのわずかしか必要とならない(例えば、「Goodson, Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984)」参照)。他の制御放出系は、Langerによるレビュー(Science 249:1527-1533 (1990))に議論されている。
【0160】
幾つかの実施形態において、有効成分は、使用前に、適切なビヒクル、例えば、滅菌パイロジェンフリー水を基にした溶液で再構成される粉末形態である。組成物は、幾つかの実施形態において、噴霧および吸入投与用に配合される。別の実施形態において、組成物は、噴霧手段が取付けられた容器に含有されている。
【0161】
一実施形態において、本発明の調製物は、例えば従来の坐剤ベース、例えばココアバターまたは他のグリセリドを用いて、直腸組成物、例えば、坐剤または停留浣腸中に配合されている。
【0162】
幾つかの実施形態において、本発明の関連での使用に適した医薬組成物は、有効成分が意図する目的を実現するのに効果的な量で含有されている組成物を包含する。幾つかの実施形態において、治療上効果的な量は、処置される対象の疾患の症状を予防、緩和もしくは寛解するか、または生存を延長するのに効果的な有効成分の量を意味する。
【0163】
一実施形態において、治療上効果的な量の決定は、当業者の能力の範囲内で十分に行われる。
【0164】
薬学的に許容しうる担体またはその成分として作用しうる物質の幾つかの例は、糖、例えば、ラクトース、グルコースおよびスクロース;デンプン、例えばコーンスターチおよびジャガイモデンプン;セルロースおよびその誘導体、例えば、カルボキシメチルセルロースナトリウム、エチルセルロース、およびメチルセルロース;粉末トラガカント;麦芽;ゼラチン;タルク;固形潤滑剤、例えば、ステアリン酸およびステアリン酸マグネシウム;硫酸カルシウム;植物油、例えば、ピーナッツ油、綿実油、ゴマ油、オリーブ油、コーン油およびカカオ油;ポリオール、例えば、プロピレングリコール、グリセリン、ソルビトール、マンニトール、およびポリエチレングリコール;アルギン酸;乳化剤、例えば、ツイーン(Tween)(商標)ブランドの乳化剤;湿潤剤、例えば、ラウリル硫酸ナトリウム;着色剤;着香剤;錠剤成形剤(tableting agents);安定化剤;抗酸化剤;防腐剤;パイロジェンフリー水;等張性生理食塩水;ならびにリン酸緩衝溶液である。化合物と一体となって用いられる、薬学的に許容しうる担体の選択は、基本的に、化合物を投与する方法により決定される。表題化合物が注射されるものである場合、一実施形態において、薬学的に許容しうる担体は、血液と適合性のある懸濁剤を有し、pHが約7.4に調整された滅菌生理食塩水である。
【0165】
加えて、組成物は更に、結合剤(例えば、アカシア、コーンスターチ、ゼラチン、カルボマー、エチルセルロース、グアーガム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポビドン)、崩壊剤(例えば、コーンスターチ、トウモロコシデンプン、アルギン酸、二酸化ケイ素、クロスカルメロースナトリウム、クロスポビドン、グアーガム、デンプングリコール酸ナトリウム)、様々なpHおよびイオン強度の緩衝剤(例えば、トリスHCl、酢酸塩、リン酸塩)、表面への吸収を予防する添加剤、例えば、アルブミンまたはゼラチン、崩壊剤(例えば、ツイーン20、ツイーン80、プルロニック(Pluronic)F68、胆汁酸塩)、プロテアーゼ阻害剤、界面活性剤(例えば、ラウリル硫酸ナトリウム)、浸透増強剤、可溶化剤(例えば、グリセロール、ポリエチレングリセロール)、抗酸化剤(例えば、アスコルビン酸、メタ重亜硫酸ナトリウム、ブチルヒドロキシアニソール)、安定化剤(例えば、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース)、粘度上昇剤(例えば、カルボマー、コロイド状二酸化ケイ素、エチルセルロース、グアーガム)、甘味剤(例えば、アスパルテーム、クエン酸)、防腐剤(例えば、チメロサール、ベンジルアルコール、パラベン)、潤滑剤(例えば、ステアリン酸、ステアリン酸マグネシウム、ポリエチレングリコール、ラウリル硫酸ナトリウム)、流動助剤(例えば、コロイド状二酸化ケイ素)、可塑剤(例えば、ジエチルフタル酸、トリエチルクエン酸)、乳化剤(例えば、カルボマー、ヒドロキシプロピルセルロース、ラウリル硫酸ナトリウム)、ポリマーコーティング(例えば、ポロキサマーまたはポロキサアミン)、コーティングおよびフィルム形成剤(例えば、エチルセルロース、アクリラート、ポリメタクリラート)ならびに/またはアジュバントを含む。
【0166】
シロップ、エリキシル、エマルジョンおよび懸濁物のための担体の典型的な成分としては、エタノール、グリセロール、プロピレングリコール、ポリエチレングリコール、液体スクロース、ソルビトールおよび水が挙げられる。懸濁物では、典型的な懸濁剤として、メチルセルロース、カルボキシメチルセルロースナトリウム、セルロース(例えば、アビセル(Avicel)(商標)、RC−591)、トラガカントおよびアルギン酸ナトリウムが挙げられ;典型的な湿潤剤としては、レシチンおよびポリエチレンオキシドソルビタン(例えば、ポリソルベート80)が挙げられる。典型的な防腐剤としては、メチルパラベンおよび安息香酸ナトリウムが挙げられる。別の実施形態において、経口液体組成物は、先に開示された成分、例えば、甘味剤、着色剤および着色剤も1種以上含有する。
【0167】
組成物は、ポリマー化合物、例えば、ポリ乳酸、ポリグリコール酸、ハイドロゲルなどの粒子状調製物の内部もしくは表面に、あるいはリポソーム、マイクロエマルジョン、ミセル、ユニラメラもしくはマルチラメラベシクル、赤血球影、またはスフェロプラストなどの表面に、活性材料を組込んだものも包含する。そのような組成物は、物理的状態、溶解度、安定性、インビボ放出速度、およびインビボクリアランス速度に影響を及ぼす。
【0168】
同じく本発明により、ポリマー(例えば、ポロキサマーまたはポロキサミン)でコートされた特定の組成物、および組織特異性の受容体、リガンドもしくは抗原に対する抗体に結合した化合物、または組織特異性受容体のリガンドに結合した化合物も包含される。
【0169】
幾つかの実施形態において、水溶性ポリマー、例えばポリエチレングリコール、ポリエチレングリコールとポリプロピレングリコールとのコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニルアルコール、ポリビニルピロリドンまたはポリプロリンの共有結合により修飾された化合物。別の実施形態において、修飾された化合物は、静脈内注射後に、対応する非修飾化合物よりも実質的に長い血中半減期を示す。一実施形態において、修飾は、同じく、水溶液中の化合物溶解度を上昇させ、凝集を排除し、化合物の物理的および化学的安定性を上昇させて、化合物の免疫原性および反応性を大きく低下させる。別の実施形態において、そのようなポリマー−化合物・付加物(abduct)を、非修飾化合物よりも少ない頻度で、または低用量で投与することにより、所望のインビボ生物活性が実現される。
【0170】
幾つかの実施形態において、有効量または用量の調製は、最初はインビトロアッセイから推定することができる。一実施形態において、用量を動物モデルにおいて配合させることができ、そのような情報を用いて、ヒトにおける有用な用量をより正確に決定することができる。
【0171】
一実施形態において、本明細書に記載された有効成分の毒性および治療有効性は、インビトロ、細胞培養、または実験動物において、標準的医薬手順により決定することができる。一実施形態において、これらのインビトロおよび細胞培養アッセイおよび動物試験から得られたデータは、ヒトに使用される一定範囲の投与量を配合させるのに用いることができる。一実施形態において、投与量は、用いられる投与形態および利用される投与経路に応じて変動する。一実施形態において、厳密な配合、投与経路および投与量は、各医師により患者の状態を考慮して選択することができる(例えば、「Fingl, et al., The Pharmacological Basis of Therapeutics, Ch. 1 p.1, (1975)」参照)。
【0172】
一実施形態において、処置される状態の重症度および応答性に応じて、投与は、単回投与または反復投与であってもよく、数日から数週間、または治癒が果たされるまで、または疾患状態の縮小に至るまで、一連の処置が継続されてもよい。
【0173】
一実施形態において、投与される組成物の量は、もちろん、処置される対象、病気の重症度、投与の手法、処方する医師の判断などに依存する。
【0174】
一実施形態において、適合しうる医薬担体中で配合される本発明の調製物をはじめとする組成物が調製され、適切な容器に入れられて、適応症の処置に関してラベル表示される。
【0175】
別の実施形態において、本明細書に記載された凝固因子は、全身投与により投与される。別の実施形態において、本明細書に記載された凝固因子は、静脈内、筋肉内または皮下注射により投与される。別の実施形態において、本明細書に記載された凝固因子は、複合有機賦形剤および安定化剤、例えば、非イオン性表面活性剤(即ち、界面活性剤)、様々な糖類、有機ポリオールおよび/またはヒト血清アルブミンと混和された凍結乾燥(即ち、フリーズドライ)調製物である。別の実施形態において、医薬組成物は、注射用滅菌水中の、凍結乾燥された上記凝固因子を含む。別の実施形態において、医薬組成物は、注射用滅菌PBS中の、凍結乾燥された上記凝固因子を含む。別の実施形態において、医薬組成物は、注射用滅菌0.9%NaCl中の、凍結乾燥された上記凝固因子を含む。
【0176】
別の実施形態において、医薬組成物は、本明細書に記載された凝固因子と、複合担体、例えば、ヒト血清アルブミン、ポリオール、糖類、および陰イオン性表面活性安定化剤とを含む。例えば、WO第89/10756号(Hara et al.、ポリオールおよびp−ヒドロキシ安息香酸を含有)を参照されたい。別の実施形態において、医薬組成物は、本明細書に記載された凝固因子と、ラクトビオン酸と、酢酸/グリシン緩衝剤とを含む。別の実施形態において、医薬組成物は、本明細書に記載された凝固因子と、水へのインターフェロン組成物の溶解度を上昇させるアミノ酸、例えば、アルギニンまたはグルタミン酸とを含む。別の実施形態において、医薬組成物は、凍結乾燥された、本明細書に記載された凝固因子と、グリシンまたはヒト血清アルブミン(HSA)、緩衝剤(例えば、酢酸塩)および等張剤(例えば、NaCl)とを含む。別の実施形態において、医薬組成物は、凍結乾燥された、本明細書に記載された凝固因子と、リン酸緩衝剤と、グリシンと、HSAとを含む。
【0177】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、約4〜7.2のpHを有する緩衝溶液中に添加されると安定化する。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、安定化剤としてのアミノ酸と、幾つかの例では、塩(アミノ酸が帯電した側鎖を含まない場合)とによって安定化される。
【0178】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、アミノ酸である安定化剤を約0.3重量%〜5重量%含む液体組成物である。
【0179】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、用量精度および製品安全性を提供する。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、注射可能な適用例に用いられる、生物活性のある安定した液体配合剤を提供する。別の実施形態において、医薬組成物は、凍結乾燥されていない、本明細書に記載された凝固因子を含む。
【0180】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、液体状態での長期貯蔵が可能であるために投与前の貯蔵および運搬が促進される液体配合剤を提供する。
【0181】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、固形脂質をマトリックス材料として含む。別の実施形態において、本明細書に記載された凝固因子を含む注射可能な医薬組成物は、固形脂質をマトリックス材料として含む。別の実施形態において、噴霧凝固法による液体微粒子の製造が、「Speiser(Speiser and al., Pharm. Res. 8 (1991) 47-54)」により記載されており、その後、経口投与のための液体ナノペレット(Speiser EP0167825(1990))を製造する。別の実施形態において、用いられる液体は、身体に十分に耐容される(例えば、非経口栄養素用のエマルジョン中に存在する脂肪酸で構成されたグリセリド)。
【0182】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、リポソームの形態である(J. E. Diederichs and al., Pharm./nd. 56 (1994) 267- 275)。
【0183】
別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、高分子微粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む注射可能な医薬組成物は、高分子微粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、ナノ粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、リポソームを含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、液体エマルジョンを含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、ミクロスフェアを含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、脂質ナノ粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、両親媒性脂質を含む脂質ナノ粒子を含む。別の実施形態において、本明細書に記載された凝固因子を含む医薬組成物は、薬物と、脂質マトリックスと、界面活性剤とを含む脂質ナノ粒子を含む。別の実施形態において、脂質マトリックスは、少なくとも50%w/wであるモノグリセリドを有する。
【0184】
一実施形態において、本発明の組成物は、有効成分を含有する単位用量形態を1種以上含有する、パックまたはディスペンサー装置、例えば、FDA認可のキットの中に存在する。一実施形態において、パックは、例えば、金属またはプラスチックのホイル、例えばブリスタパックを含む。一実施形態において、パックまたはディスペンサー装置は、投与用の器具を伴う。一実施形態において、パックまたはディスペンサーは、医薬品の製造、用法または安全性を管理する政府機関により規定された形態で、容器に添付された注意書きにより適応される、その注意書きは、組成物またはヒトもしくは家畜への投与の形態の、政府機関による認可を表している。一実施形態において、そのような注意書きは、処方薬に関する米国食品医薬品局の認可について、または認可製品のリストを、ラベル表示している。
【0185】
一実施形態において、本発明の凝固因子が、追加の活性剤と共に個体に提供されることで、各薬剤の単独での処置に比較して、改善された治療効果が実現しうることは、理解されよう。別の実施形態において、併用療法に関連する有害な副作用への方策(例えば、補助剤の投与および選択)が採られる。
【0186】
本発明の更なる目的、利益、および新規特徴は、以下の実施例の実験により当業者に明白となるが、それらは本発明の限定ではない。更に、本明細書の先に表示され、そして以下の特許請求の範囲の区分で請求される本発明の様々な実施形態および態様それぞれにより、以下の実施例の実験的サポートが見出される。
【0187】
実施例
【0188】
一般に、本明細書で用いられる命名法および本発明で用いられる検査手順は、分子学的、生化学的、微生物学的および組換えDANの技術を含む。そのような技術は、文献に完全に説明されている。例えば、「Molecular Cloning: A laboratory Manual, Sambrook et al., (1989)」;「Current Protocols in Molecular Biology, Volumes I-III Ausubel, R. M., 編 (1994)」;「Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, Maryland (1989)」;「Perbal, A Practical Guide to Molecular Cloning, John Wiley & Sons, New York (1988)」;「Watson et al., Recombinant DNA, Scientific American Books, New York」;「Birren et al. (編) Genome Analysis: A Laboratory Manual Series, Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998)」、以下に示された方法論:米国特許第4,666,828号、第4,683,202号、第4,801,531号、第5,192,659号および第5,272,057号;「Cell Biology: A Laboratory Handbook, Volumes I-III Cellis, J. E., 編. (1994)」、「Culture of Animal Cells - A Manual of Basic Technique, by Freshney, Wiley-Liss, N. Y. (1994), Third Edition」、「Current Protocols in Immunology, Volumes I-III Coligan J. E.,編 (1994)」、「Stites et al. (編), Basic and Clinical Immunology (8th Edition), Appleton & Lange, Norwalk, CT (1994)」、「Mishell and Shiigi (編), Selected Methods in Cellular Immunology, W. H. Freeman and Co., New York (1980)」を参照されたく、利用可能な免疫アッセイは、特許および科学文献に広範に記載されており、例えば、米国特許第3,791,932号;第3,839,153号;第3,850,752号;第3,850,578号;第3,853,987号;第3,867,517号;第3,879,262号;第3,901,654号;第3,935,074号;第3,984,533号;第3,996,345号;第4,034,074号;第4,098,876号;第4,879,219号;第5,011,771号および第5,281,521号、「Oligonucleotide Synthesis, Gait, M. J.,編 (1984)」;「Nucleic Acid Hybridization, Hames, B. D., and Higgins S. J.,編 (1985)」;「Transcription and Translation, Hames, B. D., and Higgins S. J.,編. (1984)」;「Animal Cell Culture, Freshney, R. I., 編(1986)」;「Immobilized Cells and Enzymes, IRL Press, (1986)」;「A Practical Guide to Molecular Cloning, Perbal, B., (1984)」;「Methods in Enzymology, Vol. 1-317, Academic Press」;「PCR Protocols: A Guide To Methods And Applications, Academic Press, San Diego, CA (1990)」;「Marshak et al., Strategies for Protein Purification and Characterization - A Laboratory Course Manual, CSHL Press (1996)」を参照されたく、それらの全てが、本明細書に参考として組入れられている。他の一般的参考文献は、この文書全体に提供されている。
【0189】
実施例1
【0190】
[第IX凝固因子の生成および利用]
【0191】
第IX因子(FIX)は、415アミノ酸(55KDa)の糖タンパク質であり、凝固系に関連するビタミンK依存性糖タンパク質の群に属する。FIXは、N−末端プロペプチドと、それに続く成熟アミノ酸配列とを有する前駆体として合成される第FVII因子、第X因子、プロテインCおよびプロトロンビンと類似のドメイン構成を有する。
【0192】
FIXは、一本鎖分子として分泌され、複雑な翻訳後修飾を受けるが、その多くが生化学的および薬物動態的性質にとって不可欠である。全ての翻訳後修飾のうち、ビタミンK依存性γ−カルボキシラーゼによりγ−カルボキシル化されるFIXのアミノ末端付近の12個のグルタミン酸残基は、最も肝要なものである。カルボキシル化は、FIXとリン脂質表面との相互作用に、そして最適なFIX活性に必要である。アミノ末端プロペプチドは、γ−カルボキシラーゼの認識部位として作用し、つまりγ−カルボキシル化に続いて、塩基性アミノ酸残基対開裂酵素(Paired basic Amino acid Cleave Enzyme)(PACE/フリン)として知られるゴルジ装置セリンプロテアーゼにより開裂される。4種の更なる翻訳後修飾がゴルジ装置で起こり、チロシン155の硫酸化、セリン158のリン酸化、セリン63および61のO−グリコシル化、そして最後にAsn157および16のN−グリコシル化が起こる。
【0193】
FIXは、一本鎖の不活性チモーゲンとして、血漿内を循環する(平均濃度5μg/ml)。1種以上の生理学的アクチベータ、FVIIa−TF複合体またはFIXaのいずれかによる、2つのペプチド結合:Arg145およびArg180のタンパク質分解開裂の際に、活性化ペプチドが除去されて、FIXを、ジスルフィド単結合により結合した軽鎖および重鎖からなる完全に活性化された酵素に変換する。N−末端軽鎖は、非触媒γ−カルボキシグルタミン酸(Gla)および2個の上皮増殖因子様ドメインを含み、C−末端重鎖は、分子のトリプシン様触媒ドメインを含む。FIXaそのものは、わずかな触媒活性により特徴づけられる。しかし、FVIIIと複合体化すると、そのタンパク質分解活性が、天然基質FXより4〜5桁上昇する。
【0194】
血友病Bは、第IX因子(FIX)遺伝子の突然変異により引き起こされるX染色体関連の出血性疾患であり、FIXのプロコアグラント活性の欠乏をきたす。血友病B患者は、特発性軟部組織出血および再発性関節血症を有し、多くの場合、手足に障害が残る関節症を来す。これらの患者の現行の処置には、組換えFIXの静脈内投与がある。しかし、経費の問題、および循環からのFIXの比較的急速なクリアランスが、長期作用性FIXの開発を困難な課題にしている。
【0195】
CTPテクノロジーが、長期作用性FIXの開発に利用された。詳細には、少なくとも1種のヒトCPTをFIXに融合することにより、組換えrFIX分子の半減期延長が実施された。組換えFIX−CTPが、哺乳類細胞内で発現され、インビトロおよびインビボで特徴づけられた。rFIX−CTPのインビトロ活性が、rFIXと同等であることが実証された。ラットにおける薬物動態および有効性試験により、rFIX−CTPの改善された性質が実証された。この試験の結果、野生型酵素と類似の止血性を有する、半減期の長いrFIX分子の開発が実現可能であることが実証された。
【0196】
組換えFIX分子のクローニングおよび発現:Dg44細胞を100mm組織培養皿に添加して、50〜60%コンフルエンスになるまで増殖させた。無タンパク質培地(インビトロジェン CD Dg44)中のヒュージーン(FuGene)試薬(ロッシュ(Roche))を用いた100mmプレート1枚のでのトランスフェクションに、合計2μg(マイクログラム)のFIX cDNAを用いた。トランスフェクションの48時間後に培地を除去して、ヌクレオシドを含まず800μg/ml G418(ネオマイシン)が存在する無タンパク質培地(インビトロジェン CD Dg44)と交換した。14日後に、トランスフェクトされた細胞集団をT25組織培養フラスコに移して、細胞が安定したクローンとして増殖し始めるまで、更に10〜14日間、選別を継続した。高発現クローンを選別した。細胞 約2×107個を用いて、ビタミンK3 5ng/ml(メナジオン重硫酸ナトリウム;シグマ(Sigma))を補足した1700cm2丸底フラスコ(コーニング(Corning)、コーニングNY)内の増殖培地300mlに播種した。細胞生存性が約70%に急速低下した後、生成培地(ハーベスト)を回収した。生成培地を、最初は透明化させ、その後、約20倍に濃縮し、流動ろ過カセット(flow filtration cassette)(10KDa MWCO、ミリポア社(Millipore Corp))を用いてPBSで透析した。
【0197】
FIX抗原レベルの測定:FIX−CTPハーベストの抗原レベルを、アッセイマックス(AssayMax)ヒトFIX ELISAキット(アッセプロ−EF1009−1)を用いて測定したが、計算されたタンパク質濃度は、2回の独立した実験での3個の異なる希釈液の平均値である(図3A)。
【0198】
【表1】

【0199】
FIXのSDS−PAGE − 免疫ブロット:FIX−CTPハーベストまたは精製rhFIX(アメリカン・ダイアグノスティックス)のタンパク質100ngを、プレシジョン・プラス・デュアル・カラー・プロテイン・マーカー(Precision plus dual color protein marker)(バイオ・ラッド(Bio-Rad))を用いて、12%トリス−グリシンゲルに負荷した。抗ヒトFIXポリクローナル抗体および抗ヒトγ−カルボキシル化モノクローナル抗体(アメリカン・ダイアグノスティックス)を用いたウェスタン免疫ブロットにより、SDS−PAGE分析を実施した。過去に報告された通り、rhFIXは55KDaに移動し、2個のCTPに融合されたFIXは75KDaに移動した。FIX−CTPタンパク質のバリアントは両者とも、γ−カルボキシル化されていることが示された(図3B)。
【0200】
FIX色素生成活性の測定:市販の色素生成活性検査キット、バイオフェン(BIOPHEN)(ハイフン・バイオメド(Hyphen BioMed) 221802)を用いて、rhFIXタンパク質(アメリカン・ダイアグノスティックス)に対するFIX−CTPハーベストのインビトロ能力の比較評価を実施した。トロンビン、リン脂質、カルシウムの存在下では、過剰量のFXIaは、採取したFIXをFIXaに活性化させる。FIXaは、トロンビン、活性化FVIII:C(過剰量で補足)、リン脂質、およびカルシウムと酵素複合体を形成して、アッセイ系に存在する第X因子をFXaに活性化させる。その活性は、限定的ファクターであるFIXの量に直接相関する。その後、生成されたFXaを、FXa色素生成基質(pNA)での特異的活性により測定する。生成されたpNAの量は、FIXa活性に直接比例する。rhFIXおよびFIX−CTPハーベストを系列希釈して、FIXハーベストの用量反応曲線をrhFIXまたはヒト血漿からなる参照調製物に比較することにより、効能を評価した。FIXの平均EC50は21ng/mlであり、FIX−(CTP)2ハーベストの計算されたEC50は382ng/mlであり、FIX−CTPハーベストの計算されたEC50は1644ng/mlであった。FIX−(CTP)2ハーベストの酵素活性において、約15倍の低下が観察された(図4)。
【0201】
FIX凝血活性(aPTT):活性化部分トロンボプラスチン時間(aPTT)は、凝固カスケードの内因系および共通系経路の統合性の指標である。aPTTは、内因系経路活性化剤、リン脂質およびカルシウムの添加の後、血漿が凝血するまでの秒数の時間である。組織因子はリン脂質と一緒には含まれず、プロトロンビン時間(PT)試薬と一緒に含まれるため、aPTT試薬は部分トロンボプラスチンと呼ばれる。活性化剤がその系を開始させ、その後、内因系経路の残りのステップがリン脂質の存在下で起こる。参照aPTTの範囲は、検査室間で変動するが、通常、27〜34秒の範囲内である。
【0202】
アッセイの原理は、rhFIXの添加により、FIX欠失ヒト血漿の凝血活性を回復させるFIX−CTPハーベストの能力を定量することである。FIX欠失ヒト血漿300μlを、rhFIXまたはFIX−CTPハーベスト 100μlと混合して、系列希釈した。37℃で60秒間インキュベートした後、トロンボプラスチン、CaCl2、およびリン脂質を混合物に添加し、秒単位での凝血時間を測定した(アメリカン・メディカル・ラボラトリーズ(America Medical Laboratories)により実施)。FIXハーベストの用量反応曲線を、rhFIXまたはヒト血漿からなる参照調製物に比較することにより効能を評価したが、FIX活性の1単位は、ヒト正常血漿1mlの活性と等しい必要FIX濃度である。表示されたaPTT結果から、FIX−(CTP)2が、rhFIXに比較して特異的凝固活性の5.7倍低下を示すことが示された。その上、aPTTの結果をインビトロアッセイでの色素生成活性と合わせると、FIX−(CTP)2ハーベストが、FIX−CTPハーベストに対比して、向上した酵素活性を有することが示唆された(図5)。FIX−CTPタンパク質の向上した活性は、発現系の最適化(即ち、フリンでのコトランスフェクションおよびビタミンK3の培地中濃度の最適化)に続いて得られる。
【0203】
【表2】

【0204】
薬物動態試験:rhFIX(アメリカン・ダイアグノスティックス)およびFIX−CTPハーベストを、スプラグー・ドーリー・ラット(6匹/物質)に用量75μg/kg体重で、単回の静脈内注射により投与した。
【0205】
【表3】

【0206】
血液試料を、投与の0.083、0.5、1.5、4、8、24、48、72時間後に、3匹ずつ交替で後眼窩から採取した。採取後直ちに血漿を調製して、分析まで−20℃で貯蔵した。FIX ELISA特異的アッセイ(アッセイプロ)によりFIX濃度を定量し、各タンパク質ごとに薬物動態プロファイルを計算したが、それらは各時間での動物3匹の平均値であり(図6)、最終半減期(terminal half lives)を、PKソルーション2.0(PK solutions 2.0)ソフトウエアを用いて計算した。表4は、異なる採取時間で観察されたFIX濃度を要約している。PKプロファイルおよび最終半減期の要約を、表5にまとめる。
【0207】
【表4】

【0208】
FIX−CTPハーベストは、rhFIXに比較して、向上したT1/2β値を示す(それぞれ2および5倍上昇)。FIX投与では、24時間後に回収した動物血清濃度は、定量限界未満(BLQ)であり、更なるPKパラメータを計算しなかった。
【0209】
【表5】

【0210】
この試験では、治療的効能を保持しながらFIX半減期を延長させるための新規なアプローチを記載した。活性タンパク質へのCTPペプチド付加は、タンパク質の活性を妨害する点で有害な可能性を有しており、それ故、CTP配列をFIXのC−末端に付加することによる活性組換えFIX−CTPの生成は予測されない。
【0211】
[免疫アフィニティー精製FIX−CTP−CTP(MOD−3012)の特徴づけ]
【0212】
MOD3012の精製
【0213】
MOD3012は、カルボキシ末端にタンデムにつながったCTP単位2個で修飾されたFIXである。FIXのN−末端領域に存在するγ−カルボキシルグルタミル(Gla)残基に対するモノクローナル抗体に結合したマトリックス(アメリカン・ダイアグノスティックス カタログ番号 3570MX)を用いて、MOD3012を精製した。モノクローナル抗体を、セファロースCL−4Bに結合させた。88μg/mlの濃度のMOD3012ハーベストを、トリス20mM、NaCl 150mMおよびEDTA pH=7.4 10mMで透析した。負荷速度は0.5ml/分であり、20mMトリス−HCl、350mM NaClおよび50mM CaClを用いて溶出を実施し、非結合画分を5回リサイクルした。最後に、溶出画分をPBSで透析し、プールして濃縮した。
【0214】
FIX抗原レベルの測定
【0215】
FIX−CTPおよびFIX−(CTP)2、つまりそれぞれMOD−3011およびMOD−3012のハーベスト、ならびにMOD3012精製タンパク質のレベルを、ヒトFIX ELISAキット(アフィニティー・バイオロジカルズ カタログ番号FIX−AG RUO)を用いて測定したが、計算されたタンパク質濃度(μg/ml)は、2回の独立した実験の平均値である(図7)。
【0216】
【表6】

【0217】
加えて、MOD−3012は、ブラッドフォードアッセイにより定量した。計算濃度は202μg/mlであり、ヒトFIX ELISAにより得られた濃度と類似している。
【0218】
SDS−PAGEブロット
【0219】
プレシジョン・プラス・デュアル・カラー・プロテイン・マーカー(バイオ・ラッド)を用いて、MOD3012ハーベスト、非結合画分および精製タンパク質を、12%トリス−グリシンゲルに負荷した。クーマシーブルー試薬(タンパク質800ng)でゲルを染色することにより、SDS−PAGE・クーマシー分析を実施し、抗ヒトFIXポリクローナル抗体(Ab)および抗ヒトγ−カルボキシル化モノクローナルAb(アメリカン・ダイアグノスティックス カタログ番号499 3570)(タンパク質100ng)を用いてウエスタンブロットを実施した。免疫アフィニティー精製手順では、MOD3012部分が有意に高濃度であり、不純物が減少した(図8)。
【0220】
N−末端配列決定:
【0221】
MOD−3012精製タンパク質を、12%トリス−グリシンSDS−PAGEにより分離し、続いてPVDF膜にエレクトロブロットした。該当するバンドを切り出して、精製されたバイオブレーン(Biobrene)処理のガラス繊維フィルター上に載せた。140C HPLCマイクログラジエントシステムを具備したパルス液相プロテインシーケンサー(pulsed liquid protein sequencer)を用いて、エドマン分解によりN−末端配列分析を実施した。N−末端配列決定により、MOD3012が、不完全なプロペプチド開裂タンパク質と完全なプロペプチド開裂タンパク質との混合物であることが明らかとなった。不適切にプロペプチドが開裂すると、FIX凝固活性を低下させることが示された。フリンとのコトランスフェクションにより、改善されたプロペプチド開裂工程を得ることができた。
【0222】
FIX色素生成活性の測定
【0223】
市販の色素生成活性検査キット、バイオフェン(ハイフン・バイオメド 221802)を用いて、rhFIX(アメリカン・ダイアグノスティックス)およびヒト正常血漿のプールに対するMOD−3012精製タンパク質のインビトロでの効能の比較評価を実施した。トロンビン、リン脂質およびカルシウムの存在下、過剰量のFXIaが、FIXをFIXaに活性化した。FIXaが、トロンビン、リン脂質(過剰量で補足)およびカルシウムとの酵素複合体を形成し、アッセイ系に存在する第X因子をFXaに活性化する。その活性は、限定的ファクターであるFIXの量に直接相関した。生成されたFXaを、FXa色素生成基質(pNA)での特異的活性により測定した。生成されたpNAの量は、FIXa活性に直接比例する。rhFIX、ヒト血漿およびMOD−3012を系列希釈して用量反応曲線を比較することにより、効能を評価した(図9)。rhFIXの平均EC50は、68.74ng/mlであり、MOD−3012の計算されたEC50は、505ng/mlであった。MOD−3012の酵素活性は、組換えFIXに対比して約7倍の低下が観察され、プールヒト正常血漿に対比して16.5倍の低下が観察された。この低下した活性は、N−末端分析により同定されたN−末端プロペプチドの不適切な開裂により説明することができた。
【0224】
FIX凝血活性(aPTT)
【0225】
活性化部分トロンボプラスチン時間(aPTT)は、凝固カスケードの内因系および共通系経路の統合性の指標である。aPTTは、内因系経路活性化剤、リン脂質およびカルシウムの添加の後、血漿が凝血するまでの時間(秒単位)である。
【0226】
そのアッセイでは、rhFIXの添加により、FIX欠失ヒト血漿の凝血活性を回復させるMOD−3012タンパク質の能力を定量した。FIX欠損ヒト血漿300μlを、rhFIX、MOD−3012(FIX−CTP−CTP(CTPがC−末端にタンデムにつながっている))、またはプールヒト正常血漿100μlと混合して、更に希釈した。37℃で60秒間インキュベートした後、組織因子(TF)、CaCl2、およびリン脂質を混合物に添加した。秒単位の凝血時間を測定した。MOD3012の用量反応曲線を、rhFIXまたはヒト血漿からなる参照調製物に比較することにより、効能を評価した。FIX活性の1単位を、ヒト正常血漿1mlの活性と等しいFIX量として定義した。
【0227】
MOD3012の凝固活性が、プールヒト正常血漿よりもわずか1.4小さく、rhFIXと類似していることが、表示されたaPTT結果から示される(図10)。aPTTの結果をインビトロアッセイでの色素生成活性と合わせると、MOD−3012精製が、活性を損なわなかったことが示唆される。
【0228】
MOD3012の薬物動態活性
【0229】
精製MOD3012、rhFIX(アメリカン・ダイアグノスティックス)ならびにMOD3012およびMOD3011(FIX−CTP)を含むハーベストを、スプラグー・ドーリー・ラット(8匹/物質)に用量100μg/kg体重で、単回の静脈内注射で投与した。
【0230】
【表7】

【0231】
血液試料を、投与の0.083、0.5、2、4、7、10、24、48、および72時間後に、4匹ずつ交替で後眼窩から採取した。採取後直ちにクエン酸血漿(0.32%)を調製して、分析まで−20℃で貯蔵した。ヒトFIX Elisaキット(アフィニティー・バイオロジカルズ)を用いて、FIX濃度を定量した。各タンパク質ごとに薬物動態プロファイルを、各時間での動物4匹の平均値として計算した(図11)。最終半減期を、PKソルーション2.0ソフトウエアを用いて計算した。表3は、異なる採取時間で観察されたFIX濃度をまとめている。PKパラメータの要約を、表4にもまとめる。
【0232】
【表8】

【0233】
【表9】

【0234】
MOD−3012ハーベストは、MOD3011ハーベストに比較して、改善されたPKプロファイルを示した。更に、精製MOD−3012は、rhFIXに比較して、T1/2β値の3倍増加およびAUCの4.5倍増加を示した。
【0235】
1個のCTPの融合物に対比して、2個のCTP分子をタンデムに融合した分泌FIX量が低値であったのは、余分なCTPの付加によるものであり、ELISAによる検出量の低下のためではないと思われる。この仮説は、ブラッドフォードアッセイでの精製MOD−3012計算濃度が、得られたELISA計算濃度と類似していることに基づいている。
【0236】
MOD3012凝血活性は、プールヒト血漿と類似していたが、インビトロ色素生成活性は、rhFIXまたはプールヒト血漿に比較して有意に低かった。色素生成活性アッセイは、凝固アッセイに比較して、非常に感度の高いアッセイであると報告されている。MOD3012の活性低下の原因は、様々であろう。CTPの付加によりFIXaへの親和力が低下したか、または翻訳後修飾が低減した(例えば、12−10個のGLA残基およびプロペプチドの開裂)。N−末端分析により、MOD−3012プロペプチドのタンパク質分解開裂が、分泌前に完全に終了していないことが明らかとなった。この翻訳後修飾は、タンパク質の正常な酵素活性にとって重大であるため、フリン−PACEプラスミドとのコトランスフェクションは好適であり、MOD3012活性を向上させる可能性がある。
【0237】
最後に、ラットにおけるMOD−3012のPK比較試験で、FIXのC−末端への2個のタンデムなCTPの融合が、半減期の長いFIXを生成することを実証した。MOD−3012のPK特性をFIX−FCまたはFIX−FP(拮抗する組換えタンパク質;以下の表5)に比較すると、MOD3012が、FIX−FPに比較して向上したT1/2を有するが、FIX−FCに比較すると低いT1/2を有することが示される。
【0238】
【表10】

【0239】
FIX欠失マウスモデル
【0240】
インビボ活性モデルを評価するために、FIXノックアウトマウスを得て、繁殖コロニーを確立した。市販の組換えhFIX(ベネフィックス(Benefix))またはrFIX−(CTP)2(MOD−3012)のいずれか10μgを、麻酔を施したFIXノックアウトマウス(22〜28g)の尾静脈に注射した。注射されたタンパク質の量は、正常な血漿の必要なFIX濃度と等しい(5μg/ml)。血液試料を、特定の時間に、剃毛した尾からへパリン付加キャピラリーチューブに採取した。血漿試料を、ELISAによりFIXレベルについて評価し、有効性をaPTT凝固アッセイにより測定した。
【0241】
FIXプロペプチド開裂有効性の上昇:CTPペプチドのcDNAを、ヒトFIX cDNAの3’末端に融合した。対応するrFIXおよびフリン発現構造体を、Dg44細胞にコトランスフェクトして、ヒトrFIX cDNAも、対照としてフリンプラスミドとコトランスフェクトした。細胞内のフリンプロテアーゼ量が限定されているため、高レベルのFIXが分泌されると、前駆因子と成熟因子FIXとの混合物の分泌が誘導される。フリン発現ベクターと前駆因子発現ベクターとのコトランスフェクションにより、回収量が増加して、完全に処理されたFIXが培地に分泌されるようになる。
【0242】
FIX−(CTP)2とフリンとのコトランスフェクションに続いて、安定したクローンを生成させて、プロペプチドの開裂評価のためにハーベストを回収する。プレシジョン・プラス・デュアル・カラー・プロテイン・マーカー(バイオ・ラッド)を用いて、タンパク質100ngを、12%トリス−グリシンゲルに負荷した。抗ヒトFIXポリクローナル抗体(アメリカン・ダイアグノスティックス)および抗プロペプチドポリクローナル抗体を用いたウェスタン免疫ブロットにより、SDS−PAGE分析を実施した。過去に報告された通り、rhFIXは55KDaに移動し、2個のCTPに融合されたFIXは75KDaに移動した。FIX−タンパク質のバリアントは両者とも、適切で完全なプロペプチド開裂を受けたことが示される。
【0243】
適切なプロペプチド開裂が、FIX−(CTP)2酵素活性を向上させるか否かを決定するために、フリンとコトランスフェクトされたFIX−(CTP)2ハーベストの色素生成活性と凝固活性との比較評価を実施する。FIX−(CTP)2特異的活性の有意な向上が観察され、それがrhFIXと類似していることが観察された。
【0244】
結論として、本明細書に記載された結果から、MOD−3012が、血友病B患者の処置に効率的に用いられうることが示唆される。CTP構造体に融合されたFIXは、特定のインビトロ測定での欠点を克服する、インビボ薬理学的性能の向上により有益である。この提案された処置は、注入速度に関してこれまでの処置よりも有利であり、必要な用量が低減される。
【0245】
アルブミン融合分子の方策を用いてFIX半減期を向上させた(延長させた)場合に、組換えFIXが不活性になったことに留意することが重要である。本発明の新規アプローチを用いれば、向上させた長期持続性活性を示す新規な組換えFIX融合タンパク質の設計および精製がもたらされる。これまで、サイズの改変だけでは、注入FIXの薬物動態は向上しなかった。FIXに融合されたCTPが薬物動態パラメータを促進するという結果は、予期されなかった。高グリコシル化ペプチドのシアル酸残基の存在により、タンパク質が安定化し、FIX機能の重要な決定因子を抑制せずに、それと血管受容体と相互作用が予防された。
【0246】
FIX−CTPは、血友病B患者においてrFIXと類似の治療有効性を有し、必要な投与頻度を低減する。FIX−CTPの単回注射により、出血エピソードが十分に抑制されること、および血友病B患者の外科的介入の際に必要となる注射頻度が低減することも考えられる。
【0247】
実施例2
【0248】
[凝固因子FVIIの生成および使用]
【0249】
組換え第VIIa凝固因子(ノボセブン(NovoSeven))(FVIIa)は市販されており、血友病患者の出血エピソードを阻害剤で処置するために1996年に認可された。しかしrFVIIaは、重大な欠点を有しており、つまりrFVIIaは、最終半減期2,5時間で急速に消失された。その結果、患者は一般に、軽度〜中等度の出血の後、適切な止血を遂げるためには、複数回の頻繁な点滴を必要とした(2〜3時間間隔で2〜3回投与)。
【0250】
本明細書では、半減期の長い組換えFVIIa−CTP分子の生成は、記載された通り、ヒトCTPへのFVIIaの融合に基づいている。組換えFVIIa−CTPを哺乳類細胞で発現させて、インビトロおよびインビボで特徴づけた。rFVII−CTP活性がrFVIIと同等であることが実証され、ラットにおける薬物動態および有効性試験により、rFVIIa−CTPの改善された特性が実証された。この試験結果から、野生型酵素と非常に類似した止血性を有する半減期の長いrFVIIa分子の開発が実現可能であることが実証された。
【0251】
組換えFVII分子のクローニングおよび発現:複数の第VII因子のクローンを、我々の真核生物発現ベクター(pCI−dhfrr)内に構築した(図1)。ヒト第VII凝固因子の配列を含むヒトMGC検査済みFL cDNAクローン(IRCM)を、オープンバイオシステムズ(Open Biosystems)(OB−MHS4426)から取り寄せた。以下のプライマーは、以下の配列でシグマ・ジェノシス(Sigma-Genosys)により合成された;プライマー67:5’CTCGAGGACATGGTCTCCCAGGCCC3’(第VII因子DNAの5’末端およびXhoIの制限部位を含む)(配列番号5);プライマー68R:5’TCTAGAATAGGTATTTTTCCACATG3’(XbaIの制限部位を含む)(配列番号6);プライマー69:5’TCTAGAAAAAAGAAATGCCAGC3’(XbaIの制限部位を含む)(配列番号7);およびプライマー70R:5’GCGGCCGCATCCTCAGGGAAATGGGGCTCGCA3’(第VII因子DNAの3’末端およびNotIの制限部位を含む)(配列番号8)。
【0252】
2組のPCR反応において、クローニングを実施した。最初の反応は、プライマー67およびプライマー68Rを用いて実施し、第VII因子配列を含むcDNAプラスミド(OB−MHS4426)をテンプレートとして用い、PCR増幅の結果、約534bpの生成物が形成され、それを単離して、TAクローニングベクター(インビトロジェン、カタログ番号 K2000−01)に連結させた。第VII因子配列のアミノ末端を含むXhoI−XbaIフラグメントを単離した。第二の反応は、プライマー69およびプライマー70Rを用いて実施し、同じく第VII因子配列を含むcDNAプラスミド(OB−MHS4426)をテンプレートとして用い、PCR増幅の結果、約813bpの生成物が形成され、それをTAクローニングベクター(インビトロジェン、カタログ番号 K2000−01)に連結させた。第VII因子配列のカルボキシ末端を含むXbaI−NotIフラグメントを単離した。2個のフラグメントを我々の真核生物発現ベクターpCI−dhfrに挿入して(トリプルライゲーション)、501−0−p136−1クローンを生成させた。
【0253】
プラスミド501−p136−1(pCI−dhfrベクター内の第VII因子)を、制限酵素XhoIおよびKpnIで消化した。約1186bpのフラグメントを単離した。部分的な第VII因子クローン(1180bp〜1322bp)に続くCTP配列、末端配列、およびジーンアート(GeneArt)により合成されたNotI配列(0721543)を、制限酵素KpnIおよびNotIで消化した。約253bpのフラグメントを単離した。2個のフラグメントを我々の真核生物発現ベクターpCI−dhfrに挿入して(トリプルライゲーション)、501−1−p137−2クローンを生成させた。pCI−dhfr−701−2−p24−2を、制限酵素XhoIおよびApaIで消化して、大きなフラグメント(ベクター)を単離した。
【0254】
pCI−dhfr−501−2−p137−2(第VII因子−ctp×1)を、制限酵素XhoIおよびApaIで消化して、約1200bp挿入物を単離した。ベクターと挿入物とを連結させて、501−2−p139−2を生成させた。Dg44細胞を100mm組織培養皿に添加して、50〜60%コンフルエンスになるまで増殖させた。無タンパク質培地(インビトロジェン CD Dg44)中のヒュージーン試薬(ロッシュ)を用いた100mmプレート 1枚のトランスフェクションに、合計2μgのDANを用いた。トランスフェクションの48時間後に培地を除去して、ヌクレオシドを含まない無タンパク質培地(インビトロジェン CD Dg44)と交換した。14日後に、トランスフェクトされた細胞集団をT25組織培養フラスコに移して、細胞が安定したクローンとして十分に増殖し始めるまで、10〜14日間、選別を継続した。高発現クローンを選別し、細胞 約2×107個を用いて、ビタミンK3 5ng/ml(メナジオン重硫酸ナトリウム;シグマ)を補足した1700cm2丸底フラスコ(コーニング、コーニングNY)内の増殖培地300mlに播種した。細胞生存性が約70%に急速低下した後、生成培地(ハーベスト)を回収した。生成培地を、最初、透明化させ、その後、約20倍に濃縮し、流動ろ過カセット(10KDaMWCO、ミリポア社、マサチューセッツ州ビレリカ)を用いて、PBSで透析した。
【0255】
FVII抗原レベルの測定
【0256】
CTPペプチドをコードするcDNAを、ヒトFVIIをコードするcDNAの3’末端に融合した。対応するrFVII構造体を、Dg44細胞にトランスフェクトした。対照として、ヒトrFVII cDNAを用いた。生成培地(ハーベスト)を回収し、濃縮して、分泌された組換えFVIIを更に評価した。rFVII、rFVII−CTPおよびrFVII−CTP−CTPの抗原レベルを、アッセイマックスヒトFVII ELISAキット(アッセイプロ)により測定した(図2A)。rFVII−CTPおよびrFVII−(CTP)2の分泌レベルは、天然型rFVIIに比較して、有意差が存在しなかった。
【0257】
SDS−PAGEブロット
【0258】
ハーベスト、精製また活性化されたrFVIIタンパク質のいずれか50ngを負荷することにより、SDS−PAGE分析を実施した。プレシジョン・プラス・デュアル・カラー・プロテイン・マーカー(バイオ・ラッド)を用いて、試料を12%トリス−グリシンゲルに負荷した。抗ヒトFVIIモノクローナル抗体(R&Dシステムズ)またはウサギで生成された抗−CTPポリクローナル抗体を用いたウェスタン免疫ブロットを実施することにより、SDS−PAGE分析を実施した。
【0259】
rFVII抗原レベルは、抗FVIIAbを免疫ブロットされたSDS−PAGEで検出されたタンパク質レベルと相関した。rFVII−CTPは単一バンドとして移動し、FVII対照の対応する分子量は約52KDaであり、両者のタンパク質は免疫ブロットでFVIIに特異的な抗体と反応した。rFVII−CTPは、CTPに特異的な抗体とも反応した。rFVIIは、活性化タンパク質を全く含まないチモーゲン形態で分泌された。
【0260】
FVII色素生成活性:
【0261】
市販の色素生成キット(アッセイセンス・ヒトFVII色素生成活性アッセイキット(AssaySense Human FVII chromogenic Activity assay kit)(アッセイプロ))を用いて、rFVII、rFVII−CTPおよびrFVII−(CTP)2ハーベストの活性を測定した。rFVII−CTPおよび更に活性化された(FVIIa)の能力を機能的に特徴づけるために、第X因子を第Xa因子に活性化してFXa特異性基質の存在下で定量シグナル(アッセイプロ)を放出する、TF/FVIIaの能力を測定するための市販の色素生成検査キットに、濃縮されたrFVII−CTP(ハーベスト)を添加した。rFVIIタンパク質のC−末端にCTPペプチドを付加しても、セリンプロテアーゼ活性は損なわれなかった(図2B、C)。
【0262】
FVII凝血活性:
【0263】
プロトロンビン時間(PT)は、凝固の外因系経路を測定する。PTは、外因系経路の活性化剤、リン脂質およびカルシウムの添加後に血漿が凝結するまでにかかる時間(秒で測定)である。具体的にはワルファリン投与量、肝障害、およびビタミンK状態の指標として、血液の凝血傾向を測定するのに、それが用いられる。プロトロンビン時間の参照範囲は通常、約12〜15秒である。具体的には、そのアッセイでは、rhFVIIの添加により、FVII欠失ヒト血漿の凝血活性を回復させるFVII−CTPおよびFVII−(CTP)2ハーベストの能力を定量した。FVII欠損ヒト血漿300μlを、特定の濃度のFVII、FVII−CTPおよびFVII−(CTP)2ハーベスト、またはプールヒト正常血漿100μlと混合して、更に希釈した。37℃で60秒間インキュベートした後、組織因子(TF)、CaCl2、およびリン脂質を混合物に添加した。秒数の凝血時間を測定した。FVII−CTPおよびFVII−(CTP)2ハーベストの用量反応曲線を、rhFVIIまたはプールヒト血漿からなる参照調製物に比較することにより、効能を評価した。活性FVIIの1単位を、ヒト正常血漿1mlの活性と等しいFVIIの量と定義した。rFVIIおよびrFVII−CTPのPT凝血活性を、コアグロメータ(インストゥルメンテーション・ラボラトリー(Instrumentation Laboratory))で測定した。
【0264】
これまで示された通り、rFVIIタンパク質のC−末端でのCTPペプチドの付加は、セリンプロテアーゼ活性を損なわず、ヒト血漿中の天然型第X因子および第IX因子の始動および活性化を誘導した。C−末端の更なるCTPにより、セリンプロテアーゼの3倍低下が観察された(図2D)。
【0265】
薬物動態試験:rFVII、rFVII−CTP、およびrFVII−(CTP)2ハーベストを、スプラグー・ドーリー・ラット(6匹/物質)に用量100μg/kg体重で静脈内投与した。インビボ実験全てで、各タンパク質の量を、FVIIElisaキットに基づいて測定した。rFVII−CTPに対するrFVIIの分子量の差を考慮して異なるモル濃度を誘導することにより、各FVII被験物質ごとに注射量を計算した。
【0266】
試料採取手順により定量されるレベルが妨害されるのを最小限に抑えるために、交替での試料採取スキームを利用して、つまり30分後、90、2、6および48時間後にラット3匹から、そして15、60分後、および1.5、4、24時間後に残りの3匹から交替で、血液試料を後眼窩から採取した。試料採取後直ちに血漿を調製して、分析まで−20℃で貯蔵した。FVII濃度を、FVII Elisa特異性アッセイにより定量した。線形台形公式を用いて、半減期および曲線下面積(AUC)を計算した。これらのクリアランスパラメータの比較により、インビボ半減期およびrFVII−(CTP)2 AUCが、rFVIIのものよりも有意に高いことが明らかとなった(表8)。
【0267】
【表9】

【0268】
組換えFVIIa−CTPの特徴づけ:
【0269】
FVIIは、活性化の際にR152で開裂されて、1本のジスルフィド架橋により連結された重鎖および軽鎖ドメインを生じる。rFVIIa−(CTP)2を精製して、イオン交換カラム精製法により活性化させる。rFVIIa−(CTP)2を完全に評価するために、市販のFVIIa(ノボセブン(登録商標))へ換算する(reducing)条件下で、タンパク質をSDS−PAGEに負荷する。重鎖および軽鎖ドメインは分離して、分子量55KDaおよび25KDaの別個のバンドとして移動する。両方のタンパク質は、FVIIに特異的な抗体と反応するが、rFVIIa−CTPの重鎖は、抗CTP特異性抗体と反応するため、このバンドが、CTPに融合されたFVII重鎖を表すことが示される。軽鎖は、抗γ−カルボキシラーゼAbと特異的に反応する。FVIIa特異性Elisaキットにより、FVIIaタンパク質濃度を測定する。
【0270】
FVIIaのN−末端配列決定
【0271】
活性化またはチモーゲン精製されたタンパク質中のrFVIIa−CTP−CTPを、SDS−PAGE(12%トリス−グリシンで)により分離し、続いてPVDF膜にエレクトロブロットする。該当するバンドを切り出して、精製されたバイオブレーン処理のガラス繊維フィルター上に載せる。140C HPLCマイクログラジエントシステムを具備したパルス液相プロテインシーケンサーを用いて、エドマン分解によりN−末端配列分析を実施する。N−末端配列決定により、組換えタンパク質および適切なプロペプチド開裂の同定を、更に検証する。
【0272】
FVIIa凝血活性:
【0273】
rFVIIa−(CTP)2凝固活性を評価するために、活性化部分トロンボプラスチン時間アッセイ(aPTT)を実施する。FVIII欠損血漿試料に代えてrFVIIa(ノボセブン)またはrFVIIa−(CTP)2を用い、FVII欠損ヒト血漿300μlを、特定の濃度のFVIIaもしくはFVIIa−(CTP)2、またはプールヒト正常血漿 100μlと混合して、更に希釈した。37℃で60秒間インキュベートした後、組織因子(TF)、CaCl2、およびリン脂質を混合物に添加する。秒数の凝血時間を測定する。rFVIIa−(CTP)2の用量反応曲線を、rhFVIIaまたはプールヒト正常血漿からなる参照調製物に比較することにより、効能を評価する。FVIIaの1単位を、ヒト正常血漿1mlの活性と等しいFVIIaの量と定義した。rFVIIおよびrFVIIa−(CTP)2のaPTT凝血活性を、コアグロメータ(インストゥルメンテーション・ラボラトリー)で測定する。rFVIIaとrFVIIa−(CTP)2のaPTT凝血活性は、類似している。
【0274】
ラットにおける薬物動態試験:
【0275】
長期作用能力(longevity potential)に対する、rFVIIaへのCTP付加の影響を特徴づけるために、ラットにおける薬物動態の比較試験を実施する。TBS中のノボセブン(rFVIIa)およびrFVIIa−(CTP)2を、SDラット6匹にIV注射する。FVIIa Elisaキットを用いて、FVIIaの経時的レベルを検出する。半減期およびAUCを、各タンパク質ごとに計算する。これらのクリアランスパラメータの比較により、rFVIIa−(CTP)2の半減期、回収率、およびAUCのインビボ測定値が、ノボセブンのそれらよりも優れていることが明らかとなる。
【0276】
FVIIa−CTPのインビボ有効性モデル:
【0277】
rFVIIa−(CTP)2のインビボ活性を評価するため、凝固因子のGlaドメインのビタミンK依存性γ−カルボキシル化を阻害するためにSDラット6匹をフェンプロクモンで処置する。FVIIIの半減期は短いため、天然型FVIIIは、他のビタミンK依存性凝固因子よりも急速に枯渇される。16時間後に、FVIII活性が、ほぼ完全に枯渇されたことが示される。この時点で、FVIIaを外部から添加すれば、ラットにおける凝血時間の低減が修正される。ノボセブンとrFVIIa−(CTP)2とを比較するために、同じ用量の両タンパク質を、フェンプロクモン処置の16時間後にラットに注射する。ラット血液の凝血時間は、両方の組換えタンパク質により正常値に修正される。つまり、両タンパク質は、このモデルにおいて同等の効果を示す。
【0278】
別々の実験で、ノボセブンおよびrFVIIa−(CTP)2を、フェンプロクモン処置後直ちに注射するが、凝固パラメータは16時間後に測定する。ノボセブンは、半減期が短いため、凝固時間をこれらの条件下で修正しない。それとは逆に、rFVIIa−(CTP)2で処置された動物の凝血時間は、健常対照の値の近似値に修正される。これは、rFVIIa−(CTP)2が依然として存在し、より長期間経過した後も生物活性を保持することを示している。更に、CTP修飾rFVIIaを用いることの大きな利益が、このデータから確認される。FIX欠失マウスモデル(未だ実施していない):
【0279】
FVIII血友病マウスモデル:
【0280】
インビボ活性モデルを評価するために、FVIIノックアウトマウスを得て、繁殖コロニーを確立する。市販の組換えhFVIIa(ノボセブン)またはrFVIIa−(CTP)2のいずれか10μgを、麻酔を施したFVIIIノックアウトマウス(22〜28g)の尾静脈に注射する。注射されたタンパク質の量は、正常血漿の必要なFVIII濃度と等しい(5μg/ml)。血液試料を、特定の時間に、剃毛された尾からへパリン付加キャピラリーチューブに採取する。血漿試料を、ELISAによりFVIIaレベルについて評価し、有効性をaPTT凝固アッセイにより測定する。
【0281】
この試験では、FVIIとCTPとの融合構造体を生成させる。この組換えタンパク質は、長い半減期と適切で好ましい治療的効能の持続とを提供する処置の主薬である。
【0282】
これらの結果から、rFVIIa−(CTP)2が、血友病患者のrFVIIaと類似の治療有効性を有することが示唆される。その上、このテクノロジーは、必要とする投与頻度を低減する。rFVIIa−(CTP)2の単回注射が、出血エピソードを十分に制御し、外科的介入の際に必要となる注射の頻度を低減すると考えられる。この組換えタンパク質は、長期予防的処置として用いられる可能性がある。
【特許請求の範囲】
【請求項1】
凝固因子と、前記凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端ペプチド(CTP)とを含むポリペプチド。
【請求項2】
前記ペプチドが、凝固因子と、前記凝固因子のカルボキシ末端に結合した1〜2個のゴナドトロピンカルボキシ末端ペプチド(CTP)とを含むことを特徴とする請求項1に記載のポリペプチド。
【請求項3】
少なくとも1個の前記CTPの配列が、配列番号1および配列番号2からなる群より選択されるアミノ酸配列を含むことを特徴とする請求項1に記載のポリペプチド。
【請求項4】
前記少なくとも1個の前記CTPが、グリコシル化されていることを特徴とする請求項1に記載のポリペプチド。
【請求項5】
前記少なくとも1個の前記CTPが、トランケートされていることを特徴とする請求項1に記載のポリペプチド。
【請求項6】
前記少なくとも1個の前記CTPが、リンカーを介して前記凝固因子に結合されていることを特徴とする請求項1に記載のポリペプチド。
【請求項7】
前記リンカーが、ペプチド結合であることを特徴とする請求項6記載のポリペプチド。
【請求項8】
前記凝固因子が、ビタミンK依存性糖タンパク質であることを特徴とする請求項1に記載のポリペプチド。
【請求項9】
前記凝固因子が、第IX因子であることを特徴とする請求項1に記載のポリペプチド。
【請求項10】
前記凝固因子が、第VII因子であることを特徴とする請求項1に記載のポリペプチド。
【請求項11】
前記凝固因子が、第VIIa因子、第VIII因子、または組換えBドメイン欠失第VIII因子(rFVIIIBDD)であることを特徴とする請求項1に記載のポリペプチド。
【請求項12】
請求項1に記載のポリペプチドを含む医薬組成物。
【請求項13】
凝固因子と、前記凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドをコードするコーディング部分を有するポリヌクレオチド分子。
【請求項14】
前記ポリペプチドが、凝固因子と、前記凝固因子のカルボキシ末端に結合した1〜2個のゴナドトロピンカルボキシ末端ペプチド1とを含むことを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項15】
少なくとも1個の前記CTPが、トランケートされていることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項16】
少なくとも1個の前記CTPが、配列番号1および配列番号2からなる群より選択されるアミノ酸配列によりコードされていることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項17】
前記凝固因子が、ビタミンK依存性糖タンパク質であることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項18】
前記凝固因子が、第IX因子であることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項19】
前記凝固因子が、第VII因子であることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項20】
前記凝固因子が、第VIIa因子、第VIII因子、または組換えBドメイン欠失第VIII因子(rFVIIIBDD)であることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項21】
請求項13に記載のポリヌクレオチド分子を含む発現ベクター。
【請求項22】
請求項21に記載の発現ベクターを含む細胞。
【請求項23】
請求項21に記載の発現ベクターを含む組成物。
【請求項24】
凝固因子の生物学的半減期を延長させる方法であって、
凝固因子のカルボキシ末端に対して、少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)を結合させるステップを含み、
それにより、前記凝固因子の生物学的半減期を延長させるようにしたことを特徴とする方法。
【請求項25】
凝固因子の曲線下面積(AUC)を増大させる方法であって、
凝固因子のカルボキシ末端に対して、少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)を結合させるステップを含み、
それにより、前記凝固因子の曲線下面積(AUC)を増大させるようにしたことを特徴とする方法。
【請求項26】
凝固因子の投与頻度を低減させる方法であって、
凝固因子のカルボキシ末端に対して、少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)を結合させるステップを含み、
それにより、前記凝固因子の投与頻度を低減させるようにしたことを特徴とする方法。
【請求項27】
凝固因子療法の利用における服薬遵守を向上させる方法であって、
凝固因子と、前記凝固因子のカルボキシ末端に結合した少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、対象に提供するステップを含み、
それにより、凝固因子療法の利用における服薬遵守を向上させるようにしたことを特徴とする方法。
【請求項28】
血友病を患っている対象を治療する方法であって、
凝固因子と、前記凝固因子のカルボキシ末端に結合した少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含んでなるポリペプチドを前記対象に提供するステップを含み、
それにより、前記対象を治療するようにしたことを特徴とする方法。
【請求項29】
前記凝固因子のカルボキシ末端に対して、1または2個の絨毛性ゴナドトロピンカルボキシ末端ペプチドを結合させるステップを含むことを特徴とする請求項24〜28記載の方法。
【請求項30】
少なくとも1個の前記絨毛性ゴナドトロピンカルボキシ末端ペプチドの配列が、配列番号1および配列番号2からなる群より選択されるアミノ酸配列によりコードされていることを特徴とする請求項24〜28に記載の方法。
【請求項1】
凝固因子と、前記凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端ペプチド(CTP)とを含むポリペプチド。
【請求項2】
前記ペプチドが、凝固因子と、前記凝固因子のカルボキシ末端に結合した1〜2個のゴナドトロピンカルボキシ末端ペプチド(CTP)とを含むことを特徴とする請求項1に記載のポリペプチド。
【請求項3】
少なくとも1個の前記CTPの配列が、配列番号1および配列番号2からなる群より選択されるアミノ酸配列を含むことを特徴とする請求項1に記載のポリペプチド。
【請求項4】
前記少なくとも1個の前記CTPが、グリコシル化されていることを特徴とする請求項1に記載のポリペプチド。
【請求項5】
前記少なくとも1個の前記CTPが、トランケートされていることを特徴とする請求項1に記載のポリペプチド。
【請求項6】
前記少なくとも1個の前記CTPが、リンカーを介して前記凝固因子に結合されていることを特徴とする請求項1に記載のポリペプチド。
【請求項7】
前記リンカーが、ペプチド結合であることを特徴とする請求項6記載のポリペプチド。
【請求項8】
前記凝固因子が、ビタミンK依存性糖タンパク質であることを特徴とする請求項1に記載のポリペプチド。
【請求項9】
前記凝固因子が、第IX因子であることを特徴とする請求項1に記載のポリペプチド。
【請求項10】
前記凝固因子が、第VII因子であることを特徴とする請求項1に記載のポリペプチド。
【請求項11】
前記凝固因子が、第VIIa因子、第VIII因子、または組換えBドメイン欠失第VIII因子(rFVIIIBDD)であることを特徴とする請求項1に記載のポリペプチド。
【請求項12】
請求項1に記載のポリペプチドを含む医薬組成物。
【請求項13】
凝固因子と、前記凝固因子のカルボキシ末端に結合した1〜5個のゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドをコードするコーディング部分を有するポリヌクレオチド分子。
【請求項14】
前記ポリペプチドが、凝固因子と、前記凝固因子のカルボキシ末端に結合した1〜2個のゴナドトロピンカルボキシ末端ペプチド1とを含むことを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項15】
少なくとも1個の前記CTPが、トランケートされていることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項16】
少なくとも1個の前記CTPが、配列番号1および配列番号2からなる群より選択されるアミノ酸配列によりコードされていることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項17】
前記凝固因子が、ビタミンK依存性糖タンパク質であることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項18】
前記凝固因子が、第IX因子であることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項19】
前記凝固因子が、第VII因子であることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項20】
前記凝固因子が、第VIIa因子、第VIII因子、または組換えBドメイン欠失第VIII因子(rFVIIIBDD)であることを特徴とする請求項13記載のポリヌクレオチド分子。
【請求項21】
請求項13に記載のポリヌクレオチド分子を含む発現ベクター。
【請求項22】
請求項21に記載の発現ベクターを含む細胞。
【請求項23】
請求項21に記載の発現ベクターを含む組成物。
【請求項24】
凝固因子の生物学的半減期を延長させる方法であって、
凝固因子のカルボキシ末端に対して、少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)を結合させるステップを含み、
それにより、前記凝固因子の生物学的半減期を延長させるようにしたことを特徴とする方法。
【請求項25】
凝固因子の曲線下面積(AUC)を増大させる方法であって、
凝固因子のカルボキシ末端に対して、少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)を結合させるステップを含み、
それにより、前記凝固因子の曲線下面積(AUC)を増大させるようにしたことを特徴とする方法。
【請求項26】
凝固因子の投与頻度を低減させる方法であって、
凝固因子のカルボキシ末端に対して、少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチド(CTP)を結合させるステップを含み、
それにより、前記凝固因子の投与頻度を低減させるようにしたことを特徴とする方法。
【請求項27】
凝固因子療法の利用における服薬遵守を向上させる方法であって、
凝固因子と、前記凝固因子のカルボキシ末端に結合した少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含むポリペプチドを、対象に提供するステップを含み、
それにより、凝固因子療法の利用における服薬遵守を向上させるようにしたことを特徴とする方法。
【請求項28】
血友病を患っている対象を治療する方法であって、
凝固因子と、前記凝固因子のカルボキシ末端に結合した少なくとも1個の絨毛性ゴナドトロピンカルボキシ末端ペプチドとを含んでなるポリペプチドを前記対象に提供するステップを含み、
それにより、前記対象を治療するようにしたことを特徴とする方法。
【請求項29】
前記凝固因子のカルボキシ末端に対して、1または2個の絨毛性ゴナドトロピンカルボキシ末端ペプチドを結合させるステップを含むことを特徴とする請求項24〜28記載の方法。
【請求項30】
少なくとも1個の前記絨毛性ゴナドトロピンカルボキシ末端ペプチドの配列が、配列番号1および配列番号2からなる群より選択されるアミノ酸配列によりコードされていることを特徴とする請求項24〜28に記載の方法。
【図1】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公表番号】特表2012−532601(P2012−532601A)
【公表日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願番号】特願2012−519119(P2012−519119)
【出願日】平成22年7月1日(2010.7.1)
【国際出願番号】PCT/IL2010/000532
【国際公開番号】WO2011/004361
【国際公開日】平成23年1月13日(2011.1.13)
【出願人】(512005715)プロラー・バイオテック・インコーポレイテッド (1)
【Fターム(参考)】
【公表日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願日】平成22年7月1日(2010.7.1)
【国際出願番号】PCT/IL2010/000532
【国際公開番号】WO2011/004361
【国際公開日】平成23年1月13日(2011.1.13)
【出願人】(512005715)プロラー・バイオテック・インコーポレイテッド (1)
【Fターム(参考)】
[ Back to top ]

