長期間送達製剤及びその使用方法
【課題】患者が長期間の薬物投与計画に従うのを手助けするための長期間徐放製剤及びその使用方法を提供する。
【解決手段】本発明は、薬物投与計画を順守することが不確かな患者の神経系疾患(特に精神病性障害)を治療するために、薬物を治療効果がある一定の濃度で長期間放出するための方法、キット、及び組成物を提供する。生分解性ポリマーと複合した薬物の製剤を使用し、該生分解性ポリマーは乳酸・グリコール酸共重合体(PLGA)であり得る。
【解決手段】本発明は、薬物投与計画を順守することが不確かな患者の神経系疾患(特に精神病性障害)を治療するために、薬物を治療効果がある一定の濃度で長期間放出するための方法、キット、及び組成物を提供する。生分解性ポリマーと複合した薬物の製剤を使用し、該生分解性ポリマーは乳酸・グリコール酸共重合体(PLGA)であり得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体分解性基質及び作用物質から構成される、長期間に渡る送達を行う製剤(long-term delivery formulation)、その製造方法、及びその使用方法に関するものである。また、本発明は、精神病性障害を治療するために、リスペリドン又は9−OH−リスペリドン成分を長期間送達する製剤に関するものである。
【背景技術】
【0002】
精神病性障害(psychotic disorder)は脳の病気であり、認識力、情緒又は気分の異常、特に他人と交流する、付き合う又は親密になる能力の異常を引き起こす識別可能な症状を特徴とする。これらの病気の、重症度、存続期間、及び機能障害は様々である。長い間、世界中のあらゆる年齢層で、大勢の人々が精神病性障害に苦しめられており、多大な人的被害と、生産性の損失による経済的負担とがもたらされている。ある場合では、精神病性障害は急性であり、数週間又は数ヶ月間しか続かない。他の場合では、精神病性障害は慢性であり、数年又は数十年続く。
【0003】
神経科学及び分子生物の両分野における研究の進歩によって、精神病性障害の治療に薬物を使用することが著しく増加した。さらに、前記分野の進歩によって、精神病及び他の脳の病気をより効果的に治療でき、付随する副作用が少ない、新規な薬物の製造及び送達機構がもたらされた。
【0004】
服薬の不履行は、様々な形態の病気で蔓延する問題である。薬がクロルプロマジンやハロペリドールなどの神経安定薬(抗精神病薬)の場合は、服薬の不履行によって、重大な医学上及び社会上の問題を引き起こされる(非特許文献1)。精神病性障害の患者が指示された投薬計画に従わないのには、多くの理由がある。患者の1/4〜2/3は、服薬を中断する理由として、副作用を挙げている(非特許文献2)。その他の患者は、家族の支援の欠如を挙げている(Robinson et al., 2002)。他の研究では、入院患者及び外来患者の両方において、精神病の重症度を服薬不履行と直接的に結び付けている(非特許文献3)。統合失調症の患者が再発及び入院する最も強い前兆は、抗精神病薬を服用する治療計画の不履行である(非特許文献4、非特許文献5)。他の研究では、さらに高い服薬不履行の発生率が報告されている(最大55%)。英国では、神経安定薬の服薬の順守率は約50%であると、研究者は結論づけている(This rate of non-consumption of prescribed medications suggests that, for many individuals, non-compliance holds more benefits than compliance,非特許文献1 p. 1315)。
【0005】
精神的健康における服薬不履行による医療費の経済的及び社会的負担は、年間23億ドルと推定される(Menzin et al., 2003)。患者が長期間の薬物投与計画に従うのを手助けする治療や、患者から意思決定プロセスを取り除いた治療は、臨床転帰を大幅に向上させるであろう。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Rogers, A. et al. [1998], "The meaning and management of neuroleptic medication: A study of patients with a diagnosis of schizoplwenia," Social Science and Medicine 47 (9): 1313-1323
【非特許文献2】del Campo, E. J. et al. [1983],"Rehospitalized schizophrenics: what they report about illness, treatment andcompliance," J. of Psychosocial Nurs. and Mental Health Sert. 21 (6): 29-33
【非特許文献3】Fenton, W. S, et al. [1997], "Determinants of medication compliance in schizophrenia: empirical and clinical findings," Schizophrenia Bull. 23 (4): 637-651
【非特許文献4】Csernansky JG, Schuchart EK: Relapse andrehospitalization rates in patients with schizophrenia effects of second generation antipsychotics. CNS Drugs 2002, 16: 473-484
【非特許文献5】Doering S, Muller E, Kopcke W, Pietzcker A, Gaebel W, Linden M, Muller P, MulIer-Spalm F, Tegeler J, Schussler G: Predictors of relapse and rehospitalization in schizophrenia and schizoaffective disorder. Schizophr. Bull 1998, 24: 87-98
【発明の開示】
【課題を解決するための手段】
【0007】
ある実施形態では、本発明は、治療を必要とする患者における神経系疾患の治療方法であって、(a)生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤を前記患者に投与するステップと、
(b)生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤を前記患者に投与するステップとを含み、前記第1及び第2の製剤の投与によって、前記薬物の有効血中濃度を約14〜420日間維持するようにした方法を提供する。
【0008】
他の実施形態では、本発明は、治療を必要とする患者における神経系疾患の治療方法であって、(a)生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤を前記患者に投与するステップと、
(b)生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤を前記患者に投与するステップとを含み、前記第1及び第2の製剤の再投与によって、前記薬物の有効血中濃度を恒久的に維持するようにした方法を提供する。
【0009】
別の実施形態では、本発明は、薬物を持続的に送達するためのキットであって、生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤と、生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤とを備えているキットを提供する。
【0010】
他の実施形態では、本発明は、精神病性障害の治療に使用される組成物であって、濃度が約95〜98%(w/w)の乳酸・グリコール酸共重合体(PLGA)と、濃度が約2〜5%(w/w)の抗精神病薬とを含んでおり、前記PLGAにおける乳酸:グリコール酸の比率が約100:0〜50:50であり、前記抗精神病薬はリスペリドン又は9−OH−リスペリドンである組成物を提供する。
【図面の簡単な説明】
【0011】
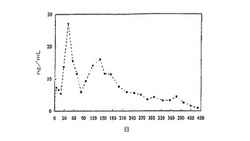
【図1】サルに埋め込まれたPLGAディスクからのハロペリドール放出を示すグラフである(合計443日間)。
【図2】(A)ウサギに埋め込まれた単一のPLGAディスク・システムからのハロペリドール放出を示すグラフである(合計379日間)。(B)複合PLGAディスク・システムからのハロペリドール放出を示すグラフである(合計379日間)。
【図3】インビボにおける、インプラントから放出されたリスペリドンの累計放出量を示すグラフである。
【図4】(A)20%、40%又は60%(w/w)のリスペリドンを有する85:15 PLGAインプラント(50mg)から放出されたリスペリドンの放出特性を示すグラフであり、リスペリドンの累計放出量を表している。(B)20%、40%又は60%(w/w)のリスペリドンを有する85:15 PLGAインプラント(50mg)から放出されたリスペリドンの放出特性を示すグラフであり、各インプラントに充填された薬物に対するパーセントを表している。
【図5】インビトロでの、ディスク又はロッド状のインプラントからの累積放出量を示すグラフである。放出特性の違いは、統計的には無意である。
【図6】6ヶ月間ごとの埋め込みの間に、目的の血清レベル周辺で振動することが予測される、生体分解性インプラントからの連続的送達のモデルを示す。
【図7】(A)単一ポリマーからの予測される放出を示すグラフである。(B)6ヶ月間ごとに再埋め込みされる単一ポリマー基質からの予測される放出を示すグラフである。(C)3ヶ月間の放出ピークを有するメンテナンスセットを併用した場合の、6ヶ月間ごとに再埋め込みされる単一ポリマー基質からの予測される放出を示すグラフである。(D)治療の最初の4ヶ月間を短縮するスターターポリマーセットからの予測される放出を示すグラフである。(E)治療の最初の4ヶ月間を短縮するスターターポリマーセットと、3ヶ月間の放出ピークを有するメンテナンスセットを併用した6ヶ月間ごとに再埋め込みされる単一ポリマー基質との組み合わせからの予測される放出を示すグラフである。
【図8A】40% ハロペリドールを有する75:25 PLGAから成るインプラントより放出されるハロペリドールを示すグラフである。
【図8B】40% ハロペリドールを有する85:15 PLGAから成るインプラントより放出されるハロペリドールを示すグラフである。
【図8C】2つのポリマーシステムから154日間に渡って放出される仮想放出の累計を示すグラフである。
【図9】インプラントの除去前と、除去した48時間後にテストされた自発運動(Locomotor activity)を示すグラフである。
【図10】ハロペリドールPLAが3ヶ月間埋め込まれたラット(3ヶ月間治療されたラット)と、PLAだけが埋め込まれたラットの線条体膜におけるD2受容体タンパクのウエスタンブロット法を示す図である。
【図11】(A)PLGA生体分解性基質中に分散されているリスペリドンの累計放出量を示すグラフである。(B)PLGA生体分解性基質中に分散されている9−OH−リスペリドンの累計放出量を示すグラフである。
【図12】PLA:PGAが85:15のブロック共重合体ポリマー生体分解性基質中に分散されている20%(w/w) 9−OH−リスペリドンの累計放出量を示すグラフである。
【図13】PLA:PGAが85:15のブロック共重合体ポリマー生体分解性基質中に分散されている20%(w/w) リスペリドンの累計放出量を示すグラフである。
【図14A】ラット又はマウスにおけるショックのプレパルス抑制(prepulse inhibition:PPI)によるインビボ行動実験に対するインプラントの効果を示すグラフである。
【図14B】アンフェタミン投与後の、ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するインプラントの効果を示すグラフである。
【図14C】アンフェタミン投与前及び投与後の、ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するリスペリドン・インプラントの効果を示すグラフである。
【図14D】PLA:PGAが85:15のPLGAインプラントからの累計放出量を経時的に示すグラフである。
【図14E】ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するリスペリドン・インプラントの効果を示すグラフである。
【図14F】媒介注入後の、ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するリスペリドン・インプラントの効果を示すグラフである。
【図14G】アンフェタミン投与後の、ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するリスペリドン・インプラントの効果を示すグラフである。
【図15A】PLA:PGAが85:15のPLGAインプラントから放出されるクエチアピンの累計放出量を経時的に示すグラフである。
【図15B】アンフェタミン注入前及び注入後の、対照に対してにインプラントからのクエチアピンの放出効果を示すグラフである。
【図15C】アンフェタミン注入前及び注入後の、対照及び偽のアンフェタミン注入に対してのインプラントからのクエチアピンの放出効果を示すグラフである。
【図16A】PLA:PGAが85:15のPLGAインプラントからのクロザピンの累計放出量を経時的に示すグラフである。
【図16B】アンフェタミン偽薬の注入前及び注入後の、対照及び偽のアンフェタミン注入に対してのクエチアピン・インプラントの放出効果を示すグラフである。
【図16C】アンフェタミン注入前及び注入後の、対照及びアンフェタミン偽薬の注入に対してのククエチアピン・インプラントの効果を示すグラフである。
【図17A】PLA:PGAが85:15のPLGAインプラントから放出されるハロペリドールの累計放出量を経時的に示すグラフである。
【図17B】PLGAインプラントからのハロペリドールの放出効果を示すグラフである。
【図17C】ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するハロペリドール・インプラントの効果を示すグラフである。
【図18A】最初の薬物充填量が、PLA:PGAが85:15のPLGAインプラントから放出されるリスペリドンの累計放出量に対して及ぼす影響を示すグラフである。
【図18B】最初の薬物充填量が、PLA:PGAが85:15のPLGAインプラントから放出されるリスペリドンの機能に対して及ぼす影響を示すグラフである。
【発明を実施するための形態】
【0012】
本発明は、ある実施形態では、長期間送達製剤(long-term delivery formulation)、及びその使用方法を提供する。
【0013】
ある実施形態では、本発明は、治療を必要とする患者における神経系疾患の治療方法を提供する。この方法は、生分解性ポリマーと複合した或る薬物の製剤であって、体内で前記薬物を見かけ上ゼロ次速度で送達する第1の製剤を前記患者に投与するステップと、生分解性ポリマーと複合した前記薬物の製剤であって、体内で前記薬物を前記第1の製剤よりも大幅に速い速度で送達する第2の製剤を前記患者に投与するステップとを含んでおり、前記第1及び第2の製剤の投与によって、前記薬物の有効血中濃度を維持する。
【0014】
他の実施形態では、本発明は、治療を必要とする患者における神経系疾患の治療方法を提供する。この方法は、その詳細については後述するが、製剤を備えているキットを使用して行う。
【0015】
ある実施形態では、本発明に係る方法は、少なくとも1つの付加的な製剤の投与をさらに含んでいる。この付加的な製剤は、生分解性ポリマーと複合した薬物の製剤であって、前記薬物の放出速度は前記第1の製剤よりも速い。前記薬物の放出速度は、ある実施形態では前記第2の製剤よりも速く、他の実施形態では前記第1の製剤よりも遅く、別の実施形態では前記第2の製剤よりも遅い。ある実施形態では、前記付加的製剤の薬物放出のピークは、前記第1の製剤(他の実施形態では前記第2の製剤)の放出ピークの前である。他の実施形態では、前記付加的製剤の薬物放出ピークは、前記第1の製剤(他の実施形態では前記第2の製剤)の放出ピークと同時である。別の実施形態では、前記付加的な製剤の薬物放出ピークは、前記第1の製剤の放出ピークの後である。
【0016】
ある実施形態では、その詳細については後述するが、本発明に係る方法、キット及び組成物は、生分解性ポリマーと複合した或る薬物の第1の製剤を含んでいる(又は利用する)。前記生分解性ポリマーは、ある実施形態では代謝され、他の実施形態では無毒性の副産物を生成し、別の実施形態では準病理学的(sub-pathologically)な有毒性の副産物を生成する。
【0017】
ある実施形態では、PLGA、乳酸及びグリコール酸の分解産物は、正常に代謝される水溶性の無毒性生成物であり、クレブス回路内で二酸化炭素中及び水中に排出される又はさらに代謝される。
【0018】
ある実施形態では、「複合する」又は「複合体」という用語は、薬物分子が生分解性ポリマー基質内で相互拡散(interdispersed)することを意味する。ある実施形態では、前記薬物は、ポリマー基質内の間質腔(interstitial space)に位置する。他の実施形態では、高速溶媒抽出によって行われる。高速溶媒抽出すると、抽出後は、ポリマーの濃度が増加し、ポリマー粘性が急増する。そして、別の実施形態では、このようにして、薬物を覆うものの拡散率を低下させる。
【0019】
ある実施形態では、「高速溶媒抽出」は、ポリマー鎖の配置構造が動力学的に再結晶不可能になる程度まで、ポリマー濃度(及びその結果生じる粘性)が増加する速度での溶媒除去を意味する。
【0020】
ある実施形態では、生分解性ポリマー基質内への薬物の封入に影響を及ぼし、その結果、ある実施形態では最初の充填に、他の実施形態ではその後の放出に、別の実施形態ではその組み合わせに影響を与える任意の要素は、本発明に係る方法に従って利用される(又は、本発明に係るキット及び組成物に利用される)。他の実施形態では、そのような要素は、とりわけ、溶媒の初期濃度、溶媒の分子サイズ及び極性、溶媒を除去する温度及び圧力、生分解性ポリマー基質の平均の分子量数(molecular weight number:MWn)、生分解性ポリマー基質の多分散性指数(polydispersity index)、薬物のサイズ及び極性、モノマー比、コポリマー鎖に沿っての分布、又はそれらの組み合わせである。さらに、生分解性ポリマーの各モノマーのD/L比は、放出速度に影響を与える。ある実施形態では、D/L比という用語は、乳酸などの単一の光学活性モノマーを観察する際に、干渉偏向レンズ(cross-polarized lense)の回転方向(D−右、L−左)に影響を与えるモノマー分子の割合を意味する。哺乳類のほとんどは、その割合が生体分解性バイオポリマーの分解速度及び分子量(粘性)に影響を与え、結果として全ての封入された薬物の放出速度に影響を与えるD−特異的酵素を持っている。
【0021】
ある実施形態では、「血中濃度」という用語は、血清を分離した後に薬物濃度を測定することによって決定される、血清中の薬物濃度を意味する。
【0022】
ある実施形態では、「治療」という用語は、本発明に係る治療方法、又は、本発明に係るキット若しくは組成物の投与の結果として、目的とする生物学的反応又は予防的反応が得られることを意味する。ある実施形態では、目的とする反応は、特定の病気又は障害(統合失調症、うつ病、精神病的不安神経症、又はそれらの組み合わせなど)の症状の軽減(完全な又は部分的な軽減)である。ある実施形態では、本発明に係る方法、キット又は組成物の使用が原因で望ましくない副作用(治療による患者の免疫欠損など)が生じた場合は、本発明は治療計画の最中に適切な症状緩和薬物の投与を提供する。
【0023】
実施例12で後述するように、統合失調症などの神経系疾患を、生分解性ポリマーと複合した薬物(ある実施形態ではリスペリドンである)によって治療することができる(放出特性を図7Aに示す)。他の実施形態では、5つの異なるポリマーと複合した薬物を含有している組成物を、同時に使用することができる。3つの複合体は、持続放出インプラントから薬物が放出されるまでの時間を埋めるために投与される製剤である、「スターターセット(starter set)」を含んでいる(図7D及び7E)。本発明のこの態様では、スターターセットは3つの複合体を含み、その内の1つは即時の放出特性を有する即時放出複合体であり、他の2つの高速放出複合体(ただし、放出特性は即時放出複合体よりも少し遅い)と同時に服用される。ある実施形態では、スターターセットは、「メンテナンスセット(maintenance set)」と同時に又は直前に服用される。メンテナンスセットは、リスペリドンの有効血中濃度を一定に維持する、少なくとも1つの(又は2つの、又は3つの、又は4つの)複合体を含んでいる。メンテナンスセットは、放出が完了した時点、ある実施形態では、スターターセット複合体から薬物が100%放出された時点で提供される。他の実施形態では、メンテナンスセットは、5番目の複合体を含み、ある実施形態では、薬物及び生体分解性基質から構成されるインプラントである。この5番目の複合体は、他の複合体と比較すると、絶対的に高い薬物濃度を有している。ある実施形態では、この5番目の複合体の放出ピークは、メンテナンスセットを含む他の複合体の薬物放出が減少すると同時に起こる。本発明のこの態様では、各複合体の放出特性は、リスペリドンの血中濃度が目的とする一定の値となるように、最適に組み合わせられる(図7E)。
【0024】
ある実施形態では、メンテナンスセットは、長期の治療を行うために、患者にいつまでも再投与される。
【0025】
他の実施形態では、本発明に係る方法は、繰り返しての使用を含む。例えば、1つ又は複数の製剤を投与する本発明に係る方法を、所定の期間で繰り返し行われる不連続的な治療に使用することができる。ある実施形態では、本発明の方法は、例えば、1つ又は複数の本発明に係る組成物を一定の間隔で投与する、周期的な使用を含んでいる。ある実施形態では、本発明に係る方法は、治療の中間評価を含んでおり、患者の症状の改善(軽減)の兆候に応じて組成物は変更される。他の実施形態では、特定の投与された組成物に対して反応しなくなった後に、治療は変更される。
【0026】
他の実施形態では、薬物及びポリマー・インプラントは、界面活性剤又は乳化剤を用いることなく、アセトンからの溶媒成形によって作成され、その後、圧縮成形される。ある実施形態では、成形するための溶媒としては、アセトンが使用される。また、他の実施形態では、別のFDAクラスIII溶媒(毒性が低く、最小限の使用で残留溶媒を除去できる)が使用される。ある実施形態では、薬物及び生分解性ポリマーは、100mg/mL以上で溶解される。他の実施形態では、このようにして作成されたインプラントは耐性及び生物活性を有する。このことは、例えば、げっ歯類を用いて実証することができる。マウス及びラットに埋め込んだ後に、耐性及び生物活性を経時的に評価する(例えば、埋め込み後3週間〜3ヶ月間)。
【0027】
ある実施形態では、使用する溶媒は、表1に記載された溶媒(FDA指針書 Q3C)から選択される。
【0028】
表1 FDAクラスIII溶媒(FDA指針書 Q3C)

【0029】
他の実施形態では、本発明に係る方法、キット及び組成物は、各薬物の各ポリマーとの相互作用である薬物放出特性を提供する。他の実施形態では、ポリマーシステムからの放出パターンに影響を及ぼす他の要因としては、薬物拡散速度、薬物/ポリマー親和性、pH、ソース/シンク濃度、分子量平均値(molecular weight average:MWw)、ポリマー数平均値(polymer number average:MWn)、それらの比率(多分散性指数、Polydispersity index:PDI)、及びバイオポリマーを可塑化するための生理液の能力がある。
【0030】
ある実施形態では、本発明に係る方法、キット及び組成物は、第1の製剤及び第2の製剤を互いに48時間以内に投与する。他の実施形態では、第1の製剤の投与は、第2の製剤の投与と同時に行われる。ある実施形態では、第1の製剤の投与は、第2の製剤の投与前に行われる。別の実施形態では、第1の製剤の投与は、第2の製剤の投与後に行われる。
【0031】
ある実施形態では、本発明に係る方法、キット及び組成物は、生分解性ポリマーを使用する。生分解性ポリマーは、ある実施形態では、乳酸・グリコール酸共重合体(Copoly lactic acid/glycolic acid:PLGA)である。ある実施形態では、生分解性PLGAポリマーは、「Kitchell. TP, Wise DL (1985) Poly (lactic/glycolic acid) biodegradable drug-polymer matrix systems. Methods Enzymol 112: 436-448」に記載されているものを使用する。
【0032】
ある実施形態では、生分解性ポリマーは、ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、それらコポリマー、それらターポリマー、又はそれらの任意の組み合わせである。ある実施形態ではコポリマーはアタクチックであり、他の実施形態ではコポリマーはシンジオタクチックである。ある実施形態では、生分解性熱可塑性ポリエステルは、ポリ乳酸、ポリグリコール酸、そのコポリマー、そのターポリマー、又はそれらの組み合わせである。
【0033】
ある実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が50:50のポリ(D,L−ポリ乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が75:25のポリ(D,L−乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が85:15のポリ(D,L−乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が60:40のポリ(D,L−乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が90:10のポリ(D,L−乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、薬物と複合した際に目的の放出特性を示すポリ(D,L−乳酸・グリコール酸)共重合体)の任意の組み合わせである。ある実施形態では、生分解性熱可塑性ポリエステルは、任意の適切な量で存在し、水媒体又は体液内で少なくとも実質的に不溶性である。
【0034】
他の実施形態では、生分解性熱可塑性ポリエステルは、好ましくは、流動性組成物の約50〜98wt.%で存在している。ある実施形態では、流動性組成物の約50〜60wt.%で存在している。他の実施形態では、流動性組成物の約60〜75wt.%で存在している。他の実施形態では、流動性組成物の約75〜90wt.%で存在している。他の実施形態では、流動性組成物の約90〜95wt.%で存在している。他の実施形態では、流動性組成物の約95〜98wt.%で存在している。
【0035】
ある実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約10,000〜200,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約15,000〜25,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約25,000〜45,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約45,000〜75,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約75,000〜100,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約100,000〜150,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約150,000〜200,000である。
【0036】
ある実施形態では、PLGAを構成する乳酸モノマーの濃度は、PLGAポリマーの50〜100%である。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの50〜60%である。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの60〜70%である。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの70〜80%である。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの80〜90%ある。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの90〜100%である。他の実施形態では、乳酸モノマー100%である。
【0037】
ある実施形態では、「約」という用語は、1〜20%の範囲のずれを意味する。他の実施形態では、1〜10%の範囲のずれを意味する。他の実施形態では、1〜5%の範囲のずれを意味する。他の実施形態では、5〜10%の範囲のずれを意味する。他の実施形態では、10〜20%の範囲のずれを意味する。
【0038】
ある実施形態では、製剤に含まれる薬物ポリマー複合体の量は、2〜75%(w/w)である。他の実施形態では、2〜5%(w/w)である。他の実施形態では、5〜10%(w/w)である。他の実施形態では、10〜25%(w/w)である。他の実施形態では、25〜35%(w/w)である。他の実施形態では、35〜50%(w/w)である。他の実施形態では、50〜75%(w/w)である。
【0039】
ある実施形態では、前記複合体は、例えばポリエチレン・グリコール、ポリエチレン・グリコール及びポリプロピレン・グリコールのコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニル・アルコール、ポリビニル・ピロリドン、又はポリプロリンなどの水溶性ポリマーの共有結合によって形成される。ある実施形態では、修飾によって、水溶液中での化合物の溶解度を高める、凝集を除去する、化合物の物理的及び化学的安定性を高める、化合物の免疫原性又は反応性を減少する、又はそれらの組み合わせをもたらすことができる。
【0040】
他の実施形態では、本発明に係る方法、キット及び組成物は、少なくとも1つの薬物を長期に渡って持続的に送達することが求められる病気及び障害を治療するために提供される。当然のことながら、任意の症状、疾患、又は障害を治療するために、第1の製剤及び第2の製剤を投与する治療計画は、本発明の一部をみなされる。前記治療計画では、特定の化合物又は組成物の有効血中濃度を得るために第1の組成物を投与し、同時に又は後に第2の製剤を投与する。第2の製剤は、第1の組成物から放出される薬物の濃度が減少すると同時に又は後に投与され、前記有効血中濃度を長期に渡って維持する。
【0041】
本発明に係る方法、キット及び組成物の第1の製剤は、薬物を見かけ上ゼロ次速度で送達する(ある実施形態では、「定常状態」(0次)放出特性である、又はほぼ定常状態である)。または、ある実施形態では、定常状態から±5〜10%の幅で、治療効果がある量の薬物を一定の時間以上送達する。ある実施形態では±5%の幅、ある実施形態では±10%の幅、ある実施形態では±20%の幅、ある実施形態では±30%の幅が、目的とする血中濃度の周辺で観察される。ある実施形態では、期間は、投与後3〜10ヶ月間である。ある実施形態では、期間は、投与後14日間〜6ヶ月間である。
【0042】
本発明に係る方法、キット及び組成物に使用される製剤の放出特性は、ある実施形態では図7Aに示したものと同様である。他の実施形態では図7Bに示したものと、他の実施形態では図7Cに示したものと、他の実施形態では図7Dに示したものと、他の実施形態では図7Eに示したものと、他の実施形態では図7Fに示したものと同様であり、他の実施形態では、それらの特性と類似している。
【0043】
ある実施形態では、前記製剤は、制御放出パッチ(patch)によって投与される。他の実施形態では、患者を治療する薬物は、経皮パッチによって送達される。ある実施形態では、パッチは、一方の側に隔膜を有する薄い中空のデバイス(flat hollow device)であり、前記パッチを患者の皮膚上で所定の位置に保つための接着剤を備えている。したがって、前記隔膜を皮膚に接触させて、パッチに蓄積された薬物を皮膚に及び皮膚を介して浸透させることができる。ある実施形態では、パッチの外側は不透水性の物質層で作成されており、隔膜側と外側はパッチの周囲で結合されており、2つの層間で、薬物及び担体の貯蔵部を形成している。パッチ技術は、活性成分を表皮と持続的に接触させることを可能とする。かなりの長時間に渡って、そのような状態で保持された薬物分子は、ある実施形態では濃度勾配によって血流中に拡散する。他の実施形態では、経皮的送達は、パッチ技術の使用によって行われる。これらの従来の薬物送達システムは、例えば薬物などの活性成分が組み込まれたパッチを含んでいる。また、パッチは、活性成分を皮膚の近傍に位置させるために、パッチを皮膚に付着させるための接着剤を備えている。例示的なパッチ技術は、Ciba-Geigy Corporation及びAlza Corporationから入手可能である。このような従来の送達デバイスは、アンフェタミン化合物と共に、容易に適用することができる。ある実施形態では、薬物のメンテナンスセットは、パッチ形態で3ヶ月に1回投与される。
【0044】
ある実施形態では、前記製剤はインプラントの形態である。他の実施形態では、インプラントからの放出、及びインプラントからの拡散は、薬物の種類によって大幅に異なる。ある実施形態では、ある化合物の設計仕様は、他の化合物には直接的に適用できない。
【0045】
ある実施形態では抗精神病薬が、他の実施形態では9−OH−リスペリドンが、本発明に係る神経系疾患(別の実施形態では双極性障害)を治療するために、本発明に係る方法、キット及び組成物の一部として使用される。
【0046】
ある実施形態では、本発明に係る方法、キット及び組成物は、パーキンソン病を治療するために、甲状腺刺激ホルモン放出ホルモン又はL−ドーパを送達するのに使用される。他の実施形態では、本発明に係る方法、キット及び組成物は、麻薬中毒を治療するために、ナルトレキソンを送達するのに使用される。
【0047】
当然のことながら、本発明に係る方法、キット及び組成物に使用される製剤は、病気の治療計画の一部である、複数の薬物の組み合わせを含み得る。
【0048】
ある実施形態では、本発明は神経系疾患の治療方法であって、前記薬物の濃度が第1又は第2製剤の約2〜5重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約5〜10重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約10〜15重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約15〜20重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約20〜30重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約30〜40重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約40〜50重量パーセントである治療方法を提供する。
【0049】
ある実施形態では、本発明は神経系疾患の治療方法であって、使用される薬物がリスペリドン、9−OH−リスペリドン、ハロペリドール、オランザピン、クロザピン、アリピプラゾール、クエチアピン、ジプラシドン、又はそれらの組み合わせである治療方法を提供する。
【0050】
ある実施形態では、前記第1及び第2の製剤は、少なくとも1つの一般的な薬物を有している。
【0051】
ある実施形態では、第1の製剤はリスペリドン及び9−OH−リスペリドンを含んでおり、第2の製剤は9−OH−リスペリドンを含んでいる。他の実施形態では、第1の製剤はリスペリドン及びハロペリドールを含んでおり、第2の製剤はハロペリドールを含んでいる。他の実施形態では、第1の製剤はクエチアピン(quetiapine)及び9−OH−リスペリドンを含んでおり、第2の製剤は9−OH−リスペリドンを含んでいる。
【0052】
ある実施形態では、第1の製剤は、慢性疾患に治療効果がある薬を含んでいる。他の実施形態では、第2の製剤は、慢性疾患の急性期に治療効果がある薬を含んでいる。例えば、ある実施形態では、多発性硬化症などの再発及び寛解型の疾患を治療する。ある実施形態では、各製剤はCopaxonを含んでおり、第1の製剤はP−インターフェロン(他の実施形態では、免疫抑制化合物)をさらに含んでいる。
【0053】
他の実施形態では、第2の製剤の放出速度は、第1の製剤の放出速度よりも速い。ある実施形態では、「速い放出速度」は、薬物の血中濃度の相対濃度が経時的に増加することを意味する。ある実施形態では、放出される薬物%は、図4Bに示されている。
【0054】
他の実施形態では、第2の製剤は、蓄積注射として投与される。他の実施形態では、第2の製剤は、生分解性ポリマー基質内に封入された薬物を含有しているミクロスフェア(microsphere)として投与される。
【0055】
ある実施形態では、本発明に係る方法、キット及び組成物における第1の製剤の薬物放出速度は、長期間の持続放出を実現できるように、十分に遅い。「十分に遅い」とは、ある実施形態では、通常の製剤の平均に対して、一桁違うことを意味する。
【0056】
ある実施形態では、本発明は、神経系疾患の治療方法であって、第1の製剤が皮下に投与されるインプラントであり、第2の製剤が経口剤型、非経口投与型又は静脈内投与の薬物である方法を提供する。
【0057】
ある実施形態では、「非経口的に投与される」という表現は、経腸及び局所性投与以外の投与方法であって、通常は注射による投与方法を意味する。また、静脈内、筋肉内、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、腫瘍内、被膜下、くも膜下、髄腔内、及び胸骨内への注射及び注入による投与方法を意味する(ただし、これらに限定されるものではない)。
【0058】
他の実施形態では、前記第1及び第2の製剤は、前記患者に周期的に投与される。当然のことながら、薬物を含有する前記第1及び第2の製剤(他の実施形態ではさらなる他の製剤)の投与順序は、本発明の範囲内であり、当業者なら理解できるであろうが、前記薬物の目的とする血中濃度を得るために変更することができる。
【0059】
ある実施形態では、前記第1及び第2の製剤は、前記薬物の血清中濃度がその薬物の治療閾値レベル以下の場合に、患者に投与される。他の実施形態では、前記第1及び第2の製剤は、前記薬物の血清中濃度が1ng/mL以下の場合に、患者に投与される。
【0060】
他の実施形態では、本発明は、神経系疾患を治療するための方法であって、製剤を最初に投与した約160〜200日後に、患者に第1及び第2の製剤を投与する方法を提供する。ある実施形態では、製剤を最初に投与した約160〜180日後に、患者に第1及び第2の製剤を投与する方法を提供する。他の実施形態では、製剤を最初に投与した約180〜200日後に、患者に第1及び第2の製剤を投与する方法を提供する。
【0061】
他の実施形態では、本発明は、神経系疾患の治療方法であって、より持続的な治療が必要とされる病気を治療するための方法を提供する。ある実施形態では、統合失調症を治療するために、埋め込み型のシステムを使用して、薬物を長期に渡って送達する方法を提供する。埋め込み型のシステムは、他の実施形態では、薬物の治療特性を最適化する能力を有している。ある実施形態では、より安全、効果的、又は確実な治療方法を提供する。ある実施形態では、本発明は、神経系疾患の治療方法であって、一般的に必要とされる薬物量がより少なく、副作用を最小限に抑えることができる方法を提供する。ある実施形態では、一定の可逆性が生じる不都合な副作用が生じた場合、埋め込み型のシステムは、医師によって取り出される。他の実施形態では、本発明は、神経系疾患の治療方法であって、生体分解性システムにより、送達間隔の最後に取り出す必要がなく、患者に対する侵襲性を半減させる方法を提供する。
【0062】
ある実施形態では、本発明は、長期間の治療が必要とされる神経疾患及び障害の治療方法を提供する。ある実施形態では、薬物は、HIV及び他のウイルス性疾患、マイコバクテリア感染、癌、多発性硬化症、糖尿病、腎臓病、又は他の病気(本発明に係る方法、キット、又は組成物が有用であると認められる病気)の治療に使用される。
【0063】
他の実施形態では、本発明は、神経系疾患を治療するための方法を提供する。前記神経系疾患としては、エイズによる認知症、統合失調症、双極性障害、境界性人格障害(BPD)、アルツハイマー病(AD)、心因性うつ病、又は精神障害(混乱、分裂或いは精神疾患を引き起こす精神障害)などがある。
【0064】
ある実施形態では、本発明に係る方法、キット又は組成物で使用される薬物は、治療計画に適用可能な任意の薬物である。ある実施形態では、前記薬物は、ペプチド、タンパク質、核酸、又は化合物である。
【0065】
ある実施形態では、「薬物(drug)」という用語は、患者に投与した際に、症状、疾患又は障害を軽減する分子を意味する。ある実施形態では、前記薬物は合成分子である。他の実施形態では、前記薬物は、自然から入手したソースから分離された、天然由来の化合物である。
【0066】
ある実施形態では、薬物としては、降圧剤、抗うつ剤、抗不安薬、抗凝固剤、抗けいれん剤、血糖降下剤、充血除去剤、抗ヒスタミン剤、鎮咳薬、抗炎症薬、抗精神病薬、向知性薬、コレステロール降下剤、抗肥満薬、自己免疫疾患剤、性的不能治療薬、抗菌及び抗真菌薬、催眠剤、抗パーキンソン薬、抗生物質、抗ウイルス薬、抗新生物薬、バルビツレート(barbiturate)、鎮静剤、栄養剤、ベータ遮断薬、催吐薬、制吐薬、利尿薬、抗凝血剤、強心剤、アンドロゲン、コルチコイド、同化剤、成長ホルモン分泌促進薬、抗感染薬、冠拡張薬、炭酸脱水酵素阻害薬、抗原虫薬、胃腸薬、セロトニン拮抗薬、麻酔薬、血糖降下薬、ドーパミン作動薬、抗アルツハイマー病薬、抗潰瘍薬、抗血小板薬、及び、グリコーゲン・ホスホリラーゼ阻害剤が挙げられる。
【0067】
本発明のある実施形態では、前記薬物の例としては、特に、降圧剤(プラゾシン、ニフェジピン、トリマゾシン、アムロジピン、メシル酸ドキサゾシンなど)、抗不安性ヒドロキシジン、血糖降下剤(グリピザイドなど)、性的不能治療薬(クエン酸シルディナフィル)、抗新生物薬(クロラムブシル、ロムスチン、エキノマイシンなど)、抗炎症薬(ベタメタゾン、プレドニゾロン、ピロキシカム、アスピリン、フルルビプロフェン、(+)−N−{4−[3−(4−フルオロフェノキシ)フェノキシ]−2−シクロペンテン −1−イル}−N−ハイロキシウレアなど)、抗ウイルス剤(アシクロビル、ネルフィナビル、ビラゾールなど)、ビタミン/栄養剤(レチノール、ビタミンEなど)、催吐薬(アポモルヒネなど)、利尿薬(クロルタリドン、スピロノラクトンなど)、抗凝血剤(ジクマロールなど)、強心剤(ジゴキシン、ジギトキシンなど)、アンドロゲン(17−メチルテストステロン、テストステロンなど)、鉱質コルチコイド(デスオキシコルチコステロンなど)、ステロイド性睡眠薬/麻酔薬(アルファキサロンなど)、同化剤(フルオキシメステロン、methanstenoloneなど)、抗うつ剤(フルオキセチン、ピロキシジン、ベンラファクシン、セルトラリン、パロキセチン、スルピリド、[3,6−ジメチル−2−(2,4,6−トリメチル−フェノキシ)−ピリジン−4−イル]−(レチルプロピル)−アミン、3,5−ジメチル−4−(3’−ペントキシ)−2−(2’,4’,6’−トリメチルフェノキシ)ピリジンなど)、抗生物質(アンピシリン、ペニシリンGなど)、抗感染薬(塩化ベンザルコニウム、クロルヘキシジンなど)、冠拡張薬(ニトログリセリン、ミオフラジンなど)、睡眠薬(エトミデート、ミオフラジンなど)、炭酸脱水酵素阻害薬(アセタゾールアミド、クロラゾールアミドなど)、抗真菌剤(エコナゾール、テルコナゾール、フルコナゾール、ボリコナゾール、グリセオフルビンなど)、抗原虫薬(メトロニダゾールなど)、イミダゾール型抗新生物薬(メトロニダゾール、チューブラーゾールなど)、駆虫薬(チアベンダゾール、オクスフェンダゾールなど)、抗ヒスタミン剤(アステミゾール、レボカバスチン、セチリジン、シンナリジンなど)、充血除去剤(プソイドエフェドリンなど)、抗精神病薬(フルスピリレン、penfluridole、リスペリドン、ジプラシドンなど)、胃腸薬(ロペラミド、シサプリドなど)、セロトニン拮抗薬(ケタンセリン、ミアンセリンなど)、麻酔薬(リドカインなど)、血糖降下薬(アセトヘキサミド など)、制吐薬(ジメンヒドリナートなど)、抗菌剤(コトリモキサゾールなど)、ドーパミン作動薬(L−DOPAなど)、抗アルツハイマー病薬(THA、ドネペジルなど)、抗潰瘍薬/H2拮抗薬(ファモチジンなど)、鎮静剤/睡眠薬(クロルジアゼポキシド、トリアゾラムなど)、血管拡張剤(アルプロスタジルなど)、抗血小板薬(プロスタサイクリンなど)、ACE抑制剤/降圧剤(エナラプリル酸、リシノプリルなど)、テトラサイクリン系抗生物質(オキシテトラサイクリン、ミノサイクリンなど)、マクロライド系抗生物質(アジスロマイシン、クラリスロマイシン、エリスロマイシン、スピラマイシンなど)、グリコーゲン・ホスホリラーゼ阻害剤([R−(R*S*)]−5−クロロ−N−[2−ヒドロキシ−3{メトキシメチルアミノ}−3−オキソ−l−(フェニルメチル)−プロピル]−IH−インドール−2−カルボキサミド、5−クロロ−l−Hインドール−2−カルボン酸[(IS)−ベンジル(2R)−ヒドロキシ−3−((3R,4S)ジヒドロキシ−ピロリジン−l−イル−)−オキシプロピル]アミドなど)が挙げられる。
【0068】
本発明に使用される薬物のさらなる例としては、グルコース降下剤(クロルプロパミド)、抗真菌剤(フルコナゾール)、高コレステロール血症抑制剤(アトルバスタチンカルシウム)、抗精神病剤(塩酸チオチキセン)、抗不安剤(塩酸ヒドロキシジン、塩酸ドキセピン)、降圧剤(アムロジピン・ベシレート)、抗炎症薬(ピロキシカム、セレコキシブ、バルデコキシブ)、抗生物質(カルベニシリン・インダニル・ナトリウム、塩酸バカンピシリン、トロレアンドマイシン、塩酸ドキシサイクリン)が挙げられる。
【0069】
他の実施形態では、本発明の薬物は、他の抗新生物薬で有り得る。そのような抗新生物薬としては、例えば、白金化合物(スピロプラチン、シスプラチン、カルボプラチンなど)、メトトレキサート、フルオロウラシル、アドリアマイシン、マイトマイシン、アンサマイトシン、ブレオマイシン、シトシン・アラビノシド、アラビノシル・アデニン、メルカプトポリリシン、ビンクリスチン、ブスルファン、クロラムブシル、メルファラン(PAM、L−PAM、フェニルアラニン・マスタードなど)、メルカプトプリン、ミトタン、塩酸プロカルバジン・ダクチノマイシン(アクチノマイシンD)、塩酸ダウノルビシン、塩酸ドキソルビシン、パクリタキセル及び他のタキサン、ラパマイシン、マニュマイシンA、TNP−470、プリカマイシン(ミトラマイシン)、アミノグルテチミド、エストラムスチンリン酸ナトリウム、フルタミド、酢酸ロイプロリド、酢酸メゲストロール、クエン酸タモキシフェン、テストラクトン、トリロスタン、アムサクリン(m−AMSA)、アスパラギナーゼ(L−スパラギナーゼ)、エルウィニア・アスパラギナーゼ(erwinia asparaginase)、インターフェロン・アルファ−2a、インターフェロン・アルファ−2b、テニポシド(VM−26)、硫酸ビンブラスチン(VLB)、硫酸ビンクリスチン、硫酸ブレオマイシン、ヒドロキシウレア、プロカルバジン、ダカルバジン、分裂抑制剤(エトポシド、コルヒチン、ビンカ・アルカロイドなど)、放射性医薬品(放射性ヨード、リン生産物など)、ホルモン(プロゲスチン、エストロゲン、抗エストロゲンなど)、駆虫薬、抗結核薬、生物製剤(免疫血清、抗毒素、血清など)、狂犬病予防製剤、細菌ワクチン、ウイルス性ワクチン、呼吸性製剤(キサンチン誘導体、テオフィリン、アミノフィリンなど)、甲状腺薬(ヨード製剤、抗甲状腺薬など)、心臓血管製剤(チーテング(cheating)剤、水銀利尿薬、強心配糖体を含む)、グルカゴン、血液製剤(非経口アイロン、ヘミン、ヘマトポルフィリン、及びそれらの派生物)、生物反応修飾物質(ムラミールジペプチド、ムラミールトリペプチドなど)、微生物細胞壁構成成分、リンフォカイン(リポ多糖体、マクロファージ活性化因子などの細菌内毒素)、バクテリアのサブユニット(マイコバクテリウム、コリネバクテリアなど)、合成ジペプチドN−アセチル−ムラミル−L−アラニル−D−イソグルタミン、抗真菌薬(ケトコナゾール、ナイスタチン、グリセオフルビン、フルシトシン(5−fc)、ミコナゾール、アムホテリシンB、リシン、シクロスポリン、βラクタム抗生物質(例えばsulfazecin)など)、ホルモン(成長ホルモン、メラニン細胞刺激ホルモン、エストラジオール、ジプロピオン酸ベクロメタゾン、ベタメタゾン、酢酸ベタメタゾン、リン酸ベタメタゾンナトリウム、リン酸ベタメタゾン二ナトリウム、リン酸ベタメタゾンナトリウム、酢酸コルチゾン、デキサメタゾン、酢酸デキサメタゾン、デキサメタゾンリン酸ナトリウム、フルニソリド、ヒドロコルチゾン、酢酸ヒドロコルチゾン、ヒドロコルチゾン・シピオネート、リン酸ナトリウム・ヒドロコルチゾン、コハク酸ナトリウム・ヒドロコルチゾン、メチルプレドニゾロン、酢酸メチルプレドニゾロン、コハク酸メチルプレドニゾロンナトリウム、酢酸パラメタゾン、プレドニゾロン、酢酸プレドニゾロン、リン酸プレドニゾロン・ナトリウム、プレドニゾロン・テブタート、プレドニゾン、トリアムシノロン、酢酸トリアムシノロン、トリアムシノロン・ジアセテート、トリアムシノロン・ヘキサアセトニド、酢酸フルドロコルチゾン、オキシトシン、バソプレシン及びそれらの派生物)、ビタミン(シアノコバラミンneinoic acid、レチノイド及びその派生物(パルミチン酸レチノール、アルファ・トコフェロール))、ペプチド(マンガニーズ・スーパーオキシド・ジスムターゼなど)、酵素(アルカリ性ホスファターゼなど)、抗アレルギー薬(amelexanoxなど)、抗凝固薬(フェンプロクーモン、ヘパリン)、循環器官用薬(プロプラノロールなど)、代謝増強剤(グルタチオンなど)、抗結核薬(パラアミノサリチル酸、イソニアジド、硫酸カプレオマイシン・サイクロセリン、塩酸エタンブトール・エチオナミド、ピラジナミド、リファンピン、硫酸ストレプトマイシンなど)、ウイルス剤(アマンタジン・アジドチミジン(AZT、DDI、ホスカネット、ジドブジン)、リバビリン及びビダラビン一水和物(アデニン・アラビノシド、ara−A)など)、抗狭心症薬(ジルチアゼム、ニフェジピン、ベラパミル、四硝酸エリトリトール、硝酸イソソルビド、ニトログリセリン(硝酸グリセリン)、四硝酸ペンタエリスリトールなど)、抗凝血剤(フェンプロクーモン、ヘパリンなど)、抗生物質(ダプソーン、クロラムフェニコール、ネオマイシン、セファクロール、セファドロキシル、セファレキシン、セフラジン・エリスロマイシン、クリンダマイシン、リンコマイシン、アモキシシリン、アンピシリン、バカンピシリン、カルベニシリン、ジクロキサシリン、シクラシリン、ピクロキサシリン、ヘタシリン、メチシリン、ナフシリン、オキサシリン、ペニシリン(ペニシリンG、ペニシリンVを含む)、チカルシリン・リファンピン、テトラサイクリンなど)、抗炎症薬(ジフルニサル、イブプロフェン、インドメタシン、メクロフェナム酸、メフェナム酸、ナプロキセン、オキシフェンブタゾン、フェニルブタゾン、ピロキシカム、スリンダク、トルメチン、アスピリン、サリチル酸塩など)、抗原虫薬(クロロキン、ヒドロキシクロロキン、メトロニダゾール、キニーネ、アンチモン酸メグルミンなど)、抗リウマチ剤(ペニシラミンなど)、麻酔薬(パレゴリックなど)、アヘン剤(コデイン、ヘロイン、メタドン、モルヒネ、アヘンなど)、強心配糖体(デスラノシド、ジギトキシン、ジゴキシン、ジギタリン、ジギタリス)、神経筋遮断薬(アトラクリウム・メシラート、ガラミン・トリエチオダイド、臭化ヘキサフルオレニウム、ヨウ化メトクリン、臭化パンクロニウム、塩化サクシニルコリン(塩化スキサメトニウム)、塩化ツボクラリン、臭化ベクロニウム)、鎮静剤(睡眠薬)(アモバルビタール、アモバルビタール・ナトリウム、アプロバルビタール、ナトリウムブタバルビタール、抱水クロラール、エスクロルビノール、エチナメート、塩酸フルラゼパム、グルテチミド、塩酸メトトリメプラジン、メチプリロン、塩酸ミダゾラム、パラアルデヒド、ペントバルビタール、ペントバルビタールナトリウム、フェノバルビタールナトリウム、セコバルビタールナトリウム、タルブタール、テマゼパム、トリアゾラムなど)、局部麻酔薬(塩酸ブピバカイン、塩酸クロロプロカイン、塩酸エチドカイン、塩酸リドカイン、塩酸メピバカイン、塩酸プロカイン、塩酸テトラカインなど)、全身麻酔薬(ドロペリドール、エトミデート、ドロペリドールと併用されるクエン酸フェンタニル、塩酸ケタミン、メトヘキシタール・ナトリウム、チオペンタール・ナトリウム)、放射性粒子又はイオン(ストロンチウム、ヨウ化レニウム、イットリウムなど)がある。
【0070】
ある実施形態では、本発明に係る方法、キット及び組成物は、上記した薬物と併用される。組み合わせは、各製剤で異なる。一般的には、患者に一度に投与される薬物は、単一の薬物である。
【0071】
ある実施形態では、本発明に係る方法は、上述したように、前記製剤を含んでいるキットの使用によって影響される。
【0072】
ある実施形態では、本発明は、少なくとも1つの薬物を持続的に送達するためキットを提供する。このキットは、生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤と、生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤とを備えている。
【0073】
他の実施形態では、本発明は、前記キットの第1及び第2の製剤の組み合わせが、投与後、約1週間〜約14ヶ月間にわたって薬物を徐放するキットを提供する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約1週間〜約1ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約1〜約3ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約3〜約6ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約6〜約9ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約9〜約12ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約12〜約14ヶ月間にわたって薬物を徐放する。
【0074】
ある実施形態では、前記キット及び組成物は、本発明に係る方法に従って使用される。他の実施形態では、前記キット及び組成物は、他のキット又は組成物と組み合わせて使用される。他の実施形態では、全身療法の一部として使用される。また、他の実施形態では、前記キットの一部又はそのキットに含まれる特定の製剤のみが使用される。
【0075】
当然のことながら、本発明に係るキットは、上述した任意の方法と共に使用することもできる。そして、他の実施形態では、ここで説明した任意の組成物又は製剤を利用することができる。
【0076】
ある実施形態では、本発明は、精神病性障害の治療に使用される組成物を提供する。この組成物は、濃度が約95〜98%(w/w)の乳酸・グリコール酸共重合体(PLGA)と、濃度が約2〜5%(w/w)の抗精神病薬とを含んでおり、乳酸・グリコール酸共重合体(PLGA)における乳酸:グリコール酸の比率が約100:0〜50:50であり、抗精神病薬はリスペリドン又は9−OH−リスペリドンである。
【0077】
本発明に係る組成物は、ある実施形態では、経口又は非経口で、局所又は皮下に投与される。ある実施形態では、前記組成物は、錠剤又はカプセルの形態で投与される。他の実施形態では、前記組成物は、注射、注入、吸入、目薬、軟膏、肛門坐剤、制御放出パッチによって投与される。
【0078】
ある実施形態では、前記薬物の有効血中濃度は、0.1〜10ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、0.1〜0.5ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、0.5〜1.0ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、1.0〜1.5ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、1.5〜2.5ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、2.5〜5ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、5〜10ng/mLの範囲である。
【0079】
ある実施形態では、第2の製剤の投与によって、血中濃度は約1〜31日間維持される。他の実施形態では、第2の製剤の投与によって、血中濃度は約1〜7日間維持される。他の実施形態では、第2の製剤の投与によって、血中濃度は約7〜14日間維持される。他の実施形態では、第2の製剤の投与によって、血中濃度は約14〜21日間維持される。他の実施形態では、第2の製剤の投与によって、血中濃度は約22〜31日間維持される。
【0080】
ある実施形態では、第1の製剤の投与によって、血中濃度は約21〜180日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約21〜31日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約31〜60日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約60〜90日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約90〜120日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約120〜150日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約150〜180日間維持される。
【0081】
ある実施形態では、本発明は、少なくとも1つの目的とする薬物の血中濃度を約1〜420日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約14〜420日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約75〜420日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約75〜180日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約180〜270日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約270〜365日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約365〜420日間維持することを提供する。
【0082】
他の実施形態では、本発明は、皮下に挿入されるインプラントを提供する。ある実施形態では、皮下へ埋め込む処置は、埋め込み前に行われる局所麻酔によって容易に耐えることができる。他の実施形態では、硬いインプラントを使用することによって、皮膚の下でインプラントをガイドする道具の使用が不要となり、筋肉内に配置される危険性が減少する。
【0083】
他の実施形態では、製剤は、任意の目的とする組織に埋め込むのに適切なように、パッチ形態である。または、経静脈的、intracavitarily、intranodally、又は他の適切な部位に注射する形態である。または、蓄積注射の形態である。他の実施形態では、投与経路及び投与間隔は、患者ごとに調整される。ある実施形態では、製剤の投与間隔は、6ヶ月に1回である。他の実施形態では、本発明に係る方法に従った投与計画、及び本発明に係るキット及び化合物の使用は、薬物の投与を行わない他の形態の治療(例えば、患者が、精神科医及び/又は治療専門家と交流する治療)と同時に行うことができる。
【0084】
ある実施形態では、本発明は、病気及び障害を治療するための方法であって、少なくとも1つの製剤がインプラントの形態である方法を提供する。インプラントは、ある実施形態ではディスク状であり、他の実施形態ではロッド状である。他の実施形態では、ポリマーと薬物は、質量で60/40の割合で混合され、アセトンから溶媒成形される。その結果と得られる膜は圧縮成形され、直径20mm、平均厚さ1.22±0.0mm、質量493±2mg、密度1.28±0.0g/ccのディスク状のインプラントが作成される(例示的なインプラントは後述する)。ある実施形態では、ロッド状のインプラントは、実施例10で後述するように、直径約1〜2mmである、長さは約10〜40mmである、又はそれらの組み合わせである。当業者なら容易に理解できるであろうが、当然のことながら、インプラントの形状は、目的とする薬物放出特性が得られるように、又は、インプラントが埋め込まれる環境(又は、本発明に係る方法に影響を与えるその他の状態)に適応するように、任意の形状に変更することができる。
【0085】
ある実施形態では、本発明は、薬物を持続的に送達するためのキットであって、生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤と、生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤とを備えているキットを提供する。
【0086】
他の実施形態では、本発明は、前記キットの第1及び第2の製剤の組み合わせが、投与後、約1週間〜約14ヶ月間にわたって薬物を徐放するキットを提供する。別の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約1週間〜約1ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約1〜3ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約3〜6ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約6〜9ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約9〜12ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約12〜14ヶ月間にわたって薬物を徐放する。
【0087】
ある実施形態では、後述する製剤の前記キット及び組成物は、上述した方法に使用される。前記キット及び組成物は、全体的に又は部分的に使用される。他の実施形態では、前記キット及び組成物は、他のキット又は組成物と組み合わせて使用される。他の実施形態では、全身療法の一部として使用される。
【0088】
ある実施形態では、本発明は、薬物を徐放するためのキットであって、前記製剤の形状が、ロッド状のインプラントであるキットを提供する。前記ロッド状のインプラントは、直径が約1〜2mmである、長さが約10〜40mmである、又はそれらの組み合わせである。
【0089】
ある実施形態では、本発明は、リスペリドン又は9−OH−リスペリドンの制御放出インプラントとして使用するのに適した、流動性を有する組成物を提供する。他の実施形態では、前記流動性組成物は、少なくとも最初は水媒体又は体液内で実質的に不溶性である生分解性熱可塑性ポリエステルを含んでいる。ある実施形態では、前記流動性組成物は、注入可能な皮下送達システムとして作成される。前記注入可能な組成物の量は、好ましくは、約0.20ML〜0.40mL、又は、約0.30ML〜0.50mLである。前記注入可能な組成物は、好ましくは、約1ヵ月に1回投与されるように作成される。他の実施形態では約3ヵ月に1回投与されるように、他の実施形態では約4ヵ月〜6ヶ月に1回投与されるように作成される。好ましくは、前記注入可能な組成物は、患者への注入に適した、液体又はゲル組成である。
【0090】
ある実施形態では、本発明は、精神障害の治療に用いる組成物であって、微小粒子の形態の組成物を提供する。他の実施形態では、前記微粒子は、実施例11で後述するようにして製造される。他の実施形態では、前記微粒子の平均径(D3,2)は、約150μm±50μmである。他の実施形態では、前記微粒子の平均径(D3,2)は、約0.75±25nmである。他の実施形態では、本発明に係る製剤(本発明に係る方法に使用される、又は、本発明に係るキット又は組成物に組み込まれる製剤)は、分解性ポリマーと複合した前記薬物から成るナノ粒子であり得る。
【0091】
本発明に係る組成物は、ある実施形態では、治療のために、任意の適切な経路を介して、人間又は他の動物に投与される。組成物は、例えば、経口的、経鼻的(例えば、スプレーによって行う)、経直腸的、経膣的、非経口的、大槽内に、及び局所的に投与される。局所的な投与は、パウダー、軟膏、又はドロップ(口腔投与及び舌下投与を含む)によって行われる。
【0092】
ある実施形態では、前記組成物は、制御放出システムによって送達される。例えば、前記物質は、静脈内注射、埋め込み型の浸透圧ポンプ、経皮パッチ、リポソーム、又は他の投与方法を使用して投与される。ある実施形態では、ポンプが使用される(see Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14: 201 (1987); Buchwald et al., Surgery 88: 507 (1980); Saudek et al., N. Engl. J. Med. 321: 574 (1989))。他の実施形態では、ポリマー材料を使用することができる。他の実施形態では、治療対象(すなわち脳)の近傍に制御放出システムを配置することができる。この場合、全身投与の場合と比べると、薬物投与量は微小で済む(see, e.g., Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984))。他の制御放出システムは、Langerによるレビューで議論されている(Science 249:1527-1533 (1990))。
【0093】
他の実施形態では、前記組成物は、経口、経静脈、動脈内、皮下、非経口、経粘膜、経皮的、又は局所性投与に適した形態に形成されている。ある実施形態では、組成物は、制御放出組成物である。他の実施形態では、組成物は、即時放出組成物である。ある実施形態では、前組成物は、液体投与形態である。他の実施形態では、組成物は、固形投与形態である。
【0094】
ある実施形態では、本発明に係る組成物の形態は、ペレット、錠剤、カプセル、溶液、懸濁液、分散液、乳液、エリキシル剤、ゲル、軟膏、クリーム、パッチ、又は坐薬であり得る。
【0095】
本発明に係る医薬組成物は、公知の、溶解、混合、顆粒化、押し出し、共押し出し、又は錠剤形成方法によって作成することができる。経口投与用には、活性成分、又はその生理学的に許容される派生物(他の実施形態では塩、エステル、N−酸化物)は、前記目的のために、慣習的な添加物(例えば、賦形剤、安定剤、又は不活性希釈)と混合され、従来の手法により投与に適した形態(例えば、錠剤、コート錠剤、硬ゼラチンカプセル剤、軟ゼラチンカプセル剤、水性溶液、アルコール性溶液、又は油性溶液)に形成される。適切な不活性媒体の例としては、結合剤(アカシア、コーンスターチ、ゼラチンなど)、崩壊剤(コーンスターチ、ジャガイモでんぷん、アルギン酸)、又は潤滑剤(ステアリン酸、ステアリン酸マグネシウム)と組み合わされた、ラクトース、サッカロース、又はコーンスターチをベースにした従来の錠剤がある。
【0096】
さらに、前記組成物は、活性成分の有効性を高めるために、少量の補助剤(湿潤剤、乳化剤、pH緩衝剤など)を含むことができる。
【0097】
活性成分は、中和された薬学的に許容される塩の形態で、組成物内に配合することができる。薬学的に許容される塩としては、無機酸(塩酸、リン酸など)又は有機酸(酢酸、シュウ酸、酒石酸、マンデル酸など)から形成される酸付加塩(抗体分子又はポリペプチドの自由アミノ基により作成された)がある。自由カルボキシル基から形成される塩は、無機塩基から作成することができる。無機塩基としては、ナトリウム、カリウム、アンモニウム、カルシウム、又は水酸化第二鉄、有機塩基(イソプロピルアミン、トリメチルアミン、2−エチルアミノ・エタノール、ヒスチジン、プロカイン)などがある。
【0098】
本発明に係る組成物は、ある実施形態では、経口送達用に作成される。活性成分は賦形剤と混合され、体内摂取可能な錠剤、バッカル錠、トローチ、カプセル、エリキシル剤、懸濁液、シロップ剤、オブラート(wafer)などの形態で使用される。錠剤、トローチ、ピル(pill)、カプセルなどは、結合剤(トラガカント・ゴム、アカシア、コーンスターチ、ゼラチンなど)、賦形剤(第二リン酸カルシウムなど)、崩壊剤(コーンスターチ、ジャガイモでんぷん、アルギン酸など)、潤滑剤(ステアリン酸マグネシウムなど)をさらに含み得る。また、甘味剤(サッカロース、ラクトース、サッカリンなど)又は香料添加剤(ペパーミント、ウィンターグリーン油、サクランボ香味料)を添加することもできる。投与形態がカプセルの場合は、上述したタイプの液体担体をさらに含み得る。被覆物として、又は投与ユニットの物理的形状は変更するために、様々な他の物質を使用し得る。例えば、タブレット、ピル又はカプセルは、セラック、砂糖又はそれらの両方によって被覆することができる。エリキシル・シロップは、甘味剤としてのサッカロース、防腐剤としてのメチル及びプロピルパラベン、染料、及び香味料(サクランボ又はオレンジ風味など)を含み得る。さらに、活性成分は、持続放出、パルス放出、制御放出、又は遅延放出を行う製剤及び組成物に組み入れることができる。
【0099】
そのような組成物は、ある実施形態では、液体又は凍結乾燥若しくは他の方法で乾燥させた組成物であり、様々な緩衝濃度、pH及びイオン強度の希釈剤(Tris−HCI、酢酸塩、リン酸塩など)、添加剤(表面への吸収を防止するためのアルブミン又はゼラチンなど)、洗浄剤(Tween 20、Tween 80、Pluronic F68、胆汁酸塩など)、可溶化剤(グリセロール、ポリエチレン・グリセロールなど)、酸化止剤(アスコルビン酸、メタ重亜硫酸ナトリウムなど)、防腐剤(チメロサール、ベンジル・アルコール、パラベンなど)、充填物質又は弾力性調整剤(ラクトース、マンニトールなど)、ポリマー(ポリエチレン・グリコール)のタンパク質への共有結合、金属イオンとの錯化、又は、物質の特定のポリマー化合物(乳酸、ポリグリコール酸、ヒドロゲルなど)若しくはリポソーム、マイクロエマルジョン、ミセル、単層或いは多層ベシクル、赤血球ゴースト、スフェロプラストの製剤への組み込みを含む。そのような組成物は、物理的状態、溶解性、インビボでの放出速度、及び、インビボでの除去速度に影響を与え得る。制御又は持続放出組成物は、脂溶性のデポー製剤(脂肪酸、ワックス、オイルなど)を含む。また、本発明は、ポリマー(ポロキサマー、ポロキサミンなど)に被覆された特定の組成物を含む。
【0100】
他の実施形態では、本発明に係る組成物は、1つ又は複数の薬学的に許容される担体材料を含む。
【0101】
ある実施形態では、前記組成物で使用される担体は生体適合性を有し、他の実施形態では生分解性を有する。他の実施形態では、前記組成物は、或る活性成分の比較的一定レベルの放出速度を提供する。しかしながら、他の実施形態では、投与直後の放出速度は、より急速であることが望ましい。他の実施形態では、活性成分の放出は、イベントによってトリガーされる。活性成分の放出をトリガーするイベントは、ある実施形態では同一であり、他の実施形態では異なる。活性成分の放出をトリガーするイベントは、ある実施形態では湿度、他の実施形態では低pH、別の実施形態では温度閾値の影響を受け得る。そのような組成物は、当業者なら周知の手法を用いて、一定の範囲内に保つことができる。このことに有用な例示的なキャリアとしては、ポリ(乳酸・グリコール酸)共重合体、ポリアクリル酸塩、ラテックス、でんぷん、セルロース、デキストランなどの微小粒子がある。他の例示的な遅延放出キャリアとしては、非流動性の親水性コア(交差結合された多糖類又はオリゴ糖)、及び随意的に両親媒性化合物(リン脂質など)を有する外層を含んでいる超分子バイオベクターがある。持続放出組成物に含まれる活性成分の量は、ある実施形態では、投与部位、放出速度、放出の予測される継続期間、及び、治療する病気の性質に依存する。
【0102】
ある実施形態では、本発明に係る方法、キット及び製剤は、癌治療の治療効果を高めるために使用される。または、HIV、単純ヘルペス、帯状ヘルペス、マイコバクテリア感染、癌、精神異常、多発性硬化症、糖尿病、腎臓病、慢性疼痛、肝炎、又は他の適用可能な疾患及び障害(例えば慢性疾患)を治療するために使用される。または、少なくとも1つの薬物を繰り返して投与する長期間の治療計画が有益である病気を治療するために使用される。
【0103】
以下の実施例は、本発明の好適な実施形態をより詳細に説明するためのものである。ただし、これらの実施例は、本発明の範囲を限定するものではない。
【実施例】
【0104】
《実施例1:サルにおけるPLGAインプラントからのハロペリドールの放出》
【0105】
(サルにおけるハロペリドールの体内放出)
霊長類におけるハロペリドールの1年間の持続的送達を評価する実験を行った。投与の霊長類の皮質組織上へのハロペリドールの長期間投与の効果を評価した。この実験は、サルにおけるハロペリドールの14ヶ月間の放出を実証した。
【0106】
(被検体)
全ての手順は、ピッツバーグ大学の動物管理使用委員会(Institutional Animal Care and Use Committee:IACUC)に承認された。2匹のサル(Macaca fascicularis, Rangos Research Facility)にインプラントを埋め込んだ。一方のサルには、対照として、薬物を含まないインプラントを埋め込み、他方のサルには、40質量%のハロペリドールを含有するインプラントを埋め込んだ。血清濃度を2〜10ng/mLにするために、ハロペリドール(Sigma, St. Louis, MO)を、約1mg/kg/日で12ヶ月間投与した。各インプラントは、ポリ(D,L−乳酸/グリコール酸)共重合体(PLGA)の単一ポリマーから作成した(Medisorb(R)Aldernzes, Cincinnati, OH)。PLGAにおけるポリ乳酸(polylactic acid:PLA):ポリグリコール酸(polyglycolic acid:PGA)の比率は、75:25、85:15、90:10(高固有粘度及び低固有粘度)、95:5、及び100:0であった。
【0107】
(インプラント製造)
ポリマーとハロペリドールを質量で60/40の割合で混合した後、アセトン(Fisher Scientific, Pittsburgh, PA)により溶媒成形した。その結果得られた膜を圧縮成形して、直径20mm、平均厚さ1.22±0.0mm、質量493±2mg、及び密度1.28±0.0g/ccのディスク状のインプラントを作成した。
【0108】
(薬物動態測定)
血液を1ヶ月に2回採取した。検体を遠心分離によって分離し、紫外線検出を用いた高速液体クロマトグラフィー(high-pressure liquid chromatography:HPLC)によって、ハロペリドールの濃度を分析した(図1)。対照動物の分析では、薬物は検出されなかった。
【0109】
(結果)
図1に示すように、ハロペリドールの放出は、合計で443日間測定された。最初の224日間の平均血清濃度は、10.5±1.5ng/mLであった。その後の176日間の平均血清濃度は、放出の終わりまで低濃度であり、4.0±0.4ng/mLであった。最後の45日間では、放出は一次減衰放出をたどり、平均血清濃度は、1.2±0.3ng/mLであった。
【0110】
《実施例2:ウサギに埋め込まれたインプラントの2つのポリマーPLGA系からのハロペリドールの放出》
【0111】
(ウサギにおけるハロペリドールの放出)
ウサギに埋め込まれたインプラントは、検視時にインプラント部位を発見しやすくするために、ひもで縛られている。2つの異なるインプラント・システムを試験した。一方は、サルの場合の実験結果(実施例1参照)を確認するために、5つの異なるポリマーのアマルガムを含んでいる。他方は、単一の長持ちするポリマーシステムから成り、1年間に渡る放出を維持する間に、最初の急増を抑制することを目的とする。これらのウサギを用いた実験は、ハロペリドールの13ヶ月間の放出を実証した。
【0112】
(被検体)
4.0〜5.7kgの範囲のウサギ(N=12, Covance, Denver, PA)を用いた。5匹のウサギに、単一ポリマーである100%ポリ乳酸(PLA)から成り、40%(w/w)のハロペリドールを含有しているインプラントを埋め込んだ。このインプラントの平均投与量は418±7mg/kg、平均の1日量は0.02mg/kg/日であり、365日間の送達が予想される。
【0113】
他の5匹の動物には、75:25、85:15、90:10(高固有粘度)、90:10(低固有粘度)、及び100:0のPLGAを含む複合ポリマーシステムから成るインプラントが埋め込まれる。このグループでの平均投与量は、473±4mg/kg、平均の1日量は、1.29±0.03mg/kg/日であり、365日間の送達が予想される。
【0114】
別の2匹のウサギには、対照として、薬物を含まないインプラントが埋め込まれる。1匹には、単一ポリマーの状態を模倣するために、PLAが100%のインプラントが埋め込まれる。もう1匹には、複合ポリマーシステムを模倣するために、75:25、85:15、90:10(高固有粘度)、90:10(低固有粘度)、及び100:0のPLGAから成るインプラントを埋め込む。
【0115】
(インプラント製造)
ウサギ用のインプラントは、サルを対象とした実施例1の方法を用いて作成される。作成されたインプラントの平均質量は536±2mgであり、密度は1.24±0.00g/ccであった。
【0116】
(薬物動態測定)
血液を1ヶ月に2回採取した。固相抽出後、血清のハロペリドールを、UV検出を用いたHPLCによって測定した(Oasis MCX columns, Waters, Milord, MA)(図2)。
【0117】
(組織学的分析)
5匹のウサギは、病理学的な中間解析を行うために、9ヶ月後に屠殺した。残りの7匹のウサギは、その4ヵ月後に屠殺した。対照以外の全ての動物で、インプラントの残余は、屠殺されたウサギの所定の位置に繋がれているのが見つかった。HPLC/UV及びNMR分光法によって、インプラントの残余内に、ハロペリドール及びPLGA分解産物の存在が確認された。組織学的分析によって、対照及び治療されたウサギの全ての器官系は、正常範囲内であることが分かった。
【0118】
(結果)
図2(A)に示すように、ウサギに埋め込まれた単一ポリマーシステムからのハロペリドール放出は、合計で379日間測定された。最初の224日間の平均血清中濃度は、2.5±0.4ng/mLであった。また、57〜274日の平均濃度は、3.8±0.4ng/mLであった。
【0119】
図2(B)に示すように、ウサギに埋め込まれた複合ポリマーシステムからのハロペリドール放出は、合計で379日間測定された。最初の224日間の平均血清中濃度は、2.5±0.4ng/mlであった。また、57〜274日の平均濃度は、3.8±0.4ng/mlであった。
【0120】
複合ポリマーシステムでは、最初の7ヶ月間では、その後の7ヶ月と比べると、血清レベルが高い(図2(B))。例えば75:25 PLGAなどの早期分解ポリマーから成るインプラントは、初期の放出量が多くなると思われる。そのため、初期の放出量を少なくするためには、75:25 PLGAインプラントの質量を減少させる必要がある。
【0121】
《実施例3:PLGAインプラントからのリスペリドン放出》
【0122】
(リスペリドンの安定性)
リスペリドン(10mg)は、100μのアセトニトリル中に溶解される。その後、10,000ng/mlの最終的な溶液を作成するために、1000mlのリン酸緩衝生理食塩水(pH7.0)中に溶解される。作成されたリスペリドン溶液は、その後、琥珀色の遮光ボトルに37℃で保存され、40rpmで攪拌される。1週間に3回、1mlのサンプルが採取され、UV分光法(AmershamBiosciences, Buckinghamshire, UK)によって、薬物含量が検査される。分析によって、薬物の濃度は依然として安定しており、285日間で、全体の0.12%が減少しており、0.05ng/日と等しいことが分かる。
【0123】
(インビトロでの個々のポリマーからのリスペリドン放出)
3つのポリマーのリスペリドン放出特性を評価した。インプラントは実施例1で上述したようにして、20%のリスペリドン(w/w)(RBI Flanders, NJ)と、80%(w/w)のポリマー(MEDISORB(TR), Alkermes Inc. Cincinati, OH)とから製造される。前記ポリマーは、50:50(PLA:PGA)(高固有粘度、inherent viscosity:IV)、65:35(低IV)、及び75:25(高IV)のPLGAである。3つのインプラントは、個々の琥珀色の遮光ボトル(リン酸緩衝生理食塩水が入っている)に37℃で保存され、40rpmで攪拌される。各ボトルから、1週間につき3回、1mlのアリコートを採取する。そして、一定容積を維持するために1mlの緩衝液を再導入した後、UV分光法(AmershamBiosciences, Buckinghamshire, UK)によって薬物含量を分析した。
【0124】
(結果)
図3は、20%の薬物が充填された50:50(高IV)、65:35(低IV)、及び75:25(高IV)のPLGAから成るインプラントより放出されるリスペリドンの累計放出量を示している(典型的な飽和曲線である)。薬物放出は、ポリマー基質内のPGA濃度次第であり、PGA濃度が低い場合はリスペリドンの放出も遅くなる。
【0125】
《実施例4:リスペリドンのインプラントへの最大充填量の測定》
(リスペリドンの最大充填量の測定)
インプラントに充填されるリスペリドンの最大濃度を設定する目的で、リスペリドンの薬物濃度が放出特性に与える影響を試験した。各インプラント・システムに薬物を最大充填量で充填することにより、インプラント・システムを小型することが可能となり、耐容性が向上する。
【0126】
(方法)
インプラントは、リスペリドンと20、40、又は60%薬物(w/w)の割合で複合したポリマー(85:15 PLGA 高IV)を使用して作成される。前記ポリマーの予想される分解時間は4ヶ月間である。各インプラントの質量は50±10mgであり、各インプラントは、10、20及び30mgの薬物を生成する。図4(A)は、放出特性を、各インプラント(50mg)から40日間で放出されたリスペリドンの累計放出量(mg)として表している。図4(B)では、放出特性を、各インプラント(50mg)から40日間で放出されたリスペリドンの%として表している。
【0127】
《実施例5:インプラントの形状に応じたPLGAインプラントからのハロペリドールの放出》
【0128】
(背景)
ディスク状のインプラントを埋め込むための大きい切開(incision)は、ある状況下では、ディスク状インプラントの人間の患者への適用性を減少させる。そのため、4mmの孔を介して挿入できるように、インプラントはロッド状に製造される。剛体のPLGAインプラントは、皮膚下でインプラントをガイドする道具を不要とし、筋肉内に挿入されずに皮下に存在することを確実にする。インプラントの形状がハロペリドールの放出に及ぼす影響を調べるために、予備的な実験を行った。
【0129】
(方法)
ハロペリドール(40% w/w)は、溶媒成形によって、50:50 PLGA(60% w/w)と複合される。その物質は、その後、ディスク状に圧縮成形される。または、高圧ピストン押出成形機(DACA Instruments, Goleta,CA)を使用してゆっくりと押出し成形される。
【0130】
(結果)
これら2つの形状(ディスク状とロッド状)の放出特性を図5に示す。図5は、インビトロでの、ディスク又はロッド状のインプラントから放出されるハロペリドールの累積放出量を示している。各点は、ディスク又はロッドのインプラントにおける3回の観測結果の平均を示している。各インプラントは、暗闇で500mlのリン酸緩衝生理食塩水(pH7.0、37℃)に入れられ、40rpmで攪拌される。ディスクとロッドの重量は等しい。2つのインプラント形状の間には、放出特性の微細な違いは見られなかった。
【0131】
《実施例6:血清中の薬物濃度を一定に保つための放出特性の制御》
【0132】
(放出特性のガウス分布)
ウサギに埋め込まれた単ポリマーシステムからの放出特性(図2(A))は、生体分解性インプラントが抗精神病薬の送達を長期の治療期間中実施できることを示唆している。このデザインは、初期に高血清濃度になることを避けるので、放出特性のガウス分布は、目的とする血清濃度に達するまでに3ヶ月間かかる。それにもかかわらず、放出特性の左右対称性は、6ヶ月毎に埋め込みを繰り返して、あるセットのインプラントにおける放出減少を次のセットのインプラントからの放出で相殺することによって、治療期間中の薬物送達を持続することを可能にする(図6)。
【0133】
図6は、生体分解性インプラントによる連続的送達のモデルを示す。ウサギに埋め込まれた100% ポリ乳酸(poly lactic Acid:PLA)インプラントの放出特性は、6ヶ月間の間隔(グレイのトレンドライン)で一時的に重なり、再埋め込み間隔をモデルする。各時点での予測される血清濃度が合計され、予想される合計放出プロットが得られる。黒のトレンドラインは、合計の血清濃度をモデルしている。このシステムは、6ヶ月間ごとに再移植を行う限り、目的とする血清濃度の周辺で振動する。
【0134】
《実施例7:人間患者に対する薬物持続放出治療のスケーリング》
【0135】
(人間へのスケーリング)
多くの種間で、薬物(ハロペリドールを含む)の代謝作用は異なる。ウサギとサルの両方では、人間と同等の血漿濃度を得るためには、人間の場合よりも約15〜30フォルド多い投与量が必要である(Bacopoulos etal., 1980; Jibiki et al., 1993; Klintenberg etal., 2002)。人間の場合は、デボー製剤として投与する場合は、ハロペリドールは約1mg/kg/月必要である。そのため、ハロペリドールを600mg含有するインプラント・システムは、体重が50kgの患者を1年間治療することができる。したがって、1年間の治療のためには、インプラントは、薬物を40%含有する1.5gmにデザインされる。この方法が有望であることが分かっているリスペリドンなどの強力な薬物も同様に使用される。リスペリドンの放出特性は、PLGA送達システムに組み入れた際に、生体内で6ヶ月間又はそれ以上に及ぶ長時間送達が得られることを示している。
【0136】
《実施例8:リスペリドンの長期間放出》
【0137】
〈長期間送達システムにおけるリスペリドンの物理化学的特性〉
【0138】
(リスペリドンの安定性)
リスペリドンの安定性は、アセトンからの溶剤成形及びゆっくりとした押出成形の後に評価される。このことにより、前記組成物がインプラントへの商業的製造に耐えられるかどうかが確認される。その後、保存期限の実験が行われる。4℃で様々な期間(最大1年間)保存された一連のインプラントのリスペリドン成分が検査される。UV分光法で検査した結果、リスペリドンは、生理的水環境(37℃、0.9% リン酸緩衝生理食塩水、pH7.0)で10ヶ月間安定していた。リスペリドンは、溶剤成形及び押出成形後、HPLC−MSピークの持続時間及び量の性質を保つ。さらに、UV検出を備えた定量的HPLCで評価したところ、リスペリドンは、生理的水環境(37℃、0.9% リン酸緩衝生理食塩水、pH7.0)で1年間保存した場合は、1%以下しか分解しなかった。
【0139】
(PLGAの安定性)
10のPLGAポリマーの保存中における安定性を、固有粘度とガラス転移温度(glass transition temperature:Tg)の測定により評価した。溶媒成形及び押出成形後、乾燥環境(4℃)で1年間保存したPLGAポリマーは、固有粘度については5%以下の変化を示し、Tgについては2℃以下の変化を示した。
【0140】
〈方法〉
(材料)
リスペリドンは、GMP法を用いて合成される。市販されている医療グレードのリスペリドンとアセトン(USP/EP)が使用される。
【0141】
(次のPLGAポリマーが使用される)
【表2】

【0142】
〈生理溶液内でのリスペリドンの経時的な安定性〉
次のようにして、リスペリドン溶液の複製が3つ作成された。アセトニトリル100μlに、リスペリドン(10mg)を溶解させる。その後、リン酸緩衝生理食塩水1000ml(pH7.0)に溶解して、10,000ng/mLの最終的な溶液を作成する。リスペリドン溶液は、その後、琥珀色の遮光ボトルに37℃で保存される。HPLC分析のために、1カ月おきに、各サンプルの3つのアリコート100μlを採取した。その後、リスペリドンの濃度を経時的にプロットし、結果として得られる線の傾斜が、組成物の安定性を示す。
【0143】
〈リスペリドン及びPLGAポリマーの埋め込み中の安定性〉
(リスペリドン)
5%の薬物と95%のポリマー(w/w)から構成されるリスペリドン・インプラントは、アセトンからの溶媒成形によって作成される。そして、その後、押出成形(60℃、ピストン速度:5mm/秒)によって、直径3.6mm、長さ20±10mmのロッドが作成される。結果として得られた物資の成分は、HPLCによって、インビトロで定量分析される。結果は、インプラント物質に充填されたリスペリドンの最初の質量に対する割合として表される。
【0144】
(ポリマー)
PLGAポリマーの安定性は、製造処理後に評価される。対照インプラントは、薬物を含有していない。対照インプラントは、アセトンからの溶媒成形によって作成され、その後、ゆっくりした速度で押出成形される。結果として得られる物質(5〜10mg)は、一定温度(25℃)でウベローデ粘度計(Ubbelhode suspended-level viscometer)を使用して、アセトン内でのIVの変化が分析される。また、示差走査熱量計(differential scanning calorimetry)を使用して、Tgの変化が分析される(20〜100℃、10°/分)。IV及びTgは両方とも、インプラントの製造前と製造後に測定される。
【0145】
〈生体分解性コポリマーの物理化学的性質に関しての、リスペリドンの体内での放出特性の測定〉
(個々のポリマーの放出パターン)
薬物が50%充填されている、100% PLAから成る単一のポリマーシステムの放出特性は、ガウス分布として表される。埋め込み後、ピーク濃度が6ヶ月間維持され、有効濃度(1ng/L以上)が2〜8ヶ月間維持される(図7A)。放出特性の対称性は、6ヶ月毎に埋め込みを繰り返すことによって、治療期間中の薬物送達を維持することを可能にする。リスペリドンの典型的な放出は、PLGA生体分解性基質中に拡散されているリスペリドンの累積放出量として、図11Aに示されている。同様に、9−OH−リスペリドンの放出特性が、図11Bに示される。同様に、図12は、20%(w/w)の9−OH−リスペリドンが充填された、PLA:PGAが85:15のブロック共重合体ポリマー生体分解性基質における、9−OH−リスペリドンの累積放出量を示している。また、図13は、20%(w/w)のリスペリドンが充填された、PLA:PGAが85:15のブロック共重合体ポリマー生体分解性基質における、リスペリドンの累積放出量を示している。
【0146】
比較的長時間の遅れと、目的とする治療有効濃度の周辺での大きな振動を避けるために、付加的なポリマー・インプラント又は放出特性の速い製剤が複合され、治療期間中は見かけ上ゼロ次速度の放出を交互に行い、治療期間中は薬物の有効濃度を維持する(図7B〜7E)。
【0147】
《実施例9:PLGAインプラントからのハロペリドール放出》
【0148】
(インプラント製造)
インプラントは、溶剤成形と圧縮成形によって製造される。ポリ乳酸とポリグリコール酸との比率が75%:25%のPLGAと、ポリ乳酸とポリグリコール酸との比率が85%:15%のPLGAとの2つのポリマーは、5ヵ月間の放出を行う複合システム内に存在している。各コポリマーは、独自の分解期間を有している。分解期間は、乳酸のグリコール酸に対する割合と、作成された分子の分子量によって決定される。ラットのインビボ試験に、別の100% ポリ乳酸(PLA)ポリマーが使用される。全てのポリマー(Alkermes Inc., Cincinnati, OH)は、クロロホルム内で0.66〜0.80DL/gの固有粘度を有しており、分子量の分布は120〜140kDである。個々のポリマー及びハロペリドール(Sigma, St. Louis, MO)は、アセトン内に溶解され、60℃、72時間で溶剤成形される。溶剤成形された物質は、80℃、25,000psiで、最終密度が1.1±0.05g/ccとなるように、圧縮成形される。
【0149】
(インビトロ分析)
個々のインプラントは、攪拌器上の1リットルのリン酸緩衝生理食塩水(PBS)(pH7.0、37℃)に入れられる。ハロペリドール濃度は、GCMS(National Medical Services, Willow Grove, PA)によって測定される。各分析は、ポリマーだけから成るインプラントの陰性対照、及び、溶媒内でハロペリドールの長期間の安定性を評価するのに標準的な100ng/ml ハロペリドールを含む。
【0150】
(動物)
インプラントは、ラット(Harlan, Indianapolis, IN)(n=9)及びマウス(Jackson Labs, Bar Harbor, ME)(n=16)を用いて試験した。全ての動物は、AAALAC適格審査に合格した動物施設に収容された。全ての手順は、ピッツバーグ大学の動物管理使用委員会(Institutional Animal Care and Use Committee:IACUC)に承認された。動物は、全ての試験で12:12の明暗サイクルで保持され、処置は明サイクル中に実施された。
【0151】
(埋め込み/除去手術)
マウス及びラットは、ケタミン/キシラジン(100/10mg/kg,i.p.)によって麻酔される。外科用メスによって、動物の背面の皮膚が1cm切開される。皮下の空間は、止血剤によって可視化され、単一のインプラントがピンセットによって真皮と筋肉との間に設置される。傷は手術用ホッチキスによって閉じられる。埋め込んだ4週間後、インプラントの位置は触診によって判断され、同一の麻酔及び切開によってインプラントは除去される。実際、インプラントはピンセットによって容易に除去される。
【0152】
(行動実験)
インプラントの移動時の影響を評価するために、16匹のC57bl/6マウスの内、8匹のマウスには75:25 PLGAのみから成るインプラントを埋め込み、残りの8匹のマウスには20%ハロペリドールが充填された75:25PLGAから成るインプラントを埋め込んだ。埋め込んだ3週間後、移動距離の合計を20分間にわたって評価した。その後、インプラントを取り出し、再テストの前に動物を48時間休息させた。再テストは、アポモルヒネ(0.5mg/kg,i.p.)(Sigma, St Louis, MO)を投与した20分後に行われた。
【0153】
(ウエスタンブロット法)
6匹のSD(Sprague-Dawley)ラットに、30〜40% ハロペリドールを有するPLAから成るインプラントを埋め込んだ。3匹のラットに、PLAのみから成るインプラントを埋め込んだ。インプラントは、動物内に3ヶ月保持された。インプラントを除去した72時間後、ラットを屠殺し、脳を急いで取り出し、切開によって4つの部分(皮質、海馬、線条体、小脳)に分割した。その後、液体窒素で冷凍した。D2受容体タンパクを定量分析するウエスタンブロット法を、線条体に対して行った。1匹の動物における皮質タンパク質の3つの濃度(2.5、5及び10μg)は、ラベリングの度合いを保証するための内部制御として、全てのブロットで行われ、分析ソフト上では直線状である。サンプルの密度が内部標準の直線領域内にあるこれらのブロットのみが分析に使用される。ウエスタンブロット法は、D2受容体タンパクのアミノ酸272−282に対するポリクローナル抗体WR−3526を使用して行われる(Research and Diagnostic Antibodies, Berkeley, Ca)。線条体は、均質化緩衝液(20mM HEPES,2mM EGTA,1mM PMSF,2μM アプロチニン、及び2mM DTE)内で均質化され、その後30秒間超音波処理される。サンプルは、100,000g、1時間、40℃で遠心分離される。ペレットは再懸濁され、0.1% Triton X−l00を含んでいる均一化緩衝溶液内に溶解される。タンパク質は予備攪拌により氷上に45分間抽出される。抽出後、タンパク質は、300,000g、30分間、40℃で遠心分離される。タンパク質のサンプルは、25% 4x NUPAGEサンプル緩衝液、10%還元剤(Invitrogen)から作成され、70℃で10分間熱ショックが与えられる。サンプルは、前もって成形された10%ミニジェル上で分離される(200ボルト、50分間)。タンパク質は、PVDFに転移される(30ボルト、1時間)。ブロットは、TBS(20mM Tris,pH=7.5, 0.5M NaCl)内の5%のミルクによってブロックされる。その後、15分間洗浄される。ブロットは、その後、抗D2容体抗体と共に一晩培養される。そしてTBSによって洗浄した後、ヤギ抗ウサギホースラディシュ・ペルオキシダーゼ複合体(BioRad,1:4800)と共に1時間培養される。ブロットは、その後、化学発光基質(Pierce)と1分間培養され、プラスチックによって覆われ、オートラジオグラフィー膜にさらされる。
【0154】
(定量化)
各バンドの強度は、濃度計モデル7100と定量分析ソフトウエア(Bio Rad, Hercules, CA)を使用して定量化される。そして、強度の割合を得るために、ラットにおける対応するバンドに対する割合として表される(rat 1=ratio of 1)。全てのサンプルは、状態間の定量比較を行うために、単一のブロットで、同時に行われる。
【0155】
(インビトロ)
2つのポリマーのハロペリドール濃度を、図8A〜Cに示す。図8は、攪拌器上のリン酸緩衝生理食塩水(pH7、37℃)に配置された、個々のインプラントのグラフを示している。緩衝液のサンプルは、1週間又は2週間の間隔で抽出され、ハロペリドールの濃度をGCMSによって評価する。累積放出は、各時点において緩衝溶液で測定された薬物充填量全体の%として表される。75:25及び85:15 PLGAポリマーから放出されるハロペリドールの累積濃度が表される。各グラフは、3つのインプラント(円、四角、三角形)からのデータを示す(3つの値の第4度多項式平均線により)。
【0156】
ハロペリドールの含有率が40%の75:25 PLGAから成るインプラントの放出特性は、初期段階(0〜28日)では、ゆっくりと放出することを特徴とする(約0.29%/日/インプラント)。第2の段階(28〜84日)では、より急速に放出する(約1.28%/日/インプラント)。75:25 PLGAから成るインプラントは、66日間で、充填されたハロペリドール全体の50%を放出する(図8A)。ハロペリドールの含有率が40%の85:15 PLGAから成るインプラントは、初期の段階(0〜56日)では、ゆっくりとした放出パターンを示す(約0.26%/日/インプラント)。そして、第2の段階(56〜140日)では、より急速に放出する(0.95%/日/インプラント)。85:15 PLGAから成るインプラントは、88日間で、充填されたハロペリドールの半分を放出する(図8B)。ハロペリドールの含有率が40%の75:25及び85:15 PLGA(理論上の複合材料システム)からの放出は、初期の段階(0〜28日間)では平均0.34%/日の放出を示し、第2の段階(28〜140日)では、0.82%/日の急速な放出を示す。75:25と85:15 PLGAの混合構造は、578日間で、充填されたハロペリドールの半分を放出する(図8C)。陽性対照溶液(100ng/ml)の値は、154日間、依然として安定している(0日間=106、154日間=100、平均±sd、実験期間中=106±11ng/ml)。
【0157】
(インビボでの自発運動)
ハロペリドール又はブランク・ポリマーのインプラントが埋め込まれたマウスの自発運動(Locomotor activity)を図9に示す。全ての動物は、75:25 PLGAだけから成るインプラント、又は、ハロペリドールの含有率が20%の75:25 PLGAから成るインプラントを埋め込んだ後に3週間試験した。基準の自発運動は、24分間測定した。対照インプラントが埋め込まれた動物の移動距離は、平均12223±433cmであった。ハロペリドールを含有しているインプラントの移動距離は、平均7664±450cmであった。したがって、ハロペリドールを含有しているインプラントが埋め込まれたマウスの移動は、対照よりも著しく少ない(p<0.01)。その後、インプラントは取り除かれ、全ての動物は、48時間回復させた。1匹の対照インプラントが埋め込まれた動物は、除去手術中に麻酔によって死亡した。インプラントを除去した48時間後、自発運動テストの24分前に、動物の腹腔内にアポモルヒネ(0.5mg/kg)を投与した。このことにより、マウスの自発運動は向上する(Ninan and Kulkami 1999)。アポモルヒネを投与した後の、対照インプラントが埋め込まれた動物の移動は、平均4721±476cmであった。一方、ハロペリドールを含有しているインプラントが埋め込まれた動物の移動は、平均8531±2536cmであった。そのため、インプラントを除去してアポモルヒネを投与した後は、ハロペリドールを含有しているインプラントが埋め込まれたマウスは、対照マウスよりも長い距離を移動した(p<0.01)。
【0158】
(ウエスタンブロット法)
全てのラットからの線条体膜に対するウエスタンブロット法は、完全長D2受容体タンパク(Expert Protein Analysis System, SwissInstitute of Bioinfo3matics, http ://www. Expasy. ch)(Bunzow et al 1988)の予測される分子量に対応する、視覚的なバンドの約50kDの分子量を明らかにする(図10)。バンドの光学濃度の平均は、レーン1(ハロペリドールで治療されたラット)に対して定量化される。3ブロットに基づく結果は、50kDバンドに対応するハロペリドール・インプラントで治療されたラットの平均±SD相対密度を生成する。一方、対照ラットの平均相対密度は、0.64±0.02であった(p<0.001、両側t検定)。
【0159】
《実施例10:リスペリドン・インプラントによる統合失調症の長期間治療》
【0160】
〈インプラント製造〉
(リスペリドン・ディスク・インプラント)
ディスク・インプラントは、溶剤成形及び/又は圧縮成形によって製造される。75:25 PLGA(ポリ乳酸:ポリグリコール酸の比が75%:25%)と、85:15 PLGA(ポリ乳酸:ポリグリコール酸の比が85%:15%)の2つのポリマーは、12〜14ヶ月間の放出を行う複合システム内に存在している。各コポリマーは、独自の分解期間を有している。分解期間は、乳酸のグリコール酸に対する割合と、作成された分子の分子量によって決定される。全てのポリマー(Alkermes Inc., Cincinnati, OH)は、クロロホルム内で0.66〜0.80DL/gの固有粘度を有しており、分子量の分布は120、000〜140、000である。個々のポリマーとリスペリドン(Sigma, St. Louis, MO)は、アセトン内に溶解され、60℃、72時間で溶剤成形される。溶剤成形された物質は、直径20mm、厚さ1.2±0.00mm、最終密度1.2±0.1g/ccのディスク状に成形される。
【0161】
(リスペリドン・ロッド・インプラント)
ロッド・インプラントは、圧縮成形によって製造される。ポリ乳酸:ポリグリコール酸が50%:50%である50:50 PLGAポリマーは、2ヶ月間の放出を行うシステム内に存在している。ポリマー(Alkermes Inc., Cincinnati, OH)は、クロロホルム内で0.66±0.1DL/gの固有粘度を有しており、分子量の分布は120、000〜140、000である。ポリマーとリスペリドン(Sigma, St. Louis, MO)は、アセトン内に95:5の割合(w/w)で溶解される。そして、高圧ピストン押出成形機(DACA Instruments, Goleta, CA)を使用して60℃、5mm/秒のピストン速度(psi)で押し出され、最終密度が1.1±0.1g/cc、直径3.5±0.5mm、長さ20±10mmとなるように成形される。放出特性は、モノマー割合(乳酸:グリコール酸)、最初に充填される薬物の量、及び製造方法によって異なる。
【0162】
(実験の対照及びモニタリング)
(A)対照被験体の第1のグループには、リスペリドンを放出する複数ポリマーシステムを6ヶ月間埋め込んだ。
(B)対照被験体の第2のグループには、最初に複数ポリマーシステムを埋め込み、6ヶ月後、「メンテナンス」インプラントを再度埋め込んだ。このようにして、12ヶ月間の連続的な薬物治療を行った。
(C)対照被験体の第3のグループには、最初に複数ポリマーシステムを埋め込み、定常状態の送達を行った。しかし、「メンテナンス」インプラントを再度埋め込むことは行わなかった。これらの対照は、埋め込んだ12ヶ月後にテストされ、このシステムが薬物送達を終了した後の毒性学的評価が行われた。
(D)対照被験体の第4のグループには、送達期間中のインプラントの物理的ダメージを評価するために、故障したインプラントを埋め込んだ。
(E)対照被験体の第5のグループは陽性対照であり、試験される送達システムとは無関係に、薬物の毒性効果を明らかにするために、リスペリドンの経口又は注射による投与を毎日受けた。
(F)対照被験体の最後のグループは陰性対照であり、リスペリドンとは無関係に、ポリマー物質の影響を評価するために、薬物を含有していないブランクのインプラントが埋め込まれた。
【0163】
(ロッド・インプラントの配置)
放出特性が異なる複数のインプラントを、患者の皮下に挿入した。インプラントは、4mmの切開によって肩に配置した。インプラントは剛性なので、インプラント・ガイドは不要である。
【0164】
(統合失調症の治療効果の判定)
患者は、治療を受けている間は、簡易精神症状評価尺度(Brief Psychiatric Rating Scale:BPRS)のスコアが向上した(Dinakar, H.S. et al., [2002] Efficacy of Olanzapine and Risperidone for Treatment-Refractory Schizophrenia Among Long-Stay State Hospital Patients, Psychiatric Services, Vol. 53 No.6, pp 755-757)。そして、体重増加などの大きな副作用は示さなかった。陰性症状(失語、感情の平坦化、意欲、無関心、引きこもり、注意力障害)と認知的作業の実行とに関しても向上が見られた(Honey, G. D., et.al. , [1999] Diffrrences in Frontal Cortical Activation by a Working Memory task after Substitution of Risperidone for Typical Antzl, sychotic Drugs in Patients with Schizophrenia. PNAS, vol. 96, No. 23, pp. 13432-13437)。
【0165】
(リスペリドンの血清中濃度)
埋め込み/再埋め込み計画に基づいて、患者から3ヵ月後毎に(又は必要に応じて)2mlの血液を採取した。血液はその後遠心分離され、血清を分離した。リスペリドン濃度は、固相抽出(MCX, Waters)及びHPLC/UV測定によって決定される。
【0166】
《実施例11:双極性障害の短期間(1〜3週間)を治療するための9−OH−リスペリドンを経口投与するために使用される微小粒子》
【0167】
(微小粒子の製造)
微小粒子は、活性成分としての9−ヒドロキシ−リスペリドンを98:2(w/w)の割合で含有する、ポリ(グリコール酸)及びポリ(D,L−乳酸)共重合体(乳酸:グリコール酸の比は75:25)から作成される。PLGAと9−ヒドロキシ−リスペリドンは、アセトン及びEVA(分散相)内に溶解される。連続相は、PVA、水、酢酸エチル、及びベンジルアルコールから作成される。乳剤を形成するために、20:80の比の分散及び連続相が、静的ミキサー(Kenics(TR) KM Series Static Chernineer, Dayton, OH)によってポンピングされる。ミクロスフェアの最終的なサイズは、相比、流速、温度、連続相の組成によって調整される。その結果生成される乳剤は、焼入液に注入される。安定させた後、結果として生成されたミクロスフェアを濾過する。そして、適切な一連の溶媒によって繰り返して洗浄した後、乾燥させる。
【0168】
(ミクロスフェアの投与)
ミクロスフェアはカプセルに封入され、患者に経口投与される。ミクロスフェアは賦形剤と混合され、体内摂取可能なカプセルとして使用される(結合剤、賦形剤、潤滑剤、さらには液体担体を含む)。
【0169】
(治療効果)
長期間の治療を受けている患者は、臨床全般印象尺度(Clinical Global Impression:CGI)及び機能の全体的評価(Global Assessment of Functioning:GAF)の平均値に基づいている基準よりも少なくとも7ポイント上の改善を示す。治療は、良好な耐容性を示し、9−OH−リスペリドンが投与されている間は、患者は気分症状の悪化を体験しない(Ghaemi, S.N. [1997] Acute Treatment of Bipolar Disorder with Adjunctive Risperidone in Outpatients. Can J Psychiatry, Vol 42, pp. 196-199)。
【0170】
《実施例12:第2世代抗精神病剤を使用した精神病性障害の徐放治療》
【0171】
(スターターの製造)
剛性インプラントが有効血清濃度に達するまでの比較的長時間の遅れを補うために、精神病性障害の症状を示す患者には、特に血清濃度を治療有効濃度まで急激に上昇させるための、注入可能な形態の抗精神病剤含有製剤が投与される。注入可能な前記製剤の投与後は、抗精神病剤を含有しているPLGAの微小粒子であって、前記薬物を高速で放出する微小粒子を経口投与する。このことにより、前記薬物の治療有効濃度は1日で得られ、送達ピークは2週間以上維持される。
【0172】
〈インプラント〉
(単ポリマー・インプラント)
上述したようにして製造されたインプラントは、単一のコポリマーから作成され、抗精神病剤を含んでいる。放出特性は、埋め込み後、治療有効濃度が3週間以内に得られ、放出ピークが5〜7ヶ月間持続し、完全に分解されるまで6〜8ヶ月間かかるようにデザインされる。単一インプラントでは、抗精神病薬の最適血清濃度の周辺で、濃度は大きな振幅で変動し得る。そのため、前記変動を補うために、単一コポリマー組成物であり、送達ピークは10〜14週間であり、完全に分解されるまで4〜5ヶ月間かかる第2のメンテナンスセットが加えられる。PLGAインプラントから放出される様々な抗精神病薬の累積放出特性の例は、図14D、15A、16A、及び17Aのグラフに示される。
【0173】
(複数のコポリマー組成物インプラント)
共押し出し法を使用して、複合インプラントの中心には長期間放出特性を有するPLGA(PLA:PGAは85:15、高IV)コポリマーが高充填(high-load)され、外側には急速放出特性を有するPLGA(PLA:PGAは50:50、低IV)が低充填(low-load)される。このことにより、メンテナンスセットが不要となり、分解までの時間を速めることができる。したがって、治療有効濃度を長期間維持することができるので、再埋め込みは9ヶ月間に1回で済む、或いは、インプラントのサイズを小型化することができる。
【0174】
(抗精神病薬の血清濃度のモニタリング)
患者からは、埋め込み/再埋め込み計画に基づいて、3ヶ月毎に又は必要に応じて、2mlの血液が採取される。採取した血液を遠心分離して、血清を分離する。抗精神病薬の濃度は、固相抽出(MCX, Waters)及びHPLC/UV測定によって決定される。
【0175】
(治療効果のモニタリング)
【0176】
治療効果は、治療する精神病疾患によって異なる。患者は、一般的に、認知的作業、感情の安定、又は感情の起伏に向上を示す、特に、作業能力、他の人間や社会との交流や親密になることに向上を示す。大きな副作用は見られず、再入院の頻度は減少する。インプラントから放出される抗精神病薬の効果を、図14〜17に示す。
【0177】
《実施例13:薬物充填の最適化》
【0178】
(背景)
リスペリドンの放出特性に対する薬物濃度の影響を調べる実験を行った。この実験の目的は、インプラントに充填されるリスペリドンの最大濃度を定めることにある。インプラントに充填されるリスペリドンの濃度を最大にすることにより、インプラントのサイズを小型化できる。そして、その結果、患者の耐容性を高めることができる。インプラントは、重量で20%、40%又は60%の割合でリスペリドンと複合した単一ポリマー(85:15 PLGA 高IV)から作成した(図18A)。ポリマーの分解期間は、4ヶ月間と予測される。各インプラントの重量は約50mgであり、薬物の充填状態に応じて、10(20%)、20(40%)、及び30mg(60%)の薬物を放出する。この実験は繰り返され、他の薬物含有割合についての試験も行った。
【0179】
(結果)
図18A・Bは、重量で20%、40%又は60%のリスペリドンが充填された85:15 PLGAから成るインプラントから放出されたリスペリドンの累積放出量を示す。各点は3つの複製の平均を示し、全ての放出パターンはトレンドラインによって示されている。図18Aでは、放出は、各インプラント(50mg)から放出されたリスペリドンの累積放出量(mg)として表している。図18Bでは、放出は、各タイプのインプラントに充填されている薬物の量に対しての%として表している。
【0180】
以上、本発明の様々な実施形態を説明したが、これらの実施形態は例示的なものであり、本発明を限定するものではない。従って、本発明の範囲は、特許請求の範囲及びその均等範囲によってのみ規定されるものである。
【技術分野】
【0001】
本発明は、生体分解性基質及び作用物質から構成される、長期間に渡る送達を行う製剤(long-term delivery formulation)、その製造方法、及びその使用方法に関するものである。また、本発明は、精神病性障害を治療するために、リスペリドン又は9−OH−リスペリドン成分を長期間送達する製剤に関するものである。
【背景技術】
【0002】
精神病性障害(psychotic disorder)は脳の病気であり、認識力、情緒又は気分の異常、特に他人と交流する、付き合う又は親密になる能力の異常を引き起こす識別可能な症状を特徴とする。これらの病気の、重症度、存続期間、及び機能障害は様々である。長い間、世界中のあらゆる年齢層で、大勢の人々が精神病性障害に苦しめられており、多大な人的被害と、生産性の損失による経済的負担とがもたらされている。ある場合では、精神病性障害は急性であり、数週間又は数ヶ月間しか続かない。他の場合では、精神病性障害は慢性であり、数年又は数十年続く。
【0003】
神経科学及び分子生物の両分野における研究の進歩によって、精神病性障害の治療に薬物を使用することが著しく増加した。さらに、前記分野の進歩によって、精神病及び他の脳の病気をより効果的に治療でき、付随する副作用が少ない、新規な薬物の製造及び送達機構がもたらされた。
【0004】
服薬の不履行は、様々な形態の病気で蔓延する問題である。薬がクロルプロマジンやハロペリドールなどの神経安定薬(抗精神病薬)の場合は、服薬の不履行によって、重大な医学上及び社会上の問題を引き起こされる(非特許文献1)。精神病性障害の患者が指示された投薬計画に従わないのには、多くの理由がある。患者の1/4〜2/3は、服薬を中断する理由として、副作用を挙げている(非特許文献2)。その他の患者は、家族の支援の欠如を挙げている(Robinson et al., 2002)。他の研究では、入院患者及び外来患者の両方において、精神病の重症度を服薬不履行と直接的に結び付けている(非特許文献3)。統合失調症の患者が再発及び入院する最も強い前兆は、抗精神病薬を服用する治療計画の不履行である(非特許文献4、非特許文献5)。他の研究では、さらに高い服薬不履行の発生率が報告されている(最大55%)。英国では、神経安定薬の服薬の順守率は約50%であると、研究者は結論づけている(This rate of non-consumption of prescribed medications suggests that, for many individuals, non-compliance holds more benefits than compliance,非特許文献1 p. 1315)。
【0005】
精神的健康における服薬不履行による医療費の経済的及び社会的負担は、年間23億ドルと推定される(Menzin et al., 2003)。患者が長期間の薬物投与計画に従うのを手助けする治療や、患者から意思決定プロセスを取り除いた治療は、臨床転帰を大幅に向上させるであろう。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Rogers, A. et al. [1998], "The meaning and management of neuroleptic medication: A study of patients with a diagnosis of schizoplwenia," Social Science and Medicine 47 (9): 1313-1323
【非特許文献2】del Campo, E. J. et al. [1983],"Rehospitalized schizophrenics: what they report about illness, treatment andcompliance," J. of Psychosocial Nurs. and Mental Health Sert. 21 (6): 29-33
【非特許文献3】Fenton, W. S, et al. [1997], "Determinants of medication compliance in schizophrenia: empirical and clinical findings," Schizophrenia Bull. 23 (4): 637-651
【非特許文献4】Csernansky JG, Schuchart EK: Relapse andrehospitalization rates in patients with schizophrenia effects of second generation antipsychotics. CNS Drugs 2002, 16: 473-484
【非特許文献5】Doering S, Muller E, Kopcke W, Pietzcker A, Gaebel W, Linden M, Muller P, MulIer-Spalm F, Tegeler J, Schussler G: Predictors of relapse and rehospitalization in schizophrenia and schizoaffective disorder. Schizophr. Bull 1998, 24: 87-98
【発明の開示】
【課題を解決するための手段】
【0007】
ある実施形態では、本発明は、治療を必要とする患者における神経系疾患の治療方法であって、(a)生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤を前記患者に投与するステップと、
(b)生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤を前記患者に投与するステップとを含み、前記第1及び第2の製剤の投与によって、前記薬物の有効血中濃度を約14〜420日間維持するようにした方法を提供する。
【0008】
他の実施形態では、本発明は、治療を必要とする患者における神経系疾患の治療方法であって、(a)生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤を前記患者に投与するステップと、
(b)生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤を前記患者に投与するステップとを含み、前記第1及び第2の製剤の再投与によって、前記薬物の有効血中濃度を恒久的に維持するようにした方法を提供する。
【0009】
別の実施形態では、本発明は、薬物を持続的に送達するためのキットであって、生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤と、生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤とを備えているキットを提供する。
【0010】
他の実施形態では、本発明は、精神病性障害の治療に使用される組成物であって、濃度が約95〜98%(w/w)の乳酸・グリコール酸共重合体(PLGA)と、濃度が約2〜5%(w/w)の抗精神病薬とを含んでおり、前記PLGAにおける乳酸:グリコール酸の比率が約100:0〜50:50であり、前記抗精神病薬はリスペリドン又は9−OH−リスペリドンである組成物を提供する。
【図面の簡単な説明】
【0011】
【図1】サルに埋め込まれたPLGAディスクからのハロペリドール放出を示すグラフである(合計443日間)。
【図2】(A)ウサギに埋め込まれた単一のPLGAディスク・システムからのハロペリドール放出を示すグラフである(合計379日間)。(B)複合PLGAディスク・システムからのハロペリドール放出を示すグラフである(合計379日間)。
【図3】インビボにおける、インプラントから放出されたリスペリドンの累計放出量を示すグラフである。
【図4】(A)20%、40%又は60%(w/w)のリスペリドンを有する85:15 PLGAインプラント(50mg)から放出されたリスペリドンの放出特性を示すグラフであり、リスペリドンの累計放出量を表している。(B)20%、40%又は60%(w/w)のリスペリドンを有する85:15 PLGAインプラント(50mg)から放出されたリスペリドンの放出特性を示すグラフであり、各インプラントに充填された薬物に対するパーセントを表している。
【図5】インビトロでの、ディスク又はロッド状のインプラントからの累積放出量を示すグラフである。放出特性の違いは、統計的には無意である。
【図6】6ヶ月間ごとの埋め込みの間に、目的の血清レベル周辺で振動することが予測される、生体分解性インプラントからの連続的送達のモデルを示す。
【図7】(A)単一ポリマーからの予測される放出を示すグラフである。(B)6ヶ月間ごとに再埋め込みされる単一ポリマー基質からの予測される放出を示すグラフである。(C)3ヶ月間の放出ピークを有するメンテナンスセットを併用した場合の、6ヶ月間ごとに再埋め込みされる単一ポリマー基質からの予測される放出を示すグラフである。(D)治療の最初の4ヶ月間を短縮するスターターポリマーセットからの予測される放出を示すグラフである。(E)治療の最初の4ヶ月間を短縮するスターターポリマーセットと、3ヶ月間の放出ピークを有するメンテナンスセットを併用した6ヶ月間ごとに再埋め込みされる単一ポリマー基質との組み合わせからの予測される放出を示すグラフである。
【図8A】40% ハロペリドールを有する75:25 PLGAから成るインプラントより放出されるハロペリドールを示すグラフである。
【図8B】40% ハロペリドールを有する85:15 PLGAから成るインプラントより放出されるハロペリドールを示すグラフである。
【図8C】2つのポリマーシステムから154日間に渡って放出される仮想放出の累計を示すグラフである。
【図9】インプラントの除去前と、除去した48時間後にテストされた自発運動(Locomotor activity)を示すグラフである。
【図10】ハロペリドールPLAが3ヶ月間埋め込まれたラット(3ヶ月間治療されたラット)と、PLAだけが埋め込まれたラットの線条体膜におけるD2受容体タンパクのウエスタンブロット法を示す図である。
【図11】(A)PLGA生体分解性基質中に分散されているリスペリドンの累計放出量を示すグラフである。(B)PLGA生体分解性基質中に分散されている9−OH−リスペリドンの累計放出量を示すグラフである。
【図12】PLA:PGAが85:15のブロック共重合体ポリマー生体分解性基質中に分散されている20%(w/w) 9−OH−リスペリドンの累計放出量を示すグラフである。
【図13】PLA:PGAが85:15のブロック共重合体ポリマー生体分解性基質中に分散されている20%(w/w) リスペリドンの累計放出量を示すグラフである。
【図14A】ラット又はマウスにおけるショックのプレパルス抑制(prepulse inhibition:PPI)によるインビボ行動実験に対するインプラントの効果を示すグラフである。
【図14B】アンフェタミン投与後の、ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するインプラントの効果を示すグラフである。
【図14C】アンフェタミン投与前及び投与後の、ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するリスペリドン・インプラントの効果を示すグラフである。
【図14D】PLA:PGAが85:15のPLGAインプラントからの累計放出量を経時的に示すグラフである。
【図14E】ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するリスペリドン・インプラントの効果を示すグラフである。
【図14F】媒介注入後の、ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するリスペリドン・インプラントの効果を示すグラフである。
【図14G】アンフェタミン投与後の、ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するリスペリドン・インプラントの効果を示すグラフである。
【図15A】PLA:PGAが85:15のPLGAインプラントから放出されるクエチアピンの累計放出量を経時的に示すグラフである。
【図15B】アンフェタミン注入前及び注入後の、対照に対してにインプラントからのクエチアピンの放出効果を示すグラフである。
【図15C】アンフェタミン注入前及び注入後の、対照及び偽のアンフェタミン注入に対してのインプラントからのクエチアピンの放出効果を示すグラフである。
【図16A】PLA:PGAが85:15のPLGAインプラントからのクロザピンの累計放出量を経時的に示すグラフである。
【図16B】アンフェタミン偽薬の注入前及び注入後の、対照及び偽のアンフェタミン注入に対してのクエチアピン・インプラントの放出効果を示すグラフである。
【図16C】アンフェタミン注入前及び注入後の、対照及びアンフェタミン偽薬の注入に対してのククエチアピン・インプラントの効果を示すグラフである。
【図17A】PLA:PGAが85:15のPLGAインプラントから放出されるハロペリドールの累計放出量を経時的に示すグラフである。
【図17B】PLGAインプラントからのハロペリドールの放出効果を示すグラフである。
【図17C】ラット又はマウスにおけるショックのプレパルス抑制(PPI)によるインビボ行動実験に対するハロペリドール・インプラントの効果を示すグラフである。
【図18A】最初の薬物充填量が、PLA:PGAが85:15のPLGAインプラントから放出されるリスペリドンの累計放出量に対して及ぼす影響を示すグラフである。
【図18B】最初の薬物充填量が、PLA:PGAが85:15のPLGAインプラントから放出されるリスペリドンの機能に対して及ぼす影響を示すグラフである。
【発明を実施するための形態】
【0012】
本発明は、ある実施形態では、長期間送達製剤(long-term delivery formulation)、及びその使用方法を提供する。
【0013】
ある実施形態では、本発明は、治療を必要とする患者における神経系疾患の治療方法を提供する。この方法は、生分解性ポリマーと複合した或る薬物の製剤であって、体内で前記薬物を見かけ上ゼロ次速度で送達する第1の製剤を前記患者に投与するステップと、生分解性ポリマーと複合した前記薬物の製剤であって、体内で前記薬物を前記第1の製剤よりも大幅に速い速度で送達する第2の製剤を前記患者に投与するステップとを含んでおり、前記第1及び第2の製剤の投与によって、前記薬物の有効血中濃度を維持する。
【0014】
他の実施形態では、本発明は、治療を必要とする患者における神経系疾患の治療方法を提供する。この方法は、その詳細については後述するが、製剤を備えているキットを使用して行う。
【0015】
ある実施形態では、本発明に係る方法は、少なくとも1つの付加的な製剤の投与をさらに含んでいる。この付加的な製剤は、生分解性ポリマーと複合した薬物の製剤であって、前記薬物の放出速度は前記第1の製剤よりも速い。前記薬物の放出速度は、ある実施形態では前記第2の製剤よりも速く、他の実施形態では前記第1の製剤よりも遅く、別の実施形態では前記第2の製剤よりも遅い。ある実施形態では、前記付加的製剤の薬物放出のピークは、前記第1の製剤(他の実施形態では前記第2の製剤)の放出ピークの前である。他の実施形態では、前記付加的製剤の薬物放出ピークは、前記第1の製剤(他の実施形態では前記第2の製剤)の放出ピークと同時である。別の実施形態では、前記付加的な製剤の薬物放出ピークは、前記第1の製剤の放出ピークの後である。
【0016】
ある実施形態では、その詳細については後述するが、本発明に係る方法、キット及び組成物は、生分解性ポリマーと複合した或る薬物の第1の製剤を含んでいる(又は利用する)。前記生分解性ポリマーは、ある実施形態では代謝され、他の実施形態では無毒性の副産物を生成し、別の実施形態では準病理学的(sub-pathologically)な有毒性の副産物を生成する。
【0017】
ある実施形態では、PLGA、乳酸及びグリコール酸の分解産物は、正常に代謝される水溶性の無毒性生成物であり、クレブス回路内で二酸化炭素中及び水中に排出される又はさらに代謝される。
【0018】
ある実施形態では、「複合する」又は「複合体」という用語は、薬物分子が生分解性ポリマー基質内で相互拡散(interdispersed)することを意味する。ある実施形態では、前記薬物は、ポリマー基質内の間質腔(interstitial space)に位置する。他の実施形態では、高速溶媒抽出によって行われる。高速溶媒抽出すると、抽出後は、ポリマーの濃度が増加し、ポリマー粘性が急増する。そして、別の実施形態では、このようにして、薬物を覆うものの拡散率を低下させる。
【0019】
ある実施形態では、「高速溶媒抽出」は、ポリマー鎖の配置構造が動力学的に再結晶不可能になる程度まで、ポリマー濃度(及びその結果生じる粘性)が増加する速度での溶媒除去を意味する。
【0020】
ある実施形態では、生分解性ポリマー基質内への薬物の封入に影響を及ぼし、その結果、ある実施形態では最初の充填に、他の実施形態ではその後の放出に、別の実施形態ではその組み合わせに影響を与える任意の要素は、本発明に係る方法に従って利用される(又は、本発明に係るキット及び組成物に利用される)。他の実施形態では、そのような要素は、とりわけ、溶媒の初期濃度、溶媒の分子サイズ及び極性、溶媒を除去する温度及び圧力、生分解性ポリマー基質の平均の分子量数(molecular weight number:MWn)、生分解性ポリマー基質の多分散性指数(polydispersity index)、薬物のサイズ及び極性、モノマー比、コポリマー鎖に沿っての分布、又はそれらの組み合わせである。さらに、生分解性ポリマーの各モノマーのD/L比は、放出速度に影響を与える。ある実施形態では、D/L比という用語は、乳酸などの単一の光学活性モノマーを観察する際に、干渉偏向レンズ(cross-polarized lense)の回転方向(D−右、L−左)に影響を与えるモノマー分子の割合を意味する。哺乳類のほとんどは、その割合が生体分解性バイオポリマーの分解速度及び分子量(粘性)に影響を与え、結果として全ての封入された薬物の放出速度に影響を与えるD−特異的酵素を持っている。
【0021】
ある実施形態では、「血中濃度」という用語は、血清を分離した後に薬物濃度を測定することによって決定される、血清中の薬物濃度を意味する。
【0022】
ある実施形態では、「治療」という用語は、本発明に係る治療方法、又は、本発明に係るキット若しくは組成物の投与の結果として、目的とする生物学的反応又は予防的反応が得られることを意味する。ある実施形態では、目的とする反応は、特定の病気又は障害(統合失調症、うつ病、精神病的不安神経症、又はそれらの組み合わせなど)の症状の軽減(完全な又は部分的な軽減)である。ある実施形態では、本発明に係る方法、キット又は組成物の使用が原因で望ましくない副作用(治療による患者の免疫欠損など)が生じた場合は、本発明は治療計画の最中に適切な症状緩和薬物の投与を提供する。
【0023】
実施例12で後述するように、統合失調症などの神経系疾患を、生分解性ポリマーと複合した薬物(ある実施形態ではリスペリドンである)によって治療することができる(放出特性を図7Aに示す)。他の実施形態では、5つの異なるポリマーと複合した薬物を含有している組成物を、同時に使用することができる。3つの複合体は、持続放出インプラントから薬物が放出されるまでの時間を埋めるために投与される製剤である、「スターターセット(starter set)」を含んでいる(図7D及び7E)。本発明のこの態様では、スターターセットは3つの複合体を含み、その内の1つは即時の放出特性を有する即時放出複合体であり、他の2つの高速放出複合体(ただし、放出特性は即時放出複合体よりも少し遅い)と同時に服用される。ある実施形態では、スターターセットは、「メンテナンスセット(maintenance set)」と同時に又は直前に服用される。メンテナンスセットは、リスペリドンの有効血中濃度を一定に維持する、少なくとも1つの(又は2つの、又は3つの、又は4つの)複合体を含んでいる。メンテナンスセットは、放出が完了した時点、ある実施形態では、スターターセット複合体から薬物が100%放出された時点で提供される。他の実施形態では、メンテナンスセットは、5番目の複合体を含み、ある実施形態では、薬物及び生体分解性基質から構成されるインプラントである。この5番目の複合体は、他の複合体と比較すると、絶対的に高い薬物濃度を有している。ある実施形態では、この5番目の複合体の放出ピークは、メンテナンスセットを含む他の複合体の薬物放出が減少すると同時に起こる。本発明のこの態様では、各複合体の放出特性は、リスペリドンの血中濃度が目的とする一定の値となるように、最適に組み合わせられる(図7E)。
【0024】
ある実施形態では、メンテナンスセットは、長期の治療を行うために、患者にいつまでも再投与される。
【0025】
他の実施形態では、本発明に係る方法は、繰り返しての使用を含む。例えば、1つ又は複数の製剤を投与する本発明に係る方法を、所定の期間で繰り返し行われる不連続的な治療に使用することができる。ある実施形態では、本発明の方法は、例えば、1つ又は複数の本発明に係る組成物を一定の間隔で投与する、周期的な使用を含んでいる。ある実施形態では、本発明に係る方法は、治療の中間評価を含んでおり、患者の症状の改善(軽減)の兆候に応じて組成物は変更される。他の実施形態では、特定の投与された組成物に対して反応しなくなった後に、治療は変更される。
【0026】
他の実施形態では、薬物及びポリマー・インプラントは、界面活性剤又は乳化剤を用いることなく、アセトンからの溶媒成形によって作成され、その後、圧縮成形される。ある実施形態では、成形するための溶媒としては、アセトンが使用される。また、他の実施形態では、別のFDAクラスIII溶媒(毒性が低く、最小限の使用で残留溶媒を除去できる)が使用される。ある実施形態では、薬物及び生分解性ポリマーは、100mg/mL以上で溶解される。他の実施形態では、このようにして作成されたインプラントは耐性及び生物活性を有する。このことは、例えば、げっ歯類を用いて実証することができる。マウス及びラットに埋め込んだ後に、耐性及び生物活性を経時的に評価する(例えば、埋め込み後3週間〜3ヶ月間)。
【0027】
ある実施形態では、使用する溶媒は、表1に記載された溶媒(FDA指針書 Q3C)から選択される。
【0028】
表1 FDAクラスIII溶媒(FDA指針書 Q3C)

【0029】
他の実施形態では、本発明に係る方法、キット及び組成物は、各薬物の各ポリマーとの相互作用である薬物放出特性を提供する。他の実施形態では、ポリマーシステムからの放出パターンに影響を及ぼす他の要因としては、薬物拡散速度、薬物/ポリマー親和性、pH、ソース/シンク濃度、分子量平均値(molecular weight average:MWw)、ポリマー数平均値(polymer number average:MWn)、それらの比率(多分散性指数、Polydispersity index:PDI)、及びバイオポリマーを可塑化するための生理液の能力がある。
【0030】
ある実施形態では、本発明に係る方法、キット及び組成物は、第1の製剤及び第2の製剤を互いに48時間以内に投与する。他の実施形態では、第1の製剤の投与は、第2の製剤の投与と同時に行われる。ある実施形態では、第1の製剤の投与は、第2の製剤の投与前に行われる。別の実施形態では、第1の製剤の投与は、第2の製剤の投与後に行われる。
【0031】
ある実施形態では、本発明に係る方法、キット及び組成物は、生分解性ポリマーを使用する。生分解性ポリマーは、ある実施形態では、乳酸・グリコール酸共重合体(Copoly lactic acid/glycolic acid:PLGA)である。ある実施形態では、生分解性PLGAポリマーは、「Kitchell. TP, Wise DL (1985) Poly (lactic/glycolic acid) biodegradable drug-polymer matrix systems. Methods Enzymol 112: 436-448」に記載されているものを使用する。
【0032】
ある実施形態では、生分解性ポリマーは、ポリ乳酸、ポリグリコール酸、ポリカプロラクトン、それらコポリマー、それらターポリマー、又はそれらの任意の組み合わせである。ある実施形態ではコポリマーはアタクチックであり、他の実施形態ではコポリマーはシンジオタクチックである。ある実施形態では、生分解性熱可塑性ポリエステルは、ポリ乳酸、ポリグリコール酸、そのコポリマー、そのターポリマー、又はそれらの組み合わせである。
【0033】
ある実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が50:50のポリ(D,L−ポリ乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が75:25のポリ(D,L−乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が85:15のポリ(D,L−乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が60:40のポリ(D,L−乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、乳酸・グリコール酸比率が90:10のポリ(D,L−乳酸・グリコール酸)共重合体である。他の実施形態では、生分解性熱可塑性ポリエステルは、薬物と複合した際に目的の放出特性を示すポリ(D,L−乳酸・グリコール酸)共重合体)の任意の組み合わせである。ある実施形態では、生分解性熱可塑性ポリエステルは、任意の適切な量で存在し、水媒体又は体液内で少なくとも実質的に不溶性である。
【0034】
他の実施形態では、生分解性熱可塑性ポリエステルは、好ましくは、流動性組成物の約50〜98wt.%で存在している。ある実施形態では、流動性組成物の約50〜60wt.%で存在している。他の実施形態では、流動性組成物の約60〜75wt.%で存在している。他の実施形態では、流動性組成物の約75〜90wt.%で存在している。他の実施形態では、流動性組成物の約90〜95wt.%で存在している。他の実施形態では、流動性組成物の約95〜98wt.%で存在している。
【0035】
ある実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約10,000〜200,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約15,000〜25,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約25,000〜45,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約45,000〜75,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約75,000〜100,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約100,000〜150,000である。他の実施形態では、生体分解性熱可塑性ポリマーの平均分子量は約150,000〜200,000である。
【0036】
ある実施形態では、PLGAを構成する乳酸モノマーの濃度は、PLGAポリマーの50〜100%である。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの50〜60%である。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの60〜70%である。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの70〜80%である。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの80〜90%ある。他の実施形態では、乳酸モノマーの濃度は、PLGAポリマーの90〜100%である。他の実施形態では、乳酸モノマー100%である。
【0037】
ある実施形態では、「約」という用語は、1〜20%の範囲のずれを意味する。他の実施形態では、1〜10%の範囲のずれを意味する。他の実施形態では、1〜5%の範囲のずれを意味する。他の実施形態では、5〜10%の範囲のずれを意味する。他の実施形態では、10〜20%の範囲のずれを意味する。
【0038】
ある実施形態では、製剤に含まれる薬物ポリマー複合体の量は、2〜75%(w/w)である。他の実施形態では、2〜5%(w/w)である。他の実施形態では、5〜10%(w/w)である。他の実施形態では、10〜25%(w/w)である。他の実施形態では、25〜35%(w/w)である。他の実施形態では、35〜50%(w/w)である。他の実施形態では、50〜75%(w/w)である。
【0039】
ある実施形態では、前記複合体は、例えばポリエチレン・グリコール、ポリエチレン・グリコール及びポリプロピレン・グリコールのコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニル・アルコール、ポリビニル・ピロリドン、又はポリプロリンなどの水溶性ポリマーの共有結合によって形成される。ある実施形態では、修飾によって、水溶液中での化合物の溶解度を高める、凝集を除去する、化合物の物理的及び化学的安定性を高める、化合物の免疫原性又は反応性を減少する、又はそれらの組み合わせをもたらすことができる。
【0040】
他の実施形態では、本発明に係る方法、キット及び組成物は、少なくとも1つの薬物を長期に渡って持続的に送達することが求められる病気及び障害を治療するために提供される。当然のことながら、任意の症状、疾患、又は障害を治療するために、第1の製剤及び第2の製剤を投与する治療計画は、本発明の一部をみなされる。前記治療計画では、特定の化合物又は組成物の有効血中濃度を得るために第1の組成物を投与し、同時に又は後に第2の製剤を投与する。第2の製剤は、第1の組成物から放出される薬物の濃度が減少すると同時に又は後に投与され、前記有効血中濃度を長期に渡って維持する。
【0041】
本発明に係る方法、キット及び組成物の第1の製剤は、薬物を見かけ上ゼロ次速度で送達する(ある実施形態では、「定常状態」(0次)放出特性である、又はほぼ定常状態である)。または、ある実施形態では、定常状態から±5〜10%の幅で、治療効果がある量の薬物を一定の時間以上送達する。ある実施形態では±5%の幅、ある実施形態では±10%の幅、ある実施形態では±20%の幅、ある実施形態では±30%の幅が、目的とする血中濃度の周辺で観察される。ある実施形態では、期間は、投与後3〜10ヶ月間である。ある実施形態では、期間は、投与後14日間〜6ヶ月間である。
【0042】
本発明に係る方法、キット及び組成物に使用される製剤の放出特性は、ある実施形態では図7Aに示したものと同様である。他の実施形態では図7Bに示したものと、他の実施形態では図7Cに示したものと、他の実施形態では図7Dに示したものと、他の実施形態では図7Eに示したものと、他の実施形態では図7Fに示したものと同様であり、他の実施形態では、それらの特性と類似している。
【0043】
ある実施形態では、前記製剤は、制御放出パッチ(patch)によって投与される。他の実施形態では、患者を治療する薬物は、経皮パッチによって送達される。ある実施形態では、パッチは、一方の側に隔膜を有する薄い中空のデバイス(flat hollow device)であり、前記パッチを患者の皮膚上で所定の位置に保つための接着剤を備えている。したがって、前記隔膜を皮膚に接触させて、パッチに蓄積された薬物を皮膚に及び皮膚を介して浸透させることができる。ある実施形態では、パッチの外側は不透水性の物質層で作成されており、隔膜側と外側はパッチの周囲で結合されており、2つの層間で、薬物及び担体の貯蔵部を形成している。パッチ技術は、活性成分を表皮と持続的に接触させることを可能とする。かなりの長時間に渡って、そのような状態で保持された薬物分子は、ある実施形態では濃度勾配によって血流中に拡散する。他の実施形態では、経皮的送達は、パッチ技術の使用によって行われる。これらの従来の薬物送達システムは、例えば薬物などの活性成分が組み込まれたパッチを含んでいる。また、パッチは、活性成分を皮膚の近傍に位置させるために、パッチを皮膚に付着させるための接着剤を備えている。例示的なパッチ技術は、Ciba-Geigy Corporation及びAlza Corporationから入手可能である。このような従来の送達デバイスは、アンフェタミン化合物と共に、容易に適用することができる。ある実施形態では、薬物のメンテナンスセットは、パッチ形態で3ヶ月に1回投与される。
【0044】
ある実施形態では、前記製剤はインプラントの形態である。他の実施形態では、インプラントからの放出、及びインプラントからの拡散は、薬物の種類によって大幅に異なる。ある実施形態では、ある化合物の設計仕様は、他の化合物には直接的に適用できない。
【0045】
ある実施形態では抗精神病薬が、他の実施形態では9−OH−リスペリドンが、本発明に係る神経系疾患(別の実施形態では双極性障害)を治療するために、本発明に係る方法、キット及び組成物の一部として使用される。
【0046】
ある実施形態では、本発明に係る方法、キット及び組成物は、パーキンソン病を治療するために、甲状腺刺激ホルモン放出ホルモン又はL−ドーパを送達するのに使用される。他の実施形態では、本発明に係る方法、キット及び組成物は、麻薬中毒を治療するために、ナルトレキソンを送達するのに使用される。
【0047】
当然のことながら、本発明に係る方法、キット及び組成物に使用される製剤は、病気の治療計画の一部である、複数の薬物の組み合わせを含み得る。
【0048】
ある実施形態では、本発明は神経系疾患の治療方法であって、前記薬物の濃度が第1又は第2製剤の約2〜5重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約5〜10重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約10〜15重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約15〜20重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約20〜30重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約30〜40重量パーセントである治療方法を提供する。他の実施形態では、本発明は神経系疾患の治療方法であって、薬物の濃度が第1又は第2製剤の約40〜50重量パーセントである治療方法を提供する。
【0049】
ある実施形態では、本発明は神経系疾患の治療方法であって、使用される薬物がリスペリドン、9−OH−リスペリドン、ハロペリドール、オランザピン、クロザピン、アリピプラゾール、クエチアピン、ジプラシドン、又はそれらの組み合わせである治療方法を提供する。
【0050】
ある実施形態では、前記第1及び第2の製剤は、少なくとも1つの一般的な薬物を有している。
【0051】
ある実施形態では、第1の製剤はリスペリドン及び9−OH−リスペリドンを含んでおり、第2の製剤は9−OH−リスペリドンを含んでいる。他の実施形態では、第1の製剤はリスペリドン及びハロペリドールを含んでおり、第2の製剤はハロペリドールを含んでいる。他の実施形態では、第1の製剤はクエチアピン(quetiapine)及び9−OH−リスペリドンを含んでおり、第2の製剤は9−OH−リスペリドンを含んでいる。
【0052】
ある実施形態では、第1の製剤は、慢性疾患に治療効果がある薬を含んでいる。他の実施形態では、第2の製剤は、慢性疾患の急性期に治療効果がある薬を含んでいる。例えば、ある実施形態では、多発性硬化症などの再発及び寛解型の疾患を治療する。ある実施形態では、各製剤はCopaxonを含んでおり、第1の製剤はP−インターフェロン(他の実施形態では、免疫抑制化合物)をさらに含んでいる。
【0053】
他の実施形態では、第2の製剤の放出速度は、第1の製剤の放出速度よりも速い。ある実施形態では、「速い放出速度」は、薬物の血中濃度の相対濃度が経時的に増加することを意味する。ある実施形態では、放出される薬物%は、図4Bに示されている。
【0054】
他の実施形態では、第2の製剤は、蓄積注射として投与される。他の実施形態では、第2の製剤は、生分解性ポリマー基質内に封入された薬物を含有しているミクロスフェア(microsphere)として投与される。
【0055】
ある実施形態では、本発明に係る方法、キット及び組成物における第1の製剤の薬物放出速度は、長期間の持続放出を実現できるように、十分に遅い。「十分に遅い」とは、ある実施形態では、通常の製剤の平均に対して、一桁違うことを意味する。
【0056】
ある実施形態では、本発明は、神経系疾患の治療方法であって、第1の製剤が皮下に投与されるインプラントであり、第2の製剤が経口剤型、非経口投与型又は静脈内投与の薬物である方法を提供する。
【0057】
ある実施形態では、「非経口的に投与される」という表現は、経腸及び局所性投与以外の投与方法であって、通常は注射による投与方法を意味する。また、静脈内、筋肉内、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、腫瘍内、被膜下、くも膜下、髄腔内、及び胸骨内への注射及び注入による投与方法を意味する(ただし、これらに限定されるものではない)。
【0058】
他の実施形態では、前記第1及び第2の製剤は、前記患者に周期的に投与される。当然のことながら、薬物を含有する前記第1及び第2の製剤(他の実施形態ではさらなる他の製剤)の投与順序は、本発明の範囲内であり、当業者なら理解できるであろうが、前記薬物の目的とする血中濃度を得るために変更することができる。
【0059】
ある実施形態では、前記第1及び第2の製剤は、前記薬物の血清中濃度がその薬物の治療閾値レベル以下の場合に、患者に投与される。他の実施形態では、前記第1及び第2の製剤は、前記薬物の血清中濃度が1ng/mL以下の場合に、患者に投与される。
【0060】
他の実施形態では、本発明は、神経系疾患を治療するための方法であって、製剤を最初に投与した約160〜200日後に、患者に第1及び第2の製剤を投与する方法を提供する。ある実施形態では、製剤を最初に投与した約160〜180日後に、患者に第1及び第2の製剤を投与する方法を提供する。他の実施形態では、製剤を最初に投与した約180〜200日後に、患者に第1及び第2の製剤を投与する方法を提供する。
【0061】
他の実施形態では、本発明は、神経系疾患の治療方法であって、より持続的な治療が必要とされる病気を治療するための方法を提供する。ある実施形態では、統合失調症を治療するために、埋め込み型のシステムを使用して、薬物を長期に渡って送達する方法を提供する。埋め込み型のシステムは、他の実施形態では、薬物の治療特性を最適化する能力を有している。ある実施形態では、より安全、効果的、又は確実な治療方法を提供する。ある実施形態では、本発明は、神経系疾患の治療方法であって、一般的に必要とされる薬物量がより少なく、副作用を最小限に抑えることができる方法を提供する。ある実施形態では、一定の可逆性が生じる不都合な副作用が生じた場合、埋め込み型のシステムは、医師によって取り出される。他の実施形態では、本発明は、神経系疾患の治療方法であって、生体分解性システムにより、送達間隔の最後に取り出す必要がなく、患者に対する侵襲性を半減させる方法を提供する。
【0062】
ある実施形態では、本発明は、長期間の治療が必要とされる神経疾患及び障害の治療方法を提供する。ある実施形態では、薬物は、HIV及び他のウイルス性疾患、マイコバクテリア感染、癌、多発性硬化症、糖尿病、腎臓病、又は他の病気(本発明に係る方法、キット、又は組成物が有用であると認められる病気)の治療に使用される。
【0063】
他の実施形態では、本発明は、神経系疾患を治療するための方法を提供する。前記神経系疾患としては、エイズによる認知症、統合失調症、双極性障害、境界性人格障害(BPD)、アルツハイマー病(AD)、心因性うつ病、又は精神障害(混乱、分裂或いは精神疾患を引き起こす精神障害)などがある。
【0064】
ある実施形態では、本発明に係る方法、キット又は組成物で使用される薬物は、治療計画に適用可能な任意の薬物である。ある実施形態では、前記薬物は、ペプチド、タンパク質、核酸、又は化合物である。
【0065】
ある実施形態では、「薬物(drug)」という用語は、患者に投与した際に、症状、疾患又は障害を軽減する分子を意味する。ある実施形態では、前記薬物は合成分子である。他の実施形態では、前記薬物は、自然から入手したソースから分離された、天然由来の化合物である。
【0066】
ある実施形態では、薬物としては、降圧剤、抗うつ剤、抗不安薬、抗凝固剤、抗けいれん剤、血糖降下剤、充血除去剤、抗ヒスタミン剤、鎮咳薬、抗炎症薬、抗精神病薬、向知性薬、コレステロール降下剤、抗肥満薬、自己免疫疾患剤、性的不能治療薬、抗菌及び抗真菌薬、催眠剤、抗パーキンソン薬、抗生物質、抗ウイルス薬、抗新生物薬、バルビツレート(barbiturate)、鎮静剤、栄養剤、ベータ遮断薬、催吐薬、制吐薬、利尿薬、抗凝血剤、強心剤、アンドロゲン、コルチコイド、同化剤、成長ホルモン分泌促進薬、抗感染薬、冠拡張薬、炭酸脱水酵素阻害薬、抗原虫薬、胃腸薬、セロトニン拮抗薬、麻酔薬、血糖降下薬、ドーパミン作動薬、抗アルツハイマー病薬、抗潰瘍薬、抗血小板薬、及び、グリコーゲン・ホスホリラーゼ阻害剤が挙げられる。
【0067】
本発明のある実施形態では、前記薬物の例としては、特に、降圧剤(プラゾシン、ニフェジピン、トリマゾシン、アムロジピン、メシル酸ドキサゾシンなど)、抗不安性ヒドロキシジン、血糖降下剤(グリピザイドなど)、性的不能治療薬(クエン酸シルディナフィル)、抗新生物薬(クロラムブシル、ロムスチン、エキノマイシンなど)、抗炎症薬(ベタメタゾン、プレドニゾロン、ピロキシカム、アスピリン、フルルビプロフェン、(+)−N−{4−[3−(4−フルオロフェノキシ)フェノキシ]−2−シクロペンテン −1−イル}−N−ハイロキシウレアなど)、抗ウイルス剤(アシクロビル、ネルフィナビル、ビラゾールなど)、ビタミン/栄養剤(レチノール、ビタミンEなど)、催吐薬(アポモルヒネなど)、利尿薬(クロルタリドン、スピロノラクトンなど)、抗凝血剤(ジクマロールなど)、強心剤(ジゴキシン、ジギトキシンなど)、アンドロゲン(17−メチルテストステロン、テストステロンなど)、鉱質コルチコイド(デスオキシコルチコステロンなど)、ステロイド性睡眠薬/麻酔薬(アルファキサロンなど)、同化剤(フルオキシメステロン、methanstenoloneなど)、抗うつ剤(フルオキセチン、ピロキシジン、ベンラファクシン、セルトラリン、パロキセチン、スルピリド、[3,6−ジメチル−2−(2,4,6−トリメチル−フェノキシ)−ピリジン−4−イル]−(レチルプロピル)−アミン、3,5−ジメチル−4−(3’−ペントキシ)−2−(2’,4’,6’−トリメチルフェノキシ)ピリジンなど)、抗生物質(アンピシリン、ペニシリンGなど)、抗感染薬(塩化ベンザルコニウム、クロルヘキシジンなど)、冠拡張薬(ニトログリセリン、ミオフラジンなど)、睡眠薬(エトミデート、ミオフラジンなど)、炭酸脱水酵素阻害薬(アセタゾールアミド、クロラゾールアミドなど)、抗真菌剤(エコナゾール、テルコナゾール、フルコナゾール、ボリコナゾール、グリセオフルビンなど)、抗原虫薬(メトロニダゾールなど)、イミダゾール型抗新生物薬(メトロニダゾール、チューブラーゾールなど)、駆虫薬(チアベンダゾール、オクスフェンダゾールなど)、抗ヒスタミン剤(アステミゾール、レボカバスチン、セチリジン、シンナリジンなど)、充血除去剤(プソイドエフェドリンなど)、抗精神病薬(フルスピリレン、penfluridole、リスペリドン、ジプラシドンなど)、胃腸薬(ロペラミド、シサプリドなど)、セロトニン拮抗薬(ケタンセリン、ミアンセリンなど)、麻酔薬(リドカインなど)、血糖降下薬(アセトヘキサミド など)、制吐薬(ジメンヒドリナートなど)、抗菌剤(コトリモキサゾールなど)、ドーパミン作動薬(L−DOPAなど)、抗アルツハイマー病薬(THA、ドネペジルなど)、抗潰瘍薬/H2拮抗薬(ファモチジンなど)、鎮静剤/睡眠薬(クロルジアゼポキシド、トリアゾラムなど)、血管拡張剤(アルプロスタジルなど)、抗血小板薬(プロスタサイクリンなど)、ACE抑制剤/降圧剤(エナラプリル酸、リシノプリルなど)、テトラサイクリン系抗生物質(オキシテトラサイクリン、ミノサイクリンなど)、マクロライド系抗生物質(アジスロマイシン、クラリスロマイシン、エリスロマイシン、スピラマイシンなど)、グリコーゲン・ホスホリラーゼ阻害剤([R−(R*S*)]−5−クロロ−N−[2−ヒドロキシ−3{メトキシメチルアミノ}−3−オキソ−l−(フェニルメチル)−プロピル]−IH−インドール−2−カルボキサミド、5−クロロ−l−Hインドール−2−カルボン酸[(IS)−ベンジル(2R)−ヒドロキシ−3−((3R,4S)ジヒドロキシ−ピロリジン−l−イル−)−オキシプロピル]アミドなど)が挙げられる。
【0068】
本発明に使用される薬物のさらなる例としては、グルコース降下剤(クロルプロパミド)、抗真菌剤(フルコナゾール)、高コレステロール血症抑制剤(アトルバスタチンカルシウム)、抗精神病剤(塩酸チオチキセン)、抗不安剤(塩酸ヒドロキシジン、塩酸ドキセピン)、降圧剤(アムロジピン・ベシレート)、抗炎症薬(ピロキシカム、セレコキシブ、バルデコキシブ)、抗生物質(カルベニシリン・インダニル・ナトリウム、塩酸バカンピシリン、トロレアンドマイシン、塩酸ドキシサイクリン)が挙げられる。
【0069】
他の実施形態では、本発明の薬物は、他の抗新生物薬で有り得る。そのような抗新生物薬としては、例えば、白金化合物(スピロプラチン、シスプラチン、カルボプラチンなど)、メトトレキサート、フルオロウラシル、アドリアマイシン、マイトマイシン、アンサマイトシン、ブレオマイシン、シトシン・アラビノシド、アラビノシル・アデニン、メルカプトポリリシン、ビンクリスチン、ブスルファン、クロラムブシル、メルファラン(PAM、L−PAM、フェニルアラニン・マスタードなど)、メルカプトプリン、ミトタン、塩酸プロカルバジン・ダクチノマイシン(アクチノマイシンD)、塩酸ダウノルビシン、塩酸ドキソルビシン、パクリタキセル及び他のタキサン、ラパマイシン、マニュマイシンA、TNP−470、プリカマイシン(ミトラマイシン)、アミノグルテチミド、エストラムスチンリン酸ナトリウム、フルタミド、酢酸ロイプロリド、酢酸メゲストロール、クエン酸タモキシフェン、テストラクトン、トリロスタン、アムサクリン(m−AMSA)、アスパラギナーゼ(L−スパラギナーゼ)、エルウィニア・アスパラギナーゼ(erwinia asparaginase)、インターフェロン・アルファ−2a、インターフェロン・アルファ−2b、テニポシド(VM−26)、硫酸ビンブラスチン(VLB)、硫酸ビンクリスチン、硫酸ブレオマイシン、ヒドロキシウレア、プロカルバジン、ダカルバジン、分裂抑制剤(エトポシド、コルヒチン、ビンカ・アルカロイドなど)、放射性医薬品(放射性ヨード、リン生産物など)、ホルモン(プロゲスチン、エストロゲン、抗エストロゲンなど)、駆虫薬、抗結核薬、生物製剤(免疫血清、抗毒素、血清など)、狂犬病予防製剤、細菌ワクチン、ウイルス性ワクチン、呼吸性製剤(キサンチン誘導体、テオフィリン、アミノフィリンなど)、甲状腺薬(ヨード製剤、抗甲状腺薬など)、心臓血管製剤(チーテング(cheating)剤、水銀利尿薬、強心配糖体を含む)、グルカゴン、血液製剤(非経口アイロン、ヘミン、ヘマトポルフィリン、及びそれらの派生物)、生物反応修飾物質(ムラミールジペプチド、ムラミールトリペプチドなど)、微生物細胞壁構成成分、リンフォカイン(リポ多糖体、マクロファージ活性化因子などの細菌内毒素)、バクテリアのサブユニット(マイコバクテリウム、コリネバクテリアなど)、合成ジペプチドN−アセチル−ムラミル−L−アラニル−D−イソグルタミン、抗真菌薬(ケトコナゾール、ナイスタチン、グリセオフルビン、フルシトシン(5−fc)、ミコナゾール、アムホテリシンB、リシン、シクロスポリン、βラクタム抗生物質(例えばsulfazecin)など)、ホルモン(成長ホルモン、メラニン細胞刺激ホルモン、エストラジオール、ジプロピオン酸ベクロメタゾン、ベタメタゾン、酢酸ベタメタゾン、リン酸ベタメタゾンナトリウム、リン酸ベタメタゾン二ナトリウム、リン酸ベタメタゾンナトリウム、酢酸コルチゾン、デキサメタゾン、酢酸デキサメタゾン、デキサメタゾンリン酸ナトリウム、フルニソリド、ヒドロコルチゾン、酢酸ヒドロコルチゾン、ヒドロコルチゾン・シピオネート、リン酸ナトリウム・ヒドロコルチゾン、コハク酸ナトリウム・ヒドロコルチゾン、メチルプレドニゾロン、酢酸メチルプレドニゾロン、コハク酸メチルプレドニゾロンナトリウム、酢酸パラメタゾン、プレドニゾロン、酢酸プレドニゾロン、リン酸プレドニゾロン・ナトリウム、プレドニゾロン・テブタート、プレドニゾン、トリアムシノロン、酢酸トリアムシノロン、トリアムシノロン・ジアセテート、トリアムシノロン・ヘキサアセトニド、酢酸フルドロコルチゾン、オキシトシン、バソプレシン及びそれらの派生物)、ビタミン(シアノコバラミンneinoic acid、レチノイド及びその派生物(パルミチン酸レチノール、アルファ・トコフェロール))、ペプチド(マンガニーズ・スーパーオキシド・ジスムターゼなど)、酵素(アルカリ性ホスファターゼなど)、抗アレルギー薬(amelexanoxなど)、抗凝固薬(フェンプロクーモン、ヘパリン)、循環器官用薬(プロプラノロールなど)、代謝増強剤(グルタチオンなど)、抗結核薬(パラアミノサリチル酸、イソニアジド、硫酸カプレオマイシン・サイクロセリン、塩酸エタンブトール・エチオナミド、ピラジナミド、リファンピン、硫酸ストレプトマイシンなど)、ウイルス剤(アマンタジン・アジドチミジン(AZT、DDI、ホスカネット、ジドブジン)、リバビリン及びビダラビン一水和物(アデニン・アラビノシド、ara−A)など)、抗狭心症薬(ジルチアゼム、ニフェジピン、ベラパミル、四硝酸エリトリトール、硝酸イソソルビド、ニトログリセリン(硝酸グリセリン)、四硝酸ペンタエリスリトールなど)、抗凝血剤(フェンプロクーモン、ヘパリンなど)、抗生物質(ダプソーン、クロラムフェニコール、ネオマイシン、セファクロール、セファドロキシル、セファレキシン、セフラジン・エリスロマイシン、クリンダマイシン、リンコマイシン、アモキシシリン、アンピシリン、バカンピシリン、カルベニシリン、ジクロキサシリン、シクラシリン、ピクロキサシリン、ヘタシリン、メチシリン、ナフシリン、オキサシリン、ペニシリン(ペニシリンG、ペニシリンVを含む)、チカルシリン・リファンピン、テトラサイクリンなど)、抗炎症薬(ジフルニサル、イブプロフェン、インドメタシン、メクロフェナム酸、メフェナム酸、ナプロキセン、オキシフェンブタゾン、フェニルブタゾン、ピロキシカム、スリンダク、トルメチン、アスピリン、サリチル酸塩など)、抗原虫薬(クロロキン、ヒドロキシクロロキン、メトロニダゾール、キニーネ、アンチモン酸メグルミンなど)、抗リウマチ剤(ペニシラミンなど)、麻酔薬(パレゴリックなど)、アヘン剤(コデイン、ヘロイン、メタドン、モルヒネ、アヘンなど)、強心配糖体(デスラノシド、ジギトキシン、ジゴキシン、ジギタリン、ジギタリス)、神経筋遮断薬(アトラクリウム・メシラート、ガラミン・トリエチオダイド、臭化ヘキサフルオレニウム、ヨウ化メトクリン、臭化パンクロニウム、塩化サクシニルコリン(塩化スキサメトニウム)、塩化ツボクラリン、臭化ベクロニウム)、鎮静剤(睡眠薬)(アモバルビタール、アモバルビタール・ナトリウム、アプロバルビタール、ナトリウムブタバルビタール、抱水クロラール、エスクロルビノール、エチナメート、塩酸フルラゼパム、グルテチミド、塩酸メトトリメプラジン、メチプリロン、塩酸ミダゾラム、パラアルデヒド、ペントバルビタール、ペントバルビタールナトリウム、フェノバルビタールナトリウム、セコバルビタールナトリウム、タルブタール、テマゼパム、トリアゾラムなど)、局部麻酔薬(塩酸ブピバカイン、塩酸クロロプロカイン、塩酸エチドカイン、塩酸リドカイン、塩酸メピバカイン、塩酸プロカイン、塩酸テトラカインなど)、全身麻酔薬(ドロペリドール、エトミデート、ドロペリドールと併用されるクエン酸フェンタニル、塩酸ケタミン、メトヘキシタール・ナトリウム、チオペンタール・ナトリウム)、放射性粒子又はイオン(ストロンチウム、ヨウ化レニウム、イットリウムなど)がある。
【0070】
ある実施形態では、本発明に係る方法、キット及び組成物は、上記した薬物と併用される。組み合わせは、各製剤で異なる。一般的には、患者に一度に投与される薬物は、単一の薬物である。
【0071】
ある実施形態では、本発明に係る方法は、上述したように、前記製剤を含んでいるキットの使用によって影響される。
【0072】
ある実施形態では、本発明は、少なくとも1つの薬物を持続的に送達するためキットを提供する。このキットは、生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤と、生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤とを備えている。
【0073】
他の実施形態では、本発明は、前記キットの第1及び第2の製剤の組み合わせが、投与後、約1週間〜約14ヶ月間にわたって薬物を徐放するキットを提供する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約1週間〜約1ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約1〜約3ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約3〜約6ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約6〜約9ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約9〜約12ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約12〜約14ヶ月間にわたって薬物を徐放する。
【0074】
ある実施形態では、前記キット及び組成物は、本発明に係る方法に従って使用される。他の実施形態では、前記キット及び組成物は、他のキット又は組成物と組み合わせて使用される。他の実施形態では、全身療法の一部として使用される。また、他の実施形態では、前記キットの一部又はそのキットに含まれる特定の製剤のみが使用される。
【0075】
当然のことながら、本発明に係るキットは、上述した任意の方法と共に使用することもできる。そして、他の実施形態では、ここで説明した任意の組成物又は製剤を利用することができる。
【0076】
ある実施形態では、本発明は、精神病性障害の治療に使用される組成物を提供する。この組成物は、濃度が約95〜98%(w/w)の乳酸・グリコール酸共重合体(PLGA)と、濃度が約2〜5%(w/w)の抗精神病薬とを含んでおり、乳酸・グリコール酸共重合体(PLGA)における乳酸:グリコール酸の比率が約100:0〜50:50であり、抗精神病薬はリスペリドン又は9−OH−リスペリドンである。
【0077】
本発明に係る組成物は、ある実施形態では、経口又は非経口で、局所又は皮下に投与される。ある実施形態では、前記組成物は、錠剤又はカプセルの形態で投与される。他の実施形態では、前記組成物は、注射、注入、吸入、目薬、軟膏、肛門坐剤、制御放出パッチによって投与される。
【0078】
ある実施形態では、前記薬物の有効血中濃度は、0.1〜10ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、0.1〜0.5ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、0.5〜1.0ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、1.0〜1.5ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、1.5〜2.5ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、2.5〜5ng/mLの範囲である。他の実施形態では、薬物の有効血中濃度は、5〜10ng/mLの範囲である。
【0079】
ある実施形態では、第2の製剤の投与によって、血中濃度は約1〜31日間維持される。他の実施形態では、第2の製剤の投与によって、血中濃度は約1〜7日間維持される。他の実施形態では、第2の製剤の投与によって、血中濃度は約7〜14日間維持される。他の実施形態では、第2の製剤の投与によって、血中濃度は約14〜21日間維持される。他の実施形態では、第2の製剤の投与によって、血中濃度は約22〜31日間維持される。
【0080】
ある実施形態では、第1の製剤の投与によって、血中濃度は約21〜180日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約21〜31日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約31〜60日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約60〜90日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約90〜120日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約120〜150日間維持される。他の実施形態では、第1の製剤の投与によって、血中濃度は約150〜180日間維持される。
【0081】
ある実施形態では、本発明は、少なくとも1つの目的とする薬物の血中濃度を約1〜420日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約14〜420日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約75〜420日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約75〜180日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約180〜270日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約270〜365日間維持することを提供する。他の実施形態では、本発明は、血中濃度を約365〜420日間維持することを提供する。
【0082】
他の実施形態では、本発明は、皮下に挿入されるインプラントを提供する。ある実施形態では、皮下へ埋め込む処置は、埋め込み前に行われる局所麻酔によって容易に耐えることができる。他の実施形態では、硬いインプラントを使用することによって、皮膚の下でインプラントをガイドする道具の使用が不要となり、筋肉内に配置される危険性が減少する。
【0083】
他の実施形態では、製剤は、任意の目的とする組織に埋め込むのに適切なように、パッチ形態である。または、経静脈的、intracavitarily、intranodally、又は他の適切な部位に注射する形態である。または、蓄積注射の形態である。他の実施形態では、投与経路及び投与間隔は、患者ごとに調整される。ある実施形態では、製剤の投与間隔は、6ヶ月に1回である。他の実施形態では、本発明に係る方法に従った投与計画、及び本発明に係るキット及び化合物の使用は、薬物の投与を行わない他の形態の治療(例えば、患者が、精神科医及び/又は治療専門家と交流する治療)と同時に行うことができる。
【0084】
ある実施形態では、本発明は、病気及び障害を治療するための方法であって、少なくとも1つの製剤がインプラントの形態である方法を提供する。インプラントは、ある実施形態ではディスク状であり、他の実施形態ではロッド状である。他の実施形態では、ポリマーと薬物は、質量で60/40の割合で混合され、アセトンから溶媒成形される。その結果と得られる膜は圧縮成形され、直径20mm、平均厚さ1.22±0.0mm、質量493±2mg、密度1.28±0.0g/ccのディスク状のインプラントが作成される(例示的なインプラントは後述する)。ある実施形態では、ロッド状のインプラントは、実施例10で後述するように、直径約1〜2mmである、長さは約10〜40mmである、又はそれらの組み合わせである。当業者なら容易に理解できるであろうが、当然のことながら、インプラントの形状は、目的とする薬物放出特性が得られるように、又は、インプラントが埋め込まれる環境(又は、本発明に係る方法に影響を与えるその他の状態)に適応するように、任意の形状に変更することができる。
【0085】
ある実施形態では、本発明は、薬物を持続的に送達するためのキットであって、生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤と、生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤とを備えているキットを提供する。
【0086】
他の実施形態では、本発明は、前記キットの第1及び第2の製剤の組み合わせが、投与後、約1週間〜約14ヶ月間にわたって薬物を徐放するキットを提供する。別の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約1週間〜約1ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約1〜3ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約3〜6ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約6〜9ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約9〜12ヶ月間にわたって薬物を徐放する。他の実施形態では、前記キットの第1及び第2の製剤の組み合わせは、投与後、約12〜14ヶ月間にわたって薬物を徐放する。
【0087】
ある実施形態では、後述する製剤の前記キット及び組成物は、上述した方法に使用される。前記キット及び組成物は、全体的に又は部分的に使用される。他の実施形態では、前記キット及び組成物は、他のキット又は組成物と組み合わせて使用される。他の実施形態では、全身療法の一部として使用される。
【0088】
ある実施形態では、本発明は、薬物を徐放するためのキットであって、前記製剤の形状が、ロッド状のインプラントであるキットを提供する。前記ロッド状のインプラントは、直径が約1〜2mmである、長さが約10〜40mmである、又はそれらの組み合わせである。
【0089】
ある実施形態では、本発明は、リスペリドン又は9−OH−リスペリドンの制御放出インプラントとして使用するのに適した、流動性を有する組成物を提供する。他の実施形態では、前記流動性組成物は、少なくとも最初は水媒体又は体液内で実質的に不溶性である生分解性熱可塑性ポリエステルを含んでいる。ある実施形態では、前記流動性組成物は、注入可能な皮下送達システムとして作成される。前記注入可能な組成物の量は、好ましくは、約0.20ML〜0.40mL、又は、約0.30ML〜0.50mLである。前記注入可能な組成物は、好ましくは、約1ヵ月に1回投与されるように作成される。他の実施形態では約3ヵ月に1回投与されるように、他の実施形態では約4ヵ月〜6ヶ月に1回投与されるように作成される。好ましくは、前記注入可能な組成物は、患者への注入に適した、液体又はゲル組成である。
【0090】
ある実施形態では、本発明は、精神障害の治療に用いる組成物であって、微小粒子の形態の組成物を提供する。他の実施形態では、前記微粒子は、実施例11で後述するようにして製造される。他の実施形態では、前記微粒子の平均径(D3,2)は、約150μm±50μmである。他の実施形態では、前記微粒子の平均径(D3,2)は、約0.75±25nmである。他の実施形態では、本発明に係る製剤(本発明に係る方法に使用される、又は、本発明に係るキット又は組成物に組み込まれる製剤)は、分解性ポリマーと複合した前記薬物から成るナノ粒子であり得る。
【0091】
本発明に係る組成物は、ある実施形態では、治療のために、任意の適切な経路を介して、人間又は他の動物に投与される。組成物は、例えば、経口的、経鼻的(例えば、スプレーによって行う)、経直腸的、経膣的、非経口的、大槽内に、及び局所的に投与される。局所的な投与は、パウダー、軟膏、又はドロップ(口腔投与及び舌下投与を含む)によって行われる。
【0092】
ある実施形態では、前記組成物は、制御放出システムによって送達される。例えば、前記物質は、静脈内注射、埋め込み型の浸透圧ポンプ、経皮パッチ、リポソーム、又は他の投与方法を使用して投与される。ある実施形態では、ポンプが使用される(see Langer, supra; Sefton, CRC Crit. Ref. Biomed. Eng. 14: 201 (1987); Buchwald et al., Surgery 88: 507 (1980); Saudek et al., N. Engl. J. Med. 321: 574 (1989))。他の実施形態では、ポリマー材料を使用することができる。他の実施形態では、治療対象(すなわち脳)の近傍に制御放出システムを配置することができる。この場合、全身投与の場合と比べると、薬物投与量は微小で済む(see, e.g., Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984))。他の制御放出システムは、Langerによるレビューで議論されている(Science 249:1527-1533 (1990))。
【0093】
他の実施形態では、前記組成物は、経口、経静脈、動脈内、皮下、非経口、経粘膜、経皮的、又は局所性投与に適した形態に形成されている。ある実施形態では、組成物は、制御放出組成物である。他の実施形態では、組成物は、即時放出組成物である。ある実施形態では、前組成物は、液体投与形態である。他の実施形態では、組成物は、固形投与形態である。
【0094】
ある実施形態では、本発明に係る組成物の形態は、ペレット、錠剤、カプセル、溶液、懸濁液、分散液、乳液、エリキシル剤、ゲル、軟膏、クリーム、パッチ、又は坐薬であり得る。
【0095】
本発明に係る医薬組成物は、公知の、溶解、混合、顆粒化、押し出し、共押し出し、又は錠剤形成方法によって作成することができる。経口投与用には、活性成分、又はその生理学的に許容される派生物(他の実施形態では塩、エステル、N−酸化物)は、前記目的のために、慣習的な添加物(例えば、賦形剤、安定剤、又は不活性希釈)と混合され、従来の手法により投与に適した形態(例えば、錠剤、コート錠剤、硬ゼラチンカプセル剤、軟ゼラチンカプセル剤、水性溶液、アルコール性溶液、又は油性溶液)に形成される。適切な不活性媒体の例としては、結合剤(アカシア、コーンスターチ、ゼラチンなど)、崩壊剤(コーンスターチ、ジャガイモでんぷん、アルギン酸)、又は潤滑剤(ステアリン酸、ステアリン酸マグネシウム)と組み合わされた、ラクトース、サッカロース、又はコーンスターチをベースにした従来の錠剤がある。
【0096】
さらに、前記組成物は、活性成分の有効性を高めるために、少量の補助剤(湿潤剤、乳化剤、pH緩衝剤など)を含むことができる。
【0097】
活性成分は、中和された薬学的に許容される塩の形態で、組成物内に配合することができる。薬学的に許容される塩としては、無機酸(塩酸、リン酸など)又は有機酸(酢酸、シュウ酸、酒石酸、マンデル酸など)から形成される酸付加塩(抗体分子又はポリペプチドの自由アミノ基により作成された)がある。自由カルボキシル基から形成される塩は、無機塩基から作成することができる。無機塩基としては、ナトリウム、カリウム、アンモニウム、カルシウム、又は水酸化第二鉄、有機塩基(イソプロピルアミン、トリメチルアミン、2−エチルアミノ・エタノール、ヒスチジン、プロカイン)などがある。
【0098】
本発明に係る組成物は、ある実施形態では、経口送達用に作成される。活性成分は賦形剤と混合され、体内摂取可能な錠剤、バッカル錠、トローチ、カプセル、エリキシル剤、懸濁液、シロップ剤、オブラート(wafer)などの形態で使用される。錠剤、トローチ、ピル(pill)、カプセルなどは、結合剤(トラガカント・ゴム、アカシア、コーンスターチ、ゼラチンなど)、賦形剤(第二リン酸カルシウムなど)、崩壊剤(コーンスターチ、ジャガイモでんぷん、アルギン酸など)、潤滑剤(ステアリン酸マグネシウムなど)をさらに含み得る。また、甘味剤(サッカロース、ラクトース、サッカリンなど)又は香料添加剤(ペパーミント、ウィンターグリーン油、サクランボ香味料)を添加することもできる。投与形態がカプセルの場合は、上述したタイプの液体担体をさらに含み得る。被覆物として、又は投与ユニットの物理的形状は変更するために、様々な他の物質を使用し得る。例えば、タブレット、ピル又はカプセルは、セラック、砂糖又はそれらの両方によって被覆することができる。エリキシル・シロップは、甘味剤としてのサッカロース、防腐剤としてのメチル及びプロピルパラベン、染料、及び香味料(サクランボ又はオレンジ風味など)を含み得る。さらに、活性成分は、持続放出、パルス放出、制御放出、又は遅延放出を行う製剤及び組成物に組み入れることができる。
【0099】
そのような組成物は、ある実施形態では、液体又は凍結乾燥若しくは他の方法で乾燥させた組成物であり、様々な緩衝濃度、pH及びイオン強度の希釈剤(Tris−HCI、酢酸塩、リン酸塩など)、添加剤(表面への吸収を防止するためのアルブミン又はゼラチンなど)、洗浄剤(Tween 20、Tween 80、Pluronic F68、胆汁酸塩など)、可溶化剤(グリセロール、ポリエチレン・グリセロールなど)、酸化止剤(アスコルビン酸、メタ重亜硫酸ナトリウムなど)、防腐剤(チメロサール、ベンジル・アルコール、パラベンなど)、充填物質又は弾力性調整剤(ラクトース、マンニトールなど)、ポリマー(ポリエチレン・グリコール)のタンパク質への共有結合、金属イオンとの錯化、又は、物質の特定のポリマー化合物(乳酸、ポリグリコール酸、ヒドロゲルなど)若しくはリポソーム、マイクロエマルジョン、ミセル、単層或いは多層ベシクル、赤血球ゴースト、スフェロプラストの製剤への組み込みを含む。そのような組成物は、物理的状態、溶解性、インビボでの放出速度、及び、インビボでの除去速度に影響を与え得る。制御又は持続放出組成物は、脂溶性のデポー製剤(脂肪酸、ワックス、オイルなど)を含む。また、本発明は、ポリマー(ポロキサマー、ポロキサミンなど)に被覆された特定の組成物を含む。
【0100】
他の実施形態では、本発明に係る組成物は、1つ又は複数の薬学的に許容される担体材料を含む。
【0101】
ある実施形態では、前記組成物で使用される担体は生体適合性を有し、他の実施形態では生分解性を有する。他の実施形態では、前記組成物は、或る活性成分の比較的一定レベルの放出速度を提供する。しかしながら、他の実施形態では、投与直後の放出速度は、より急速であることが望ましい。他の実施形態では、活性成分の放出は、イベントによってトリガーされる。活性成分の放出をトリガーするイベントは、ある実施形態では同一であり、他の実施形態では異なる。活性成分の放出をトリガーするイベントは、ある実施形態では湿度、他の実施形態では低pH、別の実施形態では温度閾値の影響を受け得る。そのような組成物は、当業者なら周知の手法を用いて、一定の範囲内に保つことができる。このことに有用な例示的なキャリアとしては、ポリ(乳酸・グリコール酸)共重合体、ポリアクリル酸塩、ラテックス、でんぷん、セルロース、デキストランなどの微小粒子がある。他の例示的な遅延放出キャリアとしては、非流動性の親水性コア(交差結合された多糖類又はオリゴ糖)、及び随意的に両親媒性化合物(リン脂質など)を有する外層を含んでいる超分子バイオベクターがある。持続放出組成物に含まれる活性成分の量は、ある実施形態では、投与部位、放出速度、放出の予測される継続期間、及び、治療する病気の性質に依存する。
【0102】
ある実施形態では、本発明に係る方法、キット及び製剤は、癌治療の治療効果を高めるために使用される。または、HIV、単純ヘルペス、帯状ヘルペス、マイコバクテリア感染、癌、精神異常、多発性硬化症、糖尿病、腎臓病、慢性疼痛、肝炎、又は他の適用可能な疾患及び障害(例えば慢性疾患)を治療するために使用される。または、少なくとも1つの薬物を繰り返して投与する長期間の治療計画が有益である病気を治療するために使用される。
【0103】
以下の実施例は、本発明の好適な実施形態をより詳細に説明するためのものである。ただし、これらの実施例は、本発明の範囲を限定するものではない。
【実施例】
【0104】
《実施例1:サルにおけるPLGAインプラントからのハロペリドールの放出》
【0105】
(サルにおけるハロペリドールの体内放出)
霊長類におけるハロペリドールの1年間の持続的送達を評価する実験を行った。投与の霊長類の皮質組織上へのハロペリドールの長期間投与の効果を評価した。この実験は、サルにおけるハロペリドールの14ヶ月間の放出を実証した。
【0106】
(被検体)
全ての手順は、ピッツバーグ大学の動物管理使用委員会(Institutional Animal Care and Use Committee:IACUC)に承認された。2匹のサル(Macaca fascicularis, Rangos Research Facility)にインプラントを埋め込んだ。一方のサルには、対照として、薬物を含まないインプラントを埋め込み、他方のサルには、40質量%のハロペリドールを含有するインプラントを埋め込んだ。血清濃度を2〜10ng/mLにするために、ハロペリドール(Sigma, St. Louis, MO)を、約1mg/kg/日で12ヶ月間投与した。各インプラントは、ポリ(D,L−乳酸/グリコール酸)共重合体(PLGA)の単一ポリマーから作成した(Medisorb(R)Aldernzes, Cincinnati, OH)。PLGAにおけるポリ乳酸(polylactic acid:PLA):ポリグリコール酸(polyglycolic acid:PGA)の比率は、75:25、85:15、90:10(高固有粘度及び低固有粘度)、95:5、及び100:0であった。
【0107】
(インプラント製造)
ポリマーとハロペリドールを質量で60/40の割合で混合した後、アセトン(Fisher Scientific, Pittsburgh, PA)により溶媒成形した。その結果得られた膜を圧縮成形して、直径20mm、平均厚さ1.22±0.0mm、質量493±2mg、及び密度1.28±0.0g/ccのディスク状のインプラントを作成した。
【0108】
(薬物動態測定)
血液を1ヶ月に2回採取した。検体を遠心分離によって分離し、紫外線検出を用いた高速液体クロマトグラフィー(high-pressure liquid chromatography:HPLC)によって、ハロペリドールの濃度を分析した(図1)。対照動物の分析では、薬物は検出されなかった。
【0109】
(結果)
図1に示すように、ハロペリドールの放出は、合計で443日間測定された。最初の224日間の平均血清濃度は、10.5±1.5ng/mLであった。その後の176日間の平均血清濃度は、放出の終わりまで低濃度であり、4.0±0.4ng/mLであった。最後の45日間では、放出は一次減衰放出をたどり、平均血清濃度は、1.2±0.3ng/mLであった。
【0110】
《実施例2:ウサギに埋め込まれたインプラントの2つのポリマーPLGA系からのハロペリドールの放出》
【0111】
(ウサギにおけるハロペリドールの放出)
ウサギに埋め込まれたインプラントは、検視時にインプラント部位を発見しやすくするために、ひもで縛られている。2つの異なるインプラント・システムを試験した。一方は、サルの場合の実験結果(実施例1参照)を確認するために、5つの異なるポリマーのアマルガムを含んでいる。他方は、単一の長持ちするポリマーシステムから成り、1年間に渡る放出を維持する間に、最初の急増を抑制することを目的とする。これらのウサギを用いた実験は、ハロペリドールの13ヶ月間の放出を実証した。
【0112】
(被検体)
4.0〜5.7kgの範囲のウサギ(N=12, Covance, Denver, PA)を用いた。5匹のウサギに、単一ポリマーである100%ポリ乳酸(PLA)から成り、40%(w/w)のハロペリドールを含有しているインプラントを埋め込んだ。このインプラントの平均投与量は418±7mg/kg、平均の1日量は0.02mg/kg/日であり、365日間の送達が予想される。
【0113】
他の5匹の動物には、75:25、85:15、90:10(高固有粘度)、90:10(低固有粘度)、及び100:0のPLGAを含む複合ポリマーシステムから成るインプラントが埋め込まれる。このグループでの平均投与量は、473±4mg/kg、平均の1日量は、1.29±0.03mg/kg/日であり、365日間の送達が予想される。
【0114】
別の2匹のウサギには、対照として、薬物を含まないインプラントが埋め込まれる。1匹には、単一ポリマーの状態を模倣するために、PLAが100%のインプラントが埋め込まれる。もう1匹には、複合ポリマーシステムを模倣するために、75:25、85:15、90:10(高固有粘度)、90:10(低固有粘度)、及び100:0のPLGAから成るインプラントを埋め込む。
【0115】
(インプラント製造)
ウサギ用のインプラントは、サルを対象とした実施例1の方法を用いて作成される。作成されたインプラントの平均質量は536±2mgであり、密度は1.24±0.00g/ccであった。
【0116】
(薬物動態測定)
血液を1ヶ月に2回採取した。固相抽出後、血清のハロペリドールを、UV検出を用いたHPLCによって測定した(Oasis MCX columns, Waters, Milord, MA)(図2)。
【0117】
(組織学的分析)
5匹のウサギは、病理学的な中間解析を行うために、9ヶ月後に屠殺した。残りの7匹のウサギは、その4ヵ月後に屠殺した。対照以外の全ての動物で、インプラントの残余は、屠殺されたウサギの所定の位置に繋がれているのが見つかった。HPLC/UV及びNMR分光法によって、インプラントの残余内に、ハロペリドール及びPLGA分解産物の存在が確認された。組織学的分析によって、対照及び治療されたウサギの全ての器官系は、正常範囲内であることが分かった。
【0118】
(結果)
図2(A)に示すように、ウサギに埋め込まれた単一ポリマーシステムからのハロペリドール放出は、合計で379日間測定された。最初の224日間の平均血清中濃度は、2.5±0.4ng/mLであった。また、57〜274日の平均濃度は、3.8±0.4ng/mLであった。
【0119】
図2(B)に示すように、ウサギに埋め込まれた複合ポリマーシステムからのハロペリドール放出は、合計で379日間測定された。最初の224日間の平均血清中濃度は、2.5±0.4ng/mlであった。また、57〜274日の平均濃度は、3.8±0.4ng/mlであった。
【0120】
複合ポリマーシステムでは、最初の7ヶ月間では、その後の7ヶ月と比べると、血清レベルが高い(図2(B))。例えば75:25 PLGAなどの早期分解ポリマーから成るインプラントは、初期の放出量が多くなると思われる。そのため、初期の放出量を少なくするためには、75:25 PLGAインプラントの質量を減少させる必要がある。
【0121】
《実施例3:PLGAインプラントからのリスペリドン放出》
【0122】
(リスペリドンの安定性)
リスペリドン(10mg)は、100μのアセトニトリル中に溶解される。その後、10,000ng/mlの最終的な溶液を作成するために、1000mlのリン酸緩衝生理食塩水(pH7.0)中に溶解される。作成されたリスペリドン溶液は、その後、琥珀色の遮光ボトルに37℃で保存され、40rpmで攪拌される。1週間に3回、1mlのサンプルが採取され、UV分光法(AmershamBiosciences, Buckinghamshire, UK)によって、薬物含量が検査される。分析によって、薬物の濃度は依然として安定しており、285日間で、全体の0.12%が減少しており、0.05ng/日と等しいことが分かる。
【0123】
(インビトロでの個々のポリマーからのリスペリドン放出)
3つのポリマーのリスペリドン放出特性を評価した。インプラントは実施例1で上述したようにして、20%のリスペリドン(w/w)(RBI Flanders, NJ)と、80%(w/w)のポリマー(MEDISORB(TR), Alkermes Inc. Cincinati, OH)とから製造される。前記ポリマーは、50:50(PLA:PGA)(高固有粘度、inherent viscosity:IV)、65:35(低IV)、及び75:25(高IV)のPLGAである。3つのインプラントは、個々の琥珀色の遮光ボトル(リン酸緩衝生理食塩水が入っている)に37℃で保存され、40rpmで攪拌される。各ボトルから、1週間につき3回、1mlのアリコートを採取する。そして、一定容積を維持するために1mlの緩衝液を再導入した後、UV分光法(AmershamBiosciences, Buckinghamshire, UK)によって薬物含量を分析した。
【0124】
(結果)
図3は、20%の薬物が充填された50:50(高IV)、65:35(低IV)、及び75:25(高IV)のPLGAから成るインプラントより放出されるリスペリドンの累計放出量を示している(典型的な飽和曲線である)。薬物放出は、ポリマー基質内のPGA濃度次第であり、PGA濃度が低い場合はリスペリドンの放出も遅くなる。
【0125】
《実施例4:リスペリドンのインプラントへの最大充填量の測定》
(リスペリドンの最大充填量の測定)
インプラントに充填されるリスペリドンの最大濃度を設定する目的で、リスペリドンの薬物濃度が放出特性に与える影響を試験した。各インプラント・システムに薬物を最大充填量で充填することにより、インプラント・システムを小型することが可能となり、耐容性が向上する。
【0126】
(方法)
インプラントは、リスペリドンと20、40、又は60%薬物(w/w)の割合で複合したポリマー(85:15 PLGA 高IV)を使用して作成される。前記ポリマーの予想される分解時間は4ヶ月間である。各インプラントの質量は50±10mgであり、各インプラントは、10、20及び30mgの薬物を生成する。図4(A)は、放出特性を、各インプラント(50mg)から40日間で放出されたリスペリドンの累計放出量(mg)として表している。図4(B)では、放出特性を、各インプラント(50mg)から40日間で放出されたリスペリドンの%として表している。
【0127】
《実施例5:インプラントの形状に応じたPLGAインプラントからのハロペリドールの放出》
【0128】
(背景)
ディスク状のインプラントを埋め込むための大きい切開(incision)は、ある状況下では、ディスク状インプラントの人間の患者への適用性を減少させる。そのため、4mmの孔を介して挿入できるように、インプラントはロッド状に製造される。剛体のPLGAインプラントは、皮膚下でインプラントをガイドする道具を不要とし、筋肉内に挿入されずに皮下に存在することを確実にする。インプラントの形状がハロペリドールの放出に及ぼす影響を調べるために、予備的な実験を行った。
【0129】
(方法)
ハロペリドール(40% w/w)は、溶媒成形によって、50:50 PLGA(60% w/w)と複合される。その物質は、その後、ディスク状に圧縮成形される。または、高圧ピストン押出成形機(DACA Instruments, Goleta,CA)を使用してゆっくりと押出し成形される。
【0130】
(結果)
これら2つの形状(ディスク状とロッド状)の放出特性を図5に示す。図5は、インビトロでの、ディスク又はロッド状のインプラントから放出されるハロペリドールの累積放出量を示している。各点は、ディスク又はロッドのインプラントにおける3回の観測結果の平均を示している。各インプラントは、暗闇で500mlのリン酸緩衝生理食塩水(pH7.0、37℃)に入れられ、40rpmで攪拌される。ディスクとロッドの重量は等しい。2つのインプラント形状の間には、放出特性の微細な違いは見られなかった。
【0131】
《実施例6:血清中の薬物濃度を一定に保つための放出特性の制御》
【0132】
(放出特性のガウス分布)
ウサギに埋め込まれた単ポリマーシステムからの放出特性(図2(A))は、生体分解性インプラントが抗精神病薬の送達を長期の治療期間中実施できることを示唆している。このデザインは、初期に高血清濃度になることを避けるので、放出特性のガウス分布は、目的とする血清濃度に達するまでに3ヶ月間かかる。それにもかかわらず、放出特性の左右対称性は、6ヶ月毎に埋め込みを繰り返して、あるセットのインプラントにおける放出減少を次のセットのインプラントからの放出で相殺することによって、治療期間中の薬物送達を持続することを可能にする(図6)。
【0133】
図6は、生体分解性インプラントによる連続的送達のモデルを示す。ウサギに埋め込まれた100% ポリ乳酸(poly lactic Acid:PLA)インプラントの放出特性は、6ヶ月間の間隔(グレイのトレンドライン)で一時的に重なり、再埋め込み間隔をモデルする。各時点での予測される血清濃度が合計され、予想される合計放出プロットが得られる。黒のトレンドラインは、合計の血清濃度をモデルしている。このシステムは、6ヶ月間ごとに再移植を行う限り、目的とする血清濃度の周辺で振動する。
【0134】
《実施例7:人間患者に対する薬物持続放出治療のスケーリング》
【0135】
(人間へのスケーリング)
多くの種間で、薬物(ハロペリドールを含む)の代謝作用は異なる。ウサギとサルの両方では、人間と同等の血漿濃度を得るためには、人間の場合よりも約15〜30フォルド多い投与量が必要である(Bacopoulos etal., 1980; Jibiki et al., 1993; Klintenberg etal., 2002)。人間の場合は、デボー製剤として投与する場合は、ハロペリドールは約1mg/kg/月必要である。そのため、ハロペリドールを600mg含有するインプラント・システムは、体重が50kgの患者を1年間治療することができる。したがって、1年間の治療のためには、インプラントは、薬物を40%含有する1.5gmにデザインされる。この方法が有望であることが分かっているリスペリドンなどの強力な薬物も同様に使用される。リスペリドンの放出特性は、PLGA送達システムに組み入れた際に、生体内で6ヶ月間又はそれ以上に及ぶ長時間送達が得られることを示している。
【0136】
《実施例8:リスペリドンの長期間放出》
【0137】
〈長期間送達システムにおけるリスペリドンの物理化学的特性〉
【0138】
(リスペリドンの安定性)
リスペリドンの安定性は、アセトンからの溶剤成形及びゆっくりとした押出成形の後に評価される。このことにより、前記組成物がインプラントへの商業的製造に耐えられるかどうかが確認される。その後、保存期限の実験が行われる。4℃で様々な期間(最大1年間)保存された一連のインプラントのリスペリドン成分が検査される。UV分光法で検査した結果、リスペリドンは、生理的水環境(37℃、0.9% リン酸緩衝生理食塩水、pH7.0)で10ヶ月間安定していた。リスペリドンは、溶剤成形及び押出成形後、HPLC−MSピークの持続時間及び量の性質を保つ。さらに、UV検出を備えた定量的HPLCで評価したところ、リスペリドンは、生理的水環境(37℃、0.9% リン酸緩衝生理食塩水、pH7.0)で1年間保存した場合は、1%以下しか分解しなかった。
【0139】
(PLGAの安定性)
10のPLGAポリマーの保存中における安定性を、固有粘度とガラス転移温度(glass transition temperature:Tg)の測定により評価した。溶媒成形及び押出成形後、乾燥環境(4℃)で1年間保存したPLGAポリマーは、固有粘度については5%以下の変化を示し、Tgについては2℃以下の変化を示した。
【0140】
〈方法〉
(材料)
リスペリドンは、GMP法を用いて合成される。市販されている医療グレードのリスペリドンとアセトン(USP/EP)が使用される。
【0141】
(次のPLGAポリマーが使用される)
【表2】

【0142】
〈生理溶液内でのリスペリドンの経時的な安定性〉
次のようにして、リスペリドン溶液の複製が3つ作成された。アセトニトリル100μlに、リスペリドン(10mg)を溶解させる。その後、リン酸緩衝生理食塩水1000ml(pH7.0)に溶解して、10,000ng/mLの最終的な溶液を作成する。リスペリドン溶液は、その後、琥珀色の遮光ボトルに37℃で保存される。HPLC分析のために、1カ月おきに、各サンプルの3つのアリコート100μlを採取した。その後、リスペリドンの濃度を経時的にプロットし、結果として得られる線の傾斜が、組成物の安定性を示す。
【0143】
〈リスペリドン及びPLGAポリマーの埋め込み中の安定性〉
(リスペリドン)
5%の薬物と95%のポリマー(w/w)から構成されるリスペリドン・インプラントは、アセトンからの溶媒成形によって作成される。そして、その後、押出成形(60℃、ピストン速度:5mm/秒)によって、直径3.6mm、長さ20±10mmのロッドが作成される。結果として得られた物資の成分は、HPLCによって、インビトロで定量分析される。結果は、インプラント物質に充填されたリスペリドンの最初の質量に対する割合として表される。
【0144】
(ポリマー)
PLGAポリマーの安定性は、製造処理後に評価される。対照インプラントは、薬物を含有していない。対照インプラントは、アセトンからの溶媒成形によって作成され、その後、ゆっくりした速度で押出成形される。結果として得られる物質(5〜10mg)は、一定温度(25℃)でウベローデ粘度計(Ubbelhode suspended-level viscometer)を使用して、アセトン内でのIVの変化が分析される。また、示差走査熱量計(differential scanning calorimetry)を使用して、Tgの変化が分析される(20〜100℃、10°/分)。IV及びTgは両方とも、インプラントの製造前と製造後に測定される。
【0145】
〈生体分解性コポリマーの物理化学的性質に関しての、リスペリドンの体内での放出特性の測定〉
(個々のポリマーの放出パターン)
薬物が50%充填されている、100% PLAから成る単一のポリマーシステムの放出特性は、ガウス分布として表される。埋め込み後、ピーク濃度が6ヶ月間維持され、有効濃度(1ng/L以上)が2〜8ヶ月間維持される(図7A)。放出特性の対称性は、6ヶ月毎に埋め込みを繰り返すことによって、治療期間中の薬物送達を維持することを可能にする。リスペリドンの典型的な放出は、PLGA生体分解性基質中に拡散されているリスペリドンの累積放出量として、図11Aに示されている。同様に、9−OH−リスペリドンの放出特性が、図11Bに示される。同様に、図12は、20%(w/w)の9−OH−リスペリドンが充填された、PLA:PGAが85:15のブロック共重合体ポリマー生体分解性基質における、9−OH−リスペリドンの累積放出量を示している。また、図13は、20%(w/w)のリスペリドンが充填された、PLA:PGAが85:15のブロック共重合体ポリマー生体分解性基質における、リスペリドンの累積放出量を示している。
【0146】
比較的長時間の遅れと、目的とする治療有効濃度の周辺での大きな振動を避けるために、付加的なポリマー・インプラント又は放出特性の速い製剤が複合され、治療期間中は見かけ上ゼロ次速度の放出を交互に行い、治療期間中は薬物の有効濃度を維持する(図7B〜7E)。
【0147】
《実施例9:PLGAインプラントからのハロペリドール放出》
【0148】
(インプラント製造)
インプラントは、溶剤成形と圧縮成形によって製造される。ポリ乳酸とポリグリコール酸との比率が75%:25%のPLGAと、ポリ乳酸とポリグリコール酸との比率が85%:15%のPLGAとの2つのポリマーは、5ヵ月間の放出を行う複合システム内に存在している。各コポリマーは、独自の分解期間を有している。分解期間は、乳酸のグリコール酸に対する割合と、作成された分子の分子量によって決定される。ラットのインビボ試験に、別の100% ポリ乳酸(PLA)ポリマーが使用される。全てのポリマー(Alkermes Inc., Cincinnati, OH)は、クロロホルム内で0.66〜0.80DL/gの固有粘度を有しており、分子量の分布は120〜140kDである。個々のポリマー及びハロペリドール(Sigma, St. Louis, MO)は、アセトン内に溶解され、60℃、72時間で溶剤成形される。溶剤成形された物質は、80℃、25,000psiで、最終密度が1.1±0.05g/ccとなるように、圧縮成形される。
【0149】
(インビトロ分析)
個々のインプラントは、攪拌器上の1リットルのリン酸緩衝生理食塩水(PBS)(pH7.0、37℃)に入れられる。ハロペリドール濃度は、GCMS(National Medical Services, Willow Grove, PA)によって測定される。各分析は、ポリマーだけから成るインプラントの陰性対照、及び、溶媒内でハロペリドールの長期間の安定性を評価するのに標準的な100ng/ml ハロペリドールを含む。
【0150】
(動物)
インプラントは、ラット(Harlan, Indianapolis, IN)(n=9)及びマウス(Jackson Labs, Bar Harbor, ME)(n=16)を用いて試験した。全ての動物は、AAALAC適格審査に合格した動物施設に収容された。全ての手順は、ピッツバーグ大学の動物管理使用委員会(Institutional Animal Care and Use Committee:IACUC)に承認された。動物は、全ての試験で12:12の明暗サイクルで保持され、処置は明サイクル中に実施された。
【0151】
(埋め込み/除去手術)
マウス及びラットは、ケタミン/キシラジン(100/10mg/kg,i.p.)によって麻酔される。外科用メスによって、動物の背面の皮膚が1cm切開される。皮下の空間は、止血剤によって可視化され、単一のインプラントがピンセットによって真皮と筋肉との間に設置される。傷は手術用ホッチキスによって閉じられる。埋め込んだ4週間後、インプラントの位置は触診によって判断され、同一の麻酔及び切開によってインプラントは除去される。実際、インプラントはピンセットによって容易に除去される。
【0152】
(行動実験)
インプラントの移動時の影響を評価するために、16匹のC57bl/6マウスの内、8匹のマウスには75:25 PLGAのみから成るインプラントを埋め込み、残りの8匹のマウスには20%ハロペリドールが充填された75:25PLGAから成るインプラントを埋め込んだ。埋め込んだ3週間後、移動距離の合計を20分間にわたって評価した。その後、インプラントを取り出し、再テストの前に動物を48時間休息させた。再テストは、アポモルヒネ(0.5mg/kg,i.p.)(Sigma, St Louis, MO)を投与した20分後に行われた。
【0153】
(ウエスタンブロット法)
6匹のSD(Sprague-Dawley)ラットに、30〜40% ハロペリドールを有するPLAから成るインプラントを埋め込んだ。3匹のラットに、PLAのみから成るインプラントを埋め込んだ。インプラントは、動物内に3ヶ月保持された。インプラントを除去した72時間後、ラットを屠殺し、脳を急いで取り出し、切開によって4つの部分(皮質、海馬、線条体、小脳)に分割した。その後、液体窒素で冷凍した。D2受容体タンパクを定量分析するウエスタンブロット法を、線条体に対して行った。1匹の動物における皮質タンパク質の3つの濃度(2.5、5及び10μg)は、ラベリングの度合いを保証するための内部制御として、全てのブロットで行われ、分析ソフト上では直線状である。サンプルの密度が内部標準の直線領域内にあるこれらのブロットのみが分析に使用される。ウエスタンブロット法は、D2受容体タンパクのアミノ酸272−282に対するポリクローナル抗体WR−3526を使用して行われる(Research and Diagnostic Antibodies, Berkeley, Ca)。線条体は、均質化緩衝液(20mM HEPES,2mM EGTA,1mM PMSF,2μM アプロチニン、及び2mM DTE)内で均質化され、その後30秒間超音波処理される。サンプルは、100,000g、1時間、40℃で遠心分離される。ペレットは再懸濁され、0.1% Triton X−l00を含んでいる均一化緩衝溶液内に溶解される。タンパク質は予備攪拌により氷上に45分間抽出される。抽出後、タンパク質は、300,000g、30分間、40℃で遠心分離される。タンパク質のサンプルは、25% 4x NUPAGEサンプル緩衝液、10%還元剤(Invitrogen)から作成され、70℃で10分間熱ショックが与えられる。サンプルは、前もって成形された10%ミニジェル上で分離される(200ボルト、50分間)。タンパク質は、PVDFに転移される(30ボルト、1時間)。ブロットは、TBS(20mM Tris,pH=7.5, 0.5M NaCl)内の5%のミルクによってブロックされる。その後、15分間洗浄される。ブロットは、その後、抗D2容体抗体と共に一晩培養される。そしてTBSによって洗浄した後、ヤギ抗ウサギホースラディシュ・ペルオキシダーゼ複合体(BioRad,1:4800)と共に1時間培養される。ブロットは、その後、化学発光基質(Pierce)と1分間培養され、プラスチックによって覆われ、オートラジオグラフィー膜にさらされる。
【0154】
(定量化)
各バンドの強度は、濃度計モデル7100と定量分析ソフトウエア(Bio Rad, Hercules, CA)を使用して定量化される。そして、強度の割合を得るために、ラットにおける対応するバンドに対する割合として表される(rat 1=ratio of 1)。全てのサンプルは、状態間の定量比較を行うために、単一のブロットで、同時に行われる。
【0155】
(インビトロ)
2つのポリマーのハロペリドール濃度を、図8A〜Cに示す。図8は、攪拌器上のリン酸緩衝生理食塩水(pH7、37℃)に配置された、個々のインプラントのグラフを示している。緩衝液のサンプルは、1週間又は2週間の間隔で抽出され、ハロペリドールの濃度をGCMSによって評価する。累積放出は、各時点において緩衝溶液で測定された薬物充填量全体の%として表される。75:25及び85:15 PLGAポリマーから放出されるハロペリドールの累積濃度が表される。各グラフは、3つのインプラント(円、四角、三角形)からのデータを示す(3つの値の第4度多項式平均線により)。
【0156】
ハロペリドールの含有率が40%の75:25 PLGAから成るインプラントの放出特性は、初期段階(0〜28日)では、ゆっくりと放出することを特徴とする(約0.29%/日/インプラント)。第2の段階(28〜84日)では、より急速に放出する(約1.28%/日/インプラント)。75:25 PLGAから成るインプラントは、66日間で、充填されたハロペリドール全体の50%を放出する(図8A)。ハロペリドールの含有率が40%の85:15 PLGAから成るインプラントは、初期の段階(0〜56日)では、ゆっくりとした放出パターンを示す(約0.26%/日/インプラント)。そして、第2の段階(56〜140日)では、より急速に放出する(0.95%/日/インプラント)。85:15 PLGAから成るインプラントは、88日間で、充填されたハロペリドールの半分を放出する(図8B)。ハロペリドールの含有率が40%の75:25及び85:15 PLGA(理論上の複合材料システム)からの放出は、初期の段階(0〜28日間)では平均0.34%/日の放出を示し、第2の段階(28〜140日)では、0.82%/日の急速な放出を示す。75:25と85:15 PLGAの混合構造は、578日間で、充填されたハロペリドールの半分を放出する(図8C)。陽性対照溶液(100ng/ml)の値は、154日間、依然として安定している(0日間=106、154日間=100、平均±sd、実験期間中=106±11ng/ml)。
【0157】
(インビボでの自発運動)
ハロペリドール又はブランク・ポリマーのインプラントが埋め込まれたマウスの自発運動(Locomotor activity)を図9に示す。全ての動物は、75:25 PLGAだけから成るインプラント、又は、ハロペリドールの含有率が20%の75:25 PLGAから成るインプラントを埋め込んだ後に3週間試験した。基準の自発運動は、24分間測定した。対照インプラントが埋め込まれた動物の移動距離は、平均12223±433cmであった。ハロペリドールを含有しているインプラントの移動距離は、平均7664±450cmであった。したがって、ハロペリドールを含有しているインプラントが埋め込まれたマウスの移動は、対照よりも著しく少ない(p<0.01)。その後、インプラントは取り除かれ、全ての動物は、48時間回復させた。1匹の対照インプラントが埋め込まれた動物は、除去手術中に麻酔によって死亡した。インプラントを除去した48時間後、自発運動テストの24分前に、動物の腹腔内にアポモルヒネ(0.5mg/kg)を投与した。このことにより、マウスの自発運動は向上する(Ninan and Kulkami 1999)。アポモルヒネを投与した後の、対照インプラントが埋め込まれた動物の移動は、平均4721±476cmであった。一方、ハロペリドールを含有しているインプラントが埋め込まれた動物の移動は、平均8531±2536cmであった。そのため、インプラントを除去してアポモルヒネを投与した後は、ハロペリドールを含有しているインプラントが埋め込まれたマウスは、対照マウスよりも長い距離を移動した(p<0.01)。
【0158】
(ウエスタンブロット法)
全てのラットからの線条体膜に対するウエスタンブロット法は、完全長D2受容体タンパク(Expert Protein Analysis System, SwissInstitute of Bioinfo3matics, http ://www. Expasy. ch)(Bunzow et al 1988)の予測される分子量に対応する、視覚的なバンドの約50kDの分子量を明らかにする(図10)。バンドの光学濃度の平均は、レーン1(ハロペリドールで治療されたラット)に対して定量化される。3ブロットに基づく結果は、50kDバンドに対応するハロペリドール・インプラントで治療されたラットの平均±SD相対密度を生成する。一方、対照ラットの平均相対密度は、0.64±0.02であった(p<0.001、両側t検定)。
【0159】
《実施例10:リスペリドン・インプラントによる統合失調症の長期間治療》
【0160】
〈インプラント製造〉
(リスペリドン・ディスク・インプラント)
ディスク・インプラントは、溶剤成形及び/又は圧縮成形によって製造される。75:25 PLGA(ポリ乳酸:ポリグリコール酸の比が75%:25%)と、85:15 PLGA(ポリ乳酸:ポリグリコール酸の比が85%:15%)の2つのポリマーは、12〜14ヶ月間の放出を行う複合システム内に存在している。各コポリマーは、独自の分解期間を有している。分解期間は、乳酸のグリコール酸に対する割合と、作成された分子の分子量によって決定される。全てのポリマー(Alkermes Inc., Cincinnati, OH)は、クロロホルム内で0.66〜0.80DL/gの固有粘度を有しており、分子量の分布は120、000〜140、000である。個々のポリマーとリスペリドン(Sigma, St. Louis, MO)は、アセトン内に溶解され、60℃、72時間で溶剤成形される。溶剤成形された物質は、直径20mm、厚さ1.2±0.00mm、最終密度1.2±0.1g/ccのディスク状に成形される。
【0161】
(リスペリドン・ロッド・インプラント)
ロッド・インプラントは、圧縮成形によって製造される。ポリ乳酸:ポリグリコール酸が50%:50%である50:50 PLGAポリマーは、2ヶ月間の放出を行うシステム内に存在している。ポリマー(Alkermes Inc., Cincinnati, OH)は、クロロホルム内で0.66±0.1DL/gの固有粘度を有しており、分子量の分布は120、000〜140、000である。ポリマーとリスペリドン(Sigma, St. Louis, MO)は、アセトン内に95:5の割合(w/w)で溶解される。そして、高圧ピストン押出成形機(DACA Instruments, Goleta, CA)を使用して60℃、5mm/秒のピストン速度(psi)で押し出され、最終密度が1.1±0.1g/cc、直径3.5±0.5mm、長さ20±10mmとなるように成形される。放出特性は、モノマー割合(乳酸:グリコール酸)、最初に充填される薬物の量、及び製造方法によって異なる。
【0162】
(実験の対照及びモニタリング)
(A)対照被験体の第1のグループには、リスペリドンを放出する複数ポリマーシステムを6ヶ月間埋め込んだ。
(B)対照被験体の第2のグループには、最初に複数ポリマーシステムを埋め込み、6ヶ月後、「メンテナンス」インプラントを再度埋め込んだ。このようにして、12ヶ月間の連続的な薬物治療を行った。
(C)対照被験体の第3のグループには、最初に複数ポリマーシステムを埋め込み、定常状態の送達を行った。しかし、「メンテナンス」インプラントを再度埋め込むことは行わなかった。これらの対照は、埋め込んだ12ヶ月後にテストされ、このシステムが薬物送達を終了した後の毒性学的評価が行われた。
(D)対照被験体の第4のグループには、送達期間中のインプラントの物理的ダメージを評価するために、故障したインプラントを埋め込んだ。
(E)対照被験体の第5のグループは陽性対照であり、試験される送達システムとは無関係に、薬物の毒性効果を明らかにするために、リスペリドンの経口又は注射による投与を毎日受けた。
(F)対照被験体の最後のグループは陰性対照であり、リスペリドンとは無関係に、ポリマー物質の影響を評価するために、薬物を含有していないブランクのインプラントが埋め込まれた。
【0163】
(ロッド・インプラントの配置)
放出特性が異なる複数のインプラントを、患者の皮下に挿入した。インプラントは、4mmの切開によって肩に配置した。インプラントは剛性なので、インプラント・ガイドは不要である。
【0164】
(統合失調症の治療効果の判定)
患者は、治療を受けている間は、簡易精神症状評価尺度(Brief Psychiatric Rating Scale:BPRS)のスコアが向上した(Dinakar, H.S. et al., [2002] Efficacy of Olanzapine and Risperidone for Treatment-Refractory Schizophrenia Among Long-Stay State Hospital Patients, Psychiatric Services, Vol. 53 No.6, pp 755-757)。そして、体重増加などの大きな副作用は示さなかった。陰性症状(失語、感情の平坦化、意欲、無関心、引きこもり、注意力障害)と認知的作業の実行とに関しても向上が見られた(Honey, G. D., et.al. , [1999] Diffrrences in Frontal Cortical Activation by a Working Memory task after Substitution of Risperidone for Typical Antzl, sychotic Drugs in Patients with Schizophrenia. PNAS, vol. 96, No. 23, pp. 13432-13437)。
【0165】
(リスペリドンの血清中濃度)
埋め込み/再埋め込み計画に基づいて、患者から3ヵ月後毎に(又は必要に応じて)2mlの血液を採取した。血液はその後遠心分離され、血清を分離した。リスペリドン濃度は、固相抽出(MCX, Waters)及びHPLC/UV測定によって決定される。
【0166】
《実施例11:双極性障害の短期間(1〜3週間)を治療するための9−OH−リスペリドンを経口投与するために使用される微小粒子》
【0167】
(微小粒子の製造)
微小粒子は、活性成分としての9−ヒドロキシ−リスペリドンを98:2(w/w)の割合で含有する、ポリ(グリコール酸)及びポリ(D,L−乳酸)共重合体(乳酸:グリコール酸の比は75:25)から作成される。PLGAと9−ヒドロキシ−リスペリドンは、アセトン及びEVA(分散相)内に溶解される。連続相は、PVA、水、酢酸エチル、及びベンジルアルコールから作成される。乳剤を形成するために、20:80の比の分散及び連続相が、静的ミキサー(Kenics(TR) KM Series Static Chernineer, Dayton, OH)によってポンピングされる。ミクロスフェアの最終的なサイズは、相比、流速、温度、連続相の組成によって調整される。その結果生成される乳剤は、焼入液に注入される。安定させた後、結果として生成されたミクロスフェアを濾過する。そして、適切な一連の溶媒によって繰り返して洗浄した後、乾燥させる。
【0168】
(ミクロスフェアの投与)
ミクロスフェアはカプセルに封入され、患者に経口投与される。ミクロスフェアは賦形剤と混合され、体内摂取可能なカプセルとして使用される(結合剤、賦形剤、潤滑剤、さらには液体担体を含む)。
【0169】
(治療効果)
長期間の治療を受けている患者は、臨床全般印象尺度(Clinical Global Impression:CGI)及び機能の全体的評価(Global Assessment of Functioning:GAF)の平均値に基づいている基準よりも少なくとも7ポイント上の改善を示す。治療は、良好な耐容性を示し、9−OH−リスペリドンが投与されている間は、患者は気分症状の悪化を体験しない(Ghaemi, S.N. [1997] Acute Treatment of Bipolar Disorder with Adjunctive Risperidone in Outpatients. Can J Psychiatry, Vol 42, pp. 196-199)。
【0170】
《実施例12:第2世代抗精神病剤を使用した精神病性障害の徐放治療》
【0171】
(スターターの製造)
剛性インプラントが有効血清濃度に達するまでの比較的長時間の遅れを補うために、精神病性障害の症状を示す患者には、特に血清濃度を治療有効濃度まで急激に上昇させるための、注入可能な形態の抗精神病剤含有製剤が投与される。注入可能な前記製剤の投与後は、抗精神病剤を含有しているPLGAの微小粒子であって、前記薬物を高速で放出する微小粒子を経口投与する。このことにより、前記薬物の治療有効濃度は1日で得られ、送達ピークは2週間以上維持される。
【0172】
〈インプラント〉
(単ポリマー・インプラント)
上述したようにして製造されたインプラントは、単一のコポリマーから作成され、抗精神病剤を含んでいる。放出特性は、埋め込み後、治療有効濃度が3週間以内に得られ、放出ピークが5〜7ヶ月間持続し、完全に分解されるまで6〜8ヶ月間かかるようにデザインされる。単一インプラントでは、抗精神病薬の最適血清濃度の周辺で、濃度は大きな振幅で変動し得る。そのため、前記変動を補うために、単一コポリマー組成物であり、送達ピークは10〜14週間であり、完全に分解されるまで4〜5ヶ月間かかる第2のメンテナンスセットが加えられる。PLGAインプラントから放出される様々な抗精神病薬の累積放出特性の例は、図14D、15A、16A、及び17Aのグラフに示される。
【0173】
(複数のコポリマー組成物インプラント)
共押し出し法を使用して、複合インプラントの中心には長期間放出特性を有するPLGA(PLA:PGAは85:15、高IV)コポリマーが高充填(high-load)され、外側には急速放出特性を有するPLGA(PLA:PGAは50:50、低IV)が低充填(low-load)される。このことにより、メンテナンスセットが不要となり、分解までの時間を速めることができる。したがって、治療有効濃度を長期間維持することができるので、再埋め込みは9ヶ月間に1回で済む、或いは、インプラントのサイズを小型化することができる。
【0174】
(抗精神病薬の血清濃度のモニタリング)
患者からは、埋め込み/再埋め込み計画に基づいて、3ヶ月毎に又は必要に応じて、2mlの血液が採取される。採取した血液を遠心分離して、血清を分離する。抗精神病薬の濃度は、固相抽出(MCX, Waters)及びHPLC/UV測定によって決定される。
【0175】
(治療効果のモニタリング)
【0176】
治療効果は、治療する精神病疾患によって異なる。患者は、一般的に、認知的作業、感情の安定、又は感情の起伏に向上を示す、特に、作業能力、他の人間や社会との交流や親密になることに向上を示す。大きな副作用は見られず、再入院の頻度は減少する。インプラントから放出される抗精神病薬の効果を、図14〜17に示す。
【0177】
《実施例13:薬物充填の最適化》
【0178】
(背景)
リスペリドンの放出特性に対する薬物濃度の影響を調べる実験を行った。この実験の目的は、インプラントに充填されるリスペリドンの最大濃度を定めることにある。インプラントに充填されるリスペリドンの濃度を最大にすることにより、インプラントのサイズを小型化できる。そして、その結果、患者の耐容性を高めることができる。インプラントは、重量で20%、40%又は60%の割合でリスペリドンと複合した単一ポリマー(85:15 PLGA 高IV)から作成した(図18A)。ポリマーの分解期間は、4ヶ月間と予測される。各インプラントの重量は約50mgであり、薬物の充填状態に応じて、10(20%)、20(40%)、及び30mg(60%)の薬物を放出する。この実験は繰り返され、他の薬物含有割合についての試験も行った。
【0179】
(結果)
図18A・Bは、重量で20%、40%又は60%のリスペリドンが充填された85:15 PLGAから成るインプラントから放出されたリスペリドンの累積放出量を示す。各点は3つの複製の平均を示し、全ての放出パターンはトレンドラインによって示されている。図18Aでは、放出は、各インプラント(50mg)から放出されたリスペリドンの累積放出量(mg)として表している。図18Bでは、放出は、各タイプのインプラントに充填されている薬物の量に対しての%として表している。
【0180】
以上、本発明の様々な実施形態を説明したが、これらの実施形態は例示的なものであり、本発明を限定するものではない。従って、本発明の範囲は、特許請求の範囲及びその均等範囲によってのみ規定されるものである。
【特許請求の範囲】
【請求項1】
薬物を持続的に送達するためのキットであって、
生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤と、
生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤とを備えているキット。
【請求項2】
請求項1に記載のキットであって、
前記第1の製剤と前記第2の製剤との組み合わせは、一度投与されると、前記薬物を約1週間〜約14ヶ月間に渡って持続的に送達することを特徴とするキット。
【請求項3】
請求項1に記載のキットであって、
前記生分解性ポリマーは、乳酸・グリコール酸共重合体(PLGA)であることを特徴とするキット。
【請求項4】
請求項3に記載のキットであって、
前記PLGAは、ポリ乳酸(PLA)又はポリグリコール酸(PGA)の、アタクチック又はシンジオタクチック・ブロック共重合体ポリマーであることを特徴とするキット。
【請求項5】
請求項3に記載のキットであって、
前記PLGAの分子量は、約10,000〜200,000であることを特徴とするキット。
【請求項6】
請求項3に記載のキットであって、
前記PLGAを構成するD,L−乳酸モノマーの濃度は、50〜100%の範囲であることを特徴とするキット。
【請求項7】
請求項1に記載のキットであって、
前記生分解性ポリマーは、ポリ乳酸であることを特徴とするキット。
【請求項8】
請求項1に記載のキットであって、
前記薬物は、リスペリドン、9−OH−リスペリドン、ハロペリドール、オランザピン、クロザピン、アリピプラゾール、クエチアピン、ジプラシドン、又はそれらの組み合わせであることを特徴とするキット。
【請求項9】
請求項1に記載のキットであって、
前記薬物の含有量は、2〜75%(w/w)であることを特徴とするキット。
【請求項10】
請求項1に記載のキットであって、
前記第1の製剤は、インプラントの形態であることを特徴とする方法。
【請求項11】
請求項10に記載のキットであって、
前記インプラントは、皮下挿入用であることを特徴とするキット。
【請求項12】
請求項10に記載のキットであって、
前記インプラントの形状は、ディスク状又はロッド状であることを特徴とするキット。
【請求項13】
請求項12に記載のキットであって、
前記ロッド状のインプラントは、直径が約1〜2mm、長さが約10〜40mm、又はその組み合わせであることを特徴とするキット。
【請求項14】
請求項1に記載のキットであって、
治療を必要としている患者における精神病性障害の治療に使用されるキット。
【請求項15】
精神病性障害の治療に使用される組成物であって、
濃度が約95〜98%(w/w)の乳酸・グリコール酸共重合体(PLGA)と、
濃度が約2〜5%(w/w)の抗精神病薬とを含んでおり、
前記PLGAにおける乳酸:グリコール酸の比率が約100:0〜50:50であり、
前記抗精神病薬はリスペリドン又は9−OH−リスペリドンである組成物。
【請求項16】
請求項15に記載の組成物であって、
前記PLGAの濃度は、98%(w/w)であることを特徴とする組成物。
【請求項17】
請求項15に記載の組成物であって、
前記PLGAの濃度は、95%(w/w)であることを特徴とする組成物。
【請求項18】
請求項15に記載の組成物であって、
前記抗精神病薬は、9−OH−リスペリドンであることを特徴とする組成物。
【請求項19】
請求項18に記載の組成物であって、
前記PLGAにおける乳酸モノマー:グリコール酸モノマーのモル比は、85:15であることを特徴とする組成物。
【請求項20】
請求項18に記載の組成物であって、
前記PLGAにおける乳酸モノマー:グリコール酸モノマーのモル比は、75:25であることを特徴とする組成物。
【請求項21】
請求項18に記載の組成物であって、
前記PLGAにおける乳酸モノマー:グリコール酸モノマーのモル比は、65:35であることを特徴とする組成物。
【請求項22】
請求項18に記載の組成物であって、
前記PLGAにおける乳酸モノマー:グリコール酸モノマーのモル比は、50:50であることを特徴とする組成物。
【請求項23】
請求項18に記載の組成物であって、
固形インプラントの形態であることを特徴とする組成物。
【請求項24】
請求項23に記載の組成物であって、
前記インプラントの形状は、ディスク状又はロッド状であることを特徴とする組成物。
【請求項25】
請求項24に記載の組成物であって、
前記ロッド状のインプラントは、直径が約1〜4mm、長さが約10〜40mm、又はその組み合わせであることを特徴とする組成物。
【請求項1】
薬物を持続的に送達するためのキットであって、
生分解性ポリマーと複合した或る薬物の製剤であって、前記薬物を体内で見かけ上ゼロ次速度で送達する第1の製剤と、
生分解性ポリマーと複合した前記薬物の製剤であって、前記薬物を体内で前記第1の製剤よりも大幅に速い速度で送達する第2の製剤とを備えているキット。
【請求項2】
請求項1に記載のキットであって、
前記第1の製剤と前記第2の製剤との組み合わせは、一度投与されると、前記薬物を約1週間〜約14ヶ月間に渡って持続的に送達することを特徴とするキット。
【請求項3】
請求項1に記載のキットであって、
前記生分解性ポリマーは、乳酸・グリコール酸共重合体(PLGA)であることを特徴とするキット。
【請求項4】
請求項3に記載のキットであって、
前記PLGAは、ポリ乳酸(PLA)又はポリグリコール酸(PGA)の、アタクチック又はシンジオタクチック・ブロック共重合体ポリマーであることを特徴とするキット。
【請求項5】
請求項3に記載のキットであって、
前記PLGAの分子量は、約10,000〜200,000であることを特徴とするキット。
【請求項6】
請求項3に記載のキットであって、
前記PLGAを構成するD,L−乳酸モノマーの濃度は、50〜100%の範囲であることを特徴とするキット。
【請求項7】
請求項1に記載のキットであって、
前記生分解性ポリマーは、ポリ乳酸であることを特徴とするキット。
【請求項8】
請求項1に記載のキットであって、
前記薬物は、リスペリドン、9−OH−リスペリドン、ハロペリドール、オランザピン、クロザピン、アリピプラゾール、クエチアピン、ジプラシドン、又はそれらの組み合わせであることを特徴とするキット。
【請求項9】
請求項1に記載のキットであって、
前記薬物の含有量は、2〜75%(w/w)であることを特徴とするキット。
【請求項10】
請求項1に記載のキットであって、
前記第1の製剤は、インプラントの形態であることを特徴とする方法。
【請求項11】
請求項10に記載のキットであって、
前記インプラントは、皮下挿入用であることを特徴とするキット。
【請求項12】
請求項10に記載のキットであって、
前記インプラントの形状は、ディスク状又はロッド状であることを特徴とするキット。
【請求項13】
請求項12に記載のキットであって、
前記ロッド状のインプラントは、直径が約1〜2mm、長さが約10〜40mm、又はその組み合わせであることを特徴とするキット。
【請求項14】
請求項1に記載のキットであって、
治療を必要としている患者における精神病性障害の治療に使用されるキット。
【請求項15】
精神病性障害の治療に使用される組成物であって、
濃度が約95〜98%(w/w)の乳酸・グリコール酸共重合体(PLGA)と、
濃度が約2〜5%(w/w)の抗精神病薬とを含んでおり、
前記PLGAにおける乳酸:グリコール酸の比率が約100:0〜50:50であり、
前記抗精神病薬はリスペリドン又は9−OH−リスペリドンである組成物。
【請求項16】
請求項15に記載の組成物であって、
前記PLGAの濃度は、98%(w/w)であることを特徴とする組成物。
【請求項17】
請求項15に記載の組成物であって、
前記PLGAの濃度は、95%(w/w)であることを特徴とする組成物。
【請求項18】
請求項15に記載の組成物であって、
前記抗精神病薬は、9−OH−リスペリドンであることを特徴とする組成物。
【請求項19】
請求項18に記載の組成物であって、
前記PLGAにおける乳酸モノマー:グリコール酸モノマーのモル比は、85:15であることを特徴とする組成物。
【請求項20】
請求項18に記載の組成物であって、
前記PLGAにおける乳酸モノマー:グリコール酸モノマーのモル比は、75:25であることを特徴とする組成物。
【請求項21】
請求項18に記載の組成物であって、
前記PLGAにおける乳酸モノマー:グリコール酸モノマーのモル比は、65:35であることを特徴とする組成物。
【請求項22】
請求項18に記載の組成物であって、
前記PLGAにおける乳酸モノマー:グリコール酸モノマーのモル比は、50:50であることを特徴とする組成物。
【請求項23】
請求項18に記載の組成物であって、
固形インプラントの形態であることを特徴とする組成物。
【請求項24】
請求項23に記載の組成物であって、
前記インプラントの形状は、ディスク状又はロッド状であることを特徴とする組成物。
【請求項25】
請求項24に記載の組成物であって、
前記ロッド状のインプラントは、直径が約1〜4mm、長さが約10〜40mm、又はその組み合わせであることを特徴とする組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図8C】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14A】


【図14B】


【図14C】


【図14D】


【図14E】


【図14F】


【図14G】


【図15A】


【図15B】


【図15C】


【図16A】


【図16B】


【図16C】


【図17A】


【図17B】


【図17C】


【図18A】


【図18B】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図8C】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14A】


【図14B】


【図14C】


【図14D】


【図14E】


【図14F】


【図14G】


【図15A】


【図15B】


【図15C】


【図16A】


【図16B】


【図16C】


【図17A】


【図17B】


【図17C】


【図18A】


【図18B】


【公開番号】特開2011−173930(P2011−173930A)
【公開日】平成23年9月8日(2011.9.8)
【国際特許分類】
【出願番号】特願2011−128930(P2011−128930)
【出願日】平成23年6月9日(2011.6.9)
【分割の表示】特願2006−549540(P2006−549540)の分割
【原出願日】平成17年1月12日(2005.1.12)
【出願人】(500429103)ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア (102)
【Fターム(参考)】
【公開日】平成23年9月8日(2011.9.8)
【国際特許分類】
【出願日】平成23年6月9日(2011.6.9)
【分割の表示】特願2006−549540(P2006−549540)の分割
【原出願日】平成17年1月12日(2005.1.12)
【出願人】(500429103)ザ・トラスティーズ・オブ・ザ・ユニバーシティ・オブ・ペンシルバニア (102)
【Fターム(参考)】
[ Back to top ]

