開花遅延または成長抑制機能を有するポリペプチド、これを暗号化するポリヌクレオチドおよびこれらの用途
本発明は、開花遅延または成長抑制機能を有するポリペプチド、これを暗号化するポリヌクレオチドおよびこれらの用途を開示する。具体的に、本発明は、開花遅延または成長抑制機能を有するポリペプチド、そのポリペプチドを暗号化するポリヌクレオチド、開花遅延表現型を有する植物体の製造方法、成長抑制表現型を有する植物体の製造方法、形質転換植物体の選別方法、および植物体の開花遅延または成長抑制誘導物質のスクリーニング方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ジベレリン信号を調節することにより開花遅延または成長抑制機能を有するポリペプチド、これを暗号化するポリヌクレオチド、およびこれらの用途に関する。
【背景技術】
【0002】
ジベレリンは、植物体に存在するホルモンの一つであって、イネ馬鹿苗病菌(Gibberella fujikuroi)が分泌する物質から発見された。
【0003】
ジベレリン(GA)は、植物においてオーキシンと共に作用して無傷植物の茎の若い組織に対する生長促進効果を示し、穀類種子のα−アミラーゼという加水分解酵素を活性化させて種子の発芽を容易にし、種子の休眠打破に関与する。また、開花時期を調節するに当たり、低温または光周期を必要とする植物にGAを処理する場合、開花が促進されるとともに花芽が形成される現象が現れる。特異的に、GAは、受精過程がない場合にも、着果および果実の生長に関与してこれを促進すると知られている。したがって、GAの場合、農業や花卉などにおいて、様々な作物が使用されており、多様な効果を示すと知られている。例えば、秋まき大麦、桃、梨、リンゴおよびブドウの低温代替開花促進や、菊科植物の花芽形成促進、夏の菊、シクラメンおよびプリムラの花開花促進、ホウレンソウやタバコの発芽促進、茄子、牛蒡、大根および油菜の休眠打破、ビールおよび麦芽の製造に使われるアミラーゼの促進などがある。これだけでなく、GA生合成阻害剤としてのアンシミドール(ancymidol)(A−Rest)或いはパクロブトラゾール(paclobutrazol)(Bonzi)を処理して背丈/節が小さくて硬い植物を作り、風や台風などによって倒れるのを防止するためにも使われる。
【0004】
最近、このようなGAに対する生理学的現象を分子水準で解明しようとする努力が登場しており、初期には様々な作物において緑の革命を主導していた矮性表現型の変異体(reduced height(rth)、dwarf−1(dl)、anther ear1(An1)−トウモロコシ;semi−dwarf(sd−1)、Dwarf1、dl−qu;ls、le、na−大豆)や、徒長する変異体(la cry-3−大豆;perocera(pro)−トマト;slender(sln)−大麦;SLN−大豆)などを分析し、GAに対する植物の反応性に関する研究の深さを増して、2000年代に入ってはこれらの遺伝子クローニングに成功し(rth(Peng et al., 1999, Nature 400:256-261)、dl(Spray et al., 1996, PNAS 93:10515-10518)、an1(Bensen et al., 4995, Plant Cell 7:75-84)、sd−1(Bensen et al., 4995, Plant Cell 7:75-84)、dwarf1(Ashikari et al., 1999, PNAS 67:11638-11643)、el(Lester ea al., 1997, Plant Cell 9:1435-1443)、na(Davidson et al., 2003, Plant Physiol. 131:335-344)、およびGAの合成、認知、反応などに関与する遺伝子を発掘し始めた。このような研究は、シロイヌナズナをモデルとして、分子遺伝学的方法論によりさらに体系的に行われてきた。
【0005】
特にGAの反応性に対する大量の変異体スクリーニング(GAに対する反応性が少ない矮性体、GAを処理すれば野生型に戻る変異体、常にGA反応を示す徒長型変異体)を介して、大きくGAの合成に関連した遺伝子(GA1、GA4、GA5など)、GAの信号伝達に関連した遺伝子(heterotrimeric G protein、GA1、RGA、SPY、SLYなど)、GAの反応に関連した遺伝子(GA−MYB、α−アミラーゼ)を発掘した。また、最近、GAホルモン受容体がイネから発見されることにより(GID1:Uefuchi-Tanaka et al., 2005, Nature 437:693-698)、GAの分子的メカニズムを理解するのに大きく役立ち、現在は発見されたこれら遺伝子の相互関連性を解明することにより、GA信号経路を総体的かつ体系的な方法によって分子的に理解しようとする努力が続けられている(Schwechheimer et al., 2008 Curr. Opin. Plant Biol., 10:461-465)。
【0006】
これと共に、GAは開花調節においても主要なホルモンとして作用すると知られている。シロイヌナズナの場合、開花時期は光や温度、光周期などの外部信号と栄養状態やホルモンなどの内部信号との相互連関作用によって調節されると知られており、細部的に開花調節経路は大きく光周期経路、内在的経路、春化経路、ジベレリン(GA)経路が知られている(Mouradov et al., 2002, Plant Cell, 14: S111-130)。特に、GAが欠乏している変異体galの場合、短日条件で花が咲かないと知られている(Wilson et al., 1992, Plant Physiol. 100:403-408)。よって、GAは短日条件で開花を調節するのに重要な役目を果たすものと思われている。このようなGAに関する開花時期は、FPF1(flowering promoting factor 1)(Kania et al., 1997, Plant Cell 9:1327-1337)、GA−MYB(Gocal, et al., 2001, Plant Physiol., 127:1682-1693)などを媒介として、SOC1(Moon et al., 2003, Plant J., 35:613-623)およびLFY遺伝子(Blazquez, et al., 1998, Plant Cell 10:791-800)によって開花が起こるものと知られている。
【0007】
一方、耕作植物において、成体の大きさまたは開花時期を調節することは重要な意味を持つ。成長調節の場合、1960年代にアジアで緑の革命が成し遂げられるほどの収穫量の増大をもたらし、現在もヨーロッパ等で風害や低温などの防止のために成長調節剤を処理することからみて、成長調節は耕作植物の収穫量と密接した連関があるといえる。また、開花時期の調節に関連しても、開花時期を調節することにより季節の変化を問わずに収穫時期を決定し且つ周辺環境に影響されない品種の開発が可能である。このような理由により、植物生物工学分野の従事者は遺伝子操作の方法で開花時期を調節するために努力している。
【0008】
本発明はこのような背景の下で行われたのである。
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の目的は、開花遅延および/または成長抑制機能を有するポリペプチドを提供することにある。
【0010】
本発明の他の目的は、前記ポリペプチドを暗号化するポリヌクレオチドを提供することにある。
【0011】
本発明の別の目的は、開花遅延表現型を有する植物体の製造方法を提供することにある。
【0012】
本発明の別の目的は、成長抑制表現型を有する植物体の製造方法を提供することにある。
【0013】
本発明の別の目的は、開花遅延表現型または成長抑制表現型を有する植物体を提供することにある。
【0014】
本発明の別の目的は、前記ポリヌクレオチドを用いた形質転換植物体の選別方法を提供することにある。
【0015】
本発明の別の目的は、植物体の開花遅延または成長抑制誘導物質のスクリーニング方法を提供することにある。
【課題を解決するための手段】
【0016】
本発明は、一側面において、開花遅延および/または成長抑制(矮化誘導)機能を有するポリペプチドに関するものである。
【0017】
本発明者らは、下記実施例から確認されるように、特定の遺伝子を平素の発現量より過剰発現させる活性タギング方法(Activation Tagging Method; Weigel et al., 2000, Plant Physiology, 122:1003-1013;その内容は下記実施例を含む本明細書に含まれるものと看做される)を用いて、開花遅延および/成長抑制表現型を示すイロイヌナズナ形質転換体を製作・選抜し、TAIL−PCR(Thermal Asymmetric Interlaced Polymerase Chain Reaction; Liu et al., 1995, Plant J. 8: 457-463;その内容は下記実施例を含む本明細書に含まれるものと看做される)方法を用いて、前記シロイヌナズナ形質転換体で開花遅延および/または成長抑制表現型に関与する遺伝子をクローニングして、配列番号1に示されるその遺伝子の塩基配列、および配列番号2に示されるその遺伝子が暗号化するポリペプチドのアミノ酸配列を確認したうえ、前記形質転換体で見られる開花遅延および/または成長抑制表現型が前記遺伝子の過剰発現による効果であるかをRNAゲルブロットで確認し、最後には前記遺伝子を過剰発現させる組み換えベクターをシロイヌナズナに導入したとき、その形質転換体が前記活性タギング方法で形質転換されたシロイヌナズナ形質転換体の表現型と同様に、開花遅延および/または成長抑制表現型を示すことを確認することができた。
【0018】
具体的に、本発明の植物体の開花遅延および/または成長抑制機能を有するポリペプチドは、下記ポリペプチドのいずれか一つである:
(a)配列番号2に示されるアミノ酸配列全体を含むポリペプチド、
(b)配列番号2に示されるアミノ酸配列の実質的な部分を含むリペプチド、および
(c)前記(a)または(b)のポリペプチドと実質的に類似のポリペプチド。
【0019】
前記において、そして請求の範囲を含む以下において、前記「開花遅延および/または成長抑制機能」とは、後述するような本発明の遺伝子(具体的には配列番号1の塩基配列を持つ遺伝子)が過剰発現されたときに開花遅延および/または成長抑制表現型を示すようにするのに関与する機能を意味するものと定義される。
【0020】
また、前記において、そして請求の範囲を含む以下において、前記「配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド」は、配列番号2に示されるアミノ酸配列からなるポリペプチドと比較したとき、依然として開花遅延および/または成長抑制機能を保有すると看做すのに十分な程度の配列番号2のアミノ酸配列の一部分を含むポリペプチドと定義される。依然として開花遅延および/または成長抑制機能を保有すれば十分なので、前記ポリペプチドの長さ、およびそのようなポリペプチドが持つ活性(すなわち、開花遅延および/または成長抑制機能)の程度は特に問題とならない。すなわち、配列番号2に示されるアミノ酸配列を含むポリペプチドに比べて活性が低くても、依然として開花遅延および/または成長抑制機能を保有するポリペプチドであれば、その長さがどうであれ前記「配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド」に含まれるのである。通常の当業者であれば、すなわち本出願時を基準として公知の関連先行技術を平均的に熟知している者であれば、配列番号2に示されるアミノ酸配列を含むポリペプチドにおける一部分が欠失しても、そのようなポリペプチドは依然として開花遅延および成長抑制機能を有するだろうと期待する。そのようなポリペプチドとして、配列番号2に示されるアミノ酸配列を含むポリペプチドにおけるN末端部分またはC末端部分が欠失したポリペプチドを挙げることができる。これは、一般に、N末端部分またはC末端部分が欠失しても、そのようなポリペプチドは本来のポリペプチドが持つ機能を有すると当業界に公知になっているためである。場合によっては、N末端部分またはC末端部分が開花遅延および/または成長抑制機能に必須的であって、N末端部分またはC末端部分の欠失したポリペプチドが前記機能を示さない場合もあるが、それにも拘らずそのような不活性のポリペプチドを活性のポリペプチドと区分して検出することは、当業者の通常の能力範囲内に属する。また、N末端部分またはC末端部分だけでなく、それ以外の他の部分が欠失しても、本来のポリペプチドが持つ機能を依然として持つことができる。ここでも、当業者であれば、その通常の能力の範囲内で、このような欠失したポリペプチドが依然として本来のポリペプチドが持つ機能を保有するかを十分に確認することができるであろう。特に、本明細書が配列番号1の塩基配列および配列番号2のアミノ酸配列を開示しているだけでなく、配列番号1の塩基配列からなる遺伝子がシロイヌナズナで過剰発現されたときにそのシロイヌナズナが開花遅延および/または成長抑制表現型を示すかを分明に確認した実施例を開示しているということからみて、配列番号2のアミノ酸配列における一部の配列が欠失したポリペプチドが、配列番号2のアミノ酸配列を含むポリペプチドが持つ機能を依然として保有するかを、当業者はその通常の能力範囲内で十分に確認することができるということが自明になる。よって、本発明において、前記「配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド」は、前記定義のとおり、本明細書の開示内容に基づいて当業者がその通常の能力範囲内で製造することができる、開花遅延または成長抑制機能を有する欠失形態の全てのポリペプチドを含む意味として理解されるべきである。
【0021】
また、前記において、そして請求の範囲を含む以下において、「前記(a)および(b)のポリペプチドと実質的に類似のポリペプチド」とは、一つ以上の置換されたアミノ酸を含むが、配列番号2のアミノ酸配列を含むポリペプチドが持つ機能、すなわち開花遅延および/または成長抑制機能を依然として保有するポリペプチドをいう。ここでも、一つ以上の置換されたアミノ酸を含むポリペプチドが開花遅延および/または成長抑制機能を依然として保有しさえすれば、そのようなポリペプチドが持つ活性の程度またはアミノ酸が置換された比率は問題とならない。換言すれば、一つ以上の置換されたアミノ酸を含むポリペプチドが、配列番号2のアミノ酸配列を含むポリペプチドに比べてどんなに低い活性を持っても、また多数の置換されたアミノ酸を含んでいるとしても、そのようなポリペプチドが開花遅延および/または成長抑制機能を保有しさえすれば本発明に含まれるのである。一つ以上のアミノ酸が置換されても、置換される前のアミノ酸が置換されたアミノ酸と化学的に等価であれば、そのような置換されたアミノ酸を含むポリペプチドは依然として本来のポリペプチドの機能を保有する。例えば、疎水性のアミノ酸であるアラニンが他の疎水性のアミノ酸、例えばグリシン、またはよりさらに疎水性のアミノ酸、例えばバリン、ロイシンまたはイソロイシンに置換されても、そのような置換されたアミノ酸を持つポリペプチドは、活性は低くても本来のポリペプチドが持つ機能を依然として保有するのである。同様に、負に荷電したアミノ酸、例えばグルタミン酸が他の負に荷電したアミノ酸、例えばアスパラギン酸に置換されても、そのような置換されたアミノ酸を持つポリペプチドも活性は低くても本来のポリペプチドが持つ機能を依然として保有するし、正に荷電したアミノ酸、例えばアルギニンが他の正に荷電したアミノ酸、例えばリシンに置換されても、そのような置換されたアミノ酸を持つポリペプチドも活性は低くても本来のポリペプチドが持つ機能を依然として保有する。さらに、ポリペプチドのN末端またはC末端部分で置換されたアミノ酸を含むポリペプチドも本来のポリペプチドが持つ機能を依然として保有するのである。当業者であれば、その前述したような一つ以上の置換されたアミノ酸を含みながらも、配列番号2のアミノ酸配列を含むポリペプチドが持つ開花遅延および/または成長抑制機能を依然として保有するポリペプチドを製造することができる。また、当業者であれば、一つ以上の置換されたアミノ酸を含むポリペプチドが依然として前記機能を持つかを確認することができる。しかも、本明細書が配列番号1の塩基配列および配列番号2のアミノ酸配列を開示しているとともに、シロイヌナズナで配列番号1の塩基配列からなる遺伝子が過剰発現されたときにそのシロイヌナズナが開花遅延および/または成長抑制表現型を示すかを分明に確認した実施例を開示しているため、本発明の「前記(a)および(b)のポリペプチドと実質的に類似のポリペプチド」は、当業者が容易に実施し得るものであることが明らかである。よって、前記(a)または(b)のポリペプチドと実質的に類似のポリペプチド」は、一つ以上の置換されたアミノ酸を含みながらも、依然として開花遅延または成長阻害機能を有する全てのポリペプチドを含む意味として理解されるべきである。
【0022】
このように「前記(a)または(b)のポリペプチドと実質的に類似のポリペプチド」は、一つ以上の置換されたアミノ酸を含みながらも、依然として開花遅延または成長抑制機能を有する全てのポリペプチドを含む意味であるが、それにもかかわらず、活性の程度という観点からみたとき、前記ポリペプチドは配列番号2のアミノ酸配列と配列相同性が高いほど好ましい。前記ポリペプチドは、配列相同性の下限において60%以上の配列相同性を持つことが好ましいが、配列相同性の上限においては当然100%の配列相同性を持つことが好ましい。
よりさらに具体的に、前記配列相同性は60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%および99.9%の順に高くなるほど好ましい。ここで、99.9%の配列相同性は配列番号2のアミノ酸配列からなるポリペプチドにおける一つのアミノ酸が置換された場合である。
【0023】
本発明の「前記(a)および(b)のポリペプチドと実質的に類似のポリペプチド」は、「配列番号2のアミノ酸配列全体を含むポリペプチドと実質的に類似のポリペプチド」だけでなく、「配列番号2のアミノ酸配列の実質的な部分を含むポリペプチドと実質的に類似のポリペプチド」を含むので、前述したような全ての説明は、「配列番号2のアミノ酸配列全体を含むポリペプチドと実質的に類似のポリペプチド」だけでなく、「配列番号2のアミノ酸配列の実質的な部分を含むポリペプチドと実質的に類似のポリペプチド」に対しても適用されるものと看做される。
【0024】
本発明は、他の側面において、前述したようなポリペプチドを暗号化する単離ポリヌクレオチドに関するものである。ここで、「前述したようなポリペプチド」とは、開花遅延および/または成長抑制機能を有しながら、配列番号2に示されるアミノ酸配列全体を含むポリペプチド、配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド、および前記ポリペプチドと実質的に類似のポリペプチドを含むうえ、前述した好適な様態の全てのポリペプチドを含む意味である。よって、本発明のポリヌクレオチドは、開花遅延および/または成長阻害機能を有しながら、配列番号2に示されるアミノ酸配列全体またはその実質的な部分を含むポリペプチドを暗号化する単離ポリヌクレオチドおよびこのようなポリペプチドと実質的に類似のポリペプチドを暗号化する単離ポリヌクレオチドを含み、ひいては、好適な様態として、開花遅延および/または成長抑制機能を有しながら、前述したような配列相同性の順にその配列相同性を持つ全てのポリペプチドを暗号化するポリヌクレオチドを含む。アミノ酸配列が解明されたとき、そのようなアミノ酸配列に基づいてそのようなアミノ酸配列を暗号化するポリヌクレオチドを、当業者であれば容易に製造することができる。
【0025】
それにも拘らず、依然として、活性の側面からみて、本発明のポリヌクレオチドは配列番号1の塩基配列の一部分を含むことが好ましく、配列番号1の塩基配列全体を含むことが好ましい。ここで、「配列番号1の塩基配列の一部分」とは、配列番号2のアミノ酸配列からなるポリペプチドの機能、すなわち開花遅延および/または成長阻害機能を依然として保有すると看做すのに十分な長さのポリペプチドをコードするポリヌクレオチドをいう。ここでも、配列番号2のアミノ酸配列からなるポリペプチドの機能を保有しさえすれば、その活性が本来のポリペプチド、すなわち配列番号2のアミノ酸配列からなるポリペプチドが持つ活性に比べて低くても問題にならない。
【0026】
一方、前記「単離ポリヌクレオチド」は、請求の範囲を含む以下において、化学的に合成されたポリヌクレオチド、生物体、特にシロイヌナズナ(Arabidopsis thaliana)から分離されたポリヌクレオチドおよび変形されたヌクレオチドを含有したポリヌクレオチドを全て含み、単一鎖または二重鎖のRNAまたはDNAの重合体を全て含むものと定義される。よって、前記「単離ポリヌクレオチド」とは、cDNAを含んでヌクレオチドを化学的に重合させたポリヌクレオチドだけでなく、生物体、特にシロイヌナズナから分離されるゲノムDNAを含む。ここで、本明細書が開示している配列番号2のアミノ酸配列、これをコードする配列番号1の塩基配列、および当業界における公知の技術などに基づく限り、cDNAを含んで前記化学的に合成されるポリヌクレオチドの製造および前記gDNAの分離などは、当業者の通常の能力範囲内に属するであろう。
【0027】
本発明の別の側面において、配列番号1の塩基配列の一部分を含むポリヌクレオチドまたは前記一部分と実質的に類似のポリヌクレオチドに関するものである。ここで、前記「配列番号1の塩基配列の一部分を含むポリヌクレオチド」とは、シロイヌナズナを含む植物において、開花遅延および/または成長抑制機能を有する遺伝子を同定および/または単離するのに十分な長さの配列を含むポリヌクレオチドをいい、また、前記「配列番号1の塩基配列の一部分と実質的に類似のポリヌクレオチド」とは、配列番号1の塩基配列の一部分と比較して一つ以上の置換されたヌクレオチドを含みながらも、シロイヌナズナを含む植物において、開花遅延および/または成長抑制機能を有する遺伝子を同定および/または単離するのに十分な程度の配列依存的結合力を持つポリヌクレオチドをいう。当業者は、シロイヌナズナまたは他の植物において、本明細書が開示している配列番号1の塩基配列に基づいてこれを用いる限り、その通常の能力範囲内でシロイヌナズナまたは他の植物から開花遅延および/または成長抑制機能の遺伝子を同定および/または単離することができる。よって、本発明の前記ポリヌクレオチドは、ポリヌクレオチドの長さに関係なく、またそのポリヌクレオチドの配列番号1の塩基配列との配列相同性の程度に関係なく、シロイヌナズナまたは他の植物から開花遅延および/または成長阻害機能の遺伝子を同定および/または単離するのに十分な配列長さおよび/または配列依存的結合力を持つ全てのポリヌクレオチドを含む。
【0028】
一般に、機能が公知になった遺伝子の塩基配列を未知の遺伝子の塩基配列と比較して、その未知の遺伝子が対比された公知の遺伝子と同一の機能を有するものと推定するために、そして未知の遺伝子を単離するためのプローブとして使用されるためには、30個以上の連続するヌクレオチド配列が必要であると知られている。よって、本発明の前記ポリヌクレオチドは、配列番号1に示される塩基配列において30個以上のヌクレオチドを含むことが好ましい。それにも拘らず、依然として本発明のポリヌクレオチドは30個以下のヌクレオチドからなるポリ(またはオリゴ)ヌクレオチドを含む。それは配列番号1に示される塩基配列と100%の配列相同性を持つか、同定および/または単離条件(バッファのpHや濃度など)が厳しければ、シロイヌナズナまたは他の植物から開花遅延および/または成長抑制機能の遺伝子を同定および/または単離するのに十分でありうるためである。ここで、シロイヌナズナまたは他の植物から開花遅延または成長抑制機能の遺伝子を同定および/または単離するのに十分な30個以下のヌクレオチドからなるポリヌクレオチドを製作、検出すること、そのようなポリヌクレオチドを用いてシロイヌナズナまたは他の植物から開花遅延または成長阻害機能の遺伝子を同定および/または単離することは、通常の当業者の能力範囲内に属する。
【0029】
一方、前記において、そして請求の範囲を含む以下において、「植物体」とは、開花によって繁殖する植物体、またはその大きさが小さくなることによりヒトに有用な結果を与えることが可能な全ての植物体を意味する。ここで、大きさが小さくなることによりヒトに有用な結果を与えることが可能な植物体の直接的な例として、農作物の生長を阻害する各種雑草植物や観賞目的の盆栽植物などがここに含まれる。また、ヒトが食用にしているか或いは食用することが可能な植物なども、食用の簡便性、運搬の便利性などの理由により、前記植物体の範囲に含まれる。具体的に、前記植物体には耕作地などの雑草植物類、稲、小麦、大麦、トウモロコシ、大豆、ジャガイモ、小麦、小豆、オート麦、モロコシキビを含む食糧作物類、シロイヌナズナ、白菜、大根、唐辛子、イチゴ、トマト、スイカ、キュウリ、キャベツ、マクワウリ、南瓜、ネギ、玉ねぎ、ニンジンを含む蔬菜作物類、高麗人参、タバコ、棉、胡麻、砂糖黍、砂糖大根、荏胡麻、落花生、油菜を含む特用作物類、リンゴの木、梨の木、棗の木、桃の木、キーウィー、ブドウ、柑橘、柿、スモモ、満州杏、バナナを含む果樹類、バラ、グラジオラス、ガーベラ、カネーション、菊、ユリ、チューリップを含む花卉類、ライグラス、レッドクローバー、オーチャードグラス、アルファルファ、トールフェスク、ペレニアルライグラスなどを含む飼料作物類などを挙げることができる。
また、前記「植物体」とは、成熟した植物だけでなく、成熟した植物に発育することが可能な植物細胞、植物組織、植物の種子などを全て含む意味として理解される。
【0030】
本発明は、別の側面において、開花遅延および/または/または成長抑制表現型を有する植物体の製造方法に関するものである。
【0031】
前記において、「開花遅延」とは、温度や、昼と夜の長さなど栽培条件が同一の場合における、野生型植物体の開花時期より遅いことを意味する。
【0032】
また、前記において、「成長抑制」とは、植物の生体量がその野生型植物の生体量に比べて少ないことを意味し、好ましくは植物の茎の生体量および/または植物の葉の生体量が野生型の植物のそれに比べて少ないことを意味する。ここで、生体量とは、葉や茎など植物の器官の重さ、長さおよび/または大きさを意味するものと理解できる。
【0033】
本発明の開花遅延および/または/または成長抑制表現型を有する植物体の製作方法は、(I)植物体において配列番号1の塩基配列からなる遺伝子、または配列番号1の塩基配列と類似の配列からなる遺伝子を過剰発現させる段階と、(II)開花遅延および/または/または成長抑制表現型が誘発された植物体を選別する段階とを含んでなる。
前記において、そして請求の範囲を含む以下において、前記「過剰発現」とは、温度や、昼と夜の長さなど栽培条件が同一の場合における、野生型植物体で発現する水準以上の発現を意味する。
【0034】
本明細書において、「配列番号1の塩基配列と類似の配列からなる遺伝子」とは、配列番号1の塩基配列からなる遺伝子の同族体(homologue)であって、植物の開花遅延および/または成長抑制表現型を誘発する機能を有しながら、植物の種類による進化的経路の相違により配列番号1の塩基配列とは異なる塩基配列からなる全ての遺伝子を含む意味である。ここで、配列番号1の塩基配列と類似の配列からなる遺伝子は、配列番号1の塩基配列と配列相同性が高いほど好ましく、最も好ましくは当然100%の配列相同性を持つときである。一方、配列相同性の下限においては前記遺伝子が配列番号1の塩基配列と60%以上の配列相同性を持つ場合が好ましい。よりさらに具体的には、前記配列相同性が60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%および99%の順に高くなるほど好ましい。
【0035】
前記配列番号1の塩基配列と類似の配列からなる遺伝子の別の好ましい例としては、コドン縮退性(codon degeneracy)によって配列番号1の塩基配列からなる遺伝子の機能的等価物を挙げることができる。この機能的等価物は、換言すると、配列番号2のアミノ酸配列からなるポリペプチドを暗号化するポリヌクレオチドである。
【0036】
前記段階(I)の過剰発現させる段階は、前述したような本発明のポリペプチドを暗号化する前記ポリヌクレオチドを植物体に形質転換させる段階を含んでなる。
【0037】
本明細書において、前記「形質転換」とは、外来性ポリヌクレオチド(本発明では、前記開花遅延および/または成長抑制機能を有するポリペプチドを暗号化するポリヌクレオチドを意味する;以下同じ)の導入による宿主植物の遺伝子型の変形を意味し、その形質転換に使用された方法と関係なく外来性ポリヌクレオチドが宿主植物、さらに正確には宿主植物の細胞内に導入されたことを意味する。宿主植物内に導入された外来性ポリヌクレオチドは、宿主植物のゲノム内に統合されて維持されるか或いは統合されずに維持されるが、本発明は両者ともを含む。
【0038】
一方、外来性ポリヌクレオチドで植物を形質転換させる方法は、当業界における一般な公知の方法(Methods of Enzymology, Vol. 153, 1987, Wu and Grossman編集, Academic Press)を使用することができる。
【0039】
外来性ポリヌクレオチドをプラスミドやウイルスなどのベクターなどの運搬体に挿入して植物を形質転換させることができ、アグロバクテリウムバクテリアを媒介体として使用することができ(Chilton et al., 1997, Cell 1:263:271)、直接外来性ポリヌクレオチドを植物細胞内に導入させて植物を形質転換させることができる(Lorz et al., 1985, Mol. Genet. 199:178-182)。
【0040】
一般に植物の形質転換に多く用いられる方法は、外来性ポリヌクレオチドで形質転換されたアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)によって幼植物体、植物細胞、種子、成熟植物などを感染させる方法である。ここで、形質転換された幼植物体、植物細胞、種子などは、当業者が公知の適切な条件の下で培養または栽培して、成熟した植物に成長および発育させることができる。
【0041】
一方、前記形質転換させる段階は、(a)前記本発明のポリペプチドを暗号化するポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに作動可能に挿入させて組み換え発現ベクターを製作する段階と、(b)前記組み換えベクターを植物体に導入する段階とを含んでなることが好ましい。
【0042】
さらに好ましくは、前記形質転換させる段階は、本発明のポリペプチドを暗号化するポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに作動可能に挿入させて組み換え発現ベクターを製作する段階と、この組み換え発現ベクターをアグロバクテリウムバクテリアに形質転換させる段階と、この形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階とを含んでなる場合である。特に、前記形質転換されたアグロバクテリウムバクテリアは形質転換されたアグロバクテリウム・ツメファシエンスであることが好ましい。
【0043】
前記「調節ヌクレオチド配列」とは、その存在がそれに連結された遺伝子の発現に影響を及ぼすことが可能な全ての配列を含む意味として理解される。このような調節ヌクレオチド配列はリーダー配列、エンハンサー配列、プロモーター配列、転写開始配列、転写終結配列、複製開始点、リボソーム結合部位などを含む。
【0044】
前記「作動可能に挿入する」とは、ある遺伝子の転写および/または翻訳が影響を受けるように挿入することを意味する。例えば、あるプロモーターがそれと共に挿入された遺伝子の転写に影響を与えるならば、その遺伝子は作動可能に挿入されたのである。
【0045】
プロモーター配列は、誘導性プロモーター(inducible promoter sequence)と構造性プロモーター(constitutive promoter sequence)の両方とも使用可能である。構造性プロモーターとしては、例えばCaMVプロモーター、CsVMVプロモーター、Nosプロモーターなどを挙げることができ、誘導性プロモーター(誘導因子の存在により、それに連結された遺伝子の発現が活発になることを可能とするプロモーター)としては、例えば、銅イオンによって活性化される酵母メタロチオネインプロモーター(Mett et al., Proc. Natl. Acad. Sci., U.S.A., 90:4567, 1993)、置換ベンゼンスルホンイミドによって活性化されるIn2−1およびIn2−2プロモーター(Hershey et al., Plant Mol. Biol., 17:679, 1991)、グルココルチコイドによって調節されるGRE調節配列(Schena et al., Proc. Natl. Acad. Sci., U.S.A., 88:10421, 1991)、エタノール調節性プロモーター(Caddick et al., Nature Biotech., 16:177, 1998)、リブロースビスリン酸カルボキシラーゼ(ssRUBISCO)の小サブユニットに由来した光調節性プロモーター(Coruzzi et al., EMBO J., 3:1671, 1984; Broglie et al., Science, 224:838, 1984)、マンノピンシンターゼプロモーター(Velta et al., EMBO J., 3:2723, 1984)、ノパリンシンターゼ(NOS)およびオクトピンシンターゼ(OCS)プロモーター、熱衝撃プロモーター(Gurley et al., Mol. Cell. Biol., 6:559, 1986; Severin et al., Plant Mol. Biol., 15:827, 1990)などを挙げることができる。
【0046】
一方、前記組み換えベクターは選別マーカー遺伝子を含むことができる。ここで、「マーカー遺伝子」とは、そのようなマーカー遺伝子を含む形質転換体の選別を可能にする形質を暗号化する遺伝子を意味する。マーカー遺伝子は抗生物質耐性遺伝子であってもよく、除草剤耐性遺伝子であってもよい。適した選別マーカー遺伝子の例としては、アデノシンデアミナーゼの遺伝子、ジヒドロ葉酸リダクターゼの遺伝子、ハイグロマイシン−B−ホスホトランスフェラーゼの遺伝子、チミジンキナーゼの遺伝子、キサンチン−グアニンホスホリボシルトランスフェラーゼの遺伝子、ホスフィノトリシンアセチルトランスフェラーゼ遺伝子などを挙げることができる。
【0047】
一方、本発明の実施例では、配列番号1に示される塩基配列からなる遺伝子を発現ベクターpCambia1302ベクターに挿入させて組み換えベクター pCambia1302−SIL1を製作した後、前記組み換えベクターをアグロバクテリウム・ツメファシエンスに形質転換させ、その形質転換されたアグロバクテリウム・ツメファシエンスをシロイヌナズナに形質転換させた。
【0048】
このような本発明の実施様態を考慮するとき、前記形質転換させる段階は、配列番号1に示される塩基配列からなる遺伝子を植物に形質転換させる段階を含むことが好ましく、さらに好ましくは前記遺伝子を含む組み換えベクター、特に pCambia1302−SIL1を植物に形質転換させる段階を含むときである。最も好ましくは前記組み換えベクター、特にpCambia1302−SIL1で形質転換されたアグロバクテリウム・ツメファシエンスを植物に形質転換させる段階を含むときである。
【0049】
一方、前記(II)選別段階は、(I)段階を行った後、開花遅延および/または成長抑制表現型を示す植物体を肉眼で選別するか、或いは形質転換の際に選別マーカー遺伝子が共に形質転換される場合には選別マーカー遺伝子を用いて選別することができる。
【0050】
本発明の別の側面において、前述したような開花遅延および/または/または成長抑制表現型を有する植物体の製造方法によって得られた植物体に関するものである。本発明の植物体は、配列番号1の塩基配列からなる遺伝子または配列番号1の塩基配列と類似の配列からなる遺伝子が過剰発現されることにより、開花遅延および/または成長抑制表現型を有する植物体として理解できる。
【0051】
別の側面において、本発明は、前述したような本発明のポリヌクレオチドをマーカー遺伝子として用いて、形質転換された植物体を選別する方法に関するものである。
【0052】
本発明の形質転換された植物体の選別方法は、(I)目的遺伝子、植物体開花遅延および/または成長抑制機能を有するポリペプチドを暗号化する前記ポリヌクレオチドおよび調節ヌクレオチド配列を含む発現ベクターを植物体に形質転換させる段階と、(II)開花遅延および/または成長抑制表現型が誘発された植物体を選別する段階とを含んでなる。
【0053】
本明細書において、「目的遺伝子」とは、発現させようとする遺伝子であって、目的する生成物(すなわち、RNAまたはポリペプチド)を暗号化する一定長さのポリヌクレオチド配列として定義できるが、このようなポリヌクレオチド配列は、切断された形態、融合された形態またはタグされた形態であってもよく、cDNAまたはgDNAであってもよく、天然形態の生成物を暗号化する配列または所望の突然変異形態の生成物を暗号化する配列であってもよい。
【0054】
前記(I)発現ベクターを植物体に形質転換させる段階は、その発現ベクターをアグロバクテリウムバクテリアに形質転換させる段階、およびこの形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階を含んで構成できる。ここで、アグロバクテリウムバクテリアはアグロバクテリウム・ツメファシエンスであることが好ましい。
【0055】
その他、本発明の形質転換された植物体の選別方法については、本発明の開花遅延表現型を有する植物体の製造方法に関連して説明したところがそのまま有効である。
【0056】
別の側面において、本発明は、植物体の開花遅延誘導物質のスクリーニング方法に関するものである。
【0057】
別の側面において、本発明は、植物体の成長抑制誘導物質のスクリーニング方法に関するものである。
【0058】
前記方法は、(I)植物体において任意の化学物質または生物学的物質を処理する段階と、(II)配列番号1の塩基配列からなる遺伝子または配列番号1の塩基配列と類似の配列からなる遺伝子を過剰発現させる物質を検出する段階とを含んでなる。
【0059】
前記「配列番号1の塩基配列と類似の配列からなる遺伝子」は、前述したとおりである。
【0060】
前記(I)植物体に任意の化学物質または生物学的物質を処理する段階において、化学物質の処理は植物体に化学物質が接触するように処理すればよく、生物学的物質の処理は前記本発明の開花遅延植物体の製造方法に関連して説明したように遺伝工学的方法で処理すればよい。
【0061】
一方、前記検出された物質、特に生物学的物質としては、配列番号1の塩基配列のセンスヌクレオチド、前記センスヌクレオチドを含む組み換えベクター、その組み換えベクターで形質転換されたアグロバクテリウム・ツメファシエンスなどを挙げることができる。
【発明の効果】
【0062】
前述したように、本発明によれば、開花遅延および/または成長抑制表現型を有するポリペプチド、そのポリペプチドを暗号化するポリヌクレオチド、開花遅延表現型を有する植物体の製造方法、成長抑制表現型を有する植物体の製造方法、形質転換植物体の選別方法、および開花遅延または成長抑制誘導物質のスクリーニング方法を提供することができる。
【図面の簡単な説明】
【0063】
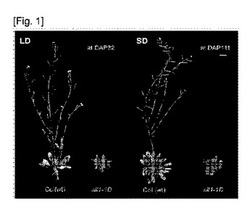
【図1】図1はシロイヌナズナコロンビア野生型(Col−0(wt))と開花遅延表現型を示すシロイヌナズナ変異体(sil1−1D)の長日(LD)/短日(SD)条件下での花軸が上がってくる時点を比較して示す写真である。DAPはdyas after plantingであって、種子を播いてから経過した日を意味する。長日/短日条件でのsil1−1D変異体は開花が顕著に遅延していることが分かる。
【図2】図2は図1の結果をグラフとして示す。Number of rosette leavesは花咲く時点での左葉の個数を示し、Bolting timeは種子を播いてから花咲くときまでかかる日を示し、Long dayは長日を意味し、short dayは短日を意味する。
【図3】図3は生長の後、野生型とsil1−1D変異体の植物成体の大きさを比較した写真である。sil1−1D変異体は成体になった後に野生型成体の大きさの半分程度に相当する成長を示す。
【図4】図4は開花遅延および/または成長抑制表現型を示すシロイヌナズナ形質転換体のゲノム内に挿入されたアクティベーションタギングベクターpSKI015の模式図である。pSKI015はシロイヌナズナゲノムにおけるAt5g10950上位発現調節因子の近くに挿入されている。4×35SEnhは4つの連続した35Sエンハンサーであり、BarRはバスター除草剤抵抗性遺伝子であり、AmpRはアンピシリン抵抗性遺伝子であり、Col E1 OriはE.coli複製起点(replication origin)である。
【図5】図5はシロイヌナズナのAt5g10950の遺伝子構造を表現した。この遺伝子は7つのアクソンと6つのイントロンからなっており、1185個のヌクレオチドからなっている。
【図6】図6はシロイヌナズナのAt5g10950のコーディングタンパク質のアミノ酸配列を表現した。このタンパク質は395個のアミノ酸から構成されており、ボックスで表記された部分はコンピュータを介してのタンパク質配列分析によって核局在化シグナル(Nuclear localization signal)として推定される部位を表現した。
【図7】図7は野生型とsil1−1D変異体においてT−DNAが入った位置の周辺遺伝子At5g10950の遺伝子の発現をRNAゲルブロット分析で検出した結果である。28S rRNAは使用したRNAの量を比較して示し、At5g10950はsil1−1D変異体において著しく増加した。
【図8】図8はpCambia 1302−SIL1組み換えベクターで形質転換されたシロイヌナズナにおいてSIL1のタンパク質の発現位置を気孔細胞から観察した結果である。一番目の絵は光学顕微鏡上で気孔細胞をみたものであり、2番目の絵の緑色蛍光はSIL1とGFPの結合タンパク質から誘導されるものであり、三番目の絵の青色蛍光はDAPI染色によって核を観察したものである。最後の図は3つの絵を全て重ね合わせておいたもので、緑色蛍光と青色蛍光とが重なり合うことが見られる。
【図9】図9は多様な濃度のジベレリン(GA)処理を施したとき、野生型とsil1−1D変異体の下胚軸(hypocotyl)成長反応をグラフとして表現した。GA濃度に応じて野生型の下胚軸の成長が長くなるが、sil1−1DではGAに対する成長反応が野生型に比べて減っていることが見られる。
【図10】図10はGA生合成阻害剤としてのパクロブトラゾール(Paclobutrazol、PAC)を多様な濃度で処理したとき、野生型とsil1−1D変異体の発芽(Germination)効率をグラフとして表現した。PAC濃度に応じて野生型の発芽効率が減ることが見られるが、sil1−1DではPACによる発芽阻害効果がさらに高いことが見られる。
【発明を実施するための形態】
【0064】
以下、本発明について実施例を参照して説明する。ところが、これらの実施例は本発明の範囲を限定するものではない。
【0065】
<実施例1>開花遅延および/または成長抑制表現型を有するシロイヌナズナ形質転換体の製作および選抜
【0066】
開花遅延および/または成長抑制表現型を有するシロイヌナズナ形質転換体の製作および選抜は、Weigelなど(Weigel et al., 2000, Plant Phtsiology, 122:1003-1013)の方法によって行われた。
【0067】
実験は、まず、図4に示すように、4つのCaMV 35SエンハンサーがT−DNAの右境界(right border)付近に存在し、バスター除草剤に対する抵抗性を与えるbar遺伝子(phophinithricin acetylltransferase gene)を含んでいる活性タギングベクターpSK1015(Activation tagging vector pSK1015; Weigel et al., 2002, Plant Physiol., 122; 1003-1013;ドイツWeigel実験室で分譲)をエレクトロポレーション方法でアグロバクテリウム・ツメファシエンスABI菌株(Agrobacterium tumefaciences strain ABI; Lazo et al., 1991, Biotechnology 9:963-967;米国Amassino実験室で分譲)に導入させ、カナマイシン(kanamycin)とカルベニシリン(carbenicillin)の含まれた培地で選抜した。その後、pSK1015ベクターの挿入された前記アグロバクテリウム菌株をフローラルディッピング方法(Clough et al., 1998, Plant J., 16:735-743)でシロイヌナズナ野生型コロンビアに形質転換させた。前記形質転換されたシロイヌナズナの種子を受けてバスター除草剤に対する抵抗性のある形質転換体を選別し、約23℃の温室で5000個のT1ラインを成長させた。これらのうち、開花および成長が阻害されている植物を肉眼で観察し、野生型に比べて開花が遅く成長速度が阻害されている変異体1つのラインを選別して、前記変異体をsil1−1D(short internode and late flowering1)と命名した。
【0068】
その後、選抜されたシロイヌナズナ形質転換体(sil1−1D)とシロイヌナズナコロンビア野生型(Col(wt))を23℃の温度で16/8の周期で調節される生長調節器(growth chambers)内でそれぞれ栽培した。
【0069】
その結果、図1および図2から確認されるように、シロイヌナズナ形質転換体sil1−1Dは長日条件および短日条件でシロイヌナズナコロンビア野生型(Col(wt))に比べて花咲く時期が遅れるし、花咲く時点で葉の数が増加する開花遅延の表現型を示した。また、sil1−1Dは、図3に示されるように、完全に成長した後にも野生型に比べて背丈が半分程度であって成長が阻害されていることを確認することができた。
【0070】
<実施例2>前記表現型を示す形質転換植物体における過剰発現遺伝子の同定
【0071】
実施例1で選抜されたシロイヌナズナ形質転換体において開花遅延および/または成長阻害表現型に関与する遺伝子をクローニングするために、TAIL−PCR(Liu et al., 1995, Plant J. 8: 457-463)を行った。
【0072】
それぞれ配列番号3〜5の塩基配列を持つ3つの任意的プライマー(Arbitray Primer;AD1、AD2、AD3)と、配列番号6〜8の塩基配列を持つ3つの特異的プライマー(AT1、AT2、AT3と命名する)が使用された。PCRはApplied Biosystems社の2700 thermocyclersを使用した。Taq酵素はTakara Extaqを使用した。
【0073】
TAIL−PCRは3段階のPCR反応で行われたが、各段階のPCR反応は下記の条件で行われた。
【0074】
(第1段階のPCR反応)
第1段階のPCR反応において、鋳型DNAとしては実施例1で得られたシロイヌナズナ形質転換体からゲノムDNAを抽出し(Dellaporta et al., 1983, Plant Mol. Biol. Rep. 1:19-21)、全体25μLの量で、第1段階のPCRを行った。各反応は3つのチューブ(AD1、AD2或いはAD3)で行われた。第1段階のPCR反応における最終濃度および行われたサイクルの回数および条件は次のとおりである。
【0075】
(最終濃度)
鋳型DNA:100ng
AT1 0.2μM
AD1、AD2またはAD3プライマー 2μM
dNTP mix:0.8mM
Taq酵素:0.5U
【0076】
(一番目の反応サイクル)
93℃で1分、95℃で1分間反応した後、94℃で30秒、62℃で1分、72℃で2分30秒の3段階を5回繰り返し行い、94℃で30秒、25℃で3分を行う。その後、3分以上の時間をおいて72℃まで温度をゆっくり増加させた後、72℃で2.5分、94℃で10秒、68℃で1分、72℃で2分30秒、94℃で10秒、68℃で1分、72℃で2分30秒、94℃で10秒、44℃で1分、72℃で2分30秒の9段階を15回繰り返し行った後、72℃で1分を1回反応する。
【0077】
(第2段階のPCR反応)
第2段階のPCR反応において、鋳型DNAとしては第1段階のPCR反応溶液50μLから1μLを取り、滅菌した水49μLを入れて1/50に希釈して使用した。各1段階反応のときに使用した任意的プライマーを同様に使用して反応させた。全体反応溶液の量は25μLである。第2段階のPCR反応における最終濃度および行われたサイクルの回数および条件は次のとおりである。
【0078】
(最終濃度)
鋳型DNA:1μL
AT2 0.2μM
AD1、AD2またはAD3プライマー:2μM
dNTP mix:0.8mM
Taq酵素:0.5U
【0079】
(サイクルの回数および条件)
94℃で10秒、64℃で1分、72℃で2分30秒、94℃で10秒、64℃で1分、72℃で2分30秒、94℃で10秒、44℃で1分、72℃で2分30秒を各12回繰り返し行い、最後に72℃で1分間反応する。
【0080】
(第3段階のPCR反応)
第3段階のPCR反応において、鋳型DNAとしては第2段階のPCR反応溶液25μLから1μLを取り、滅菌した水9μLを入れて1/10に希釈して使用した。各1段階反応のときに使用した任意的プライマーを同様に使用して反応させた。全体反応溶液の量は50μLである。第3段階のPCR反応における最終濃度および行われたサイクルの回数および条件は次のとおりである。
【0081】
(最終濃度)
鋳型DNA:1μL
AT3 0.2μM
AD1、AD2またはAD3プライマー:2μM
dNTP mix:0.8mM
Taq酵素:1U
【0082】
(サイクルの回数および条件)
94℃で15秒、44℃で1分、72℃で2分30秒間各20回繰り返し行い、72℃で1分間反応する。
【0083】
前述したようにPCR反応を3段階にわたって行った後、その結果物に対してアガロースゲル電気泳動を行い、当該カラムを分離してシーケンサー(ABI3730;Applied Biosystem Inc.)でシケーシングした。
【0084】
決定された塩基配列に基づいて、シロイヌナズナゲノムデータベースを参照してエンハンサーと最も近い転写解読枠を探し出した。その結果、図4に示すように、シロイヌナズナゲノムにおけるAt5g10950プロモーター付近に挿入されていることを確認した。前記遺伝子は7つのアクソンからなっており(図5)、配列番号1に示される1185個の塩基配列と、配列番号2に示される395個のアミノ酸(図6)から構成された遺伝子であることを確認した。ここで、その遺伝子およびタンパク質をそれぞれSIL1遺伝子およびSIL1タンパク質と命名した。
【0085】
<実施例3>RNAゲルブロット(RNA gel Bolt)によるSIL1遺伝子の過剰発現有無の確認
【0086】
SIL1遺伝子が形質転換シロイヌナズナ(sil1−1D)で過剰発現したか否かを確認するために、SIL1 cDNA断片をプローブとして用いてRNAゲルブロットを行った。まず、シロイヌナズナコロンビア野生型(Col−O(wt))と、実施例1で得られたシロイヌナズナ形質転換体sil1−1DでTRIzol−Reagent(Ivitrogen)を用いて製造社の指針に従って全体RNAをそれぞれ抽出した。抽出した各RNA30μgを1.2%ホルムアルデヒド−アガロースゲル(formaldehyde-agarose gel)上で分離し、分離したRNAを真空輸送システム(GE healthcare Bioscience)を用いてナイロン膜(Hybond N+、GE healthcare Bioscience)に移した。ナイロン膜をUV−クロスリンカー(Stratagene)で紫外線に露出させた後、65℃で1時間乾燥させた。
【0087】
乾燥したナイロン膜を放射能標識プローブ(radio-labeled probes)で処理した後、Church and Gilbert溶液(25mMリン酸ナトリウム、1mM EDTA、7% SDS、1% BSA)を用いて65℃で16時間混成化(hybridization)反応を行った。
【0088】
この際、プローブとしてはシロイヌナズナcDNAにおいて配列番号9の正方向プライマー(forward primer)0.2uMと配列番号10の逆方向プライマー(reverse primer)、dNTP(それぞれ2.5mM)を加え、GeneAmp2700(Applied Biosystems)を用いてPCRを行った。
【0089】
PCRは95℃で3分間変性させ、各回毎に94℃で15秒、53℃で30秒、および72℃で1分30秒間35回のサイクルを行い、72℃で7分間加熱して反応を終了した。PCRで増幅された遺伝子を1%アガロースゲルで100Vで1時間電気泳動した後、遺伝子バンドを切り出してゲル溶出キット(Qiagen)を用いてSIL1遺伝子を溶出した。前記溶出したDNAとランダムプライミングキット(GE healthcare Bioscience、USA)と5μL dCTP(1mCi/μL、PerkinElmer)を用いて製造会社の使用法に従って放射能を標識してプローブとして使用した。
【0090】
前記混成化反応の後、ナイロン膜を65℃で2×SSC(Sodium chloride/Sodium citrate)および0.2% SDS(Sodium dodecyl sulfate)組成の洗浄液で10分間洗浄した後、1×SSCおよび0.1% SDS組成の洗浄液で10分間洗浄し、最後に0.1×SSCおよび0.1% SDS組成の洗浄液で洗浄した。洗浄したナイロン膜はBASフィルムに2日露出させた後、phosphorimager(BAS2000、Fuji)を用いて分析した。
【0091】
その分析結果を図7に示す。
【0092】
図7に示すように、野生型ではSIL1のmRNA発現が極めて低いか或いは殆どないが、これに対し、シロイヌナズナア形質転換体(sil1−1D)では前記遺伝子が相当高い水準に発現されることを確認することができた。
【0093】
<実施例4>SIL1遺伝子を含む発現ベクターおよび形質転換体の製造、並びに細胞内発現の観察
【0094】
実施例1で得られた形質転換シロイヌナズナの表現型がSIL1遺伝子の過剰発現によるものであるかを確認するために、まず、SIL1遺伝子をpCambia 1302ベクター(Caberra, Australia; Hajdukiewicz et al, 1994, Plant Mol. Biol. 25:989-994)に入れて発現した。
【0095】
このために、シロイヌナズナcDNAにおいて、実施例3で溶出して得たSIL1プローブDNAをGEM−T easy vector kit(Promega)を用いてTベクターにサブクローニングした。2μgの前記クローンをそれぞれ2μL(10U/μL)のNheIとSpeI制限酵素で、そして2μgのpCambia 1302は2μL(10U/μL)の制限酵素SpeIで37℃で2時間処理した後、ゲル溶出キットを用いて、SIL1遺伝子を含む1.19kbのDNA断片と10.5kbのpCambia 1302ベクターのDNA断片を溶出した後、T4リガーゼ(Roche)を1μL(1μg/μL)で処理して16℃で6時間反応させた。
【0096】
このように同定されたSIL1遺伝子を含むベクター(これをpCambia 1302−SIL1と命名)をエレクトロポレーション法を用いてアグロバクテリウム(Agrobacterium tumefacience AGL1 strain)に導入し、カナマイシンの含まれた培地で選抜した。
【0097】
その後、pCambia 1302−SIL1をクローンを持つアグバクテリウム菌株をフローラルディッピング方法(Clough et al., Plant J., 16(6):735-743, 1998)に従ってシロイヌナズナ野性型コロンビアに形質転換させた。
【0098】
その後、前記形質転換されたシロイヌナズナから種子を得た後、15μg/mLのハイグロマイシンの含まれた培地で抵抗性を示す形質転換体を選抜した。
【0099】
その後、前記形質転換されたシロイヌナズナを生長室で生長させた後、開花遅延および成長抑制様相を調べた結果、sil1−1D変異体で現れた老化遅延表現型がそのまま再現されることを確認することができた。
【0100】
このことから、開花遅延および成長抑制表現型がSIL1遺伝子の活性化を通じて現れたことが分かった。
【0101】
これらの中でも、一つのラインに対して葉を採取して1μg/μLのDAPI(4’,6-diamidino-2-phenylindole)試薬を処理した後、蛍光顕微鏡(Axio Vert 200;Carl Zeiss、Gottingen)を用いてSIL1−GFP(for green fluorescence protein)蛍光タンパク質の蛍光信号を観察した結果、図8に示すように、DAPIと共に核内に存在する。これはSIL1が細胞内の核で作用するタンパク質であることを示す。
【0102】
<実施例5>sil1−1Dの変異体におけるGAに対する下胚軸の成長長さ反応調査
【0103】
実施例1から分かるように、sil1−1Dの場合、長日条件と短日条件の両方ともで開花遅延を示し、成体の生長が阻害されており、葉が濃緑色を呈する現象を示している。これは多くの場合、GAの反応性または生合成が低くなったときに起こる現象である。よって、sil1−1DでGAの反応性を調べるために、白色光の下で多様な濃度のGAが入っている1%スクロース含有1/2Gamborg B5(Duchefa)培地で7日間培養した後、15個の幼い植物個体の下胚軸成長を調べた。
【0104】
図9に示すように、白色光の下でGAの濃度が増加するほど、野生型(Col)植物の下胚軸の成長が増加していることが分かる。これに対し、sil1−1Dは野生型に比べて下胚軸の成長に対する反応濃度が低く、反応性が劣っていることを確認することができる。これはsil1−1Dの下胚軸の成長においてGAに対する反応性が低くなっていることが分かる。
【0105】
<実施例6>sil1−1D変異体におけるパクロブトラゾール(Paclobutrazol)に対する発芽反応の調査
【0106】
一般なGAは実施例5で示した下胚軸の成長だけでなく、発芽にも作用すると知られている。下胚軸の成長に、或いは成体の大きさが小さい場合には細胞の長さ成長に問題があるが、このような細胞の長さ成長には一般にGA、オーキシン、ブラシノステロイド(BA)が関与するが、発芽の場合、GA、ABAなどの植物ホルモンが主に関与し、GAの反応も分子的に異なる原理によって反応するものと知られている。よって、sil1−1DがGAに対する反応性に欠陥を持つため開花遅延および/または矮性表現型が現れることを裏付けるために、GA生合成を妨害するパクロブトラゾール(PAC)を処理して野生型(Col)とsil1−1Dで発芽効率を比較した。図10に示すように、野生型は0.35mg/L PACを処理したときもほぼ100%の発芽効果を示すが、これに対し、sil1−1Dは約50%の発芽効果を示すなど、全般的にPACによるGA合成が阻害されたときに発芽効率が低くなり、発芽反応性も低い濃度で反応した。
【0107】
これはsil1−1DがGAに対する発芽効果の増進において反応性が低くなっていることを示唆する。また、データをまとめると、SIL1を過剰発現させたときにGAの反応性に影響を与えて、成体の成長が抑制され、開花が遅延する現象を見せるといえる。
【技術分野】
【0001】
本発明は、ジベレリン信号を調節することにより開花遅延または成長抑制機能を有するポリペプチド、これを暗号化するポリヌクレオチド、およびこれらの用途に関する。
【背景技術】
【0002】
ジベレリンは、植物体に存在するホルモンの一つであって、イネ馬鹿苗病菌(Gibberella fujikuroi)が分泌する物質から発見された。
【0003】
ジベレリン(GA)は、植物においてオーキシンと共に作用して無傷植物の茎の若い組織に対する生長促進効果を示し、穀類種子のα−アミラーゼという加水分解酵素を活性化させて種子の発芽を容易にし、種子の休眠打破に関与する。また、開花時期を調節するに当たり、低温または光周期を必要とする植物にGAを処理する場合、開花が促進されるとともに花芽が形成される現象が現れる。特異的に、GAは、受精過程がない場合にも、着果および果実の生長に関与してこれを促進すると知られている。したがって、GAの場合、農業や花卉などにおいて、様々な作物が使用されており、多様な効果を示すと知られている。例えば、秋まき大麦、桃、梨、リンゴおよびブドウの低温代替開花促進や、菊科植物の花芽形成促進、夏の菊、シクラメンおよびプリムラの花開花促進、ホウレンソウやタバコの発芽促進、茄子、牛蒡、大根および油菜の休眠打破、ビールおよび麦芽の製造に使われるアミラーゼの促進などがある。これだけでなく、GA生合成阻害剤としてのアンシミドール(ancymidol)(A−Rest)或いはパクロブトラゾール(paclobutrazol)(Bonzi)を処理して背丈/節が小さくて硬い植物を作り、風や台風などによって倒れるのを防止するためにも使われる。
【0004】
最近、このようなGAに対する生理学的現象を分子水準で解明しようとする努力が登場しており、初期には様々な作物において緑の革命を主導していた矮性表現型の変異体(reduced height(rth)、dwarf−1(dl)、anther ear1(An1)−トウモロコシ;semi−dwarf(sd−1)、Dwarf1、dl−qu;ls、le、na−大豆)や、徒長する変異体(la cry-3−大豆;perocera(pro)−トマト;slender(sln)−大麦;SLN−大豆)などを分析し、GAに対する植物の反応性に関する研究の深さを増して、2000年代に入ってはこれらの遺伝子クローニングに成功し(rth(Peng et al., 1999, Nature 400:256-261)、dl(Spray et al., 1996, PNAS 93:10515-10518)、an1(Bensen et al., 4995, Plant Cell 7:75-84)、sd−1(Bensen et al., 4995, Plant Cell 7:75-84)、dwarf1(Ashikari et al., 1999, PNAS 67:11638-11643)、el(Lester ea al., 1997, Plant Cell 9:1435-1443)、na(Davidson et al., 2003, Plant Physiol. 131:335-344)、およびGAの合成、認知、反応などに関与する遺伝子を発掘し始めた。このような研究は、シロイヌナズナをモデルとして、分子遺伝学的方法論によりさらに体系的に行われてきた。
【0005】
特にGAの反応性に対する大量の変異体スクリーニング(GAに対する反応性が少ない矮性体、GAを処理すれば野生型に戻る変異体、常にGA反応を示す徒長型変異体)を介して、大きくGAの合成に関連した遺伝子(GA1、GA4、GA5など)、GAの信号伝達に関連した遺伝子(heterotrimeric G protein、GA1、RGA、SPY、SLYなど)、GAの反応に関連した遺伝子(GA−MYB、α−アミラーゼ)を発掘した。また、最近、GAホルモン受容体がイネから発見されることにより(GID1:Uefuchi-Tanaka et al., 2005, Nature 437:693-698)、GAの分子的メカニズムを理解するのに大きく役立ち、現在は発見されたこれら遺伝子の相互関連性を解明することにより、GA信号経路を総体的かつ体系的な方法によって分子的に理解しようとする努力が続けられている(Schwechheimer et al., 2008 Curr. Opin. Plant Biol., 10:461-465)。
【0006】
これと共に、GAは開花調節においても主要なホルモンとして作用すると知られている。シロイヌナズナの場合、開花時期は光や温度、光周期などの外部信号と栄養状態やホルモンなどの内部信号との相互連関作用によって調節されると知られており、細部的に開花調節経路は大きく光周期経路、内在的経路、春化経路、ジベレリン(GA)経路が知られている(Mouradov et al., 2002, Plant Cell, 14: S111-130)。特に、GAが欠乏している変異体galの場合、短日条件で花が咲かないと知られている(Wilson et al., 1992, Plant Physiol. 100:403-408)。よって、GAは短日条件で開花を調節するのに重要な役目を果たすものと思われている。このようなGAに関する開花時期は、FPF1(flowering promoting factor 1)(Kania et al., 1997, Plant Cell 9:1327-1337)、GA−MYB(Gocal, et al., 2001, Plant Physiol., 127:1682-1693)などを媒介として、SOC1(Moon et al., 2003, Plant J., 35:613-623)およびLFY遺伝子(Blazquez, et al., 1998, Plant Cell 10:791-800)によって開花が起こるものと知られている。
【0007】
一方、耕作植物において、成体の大きさまたは開花時期を調節することは重要な意味を持つ。成長調節の場合、1960年代にアジアで緑の革命が成し遂げられるほどの収穫量の増大をもたらし、現在もヨーロッパ等で風害や低温などの防止のために成長調節剤を処理することからみて、成長調節は耕作植物の収穫量と密接した連関があるといえる。また、開花時期の調節に関連しても、開花時期を調節することにより季節の変化を問わずに収穫時期を決定し且つ周辺環境に影響されない品種の開発が可能である。このような理由により、植物生物工学分野の従事者は遺伝子操作の方法で開花時期を調節するために努力している。
【0008】
本発明はこのような背景の下で行われたのである。
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の目的は、開花遅延および/または成長抑制機能を有するポリペプチドを提供することにある。
【0010】
本発明の他の目的は、前記ポリペプチドを暗号化するポリヌクレオチドを提供することにある。
【0011】
本発明の別の目的は、開花遅延表現型を有する植物体の製造方法を提供することにある。
【0012】
本発明の別の目的は、成長抑制表現型を有する植物体の製造方法を提供することにある。
【0013】
本発明の別の目的は、開花遅延表現型または成長抑制表現型を有する植物体を提供することにある。
【0014】
本発明の別の目的は、前記ポリヌクレオチドを用いた形質転換植物体の選別方法を提供することにある。
【0015】
本発明の別の目的は、植物体の開花遅延または成長抑制誘導物質のスクリーニング方法を提供することにある。
【課題を解決するための手段】
【0016】
本発明は、一側面において、開花遅延および/または成長抑制(矮化誘導)機能を有するポリペプチドに関するものである。
【0017】
本発明者らは、下記実施例から確認されるように、特定の遺伝子を平素の発現量より過剰発現させる活性タギング方法(Activation Tagging Method; Weigel et al., 2000, Plant Physiology, 122:1003-1013;その内容は下記実施例を含む本明細書に含まれるものと看做される)を用いて、開花遅延および/成長抑制表現型を示すイロイヌナズナ形質転換体を製作・選抜し、TAIL−PCR(Thermal Asymmetric Interlaced Polymerase Chain Reaction; Liu et al., 1995, Plant J. 8: 457-463;その内容は下記実施例を含む本明細書に含まれるものと看做される)方法を用いて、前記シロイヌナズナ形質転換体で開花遅延および/または成長抑制表現型に関与する遺伝子をクローニングして、配列番号1に示されるその遺伝子の塩基配列、および配列番号2に示されるその遺伝子が暗号化するポリペプチドのアミノ酸配列を確認したうえ、前記形質転換体で見られる開花遅延および/または成長抑制表現型が前記遺伝子の過剰発現による効果であるかをRNAゲルブロットで確認し、最後には前記遺伝子を過剰発現させる組み換えベクターをシロイヌナズナに導入したとき、その形質転換体が前記活性タギング方法で形質転換されたシロイヌナズナ形質転換体の表現型と同様に、開花遅延および/または成長抑制表現型を示すことを確認することができた。
【0018】
具体的に、本発明の植物体の開花遅延および/または成長抑制機能を有するポリペプチドは、下記ポリペプチドのいずれか一つである:
(a)配列番号2に示されるアミノ酸配列全体を含むポリペプチド、
(b)配列番号2に示されるアミノ酸配列の実質的な部分を含むリペプチド、および
(c)前記(a)または(b)のポリペプチドと実質的に類似のポリペプチド。
【0019】
前記において、そして請求の範囲を含む以下において、前記「開花遅延および/または成長抑制機能」とは、後述するような本発明の遺伝子(具体的には配列番号1の塩基配列を持つ遺伝子)が過剰発現されたときに開花遅延および/または成長抑制表現型を示すようにするのに関与する機能を意味するものと定義される。
【0020】
また、前記において、そして請求の範囲を含む以下において、前記「配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド」は、配列番号2に示されるアミノ酸配列からなるポリペプチドと比較したとき、依然として開花遅延および/または成長抑制機能を保有すると看做すのに十分な程度の配列番号2のアミノ酸配列の一部分を含むポリペプチドと定義される。依然として開花遅延および/または成長抑制機能を保有すれば十分なので、前記ポリペプチドの長さ、およびそのようなポリペプチドが持つ活性(すなわち、開花遅延および/または成長抑制機能)の程度は特に問題とならない。すなわち、配列番号2に示されるアミノ酸配列を含むポリペプチドに比べて活性が低くても、依然として開花遅延および/または成長抑制機能を保有するポリペプチドであれば、その長さがどうであれ前記「配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド」に含まれるのである。通常の当業者であれば、すなわち本出願時を基準として公知の関連先行技術を平均的に熟知している者であれば、配列番号2に示されるアミノ酸配列を含むポリペプチドにおける一部分が欠失しても、そのようなポリペプチドは依然として開花遅延および成長抑制機能を有するだろうと期待する。そのようなポリペプチドとして、配列番号2に示されるアミノ酸配列を含むポリペプチドにおけるN末端部分またはC末端部分が欠失したポリペプチドを挙げることができる。これは、一般に、N末端部分またはC末端部分が欠失しても、そのようなポリペプチドは本来のポリペプチドが持つ機能を有すると当業界に公知になっているためである。場合によっては、N末端部分またはC末端部分が開花遅延および/または成長抑制機能に必須的であって、N末端部分またはC末端部分の欠失したポリペプチドが前記機能を示さない場合もあるが、それにも拘らずそのような不活性のポリペプチドを活性のポリペプチドと区分して検出することは、当業者の通常の能力範囲内に属する。また、N末端部分またはC末端部分だけでなく、それ以外の他の部分が欠失しても、本来のポリペプチドが持つ機能を依然として持つことができる。ここでも、当業者であれば、その通常の能力の範囲内で、このような欠失したポリペプチドが依然として本来のポリペプチドが持つ機能を保有するかを十分に確認することができるであろう。特に、本明細書が配列番号1の塩基配列および配列番号2のアミノ酸配列を開示しているだけでなく、配列番号1の塩基配列からなる遺伝子がシロイヌナズナで過剰発現されたときにそのシロイヌナズナが開花遅延および/または成長抑制表現型を示すかを分明に確認した実施例を開示しているということからみて、配列番号2のアミノ酸配列における一部の配列が欠失したポリペプチドが、配列番号2のアミノ酸配列を含むポリペプチドが持つ機能を依然として保有するかを、当業者はその通常の能力範囲内で十分に確認することができるということが自明になる。よって、本発明において、前記「配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド」は、前記定義のとおり、本明細書の開示内容に基づいて当業者がその通常の能力範囲内で製造することができる、開花遅延または成長抑制機能を有する欠失形態の全てのポリペプチドを含む意味として理解されるべきである。
【0021】
また、前記において、そして請求の範囲を含む以下において、「前記(a)および(b)のポリペプチドと実質的に類似のポリペプチド」とは、一つ以上の置換されたアミノ酸を含むが、配列番号2のアミノ酸配列を含むポリペプチドが持つ機能、すなわち開花遅延および/または成長抑制機能を依然として保有するポリペプチドをいう。ここでも、一つ以上の置換されたアミノ酸を含むポリペプチドが開花遅延および/または成長抑制機能を依然として保有しさえすれば、そのようなポリペプチドが持つ活性の程度またはアミノ酸が置換された比率は問題とならない。換言すれば、一つ以上の置換されたアミノ酸を含むポリペプチドが、配列番号2のアミノ酸配列を含むポリペプチドに比べてどんなに低い活性を持っても、また多数の置換されたアミノ酸を含んでいるとしても、そのようなポリペプチドが開花遅延および/または成長抑制機能を保有しさえすれば本発明に含まれるのである。一つ以上のアミノ酸が置換されても、置換される前のアミノ酸が置換されたアミノ酸と化学的に等価であれば、そのような置換されたアミノ酸を含むポリペプチドは依然として本来のポリペプチドの機能を保有する。例えば、疎水性のアミノ酸であるアラニンが他の疎水性のアミノ酸、例えばグリシン、またはよりさらに疎水性のアミノ酸、例えばバリン、ロイシンまたはイソロイシンに置換されても、そのような置換されたアミノ酸を持つポリペプチドは、活性は低くても本来のポリペプチドが持つ機能を依然として保有するのである。同様に、負に荷電したアミノ酸、例えばグルタミン酸が他の負に荷電したアミノ酸、例えばアスパラギン酸に置換されても、そのような置換されたアミノ酸を持つポリペプチドも活性は低くても本来のポリペプチドが持つ機能を依然として保有するし、正に荷電したアミノ酸、例えばアルギニンが他の正に荷電したアミノ酸、例えばリシンに置換されても、そのような置換されたアミノ酸を持つポリペプチドも活性は低くても本来のポリペプチドが持つ機能を依然として保有する。さらに、ポリペプチドのN末端またはC末端部分で置換されたアミノ酸を含むポリペプチドも本来のポリペプチドが持つ機能を依然として保有するのである。当業者であれば、その前述したような一つ以上の置換されたアミノ酸を含みながらも、配列番号2のアミノ酸配列を含むポリペプチドが持つ開花遅延および/または成長抑制機能を依然として保有するポリペプチドを製造することができる。また、当業者であれば、一つ以上の置換されたアミノ酸を含むポリペプチドが依然として前記機能を持つかを確認することができる。しかも、本明細書が配列番号1の塩基配列および配列番号2のアミノ酸配列を開示しているとともに、シロイヌナズナで配列番号1の塩基配列からなる遺伝子が過剰発現されたときにそのシロイヌナズナが開花遅延および/または成長抑制表現型を示すかを分明に確認した実施例を開示しているため、本発明の「前記(a)および(b)のポリペプチドと実質的に類似のポリペプチド」は、当業者が容易に実施し得るものであることが明らかである。よって、前記(a)または(b)のポリペプチドと実質的に類似のポリペプチド」は、一つ以上の置換されたアミノ酸を含みながらも、依然として開花遅延または成長阻害機能を有する全てのポリペプチドを含む意味として理解されるべきである。
【0022】
このように「前記(a)または(b)のポリペプチドと実質的に類似のポリペプチド」は、一つ以上の置換されたアミノ酸を含みながらも、依然として開花遅延または成長抑制機能を有する全てのポリペプチドを含む意味であるが、それにもかかわらず、活性の程度という観点からみたとき、前記ポリペプチドは配列番号2のアミノ酸配列と配列相同性が高いほど好ましい。前記ポリペプチドは、配列相同性の下限において60%以上の配列相同性を持つことが好ましいが、配列相同性の上限においては当然100%の配列相同性を持つことが好ましい。
よりさらに具体的に、前記配列相同性は60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%および99.9%の順に高くなるほど好ましい。ここで、99.9%の配列相同性は配列番号2のアミノ酸配列からなるポリペプチドにおける一つのアミノ酸が置換された場合である。
【0023】
本発明の「前記(a)および(b)のポリペプチドと実質的に類似のポリペプチド」は、「配列番号2のアミノ酸配列全体を含むポリペプチドと実質的に類似のポリペプチド」だけでなく、「配列番号2のアミノ酸配列の実質的な部分を含むポリペプチドと実質的に類似のポリペプチド」を含むので、前述したような全ての説明は、「配列番号2のアミノ酸配列全体を含むポリペプチドと実質的に類似のポリペプチド」だけでなく、「配列番号2のアミノ酸配列の実質的な部分を含むポリペプチドと実質的に類似のポリペプチド」に対しても適用されるものと看做される。
【0024】
本発明は、他の側面において、前述したようなポリペプチドを暗号化する単離ポリヌクレオチドに関するものである。ここで、「前述したようなポリペプチド」とは、開花遅延および/または成長抑制機能を有しながら、配列番号2に示されるアミノ酸配列全体を含むポリペプチド、配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド、および前記ポリペプチドと実質的に類似のポリペプチドを含むうえ、前述した好適な様態の全てのポリペプチドを含む意味である。よって、本発明のポリヌクレオチドは、開花遅延および/または成長阻害機能を有しながら、配列番号2に示されるアミノ酸配列全体またはその実質的な部分を含むポリペプチドを暗号化する単離ポリヌクレオチドおよびこのようなポリペプチドと実質的に類似のポリペプチドを暗号化する単離ポリヌクレオチドを含み、ひいては、好適な様態として、開花遅延および/または成長抑制機能を有しながら、前述したような配列相同性の順にその配列相同性を持つ全てのポリペプチドを暗号化するポリヌクレオチドを含む。アミノ酸配列が解明されたとき、そのようなアミノ酸配列に基づいてそのようなアミノ酸配列を暗号化するポリヌクレオチドを、当業者であれば容易に製造することができる。
【0025】
それにも拘らず、依然として、活性の側面からみて、本発明のポリヌクレオチドは配列番号1の塩基配列の一部分を含むことが好ましく、配列番号1の塩基配列全体を含むことが好ましい。ここで、「配列番号1の塩基配列の一部分」とは、配列番号2のアミノ酸配列からなるポリペプチドの機能、すなわち開花遅延および/または成長阻害機能を依然として保有すると看做すのに十分な長さのポリペプチドをコードするポリヌクレオチドをいう。ここでも、配列番号2のアミノ酸配列からなるポリペプチドの機能を保有しさえすれば、その活性が本来のポリペプチド、すなわち配列番号2のアミノ酸配列からなるポリペプチドが持つ活性に比べて低くても問題にならない。
【0026】
一方、前記「単離ポリヌクレオチド」は、請求の範囲を含む以下において、化学的に合成されたポリヌクレオチド、生物体、特にシロイヌナズナ(Arabidopsis thaliana)から分離されたポリヌクレオチドおよび変形されたヌクレオチドを含有したポリヌクレオチドを全て含み、単一鎖または二重鎖のRNAまたはDNAの重合体を全て含むものと定義される。よって、前記「単離ポリヌクレオチド」とは、cDNAを含んでヌクレオチドを化学的に重合させたポリヌクレオチドだけでなく、生物体、特にシロイヌナズナから分離されるゲノムDNAを含む。ここで、本明細書が開示している配列番号2のアミノ酸配列、これをコードする配列番号1の塩基配列、および当業界における公知の技術などに基づく限り、cDNAを含んで前記化学的に合成されるポリヌクレオチドの製造および前記gDNAの分離などは、当業者の通常の能力範囲内に属するであろう。
【0027】
本発明の別の側面において、配列番号1の塩基配列の一部分を含むポリヌクレオチドまたは前記一部分と実質的に類似のポリヌクレオチドに関するものである。ここで、前記「配列番号1の塩基配列の一部分を含むポリヌクレオチド」とは、シロイヌナズナを含む植物において、開花遅延および/または成長抑制機能を有する遺伝子を同定および/または単離するのに十分な長さの配列を含むポリヌクレオチドをいい、また、前記「配列番号1の塩基配列の一部分と実質的に類似のポリヌクレオチド」とは、配列番号1の塩基配列の一部分と比較して一つ以上の置換されたヌクレオチドを含みながらも、シロイヌナズナを含む植物において、開花遅延および/または成長抑制機能を有する遺伝子を同定および/または単離するのに十分な程度の配列依存的結合力を持つポリヌクレオチドをいう。当業者は、シロイヌナズナまたは他の植物において、本明細書が開示している配列番号1の塩基配列に基づいてこれを用いる限り、その通常の能力範囲内でシロイヌナズナまたは他の植物から開花遅延および/または成長抑制機能の遺伝子を同定および/または単離することができる。よって、本発明の前記ポリヌクレオチドは、ポリヌクレオチドの長さに関係なく、またそのポリヌクレオチドの配列番号1の塩基配列との配列相同性の程度に関係なく、シロイヌナズナまたは他の植物から開花遅延および/または成長阻害機能の遺伝子を同定および/または単離するのに十分な配列長さおよび/または配列依存的結合力を持つ全てのポリヌクレオチドを含む。
【0028】
一般に、機能が公知になった遺伝子の塩基配列を未知の遺伝子の塩基配列と比較して、その未知の遺伝子が対比された公知の遺伝子と同一の機能を有するものと推定するために、そして未知の遺伝子を単離するためのプローブとして使用されるためには、30個以上の連続するヌクレオチド配列が必要であると知られている。よって、本発明の前記ポリヌクレオチドは、配列番号1に示される塩基配列において30個以上のヌクレオチドを含むことが好ましい。それにも拘らず、依然として本発明のポリヌクレオチドは30個以下のヌクレオチドからなるポリ(またはオリゴ)ヌクレオチドを含む。それは配列番号1に示される塩基配列と100%の配列相同性を持つか、同定および/または単離条件(バッファのpHや濃度など)が厳しければ、シロイヌナズナまたは他の植物から開花遅延および/または成長抑制機能の遺伝子を同定および/または単離するのに十分でありうるためである。ここで、シロイヌナズナまたは他の植物から開花遅延または成長抑制機能の遺伝子を同定および/または単離するのに十分な30個以下のヌクレオチドからなるポリヌクレオチドを製作、検出すること、そのようなポリヌクレオチドを用いてシロイヌナズナまたは他の植物から開花遅延または成長阻害機能の遺伝子を同定および/または単離することは、通常の当業者の能力範囲内に属する。
【0029】
一方、前記において、そして請求の範囲を含む以下において、「植物体」とは、開花によって繁殖する植物体、またはその大きさが小さくなることによりヒトに有用な結果を与えることが可能な全ての植物体を意味する。ここで、大きさが小さくなることによりヒトに有用な結果を与えることが可能な植物体の直接的な例として、農作物の生長を阻害する各種雑草植物や観賞目的の盆栽植物などがここに含まれる。また、ヒトが食用にしているか或いは食用することが可能な植物なども、食用の簡便性、運搬の便利性などの理由により、前記植物体の範囲に含まれる。具体的に、前記植物体には耕作地などの雑草植物類、稲、小麦、大麦、トウモロコシ、大豆、ジャガイモ、小麦、小豆、オート麦、モロコシキビを含む食糧作物類、シロイヌナズナ、白菜、大根、唐辛子、イチゴ、トマト、スイカ、キュウリ、キャベツ、マクワウリ、南瓜、ネギ、玉ねぎ、ニンジンを含む蔬菜作物類、高麗人参、タバコ、棉、胡麻、砂糖黍、砂糖大根、荏胡麻、落花生、油菜を含む特用作物類、リンゴの木、梨の木、棗の木、桃の木、キーウィー、ブドウ、柑橘、柿、スモモ、満州杏、バナナを含む果樹類、バラ、グラジオラス、ガーベラ、カネーション、菊、ユリ、チューリップを含む花卉類、ライグラス、レッドクローバー、オーチャードグラス、アルファルファ、トールフェスク、ペレニアルライグラスなどを含む飼料作物類などを挙げることができる。
また、前記「植物体」とは、成熟した植物だけでなく、成熟した植物に発育することが可能な植物細胞、植物組織、植物の種子などを全て含む意味として理解される。
【0030】
本発明は、別の側面において、開花遅延および/または/または成長抑制表現型を有する植物体の製造方法に関するものである。
【0031】
前記において、「開花遅延」とは、温度や、昼と夜の長さなど栽培条件が同一の場合における、野生型植物体の開花時期より遅いことを意味する。
【0032】
また、前記において、「成長抑制」とは、植物の生体量がその野生型植物の生体量に比べて少ないことを意味し、好ましくは植物の茎の生体量および/または植物の葉の生体量が野生型の植物のそれに比べて少ないことを意味する。ここで、生体量とは、葉や茎など植物の器官の重さ、長さおよび/または大きさを意味するものと理解できる。
【0033】
本発明の開花遅延および/または/または成長抑制表現型を有する植物体の製作方法は、(I)植物体において配列番号1の塩基配列からなる遺伝子、または配列番号1の塩基配列と類似の配列からなる遺伝子を過剰発現させる段階と、(II)開花遅延および/または/または成長抑制表現型が誘発された植物体を選別する段階とを含んでなる。
前記において、そして請求の範囲を含む以下において、前記「過剰発現」とは、温度や、昼と夜の長さなど栽培条件が同一の場合における、野生型植物体で発現する水準以上の発現を意味する。
【0034】
本明細書において、「配列番号1の塩基配列と類似の配列からなる遺伝子」とは、配列番号1の塩基配列からなる遺伝子の同族体(homologue)であって、植物の開花遅延および/または成長抑制表現型を誘発する機能を有しながら、植物の種類による進化的経路の相違により配列番号1の塩基配列とは異なる塩基配列からなる全ての遺伝子を含む意味である。ここで、配列番号1の塩基配列と類似の配列からなる遺伝子は、配列番号1の塩基配列と配列相同性が高いほど好ましく、最も好ましくは当然100%の配列相同性を持つときである。一方、配列相同性の下限においては前記遺伝子が配列番号1の塩基配列と60%以上の配列相同性を持つ場合が好ましい。よりさらに具体的には、前記配列相同性が60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%および99%の順に高くなるほど好ましい。
【0035】
前記配列番号1の塩基配列と類似の配列からなる遺伝子の別の好ましい例としては、コドン縮退性(codon degeneracy)によって配列番号1の塩基配列からなる遺伝子の機能的等価物を挙げることができる。この機能的等価物は、換言すると、配列番号2のアミノ酸配列からなるポリペプチドを暗号化するポリヌクレオチドである。
【0036】
前記段階(I)の過剰発現させる段階は、前述したような本発明のポリペプチドを暗号化する前記ポリヌクレオチドを植物体に形質転換させる段階を含んでなる。
【0037】
本明細書において、前記「形質転換」とは、外来性ポリヌクレオチド(本発明では、前記開花遅延および/または成長抑制機能を有するポリペプチドを暗号化するポリヌクレオチドを意味する;以下同じ)の導入による宿主植物の遺伝子型の変形を意味し、その形質転換に使用された方法と関係なく外来性ポリヌクレオチドが宿主植物、さらに正確には宿主植物の細胞内に導入されたことを意味する。宿主植物内に導入された外来性ポリヌクレオチドは、宿主植物のゲノム内に統合されて維持されるか或いは統合されずに維持されるが、本発明は両者ともを含む。
【0038】
一方、外来性ポリヌクレオチドで植物を形質転換させる方法は、当業界における一般な公知の方法(Methods of Enzymology, Vol. 153, 1987, Wu and Grossman編集, Academic Press)を使用することができる。
【0039】
外来性ポリヌクレオチドをプラスミドやウイルスなどのベクターなどの運搬体に挿入して植物を形質転換させることができ、アグロバクテリウムバクテリアを媒介体として使用することができ(Chilton et al., 1997, Cell 1:263:271)、直接外来性ポリヌクレオチドを植物細胞内に導入させて植物を形質転換させることができる(Lorz et al., 1985, Mol. Genet. 199:178-182)。
【0040】
一般に植物の形質転換に多く用いられる方法は、外来性ポリヌクレオチドで形質転換されたアグロバクテリウム・ツメファシエンス(Agrobacterium tumefaciens)によって幼植物体、植物細胞、種子、成熟植物などを感染させる方法である。ここで、形質転換された幼植物体、植物細胞、種子などは、当業者が公知の適切な条件の下で培養または栽培して、成熟した植物に成長および発育させることができる。
【0041】
一方、前記形質転換させる段階は、(a)前記本発明のポリペプチドを暗号化するポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに作動可能に挿入させて組み換え発現ベクターを製作する段階と、(b)前記組み換えベクターを植物体に導入する段階とを含んでなることが好ましい。
【0042】
さらに好ましくは、前記形質転換させる段階は、本発明のポリペプチドを暗号化するポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに作動可能に挿入させて組み換え発現ベクターを製作する段階と、この組み換え発現ベクターをアグロバクテリウムバクテリアに形質転換させる段階と、この形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階とを含んでなる場合である。特に、前記形質転換されたアグロバクテリウムバクテリアは形質転換されたアグロバクテリウム・ツメファシエンスであることが好ましい。
【0043】
前記「調節ヌクレオチド配列」とは、その存在がそれに連結された遺伝子の発現に影響を及ぼすことが可能な全ての配列を含む意味として理解される。このような調節ヌクレオチド配列はリーダー配列、エンハンサー配列、プロモーター配列、転写開始配列、転写終結配列、複製開始点、リボソーム結合部位などを含む。
【0044】
前記「作動可能に挿入する」とは、ある遺伝子の転写および/または翻訳が影響を受けるように挿入することを意味する。例えば、あるプロモーターがそれと共に挿入された遺伝子の転写に影響を与えるならば、その遺伝子は作動可能に挿入されたのである。
【0045】
プロモーター配列は、誘導性プロモーター(inducible promoter sequence)と構造性プロモーター(constitutive promoter sequence)の両方とも使用可能である。構造性プロモーターとしては、例えばCaMVプロモーター、CsVMVプロモーター、Nosプロモーターなどを挙げることができ、誘導性プロモーター(誘導因子の存在により、それに連結された遺伝子の発現が活発になることを可能とするプロモーター)としては、例えば、銅イオンによって活性化される酵母メタロチオネインプロモーター(Mett et al., Proc. Natl. Acad. Sci., U.S.A., 90:4567, 1993)、置換ベンゼンスルホンイミドによって活性化されるIn2−1およびIn2−2プロモーター(Hershey et al., Plant Mol. Biol., 17:679, 1991)、グルココルチコイドによって調節されるGRE調節配列(Schena et al., Proc. Natl. Acad. Sci., U.S.A., 88:10421, 1991)、エタノール調節性プロモーター(Caddick et al., Nature Biotech., 16:177, 1998)、リブロースビスリン酸カルボキシラーゼ(ssRUBISCO)の小サブユニットに由来した光調節性プロモーター(Coruzzi et al., EMBO J., 3:1671, 1984; Broglie et al., Science, 224:838, 1984)、マンノピンシンターゼプロモーター(Velta et al., EMBO J., 3:2723, 1984)、ノパリンシンターゼ(NOS)およびオクトピンシンターゼ(OCS)プロモーター、熱衝撃プロモーター(Gurley et al., Mol. Cell. Biol., 6:559, 1986; Severin et al., Plant Mol. Biol., 15:827, 1990)などを挙げることができる。
【0046】
一方、前記組み換えベクターは選別マーカー遺伝子を含むことができる。ここで、「マーカー遺伝子」とは、そのようなマーカー遺伝子を含む形質転換体の選別を可能にする形質を暗号化する遺伝子を意味する。マーカー遺伝子は抗生物質耐性遺伝子であってもよく、除草剤耐性遺伝子であってもよい。適した選別マーカー遺伝子の例としては、アデノシンデアミナーゼの遺伝子、ジヒドロ葉酸リダクターゼの遺伝子、ハイグロマイシン−B−ホスホトランスフェラーゼの遺伝子、チミジンキナーゼの遺伝子、キサンチン−グアニンホスホリボシルトランスフェラーゼの遺伝子、ホスフィノトリシンアセチルトランスフェラーゼ遺伝子などを挙げることができる。
【0047】
一方、本発明の実施例では、配列番号1に示される塩基配列からなる遺伝子を発現ベクターpCambia1302ベクターに挿入させて組み換えベクター pCambia1302−SIL1を製作した後、前記組み換えベクターをアグロバクテリウム・ツメファシエンスに形質転換させ、その形質転換されたアグロバクテリウム・ツメファシエンスをシロイヌナズナに形質転換させた。
【0048】
このような本発明の実施様態を考慮するとき、前記形質転換させる段階は、配列番号1に示される塩基配列からなる遺伝子を植物に形質転換させる段階を含むことが好ましく、さらに好ましくは前記遺伝子を含む組み換えベクター、特に pCambia1302−SIL1を植物に形質転換させる段階を含むときである。最も好ましくは前記組み換えベクター、特にpCambia1302−SIL1で形質転換されたアグロバクテリウム・ツメファシエンスを植物に形質転換させる段階を含むときである。
【0049】
一方、前記(II)選別段階は、(I)段階を行った後、開花遅延および/または成長抑制表現型を示す植物体を肉眼で選別するか、或いは形質転換の際に選別マーカー遺伝子が共に形質転換される場合には選別マーカー遺伝子を用いて選別することができる。
【0050】
本発明の別の側面において、前述したような開花遅延および/または/または成長抑制表現型を有する植物体の製造方法によって得られた植物体に関するものである。本発明の植物体は、配列番号1の塩基配列からなる遺伝子または配列番号1の塩基配列と類似の配列からなる遺伝子が過剰発現されることにより、開花遅延および/または成長抑制表現型を有する植物体として理解できる。
【0051】
別の側面において、本発明は、前述したような本発明のポリヌクレオチドをマーカー遺伝子として用いて、形質転換された植物体を選別する方法に関するものである。
【0052】
本発明の形質転換された植物体の選別方法は、(I)目的遺伝子、植物体開花遅延および/または成長抑制機能を有するポリペプチドを暗号化する前記ポリヌクレオチドおよび調節ヌクレオチド配列を含む発現ベクターを植物体に形質転換させる段階と、(II)開花遅延および/または成長抑制表現型が誘発された植物体を選別する段階とを含んでなる。
【0053】
本明細書において、「目的遺伝子」とは、発現させようとする遺伝子であって、目的する生成物(すなわち、RNAまたはポリペプチド)を暗号化する一定長さのポリヌクレオチド配列として定義できるが、このようなポリヌクレオチド配列は、切断された形態、融合された形態またはタグされた形態であってもよく、cDNAまたはgDNAであってもよく、天然形態の生成物を暗号化する配列または所望の突然変異形態の生成物を暗号化する配列であってもよい。
【0054】
前記(I)発現ベクターを植物体に形質転換させる段階は、その発現ベクターをアグロバクテリウムバクテリアに形質転換させる段階、およびこの形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階を含んで構成できる。ここで、アグロバクテリウムバクテリアはアグロバクテリウム・ツメファシエンスであることが好ましい。
【0055】
その他、本発明の形質転換された植物体の選別方法については、本発明の開花遅延表現型を有する植物体の製造方法に関連して説明したところがそのまま有効である。
【0056】
別の側面において、本発明は、植物体の開花遅延誘導物質のスクリーニング方法に関するものである。
【0057】
別の側面において、本発明は、植物体の成長抑制誘導物質のスクリーニング方法に関するものである。
【0058】
前記方法は、(I)植物体において任意の化学物質または生物学的物質を処理する段階と、(II)配列番号1の塩基配列からなる遺伝子または配列番号1の塩基配列と類似の配列からなる遺伝子を過剰発現させる物質を検出する段階とを含んでなる。
【0059】
前記「配列番号1の塩基配列と類似の配列からなる遺伝子」は、前述したとおりである。
【0060】
前記(I)植物体に任意の化学物質または生物学的物質を処理する段階において、化学物質の処理は植物体に化学物質が接触するように処理すればよく、生物学的物質の処理は前記本発明の開花遅延植物体の製造方法に関連して説明したように遺伝工学的方法で処理すればよい。
【0061】
一方、前記検出された物質、特に生物学的物質としては、配列番号1の塩基配列のセンスヌクレオチド、前記センスヌクレオチドを含む組み換えベクター、その組み換えベクターで形質転換されたアグロバクテリウム・ツメファシエンスなどを挙げることができる。
【発明の効果】
【0062】
前述したように、本発明によれば、開花遅延および/または成長抑制表現型を有するポリペプチド、そのポリペプチドを暗号化するポリヌクレオチド、開花遅延表現型を有する植物体の製造方法、成長抑制表現型を有する植物体の製造方法、形質転換植物体の選別方法、および開花遅延または成長抑制誘導物質のスクリーニング方法を提供することができる。
【図面の簡単な説明】
【0063】
【図1】図1はシロイヌナズナコロンビア野生型(Col−0(wt))と開花遅延表現型を示すシロイヌナズナ変異体(sil1−1D)の長日(LD)/短日(SD)条件下での花軸が上がってくる時点を比較して示す写真である。DAPはdyas after plantingであって、種子を播いてから経過した日を意味する。長日/短日条件でのsil1−1D変異体は開花が顕著に遅延していることが分かる。
【図2】図2は図1の結果をグラフとして示す。Number of rosette leavesは花咲く時点での左葉の個数を示し、Bolting timeは種子を播いてから花咲くときまでかかる日を示し、Long dayは長日を意味し、short dayは短日を意味する。
【図3】図3は生長の後、野生型とsil1−1D変異体の植物成体の大きさを比較した写真である。sil1−1D変異体は成体になった後に野生型成体の大きさの半分程度に相当する成長を示す。
【図4】図4は開花遅延および/または成長抑制表現型を示すシロイヌナズナ形質転換体のゲノム内に挿入されたアクティベーションタギングベクターpSKI015の模式図である。pSKI015はシロイヌナズナゲノムにおけるAt5g10950上位発現調節因子の近くに挿入されている。4×35SEnhは4つの連続した35Sエンハンサーであり、BarRはバスター除草剤抵抗性遺伝子であり、AmpRはアンピシリン抵抗性遺伝子であり、Col E1 OriはE.coli複製起点(replication origin)である。
【図5】図5はシロイヌナズナのAt5g10950の遺伝子構造を表現した。この遺伝子は7つのアクソンと6つのイントロンからなっており、1185個のヌクレオチドからなっている。
【図6】図6はシロイヌナズナのAt5g10950のコーディングタンパク質のアミノ酸配列を表現した。このタンパク質は395個のアミノ酸から構成されており、ボックスで表記された部分はコンピュータを介してのタンパク質配列分析によって核局在化シグナル(Nuclear localization signal)として推定される部位を表現した。
【図7】図7は野生型とsil1−1D変異体においてT−DNAが入った位置の周辺遺伝子At5g10950の遺伝子の発現をRNAゲルブロット分析で検出した結果である。28S rRNAは使用したRNAの量を比較して示し、At5g10950はsil1−1D変異体において著しく増加した。
【図8】図8はpCambia 1302−SIL1組み換えベクターで形質転換されたシロイヌナズナにおいてSIL1のタンパク質の発現位置を気孔細胞から観察した結果である。一番目の絵は光学顕微鏡上で気孔細胞をみたものであり、2番目の絵の緑色蛍光はSIL1とGFPの結合タンパク質から誘導されるものであり、三番目の絵の青色蛍光はDAPI染色によって核を観察したものである。最後の図は3つの絵を全て重ね合わせておいたもので、緑色蛍光と青色蛍光とが重なり合うことが見られる。
【図9】図9は多様な濃度のジベレリン(GA)処理を施したとき、野生型とsil1−1D変異体の下胚軸(hypocotyl)成長反応をグラフとして表現した。GA濃度に応じて野生型の下胚軸の成長が長くなるが、sil1−1DではGAに対する成長反応が野生型に比べて減っていることが見られる。
【図10】図10はGA生合成阻害剤としてのパクロブトラゾール(Paclobutrazol、PAC)を多様な濃度で処理したとき、野生型とsil1−1D変異体の発芽(Germination)効率をグラフとして表現した。PAC濃度に応じて野生型の発芽効率が減ることが見られるが、sil1−1DではPACによる発芽阻害効果がさらに高いことが見られる。
【発明を実施するための形態】
【0064】
以下、本発明について実施例を参照して説明する。ところが、これらの実施例は本発明の範囲を限定するものではない。
【0065】
<実施例1>開花遅延および/または成長抑制表現型を有するシロイヌナズナ形質転換体の製作および選抜
【0066】
開花遅延および/または成長抑制表現型を有するシロイヌナズナ形質転換体の製作および選抜は、Weigelなど(Weigel et al., 2000, Plant Phtsiology, 122:1003-1013)の方法によって行われた。
【0067】
実験は、まず、図4に示すように、4つのCaMV 35SエンハンサーがT−DNAの右境界(right border)付近に存在し、バスター除草剤に対する抵抗性を与えるbar遺伝子(phophinithricin acetylltransferase gene)を含んでいる活性タギングベクターpSK1015(Activation tagging vector pSK1015; Weigel et al., 2002, Plant Physiol., 122; 1003-1013;ドイツWeigel実験室で分譲)をエレクトロポレーション方法でアグロバクテリウム・ツメファシエンスABI菌株(Agrobacterium tumefaciences strain ABI; Lazo et al., 1991, Biotechnology 9:963-967;米国Amassino実験室で分譲)に導入させ、カナマイシン(kanamycin)とカルベニシリン(carbenicillin)の含まれた培地で選抜した。その後、pSK1015ベクターの挿入された前記アグロバクテリウム菌株をフローラルディッピング方法(Clough et al., 1998, Plant J., 16:735-743)でシロイヌナズナ野生型コロンビアに形質転換させた。前記形質転換されたシロイヌナズナの種子を受けてバスター除草剤に対する抵抗性のある形質転換体を選別し、約23℃の温室で5000個のT1ラインを成長させた。これらのうち、開花および成長が阻害されている植物を肉眼で観察し、野生型に比べて開花が遅く成長速度が阻害されている変異体1つのラインを選別して、前記変異体をsil1−1D(short internode and late flowering1)と命名した。
【0068】
その後、選抜されたシロイヌナズナ形質転換体(sil1−1D)とシロイヌナズナコロンビア野生型(Col(wt))を23℃の温度で16/8の周期で調節される生長調節器(growth chambers)内でそれぞれ栽培した。
【0069】
その結果、図1および図2から確認されるように、シロイヌナズナ形質転換体sil1−1Dは長日条件および短日条件でシロイヌナズナコロンビア野生型(Col(wt))に比べて花咲く時期が遅れるし、花咲く時点で葉の数が増加する開花遅延の表現型を示した。また、sil1−1Dは、図3に示されるように、完全に成長した後にも野生型に比べて背丈が半分程度であって成長が阻害されていることを確認することができた。
【0070】
<実施例2>前記表現型を示す形質転換植物体における過剰発現遺伝子の同定
【0071】
実施例1で選抜されたシロイヌナズナ形質転換体において開花遅延および/または成長阻害表現型に関与する遺伝子をクローニングするために、TAIL−PCR(Liu et al., 1995, Plant J. 8: 457-463)を行った。
【0072】
それぞれ配列番号3〜5の塩基配列を持つ3つの任意的プライマー(Arbitray Primer;AD1、AD2、AD3)と、配列番号6〜8の塩基配列を持つ3つの特異的プライマー(AT1、AT2、AT3と命名する)が使用された。PCRはApplied Biosystems社の2700 thermocyclersを使用した。Taq酵素はTakara Extaqを使用した。
【0073】
TAIL−PCRは3段階のPCR反応で行われたが、各段階のPCR反応は下記の条件で行われた。
【0074】
(第1段階のPCR反応)
第1段階のPCR反応において、鋳型DNAとしては実施例1で得られたシロイヌナズナ形質転換体からゲノムDNAを抽出し(Dellaporta et al., 1983, Plant Mol. Biol. Rep. 1:19-21)、全体25μLの量で、第1段階のPCRを行った。各反応は3つのチューブ(AD1、AD2或いはAD3)で行われた。第1段階のPCR反応における最終濃度および行われたサイクルの回数および条件は次のとおりである。
【0075】
(最終濃度)
鋳型DNA:100ng
AT1 0.2μM
AD1、AD2またはAD3プライマー 2μM
dNTP mix:0.8mM
Taq酵素:0.5U
【0076】
(一番目の反応サイクル)
93℃で1分、95℃で1分間反応した後、94℃で30秒、62℃で1分、72℃で2分30秒の3段階を5回繰り返し行い、94℃で30秒、25℃で3分を行う。その後、3分以上の時間をおいて72℃まで温度をゆっくり増加させた後、72℃で2.5分、94℃で10秒、68℃で1分、72℃で2分30秒、94℃で10秒、68℃で1分、72℃で2分30秒、94℃で10秒、44℃で1分、72℃で2分30秒の9段階を15回繰り返し行った後、72℃で1分を1回反応する。
【0077】
(第2段階のPCR反応)
第2段階のPCR反応において、鋳型DNAとしては第1段階のPCR反応溶液50μLから1μLを取り、滅菌した水49μLを入れて1/50に希釈して使用した。各1段階反応のときに使用した任意的プライマーを同様に使用して反応させた。全体反応溶液の量は25μLである。第2段階のPCR反応における最終濃度および行われたサイクルの回数および条件は次のとおりである。
【0078】
(最終濃度)
鋳型DNA:1μL
AT2 0.2μM
AD1、AD2またはAD3プライマー:2μM
dNTP mix:0.8mM
Taq酵素:0.5U
【0079】
(サイクルの回数および条件)
94℃で10秒、64℃で1分、72℃で2分30秒、94℃で10秒、64℃で1分、72℃で2分30秒、94℃で10秒、44℃で1分、72℃で2分30秒を各12回繰り返し行い、最後に72℃で1分間反応する。
【0080】
(第3段階のPCR反応)
第3段階のPCR反応において、鋳型DNAとしては第2段階のPCR反応溶液25μLから1μLを取り、滅菌した水9μLを入れて1/10に希釈して使用した。各1段階反応のときに使用した任意的プライマーを同様に使用して反応させた。全体反応溶液の量は50μLである。第3段階のPCR反応における最終濃度および行われたサイクルの回数および条件は次のとおりである。
【0081】
(最終濃度)
鋳型DNA:1μL
AT3 0.2μM
AD1、AD2またはAD3プライマー:2μM
dNTP mix:0.8mM
Taq酵素:1U
【0082】
(サイクルの回数および条件)
94℃で15秒、44℃で1分、72℃で2分30秒間各20回繰り返し行い、72℃で1分間反応する。
【0083】
前述したようにPCR反応を3段階にわたって行った後、その結果物に対してアガロースゲル電気泳動を行い、当該カラムを分離してシーケンサー(ABI3730;Applied Biosystem Inc.)でシケーシングした。
【0084】
決定された塩基配列に基づいて、シロイヌナズナゲノムデータベースを参照してエンハンサーと最も近い転写解読枠を探し出した。その結果、図4に示すように、シロイヌナズナゲノムにおけるAt5g10950プロモーター付近に挿入されていることを確認した。前記遺伝子は7つのアクソンからなっており(図5)、配列番号1に示される1185個の塩基配列と、配列番号2に示される395個のアミノ酸(図6)から構成された遺伝子であることを確認した。ここで、その遺伝子およびタンパク質をそれぞれSIL1遺伝子およびSIL1タンパク質と命名した。
【0085】
<実施例3>RNAゲルブロット(RNA gel Bolt)によるSIL1遺伝子の過剰発現有無の確認
【0086】
SIL1遺伝子が形質転換シロイヌナズナ(sil1−1D)で過剰発現したか否かを確認するために、SIL1 cDNA断片をプローブとして用いてRNAゲルブロットを行った。まず、シロイヌナズナコロンビア野生型(Col−O(wt))と、実施例1で得られたシロイヌナズナ形質転換体sil1−1DでTRIzol−Reagent(Ivitrogen)を用いて製造社の指針に従って全体RNAをそれぞれ抽出した。抽出した各RNA30μgを1.2%ホルムアルデヒド−アガロースゲル(formaldehyde-agarose gel)上で分離し、分離したRNAを真空輸送システム(GE healthcare Bioscience)を用いてナイロン膜(Hybond N+、GE healthcare Bioscience)に移した。ナイロン膜をUV−クロスリンカー(Stratagene)で紫外線に露出させた後、65℃で1時間乾燥させた。
【0087】
乾燥したナイロン膜を放射能標識プローブ(radio-labeled probes)で処理した後、Church and Gilbert溶液(25mMリン酸ナトリウム、1mM EDTA、7% SDS、1% BSA)を用いて65℃で16時間混成化(hybridization)反応を行った。
【0088】
この際、プローブとしてはシロイヌナズナcDNAにおいて配列番号9の正方向プライマー(forward primer)0.2uMと配列番号10の逆方向プライマー(reverse primer)、dNTP(それぞれ2.5mM)を加え、GeneAmp2700(Applied Biosystems)を用いてPCRを行った。
【0089】
PCRは95℃で3分間変性させ、各回毎に94℃で15秒、53℃で30秒、および72℃で1分30秒間35回のサイクルを行い、72℃で7分間加熱して反応を終了した。PCRで増幅された遺伝子を1%アガロースゲルで100Vで1時間電気泳動した後、遺伝子バンドを切り出してゲル溶出キット(Qiagen)を用いてSIL1遺伝子を溶出した。前記溶出したDNAとランダムプライミングキット(GE healthcare Bioscience、USA)と5μL dCTP(1mCi/μL、PerkinElmer)を用いて製造会社の使用法に従って放射能を標識してプローブとして使用した。
【0090】
前記混成化反応の後、ナイロン膜を65℃で2×SSC(Sodium chloride/Sodium citrate)および0.2% SDS(Sodium dodecyl sulfate)組成の洗浄液で10分間洗浄した後、1×SSCおよび0.1% SDS組成の洗浄液で10分間洗浄し、最後に0.1×SSCおよび0.1% SDS組成の洗浄液で洗浄した。洗浄したナイロン膜はBASフィルムに2日露出させた後、phosphorimager(BAS2000、Fuji)を用いて分析した。
【0091】
その分析結果を図7に示す。
【0092】
図7に示すように、野生型ではSIL1のmRNA発現が極めて低いか或いは殆どないが、これに対し、シロイヌナズナア形質転換体(sil1−1D)では前記遺伝子が相当高い水準に発現されることを確認することができた。
【0093】
<実施例4>SIL1遺伝子を含む発現ベクターおよび形質転換体の製造、並びに細胞内発現の観察
【0094】
実施例1で得られた形質転換シロイヌナズナの表現型がSIL1遺伝子の過剰発現によるものであるかを確認するために、まず、SIL1遺伝子をpCambia 1302ベクター(Caberra, Australia; Hajdukiewicz et al, 1994, Plant Mol. Biol. 25:989-994)に入れて発現した。
【0095】
このために、シロイヌナズナcDNAにおいて、実施例3で溶出して得たSIL1プローブDNAをGEM−T easy vector kit(Promega)を用いてTベクターにサブクローニングした。2μgの前記クローンをそれぞれ2μL(10U/μL)のNheIとSpeI制限酵素で、そして2μgのpCambia 1302は2μL(10U/μL)の制限酵素SpeIで37℃で2時間処理した後、ゲル溶出キットを用いて、SIL1遺伝子を含む1.19kbのDNA断片と10.5kbのpCambia 1302ベクターのDNA断片を溶出した後、T4リガーゼ(Roche)を1μL(1μg/μL)で処理して16℃で6時間反応させた。
【0096】
このように同定されたSIL1遺伝子を含むベクター(これをpCambia 1302−SIL1と命名)をエレクトロポレーション法を用いてアグロバクテリウム(Agrobacterium tumefacience AGL1 strain)に導入し、カナマイシンの含まれた培地で選抜した。
【0097】
その後、pCambia 1302−SIL1をクローンを持つアグバクテリウム菌株をフローラルディッピング方法(Clough et al., Plant J., 16(6):735-743, 1998)に従ってシロイヌナズナ野性型コロンビアに形質転換させた。
【0098】
その後、前記形質転換されたシロイヌナズナから種子を得た後、15μg/mLのハイグロマイシンの含まれた培地で抵抗性を示す形質転換体を選抜した。
【0099】
その後、前記形質転換されたシロイヌナズナを生長室で生長させた後、開花遅延および成長抑制様相を調べた結果、sil1−1D変異体で現れた老化遅延表現型がそのまま再現されることを確認することができた。
【0100】
このことから、開花遅延および成長抑制表現型がSIL1遺伝子の活性化を通じて現れたことが分かった。
【0101】
これらの中でも、一つのラインに対して葉を採取して1μg/μLのDAPI(4’,6-diamidino-2-phenylindole)試薬を処理した後、蛍光顕微鏡(Axio Vert 200;Carl Zeiss、Gottingen)を用いてSIL1−GFP(for green fluorescence protein)蛍光タンパク質の蛍光信号を観察した結果、図8に示すように、DAPIと共に核内に存在する。これはSIL1が細胞内の核で作用するタンパク質であることを示す。
【0102】
<実施例5>sil1−1Dの変異体におけるGAに対する下胚軸の成長長さ反応調査
【0103】
実施例1から分かるように、sil1−1Dの場合、長日条件と短日条件の両方ともで開花遅延を示し、成体の生長が阻害されており、葉が濃緑色を呈する現象を示している。これは多くの場合、GAの反応性または生合成が低くなったときに起こる現象である。よって、sil1−1DでGAの反応性を調べるために、白色光の下で多様な濃度のGAが入っている1%スクロース含有1/2Gamborg B5(Duchefa)培地で7日間培養した後、15個の幼い植物個体の下胚軸成長を調べた。
【0104】
図9に示すように、白色光の下でGAの濃度が増加するほど、野生型(Col)植物の下胚軸の成長が増加していることが分かる。これに対し、sil1−1Dは野生型に比べて下胚軸の成長に対する反応濃度が低く、反応性が劣っていることを確認することができる。これはsil1−1Dの下胚軸の成長においてGAに対する反応性が低くなっていることが分かる。
【0105】
<実施例6>sil1−1D変異体におけるパクロブトラゾール(Paclobutrazol)に対する発芽反応の調査
【0106】
一般なGAは実施例5で示した下胚軸の成長だけでなく、発芽にも作用すると知られている。下胚軸の成長に、或いは成体の大きさが小さい場合には細胞の長さ成長に問題があるが、このような細胞の長さ成長には一般にGA、オーキシン、ブラシノステロイド(BA)が関与するが、発芽の場合、GA、ABAなどの植物ホルモンが主に関与し、GAの反応も分子的に異なる原理によって反応するものと知られている。よって、sil1−1DがGAに対する反応性に欠陥を持つため開花遅延および/または矮性表現型が現れることを裏付けるために、GA生合成を妨害するパクロブトラゾール(PAC)を処理して野生型(Col)とsil1−1Dで発芽効率を比較した。図10に示すように、野生型は0.35mg/L PACを処理したときもほぼ100%の発芽効果を示すが、これに対し、sil1−1Dは約50%の発芽効果を示すなど、全般的にPACによるGA合成が阻害されたときに発芽効率が低くなり、発芽反応性も低い濃度で反応した。
【0107】
これはsil1−1DがGAに対する発芽効果の増進において反応性が低くなっていることを示唆する。また、データをまとめると、SIL1を過剰発現させたときにGAの反応性に影響を与えて、成体の成長が抑制され、開花が遅延する現象を見せるといえる。
【特許請求の範囲】
【請求項1】
下記(a)、(b)および(c)のポリペプチドよりなる群から選ばれる、開花遅延および/または成長抑制機能を有するポリペプチド:
(a)配列番号2に示されるアミノ酸配列全体を含むポリペプチド、
(b)配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド、
(c)前記(a)または(b)のポリペプチドと実質的に類似のポリペプチド。
【請求項2】
前記実質的に類似のポリペプチドは、配列番号2のアミノ酸配列と80%以上の配列相同性を有するポリペプチドであることを特徴とする、請求項1に記載の開花遅延および/または成長抑制機能を有するポリペプチド 。
【請求項3】
前記実質的に類似のポリペプチドは、配列番号2のアミノ酸配列と90%以上の配列相同性を有するポリペプチドであることを特徴とする、請求項1に記載の開花遅延および/または成長抑制機能を有するポリペプチド。
【請求項4】
前記実質的に類似のポリペプチドは、配列番号2のアミノ酸配列と95%以上の配列相同性を有するポリペプチドであることを特徴とする、請求項1に記載の開花遅延および/または成長抑制機能を有するポリペプチド。
【請求項5】
請求項1〜4のいずれか一つのポリペプチドを暗号化するポリヌクレオチド。
【請求項6】
下記(a)および(b)よりなる群から選ばれるポリヌクレオチド:
(a)配列番号1に示される塩基配列の一部分を含むポリヌクレオチド、
(b)配列番号1に示される塩基配列の一部分と実質的に類似のポリヌクレオチド。
【請求項7】
前記ポリヌクレオチドは、植物において開花遅延および/または成長抑制機能を有する遺伝子を同定または単離するのに使用されることを特徴とする、請求項6に記載のポリヌクレオチド。
【請求項8】
(II) 植物体において配列番号1の塩基配列からなる遺伝子、または配列番号1の塩基配列と類似の配列からなる遺伝子を過剰発現させる段階と、
(II)開花遅延表現型が誘発された植物体を選別する段階とを含んでなる、開花遅延表現型を有する植物体の製造方法。
【請求項9】
前記配列番号1の塩基配列と類似の配列からなる配列は、配列番号1の塩基配列と90%以上の配列相同性を有する配列であることを特徴とする、請求項8に記載の開花遅延表現型を有する植物体の製造方法。
【請求項10】
前記段階(II)の過剰発現させる段階は、請求項5のポリヌクレオチドを植物体に形質転換させる段階を含むことを特徴とする、請求項8に記載の開花遅延表現型を有する植物体の製造方法。
【請求項11】
前記形質転換させる段階は、(a)請求項5のポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに挿入させて組み換え発現ベクターを製作する段階と、(b)前記組み換えベクターを植物体に導入する段階とを含んでなることを特徴とする、請求項10に記載の開花遅延表現型を有する植物体の製造方法。
【請求項12】
前記形質転換させる段階は、 請求項5のポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに挿入させて組み換え発現ベクターを製作する段階と、前記組み換えベクターをアグロバクテリウムバクテリアに形質転換させる段階と、前記形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階とを含んでなることを特徴とする、請求項10に記載の開花遅延表現型を有する植物体の製造方法。
【請求項13】
前記形質転換させる段階は、配列番号1に示される塩基配列からなる遺伝子を含む組み換えベクターをアグロバクテリウムに形質転換させ、その形質転換されたアグロバクテリウムを植物に形質転換させることにより行われることを特徴とする、請求項10に記載の開花遅延表現型を有する植物体の製造方法。
【請求項14】
(II)植物体において配列番号1の塩基配列からなる遺伝子、または配列番号1の塩基配列と類似の配列からなる遺伝子を過剰発現させる段階と、
(II)成長抑制表現型が誘発された植物体を選別する段階とを含んでなることを特徴とする、成長抑制表現型を有する植物体の製造方法。
【請求項15】
前記配列番号1の塩基配列と類似の配列からなる配列は、配列番号1の塩基配列と90%以上の配列相同性を有する配列であることを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項16】
前記段階(II)の過剰発現させる段階は、請求項5のポリヌクレオチドを植物体に形質転換させる段階を含むことを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項17】
前記形質転換させる段階は、(a)請求項5のポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに挿入させて組み換え発現ベクターを製作する段階と、(b)前記組み換えベクターを植物体に導入する段階とを含んでなることを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項18】
前記形質転換させる段階は、請求項5のポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに挿入させて組み換え発現ベクターを製作する段階と、前記組み換えベクターをアグロバクテリウムバクテリアに形質転換させる段階と、前記形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階とを含んでなることを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項19】
前記形質転換させる段階は、配列番号1に示される塩基配列からなる遺伝子を含む組み換えベクターをアグロバクテリウムに形質転換させ、その形質転換されたアグロバクテリウムを植物に形質転換させることにより行われることを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項20】
(II)発現させようとする目的遺伝子、請求項5のポリヌクレオチドおよび調節ヌクレオチド配列を含む発現ベクターを植物体に形質転換させる段階と、
(II)開花遅延または成長抑制表現型が誘発された植物体を選別する段階とを含んでなる、形質転換植物体の選別方法。
【請求項21】
前記(II)発現ベクターを植物体に形質転換させる段階は、その発現ベクターをアグロバクテリウムバクテリアに形質転換させる段階と、前記形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階とを含んでなることを特徴とする、請求項20に記載の形質転換植物体の選別方法。
【請求項22】
前記(II)発現ベクターを植物体に形質転換させる段階は、配列番号1に示される塩基配列からなる遺伝子を含む組み換えベクターをアグロバクテリウムに形質転換させ、その形質転換されたアグロバクテリウムを植物に形質転換させることにより行われることを特徴とする、請求項20に記載の形質転換植物体の選別方法。
【請求項23】
請求項8〜13のいずれか1項に記載の方法によって得られた開花遅延表現型を有する植物体。
【請求項24】
請求項14〜19のいずれか1項に記載の方法によって得られた成長抑制表現型を有する植物体。
【請求項1】
下記(a)、(b)および(c)のポリペプチドよりなる群から選ばれる、開花遅延および/または成長抑制機能を有するポリペプチド:
(a)配列番号2に示されるアミノ酸配列全体を含むポリペプチド、
(b)配列番号2に示されるアミノ酸配列の実質的な部分を含むポリペプチド、
(c)前記(a)または(b)のポリペプチドと実質的に類似のポリペプチド。
【請求項2】
前記実質的に類似のポリペプチドは、配列番号2のアミノ酸配列と80%以上の配列相同性を有するポリペプチドであることを特徴とする、請求項1に記載の開花遅延および/または成長抑制機能を有するポリペプチド 。
【請求項3】
前記実質的に類似のポリペプチドは、配列番号2のアミノ酸配列と90%以上の配列相同性を有するポリペプチドであることを特徴とする、請求項1に記載の開花遅延および/または成長抑制機能を有するポリペプチド。
【請求項4】
前記実質的に類似のポリペプチドは、配列番号2のアミノ酸配列と95%以上の配列相同性を有するポリペプチドであることを特徴とする、請求項1に記載の開花遅延および/または成長抑制機能を有するポリペプチド。
【請求項5】
請求項1〜4のいずれか一つのポリペプチドを暗号化するポリヌクレオチド。
【請求項6】
下記(a)および(b)よりなる群から選ばれるポリヌクレオチド:
(a)配列番号1に示される塩基配列の一部分を含むポリヌクレオチド、
(b)配列番号1に示される塩基配列の一部分と実質的に類似のポリヌクレオチド。
【請求項7】
前記ポリヌクレオチドは、植物において開花遅延および/または成長抑制機能を有する遺伝子を同定または単離するのに使用されることを特徴とする、請求項6に記載のポリヌクレオチド。
【請求項8】
(II) 植物体において配列番号1の塩基配列からなる遺伝子、または配列番号1の塩基配列と類似の配列からなる遺伝子を過剰発現させる段階と、
(II)開花遅延表現型が誘発された植物体を選別する段階とを含んでなる、開花遅延表現型を有する植物体の製造方法。
【請求項9】
前記配列番号1の塩基配列と類似の配列からなる配列は、配列番号1の塩基配列と90%以上の配列相同性を有する配列であることを特徴とする、請求項8に記載の開花遅延表現型を有する植物体の製造方法。
【請求項10】
前記段階(II)の過剰発現させる段階は、請求項5のポリヌクレオチドを植物体に形質転換させる段階を含むことを特徴とする、請求項8に記載の開花遅延表現型を有する植物体の製造方法。
【請求項11】
前記形質転換させる段階は、(a)請求項5のポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに挿入させて組み換え発現ベクターを製作する段階と、(b)前記組み換えベクターを植物体に導入する段階とを含んでなることを特徴とする、請求項10に記載の開花遅延表現型を有する植物体の製造方法。
【請求項12】
前記形質転換させる段階は、 請求項5のポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに挿入させて組み換え発現ベクターを製作する段階と、前記組み換えベクターをアグロバクテリウムバクテリアに形質転換させる段階と、前記形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階とを含んでなることを特徴とする、請求項10に記載の開花遅延表現型を有する植物体の製造方法。
【請求項13】
前記形質転換させる段階は、配列番号1に示される塩基配列からなる遺伝子を含む組み換えベクターをアグロバクテリウムに形質転換させ、その形質転換されたアグロバクテリウムを植物に形質転換させることにより行われることを特徴とする、請求項10に記載の開花遅延表現型を有する植物体の製造方法。
【請求項14】
(II)植物体において配列番号1の塩基配列からなる遺伝子、または配列番号1の塩基配列と類似の配列からなる遺伝子を過剰発現させる段階と、
(II)成長抑制表現型が誘発された植物体を選別する段階とを含んでなることを特徴とする、成長抑制表現型を有する植物体の製造方法。
【請求項15】
前記配列番号1の塩基配列と類似の配列からなる配列は、配列番号1の塩基配列と90%以上の配列相同性を有する配列であることを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項16】
前記段階(II)の過剰発現させる段階は、請求項5のポリヌクレオチドを植物体に形質転換させる段階を含むことを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項17】
前記形質転換させる段階は、(a)請求項5のポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに挿入させて組み換え発現ベクターを製作する段階と、(b)前記組み換えベクターを植物体に導入する段階とを含んでなることを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項18】
前記形質転換させる段階は、請求項5のポリヌクレオチドを、調節ヌクレオチド配列を含む発現ベクターに挿入させて組み換え発現ベクターを製作する段階と、前記組み換えベクターをアグロバクテリウムバクテリアに形質転換させる段階と、前記形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階とを含んでなることを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項19】
前記形質転換させる段階は、配列番号1に示される塩基配列からなる遺伝子を含む組み換えベクターをアグロバクテリウムに形質転換させ、その形質転換されたアグロバクテリウムを植物に形質転換させることにより行われることを特徴とする、請求項14に記載の成長抑制表現型を有する植物体の製造方法。
【請求項20】
(II)発現させようとする目的遺伝子、請求項5のポリヌクレオチドおよび調節ヌクレオチド配列を含む発現ベクターを植物体に形質転換させる段階と、
(II)開花遅延または成長抑制表現型が誘発された植物体を選別する段階とを含んでなる、形質転換植物体の選別方法。
【請求項21】
前記(II)発現ベクターを植物体に形質転換させる段階は、その発現ベクターをアグロバクテリウムバクテリアに形質転換させる段階と、前記形質転換されたアグロバクテリウムバクテリアで植物体を形質転換させる段階とを含んでなることを特徴とする、請求項20に記載の形質転換植物体の選別方法。
【請求項22】
前記(II)発現ベクターを植物体に形質転換させる段階は、配列番号1に示される塩基配列からなる遺伝子を含む組み換えベクターをアグロバクテリウムに形質転換させ、その形質転換されたアグロバクテリウムを植物に形質転換させることにより行われることを特徴とする、請求項20に記載の形質転換植物体の選別方法。
【請求項23】
請求項8〜13のいずれか1項に記載の方法によって得られた開花遅延表現型を有する植物体。
【請求項24】
請求項14〜19のいずれか1項に記載の方法によって得られた成長抑制表現型を有する植物体。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公表番号】特表2012−518406(P2012−518406A)
【公表日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願番号】特願2011−551017(P2011−551017)
【出願日】平成22年2月23日(2010.2.23)
【国際出願番号】PCT/KR2010/001112
【国際公開番号】WO2010/095910
【国際公開日】平成22年8月26日(2010.8.26)
【出願人】(509242794)ポステック アカデミー‐インダストリー ファウンデーション (9)
【Fターム(参考)】
【公表日】平成24年8月16日(2012.8.16)
【国際特許分類】
【出願日】平成22年2月23日(2010.2.23)
【国際出願番号】PCT/KR2010/001112
【国際公開番号】WO2010/095910
【国際公開日】平成22年8月26日(2010.8.26)
【出願人】(509242794)ポステック アカデミー‐インダストリー ファウンデーション (9)
【Fターム(参考)】
[ Back to top ]

