間葉系細胞の分化調節剤およびこれを用いた医薬、並びに間葉系細胞への分化調節作用を有する物質のスクリーニング方法
【課題】間葉系細胞の分化を調節するための新規な剤、これを用いた医薬、並びに該医薬候補のスクリーニング方法の提供。
【解決手段】miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有し、間葉系細胞の分化を促進する、間葉系細胞の分化調節剤。上記分化調節剤を含む、医薬。miRNA−294を発現している間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物に対して被験物質を供給する工程と、前記間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比する、間葉系細胞への分化調節作用を有する物質のスクリーニング方法。
【解決手段】miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有し、間葉系細胞の分化を促進する、間葉系細胞の分化調節剤。上記分化調節剤を含む、医薬。miRNA−294を発現している間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物に対して被験物質を供給する工程と、前記間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比する、間葉系細胞への分化調節作用を有する物質のスクリーニング方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、間葉系細胞の分化調節剤(分化促進剤/分化抑制剤)およびこれを用いた医薬、並びに間葉系細胞への分化調節作用を有する物質のスクリーニング方法に関する。
【背景技術】
【0002】
近年、間葉系細胞の1種である骨芽細胞の分化を調節する様々なタンパク質が同定されているが、それらは骨形成蛋白質(Bone Morphogenetic Protein;BMP)のように種々の組織に作用してしまうような特異性の極めて低いタンパク質であるか、またはDNAに直接作用する転写制御因子である。例えばBMPは、強い骨誘導作用がある一方、筋肉等の軟部組織をも骨化させてしまうことから、医薬として用いるのは難しい。また。骨芽細胞の分化を調節する転写制御因子としてはcbfa1の他にホメオボックス遺伝子であるMsxやDlxが知られている。なかでも、Dlx5は、脊椎動物の個体の発生過程において骨組織に特異的に発現することが知られており、骨芽細胞の成熟に従ってDlx5遺伝子の発現レベルが増加し、Dlx5タンパク質が骨芽細胞の表現形質を遺伝子レベルで制御していることが報告されている。さらに、BMPの刺激によって骨芽細胞で特異的にDlx5遺伝子が誘導されること、このDlx5を過剰発現させた骨芽細胞では分化が著しく亢進していることが報告されている。
【0003】
ここで、従来、骨芽細胞の分化にmiRNA(マイクロRNA、microRNA)が関与する可能性が報告されている。miRNAは、細胞内在性の、20〜25塩基程度の非コードRNAである。miRNAは、ゲノムDNA上のmiRNA遺伝子から、まず数百〜数千塩基程度の長さの一次転写物(pri−miRNA)として転写される。次いで、プロセシングを受けて約60〜70塩基程度のヘアピン構造を有するpre−miRNAとなる。その後、核から細胞質内に移り、さらにプロセシングを受けて20〜25塩基程度の二量体(ガイド鎖およびパッセンジャー鎖)からなる成熟miRNAとなる。成熟miRNAは、そのうちのガイド鎖(アンチセンス鎖)がRISC(RNA-Induced Silencing Complex)と呼ばれるタンパク質と複合体を形成し、標的遺伝子のmRNAに作用することで、標的遺伝子の翻訳を阻害する働きをすることが知られている。
【0004】
具体的には、例えば特許文献1では、miR−125bが間葉系細胞の分化を抑制すること、および、当該miR−125bの機能抑制剤が間葉系細胞の分化を促進する分化促進剤として骨粗鬆症等の疾患を治療・予防するための医薬として用いられうること、が開示されている。
【0005】
また、本発明者らも、特許文献2において、別のmiRNAであるmiRNA−141、miRNA−200aが、ともにDlx5遺伝子の3’非翻訳領域への結合を介して間葉系細胞の分化を抑制すること、miRNA−208がEts1遺伝子を標的にして分化を抑制すること、これらのmiRNAの阻害剤が間葉系細胞の分化を促進する分化促進剤として骨粗鬆症等の疾患を予防・治療するための医薬として用いられうること、を開示している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2008−184450号公報
【特許文献2】国際公開第2010/058824号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述したように、miRNAを利用して間葉系細胞の分化を調節する技術はこれまでにもいくつか提案されているが、種々の疾患の予防・治療剤として決定的に有効なものは依然として開発されてはいないのが現状である。また、疾患の種類やその重篤度に応じた予防・治療剤のラインアップを充実させるという観点からも、数多くの分化調節剤やこれを用いた医薬、並びにかような医薬の候補となりうる物質のスクリーニング方法を開発することの意義は大きい。
【0008】
そこで本発明は、間葉系細胞の分化を調節するための新規な剤や、これを用いた医薬、並びにかような医薬の候補となりうる物質のスクリーニング方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題に鑑み鋭意研究を行った。その結果、miRNA−294が間葉系細胞の分化を促進する作用を有していることを見出し、本発明を完成させるに至った。
【0010】
すなわち、本発明の一形態によれば、miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有し、間葉系細胞の分化を促進する、間葉系細胞の分化調節剤が提供される。
【0011】
また、本発明の他の形態によれば、miRNA−294の阻害剤を有効成分として含有し、間葉系細胞の分化を抑制する、間葉系細胞の分化調節剤が提供される。
【0012】
上述した分化調節剤において、間葉系細胞は、好ましくは骨芽細胞である。
【0013】
本発明のさらに他の形態によれば、間葉系細胞の分化異常に起因する疾患を予防または治療するための医薬もまた、提供される。当該医薬は、上述した分化調節剤を含むものである。
【0014】
上述した医薬において、疾患は、好ましくは間葉系細胞の分化の障害に起因する疾患である。
【0015】
また、上述した医薬において好ましくは、間葉系細胞が骨芽細胞であり、疾患が骨粗鬆症、骨形成不全、および発達期における成長阻害からなる群から選択される1種または2種以上である。
【0016】
また、本発明のさらに他の形態によれば、間葉系細胞への分化調節作用を有する物質のスクリーニング方法もまた、提供される。当該方法は、miRNA−294を発現している間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物に対して被験物質を供給する工程と、前記間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比し、その対比結果に基づいて、前記被験物質の間葉系細胞への分化促進作用または分化抑制作用を評価する工程とを有するものである。
【発明の効果】
【0017】
本発明によれば、間葉系細胞の分化を調節するための新規な剤や、これを用いた医薬、並びにかような医薬の候補となりうる物質のスクリーニング方法が提供される。
【図面の簡単な説明】
【0018】
【図1】マウスのpre−miRNA−294の模式図である。
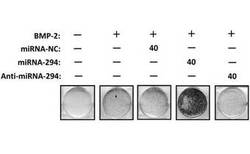
【図2】実施例1において、miRNA-294導入MC3T3-E1細胞におけるBMP-2誘導骨芽細胞分化への影響を調べた結果を示す写真である。
【図3】実施例2において、miRNA-294導入MC3T3-E1細胞のBMP-2誘導有無による分化への影響を調べた結果を示す写真である。
【図4】実施例3において、miRNA-294導入ヒト骨芽細胞株HFO-SV-40のBMP-2誘導有無による分化への影響を調べた結果を示す写真である。
【発明を実施するための形態】
【0019】
本明細書の開示は、miRNA−294およびその利用に関する。本明細書の開示は、miRNA−294が間葉系細胞の分化を促進する作用を有していることを見出したことに基づいている。すなわち、本明細書の開示によれば、miRNA−294、その前駆体およびこれらをコードするDNA構築物が間葉系細胞の分化を促進する分化調節剤として利用されうる。また、miRNA−294の阻害剤が間葉系細胞の分化を抑制する分化調節剤として利用されうる。さらに、本明細書の開示によれば、このような間葉系細胞の分化調節剤を用いた医薬や、間葉系細胞への分化調節作用を有する物質のスクリーニング方法も提供される。以下、本明細書の開示の実施形態について、より詳細に説明する。
【0020】
なお、以下の説明では、miRNA、pri−miRNA、pre−miRNAにおいて、最終的に標的となる遺伝子のmRNAと対合する、当該mRNAに対するアンチセンス鎖(または当該アンチセンス鎖を含むRNA領域)を「ガイド鎖」と表現する。一方、前記アンチセンス鎖に対するセンス鎖(または当該センス鎖を含むRNA領域)を「パッセンジャー鎖」と表現する。
【0021】
≪間葉系細胞の分化調節剤≫
本明細書に開示の分化調節剤は、間葉系細胞への分化を調節するものである。したがって、分化調節剤の適用対象は、間葉系細胞への分化能を有する細胞である。間葉系細胞への分化能を有する細胞の種類としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、間葉系幹細胞および間葉系前駆細胞が挙げられる。間葉系幹細胞および間葉系前駆細胞の入手方法としても、特に制限はなく、目的に応じて適宜選択することができ、例えば、個体の骨髄等から単離することにより得ることもできるし、既にクローン化された間葉系幹細胞として各種機関から入手することもできる。このような既にクローン化された間葉系幹細胞としては、特に制限はなく、目的に応じて適宜選択することができる。例えば、マウス由来の間葉系幹細胞としては、頭蓋骨由来前駆骨芽細胞であるMC3T3−E1、骨髄由来前脂肪細胞であるST2細胞、NRG細胞などが挙げられる(それぞれ独立行政法人理化学研究所バイオリソースセンター(BRC)から入手可能である)。なお、間葉系幹細胞以外の細胞であっても、間葉系細胞への分化能を有する細胞であれば、分化調節剤の適用対象として用いられうる。
【0022】
また、間葉系細胞の種類についても特に制限はなく、目的に応じて適宜選択することができ、例えば、骨芽細胞、脂肪細胞、筋細胞、軟骨細胞などが挙げられる。なかでも、特に骨芽細胞が好ましい。
【0023】
本発明の一形態に係る間葉系細胞の分化調節剤は、miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有する。この場合、当該分化調節剤は、間葉系細胞の分化を促進する作用を有するものである。
【0024】
(miRNA−294)
上述した分化調節剤が有効成分として含みうるマウスmiRNA−294の成熟配列(ガイド鎖の配列)は、以下に示すとおりである。
【0025】
【化1】

【0026】
なお、ヒトmiRNA−294の存在については、文献(Gurman Singh Pall et al., Nucleic Acids Research, 2007, Vol. 35, No. 8, e60)において示唆されている。当該文献においてヒトmiRNA−294の塩基配列は記載されていないが、後述する実施例において上記マウスmiRNA−294が間葉系細胞の分化誘導作用を示していることから、ヒトmiRNA−294の塩基配列はマウスmiRNA−294のものとほとんど同一であると考えられる。
【0027】
このようなmiRNA−294は、その塩基配列に基づき、従来公知の手法を用いて、天然物から単離することにより、化学的に合成することにより、あるいはin vivoまたはin vitroで遺伝子工学的に生産させることができる。また、このmiRNA−294は、内在性の成熟型miRNAを模倣するように合成された類縁体であってもよい。こうした類縁体としては、例えば、Ambion社などから入手可能である。こうしたmiRNA−294は、一本鎖であってもよいし、相補鎖を備える二本鎖であってもよい。
【0028】
(miRNA−294の前駆体)
miRNA−294の前駆体としては、例えば、pri−miRNA、pre−miRNAなどが挙げられる。その具体例としては、例えば、マウスについて以下に示すpre−miRNA−294がそれぞれ挙げられる。ここで、図1に、マウスのpre−miRNA−294の模式図を示す。なお、ヒトのpri−miRNA−294やpre−miRNA−294の塩基配列についても、マウスのものに対して高度に保存されていると考えられる。
【0029】
このようなmiRNA−294の前駆体も、従来公知の手法を用いて、天然物から単離することにより、化学的に合成することにより、あるいはin vivoまたはin vitroで遺伝子工学的に生産させることができる。さらに、miRNA−294の前駆体としては、内在性のmiRNA−294の前駆体を模倣するように合成された、miRNA−294の前駆体の類縁体を同様に用いることもできる。miRNA−294の前駆体は、一本鎖であってもよいし、二本鎖であってもよい。
【0030】
【化2】

【0031】
(miRNA等のDNA構築物)
上述したmiRNA−294またはその前駆体をコードするDNAを転写可能に保持するDNA構築物は、in vivoまたはin vitroでこれらのmiRNA−294またはその前駆体を転写可能にコードしたDNAコンストラクトである。たとえば、in vitroでmiRNA−294またはその前駆体を転写可能なコンストラクトは、ウイルスプロモーターの制御下にmiRNA−294またはその前駆体をコードするDNAを連結したベクターが挙げられる。また、in vivoでmiRNA−294またはその前駆体を転写可能なコンストラクトは、哺乳類細胞で有効なプロモーターの制御下にmiRNA−294またはその前駆体をコードするDNAを連結したベクターが挙げられる。このようなin vivoまたはin vitro転写用のベクターは商業的に入手が可能であり、そのプロトコールに従い、miRNA−294またはその前駆体の塩基配列に基づけば、容易にかかるベクターを構築できる。
【0032】
(miRNA−294の阻害剤)
miRNA−294の阻害剤は、miRNA−294の機能を低下させる物質であればよく、その具体的な形態について特に制限はない。このような阻害剤としては、例えば、miRNA−294またはその前駆体のガイド鎖の少なくとも一部の相補鎖である第1のRNA鎖(いわゆる「アンチセンスmiRNA」)が挙げられる。この第1のRNA鎖における相補鎖は、必ずしもmiRNA−294またはその前駆体の全体の相補鎖である必要はなく、その機能を低下させる作用を有する限り、その一部の相補鎖であってもよい。また、完全な相補鎖である必要はなく、miRNA−294やその前駆体の機能を低下させる作用を有する限り、不完全な相補鎖であってもよい。
【0033】
第1のRNA鎖は、内在性のmiRNA−294またはその前駆体におけるガイド鎖に対するパッセンジャー鎖と比較して相補性が高められているものであることが好ましい。すなわち、内在性のmiRNA−294において、ガイド鎖とパッセンジャー鎖との間に、ミスマッチが存在する場合、そのようなミスマッチの個数が第1のRNA鎖において低減されていることが好ましい。ミスマッチをどの程度低減すればよいかは特に限定されないが、第1のRNA鎖が阻害剤として機能する限り、すべてのミスマッチを解消する必要はなく、当該ミスマッチの一部のみが解消されているものであってもよい。阻害剤としての相補鎖において解消されるミスマッチの箇所(内在性miRNA−294のガイド鎖における位置)は特に限定されないが、3’末端側にあるミスマッチが解消されているものが、阻害剤としては好ましい。
【0034】
miRNA−294の阻害剤は、第1のRNA鎖とmiRNA−294またはその前駆体のガイド鎖である第2のRNA鎖とを備えていてもよい。こうした二本鎖状態であっても阻害剤として有効である。
【0035】
上述した第1のRNA鎖および第2のRNA鎖は、化学合成により、または遺伝子工学的に製造できるほか、Ambion社等から商業的に入手することも可能である。第1のRNA鎖および第2のRNA鎖には、細胞内等における安定性を確保する観点から、その塩基、糖等において適宜修飾が施されていてもよい。例えば、miRNA−294またはその前駆体とより強固に二本鎖を形成し、より効果的にmiRNA−294またはその前駆体の機能を阻害する(低下させる)ことができる点で、例えば、PNA(ペプチド核酸)やLNA(Locked Nucleic Acid)等の修飾を有したものであることが好ましい。前記LNA(Locked Nucleic Acid)等の修飾を有する相補鎖としては、例えば、miRCURY Knockdown Probes(Exiqon社)などを利用することができる(例えば、Biomedecine & Pharmacotherapy, Volume 60, Issue 9, November 2006, Pages 633-638参照)。また、相補鎖としては、細胞内で分解されることを阻止してより安定に存在することができ、例えば、2’−O−メチル等の修飾を有したものであることも好ましい(例えば、Nucleic Acids Research, 2003, Vol. 31, No. 11, 2705-2716参照)。
【0036】
阻害剤としては、miRNA−294またはその前駆体に対する第1のRNA鎖をコードするDNA、あるいは、第1のRNA鎖および第2のRNA鎖をコードするDNAを転写可能に保持するDNA構築物であってもよい。かかるDNA構築物は、in vivoまたはin vitro転写用のベクターを用いることで容易に得ることができる。
【0037】
本明細書に開示の分化調節剤の有効成分は、目的に応じて選択される。すなわち、分化調節剤を、間葉系細胞の分化を促進する目的で利用する場合、miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有させることができる。また、分化調節剤を間葉系細胞の分化を抑制する目的で利用する場合、上述したmiRNA−294の阻害剤を有効成分として含有させることができる。有効成分は、同一の目的に寄与する有効成分を1種単独で使用してもよいし、2種以上を併用してもよい。また、間葉系細胞の分化調節剤中の有効成分の含有量について特に制限はなく、目的に応じて適宜設定することができる。
【0038】
本明細書に開示の分化調節剤は、上記の有効成分のみを含有していてもよいが、必要に応じてそのほかの成分を含むことができる。その他の成分としては、特に制限はなく、目的に応じて適宜選択することができる。例えば、上記の有効成分を所望の濃度に希釈等するための、水、各種緩衝液などが挙げられる。また、前記その他の成分としては、間葉系細胞への分化を抑制または促進したい細胞(対象細胞;例えば、骨芽細胞等の間葉系幹細胞)に有効成分を導入するための、導入用試薬なども挙げられる。前記導入用試薬としては、特に制限はなく、目的に応じて適宜選択することができるが、例えば、Lipofectamine 2000(Invitrogen社)などが挙げられる。
【0039】
本明細書に開示の分化調節剤は、間葉系幹細胞または間葉系前駆細胞等の間葉系細胞への分化を促進または抑制することができる。したがって、当該分化調節剤は、間葉系細胞への分化に関連する疾患を予防または治療するための医薬として用いられうる。また、間葉系細胞への分化に関連する研究試薬や医薬の評価並びにスクリーニングにも好ましく用いられうる。
【0040】
≪間葉系細胞の分化異常に起因する疾患を予防または治療するための医薬≫
本明細書に開示の医薬は、間葉系細胞の分化異常に起因する疾患を予防または治療するための医薬であって、上述した分化調節剤を有効成分として含むものである。この際、分化調節剤としては、本明細書に既に開示した各種の分化調節剤から、医薬が対象とする疾患の種類に応じて選択される。本明細書に開示の医薬が間葉系細胞の分化の障害に起因する疾患であるときには、miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上が医薬の有効成分として用いられうる。一方、本明細書に開示の医薬が間葉系細胞の分化過剰に起因する疾患であるときには、上述したmiRNA−294の阻害剤が医薬の有効成分として用いられうる。
【0041】
本明細書に開示の医薬における分化調節剤の含有量について特に制限はなく、目的に応じて適宜選択することができる。また、本明細書に開示の医薬は、有効成分のみからなっていてもよいが、必要に応じてそのほかの成分を含むことができる。その他の成分としては、特に制限はなく、目的に応じて適宜選択することができる。典型的には、薬学上許容されうる担体などが挙げられる。前記担体としても特に制限はなく、例えば、医薬の剤型等に応じて適宜選択することができる。また、医薬中のその他の成分の含有量としても特に制限はなく、目的に応じて適宜選択することができる。
【0042】
本明細書に開示の医薬は、従来公知の各種の製剤形態を採ることができる。後述するような所望の投与方法に応じて適宜選択することができ、例えば、経口固形剤(錠剤、被覆錠剤、顆粒剤、散剤、カプセル剤等)、経口液剤(内服液剤、シロップ剤、エリキシル剤等)、注射剤(溶液、懸濁液、用時溶解用固形剤等)、軟膏剤、貼付剤、ゲル剤、クリーム剤、外用散剤、スプレー剤、吸入散剤などが挙げられる。こうした各種製剤において適宜必要とされる添加剤は、当業者において周知であり、当業者であれば目的に応じて種々の製剤を製造することができる。
【0043】
本明細書に開示の医薬は、好ましくは、投与対象または投与対象から採取された細胞を含む組織に対して、細胞内への医薬のトランスフェクションに適した製剤形態を採る。例えば、適用部位に応じた注射製剤(皮下注射、静脈注射、筋肉注射、骨髄注射、歯髄注射、腹腔内注射等)の形態をとることができる。注射剤は、例えば、有効成分のほか、pH調節剤、緩衝剤、安定化剤、等張化剤、局所麻酔剤等を添加し、常法により皮下用、筋肉内用、静脈内用等の注射剤を製造することができる。なお、pH調節剤および緩衝剤としては、例えば、クエン酸ナトリウム、酢酸ナトリウム、リン酸ナトリウムなどが挙げられる。安定化剤としては、例えば、ピロ亜硫酸ナトリウム、EDTA、チオグリコール酸、チオ乳酸などが挙げられる。等張化剤としては、例えば、塩化ナトリウム、ブドウ糖などが挙げられる記局所麻酔剤としては、例えば、塩酸プロカイン、塩酸リドカインなどが挙げられる。
【0044】
本明細書に開示の医薬の投与方法は特に限定されないが、医薬の剤型に応じて適宜選択される。上記のとおり、本明細書に開示の医薬は、例えば、有効成分を、患者における細胞や組織に対して導入することにより投与することができる。なお、細胞や組織は、間葉系幹細胞や間葉系前駆細胞が存在する箇所であることが好ましい。例えば、骨芽細胞への分化異常に起因する疾患においては、骨芽細胞への幹細胞や前駆細胞が存在する箇所、典型的には骨髄等を投与対象とすることが好ましい。
【0045】
また、患者等から採取した間葉系幹細胞や間葉系前駆細胞またはこれらを含む組織に導入し、その細胞を患者に移植することにより投与することができる。導入方法について特に制限はなく、例えば、従来公知のリポフェクションやエレクトロポレーション等の方法を適宜選択して利用することができる。患者の生体外でトランスフェクションを行った細胞を患者に移植する方法としても特に制限なく、例えば、従来公知の細胞移植方法が適宜利用されうる。例えば、体外でリポソームやその他のナノ粒子に包埋して全身投与、または局所投与すればよい。
【0046】
なお、本明細書に開示の医薬の投与量としては、特に制限はなく、投与対象である患者の年齢、体重、所望の効果の程度等に応じて適宜選択することができる。また、その投与回数としては、特に制限はなく、投与対象である患者の年齢、体重、所望の効果の程度等に応じて適宜選択することができる。さらに、その投与時期としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、間葉系細胞の分化異常(抑制や過剰)に起因する疾患に対して、予防的に投与されてもよいし、治療的に投与されてもよい。本明細書に開示の医薬の投与対象となる哺乳動物としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ヒトのほか、マウス、ラット、ウシ、ブタ、サル、イヌ、ネコなどの非ヒト哺乳動物が挙げられる。
【0047】
本明細書に開示の医薬が予防または治療の対象とする疾患は、間葉系細胞の分化異常(抑制や過剰)に起因する疾患である。間葉系細胞の分化抑制(分化不足)に起因する疾患としては、骨芽細胞の分化抑制または分化不足に起因する、骨粗鬆症(閉経後骨粗鬆症、老人性骨粗鬆症、ステロイド治療による骨粗鬆症、糖尿病性骨粗鬆症)、骨形成不全、発達期における成長阻害等が挙げられる。また、間葉系細胞の分化過剰に起因する疾患としては、例えば、骨芽細胞の分化過剰に起因する、骨芽細胞型骨肉腫等が挙げられる。
【0048】
≪分化調節剤の評価方法および間葉系細胞への分化調節作用を有する物質のスクリーニング方法≫
本明細書の開示によれば、間葉系細胞の分化調節剤の評価方法もまた、提供される。当該評価方法では、miRNA−294の発現および/または機能の増大または低下を指標とすることができる。この評価方法によれば、間葉系細胞の分化を調節(促進または抑制)できる分化調節剤を得ることができる。
【0049】
上記評価方法は、典型的には、miRNA−294を発現している間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物に対して被験物質を供給する工程(供給工程)と、前記間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比し、その対比結果に基づいて、前記被験物質の間葉系細胞への分化促進作用または分化抑制作用を評価する工程(評価工程)とを有する。当該評価方法は、上述した「評価する工程」の後に、間葉系幹細胞の分化を促進または抑制する被験物質を選択する工程を備えることができる。言い換えれば、上記評価方法は、間葉系細胞への分化調節作用を有する物質のスクリーニング方法であるとも言える。
【0050】
被験物質としては、例えばタンパク質、ペプチド、非ペプチド性化合物、合成化合物、発酵生産物、細胞抽出液、植物抽出液、動物組織抽出液などが挙げられ、これらの物質は新規なものであってもよいし、公知のものであってもよい。
【0051】
上記した供給工程には、既に説明したように、本明細書に開示の分化調節剤や医薬を細胞または患者等に投与する際に用いられる従来公知のトランスフェクトの方法が採用されうる。
【0052】
上記した評価工程では、間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比し、その対比結果に基づいて、前記被験物質の間葉系細胞への分化促進作用または分化抑制作用を評価する。評価の具体的な方法については特に制限はなく、目的に応じて適宜選択することができる。例えば、被験物質の存在下(供給時)および非存在下(非供給時)での内在性miRNA−294の発現量を測定し、発現の評価指標とすることができる。また、骨芽細胞に対する間葉系幹細胞や間葉系前駆細胞を細胞として用いる場合には、アルカリフォスファターゼの活性等の各種の骨芽細胞への分化指標を評価指標として用いることもできる。
【0053】
評価工程では、例えば、被験物質の非存在下(非供給時)と比べて、被験物質の存在下(供給時)においてmiRNA−294等の発現量等が増大するときには、当該被験物質が内在性miRNA−294の作用を増大させると評価することができる。すなわち、被験物質は、間葉系細胞への分化を促進する作用を有する物質であると評価できる。一方、被験物質の存在下においてmiRNA−294等の発現量等が低下するときには、当該被験物質は、内在性miRNA−294の作用を低下させると評価することができる。すなわち、被験物質は、間葉系細胞への分化を抑制する作用を有する物質であと評価できる。
【0054】
なお、以上の供給工程または評価工程のいずれかあるいはこれらの工程の間において、適宜、間葉系幹細胞や間葉系前駆細胞の間葉系細胞への分化を誘導する処理を施しておいてもよい。分化誘導処理としては、例えば、骨芽細胞への誘導処理には、BMP−2等を用いることができる。かかる分化誘導処理下で被験物質の作用を評価することで、一層明確に被験物質の分化抑制能や分化促進能を検出することができる。
【0055】
また、上述したように、本発明に係る評価方法(スクリーニング方法)は、上述した評価工程の後に、間葉系幹細胞の分化を促進または抑制する被験物質を選択する工程(選択工程)を備えることができる。選択工程は、間葉系細胞への分化を促進または抑制する作用を有する物質であると評価された被験物質を間葉系細胞への分化調節剤として選択する工程である。選択された被験物質は、本明細書に開示の分化調節剤および医薬の有効成分として、またはその候補として、有用である。
【実施例】
【0056】
以下、本発明の実施例を説明するが、本発明は、これらの実施例に何ら限定されるものではない。
【0057】
[実施例1:miRNA-294導入MC3T3-E1細胞におけるBMP-2誘導骨芽細胞分化への影響]
以下の手法により、BMP-2で誘導されたマウスMC3T3-E1細胞(頭蓋骨由来前駆骨芽細胞)の骨芽細胞への分化にmiRNA-294の導入が及ぼす影響を調べた。なお、マウスMC3T3-E1細胞は、間葉系幹細胞の1種である。
【0058】
具体的には、マウス内在性miRNA分子を模倣するように合成されたmiRNA-294、そのアンチセンス阻害剤であるAnti-miRNA-294、および、miRNA-Negative Control(いずれも、アプライドバイオサイエンス社製)を、それぞれLipofectamime(登録商標)RNAiMAX(Invitrogen社製)を用いたリポフェクション法により、MC3T3-E1細胞に終濃度が40nMとなるように導入した。
【0059】
次いで、上述した各導入細胞と何も導入していないコントロール細胞(BMP-2添加あり、なし)のそれぞれを、OPTI-MEM無血清培地(Invitrogen社製)で18時間培養後、MEM-α(10%FBS,100U/mlペニシリン、100μg/mlストレプトマイシン含有)に培地交換後72時間培養した。その後、96ウェルマルチプレートに1×105細胞/mlに調整した細胞を500μl/ウェルずつ播種し、播種3時間後にBMP-2(ベクトンディッキンソン社製)を終濃度が200ng/mlとなるように加えて分化を誘導し、72時間培養した。
【0060】
その後、PBS(-)により2度洗浄し、エタノールにて細胞固定後、分化指標であるアルカリフォスファターゼ(ALP;Alkaline phosphatase)をTRACP&ALP double-staining Kit (タカラバイオ社製)を用いて染色し、各細胞の分化の程度を評価した。結果を図2に示す。
【0061】
図2に示すように、BMP-2を添加するとMC3T3-E1細胞の骨芽細胞への分化が誘導されるが、miRNA-294を導入すると、BMP-2により誘導されたMC3T3-E1細胞の骨芽細胞への分化がよりいっそう増強されることが確認された。一方、miRNA-294のアンチセンス阻害剤であるAnti-miRNA-294を導入すると、BMP-2により誘導されたMC3T3-E1細胞の骨芽細胞への分化が減弱することが確認された。なお、miRNA-Negative Controlを導入しても、BMP-2により誘導されたMC3T3-E1細胞の骨芽細胞への分化に影響はなかった。
【0062】
以上のことから、miRNA-294は間葉系幹細胞の骨芽細胞への分化を促進する作用を有することが示された。また、Anti-miRNA-294は間葉系幹細胞の骨芽細胞への分化を抑制する作用を有することが示された。
【0063】
[実施例2:miRNA-294導入MC3T3-E1細胞のBMP-2誘導有無による分化への影響]
BMP-2を添加しなかったこと以外は、上述した実施例1と同様の手法により、マウスMC3T3-E1細胞の骨芽細胞への分化にmiRNA-294の導入が及ぼす影響を調べた。その結果を、BMP-2を添加した場合と比較して図3に示す。なお、図3において、「BMP-2(-)」はBMP-2を添加しなかった群の結果を示し、「BMP-2(+)」はBMP-2を添加した群の結果を示す。
【0064】
図3の「BMP-2(+)」に示すように、BMP-2を添加するとMC3T3-E1細胞の分化は誘導され、miRNA-294を導入したMC3T3-E1細胞ではさらにその分化能が著しく高まった(上述した実施例1の確認)。一方、図3の「BMP-2(-)」に示すように、BMP-2を添加しなくても(予め分化を誘導しなくても)、miRNA-294を導入したMC3T3-E1細胞では、その分化能が上昇した。
【0065】
以上のことから、miRNA-294は単独で用いられて細胞へ導入されても分化促進作用を示すことが示唆された。
【0066】
[実施例3:miRNA-294導入ヒト骨芽細胞株のBMP-2誘導有無による分化への影響]
MC3T3-E1細胞に代えて、ヒト骨芽細胞株であるHFO-SV-40細胞を用いたこと以外は、上述した実施例2と同様の実験を行った。結果を図4に示す。なお、図4において、「BMP-2(-)」はBMP-2を添加しなかった群の結果を示し、「BMP-2(+)」はBMP-2を添加した群の結果を示す。
【0067】
図4に示すように、MC3T3-E1細胞を用いた同様の実験(実施例2、図3)よりも作用は弱いものの、miRNA-294はやはり骨芽細胞の分化を促進する作用を示した。
【0068】
以上のことから、miRNA-294は種を越えても同様に間葉系細胞の分化促進作用を示すことが示唆された。
【配列表フリーテキスト】
【0069】
〔配列番号:1〕
マウスmiRNA−294の成熟配列(ガイド鎖の配列)のRNA配列である。
〔配列番号:2〕
マウスpre−miRNA−294のRNA配列である。
【技術分野】
【0001】
本発明は、間葉系細胞の分化調節剤(分化促進剤/分化抑制剤)およびこれを用いた医薬、並びに間葉系細胞への分化調節作用を有する物質のスクリーニング方法に関する。
【背景技術】
【0002】
近年、間葉系細胞の1種である骨芽細胞の分化を調節する様々なタンパク質が同定されているが、それらは骨形成蛋白質(Bone Morphogenetic Protein;BMP)のように種々の組織に作用してしまうような特異性の極めて低いタンパク質であるか、またはDNAに直接作用する転写制御因子である。例えばBMPは、強い骨誘導作用がある一方、筋肉等の軟部組織をも骨化させてしまうことから、医薬として用いるのは難しい。また。骨芽細胞の分化を調節する転写制御因子としてはcbfa1の他にホメオボックス遺伝子であるMsxやDlxが知られている。なかでも、Dlx5は、脊椎動物の個体の発生過程において骨組織に特異的に発現することが知られており、骨芽細胞の成熟に従ってDlx5遺伝子の発現レベルが増加し、Dlx5タンパク質が骨芽細胞の表現形質を遺伝子レベルで制御していることが報告されている。さらに、BMPの刺激によって骨芽細胞で特異的にDlx5遺伝子が誘導されること、このDlx5を過剰発現させた骨芽細胞では分化が著しく亢進していることが報告されている。
【0003】
ここで、従来、骨芽細胞の分化にmiRNA(マイクロRNA、microRNA)が関与する可能性が報告されている。miRNAは、細胞内在性の、20〜25塩基程度の非コードRNAである。miRNAは、ゲノムDNA上のmiRNA遺伝子から、まず数百〜数千塩基程度の長さの一次転写物(pri−miRNA)として転写される。次いで、プロセシングを受けて約60〜70塩基程度のヘアピン構造を有するpre−miRNAとなる。その後、核から細胞質内に移り、さらにプロセシングを受けて20〜25塩基程度の二量体(ガイド鎖およびパッセンジャー鎖)からなる成熟miRNAとなる。成熟miRNAは、そのうちのガイド鎖(アンチセンス鎖)がRISC(RNA-Induced Silencing Complex)と呼ばれるタンパク質と複合体を形成し、標的遺伝子のmRNAに作用することで、標的遺伝子の翻訳を阻害する働きをすることが知られている。
【0004】
具体的には、例えば特許文献1では、miR−125bが間葉系細胞の分化を抑制すること、および、当該miR−125bの機能抑制剤が間葉系細胞の分化を促進する分化促進剤として骨粗鬆症等の疾患を治療・予防するための医薬として用いられうること、が開示されている。
【0005】
また、本発明者らも、特許文献2において、別のmiRNAであるmiRNA−141、miRNA−200aが、ともにDlx5遺伝子の3’非翻訳領域への結合を介して間葉系細胞の分化を抑制すること、miRNA−208がEts1遺伝子を標的にして分化を抑制すること、これらのmiRNAの阻害剤が間葉系細胞の分化を促進する分化促進剤として骨粗鬆症等の疾患を予防・治療するための医薬として用いられうること、を開示している。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2008−184450号公報
【特許文献2】国際公開第2010/058824号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述したように、miRNAを利用して間葉系細胞の分化を調節する技術はこれまでにもいくつか提案されているが、種々の疾患の予防・治療剤として決定的に有効なものは依然として開発されてはいないのが現状である。また、疾患の種類やその重篤度に応じた予防・治療剤のラインアップを充実させるという観点からも、数多くの分化調節剤やこれを用いた医薬、並びにかような医薬の候補となりうる物質のスクリーニング方法を開発することの意義は大きい。
【0008】
そこで本発明は、間葉系細胞の分化を調節するための新規な剤や、これを用いた医薬、並びにかような医薬の候補となりうる物質のスクリーニング方法を提供することを目的とする。
【課題を解決するための手段】
【0009】
本発明者らは、上記課題に鑑み鋭意研究を行った。その結果、miRNA−294が間葉系細胞の分化を促進する作用を有していることを見出し、本発明を完成させるに至った。
【0010】
すなわち、本発明の一形態によれば、miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有し、間葉系細胞の分化を促進する、間葉系細胞の分化調節剤が提供される。
【0011】
また、本発明の他の形態によれば、miRNA−294の阻害剤を有効成分として含有し、間葉系細胞の分化を抑制する、間葉系細胞の分化調節剤が提供される。
【0012】
上述した分化調節剤において、間葉系細胞は、好ましくは骨芽細胞である。
【0013】
本発明のさらに他の形態によれば、間葉系細胞の分化異常に起因する疾患を予防または治療するための医薬もまた、提供される。当該医薬は、上述した分化調節剤を含むものである。
【0014】
上述した医薬において、疾患は、好ましくは間葉系細胞の分化の障害に起因する疾患である。
【0015】
また、上述した医薬において好ましくは、間葉系細胞が骨芽細胞であり、疾患が骨粗鬆症、骨形成不全、および発達期における成長阻害からなる群から選択される1種または2種以上である。
【0016】
また、本発明のさらに他の形態によれば、間葉系細胞への分化調節作用を有する物質のスクリーニング方法もまた、提供される。当該方法は、miRNA−294を発現している間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物に対して被験物質を供給する工程と、前記間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比し、その対比結果に基づいて、前記被験物質の間葉系細胞への分化促進作用または分化抑制作用を評価する工程とを有するものである。
【発明の効果】
【0017】
本発明によれば、間葉系細胞の分化を調節するための新規な剤や、これを用いた医薬、並びにかような医薬の候補となりうる物質のスクリーニング方法が提供される。
【図面の簡単な説明】
【0018】
【図1】マウスのpre−miRNA−294の模式図である。
【図2】実施例1において、miRNA-294導入MC3T3-E1細胞におけるBMP-2誘導骨芽細胞分化への影響を調べた結果を示す写真である。
【図3】実施例2において、miRNA-294導入MC3T3-E1細胞のBMP-2誘導有無による分化への影響を調べた結果を示す写真である。
【図4】実施例3において、miRNA-294導入ヒト骨芽細胞株HFO-SV-40のBMP-2誘導有無による分化への影響を調べた結果を示す写真である。
【発明を実施するための形態】
【0019】
本明細書の開示は、miRNA−294およびその利用に関する。本明細書の開示は、miRNA−294が間葉系細胞の分化を促進する作用を有していることを見出したことに基づいている。すなわち、本明細書の開示によれば、miRNA−294、その前駆体およびこれらをコードするDNA構築物が間葉系細胞の分化を促進する分化調節剤として利用されうる。また、miRNA−294の阻害剤が間葉系細胞の分化を抑制する分化調節剤として利用されうる。さらに、本明細書の開示によれば、このような間葉系細胞の分化調節剤を用いた医薬や、間葉系細胞への分化調節作用を有する物質のスクリーニング方法も提供される。以下、本明細書の開示の実施形態について、より詳細に説明する。
【0020】
なお、以下の説明では、miRNA、pri−miRNA、pre−miRNAにおいて、最終的に標的となる遺伝子のmRNAと対合する、当該mRNAに対するアンチセンス鎖(または当該アンチセンス鎖を含むRNA領域)を「ガイド鎖」と表現する。一方、前記アンチセンス鎖に対するセンス鎖(または当該センス鎖を含むRNA領域)を「パッセンジャー鎖」と表現する。
【0021】
≪間葉系細胞の分化調節剤≫
本明細書に開示の分化調節剤は、間葉系細胞への分化を調節するものである。したがって、分化調節剤の適用対象は、間葉系細胞への分化能を有する細胞である。間葉系細胞への分化能を有する細胞の種類としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、間葉系幹細胞および間葉系前駆細胞が挙げられる。間葉系幹細胞および間葉系前駆細胞の入手方法としても、特に制限はなく、目的に応じて適宜選択することができ、例えば、個体の骨髄等から単離することにより得ることもできるし、既にクローン化された間葉系幹細胞として各種機関から入手することもできる。このような既にクローン化された間葉系幹細胞としては、特に制限はなく、目的に応じて適宜選択することができる。例えば、マウス由来の間葉系幹細胞としては、頭蓋骨由来前駆骨芽細胞であるMC3T3−E1、骨髄由来前脂肪細胞であるST2細胞、NRG細胞などが挙げられる(それぞれ独立行政法人理化学研究所バイオリソースセンター(BRC)から入手可能である)。なお、間葉系幹細胞以外の細胞であっても、間葉系細胞への分化能を有する細胞であれば、分化調節剤の適用対象として用いられうる。
【0022】
また、間葉系細胞の種類についても特に制限はなく、目的に応じて適宜選択することができ、例えば、骨芽細胞、脂肪細胞、筋細胞、軟骨細胞などが挙げられる。なかでも、特に骨芽細胞が好ましい。
【0023】
本発明の一形態に係る間葉系細胞の分化調節剤は、miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有する。この場合、当該分化調節剤は、間葉系細胞の分化を促進する作用を有するものである。
【0024】
(miRNA−294)
上述した分化調節剤が有効成分として含みうるマウスmiRNA−294の成熟配列(ガイド鎖の配列)は、以下に示すとおりである。
【0025】
【化1】

【0026】
なお、ヒトmiRNA−294の存在については、文献(Gurman Singh Pall et al., Nucleic Acids Research, 2007, Vol. 35, No. 8, e60)において示唆されている。当該文献においてヒトmiRNA−294の塩基配列は記載されていないが、後述する実施例において上記マウスmiRNA−294が間葉系細胞の分化誘導作用を示していることから、ヒトmiRNA−294の塩基配列はマウスmiRNA−294のものとほとんど同一であると考えられる。
【0027】
このようなmiRNA−294は、その塩基配列に基づき、従来公知の手法を用いて、天然物から単離することにより、化学的に合成することにより、あるいはin vivoまたはin vitroで遺伝子工学的に生産させることができる。また、このmiRNA−294は、内在性の成熟型miRNAを模倣するように合成された類縁体であってもよい。こうした類縁体としては、例えば、Ambion社などから入手可能である。こうしたmiRNA−294は、一本鎖であってもよいし、相補鎖を備える二本鎖であってもよい。
【0028】
(miRNA−294の前駆体)
miRNA−294の前駆体としては、例えば、pri−miRNA、pre−miRNAなどが挙げられる。その具体例としては、例えば、マウスについて以下に示すpre−miRNA−294がそれぞれ挙げられる。ここで、図1に、マウスのpre−miRNA−294の模式図を示す。なお、ヒトのpri−miRNA−294やpre−miRNA−294の塩基配列についても、マウスのものに対して高度に保存されていると考えられる。
【0029】
このようなmiRNA−294の前駆体も、従来公知の手法を用いて、天然物から単離することにより、化学的に合成することにより、あるいはin vivoまたはin vitroで遺伝子工学的に生産させることができる。さらに、miRNA−294の前駆体としては、内在性のmiRNA−294の前駆体を模倣するように合成された、miRNA−294の前駆体の類縁体を同様に用いることもできる。miRNA−294の前駆体は、一本鎖であってもよいし、二本鎖であってもよい。
【0030】
【化2】

【0031】
(miRNA等のDNA構築物)
上述したmiRNA−294またはその前駆体をコードするDNAを転写可能に保持するDNA構築物は、in vivoまたはin vitroでこれらのmiRNA−294またはその前駆体を転写可能にコードしたDNAコンストラクトである。たとえば、in vitroでmiRNA−294またはその前駆体を転写可能なコンストラクトは、ウイルスプロモーターの制御下にmiRNA−294またはその前駆体をコードするDNAを連結したベクターが挙げられる。また、in vivoでmiRNA−294またはその前駆体を転写可能なコンストラクトは、哺乳類細胞で有効なプロモーターの制御下にmiRNA−294またはその前駆体をコードするDNAを連結したベクターが挙げられる。このようなin vivoまたはin vitro転写用のベクターは商業的に入手が可能であり、そのプロトコールに従い、miRNA−294またはその前駆体の塩基配列に基づけば、容易にかかるベクターを構築できる。
【0032】
(miRNA−294の阻害剤)
miRNA−294の阻害剤は、miRNA−294の機能を低下させる物質であればよく、その具体的な形態について特に制限はない。このような阻害剤としては、例えば、miRNA−294またはその前駆体のガイド鎖の少なくとも一部の相補鎖である第1のRNA鎖(いわゆる「アンチセンスmiRNA」)が挙げられる。この第1のRNA鎖における相補鎖は、必ずしもmiRNA−294またはその前駆体の全体の相補鎖である必要はなく、その機能を低下させる作用を有する限り、その一部の相補鎖であってもよい。また、完全な相補鎖である必要はなく、miRNA−294やその前駆体の機能を低下させる作用を有する限り、不完全な相補鎖であってもよい。
【0033】
第1のRNA鎖は、内在性のmiRNA−294またはその前駆体におけるガイド鎖に対するパッセンジャー鎖と比較して相補性が高められているものであることが好ましい。すなわち、内在性のmiRNA−294において、ガイド鎖とパッセンジャー鎖との間に、ミスマッチが存在する場合、そのようなミスマッチの個数が第1のRNA鎖において低減されていることが好ましい。ミスマッチをどの程度低減すればよいかは特に限定されないが、第1のRNA鎖が阻害剤として機能する限り、すべてのミスマッチを解消する必要はなく、当該ミスマッチの一部のみが解消されているものであってもよい。阻害剤としての相補鎖において解消されるミスマッチの箇所(内在性miRNA−294のガイド鎖における位置)は特に限定されないが、3’末端側にあるミスマッチが解消されているものが、阻害剤としては好ましい。
【0034】
miRNA−294の阻害剤は、第1のRNA鎖とmiRNA−294またはその前駆体のガイド鎖である第2のRNA鎖とを備えていてもよい。こうした二本鎖状態であっても阻害剤として有効である。
【0035】
上述した第1のRNA鎖および第2のRNA鎖は、化学合成により、または遺伝子工学的に製造できるほか、Ambion社等から商業的に入手することも可能である。第1のRNA鎖および第2のRNA鎖には、細胞内等における安定性を確保する観点から、その塩基、糖等において適宜修飾が施されていてもよい。例えば、miRNA−294またはその前駆体とより強固に二本鎖を形成し、より効果的にmiRNA−294またはその前駆体の機能を阻害する(低下させる)ことができる点で、例えば、PNA(ペプチド核酸)やLNA(Locked Nucleic Acid)等の修飾を有したものであることが好ましい。前記LNA(Locked Nucleic Acid)等の修飾を有する相補鎖としては、例えば、miRCURY Knockdown Probes(Exiqon社)などを利用することができる(例えば、Biomedecine & Pharmacotherapy, Volume 60, Issue 9, November 2006, Pages 633-638参照)。また、相補鎖としては、細胞内で分解されることを阻止してより安定に存在することができ、例えば、2’−O−メチル等の修飾を有したものであることも好ましい(例えば、Nucleic Acids Research, 2003, Vol. 31, No. 11, 2705-2716参照)。
【0036】
阻害剤としては、miRNA−294またはその前駆体に対する第1のRNA鎖をコードするDNA、あるいは、第1のRNA鎖および第2のRNA鎖をコードするDNAを転写可能に保持するDNA構築物であってもよい。かかるDNA構築物は、in vivoまたはin vitro転写用のベクターを用いることで容易に得ることができる。
【0037】
本明細書に開示の分化調節剤の有効成分は、目的に応じて選択される。すなわち、分化調節剤を、間葉系細胞の分化を促進する目的で利用する場合、miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有させることができる。また、分化調節剤を間葉系細胞の分化を抑制する目的で利用する場合、上述したmiRNA−294の阻害剤を有効成分として含有させることができる。有効成分は、同一の目的に寄与する有効成分を1種単独で使用してもよいし、2種以上を併用してもよい。また、間葉系細胞の分化調節剤中の有効成分の含有量について特に制限はなく、目的に応じて適宜設定することができる。
【0038】
本明細書に開示の分化調節剤は、上記の有効成分のみを含有していてもよいが、必要に応じてそのほかの成分を含むことができる。その他の成分としては、特に制限はなく、目的に応じて適宜選択することができる。例えば、上記の有効成分を所望の濃度に希釈等するための、水、各種緩衝液などが挙げられる。また、前記その他の成分としては、間葉系細胞への分化を抑制または促進したい細胞(対象細胞;例えば、骨芽細胞等の間葉系幹細胞)に有効成分を導入するための、導入用試薬なども挙げられる。前記導入用試薬としては、特に制限はなく、目的に応じて適宜選択することができるが、例えば、Lipofectamine 2000(Invitrogen社)などが挙げられる。
【0039】
本明細書に開示の分化調節剤は、間葉系幹細胞または間葉系前駆細胞等の間葉系細胞への分化を促進または抑制することができる。したがって、当該分化調節剤は、間葉系細胞への分化に関連する疾患を予防または治療するための医薬として用いられうる。また、間葉系細胞への分化に関連する研究試薬や医薬の評価並びにスクリーニングにも好ましく用いられうる。
【0040】
≪間葉系細胞の分化異常に起因する疾患を予防または治療するための医薬≫
本明細書に開示の医薬は、間葉系細胞の分化異常に起因する疾患を予防または治療するための医薬であって、上述した分化調節剤を有効成分として含むものである。この際、分化調節剤としては、本明細書に既に開示した各種の分化調節剤から、医薬が対象とする疾患の種類に応じて選択される。本明細書に開示の医薬が間葉系細胞の分化の障害に起因する疾患であるときには、miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上が医薬の有効成分として用いられうる。一方、本明細書に開示の医薬が間葉系細胞の分化過剰に起因する疾患であるときには、上述したmiRNA−294の阻害剤が医薬の有効成分として用いられうる。
【0041】
本明細書に開示の医薬における分化調節剤の含有量について特に制限はなく、目的に応じて適宜選択することができる。また、本明細書に開示の医薬は、有効成分のみからなっていてもよいが、必要に応じてそのほかの成分を含むことができる。その他の成分としては、特に制限はなく、目的に応じて適宜選択することができる。典型的には、薬学上許容されうる担体などが挙げられる。前記担体としても特に制限はなく、例えば、医薬の剤型等に応じて適宜選択することができる。また、医薬中のその他の成分の含有量としても特に制限はなく、目的に応じて適宜選択することができる。
【0042】
本明細書に開示の医薬は、従来公知の各種の製剤形態を採ることができる。後述するような所望の投与方法に応じて適宜選択することができ、例えば、経口固形剤(錠剤、被覆錠剤、顆粒剤、散剤、カプセル剤等)、経口液剤(内服液剤、シロップ剤、エリキシル剤等)、注射剤(溶液、懸濁液、用時溶解用固形剤等)、軟膏剤、貼付剤、ゲル剤、クリーム剤、外用散剤、スプレー剤、吸入散剤などが挙げられる。こうした各種製剤において適宜必要とされる添加剤は、当業者において周知であり、当業者であれば目的に応じて種々の製剤を製造することができる。
【0043】
本明細書に開示の医薬は、好ましくは、投与対象または投与対象から採取された細胞を含む組織に対して、細胞内への医薬のトランスフェクションに適した製剤形態を採る。例えば、適用部位に応じた注射製剤(皮下注射、静脈注射、筋肉注射、骨髄注射、歯髄注射、腹腔内注射等)の形態をとることができる。注射剤は、例えば、有効成分のほか、pH調節剤、緩衝剤、安定化剤、等張化剤、局所麻酔剤等を添加し、常法により皮下用、筋肉内用、静脈内用等の注射剤を製造することができる。なお、pH調節剤および緩衝剤としては、例えば、クエン酸ナトリウム、酢酸ナトリウム、リン酸ナトリウムなどが挙げられる。安定化剤としては、例えば、ピロ亜硫酸ナトリウム、EDTA、チオグリコール酸、チオ乳酸などが挙げられる。等張化剤としては、例えば、塩化ナトリウム、ブドウ糖などが挙げられる記局所麻酔剤としては、例えば、塩酸プロカイン、塩酸リドカインなどが挙げられる。
【0044】
本明細書に開示の医薬の投与方法は特に限定されないが、医薬の剤型に応じて適宜選択される。上記のとおり、本明細書に開示の医薬は、例えば、有効成分を、患者における細胞や組織に対して導入することにより投与することができる。なお、細胞や組織は、間葉系幹細胞や間葉系前駆細胞が存在する箇所であることが好ましい。例えば、骨芽細胞への分化異常に起因する疾患においては、骨芽細胞への幹細胞や前駆細胞が存在する箇所、典型的には骨髄等を投与対象とすることが好ましい。
【0045】
また、患者等から採取した間葉系幹細胞や間葉系前駆細胞またはこれらを含む組織に導入し、その細胞を患者に移植することにより投与することができる。導入方法について特に制限はなく、例えば、従来公知のリポフェクションやエレクトロポレーション等の方法を適宜選択して利用することができる。患者の生体外でトランスフェクションを行った細胞を患者に移植する方法としても特に制限なく、例えば、従来公知の細胞移植方法が適宜利用されうる。例えば、体外でリポソームやその他のナノ粒子に包埋して全身投与、または局所投与すればよい。
【0046】
なお、本明細書に開示の医薬の投与量としては、特に制限はなく、投与対象である患者の年齢、体重、所望の効果の程度等に応じて適宜選択することができる。また、その投与回数としては、特に制限はなく、投与対象である患者の年齢、体重、所望の効果の程度等に応じて適宜選択することができる。さらに、その投与時期としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、間葉系細胞の分化異常(抑制や過剰)に起因する疾患に対して、予防的に投与されてもよいし、治療的に投与されてもよい。本明細書に開示の医薬の投与対象となる哺乳動物としては、特に制限はなく、目的に応じて適宜選択することができ、例えば、ヒトのほか、マウス、ラット、ウシ、ブタ、サル、イヌ、ネコなどの非ヒト哺乳動物が挙げられる。
【0047】
本明細書に開示の医薬が予防または治療の対象とする疾患は、間葉系細胞の分化異常(抑制や過剰)に起因する疾患である。間葉系細胞の分化抑制(分化不足)に起因する疾患としては、骨芽細胞の分化抑制または分化不足に起因する、骨粗鬆症(閉経後骨粗鬆症、老人性骨粗鬆症、ステロイド治療による骨粗鬆症、糖尿病性骨粗鬆症)、骨形成不全、発達期における成長阻害等が挙げられる。また、間葉系細胞の分化過剰に起因する疾患としては、例えば、骨芽細胞の分化過剰に起因する、骨芽細胞型骨肉腫等が挙げられる。
【0048】
≪分化調節剤の評価方法および間葉系細胞への分化調節作用を有する物質のスクリーニング方法≫
本明細書の開示によれば、間葉系細胞の分化調節剤の評価方法もまた、提供される。当該評価方法では、miRNA−294の発現および/または機能の増大または低下を指標とすることができる。この評価方法によれば、間葉系細胞の分化を調節(促進または抑制)できる分化調節剤を得ることができる。
【0049】
上記評価方法は、典型的には、miRNA−294を発現している間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物に対して被験物質を供給する工程(供給工程)と、前記間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比し、その対比結果に基づいて、前記被験物質の間葉系細胞への分化促進作用または分化抑制作用を評価する工程(評価工程)とを有する。当該評価方法は、上述した「評価する工程」の後に、間葉系幹細胞の分化を促進または抑制する被験物質を選択する工程を備えることができる。言い換えれば、上記評価方法は、間葉系細胞への分化調節作用を有する物質のスクリーニング方法であるとも言える。
【0050】
被験物質としては、例えばタンパク質、ペプチド、非ペプチド性化合物、合成化合物、発酵生産物、細胞抽出液、植物抽出液、動物組織抽出液などが挙げられ、これらの物質は新規なものであってもよいし、公知のものであってもよい。
【0051】
上記した供給工程には、既に説明したように、本明細書に開示の分化調節剤や医薬を細胞または患者等に投与する際に用いられる従来公知のトランスフェクトの方法が採用されうる。
【0052】
上記した評価工程では、間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比し、その対比結果に基づいて、前記被験物質の間葉系細胞への分化促進作用または分化抑制作用を評価する。評価の具体的な方法については特に制限はなく、目的に応じて適宜選択することができる。例えば、被験物質の存在下(供給時)および非存在下(非供給時)での内在性miRNA−294の発現量を測定し、発現の評価指標とすることができる。また、骨芽細胞に対する間葉系幹細胞や間葉系前駆細胞を細胞として用いる場合には、アルカリフォスファターゼの活性等の各種の骨芽細胞への分化指標を評価指標として用いることもできる。
【0053】
評価工程では、例えば、被験物質の非存在下(非供給時)と比べて、被験物質の存在下(供給時)においてmiRNA−294等の発現量等が増大するときには、当該被験物質が内在性miRNA−294の作用を増大させると評価することができる。すなわち、被験物質は、間葉系細胞への分化を促進する作用を有する物質であると評価できる。一方、被験物質の存在下においてmiRNA−294等の発現量等が低下するときには、当該被験物質は、内在性miRNA−294の作用を低下させると評価することができる。すなわち、被験物質は、間葉系細胞への分化を抑制する作用を有する物質であと評価できる。
【0054】
なお、以上の供給工程または評価工程のいずれかあるいはこれらの工程の間において、適宜、間葉系幹細胞や間葉系前駆細胞の間葉系細胞への分化を誘導する処理を施しておいてもよい。分化誘導処理としては、例えば、骨芽細胞への誘導処理には、BMP−2等を用いることができる。かかる分化誘導処理下で被験物質の作用を評価することで、一層明確に被験物質の分化抑制能や分化促進能を検出することができる。
【0055】
また、上述したように、本発明に係る評価方法(スクリーニング方法)は、上述した評価工程の後に、間葉系幹細胞の分化を促進または抑制する被験物質を選択する工程(選択工程)を備えることができる。選択工程は、間葉系細胞への分化を促進または抑制する作用を有する物質であると評価された被験物質を間葉系細胞への分化調節剤として選択する工程である。選択された被験物質は、本明細書に開示の分化調節剤および医薬の有効成分として、またはその候補として、有用である。
【実施例】
【0056】
以下、本発明の実施例を説明するが、本発明は、これらの実施例に何ら限定されるものではない。
【0057】
[実施例1:miRNA-294導入MC3T3-E1細胞におけるBMP-2誘導骨芽細胞分化への影響]
以下の手法により、BMP-2で誘導されたマウスMC3T3-E1細胞(頭蓋骨由来前駆骨芽細胞)の骨芽細胞への分化にmiRNA-294の導入が及ぼす影響を調べた。なお、マウスMC3T3-E1細胞は、間葉系幹細胞の1種である。
【0058】
具体的には、マウス内在性miRNA分子を模倣するように合成されたmiRNA-294、そのアンチセンス阻害剤であるAnti-miRNA-294、および、miRNA-Negative Control(いずれも、アプライドバイオサイエンス社製)を、それぞれLipofectamime(登録商標)RNAiMAX(Invitrogen社製)を用いたリポフェクション法により、MC3T3-E1細胞に終濃度が40nMとなるように導入した。
【0059】
次いで、上述した各導入細胞と何も導入していないコントロール細胞(BMP-2添加あり、なし)のそれぞれを、OPTI-MEM無血清培地(Invitrogen社製)で18時間培養後、MEM-α(10%FBS,100U/mlペニシリン、100μg/mlストレプトマイシン含有)に培地交換後72時間培養した。その後、96ウェルマルチプレートに1×105細胞/mlに調整した細胞を500μl/ウェルずつ播種し、播種3時間後にBMP-2(ベクトンディッキンソン社製)を終濃度が200ng/mlとなるように加えて分化を誘導し、72時間培養した。
【0060】
その後、PBS(-)により2度洗浄し、エタノールにて細胞固定後、分化指標であるアルカリフォスファターゼ(ALP;Alkaline phosphatase)をTRACP&ALP double-staining Kit (タカラバイオ社製)を用いて染色し、各細胞の分化の程度を評価した。結果を図2に示す。
【0061】
図2に示すように、BMP-2を添加するとMC3T3-E1細胞の骨芽細胞への分化が誘導されるが、miRNA-294を導入すると、BMP-2により誘導されたMC3T3-E1細胞の骨芽細胞への分化がよりいっそう増強されることが確認された。一方、miRNA-294のアンチセンス阻害剤であるAnti-miRNA-294を導入すると、BMP-2により誘導されたMC3T3-E1細胞の骨芽細胞への分化が減弱することが確認された。なお、miRNA-Negative Controlを導入しても、BMP-2により誘導されたMC3T3-E1細胞の骨芽細胞への分化に影響はなかった。
【0062】
以上のことから、miRNA-294は間葉系幹細胞の骨芽細胞への分化を促進する作用を有することが示された。また、Anti-miRNA-294は間葉系幹細胞の骨芽細胞への分化を抑制する作用を有することが示された。
【0063】
[実施例2:miRNA-294導入MC3T3-E1細胞のBMP-2誘導有無による分化への影響]
BMP-2を添加しなかったこと以外は、上述した実施例1と同様の手法により、マウスMC3T3-E1細胞の骨芽細胞への分化にmiRNA-294の導入が及ぼす影響を調べた。その結果を、BMP-2を添加した場合と比較して図3に示す。なお、図3において、「BMP-2(-)」はBMP-2を添加しなかった群の結果を示し、「BMP-2(+)」はBMP-2を添加した群の結果を示す。
【0064】
図3の「BMP-2(+)」に示すように、BMP-2を添加するとMC3T3-E1細胞の分化は誘導され、miRNA-294を導入したMC3T3-E1細胞ではさらにその分化能が著しく高まった(上述した実施例1の確認)。一方、図3の「BMP-2(-)」に示すように、BMP-2を添加しなくても(予め分化を誘導しなくても)、miRNA-294を導入したMC3T3-E1細胞では、その分化能が上昇した。
【0065】
以上のことから、miRNA-294は単独で用いられて細胞へ導入されても分化促進作用を示すことが示唆された。
【0066】
[実施例3:miRNA-294導入ヒト骨芽細胞株のBMP-2誘導有無による分化への影響]
MC3T3-E1細胞に代えて、ヒト骨芽細胞株であるHFO-SV-40細胞を用いたこと以外は、上述した実施例2と同様の実験を行った。結果を図4に示す。なお、図4において、「BMP-2(-)」はBMP-2を添加しなかった群の結果を示し、「BMP-2(+)」はBMP-2を添加した群の結果を示す。
【0067】
図4に示すように、MC3T3-E1細胞を用いた同様の実験(実施例2、図3)よりも作用は弱いものの、miRNA-294はやはり骨芽細胞の分化を促進する作用を示した。
【0068】
以上のことから、miRNA-294は種を越えても同様に間葉系細胞の分化促進作用を示すことが示唆された。
【配列表フリーテキスト】
【0069】
〔配列番号:1〕
マウスmiRNA−294の成熟配列(ガイド鎖の配列)のRNA配列である。
〔配列番号:2〕
マウスpre−miRNA−294のRNA配列である。
【特許請求の範囲】
【請求項1】
miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有し、間葉系細胞の分化を促進する、間葉系細胞の分化調節剤。
【請求項2】
miRNA−294の阻害剤を有効成分として含有し、間葉系細胞の分化を抑制する、間葉系細胞の分化調節剤。
【請求項3】
前記間葉系細胞が骨芽細胞である、請求項1または2に記載の分化調節剤。
【請求項4】
間葉系細胞の分化異常に起因する疾患を予防または治療するための医薬であって、請求項1〜3のいずれか1項に記載の分化調節剤を含む、医薬。
【請求項5】
前記疾患は、前記間葉系細胞の分化の障害に起因する疾患である、請求項4に記載の医薬。
【請求項6】
前記間葉系細胞が骨芽細胞であり、前記疾患が骨粗鬆症、骨形成不全、および発達期における成長阻害からなる群から選択される1種または2種以上である、請求項5に記載の医薬。
【請求項7】
miRNA−294を発現している間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物に対して被験物質を供給する工程と、
前記間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比し、その対比結果に基づいて、前記被験物質の間葉系細胞への分化促進作用または分化抑制作用を評価する工程と、
を有する、間葉系細胞の分化調節作用を有する物質のスクリーニング方法。
【請求項1】
miRNA−294、その前駆体およびこれらをコードするDNA構築物からなる群から選択される1種または2種以上を有効成分として含有し、間葉系細胞の分化を促進する、間葉系細胞の分化調節剤。
【請求項2】
miRNA−294の阻害剤を有効成分として含有し、間葉系細胞の分化を抑制する、間葉系細胞の分化調節剤。
【請求項3】
前記間葉系細胞が骨芽細胞である、請求項1または2に記載の分化調節剤。
【請求項4】
間葉系細胞の分化異常に起因する疾患を予防または治療するための医薬であって、請求項1〜3のいずれか1項に記載の分化調節剤を含む、医薬。
【請求項5】
前記疾患は、前記間葉系細胞の分化の障害に起因する疾患である、請求項4に記載の医薬。
【請求項6】
前記間葉系細胞が骨芽細胞であり、前記疾患が骨粗鬆症、骨形成不全、および発達期における成長阻害からなる群から選択される1種または2種以上である、請求項5に記載の医薬。
【請求項7】
miRNA−294を発現している間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物に対して被験物質を供給する工程と、
前記間葉系幹細胞もしくは間葉系前駆細胞または非ヒト動物におけるmiRNA−294の発現または機能を、前記被験物質の非供給時におけるmiRNA−294の発現または機能と対比し、その対比結果に基づいて、前記被験物質の間葉系細胞への分化促進作用または分化抑制作用を評価する工程と、
を有する、間葉系細胞の分化調節作用を有する物質のスクリーニング方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−91611(P2013−91611A)
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願番号】特願2011−234162(P2011−234162)
【出願日】平成23年10月25日(2011.10.25)
【出願人】(304019399)国立大学法人岐阜大学 (289)
【出願人】(000106771)シーシーアイ株式会社 (245)
【Fターム(参考)】
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願日】平成23年10月25日(2011.10.25)
【出願人】(304019399)国立大学法人岐阜大学 (289)
【出願人】(000106771)シーシーアイ株式会社 (245)
【Fターム(参考)】
[ Back to top ]

