間葉系細胞増殖促進剤およびそれを含有する骨格系生体材料
【課題】間葉系細胞の増殖促進能を有し、骨髄組織および歯髄組織の欠損を修復するための人工骨髄や人工歯髄として有用な骨格系生体材料を提供する。
【解決手段】SVVYGLRペプチドが、骨髄由来間葉系幹細胞、歯髄細胞などの間葉系細胞に対して増殖を促進する作用を有することを見出した。SVVYGLRペプチドを含有する炭酸アパタイト・コラーゲンスポンジは骨髄または歯髄再生用生体材料として有用である。
【解決手段】SVVYGLRペプチドが、骨髄由来間葉系幹細胞、歯髄細胞などの間葉系細胞に対して増殖を促進する作用を有することを見出した。SVVYGLRペプチドを含有する炭酸アパタイト・コラーゲンスポンジは骨髄または歯髄再生用生体材料として有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、間葉系細胞増殖促進剤およびそれを含有する骨格系生体材料に関するものである。
【背景技術】
【0002】
近年の高齢化社会において、骨、歯牙組織等の欠損・損傷を再建する技術の開発が望まれている。特に、再生医療の進歩による骨格系生体材料への関心が高まっている。欠損組織の修復に用いられる画期的な技術として、硬組織の構成要素である人工骨髄・歯髄の開発が望まれている。
【0003】
歯科の領域においては、特に、より長く自己の歯を維持して生活することが望まれているため、歯髄組織を保存する治療法の重要性が高まっている。歯髄は、歯の中心に位置する組織であり、細胞間質、血管、神経等により構成されている。歯が齲蝕に罹患し、歯髄の一部にまで感染が広がった場合、限局した感染部位のみを切断し、残存する歯髄を存続させる治療法(生活歯髄切断法)が、有用な治療法として注目されている。
【0004】
しかしながら、歯髄の切断面を適切に処置するのは技術的に困難であり、必ずしも切断後の歯髄の状態を良好に保つことは期待できないのが現状である。このため、より的確に、可能な限り侵襲を抑えた治療法を確立することが望まれている。そこで、感染部位の切断により欠損した歯髄部位をもとの状態に再生し、歯髄組織を保存することができれば、国民のQOLの向上と医療費の削減に計り知れない貢献をもたらす可能性がある。
【0005】
骨組織の欠損を修復するための各種骨格系生体材料の研究は、炭酸アパタイト(CO3Ap)の生分解性の観点から進められている。本発明者らは、化学組成および結晶化度の点において、生体硬組織に類似する炭酸アパタイトおよびコラーゲンから、作製した炭酸アパタイト・コラーゲン複合体を生体材料として用いることを提案している(非特許文献1および非特許文献2を参照のこと)。この炭酸アパタイト・コラーゲン複合体を、ラットの腹部内および頭蓋骨膜下に埋め込んだ場合、良好な生体適合性を示した。
【0006】
しかしながら、炭酸アパタイト・コラーゲン複合体のinner bulk(内部バルク)には、細胞が侵入できるスペースがない。そこで、スポンジ状炭酸アパタイト・コラーゲン複合体を用いた場合、スポンジ状体の孔が大きいとき、骨芽細胞の増殖、およびこの孔の内部への細胞の侵入が促進されることが分かった(非特許文献3を参照のこと)。
【0007】
欠損組織を再生し、生体材料が生着することによって、その機能を十分に発揮するためには、細胞へ酸素および栄養を供給することが不可欠である。すなわち、骨格系生体材料に複合機能を与える血管は、骨の維持および成長のためのライフラインとして不可欠である。
【0008】
上述したように、炭酸アパタイト・コラーゲン複合体は、適切な生体適合性を示し、また、この複合体のスポンジ状体は、細胞の浸潤に十分なスペースを有している。しかしながら、スポンジ状体の内部に細胞を浸潤させたとしても、酸素および栄養を供給する血管の非存在下において、細胞が生存することは不可能である。このため、生体材料内の血管新生が不可欠である。
【0009】
血管新生プロセスは、内皮細胞による血管基底膜の消化で開始される。その後、細胞は移動および増殖して管状構造を形成する。多数の研究者らが、各種の成長因子とサイトカイン(血管内皮増殖因子(VEGF)、線維芽細胞成長因子(FGF)、インターロイキン8)から発せされる信号により、これらの細胞反応が厳重に調節されていることを報告している。
【0010】
細胞外基質蛋白質であるオステオポンチン(OPN)は、大量のシアル酸を含むリン酸蛋白質であり、骨組織、腎臓、脳、皮膚等に広く分布している。OPNは骨代謝に関与し、炎症反応と血管新生を仲介する。最近、OPN内に血管新生作用に関与するアミノ酸配列[Ser−Val−Val−Tyr−Gly−Leu−Arg(SVVYGLR)]が発見された(特許文献1、非特許文献4および非特許文献5を参照のこと)。オステオポンチン分子内でRGD配列に隣接するSVVYGLRはトロンビン切断によって暴露されていたため、このモチーフが病態において重要であると考えられる。我々は、血管成長因子としてのSVVYGLRの配列を人工合成することに既に成功している(非特許文献6を参照のこと)。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】国際公開第WO2003/030925号パンフレット
【非特許文献】
【0012】
【非特許文献1】Okazaki M, Ohmae H, Hino T. Insolubilization of apatite-collagen composites by UV irradiation. Biomaterials 1989; 10: 564-568.
【非特許文献2】Okazaki M, Ohmae H, Takahashi J, Kimura H, Sakuda M. Insolubilized properties of UV-irradiated CO3apatite-collagen composites. Biomaterials 1990; 11: 568-572.
【非特許文献3】Itoh M, Shimazu A, Hirata I, Yoshida Y, Shintani, H, Okazaki M. Characterization of CO3Ap-collagen sponges using x-ray high-resolution microtomography. Biomaterials 2004; 25: 2577-2583.
【非特許文献4】Yokosaki Y, Matsuura N, Sasaki T, Murakami I, Schneider H, Higashiyama S, Saitoh Y, Yamakido M, Taooka Y, Sheppard D. The integrin a9b1 bind to a novel recognition sequence (SVVYGLR) in the thrombin-cleaved amino-terminal fragment of osteopontin. J Biol Chem 1999; 274: 36328-36334.
【非特許文献5】Hamada Y, Nokihara K, Okazaki M, Fujitani W, Matsumoto T, Matsuo M, Umakoshi Y, Takahashi J, Matsuura N. Angiogenic activity of osteopontin- derived peptide SVVYGLR. Biochem Biophys Res Commun 2003; 310: 153-157.
【非特許文献6】Hamada Y, Yuki K, Okazaki M, Fujitani W, Matsumoto T, Kobayashi Hashida M, Harutsugu K, Nokihara K, Daito M, Matsuura N, Takahashi J. Osetpontin-derived peptide SVVYGLR induces angiogenesis in vivo. Dent Mater J 2004; 23: 650-655.
【発明の概要】
【発明が解決しようとする課題】
【0013】
上述のように、欠損組織を修復するために生体材料がその機能を十分発揮するためには、欠損組織を再生し、生体材料が生着するだけではなく、再生組織における血管新生が重要である。しかし、骨髄組織や歯髄組織の再生を促進するための生体材料として応用するためには、さらに、組織間質を構成する間葉系細胞の増殖を促進できることが望ましい。
【0014】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、間葉系細胞の増殖促進能を有する骨格系生体材料を提供することにある。
【課題を解決するための手段】
【0015】
本発明者らは、上記の課題を解決するために鋭意検討した結果、血管新生作用に関与することが知られているSVVYGLRペプチドが、骨髄由来間葉系幹細胞、歯髄細胞などの間葉系細胞に対して増殖を促進する作用を有することを新たに見出し、当該SVVYGLRペプチドを含有する炭酸アパタイト・コラーゲンスポンジを欠損した骨髄に移植すると、スポンジ領域における血管の形成およびスポンジ内部への間葉系細胞の侵入が認められ、骨髄再生用生体材料として有用であることを見出し、本発明を完成させるに至った。
【0016】
すなわち、本発明に係る間葉系細胞増殖促進剤は、配列番号1に示されるアミノ酸配列を有効成分とするペプチドであることを特徴としている。
【0017】
本発明に係る骨格系生体材料は、上記本発明に係る血管新生誘導および間葉系細胞増殖促進剤を含むことを特徴としている。当該骨格系生体材料は、炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体であることが好ましい。また、当該骨格系生体材料は、配列番号1に示されるアミノ酸配列からなるペプチドを有効成分として含有する間葉系細胞接着促進剤を含むことが好ましい。
【0018】
本発明に係る骨髄組織または歯髄組織の再生方法は、上記本発明に係る骨格系生体材料を用いることを特徴としている。
【0019】
本発明の他の目的、特徴、および優れた点は、以下に示す記載によって十分分かるであろう。また、本発明の利点は、添付図面を参照した次の説明で明白になるであろう。
【図面の簡単な説明】
【0020】
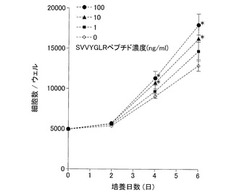
【図1】SVVYGLRペプチドがヒト骨髄由来間葉系幹細胞の増殖に及ぼす影響を検討した結果を示すグラフである。
【図2】SVVYGLRペプチドが歯髄細胞の増殖に及ぼす影響を検討した結果を示すグラフである。
【図3】図中(a)はSVVYGLRペプチドを培地に添加していない場合の間葉系細胞ペレットの位相差顕微鏡画像であり、図中(b)はSVVYGLRペプチドを培地に添加した場合の間葉系細胞ペレットの位相差顕微鏡画像である。
【図4】位相差顕微鏡で撮影したペレットの面積を画像解析ソフトを用いて測定した数値(μm2)を示すグラフである。
【図5】合成炭酸アパタイトのX線回折パターンを示すチャートである。
【図6】図中(a)は炭酸アパタイト・コラーゲンスポンジの走査電子顕微鏡画像であり、図中(b)は炭酸アパタイト・コラーゲンスポンジのX線マイクロコンピューター断層撮影で描出した3D画像である。
【図7】SVVYGLRペプチドを含む炭酸アパタイト・コラーゲンスポンジを移植した移植片の組織像であり、図中(a)は低倍率で観察した組織像、図中(b)は図中(a)のX部分の強拡大像、図中(c)は図中(a)のY部分の強拡大像である。
【図8】SVVYGLRペプチドを含まない炭酸アパタイト・コラーゲンスポンジを移植した移植片の組織像であり、図中(a)は低倍率で観察した組織像、図中(b)は図中(a)のZ部分の強拡大像である。
【図9】SVVYGLRペプチドでコーティングしたプレート上に接着したヒト骨髄由来間葉系幹細胞の細胞数を測定した数値を示すグラフである。
【図10】SVVYGLRペプチドでコーティングしたプレート上に接着したヒト歯肉線維芽細胞の細胞数を測定した数値を示すグラフである。
【図11】SVVYGLRペプチドでコーティングしたプレート上に接着したヒト歯根膜細胞の細胞数を測定した数値を示すグラフである。
【発明を実施するための形態】
【0021】
〔間葉系細胞増殖促進剤〕
本発明に係る間葉系細胞増殖促進剤は、配列番号1に示されるアミノ酸配列、すなわちSer−Val−Val−Tyr−Gly−Leu−Arg(SVVYGLR)の7アミノ酸からなるペプチド(以下、「SVVYGLRペプチド」と記す)を有効成分とするものであればよい。SVVYGLRペプチドは、オステオポンチン中に存在する血管新生作用を有するペプチドとして公知であるが、本発明者らは、後段の実施例に示すように当該SVVYGLRペプチドが間葉系細胞の増殖を促進する作用を有することを確認し、SVVYGLRペプチドは間葉系細胞増殖促進剤の有効成分となることが見出された。
【0022】
なお、本発明に係る間葉系細胞増殖促進剤は、間葉系細胞の増殖促進作用を有する限り、SVVYGLRペプチドにおいて1または数個のアミノ酸が欠失、置換もしくは付加されたペプチドを有効成分とするものであってもよい。
【0023】
ここで「1または数個のアミノ酸が欠失、置換もしくは付加された」とは、部位特異的突然変異誘発法等の公知の変異ペプチド作製法により欠失、置換もしくは付加できる程度の数(好ましくは3個、より好ましくは2個、さらに好ましくは1個)のアミノ酸が欠失、置換もしくは付加されることを意味する。このような変異ペプチドは、公知の変異ペプチド作製法により人為的に導入された変異を有するペプチドに限定されるものではなく、天然に存在するペプチドを単離精製したものであってもよい。
【0024】
好ましい変異体は、保存性もしくは非保存性アミノ酸置換、欠失、または添加を有する。好ましくは、サイレント置換、添加、および欠失であり、特に好ましくは、保存性置換である。これらは、本発明に係るペプチド活性を変化させない。
【0025】
また、本発明に係る間葉系細胞増殖促進剤の有効成分となるペプチドは、間葉系細胞の増殖促進作用を有する限り、SVVYGLRペプチドに付加的なペプチドを含むものであってもよい。付加的なペプチドは特に限定されないが、例えば、ポリアルギニンタグ(Arg−tag)やポリヒスチジンタグ(His−tag)やMyc、Flag等のエピトープ標識ペプチドが挙げられる。
【0026】
ペプチドが間葉系細胞の増殖促進作用を有するか否かは、ペプチドを添加した培養液を用いて培養した間葉系細胞の増殖曲線を、ペプチドを添加していない培養液を用いて培養した間葉系細胞の増殖曲線と比較することにより確認できる。
【0027】
また、ペプチドは、市販のペプチド合成機を用いる常法により、容易に合成することができる。具体的には、例えば、Fmoc化学による高効率固相法により合成することができる。また、常法により、遺伝子工学的に製造することも可能である。得られたペプチドをHPLC、LCMSなどに供し、質量理論値、単一ピークの存在などにより目的のペプチドであることを確認できる。
【0028】
間葉系細胞は、骨髄あるいは歯髄といった結合組織を構成する細胞で、硬組織系細胞に分化できる間葉系幹細胞も含まれる。
【0029】
上記SVVYGLRペプチドは、単独で、または生理緩衝液などの適切な溶媒に溶解した注射液等の形態で、血管新生誘導および間葉系細胞の増殖が望まれる組織に局所投与することができる。手術や外傷により生じた創傷等の近傍に本発明の間葉系細胞増殖促進剤を、注射や塗布、噴霧等の方法により局所投与することにより、間葉系細胞の増殖が促進され、創傷の治癒が促進される。ここで、注射または塗布若しくは噴霧等に用いるペプチド溶液中のペプチド濃度は、特に限定されないが、通常、0.001〜10μg/mL程度である。また、投与量は、傷などの大きさや深さにより適宜選択できるが、傷全体がペプチド溶液で被覆される程度がよい。また、傷が治癒するまで、1日〜数日毎に1回〜数回投与することができる。また、注射液には、他の消毒剤や消炎鎮痛剤など、通常、傷の治療薬に含まれる種々の成分を含んでいてもよい。
【0030】
また、SVVYGLRペプチドをキャリアに結合し、SVVYGLRペプチドが結合されたキャリアを生体に埋め込むことにより間葉系細胞の増殖を促進することもできる。これはキャリアに固定化しているために必要な部位に選択的に作用させることができ、新たなDDS(ドラッグデリバリーシステム)としての可能性に富んでいる。生体材料移植部に本発明の間葉系細胞増殖促進剤を、塗布、噴霧等の方法により局所投与することにより、間葉系細胞の増殖が促進され、術後の治癒が促進される。ここで、キャリアとしては、特に限定されるものではなく、代用骨や代用歯、人工臓器等に用いられる樹脂や、タンパク質等の生体高分子を挙げることができる。樹脂に上記ペプチドを結合することにより、当該樹脂を生体に埋め込んだ際に、樹脂と接する周辺組織中での間葉系細胞の増殖が促進される。また、より好ましい態様として、タンパク質をキャリアとして用いるができる。
【0031】
ここで、キャリアとして用いるタンパク質は、生体適合性を有するいずれのタンパク質であってもよく、とりわけ、生体組織との接合を良好にするために、細胞接着性タンパク質であることが好ましい。細胞接着性タンパク質の好ましい例として、コラーゲン(ゼラチン)、フィブロネクチン、ビトロネクチンおよびラミニン、並びにこれらの部分加水分解物を挙げることができるがこれらに限定されるものではない。なお、これらのタンパク質は、アレルゲンを除去した精製タンパク質であることが、アレルギー反応の防止の観点から好ましい。
【0032】
キャリアに結合されるペプチドの量は、特に限定されず、適宜選択することができるが、通常、キャリアとペプチドの重量比率(キャリア:ペプチド)が100:1〜1:1程度であり、好ましくは20:1〜5:1程度である。
【0033】
キャリアとペプチドとの結合は、共有結合によることが好ましい。結合は、例えばペプチドのN末端のアミノ基と、キャリア中の任意のアミノ基をグルタルアルデヒド等の結合架橋剤を用いて結合することにより容易に行うことができる。また、人工臓器等の樹脂に結合する場合には、この樹脂中に、アミノ基等の、ペプチドとの結合に用いることができる基を含むモノマーを共重合させておき、当該アミノ基等とペプチドのN末端のアミノ基を結合することができる。また、SVVYGLRペプチドの一端または両端に、任意のアミノ酸配列を有する他のペプチドを結合したものを採用し、この任意のペプチドをキャリアとの結合に供することも好ましい。
【0034】
SVVYGLRペプチドを結合したキャリアは、塗布または噴霧する他にそのままで生体内に埋め込むことができる。キャリアとして、細胞接着性タンパク質を採用した場合には、SVVYGLRペプチド結合キャリアは、縫合糸、各種整形手術材料、傷口の癒着促進剤等として単独または他の薬効成分とともに用いることができる。
【0035】
〔間葉系細胞接着促進剤〕
本発明に係る間葉系細胞接着促進剤は、配列番号1に示されるアミノ酸配列、すなわちSer−Val−Val−Tyr−Gly−Leu−Arg(SVVYGLR)の7アミノ酸からなるペプチド(以下、「SVVYGLRペプチド」と記す)を有効成分とするものであればよい。本発明者らは、後段の実施例に示すように当該SVVYGLRペプチドが間葉系細胞の接着を促進する作用を有することを確認し、SVVYGLRペプチドは間葉系細胞接着促進剤の有効成分となることが見出された。
【0036】
なお、本発明に係る間葉系細胞接着促進剤は、間葉系細胞の接着促進作用を有する限り、SVVYGLRペプチドにおいて1または数個のアミノ酸が欠失、置換もしくは付加されたペプチドを有効成分とするものであってもよい。また、本発明に係る間葉系細胞接着促進剤の有効成分となるペプチドは、間葉系細胞の接着促進作用を有する限り、SVVYGLRペプチドに付加的なペプチドを含むものであってもよい。付加的なペプチドは特に限定されないが、例えば、ポリアルギニンタグ(Arg−tag)やポリヒスチジンタグ(His−tag)やMyc、Flag等のエピトープ標識ペプチドが挙げられる。なお、本明細書中に記載の方法に従えば、当業者は、作成したペプチドが間葉系細胞の接着促進作用を有するか否かを容易に確認できる。また、ペプチドは、上述したいずれかの方法によって合成することができる。
【0037】
上記SVVYGLRペプチドは、単独で、または生理緩衝液などの適切な溶媒に溶解した注射液等の形態で、間葉系細胞の接着が望まれる組織に局所投与することができる。手術や外傷により生じた創傷等の近傍に本発明の間葉系細胞接着促進剤を、注射や塗布、噴霧等の方法により局所投与することにより、間葉系細胞の接着が促進され、創傷の治癒が促進される。ここで、注射または塗布若しくは噴霧等に用いるペプチド溶液中のペプチド濃度は、上記の〔間葉系細胞増殖促進剤〕の項で説明したものと同様である。
【0038】
また、SVVYGLRペプチドをキャリアに結合し、SVVYGLRペプチドが結合されたキャリアを生体に埋め込むことにより間葉系細胞の接着を促進することもできる。生体材料移植部に本発明の間葉系細胞接着促進剤を、塗布、噴霧等の方法により局所投与することにより、間葉系細胞の接着が促進され、術後の治癒が促進される。ここで、キャリアとして好ましい物質、キャリアに結合されるペプチドの量、キャリアの使用例については、上記の〔間葉系細胞増殖促進剤〕の項で説明したものと同様である。
【0039】
〔骨格系生体材料〕
本発明に係る骨格系生体材料は、上記本発明に係る間葉系細胞増殖促進剤を含むものであればよい。したがって、公知の骨格系生体材料に適切な方法でSVVYGLRペプチドを結合させたものが、本発明に係る骨格系生体材料として好適である。なかでも、炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体の骨格系生体材料にSVVYGLRペプチドを結合させたものが特に好ましい。
【0040】
また、本発明に係る骨格系生体材料は、上記本発明に係る間葉系細胞接着促進剤をさらに含んでいてもよい。この場合、SVVYGLRペプチドが間葉系細胞増殖促進剤の有効成分と間葉系細胞接着促進剤の有効成分とを兼ねている。したがって、SVVYGLRペプチドを結合させた骨格系生体材料が、間葉系細胞増殖作用および間葉系細胞接着促進作用を有する。
【0041】
炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体の骨格系生体材料は、例えば以下のようにして作製することができる。
【0042】
用いる炭酸アパタイトとしては、一般式;Ca10−X(PO4)6−Y(CO3)Y(OH)2−Z、ただし、0≦X≦3〜5、0≦Y≦2〜4、0≦Z≦1〜2で表されるものであり、その合成方法と炭酸アパタイトについては、各種論文(例えば非特許文献2)に報告されている。例えば、本発明者らは、後段の実施例3に記載の方法で炭酸アパタイトを合成している。
【0043】
コラーゲンとしては、特に制限はなく、市販されているいずれのコラーゲンでも用いることができる。ただし、市販のコラーゲンのなかには純度が低く、アレルゲンが含まれており、品質の再現性も劣るものがあるので、このようなコラーゲンは臨床適用には好ましくない。動物由来のコラーゲンを部分加水分解し、アレルゲンを除去したゼラチンが臨床用途のために市販されているので、このような精製されたコラーゲンまたはその部分加水分解物を用いることが好ましい。
【0044】
スポンジ状体は、コラーゲンを酸性水溶液(例えば、塩酸水溶液、リン酸水溶液)に溶解し、コラーゲン溶液および炭酸アパタイトを混合し、凍結乾燥することにより作製できる。なお、コラーゲン溶液は炭酸アパタイトを混合する前または後に中和処理(例えば、NaOH水溶液を添加)を行い、好ましくは当該溶液のpHを7〜9の範囲内にする。また、コラーゲン溶液と炭酸アパタイトの混合割合は、通常、コラーゲン溶液1gに対して炭酸アパタイト0.001〜0.01g、好ましくは0.003〜0.01gである。
【0045】
炭酸アパタイトを混合したコラーゲン溶液にさらに有機溶媒を添加してもよい。添加する有機溶媒は混合物の粘度を低下させ得るものであれば特に制限はないが、アルコール系有機溶媒が好ましく、中でもエタノールが好ましい。なお、炭酸アパタイトを混合する前のコラーゲン溶液に有機溶媒を添加してもよい。有機溶媒の添加量は、通常、コラーゲン溶液1gに対して0.01〜0.5g、好ましくは0.1〜0.3gである。また、有機溶媒の添加量は、添加後の混合物の粘度が100〜5000mPa・sの範囲内になる量であることが好ましい。
【0046】
凍結乾燥は、コラーゲン/炭酸アパタイト混合物を適当な容器等に入れ、市販の凍結乾燥機を用いて行うことができる。
【0047】
炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体(以下、「炭酸アパタイト・コラーゲンスポンジ」と記す。)にSVVYGLRペプチドを含有させる方法としては、上述の方法により得られた炭酸アパタイト・コラーゲンスポンジをSVVYGLRペプチド溶液に浸漬して、スポンジ表面にSVVYGLRペプチドを付着させる方法を挙げることができる。この場合、SVVYGLRペプチド溶液の濃度としては、10ng/ml〜10μg/mlが好ましい。
【0048】
また、上記の〔間葉系細胞増殖促進剤〕の項で説明したように、SVVYGLRペプチドを予めキャリアタンパク質としてのコラーゲンに結合させておき、SVVYGLRペプチド含有コラーゲンを用いて上述のように炭酸アパタイト・コラーゲンスポンジを作製する方法を挙げることができる。
【0049】
以上のようにして作製された本発明に係る骨格系生体材料は骨髄疾患や外傷により損傷した骨髄の再生、および生活歯髄切断法後の歯髄再生に好適に用いることができる。つまり、修復しようとする骨髄損傷部位、または、切断した歯髄部位に、本発明に係る骨格系生体材料を移植することにより、骨髄または歯髄を再生し修復することが可能となる。
【0050】
〔骨髄組織または歯髄組織の再生方法〕
本発明に係る骨髄組織または歯髄組織の再生方法は、上記本発明に係る骨格系生体材料を用いるものであればよい。本方法においては、SVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジを再生・修復したい骨髄損傷部位や歯髄切断部位に適用すればよい。
【0051】
なお、発明を実施するための最良の形態の項においてなした具体的な実施態様および以下の実施例は、あくまでも、本発明の技術内容を明らかにするものであって、そのような具体例にのみ限定して狭義に解釈されるべきものではなく、当業者は、本発明の精神および添付の特許請求の範囲内で変更して実施することができる。
【0052】
また、本明細書中に記載された学術文献および特許文献の全てが、本明細書中において参考として援用される。
【実施例】
【0053】
〔実施例1:SVVYGLRペプチドが間葉系細胞の増殖能に及ぼす影響〕
SVVYGLRペプチドが骨髄および歯髄の組織間質に存在する間葉系細胞の増殖能に及ぼす影響をin vitroの実験系で検討した。
【0054】
骨髄組織間質の間葉系細胞には、ヒト骨髄由来間葉系幹細胞(Cambrex BioScience社)を購入して用いた。また、歯髄組織の主体を成す間葉系細胞である「歯髄細胞」を、Nakamura Hらの方法(J Dent Res. 84: 515−520: 2005)に従い、Sprague−Dawleyラット(8週齢雄)の下顎切歯より分離培養し、実験に用いた。
【0055】
これらの細胞を96穴培養プレート中に5,000個/wellで播種し、SVVYGLRペプチド存在下(0〜100ng/ml)における細胞数をWST−1 Cell Counting Kit(同仁化学)を用いて測定した。培地は1日おきに交換した。
【0056】
なお、SVVYGLRペプチドはPSSM−8ペプチド合成装置(島津製作所製)を用いて、Fmoc法による固相合成(固相担体:PEG−PS)で合成した。ペプチド鎖合成後、樹脂に結合したペプチドを切り離すために側鎖保護を除いた。得られたペプチドはHPLC(島津製作所製)により、純粋なSVVYGLRペプチドであることを確認した。
【0057】
ヒト骨髄由来間葉系幹細胞の結果を図1に示した。図1において、各群はn=6であり、平均値±SDを表している。図1から明らかなように、10〜100ng/mlのSVVYGLRペプチド存在下で培養したヒト骨髄由来間葉系幹細胞の細胞数は、非存在下(0ng/ml)で培養した対照群と比較して4日目以降に有意に増加した(P<0.01)。
【0058】
歯髄細胞の結果を図2に示した。図2において、各群はn=6であり、平均値±SDを表している。図2から明らかなように、10〜100ng/mlのSVVYGLRペプチド存在下で培養した歯髄細胞の細胞数は、非存在下(0ng/ml)で培養した対照群と比較して10日目以降に有意に増加した(P<0.01)。
【0059】
これらの結果から、SVVYGLRペプチドはヒト骨髄由来間葉系幹細胞および歯髄細胞の増殖を濃度依存的に促進することが明らかとなった。
【0060】
〔実施例2:SVVYGLRペプチドが間葉系細胞の立体的増殖に及ぼす影響〕
骨髄の間質に存在する間葉系細胞が長期間をかけて立体的に増殖凝集する際にSVVYGLRペプチドが及ぼす影響をペレット培養実験により検討した。
【0061】
Sprague−Dawleyラット(8週齢雄)の大腿骨骨髄より間葉系細胞を分離培養し、Tsutsumi Sらの方法(Biochem Biophys Res Commun.288:413−419:2001)に従って50,000個の細胞からペレット培養を行った。培養には、α−MEM(high glucose:ナカライテスク)にdexamethasone(100nM,Sigma−Aldrich)、ascorbic acid(50μg/ml,Sigma−Aldrich)、ITS+ premix(100倍希釈,BD Biosciences)、recombinant human transforming growth factor−β1(10ng/ml,PeproTech EC)を添加した培地を用いた。この培地に100ng/mlのSVVYGLRペプチドを添加して26日間培養した。培地は1日おきに交換した。
【0062】
ペレットを回収し、10%リン酸緩衝ホルマリン溶液で4℃、3時間、固定した。PBS(pH7.4)で洗浄した後、ペレットを培養プレートのPBS中に浸漬し、位相差顕微鏡下で撮影した。撮影したペレットの面積を画像解析ソフトImageJ ver.1.33u(National Institute of health,USA)を用いて測定した。
【0063】
結果を図3および図4に示した。図3(a)はSVVYGLRペプチドを培地に添加していない場合のペレットの位相差顕微鏡画像であり、図3(b)はSVVYGLRペプチドを培地に添加した場合のペレットの位相差顕微鏡画像である。両者を比較すると、明らかに(b)のほうが大きいことがわかる。図4は位相差顕微鏡で撮影したペレットの面積を上記画像解析ソフトを用いて測定した数値(μm2)を示すグラフである。両群のそれぞれ3個のペレットを測定し、その平均値±SDを示している。図4から明らかなように、SVVYGLRペプチドを培地に添加した場合のペレットの大きさは、対照群の約1.5倍の大きさであった。
【0064】
これらのペレットの切片を作製しトルイジンブルー染色にて観察した結果、トルイジンブルーに特異的な染色像は見られず、細胞数自体の増加が観察された。したがって、このペレットの大きさの増加は、細胞がペレット内に産生した細胞外基質(酸性ムコ多糖)量が原因ではなく、細胞自身の増殖亢進に起因していることが確認された。以上の結果からSVVYGLRペプチドは、ペレット状態で長期間培養した間葉系細胞の増殖を促進する可能性が示唆された。
【0065】
〔実施例3:SVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジの作製〕
炭酸アパタイト合成は、温度60±1℃、pH7.4±0.2で行った。1.3mol/L酢酸バッファー1Lに、100mmol/L Ca(CH3COO)2H2O溶液0.5Lと、60mmol/L (NH4)2CO3を含む60mmol/L NH4H2PO4溶液0.5Lとを、攪拌しながら添加した。3時間攪拌を続けた後、25℃で24時間静置した。炭酸アパタイトは、ろ過によって分離し、蒸留水で洗浄後、60℃で乾燥することにより得た。
【0066】
得られた合成炭酸アパタイトのX線回折を、X線回折装置(DX1、島津製作所製)を用いて行った。図5に合成炭酸アパタイトのX線回折パターンを示した。高度に結晶化したパターンを持つヒドロキシアパタイトと比較すると、合成炭酸アパタイトは低結晶化アパタイトパターンを有し、ヒトの骨のパターンと類似していることがわかる。
【0067】
0.5wt%コラーゲン溶液(牛皮膚由来コラーゲン、(株)高研製)は、予め抗原性を最小化するために酵素処理を施したものを用いた。0.05N NaOHで中和した後、直ちに70%(w/w)炭酸アパタイト(乾燥重量)と混和した。ゲルを96穴プレートに分注し、−80℃で2時間凍結した後、凍結乾燥機(Eyela製)で24時間乾燥した。不溶性にするため、紫外線ランプ(10W、253.7nm)を10cmの距離から4時間照射した。6mm×10mmの円筒状の炭酸アパタイト・コラーゲンスポンジが得られた。
【0068】
走査電子顕微鏡(S−4100システム、日立製)で観察した画像を図6(a)に示した。また、X線マイクロコンピューター断層撮影(X−ray micro−computed tomography)で描出した3D画像を図6(b)に示した。なお、X線マイクロコンピューター断層撮影には、SkyScan製のmicro CT 1072を用いた。
【0069】
図6(a)および(b)より、約50〜300μmのサイズの孔がスポンジの奥深くまで連続していた。凝固した炭酸アパタイト結晶は、炭酸アパタイト・コラーゲンスポンジのfibrous ribbons of collagen(コラーゲン線維帯)と共に観察された。
【0070】
炭酸アパタイト・コラーゲンスポンジを100ng/mlのSVVYGLRペプチド溶液に浸漬することにより、SVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジを作製した。
【0071】
別途、SVVYGLRペプチドをコラーゲンに架橋させた後、SVVYGLRペプチド含有コラーゲンと炭酸アパタイトとを上述のとおり混和し凍結乾燥してSVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジを作製した。
【0072】
具体的には、SVVYGLRペプチド含有コラーゲンを以下のようにして作製した。すなわち、2架橋剤のGMBSを、コラーゲンに対して10等量の割合でPBS中、4℃にて2時間反応させた後、ゲルろ過カラムで未反応のGMBSを除去した。続いて、コラーゲンに対して等量のSVVYGLRペプチドを、室温で5時間反応させた。酢酸塩の形で使用するため、脱塩カラムにて酢酸塩に置換した。得られたSVVYGLRペプチド含有コラーゲンでは、SVVYGLRペプチド:コラーゲンの重量比は、約1:4であった。
【0073】
〔実施例4:SVVYGLRペプチドを含む炭酸アパタイト・コラーゲンスポンジの移植〕
4週齢のSPF/VAF Crl;CD(SD)系雄性ラット(日本チャールス・リバー)を用いた。ラットにペントバルビタール(50mg/kg)麻酔下、UV照射したSVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジを脛骨の骨髄中に外科的に埋め込んだ。具体的には、ドリルを用いて、脛骨に骨髄が露出しないように3×7mmの穴を開け、骨ノミで骨髄を露出させた。骨髄単層を捨て、移植片を配置するスペースを作った。なお、SVVYGLRペプチドを含有しない炭酸アパタイト・コラーゲンスポンジを移植したラットを対照群とした。
【0074】
移植後1週間目にラットを安楽死させ、移植片を周囲の組織とともに摘出した。切片は直ちにアセトン−ドライアイス中でOTCコンパウンド(Tissue Tek製)を用いて包埋した。
【0075】
第VIII因子(フォンビルブラント因子)に対するポリクローナル抗体(Dako製)を一次抗体として用いた。厚さ6μm凍結切片を10%リン酸緩衝ホルマリンで10分間固定した後、1:400に希釈した一次抗体を切片上に載せて4℃で14時間反応させた。0.1%のtween−20を含むTris−HCl緩衝液でリンスし、ビオチン化抗ウサギ免疫グロブリン(Amersham製)で、室温にて30分間処理した。リンスした後、アルカリホスファターゼ標識ストレプトアビジン(Dako製)を反応させた。アルカリホスファターゼ活性は、new fuchsin中で視覚化した。ヘマトキシリンで核を対比染色した。また、別途凍結切片をヘマトキシリン−エオジン染色した。
【0076】
図7(a)、(b)、(c)にSVVYGLRペプチドを含む炭酸アパタイト・コラーゲンスポンジを移植した移植片の組織像を示した。図7(a)のX部分の拡大像が(b)であり、図7(a)のY部分の拡大像が(c)である。なお、X部分は骨髄との境界に近い炭酸アパタイト・コラーゲンスポンジ領域、Y部分は骨梁部分である。
【0077】
図7(b)では、矢印で示した第VIII因子染色部位に代表されるように、第VIII因子陽性の血管内皮細胞により形成された多数の血管像が鮮明に観察された。さらに、血管内皮細胞は炭酸アパタイト・コラーゲンスポンジ内部方向への侵入が認められた。また、多数の間葉系細胞が炭酸アパタイト・コラーゲンスポンジ内部で観察された。図7(c)では、骨梁に第VIII因子陽性の血管内皮細胞により構成されたハヴァース管が認められた。
【0078】
移植された炭酸アパタイト・コラーゲンスポンジは、術後1週間では吸収や分解されず、多孔体として存在していることが確認された。
【0079】
図8(a)、(b)に、対照のSVVYGLRペプチドを含まない炭酸アパタイト・コラーゲンスポンジを移植した移植片の組織像を示した。図8(a)のZ部分の拡大像が(b)であり、Z部分は骨髄との境界に近い炭酸アパタイト・コラーゲンスポンジ領域である。
【0080】
図8では、第VIII因子陽性の細胞はほとんど観察されず、(b)の移植片と骨髄との境界領域にのみ血管は確認された。また、間葉系細胞は移植片多孔体内部でほとんど確認できなかった。
【0081】
〔実施例5:SVVYGLRペプチドが間葉系細胞の接着能に及ぼす影響〕
SVVYGLRペプチドが間葉系細胞の接着能に及ぼす影響を検討した。間葉系細胞には、ヒト骨髄由来間葉系幹細胞(研究用ヒト間葉系幹細胞:RIKEN CELL BANKより提供)、ヒト歯肉線維芽細胞(定法に従ってヒト歯肉より分離培養)およびヒト歯根膜細胞(正常ヒト歯根膜線維芽細胞:三光純薬より購入)を用いた。
【0082】
これらの細胞を培養する96穴浮遊細胞用マイクロプレート(旭テクノグラス社製)に、合成SVVYGLRペプチドを0〜100μg/mlの濃度で添加し、37℃で2時間静置した後、リン酸緩衝液(PBS:Sigma社製)で2回洗浄することによって、コーティングプレートを作製した。なお、SVVYGLRペプチドは、上記〔実施例1〕に示す方法によって合成した。
【0083】
Dulbecco’s Modified Eagle’s Medium(DMEM:ナカライテスク)に懸濁したヒト骨髄由来間葉系幹細胞、ヒト歯肉線維芽細胞およびヒト歯根膜細胞を、SVVYGLRペプチドでコーティングしたコーティングプレートに、それぞれ1ウェルあたり20,000個添加した。細胞を添加したコーティングプレートを37℃のCO2インキュベーター(5%CO2)内で30分間インキュベートした後、PBSで2回洗浄し、非付着細胞を取り除いた。
【0084】
コーティングプレート上に付着した細胞を0.1%クリスタルバイオレット(Wako社製)で10分間染色した後、PBSで3回洗浄した。各ウェルに20%TritonX(Sigma社製)を添加し、48時間後に吸光度計(BioRadモデル680)を用いて波長550nmの吸光度を測定した(参照波長630nm)。
【0085】
コーティングプレートに接着した細胞数を細胞毎に評価した結果を図9〜11に示した。図9〜11において、各群はn=8であり、平均値±SDを表している。図9はヒト骨髄由来間葉系細胞の結果を示しており、図9から明らかなように、0.01〜100μg/mlのSVVYGLRペプチドでコーティングされたプレート上に接着したヒト骨髄由来間葉系細胞の細胞数は、SVVYGLRペプチドでコーティングされていない(0μg/ml)プレート上に接着した対照群と比較して濃度依存的に有意に増加した(P<0.01)。
【0086】
また、図10および11は、それぞれヒト歯肉線維芽細胞およびヒト歯根膜細胞の結果を示しており、図10および11から明らかなように、0.01〜100μg/mlのSVVYGLRペプチドでコーティングされたプレート上に接着したヒト歯肉線維芽細胞およびヒト歯根膜細胞の細胞数は、それぞれSVVYGLRペプチドでコーティングされていない(0μg/ml)プレート上に接着した対照群と比較して濃度依存的に有意に増加した(P<0.01)。
【0087】
これらの結果から、SVVYGLRペプチドはヒト骨髄由来間葉系幹細胞、ヒト歯肉線維芽細胞およびヒト歯根膜細胞の接着を濃度依存的に促進することが明らかとなった。また、上述した炭酸アパタイト・コラーゲンスポンジのような生体材料にSVVYGLRペプチドをコーティングし、これを生体内に移植することによって、生体内において間葉系細胞の接着を促進し得ることが示唆される。
【0088】
本発明の血管新生誘導および間葉系細胞増殖促進剤は、間葉系組織の修復に有効に利用できる。特に、骨格系生体材料に含有させることにより、骨髄疾患や生活歯髄切断法後の歯髄再生に用いられる非常に有用なツールを提供できる。
【0089】
また、本発明の間葉系細胞増殖促進剤の有効成分は7個のアミノ酸から構成されるペプチドであるので、分子量の大きいタンパク質と比較して抗原性の観点から副作用が起こり難く安全であり、代謝が容易であるという利点を有している。さらに、タンパク質は組換えタンパク質や抽出タンパク質として製造する必要があるため、感染症や予期し得ない副作用の発生などの問題を孕んでいるが、ペプチドは高効率な合成方法が確立されており、製造コストおよび安全性の点からも好ましい。
【0090】
本発明により、国民のQOLの向上と医療費の削減を実現できるという効果を奏する。
【0091】
発明の詳細な説明の項においてなされた具体的な実施形態または実施例は、あくまでも、本発明の技術内容を明らかにするものであって、そのような具体例にのみ限定して狭義に解釈されるべきものではなく、本発明の精神と次に記載する請求の範囲内で、いろいろと変更して実施することができるものである。
【産業上の利用可能性】
【0092】
本発明は、人工骨髄、人工歯髄として非常に有用であり、医薬品産業や医療機器産業に利用可能である。
【技術分野】
【0001】
本発明は、間葉系細胞増殖促進剤およびそれを含有する骨格系生体材料に関するものである。
【背景技術】
【0002】
近年の高齢化社会において、骨、歯牙組織等の欠損・損傷を再建する技術の開発が望まれている。特に、再生医療の進歩による骨格系生体材料への関心が高まっている。欠損組織の修復に用いられる画期的な技術として、硬組織の構成要素である人工骨髄・歯髄の開発が望まれている。
【0003】
歯科の領域においては、特に、より長く自己の歯を維持して生活することが望まれているため、歯髄組織を保存する治療法の重要性が高まっている。歯髄は、歯の中心に位置する組織であり、細胞間質、血管、神経等により構成されている。歯が齲蝕に罹患し、歯髄の一部にまで感染が広がった場合、限局した感染部位のみを切断し、残存する歯髄を存続させる治療法(生活歯髄切断法)が、有用な治療法として注目されている。
【0004】
しかしながら、歯髄の切断面を適切に処置するのは技術的に困難であり、必ずしも切断後の歯髄の状態を良好に保つことは期待できないのが現状である。このため、より的確に、可能な限り侵襲を抑えた治療法を確立することが望まれている。そこで、感染部位の切断により欠損した歯髄部位をもとの状態に再生し、歯髄組織を保存することができれば、国民のQOLの向上と医療費の削減に計り知れない貢献をもたらす可能性がある。
【0005】
骨組織の欠損を修復するための各種骨格系生体材料の研究は、炭酸アパタイト(CO3Ap)の生分解性の観点から進められている。本発明者らは、化学組成および結晶化度の点において、生体硬組織に類似する炭酸アパタイトおよびコラーゲンから、作製した炭酸アパタイト・コラーゲン複合体を生体材料として用いることを提案している(非特許文献1および非特許文献2を参照のこと)。この炭酸アパタイト・コラーゲン複合体を、ラットの腹部内および頭蓋骨膜下に埋め込んだ場合、良好な生体適合性を示した。
【0006】
しかしながら、炭酸アパタイト・コラーゲン複合体のinner bulk(内部バルク)には、細胞が侵入できるスペースがない。そこで、スポンジ状炭酸アパタイト・コラーゲン複合体を用いた場合、スポンジ状体の孔が大きいとき、骨芽細胞の増殖、およびこの孔の内部への細胞の侵入が促進されることが分かった(非特許文献3を参照のこと)。
【0007】
欠損組織を再生し、生体材料が生着することによって、その機能を十分に発揮するためには、細胞へ酸素および栄養を供給することが不可欠である。すなわち、骨格系生体材料に複合機能を与える血管は、骨の維持および成長のためのライフラインとして不可欠である。
【0008】
上述したように、炭酸アパタイト・コラーゲン複合体は、適切な生体適合性を示し、また、この複合体のスポンジ状体は、細胞の浸潤に十分なスペースを有している。しかしながら、スポンジ状体の内部に細胞を浸潤させたとしても、酸素および栄養を供給する血管の非存在下において、細胞が生存することは不可能である。このため、生体材料内の血管新生が不可欠である。
【0009】
血管新生プロセスは、内皮細胞による血管基底膜の消化で開始される。その後、細胞は移動および増殖して管状構造を形成する。多数の研究者らが、各種の成長因子とサイトカイン(血管内皮増殖因子(VEGF)、線維芽細胞成長因子(FGF)、インターロイキン8)から発せされる信号により、これらの細胞反応が厳重に調節されていることを報告している。
【0010】
細胞外基質蛋白質であるオステオポンチン(OPN)は、大量のシアル酸を含むリン酸蛋白質であり、骨組織、腎臓、脳、皮膚等に広く分布している。OPNは骨代謝に関与し、炎症反応と血管新生を仲介する。最近、OPN内に血管新生作用に関与するアミノ酸配列[Ser−Val−Val−Tyr−Gly−Leu−Arg(SVVYGLR)]が発見された(特許文献1、非特許文献4および非特許文献5を参照のこと)。オステオポンチン分子内でRGD配列に隣接するSVVYGLRはトロンビン切断によって暴露されていたため、このモチーフが病態において重要であると考えられる。我々は、血管成長因子としてのSVVYGLRの配列を人工合成することに既に成功している(非特許文献6を参照のこと)。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】国際公開第WO2003/030925号パンフレット
【非特許文献】
【0012】
【非特許文献1】Okazaki M, Ohmae H, Hino T. Insolubilization of apatite-collagen composites by UV irradiation. Biomaterials 1989; 10: 564-568.
【非特許文献2】Okazaki M, Ohmae H, Takahashi J, Kimura H, Sakuda M. Insolubilized properties of UV-irradiated CO3apatite-collagen composites. Biomaterials 1990; 11: 568-572.
【非特許文献3】Itoh M, Shimazu A, Hirata I, Yoshida Y, Shintani, H, Okazaki M. Characterization of CO3Ap-collagen sponges using x-ray high-resolution microtomography. Biomaterials 2004; 25: 2577-2583.
【非特許文献4】Yokosaki Y, Matsuura N, Sasaki T, Murakami I, Schneider H, Higashiyama S, Saitoh Y, Yamakido M, Taooka Y, Sheppard D. The integrin a9b1 bind to a novel recognition sequence (SVVYGLR) in the thrombin-cleaved amino-terminal fragment of osteopontin. J Biol Chem 1999; 274: 36328-36334.
【非特許文献5】Hamada Y, Nokihara K, Okazaki M, Fujitani W, Matsumoto T, Matsuo M, Umakoshi Y, Takahashi J, Matsuura N. Angiogenic activity of osteopontin- derived peptide SVVYGLR. Biochem Biophys Res Commun 2003; 310: 153-157.
【非特許文献6】Hamada Y, Yuki K, Okazaki M, Fujitani W, Matsumoto T, Kobayashi Hashida M, Harutsugu K, Nokihara K, Daito M, Matsuura N, Takahashi J. Osetpontin-derived peptide SVVYGLR induces angiogenesis in vivo. Dent Mater J 2004; 23: 650-655.
【発明の概要】
【発明が解決しようとする課題】
【0013】
上述のように、欠損組織を修復するために生体材料がその機能を十分発揮するためには、欠損組織を再生し、生体材料が生着するだけではなく、再生組織における血管新生が重要である。しかし、骨髄組織や歯髄組織の再生を促進するための生体材料として応用するためには、さらに、組織間質を構成する間葉系細胞の増殖を促進できることが望ましい。
【0014】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、間葉系細胞の増殖促進能を有する骨格系生体材料を提供することにある。
【課題を解決するための手段】
【0015】
本発明者らは、上記の課題を解決するために鋭意検討した結果、血管新生作用に関与することが知られているSVVYGLRペプチドが、骨髄由来間葉系幹細胞、歯髄細胞などの間葉系細胞に対して増殖を促進する作用を有することを新たに見出し、当該SVVYGLRペプチドを含有する炭酸アパタイト・コラーゲンスポンジを欠損した骨髄に移植すると、スポンジ領域における血管の形成およびスポンジ内部への間葉系細胞の侵入が認められ、骨髄再生用生体材料として有用であることを見出し、本発明を完成させるに至った。
【0016】
すなわち、本発明に係る間葉系細胞増殖促進剤は、配列番号1に示されるアミノ酸配列を有効成分とするペプチドであることを特徴としている。
【0017】
本発明に係る骨格系生体材料は、上記本発明に係る血管新生誘導および間葉系細胞増殖促進剤を含むことを特徴としている。当該骨格系生体材料は、炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体であることが好ましい。また、当該骨格系生体材料は、配列番号1に示されるアミノ酸配列からなるペプチドを有効成分として含有する間葉系細胞接着促進剤を含むことが好ましい。
【0018】
本発明に係る骨髄組織または歯髄組織の再生方法は、上記本発明に係る骨格系生体材料を用いることを特徴としている。
【0019】
本発明の他の目的、特徴、および優れた点は、以下に示す記載によって十分分かるであろう。また、本発明の利点は、添付図面を参照した次の説明で明白になるであろう。
【図面の簡単な説明】
【0020】
【図1】SVVYGLRペプチドがヒト骨髄由来間葉系幹細胞の増殖に及ぼす影響を検討した結果を示すグラフである。
【図2】SVVYGLRペプチドが歯髄細胞の増殖に及ぼす影響を検討した結果を示すグラフである。
【図3】図中(a)はSVVYGLRペプチドを培地に添加していない場合の間葉系細胞ペレットの位相差顕微鏡画像であり、図中(b)はSVVYGLRペプチドを培地に添加した場合の間葉系細胞ペレットの位相差顕微鏡画像である。
【図4】位相差顕微鏡で撮影したペレットの面積を画像解析ソフトを用いて測定した数値(μm2)を示すグラフである。
【図5】合成炭酸アパタイトのX線回折パターンを示すチャートである。
【図6】図中(a)は炭酸アパタイト・コラーゲンスポンジの走査電子顕微鏡画像であり、図中(b)は炭酸アパタイト・コラーゲンスポンジのX線マイクロコンピューター断層撮影で描出した3D画像である。
【図7】SVVYGLRペプチドを含む炭酸アパタイト・コラーゲンスポンジを移植した移植片の組織像であり、図中(a)は低倍率で観察した組織像、図中(b)は図中(a)のX部分の強拡大像、図中(c)は図中(a)のY部分の強拡大像である。
【図8】SVVYGLRペプチドを含まない炭酸アパタイト・コラーゲンスポンジを移植した移植片の組織像であり、図中(a)は低倍率で観察した組織像、図中(b)は図中(a)のZ部分の強拡大像である。
【図9】SVVYGLRペプチドでコーティングしたプレート上に接着したヒト骨髄由来間葉系幹細胞の細胞数を測定した数値を示すグラフである。
【図10】SVVYGLRペプチドでコーティングしたプレート上に接着したヒト歯肉線維芽細胞の細胞数を測定した数値を示すグラフである。
【図11】SVVYGLRペプチドでコーティングしたプレート上に接着したヒト歯根膜細胞の細胞数を測定した数値を示すグラフである。
【発明を実施するための形態】
【0021】
〔間葉系細胞増殖促進剤〕
本発明に係る間葉系細胞増殖促進剤は、配列番号1に示されるアミノ酸配列、すなわちSer−Val−Val−Tyr−Gly−Leu−Arg(SVVYGLR)の7アミノ酸からなるペプチド(以下、「SVVYGLRペプチド」と記す)を有効成分とするものであればよい。SVVYGLRペプチドは、オステオポンチン中に存在する血管新生作用を有するペプチドとして公知であるが、本発明者らは、後段の実施例に示すように当該SVVYGLRペプチドが間葉系細胞の増殖を促進する作用を有することを確認し、SVVYGLRペプチドは間葉系細胞増殖促進剤の有効成分となることが見出された。
【0022】
なお、本発明に係る間葉系細胞増殖促進剤は、間葉系細胞の増殖促進作用を有する限り、SVVYGLRペプチドにおいて1または数個のアミノ酸が欠失、置換もしくは付加されたペプチドを有効成分とするものであってもよい。
【0023】
ここで「1または数個のアミノ酸が欠失、置換もしくは付加された」とは、部位特異的突然変異誘発法等の公知の変異ペプチド作製法により欠失、置換もしくは付加できる程度の数(好ましくは3個、より好ましくは2個、さらに好ましくは1個)のアミノ酸が欠失、置換もしくは付加されることを意味する。このような変異ペプチドは、公知の変異ペプチド作製法により人為的に導入された変異を有するペプチドに限定されるものではなく、天然に存在するペプチドを単離精製したものであってもよい。
【0024】
好ましい変異体は、保存性もしくは非保存性アミノ酸置換、欠失、または添加を有する。好ましくは、サイレント置換、添加、および欠失であり、特に好ましくは、保存性置換である。これらは、本発明に係るペプチド活性を変化させない。
【0025】
また、本発明に係る間葉系細胞増殖促進剤の有効成分となるペプチドは、間葉系細胞の増殖促進作用を有する限り、SVVYGLRペプチドに付加的なペプチドを含むものであってもよい。付加的なペプチドは特に限定されないが、例えば、ポリアルギニンタグ(Arg−tag)やポリヒスチジンタグ(His−tag)やMyc、Flag等のエピトープ標識ペプチドが挙げられる。
【0026】
ペプチドが間葉系細胞の増殖促進作用を有するか否かは、ペプチドを添加した培養液を用いて培養した間葉系細胞の増殖曲線を、ペプチドを添加していない培養液を用いて培養した間葉系細胞の増殖曲線と比較することにより確認できる。
【0027】
また、ペプチドは、市販のペプチド合成機を用いる常法により、容易に合成することができる。具体的には、例えば、Fmoc化学による高効率固相法により合成することができる。また、常法により、遺伝子工学的に製造することも可能である。得られたペプチドをHPLC、LCMSなどに供し、質量理論値、単一ピークの存在などにより目的のペプチドであることを確認できる。
【0028】
間葉系細胞は、骨髄あるいは歯髄といった結合組織を構成する細胞で、硬組織系細胞に分化できる間葉系幹細胞も含まれる。
【0029】
上記SVVYGLRペプチドは、単独で、または生理緩衝液などの適切な溶媒に溶解した注射液等の形態で、血管新生誘導および間葉系細胞の増殖が望まれる組織に局所投与することができる。手術や外傷により生じた創傷等の近傍に本発明の間葉系細胞増殖促進剤を、注射や塗布、噴霧等の方法により局所投与することにより、間葉系細胞の増殖が促進され、創傷の治癒が促進される。ここで、注射または塗布若しくは噴霧等に用いるペプチド溶液中のペプチド濃度は、特に限定されないが、通常、0.001〜10μg/mL程度である。また、投与量は、傷などの大きさや深さにより適宜選択できるが、傷全体がペプチド溶液で被覆される程度がよい。また、傷が治癒するまで、1日〜数日毎に1回〜数回投与することができる。また、注射液には、他の消毒剤や消炎鎮痛剤など、通常、傷の治療薬に含まれる種々の成分を含んでいてもよい。
【0030】
また、SVVYGLRペプチドをキャリアに結合し、SVVYGLRペプチドが結合されたキャリアを生体に埋め込むことにより間葉系細胞の増殖を促進することもできる。これはキャリアに固定化しているために必要な部位に選択的に作用させることができ、新たなDDS(ドラッグデリバリーシステム)としての可能性に富んでいる。生体材料移植部に本発明の間葉系細胞増殖促進剤を、塗布、噴霧等の方法により局所投与することにより、間葉系細胞の増殖が促進され、術後の治癒が促進される。ここで、キャリアとしては、特に限定されるものではなく、代用骨や代用歯、人工臓器等に用いられる樹脂や、タンパク質等の生体高分子を挙げることができる。樹脂に上記ペプチドを結合することにより、当該樹脂を生体に埋め込んだ際に、樹脂と接する周辺組織中での間葉系細胞の増殖が促進される。また、より好ましい態様として、タンパク質をキャリアとして用いるができる。
【0031】
ここで、キャリアとして用いるタンパク質は、生体適合性を有するいずれのタンパク質であってもよく、とりわけ、生体組織との接合を良好にするために、細胞接着性タンパク質であることが好ましい。細胞接着性タンパク質の好ましい例として、コラーゲン(ゼラチン)、フィブロネクチン、ビトロネクチンおよびラミニン、並びにこれらの部分加水分解物を挙げることができるがこれらに限定されるものではない。なお、これらのタンパク質は、アレルゲンを除去した精製タンパク質であることが、アレルギー反応の防止の観点から好ましい。
【0032】
キャリアに結合されるペプチドの量は、特に限定されず、適宜選択することができるが、通常、キャリアとペプチドの重量比率(キャリア:ペプチド)が100:1〜1:1程度であり、好ましくは20:1〜5:1程度である。
【0033】
キャリアとペプチドとの結合は、共有結合によることが好ましい。結合は、例えばペプチドのN末端のアミノ基と、キャリア中の任意のアミノ基をグルタルアルデヒド等の結合架橋剤を用いて結合することにより容易に行うことができる。また、人工臓器等の樹脂に結合する場合には、この樹脂中に、アミノ基等の、ペプチドとの結合に用いることができる基を含むモノマーを共重合させておき、当該アミノ基等とペプチドのN末端のアミノ基を結合することができる。また、SVVYGLRペプチドの一端または両端に、任意のアミノ酸配列を有する他のペプチドを結合したものを採用し、この任意のペプチドをキャリアとの結合に供することも好ましい。
【0034】
SVVYGLRペプチドを結合したキャリアは、塗布または噴霧する他にそのままで生体内に埋め込むことができる。キャリアとして、細胞接着性タンパク質を採用した場合には、SVVYGLRペプチド結合キャリアは、縫合糸、各種整形手術材料、傷口の癒着促進剤等として単独または他の薬効成分とともに用いることができる。
【0035】
〔間葉系細胞接着促進剤〕
本発明に係る間葉系細胞接着促進剤は、配列番号1に示されるアミノ酸配列、すなわちSer−Val−Val−Tyr−Gly−Leu−Arg(SVVYGLR)の7アミノ酸からなるペプチド(以下、「SVVYGLRペプチド」と記す)を有効成分とするものであればよい。本発明者らは、後段の実施例に示すように当該SVVYGLRペプチドが間葉系細胞の接着を促進する作用を有することを確認し、SVVYGLRペプチドは間葉系細胞接着促進剤の有効成分となることが見出された。
【0036】
なお、本発明に係る間葉系細胞接着促進剤は、間葉系細胞の接着促進作用を有する限り、SVVYGLRペプチドにおいて1または数個のアミノ酸が欠失、置換もしくは付加されたペプチドを有効成分とするものであってもよい。また、本発明に係る間葉系細胞接着促進剤の有効成分となるペプチドは、間葉系細胞の接着促進作用を有する限り、SVVYGLRペプチドに付加的なペプチドを含むものであってもよい。付加的なペプチドは特に限定されないが、例えば、ポリアルギニンタグ(Arg−tag)やポリヒスチジンタグ(His−tag)やMyc、Flag等のエピトープ標識ペプチドが挙げられる。なお、本明細書中に記載の方法に従えば、当業者は、作成したペプチドが間葉系細胞の接着促進作用を有するか否かを容易に確認できる。また、ペプチドは、上述したいずれかの方法によって合成することができる。
【0037】
上記SVVYGLRペプチドは、単独で、または生理緩衝液などの適切な溶媒に溶解した注射液等の形態で、間葉系細胞の接着が望まれる組織に局所投与することができる。手術や外傷により生じた創傷等の近傍に本発明の間葉系細胞接着促進剤を、注射や塗布、噴霧等の方法により局所投与することにより、間葉系細胞の接着が促進され、創傷の治癒が促進される。ここで、注射または塗布若しくは噴霧等に用いるペプチド溶液中のペプチド濃度は、上記の〔間葉系細胞増殖促進剤〕の項で説明したものと同様である。
【0038】
また、SVVYGLRペプチドをキャリアに結合し、SVVYGLRペプチドが結合されたキャリアを生体に埋め込むことにより間葉系細胞の接着を促進することもできる。生体材料移植部に本発明の間葉系細胞接着促進剤を、塗布、噴霧等の方法により局所投与することにより、間葉系細胞の接着が促進され、術後の治癒が促進される。ここで、キャリアとして好ましい物質、キャリアに結合されるペプチドの量、キャリアの使用例については、上記の〔間葉系細胞増殖促進剤〕の項で説明したものと同様である。
【0039】
〔骨格系生体材料〕
本発明に係る骨格系生体材料は、上記本発明に係る間葉系細胞増殖促進剤を含むものであればよい。したがって、公知の骨格系生体材料に適切な方法でSVVYGLRペプチドを結合させたものが、本発明に係る骨格系生体材料として好適である。なかでも、炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体の骨格系生体材料にSVVYGLRペプチドを結合させたものが特に好ましい。
【0040】
また、本発明に係る骨格系生体材料は、上記本発明に係る間葉系細胞接着促進剤をさらに含んでいてもよい。この場合、SVVYGLRペプチドが間葉系細胞増殖促進剤の有効成分と間葉系細胞接着促進剤の有効成分とを兼ねている。したがって、SVVYGLRペプチドを結合させた骨格系生体材料が、間葉系細胞増殖作用および間葉系細胞接着促進作用を有する。
【0041】
炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体の骨格系生体材料は、例えば以下のようにして作製することができる。
【0042】
用いる炭酸アパタイトとしては、一般式;Ca10−X(PO4)6−Y(CO3)Y(OH)2−Z、ただし、0≦X≦3〜5、0≦Y≦2〜4、0≦Z≦1〜2で表されるものであり、その合成方法と炭酸アパタイトについては、各種論文(例えば非特許文献2)に報告されている。例えば、本発明者らは、後段の実施例3に記載の方法で炭酸アパタイトを合成している。
【0043】
コラーゲンとしては、特に制限はなく、市販されているいずれのコラーゲンでも用いることができる。ただし、市販のコラーゲンのなかには純度が低く、アレルゲンが含まれており、品質の再現性も劣るものがあるので、このようなコラーゲンは臨床適用には好ましくない。動物由来のコラーゲンを部分加水分解し、アレルゲンを除去したゼラチンが臨床用途のために市販されているので、このような精製されたコラーゲンまたはその部分加水分解物を用いることが好ましい。
【0044】
スポンジ状体は、コラーゲンを酸性水溶液(例えば、塩酸水溶液、リン酸水溶液)に溶解し、コラーゲン溶液および炭酸アパタイトを混合し、凍結乾燥することにより作製できる。なお、コラーゲン溶液は炭酸アパタイトを混合する前または後に中和処理(例えば、NaOH水溶液を添加)を行い、好ましくは当該溶液のpHを7〜9の範囲内にする。また、コラーゲン溶液と炭酸アパタイトの混合割合は、通常、コラーゲン溶液1gに対して炭酸アパタイト0.001〜0.01g、好ましくは0.003〜0.01gである。
【0045】
炭酸アパタイトを混合したコラーゲン溶液にさらに有機溶媒を添加してもよい。添加する有機溶媒は混合物の粘度を低下させ得るものであれば特に制限はないが、アルコール系有機溶媒が好ましく、中でもエタノールが好ましい。なお、炭酸アパタイトを混合する前のコラーゲン溶液に有機溶媒を添加してもよい。有機溶媒の添加量は、通常、コラーゲン溶液1gに対して0.01〜0.5g、好ましくは0.1〜0.3gである。また、有機溶媒の添加量は、添加後の混合物の粘度が100〜5000mPa・sの範囲内になる量であることが好ましい。
【0046】
凍結乾燥は、コラーゲン/炭酸アパタイト混合物を適当な容器等に入れ、市販の凍結乾燥機を用いて行うことができる。
【0047】
炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体(以下、「炭酸アパタイト・コラーゲンスポンジ」と記す。)にSVVYGLRペプチドを含有させる方法としては、上述の方法により得られた炭酸アパタイト・コラーゲンスポンジをSVVYGLRペプチド溶液に浸漬して、スポンジ表面にSVVYGLRペプチドを付着させる方法を挙げることができる。この場合、SVVYGLRペプチド溶液の濃度としては、10ng/ml〜10μg/mlが好ましい。
【0048】
また、上記の〔間葉系細胞増殖促進剤〕の項で説明したように、SVVYGLRペプチドを予めキャリアタンパク質としてのコラーゲンに結合させておき、SVVYGLRペプチド含有コラーゲンを用いて上述のように炭酸アパタイト・コラーゲンスポンジを作製する方法を挙げることができる。
【0049】
以上のようにして作製された本発明に係る骨格系生体材料は骨髄疾患や外傷により損傷した骨髄の再生、および生活歯髄切断法後の歯髄再生に好適に用いることができる。つまり、修復しようとする骨髄損傷部位、または、切断した歯髄部位に、本発明に係る骨格系生体材料を移植することにより、骨髄または歯髄を再生し修復することが可能となる。
【0050】
〔骨髄組織または歯髄組織の再生方法〕
本発明に係る骨髄組織または歯髄組織の再生方法は、上記本発明に係る骨格系生体材料を用いるものであればよい。本方法においては、SVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジを再生・修復したい骨髄損傷部位や歯髄切断部位に適用すればよい。
【0051】
なお、発明を実施するための最良の形態の項においてなした具体的な実施態様および以下の実施例は、あくまでも、本発明の技術内容を明らかにするものであって、そのような具体例にのみ限定して狭義に解釈されるべきものではなく、当業者は、本発明の精神および添付の特許請求の範囲内で変更して実施することができる。
【0052】
また、本明細書中に記載された学術文献および特許文献の全てが、本明細書中において参考として援用される。
【実施例】
【0053】
〔実施例1:SVVYGLRペプチドが間葉系細胞の増殖能に及ぼす影響〕
SVVYGLRペプチドが骨髄および歯髄の組織間質に存在する間葉系細胞の増殖能に及ぼす影響をin vitroの実験系で検討した。
【0054】
骨髄組織間質の間葉系細胞には、ヒト骨髄由来間葉系幹細胞(Cambrex BioScience社)を購入して用いた。また、歯髄組織の主体を成す間葉系細胞である「歯髄細胞」を、Nakamura Hらの方法(J Dent Res. 84: 515−520: 2005)に従い、Sprague−Dawleyラット(8週齢雄)の下顎切歯より分離培養し、実験に用いた。
【0055】
これらの細胞を96穴培養プレート中に5,000個/wellで播種し、SVVYGLRペプチド存在下(0〜100ng/ml)における細胞数をWST−1 Cell Counting Kit(同仁化学)を用いて測定した。培地は1日おきに交換した。
【0056】
なお、SVVYGLRペプチドはPSSM−8ペプチド合成装置(島津製作所製)を用いて、Fmoc法による固相合成(固相担体:PEG−PS)で合成した。ペプチド鎖合成後、樹脂に結合したペプチドを切り離すために側鎖保護を除いた。得られたペプチドはHPLC(島津製作所製)により、純粋なSVVYGLRペプチドであることを確認した。
【0057】
ヒト骨髄由来間葉系幹細胞の結果を図1に示した。図1において、各群はn=6であり、平均値±SDを表している。図1から明らかなように、10〜100ng/mlのSVVYGLRペプチド存在下で培養したヒト骨髄由来間葉系幹細胞の細胞数は、非存在下(0ng/ml)で培養した対照群と比較して4日目以降に有意に増加した(P<0.01)。
【0058】
歯髄細胞の結果を図2に示した。図2において、各群はn=6であり、平均値±SDを表している。図2から明らかなように、10〜100ng/mlのSVVYGLRペプチド存在下で培養した歯髄細胞の細胞数は、非存在下(0ng/ml)で培養した対照群と比較して10日目以降に有意に増加した(P<0.01)。
【0059】
これらの結果から、SVVYGLRペプチドはヒト骨髄由来間葉系幹細胞および歯髄細胞の増殖を濃度依存的に促進することが明らかとなった。
【0060】
〔実施例2:SVVYGLRペプチドが間葉系細胞の立体的増殖に及ぼす影響〕
骨髄の間質に存在する間葉系細胞が長期間をかけて立体的に増殖凝集する際にSVVYGLRペプチドが及ぼす影響をペレット培養実験により検討した。
【0061】
Sprague−Dawleyラット(8週齢雄)の大腿骨骨髄より間葉系細胞を分離培養し、Tsutsumi Sらの方法(Biochem Biophys Res Commun.288:413−419:2001)に従って50,000個の細胞からペレット培養を行った。培養には、α−MEM(high glucose:ナカライテスク)にdexamethasone(100nM,Sigma−Aldrich)、ascorbic acid(50μg/ml,Sigma−Aldrich)、ITS+ premix(100倍希釈,BD Biosciences)、recombinant human transforming growth factor−β1(10ng/ml,PeproTech EC)を添加した培地を用いた。この培地に100ng/mlのSVVYGLRペプチドを添加して26日間培養した。培地は1日おきに交換した。
【0062】
ペレットを回収し、10%リン酸緩衝ホルマリン溶液で4℃、3時間、固定した。PBS(pH7.4)で洗浄した後、ペレットを培養プレートのPBS中に浸漬し、位相差顕微鏡下で撮影した。撮影したペレットの面積を画像解析ソフトImageJ ver.1.33u(National Institute of health,USA)を用いて測定した。
【0063】
結果を図3および図4に示した。図3(a)はSVVYGLRペプチドを培地に添加していない場合のペレットの位相差顕微鏡画像であり、図3(b)はSVVYGLRペプチドを培地に添加した場合のペレットの位相差顕微鏡画像である。両者を比較すると、明らかに(b)のほうが大きいことがわかる。図4は位相差顕微鏡で撮影したペレットの面積を上記画像解析ソフトを用いて測定した数値(μm2)を示すグラフである。両群のそれぞれ3個のペレットを測定し、その平均値±SDを示している。図4から明らかなように、SVVYGLRペプチドを培地に添加した場合のペレットの大きさは、対照群の約1.5倍の大きさであった。
【0064】
これらのペレットの切片を作製しトルイジンブルー染色にて観察した結果、トルイジンブルーに特異的な染色像は見られず、細胞数自体の増加が観察された。したがって、このペレットの大きさの増加は、細胞がペレット内に産生した細胞外基質(酸性ムコ多糖)量が原因ではなく、細胞自身の増殖亢進に起因していることが確認された。以上の結果からSVVYGLRペプチドは、ペレット状態で長期間培養した間葉系細胞の増殖を促進する可能性が示唆された。
【0065】
〔実施例3:SVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジの作製〕
炭酸アパタイト合成は、温度60±1℃、pH7.4±0.2で行った。1.3mol/L酢酸バッファー1Lに、100mmol/L Ca(CH3COO)2H2O溶液0.5Lと、60mmol/L (NH4)2CO3を含む60mmol/L NH4H2PO4溶液0.5Lとを、攪拌しながら添加した。3時間攪拌を続けた後、25℃で24時間静置した。炭酸アパタイトは、ろ過によって分離し、蒸留水で洗浄後、60℃で乾燥することにより得た。
【0066】
得られた合成炭酸アパタイトのX線回折を、X線回折装置(DX1、島津製作所製)を用いて行った。図5に合成炭酸アパタイトのX線回折パターンを示した。高度に結晶化したパターンを持つヒドロキシアパタイトと比較すると、合成炭酸アパタイトは低結晶化アパタイトパターンを有し、ヒトの骨のパターンと類似していることがわかる。
【0067】
0.5wt%コラーゲン溶液(牛皮膚由来コラーゲン、(株)高研製)は、予め抗原性を最小化するために酵素処理を施したものを用いた。0.05N NaOHで中和した後、直ちに70%(w/w)炭酸アパタイト(乾燥重量)と混和した。ゲルを96穴プレートに分注し、−80℃で2時間凍結した後、凍結乾燥機(Eyela製)で24時間乾燥した。不溶性にするため、紫外線ランプ(10W、253.7nm)を10cmの距離から4時間照射した。6mm×10mmの円筒状の炭酸アパタイト・コラーゲンスポンジが得られた。
【0068】
走査電子顕微鏡(S−4100システム、日立製)で観察した画像を図6(a)に示した。また、X線マイクロコンピューター断層撮影(X−ray micro−computed tomography)で描出した3D画像を図6(b)に示した。なお、X線マイクロコンピューター断層撮影には、SkyScan製のmicro CT 1072を用いた。
【0069】
図6(a)および(b)より、約50〜300μmのサイズの孔がスポンジの奥深くまで連続していた。凝固した炭酸アパタイト結晶は、炭酸アパタイト・コラーゲンスポンジのfibrous ribbons of collagen(コラーゲン線維帯)と共に観察された。
【0070】
炭酸アパタイト・コラーゲンスポンジを100ng/mlのSVVYGLRペプチド溶液に浸漬することにより、SVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジを作製した。
【0071】
別途、SVVYGLRペプチドをコラーゲンに架橋させた後、SVVYGLRペプチド含有コラーゲンと炭酸アパタイトとを上述のとおり混和し凍結乾燥してSVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジを作製した。
【0072】
具体的には、SVVYGLRペプチド含有コラーゲンを以下のようにして作製した。すなわち、2架橋剤のGMBSを、コラーゲンに対して10等量の割合でPBS中、4℃にて2時間反応させた後、ゲルろ過カラムで未反応のGMBSを除去した。続いて、コラーゲンに対して等量のSVVYGLRペプチドを、室温で5時間反応させた。酢酸塩の形で使用するため、脱塩カラムにて酢酸塩に置換した。得られたSVVYGLRペプチド含有コラーゲンでは、SVVYGLRペプチド:コラーゲンの重量比は、約1:4であった。
【0073】
〔実施例4:SVVYGLRペプチドを含む炭酸アパタイト・コラーゲンスポンジの移植〕
4週齢のSPF/VAF Crl;CD(SD)系雄性ラット(日本チャールス・リバー)を用いた。ラットにペントバルビタール(50mg/kg)麻酔下、UV照射したSVVYGLRペプチド含有炭酸アパタイト・コラーゲンスポンジを脛骨の骨髄中に外科的に埋め込んだ。具体的には、ドリルを用いて、脛骨に骨髄が露出しないように3×7mmの穴を開け、骨ノミで骨髄を露出させた。骨髄単層を捨て、移植片を配置するスペースを作った。なお、SVVYGLRペプチドを含有しない炭酸アパタイト・コラーゲンスポンジを移植したラットを対照群とした。
【0074】
移植後1週間目にラットを安楽死させ、移植片を周囲の組織とともに摘出した。切片は直ちにアセトン−ドライアイス中でOTCコンパウンド(Tissue Tek製)を用いて包埋した。
【0075】
第VIII因子(フォンビルブラント因子)に対するポリクローナル抗体(Dako製)を一次抗体として用いた。厚さ6μm凍結切片を10%リン酸緩衝ホルマリンで10分間固定した後、1:400に希釈した一次抗体を切片上に載せて4℃で14時間反応させた。0.1%のtween−20を含むTris−HCl緩衝液でリンスし、ビオチン化抗ウサギ免疫グロブリン(Amersham製)で、室温にて30分間処理した。リンスした後、アルカリホスファターゼ標識ストレプトアビジン(Dako製)を反応させた。アルカリホスファターゼ活性は、new fuchsin中で視覚化した。ヘマトキシリンで核を対比染色した。また、別途凍結切片をヘマトキシリン−エオジン染色した。
【0076】
図7(a)、(b)、(c)にSVVYGLRペプチドを含む炭酸アパタイト・コラーゲンスポンジを移植した移植片の組織像を示した。図7(a)のX部分の拡大像が(b)であり、図7(a)のY部分の拡大像が(c)である。なお、X部分は骨髄との境界に近い炭酸アパタイト・コラーゲンスポンジ領域、Y部分は骨梁部分である。
【0077】
図7(b)では、矢印で示した第VIII因子染色部位に代表されるように、第VIII因子陽性の血管内皮細胞により形成された多数の血管像が鮮明に観察された。さらに、血管内皮細胞は炭酸アパタイト・コラーゲンスポンジ内部方向への侵入が認められた。また、多数の間葉系細胞が炭酸アパタイト・コラーゲンスポンジ内部で観察された。図7(c)では、骨梁に第VIII因子陽性の血管内皮細胞により構成されたハヴァース管が認められた。
【0078】
移植された炭酸アパタイト・コラーゲンスポンジは、術後1週間では吸収や分解されず、多孔体として存在していることが確認された。
【0079】
図8(a)、(b)に、対照のSVVYGLRペプチドを含まない炭酸アパタイト・コラーゲンスポンジを移植した移植片の組織像を示した。図8(a)のZ部分の拡大像が(b)であり、Z部分は骨髄との境界に近い炭酸アパタイト・コラーゲンスポンジ領域である。
【0080】
図8では、第VIII因子陽性の細胞はほとんど観察されず、(b)の移植片と骨髄との境界領域にのみ血管は確認された。また、間葉系細胞は移植片多孔体内部でほとんど確認できなかった。
【0081】
〔実施例5:SVVYGLRペプチドが間葉系細胞の接着能に及ぼす影響〕
SVVYGLRペプチドが間葉系細胞の接着能に及ぼす影響を検討した。間葉系細胞には、ヒト骨髄由来間葉系幹細胞(研究用ヒト間葉系幹細胞:RIKEN CELL BANKより提供)、ヒト歯肉線維芽細胞(定法に従ってヒト歯肉より分離培養)およびヒト歯根膜細胞(正常ヒト歯根膜線維芽細胞:三光純薬より購入)を用いた。
【0082】
これらの細胞を培養する96穴浮遊細胞用マイクロプレート(旭テクノグラス社製)に、合成SVVYGLRペプチドを0〜100μg/mlの濃度で添加し、37℃で2時間静置した後、リン酸緩衝液(PBS:Sigma社製)で2回洗浄することによって、コーティングプレートを作製した。なお、SVVYGLRペプチドは、上記〔実施例1〕に示す方法によって合成した。
【0083】
Dulbecco’s Modified Eagle’s Medium(DMEM:ナカライテスク)に懸濁したヒト骨髄由来間葉系幹細胞、ヒト歯肉線維芽細胞およびヒト歯根膜細胞を、SVVYGLRペプチドでコーティングしたコーティングプレートに、それぞれ1ウェルあたり20,000個添加した。細胞を添加したコーティングプレートを37℃のCO2インキュベーター(5%CO2)内で30分間インキュベートした後、PBSで2回洗浄し、非付着細胞を取り除いた。
【0084】
コーティングプレート上に付着した細胞を0.1%クリスタルバイオレット(Wako社製)で10分間染色した後、PBSで3回洗浄した。各ウェルに20%TritonX(Sigma社製)を添加し、48時間後に吸光度計(BioRadモデル680)を用いて波長550nmの吸光度を測定した(参照波長630nm)。
【0085】
コーティングプレートに接着した細胞数を細胞毎に評価した結果を図9〜11に示した。図9〜11において、各群はn=8であり、平均値±SDを表している。図9はヒト骨髄由来間葉系細胞の結果を示しており、図9から明らかなように、0.01〜100μg/mlのSVVYGLRペプチドでコーティングされたプレート上に接着したヒト骨髄由来間葉系細胞の細胞数は、SVVYGLRペプチドでコーティングされていない(0μg/ml)プレート上に接着した対照群と比較して濃度依存的に有意に増加した(P<0.01)。
【0086】
また、図10および11は、それぞれヒト歯肉線維芽細胞およびヒト歯根膜細胞の結果を示しており、図10および11から明らかなように、0.01〜100μg/mlのSVVYGLRペプチドでコーティングされたプレート上に接着したヒト歯肉線維芽細胞およびヒト歯根膜細胞の細胞数は、それぞれSVVYGLRペプチドでコーティングされていない(0μg/ml)プレート上に接着した対照群と比較して濃度依存的に有意に増加した(P<0.01)。
【0087】
これらの結果から、SVVYGLRペプチドはヒト骨髄由来間葉系幹細胞、ヒト歯肉線維芽細胞およびヒト歯根膜細胞の接着を濃度依存的に促進することが明らかとなった。また、上述した炭酸アパタイト・コラーゲンスポンジのような生体材料にSVVYGLRペプチドをコーティングし、これを生体内に移植することによって、生体内において間葉系細胞の接着を促進し得ることが示唆される。
【0088】
本発明の血管新生誘導および間葉系細胞増殖促進剤は、間葉系組織の修復に有効に利用できる。特に、骨格系生体材料に含有させることにより、骨髄疾患や生活歯髄切断法後の歯髄再生に用いられる非常に有用なツールを提供できる。
【0089】
また、本発明の間葉系細胞増殖促進剤の有効成分は7個のアミノ酸から構成されるペプチドであるので、分子量の大きいタンパク質と比較して抗原性の観点から副作用が起こり難く安全であり、代謝が容易であるという利点を有している。さらに、タンパク質は組換えタンパク質や抽出タンパク質として製造する必要があるため、感染症や予期し得ない副作用の発生などの問題を孕んでいるが、ペプチドは高効率な合成方法が確立されており、製造コストおよび安全性の点からも好ましい。
【0090】
本発明により、国民のQOLの向上と医療費の削減を実現できるという効果を奏する。
【0091】
発明の詳細な説明の項においてなされた具体的な実施形態または実施例は、あくまでも、本発明の技術内容を明らかにするものであって、そのような具体例にのみ限定して狭義に解釈されるべきものではなく、本発明の精神と次に記載する請求の範囲内で、いろいろと変更して実施することができるものである。
【産業上の利用可能性】
【0092】
本発明は、人工骨髄、人工歯髄として非常に有用であり、医薬品産業や医療機器産業に利用可能である。
【特許請求の範囲】
【請求項1】
配列番号1に示されるアミノ酸配列からなるペプチドを含有する炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体を含有し、骨髄組織または歯髄組織の損傷部位または欠損部位に投与するための間葉系細胞の増殖促進剤。
【請求項1】
配列番号1に示されるアミノ酸配列からなるペプチドを含有する炭酸アパタイトおよびコラーゲンの複合体からなるスポンジ状体を含有し、骨髄組織または歯髄組織の損傷部位または欠損部位に投与するための間葉系細胞の増殖促進剤。
【図1】


【図2】


【図4】


【図5】


【図9】


【図10】


【図11】


【図3】


【図6】


【図7】


【図8】




【図2】


【図4】


【図5】


【図9】


【図10】


【図11】


【図3】


【図6】


【図7】


【図8】


【公開番号】特開2013−10010(P2013−10010A)
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願番号】特願2012−221712(P2012−221712)
【出願日】平成24年10月3日(2012.10.3)
【分割の表示】特願2008−532088(P2008−532088)の分割
【原出願日】平成19年8月29日(2007.8.29)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
【公開日】平成25年1月17日(2013.1.17)
【国際特許分類】
【出願日】平成24年10月3日(2012.10.3)
【分割の表示】特願2008−532088(P2008−532088)の分割
【原出願日】平成19年8月29日(2007.8.29)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【Fターム(参考)】
[ Back to top ]

