関節を治療する組成物および方法
【課題】変形性関節症および/またはそれに伴う疼痛などの、関節の状態を治療する組成物および方法を提供する。
【解決手段】組成物および方法は、第1の成分、すなわちヒアルロン酸(「HA」)を、凍結乾燥した第2の成分と組み合わせて使用し、この第2の成分は、HAの粘度を少なくとも一時的に低減するのに有効である。例示的な実施形態では、第2の成分は、1つまたは複数のグリコサミノグリカン(「GAG」)、例えば、CS4および/またはCS6を含むコンドロイチン硫酸(「CS」)、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ならびにケラタン硫酸である。組成物はオプションとして、グルコサミン(「GlcN」)などの、他の関節用サプリメントを含むことができる。
【解決手段】組成物および方法は、第1の成分、すなわちヒアルロン酸(「HA」)を、凍結乾燥した第2の成分と組み合わせて使用し、この第2の成分は、HAの粘度を少なくとも一時的に低減するのに有効である。例示的な実施形態では、第2の成分は、1つまたは複数のグリコサミノグリカン(「GAG」)、例えば、CS4および/またはCS6を含むコンドロイチン硫酸(「CS」)、デルマタン硫酸、ヘパリン、ヘパラン硫酸、ならびにケラタン硫酸である。組成物はオプションとして、グルコサミン(「GlcN」)などの、他の関節用サプリメントを含むことができる。
【発明の詳細な説明】
【開示の内容】
【0001】
〔発明の分野〕
本発明は、概して、関節を治療する組成物および方法に関する。
【0002】
〔発明の背景〕
関節炎の最も一般的な形態である変形性関節症(「OA」)は、関節の骨、軟骨および滑膜における変性(関節の漸進的な劣化)の、または異常な変化により特徴付けられるある種の関節炎である。OAは、患者の疼痛、腫脹、および硬直を結果として生じる炎症を時に伴う、向かい合った関節表面の進行性磨耗によってしばしば特徴付けられる。OAは、関節への外傷後、関節の感染後、または単に加齢の結果として、1つまたは複数の関節で生じ得る。さらに、異常な解剖学的構造がOAの初期発生の一因となり得るという新たな証拠がある。
【0003】
OAの治療には、一般的に、運動もしくは理学療法、ライフスタイルの変更、および鎮痛薬の組み合わせが含まれる。アセトアミノフェンは、典型的には、最初に使用されるOA治療である。軽度から中等度の症状では、有効性は、イブプロフェンなどの非ステロイド性抗炎症薬(「NSAID」)と同様である。さらに重篤な症状では、NSAIDは、より有効となり得る。しかしながら、より有効である一方で、重篤な症例でのNSAIDは、胃腸出血および腎臓の合併症などの重い副作用と関連がある。別の種類のNSAID、COX−2選択的阻害薬(セレコキシブなど)は、NSAIDと同様に有効であるが、副作用の点では、より安全というものではない。ジクロフェナクを含む、局所的用途に使用できるNSAIDがいくつかある。典型的には、それらは、経口投与より全身性の副作用が少なく、少なくともいくつかの治療効果を有している。モルヒネおよびフェンタニールなどのオピオイド鎮痛薬は疼痛を改善するが、この恩恵を、頻繁な有害事象が上回り、そのため、オピオイド鎮痛薬は日常的に使用されない。関節内ステロイド注入も、OA治療で使用され、疼痛緩和には非常に有効である。しかしながら、疼痛緩和の持続力は、4〜6週間に限られており、付随的な軟骨損傷を含み得る悪影響がある。疼痛が弱くなってきたら、関節置換手術を使用して、可動性および生活の質を改善することができる。疾患を遅らせたり逆行させたりする、実績ある治療はない。
【0004】
アセトアミノフェンのような単純な鎮痛薬または運動および理学療法により適切な疼痛緩和を得られない患者では、ヒアルロン酸(HA)の関節内注入により、症候性疼痛に対処し、関節全置換手術の必要性を遅らせる、別の治療オプションが与えられる。自然のHAの濃度(concentration)が、OAに罹っている個体において不十分であることが分かっており、したがって、外因性HAの関節注入がこれらの分子を補充し、滑液の粘弾性特性を回復すると考えられる。関節を滑らかにし、かつ保護する(cushioning)のに関与するのは、この特性である。HAが、細胞表面レセプターへの結合を通じて生物活性を有し、また、炎症緩和において役割を有し得るという証拠もある。作用のメカニズムにかかわらず、疼痛緩和は、治療過程後約6カ月間観察される。米国市場におけるHA製品の治療過程は、単回注入製品から、この疼痛緩和持続力を達成するのに週に3〜5回の注入を必要とする他のものまで、さまざまであってよい。
【0005】
OAに関係した疼痛および構造的変性に取り組むため、OA関節を治療する改善された方法および組成物、特に、1つまたは複数のGAGと組み合わせられたHAを用いて関節を治療する、改善された方法および組成物、に対する必要性が残っている。
【0006】
〔発明の概要〕
本発明は、概して、関節の病気、例えば変形性関節症および/またはそれに関係する疼痛を治療する組成物ならびに方法を提供する。一実施形態では、関節を治療するキットを提供し、このキットは、ヒアルロン酸(「HA」)を含む第1の成分と、凍結乾燥グリコサミノグリカン(「GAG」)を含む第2の成分と、第1および第2の成分の混合物を注入する注射器と、を含む。さまざまなGAGを使用することができるが、一実施形態では、GAGは、コンドロイチン硫酸を含む。このキットは、いくつかの実施形態では凍結乾燥され得る、グルコサミンなどの第3の成分も含んでよい。
【0007】
これらの成分の組成は、さまざまであってよい。一実施形態では、第1および第2の成分を組み合わせて混合物が形成されると、第1および第2の成分は、重量で約1:0.005〜1:100の範囲の、第1の成分対第2の成分の割合で、混合物内に存在する。他の態様では、ヒアルロン酸を凍結乾燥させてよい。例示的な一実施形態では、ヒアルロン酸は、約1.661×10−18g〜6.642×10−18g(約100万ダルトン(MDa)〜4MDa)の範囲の分子量、少なくとも約5mg/mL、より好ましくは少なくとも約7mg/mLの濃度を有する。このキットは、第1および第2の成分を可溶化するのに有効な流体を含む第3の成分も含んでよい。その流体は、例えば、水、食塩水、および/または緩衝液であってよい。
【0008】
注射器はさまざまな構成を有することができ、一実施形態では、注射器は、第1の成分を収容する第1のチャンバと、第2の成分を収容する第2の容器と、第1および第2の成分を混合するため第2の成分を第1のチャンバ内に注入するように構成されたプランジャーと、を有する。別の実施形態では、第2の成分は、容器内部に入れられてよく、注射器は、第1の成分を収容する第1のチャンバと、その容器を注射器に取り外し可能に連結するコネクタと、を含んでよく、注射器の第1のチャンバ内部にスライド可能に配されたプランジャーが、第1および第2の成分を混合するように、第1の成分を容器に注入することができる。
【0009】
他の態様では、関節を治療する方法が提供され、この方法は、混合物を形成するために、ヒアルロン酸を含む第1の成分を、凍結乾燥グリコサミノグリカンを含む第2の成分と組み合わせることと、その混合物を関節に注入することと、を含む。グリコサミノグリカンは、例えばコンドロイチン硫酸であってよい。キットはまた、グルコサミンなどの第3の成分を含んでよい。ある態様では、存在する場合には、グルコサミンは凍結乾燥されてよい。成分を組み合わせると、混合物の粘度は、組み合わせる前のヒアルロン酸の粘度より低くなる。別の実施形態では、ヒアルロン酸は凍結乾燥され、第1および第2の成分は、混合物を形成するために第1および第2の成分を組み合わせる前、または組み合わせている間に、可溶化される。第1および第2の成分は、例えばバイアル内で組み合わせられて、注射器内に引き込まれることができ、この注射器は、混合物を関節に注入するのに使用され得る。例示的な実施形態では、混合物の形成後、例えば、混合物の形成から約30分以内に、第1および第2の成分を注射器内に引き込む。別の実施形態では、第1の成分は、注射器の第1のチャンバ内部に入れられ、第2の成分は、注射器の第2のチャンバ内部に入れられ、第1および第2の成分を組み合わせることは、第1の成分を第2のチャンバ内へ注入することを含む。さらに別の実施形態では、第1および第2の成分を組み合わせることは、第1の成分が入った容器を、第2の成分が入った注射器に連結することと、第2の成分を注射器から容器内に注入することと、を含む。
【0010】
第1の成分は、さまざまな濃度および分子量を有してよいが、一実施形態では、濃度は、少なくとも約5mg/mL、さらに好ましくは少なくとも約7mg/mLであり、分子量は、約1.661×10−18g〜6.642×10−18g(約1MDa〜4MDa)の範囲である。例示的な実施形態では、第1および第2の成分は、混合物中に約1:0.005〜1:100の割合で存在する。
【0011】
添付図面は、前述の特徴、利点、および目的が明確になり、詳細に理解され得るように、本明細書に含まれている。これらの図面は、明細書の一部を形成する。しかしながら、添付図面は、例示的な実施形態を示しており、範囲を限定すると考えられるべきではないことに注意されたい。
【0012】
〔発明の詳細な説明〕
概して、本発明は、変形性関節症および/またはそれに関わる疼痛などの関節の病気を治療する組成物および方法を提供する。組成物および方法は、第1の成分、すなわちヒアルロン酸(「HA」)を、HAの粘度を少なくとも一時的に低減するのに有効な、凍結乾燥した第2の成分と組み合わせて利用する。例示的な実施形態では、第2の成分は、1つまたは複数のグリコサミノグリカン(「GAG」)、例えば、CS4および/またはCS6を含むコンドロイチン硫酸(「CS」)、デルマタン硫酸、ヘパリン、ヘパラン硫酸、およびケラタン硫酸、である。組成物は、グルコサミン(「GlcN」)などの、他の関節用サプリメントをオプションとして含み得る。
【0013】
凍結乾燥GAGの使用には、HAの粘度を少なくとも一時的に低減する効果があり、そのため、凍結乾燥GAGとHAとから形成した組成物は、HA単独の粘度より(少なくとも一時的に)著しく低い粘度を有することが、分かっている。高分子量および高濃度でHAを使用することが望ましいが、HAの粘度は、分子量および濃度が増大するにつれて著しく増大する。その結果、HAは、典型的には、低い分子量および濃度で使用されて、術中の混合を可能にするか、あるいは、HAは製造中に混合される。使用目的の時点より前、例えば製造時にHAを混合することにより、HA組成物の安定性および貯蔵寿命に関する問題が生じ得る。凍結乾燥GAGがHAの粘度を少なくとも一時的に低減するのに有効であるという発見により、高い分子量および濃度のHAを使用することができるようになり、したがって、HAをGAGと術中に、すなわち、手術直前または手術中に混合することができ、それにより、組成物の安定性および貯蔵寿命の問題がなくなる。この粘度の低減は、ボルテックスミキサー(vortexer)、ミキサー、もしくはスパチュラなどの機械的補助器具を使用せずに、混合を行うのに十分である。したがって、HAとCSとを組み合わせる製剤を作るために無菌性を損ない得る(compromise)特定の器具または攪拌器に対する必要性がある。
【0014】
第1の成分
第1の成分HAは、さまざまな処方を有することができ、さまざまな濃度および分子量で供給され得る。用語「ヒアルロン酸」、「ヒアルロナン」、および「HA」は、本明細書では互換可能に使用され、ヒアルロン酸またはヒアルロン酸の塩、中でも、例えばナトリウム塩、カリウム塩、マグネシウム塩、およびカルシウム塩、を指す。これらの用語は、自然のヒアルロン酸だけでなく、他の微量元素を有するヒアルロン酸、もしくは他の元素を有するさまざまな組成物中のヒアルロン酸も含むことも意図されている。用語「ヒアルロン酸」、「ヒアルロナン」、および「HA」は、HAの化学誘導体、もしくはポリマー誘導体、もしくは架橋誘導体を含む。HAに行われ得る化学修飾の例には、HAの4つの反応基、すなわちアセトアミド、カルボキシル、ヒドロキシル、および還元末端、との物質の任意の反応が含まれる。本出願で使用されるHAは、自然製剤、合成製剤、またはそれらの組み合わせを含むことが意図されている。HAは、液体もしくは固体製剤で供給されてよく、HAは、純正液体形態であるか、または様々な濃度で溶媒中にあってよい。
【0015】
HAは、グリコサミノグリカン(GAG)であり、具体的には、HAは、交互のグルクロン酸およびN-アセチルグルコサミン単位で作られた、直鎖多糖類である。HAは、コラーゲンに付着した軟骨の細胞外基質にも見られる粘弾性物質である。特に、HAは、関節軟骨の弾性特性を与える凝集プロテオグリカンの重要な構成成分である。HAは、関節を保護する軟骨を強くかつ可撓性に保つのに役立つだけでなく、関節を潤滑する滑液の供給増大にも役立つ。HAの異常は、結合組織障害において、共通のテーマ(common thread)である。したがって、HAは、結合組織障害の防止、治療、またはその外科的修復の補助のために、使用され得る。
【0016】
HAは、さまざまな分子量で、本発明の組成物および方法に使用され得る。HAはポリマー分子(polymeric molecule)であるので、HA成分は、さまざまな範囲の分子量を呈することができ、HAのほとんどの平均モーダル分子量製剤(almost any average of modal molecular weight formulation of HA)を、本発明の組成物および方法で使用することができ、これには、低分子量(「LWM」)ヒアルロナン(約8.303×10−19〜1.162×10−18g(約500〜700キロダルトン(kDa))、中間分子量(「MMW」)ヒアルロナン(1.162×10−18〜1.661×10−18g(700〜1000kDa))、および高分子量(「HMW」)ヒアルロナン(1.661×10−18〜6.642×10−18g(100万〜400万ダルトン(MDa)))が含まれる。ある例示的な実施形態では、HAは、少なくとも約8.303×10−19g(約500kDa)の分子量を有し、さらに好ましくは、HAは、少なくとも約1.661×10−18g(約1MDa)の分子量を有する高分子量(「HWM」)HAである。分子量は、例えば、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、5000kDaまたはそれ以上、またはその範囲内で導き出せる任意の範囲であってよい。化学修飾されたHAは、前述したのとかなり異なる分子量を有し得ることが予測される。架橋されたHAは、前述したものよりもはるかに高い分子量を有し得る。それにもかかわらず、これらの物質は、好ましくは、製剤中で非架橋のHAまたはわずかに架橋されたHAと組み合わされる場合、本発明でも適用可能である。
【0017】
混合物中に存在するHAの濃度もさまざまであってよいが、例示的な実施形態では、HAは、薬剤的に有効な量で供給される。例示的な実施形態では、HAは、少なくとも約5mg/mL、さらに好ましくは少なくとも約7mg/mL、さらに好ましくは少なくとも約10mg/mL、さらに好ましくは少なくとも約15mg/mLの濃度を有し、いくつかの実施形態では、濃度は、少なくとも約20mg/mLであってよい。HAの適切な濃度には、約5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、10mg/mL、11mg/mg、12mg/mL、13mg/mL、14mg/mL、15mg/mL、16mg/mL、17mg/mL、18mg/mL、19mg/mL、20mg/mL、21mg/mL、22mg/mL、23mg/mL、24mg/mL、25mg/mL、26mg/mL、27mg/mL、28mg/mL、29mg/mL、30mg/mL、31mg/mL、32mg/mL、33mg/mL、34mg/mL、35mg/mL、36mg/mL、37mg/mL、38mg/mL、39mg/mL、40mg/mL、41mg/mL、42mg/mL、43mg/mL、44mg/mL、45mg/mL、46mg/mL、47mg/mL、48mg/mL、49mg/mL、50mg/mL、51mg/mL、52mg/mL、53mg/mL、54mg/mL、55mg/mL、56mg/mL、57mg/mL、58mg/mL、59mg/mL、60mg/mL、またはそれ以上、またはその範囲内で導き出せる任意の範囲が含まれる。
【0018】
一実施形態では、第1の成分は、高い分子量(例えば、1.661×10−18g〜6.642×10−18g(1〜4MDa))、および約7〜40mg/mLの範囲の濃度を有するHAを含む。そのような1つの製品は、Anika Therapeutics, Inc.(Bedford, MA)により製造される、Orthovisc(登録商標)である。Orthovisc(登録商標)は、ヒアルロナンの、無菌の非発熱性で透明な粘弾性溶液である。Orthovisc(登録商標)は、生理食塩水に溶解され、15mg/mLの公称濃度を有する、高分子量(1.661×10−18〜4.816×10−18g(1.0〜2.9MDa))で超高純度の天然ヒアルロナンのみからなる。Orthovisc(登録商標)は、細菌発酵により単離される。当業者は、HMWのHAを、ShiseidoおよびLifecoreなどのいくつかの供給源から得ることができることを理解するであろう。これらの特徴を有する、米国におけるHA製品の別の例は、Euflexxa(登録商標)である。
【0019】
第2の成分
本発明の方法および組成物に使用される第2の成分も、さまざまな構成を有してよいが、例示的な実施形態では、第2の成分は、凍結乾燥グリコサミノグリカン(GAG)である。用語「グリコサミノグリカン」または「GAG」は、典型的には、ヘパリン、ヘパリン硫酸、コンドロイチン、コンドロイチン硫酸、ケラタン硫酸、デルマタン硫酸、およびそれらのそれぞれの誘導体を含む、硫酸ムコ多糖類のファミリーを、互換的に指す。
【0020】
グリコサミノグリカン(GAG)は、反復二糖類単位(repeating disaccharide unit)を含む長い直鎖多糖類(long unbranched polysaccharides)である。二糖類単位は、2つの修飾された糖、N-アセチルガラクトサミン(GalNAc)もしくはN-アセチルグルコサミン(GlcNAc)のいずれか、およびグルクロン酸もしくはイズロン酸などのウロン酸を含有する。GAGは、非常にマイナスに帯電した分子で、混合物に高い粘度を与える、拡張された立体構造(extended conformation)を有する。GAGは、主に、細胞の表面上、または細胞外基質(ECM)内、に位置する。GAGの高い粘度により低い圧縮性が達成され、これにより、これらの分子は、関節の潤滑流体にとって理想的なものとなる。したがって、GAGは、炎症過程を鈍化させるのに役立つことができる。同時に、それらの剛性により、細胞に構造的完全性がもたらされ、また、細胞間の通路がもたらされて、細胞移動が可能となる。さらに、CSなどのGAGは、滑液内で見られており、関節の健康において役割を果たし得る。したがって、HAと同時にCSを送達できる療法を有するのは理にかなっている。CSはHAの効力を高め得ると考えられる。しかしながら、われわれは、CS存在下でのHAが経時的に分解し得ることを観察した。したがって、この分解が起きるのを防ぐために、HAは使用されるまで冷蔵保存される必要がある。しかしながら、ほとんどの診療所および病院は、これらのタイプの製品を冷蔵庫に保存する容量を有していないことが分かっているので、HAおよびGAGを室温で保存する能力を保持しながら、HAおよびGAGを組み合わせることができる製品を提供する方法を見つける必要があった。
【0021】
製剤の安定性を増大させる1つの方法は、注入直前または注入時に希釈剤で再懸濁され得る凍結乾燥製品として、製品を提供することである。例えば、凍結乾燥GAGは、注入直前または注入時にHAゲルで再懸濁するように提供され得る。残念ながら、高分子量および/または高濃度のHAは、非常に粘性である。この高い粘度であっても、外科医は、製剤を関節内に送達することができる。これは、HA、特に非架橋HAは、ずり速度(shear rate)の増大につれて粘度が低下するためである。このずり減粘と呼ばれる現象は、HAが針を通って押された場合に生じる。HAはずり減粘するか(shear thins)または粘度が低減し、このことは、患者の関節への注入を容易にするのを助ける。HAが機械力を受けていない場合、粘度は高いままであり、機械補助もしくは混合システムなしでHAに別の活性物質(active)を溶解または混合することは困難になる。
【0022】
HAをGAG、特に凍結乾燥GAGと組み合わせた場合、GAGは、いったん溶解すると、混合を起こすことができるよう十分に、HAの粘度を少なくとも一時的に低減させ得ることが、分かっている。液体GAG製剤に対する凍結乾燥GAG製剤の利点は、より高い濃度でHA成分を使用できることである。液体GAGを、HAと組み合わせることができるが、液体GAGとHAとのこのような混合物は、より低い濃度のHAをもたらす。臨床環境で疼痛緩和の持続力をもたらすには、より高い濃度のHAが望ましいと考えられる。さまざまなGAGを使用することができるが、特定の例示的な実施形態では、凍結乾燥GAGは、硫酸処理され、さらに具体的には、CS4および/またはCS6を含むコンドロイチン硫酸(CS)、デルマタン硫酸、ヘパリン、ヘパラン硫酸、およびケラタン硫酸のうち1つまたは複数である。
【0023】
GAGは、さまざまな分子量を有し得るが、特定の例示的な実施形態では、分子量は、約8.303×10−21〜1.661×10−18g(約5〜1,000kDa)の範囲、さらに好ましくは約9.963×10−21〜8.303×10−19g(約6〜500kDa)の範囲、さらに好ましくは約1.162×10−20〜4.982×10−19g(約7〜300kDa)の範囲、さらに好ましくは約1.328×10−20〜3.321×10−19g(約8〜200kDa)の範囲、さらに好ましくは約1.494×10−20〜1.661×10−19g(約9〜100kDa)の範囲、最も好ましくは約1.661×10−20〜1.328×10−19g(約10〜80kDa)の範囲である。他の実施形態では、GAG断片の分子量は、約8.303×10−21g(約5kDa)より低く、さらに好ましくは約4.982×10−21g(約3kDa)より低い。
【0024】
混合物中に存在するGAGの濃度もさまざまであってよいが、例示的な実施形態では、GAGは、薬剤的に有効な量で供給される。例示的な実施形態では、GAGは、少なくとも約0.1mg/mL、さらに好ましくは少なくとも約2mg/mL、さらに好ましくは少なくとも約5mg/mL、さらに好ましくは少なくとも約7mg/mLの濃度を有する。GAGの適切な濃度には、約5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、10mg/mL、11mg/mg、12mg/mL、13mg/mL、14mg/mL、15mg/mL、16mg/mL、17mg/mL、18mg/mL、19mg/mL、20mg/mL、21mg/mL、22mg/mL、23mg/mL、24mg/mL、25mg/mL、26mg/mL、27mg/mL、28mg/mL、29mg/mL、30mg/mL、31mg/mL、32mg/mL、33mg/mL、34mg/mL、35mg/mL、36mg/mL、37mg/mL、38mg/mL、39mg/mL、40mg/mL、41mg/mL、42mg/mL、43mg/mL、44mg/mL、45mg/mL、46mg/mL、47mg/mL、48mg/mL、49mg/mL、50mg/mL、51mg/mL、52mg/mL、53mg/mL、54mg/mL、55mg/mL、56mg/mL、57mg/mL、58mg/mL、59mg/mL、60mg/mL、またはそれ以上、またはこの範囲内で導き出せる任意の範囲が含まれる。
【0025】
軟骨の必須成分であるコンドロイチン硫酸(CS)は、交互β(1,3)およびβ(1,4)結合により連結された硫酸D-グルクロン酸および/もしくは非硫酸D-グルクロン酸(GlcA)ならびにN-アセチル-D-ガラクトサミン(GalNAc)残渣の交互配列で構成される。これらの化合物はそれぞれ、主に約40〜100回の二糖類単位の反復のみからなるポリマー構造を有する。CSは、GAG成分に関して前述したように、さまざまな分子量および濃度で使用され得るが、例示的な実施形態では、CSは、約1.161×10−17〜1.328×10−16g(約10,000〜80,000kDa)の範囲の分子量、および約0.1〜100mg/mLの範囲の濃度を有する。CSは、ウシまたはネズミ(marine)の供給源から単離され得る。コンドロイチン鎖は、100超の個々の糖を有してよく、それらはそれぞれ、さまざまな位置および量で硫酸処理され得る。コンドロイチン-4硫酸、またN-アセチルガラクトサミン(GalNAc)糖の4位炭素(carbon 4)は、ウシおよびブタの鼻および気管の軟骨で見られる。これは、これらの動物の骨、肉、血液、皮膚、臍帯、および尿でも見られる。コンドロイチン-6硫酸、またGalNAc糖の6位炭素(carbon 6)は、これらの動物の皮膚、臍帯、および心臓弁から単離されている。コンドロイチン-6硫酸は、コンドロイチン-4硫酸と同じ組成を有するが、わずかに異なる物理特性を有する。コンドロイチン硫酸は、コラーゲンの結合に関係し、また、水分保持に直接関わる。これらは両方とも、治癒過程を助ける特性である。用語「コンドロイチン硫酸」、「CS」、「コンドロイチン」、「コンドロイチン硫酸(chondroitin sulfuric acid)」、および「コンスリド(chonsurid)」は、本明細書で互換的に使用され、本出願全体にわたり、化学的誘導体または異性体の誘導体または架橋誘導体を包含することを、当業者は認識するであろう。
【0026】
コンドロイチン硫酸Bとも呼ばれるデルマタン硫酸(DS)は、主に、β1,4もしくは1,3結合で連結されたL-イズロン酸とN-アセチル-D-ガラクトサミンとの二硫酸化および/または三硫酸化二糖類単位から作られるが、反復単位の一部が、硫酸化L-イズロン酸もしくはD-グルクロン酸をウロン酸として含有するか、または非硫酸化N-アセチルガラクトサミンもしくは4,6-二硫酸化N-アセチルガラクトサミンを、N-アセチルガラクトサミン-4-硫酸の代わりに含有する場合もある。DSは、GalNAcの存在によりコンドロイチン硫酸と定義される。DS中にイズロン酸(IdoA)が存在することにより、DSがコンドロイチン硫酸-A(4-O-硫酸化)およびコンドロイチン硫酸-C(6-O-硫酸化)と区別され、DSが、やはりこの残渣を含有するヘパリンおよびHSになぞらえられる。デルマタン硫酸は経口摂取された場合に身体に吸収されると考えられる。DSの分子量および濃度は、GAG成分に関して前述したようにさまざまであってよいが、例示的な実施形態では、分子量は、約1.661×10−20〜1.328×10−19g(約10〜80kDa)の範囲であり、濃度は、約0.1〜100mg/mLの範囲である。細菌発酵されるため、制御され得る分子量を有するHAとは異なり、デルマタン硫酸は、動物組織から単離され、断片を含有し得ることを、当業者は認識するであろう。したがって、デルマタン硫酸の分子量、およびデルマタン硫酸に含有される任意の断片は、著しく異なっていてよい。用語「デルマタン硫酸」、「DS」、および「デルマタン」は、本明細書で互換的に使用され、デルマタン硫酸の硫酸化誘導体、デルマタン硫酸ベンゼトニウム塩、デルマタン硫酸ベンゼトニウム塩の過硫酸化誘導体、およびデルマタン硫酸ナトリウム塩も含むことも、当業者は認識するであろう。
【0027】
ヘパリンおよびヘパラン硫酸(HS)は、N-アセチルグルコサミンに連結されたグルクロン酸(GlcA)で構成される。これらは、ウロン酸およびアミノ糖を含有する、α1−4結合二糖類反復単位で構成される。ヘパラン硫酸プロテオグリカンは、基底膜の不可欠な部分である。HAは、6.642×10−19g(400kDa)ほどの分子量の大きな生体分子であり、ヘパラン硫酸鎖に共有結合したコアタンパク質で構成される。多糖類鎖の数、およびコアタンパク質の大きさは、供給源に応じてさまざまであってよい。ヘパラン硫酸プロテオグリカンは、糖部分によって線維芽細胞増殖因子、血管内皮増殖因子(VEGF)、およびVEGFレセプターに結合し、マトリライシン(MMP−7)および他のマトリックスメタロプロテイナーゼのドッキング分子として作用し、細胞増殖および分化において重要な役割を果たす、多機能分子である。ヘパラン硫酸プロテオグリカンはまた、ラミニン、フィブロネクチン、IV型コラーゲン、および線維芽細胞増殖因子(塩基性)(FGF-basic)を含む細胞外基質に見られるさまざまな分子に結合することによって、細胞付着を促進する。HSの分子量および濃度は、GAG成分に関して前述したようにさまざまであってよいが、例示的な実施形態では、分子量は、約4.982×10−21〜4.982×10−20g(約3〜30kDa)(組織から単離された場合)の範囲であり、濃度は、約0.1〜100mg/mLの範囲である。
【0028】
ケラタン硫酸、またケラト硫酸(KS)は、非常にマイナスに帯電しており、硝子軟骨、線維軟骨および弾性軟骨の細胞外基質中の最も豊富なプロテオグリカンであるアグリカンで主として見られる。KSは、二糖類反復単位、-4GlcNAcβ13Galβ1-で構成される。硫酸化は、ガラクトース(Gal)もしくはGlcNAcのいずれかまたは両方の炭素位6(C6)で起きる。特定のKS型は、3つの領域:連鎖領域(alinkage region)(その1つの末端で、KS鎖がコアタンパク質に連結される)、反復二糖類単位、およびタンパク質連鎖領域に対してKS鎖の反対側の末端で発生する、鎖キャッピング領域(chain capping region)で構成される。KSの分子量および濃度は、GAG成分に関して前述したようにさまざまであってよいが、例示的な実施形態では、分子量は、約8.303×10−21〜1.661×10−20g(約5〜10kDa)(組織から単離された場合)の範囲であり、濃度は、約1〜100mg/mLの範囲である。
【0029】
凍結乾燥GAGが特に好適であるが、液体GAGも、HAの粘度を少なくとも一時的に低減するのに使用され得ることを、当業者は認識するであろう。例えば、CSは、粉末形態で入手され、水などの溶媒と混合されて、溶液を形成することができる。この溶液は、HAと組み合わせられて、HA単独の場合と比較して粘度が低減した混合物を形成することができる。HAの粘度を低減するのに有効であるが、結果として得られる混合物は、水の存在により濃度が低くなっている。したがって、液体の非凍結乾燥GAGを本発明で使用することができるが、例示的な実施形態では、GAGは、高濃度でのHAの使用を可能にするよう、凍結乾燥される。
【0030】
凍結乾燥
本発明の組成物および方法に存在する成分のうち任意の1つまたは複数は、当技術分野で既知のさまざまな技術を用いて凍結乾燥され得る。凍結乾燥は、典型的には壊れやすい材料を保存するのに使用される脱水プロセスであり、材料を凍結し、その後、周囲圧力を下げ、十分な熱を加えて材料中の凍結水を固相から気相へ直接昇華させることによって、機能する。当技術分野で既知の標準的な凍結乾燥技術を使用して、成分のうち任意の1つまたは複数を凍結乾燥させることができる。例示的な実施形態では、最低でも第2の成分、すなわち1つまたは複数のGAGを凍結乾燥させる。
【0031】
凍結乾燥前に、さまざまな溶媒を使用して、凍結乾燥すべき成分を含有する水性混合物を形成することができる。例示的な実施形態では、水性混合物は、水を成分のうち1つまたは複数と組み合わせることにより準備される。その成分は、混合物中に、さまざまな量で、例えば約1〜100mg/mLの範囲、さらに好ましくは約50mg/mLで存在することができる。例示的な実施形態では、組成物は、凍結乾燥前に0.2μmフィルターなどのフィルターを用いて殺菌される。使用され得る1つの濾過技術は、無菌濾過である。
【0032】
一実施形態では、以下のサイクルを使用して成分を凍結乾燥させることができる:
凍結: 15分で周囲温度から5℃に。
100分間5℃に保つ。
50分で−45℃まで下げる。
180分間−45℃に保つ。
一次乾燥:6.67Pa(50mTorr)の設定圧力。
175分で−15℃まで上げる(Shelf Up)。
2300分間−15℃に保つ。
二次乾燥:10Pa(75mTorr)の設定圧力。
200分で25℃まで上げる(Shelf Up)。
900分間保つ。
サイクル終了:〜9.733×104Pa(730Torr)まで窒素で埋め戻す(backfill)。
キャップ形成(Capping)およびクリンプ。
【0033】
緩衝剤を加えることで、凍結乾燥製剤中のGAGの溶解度および安定性が改善され得る。当技術分野で既知の生体適合性緩衝剤、例えばグリシン;酢酸のナトリウム塩、カリウム塩、もしくはカルシウム塩;クエン酸のナトリウム塩、カリウム塩、もしくはカルシウム塩;乳酸のナトリウム塩、カリウム塩、もしくはカルシウム塩;第一リン酸(mono-basic phosphate)、第二リン酸(di-basic phosphate)、第三リン酸(tri-basic phosphate)およびこれらの混合物を含む、リン酸のナトリウム塩もしくはカリウム塩を、使用することができる。緩衝剤は、充填剤として機能するように組成物に添加されたグリシンをさらに有してよい。
【0034】
他の関節用サプリメント
本発明の成分および方法は、治療効果を高めるよう、追加の成分または関節用サプリメントを含むこともできる。例えば、グルコサミン(C6H13NO5)(「GlcN」)は、ヒアルロナンの産生ならびにプロテオグリカンに必要な両方の反応を与えることにより、滑液の主要成分の合成を高めることができる。GlcNは、4つのヒドロキシル基とアミン基とを有するアミノ糖であり、糖化タンパク質および脂質の生化学合成における、顕著な前駆体である。GlcNは、栄養機能およびエフェクター機能を有する、自然発生分子である。例えば、GlcNは、幹細胞成長および間葉系幹細胞の分化と適合性があり、かつこれらを促進して、軟骨細胞を形成する。GlcNは、一般的には、軟骨の成長および発達など、組織発達および修復において役割を有し得る。一実施形態では、GlcNは、CSと共に凍結乾燥され得る。グルコサミンの塩形態は、液相において、限られた安定性を有し得る。さらに、GlcNのHCl塩は、いったん組み合わされたHAを分解させるよう十分にpHを下げることができる。このような理由から、成分の安定性を保持するためには、凍結乾燥形態のGlcNを、注入前にHAゲルにより可溶化させることが、有利である。
【0035】
GlcNの濃度はさまざまであってよい。適切な局所濃度は、少なくとも約10mg/mL、約9mg/mL、約8mg/mL、約7mg/mL、約6mg/mL、5mg/mL、4.5mg/mL、4mg/mL、3.5mg/mL、3mg/mL、約2.9mg/mL、約2.8mg/mL、約2.7mg/mL、約2.6mg/mL、約2.5mg/mL、約2.4mg/mL、約2.3mg/mL、約2.2mg/mL、約2.1mg/mL、約2.0mg/mL、約1.9mg/mL、約1.8mg/mL、約1.7mg/mL、約1.6mg/mL、約1.5mg/mL、約1.4mg/mL、約1.3mg/mL、約1.2mg/mL、約1.1mg/mL、約1.0mg/mL、約0.9mg/mL、約0.8mg/mL、約0.7mg/mL、約0.6mg/mL、約0.5mg/mLなどであってよい。当業者は、薬剤学分野で既知の方法を実践するGlcNの適切な局所濃度を決定でき、その決定は、所望のGlcN濃度を得るために目的のGlcN組成物の性質および組成を左右するであろう。
【0036】
本発明の組成物および方法は、例えば、アミノ酸、タンパク質、核酸、緩衝剤、界面活性剤、およびこれらの混合物を含むさまざまな他の関節治療もしくは賦形剤を含み得ることを当業者は認識するであろう。ステロイド、抗炎症剤、非ステロイド性抗炎症剤、鎮痛剤、細胞、安定剤、抗生物質、抗菌剤、抗炎症剤、成長因子、成長因子断片、小分子創傷治癒刺激薬、ホルモン、サイトカイン、ペプチド、抗体、酵素、単離細胞、血小板、免疫抑制剤、核酸、鎮痛剤、細胞型、ウィルス、ウィルス粒子、およびこれらの組み合わせ。
【0037】
組成物
第1および第2の成分、ならびに任意の追加成分を組み合わせて、組織内に注入され得る組成物を形成することができる。前述のように、成分のうち1つまたは複数、好ましくは少なくとも第2の成分(GAG)を凍結乾燥させ、それにより、固体とする。全成分を凍結乾燥させた場合、それらの成分を、1つまたは複数の容器内に供給し、次に、水、食塩水、緩衝剤、または他の溶媒と再構築することができる。凍結乾燥GAGとの凍結乾燥HAもしくは固体のHAの可溶化により、HAの可溶化を速くすることができる。成分のうち1つまたは複数が液体で、成分のうち1つまたは複数が固体である場合、固体成分は、第1の容器、または容器の第1のチャンバの中に供給されてよく、液体成分は、第2の容器、または容器の第2のチャンバの中に供給されてよい。固体成分は、液体成分によって、または希釈剤により、可溶化され得る。いったん成分が完全に可溶化されたら、組成物は、HA単独の粘度と比較して著しく低減された粘度を少なくとも一時的に示すので、注射器を使用して組成物を組織に注入することができる。
【0038】
一実施形態では、第2の成分は、凍結乾燥され、第1の成分は、水性溶液中にある。これらの成分は、別個の容器または別個のチャンバの中に供給され、手術の直前、または手術中に、凍結乾燥した第2の成分を第1の成分で再構成する。特に、HAは、液体形態で供給されてよく、凍結乾燥GAGをHAと組み合わせることができる。HA中でいったん完全に可溶化されたら、HAの粘度は、少なくとも一時的に著しく低減され、2つの成分の混合を可能にし、混合物の注入を容易にする。あるいは、凍結乾燥した第2の成分を、水、食塩水、または他の溶媒と再構成し、その後、HAと組み合わせて、注入可能な混合物を形成することができる。
【0039】
別の実施形態では、第1および第2の成分の双方を凍結乾燥し、固形で供給する。これらの成分を別個の容器またはチャンバに供給してよく、あるいは、単一の容器またはチャンバに供給してもよい。これらの成分を、水、食塩水、または他の溶媒と再構成して、注入可能な混合物を形成することができる。凍結乾燥した第2の成分、例えば1つまたは複数のGAGは、混合物の粘度を少なくとも一時的に低減する効果を有する。
【0040】
例示的な実施形態では、成分は、手術中、すなわち手術直前または手術の間に組み合わせられるように構成される。組み合わせられると、成分は、結果として得られる、すぐに使える組成物または混合物を形成でき、これは、さまざまな量で組成物中に存在する各成分を有している。すぐに使える組成物の各成分の量はさまざまであってよいが、例示的な実施形態では、第2の成分、例えば1つまたは複数のGAGが、第1の成分、例えばHAの粘度を低減するのに十分な量で存在する。例えば、第1の成分、例えばHA、および第2の成分、例えばGAGは、第1の成分対第2の成分の割合が約1:0.001〜1:200の範囲で、一部の実施形態では約1:0.005〜1:100で、混合されてよい。したがって、すぐに使える組成物中の第1の成分の、結果として得られる濃度は、全組成物の約0.6重量%〜4重量%以上の範囲であってよく、すぐに使える組成物中の第2の成分の、結果として得られる濃度は、約0.001%〜10%の範囲であってよい。さらに好ましくは、第1の成分は、全組成物の約0.6重量%、1重量%、1.5重量%、2重量%、2.5重量%、3重量%、3.5重量%、4重量%以上の濃度で、すぐに使える組成物中に存在してよく、第2の成分は、全組成物の約0.001重量%、0.01重量%、0.1重量%、1重量%、2重量%、3重量%、4重量%、5重量%、6重量%、7重量%、8重量%、9重量%、10重量%以上の濃度で、すぐに使える組成物中に存在してよい。例示的な実施形態では、開示する組成物中に存在するHAの量は、全組成物の約1.5〜2.5重量%であり、開示する組成物中に存在するGAGの量は、全組成物の約0.001〜10重量%である。
【0041】
成分のうち1つまたは複数を可溶化するのに使用され得る他の溶媒には、例えば、食塩水もしくは他の塩溶液、緩衝溶液、例えばリン酸緩衝生理食塩水、ヒスチジン、乳酸塩、琥珀酸塩、グリシン、およびグルタミン酸塩、デキストロース、グリセロール、水、ならびにこれらの組み合わせが含まれる。組成物は、生理学的に相溶性の他の成分、例えば分散媒、抗菌剤、および抗真菌薬、等張剤、および吸収遅延薬なども含んでよい。等張剤は、例えば、組成物中の、デキストロースなどの糖類、マンニトール、ソルビトールなどの多価アルコール、または塩化ナトリウムなどの塩を含む。組成物は、組成物の貯蔵寿命または有効性を高める、湿潤剤または乳化剤、防腐剤または緩衝液などの補助物質を少量含むこともできる。
【0042】
成分および/または、結果として得られる組成物は、当技術分野で既知のさまざまな技術を使用して、使用前に殺菌され得る。無菌の注入可能な混合物は、治療的に有効もしくは有益な量の活性化合物を、必要に応じて、1つの成分もしくは成分の組み合わせを有する適切な溶媒に組み込み、その後、無菌濾過して、無菌製剤を生じることにより、準備され得る。一般的に、塩基性分散媒体および任意の必要な他の成分を含有する無菌ビヒクルに、HAなどの化合物を組み込むことによって、分散物が準備される。無菌の注入可能な混合物の準備のための無菌粉末の場合、一部の方法は、組成物および先に無菌濾過されたその混合物からの任意の所望の追加成分の粉末を生じる、真空乾燥成分およびフリーズドライ成分の調製を含み得る。
【0043】
使用方法
使用中、第1および第2の成分を手術中に組み合わせ、その後、例えば注入により、治療部位に送達することができる。一実施形態では、第1および第2の成分を前述のように組み合わせて、混合物または組成物を形成することができる。凍結乾燥した第2の成分、例えば1つまたは複数のGAGを、第1の成分、例えばHAと組み合わせることは、HA混合物の粘度の一時的な低減を少なくとも一時的に誘発することができ、さらに扱いやすくなり、組み合わせたHA/GAG混合物を注射器内に入れ、患者に注入することができる。ある実施形態では、組成物を組織に注入する前に凍結乾燥成分が完全に可溶化するのに、しばらくの間(an amount of time)待つことが必要となり得る。凍結乾燥した第2の成分が第1の成分、または溶媒に可溶化するのにかかる時間は、使用する具体的な第2の成分、ならびに成分の分子量および濃度によって異なってよい。概して、第2の成分が第1の成分に完全に可溶化するか、または溶媒で再構成されるのに10秒〜30分かかり得る。
【0044】
いったん凍結乾燥成分が完全に可溶化し、第1の成分、例えばHAの粘度が著しく低減したら、粘度は、しばらくの間、低減したままであり、この時間もやはり、使用する具体的な材料、ならびに組成物中の成分の分子量および濃度によって異なり得る。ある実施形態では、いったん第2の成分が完全に可溶化したら、組成物を組織に注入するのに望ましい時間は、約1〜60分、さらに好ましくは1〜30分の範囲であってよく、さらに好ましくは、この時間は、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60分またはそれ以上、またはこの範囲内の任意の変数のいずれかであってよい。
【0045】
送達システム
前述したように、本発明の組成物および方法に使用される成分は、好ましくは手術中に組み合わせられるように構成される。したがって、これらの成分は、キットの一部として供給され得る。一実施形態では、キットは、HAなどの第1の成分、および,少なくとも1つのGAGなどの第2の成分を含むことができる。キットは、前述のように追加成分を含むこともできる。その成分は、バイアルまたは注射器などのハウジングの、単一の容器もしくはチャンバ、または別々の容器もしくはチャンバの中に収容され得る。
【0046】
例示的な実施形態では、成分は、単一の混合および送達装置に供給される。単一送達能力(single delivery capability)の利点には、薬剤投与の速度および容易さが増大すること;接続部の数を減らすことにより院内感染のリスクが減少すること;薬剤投与もしくは順序を誤るリスクが低下すること;ならびに、投与前に組み合わせを必要とする組成物がさらに迅速に送達されることが含まれる。
【0047】
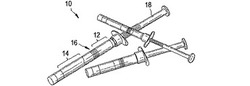
図1は、二重チャンバ注射器10の形態をした混合および送達システムの一実施形態を示す。図示のとおり、二重チャンバ注射器10は、概して、弁16により分離された近位チャンバ12および遠位チャンバ14を有するハウジングを含む。プランジャー18が、近位チャンバ12内部にスライド可能に配されており、近位チャンバ12内部に存在する流体を遠位チャンバ14に注入することにより、成分を混合するように構成されている。一実施形態では、第1の成分、例えば液体HAが、近位チャンバ12内に存在してよく、第2の成分、例えば凍結乾燥GAGが遠位チャンバ14内に存在してよい。プランジャー18は、近位チャンバ12の中を前進して、第2の成分、例えば1つまたは複数の凍結乾燥したGAGを収容する遠位チャンバ14内に、第1の成分、例えば液体HAを注入することができる。別の実施形態では、近位チャンバ12は、水もしくは食塩水などの溶媒を収容することができ、遠位チャンバ14は、固形で成分のすべてを収容することができる。例えば、遠位チャンバ14は、凍結乾燥HAもしくは固形のHA、および1つまたは複数の凍結乾燥GAGを収容することができる。プランジャー18は、近位チャンバ12の中を前進して、遠位チャンバ14に溶媒を注入することができ、それにより、遠位チャンバ14で成分を可溶化する。いったん全成分が遠位チャンバ14内で組み合わせられ、任意の固体が完全に可溶化されたら、混合物は、例えば針を二重チャンバ注射器の遠位端部に取り付けることによって、組織に送達されることができる。
【0048】
図2は、MixJect(登録商標)の商品名で商業的に販売されている混合および送達システム20の別の実施形態を示す。この実施形態では、システムは、注射器24とバイアル26との間に連結された流体制御組立体22を含む。注射器24は、液体HAもしくは溶媒などの液体を収容することができる第1のチャンバ24aを画定し、バイアルは、1つまたは複数の凍結乾燥GAGなどの固体を収容することができる第2のチャンバ26aを画定している。注射器24を通してプランジャー28を配備することにより、制御システムを通してバイアル26内へと液体が注入され、バイアルでは、固体が液体により可溶化される。いったん成分が完全に可溶化されたら、バイアル26をひっくり返してよく、プランジャー28を後退させて、混合物を注射器24のチャンバ24a内へ戻すことができる。次に、バイアル26をシステムから取り外してよく、混合物は、注射器から針29を通して組織へ注入され得る。
【0049】
当技術分野で既知の任意の二重チャンバシステムを使用してよいこと、ならびにそれらのチャンバは、単一のチャンバになるよう混ざり合う(mix into)別々の注射器プランジャーを備えた隣り合うチャンバ、または単一のプランジャーを備えた線形チャンバであってよいことを、当業者は認識するであろう。
【0050】
予め満たされた注射器は、送達可能な正確な用量の所望の化合物および希釈剤を収容することができる。非限定的な例として、予め満たされた注射器は、約0.1mL、0.2mL、0.3mL、0.4mL、0.5mL、0.6mL、0.7mL、0.8mL、0.9mL、1.0mL、1.5mL、2mL、2.5mL、3mL、3.5mL、4mL、4.5mL、5mL、5.5mL、6mL、6.5mL、7mL、7.5mL、8mL、8.5mL、9mL、9.5mL、10mLまたはそれ以上、またはそれらの任意の派生物(derivative)の容量を収容し得る。
【0051】
治療
この方法および組成物において有用なHAならびにGAGは、生体内適用では、独立して、または一緒に、注射によって非経口的に、または時間をかけて漸進的な灌流によって、投与され得る。投与は、静脈内、腹腔内、筋肉内、皮下、関節内、腔内(intracavity)、または経皮的であってよい。組成物および方法が関節障害治療において活性を与え得る、症状または疾患の例には、感染症、外傷、アレルギー、代謝障害などにより引き起こされる関節炎、慢性関節リウマチなどのリウマチ(rheumatoids)、および全身性エリテマトーデス;痛風を伴う関節疾患、変形性関節症などの関節症、関節内障、関節水腫、肩こり、腰痛などが含まれる。組成物の使用、または治療される疾患のタイプに応じて効果が変化することで、薬剤は、所望の予防的および緩和的効果を与え、または、生体に重篤な影響を与えずに関節の腫脹、疼痛、炎症、および破壊(destroying)に対する治療効果さえ与えることができる。関節障害を治療する組成物を使用して、関節障害の発症を防ぎ、関節障害が発症した後には症状を改善、軽減、および治療することができる。
【0052】
治療方法は、関節などの標的エリアに組成物を直接注入することを含み得る。注入は、毎日、毎週、1週間に数回、隔月、1ヶ月に数回、毎月のような頻度で行われてよく、または、症状の軽減をもたらすよう必要に応じた頻度で行われてもよい。関節内での使用については、関節の大きさおよび状態の重症度に応じて、関節当たり約0.1〜約500mgを注入することができる。所定の関節へのその後の注入の頻度は、その関節で症状が再発したときまで間隔をあける。例示的には、人間における組成物の投薬レベルは、膝で、関節当たり約0.1〜約500mgの注入;肩で、関節当たり約0.1〜約500mgの注入;中手骨もしくは近位指骨で、関節当たり約0.1〜約100mgの注入;肘で、関節当たり約0.1〜約300mgの注入であってよい。
【0053】
しかしながら、任意の特定の患者に対する特定の投薬レベルは、使用される特定の化合物の活性、年齢、体重、全体的な健康、性別、食事、投与時間、投与経路、排出率、薬剤の組み合わせ、および治療を受けている特定の疾患の重症度を含む、さまざまな要因によって決まることが理解されるであろう。
【0054】
一実施形態では、病状は、変形性関節症(OA)であり、組成物は、例えば、膝関節、肩関節、側頭下顎関節または手根中手関節、肘関節、股関節、手首関節、足首関節、および脊椎の腰部関節突起間関節(椎間関節)などの関節腔に投与される。関節内補充療法は、膝または他の罹患関節(afflicted joints)内に、数週間にわたって投与される単回または複数回の関節内注入により達成され得る。例えば、膝OAのヒト患者が、1つの膝関節当たり約2、3、4、5、6、7、8、9、10mLまたはそれ以上の注入を、1、2、または3回受けることができる。他の関節については、投与容量は、関節の大きさに基づいて調節されてよい。
【0055】
別の例示的な実施形態では、第1および第2の成分を有するキットを提供する。第1の成分は、2mLのOrthovisc(登録商標)を含んでよく、これは、30mgのヒアルロナン、18mgの塩化ナトリウム、および最大2.0mLの注射用蒸留水を含んでいる。HAは、約1.661×10−18〜4.816×10−18g(約1.0〜2.9MDa)の範囲の分子量を有する。第2の成分は、0.1〜100mg/mLの凍結乾燥ウシ由来CS(例えばBioiberica(Barcelona, Spain)から供給されたもので、前述のプロトコルを用いて凍結乾燥された)を含むことができる。これら2つの成分は、例えば前述の送達システムを使用して組み合わせられ、凍結乾燥CSを可溶化させることができる。完全な可溶化には約X分かかり得る。いったん完全に可溶化されたら、混合物の粘度は著しく低下し、混合物を関節内に、例えば膝関節の中に注入することができる。注入は、好ましくは可溶化から5〜30分以内に行われる。追加の注入は、合計3または4回の注入(total of three of four injections)については、1週間に1回行われてよい。標準的な関節内注入部位の準備、無菌技術、および注意を使用しなければならない。
【0056】
実験データ
実施例1 凍結乾燥
50mg/mLのグルコサミンHClと50mg/mLのコンドロイチン硫酸とを含む混合物を準備し、0.2μmのフィルターで濾過した。次に、混合物を、1mL/バイアルで3mLのガラスバイアルに入れ、凍結乾燥した。凍結乾燥した塊(cake)は、固体で白色に見えた。凍結乾燥した各サンプルは、注入のため、水、Orthovisc、または他のHAゲルで再構築されることができた。これらのHAゲルは、10〜20mg/mLの濃度であり、HAは、ShiseidoおよびLifecoreから供給された。サンプルはまた、PBSなど他の緩衝液でも再構築され得た。
【0057】
実施例2 粘度
さまざまな量の異なるGAGを前述のとおり凍結乾燥し、ふわふわした白い塊を形成した。GAGは、Bioiberica(Barcelona, Spain)により供給されたウシ由来CS、Sigma-Aldrich(Saint Louis, MO)により供給されたヘパリン、およびSigma-Aldrich(Saint Louis, MO)により供給されたデキストラン硫酸を含む。凍結乾燥GAGはそれぞれ、約20.8mmの外径および約40mmの高さを有する5mLのバイアルに入れられた。40mgの非凍結乾燥GAGも、同じ寸法を有する5mLのバイアルに入れられた。Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)を各バイアルに注入し、HAは、GAGを完全に溶解させた。2mLのOrthovisc(登録商標)のみを含む対照を、同じ寸法を有するバイアルに入れた。
【0058】
凍結乾燥GAGを完全に可溶化させるのにかかる時間を、組成物のうちいくつかについて測定し、その結果を以下に述べる。混合物の粘度は、「流速」を判断することにより測定する。本明細書で使用する「流速」とは、バイアルが逆さまにされたときに、各バイアルの中身がバイアルの一端部からバイアルの他端部まで流れるのにかかる時間を指す。結果を以下の表1に示す。流速が1分まで増大するのにかかった時間も計測し、以下の表1に示す。表1に示すすべての結果は、3回の測定値の平均に基づいている。
【表1】

【0059】
表1に示すように、HA単独のものは、非常に粘性であり、5mLの40mm高さのバイアルの一端部から反対端部まで移動する2mLのHAについて流速が約20分である。ベンダーから受領したGAG粉末、または非凍結GAGと組み合わせると、低粘度の局所エリアがあった。しかしながら、すべての粉末を完全に可溶化させるのにかかる時間の間に、混合物は、高粘度に戻る。したがって、サンプルを完全に混合しMixjectシステムの注射器に戻す時間がない。一方、凍結乾燥GAGと組み合わせると、HAは、GAGを比較的迅速に溶解させることができ、粘度は、少なくとも一時的に著しく低減し、混合物は、バイアルの一端部からバイアルの反対端部まで数秒で移動することができた。ヘパリンおよびデキストランを除いてほとんどの場合、粘度は、少なくとも約15分間、著しく低減したレベルのままであった。
【0060】
実施例3 粘度
Bioiberica(Barcelona, Spain)から入手した40mgの非凍結乾燥CS粉末を、500μLの水と混合した。次に、この溶液を、Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)と組み合わせた。穏やかに混合してから約1〜2分後、成分が完全に混合された。流速は45秒と測定された。
【0061】
500μLの水を、Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)と組み合わせた。穏やかに混合してから約3分後、流速は26秒と測定された。
【0062】
液体CSとHAとの組み合わせは、水とHAとの組み合わせに比べ、流速の低減を示した。したがって、この実験は、HAの粘度に対するCSの影響を証明するものである。
【0063】
実施例4 可溶化
40mgの非凍結乾燥CS粉末を、Bioiberica(Barcelona, Spain)から入手し、Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)と混合した。穏やかに混合してから約15〜20分後、CSはHA中で完全に可溶化された。粘度が低減した局所エリアは、可溶化中に観察されたが、完全な可溶化前には、HAゲルは、高粘度状態に戻り、注入のため中身が別の注射器に移動することが妨げられた。
【0064】
同様に、Bioiberica(Barcelona, Spain)から入手した40mgの凍結乾燥CS粉末を、Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)と混合した。穏やかに混合してから約5分後、凍結乾燥CSはHA中で完全に可溶化され、HAの粘度は、見かけ上は低減した。低減した粘度は、十分な時間にわたり保たれ、注入のため混合物を注射器に引き込むことができた。
【0065】
用語法
「治療的に有効な量」または「有効な量」は、薬理学的作用を達成する薬剤の量である。用語「治療的に有効な量」には、例えば、予防上有効な量が含まれる。「有効な量」は、過度の副作用なしで、所望の薬理学的作用または治療上の改善を達成するのに有効な量である。例えば、有効な量とは、操作性を増大するか、または患者が関節に対する負荷に耐える能力を増大するか、または、疼痛を軽減するか、または患者が通常の活動に戻るのを可能にするか、または1つもしくは複数の関節の骨および軟骨における修復を刺激するか、または関節の歪み、疼痛、腫脹、炎症もしくは硬直を軽減する、量を指す。薬剤の有効な量は、特定の患者および疾患レベルに応じて当業者により選択される。「有効な量」または「治療的に有効な量」は、消化管運動改善薬などの治療薬の代謝の差異、および/または患者の年齢、体重、全身状態、治療している病状、治療している病状の重症度、および処方医師の判断により、患者ごとに異なってよいことが理解される。
【0066】
「治療する」または「治療」とは、骨もしくは軟骨の障害に関わる障害もしくは疾患の任意の治療、例えば、その障害もしくは疾患の素因となり得るが、まだその障害もしくは疾患を有しているとは診断されていない患者においてその障害もしくは疾患の発症を妨げること;その障害もしくは疾患を阻止する、例えば、その障害もしくは疾患の発生もしくは進行を停止するか、その障害もしくは疾患を軽減するか、その障害もしくは疾患の退行を引き起こすか、その障害もしくは疾患により生じる状態を軽減するか、またはその障害もしくは疾患の症状を止めること、を指す。したがって、本明細書で使用される用語「治療する」は、用語「妨げる」と同義的に使用される。
【0067】
「同時投与される(co-administered)」は、同じ製剤における、または投与のため1つの製剤になるよう組み合わせられる2つの異なる製剤における、同時投与を意味する。一実施形態では、HAおよびGAGは、同じ製剤における送達により同時投与される。
【0068】
本明細書で使用される用語「患者」は、本発明の組成物および方法から利益を得ることができる、動物、好ましくは哺乳動物、さらに好ましくはヒト、ウマ、および犬を指す。本発明の方法から利益を得ることができる動物のタイプに制限はない。患者は、ヒトであるか、ヒトでない動物であるかにかかわらず、個体、患者、動物、宿主、またはレシピエントと呼ばれ得る。本発明の方法は、人間医学、獣医学、ならびに一般的な家畜または野生動物の畜産において適用を有する。
【0069】
当業者は、前述した実施形態に基づいて本発明のさらなる特徴および利点を認識するであろう。したがって、本発明は、請求項により示されることを除いて、具体的に図示および説明したことによって制限されない。本明細書で引用したすべての刊行物および参考文献は、参照により全体として本明細書に明白に組み込まれる。
【0070】
〔実施の態様〕
(1)関節を治療するキットにおいて、
ヒアルロン酸を含む第1の成分と、
凍結乾燥グリコサミノグリカンを含む第2の成分と、
前記第1および第2の成分の混合物を注入する注射器と、
を含む、キット。
(2) 実施態様1に記載のキットにおいて、
前記グリコサミノグリカンは、コンドロイチン硫酸を含む、キット。
(3) 実施態様1に記載のキットにおいて、
グルコサミンを含む第3の成分、
をさらに含む、キット。
(4) 実施態様3に記載のキットにおいて、
前記グルコサミンは、凍結乾燥される、キット。
(5) 実施態様1に記載のキットにおいて、
前記第1および第2の成分が組み合わせられて混合物を形成すると、前記第1および第2の成分は、約1:0.005〜1:100の範囲の、第1の成分対第2の成分の割合で、前記混合物中に存在する、キット。
【0071】
(6) 実施態様1に記載のキットにおいて、
前記注射器は、前記第1の成分を収容する第1のチャンバ、および前記第2の成分を収容する第2の容器を有し、
前記注射器は、前記第1および第2の成分を混合するために前記第2の成分を前記第1のチャンバに注入するように構成されたプランジャーを含む、キット。
(7) 実施態様1に記載のキットにおいて、
前記第2の成分は、容器内に入れられ、前記注射器は、前記第1の成分を収容する第1のチャンバ、および前記容器を前記注射器に取り外し可能に連結するコネクタを含み、前記注射器の前記第1のチャンバ内部にスライド可能に配されたプランジャーが、前記第1および第2の成分を混合するように前記第1の成分を前記容器に注入することができる、キット。
(8) 実施態様1に記載のキットにおいて、
前記ヒアルロン酸は、凍結乾燥される、キット。
(9) 実施態様1に記載のキットにおいて、
前記ヒアルロン酸は、約1.661×10−18g〜6.642×10−18g(約1MDa〜4MDa)の範囲の分子量を有する、キット。
(10) 実施態様1に記載のキットにおいて、
前記ヒアルロン酸は、少なくとも約7mg/mLの濃度を有する、キット。
【0072】
(11) 実施態様1に記載のキットにおいて、
前記第1および第2の成分を可溶化させるように構成された流体を含む第3の成分、
をさらに含む、キット。
(12) 実施態様11に記載のキットにおいて、
前記第3の成分は、水、食塩水、および緩衝液からなる群から選択される、キット。
(13) 関節を治療する方法において、
混合物を形成するよう、ヒアルロン酸を含む第1の成分を、凍結乾燥グリコサミノグリカンを含む第2の成分と組み合わせることと、
前記混合物を関節に注入することと、
を含む、方法。
(14) 実施態様13に記載の方法において、
前記グリコサミノグリカンは、コンドロイチン硫酸を含む、方法。
(15) 実施態様13に記載の方法において、
グルコサミンを含む第3の成分、
をさらに含む、方法。
【0073】
(16) 実施態様15に記載の方法において、
前記グルコサミンは、凍結乾燥される、方法。
(17) 実施態様13に記載の方法において、
前記混合物の粘度は、組み合わせる前には、前記ヒアルロン酸の粘度より低い、方法。
(18) 実施態様13に記載の方法において、
前記ヒアルロン酸は、凍結乾燥され、
前記第1および第2の成分は、混合物を形成するよう前記第1および第2の成分を組み合わせる前、または組み合わせる間に可溶化される、方法。
(19) 実施態様13に記載の方法において、
前記第1および第2の成分は、バイアル内で組み合わせられ、注射器に引き込まれ、
前記注射器は、前記混合物を関節に注入するのに使用される、方法。
(20) 実施態様19に記載の方法において、
前記第1および第2の成分は、前記混合物の形成から30分以内に前記注射器に引き込まれる、方法。
【0074】
(21) 実施態様13に記載の方法において、
前記第1の成分は、注射器の第1のチャンバ内に入れられ、前記第2の成分は、前記注射器の第2のチャンバ内に入れられ、
前記第1および第2の成分を組み合わせることは、前記第1の成分を前記第2のチャンバに注入することを含む、方法。
(22) 実施態様13に記載の方法において、
前記第1および第2の成分を組み合わせることは、前記第1の成分が入った容器を、前記第2の成分が入った注射器に連結することと、前記第2の成分を前記注射器から前記容器へ注入することと、を含む、方法。
(23) 実施態様13に記載の方法において、
前記第1の成分は、約1.661×10−18g〜6.642×10−18g(約1MDa〜4MDa)の範囲の分子量を有する、方法。
(24) 実施態様13に記載の方法において、
前記第1の成分は、少なくとも約7mg/mLの濃度を有する、方法。
(25) 実施態様13に記載の方法において、
前記第1および第2の成分は、約1:0.005〜1:100の割合で前記混合物中に存在する、方法。
【図面の簡単な説明】
【0075】
【図1】本発明の組成物および方法と共に使用される混合および送達システムの一実施形態の斜視図である。
【図2】本発明の組成物および方法と共に使用される混合および送達システムの別の実施形態の斜視図である。
【開示の内容】
【0001】
〔発明の分野〕
本発明は、概して、関節を治療する組成物および方法に関する。
【0002】
〔発明の背景〕
関節炎の最も一般的な形態である変形性関節症(「OA」)は、関節の骨、軟骨および滑膜における変性(関節の漸進的な劣化)の、または異常な変化により特徴付けられるある種の関節炎である。OAは、患者の疼痛、腫脹、および硬直を結果として生じる炎症を時に伴う、向かい合った関節表面の進行性磨耗によってしばしば特徴付けられる。OAは、関節への外傷後、関節の感染後、または単に加齢の結果として、1つまたは複数の関節で生じ得る。さらに、異常な解剖学的構造がOAの初期発生の一因となり得るという新たな証拠がある。
【0003】
OAの治療には、一般的に、運動もしくは理学療法、ライフスタイルの変更、および鎮痛薬の組み合わせが含まれる。アセトアミノフェンは、典型的には、最初に使用されるOA治療である。軽度から中等度の症状では、有効性は、イブプロフェンなどの非ステロイド性抗炎症薬(「NSAID」)と同様である。さらに重篤な症状では、NSAIDは、より有効となり得る。しかしながら、より有効である一方で、重篤な症例でのNSAIDは、胃腸出血および腎臓の合併症などの重い副作用と関連がある。別の種類のNSAID、COX−2選択的阻害薬(セレコキシブなど)は、NSAIDと同様に有効であるが、副作用の点では、より安全というものではない。ジクロフェナクを含む、局所的用途に使用できるNSAIDがいくつかある。典型的には、それらは、経口投与より全身性の副作用が少なく、少なくともいくつかの治療効果を有している。モルヒネおよびフェンタニールなどのオピオイド鎮痛薬は疼痛を改善するが、この恩恵を、頻繁な有害事象が上回り、そのため、オピオイド鎮痛薬は日常的に使用されない。関節内ステロイド注入も、OA治療で使用され、疼痛緩和には非常に有効である。しかしながら、疼痛緩和の持続力は、4〜6週間に限られており、付随的な軟骨損傷を含み得る悪影響がある。疼痛が弱くなってきたら、関節置換手術を使用して、可動性および生活の質を改善することができる。疾患を遅らせたり逆行させたりする、実績ある治療はない。
【0004】
アセトアミノフェンのような単純な鎮痛薬または運動および理学療法により適切な疼痛緩和を得られない患者では、ヒアルロン酸(HA)の関節内注入により、症候性疼痛に対処し、関節全置換手術の必要性を遅らせる、別の治療オプションが与えられる。自然のHAの濃度(concentration)が、OAに罹っている個体において不十分であることが分かっており、したがって、外因性HAの関節注入がこれらの分子を補充し、滑液の粘弾性特性を回復すると考えられる。関節を滑らかにし、かつ保護する(cushioning)のに関与するのは、この特性である。HAが、細胞表面レセプターへの結合を通じて生物活性を有し、また、炎症緩和において役割を有し得るという証拠もある。作用のメカニズムにかかわらず、疼痛緩和は、治療過程後約6カ月間観察される。米国市場におけるHA製品の治療過程は、単回注入製品から、この疼痛緩和持続力を達成するのに週に3〜5回の注入を必要とする他のものまで、さまざまであってよい。
【0005】
OAに関係した疼痛および構造的変性に取り組むため、OA関節を治療する改善された方法および組成物、特に、1つまたは複数のGAGと組み合わせられたHAを用いて関節を治療する、改善された方法および組成物、に対する必要性が残っている。
【0006】
〔発明の概要〕
本発明は、概して、関節の病気、例えば変形性関節症および/またはそれに関係する疼痛を治療する組成物ならびに方法を提供する。一実施形態では、関節を治療するキットを提供し、このキットは、ヒアルロン酸(「HA」)を含む第1の成分と、凍結乾燥グリコサミノグリカン(「GAG」)を含む第2の成分と、第1および第2の成分の混合物を注入する注射器と、を含む。さまざまなGAGを使用することができるが、一実施形態では、GAGは、コンドロイチン硫酸を含む。このキットは、いくつかの実施形態では凍結乾燥され得る、グルコサミンなどの第3の成分も含んでよい。
【0007】
これらの成分の組成は、さまざまであってよい。一実施形態では、第1および第2の成分を組み合わせて混合物が形成されると、第1および第2の成分は、重量で約1:0.005〜1:100の範囲の、第1の成分対第2の成分の割合で、混合物内に存在する。他の態様では、ヒアルロン酸を凍結乾燥させてよい。例示的な一実施形態では、ヒアルロン酸は、約1.661×10−18g〜6.642×10−18g(約100万ダルトン(MDa)〜4MDa)の範囲の分子量、少なくとも約5mg/mL、より好ましくは少なくとも約7mg/mLの濃度を有する。このキットは、第1および第2の成分を可溶化するのに有効な流体を含む第3の成分も含んでよい。その流体は、例えば、水、食塩水、および/または緩衝液であってよい。
【0008】
注射器はさまざまな構成を有することができ、一実施形態では、注射器は、第1の成分を収容する第1のチャンバと、第2の成分を収容する第2の容器と、第1および第2の成分を混合するため第2の成分を第1のチャンバ内に注入するように構成されたプランジャーと、を有する。別の実施形態では、第2の成分は、容器内部に入れられてよく、注射器は、第1の成分を収容する第1のチャンバと、その容器を注射器に取り外し可能に連結するコネクタと、を含んでよく、注射器の第1のチャンバ内部にスライド可能に配されたプランジャーが、第1および第2の成分を混合するように、第1の成分を容器に注入することができる。
【0009】
他の態様では、関節を治療する方法が提供され、この方法は、混合物を形成するために、ヒアルロン酸を含む第1の成分を、凍結乾燥グリコサミノグリカンを含む第2の成分と組み合わせることと、その混合物を関節に注入することと、を含む。グリコサミノグリカンは、例えばコンドロイチン硫酸であってよい。キットはまた、グルコサミンなどの第3の成分を含んでよい。ある態様では、存在する場合には、グルコサミンは凍結乾燥されてよい。成分を組み合わせると、混合物の粘度は、組み合わせる前のヒアルロン酸の粘度より低くなる。別の実施形態では、ヒアルロン酸は凍結乾燥され、第1および第2の成分は、混合物を形成するために第1および第2の成分を組み合わせる前、または組み合わせている間に、可溶化される。第1および第2の成分は、例えばバイアル内で組み合わせられて、注射器内に引き込まれることができ、この注射器は、混合物を関節に注入するのに使用され得る。例示的な実施形態では、混合物の形成後、例えば、混合物の形成から約30分以内に、第1および第2の成分を注射器内に引き込む。別の実施形態では、第1の成分は、注射器の第1のチャンバ内部に入れられ、第2の成分は、注射器の第2のチャンバ内部に入れられ、第1および第2の成分を組み合わせることは、第1の成分を第2のチャンバ内へ注入することを含む。さらに別の実施形態では、第1および第2の成分を組み合わせることは、第1の成分が入った容器を、第2の成分が入った注射器に連結することと、第2の成分を注射器から容器内に注入することと、を含む。
【0010】
第1の成分は、さまざまな濃度および分子量を有してよいが、一実施形態では、濃度は、少なくとも約5mg/mL、さらに好ましくは少なくとも約7mg/mLであり、分子量は、約1.661×10−18g〜6.642×10−18g(約1MDa〜4MDa)の範囲である。例示的な実施形態では、第1および第2の成分は、混合物中に約1:0.005〜1:100の割合で存在する。
【0011】
添付図面は、前述の特徴、利点、および目的が明確になり、詳細に理解され得るように、本明細書に含まれている。これらの図面は、明細書の一部を形成する。しかしながら、添付図面は、例示的な実施形態を示しており、範囲を限定すると考えられるべきではないことに注意されたい。
【0012】
〔発明の詳細な説明〕
概して、本発明は、変形性関節症および/またはそれに関わる疼痛などの関節の病気を治療する組成物および方法を提供する。組成物および方法は、第1の成分、すなわちヒアルロン酸(「HA」)を、HAの粘度を少なくとも一時的に低減するのに有効な、凍結乾燥した第2の成分と組み合わせて利用する。例示的な実施形態では、第2の成分は、1つまたは複数のグリコサミノグリカン(「GAG」)、例えば、CS4および/またはCS6を含むコンドロイチン硫酸(「CS」)、デルマタン硫酸、ヘパリン、ヘパラン硫酸、およびケラタン硫酸、である。組成物は、グルコサミン(「GlcN」)などの、他の関節用サプリメントをオプションとして含み得る。
【0013】
凍結乾燥GAGの使用には、HAの粘度を少なくとも一時的に低減する効果があり、そのため、凍結乾燥GAGとHAとから形成した組成物は、HA単独の粘度より(少なくとも一時的に)著しく低い粘度を有することが、分かっている。高分子量および高濃度でHAを使用することが望ましいが、HAの粘度は、分子量および濃度が増大するにつれて著しく増大する。その結果、HAは、典型的には、低い分子量および濃度で使用されて、術中の混合を可能にするか、あるいは、HAは製造中に混合される。使用目的の時点より前、例えば製造時にHAを混合することにより、HA組成物の安定性および貯蔵寿命に関する問題が生じ得る。凍結乾燥GAGがHAの粘度を少なくとも一時的に低減するのに有効であるという発見により、高い分子量および濃度のHAを使用することができるようになり、したがって、HAをGAGと術中に、すなわち、手術直前または手術中に混合することができ、それにより、組成物の安定性および貯蔵寿命の問題がなくなる。この粘度の低減は、ボルテックスミキサー(vortexer)、ミキサー、もしくはスパチュラなどの機械的補助器具を使用せずに、混合を行うのに十分である。したがって、HAとCSとを組み合わせる製剤を作るために無菌性を損ない得る(compromise)特定の器具または攪拌器に対する必要性がある。
【0014】
第1の成分
第1の成分HAは、さまざまな処方を有することができ、さまざまな濃度および分子量で供給され得る。用語「ヒアルロン酸」、「ヒアルロナン」、および「HA」は、本明細書では互換可能に使用され、ヒアルロン酸またはヒアルロン酸の塩、中でも、例えばナトリウム塩、カリウム塩、マグネシウム塩、およびカルシウム塩、を指す。これらの用語は、自然のヒアルロン酸だけでなく、他の微量元素を有するヒアルロン酸、もしくは他の元素を有するさまざまな組成物中のヒアルロン酸も含むことも意図されている。用語「ヒアルロン酸」、「ヒアルロナン」、および「HA」は、HAの化学誘導体、もしくはポリマー誘導体、もしくは架橋誘導体を含む。HAに行われ得る化学修飾の例には、HAの4つの反応基、すなわちアセトアミド、カルボキシル、ヒドロキシル、および還元末端、との物質の任意の反応が含まれる。本出願で使用されるHAは、自然製剤、合成製剤、またはそれらの組み合わせを含むことが意図されている。HAは、液体もしくは固体製剤で供給されてよく、HAは、純正液体形態であるか、または様々な濃度で溶媒中にあってよい。
【0015】
HAは、グリコサミノグリカン(GAG)であり、具体的には、HAは、交互のグルクロン酸およびN-アセチルグルコサミン単位で作られた、直鎖多糖類である。HAは、コラーゲンに付着した軟骨の細胞外基質にも見られる粘弾性物質である。特に、HAは、関節軟骨の弾性特性を与える凝集プロテオグリカンの重要な構成成分である。HAは、関節を保護する軟骨を強くかつ可撓性に保つのに役立つだけでなく、関節を潤滑する滑液の供給増大にも役立つ。HAの異常は、結合組織障害において、共通のテーマ(common thread)である。したがって、HAは、結合組織障害の防止、治療、またはその外科的修復の補助のために、使用され得る。
【0016】
HAは、さまざまな分子量で、本発明の組成物および方法に使用され得る。HAはポリマー分子(polymeric molecule)であるので、HA成分は、さまざまな範囲の分子量を呈することができ、HAのほとんどの平均モーダル分子量製剤(almost any average of modal molecular weight formulation of HA)を、本発明の組成物および方法で使用することができ、これには、低分子量(「LWM」)ヒアルロナン(約8.303×10−19〜1.162×10−18g(約500〜700キロダルトン(kDa))、中間分子量(「MMW」)ヒアルロナン(1.162×10−18〜1.661×10−18g(700〜1000kDa))、および高分子量(「HMW」)ヒアルロナン(1.661×10−18〜6.642×10−18g(100万〜400万ダルトン(MDa)))が含まれる。ある例示的な実施形態では、HAは、少なくとも約8.303×10−19g(約500kDa)の分子量を有し、さらに好ましくは、HAは、少なくとも約1.661×10−18g(約1MDa)の分子量を有する高分子量(「HWM」)HAである。分子量は、例えば、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、5000kDaまたはそれ以上、またはその範囲内で導き出せる任意の範囲であってよい。化学修飾されたHAは、前述したのとかなり異なる分子量を有し得ることが予測される。架橋されたHAは、前述したものよりもはるかに高い分子量を有し得る。それにもかかわらず、これらの物質は、好ましくは、製剤中で非架橋のHAまたはわずかに架橋されたHAと組み合わされる場合、本発明でも適用可能である。
【0017】
混合物中に存在するHAの濃度もさまざまであってよいが、例示的な実施形態では、HAは、薬剤的に有効な量で供給される。例示的な実施形態では、HAは、少なくとも約5mg/mL、さらに好ましくは少なくとも約7mg/mL、さらに好ましくは少なくとも約10mg/mL、さらに好ましくは少なくとも約15mg/mLの濃度を有し、いくつかの実施形態では、濃度は、少なくとも約20mg/mLであってよい。HAの適切な濃度には、約5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、10mg/mL、11mg/mg、12mg/mL、13mg/mL、14mg/mL、15mg/mL、16mg/mL、17mg/mL、18mg/mL、19mg/mL、20mg/mL、21mg/mL、22mg/mL、23mg/mL、24mg/mL、25mg/mL、26mg/mL、27mg/mL、28mg/mL、29mg/mL、30mg/mL、31mg/mL、32mg/mL、33mg/mL、34mg/mL、35mg/mL、36mg/mL、37mg/mL、38mg/mL、39mg/mL、40mg/mL、41mg/mL、42mg/mL、43mg/mL、44mg/mL、45mg/mL、46mg/mL、47mg/mL、48mg/mL、49mg/mL、50mg/mL、51mg/mL、52mg/mL、53mg/mL、54mg/mL、55mg/mL、56mg/mL、57mg/mL、58mg/mL、59mg/mL、60mg/mL、またはそれ以上、またはその範囲内で導き出せる任意の範囲が含まれる。
【0018】
一実施形態では、第1の成分は、高い分子量(例えば、1.661×10−18g〜6.642×10−18g(1〜4MDa))、および約7〜40mg/mLの範囲の濃度を有するHAを含む。そのような1つの製品は、Anika Therapeutics, Inc.(Bedford, MA)により製造される、Orthovisc(登録商標)である。Orthovisc(登録商標)は、ヒアルロナンの、無菌の非発熱性で透明な粘弾性溶液である。Orthovisc(登録商標)は、生理食塩水に溶解され、15mg/mLの公称濃度を有する、高分子量(1.661×10−18〜4.816×10−18g(1.0〜2.9MDa))で超高純度の天然ヒアルロナンのみからなる。Orthovisc(登録商標)は、細菌発酵により単離される。当業者は、HMWのHAを、ShiseidoおよびLifecoreなどのいくつかの供給源から得ることができることを理解するであろう。これらの特徴を有する、米国におけるHA製品の別の例は、Euflexxa(登録商標)である。
【0019】
第2の成分
本発明の方法および組成物に使用される第2の成分も、さまざまな構成を有してよいが、例示的な実施形態では、第2の成分は、凍結乾燥グリコサミノグリカン(GAG)である。用語「グリコサミノグリカン」または「GAG」は、典型的には、ヘパリン、ヘパリン硫酸、コンドロイチン、コンドロイチン硫酸、ケラタン硫酸、デルマタン硫酸、およびそれらのそれぞれの誘導体を含む、硫酸ムコ多糖類のファミリーを、互換的に指す。
【0020】
グリコサミノグリカン(GAG)は、反復二糖類単位(repeating disaccharide unit)を含む長い直鎖多糖類(long unbranched polysaccharides)である。二糖類単位は、2つの修飾された糖、N-アセチルガラクトサミン(GalNAc)もしくはN-アセチルグルコサミン(GlcNAc)のいずれか、およびグルクロン酸もしくはイズロン酸などのウロン酸を含有する。GAGは、非常にマイナスに帯電した分子で、混合物に高い粘度を与える、拡張された立体構造(extended conformation)を有する。GAGは、主に、細胞の表面上、または細胞外基質(ECM)内、に位置する。GAGの高い粘度により低い圧縮性が達成され、これにより、これらの分子は、関節の潤滑流体にとって理想的なものとなる。したがって、GAGは、炎症過程を鈍化させるのに役立つことができる。同時に、それらの剛性により、細胞に構造的完全性がもたらされ、また、細胞間の通路がもたらされて、細胞移動が可能となる。さらに、CSなどのGAGは、滑液内で見られており、関節の健康において役割を果たし得る。したがって、HAと同時にCSを送達できる療法を有するのは理にかなっている。CSはHAの効力を高め得ると考えられる。しかしながら、われわれは、CS存在下でのHAが経時的に分解し得ることを観察した。したがって、この分解が起きるのを防ぐために、HAは使用されるまで冷蔵保存される必要がある。しかしながら、ほとんどの診療所および病院は、これらのタイプの製品を冷蔵庫に保存する容量を有していないことが分かっているので、HAおよびGAGを室温で保存する能力を保持しながら、HAおよびGAGを組み合わせることができる製品を提供する方法を見つける必要があった。
【0021】
製剤の安定性を増大させる1つの方法は、注入直前または注入時に希釈剤で再懸濁され得る凍結乾燥製品として、製品を提供することである。例えば、凍結乾燥GAGは、注入直前または注入時にHAゲルで再懸濁するように提供され得る。残念ながら、高分子量および/または高濃度のHAは、非常に粘性である。この高い粘度であっても、外科医は、製剤を関節内に送達することができる。これは、HA、特に非架橋HAは、ずり速度(shear rate)の増大につれて粘度が低下するためである。このずり減粘と呼ばれる現象は、HAが針を通って押された場合に生じる。HAはずり減粘するか(shear thins)または粘度が低減し、このことは、患者の関節への注入を容易にするのを助ける。HAが機械力を受けていない場合、粘度は高いままであり、機械補助もしくは混合システムなしでHAに別の活性物質(active)を溶解または混合することは困難になる。
【0022】
HAをGAG、特に凍結乾燥GAGと組み合わせた場合、GAGは、いったん溶解すると、混合を起こすことができるよう十分に、HAの粘度を少なくとも一時的に低減させ得ることが、分かっている。液体GAG製剤に対する凍結乾燥GAG製剤の利点は、より高い濃度でHA成分を使用できることである。液体GAGを、HAと組み合わせることができるが、液体GAGとHAとのこのような混合物は、より低い濃度のHAをもたらす。臨床環境で疼痛緩和の持続力をもたらすには、より高い濃度のHAが望ましいと考えられる。さまざまなGAGを使用することができるが、特定の例示的な実施形態では、凍結乾燥GAGは、硫酸処理され、さらに具体的には、CS4および/またはCS6を含むコンドロイチン硫酸(CS)、デルマタン硫酸、ヘパリン、ヘパラン硫酸、およびケラタン硫酸のうち1つまたは複数である。
【0023】
GAGは、さまざまな分子量を有し得るが、特定の例示的な実施形態では、分子量は、約8.303×10−21〜1.661×10−18g(約5〜1,000kDa)の範囲、さらに好ましくは約9.963×10−21〜8.303×10−19g(約6〜500kDa)の範囲、さらに好ましくは約1.162×10−20〜4.982×10−19g(約7〜300kDa)の範囲、さらに好ましくは約1.328×10−20〜3.321×10−19g(約8〜200kDa)の範囲、さらに好ましくは約1.494×10−20〜1.661×10−19g(約9〜100kDa)の範囲、最も好ましくは約1.661×10−20〜1.328×10−19g(約10〜80kDa)の範囲である。他の実施形態では、GAG断片の分子量は、約8.303×10−21g(約5kDa)より低く、さらに好ましくは約4.982×10−21g(約3kDa)より低い。
【0024】
混合物中に存在するGAGの濃度もさまざまであってよいが、例示的な実施形態では、GAGは、薬剤的に有効な量で供給される。例示的な実施形態では、GAGは、少なくとも約0.1mg/mL、さらに好ましくは少なくとも約2mg/mL、さらに好ましくは少なくとも約5mg/mL、さらに好ましくは少なくとも約7mg/mLの濃度を有する。GAGの適切な濃度には、約5mg/mL、6mg/mL、7mg/mL、8mg/mL、9mg/mL、10mg/mL、11mg/mg、12mg/mL、13mg/mL、14mg/mL、15mg/mL、16mg/mL、17mg/mL、18mg/mL、19mg/mL、20mg/mL、21mg/mL、22mg/mL、23mg/mL、24mg/mL、25mg/mL、26mg/mL、27mg/mL、28mg/mL、29mg/mL、30mg/mL、31mg/mL、32mg/mL、33mg/mL、34mg/mL、35mg/mL、36mg/mL、37mg/mL、38mg/mL、39mg/mL、40mg/mL、41mg/mL、42mg/mL、43mg/mL、44mg/mL、45mg/mL、46mg/mL、47mg/mL、48mg/mL、49mg/mL、50mg/mL、51mg/mL、52mg/mL、53mg/mL、54mg/mL、55mg/mL、56mg/mL、57mg/mL、58mg/mL、59mg/mL、60mg/mL、またはそれ以上、またはこの範囲内で導き出せる任意の範囲が含まれる。
【0025】
軟骨の必須成分であるコンドロイチン硫酸(CS)は、交互β(1,3)およびβ(1,4)結合により連結された硫酸D-グルクロン酸および/もしくは非硫酸D-グルクロン酸(GlcA)ならびにN-アセチル-D-ガラクトサミン(GalNAc)残渣の交互配列で構成される。これらの化合物はそれぞれ、主に約40〜100回の二糖類単位の反復のみからなるポリマー構造を有する。CSは、GAG成分に関して前述したように、さまざまな分子量および濃度で使用され得るが、例示的な実施形態では、CSは、約1.161×10−17〜1.328×10−16g(約10,000〜80,000kDa)の範囲の分子量、および約0.1〜100mg/mLの範囲の濃度を有する。CSは、ウシまたはネズミ(marine)の供給源から単離され得る。コンドロイチン鎖は、100超の個々の糖を有してよく、それらはそれぞれ、さまざまな位置および量で硫酸処理され得る。コンドロイチン-4硫酸、またN-アセチルガラクトサミン(GalNAc)糖の4位炭素(carbon 4)は、ウシおよびブタの鼻および気管の軟骨で見られる。これは、これらの動物の骨、肉、血液、皮膚、臍帯、および尿でも見られる。コンドロイチン-6硫酸、またGalNAc糖の6位炭素(carbon 6)は、これらの動物の皮膚、臍帯、および心臓弁から単離されている。コンドロイチン-6硫酸は、コンドロイチン-4硫酸と同じ組成を有するが、わずかに異なる物理特性を有する。コンドロイチン硫酸は、コラーゲンの結合に関係し、また、水分保持に直接関わる。これらは両方とも、治癒過程を助ける特性である。用語「コンドロイチン硫酸」、「CS」、「コンドロイチン」、「コンドロイチン硫酸(chondroitin sulfuric acid)」、および「コンスリド(chonsurid)」は、本明細書で互換的に使用され、本出願全体にわたり、化学的誘導体または異性体の誘導体または架橋誘導体を包含することを、当業者は認識するであろう。
【0026】
コンドロイチン硫酸Bとも呼ばれるデルマタン硫酸(DS)は、主に、β1,4もしくは1,3結合で連結されたL-イズロン酸とN-アセチル-D-ガラクトサミンとの二硫酸化および/または三硫酸化二糖類単位から作られるが、反復単位の一部が、硫酸化L-イズロン酸もしくはD-グルクロン酸をウロン酸として含有するか、または非硫酸化N-アセチルガラクトサミンもしくは4,6-二硫酸化N-アセチルガラクトサミンを、N-アセチルガラクトサミン-4-硫酸の代わりに含有する場合もある。DSは、GalNAcの存在によりコンドロイチン硫酸と定義される。DS中にイズロン酸(IdoA)が存在することにより、DSがコンドロイチン硫酸-A(4-O-硫酸化)およびコンドロイチン硫酸-C(6-O-硫酸化)と区別され、DSが、やはりこの残渣を含有するヘパリンおよびHSになぞらえられる。デルマタン硫酸は経口摂取された場合に身体に吸収されると考えられる。DSの分子量および濃度は、GAG成分に関して前述したようにさまざまであってよいが、例示的な実施形態では、分子量は、約1.661×10−20〜1.328×10−19g(約10〜80kDa)の範囲であり、濃度は、約0.1〜100mg/mLの範囲である。細菌発酵されるため、制御され得る分子量を有するHAとは異なり、デルマタン硫酸は、動物組織から単離され、断片を含有し得ることを、当業者は認識するであろう。したがって、デルマタン硫酸の分子量、およびデルマタン硫酸に含有される任意の断片は、著しく異なっていてよい。用語「デルマタン硫酸」、「DS」、および「デルマタン」は、本明細書で互換的に使用され、デルマタン硫酸の硫酸化誘導体、デルマタン硫酸ベンゼトニウム塩、デルマタン硫酸ベンゼトニウム塩の過硫酸化誘導体、およびデルマタン硫酸ナトリウム塩も含むことも、当業者は認識するであろう。
【0027】
ヘパリンおよびヘパラン硫酸(HS)は、N-アセチルグルコサミンに連結されたグルクロン酸(GlcA)で構成される。これらは、ウロン酸およびアミノ糖を含有する、α1−4結合二糖類反復単位で構成される。ヘパラン硫酸プロテオグリカンは、基底膜の不可欠な部分である。HAは、6.642×10−19g(400kDa)ほどの分子量の大きな生体分子であり、ヘパラン硫酸鎖に共有結合したコアタンパク質で構成される。多糖類鎖の数、およびコアタンパク質の大きさは、供給源に応じてさまざまであってよい。ヘパラン硫酸プロテオグリカンは、糖部分によって線維芽細胞増殖因子、血管内皮増殖因子(VEGF)、およびVEGFレセプターに結合し、マトリライシン(MMP−7)および他のマトリックスメタロプロテイナーゼのドッキング分子として作用し、細胞増殖および分化において重要な役割を果たす、多機能分子である。ヘパラン硫酸プロテオグリカンはまた、ラミニン、フィブロネクチン、IV型コラーゲン、および線維芽細胞増殖因子(塩基性)(FGF-basic)を含む細胞外基質に見られるさまざまな分子に結合することによって、細胞付着を促進する。HSの分子量および濃度は、GAG成分に関して前述したようにさまざまであってよいが、例示的な実施形態では、分子量は、約4.982×10−21〜4.982×10−20g(約3〜30kDa)(組織から単離された場合)の範囲であり、濃度は、約0.1〜100mg/mLの範囲である。
【0028】
ケラタン硫酸、またケラト硫酸(KS)は、非常にマイナスに帯電しており、硝子軟骨、線維軟骨および弾性軟骨の細胞外基質中の最も豊富なプロテオグリカンであるアグリカンで主として見られる。KSは、二糖類反復単位、-4GlcNAcβ13Galβ1-で構成される。硫酸化は、ガラクトース(Gal)もしくはGlcNAcのいずれかまたは両方の炭素位6(C6)で起きる。特定のKS型は、3つの領域:連鎖領域(alinkage region)(その1つの末端で、KS鎖がコアタンパク質に連結される)、反復二糖類単位、およびタンパク質連鎖領域に対してKS鎖の反対側の末端で発生する、鎖キャッピング領域(chain capping region)で構成される。KSの分子量および濃度は、GAG成分に関して前述したようにさまざまであってよいが、例示的な実施形態では、分子量は、約8.303×10−21〜1.661×10−20g(約5〜10kDa)(組織から単離された場合)の範囲であり、濃度は、約1〜100mg/mLの範囲である。
【0029】
凍結乾燥GAGが特に好適であるが、液体GAGも、HAの粘度を少なくとも一時的に低減するのに使用され得ることを、当業者は認識するであろう。例えば、CSは、粉末形態で入手され、水などの溶媒と混合されて、溶液を形成することができる。この溶液は、HAと組み合わせられて、HA単独の場合と比較して粘度が低減した混合物を形成することができる。HAの粘度を低減するのに有効であるが、結果として得られる混合物は、水の存在により濃度が低くなっている。したがって、液体の非凍結乾燥GAGを本発明で使用することができるが、例示的な実施形態では、GAGは、高濃度でのHAの使用を可能にするよう、凍結乾燥される。
【0030】
凍結乾燥
本発明の組成物および方法に存在する成分のうち任意の1つまたは複数は、当技術分野で既知のさまざまな技術を用いて凍結乾燥され得る。凍結乾燥は、典型的には壊れやすい材料を保存するのに使用される脱水プロセスであり、材料を凍結し、その後、周囲圧力を下げ、十分な熱を加えて材料中の凍結水を固相から気相へ直接昇華させることによって、機能する。当技術分野で既知の標準的な凍結乾燥技術を使用して、成分のうち任意の1つまたは複数を凍結乾燥させることができる。例示的な実施形態では、最低でも第2の成分、すなわち1つまたは複数のGAGを凍結乾燥させる。
【0031】
凍結乾燥前に、さまざまな溶媒を使用して、凍結乾燥すべき成分を含有する水性混合物を形成することができる。例示的な実施形態では、水性混合物は、水を成分のうち1つまたは複数と組み合わせることにより準備される。その成分は、混合物中に、さまざまな量で、例えば約1〜100mg/mLの範囲、さらに好ましくは約50mg/mLで存在することができる。例示的な実施形態では、組成物は、凍結乾燥前に0.2μmフィルターなどのフィルターを用いて殺菌される。使用され得る1つの濾過技術は、無菌濾過である。
【0032】
一実施形態では、以下のサイクルを使用して成分を凍結乾燥させることができる:
凍結: 15分で周囲温度から5℃に。
100分間5℃に保つ。
50分で−45℃まで下げる。
180分間−45℃に保つ。
一次乾燥:6.67Pa(50mTorr)の設定圧力。
175分で−15℃まで上げる(Shelf Up)。
2300分間−15℃に保つ。
二次乾燥:10Pa(75mTorr)の設定圧力。
200分で25℃まで上げる(Shelf Up)。
900分間保つ。
サイクル終了:〜9.733×104Pa(730Torr)まで窒素で埋め戻す(backfill)。
キャップ形成(Capping)およびクリンプ。
【0033】
緩衝剤を加えることで、凍結乾燥製剤中のGAGの溶解度および安定性が改善され得る。当技術分野で既知の生体適合性緩衝剤、例えばグリシン;酢酸のナトリウム塩、カリウム塩、もしくはカルシウム塩;クエン酸のナトリウム塩、カリウム塩、もしくはカルシウム塩;乳酸のナトリウム塩、カリウム塩、もしくはカルシウム塩;第一リン酸(mono-basic phosphate)、第二リン酸(di-basic phosphate)、第三リン酸(tri-basic phosphate)およびこれらの混合物を含む、リン酸のナトリウム塩もしくはカリウム塩を、使用することができる。緩衝剤は、充填剤として機能するように組成物に添加されたグリシンをさらに有してよい。
【0034】
他の関節用サプリメント
本発明の成分および方法は、治療効果を高めるよう、追加の成分または関節用サプリメントを含むこともできる。例えば、グルコサミン(C6H13NO5)(「GlcN」)は、ヒアルロナンの産生ならびにプロテオグリカンに必要な両方の反応を与えることにより、滑液の主要成分の合成を高めることができる。GlcNは、4つのヒドロキシル基とアミン基とを有するアミノ糖であり、糖化タンパク質および脂質の生化学合成における、顕著な前駆体である。GlcNは、栄養機能およびエフェクター機能を有する、自然発生分子である。例えば、GlcNは、幹細胞成長および間葉系幹細胞の分化と適合性があり、かつこれらを促進して、軟骨細胞を形成する。GlcNは、一般的には、軟骨の成長および発達など、組織発達および修復において役割を有し得る。一実施形態では、GlcNは、CSと共に凍結乾燥され得る。グルコサミンの塩形態は、液相において、限られた安定性を有し得る。さらに、GlcNのHCl塩は、いったん組み合わされたHAを分解させるよう十分にpHを下げることができる。このような理由から、成分の安定性を保持するためには、凍結乾燥形態のGlcNを、注入前にHAゲルにより可溶化させることが、有利である。
【0035】
GlcNの濃度はさまざまであってよい。適切な局所濃度は、少なくとも約10mg/mL、約9mg/mL、約8mg/mL、約7mg/mL、約6mg/mL、5mg/mL、4.5mg/mL、4mg/mL、3.5mg/mL、3mg/mL、約2.9mg/mL、約2.8mg/mL、約2.7mg/mL、約2.6mg/mL、約2.5mg/mL、約2.4mg/mL、約2.3mg/mL、約2.2mg/mL、約2.1mg/mL、約2.0mg/mL、約1.9mg/mL、約1.8mg/mL、約1.7mg/mL、約1.6mg/mL、約1.5mg/mL、約1.4mg/mL、約1.3mg/mL、約1.2mg/mL、約1.1mg/mL、約1.0mg/mL、約0.9mg/mL、約0.8mg/mL、約0.7mg/mL、約0.6mg/mL、約0.5mg/mLなどであってよい。当業者は、薬剤学分野で既知の方法を実践するGlcNの適切な局所濃度を決定でき、その決定は、所望のGlcN濃度を得るために目的のGlcN組成物の性質および組成を左右するであろう。
【0036】
本発明の組成物および方法は、例えば、アミノ酸、タンパク質、核酸、緩衝剤、界面活性剤、およびこれらの混合物を含むさまざまな他の関節治療もしくは賦形剤を含み得ることを当業者は認識するであろう。ステロイド、抗炎症剤、非ステロイド性抗炎症剤、鎮痛剤、細胞、安定剤、抗生物質、抗菌剤、抗炎症剤、成長因子、成長因子断片、小分子創傷治癒刺激薬、ホルモン、サイトカイン、ペプチド、抗体、酵素、単離細胞、血小板、免疫抑制剤、核酸、鎮痛剤、細胞型、ウィルス、ウィルス粒子、およびこれらの組み合わせ。
【0037】
組成物
第1および第2の成分、ならびに任意の追加成分を組み合わせて、組織内に注入され得る組成物を形成することができる。前述のように、成分のうち1つまたは複数、好ましくは少なくとも第2の成分(GAG)を凍結乾燥させ、それにより、固体とする。全成分を凍結乾燥させた場合、それらの成分を、1つまたは複数の容器内に供給し、次に、水、食塩水、緩衝剤、または他の溶媒と再構築することができる。凍結乾燥GAGとの凍結乾燥HAもしくは固体のHAの可溶化により、HAの可溶化を速くすることができる。成分のうち1つまたは複数が液体で、成分のうち1つまたは複数が固体である場合、固体成分は、第1の容器、または容器の第1のチャンバの中に供給されてよく、液体成分は、第2の容器、または容器の第2のチャンバの中に供給されてよい。固体成分は、液体成分によって、または希釈剤により、可溶化され得る。いったん成分が完全に可溶化されたら、組成物は、HA単独の粘度と比較して著しく低減された粘度を少なくとも一時的に示すので、注射器を使用して組成物を組織に注入することができる。
【0038】
一実施形態では、第2の成分は、凍結乾燥され、第1の成分は、水性溶液中にある。これらの成分は、別個の容器または別個のチャンバの中に供給され、手術の直前、または手術中に、凍結乾燥した第2の成分を第1の成分で再構成する。特に、HAは、液体形態で供給されてよく、凍結乾燥GAGをHAと組み合わせることができる。HA中でいったん完全に可溶化されたら、HAの粘度は、少なくとも一時的に著しく低減され、2つの成分の混合を可能にし、混合物の注入を容易にする。あるいは、凍結乾燥した第2の成分を、水、食塩水、または他の溶媒と再構成し、その後、HAと組み合わせて、注入可能な混合物を形成することができる。
【0039】
別の実施形態では、第1および第2の成分の双方を凍結乾燥し、固形で供給する。これらの成分を別個の容器またはチャンバに供給してよく、あるいは、単一の容器またはチャンバに供給してもよい。これらの成分を、水、食塩水、または他の溶媒と再構成して、注入可能な混合物を形成することができる。凍結乾燥した第2の成分、例えば1つまたは複数のGAGは、混合物の粘度を少なくとも一時的に低減する効果を有する。
【0040】
例示的な実施形態では、成分は、手術中、すなわち手術直前または手術の間に組み合わせられるように構成される。組み合わせられると、成分は、結果として得られる、すぐに使える組成物または混合物を形成でき、これは、さまざまな量で組成物中に存在する各成分を有している。すぐに使える組成物の各成分の量はさまざまであってよいが、例示的な実施形態では、第2の成分、例えば1つまたは複数のGAGが、第1の成分、例えばHAの粘度を低減するのに十分な量で存在する。例えば、第1の成分、例えばHA、および第2の成分、例えばGAGは、第1の成分対第2の成分の割合が約1:0.001〜1:200の範囲で、一部の実施形態では約1:0.005〜1:100で、混合されてよい。したがって、すぐに使える組成物中の第1の成分の、結果として得られる濃度は、全組成物の約0.6重量%〜4重量%以上の範囲であってよく、すぐに使える組成物中の第2の成分の、結果として得られる濃度は、約0.001%〜10%の範囲であってよい。さらに好ましくは、第1の成分は、全組成物の約0.6重量%、1重量%、1.5重量%、2重量%、2.5重量%、3重量%、3.5重量%、4重量%以上の濃度で、すぐに使える組成物中に存在してよく、第2の成分は、全組成物の約0.001重量%、0.01重量%、0.1重量%、1重量%、2重量%、3重量%、4重量%、5重量%、6重量%、7重量%、8重量%、9重量%、10重量%以上の濃度で、すぐに使える組成物中に存在してよい。例示的な実施形態では、開示する組成物中に存在するHAの量は、全組成物の約1.5〜2.5重量%であり、開示する組成物中に存在するGAGの量は、全組成物の約0.001〜10重量%である。
【0041】
成分のうち1つまたは複数を可溶化するのに使用され得る他の溶媒には、例えば、食塩水もしくは他の塩溶液、緩衝溶液、例えばリン酸緩衝生理食塩水、ヒスチジン、乳酸塩、琥珀酸塩、グリシン、およびグルタミン酸塩、デキストロース、グリセロール、水、ならびにこれらの組み合わせが含まれる。組成物は、生理学的に相溶性の他の成分、例えば分散媒、抗菌剤、および抗真菌薬、等張剤、および吸収遅延薬なども含んでよい。等張剤は、例えば、組成物中の、デキストロースなどの糖類、マンニトール、ソルビトールなどの多価アルコール、または塩化ナトリウムなどの塩を含む。組成物は、組成物の貯蔵寿命または有効性を高める、湿潤剤または乳化剤、防腐剤または緩衝液などの補助物質を少量含むこともできる。
【0042】
成分および/または、結果として得られる組成物は、当技術分野で既知のさまざまな技術を使用して、使用前に殺菌され得る。無菌の注入可能な混合物は、治療的に有効もしくは有益な量の活性化合物を、必要に応じて、1つの成分もしくは成分の組み合わせを有する適切な溶媒に組み込み、その後、無菌濾過して、無菌製剤を生じることにより、準備され得る。一般的に、塩基性分散媒体および任意の必要な他の成分を含有する無菌ビヒクルに、HAなどの化合物を組み込むことによって、分散物が準備される。無菌の注入可能な混合物の準備のための無菌粉末の場合、一部の方法は、組成物および先に無菌濾過されたその混合物からの任意の所望の追加成分の粉末を生じる、真空乾燥成分およびフリーズドライ成分の調製を含み得る。
【0043】
使用方法
使用中、第1および第2の成分を手術中に組み合わせ、その後、例えば注入により、治療部位に送達することができる。一実施形態では、第1および第2の成分を前述のように組み合わせて、混合物または組成物を形成することができる。凍結乾燥した第2の成分、例えば1つまたは複数のGAGを、第1の成分、例えばHAと組み合わせることは、HA混合物の粘度の一時的な低減を少なくとも一時的に誘発することができ、さらに扱いやすくなり、組み合わせたHA/GAG混合物を注射器内に入れ、患者に注入することができる。ある実施形態では、組成物を組織に注入する前に凍結乾燥成分が完全に可溶化するのに、しばらくの間(an amount of time)待つことが必要となり得る。凍結乾燥した第2の成分が第1の成分、または溶媒に可溶化するのにかかる時間は、使用する具体的な第2の成分、ならびに成分の分子量および濃度によって異なってよい。概して、第2の成分が第1の成分に完全に可溶化するか、または溶媒で再構成されるのに10秒〜30分かかり得る。
【0044】
いったん凍結乾燥成分が完全に可溶化し、第1の成分、例えばHAの粘度が著しく低減したら、粘度は、しばらくの間、低減したままであり、この時間もやはり、使用する具体的な材料、ならびに組成物中の成分の分子量および濃度によって異なり得る。ある実施形態では、いったん第2の成分が完全に可溶化したら、組成物を組織に注入するのに望ましい時間は、約1〜60分、さらに好ましくは1〜30分の範囲であってよく、さらに好ましくは、この時間は、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60分またはそれ以上、またはこの範囲内の任意の変数のいずれかであってよい。
【0045】
送達システム
前述したように、本発明の組成物および方法に使用される成分は、好ましくは手術中に組み合わせられるように構成される。したがって、これらの成分は、キットの一部として供給され得る。一実施形態では、キットは、HAなどの第1の成分、および,少なくとも1つのGAGなどの第2の成分を含むことができる。キットは、前述のように追加成分を含むこともできる。その成分は、バイアルまたは注射器などのハウジングの、単一の容器もしくはチャンバ、または別々の容器もしくはチャンバの中に収容され得る。
【0046】
例示的な実施形態では、成分は、単一の混合および送達装置に供給される。単一送達能力(single delivery capability)の利点には、薬剤投与の速度および容易さが増大すること;接続部の数を減らすことにより院内感染のリスクが減少すること;薬剤投与もしくは順序を誤るリスクが低下すること;ならびに、投与前に組み合わせを必要とする組成物がさらに迅速に送達されることが含まれる。
【0047】
図1は、二重チャンバ注射器10の形態をした混合および送達システムの一実施形態を示す。図示のとおり、二重チャンバ注射器10は、概して、弁16により分離された近位チャンバ12および遠位チャンバ14を有するハウジングを含む。プランジャー18が、近位チャンバ12内部にスライド可能に配されており、近位チャンバ12内部に存在する流体を遠位チャンバ14に注入することにより、成分を混合するように構成されている。一実施形態では、第1の成分、例えば液体HAが、近位チャンバ12内に存在してよく、第2の成分、例えば凍結乾燥GAGが遠位チャンバ14内に存在してよい。プランジャー18は、近位チャンバ12の中を前進して、第2の成分、例えば1つまたは複数の凍結乾燥したGAGを収容する遠位チャンバ14内に、第1の成分、例えば液体HAを注入することができる。別の実施形態では、近位チャンバ12は、水もしくは食塩水などの溶媒を収容することができ、遠位チャンバ14は、固形で成分のすべてを収容することができる。例えば、遠位チャンバ14は、凍結乾燥HAもしくは固形のHA、および1つまたは複数の凍結乾燥GAGを収容することができる。プランジャー18は、近位チャンバ12の中を前進して、遠位チャンバ14に溶媒を注入することができ、それにより、遠位チャンバ14で成分を可溶化する。いったん全成分が遠位チャンバ14内で組み合わせられ、任意の固体が完全に可溶化されたら、混合物は、例えば針を二重チャンバ注射器の遠位端部に取り付けることによって、組織に送達されることができる。
【0048】
図2は、MixJect(登録商標)の商品名で商業的に販売されている混合および送達システム20の別の実施形態を示す。この実施形態では、システムは、注射器24とバイアル26との間に連結された流体制御組立体22を含む。注射器24は、液体HAもしくは溶媒などの液体を収容することができる第1のチャンバ24aを画定し、バイアルは、1つまたは複数の凍結乾燥GAGなどの固体を収容することができる第2のチャンバ26aを画定している。注射器24を通してプランジャー28を配備することにより、制御システムを通してバイアル26内へと液体が注入され、バイアルでは、固体が液体により可溶化される。いったん成分が完全に可溶化されたら、バイアル26をひっくり返してよく、プランジャー28を後退させて、混合物を注射器24のチャンバ24a内へ戻すことができる。次に、バイアル26をシステムから取り外してよく、混合物は、注射器から針29を通して組織へ注入され得る。
【0049】
当技術分野で既知の任意の二重チャンバシステムを使用してよいこと、ならびにそれらのチャンバは、単一のチャンバになるよう混ざり合う(mix into)別々の注射器プランジャーを備えた隣り合うチャンバ、または単一のプランジャーを備えた線形チャンバであってよいことを、当業者は認識するであろう。
【0050】
予め満たされた注射器は、送達可能な正確な用量の所望の化合物および希釈剤を収容することができる。非限定的な例として、予め満たされた注射器は、約0.1mL、0.2mL、0.3mL、0.4mL、0.5mL、0.6mL、0.7mL、0.8mL、0.9mL、1.0mL、1.5mL、2mL、2.5mL、3mL、3.5mL、4mL、4.5mL、5mL、5.5mL、6mL、6.5mL、7mL、7.5mL、8mL、8.5mL、9mL、9.5mL、10mLまたはそれ以上、またはそれらの任意の派生物(derivative)の容量を収容し得る。
【0051】
治療
この方法および組成物において有用なHAならびにGAGは、生体内適用では、独立して、または一緒に、注射によって非経口的に、または時間をかけて漸進的な灌流によって、投与され得る。投与は、静脈内、腹腔内、筋肉内、皮下、関節内、腔内(intracavity)、または経皮的であってよい。組成物および方法が関節障害治療において活性を与え得る、症状または疾患の例には、感染症、外傷、アレルギー、代謝障害などにより引き起こされる関節炎、慢性関節リウマチなどのリウマチ(rheumatoids)、および全身性エリテマトーデス;痛風を伴う関節疾患、変形性関節症などの関節症、関節内障、関節水腫、肩こり、腰痛などが含まれる。組成物の使用、または治療される疾患のタイプに応じて効果が変化することで、薬剤は、所望の予防的および緩和的効果を与え、または、生体に重篤な影響を与えずに関節の腫脹、疼痛、炎症、および破壊(destroying)に対する治療効果さえ与えることができる。関節障害を治療する組成物を使用して、関節障害の発症を防ぎ、関節障害が発症した後には症状を改善、軽減、および治療することができる。
【0052】
治療方法は、関節などの標的エリアに組成物を直接注入することを含み得る。注入は、毎日、毎週、1週間に数回、隔月、1ヶ月に数回、毎月のような頻度で行われてよく、または、症状の軽減をもたらすよう必要に応じた頻度で行われてもよい。関節内での使用については、関節の大きさおよび状態の重症度に応じて、関節当たり約0.1〜約500mgを注入することができる。所定の関節へのその後の注入の頻度は、その関節で症状が再発したときまで間隔をあける。例示的には、人間における組成物の投薬レベルは、膝で、関節当たり約0.1〜約500mgの注入;肩で、関節当たり約0.1〜約500mgの注入;中手骨もしくは近位指骨で、関節当たり約0.1〜約100mgの注入;肘で、関節当たり約0.1〜約300mgの注入であってよい。
【0053】
しかしながら、任意の特定の患者に対する特定の投薬レベルは、使用される特定の化合物の活性、年齢、体重、全体的な健康、性別、食事、投与時間、投与経路、排出率、薬剤の組み合わせ、および治療を受けている特定の疾患の重症度を含む、さまざまな要因によって決まることが理解されるであろう。
【0054】
一実施形態では、病状は、変形性関節症(OA)であり、組成物は、例えば、膝関節、肩関節、側頭下顎関節または手根中手関節、肘関節、股関節、手首関節、足首関節、および脊椎の腰部関節突起間関節(椎間関節)などの関節腔に投与される。関節内補充療法は、膝または他の罹患関節(afflicted joints)内に、数週間にわたって投与される単回または複数回の関節内注入により達成され得る。例えば、膝OAのヒト患者が、1つの膝関節当たり約2、3、4、5、6、7、8、9、10mLまたはそれ以上の注入を、1、2、または3回受けることができる。他の関節については、投与容量は、関節の大きさに基づいて調節されてよい。
【0055】
別の例示的な実施形態では、第1および第2の成分を有するキットを提供する。第1の成分は、2mLのOrthovisc(登録商標)を含んでよく、これは、30mgのヒアルロナン、18mgの塩化ナトリウム、および最大2.0mLの注射用蒸留水を含んでいる。HAは、約1.661×10−18〜4.816×10−18g(約1.0〜2.9MDa)の範囲の分子量を有する。第2の成分は、0.1〜100mg/mLの凍結乾燥ウシ由来CS(例えばBioiberica(Barcelona, Spain)から供給されたもので、前述のプロトコルを用いて凍結乾燥された)を含むことができる。これら2つの成分は、例えば前述の送達システムを使用して組み合わせられ、凍結乾燥CSを可溶化させることができる。完全な可溶化には約X分かかり得る。いったん完全に可溶化されたら、混合物の粘度は著しく低下し、混合物を関節内に、例えば膝関節の中に注入することができる。注入は、好ましくは可溶化から5〜30分以内に行われる。追加の注入は、合計3または4回の注入(total of three of four injections)については、1週間に1回行われてよい。標準的な関節内注入部位の準備、無菌技術、および注意を使用しなければならない。
【0056】
実験データ
実施例1 凍結乾燥
50mg/mLのグルコサミンHClと50mg/mLのコンドロイチン硫酸とを含む混合物を準備し、0.2μmのフィルターで濾過した。次に、混合物を、1mL/バイアルで3mLのガラスバイアルに入れ、凍結乾燥した。凍結乾燥した塊(cake)は、固体で白色に見えた。凍結乾燥した各サンプルは、注入のため、水、Orthovisc、または他のHAゲルで再構築されることができた。これらのHAゲルは、10〜20mg/mLの濃度であり、HAは、ShiseidoおよびLifecoreから供給された。サンプルはまた、PBSなど他の緩衝液でも再構築され得た。
【0057】
実施例2 粘度
さまざまな量の異なるGAGを前述のとおり凍結乾燥し、ふわふわした白い塊を形成した。GAGは、Bioiberica(Barcelona, Spain)により供給されたウシ由来CS、Sigma-Aldrich(Saint Louis, MO)により供給されたヘパリン、およびSigma-Aldrich(Saint Louis, MO)により供給されたデキストラン硫酸を含む。凍結乾燥GAGはそれぞれ、約20.8mmの外径および約40mmの高さを有する5mLのバイアルに入れられた。40mgの非凍結乾燥GAGも、同じ寸法を有する5mLのバイアルに入れられた。Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)を各バイアルに注入し、HAは、GAGを完全に溶解させた。2mLのOrthovisc(登録商標)のみを含む対照を、同じ寸法を有するバイアルに入れた。
【0058】
凍結乾燥GAGを完全に可溶化させるのにかかる時間を、組成物のうちいくつかについて測定し、その結果を以下に述べる。混合物の粘度は、「流速」を判断することにより測定する。本明細書で使用する「流速」とは、バイアルが逆さまにされたときに、各バイアルの中身がバイアルの一端部からバイアルの他端部まで流れるのにかかる時間を指す。結果を以下の表1に示す。流速が1分まで増大するのにかかった時間も計測し、以下の表1に示す。表1に示すすべての結果は、3回の測定値の平均に基づいている。
【表1】

【0059】
表1に示すように、HA単独のものは、非常に粘性であり、5mLの40mm高さのバイアルの一端部から反対端部まで移動する2mLのHAについて流速が約20分である。ベンダーから受領したGAG粉末、または非凍結GAGと組み合わせると、低粘度の局所エリアがあった。しかしながら、すべての粉末を完全に可溶化させるのにかかる時間の間に、混合物は、高粘度に戻る。したがって、サンプルを完全に混合しMixjectシステムの注射器に戻す時間がない。一方、凍結乾燥GAGと組み合わせると、HAは、GAGを比較的迅速に溶解させることができ、粘度は、少なくとも一時的に著しく低減し、混合物は、バイアルの一端部からバイアルの反対端部まで数秒で移動することができた。ヘパリンおよびデキストランを除いてほとんどの場合、粘度は、少なくとも約15分間、著しく低減したレベルのままであった。
【0060】
実施例3 粘度
Bioiberica(Barcelona, Spain)から入手した40mgの非凍結乾燥CS粉末を、500μLの水と混合した。次に、この溶液を、Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)と組み合わせた。穏やかに混合してから約1〜2分後、成分が完全に混合された。流速は45秒と測定された。
【0061】
500μLの水を、Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)と組み合わせた。穏やかに混合してから約3分後、流速は26秒と測定された。
【0062】
液体CSとHAとの組み合わせは、水とHAとの組み合わせに比べ、流速の低減を示した。したがって、この実験は、HAの粘度に対するCSの影響を証明するものである。
【0063】
実施例4 可溶化
40mgの非凍結乾燥CS粉末を、Bioiberica(Barcelona, Spain)から入手し、Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)と混合した。穏やかに混合してから約15〜20分後、CSはHA中で完全に可溶化された。粘度が低減した局所エリアは、可溶化中に観察されたが、完全な可溶化前には、HAゲルは、高粘度状態に戻り、注入のため中身が別の注射器に移動することが妨げられた。
【0064】
同様に、Bioiberica(Barcelona, Spain)から入手した40mgの凍結乾燥CS粉末を、Anika Therapeutics(Bedford, MA)により製造された、2mLのOrthovisc(登録商標)と混合した。穏やかに混合してから約5分後、凍結乾燥CSはHA中で完全に可溶化され、HAの粘度は、見かけ上は低減した。低減した粘度は、十分な時間にわたり保たれ、注入のため混合物を注射器に引き込むことができた。
【0065】
用語法
「治療的に有効な量」または「有効な量」は、薬理学的作用を達成する薬剤の量である。用語「治療的に有効な量」には、例えば、予防上有効な量が含まれる。「有効な量」は、過度の副作用なしで、所望の薬理学的作用または治療上の改善を達成するのに有効な量である。例えば、有効な量とは、操作性を増大するか、または患者が関節に対する負荷に耐える能力を増大するか、または、疼痛を軽減するか、または患者が通常の活動に戻るのを可能にするか、または1つもしくは複数の関節の骨および軟骨における修復を刺激するか、または関節の歪み、疼痛、腫脹、炎症もしくは硬直を軽減する、量を指す。薬剤の有効な量は、特定の患者および疾患レベルに応じて当業者により選択される。「有効な量」または「治療的に有効な量」は、消化管運動改善薬などの治療薬の代謝の差異、および/または患者の年齢、体重、全身状態、治療している病状、治療している病状の重症度、および処方医師の判断により、患者ごとに異なってよいことが理解される。
【0066】
「治療する」または「治療」とは、骨もしくは軟骨の障害に関わる障害もしくは疾患の任意の治療、例えば、その障害もしくは疾患の素因となり得るが、まだその障害もしくは疾患を有しているとは診断されていない患者においてその障害もしくは疾患の発症を妨げること;その障害もしくは疾患を阻止する、例えば、その障害もしくは疾患の発生もしくは進行を停止するか、その障害もしくは疾患を軽減するか、その障害もしくは疾患の退行を引き起こすか、その障害もしくは疾患により生じる状態を軽減するか、またはその障害もしくは疾患の症状を止めること、を指す。したがって、本明細書で使用される用語「治療する」は、用語「妨げる」と同義的に使用される。
【0067】
「同時投与される(co-administered)」は、同じ製剤における、または投与のため1つの製剤になるよう組み合わせられる2つの異なる製剤における、同時投与を意味する。一実施形態では、HAおよびGAGは、同じ製剤における送達により同時投与される。
【0068】
本明細書で使用される用語「患者」は、本発明の組成物および方法から利益を得ることができる、動物、好ましくは哺乳動物、さらに好ましくはヒト、ウマ、および犬を指す。本発明の方法から利益を得ることができる動物のタイプに制限はない。患者は、ヒトであるか、ヒトでない動物であるかにかかわらず、個体、患者、動物、宿主、またはレシピエントと呼ばれ得る。本発明の方法は、人間医学、獣医学、ならびに一般的な家畜または野生動物の畜産において適用を有する。
【0069】
当業者は、前述した実施形態に基づいて本発明のさらなる特徴および利点を認識するであろう。したがって、本発明は、請求項により示されることを除いて、具体的に図示および説明したことによって制限されない。本明細書で引用したすべての刊行物および参考文献は、参照により全体として本明細書に明白に組み込まれる。
【0070】
〔実施の態様〕
(1)関節を治療するキットにおいて、
ヒアルロン酸を含む第1の成分と、
凍結乾燥グリコサミノグリカンを含む第2の成分と、
前記第1および第2の成分の混合物を注入する注射器と、
を含む、キット。
(2) 実施態様1に記載のキットにおいて、
前記グリコサミノグリカンは、コンドロイチン硫酸を含む、キット。
(3) 実施態様1に記載のキットにおいて、
グルコサミンを含む第3の成分、
をさらに含む、キット。
(4) 実施態様3に記載のキットにおいて、
前記グルコサミンは、凍結乾燥される、キット。
(5) 実施態様1に記載のキットにおいて、
前記第1および第2の成分が組み合わせられて混合物を形成すると、前記第1および第2の成分は、約1:0.005〜1:100の範囲の、第1の成分対第2の成分の割合で、前記混合物中に存在する、キット。
【0071】
(6) 実施態様1に記載のキットにおいて、
前記注射器は、前記第1の成分を収容する第1のチャンバ、および前記第2の成分を収容する第2の容器を有し、
前記注射器は、前記第1および第2の成分を混合するために前記第2の成分を前記第1のチャンバに注入するように構成されたプランジャーを含む、キット。
(7) 実施態様1に記載のキットにおいて、
前記第2の成分は、容器内に入れられ、前記注射器は、前記第1の成分を収容する第1のチャンバ、および前記容器を前記注射器に取り外し可能に連結するコネクタを含み、前記注射器の前記第1のチャンバ内部にスライド可能に配されたプランジャーが、前記第1および第2の成分を混合するように前記第1の成分を前記容器に注入することができる、キット。
(8) 実施態様1に記載のキットにおいて、
前記ヒアルロン酸は、凍結乾燥される、キット。
(9) 実施態様1に記載のキットにおいて、
前記ヒアルロン酸は、約1.661×10−18g〜6.642×10−18g(約1MDa〜4MDa)の範囲の分子量を有する、キット。
(10) 実施態様1に記載のキットにおいて、
前記ヒアルロン酸は、少なくとも約7mg/mLの濃度を有する、キット。
【0072】
(11) 実施態様1に記載のキットにおいて、
前記第1および第2の成分を可溶化させるように構成された流体を含む第3の成分、
をさらに含む、キット。
(12) 実施態様11に記載のキットにおいて、
前記第3の成分は、水、食塩水、および緩衝液からなる群から選択される、キット。
(13) 関節を治療する方法において、
混合物を形成するよう、ヒアルロン酸を含む第1の成分を、凍結乾燥グリコサミノグリカンを含む第2の成分と組み合わせることと、
前記混合物を関節に注入することと、
を含む、方法。
(14) 実施態様13に記載の方法において、
前記グリコサミノグリカンは、コンドロイチン硫酸を含む、方法。
(15) 実施態様13に記載の方法において、
グルコサミンを含む第3の成分、
をさらに含む、方法。
【0073】
(16) 実施態様15に記載の方法において、
前記グルコサミンは、凍結乾燥される、方法。
(17) 実施態様13に記載の方法において、
前記混合物の粘度は、組み合わせる前には、前記ヒアルロン酸の粘度より低い、方法。
(18) 実施態様13に記載の方法において、
前記ヒアルロン酸は、凍結乾燥され、
前記第1および第2の成分は、混合物を形成するよう前記第1および第2の成分を組み合わせる前、または組み合わせる間に可溶化される、方法。
(19) 実施態様13に記載の方法において、
前記第1および第2の成分は、バイアル内で組み合わせられ、注射器に引き込まれ、
前記注射器は、前記混合物を関節に注入するのに使用される、方法。
(20) 実施態様19に記載の方法において、
前記第1および第2の成分は、前記混合物の形成から30分以内に前記注射器に引き込まれる、方法。
【0074】
(21) 実施態様13に記載の方法において、
前記第1の成分は、注射器の第1のチャンバ内に入れられ、前記第2の成分は、前記注射器の第2のチャンバ内に入れられ、
前記第1および第2の成分を組み合わせることは、前記第1の成分を前記第2のチャンバに注入することを含む、方法。
(22) 実施態様13に記載の方法において、
前記第1および第2の成分を組み合わせることは、前記第1の成分が入った容器を、前記第2の成分が入った注射器に連結することと、前記第2の成分を前記注射器から前記容器へ注入することと、を含む、方法。
(23) 実施態様13に記載の方法において、
前記第1の成分は、約1.661×10−18g〜6.642×10−18g(約1MDa〜4MDa)の範囲の分子量を有する、方法。
(24) 実施態様13に記載の方法において、
前記第1の成分は、少なくとも約7mg/mLの濃度を有する、方法。
(25) 実施態様13に記載の方法において、
前記第1および第2の成分は、約1:0.005〜1:100の割合で前記混合物中に存在する、方法。
【図面の簡単な説明】
【0075】
【図1】本発明の組成物および方法と共に使用される混合および送達システムの一実施形態の斜視図である。
【図2】本発明の組成物および方法と共に使用される混合および送達システムの別の実施形態の斜視図である。
【特許請求の範囲】
【請求項1】
関節を治療するキットにおいて、
ヒアルロン酸を含む第1の成分と、
凍結乾燥グリコサミノグリカンを含む第2の成分と、
前記第1および第2の成分の混合物を注入する注射器と、
を含む、キット。
【請求項2】
請求項1に記載のキットにおいて、
前記グリコサミノグリカンは、コンドロイチン硫酸を含む、キット。
【請求項3】
請求項1に記載のキットにおいて、
グルコサミンを含む第3の成分、
をさらに含む、キット。
【請求項4】
請求項3に記載のキットにおいて、
前記グルコサミンは、凍結乾燥される、キット。
【請求項5】
請求項1に記載のキットにおいて、
前記第1および第2の成分が組み合わせられて混合物を形成すると、前記第1および第2の成分は、約1:0.005〜1:100の範囲の、第1の成分対第2の成分の割合で、前記混合物中に存在する、キット。
【請求項6】
請求項1に記載のキットにおいて、
前記注射器は、前記第1の成分を収容する第1のチャンバ、および前記第2の成分を収容する第2の容器を有し、
前記注射器は、前記第1および第2の成分を混合するために前記第2の成分を前記第1のチャンバに注入するように構成されたプランジャーを含む、キット。
【請求項7】
請求項1に記載のキットにおいて、
前記第2の成分は、容器内に入れられ、前記注射器は、前記第1の成分を収容する第1のチャンバ、および前記容器を前記注射器に取り外し可能に連結するコネクタを含み、前記注射器の前記第1のチャンバ内部にスライド可能に配されたプランジャーが、前記第1および第2の成分を混合するように前記第1の成分を前記容器に注入することができる、キット。
【請求項8】
請求項1に記載のキットにおいて、
前記ヒアルロン酸は、凍結乾燥される、キット。
【請求項9】
請求項1に記載のキットにおいて、
前記ヒアルロン酸は、約1.661×10−18g〜6.642×10−18g(約1MDa〜4MDa)の範囲の分子量を有する、キット。
【請求項10】
請求項1に記載のキットにおいて、
前記ヒアルロン酸は、少なくとも約7mg/mLの濃度を有する、キット。
【請求項11】
請求項1に記載のキットにおいて、
前記第1および第2の成分を可溶化させるように構成された流体を含む第3の成分、
をさらに含む、キット。
【請求項12】
請求項11に記載のキットにおいて、
前記第3の成分は、水、食塩水、および緩衝液からなる群から選択される、キット。
【請求項1】
関節を治療するキットにおいて、
ヒアルロン酸を含む第1の成分と、
凍結乾燥グリコサミノグリカンを含む第2の成分と、
前記第1および第2の成分の混合物を注入する注射器と、
を含む、キット。
【請求項2】
請求項1に記載のキットにおいて、
前記グリコサミノグリカンは、コンドロイチン硫酸を含む、キット。
【請求項3】
請求項1に記載のキットにおいて、
グルコサミンを含む第3の成分、
をさらに含む、キット。
【請求項4】
請求項3に記載のキットにおいて、
前記グルコサミンは、凍結乾燥される、キット。
【請求項5】
請求項1に記載のキットにおいて、
前記第1および第2の成分が組み合わせられて混合物を形成すると、前記第1および第2の成分は、約1:0.005〜1:100の範囲の、第1の成分対第2の成分の割合で、前記混合物中に存在する、キット。
【請求項6】
請求項1に記載のキットにおいて、
前記注射器は、前記第1の成分を収容する第1のチャンバ、および前記第2の成分を収容する第2の容器を有し、
前記注射器は、前記第1および第2の成分を混合するために前記第2の成分を前記第1のチャンバに注入するように構成されたプランジャーを含む、キット。
【請求項7】
請求項1に記載のキットにおいて、
前記第2の成分は、容器内に入れられ、前記注射器は、前記第1の成分を収容する第1のチャンバ、および前記容器を前記注射器に取り外し可能に連結するコネクタを含み、前記注射器の前記第1のチャンバ内部にスライド可能に配されたプランジャーが、前記第1および第2の成分を混合するように前記第1の成分を前記容器に注入することができる、キット。
【請求項8】
請求項1に記載のキットにおいて、
前記ヒアルロン酸は、凍結乾燥される、キット。
【請求項9】
請求項1に記載のキットにおいて、
前記ヒアルロン酸は、約1.661×10−18g〜6.642×10−18g(約1MDa〜4MDa)の範囲の分子量を有する、キット。
【請求項10】
請求項1に記載のキットにおいて、
前記ヒアルロン酸は、少なくとも約7mg/mLの濃度を有する、キット。
【請求項11】
請求項1に記載のキットにおいて、
前記第1および第2の成分を可溶化させるように構成された流体を含む第3の成分、
をさらに含む、キット。
【請求項12】
請求項11に記載のキットにおいて、
前記第3の成分は、水、食塩水、および緩衝液からなる群から選択される、キット。
【図1】


【図2】




【図2】


【公開番号】特開2012−140425(P2012−140425A)
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−285276(P2011−285276)
【出願日】平成23年12月27日(2011.12.27)
【出願人】(504202690)デピュイ・ミテック・インコーポレイテッド (12)
【氏名又は名称原語表記】DePuy Mitek,Inc.
【住所又は居所原語表記】249 Vanderbilt Avenue,Norwood,MA 02062,U.S.A.
【Fターム(参考)】
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願番号】特願2011−285276(P2011−285276)
【出願日】平成23年12月27日(2011.12.27)
【出願人】(504202690)デピュイ・ミテック・インコーポレイテッド (12)
【氏名又は名称原語表記】DePuy Mitek,Inc.
【住所又は居所原語表記】249 Vanderbilt Avenue,Norwood,MA 02062,U.S.A.
【Fターム(参考)】
[ Back to top ]

