関節リウマチと関連する抗原
【課題】関節リウマチの検出及び治療のための、フィブロネクチンのエキストラドメイン-A(ED-A)アイソフォームに結合する結合メンバーを提供する。
【解決手段】フィブロネクチンのエキストラドメイン-A(ED-A)アイソフォームに結合する抗体。ペプチドリンカーによって、IL-10にコンジュゲートされている、前記抗体。関節リウマチを患う患者を治療するための医薬の製造における、前記抗体の使用。
【解決手段】フィブロネクチンのエキストラドメイン-A(ED-A)アイソフォームに結合する抗体。ペプチドリンカーによって、IL-10にコンジュゲートされている、前記抗体。関節リウマチを患う患者を治療するための医薬の製造における、前記抗体の使用。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、関節リウマチ(RA)の検出及び治療に関する。本発明は、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、特にフィブロネクチンのED-Aドメインに結合する結合メンバーの使用を含む。
【背景技術】
【0002】
関節リウマチ(RA)は、慢性の炎症であり、先進国の人口の0.5〜1%に罹患し、一般的に重大な障害となり、結果的にクオリティオブライフを低下させる破壊性関節疾患である。
【0003】
RAを患う患者の滑膜における血管形成は、発症及び疾患の永久化の重大な早期段階であると考えられている(Taylor, 2002)。腫瘍性疾患として、血管形成は拡張する滑膜に供給される(Walshら, 1998)。血管の成長は、おそらく炎症性滑膜パンヌスの増殖、及び滑膜組織への炎症性白血球の侵入の原因となる。RAを患う患者の滑膜は、増大した量の繊維芽細胞増殖因子-2(FGF-2)及び血管内皮増殖因子(VEGF)を含んでいる(Koch, 2003)。血清VEGF濃度は、疾患活性と相関しており、滑膜炎の治療による抑制が成功している場合に低下する(Taylor, 2002)。
【0004】
フィブロネクチン(FN)は糖タンパク質であり、様々な正常組織及び体液中で広く発現される。それは細胞外マトリックス(ECM)の成分であり、細胞接着、細胞移動、ホメオスタシス、血栓形成、創傷治癒、組織分化及び癌性形質転換などの多くの生物学的プロセスにおいて役割を果たしている。
【0005】
サイトカイン及び細胞外pHにより調節されるプロセスである、一次転写物FNプレmRNAの3個の領域(ED-A、ED-B、IIICS)の選択的スプライシングにより、異なるFNアイソフォームが生成される(Balza 1988; Carnemolla 1989; Borsi 1990; Borsi 1995)。フィブロネクチンは、選択的スプライシングを受け得る2個のIII型球状エキストラドメインED-A及びED-Bを含む(ffrench-Constant 1995, Hynes 1990, Kasparら、2006)。マウスフィブロネクチン及びヒトフィブロネクチンのED-Aは96.7%同一である(2つの90アミノ酸配列間で3アミノ酸のみが異なる、図2を参照)。
【0006】
フィブロネクチンのED-Aの発現は、腫瘍細胞及び固形腫瘍において、mRNAレベルで乳癌(Jacobsら、2002、Matsumotoら、1999)及び肝癌(Oyamaら、1989、Tavianら、1994)において、単離されたタンパク質レベルで線維肉腫、横紋筋肉腫及びメラノーマ(Borsiら、1987)において報告されている。
【0007】
免疫組織化学レベルでは、ED-Aの存在が、歯原性腫瘍(Heikinheimoら、1991)及び肝細胞癌(Koukoulisら、1995)の細胞外マトリックス(ECM)において検出されている。対照的に、ED-Aは、悪性乳房新生物の間質(Koukoulisら、1993)において、並びに十分に分化した腎細胞癌の血管及び基底膜(Lohiら、1995)において検出されている。しかしながら、低分化の腎細胞癌(Lohiら、1995)及び甲状腺乳頭癌(Scarpinoら、1999)では、ED-Aは血管、基底膜及び腫瘍間質において検出されている。神経膠腫の血管系においてもED-Aの存在が報告されている(Borsiら、1998)。従って、種々のタイプの腫瘍について報告されているED-Aの発現パターンは高度に変動的である。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Taylor, Arthritis Res 2002, 4 Suppl 3:S99-107.
【非特許文献2】Koch et al. Ann Rheum Dis 2003, 62 Suppl 2:ii60-67.
【非特許文献3】Balza et al. (1988), FEBS Lett., 228: 42-44.
【非特許文献4】Carnemolla et al. (1989), J. Cell. Biol., 108: 1139-1148.
【非特許文献5】Borsi et al. (1990), FEBS Lett., 261: 175-178.
【非特許文献6】Borsi et al. (1995), J. Biol.Chem., 270: 6243-6245.
【非特許文献7】ffrench-Constant (1995), Exp. Cell Res., 221, 261-271.
【非特許文献8】Hynes, R.O. (1990). Fibronectins (New York: Springer-Verlag).
【非特許文献9】Kaspar et al. (2006), Int. J. Cancer, 118, 1331-1339.
【非特許文献10】Jacobs et al. (2002), Hum. Pathol., 33, 29-38.
【非特許文献11】Matsumoto et al. (1999), Jpn. J. Cancer Res., 90, 320-325.
【非特許文献12】Oyama et al. (1989), J. Biol. Chem., 264, 10331-10334.
【非特許文献13】Tavian et al. (1994), Int. J. Cancer, 56, 820-825.
【非特許文献14】Borsi et al. (1987), J. Cell. Biol., 104, 595-600.
【非特許文献15】Heikinheimo et al. (1991), Virchows Arch. B Cell Pathol. Incl. Mol. Pathol., 61, 101-109.
【非特許文献16】Koukoulis et al. (1995), Ultrastruct. Pathol., 19, 37-43.
【非特許文献17】Koukoulis et al. (1993), J. Submicrosc. Cytol. Pathol., 25, 285-295.
【非特許文献18】Lohi et al. (1995), Int. J. Cancer, 63, 442-449.
【非特許文献19】Scarpino et al. (1999) J. Pathol. 188, 163-167.
【非特許文献20】Borsi et al. (1998), Exp. Cell Res., 240, 244-251.
【発明の概要】
【0009】
抗体を利用して生体活性薬物を血管形成部位に標的化送達することは、癌の治療のための魅力的な治療手法であるが、慢性炎症疾患についてはほとんど明らかとなっていない。本発明者は以前に、フィブロネクチンのED-Bドメイン、すなわち血管形成のマーカーが、乾癬の患者及び動物モデルにおける乾癬病巣において、並びに関節リウマチのコラーゲン誘導マウスモデルにおける関節炎の肢において発現されていることを証明している。放射性及び蛍光技法の両方を使用して、EDBに特異的なヒトモノクローナル抗体L19が、in vivoにおいて静脈内投与後に炎症部位に選択的に局在化することが見出された。これらの結果は、L19を利用した炎症部位への生体活性化合物の選択的送達のための治療法の候補であることを示唆している(Trachsel, 2007; PCT/EP2007/004044)。
【0010】
in-situハイブリダイゼーションによって、フィブロネクチンのED-B以外のもの、またED-Aドメインがヒト関節炎標本に存在する可能性があることが以前に示されている(Berndtら, 1998; Kriegsmannら, 2004)。
【0011】
本明細書において、抗EDA抗体、例えば本明細書に開示するF8抗体が、抗EDB抗体L19、並びに抗テネイシン-C抗体F16及びG11と比較して、ヒト関節炎標本に対して強い染色パターンを示すことができることを示す。
【0012】
さらに、放射性及び蛍光技法の両方を用いて、ED-Aに特異的なヒトモノクローナル抗体F8が、in vivoにおいて静脈内投与後に炎症部位に選択的に局在化することを見出した。
【0013】
従って、フィブロネクチンのED-Aは関節リウマチの血管マーカーとして適応である。
【0014】
フィブロネクチンのA-FN及び/又はED-Aに結合する抗体分子などの結合分子は、関節リウマチ(RA)の治療のための医薬の製造に用いることができる新規薬剤である。
【0015】
本発明は、関節リウマチの治療のための医薬の製造における、フィブロネクチンのエキストラドメイン-A(ED-A)アイソフォーム(A-FN)に結合する結合メンバー、例えば抗体分子の使用を提供する。また本発明は、関節リウマチの治療のための医薬の製造におけるフィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子の使用を提供する。
【0016】
本発明はさらに、関節リウマチの部位への、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー(例えば、抗体分子)にコンジュゲートされている分子を送達するための該結合メンバーの使用を提供する。また本発明は、関節リウマチの部位への、フィブロネクチンのED-Aに結合する結合メンバー(例えば、抗体分子)とコンジュゲートされている分子を送達するための該結合メンバーの使用を提供する。該結合メンバーは、そのような分子の送達のための医薬の製造のために用いることができる。
【0017】
本発明は、関節リウマチの診断における使用のための診断用製品の製造における、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子の使用を提供する。本発明はまた、関節リウマチの診断における使用のための診断用製品の製造における、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子の使用を提供する。
【0018】
本発明はさらに、ヒト又は動物において関節リウマチを検出又は診断する方法であって、
(a)該ヒト又は動物に、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を投与するステップ、及び
(b)該ヒト又は動物の体の関節リウマチ部位における該結合メンバーの存在又は非存在を決定するステップ、
を含み、関節リウマチ部位への該結合メンバーの局在化が、関節リウマチの存在を示す方法を提供する。
【0019】
本発明は、個体における関節リウマチの治療方法であって、該個体に、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子を含む治療上有効量の医薬を投与することを含む方法を提供する。本発明はまた、個体における関節リウマチの治療方法であって、該個体に、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を含む治療上有効量の医薬を投与することを含む方法を提供する。
【0020】
本発明は、個体における関節リウマチの治療方法であって、該個体に、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子を含む治療上有効量の医薬を投与することを含む方法に使用するための、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子を含む組成物を提供する。本発明はまた、個体における関節リウマチの治療方法であって、該個体に、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を含む治療上有効量の医薬を投与することを含む方法に使用するための、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を含む組成物を提供する。
【0021】
本発明は、ヒト又は動物において関節リウマチ部位の新生血管に分子を送達する方法であって、該ヒト又は動物に、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子を投与することを含み、該結合メンバーが該分子にコンジュゲートされている、上記方法を提供する。また本発明は、ヒト又は動物において関節リウマチ部位の新生血管に分子を送達する方法であって、該ヒト又は動物に、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を投与することを含み、該結合メンバーが該分子にコンジュゲートされている、上記方法を提供する。
【0022】
本発明において使用する結合メンバーは、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9、又はその変異体の1個以上の相補性決定領域(CDR)を含む、フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに結合する抗体とすることができる。好ましくは、本発明において使用する結合メンバーは、抗体B2、C5、D5、C8、F8、B7若しくはG9、又はその変異体の1個以上の相補性決定領域(CDR)を含む、フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに結合する抗体である。最も好ましくは、本発明において使用する結合メンバーは、抗体F8又はその変異体の1個以上の相補性決定領域(CDR)を含む、フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに結合する抗体である。
【0023】
本発明において使用する結合メンバーは、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9のH及び/若しくはL CDRのセット、又はH及び/若しくはL CDRの開示されたセット内に10個以下、例えば、1、2、3、4、若しくは5個のアミノ酸置換を有する、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9のH及び/若しくはL CDRのセットを含んでもよい。好ましくは、本発明において使用する結合メンバーは、H及び/若しくはL CDRの開示されたセット内に10個以下、例えば、1、2、3、4、若しくは5個のアミノ酸置換を有する、抗体B2、C5、D5、C8、F8、B7若しくはG9のH及び/若しくはL CDRのセットを含む。好ましくは、本発明において使用する結合メンバーは、H及び/若しくはL CDRの開示されたセット内に10個以下、例えば、1、2、3、4若しくは5個のアミノ酸置換を有する、抗体F8のH及び/若しくはL CDRのセットを含む。
【0024】
置換を、CDRのセット内の任意の残基で行うことができる可能性があり、CDR1、CDR2及び/又はCDR3内とすることができる。
【0025】
例えば、本発明において使用する結合メンバーは、本明細書に記載される1個以上のCDR、例えばCDR3と、場合によりCDR1及びCDR2をも含み、CDRのセットを形成してもよい。
【0026】
本発明において使用する結合メンバーはまた、抗体分子、例えばヒト抗体分子を含んでもよい。前記結合メンバーは通常、抗体VH及び/又はVLドメインを含む。結合メンバーのVHドメインも、本発明において使用するために提供される。それぞれのVH及びVLドメイン内には、相補性決定領域(「CDR」)と、フレームワーク領域(「FR」)がある。VHドメインは、HCDRのセットを含み、VLドメインはLCDRのセットを含む。抗体分子は、VH CDR1、CDR2及びCDR3並びにフレームワークを含む抗体VHドメインを含むことができる。あるいは、又はさらに、それはVL CDR1、CDR2及びCDR3並びにフレームワークを含む抗体VLドメインを含んでもよい。抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9のVH及びVLドメイン並びにCDRが本明細書に記載される。本明細書に開示される全てのVH及びVL配列、CDR配列、CDRのセット並びにHCDRのセット及びLCDRのセットは、本発明において使用する結合メンバーの実施形態である。本明細書に記載されるように、「CDRのセット」は、CDR1、CDR2及びCDR3を含む。かくして、HCDRのセットはHCDR1、HCDR2及びHCDR3を指し、LCDRのセットはLCDR1、LCDR2及びLCDR3を指す。特に指摘しない限り、「CDRのセット」はHCDR及びLCDRを含む。
【0027】
本発明において使用する結合メンバーは、相補性決定領域HCDR1、HCDR2及びHCDR3とフレームワークとを含む抗体VHドメインを含んでもよく、ここでHCDR1は配列番号3、23、33、43、53、63、73、83、93、103若しくは113であり、必要に応じて、HCDR2は配列番号4であり、及び/又はHCDR3は配列番号5である。好ましくは、HCDR1は配列番号23、33、43、53、73、83又は103である。最も好ましくは、HCDR1は配列番号83である。
【0028】
典型的には、VHドメインは、VLドメインと対形成して、抗体抗原結合部位を提供するが、以下でさらに考察するように、VH又はVLドメインのみを用いて抗原に結合させることができる。かくして、本発明において使用する結合メンバーは、相補性決定領域LCDR1、LCDR2及びLCDR3とフレームワークとを含む抗体VLドメインをさらに含んでもよく、ここでLCDR1は配列番号6、26、36、46、56、66、76、86、96、106若しくは116であり、必要に応じて、LCDR2は配列番号7であり、及び/又はLCDR3は配列番号8である。好ましくは、LCDR1は配列番号26、36、46、56、76、86又は106である。最も好ましくは、LCDR1は配列番号86である。
【0029】
本発明において使用する結合メンバーは、VHドメインとVLドメインを含む、フィブロネクチンのED-Aに対する単離された抗体分子であり、ここで、VHドメインはフレームワークと、相補性決定領域HCDR1、HCDR2及びHCDR3のセットとを含み、VLドメインは相補性決定領域LCDR1、LCDR2及びLCDR3とフレームワークとを含み、
HCDR1は配列番号3、23、33、43、53、63、73、83、93、103若しくは113のアミノ酸配列を有し、
HCDR2は配列番号4のアミノ酸配列を有し、
HCDR3は配列番号5のアミノ酸配列を有し、
LCDR1は配列番号6、26、36、46、56、66、76、86、96、106若しくは116のアミノ酸配列を有し、
LCDR2は配列番号7のアミノ酸配列を有し、
LCDR3は配列番号8のアミノ酸配列を有する。
【0030】
抗体の1個以上のCDR又はCDRのセットを、フレームワーク(例えば、ヒトフレームワーク)中に移植して、本発明における使用のための抗体分子を提供することができる。フレームワーク領域は、ヒト生殖系列遺伝子断片配列を含んでもよい。かくして、フレームワークを、生殖系列化することができ、ここで、該フレームワーク内の1個以上の残基を変化させて、最も類似するヒト生殖系列フレームワーク中の等価な位置の残基と一致させる。本発明において使用する結合メンバーは、ヒト生殖系列フレームワーク、例えばDP47中にHCDRのセットを含むVHドメインを有する単離された抗体分子であってもよい。通常、前記結合メンバーはまた、例えば、ヒト生殖系列フレームワーク中の、LCDRのセットを含むVLドメインを有する。VLドメインのヒト生殖系列フレームワークはDPK22であってよい。
【0031】
本発明において使用するVHドメインは、配列番号1、21、31、41、51、61、71、81、91、101又は111のアミノ酸配列を有してもよい。好ましくは、本発明において使用するVHドメインは、配列番号21、31、41、51、71、81又は101のアミノ酸配列を有する。最も好ましくは、本発明において使用するVHドメインは、配列番号81のアミノ酸配列を有する。本発明において使用するVLドメインは、配列番号2、22、32、42、52、62、72、82、92、102又は112のアミノ酸を有してもよい。好ましくは、本発明において使用するVLドメインは、配列番号22、32、42、52、72、82又は102のアミノ酸を有する。最も好ましくは、本発明において使用するVLドメインは、配列番号82のアミノ酸を有する。
【0032】
本発明において使用する結合メンバーは、ペプチドリンカーを介して連結されたVHドメインとVLドメインを含む一本鎖Fv(scFv)であってもよいし又はそれを含むものであってもよい。当業者であれば、リンカーの好適な長さ及び配列、例えば、少なくとも5又は10アミノ酸長から約15、20又は25アミノ酸長を選択することができる。リンカーは、アミノ酸配列GSSGG(配列番号28)を有するものであってもよい。scFvは、配列番号9のアミノ酸配列からなるか、又はそれを含んでもよい。
【0033】
一本鎖Fv(scFv)は、ミニイムノグロブリン又は小免疫タンパク質(SIP)、例えばLiら, 1997に記載されているもの内に含まれる。SIPは、ホモダイマーミニイムノグロブリン抗体分子を形成する、ヒトIgE分泌アイソフォームIgE-S2(εS2-CH4; Batistaら, 1996)のCH4ドメインと融合したscFv分子を含む。
【0034】
あるいは、本発明において使用する結合メンバーは、通常、非抗体タンパク質足場中に1個以上のCDR、例えばCDRのセットにより提供される、非抗体分子内の抗原結合部位を含んでもよい。非抗体及び抗体分子などの結合メンバーは、本明細書の他の箇所でより詳細に記載されている。
【0035】
本発明において使用する結合メンバーを、殺菌活性、細胞傷害性免疫抑制活性又は抗炎症活性を有する分子にコンジュゲートさせることができる。インターロイキン-10は、本発明において結合メンバーとコンジュゲートさせるための有利な分子であり、関節リウマチの治療に有用である。さらに、本発明において使用する結合メンバーを、放射性同位体、検出可能な標識又は光増感剤とコンジュゲートすることができる。
【0036】
本発明のこれらの態様及び他の態様を、以下でさらに詳細に説明する。
【図面の簡単な説明】
【0037】
【図1】血管形成のマーカーに対する抗体を用いたヒト関節炎標本の免疫組織化学の結果を示す。暗色の染色は、白矢印で描出されるように、抗原の強力な発現を示している。F8は本明細書で開示するED-Aに結合する抗体分子であり、L19はED-Bに結合する抗体分子(例えばPiniら 1998)であり、F16及びG11はそれぞれテネイシン-CドメインA1及びCに結合する抗体分子である(WO2006/050834号)。
【図2】フィブロネクチンのED-Aドメインに対するF8抗体分子を用いたヒト関節炎標本の免疫蛍光分析の結果を示す。白い染色は抗原の強力な発現を示す。
【図3】A:ヒトED-A(上の配列)とB:マウスED-A(下の配列)とのアラインメントを示す。星印はヒトED-AとマウスED-Aのアミノ酸が同一であるアミノ酸位置を示す。
【図4】A:抗ED-A抗体H1重鎖(VH)のヌクレオチド配列(配列番号12)を示す。抗ED-A抗体H1の重鎖CDR1のヌクレオチド配列に下線を付す。抗ED-A抗体H1の重鎖CDR2のヌクレオチド配列を、斜体かつ下線付きで示す。抗ED-A抗体H1の重鎖CDR3のヌクレオチド配列を、太字かつ下線付きで示す。B:抗ED-A抗体H1リンカー配列のヌクレオチド配列(配列番号14)を示す。C:抗ED-A抗体H1軽鎖(VL)のヌクレオチド配列(配列番号13)を示す。抗ED-A抗体H1の軽鎖CDR1のヌクレオチド配列に下線を付す。抗ED-A抗体H1の軽鎖CDR2のヌクレオチド配列を、斜体かつ下線付きで示す。抗ED-A抗体H1の軽鎖CDR3のヌクレオチド配列を、太字かつ下線付きで示す。
【図5】A:抗ED-A抗体H1重鎖(VH)のアミノ酸配列(配列番号1)を示す。抗ED-A抗体H1の重鎖CDR1のアミノ酸配列(配列番号3)に下線を付す。抗ED-A抗体H1の重鎖CDR2のアミノ酸配列(配列番号4)を、斜体かつ下線付きで示す。抗ED-A抗体H1の重鎖CDR3のアミノ酸配列(配列番号5)を、太字かつ下線付きで示す。B:抗ED-A抗体H1リンカー配列のアミノ酸配列(配列番号11)を示す。C:抗ED-A抗体H1軽鎖(VL)のアミノ酸配列(配列番号2)を示す。抗ED-A抗体H1の軽鎖CDR1のアミノ酸配列(配列番号6)に下線を付す。抗ED-A抗体H1の軽鎖CDR2のアミノ酸配列(配列番号7)を、斜体かつ下線付きで示す。抗ED-A抗体H1の軽鎖CDR3のアミノ酸配列(配列番号8)を、太字かつ下線付きで示す。
【図6】F8-IL10のコード配列を含む核酸構築物の配列を示す。構造は、HINDIII分泌配列F8(14aaリンカー)リンカー(SSSSG)3-IL10-Stop-NotIであり、以下の通りである:HINDIII制限部位は下線付きであり、分泌シグナルをコードする配列は斜体であり、F8 VHコード配列は、分泌シグナル配列の後の太字であり、14アミノ酸リンカーをコードする配列は小文字であり、F8 VLコード配列は、14アミノ酸リンカー配列の後の太字であり、リンカー(SSSSG)3配列は、斜体かつ下線付きのF8コード配列の後であり、IL-10コード配列は二重下線付きであり、続いて停止が小文字であり、その後に下線付きのNOTI制限部位である。
【図7】構造:VH-リンカー-VL-リンカー-IL-10の、リンカーを含む、抗体scFv(F8)IL-10コンジュゲートのアミノ酸配列を示す。VH及びVLドメインは太字であり、scFvリンカーは小文字であり、scFvとIL10の間のリンカーは小文字かつ斜体であり、IL-10配列は下線付きである。
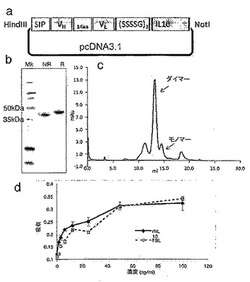
【図8】F8-IL10及びHyHel10-IL10のクローニング、発現及び精製を説明する。図8aは、F8-IL10融合タンパク質のエレメントを含有するpcDNA3.1ベクターの略図を示す。ヒトIL10部分は、15アミノ酸リンカー(SSSSG)3によりscFv抗体フラグメントのC末端と融合した。N末端における分泌配列は、組換えタンパク質の分泌に必要である。図8bは、精製された融合タンパク質のSDS-PAGE分析の結果を示す。レーン1:分子量マーカー;レーン2及び3:非還元条件下及び還元条件下におけるF8-IL10。モノマー融合タンパク質は分子量46kDaを有すると予想される。図8cは、精製されたF8-IL10のサイズ排除クロマトグラフィプロフィールを示す(Superdex 200)。13mlの保持容量におけるピーク溶出は、F8-IL10の非共有結合ホモダイマー形態に相当し、14mlの保持容量における小さなピーク溶出は、モノマー画分に相当する。図8dは、F8-IL10の活性アッセイの結果を示す。F8-IL10の活性を、MC/9細胞に対する組換えヒトIL10の活性と比較した。
【発明を実施するための形態】
【0038】
用語
フィブロネクチン
フィブロネクチンは、選択的スプライシングを受ける抗原であり、本明細書の他の箇所に記載されるように、フィブロネクチンのいくつかの代替的アイソフォームが公知である。エキストラドメインA(EDA又はED-A)はまた、ED、エキストラIII型リピートA(EIIIA)又はEDIとしても公知である。ヒトED-Aの配列は、Kornblihttら(1984)、Nucleic Acids Res. 12, 5853-5868及びPaolellaら(1988)、Nucleic Acids Res. 16, 3545-3557により公開されている。ヒトED-Aの配列は、アクセッション番号P02751で登録されたアミノ酸配列のアミノ酸1631〜1720(フィブロネクチンIII型12;エキストラドメイン2)としてSwissProtデータベース上でも入手可能である。マウスED-Aの配列は、アクセッション番号P11276で登録されたアミノ酸配列のアミノ酸1721〜1810(フィブロネクチンIII型13;エキストラドメイン2)としてSwissProtデータベース上で入手可能である。
【0039】
フィブロネクチンのED-Aアイソフォーム(A-FN)は、エキストラドメインA(ED-A)を含む。ヒトA-FNの配列は、アクセッション番号P02751でSwissProtデータベース上で入手可能である対応するヒトフィブロネクチン前駆体配列から推定することができる。マウスA-FNの配列は、アクセッション番号P11276でSwissProtデータベース上で入手可能である対応するマウスフィブロネクチン前駆体配列から推定することができる。A-FNは、フィブロネクチンのヒトED-Aアイソフォームであってもよい。ED-AはヒトフィブロネクチンのエキストラドメインAであってもよい。
【0040】
ED-Aは、選択的スプライシングによりフィブロネクチン(FN)中に挿入され、FNのドメイン11と12の間に位置する90アミノ酸の配列である(Borsiら、1987, J. Cell Biol., 104, 595-600)。ED-Aは主として、FNの血漿形態中には存在しないが、胚形成、組織再モデリング、線維症、心臓移植及び固形腫瘍増殖の間には豊富である。
【0041】
選択的スプライシング
選択的スプライシングとは、異なるmRNAを産生するDNAの一次RNA転写物のスプライシングの異なるパターンの出現を指す。イントロンの切り出し後、選択は、どのエクソンが一緒にスプライシングされてmRNAを形成するかを決定することができる。選択的スプライシングは、異なるエクソン及び/又は異なる数のエクソンを含む異なるアイソフォームの産生を誘導する。例えば、1個のアイソフォームは、1個以上のドメインを含んでもよい、1個以上のエクソンに対応する追加のアミノ酸配列を含んでもよい。
【0042】
結合メンバー
これは、互いに結合する一対の分子の一方のメンバーを説明するものである。結合対のメンバーは、天然由来であっても、又は全体的若しくは部分的に合成により作製されたものであってもよい。前記対の分子の一方のメンバーは、その表面上、又は空洞上に、前記対の分子の他方のメンバーの特定の空間構造及び極性構造に結合し、従ってそれと相補的である領域を有する。結合対の型の例は、抗原−抗体、ビオチン−アビジン、ホルモン−ホルモン受容体、受容体−リガンド、酵素−基質である。本発明は、抗原−抗体型反応に関する。
【0043】
結合メンバーは通常、抗原結合部位を有する分子を含む。例えば、結合メンバーは、抗原結合部位を含む抗体分子又は非抗体タンパク質であってよい。
【0044】
抗原結合部位を、フィブロネクチン若しくはシトクロムBなどの非抗体タンパク質足場上の相補性決定領域(CDR)の配置を用いて(Haan & Maggos, 2004; Koide 1998; Nygren 1997)、又はタンパク質足場内のループのアミノ酸残基を無作為化するか、若しくは突然変異させて、所望の標的に対する結合特異性を付与することにより、提供することができる。タンパク質中で新規結合部位を操作するための足場は、Nygrenら(1997)により詳細に概説されている。抗体模倣物質のためのタンパク質足場は、その全体が参照により本明細書に組み入れられるものとするWO 00/34784号に開示されており、発明者らは少なくとも1個の無作為化されたループを有するフィブロネクチンIII型ドメインを含むタンパク質(抗体模倣物質)を記載している。1個以上のCDR、例えばHCDRのセットを移植するのに好適な足場を、免疫グロブリン遺伝子スーパーファミリーの任意のドメインメンバーにより提供することができる。この足場はヒト又は非ヒトタンパク質であってよい。非抗体タンパク質足場の利点は、それが、少なくともいくつかの抗体分子よりも小さく、及び/又は製造が容易である足場分子中に抗原結合部位を提供することができることである。小さいサイズの結合メンバーは、細胞に進入する能力、組織中に深く浸透するか、若しくは他の構造内の標的に到達する能力、又は標的抗原のタンパク質空洞内に結合する能力などの有用な生理学的特性を付与することができる。非抗体タンパク質足場中での抗原結合部位の使用は、Wess, 2004に概説されている。安定な主鎖及び1個以上の可変ループを有するタンパク質が典型的であり、ループのアミノ酸配列を特異的若しくは無作為に突然変異させて、標的抗原に結合する抗原結合部位を作製する。そのようなタンパク質としては、黄色ブドウ球菌(S. aureus)由来プロテインAのIgG結合ドメイン、トランスフェリン、テトラネクチン、フィブロネクチン(例えば、第10フィブロネクチンIII型ドメイン)及びリポカリンが挙げられる。他の手法としては、分子内ジスルフィド結合を有する小タンパク質であるシクロチドに基づく合成「ミクロボディ」(Selecore GmbH)が挙げられる。
【0045】
抗体配列及び/又は抗原結合部位に加えて、本発明において使用する結合メンバーは、例えば、折り畳まれたドメインなどのペプチド若しくはポリペプチドを形成するか、又は抗原に結合する能力に加えて、該分子に別の機能的特性を与える他のアミノ酸を含んでもよい。本発明において使用する結合メンバーは検出可能な標識を担持してもよく、又は毒素若しくは標的化部分若しくは酵素にコンジュゲートさせることができる(例えば、ペプチド結合若しくはリンカーを介して)。例えば、結合メンバーは、触媒部位(例えば、酵素ドメイン中)及び抗原結合部位を含んでもよく、該抗原結合部位は該抗原に結合し、かくして、該触媒部位を該抗原に標的化する。触媒部位は、例えば切断により、抗原の生物学的機能を阻害することができる。
【0046】
注記されるように、CDRを非抗体足場により担持することができるが、CDR若しくはCDRのセットを担持させるための構造は、一般的にはCDR若しくはCDRのセットが、再配列された免疫グロブリン遺伝子によりコードされる天然のVH及びVL抗体可変ドメインのCDR若しくはCDRのセットに対応する位置に位置する抗体重鎖若しくは軽鎖配列又はその実質的な部分であろう。免疫グロブリン可変ドメインの構造及び位置を、Kabat 1987及び現在ではインターネット上(immuno.bme.nwu.edu又は任意の検索エンジンを用いて「Kabat」を検索する)で入手可能なそのアップデート版を参照することにより決定することができる。
【0047】
CDR領域又はCDRとは、Kabatら(1987)(Kabat 1991a、及びそれより後の版)により定義された免疫グロブリンの重鎖及び軽鎖の超可変領域を示すと意図される。抗体は、典型的には3個の重鎖CDRと3個の軽鎖CDRを含む。用語「CDR」は、本明細書では、必要に応じて、抗原若しくは抗体が認識するエピトープに対する抗体の親和性により、結合を担うアミノ酸残基の大部分を含むこれらの領域の1つ若しくはいくつか、又はこれらの領域の全部をも示すように用いられる。
【0048】
6個の短いCDR配列のうち、重鎖の3番目のCDR(HCDR3)は、より大きい程度の可変性を(それを生じる遺伝子の配置の機構に本質的に依存するより高い多様性)を有する。公知の最も長いサイズは26であるが、それは2アミノ酸の短さであってもよい。機能的には、HCDR3は抗体の特異性の決定において役割を果たしている(Segal 1974; Amit 1986; Chothia 1987; Chothia 1989; Caton 1990; Sharon 1990a; Sharon 1990b; Kabatら、1991b)。
【0049】
抗体分子
これは、天然に産生された、又は部分的若しくは全体的に合成により作製された免疫グロブリンを説明する。この用語はまた、抗体抗原結合部位を含む任意のポリペプチド又はタンパク質に関する。本発明は天然形態の抗体に関するものではない、すなわち、それらはその天然の環境にはないが、それらを天然の起源からの精製により単離若しくは取得するか、又は他に遺伝子組換え、若しくは化学的合成により取得することができたものであること、並びにその後、それらが、後に記載するように非天然アミノ酸を含んでもよいことを理解すべきである。抗体抗原結合部位を含む抗体フラグメントとしては、限定されるものではないが、Fab、Fab'、Fab'-SH、scFv、Fv、dAb、Fdなどの抗体分子;並びにダイアボディが挙げられる。
【0050】
モノクローナル抗体及び他の抗体を取得し、組換えDNA技術の技法を用いて、標的抗原に結合する他の抗体又はキメラ分子を作製することができる。そのような技術は、抗体の、免疫グロブリン可変領域、若しくはCDRをコードするDNAを、異なる免疫グロブリンの定常領域、若しくは定常領域+フレームワーク領域に導入することを含んでもよい。例えば、EP-A-184187、GB 2188638A又はEP-A-239400、及びその後の多数の文献を参照されたい。ハイブリドーマ又は抗体を産生する他の細胞を、産生される抗体の結合特異性を変化させてもさせなくてもよい遺伝子突然変異又は他の変化に供することができる。
【0051】
抗体を多くの方法で改変することができるため、用語「抗体分子」は、抗原に対する必要な特異性及び/又は結合を有する抗体抗原結合部位を有する任意の結合メンバー又は物質を包含すると解釈されるべきである。かくして、この用語は、天然のものであるか、又は全体的若しくは部分的に合成された、抗体抗原結合部位を含む任意のポリペプチドを含む、抗体フラグメント及び誘導体を包含する。従って、別のポリペプチド(例えば、別の種に由来するか、又は別の抗体クラス若しくはサブクラスに属するもの)に融合された、抗体抗原結合部位、又はその等価物を含むキメラ分子も含まれる。キメラ抗体のクローニング及び発現は、EP-A-0120694及びEP-A-0125023、並びにその後の多数の文献に記載されている。
【0052】
抗体工学の分野で利用可能なさらなる技術により、ヒト抗体及びヒト化抗体を単離することが可能になった。例えば、ヒトハイブリドーマを、Kontermann & Dubel (2001)により記載のように作製することができる。結合メンバーを作製するための別の確立された技術であるファージディスプレイは、WO 92/01047号(以下でさらに考察する)並びに米国特許第5,969,108号、第5,565,332号、第5,733,743号、第5,858,657号、第5,871,907号、第5,872,215号、第5,885,793号、第5,962,255号、第6,140,471号、第6,172,197号、第6,225,447号、第6,291,650号、第6,492,160号、第6,521,404号及びKontermann & Dubel (2001)などの多くの刊行物に詳細に記載されている。マウス免疫系の他の成分を無傷のままにしながら、マウス抗体遺伝子を不活化し、ヒト抗体遺伝子と機能的に置換するトランスジェニックマウスを、ヒト抗体を単離するために用いることができる(Mendez 1997)。
【0053】
例えば、Knappikら(2000)又はKrebsら(2001)により記載のように、好適な発現ベクター内で合成及び集合されたオリゴヌクレオチドを用いて作製された遺伝子からの発現により、合成抗体分子を作製することができる。
【0054】
全抗体のフラグメントは、抗原に結合する機能を実行することができることが示されている。結合フラグメントの例は、(i)VL、VH、CL及びCH1ドメインからなるFabフラグメント;(ii)VH及びCH1ドメインからなるFdフラグメント;(iii)単一抗体のVL及びVHドメインからなるFvフラグメント;(iv)VH若しくはVLドメインからなるdAbフラグメント(Ward 1989; McCafferty 1990; Holt 2003);(v)単離されたCDR領域;(vi)2個の連結されたFabフラグメントを含む二価フラグメントであるF(ab')2フラグメント;(vii)VHドメインとVLドメインが、2個のドメインが結合して抗原結合部位を形成するようにペプチドリンカーにより連結された一本鎖Fv分子(scFv)(Bird 1988; Huston 1988);(viii)二重特異性一本鎖Fvダイマー(PCT/US92/09965)、並びに(ix)遺伝子融合により構築された多価若しくは多重特異性フラグメントである「ダイアボディ」(WO 94/13804号; Holliger 1993a)である。Fv、scFv又はダイアボディ分子を、VH及びVLドメインを連結するジスルフィド架橋の組込みにより安定化することができる(Reiter 1996)。CH3ドメインに連結されたscFvを含むミニボディを作製することもできる(Hu 1996)。結合フラグメントの他の例は、抗体ヒンジ領域に由来する1個以上のシステインを含む、重鎖CH1ドメインのカルボキシル末端での数残基の付加によりFabフラグメントとは異なるFab'、並びに定常ドメインのシステイン残基が遊離チオール基を担持するFab'フラグメントである、Fab'-SHである。
【0055】
本発明において使用する抗体フラグメントは、ペプシン若しくはパパインなどの酵素による消化並びに/又は化学的還元によるジスルフィド架橋の切断などの方法により、本明細書に記載の抗体分子のいずれか、例えば、本明細書に記載の任意の抗体のVH及び/若しくはVLドメイン又はCDRを含む抗体分子から出発して取得することができる。別の方法では、本発明の抗体フラグメントは、同様に当業者に周知の遺伝子組換え技術により、又は他に例えば、Applied Biosystemsなどの企業により供給されるものなどの自動ペプチド合成装置を用いるペプチド合成により、又は核酸合成及び発現により取得することができる。
【0056】
本発明において機能的抗体フラグメントとしては、半減期が化学的修飾、特にPEG付加により、又はリポソーム中への組込みにより増加した、任意の機能的フラグメントが挙げられる。
【0057】
dAb(ドメイン抗体)は、抗体の小さいモノマー抗原結合フラグメント、すなわち、抗体重鎖又は軽鎖の可変領域である(Holt 2003)。VH dAbはラクダ科動物(例えば、ラクダ、ラマ)において天然に生じ、ラクダ科動物を標的抗原で免疫し、抗原特異的B細胞を単離し、個々のB細胞からdAb遺伝子を直接クローニングすることにより製造することができる。dAbは細胞培養物中でも製造可能である。その小さいサイズ、良好な溶解性及び温度安定性により、それらは特に生理学的に有用となり、選択及び親和性成熟にとって好適となる。本発明の結合メンバーは、実質的に本明細書に記載のVH若しくはVLドメイン、又は実質的に本明細書に記載のCDRのセットを含むVH若しくはVLドメインを含むdAbであってよい。
【0058】
本明細書で用いられる用語「実質的に記載の」とは、本明細書に記載の結合メンバーのVH若しくはVLドメインの関連するCDRの特徴が、該配列が本明細書に記載される特定の領域と同一であるか、又は高度に類似していることを意味する。1個以上の可変ドメインの特定の領域に関して、本明細書で用いられる用語「高度に類似する」は、1〜約5、例えば1〜4、例えば1〜3、又は1若しくは2、又は3若しくは4個のアミノ酸置換を、該CDR及び/又はVH若しくはVLドメイン中で行うことができると意図される。
【0059】
二重特異性又は二官能性抗体は、2個の異なる可変領域が同じ分子中で組み合わされた第2世代のモノクローナル抗体を形成する(Holliger 1999)。その使用は、新しいエフェクター機能を動員するか、又は腫瘍細胞の表面上のいくつかの分子を標的化する能力から、診断分野及び治療分野の両方において証明されてきた。二重特異性抗体を用いる場合、これらは様々な方法(Holliger 1993b)により製造する、例えば、化学的に調製するか、若しくはハイブリッドハイブリドーマから調製することができる従来の二重特異性抗体であってよく、又は上記の二重特異性抗体フラグメントのいずれかであってよい。これらの抗体を、化学的方法(Glennie 1987; Repp 1995)又は体細胞法(Staerz 1986; Suresh 1986)により取得することができるが、同様にヘテロダイマー化を強制し、かくして求められる抗体の精製プロセスを容易にする遺伝子操作技術(Merchand 1998)により取得することもできる。二重特異性抗体の例としては、異なる特異性を有する2個の抗体の結合ドメインを使用し、短い可撓性ペプチドを介して直接連結することができるBiTETM技術のものが挙げられる。これは短い単一のポリペプチド鎖上で2個の抗体を結合させるものである。ダイアボディ及びscFvを、Fc領域を用いずに、可変ドメインのみを用いて構築し、抗イディオタイプ反応の効果を潜在的に低下させることができる。
【0060】
二重特異性抗体を、完全なIgG、二重特異性Fab'2、Fab'PEG、ダイアボディ又は他に二重特異性scFvとして構築することができる。さらに、2個の二重特異性抗体を、当業界で公知の慣用の方法を用いて連結して、四価抗体を形成することができる。
【0061】
二重特異性全抗体とは反対に、二重特異性ダイアボディは、容易に構築し、大腸菌中で発現させることができるため、特に有用でもある。好適な結合特異性のダイアボディ(及び抗体フラグメントなどの多くの他のポリペプチド)を、ライブラリーからファージディスプレイ(WO 94/13804号)を用いて容易に選択することができる。ダイアボディの一方のアームを、例えば、標的抗原に対する特異性と共に一定に保持しようとする場合、他方のアームを変化させたライブラリーを作製し、好適な特異性の抗体を選択することができる。二重特異性全抗体を、Ridgeway 1996に記載の選択的遺伝子操作方法により作製することができる。
【0062】
標的抗原に対する抗体を取得するための様々な方法が当業界で利用可能である。前記抗体は、特にヒト、マウス、キメラ又はヒト化起源のモノクローナル抗体であってよく、当業者に周知の標準的な方法に従って取得することができる。
【0063】
一般的には、特にマウス起源のモノクローナル抗体又はその機能的フラグメントの調製のためには、特に、入門書「Antibodies」(Harlow及びLane 1988)に記載された技術、又はKohler及びMilstein, 1975により記載されたハイブリドーマからの調製の技術を参照することができる。
【0064】
モノクローナル抗体は、例えば、A-FN、又は前記モノクローナル抗体により認識されるエピトープを含むその断片の1つ、例えばED-A若しくはED-Aのペプチド断片を含む又はそれからなる断片に対して免疫された動物細胞から取得することができる。A-FN、又はその断片の1つを、特にA-FN若しくはその断片をコードするcDNA配列に含まれる核酸配列から開始する遺伝子組換えにより、A-FN及び/若しくはその断片のペプチド配列に含まれるアミノ酸の配列から開始するペプチド合成により、通常の作業方法に従って製造することができる。
【0065】
モノクローナル抗体は、例えば、A-FN又は該モノクローナル抗体により認識されるエピトープを含むその断片の1つ、例えばED-A若しくはED-Aのペプチド断片を含む又はそれからなる断片が予め固定されたアフィニティカラム上で精製することができる。モノクローナル抗体は、プロテインA及び/若しくはGを用いたクロマトグラフィー、次いで、必要に応じて、それ自身の中の、残留タンパク質夾雑物並びにDNA及びLPSを排除することを目的とするイオン交換クロマトグラフィー、次いで、必要に応じて、ダイマー若しくは他のマルチマーの存在に起因する潜在的な凝集物を排除するためのセファロースゲルを用いた排除クロマトグラフィーにより、精製することができる。これらの技術の全部を、同時に又は連続的に用いることができる。
【0066】
抗原結合部位
これは標的抗原の全部又は一部に結合し、かつこれと相補的である分子の部分を説明する。抗体分子中では、これを抗体抗原結合部位と呼び、標的抗原の全部又は一部に結合し、かつこれと相補的である抗体の部分を含む。抗原が大きい場合、抗体は該抗原の特定の部分にのみ結合することができ、その部分をエピトープと呼ぶ。抗体抗原結合部位を、1個以上の抗体可変ドメインにより提供することができる。抗体抗原結合部位は、抗体軽鎖可変領域(VL)と抗体重鎖可変領域(VH)を含んでもよい。
【0067】
単離された
これは、本発明において使用する結合メンバー又はそのような結合メンバーをコードする核酸が、一般的には本発明に係るものである状態を指す。かくして、本発明の結合メンバー、VH及び/又はVLドメインを、例えば、その天然の環境から、実質的に純粋な、若しくは均質な形態で、又は核酸の場合、必要な機能を有するポリペプチドをコードする配列以外の起源の核酸若しくは遺伝子を含まないか若しくは実質的に含まない状態で、単離及び/又は精製して提供することができる。単離されたメンバー及び単離された核酸は、それらがその天然の環境中に、又は調製がin vitro若しくはin vivoで実行される組換えDNA技術による場合、それらが調製される環境(例えば、細胞培養物)中に、見とめられる他のポリペプチド若しくは核酸などの、それらが天然に結合する材料を含まないか、又は実質的に含まないであろう。メンバー及び核酸を、希釈剤若しくはアジュバントと共に製剤化し、さらなる実用的な目的のために、単離することができる。例えば、前記メンバーを、イムノアッセイにおける使用のためにマイクロタイタープレートをコーティングするのに用いる場合には、通常はゼラチン若しくは他の担体と混合し、あるいは診断若しくは治療において用いる場合には、製薬上許容し得る担体若しくは希釈剤と混合することができる。結合メンバーを、天然に、若しくは異種真核細胞の系(例えば、CHO若しくはNS0(ECACC 85110503)細胞)によりグリコシル化するか、又はそれらを非グリコシル化(例えば、原核細胞中での発現により製造する場合)することができる。
【0068】
抗体分子を含む異種調製物も本発明において使用することができる。例えば、そのような調製物は、様々な程度の糖鎖付加及び/又はピログルタミン酸残基を形成するN末端グルタミン酸の環化などの誘導体化されたアミノ酸を有する、完全長重鎖及びC末端リジンを欠く重鎖を有する抗体の混合物であってもよい。
【0069】
抗原、例えば、フィブロネクチンのA-FN又はED-Aのための1個以上の結合メンバーは、本発明に係る結合メンバーのライブラリーと、該抗原又はその断片、例えば、ED-A若しくはED-Aのペプチド断片を含む又はそれからなる断片とを接触させ、該抗原に結合することができるライブラリーの1個以上の結合メンバーを選択することにより取得することができる。
【0070】
抗体ライブラリーを、反復コロニーフィルタースクリーニング(Iterative Colony Filter Screening (ICFS))を用いてスクリーニングすることができる。ICFSにおいては、いくつかの結合特異性をコードするDNAを含む細菌を液体培地中で増殖させ、指数増殖期に到達したら、それらのうちの数十億個を、好適に予備処理された膜フィルターからなる増殖支持体上に分布させ、完全にコンフルエントの細菌コロニーが出現するまでインキュベートする。第2のトラップ基板は、予め加湿され、所望の抗原で被覆された別の膜フィルターからなる。
【0071】
次いで、このトラップ膜フィルターを、好適な培養培地を含むプレート上に置き、上を指している細菌コロニーで被覆された表面を有する増殖フィルターで被覆する。かくして得られたサンドイッチを、室温で約16時間インキュベートする。かくして、トラップ膜上に存在する抗原と特異的に結合する、拡散作用を有する抗体フラグメントscFvがトラップされるため、それらをコードする遺伝子の発現を得ることができる。次いで、トラップ膜を、この目的に一般的に用いられる比色分析技術を用いて、結合した抗体フラグメントscFvを指摘するために処理する。
【0072】
トラップフィルター上の着色スポットの位置により、増殖膜上に存在し、トラップされた抗体フラグメントを産生した対応する細菌コロニーに戻すことができる。そのようなコロニーを収穫し、増殖させて、200〜300万個の細菌を新しい培養膜上に分布させ、上記手順を繰り返す。次いで、トラップ膜上の陽性シグナルが、それぞれ、選択に用いられる抗原に対するモノクローナル抗体フラグメントの起源となる可能性がある、1個の陽性コロニーに一致するまで、同様のサイクルを実行する。ICFSは、例えば、参照により本明細書に組み入れられるものとするWO0246455号に記載されている。また、ライブラリーを、粒子若しくは分子複合体、例えばバクテリオファージ(例えば、T7)粒子などの複製可能な遺伝子パッケージ、又はそれぞれの粒子若しくは分子複合体が、その上にディスプレイされる抗体VH可変ドメイン、及び必要に応じて、存在する場合、ディスプレイされるVLドメインをもコードする核酸を含む他のin vitroディスプレイ系上にディスプレイさせることができる。ファージディスプレイは、WO 92/01047号、並びに米国特許第5,969,108号、第5,565,332号、第5,733,743号、第5,858,657号、第5,871,907号、第5,872,215号、第5,885,793号、第5,962,255号、第6,140,471号、第6,172,197号、第6,225,447号、第6,291,650号、第6,492,160号及び第6,521,404号に記載されており、それぞれその全体が参照により本明細書に組み入れられるものとする。
【0073】
抗原に結合することができ、バクテリオファージ又は他のライブラリー粒子若しくは分子複合体上にディスプレイされた結合メンバーの選択後、その選択された結合メンバーをディスプレイするバクテリオファージ又は他の粒子若しくは分子複合体から核酸を取得することができる。前記選択された結合メンバーをディスプレイするバクテリオファージ又は他の粒子若しくは分子複合体から取得された核酸の配列を有する核酸からの発現により、結合メンバー又は抗体VH若しくはVL可変ドメインのその後の製造において、そのような核酸を用いることができる。
【0074】
前記選択された結合メンバーの抗体VH可変ドメインのアミノ酸配列を有する抗体VH可変ドメインを、単離された形態で提供することができ、同様にそのようなVHドメインを含む結合メンバーも提供することができる。
【0075】
フィブロネクチンのA-FN若しくはED-A又は他の標的抗原若しくはアイソフォームに結合する能力、例えば、A-FN又はA-FNの断片、例えばフィブロネクチンのED-Aへの結合について抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9のいずれか1個と競合する能力を、さらに試験することができる。
【0076】
本発明において使用する結合メンバーは、フィブロネクチンのA-FN及び/又はED-Aに特異的に結合することができる。本発明の結合メンバーは、例えば、scFv形式の抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9と同じ親和性で、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。本発明において使用する結合メンバーは、3×10-8 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。好ましくは、本発明において使用する結合メンバーは、2×10-8 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。より好ましくは、本発明において使用する結合メンバーは、1.7×10-8 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。さらにより好ましくは、本発明において使用する結合メンバーは、1.4×10-8 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。最も好ましくは、本発明において使用する結合メンバーは、3×10-9 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。
【0077】
本発明の結合メンバーは、抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9と、フィブロネクチンのA-FN及び/又はED-A上の同じエピトープに結合することができる。
【0078】
本発明において使用する結合メンバーは、フィブロネクチンのA-FN及び/又はED-A以外の分子への有意な結合を示さなくてもよい。特に、該結合メンバーはフィブロネクチンの他のアイソフォーム、例えばフィブロネクチンのED-Bアイソフォーム及び/又はIIICSアイソフォームに結合しなくてもよい。
【0079】
本明細書で開示される抗体分子の変異体を作製し、本発明において用いることができる。CDR、抗体VH若しくはVLドメイン及び結合メンバーのアミノ酸配列内に置換を作製するのに必要な技術は、一般的には、当業界で利用可能である。活性に対する最小の若しくは有益な効果を有すると予測される又はされない置換を有する変異体配列を作製し、フィブロネクチンのA-FN及び/若しくはED-Aに結合する能力について、並びに/又は任意の他の所望の特性について試験することができる。
【0080】
その配列が本明細書に具体的に開示されたVH及びVLドメインのいずれかの可変ドメインアミノ酸配列変異体を、考察されるように、本発明において用いることができる。特定の変異体は、1個以上のアミノ酸配列変化(アミノ酸残基の付加、欠失、置換及び/若しくは挿入)を含んでもよく、それは約20個以下の変化、約15個以下の変化、約10個以下の変化又は約5個以下の変化であってもよく、5、4、3、2又は1個の変化であってもよい。変化を、1個以上のフレームワーク領域及び/又は1個以上のCDR中で作製することができる。この変化は通常、機能の喪失をもたらさず、かくして変化したアミノ酸配列を含む結合メンバーはフィブロネクチンのA-FN及び/又はED-Aに結合する能力を保持することができる。それは、例えば、本明細書に記載のアッセイにおいて測定した場合に、変化が作製されていない結合メンバーと同じ定量的結合を保持することができる。かくして変化したアミノ酸配列を含む結合メンバーは、フィブロネクチンのA-FN及び/又はED-Aに結合する改善された能力を有し得る。
【0081】
本発明において使用するためのCDR由来配列を担持する新規VH又はVL領域を、1個以上の選択されたVH及び/又はVL遺伝子の無作為突然変異誘発を用いて作製して、可変ドメイン全体内に突然変異を作製することができる。いくつかの実施形態においては、1又は2個のアミノ酸置換を、可変ドメイン全体又はCDRのセット内に作製する。用いることができる別の方法は、VH又はVL遺伝子のCDR領域に対して突然変異誘発を指令することである。
【0082】
上記のように、本明細書に実質的に記載されたCDRアミノ酸配列を、ヒト抗体可変ドメイン又はその実質的な部分中にCDRとして担持させることができる。本明細書に実質的に記載されたHCDR3配列は、本発明の実施形態であり、例えば、これらの各々を、ヒト重鎖可変ドメイン又はその実質的な部分中にHCDR3として担持させることができる。
【0083】
本発明において用いられる可変ドメインは、任意の生殖系列若しくは再配列されたヒト可変ドメインから取得若しくは誘導することができるか、又はそれらは公知のヒト可変ドメインの共通配列若しくは実際の配列に基づく合成可変ドメインであってもよい。可変ドメインを、非ヒト抗体から誘導することができる。本発明において使用するためのCDR配列(例えば、CDR3)を、組換えDNA技術を用いて、CDR(例えば、CDR3)を欠く可変ドメインのレパートリー中に導入することができる。例えば、Marksら(1992)は、可変ドメイン領域の5'末端に対する若しくはそれに隣接する共通プライマーを、ヒトVH遺伝子の第3のフレームワーク領域に対する共通プライマーと共に用いて、CDR3を欠くVH可変ドメインのレパートリーを提供する、抗体可変ドメインのレパートリーを製造する方法を記載している。Marksらはさらに、このレパートリーを特定の抗体のCDR3と結合させる方法を記載している。同様の技術を用いて、本発明のCDR3由来配列を、CDR3を欠くVH若しくはVLドメインのレパートリーを用いてシャッフルし、シャッフルされた完全なVH若しくはVLドメインを、同族のVL若しくはVHドメインと結合させて、本発明において使用する結合メンバーを提供することができる。次いで、このレパートリーを、WO 92/01047号(その全体が参照により本明細書に組み入れられるものとする)、又はKay, Winter & McCafferty (1996)などのその後の多数の文献に記載のファージディスプレイ系などの好適な宿主系においてディスプレイし、好適な結合メンバーを選択することができる。レパートリーは、104個以上の任意の数のメンバー、例えば、少なくとも105個、少なくとも106個、少なくとも107個、少なくとも108個、少なくとも109個又は少なくとも1010個のメンバーからなっていてもよい。
【0084】
同様に、1種以上の、又は3種全部のCDRを、VH又はVLドメインのレパートリー中に移植した後、フィブロネクチンのA-FN及び/又はED-Aに対する結合メンバーについてスクリーニングすることができる。
【0085】
抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9の1種以上のHCDR1、HCDR2及びHCDR3、又はHCDRのセットを用いることができ、並びに/あるいは抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9の1種以上のX LCDR1、LCDR2及びLCDR3又は抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9のLCDRのセットを用いることができる。
【0086】
同様に、本明細書に開示された他のVH及びVLドメイン、CDRのセット並びにHCDRのセット及び/若しくはLCDRのセットを用いることができる。
【0087】
フィブロネクチンのA-FN及び/又はED-Aは、関節リウマチの治療のための医薬の製造における使用のために、結合メンバー、例えば抗体分子についてのスクリーニングにおいて用いることができる。このスクリーニングは、本明細書の他箇所に開示されたレパートリーのスクリーニングであってもよい。
【0088】
免疫グロブリン可変ドメインの実質的部分は、その介在フレームワーク領域と共に、少なくとも3個のCDR領域を含みうる。この部分はまた、第1及び第4のフレームワーク領域のいずれか若しくは両方の少なくとも約50%を含み、その50%は第1のフレームワーク領域のC末端の50%及び第4のフレームワーク領域のN末端の50%である。前記可変ドメインの実質的部分のN末端若しくはC末端のさらなる残基は、通常は天然の可変ドメイン領域と結合しないものであってよい。例えば、組換えDNA技術により作製された本発明の結合メンバーの構築は、クローニング又は他の遺伝子操作ステップを容易にするために導入されるリンカーによりコードされるN若しくはC末端残基の導入をもたらし得る。他の遺伝子操作ステップは、本発明の他箇所で開示された可変ドメインを、他のタンパク質配列、例えば抗体定常領域、他の可変ドメイン(例えば、ダイアボディの製造における)又は本明細書の他の箇所でより詳細に考察される検出可能/機能的標識などに連結するためのリンカーの導入を含む。
【0089】
結合メンバーは一対のVH及びVLドメインを含むことができるが、VH若しくはVLドメイン配列のいずれかに基づく単一結合ドメインもまた本発明において使用することができる。単一の免疫グロブリンドメイン、特にVHドメインは、特異的に標的抗原に結合することができることが知られている。例えば、上記のdAbの考察を参照されたい。
【0090】
いずれかの単一結合ドメインの場合、これらのドメインを用いて、フィブロネクチンのA-FN及び/又はED-Aに結合することができる2ドメインの結合メンバーを形成することができる相補的ドメインについてスクリーニングすることができる。H若しくはL鎖クローンのいずれかを含む個々のコロニーを用いて、他方の鎖(L若しくはH)をコードするクローンの完全なライブラリーを感染させ、得られる2鎖結合メンバーを、その参考文献に記載のものなどのファージディスプレイ技術に従って選択する、WO 92/01047号(その全体が参照により本明細書に組み入れられるものとする)に開示されたいわゆる階層的二重コンビナトリアル手法を用いるファージディスプレイスクリーニング方法により、これを達成することができる。この技術もMarks 1992に開示されている。
【0091】
本発明において使用する結合メンバーはさらに、抗体定常領域又はその一部、例えば、ヒト抗体定常領域又はその一部を含んでもよい。例えば、VLドメインを、そのC末端で、ヒトCκ若しくはCλ鎖、例えばCλなどの抗体軽鎖定常ドメインに結合させることができる。同様に、VHドメインに基づく結合メンバーを、そのC末端で、任意の抗体アイソタイプ、例えばIgG、IgA、IgE及びIgM並びに任意のアイソタイプサブクラス、特にIgG1及びIgG4から誘導された免疫グロブリン重鎖の全部又は一部(例えば、CH1ドメイン)に結合させることができる。これらの特性を有し、可変領域を安定化させる任意の合成的又は他の定常領域変異体も、本発明の実施形態において有用である。
【0092】
本発明において使用する結合メンバーを、検出可能な、又は機能的な標識を用いて標識することができる。標識は、限定されるものではないが、蛍光、放射性標識、酵素、化学発光若しくは光感作物質などのシグナルを生成するか、又は生成するように誘導することができる任意の分子であってよい。かくして、結合は、蛍光若しくは発光、放射活性、酵素活性又は光吸収を検出することにより検出及び/又は測定することができる。検出可能な標識は、当業界で公知の慣用の化学を用いて、本発明において使用するための抗体に結合させることができる。
【0093】
標識が外部的手段、例えば視覚的試験、電磁気放射、熱、及び化学試薬により検出可能なシグナルを生成することができる多くの方法が存在する。また、標識を、本発明において使用するための抗体に結合する別の結合メンバー、又は支持体に結合させることもできる。
【0094】
標識された結合メンバー、例えば、検出可能な標識で標識されたscFvを、in vivo、ex vivo若しくはin vitroで診断的に、及び/又は治療的に用いることができる。
【0095】
例えば、放射性標識された結合メンバー(例えば、放射性同位体に結合させた結合メンバー)を、放射性診断及び放射線療法において用いることができる。本発明において使用する結合メンバーにコンジュゲートさせることができる放射性同位体としては、94mTc、99mTc、186Re、188Re、203Pb、67Ga、68Ga、47Sc、111In、97Ru、62Cu、64Cu、86Y、88Y、90Y、121Sn、161Tb、153Sm、166Ho、105Rh、177Lu、123I、124I、125Iおよび131Iなどの同位体が挙げられる。
【0096】
例えば、検出可能な標識で標識された、本発明において使用する結合メンバーを用いて、ヒト又は動物における関節リウマチを検出、診断又はモニターすることができる。
【0097】
本発明の結合メンバーは、関節リウマチを診断するのに用いるための診断用製品の製造に用いることができる。
【0098】
本発明は、ヒト又は動物において関節リウマチを検出又は診断する方法であって、以下のステップ:
(a)該ヒト又は動物に、例えば、フィブロネクチンのED-Aアイソフォーム及び/若しくはフィブロネクチンのED-Aに結合する、検出可能な標識で標識された、本発明の結合メンバーを投与するステップ、並びに
(b)該ヒト又は動物の体の新生血管における該結合メンバーの存在又は非存在を決定するステップ、
を含み、ヒト又は動物の新生血管への該結合メンバーの局在化が、関節リウマチの存在を示す、前記方法を提供する。
【0099】
前記結合メンバーを検出可能な標識で標識する場合、検出可能な標識の存在又は非存在を、該標識を検出することにより決定することができる。
【0100】
本発明において使用する結合メンバーと、病変中の標的細胞上で殺菌活性、細胞傷害性免疫抑制活性若しくは抗炎症活性を示す分子との間のコンジュゲート又は融合物、並びにそのような病変中に存在する細胞外マトリックス成分に対する抗体を本発明において用いることができる。例えば、コンジュゲートされる分子は、特にインターロイキン-10、抗炎症剤若しくは他の薬剤、光増感剤、又は放射性核種とすることができる。そのようなコンジュゲートは、治療的に、例えば、本明細書で言及される関節リウマチの治療に用いることができる。
【0101】
結合メンバーと、殺菌性又は細胞傷害性分子との融合物又はコンジュゲートの製造及び使用は、例えば、参照により本明細書に組み入れられるものとするWO 01/62298号に記載されている。
【0102】
本発明は、関節リウマチの治療方法であって、本発明において使用する結合メンバーを含む治療上有効量の医薬を個体に投与することを含む方法を提供する。
【0103】
この結合メンバーは、(i)細胞相互作用により標的細胞に対して抗炎症作用を示す分子、抗炎症性分子、IL-10、TGFβ又は他の薬剤と、(ii)フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに対する結合メンバーとのコンジュゲートであってよい。
【0104】
この結合メンバーは、(i)免疫抑制作用又は抗炎症作用を示す分子と、(ii)フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに対する結合メンバーとのコンジュゲートであってよい。
【0105】
この結合メンバーは、(i)インターロイキン-10(IL10)又はTGFβと、(ii)フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに対する結合メンバーとのコンジュゲートであってよい。そのような結合メンバーは、本明細書で開示する、関節リウマチの治療に関する本発明の態様において有用である。
【0106】
本発明は、関節リウマチの治療のための医薬の製造のための本発明において使用する結合メンバーの使用を提供する。
【0107】
この結合メンバーは、本明細書に記載のような殺菌作用、細胞傷害作用、免疫抑制作用又は抗炎症作用を示す分子にコンジュゲート又は融合されたものであってよい。結合メンバーは、(i)細胞相互作用により標的細胞に対して殺菌作用若しくは細胞傷害作用を示す、又は免疫抑制作用若しくは抗炎症作用を示す分子と、(ii)本発明に係るヒトフィブロネクチンに対する結合メンバーとのコンジュゲートであってよい。
【0108】
また本明細書において、(i)細胞相互作用により標的細胞に対して殺菌作用若しくは細胞傷害作用を示す、又は免疫抑制作用若しくは抗炎症作用を示す分子と、(ii)本発明において使用するヒトフィブロネクチンに対する結合メンバーとのコンジュゲートを記載する。そのようなコンジュゲートは、殺菌性、細胞傷害性、免疫抑制性若しくは抗炎症性分子と、前記結合メンバーとを含む融合タンパク質、又は、結合メンバーが2鎖若しくは多鎖である場合、殺菌性、細胞傷害性、免疫抑制性若しくは抗炎症性分子と、前記結合メンバーのポリペプチド鎖成分とを含む融合タンパク質を含むのが好ましい。好ましくは、前記結合メンバーは、一本鎖ポリペプチド、例えば、scFvなどの一本鎖抗体分子である。
【0109】
免疫抑制性若しくは抗炎症性分子と、一本鎖Fv抗体分子とを含む融合タンパク質を本発明において使用することができる。
【0110】
細胞相互作用により標的細胞に対して免疫抑制作用若しくは抗炎症作用を示す分子は、標的細胞と直接相互作用してもよく、標的細胞上の膜結合受容体と相互作用してもよいし、又は細胞膜の電気化学ポテンシャルを摂動させてもよい。例示的な好ましい実施形態においては、前記分子は、IL-10である。
【0111】
以下にさらに考察されるように、特異的結合メンバーは、好ましくは抗体であるか、又は抗体抗原結合部位を含む。都合がよいことに、特異的結合メンバーは、一本鎖抗体などの一本鎖ポリペプチドであってよい。これにより、一本鎖抗体と免疫抑制性若しくは抗炎症性分子(例えば、インターロイキン-10若しくはTGFβ)とを含む融合タンパク質の都合のよい製造が可能になる。抗体抗原結合部位は、別々のポリペプチド中、例えば、完全な抗体中又はFab若しくはダイアボディなどの抗体フラグメント中での抗体VHドメインと抗体VLドメインとの結合により提供する。特異的結合メンバーが2鎖又は多鎖分子(例えば、それぞれ、Fab若しくは全抗体)である場合、免疫抑制性若しくは抗炎症性分子は、特異的結合メンバー中の1個以上のポリペプチド鎖との融合ポリペプチドとしてコンジュゲートさせることができる。
【0112】
結合メンバーを、ペプチド結合により、すなわち、免疫抑制性若しくは抗炎症性分子と、該特異的結合メンバー若しくはそのポリペプチド鎖成分とを含む融合ポリペプチド内で、コンジュゲートさせることができる(例えばTrachselら参照)。コンジュゲーションのための他の手段としては、化学的コンジュゲーション、特に、二官能性試薬を用いる架橋(例えば、DOUBLE-REAGENTSTM Cross-linking Reagents Selection Guide, Pierceを用いる)が挙げられる。
【0113】
また本明細書では、本発明において使用する結合メンバーをコードする単離された核酸を記載する。核酸はDNA及び/又はRNAを含んでもよい。核酸は、上記で定義されたCDR若しくはCDRのセット又はVHドメイン若しくはVLドメイン又は抗体抗原結合部位若しくは抗体分子、例えばscFv若しくはIgG、例えば、IgG1をコードする。ヌクレオチド配列は、本明細書に開示されるVH及び/又はVLドメインをコードする。
【0114】
さらに本明細書において、上記の少なくとも1個のポリヌクレオチドを含む、プラスミド、ベクター、転写物又は発現カセットの形態の構築物を記載する。
【0115】
上記の1個以上の構築物を含む組換え宿主細胞もまた記載する。提供される任意のCDR若しくはCDRのセット又はVHドメイン若しくはVLドメイン又は抗体抗原結合部位若しくは抗体分子、例えば、scFv若しくはIgG1若しくはIgG4をコードする核酸は、コードする核酸からの発現を含む、コードされた産物の産生方法と同様に記載する。好適な条件下で、前記核酸を含む組換え宿主細胞を培養することにより、発現を都合良く達成することができる。発現による産生後、VH若しくはVLドメイン、又は結合メンバーを、任意の好適な技術を用いて単離及び/又は精製した後、必要に応じて用いることができる。
【0116】
核酸は、DNA又はRNAを含んでもよく、全体的又は部分的に合成されたものであってもよい。本明細書に記載のヌクレオチド配列に対する参照は、特定の配列を有するDNA分子を包含し、また、その状況が別途必要としない限り、TがUに置換された特定の配列を有するRNA分子も包含する。
【0117】
コードする核酸からの発現を引き起こすことを含む、抗体VH可変ドメインの製造方法もまた記載する。そのような方法は、前記抗体VH可変ドメインの製造のための条件下で宿主細胞を培養することを含んでもよい。
【0118】
製造方法は、前記産物の単離及び/又は精製のステップを含んでもよい。製造方法は、前記産物を、製薬上許容し得る賦形剤などの少なくとも1種の追加成分を含む組成物に製剤化することを含んでもよい。
【0119】
様々な宿主細胞中でのポリペプチドのクローニング及び発現のための系がよく知られている。好適な宿主細胞としては、細菌、哺乳動物細胞、植物細胞、繊維性菌類、酵母及びバキュロウイルス系並びにトランスジェニック植物及び動物が挙げられる。原核細胞中での抗体及び抗体フラグメントの発現は、当業界でよく確立されている。総論については、例えば、Pluckthun 1991を参照されたい。一般的な細菌宿主は大腸菌である。
【0120】
培養中の真核細胞中での発現も、例えば、Chadd & Chamow (2001)、Anderson & Krummen (2002)、Larrick & Thomas (2001)など、結合メンバーの製造のためのオプションとして当業者には利用可能である。異種ポリペプチドの発現のために当業界で利用可能な哺乳動物細胞系としては、チャイニーズハムスター卵巣(CHO)細胞、HeLa細胞、ベビーハムスター腎細胞、NS0マウスメラノーマ細胞、YB2/0ラットミエローマ細胞、ヒト胚性腎細胞、ヒト胚性網膜細胞及び他の多くの細胞が挙げられる。
【0121】
プロモーター配列、ターミネーター配列、ポリアデニル化配列、エンハンサー配列、マーカー遺伝子及び好適な他の配列などの好適な調節配列を含む好適なベクターを選択又は構築することができる。ベクターは、必要に応じて、プラスミド、例えばファージミド、又はウイルス、例えば「ファージ」であってよい。さらなる詳細については、例えば、Sambrook & Russell (2001)を参照されたい。例えば、核酸構築物の調製、突然変異誘発、配列決定、DNAの細胞中への導入及び遺伝子発現における核酸の操作、並びにタンパク質の分析のための多くの公知の技術及びプロトコルが、Ausubel 1999に詳細に記載されている。
【0122】
宿主細胞は、本明細書に開示された核酸を含むことができる。そのような宿主細胞は、in vitroにあっても、培養物中にあってもよい。そのような宿主細胞はin vivoにあってもよい。in vivoでは、宿主細胞の存在により、「イントラボディ」又は細胞内抗体としての、本発明において使用する結合メンバーの細胞内発現が可能になる。イントラボディを、遺伝子治療に用いることができる。
【0123】
本明細書に開示する核酸を宿主細胞中に導入することを含む方法も記載する。この導入は、任意の利用可能な技術を用いることができる。真核細胞については、好適な技術として、リン酸カルシウムトランスフェクション、DEAE-デキストラン、エレクトロポレーション、リポソーム媒介トランスフェクション、及びレトロウイルス若しくは他のウイルス、例えばワクシニア、又は昆虫細胞については、バキュロウイルスを用いる形質導入が挙げられる。宿主細胞、特に真核細胞中への核酸の導入は、ウイルス又はプラスミドに基づく系を用いることができる。プラスミド系を、エピソームとして維持するか、又は宿主細胞若しくは人工染色体中に組込むことができる。組込みは、単一又は複数の遺伝子座での1以上のコピーの無作為な又は標的化された組込みによるものであってよい。細菌細胞については、好適な技術としては、塩化カルシウム形質転換、エレクトロポレーション及びバクテリオファージを用いるトランスフェクションが挙げられる。
【0124】
前記導入を行った後、例えば、遺伝子の発現のための条件下で宿主細胞を培養することにより、核酸からの発現を引き起こすか、又は可能にすることができる。発現産物の精製を、当業者には公知の方法により達成することができる。
【0125】
核酸は、宿主細胞のゲノム(例えば、染色体)中に組込むことができる。標準的な技術に従って、ゲノムとの組換えを促進する配列の含有により、組込みを促進することができる。
【0126】
上記の結合メンバー又はポリペプチドを発現させるための発現系中で上述の構築物を用いることを含む方法も記載する。
【0127】
本発明において使用する結合メンバーは、ヒト又は動物被験体、例えばヒトにおける診断又は治療の方法において用いられるように設計する。本発明において使用する結合メンバーは、関節リウマチの診断又は治療において用いることができる。
【0128】
従って、本発明は、提供される結合メンバーの投与を含む治療方法、そのような結合メンバーを含む医薬組成物、並びに、例えば該結合メンバーを製薬上許容し得る賦形剤と共に製剤化することを含む医薬又は医薬組成物を製造する方法における、投与のための医薬の製造におけるそのような結合メンバーの使用を提供する。製薬上許容し得るビヒクルは周知であり、選択される活性化合物の性質及び投与方法の関数として、当業者により適合させることができるであろう。
【0129】
通常、本発明において使用する結合メンバーは、該結合メンバーに加えて、少なくとも1種の成分を含んでもよい医薬組成物の形態で投与することができる。かくして、本発明に係る、及び本発明に係る使用のための医薬組成物は、活性成分に加えて、製薬上許容し得る賦形剤、担体、バッファー、安定化剤又は当業者に周知の他の材料を含んでもよい。そのような材料は、非毒性であるべきであり、前記活性成分の効力を阻害するべきではない。担体又は他の材料の正確な性質は、経口、吸入又は注入、例えば静脈内注入であってよい投与の経路に依存するであろう。
【0130】
例えば、ナノボディなどの経口投与のための医薬組成物も、本発明において想定される。そのような経口製剤は、錠剤、カプセル、粉末、液体又は半固体の形態にあってもよい。錠剤は、ゼラチン又はアジュバントなどの固形担体を含んでもよい。一般的には、液体医薬組成物は、水、石油、動物油若しくは野菜油、鉱油又は合成油などの液体担体を含む。生理食塩溶液、デキストロース若しくは他の糖溶液、又は、例えばエチレングリコール、プロピレングリコール若しくはポリエチレングリコールなどのグリコールを含有させることができる。
【0131】
静脈内注入、又は苦痛の部位での注入のためには、前記活性成分は、発熱源を含まず、好適なpH、等張性及び安定性を有する非経口的に許容し得る水性溶液の形態にあるであろう。当業者であれば、例えば、塩化ナトリウム注入液、リンゲル注入液、乳酸加リンゲル注入液などの等張性ビヒクルを用いて、好適な溶液を調製することができるであろう。保存剤、安定化剤、バッファー、酸化防止剤及び/又は他の添加物を、必要に応じて用いることができる。医薬製剤の調製のための多くの方法が、当業者には公知である。例えば、Robinson, 1978を参照されたい。
【0132】
治療しようとする症状に応じて、組成物を単独で投与するか、又は同時に若しくは連続的に、他の治療と組み合わせて投与するか、又は別の治療剤若しくは複数の薬剤との組合せ製剤として投与することができる。
【0133】
本発明において使用する結合メンバーは、追加の医薬成分と組合せた組合せ療法の一部として用いることができる。組合せ治療(併用療法)、特に本発明において使用する結合メンバーと、1種以上の他の薬剤との組合せを用いて、有意な相乗効果を提供することができる。本発明において使用する結合メンバーは、本明細書に列挙される1種以上の症状の治療のために、同時に若しくは連続的に投与するか、又は別の治療剤若しくは複数の薬剤との組合せ製剤として投与することができる。
【0134】
例えば、本発明において使用する結合メンバーは、関節リウマチの治療のための既存の治療剤と組み合わせて用いることができる。
【0135】
関節リウマチの治療のための既存の治療剤としては、IL-10、TGFβ、光増感剤、及び細胞傷害性薬が挙げられる。
【0136】
本発明において使用する結合メンバー及び1種以上の上記追加医薬成分を、医薬の製造において用いることができる。前記医薬は、個体への個別の、又は組み合わせた投与のためのものであってよく、従って、組合せ製剤として、又は別々の製剤として、前記結合メンバーと前記追加成分とを含んでもよい。別々の製剤を用いて、別々の、及び連続的又は同時的投与を容易にすることができ、異なる経路、例えば経口投与と非経口投与による前記成分の投与が可能になる。
【0137】
本発明において、提供される組成物を哺乳動物に投与することができる。投与は「治療上有効量」であってよく、これは患者に対する利益を示すのに十分なものである。そのような利益は、少なくとも1種の症候の少なくとも改善である。「関節リウマチの治療」とは、少なくとも1種の症候の改善を意味する。投与される実際の量、並びに投与の速度及び時間経過は、治療しようとするものの性質及び重篤度、治療する特定の哺乳動物、個々の患者の臨床症状、障害の原因、前記組成物の送達部位、結合メンバーの種類、投与方法、投与の日程並びに医師には公知の他の因子に依存するであろう。治療の処方、例えば、投薬量に関する決定などは、一般開業医及び他の医師の責任の範囲内にあり、症候の重篤度及び/又は治療する疾患の進行に依存し得る。抗体の好適な用量は、当業界で周知である(Ledermann 1991及びBagshawe 1991)。投与する医薬の種類に関して必要に応じて、本明細書、又はPhysician's Desk Reference (2003)に示される特定の用量を用いることができる。本発明において使用する結合メンバーの治療上有効量又は好適な用量を、そのin vitroでの活性と、動物モデルにおけるin vivoでの活性とを比較することにより決定することができる。マウス及び他の試験動物における有効用量をヒトに外挿する方法は公知である。正確な用量は、抗体が診断、予防若しくは治療のためのものであるかどうか、治療しようとする領域のサイズ及び位置、抗体(例えば、全抗体、フラグメント若しくはダイアボディ)の正確な性質、並びに該抗体に結合させた検出可能な標識若しくは他の分子の性質などの、いくつかの因子に依存するであろう。典型的な抗体用量は、全身適用のためには100μg〜1gの範囲にあり、局所適用のためには1μg〜1mgの範囲にあるであろう。最初はより高い負荷用量を、次いで、1種以上のより低い用量を投与することができる。抗体は、全抗体、例えば、IgG1又はIgG4アイソタイプであってよい。これは、成人患者の単回治療のための用量であり、子供及び幼児については比例的に調整し、また他の抗体形態については分子量に比例して調整することもできる。治療は、毎日、週に2回、毎週又は毎月の間隔で、医師の裁量で繰り返すことができる。治療は、皮下投与については2〜4週間毎、静脈内投与については4〜8週間毎であってもよい。本発明のいくつかの実施形態においては、治療は定期的であり、投与間の期間は約2週間以上、例えば約3週間以上、約4週間以上、又は月に約1回である。本発明の他の実施形態においては、治療を、外科手術の前及び/又は後に行ってもよく、外科的処置の解剖学的部位に投与するか、又は直接適用することができる。
【0138】
本発明のさらなる態様及び実施形態は、以下の実験的例示を含む本開示を鑑みて当業者にとっては明らかであろう。
【実施例】
【0139】
実験
結果
ヒト関節炎標本の組織化学的分析
フィブロネクチンドメインEDA及びEDB、並びにテネイシン-CドメインA1及びCの発現を、それぞれF8、L19、F16及びG11抗体を用いたヒト関節炎標本の免疫組織化学により調べた。
【0140】
図1において、暗色の染色は、(白矢印で描出されるように)各抗原の発現を示している。抗EDA抗体であるF8が最も強い染色を示し、従って、さらなる実験は全てこの抗体を用いて行った。
【0141】
F8抗体を用いた免疫蛍光実験を実施したところ、良好な血管周囲の染色が示された(図2において白い構造物として可視化されている)。
【0142】
ヒトモノクローナル抗体F8はマウスにおける関節炎の部位に選択的に蓄積する
CIAマウスモデル(Courtneyら 1980)におけるミニ抗体形態(SIP)(Borsiら 2002)のF8のin vivoターゲティング能を、抗体検出に関して蛍光及び放射能の両方を用いて試験した。SIP形態は、80kDaサイズのホモダイマータンパク質を生じる、ヒトIgEのCH4ドメインと結合したscFv抗体フラグメントからなる。
【0143】
関節炎マウスに近赤外色素Alexa 750で標識したSIP(F8)を注射した。静脈内注射の24時間後に、赤外蛍光イメージャー(Birchlerら, 1999)を用いて動物を画像化したところ、関節炎の肢に存在する損傷において強くかつ選択的な抗体蓄積が明らかとなり、白色光の肢として可視化され、マウスの前肢にはグレード2の腫れがいくつかあった。
【0144】
125Iで放射性標識したSIP(F8)の静脈内注射の24時間後に、マウスを犠牲にし、オートラジオグラフィー(ホスホルイメージング)により肢を画像化した。SIP(F8)を注射したマウスの炎症四肢において放射能の選択的蓄積が観察され、オートラジオグラフィーにおいて黒色染色として可視化された。1本の肢は関節炎スコア2(肢全体の腫れ)を示した。別の肢は関節炎のグレード1(1本の指の腫れ)と分類された。
【0145】
抗EDA抗体−インターロイキン-10融合体の活性
scFv形態の抗体分子F8を、インターロイキン-10(IL-10)と融合タンパク質内でコンジュゲートした。融合タンパク質の生物活性を、MC/9細胞のIL-4依存性増殖を誘導する能力を決定するアッセイ(Thompsonら, 1991)において、ヒトIL-10の活性を比較した。結果を図8(d)に示す。
【0146】
材料及び方法
ヒト関節炎標本における免疫組織化学的分析
ヒト関節炎標本の凍結切片を氷冷アセトン中で10分かけて固定し、ウシ胎仔血清を用いて30分間ブロッキングし、新生血管のマーカー(フィブロネクチンED-A及びED-B、テネイシン-CドメインA1及びC)について染色した。F8、L19、F16及びG11抗体は、10μg/mlの濃度でmycタグ付加scFvとして使用し、1時間インキュベートした。一次抗体を7μg/mlの濃度の抗myc抗体9E10と共にインキュベートした。三次検出抗体として、ウサギ抗マウスIgG抗体(Dako, Denmark)及びAPAAPマウスモノクローナル(Dako, Denmark)をそれぞれ5及び50μg/mlの濃度で1時間使用した。ファストレッド錠(Sigma, Switzerland)を使用して、15分間インキュベートして、染色を発色させた。スライドをヘマトキリシンで2分かけて対比染色し、水で洗浄し、Glycergelマウント培地(Dako, Denmark)にのせ、Axiovert S100 TV顕微鏡(Zeiss, Switzerland)を用いて分析した。
【0147】
ヒト関節炎標本における免疫蛍光分析
ヒト関節炎標本の凍結切片を氷冷アセトン中で10分かけて固定し、ウシ胎仔血清を用いて30分間ブロッキングし、フィブロネクチンのED-Aドメインについて染色した。F8抗体は、10μg/mlの濃度でmycタグ付加scFvとして使用し、1時間インキュベートした。一次抗体を7μg/mlの濃度の抗myc抗体9E10と共にインキュベートした。三次検出抗体として、蛍光抗マウスAlexa 596抗体(Molecular Probes, Denmark)を10μg/mlの濃度で1時間使用した。スライドをHoechst 33342で対比染色し、Glycergelマウント培地(Dako, Denmark)にのせ、AxioScop 2MOT+顕微鏡(Zeiss, Switzerland)を用いて分析した。
【0148】
動物モデル
200μgのウシII型コラーゲン(MD Biosciences)を等量のフロイント完全アジュバント(MD Biosciences)で乳化し、尾付け根における皮内注射によりDBA/1雄マウス(8〜12週齢)を免疫した。初回免疫の2週間後に、コラーゲンの乳化に不完全フロイントアジュバント(MD Biosciences)を使用して上記手順を繰り返した。マウスを毎日観察し、1又はそれ以上の肢に紅斑及び/又は肢の腫れを示した各マウスを画像化又は処置試験のために登録した。
【0149】
2つの疾患インデックス(臨床スコア及び肢の腫れ)を用いて関節炎をモニターした。臨床スコアについては、非盲検で各肢のグレードを毎日評価した。(0=正常、1=同じ肢の1又はそれ以上の指の腫れ、2=肢全体の腫れ)とし、動物当たり可能な最大スコアは8となるようにした。肢の腫れは、隔日に評価し、カリパスを用いてイソフルラン麻酔下における各肢の厚さを測定した。全4肢の平均値を各動物の肢の厚みとした。
【0150】
関節炎の肢の近赤外イメージング
関節炎マウスにおけるSIP(F8)の選択的蓄積を、Birchlerら(1999)に記載されているように近赤外イメージング分析により試験した。簡単に説明すると、精製SIP(F8)をAlexa750(MolecularProbes, Leiden, The Netherlands)で製造業者の推奨に従って標識し、100μgの標識タンパク質を関節炎マウスの尾静脈に注射した。注射の24時間後にマウスをケタミン80mg/kg及びメデトミジン0.2mg/kgで麻酔し、近赤外マウスイメージャーにおいて画像化した(Trachselら 2007; Birchlerら 1999)。
【0151】
生体分布実験
関節炎マウスにおけるSIP(F8)のin vivoターゲティング能を、以前に記載されているように生体分布分析により評価した(Borsiら 2002; Tarliら, 1999)。簡単に説明すると、精製SIP(F8)を放射性ヨウ素化し、10μgのタンパク質(11uCi 125Iに相当)を関節炎マウスの尾静脈に注射した。注射の24時間後にマウスを犠牲にし、以前に記載されているように(Trachselら 2007)、肢を1時間露光し、ホルホルイメージャー(Fujifilm BAS-5000)において読み取った。
【0152】
抗体
抗ED-B抗体フラグメントscFv(L19)の単離は、以前に記載されている(Piniら、1998)。親抗ED-A抗体を、公開された手順(Giovannoni, Nucleic. Acid Research, 2001, 29(5):E27)を用いてETH-2ライブラリーから単離した。高親和性抗ED-A抗体をもたらす、親抗ED-A抗体の親和性成熟は、以下の節に記載する。
【0153】
親抗ED-A抗体の親和性成熟
親抗ED-A抗体(ETH-2由来抗体)を、親和性成熟ライブラリーの構築のための鋳型として用いた。ライブラリーのVH CDR1(DP47生殖系列)及びVL CDR1(DPK22生殖系列)における配列可変性を、VH CDR1の31、32及び33位とVL CDR1の31、31a及び32位で無作為突然変異を作製するプロセスにおいて、部分的縮重プライマー5'-CTGGAGCCTGGCGGACCCAGCTCATMNNMNNMNNGCTAAAGGTGAATCCAGA-3'(配列番号17)(VH用)及び5'-CCAGGTTTCTGCTGGTACCAGGCTAAMNNMNNMNNGCTAACACTCTGACTGGCCCTGC-3'(配列番号18)(VL用) (全てのオリゴヌクレオチドを、Operon Biotechnologies, Cologne, Germanyから購入した)を用いるPCRにより導入した。VHVLの組合せを、鋳型としてゲル精製されたVH及びVL断片を用いる、プライマーLMB3long(5'-CAGGAAACAGCTATGACCATGATTAC-3')(配列番号19)及びfdseqlong(5'-GACGTTAGTAAATGAATTTTCTGTATGAGG-3')(配列番号20)を用いるPCR集合(assembly)によりscFv形態に集合させた。集合させたVH-VL断片を、NcoI/NotIで二重消化し、NcoI/NotI消化されたpHEN1ファージミドベクター(Hoogenboomら、1991)中にクローニングした。得られる連結産物を、Vitiら、2000に従ってエレクトロコンピテント大腸菌TG-1細胞中にエレクトロポレーションし、1.5×107個の抗体クローンを含有するライブラリーを生じさせ、改善された親和性でED-Aに結合する抗体についてスクリーニングした。
【0154】
抗ED-A抗体の選択
上記の抗体ライブラリーを、BIAcore分析を用いて、親抗ED-A抗体よりも高い親和性でED-Aに結合する抗体についてスクリーニングした。BIAcore分析において用いた抗原(11A12)は、ヒトフィブロネクチンのED-Aドメインを含み、以下のアミノ酸配列(配列番号120)を有する:
MRSYRTEIDKPSQMQVTDVQDNSISVKWLPSSSPVTGYRVTTTPKNGPGPTKTKTAGPDQ
TEMTIEGLQPTVEYVVSVYAQNPSGESQPLVQTAVTNIDRPKGLAFTDVDVDSIKIAWES
PQGQVSRYRVTYSSPEDGIHELFPAPDGEEDTAELQGLRPGSEYTVSVVALHDDMESQPL
IGTQSTAIPAPTDLKFTQVTPTSLSAQWTPPNVQLTGYRVRVTPKEKTGPMKEINLAPDS
SSVVVSGLMVATKYEVSVYALKDTLTSRPAQGVVTTLENVRSHHHHHH
【0155】
抗原(11A12)のヌクレオチド配列(配列番号121)は以下の通りである:
atgagatcctaccgaacagaaattgacaaaccatcccagatgcaagtgaccgatgttcaggacaacagcattagtgtcaagtggctgccttcaagttcccctgttactggttacagagtaaccaccactcccaaaaatggaccaggaccaacaaaaactaaaactgcaggtccagatcaaacagaaatgactattgaaggcttgcagcccacagtggagtatgtggttagtgtctatgctcagaatccaagcggagagagtcagcctctggttcagactgcagtaaccaacattgatcgccctaaaggactggcattcactgatgtggatgtcgattccatcaaaattgcttgggaaagcccacaggggcaagtttccaggtacagggtgacctactcgagccctgaggatggaatccatgagctattccctgcacctgatggtgaagaagacactgcagagctgcaaggcctcagaccgggttctgagtacacagtcagtgtggttgccttgcacgatgatatggagagccagcccctgattggaacccagtccacagctattcctgcaccaactgacctgaagttcactcaggtcacacccacaagcctgagcgcccagtggacaccacccaatgttcagctcactggatatcgagtgcgggtgacccccaaggagaagaccggaccaatgaaagaaatcaaccttgctcctgacagctcatccgtggttgtatcaggacttatggtggccaccaaatatgaagtgagtgtctatgctcttaaggacactttgacaagcagaccagctcagggagttgtcaccactctggagaatgtcagatctcatcaccatcaccatcactaa
【0156】
前記抗原のヌクレオチド配列を、5'及び3'にそれぞれBamHI及びBglII制限部位を含むプライマーを用いるPCRにより増幅した。得られるPCR産物及びベクターpQE12 (QIAGEN)をBamHI及びBglII制限エンドヌクレアーゼで消化した後、挿入物:ベクター比3:1を含む反応物中に連結した。得られるベクターを配列決定して、配列が正確であるかを調べた。
【0157】
抗原調製
10 mlの2TY、Amp、1%グルコース中のTG1エレクトロコンピテント前培養物を、11A12のDNAミニプレップ1μlの存在下でエレクトロポレーションした。次いで、前培養物を1:100に希釈し(800 mlの2TY、Amp、0.1%グルコース中に8 ml)、OD600が0.4〜0.6になるまで増殖させた後、IPTGで一晩誘導した。次の日、細胞を遠心分離し、上清を濾過した(Millipore 0.22μm)。培養培地の遠心分離及び清澄化後、11A12をFPLC上のHitrapカラムを用いて精製した。Ni/カラムを以下のように再生した:カラムを、カラムの5倍量(CV)のH2Oで洗浄した後、3CVの0.5 M EDTA/0.2 M Tris pH 8を適用して、カラムから古いニッケルを洗浄除去した。次いで、カラムを5CVのH2Oで洗浄した。次いで、カラムに2CVの100 mM NiSO4を再度導入した後、カラムを数CVのH2Oで洗浄した。次いで、カラムを5CVの溶解バッファー(20 mMイミダゾール/250 mM NaCl/PBS pH 7.4)で平衡化させた。細胞溶解物を濾過し(Millipore 0.45μm)、カラムに導入した(手動で)。次いで、カラムをFPLC上に戻し、UVシグナルが安定するまで(一定)、約3CVの溶解バッファーを流出させた。次いで、溶出プログラムを開始した:5CVの溶出バッファー(400 mMイミダゾール/250 mM NaCl/PBS pH 7.4)の0%〜100%の勾配。溶出された抗原を含む画分をプールし、PBSで一晩透析させた。
【0158】
抗ED-A抗体の発現及び精製
抗ED-A抗体を以下のように発現させ、精製した:10 mlの2TY、Amp、1%グルコース中のTG1エレクトロコンピテント前培養物を、抗ED-A抗体の1つのDNAミニプレップ1μlの存在下でエレクトロポレーションした。次いで、前培養物を1:100に希釈し(800 mlの2TY、Amp、0.1%グルコース中の8 ml)、OD600が0.4〜0.6になるまで増殖させた後、IPTGで一晩かけて誘導した。次の日、細胞を遠心分離し、上清を濾過した(Millipore 0.22μm)。scFvをプロテインA−セファロースカラム上で精製し、トリエチルアミン(Triethylemmine)を用いて、カラムからscFvを溶出させた。溶出したscFvを含む画分を、PBS中、4℃で一晩透析した。次いで、scFv画分を、PBSと共にSuperdex 75カラムに入れ、0.5 ml/分で流出させ、0.25 mlの画分を回収した。モノマー画分をBIAcore分析に用いた。
【0159】
BIAcoreTM分析1
BIAcoreTM Chipを、HBS-EPバッファーBIACORETM、0.01 M Hepes pH 7.4、0.15 M NaCl、3 mM EDTA、0.005%界面活性剤P20(アッセイに用いたのと同じバッファー)を用いて、5μl/分の流速で一晩フラッシュした。抗原(11A12)を、酢酸バッファー(pH 4.0)中に50μg/mlの濃度に希釈し、チップ上のCOOH基を、N-ヒドロキシスクシンイミド(NHS)及びエチル-N-(ジメチルアミノプロピル)-カルボジイミド(EDC)の混合物50μlの注入により活性化した。40μlの11A12抗原をチップに注入し、残留した遊離COOH基を30μlのエタノールアミンでブロッキングした。0.22μmの濾過後、20μlの各細菌上清をチップ上に注入し、抗原との相互作用をリアルタイムでモニターした。
【0160】
BIAcoreTM分析2
親抗ED-A抗体と抗ED-A抗体B2、C5、D5、C8、F8、B7及びG9のkon、koff及びKDを、表面プラスモン共鳴を用いて評価した。チップを、5μl/分のバッファー流速で、アッセイの間に用いたのと同じバッファーを用いて一晩平衡化した。コーティング手順全体をこの流速で実施した。抗原11A12を、酢酸バッファーpH 4.00(BIACORETMにより提供)で1:25に希釈して、20μg/mlの最終濃度を得た。次いで、NHS及びEDCを混合し、50μlを注入して、CM5チップ上のCOOH基を活性化した。次いで、40μlの抗原を注入した(これは約40秒(40'')続く)。次いで、30μlのエタノールアミンを注入して、最終的な遊離COOHの反応性をブロッキングした。
【0161】
各サンプルを20μl/分の流速でアッセイした。20μlの未希釈のモノマータンパク質(それはゲル濾過から得られる)を注入した。解離時間を約200秒(200'')まで行った。次いで、10μlのHCl 10 mMを注入して、チップを再生した。モノマータンパク質の注入を、異なる希釈率、すなわち、1:2希釈率(PBS中)で反復した後、HClを用いて再生した。次いで、1:4の希釈率でタンパク質の3回目の注入を行った後、再度HClで再生した。各抗ED-A抗体のkon、koff及びKD値を、BIAevaluationソフトウェアを用いて評価した。
【0162】
抗ED-A抗体の選択
BIAcoreTM分析1
BIAcoreTM分析によって、以下のように抗原に対する抗体の親和性を推定するために分析したそれぞれの抗ED-A抗体に関するグラフが得られた:それぞれのグラフのx軸は時間に対応し、y軸は共鳴単位(BIAcoreTMチップ上にコーティングされた抗原に対する試験抗体の結合親和性を示す尺度)に対応する。それぞれのグラフは、3個のピークと、バッファーの交換に対応し、従って、結果の解釈について無関係である1個の落ち込みとを示す。
【0163】
各グラフの上部は、結合期を表す。グラフのこの部分における曲線が急勾配になるほど、抗体の抗原との結合が速くなる。各グラフの下部は、抗体の抗原からの解離期を表す。グラフのこの部分における曲線が平坦になるほど、抗体の抗原からの解離がゆっくりになる。
【0164】
抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9は全て、それらが誘導された親抗ED-A抗体よりも平坦な解離曲線を示したが、これは、それらが親抗ED-A抗体よりも高い親和性でED-Aに結合し、従って、A-FNにも結合することを示している。抗体E5、F1、F8及びH1に関するグラフは、試験した全ての抗ED-A抗体の最も平坦な解離曲線を示した。抗体H1、C5、D5、E5、C8、F8及びF1の結合曲線は、親抗ED-A抗体について観察されたものよりも平坦であったが、抗体B2、B7、E8及びG9について観察された結合曲線は、親抗ED-A抗体について観察された結合曲線と同じぐらい急勾配であった。しかしながら、IPTGに誘導される大腸菌TG-1細胞の細菌上清を、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9のBIAcoreTM分析に用いたため、試験した抗体サンプルの濃度は未知であったが、比較に用いた親抗ED-A抗体サンプルの濃度よりも低い可能性が最も高い。結果として、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9の結合曲線は、BIAcoreTM分析に用いたサンプル中の抗体の濃度が低いことに起因して、人工的に低いかもしれない。しかしながら、濃度はBIAcore分析においてはその標的抗原からの抗体の解離に影響しないため、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9について観察された平坦な解離曲線は、これらの抗体が、親抗ED-A抗体と少なくとも等しい、おそらくはより高い親和性でED-Aに結合することを示している。
【0165】
BIAcore分析2
各抗ED-A抗体のkon、koff及びKD値を、BIAevaluationソフトウェアを用いて評価した。抗原11A12に対する親抗ED-A抗体、並びに抗ED-A抗体B2、C5、D5、C8、F8、B7及びG9のkon、koff及びKD値を、表2に詳細に記載する。抗ED-A抗体B2、C5、D5、C8、F8、B7及びG9は全て、それらが誘導された親抗ED-A抗体よりも良好な抗原11A12に対するKD値を有し、これは、それらが親抗ED-A抗体よりも高い親和性でED-Aに結合し、従ってA-FNにも結合することを示している。
【0166】
配列
抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9は全てscFv抗体であり、従来の方法を用いてこれらを配列決定した。抗ED-A抗体H1のヌクレオチド配列を図3に示す。抗ED-A抗体H1のアミノ酸配列を図4に示す。
【0167】
抗ED-A抗体B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9のVH及び/又はVLをコードする好ましいヌクレオチド配列は、軽鎖(VL)及び重鎖(VH)のH1 CDR1をコードするヌクレオチド配列が、それぞれの抗体について表1に列挙された軽鎖(VL)及び重鎖(VH)CDR1をコードするヌクレオチド配列と置換された以外は、抗ED-A抗体H1のVH及び/又はVLをコードするヌクレオチド配列と同一である。
【0168】
抗ED-A scFv F8ダイアボディのVH及び/又はVLをコードする好ましいヌクレオチド配列は、軽鎖(VL)及び重鎖(VH)のH1 CDR1をコードするヌクレオチド配列が、抗ED-A抗体F8について表1に列挙された軽鎖(VL)及び重鎖(VH)CDR1をコードするヌクレオチド配列と置換された以外は、抗ED-A抗体H1のVH及び/又はVLをコードするヌクレオチド配列と同一である。抗ED-A scFv F8ダイアボディのVH及びVLを連結するリンカーをコードする好ましいヌクレオチド配列は、gggtccagtggcggt(配列番号29)である。
【0169】
抗ED-A抗体B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9は、軽鎖(VL)及び重鎖(VH)のH1 CDR1のアミノ酸配列を、それぞれの抗体の表1に列挙された軽鎖(VL)及び重鎖(VH)のアミノ酸配列と置換する以外は、抗ED-A抗体H1と同一のアミノ酸配列を有する。抗ED-A scFv F8ダイアボディのアミノ酸配列は、軽鎖(VL)及び重鎖(VH)のH1 CDR1のアミノ酸配列が、抗ED-A抗体F8について表1に列挙された軽鎖(VL)及び重鎖(VH)CDR1のアミノ酸配列と置換され、H1中のリンカーのアミノ酸配列が、リンカーアミノ酸配列GSSGG(配列番号28)と置換された以外は、抗ED-A抗体H1のアミノ酸配列と同一である。
【0170】
抗ED-A抗体B2 VHドメインのアミノ酸配列(配列番号21)は、抗ED-A抗体H1のVH CDR1が配列番号23に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0171】
抗ED-A抗体C5 VHドメインのアミノ酸配列(配列番号41)は、抗ED-A抗体H1のVH CDR1が配列番号43に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0172】
抗ED-A抗体D5 VHドメインのアミノ酸配列(配列番号51)は、抗ED-A抗体H1のVH CDR1が配列番号53に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0173】
抗ED-A抗体E5 VHドメインのアミノ酸配列(配列番号61)は、抗ED-A抗体H1のVH CDR1が配列番号63に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0174】
抗ED-A抗体C8 VHドメインのアミノ酸配列(配列番号71)は、抗ED-A抗体H1のVH CDR1が配列番号73に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0175】
抗ED-A抗体F8 VHドメインのアミノ酸配列(配列番号81)は、抗ED-A抗体H1のVH CDR1が配列番号83に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。抗ED-A F8ダイアボディのVHドメインは、抗ED-A抗体F8のVHドメインと同じアミノ酸配列(すなわち、配列番号81)を有する。
【0176】
抗ED-A抗体F1 VHドメインのアミノ酸配列(配列番号91)は、抗ED-A抗体H1のVH CDR1が配列番号93に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0177】
抗ED-A抗体B7 VHドメインのアミノ酸配列(配列番号101)は、抗ED-A抗体H1のVH CDR1が配列番号103に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0178】
抗ED-A抗体E8 VHドメインのアミノ酸配列(配列番号111)は、抗ED-A抗体H1のVH CDR1が配列番号113に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0179】
抗ED-A抗体G9 VHドメインのアミノ酸配列(配列番号31)は、抗ED-A抗体H1のVH CDR1が配列番号33に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0180】
抗ED-A抗体B2 VLドメインのアミノ酸配列(配列番号22)は、抗ED-A抗体H1のVL CDR1が配列番号26に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0181】
抗ED-A抗体C5 VLドメインのアミノ酸配列(配列番号42)は、抗ED-A抗体H1のVL CDR1が配列番号46に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0182】
抗ED-A抗体D5 VLドメインのアミノ酸配列(配列番号52)は、抗ED-A抗体H1のVL CDR1が配列番号56に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0183】
抗ED-A抗体E5 VLドメインのアミノ酸配列(配列番号62)は、抗ED-A抗体H1のVL CDR1が配列番号66に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0184】
抗ED-A抗体C8 VLドメインのアミノ酸配列(配列番号72)は、抗ED-A抗体H1のVL CDR1が配列番号76に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0185】
抗ED-A抗体F8 VLドメインのアミノ酸配列(配列番号82)は、抗ED-A抗体H1のVL CDR1が配列番号86に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。抗ED-A F8ダイアボディのVLドメインは、抗ED-A抗体F8のVLドメインと同じアミノ酸配列(すなわち、配列番号82)を有する。
【0186】
抗ED-A抗体F1 VLドメインのアミノ酸配列(配列番号92)は、抗ED-A抗体H1のVL CDR1が配列番号96に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0187】
抗ED-A抗体B7 VLドメインのアミノ酸配列(配列番号102)は、抗ED-A抗体H1のVL CDR1が配列番号106に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0188】
抗ED-A抗体E8 VLドメインのアミノ酸配列(配列番号112)は、抗ED-A抗体H1のVL CDR1が配列番号116に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0189】
抗ED-A抗体G9 VLドメインのアミノ酸配列(配列番号32)は、抗ED-A抗体H1のVL CDR1が配列番号36に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0190】
必要に応じて、抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8、G9及びscFv F8ダイアボディのVHドメインの5位のアミノ酸は、図4Aに示されるようにバリン残基(V)よりもむしろ、ロイシン残基(L)であってよい。さらに、又はあるいは、抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8、G9及びscFv F8ダイアボディのVLドメインの18位のアミノ酸は、図4Cに示されるようにリジン残基(K)よりもむしろ、アルギニン残基(R)であってもよい。
【0191】
F8-IL10のクローニング、産生及び特性決定
ヒトIL-10遺伝子を以下のプライマー配列を用いてPCRにより増幅した:
バックワードアンチセンスプライマー
5'-TCGGGTAGTAGCTCTTCCGGCTCATCGTCCAGCGGCAGCCCAGGCCAGGGCACC-3'、及び
フォワードセンスプライマー
5'-TTTTCCTTTTGCGGCCGCtcattaGTTTCGTATCTTCATTGTCATGTA-3'
これは、そのN末端に15アミノ酸リンカー(SSSSG)3の付属部分があり、そのC末端に停止コドン及びNotI制限部位がある。
【0192】
一本鎖可変フラグメント(F8)をコードするDNAを、以下のプライマー対を用いてシグナルペプチドと共に増幅した:
バックワードアンチセンスプライマー
5'-CCCAAGCTTGTCGACCATGGGCTGGAGCC-3'、及び
フォワードセンスプライマー
5'-GAGCCGGAAGAGCTACTACCCGATGAGGAAGAGAATTCTTTGATTTCCACCTTGGTCCCTTG-3'。
【0193】
この手法を用いて、HindIII制限部位をN末端に挿入し、リンカー配列の相補的部分をC末端に挿入した。
【0194】
続いて、一本鎖Fv及びIL-10断片をPCRを用いて会合させ、哺乳動物細胞発現ベクターpcDNA3.1(+)のHindIII及びNotI制限部位にクローニングした。
【0195】
以前に記載されているプラスミドをCHO-S細胞に安定にトランスフェクトし、G418(0.5g/l)の存在下で選択を行った。
【0196】
G418耐性細胞のクローンをヒトフィブロネクチンの組換えEDAを抗原として用い、検出のためにプロテインAを用いて、ELISAにより融合タンパク質の発現についてスクリーニングした。
【0197】
プロテインAカラムを用いたアフィニティクロマトグラフィによる細胞培養培地から融合タンパク質を精製した。
【0198】
SDS-PAGEにおいて還元及び非還元条件下で、そしてSuperdex S-200排除カラム(Amersham Pharmacia Biotech, Dubendorf, Switzerland)におけるFPLCゲル濾過により天然条件下で、融合タンパク質のサイズを分析した。
【0199】
活性アッセイ
hIL10の生物活性は、比色MTT色素還元アッセイを用いて、MC/9細胞のIL-4依存性増殖を誘導する能力により決定した(Thompsonら, 1991)。5pg(0.05単位)のマウスIL4/ml(eBiosciences)を含む200μlの培地中の10000個のMC/9細胞(ATCC, Manassas, USA)を1ウエル当たりで96ウエルマイクロタイタープレートに入れ、種々の量のヒトIL10で48時間処理した。hIL10標準及びF8-IL10融合タンパク質を最大100ng/mlのIL10等量で使用して、連続希釈した。10μlの5mg/ml MTT(Sigma)を添加し、3〜5時間インキュベートした。続いて、細胞を遠心し、DMSOで溶解し、570nmにおける吸光を読み取った。
【0200】
参考文献
上記のいずれかで引用されたものなどの本明細書で引用される全ての参考文献は、あらゆる目的のためにその全体が参照により本明細書に組み入れられるものとする。
【0201】
Amit et al. (1986), Science, 233:747-753.
Andersen et al. (2002) Current Opinion in Biotechnology 13: 117
Ausubel et al. (1999) 4th eds., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, John Wiley & Sons.
Bagshawe K.D. et al. (1991) Antibody, Immunoconjugates and Radiopharmaceuticals 4: 915-922
Balza et al. (1988), FEBS Lett., 228: 42-44.
Batista et al. J. Exp. Med., 184: 2197-205, 1996.
Berndt et al. Histochem Cell Biol 1998, 109(3):249-255.
Birchler et al. (1999), J. Immunol. Methods, 231, 239-248.
Bird et al. (1988) Science, 242, 423-426
Borsi et al. (1987), J. Cell. Biol., 104, 595-600.
Borsi et al. (1990), FEBS Lett., 261: 175-178.
Borsi et al. (1995), J. Biol.Chem., 270: 6243-6245.
Borsi et al. (1998), Exp. Cell Res., 240, 244-251.
Borsi et al. (2000) Int J Cancer, 102(1):75-85.
Brack et al. (2006), Clin. Cancer Res., 12, 3200-3208.
Carnemolla et al. (1989), J. Cell. Biol., 108: 1139-1148.
Caton et al. (1990), J. Immunol., 144:1965-1968.
Chadd et al. (2001), Current Opinion in Biotechnology 12: 188-194
Chothia et al. (1987), J. Mol. Biol., 196:901-917.
Chothia et al. (1989), Nature, 342:877- 883.
Courtney et al. (1980) Nature, 14;283(5748):666-8.
Devos et al. (1983), Nucl. Acids Res. 11: 4307-4323.
ffrench-Constant (1995), Exp. Cell Res., 221, 261-271.
Giovannoni, Nucleic. Acid Research, 2001, 29(5):E27.
Glennie M J et al., 1987 J. Immunol. 139, 2367-2375
Haan et al. (2004), BioCentury, 12(5): A1-A6.
Hanahan et al. (2000), Cell 100, 57-70.
Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor N.Y., pp. 726, 1988
Heikinheimo et al. (1991), Virchows Arch. B Cell Pathol. Incl. Mol. Pathol., 61, 101-109.
Holliger and Bohlen 1999 Cancer and metastasis rev. 18: 411-419.
Holliger et al. (1993a), Proc. Natl. Acad. Sci. USA 90 6444-6448.
Holliger et al. (1993b), Current Opinion Biotechnol 4, 446-449.
Holt et al. (2003) Trends in Biotechnology 21, 484-490.
Hoogenboom et al. (1991), Nucleic Acids Res., 19 (15) 4133-7.
Hu et al. (1996), Cancer Res., 56, 3055-3061.
Huston et al. (1988) PNAS USA, 85, 5879-5883.
Hynes, R.O. (1990). Fibronectins (New York: Springer-Verlag).
Jacobs et al. (2002), Hum. Pathol., 33, 29-38.
Kabat et al. (1987) Sequences of Proteins of Immunological Interest. 4th Edition. US Department of Health and Human Services.
Kabat et al. (1991a), Sequences of Proteins of Immunological Interest, 5th Edition. US Department of Health and Human Services, Public Service, NIH, Washington. (a)
Kabat et al. (1991b), J. Immunol., 147:1709-1719.
Kaspar et al. (2006), Int. J. Cancer, 118, 1331-1339.
Knappik et al., (2000) J. Mol. Biol. 296, 57-86.
Koch et al. Ann Rheum Dis 2003, 62 Suppl 2:ii60-67.
Kohler and Milstein, Nature, 256:495-497, 1975
Koide et al. (1998), Journal of Molecular Biology, 284: 1141-1151.
Kontermann et al. (2001), S, Antibody Engineering, Springer-Verlag New York, LLC; ISBN: 3540413545.
Kornblihtt et al. (1984), Nucleic Acids Res. 12, 5853-5868.
Koukoulis et al. (1993), J. Submicrosc. Cytol. Pathol., 25, 285-295.
Koukoulis et al. (1995), Ultrastruct. Pathol., 19, 37-43.
Krebs et al. (2001), Journal of Immunological Methods, 254 67-84.
Kriegsmann et al.(2004) Rheumatol Int, 24(1):25-33.
Larrick JW and Thomas DW (2001) Current Opinion in Biotechnology 12:411-418.
Ledermann J.A. et al. (1991) Int. J. Cancer 47: 659-664
Li et al. Protein Engineering, 10: 731-736, 1997
Lohi et al. (1995), Int. J. Cancer, 63, 442-449.
Maeda et al. (1983) Biochem. Biophys. Res. Comm. 115: 1040-1047;
Matsumoto et al. (1999), Jpn. J. Cancer Res., 90, 320-325.
McCafferty et al., (1990) Nature, 348, 552-554.
Mendez, M. et al., (1997) Nature Genet, 15(2): 146-156.
Merchand et al., 1998 Nature Biotech. 16:677-681
Neri, D., and Bicknell, R. (2005), Nat Rev Cancer 5, 436-446.
Nygren et al. (1997), Current Opinion in Structural Biology, 7: 463-469.
Oyama et al. (1989), J. Biol. Chem., 264, 10331-10334.
Paolella et al. (1988), Nucleic Acids Res. 16, 3545-3557.
Pini et al. (1998), J. Biol. Chem., 273, 21769-21776.
Pluckthun (1991), Bio/Technology 9: 545-551.
Reiter et al. (1996), Nature Biotech, 14, 1239-1245.
Repp et al., 1995 J. Hemat. 377-382.
Ridgeway et al. (1996), Protein Eng., 9, 616-621.
Robinson ed., Sustained and Controlled Release Drug Delivery Systems, Marcel Dekker, Inc., New York, 1978
Roesli et al. (2006), Nature Protocols, 1, 192-199.
Ruf et al. (1991) J. Biol. Chem. 226: 15719-15725.
Rybak et al. (2005), Nat. Methods, 2, 291-298.
Rybak et al. (2006), ChemMedChem., 2,22-40.
Sambrook and Russell, Molecular Cloning: a Laboratory Manual: 3rd edition, 2001, Cold Spring Harbor Laboratory Press
Scarpati et al. (1987) Biochemistry 26: 5234-5238.
Scarpino et al. (1999) J. Pathol. 188, 163-167.
Scheurer et al. (2005), Proteomics 5, 3035-3039.
Segal et al. (1974), PNAS, 71:4298-4302.
Sharon et al. (1990a), PNAS, 87:4814-4817.
Sharon et al. (1990b), J. Immunol., 144:4863-4869.
Silacci et al. (2003), Proteomics, 5, 2340-2350.
Staerz U. D. and Bevan M. J. 1986 PNAS 83
Suresh et al. (1986) Method Enzymol. 121: 210-228
Taniguchi et al. (1983) Nature 302, 305-310;
Tarli et al. Blood 1999, 94(1):192-198.
Tavian et al. (1994), Int. J. Cancer, 56, 820-825.
Taylor, Arthritis Res 2002, 4 Suppl 3:S99-107.
Terrana et al. (1987), Cancer Res. 47, 3791-3797.
Thompson et al. (1991), J Exp Med, 173:507-510.
Thorpe (2004), Clin. Cancer Res., 10, 415-427.
Trachsel et al. (2006), Adv. Drug Deliv. Rev., 58, 735-754.
Trachsel et al. Arthritis Res Ther 2007, 9(1):R9.
Viti et al. (2000), Methods Enzymol., 326, 480-505.
Walsh et al. (1998) Am J Pathol, 152(3):691-702.
Ward et al. (1989), Nature 341, 544-546.
Wess In: BioCentury, The Bernstein Report on BioBusiness, 12(42), A1-A7, 2004.
【表1】

【0202】
【表2】

【技術分野】
【0001】
本発明は、関節リウマチ(RA)の検出及び治療に関する。本発明は、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、特にフィブロネクチンのED-Aドメインに結合する結合メンバーの使用を含む。
【背景技術】
【0002】
関節リウマチ(RA)は、慢性の炎症であり、先進国の人口の0.5〜1%に罹患し、一般的に重大な障害となり、結果的にクオリティオブライフを低下させる破壊性関節疾患である。
【0003】
RAを患う患者の滑膜における血管形成は、発症及び疾患の永久化の重大な早期段階であると考えられている(Taylor, 2002)。腫瘍性疾患として、血管形成は拡張する滑膜に供給される(Walshら, 1998)。血管の成長は、おそらく炎症性滑膜パンヌスの増殖、及び滑膜組織への炎症性白血球の侵入の原因となる。RAを患う患者の滑膜は、増大した量の繊維芽細胞増殖因子-2(FGF-2)及び血管内皮増殖因子(VEGF)を含んでいる(Koch, 2003)。血清VEGF濃度は、疾患活性と相関しており、滑膜炎の治療による抑制が成功している場合に低下する(Taylor, 2002)。
【0004】
フィブロネクチン(FN)は糖タンパク質であり、様々な正常組織及び体液中で広く発現される。それは細胞外マトリックス(ECM)の成分であり、細胞接着、細胞移動、ホメオスタシス、血栓形成、創傷治癒、組織分化及び癌性形質転換などの多くの生物学的プロセスにおいて役割を果たしている。
【0005】
サイトカイン及び細胞外pHにより調節されるプロセスである、一次転写物FNプレmRNAの3個の領域(ED-A、ED-B、IIICS)の選択的スプライシングにより、異なるFNアイソフォームが生成される(Balza 1988; Carnemolla 1989; Borsi 1990; Borsi 1995)。フィブロネクチンは、選択的スプライシングを受け得る2個のIII型球状エキストラドメインED-A及びED-Bを含む(ffrench-Constant 1995, Hynes 1990, Kasparら、2006)。マウスフィブロネクチン及びヒトフィブロネクチンのED-Aは96.7%同一である(2つの90アミノ酸配列間で3アミノ酸のみが異なる、図2を参照)。
【0006】
フィブロネクチンのED-Aの発現は、腫瘍細胞及び固形腫瘍において、mRNAレベルで乳癌(Jacobsら、2002、Matsumotoら、1999)及び肝癌(Oyamaら、1989、Tavianら、1994)において、単離されたタンパク質レベルで線維肉腫、横紋筋肉腫及びメラノーマ(Borsiら、1987)において報告されている。
【0007】
免疫組織化学レベルでは、ED-Aの存在が、歯原性腫瘍(Heikinheimoら、1991)及び肝細胞癌(Koukoulisら、1995)の細胞外マトリックス(ECM)において検出されている。対照的に、ED-Aは、悪性乳房新生物の間質(Koukoulisら、1993)において、並びに十分に分化した腎細胞癌の血管及び基底膜(Lohiら、1995)において検出されている。しかしながら、低分化の腎細胞癌(Lohiら、1995)及び甲状腺乳頭癌(Scarpinoら、1999)では、ED-Aは血管、基底膜及び腫瘍間質において検出されている。神経膠腫の血管系においてもED-Aの存在が報告されている(Borsiら、1998)。従って、種々のタイプの腫瘍について報告されているED-Aの発現パターンは高度に変動的である。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Taylor, Arthritis Res 2002, 4 Suppl 3:S99-107.
【非特許文献2】Koch et al. Ann Rheum Dis 2003, 62 Suppl 2:ii60-67.
【非特許文献3】Balza et al. (1988), FEBS Lett., 228: 42-44.
【非特許文献4】Carnemolla et al. (1989), J. Cell. Biol., 108: 1139-1148.
【非特許文献5】Borsi et al. (1990), FEBS Lett., 261: 175-178.
【非特許文献6】Borsi et al. (1995), J. Biol.Chem., 270: 6243-6245.
【非特許文献7】ffrench-Constant (1995), Exp. Cell Res., 221, 261-271.
【非特許文献8】Hynes, R.O. (1990). Fibronectins (New York: Springer-Verlag).
【非特許文献9】Kaspar et al. (2006), Int. J. Cancer, 118, 1331-1339.
【非特許文献10】Jacobs et al. (2002), Hum. Pathol., 33, 29-38.
【非特許文献11】Matsumoto et al. (1999), Jpn. J. Cancer Res., 90, 320-325.
【非特許文献12】Oyama et al. (1989), J. Biol. Chem., 264, 10331-10334.
【非特許文献13】Tavian et al. (1994), Int. J. Cancer, 56, 820-825.
【非特許文献14】Borsi et al. (1987), J. Cell. Biol., 104, 595-600.
【非特許文献15】Heikinheimo et al. (1991), Virchows Arch. B Cell Pathol. Incl. Mol. Pathol., 61, 101-109.
【非特許文献16】Koukoulis et al. (1995), Ultrastruct. Pathol., 19, 37-43.
【非特許文献17】Koukoulis et al. (1993), J. Submicrosc. Cytol. Pathol., 25, 285-295.
【非特許文献18】Lohi et al. (1995), Int. J. Cancer, 63, 442-449.
【非特許文献19】Scarpino et al. (1999) J. Pathol. 188, 163-167.
【非特許文献20】Borsi et al. (1998), Exp. Cell Res., 240, 244-251.
【発明の概要】
【0009】
抗体を利用して生体活性薬物を血管形成部位に標的化送達することは、癌の治療のための魅力的な治療手法であるが、慢性炎症疾患についてはほとんど明らかとなっていない。本発明者は以前に、フィブロネクチンのED-Bドメイン、すなわち血管形成のマーカーが、乾癬の患者及び動物モデルにおける乾癬病巣において、並びに関節リウマチのコラーゲン誘導マウスモデルにおける関節炎の肢において発現されていることを証明している。放射性及び蛍光技法の両方を使用して、EDBに特異的なヒトモノクローナル抗体L19が、in vivoにおいて静脈内投与後に炎症部位に選択的に局在化することが見出された。これらの結果は、L19を利用した炎症部位への生体活性化合物の選択的送達のための治療法の候補であることを示唆している(Trachsel, 2007; PCT/EP2007/004044)。
【0010】
in-situハイブリダイゼーションによって、フィブロネクチンのED-B以外のもの、またED-Aドメインがヒト関節炎標本に存在する可能性があることが以前に示されている(Berndtら, 1998; Kriegsmannら, 2004)。
【0011】
本明細書において、抗EDA抗体、例えば本明細書に開示するF8抗体が、抗EDB抗体L19、並びに抗テネイシン-C抗体F16及びG11と比較して、ヒト関節炎標本に対して強い染色パターンを示すことができることを示す。
【0012】
さらに、放射性及び蛍光技法の両方を用いて、ED-Aに特異的なヒトモノクローナル抗体F8が、in vivoにおいて静脈内投与後に炎症部位に選択的に局在化することを見出した。
【0013】
従って、フィブロネクチンのED-Aは関節リウマチの血管マーカーとして適応である。
【0014】
フィブロネクチンのA-FN及び/又はED-Aに結合する抗体分子などの結合分子は、関節リウマチ(RA)の治療のための医薬の製造に用いることができる新規薬剤である。
【0015】
本発明は、関節リウマチの治療のための医薬の製造における、フィブロネクチンのエキストラドメイン-A(ED-A)アイソフォーム(A-FN)に結合する結合メンバー、例えば抗体分子の使用を提供する。また本発明は、関節リウマチの治療のための医薬の製造におけるフィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子の使用を提供する。
【0016】
本発明はさらに、関節リウマチの部位への、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー(例えば、抗体分子)にコンジュゲートされている分子を送達するための該結合メンバーの使用を提供する。また本発明は、関節リウマチの部位への、フィブロネクチンのED-Aに結合する結合メンバー(例えば、抗体分子)とコンジュゲートされている分子を送達するための該結合メンバーの使用を提供する。該結合メンバーは、そのような分子の送達のための医薬の製造のために用いることができる。
【0017】
本発明は、関節リウマチの診断における使用のための診断用製品の製造における、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子の使用を提供する。本発明はまた、関節リウマチの診断における使用のための診断用製品の製造における、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子の使用を提供する。
【0018】
本発明はさらに、ヒト又は動物において関節リウマチを検出又は診断する方法であって、
(a)該ヒト又は動物に、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を投与するステップ、及び
(b)該ヒト又は動物の体の関節リウマチ部位における該結合メンバーの存在又は非存在を決定するステップ、
を含み、関節リウマチ部位への該結合メンバーの局在化が、関節リウマチの存在を示す方法を提供する。
【0019】
本発明は、個体における関節リウマチの治療方法であって、該個体に、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子を含む治療上有効量の医薬を投与することを含む方法を提供する。本発明はまた、個体における関節リウマチの治療方法であって、該個体に、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を含む治療上有効量の医薬を投与することを含む方法を提供する。
【0020】
本発明は、個体における関節リウマチの治療方法であって、該個体に、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子を含む治療上有効量の医薬を投与することを含む方法に使用するための、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子を含む組成物を提供する。本発明はまた、個体における関節リウマチの治療方法であって、該個体に、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を含む治療上有効量の医薬を投与することを含む方法に使用するための、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を含む組成物を提供する。
【0021】
本発明は、ヒト又は動物において関節リウマチ部位の新生血管に分子を送達する方法であって、該ヒト又は動物に、フィブロネクチンのED-Aアイソフォームに結合する結合メンバー、例えば抗体分子を投与することを含み、該結合メンバーが該分子にコンジュゲートされている、上記方法を提供する。また本発明は、ヒト又は動物において関節リウマチ部位の新生血管に分子を送達する方法であって、該ヒト又は動物に、フィブロネクチンのED-Aに結合する結合メンバー、例えば抗体分子を投与することを含み、該結合メンバーが該分子にコンジュゲートされている、上記方法を提供する。
【0022】
本発明において使用する結合メンバーは、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9、又はその変異体の1個以上の相補性決定領域(CDR)を含む、フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに結合する抗体とすることができる。好ましくは、本発明において使用する結合メンバーは、抗体B2、C5、D5、C8、F8、B7若しくはG9、又はその変異体の1個以上の相補性決定領域(CDR)を含む、フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに結合する抗体である。最も好ましくは、本発明において使用する結合メンバーは、抗体F8又はその変異体の1個以上の相補性決定領域(CDR)を含む、フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに結合する抗体である。
【0023】
本発明において使用する結合メンバーは、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9のH及び/若しくはL CDRのセット、又はH及び/若しくはL CDRの開示されたセット内に10個以下、例えば、1、2、3、4、若しくは5個のアミノ酸置換を有する、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9のH及び/若しくはL CDRのセットを含んでもよい。好ましくは、本発明において使用する結合メンバーは、H及び/若しくはL CDRの開示されたセット内に10個以下、例えば、1、2、3、4、若しくは5個のアミノ酸置換を有する、抗体B2、C5、D5、C8、F8、B7若しくはG9のH及び/若しくはL CDRのセットを含む。好ましくは、本発明において使用する結合メンバーは、H及び/若しくはL CDRの開示されたセット内に10個以下、例えば、1、2、3、4若しくは5個のアミノ酸置換を有する、抗体F8のH及び/若しくはL CDRのセットを含む。
【0024】
置換を、CDRのセット内の任意の残基で行うことができる可能性があり、CDR1、CDR2及び/又はCDR3内とすることができる。
【0025】
例えば、本発明において使用する結合メンバーは、本明細書に記載される1個以上のCDR、例えばCDR3と、場合によりCDR1及びCDR2をも含み、CDRのセットを形成してもよい。
【0026】
本発明において使用する結合メンバーはまた、抗体分子、例えばヒト抗体分子を含んでもよい。前記結合メンバーは通常、抗体VH及び/又はVLドメインを含む。結合メンバーのVHドメインも、本発明において使用するために提供される。それぞれのVH及びVLドメイン内には、相補性決定領域(「CDR」)と、フレームワーク領域(「FR」)がある。VHドメインは、HCDRのセットを含み、VLドメインはLCDRのセットを含む。抗体分子は、VH CDR1、CDR2及びCDR3並びにフレームワークを含む抗体VHドメインを含むことができる。あるいは、又はさらに、それはVL CDR1、CDR2及びCDR3並びにフレームワークを含む抗体VLドメインを含んでもよい。抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9のVH及びVLドメイン並びにCDRが本明細書に記載される。本明細書に開示される全てのVH及びVL配列、CDR配列、CDRのセット並びにHCDRのセット及びLCDRのセットは、本発明において使用する結合メンバーの実施形態である。本明細書に記載されるように、「CDRのセット」は、CDR1、CDR2及びCDR3を含む。かくして、HCDRのセットはHCDR1、HCDR2及びHCDR3を指し、LCDRのセットはLCDR1、LCDR2及びLCDR3を指す。特に指摘しない限り、「CDRのセット」はHCDR及びLCDRを含む。
【0027】
本発明において使用する結合メンバーは、相補性決定領域HCDR1、HCDR2及びHCDR3とフレームワークとを含む抗体VHドメインを含んでもよく、ここでHCDR1は配列番号3、23、33、43、53、63、73、83、93、103若しくは113であり、必要に応じて、HCDR2は配列番号4であり、及び/又はHCDR3は配列番号5である。好ましくは、HCDR1は配列番号23、33、43、53、73、83又は103である。最も好ましくは、HCDR1は配列番号83である。
【0028】
典型的には、VHドメインは、VLドメインと対形成して、抗体抗原結合部位を提供するが、以下でさらに考察するように、VH又はVLドメインのみを用いて抗原に結合させることができる。かくして、本発明において使用する結合メンバーは、相補性決定領域LCDR1、LCDR2及びLCDR3とフレームワークとを含む抗体VLドメインをさらに含んでもよく、ここでLCDR1は配列番号6、26、36、46、56、66、76、86、96、106若しくは116であり、必要に応じて、LCDR2は配列番号7であり、及び/又はLCDR3は配列番号8である。好ましくは、LCDR1は配列番号26、36、46、56、76、86又は106である。最も好ましくは、LCDR1は配列番号86である。
【0029】
本発明において使用する結合メンバーは、VHドメインとVLドメインを含む、フィブロネクチンのED-Aに対する単離された抗体分子であり、ここで、VHドメインはフレームワークと、相補性決定領域HCDR1、HCDR2及びHCDR3のセットとを含み、VLドメインは相補性決定領域LCDR1、LCDR2及びLCDR3とフレームワークとを含み、
HCDR1は配列番号3、23、33、43、53、63、73、83、93、103若しくは113のアミノ酸配列を有し、
HCDR2は配列番号4のアミノ酸配列を有し、
HCDR3は配列番号5のアミノ酸配列を有し、
LCDR1は配列番号6、26、36、46、56、66、76、86、96、106若しくは116のアミノ酸配列を有し、
LCDR2は配列番号7のアミノ酸配列を有し、
LCDR3は配列番号8のアミノ酸配列を有する。
【0030】
抗体の1個以上のCDR又はCDRのセットを、フレームワーク(例えば、ヒトフレームワーク)中に移植して、本発明における使用のための抗体分子を提供することができる。フレームワーク領域は、ヒト生殖系列遺伝子断片配列を含んでもよい。かくして、フレームワークを、生殖系列化することができ、ここで、該フレームワーク内の1個以上の残基を変化させて、最も類似するヒト生殖系列フレームワーク中の等価な位置の残基と一致させる。本発明において使用する結合メンバーは、ヒト生殖系列フレームワーク、例えばDP47中にHCDRのセットを含むVHドメインを有する単離された抗体分子であってもよい。通常、前記結合メンバーはまた、例えば、ヒト生殖系列フレームワーク中の、LCDRのセットを含むVLドメインを有する。VLドメインのヒト生殖系列フレームワークはDPK22であってよい。
【0031】
本発明において使用するVHドメインは、配列番号1、21、31、41、51、61、71、81、91、101又は111のアミノ酸配列を有してもよい。好ましくは、本発明において使用するVHドメインは、配列番号21、31、41、51、71、81又は101のアミノ酸配列を有する。最も好ましくは、本発明において使用するVHドメインは、配列番号81のアミノ酸配列を有する。本発明において使用するVLドメインは、配列番号2、22、32、42、52、62、72、82、92、102又は112のアミノ酸を有してもよい。好ましくは、本発明において使用するVLドメインは、配列番号22、32、42、52、72、82又は102のアミノ酸を有する。最も好ましくは、本発明において使用するVLドメインは、配列番号82のアミノ酸を有する。
【0032】
本発明において使用する結合メンバーは、ペプチドリンカーを介して連結されたVHドメインとVLドメインを含む一本鎖Fv(scFv)であってもよいし又はそれを含むものであってもよい。当業者であれば、リンカーの好適な長さ及び配列、例えば、少なくとも5又は10アミノ酸長から約15、20又は25アミノ酸長を選択することができる。リンカーは、アミノ酸配列GSSGG(配列番号28)を有するものであってもよい。scFvは、配列番号9のアミノ酸配列からなるか、又はそれを含んでもよい。
【0033】
一本鎖Fv(scFv)は、ミニイムノグロブリン又は小免疫タンパク質(SIP)、例えばLiら, 1997に記載されているもの内に含まれる。SIPは、ホモダイマーミニイムノグロブリン抗体分子を形成する、ヒトIgE分泌アイソフォームIgE-S2(εS2-CH4; Batistaら, 1996)のCH4ドメインと融合したscFv分子を含む。
【0034】
あるいは、本発明において使用する結合メンバーは、通常、非抗体タンパク質足場中に1個以上のCDR、例えばCDRのセットにより提供される、非抗体分子内の抗原結合部位を含んでもよい。非抗体及び抗体分子などの結合メンバーは、本明細書の他の箇所でより詳細に記載されている。
【0035】
本発明において使用する結合メンバーを、殺菌活性、細胞傷害性免疫抑制活性又は抗炎症活性を有する分子にコンジュゲートさせることができる。インターロイキン-10は、本発明において結合メンバーとコンジュゲートさせるための有利な分子であり、関節リウマチの治療に有用である。さらに、本発明において使用する結合メンバーを、放射性同位体、検出可能な標識又は光増感剤とコンジュゲートすることができる。
【0036】
本発明のこれらの態様及び他の態様を、以下でさらに詳細に説明する。
【図面の簡単な説明】
【0037】
【図1】血管形成のマーカーに対する抗体を用いたヒト関節炎標本の免疫組織化学の結果を示す。暗色の染色は、白矢印で描出されるように、抗原の強力な発現を示している。F8は本明細書で開示するED-Aに結合する抗体分子であり、L19はED-Bに結合する抗体分子(例えばPiniら 1998)であり、F16及びG11はそれぞれテネイシン-CドメインA1及びCに結合する抗体分子である(WO2006/050834号)。
【図2】フィブロネクチンのED-Aドメインに対するF8抗体分子を用いたヒト関節炎標本の免疫蛍光分析の結果を示す。白い染色は抗原の強力な発現を示す。
【図3】A:ヒトED-A(上の配列)とB:マウスED-A(下の配列)とのアラインメントを示す。星印はヒトED-AとマウスED-Aのアミノ酸が同一であるアミノ酸位置を示す。
【図4】A:抗ED-A抗体H1重鎖(VH)のヌクレオチド配列(配列番号12)を示す。抗ED-A抗体H1の重鎖CDR1のヌクレオチド配列に下線を付す。抗ED-A抗体H1の重鎖CDR2のヌクレオチド配列を、斜体かつ下線付きで示す。抗ED-A抗体H1の重鎖CDR3のヌクレオチド配列を、太字かつ下線付きで示す。B:抗ED-A抗体H1リンカー配列のヌクレオチド配列(配列番号14)を示す。C:抗ED-A抗体H1軽鎖(VL)のヌクレオチド配列(配列番号13)を示す。抗ED-A抗体H1の軽鎖CDR1のヌクレオチド配列に下線を付す。抗ED-A抗体H1の軽鎖CDR2のヌクレオチド配列を、斜体かつ下線付きで示す。抗ED-A抗体H1の軽鎖CDR3のヌクレオチド配列を、太字かつ下線付きで示す。
【図5】A:抗ED-A抗体H1重鎖(VH)のアミノ酸配列(配列番号1)を示す。抗ED-A抗体H1の重鎖CDR1のアミノ酸配列(配列番号3)に下線を付す。抗ED-A抗体H1の重鎖CDR2のアミノ酸配列(配列番号4)を、斜体かつ下線付きで示す。抗ED-A抗体H1の重鎖CDR3のアミノ酸配列(配列番号5)を、太字かつ下線付きで示す。B:抗ED-A抗体H1リンカー配列のアミノ酸配列(配列番号11)を示す。C:抗ED-A抗体H1軽鎖(VL)のアミノ酸配列(配列番号2)を示す。抗ED-A抗体H1の軽鎖CDR1のアミノ酸配列(配列番号6)に下線を付す。抗ED-A抗体H1の軽鎖CDR2のアミノ酸配列(配列番号7)を、斜体かつ下線付きで示す。抗ED-A抗体H1の軽鎖CDR3のアミノ酸配列(配列番号8)を、太字かつ下線付きで示す。
【図6】F8-IL10のコード配列を含む核酸構築物の配列を示す。構造は、HINDIII分泌配列F8(14aaリンカー)リンカー(SSSSG)3-IL10-Stop-NotIであり、以下の通りである:HINDIII制限部位は下線付きであり、分泌シグナルをコードする配列は斜体であり、F8 VHコード配列は、分泌シグナル配列の後の太字であり、14アミノ酸リンカーをコードする配列は小文字であり、F8 VLコード配列は、14アミノ酸リンカー配列の後の太字であり、リンカー(SSSSG)3配列は、斜体かつ下線付きのF8コード配列の後であり、IL-10コード配列は二重下線付きであり、続いて停止が小文字であり、その後に下線付きのNOTI制限部位である。
【図7】構造:VH-リンカー-VL-リンカー-IL-10の、リンカーを含む、抗体scFv(F8)IL-10コンジュゲートのアミノ酸配列を示す。VH及びVLドメインは太字であり、scFvリンカーは小文字であり、scFvとIL10の間のリンカーは小文字かつ斜体であり、IL-10配列は下線付きである。
【図8】F8-IL10及びHyHel10-IL10のクローニング、発現及び精製を説明する。図8aは、F8-IL10融合タンパク質のエレメントを含有するpcDNA3.1ベクターの略図を示す。ヒトIL10部分は、15アミノ酸リンカー(SSSSG)3によりscFv抗体フラグメントのC末端と融合した。N末端における分泌配列は、組換えタンパク質の分泌に必要である。図8bは、精製された融合タンパク質のSDS-PAGE分析の結果を示す。レーン1:分子量マーカー;レーン2及び3:非還元条件下及び還元条件下におけるF8-IL10。モノマー融合タンパク質は分子量46kDaを有すると予想される。図8cは、精製されたF8-IL10のサイズ排除クロマトグラフィプロフィールを示す(Superdex 200)。13mlの保持容量におけるピーク溶出は、F8-IL10の非共有結合ホモダイマー形態に相当し、14mlの保持容量における小さなピーク溶出は、モノマー画分に相当する。図8dは、F8-IL10の活性アッセイの結果を示す。F8-IL10の活性を、MC/9細胞に対する組換えヒトIL10の活性と比較した。
【発明を実施するための形態】
【0038】
用語
フィブロネクチン
フィブロネクチンは、選択的スプライシングを受ける抗原であり、本明細書の他の箇所に記載されるように、フィブロネクチンのいくつかの代替的アイソフォームが公知である。エキストラドメインA(EDA又はED-A)はまた、ED、エキストラIII型リピートA(EIIIA)又はEDIとしても公知である。ヒトED-Aの配列は、Kornblihttら(1984)、Nucleic Acids Res. 12, 5853-5868及びPaolellaら(1988)、Nucleic Acids Res. 16, 3545-3557により公開されている。ヒトED-Aの配列は、アクセッション番号P02751で登録されたアミノ酸配列のアミノ酸1631〜1720(フィブロネクチンIII型12;エキストラドメイン2)としてSwissProtデータベース上でも入手可能である。マウスED-Aの配列は、アクセッション番号P11276で登録されたアミノ酸配列のアミノ酸1721〜1810(フィブロネクチンIII型13;エキストラドメイン2)としてSwissProtデータベース上で入手可能である。
【0039】
フィブロネクチンのED-Aアイソフォーム(A-FN)は、エキストラドメインA(ED-A)を含む。ヒトA-FNの配列は、アクセッション番号P02751でSwissProtデータベース上で入手可能である対応するヒトフィブロネクチン前駆体配列から推定することができる。マウスA-FNの配列は、アクセッション番号P11276でSwissProtデータベース上で入手可能である対応するマウスフィブロネクチン前駆体配列から推定することができる。A-FNは、フィブロネクチンのヒトED-Aアイソフォームであってもよい。ED-AはヒトフィブロネクチンのエキストラドメインAであってもよい。
【0040】
ED-Aは、選択的スプライシングによりフィブロネクチン(FN)中に挿入され、FNのドメイン11と12の間に位置する90アミノ酸の配列である(Borsiら、1987, J. Cell Biol., 104, 595-600)。ED-Aは主として、FNの血漿形態中には存在しないが、胚形成、組織再モデリング、線維症、心臓移植及び固形腫瘍増殖の間には豊富である。
【0041】
選択的スプライシング
選択的スプライシングとは、異なるmRNAを産生するDNAの一次RNA転写物のスプライシングの異なるパターンの出現を指す。イントロンの切り出し後、選択は、どのエクソンが一緒にスプライシングされてmRNAを形成するかを決定することができる。選択的スプライシングは、異なるエクソン及び/又は異なる数のエクソンを含む異なるアイソフォームの産生を誘導する。例えば、1個のアイソフォームは、1個以上のドメインを含んでもよい、1個以上のエクソンに対応する追加のアミノ酸配列を含んでもよい。
【0042】
結合メンバー
これは、互いに結合する一対の分子の一方のメンバーを説明するものである。結合対のメンバーは、天然由来であっても、又は全体的若しくは部分的に合成により作製されたものであってもよい。前記対の分子の一方のメンバーは、その表面上、又は空洞上に、前記対の分子の他方のメンバーの特定の空間構造及び極性構造に結合し、従ってそれと相補的である領域を有する。結合対の型の例は、抗原−抗体、ビオチン−アビジン、ホルモン−ホルモン受容体、受容体−リガンド、酵素−基質である。本発明は、抗原−抗体型反応に関する。
【0043】
結合メンバーは通常、抗原結合部位を有する分子を含む。例えば、結合メンバーは、抗原結合部位を含む抗体分子又は非抗体タンパク質であってよい。
【0044】
抗原結合部位を、フィブロネクチン若しくはシトクロムBなどの非抗体タンパク質足場上の相補性決定領域(CDR)の配置を用いて(Haan & Maggos, 2004; Koide 1998; Nygren 1997)、又はタンパク質足場内のループのアミノ酸残基を無作為化するか、若しくは突然変異させて、所望の標的に対する結合特異性を付与することにより、提供することができる。タンパク質中で新規結合部位を操作するための足場は、Nygrenら(1997)により詳細に概説されている。抗体模倣物質のためのタンパク質足場は、その全体が参照により本明細書に組み入れられるものとするWO 00/34784号に開示されており、発明者らは少なくとも1個の無作為化されたループを有するフィブロネクチンIII型ドメインを含むタンパク質(抗体模倣物質)を記載している。1個以上のCDR、例えばHCDRのセットを移植するのに好適な足場を、免疫グロブリン遺伝子スーパーファミリーの任意のドメインメンバーにより提供することができる。この足場はヒト又は非ヒトタンパク質であってよい。非抗体タンパク質足場の利点は、それが、少なくともいくつかの抗体分子よりも小さく、及び/又は製造が容易である足場分子中に抗原結合部位を提供することができることである。小さいサイズの結合メンバーは、細胞に進入する能力、組織中に深く浸透するか、若しくは他の構造内の標的に到達する能力、又は標的抗原のタンパク質空洞内に結合する能力などの有用な生理学的特性を付与することができる。非抗体タンパク質足場中での抗原結合部位の使用は、Wess, 2004に概説されている。安定な主鎖及び1個以上の可変ループを有するタンパク質が典型的であり、ループのアミノ酸配列を特異的若しくは無作為に突然変異させて、標的抗原に結合する抗原結合部位を作製する。そのようなタンパク質としては、黄色ブドウ球菌(S. aureus)由来プロテインAのIgG結合ドメイン、トランスフェリン、テトラネクチン、フィブロネクチン(例えば、第10フィブロネクチンIII型ドメイン)及びリポカリンが挙げられる。他の手法としては、分子内ジスルフィド結合を有する小タンパク質であるシクロチドに基づく合成「ミクロボディ」(Selecore GmbH)が挙げられる。
【0045】
抗体配列及び/又は抗原結合部位に加えて、本発明において使用する結合メンバーは、例えば、折り畳まれたドメインなどのペプチド若しくはポリペプチドを形成するか、又は抗原に結合する能力に加えて、該分子に別の機能的特性を与える他のアミノ酸を含んでもよい。本発明において使用する結合メンバーは検出可能な標識を担持してもよく、又は毒素若しくは標的化部分若しくは酵素にコンジュゲートさせることができる(例えば、ペプチド結合若しくはリンカーを介して)。例えば、結合メンバーは、触媒部位(例えば、酵素ドメイン中)及び抗原結合部位を含んでもよく、該抗原結合部位は該抗原に結合し、かくして、該触媒部位を該抗原に標的化する。触媒部位は、例えば切断により、抗原の生物学的機能を阻害することができる。
【0046】
注記されるように、CDRを非抗体足場により担持することができるが、CDR若しくはCDRのセットを担持させるための構造は、一般的にはCDR若しくはCDRのセットが、再配列された免疫グロブリン遺伝子によりコードされる天然のVH及びVL抗体可変ドメインのCDR若しくはCDRのセットに対応する位置に位置する抗体重鎖若しくは軽鎖配列又はその実質的な部分であろう。免疫グロブリン可変ドメインの構造及び位置を、Kabat 1987及び現在ではインターネット上(immuno.bme.nwu.edu又は任意の検索エンジンを用いて「Kabat」を検索する)で入手可能なそのアップデート版を参照することにより決定することができる。
【0047】
CDR領域又はCDRとは、Kabatら(1987)(Kabat 1991a、及びそれより後の版)により定義された免疫グロブリンの重鎖及び軽鎖の超可変領域を示すと意図される。抗体は、典型的には3個の重鎖CDRと3個の軽鎖CDRを含む。用語「CDR」は、本明細書では、必要に応じて、抗原若しくは抗体が認識するエピトープに対する抗体の親和性により、結合を担うアミノ酸残基の大部分を含むこれらの領域の1つ若しくはいくつか、又はこれらの領域の全部をも示すように用いられる。
【0048】
6個の短いCDR配列のうち、重鎖の3番目のCDR(HCDR3)は、より大きい程度の可変性を(それを生じる遺伝子の配置の機構に本質的に依存するより高い多様性)を有する。公知の最も長いサイズは26であるが、それは2アミノ酸の短さであってもよい。機能的には、HCDR3は抗体の特異性の決定において役割を果たしている(Segal 1974; Amit 1986; Chothia 1987; Chothia 1989; Caton 1990; Sharon 1990a; Sharon 1990b; Kabatら、1991b)。
【0049】
抗体分子
これは、天然に産生された、又は部分的若しくは全体的に合成により作製された免疫グロブリンを説明する。この用語はまた、抗体抗原結合部位を含む任意のポリペプチド又はタンパク質に関する。本発明は天然形態の抗体に関するものではない、すなわち、それらはその天然の環境にはないが、それらを天然の起源からの精製により単離若しくは取得するか、又は他に遺伝子組換え、若しくは化学的合成により取得することができたものであること、並びにその後、それらが、後に記載するように非天然アミノ酸を含んでもよいことを理解すべきである。抗体抗原結合部位を含む抗体フラグメントとしては、限定されるものではないが、Fab、Fab'、Fab'-SH、scFv、Fv、dAb、Fdなどの抗体分子;並びにダイアボディが挙げられる。
【0050】
モノクローナル抗体及び他の抗体を取得し、組換えDNA技術の技法を用いて、標的抗原に結合する他の抗体又はキメラ分子を作製することができる。そのような技術は、抗体の、免疫グロブリン可変領域、若しくはCDRをコードするDNAを、異なる免疫グロブリンの定常領域、若しくは定常領域+フレームワーク領域に導入することを含んでもよい。例えば、EP-A-184187、GB 2188638A又はEP-A-239400、及びその後の多数の文献を参照されたい。ハイブリドーマ又は抗体を産生する他の細胞を、産生される抗体の結合特異性を変化させてもさせなくてもよい遺伝子突然変異又は他の変化に供することができる。
【0051】
抗体を多くの方法で改変することができるため、用語「抗体分子」は、抗原に対する必要な特異性及び/又は結合を有する抗体抗原結合部位を有する任意の結合メンバー又は物質を包含すると解釈されるべきである。かくして、この用語は、天然のものであるか、又は全体的若しくは部分的に合成された、抗体抗原結合部位を含む任意のポリペプチドを含む、抗体フラグメント及び誘導体を包含する。従って、別のポリペプチド(例えば、別の種に由来するか、又は別の抗体クラス若しくはサブクラスに属するもの)に融合された、抗体抗原結合部位、又はその等価物を含むキメラ分子も含まれる。キメラ抗体のクローニング及び発現は、EP-A-0120694及びEP-A-0125023、並びにその後の多数の文献に記載されている。
【0052】
抗体工学の分野で利用可能なさらなる技術により、ヒト抗体及びヒト化抗体を単離することが可能になった。例えば、ヒトハイブリドーマを、Kontermann & Dubel (2001)により記載のように作製することができる。結合メンバーを作製するための別の確立された技術であるファージディスプレイは、WO 92/01047号(以下でさらに考察する)並びに米国特許第5,969,108号、第5,565,332号、第5,733,743号、第5,858,657号、第5,871,907号、第5,872,215号、第5,885,793号、第5,962,255号、第6,140,471号、第6,172,197号、第6,225,447号、第6,291,650号、第6,492,160号、第6,521,404号及びKontermann & Dubel (2001)などの多くの刊行物に詳細に記載されている。マウス免疫系の他の成分を無傷のままにしながら、マウス抗体遺伝子を不活化し、ヒト抗体遺伝子と機能的に置換するトランスジェニックマウスを、ヒト抗体を単離するために用いることができる(Mendez 1997)。
【0053】
例えば、Knappikら(2000)又はKrebsら(2001)により記載のように、好適な発現ベクター内で合成及び集合されたオリゴヌクレオチドを用いて作製された遺伝子からの発現により、合成抗体分子を作製することができる。
【0054】
全抗体のフラグメントは、抗原に結合する機能を実行することができることが示されている。結合フラグメントの例は、(i)VL、VH、CL及びCH1ドメインからなるFabフラグメント;(ii)VH及びCH1ドメインからなるFdフラグメント;(iii)単一抗体のVL及びVHドメインからなるFvフラグメント;(iv)VH若しくはVLドメインからなるdAbフラグメント(Ward 1989; McCafferty 1990; Holt 2003);(v)単離されたCDR領域;(vi)2個の連結されたFabフラグメントを含む二価フラグメントであるF(ab')2フラグメント;(vii)VHドメインとVLドメインが、2個のドメインが結合して抗原結合部位を形成するようにペプチドリンカーにより連結された一本鎖Fv分子(scFv)(Bird 1988; Huston 1988);(viii)二重特異性一本鎖Fvダイマー(PCT/US92/09965)、並びに(ix)遺伝子融合により構築された多価若しくは多重特異性フラグメントである「ダイアボディ」(WO 94/13804号; Holliger 1993a)である。Fv、scFv又はダイアボディ分子を、VH及びVLドメインを連結するジスルフィド架橋の組込みにより安定化することができる(Reiter 1996)。CH3ドメインに連結されたscFvを含むミニボディを作製することもできる(Hu 1996)。結合フラグメントの他の例は、抗体ヒンジ領域に由来する1個以上のシステインを含む、重鎖CH1ドメインのカルボキシル末端での数残基の付加によりFabフラグメントとは異なるFab'、並びに定常ドメインのシステイン残基が遊離チオール基を担持するFab'フラグメントである、Fab'-SHである。
【0055】
本発明において使用する抗体フラグメントは、ペプシン若しくはパパインなどの酵素による消化並びに/又は化学的還元によるジスルフィド架橋の切断などの方法により、本明細書に記載の抗体分子のいずれか、例えば、本明細書に記載の任意の抗体のVH及び/若しくはVLドメイン又はCDRを含む抗体分子から出発して取得することができる。別の方法では、本発明の抗体フラグメントは、同様に当業者に周知の遺伝子組換え技術により、又は他に例えば、Applied Biosystemsなどの企業により供給されるものなどの自動ペプチド合成装置を用いるペプチド合成により、又は核酸合成及び発現により取得することができる。
【0056】
本発明において機能的抗体フラグメントとしては、半減期が化学的修飾、特にPEG付加により、又はリポソーム中への組込みにより増加した、任意の機能的フラグメントが挙げられる。
【0057】
dAb(ドメイン抗体)は、抗体の小さいモノマー抗原結合フラグメント、すなわち、抗体重鎖又は軽鎖の可変領域である(Holt 2003)。VH dAbはラクダ科動物(例えば、ラクダ、ラマ)において天然に生じ、ラクダ科動物を標的抗原で免疫し、抗原特異的B細胞を単離し、個々のB細胞からdAb遺伝子を直接クローニングすることにより製造することができる。dAbは細胞培養物中でも製造可能である。その小さいサイズ、良好な溶解性及び温度安定性により、それらは特に生理学的に有用となり、選択及び親和性成熟にとって好適となる。本発明の結合メンバーは、実質的に本明細書に記載のVH若しくはVLドメイン、又は実質的に本明細書に記載のCDRのセットを含むVH若しくはVLドメインを含むdAbであってよい。
【0058】
本明細書で用いられる用語「実質的に記載の」とは、本明細書に記載の結合メンバーのVH若しくはVLドメインの関連するCDRの特徴が、該配列が本明細書に記載される特定の領域と同一であるか、又は高度に類似していることを意味する。1個以上の可変ドメインの特定の領域に関して、本明細書で用いられる用語「高度に類似する」は、1〜約5、例えば1〜4、例えば1〜3、又は1若しくは2、又は3若しくは4個のアミノ酸置換を、該CDR及び/又はVH若しくはVLドメイン中で行うことができると意図される。
【0059】
二重特異性又は二官能性抗体は、2個の異なる可変領域が同じ分子中で組み合わされた第2世代のモノクローナル抗体を形成する(Holliger 1999)。その使用は、新しいエフェクター機能を動員するか、又は腫瘍細胞の表面上のいくつかの分子を標的化する能力から、診断分野及び治療分野の両方において証明されてきた。二重特異性抗体を用いる場合、これらは様々な方法(Holliger 1993b)により製造する、例えば、化学的に調製するか、若しくはハイブリッドハイブリドーマから調製することができる従来の二重特異性抗体であってよく、又は上記の二重特異性抗体フラグメントのいずれかであってよい。これらの抗体を、化学的方法(Glennie 1987; Repp 1995)又は体細胞法(Staerz 1986; Suresh 1986)により取得することができるが、同様にヘテロダイマー化を強制し、かくして求められる抗体の精製プロセスを容易にする遺伝子操作技術(Merchand 1998)により取得することもできる。二重特異性抗体の例としては、異なる特異性を有する2個の抗体の結合ドメインを使用し、短い可撓性ペプチドを介して直接連結することができるBiTETM技術のものが挙げられる。これは短い単一のポリペプチド鎖上で2個の抗体を結合させるものである。ダイアボディ及びscFvを、Fc領域を用いずに、可変ドメインのみを用いて構築し、抗イディオタイプ反応の効果を潜在的に低下させることができる。
【0060】
二重特異性抗体を、完全なIgG、二重特異性Fab'2、Fab'PEG、ダイアボディ又は他に二重特異性scFvとして構築することができる。さらに、2個の二重特異性抗体を、当業界で公知の慣用の方法を用いて連結して、四価抗体を形成することができる。
【0061】
二重特異性全抗体とは反対に、二重特異性ダイアボディは、容易に構築し、大腸菌中で発現させることができるため、特に有用でもある。好適な結合特異性のダイアボディ(及び抗体フラグメントなどの多くの他のポリペプチド)を、ライブラリーからファージディスプレイ(WO 94/13804号)を用いて容易に選択することができる。ダイアボディの一方のアームを、例えば、標的抗原に対する特異性と共に一定に保持しようとする場合、他方のアームを変化させたライブラリーを作製し、好適な特異性の抗体を選択することができる。二重特異性全抗体を、Ridgeway 1996に記載の選択的遺伝子操作方法により作製することができる。
【0062】
標的抗原に対する抗体を取得するための様々な方法が当業界で利用可能である。前記抗体は、特にヒト、マウス、キメラ又はヒト化起源のモノクローナル抗体であってよく、当業者に周知の標準的な方法に従って取得することができる。
【0063】
一般的には、特にマウス起源のモノクローナル抗体又はその機能的フラグメントの調製のためには、特に、入門書「Antibodies」(Harlow及びLane 1988)に記載された技術、又はKohler及びMilstein, 1975により記載されたハイブリドーマからの調製の技術を参照することができる。
【0064】
モノクローナル抗体は、例えば、A-FN、又は前記モノクローナル抗体により認識されるエピトープを含むその断片の1つ、例えばED-A若しくはED-Aのペプチド断片を含む又はそれからなる断片に対して免疫された動物細胞から取得することができる。A-FN、又はその断片の1つを、特にA-FN若しくはその断片をコードするcDNA配列に含まれる核酸配列から開始する遺伝子組換えにより、A-FN及び/若しくはその断片のペプチド配列に含まれるアミノ酸の配列から開始するペプチド合成により、通常の作業方法に従って製造することができる。
【0065】
モノクローナル抗体は、例えば、A-FN又は該モノクローナル抗体により認識されるエピトープを含むその断片の1つ、例えばED-A若しくはED-Aのペプチド断片を含む又はそれからなる断片が予め固定されたアフィニティカラム上で精製することができる。モノクローナル抗体は、プロテインA及び/若しくはGを用いたクロマトグラフィー、次いで、必要に応じて、それ自身の中の、残留タンパク質夾雑物並びにDNA及びLPSを排除することを目的とするイオン交換クロマトグラフィー、次いで、必要に応じて、ダイマー若しくは他のマルチマーの存在に起因する潜在的な凝集物を排除するためのセファロースゲルを用いた排除クロマトグラフィーにより、精製することができる。これらの技術の全部を、同時に又は連続的に用いることができる。
【0066】
抗原結合部位
これは標的抗原の全部又は一部に結合し、かつこれと相補的である分子の部分を説明する。抗体分子中では、これを抗体抗原結合部位と呼び、標的抗原の全部又は一部に結合し、かつこれと相補的である抗体の部分を含む。抗原が大きい場合、抗体は該抗原の特定の部分にのみ結合することができ、その部分をエピトープと呼ぶ。抗体抗原結合部位を、1個以上の抗体可変ドメインにより提供することができる。抗体抗原結合部位は、抗体軽鎖可変領域(VL)と抗体重鎖可変領域(VH)を含んでもよい。
【0067】
単離された
これは、本発明において使用する結合メンバー又はそのような結合メンバーをコードする核酸が、一般的には本発明に係るものである状態を指す。かくして、本発明の結合メンバー、VH及び/又はVLドメインを、例えば、その天然の環境から、実質的に純粋な、若しくは均質な形態で、又は核酸の場合、必要な機能を有するポリペプチドをコードする配列以外の起源の核酸若しくは遺伝子を含まないか若しくは実質的に含まない状態で、単離及び/又は精製して提供することができる。単離されたメンバー及び単離された核酸は、それらがその天然の環境中に、又は調製がin vitro若しくはin vivoで実行される組換えDNA技術による場合、それらが調製される環境(例えば、細胞培養物)中に、見とめられる他のポリペプチド若しくは核酸などの、それらが天然に結合する材料を含まないか、又は実質的に含まないであろう。メンバー及び核酸を、希釈剤若しくはアジュバントと共に製剤化し、さらなる実用的な目的のために、単離することができる。例えば、前記メンバーを、イムノアッセイにおける使用のためにマイクロタイタープレートをコーティングするのに用いる場合には、通常はゼラチン若しくは他の担体と混合し、あるいは診断若しくは治療において用いる場合には、製薬上許容し得る担体若しくは希釈剤と混合することができる。結合メンバーを、天然に、若しくは異種真核細胞の系(例えば、CHO若しくはNS0(ECACC 85110503)細胞)によりグリコシル化するか、又はそれらを非グリコシル化(例えば、原核細胞中での発現により製造する場合)することができる。
【0068】
抗体分子を含む異種調製物も本発明において使用することができる。例えば、そのような調製物は、様々な程度の糖鎖付加及び/又はピログルタミン酸残基を形成するN末端グルタミン酸の環化などの誘導体化されたアミノ酸を有する、完全長重鎖及びC末端リジンを欠く重鎖を有する抗体の混合物であってもよい。
【0069】
抗原、例えば、フィブロネクチンのA-FN又はED-Aのための1個以上の結合メンバーは、本発明に係る結合メンバーのライブラリーと、該抗原又はその断片、例えば、ED-A若しくはED-Aのペプチド断片を含む又はそれからなる断片とを接触させ、該抗原に結合することができるライブラリーの1個以上の結合メンバーを選択することにより取得することができる。
【0070】
抗体ライブラリーを、反復コロニーフィルタースクリーニング(Iterative Colony Filter Screening (ICFS))を用いてスクリーニングすることができる。ICFSにおいては、いくつかの結合特異性をコードするDNAを含む細菌を液体培地中で増殖させ、指数増殖期に到達したら、それらのうちの数十億個を、好適に予備処理された膜フィルターからなる増殖支持体上に分布させ、完全にコンフルエントの細菌コロニーが出現するまでインキュベートする。第2のトラップ基板は、予め加湿され、所望の抗原で被覆された別の膜フィルターからなる。
【0071】
次いで、このトラップ膜フィルターを、好適な培養培地を含むプレート上に置き、上を指している細菌コロニーで被覆された表面を有する増殖フィルターで被覆する。かくして得られたサンドイッチを、室温で約16時間インキュベートする。かくして、トラップ膜上に存在する抗原と特異的に結合する、拡散作用を有する抗体フラグメントscFvがトラップされるため、それらをコードする遺伝子の発現を得ることができる。次いで、トラップ膜を、この目的に一般的に用いられる比色分析技術を用いて、結合した抗体フラグメントscFvを指摘するために処理する。
【0072】
トラップフィルター上の着色スポットの位置により、増殖膜上に存在し、トラップされた抗体フラグメントを産生した対応する細菌コロニーに戻すことができる。そのようなコロニーを収穫し、増殖させて、200〜300万個の細菌を新しい培養膜上に分布させ、上記手順を繰り返す。次いで、トラップ膜上の陽性シグナルが、それぞれ、選択に用いられる抗原に対するモノクローナル抗体フラグメントの起源となる可能性がある、1個の陽性コロニーに一致するまで、同様のサイクルを実行する。ICFSは、例えば、参照により本明細書に組み入れられるものとするWO0246455号に記載されている。また、ライブラリーを、粒子若しくは分子複合体、例えばバクテリオファージ(例えば、T7)粒子などの複製可能な遺伝子パッケージ、又はそれぞれの粒子若しくは分子複合体が、その上にディスプレイされる抗体VH可変ドメイン、及び必要に応じて、存在する場合、ディスプレイされるVLドメインをもコードする核酸を含む他のin vitroディスプレイ系上にディスプレイさせることができる。ファージディスプレイは、WO 92/01047号、並びに米国特許第5,969,108号、第5,565,332号、第5,733,743号、第5,858,657号、第5,871,907号、第5,872,215号、第5,885,793号、第5,962,255号、第6,140,471号、第6,172,197号、第6,225,447号、第6,291,650号、第6,492,160号及び第6,521,404号に記載されており、それぞれその全体が参照により本明細書に組み入れられるものとする。
【0073】
抗原に結合することができ、バクテリオファージ又は他のライブラリー粒子若しくは分子複合体上にディスプレイされた結合メンバーの選択後、その選択された結合メンバーをディスプレイするバクテリオファージ又は他の粒子若しくは分子複合体から核酸を取得することができる。前記選択された結合メンバーをディスプレイするバクテリオファージ又は他の粒子若しくは分子複合体から取得された核酸の配列を有する核酸からの発現により、結合メンバー又は抗体VH若しくはVL可変ドメインのその後の製造において、そのような核酸を用いることができる。
【0074】
前記選択された結合メンバーの抗体VH可変ドメインのアミノ酸配列を有する抗体VH可変ドメインを、単離された形態で提供することができ、同様にそのようなVHドメインを含む結合メンバーも提供することができる。
【0075】
フィブロネクチンのA-FN若しくはED-A又は他の標的抗原若しくはアイソフォームに結合する能力、例えば、A-FN又はA-FNの断片、例えばフィブロネクチンのED-Aへの結合について抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9のいずれか1個と競合する能力を、さらに試験することができる。
【0076】
本発明において使用する結合メンバーは、フィブロネクチンのA-FN及び/又はED-Aに特異的に結合することができる。本発明の結合メンバーは、例えば、scFv形式の抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9と同じ親和性で、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。本発明において使用する結合メンバーは、3×10-8 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。好ましくは、本発明において使用する結合メンバーは、2×10-8 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。より好ましくは、本発明において使用する結合メンバーは、1.7×10-8 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。さらにより好ましくは、本発明において使用する結合メンバーは、1.4×10-8 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。最も好ましくは、本発明において使用する結合メンバーは、3×10-9 MのKDで、又はより良好な親和性で、フィブロネクチンのA-FN及び/又はED-Aに結合することができる。
【0077】
本発明の結合メンバーは、抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9と、フィブロネクチンのA-FN及び/又はED-A上の同じエピトープに結合することができる。
【0078】
本発明において使用する結合メンバーは、フィブロネクチンのA-FN及び/又はED-A以外の分子への有意な結合を示さなくてもよい。特に、該結合メンバーはフィブロネクチンの他のアイソフォーム、例えばフィブロネクチンのED-Bアイソフォーム及び/又はIIICSアイソフォームに結合しなくてもよい。
【0079】
本明細書で開示される抗体分子の変異体を作製し、本発明において用いることができる。CDR、抗体VH若しくはVLドメイン及び結合メンバーのアミノ酸配列内に置換を作製するのに必要な技術は、一般的には、当業界で利用可能である。活性に対する最小の若しくは有益な効果を有すると予測される又はされない置換を有する変異体配列を作製し、フィブロネクチンのA-FN及び/若しくはED-Aに結合する能力について、並びに/又は任意の他の所望の特性について試験することができる。
【0080】
その配列が本明細書に具体的に開示されたVH及びVLドメインのいずれかの可変ドメインアミノ酸配列変異体を、考察されるように、本発明において用いることができる。特定の変異体は、1個以上のアミノ酸配列変化(アミノ酸残基の付加、欠失、置換及び/若しくは挿入)を含んでもよく、それは約20個以下の変化、約15個以下の変化、約10個以下の変化又は約5個以下の変化であってもよく、5、4、3、2又は1個の変化であってもよい。変化を、1個以上のフレームワーク領域及び/又は1個以上のCDR中で作製することができる。この変化は通常、機能の喪失をもたらさず、かくして変化したアミノ酸配列を含む結合メンバーはフィブロネクチンのA-FN及び/又はED-Aに結合する能力を保持することができる。それは、例えば、本明細書に記載のアッセイにおいて測定した場合に、変化が作製されていない結合メンバーと同じ定量的結合を保持することができる。かくして変化したアミノ酸配列を含む結合メンバーは、フィブロネクチンのA-FN及び/又はED-Aに結合する改善された能力を有し得る。
【0081】
本発明において使用するためのCDR由来配列を担持する新規VH又はVL領域を、1個以上の選択されたVH及び/又はVL遺伝子の無作為突然変異誘発を用いて作製して、可変ドメイン全体内に突然変異を作製することができる。いくつかの実施形態においては、1又は2個のアミノ酸置換を、可変ドメイン全体又はCDRのセット内に作製する。用いることができる別の方法は、VH又はVL遺伝子のCDR領域に対して突然変異誘発を指令することである。
【0082】
上記のように、本明細書に実質的に記載されたCDRアミノ酸配列を、ヒト抗体可変ドメイン又はその実質的な部分中にCDRとして担持させることができる。本明細書に実質的に記載されたHCDR3配列は、本発明の実施形態であり、例えば、これらの各々を、ヒト重鎖可変ドメイン又はその実質的な部分中にHCDR3として担持させることができる。
【0083】
本発明において用いられる可変ドメインは、任意の生殖系列若しくは再配列されたヒト可変ドメインから取得若しくは誘導することができるか、又はそれらは公知のヒト可変ドメインの共通配列若しくは実際の配列に基づく合成可変ドメインであってもよい。可変ドメインを、非ヒト抗体から誘導することができる。本発明において使用するためのCDR配列(例えば、CDR3)を、組換えDNA技術を用いて、CDR(例えば、CDR3)を欠く可変ドメインのレパートリー中に導入することができる。例えば、Marksら(1992)は、可変ドメイン領域の5'末端に対する若しくはそれに隣接する共通プライマーを、ヒトVH遺伝子の第3のフレームワーク領域に対する共通プライマーと共に用いて、CDR3を欠くVH可変ドメインのレパートリーを提供する、抗体可変ドメインのレパートリーを製造する方法を記載している。Marksらはさらに、このレパートリーを特定の抗体のCDR3と結合させる方法を記載している。同様の技術を用いて、本発明のCDR3由来配列を、CDR3を欠くVH若しくはVLドメインのレパートリーを用いてシャッフルし、シャッフルされた完全なVH若しくはVLドメインを、同族のVL若しくはVHドメインと結合させて、本発明において使用する結合メンバーを提供することができる。次いで、このレパートリーを、WO 92/01047号(その全体が参照により本明細書に組み入れられるものとする)、又はKay, Winter & McCafferty (1996)などのその後の多数の文献に記載のファージディスプレイ系などの好適な宿主系においてディスプレイし、好適な結合メンバーを選択することができる。レパートリーは、104個以上の任意の数のメンバー、例えば、少なくとも105個、少なくとも106個、少なくとも107個、少なくとも108個、少なくとも109個又は少なくとも1010個のメンバーからなっていてもよい。
【0084】
同様に、1種以上の、又は3種全部のCDRを、VH又はVLドメインのレパートリー中に移植した後、フィブロネクチンのA-FN及び/又はED-Aに対する結合メンバーについてスクリーニングすることができる。
【0085】
抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9の1種以上のHCDR1、HCDR2及びHCDR3、又はHCDRのセットを用いることができ、並びに/あるいは抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9の1種以上のX LCDR1、LCDR2及びLCDR3又は抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8若しくはG9のLCDRのセットを用いることができる。
【0086】
同様に、本明細書に開示された他のVH及びVLドメイン、CDRのセット並びにHCDRのセット及び/若しくはLCDRのセットを用いることができる。
【0087】
フィブロネクチンのA-FN及び/又はED-Aは、関節リウマチの治療のための医薬の製造における使用のために、結合メンバー、例えば抗体分子についてのスクリーニングにおいて用いることができる。このスクリーニングは、本明細書の他箇所に開示されたレパートリーのスクリーニングであってもよい。
【0088】
免疫グロブリン可変ドメインの実質的部分は、その介在フレームワーク領域と共に、少なくとも3個のCDR領域を含みうる。この部分はまた、第1及び第4のフレームワーク領域のいずれか若しくは両方の少なくとも約50%を含み、その50%は第1のフレームワーク領域のC末端の50%及び第4のフレームワーク領域のN末端の50%である。前記可変ドメインの実質的部分のN末端若しくはC末端のさらなる残基は、通常は天然の可変ドメイン領域と結合しないものであってよい。例えば、組換えDNA技術により作製された本発明の結合メンバーの構築は、クローニング又は他の遺伝子操作ステップを容易にするために導入されるリンカーによりコードされるN若しくはC末端残基の導入をもたらし得る。他の遺伝子操作ステップは、本発明の他箇所で開示された可変ドメインを、他のタンパク質配列、例えば抗体定常領域、他の可変ドメイン(例えば、ダイアボディの製造における)又は本明細書の他の箇所でより詳細に考察される検出可能/機能的標識などに連結するためのリンカーの導入を含む。
【0089】
結合メンバーは一対のVH及びVLドメインを含むことができるが、VH若しくはVLドメイン配列のいずれかに基づく単一結合ドメインもまた本発明において使用することができる。単一の免疫グロブリンドメイン、特にVHドメインは、特異的に標的抗原に結合することができることが知られている。例えば、上記のdAbの考察を参照されたい。
【0090】
いずれかの単一結合ドメインの場合、これらのドメインを用いて、フィブロネクチンのA-FN及び/又はED-Aに結合することができる2ドメインの結合メンバーを形成することができる相補的ドメインについてスクリーニングすることができる。H若しくはL鎖クローンのいずれかを含む個々のコロニーを用いて、他方の鎖(L若しくはH)をコードするクローンの完全なライブラリーを感染させ、得られる2鎖結合メンバーを、その参考文献に記載のものなどのファージディスプレイ技術に従って選択する、WO 92/01047号(その全体が参照により本明細書に組み入れられるものとする)に開示されたいわゆる階層的二重コンビナトリアル手法を用いるファージディスプレイスクリーニング方法により、これを達成することができる。この技術もMarks 1992に開示されている。
【0091】
本発明において使用する結合メンバーはさらに、抗体定常領域又はその一部、例えば、ヒト抗体定常領域又はその一部を含んでもよい。例えば、VLドメインを、そのC末端で、ヒトCκ若しくはCλ鎖、例えばCλなどの抗体軽鎖定常ドメインに結合させることができる。同様に、VHドメインに基づく結合メンバーを、そのC末端で、任意の抗体アイソタイプ、例えばIgG、IgA、IgE及びIgM並びに任意のアイソタイプサブクラス、特にIgG1及びIgG4から誘導された免疫グロブリン重鎖の全部又は一部(例えば、CH1ドメイン)に結合させることができる。これらの特性を有し、可変領域を安定化させる任意の合成的又は他の定常領域変異体も、本発明の実施形態において有用である。
【0092】
本発明において使用する結合メンバーを、検出可能な、又は機能的な標識を用いて標識することができる。標識は、限定されるものではないが、蛍光、放射性標識、酵素、化学発光若しくは光感作物質などのシグナルを生成するか、又は生成するように誘導することができる任意の分子であってよい。かくして、結合は、蛍光若しくは発光、放射活性、酵素活性又は光吸収を検出することにより検出及び/又は測定することができる。検出可能な標識は、当業界で公知の慣用の化学を用いて、本発明において使用するための抗体に結合させることができる。
【0093】
標識が外部的手段、例えば視覚的試験、電磁気放射、熱、及び化学試薬により検出可能なシグナルを生成することができる多くの方法が存在する。また、標識を、本発明において使用するための抗体に結合する別の結合メンバー、又は支持体に結合させることもできる。
【0094】
標識された結合メンバー、例えば、検出可能な標識で標識されたscFvを、in vivo、ex vivo若しくはin vitroで診断的に、及び/又は治療的に用いることができる。
【0095】
例えば、放射性標識された結合メンバー(例えば、放射性同位体に結合させた結合メンバー)を、放射性診断及び放射線療法において用いることができる。本発明において使用する結合メンバーにコンジュゲートさせることができる放射性同位体としては、94mTc、99mTc、186Re、188Re、203Pb、67Ga、68Ga、47Sc、111In、97Ru、62Cu、64Cu、86Y、88Y、90Y、121Sn、161Tb、153Sm、166Ho、105Rh、177Lu、123I、124I、125Iおよび131Iなどの同位体が挙げられる。
【0096】
例えば、検出可能な標識で標識された、本発明において使用する結合メンバーを用いて、ヒト又は動物における関節リウマチを検出、診断又はモニターすることができる。
【0097】
本発明の結合メンバーは、関節リウマチを診断するのに用いるための診断用製品の製造に用いることができる。
【0098】
本発明は、ヒト又は動物において関節リウマチを検出又は診断する方法であって、以下のステップ:
(a)該ヒト又は動物に、例えば、フィブロネクチンのED-Aアイソフォーム及び/若しくはフィブロネクチンのED-Aに結合する、検出可能な標識で標識された、本発明の結合メンバーを投与するステップ、並びに
(b)該ヒト又は動物の体の新生血管における該結合メンバーの存在又は非存在を決定するステップ、
を含み、ヒト又は動物の新生血管への該結合メンバーの局在化が、関節リウマチの存在を示す、前記方法を提供する。
【0099】
前記結合メンバーを検出可能な標識で標識する場合、検出可能な標識の存在又は非存在を、該標識を検出することにより決定することができる。
【0100】
本発明において使用する結合メンバーと、病変中の標的細胞上で殺菌活性、細胞傷害性免疫抑制活性若しくは抗炎症活性を示す分子との間のコンジュゲート又は融合物、並びにそのような病変中に存在する細胞外マトリックス成分に対する抗体を本発明において用いることができる。例えば、コンジュゲートされる分子は、特にインターロイキン-10、抗炎症剤若しくは他の薬剤、光増感剤、又は放射性核種とすることができる。そのようなコンジュゲートは、治療的に、例えば、本明細書で言及される関節リウマチの治療に用いることができる。
【0101】
結合メンバーと、殺菌性又は細胞傷害性分子との融合物又はコンジュゲートの製造及び使用は、例えば、参照により本明細書に組み入れられるものとするWO 01/62298号に記載されている。
【0102】
本発明は、関節リウマチの治療方法であって、本発明において使用する結合メンバーを含む治療上有効量の医薬を個体に投与することを含む方法を提供する。
【0103】
この結合メンバーは、(i)細胞相互作用により標的細胞に対して抗炎症作用を示す分子、抗炎症性分子、IL-10、TGFβ又は他の薬剤と、(ii)フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに対する結合メンバーとのコンジュゲートであってよい。
【0104】
この結合メンバーは、(i)免疫抑制作用又は抗炎症作用を示す分子と、(ii)フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに対する結合メンバーとのコンジュゲートであってよい。
【0105】
この結合メンバーは、(i)インターロイキン-10(IL10)又はTGFβと、(ii)フィブロネクチンのED-Aアイソフォーム及び/又はフィブロネクチンのED-Aに対する結合メンバーとのコンジュゲートであってよい。そのような結合メンバーは、本明細書で開示する、関節リウマチの治療に関する本発明の態様において有用である。
【0106】
本発明は、関節リウマチの治療のための医薬の製造のための本発明において使用する結合メンバーの使用を提供する。
【0107】
この結合メンバーは、本明細書に記載のような殺菌作用、細胞傷害作用、免疫抑制作用又は抗炎症作用を示す分子にコンジュゲート又は融合されたものであってよい。結合メンバーは、(i)細胞相互作用により標的細胞に対して殺菌作用若しくは細胞傷害作用を示す、又は免疫抑制作用若しくは抗炎症作用を示す分子と、(ii)本発明に係るヒトフィブロネクチンに対する結合メンバーとのコンジュゲートであってよい。
【0108】
また本明細書において、(i)細胞相互作用により標的細胞に対して殺菌作用若しくは細胞傷害作用を示す、又は免疫抑制作用若しくは抗炎症作用を示す分子と、(ii)本発明において使用するヒトフィブロネクチンに対する結合メンバーとのコンジュゲートを記載する。そのようなコンジュゲートは、殺菌性、細胞傷害性、免疫抑制性若しくは抗炎症性分子と、前記結合メンバーとを含む融合タンパク質、又は、結合メンバーが2鎖若しくは多鎖である場合、殺菌性、細胞傷害性、免疫抑制性若しくは抗炎症性分子と、前記結合メンバーのポリペプチド鎖成分とを含む融合タンパク質を含むのが好ましい。好ましくは、前記結合メンバーは、一本鎖ポリペプチド、例えば、scFvなどの一本鎖抗体分子である。
【0109】
免疫抑制性若しくは抗炎症性分子と、一本鎖Fv抗体分子とを含む融合タンパク質を本発明において使用することができる。
【0110】
細胞相互作用により標的細胞に対して免疫抑制作用若しくは抗炎症作用を示す分子は、標的細胞と直接相互作用してもよく、標的細胞上の膜結合受容体と相互作用してもよいし、又は細胞膜の電気化学ポテンシャルを摂動させてもよい。例示的な好ましい実施形態においては、前記分子は、IL-10である。
【0111】
以下にさらに考察されるように、特異的結合メンバーは、好ましくは抗体であるか、又は抗体抗原結合部位を含む。都合がよいことに、特異的結合メンバーは、一本鎖抗体などの一本鎖ポリペプチドであってよい。これにより、一本鎖抗体と免疫抑制性若しくは抗炎症性分子(例えば、インターロイキン-10若しくはTGFβ)とを含む融合タンパク質の都合のよい製造が可能になる。抗体抗原結合部位は、別々のポリペプチド中、例えば、完全な抗体中又はFab若しくはダイアボディなどの抗体フラグメント中での抗体VHドメインと抗体VLドメインとの結合により提供する。特異的結合メンバーが2鎖又は多鎖分子(例えば、それぞれ、Fab若しくは全抗体)である場合、免疫抑制性若しくは抗炎症性分子は、特異的結合メンバー中の1個以上のポリペプチド鎖との融合ポリペプチドとしてコンジュゲートさせることができる。
【0112】
結合メンバーを、ペプチド結合により、すなわち、免疫抑制性若しくは抗炎症性分子と、該特異的結合メンバー若しくはそのポリペプチド鎖成分とを含む融合ポリペプチド内で、コンジュゲートさせることができる(例えばTrachselら参照)。コンジュゲーションのための他の手段としては、化学的コンジュゲーション、特に、二官能性試薬を用いる架橋(例えば、DOUBLE-REAGENTSTM Cross-linking Reagents Selection Guide, Pierceを用いる)が挙げられる。
【0113】
また本明細書では、本発明において使用する結合メンバーをコードする単離された核酸を記載する。核酸はDNA及び/又はRNAを含んでもよい。核酸は、上記で定義されたCDR若しくはCDRのセット又はVHドメイン若しくはVLドメイン又は抗体抗原結合部位若しくは抗体分子、例えばscFv若しくはIgG、例えば、IgG1をコードする。ヌクレオチド配列は、本明細書に開示されるVH及び/又はVLドメインをコードする。
【0114】
さらに本明細書において、上記の少なくとも1個のポリヌクレオチドを含む、プラスミド、ベクター、転写物又は発現カセットの形態の構築物を記載する。
【0115】
上記の1個以上の構築物を含む組換え宿主細胞もまた記載する。提供される任意のCDR若しくはCDRのセット又はVHドメイン若しくはVLドメイン又は抗体抗原結合部位若しくは抗体分子、例えば、scFv若しくはIgG1若しくはIgG4をコードする核酸は、コードする核酸からの発現を含む、コードされた産物の産生方法と同様に記載する。好適な条件下で、前記核酸を含む組換え宿主細胞を培養することにより、発現を都合良く達成することができる。発現による産生後、VH若しくはVLドメイン、又は結合メンバーを、任意の好適な技術を用いて単離及び/又は精製した後、必要に応じて用いることができる。
【0116】
核酸は、DNA又はRNAを含んでもよく、全体的又は部分的に合成されたものであってもよい。本明細書に記載のヌクレオチド配列に対する参照は、特定の配列を有するDNA分子を包含し、また、その状況が別途必要としない限り、TがUに置換された特定の配列を有するRNA分子も包含する。
【0117】
コードする核酸からの発現を引き起こすことを含む、抗体VH可変ドメインの製造方法もまた記載する。そのような方法は、前記抗体VH可変ドメインの製造のための条件下で宿主細胞を培養することを含んでもよい。
【0118】
製造方法は、前記産物の単離及び/又は精製のステップを含んでもよい。製造方法は、前記産物を、製薬上許容し得る賦形剤などの少なくとも1種の追加成分を含む組成物に製剤化することを含んでもよい。
【0119】
様々な宿主細胞中でのポリペプチドのクローニング及び発現のための系がよく知られている。好適な宿主細胞としては、細菌、哺乳動物細胞、植物細胞、繊維性菌類、酵母及びバキュロウイルス系並びにトランスジェニック植物及び動物が挙げられる。原核細胞中での抗体及び抗体フラグメントの発現は、当業界でよく確立されている。総論については、例えば、Pluckthun 1991を参照されたい。一般的な細菌宿主は大腸菌である。
【0120】
培養中の真核細胞中での発現も、例えば、Chadd & Chamow (2001)、Anderson & Krummen (2002)、Larrick & Thomas (2001)など、結合メンバーの製造のためのオプションとして当業者には利用可能である。異種ポリペプチドの発現のために当業界で利用可能な哺乳動物細胞系としては、チャイニーズハムスター卵巣(CHO)細胞、HeLa細胞、ベビーハムスター腎細胞、NS0マウスメラノーマ細胞、YB2/0ラットミエローマ細胞、ヒト胚性腎細胞、ヒト胚性網膜細胞及び他の多くの細胞が挙げられる。
【0121】
プロモーター配列、ターミネーター配列、ポリアデニル化配列、エンハンサー配列、マーカー遺伝子及び好適な他の配列などの好適な調節配列を含む好適なベクターを選択又は構築することができる。ベクターは、必要に応じて、プラスミド、例えばファージミド、又はウイルス、例えば「ファージ」であってよい。さらなる詳細については、例えば、Sambrook & Russell (2001)を参照されたい。例えば、核酸構築物の調製、突然変異誘発、配列決定、DNAの細胞中への導入及び遺伝子発現における核酸の操作、並びにタンパク質の分析のための多くの公知の技術及びプロトコルが、Ausubel 1999に詳細に記載されている。
【0122】
宿主細胞は、本明細書に開示された核酸を含むことができる。そのような宿主細胞は、in vitroにあっても、培養物中にあってもよい。そのような宿主細胞はin vivoにあってもよい。in vivoでは、宿主細胞の存在により、「イントラボディ」又は細胞内抗体としての、本発明において使用する結合メンバーの細胞内発現が可能になる。イントラボディを、遺伝子治療に用いることができる。
【0123】
本明細書に開示する核酸を宿主細胞中に導入することを含む方法も記載する。この導入は、任意の利用可能な技術を用いることができる。真核細胞については、好適な技術として、リン酸カルシウムトランスフェクション、DEAE-デキストラン、エレクトロポレーション、リポソーム媒介トランスフェクション、及びレトロウイルス若しくは他のウイルス、例えばワクシニア、又は昆虫細胞については、バキュロウイルスを用いる形質導入が挙げられる。宿主細胞、特に真核細胞中への核酸の導入は、ウイルス又はプラスミドに基づく系を用いることができる。プラスミド系を、エピソームとして維持するか、又は宿主細胞若しくは人工染色体中に組込むことができる。組込みは、単一又は複数の遺伝子座での1以上のコピーの無作為な又は標的化された組込みによるものであってよい。細菌細胞については、好適な技術としては、塩化カルシウム形質転換、エレクトロポレーション及びバクテリオファージを用いるトランスフェクションが挙げられる。
【0124】
前記導入を行った後、例えば、遺伝子の発現のための条件下で宿主細胞を培養することにより、核酸からの発現を引き起こすか、又は可能にすることができる。発現産物の精製を、当業者には公知の方法により達成することができる。
【0125】
核酸は、宿主細胞のゲノム(例えば、染色体)中に組込むことができる。標準的な技術に従って、ゲノムとの組換えを促進する配列の含有により、組込みを促進することができる。
【0126】
上記の結合メンバー又はポリペプチドを発現させるための発現系中で上述の構築物を用いることを含む方法も記載する。
【0127】
本発明において使用する結合メンバーは、ヒト又は動物被験体、例えばヒトにおける診断又は治療の方法において用いられるように設計する。本発明において使用する結合メンバーは、関節リウマチの診断又は治療において用いることができる。
【0128】
従って、本発明は、提供される結合メンバーの投与を含む治療方法、そのような結合メンバーを含む医薬組成物、並びに、例えば該結合メンバーを製薬上許容し得る賦形剤と共に製剤化することを含む医薬又は医薬組成物を製造する方法における、投与のための医薬の製造におけるそのような結合メンバーの使用を提供する。製薬上許容し得るビヒクルは周知であり、選択される活性化合物の性質及び投与方法の関数として、当業者により適合させることができるであろう。
【0129】
通常、本発明において使用する結合メンバーは、該結合メンバーに加えて、少なくとも1種の成分を含んでもよい医薬組成物の形態で投与することができる。かくして、本発明に係る、及び本発明に係る使用のための医薬組成物は、活性成分に加えて、製薬上許容し得る賦形剤、担体、バッファー、安定化剤又は当業者に周知の他の材料を含んでもよい。そのような材料は、非毒性であるべきであり、前記活性成分の効力を阻害するべきではない。担体又は他の材料の正確な性質は、経口、吸入又は注入、例えば静脈内注入であってよい投与の経路に依存するであろう。
【0130】
例えば、ナノボディなどの経口投与のための医薬組成物も、本発明において想定される。そのような経口製剤は、錠剤、カプセル、粉末、液体又は半固体の形態にあってもよい。錠剤は、ゼラチン又はアジュバントなどの固形担体を含んでもよい。一般的には、液体医薬組成物は、水、石油、動物油若しくは野菜油、鉱油又は合成油などの液体担体を含む。生理食塩溶液、デキストロース若しくは他の糖溶液、又は、例えばエチレングリコール、プロピレングリコール若しくはポリエチレングリコールなどのグリコールを含有させることができる。
【0131】
静脈内注入、又は苦痛の部位での注入のためには、前記活性成分は、発熱源を含まず、好適なpH、等張性及び安定性を有する非経口的に許容し得る水性溶液の形態にあるであろう。当業者であれば、例えば、塩化ナトリウム注入液、リンゲル注入液、乳酸加リンゲル注入液などの等張性ビヒクルを用いて、好適な溶液を調製することができるであろう。保存剤、安定化剤、バッファー、酸化防止剤及び/又は他の添加物を、必要に応じて用いることができる。医薬製剤の調製のための多くの方法が、当業者には公知である。例えば、Robinson, 1978を参照されたい。
【0132】
治療しようとする症状に応じて、組成物を単独で投与するか、又は同時に若しくは連続的に、他の治療と組み合わせて投与するか、又は別の治療剤若しくは複数の薬剤との組合せ製剤として投与することができる。
【0133】
本発明において使用する結合メンバーは、追加の医薬成分と組合せた組合せ療法の一部として用いることができる。組合せ治療(併用療法)、特に本発明において使用する結合メンバーと、1種以上の他の薬剤との組合せを用いて、有意な相乗効果を提供することができる。本発明において使用する結合メンバーは、本明細書に列挙される1種以上の症状の治療のために、同時に若しくは連続的に投与するか、又は別の治療剤若しくは複数の薬剤との組合せ製剤として投与することができる。
【0134】
例えば、本発明において使用する結合メンバーは、関節リウマチの治療のための既存の治療剤と組み合わせて用いることができる。
【0135】
関節リウマチの治療のための既存の治療剤としては、IL-10、TGFβ、光増感剤、及び細胞傷害性薬が挙げられる。
【0136】
本発明において使用する結合メンバー及び1種以上の上記追加医薬成分を、医薬の製造において用いることができる。前記医薬は、個体への個別の、又は組み合わせた投与のためのものであってよく、従って、組合せ製剤として、又は別々の製剤として、前記結合メンバーと前記追加成分とを含んでもよい。別々の製剤を用いて、別々の、及び連続的又は同時的投与を容易にすることができ、異なる経路、例えば経口投与と非経口投与による前記成分の投与が可能になる。
【0137】
本発明において、提供される組成物を哺乳動物に投与することができる。投与は「治療上有効量」であってよく、これは患者に対する利益を示すのに十分なものである。そのような利益は、少なくとも1種の症候の少なくとも改善である。「関節リウマチの治療」とは、少なくとも1種の症候の改善を意味する。投与される実際の量、並びに投与の速度及び時間経過は、治療しようとするものの性質及び重篤度、治療する特定の哺乳動物、個々の患者の臨床症状、障害の原因、前記組成物の送達部位、結合メンバーの種類、投与方法、投与の日程並びに医師には公知の他の因子に依存するであろう。治療の処方、例えば、投薬量に関する決定などは、一般開業医及び他の医師の責任の範囲内にあり、症候の重篤度及び/又は治療する疾患の進行に依存し得る。抗体の好適な用量は、当業界で周知である(Ledermann 1991及びBagshawe 1991)。投与する医薬の種類に関して必要に応じて、本明細書、又はPhysician's Desk Reference (2003)に示される特定の用量を用いることができる。本発明において使用する結合メンバーの治療上有効量又は好適な用量を、そのin vitroでの活性と、動物モデルにおけるin vivoでの活性とを比較することにより決定することができる。マウス及び他の試験動物における有効用量をヒトに外挿する方法は公知である。正確な用量は、抗体が診断、予防若しくは治療のためのものであるかどうか、治療しようとする領域のサイズ及び位置、抗体(例えば、全抗体、フラグメント若しくはダイアボディ)の正確な性質、並びに該抗体に結合させた検出可能な標識若しくは他の分子の性質などの、いくつかの因子に依存するであろう。典型的な抗体用量は、全身適用のためには100μg〜1gの範囲にあり、局所適用のためには1μg〜1mgの範囲にあるであろう。最初はより高い負荷用量を、次いで、1種以上のより低い用量を投与することができる。抗体は、全抗体、例えば、IgG1又はIgG4アイソタイプであってよい。これは、成人患者の単回治療のための用量であり、子供及び幼児については比例的に調整し、また他の抗体形態については分子量に比例して調整することもできる。治療は、毎日、週に2回、毎週又は毎月の間隔で、医師の裁量で繰り返すことができる。治療は、皮下投与については2〜4週間毎、静脈内投与については4〜8週間毎であってもよい。本発明のいくつかの実施形態においては、治療は定期的であり、投与間の期間は約2週間以上、例えば約3週間以上、約4週間以上、又は月に約1回である。本発明の他の実施形態においては、治療を、外科手術の前及び/又は後に行ってもよく、外科的処置の解剖学的部位に投与するか、又は直接適用することができる。
【0138】
本発明のさらなる態様及び実施形態は、以下の実験的例示を含む本開示を鑑みて当業者にとっては明らかであろう。
【実施例】
【0139】
実験
結果
ヒト関節炎標本の組織化学的分析
フィブロネクチンドメインEDA及びEDB、並びにテネイシン-CドメインA1及びCの発現を、それぞれF8、L19、F16及びG11抗体を用いたヒト関節炎標本の免疫組織化学により調べた。
【0140】
図1において、暗色の染色は、(白矢印で描出されるように)各抗原の発現を示している。抗EDA抗体であるF8が最も強い染色を示し、従って、さらなる実験は全てこの抗体を用いて行った。
【0141】
F8抗体を用いた免疫蛍光実験を実施したところ、良好な血管周囲の染色が示された(図2において白い構造物として可視化されている)。
【0142】
ヒトモノクローナル抗体F8はマウスにおける関節炎の部位に選択的に蓄積する
CIAマウスモデル(Courtneyら 1980)におけるミニ抗体形態(SIP)(Borsiら 2002)のF8のin vivoターゲティング能を、抗体検出に関して蛍光及び放射能の両方を用いて試験した。SIP形態は、80kDaサイズのホモダイマータンパク質を生じる、ヒトIgEのCH4ドメインと結合したscFv抗体フラグメントからなる。
【0143】
関節炎マウスに近赤外色素Alexa 750で標識したSIP(F8)を注射した。静脈内注射の24時間後に、赤外蛍光イメージャー(Birchlerら, 1999)を用いて動物を画像化したところ、関節炎の肢に存在する損傷において強くかつ選択的な抗体蓄積が明らかとなり、白色光の肢として可視化され、マウスの前肢にはグレード2の腫れがいくつかあった。
【0144】
125Iで放射性標識したSIP(F8)の静脈内注射の24時間後に、マウスを犠牲にし、オートラジオグラフィー(ホスホルイメージング)により肢を画像化した。SIP(F8)を注射したマウスの炎症四肢において放射能の選択的蓄積が観察され、オートラジオグラフィーにおいて黒色染色として可視化された。1本の肢は関節炎スコア2(肢全体の腫れ)を示した。別の肢は関節炎のグレード1(1本の指の腫れ)と分類された。
【0145】
抗EDA抗体−インターロイキン-10融合体の活性
scFv形態の抗体分子F8を、インターロイキン-10(IL-10)と融合タンパク質内でコンジュゲートした。融合タンパク質の生物活性を、MC/9細胞のIL-4依存性増殖を誘導する能力を決定するアッセイ(Thompsonら, 1991)において、ヒトIL-10の活性を比較した。結果を図8(d)に示す。
【0146】
材料及び方法
ヒト関節炎標本における免疫組織化学的分析
ヒト関節炎標本の凍結切片を氷冷アセトン中で10分かけて固定し、ウシ胎仔血清を用いて30分間ブロッキングし、新生血管のマーカー(フィブロネクチンED-A及びED-B、テネイシン-CドメインA1及びC)について染色した。F8、L19、F16及びG11抗体は、10μg/mlの濃度でmycタグ付加scFvとして使用し、1時間インキュベートした。一次抗体を7μg/mlの濃度の抗myc抗体9E10と共にインキュベートした。三次検出抗体として、ウサギ抗マウスIgG抗体(Dako, Denmark)及びAPAAPマウスモノクローナル(Dako, Denmark)をそれぞれ5及び50μg/mlの濃度で1時間使用した。ファストレッド錠(Sigma, Switzerland)を使用して、15分間インキュベートして、染色を発色させた。スライドをヘマトキリシンで2分かけて対比染色し、水で洗浄し、Glycergelマウント培地(Dako, Denmark)にのせ、Axiovert S100 TV顕微鏡(Zeiss, Switzerland)を用いて分析した。
【0147】
ヒト関節炎標本における免疫蛍光分析
ヒト関節炎標本の凍結切片を氷冷アセトン中で10分かけて固定し、ウシ胎仔血清を用いて30分間ブロッキングし、フィブロネクチンのED-Aドメインについて染色した。F8抗体は、10μg/mlの濃度でmycタグ付加scFvとして使用し、1時間インキュベートした。一次抗体を7μg/mlの濃度の抗myc抗体9E10と共にインキュベートした。三次検出抗体として、蛍光抗マウスAlexa 596抗体(Molecular Probes, Denmark)を10μg/mlの濃度で1時間使用した。スライドをHoechst 33342で対比染色し、Glycergelマウント培地(Dako, Denmark)にのせ、AxioScop 2MOT+顕微鏡(Zeiss, Switzerland)を用いて分析した。
【0148】
動物モデル
200μgのウシII型コラーゲン(MD Biosciences)を等量のフロイント完全アジュバント(MD Biosciences)で乳化し、尾付け根における皮内注射によりDBA/1雄マウス(8〜12週齢)を免疫した。初回免疫の2週間後に、コラーゲンの乳化に不完全フロイントアジュバント(MD Biosciences)を使用して上記手順を繰り返した。マウスを毎日観察し、1又はそれ以上の肢に紅斑及び/又は肢の腫れを示した各マウスを画像化又は処置試験のために登録した。
【0149】
2つの疾患インデックス(臨床スコア及び肢の腫れ)を用いて関節炎をモニターした。臨床スコアについては、非盲検で各肢のグレードを毎日評価した。(0=正常、1=同じ肢の1又はそれ以上の指の腫れ、2=肢全体の腫れ)とし、動物当たり可能な最大スコアは8となるようにした。肢の腫れは、隔日に評価し、カリパスを用いてイソフルラン麻酔下における各肢の厚さを測定した。全4肢の平均値を各動物の肢の厚みとした。
【0150】
関節炎の肢の近赤外イメージング
関節炎マウスにおけるSIP(F8)の選択的蓄積を、Birchlerら(1999)に記載されているように近赤外イメージング分析により試験した。簡単に説明すると、精製SIP(F8)をAlexa750(MolecularProbes, Leiden, The Netherlands)で製造業者の推奨に従って標識し、100μgの標識タンパク質を関節炎マウスの尾静脈に注射した。注射の24時間後にマウスをケタミン80mg/kg及びメデトミジン0.2mg/kgで麻酔し、近赤外マウスイメージャーにおいて画像化した(Trachselら 2007; Birchlerら 1999)。
【0151】
生体分布実験
関節炎マウスにおけるSIP(F8)のin vivoターゲティング能を、以前に記載されているように生体分布分析により評価した(Borsiら 2002; Tarliら, 1999)。簡単に説明すると、精製SIP(F8)を放射性ヨウ素化し、10μgのタンパク質(11uCi 125Iに相当)を関節炎マウスの尾静脈に注射した。注射の24時間後にマウスを犠牲にし、以前に記載されているように(Trachselら 2007)、肢を1時間露光し、ホルホルイメージャー(Fujifilm BAS-5000)において読み取った。
【0152】
抗体
抗ED-B抗体フラグメントscFv(L19)の単離は、以前に記載されている(Piniら、1998)。親抗ED-A抗体を、公開された手順(Giovannoni, Nucleic. Acid Research, 2001, 29(5):E27)を用いてETH-2ライブラリーから単離した。高親和性抗ED-A抗体をもたらす、親抗ED-A抗体の親和性成熟は、以下の節に記載する。
【0153】
親抗ED-A抗体の親和性成熟
親抗ED-A抗体(ETH-2由来抗体)を、親和性成熟ライブラリーの構築のための鋳型として用いた。ライブラリーのVH CDR1(DP47生殖系列)及びVL CDR1(DPK22生殖系列)における配列可変性を、VH CDR1の31、32及び33位とVL CDR1の31、31a及び32位で無作為突然変異を作製するプロセスにおいて、部分的縮重プライマー5'-CTGGAGCCTGGCGGACCCAGCTCATMNNMNNMNNGCTAAAGGTGAATCCAGA-3'(配列番号17)(VH用)及び5'-CCAGGTTTCTGCTGGTACCAGGCTAAMNNMNNMNNGCTAACACTCTGACTGGCCCTGC-3'(配列番号18)(VL用) (全てのオリゴヌクレオチドを、Operon Biotechnologies, Cologne, Germanyから購入した)を用いるPCRにより導入した。VHVLの組合せを、鋳型としてゲル精製されたVH及びVL断片を用いる、プライマーLMB3long(5'-CAGGAAACAGCTATGACCATGATTAC-3')(配列番号19)及びfdseqlong(5'-GACGTTAGTAAATGAATTTTCTGTATGAGG-3')(配列番号20)を用いるPCR集合(assembly)によりscFv形態に集合させた。集合させたVH-VL断片を、NcoI/NotIで二重消化し、NcoI/NotI消化されたpHEN1ファージミドベクター(Hoogenboomら、1991)中にクローニングした。得られる連結産物を、Vitiら、2000に従ってエレクトロコンピテント大腸菌TG-1細胞中にエレクトロポレーションし、1.5×107個の抗体クローンを含有するライブラリーを生じさせ、改善された親和性でED-Aに結合する抗体についてスクリーニングした。
【0154】
抗ED-A抗体の選択
上記の抗体ライブラリーを、BIAcore分析を用いて、親抗ED-A抗体よりも高い親和性でED-Aに結合する抗体についてスクリーニングした。BIAcore分析において用いた抗原(11A12)は、ヒトフィブロネクチンのED-Aドメインを含み、以下のアミノ酸配列(配列番号120)を有する:
MRSYRTEIDKPSQMQVTDVQDNSISVKWLPSSSPVTGYRVTTTPKNGPGPTKTKTAGPDQ
TEMTIEGLQPTVEYVVSVYAQNPSGESQPLVQTAVTNIDRPKGLAFTDVDVDSIKIAWES
PQGQVSRYRVTYSSPEDGIHELFPAPDGEEDTAELQGLRPGSEYTVSVVALHDDMESQPL
IGTQSTAIPAPTDLKFTQVTPTSLSAQWTPPNVQLTGYRVRVTPKEKTGPMKEINLAPDS
SSVVVSGLMVATKYEVSVYALKDTLTSRPAQGVVTTLENVRSHHHHHH
【0155】
抗原(11A12)のヌクレオチド配列(配列番号121)は以下の通りである:
atgagatcctaccgaacagaaattgacaaaccatcccagatgcaagtgaccgatgttcaggacaacagcattagtgtcaagtggctgccttcaagttcccctgttactggttacagagtaaccaccactcccaaaaatggaccaggaccaacaaaaactaaaactgcaggtccagatcaaacagaaatgactattgaaggcttgcagcccacagtggagtatgtggttagtgtctatgctcagaatccaagcggagagagtcagcctctggttcagactgcagtaaccaacattgatcgccctaaaggactggcattcactgatgtggatgtcgattccatcaaaattgcttgggaaagcccacaggggcaagtttccaggtacagggtgacctactcgagccctgaggatggaatccatgagctattccctgcacctgatggtgaagaagacactgcagagctgcaaggcctcagaccgggttctgagtacacagtcagtgtggttgccttgcacgatgatatggagagccagcccctgattggaacccagtccacagctattcctgcaccaactgacctgaagttcactcaggtcacacccacaagcctgagcgcccagtggacaccacccaatgttcagctcactggatatcgagtgcgggtgacccccaaggagaagaccggaccaatgaaagaaatcaaccttgctcctgacagctcatccgtggttgtatcaggacttatggtggccaccaaatatgaagtgagtgtctatgctcttaaggacactttgacaagcagaccagctcagggagttgtcaccactctggagaatgtcagatctcatcaccatcaccatcactaa
【0156】
前記抗原のヌクレオチド配列を、5'及び3'にそれぞれBamHI及びBglII制限部位を含むプライマーを用いるPCRにより増幅した。得られるPCR産物及びベクターpQE12 (QIAGEN)をBamHI及びBglII制限エンドヌクレアーゼで消化した後、挿入物:ベクター比3:1を含む反応物中に連結した。得られるベクターを配列決定して、配列が正確であるかを調べた。
【0157】
抗原調製
10 mlの2TY、Amp、1%グルコース中のTG1エレクトロコンピテント前培養物を、11A12のDNAミニプレップ1μlの存在下でエレクトロポレーションした。次いで、前培養物を1:100に希釈し(800 mlの2TY、Amp、0.1%グルコース中に8 ml)、OD600が0.4〜0.6になるまで増殖させた後、IPTGで一晩誘導した。次の日、細胞を遠心分離し、上清を濾過した(Millipore 0.22μm)。培養培地の遠心分離及び清澄化後、11A12をFPLC上のHitrapカラムを用いて精製した。Ni/カラムを以下のように再生した:カラムを、カラムの5倍量(CV)のH2Oで洗浄した後、3CVの0.5 M EDTA/0.2 M Tris pH 8を適用して、カラムから古いニッケルを洗浄除去した。次いで、カラムを5CVのH2Oで洗浄した。次いで、カラムに2CVの100 mM NiSO4を再度導入した後、カラムを数CVのH2Oで洗浄した。次いで、カラムを5CVの溶解バッファー(20 mMイミダゾール/250 mM NaCl/PBS pH 7.4)で平衡化させた。細胞溶解物を濾過し(Millipore 0.45μm)、カラムに導入した(手動で)。次いで、カラムをFPLC上に戻し、UVシグナルが安定するまで(一定)、約3CVの溶解バッファーを流出させた。次いで、溶出プログラムを開始した:5CVの溶出バッファー(400 mMイミダゾール/250 mM NaCl/PBS pH 7.4)の0%〜100%の勾配。溶出された抗原を含む画分をプールし、PBSで一晩透析させた。
【0158】
抗ED-A抗体の発現及び精製
抗ED-A抗体を以下のように発現させ、精製した:10 mlの2TY、Amp、1%グルコース中のTG1エレクトロコンピテント前培養物を、抗ED-A抗体の1つのDNAミニプレップ1μlの存在下でエレクトロポレーションした。次いで、前培養物を1:100に希釈し(800 mlの2TY、Amp、0.1%グルコース中の8 ml)、OD600が0.4〜0.6になるまで増殖させた後、IPTGで一晩かけて誘導した。次の日、細胞を遠心分離し、上清を濾過した(Millipore 0.22μm)。scFvをプロテインA−セファロースカラム上で精製し、トリエチルアミン(Triethylemmine)を用いて、カラムからscFvを溶出させた。溶出したscFvを含む画分を、PBS中、4℃で一晩透析した。次いで、scFv画分を、PBSと共にSuperdex 75カラムに入れ、0.5 ml/分で流出させ、0.25 mlの画分を回収した。モノマー画分をBIAcore分析に用いた。
【0159】
BIAcoreTM分析1
BIAcoreTM Chipを、HBS-EPバッファーBIACORETM、0.01 M Hepes pH 7.4、0.15 M NaCl、3 mM EDTA、0.005%界面活性剤P20(アッセイに用いたのと同じバッファー)を用いて、5μl/分の流速で一晩フラッシュした。抗原(11A12)を、酢酸バッファー(pH 4.0)中に50μg/mlの濃度に希釈し、チップ上のCOOH基を、N-ヒドロキシスクシンイミド(NHS)及びエチル-N-(ジメチルアミノプロピル)-カルボジイミド(EDC)の混合物50μlの注入により活性化した。40μlの11A12抗原をチップに注入し、残留した遊離COOH基を30μlのエタノールアミンでブロッキングした。0.22μmの濾過後、20μlの各細菌上清をチップ上に注入し、抗原との相互作用をリアルタイムでモニターした。
【0160】
BIAcoreTM分析2
親抗ED-A抗体と抗ED-A抗体B2、C5、D5、C8、F8、B7及びG9のkon、koff及びKDを、表面プラスモン共鳴を用いて評価した。チップを、5μl/分のバッファー流速で、アッセイの間に用いたのと同じバッファーを用いて一晩平衡化した。コーティング手順全体をこの流速で実施した。抗原11A12を、酢酸バッファーpH 4.00(BIACORETMにより提供)で1:25に希釈して、20μg/mlの最終濃度を得た。次いで、NHS及びEDCを混合し、50μlを注入して、CM5チップ上のCOOH基を活性化した。次いで、40μlの抗原を注入した(これは約40秒(40'')続く)。次いで、30μlのエタノールアミンを注入して、最終的な遊離COOHの反応性をブロッキングした。
【0161】
各サンプルを20μl/分の流速でアッセイした。20μlの未希釈のモノマータンパク質(それはゲル濾過から得られる)を注入した。解離時間を約200秒(200'')まで行った。次いで、10μlのHCl 10 mMを注入して、チップを再生した。モノマータンパク質の注入を、異なる希釈率、すなわち、1:2希釈率(PBS中)で反復した後、HClを用いて再生した。次いで、1:4の希釈率でタンパク質の3回目の注入を行った後、再度HClで再生した。各抗ED-A抗体のkon、koff及びKD値を、BIAevaluationソフトウェアを用いて評価した。
【0162】
抗ED-A抗体の選択
BIAcoreTM分析1
BIAcoreTM分析によって、以下のように抗原に対する抗体の親和性を推定するために分析したそれぞれの抗ED-A抗体に関するグラフが得られた:それぞれのグラフのx軸は時間に対応し、y軸は共鳴単位(BIAcoreTMチップ上にコーティングされた抗原に対する試験抗体の結合親和性を示す尺度)に対応する。それぞれのグラフは、3個のピークと、バッファーの交換に対応し、従って、結果の解釈について無関係である1個の落ち込みとを示す。
【0163】
各グラフの上部は、結合期を表す。グラフのこの部分における曲線が急勾配になるほど、抗体の抗原との結合が速くなる。各グラフの下部は、抗体の抗原からの解離期を表す。グラフのこの部分における曲線が平坦になるほど、抗体の抗原からの解離がゆっくりになる。
【0164】
抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9は全て、それらが誘導された親抗ED-A抗体よりも平坦な解離曲線を示したが、これは、それらが親抗ED-A抗体よりも高い親和性でED-Aに結合し、従って、A-FNにも結合することを示している。抗体E5、F1、F8及びH1に関するグラフは、試験した全ての抗ED-A抗体の最も平坦な解離曲線を示した。抗体H1、C5、D5、E5、C8、F8及びF1の結合曲線は、親抗ED-A抗体について観察されたものよりも平坦であったが、抗体B2、B7、E8及びG9について観察された結合曲線は、親抗ED-A抗体について観察された結合曲線と同じぐらい急勾配であった。しかしながら、IPTGに誘導される大腸菌TG-1細胞の細菌上清を、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9のBIAcoreTM分析に用いたため、試験した抗体サンプルの濃度は未知であったが、比較に用いた親抗ED-A抗体サンプルの濃度よりも低い可能性が最も高い。結果として、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9の結合曲線は、BIAcoreTM分析に用いたサンプル中の抗体の濃度が低いことに起因して、人工的に低いかもしれない。しかしながら、濃度はBIAcore分析においてはその標的抗原からの抗体の解離に影響しないため、抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9について観察された平坦な解離曲線は、これらの抗体が、親抗ED-A抗体と少なくとも等しい、おそらくはより高い親和性でED-Aに結合することを示している。
【0165】
BIAcore分析2
各抗ED-A抗体のkon、koff及びKD値を、BIAevaluationソフトウェアを用いて評価した。抗原11A12に対する親抗ED-A抗体、並びに抗ED-A抗体B2、C5、D5、C8、F8、B7及びG9のkon、koff及びKD値を、表2に詳細に記載する。抗ED-A抗体B2、C5、D5、C8、F8、B7及びG9は全て、それらが誘導された親抗ED-A抗体よりも良好な抗原11A12に対するKD値を有し、これは、それらが親抗ED-A抗体よりも高い親和性でED-Aに結合し、従ってA-FNにも結合することを示している。
【0166】
配列
抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9は全てscFv抗体であり、従来の方法を用いてこれらを配列決定した。抗ED-A抗体H1のヌクレオチド配列を図3に示す。抗ED-A抗体H1のアミノ酸配列を図4に示す。
【0167】
抗ED-A抗体B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9のVH及び/又はVLをコードする好ましいヌクレオチド配列は、軽鎖(VL)及び重鎖(VH)のH1 CDR1をコードするヌクレオチド配列が、それぞれの抗体について表1に列挙された軽鎖(VL)及び重鎖(VH)CDR1をコードするヌクレオチド配列と置換された以外は、抗ED-A抗体H1のVH及び/又はVLをコードするヌクレオチド配列と同一である。
【0168】
抗ED-A scFv F8ダイアボディのVH及び/又はVLをコードする好ましいヌクレオチド配列は、軽鎖(VL)及び重鎖(VH)のH1 CDR1をコードするヌクレオチド配列が、抗ED-A抗体F8について表1に列挙された軽鎖(VL)及び重鎖(VH)CDR1をコードするヌクレオチド配列と置換された以外は、抗ED-A抗体H1のVH及び/又はVLをコードするヌクレオチド配列と同一である。抗ED-A scFv F8ダイアボディのVH及びVLを連結するリンカーをコードする好ましいヌクレオチド配列は、gggtccagtggcggt(配列番号29)である。
【0169】
抗ED-A抗体B2、C5、D5、E5、C8、F8、F1、B7、E8及びG9は、軽鎖(VL)及び重鎖(VH)のH1 CDR1のアミノ酸配列を、それぞれの抗体の表1に列挙された軽鎖(VL)及び重鎖(VH)のアミノ酸配列と置換する以外は、抗ED-A抗体H1と同一のアミノ酸配列を有する。抗ED-A scFv F8ダイアボディのアミノ酸配列は、軽鎖(VL)及び重鎖(VH)のH1 CDR1のアミノ酸配列が、抗ED-A抗体F8について表1に列挙された軽鎖(VL)及び重鎖(VH)CDR1のアミノ酸配列と置換され、H1中のリンカーのアミノ酸配列が、リンカーアミノ酸配列GSSGG(配列番号28)と置換された以外は、抗ED-A抗体H1のアミノ酸配列と同一である。
【0170】
抗ED-A抗体B2 VHドメインのアミノ酸配列(配列番号21)は、抗ED-A抗体H1のVH CDR1が配列番号23に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0171】
抗ED-A抗体C5 VHドメインのアミノ酸配列(配列番号41)は、抗ED-A抗体H1のVH CDR1が配列番号43に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0172】
抗ED-A抗体D5 VHドメインのアミノ酸配列(配列番号51)は、抗ED-A抗体H1のVH CDR1が配列番号53に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0173】
抗ED-A抗体E5 VHドメインのアミノ酸配列(配列番号61)は、抗ED-A抗体H1のVH CDR1が配列番号63に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0174】
抗ED-A抗体C8 VHドメインのアミノ酸配列(配列番号71)は、抗ED-A抗体H1のVH CDR1が配列番号73に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0175】
抗ED-A抗体F8 VHドメインのアミノ酸配列(配列番号81)は、抗ED-A抗体H1のVH CDR1が配列番号83に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。抗ED-A F8ダイアボディのVHドメインは、抗ED-A抗体F8のVHドメインと同じアミノ酸配列(すなわち、配列番号81)を有する。
【0176】
抗ED-A抗体F1 VHドメインのアミノ酸配列(配列番号91)は、抗ED-A抗体H1のVH CDR1が配列番号93に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0177】
抗ED-A抗体B7 VHドメインのアミノ酸配列(配列番号101)は、抗ED-A抗体H1のVH CDR1が配列番号103に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0178】
抗ED-A抗体E8 VHドメインのアミノ酸配列(配列番号111)は、抗ED-A抗体H1のVH CDR1が配列番号113に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0179】
抗ED-A抗体G9 VHドメインのアミノ酸配列(配列番号31)は、抗ED-A抗体H1のVH CDR1が配列番号33に置換された以外は、抗ED-A抗体H1のVHドメインのアミノ酸配列と同一である。
【0180】
抗ED-A抗体B2 VLドメインのアミノ酸配列(配列番号22)は、抗ED-A抗体H1のVL CDR1が配列番号26に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0181】
抗ED-A抗体C5 VLドメインのアミノ酸配列(配列番号42)は、抗ED-A抗体H1のVL CDR1が配列番号46に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0182】
抗ED-A抗体D5 VLドメインのアミノ酸配列(配列番号52)は、抗ED-A抗体H1のVL CDR1が配列番号56に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0183】
抗ED-A抗体E5 VLドメインのアミノ酸配列(配列番号62)は、抗ED-A抗体H1のVL CDR1が配列番号66に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0184】
抗ED-A抗体C8 VLドメインのアミノ酸配列(配列番号72)は、抗ED-A抗体H1のVL CDR1が配列番号76に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0185】
抗ED-A抗体F8 VLドメインのアミノ酸配列(配列番号82)は、抗ED-A抗体H1のVL CDR1が配列番号86に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。抗ED-A F8ダイアボディのVLドメインは、抗ED-A抗体F8のVLドメインと同じアミノ酸配列(すなわち、配列番号82)を有する。
【0186】
抗ED-A抗体F1 VLドメインのアミノ酸配列(配列番号92)は、抗ED-A抗体H1のVL CDR1が配列番号96に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0187】
抗ED-A抗体B7 VLドメインのアミノ酸配列(配列番号102)は、抗ED-A抗体H1のVL CDR1が配列番号106に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0188】
抗ED-A抗体E8 VLドメインのアミノ酸配列(配列番号112)は、抗ED-A抗体H1のVL CDR1が配列番号116に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0189】
抗ED-A抗体G9 VLドメインのアミノ酸配列(配列番号32)は、抗ED-A抗体H1のVL CDR1が配列番号36に置換された以外は、抗ED-A抗体H1のVLドメインのアミノ酸配列と同一である。
【0190】
必要に応じて、抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8、G9及びscFv F8ダイアボディのVHドメインの5位のアミノ酸は、図4Aに示されるようにバリン残基(V)よりもむしろ、ロイシン残基(L)であってよい。さらに、又はあるいは、抗ED-A抗体H1、B2、C5、D5、E5、C8、F8、F1、B7、E8、G9及びscFv F8ダイアボディのVLドメインの18位のアミノ酸は、図4Cに示されるようにリジン残基(K)よりもむしろ、アルギニン残基(R)であってもよい。
【0191】
F8-IL10のクローニング、産生及び特性決定
ヒトIL-10遺伝子を以下のプライマー配列を用いてPCRにより増幅した:
バックワードアンチセンスプライマー
5'-TCGGGTAGTAGCTCTTCCGGCTCATCGTCCAGCGGCAGCCCAGGCCAGGGCACC-3'、及び
フォワードセンスプライマー
5'-TTTTCCTTTTGCGGCCGCtcattaGTTTCGTATCTTCATTGTCATGTA-3'
これは、そのN末端に15アミノ酸リンカー(SSSSG)3の付属部分があり、そのC末端に停止コドン及びNotI制限部位がある。
【0192】
一本鎖可変フラグメント(F8)をコードするDNAを、以下のプライマー対を用いてシグナルペプチドと共に増幅した:
バックワードアンチセンスプライマー
5'-CCCAAGCTTGTCGACCATGGGCTGGAGCC-3'、及び
フォワードセンスプライマー
5'-GAGCCGGAAGAGCTACTACCCGATGAGGAAGAGAATTCTTTGATTTCCACCTTGGTCCCTTG-3'。
【0193】
この手法を用いて、HindIII制限部位をN末端に挿入し、リンカー配列の相補的部分をC末端に挿入した。
【0194】
続いて、一本鎖Fv及びIL-10断片をPCRを用いて会合させ、哺乳動物細胞発現ベクターpcDNA3.1(+)のHindIII及びNotI制限部位にクローニングした。
【0195】
以前に記載されているプラスミドをCHO-S細胞に安定にトランスフェクトし、G418(0.5g/l)の存在下で選択を行った。
【0196】
G418耐性細胞のクローンをヒトフィブロネクチンの組換えEDAを抗原として用い、検出のためにプロテインAを用いて、ELISAにより融合タンパク質の発現についてスクリーニングした。
【0197】
プロテインAカラムを用いたアフィニティクロマトグラフィによる細胞培養培地から融合タンパク質を精製した。
【0198】
SDS-PAGEにおいて還元及び非還元条件下で、そしてSuperdex S-200排除カラム(Amersham Pharmacia Biotech, Dubendorf, Switzerland)におけるFPLCゲル濾過により天然条件下で、融合タンパク質のサイズを分析した。
【0199】
活性アッセイ
hIL10の生物活性は、比色MTT色素還元アッセイを用いて、MC/9細胞のIL-4依存性増殖を誘導する能力により決定した(Thompsonら, 1991)。5pg(0.05単位)のマウスIL4/ml(eBiosciences)を含む200μlの培地中の10000個のMC/9細胞(ATCC, Manassas, USA)を1ウエル当たりで96ウエルマイクロタイタープレートに入れ、種々の量のヒトIL10で48時間処理した。hIL10標準及びF8-IL10融合タンパク質を最大100ng/mlのIL10等量で使用して、連続希釈した。10μlの5mg/ml MTT(Sigma)を添加し、3〜5時間インキュベートした。続いて、細胞を遠心し、DMSOで溶解し、570nmにおける吸光を読み取った。
【0200】
参考文献
上記のいずれかで引用されたものなどの本明細書で引用される全ての参考文献は、あらゆる目的のためにその全体が参照により本明細書に組み入れられるものとする。
【0201】
Amit et al. (1986), Science, 233:747-753.
Andersen et al. (2002) Current Opinion in Biotechnology 13: 117
Ausubel et al. (1999) 4th eds., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, John Wiley & Sons.
Bagshawe K.D. et al. (1991) Antibody, Immunoconjugates and Radiopharmaceuticals 4: 915-922
Balza et al. (1988), FEBS Lett., 228: 42-44.
Batista et al. J. Exp. Med., 184: 2197-205, 1996.
Berndt et al. Histochem Cell Biol 1998, 109(3):249-255.
Birchler et al. (1999), J. Immunol. Methods, 231, 239-248.
Bird et al. (1988) Science, 242, 423-426
Borsi et al. (1987), J. Cell. Biol., 104, 595-600.
Borsi et al. (1990), FEBS Lett., 261: 175-178.
Borsi et al. (1995), J. Biol.Chem., 270: 6243-6245.
Borsi et al. (1998), Exp. Cell Res., 240, 244-251.
Borsi et al. (2000) Int J Cancer, 102(1):75-85.
Brack et al. (2006), Clin. Cancer Res., 12, 3200-3208.
Carnemolla et al. (1989), J. Cell. Biol., 108: 1139-1148.
Caton et al. (1990), J. Immunol., 144:1965-1968.
Chadd et al. (2001), Current Opinion in Biotechnology 12: 188-194
Chothia et al. (1987), J. Mol. Biol., 196:901-917.
Chothia et al. (1989), Nature, 342:877- 883.
Courtney et al. (1980) Nature, 14;283(5748):666-8.
Devos et al. (1983), Nucl. Acids Res. 11: 4307-4323.
ffrench-Constant (1995), Exp. Cell Res., 221, 261-271.
Giovannoni, Nucleic. Acid Research, 2001, 29(5):E27.
Glennie M J et al., 1987 J. Immunol. 139, 2367-2375
Haan et al. (2004), BioCentury, 12(5): A1-A6.
Hanahan et al. (2000), Cell 100, 57-70.
Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor N.Y., pp. 726, 1988
Heikinheimo et al. (1991), Virchows Arch. B Cell Pathol. Incl. Mol. Pathol., 61, 101-109.
Holliger and Bohlen 1999 Cancer and metastasis rev. 18: 411-419.
Holliger et al. (1993a), Proc. Natl. Acad. Sci. USA 90 6444-6448.
Holliger et al. (1993b), Current Opinion Biotechnol 4, 446-449.
Holt et al. (2003) Trends in Biotechnology 21, 484-490.
Hoogenboom et al. (1991), Nucleic Acids Res., 19 (15) 4133-7.
Hu et al. (1996), Cancer Res., 56, 3055-3061.
Huston et al. (1988) PNAS USA, 85, 5879-5883.
Hynes, R.O. (1990). Fibronectins (New York: Springer-Verlag).
Jacobs et al. (2002), Hum. Pathol., 33, 29-38.
Kabat et al. (1987) Sequences of Proteins of Immunological Interest. 4th Edition. US Department of Health and Human Services.
Kabat et al. (1991a), Sequences of Proteins of Immunological Interest, 5th Edition. US Department of Health and Human Services, Public Service, NIH, Washington. (a)
Kabat et al. (1991b), J. Immunol., 147:1709-1719.
Kaspar et al. (2006), Int. J. Cancer, 118, 1331-1339.
Knappik et al., (2000) J. Mol. Biol. 296, 57-86.
Koch et al. Ann Rheum Dis 2003, 62 Suppl 2:ii60-67.
Kohler and Milstein, Nature, 256:495-497, 1975
Koide et al. (1998), Journal of Molecular Biology, 284: 1141-1151.
Kontermann et al. (2001), S, Antibody Engineering, Springer-Verlag New York, LLC; ISBN: 3540413545.
Kornblihtt et al. (1984), Nucleic Acids Res. 12, 5853-5868.
Koukoulis et al. (1993), J. Submicrosc. Cytol. Pathol., 25, 285-295.
Koukoulis et al. (1995), Ultrastruct. Pathol., 19, 37-43.
Krebs et al. (2001), Journal of Immunological Methods, 254 67-84.
Kriegsmann et al.(2004) Rheumatol Int, 24(1):25-33.
Larrick JW and Thomas DW (2001) Current Opinion in Biotechnology 12:411-418.
Ledermann J.A. et al. (1991) Int. J. Cancer 47: 659-664
Li et al. Protein Engineering, 10: 731-736, 1997
Lohi et al. (1995), Int. J. Cancer, 63, 442-449.
Maeda et al. (1983) Biochem. Biophys. Res. Comm. 115: 1040-1047;
Matsumoto et al. (1999), Jpn. J. Cancer Res., 90, 320-325.
McCafferty et al., (1990) Nature, 348, 552-554.
Mendez, M. et al., (1997) Nature Genet, 15(2): 146-156.
Merchand et al., 1998 Nature Biotech. 16:677-681
Neri, D., and Bicknell, R. (2005), Nat Rev Cancer 5, 436-446.
Nygren et al. (1997), Current Opinion in Structural Biology, 7: 463-469.
Oyama et al. (1989), J. Biol. Chem., 264, 10331-10334.
Paolella et al. (1988), Nucleic Acids Res. 16, 3545-3557.
Pini et al. (1998), J. Biol. Chem., 273, 21769-21776.
Pluckthun (1991), Bio/Technology 9: 545-551.
Reiter et al. (1996), Nature Biotech, 14, 1239-1245.
Repp et al., 1995 J. Hemat. 377-382.
Ridgeway et al. (1996), Protein Eng., 9, 616-621.
Robinson ed., Sustained and Controlled Release Drug Delivery Systems, Marcel Dekker, Inc., New York, 1978
Roesli et al. (2006), Nature Protocols, 1, 192-199.
Ruf et al. (1991) J. Biol. Chem. 226: 15719-15725.
Rybak et al. (2005), Nat. Methods, 2, 291-298.
Rybak et al. (2006), ChemMedChem., 2,22-40.
Sambrook and Russell, Molecular Cloning: a Laboratory Manual: 3rd edition, 2001, Cold Spring Harbor Laboratory Press
Scarpati et al. (1987) Biochemistry 26: 5234-5238.
Scarpino et al. (1999) J. Pathol. 188, 163-167.
Scheurer et al. (2005), Proteomics 5, 3035-3039.
Segal et al. (1974), PNAS, 71:4298-4302.
Sharon et al. (1990a), PNAS, 87:4814-4817.
Sharon et al. (1990b), J. Immunol., 144:4863-4869.
Silacci et al. (2003), Proteomics, 5, 2340-2350.
Staerz U. D. and Bevan M. J. 1986 PNAS 83
Suresh et al. (1986) Method Enzymol. 121: 210-228
Taniguchi et al. (1983) Nature 302, 305-310;
Tarli et al. Blood 1999, 94(1):192-198.
Tavian et al. (1994), Int. J. Cancer, 56, 820-825.
Taylor, Arthritis Res 2002, 4 Suppl 3:S99-107.
Terrana et al. (1987), Cancer Res. 47, 3791-3797.
Thompson et al. (1991), J Exp Med, 173:507-510.
Thorpe (2004), Clin. Cancer Res., 10, 415-427.
Trachsel et al. (2006), Adv. Drug Deliv. Rev., 58, 735-754.
Trachsel et al. Arthritis Res Ther 2007, 9(1):R9.
Viti et al. (2000), Methods Enzymol., 326, 480-505.
Walsh et al. (1998) Am J Pathol, 152(3):691-702.
Ward et al. (1989), Nature 341, 544-546.
Wess In: BioCentury, The Bernstein Report on BioBusiness, 12(42), A1-A7, 2004.
【表1】

【0202】
【表2】

【特許請求の範囲】
【請求項1】
フィブロネクチンのエキストラドメイン-A (ED-A) アイソフォームに結合する抗体であって、該抗体が、
フレームワークと相補性決定領域HCDR1、HCDR2及び HCDR3のセットとを含むVHドメインであって、
該HCDR1は配列番号83のアミノ酸配列を有し、
該HCDR2は配列番号4のアミノ酸配列を有し、
該HCDR3は配列番号5のアミノ酸配列を有する、上記VHドメイン、ならびに、
フレームワークと相補性決定領域LCDR1、LCDR2及びLCDR3のセットとを含むVLドメインであって、
該LCDR1は配列番号86のアミノ酸配列を有し、
該LCDR2は配列番号7のアミノ酸配列を有し、
該LCDR3は配列番号8のアミノ酸配列を有する、上記VLドメイン
を含み、且つ、インターロイキン-10 (IL-10)にコンジュゲートされている、上記抗体。
【請求項2】
VHドメインフレームワーク、VLドメインフレームワーク、あるいは、VHドメインフレームワーク及びVLドメインフレームワークの両方がヒト生殖系列フレームワークである、請求項1に記載の抗体。
【請求項3】
(i)配列番号81のアミノ酸配列で示されるVHドメインであって、ただし該VHドメインにおいて5位のアミノ酸残基がバリン残基(V)よりもむしろロイシン残基(L)である、上記VHドメイン、及び
(ii)配列番号82のアミノ酸配列で示されるVLドメインであって、ただし該VLドメインにおいて18位のアミノ酸残基がリジン残基(K)よりもむしろ、アルギニン残基(R)である、上記VLドメイン、を含む、請求項1又は2に記載の抗体。
【請求項4】
一本鎖Fvを含むか、小免疫タンパク質(SIP)であるか、又はダイアボディである、請求項1〜3のいずれか1項に記載の抗体。
【請求項5】
ペプチドリンカーによって、IL-10にコンジュゲートされている、請求項1〜4のいずれか1項に記載の抗体。
【請求項6】
抗体及びIL-10が融合タンパク質として発現される、請求項1〜5のいずれか1項に記載の抗体。
【請求項7】
関節リウマチを患う患者を治療するための医薬の製造における、請求項1〜6のいずれか1項に記載の抗体の使用。
【請求項8】
フィブロネクチンのED-Aアイソフォームに結合する抗体にコンジュゲートされている分子を患者における関節リウマチ部位の新生血管へ送達するための医薬の製造における該抗体の使用であって、該抗体が、フレームワークと相補性決定領域HCDR1、HCDR2及び HCDR3のセットとを含むVHドメインであって、
該HCDR1は配列番号83のアミノ酸配列を有し、
該HCDR2は配列番号4のアミノ酸配列を有し、
該HCDR3は配列番号5のアミノ酸配列を有する、上記VHドメイン、ならびに、
フレームワークと相補性決定領域LCDR1、LCDR2及びLCDR3のセットとを含むVLドメインであって、
該LCDR1は配列番号86のアミノ酸配列を有し、
該LCDR2は配列番号7のアミノ酸配列を有し、
該LCDR3は配列番号8のアミノ酸配列を有する、上記VLドメイン
を含み、且つ、該分子がIL-10である、上記使用。
【請求項9】
抗体のVHドメインフレームワーク、VLドメインフレームワーク、あるいは、VHドメインフレームワーク及びVLドメインフレームワークの両方がヒト生殖系列フレームワークである、請求項8に記載の使用。
【請求項10】
抗体が、(i)配列番号81のアミノ酸配列で示されるVHドメインであって、ただし該VHドメインにおいて5位のアミノ酸残基がバリン残基(V)よりもむしろロイシン残基(L)である、上記VHドメイン、及び
(ii)配列番号82のアミノ酸配列で示されるVLドメインであって、ただし該VLドメインにおいて18位のアミノ酸残基がリジン残基(K)よりもむしろ、アルギニン残基(R)である、上記VLドメイン、を含む、請求項8又は9に記載の使用。
【請求項11】
抗体が一本鎖Fvを含むか、小免疫タンパク質(SIP)であるか、又はダイアボディである、請求項8〜10のいずれか1項に記載の使用。
【請求項12】
抗体がペプチドリンカーによって、IL-10にコンジュゲートされている、請求項8〜11のいずれか1項に記載の使用。
【請求項13】
抗体及びIL-10が融合タンパク質として発現される、請求項8〜12のいずれか1項に記載の使用。
【請求項14】
患者が関節リウマチを患っている、請求項7〜13のいずれか1項に記載の使用。
【請求項15】
患者における関節リウマチを治療するための医薬であって、請求項1〜6のいずれか1項に記載の、フィブロネクチンのED-Aに結合する抗体を治療上有効量含む、上記医薬。
【請求項16】
フィブロネクチンのED-Aアイソフォームに結合する抗体を含む、ヒト又は動物における関節リウマチ部位の新生血管へ、分子を送達するための医薬であって、該抗体が、
フレームワークと相補性決定領域HCDR1、HCDR2及び HCDR3のセットとを含むVHドメインであって、
該HCDR1は配列番号83のアミノ酸配列を有し、
該HCDR2は配列番号4のアミノ酸配列を有し、
該HCDR3は配列番号5のアミノ酸配列を有する、上記VHドメイン、ならびに、
フレームワークと相補性決定領域LCDR1、LCDR2及びLCDR3のセットとを含むVLドメインであって、
該LCDR1は配列番号86のアミノ酸配列を有し、
該LCDR2は配列番号7のアミノ酸配列を有し、
該LCDR3は配列番号8のアミノ酸配列を有する、上記VLドメイン
を含み、且つ、該分子にコンジュゲートされており、該分子がIL-10である、上記医薬。
【請求項17】
抗体のVHドメインフレームワーク、VLドメインフレームワーク、あるいは、VHドメインフレームワーク及びVLドメインフレームワークの両方がヒト生殖系列フレームワークである、請求項16に記載の医薬。
【請求項18】
抗体が、(i)配列番号81のアミノ酸配列で示されるVHドメインであって、ただし該VHドメインにおいて5位のアミノ酸残基がバリン残基(V)よりもむしろロイシン残基(L)である、上記VHドメイン、及び
(ii)配列番号82のアミノ酸配列で示されるVLドメインであって、ただし該VLドメインにおいて18位のアミノ酸残基がリジン残基(K)よりもむしろ、アルギニン残基(R)である、上記VLドメイン、を含む、請求項16又は17に記載の医薬。
【請求項19】
抗体が一本鎖Fvを含むか、小免疫タンパク質(SIP)であるか、又はダイアボディである、請求項16〜18のいずれか1項に記載の医薬。
【請求項20】
抗体がペプチドリンカーによって、IL-10にコンジュゲートされている、請求項16〜19のいずれか1項に記載の医薬。
【請求項21】
抗体及びIL-10が融合タンパク質として発現される、請求項16〜20のいずれか1項に記載の医薬。
【請求項1】
フィブロネクチンのエキストラドメイン-A (ED-A) アイソフォームに結合する抗体であって、該抗体が、
フレームワークと相補性決定領域HCDR1、HCDR2及び HCDR3のセットとを含むVHドメインであって、
該HCDR1は配列番号83のアミノ酸配列を有し、
該HCDR2は配列番号4のアミノ酸配列を有し、
該HCDR3は配列番号5のアミノ酸配列を有する、上記VHドメイン、ならびに、
フレームワークと相補性決定領域LCDR1、LCDR2及びLCDR3のセットとを含むVLドメインであって、
該LCDR1は配列番号86のアミノ酸配列を有し、
該LCDR2は配列番号7のアミノ酸配列を有し、
該LCDR3は配列番号8のアミノ酸配列を有する、上記VLドメイン
を含み、且つ、インターロイキン-10 (IL-10)にコンジュゲートされている、上記抗体。
【請求項2】
VHドメインフレームワーク、VLドメインフレームワーク、あるいは、VHドメインフレームワーク及びVLドメインフレームワークの両方がヒト生殖系列フレームワークである、請求項1に記載の抗体。
【請求項3】
(i)配列番号81のアミノ酸配列で示されるVHドメインであって、ただし該VHドメインにおいて5位のアミノ酸残基がバリン残基(V)よりもむしろロイシン残基(L)である、上記VHドメイン、及び
(ii)配列番号82のアミノ酸配列で示されるVLドメインであって、ただし該VLドメインにおいて18位のアミノ酸残基がリジン残基(K)よりもむしろ、アルギニン残基(R)である、上記VLドメイン、を含む、請求項1又は2に記載の抗体。
【請求項4】
一本鎖Fvを含むか、小免疫タンパク質(SIP)であるか、又はダイアボディである、請求項1〜3のいずれか1項に記載の抗体。
【請求項5】
ペプチドリンカーによって、IL-10にコンジュゲートされている、請求項1〜4のいずれか1項に記載の抗体。
【請求項6】
抗体及びIL-10が融合タンパク質として発現される、請求項1〜5のいずれか1項に記載の抗体。
【請求項7】
関節リウマチを患う患者を治療するための医薬の製造における、請求項1〜6のいずれか1項に記載の抗体の使用。
【請求項8】
フィブロネクチンのED-Aアイソフォームに結合する抗体にコンジュゲートされている分子を患者における関節リウマチ部位の新生血管へ送達するための医薬の製造における該抗体の使用であって、該抗体が、フレームワークと相補性決定領域HCDR1、HCDR2及び HCDR3のセットとを含むVHドメインであって、
該HCDR1は配列番号83のアミノ酸配列を有し、
該HCDR2は配列番号4のアミノ酸配列を有し、
該HCDR3は配列番号5のアミノ酸配列を有する、上記VHドメイン、ならびに、
フレームワークと相補性決定領域LCDR1、LCDR2及びLCDR3のセットとを含むVLドメインであって、
該LCDR1は配列番号86のアミノ酸配列を有し、
該LCDR2は配列番号7のアミノ酸配列を有し、
該LCDR3は配列番号8のアミノ酸配列を有する、上記VLドメイン
を含み、且つ、該分子がIL-10である、上記使用。
【請求項9】
抗体のVHドメインフレームワーク、VLドメインフレームワーク、あるいは、VHドメインフレームワーク及びVLドメインフレームワークの両方がヒト生殖系列フレームワークである、請求項8に記載の使用。
【請求項10】
抗体が、(i)配列番号81のアミノ酸配列で示されるVHドメインであって、ただし該VHドメインにおいて5位のアミノ酸残基がバリン残基(V)よりもむしろロイシン残基(L)である、上記VHドメイン、及び
(ii)配列番号82のアミノ酸配列で示されるVLドメインであって、ただし該VLドメインにおいて18位のアミノ酸残基がリジン残基(K)よりもむしろ、アルギニン残基(R)である、上記VLドメイン、を含む、請求項8又は9に記載の使用。
【請求項11】
抗体が一本鎖Fvを含むか、小免疫タンパク質(SIP)であるか、又はダイアボディである、請求項8〜10のいずれか1項に記載の使用。
【請求項12】
抗体がペプチドリンカーによって、IL-10にコンジュゲートされている、請求項8〜11のいずれか1項に記載の使用。
【請求項13】
抗体及びIL-10が融合タンパク質として発現される、請求項8〜12のいずれか1項に記載の使用。
【請求項14】
患者が関節リウマチを患っている、請求項7〜13のいずれか1項に記載の使用。
【請求項15】
患者における関節リウマチを治療するための医薬であって、請求項1〜6のいずれか1項に記載の、フィブロネクチンのED-Aに結合する抗体を治療上有効量含む、上記医薬。
【請求項16】
フィブロネクチンのED-Aアイソフォームに結合する抗体を含む、ヒト又は動物における関節リウマチ部位の新生血管へ、分子を送達するための医薬であって、該抗体が、
フレームワークと相補性決定領域HCDR1、HCDR2及び HCDR3のセットとを含むVHドメインであって、
該HCDR1は配列番号83のアミノ酸配列を有し、
該HCDR2は配列番号4のアミノ酸配列を有し、
該HCDR3は配列番号5のアミノ酸配列を有する、上記VHドメイン、ならびに、
フレームワークと相補性決定領域LCDR1、LCDR2及びLCDR3のセットとを含むVLドメインであって、
該LCDR1は配列番号86のアミノ酸配列を有し、
該LCDR2は配列番号7のアミノ酸配列を有し、
該LCDR3は配列番号8のアミノ酸配列を有する、上記VLドメイン
を含み、且つ、該分子にコンジュゲートされており、該分子がIL-10である、上記医薬。
【請求項17】
抗体のVHドメインフレームワーク、VLドメインフレームワーク、あるいは、VHドメインフレームワーク及びVLドメインフレームワークの両方がヒト生殖系列フレームワークである、請求項16に記載の医薬。
【請求項18】
抗体が、(i)配列番号81のアミノ酸配列で示されるVHドメインであって、ただし該VHドメインにおいて5位のアミノ酸残基がバリン残基(V)よりもむしろロイシン残基(L)である、上記VHドメイン、及び
(ii)配列番号82のアミノ酸配列で示されるVLドメインであって、ただし該VLドメインにおいて18位のアミノ酸残基がリジン残基(K)よりもむしろ、アルギニン残基(R)である、上記VLドメイン、を含む、請求項16又は17に記載の医薬。
【請求項19】
抗体が一本鎖Fvを含むか、小免疫タンパク質(SIP)であるか、又はダイアボディである、請求項16〜18のいずれか1項に記載の医薬。
【請求項20】
抗体がペプチドリンカーによって、IL-10にコンジュゲートされている、請求項16〜19のいずれか1項に記載の医薬。
【請求項21】
抗体及びIL-10が融合タンパク質として発現される、請求項16〜20のいずれか1項に記載の医薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−40183(P2013−40183A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2012−219986(P2012−219986)
【出願日】平成24年10月2日(2012.10.2)
【分割の表示】特願2010−531449(P2010−531449)の分割
【原出願日】平成20年10月27日(2008.10.27)
【出願人】(510120311)
【Fターム(参考)】
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成24年10月2日(2012.10.2)
【分割の表示】特願2010−531449(P2010−531449)の分割
【原出願日】平成20年10月27日(2008.10.27)
【出願人】(510120311)

【Fターム(参考)】
[ Back to top ]

