陰イオン結合性ポリマーとその利用
【課題】少ない薬物量で体内から選択的にイオンを除去し、患者のコンプライアンス性を高める、安全で高結合能の結合剤を提供すること。
【解決手段】本発明により、陰イオン結合性ポリマーが提供される。このポリマーは、好ましい実施形態では、標的陰イオンを結合するものであり、かつ次の特徴のうち少なくとも2つによって特徴づけられる、陰イオン結合性ポリマーである:a)膨潤率は約5未満、b)該標的陰イオンの約2倍より大きい分子量を持つ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が約60%未満。
【解決手段】本発明により、陰イオン結合性ポリマーが提供される。このポリマーは、好ましい実施形態では、標的陰イオンを結合するものであり、かつ次の特徴のうち少なくとも2つによって特徴づけられる、陰イオン結合性ポリマーである:a)膨潤率は約5未満、b)該標的陰イオンの約2倍より大きい分子量を持つ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が約60%未満。
【発明の詳細な説明】
【技術分野】
【0001】
(相互参照)
この出願は、米国特許出願番号10/806,495(名称:CROSSLINKED
AMINE POLYMERS、2004年3月22日出願)、米国特許出願番号10/701,385(名称:POLYAMINE POLYMERS、2003年11月3日出願)、米国特許出願番号10/965,044(名称:ANION−BINDING
POLYMERS AND USES THEREOF、2004年10月13日出願)の一部継続出願であり、これらの米国特許出願は、参考としてこれら全体が本明細書中に援用されており、本出願は、米国特許法第120条に基づき、これらに対して優先権を主張する。
【背景技術】
【0002】
(発明の背景)
イオン選択性吸着剤は、高リン酸血症、高シュウ酸尿症、高カルシウム血症、高カリウム血症などの状態において人間の電解質バランス障害を矯正する治療に使用されている。高リン酸血症は、腎不全患者に発生する。その患者の腎臓が充分にリン酸イオンを排出できないため、食事中の外因性リン酸の摂取分を補正できなくなる。この状態が進むと、血清中リン酸濃度が高くなり、カルシウム×リン酸の積が高まる。因果関係はまだ完全には明らかにされていないが、カルシウム×リン酸の積が高いと、軟組織の石灰化や心臓血管疾患を引き起こす。心臓血管疾患は、全透析患者の死因の約半分を占める。
【0003】
リン酸イオン吸収を消化(GI)管内で調節するためや、全身のリン酸濃度を正常に戻すために、アルミニウム塩、カルシウム塩、そして最近ではランタン塩が処方されている。しかし、これらの塩は、可溶性のアルミニウム陽イオンやカルシウム陽イオンを消化管に放出するため、一部が吸収されて血流に入り込む。アルミニウムの吸収により、アルミニウム骨疾患や痴呆などの深刻な副作用を起こす可能性があり、カルシウムの過剰摂取は高カルシウム血症をもたらし、患者に冠状血管の石灰化のリスクが生じる。
【0004】
Dowex樹脂やコレスチラミン樹脂などの強塩基性イオン交換材料に代表される、金属を含まないリン酸イオン結合剤が、リン酸結合剤として使用するために、これまでに提案されている。しかしながら結合能が低いため、用量を多くしなければならず、患者によっては辛い場合がある。
【0005】
アミン官能性ポリマーが、これまでにリン酸イオン結合剤またはシュウ酸イオン結合剤として説明されている。たとえば、特許文献1〜5を参照されたい。架橋ポリアリルアミン樹脂であるRenagelは、リン酸イオン捕捉剤であり、金属を含まないリン酸イオン結合剤として販売されている。in vitroのRenagelのリン酸イオン結合は、水中では約6mmol/g、塩化ナトリウム100mM+リン酸イオン20mMの中性pHで測定した場合は2.5mmol/gである。対象となる患者群に対する推奨用量は、6mg/dL未満のリン酸イオン濃度を維持するため、通常5g/日〜15g/日となっている。公表されている、健康な志願者を対象にしたRenagelフェーズI臨床試験によれば、Renagel 15gの投与によって尿中のリン酸イオン排出量がベースラインの25mmolから17mmolに減少し、この差は、遊離リン酸イオンおよびポリマー結合リン酸イオンとして便中に排出されていることが示されている。このデータより、in vivoの結合能範囲は0.5〜1mmol/gと見ることができるが、これはin vitroの生理食塩水中で測定された結合能6mmol/gよりもはるかに少ない。in vitroで生理食塩水中で測定されたRenagel結合能だけを考え
れば、リン酸イオン結合剤15gという用量は、平均的アメリカ人の食事中に含まれるリンの量(すなわち、37mmol/日)すべてを吸着しても余る量である。in vitro結合能と、論文にあるin vivo結合能の低さとの間には差があるため、血清中のリン酸イオン濃度を安全範囲まで下げるには多量の樹脂が必要となり、この薬剤の治療的利点にとってデメリットとなっている。
【0006】
イオン交換樹脂の結合能の損失は、複雑な消化系環境中で使用される場合のRenagelだけに限られる問題ではない。用量の多さは、毒性学の点では一般的に安全ではあるけれども、何グラムもの樹脂を服用するという不便さから、樹脂の結合能を向上させる必要が議論されている。例えば、Renagel結合剤の安全研究報告においても、8週間の治療期間中に1.2〜2.0g/日の低用量であっても患者は胃腸の不調を訴えている。Renagelを5.4g/日投与された患者では、8.9%の症例において胃腸の不調などの有害な作用が生じたため、処置が中止されている(非特許文献1および2)。よって、in vivoの結合能を向上させること、すなわち投与用量を少なくするという改善は、樹脂による治療において歓迎されるものとなる。
【0007】
これらを考慮した結果、少ない薬物量で体内から選択的にイオンを除去し、患者のコンプライアンス性を高める、安全で高結合能の結合剤に対する大きな需要が今も存在する。
【0008】
患者のコンプライアンスは、患者にとってK/DOQIの提言に従うための大きな制限的事項の1つとして認識されるようになっている、つまりその提言に従った用量の増大は、患者が800mgの錠剤を1日に10錠以上も飲まなければならないということを意味する。Renagel錠剤は飲み込む錠剤の形状になっており、最小限量の水分とともに服用するようになっている。これが、水分を制限している末期腎不全患者にとっては負担の増加となる。より服用しやすい製薬形状が好ましい。特に、チュアブルタイプの錠剤は、老人や小児用、大量の錠剤を必要とする治療においてに普及が進んでいる。チュアブルタイプの錠剤は、より効力の高い錠剤にすることが可能で、最終的に食事ごとに服用する錠剤の数を減らすことができる。チュアブル錠剤に含まれている有効成分は、咀嚼と唾液によって細かくしてから飲み込むことになる。このため、錠剤の形状や重さの条件は、飲み込むタイプの錠剤に比べ、はるかに緩和される。しかしながら、Renagelのようなヒドロゲルをチュアブル錠剤に製剤するのは、ポリマーの膨潤性の高さから、これまで不可能であった。Renagelは非常に急速に膨潤し、等張性溶液中では重量が10倍にもなる。これにより、2つの困った問題が生じる。第一は、口の中でもポリマーが膨潤し、非常に不快な感覚(口内の渇きや窒息感)をもたらすという点、第二は、口内の不快感を患者が克服したとしても、膨潤したゲルを食道経由で投与するのは危険が伴うという点である。さらに、非常に膨潤性の高いゲルであることが知られており、数グラムの範囲で投与した場合には、鼓腸や便秘、下痢などの副作用を引き起こす。
【特許文献1】米国特許第5,985,938号明細書
【特許文献2】米国特許第5,980,881号明細書
【特許文献3】米国特許第6,180,094号明細書
【特許文献4】米国特許第6,423,754号明細書
【特許文献5】国際公開第95/05184号パンフレット
【非特許文献1】Slatapolskyら,Kidney Int.,1999年、第55巻、p.299−307
【非特許文献2】Chertowら,Nephrol Dial Transplant,1999年、第14巻、p.2907−2914
【発明の開示】
【課題を解決するための手段】
【0009】
本発明の好ましい実施形態によれば、以下のポリマーなどが提供される。
(項1)
陰イオン結合性ポリマーであって、該ポリマーは、標的陰イオンを結合するものであり、かつ次の特徴のうち少なくとも2つによって特徴づけられる、陰イオン結合性ポリマー:a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量を持つ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が約60%未満。
(項2)
前記ポリマーは、胆汁酸またはクエン酸と約2mmol/g未満の結合能で結合する、上記項1に記載のポリマー。
(項3)
前記膨潤率は、等張性溶液中でおよび/または中性pHで測定される、上記項1に記載のポリマー。
(項4)
前記ポリマーは、アミン基を含む、上記項1に記載のポリマー。
(項5)
前記アミンモノマーは、アリルアミン、ビニルアミン、エチレンイミン、式1および式2からなる群より選択され、ここで式1および式2は次の構造:
【化1】

である、上記項4に記載のポリマー。
(項6)
前記アミンモノマーは、1,3−ジアミノプロパンおよびN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン、1,2,3,4−テトラアミノブタンからなる群より選択される非重合性アミンモノマーである、上記項4に記載のポリマー。
(項7)
前記ポリマーは、非重合性アミンモノマーと架橋剤から成る、上記項1に記載のポリマー。
(項8)
前記ポリマーは、アミンモノマーおよび架橋剤から成る、該架橋剤の量は、該モノマーの全アミン含有量の50モル%より多い、上記項1に記載のポリマー。
(項9)
非重合性アミンモノマーと架橋剤から成る、陰イオン結合性ポリマーであって、ここで該ポリマーは、不均一プロセスから得られ、該ポリマーの膨潤率は、5未満である、陰イオン結合性ポリマー。
(項10)
上記項1〜9に記載のポリマーと、製薬分野で受容される賦形剤を含む、医薬組成物。
(項11)
前記標的陰イオンは、リン酸イオンおよびシュウ酸イオンからなる群より選択される、上記項1に記載の組成物。
(項12)
前記標的陰イオンは、リン酸イオンである、上記項1に記載の組成物。
(項13)
非重合性アミンモノマーと架橋剤から成るリン酸イオン結合性ポリマーであって、該ポリマーは、次の特徴のうち少なくとも1つによって特徴づけられる、リン酸イオン結合性ポリマー:
a)膨潤率は約5未満、
b)約200より大きい分子量の非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージは生理学的媒体中で測定される、および
c)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉が約60%未満。
(項14)
非重合性アミンモノマーと架橋剤から成るリン酸イオン結合性ポリマーであって、該ポリマーは、次の特徴のうち少なくとも1つによって特徴づけられる、リン酸イオン結合性ポリマー:
a)膨潤率は約2.5未満、
b)約200より大きい分子量の非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージは生理学的媒体中で測定される、および
c)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉が約60%未満。
(項15)
リン酸イオン結合性ポリマーであって、該ポリマーは、次の特徴のうち少なくとも1つによって特徴づけられる、リン酸イオン結合性ポリマー:
a)約200より大きい分子量の非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージは生理学的媒体中で測定される、および
b)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉が約60%未満。
(項16)
前記ポリマーは、アミンモノマーと架橋剤から構成され、該架橋剤の量は、該モノマーの全アミン含有量の50モル%より多い、上記項15に記載のポリマー。
(項17)
前記ポリマーは、胆汁酸またはクエン酸と2mmol/g未満の結合能で結合する、上記項14に記載のポリマー。
(項18)
前記膨潤率は、等張性溶液中でおよび/または生理学的pHで測定されている、上記項14に記載のポリマー。
(項19)
前記ポリマーは、in vivoでの平均リン酸イオン結合能が約0.5mole/gより大きい、上記項15に記載のポリマー。
(項20)
前記ポリマーは、ポリアミンポリマーであり、該ポリマーの塩化物の含有量は、アミン基の含有量の約35mol%未満である、上記項15に記載のポリマー。
(項21)
1種以上のアミンモノマーと1種以上の架橋剤から成る、上記項1に記載のポリマーであって、該ポリマーは、架橋反応に先立ち、アミン:溶媒の比が約3:1〜約1:3で溶媒中に該アミンを存在させ、かつ反応混合物に加えられる該架橋剤の量は該アミンモノマーの平均結合数(NC)が約2.05〜6となるようにする方法によって製造される、ポリマー。
(項22)
反応混合物に添加される前記架橋剤総量は、NCが約2.2〜約4.5になるような量である、上記項21の組成物。
(項23)
前記架橋反応中に前記標的陰イオンを存在させる方法によって製造される、上記項1に記載のポリマー。
(項24)
上記項23に記載のポリマーであって、前記架橋反応は、次の工程:
a)前記アミンモノマーを遊離塩基として添加し、前記標的陰イオンをその酸の形態で添加する工程;
b)架橋剤を添加する工程;
c)架橋反応を実行する工程;
d)該標的イオンを洗い流す工程、
を包含する、ポリマー。
(項25)
1種以上のアミンモノマーと1種以上の架橋剤から成る、上記項1に記載のポリマーであって、該ポリマーは、以下の工程:
a)次のi)およびii):
i)前記アミンモノマーを添加する工程;次いで
ii)前記架橋剤の一部を添加して、シロップを形成する工程、
によって可溶性プレポリマーを形成する工程;
b)該シロップを油中で乳化させる工程;
c)残りの架橋剤を添加して、架橋ビーズを製造する工程、
を包含する方法によって製造される、ポリマー。
(項26)
1種以上のアミンモノマーと1種以上の架橋剤から成る、上記項1に記載のポリマーであって、該ポリマーは、以下:
a)該アミンモノマーと架橋剤との間で第1の反応を行って、ゲルを形成する工程、
b)該ゲルをアミノアルキルハライドと反応させ、該反応において、ハライド置換によアミンアルキル基を、該ゲルに化学的に結合させる工程、
を包含するプロセスによって生成される、ポリマー。
(項27)
上記項21に記載のポリマーと、製薬分野で受容される賦形剤を含む、医薬組成物。
(項28)
前記ポリマーは、粒子の形状であり、該ポリマー粒子は、外殻に収められている、上記項1に記載のポリマー。
(項29)
1種以上のアミンモノマーと1種以上の架橋剤から成るリン酸イオン結合性ポリマーであって、ここで該ポリマーは、反応混合物に添加される架橋剤含有量は該アミンモノマーの平均結合数が約2.2〜約4.5となるような量である方法によって製造される、ポリマー。
(項30)
前記アミンモノマーは、1,3−ジアミノプロパンおよびN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンからなる群より選択され、前記架橋剤は、1,3−ジクロロプロパンおよびエピクロロヒドリンからなる群より選択される、上記項29に記載のポリマー。
(項31)
上記項29に記載のポリマーと、製薬分野で受容される賦形剤を含む、医薬組成物。
(項32)
エピクロロヒドリンによって架橋されたN,N,N’,N’−テトラキス(3−アミノプ
ロピル)1,4−ジアミノブタンから成るイオン結合性ポリマーであって、ここで該ポリマーは、N,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン:水の初期濃度比が約1:3〜4:1となる製法によって製造される、イオン結合性ポリマー。
(項33)
N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン:水の初期濃度比は、約1.5:1〜約4:1である、上記項32に記載のポリマー。
(項34)
上記項32のポリマーと、製薬分野で受容される賦形剤を含む、医薬組成物。
(項35)
N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマーとエピクロロヒドリン架橋剤から成るリン酸イオン結合性ポリマーであって、ここで該ポリマーは、反応混合物に添加される該エピクロロヒドリン架橋剤が、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン全含有量の約200〜300mol%である製法によって製造される、リン酸イオン結合性ポリマー。
(項36)
前記初期反応混合物におけるモノマー:水の比は、約3:1〜約1:1である製法によって製造される、上記項35に記載のポリマー。
(項37)
前記反応混合物に添加されるエピクロロヒドリン架橋剤の合計量は、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン全含有量の約230〜270mol%である、上記項35に記載のポリマー。
(項38)
前記初期反応混合物に添加されるエピクロロヒドリン架橋剤の合計量は、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン全含有量の約250mol%である、上記項35に記載のポリマー。
(項39)
(N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン +
エピクロロヒドリン):水の比は、約1.73である製法によって製造される、上記項38に記載のポリマー。
(項40)
前記ポリマーは、球形ビーズの形状である、上記項35に記載のポリマー。
(項41)
ポリアリルアミンモノマーとエピクロロヒドリン架橋剤から成るリン酸イオン結合性ポリマーであって、ここで該ポリマーは、該ポリアリルアミンモノマーを、該モノマー:水の比が約3:1〜約1:3で溶解させることにより生成される、リン酸イオン結合性ポリマー。
(項42)
前記反応混合物に添加されるエピクロロヒドリン架橋剤の合計量は、ポリアリルアミン含有量の約10mol%である、上記項41のポリマー。
(項43)
プレポリマーから成るリン酸イオン結合性ポリマーであって、該プレポリマーは、モル比1:1で1,3−ジアミノプロパンと1,3−ジクロロプロパン架橋剤から成り、ここで該プレポリマーは、エピクロロヒドリン架橋剤によってさらに架橋され、反応混合物に添加されるエピクロロヒドリン架橋剤の量は、プレポリマー合計量に対して約200mol%であり、該反応混合物におけるプレポリマー:水の比は、約1.1:1〜1.7:1である、リン酸イオン結合性ポリマー。
(項44)
上記項10、24、31、または34の医薬組成物であって、該組成物は、製剤分野で受容される賦形剤と水を含む液体製剤である、医薬組成物。
(項45)
標的陰イオンを結合する陰イオン結合性ポリマーと、1種以上の適切な製剤用賦形剤を含む薬学的組成物であって、ここで該組成物は、チュアブル錠および/または口中で崩れる錠剤の形態であり、該ポリマーは、口腔内および食道内を移動するために必要な期間のポリマーの膨潤率が約5未満である、医薬組成物。
(項46)
標的陰イオンを結合する陰イオン結合性ポリマーと、1種以上の適切な製剤用賦形剤を含む医薬組成物であって、ここで該組成物は、チュアブル錠および/または口中で崩れる錠剤の形態であり、該ポリマーは、次の特徴を有する、医薬組成物:
a)該標的陰イオンの約2倍より大きい分子量を持つ非反応性溶質が利用可能な部分は、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、およびb)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が約60%未満。
(項47)
前記ポリマーの転移温度が約50℃より高い、上記項46に記載の組成物。
(項48)
前記製剤用賦形剤のうちの1種は、蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトール、およびこれらの組合せからなる群より選択される、該組成物は、前記ポリマーが該賦形剤とあらかじめ配合されて固溶体を形成するプロセスによって生成される、上記項46に記載の組成物。
(項49)
前記ポリマーの標的陰イオンは、リン酸イオンである、上記項46に記載の組成物。
(項50)
前記ポリマーは、in vivoにおいて、標的イオンに、0.5mmol/gより大きい結合能で結合する、上記項46に記載の組成物。
(項51)
前記陰イオン結合性ポリマーは、前記錠剤重量の約50%より多くを構成する、上記項46に記載の組成物。
(項52)
前記錠剤は、円筒形をしていて、直径は約22mm、高さは約4mmであり、前記陰イオン結合性ポリマーを約1.6gより多く含む、上記項46の組成物。
(項53)
前記賦形剤は、甘味剤、結合剤、滑沢剤、崩壊剤からなる群より選択される、上記項46に記載の医薬組成物。
(項54)
前記ポリマーは、平均で直径約40μm未満の粒子として存在する、上記項53に記載の医薬組成物。
(項55)
前記甘味剤は、蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、およびソルビトール、ならびにこれらの組合せからなる群より選択される、上記項53に記載の医薬組成物。
(項56)
イオン結合性ポリマーについての標的イオン結合干渉率を測定するための方法であって、以下:
a)該イオン結合性ポリマーを、該標的イオンを含む非干渉性緩衝液に添加し、該ポリマーの該標的イオン結合能を測定する工程;
b)哺乳動物の消化酵素を使用して標準食を人工的に消化することによって、そして/または該標準食を摂取した哺乳動物の上部消化器官から糜粥を吸引することによって、干渉性緩衝液を調製する工程であって、ここで該標準食は、標的イオンを含んでいる、工程;ならびに
c)該イオン結合性ポリマーを該干渉性緩衝液に添加して、該標的イオン結合能を測定す
る工程であって、ここで該結合能は、該イオン結合性ポリマーを添加する前と後の、該干渉性緩衝液中の標的イオン濃度の差から得られる、工程;ならびに
d)非干渉性緩衝液中での結合実験と、干渉性緩衝液中での結合実験との間で、平衡状態にある同じ標的陰イオン濃度で観察される該標的イオンの結合能の部分的低下として、結合干渉度を算出する工程、
による、方法。
(項57)
標的イオンを結合するイオン結合性ポリマーを選択するための方法であって、該ポリマーは、モノマーと架橋剤から成り、ここで該ポリマーは、次の特徴のうち少なくとも1つ:a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が約60%未満、
によって特徴づけられ、
該方法は:
i)以下:
1)モノマーに対する架橋剤の比率:
2)反応媒体中の、溶媒に対する(モノマー+架橋剤)の比率;
3)生理学的pHと生理学的浸透圧での該ポリマーの有効電荷;および/または
4)主鎖ポリマーの親水性/疎水性のバランス、
を変化させる工程;
ii)得られたポリマーの膨潤性、細孔度、イオン結合干渉率を評価する工程;
iii)該特徴のうち少なくとも1つを有するポリマーを選択する工程、
を包含する、方法。
(項58)
ポリアミンポリマーの治療的特性および/または投与適性および/または製薬性質の向上させるための方法であって、該方法は、以下の工程のうちの少なくとも1つ:
a)該ポリアミンモノマーの平均結合数が約2.05〜6になるように、架橋剤で該ポリマーを架橋する工程;
b)ポリアミン:水の初期比が約3:1〜1:3である工程によって該ポリマーを製造する工程、
を包含する、方法。
(項59)
標的陰イオンを結合する陰イオン結合性ポリマーを製造する方法であって、該方法は、不均一プロセスによってアミンモノマーと架橋剤とを反応させる工程を包含し、ここで該リン酸イオン結合性ポリマーは、次の特徴のうち少なくとも2つによって特徴づけられる、方法:
a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能な部分が、ポリマー重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、
c)非干渉性緩衝液と比した胃腸内模擬液の該標的陰イオンに対するイオン結合干渉が約60%未満。
(項60)
前記アミンモノマーは、非重合アミンモノマーである、上記項59に記載の方法。
(項61)
前記ポリマーは、アミンモノマーと架橋剤から成り、該架橋剤の量は、該モノマーの全アミン含有量の50mol%より多い、上記項59に記載の方法。
(項62)
前記アミンモノマーは、ポリアリルアミンである、上記項59に記載の方法。
(項63)
前記架橋剤は、エピクロロヒドリンである、上記項62に記載の方法。
(項64)
標的イオンを結合する陰イオン結合性ポリマーであって、ここで該ポリマーは、不均一プロセスによってアミンモノマーを架橋剤で架橋する工程を包含する製法によって製造され、該ポリマーは、次の特徴のうち少なくとも2つによって特徴づけられる、陰イオン結合性ポリマー:
a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能な部分が、ポリマー重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、および
c)非干渉性緩衝液と比した胃腸内模擬液の該標的陰イオンのイオン結合干渉は約60%未満。
(項65)
前記アミンモノマーは、非重合性アミンモノマーである、上記項64に記載のポリマー。
(項66)
前記ポリマーは、アミンモノマーと架橋剤から成り、該架橋剤の量は、該モノマーの全アミン含有量の50mol%より多い、上記項64に記載のポリマー。
(項67)
前記アミンモノマーは、ポリアリルアミンである、上記項64に記載のポリマー。
(項68)
前記ポリアリルアミンは、エピクロロヒドリンによって架橋されている、上記項64に記載のポリマー。
(項69)
動物から陰イオンを除去するための方法であって、該方法は、該動物に有効量のポリマーを投与する工程を包含し、ここで該ポリマーは、標的陰イオンを結合する陰イオン結合性ポリマーであり、該ポリマーは、次の特徴のうち少なくとも2つを有することで特徴づけられる、方法:
a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、
c)非干渉性緩衝液と比した胃腸内模擬液の該標的陰イオンに対するイオン結合干渉率が約60%未満。
(項70)
前記ポリマーは、非重合性アミンモノマーと架橋剤から成る、上記項69に記載の方法。
(項71)
前記ポリマーは、アミンモノマーと架橋剤から構成され、該架橋剤の量は、モノマーの全アミン含有量の50mol%より多い、上記項69に記載の方法。
(項72)
前記陰イオンは、リン酸イオンである、上記項69に記載の方法。
(項73)
前記動物は、高リン酸血症、低カルシウム血症、甲状腺亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、および末期腎不全からなる群より選択される少なくとも1つの疾患に罹患している、上記項72に記載の方法。
(項74)
前記動物はヒトである、上記項72に記載の方法。
(項75)
前記リン酸イオンは、消化管内から除去される、上記項72に記載の方法。
(項76)
前記投与は、経口投与である、上記項72に記載の方法。
(項77)
前記ポリマーは、プロトンポンプ阻害剤、カルシウム様作用薬、ビタミンおよびそのアナログ、リン酸イオン結合剤のうちの少なくとも1つと共に投与される、上記項72に記載の方法。
(項78)
前記リン酸イオン結合剤は、炭酸アルミニウム、炭酸カルシウム、酢酸カルシウム、炭酸ランタン、塩酸セベラマーのうちの少なくとも1つである、上記項77に記載の方法。
(発明の要旨)
本発明は、一態様において、陰イオン結合性ポリマーを提供する。いくつかの実施態様において、本発明は、ポリマーが標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーを提供し、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定したゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、膨潤率は約4未満、または約3未満、または約2.8未満、または約2.7未満、または約2.6未満、または約2.5未満である。いくつかの実施態様において、ポリマーは胆汁酸やクエン酸イオンと結合するが、その結合能は約2mmol/g未満、または約1mmol/g未満、または約0.5mmol/g未満、または約0.3mmol/g未満、または約0.1mmol/g未満である。いくつかの実施態様において、膨潤率は中性pHの等張性溶液中で測定される。いくつかの実施態様において、ポリマーはアミンモノマーから成る。いくつかの実施態様において、このアミンモノマーはアリルアミン、ビニルアミン、エチレンイミン、1,3−ジアミノプロパン、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン、1,2,3,4−テトラアミノブタン、化学式1および化学式2、のグループから選ばれる。ここに化学式1および化学式2は次の構造である:
【0010】
【化2】

いくつかの実施態様において、本発明は、逆懸濁重合によって得られ、膨潤率は5未満である架橋ポリアミンを含む陰イオン結合性ポリマーを提供する。
【0011】
いくつかの実施態様において、本発明は、次の特徴のうち少なくとも1つを有するリン酸イオン結合性ポリマーを提供する:a)膨潤率は約5未満、好ましくは約2.5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、約200よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分がゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉率は、約60%未満である。いくつかの実施態様において、膨潤率は約2.8未満、または約2.7未満、または約2.6未満である。いくつかの実施態様において、ポリマーは胆汁酸やクエン酸イオンと結合するが、その結合能は約2mmol/g未満、または約1mmol/g未満、または約0.5mmol/g未満、または約0.3mmol/g未満、または約0.1mmol/g未満である。いくつかの実施態様において、膨潤率は中性pHの等張性溶液中で測定される。
【0012】
いくつかの実施態様において、本発明はリン酸イオン結合性ポリマーを提供し、そのポリマーの膨潤率は約5未満、好ましくは約2.8未満、または約2.7未満、または約2.6未満、または約2.5未満であり、この膨潤率は中性pHの等張性溶液中で測定される。実施態様において、このポリマーの平均in vivoリン酸イオン結合能は約0.5mol/gより大きい。実施態様において、このポリマーはポリアミンポリマーであり、アミン基の含有量の約35mol%未満がそのポリマーの塩化物の含有量である。
【0013】
いくつかの実施態様において、本発明は、ポリマーが標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーを提供し、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定したゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率は、約60%未満である。ここでポリマーは、1種以上のアミンモノマーと1種以上の架橋剤から成り、架橋反応に先立ち、アミンをアミン:溶媒比が約3:1〜1:3となるように溶媒中に存在させ、反応混合物に加えられる架橋剤の総量が、アミンモノマーの平均結合数(NC)が約2.05〜6、または約2.2〜4.5となるようにする方法により製造される。いくつかの実施態様において、ポリマーは、架橋反応中に標的陰イオンを存在させる方法によっても製造される。例えば:a)遊離塩基としてアミンモノマーを、酸の形で標的陰イオンを加え、b)架橋剤を加え、c)架橋反応を実行し、そしてd)洗って標的イオンを除去する方法である。
【0014】
いくつかの実施態様において、本発明は、ポリマーが標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーを提供し、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、c)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。ここでポリマーは、1種以上のアミンモノマーと1種以上の架橋剤から成り、a)全てのアミンモノマーを加え、次に架橋剤の一部を連続して加えてシロップを生成することにより可溶性のプレポリマーを製造し、b)このシロップを油に入れて乳化し、次にc)残りの架橋剤を加えて架橋ビーズを製造する方法により製造される。
【0015】
いくつかの実施態様において、本発明は、ポリマーが標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーを提供し、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。ここでポリマーは1種以上のアミンモノマーと1種以上の架橋剤から成り、ポリマーは次を含むプロセスで生成される:a)アミンモノマーと架橋剤の間の最初の反応を実行し、ゲルを生成し、次にb)このゲルをアミノアルキルハライドと反応させ、アミン官能性ゲルによるハライド置換で、アミンアルキル基をゲルに化学的に付加する。
【0016】
いくつかの実施態様において、本発明では、1種以上のアミンモノマーと1種以上の架橋剤から成るリン酸イオン結合性ポリマーを提供し、ここでこのポリマーは、架橋剤の総量を、アミンモノマーの平均結合数が2.2〜4.5となるようにして反応混合物に加える方法により製造される。
【0017】
いくつかの実施態様において、アミンモノマーは1,3−ジアミノプロパンとN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンから成るグループから選ばれる。ここで架橋剤は1,3−ジクロロプロパンとエピクロロヒドリンから成るグループから選ばれる。実施態様において、本発明は、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンをエピクロロヒドリンによって架橋したイオン結合性ポリマーを提供する。このポリマーはN,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンの水に対する初期濃度比が約1:3〜4:1、または約1.5:1〜4:1となる方法によって製造される。
【0018】
実施態様において、本発明は、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマーと架橋剤エピクロロヒドリンから成るリン酸イオン結合性ポリマーを提供する。このポリマーは、反応混合物に加えられる架橋剤エピクロロヒドリンの合計量が、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン含有量の約200mol%〜300mol%、または約230mol%〜270mol%、または約250mol%である方法によって製造される。また一部の実施態様において、ポリマーは、最初の反応混合物におけるモノマーと水の比が約3:1〜1:1、または約1.73である方法によって製造される。いくつかの実施態様において、ポリマーは球形ビーズの形状である。
【0019】
いくつかの実施態様において、本発明は、ポリアリルアミンモノマーと架橋剤エピクロロヒドリンとから成るリン酸イオン結合性ポリマーを提供する。ポリマーは、最初にポリアリルアミンモノマーを水に対して約3:1〜1:3の割合で溶かして製造される。この一部の実施態様において、反応混合物に加える架橋剤エピクロロヒドリンの合計量は、全ポリアリルアミン含有量の約10mol%である。
【0020】
いくつかの実施態様において、本発明は、モル比1:1での1,3−ジアミノプロパンと架橋剤1,3−ジクロロプロパンから成るプレポリマーから成るリン酸イオン結合性ポリマーを提供する。ここでこのプレポリマーは、反応混合物に加えられる架橋剤エピクロロヒドリンの合計量をプレポリマー合計量に対して約200mol%として、さらに、反応混合物におけるプレポリマー:水の比は約1.1:1〜1.7:1として架橋剤エピクロロヒドリンによって架橋されたものである。
【0021】
本発明はさらに、上記ポリマーのいずれかを含む組成物を提供する。ここでポリマーは粒子の形状であり、ポリマー粒子は外殻に包まれている。
【0022】
本発明は、別の態様において、医薬組成物を提供する。ある実施態様において、医薬組成物は本発明のポリマーおよび製剤用賦形剤を含む。またいくつかの実施態様において、組成物は液体製剤であり、ポリマーが水および適切な賦形剤の溶液中に分散している。またいくつかの実施態様において、本発明は、標的陰イオンを結合する陰イオン結合性ポリマーと、1種以上の適切な製剤用賦形剤を含む医薬組成物を提供する。組成物はチュアブルまたは口中で崩れる錠剤であり、口腔内および食道内を移動する際のポリマーの膨潤率は約5未満、または約2.8未満、または約2.7未満、または約2.6未満、好ましくは約2.5未満である。いくつかの実施態様において、チュアブル錠剤には、転移温度が約50°Cを超えるポリマーが含まれている。
【0023】
いくつかの実施態様において、チュアブル錠剤には、蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトール、またはこれらの組合せからなるグループから選択された製剤用賦形剤が含まれ、ポリマーが賦形剤とあらかじめ配合されて固溶体を形成する方法によって製造される。いくつかの実施態様において、ポリマーの標的陰イオンはリン酸イオンである。いくつかの実施態様において、ポリマーはin vivoに
おいて、標的イオンに、0.5mmol/g以上の結合能で結合する。いくつかの実施態様において、陰イオン結合性ポリマーは、錠剤重量の約50%より多くを占める。いくつかの実施態様において、錠剤は円筒形をしていて、直径は約22mm、高さは約4mmであり、陰イオン結合性ポリマーは錠剤の合計重量のうち1.6g以上を占めている。本発明による、いくつかのチュアブル錠剤では、賦形剤は甘味剤、結合剤、滑沢剤、錠剤分解物質から成るグループから選ばれる。ポリマーは平均で直径約40μm未満の粒子として存在してもよい。いくつかの実施態様において、甘味料は蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトール、またはこれらの組合せからなるグループから選択される。
【0024】
別の態様において、本発明は、標的イオンを結合するイオン結合性ポリマーの、標的イオン結合干渉率を測定する次の方法を提供する:a)標的イオンを含む非干渉性緩衝液に、イオン結合性ポリマーを加え、そのポリマーの標的イオン結合能を測定し、b)哺乳類の胃腸消化酵素を用いて標準化食事を人工的に消化するか、あるいは標準化食事を摂取させた哺乳類の上部消化管内から糜粥を吸引し(標準化食事には標的イオンが含まれている)、c)イオン結合性ポリマーを加え、標的イオンの追加前と後の標的イオン濃度の減少度から標的イオン結合能を測定し、d)平衡状態にある同じイオン濃度で、非干渉性緩衝液中の結合測定値と消化された食事または体外吸引物における結合測定値との間で観察される標的イオンの結合能の減少度として、結合の阻害率を計算し、パーセントで表わす。
【0025】
さらに別の態様において、本発明は、イオン結合性ポリマーの選択方法を提供する。このポリマーはモノマーと架橋剤からなり、次の特徴のうち少なくとも1つを有している:a)膨潤率は約5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。これには、次の工程が含まれる:i)次の組成・プロセス変数を変える:1)モノマーと架橋剤の比率、2)反応液中の、(モノマー+架橋剤)と溶媒の比率、3)生理的pHと浸透圧でのポリマーの有効電荷、4)主鎖ポリマーの親水性/疎水性のバランス。ii)生成ポリマーの膨潤性、細孔度、イオン結合干渉率を評価する。iii)上記特徴のうち少なくとも1つを有するポリマーを選択する。別の態様として、本発明は、ポリアミンポリマーの治療的特性や投与適性、製薬性質の改良方法を提供する。これには次の工程のうち少なくとも1つが含まれる:a)ポリアミンモノマーの平均結合数が約2.05〜6になるように、架橋剤でポリマーを架橋させる工程、および/またはb)ポリアミンが、ポリアミン対水の初期比率が約3:1〜1:3で水中に存在するようにした方法によって、ポリマーを製造する工程。
【0026】
別の態様として、本発明は、不均一プロセスによって、架橋剤とアミンモノマーとを合わせる工程を含む、標的陰イオンを結合する陰イオン結合性ポリマーの製造方法を提供する。ここでこのリン酸イオン結合性ポリマーは、次の特徴のうち少なくとも2つを有することで特徴づけられる:a)膨潤率は約5未満、b)標的陰イオンの約2倍より大きい分子量を持つ非反応性溶質が利用可能な部分がポリマーの約20%(重量)未満(パーセンテージは生理学的媒体中において測定)およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満。いくつかの実施態様において、アミンモノマーはポリアリルアミンである。いくつかの実施態様において、架橋剤はエピクロロヒドリンである。
【0027】
別の態様として、本発明では、不均一プロセスによるポリアリルアミンの架橋を含む方法によって製造された、標的イオンを結合する陰イオン結合性ポリマーを提供する。このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)標的陰イオンの約2倍以上の分子量を持つ非反応性溶質が利用可能な部分が、ポリマー重量の
約20%未満(パーセンテージは生理学的媒体中において測定)、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満。1つの実施態様において、ポリアリルアミンはエピクロロヒドリンによって架橋される。
【0028】
別の態様において、本発明は、動物に対し本発明のポリマーの有効量を投与することにより、動物から陰イオンを除去する方法を提供する。いくつかの実施態様において、ポリマーは、標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーであり、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、ポリマーの標的陰イオンはリン酸イオンである。いくつかの実施態様において、リン酸イオンは、消化管から除去されるものである。いくつかの実施態様において、投与方法は経口投与である。いくつかの実施態様において、対象動物は、高リン酸血症、低カルシウム血症、甲状腺亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、末期腎不全からなる群のうち少なくとも1つ疾患を有している。いくつかの実施態様において、その動物とは人間である。
【0029】
いくつかの実施態様において、ポリマーは、プロトンポンプ阻害剤、カルシウム様作用薬、ビタミンおよびその類似物、リン酸イオン結合剤(炭酸アルミニウム、炭酸カルシウム、酢酸カルシウム、炭酸ランタン、塩酸セベラマーなど)のうち少なくとも1つと共に投与される。
【0030】
(参照による引用)
この特許明細書中に言及されている刊行物および特許出願はすべて、個々の刊行物や特許出願が具体的かつ個別に記述されるのと同様に、参照によって本明細書中に援用される。
【0031】
本発明の新しい特徴は、添付の特許請求の範囲に具体的に列記されている。本発明の特徴および利点をさらに理解するためには、本発明の原理を利用した具体的実施例を含む下記の詳細な説明および図面を参照されたい。
【発明を実施するための最良の形態】
【0032】
(発明の詳細な説明)
(I. 導入)
本発明は一態様において、低膨潤性、in vivoでのイオン高結合性、干渉するイオンからの低干渉性、特定の細孔度の特徴のうち、1つまたは複数を有する陰イオン結合性ポリマー材料を提供する。別の態様として、本発明は、陰イオン結合性ポリマーの医薬組成物を提供する。この医薬組成物は、チュアブル錠剤または液体製剤である。さらなる態様として、本発明は、低膨潤性、in vivoでのイオン高結合性、干渉するイオンからの低干渉性、特定の細孔度の特徴のうち、1つまたは複数を有するような、陰イオン結合性ポリマー材料の製造または改良の方法を提供する。さらなる態様として、本発明は、本発明の陰イオン結合性ポリマーを用いたイオン過剰疾患の治療方法を提供する。好ましい実施態様において、陰イオン結合性ポリマーは消化管から標的陰イオンを除去するために使用されている。消化管から除去され得る標的陰イオンの例としては、リン酸イオンとシュウ酸イオンがあるが、これらに限定されない。他の好ましい実施態様において、ここに記載される組成物は、高リン酸血症、低カルシウム血症、上皮小体亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、慢性腎不全、同化代謝などの治療に用いられる。
【0033】
(II. ポリマー)
本発明のポリマーは、イオンを結合する機能によって特徴付けられる。望ましくは、本発明のポリマーは陰イオンを結合し、さらに望ましくはリン酸イオンおよび/またはシュウ酸イオンを結合し、最も望ましくはリン酸イオンを結合する。説明では、陰イオン結合性ポリマー、特にリン酸イオン結合性ポリマーについて記述されるが、この記述は、当業者には明らかとなる変更を適宜加えることにより、あらゆるイオンおよび溶質に等しく適用されることが理解される。本明細書中において使用される場合、ポリマーがイオン(陰イオンなど)に「結合する」、またはイオンと会合する場合には「イオン結合性」ポリマーである(「リン酸イオン結合性」ポリマーなど)という場合は、通常必ずしも非共有結合である必要はなく、ポリマーが用いられるin vitro条件およびin vivo条件下で、イオンを溶液あるいは体内から除去する効果を利用するのに充分な時間、少なくとも一部のイオンが結合したままであるのに充分な強度を有していればよい。「標的イオン」はポリマーが結合するイオンのことで、通常はポリマーが結合する主要イオンであるか、または、ポリマーへの結合が、そのポリマーの治療効果を生み出すと考えられるイオンのことを指す。ポリマーは、複数の標的イオンを有することがある。陰イオンの「結合」とは、最小限の結合より多いもの、言い換えれば、ポリマー1g当たり少なくとも0.01mmolの陰イオン、さらに好ましくはポリマー1g当たり少なくとも0.05mmolの陰イオン、もっと好ましくはポリマー1g当たり少なくとも0.1mmolの陰イオン、最も好ましくはポリマー1g当たり少なくとも0.5mmolの陰イオンが結合する場合である。本発明は、陰イオンと選択的に結合する特徴を有するポリマーを提供する。例えば、いくつかの実施態様において、本発明のポリマーは胆汁酸に対して約2mmol/g未満、好ましくは約1mmol/g未満、もっと好ましくは約0.5mmol/g未満、さらに好ましくは約0.3mmol/g未満、最も好ましくは約0.1mmol/g未満の結合能を有する。いくつかの実施態様において、本発明のポリマーはクエン酸イオンに対して、約2mmol/g未満、好ましくは約1mmol/g未満、さらに好ましくは約0.5mmol/g未満、さらにより好ましくは約0.3mmol/g未満、最も好ましくは約0.1mmol/g未満の結合能を有する。
【0034】
(A. 特性)
本発明のポリマーは、次の特性のうち1つまたは複数によって特徴付けられる:1)低膨潤率、2)生理学的条件の下で、結合干渉率が低い、3)標的陰イオンは結合するが、阻害溶質は排除される適切な細孔度、4)治療用途において有効であるために充分な、標的陰イオンに対するin vivo結合能。いくつかの実施態様において、ポリマーは、陰イオン結合性ポリマー(例えば、リン酸イオンおよび/またはシュウ酸イオンを結合するポリマー)であり、このポリマーは、次の特徴のうち少なくとも2つによって特徴付けられる:1)膨潤率は約5未満、2)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分がゲル重量の約20%未満であり、3)非干渉性緩衝液と比した胃腸内模擬液の標的イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、ポリマーは、次の特徴のうち少なくとも1つによって特徴付けられる、リン酸イオン結合性ポリマーである:1)膨潤率は約5未満、好ましくは2.5未満、2)生理学的媒体中で測定されたゲル細孔体積分布において、約200よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満であり、3)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉率は、約60%未満である。いくつかの実施態様において、リン酸イオン結合性ポリマーの膨潤率は、約2.8未満、または約2.7未満、または約2.6未満である。「生理学的媒体」は、等張性でありかつ中性pHの媒体である。いくつかの実施態様において、本発明は、膨潤率(中性pHの等張性溶液中で測定)が約5未満、好ましくは2.5未満によって特徴付けられ、リン酸のin vivo結合能平均が約0.5mol/gよりも大きい特徴を有していても
よい、リン酸イオン結合性ポリマーを提供する。いくつかの実施態様において、リン酸イオン結合性ポリマーの膨潤率は、約2.8未満、または約2.7未満、または約2.6未満である。いくつかの実施態様において、本発明のポリマーは、胆汁酸に対して、約2mmol/g未満、好ましくは約1mmol/g未満、より好ましくは約0.5mmol/g未満、さらにより好ましくは約0.3mmol/g未満、最も好ましくは約0.1mmol/g未満の結合能を有する。いくつかの実施態様において、本発明のポリマーは、クエン酸イオンに対して、約2mmol/g未満、好ましくは約1mmol/g未満、より好ましくは約0.5mmol/g未満、さらにより好ましくは約0.3mmol/g未満、最も好ましくは約0.1mmol/g未満の結合能を有する。好ましくは、ポリマーは、アミンモノマーから作られる。
【0035】
一般に、これらの特徴は、ポリマー製造の際に1つまたは複数の要素を変えることによって達成される。
【0036】
(1)膨潤率) 本発明のポリマーは、架橋された物質である。これは、本発明のポリマーが溶媒には溶けず、せいぜい溶媒中で膨潤するだけであることを、意味する。
【0037】
生理学的等張性緩衝液中(消化管内などの使用環境を代表)での膨潤率は、通常約1.2〜約100の範囲であり、好ましくは約2〜20である。いくつかの実施態様において、本発明のポリマーの膨潤率は、約5未満、または約4未満、または約3未満、または約2.8未満、または約2.7未満、または約2.6未満、または約2.5未満である。明細書中で「膨潤率」とは、水溶液環境で平衡に達した状態で、1グラムの乾燥した架橋ポリマーが吸収する溶媒のグラム数である。所定のポリマーについて膨潤率を複数回測定した場合は、その測定値の平均をとって膨潤率とする。
【0038】
膨潤率は、さまざまな方法を使用して測定することができる。最も好ましい方法は重量測定法であり、これは乾燥ポリマーの重量を測定し、過剰な量の液体に加える。場合によっては、この液体は蒸留水が用いられることもあるが、好ましくは血漿と等浸透圧の水溶液を用い、最も好ましくは血漿と等張性でかつ中性pHの水溶液を用いる。例えば、0.9%NaCl溶液が使用され得る。リン酸緩衝化生理食塩水(PBS)も使用され得る。膨潤率測定に最も好ましい生理学的媒体は、0.9% NaCl溶液であって、pHを約6.5〜約7.5にするために30mMのMESを加えたものである。乾燥ポリマー(リン酸イオン結合性ポリマーなど)は通常、塩化物イオンなどの対イオンによって完全にプロトンが付加された形態で使用される。ポリマーは、平衡に達するまで液体に浸す。浸ったゲルを遠心分離にかけ、上澄みを別容器に移し、湿潤ゲルの重量を測定する。遠心分離にかける際は、gが高すぎてゲルを壊してしまわないよう、注意が必要である。膨潤率(SR)は、湿潤ゲルの重量から乾燥ポリマーの重量を引き、これを乾燥ポリマーの重量で割って算出する。
【0039】
もうひとつの方法が染料法である。この方法においては、非常に大きな分子量の、ゲルと反応しないことがわかっている染料を水溶液として調製し、乾燥ポリマーを一定量ずつ溶液に追加していく。ポリマーに対する溶液の重量比が、互いに近くなるように、かつ、予測される膨潤率よりもわずかに高くなるように、調整する。染料は、非常に分子量が大きい(例えば200,000g/molより大きい)ため、ゲルの中に水は浸透するが、染料は浸透しない。この結果、染料濃度が増大し、これから膨潤率が測定される。有用な染料の例は、フルオレセインイソチオシアネート(FITC)で改変したデキストランである。
【0040】
ポリマーの膨潤率は、温度、イオン強度、ポリマー電荷密度、ポリマー−溶媒間Flory−Huggins係数、架橋密度などのさまざまな変数に依存している。本発明のイ
オン結合性ポリマーは、ほとんどが荷電したポリマーである(例えば、リン酸イオン結合ポリアミンは、腸内pHでプロトン化した状態である)ので、その膨潤作用は、高分子電解質ゲルに典型的である。膨潤率と細孔サイズとにはある程度の相関関係はある(すなわち、膨潤率が高い場合は、通常は、細孔サイズが大きい場合が多い)が、高分子電解質ゲルの除外限界を正確に予測できる理論的根拠はない。
【0041】
(2)結合干渉率) いくつかの実施態様において、本発明のポリマーは、胃腸(GI)内模擬液において測定した場合、結合干渉率が約70%未満、より好ましくは約60%未満、さらに好ましくは約50%未満、さらに好ましくは約40%未満、さらに好ましくは約30%未満、最も好ましくは約20%未満である。本発明のリン酸イオン結合性ポリマーは、胃腸内模擬液において測定した場合、結合干渉率が約70%未満、より好ましくは約60%未満、さらに好ましくは約50%未満、さらに好ましくは約40%未満、さらに好ましくは約30%未満、最も好ましくは約20%未満を示す。
【0042】
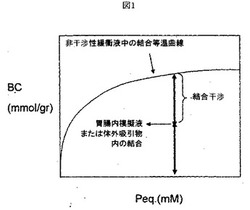
本明細書中で使用される場合、「結合干渉率」または「結合干渉」とは、標的イオンの結合能が部分的に低下する度合パーセントで表わすもので、この低下は、非干渉性緩衝液中での結合実験と、胃腸(GI)内模擬液での結合実験との間で、平衡状態にある同じ標的陰イオン濃度で観察される。本明細書中で使用される場合、「非干渉性緩衝液」とは、標的イオンの結合に干渉する1種以上の溶質が含まれておらず、かつ、胃腸内模擬液と同じpHに調整されている、緩衝液を指す。非干渉性緩衝液は、必ずしも、干渉性の溶質を一切含んでいないわけではない。例えば、非干渉性緩衝液には、胃腸内のいたるところに存在する塩化物イオンおよび重炭酸イオンのうちの一方もしくは両方が含まれていることがあり、これらは、存在する場合には、生理学的濃度になる可能性がある。非干渉性緩衝液の例を、例1に示す。本明細書中で「胃腸(GI)内模擬液」とは、食事消化後の消化管の部分環境に似せるように設計された調整液を指し、好ましくは、標的イオンの大半をポリマーが結合できる消化管の部分環境に似せるように設計された調整液を指す。胃腸内模擬液は、代表的には、実施例1に示す方法で調製する。標的イオンは、非干渉性緩衝液の検討と同じ濃度で胃腸内模擬液で存在させるようにする。阻害率は、図1において示されるように、2つの対応する結合等温線(すなわち、胃腸内模擬液と非干渉性緩衝液とにおける結合等温線)をプロットすることにより、容易に得られる。胃腸内模擬液を用いた結合干渉の測定例を、実施例1に示す。
【0043】
被験体(好ましくはヒト対象者)から採取した消化吸引物中における標的イオンの結合を、非干渉性緩衝液における標的イオンの結合と比較することにより、結合干渉率を測定することも可能である。この測定を行う場合は、吸引物は数多くの被験体から採取し、阻害率の平均をとって結合干渉率とすべきである。
【0044】
膨潤率の選択および/またはゲルの分子量排除限界の調整を注意深く行うことにより、競合的状態(すなわち、in vivoや胃腸内模擬液中など)で測定される結合能は、ゲル細孔度を最適化していない同じポリマー組成の他のゲルに比べ大幅に向上され得ることが見出されている。
【0045】
顕著なことには、架橋および/またはもつれの多いポリマーは、そうでないポリマーに比べて膨潤率が低いことが見出されたが、このようなポリマーはまた、標的イオン(リン酸イオンなど)に関する結合能は架橋および/またはもつれの少ないポリマーに比べて同等以上であった。理論によって拘束されることは望まないが、本発明のポリマーは、篩分け効果を発揮し、溶液内の特定サイズの溶質だけと結合し、それより大きな他の溶質種(従来はポリマー内の結合部位と競合していたもの)は排除される、と仮説が立てられる。分子量の大きい種としては、無機・有機の陰イオン、オリゴペプチド類、炭水化物、ビリルビン、脂質ミセル、脂質小胞などが挙げられるが、これらに限定はされない。
【0046】
(3)細孔度) 干渉物質を排除し、標的イオン(陰イオンなど)を結合するのに適切な細孔度を最適に示すようポリマーを製造する工程を操作することは可能であることが、見出されている。
【0047】
ポリマーゲルの細孔サイズ分布は、水銀細孔測定法や窒素吸着法、示差走査熱量測定法、溶質浸透分配技法などのさまざまな方法で得られる。最後の溶質浸透分配技法は、使用環境と同様の完全水和状態でゲルを調べるので、最も好ましい。溶質浸透技法は、Kuga(KugaS.J,J.of Chromatography,1986,206:449−461)によって提示された間接的手法であり、分子量が既知の溶質のゲル分配測定から成っている。この手法は、次の3つの工程からなる(Kremer et al.,Macromolecules,1994,27,2965−73):
− 1.分子サイズが既知の溶質を既知の濃度で溶かした溶液各種を、膨潤したゲルに接触させる。溶質の分子サイズは、幅広い範囲をカバーするようさまざまな種類を揃えなければならない。
− 2.ゲル中に溶質が分散する。特定の溶質の分配は、溶質サイズおよびゲル細孔のサイズ分布に依存する。
− 3.ゲルとその周囲の溶液を分離し、当該周囲の溶液中に含まれる溶質の濃度を測定する。最初のストック溶質濃度に比較して、各溶質濃度が低下している分が、ゲル細孔サイズ分布の算出に使用される。
【0048】
サイズ排除効果を分子引力効果/分子反発効果と区別するために、溶質は、ゲルポリマーとほとんど反応しないかまたは全く反応しないポリマーやオリゴマーの中から選択する。中性親水性ポリマーであり分子量分布が狭いポリエチレングリコールやポリエチレンオキシド、デキストランなどが最も適している。よって、特に記載のない限り、溶質の特定サイズ排除の体積(本明細書中で「臨界浸透体積」とも呼ばれる)は、測定に使用されるポリマーと実質的に反応しない溶質を使用して測定された体積を指す。
【0049】
Kremer et al.(Macromolecules,1994,27,2965−73)に記載されている実験プロトコルとデータ処理に従って、細孔分布が図2に示され得る。図2において、Y軸は、所定の分子サイズの溶質に利用できない膨潤ゲルの体積を示す。図面において示される実施例において、5オングストロームより小さいサイズの低分子は、ゲル全体に浸透し得る。一方、1000オングストロームよりも大きい流体半径のポリマーは、ゲルから完全に排除される。この場合、利用できない体積と、平衡にあるゲル体積とは同じである。
【0050】
ポリマーのサイズと分子量は、Mark−Houvinkの式の関係を有する。この式は、分子プローブとして使用されたポリマー溶質について、表に示す。例えば:
半径(オングストローム)=0.217M0.498 デキストラン
半径(オングストローム)=0.271M0.517 ポリエチレングリコール
半径(オングストローム)=0.166M0.573 ポリエチレンオキシド。
【0051】
低分子量プローブは、次のように使用できる:
尿素:分子半径2.5オングストローム
エチレングリコール:分子半径2.8オングストローム
グリセロール:分子半径3.1オングストローム
グルコース:分子半径4.4オングストローム
蔗糖:分子半径5.3オングストローム。
【0052】
よって、溶質のサイズは分子量に換算でき、その逆も可能である。
【0053】
溶質のサイズは、細孔のサイズとは等しくはない。もし等しいとしたら、これは、分子サイズが溶質よりも大きい細孔内に存在する液体すべてが、アクセス可能な体積として利用可能であることを意味する。排除体積効果(あるいは壁効果とも言われる)があるため、これは正しくない。
【0054】
分子排除を特徴付けるのは、簡単にまとめると、(i)分子プローブの分配の定量、(ii)上記に従った、利用可能体積(または重量)の算出、(iii)ゲル合計体積(または重量)に対する標準化、の3つである。
【0055】
好ましい分子排除限界は、ポリマー鎖のもつれと架橋密度などの製造時の変数を調整することによって達成される(下記参照)。一般に、ポリマーは、結合するイオン(陰イオンなど)や、排除したいと考えられる阻害物質の推定される性質、ならびに意図されるポリマー用途において許容可能な膨潤率に基づいている、分子排除限界を有するように生成される。本発明のいくつかの実施態様では、イオン結合性ポリマーは、上記プロトコルに従って決められたゲル細孔体積分布(臨界浸透体積)を示し、これは、生理学的媒体中で測定された標的陰イオンの約2倍よりも大きい分子量を持つ非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満を示す。本発明のいくつかの実施態様では、イオン結合性ポリマーは、分子量が標的陰イオンの1.8倍よりも大きい非反応性溶質が利用し得る体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満のゲル細孔体積分布(臨界浸透体積)を示す。本発明のいくつかの実施態様では、イオン結合性ポリマーは、分子量が標的陰イオンの1.6倍よりも大きい非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満のゲル細孔体積分布(臨界浸透体積)を示す。本発明のいくつかの実施態様では、イオン結合性ポリマーは、分子量が標的陰イオンの1.4倍よりも大きい非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満のゲル細孔体積分布(臨界浸透体積)を示す。本発明のいくつかの実施態様では、イオン結合性ポリマーは、分子量が標的陰イオンの1.2倍よりも大きい非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満のゲル細孔体積分布(臨界浸透体積)を示す。実施態様において、本発明では、上記プロトコルに従って決められ、そして、分子量が約200よりも大きく、好ましくは約180よりも大きく、より好ましくは約160よりも大きく、もっと好ましくは約140よりも大きく、最も好ましくは約120よりも大きい非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満の生理学的媒体中で測定されるゲル細孔体積分布(臨界浸透体積)を提供する、リン酸イオン結合性ポリマーを提供する。
【0056】
(4.結合能) 本明細書中に記載されているポリマーは、イオン結合性を示し、一般的には陰イオン結合性を示す。好ましい実施態様では、ポリマーは、リン酸イオン結合性を示す。イオン(リン酸イオンなど)結合能は、イオン結合剤が所定の溶液内で結合できる特定イオンの量の尺度である。例えば、イオン結合性ポリマーの結合能は、in vitro(水中や生理食塩水中など)、またはin vivo(イオン(リン酸イオンなど)の尿排出など)、またはex vivo(実験動物や患者、志願者から採取した糜粥などの吸引液などを使用する)において測定することができる。標的イオンだけを含む溶液中、または少なくとも他にポリマーとの結合を標的イオンと競合する競合溶質が存在しない溶液中で測定することができる。この場合は、非干渉性緩衝液を使用する。また別法として、樹脂との結合を標的イオンと競合する他のイオンや代謝産物などの競合溶質が存在する溶液中で測定することができる。
【0057】
ポリマーのイオン結合能は、V*(Cstart−Ceq)/P(単位mmol/gで
表わす)として算出され得る。ここでVは使用溶液の一定体積(単位L)、Cstartは溶液中の最初の標的イオン濃度(単位mM)、Ceqは、ポリマー重量P(単位g)が追加されて平衡に達するのを待った後の、平衡時の溶液中の標的イオン濃度(単位mM)である。
【0058】
いくつかの実施態様において、ポリマーはリン酸イオンと結合する。In vivoで使用する場合、例えば高リン酸血症の治療では、リン酸イオン結合能の高いポリマーが望まれる。結合能のin vitro測定は、必ずしもin vivo結合能にそのまま解釈されるわけではない。よって、In vitro能力とin vivo能力の両方の結合能を規定することが実際に役に立つ。
【0059】
本発明のポリマーの、非干渉性緩衝液中におけるin vitroのリン酸イオン結合能は、約0.5mmol/g、約1.0mmol/g、約1.5mmol/g、約2.0mmol/g、約2.5mmol/g、約3.0mmol/g、約3.5mmol/g、約4.0mmol/g、約5.0mmol/g、約6.0mmol/g、約8.0mmol/g、または約10.0mmol/gよりも大きいものであり得る。いくつかの実施態様において、標的イオンに関する本発明のポリマーのin vitroリン酸イオン結合能は、約0.5mmol/gよりも大きく、好ましくは約2.5mmol/gよりも大きく、さらに好ましくは約3mmol/gよりも大きく、もっと好ましくは約4mmol/gよりも大きく、さらにより好ましくは約6mmol/gよりも大きい。いくつかの実施態様において、リン酸イオン結合能は約0.5mmol/g〜約10mmol/gの範囲にすることができ、好ましくは約2.5mmol/g〜約8mmol/g、さらに好ましくは約3mmol/g〜約6mmol/gの範囲であり得る。リン酸イオン結合能を測定するテクニックは、いくつか知られている。本発明のポリマーのin vitroリン酸イオン結合能は、非干渉性緩衝液中の結合能の測定方法について実施例1において記載されるようにして測定される。
【0060】
いくつかの実施態様において、本発明のリン酸イオン結合性ポリマーの、ex vivoでの平均リン酸イオン結合能は、人間被験者から得た消化吸引物における測定で、約0.2mmol/g、約0.3mmol/g、約0.4mmol/g、約0.5mmol/g、約0.6mmol/g、約0.7mmol/g、約0.8mmol/g、約0.9mmol/g、約1.0mmol/g、約1.2mmol/g、約1.4mmol/g、約1.6mmol/g、約1.8mmol/g、約2.0mmol/g、約2.5mmol/g、約3.0mmol/g、約4.0mmol/g、約5.0mmol/g、または約6.0mmol/gよりも大きい。体外吸引物は、実施例1に記述されているように、正常な被験者から得られ、結合は非干渉性緩衝液に関して測定される。平均値は、被験者約5人〜約15人、または約15人〜約30人、または約30人〜約60人から得られる。いくつかの実施態様において、測定は被験者6人〜12人から得られる。
【0061】
本明細書中で使用される場合、「平均in vivoリン酸イオン結合能」とは、特記されている場合を除き、正常な人間の被験者で測定されたポリマー結合能を指し、このポリマーのリン酸イオン結合は、尿中のリン酸イオン排出量の減少分と、遊離リン酸イオンおよびポリマー結合リン酸イオンとして便中に排出されたリン酸イオンの測定値を合わせて得られる(下記参照)。平均値は、被験者約5人〜約15人、または約15人〜約30人、または約30人〜約60人から得られる。いくつかの実施態様において、測定は被験者6人〜12人から得られる。いくつかの実施態様において、好ましくは人間の被験者で測定された本発明のポリマーの平均in vivoリン酸イオン結合能は、少なくとも約0.3mmol/g、少なくとも約0.5mmol/g、少なくとも約0.8mmol/g、少なくとも約1.0mmol/g、少なくとも約1.5mmol/g、少なくとも約2.0mmol/g、少なくとも約3.0mmol/g、少なくとも約4.0mmol/
g、少なくとも約5.0mmol/g、または少なくとも約6.0mmol/gである。
【0062】
ポリマーのin vivo結合能は、哺乳類、好ましくは人間における標的イオン(リン酸イオンなど)のバランスを測定することによって、望ましく測定され得る。被験体に、リン酸イオン量を調整した食事と結合ポリマーを与え、リン酸イオンの摂取量と、尿および便に排泄されるリン酸イオンの量をモニターする。この研究は、腸内の洗浄期間、次いで被験体が日用量(好ましくはリン酸イオン結合剤を1日3回)を摂取する期間、次いで数日間治療なしで、ベースラインに戻るのを確認する。尿中のリン酸イオンの低下分は、通常、便のリン酸イオンの増加分と一致する。便中に排出されたリン酸イオンのモル数からベースライン分を差引き、投与された結合剤の重量で割ると、in vivo結合能の尺度が得られる。特記されない限り、本明細書中で言及される「in vivo」測定は、上記プロトコルを利用する。もうひとつの手法は、実施例1に示されているプロトコルに従ってin vivoとin situのリン酸イオン結合を測定することからなる。この手法では、哺乳動物にダブルルーメンチューブを挿管し、小腸の特定部位から糜粥を採取する。所定のリン酸量を含む食事と共に、既知量のリン酸イオン結合剤とマーカーを与える。マーカーは、染料または非吸収性ポリマー(ポリエチレングリコールなど)であり得、これを糜粥で滴定して、消化プロセスの間に生じる希釈度を測定する。これで、食事中の最初の濃度と、マーカー実験によって測定された希釈度から、結合剤の正確な濃度を算出する。糜粥サンプルについて、総リン酸イオン量を分析する。「可溶性」リン酸イオンは、サンプルを遠心分離にかけ、上澄みを別容器に移し、リン酸イオン量を分析することによって測定される。「結合」リン酸イオンの量は、総リン酸イオン量から可溶性リン酸イオンを差し引いて得られる。被験体(6〜12)のグループに対して2シリーズの実験を行い、それぞれプラセボ(微結晶性セルロース)または薬剤のいずれかを服用する。結合能は、2シリーズの実験(すなわち、薬剤投与のあるものとないもの)の間で「結合」リン酸イオンの増加分を測定し、これを結合剤の濃度で割ることによって算出される。計算は、被験者ごと、またはグループ単位のいずれでも行うことができる。
【0063】
(B. ポリマーの調製)
本発明のポリマーは、当業者に知られている手法によって調製される。例えば、イオン結合モノマーやその前駆物質を、架橋剤の存在下で共重合させることができる、前もって製造したイオン結合性ポリマーを、化学反応や放射線照射によってさらに架橋を進める、あるいは、ポリマー前駆物質をまず架橋し、さらにポリマー上にイオン結合官能基を導入する反応を行う。
【0064】
ポリマーは、直接懸濁重合や逆懸濁重合、乳化重合、沈殿技法、エアロゾル重合、バルク重合/架橋法を使用し、押出しや粉砕などのサイズ縮小工程も利用して得られる。これらの工程は、バッチ工程、準連続工程、連続工程のいずれでも実施できる。
【0065】
膨潤率、結合干渉率、結合能、分子量排除限界は、少なくとも次のような組成およびプロセス変数によって影響を受ける:
1−ポリマー鎖の化学的架橋の密度。
【0066】
2−架橋反応での、(モノマー+架橋剤)の溶媒に対する比率。
【0067】
3−ポリマーの有効電荷(使用される環境における生理学的pHおよび等張性において)。
【0068】
4−主鎖ポリマーの親水性/疎水性のバランス。
【0069】
5−コア−シェル構造の有無。シェル成分は、コア物質の膨潤度を制限する。
【0070】
下記で、組成変数とプロセス変数の好ましい使用範囲が、リン酸イオン結合特性を有する架橋ポリアミン材質について例示される。これらは典型的条件のものだけを取りあげており、本明細書中に記載されている方法は、当業者には明らかなように、溶質を幅広く結合するポリマーの選択・製造に使用され得ることが、理解される。
【0071】
(1)ポリマー鎖の化学的架橋の密度 化学的架橋密度は、ポリマーの膨潤特性と細孔分布を制御する重要な性質である。本発明のポリマーを説明するのに便利な方法のひとつは、アミン繰り返し単位と、ポリマーの残り部分の平均結合数を定義することである。ここで「A」はアミン繰り返し単位として定義され、「NC」はAからの平均結合数を示す。NCは2、3、4またはそれ以上になり得る。不溶性ゲルを製造するためには、NCは通常、2よりも大きくなる。
【0072】
NC値は、下記の式に示すように、アミン対架橋剤の化学量比で表わされ得る:
低分子量モノマー(例えばN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンや1,3−ジアミノプロパン)については、NC=B・Fb/Aとなる。ここでBは架橋剤のモル数、FbはAと反応して共有結合するBの反応基の数、Aはアミンのモル数である。
【0073】
ビニルアミン、ポリエチレンイミン、ポリビニルアミン、ポリアリルアミンなど、アミン物質が高分子量であり、アミンモノマーの重合によって得られたものである場合は、モノマーをつなぐ2結合がポリマー主鎖中で繰り返されるため、化学式が変わってくる。NCはNC=(2・A+B・Fb)/Aの式で表わされる。
【0074】
逆に、架橋剤とアミンのモル比は、上の式を使用することにより、望ましいNC値から算出できる:
低分子量アミン:
B/A=NC・Fb
高分子量アミン:
B/A=(NC−2)・Fb。
【0075】
下記の表は、NCと実際の架橋剤対アミン比との間の換算例である。ここでアミンは高分子量物質または低分子のいずれかであり、架橋剤は二官能性架橋剤または三官能架橋剤のいずれかである。
【0076】
【化3】

(a):B/A=NC/Fb
(b):B/A=(NC−2)/Fb。
【0077】
驚くべきことに、結合選択性(これがin vivoでの効力に反映される)は、NCにより最適となることが見出された。NC値範囲の低い側においては、そのポリマー物質はかなりの程度膨潤する傾向があり、結果として、胃腸内模擬液中で強い結合干渉を示した。しかしNC値範囲の高い側においては、そのポリマー物質の固有結合能は大幅に低くなり、明らかなin vivoにおける全体的パフォーマンスの低下をもたらした。最適なNC値は、アミン/架橋剤の系に応じて、2.05〜5の間になることが見出された。
【0078】
しかしながら、最終ポリマーの特性を望ましい組合せにするための最適範囲は、使用する特定のモノマーや架橋剤、製造方法に使用する条件(例えば反応媒質中のモノマー初期濃度など)に依存し、慣用的実験により見出していく問題である。
【0079】
いくつかの実施態様において、ポリマー中の、架橋剤のモノマーの、総アミン基に対する比は、50mol%よりも大きく、60mol%よりも大きく、70mol%よりも大きく、80mol%よりも大きく、または、90mol%よりも大きい。
【0080】
1種以上の低分子量アミンモノマーと1種以上の架橋剤から成るリン酸イオン結合性ポリマーを提供する本発明のいくつかの実施態様において、NCは、約2よりも大きいか、または約3よりも大きいか、または約4よりも大きい。いくつかの実施態様において、ポリマーは、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマー(低分子量モノマー)をエピクロロヒドリン(Fb=2)で架橋して生成されたものであり、ここでB/Aは約2.0(mol/mol)〜約3.0(mol/mol)(すなわち、NCは約4〜約6)、または約2.3(mol/mol)〜約2.7(mol/mol)(すなわち、NCは約4.6〜約5.4)、または約2.5(mol/mol)(すなわち、NCは約5.0)である。いくつかの実施態様において、ポリマーは、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマーをエピクロロヒドリンで架橋して製造されたものであり、ここでモノマー対水の初期比率は、約3:1(重量/重量)〜約1:3(重量/重量)、または約1.5:1(重
量/重量)〜約2:1(重量/重量)、または約1:1、または約3:1であり、そしてB/Aは、約2.0(mol/mol)〜約3.0(mol/mol)(すなわち、NCは約4〜約6)、または約2.3(mol/mol)〜約2.7(mol/mol)(すなわち、NCは約4.6〜約5.4)、または約2.5(mol/mol)(すなわち、NCは約5.0)である。
【0081】
(2)架橋反応での、(モノマー+架橋剤)の溶媒に対する比率 他のすべての条件を一定に保った場合、溶媒に対する(モノマー+架橋剤)の比率を高くすると、架橋密度の高い材質ができる。例えば、高分子量アミンを使用し、主鎖の長さとポリマー濃度が充分に大きい場合、鎖のもつれが生じ、化学的に架橋構造ができた後で、多くの架橋ノードが生成される。より一般的には、高分子量アミンと低分子量アミンの両方について、溶媒に対する(モノマー+架橋剤)の高い比率は、ゲル欠陥(例えば、鎖内の架橋により環状構造が生じたり、不完全な架橋反応により末端がもつれたりするなど)を引き起こす副反応の度合を最小限にする。
【0082】
この条件は主に、モノマー(アミンなど)と架橋剤との両方の反応媒質中濃度によって決まる。本発明のいくつかの実施態様において、モノマーと架橋剤との両方の反応媒質中濃度は、約20重量%よりも大きく、好ましくは約40重量%よりも大きく、さらに好ましくは約60重量%よりも大きい。いくつかの実施態様において、(モノマー+架橋剤):溶媒(水など)の比は、約3:1(重量/重量)〜約1:3(重量/重量)の間が用いられる。いくつかの実施態様において、(モノマー+架橋剤):溶媒(水など)の比は、約3:1(重量/重量)〜約1:1(重量/重量)の間が用いられる。いくつかの実施態様において、(モノマー+架橋剤):溶媒(水など)の比は、約3:1(重量/重量)、または約2.5:1(重量/重量)、または約2.0:1(重量/重量)、または約1.5:1(重量/重量)、または約1:1(重量/重量)が用いられる。架橋剤は、重合手順によって、さまざまなタイミングで添加され得る。いくつかの実施態様では、最初のモノマー:溶媒比率(架橋剤を添加する前)は、約4:1〜約1:1、または約3:1〜約1:1である。その後、最初のモノマー含有量の約100mol%〜約400mol%、または最初のモノマー含有量の約200mol%〜約300mol%の架橋剤を含むように、添加する。いくつかの実施態様では、モノマーはN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマーであり、架橋剤はエピクロロヒドリンであり、最初のモノマー:水の比率は約4:1〜1:1、または約3:1〜約1:1、または約1.7、または約1.73である。架橋剤は、モノマー含有量の約200mol%〜約300mol%、または約230mol%〜約270mol%、または約250mol%になるまで添加する。
【0083】
いくつかの実施態様(例えばモノマーがポリアリルアミンである実施態様)において、モノマーの量は架橋剤量よりもずっと大きく(モルベースで架橋剤の10倍、重量ベースではさらに大きい)、上記比率は、架橋剤を無視し、モノマー:溶媒の比率として表現し得る。いくつかの実施態様において、モノマー(ポリアリルアミンなど)は、モノマー:溶媒の比が約3:1〜約1:3で存在する。いくつかの実施態様において、モノマーはポリアリルアミンであり、架橋剤はエピクロロヒドリンであり、ポリアリルアミンは、モノマー:溶媒の比が約3:1〜約1:3で存在し、エピクロロヒドリンは総ポリアリルアミン含有量の約10mol%になるよう反応混合物に加えられる。
【0084】
可能であれば、無溶媒プロセスがさらに好ましい:ある実施態様において、アミンと架橋剤を素早く混合した後、水などの連続層にそのまま分散させる。架橋反応は分散した液滴の中で起こり、ビーズ状のポリマーとして回収される。
【0085】
(3)ポリマーの有効電荷(生理学的pHと浸透圧における) ポリマーの有効電荷は
、イオン結合のモル含有量、固有電荷、生理学的pHでのイオン化度によって得られる。電荷密度は、好ましくは3mmol/g〜20mmol/g、さらに好ましくは6mmol/g〜15mmol/gの範囲である。
【0086】
(4)主鎖ポリマーの親水性/疎水性のバランス ポリマーの親水性/疎水性のバランスをとることにより、化学的架橋密度と膨潤率をある程度独立してコントロールすることができる。膨潤率は、Flory−Hugginsの式(Flory P.J.”Principles of Polymer Chemistry,Cornell Ithaca Pub.1953)に記載されているように、ポリマー溶媒相互反応パラメータχijに非常に敏感に左右される。χij値が0.4以上に増大すると、ポリマーに対する溶媒状態が悪くなり、モノマーと溶媒(水)との相互反応が最小限になるようにされ、従って膨潤率がずっと下がる。これは、ゲルに、長鎖疎水基、(ポリ)芳香環置換基、フッ素化基などを組み込むことによって達成することができる。この戦略により膨潤度をコントロールし、その結果としてゲルの排除限界をコントロールしたとき、疎水性モノマーと架橋剤の濃度は、約0.5mol%〜約50mol%、好ましくは約20%〜約50%となる。
【0087】
好ましい方法においては、モノマーのlog Pの絶対差によって絶対疎水性が定量化される。定量的に、モノマーの疎水性/親水性の性質は、各モノマーのlog Pによって決定され得、これは時に、オクタノール−水分配係数と呼ばれる。log P値は周知であり、水/1−オクタノールの分離混合物中におけるモノマーの濃度を測定する標準的なテストに従って決定される。特に、個々のモノマーについてlog P値を見積るコンピュータプログラムが市販されており、インターネットでも得られる。本願におけるlog P値のいくつかは、ウェブサイトhttp://esc.syrres.com/interkow/kowdemo.htmで見積りを行った。このサイトでは、CAS登録番号や化学名を入力するだけで、分子のlog P値見積りが得られる。疎水性モノマーは通常、log P値がゼロより大きく、親水性モノマーは通常、log P値がゼロ近く、またはゼロより下である。一般に、本発明の目的に合った疎水性モノマーのlog
Pは少なくとも約0.5、より好ましくは少なくとも約0.75、なおより好ましくは少なくとも約1.0、さらにより好ましくは少なくとも約1.5、最も好ましくは少なくとも約2であるべきである。
【0088】
5)コア−シェル構造の存在。シェル部分は、コア物質の膨潤度を制限する。コア−シェル形態をもつゲル粒子は、本発明の趣旨において有用である:シェル物質は、コア物質(シェルなしではずっと大きな程度まで膨潤する)からの膨潤圧力に対する機械的抵抗力を付与することによって膨潤を制限することができ、従って排除限界を限定できる。シェル物質は、コアと同じ組成にすることができるが、架橋密度は高くする。このようなコア−シェル物質の設計とその生成方法は、米国特許出願第10/814,789号に見られ得る。
【0089】
シェル物質は、化学的にコア物質に固定され得るか、または物理的にコーティングされ得る。最初の方法では、例えば次のような化学的方法で、シェルがコア成分上に生成され得る:コアポリマーに固定された活性部位からのリビング重合法を使用してコアにシェルポリマーの化学的グラフトを行う方法;界面反応(すなわち、界面縮重合のようなコア粒子表面での化学反応)の方法、およびコア粒子合成中に懸濁剤としてブロックコポリマーを使用する方法。
【0090】
化学的方法を使用する場合は、界面反応とブロックポリマーの使用が好ましい。界面反応経路においては通常、コア界面で小分子または高分子を反応させることによってコア粒子の表面が化学的に修飾される。例えば、アミンを含むイオン結合コア粒子は、エポキシ
やイソシアネート、活性化エステル、ハロゲン基などのアミンと反応性の基を含むポリマーと反応させることにより、コア表面に架橋したシェルを形成する。
【0091】
他の実施態様においては、シェルを最初に調製する。すなわち界面重縮合や溶媒コアセルベーションを使用して、カプセルを製造する。次にカプセルの内部にコア形成の前駆物質を充填し、シェルカプセル内でコアを構築する。
【0092】
いくつかの実施態様では、ブロックコポリマーアプローチを使用して、両親媒性のブロックコポリマーを懸濁試薬として用い、逆懸濁または直接懸濁の粒子形成プロセスでコア粒子を形成する。油中水型の逆懸濁プロセスを使用する場合、ブロックコポリマーが連続的油相に溶ける最初のブロックとなり、別の親水性ブロックにはコアポリマーと反応できる官能基が含まれる。コア形成前駆物質と共に水相に加え、次に油相に加えると、ブロックコポリマーは油中水界面に集まり、懸濁剤として作用する。親水性ブロックはコア材料と反応するか、またはコア形成前駆物質と共反応する。粒子を油相から分離すると、ブロックコポリマーは、共有結合でコア表面に固定された薄いシェルを形成する。ブロックの化学的性質と長さは、目的の溶質に対するシェルの浸透特性を変えるために、変更することができる。
【0093】
シェル材料がコア材料に物理吸着している場合、溶媒コアセルベーションや液化ベッドスプレーコーター、マルチエマルジョンプロセスなどのマイクロカプセル化技術として周知のテクニックを使用することができる。マイクロカプセル化の好ましい方法は、Wurster構成の液化ベッドスプレーコーターである。また別の実施態様において、シェル材料は、口や食道にある間のコア粒子膨潤を遅らせるために一時的にのみはたらくものであり、必要に応じて胃や十二指腸で分解する。シェルは、疎水性が高く、水浸透性が非常に低い液体の層を形成することによって、コア粒子に水が浸透するのを妨げるようなものを選ぶ。
【0094】
ゆえに、本発明は一態様において、モノマーと架橋剤から成るイオン結合性ポリマーの選択方法を提示し、ここでこのポリマーは次の特徴のうち少なくとも1つをもつ:a)膨潤率は5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。これは、次の工程を含む:
i)次の組成およびプロセス変数を変える
1)モノマーに対する架橋剤の比率
2)反応媒質において、溶媒に対する(モノマー + 架橋剤)の比率A
3)生理学的pHと浸透圧でのポリマーの有効電荷
4)主鎖ポリマーの親水性/疎水性のバランス
ii)得られたポリマーの膨潤性、細孔度、イオン結合干渉率を評価する
iii)上記特徴のうち少なくとも1つを有するポリマーを選ぶ。
【0095】
別の態様として、本発明は、ポリアミンポリマーの治療的特性および/もしくは投与適性、ならびに/または製薬性質の改良方法を提供する。これには次の工程のうち少なくとも1つが含まれる:a)ポリアミンモノマーの平均結合数が約2.05と約6との間になるように、架橋剤でポリマーを架橋させる工程、および/またはb)ポリアミンが、ポリアミン対水の初期比率が約3:1〜約1:3で水中に存在するようにした方法によって、ポリマーを製造する工程。
【0096】
C.モノマー
本発明のポリマーには、適切なモノマーおよび架橋剤なら何でも使用することができる
。ポリマーがリン酸イオンやシュウ酸イオンと結合する場合は、このポリマーは通常ポリアミンと架橋剤から成る。ポリアミンにはアミン官能モノマーが含まれ、例えば米国特許第5,496,545号;同第5,667,775号;同第6,509,013号;同第6,132,706号;および同第5,968,499号ならびに米国特許出願第10/806,495号および同第10/701,385号に記載されているものがある。これら特許および特許出願は、その全体が参考として本明細書中に援用される。
【0097】
いくつかの実施態様において、本発明は、架橋アミン成分からなるイオン結合性ポリマーを提供する。一部の実施態様において、ポリマーは、低膨潤性、in vivoでのイオン高結合性、干渉するイオンからの低干渉性、特定の細孔度の特徴のうち、1つまたは複数の特徴を有する。ポリマー(ホモポリマーおよびコポリマーを含む)には、架橋アミン単位の繰り返しがあり、本明細書中で架橋アミンポリマーとして言及される。ポリマー中の繰り返しアミン単位は、同じ長さまたは可変長さの繰り返しリンカー(または介在)単位によって分けられる。いくつかの実施態様において、ポリマーはアミンプラス介在リンカー単位の繰り返し単位から成る。他の実施態様においては、複数のアミン単位が、1つまたは複数のリンカー単位によって分けられる。
【0098】
本発明のポリマーで有用なモノマーの1つが、式Iのアミンである。
【0099】
【化4】

ここで各nはそれぞれ独立に3以上であり、mは1以上であり、各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する。ある実施態様において本発明は式Iのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0100】
式Iの好ましいアミンとしては次のものがある:
【0101】
【化5】

一態様において本発明は、本発明ポリマーを使用した動物(人間を含む)治療の方法を提供する。この面でのある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式Iのアミンよりなる。
【0102】
本発明のポリマーで有用なモノマーの2つめが、式IIのアミンである。
【0103】
【化6】

ここでpは1、2、3、もしくは4であり;各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する;R2とR3はそれぞれ独立にHまたは必要に応じて置換されたアルキル基またはアリル基(ただしp=1のときはR2とR3の両方がHではなく、p=2、3、もしくは4のときはR2とR3がHかアルキル基か−C(R1)2−R4−N(R1)2で、ここでR4は結合手またはメチレンである);さらに一部の実施態様においては、式IIのアミンにはpが4より大きいアミンが含まれる。さまざまな実施態様において、pは8より大、12より大、16より大、20より大となり得る。他の実施態様において、pは25未満、20未満、15未満、10未満となり得る。ある実施態様において本発明は式IIのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0104】
式IIの好ましいアミンとしては次のものがある:
【0105】
【化7】

本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式IIのアミンよりなる。
【0106】
本発明のポリマーで有用なモノマーの3つめが、式IIIのアミンである。
【0107】
【化8】

ここでqはもしくは2であり、各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する。ある実施態様において本発明は式IIIのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0108】
式IIIの好ましいアミンとしては次のものがある:
【0109】
【化9】

本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式IIIのアミンよりなる。
【0110】
本発明のポリマーで有用なモノマーの4つめが、式IVのアミンである。
【0111】
【化10】

ここで各nはそれぞれ独立に3以上であり、各rは独立に0、1、もしくは2であり、各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する。ある実施態様において本発明は式IVのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0112】
式IVの好ましいアミンとしては次のものがある:
【0113】
【化11】

本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式IVのアミンを含む。
【0114】
本発明のポリマーで有用なモノマーの5つめが、式Vのアミンである。
【0115】
【化12】

ここで各nはそれぞれ独立に3以上であり、各rは独立に0、1もしくは2であり、各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する。ある実施態様において本発明は式Vのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0116】
式Vの好ましいアミンとしては次のものがある:
【0117】
【化13】

本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式Vのアミンよりなる。
【0118】
本発明のポリマーで有用なモノマーの6つめが、式VIのアミンである。
【0119】
【化14】

ここで各mは独立に、3以上である。ある実施態様において本発明は式VIのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0120】
本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式VIのアミンよりなる。
【0121】
一般式I〜VIで示されているアミンは、この分野で周知の手法によって合成することができる。この合成技術には、アルコールの触媒転換や、カルボニル化合物の還元的アミノ化、Michael付加、亜硝酸塩の水素化などがある(例えばKarsten Eller et al,Ullmann’s Encyclopedia of Indu
strial Chemistry 2002 by Wiley−VCH Verlag GmbH & Co.KGaAを参照)。小さいアミンモノマーおよび/またはアミン+介在リンカー単位をいくつかつなげたものも、市販されている。
【0122】
ある実施態様において、この発明で有用なアミンの1つであるテトラメチレンテトラミン(下記参照)は、市販されているジアミノマレオニトリル(DAMN)の触媒水素化により合成される。
【0123】
【化15】

本発明で使用され得るアミンは通常、重合反応のためのモノマーまたはモノマー単位の一部としてはたらく小さいアミンであるが、これに限定されない。いくつかの実施態様において、モノマーは低分子量モノマー(例えば分子量が200g/mol未満のモノマー)である。
【0124】
本発明の実施態様において、モノマーは非重合体(例えば非重合アミン)である。本明細書中で使用される場合、「ポリマー」とは分子量が比較的大きく、構造が主に、実際にも概念的にも分子量が比較的小さい分子から誘導された単位の複数の繰り返しで成り立っている分子を包含する。
【0125】
本発明のポリマー合成に適したアミンの例(これらに限定されない)としては、表1に示すアミンが挙げられる。
【0126】
【化16】

本発明のポリマーに使用できる可能性があるアミンモノマーとしては他に、ビシナルアミン部分がある。ポリマーはビシナルアミン単位の繰り返しを含むホモポリマーであってもよく、または、1種以上のビシナルアミンおよび他のモノマー(アクリレート、メタクリレート、アクリルアミド、メタクリルアミド、ビニルエステル、ビニルアミド、オレフィン、スチレンなど)の単位の繰り返しを含むコポリマーでもよい。ポリマーのサイズは例えば、約500〜約1,000,000ダルトンの間で可変である。
【0127】
本発明のポリマーで有用なビシナルアミンモノマーの1つが、式VIIのアミンである:
【0128】
【化17】

ここでnはゼロ、1、またはそれ以上であり、各Rは独立に、窒素の結合価を満たす適切な化学基であり、各R’は独立にH、アルキル、またはアミノである。
【0129】
他の実施態様において、ポリマーは次の式の単位を繰り返している特徴を有する:
【0130】
【化18】

または、これを含むコポリマーである。ここでnはゼロ、1、またはそれ以上、各Rは独立に、窒素の結合価を満たす適切な化学基であり、各R’は独立にH、アルキル、またはアミノであり、そして、X−はマイナス電荷を有する有機または無機の対イオンである。
【0131】
式VIIIの好ましいポリマーとしては次のものがある:
【0132】
【化19】

本発明のポリマーとしてはまた、次の式を有する単位を繰り返している特徴を有するポ
リマーがある:
【0133】
【化20】

ここでnはゼロ、1、またはそれ以上であり、各Rは独立に、窒素の結合価を満たす適切な化学基であり、各R’は独立にH、アルキル、またはアミノであり、そして、X−はマイナス電荷を有する有機または無機の対イオンである。
【0134】
ある実施態様においては、近隣の窒素原子のR基が互いにつながって、式Xに示す構造を有する。
【0135】
【化21】

ここでQは結合手、アルキル基、アルキルアミノ基、アルキルカルボニル基、アルケニル基、アリル基、またはヘテロシクリル基である。
【0136】
ここで説明するポリマーにおいて、nはゼロ、1、または1より大である。好ましい実施態様において、nは0〜5であり、さらに好ましくは、nはゼロまたは1である。
【0137】
n’の値はポリマーの所望の性質や用途可能性、使用する合成技術によって異なる。
【0138】
式VII、VIII、IX、Xのペンダント(垂れ下がった)窒素原子は、C、H、O、S、P、Nなどの原子と結合することができ、このペンダント基はニトロソ、ニトロ、ニトロキシド基、ニトロン、ニトレン、イソシアネート、カルバジド、ヒドラジノ、ジアゾ基、イミン、アミジン、グアニジン、スルファメート、ホスホラミデート、複素環などになる。
【0139】
適切なR基の例としては、H、ハロゲン、R”、CO2H、CO2R”、COR”、C(=NR”)(NR”)、CN、CONH2、CONR”2、OR”、SO3R”、Si
(R”)3、およびP(O)(OR”)2がある。適切なR”としてはH、必要に応じて置換されたアルキル基、アシル基、アルキルアミノ基、アルケニル基、ヘテロシクリル基、およびアリル基がある。好ましいR’はH、メチル基、アミノ基である。
【0140】
R”基の置換は、酸素、窒素、リン、硫黄を含むイオン性の基でも可能である。置換基の例としては、カルボキシル、スルホン、スルファミン、スルホン基、リン酸、ホスファゼン、ホスホラミデート基、第四アンモニウム基、またはアミン基(第一および第二のアルキルアミンまたはアリールアミン)が挙げられる。適した置換基の例としては他に、ヒドロキシ、アルコキシ、カルボキサミド、スルホンアミド、ハロゲン、アルキル、アリール、ヒドラジン、グアナジン、尿素、カルボン酸エステルがある。
【0141】
好ましいR基には、Hおよび次のものがある:
【0142】
【化22】

マイナス電荷を有する対イオンX−は、有機イオン、無機イオン、またはその組合せがあり得る。本発明の用途に適切な無機イオンとしては、ハライド(特に塩化物イオン)、炭酸イオン、重炭酸イオン、硫酸イオン、重硫酸イオン、水酸化イオン、硝酸イオン、過硫酸イオン、および亜硫酸イオンが挙げられる。適切な有機イオンとしては、酢酸イオン、アスコルビン酸イオン、安息香酸イオン、クエン酸イオン、クエン酸二水素イオン、クエン酸一水素イオン、シュウ酸イオン、コハク酸イオン、酒石酸イオン、タウロコール酸、グリココール酸イオン、およびコール酸イオンが挙げられる。好ましいX−は塩化物イオンまたは炭酸イオンである。
【0143】
好ましい実施態様において、対イオンは患者に対して有害な副作用がなく、患者に治療上または栄養上の利点があるよう選択される。
【0144】
本発明のポリマーで使用されるもうひとつのモノマーが、下記に示す式XIである。
【0145】
【化23】

ここでR’”はHまたはCH3であり、Rは上記と同様である。式XIの好ましい構造は、R=Hのときである。
【0146】
ある実施態様において、ポリマーはコポリマーであり、繰り返し単位の1つが本明細書中に記載されているモノマーである。
【0147】
本発明のコポリマーは、交互コポリマーまたはランダムコポリマーであり得る。一般に、アミン前駆物質と共重合し得るモノマーとしては、次のグループから選択される1種以上のモノマーが挙げられる:スチレン、置換スチレン、アルキルアクリレート、置換アルキルアクリレート、アルキルメタクリレート、置換アルキルメタクリレート、アクリロニトリル、メタクリロニトリル、アクリルアミド、メタクリルアミド、N−アルキルアクリルアミドN−アルキルメタクリルアミド、N,N−ジアルキルアクリルアミド、N,N−ジアルキルメタクリルアミド、イソプレン、ブタジエン、エチレン、酢酸ビニル、N−ビニルアミド、マレイン酸誘導体、ビニルエーテル、アリル、メタリルモノマー、およびこれらの組合せ。これらモノマーに官能基をつけたものも使用することができる。本発明に使用できるモノマーおよびコモノマーには次のようなものが挙げられるが、これらに限定されない:メチルメタクリレート、エチルメタクリレート、プロピルメタクリレート(異性体すべて)、ブチルメタクリレート(異性体すべて)、2−エチルヘキシルメタクリレート、イソボルニルメタクリレート、メタクリル酸、ベンジルメタクリレート、フェニルメタクリレート、メタクリロニトリル、α−メチルスチレン、メチルアクリレート、エチルアクリレート、プロピルアクリレート(異性体すべて)、ブチルアクリレート(異性体すべて)、2−エチルヘキシルアクリレート、イソボルニルアクリレート、アクリル酸、ベンジルアクリレート、フェニルアクリレート、アクリロニトリル、スチレン、グリシジルメタクリレート、2−ヒドロキシエチルメタクリレート、ヒドロキシプロピルメタクリレート(異性体すべて)、ヒドロキシブチルメタクリレート(異性体すべて)、N,N−ジメチルアミノエチルメタクリレート、N,N−ジエチルアミノエチルメタクリレート、トリエチレングリコールメタクリレート、無水イタコン酸、イタコン酸、グリシジルアクリレート、2−ヒドロキシエチルアクリレート、ヒドロキシプロピルアクリレート(異性体すべて)、ヒドロキシブチルアクリレート(異性体すべて)、N,N−ジメチルアミノエチルアクリレート、N,N−ジエチルアミノエチルアクリレート、トリエチレングリコールアクリレート、メタクリルアミド、N−メチルアクリルアミド、N,N−ジメチルアクリルアミド、N−tert−ブチルメタクリルアミド、N−n−ブチルメタクリルアミド、N−メチロールメタクリルアミド、N−エチロールメタクリルアミド、N−tert−ブチルアクリルアミド、N−n−ブチルアクリルアミド、N−メチロールアクリルアミド、N−エチロールアクリルアミド、4−アクリロイルモルフォリン、ビニル安息香酸(異性体すべて)、ジエチルアミノスチレン(異性体すべて)、α−メチルビニル安息香酸
(異性体すべて)、ジエチルアミノα−メチルスチレン(異性体すべて)、p−ビニルベンゼンスルホン酸、p−ビニルベンゼンスルホン酸ナトリウム塩、トリメトキシシリルプロピルメタクリレート、トリエトキシシリルプロピルメタクリレート、トリブトキシシリルプロピルメタクリレート、ジメトキシメチルシリルプロピルメタクリレート、ジエトキシメチルシリルプロピルメタクリレート、ジブトキシメチルシリルプロピルメタクリレート、ジイソプロポキシメチルシリルプロピルメタクリレート、ジメトキシメチルシリルプロピルメタクリレート、ジエトキシシリルプロピルメタクリレート、ジブトキシシリルプロピルメタクリレート、ジイソプロポキシシリルプロピルメタクリレート、トリメトキシシリルプロピルアクリレート、トリエトキシシリルプロピルアクリレート、トリブトキシシリルプロピルアクリレート、ジメトキシメチルシリルプロピルアクリレート、ジエトキシメチルシリルプロピルアクリレート、ジブトキシメチルシリルプロピルアクリレート、ジイソプロポキシメチルシリルプロピルアクリレート、ジメトキシシリルプロピルアクリレート、ジエトキシシリルプロピルアクリレート、ジブトキシシリルプロピルアクリレート、ジイソプロポキシシリルプロピルアクリレート、無水マレイン酸、N−フェニルマレイミド、N−ブチルマレイミド、N−ビニルホルムアミド、N−ビニルアセトアミド、アリルアミン、メタアリルアミン、アリルアルコール、メチルビニルエーテル、エチルビニルエーテル、ブチルビニルエーテル、ブタジエン、イソプレン、クロロプレン、エチレン、酢酸ビニル、およびこれらの組合せ。好ましいモノマーまたはコモノマーは、アクリルアミド、ジメチルアクリルアミド、N−ビニルホルムアミド、N−ビニルアセトアミド、酢酸ビニル、メチルアクリレート、ブチルアクリレートである。
【0148】
本発明のポリマーに使用できるモノマーには他に、次のものがある:
【0149】
【化24】

ここで各Rは独立に、H、または置換および/もしくは無置換アルキル基(例えば、炭素原子1〜5を有する、短鎖アルキル基など)、アルキルアミノ基(例えば、炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(フェニル基など)である。
【0150】
【化25】

ここで各Rは独立に、H、または置換および/もしくは無置換アルキル(炭素原子1〜5を有する)、アルキルアミノ基(炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(フェニル基など)であり、各X−は互換できるマイナス電荷の対イオンである。
【0151】
適切なモノマーとして他に、下式で示される構造のものがある:
【0152】
【化26】

ここで各RはH、または置換および/もしくは無置換アルキル基(例えば、炭素原子1〜5を有する)、アルキルアミノ基(例えば、炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(フェニル基など)である。
【0153】
適切なモノマーとして他に、下式で示される構造のものがある:
【0154】
【化27】

ここで各R1およびR2は独立に、H、または置換および/もしくは無置換アルキル(例えば、炭素原子1〜5を有する)、アルキルアミノ基(例えば、炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(フェニル基など)であり、各X−は互換できるマイナス電荷の対イオンである。ある実施態様において、少なくともR基の1つは水素原子である。
【0155】
適切なモノマーとして他に、下式で示される構造のものがある:
【0156】
【化28】

ここで各R1およびR2は独立に、H、または置換および/もしくは無置換アルキル基(例えば、炭素原子1〜20を有する)、アルキルアミノ基(例えば、炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(炭素原子6〜12を有する、フェニル基など)である。
【0157】
適切なモノマーとして他に、下式で示される構造のものがある:
【0158】
【化29】

ここで各R1、R2、R3は独立に、H、または置換および/もしくは無置換アルキル基(例えば、炭素原子1〜20)、アルキルアミノ基(例えば、炭素原子1〜5、エチルアミノ基など)、またはアリール基(炭素原子6〜12、フェニル基など)であり、各X−は互換できるマイナス電荷の対イオンである。
【0159】
モノマーの各例において、R基は1つまたは複数の置換基をもつことができる。適切な置換基としては、第四アンモニウム基やアミン基(例えば、第一および第二のアルキルアミンまたはアリールアミン)などの治療用アニオン基が挙げられる。適した置換基としては他に例えば、ヒドロキシ、アルコキシ、カルボキサミド、スルホンアミド、ハロゲン、アルキル、アリール、ヒドラジン、グアナジン、尿素、カルボン酸エステルがある。
【0160】
マイナス電荷を有する対イオンX−は、有機イオン、無機イオン、またはその組合せがあり得る。本発明の用途に適切な無機イオンとしては、ハライド(特に塩化物イオン)、炭酸イオン、重炭酸イオン、硫酸イオン、重硫酸イオン、水酸化イオン、硝酸イオン、過硫酸イオン、および亜硫酸イオンが挙げられる。適切な有機イオンとしては、酢酸イオン、アスコルビン酸イオン、安息香酸イオン、クエン酸イオン、クエン酸二水素イオン、クエン酸一水素イオン、シュウ酸イオン、コハク酸イオン、酒石酸イオン、タウロコール酸、グリココール酸イオン、およびコール酸イオンが挙げられる。
【0161】
グアニジノ基を含むポリマーも、所望の特性をもち、リン酸イオン、シュウ酸イオンなどの陰イオンと結合し、本明細書中に記載されているプロセスによって生成できる組成として役に立つ。このようなポリマーは米国特許第6,132,706号および同第5,968,499号に記述されており、その全体が参考として本明細書中に援用される。簡単に説明すれば、グアニジノ基は重合構造に付加されている。結合効果はグアニジノ基によるものであるため、ポリマー主鎖の性質はさほど重要ではない。架橋などの要素がコントロールできる好ましいポリマーとしては、ポリエチレン主鎖にジビニルベンゼンで架橋した構造を有するポリマーが挙げられる。主鎖が無機化合物のポリマー、例えばポリホスファゼンポリマーも使用することができる。ポリマーは、2種類以上のモノマーから誘導されるコポリマーであり得る。さらに他の有用なポリマーの例としては、セルロースやアガロースなどの炭水化物ポリマーがある。グアニジノ基は、グアニジノ基(NH2−C(=NH)−NH−)の末端NH基の化学結合によってポリマー主鎖に付いている。グアニジノ基がポリマー主鎖に付く化学結合は、直接であることもあれば、何らかの形の基を「スペーサー」として間に挟み、ポリマー主鎖に付くこともある。さまざまな形態の付加を使うことができるが、ポリマーの基本タイプによって好ましい形態が違ってくる。例えば、炭素原子1〜4のアルキレン基、アミド基、エーテル基、またはこれらの組合せを使用することができる。この場合、グアニジノ基をポリマー主鎖に付加する好ましい形態は、明らかに主鎖の性質によって違ってくるが、簡単に言えば、主鎖の原子とグアニジノ基中のNH基との間の直接結合の方がなるべくならば望ましい。
【0162】
グアニジノを含むポリマーの調製方法は、当業者には明らかであるが、例えばSchnaar,R.L.and Lee,Y.C.,1975,Biochemistry 1
4,1535−1541(その全体が参考として本明細書中に援用される)の教示に従って調製することができる。Schnaarは、ポリマーマトリックスに生物学的活性の配位子をリンクする方法を説明している。また、ポリマーは次のいずれかのポリマー主鎖にアミノ基が付いたポリマーとの反応によって簡単に調製することも可能である:(a)硝酸3,5−ジメチルピラゾール−1−カルボキサミジン、(b)硫酸S−メチルチオウロニウム、または(c)硫酸O−メチルシュードウレア。
【0163】
本発明の好ましいモノマーはアミンである。本発明のポリマーで使用するのに最も好ましいモノマーは、アリルアミン、ビニルアミン、エチレンイミン、メチレン1,3−ジアミノプロパン、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン、1,2,3,4−テトラアミノブタン、式1および式2などがある。ここで式1および式2は次の構造である:
【0164】
【化30】

いくつかの実施態様において、本発明のポリマーは、1種以上のアミンモノマーと1種以上の架橋剤から構成され、ここでポリマーは、架橋反応に先立ち、アミン:溶媒の比が約3:1〜約1:3で溶媒中にアミンを存在させ、反応混合物に加える架橋剤の合計量をアミンモノマーの平均結合数が約2.05と約6との間、または約2.2と約4.5との間となるように調整することによって製造される。いくつかの実施態様において、本発明のポリマーは、1種以上のアミンモノマーと1種以上の架橋剤から製造されるリン酸イオン結合性ポリマーであり、ここでこのポリマーは、反応混合物に加える架橋剤の合計量を、アミンモノマーの平均結合数が2.2〜4.5となるように調整することにより製造される。好ましい実施態様において、アミンモノマーは1,3−ジアミノプロパンとN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンからなる群から選ばれ、架橋剤は1,3−ジクロロプロパンとエピクロロヒドリンからなる群から選ばれる。いくつかの実施態様において、本発明のポリマーは1種以上のアミンモノマーと1種以上の架橋剤から製造され、ここでアミンモノマーはポリアリルアミンモノマーではなく、および/または架橋剤はエピクロロヒドリンではない。
【0165】
いくつかの実施態様(リン酸イオン結合性ポリマーなど)において、最終ポリマーのアミンに対する塩化物の比を、所定のレベル以下に維持することが望ましい。いくつかの実施態様において、この値は約0〜約35 mol %であり、さらに好ましくは約0〜約15mol %である。モノマーは、この基準に従って選択できる。
【0166】
D.架橋剤
架橋剤には、米国特許第5,496,545号;同第5,667,775号;同第6,509,013号;同第6,132,706号;および同第5,968,499号ならびに米国特許出願第10/806,495号および同第10/701,385号に記載されているものがある。
【0167】
架橋剤は通常、少なくとも2つの官能基を有する化合物で、ハロゲン基、カルボニル基、エポキシ基、エステル基、無水酸基、酸ハロゲン化物基、イソシアネート基、ビニル基、クロロホルメート基の中から選択される。架橋剤は炭素主鎖に付くか、またはアミンポリマーのペンダント窒素原子に付く。本発明のポリマー合成に適した架橋剤の例(これら
に限定されない)としては、表2に示される架橋剤が挙げられる。
【0168】
【化31】

【0169】
【化32】

【0170】
【化33】

【0171】
【化34】

【0172】
【化35】

【0173】
【化36】

適切な架橋剤の例として挙げられるのは、ジアクリレート類とジメタクリレート類(例えばエチレングリコールジアクリレート、プロピレングリコールジアクリレート、ブチレングリコールジアクリレート、エチレングリコールジメタクリレート、プロピレングリコールジメタクリレート、ブチレングリコールジメタクリレート、ポリエチレングリコールジメタクリレート、ポリエチレングリコールジアクリレートなど)、メチレンビスアクリルアミド、メチレンビスメタクリルアミド、エチレンビスアクリルアミド、エチレンビスメタクリルアミド、エチリデンビスアクリルアミド、ジビニルベンゼン、ビスフェノールAジメタクリレート、ビスフェノールAジアクリレート、ジエポキシド類、ジハライド類、ジイソシアネート類、ジアシルクロライド類、ジアンヒドリド類、ジメチルエステル類である。
【0174】
好ましい架橋剤の例としては、エピクロロヒドリン、1,4−ブタンジオールジグリシジルエーテル、1,2−エタンジオールジグリシジルエーテル、1,3−ジクロロプロパン、1,2−ジクロロエタン、1,3−ジブロモプロパン、1,2−ジブロモエタン、二塩化スクシニル、コハク酸ジメチル、トルエンジイソシアネート、塩化アクリロイル、アクリル酸メチル、エチレンビスアクリルアミド、および無水ピロメット酸などがある。
【0175】
E.重合
重合は、当該分野で公知の手法により達成することができる。この例は、本明細書中に開示される実施例の項で詳細に説明されている。上に述べたように、重合条件は、所望の特性をもったポリマーを製造するために調整することができる。
【0176】
架橋反応は、バルク溶液中(すなわち、無希釈アミンと無希釈架橋化合物を使用する)か、分散媒質の中で行なわれる。ゲル生成に至る架橋反応は、さまざまなプロセスを用いて行うことができるが、このプロセスは大きく2つのカテゴリーに分けられる:
i)均一プロセス:アミン官能基前駆物質(低分子アミンまたは高分子量ポリアミン)が連続相に溶解し、架橋反応によって得られたゲルが連続相中でバルクゲルまたはゲルスラリーとして回収される。バルクゲルプロセスとは、溶媒全体がゲルの網状組織にトラップされ、固まりとなり、これを押出し、すり潰しなどの方法で細かい粒子にする状況をいう。バルクプロセスを使用する場合、溶媒は、反応物質が相互溶解し、アミン架橋反応を阻害しないように選択する。適切な溶媒としては、水、低沸点アルコール(メタノール、エタノール、ブタノール)、ジメチルホルムアミド、ジメチルスルホキシド、アセトン、メチルエチルケトン、およびこれらに類似のものが挙げられる。ゲルスラリーは通常、反応媒質粘度が低い範囲にあり、剪断率が高いため、生成されたゲル粒子がスラリー中の懸
濁状態にとどまる場合に得られる。
【0177】
ii)不均一プロセス:アミン官能基前駆物質(低分子アミンまたは高分子量ポリアミン)が連続相に不溶性であり、架橋反応が進んで生成したビーズまたは不定形粒子がその連続相中に懸濁し、分散した液粒または粒子となる。
【0178】
均一プロセスは、本発明の目的である膨潤度を抑えた架橋物質を製造するためには、実際的でないことがある;所望の膨潤率と細孔分布での架橋レベルは通常、ゲル時間が非常に短く、局所的粘度が高くなるため、ラージスケールの製造には実際的でない。
【0179】
本発明のための合成モードは、不均一プロセスを利用するのが好ましい。この種のプロセスは分散媒質中の重合と呼ばれ、逆懸濁、直接懸濁、沈殿重合、乳化重合、マイクロエマルジョン重合、エアロゾル中の反応などが含まれる。連続相は、トルエン、ベンゼン、炭化水素、ハロゲン化溶媒、臨界超過二酸化炭素などの無極性溶媒の中から選択され得る。直接懸濁または乳化プロセスでは、水も使用できる。塩水も、アミンと架橋剤を液粒の分離相中で「塩析」させるのに有用である(米国特許No.5,414,068参照)。モノマー前駆物質は、そのまま、または溶液として連続相の中に分散できる。アミンと架橋剤は好ましくは2段階の手順で導入する:まずアミンを液粒として分散させ、次に架橋剤を反応媒質に追加して、分散相に移動させる。架橋反応は液粒相内で起こり、懸濁液の粘度に大きな増大は引き起こさない。これは、発熱反応によって生じた熱を拡散するのに有利であり、ビーズ内のゲル均一性が良好に保たれる。好ましい合成モードは、次のステップを含む:
i)アミンモノマーまたはアミンポリマーを水に溶かす
ii)アミンの一部を、HClなどの酸で中和する
iii)水と混和しない溶媒の中にこのアミン溶液を分散させ、乳化液をつくる
iv)架橋剤をこの乳化液に、何回かに分けて追加する
v)架橋反応を最後まで反応させる
vi)蒸留により水を除去する
vii)濾過によりビーズを分離する
viii)水洗いし乾燥させる。
【0180】
このプロセスでは、ポリマー粒子は球状のビーズとして得られる。このビーズの直径は好ましくは5〜500ミクロン範囲にコントロールされ、さらに好ましくは25〜250ミクロンにする。実施態様のいくつかにおいて、ビーズの平均直径は40ミクロン以下である。
【0181】
ゆえに一態様において、本発明では、不均一プロセスによってアミンモノマーを架橋剤と反応させる工程を含む、標的陰イオンを結合する陰イオン結合性ポリマーの製造方法を提供する。ここでこのリン酸イオン結合性ポリマーは、次の特徴のうち少なくとも2つを有することで特徴づけられる:a)膨潤率は5未満、または4.5未満、または4未満、または3未満、b)標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能なポリマーの重量が約20%未満(パーセンテージは生理学的媒体中において測定した)、c)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満。いくつかの実施態様において、アミンモノマーはポリアリルアミンである。いくつかの実施態様において、架橋剤はエピクロロヒドリンである。
【0182】
別の面として、本発明では、不均一プロセスによるポリアリルアミン架橋方法を含むプロセスによって生成された、標的イオンを結合する陰イオン結合性ポリマーを提供する。このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は5未満、または4.5未満、または4未満、または3未満、b)標的陰イオンの約2倍より大きい分子量
をもつ非反応性溶質が利用可能なポリマーの重量が約20%(重量)未満(パーセンテージは生理学的媒体中で測定した)、c)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満。1つの実施態様において、ポリアリルアミンはエピクロロヒドリンによって架橋される。
【0183】
上記で検討したように、架橋剤対アミンのモル比により、生成されるゲル物質の量と、架橋密度がコントロールされる。比率が低すぎると架橋が不十分になり、水溶性オリゴマーが生じることがある。また高すぎると網状組織が密になりすぎ、結合特性がほとんどなくなることがある。アミン成分は、単独あるいは何種類かのアミンの組合せが使用できる。架橋剤についても同様である。アミンと架橋剤の新しい組合せについては、どちらの機能性もゲル生成量と膨潤性に影響を与えるため、最適化の作業が必要となる。いくつかの実施態様(例えばFbが2の架橋剤によって低分子量モノマーを架橋した実施態様)において、架橋剤対アミンのモル比(B/A)は約0.2と約10との間、好ましくは約0.5と約5との間、最も好ましくは約0.5と約2との間である。この比率は、アミンモノマーが高分子量モノマーであるか低分子量モノマーであるか、そして/また架橋剤のFb値に基づいて、調整することができる(前記検討事項および表を参照)。
【0184】
場合によっては、ポリマーは重合後に架橋される。このような架橋が得られる方法では、ポリマーを反応させるのに二官能基の架橋剤(エピクロロヒドリン、二塩化スクシニル、ビスフェノールAのジグリシジルエーテル、無水ピロメット酸、トルエンジイソシアネート、エチレンジアミンなど)を用いる。典型的な例が、ポリ(エチレンイミン)とエピクロロヒドリンの反応である。この例では、エピクロロヒドリン(1〜100部)を、ポリエチレンイミン(100部)を含有する溶液に加え、加熱して反応させる。典型的な例が、ポリビシナルアミンとエピクロロヒドリンの反応である。この例では、エピクロロヒドリン(1〜200部)を、ポリビシナルアミン(100部)を含有する溶液に加え、加熱して反応させる。すでに重合している物質を架橋させる方法は他に、電離放射線の照射、紫外線照射、電子ビーム、ラジカル、熱分解などがあるが、これらに限定されない。
【0185】
架橋反応はバッチとして、または準連続モードで行う。準連続モードの場合、アミンまたは架橋剤のいずれか一方を最初に加え、次に一定時間をおいて一定量ずつ、もう一方の反応物質を加える。ある実施態様において、アミンモノマー成分全部を加えて溶解性のプレポリマーを用意し、次に架橋剤の一部を連続的に加えていき、シロップを形成する。このシロップを、油の連続相中の液粒として乳化し、架橋剤の残りを加えて架橋ビーズを生成させる。架橋剤がアルキルハライド化合物である場合は、反応中に形成される酸を除去するために塩基を使用することができる。無機塩基または有機塩基のいずれでもよい。NaOHが好ましい。架橋剤に対する塩基の比率は、好ましくは約0.5と約2との間である。
【0186】
いくつかの実施態様において、ポリマーは後アミノ化(3−クロロプロピルアミンとの後反応)に供される。この実施態様では、アミンモノマーと架橋剤の間の最初の反応を実行してゲルを生成し、次にこのゲルをアミノアルキルハライドと後反応させ、アミン官能ゲルによるハライド置換で、アミンアルキル基をゲルに化学的に付ける。
【0187】
本明細書中に記載されているポリマーはすべて、さらなる架橋や、リン酸イオンなどの陰イオンによるインプリントをすることができる。ある実施態様においては、標的陰イオン(リン酸イオンやシュウ酸イオン)が重合反応中に存在しており、架橋反応の完了後に洗い流される。この方法は「インプリンティング」と呼ばれ、ゲルに「鋳造」のポケットができることにより所定の陰イオンに対する結合識別が高くなり、陰イオン溶質に対するゲルの化学的親和性が増大する傾向がある。リン酸イオンインプリントを行ったゲルの例は、例えばFujiwara et al,Analytical Sciences
April 2000,vol.16,407や、ACS symposium series 703,”Molecular and Ionic Recognition
with Imprinted Polymers,Bartsch R A and
Maeda M.Editors,1998,Chap.22,315に説明されている。代表的に、陰イオンは、アミン(窒素原子として計算)に対する陰イオンのモル比が、約10〜約100%、好ましくは約10〜約60%、最も好ましくは約30〜約50%で存在する。最も好ましくは、陰イオンを酸の形態(例えば、リン酸、シュウ酸など)で導入し、アミンを遊離塩基として使用することにより、in situでアンモニウム/陰イオン塩を形成する。適切な架橋剤対アミン量比を使用して前記と同様に架橋反応を行い、膨潤率や臨界浸透体積、結合干渉率などの面で、望ましいゲル性質が得られるようにする。架橋後すぐに生成されたゲルを、強い酸性(例えば、pH<2など)または強い塩基性(例えば、pH>12など)の媒質中で徹底的に洗い、インプリントに用いた陰イオンを除去してから、中性の媒質でさらに洗い流す。すべてのパラメータ(例えば、アミン対架橋剤の比率、モノマー対溶媒の比率など)が等しければ、本明細書中に記載されているインプリンティング手法は通常、結合容量を1.1倍、1.3倍、時には1.5倍にまで増加させる。
【0188】
III.医薬組成物
本発明は、一態様において、医薬組成物を提供する。ある実施態様において、医薬組成物はチュアブル錠剤である。また別の実施態様において、医薬組成物は液体製剤である。
【0189】
本発明の医薬組成物は、本発明のポリマー(例えば、架橋アミンポリマー)の有効量、すなわち治療および/または予防のメリットを達成できる用量で存在する組成物である。個々の用途における有効量は、患者(例えば、年齢や体重)、治療される病状、投与経路によって異なってくる。有効量の決定は、特に本明細書中に記載される情報を踏まえれば、ゆうに当業者の技能の範囲内である。
【0190】
人間での使用に対する有効量は、動物モデルから決定することができる。例えば、人間の用量は、動物に効果が見出された循環中濃度および/または消化管内濃度を達成するように、処方することができる。
【0191】
医薬組成物は、ポリマー(例えば、架橋アミンポリマー)、1種以上の製薬的に受容できる担体、希釈剤や賦形剤、および必要に応じて追加される他の治療薬を含む。
【0192】
本発明に従って使用するための医薬組成物は、従来的手法により調剤することができる。すなわち、1種以上の、生理学的に受容できる担体(賦形剤と助剤を含む)を使用し、これらは、活性化合物を製薬分野で使用可能な製剤にする処理を容易にする。適切な調剤は、選択する投与経路によって異なる。アミンの医薬組成物調剤の適切なテクニックについては、当該分野で周知であり、例えばGennaro A R(ed),Remington’s Pharmaceutical Sciences,20th Edition,Lippincott,Williams and Wilkins,Baltimore Md.(2001)を参照されたい(全体が参考として本明細書中に援用される)。
【0193】
この医薬組成物は通常、周知かつ容易に入手可能な成分を用いて、公知の手順により調製される。本発明の組成物をつくるには、イオン結合性ポリマー(例えば、リン酸イオン結合性ポリマー)を単独使用、または担体に混合、または担体で希釈、または担体内(カプセル、サシェ、紙、その他の容器の形態であり得る)に封入され得る。担体が希釈剤としてはたらく場合は、担体は、ポリマーのビヒクル、賦形剤あるいは媒質としてはたらく、固体、準固体、または液体物質であり得る。よって、組成物は錠剤、丸剤、粉末、トロ
ーチ剤、サシェ剤、カシェ剤、エリキシル剤、懸濁液、シロップ、エアロゾル(固体または液体媒質)、ソフトまたはハードのゼラチンカプセル、滅菌パッケージ粉末、その他類似の形態にすることができる。好ましい製剤は、チュアブル錠剤と液体製剤である。この製剤その他に使用できる担体、賦形剤、希釈剤の例としては、食物、飲料、ラクトース、デキストロース、蔗糖、ソルビトール、マンニトール、澱粉、アラビアゴム、アルギン酸塩、トラガカントゴム、ゼラチン、ケイ酸カルシウム、微結晶性セルロース、ポリビニルピロリドン、セルロース、メチルセルロース、メチルヒドロキシベンゾエート類、プロピルヒドロキシベンゾエート類、プロピルヒドロキシベンゾエート類、タルクなどが挙げられる。
【0194】
本発明の他の態様において、陰イオン(例えば、リン酸イオン)結合ポリマーは、遊離アミンとして、対イオンなしで処方される。短期および長期研究によれば、Renagel(塩酸ポリアリルアミン)で治療を受けている維持血液透析患者は、カルシウム含有リン酸イオン結合剤(すなわち、塩化物は含まない)で治療を受けている患者に比べ、血清中の重炭酸イオンレベルが有意に低いことを示している。また、塩酸セベラマー(SEVELAMER)(Renagelの製薬有効成分の商品名)が酸の負荷を誘発し、アシドーシスを
起こすことが見出されている(Brezina B.et al,Kidney International,vo.66,suppl.90(2004),39−45)。アシドーシスは対象患者にとって深刻な副作用となり得る。別の実施態様において、アミン架橋ポリマーはポリアミンポリマーであり、ポリマーの塩化物含有量はアミン類の含有量の約40 mol%未満、より好ましくは約20 mol%未満、もっとより好ましくは約5 mol%未満である。ポリマーは実質的に無塩化物であることが最も好ましい。
【0195】
A.チュアブル錠剤
いくつかの実施態様において、本発明のポリマーは、チュアブル錠剤の形態における医薬組成物として提示される。
【0196】
現在、高リン酸血症などのイオンバランス異常障害の治療指導に患者が従うための、患者のコンプライアンスは、最大の制限要素のひとつとして認識されている。例えば、現在のリン酸イオン結合性ポリマー(RENAGELなど)を使用した高リン酸血症治療において、最近の調査によると、患者は平均で800mg丸剤を1日に9〜10錠服用しなければならず、患者の25%はさらに多く、1日に12〜15錠を服用しているという。Renagelは飲み込むことが可能な錠剤の形状になっており、錠剤を飲み込むのに必要なだけの水分とともに服用するようになっている。これが、水分を制限している末期腎不全患者にとっては負担の増加となる。服用量の多さによる患者コンプライアンスの低さは、この種類の薬剤の普及に明らかなインパクトを与える要素として突出している。
【0197】
もっと服用が簡単な製剤形態が望ましい。チュアブル錠剤によるドラッグデリバリーは、多くの場合において非常に利点が大きいが、感覚上の特性を満足させるのが困難であるため、製剤としての使用は限られている。錠剤を噛むときには、次のような感覚上のパラメータが重要である:砂っぽさ、歯の粘着性、粉っぽさ、口触り、全体的な口内感覚。
【0198】
現在のチュアブル錠剤は、かなりの量の有効成分を投与する必要がある場合に使用されることがほとんどで、ビタミンや制酸剤、緩下剤、鎮痛剤などの市販薬が含まれる。処方薬のチュアブル製品には、妊婦用ビタミンと、チュアブルの抗生物質・抗ウイルス薬で大量の用量の経口投与が必要なものが含まれる。チュアブル錠剤はしばしば大型であるが、咀嚼に適切な程度の噛みやすさと「歯ごたえ」を改善するため、外形の最適化が必要である。円形で角が面取りされた形が一般的で、高さ/直径の比は0.3〜0.4程度である。
【0199】
有効成分に加え、次のようなタイプの賦形剤が一般的に使用されている:必要な口内感覚を得るための甘味料、および、甘味料が錠剤の硬さのために充分でない場合は結合剤を追加;抜き型の壁の摩擦を抑え、錠剤を外れやすくするための滑沢剤;場合によっては咀嚼を容易にするために少量の崩壊剤が添加される。一般に、現在使用されているチュアブル錠剤の賦形剤濃度は、有効成分の3〜5倍のオーダーであり、甘味料が非有効成分の量のうち大半を占めている。
【0200】
イオン結合性ポリマーを含むチュアブル錠剤の設計において考慮すべき重要な点は、ポリマーの膨潤率である。本発明では低膨潤率のポリマーを提示しているため、チュアブル製剤に使用しても不快感がなく、高膨潤率ポリマーのチュアブル錠剤に付随する危険な副作用もない。高膨潤率で、経口投与すると窒息や食道閉塞の危険性も生じる可能性のある物質の例のひとつが、オオバコ種子である。オオバコ種子は、アジアの一部、ヨーロッパの地中海地域、北アフリカに生息する植物オオバコの種を粉砕したものであり、米国では緩下剤として広く使用されている。オオバコ種子は通常、35〜50倍に膨潤するため、大量の水分と共に摂取しなければならない。服用時に水の量が不十分だと、繊維が膨潤し、窒息、時には食道破裂を起こす危険性すらある。オオバコ種子は、嚥下困難および/または食道狭窄のある患者には禁忌である。
【0201】
本発明は、本発明のポリマーと、チュアブル錠剤の製剤に適した1種以上の製剤用賦形剤を含む、チュアブル錠剤を提供する。本発明のチュアブル錠剤に使用されているポリマーが、口腔内および食道内を移動する際の膨潤率は、約5未満、好ましくは約4未満、より好ましくは約3未満、さらに好ましくは約2.5未満、最も好ましくは約2未満である。いくつかの実施態様において、ポリマーは、リン酸イオン結合性ポリマーやシュウ酸イオン結合性ポリマーのような陰イオン結合性ポリマーであり、好ましい実施態様においては、このポリマーはリン酸イオン結合性ポリマーである。このポリマーと適切な賦形剤を含む錠剤は、口内触感、味、歯の粘着性などの感覚的特性が許容できる程度であり、同時に、噛んで唾液と接触しても食道を塞ぐ危険性がない。
【0202】
本発明のある面において、賦形剤の一般的なはたらきである機械的・熱的特性はポリマーがすでにもっているため、製剤に必要な賦形剤の量を減らすことができる。いくつかの実施態様において、有効成分(例えばポリマー、好ましくは陰イオン結合性ポリマー)は、チュアブル錠剤の重量の約30%以上、好ましくは約40%以上、より好ましくは約50%以上、最も好ましくは約60%以上を占め、残りが適切な賦形剤から成っている。いくつかの実施態様において、ポリマー(例えば陰イオン結合性ポリマー)は、錠剤の合計重量のうち約0.6g〜約2.0g、好ましくは約0.8g〜約1.6gを構成する。いくつかの実施態様において、ポリマー(例えば陰イオン結合性ポリマー)は、錠剤の約0.8g以上、好ましくは約1.2g以上、最も好ましくは約1.6g以上を占める。ポリマーは、適切な強度/脆さと粒子サイズを有するよう製造され、適切な硬さ、良好な口内触感、圧縮性など、従来の賦形剤の使用目的と同じ品質を提供する。本発明のチュアブル錠剤に使用されているポリマーの粒子サイズは、平均直径が約80ミクロン未満、70ミクロン未満、60ミクロン未満、50ミクロン未満、40ミクロン未満、30ミクロン未満、20ミクロン未満である。好ましい実施態様において、粒子サイズは約80ミクロン未満、好ましくは約60ミクロン未満、最も好ましくは約40ミクロン未満である。
【0203】
本発明のチュアブル錠剤に有用な製剤用賦形剤としては、結合剤(例えば、微結晶性セルロース、コロイド状シリカとその組合せ(Prosolv 90)、カーボポル、ポピドン(providon)、キサンタンガムなど)、矯味矯臭剤(例えば、蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトール)、滑沢剤(例えば、ステアリン酸マグネシウム、ステアリン酸、ステアリルフマル酸ナトリウム、植物性脂肪酸)、および必要に応じて崩壊剤(クロスカルメロースナトリウム、ゲランガム、セルロ
ースの低置換ヒドロキシプロピルエーテル、スターチグリコレートナトリウムなど)がある。その他の添加剤としては、成形剤、色素、タルクなどがある。添加剤およびその他の適切な成分については、この分野で周知であり、例えばGennaro A R(ed),Remington’s Pharmaceutical Sciences,20th Editionを参照されたい。
【0204】
いくつかの実施態様において、本発明は、リン酸イオン結合性ポリマーと適切な賦形剤を含むチュアブル錠剤として製剤される医薬組成物を提供する。いくつかの実施態様において、本発明は、リン酸イオン結合性ポリマーと増量剤、滑沢剤を含むチュアブル錠剤として製剤される医薬組成物を提供する。いくつかの実施態様において、本発明は、リン酸イオン結合性ポリマーと増量剤、滑沢剤を含むチュアブル錠剤として製剤される医薬組成物を提示し、ここで増量剤は蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトールの中から選び、滑沢剤はステアリン酸マグネシウムなどの脂肪酸マグネシウム塩である。
【0205】
錠剤は噛みやすく口内で分解するものであれば、どんな大きさ・形状でもよいが、好ましくは円柱形で直径約10〜約40mm、かつ高さ約2〜約10mm、最も好ましくは直径約22mm、かつ高さ約6mmである。
【0206】
いくつかの実施態様において、ポリマーの転移温度は約30℃以上で、好ましくは約50℃以上である。
【0207】
別の実施態様において、ポリマーは高Tg/高融点の低分子量賦形剤(例えばマンニトール、ソルボース、蔗糖)とあらかじめ配合しておき、ポリマーと賦形剤が完全に混合したソリッドな溶液を生成させる。押出し、スプレー乾燥、冷蔵乾燥、凍結乾燥、または湿潤顆粒形成などの混合方法が有用である。混合度の目安は、示差走査熱量計や、動的機械分析などの公知の物理的測定によって得られる。
【0208】
ポリマーをはじめとする製剤成分が含まれるチュアブル錠剤の製造方法は、当該分野で公知である。例えば、欧州特許申請No.EP373852A2および米国特許No.6,475,510や、Remington’s Pharmaceutical Sciencesを参照されたい。これら全体は、参照によってここに組み込まれる。
【0209】
B.液体製剤
いくつかの実施態様において、本発明のポリマーは、液体製剤の形態における医薬組成物として提示される。いくつかの実施態様において、医薬組成物は、イオン結合性ポリマーが適切な液体賦形剤中に分散した状態で含まれている。適切な液体賦形剤については、当該分野で公知であり、例えばRemington’s Pharmaceutical
Sciencesを参照されたい。
【0210】
IV.治療方法
本発明は、別の一態様において、イオンバランス異常障害の治療方法を提供する。本明細書中で使用される場合、「イオンバランス異常障害」とは、体内に存在するイオン濃度が異常である状態を指す。ある実施態様において、本発明はリン酸バランス異常障害の治療方法を提供する。本明細書中で使用される場合、「リン酸バランス異常障害」とは、体内に存在するリン酸濃度が異常である状態を指す。リン酸バランス異常のひとつの例が、高リン酸血症である。本明細書中で使用される場合、「高リン酸血症」とは、体内に存在するリン元素の濃度が高い状態を指す。通常、例えば血液中のリン酸レベルが約4.5mg/dL以上の場合、そして/あるいは例えば腎糸球体濾過率が約20%に減少している場合、たいていの場合、患者は、高リン酸血症と診断される。
【0211】
よって例えば、本発明は、動物に対し本発明のポリマーの有効量を投与することによって、動物から陰イオンを除去する方法を提供する。いくつかの実施態様において、ポリマーは、標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合する陰イオン結合性ポリマーであり、このポリマーは、次の特徴のうち少なくとも2つにより特徴付けられる:a)膨潤率は約5未満である、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの分子量の約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、ポリマーの標的陰イオンはリン酸イオンである。いくつかの実施態様において、リン酸イオンが消化管から除去される。いくつかの実施態様において、投与方法は経口投与である。いくつかの実施態様において、対象動物は、高リン酸血症、低カルシウム血症、甲状腺亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、および末期腎不全からなる群より選択される少なくとも1つ疾患を有している。いくつかの実施態様において、その動物とは人間である。本明細書中に記載されているポリマーはどれも、動物体内でのアニオン結合および/または動物におけるイオンバランス異常により生じる状態の治療において、役に立つ可能性がある。好ましい実施態様において、ポリマーは、次の特徴のうち少なくとも1つにより特徴付けられるリン酸イオン結合性ポリマーである:a)膨潤率は約5未満、好ましくは約2.5未満である、b)生理学的媒体中で測定されたゲル細孔体積分布において、約200より大きい分子量を有する非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%以下である、およびc)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、膨潤率は約2.8未満、または約2.7未満、または約2.6未満である。
【0212】
本発明の方法、組成物、キットで治療できる他の病気としては、低カルシウム血症、甲状腺亢進症、飢餓骨症候群、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、および軟組織(関節、肺、腎臓、結膜、および心筋組織を含む)の異所性石灰化などが挙げられる。また本発明は、上記疾患のいずれかの予防的治療を含め、末期腎不全および透析患者の治療に使用することができる。
【0213】
また、本明細書中に記載されているポリマーは、他の治療(例えばリン摂取量の食事制限、無機金属塩の透析、および/または他のポリマー樹脂などを使用するもの)の補助としても使用することができる。
【0214】
本発明の組成物は、消化管内から塩化物イオン、重炭酸イオン、鉄イオン、シュウ酸イオン、胆汁酸を除去するのにも役立つ。シュウ酸イオンを除去するポリマーは、腎臓結石の生成リスクが高くなるシュウ酸症(高シュウ酸血症)などの、シュウ酸イオンバランス異常障害の治療に用途が見出される。塩化物イオンを除去するポリマーは、例えばアシドーシス、胸焼け、酸逆流症、胃のむかつきや胃炎などの治療に用途が見出される。いくつかの実施態様において、本発明の組成物は、脂肪酸やビリルビン、その他関連物質の除去に役立つ。いくつかの実施態様では、タンパク質や核酸、ビタミン、細胞破片などの高分子量分子を結合・除去することができる。
【0215】
本発明は、動物治療のための方法、医薬組成物、キットを提供する。本明細書中で使用される場合、用語「動物」や「被験動物」とは、人間ならびに哺乳類を含む。本発明のひとつの実施態様は、本明細書中に記載されている架橋アミンポリマーの少なくとも1つの有効量を投与することによって動物の消化管内からリン酸イオンを除去する方法である。
【0216】
本明細書中で使用される用語「治療」および同等の用語は、治療効果や予防的効果の達
成が含まれる。治療効果とは、治療される疾患の根本的治癒、状態改善、または予防を意味する。例えば、高リン酸血症の患者における治療効果とは、高リン酸血症の根本的治癒または状態改善が含まれる。また治療効果は、元となっている疾患そのものはまだ残っていても、それに関連する生理学的症状の1つ以上を根本的に治癒、状態改善、または予防し、これにより患者の回復が見られるようにすることである。例えば、本明細書中に記載されている架橋アミンポリマーを腎不全および/または高リン酸血症を罹患する患者に投与すると、患者の血清リン酸濃度が下がるだけでなく、異所性石灰化や腎性骨形成異常など、腎不全および/または高リン酸血症と併発している他の疾患についても改善が見られる。予防的効果では例えば、高リン酸血症の診断がなされていなくとも、高リン酸血症を起こす高リスク患者や、高リン酸血症の生理学的症状が1つまたは複数出ている患者に、架橋アミンポリマーを投与することができる。例えば、本発明のポリマーは、高リン酸血症とは診断されていなくとも慢性腎臓病のある患者に投与することができる。
【0217】
動物におけるポリマー(例えば、架橋アミンポリマー)の投与量は、治療する疾患や投与経路、動物の身体的特徴などによって異なる。架橋アミンポリマーを用いたいくつかの実施態様において、治療および/または予防目的の架橋アミンポリマーの投与量は、約1g/日〜約30g/日の範囲となり得る。これらのポリマーは、食事と共に投与されるのが好ましい。ポリマーは1日1回、2回、3回のいずれかで投与できる。好ましい投与量の範囲は、約2g/日〜約20g/日であり、より好ましい投与量範囲は、約3g/日〜約7g/日である。本明細書中に記載されているポリマーの投与量は、約50g/日未満であり得、好ましくは約40g/日未満、より好ましくは約30g/日未満、さらに好ましくは約20g/日未満、最も好ましくは約10g/日未満である。
【0218】
好ましくは、治療および/または予防の目的で使用されるイオン結合性ポリマー(例えば、架橋アミンポリマー)は、単独で、あるいは本明細書中に記載されている医薬組成物の形で、投与できる。例えば、本発明の架橋アミンポリマーは、治療する症状によって、他の有効な医薬成分と共に投与することができる。共に投与できる薬剤の例としては、プロトンポンプ阻害剤、カルシウム様作用薬(例えば、cinacalcet)、ビタミンDおよびその類似体、リン酸イオン結合剤などがあるが、これらに限定されない。適切なリン酸イオン結合剤の例としては、炭酸アルミニウム、炭酸カルシウム、酢酸カルシウム(PhosLo)、炭酸ランタン(Fosrenol)、Renagelがあるが、これらに限定されない。共投与の際は、2つの薬剤を同じ投与形態で同時に投与することも、別々の投与形態で同時に投与することも、また別々の投与にすることもできる。例えば、高リン酸血症の治療には、高リン酸血症によって生じた低カルシウム血症の治療のために用いられるカルシウム塩を、架橋アミンポリマーと共に投与することができる。カルシウム塩とポリマーは同じ投与形態の中に一緒に製剤することができ、同時に投与することができる。また、カルシウム塩とポリマーは、両方の薬剤を別々の製剤にして、同時に投与することができる。また別の方法として、カルシウム塩の投与後にポリマーを投与、またはその逆の順で投与することができる。別の投与プロトコルでは、ポリマーとカルシウム塩の投与は数分間、数時間、数日間の間をおいて投与することができる。
【0219】
ポリマーは注射、局所、経口、経皮、直腸を経由して投与することができる。好ましくは、ポリマー、および/またはポリマーを含む医薬組成物は経口投与される。ポリマーを投与する経口剤の形態には、粉末、錠剤、カプセル、溶液、または乳剤がある。有効量を1用量で投与することもできれば、適切な時間間隔(例えば数時間)をおいて、用量を何回かに分けて投与することもできる。
【0220】
本発明では、廃水に本発明の陰イオン結合性ポリマーを接触させることにより、廃水由来のアニオン汚染物質を除去する方法が提示される。ここでアニオン汚染物質(例えばリン酸イオン)は、ポリマーに吸着される。
【0221】
V.キット
本発明は、別の一態様において、陰イオンバランス異常障害の治療(例えばリン酸イオンバランス異常障害の治療など)のためのキットを提供する。このキットは、本明細書中に記載されているポリマーと、本明細書中に記載されているさまざまな方法やアプローチに従ってキットの使用方法を指導する説明書を含む。このキットには、科学的な参照文献や同梱資料、臨床試験結果、および/またはその要約など、この組成物の活性や利点を示すか、または確立する情報も含まれていることがある。この情報は、例えば、in vivoモデルを用いた実験動物使用の研究や、人間の臨床試験に基づく研究など、さまざまな研究結果に基づいている。本明細書中に記載されているキットは、医師や看護師、薬剤師、処方担当者などの医療従事者を対象に、提供、販売、および/または宣伝することができる。美容用キットは、消費者向けに直接提供、販売、および/または宣伝することができる。
【0222】
この特許明細書中に言及されている刊行物および特許出願はすべて、個々の刊行物または特許出願が具体的かつ個別に参考として援用されることが記述されるのと同程度に、参考として本明細書中に援用される。
【0223】
添付の特許請求の範囲の趣旨あるいは範囲から外れることなく、本明細書中に提示されている開示に対し、さまざまな変更および修飾ができることは、当業者にとっては明らかである。
【実施例】
【0224】
(実施例1: リン酸イオン結合測定プロトコル)
この実施例では、ポリマーにおける陰イオン(この場合はリン酸イオン)の結合能を測定するさまざまな手順を説明する。
【0225】
(非干渉性緩衝液中のリン酸イオン結合能の測定)
重量P(g)の等分した乾燥ポリマーを、次記の一定量V(L)の緩衝液(20mM H3PO4、80mM NaCl、100mM MESナトリウム塩(モルホリノエタンスルホン酸)、pH 6.5)に、穏やかに攪拌しながら、混合した。単一の結合測定の場合は、前記の緩衝液が使用された。複数の測定が実施される場合(結合等温曲線をプロットするためなど)は、緩衝液のリン酸イオン濃度を変更した。最初のリン酸イオン濃度はPstart(mM)と記される。この溶液は、他にポリマー樹脂との結合をリン酸イオンと競合する溶質が存在しないため、非干渉性緩衝液ということができる。樹脂が平衡に達した後、溶液を遠心分離器にかけて上澄みを別容器に移し、上澄み中の残存リン酸濃度Peq(mM)をイオンクロマトグラフィーで分析した。結合能を、V*(Pstart−Peq)/Pとして計算した(単位はmmol/g)。各ポリマーについての値が表に記載されている。
【0226】
(胃腸内模擬液における結合能)
この手順を、消化器官内におけるリン酸イオン結合性ポリマー使用の条件を模して、他の代謝産物(競合溶質)が存在する中でリン酸イオン(標的溶質)に対するポリマーの結合特性を測定するためにデザインした。流動食を、ペプシンおよび膵液の存在下で人工的に消化し、胃腸内模擬液とした。消化プロセスを空腸レベルまで模するよう、酵素の追加の順序とpH条件を制御した。
【0227】
次の成分を1つずつ、次の順序で加えた: 粉末ミルク291g、Beneprotein 72.8g、デキストロース152g、ポリコース156g、NaCl 17.6gを、約2.5LのddH2Oに加え、溶解させた(泡ができないようにして、よく攪拌
)。NaClが溶けた後、コーン油240gを加えた。ddH2Oを加えて、体積を4Lに調節した。この混合液を2時間、激しく攪拌した。この時点でpHは約6.4であった。次に3M HClを153ml、1滴ずつ加えて、最終pHを2.0とした(約150ml)。この混合液を15分間攪拌した後、pHは約2.1まで上昇した。次に10mM
HCl中のペプシン800mlを加えて、最終濃度を1mg/mlとした。この混合液をRTで30分間攪拌した後、pHは約2.3となった。次に100mM NaHCO3中のパンクレアチンおよび胆汁酸塩のストック溶液5L(pH8.4)を加え、最終濃度がパンクレアチン0.3mg/ml、胆汁酸塩2mg/mlとした。この混合液を室温で120分間攪拌した後、pHは約6.5となった。この食事模擬液を−80℃で保存し、1ヶ月以内に使用した。
【0228】
胃腸内模擬液の一部を遠心分離し、上澄みについてリン酸イオン量を分析した。リン酸イオン結合試験については、溶液として胃腸内模擬液を使用する他は、上記の非干渉性緩衝液中と同様に行った。
【0229】
(体外吸引物における結合能)
健康な患者に、上記の胃腸内模擬液と同じ組成の食事を与え、小腸内に挿管したチューブを使用して、糜粥の一部を採取した。
【0230】
1本の二重管ポリビニル製チューブの端に水銀おもりをつけてチューブを動きやすくし、被験者の小腸内に収まるように挿管した。X線検査を利用して、配置の方向を調節し、二重管チューブの吸引用開口部のひとつを胃の中に、もうひとつをトライツ靱帯(上部空腸)に置いた。
【0231】
チューブの位置を正しくしたら、流動化した試験食550mL(マーカーとしてポリエチレングリコール(PEG)2g/550mLを添加)を、胃中の開口部を通して22mL/分の速度で胃に注入した。この流動食が全部胃に達するまでに約25分間かかった。これは、通常の食事にかかる時間を模している。
【0232】
チューブ(その管腔はトライツ靱帯にある)から、空腸糜粥を吸引した。この液体は、計2時間半、30分区切りで、その間中連続的に採取した。これによって得られた5つの検体を混合し、体積を測定し、凍結乾燥した。
【0233】
この体外吸引物について、リン酸イオン結合試験を実施した。リン酸イオン結合試験の手順は、溶液に体外吸引物(凍結乾燥したサンプルに適切な量の脱イオン水を加えて再構成したもの)を使用する他は、上記の非干渉性緩衝液中と同様に行った。体外吸引物におけるリン酸イオン結合能を、胃腸内模擬液の実験と同様にして算出した。
【0234】
(実施例2:バルク溶液プロセスで生成された架橋ポリマーのライブラリと、そのリン酸イオン結合能)
(ポリマーライブラリの生成)
以降の5つの実施例はそれぞれ、最大24の架橋ポリマーを含むライブラリである。ポリマーを、4×6のアレー形式に配置されたバッチ反応器で製造した。各反応器は容量が350μLまたは3mlであり、磁石で攪拌し、温度管理が行われた。典型的な手順では、アミン、架橋剤、溶媒、さらにオプションとして塩基を、自動機械を用いて各反応器に分配し、この際にオプションとして攪拌をしながら行った。反応器を密封し、指定の温度で15時間加熱した。反応器アレーを外し、架橋ポリマーの固体をガラス製バイアルに移し、すり潰し、脱イオン水で何回か洗い、凍結乾燥した。下の表3に、対応する製造時反応条件と共に、5つのライブラリを示す。
【0235】
【化37】

(非干渉性緩衝液中のリン酸イオン結合能の測定)
リン酸イオン結合能を、ライブラリの各ポリマーについても測定した。手順については実施例1を参照されたい。
【0236】
(結果)
表4〜8に、5つのライブラリそれぞれのポリマー製造に使用された材料とその量、およびその製造されたポリマーについて測定された、非干渉性緩衝液中でのリン酸結合能を示す。データは、各反応ウェル中で使用された化合物の量(mg単位)と、得られたポリマーゲルのリン酸イオン結合能を示す(空白は、その特定の反応で架橋ゲルが生成されなかったことを示す)。
【0237】
【化38】

【0238】
【化39】

【0239】
【化40】

【0240】
【化41】

【0241】
【化42】

(実施例3: 懸濁液プロセスによる1,3−ジアミノプロパン/エピクロロヒドリン架橋ビーズの合成)
四面バッフル付きの三口丸底フラスコを含む容量3リットルの反応容器を使用した。この反応フラスコにはオイルバス、冷水環流凝縮装置、3インチプロペラつきの機械スターラーを装備した。この反応容器に、1,3−ジアミノプロパン(90.2g、1.21モル)を90.2gの水に溶解した溶液を入れ、界面活性剤(分枝型ドデシルベンゼンスル
ホン酸ナトリウム塩6.4gを100gの水に溶解)と1kgのトルエンを加えた。この最初の投入溶液を600rpmで2分間攪拌し、300rpmに落としてさらに10分間攪拌してから、エピクロロヒドリンを追加した。以降は、実験中ずっと300rpmの速度を維持した。この溶液を80℃に加熱し、以降は実験中ずっとこの温度を維持した。
【0242】
別の容器に、エピクロロヒドリンが40wt%のトルエン溶液を調製した。最初の投入溶液を入れた反応容器に、シリンジポンプを使って、エピクロロヒドリン1.2当量(134.7g(1.45モル))を3時間かけて加えた。さらに2時間反応させてから、40wt%溶液中の0.75当量の水酸化ナトリウム(36.5g(0.91モル))を加えた。水酸化ナトリウム溶液を、シリンジポンプを用いて2.5時間かけて反応溶液に加えた。この反応をさらに8時間、80℃に保った。
【0243】
この後、トルエンを除去し、1000mlのアセトンで洗い、次にメタノールで洗い、20%NaOH溶液で洗い(界面活性剤を除去するため)、さらに2回、脱イオン水で洗うことで、生成したビーズを精製した。ビーズを3日間凍結乾燥して、160g(収率92%)の白い微粉末を得、平均直径は93μmであった。
【0244】
(実施例4: 1,3−ジアミノプロパン/1,3−ジクロロプロパン架橋ポリマーの合成)
溶媒として水を使用し、20mLのシンチレーションバイアル中で、B−SM−22−DA 1000mgを、X−Cl−3 1524mgおよび水2524mgと混合した。マグネチックスターラーで混ぜながら一晩80℃に保持し、さらに2時間、90℃に保持して反応させた。反応混合物の34wt%(1716mg)を精製し、水洗い/遠心分離の手順を3回行い、この実施例のポリマー粉末144.7mgを得た。
【0245】
(実施例5: 1,3−ジアミノプロパン/1,3−ジクロロプロパン架橋ポリマーの合成)
溶媒として水を使用し、20mLのシンチレーションバイアル中で、B−SM−22−DA 2000mgを、X−Cl−3 3048mgおよび水5048mgと混合した。マグネチックスターラーで混ぜながら一晩80℃に保持し、反応させた。
【0246】
3時間反応させた後、この反応中に生成した酸(使用した架橋剤はアルキルハライドであるため)を除去するためにNaOHの30wt%水溶液3597mgを加えた。反応混合物の20.3wt%(2,773.5mg)を精製し、水洗い/遠心分離の手順を3回行い、この実施例のポリマー粉末591.3mgを得た。
【0247】
(実施例6: プレポリマーアプローチを用いた、1,3−ジアミノプロパン /1,3−ジクロロプロパンによる架橋ビーズの合成)
(プレポリマーの生成)
反応容器に250mLの二口丸底フラスコを用い、冷水環流凝縮装置、マグネチックスターラーを装備し、アルゴン雰囲気中で実施した。この反応容器に、1,3−ジアミノプロパン(31.15g、0.42モル)を水30.15gに溶かした溶液を入れた。この最初の溶液を300rpmで攪拌した。この溶液を80℃に加熱し、以降は実験中ずっとこの温度を維持した。シリンジポンプを使って、1,3−ジクロロプロパン(Aldrich 99%)1当量(47.47g、40.0mL、0.42モル)を2時間かけて加えた。さらに2時間反応させてから、10mol%(1,3−ジアミノプロパンに対して)の水酸化ナトリウム(NaOH 1.68g(0.042モル)の40wt%水溶液)を加えた。水酸化ナトリウム溶液は、ピペットを用い、2分間かけて反応溶液に加えた。この反応をさらに4時間、80℃に保った。この溶液は80℃で粘性をもち、25℃に冷めると固形になり、これは水に簡単に溶ける。
【0248】
(精製)
できた固形物に水を加え、水 200mlとMeOH 200mlで洗う。1LのビーカーにMeOH/イソプロピルアルコールの50/50溶液を入れておき、洗った固形物をビーカーに入れる。白いポリマーが沈殿する。この懸濁液を遠心分離にかけ、上澄み液を除去する。イソプロピルアルコールを用いて、このプロセスをあと2回繰り返す。白い沈殿物を室温減圧下で乾燥させ、イソプロピルアルコールを除去する。分離されたポリマーの重量:Mn(ポリエチレンイミン標準に対するGPC)は約600。
【0249】
(架橋粒子の合成)
フラスコに、白いプレポリマー(8.7g)を、分枝状ドデシルベンゼンスルホン酸ナトリウム塩1.3g(30wt%水溶液)およびトルエン34.8gと共に入れた。これにより、トルエン中にポリマーが懸濁した20wt%溶液が得られた。ポリマーを、グラインダー機械でミクロンサイズの粒子にすり潰した(ブランド: IKA、モデル: Ultra−Turax T8)。得られた懸濁液2.2gを、10mLの反応フラスコに移した。フラスコにはヒーター、機械スターラー、シリンジポンプが装備されている。反応フラスコに、追加のトルエン3779mgを入れた。フラスコを80℃に加熱し、スターラーを使用した(500RPM)。この温度で3時間攪拌した後、エピクロロヒドリン112.2mg(0.0012モル)を、1.5時間かけて加えた。さらに2時間反応させてから、水酸化ナトリウム(40wt%水溶液)224.4mg(0.0056mol)を、2時間かけて追加した。これを室温に冷まし、攪拌を止めた。生成したビーズを、トルエンを除去し、メタノールで洗い、20%NaOH溶液で洗い(界面活性剤を除去するため)、さらに2回、脱イオン水で洗うことにより精製した。そのビーズを3日間冷凍乾燥して、白い微粉末を得た。非干渉性緩衝液中で測定した結合能は3.85mmol/gであった。
【0250】
(実施例7: 1,3−ジアミノプロパン/1,3−ジクロロプロパンにより調製される低分子量ポリマー(プレポリマー)1の合成と分離)
以降の実施例では、次の略語が用いられる:
エピクロロヒドリン: ECH
N,N,N’,N’−テトラキス(3−アミノプロピル) 1,4−ジアミノブタン:
BTA
BC: 結合能
この実施例では、反応混合物中のモノマー(ここではプレポリマー)対溶媒の比率の変化による、結合能と膨潤率への影響を示した。この実施例で説明するプロセスは、2つの部分に分かれる:第一は、1,3−ジアミノプロパンと1,3−ジクロロプロパンからの溶解性プレポリマー付加生成物の合成、第二は、ECHによるプレポリマーの架橋による不溶性ビーズの生成である。第二の反応は、水対プレポリマーの比を変えた逆懸濁プロセスからなった。この変化による、結合能力と膨潤への影響を評価した。
【0251】
(プレポリマーの合成)
ステップ1(プレポリマーの生成): 反応容器に250mLの二口丸底フラスコを用い、冷水環流凝縮装置、マグネチックスターラーを装備し、アルゴン雰囲気中で実施した。この反応容器に、1,3−ジアミノプロパン(31.15g、0.42モル)を水30.15gに溶かした溶液を入れた。この最初の溶液を300rpmで攪拌した。この溶液を80℃に加熱し、以降は実験中ずっとこの温度を維持した。シリンジポンプを使って、1,3−ジクロロプロパン(Aldrich 99%)1当量(47.47g、40.0mL、0.42モル)を、2時間かけて加えた。さらに2時間反応させてから、10mol%(1,3−ジアミノプロパンに対して)の水酸化ナトリウム(NaOH 1.68g(0.042モル)の40wt%水溶液)を加えた。この水酸化ナトリウム溶液を、ピペ
ットを用いて、2分間かけて反応溶液に加えた。この反応をさらに4時間、80℃に保った。この溶液は80℃で粘性をもち、25℃に冷めると固形になり、これは水に簡単に溶けた。
【0252】
ステップ2(精製):できた固形物に水を加え、水 200mlとMeOH 200mlで洗った。1LのビーカーにMeOH/イソプロピルアルコールの50/50溶液を入れておき、洗った固形物をビーカーに入れた。白いポリマーが沈殿した。遠心分離にかけ、上澄み液を除去した。イソプロピルアルコールを用いて、このプロセスをあと2回繰り返した。白い沈殿物を室温減圧下で乾燥させ、イソプロピルアルコールを除去した。分離されたポリマーの分子量: Mn(ポリエチレンイミン標準に対するGPC) は約600。
【0253】
半連続24ウェル平行重合反応器での1,3−ジアミノプロパン/1,3−ジクロロプロパンプレポリマーにより調製されるミクロンサイズの架橋粒子の合成。
【0254】
フラスコに、白いプレポリマー1(8.7g)を、分枝状ドデシルベンゼンスルホン酸ナトリウム塩1.3g(30wt%水溶液)およびトルエン34.8gと共に入れた。これにより、トルエン中にポリマーが懸濁した20wt%溶液が得られた。乳化液を、高剪断ホモジナイザーでミクロンサイズの液粒にすり潰した(ブランド: IKA、モデル:
Ultra−Turax T8)。得られた乳化液2.2gを、10mLの反応フラスコ24本に移した。フラスコにはヒーター、機械スターラー、シリンジポンプが装備されている。各反応フラスコに、追加のトルエン3779mgを入れた。フラスコを80℃に加熱し、スターラーを使用した(500RPM)。プレポリマー対水の比がさまざまになるように、必要なだけの水を各管に追加した。この温度で3時間攪拌した後、望ましい量のエピクロロヒドリン(この実施例では、エピクロロヒドリンをプレポリマー乾燥重量の20%に相当する量を加えた)を1.5時間かけて加えた。さらに2時間反応させてから、水酸化ナトリウム(40wt%水溶液)224.4mg(0.0056mol)を、2時間かけて追加した。これを室温に冷まし、攪拌を止めた。ビーズを、トルエンを除去し、メタノールで洗い、20%NaOH溶液で洗う(界面活性剤を除去するため)ことによって精製し、次にHClで洗ってビーズをプロトン化した。次にビーズを脱イオン水で2回洗って、余分のHClを除去した。ビーズを3日間凍結乾燥して、白い微粉末を得た。
【0255】
こうして合成されたポリマービーズについて、非干渉性緩衝液中と胃腸内模擬液中の結合能(BC)、および膨潤率の分析を行った。この結果を表9にまとめる。
【0256】
(表9: 1,3−ジアミノプロパン/1,3−ジクロロプロパン/ECHゲルビーズ。モノマー対水の比率の、結合容量および膨潤率に対する影響)
【0257】
【化43】

モノマー対水の比率が増加すると、非干渉性緩衝液および胃腸内模擬液の両方において、結合能が増加し、その一方で膨潤率は低下し、望ましい範囲に達することを示す。
【0258】
(実施例8: 24ウェル平行重合反応器を用いた、すり潰したBTA/ECHバルクゲルによるミクロンサイズの架橋粒子の製造)
この実施例では、架橋剤対モノマーの量の比率の変化による、結合能と膨潤率への影響を示す。
【0259】
次のストック溶液を調製した:2モル当量の濃塩酸を、1モル当量のBTAに2時間かけて加えた。次に、この溶液に水を加えて、得られる溶液が、BTA 45wt%、HCl 10wt%、水 45wt%の重量%組成となるようにした。5mLフラスコを使用した24ウェル反応器の各フラスコに、この調製したストック溶液0.6gを入れた。テストをするモノマー対架橋剤の比率にするために望ましい量のエピクロロヒドリンを各バイアルに加えた。反応器を80℃で9時間加熱した。その後、冷ました。各バイアルに水を加え、生成したゲルを膨潤させた。次にゲルを、高剪断ホモジナイザーでミクロンサイズの粒子にすり潰した (ブランド: IKA、モデル: Ultra−Turax T8)。この粒子から、水を除去し、メタノールで洗い、20%NaOH溶液で洗うことにより精製し、次にHClで洗って、アミン官能化粒子をプロトン化した。次に粒子を脱イオン水で2回洗って、余分のHClを除去した。粒子を3日間凍結乾燥して、白い微粉末を得た。
【0260】
結合能と膨潤率検討の結果を表10にまとめる。
【0261】
(表10:BTA/ECH ゲル:架橋剤含有量に対する膨潤率と結合能のデータ。バルクゲル(水に対するモノマーの比率は、75wt% Bow−Tie(2HCl)水溶液)。水に対するモノマーの比率は、3.5(ECH:BTA=0.85)〜4.8(ECH:BTA=6.4)の範囲である)
【0262】
【化44】

【0263】
【化45】

このデータにより、胃腸内模擬液における結合能は、架橋剤の比率を変えていく途中に最大値があることがわかる。この特定のシステムにおいては、胃腸内模擬液において、最適の結合能は、架橋剤比率が1.8〜2.8のときであることが認められる。このとき対応するNC値はそれぞれ3.6〜5.6である。その架橋の範囲内では、膨潤率は充分小さい。この重合プロトコルを使用して、他のモノマーや架橋剤についても同様の実験を通常通り行って、ポリマーを使用する特定用途のために望ましい結果を得るような比率を決定することができる。
【0264】
(実施例9: 逆懸濁によるミクロンサイズの架橋BTA/ECHビーズの合成)
次のストック溶液を調製した: 2モル当量の濃塩酸を1モル当量のBTAに2時間かけて加えた。水と界面活性剤(分枝状ドデシルベンゼンスルホン酸ナトリウム塩30wt%水溶液)をこの溶液に加えて、得られた溶液が、BTA 41.8wt%、HCl 9.4wt%、水 41.1wt%、界面活性剤(30wt%水溶液) 7.7wt%の重量%組成となるようにした。
【0265】
反応容器には四面バッフル付きの0.25リットル三口丸底フラスコを使用し、オイルバス、冷水環流凝縮装置、1インチプロペラつきの機械スターラーを装備した。この反応容器に、調製ストック溶液25gとトルエン75gを入れた。
【0266】
別の容器に、エピクロロヒドリンが40wt%のトルエン溶液を調製した。シリンジポンプを使用して、ECHを所望量だけ、90分間かけて加えた。さらに2時間反応させてから、ディーンスターク装置を使用して脱水を開始した。系から水がすべて除去されたときに、反応が完了した。生成したビーズからトルエンを除去し、メタノールで洗い、20%NaOH溶液で洗い (界面活性剤を除去するため)、次にHClで洗ってビーズをプロトン化した。次にビーズを脱イオン水で2回洗って、余分のHClを除去した。ビーズは3日間冷凍乾燥して、白い微粉末を得た。
【0267】
結合能と膨潤率の結果を表11にまとめる。
【0268】
(表11:BTA/ECH ゲルビーズ:架橋剤含有量に対する膨潤率と結合能)
【0269】
【化46】

この結果により、胃腸内模擬液における結合能は、アミンに対する架橋剤の比率を変えていく途中に最大値があることがわかる。この特定のシステムにおいては、胃腸内模擬液における最適な結合能は、架橋剤比率が1.75〜3のときであることが認められる。このとき対応するNC値はそれぞれ3.5〜6である。その架橋の範囲内では、膨潤率は充分小さい。この重合プロトコルを使用して、他のモノマーや架橋剤についても同様の実験を通常通り行って、ポリマーを使用する特定用途のために望ましい結果を得るような比率を決定することができる。
【0270】
(実施例10: 24ウェル平行重合反応器を用いたすり潰したポリアリルアミン/ECHバルクゲルによるミクロンサイズの架橋粒子の合成)
この実施例は、反応混合液中で水に対するモノマーの比率を変えた、高分子量モノマーを使用したポリマーの合成について示す。使用した条件は実施例8と同じであるが、BTAの代わりにポリアリルアミン(Mw=60,000g/モル)を用いた。ECH対アリルアミンの繰り返し単位は、1:0.106(NC2.2に対応)であった。水に対するポリアリルアミンの初期比率を1:1〜1:4に変えた。比較例として、Renagel錠剤から分離した架橋ポリアリルアミンを使用した。
【0271】
【化47】

これらのデータから、水に対するアミンの比率が高くなるにつれて、膨潤率が低くなり、これに伴って胃腸内模擬液における結合能が高くなっていることがわかる。この重合プロトコルを使用して、他のモノマーや架橋剤についても同様の実験を通常通り行うと、ポリマーを使用する特定用途のために望ましい結果を得るような比率を決定することができる。
【0272】
(実施例11: 結合干渉レベルの測定)
この実施例では、本発明のポリマーと、比較のために先行技術のポリマーについて、結合干渉率を測定する。架橋ポリアミン材料(EC172A)は、実施例4に記載されているプロトコルに従って、BTA:ECHモル比が2.5、水に対する(BTA+ECH)の比率が1.73として調製した。結合干渉率をRenagelと比較した。
【0273】
本明細書で使用される場合、「結合干渉率」または「結合干渉」とは、非干渉性(NI)の緩衝液中での結合実験と胃腸内模擬液(GI)での結合実験との間で認められる、平
衡状態にある同じ標的陰イオン濃度において標的イオンの結合能が部分的に低下する度合で表わす。非干渉性緩衝液中の結合等温曲線を、まず、さまざまなリン酸イオン濃度について、平衡時の結合能対リン酸イオン濃度をプロットすることによって得た。次に、この等温曲線を指数関数に当てはめて、任意のリン酸イオン濃度での結合能を予測した(予測BC)。胃腸内模擬液中で測定された結合能(BC)も、同じ等温曲線に基づいて報告し、胃腸内模擬液について平衡時のリン酸イオン濃度対リン酸イオン結合の点をプロットし、この点を通る垂線を書き、非干渉性等温曲線と交わるところまで伸ばした。ここで、阻害率は、(BCNI−BCGI)/BCNI*100として計算した。
【0274】
EC127Aの結合干渉は下の表および図3に示されている。
【0275】
【化48】

RENAGELの結合干渉は下の表および図4に示されている。
【0276】
【化49】

EC172A の結合干渉は、RENAGELよりも約34%低い。
【0277】
(実施例12: 人間の体外吸引物におけるイオン結合特性)
架橋ポリアミン材料(EC172A)を、実施例4に記載されている手順に従って、BTA:ECHモル比が2.5、水に対する(BTA+ECH)の比率を1.73として調製した。次に、実施例1の説明に従って採取された人間の体外吸引物におけるリン酸イオン結合のテストを行った。
【0278】
EC172Aのリン酸イオン結合を、Renagel(Genzyme)から分離された活性薬剤の架橋ポリアリルアミンのリン酸イオン結合と比較した。EC172Aは、ずっと低い阻害率を示し、ずっと低い膨潤率を示した(Renagelが9に対し、EC172Aは2.5)。
【0279】
【化50】

別の実験において、EC172AとRenagelの両方を、別途に人間の体外吸引物に使用して、クエン酸陰イオンや胆汁酸などの競合溶質により生じた、リン酸イオン結合の阻害率を定量化した。クエン酸陰イオンはイオンクロマトグラフィーで、胆汁酸は酵素分析によって滴定が行われた。下記のデータ(6人の志願者の平均)では、本発明のポリマーは選択性がはるかに良好で、全体的なリン酸イオン結合もずっと高い値を示す。
【0280】
【化51】

(実施例13: 溶質分配テクニックを使用したゲル細孔度測定)
この実施例では、ゲル細孔度の測定を説明する。本発明のポリマーと、比較のために市販されているリン酸イオン結合性ポリマーについて測定を行った。本発明のポリマーとして、架橋ポリアミン(EC172A)を用い、実施例10に記載されているプロトコルに従って、BTA:ECHモル比が2.5、水に対する(BTA+ECH)の比率が1.73として調製した。比較のため、Renagelについて同じ細孔度測定が行われた。
【0281】
プローブは、分子量200〜20,000Daのポリエチレングリコール(PEG)8種と、4種のポリエチレンオキシド(PEO)(30,000〜230,000Da)であった。
【0282】
プローブはすべて、pH5.5の30mM酢酸アンモニウム緩衝液(濃度5g/L)に溶かした。このプローブ溶液を、予め計量したEC172A HCl洗浄液(5mL/g)とRenagel HCl洗浄液(15mL/g 乾燥ゲル)に加え、Vortexerで4日間振盪した。
【0283】
プローブ溶液を10倍に希釈してから、Polymer Labエバポレイティブ光散乱検出器を用いてLC分析を行った(ピーク面積の比率が重量濃度比率に等しくなるよう、検出器の直線範囲内におさまるようにする)。
【0284】
接触不能体積の算出=msw+[1−cbefore/cafter]msolv;ここで
msw:ゲルが取り込んでいる水の量[g/g 乾燥ゲル]
msolv:プローブを最初に溶かした水の量[g/g 乾燥ゲル]
cbeforeおよびcafter:平衡に達する前および達した後のプローブ濃
度。比率cbefore/cafterは、LC分析で得られたピーク面積の比率に等しい。
【0285】
比較例の結果を図5および図6に示す。図5は分子量に関しての結果、図6は溶質のサイズに関しての結果を示す。EC172Aは、分子量200まで、一定の溶質分子排除を示している。これに対してRenagelは、分子量が1000程度で排除が減少している。
【0286】
(実施例14: 塩酸クロロプロピルアミンによるビーズの製造後改変)
ストック溶液の調製:
・水溶液(50wt%)中での塩酸クロロプロピルアミン(B−SM−34−A)−d=1.132
・水酸化ナトリウム30wt%水溶液(50wt%溶液を希釈)−d=1.335
合成:
実施例9に従ってBTA:ECHモル比が2.5、水に対する(BTA+ECH)の比率が1.73で調製されたリン酸イオン結合性ポリマーFR−0005−144を基質として、さらにアミノ化を行った。FR−0005−144ビーズを4mLバイアル(各21バイアルがある4×6プレート2枚)に入れ、液体注入ロボットを用いて、水、塩酸クロロプロピルアミンのストック溶液、水酸化ナトリウムのストック溶液を加えた。バイアルにキャップをして密封し、プレートを加熱機器と個別スターラーを装備した反応器にセットした。
【0287】
12時間、加熱と攪拌を行った:反応器の温度は85℃に設定し、攪拌速度は1200rpmとした。
【0288】
精製:
各物質を使い捨ての培養管(16×100mm)に移し、メタノールで1回洗い、1M塩酸で2回洗い、水で3回洗った。ビーズは毎回、遠心分離器で分離した。
【0289】
これらのビーズを凍結乾燥にかけ、消化食物(DM)スクリーン、非阻害緩衝液スクリーン、膨潤率について分析を行った。この結果を表12および図7に示す。
【0290】
(表12:塩酸クロロプロピルアミンで製造後改変したビーズのポリマー特性)
【0291】
【化52】

【0292】
【化53】

(実施例15: N,N’(テトラ−3−アミノプロピル)1,4−ジアミノブタン/エピクロロヒドリンからのリン酸イオンテンプレート使用ミクロンサイズ架橋粒子の合成)
次のストック溶液を調製した: 1モル当量のリン酸(Aldrich、85wt%水溶液)を、1モル当量のN,N’(テトラ−3−アミノプロピル)1,4−ジアミノブタンに、2時間かけて加えた。次に、この溶液に水を加えて、得られる溶液が、N,N’(テトラ−3−アミノプロピル)1,4−ジアミノブタン 42wt%、H3PO4 13wt%、水 45wt%の重量%組成となるようにした。反応器は、5mLフラスコを使用した24ウェルのものを用い、各フラスコにマグネチックスターラーを入れた。各フラスコに、調製したストック溶液0.6〜0.7gを入れた。スターラーを作動させた。エピクロロヒドリンの望ましい量を、原液で各バイアルに加えた。この反応器を60℃で1時間加熱し、その後80℃で8時間加熱した。その後、反応器を冷ました。各バイアルに水を加え、得られたゲルを膨潤させた。このゲルを、10mL試験管が並んだ4×6プレートに移した。このゲルを、グラインダー機械でミクロンサイズの粒子にすり潰した(ブランド:IKA Ultra−Turax T8)。この粒子を、水を除去し、メタノールで洗い、さらに20% NaOH溶液で洗うことによって精製した。次にゲル粒子を1.0モルのHClで洗い、30分間混ぜてから静置し、上澄みを除いた。このプロセスを5回繰り返すことによって、アミン官能化粒子を塩酸でプロトン化し、結合したH3PO4を置換した。ゲル粒子は次に20%NaOH溶液で洗い、アミン官能化ゲル粒子を脱プロトン化した。次にゲル粒子を脱イオン水で2回洗って、余分のNaOH/NaClを除去した。ゲル粒子を3日間凍結乾燥して、白い微粉末を得た。この合成結果を表13にまとめる。
【0293】
(表13:リン酸で分子インプリントされたゲルの合成。ID 102776)
【0294】
【化54】

上記のように合成されたポリマーは、リン酸イオンと結合する。
【0295】
本発明の好ましい実施態様を本明細書中で示し、記載してきたが、これらの実施態様はあくまで例として提示されていることは、当業者にとって明らかである。当業者は、本発明から乖離することなく、さまざまな応用、変更、置換を想起する。本明細書に記載されている本発明の実施態様に対するさまざまな変更は、本発明の実施にあたって用いられ得ることを理解すべきである。次記の特許請求の範囲は、本発明の範囲を定義するものであり、これらの請求項の範囲内の方法および構造、ならびにこれらの均等物が、これらの請求項によって包含されると解釈される。
【図面の簡単な説明】
【0296】
【図1】図1は、非干渉性緩衝液中での標的イオンとポリマーの結合と、干渉性媒質(胃腸内模擬液や体外吸引物など)中での標的イオンとポリマーの結合の等温曲線を比較することによる、結合干渉率の測定を図示するグラフである。
【図2】図2は、プローブ溶質半径に対するゲルの利用付加体積を図示するグラフである。
【図3】図3は、リン酸イオン結合性ポリマー(EC172A)の結合干渉の測定を示すグラフである。
【図4】図4は、リン酸イオン結合性ポリマー(RENAGEL)の結合干渉の測定を示すグラフである。
【図5】図5は、非反応性プローブについての、プローブ分子量に対する利用付加体積のプロットであって、本発明のリン酸イオン結合性ポリマー(EC 172A)と、現在販売されているリン酸イオン結合剤(RENAGEL)の差異を図示するものである。
【図6】図6は、非反応性プローブについての、プローブ半径に対する利用不可能体積のプロットであって、本発明のリン酸イオン結合性ポリマー(EC 172A)と、現在販売されているリン酸イオン結合剤(RENAGEL)の差異を図示するものである。
【図7】図7は、塩酸クロロプロピルアミンでFR−005−144を改変した場合の、結合能の変化を示すグラフである。
【技術分野】
【0001】
(相互参照)
この出願は、米国特許出願番号10/806,495(名称:CROSSLINKED
AMINE POLYMERS、2004年3月22日出願)、米国特許出願番号10/701,385(名称:POLYAMINE POLYMERS、2003年11月3日出願)、米国特許出願番号10/965,044(名称:ANION−BINDING
POLYMERS AND USES THEREOF、2004年10月13日出願)の一部継続出願であり、これらの米国特許出願は、参考としてこれら全体が本明細書中に援用されており、本出願は、米国特許法第120条に基づき、これらに対して優先権を主張する。
【背景技術】
【0002】
(発明の背景)
イオン選択性吸着剤は、高リン酸血症、高シュウ酸尿症、高カルシウム血症、高カリウム血症などの状態において人間の電解質バランス障害を矯正する治療に使用されている。高リン酸血症は、腎不全患者に発生する。その患者の腎臓が充分にリン酸イオンを排出できないため、食事中の外因性リン酸の摂取分を補正できなくなる。この状態が進むと、血清中リン酸濃度が高くなり、カルシウム×リン酸の積が高まる。因果関係はまだ完全には明らかにされていないが、カルシウム×リン酸の積が高いと、軟組織の石灰化や心臓血管疾患を引き起こす。心臓血管疾患は、全透析患者の死因の約半分を占める。
【0003】
リン酸イオン吸収を消化(GI)管内で調節するためや、全身のリン酸濃度を正常に戻すために、アルミニウム塩、カルシウム塩、そして最近ではランタン塩が処方されている。しかし、これらの塩は、可溶性のアルミニウム陽イオンやカルシウム陽イオンを消化管に放出するため、一部が吸収されて血流に入り込む。アルミニウムの吸収により、アルミニウム骨疾患や痴呆などの深刻な副作用を起こす可能性があり、カルシウムの過剰摂取は高カルシウム血症をもたらし、患者に冠状血管の石灰化のリスクが生じる。
【0004】
Dowex樹脂やコレスチラミン樹脂などの強塩基性イオン交換材料に代表される、金属を含まないリン酸イオン結合剤が、リン酸結合剤として使用するために、これまでに提案されている。しかしながら結合能が低いため、用量を多くしなければならず、患者によっては辛い場合がある。
【0005】
アミン官能性ポリマーが、これまでにリン酸イオン結合剤またはシュウ酸イオン結合剤として説明されている。たとえば、特許文献1〜5を参照されたい。架橋ポリアリルアミン樹脂であるRenagelは、リン酸イオン捕捉剤であり、金属を含まないリン酸イオン結合剤として販売されている。in vitroのRenagelのリン酸イオン結合は、水中では約6mmol/g、塩化ナトリウム100mM+リン酸イオン20mMの中性pHで測定した場合は2.5mmol/gである。対象となる患者群に対する推奨用量は、6mg/dL未満のリン酸イオン濃度を維持するため、通常5g/日〜15g/日となっている。公表されている、健康な志願者を対象にしたRenagelフェーズI臨床試験によれば、Renagel 15gの投与によって尿中のリン酸イオン排出量がベースラインの25mmolから17mmolに減少し、この差は、遊離リン酸イオンおよびポリマー結合リン酸イオンとして便中に排出されていることが示されている。このデータより、in vivoの結合能範囲は0.5〜1mmol/gと見ることができるが、これはin vitroの生理食塩水中で測定された結合能6mmol/gよりもはるかに少ない。in vitroで生理食塩水中で測定されたRenagel結合能だけを考え
れば、リン酸イオン結合剤15gという用量は、平均的アメリカ人の食事中に含まれるリンの量(すなわち、37mmol/日)すべてを吸着しても余る量である。in vitro結合能と、論文にあるin vivo結合能の低さとの間には差があるため、血清中のリン酸イオン濃度を安全範囲まで下げるには多量の樹脂が必要となり、この薬剤の治療的利点にとってデメリットとなっている。
【0006】
イオン交換樹脂の結合能の損失は、複雑な消化系環境中で使用される場合のRenagelだけに限られる問題ではない。用量の多さは、毒性学の点では一般的に安全ではあるけれども、何グラムもの樹脂を服用するという不便さから、樹脂の結合能を向上させる必要が議論されている。例えば、Renagel結合剤の安全研究報告においても、8週間の治療期間中に1.2〜2.0g/日の低用量であっても患者は胃腸の不調を訴えている。Renagelを5.4g/日投与された患者では、8.9%の症例において胃腸の不調などの有害な作用が生じたため、処置が中止されている(非特許文献1および2)。よって、in vivoの結合能を向上させること、すなわち投与用量を少なくするという改善は、樹脂による治療において歓迎されるものとなる。
【0007】
これらを考慮した結果、少ない薬物量で体内から選択的にイオンを除去し、患者のコンプライアンス性を高める、安全で高結合能の結合剤に対する大きな需要が今も存在する。
【0008】
患者のコンプライアンスは、患者にとってK/DOQIの提言に従うための大きな制限的事項の1つとして認識されるようになっている、つまりその提言に従った用量の増大は、患者が800mgの錠剤を1日に10錠以上も飲まなければならないということを意味する。Renagel錠剤は飲み込む錠剤の形状になっており、最小限量の水分とともに服用するようになっている。これが、水分を制限している末期腎不全患者にとっては負担の増加となる。より服用しやすい製薬形状が好ましい。特に、チュアブルタイプの錠剤は、老人や小児用、大量の錠剤を必要とする治療においてに普及が進んでいる。チュアブルタイプの錠剤は、より効力の高い錠剤にすることが可能で、最終的に食事ごとに服用する錠剤の数を減らすことができる。チュアブル錠剤に含まれている有効成分は、咀嚼と唾液によって細かくしてから飲み込むことになる。このため、錠剤の形状や重さの条件は、飲み込むタイプの錠剤に比べ、はるかに緩和される。しかしながら、Renagelのようなヒドロゲルをチュアブル錠剤に製剤するのは、ポリマーの膨潤性の高さから、これまで不可能であった。Renagelは非常に急速に膨潤し、等張性溶液中では重量が10倍にもなる。これにより、2つの困った問題が生じる。第一は、口の中でもポリマーが膨潤し、非常に不快な感覚(口内の渇きや窒息感)をもたらすという点、第二は、口内の不快感を患者が克服したとしても、膨潤したゲルを食道経由で投与するのは危険が伴うという点である。さらに、非常に膨潤性の高いゲルであることが知られており、数グラムの範囲で投与した場合には、鼓腸や便秘、下痢などの副作用を引き起こす。
【特許文献1】米国特許第5,985,938号明細書
【特許文献2】米国特許第5,980,881号明細書
【特許文献3】米国特許第6,180,094号明細書
【特許文献4】米国特許第6,423,754号明細書
【特許文献5】国際公開第95/05184号パンフレット
【非特許文献1】Slatapolskyら,Kidney Int.,1999年、第55巻、p.299−307
【非特許文献2】Chertowら,Nephrol Dial Transplant,1999年、第14巻、p.2907−2914
【発明の開示】
【課題を解決するための手段】
【0009】
本発明の好ましい実施形態によれば、以下のポリマーなどが提供される。
(項1)
陰イオン結合性ポリマーであって、該ポリマーは、標的陰イオンを結合するものであり、かつ次の特徴のうち少なくとも2つによって特徴づけられる、陰イオン結合性ポリマー:a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量を持つ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が約60%未満。
(項2)
前記ポリマーは、胆汁酸またはクエン酸と約2mmol/g未満の結合能で結合する、上記項1に記載のポリマー。
(項3)
前記膨潤率は、等張性溶液中でおよび/または中性pHで測定される、上記項1に記載のポリマー。
(項4)
前記ポリマーは、アミン基を含む、上記項1に記載のポリマー。
(項5)
前記アミンモノマーは、アリルアミン、ビニルアミン、エチレンイミン、式1および式2からなる群より選択され、ここで式1および式2は次の構造:
【化1】

である、上記項4に記載のポリマー。
(項6)
前記アミンモノマーは、1,3−ジアミノプロパンおよびN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン、1,2,3,4−テトラアミノブタンからなる群より選択される非重合性アミンモノマーである、上記項4に記載のポリマー。
(項7)
前記ポリマーは、非重合性アミンモノマーと架橋剤から成る、上記項1に記載のポリマー。
(項8)
前記ポリマーは、アミンモノマーおよび架橋剤から成る、該架橋剤の量は、該モノマーの全アミン含有量の50モル%より多い、上記項1に記載のポリマー。
(項9)
非重合性アミンモノマーと架橋剤から成る、陰イオン結合性ポリマーであって、ここで該ポリマーは、不均一プロセスから得られ、該ポリマーの膨潤率は、5未満である、陰イオン結合性ポリマー。
(項10)
上記項1〜9に記載のポリマーと、製薬分野で受容される賦形剤を含む、医薬組成物。
(項11)
前記標的陰イオンは、リン酸イオンおよびシュウ酸イオンからなる群より選択される、上記項1に記載の組成物。
(項12)
前記標的陰イオンは、リン酸イオンである、上記項1に記載の組成物。
(項13)
非重合性アミンモノマーと架橋剤から成るリン酸イオン結合性ポリマーであって、該ポリマーは、次の特徴のうち少なくとも1つによって特徴づけられる、リン酸イオン結合性ポリマー:
a)膨潤率は約5未満、
b)約200より大きい分子量の非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージは生理学的媒体中で測定される、および
c)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉が約60%未満。
(項14)
非重合性アミンモノマーと架橋剤から成るリン酸イオン結合性ポリマーであって、該ポリマーは、次の特徴のうち少なくとも1つによって特徴づけられる、リン酸イオン結合性ポリマー:
a)膨潤率は約2.5未満、
b)約200より大きい分子量の非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージは生理学的媒体中で測定される、および
c)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉が約60%未満。
(項15)
リン酸イオン結合性ポリマーであって、該ポリマーは、次の特徴のうち少なくとも1つによって特徴づけられる、リン酸イオン結合性ポリマー:
a)約200より大きい分子量の非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージは生理学的媒体中で測定される、および
b)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉が約60%未満。
(項16)
前記ポリマーは、アミンモノマーと架橋剤から構成され、該架橋剤の量は、該モノマーの全アミン含有量の50モル%より多い、上記項15に記載のポリマー。
(項17)
前記ポリマーは、胆汁酸またはクエン酸と2mmol/g未満の結合能で結合する、上記項14に記載のポリマー。
(項18)
前記膨潤率は、等張性溶液中でおよび/または生理学的pHで測定されている、上記項14に記載のポリマー。
(項19)
前記ポリマーは、in vivoでの平均リン酸イオン結合能が約0.5mole/gより大きい、上記項15に記載のポリマー。
(項20)
前記ポリマーは、ポリアミンポリマーであり、該ポリマーの塩化物の含有量は、アミン基の含有量の約35mol%未満である、上記項15に記載のポリマー。
(項21)
1種以上のアミンモノマーと1種以上の架橋剤から成る、上記項1に記載のポリマーであって、該ポリマーは、架橋反応に先立ち、アミン:溶媒の比が約3:1〜約1:3で溶媒中に該アミンを存在させ、かつ反応混合物に加えられる該架橋剤の量は該アミンモノマーの平均結合数(NC)が約2.05〜6となるようにする方法によって製造される、ポリマー。
(項22)
反応混合物に添加される前記架橋剤総量は、NCが約2.2〜約4.5になるような量である、上記項21の組成物。
(項23)
前記架橋反応中に前記標的陰イオンを存在させる方法によって製造される、上記項1に記載のポリマー。
(項24)
上記項23に記載のポリマーであって、前記架橋反応は、次の工程:
a)前記アミンモノマーを遊離塩基として添加し、前記標的陰イオンをその酸の形態で添加する工程;
b)架橋剤を添加する工程;
c)架橋反応を実行する工程;
d)該標的イオンを洗い流す工程、
を包含する、ポリマー。
(項25)
1種以上のアミンモノマーと1種以上の架橋剤から成る、上記項1に記載のポリマーであって、該ポリマーは、以下の工程:
a)次のi)およびii):
i)前記アミンモノマーを添加する工程;次いで
ii)前記架橋剤の一部を添加して、シロップを形成する工程、
によって可溶性プレポリマーを形成する工程;
b)該シロップを油中で乳化させる工程;
c)残りの架橋剤を添加して、架橋ビーズを製造する工程、
を包含する方法によって製造される、ポリマー。
(項26)
1種以上のアミンモノマーと1種以上の架橋剤から成る、上記項1に記載のポリマーであって、該ポリマーは、以下:
a)該アミンモノマーと架橋剤との間で第1の反応を行って、ゲルを形成する工程、
b)該ゲルをアミノアルキルハライドと反応させ、該反応において、ハライド置換によアミンアルキル基を、該ゲルに化学的に結合させる工程、
を包含するプロセスによって生成される、ポリマー。
(項27)
上記項21に記載のポリマーと、製薬分野で受容される賦形剤を含む、医薬組成物。
(項28)
前記ポリマーは、粒子の形状であり、該ポリマー粒子は、外殻に収められている、上記項1に記載のポリマー。
(項29)
1種以上のアミンモノマーと1種以上の架橋剤から成るリン酸イオン結合性ポリマーであって、ここで該ポリマーは、反応混合物に添加される架橋剤含有量は該アミンモノマーの平均結合数が約2.2〜約4.5となるような量である方法によって製造される、ポリマー。
(項30)
前記アミンモノマーは、1,3−ジアミノプロパンおよびN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンからなる群より選択され、前記架橋剤は、1,3−ジクロロプロパンおよびエピクロロヒドリンからなる群より選択される、上記項29に記載のポリマー。
(項31)
上記項29に記載のポリマーと、製薬分野で受容される賦形剤を含む、医薬組成物。
(項32)
エピクロロヒドリンによって架橋されたN,N,N’,N’−テトラキス(3−アミノプ
ロピル)1,4−ジアミノブタンから成るイオン結合性ポリマーであって、ここで該ポリマーは、N,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン:水の初期濃度比が約1:3〜4:1となる製法によって製造される、イオン結合性ポリマー。
(項33)
N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン:水の初期濃度比は、約1.5:1〜約4:1である、上記項32に記載のポリマー。
(項34)
上記項32のポリマーと、製薬分野で受容される賦形剤を含む、医薬組成物。
(項35)
N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマーとエピクロロヒドリン架橋剤から成るリン酸イオン結合性ポリマーであって、ここで該ポリマーは、反応混合物に添加される該エピクロロヒドリン架橋剤が、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン全含有量の約200〜300mol%である製法によって製造される、リン酸イオン結合性ポリマー。
(項36)
前記初期反応混合物におけるモノマー:水の比は、約3:1〜約1:1である製法によって製造される、上記項35に記載のポリマー。
(項37)
前記反応混合物に添加されるエピクロロヒドリン架橋剤の合計量は、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン全含有量の約230〜270mol%である、上記項35に記載のポリマー。
(項38)
前記初期反応混合物に添加されるエピクロロヒドリン架橋剤の合計量は、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン全含有量の約250mol%である、上記項35に記載のポリマー。
(項39)
(N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン +
エピクロロヒドリン):水の比は、約1.73である製法によって製造される、上記項38に記載のポリマー。
(項40)
前記ポリマーは、球形ビーズの形状である、上記項35に記載のポリマー。
(項41)
ポリアリルアミンモノマーとエピクロロヒドリン架橋剤から成るリン酸イオン結合性ポリマーであって、ここで該ポリマーは、該ポリアリルアミンモノマーを、該モノマー:水の比が約3:1〜約1:3で溶解させることにより生成される、リン酸イオン結合性ポリマー。
(項42)
前記反応混合物に添加されるエピクロロヒドリン架橋剤の合計量は、ポリアリルアミン含有量の約10mol%である、上記項41のポリマー。
(項43)
プレポリマーから成るリン酸イオン結合性ポリマーであって、該プレポリマーは、モル比1:1で1,3−ジアミノプロパンと1,3−ジクロロプロパン架橋剤から成り、ここで該プレポリマーは、エピクロロヒドリン架橋剤によってさらに架橋され、反応混合物に添加されるエピクロロヒドリン架橋剤の量は、プレポリマー合計量に対して約200mol%であり、該反応混合物におけるプレポリマー:水の比は、約1.1:1〜1.7:1である、リン酸イオン結合性ポリマー。
(項44)
上記項10、24、31、または34の医薬組成物であって、該組成物は、製剤分野で受容される賦形剤と水を含む液体製剤である、医薬組成物。
(項45)
標的陰イオンを結合する陰イオン結合性ポリマーと、1種以上の適切な製剤用賦形剤を含む薬学的組成物であって、ここで該組成物は、チュアブル錠および/または口中で崩れる錠剤の形態であり、該ポリマーは、口腔内および食道内を移動するために必要な期間のポリマーの膨潤率が約5未満である、医薬組成物。
(項46)
標的陰イオンを結合する陰イオン結合性ポリマーと、1種以上の適切な製剤用賦形剤を含む医薬組成物であって、ここで該組成物は、チュアブル錠および/または口中で崩れる錠剤の形態であり、該ポリマーは、次の特徴を有する、医薬組成物:
a)該標的陰イオンの約2倍より大きい分子量を持つ非反応性溶質が利用可能な部分は、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、およびb)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が約60%未満。
(項47)
前記ポリマーの転移温度が約50℃より高い、上記項46に記載の組成物。
(項48)
前記製剤用賦形剤のうちの1種は、蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトール、およびこれらの組合せからなる群より選択される、該組成物は、前記ポリマーが該賦形剤とあらかじめ配合されて固溶体を形成するプロセスによって生成される、上記項46に記載の組成物。
(項49)
前記ポリマーの標的陰イオンは、リン酸イオンである、上記項46に記載の組成物。
(項50)
前記ポリマーは、in vivoにおいて、標的イオンに、0.5mmol/gより大きい結合能で結合する、上記項46に記載の組成物。
(項51)
前記陰イオン結合性ポリマーは、前記錠剤重量の約50%より多くを構成する、上記項46に記載の組成物。
(項52)
前記錠剤は、円筒形をしていて、直径は約22mm、高さは約4mmであり、前記陰イオン結合性ポリマーを約1.6gより多く含む、上記項46の組成物。
(項53)
前記賦形剤は、甘味剤、結合剤、滑沢剤、崩壊剤からなる群より選択される、上記項46に記載の医薬組成物。
(項54)
前記ポリマーは、平均で直径約40μm未満の粒子として存在する、上記項53に記載の医薬組成物。
(項55)
前記甘味剤は、蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、およびソルビトール、ならびにこれらの組合せからなる群より選択される、上記項53に記載の医薬組成物。
(項56)
イオン結合性ポリマーについての標的イオン結合干渉率を測定するための方法であって、以下:
a)該イオン結合性ポリマーを、該標的イオンを含む非干渉性緩衝液に添加し、該ポリマーの該標的イオン結合能を測定する工程;
b)哺乳動物の消化酵素を使用して標準食を人工的に消化することによって、そして/または該標準食を摂取した哺乳動物の上部消化器官から糜粥を吸引することによって、干渉性緩衝液を調製する工程であって、ここで該標準食は、標的イオンを含んでいる、工程;ならびに
c)該イオン結合性ポリマーを該干渉性緩衝液に添加して、該標的イオン結合能を測定す
る工程であって、ここで該結合能は、該イオン結合性ポリマーを添加する前と後の、該干渉性緩衝液中の標的イオン濃度の差から得られる、工程;ならびに
d)非干渉性緩衝液中での結合実験と、干渉性緩衝液中での結合実験との間で、平衡状態にある同じ標的陰イオン濃度で観察される該標的イオンの結合能の部分的低下として、結合干渉度を算出する工程、
による、方法。
(項57)
標的イオンを結合するイオン結合性ポリマーを選択するための方法であって、該ポリマーは、モノマーと架橋剤から成り、ここで該ポリマーは、次の特徴のうち少なくとも1つ:a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が約60%未満、
によって特徴づけられ、
該方法は:
i)以下:
1)モノマーに対する架橋剤の比率:
2)反応媒体中の、溶媒に対する(モノマー+架橋剤)の比率;
3)生理学的pHと生理学的浸透圧での該ポリマーの有効電荷;および/または
4)主鎖ポリマーの親水性/疎水性のバランス、
を変化させる工程;
ii)得られたポリマーの膨潤性、細孔度、イオン結合干渉率を評価する工程;
iii)該特徴のうち少なくとも1つを有するポリマーを選択する工程、
を包含する、方法。
(項58)
ポリアミンポリマーの治療的特性および/または投与適性および/または製薬性質の向上させるための方法であって、該方法は、以下の工程のうちの少なくとも1つ:
a)該ポリアミンモノマーの平均結合数が約2.05〜6になるように、架橋剤で該ポリマーを架橋する工程;
b)ポリアミン:水の初期比が約3:1〜1:3である工程によって該ポリマーを製造する工程、
を包含する、方法。
(項59)
標的陰イオンを結合する陰イオン結合性ポリマーを製造する方法であって、該方法は、不均一プロセスによってアミンモノマーと架橋剤とを反応させる工程を包含し、ここで該リン酸イオン結合性ポリマーは、次の特徴のうち少なくとも2つによって特徴づけられる、方法:
a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能な部分が、ポリマー重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、
c)非干渉性緩衝液と比した胃腸内模擬液の該標的陰イオンに対するイオン結合干渉が約60%未満。
(項60)
前記アミンモノマーは、非重合アミンモノマーである、上記項59に記載の方法。
(項61)
前記ポリマーは、アミンモノマーと架橋剤から成り、該架橋剤の量は、該モノマーの全アミン含有量の50mol%より多い、上記項59に記載の方法。
(項62)
前記アミンモノマーは、ポリアリルアミンである、上記項59に記載の方法。
(項63)
前記架橋剤は、エピクロロヒドリンである、上記項62に記載の方法。
(項64)
標的イオンを結合する陰イオン結合性ポリマーであって、ここで該ポリマーは、不均一プロセスによってアミンモノマーを架橋剤で架橋する工程を包含する製法によって製造され、該ポリマーは、次の特徴のうち少なくとも2つによって特徴づけられる、陰イオン結合性ポリマー:
a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能な部分が、ポリマー重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、および
c)非干渉性緩衝液と比した胃腸内模擬液の該標的陰イオンのイオン結合干渉は約60%未満。
(項65)
前記アミンモノマーは、非重合性アミンモノマーである、上記項64に記載のポリマー。
(項66)
前記ポリマーは、アミンモノマーと架橋剤から成り、該架橋剤の量は、該モノマーの全アミン含有量の50mol%より多い、上記項64に記載のポリマー。
(項67)
前記アミンモノマーは、ポリアリルアミンである、上記項64に記載のポリマー。
(項68)
前記ポリアリルアミンは、エピクロロヒドリンによって架橋されている、上記項64に記載のポリマー。
(項69)
動物から陰イオンを除去するための方法であって、該方法は、該動物に有効量のポリマーを投与する工程を包含し、ここで該ポリマーは、標的陰イオンを結合する陰イオン結合性ポリマーであり、該ポリマーは、次の特徴のうち少なくとも2つを有することで特徴づけられる、方法:
a)膨潤率は約5未満、
b)該標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満、ここにパーセンテージが生理学的媒体中で測定される、
c)非干渉性緩衝液と比した胃腸内模擬液の該標的陰イオンに対するイオン結合干渉率が約60%未満。
(項70)
前記ポリマーは、非重合性アミンモノマーと架橋剤から成る、上記項69に記載の方法。
(項71)
前記ポリマーは、アミンモノマーと架橋剤から構成され、該架橋剤の量は、モノマーの全アミン含有量の50mol%より多い、上記項69に記載の方法。
(項72)
前記陰イオンは、リン酸イオンである、上記項69に記載の方法。
(項73)
前記動物は、高リン酸血症、低カルシウム血症、甲状腺亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、および末期腎不全からなる群より選択される少なくとも1つの疾患に罹患している、上記項72に記載の方法。
(項74)
前記動物はヒトである、上記項72に記載の方法。
(項75)
前記リン酸イオンは、消化管内から除去される、上記項72に記載の方法。
(項76)
前記投与は、経口投与である、上記項72に記載の方法。
(項77)
前記ポリマーは、プロトンポンプ阻害剤、カルシウム様作用薬、ビタミンおよびそのアナログ、リン酸イオン結合剤のうちの少なくとも1つと共に投与される、上記項72に記載の方法。
(項78)
前記リン酸イオン結合剤は、炭酸アルミニウム、炭酸カルシウム、酢酸カルシウム、炭酸ランタン、塩酸セベラマーのうちの少なくとも1つである、上記項77に記載の方法。
(発明の要旨)
本発明は、一態様において、陰イオン結合性ポリマーを提供する。いくつかの実施態様において、本発明は、ポリマーが標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーを提供し、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定したゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、膨潤率は約4未満、または約3未満、または約2.8未満、または約2.7未満、または約2.6未満、または約2.5未満である。いくつかの実施態様において、ポリマーは胆汁酸やクエン酸イオンと結合するが、その結合能は約2mmol/g未満、または約1mmol/g未満、または約0.5mmol/g未満、または約0.3mmol/g未満、または約0.1mmol/g未満である。いくつかの実施態様において、膨潤率は中性pHの等張性溶液中で測定される。いくつかの実施態様において、ポリマーはアミンモノマーから成る。いくつかの実施態様において、このアミンモノマーはアリルアミン、ビニルアミン、エチレンイミン、1,3−ジアミノプロパン、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン、1,2,3,4−テトラアミノブタン、化学式1および化学式2、のグループから選ばれる。ここに化学式1および化学式2は次の構造である:
【0010】
【化2】

いくつかの実施態様において、本発明は、逆懸濁重合によって得られ、膨潤率は5未満である架橋ポリアミンを含む陰イオン結合性ポリマーを提供する。
【0011】
いくつかの実施態様において、本発明は、次の特徴のうち少なくとも1つを有するリン酸イオン結合性ポリマーを提供する:a)膨潤率は約5未満、好ましくは約2.5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、約200よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分がゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉率は、約60%未満である。いくつかの実施態様において、膨潤率は約2.8未満、または約2.7未満、または約2.6未満である。いくつかの実施態様において、ポリマーは胆汁酸やクエン酸イオンと結合するが、その結合能は約2mmol/g未満、または約1mmol/g未満、または約0.5mmol/g未満、または約0.3mmol/g未満、または約0.1mmol/g未満である。いくつかの実施態様において、膨潤率は中性pHの等張性溶液中で測定される。
【0012】
いくつかの実施態様において、本発明はリン酸イオン結合性ポリマーを提供し、そのポリマーの膨潤率は約5未満、好ましくは約2.8未満、または約2.7未満、または約2.6未満、または約2.5未満であり、この膨潤率は中性pHの等張性溶液中で測定される。実施態様において、このポリマーの平均in vivoリン酸イオン結合能は約0.5mol/gより大きい。実施態様において、このポリマーはポリアミンポリマーであり、アミン基の含有量の約35mol%未満がそのポリマーの塩化物の含有量である。
【0013】
いくつかの実施態様において、本発明は、ポリマーが標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーを提供し、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定したゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率は、約60%未満である。ここでポリマーは、1種以上のアミンモノマーと1種以上の架橋剤から成り、架橋反応に先立ち、アミンをアミン:溶媒比が約3:1〜1:3となるように溶媒中に存在させ、反応混合物に加えられる架橋剤の総量が、アミンモノマーの平均結合数(NC)が約2.05〜6、または約2.2〜4.5となるようにする方法により製造される。いくつかの実施態様において、ポリマーは、架橋反応中に標的陰イオンを存在させる方法によっても製造される。例えば:a)遊離塩基としてアミンモノマーを、酸の形で標的陰イオンを加え、b)架橋剤を加え、c)架橋反応を実行し、そしてd)洗って標的イオンを除去する方法である。
【0014】
いくつかの実施態様において、本発明は、ポリマーが標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーを提供し、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、c)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。ここでポリマーは、1種以上のアミンモノマーと1種以上の架橋剤から成り、a)全てのアミンモノマーを加え、次に架橋剤の一部を連続して加えてシロップを生成することにより可溶性のプレポリマーを製造し、b)このシロップを油に入れて乳化し、次にc)残りの架橋剤を加えて架橋ビーズを製造する方法により製造される。
【0015】
いくつかの実施態様において、本発明は、ポリマーが標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーを提供し、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。ここでポリマーは1種以上のアミンモノマーと1種以上の架橋剤から成り、ポリマーは次を含むプロセスで生成される:a)アミンモノマーと架橋剤の間の最初の反応を実行し、ゲルを生成し、次にb)このゲルをアミノアルキルハライドと反応させ、アミン官能性ゲルによるハライド置換で、アミンアルキル基をゲルに化学的に付加する。
【0016】
いくつかの実施態様において、本発明では、1種以上のアミンモノマーと1種以上の架橋剤から成るリン酸イオン結合性ポリマーを提供し、ここでこのポリマーは、架橋剤の総量を、アミンモノマーの平均結合数が2.2〜4.5となるようにして反応混合物に加える方法により製造される。
【0017】
いくつかの実施態様において、アミンモノマーは1,3−ジアミノプロパンとN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンから成るグループから選ばれる。ここで架橋剤は1,3−ジクロロプロパンとエピクロロヒドリンから成るグループから選ばれる。実施態様において、本発明は、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンをエピクロロヒドリンによって架橋したイオン結合性ポリマーを提供する。このポリマーはN,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンの水に対する初期濃度比が約1:3〜4:1、または約1.5:1〜4:1となる方法によって製造される。
【0018】
実施態様において、本発明は、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマーと架橋剤エピクロロヒドリンから成るリン酸イオン結合性ポリマーを提供する。このポリマーは、反応混合物に加えられる架橋剤エピクロロヒドリンの合計量が、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン含有量の約200mol%〜300mol%、または約230mol%〜270mol%、または約250mol%である方法によって製造される。また一部の実施態様において、ポリマーは、最初の反応混合物におけるモノマーと水の比が約3:1〜1:1、または約1.73である方法によって製造される。いくつかの実施態様において、ポリマーは球形ビーズの形状である。
【0019】
いくつかの実施態様において、本発明は、ポリアリルアミンモノマーと架橋剤エピクロロヒドリンとから成るリン酸イオン結合性ポリマーを提供する。ポリマーは、最初にポリアリルアミンモノマーを水に対して約3:1〜1:3の割合で溶かして製造される。この一部の実施態様において、反応混合物に加える架橋剤エピクロロヒドリンの合計量は、全ポリアリルアミン含有量の約10mol%である。
【0020】
いくつかの実施態様において、本発明は、モル比1:1での1,3−ジアミノプロパンと架橋剤1,3−ジクロロプロパンから成るプレポリマーから成るリン酸イオン結合性ポリマーを提供する。ここでこのプレポリマーは、反応混合物に加えられる架橋剤エピクロロヒドリンの合計量をプレポリマー合計量に対して約200mol%として、さらに、反応混合物におけるプレポリマー:水の比は約1.1:1〜1.7:1として架橋剤エピクロロヒドリンによって架橋されたものである。
【0021】
本発明はさらに、上記ポリマーのいずれかを含む組成物を提供する。ここでポリマーは粒子の形状であり、ポリマー粒子は外殻に包まれている。
【0022】
本発明は、別の態様において、医薬組成物を提供する。ある実施態様において、医薬組成物は本発明のポリマーおよび製剤用賦形剤を含む。またいくつかの実施態様において、組成物は液体製剤であり、ポリマーが水および適切な賦形剤の溶液中に分散している。またいくつかの実施態様において、本発明は、標的陰イオンを結合する陰イオン結合性ポリマーと、1種以上の適切な製剤用賦形剤を含む医薬組成物を提供する。組成物はチュアブルまたは口中で崩れる錠剤であり、口腔内および食道内を移動する際のポリマーの膨潤率は約5未満、または約2.8未満、または約2.7未満、または約2.6未満、好ましくは約2.5未満である。いくつかの実施態様において、チュアブル錠剤には、転移温度が約50°Cを超えるポリマーが含まれている。
【0023】
いくつかの実施態様において、チュアブル錠剤には、蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトール、またはこれらの組合せからなるグループから選択された製剤用賦形剤が含まれ、ポリマーが賦形剤とあらかじめ配合されて固溶体を形成する方法によって製造される。いくつかの実施態様において、ポリマーの標的陰イオンはリン酸イオンである。いくつかの実施態様において、ポリマーはin vivoに
おいて、標的イオンに、0.5mmol/g以上の結合能で結合する。いくつかの実施態様において、陰イオン結合性ポリマーは、錠剤重量の約50%より多くを占める。いくつかの実施態様において、錠剤は円筒形をしていて、直径は約22mm、高さは約4mmであり、陰イオン結合性ポリマーは錠剤の合計重量のうち1.6g以上を占めている。本発明による、いくつかのチュアブル錠剤では、賦形剤は甘味剤、結合剤、滑沢剤、錠剤分解物質から成るグループから選ばれる。ポリマーは平均で直径約40μm未満の粒子として存在してもよい。いくつかの実施態様において、甘味料は蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトール、またはこれらの組合せからなるグループから選択される。
【0024】
別の態様において、本発明は、標的イオンを結合するイオン結合性ポリマーの、標的イオン結合干渉率を測定する次の方法を提供する:a)標的イオンを含む非干渉性緩衝液に、イオン結合性ポリマーを加え、そのポリマーの標的イオン結合能を測定し、b)哺乳類の胃腸消化酵素を用いて標準化食事を人工的に消化するか、あるいは標準化食事を摂取させた哺乳類の上部消化管内から糜粥を吸引し(標準化食事には標的イオンが含まれている)、c)イオン結合性ポリマーを加え、標的イオンの追加前と後の標的イオン濃度の減少度から標的イオン結合能を測定し、d)平衡状態にある同じイオン濃度で、非干渉性緩衝液中の結合測定値と消化された食事または体外吸引物における結合測定値との間で観察される標的イオンの結合能の減少度として、結合の阻害率を計算し、パーセントで表わす。
【0025】
さらに別の態様において、本発明は、イオン結合性ポリマーの選択方法を提供する。このポリマーはモノマーと架橋剤からなり、次の特徴のうち少なくとも1つを有している:a)膨潤率は約5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。これには、次の工程が含まれる:i)次の組成・プロセス変数を変える:1)モノマーと架橋剤の比率、2)反応液中の、(モノマー+架橋剤)と溶媒の比率、3)生理的pHと浸透圧でのポリマーの有効電荷、4)主鎖ポリマーの親水性/疎水性のバランス。ii)生成ポリマーの膨潤性、細孔度、イオン結合干渉率を評価する。iii)上記特徴のうち少なくとも1つを有するポリマーを選択する。別の態様として、本発明は、ポリアミンポリマーの治療的特性や投与適性、製薬性質の改良方法を提供する。これには次の工程のうち少なくとも1つが含まれる:a)ポリアミンモノマーの平均結合数が約2.05〜6になるように、架橋剤でポリマーを架橋させる工程、および/またはb)ポリアミンが、ポリアミン対水の初期比率が約3:1〜1:3で水中に存在するようにした方法によって、ポリマーを製造する工程。
【0026】
別の態様として、本発明は、不均一プロセスによって、架橋剤とアミンモノマーとを合わせる工程を含む、標的陰イオンを結合する陰イオン結合性ポリマーの製造方法を提供する。ここでこのリン酸イオン結合性ポリマーは、次の特徴のうち少なくとも2つを有することで特徴づけられる:a)膨潤率は約5未満、b)標的陰イオンの約2倍より大きい分子量を持つ非反応性溶質が利用可能な部分がポリマーの約20%(重量)未満(パーセンテージは生理学的媒体中において測定)およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満。いくつかの実施態様において、アミンモノマーはポリアリルアミンである。いくつかの実施態様において、架橋剤はエピクロロヒドリンである。
【0027】
別の態様として、本発明では、不均一プロセスによるポリアリルアミンの架橋を含む方法によって製造された、標的イオンを結合する陰イオン結合性ポリマーを提供する。このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)標的陰イオンの約2倍以上の分子量を持つ非反応性溶質が利用可能な部分が、ポリマー重量の
約20%未満(パーセンテージは生理学的媒体中において測定)、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満。1つの実施態様において、ポリアリルアミンはエピクロロヒドリンによって架橋される。
【0028】
別の態様において、本発明は、動物に対し本発明のポリマーの有効量を投与することにより、動物から陰イオンを除去する方法を提供する。いくつかの実施態様において、ポリマーは、標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合するものである陰イオン結合性ポリマーであり、このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は約5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、ポリマーの標的陰イオンはリン酸イオンである。いくつかの実施態様において、リン酸イオンは、消化管から除去されるものである。いくつかの実施態様において、投与方法は経口投与である。いくつかの実施態様において、対象動物は、高リン酸血症、低カルシウム血症、甲状腺亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、末期腎不全からなる群のうち少なくとも1つ疾患を有している。いくつかの実施態様において、その動物とは人間である。
【0029】
いくつかの実施態様において、ポリマーは、プロトンポンプ阻害剤、カルシウム様作用薬、ビタミンおよびその類似物、リン酸イオン結合剤(炭酸アルミニウム、炭酸カルシウム、酢酸カルシウム、炭酸ランタン、塩酸セベラマーなど)のうち少なくとも1つと共に投与される。
【0030】
(参照による引用)
この特許明細書中に言及されている刊行物および特許出願はすべて、個々の刊行物や特許出願が具体的かつ個別に記述されるのと同様に、参照によって本明細書中に援用される。
【0031】
本発明の新しい特徴は、添付の特許請求の範囲に具体的に列記されている。本発明の特徴および利点をさらに理解するためには、本発明の原理を利用した具体的実施例を含む下記の詳細な説明および図面を参照されたい。
【発明を実施するための最良の形態】
【0032】
(発明の詳細な説明)
(I. 導入)
本発明は一態様において、低膨潤性、in vivoでのイオン高結合性、干渉するイオンからの低干渉性、特定の細孔度の特徴のうち、1つまたは複数を有する陰イオン結合性ポリマー材料を提供する。別の態様として、本発明は、陰イオン結合性ポリマーの医薬組成物を提供する。この医薬組成物は、チュアブル錠剤または液体製剤である。さらなる態様として、本発明は、低膨潤性、in vivoでのイオン高結合性、干渉するイオンからの低干渉性、特定の細孔度の特徴のうち、1つまたは複数を有するような、陰イオン結合性ポリマー材料の製造または改良の方法を提供する。さらなる態様として、本発明は、本発明の陰イオン結合性ポリマーを用いたイオン過剰疾患の治療方法を提供する。好ましい実施態様において、陰イオン結合性ポリマーは消化管から標的陰イオンを除去するために使用されている。消化管から除去され得る標的陰イオンの例としては、リン酸イオンとシュウ酸イオンがあるが、これらに限定されない。他の好ましい実施態様において、ここに記載される組成物は、高リン酸血症、低カルシウム血症、上皮小体亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、慢性腎不全、同化代謝などの治療に用いられる。
【0033】
(II. ポリマー)
本発明のポリマーは、イオンを結合する機能によって特徴付けられる。望ましくは、本発明のポリマーは陰イオンを結合し、さらに望ましくはリン酸イオンおよび/またはシュウ酸イオンを結合し、最も望ましくはリン酸イオンを結合する。説明では、陰イオン結合性ポリマー、特にリン酸イオン結合性ポリマーについて記述されるが、この記述は、当業者には明らかとなる変更を適宜加えることにより、あらゆるイオンおよび溶質に等しく適用されることが理解される。本明細書中において使用される場合、ポリマーがイオン(陰イオンなど)に「結合する」、またはイオンと会合する場合には「イオン結合性」ポリマーである(「リン酸イオン結合性」ポリマーなど)という場合は、通常必ずしも非共有結合である必要はなく、ポリマーが用いられるin vitro条件およびin vivo条件下で、イオンを溶液あるいは体内から除去する効果を利用するのに充分な時間、少なくとも一部のイオンが結合したままであるのに充分な強度を有していればよい。「標的イオン」はポリマーが結合するイオンのことで、通常はポリマーが結合する主要イオンであるか、または、ポリマーへの結合が、そのポリマーの治療効果を生み出すと考えられるイオンのことを指す。ポリマーは、複数の標的イオンを有することがある。陰イオンの「結合」とは、最小限の結合より多いもの、言い換えれば、ポリマー1g当たり少なくとも0.01mmolの陰イオン、さらに好ましくはポリマー1g当たり少なくとも0.05mmolの陰イオン、もっと好ましくはポリマー1g当たり少なくとも0.1mmolの陰イオン、最も好ましくはポリマー1g当たり少なくとも0.5mmolの陰イオンが結合する場合である。本発明は、陰イオンと選択的に結合する特徴を有するポリマーを提供する。例えば、いくつかの実施態様において、本発明のポリマーは胆汁酸に対して約2mmol/g未満、好ましくは約1mmol/g未満、もっと好ましくは約0.5mmol/g未満、さらに好ましくは約0.3mmol/g未満、最も好ましくは約0.1mmol/g未満の結合能を有する。いくつかの実施態様において、本発明のポリマーはクエン酸イオンに対して、約2mmol/g未満、好ましくは約1mmol/g未満、さらに好ましくは約0.5mmol/g未満、さらにより好ましくは約0.3mmol/g未満、最も好ましくは約0.1mmol/g未満の結合能を有する。
【0034】
(A. 特性)
本発明のポリマーは、次の特性のうち1つまたは複数によって特徴付けられる:1)低膨潤率、2)生理学的条件の下で、結合干渉率が低い、3)標的陰イオンは結合するが、阻害溶質は排除される適切な細孔度、4)治療用途において有効であるために充分な、標的陰イオンに対するin vivo結合能。いくつかの実施態様において、ポリマーは、陰イオン結合性ポリマー(例えば、リン酸イオンおよび/またはシュウ酸イオンを結合するポリマー)であり、このポリマーは、次の特徴のうち少なくとも2つによって特徴付けられる:1)膨潤率は約5未満、2)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分がゲル重量の約20%未満であり、3)非干渉性緩衝液と比した胃腸内模擬液の標的イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、ポリマーは、次の特徴のうち少なくとも1つによって特徴付けられる、リン酸イオン結合性ポリマーである:1)膨潤率は約5未満、好ましくは2.5未満、2)生理学的媒体中で測定されたゲル細孔体積分布において、約200よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満であり、3)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉率は、約60%未満である。いくつかの実施態様において、リン酸イオン結合性ポリマーの膨潤率は、約2.8未満、または約2.7未満、または約2.6未満である。「生理学的媒体」は、等張性でありかつ中性pHの媒体である。いくつかの実施態様において、本発明は、膨潤率(中性pHの等張性溶液中で測定)が約5未満、好ましくは2.5未満によって特徴付けられ、リン酸のin vivo結合能平均が約0.5mol/gよりも大きい特徴を有していても
よい、リン酸イオン結合性ポリマーを提供する。いくつかの実施態様において、リン酸イオン結合性ポリマーの膨潤率は、約2.8未満、または約2.7未満、または約2.6未満である。いくつかの実施態様において、本発明のポリマーは、胆汁酸に対して、約2mmol/g未満、好ましくは約1mmol/g未満、より好ましくは約0.5mmol/g未満、さらにより好ましくは約0.3mmol/g未満、最も好ましくは約0.1mmol/g未満の結合能を有する。いくつかの実施態様において、本発明のポリマーは、クエン酸イオンに対して、約2mmol/g未満、好ましくは約1mmol/g未満、より好ましくは約0.5mmol/g未満、さらにより好ましくは約0.3mmol/g未満、最も好ましくは約0.1mmol/g未満の結合能を有する。好ましくは、ポリマーは、アミンモノマーから作られる。
【0035】
一般に、これらの特徴は、ポリマー製造の際に1つまたは複数の要素を変えることによって達成される。
【0036】
(1)膨潤率) 本発明のポリマーは、架橋された物質である。これは、本発明のポリマーが溶媒には溶けず、せいぜい溶媒中で膨潤するだけであることを、意味する。
【0037】
生理学的等張性緩衝液中(消化管内などの使用環境を代表)での膨潤率は、通常約1.2〜約100の範囲であり、好ましくは約2〜20である。いくつかの実施態様において、本発明のポリマーの膨潤率は、約5未満、または約4未満、または約3未満、または約2.8未満、または約2.7未満、または約2.6未満、または約2.5未満である。明細書中で「膨潤率」とは、水溶液環境で平衡に達した状態で、1グラムの乾燥した架橋ポリマーが吸収する溶媒のグラム数である。所定のポリマーについて膨潤率を複数回測定した場合は、その測定値の平均をとって膨潤率とする。
【0038】
膨潤率は、さまざまな方法を使用して測定することができる。最も好ましい方法は重量測定法であり、これは乾燥ポリマーの重量を測定し、過剰な量の液体に加える。場合によっては、この液体は蒸留水が用いられることもあるが、好ましくは血漿と等浸透圧の水溶液を用い、最も好ましくは血漿と等張性でかつ中性pHの水溶液を用いる。例えば、0.9%NaCl溶液が使用され得る。リン酸緩衝化生理食塩水(PBS)も使用され得る。膨潤率測定に最も好ましい生理学的媒体は、0.9% NaCl溶液であって、pHを約6.5〜約7.5にするために30mMのMESを加えたものである。乾燥ポリマー(リン酸イオン結合性ポリマーなど)は通常、塩化物イオンなどの対イオンによって完全にプロトンが付加された形態で使用される。ポリマーは、平衡に達するまで液体に浸す。浸ったゲルを遠心分離にかけ、上澄みを別容器に移し、湿潤ゲルの重量を測定する。遠心分離にかける際は、gが高すぎてゲルを壊してしまわないよう、注意が必要である。膨潤率(SR)は、湿潤ゲルの重量から乾燥ポリマーの重量を引き、これを乾燥ポリマーの重量で割って算出する。
【0039】
もうひとつの方法が染料法である。この方法においては、非常に大きな分子量の、ゲルと反応しないことがわかっている染料を水溶液として調製し、乾燥ポリマーを一定量ずつ溶液に追加していく。ポリマーに対する溶液の重量比が、互いに近くなるように、かつ、予測される膨潤率よりもわずかに高くなるように、調整する。染料は、非常に分子量が大きい(例えば200,000g/molより大きい)ため、ゲルの中に水は浸透するが、染料は浸透しない。この結果、染料濃度が増大し、これから膨潤率が測定される。有用な染料の例は、フルオレセインイソチオシアネート(FITC)で改変したデキストランである。
【0040】
ポリマーの膨潤率は、温度、イオン強度、ポリマー電荷密度、ポリマー−溶媒間Flory−Huggins係数、架橋密度などのさまざまな変数に依存している。本発明のイ
オン結合性ポリマーは、ほとんどが荷電したポリマーである(例えば、リン酸イオン結合ポリアミンは、腸内pHでプロトン化した状態である)ので、その膨潤作用は、高分子電解質ゲルに典型的である。膨潤率と細孔サイズとにはある程度の相関関係はある(すなわち、膨潤率が高い場合は、通常は、細孔サイズが大きい場合が多い)が、高分子電解質ゲルの除外限界を正確に予測できる理論的根拠はない。
【0041】
(2)結合干渉率) いくつかの実施態様において、本発明のポリマーは、胃腸(GI)内模擬液において測定した場合、結合干渉率が約70%未満、より好ましくは約60%未満、さらに好ましくは約50%未満、さらに好ましくは約40%未満、さらに好ましくは約30%未満、最も好ましくは約20%未満である。本発明のリン酸イオン結合性ポリマーは、胃腸内模擬液において測定した場合、結合干渉率が約70%未満、より好ましくは約60%未満、さらに好ましくは約50%未満、さらに好ましくは約40%未満、さらに好ましくは約30%未満、最も好ましくは約20%未満を示す。
【0042】
本明細書中で使用される場合、「結合干渉率」または「結合干渉」とは、標的イオンの結合能が部分的に低下する度合パーセントで表わすもので、この低下は、非干渉性緩衝液中での結合実験と、胃腸(GI)内模擬液での結合実験との間で、平衡状態にある同じ標的陰イオン濃度で観察される。本明細書中で使用される場合、「非干渉性緩衝液」とは、標的イオンの結合に干渉する1種以上の溶質が含まれておらず、かつ、胃腸内模擬液と同じpHに調整されている、緩衝液を指す。非干渉性緩衝液は、必ずしも、干渉性の溶質を一切含んでいないわけではない。例えば、非干渉性緩衝液には、胃腸内のいたるところに存在する塩化物イオンおよび重炭酸イオンのうちの一方もしくは両方が含まれていることがあり、これらは、存在する場合には、生理学的濃度になる可能性がある。非干渉性緩衝液の例を、例1に示す。本明細書中で「胃腸(GI)内模擬液」とは、食事消化後の消化管の部分環境に似せるように設計された調整液を指し、好ましくは、標的イオンの大半をポリマーが結合できる消化管の部分環境に似せるように設計された調整液を指す。胃腸内模擬液は、代表的には、実施例1に示す方法で調製する。標的イオンは、非干渉性緩衝液の検討と同じ濃度で胃腸内模擬液で存在させるようにする。阻害率は、図1において示されるように、2つの対応する結合等温線(すなわち、胃腸内模擬液と非干渉性緩衝液とにおける結合等温線)をプロットすることにより、容易に得られる。胃腸内模擬液を用いた結合干渉の測定例を、実施例1に示す。
【0043】
被験体(好ましくはヒト対象者)から採取した消化吸引物中における標的イオンの結合を、非干渉性緩衝液における標的イオンの結合と比較することにより、結合干渉率を測定することも可能である。この測定を行う場合は、吸引物は数多くの被験体から採取し、阻害率の平均をとって結合干渉率とすべきである。
【0044】
膨潤率の選択および/またはゲルの分子量排除限界の調整を注意深く行うことにより、競合的状態(すなわち、in vivoや胃腸内模擬液中など)で測定される結合能は、ゲル細孔度を最適化していない同じポリマー組成の他のゲルに比べ大幅に向上され得ることが見出されている。
【0045】
顕著なことには、架橋および/またはもつれの多いポリマーは、そうでないポリマーに比べて膨潤率が低いことが見出されたが、このようなポリマーはまた、標的イオン(リン酸イオンなど)に関する結合能は架橋および/またはもつれの少ないポリマーに比べて同等以上であった。理論によって拘束されることは望まないが、本発明のポリマーは、篩分け効果を発揮し、溶液内の特定サイズの溶質だけと結合し、それより大きな他の溶質種(従来はポリマー内の結合部位と競合していたもの)は排除される、と仮説が立てられる。分子量の大きい種としては、無機・有機の陰イオン、オリゴペプチド類、炭水化物、ビリルビン、脂質ミセル、脂質小胞などが挙げられるが、これらに限定はされない。
【0046】
(3)細孔度) 干渉物質を排除し、標的イオン(陰イオンなど)を結合するのに適切な細孔度を最適に示すようポリマーを製造する工程を操作することは可能であることが、見出されている。
【0047】
ポリマーゲルの細孔サイズ分布は、水銀細孔測定法や窒素吸着法、示差走査熱量測定法、溶質浸透分配技法などのさまざまな方法で得られる。最後の溶質浸透分配技法は、使用環境と同様の完全水和状態でゲルを調べるので、最も好ましい。溶質浸透技法は、Kuga(KugaS.J,J.of Chromatography,1986,206:449−461)によって提示された間接的手法であり、分子量が既知の溶質のゲル分配測定から成っている。この手法は、次の3つの工程からなる(Kremer et al.,Macromolecules,1994,27,2965−73):
− 1.分子サイズが既知の溶質を既知の濃度で溶かした溶液各種を、膨潤したゲルに接触させる。溶質の分子サイズは、幅広い範囲をカバーするようさまざまな種類を揃えなければならない。
− 2.ゲル中に溶質が分散する。特定の溶質の分配は、溶質サイズおよびゲル細孔のサイズ分布に依存する。
− 3.ゲルとその周囲の溶液を分離し、当該周囲の溶液中に含まれる溶質の濃度を測定する。最初のストック溶質濃度に比較して、各溶質濃度が低下している分が、ゲル細孔サイズ分布の算出に使用される。
【0048】
サイズ排除効果を分子引力効果/分子反発効果と区別するために、溶質は、ゲルポリマーとほとんど反応しないかまたは全く反応しないポリマーやオリゴマーの中から選択する。中性親水性ポリマーであり分子量分布が狭いポリエチレングリコールやポリエチレンオキシド、デキストランなどが最も適している。よって、特に記載のない限り、溶質の特定サイズ排除の体積(本明細書中で「臨界浸透体積」とも呼ばれる)は、測定に使用されるポリマーと実質的に反応しない溶質を使用して測定された体積を指す。
【0049】
Kremer et al.(Macromolecules,1994,27,2965−73)に記載されている実験プロトコルとデータ処理に従って、細孔分布が図2に示され得る。図2において、Y軸は、所定の分子サイズの溶質に利用できない膨潤ゲルの体積を示す。図面において示される実施例において、5オングストロームより小さいサイズの低分子は、ゲル全体に浸透し得る。一方、1000オングストロームよりも大きい流体半径のポリマーは、ゲルから完全に排除される。この場合、利用できない体積と、平衡にあるゲル体積とは同じである。
【0050】
ポリマーのサイズと分子量は、Mark−Houvinkの式の関係を有する。この式は、分子プローブとして使用されたポリマー溶質について、表に示す。例えば:
半径(オングストローム)=0.217M0.498 デキストラン
半径(オングストローム)=0.271M0.517 ポリエチレングリコール
半径(オングストローム)=0.166M0.573 ポリエチレンオキシド。
【0051】
低分子量プローブは、次のように使用できる:
尿素:分子半径2.5オングストローム
エチレングリコール:分子半径2.8オングストローム
グリセロール:分子半径3.1オングストローム
グルコース:分子半径4.4オングストローム
蔗糖:分子半径5.3オングストローム。
【0052】
よって、溶質のサイズは分子量に換算でき、その逆も可能である。
【0053】
溶質のサイズは、細孔のサイズとは等しくはない。もし等しいとしたら、これは、分子サイズが溶質よりも大きい細孔内に存在する液体すべてが、アクセス可能な体積として利用可能であることを意味する。排除体積効果(あるいは壁効果とも言われる)があるため、これは正しくない。
【0054】
分子排除を特徴付けるのは、簡単にまとめると、(i)分子プローブの分配の定量、(ii)上記に従った、利用可能体積(または重量)の算出、(iii)ゲル合計体積(または重量)に対する標準化、の3つである。
【0055】
好ましい分子排除限界は、ポリマー鎖のもつれと架橋密度などの製造時の変数を調整することによって達成される(下記参照)。一般に、ポリマーは、結合するイオン(陰イオンなど)や、排除したいと考えられる阻害物質の推定される性質、ならびに意図されるポリマー用途において許容可能な膨潤率に基づいている、分子排除限界を有するように生成される。本発明のいくつかの実施態様では、イオン結合性ポリマーは、上記プロトコルに従って決められたゲル細孔体積分布(臨界浸透体積)を示し、これは、生理学的媒体中で測定された標的陰イオンの約2倍よりも大きい分子量を持つ非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満を示す。本発明のいくつかの実施態様では、イオン結合性ポリマーは、分子量が標的陰イオンの1.8倍よりも大きい非反応性溶質が利用し得る体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満のゲル細孔体積分布(臨界浸透体積)を示す。本発明のいくつかの実施態様では、イオン結合性ポリマーは、分子量が標的陰イオンの1.6倍よりも大きい非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満のゲル細孔体積分布(臨界浸透体積)を示す。本発明のいくつかの実施態様では、イオン結合性ポリマーは、分子量が標的陰イオンの1.4倍よりも大きい非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満のゲル細孔体積分布(臨界浸透体積)を示す。本発明のいくつかの実施態様では、イオン結合性ポリマーは、分子量が標的陰イオンの1.2倍よりも大きい非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満のゲル細孔体積分布(臨界浸透体積)を示す。実施態様において、本発明では、上記プロトコルに従って決められ、そして、分子量が約200よりも大きく、好ましくは約180よりも大きく、より好ましくは約160よりも大きく、もっと好ましくは約140よりも大きく、最も好ましくは約120よりも大きい非反応性溶質が利用可能な体積がポリマー細孔体積の約60%未満、または約40%未満、または約20%未満の生理学的媒体中で測定されるゲル細孔体積分布(臨界浸透体積)を提供する、リン酸イオン結合性ポリマーを提供する。
【0056】
(4.結合能) 本明細書中に記載されているポリマーは、イオン結合性を示し、一般的には陰イオン結合性を示す。好ましい実施態様では、ポリマーは、リン酸イオン結合性を示す。イオン(リン酸イオンなど)結合能は、イオン結合剤が所定の溶液内で結合できる特定イオンの量の尺度である。例えば、イオン結合性ポリマーの結合能は、in vitro(水中や生理食塩水中など)、またはin vivo(イオン(リン酸イオンなど)の尿排出など)、またはex vivo(実験動物や患者、志願者から採取した糜粥などの吸引液などを使用する)において測定することができる。標的イオンだけを含む溶液中、または少なくとも他にポリマーとの結合を標的イオンと競合する競合溶質が存在しない溶液中で測定することができる。この場合は、非干渉性緩衝液を使用する。また別法として、樹脂との結合を標的イオンと競合する他のイオンや代謝産物などの競合溶質が存在する溶液中で測定することができる。
【0057】
ポリマーのイオン結合能は、V*(Cstart−Ceq)/P(単位mmol/gで
表わす)として算出され得る。ここでVは使用溶液の一定体積(単位L)、Cstartは溶液中の最初の標的イオン濃度(単位mM)、Ceqは、ポリマー重量P(単位g)が追加されて平衡に達するのを待った後の、平衡時の溶液中の標的イオン濃度(単位mM)である。
【0058】
いくつかの実施態様において、ポリマーはリン酸イオンと結合する。In vivoで使用する場合、例えば高リン酸血症の治療では、リン酸イオン結合能の高いポリマーが望まれる。結合能のin vitro測定は、必ずしもin vivo結合能にそのまま解釈されるわけではない。よって、In vitro能力とin vivo能力の両方の結合能を規定することが実際に役に立つ。
【0059】
本発明のポリマーの、非干渉性緩衝液中におけるin vitroのリン酸イオン結合能は、約0.5mmol/g、約1.0mmol/g、約1.5mmol/g、約2.0mmol/g、約2.5mmol/g、約3.0mmol/g、約3.5mmol/g、約4.0mmol/g、約5.0mmol/g、約6.0mmol/g、約8.0mmol/g、または約10.0mmol/gよりも大きいものであり得る。いくつかの実施態様において、標的イオンに関する本発明のポリマーのin vitroリン酸イオン結合能は、約0.5mmol/gよりも大きく、好ましくは約2.5mmol/gよりも大きく、さらに好ましくは約3mmol/gよりも大きく、もっと好ましくは約4mmol/gよりも大きく、さらにより好ましくは約6mmol/gよりも大きい。いくつかの実施態様において、リン酸イオン結合能は約0.5mmol/g〜約10mmol/gの範囲にすることができ、好ましくは約2.5mmol/g〜約8mmol/g、さらに好ましくは約3mmol/g〜約6mmol/gの範囲であり得る。リン酸イオン結合能を測定するテクニックは、いくつか知られている。本発明のポリマーのin vitroリン酸イオン結合能は、非干渉性緩衝液中の結合能の測定方法について実施例1において記載されるようにして測定される。
【0060】
いくつかの実施態様において、本発明のリン酸イオン結合性ポリマーの、ex vivoでの平均リン酸イオン結合能は、人間被験者から得た消化吸引物における測定で、約0.2mmol/g、約0.3mmol/g、約0.4mmol/g、約0.5mmol/g、約0.6mmol/g、約0.7mmol/g、約0.8mmol/g、約0.9mmol/g、約1.0mmol/g、約1.2mmol/g、約1.4mmol/g、約1.6mmol/g、約1.8mmol/g、約2.0mmol/g、約2.5mmol/g、約3.0mmol/g、約4.0mmol/g、約5.0mmol/g、または約6.0mmol/gよりも大きい。体外吸引物は、実施例1に記述されているように、正常な被験者から得られ、結合は非干渉性緩衝液に関して測定される。平均値は、被験者約5人〜約15人、または約15人〜約30人、または約30人〜約60人から得られる。いくつかの実施態様において、測定は被験者6人〜12人から得られる。
【0061】
本明細書中で使用される場合、「平均in vivoリン酸イオン結合能」とは、特記されている場合を除き、正常な人間の被験者で測定されたポリマー結合能を指し、このポリマーのリン酸イオン結合は、尿中のリン酸イオン排出量の減少分と、遊離リン酸イオンおよびポリマー結合リン酸イオンとして便中に排出されたリン酸イオンの測定値を合わせて得られる(下記参照)。平均値は、被験者約5人〜約15人、または約15人〜約30人、または約30人〜約60人から得られる。いくつかの実施態様において、測定は被験者6人〜12人から得られる。いくつかの実施態様において、好ましくは人間の被験者で測定された本発明のポリマーの平均in vivoリン酸イオン結合能は、少なくとも約0.3mmol/g、少なくとも約0.5mmol/g、少なくとも約0.8mmol/g、少なくとも約1.0mmol/g、少なくとも約1.5mmol/g、少なくとも約2.0mmol/g、少なくとも約3.0mmol/g、少なくとも約4.0mmol/
g、少なくとも約5.0mmol/g、または少なくとも約6.0mmol/gである。
【0062】
ポリマーのin vivo結合能は、哺乳類、好ましくは人間における標的イオン(リン酸イオンなど)のバランスを測定することによって、望ましく測定され得る。被験体に、リン酸イオン量を調整した食事と結合ポリマーを与え、リン酸イオンの摂取量と、尿および便に排泄されるリン酸イオンの量をモニターする。この研究は、腸内の洗浄期間、次いで被験体が日用量(好ましくはリン酸イオン結合剤を1日3回)を摂取する期間、次いで数日間治療なしで、ベースラインに戻るのを確認する。尿中のリン酸イオンの低下分は、通常、便のリン酸イオンの増加分と一致する。便中に排出されたリン酸イオンのモル数からベースライン分を差引き、投与された結合剤の重量で割ると、in vivo結合能の尺度が得られる。特記されない限り、本明細書中で言及される「in vivo」測定は、上記プロトコルを利用する。もうひとつの手法は、実施例1に示されているプロトコルに従ってin vivoとin situのリン酸イオン結合を測定することからなる。この手法では、哺乳動物にダブルルーメンチューブを挿管し、小腸の特定部位から糜粥を採取する。所定のリン酸量を含む食事と共に、既知量のリン酸イオン結合剤とマーカーを与える。マーカーは、染料または非吸収性ポリマー(ポリエチレングリコールなど)であり得、これを糜粥で滴定して、消化プロセスの間に生じる希釈度を測定する。これで、食事中の最初の濃度と、マーカー実験によって測定された希釈度から、結合剤の正確な濃度を算出する。糜粥サンプルについて、総リン酸イオン量を分析する。「可溶性」リン酸イオンは、サンプルを遠心分離にかけ、上澄みを別容器に移し、リン酸イオン量を分析することによって測定される。「結合」リン酸イオンの量は、総リン酸イオン量から可溶性リン酸イオンを差し引いて得られる。被験体(6〜12)のグループに対して2シリーズの実験を行い、それぞれプラセボ(微結晶性セルロース)または薬剤のいずれかを服用する。結合能は、2シリーズの実験(すなわち、薬剤投与のあるものとないもの)の間で「結合」リン酸イオンの増加分を測定し、これを結合剤の濃度で割ることによって算出される。計算は、被験者ごと、またはグループ単位のいずれでも行うことができる。
【0063】
(B. ポリマーの調製)
本発明のポリマーは、当業者に知られている手法によって調製される。例えば、イオン結合モノマーやその前駆物質を、架橋剤の存在下で共重合させることができる、前もって製造したイオン結合性ポリマーを、化学反応や放射線照射によってさらに架橋を進める、あるいは、ポリマー前駆物質をまず架橋し、さらにポリマー上にイオン結合官能基を導入する反応を行う。
【0064】
ポリマーは、直接懸濁重合や逆懸濁重合、乳化重合、沈殿技法、エアロゾル重合、バルク重合/架橋法を使用し、押出しや粉砕などのサイズ縮小工程も利用して得られる。これらの工程は、バッチ工程、準連続工程、連続工程のいずれでも実施できる。
【0065】
膨潤率、結合干渉率、結合能、分子量排除限界は、少なくとも次のような組成およびプロセス変数によって影響を受ける:
1−ポリマー鎖の化学的架橋の密度。
【0066】
2−架橋反応での、(モノマー+架橋剤)の溶媒に対する比率。
【0067】
3−ポリマーの有効電荷(使用される環境における生理学的pHおよび等張性において)。
【0068】
4−主鎖ポリマーの親水性/疎水性のバランス。
【0069】
5−コア−シェル構造の有無。シェル成分は、コア物質の膨潤度を制限する。
【0070】
下記で、組成変数とプロセス変数の好ましい使用範囲が、リン酸イオン結合特性を有する架橋ポリアミン材質について例示される。これらは典型的条件のものだけを取りあげており、本明細書中に記載されている方法は、当業者には明らかなように、溶質を幅広く結合するポリマーの選択・製造に使用され得ることが、理解される。
【0071】
(1)ポリマー鎖の化学的架橋の密度 化学的架橋密度は、ポリマーの膨潤特性と細孔分布を制御する重要な性質である。本発明のポリマーを説明するのに便利な方法のひとつは、アミン繰り返し単位と、ポリマーの残り部分の平均結合数を定義することである。ここで「A」はアミン繰り返し単位として定義され、「NC」はAからの平均結合数を示す。NCは2、3、4またはそれ以上になり得る。不溶性ゲルを製造するためには、NCは通常、2よりも大きくなる。
【0072】
NC値は、下記の式に示すように、アミン対架橋剤の化学量比で表わされ得る:
低分子量モノマー(例えばN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンや1,3−ジアミノプロパン)については、NC=B・Fb/Aとなる。ここでBは架橋剤のモル数、FbはAと反応して共有結合するBの反応基の数、Aはアミンのモル数である。
【0073】
ビニルアミン、ポリエチレンイミン、ポリビニルアミン、ポリアリルアミンなど、アミン物質が高分子量であり、アミンモノマーの重合によって得られたものである場合は、モノマーをつなぐ2結合がポリマー主鎖中で繰り返されるため、化学式が変わってくる。NCはNC=(2・A+B・Fb)/Aの式で表わされる。
【0074】
逆に、架橋剤とアミンのモル比は、上の式を使用することにより、望ましいNC値から算出できる:
低分子量アミン:
B/A=NC・Fb
高分子量アミン:
B/A=(NC−2)・Fb。
【0075】
下記の表は、NCと実際の架橋剤対アミン比との間の換算例である。ここでアミンは高分子量物質または低分子のいずれかであり、架橋剤は二官能性架橋剤または三官能架橋剤のいずれかである。
【0076】
【化3】

(a):B/A=NC/Fb
(b):B/A=(NC−2)/Fb。
【0077】
驚くべきことに、結合選択性(これがin vivoでの効力に反映される)は、NCにより最適となることが見出された。NC値範囲の低い側においては、そのポリマー物質はかなりの程度膨潤する傾向があり、結果として、胃腸内模擬液中で強い結合干渉を示した。しかしNC値範囲の高い側においては、そのポリマー物質の固有結合能は大幅に低くなり、明らかなin vivoにおける全体的パフォーマンスの低下をもたらした。最適なNC値は、アミン/架橋剤の系に応じて、2.05〜5の間になることが見出された。
【0078】
しかしながら、最終ポリマーの特性を望ましい組合せにするための最適範囲は、使用する特定のモノマーや架橋剤、製造方法に使用する条件(例えば反応媒質中のモノマー初期濃度など)に依存し、慣用的実験により見出していく問題である。
【0079】
いくつかの実施態様において、ポリマー中の、架橋剤のモノマーの、総アミン基に対する比は、50mol%よりも大きく、60mol%よりも大きく、70mol%よりも大きく、80mol%よりも大きく、または、90mol%よりも大きい。
【0080】
1種以上の低分子量アミンモノマーと1種以上の架橋剤から成るリン酸イオン結合性ポリマーを提供する本発明のいくつかの実施態様において、NCは、約2よりも大きいか、または約3よりも大きいか、または約4よりも大きい。いくつかの実施態様において、ポリマーは、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマー(低分子量モノマー)をエピクロロヒドリン(Fb=2)で架橋して生成されたものであり、ここでB/Aは約2.0(mol/mol)〜約3.0(mol/mol)(すなわち、NCは約4〜約6)、または約2.3(mol/mol)〜約2.7(mol/mol)(すなわち、NCは約4.6〜約5.4)、または約2.5(mol/mol)(すなわち、NCは約5.0)である。いくつかの実施態様において、ポリマーは、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマーをエピクロロヒドリンで架橋して製造されたものであり、ここでモノマー対水の初期比率は、約3:1(重量/重量)〜約1:3(重量/重量)、または約1.5:1(重
量/重量)〜約2:1(重量/重量)、または約1:1、または約3:1であり、そしてB/Aは、約2.0(mol/mol)〜約3.0(mol/mol)(すなわち、NCは約4〜約6)、または約2.3(mol/mol)〜約2.7(mol/mol)(すなわち、NCは約4.6〜約5.4)、または約2.5(mol/mol)(すなわち、NCは約5.0)である。
【0081】
(2)架橋反応での、(モノマー+架橋剤)の溶媒に対する比率 他のすべての条件を一定に保った場合、溶媒に対する(モノマー+架橋剤)の比率を高くすると、架橋密度の高い材質ができる。例えば、高分子量アミンを使用し、主鎖の長さとポリマー濃度が充分に大きい場合、鎖のもつれが生じ、化学的に架橋構造ができた後で、多くの架橋ノードが生成される。より一般的には、高分子量アミンと低分子量アミンの両方について、溶媒に対する(モノマー+架橋剤)の高い比率は、ゲル欠陥(例えば、鎖内の架橋により環状構造が生じたり、不完全な架橋反応により末端がもつれたりするなど)を引き起こす副反応の度合を最小限にする。
【0082】
この条件は主に、モノマー(アミンなど)と架橋剤との両方の反応媒質中濃度によって決まる。本発明のいくつかの実施態様において、モノマーと架橋剤との両方の反応媒質中濃度は、約20重量%よりも大きく、好ましくは約40重量%よりも大きく、さらに好ましくは約60重量%よりも大きい。いくつかの実施態様において、(モノマー+架橋剤):溶媒(水など)の比は、約3:1(重量/重量)〜約1:3(重量/重量)の間が用いられる。いくつかの実施態様において、(モノマー+架橋剤):溶媒(水など)の比は、約3:1(重量/重量)〜約1:1(重量/重量)の間が用いられる。いくつかの実施態様において、(モノマー+架橋剤):溶媒(水など)の比は、約3:1(重量/重量)、または約2.5:1(重量/重量)、または約2.0:1(重量/重量)、または約1.5:1(重量/重量)、または約1:1(重量/重量)が用いられる。架橋剤は、重合手順によって、さまざまなタイミングで添加され得る。いくつかの実施態様では、最初のモノマー:溶媒比率(架橋剤を添加する前)は、約4:1〜約1:1、または約3:1〜約1:1である。その後、最初のモノマー含有量の約100mol%〜約400mol%、または最初のモノマー含有量の約200mol%〜約300mol%の架橋剤を含むように、添加する。いくつかの実施態様では、モノマーはN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンモノマーであり、架橋剤はエピクロロヒドリンであり、最初のモノマー:水の比率は約4:1〜1:1、または約3:1〜約1:1、または約1.7、または約1.73である。架橋剤は、モノマー含有量の約200mol%〜約300mol%、または約230mol%〜約270mol%、または約250mol%になるまで添加する。
【0083】
いくつかの実施態様(例えばモノマーがポリアリルアミンである実施態様)において、モノマーの量は架橋剤量よりもずっと大きく(モルベースで架橋剤の10倍、重量ベースではさらに大きい)、上記比率は、架橋剤を無視し、モノマー:溶媒の比率として表現し得る。いくつかの実施態様において、モノマー(ポリアリルアミンなど)は、モノマー:溶媒の比が約3:1〜約1:3で存在する。いくつかの実施態様において、モノマーはポリアリルアミンであり、架橋剤はエピクロロヒドリンであり、ポリアリルアミンは、モノマー:溶媒の比が約3:1〜約1:3で存在し、エピクロロヒドリンは総ポリアリルアミン含有量の約10mol%になるよう反応混合物に加えられる。
【0084】
可能であれば、無溶媒プロセスがさらに好ましい:ある実施態様において、アミンと架橋剤を素早く混合した後、水などの連続層にそのまま分散させる。架橋反応は分散した液滴の中で起こり、ビーズ状のポリマーとして回収される。
【0085】
(3)ポリマーの有効電荷(生理学的pHと浸透圧における) ポリマーの有効電荷は
、イオン結合のモル含有量、固有電荷、生理学的pHでのイオン化度によって得られる。電荷密度は、好ましくは3mmol/g〜20mmol/g、さらに好ましくは6mmol/g〜15mmol/gの範囲である。
【0086】
(4)主鎖ポリマーの親水性/疎水性のバランス ポリマーの親水性/疎水性のバランスをとることにより、化学的架橋密度と膨潤率をある程度独立してコントロールすることができる。膨潤率は、Flory−Hugginsの式(Flory P.J.”Principles of Polymer Chemistry,Cornell Ithaca Pub.1953)に記載されているように、ポリマー溶媒相互反応パラメータχijに非常に敏感に左右される。χij値が0.4以上に増大すると、ポリマーに対する溶媒状態が悪くなり、モノマーと溶媒(水)との相互反応が最小限になるようにされ、従って膨潤率がずっと下がる。これは、ゲルに、長鎖疎水基、(ポリ)芳香環置換基、フッ素化基などを組み込むことによって達成することができる。この戦略により膨潤度をコントロールし、その結果としてゲルの排除限界をコントロールしたとき、疎水性モノマーと架橋剤の濃度は、約0.5mol%〜約50mol%、好ましくは約20%〜約50%となる。
【0087】
好ましい方法においては、モノマーのlog Pの絶対差によって絶対疎水性が定量化される。定量的に、モノマーの疎水性/親水性の性質は、各モノマーのlog Pによって決定され得、これは時に、オクタノール−水分配係数と呼ばれる。log P値は周知であり、水/1−オクタノールの分離混合物中におけるモノマーの濃度を測定する標準的なテストに従って決定される。特に、個々のモノマーについてlog P値を見積るコンピュータプログラムが市販されており、インターネットでも得られる。本願におけるlog P値のいくつかは、ウェブサイトhttp://esc.syrres.com/interkow/kowdemo.htmで見積りを行った。このサイトでは、CAS登録番号や化学名を入力するだけで、分子のlog P値見積りが得られる。疎水性モノマーは通常、log P値がゼロより大きく、親水性モノマーは通常、log P値がゼロ近く、またはゼロより下である。一般に、本発明の目的に合った疎水性モノマーのlog
Pは少なくとも約0.5、より好ましくは少なくとも約0.75、なおより好ましくは少なくとも約1.0、さらにより好ましくは少なくとも約1.5、最も好ましくは少なくとも約2であるべきである。
【0088】
5)コア−シェル構造の存在。シェル部分は、コア物質の膨潤度を制限する。コア−シェル形態をもつゲル粒子は、本発明の趣旨において有用である:シェル物質は、コア物質(シェルなしではずっと大きな程度まで膨潤する)からの膨潤圧力に対する機械的抵抗力を付与することによって膨潤を制限することができ、従って排除限界を限定できる。シェル物質は、コアと同じ組成にすることができるが、架橋密度は高くする。このようなコア−シェル物質の設計とその生成方法は、米国特許出願第10/814,789号に見られ得る。
【0089】
シェル物質は、化学的にコア物質に固定され得るか、または物理的にコーティングされ得る。最初の方法では、例えば次のような化学的方法で、シェルがコア成分上に生成され得る:コアポリマーに固定された活性部位からのリビング重合法を使用してコアにシェルポリマーの化学的グラフトを行う方法;界面反応(すなわち、界面縮重合のようなコア粒子表面での化学反応)の方法、およびコア粒子合成中に懸濁剤としてブロックコポリマーを使用する方法。
【0090】
化学的方法を使用する場合は、界面反応とブロックポリマーの使用が好ましい。界面反応経路においては通常、コア界面で小分子または高分子を反応させることによってコア粒子の表面が化学的に修飾される。例えば、アミンを含むイオン結合コア粒子は、エポキシ
やイソシアネート、活性化エステル、ハロゲン基などのアミンと反応性の基を含むポリマーと反応させることにより、コア表面に架橋したシェルを形成する。
【0091】
他の実施態様においては、シェルを最初に調製する。すなわち界面重縮合や溶媒コアセルベーションを使用して、カプセルを製造する。次にカプセルの内部にコア形成の前駆物質を充填し、シェルカプセル内でコアを構築する。
【0092】
いくつかの実施態様では、ブロックコポリマーアプローチを使用して、両親媒性のブロックコポリマーを懸濁試薬として用い、逆懸濁または直接懸濁の粒子形成プロセスでコア粒子を形成する。油中水型の逆懸濁プロセスを使用する場合、ブロックコポリマーが連続的油相に溶ける最初のブロックとなり、別の親水性ブロックにはコアポリマーと反応できる官能基が含まれる。コア形成前駆物質と共に水相に加え、次に油相に加えると、ブロックコポリマーは油中水界面に集まり、懸濁剤として作用する。親水性ブロックはコア材料と反応するか、またはコア形成前駆物質と共反応する。粒子を油相から分離すると、ブロックコポリマーは、共有結合でコア表面に固定された薄いシェルを形成する。ブロックの化学的性質と長さは、目的の溶質に対するシェルの浸透特性を変えるために、変更することができる。
【0093】
シェル材料がコア材料に物理吸着している場合、溶媒コアセルベーションや液化ベッドスプレーコーター、マルチエマルジョンプロセスなどのマイクロカプセル化技術として周知のテクニックを使用することができる。マイクロカプセル化の好ましい方法は、Wurster構成の液化ベッドスプレーコーターである。また別の実施態様において、シェル材料は、口や食道にある間のコア粒子膨潤を遅らせるために一時的にのみはたらくものであり、必要に応じて胃や十二指腸で分解する。シェルは、疎水性が高く、水浸透性が非常に低い液体の層を形成することによって、コア粒子に水が浸透するのを妨げるようなものを選ぶ。
【0094】
ゆえに、本発明は一態様において、モノマーと架橋剤から成るイオン結合性ポリマーの選択方法を提示し、ここでこのポリマーは次の特徴のうち少なくとも1つをもつ:a)膨潤率は5未満、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。これは、次の工程を含む:
i)次の組成およびプロセス変数を変える
1)モノマーに対する架橋剤の比率
2)反応媒質において、溶媒に対する(モノマー + 架橋剤)の比率A
3)生理学的pHと浸透圧でのポリマーの有効電荷
4)主鎖ポリマーの親水性/疎水性のバランス
ii)得られたポリマーの膨潤性、細孔度、イオン結合干渉率を評価する
iii)上記特徴のうち少なくとも1つを有するポリマーを選ぶ。
【0095】
別の態様として、本発明は、ポリアミンポリマーの治療的特性および/もしくは投与適性、ならびに/または製薬性質の改良方法を提供する。これには次の工程のうち少なくとも1つが含まれる:a)ポリアミンモノマーの平均結合数が約2.05と約6との間になるように、架橋剤でポリマーを架橋させる工程、および/またはb)ポリアミンが、ポリアミン対水の初期比率が約3:1〜約1:3で水中に存在するようにした方法によって、ポリマーを製造する工程。
【0096】
C.モノマー
本発明のポリマーには、適切なモノマーおよび架橋剤なら何でも使用することができる
。ポリマーがリン酸イオンやシュウ酸イオンと結合する場合は、このポリマーは通常ポリアミンと架橋剤から成る。ポリアミンにはアミン官能モノマーが含まれ、例えば米国特許第5,496,545号;同第5,667,775号;同第6,509,013号;同第6,132,706号;および同第5,968,499号ならびに米国特許出願第10/806,495号および同第10/701,385号に記載されているものがある。これら特許および特許出願は、その全体が参考として本明細書中に援用される。
【0097】
いくつかの実施態様において、本発明は、架橋アミン成分からなるイオン結合性ポリマーを提供する。一部の実施態様において、ポリマーは、低膨潤性、in vivoでのイオン高結合性、干渉するイオンからの低干渉性、特定の細孔度の特徴のうち、1つまたは複数の特徴を有する。ポリマー(ホモポリマーおよびコポリマーを含む)には、架橋アミン単位の繰り返しがあり、本明細書中で架橋アミンポリマーとして言及される。ポリマー中の繰り返しアミン単位は、同じ長さまたは可変長さの繰り返しリンカー(または介在)単位によって分けられる。いくつかの実施態様において、ポリマーはアミンプラス介在リンカー単位の繰り返し単位から成る。他の実施態様においては、複数のアミン単位が、1つまたは複数のリンカー単位によって分けられる。
【0098】
本発明のポリマーで有用なモノマーの1つが、式Iのアミンである。
【0099】
【化4】

ここで各nはそれぞれ独立に3以上であり、mは1以上であり、各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する。ある実施態様において本発明は式Iのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0100】
式Iの好ましいアミンとしては次のものがある:
【0101】
【化5】

一態様において本発明は、本発明ポリマーを使用した動物(人間を含む)治療の方法を提供する。この面でのある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式Iのアミンよりなる。
【0102】
本発明のポリマーで有用なモノマーの2つめが、式IIのアミンである。
【0103】
【化6】

ここでpは1、2、3、もしくは4であり;各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する;R2とR3はそれぞれ独立にHまたは必要に応じて置換されたアルキル基またはアリル基(ただしp=1のときはR2とR3の両方がHではなく、p=2、3、もしくは4のときはR2とR3がHかアルキル基か−C(R1)2−R4−N(R1)2で、ここでR4は結合手またはメチレンである);さらに一部の実施態様においては、式IIのアミンにはpが4より大きいアミンが含まれる。さまざまな実施態様において、pは8より大、12より大、16より大、20より大となり得る。他の実施態様において、pは25未満、20未満、15未満、10未満となり得る。ある実施態様において本発明は式IIのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0104】
式IIの好ましいアミンとしては次のものがある:
【0105】
【化7】

本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式IIのアミンよりなる。
【0106】
本発明のポリマーで有用なモノマーの3つめが、式IIIのアミンである。
【0107】
【化8】

ここでqはもしくは2であり、各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する。ある実施態様において本発明は式IIIのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0108】
式IIIの好ましいアミンとしては次のものがある:
【0109】
【化9】

本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式IIIのアミンよりなる。
【0110】
本発明のポリマーで有用なモノマーの4つめが、式IVのアミンである。
【0111】
【化10】

ここで各nはそれぞれ独立に3以上であり、各rは独立に0、1、もしくは2であり、各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する。ある実施態様において本発明は式IVのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0112】
式IVの好ましいアミンとしては次のものがある:
【0113】
【化11】

本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式IVのアミンを含む。
【0114】
本発明のポリマーで有用なモノマーの5つめが、式Vのアミンである。
【0115】
【化12】

ここで各nはそれぞれ独立に3以上であり、各rは独立に0、1もしくは2であり、各R1は独立にHまたは必要に応じて置換されたアルキル基もしくはアリル基であるか、または近隣のR1に結合して、必要に応じて置換された脂環基、芳香環基、複素環基を形成する。ある実施態様において本発明は式Vのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0116】
式Vの好ましいアミンとしては次のものがある:
【0117】
【化13】

本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式Vのアミンよりなる。
【0118】
本発明のポリマーで有用なモノマーの6つめが、式VIのアミンである。
【0119】
【化14】

ここで各mは独立に、3以上である。ある実施態様において本発明は式VIのアミンが架橋剤によって架橋した架橋アミンポリマーである。
【0120】
本発明のある実施態様は、有効量の架橋アミンポリマーを投与することによって動物の消化管内からリン酸イオンを除去する方法であり、ここでポリマーは、式VIのアミンよりなる。
【0121】
一般式I〜VIで示されているアミンは、この分野で周知の手法によって合成することができる。この合成技術には、アルコールの触媒転換や、カルボニル化合物の還元的アミノ化、Michael付加、亜硝酸塩の水素化などがある(例えばKarsten Eller et al,Ullmann’s Encyclopedia of Indu
strial Chemistry 2002 by Wiley−VCH Verlag GmbH & Co.KGaAを参照)。小さいアミンモノマーおよび/またはアミン+介在リンカー単位をいくつかつなげたものも、市販されている。
【0122】
ある実施態様において、この発明で有用なアミンの1つであるテトラメチレンテトラミン(下記参照)は、市販されているジアミノマレオニトリル(DAMN)の触媒水素化により合成される。
【0123】
【化15】

本発明で使用され得るアミンは通常、重合反応のためのモノマーまたはモノマー単位の一部としてはたらく小さいアミンであるが、これに限定されない。いくつかの実施態様において、モノマーは低分子量モノマー(例えば分子量が200g/mol未満のモノマー)である。
【0124】
本発明の実施態様において、モノマーは非重合体(例えば非重合アミン)である。本明細書中で使用される場合、「ポリマー」とは分子量が比較的大きく、構造が主に、実際にも概念的にも分子量が比較的小さい分子から誘導された単位の複数の繰り返しで成り立っている分子を包含する。
【0125】
本発明のポリマー合成に適したアミンの例(これらに限定されない)としては、表1に示すアミンが挙げられる。
【0126】
【化16】

本発明のポリマーに使用できる可能性があるアミンモノマーとしては他に、ビシナルアミン部分がある。ポリマーはビシナルアミン単位の繰り返しを含むホモポリマーであってもよく、または、1種以上のビシナルアミンおよび他のモノマー(アクリレート、メタクリレート、アクリルアミド、メタクリルアミド、ビニルエステル、ビニルアミド、オレフィン、スチレンなど)の単位の繰り返しを含むコポリマーでもよい。ポリマーのサイズは例えば、約500〜約1,000,000ダルトンの間で可変である。
【0127】
本発明のポリマーで有用なビシナルアミンモノマーの1つが、式VIIのアミンである:
【0128】
【化17】

ここでnはゼロ、1、またはそれ以上であり、各Rは独立に、窒素の結合価を満たす適切な化学基であり、各R’は独立にH、アルキル、またはアミノである。
【0129】
他の実施態様において、ポリマーは次の式の単位を繰り返している特徴を有する:
【0130】
【化18】

または、これを含むコポリマーである。ここでnはゼロ、1、またはそれ以上、各Rは独立に、窒素の結合価を満たす適切な化学基であり、各R’は独立にH、アルキル、またはアミノであり、そして、X−はマイナス電荷を有する有機または無機の対イオンである。
【0131】
式VIIIの好ましいポリマーとしては次のものがある:
【0132】
【化19】

本発明のポリマーとしてはまた、次の式を有する単位を繰り返している特徴を有するポ
リマーがある:
【0133】
【化20】

ここでnはゼロ、1、またはそれ以上であり、各Rは独立に、窒素の結合価を満たす適切な化学基であり、各R’は独立にH、アルキル、またはアミノであり、そして、X−はマイナス電荷を有する有機または無機の対イオンである。
【0134】
ある実施態様においては、近隣の窒素原子のR基が互いにつながって、式Xに示す構造を有する。
【0135】
【化21】

ここでQは結合手、アルキル基、アルキルアミノ基、アルキルカルボニル基、アルケニル基、アリル基、またはヘテロシクリル基である。
【0136】
ここで説明するポリマーにおいて、nはゼロ、1、または1より大である。好ましい実施態様において、nは0〜5であり、さらに好ましくは、nはゼロまたは1である。
【0137】
n’の値はポリマーの所望の性質や用途可能性、使用する合成技術によって異なる。
【0138】
式VII、VIII、IX、Xのペンダント(垂れ下がった)窒素原子は、C、H、O、S、P、Nなどの原子と結合することができ、このペンダント基はニトロソ、ニトロ、ニトロキシド基、ニトロン、ニトレン、イソシアネート、カルバジド、ヒドラジノ、ジアゾ基、イミン、アミジン、グアニジン、スルファメート、ホスホラミデート、複素環などになる。
【0139】
適切なR基の例としては、H、ハロゲン、R”、CO2H、CO2R”、COR”、C(=NR”)(NR”)、CN、CONH2、CONR”2、OR”、SO3R”、Si
(R”)3、およびP(O)(OR”)2がある。適切なR”としてはH、必要に応じて置換されたアルキル基、アシル基、アルキルアミノ基、アルケニル基、ヘテロシクリル基、およびアリル基がある。好ましいR’はH、メチル基、アミノ基である。
【0140】
R”基の置換は、酸素、窒素、リン、硫黄を含むイオン性の基でも可能である。置換基の例としては、カルボキシル、スルホン、スルファミン、スルホン基、リン酸、ホスファゼン、ホスホラミデート基、第四アンモニウム基、またはアミン基(第一および第二のアルキルアミンまたはアリールアミン)が挙げられる。適した置換基の例としては他に、ヒドロキシ、アルコキシ、カルボキサミド、スルホンアミド、ハロゲン、アルキル、アリール、ヒドラジン、グアナジン、尿素、カルボン酸エステルがある。
【0141】
好ましいR基には、Hおよび次のものがある:
【0142】
【化22】

マイナス電荷を有する対イオンX−は、有機イオン、無機イオン、またはその組合せがあり得る。本発明の用途に適切な無機イオンとしては、ハライド(特に塩化物イオン)、炭酸イオン、重炭酸イオン、硫酸イオン、重硫酸イオン、水酸化イオン、硝酸イオン、過硫酸イオン、および亜硫酸イオンが挙げられる。適切な有機イオンとしては、酢酸イオン、アスコルビン酸イオン、安息香酸イオン、クエン酸イオン、クエン酸二水素イオン、クエン酸一水素イオン、シュウ酸イオン、コハク酸イオン、酒石酸イオン、タウロコール酸、グリココール酸イオン、およびコール酸イオンが挙げられる。好ましいX−は塩化物イオンまたは炭酸イオンである。
【0143】
好ましい実施態様において、対イオンは患者に対して有害な副作用がなく、患者に治療上または栄養上の利点があるよう選択される。
【0144】
本発明のポリマーで使用されるもうひとつのモノマーが、下記に示す式XIである。
【0145】
【化23】

ここでR’”はHまたはCH3であり、Rは上記と同様である。式XIの好ましい構造は、R=Hのときである。
【0146】
ある実施態様において、ポリマーはコポリマーであり、繰り返し単位の1つが本明細書中に記載されているモノマーである。
【0147】
本発明のコポリマーは、交互コポリマーまたはランダムコポリマーであり得る。一般に、アミン前駆物質と共重合し得るモノマーとしては、次のグループから選択される1種以上のモノマーが挙げられる:スチレン、置換スチレン、アルキルアクリレート、置換アルキルアクリレート、アルキルメタクリレート、置換アルキルメタクリレート、アクリロニトリル、メタクリロニトリル、アクリルアミド、メタクリルアミド、N−アルキルアクリルアミドN−アルキルメタクリルアミド、N,N−ジアルキルアクリルアミド、N,N−ジアルキルメタクリルアミド、イソプレン、ブタジエン、エチレン、酢酸ビニル、N−ビニルアミド、マレイン酸誘導体、ビニルエーテル、アリル、メタリルモノマー、およびこれらの組合せ。これらモノマーに官能基をつけたものも使用することができる。本発明に使用できるモノマーおよびコモノマーには次のようなものが挙げられるが、これらに限定されない:メチルメタクリレート、エチルメタクリレート、プロピルメタクリレート(異性体すべて)、ブチルメタクリレート(異性体すべて)、2−エチルヘキシルメタクリレート、イソボルニルメタクリレート、メタクリル酸、ベンジルメタクリレート、フェニルメタクリレート、メタクリロニトリル、α−メチルスチレン、メチルアクリレート、エチルアクリレート、プロピルアクリレート(異性体すべて)、ブチルアクリレート(異性体すべて)、2−エチルヘキシルアクリレート、イソボルニルアクリレート、アクリル酸、ベンジルアクリレート、フェニルアクリレート、アクリロニトリル、スチレン、グリシジルメタクリレート、2−ヒドロキシエチルメタクリレート、ヒドロキシプロピルメタクリレート(異性体すべて)、ヒドロキシブチルメタクリレート(異性体すべて)、N,N−ジメチルアミノエチルメタクリレート、N,N−ジエチルアミノエチルメタクリレート、トリエチレングリコールメタクリレート、無水イタコン酸、イタコン酸、グリシジルアクリレート、2−ヒドロキシエチルアクリレート、ヒドロキシプロピルアクリレート(異性体すべて)、ヒドロキシブチルアクリレート(異性体すべて)、N,N−ジメチルアミノエチルアクリレート、N,N−ジエチルアミノエチルアクリレート、トリエチレングリコールアクリレート、メタクリルアミド、N−メチルアクリルアミド、N,N−ジメチルアクリルアミド、N−tert−ブチルメタクリルアミド、N−n−ブチルメタクリルアミド、N−メチロールメタクリルアミド、N−エチロールメタクリルアミド、N−tert−ブチルアクリルアミド、N−n−ブチルアクリルアミド、N−メチロールアクリルアミド、N−エチロールアクリルアミド、4−アクリロイルモルフォリン、ビニル安息香酸(異性体すべて)、ジエチルアミノスチレン(異性体すべて)、α−メチルビニル安息香酸
(異性体すべて)、ジエチルアミノα−メチルスチレン(異性体すべて)、p−ビニルベンゼンスルホン酸、p−ビニルベンゼンスルホン酸ナトリウム塩、トリメトキシシリルプロピルメタクリレート、トリエトキシシリルプロピルメタクリレート、トリブトキシシリルプロピルメタクリレート、ジメトキシメチルシリルプロピルメタクリレート、ジエトキシメチルシリルプロピルメタクリレート、ジブトキシメチルシリルプロピルメタクリレート、ジイソプロポキシメチルシリルプロピルメタクリレート、ジメトキシメチルシリルプロピルメタクリレート、ジエトキシシリルプロピルメタクリレート、ジブトキシシリルプロピルメタクリレート、ジイソプロポキシシリルプロピルメタクリレート、トリメトキシシリルプロピルアクリレート、トリエトキシシリルプロピルアクリレート、トリブトキシシリルプロピルアクリレート、ジメトキシメチルシリルプロピルアクリレート、ジエトキシメチルシリルプロピルアクリレート、ジブトキシメチルシリルプロピルアクリレート、ジイソプロポキシメチルシリルプロピルアクリレート、ジメトキシシリルプロピルアクリレート、ジエトキシシリルプロピルアクリレート、ジブトキシシリルプロピルアクリレート、ジイソプロポキシシリルプロピルアクリレート、無水マレイン酸、N−フェニルマレイミド、N−ブチルマレイミド、N−ビニルホルムアミド、N−ビニルアセトアミド、アリルアミン、メタアリルアミン、アリルアルコール、メチルビニルエーテル、エチルビニルエーテル、ブチルビニルエーテル、ブタジエン、イソプレン、クロロプレン、エチレン、酢酸ビニル、およびこれらの組合せ。好ましいモノマーまたはコモノマーは、アクリルアミド、ジメチルアクリルアミド、N−ビニルホルムアミド、N−ビニルアセトアミド、酢酸ビニル、メチルアクリレート、ブチルアクリレートである。
【0148】
本発明のポリマーに使用できるモノマーには他に、次のものがある:
【0149】
【化24】

ここで各Rは独立に、H、または置換および/もしくは無置換アルキル基(例えば、炭素原子1〜5を有する、短鎖アルキル基など)、アルキルアミノ基(例えば、炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(フェニル基など)である。
【0150】
【化25】

ここで各Rは独立に、H、または置換および/もしくは無置換アルキル(炭素原子1〜5を有する)、アルキルアミノ基(炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(フェニル基など)であり、各X−は互換できるマイナス電荷の対イオンである。
【0151】
適切なモノマーとして他に、下式で示される構造のものがある:
【0152】
【化26】

ここで各RはH、または置換および/もしくは無置換アルキル基(例えば、炭素原子1〜5を有する)、アルキルアミノ基(例えば、炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(フェニル基など)である。
【0153】
適切なモノマーとして他に、下式で示される構造のものがある:
【0154】
【化27】

ここで各R1およびR2は独立に、H、または置換および/もしくは無置換アルキル(例えば、炭素原子1〜5を有する)、アルキルアミノ基(例えば、炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(フェニル基など)であり、各X−は互換できるマイナス電荷の対イオンである。ある実施態様において、少なくともR基の1つは水素原子である。
【0155】
適切なモノマーとして他に、下式で示される構造のものがある:
【0156】
【化28】

ここで各R1およびR2は独立に、H、または置換および/もしくは無置換アルキル基(例えば、炭素原子1〜20を有する)、アルキルアミノ基(例えば、炭素原子1〜5を有する、エチルアミノ基など)、またはアリール基(炭素原子6〜12を有する、フェニル基など)である。
【0157】
適切なモノマーとして他に、下式で示される構造のものがある:
【0158】
【化29】

ここで各R1、R2、R3は独立に、H、または置換および/もしくは無置換アルキル基(例えば、炭素原子1〜20)、アルキルアミノ基(例えば、炭素原子1〜5、エチルアミノ基など)、またはアリール基(炭素原子6〜12、フェニル基など)であり、各X−は互換できるマイナス電荷の対イオンである。
【0159】
モノマーの各例において、R基は1つまたは複数の置換基をもつことができる。適切な置換基としては、第四アンモニウム基やアミン基(例えば、第一および第二のアルキルアミンまたはアリールアミン)などの治療用アニオン基が挙げられる。適した置換基としては他に例えば、ヒドロキシ、アルコキシ、カルボキサミド、スルホンアミド、ハロゲン、アルキル、アリール、ヒドラジン、グアナジン、尿素、カルボン酸エステルがある。
【0160】
マイナス電荷を有する対イオンX−は、有機イオン、無機イオン、またはその組合せがあり得る。本発明の用途に適切な無機イオンとしては、ハライド(特に塩化物イオン)、炭酸イオン、重炭酸イオン、硫酸イオン、重硫酸イオン、水酸化イオン、硝酸イオン、過硫酸イオン、および亜硫酸イオンが挙げられる。適切な有機イオンとしては、酢酸イオン、アスコルビン酸イオン、安息香酸イオン、クエン酸イオン、クエン酸二水素イオン、クエン酸一水素イオン、シュウ酸イオン、コハク酸イオン、酒石酸イオン、タウロコール酸、グリココール酸イオン、およびコール酸イオンが挙げられる。
【0161】
グアニジノ基を含むポリマーも、所望の特性をもち、リン酸イオン、シュウ酸イオンなどの陰イオンと結合し、本明細書中に記載されているプロセスによって生成できる組成として役に立つ。このようなポリマーは米国特許第6,132,706号および同第5,968,499号に記述されており、その全体が参考として本明細書中に援用される。簡単に説明すれば、グアニジノ基は重合構造に付加されている。結合効果はグアニジノ基によるものであるため、ポリマー主鎖の性質はさほど重要ではない。架橋などの要素がコントロールできる好ましいポリマーとしては、ポリエチレン主鎖にジビニルベンゼンで架橋した構造を有するポリマーが挙げられる。主鎖が無機化合物のポリマー、例えばポリホスファゼンポリマーも使用することができる。ポリマーは、2種類以上のモノマーから誘導されるコポリマーであり得る。さらに他の有用なポリマーの例としては、セルロースやアガロースなどの炭水化物ポリマーがある。グアニジノ基は、グアニジノ基(NH2−C(=NH)−NH−)の末端NH基の化学結合によってポリマー主鎖に付いている。グアニジノ基がポリマー主鎖に付く化学結合は、直接であることもあれば、何らかの形の基を「スペーサー」として間に挟み、ポリマー主鎖に付くこともある。さまざまな形態の付加を使うことができるが、ポリマーの基本タイプによって好ましい形態が違ってくる。例えば、炭素原子1〜4のアルキレン基、アミド基、エーテル基、またはこれらの組合せを使用することができる。この場合、グアニジノ基をポリマー主鎖に付加する好ましい形態は、明らかに主鎖の性質によって違ってくるが、簡単に言えば、主鎖の原子とグアニジノ基中のNH基との間の直接結合の方がなるべくならば望ましい。
【0162】
グアニジノを含むポリマーの調製方法は、当業者には明らかであるが、例えばSchnaar,R.L.and Lee,Y.C.,1975,Biochemistry 1
4,1535−1541(その全体が参考として本明細書中に援用される)の教示に従って調製することができる。Schnaarは、ポリマーマトリックスに生物学的活性の配位子をリンクする方法を説明している。また、ポリマーは次のいずれかのポリマー主鎖にアミノ基が付いたポリマーとの反応によって簡単に調製することも可能である:(a)硝酸3,5−ジメチルピラゾール−1−カルボキサミジン、(b)硫酸S−メチルチオウロニウム、または(c)硫酸O−メチルシュードウレア。
【0163】
本発明の好ましいモノマーはアミンである。本発明のポリマーで使用するのに最も好ましいモノマーは、アリルアミン、ビニルアミン、エチレンイミン、メチレン1,3−ジアミノプロパン、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタン、1,2,3,4−テトラアミノブタン、式1および式2などがある。ここで式1および式2は次の構造である:
【0164】
【化30】

いくつかの実施態様において、本発明のポリマーは、1種以上のアミンモノマーと1種以上の架橋剤から構成され、ここでポリマーは、架橋反応に先立ち、アミン:溶媒の比が約3:1〜約1:3で溶媒中にアミンを存在させ、反応混合物に加える架橋剤の合計量をアミンモノマーの平均結合数が約2.05と約6との間、または約2.2と約4.5との間となるように調整することによって製造される。いくつかの実施態様において、本発明のポリマーは、1種以上のアミンモノマーと1種以上の架橋剤から製造されるリン酸イオン結合性ポリマーであり、ここでこのポリマーは、反応混合物に加える架橋剤の合計量を、アミンモノマーの平均結合数が2.2〜4.5となるように調整することにより製造される。好ましい実施態様において、アミンモノマーは1,3−ジアミノプロパンとN,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンからなる群から選ばれ、架橋剤は1,3−ジクロロプロパンとエピクロロヒドリンからなる群から選ばれる。いくつかの実施態様において、本発明のポリマーは1種以上のアミンモノマーと1種以上の架橋剤から製造され、ここでアミンモノマーはポリアリルアミンモノマーではなく、および/または架橋剤はエピクロロヒドリンではない。
【0165】
いくつかの実施態様(リン酸イオン結合性ポリマーなど)において、最終ポリマーのアミンに対する塩化物の比を、所定のレベル以下に維持することが望ましい。いくつかの実施態様において、この値は約0〜約35 mol %であり、さらに好ましくは約0〜約15mol %である。モノマーは、この基準に従って選択できる。
【0166】
D.架橋剤
架橋剤には、米国特許第5,496,545号;同第5,667,775号;同第6,509,013号;同第6,132,706号;および同第5,968,499号ならびに米国特許出願第10/806,495号および同第10/701,385号に記載されているものがある。
【0167】
架橋剤は通常、少なくとも2つの官能基を有する化合物で、ハロゲン基、カルボニル基、エポキシ基、エステル基、無水酸基、酸ハロゲン化物基、イソシアネート基、ビニル基、クロロホルメート基の中から選択される。架橋剤は炭素主鎖に付くか、またはアミンポリマーのペンダント窒素原子に付く。本発明のポリマー合成に適した架橋剤の例(これら
に限定されない)としては、表2に示される架橋剤が挙げられる。
【0168】
【化31】

【0169】
【化32】

【0170】
【化33】

【0171】
【化34】

【0172】
【化35】

【0173】
【化36】

適切な架橋剤の例として挙げられるのは、ジアクリレート類とジメタクリレート類(例えばエチレングリコールジアクリレート、プロピレングリコールジアクリレート、ブチレングリコールジアクリレート、エチレングリコールジメタクリレート、プロピレングリコールジメタクリレート、ブチレングリコールジメタクリレート、ポリエチレングリコールジメタクリレート、ポリエチレングリコールジアクリレートなど)、メチレンビスアクリルアミド、メチレンビスメタクリルアミド、エチレンビスアクリルアミド、エチレンビスメタクリルアミド、エチリデンビスアクリルアミド、ジビニルベンゼン、ビスフェノールAジメタクリレート、ビスフェノールAジアクリレート、ジエポキシド類、ジハライド類、ジイソシアネート類、ジアシルクロライド類、ジアンヒドリド類、ジメチルエステル類である。
【0174】
好ましい架橋剤の例としては、エピクロロヒドリン、1,4−ブタンジオールジグリシジルエーテル、1,2−エタンジオールジグリシジルエーテル、1,3−ジクロロプロパン、1,2−ジクロロエタン、1,3−ジブロモプロパン、1,2−ジブロモエタン、二塩化スクシニル、コハク酸ジメチル、トルエンジイソシアネート、塩化アクリロイル、アクリル酸メチル、エチレンビスアクリルアミド、および無水ピロメット酸などがある。
【0175】
E.重合
重合は、当該分野で公知の手法により達成することができる。この例は、本明細書中に開示される実施例の項で詳細に説明されている。上に述べたように、重合条件は、所望の特性をもったポリマーを製造するために調整することができる。
【0176】
架橋反応は、バルク溶液中(すなわち、無希釈アミンと無希釈架橋化合物を使用する)か、分散媒質の中で行なわれる。ゲル生成に至る架橋反応は、さまざまなプロセスを用いて行うことができるが、このプロセスは大きく2つのカテゴリーに分けられる:
i)均一プロセス:アミン官能基前駆物質(低分子アミンまたは高分子量ポリアミン)が連続相に溶解し、架橋反応によって得られたゲルが連続相中でバルクゲルまたはゲルスラリーとして回収される。バルクゲルプロセスとは、溶媒全体がゲルの網状組織にトラップされ、固まりとなり、これを押出し、すり潰しなどの方法で細かい粒子にする状況をいう。バルクプロセスを使用する場合、溶媒は、反応物質が相互溶解し、アミン架橋反応を阻害しないように選択する。適切な溶媒としては、水、低沸点アルコール(メタノール、エタノール、ブタノール)、ジメチルホルムアミド、ジメチルスルホキシド、アセトン、メチルエチルケトン、およびこれらに類似のものが挙げられる。ゲルスラリーは通常、反応媒質粘度が低い範囲にあり、剪断率が高いため、生成されたゲル粒子がスラリー中の懸
濁状態にとどまる場合に得られる。
【0177】
ii)不均一プロセス:アミン官能基前駆物質(低分子アミンまたは高分子量ポリアミン)が連続相に不溶性であり、架橋反応が進んで生成したビーズまたは不定形粒子がその連続相中に懸濁し、分散した液粒または粒子となる。
【0178】
均一プロセスは、本発明の目的である膨潤度を抑えた架橋物質を製造するためには、実際的でないことがある;所望の膨潤率と細孔分布での架橋レベルは通常、ゲル時間が非常に短く、局所的粘度が高くなるため、ラージスケールの製造には実際的でない。
【0179】
本発明のための合成モードは、不均一プロセスを利用するのが好ましい。この種のプロセスは分散媒質中の重合と呼ばれ、逆懸濁、直接懸濁、沈殿重合、乳化重合、マイクロエマルジョン重合、エアロゾル中の反応などが含まれる。連続相は、トルエン、ベンゼン、炭化水素、ハロゲン化溶媒、臨界超過二酸化炭素などの無極性溶媒の中から選択され得る。直接懸濁または乳化プロセスでは、水も使用できる。塩水も、アミンと架橋剤を液粒の分離相中で「塩析」させるのに有用である(米国特許No.5,414,068参照)。モノマー前駆物質は、そのまま、または溶液として連続相の中に分散できる。アミンと架橋剤は好ましくは2段階の手順で導入する:まずアミンを液粒として分散させ、次に架橋剤を反応媒質に追加して、分散相に移動させる。架橋反応は液粒相内で起こり、懸濁液の粘度に大きな増大は引き起こさない。これは、発熱反応によって生じた熱を拡散するのに有利であり、ビーズ内のゲル均一性が良好に保たれる。好ましい合成モードは、次のステップを含む:
i)アミンモノマーまたはアミンポリマーを水に溶かす
ii)アミンの一部を、HClなどの酸で中和する
iii)水と混和しない溶媒の中にこのアミン溶液を分散させ、乳化液をつくる
iv)架橋剤をこの乳化液に、何回かに分けて追加する
v)架橋反応を最後まで反応させる
vi)蒸留により水を除去する
vii)濾過によりビーズを分離する
viii)水洗いし乾燥させる。
【0180】
このプロセスでは、ポリマー粒子は球状のビーズとして得られる。このビーズの直径は好ましくは5〜500ミクロン範囲にコントロールされ、さらに好ましくは25〜250ミクロンにする。実施態様のいくつかにおいて、ビーズの平均直径は40ミクロン以下である。
【0181】
ゆえに一態様において、本発明では、不均一プロセスによってアミンモノマーを架橋剤と反応させる工程を含む、標的陰イオンを結合する陰イオン結合性ポリマーの製造方法を提供する。ここでこのリン酸イオン結合性ポリマーは、次の特徴のうち少なくとも2つを有することで特徴づけられる:a)膨潤率は5未満、または4.5未満、または4未満、または3未満、b)標的陰イオンの約2倍より大きい分子量をもつ非反応性溶質が利用可能なポリマーの重量が約20%未満(パーセンテージは生理学的媒体中において測定した)、c)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満。いくつかの実施態様において、アミンモノマーはポリアリルアミンである。いくつかの実施態様において、架橋剤はエピクロロヒドリンである。
【0182】
別の面として、本発明では、不均一プロセスによるポリアリルアミン架橋方法を含むプロセスによって生成された、標的イオンを結合する陰イオン結合性ポリマーを提供する。このポリマーは、次の特徴のうち少なくとも2つを有する:a)膨潤率は5未満、または4.5未満、または4未満、または3未満、b)標的陰イオンの約2倍より大きい分子量
をもつ非反応性溶質が利用可能なポリマーの重量が約20%(重量)未満(パーセンテージは生理学的媒体中で測定した)、c)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満。1つの実施態様において、ポリアリルアミンはエピクロロヒドリンによって架橋される。
【0183】
上記で検討したように、架橋剤対アミンのモル比により、生成されるゲル物質の量と、架橋密度がコントロールされる。比率が低すぎると架橋が不十分になり、水溶性オリゴマーが生じることがある。また高すぎると網状組織が密になりすぎ、結合特性がほとんどなくなることがある。アミン成分は、単独あるいは何種類かのアミンの組合せが使用できる。架橋剤についても同様である。アミンと架橋剤の新しい組合せについては、どちらの機能性もゲル生成量と膨潤性に影響を与えるため、最適化の作業が必要となる。いくつかの実施態様(例えばFbが2の架橋剤によって低分子量モノマーを架橋した実施態様)において、架橋剤対アミンのモル比(B/A)は約0.2と約10との間、好ましくは約0.5と約5との間、最も好ましくは約0.5と約2との間である。この比率は、アミンモノマーが高分子量モノマーであるか低分子量モノマーであるか、そして/また架橋剤のFb値に基づいて、調整することができる(前記検討事項および表を参照)。
【0184】
場合によっては、ポリマーは重合後に架橋される。このような架橋が得られる方法では、ポリマーを反応させるのに二官能基の架橋剤(エピクロロヒドリン、二塩化スクシニル、ビスフェノールAのジグリシジルエーテル、無水ピロメット酸、トルエンジイソシアネート、エチレンジアミンなど)を用いる。典型的な例が、ポリ(エチレンイミン)とエピクロロヒドリンの反応である。この例では、エピクロロヒドリン(1〜100部)を、ポリエチレンイミン(100部)を含有する溶液に加え、加熱して反応させる。典型的な例が、ポリビシナルアミンとエピクロロヒドリンの反応である。この例では、エピクロロヒドリン(1〜200部)を、ポリビシナルアミン(100部)を含有する溶液に加え、加熱して反応させる。すでに重合している物質を架橋させる方法は他に、電離放射線の照射、紫外線照射、電子ビーム、ラジカル、熱分解などがあるが、これらに限定されない。
【0185】
架橋反応はバッチとして、または準連続モードで行う。準連続モードの場合、アミンまたは架橋剤のいずれか一方を最初に加え、次に一定時間をおいて一定量ずつ、もう一方の反応物質を加える。ある実施態様において、アミンモノマー成分全部を加えて溶解性のプレポリマーを用意し、次に架橋剤の一部を連続的に加えていき、シロップを形成する。このシロップを、油の連続相中の液粒として乳化し、架橋剤の残りを加えて架橋ビーズを生成させる。架橋剤がアルキルハライド化合物である場合は、反応中に形成される酸を除去するために塩基を使用することができる。無機塩基または有機塩基のいずれでもよい。NaOHが好ましい。架橋剤に対する塩基の比率は、好ましくは約0.5と約2との間である。
【0186】
いくつかの実施態様において、ポリマーは後アミノ化(3−クロロプロピルアミンとの後反応)に供される。この実施態様では、アミンモノマーと架橋剤の間の最初の反応を実行してゲルを生成し、次にこのゲルをアミノアルキルハライドと後反応させ、アミン官能ゲルによるハライド置換で、アミンアルキル基をゲルに化学的に付ける。
【0187】
本明細書中に記載されているポリマーはすべて、さらなる架橋や、リン酸イオンなどの陰イオンによるインプリントをすることができる。ある実施態様においては、標的陰イオン(リン酸イオンやシュウ酸イオン)が重合反応中に存在しており、架橋反応の完了後に洗い流される。この方法は「インプリンティング」と呼ばれ、ゲルに「鋳造」のポケットができることにより所定の陰イオンに対する結合識別が高くなり、陰イオン溶質に対するゲルの化学的親和性が増大する傾向がある。リン酸イオンインプリントを行ったゲルの例は、例えばFujiwara et al,Analytical Sciences
April 2000,vol.16,407や、ACS symposium series 703,”Molecular and Ionic Recognition
with Imprinted Polymers,Bartsch R A and
Maeda M.Editors,1998,Chap.22,315に説明されている。代表的に、陰イオンは、アミン(窒素原子として計算)に対する陰イオンのモル比が、約10〜約100%、好ましくは約10〜約60%、最も好ましくは約30〜約50%で存在する。最も好ましくは、陰イオンを酸の形態(例えば、リン酸、シュウ酸など)で導入し、アミンを遊離塩基として使用することにより、in situでアンモニウム/陰イオン塩を形成する。適切な架橋剤対アミン量比を使用して前記と同様に架橋反応を行い、膨潤率や臨界浸透体積、結合干渉率などの面で、望ましいゲル性質が得られるようにする。架橋後すぐに生成されたゲルを、強い酸性(例えば、pH<2など)または強い塩基性(例えば、pH>12など)の媒質中で徹底的に洗い、インプリントに用いた陰イオンを除去してから、中性の媒質でさらに洗い流す。すべてのパラメータ(例えば、アミン対架橋剤の比率、モノマー対溶媒の比率など)が等しければ、本明細書中に記載されているインプリンティング手法は通常、結合容量を1.1倍、1.3倍、時には1.5倍にまで増加させる。
【0188】
III.医薬組成物
本発明は、一態様において、医薬組成物を提供する。ある実施態様において、医薬組成物はチュアブル錠剤である。また別の実施態様において、医薬組成物は液体製剤である。
【0189】
本発明の医薬組成物は、本発明のポリマー(例えば、架橋アミンポリマー)の有効量、すなわち治療および/または予防のメリットを達成できる用量で存在する組成物である。個々の用途における有効量は、患者(例えば、年齢や体重)、治療される病状、投与経路によって異なってくる。有効量の決定は、特に本明細書中に記載される情報を踏まえれば、ゆうに当業者の技能の範囲内である。
【0190】
人間での使用に対する有効量は、動物モデルから決定することができる。例えば、人間の用量は、動物に効果が見出された循環中濃度および/または消化管内濃度を達成するように、処方することができる。
【0191】
医薬組成物は、ポリマー(例えば、架橋アミンポリマー)、1種以上の製薬的に受容できる担体、希釈剤や賦形剤、および必要に応じて追加される他の治療薬を含む。
【0192】
本発明に従って使用するための医薬組成物は、従来的手法により調剤することができる。すなわち、1種以上の、生理学的に受容できる担体(賦形剤と助剤を含む)を使用し、これらは、活性化合物を製薬分野で使用可能な製剤にする処理を容易にする。適切な調剤は、選択する投与経路によって異なる。アミンの医薬組成物調剤の適切なテクニックについては、当該分野で周知であり、例えばGennaro A R(ed),Remington’s Pharmaceutical Sciences,20th Edition,Lippincott,Williams and Wilkins,Baltimore Md.(2001)を参照されたい(全体が参考として本明細書中に援用される)。
【0193】
この医薬組成物は通常、周知かつ容易に入手可能な成分を用いて、公知の手順により調製される。本発明の組成物をつくるには、イオン結合性ポリマー(例えば、リン酸イオン結合性ポリマー)を単独使用、または担体に混合、または担体で希釈、または担体内(カプセル、サシェ、紙、その他の容器の形態であり得る)に封入され得る。担体が希釈剤としてはたらく場合は、担体は、ポリマーのビヒクル、賦形剤あるいは媒質としてはたらく、固体、準固体、または液体物質であり得る。よって、組成物は錠剤、丸剤、粉末、トロ
ーチ剤、サシェ剤、カシェ剤、エリキシル剤、懸濁液、シロップ、エアロゾル(固体または液体媒質)、ソフトまたはハードのゼラチンカプセル、滅菌パッケージ粉末、その他類似の形態にすることができる。好ましい製剤は、チュアブル錠剤と液体製剤である。この製剤その他に使用できる担体、賦形剤、希釈剤の例としては、食物、飲料、ラクトース、デキストロース、蔗糖、ソルビトール、マンニトール、澱粉、アラビアゴム、アルギン酸塩、トラガカントゴム、ゼラチン、ケイ酸カルシウム、微結晶性セルロース、ポリビニルピロリドン、セルロース、メチルセルロース、メチルヒドロキシベンゾエート類、プロピルヒドロキシベンゾエート類、プロピルヒドロキシベンゾエート類、タルクなどが挙げられる。
【0194】
本発明の他の態様において、陰イオン(例えば、リン酸イオン)結合ポリマーは、遊離アミンとして、対イオンなしで処方される。短期および長期研究によれば、Renagel(塩酸ポリアリルアミン)で治療を受けている維持血液透析患者は、カルシウム含有リン酸イオン結合剤(すなわち、塩化物は含まない)で治療を受けている患者に比べ、血清中の重炭酸イオンレベルが有意に低いことを示している。また、塩酸セベラマー(SEVELAMER)(Renagelの製薬有効成分の商品名)が酸の負荷を誘発し、アシドーシスを
起こすことが見出されている(Brezina B.et al,Kidney International,vo.66,suppl.90(2004),39−45)。アシドーシスは対象患者にとって深刻な副作用となり得る。別の実施態様において、アミン架橋ポリマーはポリアミンポリマーであり、ポリマーの塩化物含有量はアミン類の含有量の約40 mol%未満、より好ましくは約20 mol%未満、もっとより好ましくは約5 mol%未満である。ポリマーは実質的に無塩化物であることが最も好ましい。
【0195】
A.チュアブル錠剤
いくつかの実施態様において、本発明のポリマーは、チュアブル錠剤の形態における医薬組成物として提示される。
【0196】
現在、高リン酸血症などのイオンバランス異常障害の治療指導に患者が従うための、患者のコンプライアンスは、最大の制限要素のひとつとして認識されている。例えば、現在のリン酸イオン結合性ポリマー(RENAGELなど)を使用した高リン酸血症治療において、最近の調査によると、患者は平均で800mg丸剤を1日に9〜10錠服用しなければならず、患者の25%はさらに多く、1日に12〜15錠を服用しているという。Renagelは飲み込むことが可能な錠剤の形状になっており、錠剤を飲み込むのに必要なだけの水分とともに服用するようになっている。これが、水分を制限している末期腎不全患者にとっては負担の増加となる。服用量の多さによる患者コンプライアンスの低さは、この種類の薬剤の普及に明らかなインパクトを与える要素として突出している。
【0197】
もっと服用が簡単な製剤形態が望ましい。チュアブル錠剤によるドラッグデリバリーは、多くの場合において非常に利点が大きいが、感覚上の特性を満足させるのが困難であるため、製剤としての使用は限られている。錠剤を噛むときには、次のような感覚上のパラメータが重要である:砂っぽさ、歯の粘着性、粉っぽさ、口触り、全体的な口内感覚。
【0198】
現在のチュアブル錠剤は、かなりの量の有効成分を投与する必要がある場合に使用されることがほとんどで、ビタミンや制酸剤、緩下剤、鎮痛剤などの市販薬が含まれる。処方薬のチュアブル製品には、妊婦用ビタミンと、チュアブルの抗生物質・抗ウイルス薬で大量の用量の経口投与が必要なものが含まれる。チュアブル錠剤はしばしば大型であるが、咀嚼に適切な程度の噛みやすさと「歯ごたえ」を改善するため、外形の最適化が必要である。円形で角が面取りされた形が一般的で、高さ/直径の比は0.3〜0.4程度である。
【0199】
有効成分に加え、次のようなタイプの賦形剤が一般的に使用されている:必要な口内感覚を得るための甘味料、および、甘味料が錠剤の硬さのために充分でない場合は結合剤を追加;抜き型の壁の摩擦を抑え、錠剤を外れやすくするための滑沢剤;場合によっては咀嚼を容易にするために少量の崩壊剤が添加される。一般に、現在使用されているチュアブル錠剤の賦形剤濃度は、有効成分の3〜5倍のオーダーであり、甘味料が非有効成分の量のうち大半を占めている。
【0200】
イオン結合性ポリマーを含むチュアブル錠剤の設計において考慮すべき重要な点は、ポリマーの膨潤率である。本発明では低膨潤率のポリマーを提示しているため、チュアブル製剤に使用しても不快感がなく、高膨潤率ポリマーのチュアブル錠剤に付随する危険な副作用もない。高膨潤率で、経口投与すると窒息や食道閉塞の危険性も生じる可能性のある物質の例のひとつが、オオバコ種子である。オオバコ種子は、アジアの一部、ヨーロッパの地中海地域、北アフリカに生息する植物オオバコの種を粉砕したものであり、米国では緩下剤として広く使用されている。オオバコ種子は通常、35〜50倍に膨潤するため、大量の水分と共に摂取しなければならない。服用時に水の量が不十分だと、繊維が膨潤し、窒息、時には食道破裂を起こす危険性すらある。オオバコ種子は、嚥下困難および/または食道狭窄のある患者には禁忌である。
【0201】
本発明は、本発明のポリマーと、チュアブル錠剤の製剤に適した1種以上の製剤用賦形剤を含む、チュアブル錠剤を提供する。本発明のチュアブル錠剤に使用されているポリマーが、口腔内および食道内を移動する際の膨潤率は、約5未満、好ましくは約4未満、より好ましくは約3未満、さらに好ましくは約2.5未満、最も好ましくは約2未満である。いくつかの実施態様において、ポリマーは、リン酸イオン結合性ポリマーやシュウ酸イオン結合性ポリマーのような陰イオン結合性ポリマーであり、好ましい実施態様においては、このポリマーはリン酸イオン結合性ポリマーである。このポリマーと適切な賦形剤を含む錠剤は、口内触感、味、歯の粘着性などの感覚的特性が許容できる程度であり、同時に、噛んで唾液と接触しても食道を塞ぐ危険性がない。
【0202】
本発明のある面において、賦形剤の一般的なはたらきである機械的・熱的特性はポリマーがすでにもっているため、製剤に必要な賦形剤の量を減らすことができる。いくつかの実施態様において、有効成分(例えばポリマー、好ましくは陰イオン結合性ポリマー)は、チュアブル錠剤の重量の約30%以上、好ましくは約40%以上、より好ましくは約50%以上、最も好ましくは約60%以上を占め、残りが適切な賦形剤から成っている。いくつかの実施態様において、ポリマー(例えば陰イオン結合性ポリマー)は、錠剤の合計重量のうち約0.6g〜約2.0g、好ましくは約0.8g〜約1.6gを構成する。いくつかの実施態様において、ポリマー(例えば陰イオン結合性ポリマー)は、錠剤の約0.8g以上、好ましくは約1.2g以上、最も好ましくは約1.6g以上を占める。ポリマーは、適切な強度/脆さと粒子サイズを有するよう製造され、適切な硬さ、良好な口内触感、圧縮性など、従来の賦形剤の使用目的と同じ品質を提供する。本発明のチュアブル錠剤に使用されているポリマーの粒子サイズは、平均直径が約80ミクロン未満、70ミクロン未満、60ミクロン未満、50ミクロン未満、40ミクロン未満、30ミクロン未満、20ミクロン未満である。好ましい実施態様において、粒子サイズは約80ミクロン未満、好ましくは約60ミクロン未満、最も好ましくは約40ミクロン未満である。
【0203】
本発明のチュアブル錠剤に有用な製剤用賦形剤としては、結合剤(例えば、微結晶性セルロース、コロイド状シリカとその組合せ(Prosolv 90)、カーボポル、ポピドン(providon)、キサンタンガムなど)、矯味矯臭剤(例えば、蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトール)、滑沢剤(例えば、ステアリン酸マグネシウム、ステアリン酸、ステアリルフマル酸ナトリウム、植物性脂肪酸)、および必要に応じて崩壊剤(クロスカルメロースナトリウム、ゲランガム、セルロ
ースの低置換ヒドロキシプロピルエーテル、スターチグリコレートナトリウムなど)がある。その他の添加剤としては、成形剤、色素、タルクなどがある。添加剤およびその他の適切な成分については、この分野で周知であり、例えばGennaro A R(ed),Remington’s Pharmaceutical Sciences,20th Editionを参照されたい。
【0204】
いくつかの実施態様において、本発明は、リン酸イオン結合性ポリマーと適切な賦形剤を含むチュアブル錠剤として製剤される医薬組成物を提供する。いくつかの実施態様において、本発明は、リン酸イオン結合性ポリマーと増量剤、滑沢剤を含むチュアブル錠剤として製剤される医薬組成物を提供する。いくつかの実施態様において、本発明は、リン酸イオン結合性ポリマーと増量剤、滑沢剤を含むチュアブル錠剤として製剤される医薬組成物を提示し、ここで増量剤は蔗糖、マンニトール、キシリトール、マルトデキストリン、果糖、ソルビトールの中から選び、滑沢剤はステアリン酸マグネシウムなどの脂肪酸マグネシウム塩である。
【0205】
錠剤は噛みやすく口内で分解するものであれば、どんな大きさ・形状でもよいが、好ましくは円柱形で直径約10〜約40mm、かつ高さ約2〜約10mm、最も好ましくは直径約22mm、かつ高さ約6mmである。
【0206】
いくつかの実施態様において、ポリマーの転移温度は約30℃以上で、好ましくは約50℃以上である。
【0207】
別の実施態様において、ポリマーは高Tg/高融点の低分子量賦形剤(例えばマンニトール、ソルボース、蔗糖)とあらかじめ配合しておき、ポリマーと賦形剤が完全に混合したソリッドな溶液を生成させる。押出し、スプレー乾燥、冷蔵乾燥、凍結乾燥、または湿潤顆粒形成などの混合方法が有用である。混合度の目安は、示差走査熱量計や、動的機械分析などの公知の物理的測定によって得られる。
【0208】
ポリマーをはじめとする製剤成分が含まれるチュアブル錠剤の製造方法は、当該分野で公知である。例えば、欧州特許申請No.EP373852A2および米国特許No.6,475,510や、Remington’s Pharmaceutical Sciencesを参照されたい。これら全体は、参照によってここに組み込まれる。
【0209】
B.液体製剤
いくつかの実施態様において、本発明のポリマーは、液体製剤の形態における医薬組成物として提示される。いくつかの実施態様において、医薬組成物は、イオン結合性ポリマーが適切な液体賦形剤中に分散した状態で含まれている。適切な液体賦形剤については、当該分野で公知であり、例えばRemington’s Pharmaceutical
Sciencesを参照されたい。
【0210】
IV.治療方法
本発明は、別の一態様において、イオンバランス異常障害の治療方法を提供する。本明細書中で使用される場合、「イオンバランス異常障害」とは、体内に存在するイオン濃度が異常である状態を指す。ある実施態様において、本発明はリン酸バランス異常障害の治療方法を提供する。本明細書中で使用される場合、「リン酸バランス異常障害」とは、体内に存在するリン酸濃度が異常である状態を指す。リン酸バランス異常のひとつの例が、高リン酸血症である。本明細書中で使用される場合、「高リン酸血症」とは、体内に存在するリン元素の濃度が高い状態を指す。通常、例えば血液中のリン酸レベルが約4.5mg/dL以上の場合、そして/あるいは例えば腎糸球体濾過率が約20%に減少している場合、たいていの場合、患者は、高リン酸血症と診断される。
【0211】
よって例えば、本発明は、動物に対し本発明のポリマーの有効量を投与することによって、動物から陰イオンを除去する方法を提供する。いくつかの実施態様において、ポリマーは、標的陰イオン(例えば、リン酸イオンやシュウ酸イオン)を結合する陰イオン結合性ポリマーであり、このポリマーは、次の特徴のうち少なくとも2つにより特徴付けられる:a)膨潤率は約5未満である、b)生理学的媒体中で測定されたゲル細孔体積分布において、標的陰イオンの分子量の約2倍よりも大きい分子量をもつ非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%未満である、およびc)非干渉性緩衝液と比した胃腸内模擬液の標的陰イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、ポリマーの標的陰イオンはリン酸イオンである。いくつかの実施態様において、リン酸イオンが消化管から除去される。いくつかの実施態様において、投与方法は経口投与である。いくつかの実施態様において、対象動物は、高リン酸血症、低カルシウム血症、甲状腺亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、および末期腎不全からなる群より選択される少なくとも1つ疾患を有している。いくつかの実施態様において、その動物とは人間である。本明細書中に記載されているポリマーはどれも、動物体内でのアニオン結合および/または動物におけるイオンバランス異常により生じる状態の治療において、役に立つ可能性がある。好ましい実施態様において、ポリマーは、次の特徴のうち少なくとも1つにより特徴付けられるリン酸イオン結合性ポリマーである:a)膨潤率は約5未満、好ましくは約2.5未満である、b)生理学的媒体中で測定されたゲル細孔体積分布において、約200より大きい分子量を有する非反応性溶質が利用可能な細孔体積部分が、ゲル重量の約20%以下である、およびc)非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉率が、約60%未満である。いくつかの実施態様において、膨潤率は約2.8未満、または約2.7未満、または約2.6未満である。
【0212】
本発明の方法、組成物、キットで治療できる他の病気としては、低カルシウム血症、甲状腺亢進症、飢餓骨症候群、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、および軟組織(関節、肺、腎臓、結膜、および心筋組織を含む)の異所性石灰化などが挙げられる。また本発明は、上記疾患のいずれかの予防的治療を含め、末期腎不全および透析患者の治療に使用することができる。
【0213】
また、本明細書中に記載されているポリマーは、他の治療(例えばリン摂取量の食事制限、無機金属塩の透析、および/または他のポリマー樹脂などを使用するもの)の補助としても使用することができる。
【0214】
本発明の組成物は、消化管内から塩化物イオン、重炭酸イオン、鉄イオン、シュウ酸イオン、胆汁酸を除去するのにも役立つ。シュウ酸イオンを除去するポリマーは、腎臓結石の生成リスクが高くなるシュウ酸症(高シュウ酸血症)などの、シュウ酸イオンバランス異常障害の治療に用途が見出される。塩化物イオンを除去するポリマーは、例えばアシドーシス、胸焼け、酸逆流症、胃のむかつきや胃炎などの治療に用途が見出される。いくつかの実施態様において、本発明の組成物は、脂肪酸やビリルビン、その他関連物質の除去に役立つ。いくつかの実施態様では、タンパク質や核酸、ビタミン、細胞破片などの高分子量分子を結合・除去することができる。
【0215】
本発明は、動物治療のための方法、医薬組成物、キットを提供する。本明細書中で使用される場合、用語「動物」や「被験動物」とは、人間ならびに哺乳類を含む。本発明のひとつの実施態様は、本明細書中に記載されている架橋アミンポリマーの少なくとも1つの有効量を投与することによって動物の消化管内からリン酸イオンを除去する方法である。
【0216】
本明細書中で使用される用語「治療」および同等の用語は、治療効果や予防的効果の達
成が含まれる。治療効果とは、治療される疾患の根本的治癒、状態改善、または予防を意味する。例えば、高リン酸血症の患者における治療効果とは、高リン酸血症の根本的治癒または状態改善が含まれる。また治療効果は、元となっている疾患そのものはまだ残っていても、それに関連する生理学的症状の1つ以上を根本的に治癒、状態改善、または予防し、これにより患者の回復が見られるようにすることである。例えば、本明細書中に記載されている架橋アミンポリマーを腎不全および/または高リン酸血症を罹患する患者に投与すると、患者の血清リン酸濃度が下がるだけでなく、異所性石灰化や腎性骨形成異常など、腎不全および/または高リン酸血症と併発している他の疾患についても改善が見られる。予防的効果では例えば、高リン酸血症の診断がなされていなくとも、高リン酸血症を起こす高リスク患者や、高リン酸血症の生理学的症状が1つまたは複数出ている患者に、架橋アミンポリマーを投与することができる。例えば、本発明のポリマーは、高リン酸血症とは診断されていなくとも慢性腎臓病のある患者に投与することができる。
【0217】
動物におけるポリマー(例えば、架橋アミンポリマー)の投与量は、治療する疾患や投与経路、動物の身体的特徴などによって異なる。架橋アミンポリマーを用いたいくつかの実施態様において、治療および/または予防目的の架橋アミンポリマーの投与量は、約1g/日〜約30g/日の範囲となり得る。これらのポリマーは、食事と共に投与されるのが好ましい。ポリマーは1日1回、2回、3回のいずれかで投与できる。好ましい投与量の範囲は、約2g/日〜約20g/日であり、より好ましい投与量範囲は、約3g/日〜約7g/日である。本明細書中に記載されているポリマーの投与量は、約50g/日未満であり得、好ましくは約40g/日未満、より好ましくは約30g/日未満、さらに好ましくは約20g/日未満、最も好ましくは約10g/日未満である。
【0218】
好ましくは、治療および/または予防の目的で使用されるイオン結合性ポリマー(例えば、架橋アミンポリマー)は、単独で、あるいは本明細書中に記載されている医薬組成物の形で、投与できる。例えば、本発明の架橋アミンポリマーは、治療する症状によって、他の有効な医薬成分と共に投与することができる。共に投与できる薬剤の例としては、プロトンポンプ阻害剤、カルシウム様作用薬(例えば、cinacalcet)、ビタミンDおよびその類似体、リン酸イオン結合剤などがあるが、これらに限定されない。適切なリン酸イオン結合剤の例としては、炭酸アルミニウム、炭酸カルシウム、酢酸カルシウム(PhosLo)、炭酸ランタン(Fosrenol)、Renagelがあるが、これらに限定されない。共投与の際は、2つの薬剤を同じ投与形態で同時に投与することも、別々の投与形態で同時に投与することも、また別々の投与にすることもできる。例えば、高リン酸血症の治療には、高リン酸血症によって生じた低カルシウム血症の治療のために用いられるカルシウム塩を、架橋アミンポリマーと共に投与することができる。カルシウム塩とポリマーは同じ投与形態の中に一緒に製剤することができ、同時に投与することができる。また、カルシウム塩とポリマーは、両方の薬剤を別々の製剤にして、同時に投与することができる。また別の方法として、カルシウム塩の投与後にポリマーを投与、またはその逆の順で投与することができる。別の投与プロトコルでは、ポリマーとカルシウム塩の投与は数分間、数時間、数日間の間をおいて投与することができる。
【0219】
ポリマーは注射、局所、経口、経皮、直腸を経由して投与することができる。好ましくは、ポリマー、および/またはポリマーを含む医薬組成物は経口投与される。ポリマーを投与する経口剤の形態には、粉末、錠剤、カプセル、溶液、または乳剤がある。有効量を1用量で投与することもできれば、適切な時間間隔(例えば数時間)をおいて、用量を何回かに分けて投与することもできる。
【0220】
本発明では、廃水に本発明の陰イオン結合性ポリマーを接触させることにより、廃水由来のアニオン汚染物質を除去する方法が提示される。ここでアニオン汚染物質(例えばリン酸イオン)は、ポリマーに吸着される。
【0221】
V.キット
本発明は、別の一態様において、陰イオンバランス異常障害の治療(例えばリン酸イオンバランス異常障害の治療など)のためのキットを提供する。このキットは、本明細書中に記載されているポリマーと、本明細書中に記載されているさまざまな方法やアプローチに従ってキットの使用方法を指導する説明書を含む。このキットには、科学的な参照文献や同梱資料、臨床試験結果、および/またはその要約など、この組成物の活性や利点を示すか、または確立する情報も含まれていることがある。この情報は、例えば、in vivoモデルを用いた実験動物使用の研究や、人間の臨床試験に基づく研究など、さまざまな研究結果に基づいている。本明細書中に記載されているキットは、医師や看護師、薬剤師、処方担当者などの医療従事者を対象に、提供、販売、および/または宣伝することができる。美容用キットは、消費者向けに直接提供、販売、および/または宣伝することができる。
【0222】
この特許明細書中に言及されている刊行物および特許出願はすべて、個々の刊行物または特許出願が具体的かつ個別に参考として援用されることが記述されるのと同程度に、参考として本明細書中に援用される。
【0223】
添付の特許請求の範囲の趣旨あるいは範囲から外れることなく、本明細書中に提示されている開示に対し、さまざまな変更および修飾ができることは、当業者にとっては明らかである。
【実施例】
【0224】
(実施例1: リン酸イオン結合測定プロトコル)
この実施例では、ポリマーにおける陰イオン(この場合はリン酸イオン)の結合能を測定するさまざまな手順を説明する。
【0225】
(非干渉性緩衝液中のリン酸イオン結合能の測定)
重量P(g)の等分した乾燥ポリマーを、次記の一定量V(L)の緩衝液(20mM H3PO4、80mM NaCl、100mM MESナトリウム塩(モルホリノエタンスルホン酸)、pH 6.5)に、穏やかに攪拌しながら、混合した。単一の結合測定の場合は、前記の緩衝液が使用された。複数の測定が実施される場合(結合等温曲線をプロットするためなど)は、緩衝液のリン酸イオン濃度を変更した。最初のリン酸イオン濃度はPstart(mM)と記される。この溶液は、他にポリマー樹脂との結合をリン酸イオンと競合する溶質が存在しないため、非干渉性緩衝液ということができる。樹脂が平衡に達した後、溶液を遠心分離器にかけて上澄みを別容器に移し、上澄み中の残存リン酸濃度Peq(mM)をイオンクロマトグラフィーで分析した。結合能を、V*(Pstart−Peq)/Pとして計算した(単位はmmol/g)。各ポリマーについての値が表に記載されている。
【0226】
(胃腸内模擬液における結合能)
この手順を、消化器官内におけるリン酸イオン結合性ポリマー使用の条件を模して、他の代謝産物(競合溶質)が存在する中でリン酸イオン(標的溶質)に対するポリマーの結合特性を測定するためにデザインした。流動食を、ペプシンおよび膵液の存在下で人工的に消化し、胃腸内模擬液とした。消化プロセスを空腸レベルまで模するよう、酵素の追加の順序とpH条件を制御した。
【0227】
次の成分を1つずつ、次の順序で加えた: 粉末ミルク291g、Beneprotein 72.8g、デキストロース152g、ポリコース156g、NaCl 17.6gを、約2.5LのddH2Oに加え、溶解させた(泡ができないようにして、よく攪拌
)。NaClが溶けた後、コーン油240gを加えた。ddH2Oを加えて、体積を4Lに調節した。この混合液を2時間、激しく攪拌した。この時点でpHは約6.4であった。次に3M HClを153ml、1滴ずつ加えて、最終pHを2.0とした(約150ml)。この混合液を15分間攪拌した後、pHは約2.1まで上昇した。次に10mM
HCl中のペプシン800mlを加えて、最終濃度を1mg/mlとした。この混合液をRTで30分間攪拌した後、pHは約2.3となった。次に100mM NaHCO3中のパンクレアチンおよび胆汁酸塩のストック溶液5L(pH8.4)を加え、最終濃度がパンクレアチン0.3mg/ml、胆汁酸塩2mg/mlとした。この混合液を室温で120分間攪拌した後、pHは約6.5となった。この食事模擬液を−80℃で保存し、1ヶ月以内に使用した。
【0228】
胃腸内模擬液の一部を遠心分離し、上澄みについてリン酸イオン量を分析した。リン酸イオン結合試験については、溶液として胃腸内模擬液を使用する他は、上記の非干渉性緩衝液中と同様に行った。
【0229】
(体外吸引物における結合能)
健康な患者に、上記の胃腸内模擬液と同じ組成の食事を与え、小腸内に挿管したチューブを使用して、糜粥の一部を採取した。
【0230】
1本の二重管ポリビニル製チューブの端に水銀おもりをつけてチューブを動きやすくし、被験者の小腸内に収まるように挿管した。X線検査を利用して、配置の方向を調節し、二重管チューブの吸引用開口部のひとつを胃の中に、もうひとつをトライツ靱帯(上部空腸)に置いた。
【0231】
チューブの位置を正しくしたら、流動化した試験食550mL(マーカーとしてポリエチレングリコール(PEG)2g/550mLを添加)を、胃中の開口部を通して22mL/分の速度で胃に注入した。この流動食が全部胃に達するまでに約25分間かかった。これは、通常の食事にかかる時間を模している。
【0232】
チューブ(その管腔はトライツ靱帯にある)から、空腸糜粥を吸引した。この液体は、計2時間半、30分区切りで、その間中連続的に採取した。これによって得られた5つの検体を混合し、体積を測定し、凍結乾燥した。
【0233】
この体外吸引物について、リン酸イオン結合試験を実施した。リン酸イオン結合試験の手順は、溶液に体外吸引物(凍結乾燥したサンプルに適切な量の脱イオン水を加えて再構成したもの)を使用する他は、上記の非干渉性緩衝液中と同様に行った。体外吸引物におけるリン酸イオン結合能を、胃腸内模擬液の実験と同様にして算出した。
【0234】
(実施例2:バルク溶液プロセスで生成された架橋ポリマーのライブラリと、そのリン酸イオン結合能)
(ポリマーライブラリの生成)
以降の5つの実施例はそれぞれ、最大24の架橋ポリマーを含むライブラリである。ポリマーを、4×6のアレー形式に配置されたバッチ反応器で製造した。各反応器は容量が350μLまたは3mlであり、磁石で攪拌し、温度管理が行われた。典型的な手順では、アミン、架橋剤、溶媒、さらにオプションとして塩基を、自動機械を用いて各反応器に分配し、この際にオプションとして攪拌をしながら行った。反応器を密封し、指定の温度で15時間加熱した。反応器アレーを外し、架橋ポリマーの固体をガラス製バイアルに移し、すり潰し、脱イオン水で何回か洗い、凍結乾燥した。下の表3に、対応する製造時反応条件と共に、5つのライブラリを示す。
【0235】
【化37】

(非干渉性緩衝液中のリン酸イオン結合能の測定)
リン酸イオン結合能を、ライブラリの各ポリマーについても測定した。手順については実施例1を参照されたい。
【0236】
(結果)
表4〜8に、5つのライブラリそれぞれのポリマー製造に使用された材料とその量、およびその製造されたポリマーについて測定された、非干渉性緩衝液中でのリン酸結合能を示す。データは、各反応ウェル中で使用された化合物の量(mg単位)と、得られたポリマーゲルのリン酸イオン結合能を示す(空白は、その特定の反応で架橋ゲルが生成されなかったことを示す)。
【0237】
【化38】

【0238】
【化39】

【0239】
【化40】

【0240】
【化41】

【0241】
【化42】

(実施例3: 懸濁液プロセスによる1,3−ジアミノプロパン/エピクロロヒドリン架橋ビーズの合成)
四面バッフル付きの三口丸底フラスコを含む容量3リットルの反応容器を使用した。この反応フラスコにはオイルバス、冷水環流凝縮装置、3インチプロペラつきの機械スターラーを装備した。この反応容器に、1,3−ジアミノプロパン(90.2g、1.21モル)を90.2gの水に溶解した溶液を入れ、界面活性剤(分枝型ドデシルベンゼンスル
ホン酸ナトリウム塩6.4gを100gの水に溶解)と1kgのトルエンを加えた。この最初の投入溶液を600rpmで2分間攪拌し、300rpmに落としてさらに10分間攪拌してから、エピクロロヒドリンを追加した。以降は、実験中ずっと300rpmの速度を維持した。この溶液を80℃に加熱し、以降は実験中ずっとこの温度を維持した。
【0242】
別の容器に、エピクロロヒドリンが40wt%のトルエン溶液を調製した。最初の投入溶液を入れた反応容器に、シリンジポンプを使って、エピクロロヒドリン1.2当量(134.7g(1.45モル))を3時間かけて加えた。さらに2時間反応させてから、40wt%溶液中の0.75当量の水酸化ナトリウム(36.5g(0.91モル))を加えた。水酸化ナトリウム溶液を、シリンジポンプを用いて2.5時間かけて反応溶液に加えた。この反応をさらに8時間、80℃に保った。
【0243】
この後、トルエンを除去し、1000mlのアセトンで洗い、次にメタノールで洗い、20%NaOH溶液で洗い(界面活性剤を除去するため)、さらに2回、脱イオン水で洗うことで、生成したビーズを精製した。ビーズを3日間凍結乾燥して、160g(収率92%)の白い微粉末を得、平均直径は93μmであった。
【0244】
(実施例4: 1,3−ジアミノプロパン/1,3−ジクロロプロパン架橋ポリマーの合成)
溶媒として水を使用し、20mLのシンチレーションバイアル中で、B−SM−22−DA 1000mgを、X−Cl−3 1524mgおよび水2524mgと混合した。マグネチックスターラーで混ぜながら一晩80℃に保持し、さらに2時間、90℃に保持して反応させた。反応混合物の34wt%(1716mg)を精製し、水洗い/遠心分離の手順を3回行い、この実施例のポリマー粉末144.7mgを得た。
【0245】
(実施例5: 1,3−ジアミノプロパン/1,3−ジクロロプロパン架橋ポリマーの合成)
溶媒として水を使用し、20mLのシンチレーションバイアル中で、B−SM−22−DA 2000mgを、X−Cl−3 3048mgおよび水5048mgと混合した。マグネチックスターラーで混ぜながら一晩80℃に保持し、反応させた。
【0246】
3時間反応させた後、この反応中に生成した酸(使用した架橋剤はアルキルハライドであるため)を除去するためにNaOHの30wt%水溶液3597mgを加えた。反応混合物の20.3wt%(2,773.5mg)を精製し、水洗い/遠心分離の手順を3回行い、この実施例のポリマー粉末591.3mgを得た。
【0247】
(実施例6: プレポリマーアプローチを用いた、1,3−ジアミノプロパン /1,3−ジクロロプロパンによる架橋ビーズの合成)
(プレポリマーの生成)
反応容器に250mLの二口丸底フラスコを用い、冷水環流凝縮装置、マグネチックスターラーを装備し、アルゴン雰囲気中で実施した。この反応容器に、1,3−ジアミノプロパン(31.15g、0.42モル)を水30.15gに溶かした溶液を入れた。この最初の溶液を300rpmで攪拌した。この溶液を80℃に加熱し、以降は実験中ずっとこの温度を維持した。シリンジポンプを使って、1,3−ジクロロプロパン(Aldrich 99%)1当量(47.47g、40.0mL、0.42モル)を2時間かけて加えた。さらに2時間反応させてから、10mol%(1,3−ジアミノプロパンに対して)の水酸化ナトリウム(NaOH 1.68g(0.042モル)の40wt%水溶液)を加えた。水酸化ナトリウム溶液は、ピペットを用い、2分間かけて反応溶液に加えた。この反応をさらに4時間、80℃に保った。この溶液は80℃で粘性をもち、25℃に冷めると固形になり、これは水に簡単に溶ける。
【0248】
(精製)
できた固形物に水を加え、水 200mlとMeOH 200mlで洗う。1LのビーカーにMeOH/イソプロピルアルコールの50/50溶液を入れておき、洗った固形物をビーカーに入れる。白いポリマーが沈殿する。この懸濁液を遠心分離にかけ、上澄み液を除去する。イソプロピルアルコールを用いて、このプロセスをあと2回繰り返す。白い沈殿物を室温減圧下で乾燥させ、イソプロピルアルコールを除去する。分離されたポリマーの重量:Mn(ポリエチレンイミン標準に対するGPC)は約600。
【0249】
(架橋粒子の合成)
フラスコに、白いプレポリマー(8.7g)を、分枝状ドデシルベンゼンスルホン酸ナトリウム塩1.3g(30wt%水溶液)およびトルエン34.8gと共に入れた。これにより、トルエン中にポリマーが懸濁した20wt%溶液が得られた。ポリマーを、グラインダー機械でミクロンサイズの粒子にすり潰した(ブランド: IKA、モデル: Ultra−Turax T8)。得られた懸濁液2.2gを、10mLの反応フラスコに移した。フラスコにはヒーター、機械スターラー、シリンジポンプが装備されている。反応フラスコに、追加のトルエン3779mgを入れた。フラスコを80℃に加熱し、スターラーを使用した(500RPM)。この温度で3時間攪拌した後、エピクロロヒドリン112.2mg(0.0012モル)を、1.5時間かけて加えた。さらに2時間反応させてから、水酸化ナトリウム(40wt%水溶液)224.4mg(0.0056mol)を、2時間かけて追加した。これを室温に冷まし、攪拌を止めた。生成したビーズを、トルエンを除去し、メタノールで洗い、20%NaOH溶液で洗い(界面活性剤を除去するため)、さらに2回、脱イオン水で洗うことにより精製した。そのビーズを3日間冷凍乾燥して、白い微粉末を得た。非干渉性緩衝液中で測定した結合能は3.85mmol/gであった。
【0250】
(実施例7: 1,3−ジアミノプロパン/1,3−ジクロロプロパンにより調製される低分子量ポリマー(プレポリマー)1の合成と分離)
以降の実施例では、次の略語が用いられる:
エピクロロヒドリン: ECH
N,N,N’,N’−テトラキス(3−アミノプロピル) 1,4−ジアミノブタン:
BTA
BC: 結合能
この実施例では、反応混合物中のモノマー(ここではプレポリマー)対溶媒の比率の変化による、結合能と膨潤率への影響を示した。この実施例で説明するプロセスは、2つの部分に分かれる:第一は、1,3−ジアミノプロパンと1,3−ジクロロプロパンからの溶解性プレポリマー付加生成物の合成、第二は、ECHによるプレポリマーの架橋による不溶性ビーズの生成である。第二の反応は、水対プレポリマーの比を変えた逆懸濁プロセスからなった。この変化による、結合能力と膨潤への影響を評価した。
【0251】
(プレポリマーの合成)
ステップ1(プレポリマーの生成): 反応容器に250mLの二口丸底フラスコを用い、冷水環流凝縮装置、マグネチックスターラーを装備し、アルゴン雰囲気中で実施した。この反応容器に、1,3−ジアミノプロパン(31.15g、0.42モル)を水30.15gに溶かした溶液を入れた。この最初の溶液を300rpmで攪拌した。この溶液を80℃に加熱し、以降は実験中ずっとこの温度を維持した。シリンジポンプを使って、1,3−ジクロロプロパン(Aldrich 99%)1当量(47.47g、40.0mL、0.42モル)を、2時間かけて加えた。さらに2時間反応させてから、10mol%(1,3−ジアミノプロパンに対して)の水酸化ナトリウム(NaOH 1.68g(0.042モル)の40wt%水溶液)を加えた。この水酸化ナトリウム溶液を、ピペ
ットを用いて、2分間かけて反応溶液に加えた。この反応をさらに4時間、80℃に保った。この溶液は80℃で粘性をもち、25℃に冷めると固形になり、これは水に簡単に溶けた。
【0252】
ステップ2(精製):できた固形物に水を加え、水 200mlとMeOH 200mlで洗った。1LのビーカーにMeOH/イソプロピルアルコールの50/50溶液を入れておき、洗った固形物をビーカーに入れた。白いポリマーが沈殿した。遠心分離にかけ、上澄み液を除去した。イソプロピルアルコールを用いて、このプロセスをあと2回繰り返した。白い沈殿物を室温減圧下で乾燥させ、イソプロピルアルコールを除去した。分離されたポリマーの分子量: Mn(ポリエチレンイミン標準に対するGPC) は約600。
【0253】
半連続24ウェル平行重合反応器での1,3−ジアミノプロパン/1,3−ジクロロプロパンプレポリマーにより調製されるミクロンサイズの架橋粒子の合成。
【0254】
フラスコに、白いプレポリマー1(8.7g)を、分枝状ドデシルベンゼンスルホン酸ナトリウム塩1.3g(30wt%水溶液)およびトルエン34.8gと共に入れた。これにより、トルエン中にポリマーが懸濁した20wt%溶液が得られた。乳化液を、高剪断ホモジナイザーでミクロンサイズの液粒にすり潰した(ブランド: IKA、モデル:
Ultra−Turax T8)。得られた乳化液2.2gを、10mLの反応フラスコ24本に移した。フラスコにはヒーター、機械スターラー、シリンジポンプが装備されている。各反応フラスコに、追加のトルエン3779mgを入れた。フラスコを80℃に加熱し、スターラーを使用した(500RPM)。プレポリマー対水の比がさまざまになるように、必要なだけの水を各管に追加した。この温度で3時間攪拌した後、望ましい量のエピクロロヒドリン(この実施例では、エピクロロヒドリンをプレポリマー乾燥重量の20%に相当する量を加えた)を1.5時間かけて加えた。さらに2時間反応させてから、水酸化ナトリウム(40wt%水溶液)224.4mg(0.0056mol)を、2時間かけて追加した。これを室温に冷まし、攪拌を止めた。ビーズを、トルエンを除去し、メタノールで洗い、20%NaOH溶液で洗う(界面活性剤を除去するため)ことによって精製し、次にHClで洗ってビーズをプロトン化した。次にビーズを脱イオン水で2回洗って、余分のHClを除去した。ビーズを3日間凍結乾燥して、白い微粉末を得た。
【0255】
こうして合成されたポリマービーズについて、非干渉性緩衝液中と胃腸内模擬液中の結合能(BC)、および膨潤率の分析を行った。この結果を表9にまとめる。
【0256】
(表9: 1,3−ジアミノプロパン/1,3−ジクロロプロパン/ECHゲルビーズ。モノマー対水の比率の、結合容量および膨潤率に対する影響)
【0257】
【化43】

モノマー対水の比率が増加すると、非干渉性緩衝液および胃腸内模擬液の両方において、結合能が増加し、その一方で膨潤率は低下し、望ましい範囲に達することを示す。
【0258】
(実施例8: 24ウェル平行重合反応器を用いた、すり潰したBTA/ECHバルクゲルによるミクロンサイズの架橋粒子の製造)
この実施例では、架橋剤対モノマーの量の比率の変化による、結合能と膨潤率への影響を示す。
【0259】
次のストック溶液を調製した:2モル当量の濃塩酸を、1モル当量のBTAに2時間かけて加えた。次に、この溶液に水を加えて、得られる溶液が、BTA 45wt%、HCl 10wt%、水 45wt%の重量%組成となるようにした。5mLフラスコを使用した24ウェル反応器の各フラスコに、この調製したストック溶液0.6gを入れた。テストをするモノマー対架橋剤の比率にするために望ましい量のエピクロロヒドリンを各バイアルに加えた。反応器を80℃で9時間加熱した。その後、冷ました。各バイアルに水を加え、生成したゲルを膨潤させた。次にゲルを、高剪断ホモジナイザーでミクロンサイズの粒子にすり潰した (ブランド: IKA、モデル: Ultra−Turax T8)。この粒子から、水を除去し、メタノールで洗い、20%NaOH溶液で洗うことにより精製し、次にHClで洗って、アミン官能化粒子をプロトン化した。次に粒子を脱イオン水で2回洗って、余分のHClを除去した。粒子を3日間凍結乾燥して、白い微粉末を得た。
【0260】
結合能と膨潤率検討の結果を表10にまとめる。
【0261】
(表10:BTA/ECH ゲル:架橋剤含有量に対する膨潤率と結合能のデータ。バルクゲル(水に対するモノマーの比率は、75wt% Bow−Tie(2HCl)水溶液)。水に対するモノマーの比率は、3.5(ECH:BTA=0.85)〜4.8(ECH:BTA=6.4)の範囲である)
【0262】
【化44】

【0263】
【化45】

このデータにより、胃腸内模擬液における結合能は、架橋剤の比率を変えていく途中に最大値があることがわかる。この特定のシステムにおいては、胃腸内模擬液において、最適の結合能は、架橋剤比率が1.8〜2.8のときであることが認められる。このとき対応するNC値はそれぞれ3.6〜5.6である。その架橋の範囲内では、膨潤率は充分小さい。この重合プロトコルを使用して、他のモノマーや架橋剤についても同様の実験を通常通り行って、ポリマーを使用する特定用途のために望ましい結果を得るような比率を決定することができる。
【0264】
(実施例9: 逆懸濁によるミクロンサイズの架橋BTA/ECHビーズの合成)
次のストック溶液を調製した: 2モル当量の濃塩酸を1モル当量のBTAに2時間かけて加えた。水と界面活性剤(分枝状ドデシルベンゼンスルホン酸ナトリウム塩30wt%水溶液)をこの溶液に加えて、得られた溶液が、BTA 41.8wt%、HCl 9.4wt%、水 41.1wt%、界面活性剤(30wt%水溶液) 7.7wt%の重量%組成となるようにした。
【0265】
反応容器には四面バッフル付きの0.25リットル三口丸底フラスコを使用し、オイルバス、冷水環流凝縮装置、1インチプロペラつきの機械スターラーを装備した。この反応容器に、調製ストック溶液25gとトルエン75gを入れた。
【0266】
別の容器に、エピクロロヒドリンが40wt%のトルエン溶液を調製した。シリンジポンプを使用して、ECHを所望量だけ、90分間かけて加えた。さらに2時間反応させてから、ディーンスターク装置を使用して脱水を開始した。系から水がすべて除去されたときに、反応が完了した。生成したビーズからトルエンを除去し、メタノールで洗い、20%NaOH溶液で洗い (界面活性剤を除去するため)、次にHClで洗ってビーズをプロトン化した。次にビーズを脱イオン水で2回洗って、余分のHClを除去した。ビーズは3日間冷凍乾燥して、白い微粉末を得た。
【0267】
結合能と膨潤率の結果を表11にまとめる。
【0268】
(表11:BTA/ECH ゲルビーズ:架橋剤含有量に対する膨潤率と結合能)
【0269】
【化46】

この結果により、胃腸内模擬液における結合能は、アミンに対する架橋剤の比率を変えていく途中に最大値があることがわかる。この特定のシステムにおいては、胃腸内模擬液における最適な結合能は、架橋剤比率が1.75〜3のときであることが認められる。このとき対応するNC値はそれぞれ3.5〜6である。その架橋の範囲内では、膨潤率は充分小さい。この重合プロトコルを使用して、他のモノマーや架橋剤についても同様の実験を通常通り行って、ポリマーを使用する特定用途のために望ましい結果を得るような比率を決定することができる。
【0270】
(実施例10: 24ウェル平行重合反応器を用いたすり潰したポリアリルアミン/ECHバルクゲルによるミクロンサイズの架橋粒子の合成)
この実施例は、反応混合液中で水に対するモノマーの比率を変えた、高分子量モノマーを使用したポリマーの合成について示す。使用した条件は実施例8と同じであるが、BTAの代わりにポリアリルアミン(Mw=60,000g/モル)を用いた。ECH対アリルアミンの繰り返し単位は、1:0.106(NC2.2に対応)であった。水に対するポリアリルアミンの初期比率を1:1〜1:4に変えた。比較例として、Renagel錠剤から分離した架橋ポリアリルアミンを使用した。
【0271】
【化47】

これらのデータから、水に対するアミンの比率が高くなるにつれて、膨潤率が低くなり、これに伴って胃腸内模擬液における結合能が高くなっていることがわかる。この重合プロトコルを使用して、他のモノマーや架橋剤についても同様の実験を通常通り行うと、ポリマーを使用する特定用途のために望ましい結果を得るような比率を決定することができる。
【0272】
(実施例11: 結合干渉レベルの測定)
この実施例では、本発明のポリマーと、比較のために先行技術のポリマーについて、結合干渉率を測定する。架橋ポリアミン材料(EC172A)は、実施例4に記載されているプロトコルに従って、BTA:ECHモル比が2.5、水に対する(BTA+ECH)の比率が1.73として調製した。結合干渉率をRenagelと比較した。
【0273】
本明細書で使用される場合、「結合干渉率」または「結合干渉」とは、非干渉性(NI)の緩衝液中での結合実験と胃腸内模擬液(GI)での結合実験との間で認められる、平
衡状態にある同じ標的陰イオン濃度において標的イオンの結合能が部分的に低下する度合で表わす。非干渉性緩衝液中の結合等温曲線を、まず、さまざまなリン酸イオン濃度について、平衡時の結合能対リン酸イオン濃度をプロットすることによって得た。次に、この等温曲線を指数関数に当てはめて、任意のリン酸イオン濃度での結合能を予測した(予測BC)。胃腸内模擬液中で測定された結合能(BC)も、同じ等温曲線に基づいて報告し、胃腸内模擬液について平衡時のリン酸イオン濃度対リン酸イオン結合の点をプロットし、この点を通る垂線を書き、非干渉性等温曲線と交わるところまで伸ばした。ここで、阻害率は、(BCNI−BCGI)/BCNI*100として計算した。
【0274】
EC127Aの結合干渉は下の表および図3に示されている。
【0275】
【化48】

RENAGELの結合干渉は下の表および図4に示されている。
【0276】
【化49】

EC172A の結合干渉は、RENAGELよりも約34%低い。
【0277】
(実施例12: 人間の体外吸引物におけるイオン結合特性)
架橋ポリアミン材料(EC172A)を、実施例4に記載されている手順に従って、BTA:ECHモル比が2.5、水に対する(BTA+ECH)の比率を1.73として調製した。次に、実施例1の説明に従って採取された人間の体外吸引物におけるリン酸イオン結合のテストを行った。
【0278】
EC172Aのリン酸イオン結合を、Renagel(Genzyme)から分離された活性薬剤の架橋ポリアリルアミンのリン酸イオン結合と比較した。EC172Aは、ずっと低い阻害率を示し、ずっと低い膨潤率を示した(Renagelが9に対し、EC172Aは2.5)。
【0279】
【化50】

別の実験において、EC172AとRenagelの両方を、別途に人間の体外吸引物に使用して、クエン酸陰イオンや胆汁酸などの競合溶質により生じた、リン酸イオン結合の阻害率を定量化した。クエン酸陰イオンはイオンクロマトグラフィーで、胆汁酸は酵素分析によって滴定が行われた。下記のデータ(6人の志願者の平均)では、本発明のポリマーは選択性がはるかに良好で、全体的なリン酸イオン結合もずっと高い値を示す。
【0280】
【化51】

(実施例13: 溶質分配テクニックを使用したゲル細孔度測定)
この実施例では、ゲル細孔度の測定を説明する。本発明のポリマーと、比較のために市販されているリン酸イオン結合性ポリマーについて測定を行った。本発明のポリマーとして、架橋ポリアミン(EC172A)を用い、実施例10に記載されているプロトコルに従って、BTA:ECHモル比が2.5、水に対する(BTA+ECH)の比率が1.73として調製した。比較のため、Renagelについて同じ細孔度測定が行われた。
【0281】
プローブは、分子量200〜20,000Daのポリエチレングリコール(PEG)8種と、4種のポリエチレンオキシド(PEO)(30,000〜230,000Da)であった。
【0282】
プローブはすべて、pH5.5の30mM酢酸アンモニウム緩衝液(濃度5g/L)に溶かした。このプローブ溶液を、予め計量したEC172A HCl洗浄液(5mL/g)とRenagel HCl洗浄液(15mL/g 乾燥ゲル)に加え、Vortexerで4日間振盪した。
【0283】
プローブ溶液を10倍に希釈してから、Polymer Labエバポレイティブ光散乱検出器を用いてLC分析を行った(ピーク面積の比率が重量濃度比率に等しくなるよう、検出器の直線範囲内におさまるようにする)。
【0284】
接触不能体積の算出=msw+[1−cbefore/cafter]msolv;ここで
msw:ゲルが取り込んでいる水の量[g/g 乾燥ゲル]
msolv:プローブを最初に溶かした水の量[g/g 乾燥ゲル]
cbeforeおよびcafter:平衡に達する前および達した後のプローブ濃
度。比率cbefore/cafterは、LC分析で得られたピーク面積の比率に等しい。
【0285】
比較例の結果を図5および図6に示す。図5は分子量に関しての結果、図6は溶質のサイズに関しての結果を示す。EC172Aは、分子量200まで、一定の溶質分子排除を示している。これに対してRenagelは、分子量が1000程度で排除が減少している。
【0286】
(実施例14: 塩酸クロロプロピルアミンによるビーズの製造後改変)
ストック溶液の調製:
・水溶液(50wt%)中での塩酸クロロプロピルアミン(B−SM−34−A)−d=1.132
・水酸化ナトリウム30wt%水溶液(50wt%溶液を希釈)−d=1.335
合成:
実施例9に従ってBTA:ECHモル比が2.5、水に対する(BTA+ECH)の比率が1.73で調製されたリン酸イオン結合性ポリマーFR−0005−144を基質として、さらにアミノ化を行った。FR−0005−144ビーズを4mLバイアル(各21バイアルがある4×6プレート2枚)に入れ、液体注入ロボットを用いて、水、塩酸クロロプロピルアミンのストック溶液、水酸化ナトリウムのストック溶液を加えた。バイアルにキャップをして密封し、プレートを加熱機器と個別スターラーを装備した反応器にセットした。
【0287】
12時間、加熱と攪拌を行った:反応器の温度は85℃に設定し、攪拌速度は1200rpmとした。
【0288】
精製:
各物質を使い捨ての培養管(16×100mm)に移し、メタノールで1回洗い、1M塩酸で2回洗い、水で3回洗った。ビーズは毎回、遠心分離器で分離した。
【0289】
これらのビーズを凍結乾燥にかけ、消化食物(DM)スクリーン、非阻害緩衝液スクリーン、膨潤率について分析を行った。この結果を表12および図7に示す。
【0290】
(表12:塩酸クロロプロピルアミンで製造後改変したビーズのポリマー特性)
【0291】
【化52】

【0292】
【化53】

(実施例15: N,N’(テトラ−3−アミノプロピル)1,4−ジアミノブタン/エピクロロヒドリンからのリン酸イオンテンプレート使用ミクロンサイズ架橋粒子の合成)
次のストック溶液を調製した: 1モル当量のリン酸(Aldrich、85wt%水溶液)を、1モル当量のN,N’(テトラ−3−アミノプロピル)1,4−ジアミノブタンに、2時間かけて加えた。次に、この溶液に水を加えて、得られる溶液が、N,N’(テトラ−3−アミノプロピル)1,4−ジアミノブタン 42wt%、H3PO4 13wt%、水 45wt%の重量%組成となるようにした。反応器は、5mLフラスコを使用した24ウェルのものを用い、各フラスコにマグネチックスターラーを入れた。各フラスコに、調製したストック溶液0.6〜0.7gを入れた。スターラーを作動させた。エピクロロヒドリンの望ましい量を、原液で各バイアルに加えた。この反応器を60℃で1時間加熱し、その後80℃で8時間加熱した。その後、反応器を冷ました。各バイアルに水を加え、得られたゲルを膨潤させた。このゲルを、10mL試験管が並んだ4×6プレートに移した。このゲルを、グラインダー機械でミクロンサイズの粒子にすり潰した(ブランド:IKA Ultra−Turax T8)。この粒子を、水を除去し、メタノールで洗い、さらに20% NaOH溶液で洗うことによって精製した。次にゲル粒子を1.0モルのHClで洗い、30分間混ぜてから静置し、上澄みを除いた。このプロセスを5回繰り返すことによって、アミン官能化粒子を塩酸でプロトン化し、結合したH3PO4を置換した。ゲル粒子は次に20%NaOH溶液で洗い、アミン官能化ゲル粒子を脱プロトン化した。次にゲル粒子を脱イオン水で2回洗って、余分のNaOH/NaClを除去した。ゲル粒子を3日間凍結乾燥して、白い微粉末を得た。この合成結果を表13にまとめる。
【0293】
(表13:リン酸で分子インプリントされたゲルの合成。ID 102776)
【0294】
【化54】

上記のように合成されたポリマーは、リン酸イオンと結合する。
【0295】
本発明の好ましい実施態様を本明細書中で示し、記載してきたが、これらの実施態様はあくまで例として提示されていることは、当業者にとって明らかである。当業者は、本発明から乖離することなく、さまざまな応用、変更、置換を想起する。本明細書に記載されている本発明の実施態様に対するさまざまな変更は、本発明の実施にあたって用いられ得ることを理解すべきである。次記の特許請求の範囲は、本発明の範囲を定義するものであり、これらの請求項の範囲内の方法および構造、ならびにこれらの均等物が、これらの請求項によって包含されると解釈される。
【図面の簡単な説明】
【0296】
【図1】図1は、非干渉性緩衝液中での標的イオンとポリマーの結合と、干渉性媒質(胃腸内模擬液や体外吸引物など)中での標的イオンとポリマーの結合の等温曲線を比較することによる、結合干渉率の測定を図示するグラフである。
【図2】図2は、プローブ溶質半径に対するゲルの利用付加体積を図示するグラフである。
【図3】図3は、リン酸イオン結合性ポリマー(EC172A)の結合干渉の測定を示すグラフである。
【図4】図4は、リン酸イオン結合性ポリマー(RENAGEL)の結合干渉の測定を示すグラフである。
【図5】図5は、非反応性プローブについての、プローブ分子量に対する利用付加体積のプロットであって、本発明のリン酸イオン結合性ポリマー(EC 172A)と、現在販売されているリン酸イオン結合剤(RENAGEL)の差異を図示するものである。
【図6】図6は、非反応性プローブについての、プローブ半径に対する利用不可能体積のプロットであって、本発明のリン酸イオン結合性ポリマー(EC 172A)と、現在販売されているリン酸イオン結合剤(RENAGEL)の差異を図示するものである。
【図7】図7は、塩酸クロロプロピルアミンでFR−005−144を改変した場合の、結合能の変化を示すグラフである。
【特許請求の範囲】
【請求項1】
下式のアミンモノマーが100mol%〜400mol%の架橋剤により架橋されたものである架橋アミンポリマー:
【化1】

(式中、nは3、4または5である)、ただし、該架橋剤はエピクロロヒドリンではない。
【請求項2】
前記アミンモノマーが、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンである、請求項1に記載の架橋アミンポリマー。
【請求項3】
前記アミンモノマーの反応性アミン基に対する架橋剤の比が、200mol%〜300mol%である、請求項1または2に記載の架橋アミンポリマー。
【請求項4】
膨潤率が5未満であることによって特徴づけられる、請求項1に記載の架橋アミンポリマー。
【請求項5】
200より大きい分子量の非反応性溶質が利用可能な部分が、ゲル重量の20%未満であることによって特徴づけられる、請求項1に記載の架橋アミンポリマー。
【請求項6】
非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉率が60%未満であることによって特徴づけられる、請求項1に記載の架橋アミンポリマー。
【請求項7】
請求項1に記載の架橋アミンポリマーを製造する方法であって、不均一プロセスである分散媒質中の重合を含むものであり、ここに該方法は、アミンモノマーは連続相に不溶性で液粒として分散され、架橋反応は該液粒相内で起こり、架橋反応が進んで生成した架橋ポリマーを、連続相中に分散したビーズまたは不定形粒子として得る、方法。
【請求項8】
前記不均一プロセスが、逆懸濁、直接懸濁、沈殿重合、乳化重合およびマイクロエマルジョン重合、ならびにエアロゾル中の反応から選択される、請求項6に記載の方法。
【請求項9】
請求項7または8に記載の方法であって、次の工程を包含する、方法:
i)アミンモノマーを水または水溶液に溶かす工程、
ii)該アミンモノマーの一部を、酸で中和する工程、
iii)水と混和しない溶媒の中に該アミンモノマー溶液を分散させ、乳化液をつくる工程、
iv)架橋剤を該乳化液に、何回かに分けて追加する工程、及び
v)架橋反応を最後まで反応させて、架橋アミンポリマーを製造する工程。
【請求項10】
請求項7〜9のいずれか1項に記載の方法によって製造される、請求項1に記載の架橋アミンポリマー。
【請求項11】
請求項1〜6および10のいずれか1項に記載の架橋アミンポリマーを活性成分として含有する医薬。
【請求項12】
高リン酸血症、低カルシウム血症、上皮小体亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、慢性腎不全、および同化代謝から選択される疾患の治療剤である、請求項11に記載の医薬。
【請求項13】
高リン酸血症の治療剤である、請求項11に記載の医薬。
【請求項1】
下式のアミンモノマーが100mol%〜400mol%の架橋剤により架橋されたものである架橋アミンポリマー:
【化1】

(式中、nは3、4または5である)、ただし、該架橋剤はエピクロロヒドリンではない。
【請求項2】
前記アミンモノマーが、N,N,N’,N’−テトラキス(3−アミノプロピル)1,4−ジアミノブタンである、請求項1に記載の架橋アミンポリマー。
【請求項3】
前記アミンモノマーの反応性アミン基に対する架橋剤の比が、200mol%〜300mol%である、請求項1または2に記載の架橋アミンポリマー。
【請求項4】
膨潤率が5未満であることによって特徴づけられる、請求項1に記載の架橋アミンポリマー。
【請求項5】
200より大きい分子量の非反応性溶質が利用可能な部分が、ゲル重量の20%未満であることによって特徴づけられる、請求項1に記載の架橋アミンポリマー。
【請求項6】
非干渉性緩衝液と比した胃腸内模擬液のリン酸イオンに対するイオン結合干渉率が60%未満であることによって特徴づけられる、請求項1に記載の架橋アミンポリマー。
【請求項7】
請求項1に記載の架橋アミンポリマーを製造する方法であって、不均一プロセスである分散媒質中の重合を含むものであり、ここに該方法は、アミンモノマーは連続相に不溶性で液粒として分散され、架橋反応は該液粒相内で起こり、架橋反応が進んで生成した架橋ポリマーを、連続相中に分散したビーズまたは不定形粒子として得る、方法。
【請求項8】
前記不均一プロセスが、逆懸濁、直接懸濁、沈殿重合、乳化重合およびマイクロエマルジョン重合、ならびにエアロゾル中の反応から選択される、請求項6に記載の方法。
【請求項9】
請求項7または8に記載の方法であって、次の工程を包含する、方法:
i)アミンモノマーを水または水溶液に溶かす工程、
ii)該アミンモノマーの一部を、酸で中和する工程、
iii)水と混和しない溶媒の中に該アミンモノマー溶液を分散させ、乳化液をつくる工程、
iv)架橋剤を該乳化液に、何回かに分けて追加する工程、及び
v)架橋反応を最後まで反応させて、架橋アミンポリマーを製造する工程。
【請求項10】
請求項7〜9のいずれか1項に記載の方法によって製造される、請求項1に記載の架橋アミンポリマー。
【請求項11】
請求項1〜6および10のいずれか1項に記載の架橋アミンポリマーを活性成分として含有する医薬。
【請求項12】
高リン酸血症、低カルシウム血症、上皮小体亢進症、腎臓でのカルシトリオール合成低下、低カルシウム血症によるテタニー、腎不全、軟組織の異所性石灰化、慢性腎不全、および同化代謝から選択される疾患の治療剤である、請求項11に記載の医薬。
【請求項13】
高リン酸血症の治療剤である、請求項11に記載の医薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2007−262421(P2007−262421A)
【公開日】平成19年10月11日(2007.10.11)
【国際特許分類】
【出願番号】特願2007−176813(P2007−176813)
【出願日】平成19年7月4日(2007.7.4)
【分割の表示】特願2006−538481(P2006−538481)の分割
【原出願日】平成16年11月3日(2004.11.3)
【出願人】(506151486)イリプサ, インコーポレイテッド (11)
【Fターム(参考)】
【公開日】平成19年10月11日(2007.10.11)
【国際特許分類】
【出願日】平成19年7月4日(2007.7.4)
【分割の表示】特願2006−538481(P2006−538481)の分割
【原出願日】平成16年11月3日(2004.11.3)
【出願人】(506151486)イリプサ, インコーポレイテッド (11)
【Fターム(参考)】
[ Back to top ]

