障害のある血管の治療をモニターするための部位局在化および方法
血管の欠陥を特定し、このような欠陥を治療するための方法が提供される。当該方法は、患者に、血管が損傷した部位で蓄積できる標識された送達用リガンドを含む組成物を投与する工程を含む。ある実施形態では、送達された血管は、欠陥に対する1つ以上の活性剤を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、障害のある血管の治療をモニターするための部位局在化および方法に関する。
【背景技術】
【0002】
出血(bleeding)(技術的に出血(hemorrhaging)として知られる)は、循環系からの血液の損失である。出血は、身体内の血管が裂け、または漏れた場合に生じる。血管は、身体的な外傷または非外傷性の理由(破裂動脈瘤等)から破裂し得る。さらに、血管は、炎症または血管新生をもたらす疾患によって漏出性になり得る。破裂した、または漏出性の血管は、ショックまたは死さえももたらし得る、重度の内出血の原因になる可能性がある。例えば、破裂動脈瘤を経験した全人口の約半分は、1日以内または3ヶ月以内のいずれかに死亡する。生存者のうち約50%には、通常、生涯にわたる身体障害が残る。
【発明の概要】
【発明が解決しようとする課題】
【0003】
従って、当該技術分野において、血管の欠陥を検出し、このような欠陥を治療する方法に対するニーズがある。
【課題を解決するための手段】
【0004】
1つの態様では、血管中の欠陥(漏出、孔または破裂等)の特定方法が提供される。このような方法は、患者に標識された送達用リガンドを含む組成物を投与する工程を含む。送達用リガンドの量は、標識の強度、および、送達用リガンドが血管の欠陥部位を探索し、蓄積する能力に依存する可能性がある。投与後、送達用リガンドは、欠陥が存在する場合は、欠陥部位に蓄積し、欠陥の正確な位置および重症度は、送達用リガンドを可視化することによって特定してもよい。
【0005】
ある実施形態では、送達用リガンドは、親水性または両親媒性のポリマーから選択されてもよい。ある実施形態では、送達用リガンドは、ポリエチレングリコール(PEG)であってもよい。
【0006】
別の態様では、血管の欠陥への活性剤の送達をモニターする方法が提供される。このような方法は、患者に、標識された送達用ポリマーおよび当該送達用リガンドに結合する1つ以上の活性剤を含む組成物を投与する工程と、当該標識された送達用ポリマーを検出する工程とを含む。
【0007】
ある実施形態では、送達用リガンドは親水性または両親媒性のポリマー(ポリエチレングリコール等)から選択されてもよく、当該活性剤は、金属イオンである。
【0008】
さらに別の態様では、損傷した血管の治療をモニターする方法が提供される。このような方法は、患者に、体積あたり約15〜約60質量%の標識されたPEG、および体積あたり約0.1質量%〜約20質量%の送達用リガンドに結合した活性剤を含む組成物を投与する工程と、当該組成物の治療効果をモニターする工程とを含む。
【0009】
様々な実施態様のさらなる特徴および利点について、一部は下記に記載され、一部は当該記載から明らかであるか、または様々な実施態様の実施によって知ることができる。様々な実施態様の目的および他の利点は、本願明細書および請求項で具体的に記載された要素および組み合わせによって認識でき、かつ、実現できる。
【0010】
部分的に、実施態様の他の態様、特徴、利益および利点は、下記の記載、添付の請求項および添付の図面から明らかである。
【図面の簡単な説明】
【0011】
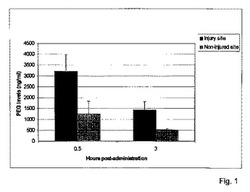
【図1】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【図2a】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【図2b】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【図4a】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【図4b】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【発明を実施するための形態】
【0012】
図面は原寸で描かれていないことが理解されるはずである。さらに、図面中の物体間の関係は原寸通りではない可能性があり、実際はサイズについて逆の関係性を有する可能性がある。図面は、示された各物体の構造についての理解および明確さをもたらすことを意図しており、従って、いくつかの特徴は、構造についての特定の特徴を示すために誇張される可能性がある。
【0013】
本願明細書および添付の請求項について、別段の記載がない限り、本願明細書および請求項において使用される成分の量、物質の割合または比率、反応条件を表わす全ての数および他の数値は、用語「約」によって、全ての例において修飾されるものとして理解されるはずである。従って、別段の記載がない限り、本願明細書および添付の請求項に記載された数値パラメータは、本発明によって得ようとする所望の特性に応じて変動する可能性がある近似値である。最低限でも、そして、請求項の範囲の均討論の適用を制限することを意図することなく、各数値パラメータは、少なくとも、報告された有効数字の値に基づいて、通常の丸め方を適用することによって解釈されなければならない。
【0014】
本発明の広範な範囲を示す数値範囲およびパラメータが近似値であるかに関わらず、特定の例に記載された数値は可能な限り正確に報告される。しかし、全ての数値は、各試験の測定値において認められる標準偏差から必然的に生じる特定の誤差を本質的に含む。さらに、本願明細書に開示される全ての範囲は、これらに包含されるいずれか、および全ての部分的な範囲を含むものと理解されるはずである。例えば、「1〜10」という範囲は、最小値1と最大値10との間(およびこれらを含む)のうちのいずれか、および全ての部分的な範囲、すなわち、1に等しいか、もしくはこれよりも大きい最小値、および10に等しいか、またはそれ未満の最大値を有するいずれか、および全ての部分的な範囲(例えば、5.5〜10)を含む。
【0015】
本願明細書および添付の請求項において使用される場合、単数形「1つの(a、an)」および「その(the)」には、1つの参照対象にはっきりと明示して制限されていない限り、複数形の参照対象が含まれることに注意されたい。
【0016】
1つの態様では、血管中の欠陥(漏出、孔または破裂等)の特定方法が提供される。このような方法は、患者に、標識された送達用リガンドを含む組成物を投与する工程を含む。送達用リガンドの量は、標識の強度、または、送達用リガンドが血管の欠陥部位を探索し、蓄積する能力に依存する可能性がある。患者に送達される標識されたリガンドの量は、例えば、組成物中のリガンド濃度を変化させることによって、異なる分子量のリガンドを利用することによって、または組成物の用量を変えることによって調整してもよい。
【0017】
非限定的な例として、本発明の組成物中の血管閉塞化合物の濃度は、体積あたり約0.1〜60質量%、すなわち100mlの溶液に対して0.1gの化合物、より好ましくは体積あたり約20〜約40質量%に及んでもよい。分子量が約100〜20,000Da、約1000〜9000Da、または約2,000Da〜約4,000Daであるリガンドは、本発明の組成物中の送達用リガンドとしての使用に適している。最終的に、本発明の組成物の用量は、患者の体重1kgあたり約0.1〜10mlの組成物、または患者の体重1kgあたり約1〜10mlの組成物に及んでもよい。
【0018】
適した本発明の組成物中の送達用リガンドは、下記の基準を満たしてもよい;(1)水溶性である、(2)血管が無傷である場合、迅速に排泄される、(3)血管の欠陥がある場所に優先的に蓄積する、および(4)親水性を有する。さらに、適した送達用リガンドは、下記に詳述されるように、陽イオンとのイオン結合に適したキレート部位を含んでいてもよい。
【0019】
上述の通り、送達用リガンドは、血管が無傷である場合、身体から迅速に排泄されることが望ましい。従って、適した送達用リガンドは、3時間未満、2時間未満、または1時間未満の半減期を有していてもよい。送達用リガンドの排泄速度または半減期は、リガンドの分子量に関連し、より高い分子量のリガンドは、より長い半減期を有する。さらに、同一の分子量については、親水性リガンドは、より疎水性のリガンドよりも半減期が短い。ほとんど変化せずに尿から排泄され得る親水性リガンドは、排泄の前に何らかの変換が要求されるリガンドよりも、半減期が短い。例えば、糸球体濾過のカットオフ値は24,000Daであるため、24,000Daよりも重い全てのポリマーは、排泄され得る前に、ある程度まで分解される必要があり、これによってポリマーの半減期が延びる。従って、送達用リガンドは、24,000Da未満の分子量を有する親水特性を有するポリマーから選択されてもよい。
【0020】
親水特性を有するポリマーは、親水性または両親媒性ポリマーから選択されてもよい。本願明細書で使用される用語「親水性ポリマー」は、水分子への親和性や誘引を示し、鎖状および/または分岐状の構造において互いに結合する同一のサブユニット(「モノマー」)についての複数の例を含む全ての高分子(200ダルトン以上の分子量)を意味する。親水性ポリマーは、合成または自然に存在する親水性ポリマーであってもよい。
【0021】
自然に存在する親水性ポリマーとしては下記が挙げられるが、これらに限定されない。コラーゲンおよびその誘導体、フィブロネクチン、アルブミン、グロブリン、フィブリノーゲンおよびフィブリン等のタンパク質;ポリマンヌロン酸およびポリガラクツロン酸等のカルボキシル化ポリサッカライド;アミノ化ポリサッカライド、特にグリコサミノグリカン、例えば、ヒアルロン酸、キチン、コンドロイチン硫酸A、B、またはC、硫酸ケラチン、ケラタン硫酸およびヘパリン;メチルセルロース、カルボキシルメチルセルロースナトリウムおよび活性化ポリサッカライド(デキストラン等)およびデンプン誘導体。
【0022】
有用な合成親水性ポリマーとしては下記が挙げられるが、これらに限定されない。ポリアルキレンオキシド、特にポリエチレングリコールおよびポリ(エチレンオキシド)−ポリ(プロピレンオキシド)コポリマー(ブロックコポリマーおよびランダムコポリマー等);グリセロール、ポリグリセロール(特に高度分岐ポリグリセロール)、ポリ(メタクリル酸ポリエチレングリコール)、ポリ(メタクリル酸グリセロール)、ポリ(アクリル酸グリセロール)、ポリ(アクリル酸ポリエチレングリコール)、ポリ(アルキルオキサゾリン)、ホスホリルコリンポリマー、ポリメタクリル酸ナトリウムおよびポリメタクリル酸カリウム、ポリアクリル酸ナトリウムおよびポリアクリル酸カリウム、ポリメタクリル酸およびポリアクリル酸、1つ以上のポリアルキレンオキシドで置換されたプロピレングリコールおよびトリメチレングリコール(例えば、モノ−、ジ−およびトリ−ポリオキシエチル化グリセロール、モノ−およびジ−ポリオキシエチル化プロピレングリコール、ならびにモノ−およびジ−ポリオキシエチル化トリメチレングリコール)等のポリオール;ポリオキシエチル化ソルビトール、ポリオキシエチル化グルコース;アクリル酸ポリマーならびにその類似体およびコポリマー(例えば、ポリアクリル酸それ自体、ポリメタクリル酸、ポリ(メタクリル酸ヒドロキシエチル)、ポリ(アクリル酸ヒドロキシエチル)、ポリ(メタクリル酸メチルアルキルスルホキシド)、ポリ(アクリル酸メチルアルキルスルホキシド)および上述のうちいずれかのコポリマー)、ならびに/またはさらなるアクリレート化学種(アクリル酸アミノエチル等)を含むもの、ならびにモノ−2−(アクリルオキシ)−エチルコハク酸エステル;ポリマレイン酸;ポリアクリルアミドそれ自体、ポリ(メタクリルアミド)、ポリ(ジメチルアクリルアミド)、およびポリ(N−イソプロピル−アクリルアミド)等のポリ(アクリルアミド);ポリ(ビニルアルコール)等のポリ(オレフィンアルコール);ポリ(ビニルピロリドン)、ポリ(N−ビニルカプロラクタム)およびそのコポリマー等のポリ(N−ビニルラクタム);ポリ(メチルオキサゾリン)およびポリ(エチルオキサゾリン)等のポリオキサゾリン;およびポリビニルアミン。
【0023】
本願明細書で使用される用語「両親媒性ポリマー」とは、極性部分構造および非極性部分構造を生じさせる電荷の局所的な量の変化を有する全ての高分子(分子量が200ダルトン以上)を指す。極性部分構造は、他の極性分子構造(水分子等)への親和性または誘引(親水性)を示す一方で、非極性部分構造は、非極性分子(例えば、脂質、油、グリース、脂肪等)への親和性または誘引(親油性)を示す。適した両親媒性ポリマーとしては、ポロキサマー P−188、ポリエーテルエステルコポリマー(ポリエチレングリコールおよびポリブチレンテレフタラートのコポリマー、ポリエチレングリコールおよびポリプロピレンオキシドのコポリマー、ポリエチレングリコールおよびポリプロピレングリコールのブロックコポリマー等)が挙げられるが、これらに限定されない。
【0024】
両親媒性ポリマーはまた、Jeffamine(登録商標)として知られるポリエーテルアミンのファミリーを含む。これらのポリエーテルアミンは、ポリエーテル骨格の末端に結合した一級アミノ基を含み、この骨格は典型的にプロピレンオキシド(PO)、エチレンオキシド(EO)、またはその混合物に基づく。Jeffamine(登録商標)ファミリーは、モノアミン、ジアミン、トリアミンおよび二級アミンを含む。Jeffamine(登録商標)は、Huntsman Corporation(本社;テキサス州、ザ ウッドランド)から購入できる。
【0025】
ある実施態様では、送達用ポリマーは、ポリエチレングリコール(PEG)を含んでいてもよい。異なる分子量のPEGは、例えば、シグマアルドリッチ(米国、ミズーリ州、セントルイス)から得てもよい。
【0026】
送達用リガンドは、医用イメージング技術(例えば、MRI、X線、CTスキャン、PETスキャン等)によって検出可能な、好ましくは数量化できるシグナルを与えることができる化合物(以下、標識と呼ぶ)で標識されてもよい。適した標識の例としては、放射性同位元素含有部分、マスタグ(mass−tag)、蛍光標識および蛍光色素が挙げられるが、これらに限定されない。従って、本発明の組成物の投与後、欠陥の存在、正確な位置および範囲を、送達用リガンドが蓄積している場所、および送達用リガンドが蓄積しているかどうかを視覚化する医用イメージング技術を使用して特定できる。本発明の組成物はまた、患者の進行をモニターするために、治療後に投与してもよい。
【0027】
別の態様では、損傷した組織への活性剤の送達をモニターする方法が提供される。このような方法は、患者に、標識された送達用ポリマーおよび当該送達用リガンドに結合する1つ以上の活性剤を含む組成物を投与する工程と、当該標識された送達用ポリマーを検出する工程と、を含む。組成物の用量は、患者の体重1kgあたり約0.1ml〜10mlの組成物、または約1〜5ml/患者の体重(kg)の比率を使用して、患者の体重に基づいて見積もってもよい。
【0028】
本願明細書で使用される用語「活性剤」は、血管の欠陥の兆候もしくは症候を軽減し、または、このような欠陥の部位へ送達される必要がある化学元素または化合物を指す。本発明の組成物中の活性剤の濃度は、体積あたり約0.1質量%〜約20質量%、より好ましくは体積あたり0.8〜20質量%に及んでもよい。
【0029】
送達用リガンドと1つ以上の活性剤との相互作用を「キレート化」様効果と定義することができる。活性剤の陽イオンは、送達用リガンドの特定のヘテロ原子(例えば、送達用リガンドのN、OおよびS原子)への静電引力を形成し得る。このような結合部位を、本願明細書ではキレート部位と呼ぶ。例えば、ポリエチレングリコール(PEG)全体は非イオン性であるが、PEG鎖上のエーテル酸素における電子の非共有電子対は、ポリマーに陰イオン性の特性を与え、陽イオン(金属イオン等)に結合できる。これらのイオン性の相互作用は、キレート形成に似ているが、陽イオンのイオン価、送達用リガンドおよび塩の水和状態、ポリマー鎖の誘電性の不連続部、ならびに送達用リガンドの分子構造等の他の要素も相互作用に影響していると思われるため、キレートと呼ぶことはできない。この知見は、クラウンエーテル等の特定の化学試薬の、試薬の親和性およびイオン特性に応じた、特定のイオンへの結合能により近い。
【0030】
送達用リガンド中のキレート部位の数は、その分子量および、リガンドを形成するサブユニットの種類に依存する。送達用リガンドは、1つ以上の種類の、そのうちの少なくともいくつかはキレート部位を含むものの繰り返しサブユニットからなる。より高い分子量を有する送達用リガンドは、より多くのサブユニットからなり、従って、より低い分子量を有する送達用リガンドよりも、より多くのキレート部位を有する傾向がある。さらに、いくつかのサブユニットは、いくつかのキレート部位を有する可能性がある一方で、キレート部位を持たないものがある可能性もある。従って、通常は、組成物中のより高い分子量を有する送達用リガンドの濃度は、同じサブユニットを含み、かつ、より低い分子量を有する送達用リガンドの濃度よりも低い可能性がある。
【0031】
ある実施形態では、活性剤は、下記の金属イオンから選択されてもよいが、これらに限定されない;単座の金属イオン(カリウムおよびリチウム等);二座の金属イオン(マグネシウムおよびカルシウム等);遷移金属(鉄、亜鉛、および銅等);より複雑な金属イオン(アルミニウム等);およびこのような金属イオンを含む化合物。このような金属イオンは、送達用リガンドの特定のヘテロ原子(窒素、酸素または硫黄原子等)への静電引力によって、イオン結合を形成することにより、送達用リガンドと錯体を形成する。イオン結合の種類は、1つ以上の金属イオンと送達用リガンドの1つ以上のサブユニットとの電子共有とともに変化し得る。金属対イオンもまた、送達用リガンドとの錯体の形成に関与する可能性がある。
【0032】
ある実施形態では、本発明の組成物はまた、親水性の疾患修飾剤、神経伝達物質、神経ペプチドおよび神経受容体調節因子、抗炎症性および免疫調節剤、抗酸化剤、抗アポトーシス剤;向知性薬および成長剤、脂質の形成および輸送の調節因子、血流および血管形成の調節因子、鎮痛剤、ステロイド系抗炎症剤(副腎皮質ステロイド等)、非ステロイド系抗炎症剤(サリチル酸エステル等)、COX−2阻害剤、TNFα阻害剤、オピエートおよびモルヒネ様作用薬等を含んでいてもよい。
【0033】
ある特定の実施形態では、当該活性剤は、マグネシウム化合物を含む。様々なマグネシウム塩が、マグネシウム化合物の供給源をもたらし得る。適したマグネシウム塩としては、硫酸マグネシウム、炭酸マグネシウム、塩化マグネシウム、アスパラギン酸マグネシウム、酸化マグネシウム、ステアリン酸マグネシウム、水酸化マグネシウム、三ケイ酸マグネシウム、グルコン酸マグネシウム、マグネシウムATPまたはこれらのいずれかの組み合わせが挙げられるが、これらに限定されない。これらの化合物は、例えば、シグマアルドリッチ(米国、ミズーリ州、セントルイス)から容易に購入できる。
【0034】
組成物の投与後、標識された送達用リガンドは、活性剤が、その標的へ送達されたがどうか、および、送達された活性剤の量を特定するために可視化してもよい。送達された活性剤の量を算出するために、送達用リガンドのキレート部位の数を送達用リガンドの化学式から算出してもよい。さらに、活性剤によって結合されたキレート部位の割合は、実験で決定するか、または見積もってもよい。このデータから、送達用リガンドによって送達された活性剤の量は、送達用リガンドの量の関数として表わしてもよく、損傷部位に送達された活性剤の量は、損傷部位に蓄積した送達用リガンドの量から算出してもよい。例えば、10mgの送達用リガンドが1mgの活性剤を運ぶことが知られ、20mgの送達用リガンドが損傷部位に蓄積したと特定される場合、損傷部位に送達された活性剤の量は約2mgであると見積もることができる。損傷部位に送達される活性剤の量が分かると、医師が治療の安全性および有効性を改善できるため、非常に有益である。
【0035】
本発明の方法はまた、治療の進行のモニターを可能にする。治療の開始後、特定の時間間隔で、さらなる量の送達用リガンド(活性剤を含む、または含まない)を治療される患者に投与してもよい。欠陥が依然として存在する場合、送達用リガンドは欠陥部位で蓄積して可視化される。そのため、医師は、欠陥が治癒したか、悪化したか、または維持されたままかを判定することができる。さらに、治療の開始後に新たな欠陥が形成した場合、この欠陥もまた検出される。
【0036】
非限定的な例として、米国特許出願第11/418,153号明細書および米国特許出願第11/418,152号明細書(これらは参照により、その全体が本願明細書に組み入れられる)に開示された組成物を、標識と組み合わせて使用してもよい。
【0037】
当該送達用リガンドおよび活性剤に加えて、本発明の組成物は、1つ以上の薬理学的に許容できる担体を含んでいてもよい。本発明の組成物は、賦形剤(例えば、溶媒、結合剤、フィラー、崩壊剤、潤滑剤、懸濁剤、界面活性剤、増粘剤、緩衝剤、抗菌剤等)を含んでいてもよい。多くの異なる薬理学的に許容できる担体および賦形剤が知られており、例えば、Remington’s Pharmaceutical Sciences、Lippincott Williams & Wilkins、第21版(2005年5月1日)に開示されている。
【0038】
以上で本発明の全般について記載した。これについては、例証によって与えられ、特段の記載がない限り本発明を制限する意図ではない下記の実施例への参照によってさらに容易に理解できるであろう。
【実施例】
【0039】
<方法および試験>
オスのスプラーグドーリーラットをイソフルランで麻酔し、定位フレーム上に腹臥位で置いた。T9/10椎弓切除を行い、オハイオ州立大学のインパクターで、1.5mmの置換で動物を挫傷させた。
【0040】
SCIの2時間後に、生理食塩水、生理食塩水中のマグネシウム、PEG中のマグネシウム、またはPEG−ビオチン製剤中のマグネシウムを、静脈内注射(2〜5ml/kg)によって、10〜30分間かけて投与した。注射バイアルの中身は、注射および分析の両方を行う研究者に知らせなかった。
【0041】
図1に示された組織学分析について、索を所定の時点で回収し、20μmの厚さに水平に切り、ビオチン分子(本例ではPEG−ビオチン)が存在すると、アビジン−ペルオキシダーゼ複合体とペルオキシダーゼ基質DAB標識との反応が褐色を呈するABC比色分析キットを使用して処理した。
【0042】
下記に、脊髄損傷部位での出血の範囲についての機能分析または評価の方法を記載する。最後の注射から1時間後、動物を断頭し、損傷を中心に脊髄の15mmの分節を回収し、凍結し、厚さ20μmで低温切片を作成した。索あたり11切片(損傷の中央および吻側および尾側から400μm、800μm、1600μm、2800μmおよび3200μmの区分)を分析のために選択した。スライドにカバースリップを載せ、5倍の対物レンズで、ライカの光学顕微鏡を使用して、脊髄のカラー画像を得た。赤のチャネル(組織への出血を示す)をグレースケールの画像上でキャプチャし、強度の閾値を全ての画像にわたって230に設定し、全体的に一貫させた。脊髄を、下部で捉えられた硬膜および血液を除いて、緑の輪で囲った。赤で表わされ、かつ緑の輪で囲われた重複した信号を、Sigma Scan中のツールバーからのImageについてOverlay Math機能を使用して、青でハイライトし、青の信号の全面積を出血の範囲として測定した。
【0043】
<結果>
損傷部位は、PEG組成物の投与後に可視化できる。図1a〜1fについて、注射から2時間、24時間および7日後に回収した脊髄の水平切片に対するDAB染色は、ビオチン標識されたPEGが損傷後2時間以内に、損傷部位に存在し、注射から24時間後までに損傷部位内に蓄積し、注射から7日後までに大半が消失したことを明らかにした。非特異的なDAB染色は、生理食塩水で処理された動物の脊髄においては見られなかった。
【0044】
本発明は、特定の実施態様を参照して記載されたが、これらの実施態様は本発明の原理および応用を説明するものでしかないことが理解されるはずである。従って、説明した実施態様に多数の改変を行ってもよく、請求項によって定義される本発明の趣旨および範囲から逸脱することなく他の組み合わせを考案してもよいことが理解されるはずである。
【技術分野】
【0001】
本発明は、障害のある血管の治療をモニターするための部位局在化および方法に関する。
【背景技術】
【0002】
出血(bleeding)(技術的に出血(hemorrhaging)として知られる)は、循環系からの血液の損失である。出血は、身体内の血管が裂け、または漏れた場合に生じる。血管は、身体的な外傷または非外傷性の理由(破裂動脈瘤等)から破裂し得る。さらに、血管は、炎症または血管新生をもたらす疾患によって漏出性になり得る。破裂した、または漏出性の血管は、ショックまたは死さえももたらし得る、重度の内出血の原因になる可能性がある。例えば、破裂動脈瘤を経験した全人口の約半分は、1日以内または3ヶ月以内のいずれかに死亡する。生存者のうち約50%には、通常、生涯にわたる身体障害が残る。
【発明の概要】
【発明が解決しようとする課題】
【0003】
従って、当該技術分野において、血管の欠陥を検出し、このような欠陥を治療する方法に対するニーズがある。
【課題を解決するための手段】
【0004】
1つの態様では、血管中の欠陥(漏出、孔または破裂等)の特定方法が提供される。このような方法は、患者に標識された送達用リガンドを含む組成物を投与する工程を含む。送達用リガンドの量は、標識の強度、および、送達用リガンドが血管の欠陥部位を探索し、蓄積する能力に依存する可能性がある。投与後、送達用リガンドは、欠陥が存在する場合は、欠陥部位に蓄積し、欠陥の正確な位置および重症度は、送達用リガンドを可視化することによって特定してもよい。
【0005】
ある実施形態では、送達用リガンドは、親水性または両親媒性のポリマーから選択されてもよい。ある実施形態では、送達用リガンドは、ポリエチレングリコール(PEG)であってもよい。
【0006】
別の態様では、血管の欠陥への活性剤の送達をモニターする方法が提供される。このような方法は、患者に、標識された送達用ポリマーおよび当該送達用リガンドに結合する1つ以上の活性剤を含む組成物を投与する工程と、当該標識された送達用ポリマーを検出する工程とを含む。
【0007】
ある実施形態では、送達用リガンドは親水性または両親媒性のポリマー(ポリエチレングリコール等)から選択されてもよく、当該活性剤は、金属イオンである。
【0008】
さらに別の態様では、損傷した血管の治療をモニターする方法が提供される。このような方法は、患者に、体積あたり約15〜約60質量%の標識されたPEG、および体積あたり約0.1質量%〜約20質量%の送達用リガンドに結合した活性剤を含む組成物を投与する工程と、当該組成物の治療効果をモニターする工程とを含む。
【0009】
様々な実施態様のさらなる特徴および利点について、一部は下記に記載され、一部は当該記載から明らかであるか、または様々な実施態様の実施によって知ることができる。様々な実施態様の目的および他の利点は、本願明細書および請求項で具体的に記載された要素および組み合わせによって認識でき、かつ、実現できる。
【0010】
部分的に、実施態様の他の態様、特徴、利益および利点は、下記の記載、添付の請求項および添付の図面から明らかである。
【図面の簡単な説明】
【0011】
【図1】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【図2a】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【図2b】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【図4a】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【図4b】1週間にわたる急性機械的損傷部位内のビオチン標識されたPEGの蓄積および保持を示す。
【発明を実施するための形態】
【0012】
図面は原寸で描かれていないことが理解されるはずである。さらに、図面中の物体間の関係は原寸通りではない可能性があり、実際はサイズについて逆の関係性を有する可能性がある。図面は、示された各物体の構造についての理解および明確さをもたらすことを意図しており、従って、いくつかの特徴は、構造についての特定の特徴を示すために誇張される可能性がある。
【0013】
本願明細書および添付の請求項について、別段の記載がない限り、本願明細書および請求項において使用される成分の量、物質の割合または比率、反応条件を表わす全ての数および他の数値は、用語「約」によって、全ての例において修飾されるものとして理解されるはずである。従って、別段の記載がない限り、本願明細書および添付の請求項に記載された数値パラメータは、本発明によって得ようとする所望の特性に応じて変動する可能性がある近似値である。最低限でも、そして、請求項の範囲の均討論の適用を制限することを意図することなく、各数値パラメータは、少なくとも、報告された有効数字の値に基づいて、通常の丸め方を適用することによって解釈されなければならない。
【0014】
本発明の広範な範囲を示す数値範囲およびパラメータが近似値であるかに関わらず、特定の例に記載された数値は可能な限り正確に報告される。しかし、全ての数値は、各試験の測定値において認められる標準偏差から必然的に生じる特定の誤差を本質的に含む。さらに、本願明細書に開示される全ての範囲は、これらに包含されるいずれか、および全ての部分的な範囲を含むものと理解されるはずである。例えば、「1〜10」という範囲は、最小値1と最大値10との間(およびこれらを含む)のうちのいずれか、および全ての部分的な範囲、すなわち、1に等しいか、もしくはこれよりも大きい最小値、および10に等しいか、またはそれ未満の最大値を有するいずれか、および全ての部分的な範囲(例えば、5.5〜10)を含む。
【0015】
本願明細書および添付の請求項において使用される場合、単数形「1つの(a、an)」および「その(the)」には、1つの参照対象にはっきりと明示して制限されていない限り、複数形の参照対象が含まれることに注意されたい。
【0016】
1つの態様では、血管中の欠陥(漏出、孔または破裂等)の特定方法が提供される。このような方法は、患者に、標識された送達用リガンドを含む組成物を投与する工程を含む。送達用リガンドの量は、標識の強度、または、送達用リガンドが血管の欠陥部位を探索し、蓄積する能力に依存する可能性がある。患者に送達される標識されたリガンドの量は、例えば、組成物中のリガンド濃度を変化させることによって、異なる分子量のリガンドを利用することによって、または組成物の用量を変えることによって調整してもよい。
【0017】
非限定的な例として、本発明の組成物中の血管閉塞化合物の濃度は、体積あたり約0.1〜60質量%、すなわち100mlの溶液に対して0.1gの化合物、より好ましくは体積あたり約20〜約40質量%に及んでもよい。分子量が約100〜20,000Da、約1000〜9000Da、または約2,000Da〜約4,000Daであるリガンドは、本発明の組成物中の送達用リガンドとしての使用に適している。最終的に、本発明の組成物の用量は、患者の体重1kgあたり約0.1〜10mlの組成物、または患者の体重1kgあたり約1〜10mlの組成物に及んでもよい。
【0018】
適した本発明の組成物中の送達用リガンドは、下記の基準を満たしてもよい;(1)水溶性である、(2)血管が無傷である場合、迅速に排泄される、(3)血管の欠陥がある場所に優先的に蓄積する、および(4)親水性を有する。さらに、適した送達用リガンドは、下記に詳述されるように、陽イオンとのイオン結合に適したキレート部位を含んでいてもよい。
【0019】
上述の通り、送達用リガンドは、血管が無傷である場合、身体から迅速に排泄されることが望ましい。従って、適した送達用リガンドは、3時間未満、2時間未満、または1時間未満の半減期を有していてもよい。送達用リガンドの排泄速度または半減期は、リガンドの分子量に関連し、より高い分子量のリガンドは、より長い半減期を有する。さらに、同一の分子量については、親水性リガンドは、より疎水性のリガンドよりも半減期が短い。ほとんど変化せずに尿から排泄され得る親水性リガンドは、排泄の前に何らかの変換が要求されるリガンドよりも、半減期が短い。例えば、糸球体濾過のカットオフ値は24,000Daであるため、24,000Daよりも重い全てのポリマーは、排泄され得る前に、ある程度まで分解される必要があり、これによってポリマーの半減期が延びる。従って、送達用リガンドは、24,000Da未満の分子量を有する親水特性を有するポリマーから選択されてもよい。
【0020】
親水特性を有するポリマーは、親水性または両親媒性ポリマーから選択されてもよい。本願明細書で使用される用語「親水性ポリマー」は、水分子への親和性や誘引を示し、鎖状および/または分岐状の構造において互いに結合する同一のサブユニット(「モノマー」)についての複数の例を含む全ての高分子(200ダルトン以上の分子量)を意味する。親水性ポリマーは、合成または自然に存在する親水性ポリマーであってもよい。
【0021】
自然に存在する親水性ポリマーとしては下記が挙げられるが、これらに限定されない。コラーゲンおよびその誘導体、フィブロネクチン、アルブミン、グロブリン、フィブリノーゲンおよびフィブリン等のタンパク質;ポリマンヌロン酸およびポリガラクツロン酸等のカルボキシル化ポリサッカライド;アミノ化ポリサッカライド、特にグリコサミノグリカン、例えば、ヒアルロン酸、キチン、コンドロイチン硫酸A、B、またはC、硫酸ケラチン、ケラタン硫酸およびヘパリン;メチルセルロース、カルボキシルメチルセルロースナトリウムおよび活性化ポリサッカライド(デキストラン等)およびデンプン誘導体。
【0022】
有用な合成親水性ポリマーとしては下記が挙げられるが、これらに限定されない。ポリアルキレンオキシド、特にポリエチレングリコールおよびポリ(エチレンオキシド)−ポリ(プロピレンオキシド)コポリマー(ブロックコポリマーおよびランダムコポリマー等);グリセロール、ポリグリセロール(特に高度分岐ポリグリセロール)、ポリ(メタクリル酸ポリエチレングリコール)、ポリ(メタクリル酸グリセロール)、ポリ(アクリル酸グリセロール)、ポリ(アクリル酸ポリエチレングリコール)、ポリ(アルキルオキサゾリン)、ホスホリルコリンポリマー、ポリメタクリル酸ナトリウムおよびポリメタクリル酸カリウム、ポリアクリル酸ナトリウムおよびポリアクリル酸カリウム、ポリメタクリル酸およびポリアクリル酸、1つ以上のポリアルキレンオキシドで置換されたプロピレングリコールおよびトリメチレングリコール(例えば、モノ−、ジ−およびトリ−ポリオキシエチル化グリセロール、モノ−およびジ−ポリオキシエチル化プロピレングリコール、ならびにモノ−およびジ−ポリオキシエチル化トリメチレングリコール)等のポリオール;ポリオキシエチル化ソルビトール、ポリオキシエチル化グルコース;アクリル酸ポリマーならびにその類似体およびコポリマー(例えば、ポリアクリル酸それ自体、ポリメタクリル酸、ポリ(メタクリル酸ヒドロキシエチル)、ポリ(アクリル酸ヒドロキシエチル)、ポリ(メタクリル酸メチルアルキルスルホキシド)、ポリ(アクリル酸メチルアルキルスルホキシド)および上述のうちいずれかのコポリマー)、ならびに/またはさらなるアクリレート化学種(アクリル酸アミノエチル等)を含むもの、ならびにモノ−2−(アクリルオキシ)−エチルコハク酸エステル;ポリマレイン酸;ポリアクリルアミドそれ自体、ポリ(メタクリルアミド)、ポリ(ジメチルアクリルアミド)、およびポリ(N−イソプロピル−アクリルアミド)等のポリ(アクリルアミド);ポリ(ビニルアルコール)等のポリ(オレフィンアルコール);ポリ(ビニルピロリドン)、ポリ(N−ビニルカプロラクタム)およびそのコポリマー等のポリ(N−ビニルラクタム);ポリ(メチルオキサゾリン)およびポリ(エチルオキサゾリン)等のポリオキサゾリン;およびポリビニルアミン。
【0023】
本願明細書で使用される用語「両親媒性ポリマー」とは、極性部分構造および非極性部分構造を生じさせる電荷の局所的な量の変化を有する全ての高分子(分子量が200ダルトン以上)を指す。極性部分構造は、他の極性分子構造(水分子等)への親和性または誘引(親水性)を示す一方で、非極性部分構造は、非極性分子(例えば、脂質、油、グリース、脂肪等)への親和性または誘引(親油性)を示す。適した両親媒性ポリマーとしては、ポロキサマー P−188、ポリエーテルエステルコポリマー(ポリエチレングリコールおよびポリブチレンテレフタラートのコポリマー、ポリエチレングリコールおよびポリプロピレンオキシドのコポリマー、ポリエチレングリコールおよびポリプロピレングリコールのブロックコポリマー等)が挙げられるが、これらに限定されない。
【0024】
両親媒性ポリマーはまた、Jeffamine(登録商標)として知られるポリエーテルアミンのファミリーを含む。これらのポリエーテルアミンは、ポリエーテル骨格の末端に結合した一級アミノ基を含み、この骨格は典型的にプロピレンオキシド(PO)、エチレンオキシド(EO)、またはその混合物に基づく。Jeffamine(登録商標)ファミリーは、モノアミン、ジアミン、トリアミンおよび二級アミンを含む。Jeffamine(登録商標)は、Huntsman Corporation(本社;テキサス州、ザ ウッドランド)から購入できる。
【0025】
ある実施態様では、送達用ポリマーは、ポリエチレングリコール(PEG)を含んでいてもよい。異なる分子量のPEGは、例えば、シグマアルドリッチ(米国、ミズーリ州、セントルイス)から得てもよい。
【0026】
送達用リガンドは、医用イメージング技術(例えば、MRI、X線、CTスキャン、PETスキャン等)によって検出可能な、好ましくは数量化できるシグナルを与えることができる化合物(以下、標識と呼ぶ)で標識されてもよい。適した標識の例としては、放射性同位元素含有部分、マスタグ(mass−tag)、蛍光標識および蛍光色素が挙げられるが、これらに限定されない。従って、本発明の組成物の投与後、欠陥の存在、正確な位置および範囲を、送達用リガンドが蓄積している場所、および送達用リガンドが蓄積しているかどうかを視覚化する医用イメージング技術を使用して特定できる。本発明の組成物はまた、患者の進行をモニターするために、治療後に投与してもよい。
【0027】
別の態様では、損傷した組織への活性剤の送達をモニターする方法が提供される。このような方法は、患者に、標識された送達用ポリマーおよび当該送達用リガンドに結合する1つ以上の活性剤を含む組成物を投与する工程と、当該標識された送達用ポリマーを検出する工程と、を含む。組成物の用量は、患者の体重1kgあたり約0.1ml〜10mlの組成物、または約1〜5ml/患者の体重(kg)の比率を使用して、患者の体重に基づいて見積もってもよい。
【0028】
本願明細書で使用される用語「活性剤」は、血管の欠陥の兆候もしくは症候を軽減し、または、このような欠陥の部位へ送達される必要がある化学元素または化合物を指す。本発明の組成物中の活性剤の濃度は、体積あたり約0.1質量%〜約20質量%、より好ましくは体積あたり0.8〜20質量%に及んでもよい。
【0029】
送達用リガンドと1つ以上の活性剤との相互作用を「キレート化」様効果と定義することができる。活性剤の陽イオンは、送達用リガンドの特定のヘテロ原子(例えば、送達用リガンドのN、OおよびS原子)への静電引力を形成し得る。このような結合部位を、本願明細書ではキレート部位と呼ぶ。例えば、ポリエチレングリコール(PEG)全体は非イオン性であるが、PEG鎖上のエーテル酸素における電子の非共有電子対は、ポリマーに陰イオン性の特性を与え、陽イオン(金属イオン等)に結合できる。これらのイオン性の相互作用は、キレート形成に似ているが、陽イオンのイオン価、送達用リガンドおよび塩の水和状態、ポリマー鎖の誘電性の不連続部、ならびに送達用リガンドの分子構造等の他の要素も相互作用に影響していると思われるため、キレートと呼ぶことはできない。この知見は、クラウンエーテル等の特定の化学試薬の、試薬の親和性およびイオン特性に応じた、特定のイオンへの結合能により近い。
【0030】
送達用リガンド中のキレート部位の数は、その分子量および、リガンドを形成するサブユニットの種類に依存する。送達用リガンドは、1つ以上の種類の、そのうちの少なくともいくつかはキレート部位を含むものの繰り返しサブユニットからなる。より高い分子量を有する送達用リガンドは、より多くのサブユニットからなり、従って、より低い分子量を有する送達用リガンドよりも、より多くのキレート部位を有する傾向がある。さらに、いくつかのサブユニットは、いくつかのキレート部位を有する可能性がある一方で、キレート部位を持たないものがある可能性もある。従って、通常は、組成物中のより高い分子量を有する送達用リガンドの濃度は、同じサブユニットを含み、かつ、より低い分子量を有する送達用リガンドの濃度よりも低い可能性がある。
【0031】
ある実施形態では、活性剤は、下記の金属イオンから選択されてもよいが、これらに限定されない;単座の金属イオン(カリウムおよびリチウム等);二座の金属イオン(マグネシウムおよびカルシウム等);遷移金属(鉄、亜鉛、および銅等);より複雑な金属イオン(アルミニウム等);およびこのような金属イオンを含む化合物。このような金属イオンは、送達用リガンドの特定のヘテロ原子(窒素、酸素または硫黄原子等)への静電引力によって、イオン結合を形成することにより、送達用リガンドと錯体を形成する。イオン結合の種類は、1つ以上の金属イオンと送達用リガンドの1つ以上のサブユニットとの電子共有とともに変化し得る。金属対イオンもまた、送達用リガンドとの錯体の形成に関与する可能性がある。
【0032】
ある実施形態では、本発明の組成物はまた、親水性の疾患修飾剤、神経伝達物質、神経ペプチドおよび神経受容体調節因子、抗炎症性および免疫調節剤、抗酸化剤、抗アポトーシス剤;向知性薬および成長剤、脂質の形成および輸送の調節因子、血流および血管形成の調節因子、鎮痛剤、ステロイド系抗炎症剤(副腎皮質ステロイド等)、非ステロイド系抗炎症剤(サリチル酸エステル等)、COX−2阻害剤、TNFα阻害剤、オピエートおよびモルヒネ様作用薬等を含んでいてもよい。
【0033】
ある特定の実施形態では、当該活性剤は、マグネシウム化合物を含む。様々なマグネシウム塩が、マグネシウム化合物の供給源をもたらし得る。適したマグネシウム塩としては、硫酸マグネシウム、炭酸マグネシウム、塩化マグネシウム、アスパラギン酸マグネシウム、酸化マグネシウム、ステアリン酸マグネシウム、水酸化マグネシウム、三ケイ酸マグネシウム、グルコン酸マグネシウム、マグネシウムATPまたはこれらのいずれかの組み合わせが挙げられるが、これらに限定されない。これらの化合物は、例えば、シグマアルドリッチ(米国、ミズーリ州、セントルイス)から容易に購入できる。
【0034】
組成物の投与後、標識された送達用リガンドは、活性剤が、その標的へ送達されたがどうか、および、送達された活性剤の量を特定するために可視化してもよい。送達された活性剤の量を算出するために、送達用リガンドのキレート部位の数を送達用リガンドの化学式から算出してもよい。さらに、活性剤によって結合されたキレート部位の割合は、実験で決定するか、または見積もってもよい。このデータから、送達用リガンドによって送達された活性剤の量は、送達用リガンドの量の関数として表わしてもよく、損傷部位に送達された活性剤の量は、損傷部位に蓄積した送達用リガンドの量から算出してもよい。例えば、10mgの送達用リガンドが1mgの活性剤を運ぶことが知られ、20mgの送達用リガンドが損傷部位に蓄積したと特定される場合、損傷部位に送達された活性剤の量は約2mgであると見積もることができる。損傷部位に送達される活性剤の量が分かると、医師が治療の安全性および有効性を改善できるため、非常に有益である。
【0035】
本発明の方法はまた、治療の進行のモニターを可能にする。治療の開始後、特定の時間間隔で、さらなる量の送達用リガンド(活性剤を含む、または含まない)を治療される患者に投与してもよい。欠陥が依然として存在する場合、送達用リガンドは欠陥部位で蓄積して可視化される。そのため、医師は、欠陥が治癒したか、悪化したか、または維持されたままかを判定することができる。さらに、治療の開始後に新たな欠陥が形成した場合、この欠陥もまた検出される。
【0036】
非限定的な例として、米国特許出願第11/418,153号明細書および米国特許出願第11/418,152号明細書(これらは参照により、その全体が本願明細書に組み入れられる)に開示された組成物を、標識と組み合わせて使用してもよい。
【0037】
当該送達用リガンドおよび活性剤に加えて、本発明の組成物は、1つ以上の薬理学的に許容できる担体を含んでいてもよい。本発明の組成物は、賦形剤(例えば、溶媒、結合剤、フィラー、崩壊剤、潤滑剤、懸濁剤、界面活性剤、増粘剤、緩衝剤、抗菌剤等)を含んでいてもよい。多くの異なる薬理学的に許容できる担体および賦形剤が知られており、例えば、Remington’s Pharmaceutical Sciences、Lippincott Williams & Wilkins、第21版(2005年5月1日)に開示されている。
【0038】
以上で本発明の全般について記載した。これについては、例証によって与えられ、特段の記載がない限り本発明を制限する意図ではない下記の実施例への参照によってさらに容易に理解できるであろう。
【実施例】
【0039】
<方法および試験>
オスのスプラーグドーリーラットをイソフルランで麻酔し、定位フレーム上に腹臥位で置いた。T9/10椎弓切除を行い、オハイオ州立大学のインパクターで、1.5mmの置換で動物を挫傷させた。
【0040】
SCIの2時間後に、生理食塩水、生理食塩水中のマグネシウム、PEG中のマグネシウム、またはPEG−ビオチン製剤中のマグネシウムを、静脈内注射(2〜5ml/kg)によって、10〜30分間かけて投与した。注射バイアルの中身は、注射および分析の両方を行う研究者に知らせなかった。
【0041】
図1に示された組織学分析について、索を所定の時点で回収し、20μmの厚さに水平に切り、ビオチン分子(本例ではPEG−ビオチン)が存在すると、アビジン−ペルオキシダーゼ複合体とペルオキシダーゼ基質DAB標識との反応が褐色を呈するABC比色分析キットを使用して処理した。
【0042】
下記に、脊髄損傷部位での出血の範囲についての機能分析または評価の方法を記載する。最後の注射から1時間後、動物を断頭し、損傷を中心に脊髄の15mmの分節を回収し、凍結し、厚さ20μmで低温切片を作成した。索あたり11切片(損傷の中央および吻側および尾側から400μm、800μm、1600μm、2800μmおよび3200μmの区分)を分析のために選択した。スライドにカバースリップを載せ、5倍の対物レンズで、ライカの光学顕微鏡を使用して、脊髄のカラー画像を得た。赤のチャネル(組織への出血を示す)をグレースケールの画像上でキャプチャし、強度の閾値を全ての画像にわたって230に設定し、全体的に一貫させた。脊髄を、下部で捉えられた硬膜および血液を除いて、緑の輪で囲った。赤で表わされ、かつ緑の輪で囲われた重複した信号を、Sigma Scan中のツールバーからのImageについてOverlay Math機能を使用して、青でハイライトし、青の信号の全面積を出血の範囲として測定した。
【0043】
<結果>
損傷部位は、PEG組成物の投与後に可視化できる。図1a〜1fについて、注射から2時間、24時間および7日後に回収した脊髄の水平切片に対するDAB染色は、ビオチン標識されたPEGが損傷後2時間以内に、損傷部位に存在し、注射から24時間後までに損傷部位内に蓄積し、注射から7日後までに大半が消失したことを明らかにした。非特異的なDAB染色は、生理食塩水で処理された動物の脊髄においては見られなかった。
【0044】
本発明は、特定の実施態様を参照して記載されたが、これらの実施態様は本発明の原理および応用を説明するものでしかないことが理解されるはずである。従って、説明した実施態様に多数の改変を行ってもよく、請求項によって定義される本発明の趣旨および範囲から逸脱することなく他の組み合わせを考案してもよいことが理解されるはずである。
【特許請求の範囲】
【請求項1】
損傷した組織を特定する方法であって、
患者に、標識された送達用ポリマーを含む組成物を投与する工程と、
前記標識された送達用ポリマーの位置を検出する工程と、を含む方法。
【請求項2】
前記組成物は、体積あたり約15〜約60質量%の前記送達用ポリマーを含む請求項1記載の方法。
【請求項3】
前記送達用ポリマーは、親水性または両親媒性のポリマーを含む請求項1記載の方法。
【請求項4】
前記組成物は、静脈内投与される請求項1記載の方法。
【請求項5】
前記送達用ポリマーは、ポリエチレングリコール(PEG)を含む請求項1記載の方法。
【請求項6】
前記組成物は、活性剤をさらに含む請求項1記載の方法。
【請求項7】
損傷した組織への活性剤の送達をモニターする方法であって、
患者に、標識された送達用ポリマーおよび1つ以上の活性剤を含む組成物を投与する工程と、
前記標識された送達用ポリマーを検出する工程と、を含む方法。
【請求項8】
前記活性剤は、親水性である請求項7記載の方法。
【請求項9】
前記活性剤は、マグネシウムイオンである請求項7記載の方法。
【請求項10】
前記活性剤は、金属イオンである請求項7記載の方法。
【請求項11】
前記組成物は、体積あたり約15〜約60質量%の前記送達用ポリマーを含む請求項7記載の方法。
【請求項12】
損傷した血管の治療をモニターする方法であって、
患者に、体積あたり約15〜約60質量の標識されたPEGおよび体積あたり約0.1質量%〜約20質量%の活性剤を含む組成物を投与する工程と、
前記組成物の治療効果をモニターする工程と、を含む方法。
【請求項1】
損傷した組織を特定する方法であって、
患者に、標識された送達用ポリマーを含む組成物を投与する工程と、
前記標識された送達用ポリマーの位置を検出する工程と、を含む方法。
【請求項2】
前記組成物は、体積あたり約15〜約60質量%の前記送達用ポリマーを含む請求項1記載の方法。
【請求項3】
前記送達用ポリマーは、親水性または両親媒性のポリマーを含む請求項1記載の方法。
【請求項4】
前記組成物は、静脈内投与される請求項1記載の方法。
【請求項5】
前記送達用ポリマーは、ポリエチレングリコール(PEG)を含む請求項1記載の方法。
【請求項6】
前記組成物は、活性剤をさらに含む請求項1記載の方法。
【請求項7】
損傷した組織への活性剤の送達をモニターする方法であって、
患者に、標識された送達用ポリマーおよび1つ以上の活性剤を含む組成物を投与する工程と、
前記標識された送達用ポリマーを検出する工程と、を含む方法。
【請求項8】
前記活性剤は、親水性である請求項7記載の方法。
【請求項9】
前記活性剤は、マグネシウムイオンである請求項7記載の方法。
【請求項10】
前記活性剤は、金属イオンである請求項7記載の方法。
【請求項11】
前記組成物は、体積あたり約15〜約60質量%の前記送達用ポリマーを含む請求項7記載の方法。
【請求項12】
損傷した血管の治療をモニターする方法であって、
患者に、体積あたり約15〜約60質量の標識されたPEGおよび体積あたり約0.1質量%〜約20質量%の活性剤を含む組成物を投与する工程と、
前記組成物の治療効果をモニターする工程と、を含む方法。
【図1】


【図2a】


【図2b】


【図4a】


【図4b】




【図2a】


【図2b】


【図4a】


【図4b】


【公表番号】特表2012−521439(P2012−521439A)
【公表日】平成24年9月13日(2012.9.13)
【国際特許分類】
【出願番号】特願2012−502156(P2012−502156)
【出願日】平成22年3月23日(2010.3.23)
【国際出願番号】PCT/US2010/028233
【国際公開番号】WO2010/111219
【国際公開日】平成22年9月30日(2010.9.30)
【出願人】(506298792)ウォーソー・オーソペディック・インコーポレーテッド (366)
【Fターム(参考)】
【公表日】平成24年9月13日(2012.9.13)
【国際特許分類】
【出願日】平成22年3月23日(2010.3.23)
【国際出願番号】PCT/US2010/028233
【国際公開番号】WO2010/111219
【国際公開日】平成22年9月30日(2010.9.30)
【出願人】(506298792)ウォーソー・オーソペディック・インコーポレーテッド (366)
【Fターム(参考)】
[ Back to top ]

