電子デバイスのための化合物
本発明は、式(1)で表される化合物、好ましくは正孔輸送材料および/または発光材料としての有機電子デバイスにおけるその使用、ならびに式(1)で表される化合物を含む有機電子デバイスに関する:
【化1】

【化1】

【発明の詳細な説明】
【発明の概要】
【0001】
本発明は、式(1)で表される化合物および電子デバイスにおけるその使用、ならびにこれらの化合物を含む電子デバイスに関する。
【0002】
有機エレクトロルミネッセンス素子の一般的な構造は、例えば、US 4539507、US 5151629、EP 0676461およびWO 98/27136に記載されている。しかしながら、これらデバイスにおける改善の必要性が依然としてある:
1.特に蛍光OLEDにおいては、効率が依然として改善されるべきである。
【0003】
2.特に青色発光の場合においては、動作寿命が依然として短く、改善に対する必要性が依然としてある。
【0004】
3.特に蛍光OLEDにおいては、動作電圧が非常に高いため、さらに低くして電力効率を改善するべきである。これは、特にモバイル用に対して非常に重要である。特に電荷輸送材料において、さらなる改善が望まれている。
【0005】
4.先行技術による正孔輸送材料の場合、電圧は、正孔輸送層の厚さに依存する。実際に、相対的に厚い正孔輸送層が一般的に望ましい。しかしながら、付随する電圧の上昇のため、先行技術による材料を用いて達成することはできない。
【0006】
5.有機エレクトロルミネッセンス素子において先行技術により使用される多くの材料は、エレクトロルミネッセンス素子の製造のためのプロセスにおける蒸着源において結晶化し、蒸着源を詰まらせる傾向がある。それ故、これらの材料は、技術的な複雑性が増大した大量生産においてのみ使用され得る。
【0007】
アリールアミンは、正孔輸送材料および正孔注入材料として使用される。インデノフルオレンに基づくこのタイプの材料は、例えば、WO 06/100896およびWO 06/122630に開示されている。上記インデノフルオレンアミンは、蒸着またはコーティング、初期の積層(premature deposition)の間の加工性に不都合があり、それ故、工業的プロセスの複雑化が生じ得る。さらに、正孔輸送材料は、一般的に、頻繁に、電子安定性が低く、実施において、関連するダイオードの寿命が短くなる。これに対する改善にの必要性が存在し続ける。
【0008】
さらに、キナクリジン誘導体および電子デバイスにおけるその使用が、WO 07/064104に開示されている。
【0009】
本発明は、特にエレクトロルミネッセンス素子の発光層および/または正孔輸送層および/または正孔注入層における使用のための、発光特性および正孔輸送特性を有する新規分類の材料としての、ピペリジン誘導体および関連する複素環誘導体について述べる。
【0010】
驚くべきことに、本発明による化合物を使用することにより、先行技術と比較した改善を生じる。LUMOのエネルギーレベルの上昇を介して達成される、おそらく電子安定性の増大による、動作電圧の低下、ならびに正孔移動性の増大および寿命の改善が、ここでの中心である。さらに、この分類は、その可動性の配置により、先行技術によるアリールアミンよりも結晶化に対する傾向が低い。
【0011】
さらに、本発明による化合物は、燐光発光体を含む有機エレクトロルミネッセンス素子における使用に非常に適していることが見出されている。燐光発光体を含むデバイスの正孔輸送層または発光層において式(1)の化合物を使用することにより、エレクトロルミネッセンス素子の寿命およびエネルギー効率に関して特に好ましい結果が得られている。
【0012】
本発明は、以下の式(1)で表される化合物に関する。
【化1】

【0013】
式中で使用されている記号および添え字は、以下のように定義される:
Xは、それぞれ同じまたは異なり、B(R1)、C(R1)2、Si(R1)2、C=O、C=NR1、C=C(R1)2、O、S、S=O、SO2、N(R1)、P(R1)およびP(=O)R1からなる群より選択される2価のブリッジ(bridge)であり;
Ar1は、10〜40の芳香環原子を有する芳香環構造または5〜40の芳香環原子を有する芳香族複素環構造であり、それぞれが1以上のR1基で置換されてよく;
Ar2〜Ar5は、それぞれ同じまたは異なり、5〜40の芳香環原子を有する芳香環または芳香族複素環構造であり、それぞれが1つ以上のR1基で置換されてよく;
R1は、それぞれ同じまたは異なり、H、D、F、Cl、Br、I、CHO、N(R2)2、N(Ar6)2、C(=O)Ar6、P(=O)(Ar6)2、S(=O)Ar6、S(=O)2Ar6、CR2=CR2Ar6、CN、NO2、Si(R2)3、B(OR2)2、OSO2R2、1〜40の炭素原子を有する直鎖アルキル基、アルケニル基、アルコキシ基およびチオアルコキシ基、ならびに3〜40の炭素原子を有する分枝鎖状、モノまたはポリ環状アルキル基、アルケニル基、アルコキシ基およびチオアルコキシ基(これらはそれぞれ、1以上のR2基で置換されてよく、1以上の隣接しないCH2基は、R2C=CR2、C≡C、Si(R2)2、Ge(R2)2、Sn(R2)2、C=O、C=S、C=Se、C=NR2、P(=O)(R2)、SO、SO2、NR2、O、SまたはCONR2で置換されてよく、1以上のH原子は、F、Cl、Br、I、CNもしくはNO2で置換されてよい)、ならびに5〜40の芳香環原子を有する芳香環または芳香族複素環(これらはそれぞれ、1以上のR2基で置換されてよい)、および5〜40の芳香環原子を有するアリールオキシもしくはヘテロアリールオキシ基(これらは、1以上のR2基で置換されてよい)、ならびにこれらの構造の組み合わせ(ここでの2以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい)からなる群より選択され;
R2は、それぞれ同じまたは異なり、H、D、F、Cl、Br、I、CHO、N(R3)2、N(Ar6)2、C(=O)Ar6、P(=O)(Ar6)2、S(=O)Ar6、S(=O)2Ar6、CR3=CR3Ar6、CN、NO2、Si(R3)3、B(OR3)2、OSO2R3、1〜40の炭素原子を有する直鎖アルキル基、アルコキシ基およびチオアルコキシ基、ならびに3〜40の炭素原子を有する分枝鎖状、モノもしくはポリ環状アルキル基、アルコキシ基およびチオアルコキシ基(これらはそれぞれ1以上のR3基で置換されてよく、1以上の隣接しないCH2基は、R3C=CR3、C≡C、Si(R3)2、Ge(R3)2、Sn(R3)2、C=O、C=S、C=Se、C=NR3、P(=O)(R3)、SO、SO2、NR3、O、SまたはCONR3で置換されてよく、1以上のH原子は、F、Cl、Br、I、CNまたはNO2で置換されてよい)、ならびにこれらの構造の組み合わせ(ここでの2以上の隣接する置換基R2は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい)からなる群より選択され;
R3は、それぞれ同じまたは異なり、H、Fまたは1〜20の炭素原子を有する脂肪族、芳香族および/または芳香族複素環炭化水素基であり、さらに、1以上のH原子は、F原子で置換されてよく、ここでの2以上の隣接する置換基R3は、互いに単環または多環の脂肪族または芳香環構造を形成してもよく;
Ar6は、それぞれ同じまたは異なり、1以上のR3基で置換されてよい、5〜30の芳香環原子を有する芳香環または芳香族複素環構造であり、さらに、同じ窒素原子またはリン原子に結合する2つのAr6基は、単結合またはB(R3)、C(R3)2、Si(R3)2、C=O、C=NR3、C=C(R3)2、O、S、S=O、SO2、N(R3)、P(R3)およびP(=O)R3からなる群より選択されるブリッジにより相互に連結されてよく;
m1〜m6は、それぞれ同じまたは異なり、0または1であり、mが0の場合は、水素原子またはR1基がXの代わりに存在することを意味し、添え字m1、m3、m4および/またはm6の少なくとも1つは1であり;
nは、1、2または3である。
【0014】
本発明の目的のために、隣接する置換基は、同じ原子に結合する置換基(すなわち、例えばC(R1)2基における2つの置換基R1)であるか、または直接隣接する原子に結合する置換基(すなわち、例えばC(R1)-C(R1)基における2つの置換基R1)を意味する。
【0015】
本発明の目的のために、アリール基またはヘテロアリール基は、それぞれ通常の芳香族電子系を有する芳香族基または複素環式芳香族基を意味し、アリール基は6〜40、好ましくは6〜24の炭素原子を含み、ヘテロアリール基は2〜40、好ましくは2〜24の炭素原子を含み、全体で少なくとも5の芳香環原子を含む。へテロ原子は、好ましくは、N、Oおよび/またはSから選択される。本発明の目的のために、これは、単純な単素環または複素環、例えば、ベンゼン、ピリジン、チオフェン等であってよく、または、少なくとも2つの芳香環または芳香族複素環(例えばベンゼン環)が互いに融合した縮合型の芳香環構造であってよく、すなわち環化により相互に縮合し、すなわち少なくとも1つの共通の端部を有し、それ故共通の芳香族構造を有するものであってよい。縮合型の芳香環は、直鎖状または角ばった態様(angular manner)で縮合してよい。アリール基またはヘテロアリール基は、置換されても置換されなくてもよく;いずれかの置換基は、同様に、さらなる環構造を形成してよい。例えば、ナフタレン、アントラセン、フェナントレン、ベンズアントラセン、ピレン等の構造は、本発明の目的のためにアリール基とみなされ、キノリン、アクリジン、ベンゾチオフェン、カルバゾール等は、本発明の目的のためにヘテロアリール基とみなされる一方、例えば、ビフェニル、フルオレン、スピロビフルオレン等は、分離した芳香族電子系が存在するため、アリール基とはみなさない。直鎖状に縮合した(anellate)芳香環構造は、例えば、アントラセン、テトラセンおよびペンタセンである。角ばった態様で縮合した芳香環構造は、例えば、フェナントレン、ピレン、クリセンおよびベンズアントラセンである。
【0016】
本発明の目的のために、芳香環構造は、環構造中に6〜40の炭素原子を含む。本発明の目的のために、芳香族複素環構造は、環構造中に2〜40の炭素原子および少なくとも1つのヘテロ原子を含み、ただし、炭素原子およびヘテロ原子の総数は少なくとも5である。へテロ原子は、好ましくは、N、Oおよび/またはSから選択される。本発明の目的のために、芳香環または芳香族複素環構造は、必ずしもアリール基またはヘテロアリール基のみを含むものではないが、その代わりに、さらに、複数のアリール基またはヘテロアリール基が、短い、非芳香族性の単位(H以外の原子が10%未満、好ましくはH以外の原子が5%未満)(例えば、C、NまたはO原子)により連結されてよい。それ故、例えば、9,9’-スピロビフルオレン、9,9-ジアリールフルオレン、トリアリールアミン、ジアリールエーテル等の構造も、本発明の目的のために、芳香環構造としてみなされる。上述したアリール基およびヘテロアリール基とは別に、本発明の目的のために、芳香環および芳香族複素環構造は、特に、ビフェニレン、テルフェニレン、フルオレン、スポロビフルオレン、ジヒドロフェナントレン、テトラヒドロピレンおよびcis-またはtrans-インデノフルオレンを意味する。
【0017】
本発明の目的のために、個々のH原子またはCH2基が上述した基でさらに置換されてもよいC1〜C40アルキル基は、特に好ましくは、メチル、エチル、n-プロピル、i-プロピル、n-ブチル、i-ブチル、s-ブチル、t-ブチル、2-メチルブチル、n-ペンチル、s-ペンチル、tert-ペンチル、2-ペンチル、シクロペンチル、n-ヘキシル、s-ヘキシル、tert-ヘキシル、2-ヘキシル、3-ヘキシル、シクロヘキシル、2-メチルペンチル、n-ヘプチル、2-ヘプチル、3-ヘプチル、4-ヘプチル、シクロヘプチル、1-メチルシクロヘキシル、n-オクチル、2-エチルヘキシル、シクロオクチル、1-ビシクロ[2,2,2]オクチル、2-ビシクロ[2,2,2]オクチル、2-(2,6-ジメチル)オクチル、3-(3,7-ジメチル)オクチル、トリフルオロメチル、ペンタフルオロエチルおよび2,2,2-トリフルオロエチルを意味する。本発明の目的のために、アルケニル基は、特に好ましくは、エテニル、プロペニル、ブテニル、ペンテニル、シクロペンテニル、ヘキセニル、シクロヘキセニル、ヘプテニル、シクロヘプテニル、オクテニルおよびシクロオクテニルを意味する。本発明の目的のために、アルキニル基は、特に好ましくは、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニルおよびオクチニルを意味する。C1〜C40-アルコキシ基は、特に好ましくは、メトキシ、エトキシ、n-プロポキシ、i-プロポキシ、n-ブトキシ、i-ブトキシ、s-ブトキシ、t-ブトキシおよび2-メチルブトキシを意味する。
【0018】
アリールまたは-ヘテロアリール基は、使用に応じて1価または2価であってよく、それぞれの場合において上述したR1基で置換されてよく、いずれかの望ましい位置を介して芳香環または芳香族複素環構造と連結してよく、特に、ベンゼン、ナフタレン、アントラセン、フェナントレン、ピレン、ジヒドロピレン、クリセン、ぺリレン、フルオロアントラセン、ベンズアントラセン、テトラセン、ペンタセン、ベンゾピレン、フラン、ベンゾフラン、イソベンゾフラン、ジベンゾフラン、チオフェン、ベンゾチオフェン、イソベンゾチオフェン、ジベンゾチオフェン、ピロール、インドール、イソインドール、カルバゾール、ピリジン、キノリン、イソキノリン、アクリジン、フェナントリジン、ベンゾ-5,6-キノリン、ベンゾ-6,7-キノリン、ベンゾ-7,8-キノリン、フェノチアジン、フェノキサジン、ピラゾール、インダゾール、イミダゾール、ベンズイミダゾール、ナフトイミダゾール、フェナントリミダゾール、ピリドイミダゾール、ピラジンイミダゾール、キノキサリンイミダゾール、オキサゾール、ベンズオキサゾール、ナフトキサゾール、アントロキサゾール、フェナントロキサゾール、イソキサゾール、1,2-チアゾール、1,3-チアゾール、ベンゾチアゾール、ピリダジン、ベンゾピリダジン、ピリミジン、ベンゾピリミジン、キノキサリン、ピラジン、フェナジン、ナフチリジン、アザカルバゾール、ベンゾカルボリン、フェナントロリン、1,2,3-トリアゾール、1,2,4-トリアゾール、ベンゾトリアゾール、1,2,3-オキサジアゾール、1,2,4-オキサジアゾール、1,2,5-オキサジアゾール、1,3,4-オキサジアゾール、1,2,3-チアジアゾール、1,2,4-チアジアゾール、1,2,5-チアジアゾール、1,3,4-チアジアゾール、1,3,5-トリアジン、1,2,4-トリアジン、1,2,3-トリアジン、テトラゾール、1,2,4,5-テトラジン、1,2,3,4-テトラジン、1,2,3,5-テトラジン、プリン、プテリジン、インドリジン、ベンゾチアジアゾールに由来する基を意味する。
【0019】
本発明の好ましい実施形態において、Ar2〜Ar5は、それぞれ同じまたは異なり、フェニル、1-ナフチルまたは2-ナフチル、特に好ましくはフェニルまたは2-ナフチル、中でも特に好ましくはフェニルであり、それぞれが1つ以上のR1基で置換されてよい。
【0020】
特に、以下の式(2)で表される化合物が好ましい:
【化2】

【0021】
式中に使用されている記号および添え字は、上述した意味を有する。
【0022】
式(1)または(2)におけるXは、さらに好ましくは、それぞれ同じまたは異なり、2価のブリッジC(R1)2を意味し、ここでのR1は上記で定義した通りであり、好ましくはそれぞれ同じまたは異なり、特に好ましくは同じであり、H、F、1〜6の炭素原子を有する直鎖状アルキル基(好ましくはメチル基であり、ここでの1以上のHは、Fで置換されてよい)、ならびにフェニルおよびナフチル(好ましくはフェニルであり、それぞれが1つ以上のR2基、好ましくはメチル基で置換されてよいが、特に好ましくは非置換である)、ならびにこれらの構造の組み合わせであり、ここでの2つ以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい。
【0023】
本発明の好ましい実施形態において、Ar1基は、12〜30の芳香環原子を有する多環式の芳香環構造を意味するか、または10〜20の芳香族炭素原子を有する縮合型の芳香族炭化水素基を意味し、それぞれが1つ以上のR1基で置換されてよい。
【0024】
本発明の特に好ましい実施形態において、Ar1基は、以下の式(3)〜(5)の基を意味する。
【化3−1】

【化3−2】

【0025】
これらの基は、それぞれ1つ以上のR1基で置換されてよく、ここでのR1は上記で定義したとおりであり、さらに、
Yは、Xと同じ意味を有し、好ましくは、それぞれ同じまたは異なり、C(R1)2、Si(R1)2、O、S、N(R1)、P(R1)からなる群より選択される2価のブリッジであり、特に好ましくは、C(R1)2、SおよびN(R1)からなる群より選択され;
pは、それぞれ同じまたは異なり、0または1であり、p = 0の場合、水素原子またはR1基がYの代わりに存在し;
qは0、1または2であり、好ましくは0または1であり;
記号「-----」は、式(3)〜(15)の基の炭素原子と式(1)に示した2つの窒素原子の1つとの間のそれぞれの単結合を意味し;X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【0026】
式(3)〜(15)のAr1基の特に好ましい実施形態は、以下の式(16)〜(48)に示す基である。
【化4−1】

【化4−2】

【化4−3】

【化4−4】

【0027】
式中、上記基のそれぞれは、さらに、各場合において、1つ以上のR1基で置換されてよいが、好ましくはさらには置換されず;
上記式における記号「-----」は、Ar1から式1に示した2つの窒素原子の1つへの各単結合を意味し;
X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【0028】
本発明の好ましい実施形態において、式(41)、(42)、(43)、(44)および(46)の構造におけるAr1基は、フェニルを意味し、それぞれ同じまたは異なるように1〜4の炭素原子を有する1つ以上のアルキル基で置換されてよい。
【0029】
Ar1基が上記基(16)〜(48)から選択される場合、添え字n=1である。
【0030】
本発明のさらに好ましい実施形態において、Ar1は、以下の式(49)〜(51)のユニットから選択される3価の基である:
【化5】

【0031】
特に、
【化6】

【0032】
式中、
Yは、上記で定義した通りであり、好ましくは、それぞれ同じまたは異なり、各場合において、C(R1)2、Si(R1)2、O、S、N(R1)およびP(R1)からなる群より選択される2価のブリッジであり、特に好ましくは、C(R1)2、SおよびN(R1)からなる群より選択され;
R1は、上記で定義した通りであり、好ましくはそれぞれ同じまたは異なり、特に好ましくは同じであり、H、F、1〜6の炭素原子を有する直鎖状アルキル基(好ましくはメチルであり、ここでの1以上のHは、Fで置換されてよい)、ならびにフェニルおよびナフチル(好ましくはフェニルであり、それぞれが1つ以上のR2基、好ましくはメチル基で置換されてよいが、特に好ましくは非置換である)、ならびにこれらの構造の組み合わせであり、ここでの2つ以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよく;
上記基のそれぞれは、さらに、各場合において、1つ以上のR1基で置換されてよいが、好ましくはさらには置換されず;
記号「-----」は、Ar1から式(1)に示した2つの窒素原子の1つへの各単結合を意味し;
X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【0033】
Ar1が上記基(49)〜(51)から選択される場合、添え字nは2を意味する。
【0034】
本発明のさらに好ましい実施形態において、Ar1は、以下の式(52)で表される4価の基である:
【化7】

【0035】
式中、記号「-----」は、Ar1から式(1)に示した2つの窒素原子の1つへの各単結合を意味し;
X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【0036】
Ar1が式(52)の基である場合、添え字nは3を意味する。
【0037】
添え字m1〜m6は、0または1であり、m1、m3、m4および/またはm6の少なくとも1つは1である。好ましくは、添え字m1〜m6の少なくとも2つは1に等しい。
【0038】
添え字m1〜m6の特に好ましい例を以下に示す:
m1 = m6 = 1 および m2 = m3 = m4 = m5 = 0; または
m1 = m4 = 1 および m2 = m3 = m5 = m6 = 0; または
m1 = m2 = m4 = m5 = 1 および m3 = m6 = 0; または
m1 = m2 = m5 = m6 = 1 および m3 = m4 = 0; または
m1 = m2 = 1 および m3 = m4 = m5 = m6 = 0; または
m1 = 1 および m2 = m3 = m4 = m5 = m6 = 0; または
m2 = m3 = m4 = m5 = 1 および m1 = m6 = 0; または
m3 = m4 = 1 および m1 = m2 = m5 = m6 = 0。
【0039】
特に好ましくは、上記式(2)の化合物が提供され、Ar1は式(16)〜(48)の基を意味する。特に好ましくは、Xが同時にC(R1)2を意味し、Xは、窒素原子と結合する炭素原子に隣接する炭素原子と結合する。中でも特に好ましくは、上述した好ましい実施形態がさらに同時に添え字m1〜m6に適用された化合物が提供される。
【0040】
式(1)で表される好ましい化合物の例は、以下に示す構造(1)〜(110)である。
【表A−1】

【表A−2】

【表A−3】

【表A−4】

【表A−5】

【表A−6】

【表A−7】

【表A−8】

【表A−9】

【表A−10】

【表A−11】

【0041】
本発明の化合物は、例えばHartwig-Buchwaldカップリングおよび酸触媒閉環反応のような、当業者に既知の合成ステップにより得られる。それ故、Hartwig-Buchwaldカップリングにおいて、例えば、ハロゲン(特にBrまたはI)のような反応性脱離基により置換されたAr1基は、オルト位がカルボキシレート基で置換されたアリールアミンと結合する。カルボキシレート基は、その後、例えば有機リチウム化合物またはグリニャール試薬のような有機金属試薬の付加反応により変換され、対応するアルコールとなり、Ar1との酸触媒閉環反応を受ける。最後のステップにおいて、さらなる芳香族基は、Hartwig-Buchwaldカップリングにおいて、窒素と結合し得る。このような反応に対して通常選択される反応条件は、有機合成の分野における当業者に一般的に既知である。この合成は、式(1)の2つの化合物に対して、スキーム1および2に例示する。しかしながら、当業者は、他のAr1基または他の芳香族アミンを使用して、発展的なステップを必要とすることなく単純な態様で、式(1)のさらなる化合物を合成することができる。
【化8−1】

【化8−2】

【0042】
本発明は、さらに、以下の反応ステップを含む式(1)の化合物の製造方法に関する:
a)適切に置換されたAr1基を、アリールアミンと結合させることと(ここでのアリールアミンは、オルト位において適切に置換され、アリール基がAr2基またはAr3基またはAr4基またはAr5基に対応する)、
b)アリールアミンのオルト位における置換基とAr1基の閉環反応を行うこと。
【0043】
これらの方法ステップは、任意に、その後さらなるカップリング反応を行うことにより、さらなるAr2基またはAr3基またはAr4基またはAr5基を導入してよく、あるいはこのカップリング反応は、閉環反応の前に行われてよい。
【0044】
本発明による化合物は、オリゴマー、ポリマーまたはデンドリマーの一部であってもよい。この場合、本発明の化合物における置換基との結合は、オリゴマー、ポリマー、デンドリマーとの結合に置き換えられてよい。それ故、本発明はさらに、上記化合物の1つ以上を含むオリゴマー、ポリマーおよびデンドリマーにも関する。
【0045】
本発明による式(1)の化合物は、電子デバイス、特に有機エレクトロルミネッセンス素子(OLED)における使用に適している。置換に依存して、前記化合物は、種々の機能および層において使用される。
【0046】
それ故、本発明はさらに、電子デバイスにおける本発明による式(1)の化合物の使用に関する。電子デバイスは、ここでは、好ましくは、有機集積回路(O-IC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光学検出器、有機感光体、有機電場消光素子(O-FQD)、発光電気化学電池(LEC)、有機レーザーダイオード(O-laser)および特に好ましくは有機エレクトロルミネッセンス素子(OLED)からなる群より選択される。
【0047】
本発明は、さらに、少なくとも1つの式(1)の化合物を含む電子デバイスにも関する。ここでの電子デバイスは、好ましくは上記デバイスから選択される。特に好ましくは、アノードとカソードと少なくとも1つの発光層とを含む有機エレクトロルミネッセンス素子が提供され、発光層、正孔輸送層またはその他の層であってよい少なくとも1つの有機層が、少なくとも1つの式(1)の化合物を含むことを特徴とする。
【0048】
カソード、アノードおよび発光層とは別に、有機エレクトロルミネッセンス素子は、さらなる層を含んでもよい。これらは、例えば、それぞれの場合において、1以上の正孔注入層、正孔輸送層、正孔遮断層、電子輸送層、電子注入層、電子遮断層、励起子遮断層、電荷発生層(IDMC 2003, Taiwan; Session 21 OLED (5), T. Matsumoto, T. Nakada, J. Endo, K. Mori, N. Kawamura, A. Yokoi, J. Kido, Multiphoton Organic EL Device Having Charge Generation Layer)および/または有機もしくは無機のp/n接合から選択される。しかしながら、これらの層のそれぞれは、必ずしも存在する必要はなく、層の選択は、常に、使用される化合物および特にそれが蛍光のエレクトロルミネッセンス素子であるかリン光のエレクトロルミネッセンス素子であるかに依存することを指摘するべきである。
【0049】
有機エレクトロルミネッセンス素子は、複数の発光層を含んでもよい。この場合、これらの発光層は、特に好ましくは、全体として、総合的に白色の発光を生じる380nm〜750nmの間に複数の発光極大を有していることが好ましく、すなわち、蛍光またはリン光を発し、青色および黄色、オレンジ色または赤色の光を発する種々の発光化合物が発光層において使用される。3層構造、すなわち3つの発光層を有する構造が特に好ましく、これらの層の少なくとも1つは、少なくとも1つの式(1)の化合物を含み、3つの層は、青色、緑色およびオレンジ色または赤色の発光を示す(基本的な構造、例えばWO 05/011013を参照されたい)。広帯域の発光域を有し、それ故白色発光を示す発光体も、白色発光に同様に適している。
【0050】
本発明の好ましい実施形態において、式(1)の化合物は、正孔輸送材料として使用される。前記化合物は、正孔輸送層および/または正孔注入層において使用されることが好ましい。本発明の目的のために、正孔注入層は、アノードに直接隣接する層である。本発明の目的のために、正孔輸送層は、正孔注入層と発光層の間に位置する層である。式(1)の化合物が正孔輸送材料として使用される場合、例えばF4-TCNQのような電子受容化合物またはEP 1476881もしくはEP 1596445に記載されているような化合物にドープすることが好ましい。正孔輸送層中の正孔輸送材料として式(1)の化合物を使用する場合、100%の割合、すなわち純粋な材料としてその化合物が使用されてよく、あるいは正孔輸送層におけるさらなる化合物との組み合わせとして使用されてよい。
【0051】
本発明において、式(1)の化合物は、1つ以上のリン光発光体を含む電子デバイスにおいて使用されることが好ましい。前記化合物は、ここでは、正孔輸送層、正孔注入層または発光層、特に好ましくは正孔輸送層において使用され得る。
【0052】
適切なリン光発光体化合物(=三重項発光体)は、特に、好ましくは可視領域において、適切な励起状態で光を発する化合物であり、さらに、原子番号が20より大きく、好ましくは38より大きく84未満 、特に好ましくは56より大きく80未満である少なくとも1つの原子を含む化合物である。使用されるリン光発光体は、好ましくは、銅、モリブデン、タングステン、レニウム、ルテニウム、オスミウム、ロジウム、イリジウム、パラジウム、白金、銀、金またはユーロピウムを含む化合物であり、特に、イリジウムまたは白金を含む化合物である。
【0053】
上述した発光体の例は、WO 00/70655、WO 01/41512、WO 02/02714、WO 02/15645、EP 1191613、EP 1191612、EP 1191614、WO 05/033244、WO 05/019373およびUS 2005/0258742の出願に記載されている。一般的に、リン光OLEDについての先行技術において使用され、有機エレクトロルミネッセンスの分野の当業者に既知の全てのリン光錯体が適している。さらに、当業者は、発展的なステップを必要とすることなく、本発明による化合物を含む有機エレクトロルミネッセンス素子における発光材料としてさらなるリン光錯体を使用することができるであろう。
【0054】
本発明のさらに好ましい実施形態において、式(1)の化合物は、発光層における発光材料として使用される。式(1)の化合物は、Ar1〜Ar5の基の少なくとも1つ、特にAr1が、特に少なくとも3つの縮合した芳香環または芳香族複素環を有する縮合型の芳香環または芳香族複素環構造を意味する場合に、発光材料として特に適している。特に好ましい発光材料は、Ar1がアントラセンまたはクリセンを意味する式(1)の化合物である。
【0055】
式(1)の化合物が発光層における発光材料として使用される場合、ホスト材料と組み合わせて使用されることが好ましい。ホストおよびドーパントを含む系において、ホスト材料は、系により高い割合で存在する成分を意味する。ホストおよび複数のドーパントを含む系において、ホストは、混合物中での割合が最も高い成分を意味する。
【0056】
発光層の混合物において、式(1)の化合物の割合は、0.1〜50.0容量%、好ましくは0.5〜20.0容量%、特に好ましくは1.0〜10.0容量%である。それに対応して、ホスト材料の割合は、50.0〜99.9容量%、好ましくは80.0〜99.5容量%、特に好ましくは90.0〜99.0容量%である。
【0057】
この目的に対して適切なホスト材料は、種々の分類の物質に由来する材料である。好ましいホスト材料は、オリゴアリーレン(例えば、EP 676461に記載されている2,2‘,7,7‘-テトラフェニルスピロビフルオレンまたはジナフチルアントラセン)、特に縮合型の芳香族基を含むオリゴアリーレン、オリゴアリーレンビニレン(例えば、EP 676461に記載されているDPVBiまたはスピロ-DPVBi)、多座(polypodal)金属錯体(例えば、WO 04/081017に記載されている)、正孔伝導化合物(例えば、WO 04/058911に記載されている)、電子伝導化合物、特に、ケトン、ホスフィンオキシド、スルホキシド等(例えば、WO 05/084081およびWO 05/084082に記載されている)、アトロプ異性体(例えば、WO 06/048268に記載されている)、ボロン酸誘導体(例えば、WO 06/117052に記載されている)またはベンズアントラセン(例えば、WO 08/145239に記載されている)の分類から選択される。特に好ましいホスト材料は、ナフタレン、アントラセン、ベンズアントラセンおよび/またはピレンを含むオリゴアリーレン、またはこれらの化合物のアトロプ異性体、ケトン、ホスフィンオキシドおよびスルホキシドの分類から選択される。中でも特に好ましいホスト材料は、アントラセン、ベンズアントラセンおよび/またはピレンを含むオリゴアリーレン、またはこれらの化合物のアトロプ異性体の分類から選択される。本発明の目的のために、オリゴアリーレンは、少なくとも3つのアリールまたはアリーレン基が相互に結合した化合物を意味するものとする。
【0058】
好ましいホスト材料は、特に、以下の式(53)で表される化合物から選択される:
Ar7-(Ar8)r-Ar9 式(53)
式中、Ar7、Ar8、Ar9は、それぞれ同じまたは異なり、5〜30の芳香環原子を有するアリールまたはヘテロアリール基であり、1つ以上のR1基で置換されてよく、R1は上述したのと同じ意味を有し、pは、0、1、2または3の数値であってよい。式(53)のホスト材料におけるAr8基は、特に好ましくはアントラセンを意味し、1つ以上のR1基で置換されてよく、Ar7およびAr9基は、9および10位に結合する。中でも特に、Ar7および/またはAr9基の少なくとも1つが、1-もしくは2-ナフチル、2-, 3-もしくは9-フェナントレニルまたは2-, 3-, 4-, 5-, 6-または7-ベンズアントラセニルから選択される縮合型のアリール基であり、これらはそれぞれ、1つ以上のR1基で置換されてよい。
【0059】
好ましくはさらに、1つ以上の層が昇華プロセスにより塗布されることを特徴とする有機エレクトロルミネッセンス素子が提供され、材料は、10-5 mbar未満、好ましくは10-6 mbar未満の初期圧力で、減圧昇華ユニットにおいて蒸着される。しかしながら、ここでの初期圧力はさらに低くてもよく、例えば10-7 mbar未満であってもよい。
【0060】
同様に、1以上の層がOVPD(有機気相蒸着)法により、またはキャリアガス昇華の助けを受けて塗布されたことを特徴とする、有機エレクトロルミネッセンス素子が提供されることが好ましい。ここで、材料は、10-5 mbar〜1 barの圧力で塗布される。この方法の特別な場合は、OVJP(有機気相ジェットプリンティング)プロセスであり、材料がノズルを通して直接塗布され、構築される(例えば、M. S. Arnold et al., Appl. Phys. Lett. 2008, 92, 053301)。
【0061】
好ましくは、さらに、1以上の層が、例えば、スピンコーティング、または望ましい印刷工程(例えば、スクリーン印刷、フレキソ印刷もしくはオフセット印刷)により、溶液から形成され、特に好ましくは、LITI(光誘起熱画像化;light-induced thermal imaging、熱転写印刷;thermal transfer printing)またはインクジェット印刷により形成されることを特徴とする有機エレクトロルミネッセンス素子が提供される。式(1)の可溶性化合物が、この目的のために必要である。高い溶解性は、化合物の適切な置換により達成することができる。
【0062】
有機エレクトロルミネッセンス素子における使用について、本発明による化合物は、以下に示すような先行技術と比較した驚くべき利点を有している:
1.正孔輸送層および/または正孔注入層における正孔輸送材料として本発明の化合物を使用する場合、ブリッジする基Xを含まない先行技術による化合物よりも、必要とする使用電圧および動作電圧が低い。従って、本発明による化合物を使用することにより、有意に高い電力効率のOLEDが得られる。
【0063】
2.本発明による化合物は、リン光発光体を含む電子デバイスにおける使用に特に適しており、デバイスの寿命および電力効率における改善が得られる。
【0064】
3.正孔輸送層および/または正孔注入層における正孔輸送材料として本発明の化合物を使用する場合のさらなる利点は、薄い(20 nm)正孔輸送層と厚い(110 nm)正孔輸送層との間の電位差が小さくなることである。これにより、電力効率の有意な低下を生じることなく、より厚い正孔輸送層に本発明による化合物を使用することが可能になる。光カップリングアウト効率(Optical coupling-out efficiency)は、正孔輸送層の厚さを変化させることにより、決定的な様式で制御されるため、このことは重要である。0.1 Vの領域での改善も、ここでは有意な利点とみなす。
【0065】
4.本発明による化合物は、発光層におけるドーパントとしての本発明の化合物の使用において、非常に良好な効率および寿命を示す。
【0066】
5.本発明の化合物の加工性(processibility)は、ブリッジする基Xを含まない先行技術の材料と比較して、有意に改善されている。それ故、本発明の化合物は、同じ蒸着条件下で、蒸着源の縁において詰まりを示す傾向が低い。本発明の化合物は、それ故、先行技術の材料よりも大量生産に適している。
【0067】
本発明は、限定されることなく、以下の実施例によりさらに詳細に説明される。
【実施例】
【0068】
以下の合成は、特に示さない限り、保護ガス(protective gas)雰囲気下において、乾燥溶媒中で行う。出発物質は、ALDRICHから購入することができる。
【0069】
例1:実施例化合物1の合成
a)ビス[N-(2-カルボキシメチルフェニル)]-6,6,12,12-テトラメチル-6-12-ジヒドロインデノ[1,2b]フルオレンジアミン
【化9】

【0070】
35.51 g (234.9 mmol) のメチルアントラニレートを500 mlのトルエンに溶解し、その溶液を十分に脱気する。50.0 g (106.8 mmol) の6,6,12,12-テトラメチル-6-12-ジヒドロインデノ[1,2b]フルオレニルジブロミド、2.1 g (10.7 mmol) の4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテン、1.19 g (5.34 mmol) のPd(OAc)2 および76.5 g (234.9 mmol) のCs2CO3を加え、続いて混合物を脱気し、保護ガス雰囲気下で24時間、100℃で撹拌する。続いて、セライトを通して固体をろ過し、有機層を水で洗浄し、MgSO4で乾燥し、蒸発させる。粗生成物を熱ヘプタンと共に撹拌することにより洗浄し、56 g (86%) の黄色い固体として生成物を得る。
【0071】
b)ビス[N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-6,6,12,12-テトラメチル-6-12-ジヒドロインデノ[1,2b]フルオレンジアミン
【化10】

【0072】
56.0 g (92.0 mmol) のa) で得られた化合物を、1200 mlの乾燥THFに溶解し、その溶液を脱気する。溶液を−78℃に冷却し、334.53 ml (736.0 mmol) のジエチルエーテル中のメチルリチウム2.2 M溶液を40分かけて加える。混合物を、1時間かけて−40℃に温め、反応をTLCにより確認する。反応が終了したら、−30℃でMeOHを加えて慎重に反応停止する。反応溶液を1/3に濃縮し、1 lの塩化メチレンを加え、混合物を洗浄し、有機層をMgSO4で乾燥し、蒸発させる。黄色の粗生成物はさらなる精製を行わず、次のステップに直接使用する。
【0073】
c)ビスアクリジン化合物
【化11】

【0074】
55.0 g (90.3 mmol) のビス[N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-6,6,12,12-テトラメチル-6,12-ジヒドロインデノ[1,2b]フルオレンジアミンを、1200 mlの脱気したトルエンに溶解し、70 gのポリリン酸の懸濁液および50 mlのメタンスルホン酸を加え、混合物を60℃で1時間加熱する。バッチを冷却し、水を加える。固体が沈殿し、塩化メチレン/THF (1:1)を用いて溶解する。得られた溶液を、20% NaOHを用いて注意深くアルカリ性にし、相を分離し、MgSO4で乾燥する。得られた固体を、ヘプタンと共に撹拌することにより洗浄し、直接使用することができる36 g (70%) の生成物を得る。
【0075】
d)実施例化合物1
【化12】

【0076】
50.0 g (87.3 mmol) のc)で得られたビスアクリジンおよび34.75 ml (261.8 mmol) のブロモベンゼンを、2500 mlの脱気したトルエンに溶解し、その溶液を脱気する。トリ-tert-ブチルホスフィン (6.11 ml, トルエン中の1M溶液) を加え、685.9 mg (3.05 mmol) のPd(OAc)2 および25.1 g (209.4 mmol) のナトリウムtert-ブトキシドを加え、混合物を簡単に脱気し、還流下で3時間加熱する。反応溶液を水で洗浄し、沈殿した固体と有機相を混合し、蒸発させ、トルエンを用いて何回も共沸乾燥し、49.1 g (77%) の黄色の固体を得る。それは、Soxhlet抽出およびNMPからの結晶化により、さらに精製される。
【0077】
例2:実施例化合物2の合成
a)ビス[1,1'-N-(2-カルボキシメチルフェニル)]-4,4'-ビフェニルジアミン
【化13】

【0078】
100.0 g (320.5 mmol) の4,4'-ジブロモビフェニルおよび106.6 g (705.1 mmol) のメチルアントラニレートを、1200 mlの脱気したトルエンに溶解し、その溶液を脱気し、229.7 g (705.1 mmol) のCs2CO3、3.59 g (16.03 mmol) のPd(OAc)2および6.29 g (32.05 mmol) の4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテンを加える。反応混合物を、内部温度100℃で48時間撹拌する。冷却した反応溶液を、酸化アルミニウムを通してろ過し、水で洗浄し、MgSO4で乾燥し、蒸発させる。ヘプタンと共に撹拌することにより粗生成物を洗浄し、129 g (89%) の生成物を白色の固体として得る。
【0079】
b)ビス[1,1'-N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-4,4'-ビフェニルジアミン
【化14】

【0080】
64.5 g (142.5 mmol) のビス[1,1'-N-(2-(カルボキシメチル)フェニル)]-4,4'-ビフェニルジアミンを、1500 mlの乾燥THFに溶解し、その溶液を−78℃に冷却し、518.3 mlのメチルリチウム (ジエチルエーテル中、2.2 M) を滴下する。得られた混合物をゆっくりと−40℃に温め、さらに1時間撹拌する。MeOHを用いて、−30℃で反応をゆっくりと慎重に停止させ、反応溶液を1/3に濃縮する。トルエンを加え、混合物を水で洗浄し、MgSO4で乾燥し、蒸発させる。この変換は定量的であり、反応生成物は、次の反応に直接使用できる。
【0081】
c)ビスアクリジン化合物
【化15】

【0082】
61.6 g (136.1 mmol) のビス[1,1'-N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-4,4'-ビフェニルジアミンを、1200 mlの脱気したトルエンに溶解し、110.9 gのポリリン酸および77.2 mlのメタンスルホン酸を室温で加える。得られた混合物を50℃に加熱し、その温度で2時間撹拌する。冷却トルエン相をデカントし、メタノール/THF (1:1)を用いて沈殿した固体を溶解し、その溶液を氷冷水に加え、20% NaOH溶液を用いて混合物を慎重にpH = 8に調整する。有機相(不均一)を分離し、乾燥し、トルエンを用いて共沸乾燥する。この変換は定量的であり、反応生成物は、次の反応に直接使用できる。
【0083】
d)実施例化合物2
【化16】

【0084】
54.0 g (129.6 mmol) のc)で得られたビスアクリジンおよび40.95 ml (388.9 mmol) のブロモベンゼンを、2000 mlの脱気したトルエンに溶解し、続いてその溶液を脱気し、9.07 ml (9.07 mmol, トルエン中の1M溶液) のトリ-tert-ブチルホスフィン、611.18 mg (2.72 mmol) のPd(OAc)2 および37.3 g (388.9 mmol) のナトリウム tert-ブトキシドを加え、その混合物を還流下で2.5時間加熱する。冷却したバッチを水で洗浄し、MgSO4で乾燥し、蒸発させ、69 g (93%) の白色固体を得る。それは、Soxhlet抽出およびトルエンからの結晶化によりさらに精製される。
【0085】
例3:実施例化合物3の合成
a)Bis[2,7-N-(2-カルボキシメチルフェニル)]-9,9-ジメチルフルオレンジアミン
【化17】

【0086】
137.94 g (372.21 mmol) の2,7-ジブロモ-9,9-ジメチルフルオレンおよび105.79 ml (818.87 mmol) のメチルアントラニレートを、2000 mlの脱気したトルエンに溶解する。266.79 g (818.87 mmol) のCs2CO3、4.17 g (18.61 mmol) のPd(OAc)2 および7.31 g (37.22 mmol) の4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテン (キサントホス;xantphos) を加える。反応混合物を、還流下で9時間加熱し、その後冷却し、酢酸エチルを加える。得られた混合物を水で洗浄し、MgSO4で乾燥し、ロータリーエバポレーターで蒸発させる。熱ヘプタンと共に撹拌することにより洗浄し、161.4 g (88%) の生成物を黄色の固体として得る。
【0087】
b)ビス[2,7-N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-9,9-ジメチルフルオレンジアミン
【化18】

【0088】
20.0 g (40.60 mmol) のa)で得られた化合物を、500 mlのTHFに溶解し、147.65 mlのメチルリチウム (ジエチルエーテル中の2.2 M溶液) を−78℃で滴下する。続いて、反応をゆっくりと−40℃にし、変換をTLCで確認した。反応終了後、メタノールを用いて−30℃で慎重に反応停止し、反応溶液を蒸発させる。トルエンを固体に加え、その混合物を水で洗浄する。有機相をMgSO4で乾燥し、ロータリーエバポレーターで蒸発させ、残留物を酢酸エチルから再結晶し、12.6 g (63%) の生成物を黄色がかった固体として得る。
【0089】
c)ビスアクリジン化合物
【化19】

【0090】
20.0 g (40.59 mmol) のb)で得られた化合物を、400 mlのトルエンに最初に導入し、30 gのポリリン酸と22 mlのメタンスルホン酸のトルエン中のエマルジョンとしての混合物を室温で加える。この添加の間、温度を約40℃に上昇させ、続いて混合物を50℃に加熱する。2つの相が形成され、生成物は固体として沈殿する。トルエン相を分離し、水/酢酸エチルを残留物に加え、その後、20% NaOH溶液を用いて混合物を慎重にpH = 8に調整する。有機相を分離し、MgSO4で乾燥し、17 g (92%) の生成物を黄色の固体として得る。
【0091】
d)実施例化合物3
【化20】

【0092】
100.0 g (219.0 mmol) のc)で得られた化合物を、200 ml のトルエンに溶解し、その溶液を脱気する。15.3 ml (トルエン中、1 M) のトリス-tert-ブチルホスフィン、196.67 mg (8.76 mmol) のPd(OAc)2 および63.14 g (657.0 mmol) のナトリウムtert-ブトキシドを加え、反応混合物を還流下で2.5時間加熱する。反応溶液に水を加え、相を分離し、有機相をMgSO4で乾燥し、Alox Bを用いてSoxhlet抽出を行い、65.3 g (81%) の生成物を黄色の粉末として得る。
【0093】
例4:実施例化合物4の合成
a)メチル2-(4'-ブロモビフェニル-4-イルアミノ)ベンゾエート
【化21】

【0094】
200 g (641.0 mmol) の4,4’-ジブロモベンゼンおよび41.4 ml (320.5 mmol) のメチルアントラニレートを、1500 mlのトルエンに溶解し、その溶液を不活性ガスを通して脱気する。229.7 g (705.1 mmol) のCs2CO3、3.59 g (16.02 mmol) のPd(OAc)2および6.29 g (32.05 mmol) のキサントホス (4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテン)(全て脱気)を、続いて加える。その後、反応混合物を82℃で6時間撹拌し、酸化アルミニウム(塩基性活性度1)を通してろ過する。生成物を、シリカゲルによるカラムクロマトグラフィーにより、ヘプタン/トルエン(1:49)を用いて精製し、79.2 g (65%) の生成物を淡黄色の固体として得る。
【0095】
b)2-[2-(4'-ブロモビフェニル-4-イルアミノ)フェニル]プロパン-2-オール
【化22】

【0096】
59.7 g (156 mmol) のa)で得られた化合物を、1800 mlの乾燥THFに最初に導入し、Et2O中のMeLiの2M溶液284.0 ml (624.7 mmol) を−78℃で加え、その後、3時間かけて混合物を−40℃に温める。反応終了後、300 mlのMeOHをゆっくりと慎重に−30℃で加え、過剰なMeLiを反応停止する。混合物を室温にし、1/3に濃縮し、酢酸エチルを加え、有機相を水で洗浄する。続いて、有機相をMgSO4で乾燥し、蒸発し、59.7 g (quant.) の生成物を固体として得る。
【0097】
c)2-(4-ブロモフェニル)-9,9-ジメチル-9,10-ジヒドロアクリジン
【化23】

【0098】
b)で得られた化合物を、1000 mlのトルエンに溶解し、その溶液を不活性ガスを通して脱気する。178 gのポリリン酸と123 mlのメタンスルホン酸の混合物を、室温で滴下し、混合物を50℃に加熱する。反応終了後(約30分)、pH 8になるまで、よく冷却しながら
20% NaOH溶液を反応溶液に慎重に加える。有機相を分離し、水相をトルエンで抽出し、続いて混合性有機相をMgSO4で乾燥し、蒸発させ、49 g (86%) の生成物を固体として得る。
【0099】
d)tert-ブチル 2-(4-ブロモフェニル)-9,9-ジメチル-9H-アクリジン-10-カルボキシレート
【化24】

【0100】
43.2 ml (188.3 mmol) のジ-tert-ブチルジカルボネートを、600 mlのTHFに溶解し、続いて、49.0 g (134.5 mmol) のc)で得られた化合物を加え、その後、1.66 g (13.45 mmol) のDMAP (4-ジメチルアミノ)ピリジンを加える。反応混合物を還流下で1.5時間加熱する。反応終了後、反応溶液を氷水に慎重に加え、有機相を分離し、水で洗浄し、MgSO4で乾燥し、蒸発させる。得られる黄色の油をヘプタン中に取り、温度を上昇させて溶解する。室温で生成物が白色沈殿として沈殿し、47.7 g (76%) の生成物を得る。
【0101】
e)tert-ブチル 2-[4-(ビフェニルl-4-イルフェニルアミノ)フェニル]-9,9-ジメチル-9H-アクリジン-10-カルボキシレート
【化25】

【0102】
50.0 g (107.7 mmol) のd)で得られた化合物および34.3 gのビフェニルフェニルアミンを、500 mlのトルエンに溶解し、その溶液を十分に脱気する。2.15 ml (トルエン中1 M, 2.15 mmol) のトリ-tert-ブチルホスフィン、241.7 mg (1.07 mmol) のPdOAc2および15.5 g (161.5 mmol) のナトリウムtert-ブトキシドを加える。全ての固体を予め脱気する。反応混合物を還流下で撹拌し、反応終了後(約3時間)、酸化アルミニウム(塩基性)を通してろ過し、カラムろ過により精製し、生成物を黄色の油として、定量的な収量で得る。
【0103】
f)ビフェニル-4-イル-[4-(9,9-ジメチル-9,10-ジヒドロアクリジン-2-イル)フェニルアミン
【化26】

【0104】
67.7 g (107.7 mmol) のe)で得られた化合物を、400 mlのジクロロメタンに溶解し、23.9 ml (324 mmol) のトリフルオロ酢酸を室温 (RT)で加える。混合物を室温で16時間撹拌し、反応混合物を氷水に慎重に加え、その後、20% NaOHを用いて中和する。混合物をジクロロメタンで抽出し、MgSO4で乾燥し、蒸発させる。熱ヘプタンと共に撹拌することにより洗浄した後、酢酸エチルを室温で加え、生成物(25 g, 68%) を固体として沈殿させる。
【0105】
g)ビフェニル-4-イル-[4-(9,9-ジメチル-10-フェニル-9,10-ジヒドロアクリジン-2-イル)フェニル]フェニルアミン (実施例化合物4)
【化27】

【0106】
38.3 g (72.4 mmol) のf)で得られた化合物および11.4 ml (108.7 mmol) のブロモベンゼンを、1000 mlの乾燥トルエンに溶解し、5.07 ml (5.07 mmol / トルエン中、1 M) のトリ-tert-ブチルホスフィン、650.6 mgのPdOAc2および10.4 g (108.7 mmol) のナトリウムtert-ブトキシドを加える (固体を予め脱気する)。反応混合物を還流下で2時間撹拌し、続いて、温めながら、酸化アルミニウム(塩基性)を通してろ過する。続いて、混合物を温ヘプタンと共に撹拌することにより洗浄し、油状の固体がそれ以上沈殿しなくなるまで、温めた混合物に十分な酢酸エチルを加える。室温まで冷却した後、生成物が白色固体として沈殿する。続いて、熱ヘプタンおおよび酢酸エチルと共に撹拌することにより洗浄し、昇華させ、28.7 g (65%) の生成物を得る。
【0107】
例5:実施例化合物5の合成
実施例化合物5の合成は、例4において示した合成の最初の4つのステップa)〜d)に対応する。実施例化合物5を合成するための続くステップe)、f)およびg)を、以下に示す。
【0108】
e)tert-ブチル 2-[4-(ジ-o-トリルアミノ)フェニル]-9,9-ジメチル-9,9a-ジヒドロ-4aH-アクリジン-10-カルボキシレート
【化28】

【0109】
35.0 g (75.4 mmol) の例4d)で得られた化合物および19.3 g (97.9 mmol) のジ-o-トリルアミンを、500 mlの乾燥トルエンに溶解する。1.5 ml (1.5 mmol / トルエン中、1 M) のトリ-tert-ブチルホスフィン、169.2 mg (0.754 mmol) のPd(OAc)2および10.8 g (113.1 mmol) のNaOtBuを続いて加える(全ての固体を脱気する)。続いて、反応混合物を還流下で2時間撹拌し、反応終了後、Alox B (活性度1)を通してろ過し、蒸発させる。熱ヘプタンと共に撹拌することにより、粗生成物を洗浄し、23 g (53%) の生成物を固体として得る。
【0110】
f)[4-(9,9-ジメチル-9,10-ジヒドロアクリジン-2-イル)フェニル]ジ-o-トリルアミン
【化29】

【0111】
25.1 g (43.2 mmol) のe)で得られた化合物を、250 mlのジクロロメタンに溶解し、9.63 ml (129.7 mmol) のトリフルオロ酢酸を続いて加え、混合物を室温で24時間撹拌する。続いて、反応溶液を氷水に慎重に加え、強く撹拌しながら20% NaOHを用いて中和する。混合物をジクロロメタンで抽出し、乾燥し、蒸発させる。温トルエン中の残留物を、酸化アルミニウム(塩基性)を通してろ過し、続いて温ヘプタンと共に撹拌することにより洗浄し、14.3 g (72%) の生成物を白色固体として得る。
【0112】
g)[4-(9,9-ジメチル-10-p-トリル-9,10-ジヒドロアクリジン-2-イル)フェニル]ジ-o-トリルアミン (実施例化合物5)
【化30】

【0113】
14.3 g (29.8 mmol) のf)で得られた化合物および5.4 ml (44.6 mmol) のブロモトルエンを、100 mlの乾燥トルエンに溶解し、溶液を脱気する。2.08 ml (208 mmol) のトリ-tert-ブチルホスフィン、267.1 mg (1.19 mmol) のPd(OAc)2および4.28 g (44.62 mmol) のNaOtBuを加える。全ての固体は、アルゴンを用いて予め十分に脱気する。反応混合物を還流下で1時間撹拌し、反応終了後、酸化アルミニウム(塩基性)を通して濾過する。粗生成物をヘプタンおよび酢酸エチルから結晶化し、8.8 g (42%) の生成物を白色固体として得る。
【0114】
例6〜11:OLEDの作製
本発明によるOLEDは、ここに記載した条件(層の厚みの変化、使用する材料)に適応したWO 04/058911に記載されている一般的な方法により作製される。
【0115】
以下の例6〜11において、種々のOLEDについての結果を示す。構造化ITO(インジウム錫酸化物)でコートされたガラス板は、OLEDの基板を形成する。加工性を改善するために、20 nmのPEDOT (水からのスピンコーティング; H. C. Starck, Goslar, Germanyから購入; ポリ(3,4-エチレンジオキシ-2,5-チオフェン))を基板に塗布する。OLEDは、以下に示す層配列からなる: 基板 / PEDOT 20 nm / HIL1 5 nm / 正孔輸送層 (HTM) 20または110 nm / NPB 20 nm / 発光層 (EML) 30 nm / Alq3 20 nm および最後にカソード。
【0116】
PEDOTから離れている材料は、真空チャンバーにおいて熱的に蒸着される。ここでの発光層は、常に、マトリックス材料(ホスト)および共蒸着によりホストと混合されるドーパントからなる。カソードは、厚さ1 nmのLiF層および一番上に積層される厚さ100 nmのAl層により形成される。表1に、OLED作製のために使用する材料の化学構造を示す。
【0117】
これらのOLEDは、標準的な方法により特徴付けられ;この目的のために、エレクトロルミネッセンススペクトル、効率(cd/Aで測定)、輝度の関数としての電力効率(lm/Wで測定、電流/電圧/輝度特性線(IUL特性線)から計算)、および寿命が測定される。寿命は、最初の輝度25,000 cd/cm2から半分に低下するまでの時間として定義される。使用電圧は、OLEDが1 cd/m2の輝度を達成する電圧として定義される。
【0118】
表2は、いくつかのOLEDに対する結果を示す(例6〜11)。本発明に使用される正孔輸送材料は、実施例化合物2および3であり、合成については上記で示した通りである。比較のために、先行技術による化合物HTM1を使用する。化合物2および3は、使用電圧の低下および/または動作電圧の低下および/または効率の有意な改善により、先行技術による化合物HTM1と区別されるが、特に、輝度1000 cd/m2における電力効率が改善される。さらに、本発明による化合物を使用することにより、薄い(20 nm)場合と厚い(110 nm)場合の間の電位差が小さくなる。光カップリングアウト効率は、正孔輸送層の厚さを変化させることにより決定的な態様で制御されるため、このことは実施において重要である。本発明による化合物2および3の使用における寿命およびカラーコーディネートは、先行技術による化合物HTM1を使用した場合と非常に類似しているか、またはわずかに優れている。
【0119】
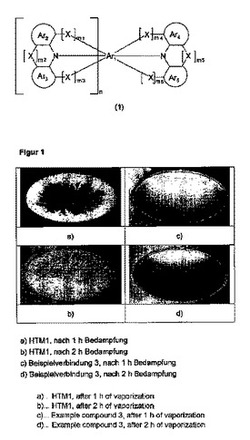
本発明による化合物の顕著な利点は、先行技術のHTM1と比較した非常に優れた加工性である。同じ蒸着条件下で、本発明の化合物は、先行技術のHTM1と比較して、蒸着源に詰まりが生じる傾向が全くない。それ故、本発明による化合物は、先行技術による化合物HTM1よりも大量生産にずっと適している。本発明による材料の加工性の改善は、図1における実施例化合物3に示されており、それは、0.1 nm/sの速度で1時間および2時間蒸着した後の蒸着源の上縁の写真を示す。明確に分かるように、比較材料HTM1を使用した場合、たった2時間後に蒸着源が詰まり(図1b)、一方、実施例化合物3の場合には、蒸着源の縁に結晶化が全く見られない(図1d)。
【表1】

【表2】

【図面の簡単な説明】
【0120】
【図1】本発明による材料の加工性の改善を示す図。
【発明の概要】
【0001】
本発明は、式(1)で表される化合物および電子デバイスにおけるその使用、ならびにこれらの化合物を含む電子デバイスに関する。
【0002】
有機エレクトロルミネッセンス素子の一般的な構造は、例えば、US 4539507、US 5151629、EP 0676461およびWO 98/27136に記載されている。しかしながら、これらデバイスにおける改善の必要性が依然としてある:
1.特に蛍光OLEDにおいては、効率が依然として改善されるべきである。
【0003】
2.特に青色発光の場合においては、動作寿命が依然として短く、改善に対する必要性が依然としてある。
【0004】
3.特に蛍光OLEDにおいては、動作電圧が非常に高いため、さらに低くして電力効率を改善するべきである。これは、特にモバイル用に対して非常に重要である。特に電荷輸送材料において、さらなる改善が望まれている。
【0005】
4.先行技術による正孔輸送材料の場合、電圧は、正孔輸送層の厚さに依存する。実際に、相対的に厚い正孔輸送層が一般的に望ましい。しかしながら、付随する電圧の上昇のため、先行技術による材料を用いて達成することはできない。
【0006】
5.有機エレクトロルミネッセンス素子において先行技術により使用される多くの材料は、エレクトロルミネッセンス素子の製造のためのプロセスにおける蒸着源において結晶化し、蒸着源を詰まらせる傾向がある。それ故、これらの材料は、技術的な複雑性が増大した大量生産においてのみ使用され得る。
【0007】
アリールアミンは、正孔輸送材料および正孔注入材料として使用される。インデノフルオレンに基づくこのタイプの材料は、例えば、WO 06/100896およびWO 06/122630に開示されている。上記インデノフルオレンアミンは、蒸着またはコーティング、初期の積層(premature deposition)の間の加工性に不都合があり、それ故、工業的プロセスの複雑化が生じ得る。さらに、正孔輸送材料は、一般的に、頻繁に、電子安定性が低く、実施において、関連するダイオードの寿命が短くなる。これに対する改善にの必要性が存在し続ける。
【0008】
さらに、キナクリジン誘導体および電子デバイスにおけるその使用が、WO 07/064104に開示されている。
【0009】
本発明は、特にエレクトロルミネッセンス素子の発光層および/または正孔輸送層および/または正孔注入層における使用のための、発光特性および正孔輸送特性を有する新規分類の材料としての、ピペリジン誘導体および関連する複素環誘導体について述べる。
【0010】
驚くべきことに、本発明による化合物を使用することにより、先行技術と比較した改善を生じる。LUMOのエネルギーレベルの上昇を介して達成される、おそらく電子安定性の増大による、動作電圧の低下、ならびに正孔移動性の増大および寿命の改善が、ここでの中心である。さらに、この分類は、その可動性の配置により、先行技術によるアリールアミンよりも結晶化に対する傾向が低い。
【0011】
さらに、本発明による化合物は、燐光発光体を含む有機エレクトロルミネッセンス素子における使用に非常に適していることが見出されている。燐光発光体を含むデバイスの正孔輸送層または発光層において式(1)の化合物を使用することにより、エレクトロルミネッセンス素子の寿命およびエネルギー効率に関して特に好ましい結果が得られている。
【0012】
本発明は、以下の式(1)で表される化合物に関する。
【化1】

【0013】
式中で使用されている記号および添え字は、以下のように定義される:
Xは、それぞれ同じまたは異なり、B(R1)、C(R1)2、Si(R1)2、C=O、C=NR1、C=C(R1)2、O、S、S=O、SO2、N(R1)、P(R1)およびP(=O)R1からなる群より選択される2価のブリッジ(bridge)であり;
Ar1は、10〜40の芳香環原子を有する芳香環構造または5〜40の芳香環原子を有する芳香族複素環構造であり、それぞれが1以上のR1基で置換されてよく;
Ar2〜Ar5は、それぞれ同じまたは異なり、5〜40の芳香環原子を有する芳香環または芳香族複素環構造であり、それぞれが1つ以上のR1基で置換されてよく;
R1は、それぞれ同じまたは異なり、H、D、F、Cl、Br、I、CHO、N(R2)2、N(Ar6)2、C(=O)Ar6、P(=O)(Ar6)2、S(=O)Ar6、S(=O)2Ar6、CR2=CR2Ar6、CN、NO2、Si(R2)3、B(OR2)2、OSO2R2、1〜40の炭素原子を有する直鎖アルキル基、アルケニル基、アルコキシ基およびチオアルコキシ基、ならびに3〜40の炭素原子を有する分枝鎖状、モノまたはポリ環状アルキル基、アルケニル基、アルコキシ基およびチオアルコキシ基(これらはそれぞれ、1以上のR2基で置換されてよく、1以上の隣接しないCH2基は、R2C=CR2、C≡C、Si(R2)2、Ge(R2)2、Sn(R2)2、C=O、C=S、C=Se、C=NR2、P(=O)(R2)、SO、SO2、NR2、O、SまたはCONR2で置換されてよく、1以上のH原子は、F、Cl、Br、I、CNもしくはNO2で置換されてよい)、ならびに5〜40の芳香環原子を有する芳香環または芳香族複素環(これらはそれぞれ、1以上のR2基で置換されてよい)、および5〜40の芳香環原子を有するアリールオキシもしくはヘテロアリールオキシ基(これらは、1以上のR2基で置換されてよい)、ならびにこれらの構造の組み合わせ(ここでの2以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい)からなる群より選択され;
R2は、それぞれ同じまたは異なり、H、D、F、Cl、Br、I、CHO、N(R3)2、N(Ar6)2、C(=O)Ar6、P(=O)(Ar6)2、S(=O)Ar6、S(=O)2Ar6、CR3=CR3Ar6、CN、NO2、Si(R3)3、B(OR3)2、OSO2R3、1〜40の炭素原子を有する直鎖アルキル基、アルコキシ基およびチオアルコキシ基、ならびに3〜40の炭素原子を有する分枝鎖状、モノもしくはポリ環状アルキル基、アルコキシ基およびチオアルコキシ基(これらはそれぞれ1以上のR3基で置換されてよく、1以上の隣接しないCH2基は、R3C=CR3、C≡C、Si(R3)2、Ge(R3)2、Sn(R3)2、C=O、C=S、C=Se、C=NR3、P(=O)(R3)、SO、SO2、NR3、O、SまたはCONR3で置換されてよく、1以上のH原子は、F、Cl、Br、I、CNまたはNO2で置換されてよい)、ならびにこれらの構造の組み合わせ(ここでの2以上の隣接する置換基R2は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい)からなる群より選択され;
R3は、それぞれ同じまたは異なり、H、Fまたは1〜20の炭素原子を有する脂肪族、芳香族および/または芳香族複素環炭化水素基であり、さらに、1以上のH原子は、F原子で置換されてよく、ここでの2以上の隣接する置換基R3は、互いに単環または多環の脂肪族または芳香環構造を形成してもよく;
Ar6は、それぞれ同じまたは異なり、1以上のR3基で置換されてよい、5〜30の芳香環原子を有する芳香環または芳香族複素環構造であり、さらに、同じ窒素原子またはリン原子に結合する2つのAr6基は、単結合またはB(R3)、C(R3)2、Si(R3)2、C=O、C=NR3、C=C(R3)2、O、S、S=O、SO2、N(R3)、P(R3)およびP(=O)R3からなる群より選択されるブリッジにより相互に連結されてよく;
m1〜m6は、それぞれ同じまたは異なり、0または1であり、mが0の場合は、水素原子またはR1基がXの代わりに存在することを意味し、添え字m1、m3、m4および/またはm6の少なくとも1つは1であり;
nは、1、2または3である。
【0014】
本発明の目的のために、隣接する置換基は、同じ原子に結合する置換基(すなわち、例えばC(R1)2基における2つの置換基R1)であるか、または直接隣接する原子に結合する置換基(すなわち、例えばC(R1)-C(R1)基における2つの置換基R1)を意味する。
【0015】
本発明の目的のために、アリール基またはヘテロアリール基は、それぞれ通常の芳香族電子系を有する芳香族基または複素環式芳香族基を意味し、アリール基は6〜40、好ましくは6〜24の炭素原子を含み、ヘテロアリール基は2〜40、好ましくは2〜24の炭素原子を含み、全体で少なくとも5の芳香環原子を含む。へテロ原子は、好ましくは、N、Oおよび/またはSから選択される。本発明の目的のために、これは、単純な単素環または複素環、例えば、ベンゼン、ピリジン、チオフェン等であってよく、または、少なくとも2つの芳香環または芳香族複素環(例えばベンゼン環)が互いに融合した縮合型の芳香環構造であってよく、すなわち環化により相互に縮合し、すなわち少なくとも1つの共通の端部を有し、それ故共通の芳香族構造を有するものであってよい。縮合型の芳香環は、直鎖状または角ばった態様(angular manner)で縮合してよい。アリール基またはヘテロアリール基は、置換されても置換されなくてもよく;いずれかの置換基は、同様に、さらなる環構造を形成してよい。例えば、ナフタレン、アントラセン、フェナントレン、ベンズアントラセン、ピレン等の構造は、本発明の目的のためにアリール基とみなされ、キノリン、アクリジン、ベンゾチオフェン、カルバゾール等は、本発明の目的のためにヘテロアリール基とみなされる一方、例えば、ビフェニル、フルオレン、スピロビフルオレン等は、分離した芳香族電子系が存在するため、アリール基とはみなさない。直鎖状に縮合した(anellate)芳香環構造は、例えば、アントラセン、テトラセンおよびペンタセンである。角ばった態様で縮合した芳香環構造は、例えば、フェナントレン、ピレン、クリセンおよびベンズアントラセンである。
【0016】
本発明の目的のために、芳香環構造は、環構造中に6〜40の炭素原子を含む。本発明の目的のために、芳香族複素環構造は、環構造中に2〜40の炭素原子および少なくとも1つのヘテロ原子を含み、ただし、炭素原子およびヘテロ原子の総数は少なくとも5である。へテロ原子は、好ましくは、N、Oおよび/またはSから選択される。本発明の目的のために、芳香環または芳香族複素環構造は、必ずしもアリール基またはヘテロアリール基のみを含むものではないが、その代わりに、さらに、複数のアリール基またはヘテロアリール基が、短い、非芳香族性の単位(H以外の原子が10%未満、好ましくはH以外の原子が5%未満)(例えば、C、NまたはO原子)により連結されてよい。それ故、例えば、9,9’-スピロビフルオレン、9,9-ジアリールフルオレン、トリアリールアミン、ジアリールエーテル等の構造も、本発明の目的のために、芳香環構造としてみなされる。上述したアリール基およびヘテロアリール基とは別に、本発明の目的のために、芳香環および芳香族複素環構造は、特に、ビフェニレン、テルフェニレン、フルオレン、スポロビフルオレン、ジヒドロフェナントレン、テトラヒドロピレンおよびcis-またはtrans-インデノフルオレンを意味する。
【0017】
本発明の目的のために、個々のH原子またはCH2基が上述した基でさらに置換されてもよいC1〜C40アルキル基は、特に好ましくは、メチル、エチル、n-プロピル、i-プロピル、n-ブチル、i-ブチル、s-ブチル、t-ブチル、2-メチルブチル、n-ペンチル、s-ペンチル、tert-ペンチル、2-ペンチル、シクロペンチル、n-ヘキシル、s-ヘキシル、tert-ヘキシル、2-ヘキシル、3-ヘキシル、シクロヘキシル、2-メチルペンチル、n-ヘプチル、2-ヘプチル、3-ヘプチル、4-ヘプチル、シクロヘプチル、1-メチルシクロヘキシル、n-オクチル、2-エチルヘキシル、シクロオクチル、1-ビシクロ[2,2,2]オクチル、2-ビシクロ[2,2,2]オクチル、2-(2,6-ジメチル)オクチル、3-(3,7-ジメチル)オクチル、トリフルオロメチル、ペンタフルオロエチルおよび2,2,2-トリフルオロエチルを意味する。本発明の目的のために、アルケニル基は、特に好ましくは、エテニル、プロペニル、ブテニル、ペンテニル、シクロペンテニル、ヘキセニル、シクロヘキセニル、ヘプテニル、シクロヘプテニル、オクテニルおよびシクロオクテニルを意味する。本発明の目的のために、アルキニル基は、特に好ましくは、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニルおよびオクチニルを意味する。C1〜C40-アルコキシ基は、特に好ましくは、メトキシ、エトキシ、n-プロポキシ、i-プロポキシ、n-ブトキシ、i-ブトキシ、s-ブトキシ、t-ブトキシおよび2-メチルブトキシを意味する。
【0018】
アリールまたは-ヘテロアリール基は、使用に応じて1価または2価であってよく、それぞれの場合において上述したR1基で置換されてよく、いずれかの望ましい位置を介して芳香環または芳香族複素環構造と連結してよく、特に、ベンゼン、ナフタレン、アントラセン、フェナントレン、ピレン、ジヒドロピレン、クリセン、ぺリレン、フルオロアントラセン、ベンズアントラセン、テトラセン、ペンタセン、ベンゾピレン、フラン、ベンゾフラン、イソベンゾフラン、ジベンゾフラン、チオフェン、ベンゾチオフェン、イソベンゾチオフェン、ジベンゾチオフェン、ピロール、インドール、イソインドール、カルバゾール、ピリジン、キノリン、イソキノリン、アクリジン、フェナントリジン、ベンゾ-5,6-キノリン、ベンゾ-6,7-キノリン、ベンゾ-7,8-キノリン、フェノチアジン、フェノキサジン、ピラゾール、インダゾール、イミダゾール、ベンズイミダゾール、ナフトイミダゾール、フェナントリミダゾール、ピリドイミダゾール、ピラジンイミダゾール、キノキサリンイミダゾール、オキサゾール、ベンズオキサゾール、ナフトキサゾール、アントロキサゾール、フェナントロキサゾール、イソキサゾール、1,2-チアゾール、1,3-チアゾール、ベンゾチアゾール、ピリダジン、ベンゾピリダジン、ピリミジン、ベンゾピリミジン、キノキサリン、ピラジン、フェナジン、ナフチリジン、アザカルバゾール、ベンゾカルボリン、フェナントロリン、1,2,3-トリアゾール、1,2,4-トリアゾール、ベンゾトリアゾール、1,2,3-オキサジアゾール、1,2,4-オキサジアゾール、1,2,5-オキサジアゾール、1,3,4-オキサジアゾール、1,2,3-チアジアゾール、1,2,4-チアジアゾール、1,2,5-チアジアゾール、1,3,4-チアジアゾール、1,3,5-トリアジン、1,2,4-トリアジン、1,2,3-トリアジン、テトラゾール、1,2,4,5-テトラジン、1,2,3,4-テトラジン、1,2,3,5-テトラジン、プリン、プテリジン、インドリジン、ベンゾチアジアゾールに由来する基を意味する。
【0019】
本発明の好ましい実施形態において、Ar2〜Ar5は、それぞれ同じまたは異なり、フェニル、1-ナフチルまたは2-ナフチル、特に好ましくはフェニルまたは2-ナフチル、中でも特に好ましくはフェニルであり、それぞれが1つ以上のR1基で置換されてよい。
【0020】
特に、以下の式(2)で表される化合物が好ましい:
【化2】

【0021】
式中に使用されている記号および添え字は、上述した意味を有する。
【0022】
式(1)または(2)におけるXは、さらに好ましくは、それぞれ同じまたは異なり、2価のブリッジC(R1)2を意味し、ここでのR1は上記で定義した通りであり、好ましくはそれぞれ同じまたは異なり、特に好ましくは同じであり、H、F、1〜6の炭素原子を有する直鎖状アルキル基(好ましくはメチル基であり、ここでの1以上のHは、Fで置換されてよい)、ならびにフェニルおよびナフチル(好ましくはフェニルであり、それぞれが1つ以上のR2基、好ましくはメチル基で置換されてよいが、特に好ましくは非置換である)、ならびにこれらの構造の組み合わせであり、ここでの2つ以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい。
【0023】
本発明の好ましい実施形態において、Ar1基は、12〜30の芳香環原子を有する多環式の芳香環構造を意味するか、または10〜20の芳香族炭素原子を有する縮合型の芳香族炭化水素基を意味し、それぞれが1つ以上のR1基で置換されてよい。
【0024】
本発明の特に好ましい実施形態において、Ar1基は、以下の式(3)〜(5)の基を意味する。
【化3−1】

【化3−2】

【0025】
これらの基は、それぞれ1つ以上のR1基で置換されてよく、ここでのR1は上記で定義したとおりであり、さらに、
Yは、Xと同じ意味を有し、好ましくは、それぞれ同じまたは異なり、C(R1)2、Si(R1)2、O、S、N(R1)、P(R1)からなる群より選択される2価のブリッジであり、特に好ましくは、C(R1)2、SおよびN(R1)からなる群より選択され;
pは、それぞれ同じまたは異なり、0または1であり、p = 0の場合、水素原子またはR1基がYの代わりに存在し;
qは0、1または2であり、好ましくは0または1であり;
記号「-----」は、式(3)〜(15)の基の炭素原子と式(1)に示した2つの窒素原子の1つとの間のそれぞれの単結合を意味し;X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【0026】
式(3)〜(15)のAr1基の特に好ましい実施形態は、以下の式(16)〜(48)に示す基である。
【化4−1】

【化4−2】

【化4−3】

【化4−4】

【0027】
式中、上記基のそれぞれは、さらに、各場合において、1つ以上のR1基で置換されてよいが、好ましくはさらには置換されず;
上記式における記号「-----」は、Ar1から式1に示した2つの窒素原子の1つへの各単結合を意味し;
X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【0028】
本発明の好ましい実施形態において、式(41)、(42)、(43)、(44)および(46)の構造におけるAr1基は、フェニルを意味し、それぞれ同じまたは異なるように1〜4の炭素原子を有する1つ以上のアルキル基で置換されてよい。
【0029】
Ar1基が上記基(16)〜(48)から選択される場合、添え字n=1である。
【0030】
本発明のさらに好ましい実施形態において、Ar1は、以下の式(49)〜(51)のユニットから選択される3価の基である:
【化5】

【0031】
特に、
【化6】

【0032】
式中、
Yは、上記で定義した通りであり、好ましくは、それぞれ同じまたは異なり、各場合において、C(R1)2、Si(R1)2、O、S、N(R1)およびP(R1)からなる群より選択される2価のブリッジであり、特に好ましくは、C(R1)2、SおよびN(R1)からなる群より選択され;
R1は、上記で定義した通りであり、好ましくはそれぞれ同じまたは異なり、特に好ましくは同じであり、H、F、1〜6の炭素原子を有する直鎖状アルキル基(好ましくはメチルであり、ここでの1以上のHは、Fで置換されてよい)、ならびにフェニルおよびナフチル(好ましくはフェニルであり、それぞれが1つ以上のR2基、好ましくはメチル基で置換されてよいが、特に好ましくは非置換である)、ならびにこれらの構造の組み合わせであり、ここでの2つ以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよく;
上記基のそれぞれは、さらに、各場合において、1つ以上のR1基で置換されてよいが、好ましくはさらには置換されず;
記号「-----」は、Ar1から式(1)に示した2つの窒素原子の1つへの各単結合を意味し;
X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【0033】
Ar1が上記基(49)〜(51)から選択される場合、添え字nは2を意味する。
【0034】
本発明のさらに好ましい実施形態において、Ar1は、以下の式(52)で表される4価の基である:
【化7】

【0035】
式中、記号「-----」は、Ar1から式(1)に示した2つの窒素原子の1つへの各単結合を意味し;
X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【0036】
Ar1が式(52)の基である場合、添え字nは3を意味する。
【0037】
添え字m1〜m6は、0または1であり、m1、m3、m4および/またはm6の少なくとも1つは1である。好ましくは、添え字m1〜m6の少なくとも2つは1に等しい。
【0038】
添え字m1〜m6の特に好ましい例を以下に示す:
m1 = m6 = 1 および m2 = m3 = m4 = m5 = 0; または
m1 = m4 = 1 および m2 = m3 = m5 = m6 = 0; または
m1 = m2 = m4 = m5 = 1 および m3 = m6 = 0; または
m1 = m2 = m5 = m6 = 1 および m3 = m4 = 0; または
m1 = m2 = 1 および m3 = m4 = m5 = m6 = 0; または
m1 = 1 および m2 = m3 = m4 = m5 = m6 = 0; または
m2 = m3 = m4 = m5 = 1 および m1 = m6 = 0; または
m3 = m4 = 1 および m1 = m2 = m5 = m6 = 0。
【0039】
特に好ましくは、上記式(2)の化合物が提供され、Ar1は式(16)〜(48)の基を意味する。特に好ましくは、Xが同時にC(R1)2を意味し、Xは、窒素原子と結合する炭素原子に隣接する炭素原子と結合する。中でも特に好ましくは、上述した好ましい実施形態がさらに同時に添え字m1〜m6に適用された化合物が提供される。
【0040】
式(1)で表される好ましい化合物の例は、以下に示す構造(1)〜(110)である。
【表A−1】

【表A−2】

【表A−3】

【表A−4】

【表A−5】

【表A−6】

【表A−7】

【表A−8】

【表A−9】

【表A−10】

【表A−11】

【0041】
本発明の化合物は、例えばHartwig-Buchwaldカップリングおよび酸触媒閉環反応のような、当業者に既知の合成ステップにより得られる。それ故、Hartwig-Buchwaldカップリングにおいて、例えば、ハロゲン(特にBrまたはI)のような反応性脱離基により置換されたAr1基は、オルト位がカルボキシレート基で置換されたアリールアミンと結合する。カルボキシレート基は、その後、例えば有機リチウム化合物またはグリニャール試薬のような有機金属試薬の付加反応により変換され、対応するアルコールとなり、Ar1との酸触媒閉環反応を受ける。最後のステップにおいて、さらなる芳香族基は、Hartwig-Buchwaldカップリングにおいて、窒素と結合し得る。このような反応に対して通常選択される反応条件は、有機合成の分野における当業者に一般的に既知である。この合成は、式(1)の2つの化合物に対して、スキーム1および2に例示する。しかしながら、当業者は、他のAr1基または他の芳香族アミンを使用して、発展的なステップを必要とすることなく単純な態様で、式(1)のさらなる化合物を合成することができる。
【化8−1】

【化8−2】

【0042】
本発明は、さらに、以下の反応ステップを含む式(1)の化合物の製造方法に関する:
a)適切に置換されたAr1基を、アリールアミンと結合させることと(ここでのアリールアミンは、オルト位において適切に置換され、アリール基がAr2基またはAr3基またはAr4基またはAr5基に対応する)、
b)アリールアミンのオルト位における置換基とAr1基の閉環反応を行うこと。
【0043】
これらの方法ステップは、任意に、その後さらなるカップリング反応を行うことにより、さらなるAr2基またはAr3基またはAr4基またはAr5基を導入してよく、あるいはこのカップリング反応は、閉環反応の前に行われてよい。
【0044】
本発明による化合物は、オリゴマー、ポリマーまたはデンドリマーの一部であってもよい。この場合、本発明の化合物における置換基との結合は、オリゴマー、ポリマー、デンドリマーとの結合に置き換えられてよい。それ故、本発明はさらに、上記化合物の1つ以上を含むオリゴマー、ポリマーおよびデンドリマーにも関する。
【0045】
本発明による式(1)の化合物は、電子デバイス、特に有機エレクトロルミネッセンス素子(OLED)における使用に適している。置換に依存して、前記化合物は、種々の機能および層において使用される。
【0046】
それ故、本発明はさらに、電子デバイスにおける本発明による式(1)の化合物の使用に関する。電子デバイスは、ここでは、好ましくは、有機集積回路(O-IC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光学検出器、有機感光体、有機電場消光素子(O-FQD)、発光電気化学電池(LEC)、有機レーザーダイオード(O-laser)および特に好ましくは有機エレクトロルミネッセンス素子(OLED)からなる群より選択される。
【0047】
本発明は、さらに、少なくとも1つの式(1)の化合物を含む電子デバイスにも関する。ここでの電子デバイスは、好ましくは上記デバイスから選択される。特に好ましくは、アノードとカソードと少なくとも1つの発光層とを含む有機エレクトロルミネッセンス素子が提供され、発光層、正孔輸送層またはその他の層であってよい少なくとも1つの有機層が、少なくとも1つの式(1)の化合物を含むことを特徴とする。
【0048】
カソード、アノードおよび発光層とは別に、有機エレクトロルミネッセンス素子は、さらなる層を含んでもよい。これらは、例えば、それぞれの場合において、1以上の正孔注入層、正孔輸送層、正孔遮断層、電子輸送層、電子注入層、電子遮断層、励起子遮断層、電荷発生層(IDMC 2003, Taiwan; Session 21 OLED (5), T. Matsumoto, T. Nakada, J. Endo, K. Mori, N. Kawamura, A. Yokoi, J. Kido, Multiphoton Organic EL Device Having Charge Generation Layer)および/または有機もしくは無機のp/n接合から選択される。しかしながら、これらの層のそれぞれは、必ずしも存在する必要はなく、層の選択は、常に、使用される化合物および特にそれが蛍光のエレクトロルミネッセンス素子であるかリン光のエレクトロルミネッセンス素子であるかに依存することを指摘するべきである。
【0049】
有機エレクトロルミネッセンス素子は、複数の発光層を含んでもよい。この場合、これらの発光層は、特に好ましくは、全体として、総合的に白色の発光を生じる380nm〜750nmの間に複数の発光極大を有していることが好ましく、すなわち、蛍光またはリン光を発し、青色および黄色、オレンジ色または赤色の光を発する種々の発光化合物が発光層において使用される。3層構造、すなわち3つの発光層を有する構造が特に好ましく、これらの層の少なくとも1つは、少なくとも1つの式(1)の化合物を含み、3つの層は、青色、緑色およびオレンジ色または赤色の発光を示す(基本的な構造、例えばWO 05/011013を参照されたい)。広帯域の発光域を有し、それ故白色発光を示す発光体も、白色発光に同様に適している。
【0050】
本発明の好ましい実施形態において、式(1)の化合物は、正孔輸送材料として使用される。前記化合物は、正孔輸送層および/または正孔注入層において使用されることが好ましい。本発明の目的のために、正孔注入層は、アノードに直接隣接する層である。本発明の目的のために、正孔輸送層は、正孔注入層と発光層の間に位置する層である。式(1)の化合物が正孔輸送材料として使用される場合、例えばF4-TCNQのような電子受容化合物またはEP 1476881もしくはEP 1596445に記載されているような化合物にドープすることが好ましい。正孔輸送層中の正孔輸送材料として式(1)の化合物を使用する場合、100%の割合、すなわち純粋な材料としてその化合物が使用されてよく、あるいは正孔輸送層におけるさらなる化合物との組み合わせとして使用されてよい。
【0051】
本発明において、式(1)の化合物は、1つ以上のリン光発光体を含む電子デバイスにおいて使用されることが好ましい。前記化合物は、ここでは、正孔輸送層、正孔注入層または発光層、特に好ましくは正孔輸送層において使用され得る。
【0052】
適切なリン光発光体化合物(=三重項発光体)は、特に、好ましくは可視領域において、適切な励起状態で光を発する化合物であり、さらに、原子番号が20より大きく、好ましくは38より大きく84未満 、特に好ましくは56より大きく80未満である少なくとも1つの原子を含む化合物である。使用されるリン光発光体は、好ましくは、銅、モリブデン、タングステン、レニウム、ルテニウム、オスミウム、ロジウム、イリジウム、パラジウム、白金、銀、金またはユーロピウムを含む化合物であり、特に、イリジウムまたは白金を含む化合物である。
【0053】
上述した発光体の例は、WO 00/70655、WO 01/41512、WO 02/02714、WO 02/15645、EP 1191613、EP 1191612、EP 1191614、WO 05/033244、WO 05/019373およびUS 2005/0258742の出願に記載されている。一般的に、リン光OLEDについての先行技術において使用され、有機エレクトロルミネッセンスの分野の当業者に既知の全てのリン光錯体が適している。さらに、当業者は、発展的なステップを必要とすることなく、本発明による化合物を含む有機エレクトロルミネッセンス素子における発光材料としてさらなるリン光錯体を使用することができるであろう。
【0054】
本発明のさらに好ましい実施形態において、式(1)の化合物は、発光層における発光材料として使用される。式(1)の化合物は、Ar1〜Ar5の基の少なくとも1つ、特にAr1が、特に少なくとも3つの縮合した芳香環または芳香族複素環を有する縮合型の芳香環または芳香族複素環構造を意味する場合に、発光材料として特に適している。特に好ましい発光材料は、Ar1がアントラセンまたはクリセンを意味する式(1)の化合物である。
【0055】
式(1)の化合物が発光層における発光材料として使用される場合、ホスト材料と組み合わせて使用されることが好ましい。ホストおよびドーパントを含む系において、ホスト材料は、系により高い割合で存在する成分を意味する。ホストおよび複数のドーパントを含む系において、ホストは、混合物中での割合が最も高い成分を意味する。
【0056】
発光層の混合物において、式(1)の化合物の割合は、0.1〜50.0容量%、好ましくは0.5〜20.0容量%、特に好ましくは1.0〜10.0容量%である。それに対応して、ホスト材料の割合は、50.0〜99.9容量%、好ましくは80.0〜99.5容量%、特に好ましくは90.0〜99.0容量%である。
【0057】
この目的に対して適切なホスト材料は、種々の分類の物質に由来する材料である。好ましいホスト材料は、オリゴアリーレン(例えば、EP 676461に記載されている2,2‘,7,7‘-テトラフェニルスピロビフルオレンまたはジナフチルアントラセン)、特に縮合型の芳香族基を含むオリゴアリーレン、オリゴアリーレンビニレン(例えば、EP 676461に記載されているDPVBiまたはスピロ-DPVBi)、多座(polypodal)金属錯体(例えば、WO 04/081017に記載されている)、正孔伝導化合物(例えば、WO 04/058911に記載されている)、電子伝導化合物、特に、ケトン、ホスフィンオキシド、スルホキシド等(例えば、WO 05/084081およびWO 05/084082に記載されている)、アトロプ異性体(例えば、WO 06/048268に記載されている)、ボロン酸誘導体(例えば、WO 06/117052に記載されている)またはベンズアントラセン(例えば、WO 08/145239に記載されている)の分類から選択される。特に好ましいホスト材料は、ナフタレン、アントラセン、ベンズアントラセンおよび/またはピレンを含むオリゴアリーレン、またはこれらの化合物のアトロプ異性体、ケトン、ホスフィンオキシドおよびスルホキシドの分類から選択される。中でも特に好ましいホスト材料は、アントラセン、ベンズアントラセンおよび/またはピレンを含むオリゴアリーレン、またはこれらの化合物のアトロプ異性体の分類から選択される。本発明の目的のために、オリゴアリーレンは、少なくとも3つのアリールまたはアリーレン基が相互に結合した化合物を意味するものとする。
【0058】
好ましいホスト材料は、特に、以下の式(53)で表される化合物から選択される:
Ar7-(Ar8)r-Ar9 式(53)
式中、Ar7、Ar8、Ar9は、それぞれ同じまたは異なり、5〜30の芳香環原子を有するアリールまたはヘテロアリール基であり、1つ以上のR1基で置換されてよく、R1は上述したのと同じ意味を有し、pは、0、1、2または3の数値であってよい。式(53)のホスト材料におけるAr8基は、特に好ましくはアントラセンを意味し、1つ以上のR1基で置換されてよく、Ar7およびAr9基は、9および10位に結合する。中でも特に、Ar7および/またはAr9基の少なくとも1つが、1-もしくは2-ナフチル、2-, 3-もしくは9-フェナントレニルまたは2-, 3-, 4-, 5-, 6-または7-ベンズアントラセニルから選択される縮合型のアリール基であり、これらはそれぞれ、1つ以上のR1基で置換されてよい。
【0059】
好ましくはさらに、1つ以上の層が昇華プロセスにより塗布されることを特徴とする有機エレクトロルミネッセンス素子が提供され、材料は、10-5 mbar未満、好ましくは10-6 mbar未満の初期圧力で、減圧昇華ユニットにおいて蒸着される。しかしながら、ここでの初期圧力はさらに低くてもよく、例えば10-7 mbar未満であってもよい。
【0060】
同様に、1以上の層がOVPD(有機気相蒸着)法により、またはキャリアガス昇華の助けを受けて塗布されたことを特徴とする、有機エレクトロルミネッセンス素子が提供されることが好ましい。ここで、材料は、10-5 mbar〜1 barの圧力で塗布される。この方法の特別な場合は、OVJP(有機気相ジェットプリンティング)プロセスであり、材料がノズルを通して直接塗布され、構築される(例えば、M. S. Arnold et al., Appl. Phys. Lett. 2008, 92, 053301)。
【0061】
好ましくは、さらに、1以上の層が、例えば、スピンコーティング、または望ましい印刷工程(例えば、スクリーン印刷、フレキソ印刷もしくはオフセット印刷)により、溶液から形成され、特に好ましくは、LITI(光誘起熱画像化;light-induced thermal imaging、熱転写印刷;thermal transfer printing)またはインクジェット印刷により形成されることを特徴とする有機エレクトロルミネッセンス素子が提供される。式(1)の可溶性化合物が、この目的のために必要である。高い溶解性は、化合物の適切な置換により達成することができる。
【0062】
有機エレクトロルミネッセンス素子における使用について、本発明による化合物は、以下に示すような先行技術と比較した驚くべき利点を有している:
1.正孔輸送層および/または正孔注入層における正孔輸送材料として本発明の化合物を使用する場合、ブリッジする基Xを含まない先行技術による化合物よりも、必要とする使用電圧および動作電圧が低い。従って、本発明による化合物を使用することにより、有意に高い電力効率のOLEDが得られる。
【0063】
2.本発明による化合物は、リン光発光体を含む電子デバイスにおける使用に特に適しており、デバイスの寿命および電力効率における改善が得られる。
【0064】
3.正孔輸送層および/または正孔注入層における正孔輸送材料として本発明の化合物を使用する場合のさらなる利点は、薄い(20 nm)正孔輸送層と厚い(110 nm)正孔輸送層との間の電位差が小さくなることである。これにより、電力効率の有意な低下を生じることなく、より厚い正孔輸送層に本発明による化合物を使用することが可能になる。光カップリングアウト効率(Optical coupling-out efficiency)は、正孔輸送層の厚さを変化させることにより、決定的な様式で制御されるため、このことは重要である。0.1 Vの領域での改善も、ここでは有意な利点とみなす。
【0065】
4.本発明による化合物は、発光層におけるドーパントとしての本発明の化合物の使用において、非常に良好な効率および寿命を示す。
【0066】
5.本発明の化合物の加工性(processibility)は、ブリッジする基Xを含まない先行技術の材料と比較して、有意に改善されている。それ故、本発明の化合物は、同じ蒸着条件下で、蒸着源の縁において詰まりを示す傾向が低い。本発明の化合物は、それ故、先行技術の材料よりも大量生産に適している。
【0067】
本発明は、限定されることなく、以下の実施例によりさらに詳細に説明される。
【実施例】
【0068】
以下の合成は、特に示さない限り、保護ガス(protective gas)雰囲気下において、乾燥溶媒中で行う。出発物質は、ALDRICHから購入することができる。
【0069】
例1:実施例化合物1の合成
a)ビス[N-(2-カルボキシメチルフェニル)]-6,6,12,12-テトラメチル-6-12-ジヒドロインデノ[1,2b]フルオレンジアミン
【化9】

【0070】
35.51 g (234.9 mmol) のメチルアントラニレートを500 mlのトルエンに溶解し、その溶液を十分に脱気する。50.0 g (106.8 mmol) の6,6,12,12-テトラメチル-6-12-ジヒドロインデノ[1,2b]フルオレニルジブロミド、2.1 g (10.7 mmol) の4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテン、1.19 g (5.34 mmol) のPd(OAc)2 および76.5 g (234.9 mmol) のCs2CO3を加え、続いて混合物を脱気し、保護ガス雰囲気下で24時間、100℃で撹拌する。続いて、セライトを通して固体をろ過し、有機層を水で洗浄し、MgSO4で乾燥し、蒸発させる。粗生成物を熱ヘプタンと共に撹拌することにより洗浄し、56 g (86%) の黄色い固体として生成物を得る。
【0071】
b)ビス[N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-6,6,12,12-テトラメチル-6-12-ジヒドロインデノ[1,2b]フルオレンジアミン
【化10】

【0072】
56.0 g (92.0 mmol) のa) で得られた化合物を、1200 mlの乾燥THFに溶解し、その溶液を脱気する。溶液を−78℃に冷却し、334.53 ml (736.0 mmol) のジエチルエーテル中のメチルリチウム2.2 M溶液を40分かけて加える。混合物を、1時間かけて−40℃に温め、反応をTLCにより確認する。反応が終了したら、−30℃でMeOHを加えて慎重に反応停止する。反応溶液を1/3に濃縮し、1 lの塩化メチレンを加え、混合物を洗浄し、有機層をMgSO4で乾燥し、蒸発させる。黄色の粗生成物はさらなる精製を行わず、次のステップに直接使用する。
【0073】
c)ビスアクリジン化合物
【化11】

【0074】
55.0 g (90.3 mmol) のビス[N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-6,6,12,12-テトラメチル-6,12-ジヒドロインデノ[1,2b]フルオレンジアミンを、1200 mlの脱気したトルエンに溶解し、70 gのポリリン酸の懸濁液および50 mlのメタンスルホン酸を加え、混合物を60℃で1時間加熱する。バッチを冷却し、水を加える。固体が沈殿し、塩化メチレン/THF (1:1)を用いて溶解する。得られた溶液を、20% NaOHを用いて注意深くアルカリ性にし、相を分離し、MgSO4で乾燥する。得られた固体を、ヘプタンと共に撹拌することにより洗浄し、直接使用することができる36 g (70%) の生成物を得る。
【0075】
d)実施例化合物1
【化12】

【0076】
50.0 g (87.3 mmol) のc)で得られたビスアクリジンおよび34.75 ml (261.8 mmol) のブロモベンゼンを、2500 mlの脱気したトルエンに溶解し、その溶液を脱気する。トリ-tert-ブチルホスフィン (6.11 ml, トルエン中の1M溶液) を加え、685.9 mg (3.05 mmol) のPd(OAc)2 および25.1 g (209.4 mmol) のナトリウムtert-ブトキシドを加え、混合物を簡単に脱気し、還流下で3時間加熱する。反応溶液を水で洗浄し、沈殿した固体と有機相を混合し、蒸発させ、トルエンを用いて何回も共沸乾燥し、49.1 g (77%) の黄色の固体を得る。それは、Soxhlet抽出およびNMPからの結晶化により、さらに精製される。
【0077】
例2:実施例化合物2の合成
a)ビス[1,1'-N-(2-カルボキシメチルフェニル)]-4,4'-ビフェニルジアミン
【化13】

【0078】
100.0 g (320.5 mmol) の4,4'-ジブロモビフェニルおよび106.6 g (705.1 mmol) のメチルアントラニレートを、1200 mlの脱気したトルエンに溶解し、その溶液を脱気し、229.7 g (705.1 mmol) のCs2CO3、3.59 g (16.03 mmol) のPd(OAc)2および6.29 g (32.05 mmol) の4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテンを加える。反応混合物を、内部温度100℃で48時間撹拌する。冷却した反応溶液を、酸化アルミニウムを通してろ過し、水で洗浄し、MgSO4で乾燥し、蒸発させる。ヘプタンと共に撹拌することにより粗生成物を洗浄し、129 g (89%) の生成物を白色の固体として得る。
【0079】
b)ビス[1,1'-N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-4,4'-ビフェニルジアミン
【化14】

【0080】
64.5 g (142.5 mmol) のビス[1,1'-N-(2-(カルボキシメチル)フェニル)]-4,4'-ビフェニルジアミンを、1500 mlの乾燥THFに溶解し、その溶液を−78℃に冷却し、518.3 mlのメチルリチウム (ジエチルエーテル中、2.2 M) を滴下する。得られた混合物をゆっくりと−40℃に温め、さらに1時間撹拌する。MeOHを用いて、−30℃で反応をゆっくりと慎重に停止させ、反応溶液を1/3に濃縮する。トルエンを加え、混合物を水で洗浄し、MgSO4で乾燥し、蒸発させる。この変換は定量的であり、反応生成物は、次の反応に直接使用できる。
【0081】
c)ビスアクリジン化合物
【化15】

【0082】
61.6 g (136.1 mmol) のビス[1,1'-N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-4,4'-ビフェニルジアミンを、1200 mlの脱気したトルエンに溶解し、110.9 gのポリリン酸および77.2 mlのメタンスルホン酸を室温で加える。得られた混合物を50℃に加熱し、その温度で2時間撹拌する。冷却トルエン相をデカントし、メタノール/THF (1:1)を用いて沈殿した固体を溶解し、その溶液を氷冷水に加え、20% NaOH溶液を用いて混合物を慎重にpH = 8に調整する。有機相(不均一)を分離し、乾燥し、トルエンを用いて共沸乾燥する。この変換は定量的であり、反応生成物は、次の反応に直接使用できる。
【0083】
d)実施例化合物2
【化16】

【0084】
54.0 g (129.6 mmol) のc)で得られたビスアクリジンおよび40.95 ml (388.9 mmol) のブロモベンゼンを、2000 mlの脱気したトルエンに溶解し、続いてその溶液を脱気し、9.07 ml (9.07 mmol, トルエン中の1M溶液) のトリ-tert-ブチルホスフィン、611.18 mg (2.72 mmol) のPd(OAc)2 および37.3 g (388.9 mmol) のナトリウム tert-ブトキシドを加え、その混合物を還流下で2.5時間加熱する。冷却したバッチを水で洗浄し、MgSO4で乾燥し、蒸発させ、69 g (93%) の白色固体を得る。それは、Soxhlet抽出およびトルエンからの結晶化によりさらに精製される。
【0085】
例3:実施例化合物3の合成
a)Bis[2,7-N-(2-カルボキシメチルフェニル)]-9,9-ジメチルフルオレンジアミン
【化17】

【0086】
137.94 g (372.21 mmol) の2,7-ジブロモ-9,9-ジメチルフルオレンおよび105.79 ml (818.87 mmol) のメチルアントラニレートを、2000 mlの脱気したトルエンに溶解する。266.79 g (818.87 mmol) のCs2CO3、4.17 g (18.61 mmol) のPd(OAc)2 および7.31 g (37.22 mmol) の4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテン (キサントホス;xantphos) を加える。反応混合物を、還流下で9時間加熱し、その後冷却し、酢酸エチルを加える。得られた混合物を水で洗浄し、MgSO4で乾燥し、ロータリーエバポレーターで蒸発させる。熱ヘプタンと共に撹拌することにより洗浄し、161.4 g (88%) の生成物を黄色の固体として得る。
【0087】
b)ビス[2,7-N-(2-(1-メチル-1-ヒドロキシエチル)フェニル)]-9,9-ジメチルフルオレンジアミン
【化18】

【0088】
20.0 g (40.60 mmol) のa)で得られた化合物を、500 mlのTHFに溶解し、147.65 mlのメチルリチウム (ジエチルエーテル中の2.2 M溶液) を−78℃で滴下する。続いて、反応をゆっくりと−40℃にし、変換をTLCで確認した。反応終了後、メタノールを用いて−30℃で慎重に反応停止し、反応溶液を蒸発させる。トルエンを固体に加え、その混合物を水で洗浄する。有機相をMgSO4で乾燥し、ロータリーエバポレーターで蒸発させ、残留物を酢酸エチルから再結晶し、12.6 g (63%) の生成物を黄色がかった固体として得る。
【0089】
c)ビスアクリジン化合物
【化19】

【0090】
20.0 g (40.59 mmol) のb)で得られた化合物を、400 mlのトルエンに最初に導入し、30 gのポリリン酸と22 mlのメタンスルホン酸のトルエン中のエマルジョンとしての混合物を室温で加える。この添加の間、温度を約40℃に上昇させ、続いて混合物を50℃に加熱する。2つの相が形成され、生成物は固体として沈殿する。トルエン相を分離し、水/酢酸エチルを残留物に加え、その後、20% NaOH溶液を用いて混合物を慎重にpH = 8に調整する。有機相を分離し、MgSO4で乾燥し、17 g (92%) の生成物を黄色の固体として得る。
【0091】
d)実施例化合物3
【化20】

【0092】
100.0 g (219.0 mmol) のc)で得られた化合物を、200 ml のトルエンに溶解し、その溶液を脱気する。15.3 ml (トルエン中、1 M) のトリス-tert-ブチルホスフィン、196.67 mg (8.76 mmol) のPd(OAc)2 および63.14 g (657.0 mmol) のナトリウムtert-ブトキシドを加え、反応混合物を還流下で2.5時間加熱する。反応溶液に水を加え、相を分離し、有機相をMgSO4で乾燥し、Alox Bを用いてSoxhlet抽出を行い、65.3 g (81%) の生成物を黄色の粉末として得る。
【0093】
例4:実施例化合物4の合成
a)メチル2-(4'-ブロモビフェニル-4-イルアミノ)ベンゾエート
【化21】

【0094】
200 g (641.0 mmol) の4,4’-ジブロモベンゼンおよび41.4 ml (320.5 mmol) のメチルアントラニレートを、1500 mlのトルエンに溶解し、その溶液を不活性ガスを通して脱気する。229.7 g (705.1 mmol) のCs2CO3、3.59 g (16.02 mmol) のPd(OAc)2および6.29 g (32.05 mmol) のキサントホス (4,5-ビス(ジフェニルホスフィノ)-9,9-ジメチルキサンテン)(全て脱気)を、続いて加える。その後、反応混合物を82℃で6時間撹拌し、酸化アルミニウム(塩基性活性度1)を通してろ過する。生成物を、シリカゲルによるカラムクロマトグラフィーにより、ヘプタン/トルエン(1:49)を用いて精製し、79.2 g (65%) の生成物を淡黄色の固体として得る。
【0095】
b)2-[2-(4'-ブロモビフェニル-4-イルアミノ)フェニル]プロパン-2-オール
【化22】

【0096】
59.7 g (156 mmol) のa)で得られた化合物を、1800 mlの乾燥THFに最初に導入し、Et2O中のMeLiの2M溶液284.0 ml (624.7 mmol) を−78℃で加え、その後、3時間かけて混合物を−40℃に温める。反応終了後、300 mlのMeOHをゆっくりと慎重に−30℃で加え、過剰なMeLiを反応停止する。混合物を室温にし、1/3に濃縮し、酢酸エチルを加え、有機相を水で洗浄する。続いて、有機相をMgSO4で乾燥し、蒸発し、59.7 g (quant.) の生成物を固体として得る。
【0097】
c)2-(4-ブロモフェニル)-9,9-ジメチル-9,10-ジヒドロアクリジン
【化23】

【0098】
b)で得られた化合物を、1000 mlのトルエンに溶解し、その溶液を不活性ガスを通して脱気する。178 gのポリリン酸と123 mlのメタンスルホン酸の混合物を、室温で滴下し、混合物を50℃に加熱する。反応終了後(約30分)、pH 8になるまで、よく冷却しながら
20% NaOH溶液を反応溶液に慎重に加える。有機相を分離し、水相をトルエンで抽出し、続いて混合性有機相をMgSO4で乾燥し、蒸発させ、49 g (86%) の生成物を固体として得る。
【0099】
d)tert-ブチル 2-(4-ブロモフェニル)-9,9-ジメチル-9H-アクリジン-10-カルボキシレート
【化24】

【0100】
43.2 ml (188.3 mmol) のジ-tert-ブチルジカルボネートを、600 mlのTHFに溶解し、続いて、49.0 g (134.5 mmol) のc)で得られた化合物を加え、その後、1.66 g (13.45 mmol) のDMAP (4-ジメチルアミノ)ピリジンを加える。反応混合物を還流下で1.5時間加熱する。反応終了後、反応溶液を氷水に慎重に加え、有機相を分離し、水で洗浄し、MgSO4で乾燥し、蒸発させる。得られる黄色の油をヘプタン中に取り、温度を上昇させて溶解する。室温で生成物が白色沈殿として沈殿し、47.7 g (76%) の生成物を得る。
【0101】
e)tert-ブチル 2-[4-(ビフェニルl-4-イルフェニルアミノ)フェニル]-9,9-ジメチル-9H-アクリジン-10-カルボキシレート
【化25】

【0102】
50.0 g (107.7 mmol) のd)で得られた化合物および34.3 gのビフェニルフェニルアミンを、500 mlのトルエンに溶解し、その溶液を十分に脱気する。2.15 ml (トルエン中1 M, 2.15 mmol) のトリ-tert-ブチルホスフィン、241.7 mg (1.07 mmol) のPdOAc2および15.5 g (161.5 mmol) のナトリウムtert-ブトキシドを加える。全ての固体を予め脱気する。反応混合物を還流下で撹拌し、反応終了後(約3時間)、酸化アルミニウム(塩基性)を通してろ過し、カラムろ過により精製し、生成物を黄色の油として、定量的な収量で得る。
【0103】
f)ビフェニル-4-イル-[4-(9,9-ジメチル-9,10-ジヒドロアクリジン-2-イル)フェニルアミン
【化26】

【0104】
67.7 g (107.7 mmol) のe)で得られた化合物を、400 mlのジクロロメタンに溶解し、23.9 ml (324 mmol) のトリフルオロ酢酸を室温 (RT)で加える。混合物を室温で16時間撹拌し、反応混合物を氷水に慎重に加え、その後、20% NaOHを用いて中和する。混合物をジクロロメタンで抽出し、MgSO4で乾燥し、蒸発させる。熱ヘプタンと共に撹拌することにより洗浄した後、酢酸エチルを室温で加え、生成物(25 g, 68%) を固体として沈殿させる。
【0105】
g)ビフェニル-4-イル-[4-(9,9-ジメチル-10-フェニル-9,10-ジヒドロアクリジン-2-イル)フェニル]フェニルアミン (実施例化合物4)
【化27】

【0106】
38.3 g (72.4 mmol) のf)で得られた化合物および11.4 ml (108.7 mmol) のブロモベンゼンを、1000 mlの乾燥トルエンに溶解し、5.07 ml (5.07 mmol / トルエン中、1 M) のトリ-tert-ブチルホスフィン、650.6 mgのPdOAc2および10.4 g (108.7 mmol) のナトリウムtert-ブトキシドを加える (固体を予め脱気する)。反応混合物を還流下で2時間撹拌し、続いて、温めながら、酸化アルミニウム(塩基性)を通してろ過する。続いて、混合物を温ヘプタンと共に撹拌することにより洗浄し、油状の固体がそれ以上沈殿しなくなるまで、温めた混合物に十分な酢酸エチルを加える。室温まで冷却した後、生成物が白色固体として沈殿する。続いて、熱ヘプタンおおよび酢酸エチルと共に撹拌することにより洗浄し、昇華させ、28.7 g (65%) の生成物を得る。
【0107】
例5:実施例化合物5の合成
実施例化合物5の合成は、例4において示した合成の最初の4つのステップa)〜d)に対応する。実施例化合物5を合成するための続くステップe)、f)およびg)を、以下に示す。
【0108】
e)tert-ブチル 2-[4-(ジ-o-トリルアミノ)フェニル]-9,9-ジメチル-9,9a-ジヒドロ-4aH-アクリジン-10-カルボキシレート
【化28】

【0109】
35.0 g (75.4 mmol) の例4d)で得られた化合物および19.3 g (97.9 mmol) のジ-o-トリルアミンを、500 mlの乾燥トルエンに溶解する。1.5 ml (1.5 mmol / トルエン中、1 M) のトリ-tert-ブチルホスフィン、169.2 mg (0.754 mmol) のPd(OAc)2および10.8 g (113.1 mmol) のNaOtBuを続いて加える(全ての固体を脱気する)。続いて、反応混合物を還流下で2時間撹拌し、反応終了後、Alox B (活性度1)を通してろ過し、蒸発させる。熱ヘプタンと共に撹拌することにより、粗生成物を洗浄し、23 g (53%) の生成物を固体として得る。
【0110】
f)[4-(9,9-ジメチル-9,10-ジヒドロアクリジン-2-イル)フェニル]ジ-o-トリルアミン
【化29】

【0111】
25.1 g (43.2 mmol) のe)で得られた化合物を、250 mlのジクロロメタンに溶解し、9.63 ml (129.7 mmol) のトリフルオロ酢酸を続いて加え、混合物を室温で24時間撹拌する。続いて、反応溶液を氷水に慎重に加え、強く撹拌しながら20% NaOHを用いて中和する。混合物をジクロロメタンで抽出し、乾燥し、蒸発させる。温トルエン中の残留物を、酸化アルミニウム(塩基性)を通してろ過し、続いて温ヘプタンと共に撹拌することにより洗浄し、14.3 g (72%) の生成物を白色固体として得る。
【0112】
g)[4-(9,9-ジメチル-10-p-トリル-9,10-ジヒドロアクリジン-2-イル)フェニル]ジ-o-トリルアミン (実施例化合物5)
【化30】

【0113】
14.3 g (29.8 mmol) のf)で得られた化合物および5.4 ml (44.6 mmol) のブロモトルエンを、100 mlの乾燥トルエンに溶解し、溶液を脱気する。2.08 ml (208 mmol) のトリ-tert-ブチルホスフィン、267.1 mg (1.19 mmol) のPd(OAc)2および4.28 g (44.62 mmol) のNaOtBuを加える。全ての固体は、アルゴンを用いて予め十分に脱気する。反応混合物を還流下で1時間撹拌し、反応終了後、酸化アルミニウム(塩基性)を通して濾過する。粗生成物をヘプタンおよび酢酸エチルから結晶化し、8.8 g (42%) の生成物を白色固体として得る。
【0114】
例6〜11:OLEDの作製
本発明によるOLEDは、ここに記載した条件(層の厚みの変化、使用する材料)に適応したWO 04/058911に記載されている一般的な方法により作製される。
【0115】
以下の例6〜11において、種々のOLEDについての結果を示す。構造化ITO(インジウム錫酸化物)でコートされたガラス板は、OLEDの基板を形成する。加工性を改善するために、20 nmのPEDOT (水からのスピンコーティング; H. C. Starck, Goslar, Germanyから購入; ポリ(3,4-エチレンジオキシ-2,5-チオフェン))を基板に塗布する。OLEDは、以下に示す層配列からなる: 基板 / PEDOT 20 nm / HIL1 5 nm / 正孔輸送層 (HTM) 20または110 nm / NPB 20 nm / 発光層 (EML) 30 nm / Alq3 20 nm および最後にカソード。
【0116】
PEDOTから離れている材料は、真空チャンバーにおいて熱的に蒸着される。ここでの発光層は、常に、マトリックス材料(ホスト)および共蒸着によりホストと混合されるドーパントからなる。カソードは、厚さ1 nmのLiF層および一番上に積層される厚さ100 nmのAl層により形成される。表1に、OLED作製のために使用する材料の化学構造を示す。
【0117】
これらのOLEDは、標準的な方法により特徴付けられ;この目的のために、エレクトロルミネッセンススペクトル、効率(cd/Aで測定)、輝度の関数としての電力効率(lm/Wで測定、電流/電圧/輝度特性線(IUL特性線)から計算)、および寿命が測定される。寿命は、最初の輝度25,000 cd/cm2から半分に低下するまでの時間として定義される。使用電圧は、OLEDが1 cd/m2の輝度を達成する電圧として定義される。
【0118】
表2は、いくつかのOLEDに対する結果を示す(例6〜11)。本発明に使用される正孔輸送材料は、実施例化合物2および3であり、合成については上記で示した通りである。比較のために、先行技術による化合物HTM1を使用する。化合物2および3は、使用電圧の低下および/または動作電圧の低下および/または効率の有意な改善により、先行技術による化合物HTM1と区別されるが、特に、輝度1000 cd/m2における電力効率が改善される。さらに、本発明による化合物を使用することにより、薄い(20 nm)場合と厚い(110 nm)場合の間の電位差が小さくなる。光カップリングアウト効率は、正孔輸送層の厚さを変化させることにより決定的な態様で制御されるため、このことは実施において重要である。本発明による化合物2および3の使用における寿命およびカラーコーディネートは、先行技術による化合物HTM1を使用した場合と非常に類似しているか、またはわずかに優れている。
【0119】
本発明による化合物の顕著な利点は、先行技術のHTM1と比較した非常に優れた加工性である。同じ蒸着条件下で、本発明の化合物は、先行技術のHTM1と比較して、蒸着源に詰まりが生じる傾向が全くない。それ故、本発明による化合物は、先行技術による化合物HTM1よりも大量生産にずっと適している。本発明による材料の加工性の改善は、図1における実施例化合物3に示されており、それは、0.1 nm/sの速度で1時間および2時間蒸着した後の蒸着源の上縁の写真を示す。明確に分かるように、比較材料HTM1を使用した場合、たった2時間後に蒸着源が詰まり(図1b)、一方、実施例化合物3の場合には、蒸着源の縁に結晶化が全く見られない(図1d)。
【表1】

【表2】

【図面の簡単な説明】
【0120】
【図1】本発明による材料の加工性の改善を示す図。
【特許請求の範囲】
【請求項1】
以下の式(1)で表される化合物:
【化1】

式中で使用されている記号および添え字は、以下のように定義される;
Xは、それぞれ同じまたは異なり、B(R1)、C(R1)2、Si(R1)2、C=O、C=NR1、C=C(R1)2、O、S、S=O、SO2、N(R1)、P(R1)およびP(=O)R1からなる群より選択される2価のブリッジ(bridge)であり;
Ar1は、10〜40の芳香環原子を有する芳香環構造または5〜40の芳香環原子を有する芳香族複素環構造であり、それぞれが1以上のR1基で置換されてよく;
Ar2〜Ar5は、それぞれ同じまたは異なり、5〜40の芳香環原子を有する芳香環または芳香族複素環構造であり、それぞれが1つ以上のR1基で置換されてよく;
R1は、それぞれ同じまたは異なり、H、D、F、Cl、Br、I、CHO、N(R2)2、N(Ar6)2、C(=O)Ar6、P(=O)(Ar6)2、S(=O)Ar6、S(=O)2Ar6、CR2=CR2Ar6、CN、NO2、Si(R2)3、B(OR2)2、OSO2R2、1〜40の炭素原子を有する直鎖アルキル基、アルケニル基、アルコキシ基およびチオアルコキシ基、ならびに3〜40の炭素原子を有する分枝鎖状、モノまたはポリ環状アルキル基、アルケニル基、アルコキシ基およびチオアルコキシ基(これらはそれぞれ、1以上のR2基で置換されてよく、1以上の隣接しないCH2基は、R2C=CR2、C≡C、Si(R2)2、Ge(R2)2、Sn(R2)2、C=O、C=S、C=Se、C=NR2、P(=O)(R2)、SO、SO2、NR2、O、SまたはCONR2で置換されてよく、1以上のH原子は、F、Cl、Br、I、CNもしくはNO2で置換されてよい)、ならびに5〜40の芳香環原子を有する芳香環または芳香族複素環構造(これらはそれぞれ、1以上のR2基で置換されてよい)、および5〜40の芳香環原子を有するアリールオキシもしくはヘテロアリールオキシ基(これらは、1以上のR2基で置換されてよい)、ならびにこれらの構造の組み合わせ(ここでの2以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい)からなる群より選択され;
R2は、それぞれ同じまたは異なり、H、D、F、Cl、Br、I、CHO、N(R3)2、N(Ar6)2、C(=O)Ar6、P(=O)(Ar6)2、S(=O)Ar6、S(=O)2Ar6、CR3=CR3Ar6、CN、NO2、Si(R3)3、B(OR3)2、OSO2R3、1〜40の炭素原子を有する直鎖アルキル基、アルコキシ基およびチオアルコキシ基、ならびに3〜40の炭素原子を有する分枝鎖状、モノもしくはポリ環状アルキル基、アルコキシ基およびチオアルコキシ基(これらはそれぞれ1以上のR3基で置換されてよく、1以上の隣接しないCH2基は、R3C=CR3、C≡C、Si(R3)2、Ge(R3)2、Sn(R3)2、C=O、C=S、C=Se、C=NR3、P(=O)(R3)、SO、SO2、NR3、O、SまたはCONR3で置換されてよく、1以上のH原子は、F、Cl、Br、I、CNまたはNO2で置換されてよい)、ならびにこれらの構造の組み合わせ(ここでの2以上の隣接する置換基R2は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい)からなる群より選択され;
R3は、それぞれ同じまたは異なり、H、Fまたは1〜20の炭素原子を有する脂肪族、芳香族および/または芳香族複素環炭化水素基であり、さらに、1以上のH原子は、F原子で置換されてよく、ここでの2以上の隣接する置換基R3は、互いに単環または多環の脂肪族または芳香環構造を形成してもよく;
Ar6は、それぞれ同じまたは異なり、1以上のR3基で置換されてよい、5〜30の芳香環原子を有する芳香環または芳香族複素環構造であり、さらに、同じ窒素原子またはリン原子に結合する2つのAr6基は、単結合またはB(R3)、C(R3)2、Si(R3)2、C=O、C=NR3、C=C(R3)2、O、S、S=O、SO2、N(R3)、P(R3)およびP(=O)R3からなる群より選択されるブリッジにより相互に連結されてよく;
m1〜m6は、それぞれ同じまたは異なり、0または1であり、mが0の場合は、水素原子またはR1基がXの代わりに存在することを意味し、添え字m1、m3、m4および/またはm6の少なくとも1つは1であり;
nは、1、2または3である。
【請求項2】
請求項1に記載の化合物であって、Ar2、Ar3、Ar4およびAr5は、それぞれ同じまたは異なり、フェニル、1-ナフチルまたは2-ナフチルを意味し、好ましくはフェニルまたは2-ナフチルを意味し、特に好ましくはフェニルを意味し、それぞれが1つ以上のR1基で置換されてよいことを特徴とする化合物。
【請求項3】
以下の式(2)で表される、請求項1または2に記載の化合物:
【化2】

式中の記号および添え字は、請求項1に記載した意味を有し、前記フェニル基は、さらに1つ以上のR1基で置換されてよい化合物。
【請求項4】
請求項1〜3のいずれか1項に記載の化合物であって、Xは、それぞれ同じまたは異なり、2価のブリッジC(R1)2を意味し、ここでのR1は、請求項1で定義した通りであり、好ましくはそれぞれ同じまたは異なり、特に好ましくは同じであり、H、F、1〜6の炭素原子を有する直鎖状アルキル基(好ましくはメチル基であり、ここでの1以上のHは、Fで置換されてよい)、ならびにフェニルおよびナフチル(好ましくはフェニルであり、それぞれが1つ以上のR2基、好ましくはメチル基で置換されてよいが、特に好ましくは非置換である)、ならびにこれらの構造の組み合わせであり、ここでの2つ以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよいことを特徴とする化合物。
【請求項5】
請求項1〜4のいずれか1項に記載の化合物であって、Ar1は、12〜30の芳香環原子を有する多環式芳香環構造、または10〜20の芳香族炭素原子を有する縮合型の芳香族炭化水素基を意味し、それぞれが1つ以上のR1基で置換されてよいことを特徴とする化合物。
【請求項6】
請求項1〜5のいずれか1項に記載の化合物であって、Ar1基が以下の式(3)〜(15)からなる群より選択されることを特徴とする化合物:
【化3−1】

【化3−2】

これらの基は、それぞれ1つ以上のR1基で置換されてよく、ここでのR1は上記で定義した通りであり、さらに、
Yは、Xと同じ意味を有し、好ましくは、それぞれ同じまたは異なり、C(R1)2、Si(R1)2、O、S、N(R1)、P(R1)からなる群より選択される2価のブリッジであり、特に好ましくは、C(R1)2、SおよびN(R1)からなる群より選択され;
pは、それぞれ同じまたは異なり、0または1であり、p = 0の場合、水素原子またはR1基がYの代わりに存在し;
qは0、1または2であり、好ましくは0または1であり;
記号「-----」は、式(3)〜(15)の基の炭素原子と式(1)に示した2つの窒素原子の1つとの間のそれぞれの単結合を意味し;X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【請求項7】
請求項1〜6のいずれか1項に記載の化合物であって、Ar1基が以下の式(16)〜(52)の基から選択されることを特徴とする化合物:
【化4−1】

【化4−2】

【化4−3】

【化4−4】

【化4−5】

【化4−6】

式中、YおよびR1は、請求項1および6で定義したとおりであり;
上記基のそれぞれは、さらに、各場合において、1つ以上のR1基で置換されてよく;
上記式における記号「-----」は、Ar1から式(1)に示した2つの窒素原子の1つへの各単結合を意味し;
X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【請求項8】
請求項1〜7のいずれか1項に記載の化合物であって、請求項3に記載の式(2)の化合物から選択され、Ar1は、請求項7に記載の式(16)〜(52)の基を意味し、Xは、好ましくは同時にC(R1)2を意味することを特徴とする化合物。
【請求項9】
請求項1〜8のいずれか1項に記載の化合物であって、添え字m1〜m6に、以下に示す定義が適用されることを特徴とする化合物:
m1 = m6 = 1 および m2 = m3 = m4 = m5 = 0; または
m1 = m4 = 1 および m2 = m3 = m5 = m6 = 0; または
m1 = m2 = m4 = m5 = 1 および m3 = m6 = 0; または
m1 = m2 = m5 = m6 = 1 および m3 = m4 = 0; または
m1 = m2 = 1 および m3 = m4 = m5 = m6 = 0; または
m1 = 1 および m2 = m3 = m4 = m5 = m6 = 0; または
m2 = m3 = m4 = m5 = 1 および m1 = m6 = 0; または
m3 = m4 = 1 および m1 = m2 = m5 = m6 = 0。
【請求項10】
請求項1〜9のいずれか1項に記載の化合物を1つ以上含むオリゴマー、ポリマーまたはデンドリマーであって、1つ以上の置換基に対する1つ以上の結合が、前記オリゴマー、ポリマーまたはデンドリマーに対する結合に置き換えられるオリゴマー、ポリマーまたはデンドリマー。
【請求項11】
請求項1〜9のいずれか1項に記載の化合物の製造方法であって、以下のステップを含む方法:
a)適切に置換されたAr1基を、アリールアミンと結合させることと(前記アリールアミンは、オルト位において適切に置換され、アリール基がAr2基またはAr3基またはAr4基またはAr5基に対応する)、
b)前記アリールアミンのオルト位における置換基と前記Ar1基の閉環反応を行うこと。
【請求項12】
電子デバイスにおける請求項1〜10のいずれか1項に記載の化合物の使用であって、前記電子デバイスは、特に、有機集積回路(O-IC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光学検出器、有機感光体、有機電場消光素子(O-FQD)、発光電気化学電池(LEC)、有機レーザーダイオード(O-laser)および有機エレクトロルミネッセンス素子(OLED)からなる群より選択される使用。
【請求項13】
請求項1〜10のいずれか1項に記載の化合物を少なくとも1つ含む電子デバイスであって、特に、有機集積回路(O-IC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光学検出器、有機感光体、有機電場消光素子(O-FQD)、発光電気化学電池(LEC)、有機レーザーダイオード(O-laser)および有機エレクトロルミネッセンス素子(OLED)からなる群より選択される電子デバイス。
【請求項14】
請求項13に記載の有機エレクトロルミネッセンス素子であって、請求項1〜10のいずれか1項に記載の化合物が、正孔輸送層および/または正孔注入層における正孔輸送材料として使用されることを特徴とする有機エレクトロルミネッセンス素子。
【請求項15】
請求項13または14に記載の有機エレクトロルミネッセンス素子であって、請求項1〜10のいずれか1項に記載の化合物が、発光層における発光材料として、特にホスト材料と組み合わせて使用されることを特徴とする有機エレクトロルミネッセンス素子。
【請求項1】
以下の式(1)で表される化合物:
【化1】

式中で使用されている記号および添え字は、以下のように定義される;
Xは、それぞれ同じまたは異なり、B(R1)、C(R1)2、Si(R1)2、C=O、C=NR1、C=C(R1)2、O、S、S=O、SO2、N(R1)、P(R1)およびP(=O)R1からなる群より選択される2価のブリッジ(bridge)であり;
Ar1は、10〜40の芳香環原子を有する芳香環構造または5〜40の芳香環原子を有する芳香族複素環構造であり、それぞれが1以上のR1基で置換されてよく;
Ar2〜Ar5は、それぞれ同じまたは異なり、5〜40の芳香環原子を有する芳香環または芳香族複素環構造であり、それぞれが1つ以上のR1基で置換されてよく;
R1は、それぞれ同じまたは異なり、H、D、F、Cl、Br、I、CHO、N(R2)2、N(Ar6)2、C(=O)Ar6、P(=O)(Ar6)2、S(=O)Ar6、S(=O)2Ar6、CR2=CR2Ar6、CN、NO2、Si(R2)3、B(OR2)2、OSO2R2、1〜40の炭素原子を有する直鎖アルキル基、アルケニル基、アルコキシ基およびチオアルコキシ基、ならびに3〜40の炭素原子を有する分枝鎖状、モノまたはポリ環状アルキル基、アルケニル基、アルコキシ基およびチオアルコキシ基(これらはそれぞれ、1以上のR2基で置換されてよく、1以上の隣接しないCH2基は、R2C=CR2、C≡C、Si(R2)2、Ge(R2)2、Sn(R2)2、C=O、C=S、C=Se、C=NR2、P(=O)(R2)、SO、SO2、NR2、O、SまたはCONR2で置換されてよく、1以上のH原子は、F、Cl、Br、I、CNもしくはNO2で置換されてよい)、ならびに5〜40の芳香環原子を有する芳香環または芳香族複素環構造(これらはそれぞれ、1以上のR2基で置換されてよい)、および5〜40の芳香環原子を有するアリールオキシもしくはヘテロアリールオキシ基(これらは、1以上のR2基で置換されてよい)、ならびにこれらの構造の組み合わせ(ここでの2以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい)からなる群より選択され;
R2は、それぞれ同じまたは異なり、H、D、F、Cl、Br、I、CHO、N(R3)2、N(Ar6)2、C(=O)Ar6、P(=O)(Ar6)2、S(=O)Ar6、S(=O)2Ar6、CR3=CR3Ar6、CN、NO2、Si(R3)3、B(OR3)2、OSO2R3、1〜40の炭素原子を有する直鎖アルキル基、アルコキシ基およびチオアルコキシ基、ならびに3〜40の炭素原子を有する分枝鎖状、モノもしくはポリ環状アルキル基、アルコキシ基およびチオアルコキシ基(これらはそれぞれ1以上のR3基で置換されてよく、1以上の隣接しないCH2基は、R3C=CR3、C≡C、Si(R3)2、Ge(R3)2、Sn(R3)2、C=O、C=S、C=Se、C=NR3、P(=O)(R3)、SO、SO2、NR3、O、SまたはCONR3で置換されてよく、1以上のH原子は、F、Cl、Br、I、CNまたはNO2で置換されてよい)、ならびにこれらの構造の組み合わせ(ここでの2以上の隣接する置換基R2は、互いに単環または多環の脂肪族または芳香環構造を形成してもよい)からなる群より選択され;
R3は、それぞれ同じまたは異なり、H、Fまたは1〜20の炭素原子を有する脂肪族、芳香族および/または芳香族複素環炭化水素基であり、さらに、1以上のH原子は、F原子で置換されてよく、ここでの2以上の隣接する置換基R3は、互いに単環または多環の脂肪族または芳香環構造を形成してもよく;
Ar6は、それぞれ同じまたは異なり、1以上のR3基で置換されてよい、5〜30の芳香環原子を有する芳香環または芳香族複素環構造であり、さらに、同じ窒素原子またはリン原子に結合する2つのAr6基は、単結合またはB(R3)、C(R3)2、Si(R3)2、C=O、C=NR3、C=C(R3)2、O、S、S=O、SO2、N(R3)、P(R3)およびP(=O)R3からなる群より選択されるブリッジにより相互に連結されてよく;
m1〜m6は、それぞれ同じまたは異なり、0または1であり、mが0の場合は、水素原子またはR1基がXの代わりに存在することを意味し、添え字m1、m3、m4および/またはm6の少なくとも1つは1であり;
nは、1、2または3である。
【請求項2】
請求項1に記載の化合物であって、Ar2、Ar3、Ar4およびAr5は、それぞれ同じまたは異なり、フェニル、1-ナフチルまたは2-ナフチルを意味し、好ましくはフェニルまたは2-ナフチルを意味し、特に好ましくはフェニルを意味し、それぞれが1つ以上のR1基で置換されてよいことを特徴とする化合物。
【請求項3】
以下の式(2)で表される、請求項1または2に記載の化合物:
【化2】

式中の記号および添え字は、請求項1に記載した意味を有し、前記フェニル基は、さらに1つ以上のR1基で置換されてよい化合物。
【請求項4】
請求項1〜3のいずれか1項に記載の化合物であって、Xは、それぞれ同じまたは異なり、2価のブリッジC(R1)2を意味し、ここでのR1は、請求項1で定義した通りであり、好ましくはそれぞれ同じまたは異なり、特に好ましくは同じであり、H、F、1〜6の炭素原子を有する直鎖状アルキル基(好ましくはメチル基であり、ここでの1以上のHは、Fで置換されてよい)、ならびにフェニルおよびナフチル(好ましくはフェニルであり、それぞれが1つ以上のR2基、好ましくはメチル基で置換されてよいが、特に好ましくは非置換である)、ならびにこれらの構造の組み合わせであり、ここでの2つ以上の隣接する置換基R1は、互いに単環または多環の脂肪族または芳香環構造を形成してもよいことを特徴とする化合物。
【請求項5】
請求項1〜4のいずれか1項に記載の化合物であって、Ar1は、12〜30の芳香環原子を有する多環式芳香環構造、または10〜20の芳香族炭素原子を有する縮合型の芳香族炭化水素基を意味し、それぞれが1つ以上のR1基で置換されてよいことを特徴とする化合物。
【請求項6】
請求項1〜5のいずれか1項に記載の化合物であって、Ar1基が以下の式(3)〜(15)からなる群より選択されることを特徴とする化合物:
【化3−1】

【化3−2】

これらの基は、それぞれ1つ以上のR1基で置換されてよく、ここでのR1は上記で定義した通りであり、さらに、
Yは、Xと同じ意味を有し、好ましくは、それぞれ同じまたは異なり、C(R1)2、Si(R1)2、O、S、N(R1)、P(R1)からなる群より選択される2価のブリッジであり、特に好ましくは、C(R1)2、SおよびN(R1)からなる群より選択され;
pは、それぞれ同じまたは異なり、0または1であり、p = 0の場合、水素原子またはR1基がYの代わりに存在し;
qは0、1または2であり、好ましくは0または1であり;
記号「-----」は、式(3)〜(15)の基の炭素原子と式(1)に示した2つの窒素原子の1つとの間のそれぞれの単結合を意味し;X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【請求項7】
請求項1〜6のいずれか1項に記載の化合物であって、Ar1基が以下の式(16)〜(52)の基から選択されることを特徴とする化合物:
【化4−1】

【化4−2】

【化4−3】

【化4−4】

【化4−5】

【化4−6】

式中、YおよびR1は、請求項1および6で定義したとおりであり;
上記基のそれぞれは、さらに、各場合において、1つ以上のR1基で置換されてよく;
上記式における記号「-----」は、Ar1から式(1)に示した2つの窒素原子の1つへの各単結合を意味し;
X基がユニットAr1に結合する場合、好ましくは、窒素との結合に隣接する位置で結合する。
【請求項8】
請求項1〜7のいずれか1項に記載の化合物であって、請求項3に記載の式(2)の化合物から選択され、Ar1は、請求項7に記載の式(16)〜(52)の基を意味し、Xは、好ましくは同時にC(R1)2を意味することを特徴とする化合物。
【請求項9】
請求項1〜8のいずれか1項に記載の化合物であって、添え字m1〜m6に、以下に示す定義が適用されることを特徴とする化合物:
m1 = m6 = 1 および m2 = m3 = m4 = m5 = 0; または
m1 = m4 = 1 および m2 = m3 = m5 = m6 = 0; または
m1 = m2 = m4 = m5 = 1 および m3 = m6 = 0; または
m1 = m2 = m5 = m6 = 1 および m3 = m4 = 0; または
m1 = m2 = 1 および m3 = m4 = m5 = m6 = 0; または
m1 = 1 および m2 = m3 = m4 = m5 = m6 = 0; または
m2 = m3 = m4 = m5 = 1 および m1 = m6 = 0; または
m3 = m4 = 1 および m1 = m2 = m5 = m6 = 0。
【請求項10】
請求項1〜9のいずれか1項に記載の化合物を1つ以上含むオリゴマー、ポリマーまたはデンドリマーであって、1つ以上の置換基に対する1つ以上の結合が、前記オリゴマー、ポリマーまたはデンドリマーに対する結合に置き換えられるオリゴマー、ポリマーまたはデンドリマー。
【請求項11】
請求項1〜9のいずれか1項に記載の化合物の製造方法であって、以下のステップを含む方法:
a)適切に置換されたAr1基を、アリールアミンと結合させることと(前記アリールアミンは、オルト位において適切に置換され、アリール基がAr2基またはAr3基またはAr4基またはAr5基に対応する)、
b)前記アリールアミンのオルト位における置換基と前記Ar1基の閉環反応を行うこと。
【請求項12】
電子デバイスにおける請求項1〜10のいずれか1項に記載の化合物の使用であって、前記電子デバイスは、特に、有機集積回路(O-IC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光学検出器、有機感光体、有機電場消光素子(O-FQD)、発光電気化学電池(LEC)、有機レーザーダイオード(O-laser)および有機エレクトロルミネッセンス素子(OLED)からなる群より選択される使用。
【請求項13】
請求項1〜10のいずれか1項に記載の化合物を少なくとも1つ含む電子デバイスであって、特に、有機集積回路(O-IC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光学検出器、有機感光体、有機電場消光素子(O-FQD)、発光電気化学電池(LEC)、有機レーザーダイオード(O-laser)および有機エレクトロルミネッセンス素子(OLED)からなる群より選択される電子デバイス。
【請求項14】
請求項13に記載の有機エレクトロルミネッセンス素子であって、請求項1〜10のいずれか1項に記載の化合物が、正孔輸送層および/または正孔注入層における正孔輸送材料として使用されることを特徴とする有機エレクトロルミネッセンス素子。
【請求項15】
請求項13または14に記載の有機エレクトロルミネッセンス素子であって、請求項1〜10のいずれか1項に記載の化合物が、発光層における発光材料として、特にホスト材料と組み合わせて使用されることを特徴とする有機エレクトロルミネッセンス素子。
【図1】




【公表番号】特表2012−515732(P2012−515732A)
【公表日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2011−546613(P2011−546613)
【出願日】平成21年12月22日(2009.12.22)
【国際出願番号】PCT/EP2009/009219
【国際公開番号】WO2010/083871
【国際公開日】平成22年7月29日(2010.7.29)
【出願人】(597035528)メルク パテント ゲーエムベーハー (209)
【Fターム(参考)】
【公表日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願日】平成21年12月22日(2009.12.22)
【国際出願番号】PCT/EP2009/009219
【国際公開番号】WO2010/083871
【国際公開日】平成22年7月29日(2010.7.29)
【出願人】(597035528)メルク パテント ゲーエムベーハー (209)
【Fターム(参考)】
[ Back to top ]

