電気化学キャパシタ
【課題】高エネルギー密度化を達成でき、かつ長期安定性に優れた電気化学キャパシタを実現する。
【解決手段】本発明の電気化学キャパシタは、正極及び負極を備え、該正極及び負極間に非水系電解液が介在している電気化学キャパシタであって、非水系電解液は、ハロゲン化物を含有することを特徴としている。また、本発明の電気化学キャパシタは、正極及び負極からなる一対の電極を備え、該電極間に水系電解液が介在した電気化学キャパシタであって、上記水系電解液は、ヨウ化物塩を含む水溶液であることを特徴としている。
【解決手段】本発明の電気化学キャパシタは、正極及び負極を備え、該正極及び負極間に非水系電解液が介在している電気化学キャパシタであって、非水系電解液は、ハロゲン化物を含有することを特徴としている。また、本発明の電気化学キャパシタは、正極及び負極からなる一対の電極を備え、該電極間に水系電解液が介在した電気化学キャパシタであって、上記水系電解液は、ヨウ化物塩を含む水溶液であることを特徴としている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、電気化学キャパシタに関する。
【背景技術】
【0002】
電気化学キャパシタは、リチウムイオン二次電池と比較して、長寿命、高出力という点で優れた特徴を有している。さらに、電気自動車や自然エネルギー用途などといった蓄電デバイス市場の拡大から、電気化学キャパシタの要求性が高まっている。特に、電気化学キャパシタについて、従来よりも高いエネルギー密度が求められている。
【0003】
電気化学キャパシタにおけるエネルギー貯蔵メカニズムは、2つのメカニズムに区分される。すなわち、電極/電解液界面に形成される電気二重層に電荷を蓄積させるメカニズムと、少なくとも1つの電極が金属酸化物等からなり、この電極自体の酸化還元反応を利用して電荷を蓄積させるメカニズムとに区分される。前者のメカニズムとしては、電気二重層キャパシタが挙げられ、後者のメカニズムとしては、シュードキャパシタ、レドックスキャパシタが挙げられる。
【0004】
上記の高いエネルギー密度の付与は、前者のメカニズムにおいて、電気二重層の形成サイトをより効率的に増加させるために電極構造を最適化することで、高容量化を実現することができる。また、後者のメカニズムでは、キャパシタの性能を向上させるために、酸化還元反応の活性部分を増加させたり、新規の活物質材料を適用したりする等、数多くの方策がなされている。
【0005】
電気二重層キャパシタでは高比表面積を有する活性炭などを主成分とする分極性電極が用いられる。この分極性電極としては、従来、以下のものが用いられている。例えば、活性炭繊維に集電体を溶射或いは、蒸着法で密着させた電極、活性炭粉末にフッ素樹脂を少量混合して集電体にプレス成形した電極、活性炭粉末に少量のアセチレンブラック、接着剤と、揮発性の溶剤を混入して作製したペーストを集電体に圧着した後加熱、加圧してシート状にした電極等が挙げられる。
【0006】
上記電極と電解液界面に形成される電気二重層とに電荷を蓄積させるメカニズムを利用した、いわゆる電気二重層キャパシタを高容量するために、例えば、特許文献1に開示されているように、高比表面積を有する活性炭電極などの分極性電極が利用され、またその処理方法による高容量化が挙げられる。
【0007】
特許文献2に記載の電気二重層キャパシタ用活性炭電極は、石炭由来の活性炭を水蒸気賦活することにより、BET比表面積が1350m2/g以上の高比表面積を有している。
【0008】
また、特許文献3では、電気二重層キャパシタのエネルギー密度を向上させることが提案されている。その手法は、黒鉛類似の層状構造を持つ微結晶炭素を含有した炭素材料を賦活処理することで、その層間距離が黒鉛よりもやや長い0.343nm以下の構造を持つ微結晶炭素を含む電極を電気二重層キャパシタに用いるというものである。
【0009】
電極自身の酸化還元反応を利用するシュードキャパシタは、例えば、特許文献4および5に記載されているルテニウム酸化物などを用いることができ、当該ルテニウム酸化物などの形状として粒子状やシート状などが挙げられる。
【0010】
電気化学キャパシタに含まれる電解液には、水系および非水系の両者があり、電気化学キャパシタの用途に応じて選択されている。両者を比較すると、非水系電解液の方がエネルギー密度および温度特性(特に低温での温度特性)に優れ、より実用に供されている。上記水系電解液として、特許文献6,7の技術では、電解液として、硫酸、塩酸などを含む酸性の水溶液、中性塩を含む水溶液、水酸化ナトリウムなどの塩基性の水溶液が用いられている。一方、正極と負極との間に介在させる上記非水系電解液として、例えば、特許文献8には、プロピレンカーボネートまたはγ−ブチロラクトン等の非プロトン性有機溶媒に、テトラエチルアンモニウムテトラフルオロボレート、トリエチルメチルアンモニウムテトラフルオロボレートまたはテトラエチルホスホニウムテトラフルオロボレート等を溶解させた非水系有機溶液が挙げられている。また、電解液としてイオン液体を利用し高電圧化することで、エネルギー密度を向上させる技術も知られている。(特許文献8)
また、正極と負極との間に介在する電解液中にはセパレータが配置されている。このセパレータとしては、ガラス繊維不織布、ポリプロピレン不織布等が用いられている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2006−279003号公報(2006年10月12日公開)
【特許文献2】特開2001−319837号公報(2001年11月16日公開)
【特許文献3】特開2003−051430号公報(2003年 2月21日公開)
【特許文献4】特開2006−233232号公報(2006年 9月 7日公開)
【特許文献5】特開2004−315347号公報(2004年11月11日公開)
【特許文献6】特開平9−293649号公報 (1997年11月11日公開)
【特許文献7】特開2002−289477号公報(2002年10月 4日公開)
【特許文献8】特開2004−335875号公報(2004年11月25日公開)
【特許文献9】特開2006−236829号公報(2006年 9月 7日公開)
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかしながら、上述の従来の電気化学キャパシタについて高エネルギー密度化を実現する場合、電気二重層の形成サイトをより効率的に増加させる為に電極構造を最適化すると、電極構造の劣化が促進したり、体積当たりのエネルギー密度が低下したりする虞がある。また、電極自体の酸化還元反応を利用して電荷を蓄積させる電気化学キャパシタでは、コストや出力特性の点から実用化に至らないケースがほとんどであり、実用化されても特殊な用途に限られるのが現状である。また、電解液として有機溶液を用いた場合、水系溶液を用いた場合よりも安全性に劣る。また、電解液としてイオン液体を利用した場合、出力特性や長期安定性に問題が生じることがある。
【0013】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、高容量化及び高エネルギー密度化を達成でき、かつ長期安定性に優れた電気化学キャパシタを提供することにある。
【課題を解決するための手段】
【0014】
本発明者らは、上記の課題を解決するために鋭意検討した結果、ハロゲン化物を溶解させた非水系電解液および水系電解液を用い、ハロゲン化物のレドックス反応を利用した電解液の容量発現に成功し、上記電解液の容量発現を利用することにより、高容量化及び高エネルギー密度化を達成でき、かつ長期安定性に優れた電気化学キャパシタを実現できることを見出し、本発明を完成するに至った。
【0015】
すなわち、本発明の電気化学キャパシタの第1の構成は、上記の課題を解決するために、一対の電極を備え、該電極間に非水系電解液が介在した電気化学キャパシタであって、上記非水系電解液は、ハロゲン化物を含有することを特徴としている。
【0016】
また、本発明の電気化学キャパシタでは、上記ハロゲン化物は、臭化物またはヨウ化物であることが好ましい。
【0017】
また、本発明の電気化学キャパシタでは、上記非水系電解液は非水系媒体としてのイオン液体を含有することが好ましい、すなわち、上記ハロゲン化物の塩とイオン液体の混合電解液であることが好ましい。上記非水系電解液にイオン液体を含んでいるため、揮発性の低減による難燃性を備えている。
【0018】
また、本発明の電気化学キャパシタでは、上記ハロゲン化物は、上記イオン液体と同一のカチオンを有するハロゲン化塩であることが好ましい。上記非水系電解液に含まれるカチオンを共通化することにより、ハロゲン化物の溶解度を高めることができる。
【0019】
また、本発明の電気化学キャパシタでは、上記イオン液体は、1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMI−BF4)であることが好ましい。
【0020】
また、本発明の電気化学キャパシタでは、上記非水系電解液は、非水系媒体としての有機溶媒を含有することが好ましい。上記非水系電解液が非水系媒体としての有機溶媒を含有する、すなわち、有機溶媒にハロゲン化物の塩が溶解した非水系電解液であるため、高出力の電気化学キャパシタを実現することができる。
【0021】
また、本発明の電気化学キャパシタでは、上記有機溶媒は、プロピレンカーボネート(PC)であることが好ましい。
【0022】
また、本発明の電気化学キャパシタでは、上記一対の電極は、活性炭を含む分極性電極であることが好ましい。
【0023】
また、本発明の電気化学キャパシタでは、上記分極性電極のうち少なくとも正極は、ハロゲンを含む水溶液に浸漬する前処理が行われていることが好ましい。
【0024】
また、本発明の電気化学キャパシタでは、上記非水系電解液がリチウム塩を含有することが好ましい。
【0025】
また、本発明の電気化学キャパシタでは、上記リチウム塩は、ハロゲン化リチウムであることが好ましい。
【0026】
また、本発明の電気化学キャパシタでは、上記ハロゲン化リチウムが、臭化リチウムまたはヨウ化リチウムであることが好ましい。
【0027】
また、本発明の電気化学キャパシタでは、上記分極性電極のうち少なくとも負極は、ハードカーボンによって構成されていることが好ましい。
【0028】
また、本発明に係る電気化学キャパシタの第2の構成は、上記の課題を解決するために、正極及び負極からなる一対の電極を備え、該電極間に水系電解液が介在した電気化学キャパシタであって、上記水系電解液は、ヨウ化物塩を含む水溶液であることを特徴としている。また、上記正極は、ヨウ素を含む水溶液に浸漬する前処理が行われていることが好ましい。
【発明の効果】
【0029】
本発明に係る電気化学キャパシタの第1の構成は、以上のように、一対の電極を備え、該電極間に非水系電解液が介在した電気化学キャパシタであって、上記非水系電解液は、ハロゲン化物を含有する構成である。
【0030】
また、本発明に係る電気化学キャパシタの第2の構成は、以上のように、正極及び負極からなる一対の電極を備え、該電極間に水系電解液が介在した電気化学キャパシタであって、上記水系電解液は、ヨウ化物塩を含む水溶液であるとともに、上記正極は、ヨウ素を含む水溶液に浸漬する前処理が行われている構成である。
【0031】
それゆえ、上記非水系および水系電解液に含まれるハロゲンが酸化還元反応による擬似容量を発現し、高容量化及び高エネルギー密度化を達成できる。また、上記ハロゲンが電解液に含まれることから、長期安定性に優れた電気化学キャパシタを実現することができる。
【図面の簡単な説明】
【0032】
【図1】従来の電気二重層キャパシタの充放電カーブ(左側)と電気二重層キャパシタに本発明を適用したキャパシタの充放電カーブ(右側)とを模式的に示した模式図である。
【図2】実施例1,2及び比較例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、(a)はセル全体の電圧に基づく充放電カーブを示し、(b)は正極、負極各々の電位に基づく充放電カーブを示す。
【図3】実施例1,2及び比較例1の電気化学キャパシタセルについて、放電容量を測定した結果を示すグラフである。
【図4】実施例1及び比較例1の電気化学キャパシタセルについて、作動電圧2.0Vで15時間保持してリーク電流試験を実施し、両電気化学キャパシタセルでリーク電流の比較を行った結果を示すグラフである。
【図5】実施例1及び比較例1の電気化学キャパシタセルについて1,000サイクル充放電した場合の、セル当たりの放電容量、およびクーロン効率の変化を示すグラフであり、(a)はセル当たりの放電容量の変化を示し、(b)はクーロン効率の変化を示す。
【図6】実施例3及び4、実施例1、比較例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、(a)は実施例3及び実施例1、比較例1の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示し、(b)は実施例4の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示す。
【図7】実施例5及び比較例2の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、正極、負極各々の電位に基づく充放電カーブを示す。
【図8】実施例5及び比較例3の電気化学キャパシタセルについて、各放電電流密度にて放電した際の放電容量を測定した結果を示すグラフである。
【図9】実施例5及び比較例3の電気化学キャパシタセルについて5,000mA g−1の電流密度で100,000サイクル充放電した場合の、セル当たりの放電容量を示すグラフである。
【図10】電気二重層キャパシタに本発明を適用したキャパシタの充放電カーブを示した模式図である。
【図11】実施例1、6の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブの測定結果を示すグラフであり、(a)は実施例1、(b)は、実施例6に係るグラフである。
【図12】電気化学キャパシタセルの測定結果を示すグラフであり、(a)は、実施例1、(b)は、実施例6に係る測定結果を示すグラフである。
【図13】実施例7及び比較例4の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、(a)はセル全体の電圧に基づく充放電カーブを示し、(b)は正極、負極各々の電位に基づく充放電カーブを示す。
【図14】実施例7及び比較例4の電気化学キャパシタセルについて、1000mA g−1の電流密度で1,000サイクル充放電した場合の測定結果を示すグラフであり、(a)はセル当たりの放電容量の変化を示し、(b)はクーロン効率の変化を示す。
【図15】実施例6、8及び比較例5の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示すグラフである。
【発明を実施するための形態】
【0033】
〔実施の形態1〕
以下、本発明の実施の形態について、詳細に説明する。
【0034】
<1.電気化学キャパシタの概要>
本実施形態の電気化学キャパシタ(以下、本電気化学キャパシタと記す)は、互いに対向配置された一対の電極と、非水系電解液とを備えている。本発明の電気化学キャパシタにおいては、非水系電解液は、一対の電極間に介在している。また、本電気化学キャパシタは、セパレータを備えている。本発明の電気化学キャパシタがセパレータを備えた場合、電極はセパレータを介して対向配置される。
【0035】
<2.非水系電解液>
本電気化学キャパシタで用いられる非水系電解液は、電解質塩と、該電解質塩を溶解する非水系媒体とを含んでいる。また、電解質塩は、非水系電解液中でレドックス反応を起こし得る化合物(以下、レドックス反応種と記す)であり、具体的にはハロゲン化物である。本電気化学キャパシタでは、非水系電解液中に溶解あるいは混合させたハロゲン化物のレドックス反応を利用することで、高容量化及び高エネルギー密度化を実現している。
【0036】
<2−1.非水系媒体>
非水系媒体は、従来公知の電気化学キャパシタに用いられる非水系媒体であればよい。特に、非水系媒体は、イオン液体であることが好ましい。ここでいう「イオン液体」とは、室温でも液体で存在する塩を意味する。このイオン液体のカチオンとしては、例えば、イミダゾリウム、ピリジニウム、ピロリジニウム、ピペリジニウム、テトラアルキルアンモニウム、ピラゾリウム、又はホスホニウム等が挙げられる。
【0037】
前記イミダゾリウムとしては、例えば、1−エチル−3−メチルイミダゾリウム、1−ブチル−3−メチルイミダゾリウム、1−エチル−2,3−ジメチルイミダゾリウム、1−アリル−3−メチルイミダゾリウム、1−アリル−3−エチルイミダゾリウム、1−アリル−3−ブチルイミダゾリウム、1,3−ジアリルイミダゾリウム等が挙げられる。
【0038】
また、前記ピリジニウムとしては、例えば、1−プロピルピリジニウム、1−ブチルピリジニウム、1−エチル−3−(ヒドロキシメチル)ピリジニウム、1−エチル−3−メチルピリジニウム等が挙げられる。
【0039】
前記ピロリジニウムとしては、例えば、N−メチル−N−プロピルピロリジニウム、N−メチル−N−ブチルピロリジニウム、N−メチル−N−メトキシメチルピロリジニウム等が挙げられる。
【0040】
また、前記ピペリジニウムとしては、例えば、N−メチル−N−プロピルピペリジニウム等が挙げられる。
【0041】
また、前記テトラアルキルアンモニウムとしては、例えば、N,N,N−トリメチル−N−プロピルアンモニウム、メチルトリオクチルアンモニウム等が挙げられる。
【0042】
また、前記ピラゾリウムとしては、例えば、1−エチル−2,3,5−トリメチルピラゾリウム、1−プロピル−2,3,5−トリメチルピラゾリウム、1−ブチル−2,3,5−トリメチルピラゾリウム等が挙げられる。
【0043】
また、上記カチオンと組み合わされてイオン液体を構成するアニオンとしては、例えば、BF4−、NO3−、PF6−、SbF6−、CH3CH2OSO3−、CH3CO2−、(FSO2)2N−[ビス(フルオロスルフォニル)イミドアニオン]、又はフルオロアルキル基含有アニオン等が挙げられる。
【0044】
また、前記フルオロアルキル基含有アニオンとしては、例えば、CF3CO2−、パーフルオロアルキルスルホニル基含有アニオン等が挙げられる。
【0045】
また、前記パーフルオロアルキルスルホニル基含有アニオンとしては、例えば、CF3SO3−、(CF3SO2)2N−[ビス(トリフルオロメチルスルフォニル)イミド]、(CF3SO2)3C−等が挙げられる。
【0046】
前記イオン液体としては、これら各種アニオンの少なくとも1種とこれら各種カチオンの少なくとも1種とを組み合わせたものを採用することができる。なかでも、(1)蓄電デバイスにおける電気的特性がより優れたものとなりつつ該電気的特性の低下が抑制されるという点および(2)入手し易く電解液の有する電気的特性の低下が蓄電デバイスにおいてより抑制されるという点では、テトラフルオロボレート(BF4−)アニオンを含むイオン液体が好ましい。
【0047】
また、大気中での取り扱いが容易という点では、パーフルオロアルキルスルホニル基含有アニオンを含むイオン液体が好ましく、(FSO2)2N−[ビス(フルオロスルフォニル)イミドアニオン]を含むイオン液体がより好ましい。
【0048】
また、前記非水系電解液としては、比較的低粘度であり、イオン伝導性に優れ、電気化学的な安定性に優れるという点で、イミダゾリウムカチオン又はピロリジニウムカチオンを含むイオン液体が好ましい。
【0049】
具体的には、前記非水系電解液としては、アニオンとしてのビス(フルオロスルフォニル)イミドアニオン又はテトラフルオロボレートと、カチオンとしてのイミダゾリウムとの塩が好ましく、より具体的には、1−エチル−3−メチルイミダゾリウム ビス(フルオロスルフォニル)イミド、又は、1−エチル−3−メチルイミダゾリウム テトラフルオロボレートが好ましい。なお、前記イオン液体は、単独又は2種以上が組み合わされて用いられ得る。
【0050】
一方、非水系媒体は、「イオン液体」に限らず、電気化学キャパシタの非水系媒体に用いられる、有機系溶媒であってもよい。このような有機系溶媒として、具体的には、アセトニトリル、エチレンカーボネート、ジメチルカーボネート、ジエチルカーボネート、ジエチルエーテル、プロピレンカーボネート等を単一もしくは複数含む溶媒が挙げられる。これらの中でも、低粘度であり、イオン伝導性に優れ、電気化学的な安定性に優れる点で、プロピレンカーボネートが好ましい。
【0051】
<2−2.レドックス反応種としてのハロゲン化物>
本電気化学キャパシタでは、ハロゲン化物を上記非水系媒体に溶解させた非水系電解液を用いることにより、従来の電気化学キャパシタによる容量発現に加え、レドックス反応種としてのハロゲン化物が発現する擬似容量を利用して、高容量化及び高エネルギー密度化を実現している。
【0052】
従来、電気化学キャパシタを高容量化させるために、以下の方策が採られてきた。
【0053】
電気化学キャパシタが電気二重層キャパシタである場合、電極の細孔構造、電解液を最適化することで、電気化学キャパシタを高容量化させてきた。また、電気化学キャパシタがシュードキャパシタである場合、電極を構成する新規な金属酸化物あるいは導電性高分子を探索すること、および、金属酸化物あるいは導電性高分子の利用率を向上させることで、電気化学キャパシタを高容量化させてきた。すなわち、従来の電気化学キャパシタでは、電極の容量発現を最適化することで、高容量化してきた。
【0054】
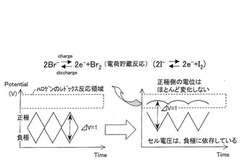
一方、本電気化学キャパシタは、電極ではなく、非水系電解液のレドックス反応による容量発現を利用して高容量化を実現しており、従来の電気化学キャパシタと電荷貯蔵メカニズムが異なる。以下、本電気化学キャパシタにおける電荷貯蔵メカニズムについて、図1を参照して説明する。図1は、従来の電気二重層キャパシタの充放電カーブ(左側)と電気二重層キャパシタに本発明を適用した本電気化学キャパシタの充放電カーブ(右側)とを模式的に示した模式図である。なお、図1では、ハロゲン化物を臭化物またはヨウ化物としている。
【0055】
従来の電気二重層キャパシタにおいて、正極、負極に用いている活物質は、電解液中において、所定の電位を有している。そして、充電することにより、正極表面にはアニオンが電気二重層を形成し正極電位は上昇する。一方、負極表面にはカチオンが電気二重層を形成し負極電位が下降する。逆に、放電時には、正極からアニオンが放出され、負極からはカチオンが放出される。その結果、放電時には、正極電位は下降し、負極電位は上昇することになる。すなわち、従来の電気二重層キャパシタでは、正極および負極が同一の場合、各電極が示す充放電カーブは、図1の左側に示されるように、所定の電位を境に線対称になっており、正極の電位変化量と負極の電位変化量とがほぼ同じになっている(電気二重層応答)。
【0056】
一方、本電気化学キャパシタでは、非水系電解液中にハロゲン化物イオンが溶解しているため、充電過程においては正極の細孔内にハロゲン化物が過剰となり、ある電位に達することで、ハロゲン化物の酸化体が生成する。その結果、正極が示す電位はハロゲン化物イオンとその酸化体との平衡反応により、高電位側への電位のシフトが起こる。また、この電位において、ハロゲン化物の酸化反応が起こり、電荷が貯蔵される(電荷貯蔵反応)。上記ハロゲン化物とはBr−もしくはI−であり、ハロゲン化物の酸化体とはBr−もしくはI−よりも高い酸化数を有するハロゲン誘導体である。その結果、図1の右側の充放電カーブに示されるように、正極電位は、ハロゲンのレドックス反応を起こす電位領域内でほとんど変化しない(レドックス反応応答)。このため、本電気化学キャパシタの電圧は、負極電位の変化のみに依存することになる。それゆえ、本電気化学キャパシタは、従来の電気二重層キャパシタよりも、充放電時間が大幅に長くなり、容量が高くなる。
【0057】
上述のように、本電気化学キャパシタは、電解液に含まれるハロゲン化物のレドックス反応を利用した電荷貯蔵メカニズムになっており、このメカニズムは、電解液の容量発現を利用したメカニズムであるといえる。しかしながら、このように電解液の容量発現を利用したメカニズムは、電極側の容量発現を最適化する従来のメカニズムと異なり、レドックス反応種が電解液中を拡散することにより、貯蔵された電荷を失うおそれがある(シャトル効果)。このシャトル効果は、電気化学キャパシタにおいてリーク電流として観察される。本電気化学キャパシタは、後述の実施例に示されるように、リーク電流を抑えることができ、レドックス反応種の電解液中の拡散を抑制している(図4)。
【0058】
ハロゲン化物は、上述の非水系媒体に溶解可能であり、かつ溶解したときにアニオン種としてハロゲン化物イオンが存在する化合物であればよい。すなわち、ハロゲン化物イオンを含む塩であればよく、カチオンの種類は、特に限定されない。ハロゲン化物は、臭化物またはヨウ化物であることが好ましい。カチオンの例として、イミダゾリウム、ピリジニウム、ピロリジニウム、ピペリジニウム、テトラアルキルアンモニウム、ピラゾリウム、又はホスホニウム等が挙げられる。
【0059】
前記イミダゾリウムとしては、例えば、1−エチル−3−メチルイミダゾリウム、1−ブチル−3−メチルイミダゾリウム、1−エチル−2,3−ジメチルイミダゾリウム、1−アリル−3−メチルイミダゾリウム、1−アリル−3−エチルイミダゾリウム、1−アリル−3−ブチルイミダゾリウム、1,3−ジアリルイミダゾリウム等が挙げられる。
【0060】
また、前記ピリジニウムとしては、例えば、1−プロピルピリジニウム、1−ブチルピリジニウム、1−エチル−3−(ヒドロキシメチル)ピリジニウム、1−エチル−3−メチルピリジニウム等が挙げられる。
【0061】
前記ピロリジニウムとしては、例えば、N−メチル−N−プロピルピロリジニウム、N−メチル−N−ブチルピロリジニウム、N−メチル−N−メトキシメチルピロリジニウム等が挙げられる。
【0062】
また、前記ピペリジニウムとしては、例えば、N−メチル−N−プロピルピペリジニウム等が挙げられる。
【0063】
また、前記テトラアルキルアンモニウムとしては、例えば、N,N,N−トリメチル−N−プロピルアンモニウム、メチルトリオクチルアンモニウム等が挙げられる。
【0064】
また、前記ピラゾリウムとしては、例えば、1−エチル−2,3,5−トリメチルピラゾリウム、1−プロピル−2,3,5−トリメチルピラゾリウム、1−ブチル−2,3,5−トリメチルピラゾリウム等が挙げられる。また、非水系電解液が非水系媒体としてイオン液体を含む場合、ハロゲン化物のカチオン種は、イオン液体と同一であることが好ましい。例えば、非水系電解液の非水系媒体が1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMI−BF4)である場合、ハロゲン化物は、EMIのハロゲン化塩であることがより好ましく、例えば、1−エチル−3−メチルイミダゾリウムブロマイド(EMIBr)、1−エチル−3−メチルイミダゾリウムヨウシド(EMII)等が挙げられる。
【0065】
また、非水系媒体が有機溶媒である場合、上記カチオンを含むハロゲン化物に加え、ハロゲン化物として、臭化トリエチルメチルアンモニウム、臭化テトラエチルアンモニウム、ヨウ化トリエチルメチルアンモニウム,ヨウ化テトラエチルアンモニウム等を用いることができる。有機溶媒への溶解度が高い点から、EMIのハロゲン化物塩が好ましい。
【0066】
非水系電解液におけるハロゲン化物の濃度は、非水系媒体およびハロゲン化物の種類によって異なるが、概して、0.3mol dm−3以上、2.5mol dm−3以下とすることができ、好ましくは、0.8mol dm−3以上、1.5mol dm−3以下とすることができる。ハロゲン化物の濃度が上記範囲であることにより、電気化学キャパシタの正極におけるレドックス反応を好適に発現させることができる。
【0067】
上述したように、本電気化学キャパシタではレドックス反応応答が発現するため、容量が高いものである。ここで、本電気化学キャパシタの電圧は、負極電位の変化に依存するため、負極電位の改良について本発明者らは鋭意検討を行い、非水系電解液に、ハロゲン化物イオンおよびリチウムイオンを溶解させることを見出した。非水系電解液中においてリチウムイオンが存在することによって、ハロゲン化物イオンが安定して存在し、レドックス反応において電極からより離れ難いと考えられる。
【0068】
図10は、本発明に係る電気化学キャパシタにおいて、非水系電解液中にリチウムイオン電池負極を含まないEMIBr/EMI−BF4の系(実線)と、非水系電解液中にリチウムイオン電池負極を含むLiBr/EMI−BF4の系(破線)の充放電カーブを示した模式図である。
【0069】
EMIBr/EMI−BF4の系(実線)では、正極および負極に活性炭を用いている。同図に示すように、正極ではハロゲンのレドックス反応が生じており、負極では、二重層応答が生じ、従来の電気二重層キャパシタ(ハロゲンを含んでいないもの)よりも容量は増加する。しかしながら、負極電位が直線状の傾きを有しており、負極の容量が小さい。また、更なるエネルギー密度を拡大させるため作動電圧を大きくした場合、負極の周囲の電解液が分解するため作動電圧を拡大できない。つまり、比表面積が大きい活性炭を用いているため、電解液の還元分解反応が起こり易い。
【0070】
一方、LiBr/EMI−BF4の系(破線)では、非水系電解液にハロゲン化物イオンおよびリチウムイオンが存在している。したがって、正極でハロゲンのレドックス反応が生じ、負極ではリチウムの挿入および脱離反応(電池の充放電メカニズム)が生じ、電気化学キャパシタの容量が増加する。また、リチウムイオンの存在により、負極電位の電気二重層の形が変化し、分解反応が起こり難くなると考えられる。このため、分解反応が起こり易い負極(比表面積の高い負極)を使用したとしても、負極による作動電圧が拡大し難い作用を上回って、作動電圧を拡大することが可能となる。
【0071】
このようなリチウムイオンの効果に加えて、LiBr/EMI−BF4の系では正極に活性炭を、負極にハードカーボンを用いている。ハードカーボンの負極は、比表面積が活性炭と比較し小さいため、電解液の分解反応が起こり難く(分解が起こった場合でもリチウムイオン電池負極で生じる固体電解質界面(SEI)の形成程度)、負極による作動電圧が拡大し難い作用を抑えて、作動電圧を拡大することができる。すなわち、図10に示すように、負極電位は緩やかに減少し、その後、緩やかに増大することとなる。
【0072】
具体的な値で比較すると、「EMIBr/EMI−BF4の系」の場合、従来技術に比較して2倍ほどの容量であり、「LiBr/EMI−BF4の系」の場合、従来技術の2倍〜3.6倍(2V〜3.6V)程度の容量となる。この容量の増大は、驚くべき飛躍であるといえる。
【0073】
上記の効果に加えて、リチウムイオンが存在することにより、負極におけるハロゲン化物イオンの分離反応が生じ難くなるため、実施例に基づき後述するように(図12)、高い作動電圧であっても、クーロン効率が高い電気化学キャパシタを実現できる。
【0074】
本発明に係る非水系電解液はハロゲン化物を必須に含有するものであるため、本発明に係るリチウム塩としては、ハロゲンを含まないリチウム塩であってもハロゲンを含むハロゲン化リチウムであっても使用することができる。ハロゲンを含まないリチウム塩を使用する場合、上述したハロゲン化物と併用すればよい。
【0075】
一方、ハロゲン化リチウムを使用する場合、上述したハロゲン化物と併用することも可能である。また、ハロゲン化物を使用せず、ハロゲン化リチウムを非水系電解質に含有させて用いることもできる。このため、非水系電解質を簡便に調製する観点から、ハロゲン化リチウムを用いることが好ましい。
【0076】
リチウム塩の具体例としては、ハロゲンを含まないリチウム塩として、六フッ化リン酸リチウム(LiPF6)、四フッ化ホウ素リチウム(LiBF4)、過塩素酸リチウム(LiClO4)、ビスペンタフルオロエタンスルホン酸イミド(LiBETI)、リチウムビス(トリフルオロメタンスルホニル)イミド(LiTFSI)などを挙げることができる。一方、ハロゲン化リチウムとして、臭化リチウム、ヨウ化リチウムなどを挙げることができる。
【0077】
非水系電解液におけるリチウム塩(ハロゲン化リチウム)の濃度は、非水系媒体、リチウム塩の種類によって異なるが、概して、0.3mol dm−3以上、2.0mol dm−3以下とすることができ、好ましくは、0.8mol dm−3以上、1.2mol dm−3以下とすることができる。リチウム塩の濃度が上記範囲であることにより、電気化学キャパシタの負極電位の平坦性を好適に発現させることができる。
【0078】
<3.電極>
本電気化学キャパシタは、互いに対向配置された一対の電極を備え、この電極間に非水系電解液が介在する構成になっている。
【0079】
電極は、本電気化学キャパシタがキャパシタとして動作し得るものであれば、特に限定されない。例えば、本電気化学キャパシタが電気二重層キャパシタである場合、電極としては、通常、高比表面積を有する分極性電極(正極及び負極)を用いる。このような分極性電極の材料としては、例えば活性炭が挙げられる。上記活性炭は形状を限定せず、粒子状もしくは繊維布状等を用いることができる。また、上記活性炭以外の非多孔性炭素であるカーボンナノチューブ、カーボンナノホーン、フラーレン、グラフェン、ケッチェンブラック、カーボンナノファイバー、ハードカーボン等の材料を電極として用いることができる。
【0080】
ハードカーボン電極としては、公知の構成を採用でき、例えば、ハードカーボン、導電助剤、結着剤および増粘剤から構成できる。導電助剤としては、カーボンブラック、アセチレンブラック、ケッチェンブラック等の炭素類、黒鉛、金属類を例示できる。また、結着剤としては、ポリフッ化ビニリデン、スチレンブタジエンゴム、ポリテトラフルオロエチレンなどのポリマーを例示でき、増粘剤としては、カルボキシメチルセルロース、エチレングリコールなどを例示できる。本発明に係る電気化学キャパシタでは、分極性電極のうち少なくとも負極は、ハードカーボンによって構成されていてもよい。具体的には、正極に活性炭、負極にハードカーボンを適用することができ、当該正極および負極は、リチウム塩を用いた電気化学キャパシタにおいて好適に適用される。
【0081】
また、炭素以外にも、電極材料として、金属酸化物もしくは金属、導電性高分子等に加えて、これらの複合材料を挙げることができる。
【0082】
また、電極は、ハロゲンを含む水溶液に浸漬する前処理が行われていてもよい。前処理するための水溶液は、ハロゲンを含む水溶液であれば、特に限定されない。具体的には、臭素水、ヨウ素を含む水溶液等が挙げられる。なお、ヨウ素を含む水溶液には、ヨウ素の他にヨウ化物塩が含まれていてもよい。
【0083】
以上のように、本電気化学キャパシタでは、電解液としてハロゲン化物を溶解した非水系電解液を用いることにより、大幅なエネルギー密度の向上を実現することができる。そして、本電気化学キャパシタが電気二重層キャパシタである場合、電気二重層キャパシタの搭載先として考えられる電気自動車、家電製品、自然エネルギー蓄電システム等に適用することができる。そして、これらに適用した場合、体積あたりのエネルギー密度を大幅に向上することができるため、高性能かつコンパクトな蓄電デバイスを提供することができる。
【0084】
また、本電気化学キャパシタの電荷貯蔵メカニズムは、従来と全く異なるため、このシステムは、リチウムイオン二次電池の正極や色素増感型太陽電池とキャパシタとを組み合わせた光キャパシタ等に適用することができる。よって、本電気化学キャパシタの電極として、電気二重層キャパシタ、シュードキャパシタ、リチウムイオン二次電池の正極、光キャパシタ等に用いられる電極を用いることができる。
【0085】
〔実施の形態2〕
本発明の他の実施形態について説明すると以下の通りである。
【0086】
本実施形態の電気化学キャパシタ(以下、本電気化学キャパシタと記す)は、互いに対向配置され、正極及び負極からなる一対の電極と、ヨウ化物塩を含む水系電解液とを備えている。本発明の電気化学キャパシタにおいては、水系電解液は、一対の電極間に介在している。また、本電気化学キャパシタは、セパレータを備えている。本電気化学キャパシタがセパレータを備えた場合、電極はセパレータを介して対向配置される。
【0087】
本電気化学キャパシタによれば、正極は、ヨウ素を含む水溶液に浸漬する前処理が行われており、かつヨウ化物塩を含む水系電解液は、一対の電極間に介在している。このため、正極の細孔内において、電解液に存在するヨウ化物イオン(I−)(還元体)と前処理にて供給されたI−より高い酸化数を有するヨウ化物(酸化体)の平衡反応により、正極電位の高電位側へのシフトが起こり、充放電時において、この電位でハロゲン化物のレドックス反応が起きる(電荷貯蔵反応)。その結果、上記実施の形態1にて説明した図1の右側の充放電カーブと同様に、正極電位は、ハロゲンのレドックス反応を起こす電位領域内でほとんど変化しない(レドックス反応応答)。このため、本電気化学キャパシタの電圧は、負極電位の変化に依存することになる。それゆえ、本電気化学キャパシタは、従来の電気二重層キャパシタよりも、充放電時間が大幅に長くなり、容量が高くなる。
【0088】
本電気化学キャパシタに適用される水系電解液は、ヨウ化物塩を含有する水溶液であれば、特に限定されない。また、ヨウ化物イオンと組み合わされてヨウ化物塩を構成するカチオン種としては、例えば、ナトリウムイオン、カリウムイオン、セシウムイオン等が好ましく、ナトリウムイオン、カリウムイオンがより好ましい。
【0089】
本電気化学キャパシタに適用可能な「ヨウ化物塩」としては、上述したカチオン種とヨウ化物イオンとの組み合わせからなる塩であることが好ましい。中でも特に好ましい具体例を挙げると、ヨウ化カリウム(KI)、ヨウ化ナトリウム(NaI)等が挙げられる。
【0090】
水系電解液におけるヨウ化物塩の濃度は、水系媒体の種類によって異なるが、概して、0.3mol dm−3以上、3.0mol dm−3以下とすることができ、好ましくは、0.8mol dm−3以上、1.0mol dm−3以下とすることができる。ヨウ化物塩の濃度が上記範囲であることにより、電気化学キャパシタの正極におけるレドックス反応を好適に発現させることができる。
【0091】
また、本電気化学キャパシタにおける電極の構成材料は、上記実施の形態1と同様であるので、説明を省略する。本電気化学キャパシタにおいては、一対の電極のうち正極は、ヨウ素を含む水溶液に浸漬する前処理が行われている。ヨウ素を含む水溶液には、ヨウ素の他にヨウ化物塩が含まれていてもよい。
【0092】
本発明は上述した実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、それぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【0093】
以下、実施例を示し、本発明の実施の形態についてさらに詳しく説明する。もちろん、本発明は以下の実施例に限定されるものではなく、細部については様々な態様が可能であることはいうまでもない。
【実施例】
【0094】
以下の実施例1、2、及び比較例1では、以下の評価用電気化学キャパシタセルを使用した。
【0095】
セル:テフロン(登録商標)製スクリュー型セル
電極:活性炭繊維布(ACF)〔ACC−5092−20(日本カイノール株式会社製〕直径10mm
集電板:白金板〔株式会社ニラコ社製〕直径11mm
セパレータ:ガラス製ろ紙〔GB−100R(東洋濾紙株式会社製)〕直径13mm
擬似参照極:白金線〔株式会社ニラコ社製〕。
【0096】
〔実施例1〕
非水系媒体として、イオン液体である1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMIBF4:東洋合成工業株式会社製)を用いた。また、臭化物塩として、1−エチル−3−メチルイミダゾリウムブロマイド(EMIBr:和光純薬工業株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、EMIBrを、1.0mol dm−3の濃度になるようにEMIBF4に溶解させて、非水系電解液である1.0mol dm−3EMIBr/EMIBF4を調製した。
【0097】
次に、電気化学キャパシタセルを作製した。具体的には、調製した1.0mol dm−3EMIBr/EMIBF4をサンプル管に注ぎ、該サンプル管に2枚のセパレータと2枚の電極(重量を測定済)とを入れた。その後、セパレータ及び電極の両者に非水系電解液を十分に含浸させるため、これらを減圧装置内にて、30分間、10−1Paに保った。その後、テフロン(登録商標)製試験セルに、白金板|電極|セパレータ|参照極|セパレータ|電極|白金板となるように配置し、電気化学キャパシタセルを作製した。なお、上記白金板にはリードとして白金線が溶接されている。また、作製したセルは、密閉容器に入れられ、密閉することで空気中の水分を遮断し、かつ不活性雰囲気を維持した状態になっている。なお、全ての作業は、アルゴン雰囲気のグローブボックス内で行われた。
【0098】
〔実施例2〕
非水系媒体として、イオン液体である1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMIBF4:東洋合成工業株式会社製)を用いた。また、ヨウ化物塩として、1−エチル−3−メチルイミダゾリウムヨージド(EMII:和光純薬工業株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、EMIIを、1.0mol dm−3の濃度になるようにEMIBF4に溶解させて、非水系電解液である1.0mol dm−3EMII/EMIBF4を調製した。
【0099】
次に、電気化学キャパシタセルを作製した。具体的には、調製した1.0moldm−3EMII/EMIBF4をサンプル管に注ぎ、該サンプル管に2枚のセパレータと2枚の電極(重量を測定済)とを入れた。その後、セパレータ及び電極の両者に非水系電解液を十分に含浸させるため、これらを減圧装置内にて30分間、10−1Paに保った。その後、テフロン(登録商標)製試験セルに、白金板|電極|セパレータ|参照極|セパレータ|電極|白金板となるように配置し、電気化学キャパシタセルを作製した。なお、上記白金板にはリードとして白金線が溶接されている。また、作製したセルは、密閉容器に入れられ、密閉することで空気中の水分を遮断し、かつ不活性雰囲気を維持した状態になっている。なお、全ての作業は、アルゴン雰囲気のグローブボックス内で行われた。
【0100】
〔比較例1〕
比較例1では、イオン液体である1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMIBF4:東洋合成工業株式会社製)を、非水系電解液として用いて、電気化学キャパシタセルを作製した。
【0101】
具体的には、EMIBF4をサンプル管に注ぎ、該サンプル管に2枚のセパレータと2枚の電極(重量を測定済)とを入れた。その後、セパレータ及び電極の両者に非水系電解液を十分に含浸させるため、上記試験セルを減圧装置内にて、30分間、10−1Paに保った。その後、テフロン(登録商標)製試験セルに、白金板|電極|セパレータ|参照極|セパレータ|電極|白金板となるように配置し、電気化学キャパシタセルを作製した。なお、上記白金板にはリードとして白金線が溶接されている。また、作製したセルは、密閉容器に入れられ、密閉することで空気中の水分を遮断し、かつ不活性雰囲気を維持した状態になっている。なお、全ての作業は、アルゴン雰囲気のグローブボックス内で行われた。
【0102】
実施例1,2及び比較例1それぞれで作製した電気化学キャパシタセルについて、キャパシタ性能を調べた。
【0103】
まず、実施例1,2及び比較例1の電気化学キャパシタセルについて、充放電カーブを測定した。具体的には、各電気化学キャパシタセルについて、作動電圧2Vで、100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図2は、実施例1,2及び比較例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、図2(a)はセル全体の電圧に基づく充放電カーブを示し、図2(b)は正極、負極各々の電位に基づく充放電カーブを示す。
【0104】
図2(a)に示されるように、実施例1及び2の電気化学キャパシタセルは、典型的な電気化学キャパシタの充放電カーブを示した。加えて、両者とも比較例1の電気化学キャパシタセルと比較して、充放電時間が大幅に増加した。
【0105】
図2(b)に示されるように、非水系電解液がEMIBr/EMIBF4である実施例1の電気化学キャパシタセルでは、正極電位について、充電における初期段階及び放電における末期段階で、電気二重層応答が見られた。すなわち、充電における初期段階で正極電位の上昇が見られ、放電における末期段階で正極電位の下降が見られた。また、充電における初期段階及び放電における末期段階以外の期間では、正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。また、非水系電解液がEMII/EMIBF4である実施例2の電気化学キャパシタセルでは、充電の初期段階から正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。一方、非水系電解液がEMIBF4のみである比較例1の電気化学キャパシタセルでは、充電及び放電過程において、正極電位がそれぞれ上昇及び下降する典型的な電気二重層応答が見られた。よって、図2(a)及び(b)の結果から、レドックス反応種を含む非水系電解液を用いることで容量が大幅に増加することがわかった。
【0106】
次に、実施例1,2及び比較例1の電気化学キャパシタセルについて、放電容量を測定した。図3に、放電容量の測定結果を示す。図3に示されるように、実施例2の電気化学キャパシタセルは、実施例1の電気化学キャパシタセルよりも放電容量が増加していた。I−のレドックス反応は、Br−よりも低い反応電位で始まる。このため、非水系電解液がEMII/EMIBF4である実施例2の電気化学キャパシタセルは、EMIBr/EMIBF4である実施例1の電気化学キャパシタセルよりも、充電初期からハロゲンのレドックス反応を伴うため、結果、高い放電容量が得られたと考えられる。
【0107】
また、実施例2の電気化学キャパシタセルは、比較例1の電気化学キャパシタセルと比較すると、電流密度100mA g−1において、放電容量が2.5倍高くなっていた。また、実施例1の電気化学キャパシタセルは、比較例1の電気化学キャパシタセルよりも同電流密度において、放電容量が2倍に増加していた。
【0108】
次に、実施例1の電気化学キャパシタセルについて、レドックス反応種(臭化物)の正極から電解液あるいは負極への拡散が抑制されるか否かを確認した。具体的には、実施例1及び比較例1の電気化学キャパシタセルについて、作動電圧2.0Vで15時間保持してリーク電流試験を実施し、両電気化学キャパシタセルでリーク電流の比較を行った。結果を図4に示す。
【0109】
図4に示されるように、実施例1の電気化学キャパシタセルは、試験開始後の4時間まで、比較例1の電気化学キャパシタセルよりも応答電流(リーク電流)が大きくなっていた。これは、実施例1の電気化学キャパシタセルにおける未充電部分の影響であると考えられる。また、試験開始4時間後以降では、リーク電流は、実施例1及び比較例1の電気化学キャパシタセルでほぼ同じであった。図4の結果から、実施例1の電気化学キャパシタセルでは、レドックス反応種の拡散が抑制されていることが確認された。
【0110】
次に、実施例1及び比較例1の電気化学キャパシタセルについて、0.5〜2.0Vの作動電圧範囲で、500mA g−1の電流密度で1,000サイクル充放電し、各サイクルにおけるセル当たりの放電容量、およびクーロン効率の変化を調べた。図5は、実施例1及び比較例1の電気化学キャパシタセルについて1,000サイクル充放電した場合の、セル当たりの放電容量、およびクーロン効率の変化を示すグラフである。また、図5(a)はセル当たりの放電容量の変化を示し、図5(b)はクーロン効率の変化を示す。なお、クーロン効率は、「(放電時間/充電時間)×100」で算出される効率である。
【0111】
図5(a)及び(b)に示されるように、実施例1の電気化学キャパシタセルは、1,000サイクルを経ても、放電容量の低下が見られず、クーロン効率もほぼ100%に維持されていた。このことから、実施例1の電気化学キャパシタセルは、安定なサイクル特性を示すことがわかる。
【0112】
〔実施例3〕
2枚の活性炭繊維布電極のうち、正極として利用するものを臭素水(1wt%;関東化学株式会社製)に浸漬させた。浸漬後、上記電極について、余分な臭素水を蒸留水で洗い流し、必要に応じて5〜10分程度の超音波洗浄を行った。そして、洗浄した2枚の電極を100℃にて1〜2日間減圧乾燥(10−1Pa)し、臭素水で前処理した正極を得た。
【0113】
臭素水で前処理した正極を用いて、実施例1と同様の方法で電気化学キャパシタセルを作製した。なお、正極の前処理以外は実施例1と同様であるため説明を省略する。
【0114】
〔実施例4〕
実施例3と同様の方法で、臭素水で前処理した正極を得た。
【0115】
また、非水系媒体として、有機溶媒であるプロピレンカーボネート(PC)を用いた。また、臭化物として、1−エチル−3−メチルイミダゾリウムブロマイド(EMIBr:和光純薬工業株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、EMIBrを、1.0mol dm−3の濃度になるようにPCに溶解させて、非水系電解液である1.0mol dm−3EMIBr/PCを調製した。
【0116】
非水系電解液として1.0mol dm−3EMIBr/PCを用いて、実施例3と同様の方法で電気化学キャパシタセルを作製した。
【0117】
実施例3及び4それぞれで作製した電気化学キャパシタセルについて、キャパシタ性能を調べた。
【0118】
まず、実施例3及び4の電気化学キャパシタセルについて、充放電カーブを測定した。具体的には、各電気化学キャパシタセルについて、5mA cm−2の電流密度で充放電を行ったときの充放電カーブを測定した。図6は、実施例3及び4、実施例1、比較例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフである。図6(a)は実施例3及び実施例1、比較例1の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示し、図6(b)は実施例4の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示す。
【0119】
図6(a)に示されるように、非水系電解液がEMIBr/EMIBF4であり、かつ電極が臭素水で前処理された実施例3の電気化学キャパシタセルでは、正極電位の停滞が観側された。すなわち、正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。加えて、正極の前処理を行っていない系(実施例1)と比較すると、正極電位の停滞範囲が広く、安定している。一方、実施例3の電気化学キャパシタは、比較例1の電気化学キャパシタと比較して、高容量である(充放電にかかる時間が長い)ことが明らかとなった。このことから、電極が臭素水で前処理された電極は、高容量化、正極電位の安定化という観点で、効果が非常に高いといえる。
【0120】
また、図6(b)に示されるように、非水系電解液がEMIBr/PCであり、かつ電極が臭素水で前処理された実施例4の電気化学キャパシタセルにおいても、実施例3と同様に、正極電位の停滞が観側された。つまり、非水系媒体はイオン液体及び有機溶媒にかかわらず、両者の非水系電解液に対して、正極の臭素水による前処理は正極電位の停滞に効果的である。
【0121】
以下の実施例5及び比較例2、3では、以下の実験器具を使用した。
【0122】
セル:テフロン(登録商標)製スクリュー型セル
電極:活性炭繊維布(ACF)〔ACC−5092−20(日本カイノール株式会社製〕直径10mm
集電板:白金板〔株式会社ニラコ社製〕直径11mm
セパレータ:ガラス製ろ紙〔GB−100R(東洋濾紙株式会社製)〕直径13mm
参照極:Ag/AgCl参照極〔北斗電工株式会社製〕。
【0123】
〔実施例5〕
ヨウ素を、1wt%の濃度になるように3.5mol dm−3ヨウ化ナトリウム(NaI)水溶液に溶解させて、ヨウ素水を調製した。
【0124】
作製したヨウ素水をサンプル管に入れ、正極に用いるACFを入れた。また、別のサンプル管に3.5mol dm−3NaI水溶液(電解液)を入れ、負極に用いるACF及びセパレータを入れた。正極、負極、及びセパレータに電解液を十分に含浸させるために、これらをバキュームオーブン中に入れ、30分間、減圧20kPaに保った。その後、テフロン(登録商標)製試験セルに白金板と白金線とスペーサーとをつなげ,上記正極及び上記負極を向かい合わせに並べ、その間にセパレータを挟み込むことで電気化学キャパシタセルを作製した。
【0125】
次に、組み立てた電気化学キャパシタセルを50mlビーカーに入れ、そこに電解液を加えて、電気化学キャパシタセルを電解液に浸した。それを、もう一度20kPaの下で30分間減圧含浸を行った。その後、電気化学特性を評価した。
【0126】
〔比較例2〕
電解液である3.5mol dm−3 臭化ナトリウム(NaBr)水溶液をサンプル管に入れ、その中に2枚の電極と1枚のセパレータとを入れた。その後、電極及びセパレータに電解液を十分に含浸させるため、それらをバキュームオーブン中に入れ,30分間、減圧20kPaに保った。その後、白金集電板を含むテフロン(登録商標)製試験セルに上記2枚の電極とセパレータとを挟み込むことで電気化学キャパシタセルを作製した。そして、組み立てた電気化学キャパシタセルを50mlビーカーに入れ、そこに電解液を加え、電気化学キャパシタセルを電解液に浸した。それを、もう一度20kPaの下で30分間減圧含浸を行った。その後、電気化学特性を評価した。
【0127】
〔比較例3〕
電解液である1.75mol dm−3硫酸水溶液をサンプル管に入れ、その中に2枚の電極と1枚のセパレータとを入れた。その後、電極及びセパレータに電解液を十分に含浸させるため、それらをバキュームオーブン中に入れ,30分間、減圧20kPaに保った。その後、白金集電板を含むテフロン(登録商標)製試験セルに上記2枚の電極とセパレータとを挟み込むことで電気化学キャパシタセルを作製した。そして、組み立てた電気化学キャパシタセルを50mlビーカーに入れ、そこに電解液を加え、電気化学キャパシタセルを電解液に浸した。それを、もう一度20kPaの下で30分間減圧含浸を行った。その後、電気化学特性を評価した。
【0128】
実施例5及び比較例2,3のそれぞれで作製した電気化学キャパシタセルについて、キャパシタ性能を調べた。
【0129】
まず、実施例5及び比較例2の電気化学キャパシタセルについて、充放電カーブを測定した。具体的には、実施例5の電気化学キャパシタセルについて、0.5〜1.0Vの作動電圧範囲で、100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。また、比較例3の電気化学キャパシタセルについては、0〜1.0Vの作動電圧範囲で、100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図7は、実施例5及び比較例2の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、正極、負極各々の電位に基づく充放電カーブを示す。なお、図7において、実線は実施例5の電気化学キャパシタセルを示し、点線は比較例2の電気化学キャパシタセルを示す。
【0130】
図7に示されるように、電極がヨウ素水で前処理された実施例5の電気化学キャパシタセルでは、正極電位の停滞が観側された。すなわち、ヨウ素化物のレドックス応答により、正極電位がほぼ一定(平坦)であった。一方、比較例2の電気化学キャパシタセルでは、正極において、時間とともに正極電位が変化する典型的な電気二重層応答が見られた。加えて、実施例5の電気化学キャパシタの充電前正極電位は、比較例2の充電前正極電位よりも高電位であった。よって、実施例5の電気化学キャパシタは、セル電圧変位が小さいにもかかわらず比較例2の電気化学キャパシタと同程度の充放電時間を示すことから、高容量であることが明らかとなった。
【0131】
これらの結果から、電解液が水系・非水系に関わらず、ハロゲンを含む水溶液で電極を浸漬する前処理を行い、ハロゲン化物を含む電解液を使用することで、キャパシタの高容量化、正極電位の維持を実現できることがわかった。
【0132】
次に、実施例5及び比較例3の電気化学キャパシタセルについて、充電電流密度100mA g−1にて1.0Vまで充電後、100〜10,000mA g−1の各放電電流密度にて放電した際の放電容量を測定した。図8に、放電容量の測定結果を示す。図8の結果から、全ての電流密度において、実施例5(loaded I2)の電気化学キャパシタセルは、一般的な水系電解液である硫酸(H2SO4)を用いた比較例3(aqueous H2SO4 solution)よりも放電容量が高くなっていることがわかった。
【0133】
次に、実施例5及び比較例3の電気化学キャパシタセルについて、5,000mA g−1の電流密度で100,000サイクル充放電し、セル当たりの放電容量を調べた。図9は、実施例5(loaded I2)及び比較例3(aqueous H2SO4solution)の電気化学キャパシタセルについて100,000サイクル充放電した場合の、セル当たりの放電容量を示すグラフである。
【0134】
図9に示されるように、実施例5の電気化学キャパシタセルは、100,000サイクルを経ても、放電容量の低下が見られなかった。このことから、実施例5の電気化学キャパシタセルは、安定なサイクル特性を示すことがわかった。加えて、100,000サイクルの間、比較例3の電気化学キャパシタが示す放電容量をはるかに上まわっており、ハロゲンを含む水溶液で前処理し、ハロゲン化物を含む電解液を用いる電気化学キャパシタの優位性が明白である。
【0135】
以下の実施例6では、実施例1と同じ評価用電気化学キャパシタセルを使用した。
【0136】
〔実施例6〕
非水系媒体として、イオン液体である1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMIBF4:東洋合成工業株式会社製)を用いた。また、ハロゲン化リチウムとして、臭化リチウム(LiBr:キシダ化学株式会社製))を用いた。具体的には、5mlのメスフラスコを用いて、LiBrを、1.0mol dm−3(1.0M)の濃度になるようにEMIBF4に溶解させて、非水系電解液であるLiBr/EMIBF4を調製した。次に、実施例1と同様に電気化学キャパシタセルを作製した。
【0137】
以下の実施例7および比較例4では、以下の評価用電気化学キャパシタセルを使用した。
【0138】
セル:テフロン(登録商標)製スクリュー型セル
正極:活性炭繊維布(ACF)〔ACC−5092−20(日本カイノール株式会社製)直径12mm
負極:ハードカーボン 直径12mm
導電助剤:アセチレンブラック(AB)
結着剤 :アセチレンブタジエンゴム(40重量%)(SBR)
増粘剤 :カルボキシメチルセルロース(2重量%)(CMC)
組成比 :ハードカーボン:AB:SBR:CMC=93:3:2:2
集電板:白金板〔株式会社ニラコ社製〕直径11mm
セパレータ:ガラス製ろ紙〔GB−100R(東洋濾紙株式会社製)〕直径13mm
擬似参照極:白金線〔株式会社ニラコ社製〕。
【0139】
〔実施例7〕
非水系媒体として、エチレンカーボネート(EC)およびジメチルカーボネート(DMC)を1:1の体積比にて用いた。また、ハロゲン化リチウムとして、臭化リチウム(LiBr:キシダ化学株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、LiBrを、1.0mol dm−3の濃度になるようにEC/DMCの混合溶媒に溶解させて、非水系電解液であるLiBr/EC/DMCを調製した。
【0140】
次に、電気化学キャパシタセルを作製した。具体的には、調製した1.0mol LiBr/EC/DMCをサンプル管に注ぎ、該サンプル管に2枚のセパレータ、正極および負極(重量を測定済)を入れた。その後、セパレータ、正極および負極に非水系電解液を十分に含浸させるため、これらを減圧装置内にて、30分間、10−1Paに保った。その後、テフロン(登録商標)製試験セルに、白金板|正極|セパレータ|参照極|セパレータ|負極|白金板となるように配置し、電気化学キャパシタセルを作製した。なお、上記白金板にはリードとして白金線が溶接されている。また、作製したセルは、密閉容器に入れられ、密閉することで空気中の水分を遮断し、かつ不活性雰囲気を維持した状態になっている。なお、全ての作業は、アルゴン雰囲気のグローブボックス内で行われた。
【0141】
〔比較例4〕
非水系媒体として、エチレンカーボネート(EC)およびジメチルカーボネート(DMC)を1:1の体積比にて用いた。また、電解質として六フッ化リン酸リチウム(LiPF6:キシダ化学株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、LiPF6を、1.0mol dm−3の濃度になるようにEC/DMCの混合溶媒に溶解させて、非水系電解液であるLiPF6/EC/DMCを調製した。次に、実施例7と同様にして電気化学キャパシタセルを作製した。
【0142】
〔実施例8〕
LiBrに代えてヨウ化リチウム(LiI:キシダ化学株式会社製)を用いた以外は実施例6と同様にして、電気化学キャパシタセルを作製した。
【0143】
〔比較例5〕
LiBrに代えてLiPF6を用いた以外は、実施例6と同様にして、電気化学キャパシタセルを作製した。
【0144】
実施例6、7、比較例4、実施例8および比較例5の電気化学キャパシタセルについてキャパシタ性能を調べた。
【0145】
まず、比較のために実施例1に係る、リチウム塩が使用されていない電気化学キャパシタセルについて、2V、2.3V、2.4Vの3種類の作動電圧にて100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図11(a)は、実施例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフである。
【0146】
一方、実施例6に係る、ハロゲン化リチウムが使用された電気化学キャパシタセルについて、2.0V、2.5V、2.6V、2.7V、3.0Vの5種類の作動電圧にて100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図11(b)は、実施例6の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフである。同図に示すように、ハロゲン化リチウムを添加した系では、正極電位の増大が観測され、電気化学キャパシタセルの作動電圧が拡大されている。
【0147】
さらに、実施例1および実施例6に係る電気化学キャパシタセルについて、2.0V〜3.0Vの作動電圧、500mA g−1の電流密度にて1000サイクル充放電したときのクーロン効率を測定した。図12(a)は、実施例1に係る電気化学キャパシタセルの測定結果を示すグラフであり、図12(b)は、実施例6に係る電気化学キャパシタセルの測定結果を示すグラフである。
【0148】
図12(a)に示すように、実施例1に係る電気化学キャパシタセルでは、作動電圧が2.3Vの測定条件でクーロン効率が90%程度となっており、作動電圧が2.4Vの測定条件でクーロン効率が84%程度となり、さらに作動電圧を上げるにつれてクーロン効率が低下した。すなわち、2.4V付近で負極からハロゲン化物イオンが拡散しているものと推察される。
【0149】
これに対して、図12(b)に示すように、実施例6に係る電気化学キャパシタセルでは、作動電圧が2.0V〜2.5Vではクーロン効率が95%以上と高い値が示されており、作動電圧が2.8Vでクーロン効率が90%程度となっている。すなわち、非水系電解液にハロゲン化リチウムを添加することにより、2.8Vの高い作動電圧であっても、負極からハロゲン化物イオンが拡散せず(離れず)、クーロン効率が高い電気化学キャパシタセルの作製に成功していることがわかる。
【0150】
次に、負極としてハードカーボンを用いた実施例7および比較例4に係る電気化学セルについて、1.6〜3.6Vの電圧範囲、500mA g−1の電流密度にて測定したセル全体の電圧を示す。図13は、実施例7及び比較例4の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、図13(a)はセル全体の電圧に基づく充放電カーブを示し、図13(b)は正極、負極各々の電位に基づく充放電カーブを示す。
【0151】
図13(a)に示されるように、実施例7に係るLiBrを用いた電気化学キャパシタセルは最大約3.5Vのセル電圧を示した。ハロゲンを含まないLiPF6を用いた比較例4の結果と実施例7の結果とを比較すると、実施例7では、充放電時間が約4倍となっており、ハロゲン化リチウムを使用した電気化学キャパシタセルは、セル電圧および充放電時間の両方に優れることが分かる。
【0152】
また、図13(b)に示されるように、非水系電解質がLiBr/EC/DMCである実施例7の電気化学キャパシタセルでは、正極電位について、充電における初期段階及び放電における末期段階で、電気二重層応答が見られた。すなわち、充電における初期段階で正極電位の上昇が見られ、放電における末期段階で正極電位の下降が見られた。また、充電における初期段階及び放電における末期段階以外の期間では、正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。また、非水系電解液がEMII/EMIBF4である実施例2の電気化学キャパシタセルでは、充電の初期段階から正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。
【0153】
一方、非水系電解液がLiBr/EC/DMCである比較例4の電気化学キャパシタセルでは、充電及び放電過程において、正極電位がそれぞれ上昇及び下降する典型的な電気二重層応答が見られた。よって、図13(a)及び(b)の結果から、LiBrのレドックス反応種を含む非水系電解液を用いることで容量が大幅に増加することが分かった。
【0154】
実施例7における作動電圧は3.6Vであり、本発明に係る非リチウム系の非水系電解質を使用した場合の作動電圧(2V)よりも優れた結果が得られており、作動電圧の拡大に成功したことが明確に示されている。
【0155】
図14は、実施例7及び比較例4の電気化学キャパシタセルについて、1000mA g−1の電流密度で1,000サイクル充放電した場合の、セル当たりの放電容量、およびクーロン効率の変化を示すグラフである。図14(a)はセル当たりの放電容量の変化を示し、図14(b)はクーロン効率の変化を示す。
【0156】
図14(a)に示されるように、実施例7の電気化学キャパシタセルでは、1000サイクルまで約25mA h g−1の放電容量を示したが、比較例4の電気化学キャパシタセルでは、600サイクルで約0mA h g−1の放電容量となり、本発明の優位性が示されている。また、図14(b)に示されるように、実施例7の電気化学キャパシタセルでは、1000サイクルまでのクーロン効率がほぼ100%であり、セル当たりの放電容量に加えて、クーロン効率についても優れたサイクル特性が示されている。
【0157】
実施例8および比較例5にて作製した電気化学キャパシタセルについて、充放電カーブを測定した。また、比較のため、実施例6の電気化学キャパシタセルについても充放電カーブを測定した。具体的には、電気化学キャパシタセルについて、作動電圧0.5〜2V(セル電圧)で、100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図15は、実施例6、8及び比較例5の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示すグラフである。
【0158】
図15に示すように、ハロゲン化リチウムとしてヨウ化リチウムを使用した実施例8では、充電の初期段階から正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。一方、負極電位については、LiBrの実施例6と同様に、負極電位の変化が直線的であり、電気二重層応答が観測された。このように、ハロゲン化リチウムとしてLiIを使用した場合であっても、本発明に係るハロゲン化物がハロゲン化リチウムである電気化学キャパシタセルを作製できることが示されている。
【0159】
本発明は上述した各実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【産業上の利用可能性】
【0160】
本発明は、高容量化及び高エネルギー密度化を達成でき、かつ長期安定性に優れているので、コンデンサ業界、自動車業界、電池業界、家電業界等に利用することができる。
【技術分野】
【0001】
本発明は、電気化学キャパシタに関する。
【背景技術】
【0002】
電気化学キャパシタは、リチウムイオン二次電池と比較して、長寿命、高出力という点で優れた特徴を有している。さらに、電気自動車や自然エネルギー用途などといった蓄電デバイス市場の拡大から、電気化学キャパシタの要求性が高まっている。特に、電気化学キャパシタについて、従来よりも高いエネルギー密度が求められている。
【0003】
電気化学キャパシタにおけるエネルギー貯蔵メカニズムは、2つのメカニズムに区分される。すなわち、電極/電解液界面に形成される電気二重層に電荷を蓄積させるメカニズムと、少なくとも1つの電極が金属酸化物等からなり、この電極自体の酸化還元反応を利用して電荷を蓄積させるメカニズムとに区分される。前者のメカニズムとしては、電気二重層キャパシタが挙げられ、後者のメカニズムとしては、シュードキャパシタ、レドックスキャパシタが挙げられる。
【0004】
上記の高いエネルギー密度の付与は、前者のメカニズムにおいて、電気二重層の形成サイトをより効率的に増加させるために電極構造を最適化することで、高容量化を実現することができる。また、後者のメカニズムでは、キャパシタの性能を向上させるために、酸化還元反応の活性部分を増加させたり、新規の活物質材料を適用したりする等、数多くの方策がなされている。
【0005】
電気二重層キャパシタでは高比表面積を有する活性炭などを主成分とする分極性電極が用いられる。この分極性電極としては、従来、以下のものが用いられている。例えば、活性炭繊維に集電体を溶射或いは、蒸着法で密着させた電極、活性炭粉末にフッ素樹脂を少量混合して集電体にプレス成形した電極、活性炭粉末に少量のアセチレンブラック、接着剤と、揮発性の溶剤を混入して作製したペーストを集電体に圧着した後加熱、加圧してシート状にした電極等が挙げられる。
【0006】
上記電極と電解液界面に形成される電気二重層とに電荷を蓄積させるメカニズムを利用した、いわゆる電気二重層キャパシタを高容量するために、例えば、特許文献1に開示されているように、高比表面積を有する活性炭電極などの分極性電極が利用され、またその処理方法による高容量化が挙げられる。
【0007】
特許文献2に記載の電気二重層キャパシタ用活性炭電極は、石炭由来の活性炭を水蒸気賦活することにより、BET比表面積が1350m2/g以上の高比表面積を有している。
【0008】
また、特許文献3では、電気二重層キャパシタのエネルギー密度を向上させることが提案されている。その手法は、黒鉛類似の層状構造を持つ微結晶炭素を含有した炭素材料を賦活処理することで、その層間距離が黒鉛よりもやや長い0.343nm以下の構造を持つ微結晶炭素を含む電極を電気二重層キャパシタに用いるというものである。
【0009】
電極自身の酸化還元反応を利用するシュードキャパシタは、例えば、特許文献4および5に記載されているルテニウム酸化物などを用いることができ、当該ルテニウム酸化物などの形状として粒子状やシート状などが挙げられる。
【0010】
電気化学キャパシタに含まれる電解液には、水系および非水系の両者があり、電気化学キャパシタの用途に応じて選択されている。両者を比較すると、非水系電解液の方がエネルギー密度および温度特性(特に低温での温度特性)に優れ、より実用に供されている。上記水系電解液として、特許文献6,7の技術では、電解液として、硫酸、塩酸などを含む酸性の水溶液、中性塩を含む水溶液、水酸化ナトリウムなどの塩基性の水溶液が用いられている。一方、正極と負極との間に介在させる上記非水系電解液として、例えば、特許文献8には、プロピレンカーボネートまたはγ−ブチロラクトン等の非プロトン性有機溶媒に、テトラエチルアンモニウムテトラフルオロボレート、トリエチルメチルアンモニウムテトラフルオロボレートまたはテトラエチルホスホニウムテトラフルオロボレート等を溶解させた非水系有機溶液が挙げられている。また、電解液としてイオン液体を利用し高電圧化することで、エネルギー密度を向上させる技術も知られている。(特許文献8)
また、正極と負極との間に介在する電解液中にはセパレータが配置されている。このセパレータとしては、ガラス繊維不織布、ポリプロピレン不織布等が用いられている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2006−279003号公報(2006年10月12日公開)
【特許文献2】特開2001−319837号公報(2001年11月16日公開)
【特許文献3】特開2003−051430号公報(2003年 2月21日公開)
【特許文献4】特開2006−233232号公報(2006年 9月 7日公開)
【特許文献5】特開2004−315347号公報(2004年11月11日公開)
【特許文献6】特開平9−293649号公報 (1997年11月11日公開)
【特許文献7】特開2002−289477号公報(2002年10月 4日公開)
【特許文献8】特開2004−335875号公報(2004年11月25日公開)
【特許文献9】特開2006−236829号公報(2006年 9月 7日公開)
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかしながら、上述の従来の電気化学キャパシタについて高エネルギー密度化を実現する場合、電気二重層の形成サイトをより効率的に増加させる為に電極構造を最適化すると、電極構造の劣化が促進したり、体積当たりのエネルギー密度が低下したりする虞がある。また、電極自体の酸化還元反応を利用して電荷を蓄積させる電気化学キャパシタでは、コストや出力特性の点から実用化に至らないケースがほとんどであり、実用化されても特殊な用途に限られるのが現状である。また、電解液として有機溶液を用いた場合、水系溶液を用いた場合よりも安全性に劣る。また、電解液としてイオン液体を利用した場合、出力特性や長期安定性に問題が生じることがある。
【0013】
本発明は、上記の問題点に鑑みてなされたものであり、その目的は、高容量化及び高エネルギー密度化を達成でき、かつ長期安定性に優れた電気化学キャパシタを提供することにある。
【課題を解決するための手段】
【0014】
本発明者らは、上記の課題を解決するために鋭意検討した結果、ハロゲン化物を溶解させた非水系電解液および水系電解液を用い、ハロゲン化物のレドックス反応を利用した電解液の容量発現に成功し、上記電解液の容量発現を利用することにより、高容量化及び高エネルギー密度化を達成でき、かつ長期安定性に優れた電気化学キャパシタを実現できることを見出し、本発明を完成するに至った。
【0015】
すなわち、本発明の電気化学キャパシタの第1の構成は、上記の課題を解決するために、一対の電極を備え、該電極間に非水系電解液が介在した電気化学キャパシタであって、上記非水系電解液は、ハロゲン化物を含有することを特徴としている。
【0016】
また、本発明の電気化学キャパシタでは、上記ハロゲン化物は、臭化物またはヨウ化物であることが好ましい。
【0017】
また、本発明の電気化学キャパシタでは、上記非水系電解液は非水系媒体としてのイオン液体を含有することが好ましい、すなわち、上記ハロゲン化物の塩とイオン液体の混合電解液であることが好ましい。上記非水系電解液にイオン液体を含んでいるため、揮発性の低減による難燃性を備えている。
【0018】
また、本発明の電気化学キャパシタでは、上記ハロゲン化物は、上記イオン液体と同一のカチオンを有するハロゲン化塩であることが好ましい。上記非水系電解液に含まれるカチオンを共通化することにより、ハロゲン化物の溶解度を高めることができる。
【0019】
また、本発明の電気化学キャパシタでは、上記イオン液体は、1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMI−BF4)であることが好ましい。
【0020】
また、本発明の電気化学キャパシタでは、上記非水系電解液は、非水系媒体としての有機溶媒を含有することが好ましい。上記非水系電解液が非水系媒体としての有機溶媒を含有する、すなわち、有機溶媒にハロゲン化物の塩が溶解した非水系電解液であるため、高出力の電気化学キャパシタを実現することができる。
【0021】
また、本発明の電気化学キャパシタでは、上記有機溶媒は、プロピレンカーボネート(PC)であることが好ましい。
【0022】
また、本発明の電気化学キャパシタでは、上記一対の電極は、活性炭を含む分極性電極であることが好ましい。
【0023】
また、本発明の電気化学キャパシタでは、上記分極性電極のうち少なくとも正極は、ハロゲンを含む水溶液に浸漬する前処理が行われていることが好ましい。
【0024】
また、本発明の電気化学キャパシタでは、上記非水系電解液がリチウム塩を含有することが好ましい。
【0025】
また、本発明の電気化学キャパシタでは、上記リチウム塩は、ハロゲン化リチウムであることが好ましい。
【0026】
また、本発明の電気化学キャパシタでは、上記ハロゲン化リチウムが、臭化リチウムまたはヨウ化リチウムであることが好ましい。
【0027】
また、本発明の電気化学キャパシタでは、上記分極性電極のうち少なくとも負極は、ハードカーボンによって構成されていることが好ましい。
【0028】
また、本発明に係る電気化学キャパシタの第2の構成は、上記の課題を解決するために、正極及び負極からなる一対の電極を備え、該電極間に水系電解液が介在した電気化学キャパシタであって、上記水系電解液は、ヨウ化物塩を含む水溶液であることを特徴としている。また、上記正極は、ヨウ素を含む水溶液に浸漬する前処理が行われていることが好ましい。
【発明の効果】
【0029】
本発明に係る電気化学キャパシタの第1の構成は、以上のように、一対の電極を備え、該電極間に非水系電解液が介在した電気化学キャパシタであって、上記非水系電解液は、ハロゲン化物を含有する構成である。
【0030】
また、本発明に係る電気化学キャパシタの第2の構成は、以上のように、正極及び負極からなる一対の電極を備え、該電極間に水系電解液が介在した電気化学キャパシタであって、上記水系電解液は、ヨウ化物塩を含む水溶液であるとともに、上記正極は、ヨウ素を含む水溶液に浸漬する前処理が行われている構成である。
【0031】
それゆえ、上記非水系および水系電解液に含まれるハロゲンが酸化還元反応による擬似容量を発現し、高容量化及び高エネルギー密度化を達成できる。また、上記ハロゲンが電解液に含まれることから、長期安定性に優れた電気化学キャパシタを実現することができる。
【図面の簡単な説明】
【0032】
【図1】従来の電気二重層キャパシタの充放電カーブ(左側)と電気二重層キャパシタに本発明を適用したキャパシタの充放電カーブ(右側)とを模式的に示した模式図である。
【図2】実施例1,2及び比較例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、(a)はセル全体の電圧に基づく充放電カーブを示し、(b)は正極、負極各々の電位に基づく充放電カーブを示す。
【図3】実施例1,2及び比較例1の電気化学キャパシタセルについて、放電容量を測定した結果を示すグラフである。
【図4】実施例1及び比較例1の電気化学キャパシタセルについて、作動電圧2.0Vで15時間保持してリーク電流試験を実施し、両電気化学キャパシタセルでリーク電流の比較を行った結果を示すグラフである。
【図5】実施例1及び比較例1の電気化学キャパシタセルについて1,000サイクル充放電した場合の、セル当たりの放電容量、およびクーロン効率の変化を示すグラフであり、(a)はセル当たりの放電容量の変化を示し、(b)はクーロン効率の変化を示す。
【図6】実施例3及び4、実施例1、比較例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、(a)は実施例3及び実施例1、比較例1の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示し、(b)は実施例4の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示す。
【図7】実施例5及び比較例2の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、正極、負極各々の電位に基づく充放電カーブを示す。
【図8】実施例5及び比較例3の電気化学キャパシタセルについて、各放電電流密度にて放電した際の放電容量を測定した結果を示すグラフである。
【図9】実施例5及び比較例3の電気化学キャパシタセルについて5,000mA g−1の電流密度で100,000サイクル充放電した場合の、セル当たりの放電容量を示すグラフである。
【図10】電気二重層キャパシタに本発明を適用したキャパシタの充放電カーブを示した模式図である。
【図11】実施例1、6の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブの測定結果を示すグラフであり、(a)は実施例1、(b)は、実施例6に係るグラフである。
【図12】電気化学キャパシタセルの測定結果を示すグラフであり、(a)は、実施例1、(b)は、実施例6に係る測定結果を示すグラフである。
【図13】実施例7及び比較例4の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、(a)はセル全体の電圧に基づく充放電カーブを示し、(b)は正極、負極各々の電位に基づく充放電カーブを示す。
【図14】実施例7及び比較例4の電気化学キャパシタセルについて、1000mA g−1の電流密度で1,000サイクル充放電した場合の測定結果を示すグラフであり、(a)はセル当たりの放電容量の変化を示し、(b)はクーロン効率の変化を示す。
【図15】実施例6、8及び比較例5の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示すグラフである。
【発明を実施するための形態】
【0033】
〔実施の形態1〕
以下、本発明の実施の形態について、詳細に説明する。
【0034】
<1.電気化学キャパシタの概要>
本実施形態の電気化学キャパシタ(以下、本電気化学キャパシタと記す)は、互いに対向配置された一対の電極と、非水系電解液とを備えている。本発明の電気化学キャパシタにおいては、非水系電解液は、一対の電極間に介在している。また、本電気化学キャパシタは、セパレータを備えている。本発明の電気化学キャパシタがセパレータを備えた場合、電極はセパレータを介して対向配置される。
【0035】
<2.非水系電解液>
本電気化学キャパシタで用いられる非水系電解液は、電解質塩と、該電解質塩を溶解する非水系媒体とを含んでいる。また、電解質塩は、非水系電解液中でレドックス反応を起こし得る化合物(以下、レドックス反応種と記す)であり、具体的にはハロゲン化物である。本電気化学キャパシタでは、非水系電解液中に溶解あるいは混合させたハロゲン化物のレドックス反応を利用することで、高容量化及び高エネルギー密度化を実現している。
【0036】
<2−1.非水系媒体>
非水系媒体は、従来公知の電気化学キャパシタに用いられる非水系媒体であればよい。特に、非水系媒体は、イオン液体であることが好ましい。ここでいう「イオン液体」とは、室温でも液体で存在する塩を意味する。このイオン液体のカチオンとしては、例えば、イミダゾリウム、ピリジニウム、ピロリジニウム、ピペリジニウム、テトラアルキルアンモニウム、ピラゾリウム、又はホスホニウム等が挙げられる。
【0037】
前記イミダゾリウムとしては、例えば、1−エチル−3−メチルイミダゾリウム、1−ブチル−3−メチルイミダゾリウム、1−エチル−2,3−ジメチルイミダゾリウム、1−アリル−3−メチルイミダゾリウム、1−アリル−3−エチルイミダゾリウム、1−アリル−3−ブチルイミダゾリウム、1,3−ジアリルイミダゾリウム等が挙げられる。
【0038】
また、前記ピリジニウムとしては、例えば、1−プロピルピリジニウム、1−ブチルピリジニウム、1−エチル−3−(ヒドロキシメチル)ピリジニウム、1−エチル−3−メチルピリジニウム等が挙げられる。
【0039】
前記ピロリジニウムとしては、例えば、N−メチル−N−プロピルピロリジニウム、N−メチル−N−ブチルピロリジニウム、N−メチル−N−メトキシメチルピロリジニウム等が挙げられる。
【0040】
また、前記ピペリジニウムとしては、例えば、N−メチル−N−プロピルピペリジニウム等が挙げられる。
【0041】
また、前記テトラアルキルアンモニウムとしては、例えば、N,N,N−トリメチル−N−プロピルアンモニウム、メチルトリオクチルアンモニウム等が挙げられる。
【0042】
また、前記ピラゾリウムとしては、例えば、1−エチル−2,3,5−トリメチルピラゾリウム、1−プロピル−2,3,5−トリメチルピラゾリウム、1−ブチル−2,3,5−トリメチルピラゾリウム等が挙げられる。
【0043】
また、上記カチオンと組み合わされてイオン液体を構成するアニオンとしては、例えば、BF4−、NO3−、PF6−、SbF6−、CH3CH2OSO3−、CH3CO2−、(FSO2)2N−[ビス(フルオロスルフォニル)イミドアニオン]、又はフルオロアルキル基含有アニオン等が挙げられる。
【0044】
また、前記フルオロアルキル基含有アニオンとしては、例えば、CF3CO2−、パーフルオロアルキルスルホニル基含有アニオン等が挙げられる。
【0045】
また、前記パーフルオロアルキルスルホニル基含有アニオンとしては、例えば、CF3SO3−、(CF3SO2)2N−[ビス(トリフルオロメチルスルフォニル)イミド]、(CF3SO2)3C−等が挙げられる。
【0046】
前記イオン液体としては、これら各種アニオンの少なくとも1種とこれら各種カチオンの少なくとも1種とを組み合わせたものを採用することができる。なかでも、(1)蓄電デバイスにおける電気的特性がより優れたものとなりつつ該電気的特性の低下が抑制されるという点および(2)入手し易く電解液の有する電気的特性の低下が蓄電デバイスにおいてより抑制されるという点では、テトラフルオロボレート(BF4−)アニオンを含むイオン液体が好ましい。
【0047】
また、大気中での取り扱いが容易という点では、パーフルオロアルキルスルホニル基含有アニオンを含むイオン液体が好ましく、(FSO2)2N−[ビス(フルオロスルフォニル)イミドアニオン]を含むイオン液体がより好ましい。
【0048】
また、前記非水系電解液としては、比較的低粘度であり、イオン伝導性に優れ、電気化学的な安定性に優れるという点で、イミダゾリウムカチオン又はピロリジニウムカチオンを含むイオン液体が好ましい。
【0049】
具体的には、前記非水系電解液としては、アニオンとしてのビス(フルオロスルフォニル)イミドアニオン又はテトラフルオロボレートと、カチオンとしてのイミダゾリウムとの塩が好ましく、より具体的には、1−エチル−3−メチルイミダゾリウム ビス(フルオロスルフォニル)イミド、又は、1−エチル−3−メチルイミダゾリウム テトラフルオロボレートが好ましい。なお、前記イオン液体は、単独又は2種以上が組み合わされて用いられ得る。
【0050】
一方、非水系媒体は、「イオン液体」に限らず、電気化学キャパシタの非水系媒体に用いられる、有機系溶媒であってもよい。このような有機系溶媒として、具体的には、アセトニトリル、エチレンカーボネート、ジメチルカーボネート、ジエチルカーボネート、ジエチルエーテル、プロピレンカーボネート等を単一もしくは複数含む溶媒が挙げられる。これらの中でも、低粘度であり、イオン伝導性に優れ、電気化学的な安定性に優れる点で、プロピレンカーボネートが好ましい。
【0051】
<2−2.レドックス反応種としてのハロゲン化物>
本電気化学キャパシタでは、ハロゲン化物を上記非水系媒体に溶解させた非水系電解液を用いることにより、従来の電気化学キャパシタによる容量発現に加え、レドックス反応種としてのハロゲン化物が発現する擬似容量を利用して、高容量化及び高エネルギー密度化を実現している。
【0052】
従来、電気化学キャパシタを高容量化させるために、以下の方策が採られてきた。
【0053】
電気化学キャパシタが電気二重層キャパシタである場合、電極の細孔構造、電解液を最適化することで、電気化学キャパシタを高容量化させてきた。また、電気化学キャパシタがシュードキャパシタである場合、電極を構成する新規な金属酸化物あるいは導電性高分子を探索すること、および、金属酸化物あるいは導電性高分子の利用率を向上させることで、電気化学キャパシタを高容量化させてきた。すなわち、従来の電気化学キャパシタでは、電極の容量発現を最適化することで、高容量化してきた。
【0054】
一方、本電気化学キャパシタは、電極ではなく、非水系電解液のレドックス反応による容量発現を利用して高容量化を実現しており、従来の電気化学キャパシタと電荷貯蔵メカニズムが異なる。以下、本電気化学キャパシタにおける電荷貯蔵メカニズムについて、図1を参照して説明する。図1は、従来の電気二重層キャパシタの充放電カーブ(左側)と電気二重層キャパシタに本発明を適用した本電気化学キャパシタの充放電カーブ(右側)とを模式的に示した模式図である。なお、図1では、ハロゲン化物を臭化物またはヨウ化物としている。
【0055】
従来の電気二重層キャパシタにおいて、正極、負極に用いている活物質は、電解液中において、所定の電位を有している。そして、充電することにより、正極表面にはアニオンが電気二重層を形成し正極電位は上昇する。一方、負極表面にはカチオンが電気二重層を形成し負極電位が下降する。逆に、放電時には、正極からアニオンが放出され、負極からはカチオンが放出される。その結果、放電時には、正極電位は下降し、負極電位は上昇することになる。すなわち、従来の電気二重層キャパシタでは、正極および負極が同一の場合、各電極が示す充放電カーブは、図1の左側に示されるように、所定の電位を境に線対称になっており、正極の電位変化量と負極の電位変化量とがほぼ同じになっている(電気二重層応答)。
【0056】
一方、本電気化学キャパシタでは、非水系電解液中にハロゲン化物イオンが溶解しているため、充電過程においては正極の細孔内にハロゲン化物が過剰となり、ある電位に達することで、ハロゲン化物の酸化体が生成する。その結果、正極が示す電位はハロゲン化物イオンとその酸化体との平衡反応により、高電位側への電位のシフトが起こる。また、この電位において、ハロゲン化物の酸化反応が起こり、電荷が貯蔵される(電荷貯蔵反応)。上記ハロゲン化物とはBr−もしくはI−であり、ハロゲン化物の酸化体とはBr−もしくはI−よりも高い酸化数を有するハロゲン誘導体である。その結果、図1の右側の充放電カーブに示されるように、正極電位は、ハロゲンのレドックス反応を起こす電位領域内でほとんど変化しない(レドックス反応応答)。このため、本電気化学キャパシタの電圧は、負極電位の変化のみに依存することになる。それゆえ、本電気化学キャパシタは、従来の電気二重層キャパシタよりも、充放電時間が大幅に長くなり、容量が高くなる。
【0057】
上述のように、本電気化学キャパシタは、電解液に含まれるハロゲン化物のレドックス反応を利用した電荷貯蔵メカニズムになっており、このメカニズムは、電解液の容量発現を利用したメカニズムであるといえる。しかしながら、このように電解液の容量発現を利用したメカニズムは、電極側の容量発現を最適化する従来のメカニズムと異なり、レドックス反応種が電解液中を拡散することにより、貯蔵された電荷を失うおそれがある(シャトル効果)。このシャトル効果は、電気化学キャパシタにおいてリーク電流として観察される。本電気化学キャパシタは、後述の実施例に示されるように、リーク電流を抑えることができ、レドックス反応種の電解液中の拡散を抑制している(図4)。
【0058】
ハロゲン化物は、上述の非水系媒体に溶解可能であり、かつ溶解したときにアニオン種としてハロゲン化物イオンが存在する化合物であればよい。すなわち、ハロゲン化物イオンを含む塩であればよく、カチオンの種類は、特に限定されない。ハロゲン化物は、臭化物またはヨウ化物であることが好ましい。カチオンの例として、イミダゾリウム、ピリジニウム、ピロリジニウム、ピペリジニウム、テトラアルキルアンモニウム、ピラゾリウム、又はホスホニウム等が挙げられる。
【0059】
前記イミダゾリウムとしては、例えば、1−エチル−3−メチルイミダゾリウム、1−ブチル−3−メチルイミダゾリウム、1−エチル−2,3−ジメチルイミダゾリウム、1−アリル−3−メチルイミダゾリウム、1−アリル−3−エチルイミダゾリウム、1−アリル−3−ブチルイミダゾリウム、1,3−ジアリルイミダゾリウム等が挙げられる。
【0060】
また、前記ピリジニウムとしては、例えば、1−プロピルピリジニウム、1−ブチルピリジニウム、1−エチル−3−(ヒドロキシメチル)ピリジニウム、1−エチル−3−メチルピリジニウム等が挙げられる。
【0061】
前記ピロリジニウムとしては、例えば、N−メチル−N−プロピルピロリジニウム、N−メチル−N−ブチルピロリジニウム、N−メチル−N−メトキシメチルピロリジニウム等が挙げられる。
【0062】
また、前記ピペリジニウムとしては、例えば、N−メチル−N−プロピルピペリジニウム等が挙げられる。
【0063】
また、前記テトラアルキルアンモニウムとしては、例えば、N,N,N−トリメチル−N−プロピルアンモニウム、メチルトリオクチルアンモニウム等が挙げられる。
【0064】
また、前記ピラゾリウムとしては、例えば、1−エチル−2,3,5−トリメチルピラゾリウム、1−プロピル−2,3,5−トリメチルピラゾリウム、1−ブチル−2,3,5−トリメチルピラゾリウム等が挙げられる。また、非水系電解液が非水系媒体としてイオン液体を含む場合、ハロゲン化物のカチオン種は、イオン液体と同一であることが好ましい。例えば、非水系電解液の非水系媒体が1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMI−BF4)である場合、ハロゲン化物は、EMIのハロゲン化塩であることがより好ましく、例えば、1−エチル−3−メチルイミダゾリウムブロマイド(EMIBr)、1−エチル−3−メチルイミダゾリウムヨウシド(EMII)等が挙げられる。
【0065】
また、非水系媒体が有機溶媒である場合、上記カチオンを含むハロゲン化物に加え、ハロゲン化物として、臭化トリエチルメチルアンモニウム、臭化テトラエチルアンモニウム、ヨウ化トリエチルメチルアンモニウム,ヨウ化テトラエチルアンモニウム等を用いることができる。有機溶媒への溶解度が高い点から、EMIのハロゲン化物塩が好ましい。
【0066】
非水系電解液におけるハロゲン化物の濃度は、非水系媒体およびハロゲン化物の種類によって異なるが、概して、0.3mol dm−3以上、2.5mol dm−3以下とすることができ、好ましくは、0.8mol dm−3以上、1.5mol dm−3以下とすることができる。ハロゲン化物の濃度が上記範囲であることにより、電気化学キャパシタの正極におけるレドックス反応を好適に発現させることができる。
【0067】
上述したように、本電気化学キャパシタではレドックス反応応答が発現するため、容量が高いものである。ここで、本電気化学キャパシタの電圧は、負極電位の変化に依存するため、負極電位の改良について本発明者らは鋭意検討を行い、非水系電解液に、ハロゲン化物イオンおよびリチウムイオンを溶解させることを見出した。非水系電解液中においてリチウムイオンが存在することによって、ハロゲン化物イオンが安定して存在し、レドックス反応において電極からより離れ難いと考えられる。
【0068】
図10は、本発明に係る電気化学キャパシタにおいて、非水系電解液中にリチウムイオン電池負極を含まないEMIBr/EMI−BF4の系(実線)と、非水系電解液中にリチウムイオン電池負極を含むLiBr/EMI−BF4の系(破線)の充放電カーブを示した模式図である。
【0069】
EMIBr/EMI−BF4の系(実線)では、正極および負極に活性炭を用いている。同図に示すように、正極ではハロゲンのレドックス反応が生じており、負極では、二重層応答が生じ、従来の電気二重層キャパシタ(ハロゲンを含んでいないもの)よりも容量は増加する。しかしながら、負極電位が直線状の傾きを有しており、負極の容量が小さい。また、更なるエネルギー密度を拡大させるため作動電圧を大きくした場合、負極の周囲の電解液が分解するため作動電圧を拡大できない。つまり、比表面積が大きい活性炭を用いているため、電解液の還元分解反応が起こり易い。
【0070】
一方、LiBr/EMI−BF4の系(破線)では、非水系電解液にハロゲン化物イオンおよびリチウムイオンが存在している。したがって、正極でハロゲンのレドックス反応が生じ、負極ではリチウムの挿入および脱離反応(電池の充放電メカニズム)が生じ、電気化学キャパシタの容量が増加する。また、リチウムイオンの存在により、負極電位の電気二重層の形が変化し、分解反応が起こり難くなると考えられる。このため、分解反応が起こり易い負極(比表面積の高い負極)を使用したとしても、負極による作動電圧が拡大し難い作用を上回って、作動電圧を拡大することが可能となる。
【0071】
このようなリチウムイオンの効果に加えて、LiBr/EMI−BF4の系では正極に活性炭を、負極にハードカーボンを用いている。ハードカーボンの負極は、比表面積が活性炭と比較し小さいため、電解液の分解反応が起こり難く(分解が起こった場合でもリチウムイオン電池負極で生じる固体電解質界面(SEI)の形成程度)、負極による作動電圧が拡大し難い作用を抑えて、作動電圧を拡大することができる。すなわち、図10に示すように、負極電位は緩やかに減少し、その後、緩やかに増大することとなる。
【0072】
具体的な値で比較すると、「EMIBr/EMI−BF4の系」の場合、従来技術に比較して2倍ほどの容量であり、「LiBr/EMI−BF4の系」の場合、従来技術の2倍〜3.6倍(2V〜3.6V)程度の容量となる。この容量の増大は、驚くべき飛躍であるといえる。
【0073】
上記の効果に加えて、リチウムイオンが存在することにより、負極におけるハロゲン化物イオンの分離反応が生じ難くなるため、実施例に基づき後述するように(図12)、高い作動電圧であっても、クーロン効率が高い電気化学キャパシタを実現できる。
【0074】
本発明に係る非水系電解液はハロゲン化物を必須に含有するものであるため、本発明に係るリチウム塩としては、ハロゲンを含まないリチウム塩であってもハロゲンを含むハロゲン化リチウムであっても使用することができる。ハロゲンを含まないリチウム塩を使用する場合、上述したハロゲン化物と併用すればよい。
【0075】
一方、ハロゲン化リチウムを使用する場合、上述したハロゲン化物と併用することも可能である。また、ハロゲン化物を使用せず、ハロゲン化リチウムを非水系電解質に含有させて用いることもできる。このため、非水系電解質を簡便に調製する観点から、ハロゲン化リチウムを用いることが好ましい。
【0076】
リチウム塩の具体例としては、ハロゲンを含まないリチウム塩として、六フッ化リン酸リチウム(LiPF6)、四フッ化ホウ素リチウム(LiBF4)、過塩素酸リチウム(LiClO4)、ビスペンタフルオロエタンスルホン酸イミド(LiBETI)、リチウムビス(トリフルオロメタンスルホニル)イミド(LiTFSI)などを挙げることができる。一方、ハロゲン化リチウムとして、臭化リチウム、ヨウ化リチウムなどを挙げることができる。
【0077】
非水系電解液におけるリチウム塩(ハロゲン化リチウム)の濃度は、非水系媒体、リチウム塩の種類によって異なるが、概して、0.3mol dm−3以上、2.0mol dm−3以下とすることができ、好ましくは、0.8mol dm−3以上、1.2mol dm−3以下とすることができる。リチウム塩の濃度が上記範囲であることにより、電気化学キャパシタの負極電位の平坦性を好適に発現させることができる。
【0078】
<3.電極>
本電気化学キャパシタは、互いに対向配置された一対の電極を備え、この電極間に非水系電解液が介在する構成になっている。
【0079】
電極は、本電気化学キャパシタがキャパシタとして動作し得るものであれば、特に限定されない。例えば、本電気化学キャパシタが電気二重層キャパシタである場合、電極としては、通常、高比表面積を有する分極性電極(正極及び負極)を用いる。このような分極性電極の材料としては、例えば活性炭が挙げられる。上記活性炭は形状を限定せず、粒子状もしくは繊維布状等を用いることができる。また、上記活性炭以外の非多孔性炭素であるカーボンナノチューブ、カーボンナノホーン、フラーレン、グラフェン、ケッチェンブラック、カーボンナノファイバー、ハードカーボン等の材料を電極として用いることができる。
【0080】
ハードカーボン電極としては、公知の構成を採用でき、例えば、ハードカーボン、導電助剤、結着剤および増粘剤から構成できる。導電助剤としては、カーボンブラック、アセチレンブラック、ケッチェンブラック等の炭素類、黒鉛、金属類を例示できる。また、結着剤としては、ポリフッ化ビニリデン、スチレンブタジエンゴム、ポリテトラフルオロエチレンなどのポリマーを例示でき、増粘剤としては、カルボキシメチルセルロース、エチレングリコールなどを例示できる。本発明に係る電気化学キャパシタでは、分極性電極のうち少なくとも負極は、ハードカーボンによって構成されていてもよい。具体的には、正極に活性炭、負極にハードカーボンを適用することができ、当該正極および負極は、リチウム塩を用いた電気化学キャパシタにおいて好適に適用される。
【0081】
また、炭素以外にも、電極材料として、金属酸化物もしくは金属、導電性高分子等に加えて、これらの複合材料を挙げることができる。
【0082】
また、電極は、ハロゲンを含む水溶液に浸漬する前処理が行われていてもよい。前処理するための水溶液は、ハロゲンを含む水溶液であれば、特に限定されない。具体的には、臭素水、ヨウ素を含む水溶液等が挙げられる。なお、ヨウ素を含む水溶液には、ヨウ素の他にヨウ化物塩が含まれていてもよい。
【0083】
以上のように、本電気化学キャパシタでは、電解液としてハロゲン化物を溶解した非水系電解液を用いることにより、大幅なエネルギー密度の向上を実現することができる。そして、本電気化学キャパシタが電気二重層キャパシタである場合、電気二重層キャパシタの搭載先として考えられる電気自動車、家電製品、自然エネルギー蓄電システム等に適用することができる。そして、これらに適用した場合、体積あたりのエネルギー密度を大幅に向上することができるため、高性能かつコンパクトな蓄電デバイスを提供することができる。
【0084】
また、本電気化学キャパシタの電荷貯蔵メカニズムは、従来と全く異なるため、このシステムは、リチウムイオン二次電池の正極や色素増感型太陽電池とキャパシタとを組み合わせた光キャパシタ等に適用することができる。よって、本電気化学キャパシタの電極として、電気二重層キャパシタ、シュードキャパシタ、リチウムイオン二次電池の正極、光キャパシタ等に用いられる電極を用いることができる。
【0085】
〔実施の形態2〕
本発明の他の実施形態について説明すると以下の通りである。
【0086】
本実施形態の電気化学キャパシタ(以下、本電気化学キャパシタと記す)は、互いに対向配置され、正極及び負極からなる一対の電極と、ヨウ化物塩を含む水系電解液とを備えている。本発明の電気化学キャパシタにおいては、水系電解液は、一対の電極間に介在している。また、本電気化学キャパシタは、セパレータを備えている。本電気化学キャパシタがセパレータを備えた場合、電極はセパレータを介して対向配置される。
【0087】
本電気化学キャパシタによれば、正極は、ヨウ素を含む水溶液に浸漬する前処理が行われており、かつヨウ化物塩を含む水系電解液は、一対の電極間に介在している。このため、正極の細孔内において、電解液に存在するヨウ化物イオン(I−)(還元体)と前処理にて供給されたI−より高い酸化数を有するヨウ化物(酸化体)の平衡反応により、正極電位の高電位側へのシフトが起こり、充放電時において、この電位でハロゲン化物のレドックス反応が起きる(電荷貯蔵反応)。その結果、上記実施の形態1にて説明した図1の右側の充放電カーブと同様に、正極電位は、ハロゲンのレドックス反応を起こす電位領域内でほとんど変化しない(レドックス反応応答)。このため、本電気化学キャパシタの電圧は、負極電位の変化に依存することになる。それゆえ、本電気化学キャパシタは、従来の電気二重層キャパシタよりも、充放電時間が大幅に長くなり、容量が高くなる。
【0088】
本電気化学キャパシタに適用される水系電解液は、ヨウ化物塩を含有する水溶液であれば、特に限定されない。また、ヨウ化物イオンと組み合わされてヨウ化物塩を構成するカチオン種としては、例えば、ナトリウムイオン、カリウムイオン、セシウムイオン等が好ましく、ナトリウムイオン、カリウムイオンがより好ましい。
【0089】
本電気化学キャパシタに適用可能な「ヨウ化物塩」としては、上述したカチオン種とヨウ化物イオンとの組み合わせからなる塩であることが好ましい。中でも特に好ましい具体例を挙げると、ヨウ化カリウム(KI)、ヨウ化ナトリウム(NaI)等が挙げられる。
【0090】
水系電解液におけるヨウ化物塩の濃度は、水系媒体の種類によって異なるが、概して、0.3mol dm−3以上、3.0mol dm−3以下とすることができ、好ましくは、0.8mol dm−3以上、1.0mol dm−3以下とすることができる。ヨウ化物塩の濃度が上記範囲であることにより、電気化学キャパシタの正極におけるレドックス反応を好適に発現させることができる。
【0091】
また、本電気化学キャパシタにおける電極の構成材料は、上記実施の形態1と同様であるので、説明を省略する。本電気化学キャパシタにおいては、一対の電極のうち正極は、ヨウ素を含む水溶液に浸漬する前処理が行われている。ヨウ素を含む水溶液には、ヨウ素の他にヨウ化物塩が含まれていてもよい。
【0092】
本発明は上述した実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、それぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【0093】
以下、実施例を示し、本発明の実施の形態についてさらに詳しく説明する。もちろん、本発明は以下の実施例に限定されるものではなく、細部については様々な態様が可能であることはいうまでもない。
【実施例】
【0094】
以下の実施例1、2、及び比較例1では、以下の評価用電気化学キャパシタセルを使用した。
【0095】
セル:テフロン(登録商標)製スクリュー型セル
電極:活性炭繊維布(ACF)〔ACC−5092−20(日本カイノール株式会社製〕直径10mm
集電板:白金板〔株式会社ニラコ社製〕直径11mm
セパレータ:ガラス製ろ紙〔GB−100R(東洋濾紙株式会社製)〕直径13mm
擬似参照極:白金線〔株式会社ニラコ社製〕。
【0096】
〔実施例1〕
非水系媒体として、イオン液体である1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMIBF4:東洋合成工業株式会社製)を用いた。また、臭化物塩として、1−エチル−3−メチルイミダゾリウムブロマイド(EMIBr:和光純薬工業株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、EMIBrを、1.0mol dm−3の濃度になるようにEMIBF4に溶解させて、非水系電解液である1.0mol dm−3EMIBr/EMIBF4を調製した。
【0097】
次に、電気化学キャパシタセルを作製した。具体的には、調製した1.0mol dm−3EMIBr/EMIBF4をサンプル管に注ぎ、該サンプル管に2枚のセパレータと2枚の電極(重量を測定済)とを入れた。その後、セパレータ及び電極の両者に非水系電解液を十分に含浸させるため、これらを減圧装置内にて、30分間、10−1Paに保った。その後、テフロン(登録商標)製試験セルに、白金板|電極|セパレータ|参照極|セパレータ|電極|白金板となるように配置し、電気化学キャパシタセルを作製した。なお、上記白金板にはリードとして白金線が溶接されている。また、作製したセルは、密閉容器に入れられ、密閉することで空気中の水分を遮断し、かつ不活性雰囲気を維持した状態になっている。なお、全ての作業は、アルゴン雰囲気のグローブボックス内で行われた。
【0098】
〔実施例2〕
非水系媒体として、イオン液体である1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMIBF4:東洋合成工業株式会社製)を用いた。また、ヨウ化物塩として、1−エチル−3−メチルイミダゾリウムヨージド(EMII:和光純薬工業株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、EMIIを、1.0mol dm−3の濃度になるようにEMIBF4に溶解させて、非水系電解液である1.0mol dm−3EMII/EMIBF4を調製した。
【0099】
次に、電気化学キャパシタセルを作製した。具体的には、調製した1.0moldm−3EMII/EMIBF4をサンプル管に注ぎ、該サンプル管に2枚のセパレータと2枚の電極(重量を測定済)とを入れた。その後、セパレータ及び電極の両者に非水系電解液を十分に含浸させるため、これらを減圧装置内にて30分間、10−1Paに保った。その後、テフロン(登録商標)製試験セルに、白金板|電極|セパレータ|参照極|セパレータ|電極|白金板となるように配置し、電気化学キャパシタセルを作製した。なお、上記白金板にはリードとして白金線が溶接されている。また、作製したセルは、密閉容器に入れられ、密閉することで空気中の水分を遮断し、かつ不活性雰囲気を維持した状態になっている。なお、全ての作業は、アルゴン雰囲気のグローブボックス内で行われた。
【0100】
〔比較例1〕
比較例1では、イオン液体である1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMIBF4:東洋合成工業株式会社製)を、非水系電解液として用いて、電気化学キャパシタセルを作製した。
【0101】
具体的には、EMIBF4をサンプル管に注ぎ、該サンプル管に2枚のセパレータと2枚の電極(重量を測定済)とを入れた。その後、セパレータ及び電極の両者に非水系電解液を十分に含浸させるため、上記試験セルを減圧装置内にて、30分間、10−1Paに保った。その後、テフロン(登録商標)製試験セルに、白金板|電極|セパレータ|参照極|セパレータ|電極|白金板となるように配置し、電気化学キャパシタセルを作製した。なお、上記白金板にはリードとして白金線が溶接されている。また、作製したセルは、密閉容器に入れられ、密閉することで空気中の水分を遮断し、かつ不活性雰囲気を維持した状態になっている。なお、全ての作業は、アルゴン雰囲気のグローブボックス内で行われた。
【0102】
実施例1,2及び比較例1それぞれで作製した電気化学キャパシタセルについて、キャパシタ性能を調べた。
【0103】
まず、実施例1,2及び比較例1の電気化学キャパシタセルについて、充放電カーブを測定した。具体的には、各電気化学キャパシタセルについて、作動電圧2Vで、100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図2は、実施例1,2及び比較例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、図2(a)はセル全体の電圧に基づく充放電カーブを示し、図2(b)は正極、負極各々の電位に基づく充放電カーブを示す。
【0104】
図2(a)に示されるように、実施例1及び2の電気化学キャパシタセルは、典型的な電気化学キャパシタの充放電カーブを示した。加えて、両者とも比較例1の電気化学キャパシタセルと比較して、充放電時間が大幅に増加した。
【0105】
図2(b)に示されるように、非水系電解液がEMIBr/EMIBF4である実施例1の電気化学キャパシタセルでは、正極電位について、充電における初期段階及び放電における末期段階で、電気二重層応答が見られた。すなわち、充電における初期段階で正極電位の上昇が見られ、放電における末期段階で正極電位の下降が見られた。また、充電における初期段階及び放電における末期段階以外の期間では、正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。また、非水系電解液がEMII/EMIBF4である実施例2の電気化学キャパシタセルでは、充電の初期段階から正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。一方、非水系電解液がEMIBF4のみである比較例1の電気化学キャパシタセルでは、充電及び放電過程において、正極電位がそれぞれ上昇及び下降する典型的な電気二重層応答が見られた。よって、図2(a)及び(b)の結果から、レドックス反応種を含む非水系電解液を用いることで容量が大幅に増加することがわかった。
【0106】
次に、実施例1,2及び比較例1の電気化学キャパシタセルについて、放電容量を測定した。図3に、放電容量の測定結果を示す。図3に示されるように、実施例2の電気化学キャパシタセルは、実施例1の電気化学キャパシタセルよりも放電容量が増加していた。I−のレドックス反応は、Br−よりも低い反応電位で始まる。このため、非水系電解液がEMII/EMIBF4である実施例2の電気化学キャパシタセルは、EMIBr/EMIBF4である実施例1の電気化学キャパシタセルよりも、充電初期からハロゲンのレドックス反応を伴うため、結果、高い放電容量が得られたと考えられる。
【0107】
また、実施例2の電気化学キャパシタセルは、比較例1の電気化学キャパシタセルと比較すると、電流密度100mA g−1において、放電容量が2.5倍高くなっていた。また、実施例1の電気化学キャパシタセルは、比較例1の電気化学キャパシタセルよりも同電流密度において、放電容量が2倍に増加していた。
【0108】
次に、実施例1の電気化学キャパシタセルについて、レドックス反応種(臭化物)の正極から電解液あるいは負極への拡散が抑制されるか否かを確認した。具体的には、実施例1及び比較例1の電気化学キャパシタセルについて、作動電圧2.0Vで15時間保持してリーク電流試験を実施し、両電気化学キャパシタセルでリーク電流の比較を行った。結果を図4に示す。
【0109】
図4に示されるように、実施例1の電気化学キャパシタセルは、試験開始後の4時間まで、比較例1の電気化学キャパシタセルよりも応答電流(リーク電流)が大きくなっていた。これは、実施例1の電気化学キャパシタセルにおける未充電部分の影響であると考えられる。また、試験開始4時間後以降では、リーク電流は、実施例1及び比較例1の電気化学キャパシタセルでほぼ同じであった。図4の結果から、実施例1の電気化学キャパシタセルでは、レドックス反応種の拡散が抑制されていることが確認された。
【0110】
次に、実施例1及び比較例1の電気化学キャパシタセルについて、0.5〜2.0Vの作動電圧範囲で、500mA g−1の電流密度で1,000サイクル充放電し、各サイクルにおけるセル当たりの放電容量、およびクーロン効率の変化を調べた。図5は、実施例1及び比較例1の電気化学キャパシタセルについて1,000サイクル充放電した場合の、セル当たりの放電容量、およびクーロン効率の変化を示すグラフである。また、図5(a)はセル当たりの放電容量の変化を示し、図5(b)はクーロン効率の変化を示す。なお、クーロン効率は、「(放電時間/充電時間)×100」で算出される効率である。
【0111】
図5(a)及び(b)に示されるように、実施例1の電気化学キャパシタセルは、1,000サイクルを経ても、放電容量の低下が見られず、クーロン効率もほぼ100%に維持されていた。このことから、実施例1の電気化学キャパシタセルは、安定なサイクル特性を示すことがわかる。
【0112】
〔実施例3〕
2枚の活性炭繊維布電極のうち、正極として利用するものを臭素水(1wt%;関東化学株式会社製)に浸漬させた。浸漬後、上記電極について、余分な臭素水を蒸留水で洗い流し、必要に応じて5〜10分程度の超音波洗浄を行った。そして、洗浄した2枚の電極を100℃にて1〜2日間減圧乾燥(10−1Pa)し、臭素水で前処理した正極を得た。
【0113】
臭素水で前処理した正極を用いて、実施例1と同様の方法で電気化学キャパシタセルを作製した。なお、正極の前処理以外は実施例1と同様であるため説明を省略する。
【0114】
〔実施例4〕
実施例3と同様の方法で、臭素水で前処理した正極を得た。
【0115】
また、非水系媒体として、有機溶媒であるプロピレンカーボネート(PC)を用いた。また、臭化物として、1−エチル−3−メチルイミダゾリウムブロマイド(EMIBr:和光純薬工業株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、EMIBrを、1.0mol dm−3の濃度になるようにPCに溶解させて、非水系電解液である1.0mol dm−3EMIBr/PCを調製した。
【0116】
非水系電解液として1.0mol dm−3EMIBr/PCを用いて、実施例3と同様の方法で電気化学キャパシタセルを作製した。
【0117】
実施例3及び4それぞれで作製した電気化学キャパシタセルについて、キャパシタ性能を調べた。
【0118】
まず、実施例3及び4の電気化学キャパシタセルについて、充放電カーブを測定した。具体的には、各電気化学キャパシタセルについて、5mA cm−2の電流密度で充放電を行ったときの充放電カーブを測定した。図6は、実施例3及び4、実施例1、比較例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフである。図6(a)は実施例3及び実施例1、比較例1の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示し、図6(b)は実施例4の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示す。
【0119】
図6(a)に示されるように、非水系電解液がEMIBr/EMIBF4であり、かつ電極が臭素水で前処理された実施例3の電気化学キャパシタセルでは、正極電位の停滞が観側された。すなわち、正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。加えて、正極の前処理を行っていない系(実施例1)と比較すると、正極電位の停滞範囲が広く、安定している。一方、実施例3の電気化学キャパシタは、比較例1の電気化学キャパシタと比較して、高容量である(充放電にかかる時間が長い)ことが明らかとなった。このことから、電極が臭素水で前処理された電極は、高容量化、正極電位の安定化という観点で、効果が非常に高いといえる。
【0120】
また、図6(b)に示されるように、非水系電解液がEMIBr/PCであり、かつ電極が臭素水で前処理された実施例4の電気化学キャパシタセルにおいても、実施例3と同様に、正極電位の停滞が観側された。つまり、非水系媒体はイオン液体及び有機溶媒にかかわらず、両者の非水系電解液に対して、正極の臭素水による前処理は正極電位の停滞に効果的である。
【0121】
以下の実施例5及び比較例2、3では、以下の実験器具を使用した。
【0122】
セル:テフロン(登録商標)製スクリュー型セル
電極:活性炭繊維布(ACF)〔ACC−5092−20(日本カイノール株式会社製〕直径10mm
集電板:白金板〔株式会社ニラコ社製〕直径11mm
セパレータ:ガラス製ろ紙〔GB−100R(東洋濾紙株式会社製)〕直径13mm
参照極:Ag/AgCl参照極〔北斗電工株式会社製〕。
【0123】
〔実施例5〕
ヨウ素を、1wt%の濃度になるように3.5mol dm−3ヨウ化ナトリウム(NaI)水溶液に溶解させて、ヨウ素水を調製した。
【0124】
作製したヨウ素水をサンプル管に入れ、正極に用いるACFを入れた。また、別のサンプル管に3.5mol dm−3NaI水溶液(電解液)を入れ、負極に用いるACF及びセパレータを入れた。正極、負極、及びセパレータに電解液を十分に含浸させるために、これらをバキュームオーブン中に入れ、30分間、減圧20kPaに保った。その後、テフロン(登録商標)製試験セルに白金板と白金線とスペーサーとをつなげ,上記正極及び上記負極を向かい合わせに並べ、その間にセパレータを挟み込むことで電気化学キャパシタセルを作製した。
【0125】
次に、組み立てた電気化学キャパシタセルを50mlビーカーに入れ、そこに電解液を加えて、電気化学キャパシタセルを電解液に浸した。それを、もう一度20kPaの下で30分間減圧含浸を行った。その後、電気化学特性を評価した。
【0126】
〔比較例2〕
電解液である3.5mol dm−3 臭化ナトリウム(NaBr)水溶液をサンプル管に入れ、その中に2枚の電極と1枚のセパレータとを入れた。その後、電極及びセパレータに電解液を十分に含浸させるため、それらをバキュームオーブン中に入れ,30分間、減圧20kPaに保った。その後、白金集電板を含むテフロン(登録商標)製試験セルに上記2枚の電極とセパレータとを挟み込むことで電気化学キャパシタセルを作製した。そして、組み立てた電気化学キャパシタセルを50mlビーカーに入れ、そこに電解液を加え、電気化学キャパシタセルを電解液に浸した。それを、もう一度20kPaの下で30分間減圧含浸を行った。その後、電気化学特性を評価した。
【0127】
〔比較例3〕
電解液である1.75mol dm−3硫酸水溶液をサンプル管に入れ、その中に2枚の電極と1枚のセパレータとを入れた。その後、電極及びセパレータに電解液を十分に含浸させるため、それらをバキュームオーブン中に入れ,30分間、減圧20kPaに保った。その後、白金集電板を含むテフロン(登録商標)製試験セルに上記2枚の電極とセパレータとを挟み込むことで電気化学キャパシタセルを作製した。そして、組み立てた電気化学キャパシタセルを50mlビーカーに入れ、そこに電解液を加え、電気化学キャパシタセルを電解液に浸した。それを、もう一度20kPaの下で30分間減圧含浸を行った。その後、電気化学特性を評価した。
【0128】
実施例5及び比較例2,3のそれぞれで作製した電気化学キャパシタセルについて、キャパシタ性能を調べた。
【0129】
まず、実施例5及び比較例2の電気化学キャパシタセルについて、充放電カーブを測定した。具体的には、実施例5の電気化学キャパシタセルについて、0.5〜1.0Vの作動電圧範囲で、100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。また、比較例3の電気化学キャパシタセルについては、0〜1.0Vの作動電圧範囲で、100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図7は、実施例5及び比較例2の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、正極、負極各々の電位に基づく充放電カーブを示す。なお、図7において、実線は実施例5の電気化学キャパシタセルを示し、点線は比較例2の電気化学キャパシタセルを示す。
【0130】
図7に示されるように、電極がヨウ素水で前処理された実施例5の電気化学キャパシタセルでは、正極電位の停滞が観側された。すなわち、ヨウ素化物のレドックス応答により、正極電位がほぼ一定(平坦)であった。一方、比較例2の電気化学キャパシタセルでは、正極において、時間とともに正極電位が変化する典型的な電気二重層応答が見られた。加えて、実施例5の電気化学キャパシタの充電前正極電位は、比較例2の充電前正極電位よりも高電位であった。よって、実施例5の電気化学キャパシタは、セル電圧変位が小さいにもかかわらず比較例2の電気化学キャパシタと同程度の充放電時間を示すことから、高容量であることが明らかとなった。
【0131】
これらの結果から、電解液が水系・非水系に関わらず、ハロゲンを含む水溶液で電極を浸漬する前処理を行い、ハロゲン化物を含む電解液を使用することで、キャパシタの高容量化、正極電位の維持を実現できることがわかった。
【0132】
次に、実施例5及び比較例3の電気化学キャパシタセルについて、充電電流密度100mA g−1にて1.0Vまで充電後、100〜10,000mA g−1の各放電電流密度にて放電した際の放電容量を測定した。図8に、放電容量の測定結果を示す。図8の結果から、全ての電流密度において、実施例5(loaded I2)の電気化学キャパシタセルは、一般的な水系電解液である硫酸(H2SO4)を用いた比較例3(aqueous H2SO4 solution)よりも放電容量が高くなっていることがわかった。
【0133】
次に、実施例5及び比較例3の電気化学キャパシタセルについて、5,000mA g−1の電流密度で100,000サイクル充放電し、セル当たりの放電容量を調べた。図9は、実施例5(loaded I2)及び比較例3(aqueous H2SO4solution)の電気化学キャパシタセルについて100,000サイクル充放電した場合の、セル当たりの放電容量を示すグラフである。
【0134】
図9に示されるように、実施例5の電気化学キャパシタセルは、100,000サイクルを経ても、放電容量の低下が見られなかった。このことから、実施例5の電気化学キャパシタセルは、安定なサイクル特性を示すことがわかった。加えて、100,000サイクルの間、比較例3の電気化学キャパシタが示す放電容量をはるかに上まわっており、ハロゲンを含む水溶液で前処理し、ハロゲン化物を含む電解液を用いる電気化学キャパシタの優位性が明白である。
【0135】
以下の実施例6では、実施例1と同じ評価用電気化学キャパシタセルを使用した。
【0136】
〔実施例6〕
非水系媒体として、イオン液体である1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMIBF4:東洋合成工業株式会社製)を用いた。また、ハロゲン化リチウムとして、臭化リチウム(LiBr:キシダ化学株式会社製))を用いた。具体的には、5mlのメスフラスコを用いて、LiBrを、1.0mol dm−3(1.0M)の濃度になるようにEMIBF4に溶解させて、非水系電解液であるLiBr/EMIBF4を調製した。次に、実施例1と同様に電気化学キャパシタセルを作製した。
【0137】
以下の実施例7および比較例4では、以下の評価用電気化学キャパシタセルを使用した。
【0138】
セル:テフロン(登録商標)製スクリュー型セル
正極:活性炭繊維布(ACF)〔ACC−5092−20(日本カイノール株式会社製)直径12mm
負極:ハードカーボン 直径12mm
導電助剤:アセチレンブラック(AB)
結着剤 :アセチレンブタジエンゴム(40重量%)(SBR)
増粘剤 :カルボキシメチルセルロース(2重量%)(CMC)
組成比 :ハードカーボン:AB:SBR:CMC=93:3:2:2
集電板:白金板〔株式会社ニラコ社製〕直径11mm
セパレータ:ガラス製ろ紙〔GB−100R(東洋濾紙株式会社製)〕直径13mm
擬似参照極:白金線〔株式会社ニラコ社製〕。
【0139】
〔実施例7〕
非水系媒体として、エチレンカーボネート(EC)およびジメチルカーボネート(DMC)を1:1の体積比にて用いた。また、ハロゲン化リチウムとして、臭化リチウム(LiBr:キシダ化学株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、LiBrを、1.0mol dm−3の濃度になるようにEC/DMCの混合溶媒に溶解させて、非水系電解液であるLiBr/EC/DMCを調製した。
【0140】
次に、電気化学キャパシタセルを作製した。具体的には、調製した1.0mol LiBr/EC/DMCをサンプル管に注ぎ、該サンプル管に2枚のセパレータ、正極および負極(重量を測定済)を入れた。その後、セパレータ、正極および負極に非水系電解液を十分に含浸させるため、これらを減圧装置内にて、30分間、10−1Paに保った。その後、テフロン(登録商標)製試験セルに、白金板|正極|セパレータ|参照極|セパレータ|負極|白金板となるように配置し、電気化学キャパシタセルを作製した。なお、上記白金板にはリードとして白金線が溶接されている。また、作製したセルは、密閉容器に入れられ、密閉することで空気中の水分を遮断し、かつ不活性雰囲気を維持した状態になっている。なお、全ての作業は、アルゴン雰囲気のグローブボックス内で行われた。
【0141】
〔比較例4〕
非水系媒体として、エチレンカーボネート(EC)およびジメチルカーボネート(DMC)を1:1の体積比にて用いた。また、電解質として六フッ化リン酸リチウム(LiPF6:キシダ化学株式会社製)を用いた。具体的には、5mlのメスフラスコを用いて、LiPF6を、1.0mol dm−3の濃度になるようにEC/DMCの混合溶媒に溶解させて、非水系電解液であるLiPF6/EC/DMCを調製した。次に、実施例7と同様にして電気化学キャパシタセルを作製した。
【0142】
〔実施例8〕
LiBrに代えてヨウ化リチウム(LiI:キシダ化学株式会社製)を用いた以外は実施例6と同様にして、電気化学キャパシタセルを作製した。
【0143】
〔比較例5〕
LiBrに代えてLiPF6を用いた以外は、実施例6と同様にして、電気化学キャパシタセルを作製した。
【0144】
実施例6、7、比較例4、実施例8および比較例5の電気化学キャパシタセルについてキャパシタ性能を調べた。
【0145】
まず、比較のために実施例1に係る、リチウム塩が使用されていない電気化学キャパシタセルについて、2V、2.3V、2.4Vの3種類の作動電圧にて100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図11(a)は、実施例1の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフである。
【0146】
一方、実施例6に係る、ハロゲン化リチウムが使用された電気化学キャパシタセルについて、2.0V、2.5V、2.6V、2.7V、3.0Vの5種類の作動電圧にて100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図11(b)は、実施例6の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフである。同図に示すように、ハロゲン化リチウムを添加した系では、正極電位の増大が観測され、電気化学キャパシタセルの作動電圧が拡大されている。
【0147】
さらに、実施例1および実施例6に係る電気化学キャパシタセルについて、2.0V〜3.0Vの作動電圧、500mA g−1の電流密度にて1000サイクル充放電したときのクーロン効率を測定した。図12(a)は、実施例1に係る電気化学キャパシタセルの測定結果を示すグラフであり、図12(b)は、実施例6に係る電気化学キャパシタセルの測定結果を示すグラフである。
【0148】
図12(a)に示すように、実施例1に係る電気化学キャパシタセルでは、作動電圧が2.3Vの測定条件でクーロン効率が90%程度となっており、作動電圧が2.4Vの測定条件でクーロン効率が84%程度となり、さらに作動電圧を上げるにつれてクーロン効率が低下した。すなわち、2.4V付近で負極からハロゲン化物イオンが拡散しているものと推察される。
【0149】
これに対して、図12(b)に示すように、実施例6に係る電気化学キャパシタセルでは、作動電圧が2.0V〜2.5Vではクーロン効率が95%以上と高い値が示されており、作動電圧が2.8Vでクーロン効率が90%程度となっている。すなわち、非水系電解液にハロゲン化リチウムを添加することにより、2.8Vの高い作動電圧であっても、負極からハロゲン化物イオンが拡散せず(離れず)、クーロン効率が高い電気化学キャパシタセルの作製に成功していることがわかる。
【0150】
次に、負極としてハードカーボンを用いた実施例7および比較例4に係る電気化学セルについて、1.6〜3.6Vの電圧範囲、500mA g−1の電流密度にて測定したセル全体の電圧を示す。図13は、実施例7及び比較例4の電気化学キャパシタセルにおける充放電カーブの測定結果を示すグラフであり、図13(a)はセル全体の電圧に基づく充放電カーブを示し、図13(b)は正極、負極各々の電位に基づく充放電カーブを示す。
【0151】
図13(a)に示されるように、実施例7に係るLiBrを用いた電気化学キャパシタセルは最大約3.5Vのセル電圧を示した。ハロゲンを含まないLiPF6を用いた比較例4の結果と実施例7の結果とを比較すると、実施例7では、充放電時間が約4倍となっており、ハロゲン化リチウムを使用した電気化学キャパシタセルは、セル電圧および充放電時間の両方に優れることが分かる。
【0152】
また、図13(b)に示されるように、非水系電解質がLiBr/EC/DMCである実施例7の電気化学キャパシタセルでは、正極電位について、充電における初期段階及び放電における末期段階で、電気二重層応答が見られた。すなわち、充電における初期段階で正極電位の上昇が見られ、放電における末期段階で正極電位の下降が見られた。また、充電における初期段階及び放電における末期段階以外の期間では、正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。また、非水系電解液がEMII/EMIBF4である実施例2の電気化学キャパシタセルでは、充電の初期段階から正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。
【0153】
一方、非水系電解液がLiBr/EC/DMCである比較例4の電気化学キャパシタセルでは、充電及び放電過程において、正極電位がそれぞれ上昇及び下降する典型的な電気二重層応答が見られた。よって、図13(a)及び(b)の結果から、LiBrのレドックス反応種を含む非水系電解液を用いることで容量が大幅に増加することが分かった。
【0154】
実施例7における作動電圧は3.6Vであり、本発明に係る非リチウム系の非水系電解質を使用した場合の作動電圧(2V)よりも優れた結果が得られており、作動電圧の拡大に成功したことが明確に示されている。
【0155】
図14は、実施例7及び比較例4の電気化学キャパシタセルについて、1000mA g−1の電流密度で1,000サイクル充放電した場合の、セル当たりの放電容量、およびクーロン効率の変化を示すグラフである。図14(a)はセル当たりの放電容量の変化を示し、図14(b)はクーロン効率の変化を示す。
【0156】
図14(a)に示されるように、実施例7の電気化学キャパシタセルでは、1000サイクルまで約25mA h g−1の放電容量を示したが、比較例4の電気化学キャパシタセルでは、600サイクルで約0mA h g−1の放電容量となり、本発明の優位性が示されている。また、図14(b)に示されるように、実施例7の電気化学キャパシタセルでは、1000サイクルまでのクーロン効率がほぼ100%であり、セル当たりの放電容量に加えて、クーロン効率についても優れたサイクル特性が示されている。
【0157】
実施例8および比較例5にて作製した電気化学キャパシタセルについて、充放電カーブを測定した。また、比較のため、実施例6の電気化学キャパシタセルについても充放電カーブを測定した。具体的には、電気化学キャパシタセルについて、作動電圧0.5〜2V(セル電圧)で、100mA g−1の電流密度で充放電を行ったときの充放電カーブを測定した。図15は、実施例6、8及び比較例5の電気化学キャパシタセルにおける正極、負極各々の電位に基づく充放電カーブを示すグラフである。
【0158】
図15に示すように、ハロゲン化リチウムとしてヨウ化リチウムを使用した実施例8では、充電の初期段階から正極電位がほぼ一定(平坦)であり、レドックス応答が見られた。一方、負極電位については、LiBrの実施例6と同様に、負極電位の変化が直線的であり、電気二重層応答が観測された。このように、ハロゲン化リチウムとしてLiIを使用した場合であっても、本発明に係るハロゲン化物がハロゲン化リチウムである電気化学キャパシタセルを作製できることが示されている。
【0159】
本発明は上述した各実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【産業上の利用可能性】
【0160】
本発明は、高容量化及び高エネルギー密度化を達成でき、かつ長期安定性に優れているので、コンデンサ業界、自動車業界、電池業界、家電業界等に利用することができる。
【特許請求の範囲】
【請求項1】
一対の電極を備え、該電極間に非水系電解液が介在した電気化学キャパシタであって、
上記非水系電解液は、ハロゲン化物を含有することを特徴とする電気化学キャパシタ。
【請求項2】
上記ハロゲン化物は、臭化物またはヨウ化物であることを特徴とする請求項1に記載の電気化学キャパシタ。
【請求項3】
上記非水系電解液は、非水系媒体としてのイオン液体を含有することを特徴とする請求項1または2に記載の電気化学キャパシタ。
【請求項4】
上記ハロゲン化物は、上記イオン液体と同一のカチオンを有するハロゲン化塩であることを特徴とする請求項3に記載の電気化学キャパシタ。
【請求項5】
上記イオン液体は、1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMI−BF4)であることを特徴とする請求項3または4に記載の電気化学キャパシタ。
【請求項6】
上記非水系電解液は、非水系媒体としての有機溶媒を含有することを特徴とする請求項1または2に記載の電気化学キャパシタ。
【請求項7】
上記有機溶媒は、プロピレンカーボネート(PC)であることを特徴とする請求項6に記載の電気化学キャパシタ。
【請求項8】
上記一対の電極は、活性炭を含む分極性電極であることを特徴とする請求項1〜7の何れか1項に記載の電気化学キャパシタ。
【請求項9】
上記分極性電極のうち少なくとも正極は、ハロゲンを含む水溶液に浸漬する前処理が行われていることを特徴とする請求項8に記載の電気化学キャパシタ。
【請求項10】
上記非水系電解液がリチウム塩を含有することを特徴とする請求項1〜9の何れか1項に記載の電気化学キャパシタ。
【請求項11】
上記リチウム塩は、ハロゲン化リチウムであることを特徴とする請求項10に記載の電気化学キャパシタ。
【請求項12】
上記ハロゲン化リチウムが、臭化リチウムまたはヨウ化リチウムであることを特徴とする請求項11に記載の電気化学キャパシタ。
【請求項13】
上記分極性電極のうち少なくとも負極は、ハードカーボンによって構成されていることを特徴とする請求項8に記載の電気化学キャパシタ。
【請求項14】
正極及び負極からなる一対の電極を備え、該電極間に水系電解液が介在した電気化学キャパシタであって、
上記水系電解液は、ヨウ化物塩を含む水溶液であるとともに、
上記正極は、ヨウ素を含む水溶液に浸漬する前処理が行われていることを特徴とする電気化学キャパシタ。
【請求項1】
一対の電極を備え、該電極間に非水系電解液が介在した電気化学キャパシタであって、
上記非水系電解液は、ハロゲン化物を含有することを特徴とする電気化学キャパシタ。
【請求項2】
上記ハロゲン化物は、臭化物またはヨウ化物であることを特徴とする請求項1に記載の電気化学キャパシタ。
【請求項3】
上記非水系電解液は、非水系媒体としてのイオン液体を含有することを特徴とする請求項1または2に記載の電気化学キャパシタ。
【請求項4】
上記ハロゲン化物は、上記イオン液体と同一のカチオンを有するハロゲン化塩であることを特徴とする請求項3に記載の電気化学キャパシタ。
【請求項5】
上記イオン液体は、1−エチル−3−メチルイミダゾリウムテトラフルオロボレート(EMI−BF4)であることを特徴とする請求項3または4に記載の電気化学キャパシタ。
【請求項6】
上記非水系電解液は、非水系媒体としての有機溶媒を含有することを特徴とする請求項1または2に記載の電気化学キャパシタ。
【請求項7】
上記有機溶媒は、プロピレンカーボネート(PC)であることを特徴とする請求項6に記載の電気化学キャパシタ。
【請求項8】
上記一対の電極は、活性炭を含む分極性電極であることを特徴とする請求項1〜7の何れか1項に記載の電気化学キャパシタ。
【請求項9】
上記分極性電極のうち少なくとも正極は、ハロゲンを含む水溶液に浸漬する前処理が行われていることを特徴とする請求項8に記載の電気化学キャパシタ。
【請求項10】
上記非水系電解液がリチウム塩を含有することを特徴とする請求項1〜9の何れか1項に記載の電気化学キャパシタ。
【請求項11】
上記リチウム塩は、ハロゲン化リチウムであることを特徴とする請求項10に記載の電気化学キャパシタ。
【請求項12】
上記ハロゲン化リチウムが、臭化リチウムまたはヨウ化リチウムであることを特徴とする請求項11に記載の電気化学キャパシタ。
【請求項13】
上記分極性電極のうち少なくとも負極は、ハードカーボンによって構成されていることを特徴とする請求項8に記載の電気化学キャパシタ。
【請求項14】
正極及び負極からなる一対の電極を備え、該電極間に水系電解液が介在した電気化学キャパシタであって、
上記水系電解液は、ヨウ化物塩を含む水溶液であるとともに、
上記正極は、ヨウ素を含む水溶液に浸漬する前処理が行われていることを特徴とする電気化学キャパシタ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【公開番号】特開2012−119653(P2012−119653A)
【公開日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願番号】特願2011−70762(P2011−70762)
【出願日】平成23年3月28日(2011.3.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 刊行物名 第51回電池討論会 講演要旨集 発行日 平成22年11月8日 発行所 社団法人電気化学会電池技術委員会(社団法人電気化学会)
【出願人】(399030060)学校法人 関西大学 (208)
【Fターム(参考)】
【公開日】平成24年6月21日(2012.6.21)
【国際特許分類】
【出願日】平成23年3月28日(2011.3.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 刊行物名 第51回電池討論会 講演要旨集 発行日 平成22年11月8日 発行所 社団法人電気化学会電池技術委員会(社団法人電気化学会)
【出願人】(399030060)学校法人 関西大学 (208)
【Fターム(参考)】
[ Back to top ]

