電気化学的セル
【課題】 精度、信頼性、速度のいずれかあるいはすべてを向上させた装置を提供する。
【解決手段】 電気化学電池においてレドックス・スペシーズの濃度を測定する装置であって、作用電極および対電極(または対/参照電極)を有し、それらの電極が互いに対面している電気化学電池と、前記電極間に電位差を印加する手段と、経時電流変化を測定する手段とを包含する装置において、作用電極が20−200μmだけ対電極から隔たっていることを特徴とする装置。
【解決手段】 電気化学電池においてレドックス・スペシーズの濃度を測定する装置であって、作用電極および対電極(または対/参照電極)を有し、それらの電極が互いに対面している電気化学電池と、前記電極間に電位差を印加する手段と、経時電流変化を測定する手段とを包含する装置において、作用電極が20−200μmだけ対電極から隔たっていることを特徴とする装置。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオセンサ、一層詳しくは、キャリヤ内の検体の濃度を測定する電気化学バイオセンサに関する。本発明は、特に、血液中のグルコースの濃度を測定するのに有用であり、ここではその用途について説明するが、本発明が他の分析測定にも適用可能であることは了解されたい。
【背景技術】
【0002】
電気化学バイオセンサは、一般的には、作用電極、対電極、参照電極を有する電気化学的セルを包含する。時には、対電極と参照電極の機能を「対/参照」電極または「疑似参照電極」と呼ばれる単一の電極にまとめることもある。ここで使用する「対電極」という用語は文脈上認められる場合には対/参照電極を含む。
【0003】
検体を含むサンプルは電気化学的セル内の酵素、レドックス・メディエイタを含む試液と接触させられる。メディエイタが還元される(少なくとも1つの電子を受け取る)一方で、検体が酸化される(少なくとも1つの電子を失う)か、あるいは、この逆の反応が行われる。通常、酸化されるのは検体であり、還元されるのはメディエイタである。本発明は、ここでは原則としてこのようなシステムについて説明するが、検体が還元され、メディエイタが酸化されるシステムにも適用可能である。
【0004】
血液グルコース・レベルを監視するために糖尿病患者に使用されたり、診療所、病院で使用されたりするような電気化学グルコース分析器は、普通、グルコースオキシダーゼデヒドロゲナーゼ(GOD)のような酵素や、フェリシアニドあるいはフェロシアニドのようなレドックス・メディエイタを使用することを基本とする。このような従来のシステムでは、検体(たとえば、グルコース)を含有するサンプル(たとえば、血液)は電気化学的セル内の試液と接触させられる。グルコースは酸化されてグルコン酸となり、それによって、グルコースオキシダーゼが還元される。次に、メディエイタがグルコースオキシダーゼを再度酸化させ、還元される。還元されたメディエイタは、電子を作用電極に移送するときに再酸化させられる。ファラデー電流の正確な評価を得るに充分な所定時間の経過後、グルコースの濃度が電流の大きさあるいは次に測定された電圧の大きさから推断される。
【0005】
従来の電気化学的セルは2つ(または3つ)の隣接した電極からなり、これらの電極は絶縁体の片側で互いに隔たっており、測定装置に接続できるようになっている。血液サンプルを置くターゲット領域が電極上あるいはそれらの間に構成してある。審査中の出願PCT/AU95/00207が多孔性膜の両側に電極を配置し、電極の1つが液体透過性ターゲット領域を有する電気化学的セルを記載している。
【0006】
従来技術では、作用電極を対電極(または対/参照電極)から充分に離し、1つの電極での電気化学反応の生成物が他方の電極のところでの生成物と干渉しないようにする必要がある。実際、許容できる精度を得るには、電極が500μmより大きく分離している必要がある。
【0007】
電気化学的セルの各バッチは、予め較正しておかなければならない。サンプル成分や周囲条件に応じて、バッチの変動のために精度を得られないことがある。
【0008】
このようなバイオセンサの精度、信頼性を向上させることが望まれる。この目的の達成は、血液内の検体の濃度を測定することを意図したセンサの場合、血液が溶解ガス、イオン、コロイド、コンプレックス・ミセル、小規模細胞破片、主水性媒体内の生きている細胞成分を含んでいるために、難しい。これらのうちいずれもが測定の邪魔となる可能性がある。現存のセンサは、また、サンプル内に存在する可能性があり、作用電極のところで酸化させられて、当該検体と誤って識別される可能性のある他の妨害物質からの影響も受けやすい。あるいは、妨害物質はレドックス・メディエイタの酸化形態を還元する可能性がある。これらの影響は検体濃度の推定値を人工的に高めることになる。これに加えて、常に、検体を加える前に若干の還元したレドックス・メディエイタが存在し、その濃度を知っていて、還元メディエイタの測定値から引いて、検体の正確な濃度を求める必要がある。さらに、血液中の酸素も、フェロシアニドと競合して、グルコースオキシダーゼデヒドロゲナーゼ(GOD)に対するレドックス・メディエイタとして作用する。こうして、高い酸素濃度がグルコース濃度の推定値を低下させる可能性がある。さらに、測定値は、湿度、温度、溶液粘度、ヘマトクリット値の変化のようなファクタに敏感である。
【特許文献1】特開平5−312761号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明の目的は、分析方法および従来技術の欠点のうちの少なくともいくつかを回避あるいは改善する、この方法で使用する装置を提供することにある。本発明の好ましい形態の目的は、精度、信頼性、速度のいずれかあるいはすべてを向上させたバイオセンサおよびそれを使用する方法を提供することにある。
【課題を解決するための手段】
【0010】
一特徴によれば、本発明は、作用電極およびこの作用電極から所定距離隔たった対電極とを包含する種類の電気化学的セルにおいてレドックス・スペシーズの還元(または酸化)形態の濃度を測定する方法であって、
(1)電極間に電位差を印加する段階と、
(2)スペシーズの還元形態の電気酸化(または酸化形態の電気還元)の率を拡散制御するように作用電極の電位を選定する段階と、
(3)対電極からの反応生成物が作用電極に到達するように作用電極と対電極の間隔を選定する段階と、
(4)電位の印加後で、安定状態の達成前に時間関数として電流を測定する段階と、
(5)安定状態電流の大きさを判断する段階と、
(6)電流経時変化および安定状態電流の大きさから、拡散係数またはスペシーズの還元形態(または酸化形態)の濃度あるいはこれら両方を示す値を得る段階とを包含する方法にある。
【0011】
このようにして測定した濃度は、もしあるとして還元形態の拡散係数における変動からほぼ独立しており、したがって、温度および粘度における変動について補正される。こうして測定した濃度は、レドックス・スペシーズの還元形態の拡散係数に影響を与えるヘマトクリットその他の物質における変動から独立している。
【0012】
ここで、本発明の方法が電気化学的セル内でレドックス・スペシーズの還元形態あるいはレドックス・スペシーズの酸化形態の濃度を測定するのにも同等に適用可能であることは了解されたい。還元形態の濃度を測定しようとしている場合、作用電極の電位は、還元形態の電気酸化の率を段階(2)で拡散制御し、段階(5)で得られる還元形態の濃度となるように維持しなければならない。酸化形態の濃度を測定しようとしている場合には、作用電極の電位は、酸化形態の電気還元の率を段階(2)で拡散制御し、段階(5)で得られる酸化形態の濃度となるように維持しなければならない。
【0013】
レドックス・スペシーズは検体であってもよいし、レドックス・メディエイタであってもよい。
【0014】
本発明の好ましい具体例では、メディエイタを用い、このメディエイタの還元形態(または酸化形態)の濃度が検体の濃度を示し、メディエイタの還元形態(または酸化形態)の拡散係数の値が検体濃度の測定に対する前駆値として測定される。
【0015】
なるべくなら、電気化学的セルは作用電極と対/参照電極とを包含する。対電極から分離した参照電極を用いる場合には、参照電極を任意都合の良い場所に置き、そこにおいてセンサ内のサンプルと接触させてもよい。
【0016】
従来技術と異なり、本発明の方法を導入するとき、電極は充分に接近しており、対電極のところでの電気化学反応の生成物はテスト期間中に作用電極に移動する。たとえば、酵素フェリシアニド系においては、対電極のところで生じたフェロシアニドは作用電極に向かって拡散する。
【0017】
これにより、電極間に安定状態濃度分布が達成され、安定状態電流を得ることができる。これは、順次、サンプル変動から独立してレドックス・スペシーズ(メディエイタ)の拡散係数および濃度を測定するのを可能とし、したがって、精度、信頼性を大きく向上させる。
【0018】
この方法は、また、ルックアップ・テーブルを使用することによって(あるいは、血漿から赤血球を分離し、赤血球部分の拡散係数を測定することによって)赤血球部分と血漿部分とを比較して拡散係数から血液ヘマトクリット濃度を測定することも可能とする。
第2の特徴によれば、本発明は、電気化学的セルにおいてレドックス・スペシーズの濃度を測定する装置であって、作用電極および対電極(または対/参照電極)を有する電気化学的セルと、前記電極間に電位差を印加する手段と、電流経時変化を測定する手段とを包含する装置において、作用電極が対電極から500μm未満隔たっていることを特徴とする装置にある。
【0019】
好ましい具体例において、電気化学的セルの有効容積は1.5マイクロリットル以下である。本発明で使用するための装置は、多孔性膜と、この膜の片側にある作用電極と、反対側にある対/参照電極とを包含し、前記電極がそれらの間の膜ゾーンと共に電気化学的セルを構成しており、膜が電気化学的セルから側方へサンプル堆積領域まで延びており、このサンプル堆積領域が膜の厚さよりも大きい距離だけ電気化学的セルゾーンから隔たっていることを特徴とする装置にある。
【0020】
好ましくは、多孔性膜、電気化学的セル部分からのターゲット領域の距離および膜の厚さは組み合わせて選定し、血液(血漿と赤血球を含む)をターゲット領域に置いたときに、血漿が赤血球よりも進んで電気化学的セルゾーンに向かって側方へフロント拡散するようにする。
【0021】
こうして、薄層電気化学的セルをほとんどヘマトクリットのない血漿で満たすことが可能となる。ヘマトクリットは、レドックス・メディエイタの拡散係数の変化を生じさせ、後に説明するようにテストの精度に影響を与えることになる。
【0022】
本発明のバイオセンサの好ましい具体例において、膜の第2電気化学的セルゾーンが、第2作用電極とこの第2作用電極とは膜の反対側にある第2対/参照電極とによって構成される。第2電気化学的セルゾーンは、第1電気化学的セルゾーンとサンプル堆積領域すなわち「ターゲット」領域との間に位置していてもよいし、ターゲット領域の第1電気化学的セルゾーンとは反対の側に位置してもよい。これらの具体例において、血漿は第1電気化学的セル内の酵素と接触するかあるいは第1電気化学的セルへの途中にあり、血漿が第2電気化学的セルに到達することはない。こうして、使用時、第1電気化学的セルが血漿(電気化学的妨害物質を含む)および酵素の存在の下に還元メディエイタの濃度を測定する一方で、第2電気化学的セルが血漿(電気化学的妨害物質を含む)の存在の下、酵素のない状態で、還元メディエイタの濃度を測定する。これにより、第2電気化学的セルにおいて還元妨害物質の濃度を測定し、第1電気化学的セルにおいて還元妨害物質および検体の濃度を測定する。一方の値を他方の値から引き算することによって、検体の絶対濃度を得ることができる。
【0023】
本発明の非常に好ましい具体例では、中空の電気化学的セルを使用する。この場合、作用電極および参照電極(または対/参照電極)は500μm未満、好ましくは20〜200μm互いに隔たる。
【発明を実施するための最良の形態】
【0024】
以下、添付図面を参照しながら本発明を具体例によってより詳しく説明する。
図1は、本発明による第1具体例の概略側面図(縮尺は合わせてない)である。図2は、図1の具体例の頂面図である。図3は、図1の具体例の底面図である。図4は、図1の具体例の端面図である。図5は、本発明による第2具体例の概略側面図(縮尺は合わせてない)である。図6は、図5の具体例の頂面図である。図7は、本発明による第3具体例の概略側面図(縮尺は合わせてない)である。図8は、図7の具体例の頂面図である。図9は、本発明の第4具体例の概略頂面図(縮尺は合わせてない)である。図10は、図9の具体例の端面図である。図11は、図9の具体例の側面図である。図12は、本発明による中空電気化学的セル具体例の概略横断面図(縮尺は合わせてない)である。図13は、本発明による方法を導入するに際しての電流(縦軸)対時間(横軸)のプロットを示すグラフである。図14は、本発明の方法を説明するのに使用する別のグラフである。
【0025】
図5〜12において、図1〜4の具体例の構成要素に機能で対応する構成要素は同一の符号または記号が付けてある。
【0026】
図1〜4を参照して、ここには、本発明の装置の第1具体例が示してあり、この場合、装置は血液中のグルコースを測定するバイオセンサである。この具体例は、上下の表面2、3を有する薄いストリップ状の膜1を包含する。膜は、上面2に配置した作用電極5と下面3に配置した対電極6との間に構成された電気化学的セルゾーン4を有する。この膜の厚さは、電極が距離「l」だけ分離するように選定する。この距離「l」は対電極のところでの電気化学反応の生成物がテスト期間中に作用電極に移動し、安定状態拡散分布が充分に達成されるに充分な程度に短い。代表的には、「l」は500μm未満である。サンプル堆積領域すなわち「ターゲット」領域7が膜1の上面2に構成してあり、この領域は電気化学的セルゾーン4から膜厚さよりも大きな距離隔たっている。膜1はターゲット領域7と電気化学的セルゾーン4の間に延在する拡散ゾーン8を有する。レドックス・メディエイタ「M」、酵素「E」およびpHバッファ「B」を包含する適当な試液が、膜の電気化学的セルゾーン4内あるいは電気化学的セルゾーン4とターゲット領域7の間またはこれら両方に含まれている。試液は安定剤などを含んでいてもよい。
【0027】
或る場合には、酵素、メディエイタ、バッファを膜の異なったゾーンに置くと好ましい。たとえば、メディエイタを最初に電気化学的セルゾーン4内に置き、酵素をターゲット領域7の下あるいは拡散領域8に置いてもよい。
【0028】
pHが低いときにはヘモグロビンが排出し、pHが高いと、かなり強固に酸素と結合する。酸素はグルコースオキシダーゼデヒドロゲナーゼ(GOD)に対するレドックス・メディエイタとして作用する。グルコース・センサにおいては、これはレドックス・メディエイタと競合し、グルコース濃度の測定値が低くなる。したがって、所望に応じて、第1pHバッファをターゲット領域7付近に含ませてすべての酸素がヘモグロビンに結合するレベルまでpHを上昇させるとよい。このpHは、GOD/グルコースの運動学にとっては不適であり、テストの速度、感度にとって有害となろう。本発明の好ましい具体例では、第2のpHバッファを作用電極付近で試液として含ませ、pHを運動学的に最適なレベルに復帰させる。第2バッファを使用しても、ヘモグロビンが血液細胞内に含まれているときに酸素がヘモグロビンから放出されることはない。血液細胞は、血液ターゲット領域7付近に保持されるか、あるいは、血漿と比較して拡散放出され、したがって、第2バッファによって影響を受けない。こうして、酸素の妨害をかなり減らすか、なくすことができる。
【0029】
センサの使用にあたっては、測定しようとしている或る濃度のグルコースを含む血液のドロップをターゲット領域7に置く。血液成分は電気化学的セルゾーン4に吸い上げられ、血漿成分は赤血球細胞よりも急速に拡散し、血漿フロントが赤血球細胞よりも先に電気化学的セルゾーン4に到達する。
【0030】
血漿が吸い上げられて試液と接触すると、試液は溶解し、反応が生じて検体を酸化させ、メディエイタを還元させる。この反応を完了する所定の時間後、電位差が作用電極と対電極の間に印加される。作用電極の電位は充分に陽極性に保たれ、作用電極のところでのメディエイタの還元形態の電気酸化率は作用電極へのメディエイタの還元形態の拡散率によって決まり、電極/溶液界面を横切る電子移動速度によっては決まらない。
【0031】
加えて、対電極のところでのメディエイタの酸化形態の濃度は、充分なレベルに維持され、電流が電気化学的セル内を流れるとき、対電極の電位、したがって、作用電極の電位は或る程度まで陰極方向にシフトされず、作用電極の電位はもはや拡散制御領域にはない。すなわち、対電極のところでの酸化形態の濃度は作用電極のところでのメディエイタの還元形態の拡散制御電気酸化を維持するに充分でなければならない。
【0032】
薄層電気化学的セルの動作は、レドックス・カップルの酸化、還元両形態が存在する場合に、最終的には電気化学的セルを横切って安定状態濃度分布が確立されるような動作である。これが安定状態電流を生じさせる。安定状態電流の測定値を安定状態が達成される前の電流過渡状態において電流が変化する率と比較することによって、レドックス・メディエイタの拡散係数を濃度と共に測定することができる。これは従来技術で測定されるコットレル(Cottrell)電流と対照的である。センサ電極への電位の印加後の既知の時刻にコットレル電流を測定することによっては、製品濃度×拡散係数の平方根を測定できるだけであり、したがって、拡散係数から独立してメディエイタの濃度を測定することはできない。
【0033】
本発明による電気化学的セルにおいては、この状況について拡散式を解くことによって、限られた時間にわたってln(i/i∞−1)対時間(秒)のプロットが扇形であり、−4π2D/l2に等しい勾配(Sで示す)を有することを示すことができる。ここで、「i」は時刻「t」での電流、「i∞」は安定状態電流、「D」は拡散係数(cm2/sec)、「l」は電極間の距離(cm)、「π」は約3.14159である。電位を電極間に印加したときに存在する還元メディエイタの濃度は2π2i∞/FAlSで与えられる。ここで、「F」はファラデー常数、Aは作用電極面積であり、他の記号は上記と同じである。この後者の式でSを用いるとき、それは拡散係数の測定値を含む。
【0034】
lが所与の電気化学的セルについての常数であるから、時間およびi∞の関数としてのiの測定値は、レドックス・メディエイタの拡散係数値の計算および検体の濃度測定を可能とする。
【0035】
さらに、検体濃度の測定は作用電極のところで電気酸化あるいは電気還元されるスペシーズの拡散係数についてのいかなる変化も補正する。拡散係数値の変化は、溶液の温度、粘度の変化あるいは膜透過性の変化の結果として生じる可能性がある。電気化学的セルの幾何学構成の変化、酵素化学への変化あるいは測定濃度に影響する可能性のある他のファクタを説明するには濃度測定値に対する他の調整が必要であるかもしれない。ヘマトクリット(もしこれが存在すると、レドックス・メディエイタの拡散係数に変化を生じさせる)がほとんどない血漿に測定を行う場合には、本方法の精度はさらに向上する。
【0036】
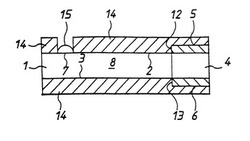
電極5、6の各々は予め定義した面積を有する。図1〜4の具体例においては、電気化学的セルゾーン4は、電極5、6の縁と一致する膜の縁9、10、11によって、および、電極の前縁(ターゲット領域7に対して)12、13によって構成される。本具体例では、電極は約600オングストロームの厚さを有し、1〜5mmの幅を有する。
【0037】
オプションとして、膜の両面を、ターゲット領域7を除いて、積層14(平面図では省略している)で覆う。この積層はサンプルからの水の蒸発を防ぐと共に装置への機械的な頑丈さを与えるのに役立つ。水の蒸発は、それがサンプルを濃縮し、電極を乾燥させ、溶液を冷却し、拡散係数に影響を与え、酵素の運動を遅らせるので望ましくないが、拡散係数は上記の通りに推断できる。
【0038】
図5、6に示す本発明の第2具体例は、第2作用電極25とそれとの間で第2電気化学的セルゾーン24を構成する対/参照電極26とを含むという点で第1具体例と異なる。これらの電極も本具体例では500μm未満隔たっている。第2電極25、26は電気化学的セルゾーン4とターゲット領域7の間に設置される。この具体例では、レドックス・メディエイタは、ターゲット領域7の下あるいはそれに隣接してあるいはターゲット領域7と第1電気化学的セルゾーン4の間で膜に含まれる。酵素は第1、第2の電気化学的セルゾーン4、24において膜に含まれる。酵素が第2電気化学的セル24内に延びることはない。この場合、血液をターゲット領域に加えたとき、それはレドックス・メディエイタを溶解する。これは膜に沿って吸い上げられ、その結果、第2電気化学的セル24がレドックス・メディエイタ検体を含み、電気化学的妨害物質を含む漿液を含むことになる。第1電気化学的セルはメディエイタ、検体、電気化学的妨害物質を含む漿液、酵素を受け取る。次に、作用電極、対電極(単数または複数)両電極間に電位が印加されるが、経時電流変化は各対に対して個別に測定される。これにより、検体の存在しない状態の還元メディエイタの濃度プラス第2電気化学的セルにおける電気化学的妨害物質の濃度および第1電気化学的セルにおけるこれらプラス検体の濃度を測定することができる。一方の値から他方の値を引き算することにより、検体の絶対濃度を得ることができる。
【0039】
同じ利益が図7、8の具体例において異なった幾何学的配置によって達成される。この具体例において、第2作用電極および第2対/参照電極は、ターゲット領域7の、第1電気化学的セル4とは反対の側で第2電気化学的セル24を構成する。この場合、酵素はターゲット領域と電気化学的セル1の間で膜ストリップに含ませてもよい。レドックス・メディエイタは、ターゲット領域付近あるいはターゲット領域と各電気化学的セルの間にあってもよい。メディエイタの拡散係数は不溶解酵素によって低下し、図7、8の配置は薄層電気化学的セルの外に酵素を保つという利点を有し、より急速なテストを可能とする(より急速に安定状態電流に達したとき)。さらに、レドックス・メディエイタの拡散常数は両薄層電気化学的セルで同じであり、精密な妨害の減少が可能である。
【0040】
図1〜8の具体例は一体のセンサであるが、図9〜11の具体例に示すように複数のセンサを単一の膜上に形成することもできることは了解されたい。この場合、1つのセンサの電極は隣のセンサの電極に導電接続される。センサを連続的に用いて使用後ストリップから切断してもよい。
【0041】
図9〜11の具体例において、電極寸法は拡散方向(矢印によって示す)において電極の幅によって定められる。拡散方向に対して横方向における電極の有効寸法は審査中の出願PCT/AU96/00210により完全に説明されている方法で膜の圧縮部分16間に定められる。この出願の開示は全体的に参考資料として援用する。説明をはっきりさせるために、図1の積層14は図9〜11からは省略した。
【0042】
図12の具体例において、ここには本発明による中空の電気化学的セルが示してあり、この電気化学的セルにおいて、電極5、6は間隔を置いたポリマー壁30によって支持され、中空の電気化学的セルを構成している。開口31が電気化学的セルの片側に設けてあり、それによって、サンプルを空所32内に入れることができる。この具体例において、膜は使用されない。先の具体例と同様に、電極は500μm、好ましくは、20〜400μm、より好ましくは、20〜200μm互いに隔たっている。有効電気化学的セル容積は1.5マイクロリットル以下であると望ましい。
【0043】
ここで、電極面間に充分に小さい距離を与えるように修正したとしても、本発明の方法を審査中の出願PCT/AU95/00207に従って構成した電気化学的セルあるいは他の公知のデザインの電気化学的セルで実施し得ることは了解されたい。
【0044】
本発明の方法を、以下、図13、14を参照しながら更に説明する。
【実施例】
【0045】
実施例1
130ミクロン厚の膜の両面を60ナノメートル厚のプラチナで被覆した。膜を圧縮することによって12.6平方mmの面積を定めた。0.2モルのフェリシアン化カリウムおよび1重量%のグルコースオキシダーゼデヒドロゲナーゼを含有する1.5マイクロリットルの溶液を膜の定めた面積に加え、水を蒸発させた。
【0046】
次に、プラチナ層を作用電極、対/参照電極として使用しようとしているポテンシオスタットに接続した。5ミリモルのD−グルコースと0.9重量%のNaClを含有する3.0マイクロリットルの水性溶液を膜の定めた面積に滴下させた。20秒経過後、300ミリボルトの電圧を作用電極と対/参照電極の間に印加し、0.1秒の間隔でさらに30秒間記録した。
【0047】
図13は上記測定の基づく電流対時間のグラフである。26.9マイクロアンペアの安定状態電流の値を使用して、関数ln(i/26.9−1)を計算し、時間に対してプロットした。グラフ(図14)の勾配は−0.342であり、これは毎秒1.5×10-6cm2の拡散係数と、5.0ミリモルの訂正グルコース濃度(背景フェロシアニド減算)に対応する。
【0048】
安定状態電流は、テスト中にさらなる有意の電流変化が生じないものである。当業者であれば理解できるように、最低電流に達した後、側方拡散、蒸発、妨害電気化学反応などのようなファクタによるドリフトがある可能性がある。しかしながら、実際には、「安定状態」電流(i∞)wを測定することは難しい。これを行う1つの方法としては、i∞についての初期値を近似する方法である。i対tデータの理論カーブへの適合を用いて、i∞のより良い測定値を得る。これを、測定値および近似値が或る許容できる差内に集束するまで繰り返し、評価i∞を生成する。
【0049】
実際に、時刻tでの電流iの測定は、電位を印加した後に最小時刻tminと最大時刻tmaxの間で行う。最小、最大の時刻は方程式の適用性で決まり、決まりきった実験によって容易に決定できる。所望に応じて、電圧をオフにし、レドックス・スペシーズの濃度分布を初期状態に戻すことによってテストを繰り返してもよい。
【0050】
ここで、電流対時刻カーブの分析を行って拡散係数または濃度あるいは両方の値を得ることが上記の方法に限られるものではなくて他の方法によっても達成できることは了解されたい。
【0051】
たとえば、電流対時刻カーブの早期の部分をコットレル式によって分析してD1/2×Co(Co = 検体の濃度)の値を得、安定状態電流を分析してD×Coの値を得ることもできる。これら2つの値を次に比較してD、Cを別々に得ることができる。
【0052】
ここで、本発明の実施にあたって、経時電流変化を示す装置によって電気信号が発せられる。この信号はアナログ信号でもディジタル信号でもよく、あるいは、所定時間間隔で発せられる一連の信号であってもよい。これらの信号はマイクロプロセッサその他の普通の回路によって処理して記憶したアルゴリズムに従って必要な演算を行い、拡散係数、検体濃度、ヘマトクリット濃度などをそれぞれ示す出力信号を発生させてもよい。1つまたはそれ以上のこのような出力信号をアナログあるいはディジタルのディスプレイで表示してもよい。
【0053】
また、適当な電気化学的セルデザインによれば、メディエイタを消耗させるのに必要な電流を測定する消耗電気化学的セルとして電気化学的セルを作動させることもできる。たとえば、図5の具体例において、本発明の方法を、500μm未満隔たった電極5、6を用いて実施してもよい。500μmより大きく隔たった電極5、26を用いて電流測定式あるいはボルタンメトリー式の消耗測定を行ってもよく、その場合、電極5、26のところで電流測定式に測定されているレドックス・スペシーズ間に干渉はない。
【0054】
消耗測定は、本発明の方法による拡散係数の測定前、最中、その後のいずれで行ってもよい。これにより、精度、再現性をかなり向上させることができる。
【0055】
上述の具体例において、膜が、米国特許第4,629,563号明細書、米国特許第4,774,039号明細書に記載されている種類の非対称多孔性膜であると好ましい。これら特許は共にその全体を参考資料としてここに援用する。しかしながら、対称多孔性膜も使用できる。膜は、シート、チューブ、中空ファイバその他適当な形態を取り得る。
膜が非対称である場合には、ターゲット領域が非対称膜の開きの大きい側にあると好ましい。未圧縮時の膜の厚さは20〜500μmであると望ましい。最小厚さは、速度、感度、精度、コストに合わせて選定する。所望に応じて、ゲルを用いてヘマトクリットをGODから分離してもよい。ゲルは電極間あるいはサンプル適用領域と電極の間のスペースまたはこれら両方に存在してよい。
【0056】
作用電極は任意適当な金属、たとえば、金、銀、プラチナ、パラジウム、イリジウム、鉛、適当な合金のいずれかで作る。作用電極は、任意適当な方法、たとえば、スパッタリング、部分真空下蒸発、無電極めっき、電気めっきなどによって予形成してもよいし、現場で形成してもよい。適当な非金属導線を電極構造に用いてもよい。たとえば、ポリ(ピロル)、ポリ(アニリン)、ポルフィリン「ワイヤ」、ポリ(イソプレン)、沃素でドープしたポリ(シス−ブタジエン)、「ラダーポリマー」のような導電性ポリマーがある。他の非金属電極としては、バインダと混合したグラファイトまたはカーボン、あるいはカーボン充填プラスチックがある。In2O3またはSnO2のような無機電極も使用し得る。対/参照電極は、たとえば、作用電極に類似した構造であってもよい。対/参照電極を形成するのに水酸化ニッケルあるいはハロゲン化銀も使用し得る。塩化銀も使用できるが、塩素化処理は不要であり、充分な塩素イオンが血液サンプル内に存在する場合には銀を使用してもよいことは了解されたい。上述の具体例においては作用電極をバイオセンサの上面に置いて示し、対/参照電極を下面に置いて示したが、それを逆にしてもよい。
【0057】
作用電極および対電極(または対/参照電極)はほぼ同じ有効幾何学的面積を持つものであると好ましい。
【0058】
別体の参照電極と対電極を用いる場合には、それらを同じ構造としてもよい。参照電極は任意適当な位置においてもよい。
【0059】
ここで、上述の一具体例の特徴を別の具体例の特徴と組み合わせてもよいことは了解されたい。本発明は、酵素とメディエイタの任意特定の組合せに限定されるものではなく、EP0351892などに記載されているような組合せも使用し得る。本システムを適当な試液の適用および適当な膜選択によってグルコース以外の検体(たとえば、コレステロール)を測定するのに使用してもよい。また、本システムを血液以外の媒質と一緒に用いるようにしてもよい。たとえば、水中の不純物、たとえば、塩素、鉄、鉛、カドミウム、銅などの濃度を測定するのに本方法を使用してもよい。
【0060】
ここに記載した電気化学的セルはほぼ扁平で平行な電極を持っているが、他の形態も使用し得ることは了解されたい。たとえば、1つの電極が棒状あるいは針状で、他方が同心のスリーブであってもよい。
【0061】
ここに開示した発明概念から逸脱することなく本発明を他の形態で具体化し得ることは当業者であれば本開示内容から明らかであろう。
【図面の簡単な説明】
【0062】
【図1】本発明による第1具体例の概略側面図(縮尺は合わせてない)である。
【図2】図1の具体例の頂面図である。
【図3】図1の具体例の底面図である。
【図4】図1の具体例の端面図である。
【図5】本発明による第2具体例の概略側面図(縮尺は合わせてない)である。
【図6】図5の具体例の頂面図である。
【図7】本発明による第3具体例の概略側面図(縮尺は合わせてない)である。
【図8】図7の具体例の頂面図である。
【図9】本発明の第4具体例の概略頂面図(縮尺は合わせてない)である。
【図10】図9の具体例の端面図である。
【図11】図9の具体例の側面図である。
【図12】本発明による中空電気化学的セル具体例の概略横断面図(縮尺は合わせてない)である。
【図13】本発明による方法を導入するに際しての電流(縦軸)対時間(横軸)のプロットを示すグラフである。
【図14】本発明の方法を説明するのに使用する別のグラフである。
【技術分野】
【0001】
本発明は、バイオセンサ、一層詳しくは、キャリヤ内の検体の濃度を測定する電気化学バイオセンサに関する。本発明は、特に、血液中のグルコースの濃度を測定するのに有用であり、ここではその用途について説明するが、本発明が他の分析測定にも適用可能であることは了解されたい。
【背景技術】
【0002】
電気化学バイオセンサは、一般的には、作用電極、対電極、参照電極を有する電気化学的セルを包含する。時には、対電極と参照電極の機能を「対/参照」電極または「疑似参照電極」と呼ばれる単一の電極にまとめることもある。ここで使用する「対電極」という用語は文脈上認められる場合には対/参照電極を含む。
【0003】
検体を含むサンプルは電気化学的セル内の酵素、レドックス・メディエイタを含む試液と接触させられる。メディエイタが還元される(少なくとも1つの電子を受け取る)一方で、検体が酸化される(少なくとも1つの電子を失う)か、あるいは、この逆の反応が行われる。通常、酸化されるのは検体であり、還元されるのはメディエイタである。本発明は、ここでは原則としてこのようなシステムについて説明するが、検体が還元され、メディエイタが酸化されるシステムにも適用可能である。
【0004】
血液グルコース・レベルを監視するために糖尿病患者に使用されたり、診療所、病院で使用されたりするような電気化学グルコース分析器は、普通、グルコースオキシダーゼデヒドロゲナーゼ(GOD)のような酵素や、フェリシアニドあるいはフェロシアニドのようなレドックス・メディエイタを使用することを基本とする。このような従来のシステムでは、検体(たとえば、グルコース)を含有するサンプル(たとえば、血液)は電気化学的セル内の試液と接触させられる。グルコースは酸化されてグルコン酸となり、それによって、グルコースオキシダーゼが還元される。次に、メディエイタがグルコースオキシダーゼを再度酸化させ、還元される。還元されたメディエイタは、電子を作用電極に移送するときに再酸化させられる。ファラデー電流の正確な評価を得るに充分な所定時間の経過後、グルコースの濃度が電流の大きさあるいは次に測定された電圧の大きさから推断される。
【0005】
従来の電気化学的セルは2つ(または3つ)の隣接した電極からなり、これらの電極は絶縁体の片側で互いに隔たっており、測定装置に接続できるようになっている。血液サンプルを置くターゲット領域が電極上あるいはそれらの間に構成してある。審査中の出願PCT/AU95/00207が多孔性膜の両側に電極を配置し、電極の1つが液体透過性ターゲット領域を有する電気化学的セルを記載している。
【0006】
従来技術では、作用電極を対電極(または対/参照電極)から充分に離し、1つの電極での電気化学反応の生成物が他方の電極のところでの生成物と干渉しないようにする必要がある。実際、許容できる精度を得るには、電極が500μmより大きく分離している必要がある。
【0007】
電気化学的セルの各バッチは、予め較正しておかなければならない。サンプル成分や周囲条件に応じて、バッチの変動のために精度を得られないことがある。
【0008】
このようなバイオセンサの精度、信頼性を向上させることが望まれる。この目的の達成は、血液内の検体の濃度を測定することを意図したセンサの場合、血液が溶解ガス、イオン、コロイド、コンプレックス・ミセル、小規模細胞破片、主水性媒体内の生きている細胞成分を含んでいるために、難しい。これらのうちいずれもが測定の邪魔となる可能性がある。現存のセンサは、また、サンプル内に存在する可能性があり、作用電極のところで酸化させられて、当該検体と誤って識別される可能性のある他の妨害物質からの影響も受けやすい。あるいは、妨害物質はレドックス・メディエイタの酸化形態を還元する可能性がある。これらの影響は検体濃度の推定値を人工的に高めることになる。これに加えて、常に、検体を加える前に若干の還元したレドックス・メディエイタが存在し、その濃度を知っていて、還元メディエイタの測定値から引いて、検体の正確な濃度を求める必要がある。さらに、血液中の酸素も、フェロシアニドと競合して、グルコースオキシダーゼデヒドロゲナーゼ(GOD)に対するレドックス・メディエイタとして作用する。こうして、高い酸素濃度がグルコース濃度の推定値を低下させる可能性がある。さらに、測定値は、湿度、温度、溶液粘度、ヘマトクリット値の変化のようなファクタに敏感である。
【特許文献1】特開平5−312761号公報
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明の目的は、分析方法および従来技術の欠点のうちの少なくともいくつかを回避あるいは改善する、この方法で使用する装置を提供することにある。本発明の好ましい形態の目的は、精度、信頼性、速度のいずれかあるいはすべてを向上させたバイオセンサおよびそれを使用する方法を提供することにある。
【課題を解決するための手段】
【0010】
一特徴によれば、本発明は、作用電極およびこの作用電極から所定距離隔たった対電極とを包含する種類の電気化学的セルにおいてレドックス・スペシーズの還元(または酸化)形態の濃度を測定する方法であって、
(1)電極間に電位差を印加する段階と、
(2)スペシーズの還元形態の電気酸化(または酸化形態の電気還元)の率を拡散制御するように作用電極の電位を選定する段階と、
(3)対電極からの反応生成物が作用電極に到達するように作用電極と対電極の間隔を選定する段階と、
(4)電位の印加後で、安定状態の達成前に時間関数として電流を測定する段階と、
(5)安定状態電流の大きさを判断する段階と、
(6)電流経時変化および安定状態電流の大きさから、拡散係数またはスペシーズの還元形態(または酸化形態)の濃度あるいはこれら両方を示す値を得る段階とを包含する方法にある。
【0011】
このようにして測定した濃度は、もしあるとして還元形態の拡散係数における変動からほぼ独立しており、したがって、温度および粘度における変動について補正される。こうして測定した濃度は、レドックス・スペシーズの還元形態の拡散係数に影響を与えるヘマトクリットその他の物質における変動から独立している。
【0012】
ここで、本発明の方法が電気化学的セル内でレドックス・スペシーズの還元形態あるいはレドックス・スペシーズの酸化形態の濃度を測定するのにも同等に適用可能であることは了解されたい。還元形態の濃度を測定しようとしている場合、作用電極の電位は、還元形態の電気酸化の率を段階(2)で拡散制御し、段階(5)で得られる還元形態の濃度となるように維持しなければならない。酸化形態の濃度を測定しようとしている場合には、作用電極の電位は、酸化形態の電気還元の率を段階(2)で拡散制御し、段階(5)で得られる酸化形態の濃度となるように維持しなければならない。
【0013】
レドックス・スペシーズは検体であってもよいし、レドックス・メディエイタであってもよい。
【0014】
本発明の好ましい具体例では、メディエイタを用い、このメディエイタの還元形態(または酸化形態)の濃度が検体の濃度を示し、メディエイタの還元形態(または酸化形態)の拡散係数の値が検体濃度の測定に対する前駆値として測定される。
【0015】
なるべくなら、電気化学的セルは作用電極と対/参照電極とを包含する。対電極から分離した参照電極を用いる場合には、参照電極を任意都合の良い場所に置き、そこにおいてセンサ内のサンプルと接触させてもよい。
【0016】
従来技術と異なり、本発明の方法を導入するとき、電極は充分に接近しており、対電極のところでの電気化学反応の生成物はテスト期間中に作用電極に移動する。たとえば、酵素フェリシアニド系においては、対電極のところで生じたフェロシアニドは作用電極に向かって拡散する。
【0017】
これにより、電極間に安定状態濃度分布が達成され、安定状態電流を得ることができる。これは、順次、サンプル変動から独立してレドックス・スペシーズ(メディエイタ)の拡散係数および濃度を測定するのを可能とし、したがって、精度、信頼性を大きく向上させる。
【0018】
この方法は、また、ルックアップ・テーブルを使用することによって(あるいは、血漿から赤血球を分離し、赤血球部分の拡散係数を測定することによって)赤血球部分と血漿部分とを比較して拡散係数から血液ヘマトクリット濃度を測定することも可能とする。
第2の特徴によれば、本発明は、電気化学的セルにおいてレドックス・スペシーズの濃度を測定する装置であって、作用電極および対電極(または対/参照電極)を有する電気化学的セルと、前記電極間に電位差を印加する手段と、電流経時変化を測定する手段とを包含する装置において、作用電極が対電極から500μm未満隔たっていることを特徴とする装置にある。
【0019】
好ましい具体例において、電気化学的セルの有効容積は1.5マイクロリットル以下である。本発明で使用するための装置は、多孔性膜と、この膜の片側にある作用電極と、反対側にある対/参照電極とを包含し、前記電極がそれらの間の膜ゾーンと共に電気化学的セルを構成しており、膜が電気化学的セルから側方へサンプル堆積領域まで延びており、このサンプル堆積領域が膜の厚さよりも大きい距離だけ電気化学的セルゾーンから隔たっていることを特徴とする装置にある。
【0020】
好ましくは、多孔性膜、電気化学的セル部分からのターゲット領域の距離および膜の厚さは組み合わせて選定し、血液(血漿と赤血球を含む)をターゲット領域に置いたときに、血漿が赤血球よりも進んで電気化学的セルゾーンに向かって側方へフロント拡散するようにする。
【0021】
こうして、薄層電気化学的セルをほとんどヘマトクリットのない血漿で満たすことが可能となる。ヘマトクリットは、レドックス・メディエイタの拡散係数の変化を生じさせ、後に説明するようにテストの精度に影響を与えることになる。
【0022】
本発明のバイオセンサの好ましい具体例において、膜の第2電気化学的セルゾーンが、第2作用電極とこの第2作用電極とは膜の反対側にある第2対/参照電極とによって構成される。第2電気化学的セルゾーンは、第1電気化学的セルゾーンとサンプル堆積領域すなわち「ターゲット」領域との間に位置していてもよいし、ターゲット領域の第1電気化学的セルゾーンとは反対の側に位置してもよい。これらの具体例において、血漿は第1電気化学的セル内の酵素と接触するかあるいは第1電気化学的セルへの途中にあり、血漿が第2電気化学的セルに到達することはない。こうして、使用時、第1電気化学的セルが血漿(電気化学的妨害物質を含む)および酵素の存在の下に還元メディエイタの濃度を測定する一方で、第2電気化学的セルが血漿(電気化学的妨害物質を含む)の存在の下、酵素のない状態で、還元メディエイタの濃度を測定する。これにより、第2電気化学的セルにおいて還元妨害物質の濃度を測定し、第1電気化学的セルにおいて還元妨害物質および検体の濃度を測定する。一方の値を他方の値から引き算することによって、検体の絶対濃度を得ることができる。
【0023】
本発明の非常に好ましい具体例では、中空の電気化学的セルを使用する。この場合、作用電極および参照電極(または対/参照電極)は500μm未満、好ましくは20〜200μm互いに隔たる。
【発明を実施するための最良の形態】
【0024】
以下、添付図面を参照しながら本発明を具体例によってより詳しく説明する。
図1は、本発明による第1具体例の概略側面図(縮尺は合わせてない)である。図2は、図1の具体例の頂面図である。図3は、図1の具体例の底面図である。図4は、図1の具体例の端面図である。図5は、本発明による第2具体例の概略側面図(縮尺は合わせてない)である。図6は、図5の具体例の頂面図である。図7は、本発明による第3具体例の概略側面図(縮尺は合わせてない)である。図8は、図7の具体例の頂面図である。図9は、本発明の第4具体例の概略頂面図(縮尺は合わせてない)である。図10は、図9の具体例の端面図である。図11は、図9の具体例の側面図である。図12は、本発明による中空電気化学的セル具体例の概略横断面図(縮尺は合わせてない)である。図13は、本発明による方法を導入するに際しての電流(縦軸)対時間(横軸)のプロットを示すグラフである。図14は、本発明の方法を説明するのに使用する別のグラフである。
【0025】
図5〜12において、図1〜4の具体例の構成要素に機能で対応する構成要素は同一の符号または記号が付けてある。
【0026】
図1〜4を参照して、ここには、本発明の装置の第1具体例が示してあり、この場合、装置は血液中のグルコースを測定するバイオセンサである。この具体例は、上下の表面2、3を有する薄いストリップ状の膜1を包含する。膜は、上面2に配置した作用電極5と下面3に配置した対電極6との間に構成された電気化学的セルゾーン4を有する。この膜の厚さは、電極が距離「l」だけ分離するように選定する。この距離「l」は対電極のところでの電気化学反応の生成物がテスト期間中に作用電極に移動し、安定状態拡散分布が充分に達成されるに充分な程度に短い。代表的には、「l」は500μm未満である。サンプル堆積領域すなわち「ターゲット」領域7が膜1の上面2に構成してあり、この領域は電気化学的セルゾーン4から膜厚さよりも大きな距離隔たっている。膜1はターゲット領域7と電気化学的セルゾーン4の間に延在する拡散ゾーン8を有する。レドックス・メディエイタ「M」、酵素「E」およびpHバッファ「B」を包含する適当な試液が、膜の電気化学的セルゾーン4内あるいは電気化学的セルゾーン4とターゲット領域7の間またはこれら両方に含まれている。試液は安定剤などを含んでいてもよい。
【0027】
或る場合には、酵素、メディエイタ、バッファを膜の異なったゾーンに置くと好ましい。たとえば、メディエイタを最初に電気化学的セルゾーン4内に置き、酵素をターゲット領域7の下あるいは拡散領域8に置いてもよい。
【0028】
pHが低いときにはヘモグロビンが排出し、pHが高いと、かなり強固に酸素と結合する。酸素はグルコースオキシダーゼデヒドロゲナーゼ(GOD)に対するレドックス・メディエイタとして作用する。グルコース・センサにおいては、これはレドックス・メディエイタと競合し、グルコース濃度の測定値が低くなる。したがって、所望に応じて、第1pHバッファをターゲット領域7付近に含ませてすべての酸素がヘモグロビンに結合するレベルまでpHを上昇させるとよい。このpHは、GOD/グルコースの運動学にとっては不適であり、テストの速度、感度にとって有害となろう。本発明の好ましい具体例では、第2のpHバッファを作用電極付近で試液として含ませ、pHを運動学的に最適なレベルに復帰させる。第2バッファを使用しても、ヘモグロビンが血液細胞内に含まれているときに酸素がヘモグロビンから放出されることはない。血液細胞は、血液ターゲット領域7付近に保持されるか、あるいは、血漿と比較して拡散放出され、したがって、第2バッファによって影響を受けない。こうして、酸素の妨害をかなり減らすか、なくすことができる。
【0029】
センサの使用にあたっては、測定しようとしている或る濃度のグルコースを含む血液のドロップをターゲット領域7に置く。血液成分は電気化学的セルゾーン4に吸い上げられ、血漿成分は赤血球細胞よりも急速に拡散し、血漿フロントが赤血球細胞よりも先に電気化学的セルゾーン4に到達する。
【0030】
血漿が吸い上げられて試液と接触すると、試液は溶解し、反応が生じて検体を酸化させ、メディエイタを還元させる。この反応を完了する所定の時間後、電位差が作用電極と対電極の間に印加される。作用電極の電位は充分に陽極性に保たれ、作用電極のところでのメディエイタの還元形態の電気酸化率は作用電極へのメディエイタの還元形態の拡散率によって決まり、電極/溶液界面を横切る電子移動速度によっては決まらない。
【0031】
加えて、対電極のところでのメディエイタの酸化形態の濃度は、充分なレベルに維持され、電流が電気化学的セル内を流れるとき、対電極の電位、したがって、作用電極の電位は或る程度まで陰極方向にシフトされず、作用電極の電位はもはや拡散制御領域にはない。すなわち、対電極のところでの酸化形態の濃度は作用電極のところでのメディエイタの還元形態の拡散制御電気酸化を維持するに充分でなければならない。
【0032】
薄層電気化学的セルの動作は、レドックス・カップルの酸化、還元両形態が存在する場合に、最終的には電気化学的セルを横切って安定状態濃度分布が確立されるような動作である。これが安定状態電流を生じさせる。安定状態電流の測定値を安定状態が達成される前の電流過渡状態において電流が変化する率と比較することによって、レドックス・メディエイタの拡散係数を濃度と共に測定することができる。これは従来技術で測定されるコットレル(Cottrell)電流と対照的である。センサ電極への電位の印加後の既知の時刻にコットレル電流を測定することによっては、製品濃度×拡散係数の平方根を測定できるだけであり、したがって、拡散係数から独立してメディエイタの濃度を測定することはできない。
【0033】
本発明による電気化学的セルにおいては、この状況について拡散式を解くことによって、限られた時間にわたってln(i/i∞−1)対時間(秒)のプロットが扇形であり、−4π2D/l2に等しい勾配(Sで示す)を有することを示すことができる。ここで、「i」は時刻「t」での電流、「i∞」は安定状態電流、「D」は拡散係数(cm2/sec)、「l」は電極間の距離(cm)、「π」は約3.14159である。電位を電極間に印加したときに存在する還元メディエイタの濃度は2π2i∞/FAlSで与えられる。ここで、「F」はファラデー常数、Aは作用電極面積であり、他の記号は上記と同じである。この後者の式でSを用いるとき、それは拡散係数の測定値を含む。
【0034】
lが所与の電気化学的セルについての常数であるから、時間およびi∞の関数としてのiの測定値は、レドックス・メディエイタの拡散係数値の計算および検体の濃度測定を可能とする。
【0035】
さらに、検体濃度の測定は作用電極のところで電気酸化あるいは電気還元されるスペシーズの拡散係数についてのいかなる変化も補正する。拡散係数値の変化は、溶液の温度、粘度の変化あるいは膜透過性の変化の結果として生じる可能性がある。電気化学的セルの幾何学構成の変化、酵素化学への変化あるいは測定濃度に影響する可能性のある他のファクタを説明するには濃度測定値に対する他の調整が必要であるかもしれない。ヘマトクリット(もしこれが存在すると、レドックス・メディエイタの拡散係数に変化を生じさせる)がほとんどない血漿に測定を行う場合には、本方法の精度はさらに向上する。
【0036】
電極5、6の各々は予め定義した面積を有する。図1〜4の具体例においては、電気化学的セルゾーン4は、電極5、6の縁と一致する膜の縁9、10、11によって、および、電極の前縁(ターゲット領域7に対して)12、13によって構成される。本具体例では、電極は約600オングストロームの厚さを有し、1〜5mmの幅を有する。
【0037】
オプションとして、膜の両面を、ターゲット領域7を除いて、積層14(平面図では省略している)で覆う。この積層はサンプルからの水の蒸発を防ぐと共に装置への機械的な頑丈さを与えるのに役立つ。水の蒸発は、それがサンプルを濃縮し、電極を乾燥させ、溶液を冷却し、拡散係数に影響を与え、酵素の運動を遅らせるので望ましくないが、拡散係数は上記の通りに推断できる。
【0038】
図5、6に示す本発明の第2具体例は、第2作用電極25とそれとの間で第2電気化学的セルゾーン24を構成する対/参照電極26とを含むという点で第1具体例と異なる。これらの電極も本具体例では500μm未満隔たっている。第2電極25、26は電気化学的セルゾーン4とターゲット領域7の間に設置される。この具体例では、レドックス・メディエイタは、ターゲット領域7の下あるいはそれに隣接してあるいはターゲット領域7と第1電気化学的セルゾーン4の間で膜に含まれる。酵素は第1、第2の電気化学的セルゾーン4、24において膜に含まれる。酵素が第2電気化学的セル24内に延びることはない。この場合、血液をターゲット領域に加えたとき、それはレドックス・メディエイタを溶解する。これは膜に沿って吸い上げられ、その結果、第2電気化学的セル24がレドックス・メディエイタ検体を含み、電気化学的妨害物質を含む漿液を含むことになる。第1電気化学的セルはメディエイタ、検体、電気化学的妨害物質を含む漿液、酵素を受け取る。次に、作用電極、対電極(単数または複数)両電極間に電位が印加されるが、経時電流変化は各対に対して個別に測定される。これにより、検体の存在しない状態の還元メディエイタの濃度プラス第2電気化学的セルにおける電気化学的妨害物質の濃度および第1電気化学的セルにおけるこれらプラス検体の濃度を測定することができる。一方の値から他方の値を引き算することにより、検体の絶対濃度を得ることができる。
【0039】
同じ利益が図7、8の具体例において異なった幾何学的配置によって達成される。この具体例において、第2作用電極および第2対/参照電極は、ターゲット領域7の、第1電気化学的セル4とは反対の側で第2電気化学的セル24を構成する。この場合、酵素はターゲット領域と電気化学的セル1の間で膜ストリップに含ませてもよい。レドックス・メディエイタは、ターゲット領域付近あるいはターゲット領域と各電気化学的セルの間にあってもよい。メディエイタの拡散係数は不溶解酵素によって低下し、図7、8の配置は薄層電気化学的セルの外に酵素を保つという利点を有し、より急速なテストを可能とする(より急速に安定状態電流に達したとき)。さらに、レドックス・メディエイタの拡散常数は両薄層電気化学的セルで同じであり、精密な妨害の減少が可能である。
【0040】
図1〜8の具体例は一体のセンサであるが、図9〜11の具体例に示すように複数のセンサを単一の膜上に形成することもできることは了解されたい。この場合、1つのセンサの電極は隣のセンサの電極に導電接続される。センサを連続的に用いて使用後ストリップから切断してもよい。
【0041】
図9〜11の具体例において、電極寸法は拡散方向(矢印によって示す)において電極の幅によって定められる。拡散方向に対して横方向における電極の有効寸法は審査中の出願PCT/AU96/00210により完全に説明されている方法で膜の圧縮部分16間に定められる。この出願の開示は全体的に参考資料として援用する。説明をはっきりさせるために、図1の積層14は図9〜11からは省略した。
【0042】
図12の具体例において、ここには本発明による中空の電気化学的セルが示してあり、この電気化学的セルにおいて、電極5、6は間隔を置いたポリマー壁30によって支持され、中空の電気化学的セルを構成している。開口31が電気化学的セルの片側に設けてあり、それによって、サンプルを空所32内に入れることができる。この具体例において、膜は使用されない。先の具体例と同様に、電極は500μm、好ましくは、20〜400μm、より好ましくは、20〜200μm互いに隔たっている。有効電気化学的セル容積は1.5マイクロリットル以下であると望ましい。
【0043】
ここで、電極面間に充分に小さい距離を与えるように修正したとしても、本発明の方法を審査中の出願PCT/AU95/00207に従って構成した電気化学的セルあるいは他の公知のデザインの電気化学的セルで実施し得ることは了解されたい。
【0044】
本発明の方法を、以下、図13、14を参照しながら更に説明する。
【実施例】
【0045】
実施例1
130ミクロン厚の膜の両面を60ナノメートル厚のプラチナで被覆した。膜を圧縮することによって12.6平方mmの面積を定めた。0.2モルのフェリシアン化カリウムおよび1重量%のグルコースオキシダーゼデヒドロゲナーゼを含有する1.5マイクロリットルの溶液を膜の定めた面積に加え、水を蒸発させた。
【0046】
次に、プラチナ層を作用電極、対/参照電極として使用しようとしているポテンシオスタットに接続した。5ミリモルのD−グルコースと0.9重量%のNaClを含有する3.0マイクロリットルの水性溶液を膜の定めた面積に滴下させた。20秒経過後、300ミリボルトの電圧を作用電極と対/参照電極の間に印加し、0.1秒の間隔でさらに30秒間記録した。
【0047】
図13は上記測定の基づく電流対時間のグラフである。26.9マイクロアンペアの安定状態電流の値を使用して、関数ln(i/26.9−1)を計算し、時間に対してプロットした。グラフ(図14)の勾配は−0.342であり、これは毎秒1.5×10-6cm2の拡散係数と、5.0ミリモルの訂正グルコース濃度(背景フェロシアニド減算)に対応する。
【0048】
安定状態電流は、テスト中にさらなる有意の電流変化が生じないものである。当業者であれば理解できるように、最低電流に達した後、側方拡散、蒸発、妨害電気化学反応などのようなファクタによるドリフトがある可能性がある。しかしながら、実際には、「安定状態」電流(i∞)wを測定することは難しい。これを行う1つの方法としては、i∞についての初期値を近似する方法である。i対tデータの理論カーブへの適合を用いて、i∞のより良い測定値を得る。これを、測定値および近似値が或る許容できる差内に集束するまで繰り返し、評価i∞を生成する。
【0049】
実際に、時刻tでの電流iの測定は、電位を印加した後に最小時刻tminと最大時刻tmaxの間で行う。最小、最大の時刻は方程式の適用性で決まり、決まりきった実験によって容易に決定できる。所望に応じて、電圧をオフにし、レドックス・スペシーズの濃度分布を初期状態に戻すことによってテストを繰り返してもよい。
【0050】
ここで、電流対時刻カーブの分析を行って拡散係数または濃度あるいは両方の値を得ることが上記の方法に限られるものではなくて他の方法によっても達成できることは了解されたい。
【0051】
たとえば、電流対時刻カーブの早期の部分をコットレル式によって分析してD1/2×Co(Co = 検体の濃度)の値を得、安定状態電流を分析してD×Coの値を得ることもできる。これら2つの値を次に比較してD、Cを別々に得ることができる。
【0052】
ここで、本発明の実施にあたって、経時電流変化を示す装置によって電気信号が発せられる。この信号はアナログ信号でもディジタル信号でもよく、あるいは、所定時間間隔で発せられる一連の信号であってもよい。これらの信号はマイクロプロセッサその他の普通の回路によって処理して記憶したアルゴリズムに従って必要な演算を行い、拡散係数、検体濃度、ヘマトクリット濃度などをそれぞれ示す出力信号を発生させてもよい。1つまたはそれ以上のこのような出力信号をアナログあるいはディジタルのディスプレイで表示してもよい。
【0053】
また、適当な電気化学的セルデザインによれば、メディエイタを消耗させるのに必要な電流を測定する消耗電気化学的セルとして電気化学的セルを作動させることもできる。たとえば、図5の具体例において、本発明の方法を、500μm未満隔たった電極5、6を用いて実施してもよい。500μmより大きく隔たった電極5、26を用いて電流測定式あるいはボルタンメトリー式の消耗測定を行ってもよく、その場合、電極5、26のところで電流測定式に測定されているレドックス・スペシーズ間に干渉はない。
【0054】
消耗測定は、本発明の方法による拡散係数の測定前、最中、その後のいずれで行ってもよい。これにより、精度、再現性をかなり向上させることができる。
【0055】
上述の具体例において、膜が、米国特許第4,629,563号明細書、米国特許第4,774,039号明細書に記載されている種類の非対称多孔性膜であると好ましい。これら特許は共にその全体を参考資料としてここに援用する。しかしながら、対称多孔性膜も使用できる。膜は、シート、チューブ、中空ファイバその他適当な形態を取り得る。
膜が非対称である場合には、ターゲット領域が非対称膜の開きの大きい側にあると好ましい。未圧縮時の膜の厚さは20〜500μmであると望ましい。最小厚さは、速度、感度、精度、コストに合わせて選定する。所望に応じて、ゲルを用いてヘマトクリットをGODから分離してもよい。ゲルは電極間あるいはサンプル適用領域と電極の間のスペースまたはこれら両方に存在してよい。
【0056】
作用電極は任意適当な金属、たとえば、金、銀、プラチナ、パラジウム、イリジウム、鉛、適当な合金のいずれかで作る。作用電極は、任意適当な方法、たとえば、スパッタリング、部分真空下蒸発、無電極めっき、電気めっきなどによって予形成してもよいし、現場で形成してもよい。適当な非金属導線を電極構造に用いてもよい。たとえば、ポリ(ピロル)、ポリ(アニリン)、ポルフィリン「ワイヤ」、ポリ(イソプレン)、沃素でドープしたポリ(シス−ブタジエン)、「ラダーポリマー」のような導電性ポリマーがある。他の非金属電極としては、バインダと混合したグラファイトまたはカーボン、あるいはカーボン充填プラスチックがある。In2O3またはSnO2のような無機電極も使用し得る。対/参照電極は、たとえば、作用電極に類似した構造であってもよい。対/参照電極を形成するのに水酸化ニッケルあるいはハロゲン化銀も使用し得る。塩化銀も使用できるが、塩素化処理は不要であり、充分な塩素イオンが血液サンプル内に存在する場合には銀を使用してもよいことは了解されたい。上述の具体例においては作用電極をバイオセンサの上面に置いて示し、対/参照電極を下面に置いて示したが、それを逆にしてもよい。
【0057】
作用電極および対電極(または対/参照電極)はほぼ同じ有効幾何学的面積を持つものであると好ましい。
【0058】
別体の参照電極と対電極を用いる場合には、それらを同じ構造としてもよい。参照電極は任意適当な位置においてもよい。
【0059】
ここで、上述の一具体例の特徴を別の具体例の特徴と組み合わせてもよいことは了解されたい。本発明は、酵素とメディエイタの任意特定の組合せに限定されるものではなく、EP0351892などに記載されているような組合せも使用し得る。本システムを適当な試液の適用および適当な膜選択によってグルコース以外の検体(たとえば、コレステロール)を測定するのに使用してもよい。また、本システムを血液以外の媒質と一緒に用いるようにしてもよい。たとえば、水中の不純物、たとえば、塩素、鉄、鉛、カドミウム、銅などの濃度を測定するのに本方法を使用してもよい。
【0060】
ここに記載した電気化学的セルはほぼ扁平で平行な電極を持っているが、他の形態も使用し得ることは了解されたい。たとえば、1つの電極が棒状あるいは針状で、他方が同心のスリーブであってもよい。
【0061】
ここに開示した発明概念から逸脱することなく本発明を他の形態で具体化し得ることは当業者であれば本開示内容から明らかであろう。
【図面の簡単な説明】
【0062】
【図1】本発明による第1具体例の概略側面図(縮尺は合わせてない)である。
【図2】図1の具体例の頂面図である。
【図3】図1の具体例の底面図である。
【図4】図1の具体例の端面図である。
【図5】本発明による第2具体例の概略側面図(縮尺は合わせてない)である。
【図6】図5の具体例の頂面図である。
【図7】本発明による第3具体例の概略側面図(縮尺は合わせてない)である。
【図8】図7の具体例の頂面図である。
【図9】本発明の第4具体例の概略頂面図(縮尺は合わせてない)である。
【図10】図9の具体例の端面図である。
【図11】図9の具体例の側面図である。
【図12】本発明による中空電気化学的セル具体例の概略横断面図(縮尺は合わせてない)である。
【図13】本発明による方法を導入するに際しての電流(縦軸)対時間(横軸)のプロットを示すグラフである。
【図14】本発明の方法を説明するのに使用する別のグラフである。
【特許請求の範囲】
【請求項1】
電気化学電池においてレドックス・スペシーズの濃度を測定する装置であって、作用電極および対電極(または対/参照電極)を有し、それらの電極が互いに対面している電気化学電池と、前記電極間に電位差を印加する手段と、経時電流変化を測定する手段とを包含する装置において、作用電極が20−200μmだけ対電極から隔たっていることを特徴とする装置。
【請求項2】
作用電極と、対電極と、検体を内部に流入させる開口とを包含し、作用電極が500μmだけ対電極から隔たっていることを特徴とする中空の電気化学電池。
【請求項3】
請求項1または請求項2に記載の電気化学電池において、電極が100〜200μm隔たっていることを特徴とする電気化学電池。
【請求項4】
請求項1から請求項3のうちいずれか1つに記載の電気化学電池において、電極が互いに対面していることを特徴とする電気化学電池。
【請求項5】
請求項1から請求項4のうちいずれか1つに記載の電気化学電池において、電極がほぼ一致する面積を有することを特徴とする電気化学電池。
【請求項6】
請求項1から請求項5のうちいずれか1つに記載の電気化学電池において、作用電極、対電極および別体の参照電極を包含することを特徴とする電気化学電池。
【請求項7】
請求項1から請求項6のうちいずれか1つに記載の電気化学電池において、1.5マイクロリットル未満の有効電池容積を有することを特徴とする電気化学電池。
【請求項8】
請求項1から請求項7のうちいずれか1つに記載の装置であって、血液中のグルコースの濃度を測定するのに使用することを特徴とする装置。
【請求項1】
電気化学電池においてレドックス・スペシーズの濃度を測定する装置であって、作用電極および対電極(または対/参照電極)を有し、それらの電極が互いに対面している電気化学電池と、前記電極間に電位差を印加する手段と、経時電流変化を測定する手段とを包含する装置において、作用電極が20−200μmだけ対電極から隔たっていることを特徴とする装置。
【請求項2】
作用電極と、対電極と、検体を内部に流入させる開口とを包含し、作用電極が500μmだけ対電極から隔たっていることを特徴とする中空の電気化学電池。
【請求項3】
請求項1または請求項2に記載の電気化学電池において、電極が100〜200μm隔たっていることを特徴とする電気化学電池。
【請求項4】
請求項1から請求項3のうちいずれか1つに記載の電気化学電池において、電極が互いに対面していることを特徴とする電気化学電池。
【請求項5】
請求項1から請求項4のうちいずれか1つに記載の電気化学電池において、電極がほぼ一致する面積を有することを特徴とする電気化学電池。
【請求項6】
請求項1から請求項5のうちいずれか1つに記載の電気化学電池において、作用電極、対電極および別体の参照電極を包含することを特徴とする電気化学電池。
【請求項7】
請求項1から請求項6のうちいずれか1つに記載の電気化学電池において、1.5マイクロリットル未満の有効電池容積を有することを特徴とする電気化学電池。
【請求項8】
請求項1から請求項7のうちいずれか1つに記載の装置であって、血液中のグルコースの濃度を測定するのに使用することを特徴とする装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2007−225619(P2007−225619A)
【公開日】平成19年9月6日(2007.9.6)
【国際特許分類】
【出願番号】特願2007−102675(P2007−102675)
【出願日】平成19年4月10日(2007.4.10)
【分割の表示】特願平9−502421の分割
【原出願日】平成8年6月19日(1996.6.19)
【出願人】(596159500)ライフスキャン・インコーポレイテッド (100)
【氏名又は名称原語表記】Lifescan,Inc.
【住所又は居所原語表記】1000 Gibraltar Drive,Milpitas,California 95035,United States of America
【公開日】平成19年9月6日(2007.9.6)
【国際特許分類】
【出願日】平成19年4月10日(2007.4.10)
【分割の表示】特願平9−502421の分割
【原出願日】平成8年6月19日(1996.6.19)
【出願人】(596159500)ライフスキャン・インコーポレイテッド (100)
【氏名又は名称原語表記】Lifescan,Inc.
【住所又は居所原語表記】1000 Gibraltar Drive,Milpitas,California 95035,United States of America
[ Back to top ]

