電気泳動法によるヘモグロビンの分析方法
【課題】ヘモグロビンA1c(HbA1c)および修飾ヘモグロビンの分析精度を向上し、分析時間を短縮可能な、電気泳動法によるヘモグロビン分析方法を提供する。
【解決手段】 電気泳動法によるヘモグロビンの分析方法であって、前記電気泳動法が、泳動液中にカルボキシル基を二つ以上有する酸性物質を有する条件下で実施され、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする。
【解決手段】 電気泳動法によるヘモグロビンの分析方法であって、前記電気泳動法が、泳動液中にカルボキシル基を二つ以上有する酸性物質を有する条件下で実施され、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、電気泳動法によるヘモグロビンの分析方法に関する。
【背景技術】
【0002】
血液中のヘモグロビンは、血液中のグルコースと反応して糖化ヘモグロビンとなる。前記糖化ヘモグロビンの中でも、特に、ヘモグロビンA1c(HbA1c)は、糖尿病の診断や治療等において、重要な指標である。HbA1cは、ヘモグロビンA(HbA0)のβ鎖N末端のバリンが糖化したものであり、糖化反応の段階によって、安定型ヘモグロビンA1c(以下、「安定型A1c」または「s−A1c」ともいう。)および不安定型ヘモグロビンA1c(以下、「不安定型A1c」または「L−A1c」ともいう。)が存在する。不安定型A1cは、HbA0のβ鎖N末端のバリンに、グルコースがシッフ塩基結合して、アルジミンとなったものである。前記不安定型A1cが、さらにアマドリ転移を受けてケトアミン化合物となったものが、安定型A1cである。安定型A1cは、過去数ヶ月間の血糖値を反映し、日本糖尿病学会の標準測定法の測定項目となっている。
【0003】
血液中の糖化ヘモグロビンの測定方法は、例えば、免疫法、酵素法、アフィニティクロマトグラフィ法、HPLC法、キャピラリー電気泳動法等がある。前記免疫法および前記酵素法は、自動分析装置に適用可能である。このため、検体を大量に処理できるという長所を有するが、糖尿病患者の血糖コントロール指標および/または合併症の発症予防マーカーとして用いるには、測定精度に欠ける。前記アフィニティクロマトグラフィ法は、分離原理上、β鎖N末端の糖化バリンに対する特異性が低く、Hb分子中の糖化リジンが測定値に含まれてしまうため、HbA1cの測定精度が低い。また、前記HPLC法は、糖尿病患者の治療における糖化ヘモグロビンの測定方法として汎用されているが(特許文献1)、大型で高価な専用の装置を必要とし、装置の小型化および低コスト化が困難である。集団検診への利用等の理由から、ヘモグロビンの分析装置に対しては、小型化が求められているが、前述のように、前記HPLC法は、この要請に応えることは困難である。
【0004】
他方、前記キャピラリー電気泳動法では、キャピラリー流路の内壁に集合したイオンが、印加によって移動することで電気浸透流が生じ、これにより試料が移動して電気泳動が行われる。前記キャピラリー電気泳動法は、例えば、前記キャピラリー流路の短縮化、キャピラリー電気泳動装置の一部のマイクロチップ化によって、装置全体の小型化が可能である。前記キャピラリー電気泳動法によるHbA1cの分析方法は、例えば、キャピラリーの内壁に、陰極性層が積層されたキャピラリー管を使用した方法(特許文献2および3)が報告されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第3429709号公報
【特許文献2】国際公開第2008/029684号パンフレット
【特許文献3】国際公開第2008/029685号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、s−A1cの分析精度は、s−A1cと、不安定型A1cおよび修飾ヘモグロビンとの分離精度に大きく影響される。このため、短時間で、高精度に分析可能なs−A1c分析方法の開発が望まれていた。
【0007】
そこで、本発明は、電気泳動法によるヘモグロビン分析方法であって、ヘモグロビンA1c(HbA1c)および他のヘモグロビンの分離精度に優れ、かつ分析時間を短縮可能な分析方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明の分析方法は、泳動液中にカルボキシル基を二つ以上有する酸性物質を有する条件下で電気泳動を実施し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、電気泳動法によるヘモグロビンの分析方法である。
【発明の効果】
【0009】
本発明によれば、HbA1cと他のヘモグロビンとの分離精度が向上するため、例えば、分離キャピラリー流路の流路長を短縮化しても、高精度に分析可能であり、分析時間の短縮化が可能となる。
【図面の簡単な説明】
【0010】
【図1】図1は、実施例1におけるヘモグロビンの検出結果を示すグラフである。
【図2】図2は、実施例2におけるヘモグロビンの検出結果を示すグラフである。
【図3】図3は、実施例3におけるヘモグロビンの検出結果を示すグラフである。
【図4】図4は、実施例4におけるヘモグロビンの検出結果を示すグラフである。
【図5】図5は、実施例5におけるヘモグロビンの検出結果を示すグラフである。
【図6】図6は、比較例1におけるヘモグロビンの検出結果を示すグラフである。
【発明を実施するための形態】
【0011】
本発明の分析方法は、前記酸性物質の二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことが好ましい。
【0012】
本発明の分析方法は、前記泳動液が、緩衝剤および分離改善剤を含み、前記分離改善剤が、前記酸性物質を含むことが好ましい。
【0013】
本発明の分析方法は、前記酸性物質の二つ以上のカルボキシル基の各酸解離定数(pKa)が、分析時の前記泳動液のpHよりも0.7以上低いことが好ましい。
【0014】
本発明の分析方法は、前記泳動液が、緩衝剤を含み、前記緩衝剤の緩衝能に関与する酸解離定数(pKa)が、分析時の前記泳動液のpH−0.3の値以上であることが好ましい。
【0015】
本発明の分析方法は、前記泳動液が、緩衝剤および分離改善剤を含み、前記分離改善剤が、前記酸性物質を含み、前記緩衝剤の緩衝能に関与する酸解離定数(pKa)から、前記分離改善剤の前記酸性物質のカルボキシル基の第二酸解離定数(pKa2)を引いた差が、0.2以上であることが好ましい。
【0016】
本発明の分析方法は、ヘモグロビンを含む試料液のpHと、前記泳動液のpHとの差が、0.3未満であることが好ましい。
【0017】
本発明の分析方法は、前記酸性物質が、シクロヘキサン環を有する構造であることが好ましい。
【0018】
本発明の分析方法は、前記電気泳動法によるヘモグロビンの分離が、分離キャピラリー流路で実施されることが好ましい。
【0019】
本発明の分析方法は、ヘモグロビンを含む試料液を、連続して前記分離キャピラリー流路に導入する、連続試料導入法により実施されることが好ましい。
【0020】
本発明の分析方法は、前記分離キャピラリー流路が、マイクロチップに形成されており、前記電気泳動法が、マイクロチップ電気泳動法であるという態様でもよい。
【0021】
本発明の分析方法は、前記分離キャピラリー流路が、キャピラリー管であり、前記電気泳動法が、キャピラリー電気泳動法であるという態様でもよい。
【0022】
本発明の分析方法は、前記ヘモグロビンが、ヘモグロビンA1cであることが好ましい。
【0023】
本発明の分析方法は、前記ヘモグロビンA1cが、安定型ヘモグロビンA1cおよび不安定型ヘモグロビンA1cの少なくとも一方であることが好ましい。
【0024】
本発明の分析方法は、前記ヘモグロビンが、カルバミル化ヘモグロビン、アルデヒド化ヘモグロビンおよびアセチル化ヘモグロビンからなる群から選択される少なくとも一種の修飾ヘモグロビンであることが好ましい。
【0025】
つぎに、本発明の分離改善剤は、カルボキシル基を二つ以上有する酸性物質を含有し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、前記本発明の分析方法に用いる分離改善剤である。本発明の分離改善剤において、好ましい条件および態様は、本発明のヘモグロビンの分析方法と同じである。
【0026】
つぎに、本発明の泳動液試薬は、前記本発明の分析方法に用いる前記分離改善剤を含むことを特徴とする。本発明の泳動液試薬において、好ましい条件および態様は、本発明のヘモグロビンの分析方法と同じである。
【0027】
つぎに、本発明のマイクロチップは、分離キャピラリー流路および複数の液槽を含み、前記複数の液槽は、前記分離キャピラリー流路で連通され、前記分離キャピラリー流路および前記液槽の少なくとも一方に、泳動液が充填され、前記泳動液が、カルボキシル基を二つ以上有する酸性物質を含有し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、前記本発明の分析方法に使用するマイクロチップである。本発明のマイクロチップにおいて、好ましい条件および態様は、本発明のヘモグロビンの分析方法と同じである。
【0028】
つぎに、本発明の試薬は、前記本発明の分離改善剤を含むことを特徴とする、前記本発明の分析方法に使用する試薬である。本発明の試薬は、前記分離改善剤に加え、例えば、泳動液、緩衝剤、添加剤、界面活性剤、安定化剤等を含んでもよい。本発明の試薬は、例えば、泳動液試薬、希釈液試薬、試料液試薬等として使用してもよい。
【0029】
本発明の分析キットは、前記本発明の試薬を含むことを特徴とする。本発明の分析キットは、前記本発明の分析方法に用いる分離改善剤を含み、前記分離改善剤が、カルボキシル基を二つ以上有する酸性物質を含有し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする。すなわち、本発明の分析キットは、前記本発明の分離改善剤を含む。
【0030】
以下、本発明について詳細に説明する。以下、ヘモグロビンを「Hb」と記載する。
【0031】
本発明の分析方法は、前述のように、泳動液中にカルボキシル基を二つ以上有する酸性物質を有する条件下で電気泳動を実施し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、電気泳動法によるHbの分析方法である。本発明の分析方法は、特に制限されず、例えば、後述するように、前記電気泳動が、キャピラリー電気泳動またはマイクロチップ電気泳動であることが好ましい。
【0032】
本発明において、前記泳動液は、電圧を印加してHbを電気泳動により分離するための液をいう。前記泳動液は、例えば、電気泳動前の泳動液と、電気泳動時の泳動液に分けることができる。本発明において、電気泳動前の泳動液を「分析前の泳動液」と言い、電気泳動時の泳動液を「分析時の泳動液」と言うことができる。「電気泳動前」または「分析前」は、例えば、前記泳動液に電圧を印可する前を意味し、「電気泳動時」または「分析時」は、例えば、前記泳動液に電圧を印可している状態を意味し、試料が添加されている状態である。前記分析時の泳動液は、前記酸性物質を含んでいるが、前記分析前の泳動液は、前記酸性物質を含んでいてもよいし、含んでいなくてもよい。前記分析前の泳動液および前記分析時の泳動液は、例えば、緩衝剤等を含んでいてもよい。
【0033】
前記酸性物質は、分析時に、前記泳動液中に存在していればよい。このため、前記酸性物質は、例えば、前記分析前の泳動液に予め添加してもよいし、Hbを含む試料液に予め添加してもよい。前者の場合は、例えば、分離キャピラリー流路内に、分析前に充填する液として、前記酸性物質を含む液を使用することが好ましい。前記分離キャピラリー流路は、例えば、キャピラリー管、キャピラリー流路等があげられる。後者の場合、例えば、前記酸性物質を、溶血試料等のような液体試料に直接添加してもよいし、後述するような、試料を希釈する溶媒に予め添加してもよい。
【0034】
前記酸性物質は、前述のように、カルボキシル基を二つ以上有する。前記酸性物質における前記カルボキシル基の数は、例えば、2〜6であり、好ましくは、2〜4である。
【0035】
前記酸性物質は、例えば、さらに、カルボキシル基以外の官能基を有してもよい。その他の官能基は、特に制限されず、例えば、水素原子、アミノ基、ヒドロキシ基、炭素数1〜5のアルキル基、前記炭素数1〜5のアルコキシ基、炭素数1〜5のアルキルチオ基等があげられる。前記官能基における水素原子は、例えば、その一つ以上が任意の置換基によって置換されていてもよい。前記置換基は、例えば、フルオロ基、ブロモ基、クロロ基、ヨード基等のハロゲン基があげられ、好ましくはフルオロ基である。
【0036】
前記酸性物質は、二つ以上のカルボキシル基を有し、それぞれのカルボキシル基毎に酸解離定数(pKa)を有する。本発明において、少なくとも二つのカルボキシル基の酸解離定数(pKa)の範囲は、例えば、2〜5であり、好ましくは、2〜4である。
【0037】
前記酸性物質の二つ以上のカルボキシル基の酸解離定数(pKa)は、分析時の前記泳動液のpHよりも、好ましくは、0.5以上低く、より好ましくは、0.7以上低く、さらにより好ましくは、1.0以上低い。
【0038】
前記酸性物質は、具体的には、例えば、カルボン酸、アミノ酸等があげられる。
【0039】
前記カルボン酸は、例えば、ジカルボン酸、トリカルボン酸、テトラカルボン酸、ペンタカルボン酸、ヘキサカルボン酸、ヘプタカルボン酸、オクタカルボン酸、ノナカルボン酸、デカカルボン酸等があげられ、好ましくは、ジカルボン酸、トリカルボン酸、テトラカルボン酸、ペンタカルボン酸、ヘキサカルボン酸である。前記カルボン酸は、例えば、いずれか一種類を使用してもよいし、二種類以上を使用してもよい。
【0040】
前記カルボン酸は、例えば、脂肪族カルボン酸、炭素環カルボン酸等があげられる。前記脂肪族カルボン酸は、例えば、フマル酸、D−酒石酸等があげられ、好ましくは、D−酒石酸である。前記炭素環カルボン酸は、例えば、シクロヘキサンカルボン酸等があげられる。
【0041】
前記シクロヘキサンカルボン酸は、シクロヘキサン環を有する構造である。前記シクロヘキサンカルボン酸は、例えば、下記一般式(1)で表される化合物、その互変異性体もしくは立体異性体、またはそれらの塩、溶媒和物もしくは水和物が好ましい。
【化1】

ただし、前記一般式(1)は、少なくとも二つのカルボキシル基を有し、前記一般式(1)中、R1〜R12は、それぞれ同一であるかまたは異なる官能基である。前記R1〜R12の中で、少なくとも二つの官能基が、カルボキシル基を有する官能基である、および/または、少なくとも一つの官能基が、少なくとも二つのカルボキシル基を有する官能基である。前者、すなわち、少なくとも一つのカルボキシル基を有する官能基は、例えば、カルボキシル基、カルボキシアルキル基である。前記カルボキシアルキル基において、アルキル基部分は、例えば、炭素数1〜5であり、炭素数1が好ましく、前記カルボキシアルキル基の具体例は、例えば、−CH2COOHがあげられる。後者、すなわち、少なくとも二つのカルボキシル基を有する官能基は、例えば、ビス(カルボキシアルキル)アミノ基である。前記ビス(カルボキシアルキル)アミノ基において、アルキル基部分は、例えば、炭素数1〜5であり、炭素数1が好ましく、前記ビス(カルボキシアルキル)アミノ基の具体例は、例えば、−N(CH2COOH)2があげられる。前記官能基は、具体的には、前記カルボキシル基を含む官能基の他に、例えば、水素原子、アミノ基、炭素数1〜5のアルキル基、炭素数1〜5のアルコキシ基または炭素数1〜5のアルキルチオ基である。前記R1〜R12上の水素原子は、その一つ以上が任意の置換基によって置換されていてもよい。前記R1〜R12上の水素原子および前記置換基のうち少なくとも二つが、カルボキシル基に置換されていてもよい。前記置換基は、特に制限されず、例えば、カルボキシル基、アシル基、アミノ基、アルキル基、水酸基等があげられる。前記水酸基は、例えば、異性化し、オキソ基(=O)として存在してもよい。前記置換基における水素原子は、例えば、カルボキシル基、アミノ基、水酸基等の置換基によって置換されていてもよい。
【0042】
前記アルキル基は、特に限定されず、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、イソペンチル基、ネオペンチル基、tert−ペンチル基等があげられ、アルキル基を構造中に含む、アルコキシ基およびアルキルチオ基においても同様である。前記アルキル基は、例えば、その一つ以上の水素原子が任意の置換基に置換されていてもよい。前記アルキル基における置換基は、特に制限されず、例えば、前述の置換基等があげられる。
【0043】
前記アルコキシ基は、特に限定されず、例えば、メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基等があげられる。前記アルコキシ基は、例えば、その一つ以上の水素原子が任意の置換基に置換されていてもよい。前記アルコキシ基における置換基は、特に制限されず、例えば、前述の置換基等があげられる。
【0044】
前記アルキルチオ基は、特に制限されず、例えば、メチルチオ基、エチルチオ基、n−プロピルチオ基、イソプロピルチオ基等があげられる。前記アルキルチオ基は、例えば、その一つ以上の水素原子が任意の置換基に置換されていてもよい。前記アルキルチオ基における置換基は、特に制限されず、例えば、前述の置換基等があげられる。
【0045】
前記R1〜R12について、前記カルボキシル基を有する官能基の具体例は、特に制限されず、例えば、カルボキシル基(−COOH)、前記カルボキシアルキル基、前記ビス(カルボキシアルキル)アミノ基等があげられ、前記カルボキシアルキル基は、−CH2−COOHが好ましく、前記ビス(カルボキシアルキル)アミノ基は、−N−(CH2COOH)2が好ましい。
【0046】
前記シクロヘキサンカルボン酸は、具体的には、例えば、トランス−1,2−シクロヘキサンジアミン−N,N,N’,N’−四酢酸(CyDTA)、1,1−シクロヘキサン二酢酸、(1α,2α,4α)−1,2,4−シクロヘキサントリカルボン酸、1,2,3,4,5,6−シクロヘキサンヘキサカルボン酸一水和物等が好ましい。前記シクロヘキサンカルボン酸は、一種類でもよいし、二種類以上を併用してもよい。
【0047】
前記アミノ酸は、例えば、アスパラギン酸、グルタミン酸等があげられ、好ましくは、グルタミン酸である。前記アミノ酸は、一種類を使用してもよいし、二種類以上を併用してもよい。
【0048】
前記酸性物質は、前述のように、例えば、二つ以上のカルボキシル基を有し、それぞれのカルボキシル基毎に酸解離定数(pKa)を有する。少なくとも二つのカルボキシル基の酸解離定数(pKa)の範囲は、例えば、2〜5であり、好ましくは、2〜4である。このような範囲の酸解離定数を有する酸性物質は、例えば、CyDTA、(1α,2α,4α)−1,2,4−シクロヘキサントリカルボン酸、L−グルタミン酸、D−酒石酸、L−酒石酸、フマル酸、クエン酸、アスパラギン酸、フタル酸、D−リンゴ酸等があげられる。
【0049】
前記酸性物質の二つ以上のカルボキシル基の酸解離定数(pKa)は、分析時の前記泳動液のpHよりも低いことが好ましく、より好ましくは、0.5以上低く、さらに好ましくは、0.7以上低く、特に好ましくは、1.0以上低い。このような酸性物質は、特に制限されず、例えば、CyDTA、D−酒石酸、フマル酸、アスパラギン酸等があげられる。このような酸性物質は、例えば、金属のキレート剤としても使用可能であり、これによって、例えば、試料中のカルシウムイオン、マグネシウムイオン等のイオンを除去することも可能である。また、これらのイオンを除去することによって、例えば、後述するような陰極性基含有化合物の凝集を抑制することも可能である。
【0050】
前記泳動液は、前記酸性物質のうち、いずれか一種類を含んでもよいし、二種類以上を含んでもよい。前記酸性物質の組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0051】
前記泳動液における前記酸性物質の濃度は、特に制限されず、例えば、0.1〜100mmol/Lであり、好ましくは、0.1〜50mmol/Lであり、より好ましくは、0.5〜10mmol/Lであり、さらにより好ましくは、1〜5mmol/Lである。
【0052】
前記泳動液は、例えば、分離改善剤と緩衝剤とを含み、前記分離改善剤が、前記酸性物質を含んでもよい。
【0053】
前記分離改善剤は、例えば、前記酸性物質の他に、さらに、任意の物質を含んでもよい。前記物質の組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0054】
前記分離改善剤は、例えば、分析時に、前記泳動液中に存在していればよい。このため、前記分離改善剤は、例えば、分析前の前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。前者の場合は、例えば、分離キャピラリー流路内に、分析前に充填する液として、前記分離改善剤を含む液を使用することが好ましい。前記分離キャピラリー流路は、例えば、キャピラリー管、キャピラリー流路等があげられる。後者の場合、例えば、前記分離改善剤を、前記試料に直接添加してもよいし、後述するような、試料を希釈する溶媒に予め添加してもよい。
【0055】
前記緩衝剤は、例えば、従来公知の緩衝物質があげられる。前記緩衝物質は、具体的には、例えば、リン酸、ホウ酸等の無機酸、L−酒石酸、酢酸、マレイン酸、マロン酸、フタル酸、クエン酸、ギ酸、乳酸、安息香酸、コハク酸、プロピオン酸、リンゴ酸、グルタル酸、トリス(ヒドロキシメチル)アミノメタン(Tris)、モルフォリノエタンスルホン酸(MES)、N−(2−アセトアミド)イミノ二酢酸(ADA)、N−(2−アセトアミド)−2−アミノエタンスルホン酸(ACES)、N,N−ビス(2−ヒドロキシエチル)−2−アミノエタンスルホン酸(BES)、3−モルフォリノプロパンスルホン酸(MOPS)、N−トリス(ヒドロキシメチル)メチル−2−アミノエタンスルホン酸(TES)、2−(4−(2−ヒドロキシエチル)−1−ピペラジニル)エタンスルホン酸(HEPES)等の有機酸、システイン、チロシン、ヒスチジン、リシン、アルギニン等のアミノ酸等があげられる。前記泳動液は、前記緩衝剤として、前記緩衝物質のうち、いずれか一種類を含んでもよいし、二種類以上を含んでもよい。前記緩衝物質の組み合わせおよび割合は、特に制限されず、適宜設定できる。前記泳動液が緩衝剤と分離改善剤とを含む場合、前記緩衝剤は、例えば、前記酸性物質以外の緩衝物質でもよいし、前記酸性物質でもよい。
【0056】
前記緩衝剤は、例えば、分析時に、前記泳動液中に存在していればよい。このため、前記緩衝剤は、例えば、分析前の前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。前者の場合は、例えば、分離キャピラリー流路内に、分析前に充填する液として、前記緩衝剤を含む液を使用することが好ましい。前記分離キャピラリー流路は、例えば、キャピラリー管、キャピラリー流路等があげられる。後者の場合、例えば、前記緩衝剤を前記試料に直接添加してもよいし、後述するような、試料を希釈する溶媒に予め添加してもよい。前記緩衝剤は、例えば、分析前の前記泳動液に予め添加するのが好ましい。分析前の前記泳動液に前記緩衝剤を添加することにより、例えば、前記試料液と分析前の前記泳動液とのpHの差を、後述の範囲に設定できる。
【0057】
前記緩衝剤の酸解離定数(pKa)は、特に制限されず、例えば、4.5〜6であり、好ましくは、4.5〜5.5である。このような範囲の酸解離定数を有する緩衝剤は、例えば、L−酒石酸、クエン酸、グルタル酸、コハク酸、酢酸、フタル酸、マロン酸、マレイン酸、リンゴ酸、プロピオン酸等があげられる。
【0058】
前記緩衝剤が複数の酸解離定数(pKa)を有する場合、前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))は、例えば、前記緩衝剤の酸解離定数(pKa)のうち、分析時の前記泳動液のpH(X)に最も近い値の酸解離定数をいう。前記緩衝剤が一つの酸解離定数(pKa)を有する場合、例えば、前記酸解離定数が、前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))である。前記緩衝剤の酸解離定数(pKa)のうち、前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))は、例えば、分析時の前記泳動液のpH−0.3の値以上であるのが好ましい。つまり、分析時の前記泳動液のpHの値を「X」とした場合、前記酸解離定数(pKan(B))は、例えば、[X−0.3]以上が好ましい。
【0059】
前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))と、前記分析時の前記泳動液のpH(X)との差は、例えば、−0.3以上である。このような範囲の酸解離定数を有する緩衝剤は、例えば、L−酒石酸、グルタル酸、酢酸、フタル酸、リンゴ酸、プロピオン酸等があげられる。
【0060】
前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))は、例えば、前記分離改善剤の前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)より高いことが好ましい。前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))と、前記分離改善剤の前記酸性物質の少なくとも二つのカルボキシル基の各酸解離定数(pKa(A))との差、すなわち、[pKan(B)−pKa(A)]は、例えば、0.2以上であり、好ましくは、0.5以上であり、より好ましくは、0.7以上である。具体的には、前記緩衝剤の酸解離定数(pKan(B))と、前記分離改善剤の前記酸性物質の第2酸解離定数(pKa2)との差、すなわち、[pKan(B)−pKa2]は、例えば、0.2以上であり、好ましくは、0.5以上であり、より好ましくは、0.7以上である。このような関係を満たす前記緩衝剤と前記酸性物質との組み合わせは、特に制限されず、例えば、L−酒石酸とCyDTAの組み合わせ、L−酒石酸とL−グルタミン酸の組み合わせ、リンゴ酸とCyDTAの組み合わせ、リンゴ酸とD−酒石酸の組み合わせ、クエン酸とCyDTAの組み合わせ、クエン酸とフマル酸の組み合わせ等があげられる。
【0061】
前記泳動液は、例えば、さらに、添加剤、界面活性剤、安定化剤等を含んでもよい。前記添加剤は、例えば、分析時に、前記泳動液中に存在していればよい。このため、前記添加剤は、例えば、分析前の前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。前者の場合は、例えば、分離キャピラリー流路内に、分析前に充填する液として、前記添加剤を含む液を使用することが好ましい。前記分離キャピラリー流路は、例えば、キャピラリー管、キャピラリー流路等があげられる。後者の場合、例えば、前記添加剤を、前記試料に直接添加してもよいし、後述するような、試料を希釈する溶媒に予め添加してもよい。前記界面活性剤および安定化剤も、例えば、分析時に、前記泳動液中に存在していればよい。前記界面活性剤および安定化剤は、例えば、前述の添加剤と同様にして、前記泳動液、前記試料液等に添加すればよい。
【0062】
前記添加剤は、特に制限されず、例えば、陰極性基含有化合物、陰イオン性カオトロピックイオン等があげられる。
【0063】
前記陰極性基含有化合物は、特に制限されず、例えば、陰極性基含有多糖類等があげられる。前記陰極性基含有多糖類は、特に限定されず、例えば、硫酸化多糖類、カルボン酸化多糖類、スルホン酸化多糖類、リン酸化多糖類等があげられ、この中で、硫酸化多糖類およびカルボン酸化多糖類が好ましい。前記硫酸化多糖類は、例えば、コンドロイチン硫酸、ヘパリンまたはこれらの塩等が好ましく、より好ましくは、コンドロイチン硫酸またはその塩である。前記カルボン酸化多糖類は、例えば、アルギン酸、ヒアルロン酸またはこれらの塩が好ましい。前記塩は、例えば、アルギン酸ナトリウム、ヒアルロン酸ナトリウム等があげられる。前記コンドロイチン硫酸は、例えば、コンドロイチン硫酸A、コンドロイチン硫酸B、コンドロイチン硫酸C、コンドロイチン硫酸D、コンドロイチン硫酸E、コンドロイチン硫酸Hおよびコンドロイチン硫酸K等があげられる。前記陰極性基含有化合物は、例えば、いずれか一種類でもよいし、二種類以上を併用してもよい。前記陰極性基含有化合物の組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0064】
分析時の前記泳動液における前記陰極性基含有化合物の濃度は、特に限定されず、例えば、約0.01〜5重量%であり、好ましくは、約0.1〜2重量%である。前述のように、前記陰極性基含有化合物は、例えば、前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。したがって、前者の場合、前記泳動液中の前記陰極性基含有化合物の濃度は、特に制限されず、例えば、分析時において、前述の範囲になるように添加することが好ましい。後者の場合、前記試料液中の前記陰極性基含有化合物の濃度は、特に制限されず、例えば、分析時において、前述の範囲になるように添加することが好ましい。
【0065】
前記陰極性基含有化合物の存在下で前記試料液を電気泳動する場合、例えば、前記試料液中のHbは、前記陰極性基含有化合物と複合体を形成した状態で、前記泳動液中を電気泳動する。この複合体形成により、例えば、分析精度をさらに向上させ、前記分離キャピラリー流路の長さ(分離長)をさらに短縮可能である。このため、例えば、分析時間をさらに短縮できる。
【0066】
カオトロピックイオンは、一般的に、水分子間の相互作用を破壊して、疎水性分子との接触による水のエントロピーの減少を抑制することにより、疎水性分子の水溶性を高めるイオンである。前記陰イオン性カオトロピックイオンは、特に制限されず、例えば、過塩素酸イオン(ClO4−)、チオシアン酸イオン(SCN−)、トリクロロ酢酸イオン(CCl3COO−)、トリフルオロ酢酸イオン(CF3COO−)、硝酸イオン(NO3−)、ジクロロ酢酸イオン(CCl2COO−)、ハロゲン化物イオン等があげられる。前記ハロゲン化物イオンは、特に制限されず、例えば、フッ化物イオン(F−)、塩化物イオン(Cl−)、臭化物イオン(Br−)、ヨウ化物イオン(I−)、アスタチン化物イオン(At−)等があげられ、好ましくは、臭化物イオン(Br−)、ヨウ化物イオン(I−)である。前記カオトロピックイオンは、例えば、一種類でもよいし、二種類以上を併用してもよい。前記カオトロピックイオンの組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0067】
前記泳動液は、例えば、前記陰イオン性カオトロピックイオンを含んでもよいし、前記陰イオン性カオトロピックイオンを含む塩、および、電離して前記陰イオン性カオトロピックイオンを生じる物質の少なくともいずれかを含んでもよい。本発明では、後述のように、前記陰イオン性カオトロピックイオンは、例えば、使用しないか、低濃度で用いることが好ましい。前記塩は、例えば、酸性塩、中性塩、塩基性塩があげられる。前記陰イオン性カオトロピックイオンを含む塩、および前記電離して陰イオン性カオトロピックイオンを生じる物質は、特に限定されず、具体的には、例えば、ヨウ化カリウム、臭化カリウム等のハロゲン化カリウム、過塩素酸ナトリウム、チオシアン酸カリウム、トリクロロ酢酸カリウム、トリフルオロ酢酸カリウム等があげられる。したがって、本発明において、前記陰イオン性カオトロピックイオンは、例えば、前記陰イオン性カオトロピックイオンを含む塩、または前記電離して陰イオン性カオトロピックイオンを生じる物質等も含まれる。前記陰イオン性カオトロピックイオンは、例えば、いずれか一種類でもよいし、二種類以上を併用してもよい。前記陰イオン性カオトロピックイオンの組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0068】
前述のように、前記陰イオン性カオトロピックイオンを使用すれば、例えば、分離精度は向上するが、高濃度の陰イオン性カオトロピックイオン存在下で電気泳動法を実施すると、電流量の増加により、発熱量が増加する場合がある。この発熱量の増加により、例えば、Hbの分離精度が低下し、泳動速度は遅くなる。本発明によれば、前述のように、前記泳動液中に前記酸性物質を有する条件下で電気泳動が実施されることにより、Hbの分離精度が向上する。このため、例えば、前記陰イオン性カオトロピックイオンの濃度を低減した条件下でも、Hbを高精度に分離できる。したがって、本発明は、例えば、前記陰イオン性カオトロピックイオンの低減により、前述のHbの分離精度および泳動速度への影響を抑制でき、より高精度に分析可能である。
【0069】
分析時の前記泳動液における前記陰イオン性カオトロピックイオンは、例えば、含まれないか、比較的低濃度であるのが好ましい。分析時の前記泳動液における前記陰イオン性カオトロピックイオンの濃度は、具体的には、例えば、1〜3000mmol/Lであり、好ましくは、5〜100mmol/Lであり、より好ましくは、10〜50mmol/Lである。前記陰イオン性カオトロピックイオンは、例えば、分析時に前述のような範囲になるように、前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。
【0070】
前記界面活性剤は、特に限定されず、例えば、非イオン性界面活性剤等があげられる。前記非イオン性界面活性剤は、特に制限されず、例えば、ポリオキシエチレンイソオクチルフェニルエーテル(商品名「Triton(登録商標)X−100」)等があげられる。
【0071】
前記安定化剤は、特に制限されず、例えば、アジ化ナトリウム、グルタチオン、エチレンジアミン四酢酸(EDTA)等があげられる。
【0072】
分析前および分析時の前記泳動液のイオン強度は、特に制限されない。前記泳動液のpHは、特に制限されず、例えば、4.5〜6であり、好ましくは、4.5〜5.5である。
【0073】
本発明の分析方法は、例えば、試料液を前記泳動液に導入して、電気泳動するのが好ましい。前記試料液は、Hbを含む試料である。前記試料は、例えば、生体由来の試料でもよいし、Hbを含有する市販品を含む試料でもよい。前記生体由来の試料は、例えば、血液試料があげられ、具体的には、例えば、全血、血球画分等の血球含有物があげられる。前記試料液は、例えば、生体から採取した試料そのものでもよいし、前記採取した試料を溶媒で希釈した希釈試料でもよい。
【0074】
前記血液試料は、特に制限されず、前記血球含有物を溶血処理した溶血試料等があげられる。前記溶血処理は、特に制限されず、例えば、超音波処理、凍結解凍処理、加圧処理、浸透圧処理、界面活性剤処理等があげられ、好ましくは、浸透圧処理である。前記浸透圧処理は、特に制限されず、例えば、前記血球含有物を低張液等で処理してもよい。前記低張液は、特に制限されず、例えば、水、緩衝液等があげられる。前記緩衝液は、特に制限されず、例えば、前述の緩衝剤、添加剤等を含んでもよい。
【0075】
前記希釈用の溶媒は、特に制限されず、例えば、水、生理食塩水、緩衝液等があげられる。前記緩衝液は、特に制限されず、例えば、前述の分離改善剤、緩衝剤、添加剤、界面活性剤、安定化剤等を含んでもよい。
【0076】
前述のように、前記試料液に前記分離改善剤を添加する場合、前記分離改善剤は、例えば、溶血処理時に添加してもよく、希釈時に添加してもよい。前者の場合、例えば、浸透圧処理に使用する前記低張液に、予め前記分離改善剤を添加してもよい。後者の場合、例えば、前記希釈用の溶媒に、予め前記分離改善剤を添加してもよい。前記緩衝剤、添加剤、界面活性剤、安定化剤を前記試料液に添加する場合も、例えば、前述の分離改善剤と同様である。
【0077】
前記試料液のイオン強度は、特に制限されない。前記試料液のpHは、特に制限されず、例えば、4.5〜6が好ましく、より好ましくは、4.5〜5.5である。
【0078】
試料液によって泳動液にpH変動を与える場合、前記試料液のpHと、前記泳動液のpHとの差は、小さいほど好ましく、前記差は、例えば、0〜0.3であり、好ましくは、0〜0.1である。前記泳動液のpHは、例えば、分析前および分析時のいずれかの前記泳動液のpHであり、好ましくは、分析時の前記泳動液のpHである。
【0079】
前記pHの差は、例えば、前記試料液に前記緩衝剤を添加することにより調整してもよいし、前述のように、分析前の前記泳動液に前記緩衝剤を添加することにより調整してもよい。好ましくは、後者である。前記分離改善剤のみで調整した試料液のpHと、分析時の泳動液のpHとの差は、例えば、0.3以上であるが、緩衝剤を添加してpHの前記差を、0.3未満とすることが好ましい。
【0080】
前記Hbは、特に限定されず、例えば、ヘモグロビンA1a(HbA1a)、ヘモグロビンA1b(HbA1b)、安定型ヘモグロビンA1c(安定型A1c、s−A1c)、不安定型ヘモグロビンA1c(不安定型A1c、L−A1c)等の糖化ヘモグロビン;カルバミル化ヘモグロビン(カルバミル化Hb)、アセチル化ヘモグロビン(アセチル化Hb)等の修飾ヘモグロビン;ヘモグロビンS(HbS)、ヘモグロビンC(HbC)、ヘモグロビンM(HbM)、ヘモグロビンH(HbH)等の変異型ヘモグロビン;正常ヘモグロビン(HbA0);胎児ヘモグロビン(HbF);HbA2等があげられる。本発明は、例えば、HbA1cと他のHbとを、高精度かつ短時間に分離して検出できる。したがって、本発明の分析対象は、例えば、HbA1cを含むことが好ましく、HbA1cおよび修飾Hbを含むのがより好ましい。
【0081】
本発明は、前記Hbに加えて、さらに、その他の成分を分析対象としてもよい。前記その他の成分は、特に制限されず、例えば、アルブミン(Alb)、グロブリン(α1、α2、β、γグロブリン)、フィブリノーゲン、グルコース、グリコアルブミン等があげられる。
【0082】
本発明の分析方法は、電気泳動法によるHbの分離が、例えば、分離キャピラリー流路で実施されてもよい。この場合、前記電気泳動法を、キャピラリー電気泳動法ともいう。前記分析方法は、例えば、連続試料導入法により実施されるのが好ましく、これは、一般に、Hbを含む試料液を、連続的に前記分離キャピラリー流路に導入する方法である。
【0083】
前記分離キャピラリー流路は、特に制限されず、例えば、キャピラリー管、マイクロチップ等の基板に形成されたキャピラリー流路等があげられる。したがって、前記分析方法は、例えば、前記分離キャピラリー流路が、マイクロチップに形成されており、前記電気泳動法が、マイクロチップ電気泳動法でもよい。また、前記分析方法は、例えば、前記分離キャピラリー流路が、キャピラリー管であり、前記電気泳動法が、キャピラリー電気泳動法でもよい。
【0084】
本発明の分析方法は、例えば、キャピラリー管、キャピラリー流路を備えるマイクロチップ等を、前記分離キャピラリー流路を備えるデバイスとして使用できる。前記分離キャピラリー流路を備えるデバイスは、例えば、自家作製してもよいし、市販品を用いてもよい。
【0085】
まず、前記キャピラリー管について、以下に説明する。本発明は、これには制限されない。
【0086】
前記キャピラリー管の内径は、特に限定されず、例えば、10〜200μm、好ましくは、25〜100μmである。前記キャピラリー管の長さは、特に限定されず、例えば、10〜1000mmであり、好ましくは、15〜300mmである。
【0087】
前記キャピラリー管の材質は、特に限定されず、例えば、ガラス、ポリマー等があげられる。前記キャピラリー管は、例えば、市販品を用いてもよい。前記ガラスは、特に制限されず、例えば、合成石英ガラス、溶融シリカ、ホウケイ酸ガラス等があげられる。前記ポリマーは、特に制限されず、具体的には、例えば、ポリメチルメタクリレート(PMMA)、ポリカーボネート(PC)、ポリスチレン(PS)、ポリエチレン(PE)、ポリテトラフルオロエチレン(PTFE)、ポリエーテルエーテルケトン(PEEK)、シクロオレフィンポリマー(COP)、ポリジメチルシロキサン(PDMS)、ポリ乳酸等があげられる。
【0088】
前記キャピラリー管の内壁は、例えば、陽極性基を有する被覆剤または陰極性基を有する被覆剤により被覆されてもよい。
【0089】
前記陽極性基を有する被覆剤は、例えば、前記陽極性基および反応基を含む化合物を使用できる。前記反応基は、例えば、シリル基(例えば、アルキルシリル基およびアルコキシシリル基)、アルコキシ基、ハロゲン基等があげられる。前記アルコキシ基は、例えば、メトキシ基、エトキシ基等があげられる。前記ハロゲン基は、例えば、フルオロ基、ブロモ基、クロロ基、ヨード基等があげられ、好ましくはクロロ基である。前述のように、例えば、前記キャピラリー管がガラス製の場合、前記陽極性基を有する被覆剤は、例えば、陽極性基およびケイ素を有する化合物(シリル化剤)を使用することが好ましい。前記陽極性基は、例えば、アミノ基、アンモニウム基等があげられる。前記陽極性基を有する被覆剤は、例えば、アミノ基およびアンモニウム基の少なくとも一方の陽極性基を有するシリル化剤が好ましい。前記アミノ基は、一級、二級、三級のいずれでもよい。前記陽極性基を有する被覆剤として、前記陽極性基を有するシリル化剤を用いることにより、例えば、分析精度をさらに向上できる。
【0090】
前記陽極性基を有するシリル化剤は、例えば、N−(2−ジアミノエチル)−3−プロピルトリメトキシシラン、アミノフェノキシジメチルビニルシラン、3−アミノプロピルジイソプロピルエトキシシラン、3−アミノプロピルメチルビス(トリメチルシロキシ)シラン、3−アミノプロピルペンタメチルジシロキサン、3−アミノプロピルシラントリオール、ビス(P−アミノフェノキシ)ジメチルシラン、1,3−ビス(3−アミノプロピル)テトラメチルジシロキサン、ビス(ジメチルアミノ)ジメチルシラン、ビス(ジメチルアミノ)ビニルメチルシラン、ビス(2−ヒドロキシエチル)−3−アミノプロピルトリエトキシシラン、3−シアノプロピル(ジイソプロピル)ジメチルアミノシラン、(アミノエチルアミノメチル)フェネチルトリメトキシシラン、N−メチルアミノプロピルトリエトキシシラン、テトラキス(ジエチルアミノ)シラン、トリス(ジメチルアミノ)クロロシラン、トリス(ジメチルアミノ)シラン等があげられる。
【0091】
前記陽極性基を有するシリル化剤として、例えば、ケイ素原子をチタンまたはジルコニウムに置換したものを用いてもよい。前記陽極性基を有するシリル化剤は、例えば、一種類を単独で使用してもよいし、二種類以上を併用してもよい。
【0092】
前記陽極性基を有するシリル化剤を用いる場合、前記キャピラリー管の内壁の被覆は、例えば、つぎのようにして行うことができる。まず、前記シリル化剤を有機溶媒に溶解もしくは分散させて処理液を調製する。前記有機溶媒は、例えば、ジクロロメタン、トルエン等があげられる。前記処理液中の前記シリル化剤の濃度は、特に限定されない。前記処理液を、ガラス製のキャピラリー管に通液し、加熱する。この加熱によって、前記シリル化剤が、前記キャピラリー管の内壁に共有結合で結合する。その結果、前記シリル化剤の前記陽極性基が前記キャピラリー管の内壁に配置されることになる。その後、洗浄液により、前記キャピラリー管の内壁を洗浄する。前記洗浄液は、例えば、有機溶媒、酸性溶液、アルカリ性溶液および界面活性剤溶液からなる群から選択される少なくとも一つが使用できる。前記有機溶媒は、例えば、ジクロロメタン、メタノール、アセトン等、前記酸性溶液は、リン酸溶液等があげられる。この洗浄は、任意であるが、実施することが好ましい。前記陽極性基を有するシリル化剤で内壁が被覆されたキャピラリー管は、市販品を用いてもよい。
【0093】
前記陰極性基を有する被覆剤は、特に制限されず、例えば、前述した陰極性基含有化合物が使用でき、中でも、陰極性基および反応基を含む化合物が好ましい。前記反応基は、例えば、シリル基(例えば、アルキルシリル基およびアルコキシシリル基)、アルコキシ基、ハロゲン基等があげられる。前記アルコキシ基は、例えば、メトキシ基、エトキシ基等があげられる。前記ハロゲン基は、例えば、フルオロ基、ブロモ基、クロロ基、ヨード基等があげられ、好ましくはクロロ基である。前記陰極性基および反応基を含む化合物は、例えば、陰極性基およびケイ素を有する化合物(シリル化剤)等があげられる。前記陰極性基を有する被覆剤は、例えば、陰極性基を有するシリル化剤が好ましい。前記陰極性基は、例えば、硫酸基、カルボン酸基、スルホン酸基、リン酸基等があげられる。前記陰極性基を有する被覆剤として、前記陰極性基を有するシリル化剤を用いることにより、例えば、分析精度をさらに向上できる。前記陰極性基を有するシリル化剤を用いる場合、前記キャピラリー管の内壁の被覆は、例えば、前記陽極性基を有するシリル化剤による被覆と同様にして行うことができる。
【0094】
前記陰極性基を有するシリル化剤は、例えば、クロロスルホニルフェニルエチルトリメトキシシラン、クロロスルホニルフェニルエチルトリクロロシラン等があげられる。
【0095】
前記陰極性基含有化合物は、これらの他に、例えば、陰極性基含有多糖類があげられる。前記陰極性基含有多糖類は、前述と同様のものが使用できる。前記陰極性基含有多糖類を有する被覆も、例えば、前記シリル化剤による被覆と同様にして行うことができる。また、例えば、既存の方法(例えば、特許第2711112号等を参照)を用いることによって、前記内壁を共有結合により被覆することもできる。
【0096】
前記キャピラリー管を用いた場合、本発明の分析方法は、例えば、つぎのように実施できる。
【0097】
まず、前記酸性物質を含む泳動液を、ポンプ等により減圧または加圧して、前記キャピラリー管に通液する。通液の時間は、例えば、1〜60分間であり、通液の圧力は、例えば、0.05〜0.1MPaである。
【0098】
つぎに、前記キャピラリー管内に、前記泳動液が存在する状態で、Hbを含む前記試料液を前記泳動液中に導入する。そして、前記キャピラリー管の両端に配置した電極間に電圧を印加して、電気泳動を行う。前記試料液の導入は、前記キャピラリー管の陽極側から行う。電圧印加により、前記キャピラリー管内の前記泳動液において電気浸透流が生じ、導入された前記試料液中のHbは、前記キャピラリー管の陰極側に向かって移動する。分析時に、例えば、前記泳動液中に前記陰極性基含有化合物が存在する場合は、導入された前記試料液中のHbは、前記陰極性基含有化合物と複合体を形成した状態で、前記キャピラリー管の陰極側に向かって移動する。前記キャピラリー管への前記電圧印加の程度は、例えば、1〜30kVである。前記Hbの移動は、例えば、光学的手法により検出する。前記光学的手法による検出方法は、特に制限されず、例えば、415nmの波長で行うことが好ましい。前記試料液中の各Hbは、移動速度の差により分離される。分離された前記試料液中の各Hbを、検出器を用いて検出する。本実施形態において、前記分離キャピラリー流路における、前記試料液の泳動開始点から前記検出器による検出点までの長さを、分離長という。前記キャピラリー管における分離長は、例えば、10〜1000mmであり、好ましくは、15〜300mmである。
【0099】
つぎに、前記分離キャピラリー流路を備えるマイクロチップについて、以下に説明する。本発明は、これには制限されない。
【0100】
前記マイクロチップに形成された分離キャピラリー流路は、特に制限されず、例えば、前記マイクロチップの基板上に溝を掘って形成されたキャピラリー流路、マイクロチップの基板上に形成された溝に埋設されたキャピラリー管等があげられる。
【0101】
前記基板上に溝を掘って形成されたキャピラリー流路は、例えば、その断面形状は、制限されず、円形、半円形、矩形等があげられる。前記断面形状とは、例えば、前記キャピラリー流路の試料の流れ方向に対して垂直方向に切断した際の断面形状である。前記キャピラリー流路の内壁は、例えば、前述のキャピラリー管の内壁と同様に、被覆してもよい。
【0102】
前記基板上に溝を掘って形成されたキャピラリー流路の材質は、特に制限されない。前記材質は、例えば、ガラス、ポリマー等があげられる。前記ガラスは、特に制限されず、例えば、合成石英ガラス、溶融シリカ、ホウケイ酸ガラス等があげられる。前記ポリマーは、特に制限されず、例えば、ポリメチルメタクリレート(PMMA)、シクロオレフィンポリマー(COP)、ポリカーボネート(PC)、ポリジメチルシロキサン(PDMS)、ポリスチレン(PS)、ポリ乳酸、ポリエチレン(PE)、ポリテトラフルオロエチレン(PTFE)、ポリエーテルエーテルケトン(PEEK)等があげられる。前記基板に溝を掘って形成されることから、前記基板が、これらの材質でもよい。
【0103】
前記基板上に形成された溝に埋設されたキャピラリー管の材質は、特に限定されない。前記材質は、例えば、前述のキャピラリー管と同様の材質があげられる。また、前記埋設されたキャピラリー管の内壁は、例えば、前述のキャピラリー管と同様に、被覆してもよい。
【0104】
前記マイクロチップにおいて、前記分離キャピラリー流路は、その内径の最大径が、例えば、10〜200μmであり、好ましくは、25〜100μmである。その最大長さは、例えば、0.1mm〜15cmであり、好ましくは、0.5mm〜15cmである。前記マイクロチップに形成された前記分離キャピラリー流路の内径の最大径とは、例えば、前記分離キャピラリー流路の断面形状が半円形の場合は、前記半円の直径であり、前記分離キャピラリー流路の断面形状が半円形でない場合は、断面積が最も大きい部分のその断面積に対応する面積の円の直径をいう。
【0105】
前記マイクロチップに形成された分離キャピラリー流路を用いた場合、本発明の分析方法は、例えば、つぎのようにして実施できる。
【0106】
前記マイクロチップとして、基板上に、両端に溶液槽を持つ分離キャピラリー流路が形成されたマイクロチップを使用する。具体的には、前記基板が、前記分離キャピラリー流路と前記2つの溶液槽とを有し、前記流路の両端が、それぞれ前記溶液槽と連通しており、前記流路の両端に、印可可能なように電極が配置されている。前記基板において、前記溶液槽は、例えば、前記基板に設けられた凹状の空隙である。前記溶液槽は、一方が、前記試料液を導入する導入槽であり、他方が、前記分離キャピラリー流路を流れた前記試料液が到達する回収槽である。
【0107】
前記分離キャピラリー流路に、前記酸性物質を含む泳動液を充填する。前記分離キャピラリー流路の一端に形成された前記導入槽に、Hbを含む前記試料液を導入した後、前記分離キャピラリー流路の両端に配置した電極間に、電圧を印可する。電圧は、例えば、0.5〜10kVである。この印可により、前記試料液が、前記分離キャピラリー流路の他端に形成された前記回収槽に向かって移動する。前記Hbの移動は、例えば、光学的手法により検出する。前記光学的手法による検出方法は、特に制限されず、例えば、415nmの波長で行うことが好ましい。前記試料液中の各Hbは、移動速度の差により分離される。分離された前記試料液中の各Hbを、検出器を用いて検出する。前記分離キャピラリー流路における分離長は、例えば、0.1mm〜15cmであり、好ましくは、0.5mm〜15cmである。このようにして、前記試料液中の各成分を分離して、分析することが可能である。前記マイクロチップの使用により、例えば、分析装置の一層の小型化が可能である。
【0108】
前記マイクロチップに形成された分離キャピラリー流路を用いた場合、本発明の分析方法は、例えば、試料液を連続的に導入する、前述の電気泳動法に限られず、例えば、つぎのようにして実施してもよい。特に示さない限り、前述の方法と同様である。
【0109】
前記マイクロチップとして、基板上に、導入キャピラリー流路および分離キャピラリー流路が、十字状に交差して形成されたマイクロチップを使用する。前記導入キャピラリー流路と前記分離キャピラリー流路とは、前記交差部分で連通している。具体的には、前記基板が、前記導入キャピラリー流路および分離キャピラリー流路と2つの溶液槽とを有し、前記導入キャピラリー流路の一端が一方の溶液槽と連通し、前記分離キャピラリー流路の一端が他方の溶液槽と連通し、前記導入キャピラリー流路の両端および前記分離キャピラリー流路の両端に、それぞれ、印可可能なように電極が配置されている。前記導入キャピラリー流路と連通する前記溶液槽が、前記試料液を導入する導入槽であり、前記分離キャピラリー流路と連通する前記溶液槽が、前記分離キャピラリー流路を流れた前記試料液が到達する回収槽である。
【0110】
前記導入キャピラリー流路および前記分離キャピラリー流路に、前記酸性物質を含む泳動液を充填する。前記導入キャピラリー流路の一端に形成された前記導入槽に、Hbを含む前記試料液を導入した後、前記導入キャピラリー流路の両端に配置した電極間に、電圧を印可する。電圧は、例えば、0.5〜10kVである。この印加により、前記試料液が、前記交差部分まで移動する。さらに、前記分離キャピラリー流路の両端に配置した電極間に、電圧を印可する。電圧は、例えば、0.5〜10kVである。この印可により、前記試料液が、前記分離キャピラリー流路の一端に形成された前記回収槽に向かって移動する。前記Hbの移動は、例えば、光学的手法により検出する。前記光学的手法による検出方法は、特に制限されず、例えば、415nmの波長で行うことが好ましい。前記試料液中の各Hbは、移動速度の差により分離される。分離された前記試料液中の各Hbを、検出器を用いて検出する。本実施形態において、前記分離キャピラリー流路おける、前記交差部分、すなわち、分離キャピラリー流路における前記試料液の泳動開始点から、前記検出器による検出点までの長さを、前記分離長という。前記分離キャピラリー流路における分離長は、例えば、0.1mm〜15cmであり、好ましくは、0.5mm〜15cmである。このようにして、前記試料液中の各成分を分離して、分析することが可能である。前記マイクロチップの使用により、例えば、分析装置の一層の小型化が可能である。
【0111】
つぎに、本発明の分析キットは、前述のように、前記本発明の分離改善剤を含む。本発明の分析キットは、例えば、その他に、さらに、泳動液、緩衝剤、添加剤、界面活性剤、安定化剤等を含んでもよい。本発明分析キットは、例えば、さらに、前記分離キャピラリー流路を備えてもよい。前記分離キャピラリー流路は、例えば、前述と同様であり、キャピラリー管、基板に形成されたキャピラリー流路等があげられ、後者としては、例えば、マイクロチップがあげられる。本発明の分析キットは、例えば、さらに使用説明書を備えてもよい。
【実施例】
【0112】
以下に、本発明の実施例について、比較例と併せて説明する。本発明は、下記実施例および比較例により制限されない。
【0113】
(実施例1)
本例では、前記分離改善剤として、前記酸性物質であるシクロヘキサンカルボン酸を用いて、カルバミル化Hbを含む試料液を分析した。
【0114】
下記表の組成の泳動液を調製した。前記泳動液は、まず、緩衝液として、下記L−酒石酸−アルギニン水溶液を調製し、これに種々の成分を添加して調製した。前記泳動液において、前記分離改善剤は、前記シクロヘキサンカルボン酸である、CyDTA(pKa1=2.42、pKa2=3.53)、1,1−シクロヘキサン二酢酸、1,2,4−シクロヘキサントリカルボン酸(pKa1=2.6、pKa2=4.59)および1,2,3,4,5,6−シクロヘキサンヘキサカルボン酸一水和物を使用した。L−酒石酸の酸解離定数は、pKa1=3.02であり、pKa2=4.54である。
【0115】
【表1】

【0116】
また、試料液の調製に使用する希釈液として、前記各泳動液を1.1倍濃度に設定した溶液(pH4.8)を、それぞれ調製した。
【0117】
Hbコントロールサンプル(BML社製)に、シアン酸ナトリウムを10mg/100mLとなるように添加し、37℃で2時間反応させた。この反応によって、Hbをシアン化した。この反応液と、前記各希釈液とを、1:10の体積比で混合し、試料液(pH4.8)を調製した。
【0118】
分離キャピラリー流路(全長35mm、内径50μm)を有するPMMA製マイクロチップを使用した。前記マイクロチップの前記分離キャピラリー流路に、0.01重量%のアルギン酸水溶液を通液し、前記分離キャピラリー流路の内壁を被覆処理した。
【0119】
前記キャピラリー流路に、前記泳動液を、0.1MPa(1000mbar)で加圧して充填後、前記試料液を前記キャピラリー流路の陽極側に注入した。前記キャピラリー流路の両端に配置した電極間に1400Vの電圧を印加し、前記試料液を電気泳動させた。分光光度計を使用し、検出点において、415nmにおける吸光度を測定した。本例では、前記試料液の注入箇所から20mm陰極側を検出点とし、分離長を20mmとした。検出時間と吸光度との関係を示すグラフを作成し、下記式を用いて、安定型HbA1c(s−A1c)と修飾Hb(本例ではカルバミル化Hb)のピークとの分離度を算出した。
分離度=1.18×(t2−t1)/(p1+p2)
t1=修飾Hbのピークの検出時間
t2=安定型HbA1cのピークの検出時間
p1=修飾Hbのピークのピーク半値幅※
p2=安定型HbA1cのピークのピーク半値幅※
※ピーク半値幅:ピーク高さの中点におけるピーク幅
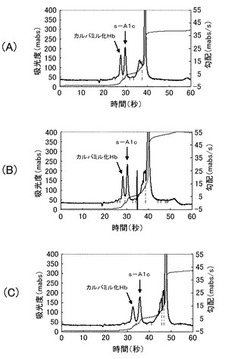
【0120】
図1のグラフに、実施例1の検出結果を示す。図1において、(A)は、L−酒石酸およびCyDTAを添加した結果であり、(B)は、L−酒石酸および1,1−シクロヘキサン二酢酸を添加した結果であり、(C)は、L−酒石酸および1,2,4−シクロヘキサントリカルボン酸を添加した結果である。図1のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。これらのグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。これらのグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(カルバミル化Hb)および安定型HbA1c(s−A1c)である。
【0121】
図1(A)〜(C)に示すように、実施例1では、s−A1cおよびカルバミル化Hbのピークが、測定開始から約40秒以内に、分離して検出された。分離度は、(A)L−酒石酸およびCyDTAを添加した場合、(B)L−酒石酸および1,1−シクロヘキサン二酢酸を添加した場合、(C)L−酒石酸および1,2,4−シクロヘキサントリカルボン酸を添加した場合、ともに1.3であった。特に、図1(A)および(B)に示すように、(A)L−酒石酸とCyDTAまたは(B)L−酒石酸と1,1−シクロヘキサン二酢酸とを添加した場合、s−A1cおよびカルバミル化Hbのピークが、より明瞭に分離され、測定開始から約30秒以内に検出された。また、図示していないが、1,2,3,4,5,6−シクロヘキサンヘキサカルボン酸一水和物を添加した場合も、同様に、s−A1cおよびカルバミル化Hbが分離して検出され、分離度は、1.2であった。なお、実施例1において、分析時の前記泳動液のpHは、4.8であった。このように、前記酸性物質の添加により、s−A1cおよびカルバミル化Hbの分離精度が向上し、分析時間が短縮した。
【0122】
(実施例2)
本例では、Hbコントロールサンプルに代えて、ヒト全血を使用し、前記シアン酸ナトリウムに代えて、Hbのアルデヒド化のためにアセトアルデヒドを使用した。そして、アセトアルデヒドが10mg/100mLとなるようにヒト全血に添加した以外は、前記実施例1と同様にして、試料液(pH4.8)を調製した。この試料液を使用した以外は、実施例1と同様にして分析した。
【0123】
図2のグラフに、実施例2においてCyDTAを添加した場合の検出結果を示す。図2のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。図2のグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図2のグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(アルデヒド化Hb)および安定型HbA1c(s−A1c)である。
【0124】
図2に示すように、実施例2では、CyDTAを添加した結果、s−A1cおよびアルデヒド化Hbのピークが、測定開始から約30秒以内に、分離して検出された。また、図示していないが、前記実施例1で使用したその他のシクロヘキサンカルボン酸を添加した場合も、CyDTAと同様に、s−A1cおよびアルデヒド化Hbが分離して検出された。特に、図2に示すように、CyDTAを添加した場合、s−A1cおよびアルデヒド化Hbのピークが、より明瞭に分離された。なお、実施例2において、分析時の泳動液のpHは、4.8であった。このように、前記酸性物質の添加により、s−A1cおよびアルデヒド化Hbの分離精度が向上した。
【0125】
(実施例3)
本例では、Hbコントロールサンプルに代えて、ヒト全血を使用し、前記シアン酸ナトリウムに代えて、Hbの糖化のためにグルコースを使用した。そして、グルコースが1500mg/100mLとなるようにヒト全血に添加した以外は、前記実施例1と同様にして、試料液(pH4.8)を調製した。この試料液を使用した以外は、実施例1と同様にして分析した。
【0126】
図3のグラフに、実施例3においてCyDTAを添加した場合の検出結果を示す。図3のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。図3のグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図3のグラフにおいて、矢印で指し示すピークは、左から順に、不安定型A1c(L−A1c)および安定型A1c(s−A1c)である。
【0127】
図3に示すように、実施例3では、CyDTAを添加した結果、s−A1cおよび不安定型A1cのピークが、測定開始から約30秒以内に、分離して検出された。また、図示していないが、前記実施例1で使用したその他のシクロヘキサンカルボン酸を添加した場合も、CyDTAと同様に、s−A1cおよび不安定型A1cが分離して検出された。特に、図3に示すように、CyDTAを添加した場合、s−A1cおよび不安定型A1cのピークは、より明瞭に分離された。なお、実施例3において、分析時の泳動液のpHは、4.8であった。このように、前記酸性物質の添加により、s−A1cおよび不安定型A1cの分離精度が向上した。
【0128】
(実施例4)
本例では、前記分離改善剤として、前記シクロヘキサンカルボン酸に代えて、L−グルタミン酸(pKa1=2.18、pKa2=4.20)を用いた以外は、実施例1と同様にして分析した。
【0129】
図4のグラフに、実施例4の検出結果を示す。図4のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。図4のグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図4のグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(カルバミル化Hb)および安定型HbA1c(s−A1c)である。
【0130】
図4に示すように、実施例4では、L−グルタミン酸を添加した結果、s−A1cおよびカルバミル化Hbのピークが、測定開始から約35秒以内に、分離して検出された。その分離度は、1.24であった。なお、実施例4において、分析時の泳動液のpHは、4.8であった。このように、前記酸性物質の添加により、s−A1cおよびカルバミル化Hbの分離精度が向上し、分析時間が短縮した。
【0131】
(実施例5)
本例では、前記表1の泳動液の組成において、前記分離改善剤を無添加とし、緩衝剤であるL−酒石酸に代えて、前記酸性物質であるD−酒石酸を100mmol/Lとなるように添加して、泳動液を調製した。また、この泳動液の組成に基づいて、前記実施例1と同様にして、希釈液を調製した。前記泳動液および前記希釈液を用いた以外は、実施例1と同様にして分析した。D−酒石酸の酸解離定数は、pKa1=2.82であり、pKa2=3.96である。
【0132】
図5のグラフに、実施例5の検出結果を示す。図5のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。図5のグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図5のグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(カルバミル化Hb)および安定型HbA1c(s−A1c)である。
【0133】
図5に示すように、実施例5では、D−酒石酸を添加した結果、s−A1cおよびカルバミル化Hbのピークが、測定開始から約35秒以内に、分離して検出された。なお、実施例5において、分析時の泳動液のpHは、4.8であった。このように、D−酒石酸の添加により、s−A1cおよびカルバミル化Hbの分析精度が向上し、分析時間が短縮した。
【0134】
(比較例1)
本例では、前記表1の泳動液の組成において、前記分離改善剤を無添加として、緩衝液として、L−酒石酸−アルギニン水溶液に代えて、100mmol/L グルタル酸−アルギニン水溶液または100mmol/L プロピオン酸−アルギニン水溶液を使用して、泳動液を調製した。また、この泳動液の組成に基づいて、前記実施例1と同様にして、希釈液を調製した。前記泳動液および前記希釈液を用いた以外は、実施例1と同様にして分析した。グルタル酸は、2つのカルボキシル基を有し、前記カルボキシル基の酸解離定数は、pKa1=4.13、pKa2=5.01である。また、プロピオン酸は、カルボキシル基を1つのみ有し、酸解離定数は、pKa=4.86である。
【0135】
図6のグラフに、比較例1の検出結果を示す。図6において、(A)はグルタル酸−アルギニン水溶液を用いた結果であり、(B)はプロピオン酸−アルギニン水溶液を用いた結果である。図6のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。両グラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図6(A)のグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(カルバミル化Hb)および安定型HbA1c(s−A1c)である。
【0136】
図6(A)に示すように、グルタル酸−アルギニン水溶液を用いた場合、s−A1cおよびカルバミル化Hbのピークは、低くかつブロードとなり、分離して検出できなかった。その分離度は、0.5であった。図6(B)に示すように、プロピオン酸−アルギニン水溶液を用いた場合、ピークを検出できなかった。なお、比較例1において、分析時の泳動液のpHは、5.0であった。このように、グルタル酸またはプロピオン酸の存在下では、s−A1cおよびカルバミル化Hbを分離して検出できなかった。
【0137】
前記実施例1〜5および前記比較例1の結果から明らかなように、前記酸性物質の存在下で、試料液を電気泳動することにより、Hbの分離精度が向上し、分析時間が短縮した。特に、安定型HbA1c(s−A1c)と、修飾Hbまたは不安定型A1cとの分離精度が向上した。
【産業上の利用可能性】
【0138】
以上のように、本発明は、例えば、HbA1cおよび修飾ヘモグロビン等のHbの分析精度を向上し、分析時間を短縮可能である。本発明は、例えば、臨床検査、生化学検査、医学研究等のヘモグロビンを分析する全ての分野に適用することができ、その用途は限定されず、広い分野に適用可能である。
【技術分野】
【0001】
本発明は、電気泳動法によるヘモグロビンの分析方法に関する。
【背景技術】
【0002】
血液中のヘモグロビンは、血液中のグルコースと反応して糖化ヘモグロビンとなる。前記糖化ヘモグロビンの中でも、特に、ヘモグロビンA1c(HbA1c)は、糖尿病の診断や治療等において、重要な指標である。HbA1cは、ヘモグロビンA(HbA0)のβ鎖N末端のバリンが糖化したものであり、糖化反応の段階によって、安定型ヘモグロビンA1c(以下、「安定型A1c」または「s−A1c」ともいう。)および不安定型ヘモグロビンA1c(以下、「不安定型A1c」または「L−A1c」ともいう。)が存在する。不安定型A1cは、HbA0のβ鎖N末端のバリンに、グルコースがシッフ塩基結合して、アルジミンとなったものである。前記不安定型A1cが、さらにアマドリ転移を受けてケトアミン化合物となったものが、安定型A1cである。安定型A1cは、過去数ヶ月間の血糖値を反映し、日本糖尿病学会の標準測定法の測定項目となっている。
【0003】
血液中の糖化ヘモグロビンの測定方法は、例えば、免疫法、酵素法、アフィニティクロマトグラフィ法、HPLC法、キャピラリー電気泳動法等がある。前記免疫法および前記酵素法は、自動分析装置に適用可能である。このため、検体を大量に処理できるという長所を有するが、糖尿病患者の血糖コントロール指標および/または合併症の発症予防マーカーとして用いるには、測定精度に欠ける。前記アフィニティクロマトグラフィ法は、分離原理上、β鎖N末端の糖化バリンに対する特異性が低く、Hb分子中の糖化リジンが測定値に含まれてしまうため、HbA1cの測定精度が低い。また、前記HPLC法は、糖尿病患者の治療における糖化ヘモグロビンの測定方法として汎用されているが(特許文献1)、大型で高価な専用の装置を必要とし、装置の小型化および低コスト化が困難である。集団検診への利用等の理由から、ヘモグロビンの分析装置に対しては、小型化が求められているが、前述のように、前記HPLC法は、この要請に応えることは困難である。
【0004】
他方、前記キャピラリー電気泳動法では、キャピラリー流路の内壁に集合したイオンが、印加によって移動することで電気浸透流が生じ、これにより試料が移動して電気泳動が行われる。前記キャピラリー電気泳動法は、例えば、前記キャピラリー流路の短縮化、キャピラリー電気泳動装置の一部のマイクロチップ化によって、装置全体の小型化が可能である。前記キャピラリー電気泳動法によるHbA1cの分析方法は、例えば、キャピラリーの内壁に、陰極性層が積層されたキャピラリー管を使用した方法(特許文献2および3)が報告されている。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許第3429709号公報
【特許文献2】国際公開第2008/029684号パンフレット
【特許文献3】国際公開第2008/029685号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかしながら、s−A1cの分析精度は、s−A1cと、不安定型A1cおよび修飾ヘモグロビンとの分離精度に大きく影響される。このため、短時間で、高精度に分析可能なs−A1c分析方法の開発が望まれていた。
【0007】
そこで、本発明は、電気泳動法によるヘモグロビン分析方法であって、ヘモグロビンA1c(HbA1c)および他のヘモグロビンの分離精度に優れ、かつ分析時間を短縮可能な分析方法を提供することを目的とする。
【課題を解決するための手段】
【0008】
本発明の分析方法は、泳動液中にカルボキシル基を二つ以上有する酸性物質を有する条件下で電気泳動を実施し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、電気泳動法によるヘモグロビンの分析方法である。
【発明の効果】
【0009】
本発明によれば、HbA1cと他のヘモグロビンとの分離精度が向上するため、例えば、分離キャピラリー流路の流路長を短縮化しても、高精度に分析可能であり、分析時間の短縮化が可能となる。
【図面の簡単な説明】
【0010】
【図1】図1は、実施例1におけるヘモグロビンの検出結果を示すグラフである。
【図2】図2は、実施例2におけるヘモグロビンの検出結果を示すグラフである。
【図3】図3は、実施例3におけるヘモグロビンの検出結果を示すグラフである。
【図4】図4は、実施例4におけるヘモグロビンの検出結果を示すグラフである。
【図5】図5は、実施例5におけるヘモグロビンの検出結果を示すグラフである。
【図6】図6は、比較例1におけるヘモグロビンの検出結果を示すグラフである。
【発明を実施するための形態】
【0011】
本発明の分析方法は、前記酸性物質の二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことが好ましい。
【0012】
本発明の分析方法は、前記泳動液が、緩衝剤および分離改善剤を含み、前記分離改善剤が、前記酸性物質を含むことが好ましい。
【0013】
本発明の分析方法は、前記酸性物質の二つ以上のカルボキシル基の各酸解離定数(pKa)が、分析時の前記泳動液のpHよりも0.7以上低いことが好ましい。
【0014】
本発明の分析方法は、前記泳動液が、緩衝剤を含み、前記緩衝剤の緩衝能に関与する酸解離定数(pKa)が、分析時の前記泳動液のpH−0.3の値以上であることが好ましい。
【0015】
本発明の分析方法は、前記泳動液が、緩衝剤および分離改善剤を含み、前記分離改善剤が、前記酸性物質を含み、前記緩衝剤の緩衝能に関与する酸解離定数(pKa)から、前記分離改善剤の前記酸性物質のカルボキシル基の第二酸解離定数(pKa2)を引いた差が、0.2以上であることが好ましい。
【0016】
本発明の分析方法は、ヘモグロビンを含む試料液のpHと、前記泳動液のpHとの差が、0.3未満であることが好ましい。
【0017】
本発明の分析方法は、前記酸性物質が、シクロヘキサン環を有する構造であることが好ましい。
【0018】
本発明の分析方法は、前記電気泳動法によるヘモグロビンの分離が、分離キャピラリー流路で実施されることが好ましい。
【0019】
本発明の分析方法は、ヘモグロビンを含む試料液を、連続して前記分離キャピラリー流路に導入する、連続試料導入法により実施されることが好ましい。
【0020】
本発明の分析方法は、前記分離キャピラリー流路が、マイクロチップに形成されており、前記電気泳動法が、マイクロチップ電気泳動法であるという態様でもよい。
【0021】
本発明の分析方法は、前記分離キャピラリー流路が、キャピラリー管であり、前記電気泳動法が、キャピラリー電気泳動法であるという態様でもよい。
【0022】
本発明の分析方法は、前記ヘモグロビンが、ヘモグロビンA1cであることが好ましい。
【0023】
本発明の分析方法は、前記ヘモグロビンA1cが、安定型ヘモグロビンA1cおよび不安定型ヘモグロビンA1cの少なくとも一方であることが好ましい。
【0024】
本発明の分析方法は、前記ヘモグロビンが、カルバミル化ヘモグロビン、アルデヒド化ヘモグロビンおよびアセチル化ヘモグロビンからなる群から選択される少なくとも一種の修飾ヘモグロビンであることが好ましい。
【0025】
つぎに、本発明の分離改善剤は、カルボキシル基を二つ以上有する酸性物質を含有し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、前記本発明の分析方法に用いる分離改善剤である。本発明の分離改善剤において、好ましい条件および態様は、本発明のヘモグロビンの分析方法と同じである。
【0026】
つぎに、本発明の泳動液試薬は、前記本発明の分析方法に用いる前記分離改善剤を含むことを特徴とする。本発明の泳動液試薬において、好ましい条件および態様は、本発明のヘモグロビンの分析方法と同じである。
【0027】
つぎに、本発明のマイクロチップは、分離キャピラリー流路および複数の液槽を含み、前記複数の液槽は、前記分離キャピラリー流路で連通され、前記分離キャピラリー流路および前記液槽の少なくとも一方に、泳動液が充填され、前記泳動液が、カルボキシル基を二つ以上有する酸性物質を含有し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、前記本発明の分析方法に使用するマイクロチップである。本発明のマイクロチップにおいて、好ましい条件および態様は、本発明のヘモグロビンの分析方法と同じである。
【0028】
つぎに、本発明の試薬は、前記本発明の分離改善剤を含むことを特徴とする、前記本発明の分析方法に使用する試薬である。本発明の試薬は、前記分離改善剤に加え、例えば、泳動液、緩衝剤、添加剤、界面活性剤、安定化剤等を含んでもよい。本発明の試薬は、例えば、泳動液試薬、希釈液試薬、試料液試薬等として使用してもよい。
【0029】
本発明の分析キットは、前記本発明の試薬を含むことを特徴とする。本発明の分析キットは、前記本発明の分析方法に用いる分離改善剤を含み、前記分離改善剤が、カルボキシル基を二つ以上有する酸性物質を含有し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする。すなわち、本発明の分析キットは、前記本発明の分離改善剤を含む。
【0030】
以下、本発明について詳細に説明する。以下、ヘモグロビンを「Hb」と記載する。
【0031】
本発明の分析方法は、前述のように、泳動液中にカルボキシル基を二つ以上有する酸性物質を有する条件下で電気泳動を実施し、前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、電気泳動法によるHbの分析方法である。本発明の分析方法は、特に制限されず、例えば、後述するように、前記電気泳動が、キャピラリー電気泳動またはマイクロチップ電気泳動であることが好ましい。
【0032】
本発明において、前記泳動液は、電圧を印加してHbを電気泳動により分離するための液をいう。前記泳動液は、例えば、電気泳動前の泳動液と、電気泳動時の泳動液に分けることができる。本発明において、電気泳動前の泳動液を「分析前の泳動液」と言い、電気泳動時の泳動液を「分析時の泳動液」と言うことができる。「電気泳動前」または「分析前」は、例えば、前記泳動液に電圧を印可する前を意味し、「電気泳動時」または「分析時」は、例えば、前記泳動液に電圧を印可している状態を意味し、試料が添加されている状態である。前記分析時の泳動液は、前記酸性物質を含んでいるが、前記分析前の泳動液は、前記酸性物質を含んでいてもよいし、含んでいなくてもよい。前記分析前の泳動液および前記分析時の泳動液は、例えば、緩衝剤等を含んでいてもよい。
【0033】
前記酸性物質は、分析時に、前記泳動液中に存在していればよい。このため、前記酸性物質は、例えば、前記分析前の泳動液に予め添加してもよいし、Hbを含む試料液に予め添加してもよい。前者の場合は、例えば、分離キャピラリー流路内に、分析前に充填する液として、前記酸性物質を含む液を使用することが好ましい。前記分離キャピラリー流路は、例えば、キャピラリー管、キャピラリー流路等があげられる。後者の場合、例えば、前記酸性物質を、溶血試料等のような液体試料に直接添加してもよいし、後述するような、試料を希釈する溶媒に予め添加してもよい。
【0034】
前記酸性物質は、前述のように、カルボキシル基を二つ以上有する。前記酸性物質における前記カルボキシル基の数は、例えば、2〜6であり、好ましくは、2〜4である。
【0035】
前記酸性物質は、例えば、さらに、カルボキシル基以外の官能基を有してもよい。その他の官能基は、特に制限されず、例えば、水素原子、アミノ基、ヒドロキシ基、炭素数1〜5のアルキル基、前記炭素数1〜5のアルコキシ基、炭素数1〜5のアルキルチオ基等があげられる。前記官能基における水素原子は、例えば、その一つ以上が任意の置換基によって置換されていてもよい。前記置換基は、例えば、フルオロ基、ブロモ基、クロロ基、ヨード基等のハロゲン基があげられ、好ましくはフルオロ基である。
【0036】
前記酸性物質は、二つ以上のカルボキシル基を有し、それぞれのカルボキシル基毎に酸解離定数(pKa)を有する。本発明において、少なくとも二つのカルボキシル基の酸解離定数(pKa)の範囲は、例えば、2〜5であり、好ましくは、2〜4である。
【0037】
前記酸性物質の二つ以上のカルボキシル基の酸解離定数(pKa)は、分析時の前記泳動液のpHよりも、好ましくは、0.5以上低く、より好ましくは、0.7以上低く、さらにより好ましくは、1.0以上低い。
【0038】
前記酸性物質は、具体的には、例えば、カルボン酸、アミノ酸等があげられる。
【0039】
前記カルボン酸は、例えば、ジカルボン酸、トリカルボン酸、テトラカルボン酸、ペンタカルボン酸、ヘキサカルボン酸、ヘプタカルボン酸、オクタカルボン酸、ノナカルボン酸、デカカルボン酸等があげられ、好ましくは、ジカルボン酸、トリカルボン酸、テトラカルボン酸、ペンタカルボン酸、ヘキサカルボン酸である。前記カルボン酸は、例えば、いずれか一種類を使用してもよいし、二種類以上を使用してもよい。
【0040】
前記カルボン酸は、例えば、脂肪族カルボン酸、炭素環カルボン酸等があげられる。前記脂肪族カルボン酸は、例えば、フマル酸、D−酒石酸等があげられ、好ましくは、D−酒石酸である。前記炭素環カルボン酸は、例えば、シクロヘキサンカルボン酸等があげられる。
【0041】
前記シクロヘキサンカルボン酸は、シクロヘキサン環を有する構造である。前記シクロヘキサンカルボン酸は、例えば、下記一般式(1)で表される化合物、その互変異性体もしくは立体異性体、またはそれらの塩、溶媒和物もしくは水和物が好ましい。
【化1】

ただし、前記一般式(1)は、少なくとも二つのカルボキシル基を有し、前記一般式(1)中、R1〜R12は、それぞれ同一であるかまたは異なる官能基である。前記R1〜R12の中で、少なくとも二つの官能基が、カルボキシル基を有する官能基である、および/または、少なくとも一つの官能基が、少なくとも二つのカルボキシル基を有する官能基である。前者、すなわち、少なくとも一つのカルボキシル基を有する官能基は、例えば、カルボキシル基、カルボキシアルキル基である。前記カルボキシアルキル基において、アルキル基部分は、例えば、炭素数1〜5であり、炭素数1が好ましく、前記カルボキシアルキル基の具体例は、例えば、−CH2COOHがあげられる。後者、すなわち、少なくとも二つのカルボキシル基を有する官能基は、例えば、ビス(カルボキシアルキル)アミノ基である。前記ビス(カルボキシアルキル)アミノ基において、アルキル基部分は、例えば、炭素数1〜5であり、炭素数1が好ましく、前記ビス(カルボキシアルキル)アミノ基の具体例は、例えば、−N(CH2COOH)2があげられる。前記官能基は、具体的には、前記カルボキシル基を含む官能基の他に、例えば、水素原子、アミノ基、炭素数1〜5のアルキル基、炭素数1〜5のアルコキシ基または炭素数1〜5のアルキルチオ基である。前記R1〜R12上の水素原子は、その一つ以上が任意の置換基によって置換されていてもよい。前記R1〜R12上の水素原子および前記置換基のうち少なくとも二つが、カルボキシル基に置換されていてもよい。前記置換基は、特に制限されず、例えば、カルボキシル基、アシル基、アミノ基、アルキル基、水酸基等があげられる。前記水酸基は、例えば、異性化し、オキソ基(=O)として存在してもよい。前記置換基における水素原子は、例えば、カルボキシル基、アミノ基、水酸基等の置換基によって置換されていてもよい。
【0042】
前記アルキル基は、特に限定されず、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、イソペンチル基、ネオペンチル基、tert−ペンチル基等があげられ、アルキル基を構造中に含む、アルコキシ基およびアルキルチオ基においても同様である。前記アルキル基は、例えば、その一つ以上の水素原子が任意の置換基に置換されていてもよい。前記アルキル基における置換基は、特に制限されず、例えば、前述の置換基等があげられる。
【0043】
前記アルコキシ基は、特に限定されず、例えば、メトキシ基、エトキシ基、n−プロポキシ基、イソプロポキシ基等があげられる。前記アルコキシ基は、例えば、その一つ以上の水素原子が任意の置換基に置換されていてもよい。前記アルコキシ基における置換基は、特に制限されず、例えば、前述の置換基等があげられる。
【0044】
前記アルキルチオ基は、特に制限されず、例えば、メチルチオ基、エチルチオ基、n−プロピルチオ基、イソプロピルチオ基等があげられる。前記アルキルチオ基は、例えば、その一つ以上の水素原子が任意の置換基に置換されていてもよい。前記アルキルチオ基における置換基は、特に制限されず、例えば、前述の置換基等があげられる。
【0045】
前記R1〜R12について、前記カルボキシル基を有する官能基の具体例は、特に制限されず、例えば、カルボキシル基(−COOH)、前記カルボキシアルキル基、前記ビス(カルボキシアルキル)アミノ基等があげられ、前記カルボキシアルキル基は、−CH2−COOHが好ましく、前記ビス(カルボキシアルキル)アミノ基は、−N−(CH2COOH)2が好ましい。
【0046】
前記シクロヘキサンカルボン酸は、具体的には、例えば、トランス−1,2−シクロヘキサンジアミン−N,N,N’,N’−四酢酸(CyDTA)、1,1−シクロヘキサン二酢酸、(1α,2α,4α)−1,2,4−シクロヘキサントリカルボン酸、1,2,3,4,5,6−シクロヘキサンヘキサカルボン酸一水和物等が好ましい。前記シクロヘキサンカルボン酸は、一種類でもよいし、二種類以上を併用してもよい。
【0047】
前記アミノ酸は、例えば、アスパラギン酸、グルタミン酸等があげられ、好ましくは、グルタミン酸である。前記アミノ酸は、一種類を使用してもよいし、二種類以上を併用してもよい。
【0048】
前記酸性物質は、前述のように、例えば、二つ以上のカルボキシル基を有し、それぞれのカルボキシル基毎に酸解離定数(pKa)を有する。少なくとも二つのカルボキシル基の酸解離定数(pKa)の範囲は、例えば、2〜5であり、好ましくは、2〜4である。このような範囲の酸解離定数を有する酸性物質は、例えば、CyDTA、(1α,2α,4α)−1,2,4−シクロヘキサントリカルボン酸、L−グルタミン酸、D−酒石酸、L−酒石酸、フマル酸、クエン酸、アスパラギン酸、フタル酸、D−リンゴ酸等があげられる。
【0049】
前記酸性物質の二つ以上のカルボキシル基の酸解離定数(pKa)は、分析時の前記泳動液のpHよりも低いことが好ましく、より好ましくは、0.5以上低く、さらに好ましくは、0.7以上低く、特に好ましくは、1.0以上低い。このような酸性物質は、特に制限されず、例えば、CyDTA、D−酒石酸、フマル酸、アスパラギン酸等があげられる。このような酸性物質は、例えば、金属のキレート剤としても使用可能であり、これによって、例えば、試料中のカルシウムイオン、マグネシウムイオン等のイオンを除去することも可能である。また、これらのイオンを除去することによって、例えば、後述するような陰極性基含有化合物の凝集を抑制することも可能である。
【0050】
前記泳動液は、前記酸性物質のうち、いずれか一種類を含んでもよいし、二種類以上を含んでもよい。前記酸性物質の組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0051】
前記泳動液における前記酸性物質の濃度は、特に制限されず、例えば、0.1〜100mmol/Lであり、好ましくは、0.1〜50mmol/Lであり、より好ましくは、0.5〜10mmol/Lであり、さらにより好ましくは、1〜5mmol/Lである。
【0052】
前記泳動液は、例えば、分離改善剤と緩衝剤とを含み、前記分離改善剤が、前記酸性物質を含んでもよい。
【0053】
前記分離改善剤は、例えば、前記酸性物質の他に、さらに、任意の物質を含んでもよい。前記物質の組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0054】
前記分離改善剤は、例えば、分析時に、前記泳動液中に存在していればよい。このため、前記分離改善剤は、例えば、分析前の前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。前者の場合は、例えば、分離キャピラリー流路内に、分析前に充填する液として、前記分離改善剤を含む液を使用することが好ましい。前記分離キャピラリー流路は、例えば、キャピラリー管、キャピラリー流路等があげられる。後者の場合、例えば、前記分離改善剤を、前記試料に直接添加してもよいし、後述するような、試料を希釈する溶媒に予め添加してもよい。
【0055】
前記緩衝剤は、例えば、従来公知の緩衝物質があげられる。前記緩衝物質は、具体的には、例えば、リン酸、ホウ酸等の無機酸、L−酒石酸、酢酸、マレイン酸、マロン酸、フタル酸、クエン酸、ギ酸、乳酸、安息香酸、コハク酸、プロピオン酸、リンゴ酸、グルタル酸、トリス(ヒドロキシメチル)アミノメタン(Tris)、モルフォリノエタンスルホン酸(MES)、N−(2−アセトアミド)イミノ二酢酸(ADA)、N−(2−アセトアミド)−2−アミノエタンスルホン酸(ACES)、N,N−ビス(2−ヒドロキシエチル)−2−アミノエタンスルホン酸(BES)、3−モルフォリノプロパンスルホン酸(MOPS)、N−トリス(ヒドロキシメチル)メチル−2−アミノエタンスルホン酸(TES)、2−(4−(2−ヒドロキシエチル)−1−ピペラジニル)エタンスルホン酸(HEPES)等の有機酸、システイン、チロシン、ヒスチジン、リシン、アルギニン等のアミノ酸等があげられる。前記泳動液は、前記緩衝剤として、前記緩衝物質のうち、いずれか一種類を含んでもよいし、二種類以上を含んでもよい。前記緩衝物質の組み合わせおよび割合は、特に制限されず、適宜設定できる。前記泳動液が緩衝剤と分離改善剤とを含む場合、前記緩衝剤は、例えば、前記酸性物質以外の緩衝物質でもよいし、前記酸性物質でもよい。
【0056】
前記緩衝剤は、例えば、分析時に、前記泳動液中に存在していればよい。このため、前記緩衝剤は、例えば、分析前の前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。前者の場合は、例えば、分離キャピラリー流路内に、分析前に充填する液として、前記緩衝剤を含む液を使用することが好ましい。前記分離キャピラリー流路は、例えば、キャピラリー管、キャピラリー流路等があげられる。後者の場合、例えば、前記緩衝剤を前記試料に直接添加してもよいし、後述するような、試料を希釈する溶媒に予め添加してもよい。前記緩衝剤は、例えば、分析前の前記泳動液に予め添加するのが好ましい。分析前の前記泳動液に前記緩衝剤を添加することにより、例えば、前記試料液と分析前の前記泳動液とのpHの差を、後述の範囲に設定できる。
【0057】
前記緩衝剤の酸解離定数(pKa)は、特に制限されず、例えば、4.5〜6であり、好ましくは、4.5〜5.5である。このような範囲の酸解離定数を有する緩衝剤は、例えば、L−酒石酸、クエン酸、グルタル酸、コハク酸、酢酸、フタル酸、マロン酸、マレイン酸、リンゴ酸、プロピオン酸等があげられる。
【0058】
前記緩衝剤が複数の酸解離定数(pKa)を有する場合、前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))は、例えば、前記緩衝剤の酸解離定数(pKa)のうち、分析時の前記泳動液のpH(X)に最も近い値の酸解離定数をいう。前記緩衝剤が一つの酸解離定数(pKa)を有する場合、例えば、前記酸解離定数が、前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))である。前記緩衝剤の酸解離定数(pKa)のうち、前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))は、例えば、分析時の前記泳動液のpH−0.3の値以上であるのが好ましい。つまり、分析時の前記泳動液のpHの値を「X」とした場合、前記酸解離定数(pKan(B))は、例えば、[X−0.3]以上が好ましい。
【0059】
前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))と、前記分析時の前記泳動液のpH(X)との差は、例えば、−0.3以上である。このような範囲の酸解離定数を有する緩衝剤は、例えば、L−酒石酸、グルタル酸、酢酸、フタル酸、リンゴ酸、プロピオン酸等があげられる。
【0060】
前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))は、例えば、前記分離改善剤の前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)より高いことが好ましい。前記緩衝剤の緩衝能に関与する酸解離定数(pKan(B))と、前記分離改善剤の前記酸性物質の少なくとも二つのカルボキシル基の各酸解離定数(pKa(A))との差、すなわち、[pKan(B)−pKa(A)]は、例えば、0.2以上であり、好ましくは、0.5以上であり、より好ましくは、0.7以上である。具体的には、前記緩衝剤の酸解離定数(pKan(B))と、前記分離改善剤の前記酸性物質の第2酸解離定数(pKa2)との差、すなわち、[pKan(B)−pKa2]は、例えば、0.2以上であり、好ましくは、0.5以上であり、より好ましくは、0.7以上である。このような関係を満たす前記緩衝剤と前記酸性物質との組み合わせは、特に制限されず、例えば、L−酒石酸とCyDTAの組み合わせ、L−酒石酸とL−グルタミン酸の組み合わせ、リンゴ酸とCyDTAの組み合わせ、リンゴ酸とD−酒石酸の組み合わせ、クエン酸とCyDTAの組み合わせ、クエン酸とフマル酸の組み合わせ等があげられる。
【0061】
前記泳動液は、例えば、さらに、添加剤、界面活性剤、安定化剤等を含んでもよい。前記添加剤は、例えば、分析時に、前記泳動液中に存在していればよい。このため、前記添加剤は、例えば、分析前の前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。前者の場合は、例えば、分離キャピラリー流路内に、分析前に充填する液として、前記添加剤を含む液を使用することが好ましい。前記分離キャピラリー流路は、例えば、キャピラリー管、キャピラリー流路等があげられる。後者の場合、例えば、前記添加剤を、前記試料に直接添加してもよいし、後述するような、試料を希釈する溶媒に予め添加してもよい。前記界面活性剤および安定化剤も、例えば、分析時に、前記泳動液中に存在していればよい。前記界面活性剤および安定化剤は、例えば、前述の添加剤と同様にして、前記泳動液、前記試料液等に添加すればよい。
【0062】
前記添加剤は、特に制限されず、例えば、陰極性基含有化合物、陰イオン性カオトロピックイオン等があげられる。
【0063】
前記陰極性基含有化合物は、特に制限されず、例えば、陰極性基含有多糖類等があげられる。前記陰極性基含有多糖類は、特に限定されず、例えば、硫酸化多糖類、カルボン酸化多糖類、スルホン酸化多糖類、リン酸化多糖類等があげられ、この中で、硫酸化多糖類およびカルボン酸化多糖類が好ましい。前記硫酸化多糖類は、例えば、コンドロイチン硫酸、ヘパリンまたはこれらの塩等が好ましく、より好ましくは、コンドロイチン硫酸またはその塩である。前記カルボン酸化多糖類は、例えば、アルギン酸、ヒアルロン酸またはこれらの塩が好ましい。前記塩は、例えば、アルギン酸ナトリウム、ヒアルロン酸ナトリウム等があげられる。前記コンドロイチン硫酸は、例えば、コンドロイチン硫酸A、コンドロイチン硫酸B、コンドロイチン硫酸C、コンドロイチン硫酸D、コンドロイチン硫酸E、コンドロイチン硫酸Hおよびコンドロイチン硫酸K等があげられる。前記陰極性基含有化合物は、例えば、いずれか一種類でもよいし、二種類以上を併用してもよい。前記陰極性基含有化合物の組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0064】
分析時の前記泳動液における前記陰極性基含有化合物の濃度は、特に限定されず、例えば、約0.01〜5重量%であり、好ましくは、約0.1〜2重量%である。前述のように、前記陰極性基含有化合物は、例えば、前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。したがって、前者の場合、前記泳動液中の前記陰極性基含有化合物の濃度は、特に制限されず、例えば、分析時において、前述の範囲になるように添加することが好ましい。後者の場合、前記試料液中の前記陰極性基含有化合物の濃度は、特に制限されず、例えば、分析時において、前述の範囲になるように添加することが好ましい。
【0065】
前記陰極性基含有化合物の存在下で前記試料液を電気泳動する場合、例えば、前記試料液中のHbは、前記陰極性基含有化合物と複合体を形成した状態で、前記泳動液中を電気泳動する。この複合体形成により、例えば、分析精度をさらに向上させ、前記分離キャピラリー流路の長さ(分離長)をさらに短縮可能である。このため、例えば、分析時間をさらに短縮できる。
【0066】
カオトロピックイオンは、一般的に、水分子間の相互作用を破壊して、疎水性分子との接触による水のエントロピーの減少を抑制することにより、疎水性分子の水溶性を高めるイオンである。前記陰イオン性カオトロピックイオンは、特に制限されず、例えば、過塩素酸イオン(ClO4−)、チオシアン酸イオン(SCN−)、トリクロロ酢酸イオン(CCl3COO−)、トリフルオロ酢酸イオン(CF3COO−)、硝酸イオン(NO3−)、ジクロロ酢酸イオン(CCl2COO−)、ハロゲン化物イオン等があげられる。前記ハロゲン化物イオンは、特に制限されず、例えば、フッ化物イオン(F−)、塩化物イオン(Cl−)、臭化物イオン(Br−)、ヨウ化物イオン(I−)、アスタチン化物イオン(At−)等があげられ、好ましくは、臭化物イオン(Br−)、ヨウ化物イオン(I−)である。前記カオトロピックイオンは、例えば、一種類でもよいし、二種類以上を併用してもよい。前記カオトロピックイオンの組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0067】
前記泳動液は、例えば、前記陰イオン性カオトロピックイオンを含んでもよいし、前記陰イオン性カオトロピックイオンを含む塩、および、電離して前記陰イオン性カオトロピックイオンを生じる物質の少なくともいずれかを含んでもよい。本発明では、後述のように、前記陰イオン性カオトロピックイオンは、例えば、使用しないか、低濃度で用いることが好ましい。前記塩は、例えば、酸性塩、中性塩、塩基性塩があげられる。前記陰イオン性カオトロピックイオンを含む塩、および前記電離して陰イオン性カオトロピックイオンを生じる物質は、特に限定されず、具体的には、例えば、ヨウ化カリウム、臭化カリウム等のハロゲン化カリウム、過塩素酸ナトリウム、チオシアン酸カリウム、トリクロロ酢酸カリウム、トリフルオロ酢酸カリウム等があげられる。したがって、本発明において、前記陰イオン性カオトロピックイオンは、例えば、前記陰イオン性カオトロピックイオンを含む塩、または前記電離して陰イオン性カオトロピックイオンを生じる物質等も含まれる。前記陰イオン性カオトロピックイオンは、例えば、いずれか一種類でもよいし、二種類以上を併用してもよい。前記陰イオン性カオトロピックイオンの組み合わせおよび割合は、特に制限されず、適宜設定できる。
【0068】
前述のように、前記陰イオン性カオトロピックイオンを使用すれば、例えば、分離精度は向上するが、高濃度の陰イオン性カオトロピックイオン存在下で電気泳動法を実施すると、電流量の増加により、発熱量が増加する場合がある。この発熱量の増加により、例えば、Hbの分離精度が低下し、泳動速度は遅くなる。本発明によれば、前述のように、前記泳動液中に前記酸性物質を有する条件下で電気泳動が実施されることにより、Hbの分離精度が向上する。このため、例えば、前記陰イオン性カオトロピックイオンの濃度を低減した条件下でも、Hbを高精度に分離できる。したがって、本発明は、例えば、前記陰イオン性カオトロピックイオンの低減により、前述のHbの分離精度および泳動速度への影響を抑制でき、より高精度に分析可能である。
【0069】
分析時の前記泳動液における前記陰イオン性カオトロピックイオンは、例えば、含まれないか、比較的低濃度であるのが好ましい。分析時の前記泳動液における前記陰イオン性カオトロピックイオンの濃度は、具体的には、例えば、1〜3000mmol/Lであり、好ましくは、5〜100mmol/Lであり、より好ましくは、10〜50mmol/Lである。前記陰イオン性カオトロピックイオンは、例えば、分析時に前述のような範囲になるように、前記泳動液に予め添加してもよいし、前記試料液に予め添加してもよい。
【0070】
前記界面活性剤は、特に限定されず、例えば、非イオン性界面活性剤等があげられる。前記非イオン性界面活性剤は、特に制限されず、例えば、ポリオキシエチレンイソオクチルフェニルエーテル(商品名「Triton(登録商標)X−100」)等があげられる。
【0071】
前記安定化剤は、特に制限されず、例えば、アジ化ナトリウム、グルタチオン、エチレンジアミン四酢酸(EDTA)等があげられる。
【0072】
分析前および分析時の前記泳動液のイオン強度は、特に制限されない。前記泳動液のpHは、特に制限されず、例えば、4.5〜6であり、好ましくは、4.5〜5.5である。
【0073】
本発明の分析方法は、例えば、試料液を前記泳動液に導入して、電気泳動するのが好ましい。前記試料液は、Hbを含む試料である。前記試料は、例えば、生体由来の試料でもよいし、Hbを含有する市販品を含む試料でもよい。前記生体由来の試料は、例えば、血液試料があげられ、具体的には、例えば、全血、血球画分等の血球含有物があげられる。前記試料液は、例えば、生体から採取した試料そのものでもよいし、前記採取した試料を溶媒で希釈した希釈試料でもよい。
【0074】
前記血液試料は、特に制限されず、前記血球含有物を溶血処理した溶血試料等があげられる。前記溶血処理は、特に制限されず、例えば、超音波処理、凍結解凍処理、加圧処理、浸透圧処理、界面活性剤処理等があげられ、好ましくは、浸透圧処理である。前記浸透圧処理は、特に制限されず、例えば、前記血球含有物を低張液等で処理してもよい。前記低張液は、特に制限されず、例えば、水、緩衝液等があげられる。前記緩衝液は、特に制限されず、例えば、前述の緩衝剤、添加剤等を含んでもよい。
【0075】
前記希釈用の溶媒は、特に制限されず、例えば、水、生理食塩水、緩衝液等があげられる。前記緩衝液は、特に制限されず、例えば、前述の分離改善剤、緩衝剤、添加剤、界面活性剤、安定化剤等を含んでもよい。
【0076】
前述のように、前記試料液に前記分離改善剤を添加する場合、前記分離改善剤は、例えば、溶血処理時に添加してもよく、希釈時に添加してもよい。前者の場合、例えば、浸透圧処理に使用する前記低張液に、予め前記分離改善剤を添加してもよい。後者の場合、例えば、前記希釈用の溶媒に、予め前記分離改善剤を添加してもよい。前記緩衝剤、添加剤、界面活性剤、安定化剤を前記試料液に添加する場合も、例えば、前述の分離改善剤と同様である。
【0077】
前記試料液のイオン強度は、特に制限されない。前記試料液のpHは、特に制限されず、例えば、4.5〜6が好ましく、より好ましくは、4.5〜5.5である。
【0078】
試料液によって泳動液にpH変動を与える場合、前記試料液のpHと、前記泳動液のpHとの差は、小さいほど好ましく、前記差は、例えば、0〜0.3であり、好ましくは、0〜0.1である。前記泳動液のpHは、例えば、分析前および分析時のいずれかの前記泳動液のpHであり、好ましくは、分析時の前記泳動液のpHである。
【0079】
前記pHの差は、例えば、前記試料液に前記緩衝剤を添加することにより調整してもよいし、前述のように、分析前の前記泳動液に前記緩衝剤を添加することにより調整してもよい。好ましくは、後者である。前記分離改善剤のみで調整した試料液のpHと、分析時の泳動液のpHとの差は、例えば、0.3以上であるが、緩衝剤を添加してpHの前記差を、0.3未満とすることが好ましい。
【0080】
前記Hbは、特に限定されず、例えば、ヘモグロビンA1a(HbA1a)、ヘモグロビンA1b(HbA1b)、安定型ヘモグロビンA1c(安定型A1c、s−A1c)、不安定型ヘモグロビンA1c(不安定型A1c、L−A1c)等の糖化ヘモグロビン;カルバミル化ヘモグロビン(カルバミル化Hb)、アセチル化ヘモグロビン(アセチル化Hb)等の修飾ヘモグロビン;ヘモグロビンS(HbS)、ヘモグロビンC(HbC)、ヘモグロビンM(HbM)、ヘモグロビンH(HbH)等の変異型ヘモグロビン;正常ヘモグロビン(HbA0);胎児ヘモグロビン(HbF);HbA2等があげられる。本発明は、例えば、HbA1cと他のHbとを、高精度かつ短時間に分離して検出できる。したがって、本発明の分析対象は、例えば、HbA1cを含むことが好ましく、HbA1cおよび修飾Hbを含むのがより好ましい。
【0081】
本発明は、前記Hbに加えて、さらに、その他の成分を分析対象としてもよい。前記その他の成分は、特に制限されず、例えば、アルブミン(Alb)、グロブリン(α1、α2、β、γグロブリン)、フィブリノーゲン、グルコース、グリコアルブミン等があげられる。
【0082】
本発明の分析方法は、電気泳動法によるHbの分離が、例えば、分離キャピラリー流路で実施されてもよい。この場合、前記電気泳動法を、キャピラリー電気泳動法ともいう。前記分析方法は、例えば、連続試料導入法により実施されるのが好ましく、これは、一般に、Hbを含む試料液を、連続的に前記分離キャピラリー流路に導入する方法である。
【0083】
前記分離キャピラリー流路は、特に制限されず、例えば、キャピラリー管、マイクロチップ等の基板に形成されたキャピラリー流路等があげられる。したがって、前記分析方法は、例えば、前記分離キャピラリー流路が、マイクロチップに形成されており、前記電気泳動法が、マイクロチップ電気泳動法でもよい。また、前記分析方法は、例えば、前記分離キャピラリー流路が、キャピラリー管であり、前記電気泳動法が、キャピラリー電気泳動法でもよい。
【0084】
本発明の分析方法は、例えば、キャピラリー管、キャピラリー流路を備えるマイクロチップ等を、前記分離キャピラリー流路を備えるデバイスとして使用できる。前記分離キャピラリー流路を備えるデバイスは、例えば、自家作製してもよいし、市販品を用いてもよい。
【0085】
まず、前記キャピラリー管について、以下に説明する。本発明は、これには制限されない。
【0086】
前記キャピラリー管の内径は、特に限定されず、例えば、10〜200μm、好ましくは、25〜100μmである。前記キャピラリー管の長さは、特に限定されず、例えば、10〜1000mmであり、好ましくは、15〜300mmである。
【0087】
前記キャピラリー管の材質は、特に限定されず、例えば、ガラス、ポリマー等があげられる。前記キャピラリー管は、例えば、市販品を用いてもよい。前記ガラスは、特に制限されず、例えば、合成石英ガラス、溶融シリカ、ホウケイ酸ガラス等があげられる。前記ポリマーは、特に制限されず、具体的には、例えば、ポリメチルメタクリレート(PMMA)、ポリカーボネート(PC)、ポリスチレン(PS)、ポリエチレン(PE)、ポリテトラフルオロエチレン(PTFE)、ポリエーテルエーテルケトン(PEEK)、シクロオレフィンポリマー(COP)、ポリジメチルシロキサン(PDMS)、ポリ乳酸等があげられる。
【0088】
前記キャピラリー管の内壁は、例えば、陽極性基を有する被覆剤または陰極性基を有する被覆剤により被覆されてもよい。
【0089】
前記陽極性基を有する被覆剤は、例えば、前記陽極性基および反応基を含む化合物を使用できる。前記反応基は、例えば、シリル基(例えば、アルキルシリル基およびアルコキシシリル基)、アルコキシ基、ハロゲン基等があげられる。前記アルコキシ基は、例えば、メトキシ基、エトキシ基等があげられる。前記ハロゲン基は、例えば、フルオロ基、ブロモ基、クロロ基、ヨード基等があげられ、好ましくはクロロ基である。前述のように、例えば、前記キャピラリー管がガラス製の場合、前記陽極性基を有する被覆剤は、例えば、陽極性基およびケイ素を有する化合物(シリル化剤)を使用することが好ましい。前記陽極性基は、例えば、アミノ基、アンモニウム基等があげられる。前記陽極性基を有する被覆剤は、例えば、アミノ基およびアンモニウム基の少なくとも一方の陽極性基を有するシリル化剤が好ましい。前記アミノ基は、一級、二級、三級のいずれでもよい。前記陽極性基を有する被覆剤として、前記陽極性基を有するシリル化剤を用いることにより、例えば、分析精度をさらに向上できる。
【0090】
前記陽極性基を有するシリル化剤は、例えば、N−(2−ジアミノエチル)−3−プロピルトリメトキシシラン、アミノフェノキシジメチルビニルシラン、3−アミノプロピルジイソプロピルエトキシシラン、3−アミノプロピルメチルビス(トリメチルシロキシ)シラン、3−アミノプロピルペンタメチルジシロキサン、3−アミノプロピルシラントリオール、ビス(P−アミノフェノキシ)ジメチルシラン、1,3−ビス(3−アミノプロピル)テトラメチルジシロキサン、ビス(ジメチルアミノ)ジメチルシラン、ビス(ジメチルアミノ)ビニルメチルシラン、ビス(2−ヒドロキシエチル)−3−アミノプロピルトリエトキシシラン、3−シアノプロピル(ジイソプロピル)ジメチルアミノシラン、(アミノエチルアミノメチル)フェネチルトリメトキシシラン、N−メチルアミノプロピルトリエトキシシラン、テトラキス(ジエチルアミノ)シラン、トリス(ジメチルアミノ)クロロシラン、トリス(ジメチルアミノ)シラン等があげられる。
【0091】
前記陽極性基を有するシリル化剤として、例えば、ケイ素原子をチタンまたはジルコニウムに置換したものを用いてもよい。前記陽極性基を有するシリル化剤は、例えば、一種類を単独で使用してもよいし、二種類以上を併用してもよい。
【0092】
前記陽極性基を有するシリル化剤を用いる場合、前記キャピラリー管の内壁の被覆は、例えば、つぎのようにして行うことができる。まず、前記シリル化剤を有機溶媒に溶解もしくは分散させて処理液を調製する。前記有機溶媒は、例えば、ジクロロメタン、トルエン等があげられる。前記処理液中の前記シリル化剤の濃度は、特に限定されない。前記処理液を、ガラス製のキャピラリー管に通液し、加熱する。この加熱によって、前記シリル化剤が、前記キャピラリー管の内壁に共有結合で結合する。その結果、前記シリル化剤の前記陽極性基が前記キャピラリー管の内壁に配置されることになる。その後、洗浄液により、前記キャピラリー管の内壁を洗浄する。前記洗浄液は、例えば、有機溶媒、酸性溶液、アルカリ性溶液および界面活性剤溶液からなる群から選択される少なくとも一つが使用できる。前記有機溶媒は、例えば、ジクロロメタン、メタノール、アセトン等、前記酸性溶液は、リン酸溶液等があげられる。この洗浄は、任意であるが、実施することが好ましい。前記陽極性基を有するシリル化剤で内壁が被覆されたキャピラリー管は、市販品を用いてもよい。
【0093】
前記陰極性基を有する被覆剤は、特に制限されず、例えば、前述した陰極性基含有化合物が使用でき、中でも、陰極性基および反応基を含む化合物が好ましい。前記反応基は、例えば、シリル基(例えば、アルキルシリル基およびアルコキシシリル基)、アルコキシ基、ハロゲン基等があげられる。前記アルコキシ基は、例えば、メトキシ基、エトキシ基等があげられる。前記ハロゲン基は、例えば、フルオロ基、ブロモ基、クロロ基、ヨード基等があげられ、好ましくはクロロ基である。前記陰極性基および反応基を含む化合物は、例えば、陰極性基およびケイ素を有する化合物(シリル化剤)等があげられる。前記陰極性基を有する被覆剤は、例えば、陰極性基を有するシリル化剤が好ましい。前記陰極性基は、例えば、硫酸基、カルボン酸基、スルホン酸基、リン酸基等があげられる。前記陰極性基を有する被覆剤として、前記陰極性基を有するシリル化剤を用いることにより、例えば、分析精度をさらに向上できる。前記陰極性基を有するシリル化剤を用いる場合、前記キャピラリー管の内壁の被覆は、例えば、前記陽極性基を有するシリル化剤による被覆と同様にして行うことができる。
【0094】
前記陰極性基を有するシリル化剤は、例えば、クロロスルホニルフェニルエチルトリメトキシシラン、クロロスルホニルフェニルエチルトリクロロシラン等があげられる。
【0095】
前記陰極性基含有化合物は、これらの他に、例えば、陰極性基含有多糖類があげられる。前記陰極性基含有多糖類は、前述と同様のものが使用できる。前記陰極性基含有多糖類を有する被覆も、例えば、前記シリル化剤による被覆と同様にして行うことができる。また、例えば、既存の方法(例えば、特許第2711112号等を参照)を用いることによって、前記内壁を共有結合により被覆することもできる。
【0096】
前記キャピラリー管を用いた場合、本発明の分析方法は、例えば、つぎのように実施できる。
【0097】
まず、前記酸性物質を含む泳動液を、ポンプ等により減圧または加圧して、前記キャピラリー管に通液する。通液の時間は、例えば、1〜60分間であり、通液の圧力は、例えば、0.05〜0.1MPaである。
【0098】
つぎに、前記キャピラリー管内に、前記泳動液が存在する状態で、Hbを含む前記試料液を前記泳動液中に導入する。そして、前記キャピラリー管の両端に配置した電極間に電圧を印加して、電気泳動を行う。前記試料液の導入は、前記キャピラリー管の陽極側から行う。電圧印加により、前記キャピラリー管内の前記泳動液において電気浸透流が生じ、導入された前記試料液中のHbは、前記キャピラリー管の陰極側に向かって移動する。分析時に、例えば、前記泳動液中に前記陰極性基含有化合物が存在する場合は、導入された前記試料液中のHbは、前記陰極性基含有化合物と複合体を形成した状態で、前記キャピラリー管の陰極側に向かって移動する。前記キャピラリー管への前記電圧印加の程度は、例えば、1〜30kVである。前記Hbの移動は、例えば、光学的手法により検出する。前記光学的手法による検出方法は、特に制限されず、例えば、415nmの波長で行うことが好ましい。前記試料液中の各Hbは、移動速度の差により分離される。分離された前記試料液中の各Hbを、検出器を用いて検出する。本実施形態において、前記分離キャピラリー流路における、前記試料液の泳動開始点から前記検出器による検出点までの長さを、分離長という。前記キャピラリー管における分離長は、例えば、10〜1000mmであり、好ましくは、15〜300mmである。
【0099】
つぎに、前記分離キャピラリー流路を備えるマイクロチップについて、以下に説明する。本発明は、これには制限されない。
【0100】
前記マイクロチップに形成された分離キャピラリー流路は、特に制限されず、例えば、前記マイクロチップの基板上に溝を掘って形成されたキャピラリー流路、マイクロチップの基板上に形成された溝に埋設されたキャピラリー管等があげられる。
【0101】
前記基板上に溝を掘って形成されたキャピラリー流路は、例えば、その断面形状は、制限されず、円形、半円形、矩形等があげられる。前記断面形状とは、例えば、前記キャピラリー流路の試料の流れ方向に対して垂直方向に切断した際の断面形状である。前記キャピラリー流路の内壁は、例えば、前述のキャピラリー管の内壁と同様に、被覆してもよい。
【0102】
前記基板上に溝を掘って形成されたキャピラリー流路の材質は、特に制限されない。前記材質は、例えば、ガラス、ポリマー等があげられる。前記ガラスは、特に制限されず、例えば、合成石英ガラス、溶融シリカ、ホウケイ酸ガラス等があげられる。前記ポリマーは、特に制限されず、例えば、ポリメチルメタクリレート(PMMA)、シクロオレフィンポリマー(COP)、ポリカーボネート(PC)、ポリジメチルシロキサン(PDMS)、ポリスチレン(PS)、ポリ乳酸、ポリエチレン(PE)、ポリテトラフルオロエチレン(PTFE)、ポリエーテルエーテルケトン(PEEK)等があげられる。前記基板に溝を掘って形成されることから、前記基板が、これらの材質でもよい。
【0103】
前記基板上に形成された溝に埋設されたキャピラリー管の材質は、特に限定されない。前記材質は、例えば、前述のキャピラリー管と同様の材質があげられる。また、前記埋設されたキャピラリー管の内壁は、例えば、前述のキャピラリー管と同様に、被覆してもよい。
【0104】
前記マイクロチップにおいて、前記分離キャピラリー流路は、その内径の最大径が、例えば、10〜200μmであり、好ましくは、25〜100μmである。その最大長さは、例えば、0.1mm〜15cmであり、好ましくは、0.5mm〜15cmである。前記マイクロチップに形成された前記分離キャピラリー流路の内径の最大径とは、例えば、前記分離キャピラリー流路の断面形状が半円形の場合は、前記半円の直径であり、前記分離キャピラリー流路の断面形状が半円形でない場合は、断面積が最も大きい部分のその断面積に対応する面積の円の直径をいう。
【0105】
前記マイクロチップに形成された分離キャピラリー流路を用いた場合、本発明の分析方法は、例えば、つぎのようにして実施できる。
【0106】
前記マイクロチップとして、基板上に、両端に溶液槽を持つ分離キャピラリー流路が形成されたマイクロチップを使用する。具体的には、前記基板が、前記分離キャピラリー流路と前記2つの溶液槽とを有し、前記流路の両端が、それぞれ前記溶液槽と連通しており、前記流路の両端に、印可可能なように電極が配置されている。前記基板において、前記溶液槽は、例えば、前記基板に設けられた凹状の空隙である。前記溶液槽は、一方が、前記試料液を導入する導入槽であり、他方が、前記分離キャピラリー流路を流れた前記試料液が到達する回収槽である。
【0107】
前記分離キャピラリー流路に、前記酸性物質を含む泳動液を充填する。前記分離キャピラリー流路の一端に形成された前記導入槽に、Hbを含む前記試料液を導入した後、前記分離キャピラリー流路の両端に配置した電極間に、電圧を印可する。電圧は、例えば、0.5〜10kVである。この印可により、前記試料液が、前記分離キャピラリー流路の他端に形成された前記回収槽に向かって移動する。前記Hbの移動は、例えば、光学的手法により検出する。前記光学的手法による検出方法は、特に制限されず、例えば、415nmの波長で行うことが好ましい。前記試料液中の各Hbは、移動速度の差により分離される。分離された前記試料液中の各Hbを、検出器を用いて検出する。前記分離キャピラリー流路における分離長は、例えば、0.1mm〜15cmであり、好ましくは、0.5mm〜15cmである。このようにして、前記試料液中の各成分を分離して、分析することが可能である。前記マイクロチップの使用により、例えば、分析装置の一層の小型化が可能である。
【0108】
前記マイクロチップに形成された分離キャピラリー流路を用いた場合、本発明の分析方法は、例えば、試料液を連続的に導入する、前述の電気泳動法に限られず、例えば、つぎのようにして実施してもよい。特に示さない限り、前述の方法と同様である。
【0109】
前記マイクロチップとして、基板上に、導入キャピラリー流路および分離キャピラリー流路が、十字状に交差して形成されたマイクロチップを使用する。前記導入キャピラリー流路と前記分離キャピラリー流路とは、前記交差部分で連通している。具体的には、前記基板が、前記導入キャピラリー流路および分離キャピラリー流路と2つの溶液槽とを有し、前記導入キャピラリー流路の一端が一方の溶液槽と連通し、前記分離キャピラリー流路の一端が他方の溶液槽と連通し、前記導入キャピラリー流路の両端および前記分離キャピラリー流路の両端に、それぞれ、印可可能なように電極が配置されている。前記導入キャピラリー流路と連通する前記溶液槽が、前記試料液を導入する導入槽であり、前記分離キャピラリー流路と連通する前記溶液槽が、前記分離キャピラリー流路を流れた前記試料液が到達する回収槽である。
【0110】
前記導入キャピラリー流路および前記分離キャピラリー流路に、前記酸性物質を含む泳動液を充填する。前記導入キャピラリー流路の一端に形成された前記導入槽に、Hbを含む前記試料液を導入した後、前記導入キャピラリー流路の両端に配置した電極間に、電圧を印可する。電圧は、例えば、0.5〜10kVである。この印加により、前記試料液が、前記交差部分まで移動する。さらに、前記分離キャピラリー流路の両端に配置した電極間に、電圧を印可する。電圧は、例えば、0.5〜10kVである。この印可により、前記試料液が、前記分離キャピラリー流路の一端に形成された前記回収槽に向かって移動する。前記Hbの移動は、例えば、光学的手法により検出する。前記光学的手法による検出方法は、特に制限されず、例えば、415nmの波長で行うことが好ましい。前記試料液中の各Hbは、移動速度の差により分離される。分離された前記試料液中の各Hbを、検出器を用いて検出する。本実施形態において、前記分離キャピラリー流路おける、前記交差部分、すなわち、分離キャピラリー流路における前記試料液の泳動開始点から、前記検出器による検出点までの長さを、前記分離長という。前記分離キャピラリー流路における分離長は、例えば、0.1mm〜15cmであり、好ましくは、0.5mm〜15cmである。このようにして、前記試料液中の各成分を分離して、分析することが可能である。前記マイクロチップの使用により、例えば、分析装置の一層の小型化が可能である。
【0111】
つぎに、本発明の分析キットは、前述のように、前記本発明の分離改善剤を含む。本発明の分析キットは、例えば、その他に、さらに、泳動液、緩衝剤、添加剤、界面活性剤、安定化剤等を含んでもよい。本発明分析キットは、例えば、さらに、前記分離キャピラリー流路を備えてもよい。前記分離キャピラリー流路は、例えば、前述と同様であり、キャピラリー管、基板に形成されたキャピラリー流路等があげられ、後者としては、例えば、マイクロチップがあげられる。本発明の分析キットは、例えば、さらに使用説明書を備えてもよい。
【実施例】
【0112】
以下に、本発明の実施例について、比較例と併せて説明する。本発明は、下記実施例および比較例により制限されない。
【0113】
(実施例1)
本例では、前記分離改善剤として、前記酸性物質であるシクロヘキサンカルボン酸を用いて、カルバミル化Hbを含む試料液を分析した。
【0114】
下記表の組成の泳動液を調製した。前記泳動液は、まず、緩衝液として、下記L−酒石酸−アルギニン水溶液を調製し、これに種々の成分を添加して調製した。前記泳動液において、前記分離改善剤は、前記シクロヘキサンカルボン酸である、CyDTA(pKa1=2.42、pKa2=3.53)、1,1−シクロヘキサン二酢酸、1,2,4−シクロヘキサントリカルボン酸(pKa1=2.6、pKa2=4.59)および1,2,3,4,5,6−シクロヘキサンヘキサカルボン酸一水和物を使用した。L−酒石酸の酸解離定数は、pKa1=3.02であり、pKa2=4.54である。
【0115】
【表1】

【0116】
また、試料液の調製に使用する希釈液として、前記各泳動液を1.1倍濃度に設定した溶液(pH4.8)を、それぞれ調製した。
【0117】
Hbコントロールサンプル(BML社製)に、シアン酸ナトリウムを10mg/100mLとなるように添加し、37℃で2時間反応させた。この反応によって、Hbをシアン化した。この反応液と、前記各希釈液とを、1:10の体積比で混合し、試料液(pH4.8)を調製した。
【0118】
分離キャピラリー流路(全長35mm、内径50μm)を有するPMMA製マイクロチップを使用した。前記マイクロチップの前記分離キャピラリー流路に、0.01重量%のアルギン酸水溶液を通液し、前記分離キャピラリー流路の内壁を被覆処理した。
【0119】
前記キャピラリー流路に、前記泳動液を、0.1MPa(1000mbar)で加圧して充填後、前記試料液を前記キャピラリー流路の陽極側に注入した。前記キャピラリー流路の両端に配置した電極間に1400Vの電圧を印加し、前記試料液を電気泳動させた。分光光度計を使用し、検出点において、415nmにおける吸光度を測定した。本例では、前記試料液の注入箇所から20mm陰極側を検出点とし、分離長を20mmとした。検出時間と吸光度との関係を示すグラフを作成し、下記式を用いて、安定型HbA1c(s−A1c)と修飾Hb(本例ではカルバミル化Hb)のピークとの分離度を算出した。
分離度=1.18×(t2−t1)/(p1+p2)
t1=修飾Hbのピークの検出時間
t2=安定型HbA1cのピークの検出時間
p1=修飾Hbのピークのピーク半値幅※
p2=安定型HbA1cのピークのピーク半値幅※
※ピーク半値幅:ピーク高さの中点におけるピーク幅
【0120】
図1のグラフに、実施例1の検出結果を示す。図1において、(A)は、L−酒石酸およびCyDTAを添加した結果であり、(B)は、L−酒石酸および1,1−シクロヘキサン二酢酸を添加した結果であり、(C)は、L−酒石酸および1,2,4−シクロヘキサントリカルボン酸を添加した結果である。図1のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。これらのグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。これらのグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(カルバミル化Hb)および安定型HbA1c(s−A1c)である。
【0121】
図1(A)〜(C)に示すように、実施例1では、s−A1cおよびカルバミル化Hbのピークが、測定開始から約40秒以内に、分離して検出された。分離度は、(A)L−酒石酸およびCyDTAを添加した場合、(B)L−酒石酸および1,1−シクロヘキサン二酢酸を添加した場合、(C)L−酒石酸および1,2,4−シクロヘキサントリカルボン酸を添加した場合、ともに1.3であった。特に、図1(A)および(B)に示すように、(A)L−酒石酸とCyDTAまたは(B)L−酒石酸と1,1−シクロヘキサン二酢酸とを添加した場合、s−A1cおよびカルバミル化Hbのピークが、より明瞭に分離され、測定開始から約30秒以内に検出された。また、図示していないが、1,2,3,4,5,6−シクロヘキサンヘキサカルボン酸一水和物を添加した場合も、同様に、s−A1cおよびカルバミル化Hbが分離して検出され、分離度は、1.2であった。なお、実施例1において、分析時の前記泳動液のpHは、4.8であった。このように、前記酸性物質の添加により、s−A1cおよびカルバミル化Hbの分離精度が向上し、分析時間が短縮した。
【0122】
(実施例2)
本例では、Hbコントロールサンプルに代えて、ヒト全血を使用し、前記シアン酸ナトリウムに代えて、Hbのアルデヒド化のためにアセトアルデヒドを使用した。そして、アセトアルデヒドが10mg/100mLとなるようにヒト全血に添加した以外は、前記実施例1と同様にして、試料液(pH4.8)を調製した。この試料液を使用した以外は、実施例1と同様にして分析した。
【0123】
図2のグラフに、実施例2においてCyDTAを添加した場合の検出結果を示す。図2のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。図2のグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図2のグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(アルデヒド化Hb)および安定型HbA1c(s−A1c)である。
【0124】
図2に示すように、実施例2では、CyDTAを添加した結果、s−A1cおよびアルデヒド化Hbのピークが、測定開始から約30秒以内に、分離して検出された。また、図示していないが、前記実施例1で使用したその他のシクロヘキサンカルボン酸を添加した場合も、CyDTAと同様に、s−A1cおよびアルデヒド化Hbが分離して検出された。特に、図2に示すように、CyDTAを添加した場合、s−A1cおよびアルデヒド化Hbのピークが、より明瞭に分離された。なお、実施例2において、分析時の泳動液のpHは、4.8であった。このように、前記酸性物質の添加により、s−A1cおよびアルデヒド化Hbの分離精度が向上した。
【0125】
(実施例3)
本例では、Hbコントロールサンプルに代えて、ヒト全血を使用し、前記シアン酸ナトリウムに代えて、Hbの糖化のためにグルコースを使用した。そして、グルコースが1500mg/100mLとなるようにヒト全血に添加した以外は、前記実施例1と同様にして、試料液(pH4.8)を調製した。この試料液を使用した以外は、実施例1と同様にして分析した。
【0126】
図3のグラフに、実施例3においてCyDTAを添加した場合の検出結果を示す。図3のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。図3のグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図3のグラフにおいて、矢印で指し示すピークは、左から順に、不安定型A1c(L−A1c)および安定型A1c(s−A1c)である。
【0127】
図3に示すように、実施例3では、CyDTAを添加した結果、s−A1cおよび不安定型A1cのピークが、測定開始から約30秒以内に、分離して検出された。また、図示していないが、前記実施例1で使用したその他のシクロヘキサンカルボン酸を添加した場合も、CyDTAと同様に、s−A1cおよび不安定型A1cが分離して検出された。特に、図3に示すように、CyDTAを添加した場合、s−A1cおよび不安定型A1cのピークは、より明瞭に分離された。なお、実施例3において、分析時の泳動液のpHは、4.8であった。このように、前記酸性物質の添加により、s−A1cおよび不安定型A1cの分離精度が向上した。
【0128】
(実施例4)
本例では、前記分離改善剤として、前記シクロヘキサンカルボン酸に代えて、L−グルタミン酸(pKa1=2.18、pKa2=4.20)を用いた以外は、実施例1と同様にして分析した。
【0129】
図4のグラフに、実施例4の検出結果を示す。図4のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。図4のグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図4のグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(カルバミル化Hb)および安定型HbA1c(s−A1c)である。
【0130】
図4に示すように、実施例4では、L−グルタミン酸を添加した結果、s−A1cおよびカルバミル化Hbのピークが、測定開始から約35秒以内に、分離して検出された。その分離度は、1.24であった。なお、実施例4において、分析時の泳動液のpHは、4.8であった。このように、前記酸性物質の添加により、s−A1cおよびカルバミル化Hbの分離精度が向上し、分析時間が短縮した。
【0131】
(実施例5)
本例では、前記表1の泳動液の組成において、前記分離改善剤を無添加とし、緩衝剤であるL−酒石酸に代えて、前記酸性物質であるD−酒石酸を100mmol/Lとなるように添加して、泳動液を調製した。また、この泳動液の組成に基づいて、前記実施例1と同様にして、希釈液を調製した。前記泳動液および前記希釈液を用いた以外は、実施例1と同様にして分析した。D−酒石酸の酸解離定数は、pKa1=2.82であり、pKa2=3.96である。
【0132】
図5のグラフに、実施例5の検出結果を示す。図5のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。図5のグラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図5のグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(カルバミル化Hb)および安定型HbA1c(s−A1c)である。
【0133】
図5に示すように、実施例5では、D−酒石酸を添加した結果、s−A1cおよびカルバミル化Hbのピークが、測定開始から約35秒以内に、分離して検出された。なお、実施例5において、分析時の泳動液のpHは、4.8であった。このように、D−酒石酸の添加により、s−A1cおよびカルバミル化Hbの分析精度が向上し、分析時間が短縮した。
【0134】
(比較例1)
本例では、前記表1の泳動液の組成において、前記分離改善剤を無添加として、緩衝液として、L−酒石酸−アルギニン水溶液に代えて、100mmol/L グルタル酸−アルギニン水溶液または100mmol/L プロピオン酸−アルギニン水溶液を使用して、泳動液を調製した。また、この泳動液の組成に基づいて、前記実施例1と同様にして、希釈液を調製した。前記泳動液および前記希釈液を用いた以外は、実施例1と同様にして分析した。グルタル酸は、2つのカルボキシル基を有し、前記カルボキシル基の酸解離定数は、pKa1=4.13、pKa2=5.01である。また、プロピオン酸は、カルボキシル基を1つのみ有し、酸解離定数は、pKa=4.86である。
【0135】
図6のグラフに、比較例1の検出結果を示す。図6において、(A)はグルタル酸−アルギニン水溶液を用いた結果であり、(B)はプロピオン酸−アルギニン水溶液を用いた結果である。図6のグラフにおいて、太線は、415nmにおける吸光度を示し、細線は、勾配(吸光度変化率、mAbs/秒)を示す。両グラフにおいて、左の縦軸は、415nmにおける吸光度値(mAbs)であり、右の縦軸は、勾配(吸光度変化率、mAbs/秒)であり、横軸は、時間(秒)である。図6(A)のグラフにおいて、矢印で指し示すピークは、左から順に、修飾Hb(カルバミル化Hb)および安定型HbA1c(s−A1c)である。
【0136】
図6(A)に示すように、グルタル酸−アルギニン水溶液を用いた場合、s−A1cおよびカルバミル化Hbのピークは、低くかつブロードとなり、分離して検出できなかった。その分離度は、0.5であった。図6(B)に示すように、プロピオン酸−アルギニン水溶液を用いた場合、ピークを検出できなかった。なお、比較例1において、分析時の泳動液のpHは、5.0であった。このように、グルタル酸またはプロピオン酸の存在下では、s−A1cおよびカルバミル化Hbを分離して検出できなかった。
【0137】
前記実施例1〜5および前記比較例1の結果から明らかなように、前記酸性物質の存在下で、試料液を電気泳動することにより、Hbの分離精度が向上し、分析時間が短縮した。特に、安定型HbA1c(s−A1c)と、修飾Hbまたは不安定型A1cとの分離精度が向上した。
【産業上の利用可能性】
【0138】
以上のように、本発明は、例えば、HbA1cおよび修飾ヘモグロビン等のHbの分析精度を向上し、分析時間を短縮可能である。本発明は、例えば、臨床検査、生化学検査、医学研究等のヘモグロビンを分析する全ての分野に適用することができ、その用途は限定されず、広い分野に適用可能である。
【特許請求の範囲】
【請求項1】
泳動液中にカルボキシル基を二つ以上有する酸性物質を有する条件下で電気泳動を実施し、
前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、電気泳動法によるヘモグロビンの分析方法。
【請求項2】
前記酸性物質の二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、請求項1記載の分析方法。
【請求項3】
前記泳動液が、緩衝剤および分離改善剤を含み、
前記分離改善剤が、前記酸性物質を含むことを特徴とする、請求項1または2記載の分析方法。
【請求項4】
前記酸性物質の二つ以上のカルボキシル基の各酸解離定数(pKa)が、分析時の前記泳動液のpHよりも0.7以上低いことを特徴とする、請求項1から3のいずれか一項に記載の分析方法。
【請求項5】
前記泳動液が、緩衝剤を含み、前記緩衝剤の緩衝能に関与する酸解離定数(pKa)が、分析時の前記泳動液のpH−0.3の値以上であることを特徴とする、請求項1から4のいずれか一項に記載の分析方法。
【請求項6】
前記泳動液が、緩衝剤および分離改善剤を含み、
前記分離改善剤が、前記酸性物質を含み、
前記緩衝剤の緩衝能に関与する酸解離定数(pKa)から、前記分離改善剤の前記酸性物質のカルボキシル基の第二解離定数(pKa2)を引いた差が、0.2以上であることを特徴とする、請求項1から5のいずれか一項に記載の分析方法。
【請求項7】
ヘモグロビンを含む試料液のpHと、前記泳動液のpHとの差が、0.3未満であることを特徴とする、請求項1から6のいずれか一項に記載の分析方法。
【請求項8】
前記酸性物質が、シクロヘキサン環を有する構造であることを特徴とする、請求項1から7のいずれか一項に記載の分析方法。
【請求項9】
前記電気泳動法によるヘモグロビンの分離が、分離キャピラリー流路で実施されることを特徴とする、請求項1から8のいずれか一項に記載の分析方法。
【請求項10】
ヘモグロビンを含む試料液を、連続して前記分離キャピラリー流路に導入する、連続試料導入法により実施されることを特徴とする、請求項9記載の分析方法。
【請求項11】
前記分離キャピラリー流路が、マイクロチップに形成されており、
前記電気泳動法が、マイクロチップ電気泳動法であることを特徴とする、請求項9または10記載の分析方法。
【請求項12】
前記分離キャピラリー流路が、キャピラリー管であり、
前記電気泳動法が、キャピラリー電気泳動法であることを特徴とする、請求項9または10記載の分析方法。
【請求項13】
前記ヘモグロビンが、ヘモグロビンA1cであることを特徴とする、請求項1から12のいずれか一項に記載の分析方法。
【請求項14】
前記ヘモグロビンA1cが、安定型ヘモグロビンA1cおよび不安定型ヘモグロビンA1cの少なくとも一方であることを特徴とする、請求項13記載の分析方法。
【請求項15】
前記ヘモグロビンが、カルバミル化ヘモグロビン、アルデヒド化ヘモグロビンおよびアセチル化ヘモグロビンからなる群から選択される少なくとも一種の修飾ヘモグロビンであることを特徴とする、請求項1から14のいずれか一項に記載の分析方法。
【請求項16】
前記酸性物質が、カルボン酸およびアミノ酸の少なくとも一方であることを特徴とする、請求項1から15のいずれか一項に記載の分析方法。
【請求項17】
前記カルボン酸が、脂肪族カルボン酸および炭素環カルボン酸の少なくとも一方であることを特徴とする、請求項16記載の分析方法。
【請求項18】
前記脂肪族カルボン酸が、フマル酸およびD−酒石酸の少なくとも一方であることを特徴とする、請求項17記載の分析方法。
【請求項19】
前記炭素環カルボン酸が、シクロヘキサンカルボン酸であることを特徴とする、請求項17記載の分析方法。
【請求項20】
前記シクロヘキサンカルボン酸が、トランス−1,2−シクロヘキサンジアミン−N,N,N’,N’−四酢酸(CyDTA)、1,1−シクロヘキサン二酢酸、(1α,2α,4α)−1,2,4−シクロヘキサントリカルボン酸および1,2,3,4,5,6−シクロヘキサンヘキサカルボン酸一水和物からなる群から選択された少なくとも一つであることを特徴とする、請求項19記載の分析方法。
【請求項21】
請求項1から20のいずれか一項に記載の分析方法に用いる分離改善剤を含む泳動液試薬。
【請求項22】
カルボキシル基を二つ以上有する酸性物質を含有し、
前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、請求項1から20のいずれか一項に記載の分析方法に用いる分離改善剤。
【請求項23】
請求項22記載の分離改善剤を含むことを特徴とする、分析キット。
【請求項24】
分離キャピラリー流路および複数の液槽を含み、
前記複数の液槽は、前記分離キャピラリー流路で連通され、
前記分離キャピラリー流路および前記液槽の少なくとも一方に、泳動液が充填され、
前記泳動液が、カルボキシル基を二つ以上有する酸性物質を含有し、
前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、請求項11記載の分析方法に使用することを特徴とする、マイクロチップ。
【請求項1】
泳動液中にカルボキシル基を二つ以上有する酸性物質を有する条件下で電気泳動を実施し、
前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、電気泳動法によるヘモグロビンの分析方法。
【請求項2】
前記酸性物質の二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、請求項1記載の分析方法。
【請求項3】
前記泳動液が、緩衝剤および分離改善剤を含み、
前記分離改善剤が、前記酸性物質を含むことを特徴とする、請求項1または2記載の分析方法。
【請求項4】
前記酸性物質の二つ以上のカルボキシル基の各酸解離定数(pKa)が、分析時の前記泳動液のpHよりも0.7以上低いことを特徴とする、請求項1から3のいずれか一項に記載の分析方法。
【請求項5】
前記泳動液が、緩衝剤を含み、前記緩衝剤の緩衝能に関与する酸解離定数(pKa)が、分析時の前記泳動液のpH−0.3の値以上であることを特徴とする、請求項1から4のいずれか一項に記載の分析方法。
【請求項6】
前記泳動液が、緩衝剤および分離改善剤を含み、
前記分離改善剤が、前記酸性物質を含み、
前記緩衝剤の緩衝能に関与する酸解離定数(pKa)から、前記分離改善剤の前記酸性物質のカルボキシル基の第二解離定数(pKa2)を引いた差が、0.2以上であることを特徴とする、請求項1から5のいずれか一項に記載の分析方法。
【請求項7】
ヘモグロビンを含む試料液のpHと、前記泳動液のpHとの差が、0.3未満であることを特徴とする、請求項1から6のいずれか一項に記載の分析方法。
【請求項8】
前記酸性物質が、シクロヘキサン環を有する構造であることを特徴とする、請求項1から7のいずれか一項に記載の分析方法。
【請求項9】
前記電気泳動法によるヘモグロビンの分離が、分離キャピラリー流路で実施されることを特徴とする、請求項1から8のいずれか一項に記載の分析方法。
【請求項10】
ヘモグロビンを含む試料液を、連続して前記分離キャピラリー流路に導入する、連続試料導入法により実施されることを特徴とする、請求項9記載の分析方法。
【請求項11】
前記分離キャピラリー流路が、マイクロチップに形成されており、
前記電気泳動法が、マイクロチップ電気泳動法であることを特徴とする、請求項9または10記載の分析方法。
【請求項12】
前記分離キャピラリー流路が、キャピラリー管であり、
前記電気泳動法が、キャピラリー電気泳動法であることを特徴とする、請求項9または10記載の分析方法。
【請求項13】
前記ヘモグロビンが、ヘモグロビンA1cであることを特徴とする、請求項1から12のいずれか一項に記載の分析方法。
【請求項14】
前記ヘモグロビンA1cが、安定型ヘモグロビンA1cおよび不安定型ヘモグロビンA1cの少なくとも一方であることを特徴とする、請求項13記載の分析方法。
【請求項15】
前記ヘモグロビンが、カルバミル化ヘモグロビン、アルデヒド化ヘモグロビンおよびアセチル化ヘモグロビンからなる群から選択される少なくとも一種の修飾ヘモグロビンであることを特徴とする、請求項1から14のいずれか一項に記載の分析方法。
【請求項16】
前記酸性物質が、カルボン酸およびアミノ酸の少なくとも一方であることを特徴とする、請求項1から15のいずれか一項に記載の分析方法。
【請求項17】
前記カルボン酸が、脂肪族カルボン酸および炭素環カルボン酸の少なくとも一方であることを特徴とする、請求項16記載の分析方法。
【請求項18】
前記脂肪族カルボン酸が、フマル酸およびD−酒石酸の少なくとも一方であることを特徴とする、請求項17記載の分析方法。
【請求項19】
前記炭素環カルボン酸が、シクロヘキサンカルボン酸であることを特徴とする、請求項17記載の分析方法。
【請求項20】
前記シクロヘキサンカルボン酸が、トランス−1,2−シクロヘキサンジアミン−N,N,N’,N’−四酢酸(CyDTA)、1,1−シクロヘキサン二酢酸、(1α,2α,4α)−1,2,4−シクロヘキサントリカルボン酸および1,2,3,4,5,6−シクロヘキサンヘキサカルボン酸一水和物からなる群から選択された少なくとも一つであることを特徴とする、請求項19記載の分析方法。
【請求項21】
請求項1から20のいずれか一項に記載の分析方法に用いる分離改善剤を含む泳動液試薬。
【請求項22】
カルボキシル基を二つ以上有する酸性物質を含有し、
前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、請求項1から20のいずれか一項に記載の分析方法に用いる分離改善剤。
【請求項23】
請求項22記載の分離改善剤を含むことを特徴とする、分析キット。
【請求項24】
分離キャピラリー流路および複数の液槽を含み、
前記複数の液槽は、前記分離キャピラリー流路で連通され、
前記分離キャピラリー流路および前記液槽の少なくとも一方に、泳動液が充填され、
前記泳動液が、カルボキシル基を二つ以上有する酸性物質を含有し、
前記酸性物質の少なくとも二つのカルボキシル基の酸解離定数(pKa)が、分析時の前記泳動液のpHよりも低いことを特徴とする、請求項11記載の分析方法に使用することを特徴とする、マイクロチップ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−149934(P2011−149934A)
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願番号】特願2010−288142(P2010−288142)
【出願日】平成22年12月24日(2010.12.24)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成23年8月4日(2011.8.4)
【国際特許分類】
【出願日】平成22年12月24日(2010.12.24)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

