電気的インピーダンス断層像測定装置。
【課題】呼吸と心拍の影響を除去し、血流由来の電気的特性値の局所的な絶対値を一意で高精度に得る。
【解決手段】出力ペア電極に発生する第二の電位差(Dmean(t))を測定し、呼吸由来成分と心拍由来成分に分離し、第二の電位差の呼吸由来成分から、所定呼吸状態を検出し、所定心拍状態を検出し、所定呼吸状態にある複数の第二の電位差、を抽出する第一の抽出手段41と、前記第一の抽出手段により抽出された複数の第二の電位差を所定心拍タイミングに基づいて同期加算し、呼吸由来成分が除去された第二の電位差、を抽出する第二の抽出手段42と、前記呼吸由来成分が除去された第二の電位差を用いて、各画素に対応した血流由来の絶対的な最適電気的特性値を推定する決定手段43とを備える。
【解決手段】出力ペア電極に発生する第二の電位差(Dmean(t))を測定し、呼吸由来成分と心拍由来成分に分離し、第二の電位差の呼吸由来成分から、所定呼吸状態を検出し、所定心拍状態を検出し、所定呼吸状態にある複数の第二の電位差、を抽出する第一の抽出手段41と、前記第一の抽出手段により抽出された複数の第二の電位差を所定心拍タイミングに基づいて同期加算し、呼吸由来成分が除去された第二の電位差、を抽出する第二の抽出手段42と、前記呼吸由来成分が除去された第二の電位差を用いて、各画素に対応した血流由来の絶対的な最適電気的特性値を推定する決定手段43とを備える。
【発明の詳細な説明】
【技術分野】
【0001】
この発明は、生体断面における組織に関する電気的特性値を測定し表示する生体の電気的インピーダンス断層像測定装置に関するものである。
【背景技術】
【0002】
従来、EIT(Electrical Impedance Tomography)と称される電気インピーダンスCTが知られている。この装置は、例えば胸部生体表面に、例えば心電図用電極を水平かつ等間隔に8枚貼着し、微弱な定電流を加えることにより、体表面に生じる電位分布から生体内部の呼吸による換気量の変化に由来する電気インピーダンスを推定し、断層画像を得るものである。
【0003】
このEITは、電極を貼るだけであるから非侵襲で拘束性が少なく、装置が小型であり、可搬性があり、測定に特別な技術を要することがなく、リアルタイムの画像を得ることができ、長時間の測定が可能である等の利点を有する。
【0004】
さらに、EITを用いた応用として、血流由来の電気インピーダンスの変化を測定することにより、例えば肺血流を非侵襲かつリアルタイムで測定する試みをも広く行われている。
【0005】
しかしながら、例えば体幹部での血流由来の電気インピーダンス変化を測定しようとしたとき、血流由来の電気インピーダンス変化は呼吸由来の電気インピーダンス変化の1/10程度と小さいため、これを高精度かつ高速に測定することは容易ではない。
【0006】
EITを用いた血流由来の電気インピーダンスの変化を測定する方法として、EITで測定したインピーダンスから心拍に同期した成分を抽出したり、装置を低ノイズ化したりすることにより、血流由来の電気インピーダンスの測定精度を向上させる方法(特許文献1参照)が知られているが実用に足りうる精度は得られなかった。
【0007】
血管に生理食塩水を注入し、インピーダンスを極端に低下させ、血流を測定する方法も提案されているが、手間がかかるだけでなく、効果は極めて短時間であるため、連続的なモニタリングには適さない。
【0008】
EITを用いて肺をはじめとする体幹の臓器における血流由来の電気インピーダンスを測定する場合、呼吸による胸郭等の体型の変化が直接電気インピーダンスの変化に影響するため、呼吸の影響の除去により微小な血流由来の電気インピーダンスの測定精度を向上することが可能であるが、従来の機器で、肺野全体のガス量の絶対値を常時、連続的にモニタすることは困難である。
【0009】
これに対し、近年EITでは、電気インピーダンスの絶対値を得るEITが開発され、肺野全体のガス量の絶対値を常時、連続的にモニタすることが可能となりつつある。
【0010】
例えば、関心領域におけるインピーダンス分布を、予測された境界電圧と実測された境界電圧の最小2乗誤差を生成して反復的な処理により収束させて電気インピーダンスの絶対値を得るものが知られている(特許文献2参照)。しかしながら、上記の手法によるEITは、他の装置を用いたキャリブレーションが必要であることに加え、得られる電気インピーダンスが、実測値から一意に電気インピーダンスの絶対値を得ることができない。すなわち、上記において得られる電気的インピーダンスの絶対値は、幾つかの正解の一つに過ぎない、という精度上の問題があり、この方法で呼吸の影響を除去して算出した血流の電気インピーダンスは、精度的に実用に耐えうるものにはなり得ない。
【0011】
また、所定の臓器全体の平均値として絶対的電気インピーダンスを推定後、これを基準値として局所的な相対的インピーダンスと合算して、局所的な絶対的インピーダンスを計算するEITも公知であるが、臓器の局所的な基準値は臓器全体で平均にしたものとの乖離が大きいため、得られる局所的な絶対的インピーダンスの信頼性が低く、この方法で呼吸の影響を除去して算出した血流の電気インピーダンスも、精度的に実用に耐えうるものにはなり得ない。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特表平05−507864号公報
【特許文献2】特表2003−534867号公報
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は上記のような生体の電気的インピーダンス断層像測定装置の現状に鑑みてなされたもので、その目的は、呼吸による影響を的確に除去して高精度な血流由来の局所的な絶対的電気インピーダンスを得ることができる生体の電気的インピーダンス断層像測定装置を提供することである。
【課題を解決するための手段】
【0014】
本発明に係る電気的インピーダンス断層像測定装置は、生体の臓器や組織の位置およびその電気的特性に基づき、前記生体断面を分割し、各メッシュの電気的特性値を複数(n)に変化させて演算可能な3次元以上の数学モデルを作成する数学モデル作成手段と、定電流を印加するための入力ペア電極と電位差を検出するための出力ペア電極とを含む生体の表面の所定の位置を囲繞するように貼着された複数の電極と、前記入力ペア電極に定電流を印加する定電流印加手段と、前記数学モデルを用いて任意のメッシュの電気的特性値を複数(n)に変化させ、前記入力ペア電極に定電流を印加した場合に、前記出力ペア電極にそれぞれ発生する複数(n)の第一の電位差(Dmodel)を算出するDmodel算出手段と、前記入力ペア電極に定電流を印加した場合に、前記出力ペア電極に発生する第二の電位差(Dmean(t))を測定する測定手段と、前記第二の電位差を、呼吸由来成分と心拍由来成分に分離する、呼吸心拍分離手段と、前記呼吸心拍分離手段により分離された、前記第二の電位差の呼吸由来成分から、所定呼吸状態を検出する呼吸状態検出手段と、所定心拍状態を検出する心拍状態検出手段と、前記心拍由来成分から、前記呼吸状態検出手段により検出された所定呼吸状態にある複数の第二の電位差、を抽出する第一の抽出手段と、前記心拍状態検出手段により検出された所定心拍状態に基づき、前記第一の抽出手段により抽出された複数の第二の電位差を同期加算して、呼吸由来成分が除去された第二の電位差、を抽出する第二の抽出手段と、前記呼吸由来成分が除去された第二の電位差を用いて、各画素に対応した複数(n)の血流由来の電気的特性値を算出するEIT(n)算出手段と、前記複数(n)の血流由来の電気的特性値から各画素における最適な血流由来の電気的特性値を決定する決定手段と、各画素における最適な血流由来の電気的特性値に基づき断層画像を表示する血流断層画像表示制御手段とを備えることを特徴とする。
【0015】
本発明に係る電気的インピーダンス断層像測定装置では、前記血流由来の電気的特性値とは、抵抗率、導電率、誘電率、透磁率、のいずれか一つ、あるいは複数であることを特徴とする。
【0016】
本発明に係る電気的インピーダンス断層像測定装置では、前記Dmodel算出手段により算出される各画素に対応した複数(n)の電気的特性値の二乗、又は絶対値が最小であるものを最適な電気的特性値と決定することを特徴とする。
【0017】
本発明に係る電気的インピーダンス断層像測定装置では、呼吸状態検出手段は、前記第二の電位差から前記呼吸心拍分離手段により分離した呼吸由来成分を用い、所定の呼吸状態を検出することを特徴とする。
【0018】
本発明に係る電気的インピーダンス断層像測定装置では、心電図データを検出する心電図検出手段を有し、前記所定の心拍状態を検出するとは、心電図データからR波を検出することを特徴とする。
【0019】
本発明に係る電気的インピーダンス断層像測定装置では、前記所定呼吸状態を検出するとは、所定のガス量を検出することを特徴とする。
【0020】
本発明に係る電気的インピーダンス断層像測定装置では、心電図データを検出する心電図検出手段を有し、第二の抽出手段は心電図データのR波のタイミングで同期加算することを特徴とする。
【0021】
本発明に係る電気的インピーダンス断層像測定装置では、前記Dmodel算出手段は、予め定められた生体内の組織の電気的特性値を用いて、第一の電位差を算出することを特徴とする。
【発明の効果】
【0022】
本発明に係る電気的インピーダンス断層像測定装置によれば、所定の呼吸状態と所定の心拍状態を検出し、同期加算することにより、呼吸による影響を的確に除去した、血流由来の電気的特性値の局所的な絶対値を高精度に得ることができる。特に、呼吸による胸郭などの体型の変化による影響を受けずに、血流などの流体を精度良く連続的にモニタリング可能とする。
【0023】
本発明に係る電気的インピーダンス断層像測定装置によれば、例えば、肺野の換気と血流の絶対値の変化を同時にモニタリングすることにより、酸素化が悪いときに換気が悪いのか血流が悪いのかが一目瞭然となり、適切な治療方針を選択することが可能となる。
【0024】
また、従来、肺塞栓の患者では、SpO2が急激に低下したことは分かっても、その原因が肺塞栓であることを特定することが難しかったが、本発明に係る電気的インピーダンス断層像測定装置により、肺塞栓も迅速に特定することが可能となり、カテーテルによる吸引や血栓溶解剤の投与等の処置を迅速に行うことが可能となる。
【0025】
さらに、腎臓や心臓といった臓器の血流もモニタリングが可能であるので、投薬による薬効をリアルタイムで確認したり、電気的特性値の絶対値から心拍出量等のパラメータを非侵襲で測定したりすることも可能となる。
【図面の簡単な説明】
【0026】
【図1】本発明に係る電気的インピーダンス断層像測定装置の構成を示すブロック図。
【図2】本発明におけるEITにおける電極配置とスライスの関係を示す斜視図。
【図3】本発明において、X線CT画像に基づき胸部FEMモデルを作成する過程の組織分けした断面画像を示す図。
【図4】本発明において、X線CT画像に基づき胸部FEMモデルを作成する過程の電極配置のための断面画像を示す図。
【図5】本発明において、X線CT画像に基づき作成された胸部FEMモデルを示す断面図。
【図6】本発明において、健常者モデルのシュミュレーションにより得られた電位差の結果を示す図。
【図7】本発明において、健常者モデルのシュミュレーションにより得られた電位差の結果を用いて作成した回帰曲線の一例を示す図。
【図8】本発明において、健常者モデルのシュミュレーションにより得られた電位差の結果を用いて作成した回帰曲線の一例を示す図。
【図9】本発明において、健常者モデルのシュミュレーションにより得られた電流密度分布の結果を示す図。
【図10】本発明の実施形態に係る電気的インピーダンス断層像測定装置による呼吸の影響を除去する工程を説明するための図。
【図11】健常者の肺抵抗の経時変化を示す図であり、(a)は自然呼吸状態のものを示す図、(b)は無呼吸状態のものを示す図。
【図12】(a)は本発明の実施形態に係る電気的インピーダンス断層像測定装置によって各出力ペア電極から得られた電位差から、第一の抽出手段により抽出された心拍由来の複数の第二の電位差を示す図であり、(b)は(a)の電位差を同期加算した結果を示す図。
【図13】本発明により肺野の1ピクセル毎に最適な電気的特性値としての抵抗率を求める曲線を示す図。
【図14】本発明に係る電気的インピーダンス断層像測定装置の動作を示すフローチャート。
【図15】本発明に係る電気的インピーダンス断層像測定装置の動作を示すフローチャート。
【図16】本発明に係る電気的インピーダンス断層像測定装置により処理される波形を示す図であり、(a)は、心電図データDECG(t)であり、(b)は、(a)に微分等の処理を施し、丸印で示すR波を複数検出することを示し、(c)はある入力電極ペアと出力電極ペアによって測定した電位差マトリクスDmean(t)であり、(d)に、そこから呼吸心拍分離手段38により分離した心拍由来成分を示し、(e)に呼吸由来成分を示す。
【図17】本発明に係る電気的インピーダンス断層像測定装置により、血流の最適電気的特性値とその経時変化を、あらかじめ電気的特性値に応じて設定した色を用いて、リアルタイムで表示した画像を示す図。
【発明を実施するための形態】
【0027】
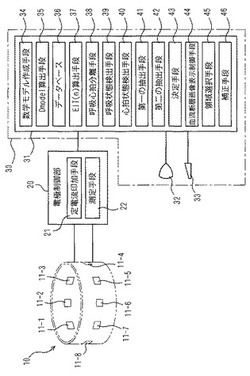
以下添付図面を参照して、本発明に係る生体の電気的インピーダンス断層像測定装置の実施例を説明する。各図において、同一の構成要素には同一の符号を付して重複する説明を省略する。図1には、本発明に係る生体の電気的インピーダンス断層像測定装置の実施形態を示す構成図が示されている。この装置は、電位差検出手段を構成する電極部10と電極制御部20を備え、電極制御部20がコンピュータシステム30に接続されている。
【0028】
コンピュータシステム30は、CPUや主記憶部及び外部記憶部などを含む本体部31と、本体部31に接続されたLEDなどにより構成される表示部32とキーボードやマウスなどにより構成される入力部33とを備えている。本体部31には、FEM(有限要素法)などの3次元以上の数学モデルを作成する数学モデル作成手段34としてのソフトウエアが備えられている。
【0029】
3次元胸部FEMモデルを例とすると、健常男性1名のX線CT画像を参考にして、CT画像を図3に示すように組織ごとに領域分けして、領域に組織番号を付して数学モデル作成手段34に保持させる。各組織と番号及び抵抗率の対応関係を示す表1の内容を有するデータベースを備え、対応付けを行うことが可能としておく。上記の領域分け処理は、例えば1.3mmスライス幅のCT画像234枚(鎖骨から腎上部)に対して行う。
【0030】
【表1】

【0031】
次に、3次元胸部FEMモデルに対し、図1の電極部10における電極11−1〜11−8を含む各電極(例えば、縦6.5mm、横5mm)を設定する。具体的には、図4に示すようにスライス画像に中心から等角度の8本線lを引き、生体表面に横5mmの電極をプロットし、例えば1.3mmスライス幅のCT画像を所定枚数重ねることにより電極の縦の寸法に対応させる。
【0032】
一例として、要素数2,660960、節点数527,571を有する3次元胸部FEMモデルの平面図を図5に示す。図5は、紙面に垂直な奥側が頭部であり、脊髄51の位置から明らかな通り、図5の上方が腹部側であり、下方が背中側である。主な臓器として、心臓52、右肺53、左肺54が示されている。なお、図5では、1スライス面に16個の電極Dが設定されているが、これは、正中切開患者のように電極位置を変えてEITデータを得る必要がある場合に備えたものである。
【0033】
次に、上記の構築された3次元胸部FEMモデルについてDmodel算出手段35を用いて電極11−1〜11−8のいずれかの入力ペア電極(例えば、11−1&11−2)に所定の周波数の定電流を印加したときの、入力ペア電極とは異なる組み合わせの出力ペア電極(電極11−1〜11−8の組み合わせ)から出力される(第一の)電位差を、肺野の抵抗率を変えてシミュレーションする。
【0034】
次に、入力ペア電極を別のペア(例えば、11−2&11−3)に変えて同様に電位差をシミュレーションする。以下同様に、電極11−1〜11−8のいずれかのペア全てについて、順次に入力ペア電極として、同様に電位差をシミュレーションする。他のスライスに電極11−1〜11−8以外の電極が配置されている場合についても同様にして電位差のシミュレーションを行う。
【0035】
肺抵抗率は個人差があるものの、通常、健常者の肺は5Ωm以上であり、肺炎の肺では3Ωm以下であることが多いことから、一例として、肺の抵抗率を5〜16.7Ωmの間において8段階(5、5.55、6.25、7.14、8.33、10、12.5、16.7Ωm)に変化させ、電極D1〜D8の入力ペア電極に1mAの定電流を印加したシミュレーションをについて説明する。なお、実際のシミュレーションでは導電率を用いるため、上記抵抗率と導電率の換算表を表2に示す。
【0036】
【表2】

【0037】
図5の電極D1〜D8において、縦方向に入力ペア電極をとり、横方向に出力ペア電極をとり、肺の抵抗率を16.7Ωmとして出力ペア電極から得られた電位差を表にして示すと図6の通りになる。入力出力が同じペアによる検出は不正確となるので、0とした。また、出力ペア電極に入力ペア電極の一つを含む場合の電位差も不正確と思われる。この図6のようなマトリクスを抵抗率毎(上記の例では8段階)に算出することにより得ることができ、Dmodel算出手段35により対象組織に対して設定された抵抗率と出力ペア電極から検出される電位差、の対応関係のデータベース36(図1)が構成される。
【0038】
以上の不適切と思われる場合を除いた電位差データは40通りとなるため、それぞれについて設定した8つの抵抗率(導電率)に対する8つの電位差から回帰曲線を算出し、実質、多段階に抵抗率を変化させた場合の電位差をシミュレートすることが可能である。
【0039】
一例として、電極D1,D2を入力ペア電極とし、電極D3,D4の出力ペア電極から得られる電位差によって作成される回帰曲線を図7に示す。また、電極D2,D3を入力ペア電極とし、電極D4,D5の出力ペア電極から得られる電位差によって作成される回帰曲線を図8に示す。それぞれの図に寄与率R2を示してあるが、いずれも0.99以上となり、高い相関が得られた。上述の回帰曲線を算出する代わりに抵抗率を細かく多段階に変化させてもよい。
【0040】
図9に、上記のシミュレーションにおいて得られた電流部分布の例を示す。輝度の高い部分が電流密度の高い部分であり、電流が多く流れていることを示す。この図9において、左上部分において電流密度が高いのは電極D1,D2を入力ペア電極としているためである。また、肺は抵抗が高いために電流が多くは流れず、抵抗の低い心臓や肺の周囲に存在する血管や脂肪などに多くの電流が集中することが分かる。
【0041】
ここで、心臓は収縮拡張により、その大きさおよび電気的特性値が周期的に変化しており、その電気的特性値の変化量は呼吸による肺野のガス量による変化よりも大きい。そのため、例えば、小児のように、肺に比べ心臓が相対的に大きい場合、あるいはより高い精度を必要とする場合、心臓の大きさと電気的特性値を周期的に変化させられる数学モデルを使用し、時間情報をもつより精緻なDmodelを算出することで、より正確な血流由来の電気的特性値を推定することが可能である。
【0042】
次に測定手段22について説明する。電極部10には、例えば8個の電極11−1〜11−8が備えられ、生体の表面を囲繞するように貼着される。ここで、生体の表面は、頭部、胴体、四肢等の所要部における表面とすることができるが、ここでは胸部を対象とし、呼吸により肺内ガス量および胸郭等の体型に変化がある場合の肺血流の測定を例示する。電極11−1〜11−8は、生体に等間隔に生体に貼着される。電極11−1〜11−8は、図2に示されるように複数スライスに配置しても良い。
【0043】
電極11−1〜11−8を含む各電極は、リード線を介して電極制御部20に接続されている。電極制御部はリード線を介さず各電極上に直接配置してもよい。電極制御部20は、定電流印加手段21と測定手段22とを含む。定電流印加手段21と測定手段22とは、同じクロックを与えられて同期して動作する。
【0044】
定電流印加手段21に印加される定電流の周波数は目的に応じて、数十kHz〜数百kHz、さらには細胞壁を直進する高い周波数(例えば数MHz以上)のうちの一つ、あるいは複数の組合せで使用する。定電流印加手段21は、図1の例に示した電極11−1〜11−8を含むスライス面を例にすると、電極11−1〜11−8のいずれかの入力ペア電極(例えば、11−1&11−2)に電流を印加する。
【0045】
測定手段22は、このとき電極11−1〜11−8のうちの2枚の電極を組み合わせた出力ペア電極で観測される(第二の)電位差を取り込み、ディジタル化してコンピュータシステム30へ送る。このとき、出力ペア電極を隣り合う2枚に限定すると、出力ペア電極は8通り存在するが、入力ペア電極の片方あるいは両方が含まれる出力ペア電極(11−1&11−2、11−1&11−8、11−2&11−3)による検出は不正確となるので、採用しない。
【0046】
次に、入力ペア電極を異なるペア(例えば、11−2&11−3)に変えて同様に電位差を求める。以下同様に、1シーケンス内で、電極11−1〜11−8のうち、あらかじめ設定されたペアを入力ペア電極として順次切り替え、前述の手順に基づき、出力ペア電極の電位差を測定する。このようにして1シーケンス中に得られた実測の電位差マトリクスをDmean(t)とする。電極11−1〜11−8以外の電極により測定されるスライスについても同様に電位差測定を行う。
【0047】
ここで、定電流印加手段21に印加する定電流の周波数は、1MHzを超えるような高周波の定電流を直接印加するかわりに、複数の低い周波数の定電流を印加し、図1の補正手段46より高周波の定電流を印加したときに観測される電位差に補正することも可能である。補正手段46は、Cole−Cole方程式に基づき、周波数をスィープさせて平面上にプロットし、複数の低い周波数により測定した曲線を用いて高い周波数での電位差を推定する、ものである。
【0048】
さらに、本体部31に備えられた呼吸心拍分離手段38により、電位差マトリクスDmean(t)から呼吸由来成分Dmean(t)Rと心拍由来成分Dmean(t)Cに分離する。具体的には、0.5〜1Hz程度のカットオフ周波数を設定し、ローパスフィルタにより呼吸由来成分をDmean(t)R、ハイパスフィルタにより心拍由来成分をDmean(t)C、をそれぞれ抽出する方法などが挙げられる。なお、カットオフ周波数は、実際にEITで呼吸を測定し、自動的に変化させることも可能である。図16(c)はある入力電極ペアと出力電極ペアによって測定した電位差マトリクスDmean(t)であり、そこから呼吸心拍分離手段38により分離した心拍由来成分を図16(d)、呼吸由来成分を図16(e)に示す。
【0049】
図11(a)は、自然呼吸時に得られる電気インピーダンスの変化を示したものであり、呼吸由来の電気インピーダンス変化に心拍由来の電気インピーダンス変化が重畳していることがわかる。また、図11(b)は無呼吸状態での同様な電気インピーダンスの変化を示したものであり、呼吸による肺内ガス量の変化および胸郭形状の変化がないため、呼吸由来の電気インピーダンス変化の影響が除去され、心拍由来の電気インピーダンス変化のみが抽出されていることがわかる。逆に、肺野全体のガス量が同じタイミングでは、胸郭等の体幹部の体型もほぼ同じ形状であると考えられることから、呼吸状態検出手段39によって、呼吸成分Dmean(t)Rを用いて肺野全体のガス量の変化を推定することにより、肺内ガス量が所定の範囲にある状態を検出する。
【0050】
本体部31のEIT(n)算出手段37は、測定した電位差から呼吸成分を抽出した電位差マトリクスDmean(t)Rと、データベース36に記憶されているシミュレート結果である複数(n)の抵抗率に対する電位差マトリクスDmodel(n)と、感度理論の基づく感度マトリクス(sensitivity matrix)あるいはヤコビアン(Jacobian matrix)として知られる重み付けの補正係数を用い、各画素に対する抵抗率等の電気的特性値を複数(n)算出する。ここで、感度マトリクス等の補正係数は公知の手法により算出し、データベース36として記憶しておくことができる。また、nは、設定した肺抵抗率の数であり、本例では表2などに示すように8種としたが、0.2Ωm刻みで300種、などを事前に計算しておき、データベース36としてもよい。
【0051】
近年EITで広く採用されている感度マトリクスを用いた場合、Dmean(t)Rの各要素とDmodel(n)の各要素で除算により比較し、さらに各要素の重み付けをするために感度マトリクスを乗算して補正した値EIT(n)を画素毎に算出することができる。
【0052】
各画素について、Dmean(t)RとDmodel(n)に差がない状態のn、すなわち変化率がゼロとなるnのときが最終的に求めたい抵抗率であるので、理想的には感度マトリクスを乗算して補正したEIT(n)がゼロとなるnのときが最終的に求めたい抵抗率である。決定手段43は反復計算によりEIT(n)がゼロに収束するときを最終的に求めたい抵抗率に決定することもできるし、nを離散的に設定し、EIT(n)の絶対値、あるいは図13のように変化する[EIT(n)]2が最小となるnのときを最終的に求めたい抵抗率(図13では、最適値)に決定することもできる。他のスライスがある場合は他のスライスについても同様の処理を行う。ここまで説明したEIT(n)算出手段37と決定手段43により、最適な電気的特性値としての抵抗率を推定するために実行された処理を最適電気的特性値の推定処理と呼ぶこととする。
【0053】
このようにして推定された最適電気的特性値は絶対的な値であるため、各画素の最適電気的特性値は、対応する肺野の局所的なガス量に1対1で対応し、これらを合算したものが肺野全体のガス量となる。呼吸状態検出手段39は、ある所定の時間内(t1〜t2)にバッファリングされたDmean(t)に対し、同様の手順で図10にFで示すような肺野全体のガス量の時間変化を算出し、時刻t1からt2の中で図10のLで示すようなガス量が所定の値、あるいは範囲内にある時間、すなわち、呼吸に伴って変化する肺内のガス量と胸郭等の体型がほぼ同一の状態を、所定の呼吸状態、として検出する。なお、呼吸状態検出手段は、病態等に大きな変化がなく、機能的残気量(FRC)や残気量(RV)、全肺気量(TLC)の変化がほとんどない状態では、擬似的に人工呼吸器等の呼吸に関するパラメータの設定値とフローセンサ等の瞬時値、あるいはフローセンサ等の機器単体によるもので代用することも可能である。
【0054】
本体部31に備えられている第一の抽出手段41は、呼吸状態検出手段により検出された所定呼吸状態における、心拍由来の複数の第二の電位差、を抽出する。まず、第一の抽出手段41は、呼吸状態検出手段39により検出された所定の呼吸状態であるときのデータを電位差マトリクスDmean(t)Cから抽出し、肺内ガス量および胸郭等の体型が同一、すなわち呼吸の影響のない、電位差マトリクスDmean(t)C_RSyncとする。ここで、所定の呼吸状態の一例として、換気量を含むガス量が所定の範囲内にあることがあげられる。
【0055】
本体部31に備えられている心拍状態検出手段40は、電極部10に備えられた電極群の電極のうちの2個とGND電極によって別途測定し、コンピュータシステム30にバッファリングした図26(a)に示すような心電図データDECG(t)から、ある所定の時間内(t1〜t2)における心拍同期情報を検出する。具体的には、図16(a)の心電図データDECG(t)に微分等の処理を施し、図16(b)に丸印で示すR波を複数検出し、各R波での時刻tRをT=0、次のR波までのRR間隔をTRRとなるようtからTへの変換を行う。t1〜t2のRR間隔の平均値TRR_meanを求め、等時間間隔データに変換して扱ってもよい。
【0056】
心電図データDECG(t)は、実測の電位差マトリクスDmean(t)Cと同期可能であれば、外部のECGからの心電図信号やパルスオキシメータなどの各種センサを採用してもよく、Dmean(t)Cから所定の入力&主力ペア電極で測定された電位差信号についてフィルタリング処理等によって抽出したり、特定の入力&主力ペア電極を用いて、Dmean(t)測定シーケンス毎に別途、測定したりしたものでもよい。
【0057】
第二の抽出手段42は、Dmean(t)C_RSyncの時刻tをTに変換して、図12(a)に示す複数のDmean(T)C_RSyncを同期加算して、呼吸由来成分が除去され、心拍タイミングに基づいた第二の電位差、を抽出する。即ち、第二の抽出手段42は、Dmean(t)C_RSyncの時刻tをTに変換して得られた、図12(a)に示す複数のDmean(T)C_RSyncを加算処理し、図12(b)に示す心拍一周期分の電位差マトリクスDmean(T)C_Syncを抽出する。なお、加算するDmean(T)C_RSyncは、時刻T=0からTRR_mean等の所定の時間までのデータとしてもよいし、所定の時間t1〜t2に対して処理を行う代りに、呼吸あるいは心拍を所定の回数検出する方法でもよい。また、第一の抽出手段41における所定の呼吸状態の検出と第二の抽出手段42における所定の心拍のタイミングの検出とは、互いに置き換えられても良い。ここで、R波のタイミングで同期加算を行うのが望ましい。
【0058】
上記加算処理には、単純加算処理、加算平均処理、重み付け加算処理などが含まれる。また、心拍一周期分の電位差マトリクスDmean(T)C_Syncをより少ない加算で高速に得るために、テンプレートマッチングやスプライン補完の処理を行ってもよい。
【0059】
EIT(n)算出手段37は、呼吸由来成分が除去された電位差マトリクスDmean(t)C_Syncと、データベース36に記憶されているシミュレート結果である複数(n)の抵抗率に対する電位差マトリクスDmodel(n)と、感度理論の基づく感度マトリクス(sensitivity matrix)あるいはヤコビアン(Jacobian matrix)として知られる重み付けの補正係数を用い、各画素の抵抗率等の電気的特性値を複数(n)算出する。ここで、感度マトリクス等の補正係数は公知の手法により算出し、データベース36として記憶しておくことができる。また、nは、設定した肺抵抗率の数であり、本例では表2などに示すように8種としたが、実際には0.2Ωm刻みで300種ほどのものを求めてデータベース36としてもよい。
【0060】
近年EITで広く採用されている感度マトリクスを用いた場合、Dmean(t)C_Syncの各要素をDmodelの各要素で除算して比較し、さらに各要素の重み付けをするために感度マトリクスを乗算して補正した値EIT(n)を画素毎に算出することができる。
【0061】
各画素について、Dmean(t)C_SyncとDmodel(n)に差がない状態のn、すなわち変化率がゼロとなるnのときが最終的に求めたい抵抗率であるので、理想的には感度マトリクスを乗算して補正したEIT(n)がゼロとなるnのときが最終的に求めたい抵抗率である。決定手段43は反復計算によりEIT(n)がゼロに収束するときを最終的に求めたい抵抗率に決定することもできるし、nを離散的に設定し、EIT(n)の絶対値、あるいは図13のように変化する[EIT(n)]2が最小となるnのときを最終的に求めたい抵抗率(図13では最適値)に決定することもできる。他のスライスがある場合は他のスライスについても同様の処理を行う。ここまで説明したEIT(n)算出手段37と決定手段43により、最適な電気的特性値としての抵抗率を求めるために実行された処理を血流の最適電気的特性値の決定処理と呼ぶこととする。
【0062】
本体部31の血流断層画像表示制御手段44は、このようにして推定された各画素に対する血流の最適電気的特性値を、あらかじめ電気的特性値に応じて設定した色を用いて、リアルタイムで表示する。図17はその一例であり、血流の最適電気的特性値は絶対的な値であるため、例えば、肺野について測定した血流の最適電気的特性値は、各画素に対応する肺野の局所的な血流量に一対一で対応する。すなわち、血流断層画像表示制御手段44によって表示される同一部位の断層画像は、肺野の局所的な血流量の状態を、同じ基準で客観的に判断することが可能である。特に、図17の左図は、断層画像の1/25秒ごとの変化を下に向かって経時的に示したものである。この図17の画像によって、胸郭の変化などの影響を受けることなく、肺野に流れる血流は、心臓に近い側から流れていくことを把握することができる。
【0063】
本体部31の領域選択手段45は、血流断層画像表示制御手段44によって生成された断層画像から、病態の疑われる部位等の所定の領域を選択し、より正確な血流の最適電気的特性値を推定する。すなわち、肺を対象組織とした場合、肺全体、右肺、左肺、右前、右後、左前、左後、画素単位等、適宜所望の領域を選択し、選択領域に対応する数学モデル作成手段34により作成された数学モデルのメッシュの電気的特性値をnよりも多く変化させることで、所定の領域における血流の電気的特性値をより正確に推定することが可能となる。
【0064】
以上の説明をまとめると、本実施形態に係る電気的インピーダンス断層像測定装置は、図14、図15のフローチャートに示すように動作する。即ち、図3を用いて説明した如く、生体の数学モデルを作成し(S11)、その数学モデルに対し電極を設置し(S12)、対象臓器内において領域の選択がされているかを検出し(S19B)、当初は選択されないので、NOへ分岐して、対象臓器の電気的特性値をn通りに設定する(S13A)。
【0065】
次に、n通りの電気的特性値に対し、入力ペア電極を決めて出力ペア電極から電位差を検出し、入力ペア電極を順次シフトして全ての隣り合う電極ペアを入力ペア電極としたシミュレーションを実行する(S14)。シミュレーションの結果を用いて電極間電位差と電気的特性値変化の関係を示す図6のような電位差マトリクスDmodel(n)を求める(S15)。これは前述の通り、データベース36に記憶されてもよい。
【0066】
次に、電極部10と電極制御部20を用いて電位差を実測し、電位差マトリクスDmean(t)を得る(S16)。ここで、実測時に印加された定電流の周波数が低い場合、Cole−Cole方程式により、実際に用いた定電流よりも高い周波数で印加した場合に得られる電位差Dmean(t)に補正する(S16A)。さらに、Dmean(t)を呼吸成分(Dmean(t)R)と心拍成分(Dmean(t)C)を分離する(S17)。
【0067】
このようにして得られた電位差マトリックスDmean(t)Rと、シミュレーション結果の電位差マトリックスDmodel及び感度マトリックスS等の重み付け係数に基づき、各画素におけるEIT(n) を算出する(S18)。
【0068】
各画素について、EIT(n)の絶対値、あるいは[EIT(n)]2が最小となるnのとき、すなわち、Dmean(t)C_SyncとDmodel(n)に差がない状態のnでの抵抗率を求め、呼吸由来の絶対的な最適電気的特性値を決定(S19)する。
【0069】
呼吸由来の絶対的な最適電気的特性値から、換気量が一定範囲にある所定の呼吸状態を検出し(S20)、所定の呼吸状態にあるDmean(t)C_RSyncを抽出する(S21)。
【0070】
一方、ステップS22においてECGデータを収集しておくか、ステップS17において得られたDmean(t)Cから、心拍一周期(R波から次のR波etc.)を順次、検出する(S23)。
ステップS21とステップS23の処理を受けて、Dmean(t)C_RSyncから心拍の各周期に同期した成分を抽出し、同期加算してDmean(t)C_Syncを求める(S24)。
【0071】
更に、Dmean(t)C_Syncと、シミュレーション結果の電位差マトリックスDmodel及び感度マトリックスS等の重み付け係数に基づき、各画素におけるEIT(n)を算出する(S25)。EIT(n) の絶対値あるいは2乗値の比較を行い、最小値となるnの場合の電気的特性値を、当該画素単位の最適な電気的特性値として最終決定し(S26)、画素毎の最適な電気的特性値を輝度に変換し、断層画像として表示する(S27)。これ以降はステップS19Bへ戻り処理を行うが、選択したことを検出するとS19BにおいてYESへ分岐することになり、選択領域を詳細に測定するため、対象臓器の電気的特性値を複数(n)、選択領域の電気的特性値を複数(n)以上、にそれぞれ設定し(S13B)、ステップS14へ進んでそれ以降の処理を行う。
【0072】
本発明に係る電気的インピーダンス断層像測定装置によれば、所定の呼吸状態と所定の心拍状態を検出し、抽出することにより、呼吸による影響を的確に除去した、血流由来の電気的特性値の局所的な絶対値を得ることができ、断層像として表示することで、生体内部の血流の状態をリアルタイムで直感的に把握することが可能となる。
【0073】
本発明に係る電気的インピーダンス断層像測定装置によれば、例えば、肺野の換気と血流の絶対値の変化を同時にモニタリングすることにより、酸素化が悪いときに換気が悪いのか血流が悪いのかが一目瞭然となり、適切な治療方針を選択することが可能となる。
【0074】
また、従来、肺塞栓の患者では、SpO2が急激に低下したことは分かっても、その原因が肺塞栓であることを特定することが難しかったが、本発明に係る電気的インピーダンス断層像測定装置により、肺塞栓も迅速に特定することが可能となり、カテーテルによる吸引や血栓溶解剤の投与等の処置を迅速に行うことが可能となる。
【0075】
さらに、腎臓や心臓といった臓器の血流もモニタリングが可能であるので、投薬による薬効をリアルタイムで確認したり、電気的特性値の絶対値から心拍出量等のパラメータを非侵襲で測定したりすることも可能となる。
【符号の説明】
【0076】
10 電極部
11−1〜11−8 電極
20 電極制御部
21 定電流印加手段
22 測定手段
30 コンピュータシステム
31 本体部
32 表示部
33 入力部
34 数学モデル作成手段
35 Dmodel算出手段
36 データベース
37 EIT(n)算出手段
38 呼吸心拍分離手段
40 心拍状態検出手段
41 第一の抽出手段
42 第二の抽出手段
43 決定手段
44 血流断層画像表示制御手段
45 補正手段
【技術分野】
【0001】
この発明は、生体断面における組織に関する電気的特性値を測定し表示する生体の電気的インピーダンス断層像測定装置に関するものである。
【背景技術】
【0002】
従来、EIT(Electrical Impedance Tomography)と称される電気インピーダンスCTが知られている。この装置は、例えば胸部生体表面に、例えば心電図用電極を水平かつ等間隔に8枚貼着し、微弱な定電流を加えることにより、体表面に生じる電位分布から生体内部の呼吸による換気量の変化に由来する電気インピーダンスを推定し、断層画像を得るものである。
【0003】
このEITは、電極を貼るだけであるから非侵襲で拘束性が少なく、装置が小型であり、可搬性があり、測定に特別な技術を要することがなく、リアルタイムの画像を得ることができ、長時間の測定が可能である等の利点を有する。
【0004】
さらに、EITを用いた応用として、血流由来の電気インピーダンスの変化を測定することにより、例えば肺血流を非侵襲かつリアルタイムで測定する試みをも広く行われている。
【0005】
しかしながら、例えば体幹部での血流由来の電気インピーダンス変化を測定しようとしたとき、血流由来の電気インピーダンス変化は呼吸由来の電気インピーダンス変化の1/10程度と小さいため、これを高精度かつ高速に測定することは容易ではない。
【0006】
EITを用いた血流由来の電気インピーダンスの変化を測定する方法として、EITで測定したインピーダンスから心拍に同期した成分を抽出したり、装置を低ノイズ化したりすることにより、血流由来の電気インピーダンスの測定精度を向上させる方法(特許文献1参照)が知られているが実用に足りうる精度は得られなかった。
【0007】
血管に生理食塩水を注入し、インピーダンスを極端に低下させ、血流を測定する方法も提案されているが、手間がかかるだけでなく、効果は極めて短時間であるため、連続的なモニタリングには適さない。
【0008】
EITを用いて肺をはじめとする体幹の臓器における血流由来の電気インピーダンスを測定する場合、呼吸による胸郭等の体型の変化が直接電気インピーダンスの変化に影響するため、呼吸の影響の除去により微小な血流由来の電気インピーダンスの測定精度を向上することが可能であるが、従来の機器で、肺野全体のガス量の絶対値を常時、連続的にモニタすることは困難である。
【0009】
これに対し、近年EITでは、電気インピーダンスの絶対値を得るEITが開発され、肺野全体のガス量の絶対値を常時、連続的にモニタすることが可能となりつつある。
【0010】
例えば、関心領域におけるインピーダンス分布を、予測された境界電圧と実測された境界電圧の最小2乗誤差を生成して反復的な処理により収束させて電気インピーダンスの絶対値を得るものが知られている(特許文献2参照)。しかしながら、上記の手法によるEITは、他の装置を用いたキャリブレーションが必要であることに加え、得られる電気インピーダンスが、実測値から一意に電気インピーダンスの絶対値を得ることができない。すなわち、上記において得られる電気的インピーダンスの絶対値は、幾つかの正解の一つに過ぎない、という精度上の問題があり、この方法で呼吸の影響を除去して算出した血流の電気インピーダンスは、精度的に実用に耐えうるものにはなり得ない。
【0011】
また、所定の臓器全体の平均値として絶対的電気インピーダンスを推定後、これを基準値として局所的な相対的インピーダンスと合算して、局所的な絶対的インピーダンスを計算するEITも公知であるが、臓器の局所的な基準値は臓器全体で平均にしたものとの乖離が大きいため、得られる局所的な絶対的インピーダンスの信頼性が低く、この方法で呼吸の影響を除去して算出した血流の電気インピーダンスも、精度的に実用に耐えうるものにはなり得ない。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】特表平05−507864号公報
【特許文献2】特表2003−534867号公報
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は上記のような生体の電気的インピーダンス断層像測定装置の現状に鑑みてなされたもので、その目的は、呼吸による影響を的確に除去して高精度な血流由来の局所的な絶対的電気インピーダンスを得ることができる生体の電気的インピーダンス断層像測定装置を提供することである。
【課題を解決するための手段】
【0014】
本発明に係る電気的インピーダンス断層像測定装置は、生体の臓器や組織の位置およびその電気的特性に基づき、前記生体断面を分割し、各メッシュの電気的特性値を複数(n)に変化させて演算可能な3次元以上の数学モデルを作成する数学モデル作成手段と、定電流を印加するための入力ペア電極と電位差を検出するための出力ペア電極とを含む生体の表面の所定の位置を囲繞するように貼着された複数の電極と、前記入力ペア電極に定電流を印加する定電流印加手段と、前記数学モデルを用いて任意のメッシュの電気的特性値を複数(n)に変化させ、前記入力ペア電極に定電流を印加した場合に、前記出力ペア電極にそれぞれ発生する複数(n)の第一の電位差(Dmodel)を算出するDmodel算出手段と、前記入力ペア電極に定電流を印加した場合に、前記出力ペア電極に発生する第二の電位差(Dmean(t))を測定する測定手段と、前記第二の電位差を、呼吸由来成分と心拍由来成分に分離する、呼吸心拍分離手段と、前記呼吸心拍分離手段により分離された、前記第二の電位差の呼吸由来成分から、所定呼吸状態を検出する呼吸状態検出手段と、所定心拍状態を検出する心拍状態検出手段と、前記心拍由来成分から、前記呼吸状態検出手段により検出された所定呼吸状態にある複数の第二の電位差、を抽出する第一の抽出手段と、前記心拍状態検出手段により検出された所定心拍状態に基づき、前記第一の抽出手段により抽出された複数の第二の電位差を同期加算して、呼吸由来成分が除去された第二の電位差、を抽出する第二の抽出手段と、前記呼吸由来成分が除去された第二の電位差を用いて、各画素に対応した複数(n)の血流由来の電気的特性値を算出するEIT(n)算出手段と、前記複数(n)の血流由来の電気的特性値から各画素における最適な血流由来の電気的特性値を決定する決定手段と、各画素における最適な血流由来の電気的特性値に基づき断層画像を表示する血流断層画像表示制御手段とを備えることを特徴とする。
【0015】
本発明に係る電気的インピーダンス断層像測定装置では、前記血流由来の電気的特性値とは、抵抗率、導電率、誘電率、透磁率、のいずれか一つ、あるいは複数であることを特徴とする。
【0016】
本発明に係る電気的インピーダンス断層像測定装置では、前記Dmodel算出手段により算出される各画素に対応した複数(n)の電気的特性値の二乗、又は絶対値が最小であるものを最適な電気的特性値と決定することを特徴とする。
【0017】
本発明に係る電気的インピーダンス断層像測定装置では、呼吸状態検出手段は、前記第二の電位差から前記呼吸心拍分離手段により分離した呼吸由来成分を用い、所定の呼吸状態を検出することを特徴とする。
【0018】
本発明に係る電気的インピーダンス断層像測定装置では、心電図データを検出する心電図検出手段を有し、前記所定の心拍状態を検出するとは、心電図データからR波を検出することを特徴とする。
【0019】
本発明に係る電気的インピーダンス断層像測定装置では、前記所定呼吸状態を検出するとは、所定のガス量を検出することを特徴とする。
【0020】
本発明に係る電気的インピーダンス断層像測定装置では、心電図データを検出する心電図検出手段を有し、第二の抽出手段は心電図データのR波のタイミングで同期加算することを特徴とする。
【0021】
本発明に係る電気的インピーダンス断層像測定装置では、前記Dmodel算出手段は、予め定められた生体内の組織の電気的特性値を用いて、第一の電位差を算出することを特徴とする。
【発明の効果】
【0022】
本発明に係る電気的インピーダンス断層像測定装置によれば、所定の呼吸状態と所定の心拍状態を検出し、同期加算することにより、呼吸による影響を的確に除去した、血流由来の電気的特性値の局所的な絶対値を高精度に得ることができる。特に、呼吸による胸郭などの体型の変化による影響を受けずに、血流などの流体を精度良く連続的にモニタリング可能とする。
【0023】
本発明に係る電気的インピーダンス断層像測定装置によれば、例えば、肺野の換気と血流の絶対値の変化を同時にモニタリングすることにより、酸素化が悪いときに換気が悪いのか血流が悪いのかが一目瞭然となり、適切な治療方針を選択することが可能となる。
【0024】
また、従来、肺塞栓の患者では、SpO2が急激に低下したことは分かっても、その原因が肺塞栓であることを特定することが難しかったが、本発明に係る電気的インピーダンス断層像測定装置により、肺塞栓も迅速に特定することが可能となり、カテーテルによる吸引や血栓溶解剤の投与等の処置を迅速に行うことが可能となる。
【0025】
さらに、腎臓や心臓といった臓器の血流もモニタリングが可能であるので、投薬による薬効をリアルタイムで確認したり、電気的特性値の絶対値から心拍出量等のパラメータを非侵襲で測定したりすることも可能となる。
【図面の簡単な説明】
【0026】
【図1】本発明に係る電気的インピーダンス断層像測定装置の構成を示すブロック図。
【図2】本発明におけるEITにおける電極配置とスライスの関係を示す斜視図。
【図3】本発明において、X線CT画像に基づき胸部FEMモデルを作成する過程の組織分けした断面画像を示す図。
【図4】本発明において、X線CT画像に基づき胸部FEMモデルを作成する過程の電極配置のための断面画像を示す図。
【図5】本発明において、X線CT画像に基づき作成された胸部FEMモデルを示す断面図。
【図6】本発明において、健常者モデルのシュミュレーションにより得られた電位差の結果を示す図。
【図7】本発明において、健常者モデルのシュミュレーションにより得られた電位差の結果を用いて作成した回帰曲線の一例を示す図。
【図8】本発明において、健常者モデルのシュミュレーションにより得られた電位差の結果を用いて作成した回帰曲線の一例を示す図。
【図9】本発明において、健常者モデルのシュミュレーションにより得られた電流密度分布の結果を示す図。
【図10】本発明の実施形態に係る電気的インピーダンス断層像測定装置による呼吸の影響を除去する工程を説明するための図。
【図11】健常者の肺抵抗の経時変化を示す図であり、(a)は自然呼吸状態のものを示す図、(b)は無呼吸状態のものを示す図。
【図12】(a)は本発明の実施形態に係る電気的インピーダンス断層像測定装置によって各出力ペア電極から得られた電位差から、第一の抽出手段により抽出された心拍由来の複数の第二の電位差を示す図であり、(b)は(a)の電位差を同期加算した結果を示す図。
【図13】本発明により肺野の1ピクセル毎に最適な電気的特性値としての抵抗率を求める曲線を示す図。
【図14】本発明に係る電気的インピーダンス断層像測定装置の動作を示すフローチャート。
【図15】本発明に係る電気的インピーダンス断層像測定装置の動作を示すフローチャート。
【図16】本発明に係る電気的インピーダンス断層像測定装置により処理される波形を示す図であり、(a)は、心電図データDECG(t)であり、(b)は、(a)に微分等の処理を施し、丸印で示すR波を複数検出することを示し、(c)はある入力電極ペアと出力電極ペアによって測定した電位差マトリクスDmean(t)であり、(d)に、そこから呼吸心拍分離手段38により分離した心拍由来成分を示し、(e)に呼吸由来成分を示す。
【図17】本発明に係る電気的インピーダンス断層像測定装置により、血流の最適電気的特性値とその経時変化を、あらかじめ電気的特性値に応じて設定した色を用いて、リアルタイムで表示した画像を示す図。
【発明を実施するための形態】
【0027】
以下添付図面を参照して、本発明に係る生体の電気的インピーダンス断層像測定装置の実施例を説明する。各図において、同一の構成要素には同一の符号を付して重複する説明を省略する。図1には、本発明に係る生体の電気的インピーダンス断層像測定装置の実施形態を示す構成図が示されている。この装置は、電位差検出手段を構成する電極部10と電極制御部20を備え、電極制御部20がコンピュータシステム30に接続されている。
【0028】
コンピュータシステム30は、CPUや主記憶部及び外部記憶部などを含む本体部31と、本体部31に接続されたLEDなどにより構成される表示部32とキーボードやマウスなどにより構成される入力部33とを備えている。本体部31には、FEM(有限要素法)などの3次元以上の数学モデルを作成する数学モデル作成手段34としてのソフトウエアが備えられている。
【0029】
3次元胸部FEMモデルを例とすると、健常男性1名のX線CT画像を参考にして、CT画像を図3に示すように組織ごとに領域分けして、領域に組織番号を付して数学モデル作成手段34に保持させる。各組織と番号及び抵抗率の対応関係を示す表1の内容を有するデータベースを備え、対応付けを行うことが可能としておく。上記の領域分け処理は、例えば1.3mmスライス幅のCT画像234枚(鎖骨から腎上部)に対して行う。
【0030】
【表1】

【0031】
次に、3次元胸部FEMモデルに対し、図1の電極部10における電極11−1〜11−8を含む各電極(例えば、縦6.5mm、横5mm)を設定する。具体的には、図4に示すようにスライス画像に中心から等角度の8本線lを引き、生体表面に横5mmの電極をプロットし、例えば1.3mmスライス幅のCT画像を所定枚数重ねることにより電極の縦の寸法に対応させる。
【0032】
一例として、要素数2,660960、節点数527,571を有する3次元胸部FEMモデルの平面図を図5に示す。図5は、紙面に垂直な奥側が頭部であり、脊髄51の位置から明らかな通り、図5の上方が腹部側であり、下方が背中側である。主な臓器として、心臓52、右肺53、左肺54が示されている。なお、図5では、1スライス面に16個の電極Dが設定されているが、これは、正中切開患者のように電極位置を変えてEITデータを得る必要がある場合に備えたものである。
【0033】
次に、上記の構築された3次元胸部FEMモデルについてDmodel算出手段35を用いて電極11−1〜11−8のいずれかの入力ペア電極(例えば、11−1&11−2)に所定の周波数の定電流を印加したときの、入力ペア電極とは異なる組み合わせの出力ペア電極(電極11−1〜11−8の組み合わせ)から出力される(第一の)電位差を、肺野の抵抗率を変えてシミュレーションする。
【0034】
次に、入力ペア電極を別のペア(例えば、11−2&11−3)に変えて同様に電位差をシミュレーションする。以下同様に、電極11−1〜11−8のいずれかのペア全てについて、順次に入力ペア電極として、同様に電位差をシミュレーションする。他のスライスに電極11−1〜11−8以外の電極が配置されている場合についても同様にして電位差のシミュレーションを行う。
【0035】
肺抵抗率は個人差があるものの、通常、健常者の肺は5Ωm以上であり、肺炎の肺では3Ωm以下であることが多いことから、一例として、肺の抵抗率を5〜16.7Ωmの間において8段階(5、5.55、6.25、7.14、8.33、10、12.5、16.7Ωm)に変化させ、電極D1〜D8の入力ペア電極に1mAの定電流を印加したシミュレーションをについて説明する。なお、実際のシミュレーションでは導電率を用いるため、上記抵抗率と導電率の換算表を表2に示す。
【0036】
【表2】

【0037】
図5の電極D1〜D8において、縦方向に入力ペア電極をとり、横方向に出力ペア電極をとり、肺の抵抗率を16.7Ωmとして出力ペア電極から得られた電位差を表にして示すと図6の通りになる。入力出力が同じペアによる検出は不正確となるので、0とした。また、出力ペア電極に入力ペア電極の一つを含む場合の電位差も不正確と思われる。この図6のようなマトリクスを抵抗率毎(上記の例では8段階)に算出することにより得ることができ、Dmodel算出手段35により対象組織に対して設定された抵抗率と出力ペア電極から検出される電位差、の対応関係のデータベース36(図1)が構成される。
【0038】
以上の不適切と思われる場合を除いた電位差データは40通りとなるため、それぞれについて設定した8つの抵抗率(導電率)に対する8つの電位差から回帰曲線を算出し、実質、多段階に抵抗率を変化させた場合の電位差をシミュレートすることが可能である。
【0039】
一例として、電極D1,D2を入力ペア電極とし、電極D3,D4の出力ペア電極から得られる電位差によって作成される回帰曲線を図7に示す。また、電極D2,D3を入力ペア電極とし、電極D4,D5の出力ペア電極から得られる電位差によって作成される回帰曲線を図8に示す。それぞれの図に寄与率R2を示してあるが、いずれも0.99以上となり、高い相関が得られた。上述の回帰曲線を算出する代わりに抵抗率を細かく多段階に変化させてもよい。
【0040】
図9に、上記のシミュレーションにおいて得られた電流部分布の例を示す。輝度の高い部分が電流密度の高い部分であり、電流が多く流れていることを示す。この図9において、左上部分において電流密度が高いのは電極D1,D2を入力ペア電極としているためである。また、肺は抵抗が高いために電流が多くは流れず、抵抗の低い心臓や肺の周囲に存在する血管や脂肪などに多くの電流が集中することが分かる。
【0041】
ここで、心臓は収縮拡張により、その大きさおよび電気的特性値が周期的に変化しており、その電気的特性値の変化量は呼吸による肺野のガス量による変化よりも大きい。そのため、例えば、小児のように、肺に比べ心臓が相対的に大きい場合、あるいはより高い精度を必要とする場合、心臓の大きさと電気的特性値を周期的に変化させられる数学モデルを使用し、時間情報をもつより精緻なDmodelを算出することで、より正確な血流由来の電気的特性値を推定することが可能である。
【0042】
次に測定手段22について説明する。電極部10には、例えば8個の電極11−1〜11−8が備えられ、生体の表面を囲繞するように貼着される。ここで、生体の表面は、頭部、胴体、四肢等の所要部における表面とすることができるが、ここでは胸部を対象とし、呼吸により肺内ガス量および胸郭等の体型に変化がある場合の肺血流の測定を例示する。電極11−1〜11−8は、生体に等間隔に生体に貼着される。電極11−1〜11−8は、図2に示されるように複数スライスに配置しても良い。
【0043】
電極11−1〜11−8を含む各電極は、リード線を介して電極制御部20に接続されている。電極制御部はリード線を介さず各電極上に直接配置してもよい。電極制御部20は、定電流印加手段21と測定手段22とを含む。定電流印加手段21と測定手段22とは、同じクロックを与えられて同期して動作する。
【0044】
定電流印加手段21に印加される定電流の周波数は目的に応じて、数十kHz〜数百kHz、さらには細胞壁を直進する高い周波数(例えば数MHz以上)のうちの一つ、あるいは複数の組合せで使用する。定電流印加手段21は、図1の例に示した電極11−1〜11−8を含むスライス面を例にすると、電極11−1〜11−8のいずれかの入力ペア電極(例えば、11−1&11−2)に電流を印加する。
【0045】
測定手段22は、このとき電極11−1〜11−8のうちの2枚の電極を組み合わせた出力ペア電極で観測される(第二の)電位差を取り込み、ディジタル化してコンピュータシステム30へ送る。このとき、出力ペア電極を隣り合う2枚に限定すると、出力ペア電極は8通り存在するが、入力ペア電極の片方あるいは両方が含まれる出力ペア電極(11−1&11−2、11−1&11−8、11−2&11−3)による検出は不正確となるので、採用しない。
【0046】
次に、入力ペア電極を異なるペア(例えば、11−2&11−3)に変えて同様に電位差を求める。以下同様に、1シーケンス内で、電極11−1〜11−8のうち、あらかじめ設定されたペアを入力ペア電極として順次切り替え、前述の手順に基づき、出力ペア電極の電位差を測定する。このようにして1シーケンス中に得られた実測の電位差マトリクスをDmean(t)とする。電極11−1〜11−8以外の電極により測定されるスライスについても同様に電位差測定を行う。
【0047】
ここで、定電流印加手段21に印加する定電流の周波数は、1MHzを超えるような高周波の定電流を直接印加するかわりに、複数の低い周波数の定電流を印加し、図1の補正手段46より高周波の定電流を印加したときに観測される電位差に補正することも可能である。補正手段46は、Cole−Cole方程式に基づき、周波数をスィープさせて平面上にプロットし、複数の低い周波数により測定した曲線を用いて高い周波数での電位差を推定する、ものである。
【0048】
さらに、本体部31に備えられた呼吸心拍分離手段38により、電位差マトリクスDmean(t)から呼吸由来成分Dmean(t)Rと心拍由来成分Dmean(t)Cに分離する。具体的には、0.5〜1Hz程度のカットオフ周波数を設定し、ローパスフィルタにより呼吸由来成分をDmean(t)R、ハイパスフィルタにより心拍由来成分をDmean(t)C、をそれぞれ抽出する方法などが挙げられる。なお、カットオフ周波数は、実際にEITで呼吸を測定し、自動的に変化させることも可能である。図16(c)はある入力電極ペアと出力電極ペアによって測定した電位差マトリクスDmean(t)であり、そこから呼吸心拍分離手段38により分離した心拍由来成分を図16(d)、呼吸由来成分を図16(e)に示す。
【0049】
図11(a)は、自然呼吸時に得られる電気インピーダンスの変化を示したものであり、呼吸由来の電気インピーダンス変化に心拍由来の電気インピーダンス変化が重畳していることがわかる。また、図11(b)は無呼吸状態での同様な電気インピーダンスの変化を示したものであり、呼吸による肺内ガス量の変化および胸郭形状の変化がないため、呼吸由来の電気インピーダンス変化の影響が除去され、心拍由来の電気インピーダンス変化のみが抽出されていることがわかる。逆に、肺野全体のガス量が同じタイミングでは、胸郭等の体幹部の体型もほぼ同じ形状であると考えられることから、呼吸状態検出手段39によって、呼吸成分Dmean(t)Rを用いて肺野全体のガス量の変化を推定することにより、肺内ガス量が所定の範囲にある状態を検出する。
【0050】
本体部31のEIT(n)算出手段37は、測定した電位差から呼吸成分を抽出した電位差マトリクスDmean(t)Rと、データベース36に記憶されているシミュレート結果である複数(n)の抵抗率に対する電位差マトリクスDmodel(n)と、感度理論の基づく感度マトリクス(sensitivity matrix)あるいはヤコビアン(Jacobian matrix)として知られる重み付けの補正係数を用い、各画素に対する抵抗率等の電気的特性値を複数(n)算出する。ここで、感度マトリクス等の補正係数は公知の手法により算出し、データベース36として記憶しておくことができる。また、nは、設定した肺抵抗率の数であり、本例では表2などに示すように8種としたが、0.2Ωm刻みで300種、などを事前に計算しておき、データベース36としてもよい。
【0051】
近年EITで広く採用されている感度マトリクスを用いた場合、Dmean(t)Rの各要素とDmodel(n)の各要素で除算により比較し、さらに各要素の重み付けをするために感度マトリクスを乗算して補正した値EIT(n)を画素毎に算出することができる。
【0052】
各画素について、Dmean(t)RとDmodel(n)に差がない状態のn、すなわち変化率がゼロとなるnのときが最終的に求めたい抵抗率であるので、理想的には感度マトリクスを乗算して補正したEIT(n)がゼロとなるnのときが最終的に求めたい抵抗率である。決定手段43は反復計算によりEIT(n)がゼロに収束するときを最終的に求めたい抵抗率に決定することもできるし、nを離散的に設定し、EIT(n)の絶対値、あるいは図13のように変化する[EIT(n)]2が最小となるnのときを最終的に求めたい抵抗率(図13では、最適値)に決定することもできる。他のスライスがある場合は他のスライスについても同様の処理を行う。ここまで説明したEIT(n)算出手段37と決定手段43により、最適な電気的特性値としての抵抗率を推定するために実行された処理を最適電気的特性値の推定処理と呼ぶこととする。
【0053】
このようにして推定された最適電気的特性値は絶対的な値であるため、各画素の最適電気的特性値は、対応する肺野の局所的なガス量に1対1で対応し、これらを合算したものが肺野全体のガス量となる。呼吸状態検出手段39は、ある所定の時間内(t1〜t2)にバッファリングされたDmean(t)に対し、同様の手順で図10にFで示すような肺野全体のガス量の時間変化を算出し、時刻t1からt2の中で図10のLで示すようなガス量が所定の値、あるいは範囲内にある時間、すなわち、呼吸に伴って変化する肺内のガス量と胸郭等の体型がほぼ同一の状態を、所定の呼吸状態、として検出する。なお、呼吸状態検出手段は、病態等に大きな変化がなく、機能的残気量(FRC)や残気量(RV)、全肺気量(TLC)の変化がほとんどない状態では、擬似的に人工呼吸器等の呼吸に関するパラメータの設定値とフローセンサ等の瞬時値、あるいはフローセンサ等の機器単体によるもので代用することも可能である。
【0054】
本体部31に備えられている第一の抽出手段41は、呼吸状態検出手段により検出された所定呼吸状態における、心拍由来の複数の第二の電位差、を抽出する。まず、第一の抽出手段41は、呼吸状態検出手段39により検出された所定の呼吸状態であるときのデータを電位差マトリクスDmean(t)Cから抽出し、肺内ガス量および胸郭等の体型が同一、すなわち呼吸の影響のない、電位差マトリクスDmean(t)C_RSyncとする。ここで、所定の呼吸状態の一例として、換気量を含むガス量が所定の範囲内にあることがあげられる。
【0055】
本体部31に備えられている心拍状態検出手段40は、電極部10に備えられた電極群の電極のうちの2個とGND電極によって別途測定し、コンピュータシステム30にバッファリングした図26(a)に示すような心電図データDECG(t)から、ある所定の時間内(t1〜t2)における心拍同期情報を検出する。具体的には、図16(a)の心電図データDECG(t)に微分等の処理を施し、図16(b)に丸印で示すR波を複数検出し、各R波での時刻tRをT=0、次のR波までのRR間隔をTRRとなるようtからTへの変換を行う。t1〜t2のRR間隔の平均値TRR_meanを求め、等時間間隔データに変換して扱ってもよい。
【0056】
心電図データDECG(t)は、実測の電位差マトリクスDmean(t)Cと同期可能であれば、外部のECGからの心電図信号やパルスオキシメータなどの各種センサを採用してもよく、Dmean(t)Cから所定の入力&主力ペア電極で測定された電位差信号についてフィルタリング処理等によって抽出したり、特定の入力&主力ペア電極を用いて、Dmean(t)測定シーケンス毎に別途、測定したりしたものでもよい。
【0057】
第二の抽出手段42は、Dmean(t)C_RSyncの時刻tをTに変換して、図12(a)に示す複数のDmean(T)C_RSyncを同期加算して、呼吸由来成分が除去され、心拍タイミングに基づいた第二の電位差、を抽出する。即ち、第二の抽出手段42は、Dmean(t)C_RSyncの時刻tをTに変換して得られた、図12(a)に示す複数のDmean(T)C_RSyncを加算処理し、図12(b)に示す心拍一周期分の電位差マトリクスDmean(T)C_Syncを抽出する。なお、加算するDmean(T)C_RSyncは、時刻T=0からTRR_mean等の所定の時間までのデータとしてもよいし、所定の時間t1〜t2に対して処理を行う代りに、呼吸あるいは心拍を所定の回数検出する方法でもよい。また、第一の抽出手段41における所定の呼吸状態の検出と第二の抽出手段42における所定の心拍のタイミングの検出とは、互いに置き換えられても良い。ここで、R波のタイミングで同期加算を行うのが望ましい。
【0058】
上記加算処理には、単純加算処理、加算平均処理、重み付け加算処理などが含まれる。また、心拍一周期分の電位差マトリクスDmean(T)C_Syncをより少ない加算で高速に得るために、テンプレートマッチングやスプライン補完の処理を行ってもよい。
【0059】
EIT(n)算出手段37は、呼吸由来成分が除去された電位差マトリクスDmean(t)C_Syncと、データベース36に記憶されているシミュレート結果である複数(n)の抵抗率に対する電位差マトリクスDmodel(n)と、感度理論の基づく感度マトリクス(sensitivity matrix)あるいはヤコビアン(Jacobian matrix)として知られる重み付けの補正係数を用い、各画素の抵抗率等の電気的特性値を複数(n)算出する。ここで、感度マトリクス等の補正係数は公知の手法により算出し、データベース36として記憶しておくことができる。また、nは、設定した肺抵抗率の数であり、本例では表2などに示すように8種としたが、実際には0.2Ωm刻みで300種ほどのものを求めてデータベース36としてもよい。
【0060】
近年EITで広く採用されている感度マトリクスを用いた場合、Dmean(t)C_Syncの各要素をDmodelの各要素で除算して比較し、さらに各要素の重み付けをするために感度マトリクスを乗算して補正した値EIT(n)を画素毎に算出することができる。
【0061】
各画素について、Dmean(t)C_SyncとDmodel(n)に差がない状態のn、すなわち変化率がゼロとなるnのときが最終的に求めたい抵抗率であるので、理想的には感度マトリクスを乗算して補正したEIT(n)がゼロとなるnのときが最終的に求めたい抵抗率である。決定手段43は反復計算によりEIT(n)がゼロに収束するときを最終的に求めたい抵抗率に決定することもできるし、nを離散的に設定し、EIT(n)の絶対値、あるいは図13のように変化する[EIT(n)]2が最小となるnのときを最終的に求めたい抵抗率(図13では最適値)に決定することもできる。他のスライスがある場合は他のスライスについても同様の処理を行う。ここまで説明したEIT(n)算出手段37と決定手段43により、最適な電気的特性値としての抵抗率を求めるために実行された処理を血流の最適電気的特性値の決定処理と呼ぶこととする。
【0062】
本体部31の血流断層画像表示制御手段44は、このようにして推定された各画素に対する血流の最適電気的特性値を、あらかじめ電気的特性値に応じて設定した色を用いて、リアルタイムで表示する。図17はその一例であり、血流の最適電気的特性値は絶対的な値であるため、例えば、肺野について測定した血流の最適電気的特性値は、各画素に対応する肺野の局所的な血流量に一対一で対応する。すなわち、血流断層画像表示制御手段44によって表示される同一部位の断層画像は、肺野の局所的な血流量の状態を、同じ基準で客観的に判断することが可能である。特に、図17の左図は、断層画像の1/25秒ごとの変化を下に向かって経時的に示したものである。この図17の画像によって、胸郭の変化などの影響を受けることなく、肺野に流れる血流は、心臓に近い側から流れていくことを把握することができる。
【0063】
本体部31の領域選択手段45は、血流断層画像表示制御手段44によって生成された断層画像から、病態の疑われる部位等の所定の領域を選択し、より正確な血流の最適電気的特性値を推定する。すなわち、肺を対象組織とした場合、肺全体、右肺、左肺、右前、右後、左前、左後、画素単位等、適宜所望の領域を選択し、選択領域に対応する数学モデル作成手段34により作成された数学モデルのメッシュの電気的特性値をnよりも多く変化させることで、所定の領域における血流の電気的特性値をより正確に推定することが可能となる。
【0064】
以上の説明をまとめると、本実施形態に係る電気的インピーダンス断層像測定装置は、図14、図15のフローチャートに示すように動作する。即ち、図3を用いて説明した如く、生体の数学モデルを作成し(S11)、その数学モデルに対し電極を設置し(S12)、対象臓器内において領域の選択がされているかを検出し(S19B)、当初は選択されないので、NOへ分岐して、対象臓器の電気的特性値をn通りに設定する(S13A)。
【0065】
次に、n通りの電気的特性値に対し、入力ペア電極を決めて出力ペア電極から電位差を検出し、入力ペア電極を順次シフトして全ての隣り合う電極ペアを入力ペア電極としたシミュレーションを実行する(S14)。シミュレーションの結果を用いて電極間電位差と電気的特性値変化の関係を示す図6のような電位差マトリクスDmodel(n)を求める(S15)。これは前述の通り、データベース36に記憶されてもよい。
【0066】
次に、電極部10と電極制御部20を用いて電位差を実測し、電位差マトリクスDmean(t)を得る(S16)。ここで、実測時に印加された定電流の周波数が低い場合、Cole−Cole方程式により、実際に用いた定電流よりも高い周波数で印加した場合に得られる電位差Dmean(t)に補正する(S16A)。さらに、Dmean(t)を呼吸成分(Dmean(t)R)と心拍成分(Dmean(t)C)を分離する(S17)。
【0067】
このようにして得られた電位差マトリックスDmean(t)Rと、シミュレーション結果の電位差マトリックスDmodel及び感度マトリックスS等の重み付け係数に基づき、各画素におけるEIT(n) を算出する(S18)。
【0068】
各画素について、EIT(n)の絶対値、あるいは[EIT(n)]2が最小となるnのとき、すなわち、Dmean(t)C_SyncとDmodel(n)に差がない状態のnでの抵抗率を求め、呼吸由来の絶対的な最適電気的特性値を決定(S19)する。
【0069】
呼吸由来の絶対的な最適電気的特性値から、換気量が一定範囲にある所定の呼吸状態を検出し(S20)、所定の呼吸状態にあるDmean(t)C_RSyncを抽出する(S21)。
【0070】
一方、ステップS22においてECGデータを収集しておくか、ステップS17において得られたDmean(t)Cから、心拍一周期(R波から次のR波etc.)を順次、検出する(S23)。
ステップS21とステップS23の処理を受けて、Dmean(t)C_RSyncから心拍の各周期に同期した成分を抽出し、同期加算してDmean(t)C_Syncを求める(S24)。
【0071】
更に、Dmean(t)C_Syncと、シミュレーション結果の電位差マトリックスDmodel及び感度マトリックスS等の重み付け係数に基づき、各画素におけるEIT(n)を算出する(S25)。EIT(n) の絶対値あるいは2乗値の比較を行い、最小値となるnの場合の電気的特性値を、当該画素単位の最適な電気的特性値として最終決定し(S26)、画素毎の最適な電気的特性値を輝度に変換し、断層画像として表示する(S27)。これ以降はステップS19Bへ戻り処理を行うが、選択したことを検出するとS19BにおいてYESへ分岐することになり、選択領域を詳細に測定するため、対象臓器の電気的特性値を複数(n)、選択領域の電気的特性値を複数(n)以上、にそれぞれ設定し(S13B)、ステップS14へ進んでそれ以降の処理を行う。
【0072】
本発明に係る電気的インピーダンス断層像測定装置によれば、所定の呼吸状態と所定の心拍状態を検出し、抽出することにより、呼吸による影響を的確に除去した、血流由来の電気的特性値の局所的な絶対値を得ることができ、断層像として表示することで、生体内部の血流の状態をリアルタイムで直感的に把握することが可能となる。
【0073】
本発明に係る電気的インピーダンス断層像測定装置によれば、例えば、肺野の換気と血流の絶対値の変化を同時にモニタリングすることにより、酸素化が悪いときに換気が悪いのか血流が悪いのかが一目瞭然となり、適切な治療方針を選択することが可能となる。
【0074】
また、従来、肺塞栓の患者では、SpO2が急激に低下したことは分かっても、その原因が肺塞栓であることを特定することが難しかったが、本発明に係る電気的インピーダンス断層像測定装置により、肺塞栓も迅速に特定することが可能となり、カテーテルによる吸引や血栓溶解剤の投与等の処置を迅速に行うことが可能となる。
【0075】
さらに、腎臓や心臓といった臓器の血流もモニタリングが可能であるので、投薬による薬効をリアルタイムで確認したり、電気的特性値の絶対値から心拍出量等のパラメータを非侵襲で測定したりすることも可能となる。
【符号の説明】
【0076】
10 電極部
11−1〜11−8 電極
20 電極制御部
21 定電流印加手段
22 測定手段
30 コンピュータシステム
31 本体部
32 表示部
33 入力部
34 数学モデル作成手段
35 Dmodel算出手段
36 データベース
37 EIT(n)算出手段
38 呼吸心拍分離手段
40 心拍状態検出手段
41 第一の抽出手段
42 第二の抽出手段
43 決定手段
44 血流断層画像表示制御手段
45 補正手段
【特許請求の範囲】
【請求項1】
生体の臓器や組織の位置およびその電気的特性に基づき、前記生体断面を分割し、各メッシュの電気的特性値を複数(n)に変化させて演算可能な3次元以上の数学モデルを作成する数学モデル作成手段と、
定電流を印加するための入力ペア電極と
電位差を検出するための出力ペア電極と
を含む生体の表面の所定の位置を囲繞するように貼着された複数の電極と、
前記入力ペア電極に定電流を印加する定電流印加手段と、
前記数学モデルを用いて任意のメッシュの電気的特性値を複数(n)に変化させ、前記入力ペア電極に定電流を印加した場合に、前記出力ペア電極にそれぞれ発生する複数(n)の第一の電位差(Dmodel)を算出するDmodel算出手段と、
前記入力ペア電極に定電流を印加した場合に、前記出力ペア電極に発生する第二の電位差(Dmean(t))を測定する測定手段と、
前記第二の電位差を、呼吸由来成分と心拍由来成分に分離する、呼吸心拍分離手段と、
前記呼吸心拍分離手段により分離された、前記第二の電位差の呼吸由来成分から、所定呼吸状態を検出する呼吸状態検出手段と、
所定心拍状態を検出する心拍状態検出手段と、
前記心拍由来成分から、前記呼吸状態検出手段により検出された所定呼吸状態にある複数の第二の電位差、を抽出する第一の抽出手段と、
前記心拍状態検出手段により検出された所定心拍状態に基づき、前記第一の抽出手段により抽出された複数の第二の電位差を同期加算して、呼吸由来成分が除去された第二の電位差、を抽出する第二の抽出手段と、
前記呼吸由来成分が除去された第二の電位差を用いて、各画素に対応した複数(n)の血流由来の電気的特性値を算出するEIT(n)算出手段と、
前記複数(n)の血流由来の電気的特性値から各画素における最適な血流由来の電気的特性値を決定する決定手段と、
各画素における最適な血流由来の電気的特性値に基づき断層画像を表示する血流断層画像表示制御手段と
を備えることを特徴とする電気的インピーダンス断層像測定装置。
【請求項2】
前記血流由来の電気的特性値とは、抵抗率、導電率、誘電率、透磁率、のいずれか一つ、あるいは複数である
ことを特徴とする請求項1に記載の電気的インピーダンス断層像測定装置。
【請求項3】
前記決定手段は、前記Dmodel算出手段により算出される各画素に対応した複数(n)の電気的特性値の二乗、又は絶対値が最小であるものを最適な電気的特性値と決定する
ことを特徴とする請求項1又は請求項2に記載の電気的インピーダンス断層像測定装置。
【請求項4】
呼吸状態検出手段は、前記第二の電位差から前記呼吸心拍分離手段により分離した呼吸由来成分を用い、所定の呼吸状態を検出することを特徴とする請求項1乃至3のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項5】
心電図データを検出する心電図検出手段を有し、前記所定の心拍状態を検出するとは、心電図データからR波を検出することを特徴とする請求項1乃至4のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項6】
前記所定呼吸状態を検出するとは、所定のガス量を検出することを特徴とする請求項1乃至5のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項7】
心電図データを検出する心電図検出手段を有し、第二の抽出手段は心電図データのR波のタイミングで同期加算することを特徴とする請求項1乃至6のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項8】
前記Dmodel算出手段は、
予め定められた生体内の組織の電気的特性値を用いて、第一の電位差を算出する
ことを特徴とする請求項1乃至7のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項1】
生体の臓器や組織の位置およびその電気的特性に基づき、前記生体断面を分割し、各メッシュの電気的特性値を複数(n)に変化させて演算可能な3次元以上の数学モデルを作成する数学モデル作成手段と、
定電流を印加するための入力ペア電極と
電位差を検出するための出力ペア電極と
を含む生体の表面の所定の位置を囲繞するように貼着された複数の電極と、
前記入力ペア電極に定電流を印加する定電流印加手段と、
前記数学モデルを用いて任意のメッシュの電気的特性値を複数(n)に変化させ、前記入力ペア電極に定電流を印加した場合に、前記出力ペア電極にそれぞれ発生する複数(n)の第一の電位差(Dmodel)を算出するDmodel算出手段と、
前記入力ペア電極に定電流を印加した場合に、前記出力ペア電極に発生する第二の電位差(Dmean(t))を測定する測定手段と、
前記第二の電位差を、呼吸由来成分と心拍由来成分に分離する、呼吸心拍分離手段と、
前記呼吸心拍分離手段により分離された、前記第二の電位差の呼吸由来成分から、所定呼吸状態を検出する呼吸状態検出手段と、
所定心拍状態を検出する心拍状態検出手段と、
前記心拍由来成分から、前記呼吸状態検出手段により検出された所定呼吸状態にある複数の第二の電位差、を抽出する第一の抽出手段と、
前記心拍状態検出手段により検出された所定心拍状態に基づき、前記第一の抽出手段により抽出された複数の第二の電位差を同期加算して、呼吸由来成分が除去された第二の電位差、を抽出する第二の抽出手段と、
前記呼吸由来成分が除去された第二の電位差を用いて、各画素に対応した複数(n)の血流由来の電気的特性値を算出するEIT(n)算出手段と、
前記複数(n)の血流由来の電気的特性値から各画素における最適な血流由来の電気的特性値を決定する決定手段と、
各画素における最適な血流由来の電気的特性値に基づき断層画像を表示する血流断層画像表示制御手段と
を備えることを特徴とする電気的インピーダンス断層像測定装置。
【請求項2】
前記血流由来の電気的特性値とは、抵抗率、導電率、誘電率、透磁率、のいずれか一つ、あるいは複数である
ことを特徴とする請求項1に記載の電気的インピーダンス断層像測定装置。
【請求項3】
前記決定手段は、前記Dmodel算出手段により算出される各画素に対応した複数(n)の電気的特性値の二乗、又は絶対値が最小であるものを最適な電気的特性値と決定する
ことを特徴とする請求項1又は請求項2に記載の電気的インピーダンス断層像測定装置。
【請求項4】
呼吸状態検出手段は、前記第二の電位差から前記呼吸心拍分離手段により分離した呼吸由来成分を用い、所定の呼吸状態を検出することを特徴とする請求項1乃至3のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項5】
心電図データを検出する心電図検出手段を有し、前記所定の心拍状態を検出するとは、心電図データからR波を検出することを特徴とする請求項1乃至4のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項6】
前記所定呼吸状態を検出するとは、所定のガス量を検出することを特徴とする請求項1乃至5のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項7】
心電図データを検出する心電図検出手段を有し、第二の抽出手段は心電図データのR波のタイミングで同期加算することを特徴とする請求項1乃至6のいずれかに記載の電気的インピーダンス断層像測定装置。
【請求項8】
前記Dmodel算出手段は、
予め定められた生体内の組織の電気的特性値を用いて、第一の電位差を算出する
ことを特徴とする請求項1乃至7のいずれかに記載の電気的インピーダンス断層像測定装置。
【図1】


【図2】


【図5】


【図6】


【図7】


【図8】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図3】


【図4】


【図9】


【図17】




【図2】


【図5】


【図6】


【図7】


【図8】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図3】


【図4】


【図9】


【図17】


【公開番号】特開2012−65791(P2012−65791A)
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願番号】特願2010−212311(P2010−212311)
【出願日】平成22年9月22日(2010.9.22)
【出願人】(598041566)学校法人北里研究所 (180)
【出願人】(000230962)日本光電工業株式会社 (179)
【Fターム(参考)】
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願日】平成22年9月22日(2010.9.22)
【出願人】(598041566)学校法人北里研究所 (180)
【出願人】(000230962)日本光電工業株式会社 (179)
【Fターム(参考)】
[ Back to top ]

