電源内蔵式マイクロ流体の装置、方法およびシステム
マイクロ流体装置の作動のための電源、ならびにそれに関連する装置、方法およびシステム。この電源は、緩衝液チャンバー、このマイクロ流体装置の中に位置する第一の流体チャンバー、およびこのマイクロ流体装置に位置する第二の流体チャンバーへの流体通路を含む。この電源の中で、ピンはこの第一の流体チャンバーと接触し、かつこの第一の流体チャンバーの中の第一の流体から反応生成物を化学的に生成し、この第二の流体チャンバーの中の第二の流体を作動させるように構成される。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2008年12月2日に出願された「全血のマルチプレックスタンパク質分析のための電源内蔵式マイクロ流体チップ」と題する米国特許仮出願第61/200,674号に対する優先権を主張し、これは参照により本明細書にその全体が組み込まれる。
【0002】
米国国立衛生研究所(NIH)によって授与されたARO助成金第CA119347号によって授与された助成金第DAADl9−03−D−0004号に従って、米国政府は本発明に一定の権利を有する。
【0003】
本開示は、マイクロ流体装置の作動に適した電源ならびにそれに関連する装置、方法およびシステムに関する。
【背景技術】
【0004】
マイクロ流体装置は、比較的少量の流体を使用する様々な化学的および生物学的分析を行うための方法を提供する。分析をマイクロ流体システムに組み込むことにより、かかるシステムは反応をより簡単に測定することができるので、少量の試料から最適な標的物(例えば、診断マーカー)の評価を行うことができる。
【0005】
しかし、ほとんどのマイクロ流体に基づく分析は、ポンプ、電源およびパワーサプライならびに流体作動システムなどの重要な外付けの付属品を含む(P.S.Dittrich,K.Tachikawa and A.Manz,Analytical Chemistry,2006,78,3887−3907.T.Thorsen,S.J.Maerkl and S.R.Quake,Science(Washington,DC,United States),2002,298,580−584.J.Gao,J.Xu,L.E.Locascio and C.S.Lee,Anal.Chem.,2001,73,2648−2655)。
【0006】
これらの付属品は、次々に、マイクロ流体装置の使用に複雑さを加え、かかる装置の可搬性および可動性を制限する。効率的で、持ち運びできる、マイクロ流体装置に内蔵式の電源は、マイクロ流体装置の効率を上げる。本開示の様々な実施形態は、1つまたは複数のこれらなどのニーズを満たす。
【発明の概要】
【0007】
いくつかの実施形態において、電源内蔵式マイクロ流体装置と連結して作動できる電源、装置、方法およびシステムを本明細書に提供する。
【0008】
第一の態様に従って、マイクロ流体装置のための電源について記載する。この電源は、緩衝液チャンバー、このマイクロ流体装置に位置する第一の流体チャンバー、およびこのマイクロ流体装置に位置する第二の流体チャンバーへの流体通路を含む。この電源において、ピンは第一の流体チャンバーと接触し、かつ第一の流体チャンバーの中の第一の流体から反応生成物を化学的に生成し、第二の流体チャンバーの中の第二の流体を作動させるように構成される。
【0009】
第二の態様に従って、マイクロ流体装置の圧力を化学的に発生させるポンプシステムについて記載する。このポンプシステムは、貯蔵チャンバー、ピン、緩衝液チャンバーおよび試料添加チャンバーを含む。このポンプシステムにおいて、この貯蔵チャンバーはこのマイクロ流体装置に位置し、貯蔵流体を含む。このポンプシステムにおいて、このピンはこのマイクロ流体装置に位置し、この貯蔵流体を作動するように構成され、この貯蔵チャンバーにおいて膨張可能な反応生成物を化学的に生成する。このポンプシステムにおいて、この緩衝液チャンバーはこのマイクロ流体装置に位置し、この貯蔵チャンバーと流体的に連結し、この貯蔵チャンバーからこの緩衝液チャンバーへの貯蔵流体の通過を可能にし、逆もまた同様であり、この貯蔵チャンバーからこの緩衝液チャンバーへの膨張可能な反応生成物の通過を妨げる。このポンプシステムにおいて、この試料添加チャンバーはこのマイクロ流体装置に位置し、この貯蔵チャンバーと流体的に連結し、この貯蔵チャンバーからこの試料添加チャンバーへの膨張可能な反応生成物の通過を可能にし、この試料添加チャンバーからこの貯蔵チャンバーへの試料の通過を妨げる。
【0010】
第三の態様に従って、マイクロ流体装置の圧力発生法について記載する。この圧力発生法は、第一のマイクロ流体チャンバーの中に液体を準備するステップ、この液体の触媒分解を行い、この分解を経て圧力を発生させるステップ、ならびに第一のマイクロ流体チャンバーと連結された第二のマイクロ流体チャンバーを準備するステップを含む。具体的には、この発生した圧力の結果として、第二のマイクロ流体チャンバーを準備し、第一のマイクロ流体チャンバーから第二のマイクロ流体チャンバーへのこの液体の移動を可能にし、この発生した圧力が低下する時、第二のマイクロ流体チャンバーから第一のマイクロ流体チャンバーへこの液体の移動を逆にすることを可能にする。この方法において、この触媒分解は第一のマイクロ流体チャンバー内の液体レベルによって決まり、第一のマイクロ流体チャンバーから第二のマイクロ流体チャンバーへの液体の移動に起因するこの液体のレベルの減少がこの触媒分解を防ぎ、第二のマイクロ流体チャンバーから第一のマイクロ流体チャンバーへのこの液体の移動に起因する第一のマイクロ流体チャンバー内のこの液体のレベルの増加がこの触媒分解を促進する。
【0011】
第四の態様に従って、電源内蔵式マイクロ流体装置について記載する。この電源内蔵式マイクロ流体装置は、1つまたは複数の試薬が流れるように構成されるマイクロ流体チャネルの配置、このマイクロ流体チャネルを通してこれらの試薬を送り込む圧力源、および1つまたは複数の試薬を含む試薬チャンバーを含む。この電源内蔵式マイクロ流体装置において、この圧力源は、圧力を発生させる反応生成物を生成するのに適した物質を含む貯蔵所、この貯蔵所に連結し、この圧力を発生させる反応生成物を生成する物質と反応するように適合されたトリガー、ならびにこの貯蔵所と流体連通し、この圧力を発生させる反応生成物の生成の際にこの物質を留めておくように構成される緩衝液チャンバーを含む。この電源内蔵式マイクロ流体装置において、この試薬チャンバーは、この圧力源とマイクロ流体チャネルの配置の間に連結される。
【0012】
いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、このマイクロ流体装置への外付けの機器を必要とせず、マイクロ流体装置の作動を可能にする。具体的には、いくつかの実施形態において、本明細書記載の電源、配置、方法および装置は、電力供給をせずにマイクロ流体装置の作動を可能にする。
【0013】
従って、いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、遠隔地および/またはこのマイクロ流体装置とチップをはずした機器との連結が実行可能ではないか、あるいは単に望まれない位置において、マイクロ流体装置の作動を可能にする。
【0014】
さらに、いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、この装置の構造および作動ステップを単純化することを可能にし、それゆえに、極わずかな訓練しかうけていない個人がこのマイクロ流体装置を使用することが可能である。
【0015】
さらに、いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、このマイクロ流体装置に供給される電力の量および/または継続性という点から制御可能な方法で、マイクロ流体装置へ電力を供給することを可能にする。
【0016】
いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、化学的に電力が供給される完全内蔵型チップを含み、この化学反応それ自体は制御されることが可能であり、流速を越える広範な制御を可能にする。
【0017】
本明細書記載の電源、装置、方法およびシステムを、マイクロ流体装置の作動が望まれるどんな適用とも関連して使用することができ、その適用には、例えば、標的検出向けのハイスループットなマルチプレックス分析を含む、マイクロ流体環境における様々な種類の分析の実行が含まれる。結果として、本明細書記載の電源、配列、方法および装置を使用することができる分野の例として、医学、診断分野、生物学的研究、および獣医学が含まれる。
【0018】
1つまたは複数の本開示の実施形態の詳細を、添付の図面および以下の発明を実施するための形態に記述する。他の特徴、目的、利点は、発明を実施するための形態および図面、ならびに特許請求の範囲から明らかとなる。
【0019】
添付の図面はこの明細書の一部に組み込まれ、この明細書の一部を構成し、発明を実施するための形態および実施例の項と共に本開示の1つまたは複数の実施形態を説明し、本開示の原理および実施を明らかにするのに役立つ。
【図面の簡単な説明】
【0020】
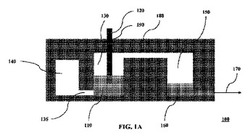
【図1A】電源の断面の概略図である。
【図1B】電源の断面の概略図である。
【図2】マイクロ流体装置の概略図である。
【図3】マイクロ流体装置の代表の写真である。
【図4】このマイクロ流体装置内の圧電式マイクロ圧力変換器によって測定されるチャンバーの圧力を示す図表である。
【図5】電源内蔵式マイクロ流体装置を用いて、刺激した全血から行ったIL−12の測定の結果を示す。図5Aは、IL−12の4つの異なる刺激濃度のバーコード画像である。(明るい灰色の矢印で示される)IL−10は血液で検出される。図5Bは、10ピコモル以下の濃度領域の蛍光強度対濃度の定量化のグラフである。
【図6】電源内蔵式マイクロ流体装置を用いて、ヒト血液において行ったタンパク質同定のグラフおよび蛍光像を示す。図6Aは、刺激されない血液(上)および刺激される血液(下)のX線蛍光像の全体を示す。図6Bは、刺激されない血液の、図6Aの四角(400倍)のX線蛍光像の拡大図であり、図6Cは、刺激される血液の四角(500倍)のX線蛍光像の拡大図である。図6Dは、刺激されない血液の(3倍増幅の)線形状のシグナルを示し、図6Eは、刺激される血液(3倍増幅の)線形状のシグナルを示す。
【図7】電源内蔵式マイクロ流体装置を用いて行った刺激されるヒト血液の流速試験を示す。図7Aは、多数のチャネルを含むチャネル設計の概略図を示し、各チャネルは、血漿の速度を他とは異なる速度にすることができるように構成される。図7Bは、電源内蔵式マイクロ流体装置を用いて行った2分間の血液分析のX線蛍光像を示す。図7Cは、電源内蔵式マイクロ流体装置を用いて行った5分間の分析のX線蛍光像を示す。図7Dおよび図7Eは、図7Bおよび図7Cのそれぞれ四角の領域(600)および(700)の、垂直方向における線形状の画像を示す。
【図8】図8Aは、電源内蔵式マイクロ流体装置の中の電源と連通して作動することができる流れの通路およびマイクロ流体装置の例の概略図である。図8B、電源内蔵式マイクロ流体装置において行うことができる分析の例の概略図である。
【図9】電源内蔵式マイクロ流体装置の例となる型の血漿スキミングチャネルの高さプロファイルである。
【図10】電源内蔵式マイクロ流体装置の中の電源と連通して作動することができるマイクロ流体チャネルの組み合わせの例の概略図である。
【図11】電源内蔵式マイクロ流体装置の例となる型の血漿スキミングチャネルの高さプロファイルである。
【発明を実施するための形態】
【0021】
電源およびそれに関連するマイクロ流体装置、組み合わせ、方法およびシステムを本明細書に提供する。具体的には、本明細書記載の電源はチップ上にある電源であり、このマイクロ流体装置に含まれ、このマイクロ流体装置に向けて適用されるように設計される。
【0022】
いくつかの実施形態において、本明細書記載の電源は、膨張可能な反応生成物を生成する化学反応に基づき、このマイクロ流体装置を作動させる。具体的には、本開示で意味する膨張可能な反応生成物は、量を増やすことができ、この反応生成物が生成される電源の1つまたは複数の表面上で圧力を発することができる反応生成物である。膨張可能な反応生成物の例として、気体および他の膨張可能な流体が含まれる。一般的に、この電源は、制御可能な方法で化学反応を起こすことができ、制御可能な方法でこの反応生成物をこのマイクロ流体装置へ移動させることもできるように構成されるチャンバーのシステムを含む。
【0023】
いくつかの実施形態において、この電源は、この化学反応の少なくとも1種類の流体試薬を含むように構成される貯蔵チャンバー、(この反応生成物を生成する際には、この貯蔵チャンバーから緩衝液チャンバーへ、この反応生成物の生成が減少する際には、この緩衝液チャンバーからこの貯蔵チャンバーへの試薬の通過を可能にする)この貯蔵チャンバーと流体的に連結された緩衝液チャンバー、および(流体試料を含み、この貯蔵チャンバーからこの反応生成物を受け取るように構成される)試料添加チャンバーを含む。
【0024】
いくつかの実施形態において、この化学反応を、チップ上のボタンを作動することによって触媒的に引き起こす。具体的には、この作動は、試薬または触媒の、この貯蔵チャンバーの中の少なくとも1種類の試薬との接触を可能にし、この試料添加チャンバーへ運ばれる反応生成物の生成を引き起こす。
【0025】
一実施形態において、この反応生成物は、O2供与体(例えば、水性の過酸化水素)によって生成されるO2であり、次式に従って、PtまたはAgなどの触媒で活性化される。
【化1】

【0026】
図1Aは、電源(100)の断面図である。具体的には、H2O2(過酸化水素)貯蔵所(110)をピン(120)によって作動されるように構成した。本開示の一実施形態において、ピン(120)は、Pt/Agピンである。貯蔵所(110)は貯蔵チャンバー(130)に位置し、チャネル(135)を通って空の緩衝液チャンバー(140)と流体的に連通し、かつ試料(160)が位置する試料添加チャンバー(150)と流体的に連通する。一実施形態において、この試料は全血であり、下流のマイクロ流体回路(図に示さず)と流体連通(170)で位置する。蓋(180)、例えば、ポリジメチルシロキサン(PDMS)の蓋も図に示し、この蓋を通ってピン(120)が通過できるように、ピンホール(190)をマイクロ加工した。試料(160)は、生物環境、標本、培養物、組織、市販の組換えタンパク質、合成化合物またはその部分に由来する流体を含むが、それらに限定されない任意の試料を含むと考えられる。さらに、試料の例として、唾液、CSF、汗、尿、精液、生検標本、子宮頸部細胞診試料または液体成分および細胞成分を含むヒトまたは動物から得られる任意の他の試料などの体液が含まれる。
【0027】
図1Aの説明図において、酸素生成の際に貯蔵チャンバー(130)から緩衝液チャンバー(140)へ過酸化物が通過でき、過酸化物(110)をピン(120)から分離して酸素生成が止まると、緩衝液チャンバー(140)から貯蔵チャンバー(130)へ過酸化物(110)が逆流できるように、これらのチャンバーを構成した。具体的には、図1Aの構造は、緩衝液チャンバー(140)から貯蔵チャンバー(130)への過酸化物(110)の逆流を可能にし、一定レベルの酸素が貯蔵チャンバー(130)に存在する時にその逆流が起き、その結果、貯蔵チャンバー(130)から試料添加チャンバー(150)への酸素の連続流をもたらす。
【0028】
図1Bで説明される代替構造において、図1Aの電源の中で過酸化物(110)の分解によって生成されるのと同じ量の酸素と、図1Aの電源で生成される圧力に匹敵する、過酸化物(110)に適用される圧力を与えると、緩衝液チャンバー(140)から貯蔵チャンバー(130)への過酸化物(110)の逆流は、酸素の特定の一部(過酸化物(110)の分解によって生成される最高で全部の酸素を含むことができる)が試料添加チャンバーへ移動した時のみ可能になる。
【0029】
結果として、図1Aの構造において、過酸化物(110)の分解によって生成される酸素の通過は試料添加チャンバー(150)へ連続してもたらされ、図1Bの構造において、試料添加チャンバーへの酸素の通過は酸素生成のギャップを考慮して不連続的に行われ、緩衝液チャンバー(140)から貯蔵チャンバー(130)への過酸化物(110)の逆流の遅延が結果として起こる。
【0030】
所望の実験計画に従って、この貯蔵所からこの試料添加チャンバーへの過酸化物の通過の制御およびこのマイクロ流体装置の対応する作動を、この反応生成物の生成の化学的制御によって、ならびに/またはこの試料添加チャンバー、この貯蔵チャンバーおよびこの緩衝液チャンバーの構造を調節することによって行うことができ、このマイクロ流体装置の流体連通およびそれに関連する作動を可能にする。
【0031】
例えば、いくつかの実施形態において、特定の電力の発生および所定の少なくとも1種類の試薬と所定のピンの間におきる所定の化学反応が望まれる場合、チャンバーの容積、関連性のある流体連結、少なくとも1種類の試薬および電源の中のピンの表面の量および容積などの他のパラメータを調節することができ、少なくとも1種類の試薬とピンの間の反応は、所定の化学反応の実行後に所望の電力を供給する。
【0032】
他の実施形態において、所定の電力の発生に関連して、特定の容積のチャンバーおよびこれらのチャンバーの流体連結が望まれる場合、対応する反応生成物の生成が所定の電力の発生をもたらすように化学反応、化学的性質、少なくとも1種類の試薬の量および容積、化学的性質、ピンの量および表面を調整することができる。
【0033】
図1Aおよび図1Bの実施形態において、この化学反応はPt/Agピンによって触媒される過酸化物の分解であり、この反応生成物はO2である。
【0034】
それらの実施形態において、このPt/Agピンを、0.1mm〜3mmの範囲の直径および5mm〜30mmの長さを有する金属棒と取り換えることができ、PtまたはAgの、10〜100nmの厚いフィルムでコーティングされた任意の硬質金属芯から作ることができる。
【0035】
それらの実施形態において、過酸化水素濃度を、約1%〜約30%の範囲、具体的には約5%〜約10%の範囲、より具体的には6%の範囲で使用することができる。30%より高い過酸化水素濃度を、生成される酸素およびそれに関連して発生する電力の所望の量が特に高い時の適用において使用することができる。
【0036】
ピンの中の第一の試薬/触媒と貯蔵チャンバーの中の第二の試薬/触媒とを接触させることにより気体生成物をもたらす追加の反応も、本明細書記載の電源に適する。
【0037】
例えば、一実施形態において、光の存在下、次式に従って水素および酸素を生成するために、チタニア(TiO2)によって触媒される水の解離によって、反応生成物H2およびO2を生成することができる。
【化2】

【0038】
別の例となる実施形態において、次式に従って、亜鉛または鉄などの金属(Me)が塩素酸などの酸と反応することによって、反応生成物H2を生成することができる。
【化3】

【0039】
膨張可能な反応生成物の生成をもたらす多くの追加反応は本明細書記載の電源に適し、当該技術者が本開示を読むことにより特定可能である。
【0040】
この貯蔵チャンバーの中の流体によって生成される反応生成物の量を決定する手順の例を、実施例1で説明する。しかし、これらの実施形態がこれらの発明を実施するための形態に限定されることなく実施され得ることは当該技術者にとって明らかである。これらの実施形態を不必要に分かりにくくしないようにするために、当該技術者が特定可能な追加的な周知の方法および構造を詳細に記述しなかった。過酸化水素のレベルおよび濃度を変更し、反応生成物を決定づける異なるレベルの酸素を生成することが可能である。本開示の電源を作動するのに適した追加的化学反応が考えられる。
【0041】
図1Aおよび図1Bの実施形態においても、貯蔵チャンバー(130)の中の過酸化物のレベルおよびそれに関連する過酸化物(110)とピン(120)との接触は、主に緩衝液チャンバー(140)の代替構造に起因して作動中に変化する。1つまたは複数の貯蔵チャンバー(130)、試料添加チャンバー(150)、チャネル(135)、流体連通(170)および/もしくはそれに関連する流体連結に加えてまたはそれらとは別の方法で、緩衝液チャンバー(140)の構造を選択することによって同様の結果を得ることができる。本開示の概説において当該技術者に理解されるように、貯蔵チャンバー(130)の中で実行される化学反応によって発生する所望の電力を考慮して、かかる選択を行うことができる。
【0042】
本明細書の範例となる実施形態において、貯蔵チャンバー(130)から緩衝液チャンバー(140)への反応生成物の流体通過、貯蔵チャンバー(130)および試料添加チャンバー(150)からの過酸化物(110)の流体通過、ならびに試料添加チャンバー(150)から貯蔵チャンバー(130)への試料の流体通過は、これらのチャンバー間の流体連通を請け負うこれらのチャンバーおよびチャネルの特有の構造によって妨げられる。従って、これらの実施形態において、この電源によって発生する電力の制御は、この貯蔵チャンバーの中で発生する酸素の試料添加チャンバーへの選択的移動によって増加し、この装置を作動させる。具体的には、それらの実施形態において、この反応によって発生する圧力は、発生する圧力の作用において、電源の中のチャンバーの対応する構造に応じて連続的にまたは不連続的に試料チャネルに選択的に運ばれる。
【0043】
いくつかの実施形態において、この電源からこのマイクロ流体装置へのこの反応生成物の連続的または不連続的な流れを通じて、この電源の中のチャンバーを、このマイクロ流体装置が連続的または不連続的に作動できるように構成することができる。これらのチャンバーの構造およびこれらの貯蔵チャンバーの中で化学的に発生する対応する電力を選択することによって、この作動の制御を行うことができる。
【0044】
マイクロ流体チャネル内の流体(例えば試料流体)を作動する電力を必要とするいくつかのマイクロ流体装置に関連して、本明細書記載の電源を使用することができる。本開示おいて、全血から血漿を分離し、その次に、血漿バイオマーカータンパク質パネルのマルチプレックス分析を実行するように設計されたマイクロ流体に基づくプラットフォームについて言及する。このマイクロ流体装置に関連して電源構造およびそれに関連する作動を説明する例として、関連記述を提供する。技術者は、血液関連分析に関連して提供される記述を、異なる試料を用いて行われる分析および/または関連部分に適応することができる。
【0045】
図2は、図1のポンプ配置を含む血液分析チップ(200)の拡大詳細の合成上面図を示す。参照数字(240)は、図1の緩衝液チャンバー(140)の上面概略図を示す。同様に、参照数字(230)は、図1の貯蔵チャンバー(130)の上面概略図を示す。チャンバー(230)と(240)間の連結を、図1のチャネル(135)に対応するチャネル(235)を通して得る。図2の実施形態において、図2の拡大部分にさらに示されるように、チャンバー(250)は下流のマイクロ流体回路(260)に送り込まれる全血を含み、最初の血液試料から血漿を分離するように構成されるチャネルである血液スキミングチャネル(270)を含む。血液廃棄物排水口(280)および血漿排水口(290)もこの図に示す。
【0046】
図3は、図1および図2に模式的に記載されたチップ上の電源を含む自動血液分析装置を示す。
【0047】
従って、図3の自動血液分析装置において、電源は、希釈したH2O2のPt/Ag触媒分解から貯蔵チャンバー(230)の中で発生し、酸素を生成する(図1)。出発H2O2濃度に応じて、O2反応生成物は、出発液体体積に対して最高で100倍に膨張する(P.A.Giguere,B.G.Morissette,A.W.Olmos and O.Knop,Can.J.Chem.,1955,33,804−820.)。H2O2分解は自発的であるが(μG0=−119.2kJmol−1)、市販のH2O2は分解防止剤を有し、触媒トリガーに曝露されるまで安定である。おそらく、触媒表面へのH2O2の拡散によって制限される速度で、Pt触媒はH2O2の一次分解を促進する。図3に示されるように、設計されたマイクロ流体装置は、図2のチャンバー(230)および図1のチャンバー(130)に対応する過酸化水素貯蔵所(330)を含み、図2のチャネル(235)および図1のチャンバー(135)に対応する橋渡しチャネル(335)によりマイクロ流体に基づく分析の機能領域と連結する。橋(335)はこの装置の上面を横断し、それゆえに、H2O2貯蔵所(330)と試料チャンバー(350)の間の接触を回避する。この装置の上部を約2mmの厚さのPDMS蓋(380)で覆い、ピンホール(390)をこの蓋の中に作り、この装置を始動させるためにPt/Ag触媒ピンプラグを挿入する(図1のピン(120)に関して対応するピンホール(190)参照)。
【0048】
図3の装置において、この化学反応によって発生する圧力は、仲介されない場合、この装置全体の層が剥離するのに十分であり得る。この問題を回避するために、空の緩衝液チャンバー(340)が、下部のチャネルを通って過酸化物貯蔵所(330)と連結する。この反応が始動する時、発生した圧力は、この緩衝液チャンバーの中に過酸化物溶液を押し入れる。この結果は、過酸化物燃料レベルがPt/Ag触媒ピンのレベル以下に低下すると、O2生成を止め、この装置の加圧を防ぐというものである。その後、この気体がマイクロ流体チャネルを通って流体を追いやるにつれて、過酸化物チャンバー内の圧力は減少する。これは、過酸化物がPt/Agピンと再び接触するようにこの反応チャンバーの中の過酸化物溶液のレベルを上昇させる。この分析のために、信頼でき順調に作動する電源を発生させるようにこれら2つの作用のバランスをとることを、過酸化物溶液の量、過酸化物濃度、およびピン/プラグのサイズを制御することによって達成する。PDMSは気体を透過させるが、PDMSを通る気体の移送はO2生成の速度に匹敵しない。
【0049】
図3の特定の電源内蔵式の、内蔵型マイクロ流体に基づく装置を、全血から血漿を分離し、その後、血漿バイオマーカータンパク質パネルのマルチプレックス分析を実行するように設計する。N.L.Anderson and N.G.Anderson,Molecular & Cellular Proteomics,2002,1,845,867.L.A.Liotta,M.Ferrari and E.Petricoin,Nature,2003,425,905.R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin,H.Ahmad,G.A.Kwong,C−C.Liu,J.Gould,L.Hood and J.R.Heath,Nat Biotech,2008,26,1373−1378に記載される分析などのこの電源内蔵式装置を用いて、血液に基づくいくつかの分析を行うことができる。トリプル4重極質量分析器と連結するレーザー脱離(例えば、MALDI)イオン源を含む質量分析定量技術によって、タンパク質を解析してもよい。タンパク質サンドイッチ法によりタンパク質を解析してもよく、または他の方法(T.G.Henares,F.Mizutani and H.Hisamoto,Analytica Chimica Acta,2008,611,17−30.J.H.Cho,S.M.Han,E.H.Paek,I.H.Cho and S.H.Paek,Anal.Chem.,2006,78,793−800)のうちで、酵素結合免疫吸着分析(ELISA)(E.Engvall and P.Perlmann,Immunochemistry,1971,8,871−874)はタンパク質バイオマーカーレベルを測定するために広く用いられている。
【0050】
他の実施形態において、このマイクロ流体装置のチャネル構造を、血液もしくは他の流体試料および/または試料以外の流体における他の分析を可能にするように改良することができる。最適なマイクロ流体装置の特定のチャネル構造を作動するのに必要とされる電力は、膨張可能な反応生成物の生成のために用いられる特定の試薬に関連して構成される適切な電源で供給され得る。
【0051】
いくつかの実施形態において、この電源は、同じ試薬または別の試薬で詰め替え可能である。具体的には、これらの実施形態のうちのいくつかにおいて、同じまたは異なる電力を、特異的な電源構造を考慮して、この貯蔵チャンバーに含まれる試薬の種類および量ならびに反応生成物の対応する生成を制御することによって供給することができる。
【0052】
いくつかの実施形態において、この電源内蔵式マイクロ流体装置に関連して、交換可能な電源を供給することができる。それらの実施形態において、この電源を、貯蔵チャンバーの中の試薬が枯渇した時に交換することができる。
【0053】
いくつかの実施形態において、この電源、同じもしくは異なる量の1つまたは複数の試薬、同じもしくは異なるサイズの1つまたは複数のピン、ならびに/またはこの電源を留めるのに適したマイクロ流体装置をシステムの中に提供することができ、このシステムは部品のキットの形態をとることができる。
【実施例】
【0054】
本明細書記載の電源、装置、方法およびシステムを以下の実施例においてさらに説明し、この実施例を説明の目的で提供し、制限するものとは意図しない。
【0055】
以下の実施例は、チップ上のマイクロ流体装置の電源を説明し、この電源は、全血から血漿を分離し、その後、血漿タンパク質パネルのマルチプレックス分析を実行するように設計されたマイクロ流体に基づくプラットフォームを駆動するように指示する。この電源は、電源内蔵式および内蔵型マイクロ装置上のボタンを押すことによって、触媒作用で引き起こされる化学反応に基づく。
【0056】
全血からの血漿のチップ上での分離、続いて、血液タンパク質バイオマーカーのマルチプレックス分析のために設計された、対応する(外部から電力が供給される)統合された血液バーコードチップ(IBBC)を、出願者らは以前に開発した(米国特許公開第20090053732号)(R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin,H.Ahmad,G.A.Kwong,C−C.Liu,J.Gould,L.Hood and J.R.Heath,Nat Biotech,2008,26,1373−1378も参照)。この分析は迅速に完了した。それらの分析において、(フィンガープリックによって得られる)血液試料から決定的なステップの完了までの時間は、10分未満であった(S.Yang,A.Undar and J.D.Zahn,Lab on a Chip,2006,6,871−880)。Zweifach−Fung効果を用いて、血漿スキミングチャネルの中で、血漿を全血から分離した(K.Svanes and B.W.Zweifach, Microvascular Research,1968,1,210−220.Y.C.Fung,Microvasc.Res.,1973,5,34−38)。血漿スキミングチャネルのガラスの底部表面をssDNAバーコードで事前にパターン形成する。これらのバーコードを、DNAをコードする抗体ライブラリー(DEAL)を用いて抗体バーコードに変換する(米国特許公開第20090036324号参照)(R.C.Bailey,G.A.Kwong,C.G.Radu,O.N. Witte and J.R.Heath,Journal of the American Chemical Society,2007,129,1959−1967)。
【0057】
血漿タンパク質バイオマーカーを、特異的な抗体−抗原結合を用いて個々のバーコードの縞上で捕捉する;バーコード内の各縞は、1種類のタンパク質についての分析を表す;完全なバーコードは、この場合、12種類のタンパク質バイオマーカーパネルについての完全分析を表す。ビオチン化抗体、続いて蛍光標識ストレプトアビジンを流すことによって、サンドイッチ分析を完了する。
[実施例1]
【0058】
電源は貯蔵チャンバーの中で発生する圧力を制御する。
図3で説明する装置を作動し、貯蔵チャンバーの中で圧力を発生させた。過酸化物装置内で発生するチャンバーの圧力を、圧電式マイクロ圧力変換器によって測定した。
【0059】
図3の装置において、圧力を、自動化IBBC燃料貯蔵所の中のH2O2濃度によって制御し、保護チャンバーによって調節した。このチャンバーは、反応生成物に由来する圧力上昇からこの装置を保護する役割を果たす。図3の装置において、緩衝液チャンバー内で発生する圧力を、圧電式マイクロ圧力変換器(Endevco8507C−15)を用いて監視し、これは約0.01KPaの正確さで圧力変化を監視する。この実施例において、Ptピンサイズは直径0.64mmであったが、他のピンサイズを用いてもよい。例えば、このピンサイズは、0.1〜1.1mmの範囲、0.2〜0.9mmの範囲、0.5〜0.8mmの範囲であり得る。一実施形態において、用いたピンサイズは0.6〜0.7mmの範囲であった。圧力対時間のプロットを作成した。
【0060】
図4で説明する結果は、6%過酸化物溶液について、1分以内の作動で圧力は3KPa上昇し、15kPaで安定し、5時間を越える連続作動を可能にしたことを示す(図4黒い曲線)。最適な圧力およびピンサイズならびに保護チャンバーの設計は、全血からの血漿の自動分離、それに続く、血液タンパク質の迅速分析を可能にした。
[実施例2]
【0061】
電源内蔵式マイクロ流体装置の製造
本開示に従って、電源内蔵式IBBC装置の例を、標準的マイクロ流体装置のプロトコルを用いて作った。SPR−220−7フォトレジストを用いて、最初に、設計した流動層のフォトマスクパターン(図2)を、シリコンウエハー上で陽電極構造に変えた。
【0062】
その後、このマイクロ流体チップの約8mmの10:1PDMS(10:1 GE RTV 615 A&B)流動層を形成するための型としてこの構造を使用した。本明細書で説明する実験に用いた装置の例の中にある血漿スキミングチャネルの寸法を説明する図9の局所分布画像に示すように、この流動層チャネルの厚さを平均約11μmに保った。血液分離を助ける目的で、意図的にチャネルを丸くした(図9)。
【0063】
変わりに、制御層のチャネルの厚さを約20μmに保った。PDMSの型に穴をあけ(図2の丸)、ssDNAバーコードで事前にパターンを形成したガラススライドと接着させた(R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin, H.Ahmad,G.A.Kwong,C−C.Liu,J.Gould,L.Hood and J. R.Heath,Nat Biotech,2008,26,1373−1378)。
【0064】
具体的に、事前にパターンを形成するのに利用したバーコード読み取り計画は、R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin,H.Ahmad,G.A.Kwong,C−C.Liu,J.Gould,L.Hood and J.R.Heath,Nat Biotech,2008,26,1373−1378および米国特許公開第2009−0036324号に記載の計画と同じであり、これらの各々は参照によりその全体は本明細書に組込まれる。この読み取り計画を図8に示す。
【0065】
最初に、マイクロ流体に導かれる流動式パターン形成の技術を用いて、ポリリシンガラススライド上に1組のssDNAオリゴマーのパターンを形成した(図8A)(R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin,H.Ahmad,G.A.Kwong,C−C Liu,J.Gould,L.Hood and J.R.Heath,Nat Biotech,2008,26,1373−1378)。これはバーコードを形成し、各バーコードの縞は特有のssDNAオリゴマーを含んだ。
【0066】
その後、自動化IBBCチップを組み立てた。過酸化物貯蔵所と試料注入チャンバーの間の橋渡し連結を含む上部のPDMS層を流動層と整列させて結合し、最終装置を形成した(図3)。マイクロポンプ、試料注入、血漿スキミング構成要素、およびタンパク質分析の領域を、小型パッケージに全て統合した(図3)。その後、得られたチップのプライミングの準備をした。
【0067】
一般に、本明細書が例示したように製造したチップを分析のためにプライミングすることができ、その後、4℃で1週間保存して使用するか、またはプライミングを行わないで保存した。プライミングステップについては、図8Bに模式的に説明した方法を用いるssDNA標識1次抗体を用いて、このssDNAバーコードを最初に抗体バーコードに変換することができる。
【0068】
この方法に従って、相補的ssDNAオリゴマーと結合した1次(10)抗体(図8B)は血漿スキミングチャネルを通って流れ、これが、DNAハイブリダイゼーションによりssDNAバーコードを抗体バーコードに変換した。この分析ステップにおいて、血漿試料のタンパク質バイオマーカーは、存在する場合、抗体バーコードと結合した。読み出しステップにおいて、関連する全てのビオチン化2次抗体は血漿チャネルを通って流れ、その後、ストレプトアビジン−Cy5蛍光標識を加えて、分析試料を現像した(図8B)。
【0069】
以下の実施例で用いる装置を製造するために、50μLの1%BSA/PBS溶液を通常の注射器を用いて各試料注入チャンバーに加え、この溶液をマイクロ流体領域に少し押し通した。混合した1次抗体を、ガラス基質上のオリゴマーと相補的なssDNAオリゴマーと結合させ(図8B)、その後、装置に添加して洗浄した。その後、燃料貯蔵所を0.1mlの6%H2O2で満たし、Ptピンを上部のピンホールに取り付けたが、H2O2燃料とは接触させなかった。保存の時、チップは安定である。
【0070】
この実施例のチップのパターン形成およびプライミングに使用した試薬を表1にまとめた。
【表1】


【0071】
得られたマイクロ流体装置を2つの別々の分析用に設計し(一方は新鮮な血液を用いて開始され、他方は新鮮な刺激した血液を用いて開始され、対照としての役割を果たした)、実施例3〜5に例示した手順に従って作動させた。
[実施例3]
【0072】
電源内蔵式マイクロ流体装置の作動
実施例2に例示した手順で製造した装置を作動して、様々な分析を行った。
【0073】
典型的な分析において、フィンガープリックでヒト血液(約2μL)を採取し、注射器により試料貯蔵所へ加え、20μLの事前に添加したEDTA/BSA/PBSで拡散することにより混合した。カリフォルニア工科大学の施設内審査委員会によって承認されたプロトコルに従って手順を行った。2つの(非触媒)ピンを用いて血液注入口を塞いだ。
【0074】
この分析を、Ptピンを押し入れて過酸化物貯蔵所と接触させることにより始動させた。数秒以内にこの装置の中で圧力が蓄積し、血液スキミングチャネルを通って血液を流れさせる(データ示さず)。血漿(>99%無細胞)をすくい取って分析チャネルに入れた(図2)。操作の設定時間後、このPtピンを上げることにより、流れを止めた。原理上は、(蛍光標識2次抗体を用いて)分析試料の現像を同様に自動化してもよい。しかし、この実施例については、PDMS層をガラススライドから容易にはがし、その後、現像およびバーコード読み出しステップをガラススライド上で行った。現像ステップは、ビオチン化2次抗体およびストレプトアビジン−Cy5を含む単一溶液の付加を含む。標準遺伝子チップスキャナー(Axon Genepix 4000B)を用いて、現像したバーコード分析試料を読み込み、検出されたタンパク質はバーコード内の蛍光の帯として現れる(実施例4および5参照)。完全に現像したバーコード分析試料を、読み出しに影響を与えることなく、数日間保存してもよい。
[実施例4]
【0075】
電源内蔵式マイクル流体装置を用いて行った標的の定量的検出
米国特許出願公開第2009−0036324号および同第2009−0053732号(これらは参照によりその全体が本明細書に組込まれる)に記載されるように、図8Aで説明したマイクロ流体チャネル配置を含む、電力供給がチップ上で行われないIBBCを、ヒト血漿におけるタンパク質の定量的検出に以前に利用した。
【0076】
ヒトの全血から、これらの自動化IBBCについて、および代表的タンパク質:インターロイキン−12(IL−12)についての検出限界を測定した。
【0077】
エッペンドルフ試験管の中で、健常なヒト提供者の新鮮な血液を用いて、様々な濃度のIL−12で血液を刺激し、その後、実施例2および3に記載したように製造および作動した自動化IBBCを用いて、IL−12について分析した。
【0078】
具体的には、BD Microtainer Contact−Activated Lancets(紫色のランセット−低用量、血液1滴)を用いて、フィンガープリックを行った。以下で論じるように、25mMのEDTA溶液を事前に満たしたSAFE−T−FILL毛細血管採取管(RAM Scientific)を用いて血液を採取した。全血の1滴から2つの試料を準備した。
【0079】
(i)刺激していない血液試料:80μLの25mM EDTA溶液で血液採取管を事前に満たし、その後、10μLの新鮮なヒト血液をEDTA被膜キャピラリーに採取し、この試験管に分注し、数回反転させることにより素早く混合した。
【0080】
(ii)刺激した血液試料:40μLの25mM EDTA溶液で血液採取管を事前に満たした。全てのタンパク質標準物質を含む40μLの組換えタンパク質溶液を加えた。その後、2μLの0.5M EDTAを加え、EDTAの総濃度を最高で25mMにした。最終的に、EDTA被膜キャピラリーに10μLの新鮮なヒト血液を採取し、試験管に加え、数回反転させることにより素早く混合した。全てのタンパク質標準物質の最終濃度は約10nMであった。しかし、これらの「標準物質」の質および捕捉抗体の親和性は実質的に変化する。タンパク質標準物質の中で刺激する目的は、高濃度のタンパク質におけるシグナルを、採取したままの新鮮な全血のシグナルと唯一対比させることであった。
【0081】
使用する前に、30〜60分間、このマイクロ流体装置の全てのマイクロ流体チャネルを分析緩衝溶液(98%純度の牛血清アルブミン画分V(Sigma)を150mMの1×PBS(カルシウム/マグネシウム塩なし)(Irvine Scientific)に加えることによって調製した1%重量/体積のBSA/PBS溶液)で塞いだ。
【0082】
全てのDNA−抗体複合体を含む溶液を、約30〜45分間、血液分離/タンパク質分析(BS/PA)の分析チャネルを通って流し、DNAバーコードマイクロアレイを抗体マイクロアレイに変換し、次の表面結合免疫測定法を可能にした。非結合複合体を、10分間、分析緩衝溶液を流すことによって除去した。1%BSA/PBSの中で全ての合成複合体を混合することによりDEAL−共役溶液を調製し、最終濃度は5μg/mlであった。直交性について、DNAコードオリゴマーを事前に試験し、非相補性オリゴマー鎖間の交差ハイブリダイゼーションが、相補的な対のシグナル強度の5%を超えない蛍光強度を生じることを確かめた。
【0083】
血液試料を採取1分以内にBS/PAチップに流し入れた。チップ内で血液細胞から血漿を素早く分離し、DEALバーコードアレイを含む下流の分析区域で所望のタンパク質を捕捉した。全てのステップを手動で行ったが、フィンガープリックから血漿タンパク質捕捉の完了までの全工程は非常に迅速であった(<10分)。自動化工程は、<5分で全工程を迅速に処理することができた。短時間の規模のこの分析は、マイクロ流体の流れ環境において、拡散障壁を減少させるのに大いに起因する。従来の免疫測定法は1〜2時間以上かかり、最初に、血液細胞を遠心分離する必要がある。
【0084】
約30分間、ビオチン標識検出抗体の混合物をマイクロ流体装置に流し入れ、DEAL分析を完了した。検出抗体溶液は、1%BSA/PBSで調製した約5μMの濃度でビオチン化検出抗体を含んだ。その後、BS/PAチップの中の非結合検出抗体を、約10分間、分析緩衝液を流すことによって除去した。
【0085】
Cy5蛍光染料標識ストレプトアビジンおよび参考のCy3標識相補ssDNA(DNAコードM/M’)を混合し、その後、30分間、BS/PAチップに流し入れた。最後に、分析緩衝液を10分間流し、非結合ストレプトアビジン−Cy5を除去した。
【0086】
DNAでパターン形成したガラススライドから、PDMS血液チップ装置を除去した。このスライドを、以下の溶液に各6回ずつ即座に浸した:順に、1%BSA/PBS溶液、1×PBS溶液、1/2×PBS溶液、脱イオン化ミリポアH2O。ミリポアH2Oを流しながら、数秒間、このスライドを軽くすすぎ、その後、窒素ガンを用いて乾燥させた。
【0087】
このスライドをAxon Instruments Genepix Scannerで走査した。最も質の高い解像度(5μm)を選択した。2色のチャネル(緑はCy3チャネルおよび赤はCy5チャネル)のスイッチを入れ、蛍光シグナルを集めた。
【0088】
各濃度について、IL−12の読み出し位置に対応する10個の異なるバーコードの帯の像を取得し、デジタル化し、Image J(www page rsbweb.nih.gov/ij参照)によって平均化した。
【0089】
図5で説明される結果は、約0.4PMの検出限界で、IL−12が強度対濃度の一貫性のある傾向を見せたことを示した。これは、15pg/ml(0.3PM)のメーカーが引用するELISA検出感度に匹敵する(eBioscience(登録商標))。このデータは、自動化IBBCが臨床的に意義のある濃度範囲内の血液タンパク質について分析することができることを示す(L.Romani,P.Puccetti and F.Bistoni,Clin.Microbiol.Rev.,1997,10,611−636)。
[実施例6]
【0090】
電源内蔵式マイクロ流体装置を用いて行ったマルチプレックス標的検出
マルチプレックスな、タンパク質分析の実演として、12種類のサイトカインバイオマーカーパネルを用いて、同じ健常志願者の血液を分析した。
【0091】
一方のフィンガープリックの血液(一般的に、約500マイクログラム以下)をこのマイクロ流体装置に直接添加し、他方のフィンガープリックの血液(一般的に、約500マイクログラム以下)をエッペンドルフ試験管に加え、図6にまとめた12種類のタンパク質を用いて、約300pg/mlの濃度で刺激した(N.L.Anderson and N.G.Anderson,Molecular&Cellular Proteomics,2002,1,845−867)。各バーコード内の1つの帯を、任意のssDNA標識1次(10)抗体複合体と相補的ではないssDNAオリゴマーで機能的にし、整列マーカーおよび陰性対照として役割を果たさせた(B.Schweitzer,S.Roberts,B.Grimwade,W.P.Shao,M.J.Wang,Q.Fu,Q.P.Shu,I.Laroche,Z.M.Zhou,V.T.Tchernev,J.Christiansen,M.Velleca and S.F.Kingsmore,Nature Biotechnology,2002,20,359−36V.W.W.Lin and M.Karin,Journal of Clinical Investigation,2007,117,1175−1183.M.Zimmermann,E.Delamarche,M.Wolf and P.Hunziker,Biomedical Microdevices,2005,7,99−110)。同じチップ上で、刺激していない血液試料と刺激した血液試料の両方を同時に分析し、同時に読み取った。
【0092】
結果を図6で説明し、調べた12種類のタンパク質およびそれらに対応するバーコードの位置をこの図の右下部分にまとめる。具体的には、図6の解析の刺激したヒト血液試料は112のタンパク質の帯および(ブランク)対照(帯番号11)を示す。しかし、刺激していない血液試料については、バックグラウンド比3.5のシグナル(標準偏差=0.6)と共にIL−10のみ検出され(図6Bおよび図6Dも参照)、結果は以前の研究(参考文献)に基づいて期待されたものであった(J.Karcher,C.Reisser,V.Daniel and C.Herold−Mende,Hno,1999,47,879−884.M.Kupczyk,I.Kupryae−Lipinska,M.Bocheuska−Marciniak,P.Gorski and P.Kuna,Allergy,2007,62,248−248.M.Navarrete,A.Palacios,M.J.Cruz,A.Blanco,I.Caragol and A.Lopez,Blood,2006,108,227B−227B)。
[実施例7]
【0093】
電源内蔵式マイクロ流体装置の流速
十分に高い血漿流速の条件下で行った分析は、抗体/タンパク質結合動態に制限され、それゆえに、特に効率的である(M.Zimmermann,E.Delamarche,M.Wolf and P.Hunziker,Biomedical Microdevices,2005,7,99−110)。したがって、完全な視覚化には約1〜2時間を必要とし得るが、これらの分析は、このチップ上への血液の添加から5〜10分内で完了することができた。
【0094】
自動血液分析の電源内蔵式マイクロ流体装置を用いて、出願者らはこの動態を研究した。いくつかの流速を用いて、どうにかして、1分析あたりに必要とされる最短時間を同定した。
【0095】
この目的のために、異なるチャネル幅(図7上部)を有し、それ故に、他の同一分析内に異なる流速を有する6つの血漿スキミングチャネルを、単一フィンガープリック測定装置内に設計した。
【0096】
具体的には、異なるチャネル幅を有する測定装置において、図10の概略図で例として説明するように、最初の幅の広い単一血漿チャネルと比較して、6種類の異なる幅のサブチャネルを延長する。この延長は、6つのサブチャネル間の流れ抵抗の違いを増加させる。チャネルの高さプロファイルも測定し、6つのサブチャネルの寸法を明らかにする。
【0097】
図10の図解において、変流速実験における6つのサブチャネルの血漿チャネルの長さを、図9の図解の最初の単一血漿チャネル(実施例4参照)と比較して示す。この長さを5mm〜7.5mmに延長する。
【0098】
サブチャネルの寸法を高さプロファイル走査によって特徴づけ、図11は装置型の血漿スキミングチャネルの高さプロファイルを示す。
【0099】
幅の変動に加えて、最も狭いものから最も広いもの(約1×、2×、6×、8×、10×、および15×)までの、(フォトレジストの現像中に生じた)装置加工ステップに起因するわずかな高さ変動がある。これらのチャネルも加工中に丸くした。この装置を設計する時、出願者らはダーシーの法則を用いて流速変動を計算し、この装置は1×、2×、6×、8×、10×、および15×の流速変動を与える。実際の流速は、チャネルの物質、粗さ、および他の因子に関連する。出願者らは、チャネル寸法が流速を制御していることをはっきり示すことができた(データ示さず)。
【0100】
サブチャネルを延長し、チャネル間の流れの速さの違いを理解した−血漿分離工程を変化させない設計改良(D.J.Beebe,G.A.Mensing and G.M.Walker,Annual Review of Biomedical Engineering,2002,4,261−286)。2分間流した後、6つ個々のチャネルの中で記録されたタンパク質レベルは異なった:最も広い(最も速い流速)チャネルは、予想したとおり高いシグナルレベルを示した(O.Hofmann,G.Voirin,P.Niedermann and A.Manz,Anal.Chem.,2002,74,V243−5250.V.G.Levich,Physiochemical Hydrodynamics,Prentice Hall,Englewood Cliffs,NJ,1962)。しかし、5分間流した場合、全てのスキミングチャネルの測定シグナルは飽和状態で、同一シグナルレベルを生じた(図7Cおよび図7E)。マイクロ流体チャネルの中の検体の流れは、チャネル壁近くは流れが低く、チャネル中心においては流れが高いという放物線の流れプロファイルを有する(M.Zimmermann,E.Delamarche,M.Wolf and P.Hunziker,Biomedical Microdevices,2005,7,99−110)。不飽和分析(図7D)については、流速のこの変動は、放物線型シグナルをもたらし、チャネルの中心に対応したバーコードの領域でピークに達する。飽和分析については、この効果はなくなった。この研究は、フィンガープリックから臨床分析ステップの完了までの時間を、強度を損失することなく、5分に減少することができることを示唆する。この分析は再現可能であり、20回繰り返した。検出の感度および精度は、自動化によってではなく、バーコードのパターン形成(M.Navarrete,A.Palacios,M.J.Cruz,A.Blanco,I.Caragol and A.Lopez,Blood,2006,108,227B−227B)、または試験される抗体によってのみ制限された。
【0101】
高速測定の分析を最適化する方法は、参考文献のM.Zimmermann,E.Delamarche,M.Wolf and P.Hunziker,Biomedical Microdevices,2005,7,99−110で広範に議論された。
【0102】
マイクロチャネルに導かれる流れのパターン形成を用いて、高密度でssDNAバーコードのパターンを形成し、この少量から多くのタンパク質バイオマーカーパネルを測定した。出願者らは、ポリアミン被膜ガラススライド上に熱結合させたPDMS型を用いて、ssDNAバーコード全体のパターンを形成した。ポリアミノ化表面は、従来のアミノ化表面より実質的に高いDNA添加を可能にし、付随する分析感度の増加をもたらす。各々が特異的ssDNAオリゴマーを含む異なる溶液は、異なるチャネルを通って流れ、ガス透過可能なPDMSスタンプを通って蒸発し、DNA分子の個々の縞をもたらした。縞の1つの完全集合は1つのバーコードを表す。全ての測定は、40μmピッチで間隔をあけた20μmの幅の帯を使用した。この配列密度は、(典型的な寸法が、400μmピッチの150μm直径スポットである)標準の点状アレイをこえて約10倍増加し、したがって、少量で測定することができるタンパク質の数を大きくする。バーコードアレイと血漿チャネル間の整列化は必要としなかった。ガン患者の血清実験において、受け取ったままの血清試料を、いかなる事前処理をすることなく(すなわち、精製も希釈もせず)、IBBCに流し入れた。その後、タンパク質パネル全体に対するビオチン標識検出抗体の混合物および蛍光Cy5−ストレプトアビジン複合体を連続してIBBCに流し入れ、DEAL免疫測定法を完了した。緩衝溶液を10分間流すことにより、非結合蛍光プローブを洗い流した。最後に、PDMSチップをガラススライドから除去した。このスライドを1/2PBS溶液および脱イオン水で即座にすすぎ、その後、窒素ガンで乾燥させた。最終的に、DEALバーコードスライドをマイクロアレイスキャナーによって走査した。全てのタンパク質分析は1色蛍光色素分子を用い、異なる色で蛍光を発した参考マーカーを用いて空間的に同定した。
【0103】
迅速分析の計画は、大量輸送の制限を防ぐために高い流量速度を有すること、検体利用を増加させるために小さい捕捉領域を有することである。マイクロ流体チャネルの中の検体の流れは、放物線の流れプロファイルを有し、これは結果に影響を与えることができる。比較的低流速に対しては、図7Dの分析はこれらの速度プロファイルに反映するが、飽和分析に対しては、効果はない。さらに、放物線の流れプロファイルは、チャネル壁近くの血液細胞の遅い流れもおそらく説明する。
【0104】
上で説明したこれらの実験結果は、全血からの迅速血液タンパク質分析などの様々な分析に適する自動の電源内蔵式マイクロ流体装置の設計を例示する。これらの実施例の特定の方法において、H2O2を用いて、装置上に統合される装置に電力を供給した。ピンによって作動する単純な押しボタン式操作を用いて、出願者らは血液に基づく12種類のタンパク質バイオマーカーを調べた。この単純な「プラットフォーム」は、いくつかの実施形態において、少なくともハイスループットで、精密な、マルチプレックス血液診断測定を可能にすることが期待される。
【0105】
要約すれば、本開示の実施形態は、マイクロ流体装置の作動のための電源、ならびにそれに関連する装置、方法およびシステムに関する。
【0106】
当該技術者に、本開示の電源、装置、システムおよび方法の実施形態の作り方および使い方の完全開示ならびに説明書を与えるために、上で説明した実施例を提供するが、発明者らが彼らの開示とみなすものの範囲に制限されるようには意図しない。当該技術者に明らかである本開示を実行するための上記の方法の改良は、以下の特許請求の範囲内にあると意図される。明細書で述べた全ての特許および公表文献は、本開示が関係する当該技術分野の技術者の技能のレベルを示す。本開示に引用した全ての参考文献は、各参考文献が参照によりその全体が個々に組込まれたように、参照により同じ範囲に組込まれる。
【0107】
背景技術、発明の概要、発明を実施するための形態、および実施例において引用した(特許、特許出願、学術論文、要約書、実験室のマニュアル、本、または他の開示を含む)各書類の開示全体は、参照により本明細書に組込まれる。さらに、本明細書と共に提出された配列表のハードコピーおよび対応するコンピュータ−が読み取り可能な用紙は、本開示の一部を形成し、共に参照によりそれらの全体が本明細書に組込まれる。
【0108】
本開示は、もちろん変化することができる特定の組成物または生物系に限定されないことが理解されるべきである。本明細書で使用される専門用語は、特定の実施形態のみを記載する目的で使用され、制限するようには意図されないことも理解されるべきである。本明細書および添付の特許請求の範囲で使用されるように、単数形「1つ(a)」「1つ(an)」および「1つ(the)」は、その内容が特にはっきりと指示されない限り、複数の参照対象を含む。「多数」という用語は、その内容が特にはっきりと指示されない限り、2つ以上の参照対象を含む。はっきりと定義されない限り、本明細書で使用される全ての技術用語および科学用語は、本開示が関係する当該技術分野の技術者が一般に理解するのと同じ意味を有する。
【0109】
本明細書に記載の方法および物質と同じまたは同等の任意の方法および物質を、本開示の生成物、方法およびシステムの試験を実施するのに用いることができるが、適切な物質および方法の例を、ガイダンスの目的で本明細書に記載する。
【0110】
本開示の多数の実施形態を記載した。それにもかかわらず、本開示の趣旨および範囲から逸脱することなく、様々な改良が行われ得ることが理解される。したがって、他の実施形態は以下の特許請求の範囲内にある。
【技術分野】
【0001】
本出願は、2008年12月2日に出願された「全血のマルチプレックスタンパク質分析のための電源内蔵式マイクロ流体チップ」と題する米国特許仮出願第61/200,674号に対する優先権を主張し、これは参照により本明細書にその全体が組み込まれる。
【0002】
米国国立衛生研究所(NIH)によって授与されたARO助成金第CA119347号によって授与された助成金第DAADl9−03−D−0004号に従って、米国政府は本発明に一定の権利を有する。
【0003】
本開示は、マイクロ流体装置の作動に適した電源ならびにそれに関連する装置、方法およびシステムに関する。
【背景技術】
【0004】
マイクロ流体装置は、比較的少量の流体を使用する様々な化学的および生物学的分析を行うための方法を提供する。分析をマイクロ流体システムに組み込むことにより、かかるシステムは反応をより簡単に測定することができるので、少量の試料から最適な標的物(例えば、診断マーカー)の評価を行うことができる。
【0005】
しかし、ほとんどのマイクロ流体に基づく分析は、ポンプ、電源およびパワーサプライならびに流体作動システムなどの重要な外付けの付属品を含む(P.S.Dittrich,K.Tachikawa and A.Manz,Analytical Chemistry,2006,78,3887−3907.T.Thorsen,S.J.Maerkl and S.R.Quake,Science(Washington,DC,United States),2002,298,580−584.J.Gao,J.Xu,L.E.Locascio and C.S.Lee,Anal.Chem.,2001,73,2648−2655)。
【0006】
これらの付属品は、次々に、マイクロ流体装置の使用に複雑さを加え、かかる装置の可搬性および可動性を制限する。効率的で、持ち運びできる、マイクロ流体装置に内蔵式の電源は、マイクロ流体装置の効率を上げる。本開示の様々な実施形態は、1つまたは複数のこれらなどのニーズを満たす。
【発明の概要】
【0007】
いくつかの実施形態において、電源内蔵式マイクロ流体装置と連結して作動できる電源、装置、方法およびシステムを本明細書に提供する。
【0008】
第一の態様に従って、マイクロ流体装置のための電源について記載する。この電源は、緩衝液チャンバー、このマイクロ流体装置に位置する第一の流体チャンバー、およびこのマイクロ流体装置に位置する第二の流体チャンバーへの流体通路を含む。この電源において、ピンは第一の流体チャンバーと接触し、かつ第一の流体チャンバーの中の第一の流体から反応生成物を化学的に生成し、第二の流体チャンバーの中の第二の流体を作動させるように構成される。
【0009】
第二の態様に従って、マイクロ流体装置の圧力を化学的に発生させるポンプシステムについて記載する。このポンプシステムは、貯蔵チャンバー、ピン、緩衝液チャンバーおよび試料添加チャンバーを含む。このポンプシステムにおいて、この貯蔵チャンバーはこのマイクロ流体装置に位置し、貯蔵流体を含む。このポンプシステムにおいて、このピンはこのマイクロ流体装置に位置し、この貯蔵流体を作動するように構成され、この貯蔵チャンバーにおいて膨張可能な反応生成物を化学的に生成する。このポンプシステムにおいて、この緩衝液チャンバーはこのマイクロ流体装置に位置し、この貯蔵チャンバーと流体的に連結し、この貯蔵チャンバーからこの緩衝液チャンバーへの貯蔵流体の通過を可能にし、逆もまた同様であり、この貯蔵チャンバーからこの緩衝液チャンバーへの膨張可能な反応生成物の通過を妨げる。このポンプシステムにおいて、この試料添加チャンバーはこのマイクロ流体装置に位置し、この貯蔵チャンバーと流体的に連結し、この貯蔵チャンバーからこの試料添加チャンバーへの膨張可能な反応生成物の通過を可能にし、この試料添加チャンバーからこの貯蔵チャンバーへの試料の通過を妨げる。
【0010】
第三の態様に従って、マイクロ流体装置の圧力発生法について記載する。この圧力発生法は、第一のマイクロ流体チャンバーの中に液体を準備するステップ、この液体の触媒分解を行い、この分解を経て圧力を発生させるステップ、ならびに第一のマイクロ流体チャンバーと連結された第二のマイクロ流体チャンバーを準備するステップを含む。具体的には、この発生した圧力の結果として、第二のマイクロ流体チャンバーを準備し、第一のマイクロ流体チャンバーから第二のマイクロ流体チャンバーへのこの液体の移動を可能にし、この発生した圧力が低下する時、第二のマイクロ流体チャンバーから第一のマイクロ流体チャンバーへこの液体の移動を逆にすることを可能にする。この方法において、この触媒分解は第一のマイクロ流体チャンバー内の液体レベルによって決まり、第一のマイクロ流体チャンバーから第二のマイクロ流体チャンバーへの液体の移動に起因するこの液体のレベルの減少がこの触媒分解を防ぎ、第二のマイクロ流体チャンバーから第一のマイクロ流体チャンバーへのこの液体の移動に起因する第一のマイクロ流体チャンバー内のこの液体のレベルの増加がこの触媒分解を促進する。
【0011】
第四の態様に従って、電源内蔵式マイクロ流体装置について記載する。この電源内蔵式マイクロ流体装置は、1つまたは複数の試薬が流れるように構成されるマイクロ流体チャネルの配置、このマイクロ流体チャネルを通してこれらの試薬を送り込む圧力源、および1つまたは複数の試薬を含む試薬チャンバーを含む。この電源内蔵式マイクロ流体装置において、この圧力源は、圧力を発生させる反応生成物を生成するのに適した物質を含む貯蔵所、この貯蔵所に連結し、この圧力を発生させる反応生成物を生成する物質と反応するように適合されたトリガー、ならびにこの貯蔵所と流体連通し、この圧力を発生させる反応生成物の生成の際にこの物質を留めておくように構成される緩衝液チャンバーを含む。この電源内蔵式マイクロ流体装置において、この試薬チャンバーは、この圧力源とマイクロ流体チャネルの配置の間に連結される。
【0012】
いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、このマイクロ流体装置への外付けの機器を必要とせず、マイクロ流体装置の作動を可能にする。具体的には、いくつかの実施形態において、本明細書記載の電源、配置、方法および装置は、電力供給をせずにマイクロ流体装置の作動を可能にする。
【0013】
従って、いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、遠隔地および/またはこのマイクロ流体装置とチップをはずした機器との連結が実行可能ではないか、あるいは単に望まれない位置において、マイクロ流体装置の作動を可能にする。
【0014】
さらに、いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、この装置の構造および作動ステップを単純化することを可能にし、それゆえに、極わずかな訓練しかうけていない個人がこのマイクロ流体装置を使用することが可能である。
【0015】
さらに、いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、このマイクロ流体装置に供給される電力の量および/または継続性という点から制御可能な方法で、マイクロ流体装置へ電力を供給することを可能にする。
【0016】
いくつかの実施形態において、本明細書記載の電源、装置、方法およびシステムは、化学的に電力が供給される完全内蔵型チップを含み、この化学反応それ自体は制御されることが可能であり、流速を越える広範な制御を可能にする。
【0017】
本明細書記載の電源、装置、方法およびシステムを、マイクロ流体装置の作動が望まれるどんな適用とも関連して使用することができ、その適用には、例えば、標的検出向けのハイスループットなマルチプレックス分析を含む、マイクロ流体環境における様々な種類の分析の実行が含まれる。結果として、本明細書記載の電源、配列、方法および装置を使用することができる分野の例として、医学、診断分野、生物学的研究、および獣医学が含まれる。
【0018】
1つまたは複数の本開示の実施形態の詳細を、添付の図面および以下の発明を実施するための形態に記述する。他の特徴、目的、利点は、発明を実施するための形態および図面、ならびに特許請求の範囲から明らかとなる。
【0019】
添付の図面はこの明細書の一部に組み込まれ、この明細書の一部を構成し、発明を実施するための形態および実施例の項と共に本開示の1つまたは複数の実施形態を説明し、本開示の原理および実施を明らかにするのに役立つ。
【図面の簡単な説明】
【0020】
【図1A】電源の断面の概略図である。
【図1B】電源の断面の概略図である。
【図2】マイクロ流体装置の概略図である。
【図3】マイクロ流体装置の代表の写真である。
【図4】このマイクロ流体装置内の圧電式マイクロ圧力変換器によって測定されるチャンバーの圧力を示す図表である。
【図5】電源内蔵式マイクロ流体装置を用いて、刺激した全血から行ったIL−12の測定の結果を示す。図5Aは、IL−12の4つの異なる刺激濃度のバーコード画像である。(明るい灰色の矢印で示される)IL−10は血液で検出される。図5Bは、10ピコモル以下の濃度領域の蛍光強度対濃度の定量化のグラフである。
【図6】電源内蔵式マイクロ流体装置を用いて、ヒト血液において行ったタンパク質同定のグラフおよび蛍光像を示す。図6Aは、刺激されない血液(上)および刺激される血液(下)のX線蛍光像の全体を示す。図6Bは、刺激されない血液の、図6Aの四角(400倍)のX線蛍光像の拡大図であり、図6Cは、刺激される血液の四角(500倍)のX線蛍光像の拡大図である。図6Dは、刺激されない血液の(3倍増幅の)線形状のシグナルを示し、図6Eは、刺激される血液(3倍増幅の)線形状のシグナルを示す。
【図7】電源内蔵式マイクロ流体装置を用いて行った刺激されるヒト血液の流速試験を示す。図7Aは、多数のチャネルを含むチャネル設計の概略図を示し、各チャネルは、血漿の速度を他とは異なる速度にすることができるように構成される。図7Bは、電源内蔵式マイクロ流体装置を用いて行った2分間の血液分析のX線蛍光像を示す。図7Cは、電源内蔵式マイクロ流体装置を用いて行った5分間の分析のX線蛍光像を示す。図7Dおよび図7Eは、図7Bおよび図7Cのそれぞれ四角の領域(600)および(700)の、垂直方向における線形状の画像を示す。
【図8】図8Aは、電源内蔵式マイクロ流体装置の中の電源と連通して作動することができる流れの通路およびマイクロ流体装置の例の概略図である。図8B、電源内蔵式マイクロ流体装置において行うことができる分析の例の概略図である。
【図9】電源内蔵式マイクロ流体装置の例となる型の血漿スキミングチャネルの高さプロファイルである。
【図10】電源内蔵式マイクロ流体装置の中の電源と連通して作動することができるマイクロ流体チャネルの組み合わせの例の概略図である。
【図11】電源内蔵式マイクロ流体装置の例となる型の血漿スキミングチャネルの高さプロファイルである。
【発明を実施するための形態】
【0021】
電源およびそれに関連するマイクロ流体装置、組み合わせ、方法およびシステムを本明細書に提供する。具体的には、本明細書記載の電源はチップ上にある電源であり、このマイクロ流体装置に含まれ、このマイクロ流体装置に向けて適用されるように設計される。
【0022】
いくつかの実施形態において、本明細書記載の電源は、膨張可能な反応生成物を生成する化学反応に基づき、このマイクロ流体装置を作動させる。具体的には、本開示で意味する膨張可能な反応生成物は、量を増やすことができ、この反応生成物が生成される電源の1つまたは複数の表面上で圧力を発することができる反応生成物である。膨張可能な反応生成物の例として、気体および他の膨張可能な流体が含まれる。一般的に、この電源は、制御可能な方法で化学反応を起こすことができ、制御可能な方法でこの反応生成物をこのマイクロ流体装置へ移動させることもできるように構成されるチャンバーのシステムを含む。
【0023】
いくつかの実施形態において、この電源は、この化学反応の少なくとも1種類の流体試薬を含むように構成される貯蔵チャンバー、(この反応生成物を生成する際には、この貯蔵チャンバーから緩衝液チャンバーへ、この反応生成物の生成が減少する際には、この緩衝液チャンバーからこの貯蔵チャンバーへの試薬の通過を可能にする)この貯蔵チャンバーと流体的に連結された緩衝液チャンバー、および(流体試料を含み、この貯蔵チャンバーからこの反応生成物を受け取るように構成される)試料添加チャンバーを含む。
【0024】
いくつかの実施形態において、この化学反応を、チップ上のボタンを作動することによって触媒的に引き起こす。具体的には、この作動は、試薬または触媒の、この貯蔵チャンバーの中の少なくとも1種類の試薬との接触を可能にし、この試料添加チャンバーへ運ばれる反応生成物の生成を引き起こす。
【0025】
一実施形態において、この反応生成物は、O2供与体(例えば、水性の過酸化水素)によって生成されるO2であり、次式に従って、PtまたはAgなどの触媒で活性化される。
【化1】

【0026】
図1Aは、電源(100)の断面図である。具体的には、H2O2(過酸化水素)貯蔵所(110)をピン(120)によって作動されるように構成した。本開示の一実施形態において、ピン(120)は、Pt/Agピンである。貯蔵所(110)は貯蔵チャンバー(130)に位置し、チャネル(135)を通って空の緩衝液チャンバー(140)と流体的に連通し、かつ試料(160)が位置する試料添加チャンバー(150)と流体的に連通する。一実施形態において、この試料は全血であり、下流のマイクロ流体回路(図に示さず)と流体連通(170)で位置する。蓋(180)、例えば、ポリジメチルシロキサン(PDMS)の蓋も図に示し、この蓋を通ってピン(120)が通過できるように、ピンホール(190)をマイクロ加工した。試料(160)は、生物環境、標本、培養物、組織、市販の組換えタンパク質、合成化合物またはその部分に由来する流体を含むが、それらに限定されない任意の試料を含むと考えられる。さらに、試料の例として、唾液、CSF、汗、尿、精液、生検標本、子宮頸部細胞診試料または液体成分および細胞成分を含むヒトまたは動物から得られる任意の他の試料などの体液が含まれる。
【0027】
図1Aの説明図において、酸素生成の際に貯蔵チャンバー(130)から緩衝液チャンバー(140)へ過酸化物が通過でき、過酸化物(110)をピン(120)から分離して酸素生成が止まると、緩衝液チャンバー(140)から貯蔵チャンバー(130)へ過酸化物(110)が逆流できるように、これらのチャンバーを構成した。具体的には、図1Aの構造は、緩衝液チャンバー(140)から貯蔵チャンバー(130)への過酸化物(110)の逆流を可能にし、一定レベルの酸素が貯蔵チャンバー(130)に存在する時にその逆流が起き、その結果、貯蔵チャンバー(130)から試料添加チャンバー(150)への酸素の連続流をもたらす。
【0028】
図1Bで説明される代替構造において、図1Aの電源の中で過酸化物(110)の分解によって生成されるのと同じ量の酸素と、図1Aの電源で生成される圧力に匹敵する、過酸化物(110)に適用される圧力を与えると、緩衝液チャンバー(140)から貯蔵チャンバー(130)への過酸化物(110)の逆流は、酸素の特定の一部(過酸化物(110)の分解によって生成される最高で全部の酸素を含むことができる)が試料添加チャンバーへ移動した時のみ可能になる。
【0029】
結果として、図1Aの構造において、過酸化物(110)の分解によって生成される酸素の通過は試料添加チャンバー(150)へ連続してもたらされ、図1Bの構造において、試料添加チャンバーへの酸素の通過は酸素生成のギャップを考慮して不連続的に行われ、緩衝液チャンバー(140)から貯蔵チャンバー(130)への過酸化物(110)の逆流の遅延が結果として起こる。
【0030】
所望の実験計画に従って、この貯蔵所からこの試料添加チャンバーへの過酸化物の通過の制御およびこのマイクロ流体装置の対応する作動を、この反応生成物の生成の化学的制御によって、ならびに/またはこの試料添加チャンバー、この貯蔵チャンバーおよびこの緩衝液チャンバーの構造を調節することによって行うことができ、このマイクロ流体装置の流体連通およびそれに関連する作動を可能にする。
【0031】
例えば、いくつかの実施形態において、特定の電力の発生および所定の少なくとも1種類の試薬と所定のピンの間におきる所定の化学反応が望まれる場合、チャンバーの容積、関連性のある流体連結、少なくとも1種類の試薬および電源の中のピンの表面の量および容積などの他のパラメータを調節することができ、少なくとも1種類の試薬とピンの間の反応は、所定の化学反応の実行後に所望の電力を供給する。
【0032】
他の実施形態において、所定の電力の発生に関連して、特定の容積のチャンバーおよびこれらのチャンバーの流体連結が望まれる場合、対応する反応生成物の生成が所定の電力の発生をもたらすように化学反応、化学的性質、少なくとも1種類の試薬の量および容積、化学的性質、ピンの量および表面を調整することができる。
【0033】
図1Aおよび図1Bの実施形態において、この化学反応はPt/Agピンによって触媒される過酸化物の分解であり、この反応生成物はO2である。
【0034】
それらの実施形態において、このPt/Agピンを、0.1mm〜3mmの範囲の直径および5mm〜30mmの長さを有する金属棒と取り換えることができ、PtまたはAgの、10〜100nmの厚いフィルムでコーティングされた任意の硬質金属芯から作ることができる。
【0035】
それらの実施形態において、過酸化水素濃度を、約1%〜約30%の範囲、具体的には約5%〜約10%の範囲、より具体的には6%の範囲で使用することができる。30%より高い過酸化水素濃度を、生成される酸素およびそれに関連して発生する電力の所望の量が特に高い時の適用において使用することができる。
【0036】
ピンの中の第一の試薬/触媒と貯蔵チャンバーの中の第二の試薬/触媒とを接触させることにより気体生成物をもたらす追加の反応も、本明細書記載の電源に適する。
【0037】
例えば、一実施形態において、光の存在下、次式に従って水素および酸素を生成するために、チタニア(TiO2)によって触媒される水の解離によって、反応生成物H2およびO2を生成することができる。
【化2】

【0038】
別の例となる実施形態において、次式に従って、亜鉛または鉄などの金属(Me)が塩素酸などの酸と反応することによって、反応生成物H2を生成することができる。
【化3】

【0039】
膨張可能な反応生成物の生成をもたらす多くの追加反応は本明細書記載の電源に適し、当該技術者が本開示を読むことにより特定可能である。
【0040】
この貯蔵チャンバーの中の流体によって生成される反応生成物の量を決定する手順の例を、実施例1で説明する。しかし、これらの実施形態がこれらの発明を実施するための形態に限定されることなく実施され得ることは当該技術者にとって明らかである。これらの実施形態を不必要に分かりにくくしないようにするために、当該技術者が特定可能な追加的な周知の方法および構造を詳細に記述しなかった。過酸化水素のレベルおよび濃度を変更し、反応生成物を決定づける異なるレベルの酸素を生成することが可能である。本開示の電源を作動するのに適した追加的化学反応が考えられる。
【0041】
図1Aおよび図1Bの実施形態においても、貯蔵チャンバー(130)の中の過酸化物のレベルおよびそれに関連する過酸化物(110)とピン(120)との接触は、主に緩衝液チャンバー(140)の代替構造に起因して作動中に変化する。1つまたは複数の貯蔵チャンバー(130)、試料添加チャンバー(150)、チャネル(135)、流体連通(170)および/もしくはそれに関連する流体連結に加えてまたはそれらとは別の方法で、緩衝液チャンバー(140)の構造を選択することによって同様の結果を得ることができる。本開示の概説において当該技術者に理解されるように、貯蔵チャンバー(130)の中で実行される化学反応によって発生する所望の電力を考慮して、かかる選択を行うことができる。
【0042】
本明細書の範例となる実施形態において、貯蔵チャンバー(130)から緩衝液チャンバー(140)への反応生成物の流体通過、貯蔵チャンバー(130)および試料添加チャンバー(150)からの過酸化物(110)の流体通過、ならびに試料添加チャンバー(150)から貯蔵チャンバー(130)への試料の流体通過は、これらのチャンバー間の流体連通を請け負うこれらのチャンバーおよびチャネルの特有の構造によって妨げられる。従って、これらの実施形態において、この電源によって発生する電力の制御は、この貯蔵チャンバーの中で発生する酸素の試料添加チャンバーへの選択的移動によって増加し、この装置を作動させる。具体的には、それらの実施形態において、この反応によって発生する圧力は、発生する圧力の作用において、電源の中のチャンバーの対応する構造に応じて連続的にまたは不連続的に試料チャネルに選択的に運ばれる。
【0043】
いくつかの実施形態において、この電源からこのマイクロ流体装置へのこの反応生成物の連続的または不連続的な流れを通じて、この電源の中のチャンバーを、このマイクロ流体装置が連続的または不連続的に作動できるように構成することができる。これらのチャンバーの構造およびこれらの貯蔵チャンバーの中で化学的に発生する対応する電力を選択することによって、この作動の制御を行うことができる。
【0044】
マイクロ流体チャネル内の流体(例えば試料流体)を作動する電力を必要とするいくつかのマイクロ流体装置に関連して、本明細書記載の電源を使用することができる。本開示おいて、全血から血漿を分離し、その次に、血漿バイオマーカータンパク質パネルのマルチプレックス分析を実行するように設計されたマイクロ流体に基づくプラットフォームについて言及する。このマイクロ流体装置に関連して電源構造およびそれに関連する作動を説明する例として、関連記述を提供する。技術者は、血液関連分析に関連して提供される記述を、異なる試料を用いて行われる分析および/または関連部分に適応することができる。
【0045】
図2は、図1のポンプ配置を含む血液分析チップ(200)の拡大詳細の合成上面図を示す。参照数字(240)は、図1の緩衝液チャンバー(140)の上面概略図を示す。同様に、参照数字(230)は、図1の貯蔵チャンバー(130)の上面概略図を示す。チャンバー(230)と(240)間の連結を、図1のチャネル(135)に対応するチャネル(235)を通して得る。図2の実施形態において、図2の拡大部分にさらに示されるように、チャンバー(250)は下流のマイクロ流体回路(260)に送り込まれる全血を含み、最初の血液試料から血漿を分離するように構成されるチャネルである血液スキミングチャネル(270)を含む。血液廃棄物排水口(280)および血漿排水口(290)もこの図に示す。
【0046】
図3は、図1および図2に模式的に記載されたチップ上の電源を含む自動血液分析装置を示す。
【0047】
従って、図3の自動血液分析装置において、電源は、希釈したH2O2のPt/Ag触媒分解から貯蔵チャンバー(230)の中で発生し、酸素を生成する(図1)。出発H2O2濃度に応じて、O2反応生成物は、出発液体体積に対して最高で100倍に膨張する(P.A.Giguere,B.G.Morissette,A.W.Olmos and O.Knop,Can.J.Chem.,1955,33,804−820.)。H2O2分解は自発的であるが(μG0=−119.2kJmol−1)、市販のH2O2は分解防止剤を有し、触媒トリガーに曝露されるまで安定である。おそらく、触媒表面へのH2O2の拡散によって制限される速度で、Pt触媒はH2O2の一次分解を促進する。図3に示されるように、設計されたマイクロ流体装置は、図2のチャンバー(230)および図1のチャンバー(130)に対応する過酸化水素貯蔵所(330)を含み、図2のチャネル(235)および図1のチャンバー(135)に対応する橋渡しチャネル(335)によりマイクロ流体に基づく分析の機能領域と連結する。橋(335)はこの装置の上面を横断し、それゆえに、H2O2貯蔵所(330)と試料チャンバー(350)の間の接触を回避する。この装置の上部を約2mmの厚さのPDMS蓋(380)で覆い、ピンホール(390)をこの蓋の中に作り、この装置を始動させるためにPt/Ag触媒ピンプラグを挿入する(図1のピン(120)に関して対応するピンホール(190)参照)。
【0048】
図3の装置において、この化学反応によって発生する圧力は、仲介されない場合、この装置全体の層が剥離するのに十分であり得る。この問題を回避するために、空の緩衝液チャンバー(340)が、下部のチャネルを通って過酸化物貯蔵所(330)と連結する。この反応が始動する時、発生した圧力は、この緩衝液チャンバーの中に過酸化物溶液を押し入れる。この結果は、過酸化物燃料レベルがPt/Ag触媒ピンのレベル以下に低下すると、O2生成を止め、この装置の加圧を防ぐというものである。その後、この気体がマイクロ流体チャネルを通って流体を追いやるにつれて、過酸化物チャンバー内の圧力は減少する。これは、過酸化物がPt/Agピンと再び接触するようにこの反応チャンバーの中の過酸化物溶液のレベルを上昇させる。この分析のために、信頼でき順調に作動する電源を発生させるようにこれら2つの作用のバランスをとることを、過酸化物溶液の量、過酸化物濃度、およびピン/プラグのサイズを制御することによって達成する。PDMSは気体を透過させるが、PDMSを通る気体の移送はO2生成の速度に匹敵しない。
【0049】
図3の特定の電源内蔵式の、内蔵型マイクロ流体に基づく装置を、全血から血漿を分離し、その後、血漿バイオマーカータンパク質パネルのマルチプレックス分析を実行するように設計する。N.L.Anderson and N.G.Anderson,Molecular & Cellular Proteomics,2002,1,845,867.L.A.Liotta,M.Ferrari and E.Petricoin,Nature,2003,425,905.R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin,H.Ahmad,G.A.Kwong,C−C.Liu,J.Gould,L.Hood and J.R.Heath,Nat Biotech,2008,26,1373−1378に記載される分析などのこの電源内蔵式装置を用いて、血液に基づくいくつかの分析を行うことができる。トリプル4重極質量分析器と連結するレーザー脱離(例えば、MALDI)イオン源を含む質量分析定量技術によって、タンパク質を解析してもよい。タンパク質サンドイッチ法によりタンパク質を解析してもよく、または他の方法(T.G.Henares,F.Mizutani and H.Hisamoto,Analytica Chimica Acta,2008,611,17−30.J.H.Cho,S.M.Han,E.H.Paek,I.H.Cho and S.H.Paek,Anal.Chem.,2006,78,793−800)のうちで、酵素結合免疫吸着分析(ELISA)(E.Engvall and P.Perlmann,Immunochemistry,1971,8,871−874)はタンパク質バイオマーカーレベルを測定するために広く用いられている。
【0050】
他の実施形態において、このマイクロ流体装置のチャネル構造を、血液もしくは他の流体試料および/または試料以外の流体における他の分析を可能にするように改良することができる。最適なマイクロ流体装置の特定のチャネル構造を作動するのに必要とされる電力は、膨張可能な反応生成物の生成のために用いられる特定の試薬に関連して構成される適切な電源で供給され得る。
【0051】
いくつかの実施形態において、この電源は、同じ試薬または別の試薬で詰め替え可能である。具体的には、これらの実施形態のうちのいくつかにおいて、同じまたは異なる電力を、特異的な電源構造を考慮して、この貯蔵チャンバーに含まれる試薬の種類および量ならびに反応生成物の対応する生成を制御することによって供給することができる。
【0052】
いくつかの実施形態において、この電源内蔵式マイクロ流体装置に関連して、交換可能な電源を供給することができる。それらの実施形態において、この電源を、貯蔵チャンバーの中の試薬が枯渇した時に交換することができる。
【0053】
いくつかの実施形態において、この電源、同じもしくは異なる量の1つまたは複数の試薬、同じもしくは異なるサイズの1つまたは複数のピン、ならびに/またはこの電源を留めるのに適したマイクロ流体装置をシステムの中に提供することができ、このシステムは部品のキットの形態をとることができる。
【実施例】
【0054】
本明細書記載の電源、装置、方法およびシステムを以下の実施例においてさらに説明し、この実施例を説明の目的で提供し、制限するものとは意図しない。
【0055】
以下の実施例は、チップ上のマイクロ流体装置の電源を説明し、この電源は、全血から血漿を分離し、その後、血漿タンパク質パネルのマルチプレックス分析を実行するように設計されたマイクロ流体に基づくプラットフォームを駆動するように指示する。この電源は、電源内蔵式および内蔵型マイクロ装置上のボタンを押すことによって、触媒作用で引き起こされる化学反応に基づく。
【0056】
全血からの血漿のチップ上での分離、続いて、血液タンパク質バイオマーカーのマルチプレックス分析のために設計された、対応する(外部から電力が供給される)統合された血液バーコードチップ(IBBC)を、出願者らは以前に開発した(米国特許公開第20090053732号)(R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin,H.Ahmad,G.A.Kwong,C−C.Liu,J.Gould,L.Hood and J.R.Heath,Nat Biotech,2008,26,1373−1378も参照)。この分析は迅速に完了した。それらの分析において、(フィンガープリックによって得られる)血液試料から決定的なステップの完了までの時間は、10分未満であった(S.Yang,A.Undar and J.D.Zahn,Lab on a Chip,2006,6,871−880)。Zweifach−Fung効果を用いて、血漿スキミングチャネルの中で、血漿を全血から分離した(K.Svanes and B.W.Zweifach, Microvascular Research,1968,1,210−220.Y.C.Fung,Microvasc.Res.,1973,5,34−38)。血漿スキミングチャネルのガラスの底部表面をssDNAバーコードで事前にパターン形成する。これらのバーコードを、DNAをコードする抗体ライブラリー(DEAL)を用いて抗体バーコードに変換する(米国特許公開第20090036324号参照)(R.C.Bailey,G.A.Kwong,C.G.Radu,O.N. Witte and J.R.Heath,Journal of the American Chemical Society,2007,129,1959−1967)。
【0057】
血漿タンパク質バイオマーカーを、特異的な抗体−抗原結合を用いて個々のバーコードの縞上で捕捉する;バーコード内の各縞は、1種類のタンパク質についての分析を表す;完全なバーコードは、この場合、12種類のタンパク質バイオマーカーパネルについての完全分析を表す。ビオチン化抗体、続いて蛍光標識ストレプトアビジンを流すことによって、サンドイッチ分析を完了する。
[実施例1]
【0058】
電源は貯蔵チャンバーの中で発生する圧力を制御する。
図3で説明する装置を作動し、貯蔵チャンバーの中で圧力を発生させた。過酸化物装置内で発生するチャンバーの圧力を、圧電式マイクロ圧力変換器によって測定した。
【0059】
図3の装置において、圧力を、自動化IBBC燃料貯蔵所の中のH2O2濃度によって制御し、保護チャンバーによって調節した。このチャンバーは、反応生成物に由来する圧力上昇からこの装置を保護する役割を果たす。図3の装置において、緩衝液チャンバー内で発生する圧力を、圧電式マイクロ圧力変換器(Endevco8507C−15)を用いて監視し、これは約0.01KPaの正確さで圧力変化を監視する。この実施例において、Ptピンサイズは直径0.64mmであったが、他のピンサイズを用いてもよい。例えば、このピンサイズは、0.1〜1.1mmの範囲、0.2〜0.9mmの範囲、0.5〜0.8mmの範囲であり得る。一実施形態において、用いたピンサイズは0.6〜0.7mmの範囲であった。圧力対時間のプロットを作成した。
【0060】
図4で説明する結果は、6%過酸化物溶液について、1分以内の作動で圧力は3KPa上昇し、15kPaで安定し、5時間を越える連続作動を可能にしたことを示す(図4黒い曲線)。最適な圧力およびピンサイズならびに保護チャンバーの設計は、全血からの血漿の自動分離、それに続く、血液タンパク質の迅速分析を可能にした。
[実施例2]
【0061】
電源内蔵式マイクロ流体装置の製造
本開示に従って、電源内蔵式IBBC装置の例を、標準的マイクロ流体装置のプロトコルを用いて作った。SPR−220−7フォトレジストを用いて、最初に、設計した流動層のフォトマスクパターン(図2)を、シリコンウエハー上で陽電極構造に変えた。
【0062】
その後、このマイクロ流体チップの約8mmの10:1PDMS(10:1 GE RTV 615 A&B)流動層を形成するための型としてこの構造を使用した。本明細書で説明する実験に用いた装置の例の中にある血漿スキミングチャネルの寸法を説明する図9の局所分布画像に示すように、この流動層チャネルの厚さを平均約11μmに保った。血液分離を助ける目的で、意図的にチャネルを丸くした(図9)。
【0063】
変わりに、制御層のチャネルの厚さを約20μmに保った。PDMSの型に穴をあけ(図2の丸)、ssDNAバーコードで事前にパターンを形成したガラススライドと接着させた(R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin, H.Ahmad,G.A.Kwong,C−C.Liu,J.Gould,L.Hood and J. R.Heath,Nat Biotech,2008,26,1373−1378)。
【0064】
具体的に、事前にパターンを形成するのに利用したバーコード読み取り計画は、R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin,H.Ahmad,G.A.Kwong,C−C.Liu,J.Gould,L.Hood and J.R.Heath,Nat Biotech,2008,26,1373−1378および米国特許公開第2009−0036324号に記載の計画と同じであり、これらの各々は参照によりその全体は本明細書に組込まれる。この読み取り計画を図8に示す。
【0065】
最初に、マイクロ流体に導かれる流動式パターン形成の技術を用いて、ポリリシンガラススライド上に1組のssDNAオリゴマーのパターンを形成した(図8A)(R.Fan,O.Vermesh,A.Srivastava,B.K.H.Yen,L.Qin,H.Ahmad,G.A.Kwong,C−C Liu,J.Gould,L.Hood and J.R.Heath,Nat Biotech,2008,26,1373−1378)。これはバーコードを形成し、各バーコードの縞は特有のssDNAオリゴマーを含んだ。
【0066】
その後、自動化IBBCチップを組み立てた。過酸化物貯蔵所と試料注入チャンバーの間の橋渡し連結を含む上部のPDMS層を流動層と整列させて結合し、最終装置を形成した(図3)。マイクロポンプ、試料注入、血漿スキミング構成要素、およびタンパク質分析の領域を、小型パッケージに全て統合した(図3)。その後、得られたチップのプライミングの準備をした。
【0067】
一般に、本明細書が例示したように製造したチップを分析のためにプライミングすることができ、その後、4℃で1週間保存して使用するか、またはプライミングを行わないで保存した。プライミングステップについては、図8Bに模式的に説明した方法を用いるssDNA標識1次抗体を用いて、このssDNAバーコードを最初に抗体バーコードに変換することができる。
【0068】
この方法に従って、相補的ssDNAオリゴマーと結合した1次(10)抗体(図8B)は血漿スキミングチャネルを通って流れ、これが、DNAハイブリダイゼーションによりssDNAバーコードを抗体バーコードに変換した。この分析ステップにおいて、血漿試料のタンパク質バイオマーカーは、存在する場合、抗体バーコードと結合した。読み出しステップにおいて、関連する全てのビオチン化2次抗体は血漿チャネルを通って流れ、その後、ストレプトアビジン−Cy5蛍光標識を加えて、分析試料を現像した(図8B)。
【0069】
以下の実施例で用いる装置を製造するために、50μLの1%BSA/PBS溶液を通常の注射器を用いて各試料注入チャンバーに加え、この溶液をマイクロ流体領域に少し押し通した。混合した1次抗体を、ガラス基質上のオリゴマーと相補的なssDNAオリゴマーと結合させ(図8B)、その後、装置に添加して洗浄した。その後、燃料貯蔵所を0.1mlの6%H2O2で満たし、Ptピンを上部のピンホールに取り付けたが、H2O2燃料とは接触させなかった。保存の時、チップは安定である。
【0070】
この実施例のチップのパターン形成およびプライミングに使用した試薬を表1にまとめた。
【表1】


【0071】
得られたマイクロ流体装置を2つの別々の分析用に設計し(一方は新鮮な血液を用いて開始され、他方は新鮮な刺激した血液を用いて開始され、対照としての役割を果たした)、実施例3〜5に例示した手順に従って作動させた。
[実施例3]
【0072】
電源内蔵式マイクロ流体装置の作動
実施例2に例示した手順で製造した装置を作動して、様々な分析を行った。
【0073】
典型的な分析において、フィンガープリックでヒト血液(約2μL)を採取し、注射器により試料貯蔵所へ加え、20μLの事前に添加したEDTA/BSA/PBSで拡散することにより混合した。カリフォルニア工科大学の施設内審査委員会によって承認されたプロトコルに従って手順を行った。2つの(非触媒)ピンを用いて血液注入口を塞いだ。
【0074】
この分析を、Ptピンを押し入れて過酸化物貯蔵所と接触させることにより始動させた。数秒以内にこの装置の中で圧力が蓄積し、血液スキミングチャネルを通って血液を流れさせる(データ示さず)。血漿(>99%無細胞)をすくい取って分析チャネルに入れた(図2)。操作の設定時間後、このPtピンを上げることにより、流れを止めた。原理上は、(蛍光標識2次抗体を用いて)分析試料の現像を同様に自動化してもよい。しかし、この実施例については、PDMS層をガラススライドから容易にはがし、その後、現像およびバーコード読み出しステップをガラススライド上で行った。現像ステップは、ビオチン化2次抗体およびストレプトアビジン−Cy5を含む単一溶液の付加を含む。標準遺伝子チップスキャナー(Axon Genepix 4000B)を用いて、現像したバーコード分析試料を読み込み、検出されたタンパク質はバーコード内の蛍光の帯として現れる(実施例4および5参照)。完全に現像したバーコード分析試料を、読み出しに影響を与えることなく、数日間保存してもよい。
[実施例4]
【0075】
電源内蔵式マイクル流体装置を用いて行った標的の定量的検出
米国特許出願公開第2009−0036324号および同第2009−0053732号(これらは参照によりその全体が本明細書に組込まれる)に記載されるように、図8Aで説明したマイクロ流体チャネル配置を含む、電力供給がチップ上で行われないIBBCを、ヒト血漿におけるタンパク質の定量的検出に以前に利用した。
【0076】
ヒトの全血から、これらの自動化IBBCについて、および代表的タンパク質:インターロイキン−12(IL−12)についての検出限界を測定した。
【0077】
エッペンドルフ試験管の中で、健常なヒト提供者の新鮮な血液を用いて、様々な濃度のIL−12で血液を刺激し、その後、実施例2および3に記載したように製造および作動した自動化IBBCを用いて、IL−12について分析した。
【0078】
具体的には、BD Microtainer Contact−Activated Lancets(紫色のランセット−低用量、血液1滴)を用いて、フィンガープリックを行った。以下で論じるように、25mMのEDTA溶液を事前に満たしたSAFE−T−FILL毛細血管採取管(RAM Scientific)を用いて血液を採取した。全血の1滴から2つの試料を準備した。
【0079】
(i)刺激していない血液試料:80μLの25mM EDTA溶液で血液採取管を事前に満たし、その後、10μLの新鮮なヒト血液をEDTA被膜キャピラリーに採取し、この試験管に分注し、数回反転させることにより素早く混合した。
【0080】
(ii)刺激した血液試料:40μLの25mM EDTA溶液で血液採取管を事前に満たした。全てのタンパク質標準物質を含む40μLの組換えタンパク質溶液を加えた。その後、2μLの0.5M EDTAを加え、EDTAの総濃度を最高で25mMにした。最終的に、EDTA被膜キャピラリーに10μLの新鮮なヒト血液を採取し、試験管に加え、数回反転させることにより素早く混合した。全てのタンパク質標準物質の最終濃度は約10nMであった。しかし、これらの「標準物質」の質および捕捉抗体の親和性は実質的に変化する。タンパク質標準物質の中で刺激する目的は、高濃度のタンパク質におけるシグナルを、採取したままの新鮮な全血のシグナルと唯一対比させることであった。
【0081】
使用する前に、30〜60分間、このマイクロ流体装置の全てのマイクロ流体チャネルを分析緩衝溶液(98%純度の牛血清アルブミン画分V(Sigma)を150mMの1×PBS(カルシウム/マグネシウム塩なし)(Irvine Scientific)に加えることによって調製した1%重量/体積のBSA/PBS溶液)で塞いだ。
【0082】
全てのDNA−抗体複合体を含む溶液を、約30〜45分間、血液分離/タンパク質分析(BS/PA)の分析チャネルを通って流し、DNAバーコードマイクロアレイを抗体マイクロアレイに変換し、次の表面結合免疫測定法を可能にした。非結合複合体を、10分間、分析緩衝溶液を流すことによって除去した。1%BSA/PBSの中で全ての合成複合体を混合することによりDEAL−共役溶液を調製し、最終濃度は5μg/mlであった。直交性について、DNAコードオリゴマーを事前に試験し、非相補性オリゴマー鎖間の交差ハイブリダイゼーションが、相補的な対のシグナル強度の5%を超えない蛍光強度を生じることを確かめた。
【0083】
血液試料を採取1分以内にBS/PAチップに流し入れた。チップ内で血液細胞から血漿を素早く分離し、DEALバーコードアレイを含む下流の分析区域で所望のタンパク質を捕捉した。全てのステップを手動で行ったが、フィンガープリックから血漿タンパク質捕捉の完了までの全工程は非常に迅速であった(<10分)。自動化工程は、<5分で全工程を迅速に処理することができた。短時間の規模のこの分析は、マイクロ流体の流れ環境において、拡散障壁を減少させるのに大いに起因する。従来の免疫測定法は1〜2時間以上かかり、最初に、血液細胞を遠心分離する必要がある。
【0084】
約30分間、ビオチン標識検出抗体の混合物をマイクロ流体装置に流し入れ、DEAL分析を完了した。検出抗体溶液は、1%BSA/PBSで調製した約5μMの濃度でビオチン化検出抗体を含んだ。その後、BS/PAチップの中の非結合検出抗体を、約10分間、分析緩衝液を流すことによって除去した。
【0085】
Cy5蛍光染料標識ストレプトアビジンおよび参考のCy3標識相補ssDNA(DNAコードM/M’)を混合し、その後、30分間、BS/PAチップに流し入れた。最後に、分析緩衝液を10分間流し、非結合ストレプトアビジン−Cy5を除去した。
【0086】
DNAでパターン形成したガラススライドから、PDMS血液チップ装置を除去した。このスライドを、以下の溶液に各6回ずつ即座に浸した:順に、1%BSA/PBS溶液、1×PBS溶液、1/2×PBS溶液、脱イオン化ミリポアH2O。ミリポアH2Oを流しながら、数秒間、このスライドを軽くすすぎ、その後、窒素ガンを用いて乾燥させた。
【0087】
このスライドをAxon Instruments Genepix Scannerで走査した。最も質の高い解像度(5μm)を選択した。2色のチャネル(緑はCy3チャネルおよび赤はCy5チャネル)のスイッチを入れ、蛍光シグナルを集めた。
【0088】
各濃度について、IL−12の読み出し位置に対応する10個の異なるバーコードの帯の像を取得し、デジタル化し、Image J(www page rsbweb.nih.gov/ij参照)によって平均化した。
【0089】
図5で説明される結果は、約0.4PMの検出限界で、IL−12が強度対濃度の一貫性のある傾向を見せたことを示した。これは、15pg/ml(0.3PM)のメーカーが引用するELISA検出感度に匹敵する(eBioscience(登録商標))。このデータは、自動化IBBCが臨床的に意義のある濃度範囲内の血液タンパク質について分析することができることを示す(L.Romani,P.Puccetti and F.Bistoni,Clin.Microbiol.Rev.,1997,10,611−636)。
[実施例6]
【0090】
電源内蔵式マイクロ流体装置を用いて行ったマルチプレックス標的検出
マルチプレックスな、タンパク質分析の実演として、12種類のサイトカインバイオマーカーパネルを用いて、同じ健常志願者の血液を分析した。
【0091】
一方のフィンガープリックの血液(一般的に、約500マイクログラム以下)をこのマイクロ流体装置に直接添加し、他方のフィンガープリックの血液(一般的に、約500マイクログラム以下)をエッペンドルフ試験管に加え、図6にまとめた12種類のタンパク質を用いて、約300pg/mlの濃度で刺激した(N.L.Anderson and N.G.Anderson,Molecular&Cellular Proteomics,2002,1,845−867)。各バーコード内の1つの帯を、任意のssDNA標識1次(10)抗体複合体と相補的ではないssDNAオリゴマーで機能的にし、整列マーカーおよび陰性対照として役割を果たさせた(B.Schweitzer,S.Roberts,B.Grimwade,W.P.Shao,M.J.Wang,Q.Fu,Q.P.Shu,I.Laroche,Z.M.Zhou,V.T.Tchernev,J.Christiansen,M.Velleca and S.F.Kingsmore,Nature Biotechnology,2002,20,359−36V.W.W.Lin and M.Karin,Journal of Clinical Investigation,2007,117,1175−1183.M.Zimmermann,E.Delamarche,M.Wolf and P.Hunziker,Biomedical Microdevices,2005,7,99−110)。同じチップ上で、刺激していない血液試料と刺激した血液試料の両方を同時に分析し、同時に読み取った。
【0092】
結果を図6で説明し、調べた12種類のタンパク質およびそれらに対応するバーコードの位置をこの図の右下部分にまとめる。具体的には、図6の解析の刺激したヒト血液試料は112のタンパク質の帯および(ブランク)対照(帯番号11)を示す。しかし、刺激していない血液試料については、バックグラウンド比3.5のシグナル(標準偏差=0.6)と共にIL−10のみ検出され(図6Bおよび図6Dも参照)、結果は以前の研究(参考文献)に基づいて期待されたものであった(J.Karcher,C.Reisser,V.Daniel and C.Herold−Mende,Hno,1999,47,879−884.M.Kupczyk,I.Kupryae−Lipinska,M.Bocheuska−Marciniak,P.Gorski and P.Kuna,Allergy,2007,62,248−248.M.Navarrete,A.Palacios,M.J.Cruz,A.Blanco,I.Caragol and A.Lopez,Blood,2006,108,227B−227B)。
[実施例7]
【0093】
電源内蔵式マイクロ流体装置の流速
十分に高い血漿流速の条件下で行った分析は、抗体/タンパク質結合動態に制限され、それゆえに、特に効率的である(M.Zimmermann,E.Delamarche,M.Wolf and P.Hunziker,Biomedical Microdevices,2005,7,99−110)。したがって、完全な視覚化には約1〜2時間を必要とし得るが、これらの分析は、このチップ上への血液の添加から5〜10分内で完了することができた。
【0094】
自動血液分析の電源内蔵式マイクロ流体装置を用いて、出願者らはこの動態を研究した。いくつかの流速を用いて、どうにかして、1分析あたりに必要とされる最短時間を同定した。
【0095】
この目的のために、異なるチャネル幅(図7上部)を有し、それ故に、他の同一分析内に異なる流速を有する6つの血漿スキミングチャネルを、単一フィンガープリック測定装置内に設計した。
【0096】
具体的には、異なるチャネル幅を有する測定装置において、図10の概略図で例として説明するように、最初の幅の広い単一血漿チャネルと比較して、6種類の異なる幅のサブチャネルを延長する。この延長は、6つのサブチャネル間の流れ抵抗の違いを増加させる。チャネルの高さプロファイルも測定し、6つのサブチャネルの寸法を明らかにする。
【0097】
図10の図解において、変流速実験における6つのサブチャネルの血漿チャネルの長さを、図9の図解の最初の単一血漿チャネル(実施例4参照)と比較して示す。この長さを5mm〜7.5mmに延長する。
【0098】
サブチャネルの寸法を高さプロファイル走査によって特徴づけ、図11は装置型の血漿スキミングチャネルの高さプロファイルを示す。
【0099】
幅の変動に加えて、最も狭いものから最も広いもの(約1×、2×、6×、8×、10×、および15×)までの、(フォトレジストの現像中に生じた)装置加工ステップに起因するわずかな高さ変動がある。これらのチャネルも加工中に丸くした。この装置を設計する時、出願者らはダーシーの法則を用いて流速変動を計算し、この装置は1×、2×、6×、8×、10×、および15×の流速変動を与える。実際の流速は、チャネルの物質、粗さ、および他の因子に関連する。出願者らは、チャネル寸法が流速を制御していることをはっきり示すことができた(データ示さず)。
【0100】
サブチャネルを延長し、チャネル間の流れの速さの違いを理解した−血漿分離工程を変化させない設計改良(D.J.Beebe,G.A.Mensing and G.M.Walker,Annual Review of Biomedical Engineering,2002,4,261−286)。2分間流した後、6つ個々のチャネルの中で記録されたタンパク質レベルは異なった:最も広い(最も速い流速)チャネルは、予想したとおり高いシグナルレベルを示した(O.Hofmann,G.Voirin,P.Niedermann and A.Manz,Anal.Chem.,2002,74,V243−5250.V.G.Levich,Physiochemical Hydrodynamics,Prentice Hall,Englewood Cliffs,NJ,1962)。しかし、5分間流した場合、全てのスキミングチャネルの測定シグナルは飽和状態で、同一シグナルレベルを生じた(図7Cおよび図7E)。マイクロ流体チャネルの中の検体の流れは、チャネル壁近くは流れが低く、チャネル中心においては流れが高いという放物線の流れプロファイルを有する(M.Zimmermann,E.Delamarche,M.Wolf and P.Hunziker,Biomedical Microdevices,2005,7,99−110)。不飽和分析(図7D)については、流速のこの変動は、放物線型シグナルをもたらし、チャネルの中心に対応したバーコードの領域でピークに達する。飽和分析については、この効果はなくなった。この研究は、フィンガープリックから臨床分析ステップの完了までの時間を、強度を損失することなく、5分に減少することができることを示唆する。この分析は再現可能であり、20回繰り返した。検出の感度および精度は、自動化によってではなく、バーコードのパターン形成(M.Navarrete,A.Palacios,M.J.Cruz,A.Blanco,I.Caragol and A.Lopez,Blood,2006,108,227B−227B)、または試験される抗体によってのみ制限された。
【0101】
高速測定の分析を最適化する方法は、参考文献のM.Zimmermann,E.Delamarche,M.Wolf and P.Hunziker,Biomedical Microdevices,2005,7,99−110で広範に議論された。
【0102】
マイクロチャネルに導かれる流れのパターン形成を用いて、高密度でssDNAバーコードのパターンを形成し、この少量から多くのタンパク質バイオマーカーパネルを測定した。出願者らは、ポリアミン被膜ガラススライド上に熱結合させたPDMS型を用いて、ssDNAバーコード全体のパターンを形成した。ポリアミノ化表面は、従来のアミノ化表面より実質的に高いDNA添加を可能にし、付随する分析感度の増加をもたらす。各々が特異的ssDNAオリゴマーを含む異なる溶液は、異なるチャネルを通って流れ、ガス透過可能なPDMSスタンプを通って蒸発し、DNA分子の個々の縞をもたらした。縞の1つの完全集合は1つのバーコードを表す。全ての測定は、40μmピッチで間隔をあけた20μmの幅の帯を使用した。この配列密度は、(典型的な寸法が、400μmピッチの150μm直径スポットである)標準の点状アレイをこえて約10倍増加し、したがって、少量で測定することができるタンパク質の数を大きくする。バーコードアレイと血漿チャネル間の整列化は必要としなかった。ガン患者の血清実験において、受け取ったままの血清試料を、いかなる事前処理をすることなく(すなわち、精製も希釈もせず)、IBBCに流し入れた。その後、タンパク質パネル全体に対するビオチン標識検出抗体の混合物および蛍光Cy5−ストレプトアビジン複合体を連続してIBBCに流し入れ、DEAL免疫測定法を完了した。緩衝溶液を10分間流すことにより、非結合蛍光プローブを洗い流した。最後に、PDMSチップをガラススライドから除去した。このスライドを1/2PBS溶液および脱イオン水で即座にすすぎ、その後、窒素ガンで乾燥させた。最終的に、DEALバーコードスライドをマイクロアレイスキャナーによって走査した。全てのタンパク質分析は1色蛍光色素分子を用い、異なる色で蛍光を発した参考マーカーを用いて空間的に同定した。
【0103】
迅速分析の計画は、大量輸送の制限を防ぐために高い流量速度を有すること、検体利用を増加させるために小さい捕捉領域を有することである。マイクロ流体チャネルの中の検体の流れは、放物線の流れプロファイルを有し、これは結果に影響を与えることができる。比較的低流速に対しては、図7Dの分析はこれらの速度プロファイルに反映するが、飽和分析に対しては、効果はない。さらに、放物線の流れプロファイルは、チャネル壁近くの血液細胞の遅い流れもおそらく説明する。
【0104】
上で説明したこれらの実験結果は、全血からの迅速血液タンパク質分析などの様々な分析に適する自動の電源内蔵式マイクロ流体装置の設計を例示する。これらの実施例の特定の方法において、H2O2を用いて、装置上に統合される装置に電力を供給した。ピンによって作動する単純な押しボタン式操作を用いて、出願者らは血液に基づく12種類のタンパク質バイオマーカーを調べた。この単純な「プラットフォーム」は、いくつかの実施形態において、少なくともハイスループットで、精密な、マルチプレックス血液診断測定を可能にすることが期待される。
【0105】
要約すれば、本開示の実施形態は、マイクロ流体装置の作動のための電源、ならびにそれに関連する装置、方法およびシステムに関する。
【0106】
当該技術者に、本開示の電源、装置、システムおよび方法の実施形態の作り方および使い方の完全開示ならびに説明書を与えるために、上で説明した実施例を提供するが、発明者らが彼らの開示とみなすものの範囲に制限されるようには意図しない。当該技術者に明らかである本開示を実行するための上記の方法の改良は、以下の特許請求の範囲内にあると意図される。明細書で述べた全ての特許および公表文献は、本開示が関係する当該技術分野の技術者の技能のレベルを示す。本開示に引用した全ての参考文献は、各参考文献が参照によりその全体が個々に組込まれたように、参照により同じ範囲に組込まれる。
【0107】
背景技術、発明の概要、発明を実施するための形態、および実施例において引用した(特許、特許出願、学術論文、要約書、実験室のマニュアル、本、または他の開示を含む)各書類の開示全体は、参照により本明細書に組込まれる。さらに、本明細書と共に提出された配列表のハードコピーおよび対応するコンピュータ−が読み取り可能な用紙は、本開示の一部を形成し、共に参照によりそれらの全体が本明細書に組込まれる。
【0108】
本開示は、もちろん変化することができる特定の組成物または生物系に限定されないことが理解されるべきである。本明細書で使用される専門用語は、特定の実施形態のみを記載する目的で使用され、制限するようには意図されないことも理解されるべきである。本明細書および添付の特許請求の範囲で使用されるように、単数形「1つ(a)」「1つ(an)」および「1つ(the)」は、その内容が特にはっきりと指示されない限り、複数の参照対象を含む。「多数」という用語は、その内容が特にはっきりと指示されない限り、2つ以上の参照対象を含む。はっきりと定義されない限り、本明細書で使用される全ての技術用語および科学用語は、本開示が関係する当該技術分野の技術者が一般に理解するのと同じ意味を有する。
【0109】
本明細書に記載の方法および物質と同じまたは同等の任意の方法および物質を、本開示の生成物、方法およびシステムの試験を実施するのに用いることができるが、適切な物質および方法の例を、ガイダンスの目的で本明細書に記載する。
【0110】
本開示の多数の実施形態を記載した。それにもかかわらず、本開示の趣旨および範囲から逸脱することなく、様々な改良が行われ得ることが理解される。したがって、他の実施形態は以下の特許請求の範囲内にある。
【特許請求の範囲】
【請求項1】
以下を含むマイクロ流体装置のための電源:
緩衝液チャンバーと、
第一の流体チャンバーと、
前記マイクロ流体装置に位置する前記第一の流体チャンバーと接触するピンと、および、
前記マイクロ流体装置に位置する第二の流体チャンバーへの流体通路と、
を含み、
前記ピンは前記第一の流体チャンバーの第一の流体から反応生成物を化学的に生成し、前記第二の流体チャンバーの第二の流体を作動させるように適合される。
【請求項2】
前記ピンが、前記第一の流体チャンバーの前記第一の流体の解離を経て前記反応生成物を生成するための触媒を含む、請求項1に記載の電源。
【請求項3】
前記第一の流体チャンバーの前記第一の流体が過酸化水素であり、前記反応生成物が酸素である、請求項1または2に記載の電源。
【請求項4】
前記触媒がPtまたはAgである、請求項3に記載の電源。
【請求項5】
前記第二の流体チャンバーの前記第二の流体が血液である、請求項1〜3のいずれか1項に記載の電源。
【請求項6】
前記ピンが0.6〜0.8mmの範囲で測定される、請求項1〜3のいずれか1項に記載の電源。
【請求項7】
前記第一の流体の化学成分が制御可能であり、前記第一の流体チャンバーから前記第二の流体チャンバーに通過する前記反応生成物の量を制御し、前記第二の流体の作動を制御する、請求項1〜6のいずれか1項に記載の電源。
【請求項8】
前記ピン、前記緩衝液チャンバーおよび前記第一の流体チャンバーが、前記第二の流体の連続作動を可能にするように構成される、請求項1〜7のいずれか1項に記載の電源。
【請求項9】
以下を含むマイクロ流体装置のための圧力を化学的に発生するポンプシステム:
前記マイクロ流体装置に位置し、貯蔵流体を含む貯蔵チャンバーと、
前記マイクロ流体装置に位置するピン(前記ピンは前記貯蔵流体を作動し、前記貯蔵チャンバーの中で膨張可能な反応生成物を化学的に生成するように適合される)と、
前記マイクロ流体装置に位置し、前記貯蔵チャンバーと流体的に連結され、前記貯蔵チャンバーと前記緩衝液チャンバーの間の前記貯蔵流体の通過を可能にし、前記貯蔵チャンバーから前記緩衝液チャンバーへの前記膨張可能な反応生成物の通過を妨げる緩衝液チャンバーと、および、
前記マイクロ流体装置に位置し、前記貯蔵チャンバーと流体的に連結され、前記貯蔵チャンバーから前記試料添加チャンバーへの前記膨張可能な反応生成物の通過を可能にし、前記試料添加チャンバーから前記貯蔵チャンバーへの試料の通過を妨げる試料添加チャンバーと、
を含む。
【請求項10】
前記貯蔵流体が液体であり、前記膨張可能な反応生成物が気体である、請求項9に記載のポンプシステム。
【請求項11】
前記液体が過酸化水素であり、前記反応生成物が酸素であり、前記ピンが前記過酸化物の解離を経て前記酸素を生成するように適合された触媒を含む、請求項10に記載のポンプシステム。
【請求項12】
前記触媒がPtである、請求項11に記載のポンプシステム。
【請求項13】
前記貯蔵チャンバーおよび前記緩衝液チャンバーが、前記貯蔵流体および前記試料添加チャンバーの上に位置する橋渡しチャネルを介して連結される、請求項9〜12のいずれか1項に記載のポンプシステム。
【請求項14】
前記貯蔵チャンバーおよび前記緩衝液チャンバーが、前記液体貯蔵のレベルが以下の間を動くことができるように構成される、請求項9〜13のいずれか1項に記載のポンプシステム:
i)前記液体の一部が前記緩衝液チャンバーへ移動する間、前記膨張可能な反応生成物をさらに化学的に生成するための、前記ピンの底部より上の第一のレベル、ならびに、
ii)前記貯蔵チャンバーから前記試料チャンバーへの前記反応生成物の通過の際に、前記緩衝液チャンバーから前記貯蔵チャンバーへ前記液体の移動をさらに逆にし、前記第二のレベルを前記第一のレベルへ上げ、それゆえに、圧力電源を形成するための、前記ピンの底部より下の第二のレベル。
【請求項15】
請求項1〜8のいずれか1項に記載の電源を含むマイクロ流体装置。
【請求項16】
自動血液分析配置をさらに含む、請求項15に記載のマイクロ流体装置。
【請求項17】
請求項9〜14のいずれか1項に記載のポンプシステムを含むマイクロ流体装置。
【請求項18】
自動血液分析配置をさらに含む、請求項17に記載のマイクロ流体装置。
【請求項19】
以下を含むマイクロ流体装置のための圧力発生法:
液体を第一のマイクロ流体チャンバーに準備するステップと、
前記液体の触媒分解を行い、前記分解を経て圧力を発生させるステップと、
前記第一のマイクロ流体チャンバーと連結される第二のマイクロ流体チャンバーを準備するステップと、
を含み、
前記発生した圧力の結果として前記第一のマイクロ流体チャンバーから前記第二のマイクロ流体チャンバーへの前記液体の移動を可能にし、前記発生した圧力が減少する時、前記第二のマイクロ流体チャンバーから前記第一のマイクロ流体チャンバーへ前記液体の移動を逆にすることを可能にし、前記触媒分解は前記第一のマイクロ流体チャンバー内の前記液体のレベルによって決まり、前記第一のマイクロ流体チャンバーから前記第二のマイクロ流体チャンバーへの前記液体の移動に起因する前記液体のレベルの減少が前記触媒分解を防ぎ、前記第二のマイクロ流体チャンバーから前記第一のマイクロ流体チャンバーへの前記液体の移動に起因する前記第一のマイクロ流体チャンバー内の前記液体のレベルの増加が前記触媒分解を促進する。
【請求項20】
前記液体が過酸化水素水または塩素酸である、請求項19に記載の方法。
【請求項21】
前記第一のマイクロ流体チャンバーおよび前記第二のマイクロ流体チャンバーが前記マイクロ流体装置の上に位置する、請求項19または20に記載の方法。
【請求項22】
前記マイクロ流体装置がマイクロ流体血液分離装置である、請求項19〜21のいずれか1項に記載の方法。
【請求項23】
前記触媒分解によって発生する前記圧力が、前記血液を前記血液分離装置に送り込む、請求項22に記載の方法。
【請求項24】
送り込まれる前記血液が、前記第二のマイクロ流体チャンバーと前記血液分離装置の間に連結される第三のマイクロ流体チャンバーに位置する、請求項23に記載の方法。
【請求項25】
前記血液分離装置が全血から血漿を分離し、血液タンパク質バイオマーカーのマルチプレックス分析と連結する、請求項23または24に記載の方法。
【請求項26】
以下を含む電源内蔵式マイクロ流体装置:
1つまたは複数の試薬が流れるように構成されるマイクロ流体チャネルの配置と、および、
前記マイクロ流体チャネルを通って前記試薬を送り込む圧力源と、
を含み、
前記圧力源は以下を含む:
圧力を発生する反応生成物を生成するように適合された物質を含む貯蔵所と、
前記貯蔵所と関連し、前記圧力を発生する反応生成物を生成する物質と反応するように適合されるトリガーと、
前記貯蔵所と流体連通し、前記圧力を発生する反応生成物の生成の際に、前記物質を留めておくように構成される緩衝液チャンバーと、および、
1つまたは複数の試薬を含む試薬チャンバーと、
を含み、
前記チャンバーは前記圧力源とマイクロ流体チャネルの配置の間を連結する。
【請求項27】
前記物質が過酸化水素であり、前記圧力を発生する反応生成物が酸素である、請求項26に記載のマイクロ流体装置。
【請求項28】
前記貯蔵所と前記チャンバーの間を橋渡しするチャネルをさらに含む、請求項26または27に記載のマイクロ流体装置。
【請求項29】
マイクロ流体チャネルの配置が、全血から血漿を分離するためのマイクロ流体分析である、請求項26〜28のいずれか1項に記載のマイクロ流体装置。
【請求項1】
以下を含むマイクロ流体装置のための電源:
緩衝液チャンバーと、
第一の流体チャンバーと、
前記マイクロ流体装置に位置する前記第一の流体チャンバーと接触するピンと、および、
前記マイクロ流体装置に位置する第二の流体チャンバーへの流体通路と、
を含み、
前記ピンは前記第一の流体チャンバーの第一の流体から反応生成物を化学的に生成し、前記第二の流体チャンバーの第二の流体を作動させるように適合される。
【請求項2】
前記ピンが、前記第一の流体チャンバーの前記第一の流体の解離を経て前記反応生成物を生成するための触媒を含む、請求項1に記載の電源。
【請求項3】
前記第一の流体チャンバーの前記第一の流体が過酸化水素であり、前記反応生成物が酸素である、請求項1または2に記載の電源。
【請求項4】
前記触媒がPtまたはAgである、請求項3に記載の電源。
【請求項5】
前記第二の流体チャンバーの前記第二の流体が血液である、請求項1〜3のいずれか1項に記載の電源。
【請求項6】
前記ピンが0.6〜0.8mmの範囲で測定される、請求項1〜3のいずれか1項に記載の電源。
【請求項7】
前記第一の流体の化学成分が制御可能であり、前記第一の流体チャンバーから前記第二の流体チャンバーに通過する前記反応生成物の量を制御し、前記第二の流体の作動を制御する、請求項1〜6のいずれか1項に記載の電源。
【請求項8】
前記ピン、前記緩衝液チャンバーおよび前記第一の流体チャンバーが、前記第二の流体の連続作動を可能にするように構成される、請求項1〜7のいずれか1項に記載の電源。
【請求項9】
以下を含むマイクロ流体装置のための圧力を化学的に発生するポンプシステム:
前記マイクロ流体装置に位置し、貯蔵流体を含む貯蔵チャンバーと、
前記マイクロ流体装置に位置するピン(前記ピンは前記貯蔵流体を作動し、前記貯蔵チャンバーの中で膨張可能な反応生成物を化学的に生成するように適合される)と、
前記マイクロ流体装置に位置し、前記貯蔵チャンバーと流体的に連結され、前記貯蔵チャンバーと前記緩衝液チャンバーの間の前記貯蔵流体の通過を可能にし、前記貯蔵チャンバーから前記緩衝液チャンバーへの前記膨張可能な反応生成物の通過を妨げる緩衝液チャンバーと、および、
前記マイクロ流体装置に位置し、前記貯蔵チャンバーと流体的に連結され、前記貯蔵チャンバーから前記試料添加チャンバーへの前記膨張可能な反応生成物の通過を可能にし、前記試料添加チャンバーから前記貯蔵チャンバーへの試料の通過を妨げる試料添加チャンバーと、
を含む。
【請求項10】
前記貯蔵流体が液体であり、前記膨張可能な反応生成物が気体である、請求項9に記載のポンプシステム。
【請求項11】
前記液体が過酸化水素であり、前記反応生成物が酸素であり、前記ピンが前記過酸化物の解離を経て前記酸素を生成するように適合された触媒を含む、請求項10に記載のポンプシステム。
【請求項12】
前記触媒がPtである、請求項11に記載のポンプシステム。
【請求項13】
前記貯蔵チャンバーおよび前記緩衝液チャンバーが、前記貯蔵流体および前記試料添加チャンバーの上に位置する橋渡しチャネルを介して連結される、請求項9〜12のいずれか1項に記載のポンプシステム。
【請求項14】
前記貯蔵チャンバーおよび前記緩衝液チャンバーが、前記液体貯蔵のレベルが以下の間を動くことができるように構成される、請求項9〜13のいずれか1項に記載のポンプシステム:
i)前記液体の一部が前記緩衝液チャンバーへ移動する間、前記膨張可能な反応生成物をさらに化学的に生成するための、前記ピンの底部より上の第一のレベル、ならびに、
ii)前記貯蔵チャンバーから前記試料チャンバーへの前記反応生成物の通過の際に、前記緩衝液チャンバーから前記貯蔵チャンバーへ前記液体の移動をさらに逆にし、前記第二のレベルを前記第一のレベルへ上げ、それゆえに、圧力電源を形成するための、前記ピンの底部より下の第二のレベル。
【請求項15】
請求項1〜8のいずれか1項に記載の電源を含むマイクロ流体装置。
【請求項16】
自動血液分析配置をさらに含む、請求項15に記載のマイクロ流体装置。
【請求項17】
請求項9〜14のいずれか1項に記載のポンプシステムを含むマイクロ流体装置。
【請求項18】
自動血液分析配置をさらに含む、請求項17に記載のマイクロ流体装置。
【請求項19】
以下を含むマイクロ流体装置のための圧力発生法:
液体を第一のマイクロ流体チャンバーに準備するステップと、
前記液体の触媒分解を行い、前記分解を経て圧力を発生させるステップと、
前記第一のマイクロ流体チャンバーと連結される第二のマイクロ流体チャンバーを準備するステップと、
を含み、
前記発生した圧力の結果として前記第一のマイクロ流体チャンバーから前記第二のマイクロ流体チャンバーへの前記液体の移動を可能にし、前記発生した圧力が減少する時、前記第二のマイクロ流体チャンバーから前記第一のマイクロ流体チャンバーへ前記液体の移動を逆にすることを可能にし、前記触媒分解は前記第一のマイクロ流体チャンバー内の前記液体のレベルによって決まり、前記第一のマイクロ流体チャンバーから前記第二のマイクロ流体チャンバーへの前記液体の移動に起因する前記液体のレベルの減少が前記触媒分解を防ぎ、前記第二のマイクロ流体チャンバーから前記第一のマイクロ流体チャンバーへの前記液体の移動に起因する前記第一のマイクロ流体チャンバー内の前記液体のレベルの増加が前記触媒分解を促進する。
【請求項20】
前記液体が過酸化水素水または塩素酸である、請求項19に記載の方法。
【請求項21】
前記第一のマイクロ流体チャンバーおよび前記第二のマイクロ流体チャンバーが前記マイクロ流体装置の上に位置する、請求項19または20に記載の方法。
【請求項22】
前記マイクロ流体装置がマイクロ流体血液分離装置である、請求項19〜21のいずれか1項に記載の方法。
【請求項23】
前記触媒分解によって発生する前記圧力が、前記血液を前記血液分離装置に送り込む、請求項22に記載の方法。
【請求項24】
送り込まれる前記血液が、前記第二のマイクロ流体チャンバーと前記血液分離装置の間に連結される第三のマイクロ流体チャンバーに位置する、請求項23に記載の方法。
【請求項25】
前記血液分離装置が全血から血漿を分離し、血液タンパク質バイオマーカーのマルチプレックス分析と連結する、請求項23または24に記載の方法。
【請求項26】
以下を含む電源内蔵式マイクロ流体装置:
1つまたは複数の試薬が流れるように構成されるマイクロ流体チャネルの配置と、および、
前記マイクロ流体チャネルを通って前記試薬を送り込む圧力源と、
を含み、
前記圧力源は以下を含む:
圧力を発生する反応生成物を生成するように適合された物質を含む貯蔵所と、
前記貯蔵所と関連し、前記圧力を発生する反応生成物を生成する物質と反応するように適合されるトリガーと、
前記貯蔵所と流体連通し、前記圧力を発生する反応生成物の生成の際に、前記物質を留めておくように構成される緩衝液チャンバーと、および、
1つまたは複数の試薬を含む試薬チャンバーと、
を含み、
前記チャンバーは前記圧力源とマイクロ流体チャネルの配置の間を連結する。
【請求項27】
前記物質が過酸化水素であり、前記圧力を発生する反応生成物が酸素である、請求項26に記載のマイクロ流体装置。
【請求項28】
前記貯蔵所と前記チャンバーの間を橋渡しするチャネルをさらに含む、請求項26または27に記載のマイクロ流体装置。
【請求項29】
マイクロ流体チャネルの配置が、全血から血漿を分離するためのマイクロ流体分析である、請求項26〜28のいずれか1項に記載のマイクロ流体装置。
【図1A】


【図1B】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図1B】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公表番号】特表2012−510635(P2012−510635A)
【公表日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願番号】特願2011−539659(P2011−539659)
【出願日】平成21年12月2日(2009.12.2)
【国際出願番号】PCT/US2009/066444
【国際公開番号】WO2010/065661
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(508032284)カリフォルニア インスティチュート オブ テクノロジー (17)
【Fターム(参考)】
【公表日】平成24年5月10日(2012.5.10)
【国際特許分類】
【出願日】平成21年12月2日(2009.12.2)
【国際出願番号】PCT/US2009/066444
【国際公開番号】WO2010/065661
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(508032284)カリフォルニア インスティチュート オブ テクノロジー (17)
【Fターム(参考)】
[ Back to top ]

