非免疫原性ポリマー結合体の調製のための凝集体非含有尿酸オキシダーゼ
【課題】尿酸分解活性を弱めずにウリカーゼ免疫原性を実質的に排除するポリ(アルキレングリコール)−ウリカーゼ結合体を提供する。
【解決手段】八量体より大きい凝集体を実質的に含有しない精製尿酸オキシダーゼ(ウリカーゼ)。ウリカーゼの精製方法であって、八量体より大きいウリカーゼ凝集体を分離する工程と、精製ウリカーゼからこのような凝集体を排除する工程とを包含する。及び前記分離工程が、イオン交換クロマトグラフィー、サイズ排除クロマトグラフィーおよび限外濾過からなる群から選択される。
【解決手段】八量体より大きい凝集体を実質的に含有しない精製尿酸オキシダーゼ(ウリカーゼ)。ウリカーゼの精製方法であって、八量体より大きいウリカーゼ凝集体を分離する工程と、精製ウリカーゼからこのような凝集体を排除する工程とを包含する。及び前記分離工程が、イオン交換クロマトグラフィー、サイズ排除クロマトグラフィーおよび限外濾過からなる群から選択される。
【発明の詳細な説明】
【技術分野】
【0001】
[本発明における政府権利の記述]
本出願に記載された研究の一部は、米国−イスラエル二国に関する工業的研究および開発財団(U.S.-Israel Binational Industrial Research and Development Foundation)からの支持により成された。したがって米国政府は、本発明において一定の権利を有し得る。
【0002】
発明の分野
本発明は、タンパク質の循環寿命を延長し、タンパク質の免疫原性を低減するためのタンパク質の精製および化学修飾に関する。より具体的には、本発明は、ポリ(エチレングリコール)またはポリ(エチレンオキシド)の結合前の尿酸オキシダーゼ(ウリカーゼ)からの八量体より大きい凝集体の除去に関する。これは、その尿酸分解活性を弱めることなくウリカーゼ免疫原性を実質的に排除する。
【背景技術】
【0003】
関連技術の説明
この背景の節に含まれる記述は従来技術の自認を構成しないが、代わりに発明者自身の独自の意見および本発明が成された時点の当該技術分野の状態の解釈を反映する。これらの解釈は、発明者等の個人的な、今まで開示されていない見識を包含し得るが、この見識はそれ自体従来技術の一部ではなかった。
【0004】
尿酸オキシダーゼ(ウリカーゼ;E.C.1.7.3.3)は、より容易に排出されるプリン代謝物質である可溶性物質アラントインへの尿酸の酸化を触媒する酵素である。ヒトは、高等霊長類の進化中に獲得されたウリカーゼに関する遺伝子におけるいくつかの突然変異の結果として、酵素的に活性なウリカーゼを生産しない。(Wu, X, et al., (1992) J Mol Evol 34:78-84)。結果として、感受性個体においては、血中(高尿酸血症)および尿中(高尿酸尿症)の過剰濃度の尿酸は、疼痛性関節炎(痛風)、形状損傷性尿酸塩沈着(痛風結節)および腎不全を引き起こし得る。罹患個体では、利用可能な薬剤、例えばアロプリノール(尿酸合成の阻害剤)が治療を限定する副作用を生じるか、あるいはこれらの症状を適切に軽減しない場合がある(Hande, KR, et al., (1984) Am J Med 76:47-56; Fam, AG, (1990) Bailliere's Clin Rheumatol 4: 177-192)。ウリカーゼの注入は、高尿酸血症および高尿酸尿症を少なくとも一次的に低減し得る。しかしながら、ウリカーゼはヒトにおいては外来タンパク質であるため、黄色アスペルギルス(Aspergillus flavus)由来の非修飾タンパク質の一次注射でさえ、処置患者の数パーセントにおいてアナフィラキシー反応を誘導し(Pui, C-H, et al., (1997) Leukemia 11:1813-1816)、免疫学的応答は長期または間欠的処置に対するその実用性を制限する(Donadio, D, et al., (1981) Nouv Presse Med 10:711-712; Leaustic, M, et al., (1983) Rev Rhum Mal Osteoartic 50:553-554)。
【0005】
米国特許出願第09/370,084号および公開済国際出願PCT/US99/17514は、非結合化ウリカーゼの尿酸分解活性の少なくとも約75%を保持し、免疫原性の実質的低減を示すポリ(エチレングリコール)−尿酸オキシダーゼ(PEG−ウリカーゼ)を開示する。このような一精製ウリカーゼにおいては、各サブユニットは平均2〜10鎖のPEGに共有結合し、この場合、PEGの各分子は約5kDa〜100kDaの分子量を有し得る。
【0006】
タンパク質の凝集は、それらの免疫原性を増大することが既知である。この理解は、ワクチンの調製に用いる前の熱変性およびグルタルアルデヒド曝露による架橋のような処理によるタンパク質の故意の凝集のための、あるいは抗血清を産生する動物の免疫感作のための方法の開発に寄与した。
【0007】
タンパク質の故意でない凝集はまた、治療用タンパク質の、例えばヒトγグロブリンに関する(Henney et al. (1968) N. Engl. J. Med. 278:2244-2246)ならびにヒト成長ホルモンに関する(Moore et al. (1980) J. Clin. Endocrinol. Metab. 51:691-697)臨床的使用中の免疫感作または感作に寄与すると認識されている。ヒトインターフェロンαの免疫原性への凝集体の寄与は、BALB/cマウスにおいて立証されており(Braun et al.
(1997) Pharm. Res. 14:1472-1478)、それらの測定のために酵素結合免疫吸着アッセイ(ELISA)が開発された(Braun et al. (1997) Pharm. Res. 14: 1394-1400)。
【発明の概要】
【発明が解決しようとする課題】
【0008】
タンパク質の免疫原性に及ぼす凝集の既知の影響に対比して、PEGなどのポリ(アルキレングリコール)に結合したタンパク質の免疫原性に及ぼす凝集の影響の報告はない。その尿酸分解活性を弱めずにウリカーゼ免疫原性を実質的に排除するポリ(アルキレングリコール)−ウリカーゼ結合体が必要とされている。本発明は、このような組成物を提供する。
【課題を解決するための手段】
【0009】
ポリ(アルキレングリコール)、特にPEGとのタンパク質の結合は、免疫原性の低減および血流中の存続の増大を示す結合体を生じる。非修飾化ウリカーゼ調製物の実質的にすべての尿酸分解活性を保持するウリカーゼの実質的非免疫原性結合体を生成しようとして、出発物質中の微量のウリカーゼ大型凝集体が意外にも、このような凝集体を含有するウリカーゼから調製されるPEG結合体の反復注射後、ともに有害である抗体生成および循環からのクリアランス促進の両方を引き起こすのに有効である、ということが発見された。意外にも、免疫原性増大およびクリアランス促進は天然四量体より大きいウリカーゼサブユニットのよく知られた中等度サイズの凝集体、例えば8個のサブユニットを含有する凝集体(八量体)の存在によるものではない、ということを本発明者等は見出した。ウリカーゼの八量体形態は、例えば214nmまたは276nmでのUV光のその吸光度により、あるいは屈折率またはタンパク質濃度のその他の測定に対するその寄与により検出可能である、ウリカーゼのほとんどの調製物中に十分高濃度で存在する。それにもかかわらず、試験された条件下でUV吸光度により検出不可能であるが、静的(Raleigh)または動的光散乱により容易に検出される非常に少量の極大型凝集体と対照を成して、八量体それ自体はPEG−ウリカーゼ結合体の免疫原性およびクリアランス促進に最小度に寄与することが判明した。したがって、PEGとの結合前のこのような微量の極大型凝集体の除去は、結果的に生じるPEG−ウリカーゼ結合体の免疫原性およびクリアランス促進を驚くべき程度に低減することが見出された。
【0010】
本発明の一実施形態は、八量体より大きい凝集体を実質的に含有しない精製尿酸オキシダーゼ(ウリカーゼ)である。好ましくはウリカーゼは哺乳類ウリカーゼである。さらに好ましくは、ウリカーゼはブタ肝臓、ウシ肝臓またはヒツジ肝臓ウリカーゼである。この好ましい実施形態の一態様において、ウリカーゼは組換え体である。この好ましい実施形態の別の態様では、ウリカーゼはブタ、ウシ、ヒツジまたはヒヒ肝臓ウリカーゼの配列を実質的に有する。ウリカーゼはキメラであるのが有益である。好ましくはウリカーゼはPKSウリカーゼである。この好ましい実施形態の別の態様では、ウリカーゼは、チロシン97がヒスチジンにより置換されたヒヒ肝臓ウリカーゼの配列を実質的に有する。好ましくは、ウリカーゼは、アミノ末端およびカルボキシ末端を含み、そしてウリカーゼは一方の末端または両端で短縮されている。ウリカーゼが真菌または微生物ウリカーゼであるのが有益である。好ましくは、真菌または微生物ウリカーゼは黄色アスペルギルス(Aspergillus falvus)、アルスロバクター・グロビフォルミス(Arthrobacter globiformis)、バチルス種(Bacillus sp.)またはカンジダ・ユチリス(Candida utilis)から単離されるか、あるいは上記ウリカーゼのうちの1つの配列を実質的に有する組換え酵素である。あるいはウリカーゼは無脊椎動物ウリカーゼである。好ましくは、無脊椎動物ウリカーゼはキイロショウジョウバエ(Drosophila melanogaster)またはウスグロショウジョウバエ(Drosophila
pseudoobscura)から単離されるか、あるいは上記ウリカーゼのうちの1つの配列を実質的に有する組換え酵素である。この好ましい実施形態の別の態様では、ウリカーゼは植物ウリカーゼである。好ましくは、植物ウリカーゼはダイズ(Glycine max)の根粒から単離されるか、あるいはウリカーゼの配列を実質的に有する組換え酵素である。
【0011】
この好ましい実施形態の一態様では、上記のウリカーゼは、結合体中のウリカーゼが八量体より大きい凝集体を実質的に含有しないような条件下で、ポリ(エチレングリコール)またはポリ(エチレンオキシド)と結合される。好ましくは、ウリカーゼはウレタン(カルバメート)、第二アミンまたはアミド結合を介してポリ(エチレングリコール)またはポリ(エチレンオキシド)と結合される。この好ましい実施形態の一態様では、ポリ(エチレングリコール)はモノメトキシポリ(エチレングリコール)である。この好ましい実施形態の別の態様では、ポリ(エチレングリコール)またはポリ(エチレンオキシド)は約5kDa〜30kDaの分子量を有する。好ましくは、ポリ(エチレングリコール)またはポリ(エチレンオキシド)は約10kDa〜20kDaの分子量を有する。上記のポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が約2〜12鎖/ウリカーゼサブユニットであるのが有益である。上記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が約6〜10/ウリカーゼサブユニットであるのはさらに有益である。上記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が約7〜9/ウリカーゼサブユニットであるのが最も有益である。好ましくは、ポリ(エチレングリコール)またはポリ(エチレンオキシド)は線状である。あるいはポリ(エチレングリコール)またはポリ(エチレンオキシド)は分枝状である。
【0012】
本発明は、体液または組織中の尿酸レベルを低下させるための薬学的組成物であって、上記のウリカーゼ結合体および薬学的に許容可能な担体を含む組成物も提供する。好ましくは、組成物は凍結乾燥により安定化され、非経口投与に適した溶液を提供するための再構成時に溶解される。
【0013】
本発明の別の実施形態は、免疫原性低減を示すウリカーゼの精製方法であって、ウリカーゼ画分中の八量体より大きいウリカーゼ凝集体を分離する工程と、精製ウリカーゼからこのような凝集体を排除する工程を包含する方法である。好ましくは、分離工程は、ウリカーゼ画分の少なくとも一部分から八量体より大きい凝集体を検出し、そして凝集体を含有する画分を排除する工程を包含する。検出工程が光散乱の測定を包含するのが有益である。
【0014】
本発明は、上記の方法により調製される単離ウリカーゼをも提供する。
【図面の簡単な説明】
【0015】
【図1】Pharmacia BiotechのMono Q(1×10cm)陰イオン交換カラムからの画分中のウリカーゼ活性、総タンパク質および塩濃度を示す。ウリカーゼ活性は、200mMホウ酸ナトリウム、pH9.2中の100μM尿酸の292nmでの吸光度の減少をモニターすることにより室温で測定した。総タンパク質は、サイズ排除HPLC分析におけるウリカーゼの吸光度ピークの曲線下面積から決定した。
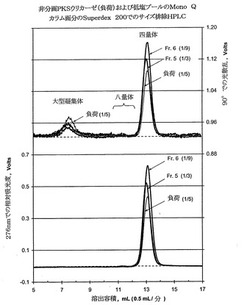
【図2】90℃での光散乱検出器により(上部曲線)ならびに276nmでの吸光度により(下部曲線)得られたデータを示す突然変異R291KおよびT301Sを含有するブタウリカーゼ(PKSウリカーゼ)の調製用Mono Qクロマトグラフィーからの負荷および選択画分のPharmaciaのSuperdex 200カラム(1×30cm)でのサイズ排除HPLC分析を示す。非分画試料(負荷)および種々の画分中の四量体、八量体およびより高度凝集形態のウリカーゼの異なるシグナル強度が明白である。負荷はMono Qカラム緩衝液で1/5に希釈し、画分5は1/3に、画分6は1/9に希釈した。画分5および6を合わせて、「低塩プール」を形成した。
【図3】図2の場合と同様に、90℃での光散乱検出器によりおよび276nmでの吸光度により得られたデータを示す図1における、Mono Qカラムからの画分のサイズ排除分析を示す。この図に示した画分を用いて「高塩プール」を形成し、それからPEG結合体を調製し、BALB/cマウスに注入した。その結果生じたBALB/cマウスにおける血清活性および免疫原性応答を、図5および6に示す。
【図4】PKSウリカーゼの調製用Mono Qカラムクロマトグラフィー(図1)からの非分画PKSウリカーゼのおよび選択画分の、図2および3におけるデータから算定した、276nmでの吸光度により、および90°での光散乱により確定した八量体含有量を示す。
【図5】Mono Qカラム画分からのPKSウリカーゼのまたはプールの6×10kDaPEG結合体の6回の毎週注射の各々の24時間後に採取した血清中の、37℃で4時間インキュベーション後のウリカーゼの活性の、図1と同様のUVアッセイを示す。
【図6】0.2mgのウリカーゼタンパク質/体重20gを用いた雌BALB/cマウスの6回の毎週注射の各々の24時間後に採取した血清中の、図1に示したMono Qカラムからの画分のPKSウリカーゼのPEG結合体に対するならびにそのプールのPEG結合体に対するIgG抗体生成のELISA分析を示す。各マウスに関して、1回目〜6回目の注射後24時間目の採血からのデータを、左から右に示す。アッセイ条件は、実施例6に記載されている。左から右に、免疫応答増大の順に、各群の8匹のマウスに関するデータを並べた。
【発明を実施するための形態】
【0016】
従来の研究は、ウリカーゼの免疫原性および/または抗原性の有意の低減がPEGとの結合(PEG化)により成し遂げられる場合、それはいつも尿酸分解活性の実質的損失と関連することを示している。八量体より大きい尿酸オキシダーゼの微量の凝集体がPEGウリカーゼ結合体の免疫原性およびクリアランス促進の誘導に実質的に寄与する、という観察を本発明は包含する。この発見は、インターフェロンおよび成長因子を含むウリカーゼ以外のタンパク質に最も適用可能であると思われる。
【0017】
生物薬剤の安全性、便利性および費用効果はすべて、それらの効能の低減により悪影響を受け、その結果として生じるのは投与量増大の必要性である。したがって、血液および尿を含む体液中の、尿酸のレベル増大を低下させるための安全かつ有効な代替手段が必要とされる。本発明は、PEG−ウリカーゼの合成に用いるための、八量体より大きいウリカーゼ凝集体を排除するウリカーゼの製造方法を提供する。このPEG−ウリカーゼは、非修飾酵素の尿酸分解活性のすべてまたはほとんどすべてを保持する。本発明は、八量体より大きい凝集体を実質的に含有しない精製ウリカーゼも提供する。「実質的に含有しない」という用語は、精製ウリカーゼが約2%より多くない、好ましくは約1%より多くない八量体より大きい凝集体を含有することを意味する。
【0018】
本発明は、八量体より大きい凝集体が精製調製物から排除されるようにウリカーゼを精製するための方法を提供する。これらの大型凝集体は高免疫原性であり、精製ウリカーゼ調製物中のそれらの存在は望ましくないからである。凝集体は薄すぎて紫外線吸光度により検出されないため、当該方法は、280nmでの紫外線吸光度よりむしろ、またはそれに加えて、光散乱によりカラム画分をモニタリングすることを包含する。次に精製ウリカーゼは、同時係属中米国特許出願第09/370,084号に記載されているように、水溶性ポリマー、好ましくはポリ(エチレングリコール)またはポリ(エチレンオキシド)と結合される。
【0019】
主に四量体ウリカーゼからなる調製物からの凝集ウリカーゼの除去は、サイズ排除クロマトグラフィー、イオン交換クロマトグラフィー、微細孔膜を通す限外濾過および超遠心分離を含む遠心分離を含む、当業者に既知の方法のうちのいずれかにより成し遂げられ得る。分離方法は、画分の分離および分析、ならびに余分量の大型凝集体を含有する画分の拒絶または排除を包含し得る。その結果生じるウリカーゼ調製物は、非分画ウリカーゼよりもウリカーゼの実質的非免疫原性結合体の合成のためによく適している。長期投与のためには、タンパク質のPEG結合体、例えばPEG−ウリカーゼは低免疫原性を有し、反復投与後の血流からのより迅速なクリアランスを積極的に惹起しないことが重要である。
【0020】
本発明は、ポリマー−ウリカーゼ結合体の薬学的組成物も提供する。これらの結合体は実質的に非免疫原性であり、そして少なくとも75%、好ましくは85%、さらに好ましくは95%またはそれ以上の非修飾酵素の尿酸分解活性を保持する。水溶性ポリマーとの結合に適したウリカーゼとしては、細菌、真菌から、ならびに植物および動物(脊椎動物および無脊椎動物の両方)の組織から単離される天然に存在する尿酸オキシダーゼ、ならびにウリカーゼの突然変異、ハイブリッドおよび/または切断酵素的活性変異体を含む組換え体のウリカーゼが挙げられる。本発明に用いるのに適した水溶性ポリマーとしては、線状および分枝状ポリ(エチレングリコール)またはポリ(エチレンオキシド)が挙げられ、すべてPEGとして一般的に既知である。分枝鎖PEGの例は、米国特許第5,643,575号の対象である。線状PEGの好ましい一例は、一般式CH3O−(CH2CH2O)nH(式中、nは約100から約2,300まで変化する)のモノメトキシPEGである。
【0021】
本発明の一実施形態は、非結合化ウリカーゼの尿酸分解活性の少なくとも約75%を保持し、免疫原性の実質的低減を示す尿酸オキシダーゼ(ウリカーゼ)の結合体である。本発明のこの局面のウリカーゼは、組換え体であり得る。組換え体であろうとなかろうと、ウリカーゼは哺乳類起源のものであり得る。この実施形態の一態様では、ウリカーゼはブタ、ウシまたはヒツジ肝臓ウリカーゼである。この実施形態の別の局面では、ウリカーゼはキメラであり得る。キメラウリカーゼは、ブタ肝臓および/またはヒヒ肝臓ウリカーゼの一部を含有し得る。例えばキメラウリカーゼは、突然変異R291KおよびT301Sを含有するブタウリカーゼ(PKSウリカーゼ)であり得る。あるいはウリカーゼは、チロシン97がヒスチジンにより置換されたヒヒ肝臓ウリカーゼであり、それによりウリカーゼの特異的活性は少なくとも約60%増大され得る。本発明のウリカーゼは、起源が何であれ、アミノ末端で、またはカルボキシル末端で、または両端で短縮されている形態でもあり得る。同様に、ウリカーゼは、真菌または微生物ウリカーゼであり得る。この実施形態の一態様では、真菌または微生物ウリカーゼは、黄色アスペルギルス(Aspergillus falvus)、アルトロバクター・グロビフォルミス(Arthrobacter globiformis)、バチルス種(Bacillus sp.)またはカンジダ・ウチリス(Candida utilis)からの天然に存在する形態または組換え体のウリカーゼであり得る。あるいはウリカーゼは、無脊椎動物ウリカーゼ、例えばキイロショウジョウバエ(Drosophila melanogaster)またはウスグロショウジョウバエ(Drosophila pseudoobscura)からの天然に存在するまたは組換え体形態のウリカーゼであり得る。本発明のウリカーゼは、植物ウリカーゼ、例えばダイズの根粒(Glycine max)からの天然に存在する形態または組換え体形態のウリカーゼでもあり得る。PEGは、約5kDa〜100kDaの平均分子量を有し、好ましくはPEGは約8kDa〜約60kDaの平均分子量を有し、さらに好ましくはPEGは約10kDa〜40kDa、例えば10〜20kDaの平均分子量を有し得る。PEGの共有結合鎖の平均数は、ウリカーゼサブユニット1つにつき2〜12鎖であり、好ましくはPEGの共有結合鎖の平均数は、サブユニット1つあたり6〜10鎖であり、さらに好ましくはPEGの共有結合鎖の平均数は、サブユニット1つあたり7〜9鎖であり得る。この実施形態の一態様では、ウリカーゼは四量体性であり得る。PEGの鎖は、ウレタン(カルバメート)結合、第二級アミン結合および/またはアミド結合を介してウリカーゼと共有結合され得る。ウリカーゼが本明細書中に記載したウリカーゼのいずれかの組換え体形態である場合、組換え体形態は実質的に天然に存在する形態の配列を有し得る。
【0022】
好ましい一哺乳類ウリカーゼは、ともにWu et al.(1989)により最初に決定されたブタ肝臓およびヒヒ肝臓ウリカーゼの配列の一部で構成される組換えブタ−ヒヒキメラウリカーゼである。このようなキメラウリカーゼの一例は、ブタ配列(配列番号1)からの最初の288アミノ酸およびヒヒ配列(配列番号2)からの最後の16アミノ酸を含有する(国際公開第00/08196号尿酸オキシダーゼ(Hershfiels et al.、2000年2月17日公開))。後者の配列は2つの位置でのみブタ配列と異なり、残基291のアルギニンの代わりにリシン(K)を、そして残基301のトレオニンの代わりにセリン(S)を有するため、この突然変異体はブタ−K−SまたはPKSウリカーゼ(配列番号3)と呼ばれる。PKSウリカーゼは1つより多いリシン残基を有し、それゆえブタまたはヒヒ配列より1つより多いPEG化の潜在部位を有する。
【0023】
PKSウリカーゼを含む種々の哺乳類ウリカーゼに関するcDNAがサブクローニングされ、標準的方法を用いて大腸菌中での発現のための最適条件が確定された。Erlich, HA, (Ed.) (1989) PCR Technology. Principles and Applications for DNA Amplification. New York: Stockton Press; Sambrook, J, et al.,(1989) Molecular Cloning. A Laboratory Manual,Second Edition. Cold Spring Harbor, NY:Cold Spring Harbor Laboratory Pressを参照。組換えウリカーゼは抽出され、精製され、その安定性と活性が標準アッセイの変法を用いて評価された。Fridovich, I, (1965) J Biol Chem 240: 2491-2494; Nishimura, et al., (1979)ならびに実施例1および5を参照。
【0024】
本発明の一実施形態では、ウリカーゼは、相対的少数のPEG鎖との生物学的に安定な無毒性の共有結合を介して結合され得る。このような結合には、ウレタン(カルバメート)結合、第二アミン結合およびアミド結合が含まれ得る。このような結合に適した種々の活性化PEGは、Shearwater Polymers, Huntsville, ALから市販されている。
【0025】
例えばウリカーゼとのウレタン結合は、PEGのスクシンイミジルカーボネート(SC)またはp−ニトロフェニルカーボネート(NPC)誘導体の存在下でウリカーゼをインキュベートすることにより形成され得る。SC−PEGは、米国特許第5,612,460号に記載された手法を用いて合成され得る。NPC−PEGは、Veronese, FM, et al., (1985) Appl Biochem Biotechnol 11: 141-152に、および米国特許第5,286,637号に記載された方法にしたがって、PEGをp−ニトロフェニルクロロホルメートと反応させることにより合成され得る。'637特許に記載された方法は、同様の化学量論を維持するために反応体の濃度を調整することによってより高分子量のPEGに適応される。NPC−PEGの合成の代替的方法は、東独特許明細書DD279486A1(Buttner, W et al.)に記載されている。
【0026】
ウリカーゼとのアミド結合は、PEGのカルボン酸誘導体のN−ヒドロキシスクシンイミドエステル(Shearwater Polymers)を用いて得られる。第二アミン結合は、2,2,2−トリフルオロエタンスルホニルPEG(トレシルPEG;Shearwater Polymers)を用いて、またはPEGアルデヒド(Shearwater Polymers)およびシアノ水素化ホウ素ナトリウムを用いた還元的アルキル化により形成され得る。
【0027】
10kDaの分子量を有するPEGを含有する結合体では、非修飾酵素の尿酸分解活性の少なくとも75%を保持しながらサブユニット当たりで結合されるPEG鎖の最大数は、哺乳類ウリカーゼに関しては約12鎖であった(例えばブタウリカーゼの突然変異タンパク質であるPKSウリカーゼ;実施例5のアッセイ条件参照)。後者のPEG化度は、総アミノ基の約40%に対応する。本発明の一実施形態では、ウリカーゼサブユニット1つにつき結合されるPEG鎖の平均数は、約2〜12である。好ましい実施形態では、ウリカーゼサブユニット1つにつき結合されるPEG鎖の平均数は、約6〜10である。より好ましい実施形態では、ウリカーゼサブユニット1つにつき共有結合されるPEG鎖の平均数は、約7〜9である。別の実施形態では、カップリング反応に用いられるPEGの分子量は約5kDa〜30kDa、好ましくは約10kDa〜20kDaである。
【0028】
所定形態のウリカーゼとの結合のためのPEGの最適分子量および鎖数の選択に影響し得るいくつかの因子が存在する。概して、尿酸分解活性の実質的損失を伴わない免疫原性の低減または排除は、高分子量の相対的少数のPEG鎖と比較して、より低分子量の相対的により多数のPEG鎖の結合を要し得る。同様に各々の異なる形態のウリカーゼは、サイズおよび鎖数の両方に関して異なる最適性を有し得る。PEG鎖の最適数およびPEG分子量は、本明細書中に記載した方法を用いて容易に確定され得る。
【0029】
哺乳類ウリカーゼのPEG結合体が精製四量体および八量体形態の酵素(約35kDaの4または8サブユニットを含有する)から調製される場合、それらは、大型凝集体を含有するウリカーゼ調製物のPEG結合体の中等度の免疫原性(図6参照)および非修飾酵素の非常に高い免疫原性と対照をなして、マウスにおける免疫原性の顕著な低減を示した。
【0030】
天然および組換えウリカーゼの精製調製物は、通常は四量体(140kDa)および八量体(280kDa)形態に加えて、酵素の極大型凝集体の混合物を含有し得る。四量体または八量体形態である各ウリカーゼ調製物のパーセントは、一般に約20%から95%まで変化する(図2〜4参照)。いくつかの他のタンパク質の非PEG化凝集体が高免疫原性である(例えば、Moore, WV, et al., (1980) J Clin Endocrinol Metab 51:691-697参照)という証拠にもかかわらず、PEG−ウリカーゼについての従来の研究は凝集体の含量を限定するいかなる努力も記載せず、このことは、PEG修飾凝集体の潜在的免疫原性が考慮されなかったことを示唆する。本発明の観察に基づいて、このような凝集体は、PEG−ウリカーゼの従来の合成のために用いられた酵素調製物中に存在したと思われる。それらの存在は、非免疫原性結合体を調製するという仕事をより困難にさせ得る。ウリカーゼをPEG化するための従来の尽力において観察された尿酸分解活性の大きな損失は、結合された低分子量PEGの多数の鎖に関係があったとも考えられる。他方、本明細書中に記載されたウリカーゼ精製およびPEG化の方法は、少なくともある種のウリカーゼ、例えばPKSウリカーゼ(ブタウリカーゼの突然変異タンパク質)および好熱性バチルス属由来の酵素に関しては、尿酸分解活性の75%より多くを保持しながら、サブユニット当たり12鎖のPEGという多数の共有結合を可能にする。
【0031】
別の好ましい実施形態では、酵素の実質的にすべての大型凝集体は、約9〜10.5、好ましくは10.2のpHで、結果的に生じるウリカーゼの実質的凝集体無含有調製物のPEGとの結合前に、イオン交換クロマトグラフィー(図1〜3)またはサイズ排除クロマトグラフィーにより除去され得る。調製用カラムからの各画分中のウリカーゼの分子量は、任意のサイズ依存性分析技法、例えばHPLC、慣用的サイズ排除クロマトグラフィー、遠心分離、光散乱、非変性緩衝液中でのキャピラリー電気泳動またはゲル電気泳動によりモニターされ得る。サイズ排除クロマトグラフィーを用いて単離される凝集体非含有ウリカーゼに関しては、140kDaおよび280kDa形態の酵素のみを含有する画分がプールされ、PEGとの結合のために用いられ得る。イオン交換クロマトグラフィーを用いて単離される四量体+八量体ウリカーゼに関しては、イオン交換カラムからの画分は、光散乱により検出される大型凝集体を伴わずに画分が実質量の四量体および八量体形態を含有することを確定するためにサイズに関して分析され得る。精製産物中では、望ましくない大型凝集体は、したがって、総ウリカーゼの約1%またはそれ未満という少量を構成し得る。
【0032】
本明細書中に示された結果は、広範にPEG化された場合でさえ、八量体より大きいPKSウリカーゼの形態はクリアランス促進を惹起し(図5)、そしてマウスにおいてはやや免疫原性である(図6)ということを示す。これに対比して、大型凝集体(光散乱により検出可能)を本質的に含有しないウリカーゼから調製される結合体は、1週間間隔で少なくとも6回、再注射されて、クリアランス率促進の非常に少ない証拠を示し(図5)、そして感受性酵素結合イムノアッセイにより測定した場合に、抗体の検出可能な生成を伴わない(図6)。高精製四量体または八量体ウリカーゼの使用は、従来記載されたPEG−ウリカーゼ調製物から本発明の改良型結合体をさらに識別する。これに対比して、数名の従来の研究者により用いられたウリカーゼ調製物中の有意含量の大型凝集体の存在は、免疫原性を抑制しようとして、それらをPEGの多数の鎖と結合させた。したがって、その結果生じる結合体の酵素活性が実質的に低減された。
【0033】
本発明のPEG−ウリカーゼ結合体は、哺乳類、好ましくはヒトの体液および組織中の尿酸のレベルを低下させるのに有用であり、したがって痛風、痛風結節、腎不全、臓器移植および悪性疾患を含む症状に関連した尿酸レベル増大の治療のために用いられ得る。PEG−ウリカーゼ結合体は、静脈内、皮下、皮内、粘膜内および腹腔内経路を含む多数の経路のうちのいずれかにより、過剰尿酸レベルを有する哺乳類に注射され得る。あるいはそれらは、エーロゾル化され、吸入され得る。Patton, JS, (1996) Adv Drug Delivery Rev
19:3-36および米国特許第5,458,135号を参照。本発明のPEG−ウリカーゼの有効用量は、尿酸レベルおよび個体のサイズによっている。本発明のこの態様の一実施形態では、PEG−ウリカーゼは、約10μg〜約1gの範囲の量で、薬学的に上許容可能な補形剤または希釈剤中で投与される。好ましい実施形態では、投与される量は約100μg〜500mgである。さらに好ましくは、結合ウリカーゼは、1mg〜100mg、例えば5mg、20mgまたは50mgの量で投与される。実施形態の投薬量に関して示される質量は、結合体中のタンパク質の量を指す。
【0034】
PEG−ウリカーゼを含有する薬学的配合物は、例えばGennaro, AR (Ed.) (1990) Remington's Pharmaceutical Sciences, 18th Edition, Easton, PA: Mack Publishing Co.に記載されているような慣用的技法により調製され得る。注射用溶液の調製のための適切な補形剤としては、例えばリン塩緩衝生理食塩水、乳酸加リンガー溶液、水、ポリオールおよびグリセロールを含む。非経口注入のための薬学的組成物は、薬学的に許容可能な滅菌水性または非水性液、分散液、懸濁液または乳濁液、ならびに使用直前に滅菌注射用溶液または分散液中での再構成のための滅菌粉末を含む。これらの配合物は、さらなる構成成分、例えば防腐剤、可溶化剤、安定剤、湿潤剤、乳化剤、緩衝剤、酸化防止剤および希釈剤を含有し得る。
【0035】
PEG−ウリカーゼは、体液中の尿酸レベル増大を継続的に制御するために個体中への移植のための制御放出組成物としても提供され得る。例えば、ポリ乳酸、ポリグリコール酸、再生コラーゲン、ポリ−L−リシン、アルギン酸ナトリウム、ゲランゴム、キトサン、アガロース、多層膜リポソームおよび多数のその他の慣用的蓄積用(depot)配合物は、生物学的活性組成物とともに配合され得る生侵食性または生分解性物質を含む。これらの物質は、移植されるかまたは注射されると、漸次分解されて、周囲組織に活性物質を放出する。例えばPEG−ウリカーゼを封入する一方法は、米国特許第5,653,974号に開示された方法を含む。生侵食性、生分解性およびその他の蓄積用配合物の使用は、本発明において特に意図される。PEG−ウリカーゼの送達のための注入ポンプおよびマトリックスエントラップ系の使用も、本発明の範囲内である。PEG−ウリカーゼは、ミセルまたはリポソーム中に有益に封入され得る。リポソーム封入技法は、当該技術分野で既知である。例えば、Lasic, D, et al., (Eds.) (1995) Stealth Liposomes. Boca Raton, FL: CRC Pressを参照。
【0036】
本発明のPEG−ウリカーゼ薬学的組成物は、尿酸塩誘導性腎不全の危険性の高い患者、例えば臓器移植片レシピエント(Venkataseshan, VS, et al., (1990) Nephron 56:317-321参照)およびいくつかの悪性疾患を有する患者における血液透析の必要性を低減するであろう。結晶尿酸塩の大蓄積(痛風結節)を有する患者では、このような薬学的組成物は、現在利用可能な治療より迅速にクオリティオブライフを改善するであろう。
【0037】
以下の実施例は、上記に開示された種々の態様を説明するものであって、いかなる点においても本発明を限定するものと解釈されない。これらの実施例は、活性化PEG(例えばp−ニトロフェニルカルボネート誘導体)をブタウリカーゼの突然変異タンパク質に結合することにより調製されるPEG−ウリカーゼを記載する。これらの実施例は、非修飾酵素の尿酸分解活性の少なくとも約75%を保持し、長期投与によく適しているウリカーゼの実質的非免疫原性結合体を製造するために当業者に指針を提供する。
【実施例】
【0038】
実施例1
ウリカーゼの調製用イオン交換クロマトグラフィー
調製用イオン交換クロマトグラフィーを高速タンパク質精製用液体クロマトグラフィー(FPLC)装置にて行った(Amersham Pharmacia, Piscataway, NJ)。Mono Qカラム(1×10cm、Amersham Pharmacia)を、50mM炭酸ナトリウム、pH10.3、0.1M塩化ナトリウム(緩衝液A)から50mM炭酸ナトリウム、pH10.3、0.6M塩化ナトリウム(緩衝液B)の勾配で、0.5ml/分の流速にて溶出させた。但し、試料は低流速にて負荷した。この技法は、PKSウリカーゼ溶液(pH10.3)25mlを分画するために用いられた。PKSウリカーゼは、Bio-Technology General Limited(Rehovot, Israel)から入手した。後者は組換えブタウリカーゼであり、ブタウリカーゼ親配列のリシン(K)1残基およびセリン(S)1残基がそれぞれアルギニン1残基およびスレオニン1残基と置換されている(Lee et al. (1988) Science 239:1288-1291; Wu et al.(1989) Proc. Natl. Acad. Sci. U.S.A. 86:9412-9416)。試料を負荷した後、緩衝液A100mlにてカラムを洗浄した。ウリカーゼのピークは、31mlの0〜26%の緩衝液Bの直線勾配の最後に溶出し始めた。ウリカーゼのほとんどは、26%緩衝液Bを含む緩衝液7mlにより定組成的に溶出した。回収されたウリカーゼの残部は89mlの26〜100%の緩衝液Bの直線勾配により溶出した。4mlまたは6mlの画分を集めた。画分#4〜11の一定分量をウリカーゼおよび総タンパク質に関してアッセイし(図1)、実施例2(図2および3)に記載するように、サイズ排除高速液体クロマトグラフィー(HPLC)により分析した。実施例3に記載するように、画分#5〜10の残部はPEGと結合した。実施例2における分析結果に基づいて、図1に示すように、画分#5および6のPEG結合体は「低塩プール」として合わせ、画分#7〜10のPEG結合体は「高塩プール」として合わせた。
【0039】
実施例2
光散乱および紫外線吸光度によりモニターされるウリカーゼのサイズ排除クロマトグラフィー
室温にて、Superdex 200カラム(1×30cm、Amersham Pharmacia Biotech)にて、実施例1のPKSウリカーゼの調製用Mono Qカラムクロマトグラフィーからの非分画PKSウリカーゼおよび選択した画分について、サイズ排除HPLCを行った。熱分離(Thermo Separations)HPLC(Sunnyvale, CA)の吸光度モニター(UV 2000)からの溶出液をWyatt Technologies(Santa Barbara, CA)製のMiniDawn検出器を用いて、入射光に対して90°での光散乱により分析した。
【0040】
図2〜4に示した結果はウリカーゼサブユニットの四量体、八量体、およびより大きい凝集体の分解能、ならびに各種試料におけるウリカーゼのこれらの形態から検出されるシグナルの種々な比率を示している。濃度に正比例する吸光度シグナルと異なり、光散乱シグナルは生成物の濃度と光散乱ユニットの大きさの積に比例する。極少量の高凝集ウリカーゼに対する光散乱検出器の感度の結果は、ボイド容量(約7ml)にてまたはその付近で溶出する最も大きい凝集体の存在を明らかにした。
【0041】
実施例3
PEGウリカーゼ結合体の合成
非分画PKSウリカーゼ(Bio-Technology General Limitedから)および実施例1のMono Qカラムからの画分中のウリカーゼをShearwater Polymers(Huntville, AL)から得られるPEGのp−ニトロフェニルカーボネート(NPC−PEG)を用いて10kDaのPEGに結合させた。フェニルクロロホルメートを用いたPEGからのNPC−PEGの調製は、数種の報告書に示されており(例えば、Veronese, FM, et al., (1995) Appl Biochem Biotechnol 11:141-152; Kito, M, et al., (1996) J Clin Biochem Nutr 21:101-111)、NPC−PEGは、本発明者等を含むこれまでの研究者により、タンパク質結体の合成のために用いられてきた(例えば、上述のVeronese et al.; Sherman, MR, et al., in JM Harris, et al., (Eds.) Poly(ethylene glycol) Chemistry and Biological Applications. ACS Symposium Series 680(pp. 155-176) Washington, DC: American Chemical Society)。ウリカーゼの各サブユニットに結合する10kDのPEGの鎖数は、Kunitani, M, et al., (1991) J Chromatogr 588:125-137に記載される方法により、6個であることが測定された。
【0042】
実施例4
ウリカーゼおよびPEGウリカーゼのin vivo血清持続性ならびに免疫原性
実施例3の方法に従い調製した組換え哺乳類ウリカーゼのPEG結合体を注射用に、リン酸緩衝生理食塩水(PBS)中1mgタンパク質/ml、pH7.4に調整した。試料を凍結し、分析または注射まで保存した。8匹のBALB/c雌マウス群への注射に先立ち、試料を最高1時間まで37℃に加温した。本研究の開始時点において、マウス群は18〜22gの範囲の平均体重を有していた。
【0043】
全てのマウスの体重をモニターし、注射に対する副作用の兆候または健康障害の他の兆候を記録した。週毎の各6回の注射の24時間後、動物をケタミンで麻酔し、眼窩後部から100〜200μlの血液を得た(但し、より多くの容量を収集する場合は、屠殺(全採血))。血清は、2〜8℃で4時間〜32時間、凝固させた血液から調製した。血清を20℃で保存した。血清を、実施例5の記載のように尿酸分解活性に関して分析し、実施例6の記載のようにウリガーゼに対する抗体に関して分析した。
【0044】
実施例5
PEGウリカーゼを注射したマウス由来の血清中のPEGウリカーゼの尿酸分解活性アッセイ
紫外線光吸光度に基づく活性アッセイ(UVアッセイ)を、I. Fridovich(J Biol Chem. (1965) 240:2491-2494)の方法のマイクロプレート改作物にて、200mMホウ酸ナトリウム(pH9.2)中で基質として100μM尿酸を用いて行った。UV透過ボトムを有する96ウェルプレート(Costar, Corning, NY)において、Molecular Devices(Sunyvale, CA)製SpectraMAX 250マイクロプレートリーダーを用いて、室温にて15分間、292nmでの吸光度の減少をモニターした。データを、10%〜40%の基質が酸化される間に行われた吸光度測定の最大傾き(ミリ吸光度単位/分)を見つけることにより分析した。このアッセイで得られた結果を図1および5に示した。
【0045】
サブユニット1つにつき10kDaのPEGの6本の鎖に結合したPKSウリカーゼ(6×10kDaPEG PKS)を初めて注射したマウスの血清の平均半減期は、注射の24時間および72時間後に得た血清のデータに基づいて、29±4時間であった。
【0046】
別個の実験において、PEGウリカーゼを注射したマウスの血清における検出可能な尿酸分解活性は−20℃での保存中に下降し、この活性の最大の回収はアッセイ前の37℃での4時間のインキュベーションにより得られることを確立した。図5は、毎週の6×10kDaPEG PKSウリカーゼの反復注射後の尿酸分解活性の回復は、実施例3の方法に従ったPEG化の前に、実施例1のように、酵素をMono Qカラムクロマトグラフィーにて酵素を精製したときに最大であったことを示している。回復は、実施例1の高塩溶出プールから調製した結合体の注射後に最も高く(図1参照)、それは非常に大きい凝集体の最も低い含有量を有していた(図3の画分7〜10の光散乱プロフィールを参照)。中程度の回復が、実施例1のMono Qカラムからの低塩溶出プールから調製された結合体において得られ、また最も低い回復は非分画PKSウリカーゼから作製した結合体において得られ、それは非常に大きい凝集体の最も高い含有量を有していた(図2参照)。上述のUVアッセイを用いるか、またはP. Fossati et al.(J.Clin Chem(1980) 26:227-231)より適用した比色アッセイを用いるかに関わらず、かつ血清をアッセイする前に37℃でインキュベートしたかどうかに関わらず、反復注射後の血清中において、同じ順番(高塩プール>低塩プール>非分画ウリカーゼ)の回復された相対活性が観察された。
【0047】
実施例6
PEG−ウリカーゼを注射したマウスからの血清の酵素結合免疫吸着アッセイ(ELISA)
96ウエルイムロン2プレート(Dynex Technologies;VWR Scientific, San Francisco,
CAから)に結合されたブタウリカーゼを用いて、非競合的ELISAアッセイを実施した。一次抗血清は、実施例3の方法にしたがって調製したウリカーゼまたは6×10kDaPEG結合体を注射したマウスからのものであった。B. Porstmann et al. (J Clin. Chem. Clin. Biochem. (1981) 19:435-440)により記載されているように、二次抗体は、ホースラディッシュペルオキシダーゼに結合されたヤギ抗マウスIgG(Calbiochem-Novabiochem #401 253, La Jolla, CA)であり、そして基質はo−フェニレンジアミンジヒドロクロリド(Sigma P-9187, St. Louis, MO)であった。
【0048】
図6は、非競合的ELISA分析の結果を示す。結果は、実施例1のMono Qカラムからの高塩溶出液(図1に示されている)から実施例3の方法にしたがって合成した6×10kDaPEG PKSウリカーゼが、毎週注射を6週間施された8匹のマウスのいずれにおいても検出可能な免疫応答を生じなかったことを示す。実施例3の方法により非分画PKSウリカーゼから調製された結合体を注射した2〜3匹のマウスは、低いがしかし検出可能な免疫応答を示した。免疫応答の最高発生率は、実施例1のMono Qカラムからの低塩溶出液プールから実施例3の方法にしたがって調製された結合体を注射されたマウスにおいてであった。
【0049】
実施例2に記載されているようなサイズ排除HPLC分析用光散乱検出器の利益を用いない場合、ウリカーゼの八量体形態のものでない最大凝集体の存在は、実施例5で観察されたように、反復注射後にPEG−ウリカーゼ結合体の回復の漸次低減(図5)に、ならびに実施例6で観察されたように、BALB/cマウスにおける免疫原性の増大(図6)に関連するということが明白でなかった。これらの結果は、臨床用途のためのPEG−ウリカーゼの製造用出発物質として用いられるウリカーゼの特定のための重要な意味を有する。
【0050】
上記の発明は明快な理解のために説明および実施例により多少詳細に記載されてきたが、記載し、特許請求したものの精神および範囲を逸脱しない限り、ある種の変更および修正がなされうるということは、本発明の教示に鑑みて、当業者には容易に明らかである。
【技術分野】
【0001】
[本発明における政府権利の記述]
本出願に記載された研究の一部は、米国−イスラエル二国に関する工業的研究および開発財団(U.S.-Israel Binational Industrial Research and Development Foundation)からの支持により成された。したがって米国政府は、本発明において一定の権利を有し得る。
【0002】
発明の分野
本発明は、タンパク質の循環寿命を延長し、タンパク質の免疫原性を低減するためのタンパク質の精製および化学修飾に関する。より具体的には、本発明は、ポリ(エチレングリコール)またはポリ(エチレンオキシド)の結合前の尿酸オキシダーゼ(ウリカーゼ)からの八量体より大きい凝集体の除去に関する。これは、その尿酸分解活性を弱めることなくウリカーゼ免疫原性を実質的に排除する。
【背景技術】
【0003】
関連技術の説明
この背景の節に含まれる記述は従来技術の自認を構成しないが、代わりに発明者自身の独自の意見および本発明が成された時点の当該技術分野の状態の解釈を反映する。これらの解釈は、発明者等の個人的な、今まで開示されていない見識を包含し得るが、この見識はそれ自体従来技術の一部ではなかった。
【0004】
尿酸オキシダーゼ(ウリカーゼ;E.C.1.7.3.3)は、より容易に排出されるプリン代謝物質である可溶性物質アラントインへの尿酸の酸化を触媒する酵素である。ヒトは、高等霊長類の進化中に獲得されたウリカーゼに関する遺伝子におけるいくつかの突然変異の結果として、酵素的に活性なウリカーゼを生産しない。(Wu, X, et al., (1992) J Mol Evol 34:78-84)。結果として、感受性個体においては、血中(高尿酸血症)および尿中(高尿酸尿症)の過剰濃度の尿酸は、疼痛性関節炎(痛風)、形状損傷性尿酸塩沈着(痛風結節)および腎不全を引き起こし得る。罹患個体では、利用可能な薬剤、例えばアロプリノール(尿酸合成の阻害剤)が治療を限定する副作用を生じるか、あるいはこれらの症状を適切に軽減しない場合がある(Hande, KR, et al., (1984) Am J Med 76:47-56; Fam, AG, (1990) Bailliere's Clin Rheumatol 4: 177-192)。ウリカーゼの注入は、高尿酸血症および高尿酸尿症を少なくとも一次的に低減し得る。しかしながら、ウリカーゼはヒトにおいては外来タンパク質であるため、黄色アスペルギルス(Aspergillus flavus)由来の非修飾タンパク質の一次注射でさえ、処置患者の数パーセントにおいてアナフィラキシー反応を誘導し(Pui, C-H, et al., (1997) Leukemia 11:1813-1816)、免疫学的応答は長期または間欠的処置に対するその実用性を制限する(Donadio, D, et al., (1981) Nouv Presse Med 10:711-712; Leaustic, M, et al., (1983) Rev Rhum Mal Osteoartic 50:553-554)。
【0005】
米国特許出願第09/370,084号および公開済国際出願PCT/US99/17514は、非結合化ウリカーゼの尿酸分解活性の少なくとも約75%を保持し、免疫原性の実質的低減を示すポリ(エチレングリコール)−尿酸オキシダーゼ(PEG−ウリカーゼ)を開示する。このような一精製ウリカーゼにおいては、各サブユニットは平均2〜10鎖のPEGに共有結合し、この場合、PEGの各分子は約5kDa〜100kDaの分子量を有し得る。
【0006】
タンパク質の凝集は、それらの免疫原性を増大することが既知である。この理解は、ワクチンの調製に用いる前の熱変性およびグルタルアルデヒド曝露による架橋のような処理によるタンパク質の故意の凝集のための、あるいは抗血清を産生する動物の免疫感作のための方法の開発に寄与した。
【0007】
タンパク質の故意でない凝集はまた、治療用タンパク質の、例えばヒトγグロブリンに関する(Henney et al. (1968) N. Engl. J. Med. 278:2244-2246)ならびにヒト成長ホルモンに関する(Moore et al. (1980) J. Clin. Endocrinol. Metab. 51:691-697)臨床的使用中の免疫感作または感作に寄与すると認識されている。ヒトインターフェロンαの免疫原性への凝集体の寄与は、BALB/cマウスにおいて立証されており(Braun et al.
(1997) Pharm. Res. 14:1472-1478)、それらの測定のために酵素結合免疫吸着アッセイ(ELISA)が開発された(Braun et al. (1997) Pharm. Res. 14: 1394-1400)。
【発明の概要】
【発明が解決しようとする課題】
【0008】
タンパク質の免疫原性に及ぼす凝集の既知の影響に対比して、PEGなどのポリ(アルキレングリコール)に結合したタンパク質の免疫原性に及ぼす凝集の影響の報告はない。その尿酸分解活性を弱めずにウリカーゼ免疫原性を実質的に排除するポリ(アルキレングリコール)−ウリカーゼ結合体が必要とされている。本発明は、このような組成物を提供する。
【課題を解決するための手段】
【0009】
ポリ(アルキレングリコール)、特にPEGとのタンパク質の結合は、免疫原性の低減および血流中の存続の増大を示す結合体を生じる。非修飾化ウリカーゼ調製物の実質的にすべての尿酸分解活性を保持するウリカーゼの実質的非免疫原性結合体を生成しようとして、出発物質中の微量のウリカーゼ大型凝集体が意外にも、このような凝集体を含有するウリカーゼから調製されるPEG結合体の反復注射後、ともに有害である抗体生成および循環からのクリアランス促進の両方を引き起こすのに有効である、ということが発見された。意外にも、免疫原性増大およびクリアランス促進は天然四量体より大きいウリカーゼサブユニットのよく知られた中等度サイズの凝集体、例えば8個のサブユニットを含有する凝集体(八量体)の存在によるものではない、ということを本発明者等は見出した。ウリカーゼの八量体形態は、例えば214nmまたは276nmでのUV光のその吸光度により、あるいは屈折率またはタンパク質濃度のその他の測定に対するその寄与により検出可能である、ウリカーゼのほとんどの調製物中に十分高濃度で存在する。それにもかかわらず、試験された条件下でUV吸光度により検出不可能であるが、静的(Raleigh)または動的光散乱により容易に検出される非常に少量の極大型凝集体と対照を成して、八量体それ自体はPEG−ウリカーゼ結合体の免疫原性およびクリアランス促進に最小度に寄与することが判明した。したがって、PEGとの結合前のこのような微量の極大型凝集体の除去は、結果的に生じるPEG−ウリカーゼ結合体の免疫原性およびクリアランス促進を驚くべき程度に低減することが見出された。
【0010】
本発明の一実施形態は、八量体より大きい凝集体を実質的に含有しない精製尿酸オキシダーゼ(ウリカーゼ)である。好ましくはウリカーゼは哺乳類ウリカーゼである。さらに好ましくは、ウリカーゼはブタ肝臓、ウシ肝臓またはヒツジ肝臓ウリカーゼである。この好ましい実施形態の一態様において、ウリカーゼは組換え体である。この好ましい実施形態の別の態様では、ウリカーゼはブタ、ウシ、ヒツジまたはヒヒ肝臓ウリカーゼの配列を実質的に有する。ウリカーゼはキメラであるのが有益である。好ましくはウリカーゼはPKSウリカーゼである。この好ましい実施形態の別の態様では、ウリカーゼは、チロシン97がヒスチジンにより置換されたヒヒ肝臓ウリカーゼの配列を実質的に有する。好ましくは、ウリカーゼは、アミノ末端およびカルボキシ末端を含み、そしてウリカーゼは一方の末端または両端で短縮されている。ウリカーゼが真菌または微生物ウリカーゼであるのが有益である。好ましくは、真菌または微生物ウリカーゼは黄色アスペルギルス(Aspergillus falvus)、アルスロバクター・グロビフォルミス(Arthrobacter globiformis)、バチルス種(Bacillus sp.)またはカンジダ・ユチリス(Candida utilis)から単離されるか、あるいは上記ウリカーゼのうちの1つの配列を実質的に有する組換え酵素である。あるいはウリカーゼは無脊椎動物ウリカーゼである。好ましくは、無脊椎動物ウリカーゼはキイロショウジョウバエ(Drosophila melanogaster)またはウスグロショウジョウバエ(Drosophila
pseudoobscura)から単離されるか、あるいは上記ウリカーゼのうちの1つの配列を実質的に有する組換え酵素である。この好ましい実施形態の別の態様では、ウリカーゼは植物ウリカーゼである。好ましくは、植物ウリカーゼはダイズ(Glycine max)の根粒から単離されるか、あるいはウリカーゼの配列を実質的に有する組換え酵素である。
【0011】
この好ましい実施形態の一態様では、上記のウリカーゼは、結合体中のウリカーゼが八量体より大きい凝集体を実質的に含有しないような条件下で、ポリ(エチレングリコール)またはポリ(エチレンオキシド)と結合される。好ましくは、ウリカーゼはウレタン(カルバメート)、第二アミンまたはアミド結合を介してポリ(エチレングリコール)またはポリ(エチレンオキシド)と結合される。この好ましい実施形態の一態様では、ポリ(エチレングリコール)はモノメトキシポリ(エチレングリコール)である。この好ましい実施形態の別の態様では、ポリ(エチレングリコール)またはポリ(エチレンオキシド)は約5kDa〜30kDaの分子量を有する。好ましくは、ポリ(エチレングリコール)またはポリ(エチレンオキシド)は約10kDa〜20kDaの分子量を有する。上記のポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が約2〜12鎖/ウリカーゼサブユニットであるのが有益である。上記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が約6〜10/ウリカーゼサブユニットであるのはさらに有益である。上記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が約7〜9/ウリカーゼサブユニットであるのが最も有益である。好ましくは、ポリ(エチレングリコール)またはポリ(エチレンオキシド)は線状である。あるいはポリ(エチレングリコール)またはポリ(エチレンオキシド)は分枝状である。
【0012】
本発明は、体液または組織中の尿酸レベルを低下させるための薬学的組成物であって、上記のウリカーゼ結合体および薬学的に許容可能な担体を含む組成物も提供する。好ましくは、組成物は凍結乾燥により安定化され、非経口投与に適した溶液を提供するための再構成時に溶解される。
【0013】
本発明の別の実施形態は、免疫原性低減を示すウリカーゼの精製方法であって、ウリカーゼ画分中の八量体より大きいウリカーゼ凝集体を分離する工程と、精製ウリカーゼからこのような凝集体を排除する工程を包含する方法である。好ましくは、分離工程は、ウリカーゼ画分の少なくとも一部分から八量体より大きい凝集体を検出し、そして凝集体を含有する画分を排除する工程を包含する。検出工程が光散乱の測定を包含するのが有益である。
【0014】
本発明は、上記の方法により調製される単離ウリカーゼをも提供する。
【図面の簡単な説明】
【0015】
【図1】Pharmacia BiotechのMono Q(1×10cm)陰イオン交換カラムからの画分中のウリカーゼ活性、総タンパク質および塩濃度を示す。ウリカーゼ活性は、200mMホウ酸ナトリウム、pH9.2中の100μM尿酸の292nmでの吸光度の減少をモニターすることにより室温で測定した。総タンパク質は、サイズ排除HPLC分析におけるウリカーゼの吸光度ピークの曲線下面積から決定した。
【図2】90℃での光散乱検出器により(上部曲線)ならびに276nmでの吸光度により(下部曲線)得られたデータを示す突然変異R291KおよびT301Sを含有するブタウリカーゼ(PKSウリカーゼ)の調製用Mono Qクロマトグラフィーからの負荷および選択画分のPharmaciaのSuperdex 200カラム(1×30cm)でのサイズ排除HPLC分析を示す。非分画試料(負荷)および種々の画分中の四量体、八量体およびより高度凝集形態のウリカーゼの異なるシグナル強度が明白である。負荷はMono Qカラム緩衝液で1/5に希釈し、画分5は1/3に、画分6は1/9に希釈した。画分5および6を合わせて、「低塩プール」を形成した。
【図3】図2の場合と同様に、90℃での光散乱検出器によりおよび276nmでの吸光度により得られたデータを示す図1における、Mono Qカラムからの画分のサイズ排除分析を示す。この図に示した画分を用いて「高塩プール」を形成し、それからPEG結合体を調製し、BALB/cマウスに注入した。その結果生じたBALB/cマウスにおける血清活性および免疫原性応答を、図5および6に示す。
【図4】PKSウリカーゼの調製用Mono Qカラムクロマトグラフィー(図1)からの非分画PKSウリカーゼのおよび選択画分の、図2および3におけるデータから算定した、276nmでの吸光度により、および90°での光散乱により確定した八量体含有量を示す。
【図5】Mono Qカラム画分からのPKSウリカーゼのまたはプールの6×10kDaPEG結合体の6回の毎週注射の各々の24時間後に採取した血清中の、37℃で4時間インキュベーション後のウリカーゼの活性の、図1と同様のUVアッセイを示す。
【図6】0.2mgのウリカーゼタンパク質/体重20gを用いた雌BALB/cマウスの6回の毎週注射の各々の24時間後に採取した血清中の、図1に示したMono Qカラムからの画分のPKSウリカーゼのPEG結合体に対するならびにそのプールのPEG結合体に対するIgG抗体生成のELISA分析を示す。各マウスに関して、1回目〜6回目の注射後24時間目の採血からのデータを、左から右に示す。アッセイ条件は、実施例6に記載されている。左から右に、免疫応答増大の順に、各群の8匹のマウスに関するデータを並べた。
【発明を実施するための形態】
【0016】
従来の研究は、ウリカーゼの免疫原性および/または抗原性の有意の低減がPEGとの結合(PEG化)により成し遂げられる場合、それはいつも尿酸分解活性の実質的損失と関連することを示している。八量体より大きい尿酸オキシダーゼの微量の凝集体がPEGウリカーゼ結合体の免疫原性およびクリアランス促進の誘導に実質的に寄与する、という観察を本発明は包含する。この発見は、インターフェロンおよび成長因子を含むウリカーゼ以外のタンパク質に最も適用可能であると思われる。
【0017】
生物薬剤の安全性、便利性および費用効果はすべて、それらの効能の低減により悪影響を受け、その結果として生じるのは投与量増大の必要性である。したがって、血液および尿を含む体液中の、尿酸のレベル増大を低下させるための安全かつ有効な代替手段が必要とされる。本発明は、PEG−ウリカーゼの合成に用いるための、八量体より大きいウリカーゼ凝集体を排除するウリカーゼの製造方法を提供する。このPEG−ウリカーゼは、非修飾酵素の尿酸分解活性のすべてまたはほとんどすべてを保持する。本発明は、八量体より大きい凝集体を実質的に含有しない精製ウリカーゼも提供する。「実質的に含有しない」という用語は、精製ウリカーゼが約2%より多くない、好ましくは約1%より多くない八量体より大きい凝集体を含有することを意味する。
【0018】
本発明は、八量体より大きい凝集体が精製調製物から排除されるようにウリカーゼを精製するための方法を提供する。これらの大型凝集体は高免疫原性であり、精製ウリカーゼ調製物中のそれらの存在は望ましくないからである。凝集体は薄すぎて紫外線吸光度により検出されないため、当該方法は、280nmでの紫外線吸光度よりむしろ、またはそれに加えて、光散乱によりカラム画分をモニタリングすることを包含する。次に精製ウリカーゼは、同時係属中米国特許出願第09/370,084号に記載されているように、水溶性ポリマー、好ましくはポリ(エチレングリコール)またはポリ(エチレンオキシド)と結合される。
【0019】
主に四量体ウリカーゼからなる調製物からの凝集ウリカーゼの除去は、サイズ排除クロマトグラフィー、イオン交換クロマトグラフィー、微細孔膜を通す限外濾過および超遠心分離を含む遠心分離を含む、当業者に既知の方法のうちのいずれかにより成し遂げられ得る。分離方法は、画分の分離および分析、ならびに余分量の大型凝集体を含有する画分の拒絶または排除を包含し得る。その結果生じるウリカーゼ調製物は、非分画ウリカーゼよりもウリカーゼの実質的非免疫原性結合体の合成のためによく適している。長期投与のためには、タンパク質のPEG結合体、例えばPEG−ウリカーゼは低免疫原性を有し、反復投与後の血流からのより迅速なクリアランスを積極的に惹起しないことが重要である。
【0020】
本発明は、ポリマー−ウリカーゼ結合体の薬学的組成物も提供する。これらの結合体は実質的に非免疫原性であり、そして少なくとも75%、好ましくは85%、さらに好ましくは95%またはそれ以上の非修飾酵素の尿酸分解活性を保持する。水溶性ポリマーとの結合に適したウリカーゼとしては、細菌、真菌から、ならびに植物および動物(脊椎動物および無脊椎動物の両方)の組織から単離される天然に存在する尿酸オキシダーゼ、ならびにウリカーゼの突然変異、ハイブリッドおよび/または切断酵素的活性変異体を含む組換え体のウリカーゼが挙げられる。本発明に用いるのに適した水溶性ポリマーとしては、線状および分枝状ポリ(エチレングリコール)またはポリ(エチレンオキシド)が挙げられ、すべてPEGとして一般的に既知である。分枝鎖PEGの例は、米国特許第5,643,575号の対象である。線状PEGの好ましい一例は、一般式CH3O−(CH2CH2O)nH(式中、nは約100から約2,300まで変化する)のモノメトキシPEGである。
【0021】
本発明の一実施形態は、非結合化ウリカーゼの尿酸分解活性の少なくとも約75%を保持し、免疫原性の実質的低減を示す尿酸オキシダーゼ(ウリカーゼ)の結合体である。本発明のこの局面のウリカーゼは、組換え体であり得る。組換え体であろうとなかろうと、ウリカーゼは哺乳類起源のものであり得る。この実施形態の一態様では、ウリカーゼはブタ、ウシまたはヒツジ肝臓ウリカーゼである。この実施形態の別の局面では、ウリカーゼはキメラであり得る。キメラウリカーゼは、ブタ肝臓および/またはヒヒ肝臓ウリカーゼの一部を含有し得る。例えばキメラウリカーゼは、突然変異R291KおよびT301Sを含有するブタウリカーゼ(PKSウリカーゼ)であり得る。あるいはウリカーゼは、チロシン97がヒスチジンにより置換されたヒヒ肝臓ウリカーゼであり、それによりウリカーゼの特異的活性は少なくとも約60%増大され得る。本発明のウリカーゼは、起源が何であれ、アミノ末端で、またはカルボキシル末端で、または両端で短縮されている形態でもあり得る。同様に、ウリカーゼは、真菌または微生物ウリカーゼであり得る。この実施形態の一態様では、真菌または微生物ウリカーゼは、黄色アスペルギルス(Aspergillus falvus)、アルトロバクター・グロビフォルミス(Arthrobacter globiformis)、バチルス種(Bacillus sp.)またはカンジダ・ウチリス(Candida utilis)からの天然に存在する形態または組換え体のウリカーゼであり得る。あるいはウリカーゼは、無脊椎動物ウリカーゼ、例えばキイロショウジョウバエ(Drosophila melanogaster)またはウスグロショウジョウバエ(Drosophila pseudoobscura)からの天然に存在するまたは組換え体形態のウリカーゼであり得る。本発明のウリカーゼは、植物ウリカーゼ、例えばダイズの根粒(Glycine max)からの天然に存在する形態または組換え体形態のウリカーゼでもあり得る。PEGは、約5kDa〜100kDaの平均分子量を有し、好ましくはPEGは約8kDa〜約60kDaの平均分子量を有し、さらに好ましくはPEGは約10kDa〜40kDa、例えば10〜20kDaの平均分子量を有し得る。PEGの共有結合鎖の平均数は、ウリカーゼサブユニット1つにつき2〜12鎖であり、好ましくはPEGの共有結合鎖の平均数は、サブユニット1つあたり6〜10鎖であり、さらに好ましくはPEGの共有結合鎖の平均数は、サブユニット1つあたり7〜9鎖であり得る。この実施形態の一態様では、ウリカーゼは四量体性であり得る。PEGの鎖は、ウレタン(カルバメート)結合、第二級アミン結合および/またはアミド結合を介してウリカーゼと共有結合され得る。ウリカーゼが本明細書中に記載したウリカーゼのいずれかの組換え体形態である場合、組換え体形態は実質的に天然に存在する形態の配列を有し得る。
【0022】
好ましい一哺乳類ウリカーゼは、ともにWu et al.(1989)により最初に決定されたブタ肝臓およびヒヒ肝臓ウリカーゼの配列の一部で構成される組換えブタ−ヒヒキメラウリカーゼである。このようなキメラウリカーゼの一例は、ブタ配列(配列番号1)からの最初の288アミノ酸およびヒヒ配列(配列番号2)からの最後の16アミノ酸を含有する(国際公開第00/08196号尿酸オキシダーゼ(Hershfiels et al.、2000年2月17日公開))。後者の配列は2つの位置でのみブタ配列と異なり、残基291のアルギニンの代わりにリシン(K)を、そして残基301のトレオニンの代わりにセリン(S)を有するため、この突然変異体はブタ−K−SまたはPKSウリカーゼ(配列番号3)と呼ばれる。PKSウリカーゼは1つより多いリシン残基を有し、それゆえブタまたはヒヒ配列より1つより多いPEG化の潜在部位を有する。
【0023】
PKSウリカーゼを含む種々の哺乳類ウリカーゼに関するcDNAがサブクローニングされ、標準的方法を用いて大腸菌中での発現のための最適条件が確定された。Erlich, HA, (Ed.) (1989) PCR Technology. Principles and Applications for DNA Amplification. New York: Stockton Press; Sambrook, J, et al.,(1989) Molecular Cloning. A Laboratory Manual,Second Edition. Cold Spring Harbor, NY:Cold Spring Harbor Laboratory Pressを参照。組換えウリカーゼは抽出され、精製され、その安定性と活性が標準アッセイの変法を用いて評価された。Fridovich, I, (1965) J Biol Chem 240: 2491-2494; Nishimura, et al., (1979)ならびに実施例1および5を参照。
【0024】
本発明の一実施形態では、ウリカーゼは、相対的少数のPEG鎖との生物学的に安定な無毒性の共有結合を介して結合され得る。このような結合には、ウレタン(カルバメート)結合、第二アミン結合およびアミド結合が含まれ得る。このような結合に適した種々の活性化PEGは、Shearwater Polymers, Huntsville, ALから市販されている。
【0025】
例えばウリカーゼとのウレタン結合は、PEGのスクシンイミジルカーボネート(SC)またはp−ニトロフェニルカーボネート(NPC)誘導体の存在下でウリカーゼをインキュベートすることにより形成され得る。SC−PEGは、米国特許第5,612,460号に記載された手法を用いて合成され得る。NPC−PEGは、Veronese, FM, et al., (1985) Appl Biochem Biotechnol 11: 141-152に、および米国特許第5,286,637号に記載された方法にしたがって、PEGをp−ニトロフェニルクロロホルメートと反応させることにより合成され得る。'637特許に記載された方法は、同様の化学量論を維持するために反応体の濃度を調整することによってより高分子量のPEGに適応される。NPC−PEGの合成の代替的方法は、東独特許明細書DD279486A1(Buttner, W et al.)に記載されている。
【0026】
ウリカーゼとのアミド結合は、PEGのカルボン酸誘導体のN−ヒドロキシスクシンイミドエステル(Shearwater Polymers)を用いて得られる。第二アミン結合は、2,2,2−トリフルオロエタンスルホニルPEG(トレシルPEG;Shearwater Polymers)を用いて、またはPEGアルデヒド(Shearwater Polymers)およびシアノ水素化ホウ素ナトリウムを用いた還元的アルキル化により形成され得る。
【0027】
10kDaの分子量を有するPEGを含有する結合体では、非修飾酵素の尿酸分解活性の少なくとも75%を保持しながらサブユニット当たりで結合されるPEG鎖の最大数は、哺乳類ウリカーゼに関しては約12鎖であった(例えばブタウリカーゼの突然変異タンパク質であるPKSウリカーゼ;実施例5のアッセイ条件参照)。後者のPEG化度は、総アミノ基の約40%に対応する。本発明の一実施形態では、ウリカーゼサブユニット1つにつき結合されるPEG鎖の平均数は、約2〜12である。好ましい実施形態では、ウリカーゼサブユニット1つにつき結合されるPEG鎖の平均数は、約6〜10である。より好ましい実施形態では、ウリカーゼサブユニット1つにつき共有結合されるPEG鎖の平均数は、約7〜9である。別の実施形態では、カップリング反応に用いられるPEGの分子量は約5kDa〜30kDa、好ましくは約10kDa〜20kDaである。
【0028】
所定形態のウリカーゼとの結合のためのPEGの最適分子量および鎖数の選択に影響し得るいくつかの因子が存在する。概して、尿酸分解活性の実質的損失を伴わない免疫原性の低減または排除は、高分子量の相対的少数のPEG鎖と比較して、より低分子量の相対的により多数のPEG鎖の結合を要し得る。同様に各々の異なる形態のウリカーゼは、サイズおよび鎖数の両方に関して異なる最適性を有し得る。PEG鎖の最適数およびPEG分子量は、本明細書中に記載した方法を用いて容易に確定され得る。
【0029】
哺乳類ウリカーゼのPEG結合体が精製四量体および八量体形態の酵素(約35kDaの4または8サブユニットを含有する)から調製される場合、それらは、大型凝集体を含有するウリカーゼ調製物のPEG結合体の中等度の免疫原性(図6参照)および非修飾酵素の非常に高い免疫原性と対照をなして、マウスにおける免疫原性の顕著な低減を示した。
【0030】
天然および組換えウリカーゼの精製調製物は、通常は四量体(140kDa)および八量体(280kDa)形態に加えて、酵素の極大型凝集体の混合物を含有し得る。四量体または八量体形態である各ウリカーゼ調製物のパーセントは、一般に約20%から95%まで変化する(図2〜4参照)。いくつかの他のタンパク質の非PEG化凝集体が高免疫原性である(例えば、Moore, WV, et al., (1980) J Clin Endocrinol Metab 51:691-697参照)という証拠にもかかわらず、PEG−ウリカーゼについての従来の研究は凝集体の含量を限定するいかなる努力も記載せず、このことは、PEG修飾凝集体の潜在的免疫原性が考慮されなかったことを示唆する。本発明の観察に基づいて、このような凝集体は、PEG−ウリカーゼの従来の合成のために用いられた酵素調製物中に存在したと思われる。それらの存在は、非免疫原性結合体を調製するという仕事をより困難にさせ得る。ウリカーゼをPEG化するための従来の尽力において観察された尿酸分解活性の大きな損失は、結合された低分子量PEGの多数の鎖に関係があったとも考えられる。他方、本明細書中に記載されたウリカーゼ精製およびPEG化の方法は、少なくともある種のウリカーゼ、例えばPKSウリカーゼ(ブタウリカーゼの突然変異タンパク質)および好熱性バチルス属由来の酵素に関しては、尿酸分解活性の75%より多くを保持しながら、サブユニット当たり12鎖のPEGという多数の共有結合を可能にする。
【0031】
別の好ましい実施形態では、酵素の実質的にすべての大型凝集体は、約9〜10.5、好ましくは10.2のpHで、結果的に生じるウリカーゼの実質的凝集体無含有調製物のPEGとの結合前に、イオン交換クロマトグラフィー(図1〜3)またはサイズ排除クロマトグラフィーにより除去され得る。調製用カラムからの各画分中のウリカーゼの分子量は、任意のサイズ依存性分析技法、例えばHPLC、慣用的サイズ排除クロマトグラフィー、遠心分離、光散乱、非変性緩衝液中でのキャピラリー電気泳動またはゲル電気泳動によりモニターされ得る。サイズ排除クロマトグラフィーを用いて単離される凝集体非含有ウリカーゼに関しては、140kDaおよび280kDa形態の酵素のみを含有する画分がプールされ、PEGとの結合のために用いられ得る。イオン交換クロマトグラフィーを用いて単離される四量体+八量体ウリカーゼに関しては、イオン交換カラムからの画分は、光散乱により検出される大型凝集体を伴わずに画分が実質量の四量体および八量体形態を含有することを確定するためにサイズに関して分析され得る。精製産物中では、望ましくない大型凝集体は、したがって、総ウリカーゼの約1%またはそれ未満という少量を構成し得る。
【0032】
本明細書中に示された結果は、広範にPEG化された場合でさえ、八量体より大きいPKSウリカーゼの形態はクリアランス促進を惹起し(図5)、そしてマウスにおいてはやや免疫原性である(図6)ということを示す。これに対比して、大型凝集体(光散乱により検出可能)を本質的に含有しないウリカーゼから調製される結合体は、1週間間隔で少なくとも6回、再注射されて、クリアランス率促進の非常に少ない証拠を示し(図5)、そして感受性酵素結合イムノアッセイにより測定した場合に、抗体の検出可能な生成を伴わない(図6)。高精製四量体または八量体ウリカーゼの使用は、従来記載されたPEG−ウリカーゼ調製物から本発明の改良型結合体をさらに識別する。これに対比して、数名の従来の研究者により用いられたウリカーゼ調製物中の有意含量の大型凝集体の存在は、免疫原性を抑制しようとして、それらをPEGの多数の鎖と結合させた。したがって、その結果生じる結合体の酵素活性が実質的に低減された。
【0033】
本発明のPEG−ウリカーゼ結合体は、哺乳類、好ましくはヒトの体液および組織中の尿酸のレベルを低下させるのに有用であり、したがって痛風、痛風結節、腎不全、臓器移植および悪性疾患を含む症状に関連した尿酸レベル増大の治療のために用いられ得る。PEG−ウリカーゼ結合体は、静脈内、皮下、皮内、粘膜内および腹腔内経路を含む多数の経路のうちのいずれかにより、過剰尿酸レベルを有する哺乳類に注射され得る。あるいはそれらは、エーロゾル化され、吸入され得る。Patton, JS, (1996) Adv Drug Delivery Rev
19:3-36および米国特許第5,458,135号を参照。本発明のPEG−ウリカーゼの有効用量は、尿酸レベルおよび個体のサイズによっている。本発明のこの態様の一実施形態では、PEG−ウリカーゼは、約10μg〜約1gの範囲の量で、薬学的に上許容可能な補形剤または希釈剤中で投与される。好ましい実施形態では、投与される量は約100μg〜500mgである。さらに好ましくは、結合ウリカーゼは、1mg〜100mg、例えば5mg、20mgまたは50mgの量で投与される。実施形態の投薬量に関して示される質量は、結合体中のタンパク質の量を指す。
【0034】
PEG−ウリカーゼを含有する薬学的配合物は、例えばGennaro, AR (Ed.) (1990) Remington's Pharmaceutical Sciences, 18th Edition, Easton, PA: Mack Publishing Co.に記載されているような慣用的技法により調製され得る。注射用溶液の調製のための適切な補形剤としては、例えばリン塩緩衝生理食塩水、乳酸加リンガー溶液、水、ポリオールおよびグリセロールを含む。非経口注入のための薬学的組成物は、薬学的に許容可能な滅菌水性または非水性液、分散液、懸濁液または乳濁液、ならびに使用直前に滅菌注射用溶液または分散液中での再構成のための滅菌粉末を含む。これらの配合物は、さらなる構成成分、例えば防腐剤、可溶化剤、安定剤、湿潤剤、乳化剤、緩衝剤、酸化防止剤および希釈剤を含有し得る。
【0035】
PEG−ウリカーゼは、体液中の尿酸レベル増大を継続的に制御するために個体中への移植のための制御放出組成物としても提供され得る。例えば、ポリ乳酸、ポリグリコール酸、再生コラーゲン、ポリ−L−リシン、アルギン酸ナトリウム、ゲランゴム、キトサン、アガロース、多層膜リポソームおよび多数のその他の慣用的蓄積用(depot)配合物は、生物学的活性組成物とともに配合され得る生侵食性または生分解性物質を含む。これらの物質は、移植されるかまたは注射されると、漸次分解されて、周囲組織に活性物質を放出する。例えばPEG−ウリカーゼを封入する一方法は、米国特許第5,653,974号に開示された方法を含む。生侵食性、生分解性およびその他の蓄積用配合物の使用は、本発明において特に意図される。PEG−ウリカーゼの送達のための注入ポンプおよびマトリックスエントラップ系の使用も、本発明の範囲内である。PEG−ウリカーゼは、ミセルまたはリポソーム中に有益に封入され得る。リポソーム封入技法は、当該技術分野で既知である。例えば、Lasic, D, et al., (Eds.) (1995) Stealth Liposomes. Boca Raton, FL: CRC Pressを参照。
【0036】
本発明のPEG−ウリカーゼ薬学的組成物は、尿酸塩誘導性腎不全の危険性の高い患者、例えば臓器移植片レシピエント(Venkataseshan, VS, et al., (1990) Nephron 56:317-321参照)およびいくつかの悪性疾患を有する患者における血液透析の必要性を低減するであろう。結晶尿酸塩の大蓄積(痛風結節)を有する患者では、このような薬学的組成物は、現在利用可能な治療より迅速にクオリティオブライフを改善するであろう。
【0037】
以下の実施例は、上記に開示された種々の態様を説明するものであって、いかなる点においても本発明を限定するものと解釈されない。これらの実施例は、活性化PEG(例えばp−ニトロフェニルカルボネート誘導体)をブタウリカーゼの突然変異タンパク質に結合することにより調製されるPEG−ウリカーゼを記載する。これらの実施例は、非修飾酵素の尿酸分解活性の少なくとも約75%を保持し、長期投与によく適しているウリカーゼの実質的非免疫原性結合体を製造するために当業者に指針を提供する。
【実施例】
【0038】
実施例1
ウリカーゼの調製用イオン交換クロマトグラフィー
調製用イオン交換クロマトグラフィーを高速タンパク質精製用液体クロマトグラフィー(FPLC)装置にて行った(Amersham Pharmacia, Piscataway, NJ)。Mono Qカラム(1×10cm、Amersham Pharmacia)を、50mM炭酸ナトリウム、pH10.3、0.1M塩化ナトリウム(緩衝液A)から50mM炭酸ナトリウム、pH10.3、0.6M塩化ナトリウム(緩衝液B)の勾配で、0.5ml/分の流速にて溶出させた。但し、試料は低流速にて負荷した。この技法は、PKSウリカーゼ溶液(pH10.3)25mlを分画するために用いられた。PKSウリカーゼは、Bio-Technology General Limited(Rehovot, Israel)から入手した。後者は組換えブタウリカーゼであり、ブタウリカーゼ親配列のリシン(K)1残基およびセリン(S)1残基がそれぞれアルギニン1残基およびスレオニン1残基と置換されている(Lee et al. (1988) Science 239:1288-1291; Wu et al.(1989) Proc. Natl. Acad. Sci. U.S.A. 86:9412-9416)。試料を負荷した後、緩衝液A100mlにてカラムを洗浄した。ウリカーゼのピークは、31mlの0〜26%の緩衝液Bの直線勾配の最後に溶出し始めた。ウリカーゼのほとんどは、26%緩衝液Bを含む緩衝液7mlにより定組成的に溶出した。回収されたウリカーゼの残部は89mlの26〜100%の緩衝液Bの直線勾配により溶出した。4mlまたは6mlの画分を集めた。画分#4〜11の一定分量をウリカーゼおよび総タンパク質に関してアッセイし(図1)、実施例2(図2および3)に記載するように、サイズ排除高速液体クロマトグラフィー(HPLC)により分析した。実施例3に記載するように、画分#5〜10の残部はPEGと結合した。実施例2における分析結果に基づいて、図1に示すように、画分#5および6のPEG結合体は「低塩プール」として合わせ、画分#7〜10のPEG結合体は「高塩プール」として合わせた。
【0039】
実施例2
光散乱および紫外線吸光度によりモニターされるウリカーゼのサイズ排除クロマトグラフィー
室温にて、Superdex 200カラム(1×30cm、Amersham Pharmacia Biotech)にて、実施例1のPKSウリカーゼの調製用Mono Qカラムクロマトグラフィーからの非分画PKSウリカーゼおよび選択した画分について、サイズ排除HPLCを行った。熱分離(Thermo Separations)HPLC(Sunnyvale, CA)の吸光度モニター(UV 2000)からの溶出液をWyatt Technologies(Santa Barbara, CA)製のMiniDawn検出器を用いて、入射光に対して90°での光散乱により分析した。
【0040】
図2〜4に示した結果はウリカーゼサブユニットの四量体、八量体、およびより大きい凝集体の分解能、ならびに各種試料におけるウリカーゼのこれらの形態から検出されるシグナルの種々な比率を示している。濃度に正比例する吸光度シグナルと異なり、光散乱シグナルは生成物の濃度と光散乱ユニットの大きさの積に比例する。極少量の高凝集ウリカーゼに対する光散乱検出器の感度の結果は、ボイド容量(約7ml)にてまたはその付近で溶出する最も大きい凝集体の存在を明らかにした。
【0041】
実施例3
PEGウリカーゼ結合体の合成
非分画PKSウリカーゼ(Bio-Technology General Limitedから)および実施例1のMono Qカラムからの画分中のウリカーゼをShearwater Polymers(Huntville, AL)から得られるPEGのp−ニトロフェニルカーボネート(NPC−PEG)を用いて10kDaのPEGに結合させた。フェニルクロロホルメートを用いたPEGからのNPC−PEGの調製は、数種の報告書に示されており(例えば、Veronese, FM, et al., (1995) Appl Biochem Biotechnol 11:141-152; Kito, M, et al., (1996) J Clin Biochem Nutr 21:101-111)、NPC−PEGは、本発明者等を含むこれまでの研究者により、タンパク質結体の合成のために用いられてきた(例えば、上述のVeronese et al.; Sherman, MR, et al., in JM Harris, et al., (Eds.) Poly(ethylene glycol) Chemistry and Biological Applications. ACS Symposium Series 680(pp. 155-176) Washington, DC: American Chemical Society)。ウリカーゼの各サブユニットに結合する10kDのPEGの鎖数は、Kunitani, M, et al., (1991) J Chromatogr 588:125-137に記載される方法により、6個であることが測定された。
【0042】
実施例4
ウリカーゼおよびPEGウリカーゼのin vivo血清持続性ならびに免疫原性
実施例3の方法に従い調製した組換え哺乳類ウリカーゼのPEG結合体を注射用に、リン酸緩衝生理食塩水(PBS)中1mgタンパク質/ml、pH7.4に調整した。試料を凍結し、分析または注射まで保存した。8匹のBALB/c雌マウス群への注射に先立ち、試料を最高1時間まで37℃に加温した。本研究の開始時点において、マウス群は18〜22gの範囲の平均体重を有していた。
【0043】
全てのマウスの体重をモニターし、注射に対する副作用の兆候または健康障害の他の兆候を記録した。週毎の各6回の注射の24時間後、動物をケタミンで麻酔し、眼窩後部から100〜200μlの血液を得た(但し、より多くの容量を収集する場合は、屠殺(全採血))。血清は、2〜8℃で4時間〜32時間、凝固させた血液から調製した。血清を20℃で保存した。血清を、実施例5の記載のように尿酸分解活性に関して分析し、実施例6の記載のようにウリガーゼに対する抗体に関して分析した。
【0044】
実施例5
PEGウリカーゼを注射したマウス由来の血清中のPEGウリカーゼの尿酸分解活性アッセイ
紫外線光吸光度に基づく活性アッセイ(UVアッセイ)を、I. Fridovich(J Biol Chem. (1965) 240:2491-2494)の方法のマイクロプレート改作物にて、200mMホウ酸ナトリウム(pH9.2)中で基質として100μM尿酸を用いて行った。UV透過ボトムを有する96ウェルプレート(Costar, Corning, NY)において、Molecular Devices(Sunyvale, CA)製SpectraMAX 250マイクロプレートリーダーを用いて、室温にて15分間、292nmでの吸光度の減少をモニターした。データを、10%〜40%の基質が酸化される間に行われた吸光度測定の最大傾き(ミリ吸光度単位/分)を見つけることにより分析した。このアッセイで得られた結果を図1および5に示した。
【0045】
サブユニット1つにつき10kDaのPEGの6本の鎖に結合したPKSウリカーゼ(6×10kDaPEG PKS)を初めて注射したマウスの血清の平均半減期は、注射の24時間および72時間後に得た血清のデータに基づいて、29±4時間であった。
【0046】
別個の実験において、PEGウリカーゼを注射したマウスの血清における検出可能な尿酸分解活性は−20℃での保存中に下降し、この活性の最大の回収はアッセイ前の37℃での4時間のインキュベーションにより得られることを確立した。図5は、毎週の6×10kDaPEG PKSウリカーゼの反復注射後の尿酸分解活性の回復は、実施例3の方法に従ったPEG化の前に、実施例1のように、酵素をMono Qカラムクロマトグラフィーにて酵素を精製したときに最大であったことを示している。回復は、実施例1の高塩溶出プールから調製した結合体の注射後に最も高く(図1参照)、それは非常に大きい凝集体の最も低い含有量を有していた(図3の画分7〜10の光散乱プロフィールを参照)。中程度の回復が、実施例1のMono Qカラムからの低塩溶出プールから調製された結合体において得られ、また最も低い回復は非分画PKSウリカーゼから作製した結合体において得られ、それは非常に大きい凝集体の最も高い含有量を有していた(図2参照)。上述のUVアッセイを用いるか、またはP. Fossati et al.(J.Clin Chem(1980) 26:227-231)より適用した比色アッセイを用いるかに関わらず、かつ血清をアッセイする前に37℃でインキュベートしたかどうかに関わらず、反復注射後の血清中において、同じ順番(高塩プール>低塩プール>非分画ウリカーゼ)の回復された相対活性が観察された。
【0047】
実施例6
PEG−ウリカーゼを注射したマウスからの血清の酵素結合免疫吸着アッセイ(ELISA)
96ウエルイムロン2プレート(Dynex Technologies;VWR Scientific, San Francisco,
CAから)に結合されたブタウリカーゼを用いて、非競合的ELISAアッセイを実施した。一次抗血清は、実施例3の方法にしたがって調製したウリカーゼまたは6×10kDaPEG結合体を注射したマウスからのものであった。B. Porstmann et al. (J Clin. Chem. Clin. Biochem. (1981) 19:435-440)により記載されているように、二次抗体は、ホースラディッシュペルオキシダーゼに結合されたヤギ抗マウスIgG(Calbiochem-Novabiochem #401 253, La Jolla, CA)であり、そして基質はo−フェニレンジアミンジヒドロクロリド(Sigma P-9187, St. Louis, MO)であった。
【0048】
図6は、非競合的ELISA分析の結果を示す。結果は、実施例1のMono Qカラムからの高塩溶出液(図1に示されている)から実施例3の方法にしたがって合成した6×10kDaPEG PKSウリカーゼが、毎週注射を6週間施された8匹のマウスのいずれにおいても検出可能な免疫応答を生じなかったことを示す。実施例3の方法により非分画PKSウリカーゼから調製された結合体を注射した2〜3匹のマウスは、低いがしかし検出可能な免疫応答を示した。免疫応答の最高発生率は、実施例1のMono Qカラムからの低塩溶出液プールから実施例3の方法にしたがって調製された結合体を注射されたマウスにおいてであった。
【0049】
実施例2に記載されているようなサイズ排除HPLC分析用光散乱検出器の利益を用いない場合、ウリカーゼの八量体形態のものでない最大凝集体の存在は、実施例5で観察されたように、反復注射後にPEG−ウリカーゼ結合体の回復の漸次低減(図5)に、ならびに実施例6で観察されたように、BALB/cマウスにおける免疫原性の増大(図6)に関連するということが明白でなかった。これらの結果は、臨床用途のためのPEG−ウリカーゼの製造用出発物質として用いられるウリカーゼの特定のための重要な意味を有する。
【0050】
上記の発明は明快な理解のために説明および実施例により多少詳細に記載されてきたが、記載し、特許請求したものの精神および範囲を逸脱しない限り、ある種の変更および修正がなされうるということは、本発明の教示に鑑みて、当業者には容易に明らかである。
【特許請求の範囲】
【請求項1】
八量体より大きい凝集体を実質的に含有しない精製尿酸オキシダーゼ(ウリカーゼ)。
【請求項2】
前記ウリカーゼが、哺乳類ウリカーゼである請求項1記載のウリカーゼ。
【請求項3】
前記ウリカーゼが、ブタ肝臓、ウシ肝臓またはヒツジ肝臓のウリカーゼである請求項2記載のウリカーゼ。
【請求項4】
前記ウリカーゼが、組換え体である請求項1記載のウリカーゼ。
【請求項5】
前記ウリカーゼが、ブタ、ウシ、ヒツジまたはヒヒの肝臓ウリカーゼの配列を実質的に有する請求項4記載のウリカーゼ。
【請求項6】
前記ウリカーゼが、キメラである請求項4記載のウリカーゼ。
【請求項7】
前記キメラウリカーゼが、ブタ肝臓およびヒヒ肝臓のウリカーゼの一部を含有する請求項6記載のウリカーゼ。
【請求項8】
前記キメラウリカーゼがPKSウリカーゼである請求項7記載のウリカーゼ。
【請求項9】
前記ウリカーゼが、チロシン97がヒスチジンにより置換されたヒヒ肝臓ウリカーゼの配列を実質的に有する請求項4記載のウリカーゼ。
【請求項10】
前記ウリカーゼが、アミノ末端およびカルボキシ末端を含み、一方の末端または両端が短縮されている請求項4記載のウリカーゼ。
【請求項11】
前記ウリカーゼが、真菌または微生物のウリカーゼである請求項1記載のウリカーゼ。
【請求項12】
前記の真菌または微生物のウリカーゼが、黄色アスペルギルス(Aspergillus falvus)、アルトロバクター・グロビフォルミス(Arthrobacter globiformis)、バチルス種(Bacillus sp.)またはカンジダ・ウチリス(Candida utilis)から単離されるか、前記ウリカーゼのうちの1つの配列を実質的に有する組換え酵素である請求項11記載のウリカーゼ。
【請求項13】
前記ウリカーゼが、無脊椎動物ウリカーゼである請求項1記載のウリカーゼ。
【請求項14】
前記無脊椎動物ウリカーゼが、黄色ショウジョウバエ(Drosophila melanogaster)またはウスグロショウジョウバエ(Drosophila pseudoobscura)から単離されるか、あるいは前記ウリカーゼのうちの1つの配列を実質的に有する組換え酵素である請求項13記載のウリカーゼ。
【請求項15】
前記ウリカーゼが、植物ウリカーゼである請求項1記載のウリカーゼ。
【請求項16】
前記植物ウリカーゼが、ダイズ(Glycine max)の根粒から単離されるか、あるいは前記ウリカーゼの配列を実質的に有する組換え酵素である請求項15記載のウリカーゼ。
【請求項17】
ポリ(エチレングリコール)またはポリ(エチレンオキシド)に結合される請求項1記載のウリカーゼであって、前記結合体中の前記ウリカーゼが、八量体より大きい凝集体を実質的に含有しないウリカーゼ。
【請求項18】
前記ポリ(エチレングリコール)が、モノメトキシポリ(エチレングリコール)である請求項17記載のウリカーゼ結合体。
【請求項19】
前記ウリカーゼが、ウレタン(カルバメート)、第二アミンおよびアミドからなる群から選択される結合を介して前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)に結合される請求項17記載のウリカーゼ。
【請求項20】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)が、約5kDa〜30kDaの分子量を有する請求項17記載のウリカーゼ結合体。
【請求項21】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)が、約10kDa〜20kDaの分子量を有する請求項20記載のウリカーゼ結合体。
【請求項22】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が、ウリカーゼサブユニット1つにつき約2〜12である請求項17記載のウリカーゼ結合体。
【請求項23】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が、ウリカーゼサブユニット1つにつき約6〜10である請求項22記載のウリカーゼ結合体。
【請求項24】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が、ウリカーゼサブユニットにつき約7〜9である請求項23記載のウリカーゼ結合体。
【請求項25】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)が、線状である請求項17記載のウリカーゼ結合体。
【請求項26】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)が、分枝状である請求項17記載のウリカーゼ結合体。
【請求項27】
体液または組織中の尿酸レベルを低下させるための薬学的組成物であって、請求項17記載の結合体および薬学的に許容可能な担体を含む組成物。
【請求項28】
前記組成物が、凍結乾燥により安定化され、非経口投与に適した溶液を提供するための再構成時に溶解される、請求項27記載の薬学的組成物。
【請求項29】
低減した免疫原性を有するウリカーゼの精製方法であって、ウリカーゼ画分中の八量体より大きいウリカーゼ凝集体を分離する工程と、精製ウリカーゼからこのような凝集体を排除する工程とを包含する方法。
【請求項30】
前記分離工程が、イオン交換クロマトグラフィー、サイズ排除クロマトグラフィーおよび限外濾過からなる群から選択される請求項29記載の方法。
【請求項31】
前記分離工程が、ウリカーゼ画分中の八量体より大きい凝集体を検出する工程と、前記凝集体を含有する前記画分を排除する工程とを包含する請求項30記載の方法。
【請求項32】
前記検出工程が、光散乱の測定を包含する請求項31記載の方法。
【請求項33】
請求項29記載の方法により調製される単離ウリカーゼ。
【請求項34】
明細書に具体的に記載された単離ウリカーゼ。
【請求項1】
八量体より大きい凝集体を実質的に含有しない精製尿酸オキシダーゼ(ウリカーゼ)。
【請求項2】
前記ウリカーゼが、哺乳類ウリカーゼである請求項1記載のウリカーゼ。
【請求項3】
前記ウリカーゼが、ブタ肝臓、ウシ肝臓またはヒツジ肝臓のウリカーゼである請求項2記載のウリカーゼ。
【請求項4】
前記ウリカーゼが、組換え体である請求項1記載のウリカーゼ。
【請求項5】
前記ウリカーゼが、ブタ、ウシ、ヒツジまたはヒヒの肝臓ウリカーゼの配列を実質的に有する請求項4記載のウリカーゼ。
【請求項6】
前記ウリカーゼが、キメラである請求項4記載のウリカーゼ。
【請求項7】
前記キメラウリカーゼが、ブタ肝臓およびヒヒ肝臓のウリカーゼの一部を含有する請求項6記載のウリカーゼ。
【請求項8】
前記キメラウリカーゼがPKSウリカーゼである請求項7記載のウリカーゼ。
【請求項9】
前記ウリカーゼが、チロシン97がヒスチジンにより置換されたヒヒ肝臓ウリカーゼの配列を実質的に有する請求項4記載のウリカーゼ。
【請求項10】
前記ウリカーゼが、アミノ末端およびカルボキシ末端を含み、一方の末端または両端が短縮されている請求項4記載のウリカーゼ。
【請求項11】
前記ウリカーゼが、真菌または微生物のウリカーゼである請求項1記載のウリカーゼ。
【請求項12】
前記の真菌または微生物のウリカーゼが、黄色アスペルギルス(Aspergillus falvus)、アルトロバクター・グロビフォルミス(Arthrobacter globiformis)、バチルス種(Bacillus sp.)またはカンジダ・ウチリス(Candida utilis)から単離されるか、前記ウリカーゼのうちの1つの配列を実質的に有する組換え酵素である請求項11記載のウリカーゼ。
【請求項13】
前記ウリカーゼが、無脊椎動物ウリカーゼである請求項1記載のウリカーゼ。
【請求項14】
前記無脊椎動物ウリカーゼが、黄色ショウジョウバエ(Drosophila melanogaster)またはウスグロショウジョウバエ(Drosophila pseudoobscura)から単離されるか、あるいは前記ウリカーゼのうちの1つの配列を実質的に有する組換え酵素である請求項13記載のウリカーゼ。
【請求項15】
前記ウリカーゼが、植物ウリカーゼである請求項1記載のウリカーゼ。
【請求項16】
前記植物ウリカーゼが、ダイズ(Glycine max)の根粒から単離されるか、あるいは前記ウリカーゼの配列を実質的に有する組換え酵素である請求項15記載のウリカーゼ。
【請求項17】
ポリ(エチレングリコール)またはポリ(エチレンオキシド)に結合される請求項1記載のウリカーゼであって、前記結合体中の前記ウリカーゼが、八量体より大きい凝集体を実質的に含有しないウリカーゼ。
【請求項18】
前記ポリ(エチレングリコール)が、モノメトキシポリ(エチレングリコール)である請求項17記載のウリカーゼ結合体。
【請求項19】
前記ウリカーゼが、ウレタン(カルバメート)、第二アミンおよびアミドからなる群から選択される結合を介して前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)に結合される請求項17記載のウリカーゼ。
【請求項20】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)が、約5kDa〜30kDaの分子量を有する請求項17記載のウリカーゼ結合体。
【請求項21】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)が、約10kDa〜20kDaの分子量を有する請求項20記載のウリカーゼ結合体。
【請求項22】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が、ウリカーゼサブユニット1つにつき約2〜12である請求項17記載のウリカーゼ結合体。
【請求項23】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が、ウリカーゼサブユニット1つにつき約6〜10である請求項22記載のウリカーゼ結合体。
【請求項24】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)鎖の平均鎖数が、ウリカーゼサブユニットにつき約7〜9である請求項23記載のウリカーゼ結合体。
【請求項25】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)が、線状である請求項17記載のウリカーゼ結合体。
【請求項26】
前記ポリ(エチレングリコール)またはポリ(エチレンオキシド)が、分枝状である請求項17記載のウリカーゼ結合体。
【請求項27】
体液または組織中の尿酸レベルを低下させるための薬学的組成物であって、請求項17記載の結合体および薬学的に許容可能な担体を含む組成物。
【請求項28】
前記組成物が、凍結乾燥により安定化され、非経口投与に適した溶液を提供するための再構成時に溶解される、請求項27記載の薬学的組成物。
【請求項29】
低減した免疫原性を有するウリカーゼの精製方法であって、ウリカーゼ画分中の八量体より大きいウリカーゼ凝集体を分離する工程と、精製ウリカーゼからこのような凝集体を排除する工程とを包含する方法。
【請求項30】
前記分離工程が、イオン交換クロマトグラフィー、サイズ排除クロマトグラフィーおよび限外濾過からなる群から選択される請求項29記載の方法。
【請求項31】
前記分離工程が、ウリカーゼ画分中の八量体より大きい凝集体を検出する工程と、前記凝集体を含有する前記画分を排除する工程とを包含する請求項30記載の方法。
【請求項32】
前記検出工程が、光散乱の測定を包含する請求項31記載の方法。
【請求項33】
請求項29記載の方法により調製される単離ウリカーゼ。
【請求項34】
明細書に具体的に記載された単離ウリカーゼ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−188861(P2011−188861A)
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願番号】特願2011−88663(P2011−88663)
【出願日】平成23年4月12日(2011.4.12)
【分割の表示】特願2001−558218(P2001−558218)の分割
【原出願日】平成13年2月7日(2001.2.7)
【出願人】(501052823)マウンテン ビュー ファーマシューティカルズ,インコーポレイテッド (9)
【出願人】(507189666)デューク ユニバーシティ (25)
【Fターム(参考)】
【公開日】平成23年9月29日(2011.9.29)
【国際特許分類】
【出願日】平成23年4月12日(2011.4.12)
【分割の表示】特願2001−558218(P2001−558218)の分割
【原出願日】平成13年2月7日(2001.2.7)
【出願人】(501052823)マウンテン ビュー ファーマシューティカルズ,インコーポレイテッド (9)
【出願人】(507189666)デューク ユニバーシティ (25)
【Fターム(参考)】
[ Back to top ]

