非常に速い皮膚及び膜浸透速度を有するNSAIAプロドラッグ及びその新規医薬使用
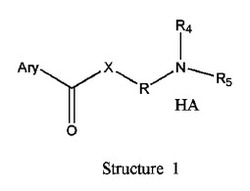
化学構造1、2a、2b、2c、又は2dの、新規な正荷電したNSAIAプロドラッグを設計し合成した。
【化1】

上に示す化合物は、適切なハライド化合物を用いて、NSAIA金属塩、有機塩基性塩又は固定化した塩基性塩から調製できる。本発明においてプロドラッグの正荷電したアミノ基は、水中での薬剤の溶解度を非常に大きくし、膜のリン酸ヘッドグループの負荷電と結合する。この結合は膜をやや不安定化し、プロドラッグの親油性部分に対していくらかの余地を作ることができ、プロドラッグの結合によりわずかに「ひび」が入る場合がある。これによりプロドラッグは膜内に入るようになる。pH7.4においてはアミノ基の約99%がプロトン化される。アミノ基がプロトン化されないときにはプロドラッグのアミノ基と膜のリン酸ヘッドグループとの間の結合は乖離し、プロドラッグは完全に膜に入ることになる。
【化1】

上に示す化合物は、適切なハライド化合物を用いて、NSAIA金属塩、有機塩基性塩又は固定化した塩基性塩から調製できる。本発明においてプロドラッグの正荷電したアミノ基は、水中での薬剤の溶解度を非常に大きくし、膜のリン酸ヘッドグループの負荷電と結合する。この結合は膜をやや不安定化し、プロドラッグの親油性部分に対していくらかの余地を作ることができ、プロドラッグの結合によりわずかに「ひび」が入る場合がある。これによりプロドラッグは膜内に入るようになる。pH7.4においてはアミノ基の約99%がプロトン化される。アミノ基がプロトン化されないときにはプロドラッグのアミノ基と膜のリン酸ヘッドグループとの間の結合は乖離し、プロドラッグは完全に膜に入ることになる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、非常に速い皮膚及び血液脳関門浸透速度を有する、非ステロイド抗炎症剤(NSAIA)の正荷電した水溶性プロドラッグの設計及び調製と、糖尿病(I型及びII型)、血糖及び血中脂質の異常レベル、脳卒中、心臓発作等の心臓及び血管疾患、アルツハイマー病、パーキンソン病及び他の神経変性疾患、乾癬、円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患、筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状、及び肛門掻痒、前立腺炎、前立腺膀胱炎、食道静脈瘤、自己免疫性肝炎、自己免疫性腎炎、結腸直腸炎、腸炎、静脈炎及び他の炎症、皮膚癌、乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌、傷、異常血管性皮膚病変、あざ、ほくろ(母斑)、スキンタグ、高齢スポット(肝斑)、及び他の皮膚疾患の治療及び予防における新規医薬使用と、に関する。これらのプロドラッグは、経皮吸収促進剤の補助なしに経皮投与できる。
【背景技術】
【0002】
NSAIAは、慢性関節リウマチ、変形性関節症及び強直性脊椎炎の徴候及び症状を緩和するために用いられる。NSAIAは、胆石疝痛、発熱、及び会陰切開の痛みの治療において単独又は補助として用いられる。これは、痛風、急性片頭痛、及び腎疝痛、並びに白内障抽出術を受ける患者の術後炎症治療にも用いられる。アスピリンは、心臓及び血管の疾患予防に用いられる。
【0003】
残念ながら、消化不良、胃十二指腸出血、胃の潰瘍、胃炎等の非常に顕著な胃腸障害という、多数の副作用がNSAIA使用には伴う。Fishman(Fishman;Robert、米国特許第7052715号)は、痛み又は炎症の遠位領域を効果的に治療する目的では、血流中においてかなりの濃度レベルに達しなければならないという、経口医薬に伴う追加的な問題点を示した。このレベルは、痛み又は傷の特定部位を正確に目標とすることが可能な場合に必要となるものよりも、ずっと高いことが多い。フィッシュマン及び多くの報告者により(Van Engelenら、米国特許第6416772号;Macridesら、米国特許第6346278号;Kirbyら、米国特許第6444234号、Pearsonら、米国特許第6528040号、及びBotknechtら、米国特許第5885597)、処方によって経皮的に塗布するための送達システムの開発が試行されてきた。Songらは、ジクロフェナクジエチルアンモニウム塩を含む抗炎症鎮痛薬のための経皮的薬物送達システムを開発した(Songら、米国特許第6723337号)。Donatiらは、ヘパリン及びジクロフェナクを含有する局所使用するための膏薬を開発した(Donatiら、米国特許第6592891号)。Kawajiらは、ジクロフェナクナトリウム塩を含有する外用の油性パッチを開発した(Kawajiら、米国特許第6262121号)。Effingらは、ジクロフェナクを経皮的に送達する装置を開発した(Effingら、米国特許第6193996号)。しかしながら、処方によって患者内に治療上有効なNSAIAの血漿濃度を送達することはたいへん困難である。Susan Milosovichらは、テストステロニル−4−ジメチルアミノブチラートを設計し調製した。HCl(TSBH)は、親油性部分及び生理的pHにおいてプロトン化された形式で存在する第三級アミン基を有する。彼らは、プロドラッグ(TSBH)が、薬物(TS)自体の約60倍の早さでヒトの皮膚を通じて拡散することを見出した(Susan Milosovichら、J.Pharm.Sci.、第82巻、227ページ、1993年)。
【発明の概要】
【発明が解決しようとする課題】
【0004】
NSAIAは、100年以上、医薬として使用されてきた。NSAIAは、慢性関節リウマチ及び変形性関節症の徴候及び症状の緩和、痛みを和らげる穏やかな緩和、発熱の低減、及び月経困難症の治療に適応される。これは、世界的に最も広範に使用される薬物である。
【0005】
残念ながら、消化不良、胸焼け、嘔吐、胃十二指腸出血、胃の潰瘍、胃炎等の非常に顕著な胃腸障害という、多数の副作用がNSAIA使用には伴う。NSAIAにより引き起こされる胃十二指腸出血は、一般的に無痛であるが、糞便への失血を導く可能性があり、持続的な欠乏性貧血を招く場合がある。
【0006】
経皮送達システムは、胃腸管を直接的に傷つけることと、胃腸管及び肝臓における「初回通過代謝」により生じる薬物の不活性化とを、回避する助けとなる。従来の経皮吸収促進剤を用いる経皮的薬物送達システムには限界がある。第一に、浸透速度は非常に遅い(μg/cm2/時間のスケール)。第二に、大量の促進剤が患者体内に入ることになる。
【課題を解決するための手段】
【0007】
経皮送達システムは、胃腸管を直接的に傷つけることと、胃腸管及び肝臓における「初回通過代謝」により生じる薬物の不活性化とを、回避する助けとなる。従来の経皮吸収促進剤を用いる経皮的薬物送達システムには限界がある。第一に、浸透速度は非常に遅い(μg/in2/時間のスケール)。第二に、大量の促進剤が患者体内に入ることになり、余分な副作用を生じる場合がある。第三に、経皮吸収促進剤の使用による従来の経皮的薬物送達においては、処方中の高濃度促進剤が薬物の皮膚通過の補助となりうるが、促進剤及び薬物が皮膚に入るときには、促進剤の濃度は非常に薄められ、薬物分子がより生物的な膜を通過するための助けにはならず、薬物分子は皮下脂肪層に累積することになり、累積した薬物は非常に深刻かつ致死的ですらある副作用を生じる場合がある。
【0008】
薬物の生物活性は、全身循環に達する相対的な薬物投与量を測定する。しかしながら、全身循環は、ほとんどの薬物にとって「作用部位」ではない。薬物分子は、たとえ全身循環に達した場合であっても、より生物的な膜を通過しなければならず、これは消化器官の膜よりも透過性が低く、「作用部位」と呼ばれるとらえどころのない流体に達する前に分子間及び分子内流体と相互作用し、このためにほとんどの薬物は、「作用部位」に達する前に、腸粘膜、肝臓、腎臓及び肺により代謝されることになる。この状況は、治療効果が非常に低くなるだけでなく、腸粘膜、肝臓、腎臓及び肺に有毒な負担も発生する。様々な膜における薬物の浸透速度を増すことができれば、薬物の治療効果及び臨床反応は非常に向上するので、必要な薬物服用はより少量となり、副作用を低減することになる。非常に速い皮膚及び膜の浸透速度を有するプロドラッグのための、経皮的なプロドラッグ送達は、局所疾患だけでなく、全身性疾患に対しても非常に有用となる。これらのプロドラッグは、親薬物の数十倍から数百倍の有効性を有するため、通常薬物の数十分の一から数百分の一のみを必要とし、副作用は非常に少なくなる。これは、経皮的な薬物送達のみならず、任意の他の薬物送達システム(経口、皮下、静脈内、吸入、及び経鼻)に対しても有用となる。
【0009】
発明者らは、親油性部分と、生理的pHにおいてプロトン化された形式(親水性部分)で存在する第一級、第二級、第三級アミン基(好適には第三級アミン基)とを有する薬物が、皮膚、血液脳、及び血液胎盤の関門を非常に高速に(mg/cm2/時間のスケールで)浸透できることを見出した。これらのプロドラッグの設計原理を以下に示す。
1.本プロドラッグは、親油性部分と、生理的pHにおいてプロトン化された形式(親水性部分)で存在する第一級、第二級、第三級アミン基(好適には第三級アミン基)とを有しなければならない。
2.全てのNSAIAプロドラッグは、生理的pHにおいてプロトン化された形式(親水性部分)で存在する第一級、第二級、第三級アミン基を、一つ又は二つ(好適には一つ)のみ有するべきである。
3.第一級、第二級、第三級アミン基の主要な役割は、皮膚、膜、血液脳、血液胎盤、傷、又は他の関門を薬物が通過する助けとなることである。第一級、第二級、第三級アミン基は、無毒かつ親薬物の生物活性を仲介する任意の構造とすることができる。
【0010】
発明者らは、一般式(1)の「化学構造1」を有する全てのNSAIAプロドラッグのいくつかを、特許として開示した(国際出願第PCT/IB2006/052732号、第PCT/IB2006/052318号、第PCT/IB2006/052815号、第PCT/IB2006/052563号、第PCT/IB2006/052575号、第PCT/IB2006/053741号、第PCT/IB2006/053091号、第PCT/IB2006/053090号、第PCT/IB2006/052549号)。
【化1】

【0011】
式中、Rは分岐又は直鎖の−(CH2)n−を表し、−(CH2)n−においてn=0,1,2,3,4,5,6,7,8,9,10,11,12,…であり、いずれのCH2がO、S、NR8、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール残基、又は薬理学的に許容できる任意の他の部分と置き換えられてもよく;R1又はR2は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール部分、又は薬理学的に許容できる任意の他の部分と置き換えられてもよく;Xは、O、NH、NR8、S、又は存在しないことを表し;R8は、H、OH、Cl、F、Br、I、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;R9は、H、OH、Cl、F、Br、I、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;HAは、存在しない、HCl、HBr、HF、HI、HOAc、クエン酸、又は薬理学的に許容できる任意の酸を表す。全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、分岐又は直鎖であり、C、H、O、Cl、Br、F、I、P、S、N又は任意の他の薬理学的に許容できる原子を含んでもよく、単結合、二重結合、及び/又は三重結合を含んでもよく;全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、アキラル又はキラルでもよく;基がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよく;Ary−は次式を表すが限定されず、
【化2】

【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

式中、Rxは、H、CH3、CH3O、OH、CH3CH2、CF3、CHF2、CH2F、Cl、F、Br、Fを表し;Ryは、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;X1又はX4は、CH2、S、O、NH、又はCOを表し;X2又はX5は、CH、CR8、又はNを表し;X3は、O、S、NH、又はNR8を表し;Y、Y1、Y2、Y3、Y4、Y5、又はY6は、独立してH、HO、CH3COO、RyCOO、HS、NO2、CN、CH3COS、NH2、CH3CONH、RyCONH、CH3、CH3CH2、C3H7、C4H9、CH3O、CH3CH2O、C3H7O、Cl、F、Br、I、CH3S、CHF2O、CF3O、CF3CF2O、C3F7O、CF3、CF3CF2、C3F7、C4F9、CH3SO2、RySO2、CH3SO、RySO、CH3CO、CH3CH2COを表し;いずれのAry−は、アキラル又はキラルであり;Ary−がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよい。
【0012】
発明者らは、第一級、第二級、第三級アミン基の主要な役割は、皮膚、膜、血液脳、血液胎盤、傷、又は他の関門を薬物が通過する助けとなることのみであるため、第一級、第二級、第三級アミン基は、無毒かつ親薬物の生物活性を仲介する任意の構造とすることができることを見出した。したがって、発明者らは、この性質に対して様々な種類のアミン基を設計し調製した。新規なNSAIAプロドラッグは、一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」を有する。
【化12】

式中、Rは分岐又は直鎖の−(CH2)n−を表し、−(CH2)n−においてn=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R1は分岐又は直鎖の−(CH2)a−を表し、−(CH2)a−においてa=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R2は分岐又は直鎖の−(CH2)b−を表し、−(CH2)b−においてb=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R3は分岐又は直鎖の−(CH2)c−を表し、−(CH2)c−においてc=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R4はH、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;R5は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R6、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;R6は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R5、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく、R7は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R5、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく、Xは、存在しない、O、NH、NR6又はSを表し;一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」におけるAry−は、一般式(1)の「化学構造1」におけるAry−と同一に定義され、HAは、存在しない、HCl、HBr、HF、HI、HOAc、クエン酸、又は薬理学的に許容できる任意の酸を表す。全てのR、R1、R2、R3、R4、R5、R6、R7、又は−(CH2)n−基は、分岐又は直鎖であり、C、H、O、Cl、Br、F、I、P、S、N又は任意の他の薬理学的に許容できる原子を含んでもよく、単結合、二重結合、及び/又は三重結合を含んでもよく;全てのR、R1、R2、R3、R4、R5、R6、R7、又は−(CH2)n−基は、アキラル又はキラルでもよく;基がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよい。
【0013】
薬物吸収は、消化管又は他の部位からのいずれでも、隔膜を通じる分子形式での薬物通過を必要とする。薬物は、最初に溶解しなければならず、薬物が好適な生物医薬特性を有している場合には、高濃度領域から低濃度領域へ、膜を通じて血中又は全身循環の中に通過することになる。全ての生物的な膜は、主要構成物として脂質を含有する。膜形成に支配的役割を演じる分子は、全てリン酸を含有する極性の大きなヘッドグループを有し、ほとんどの場合に二つの疎水性炭化水素テールを有する。膜は二層であり、親水性ヘッドグループは、両サイドにおいて水溶性領域に外向きとなる。親水性の高い薬物は、膜の疎水性層を通過できず、親水性の高い薬物は、その類似性のために膜の一部として疎水性の膜内にとどまることになり、効率的に内部の細胞質に入ることはできない。
【0014】
本発明の一つの目的は、経口投与を可能とする胃液中でのNSAIAの溶解度と、経皮的な(局所的な)投与を可能とする膜及び皮膚障壁を通過するNSAIAの浸透速度とを増すことにより、NSAIAの副作用を避けることである。本発明の最も重要な目標は、皮膚、細胞膜、特に脳細胞及び神経細胞の膜を浸透することができ、全身循環に極めて短時間とどまり、これにより親薬物の数百倍の有効性を有し、通常薬剤服用量の数十分の一から数百分の一のみを必要として副作用の発生を極めて少なくすることのできる、NSAIAプロドラッグを設計することである。これは、経皮的薬物送達だけでなく、他の薬物送達システム(経口、皮下、静脈内、吸入、及び経鼻等)にも有効であり、親薬物によっては治療できない多くの症状を治療することができる。これらの新規なNSAIAプロドラッグは、一般的に二つの構造上の特徴を有する。すなわち、これは、親油性部分と、生理的pHにおいてプロトン化される形式(親水性部分)で存在する第一級、第二級、又は第三級アミン基とを有する。このような親水性−親油性の均衡は、膜障壁を介しての効率的な通過に必要である(Susan Milosovichら、J.Pharm.Sci.、第82巻、227ページ、1993年)。正荷電したアミノ基は、水中での薬物の溶解度を非常に大きくする。これらのプロドラッグ上のアミノ基の正荷電は、膜のリン酸ヘッドグループの負荷電と結合することになる。したがって、膜又は皮膚の外側での局所的な濃度は非常に高く、高濃度領域から低濃度領域へのこれらのプロドラッグの通過を容易にすることになる。この結合は、膜をやや不安定化し、プロドラッグの親油性部分に対していくらかの余地を作ることができる。膜分子が移動するときには、膜は、プロドラッグの結合により、わずかに「ひび」が入る場合がある。これにより、プロドラッグは膜内に入るようになる。pH7.4においては、アミノ基の約99%のみがプロトン化される。アミノ基がプロトン化されないときには、プロドラッグのアミノ基と膜のリン酸ヘッドグループとの間の結合は乖離し、プロドラッグは完全に膜に入ることになる。プロドラッグのアミノ基が膜の反対側に移動してプロトン化されると、このときにはプロドラッグは、半流動体の濃縮された水溶液又はサスペンジョンである細胞基質に引き込まれる。消化管内の滞在が短時間であるため、本プロドラッグは、胃粘膜細胞の損傷を生じない。新規なプロドラッグのヒトの皮膚を介する浸透速度は、腹側及び背側大腿領域のヒト皮膚組織(厚さ360〜400μm)由来のフランツ改良型透過セルを用いて、試験管内で測定した。受容流体は、通常生理食塩水10mLに2%ウシ血清アルブミンで構成し、毎分600回転でかき混ぜた。プロドラッグ及び皮膚に入る薬物の経時的な累積量を、選択的高速液体クロマトグラフィ法により決定した。NSAIAプロドラッグの見かけのフラックス値は、0.1〜50mg/cm2/時間であった。この結果は、本プロドラッグは、その親薬物よりも少なくとも数百倍高速にヒトの皮膚を介して拡散することを示唆する。この結果は、ジアルキルアミノエチル基上の正荷電は、膜及び皮膚障壁を介する薬物の通過において重要な役割を有することを示唆する。
【0015】
新規なNSAIAプロドラッグは、皮膚障壁、血液脳関門、及び血液胎盤関門を浸透できる。無傷のラット皮膚を介してのプロドラッグ及びその親薬物の試験管内での浸透速度を比較した。エタノール1mL中20%のプロドラッグ又はその親薬物を、ラット(約200g)背部の約5cm2の領域に塗布して、ドナーを構成した。4時間後、ラットを殺し、メタノール5mLを血液1mL、肝臓1g、腎臓1g、脳1g(肝臓、腎臓又は脳は、pH7.2のバッファで3回洗浄した)に加え、混合物をホモジナイズした。次いで、試料を5分間超遠心分離し、HPLCを用いて分析した。結果を表1から表5に示す。
【0016】
【表1】

【0017】
【表2】

【0018】
【表3】

【0019】
【表4】

【0020】
【表5】

【0021】
エタノール1mL中20%のアスピリン、ジクロフェナク、ケトプロフェン、フェノプロフェン、又はイブプロフェンを、ラット背部の約5cm2の領域に塗布した。4時間後、ラットを殺し、メタノール5mLを血液1mL、肝臓1g、腎臓1g、脳1g(肝臓、腎臓又は脳は、pH7.2のバッファで3回洗浄した)に加え、混合物をホモジナイズした。いずれのラットの組織又は血漿中にも、これらの薬物は見られなかった。この結果は、NSAIAプロドラッグは、皮膚障壁、血液脳関門、及び他の膜障壁を、非常に高速に浸透することができるが、親であるNSAIAは、検出可能な量では皮膚障壁を浸透できないことを示している。
【0022】
一般式(1)の「化学構造1」のプロドラッグは、発明者らの特許(国際出願番号第PCT/IB2006/052732号、第PCT/IB2006/052318号、第PCT/IB2006/052815号、第PCT/IB2006/052563号、第PCT/IB2006/052575号、第PCT/IB2006/053741号、第PCT/IB2006/053091号、第PCT/IB2006/053090号、第PCT/IB2006/052549号)において、抗炎症性、鎮痛性、解熱性、及び抗リウマチ性の活性を示した。発明者らは、一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」のプロドラッグの全てが、抗炎症性、鎮痛性、解熱性、及び抗リウマチ性の活性を示すことを見出した。本発明の主要な目的は、NSAIAプロドラッグの新規な医薬利用である。
【0023】
炎症と癌との間の関係は周知である。Thea D.Tlsty博士は、講演において(Keystone Symposia:Inflammation and Cancer、米国コロラド州のブリッケンリッジ、2005年2月27日〜3月3日)シクロオキシゲナーゼ−2(COX−2)がアロマターゼ活性、血管新生、増殖、浸潤、及びプロスタグランジン合成を刺激することを述べている。プロスタグランジンの増加は、細胞死の阻害を導く。アスピリン及び他のNSAIAは、COX−1及びCOX−2を阻害する。大腸癌、食道癌、卵巣癌又は他の癌の全体的な相対リスクは、長期にアスピリンを摂取する人において低下する。しかしながら、癌細胞は、NSAIAが癌細胞に入らないよう、その膜構造を変化する場合がある。本発明の新規プロドラッグは、いかなる膜障壁にも浸透でき、癌の場所の外側皮膚領域に局所的に塗布することができ、全身暴露を極めて低くして癌細胞に大量のプロドラッグが入ることになる。
【0024】
NSAIAプロドラッグの抗腫瘍活性を評価するために、ヒト乳癌細胞(BCAP−37、各マウスに2−3mm3の腫瘍組織を用いた)をヌードマウス(BALB、12群、各群に7匹のマウス)に対し皮下的に異種移植した。14日後に、腫瘍は、50±10mm3(0.05ml)のサイズに増殖していた。次いで、30μlの5%(プロドラッグ1.5mgに等しい)ジエチルアミノエチルアセチルサリチラートアセチルサリチル酸塩(P−1、アセトン中);1−ピペリジンプロピル2[(2,6−ジクロロフェニル)アミノ]ベンゼンアセタート.AcOH(P−2、水中)、1−ピロリジンプロピル2−(3−ベンゾイルフェニル)プロピオナート.AcOH(P−3、水中)、4−ピペリジンメチル2−(3−フェノキシフェニル)プロピオナート.AcOH(P−4、水中)、3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOH(P−5、水中)、ジエチルアミノエチル1−(p−クロロベンゾイル)−5−メトキシ−2−メチルインドール3−アセタート.AcOH(P−11、水中)、2−(4−モルホリニル)エチル(Z)−5−フルオロ−2−メチル−1−[(4−メチルスルフィニル)フェニルメチレン]−1H−インデン−3−アセタート.AcOH(P−12、水中)、ジエチルアミノエチル2−(2,4−ジクロロフェノキシ)ベンゼンアセタート.AcOH(P−19、水中)、ジエチルアミノエチル2−(8−メチル−10,11−ジヒドロ−11−オキソジベンズ(b,f)オキゼピン−2−イル)プロピオナート.AcOH(P−37、水中)、1−ピロリジンプロピル2−[[(3−(トリフルオロメチル)フェニル)アミノ]ベンゾエート.AcOH(P−48、水中)、4−N,N−ジメチルアミノブチリルオキシ−2−メチル−N−2−ピリジニル−2H,1,2−ベンゾチアジン−3−カルボキサミド1,1−ジオキシド.HCl(P−51、アセトン中)を、8週ごとにヒト乳癌細胞の移植領域(前足付近)に局所塗布した。42日目における腫瘍サイズを、表6及び表7に示す。
【0025】
【表6】

【0026】
【表7】

【0027】
第二の抗腫瘍実験においては、ヒト大腸癌細胞(LS174J、2−3mm3の腫瘍組織を各マウスに用いた)を、ヌードマウス(BALB)に皮下的に異種移植した。7日後に、腫瘍は55±10mm3(0.055ml)のサイズに増殖していた。次いで、約30μLの5%(プロドラッグ1.5mgに等しい)ジエチルアミノエチルアセチルサリチラートアセチルサリチル酸塩(P−1、アセトン中);1−ピペリジンプロピル2[(2,6−ジクロロフェニル)アミノ]ベンゼンアセタート.AcOH(P−2、水中)、1−ピロリジンプロピル2−(3−ベンゾイルフェニル)プロピオナート.AcOH(P−3、水中)、4−ピペリジンメチル2−(3−フェノキシフェニル)プロピオナート.AcOH(P−4、水中)、3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOH(P−5、水中)、ジエチルアミノエチル1−メチル−5−(4−メチルベンゾイル)−1H−ピロール−2−アセタート.AcOH(P−13、水中)、2−(4−モルホリニル)エチル2−アミノ−3−ベンゾイルベンゼンアセタート.AcOH(P−16、水中)、ジエチルアミノエチル2−(10,11−ジヒドロ−10−オキソジベンゾ(b,f)チエピン−2−イル)プロピオナート.AcOH(P−36)、ジエチルアミノエチル2−[(2,3−ジメチルフェニル)アミノ]ベンゾエート.AcOH(P−46、水中)、ジエチルアミノエチル2−[(2,6−ジクロロ−3−メチルフェニル)アミノ]ベンゾエート.AcOH(P−47、水中)、N−(2−チアゾイル)−4−N,N−ジメチルアミノブチリルオキシ−2−メチル−2H,1,2−ベンゾチアジン−3−カルボキサミド1,1−ジオキシド.HCl(P−52、アセトン中)を、ヒト大腸癌細胞の移植領域(前足付近)に8週ごとに局所塗布した。30日目における腫瘍サイズを、表8及び表9に示す。
【0028】
【表8】

【0029】
【表9】

これらの結果は、NSAIAプロドラッグが非常に強い抗腫瘍活性を有し、副作用がないかほとんどないことも示している。
【0030】
サリチラートの低血糖効果は、100年以上前にドイツ人医師らによって最初に観察された(Edmund J.Hengesh、「Principles of medicinal chemistry」、第4版、591ページ、Williams&Wilkins社、1995年)。サリチラートは、グルコースによって刺激されるインシュリン分泌を高め、乳酸及びアラニンからの糖生成を阻害する(H.F.Woodsら、Clin.Exp.Pharmacol Physiol.、第1巻、534ページ、1974年)。ある種のサリチラートは、フリーの脂肪酸、トリグリセリド、及びコレステロールの血漿濃度を低下させる。血漿のフリー脂肪酸濃度が上昇すると、ブドウ糖の利用が阻害され、その濃度が低下すると低血糖作用に寄与することができる。残念ながら、血糖値及び血中脂質濃度の適切な制御を維持するためには、サリチラートの大量服用(毎日5g)が必要である。この服用レベルでは、胃の不快感、吐き気、嘔吐、耳鳴り等の、無数の副作用が頻繁に発生する。本発明の新規プロドラッグは、非常に速い皮膚及び膜の浸透速度を有する。これは、「作用部位」に非常に高速に到達でき、これらのプロドラッグの薬理的効果及び臨床反応は非常に向上するので、必要な薬物服用量はずっと少なく(親薬物の数百分の一から数十分の一のみを要する)、副作用の発生を非常に少なくすることになる。
【0031】
本発明のプロドラッグは、ラットモデル(SLAC/GK、2型糖尿病、n=7)において血糖値を低下させる。ジエチルアミノエチルアセチルサリチラートアセチルサリチル酸塩(P−1、アセトン中)の50%アセトン溶液;4−アセトアミドフェニルサリチリルジメチルアミノブチラート.HCl(P−6)、ジエチルアミノエチル5−(2,4−ジフルオロフェニル)アセチルサリチラート.5−(2,4−ジフルオロフェニル)アセチルサリチル酸塩(P−8)、ジエチルアミノエチルサリチルサリチラート.AcOH(P−9)、ジエチルアミノエチルサリチラート.AcOH(P−10)、ジエチルアミノエチル5−アセトアミド−アセチルサリチラート(P−58)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチル酸塩(P−59)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチルサリチル酸塩(P−60)(20mg/kgのNSAIAに等しい)を、5週間、1日1回(午前8時に)、ラット(被毛を剃った)背部(約1.5cm2)に経皮投与した。血糖値は、第2週から第5週までの、3日に1回、午後3時に(絶食なし)測定した。結果を表10に示す。血中脂質濃度は、第5週の最後に測定した。結果を表11に示す。
【0032】
【表10】

この結果は、NSAIAプロドラッグが、糖尿病ラットモデルにおいて非常に効果的に血糖値を低下させ、正常ラットの血糖値には影響しないことを示した。最も興味深いことは、処置を30日間停止した後に、ラットの血糖値が通常レベル(7〜8mmol/L、絶食なし)にとどまったことである。これは、本プロドラッグが血糖値を低下するだけでなく、糖尿病を治療できることも意味している。
【0033】
【表11】

この結果は、NSAIAプロドラッグが、糖尿病ラットモデルにおいて非常に効果的に血中脂質濃度(全コレステロール及びトリグリセリド)を低下し、HDLレベルには影響しないことを示した。
【0034】
胃液のpHは1から3である。リン酸ヘッドグループの負荷電は水素イオンによって中和され、これらのプロドラッグのアミノ基の正電荷は膜のリン酸ヘッドグループとは結合できないため、プロドラッグは、胃壁を介して通過することができず、胃を痛めたり悪くしたりすることがない。十二指腸のpHは約5〜7であり、プロドラッグは、十二指腸の粘膜を通過できる。膵臓が近傍にあり、プロドラッグの大部分は、肝臓、腎臓、及び全身循環に至る前にこれに入ることになり、ここで薬物は代謝されるので、これらのプロドラッグでは非常にわずかな服用量のみが必要であり、副作用の発生は非常に少数かつ低度となる。ジエチルアミノエチルアセチルサリチラート.アセチルサリチル酸塩(P−1、アセトン中)の20%アセトン溶液;4−アセトアミドフェニルサリチリルジメチルアミノブチラート.HCl(P−6)、ジエチルアミノエチル5−(2,4−ジフルオロフェニル)アセチルサリチラート.5−(2,4−ジフルオロフェニル)アセチルサリチル酸塩(P−8)、ジエチルアミノエチルサリチルサリチラート.AcOH(P−9)、ジエチルアミノエチルサリチラート.AcOH(P−10)、ジエチルアミノエチル5−アセトアミド−アセチルサリチラート(P−58)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチル酸塩(P−59)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチルサリチル酸塩(P−60)(20mg/kgのNSAIAに等しい)を、5週間、毎日、食事と共にラット(SLAC/GK、2型糖尿病、n=7)に経口投与した。血糖値は、第2週から第5週まで、3日ごとに1回、午後3時に測定した(絶食なし)。結果を表12に示す。血中脂質濃度は、第5週の最後に測定した。結果を表13に示す。
【0035】
【表12】

この結果は、プロドラッグが経口摂取され、親薬物よりも服用量がずっと少量であるときに、NSAIAプロドラッグが、糖尿病ラットモデルにおいて非常に効果的に血糖値を低下させ、正常ラットの血糖値には影響しないことを示した。
【0036】
【表13】

この結果は、プロドラッグが経口摂取され、親薬物よりも服用量がずっと少量であるときに、NSAIAプロドラッグが、糖尿病ラットモデルにおいて非常に効果的に血中脂質濃度を低下することを示した。
【0037】
本発明のプロドラッグは、ラットモデル(SLAC:NOD−IDDM、1型糖尿病、n=7)において血糖値を低下させる。ジエチルアミノエチルアセチルサリチラート.アセチルサリチル酸塩(P−1、アセトン中)の50%アセトン溶液;4−アセトアミドフェニルサリチリルジメチルアミノブチラート.HCl(P−6)、ジエチルアミノエチル5−(2,4−ジフルオロフェニル)アセチルサリチラート.5−(2,4−ジフルオロフェニル)アセチルサリチル酸塩(P−8)、ジエチルアミノエチルサリチルサリチラート.AcOH(P−9)、ジエチルアミノエチルサリチラート.AcOH(P−10)、ジエチルアミノエチル5−アセトアミド−アセチルサリチラート(P−58)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチル酸塩(P−59)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチルサリチル酸塩(P−60)(30mg/kgのNSAIAに等しい)を、7週間、1日1回(午前8時に)、ラット(被毛を剃った)背部(約1.5cm2)に経皮投与した。血糖値は、第4週から第7週までの、3日に1回、午後3時に(絶食なし)測定した。結果を表14に示す。
【0038】
【表14】

この結果は、NSAIAプロドラッグが、糖尿病(I型)マウスモデルにおいて非常に効果的に血糖値を低下することを示した。
【0039】
体重3.0から3.5kg(6〜7月齢)のチャイニーズシロウサギ18匹を選別し、3群に分けた(対照、P−1及びP10群、n=6)。実験の1時間前に、静脈血(1mL)を滅菌ボトルに吸引して凝固することにより、血栓を作製した。破断化及び低速な溶解を避けるため、自家移植の血液凝固物は、温度制御した(70℃)蒸留水で10分間安定化させた。麻酔後に、大腿回旋静脈を露出して遠位隔離し、より早期に隔離した大腿回旋静脈内に配置した留置カテーテル(20GA)を通じて、自家移植の血栓(0.05g/kg)を注射した。ジエチルアミノエチルアセチルサリチラート.アセチルサリチル酸塩(P−1、アセトン中、20mg/kg)及びジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチル酸塩(P−59、20mg/kg)の50%アセトン溶液を、ウサギ背部に局所塗布した。2日後に、アモバルビタールナトリウムの過剰静脈注射(60mg/kg)により、ウサギを安楽死させた。肺及び心臓を隔離し、血栓が肺動脈に存在するかどうかを観察した。肺は、10%ホルマリンに24時間浸漬した。塞栓された肺動脈に沿った連続横断面をパラフィン包埋し、ヘマトキシリン−エオシンで染色した。対照群においては、血小板の血栓及び混合した血栓が、注入した凝血を取り囲み、大サイズの血管並びに拡張した血管壁において、近位及び遠位方向の両方とも存在していた。これらの血管には、内皮細胞及び繊維細胞の過剰な増殖があった。加えて、急性の肺うっ血があった。P−1及びP−59群においては、両者の肺組織及び血管壁は正常であった。この結果は、血栓作用、及びその塞栓に付随する血栓の進行が、これらのNSAIAプロドラッグによって予防できることを示した。これらのプロドラッグは、脳卒中、心臓麻痺及び臓器移植拒絶反応の主要な原因である血液凝固の予防及び治療に、非常に有用でありうる。
【0040】
本発明のプロドラッグは、ウサギモデルにおいて、外傷を治癒し、切り傷や火傷跡を軟化して縮小する助けとなることができる。本プロドラッグにより治療したウサギの平均的な傷の面積は、チャイニーズシロウサギモデルにおいて、同一の切り傷に由来する対照のウサギのものの三分の一にすぎず、その傷は正常な無傷の組織と同様の柔軟さである。
【0041】
COX−1及びCOX−2は、動物の免疫応答において非常に重要な役割を演じる。NSAIAは、COX−1及びCOX−2を阻害する。本発明のNSAIAプロドラッグは、乾癬、円板状エリテマトーデス、全身性エリテマトーデス(SLE)、及び他の自己免疫疾患の治療に対して非常に有用でありうる。チャイニーズシロウサギ(n=4×6)背部の剃毛皮膚に、高濃度マラセジア(Malassezia)サスペンジョン(Rosenberg,E.W.ら、Mycopathologia、第72巻、147−154ページ、1980年)を、2週間、1日2回(午前7時及び午後7時)塗布し、乾癬様の病斑を発生させた。次いで、3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOH(P−5)、ジエチルアミノエチル1−メチル−5−(4−メチルベンゾイル)−1H−ピロール−2−アセタート.AcOH(P−13)、ジエチルアミノエチル5−(4−クロロベンゾイル)−1,4−ジメチル−1H−ピロール−2−アセタート.AcOH(P−14)、ジエチルアミノエチル1,8−ジエチル−1,3,4,9−テトラヒドロピラノ−[3,4−b]インドール−1−アセタート.AcOH(P−15)、ジエチルアミノエチル2−アミノ−3−(4−ブロモ−ベンゾイル)ベンゼンアセタート.AcOH(P−17)、ジエチルアミノエチル3−クロロ−4−(2−プロペニルオキシ)ベンゼンアセタート.AcOH(P−18)、ジエチルアミノエチル1−(4−クロロベンゾイル−5−メトキシ−2−メチル−1H−インドール−3−アセトキシアセタート.AcOH(P−20)、ジエチルアミノエチル4−(4−クロロフェニル)−2−フェニル−5−チアゾールアセタート.AcOH(P−21)、ジエチルアミノエチル3−(4−クロロフェニル)−1−フェニル−1H−ピラゾール−4−アセタート.AcOH(P−22)の5%水溶液を、高濃度マラセジアサスペンジョンの塗布(午前7時及び午後7時)の3時間後(午前10時及び午後10時)に、同一領域に塗布した。これらのプロドラッグ塗布の10日後に、病斑を分離した。
【0042】
抗エリテマトーデス活性の評価のため、5%ジエチルアミノエチルアセチルサリチラートアセチルサリチル酸塩(P−1、アセトン中、30mg/kg)、又は3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOH(P−5、水中、30mg/kg)を、円板状エリテマトーデス、全身性エリテマトーデスを有するマウス(MRL/LPR、n=5×3)背部の皮膚に、1日2回、局所塗布した。6週後、全ての皮膚病斑及びループス腎炎は、プロドラッグ処理マウスにおいては解消されたが、対照マウスの症状は悪化していた。
【0043】
これらの結果は、これらのNSAIAプロドラッグが、ヒトにおける乾癬、円板状エリテマトーデス、全身性エリテマトーデス(SLE)、多発性硬化症(MS)、及び他の自己免疫疾患の治療について有望な薬剤であることを示唆している。
【0044】
筋萎縮性側索硬化症(ALS)における細胞死の発症は、グルタメート媒介の興奮毒性、酸化的損傷、及びアポトーシスを含む場合がある。シクロオキシゲナーゼ−2は、脊髄ニューロン及び星状膠細胞に存在し、プロスタグランジンE2の合成を触媒する。プロスタグランジンE2が、星状膠細胞からのグルタメート放出を刺激する一方で、シクロオキシゲナーゼ−2は、炎症誘発性のサイトカイン、反応性の酸素種、及びフリーラジカルの生産に重要な役割も演じる。選択的シクロオキシゲナーゼ−2阻害剤であるセレコキシブを用いる治療は、ALSマウスの脊髄におけるプロスタグランジンE2の生産を顕著に阻害した。セレコキシブ治療は、衰弱及び体重減少の開始を顕著に遅延させ、生存を25%延長させた。治療したALSマウスの脊髄は、脊髄ニューロンの保存が顕著であり、星状膠細胞増生及び小膠細胞の活性化は低下することを示した(Merit.E.Cudkowiczら、Annals of neurology、第52巻、771−778ページ、2002年)。これらの結果は、シクロオキシゲナーゼ−2の阻害が、ALS患者に有益でありうることを示唆する。本発明のNSAIAプロドラッグは、皮膚及び神経細胞膜の障壁を、非常に速い速度で浸透でき(ほとんどのNSAIAは、効果的には神経細胞に浸透できない)、消化管を傷付けることなく経皮投与できるため、これらのプロドラッグは、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患、筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患の治療に対して非常に有用な薬剤である。
【0045】
炎症のメカニズムは、アルツハイマー病の発病カスケードにおける重要な媒介として提案されてきた(McGeer PL、McGeer EG、“The inflammatory response system of brain implications for the therapy of Alzheimer and other neurodegenerative diseases.”、Brain Res.Rev.、1995年;第21巻:195−218ページ)。in’t Veldらの研究(the New England Journal of Medicine、2001年;第345巻、1515ページ)において、彼らは、アルツハイマー病のリスクのある約7000人を7年近く追跡した。彼らの結果は、NSAIAが、認知症の開始以前のNSAIAの累積的使用が少なくとも2年、又は2年以上である人に対して、相対的リスクを低減できることを示唆した。NSAIAの神経保護能が認知症開始の直前の年に停止すると、これらの化合物は、病気の前駆症状を有するほとんどの人において、進行に対する防御を与えなくなった。発明者らは、この理由は、損傷した神経細胞周辺の組織が、さらなる損傷から神経細胞を保護するために傷跡を形成すると考えている。ほとんどのNSAIAは、脳血液及び神経細胞障壁の浸透速度が非常に遅く、傷跡の障壁に浸透することができない。本発明のこれらのプロドラッグは、非常に速い皮膚、血液脳、神経細胞膜、及び傷跡の障壁への浸透速度を有し、アルツハイマー病、パーキンソン病及び他の進行性神経変性疾患の治療に対して非常に有望な薬剤である。
【0046】
これらのプロドラッグは、損傷脊髄周辺の保護された傷跡により治癒が停止された、脊髄損傷を有する患者を助けることができる。ほとんどのNSAIAは、治療上有効量において傷跡の障壁に浸透することができないが、本発明のプロドラッグは、傷跡の障壁に浸透でき、抗炎症活性を有し、傷の治癒の助けとなることができる。
【0047】
NSAIAは、上述の症状の治療に対してあまり効果的ではなく、細胞膜、特に脳細胞及び神経細胞にあまり効果的に浸透できないために深刻な副作用を有し、全身循環の滞在が長すぎるため、薬物の大部分は「作用部位」に達する前に腸粘膜、肝臓、腎臓、及び肺により代謝されることになる。この状況は、非常に低い薬理的効果を生むだけでなく、腸粘膜、肝臓、腎臓、肺、及び他の身体部分に有毒な負担も生じる。これらのプロドラッグは、皮膚、脳血液、脳細胞、神経細胞及び他の膜障壁に非常に良好に浸透し、親薬物の数百倍の能力を有し、通常の薬物服用量のわずか数十分の一又は数百分の一を必要とし、副作用の発生が非常に少なくなる。これは、経皮的な薬物送達だけでなく、任意の薬物送達システム(経口、皮下、静脈内、吸入、及び経鼻等)にも有益となり、それぞれの親薬物によって治療可能であるよりも良好に多くの症状を、及びそれぞれの親薬物では治療できないいくつかの症状さえ、治療できる。
【0048】
上述の一般式1、2a、2b、2c、又は2dの「化学構造1、2a、2b、2c、又は2d」の化合物は、N,N’−ジシクロヘキシルカルボジイミド、N,N’−ジイソプロピルカルボジイミド又は他のカップリング試薬を用いて無水物を形成する反応、次いで適切なアルコール、チオール、又はアミンを用いる反応によって、NSAIAから調製することができる。
【0049】
上記の一般式1、2a、2b、2c、又は2dの「化学構造1、2a、2b、2c、又は2d」の化合物は、適切なハロゲン化物を用いて、NSAIAの金属塩、有機塩基性塩、又は固定化された塩基性塩から調製することができる。
【0050】
有効成分としての、一般的な「化学構造1、2a、2b、2c、又は2d」の化合物、又は一般的な「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物の、経皮的治療アプリケーションシステムは、ヒト又は動物におけるNSAIAによる治療が可能な任意の症状、及び本発明に記載の新規症状を治療するために使用できる。これらのシステムは、一つの有効成分を含有するマトリクス層と、不浸透性の裏地層とを含む、バンデージ又はパッチとすることができる。最も好適なシステムは、有効成分収容体であり、皮膚に面する浸透性の底部を有する。放出率を制御することにより、本システムは、NSAIAが至適な治療上血液濃度に一定に達し、有効性を増し、NSAIAの副作用を低減するようにできる。これらのシステムは、手首、足首、腕、脚、又は身体の任意の部分に装着できる。
【発明の効果】
【0051】
NSAIAは、上述の症状の治療に対してあまり効果的ではなく、細胞膜、特に脳細胞及び神経細胞にあまり効果的に浸透できないために深刻な副作用を有し、全身循環の滞在が長すぎるため、薬物の大部分は「作用部位」に達する前に腸粘膜、肝臓、腎臓、及び肺により代謝されることになる。この状況は、非常に低い薬理的効果を生むだけでなく、腸粘膜、肝臓、腎臓、肺、及び任意の他の身体部分に有毒な負担も生じる。これらのプロドラッグは、皮膚、脳血液、脳細胞、神経細胞及び他の膜障壁に非常に良好に浸透し、親薬物の数百倍の能力を有し、通常の薬物服用量のわずか数十分の一又は数百分の一を必要とし、副作用の発生が非常に少なくなる。これは、経皮的な薬物送達だけでなく、任意の薬物送達システム(経口、皮下、静脈内、吸入、及び経鼻等)にも有益となり、親薬物では治療できない多くの症状を治療できる。これらのプロドラッグは、経皮だけでなく、任意の種類の医薬治療に対して経口(胃壁に浸透できないため、胃を傷つけることがない)でも投与でき、NSAIAの副作用の大部分である、消化不良、胃十二指腸出血、胃の潰瘍、胃炎等の非常に顕著な胃腸障害を避けるはずである。これらのプロドラッグの経皮投与の別の大きな利益は、特に子供への医薬品投与が非常に容易であることである。
【図面の簡単な説明】
【0052】
【図1】図中、一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」におけるR、R1、R2、R3、R4、R5、R6、R7、R8、R9、X、HA、及びAry−は、請求項1及び請求項2におけるR、R1、R2、R3、R4、R5、R6、R7、R8、R9、X、HA、及びAry−と同一と定義する。
【発明を実施するための形態】
【0053】
(最良の形態)
ジエチルアミノエチルアセチルサリチラート.アセチルサリチル酸塩の調製
180gの2−アセチルサリチル酸を、1000mlのクロロホルムに溶解した。混合物を5℃に冷却した。103gの1,3−ジシクロヘキシルカルボジイミドを、混合物に加えた。混合物を、室温で2時間かき混ぜた。固形廃棄物を濾過して取り除き、クロロホルムで洗浄した(3×300ml)。59gのジエチルアミノエタノールを、反応混合物に加えた。混合物を、室温で3時間かき混ぜた。有機溶液を蒸発させた。乾燥後、所望生成物220gを得た(96%)。元素分析:C24H29NO8、分子量:459.18.計算%C:62.73、H:6.36、N:3.05、O:27.86、実測%C:62.70、H:6.40、Cl:N:3.01、O:27.90。
【0054】
(発明の形態)
1−ピペリジンプロピル2[(2,6−ジクロロフェニル)アミノ]ベンゼンアセタート.AcOHの調製
31.8g(0.1mol)のナトリウム2[(2,6−ジクロロフェニル)アミノ]ベンゼンアセタートを、180mlのクロロホルム中にサスペンドした。28.6g(0.1mol)の1−ピペリジンプロピルブロミド.HBrを混合物に加え、室温で5時間かき混ぜた。混合物を5%Na2CO3(1×300ml)及び水(3×100ml)で洗浄した。混合物を無水Na2SO4で乾燥した。硫酸ナトリウムを濾過して取り除き、クロロホルム(3×50ml)で洗浄した。6gの酢酸を溶液に加えた。溶液を真空中で100mlまで濃縮した。次いで、300mlのヘキサンを溶液に加えた。固体生成物を濾過して集め、ヘキサン(3×100ml)で洗浄した。乾燥後、所望生成物40gを得た(86%)。元素分析:C24H30Cl2N2O4、分子量:481.43、計算%C:59.88、H:6.28、Cl:14.73、N:5.82、O:13.29、実測%C:59.83、H:6.32、Cl:14.71、N:5.79、O:13.35。
【0055】
3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOHの調製
60gのポリマー結合トリエチルアミン(3mmol/g、100−200メッシュ)を、180mlのクロロホルム中にサスペンドした。20.6g(0.1mol)の2−(ρ−イソブチルフェニル)プロピオン酸を、かき混ぜながら混合物に加えた。39g(0.15mol)の3−ピペリジンメチルブロミド.HBrを混合物に加え、混合物を室温で5時間かき混ぜた。ポリマーを濾過して取り除き、アセトン(3×50ml)で洗浄した。300mlの5%Na2CO3を、かき混ぜながら溶液に加えた。混合物を30分間かき混ぜた。クロロホルム溶液を水(3×100ml)で洗浄し、Na2SO4で乾燥した。硫酸銅を濾過して取り除き、クロロホルム(3×100ml)で洗浄した。6gの酢酸を混合物に加えた。溶液を真空中で100mlまで濃縮した。300mlのヘキサンを溶液に加えた。固体生成物を濾過して集め、ヘキサン(3×100ml)で洗浄した。乾燥後、所望生成物35gを得た(96%)。元素分析:C21H33NO4、分子量:363.49、計算%C:69.39、H:9.15、N:3.85、O:17.61、実測%C:69.35、H:9.18、N:3.83、O:17.64。
【産業上の利用可能性】
【0056】
一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」のプロドラッグは、NSAIAよりも優れている。これらは、NSAIAによる治療が可能なヒト又は動物の任意の症状の治療に、医薬として使用できる。これらは、糖尿病(I型及びII型)、血糖及び血中脂質の異常レベル、脳卒中、心臓発作等の心臓及び血管疾患、アルツハイマー病、パーキンソン病及び他の神経変性疾患、乾癬、円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患、筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状及び肛門掻痒、前立腺炎、前立腺膀胱炎、自己免疫性肝炎、自己免疫性腎炎、静脈炎及び他の炎症、脊髄損傷、傷、乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌、並びに他の多くの症状の治療及び予防にも使用できる。これらのプロドラッグは、経皮吸収促進剤の補助なしに経皮投与できる。
【技術分野】
【0001】
本発明は、非常に速い皮膚及び血液脳関門浸透速度を有する、非ステロイド抗炎症剤(NSAIA)の正荷電した水溶性プロドラッグの設計及び調製と、糖尿病(I型及びII型)、血糖及び血中脂質の異常レベル、脳卒中、心臓発作等の心臓及び血管疾患、アルツハイマー病、パーキンソン病及び他の神経変性疾患、乾癬、円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患、筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状、及び肛門掻痒、前立腺炎、前立腺膀胱炎、食道静脈瘤、自己免疫性肝炎、自己免疫性腎炎、結腸直腸炎、腸炎、静脈炎及び他の炎症、皮膚癌、乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌、傷、異常血管性皮膚病変、あざ、ほくろ(母斑)、スキンタグ、高齢スポット(肝斑)、及び他の皮膚疾患の治療及び予防における新規医薬使用と、に関する。これらのプロドラッグは、経皮吸収促進剤の補助なしに経皮投与できる。
【背景技術】
【0002】
NSAIAは、慢性関節リウマチ、変形性関節症及び強直性脊椎炎の徴候及び症状を緩和するために用いられる。NSAIAは、胆石疝痛、発熱、及び会陰切開の痛みの治療において単独又は補助として用いられる。これは、痛風、急性片頭痛、及び腎疝痛、並びに白内障抽出術を受ける患者の術後炎症治療にも用いられる。アスピリンは、心臓及び血管の疾患予防に用いられる。
【0003】
残念ながら、消化不良、胃十二指腸出血、胃の潰瘍、胃炎等の非常に顕著な胃腸障害という、多数の副作用がNSAIA使用には伴う。Fishman(Fishman;Robert、米国特許第7052715号)は、痛み又は炎症の遠位領域を効果的に治療する目的では、血流中においてかなりの濃度レベルに達しなければならないという、経口医薬に伴う追加的な問題点を示した。このレベルは、痛み又は傷の特定部位を正確に目標とすることが可能な場合に必要となるものよりも、ずっと高いことが多い。フィッシュマン及び多くの報告者により(Van Engelenら、米国特許第6416772号;Macridesら、米国特許第6346278号;Kirbyら、米国特許第6444234号、Pearsonら、米国特許第6528040号、及びBotknechtら、米国特許第5885597)、処方によって経皮的に塗布するための送達システムの開発が試行されてきた。Songらは、ジクロフェナクジエチルアンモニウム塩を含む抗炎症鎮痛薬のための経皮的薬物送達システムを開発した(Songら、米国特許第6723337号)。Donatiらは、ヘパリン及びジクロフェナクを含有する局所使用するための膏薬を開発した(Donatiら、米国特許第6592891号)。Kawajiらは、ジクロフェナクナトリウム塩を含有する外用の油性パッチを開発した(Kawajiら、米国特許第6262121号)。Effingらは、ジクロフェナクを経皮的に送達する装置を開発した(Effingら、米国特許第6193996号)。しかしながら、処方によって患者内に治療上有効なNSAIAの血漿濃度を送達することはたいへん困難である。Susan Milosovichらは、テストステロニル−4−ジメチルアミノブチラートを設計し調製した。HCl(TSBH)は、親油性部分及び生理的pHにおいてプロトン化された形式で存在する第三級アミン基を有する。彼らは、プロドラッグ(TSBH)が、薬物(TS)自体の約60倍の早さでヒトの皮膚を通じて拡散することを見出した(Susan Milosovichら、J.Pharm.Sci.、第82巻、227ページ、1993年)。
【発明の概要】
【発明が解決しようとする課題】
【0004】
NSAIAは、100年以上、医薬として使用されてきた。NSAIAは、慢性関節リウマチ及び変形性関節症の徴候及び症状の緩和、痛みを和らげる穏やかな緩和、発熱の低減、及び月経困難症の治療に適応される。これは、世界的に最も広範に使用される薬物である。
【0005】
残念ながら、消化不良、胸焼け、嘔吐、胃十二指腸出血、胃の潰瘍、胃炎等の非常に顕著な胃腸障害という、多数の副作用がNSAIA使用には伴う。NSAIAにより引き起こされる胃十二指腸出血は、一般的に無痛であるが、糞便への失血を導く可能性があり、持続的な欠乏性貧血を招く場合がある。
【0006】
経皮送達システムは、胃腸管を直接的に傷つけることと、胃腸管及び肝臓における「初回通過代謝」により生じる薬物の不活性化とを、回避する助けとなる。従来の経皮吸収促進剤を用いる経皮的薬物送達システムには限界がある。第一に、浸透速度は非常に遅い(μg/cm2/時間のスケール)。第二に、大量の促進剤が患者体内に入ることになる。
【課題を解決するための手段】
【0007】
経皮送達システムは、胃腸管を直接的に傷つけることと、胃腸管及び肝臓における「初回通過代謝」により生じる薬物の不活性化とを、回避する助けとなる。従来の経皮吸収促進剤を用いる経皮的薬物送達システムには限界がある。第一に、浸透速度は非常に遅い(μg/in2/時間のスケール)。第二に、大量の促進剤が患者体内に入ることになり、余分な副作用を生じる場合がある。第三に、経皮吸収促進剤の使用による従来の経皮的薬物送達においては、処方中の高濃度促進剤が薬物の皮膚通過の補助となりうるが、促進剤及び薬物が皮膚に入るときには、促進剤の濃度は非常に薄められ、薬物分子がより生物的な膜を通過するための助けにはならず、薬物分子は皮下脂肪層に累積することになり、累積した薬物は非常に深刻かつ致死的ですらある副作用を生じる場合がある。
【0008】
薬物の生物活性は、全身循環に達する相対的な薬物投与量を測定する。しかしながら、全身循環は、ほとんどの薬物にとって「作用部位」ではない。薬物分子は、たとえ全身循環に達した場合であっても、より生物的な膜を通過しなければならず、これは消化器官の膜よりも透過性が低く、「作用部位」と呼ばれるとらえどころのない流体に達する前に分子間及び分子内流体と相互作用し、このためにほとんどの薬物は、「作用部位」に達する前に、腸粘膜、肝臓、腎臓及び肺により代謝されることになる。この状況は、治療効果が非常に低くなるだけでなく、腸粘膜、肝臓、腎臓及び肺に有毒な負担も発生する。様々な膜における薬物の浸透速度を増すことができれば、薬物の治療効果及び臨床反応は非常に向上するので、必要な薬物服用はより少量となり、副作用を低減することになる。非常に速い皮膚及び膜の浸透速度を有するプロドラッグのための、経皮的なプロドラッグ送達は、局所疾患だけでなく、全身性疾患に対しても非常に有用となる。これらのプロドラッグは、親薬物の数十倍から数百倍の有効性を有するため、通常薬物の数十分の一から数百分の一のみを必要とし、副作用は非常に少なくなる。これは、経皮的な薬物送達のみならず、任意の他の薬物送達システム(経口、皮下、静脈内、吸入、及び経鼻)に対しても有用となる。
【0009】
発明者らは、親油性部分と、生理的pHにおいてプロトン化された形式(親水性部分)で存在する第一級、第二級、第三級アミン基(好適には第三級アミン基)とを有する薬物が、皮膚、血液脳、及び血液胎盤の関門を非常に高速に(mg/cm2/時間のスケールで)浸透できることを見出した。これらのプロドラッグの設計原理を以下に示す。
1.本プロドラッグは、親油性部分と、生理的pHにおいてプロトン化された形式(親水性部分)で存在する第一級、第二級、第三級アミン基(好適には第三級アミン基)とを有しなければならない。
2.全てのNSAIAプロドラッグは、生理的pHにおいてプロトン化された形式(親水性部分)で存在する第一級、第二級、第三級アミン基を、一つ又は二つ(好適には一つ)のみ有するべきである。
3.第一級、第二級、第三級アミン基の主要な役割は、皮膚、膜、血液脳、血液胎盤、傷、又は他の関門を薬物が通過する助けとなることである。第一級、第二級、第三級アミン基は、無毒かつ親薬物の生物活性を仲介する任意の構造とすることができる。
【0010】
発明者らは、一般式(1)の「化学構造1」を有する全てのNSAIAプロドラッグのいくつかを、特許として開示した(国際出願第PCT/IB2006/052732号、第PCT/IB2006/052318号、第PCT/IB2006/052815号、第PCT/IB2006/052563号、第PCT/IB2006/052575号、第PCT/IB2006/053741号、第PCT/IB2006/053091号、第PCT/IB2006/053090号、第PCT/IB2006/052549号)。
【化1】

【0011】
式中、Rは分岐又は直鎖の−(CH2)n−を表し、−(CH2)n−においてn=0,1,2,3,4,5,6,7,8,9,10,11,12,…であり、いずれのCH2がO、S、NR8、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール残基、又は薬理学的に許容できる任意の他の部分と置き換えられてもよく;R1又はR2は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール部分、又は薬理学的に許容できる任意の他の部分と置き換えられてもよく;Xは、O、NH、NR8、S、又は存在しないことを表し;R8は、H、OH、Cl、F、Br、I、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;R9は、H、OH、Cl、F、Br、I、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;HAは、存在しない、HCl、HBr、HF、HI、HOAc、クエン酸、又は薬理学的に許容できる任意の酸を表す。全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、分岐又は直鎖であり、C、H、O、Cl、Br、F、I、P、S、N又は任意の他の薬理学的に許容できる原子を含んでもよく、単結合、二重結合、及び/又は三重結合を含んでもよく;全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、アキラル又はキラルでもよく;基がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよく;Ary−は次式を表すが限定されず、
【化2】

【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

式中、Rxは、H、CH3、CH3O、OH、CH3CH2、CF3、CHF2、CH2F、Cl、F、Br、Fを表し;Ryは、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;X1又はX4は、CH2、S、O、NH、又はCOを表し;X2又はX5は、CH、CR8、又はNを表し;X3は、O、S、NH、又はNR8を表し;Y、Y1、Y2、Y3、Y4、Y5、又はY6は、独立してH、HO、CH3COO、RyCOO、HS、NO2、CN、CH3COS、NH2、CH3CONH、RyCONH、CH3、CH3CH2、C3H7、C4H9、CH3O、CH3CH2O、C3H7O、Cl、F、Br、I、CH3S、CHF2O、CF3O、CF3CF2O、C3F7O、CF3、CF3CF2、C3F7、C4F9、CH3SO2、RySO2、CH3SO、RySO、CH3CO、CH3CH2COを表し;いずれのAry−は、アキラル又はキラルであり;Ary−がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよい。
【0012】
発明者らは、第一級、第二級、第三級アミン基の主要な役割は、皮膚、膜、血液脳、血液胎盤、傷、又は他の関門を薬物が通過する助けとなることのみであるため、第一級、第二級、第三級アミン基は、無毒かつ親薬物の生物活性を仲介する任意の構造とすることができることを見出した。したがって、発明者らは、この性質に対して様々な種類のアミン基を設計し調製した。新規なNSAIAプロドラッグは、一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」を有する。
【化12】

式中、Rは分岐又は直鎖の−(CH2)n−を表し、−(CH2)n−においてn=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R1は分岐又は直鎖の−(CH2)a−を表し、−(CH2)a−においてa=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R2は分岐又は直鎖の−(CH2)b−を表し、−(CH2)b−においてb=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R3は分岐又は直鎖の−(CH2)c−を表し、−(CH2)c−においてc=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R4はH、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;R5は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R6、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;R6は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R5、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく、R7は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R5、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく、Xは、存在しない、O、NH、NR6又はSを表し;一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」におけるAry−は、一般式(1)の「化学構造1」におけるAry−と同一に定義され、HAは、存在しない、HCl、HBr、HF、HI、HOAc、クエン酸、又は薬理学的に許容できる任意の酸を表す。全てのR、R1、R2、R3、R4、R5、R6、R7、又は−(CH2)n−基は、分岐又は直鎖であり、C、H、O、Cl、Br、F、I、P、S、N又は任意の他の薬理学的に許容できる原子を含んでもよく、単結合、二重結合、及び/又は三重結合を含んでもよく;全てのR、R1、R2、R3、R4、R5、R6、R7、又は−(CH2)n−基は、アキラル又はキラルでもよく;基がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよい。
【0013】
薬物吸収は、消化管又は他の部位からのいずれでも、隔膜を通じる分子形式での薬物通過を必要とする。薬物は、最初に溶解しなければならず、薬物が好適な生物医薬特性を有している場合には、高濃度領域から低濃度領域へ、膜を通じて血中又は全身循環の中に通過することになる。全ての生物的な膜は、主要構成物として脂質を含有する。膜形成に支配的役割を演じる分子は、全てリン酸を含有する極性の大きなヘッドグループを有し、ほとんどの場合に二つの疎水性炭化水素テールを有する。膜は二層であり、親水性ヘッドグループは、両サイドにおいて水溶性領域に外向きとなる。親水性の高い薬物は、膜の疎水性層を通過できず、親水性の高い薬物は、その類似性のために膜の一部として疎水性の膜内にとどまることになり、効率的に内部の細胞質に入ることはできない。
【0014】
本発明の一つの目的は、経口投与を可能とする胃液中でのNSAIAの溶解度と、経皮的な(局所的な)投与を可能とする膜及び皮膚障壁を通過するNSAIAの浸透速度とを増すことにより、NSAIAの副作用を避けることである。本発明の最も重要な目標は、皮膚、細胞膜、特に脳細胞及び神経細胞の膜を浸透することができ、全身循環に極めて短時間とどまり、これにより親薬物の数百倍の有効性を有し、通常薬剤服用量の数十分の一から数百分の一のみを必要として副作用の発生を極めて少なくすることのできる、NSAIAプロドラッグを設計することである。これは、経皮的薬物送達だけでなく、他の薬物送達システム(経口、皮下、静脈内、吸入、及び経鼻等)にも有効であり、親薬物によっては治療できない多くの症状を治療することができる。これらの新規なNSAIAプロドラッグは、一般的に二つの構造上の特徴を有する。すなわち、これは、親油性部分と、生理的pHにおいてプロトン化される形式(親水性部分)で存在する第一級、第二級、又は第三級アミン基とを有する。このような親水性−親油性の均衡は、膜障壁を介しての効率的な通過に必要である(Susan Milosovichら、J.Pharm.Sci.、第82巻、227ページ、1993年)。正荷電したアミノ基は、水中での薬物の溶解度を非常に大きくする。これらのプロドラッグ上のアミノ基の正荷電は、膜のリン酸ヘッドグループの負荷電と結合することになる。したがって、膜又は皮膚の外側での局所的な濃度は非常に高く、高濃度領域から低濃度領域へのこれらのプロドラッグの通過を容易にすることになる。この結合は、膜をやや不安定化し、プロドラッグの親油性部分に対していくらかの余地を作ることができる。膜分子が移動するときには、膜は、プロドラッグの結合により、わずかに「ひび」が入る場合がある。これにより、プロドラッグは膜内に入るようになる。pH7.4においては、アミノ基の約99%のみがプロトン化される。アミノ基がプロトン化されないときには、プロドラッグのアミノ基と膜のリン酸ヘッドグループとの間の結合は乖離し、プロドラッグは完全に膜に入ることになる。プロドラッグのアミノ基が膜の反対側に移動してプロトン化されると、このときにはプロドラッグは、半流動体の濃縮された水溶液又はサスペンジョンである細胞基質に引き込まれる。消化管内の滞在が短時間であるため、本プロドラッグは、胃粘膜細胞の損傷を生じない。新規なプロドラッグのヒトの皮膚を介する浸透速度は、腹側及び背側大腿領域のヒト皮膚組織(厚さ360〜400μm)由来のフランツ改良型透過セルを用いて、試験管内で測定した。受容流体は、通常生理食塩水10mLに2%ウシ血清アルブミンで構成し、毎分600回転でかき混ぜた。プロドラッグ及び皮膚に入る薬物の経時的な累積量を、選択的高速液体クロマトグラフィ法により決定した。NSAIAプロドラッグの見かけのフラックス値は、0.1〜50mg/cm2/時間であった。この結果は、本プロドラッグは、その親薬物よりも少なくとも数百倍高速にヒトの皮膚を介して拡散することを示唆する。この結果は、ジアルキルアミノエチル基上の正荷電は、膜及び皮膚障壁を介する薬物の通過において重要な役割を有することを示唆する。
【0015】
新規なNSAIAプロドラッグは、皮膚障壁、血液脳関門、及び血液胎盤関門を浸透できる。無傷のラット皮膚を介してのプロドラッグ及びその親薬物の試験管内での浸透速度を比較した。エタノール1mL中20%のプロドラッグ又はその親薬物を、ラット(約200g)背部の約5cm2の領域に塗布して、ドナーを構成した。4時間後、ラットを殺し、メタノール5mLを血液1mL、肝臓1g、腎臓1g、脳1g(肝臓、腎臓又は脳は、pH7.2のバッファで3回洗浄した)に加え、混合物をホモジナイズした。次いで、試料を5分間超遠心分離し、HPLCを用いて分析した。結果を表1から表5に示す。
【0016】
【表1】

【0017】
【表2】

【0018】
【表3】

【0019】
【表4】

【0020】
【表5】

【0021】
エタノール1mL中20%のアスピリン、ジクロフェナク、ケトプロフェン、フェノプロフェン、又はイブプロフェンを、ラット背部の約5cm2の領域に塗布した。4時間後、ラットを殺し、メタノール5mLを血液1mL、肝臓1g、腎臓1g、脳1g(肝臓、腎臓又は脳は、pH7.2のバッファで3回洗浄した)に加え、混合物をホモジナイズした。いずれのラットの組織又は血漿中にも、これらの薬物は見られなかった。この結果は、NSAIAプロドラッグは、皮膚障壁、血液脳関門、及び他の膜障壁を、非常に高速に浸透することができるが、親であるNSAIAは、検出可能な量では皮膚障壁を浸透できないことを示している。
【0022】
一般式(1)の「化学構造1」のプロドラッグは、発明者らの特許(国際出願番号第PCT/IB2006/052732号、第PCT/IB2006/052318号、第PCT/IB2006/052815号、第PCT/IB2006/052563号、第PCT/IB2006/052575号、第PCT/IB2006/053741号、第PCT/IB2006/053091号、第PCT/IB2006/053090号、第PCT/IB2006/052549号)において、抗炎症性、鎮痛性、解熱性、及び抗リウマチ性の活性を示した。発明者らは、一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」のプロドラッグの全てが、抗炎症性、鎮痛性、解熱性、及び抗リウマチ性の活性を示すことを見出した。本発明の主要な目的は、NSAIAプロドラッグの新規な医薬利用である。
【0023】
炎症と癌との間の関係は周知である。Thea D.Tlsty博士は、講演において(Keystone Symposia:Inflammation and Cancer、米国コロラド州のブリッケンリッジ、2005年2月27日〜3月3日)シクロオキシゲナーゼ−2(COX−2)がアロマターゼ活性、血管新生、増殖、浸潤、及びプロスタグランジン合成を刺激することを述べている。プロスタグランジンの増加は、細胞死の阻害を導く。アスピリン及び他のNSAIAは、COX−1及びCOX−2を阻害する。大腸癌、食道癌、卵巣癌又は他の癌の全体的な相対リスクは、長期にアスピリンを摂取する人において低下する。しかしながら、癌細胞は、NSAIAが癌細胞に入らないよう、その膜構造を変化する場合がある。本発明の新規プロドラッグは、いかなる膜障壁にも浸透でき、癌の場所の外側皮膚領域に局所的に塗布することができ、全身暴露を極めて低くして癌細胞に大量のプロドラッグが入ることになる。
【0024】
NSAIAプロドラッグの抗腫瘍活性を評価するために、ヒト乳癌細胞(BCAP−37、各マウスに2−3mm3の腫瘍組織を用いた)をヌードマウス(BALB、12群、各群に7匹のマウス)に対し皮下的に異種移植した。14日後に、腫瘍は、50±10mm3(0.05ml)のサイズに増殖していた。次いで、30μlの5%(プロドラッグ1.5mgに等しい)ジエチルアミノエチルアセチルサリチラートアセチルサリチル酸塩(P−1、アセトン中);1−ピペリジンプロピル2[(2,6−ジクロロフェニル)アミノ]ベンゼンアセタート.AcOH(P−2、水中)、1−ピロリジンプロピル2−(3−ベンゾイルフェニル)プロピオナート.AcOH(P−3、水中)、4−ピペリジンメチル2−(3−フェノキシフェニル)プロピオナート.AcOH(P−4、水中)、3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOH(P−5、水中)、ジエチルアミノエチル1−(p−クロロベンゾイル)−5−メトキシ−2−メチルインドール3−アセタート.AcOH(P−11、水中)、2−(4−モルホリニル)エチル(Z)−5−フルオロ−2−メチル−1−[(4−メチルスルフィニル)フェニルメチレン]−1H−インデン−3−アセタート.AcOH(P−12、水中)、ジエチルアミノエチル2−(2,4−ジクロロフェノキシ)ベンゼンアセタート.AcOH(P−19、水中)、ジエチルアミノエチル2−(8−メチル−10,11−ジヒドロ−11−オキソジベンズ(b,f)オキゼピン−2−イル)プロピオナート.AcOH(P−37、水中)、1−ピロリジンプロピル2−[[(3−(トリフルオロメチル)フェニル)アミノ]ベンゾエート.AcOH(P−48、水中)、4−N,N−ジメチルアミノブチリルオキシ−2−メチル−N−2−ピリジニル−2H,1,2−ベンゾチアジン−3−カルボキサミド1,1−ジオキシド.HCl(P−51、アセトン中)を、8週ごとにヒト乳癌細胞の移植領域(前足付近)に局所塗布した。42日目における腫瘍サイズを、表6及び表7に示す。
【0025】
【表6】

【0026】
【表7】

【0027】
第二の抗腫瘍実験においては、ヒト大腸癌細胞(LS174J、2−3mm3の腫瘍組織を各マウスに用いた)を、ヌードマウス(BALB)に皮下的に異種移植した。7日後に、腫瘍は55±10mm3(0.055ml)のサイズに増殖していた。次いで、約30μLの5%(プロドラッグ1.5mgに等しい)ジエチルアミノエチルアセチルサリチラートアセチルサリチル酸塩(P−1、アセトン中);1−ピペリジンプロピル2[(2,6−ジクロロフェニル)アミノ]ベンゼンアセタート.AcOH(P−2、水中)、1−ピロリジンプロピル2−(3−ベンゾイルフェニル)プロピオナート.AcOH(P−3、水中)、4−ピペリジンメチル2−(3−フェノキシフェニル)プロピオナート.AcOH(P−4、水中)、3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOH(P−5、水中)、ジエチルアミノエチル1−メチル−5−(4−メチルベンゾイル)−1H−ピロール−2−アセタート.AcOH(P−13、水中)、2−(4−モルホリニル)エチル2−アミノ−3−ベンゾイルベンゼンアセタート.AcOH(P−16、水中)、ジエチルアミノエチル2−(10,11−ジヒドロ−10−オキソジベンゾ(b,f)チエピン−2−イル)プロピオナート.AcOH(P−36)、ジエチルアミノエチル2−[(2,3−ジメチルフェニル)アミノ]ベンゾエート.AcOH(P−46、水中)、ジエチルアミノエチル2−[(2,6−ジクロロ−3−メチルフェニル)アミノ]ベンゾエート.AcOH(P−47、水中)、N−(2−チアゾイル)−4−N,N−ジメチルアミノブチリルオキシ−2−メチル−2H,1,2−ベンゾチアジン−3−カルボキサミド1,1−ジオキシド.HCl(P−52、アセトン中)を、ヒト大腸癌細胞の移植領域(前足付近)に8週ごとに局所塗布した。30日目における腫瘍サイズを、表8及び表9に示す。
【0028】
【表8】

【0029】
【表9】

これらの結果は、NSAIAプロドラッグが非常に強い抗腫瘍活性を有し、副作用がないかほとんどないことも示している。
【0030】
サリチラートの低血糖効果は、100年以上前にドイツ人医師らによって最初に観察された(Edmund J.Hengesh、「Principles of medicinal chemistry」、第4版、591ページ、Williams&Wilkins社、1995年)。サリチラートは、グルコースによって刺激されるインシュリン分泌を高め、乳酸及びアラニンからの糖生成を阻害する(H.F.Woodsら、Clin.Exp.Pharmacol Physiol.、第1巻、534ページ、1974年)。ある種のサリチラートは、フリーの脂肪酸、トリグリセリド、及びコレステロールの血漿濃度を低下させる。血漿のフリー脂肪酸濃度が上昇すると、ブドウ糖の利用が阻害され、その濃度が低下すると低血糖作用に寄与することができる。残念ながら、血糖値及び血中脂質濃度の適切な制御を維持するためには、サリチラートの大量服用(毎日5g)が必要である。この服用レベルでは、胃の不快感、吐き気、嘔吐、耳鳴り等の、無数の副作用が頻繁に発生する。本発明の新規プロドラッグは、非常に速い皮膚及び膜の浸透速度を有する。これは、「作用部位」に非常に高速に到達でき、これらのプロドラッグの薬理的効果及び臨床反応は非常に向上するので、必要な薬物服用量はずっと少なく(親薬物の数百分の一から数十分の一のみを要する)、副作用の発生を非常に少なくすることになる。
【0031】
本発明のプロドラッグは、ラットモデル(SLAC/GK、2型糖尿病、n=7)において血糖値を低下させる。ジエチルアミノエチルアセチルサリチラートアセチルサリチル酸塩(P−1、アセトン中)の50%アセトン溶液;4−アセトアミドフェニルサリチリルジメチルアミノブチラート.HCl(P−6)、ジエチルアミノエチル5−(2,4−ジフルオロフェニル)アセチルサリチラート.5−(2,4−ジフルオロフェニル)アセチルサリチル酸塩(P−8)、ジエチルアミノエチルサリチルサリチラート.AcOH(P−9)、ジエチルアミノエチルサリチラート.AcOH(P−10)、ジエチルアミノエチル5−アセトアミド−アセチルサリチラート(P−58)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチル酸塩(P−59)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチルサリチル酸塩(P−60)(20mg/kgのNSAIAに等しい)を、5週間、1日1回(午前8時に)、ラット(被毛を剃った)背部(約1.5cm2)に経皮投与した。血糖値は、第2週から第5週までの、3日に1回、午後3時に(絶食なし)測定した。結果を表10に示す。血中脂質濃度は、第5週の最後に測定した。結果を表11に示す。
【0032】
【表10】

この結果は、NSAIAプロドラッグが、糖尿病ラットモデルにおいて非常に効果的に血糖値を低下させ、正常ラットの血糖値には影響しないことを示した。最も興味深いことは、処置を30日間停止した後に、ラットの血糖値が通常レベル(7〜8mmol/L、絶食なし)にとどまったことである。これは、本プロドラッグが血糖値を低下するだけでなく、糖尿病を治療できることも意味している。
【0033】
【表11】

この結果は、NSAIAプロドラッグが、糖尿病ラットモデルにおいて非常に効果的に血中脂質濃度(全コレステロール及びトリグリセリド)を低下し、HDLレベルには影響しないことを示した。
【0034】
胃液のpHは1から3である。リン酸ヘッドグループの負荷電は水素イオンによって中和され、これらのプロドラッグのアミノ基の正電荷は膜のリン酸ヘッドグループとは結合できないため、プロドラッグは、胃壁を介して通過することができず、胃を痛めたり悪くしたりすることがない。十二指腸のpHは約5〜7であり、プロドラッグは、十二指腸の粘膜を通過できる。膵臓が近傍にあり、プロドラッグの大部分は、肝臓、腎臓、及び全身循環に至る前にこれに入ることになり、ここで薬物は代謝されるので、これらのプロドラッグでは非常にわずかな服用量のみが必要であり、副作用の発生は非常に少数かつ低度となる。ジエチルアミノエチルアセチルサリチラート.アセチルサリチル酸塩(P−1、アセトン中)の20%アセトン溶液;4−アセトアミドフェニルサリチリルジメチルアミノブチラート.HCl(P−6)、ジエチルアミノエチル5−(2,4−ジフルオロフェニル)アセチルサリチラート.5−(2,4−ジフルオロフェニル)アセチルサリチル酸塩(P−8)、ジエチルアミノエチルサリチルサリチラート.AcOH(P−9)、ジエチルアミノエチルサリチラート.AcOH(P−10)、ジエチルアミノエチル5−アセトアミド−アセチルサリチラート(P−58)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチル酸塩(P−59)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチルサリチル酸塩(P−60)(20mg/kgのNSAIAに等しい)を、5週間、毎日、食事と共にラット(SLAC/GK、2型糖尿病、n=7)に経口投与した。血糖値は、第2週から第5週まで、3日ごとに1回、午後3時に測定した(絶食なし)。結果を表12に示す。血中脂質濃度は、第5週の最後に測定した。結果を表13に示す。
【0035】
【表12】

この結果は、プロドラッグが経口摂取され、親薬物よりも服用量がずっと少量であるときに、NSAIAプロドラッグが、糖尿病ラットモデルにおいて非常に効果的に血糖値を低下させ、正常ラットの血糖値には影響しないことを示した。
【0036】
【表13】

この結果は、プロドラッグが経口摂取され、親薬物よりも服用量がずっと少量であるときに、NSAIAプロドラッグが、糖尿病ラットモデルにおいて非常に効果的に血中脂質濃度を低下することを示した。
【0037】
本発明のプロドラッグは、ラットモデル(SLAC:NOD−IDDM、1型糖尿病、n=7)において血糖値を低下させる。ジエチルアミノエチルアセチルサリチラート.アセチルサリチル酸塩(P−1、アセトン中)の50%アセトン溶液;4−アセトアミドフェニルサリチリルジメチルアミノブチラート.HCl(P−6)、ジエチルアミノエチル5−(2,4−ジフルオロフェニル)アセチルサリチラート.5−(2,4−ジフルオロフェニル)アセチルサリチル酸塩(P−8)、ジエチルアミノエチルサリチルサリチラート.AcOH(P−9)、ジエチルアミノエチルサリチラート.AcOH(P−10)、ジエチルアミノエチル5−アセトアミド−アセチルサリチラート(P−58)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチル酸塩(P−59)、ジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチルサリチル酸塩(P−60)(30mg/kgのNSAIAに等しい)を、7週間、1日1回(午前8時に)、ラット(被毛を剃った)背部(約1.5cm2)に経皮投与した。血糖値は、第4週から第7週までの、3日に1回、午後3時に(絶食なし)測定した。結果を表14に示す。
【0038】
【表14】

この結果は、NSAIAプロドラッグが、糖尿病(I型)マウスモデルにおいて非常に効果的に血糖値を低下することを示した。
【0039】
体重3.0から3.5kg(6〜7月齢)のチャイニーズシロウサギ18匹を選別し、3群に分けた(対照、P−1及びP10群、n=6)。実験の1時間前に、静脈血(1mL)を滅菌ボトルに吸引して凝固することにより、血栓を作製した。破断化及び低速な溶解を避けるため、自家移植の血液凝固物は、温度制御した(70℃)蒸留水で10分間安定化させた。麻酔後に、大腿回旋静脈を露出して遠位隔離し、より早期に隔離した大腿回旋静脈内に配置した留置カテーテル(20GA)を通じて、自家移植の血栓(0.05g/kg)を注射した。ジエチルアミノエチルアセチルサリチラート.アセチルサリチル酸塩(P−1、アセトン中、20mg/kg)及びジエチルアミノエチルアセチルサリチルサリチラート.アセチルサリチルサリチル酸塩(P−59、20mg/kg)の50%アセトン溶液を、ウサギ背部に局所塗布した。2日後に、アモバルビタールナトリウムの過剰静脈注射(60mg/kg)により、ウサギを安楽死させた。肺及び心臓を隔離し、血栓が肺動脈に存在するかどうかを観察した。肺は、10%ホルマリンに24時間浸漬した。塞栓された肺動脈に沿った連続横断面をパラフィン包埋し、ヘマトキシリン−エオシンで染色した。対照群においては、血小板の血栓及び混合した血栓が、注入した凝血を取り囲み、大サイズの血管並びに拡張した血管壁において、近位及び遠位方向の両方とも存在していた。これらの血管には、内皮細胞及び繊維細胞の過剰な増殖があった。加えて、急性の肺うっ血があった。P−1及びP−59群においては、両者の肺組織及び血管壁は正常であった。この結果は、血栓作用、及びその塞栓に付随する血栓の進行が、これらのNSAIAプロドラッグによって予防できることを示した。これらのプロドラッグは、脳卒中、心臓麻痺及び臓器移植拒絶反応の主要な原因である血液凝固の予防及び治療に、非常に有用でありうる。
【0040】
本発明のプロドラッグは、ウサギモデルにおいて、外傷を治癒し、切り傷や火傷跡を軟化して縮小する助けとなることができる。本プロドラッグにより治療したウサギの平均的な傷の面積は、チャイニーズシロウサギモデルにおいて、同一の切り傷に由来する対照のウサギのものの三分の一にすぎず、その傷は正常な無傷の組織と同様の柔軟さである。
【0041】
COX−1及びCOX−2は、動物の免疫応答において非常に重要な役割を演じる。NSAIAは、COX−1及びCOX−2を阻害する。本発明のNSAIAプロドラッグは、乾癬、円板状エリテマトーデス、全身性エリテマトーデス(SLE)、及び他の自己免疫疾患の治療に対して非常に有用でありうる。チャイニーズシロウサギ(n=4×6)背部の剃毛皮膚に、高濃度マラセジア(Malassezia)サスペンジョン(Rosenberg,E.W.ら、Mycopathologia、第72巻、147−154ページ、1980年)を、2週間、1日2回(午前7時及び午後7時)塗布し、乾癬様の病斑を発生させた。次いで、3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOH(P−5)、ジエチルアミノエチル1−メチル−5−(4−メチルベンゾイル)−1H−ピロール−2−アセタート.AcOH(P−13)、ジエチルアミノエチル5−(4−クロロベンゾイル)−1,4−ジメチル−1H−ピロール−2−アセタート.AcOH(P−14)、ジエチルアミノエチル1,8−ジエチル−1,3,4,9−テトラヒドロピラノ−[3,4−b]インドール−1−アセタート.AcOH(P−15)、ジエチルアミノエチル2−アミノ−3−(4−ブロモ−ベンゾイル)ベンゼンアセタート.AcOH(P−17)、ジエチルアミノエチル3−クロロ−4−(2−プロペニルオキシ)ベンゼンアセタート.AcOH(P−18)、ジエチルアミノエチル1−(4−クロロベンゾイル−5−メトキシ−2−メチル−1H−インドール−3−アセトキシアセタート.AcOH(P−20)、ジエチルアミノエチル4−(4−クロロフェニル)−2−フェニル−5−チアゾールアセタート.AcOH(P−21)、ジエチルアミノエチル3−(4−クロロフェニル)−1−フェニル−1H−ピラゾール−4−アセタート.AcOH(P−22)の5%水溶液を、高濃度マラセジアサスペンジョンの塗布(午前7時及び午後7時)の3時間後(午前10時及び午後10時)に、同一領域に塗布した。これらのプロドラッグ塗布の10日後に、病斑を分離した。
【0042】
抗エリテマトーデス活性の評価のため、5%ジエチルアミノエチルアセチルサリチラートアセチルサリチル酸塩(P−1、アセトン中、30mg/kg)、又は3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOH(P−5、水中、30mg/kg)を、円板状エリテマトーデス、全身性エリテマトーデスを有するマウス(MRL/LPR、n=5×3)背部の皮膚に、1日2回、局所塗布した。6週後、全ての皮膚病斑及びループス腎炎は、プロドラッグ処理マウスにおいては解消されたが、対照マウスの症状は悪化していた。
【0043】
これらの結果は、これらのNSAIAプロドラッグが、ヒトにおける乾癬、円板状エリテマトーデス、全身性エリテマトーデス(SLE)、多発性硬化症(MS)、及び他の自己免疫疾患の治療について有望な薬剤であることを示唆している。
【0044】
筋萎縮性側索硬化症(ALS)における細胞死の発症は、グルタメート媒介の興奮毒性、酸化的損傷、及びアポトーシスを含む場合がある。シクロオキシゲナーゼ−2は、脊髄ニューロン及び星状膠細胞に存在し、プロスタグランジンE2の合成を触媒する。プロスタグランジンE2が、星状膠細胞からのグルタメート放出を刺激する一方で、シクロオキシゲナーゼ−2は、炎症誘発性のサイトカイン、反応性の酸素種、及びフリーラジカルの生産に重要な役割も演じる。選択的シクロオキシゲナーゼ−2阻害剤であるセレコキシブを用いる治療は、ALSマウスの脊髄におけるプロスタグランジンE2の生産を顕著に阻害した。セレコキシブ治療は、衰弱及び体重減少の開始を顕著に遅延させ、生存を25%延長させた。治療したALSマウスの脊髄は、脊髄ニューロンの保存が顕著であり、星状膠細胞増生及び小膠細胞の活性化は低下することを示した(Merit.E.Cudkowiczら、Annals of neurology、第52巻、771−778ページ、2002年)。これらの結果は、シクロオキシゲナーゼ−2の阻害が、ALS患者に有益でありうることを示唆する。本発明のNSAIAプロドラッグは、皮膚及び神経細胞膜の障壁を、非常に速い速度で浸透でき(ほとんどのNSAIAは、効果的には神経細胞に浸透できない)、消化管を傷付けることなく経皮投与できるため、これらのプロドラッグは、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患、筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患の治療に対して非常に有用な薬剤である。
【0045】
炎症のメカニズムは、アルツハイマー病の発病カスケードにおける重要な媒介として提案されてきた(McGeer PL、McGeer EG、“The inflammatory response system of brain implications for the therapy of Alzheimer and other neurodegenerative diseases.”、Brain Res.Rev.、1995年;第21巻:195−218ページ)。in’t Veldらの研究(the New England Journal of Medicine、2001年;第345巻、1515ページ)において、彼らは、アルツハイマー病のリスクのある約7000人を7年近く追跡した。彼らの結果は、NSAIAが、認知症の開始以前のNSAIAの累積的使用が少なくとも2年、又は2年以上である人に対して、相対的リスクを低減できることを示唆した。NSAIAの神経保護能が認知症開始の直前の年に停止すると、これらの化合物は、病気の前駆症状を有するほとんどの人において、進行に対する防御を与えなくなった。発明者らは、この理由は、損傷した神経細胞周辺の組織が、さらなる損傷から神経細胞を保護するために傷跡を形成すると考えている。ほとんどのNSAIAは、脳血液及び神経細胞障壁の浸透速度が非常に遅く、傷跡の障壁に浸透することができない。本発明のこれらのプロドラッグは、非常に速い皮膚、血液脳、神経細胞膜、及び傷跡の障壁への浸透速度を有し、アルツハイマー病、パーキンソン病及び他の進行性神経変性疾患の治療に対して非常に有望な薬剤である。
【0046】
これらのプロドラッグは、損傷脊髄周辺の保護された傷跡により治癒が停止された、脊髄損傷を有する患者を助けることができる。ほとんどのNSAIAは、治療上有効量において傷跡の障壁に浸透することができないが、本発明のプロドラッグは、傷跡の障壁に浸透でき、抗炎症活性を有し、傷の治癒の助けとなることができる。
【0047】
NSAIAは、上述の症状の治療に対してあまり効果的ではなく、細胞膜、特に脳細胞及び神経細胞にあまり効果的に浸透できないために深刻な副作用を有し、全身循環の滞在が長すぎるため、薬物の大部分は「作用部位」に達する前に腸粘膜、肝臓、腎臓、及び肺により代謝されることになる。この状況は、非常に低い薬理的効果を生むだけでなく、腸粘膜、肝臓、腎臓、肺、及び他の身体部分に有毒な負担も生じる。これらのプロドラッグは、皮膚、脳血液、脳細胞、神経細胞及び他の膜障壁に非常に良好に浸透し、親薬物の数百倍の能力を有し、通常の薬物服用量のわずか数十分の一又は数百分の一を必要とし、副作用の発生が非常に少なくなる。これは、経皮的な薬物送達だけでなく、任意の薬物送達システム(経口、皮下、静脈内、吸入、及び経鼻等)にも有益となり、それぞれの親薬物によって治療可能であるよりも良好に多くの症状を、及びそれぞれの親薬物では治療できないいくつかの症状さえ、治療できる。
【0048】
上述の一般式1、2a、2b、2c、又は2dの「化学構造1、2a、2b、2c、又は2d」の化合物は、N,N’−ジシクロヘキシルカルボジイミド、N,N’−ジイソプロピルカルボジイミド又は他のカップリング試薬を用いて無水物を形成する反応、次いで適切なアルコール、チオール、又はアミンを用いる反応によって、NSAIAから調製することができる。
【0049】
上記の一般式1、2a、2b、2c、又は2dの「化学構造1、2a、2b、2c、又は2d」の化合物は、適切なハロゲン化物を用いて、NSAIAの金属塩、有機塩基性塩、又は固定化された塩基性塩から調製することができる。
【0050】
有効成分としての、一般的な「化学構造1、2a、2b、2c、又は2d」の化合物、又は一般的な「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物の、経皮的治療アプリケーションシステムは、ヒト又は動物におけるNSAIAによる治療が可能な任意の症状、及び本発明に記載の新規症状を治療するために使用できる。これらのシステムは、一つの有効成分を含有するマトリクス層と、不浸透性の裏地層とを含む、バンデージ又はパッチとすることができる。最も好適なシステムは、有効成分収容体であり、皮膚に面する浸透性の底部を有する。放出率を制御することにより、本システムは、NSAIAが至適な治療上血液濃度に一定に達し、有効性を増し、NSAIAの副作用を低減するようにできる。これらのシステムは、手首、足首、腕、脚、又は身体の任意の部分に装着できる。
【発明の効果】
【0051】
NSAIAは、上述の症状の治療に対してあまり効果的ではなく、細胞膜、特に脳細胞及び神経細胞にあまり効果的に浸透できないために深刻な副作用を有し、全身循環の滞在が長すぎるため、薬物の大部分は「作用部位」に達する前に腸粘膜、肝臓、腎臓、及び肺により代謝されることになる。この状況は、非常に低い薬理的効果を生むだけでなく、腸粘膜、肝臓、腎臓、肺、及び任意の他の身体部分に有毒な負担も生じる。これらのプロドラッグは、皮膚、脳血液、脳細胞、神経細胞及び他の膜障壁に非常に良好に浸透し、親薬物の数百倍の能力を有し、通常の薬物服用量のわずか数十分の一又は数百分の一を必要とし、副作用の発生が非常に少なくなる。これは、経皮的な薬物送達だけでなく、任意の薬物送達システム(経口、皮下、静脈内、吸入、及び経鼻等)にも有益となり、親薬物では治療できない多くの症状を治療できる。これらのプロドラッグは、経皮だけでなく、任意の種類の医薬治療に対して経口(胃壁に浸透できないため、胃を傷つけることがない)でも投与でき、NSAIAの副作用の大部分である、消化不良、胃十二指腸出血、胃の潰瘍、胃炎等の非常に顕著な胃腸障害を避けるはずである。これらのプロドラッグの経皮投与の別の大きな利益は、特に子供への医薬品投与が非常に容易であることである。
【図面の簡単な説明】
【0052】
【図1】図中、一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」におけるR、R1、R2、R3、R4、R5、R6、R7、R8、R9、X、HA、及びAry−は、請求項1及び請求項2におけるR、R1、R2、R3、R4、R5、R6、R7、R8、R9、X、HA、及びAry−と同一と定義する。
【発明を実施するための形態】
【0053】
(最良の形態)
ジエチルアミノエチルアセチルサリチラート.アセチルサリチル酸塩の調製
180gの2−アセチルサリチル酸を、1000mlのクロロホルムに溶解した。混合物を5℃に冷却した。103gの1,3−ジシクロヘキシルカルボジイミドを、混合物に加えた。混合物を、室温で2時間かき混ぜた。固形廃棄物を濾過して取り除き、クロロホルムで洗浄した(3×300ml)。59gのジエチルアミノエタノールを、反応混合物に加えた。混合物を、室温で3時間かき混ぜた。有機溶液を蒸発させた。乾燥後、所望生成物220gを得た(96%)。元素分析:C24H29NO8、分子量:459.18.計算%C:62.73、H:6.36、N:3.05、O:27.86、実測%C:62.70、H:6.40、Cl:N:3.01、O:27.90。
【0054】
(発明の形態)
1−ピペリジンプロピル2[(2,6−ジクロロフェニル)アミノ]ベンゼンアセタート.AcOHの調製
31.8g(0.1mol)のナトリウム2[(2,6−ジクロロフェニル)アミノ]ベンゼンアセタートを、180mlのクロロホルム中にサスペンドした。28.6g(0.1mol)の1−ピペリジンプロピルブロミド.HBrを混合物に加え、室温で5時間かき混ぜた。混合物を5%Na2CO3(1×300ml)及び水(3×100ml)で洗浄した。混合物を無水Na2SO4で乾燥した。硫酸ナトリウムを濾過して取り除き、クロロホルム(3×50ml)で洗浄した。6gの酢酸を溶液に加えた。溶液を真空中で100mlまで濃縮した。次いで、300mlのヘキサンを溶液に加えた。固体生成物を濾過して集め、ヘキサン(3×100ml)で洗浄した。乾燥後、所望生成物40gを得た(86%)。元素分析:C24H30Cl2N2O4、分子量:481.43、計算%C:59.88、H:6.28、Cl:14.73、N:5.82、O:13.29、実測%C:59.83、H:6.32、Cl:14.71、N:5.79、O:13.35。
【0055】
3−ピペリジンメチル2−(ρ−イソブチルフェニル)プロピオナート.AcOHの調製
60gのポリマー結合トリエチルアミン(3mmol/g、100−200メッシュ)を、180mlのクロロホルム中にサスペンドした。20.6g(0.1mol)の2−(ρ−イソブチルフェニル)プロピオン酸を、かき混ぜながら混合物に加えた。39g(0.15mol)の3−ピペリジンメチルブロミド.HBrを混合物に加え、混合物を室温で5時間かき混ぜた。ポリマーを濾過して取り除き、アセトン(3×50ml)で洗浄した。300mlの5%Na2CO3を、かき混ぜながら溶液に加えた。混合物を30分間かき混ぜた。クロロホルム溶液を水(3×100ml)で洗浄し、Na2SO4で乾燥した。硫酸銅を濾過して取り除き、クロロホルム(3×100ml)で洗浄した。6gの酢酸を混合物に加えた。溶液を真空中で100mlまで濃縮した。300mlのヘキサンを溶液に加えた。固体生成物を濾過して集め、ヘキサン(3×100ml)で洗浄した。乾燥後、所望生成物35gを得た(96%)。元素分析:C21H33NO4、分子量:363.49、計算%C:69.39、H:9.15、N:3.85、O:17.61、実測%C:69.35、H:9.18、N:3.83、O:17.64。
【産業上の利用可能性】
【0056】
一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」のプロドラッグは、NSAIAよりも優れている。これらは、NSAIAによる治療が可能なヒト又は動物の任意の症状の治療に、医薬として使用できる。これらは、糖尿病(I型及びII型)、血糖及び血中脂質の異常レベル、脳卒中、心臓発作等の心臓及び血管疾患、アルツハイマー病、パーキンソン病及び他の神経変性疾患、乾癬、円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患、筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状及び肛門掻痒、前立腺炎、前立腺膀胱炎、自己免疫性肝炎、自己免疫性腎炎、静脈炎及び他の炎症、脊髄損傷、傷、乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌、並びに他の多くの症状の治療及び予防にも使用できる。これらのプロドラッグは、経皮吸収促進剤の補助なしに経皮投与できる。
【特許請求の範囲】
【請求項1】
一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」の化合物であって、
【化1】

式中、Rは分岐又は直鎖の−(CH2)n−を表し、−(CH2)n−においてn=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R1は分岐又は直鎖の−(CH2)a−を表し、−(CH2)a−においてa=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R2は分岐又は直鎖の−(CH2)b−を表し、−(CH2)b−においてb=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R3は分岐又は直鎖の−(CH2)c−を表し、−(CH2)c−においてc=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R4はH、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;R5は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R6、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;R6は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R5、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく、R7は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R5、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;Xは、存在しない、O、NH、NR6又はSを表し;HAは、存在しない、HCl、HBr、HF、HI、HOAc、クエン酸、又は薬理学的に許容できる任意の他の酸を表し、全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、分岐又は直鎖であり、C、H、O、Cl、Br、F、I、P、S、N又は任意の他の薬理学的に許容できる原子を含んでもよく、単結合、二重結合、及び/又は三重結合を含んでもよく;全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、アキラル又はキラルでもよく;基がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよく、Ary−は次式を表すが限定されず、
【化2】

【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

式中、Rxは、H、CH3、CH3O、HO、CH3CH2、CF3、CHF2、CH2F、Cl、F、Br、Fを表し;Ryは、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;X1又はX4は、CH2、S、O、NH、又はCOを表し;X2又はX5は、CH、CR8、又はNを表し;X3は、O、S、NH、又はNR8を表し;Y、Y1、Y2、Y3、Y4、Y5、又はY6は、独立してH、HO、CH3COO、RyCOO、HS、NO2、CN、CH3COS、NH2、CH3CONH、RyCONH、CH3、CH3CH2、C3H7、C4H9、CH3O、CH3CH2O、C3H7O、Cl、F、Br、I、CH3S、CHF2O、CF3O、CF3CF2O、C3F7O、CF3、CF3CF2、C3F7、C4F9、CH3SO2、RySO2、CH3SO、RySO、CH3CO、CH3CH2COを表し;いずれのAry−は、アキラル又はキラルであり;Ary−がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよい、化合物。
【請求項2】
一般式(1)の「化学構造1」の化合物であって、
【化12】

式中、Rは分岐又は直鎖の−(CH2)n−を表し、−(CH2)n−においてn=0,1,2,3,4,5,6,7,8,9,10,11,12,…であり、いずれのCH2がO、S、NR8、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール残基、又は薬理学的に許容できる任意の他の部分と置き換えられてもよく;R1は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール部分、又は薬理学的に許容できる任意の他の部分と置き換えられてもよく;R2は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール部分、又は薬理学的に許容できる他の部分と置き換えられてもよく;Xは、O、NH、NR8、S、又は存在しないことを表し;R8は、H、OH、Cl、F、Br、I、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;R9は、H、OH、Cl、F、Br、I、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;前記一般式(1)の「化学構造1」におけるAry−は、請求項1に記載の前記一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」と同一のAry−として定義され;HAは、存在しない、HCl、HBr、HF、HI、HOAc、クエン酸、又は薬理学的に許容できる任意の酸を表し;全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、分岐又は直鎖であり、C、H、O、Cl、Br、F、I、P、S、N又は任意の他の薬理学的に許容できる原子を含んでもよく、単結合、二重結合、及び/又は三重結合を含んでもよく;全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、アキラル又はキラルでもよく;基がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよい、化合物。
【請求項3】
請求項1及び請求項2に記載の前記一般式1、2a、2b、2c、又は2dの「化学構造1、2a、2b、2c、又は2d」の化合物を、N,N’−ジシクロヘキシルカルボジイミド、N,N’−ジイソプロピルカルボジイミド又は他のカップリング試薬を用いて無水物を形成する反応、次いで適切なアルコール、チオール、又はアミンを用いる反応により、NSAIAから調製することができる、請求項1及び請求項2に記載の前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物を調製する方法。
【請求項4】
請求項1及び請求項2に記載の前記一般式1、2a、2b、2c、又は2dの「化学構造1、2a、2b、2c、又は2d」の化合物を、適切なハロゲン化物を用いて、NSAIAの金属塩、有機塩基性塩、又は固定化された塩基性塩から調製することができる、請求項1及び請求項2に記載の前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物を調製する方法。
【請求項5】
ヒト又は動物における任意のNSAIAにより治療可能な症状を治療するために、経皮、経口、皮下、静脈内、又は経鼻的に投与することができる、請求項1及び2に記載の、有効成分としての、前記一般「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物であって、前記NSAIAにより治療可能な症状は、歯痛、頭痛、関節炎及び他の炎症性の痛みに由来する痛み、発熱、癌、月経困難症、急性片頭痛、急性痛風性関節炎、強直性脊椎炎、関節リウマチ、変形性関節症、月経困難症、及び認知症を含むが、これらに限定されない。
【請求項6】
請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物の、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することによってヒト又は動物における任意のNSAIAにより治療可能な症状を治療する方法。
【請求項7】
請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の前記化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物の治療上有効量を炎症領域に局所的に投与することにより、ヒト又は動物における頭痛、歯痛、筋肉痛、並びに関節炎及び他の炎症性の痛みを局所的に治療する方法。
【請求項8】
ヒト又は動物における糖尿病(I型及びII型)、異常血糖、異常血中脂質濃度、及び他の代謝疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項9】
ヒト又は動物における糖尿病(I型及びII型)、異常血糖値、異常血中脂質濃度、及び他の代謝疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項10】
ヒト又は動物における異常血圧及び異常血中脂質濃度の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項11】
ヒト又は動物における異常血圧及び異常血中脂質濃度の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項12】
ヒト又は動物における脳卒中、心臓発作、及び他の心臓と血管の病気の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与し得る、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項13】
治療上有効量を感染領域(首、頭、胸、脚、又は/及び身体の任意の他の部分等)に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における脳卒中、心臓発作、及び他の心臓と血管の病気を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項14】
ヒト又は動物における脳卒中、心臓発作、及び他の心臓と血管の病気の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項15】
ヒト又は動物における臓器移植拒絶反応の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与し得る、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項16】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における臓器移植拒絶反応を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項17】
ヒト又は動物における臓器移植拒絶反応の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項18】
アルツハイマー病、パーキンソン病及び他の神経変性疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(好ましくは首及び頭に、溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項19】
アルツハイマー病、パーキンソン病及び他の神経変性疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項20】
乾癬及び他の皮膚疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又ゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項21】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における乾癬及び他の皮膚疾患を治療するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項22】
乾癬及び他の皮膚疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項23】
ヒト又は動物における円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項24】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項25】
ヒト又は動物における円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項26】
ヒト又は動物における筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項27】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項28】
ヒト又は動物における筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項29】
前立腺の炎症(前立腺炎)、前立腺膀胱炎、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状、及び肛門掻痒の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項30】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、前立腺の炎症(前立腺炎)、前立腺膀胱炎、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状、及び肛門掻痒を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項31】
前立腺の炎症(前立腺炎)、前立腺膀胱炎、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状、及び肛門掻痒の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項32】
ヒト又は動物における自己免疫性肝炎、自己免疫性腎炎、結腸直腸炎、腸炎、静脈炎、血管炎、及び他の炎症の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項33】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における自己免疫性肝炎、自己免疫性腎炎、結腸直腸炎、腸炎、静脈炎、血管炎、及び他の炎症を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項34】
ヒト又は動物における自己免疫性肝炎、自己免疫性腎炎、結腸直腸炎、腸炎、静脈炎、血管炎、及び他の炎症の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項35】
ヒト又は動物における脊髄損傷の治療のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項36】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における脊髄損傷を治療するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項37】
ヒト又は動物における脊髄損傷の治療のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項38】
ヒト又は動物における乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項39】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項40】
ヒト又は動物における乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項41】
ヒト又は動物における乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌の治療及び予防のために、経皮的に、皮下に、静脈内に、経鼻的に又は経口的に、単独で又は他の癌治療薬と組み合わせて投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項42】
ヒト又は動物における乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌の治療のために、癌を取り除く手術の前又は後に、経皮的に、経口的に、皮下に、静脈内に、又は経鼻的に投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項43】
切り傷、火傷、又は他の外傷の治療のために、溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で経皮的に(局所的に)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項44】
異常血管性皮膚病変、あざ、ほくろ(母斑)、スキンタグ、高齢スポット(肝斑)、及び他の皮膚疾患の治療のために、溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で経皮的に(局所的に)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項45】
ヒト又は動物におけるNSAIAによる治療が可能な任意の症状、及び本発明に記載の新規症状を治療するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物の、経皮的治療応用システムであって、一つの有効成分を含有するマトリクス層と、不浸透性の裏地層とを含む、バンデージ又はパッチとすることができ、最も好適なシステムは、有効成分収容体であり、皮膚に面する浸透性の底部を有し、放出率を制御することにより、前記NSAIAが至適な治療上血液濃度に一定に達し、有効性を増し、NSAIAの副作用を低減することを可能にするシステム。
【請求項1】
一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」の化合物であって、
【化1】

式中、Rは分岐又は直鎖の−(CH2)n−を表し、−(CH2)n−においてn=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R1は分岐又は直鎖の−(CH2)a−を表し、−(CH2)a−においてa=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R2は分岐又は直鎖の−(CH2)b−を表し、−(CH2)b−においてb=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R3は分岐又は直鎖の−(CH2)c−を表し、−(CH2)c−においてc=0,1,2,3,4,5,6,7,8,9,10…であり、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール残基、又は他の環系と置き換えられてもよく;R4はH、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR6R7、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;R5は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R6、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;R6は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R5、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく、R7は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR6、CR7R5、アリール又はヘテロアリール部分、又は他の環部分と置き換えられてもよく;Xは、存在しない、O、NH、NR6又はSを表し;HAは、存在しない、HCl、HBr、HF、HI、HOAc、クエン酸、又は薬理学的に許容できる任意の他の酸を表し、全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、分岐又は直鎖であり、C、H、O、Cl、Br、F、I、P、S、N又は任意の他の薬理学的に許容できる原子を含んでもよく、単結合、二重結合、及び/又は三重結合を含んでもよく;全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、アキラル又はキラルでもよく;基がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよく、Ary−は次式を表すが限定されず、
【化2】

【化3】

【化4】

【化5】

【化6】

【化7】

【化8】

【化9】

【化10】

【化11】

式中、Rxは、H、CH3、CH3O、HO、CH3CH2、CF3、CHF2、CH2F、Cl、F、Br、Fを表し;Ryは、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;X1又はX4は、CH2、S、O、NH、又はCOを表し;X2又はX5は、CH、CR8、又はNを表し;X3は、O、S、NH、又はNR8を表し;Y、Y1、Y2、Y3、Y4、Y5、又はY6は、独立してH、HO、CH3COO、RyCOO、HS、NO2、CN、CH3COS、NH2、CH3CONH、RyCONH、CH3、CH3CH2、C3H7、C4H9、CH3O、CH3CH2O、C3H7O、Cl、F、Br、I、CH3S、CHF2O、CF3O、CF3CF2O、C3F7O、CF3、CF3CF2、C3F7、C4F9、CH3SO2、RySO2、CH3SO、RySO、CH3CO、CH3CH2COを表し;いずれのAry−は、アキラル又はキラルであり;Ary−がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよい、化合物。
【請求項2】
一般式(1)の「化学構造1」の化合物であって、
【化12】

式中、Rは分岐又は直鎖の−(CH2)n−を表し、−(CH2)n−においてn=0,1,2,3,4,5,6,7,8,9,10,11,12,…であり、いずれのCH2がO、S、NR8、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール残基、又は薬理学的に許容できる任意の他の部分と置き換えられてもよく;R1は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル、若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール部分、又は薬理学的に許容できる任意の他の部分と置き換えられてもよく;R2は、H、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し、いずれのCH2がO、S、CH=CH、C≡C、CHR8、CR8R9、アリール又はヘテロアリール部分、又は薬理学的に許容できる他の部分と置き換えられてもよく;Xは、O、NH、NR8、S、又は存在しないことを表し;R8は、H、OH、Cl、F、Br、I、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;R9は、H、OH、Cl、F、Br、I、1から12の炭素原子を有するアルキル、アルキルオキシ、アルケニル、パーフルオロアルキル、ハロゲン化アルキル若しくはアルキニル残基、アリール又はヘテロアリール部分のいずれか一つを表し;前記一般式(1)の「化学構造1」におけるAry−は、請求項1に記載の前記一般式(2a、2b、2c、又は2d)の「化学構造2a、2b、2c、又は2d」と同一のAry−として定義され;HAは、存在しない、HCl、HBr、HF、HI、HOAc、クエン酸、又は薬理学的に許容できる任意の酸を表し;全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、分岐又は直鎖であり、C、H、O、Cl、Br、F、I、P、S、N又は任意の他の薬理学的に許容できる原子を含んでもよく、単結合、二重結合、及び/又は三重結合を含んでもよく;全てのR、R1、R2、R8、R9、又は−(CH2)n−基は、アキラル又はキラルでもよく;基がキラルであれば、一以上のキラル中心を有してもよく、単独の(R)若しくは(S)エナンチオマー又は(R)及び(S)エナンチオマーの混合物でもよい、化合物。
【請求項3】
請求項1及び請求項2に記載の前記一般式1、2a、2b、2c、又は2dの「化学構造1、2a、2b、2c、又は2d」の化合物を、N,N’−ジシクロヘキシルカルボジイミド、N,N’−ジイソプロピルカルボジイミド又は他のカップリング試薬を用いて無水物を形成する反応、次いで適切なアルコール、チオール、又はアミンを用いる反応により、NSAIAから調製することができる、請求項1及び請求項2に記載の前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物を調製する方法。
【請求項4】
請求項1及び請求項2に記載の前記一般式1、2a、2b、2c、又は2dの「化学構造1、2a、2b、2c、又は2d」の化合物を、適切なハロゲン化物を用いて、NSAIAの金属塩、有機塩基性塩、又は固定化された塩基性塩から調製することができる、請求項1及び請求項2に記載の前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物を調製する方法。
【請求項5】
ヒト又は動物における任意のNSAIAにより治療可能な症状を治療するために、経皮、経口、皮下、静脈内、又は経鼻的に投与することができる、請求項1及び2に記載の、有効成分としての、前記一般「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物であって、前記NSAIAにより治療可能な症状は、歯痛、頭痛、関節炎及び他の炎症性の痛みに由来する痛み、発熱、癌、月経困難症、急性片頭痛、急性痛風性関節炎、強直性脊椎炎、関節リウマチ、変形性関節症、月経困難症、及び認知症を含むが、これらに限定されない。
【請求項6】
請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物の、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することによってヒト又は動物における任意のNSAIAにより治療可能な症状を治療する方法。
【請求項7】
請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の前記化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物の治療上有効量を炎症領域に局所的に投与することにより、ヒト又は動物における頭痛、歯痛、筋肉痛、並びに関節炎及び他の炎症性の痛みを局所的に治療する方法。
【請求項8】
ヒト又は動物における糖尿病(I型及びII型)、異常血糖、異常血中脂質濃度、及び他の代謝疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項9】
ヒト又は動物における糖尿病(I型及びII型)、異常血糖値、異常血中脂質濃度、及び他の代謝疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項10】
ヒト又は動物における異常血圧及び異常血中脂質濃度の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項11】
ヒト又は動物における異常血圧及び異常血中脂質濃度の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項12】
ヒト又は動物における脳卒中、心臓発作、及び他の心臓と血管の病気の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与し得る、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項13】
治療上有効量を感染領域(首、頭、胸、脚、又は/及び身体の任意の他の部分等)に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における脳卒中、心臓発作、及び他の心臓と血管の病気を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項14】
ヒト又は動物における脳卒中、心臓発作、及び他の心臓と血管の病気の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項15】
ヒト又は動物における臓器移植拒絶反応の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与し得る、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項16】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における臓器移植拒絶反応を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項17】
ヒト又は動物における臓器移植拒絶反応の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項18】
アルツハイマー病、パーキンソン病及び他の神経変性疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(好ましくは首及び頭に、溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項19】
アルツハイマー病、パーキンソン病及び他の神経変性疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項20】
乾癬及び他の皮膚疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又ゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項21】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における乾癬及び他の皮膚疾患を治療するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項22】
乾癬及び他の皮膚疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項23】
ヒト又は動物における円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項24】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項25】
ヒト又は動物における円板状エリテマトーデス、全身性エリテマトーデス(SLE)、自己免疫疾患肝炎、強皮症、シェーグレン症候群、関節リウマチ、多発性筋炎、強皮症、橋本甲状腺炎、若年型糖尿病、アジソン病、白斑、悪性貧血、糸球体腎炎、肺線維症、多発性硬化症(MS)、クローン病、及び他の自己免疫疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項26】
ヒト又は動物における筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項27】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項28】
ヒト又は動物における筋萎縮性側索硬化症(ALS)、眼球咽頭型筋ジストロフィー(OPMD)、筋緊張性ジストロフィー(MD)、デュシェンヌ型筋ジストロフィー(DMD)、多発性筋炎(PM)、皮膚筋炎(DM)、封入体筋炎(IBM)、及びその他の筋疾患の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項29】
前立腺の炎症(前立腺炎)、前立腺膀胱炎、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状、及び肛門掻痒の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項30】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、前立腺の炎症(前立腺炎)、前立腺膀胱炎、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状、及び肛門掻痒を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項31】
前立腺の炎症(前立腺炎)、前立腺膀胱炎、痔、炎症性の痔、照射(人工形成)後直腸炎、慢性潰瘍性大腸炎、腺窩炎、他の肛門直腸の炎症性症状、及び肛門掻痒の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項32】
ヒト又は動物における自己免疫性肝炎、自己免疫性腎炎、結腸直腸炎、腸炎、静脈炎、血管炎、及び他の炎症の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項33】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における自己免疫性肝炎、自己免疫性腎炎、結腸直腸炎、腸炎、静脈炎、血管炎、及び他の炎症を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項34】
ヒト又は動物における自己免疫性肝炎、自己免疫性腎炎、結腸直腸炎、腸炎、静脈炎、血管炎、及び他の炎症の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項35】
ヒト又は動物における脊髄損傷の治療のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項36】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、ヒト又は動物における脊髄損傷を治療するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項37】
ヒト又は動物における脊髄損傷の治療のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項38】
ヒト又は動物における乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌の治療及び予防のため、治療上有効な血漿濃度を送達するために、身体の任意の部分に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)経皮投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項39】
治療上有効量を感染領域に局所的に(溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で)投与することにより、乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌を治療及び予防するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の化合物、又は前記一般式(1、2a、2b、2c、及び2d)の「化学構造1、2a、2b、2c、及び2d」の少なくとも一つの化合物を含む組成物。
【請求項40】
ヒト又は動物における乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌の治療及び予防のために、経口的に、皮下に、静脈内に、又は経鼻的に(溶液、スプレー、エマルジョン、丸剤、錠剤、又は任意の他の処方の形式で)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項41】
ヒト又は動物における乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌の治療及び予防のために、経皮的に、皮下に、静脈内に、経鼻的に又は経口的に、単独で又は他の癌治療薬と組み合わせて投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項42】
ヒト又は動物における乳癌、結腸直腸癌、口腔癌、肺及び他の呼吸器系の癌、皮膚癌、子宮癌、生殖器癌、泌尿器癌、白血病及び他の血液とリンパ組織の癌並びに他の癌の治療のために、癌を取り除く手術の前又は後に、経皮的に、経口的に、皮下に、静脈内に、又は経鼻的に投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項43】
切り傷、火傷、又は他の外傷の治療のために、溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で経皮的に(局所的に)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項44】
異常血管性皮膚病変、あざ、ほくろ(母斑)、スキンタグ、高齢スポット(肝斑)、及び他の皮膚疾患の治療のために、溶液、スプレー、ローション、軟膏、エマルジョン又はゲルの形式で経皮的に(局所的に)投与することのできる、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物。
【請求項45】
ヒト又は動物におけるNSAIAによる治療が可能な任意の症状、及び本発明に記載の新規症状を治療するための、請求項1及び2に記載の、有効成分としての、前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の化合物、又は前記一般式(1、2a、2b、2c、又は2d)の「化学構造1、2a、2b、2c、又は2d」の少なくとも一つの化合物を含む組成物の、経皮的治療応用システムであって、一つの有効成分を含有するマトリクス層と、不浸透性の裏地層とを含む、バンデージ又はパッチとすることができ、最も好適なシステムは、有効成分収容体であり、皮膚に面する浸透性の底部を有し、放出率を制御することにより、前記NSAIAが至適な治療上血液濃度に一定に達し、有効性を増し、NSAIAの副作用を低減することを可能にするシステム。
【図1】




【公表番号】特表2010−529101(P2010−529101A)
【公表日】平成22年8月26日(2010.8.26)
【国際特許分類】
【出願番号】特願2010−510895(P2010−510895)
【出願日】平成19年6月4日(2007.6.4)
【国際出願番号】PCT/IB2007/052090
【国際公開番号】WO2008/149181
【国際公開日】平成20年12月11日(2008.12.11)
【出願人】(509335236)テックフィールズ インコーポレイテッド (1)
【出願人】(509023539)
【Fターム(参考)】
【公表日】平成22年8月26日(2010.8.26)
【国際特許分類】
【出願日】平成19年6月4日(2007.6.4)
【国際出願番号】PCT/IB2007/052090
【国際公開番号】WO2008/149181
【国際公開日】平成20年12月11日(2008.12.11)
【出願人】(509335236)テックフィールズ インコーポレイテッド (1)
【出願人】(509023539)

【Fターム(参考)】
[ Back to top ]

