非平面状の固体支持体を用いた微生物の分離方法及び分離装置
【課題】微生物の分離方法及び分離装置を提供する。
【解決手段】微生物を含む試料から微生物を分離する方法であって、非平面状の固体支持体と、微生物を含む試料とをpH3.0〜6.0で接触させる段階を含む、微生物の分離方法である。
【解決手段】微生物を含む試料から微生物を分離する方法であって、非平面状の固体支持体と、微生物を含む試料とをpH3.0〜6.0で接触させる段階を含む、微生物の分離方法である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物の分離方法及び分離装置に関する。
【背景技術】
【0002】
従来より、試料から微生物を分離する方法として、遠心分離及びろ過が一般的に用いられている。また、特定の細胞を濃縮または分離する場合、その特定の細胞に特異的に結合する受容体またはリガンドが結合している支持体に、前記細胞を結合させて、これを濃縮または分離する方法が用いられている。例えば、ある細胞と特異的に結合する抗体が結合している支持体に、前記細胞を含む試料を流し、前記細胞を前記抗体と結合させ、その後、結合していない細胞を洗浄する段階を含むという、アフィニティークロマトグラフィーが挙げられる。
【0003】
また、特許文献1には超音波場及び進行波誘電泳動を用いた細胞分離システムが開示されている。かかるシステムは、上部ガラス基板の両端で連結しており、外部からの電気的入力を機械的振動に変換して、前記上部ガラス基板に加える圧電変換器と、前記上部ガラス基板と平行な下部基板上に配列したn個の電極とを備えている。そして、前記上部ガラス基板と下部基板との間には細胞を含む流体が充填されており、前記各電極は、前記圧電変換器の長手方向と垂直に置かれ、前記n個の電極は、前記圧電変換器の長手方向に沿って一定間隔で配列している細胞分離装置を備えることを特徴とする。
【特許文献1】韓国特許出願公開第2006−0068979号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかし、上記従来技術は、固体基板上にリガンドまたは受容体を固定化するか、あるいは外部動力を供給して特定の細胞を選択的に濃縮または分離するものである。このような場合、分離工程が煩雑であるだけでなく、支持体の表面当たりで見ると、分離できる微生物量は比較的少量とならざるを得ず、非効率的である。リガンドまたは受容体を固定化する費用、これらと微生物を反応させる段階、及び反応された微生物を分離する段階が必要であり、これらの段階にかかる時間と費用を考慮すれば、単位時間当たりの微生物の分離量について多くを望むことはできない。また、外部動力を供給した場合、別途の動力を供給しなければならないため、費用がさらにかかり、やはり、単位時間当たりの微生物の分離量について多くを望むことはできない。そのため、分離が簡便で、かつ分離効率を有意に高くすることができるような微生物の分離方法や装置が、大量迅速に微生物を扱うあらゆる産業上の分野で強く要求されている。
【0005】
本発明の目的は、試料からの微生物の分離効率を向上させることのできる方法を提供することである。
【0006】
また、本発明の目的は、試料からの微生物の分離効率を向上させることのできる装置を提供することである。
【課題を解決するための手段】
【0007】
本発明者らが鋭意研究を重ねた結果、固体支持体自体の特性及び液体培地の条件を調整することによって、操作が簡便で、かつ試料から微生物を分離できる量を有意に増すことができることを見出した。
【0008】
そこで、本発明は、非平面状の固体支持体と、微生物を含む試料とをpH3.0〜6.0で接触させる段階を含む微生物の分離方法、及び非平面状の固体支持体を用いた分離装置を提供する。
【発明の効果】
【0009】
本発明の微生物の分離方法によれば、生物学的試料中に存在する細菌細胞、真菌細胞、またはウイルスを含む微生物細胞を簡便かつ効率的に分離できる。また、本発明の微生物を分離するための装置によれば、細菌細胞、真菌細胞、またはウイルスを含む微生物細胞を簡便かつ効率的に分離できる。
【発明を実施するための最良の形態】
【0010】
本発明の第1実施形態は、微生物を含む試料から微生物を分離する方法であって、非平面状の固体支持体と、微生物を含む試料とをpH3.0〜6.0で接触させる段階を含む、微生物の分離方法である。前記接触により、前記微生物を前記固体支持体に付着させる。
【0011】
固体支持体を含む液体培地中で、微生物は液体培地中に存在するか、または固体支持体に付着されうる。このような液体培地と固体支持体との分布は、液体培地の表面張力と微生物の表面張力との差によって決まることが知られている。すなわち、液体培地の表面張力が微生物の表面張力より大きい場合、前記微生物は、表面張力の小さい固体支持体、すなわち疎水性固体支持体により容易に付着し、微生物の表面張力が液体培地の表面張力より大きい場合、前記微生物は、表面張力の大きい固体支持体、すなわち親水性固体支持体により容易に付着し、微生物の表面張力が液体培地の表面張力と同じ場合には、微生物細胞の固体支持体への付着には表面張力の影響がなく、静電気的相互作用のような他の相互作用が影響を及ぼすと報告されている(Applied and Environmental Microbiology, July 1983、p.90−97)。また、前記の表面張力に基づいた熱力学的接近を通じて、微生物細胞が付着するだけでなく、静電気的な引力特性を通じても微生物細胞が表面に付着可能であることも知られている。しかし、このような現象は、その付着速度が非常に小さいという問題点がある。
【0012】
これに対し、本発明者らは上記のような従来技術の問題点を解決するために、非平面状の固体支持体を使用すると共に、微生物を含む試料をpH3.0〜6.0の範囲で前記固体支持体に接触させることによって、高い収率で微生物を分離できることを確認した。これは、固体支持体の表面積が増加するのと同時に、pH3.0〜6.0の液体培地を使用することによって、微生物の細胞膜が変性し、溶液に対する溶解度が低下して、固体表面に付着する比率が相対的に高くなるためであると推測されるが、本発明の範囲はこのような特定の作用機作に限定されることはない。
【0013】
前記接触段階において、前記試料は、微生物を含んでいれば特に制限されることはない。好ましくは、前記微生物を含む生物学的試料、臨床試料、または実験室試料から選択される。本明細書において、「生物学的試料」とは、個体から分離された細胞、または生物学的液体のような細胞若しくは組織物を含むか、あるいはこれらによって構成される試料を意味する。前記個体は、人間を含む動物でありうる。生物学的試料の例として、以下に制限されることはないが、唾液、喀痰、血液、血液細胞(白血球、赤血球など)、羊水、血清、精液、骨髄、組織または微細針状の生検試料、尿、腹膜液、肋膜液及び細胞培養物などが挙げられる。生物学的試料には、組織学上の目的のために取られた冷凍切片のような組織切片が含まれる。前記生物学的試料は、人間の患者由来の試料(臨床試料)であることが好ましく、入手容易の観点から、血液、尿、唾液または喀痰であることがより好ましく、このうち、血液、尿または唾液が特に好ましい。
【0014】
本発明において、分離の対象となる微生物として、細菌、真菌及び/またはウイルスが含まれうる。
【0015】
前記接触段階において、前記試料は、前記微生物を上記範囲の低pHで緩衝できる溶液(緩衝液)によって希釈されうる。前記緩衝液は、生物学的用途に好適に使用できる観点から、リン酸緩衝液(例えばリン酸ナトリウム)または酢酸緩衝液(例えば酢酸ナトリウム)であることが好ましい。前記希釈の程度、すなわち前記試料と緩衝液との体積比率は特に限定されないが、緩衝作用が十分に得られるという観点から、好ましくは1:1〜1:1,000、より好ましくは1:1〜1:10である。
【0016】
前記接触段階において、前記試料の塩濃度は、好ましくは10〜500mM、より好ましくは50〜300mMである。試料と緩衝液とを混合した後の最終塩濃度が上記範囲内である場合、結合効率を有意に増大させることができる。また、前記試料は、上記の塩濃度範囲の酢酸及びリン酸からなる群から選択されたイオン濃度を有することが好ましい。
【0017】
前記接触段階において、前記固体支持体は非平面状であり、表面積が平面の場合よりも大きいことを特徴とする。前記固体支持体は、表面に凹凸構造が形成されていてもよい。本発明において、「凹凸構造」とは、表面が平らでなく凹面と凸面とがある構造をいう。このような凹凸構造の例として、複数個のピラーが形成されたピラー構造を有する表面、または複数個の孔隙が形成された網状構造を有する表面が挙げられるが、これらに限定されるものではない。このような凹凸構造により、微生物との接触面積を増やし、より効率的な微生物の分離が可能となる。
【0018】
前記接触段階において、前記非平面状の固体支持体は任意の形状を有しうる。例えば、表面に複数のピラーが形成されたピラー構造を有する固体支持体、表面にビーズ形状を有する固体支持体、及び表面に複数個の孔隙が形成された篩構造を有する固体支持体からなる群から選択されるものでありうる。前記ビーズ形状の固体支持体は、カラムのような容器内に充填されて使用されうる。前記ビーズ形状の固体支持体(すなわちビーズ)の大きさは、直径が1〜100μmであることがより好ましく、前記ビーズ形状の固体支持体が容器内に充填される場合、当該容器の容積に対して40%以上充填することが好ましい。前記篩構造を有する固体支持体の場合、前記孔隙の直径は、1〜25μmであることがより好ましい。前記非平面状の固体支持体は、1つの固体支持体または複数個の固体支持体の組み合わせ(例えば、チューブまたは容器を満たす固体支持体の集合)でありうる。
【0019】
前記接触段階において、前記固体支持体は、微細流動装置内のマイクロチャンネルまたはマイクロチャンバの内壁の形態でありうる。したがって、本発明の微生物の分離方法は、一以上の入口及び出口が備えられていて、前記入口及び出口がチャンネルまたはマイクロチャンネルを介して連通している流動装置または微細流動装置内で行われうる。
【0020】
本明細書において、「微細流動装置(microfluidic device)」という用語は、微細流動チャンネル(または、マイクロチャンネルまたはマイクロレベルのチャンネルとも言われる)のような微細流動要素(microfluidic elements)を含む微細流動装置をいう。本明細書における「微細流動(microfluidic)」という用語は、約0.1μm〜1000μmの深さ、広さ、長さ、直径のような一つ以上の断面積次元を含む装置部分(component)、例えば、チャンバ、チャンネル、保存所などを示す。したがって、「マイクロチャンバ(microchamber)」及び「マイクロチャンネル(microchannel)」という用語は、それぞれ約0.1μm〜1000μmの深さ、広さ、長さ、直径のような一つ以上の断面積次元を含むチャンネル及びチャンバを示す。
【0021】
本発明による方法の一具体例によれば、前記接触段階において、前記固体支持体は、その表面に複数個のピラーが形成されたピラー構造を有しうる。固体支持体上にピラーを製造することは、当業者界で周知である。例えば、半導体製造工程に使われるフォトリソグラフィ工程などを使用して、微細なピラーを高密度で形成させることができる。前記ピラーのアスペクト比(前記ピラーの高さと前記ピラーの断面の長さとの比)が1:1〜20:1であることが好ましいが、かかる範囲に限定されるものではない。前記断面の長さとは、ピラーの断面形状が円の場合には断面の直径を意味し、断面形状が四方形の場合には各辺の長さの平均値を意味する。前記ピラー構造において、ピラーの高さと隣接するピラーの距離との比率は、1:1〜25:1であることが好ましい。前記ピラー構造において、前記ピラーと隣接する前記ピラーとの距離は、5〜100μmであることが好ましく、5〜25μmであることがより好ましい。上記距離範囲内である場合、閉じ込め効率を上昇させることができる。
【0022】
本発明の方法において、前記接触段階において、前記非平面状の固体支持体が疎水性であり、70°〜95°の水接触角を有することが好ましい。かかる範囲内の場合、前記非平面状の固体支持体は十分な疎水性を発揮でき、結果として微生物を固体支持体に容易に付着させることができる。前記疎水性の固体支持体は、表面をオクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム(OTC)、トリデカフルオロテトラヒドロオクチルトリメトキシシラン(DFS)、CF3(CF2) 3CH2CH2Si(OCH3)3、CF3(CF2)5CH2CH2Si(OCH3)3、CF3(CF2)7CH2CH2Si(OCH3)3、CF3(CF2)9CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)4CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)6CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)8CH2CH2Si(OCH3)3、CF3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 5(C6H4)C2H4Si(OCH3)3、CF3(CF2) 7(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3CH2CH2SiCH3(OCH3)2、CF3(CF2) 5CH2CH2SiCH3(OCH3)2、CF3(CF2) 7CH2CH2SiCH3(OCH3)2、CF3(CF2)9CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 4CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 6CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2)8CH2CH2SiCH3(OCH3)2、CF3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 5(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 7(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3CH2CH2Si(OCH2CH3)3、CF3(CF2)5CH2CH2Si(OCH2CH3)3、及びCF3(CF2) 7CH2CH2Si(OCH2CH3)3からなる群から選択された物質でコーティングすることにより得られる。より詳細には、前記水接触角が70°〜95°である表面は、固体支持体のSiO2層上にオクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム(OTC)、トリデカフルオロテトラヒドロオクチルトリメトキシシラン(DFS)、CF3(CF2) 3CH2CH2Si(OCH3)3、CF3(CF2)5CH2CH2Si(OCH3)3、CF3(CF2)7CH2CH2Si(OCH3)3、CF3(CF2)9CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)4CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)6CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)8CH2CH2Si(OCH3)3、CF3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 5(C6H4)C2H4Si(OCH3)3、CF3(CF2) 7(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3CH2CH2SiCH3(OCH3)2、CF3(CF2) 5CH2CH2SiCH3(OCH3)2、CF3(CF2) 7CH2CH2SiCH3(OCH3)2、CF3(CF2)9CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 4CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 6CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2)8CH2CH2SiCH3(OCH3)2、CF3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 5(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 7(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3CH2CH2Si(OCH2CH3)3、CF3(CF2)5CH2CH2Si(OCH2CH3)3、及びCF3(CF2) 7CH2CH2Si(OCH2CH3)3からなる群から選択された物質がコーティングされてなる自己組織化単分子膜(SAM)により得られる。
【0023】
本発明の方法の接触段階において、前記非平面状の固体支持体は、表面にアミン系の官能基を一以上有しうる。前記アミン系の官能基を一以上有する表面は、ポリエチレンイミントリメトキシシラン(PEIM)、アミノプロピルトリエトキシシラン、N−[3−(トリメトキシシリル)−プロピル]エチレンジアミン、及びN−トリメトキシシリルプロピル−N,N,N−塩化トリメチルアンモニウムからなる群から選択された物質でコーティングすることにより得られる。例えば、前記コーティングされた表面は、自己組織化単分子膜(SAM)コーティング法を用いて、固体支持体のSiO2層上にポリエチレンイミントリメトキシシラン(PEIM)をコーティングすることにより得られる。前記アミン系の官能基は、pH3.0〜6.0の範囲で正電荷を帯びる。
【0024】
本発明の方法の接触段階において、前記固体支持体は上記のような水接触角特性を有するもの、またはその表面に一以上のアミン系官能基を有するものであれば、いずれの材質の支持体も含まれる。例えば、ガラス、シリコンウェーハ、及びプラスチック物質などが含まれるが、これらに限定されるものではない。前記水接触角が70°〜95°である表面、またはその表面に一以上のアミン系官能基を有する表面である場合、そのような表面を有する固体支持体に微生物を含む試料が接触すると、微生物が付着しうる。しかし、本発明はこのような特定の作用機作に限定されるものではない。
【0025】
本願において、「水接触角(water contact angle)」という用語は、Kruss Drop Shape Analysis System type DSA 10 Mk2によって測定された水接触角を示す。測定方法について説明すると、まず、1.5μlの蒸溜水滴を試料上に自動的に位置させる。前記水滴をCCD−カメラによって0.2秒ごとに10秒間モニターし、Drop Shape Analysis software(DSA version 1.7,Kruss)によって分析する。前記水滴の完全な形状は、タンジェント(方法)による円錐曲線の切片方程式(conic section equation)に、一般に適合する(fitted)。各水滴の角は、右側及び左側の両方について測定し、各水滴に対する平均値を測定し、全ての試料について5滴ずつ測定する。前記5滴の平均を前記水接触角とする。
【0026】
本発明の微生物の分離方法は、前記接触の段階後に、前記非平面状の固体支持体に結合していない物質、すなわち目的微生物以外の物質を洗浄する段階をさらに含みうる。かかる洗浄には、固体支持体の表面に付着した目的微生物を前記固体支持体から離脱させることなく、後続工程に悪影響を及ぼしうる不純物を除去できる任意の溶液が使われうる。例えば、上記の接触段階で用いられる酢酸緩衝液及びリン酸緩衝液などが使用可能である。前記洗浄溶液は、好ましくは、pH3.0〜6.0の範囲に含まれるpHを有する緩衝液である。
【0027】
本発明において、「微生物の分離」とは、試料中の微生物を純粋に分離することだけでなく濃縮することも含む。
【0028】
本発明の方法によって、前記固体支持体上に付着し、濃縮された微生物は、前記固体支持体上に付着した状態でのDNAの分離のような追加的な処理段階に使われうる。また、前記固体支持体上に付着して濃縮された微生物は、前記固体支持体から溶出して追加的な処理段階に使われうる。
【0029】
したがって、本発明の方法は、前記接触段階及び/または洗浄段階後に前記付着した微生物を溶出する段階をさらに含んでもよい。前記溶出段階において、溶出に使われる溶液は、前記固体支持体から微生物を離脱させる性質を有するものであれば、当業者界に知られた任意の溶液が使用可能である。例えば、水及びトリス緩衝液などが使われうる。前記溶出溶液は、好ましくは、pH6.0以上の溶液である。
【0030】
本発明の第2実施形態は、微生物を含む試料から微生物を分離する装置であって、非平面状の固体支持体を含む容器と、前記容器に備え付けられる試料注入部と、前記容器に備え付けられる緩衝液保存部と、を含む微生物の分離装置である。
【0031】
本発明の装置における固体支持体自体(形状、構造、性質)については上記第1実施形態で説明したものと同様であるので、ここでは省略する。
【0032】
本発明の装置において、前記固体支持体は、微細流動装置内のマイクロチャンネルまたはマイクロチャンバの内壁でありうる。また、本発明の微生物分離装置は、一以上の入口及び出口を備え、前記入口及び出口がチャンネルまたはマイクロチャンネルを介して連通している流動装置又は微細流動装置でありうる。
【0033】
本発明の装置において、前記固体支持体が含まれている容器は、任意の形態を有し、例えば、チャンバ、チャンネル、またはカラムの形態が挙げられる。本発明の装置の一具体例は、ビーズ形状の前記固体支持体がカラム内に充填されている装置である。
【0034】
本発明の装置はまた、前記容器に試料注入部及び緩衝液保存部を備える。前記緩衝液保存部は、微生物を含む試料をpH3.0〜6.0に調整するか希釈するのに使われうる緩衝液を含む。前記緩衝液は、特に制限されることはないが、生物学的用途に好適に使用できる観点から酢酸緩衝液またはリン酸緩衝液であることが好ましい。前記試料注入部と前記緩衝液保存部とは、前記容器の内部を介して流体連通している。
【0035】
以下、本発明を、実施例を通じてさらに詳細に説明する。しかし、以下の実施例は本発明を例示的に説明するためのものであり、本発明の技術的範囲が以下の実施例に限定されることはない。
【実施例】
【0036】
<実施例1>流動装置内にピラーアレイを有する固体支持体を用いて、細菌を捕捉する際に、緩衝液の種類及び濃度が及ぼす影響
本実施例では、入口と出口とが備えられ、サイズが10mm×23mmであるシリコン材質のチップ上にピラーのアレイが形成されているチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細胞を前記固体支持体上に付着させ、流れ出る試料中の細胞の数をコロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0037】
前記ピラーアレイが形成された領域の表面には、OTC(水接触角80゜)がコーティングされている。
【0038】
使われた細菌試料は、LB培地中でOD600が1.0の大腸菌試料を1×PBS(pH7.0)に懸濁し、これを所定の緩衝液(100mMのリン酸ナトリウムを含む緩衝液(pH4.0)、100mMの酢酸ナトリウムを含む緩衝液(pH4.0)、及び100mMのクエン酸ナトリウムを含む緩衝液(pH4.0))で100倍希釈してOD600が0.01の試料を調製した。この試料をpH4.0に調整した後、流速300μl/分で200μlを入口から前記チャンバを介して出口に流した。実験は、それぞれ3回繰り返した。
【0039】
図1は、流動装置において、ピラーアレイが形成された表面を有する固体支持体上に細胞が付着する際の、緩衝液の種類による影響を示すグラフである。図1に示すように、低いpHで緩衝力を有する緩衝液のうち、リン酸ナトリウムを含むリン酸緩衝液及び酢酸ナトリウムを含む酢酸緩衝液が、クエン酸ナトリウムを含むクエン酸緩衝液に比べて細菌細胞を固体支持体に付着させる効率の高いことを確認した。
【0040】
図2は、流動装置において、ピラーアレイが形成された表面を有する固体支持体上に細胞が付着する際の、緩衝液濃度による影響を示すグラフである。図2に示すように、緩衝液の濃度が低いほど固体支持体に細胞を付着させる効率が高かった。しかし、生物学的試料のような実際の試料は、pH3.0〜6.0の範囲で維持するために一定レベルの緩衝力を有する緩衝液を必要とする。これを考慮した場合、固体支持体に細胞を高い効率で付着させるのに適した緩衝液の濃度は、10〜500mM、好ましくは、50〜300mMである(データは示していない)。
【0041】
<実施例2>流動装置内にピラーアレイを有する固体支持体を用いた、血液中の細菌細胞の捕捉
本実施例では、入口と出口とが備えられ、サイズが10mm×23mmであるシリコン材質のチップ上にピラーのアレイが形成されているチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細菌細胞を前記固体支持体上に付着させ、流れ出る試料中の細菌細胞の数を、コロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0042】
ピラーアレイは4個準備し、前記ピラーアレイが形成された領域の表面には、SiO2層を有する表面及びSiO2層上にPEIM、OTC、及びDFSがそれぞれコーティングされている。
【0043】
1×PBS(pH7.0)に懸濁されたOD600が1.0の大腸菌10μlを、血液495μl及び緩衝液(100mM酢酸ナトリウム(pH3.0)または100mMリン酸ナトリウム(pH7.0))495μlに加えて、OD600が0.01の血液希釈試料を調製した。なお、最終pHが4.0または7.0となるように調製した。
【0044】
上記により希釈した血液試料200μlを、流速200μl/分で入口から前記チャンバを介して出口方向に流した。次に、100mMの酢酸ナトリウム(pH4.0)300μlを流速200μl/分で入口から前記チャンバを介して出口方向に流して洗浄した。実験は、それぞれ3回繰り返した。
【0045】
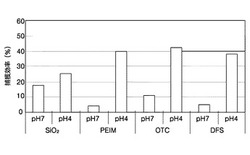
図3は、流動装置において、ピラーアレイが形成された表面を有する固体支持体上に大腸菌が付着する際の、pH、及びピラーのアレイを有する表面の特性による影響を示すグラフである。図3に示すように、相対的に低いpHの試料を使用する場合、固体支持体に付着する効率がより高くなることを確認した。一方、固体支持体の表面の特性が細胞付着に及ぼす影響は相対的に小さいことが分かる。しかし、静電気的特性が相対的に弱く、表面張力の相対的に大きいSiO2より、相対的に強い静電気的特性が存在するか表面張力が低い、すなわち相対的に疎水性である表面が同一かつ低いpH下で優れた特性を示すことを確認した。
【0046】
図4は、流動装置において、酢酸ナトリウム緩衝液で希釈した血液試料(pH5.2)を、ピラーアレイが形成された表面を有する固体支持体を通じて流し、100mMの酢酸ナトリウム(pH4.0)を流して洗浄した後、前記ピラーアレイが形成されている表面を光学顕微鏡で観察した結果である。流体装置から溶出した血液希釈試料をコロニー計数したところ、大腸菌細胞は固体支持体から溶出していないことが分かった。また、図4を見れば、前記洗浄過程によって、PCR阻害剤として作用しうる赤血球のような動物細胞を除去したことを顕微鏡で確認することができる。図4のうち上図(洗浄前)において、四角形状の構造物同士の間に見られる不純物は、赤血球、白血球及び/または蛋白質である。図4のうち下図(洗浄後)は、細菌を除いた前記不純物が洗浄過程で除去可能であるということを示す。本発明の方法は、前記不純物を除去した後、標的細菌細胞を閉じ込めることに関するものである。図4により、細菌ではない赤血球及び/または白血球のような動物細胞の除去が、顕微鏡により顕著に起こっていることを確認することができた。
【0047】
<実施例3>平坦な固体支持体を用いた尿中の細菌細胞の付着
本実施例では、サイズが25.4mm×25.4mmである平らなSiO2層からなる表面を有するシリコンチップ、前記チップ上にそれぞれPEIM、OTC、及びDFSがコーティングされている表面を有する基板に、細菌細胞を含む試料を加えて細菌細胞を前記固体支持体上に付着させ、洗浄した後、顕微鏡を通じて細菌細胞の付着挙動を観察した。
【0048】
1×PBS(pH7.0)に懸濁した、OD600が1.0の大腸菌10μlを、緩衝液(100mM酢酸ナトリウム(pH3.0)または100mMリン酸ナトリウム(pH7.0))495μlと尿495μlとを混合した990μlの溶液に加えてから混合し、OD600が0.01の試料を調製した。
【0049】
上記により希釈した尿試料は、パッチが覆われた前記基板上に加えて5分間放置した後、それぞれの緩衝液、すなわち、酢酸ナトリウム緩衝液を使用したものは酢酸ナトリウム緩衝液で、リン酸ナトリウム緩衝液を使用したものはリン酸ナトリウム緩衝液で5分間洗浄した。
【0050】
図5は、希釈した尿試料に含まれる大腸菌の固体支持体への付着の際の、尿試料のpHの影響を示す図である。図5に示すように、大腸菌の固体支持体への付着は、pHによって影響を大きく受けるということが分かる。また、pH6.0を超えると、大腸菌が前記固体支持体に付着しないということが分かる。したがって、細菌細胞を分離するためには、pH6.0以下で行うことが好ましい。具体的に、図5に示すように、SiO2層を有する基板、PEIMでコーティングされたSiO2層を有する基板、OTCでコーティングされたSiO2層を有する基板、またはDFSでコーティングされたSiO2層を有する基板に付着された大腸菌の数は、pH5.6(上部パネル)の下では25.4mm×25.4mm(24単位細胞)シリコンチップ当たりそれぞれ約97細胞、95細胞、56細胞、46細胞であったが、pH6.4(下部パネル)の下では同じ固体基板に大腸菌が付着していなかった。固体支持体に付着された大腸菌細胞の数は、顕微鏡上で計数することにより求めた。
【0051】
<実施例4>ピラーアレイが形成されている表面を有する固体支持体を用いた、尿中の細菌細胞の捕捉
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコン基板上にピラーのアレイが形成された表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細胞を固体支持体上に付着させ、流れ出る試料中の細胞の数をコロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0052】
前記ピラーアレイが形成された領域の表面には、SiO2層上にPEIMがコーティングされている。
【0053】
1×PBS(pH7.0)に懸濁されたOD600が1.0の大腸菌10μlを、緩衝液(100mM酢酸ナトリウム(pH3.0)または100mMリン酸ナトリウム(pH7.0))495μlと尿495μlとを混合した990μlの溶液に加えて、OD600が0.01の試料を調製した。
【0054】
上記により希釈された尿試料を、流速200μl/分で入口から前記チャンバを介して出口方向に200μl流した。次に、100mMの酢酸ナトリウム(pH4.0)を流速200μl/分で入口から前記チャンバを介して出口方向に300μl流して洗浄した。実験は、それぞれ3回繰り返した。
【0055】
図6は、希釈尿試料中の大腸菌が、ピラーアレイの形成された表面を有する固体支持体に付着する際に、pH及び表面の性質による影響を示すグラフである。図6に示すように、pH4.7で大腸菌の付着効率が高いことを確認した。本実施例で測定した細胞捕捉効率は、以下の表1の通りである。
【0056】
【表1】

【0057】
<実施例5>ピラーアレイが形成された表面を有する固体支持体を用いた、尿中の細菌細胞の捕捉:尿の性質の変化による捕捉効果の測定
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコンチップ上に、ピラーのアレイが形成された表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細胞を前記固体支持体上に付着させ、流れ出る試料中の細胞の数をコロニー計数を通じて決定し、これから前記固体支持体による細胞捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0058】
前記ピラーアレイが形成された領域の表面は、SiO2層上にPEIMがコーティングされている。
【0059】
1×PBS(pH7.0)に懸濁されたOD600が1.0の大腸菌10μlを、緩衝液(100mM酢酸ナトリウム(pH3.0)または100mMリン酸ナトリウム(pH7.0))と尿とをそれぞれ495μlずつ混合した990μlの溶液に加えて、OD600が0.01の試料を調製した。
【0060】
上記の希釈された尿試料を、流速200μl/分で入口から前記チャンバを介して出口へと200μl流した。次に、100mMの酢酸ナトリウム(pH4.0)を、流速200μl/分で入口から前記チャンバを介して出口方向に300μm流して洗浄した。細胞計数は、前記固体支持体に尿試料を流す前後の、出口から出てきた流出液中の細胞数により計算した。
【0061】
図7は、ピラーアレイが形成されている表面を有する固体支持体を用いて尿中の大腸菌細胞を分離した結果を示すグラフであり、尿の性質の変化による結果を示す。図7に示すように、尿の種類によって、細胞捕捉効率が大きく異なる。身体の状態及び摂取食物の種類による塩及びその他の成分の濃度の差異が、このような細胞捕捉効率の差をもたらしたと推測されるが、本発明はこのような特定の作用機作に限定されるものではない。なお、pHや導電性は、このような捕捉効率の差とは関係がないと推測される(データは示していない)。
【0062】
<実施例6>ピラーアレイが形成された表面を有する固体支持体を用いた、尿中の細菌細胞の捕捉:尿の希釈及び洗浄による捕捉効果の測定
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコンチップ上にピラーのアレイが形成された表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細菌細胞を前記固体支持体上に付着させ、流れ出る試料中の細菌細胞の数を、コロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0063】
前記ピラーアレイが形成された領域の表面には、SiO2層上にそれぞれPEIM及びOTCをコーティングした。
【0064】
前記細胞試料は、OD600が0.01の大腸菌を含む100mMの酢酸ナトリウム緩衝液(pH3.0)と尿とを1:1で混合して、最終pHが3.97の試料(以下、「1/2希釈試料」と称す)、尿とOD600が0.01の大腸菌とを含む100mMの酢酸ナトリウム緩衝液(pH4.0)とを1:4で混合して、最終pHが4.05の試料(以下、「1/5希釈試料」と称す)、及び尿とOD600が0.01の大腸菌とを含む100mMの酢酸ナトリウム緩衝液(pH4.0)とを1:6で混合して、最終pHが4.05の試料(以下、「1/7希釈試料」と称す)を使用した。
【0065】
前記希釈された尿試料を、流速200μl/分で入口から前記チャンバを介して出口方向に200μl流した。次に、100mMの酢酸ナトリウム(pH4.0)を流速200μl/分で入口から前記チャンバを介して出口方向に300μmを流して洗浄した。実験は、それぞれ3回繰り返した。細胞計数は、前記固体支持体に尿試料を流す前後の、出口から出てきた流出液中の大腸菌細胞の数で計算した。
【0066】
図8は、ピラーアレイが形成された表面を有する固体支持体を用いて尿中の細胞を捕捉した結果を示すグラフであって、尿の希釈による結果を示す。図8に示すように、希釈倍数が高くなるにつれて、細胞捕捉効率が大きく増加することを確認した。洗浄過程では、細胞溶出がほとんど起こらなかった。
【0067】
<実施例7>ピラーアレイが形成された表面を有する固体支持体を用いた、尿の模倣溶液中の大腸菌の捕捉:細胞捕捉を妨害する因子探索
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコンチップ上にピラーのアレイが形成された表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細胞を前記固体支持体上に付着させ、流れ出る試料中の細菌細胞の数を、コロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は一辺の長さが25μmの正方形である。
【0068】
前記ピラーアレイが形成された領域の表面は、SiO2層上にOTCがSAMコーティングされた表面を有する。
【0069】
前記細胞試料として、OD600が0.01の大腸菌を含む、酢酸ナトリウム緩衝液をベースとする溶液と透析された尿をベースとする溶液とを使用した。
【0070】
前記酢酸ナトリウム緩衝液に基づいた溶液(pH4.0)は、以下の通りである。
【0071】
【表2】

【0072】
上記の透析された尿をベースとする溶液は、透析した尿と、2×酢酸ナトリウム緩衝液をベースとする各溶液とを1:1で混合して得られたものであり、最終pHが3.97である。
【0073】
前記尿試料は、流速200μl/分で入口から前記チャンバを介して出口方向に200μl流した。実験は、それぞれ3回繰り返した。細胞計数は、前記固体支持体に尿試料を流す前後の、出口を介して出てくる流出液中の細胞数により計算した。
【0074】
図9は、ピラーアレイが形成された表面を有する固体支持体を用いて、尿中の細胞を捕捉した結果を示すグラフである。尿中に存在する塩及びその他の物質(主にクレアチン)の濃度により、捕捉効率が低くなることを確認した。
【0075】
実施例8:ピラーアレイが形成された表面を有する固体支持体を用いた、尿中の大腸菌の捕捉:尿の希釈比率及び流速による捕捉効果の測定
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコンチップ上にピラーのアレイが形成されている表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細菌細胞を前記固体支持体上に付着させ、流れ出る試料中の細胞の数を、コロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0076】
前記ピラーアレイが形成された領域の表面は、SiO2層上にPEIMがSAMコーティングされた表面を有する。
【0077】
試料は次のように準備した。すなわち、緩衝液と尿とを、各々定められた希釈倍率に調節しながら最終体積が1mlとなるように混合した。ここにOD600が1.0の大腸菌10μlを入れた。
【0078】
上記の希釈された尿試料は、流速200μl/分で入口から前記チャンバを介して出口方向に200μl流した。実験はそれぞれ3回繰り返した。細菌細胞の計数は、前記固体支持体に尿試料を流す前後の、出口に出てきた流出液中の細胞数で計算した。
【0079】
図10は、ピラーアレイが形成された表面を有する固体支持体を用いて、尿中の細胞を捕捉した結果を示すグラフであって、尿の希釈及び流速による結果を示す。なお、図10において、F100は流速100μl/分、F300は流速300μl/分、F500は流速500μl/分の試験区であることを示している。図10に示すように、希釈倍率が上昇するにつれて細胞の捕捉効率が増加し、流速が増加するにつれて細胞の捕捉効率が減少することを確認した。
【産業上の利用可能性】
【0080】
本発明は、微生物の分離関連の技術分野に好適に用いられる。
【図面の簡単な説明】
【0081】
【図1】流動装置において、固体支持体上に細胞が付着する際の、緩衝液の種類による影響を示すグラフである。
【図2】流動装置において、固体支持体上に細胞が付着する際の、緩衝液の濃度による影響を示すグラフである。
【図3】流動装置において、固体支持体上に大腸菌が付着する際の、pH、及びピラーのアレイを有する表面の特性による影響を示すグラフである。
【図4】流動装置において、所定の血液試料を、固体支持体を通じて流し、洗浄した後、固体支持体表面を光学顕微鏡で観察した結果である。
【図5】希釈した尿試料に含まれる大腸菌の固体支持体への付着の際の、尿試料のpHの影響を示す図である。
【図6】希釈尿試料中の大腸菌が、ピラーアレイの形成された表面を有する固体支持体に付着する際に、pH及び表面の性質による影響を示すグラフである。
【図7】固体支持体を用いて尿中の大腸菌細胞を分離した結果を示すグラフである。
【図8】固体支持体を用いて尿中の細胞を捕捉した結果を示すグラフである。
【図9】固体支持体を用いて尿中の細胞を捕捉した結果を示すグラフである。
【図10】固体支持体を用いて尿中の細胞を捕捉した結果を示すグラフである。
【技術分野】
【0001】
本発明は、微生物の分離方法及び分離装置に関する。
【背景技術】
【0002】
従来より、試料から微生物を分離する方法として、遠心分離及びろ過が一般的に用いられている。また、特定の細胞を濃縮または分離する場合、その特定の細胞に特異的に結合する受容体またはリガンドが結合している支持体に、前記細胞を結合させて、これを濃縮または分離する方法が用いられている。例えば、ある細胞と特異的に結合する抗体が結合している支持体に、前記細胞を含む試料を流し、前記細胞を前記抗体と結合させ、その後、結合していない細胞を洗浄する段階を含むという、アフィニティークロマトグラフィーが挙げられる。
【0003】
また、特許文献1には超音波場及び進行波誘電泳動を用いた細胞分離システムが開示されている。かかるシステムは、上部ガラス基板の両端で連結しており、外部からの電気的入力を機械的振動に変換して、前記上部ガラス基板に加える圧電変換器と、前記上部ガラス基板と平行な下部基板上に配列したn個の電極とを備えている。そして、前記上部ガラス基板と下部基板との間には細胞を含む流体が充填されており、前記各電極は、前記圧電変換器の長手方向と垂直に置かれ、前記n個の電極は、前記圧電変換器の長手方向に沿って一定間隔で配列している細胞分離装置を備えることを特徴とする。
【特許文献1】韓国特許出願公開第2006−0068979号公報
【発明の開示】
【発明が解決しようとする課題】
【0004】
しかし、上記従来技術は、固体基板上にリガンドまたは受容体を固定化するか、あるいは外部動力を供給して特定の細胞を選択的に濃縮または分離するものである。このような場合、分離工程が煩雑であるだけでなく、支持体の表面当たりで見ると、分離できる微生物量は比較的少量とならざるを得ず、非効率的である。リガンドまたは受容体を固定化する費用、これらと微生物を反応させる段階、及び反応された微生物を分離する段階が必要であり、これらの段階にかかる時間と費用を考慮すれば、単位時間当たりの微生物の分離量について多くを望むことはできない。また、外部動力を供給した場合、別途の動力を供給しなければならないため、費用がさらにかかり、やはり、単位時間当たりの微生物の分離量について多くを望むことはできない。そのため、分離が簡便で、かつ分離効率を有意に高くすることができるような微生物の分離方法や装置が、大量迅速に微生物を扱うあらゆる産業上の分野で強く要求されている。
【0005】
本発明の目的は、試料からの微生物の分離効率を向上させることのできる方法を提供することである。
【0006】
また、本発明の目的は、試料からの微生物の分離効率を向上させることのできる装置を提供することである。
【課題を解決するための手段】
【0007】
本発明者らが鋭意研究を重ねた結果、固体支持体自体の特性及び液体培地の条件を調整することによって、操作が簡便で、かつ試料から微生物を分離できる量を有意に増すことができることを見出した。
【0008】
そこで、本発明は、非平面状の固体支持体と、微生物を含む試料とをpH3.0〜6.0で接触させる段階を含む微生物の分離方法、及び非平面状の固体支持体を用いた分離装置を提供する。
【発明の効果】
【0009】
本発明の微生物の分離方法によれば、生物学的試料中に存在する細菌細胞、真菌細胞、またはウイルスを含む微生物細胞を簡便かつ効率的に分離できる。また、本発明の微生物を分離するための装置によれば、細菌細胞、真菌細胞、またはウイルスを含む微生物細胞を簡便かつ効率的に分離できる。
【発明を実施するための最良の形態】
【0010】
本発明の第1実施形態は、微生物を含む試料から微生物を分離する方法であって、非平面状の固体支持体と、微生物を含む試料とをpH3.0〜6.0で接触させる段階を含む、微生物の分離方法である。前記接触により、前記微生物を前記固体支持体に付着させる。
【0011】
固体支持体を含む液体培地中で、微生物は液体培地中に存在するか、または固体支持体に付着されうる。このような液体培地と固体支持体との分布は、液体培地の表面張力と微生物の表面張力との差によって決まることが知られている。すなわち、液体培地の表面張力が微生物の表面張力より大きい場合、前記微生物は、表面張力の小さい固体支持体、すなわち疎水性固体支持体により容易に付着し、微生物の表面張力が液体培地の表面張力より大きい場合、前記微生物は、表面張力の大きい固体支持体、すなわち親水性固体支持体により容易に付着し、微生物の表面張力が液体培地の表面張力と同じ場合には、微生物細胞の固体支持体への付着には表面張力の影響がなく、静電気的相互作用のような他の相互作用が影響を及ぼすと報告されている(Applied and Environmental Microbiology, July 1983、p.90−97)。また、前記の表面張力に基づいた熱力学的接近を通じて、微生物細胞が付着するだけでなく、静電気的な引力特性を通じても微生物細胞が表面に付着可能であることも知られている。しかし、このような現象は、その付着速度が非常に小さいという問題点がある。
【0012】
これに対し、本発明者らは上記のような従来技術の問題点を解決するために、非平面状の固体支持体を使用すると共に、微生物を含む試料をpH3.0〜6.0の範囲で前記固体支持体に接触させることによって、高い収率で微生物を分離できることを確認した。これは、固体支持体の表面積が増加するのと同時に、pH3.0〜6.0の液体培地を使用することによって、微生物の細胞膜が変性し、溶液に対する溶解度が低下して、固体表面に付着する比率が相対的に高くなるためであると推測されるが、本発明の範囲はこのような特定の作用機作に限定されることはない。
【0013】
前記接触段階において、前記試料は、微生物を含んでいれば特に制限されることはない。好ましくは、前記微生物を含む生物学的試料、臨床試料、または実験室試料から選択される。本明細書において、「生物学的試料」とは、個体から分離された細胞、または生物学的液体のような細胞若しくは組織物を含むか、あるいはこれらによって構成される試料を意味する。前記個体は、人間を含む動物でありうる。生物学的試料の例として、以下に制限されることはないが、唾液、喀痰、血液、血液細胞(白血球、赤血球など)、羊水、血清、精液、骨髄、組織または微細針状の生検試料、尿、腹膜液、肋膜液及び細胞培養物などが挙げられる。生物学的試料には、組織学上の目的のために取られた冷凍切片のような組織切片が含まれる。前記生物学的試料は、人間の患者由来の試料(臨床試料)であることが好ましく、入手容易の観点から、血液、尿、唾液または喀痰であることがより好ましく、このうち、血液、尿または唾液が特に好ましい。
【0014】
本発明において、分離の対象となる微生物として、細菌、真菌及び/またはウイルスが含まれうる。
【0015】
前記接触段階において、前記試料は、前記微生物を上記範囲の低pHで緩衝できる溶液(緩衝液)によって希釈されうる。前記緩衝液は、生物学的用途に好適に使用できる観点から、リン酸緩衝液(例えばリン酸ナトリウム)または酢酸緩衝液(例えば酢酸ナトリウム)であることが好ましい。前記希釈の程度、すなわち前記試料と緩衝液との体積比率は特に限定されないが、緩衝作用が十分に得られるという観点から、好ましくは1:1〜1:1,000、より好ましくは1:1〜1:10である。
【0016】
前記接触段階において、前記試料の塩濃度は、好ましくは10〜500mM、より好ましくは50〜300mMである。試料と緩衝液とを混合した後の最終塩濃度が上記範囲内である場合、結合効率を有意に増大させることができる。また、前記試料は、上記の塩濃度範囲の酢酸及びリン酸からなる群から選択されたイオン濃度を有することが好ましい。
【0017】
前記接触段階において、前記固体支持体は非平面状であり、表面積が平面の場合よりも大きいことを特徴とする。前記固体支持体は、表面に凹凸構造が形成されていてもよい。本発明において、「凹凸構造」とは、表面が平らでなく凹面と凸面とがある構造をいう。このような凹凸構造の例として、複数個のピラーが形成されたピラー構造を有する表面、または複数個の孔隙が形成された網状構造を有する表面が挙げられるが、これらに限定されるものではない。このような凹凸構造により、微生物との接触面積を増やし、より効率的な微生物の分離が可能となる。
【0018】
前記接触段階において、前記非平面状の固体支持体は任意の形状を有しうる。例えば、表面に複数のピラーが形成されたピラー構造を有する固体支持体、表面にビーズ形状を有する固体支持体、及び表面に複数個の孔隙が形成された篩構造を有する固体支持体からなる群から選択されるものでありうる。前記ビーズ形状の固体支持体は、カラムのような容器内に充填されて使用されうる。前記ビーズ形状の固体支持体(すなわちビーズ)の大きさは、直径が1〜100μmであることがより好ましく、前記ビーズ形状の固体支持体が容器内に充填される場合、当該容器の容積に対して40%以上充填することが好ましい。前記篩構造を有する固体支持体の場合、前記孔隙の直径は、1〜25μmであることがより好ましい。前記非平面状の固体支持体は、1つの固体支持体または複数個の固体支持体の組み合わせ(例えば、チューブまたは容器を満たす固体支持体の集合)でありうる。
【0019】
前記接触段階において、前記固体支持体は、微細流動装置内のマイクロチャンネルまたはマイクロチャンバの内壁の形態でありうる。したがって、本発明の微生物の分離方法は、一以上の入口及び出口が備えられていて、前記入口及び出口がチャンネルまたはマイクロチャンネルを介して連通している流動装置または微細流動装置内で行われうる。
【0020】
本明細書において、「微細流動装置(microfluidic device)」という用語は、微細流動チャンネル(または、マイクロチャンネルまたはマイクロレベルのチャンネルとも言われる)のような微細流動要素(microfluidic elements)を含む微細流動装置をいう。本明細書における「微細流動(microfluidic)」という用語は、約0.1μm〜1000μmの深さ、広さ、長さ、直径のような一つ以上の断面積次元を含む装置部分(component)、例えば、チャンバ、チャンネル、保存所などを示す。したがって、「マイクロチャンバ(microchamber)」及び「マイクロチャンネル(microchannel)」という用語は、それぞれ約0.1μm〜1000μmの深さ、広さ、長さ、直径のような一つ以上の断面積次元を含むチャンネル及びチャンバを示す。
【0021】
本発明による方法の一具体例によれば、前記接触段階において、前記固体支持体は、その表面に複数個のピラーが形成されたピラー構造を有しうる。固体支持体上にピラーを製造することは、当業者界で周知である。例えば、半導体製造工程に使われるフォトリソグラフィ工程などを使用して、微細なピラーを高密度で形成させることができる。前記ピラーのアスペクト比(前記ピラーの高さと前記ピラーの断面の長さとの比)が1:1〜20:1であることが好ましいが、かかる範囲に限定されるものではない。前記断面の長さとは、ピラーの断面形状が円の場合には断面の直径を意味し、断面形状が四方形の場合には各辺の長さの平均値を意味する。前記ピラー構造において、ピラーの高さと隣接するピラーの距離との比率は、1:1〜25:1であることが好ましい。前記ピラー構造において、前記ピラーと隣接する前記ピラーとの距離は、5〜100μmであることが好ましく、5〜25μmであることがより好ましい。上記距離範囲内である場合、閉じ込め効率を上昇させることができる。
【0022】
本発明の方法において、前記接触段階において、前記非平面状の固体支持体が疎水性であり、70°〜95°の水接触角を有することが好ましい。かかる範囲内の場合、前記非平面状の固体支持体は十分な疎水性を発揮でき、結果として微生物を固体支持体に容易に付着させることができる。前記疎水性の固体支持体は、表面をオクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム(OTC)、トリデカフルオロテトラヒドロオクチルトリメトキシシラン(DFS)、CF3(CF2) 3CH2CH2Si(OCH3)3、CF3(CF2)5CH2CH2Si(OCH3)3、CF3(CF2)7CH2CH2Si(OCH3)3、CF3(CF2)9CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)4CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)6CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)8CH2CH2Si(OCH3)3、CF3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 5(C6H4)C2H4Si(OCH3)3、CF3(CF2) 7(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3CH2CH2SiCH3(OCH3)2、CF3(CF2) 5CH2CH2SiCH3(OCH3)2、CF3(CF2) 7CH2CH2SiCH3(OCH3)2、CF3(CF2)9CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 4CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 6CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2)8CH2CH2SiCH3(OCH3)2、CF3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 5(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 7(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3CH2CH2Si(OCH2CH3)3、CF3(CF2)5CH2CH2Si(OCH2CH3)3、及びCF3(CF2) 7CH2CH2Si(OCH2CH3)3からなる群から選択された物質でコーティングすることにより得られる。より詳細には、前記水接触角が70°〜95°である表面は、固体支持体のSiO2層上にオクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム(OTC)、トリデカフルオロテトラヒドロオクチルトリメトキシシラン(DFS)、CF3(CF2) 3CH2CH2Si(OCH3)3、CF3(CF2)5CH2CH2Si(OCH3)3、CF3(CF2)7CH2CH2Si(OCH3)3、CF3(CF2)9CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)4CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)6CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)8CH2CH2Si(OCH3)3、CF3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 5(C6H4)C2H4Si(OCH3)3、CF3(CF2) 7(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3CH2CH2SiCH3(OCH3)2、CF3(CF2) 5CH2CH2SiCH3(OCH3)2、CF3(CF2) 7CH2CH2SiCH3(OCH3)2、CF3(CF2)9CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 4CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 6CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2)8CH2CH2SiCH3(OCH3)2、CF3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 5(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 7(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3CH2CH2Si(OCH2CH3)3、CF3(CF2)5CH2CH2Si(OCH2CH3)3、及びCF3(CF2) 7CH2CH2Si(OCH2CH3)3からなる群から選択された物質がコーティングされてなる自己組織化単分子膜(SAM)により得られる。
【0023】
本発明の方法の接触段階において、前記非平面状の固体支持体は、表面にアミン系の官能基を一以上有しうる。前記アミン系の官能基を一以上有する表面は、ポリエチレンイミントリメトキシシラン(PEIM)、アミノプロピルトリエトキシシラン、N−[3−(トリメトキシシリル)−プロピル]エチレンジアミン、及びN−トリメトキシシリルプロピル−N,N,N−塩化トリメチルアンモニウムからなる群から選択された物質でコーティングすることにより得られる。例えば、前記コーティングされた表面は、自己組織化単分子膜(SAM)コーティング法を用いて、固体支持体のSiO2層上にポリエチレンイミントリメトキシシラン(PEIM)をコーティングすることにより得られる。前記アミン系の官能基は、pH3.0〜6.0の範囲で正電荷を帯びる。
【0024】
本発明の方法の接触段階において、前記固体支持体は上記のような水接触角特性を有するもの、またはその表面に一以上のアミン系官能基を有するものであれば、いずれの材質の支持体も含まれる。例えば、ガラス、シリコンウェーハ、及びプラスチック物質などが含まれるが、これらに限定されるものではない。前記水接触角が70°〜95°である表面、またはその表面に一以上のアミン系官能基を有する表面である場合、そのような表面を有する固体支持体に微生物を含む試料が接触すると、微生物が付着しうる。しかし、本発明はこのような特定の作用機作に限定されるものではない。
【0025】
本願において、「水接触角(water contact angle)」という用語は、Kruss Drop Shape Analysis System type DSA 10 Mk2によって測定された水接触角を示す。測定方法について説明すると、まず、1.5μlの蒸溜水滴を試料上に自動的に位置させる。前記水滴をCCD−カメラによって0.2秒ごとに10秒間モニターし、Drop Shape Analysis software(DSA version 1.7,Kruss)によって分析する。前記水滴の完全な形状は、タンジェント(方法)による円錐曲線の切片方程式(conic section equation)に、一般に適合する(fitted)。各水滴の角は、右側及び左側の両方について測定し、各水滴に対する平均値を測定し、全ての試料について5滴ずつ測定する。前記5滴の平均を前記水接触角とする。
【0026】
本発明の微生物の分離方法は、前記接触の段階後に、前記非平面状の固体支持体に結合していない物質、すなわち目的微生物以外の物質を洗浄する段階をさらに含みうる。かかる洗浄には、固体支持体の表面に付着した目的微生物を前記固体支持体から離脱させることなく、後続工程に悪影響を及ぼしうる不純物を除去できる任意の溶液が使われうる。例えば、上記の接触段階で用いられる酢酸緩衝液及びリン酸緩衝液などが使用可能である。前記洗浄溶液は、好ましくは、pH3.0〜6.0の範囲に含まれるpHを有する緩衝液である。
【0027】
本発明において、「微生物の分離」とは、試料中の微生物を純粋に分離することだけでなく濃縮することも含む。
【0028】
本発明の方法によって、前記固体支持体上に付着し、濃縮された微生物は、前記固体支持体上に付着した状態でのDNAの分離のような追加的な処理段階に使われうる。また、前記固体支持体上に付着して濃縮された微生物は、前記固体支持体から溶出して追加的な処理段階に使われうる。
【0029】
したがって、本発明の方法は、前記接触段階及び/または洗浄段階後に前記付着した微生物を溶出する段階をさらに含んでもよい。前記溶出段階において、溶出に使われる溶液は、前記固体支持体から微生物を離脱させる性質を有するものであれば、当業者界に知られた任意の溶液が使用可能である。例えば、水及びトリス緩衝液などが使われうる。前記溶出溶液は、好ましくは、pH6.0以上の溶液である。
【0030】
本発明の第2実施形態は、微生物を含む試料から微生物を分離する装置であって、非平面状の固体支持体を含む容器と、前記容器に備え付けられる試料注入部と、前記容器に備え付けられる緩衝液保存部と、を含む微生物の分離装置である。
【0031】
本発明の装置における固体支持体自体(形状、構造、性質)については上記第1実施形態で説明したものと同様であるので、ここでは省略する。
【0032】
本発明の装置において、前記固体支持体は、微細流動装置内のマイクロチャンネルまたはマイクロチャンバの内壁でありうる。また、本発明の微生物分離装置は、一以上の入口及び出口を備え、前記入口及び出口がチャンネルまたはマイクロチャンネルを介して連通している流動装置又は微細流動装置でありうる。
【0033】
本発明の装置において、前記固体支持体が含まれている容器は、任意の形態を有し、例えば、チャンバ、チャンネル、またはカラムの形態が挙げられる。本発明の装置の一具体例は、ビーズ形状の前記固体支持体がカラム内に充填されている装置である。
【0034】
本発明の装置はまた、前記容器に試料注入部及び緩衝液保存部を備える。前記緩衝液保存部は、微生物を含む試料をpH3.0〜6.0に調整するか希釈するのに使われうる緩衝液を含む。前記緩衝液は、特に制限されることはないが、生物学的用途に好適に使用できる観点から酢酸緩衝液またはリン酸緩衝液であることが好ましい。前記試料注入部と前記緩衝液保存部とは、前記容器の内部を介して流体連通している。
【0035】
以下、本発明を、実施例を通じてさらに詳細に説明する。しかし、以下の実施例は本発明を例示的に説明するためのものであり、本発明の技術的範囲が以下の実施例に限定されることはない。
【実施例】
【0036】
<実施例1>流動装置内にピラーアレイを有する固体支持体を用いて、細菌を捕捉する際に、緩衝液の種類及び濃度が及ぼす影響
本実施例では、入口と出口とが備えられ、サイズが10mm×23mmであるシリコン材質のチップ上にピラーのアレイが形成されているチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細胞を前記固体支持体上に付着させ、流れ出る試料中の細胞の数をコロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0037】
前記ピラーアレイが形成された領域の表面には、OTC(水接触角80゜)がコーティングされている。
【0038】
使われた細菌試料は、LB培地中でOD600が1.0の大腸菌試料を1×PBS(pH7.0)に懸濁し、これを所定の緩衝液(100mMのリン酸ナトリウムを含む緩衝液(pH4.0)、100mMの酢酸ナトリウムを含む緩衝液(pH4.0)、及び100mMのクエン酸ナトリウムを含む緩衝液(pH4.0))で100倍希釈してOD600が0.01の試料を調製した。この試料をpH4.0に調整した後、流速300μl/分で200μlを入口から前記チャンバを介して出口に流した。実験は、それぞれ3回繰り返した。
【0039】
図1は、流動装置において、ピラーアレイが形成された表面を有する固体支持体上に細胞が付着する際の、緩衝液の種類による影響を示すグラフである。図1に示すように、低いpHで緩衝力を有する緩衝液のうち、リン酸ナトリウムを含むリン酸緩衝液及び酢酸ナトリウムを含む酢酸緩衝液が、クエン酸ナトリウムを含むクエン酸緩衝液に比べて細菌細胞を固体支持体に付着させる効率の高いことを確認した。
【0040】
図2は、流動装置において、ピラーアレイが形成された表面を有する固体支持体上に細胞が付着する際の、緩衝液濃度による影響を示すグラフである。図2に示すように、緩衝液の濃度が低いほど固体支持体に細胞を付着させる効率が高かった。しかし、生物学的試料のような実際の試料は、pH3.0〜6.0の範囲で維持するために一定レベルの緩衝力を有する緩衝液を必要とする。これを考慮した場合、固体支持体に細胞を高い効率で付着させるのに適した緩衝液の濃度は、10〜500mM、好ましくは、50〜300mMである(データは示していない)。
【0041】
<実施例2>流動装置内にピラーアレイを有する固体支持体を用いた、血液中の細菌細胞の捕捉
本実施例では、入口と出口とが備えられ、サイズが10mm×23mmであるシリコン材質のチップ上にピラーのアレイが形成されているチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細菌細胞を前記固体支持体上に付着させ、流れ出る試料中の細菌細胞の数を、コロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0042】
ピラーアレイは4個準備し、前記ピラーアレイが形成された領域の表面には、SiO2層を有する表面及びSiO2層上にPEIM、OTC、及びDFSがそれぞれコーティングされている。
【0043】
1×PBS(pH7.0)に懸濁されたOD600が1.0の大腸菌10μlを、血液495μl及び緩衝液(100mM酢酸ナトリウム(pH3.0)または100mMリン酸ナトリウム(pH7.0))495μlに加えて、OD600が0.01の血液希釈試料を調製した。なお、最終pHが4.0または7.0となるように調製した。
【0044】
上記により希釈した血液試料200μlを、流速200μl/分で入口から前記チャンバを介して出口方向に流した。次に、100mMの酢酸ナトリウム(pH4.0)300μlを流速200μl/分で入口から前記チャンバを介して出口方向に流して洗浄した。実験は、それぞれ3回繰り返した。
【0045】
図3は、流動装置において、ピラーアレイが形成された表面を有する固体支持体上に大腸菌が付着する際の、pH、及びピラーのアレイを有する表面の特性による影響を示すグラフである。図3に示すように、相対的に低いpHの試料を使用する場合、固体支持体に付着する効率がより高くなることを確認した。一方、固体支持体の表面の特性が細胞付着に及ぼす影響は相対的に小さいことが分かる。しかし、静電気的特性が相対的に弱く、表面張力の相対的に大きいSiO2より、相対的に強い静電気的特性が存在するか表面張力が低い、すなわち相対的に疎水性である表面が同一かつ低いpH下で優れた特性を示すことを確認した。
【0046】
図4は、流動装置において、酢酸ナトリウム緩衝液で希釈した血液試料(pH5.2)を、ピラーアレイが形成された表面を有する固体支持体を通じて流し、100mMの酢酸ナトリウム(pH4.0)を流して洗浄した後、前記ピラーアレイが形成されている表面を光学顕微鏡で観察した結果である。流体装置から溶出した血液希釈試料をコロニー計数したところ、大腸菌細胞は固体支持体から溶出していないことが分かった。また、図4を見れば、前記洗浄過程によって、PCR阻害剤として作用しうる赤血球のような動物細胞を除去したことを顕微鏡で確認することができる。図4のうち上図(洗浄前)において、四角形状の構造物同士の間に見られる不純物は、赤血球、白血球及び/または蛋白質である。図4のうち下図(洗浄後)は、細菌を除いた前記不純物が洗浄過程で除去可能であるということを示す。本発明の方法は、前記不純物を除去した後、標的細菌細胞を閉じ込めることに関するものである。図4により、細菌ではない赤血球及び/または白血球のような動物細胞の除去が、顕微鏡により顕著に起こっていることを確認することができた。
【0047】
<実施例3>平坦な固体支持体を用いた尿中の細菌細胞の付着
本実施例では、サイズが25.4mm×25.4mmである平らなSiO2層からなる表面を有するシリコンチップ、前記チップ上にそれぞれPEIM、OTC、及びDFSがコーティングされている表面を有する基板に、細菌細胞を含む試料を加えて細菌細胞を前記固体支持体上に付着させ、洗浄した後、顕微鏡を通じて細菌細胞の付着挙動を観察した。
【0048】
1×PBS(pH7.0)に懸濁した、OD600が1.0の大腸菌10μlを、緩衝液(100mM酢酸ナトリウム(pH3.0)または100mMリン酸ナトリウム(pH7.0))495μlと尿495μlとを混合した990μlの溶液に加えてから混合し、OD600が0.01の試料を調製した。
【0049】
上記により希釈した尿試料は、パッチが覆われた前記基板上に加えて5分間放置した後、それぞれの緩衝液、すなわち、酢酸ナトリウム緩衝液を使用したものは酢酸ナトリウム緩衝液で、リン酸ナトリウム緩衝液を使用したものはリン酸ナトリウム緩衝液で5分間洗浄した。
【0050】
図5は、希釈した尿試料に含まれる大腸菌の固体支持体への付着の際の、尿試料のpHの影響を示す図である。図5に示すように、大腸菌の固体支持体への付着は、pHによって影響を大きく受けるということが分かる。また、pH6.0を超えると、大腸菌が前記固体支持体に付着しないということが分かる。したがって、細菌細胞を分離するためには、pH6.0以下で行うことが好ましい。具体的に、図5に示すように、SiO2層を有する基板、PEIMでコーティングされたSiO2層を有する基板、OTCでコーティングされたSiO2層を有する基板、またはDFSでコーティングされたSiO2層を有する基板に付着された大腸菌の数は、pH5.6(上部パネル)の下では25.4mm×25.4mm(24単位細胞)シリコンチップ当たりそれぞれ約97細胞、95細胞、56細胞、46細胞であったが、pH6.4(下部パネル)の下では同じ固体基板に大腸菌が付着していなかった。固体支持体に付着された大腸菌細胞の数は、顕微鏡上で計数することにより求めた。
【0051】
<実施例4>ピラーアレイが形成されている表面を有する固体支持体を用いた、尿中の細菌細胞の捕捉
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコン基板上にピラーのアレイが形成された表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細胞を固体支持体上に付着させ、流れ出る試料中の細胞の数をコロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0052】
前記ピラーアレイが形成された領域の表面には、SiO2層上にPEIMがコーティングされている。
【0053】
1×PBS(pH7.0)に懸濁されたOD600が1.0の大腸菌10μlを、緩衝液(100mM酢酸ナトリウム(pH3.0)または100mMリン酸ナトリウム(pH7.0))495μlと尿495μlとを混合した990μlの溶液に加えて、OD600が0.01の試料を調製した。
【0054】
上記により希釈された尿試料を、流速200μl/分で入口から前記チャンバを介して出口方向に200μl流した。次に、100mMの酢酸ナトリウム(pH4.0)を流速200μl/分で入口から前記チャンバを介して出口方向に300μl流して洗浄した。実験は、それぞれ3回繰り返した。
【0055】
図6は、希釈尿試料中の大腸菌が、ピラーアレイの形成された表面を有する固体支持体に付着する際に、pH及び表面の性質による影響を示すグラフである。図6に示すように、pH4.7で大腸菌の付着効率が高いことを確認した。本実施例で測定した細胞捕捉効率は、以下の表1の通りである。
【0056】
【表1】

【0057】
<実施例5>ピラーアレイが形成された表面を有する固体支持体を用いた、尿中の細菌細胞の捕捉:尿の性質の変化による捕捉効果の測定
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコンチップ上に、ピラーのアレイが形成された表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細胞を前記固体支持体上に付着させ、流れ出る試料中の細胞の数をコロニー計数を通じて決定し、これから前記固体支持体による細胞捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0058】
前記ピラーアレイが形成された領域の表面は、SiO2層上にPEIMがコーティングされている。
【0059】
1×PBS(pH7.0)に懸濁されたOD600が1.0の大腸菌10μlを、緩衝液(100mM酢酸ナトリウム(pH3.0)または100mMリン酸ナトリウム(pH7.0))と尿とをそれぞれ495μlずつ混合した990μlの溶液に加えて、OD600が0.01の試料を調製した。
【0060】
上記の希釈された尿試料を、流速200μl/分で入口から前記チャンバを介して出口へと200μl流した。次に、100mMの酢酸ナトリウム(pH4.0)を、流速200μl/分で入口から前記チャンバを介して出口方向に300μm流して洗浄した。細胞計数は、前記固体支持体に尿試料を流す前後の、出口から出てきた流出液中の細胞数により計算した。
【0061】
図7は、ピラーアレイが形成されている表面を有する固体支持体を用いて尿中の大腸菌細胞を分離した結果を示すグラフであり、尿の性質の変化による結果を示す。図7に示すように、尿の種類によって、細胞捕捉効率が大きく異なる。身体の状態及び摂取食物の種類による塩及びその他の成分の濃度の差異が、このような細胞捕捉効率の差をもたらしたと推測されるが、本発明はこのような特定の作用機作に限定されるものではない。なお、pHや導電性は、このような捕捉効率の差とは関係がないと推測される(データは示していない)。
【0062】
<実施例6>ピラーアレイが形成された表面を有する固体支持体を用いた、尿中の細菌細胞の捕捉:尿の希釈及び洗浄による捕捉効果の測定
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコンチップ上にピラーのアレイが形成された表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細菌細胞を前記固体支持体上に付着させ、流れ出る試料中の細菌細胞の数を、コロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0063】
前記ピラーアレイが形成された領域の表面には、SiO2層上にそれぞれPEIM及びOTCをコーティングした。
【0064】
前記細胞試料は、OD600が0.01の大腸菌を含む100mMの酢酸ナトリウム緩衝液(pH3.0)と尿とを1:1で混合して、最終pHが3.97の試料(以下、「1/2希釈試料」と称す)、尿とOD600が0.01の大腸菌とを含む100mMの酢酸ナトリウム緩衝液(pH4.0)とを1:4で混合して、最終pHが4.05の試料(以下、「1/5希釈試料」と称す)、及び尿とOD600が0.01の大腸菌とを含む100mMの酢酸ナトリウム緩衝液(pH4.0)とを1:6で混合して、最終pHが4.05の試料(以下、「1/7希釈試料」と称す)を使用した。
【0065】
前記希釈された尿試料を、流速200μl/分で入口から前記チャンバを介して出口方向に200μl流した。次に、100mMの酢酸ナトリウム(pH4.0)を流速200μl/分で入口から前記チャンバを介して出口方向に300μmを流して洗浄した。実験は、それぞれ3回繰り返した。細胞計数は、前記固体支持体に尿試料を流す前後の、出口から出てきた流出液中の大腸菌細胞の数で計算した。
【0066】
図8は、ピラーアレイが形成された表面を有する固体支持体を用いて尿中の細胞を捕捉した結果を示すグラフであって、尿の希釈による結果を示す。図8に示すように、希釈倍数が高くなるにつれて、細胞捕捉効率が大きく増加することを確認した。洗浄過程では、細胞溶出がほとんど起こらなかった。
【0067】
<実施例7>ピラーアレイが形成された表面を有する固体支持体を用いた、尿の模倣溶液中の大腸菌の捕捉:細胞捕捉を妨害する因子探索
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコンチップ上にピラーのアレイが形成された表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細胞を前記固体支持体上に付着させ、流れ出る試料中の細菌細胞の数を、コロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は一辺の長さが25μmの正方形である。
【0068】
前記ピラーアレイが形成された領域の表面は、SiO2層上にOTCがSAMコーティングされた表面を有する。
【0069】
前記細胞試料として、OD600が0.01の大腸菌を含む、酢酸ナトリウム緩衝液をベースとする溶液と透析された尿をベースとする溶液とを使用した。
【0070】
前記酢酸ナトリウム緩衝液に基づいた溶液(pH4.0)は、以下の通りである。
【0071】
【表2】

【0072】
上記の透析された尿をベースとする溶液は、透析した尿と、2×酢酸ナトリウム緩衝液をベースとする各溶液とを1:1で混合して得られたものであり、最終pHが3.97である。
【0073】
前記尿試料は、流速200μl/分で入口から前記チャンバを介して出口方向に200μl流した。実験は、それぞれ3回繰り返した。細胞計数は、前記固体支持体に尿試料を流す前後の、出口を介して出てくる流出液中の細胞数により計算した。
【0074】
図9は、ピラーアレイが形成された表面を有する固体支持体を用いて、尿中の細胞を捕捉した結果を示すグラフである。尿中に存在する塩及びその他の物質(主にクレアチン)の濃度により、捕捉効率が低くなることを確認した。
【0075】
実施例8:ピラーアレイが形成された表面を有する固体支持体を用いた、尿中の大腸菌の捕捉:尿の希釈比率及び流速による捕捉効果の測定
本実施例では、入口と出口とが備えられており、サイズが10mm×23mmであるシリコンチップ上にピラーのアレイが形成されている表面を有するチャンバを備えた流動装置に、細菌細胞を含む試料を流しながら、細菌細胞を前記固体支持体上に付着させ、流れ出る試料中の細胞の数を、コロニー計数を通じて決定し、これから前記固体支持体による細菌細胞の捕捉効率を計算した。前記ピラーアレイにおいて、隣接するピラー同士の間の距離は12μmであり、ピラー高さが100μmであり、各ピラーの断面は、一辺の長さが25μmの正方形である。
【0076】
前記ピラーアレイが形成された領域の表面は、SiO2層上にPEIMがSAMコーティングされた表面を有する。
【0077】
試料は次のように準備した。すなわち、緩衝液と尿とを、各々定められた希釈倍率に調節しながら最終体積が1mlとなるように混合した。ここにOD600が1.0の大腸菌10μlを入れた。
【0078】
上記の希釈された尿試料は、流速200μl/分で入口から前記チャンバを介して出口方向に200μl流した。実験はそれぞれ3回繰り返した。細菌細胞の計数は、前記固体支持体に尿試料を流す前後の、出口に出てきた流出液中の細胞数で計算した。
【0079】
図10は、ピラーアレイが形成された表面を有する固体支持体を用いて、尿中の細胞を捕捉した結果を示すグラフであって、尿の希釈及び流速による結果を示す。なお、図10において、F100は流速100μl/分、F300は流速300μl/分、F500は流速500μl/分の試験区であることを示している。図10に示すように、希釈倍率が上昇するにつれて細胞の捕捉効率が増加し、流速が増加するにつれて細胞の捕捉効率が減少することを確認した。
【産業上の利用可能性】
【0080】
本発明は、微生物の分離関連の技術分野に好適に用いられる。
【図面の簡単な説明】
【0081】
【図1】流動装置において、固体支持体上に細胞が付着する際の、緩衝液の種類による影響を示すグラフである。
【図2】流動装置において、固体支持体上に細胞が付着する際の、緩衝液の濃度による影響を示すグラフである。
【図3】流動装置において、固体支持体上に大腸菌が付着する際の、pH、及びピラーのアレイを有する表面の特性による影響を示すグラフである。
【図4】流動装置において、所定の血液試料を、固体支持体を通じて流し、洗浄した後、固体支持体表面を光学顕微鏡で観察した結果である。
【図5】希釈した尿試料に含まれる大腸菌の固体支持体への付着の際の、尿試料のpHの影響を示す図である。
【図6】希釈尿試料中の大腸菌が、ピラーアレイの形成された表面を有する固体支持体に付着する際に、pH及び表面の性質による影響を示すグラフである。
【図7】固体支持体を用いて尿中の大腸菌細胞を分離した結果を示すグラフである。
【図8】固体支持体を用いて尿中の細胞を捕捉した結果を示すグラフである。
【図9】固体支持体を用いて尿中の細胞を捕捉した結果を示すグラフである。
【図10】固体支持体を用いて尿中の細胞を捕捉した結果を示すグラフである。
【特許請求の範囲】
【請求項1】
微生物を含む試料から微生物を分離する方法であって、
非平面状の固体支持体と、微生物を含む試料とをpH3.0〜6.0で接触させる段階を含む、微生物の分離方法。
【請求項2】
前記微生物が、細菌、真菌及びウイルスからなる群から選択される1種以上である、請求項1に記載の方法。
【請求項3】
前記試料が、生物学的試料である、請求項1または2に記載の方法。
【請求項4】
前記試料が、血液、尿、または唾液である、請求項3に記載の方法。
【請求項5】
前記試料が、リン酸緩衝液または酢酸緩衝液で希釈されてなる、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記試料と前記リン酸緩衝液または酢酸緩衝液との体積比率が、1:1〜1:10である、請求項5に記載の方法。
【請求項7】
前記試料が、10〜500mMの塩濃度を有する、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
前記試料が、50〜300mMの塩濃度を有する、請求項7に記載の方法。
【請求項9】
前記非平面状の固体支持体は、表面に複数個のピラーが形成されたピラー構造を有する固体支持体、表面にビーズ形状を有する固体支持体、または表面に複数個の孔隙が形成された篩構造を有する固体支持体である、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
前記ピラーの高さと前記ピラーの断面の長さとの比が、1:1〜20:1である、請求項9に記載の方法。
【請求項11】
前記ピラー構造において、前記ピラーの高さと隣接する前記ピラーの距離との比率が1:1〜25:1である、請求項9または10に記載の方法。
【請求項12】
前記ピラー構造において、前記ピラーと隣接する前記ピラーとの距離が5〜100μmである、請求項9〜11のいずれか1項に記載の方法。
【請求項13】
前記非平面状の固体支持体が疎水性であり、70°〜95°の水接触角を有する、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
前記疎水性の固体支持体は、表面をオクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム、トリデカフルオロテトラヒドロオクチルトリメトキシシラン、CF3(CF2) 3CH2CH2Si(OCH3)3、CF3(CF2)5CH2CH2Si(OCH3)3、CF3(CF2)7CH2CH2Si(OCH3)3、CF3(CF2)9CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)4CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)6CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)8CH2CH2Si(OCH3)3、CF3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 5(C6H4)C2H4Si(OCH3)3、CF3(CF2) 7(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3CH2CH2SiCH3(OCH3)2、CF3(CF2) 5CH2CH2SiCH3(OCH3)2、CF3(CF2) 7CH2CH2SiCH3(OCH3)2、CF3(CF2)9CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 4CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 6CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2)8CH2CH2SiCH3(OCH3)2、CF3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 5(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 7(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3CH2CH2Si(OCH2CH3)3、CF3(CF2)5CH2CH2Si(OCH2CH3)3、及びCF3(CF2) 7CH2CH2Si(OCH2CH3)3からなる群から選択された物質でコーティングすることにより得られる、請求項13に記載の方法。
【請求項15】
前記非平面状の固体支持体は、表面にアミン系の官能基を一以上有する、請求項1〜14のいずれか1項に記載の方法。
【請求項16】
前記アミン系の官能基を一以上有する表面は、ポリエチレンイミントリメトキシシラン、アミノプロピルトリエトキシシラン、N−[3−(トリメトキシシリル)−プロピル]エチレンジアミン、及びN−トリメトキシシリルプロピル−N,N,N−塩化トリメチルアンモニウムからなる群から選択された物質でコーティングすることにより得られる、請求項15に記載の方法。
【請求項17】
前記接触の段階後に、前記非平面状の固体支持体に結合していない物質を洗浄する段階をさらに含む、請求項1〜16のいずれか1項に記載の方法。
【請求項18】
微生物を含む試料から微生物を分離する装置であって、
非平面状の固体支持体を含む容器と、
前記容器に備え付けられる試料注入部と、
前記容器に備え付けられる緩衝液保存部と、
を含む、微生物の分離装置。
【請求項19】
前記非平面状の固体支持体は、表面に複数個のピラーが形成されたピラー構造を有する固体支持体、表面にビーズ形状を有する固体支持体、または表面に複数個の孔隙が形成された篩構造を有する固体支持体である、請求項18に記載の装置。
【請求項20】
前記ピラーの高さと前記ピラーの断面の長さとの比が1:1〜20:1である、請求項18または19に記載の装置。
【請求項21】
前記ピラー構造において、前記ピラーの高さと隣接する前記ピラーの距離との比率が1:1〜25:1である、請求項19または20に記載の装置。
【請求項22】
前記ピラー構造において、隣接する前記ピラー同士の間の距離が5〜100μmである、請求項19〜21のいずれか1項に記載の装置。
【請求項23】
前記非平面状の固体支持体が疎水性であり、70°〜95°の水接触角を有する、請求項18〜22のいずれか1項に記載の装置。
【請求項24】
前記疎水性の固体支持体は、表面をオクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム、トリデカフルオロテトラヒドロオクチルトリメトキシシラン、CF3(CF2) 3CH2CH2Si(OCH3)3、CF3(CF2)5CH2CH2Si(OCH3)3、CF3(CF2)7CH2CH2Si(OCH3)3、CF3(CF2)9CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)4CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)6CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)8CH2CH2Si(OCH3)3、CF3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 5(C6H4)C2H4Si(OCH3)3、CF3(CF2) 7(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3CH2CH2SiCH3(OCH3)2、CF3(CF2) 5CH2CH2SiCH3(OCH3)2、CF3(CF2) 7CH2CH2SiCH3(OCH3)2、CF3(CF2)9CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 4CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 6CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2)8CH2CH2SiCH3(OCH3)2、CF3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 5(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 7(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3CH2CH2Si(OCH2CH3)3、CF3(CF2)5CH2CH2Si(OCH2CH3)3、及びCF3(CF2) 7CH2CH2Si(OCH2CH3)3からなる群から選択された物質でコーティングすることにより得られる、請求項23に記載の装置。
【請求項25】
前記非平面状の固体支持体は、表面にアミン系の官能基を一以上有する、請求項18〜24のいずれか1項に記載の装置。
【請求項26】
前記アミン系の官能基を一以上有する表面は、ポリエチレンイミントリメトキシシラン、アミノプロピルトリエトキシシラン、N−[3−(トリメトキシシリル)−プロピル]エチレンジアミン、及びN−トリメトキシシリルプロピル−N,N,N−塩化トリメチルアンモニウムからなる群から選択された物質でコーティングすることにより得られる、請求項25に記載の装置。
【請求項1】
微生物を含む試料から微生物を分離する方法であって、
非平面状の固体支持体と、微生物を含む試料とをpH3.0〜6.0で接触させる段階を含む、微生物の分離方法。
【請求項2】
前記微生物が、細菌、真菌及びウイルスからなる群から選択される1種以上である、請求項1に記載の方法。
【請求項3】
前記試料が、生物学的試料である、請求項1または2に記載の方法。
【請求項4】
前記試料が、血液、尿、または唾液である、請求項3に記載の方法。
【請求項5】
前記試料が、リン酸緩衝液または酢酸緩衝液で希釈されてなる、請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記試料と前記リン酸緩衝液または酢酸緩衝液との体積比率が、1:1〜1:10である、請求項5に記載の方法。
【請求項7】
前記試料が、10〜500mMの塩濃度を有する、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
前記試料が、50〜300mMの塩濃度を有する、請求項7に記載の方法。
【請求項9】
前記非平面状の固体支持体は、表面に複数個のピラーが形成されたピラー構造を有する固体支持体、表面にビーズ形状を有する固体支持体、または表面に複数個の孔隙が形成された篩構造を有する固体支持体である、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
前記ピラーの高さと前記ピラーの断面の長さとの比が、1:1〜20:1である、請求項9に記載の方法。
【請求項11】
前記ピラー構造において、前記ピラーの高さと隣接する前記ピラーの距離との比率が1:1〜25:1である、請求項9または10に記載の方法。
【請求項12】
前記ピラー構造において、前記ピラーと隣接する前記ピラーとの距離が5〜100μmである、請求項9〜11のいずれか1項に記載の方法。
【請求項13】
前記非平面状の固体支持体が疎水性であり、70°〜95°の水接触角を有する、請求項1〜12のいずれか1項に記載の方法。
【請求項14】
前記疎水性の固体支持体は、表面をオクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム、トリデカフルオロテトラヒドロオクチルトリメトキシシラン、CF3(CF2) 3CH2CH2Si(OCH3)3、CF3(CF2)5CH2CH2Si(OCH3)3、CF3(CF2)7CH2CH2Si(OCH3)3、CF3(CF2)9CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)4CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)6CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)8CH2CH2Si(OCH3)3、CF3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 5(C6H4)C2H4Si(OCH3)3、CF3(CF2) 7(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3CH2CH2SiCH3(OCH3)2、CF3(CF2) 5CH2CH2SiCH3(OCH3)2、CF3(CF2) 7CH2CH2SiCH3(OCH3)2、CF3(CF2)9CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 4CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 6CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2)8CH2CH2SiCH3(OCH3)2、CF3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 5(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 7(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3CH2CH2Si(OCH2CH3)3、CF3(CF2)5CH2CH2Si(OCH2CH3)3、及びCF3(CF2) 7CH2CH2Si(OCH2CH3)3からなる群から選択された物質でコーティングすることにより得られる、請求項13に記載の方法。
【請求項15】
前記非平面状の固体支持体は、表面にアミン系の官能基を一以上有する、請求項1〜14のいずれか1項に記載の方法。
【請求項16】
前記アミン系の官能基を一以上有する表面は、ポリエチレンイミントリメトキシシラン、アミノプロピルトリエトキシシラン、N−[3−(トリメトキシシリル)−プロピル]エチレンジアミン、及びN−トリメトキシシリルプロピル−N,N,N−塩化トリメチルアンモニウムからなる群から選択された物質でコーティングすることにより得られる、請求項15に記載の方法。
【請求項17】
前記接触の段階後に、前記非平面状の固体支持体に結合していない物質を洗浄する段階をさらに含む、請求項1〜16のいずれか1項に記載の方法。
【請求項18】
微生物を含む試料から微生物を分離する装置であって、
非平面状の固体支持体を含む容器と、
前記容器に備え付けられる試料注入部と、
前記容器に備え付けられる緩衝液保存部と、
を含む、微生物の分離装置。
【請求項19】
前記非平面状の固体支持体は、表面に複数個のピラーが形成されたピラー構造を有する固体支持体、表面にビーズ形状を有する固体支持体、または表面に複数個の孔隙が形成された篩構造を有する固体支持体である、請求項18に記載の装置。
【請求項20】
前記ピラーの高さと前記ピラーの断面の長さとの比が1:1〜20:1である、請求項18または19に記載の装置。
【請求項21】
前記ピラー構造において、前記ピラーの高さと隣接する前記ピラーの距離との比率が1:1〜25:1である、請求項19または20に記載の装置。
【請求項22】
前記ピラー構造において、隣接する前記ピラー同士の間の距離が5〜100μmである、請求項19〜21のいずれか1項に記載の装置。
【請求項23】
前記非平面状の固体支持体が疎水性であり、70°〜95°の水接触角を有する、請求項18〜22のいずれか1項に記載の装置。
【請求項24】
前記疎水性の固体支持体は、表面をオクタデシルジメチル(3−トリメトキシシリルプロピル)アンモニウム、トリデカフルオロテトラヒドロオクチルトリメトキシシラン、CF3(CF2) 3CH2CH2Si(OCH3)3、CF3(CF2)5CH2CH2Si(OCH3)3、CF3(CF2)7CH2CH2Si(OCH3)3、CF3(CF2)9CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)4CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)6CH2CH2Si(OCH3)3、(CF3) 2CF(CF2)8CH2CH2Si(OCH3)3、CF3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3(C6H4)C2H4Si(OCH3)3、CF3(CF2) 5(C6H4)C2H4Si(OCH3)3、CF3(CF2) 7(C6H4)C2H4Si(OCH3)3、CF3(CF2) 3CH2CH2SiCH3(OCH3)2、CF3(CF2) 5CH2CH2SiCH3(OCH3)2、CF3(CF2) 7CH2CH2SiCH3(OCH3)2、CF3(CF2)9CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 4CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2) 6CH2CH2SiCH3(OCH3)2、(CF3) 2CF(CF2)8CH2CH2SiCH3(OCH3)2、CF3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 5(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 7(C6H4)C2H4SiCH3(OCH3)2、CF3(CF2) 3CH2CH2Si(OCH2CH3)3、CF3(CF2)5CH2CH2Si(OCH2CH3)3、及びCF3(CF2) 7CH2CH2Si(OCH2CH3)3からなる群から選択された物質でコーティングすることにより得られる、請求項23に記載の装置。
【請求項25】
前記非平面状の固体支持体は、表面にアミン系の官能基を一以上有する、請求項18〜24のいずれか1項に記載の装置。
【請求項26】
前記アミン系の官能基を一以上有する表面は、ポリエチレンイミントリメトキシシラン、アミノプロピルトリエトキシシラン、N−[3−(トリメトキシシリル)−プロピル]エチレンジアミン、及びN−トリメトキシシリルプロピル−N,N,N−塩化トリメチルアンモニウムからなる群から選択された物質でコーティングすることにより得られる、請求項25に記載の装置。
【図1】


【図2】


【図3】


【図7】


【図8】


【図9】


【図10】


【図4】


【図5】


【図6】




【図2】


【図3】


【図7】


【図8】


【図9】


【図10】


【図4】


【図5】


【図6】


【公開番号】特開2008−48735(P2008−48735A)
【公開日】平成20年3月6日(2008.3.6)
【国際特許分類】
【出願番号】特願2007−213969(P2007−213969)
【出願日】平成19年8月20日(2007.8.20)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】Samsung Electronics Co.,Ltd.
【Fターム(参考)】
【公開日】平成20年3月6日(2008.3.6)
【国際特許分類】
【出願日】平成19年8月20日(2007.8.20)
【出願人】(390019839)三星電子株式会社 (8,520)
【氏名又は名称原語表記】Samsung Electronics Co.,Ltd.
【Fターム(参考)】
[ Back to top ]

