非晶質シクロスポリンを含んで成るナノ粒状組成物並びに当該組成物の製造方法及び使用方法
【課題】従来のマクロサイズのシクロスポリン及び製剤と比較して、生物学的利用能の増大及び生物学的利用能の一貫性の増大を示すシクロスポリン組成物の提供。
【解決手段】非晶質シクロスポリン粒子及び前記シクロスポリン粒子の表面上に吸着された、少なくとも1つの非架橋型表面安定剤を含んで成り、約2000nm未満の有効平均粒度を有するナノ粒状組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が、約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物。
【解決手段】非晶質シクロスポリン粒子及び前記シクロスポリン粒子の表面上に吸着された、少なくとも1つの非架橋型表面安定剤を含んで成り、約2000nm未満の有効平均粒度を有するナノ粒状組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が、約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明の分野
本発明は非晶質シクロスポリン、又は非晶質シクロスポリンと結晶性シクロスポリンとの混合物を含んで成るナノ粒状組成物、並びに当該組成物の製造方法及び使用方法に関する。
【背景技術】
【0002】
本発明の背景
シクロスポリンは、免疫抑制、抗炎症、抗菌、及び抗寄生虫活性を発揮する疎水性の、環状ウンデカペプチドである。免疫抑制剤の投薬は、多くの小児科の疾患の管理において大きな役割を果たす。シクロスポリンは、中実の器官及び骨髄移植後の拒絶を予防するために使用される主要な手段であって;移植片の生存を向上させ、入院を減少させ、そして患者の罹患率を低下させることによって、移植の大変革をもたらした薬物である。シクロスポリンは、米国において腎臓移植を受けた子供の90%以上に与えられていると推定されている。シクロスポリンはまた、種々の他の自己免疫症状、例えばブドウ膜炎、乾癬、I型糖尿病、リウマチ様関節炎、炎症性腸疾患、ある種の腎症、難治性のクローン病、潰瘍性大腸炎、胆汁性肝硬変、再生不良性貧血、リウマチ様関節炎、重症筋無力症、及び皮膚筋炎において有効とされている。
【0003】
シクロスポリンは、商標名SANDIMMUNE(商標)(Novartis)、NEORAL(商標)(Novartis)、及びSANGCYA(商標)(SangStat)のもと、世界中で臨床的に使用されている。1983年に発表されたSANDIMMUNE(商標)は、乏しく、かつ広範に変化する吸収率に苦しんでいた。このことは、量及び一貫性、その両方においてSANDIMMUNE(商標)よりも優れた吸収を有するマイクロエマルジョン製剤である、第二世代のシクロスポリン製剤の開発を促した。NEORAL(商標)が発表された1995年から、約70%の患者がSANDIMMUNE(商標)からNEORAL(商標)に切り換えられ、このことはシクロスポリンの乏しく、かつ一貫性のない吸収の重大性を示している。NEORAL(商標)と生物学的に同等な、改良された経口溶液であるSANGCYA(商標)は1998年に発表された。
【0004】
シクロスポリンは経口及び静脈(IV)から投与される。経口投与後、およそ20〜50%が吸収されるが、吸収は大きく変化し得る。初回通過代謝、投与形態、及び薬物間相互作用の全てがシクロスポリンの吸収に影響を及ぼす。食品は、NEORAL(商標)及びSANGCYA(商標)の吸収を低下させる。
【0005】
シクロスポリンは極度に疎水性である。IV製剤は、当該薬物を溶解するために33%のアルコール及びオリーブ油を含んでおり、このことは時折起こる深刻な超過敏反応の原因となると考えられている。経口調製物は、低濃度であるが、トウモロコシ油、ヒマシ油又はオリーブ油及びエタノールを含むことがある。投与量で標準化した濃度曲線下面積(AUC)は、NEORAL(商標)又はSANGCYA(商標)の場合、SANDIMMUNE(商標)と比較して、腎移植、リウマチ様関節、及び乾癬の患者において23%大きく、そして肝臓移植の患者において50%大きい。心臓移植の患者に関するデータは制限されるが、同様の増大が認められている。ピークの血液シクロスポリン濃度における増大(SANDIMMUNE(商標)と比較されたNEORAL(商標)及びSANGCYA(商標))は、腎移植の患者の場合40〜106%に及び、そして肝臓移植の患者の場合90%に及んだ。
【0006】
NEORAL(商標)及びSANGCYA(商標)はSANDIMMUNE(商標)以上に改良されたものであるが、常用のシクロスポリン製剤が乏しい生物学的利用能に苦しんでいるのは、特に、シクロスポリンがほとんど水溶性ではないためである。更に、現在注目されているシクロスポリン製剤は、不都合な「対象者間の変化性」を有することが知られており、すなわち、同じ投与量が与えることで、シクロスポリンの実際の血液レベルが患者間で有意に変化することが明らかとなっている。Physicians' Desk Reference (1998) at 1882(非特許文献1)を参照のこと。このことはこれらの薬物重大な欠点を代表している。具体的には、シクロスポリンが狭い治療指数(有効量と有害量との間の範囲が狭い)を有するので、薬物吸収を予測出来ないということは、医者が近くで各患者をモニタリングし、基準線の吸収レベルを確立することを必要とする。その様なモニタリングは高価であり、かつ時間がかかる。更に、既知のシクロスポリン製剤の乏しい吸収及び患者の変化性は、投与製剤を困難にし得る。シクロスポリンについての適切な投与製剤が重要であるのは、当該薬物が一般的な免疫抑制剤であるためである。従って、当該薬物は感染に対する感受性の増大をもたらし得る。多過ぎる薬物は非制御型感染をもたらすことがあり、一方、少なすぎると臓器拒絶が起こり得る。
【0007】
前記薬物の生物学的利用能を増大せしめ、吸収率、量及び一貫性を増大せしめ、毒性を低下せしめ得る1つの薬物送達法は、前記薬物をナノ粒状組成物に調製することである。米国特許第5,145,684号(「 '684号特許」)(特許文献1)において最初に記載されたナノ粒状組成物は、非架橋型表面安定剤が吸着した、ほとんど可溶性でない結晶性の治療又は診断剤から成る粒子である。シクロスポリンを含んで成るナノ粒状組成物は、 '684号特許(特許文献1)には記載されていない。結晶性であるが、非晶質ではないシクロスポリンを含むナノ粒状組成物は、米国特許第5,494,683号(特許文献2)及び第5,399,363号(特許文献3)に開示されている。
【0008】
常用の巨大な粒径の非晶質シクロスポリン組成物は、米国特許第5,389,382号(「 '382号特許」)(特許文献4)及び第5,827,822号(「 '822号特許」)(特許文献5)に記載されている。これらの開示は、種々の欠如に苦しんでいる。例えば、 '382号特許(特許文献4)は懸濁されているか、又は乾燥している、静脈から適用可能な、安定化された医薬として許容される形態の、シクロスポリンのヒドロゾルを記載している。当該ヒドロゾル製剤は、制御型沈澱法によって得られる。この様な方法は、それらが表面安定剤に対して薬物の比が低い、固形の投与製剤及び固形分が少ない液体分散製剤をもたらすという欠点がある。このことは、制御型沈澱法が、小さいサイズの沈澱粒子を生成するために、過剰量の表面安定剤及び水を必要とするためである。過剰な表面安定剤は、大量の安定剤及び少量の薬物を有する固形の投与組成物を生成し、そして過剰な水は、固形分が少ない、その結果として薬物含量が少ない液体分散製剤を生成する。
【0009】
固形の投与製剤又は液体分散製剤の場合に高い薬物含量が好ましいのは、それが更に濃縮された投与製剤を生成するためである。シクロスポリンの濃縮された剤形が特に望ましいのは、この薬物の投与量が比較的多く、すなわち約100mg/日又はそれ以上であるためである。薬物含量が少ないが、多くの一日量を必要とする投与製剤は、患者に投与するためにより大きな丸薬、カプセル、又は液体の量、又はその様な製剤の複数回投与のいずれかを引き起こす。対照的に、濃縮型の剤形は、経口投与される丸薬又はカプセルのサイズ、あるいは1日の投与回数の最小化を可能にする。
【0010】
'822号特許(特許文献5)は、溶解剤として低級アルカノール及びポリオキシアルキレン界面活性剤を含む非晶質シクロスポリンAの水性分散製剤に関する。アルコール溶解剤の添加がしばしば不所望であるのは、それらが患者のアレルギー反応を引き起こし得るためである。その様な溶解剤は、シクロスポリンの溶解性を増大させるために、従来技術のシクロスポリン組成物にしばしば必要とされる。薬物は、効力を発揮する前に患者に吸収されなければならない。従って、しばしば高度に不溶性の薬物の医薬製剤は、投与後の薬物の吸収を助けるために、更に溶解剤を含む。
【0011】
当業界において、高用量の製剤として送達されることができ、一定かつ有効な吸収を示し、既知のシクロスポリン製剤と比較して低下した毒性を有し、そしてアルコール溶解剤の存在を必要としないシクロスポリン製剤に関する必要性が残されている。本発明はこれらの必要性を満たしている。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】米国特許第5,145,684号
【特許文献2】米国特許第5,494,683号
【特許文献3】米国特許第5,399,363号
【特許文献4】米国特許第5,389,382号
【特許文献5】米国特許第5,827,822号
【非特許文献】
【0013】
【非特許文献1】Physicians' Desk Reference (1998) at 1882
【発明の概要】
【0014】
本発明の要約
本発明は、非晶質シクロスポリン及び、当該シクロスポリンの表面に吸着された、少なくとも1つの非架橋型表面安定剤のナノ粒状組成物に関する。ナノ粒状組成物のシクロスポリン粒子は、約2000nm未満の有効平均粒度を有する。
【0015】
別の態様において、本発明は非晶質シクロスポリン及び結晶性シクロスポリンの混合物並びに、当該シクロスポリンの表面に吸着された、少なくとも1つの非架橋型表面安定剤のナノ粒状組成物を包含する。ナノ粒状組成物のシクロスポリン粒子は、約2000nm未満の有効平均粒度を有する。
【0016】
本発明の別の観点は、本発明の1又は複数のナノ粒状組成物を含んで成る医薬組成物に関する。当該医薬組成物は、好ましくは上述のナノ粒状組成物及び医薬として許容される担体、並びに任意の所望の賦形剤を含んで成る。高用量の製剤として送達され得る当該組成物は、常用のシクロスポリン製剤と比較して低下した毒性を示し、そして増大した吸収を示す、所定の用量に関して患者間で向上したシクロスポリン吸収の一貫性を提供する。
【0017】
本発明は更に、本発明に従いナノ粒状組成物を作製する方法を開示する。最初の方法は、安定なナノ粒状組成物を提供するのに十分な時間及び条件で、非晶質シクロスポリン、又は非晶質シクロスポリン及び結晶性シクロスポリンの混合物を、少なくとも1つの表面安定剤と接触させることを含んで成る。前記表面安定剤は、シクロスポリン粒子の粉砕の前、間、又は後のいずれかに、シクロスポリン粒子と接触され得る。当該ナノ粒状組成物のシクロスポリン粒子は、約2000nm未満の有効平均粒度を有する。
【0018】
本発明は更に、治療に有効な量の本発明に従うナノ粒状組成物を、必要としている哺乳類に投与することを含んで成る処置方法に関する。当該ナノ粒状シクロスポリン組成物は、任意な常用の経路を介して投与され得る。
【0019】
前述の一般的な説明及び後述の詳細な説明は共に例示及び説明的なものであり、そして特許請求の範囲にある様に本発明の更なる説明を提供することが意図されている。他の目的、利点及び新規な特徴は、以下の本発明の詳細な説明から、当業者にとって容易に理解されるだろう。
【図面の簡単な説明】
【0020】
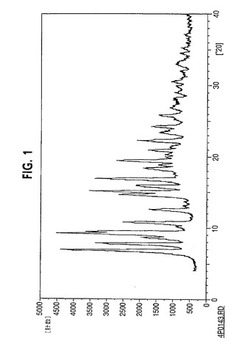
【図1】図1は、未加工のシクロスポリン薬物物質のX線粉末回折の結果を示す。
【図2】図2は、表面安定剤としてPluronic(商標)F108を有する、ミル粉砕したシクロスポリン製剤のX線粉末回折の結果を示す。
【図3】図3は、表面安定剤としてHPC−SLを有する、ミル粉砕したシクロスポリン製剤のX線粉末回折の結果を示す。
【発明を実施するための形態】
【0021】
本発明の詳細な説明
本発明はナノ粒状非晶質シクロスポリン、又は非晶質シクロスポリン及び結晶性シクロスポリンの混合物を含んで成る組成物、並びに当該ナノ粒状組成物の製造方法及び使用方法に関する。本明細書で使用する場合、表現を単純にするためだけに単一の用語が使用されており、そして本発明又は本発明の観点を単一の態様に限定することは意図されていない。従って、例えば「表面安定剤」の記載は、特に明示しない限り、「1又は複数の」表面安定剤を説明することを意味する。
【0022】
本発明以前は、 '684号によって教示されていた様に、結晶性薬物がナノ粒状組成物へと調製され得ることが知られていた。当該組成物において、表面安定剤は前記薬物の結晶表面に吸着し、そして他の薬物粒子に対して立体的な障壁として働き、凝集を防ぐ。このことは、粒度が溶解及び再結晶又は凝集を介して、時間の経過によって有意に増大しない、安定なナノ粒状組成物をもたらす。表面安定剤が結晶性薬物の表面に吸着し、そして薬物と化学反応しないので、非晶質薬物が '684号特許に記載のナノ粒状組成物に利用され得ないと考えられていた。非晶質薬物は、結晶性の固形の状態の特徴である、分子間格子構造を持たない。驚いたことに、非晶質シクロスポリンがナノ粒状組成物に組み込まれ得ることが発見された。
【0023】
非晶質化合物は結晶性化合物よりも高度なエネルギーレベルを有している。このために、非晶質化合物は一般的に不安定であり、その結果、天然において当該化合物はより低エネルギーの結晶状態に変換されやすい。非晶質化合物が結晶性化合物よりも高度なエネルギーレベルを有するので、薬物は非晶状態にあることが好ましい。非晶状態は結晶状態ほど安定ではなく;それ故に、固形は結晶状態よりも非晶状態においてより可溶性であるだろう。向上した溶解性は素速い、かつ更に完全な溶解をもたらし、そして溶解性が乏しい薬物物質の場合には、向上した生物学的利用能をもたらすだろう。
【0024】
本発明の組成物は、シクロスポリンの表面上に吸着する1又は複数の表面安定剤を有する、ナノ粒状非晶質シクロスポリン、又は非晶質シクロスポリン及び結晶性シクロスポリンの混合物を含んで成る。本明細書で有用な表面安定剤は、ナノ粒状シクロスポリンの表面に物理的に吸着するが、シクロスポリン自身とは化学反応しない。個々に吸着した表面安定剤の分子は、本質的に分子間架橋を欠いている。
【0025】
本発明はまた、非経口注射、経口投与、直腸又は局所投与等のための、集合的に担体と称される、1又は複数の無毒の生理学的に許容される担体、アジュバント、又は媒体と一緒に組成物へと調製されるナノ粒状組成物を含む。本発明は更に、固形の投与製剤及び液体の分散製剤におけるナノ粒状組成物を含む。
【0026】
1.シクロスポリン
当該シクロスポリンは、有用な免疫抑制、抗炎症、及び抗寄生虫活性を有する、環状の非極性オリゴペプチドのクラスを含んで成る。単離された最初のシクロスポリン及び前記クラスの「親」化合物と称されているものは、単純に「シクロスポリン」又は「シクロスポリンA」として引用される天然の菌類代謝物である。
【0027】
シクロスポリンAの発見から、広範な天然シクロスポリンが単離され、そして同定され、そして他の非天然シクロスポリンが合成手段によって、又は改良された培養技術を介して調製されてきた。その様な化合物は当業界で知られており、そして例えば米国特許第5,389,382号及びThe Merck Index (12th ed, 1996)の464−465に記載されている。本明細書で使用する場合、用語シクロスポリンはシクロスポリンA及び他のシクロスポリン、例えばシクロスポリンB〜I及びそれらの合成類似体を含むことを意味する。本明細書で使用する好ましいシクロスポリンはシクロスポリンAである。
【0028】
本発明のシクロスポリン組成物は、天然で部分的に又は主に非晶質である。このことは、前記ナノ粒状組成物を得るために使用される出発シクロスポリン化合物が天然で主に結晶性であっても同様である。用語「非晶質」は、化学業界で認識されている意味を有する用語であり、そして非結晶性の構造、すなわち分子間格子構造を欠いている構造を説明している。前記ナノ粒状組成物が結晶又は非晶状態にあるか否かは、例えばX線粉末回折パターン又は当業者に知られている他の方法によって決定され得る。
【0029】
2.表面安定剤
適当な表面安定剤は、好ましくは既知の有機性及び無機性医薬賦形剤から選択され得る。その様な賦形剤は種々のポリマー、低分子量オリゴマー、天然生成物、及び界面活性剤を含む。好ましい表面安定剤は、非イオン性及びイオン性界面活性剤を含む。2又はそれ以上の表面安定剤が組み合わせて使用され得る。
【0030】
表面安定剤の代表例は、塩化セチルピリジニウム、ゼラチン、カゼイン、レシチン(ホスファチド)、デキストラン、グリセロール、アカシアゴム、コレステロール、トラガカント、ステアリン酸、塩化ベンズアルコニウム、ステアリン酸カルシウム、モノステアリン酸グリセロール、セトステアリルアルコール、セトマクロゴール乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル(例えばマクロゴールエーテル、例えばセトマクロゴール1000)、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル(例えば市販のTween(商標)、例えばTween 20(商標)及びTween 80(商標)(ICI Speciality Chemicals));ポリエチレングリコール(例えば、Carbowax 3350(商標)及び1450(商標)、並びにCarbopol 934(商標)(Union Carbide))、ドデシルトリメチル臭化アンモニウム、ステアリン酸ポリオキシエチレン、コロイド性二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、ヒドロキシプロピルセルロース(例えばHPC,HPC−SL、及びHPC−L)、ヒドロキシプロピルメチルセルロース(HPMC)、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、フタル酸ヒドロキシプロピルメチル−セルロース、非結晶性セルロース、アルミニウムケイ酸マグネシウム、トリエタノールアミン、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー(チロキサポールとしても知られている)、ポロキサマー(例えば、エチレンオキシド及びプロピレンオキシドのブロックコポリマーである、Pluronic F68(商標)及びF108(商標));ポロキサミン(例えば、エチレンジアミンに対するプロピレンオキシド及びエチレンオキシドの逐次添加から誘導された四官能性ブロックコポリマーである、Poloxamine 908(商標)としても知られているTetronic 908(商標)(BASF Corporation, Parsippany, N.J.));荷電リン脂質、例えばジミリストイルホスファチジルグリセロール、ジオクチルスルホコハク酸塩(DOSS);Tetronic 1508(商標)(T−1508)(BASF Corporation)、スルホコハク酸ナトリウムのジアルキルエステル(例えば、スルホコハク酸ナトリウムのジオクチルエステルである、Acrosol OT(商標)(American Cyanamid));ラウリル硫酸ナトリウムである、Duponol P(商標);スルホン酸アルキルアリールポリエーテルである、Triton X−200(商標)(Rohmand Haas);ステアリン酸スクロースとジステアリン酸スクロースの混合物である、Crodesta F−110(商標)(Croda Inc.);Olin−10G(商標)又はSurfactant 10−G(商標)としても知られている、p−イソノニルフェノキシポリ−(グリシドール)(Olin Chemicals, Stanford, CT);Crodesta SL−40(商標)(Croda, Inc.);C18H37CH2 (CON(CH3 )−CH2 (CHOCH)4(CH2 OH)2 である、SA9OHCO(Eastman Kodak Co.)、構造−(−PEO)−−(−PBO−)−−(−PEO−)−のトリブロックコポリマー(B20−5000として知られている)等を含む。
【0031】
これらの表面安定剤の多くが既知の医薬賦形剤であり、そして具体的に引用によって組み入れられる、the American Pharmaceutical Association及びThe Pharmaceutical Society of Great Britainによって一緒に出版された、Hand book of Excipients(The Pharmaceutical Press, 1986)に詳細に記載されている。当該表面安定剤は市販されており、そして/あるいは当業界で知られている技術によって調製され得る。
【0032】
本発明は、上記安定剤又は本明細書に記載され、若しくは本明細書で引用した文献に記載された他の安定剤が、単独で、互いに組み合わせて、又は他の表面安定剤と一緒に、そのいずれかで使用され得る。
【0033】
3.ナノ粒子の粒度
好ましくは、本発明の組成物は光散乱法又は当業界で認められている他の方法によって測定された、約2000nm未満、約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、又は約50nm未満の有効平均粒度を有するナノ粒子を含む。「約2000nm未満の有効平均粒度」によって、少なくとも50%の薬物粒子が、光散乱法又は他の常用の技術によって測定された場合に、約2000nm未満の重量平均粒度を有することが意味される。好ましくは、少なくとも70%の薬物粒子が約2000nm未満の平均粒度を有し、更に好ましくは少なくとも90%の薬物粒子が約2000nm未満の平均粒度を有し、そして更に好ましくは少なくとも約95%の粒子が約2000nm未満の重量平均粒度を有する。
【0034】
4.シクロスポリン及び表面安定剤の濃度
表面安定剤に対するシクロスポリンの好ましい重量比は約10:1〜約1.5:1である。液体分散により、好ましい薬物含量は重量当たり約50%〜約2%である。
【0035】
B.ナノ粒状製剤の製造方法
ナノ粒状組成物を製造する例示的な方法は、 '684号特許に記載されている。本発明の最適な有効平均粒度は粒度の低下過程を制御することによって、例えばミル粉砕の時間及び加えられる表面安定剤の量を制御することによって得られ得る。粒子の成長及び粒子の凝集も、より冷たい温度のもとで前記組成物をミル粉砕し、そしてより冷たい温度で最終組成物を保存することによっても最小化され得る。
【0036】
ナノ粒状組成物を得るためのミル粉砕は、シクロスポリン粒子を液体分散媒中で分散し、続いて、シクロスポリンの粒度を所望の有効平均粒度に縮小させるための粉砕媒体の存在下で機械的手段を適用することを含んで成る。シクロスポリン粒子は、1又は複数の表面安定剤の存在下でサイズが縮小され得る。あるいは、シクロスポリン粒子は磨砕後に1又は複数の表面安定剤と接触され得る。他の化合物、例えば希釈剤が、サイズの縮小過程の間にシクロスポリン/表面安定剤組成物に加えられ得る。分散液は連続的に又はバッチモードで製造され得る。生じたナノ粒状シクロスポリン分散液は、固形又は液体の投与製剤において利用され得る。例示的な有用なミルは、低エネルギーミル、例えばローラーミル又はボールミル、並びに高エネルギーミル、例えばDynoミル、Netzschミル、DCミル及びPlanetaryミルを含む。
【0037】
出発材料のシクロスポリン組成物は主に結晶であっても、主に非晶質であっても、又はそれらの混合物であってもよい。生じたシクロスポリン組成物は主に非晶質である。
【0038】
固形の投与製剤は、粉砕後に、ナノ粒状非晶質シクロスポリン、又は非晶質シクロスポリン及び結晶性シクロスポリンの混合物を乾燥させることによって調製され得る。好ましい乾燥方法はスプレー乾燥である。スプレー乾燥工程は、シクロスポリンをナノ粒子に変換するために使用されるミル粉砕工程後に、ナノ粒状粉末を得るために使用される。その様なナノ粒状粉末は経口投与のための錠剤へと調製され得る。
【0039】
C.本発明のナノ粒状組成物の使用方法
本発明のナノ粒状組成物は経口、経直腸、非経口(静脈内、筋肉内、又は皮下)、大槽内、腔内、腹腔内から、局所的に(粉末、軟膏又は点滴薬)、又は口腔内若しくは鼻内スプレーとして、そのいずれかでヒト及び動物に投与され得る。
【0040】
非経口注射に適した組成物は、生理学的に許容される滅菌水溶液又は非水溶液、分散液、懸濁液又は乳濁液及び滅菌注射溶液又は分散液への再構成のための滅菌粉末を含んで成ることがある。適当な水性及び非水性担体、希釈剤、溶媒、又は媒体の例は、水、エタノール、ポリオール(プロピレングリコール、ポリエチレングリコール、グリセロール等)、適当なそれらの混合物、植物油(例えばオリーブ油)及び注射用有機エステル、例えばオレイン酸エチルを含む。適切な流度が、例えばコーティング、例えばレシチンの使用によって、分散液の場合には必要な粒度の維持によって、そして界面活性剤の使用によって維持され得る。
【0041】
当該ナノ粒状組成物は更に、アジュバント、例えば防腐剤、湿潤剤、乳化剤、及び分散剤を含むことがある。微生物の増殖の予防は、種々の抗菌剤及び抗真菌剤、例えばパラベン、クロロブタノール、フェノール、ソルビン酸等によって保証され得る。等張性の物質、例えば糖類、塩化ナトリウム等を含むことが望ましいこともある。注射用医薬形態の吸収の延長は、吸収を遅らせる物質、例えばモノステアリン酸アルミニウム及びゼラチンの使用によってもたらされることがある。
【0042】
経口投与のための固形の剤形は、カプセル、錠剤、丸薬、粉末、及び顆粒を含む。その様な固形の剤形において、活性化合物は少なくとも1つの以下のもの:(a)1又は複数の不活性な賦形剤(又は担体)、例えばリン酸二カルシウム;(b)充填剤又は増量剤、例えばデンプン、ラクトース、スクロース、グルコース、マンニトール、及びケイ酸;(c)結合剤、例えばカルボキシメチルセルロース、アルギン酸塩(alignate)、ゼラチン、ポリビニルピロリドン、スクロース及びアカシア;(d)湿潤剤、例えばグリセロール;(e)崩壊剤、例えば寒天、炭酸カルシウム、ジャガイモ又はタピオカデンプン、アルギン酸、ある複合体のケイ酸塩、及び炭酸ナトリウム;(f)溶液凝固遅延剤、例えばパラフィン;(g)吸収促進剤、例えば第4級アンモニウム化合物;(h)加湿剤、例えばセチルアルコール及びモノステアリン酸グリセロール;(i)吸着剤、例えばカオリン及びベントナイト;並びに(j)潤滑剤、例えばタルク、ステアリン酸カルシウム、ステアリン酸マグネシウム、固形のポリエチレングリコール、ラウリル硫酸ナトリウム、又はそれらの混合物と混合される。カプセル、錠剤、及び丸剤に関して、当該剤形は更に緩衝剤を含んで成ることもある。
【0043】
経口投与のための液体の剤形は、医薬として許容される乳濁液、溶液、懸濁液、シロップ、及びエリキシルを含む。活性化合物に加えて、当該液体剤形は、当業界で一般的に使用される不活性な希釈剤、例えば水又は他の溶媒、溶解剤、及び乳化剤を含んで成ることもある。例示的な乳化剤はエチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3−ブチレングリコール、ジメチルホルムアミド、油、例えば綿実油、落花生油、トウモロコシ胚油、オリーブ油、ヒマシ油、及びゴマ油、グリセロール、テトラヒドロフラニルアルコール、ポリエチレングリコール、ソルビタン脂肪酸エステル、又はこれらの物質の混合物等を含んで成ることもある。
【0044】
この様な不活性な希釈剤の他に、当該組成物はアジュバント、例えば加湿剤、乳化剤及び懸濁剤、甘味剤、香料添加剤、及び香料を含むこともある。
【0045】
本発明のナノ粒状組成物における活性成分の正味の用量レベルは、特定の組成物及び投与方法にとって所望の治療的応答を得るために有効な活性成分の量を得るために変更され得る。従って、選択される用量レベルは所望の治療効果、投与経路、所望の治療期間、及び他の要因に依存する。
【0046】
単回又は分割量で宿主に投与される本発明の化合物の合計の一日量は、様々な要因、例えば体重、身体全体の健康、性別、食生活、投与の時間及び経路、吸収及び排出の速度、他の薬物との組み合わせ、並びに処置される特定の症状の重症度に依存して変更し得る。例えば、推奨されるNEORAL(商標)の一日量は、腎移植の患者の場合の9±3mg/kg/日から乾癬及びリウマチ様関節炎の場合の2.5mg/kg/日に及び、一方、移植患者の場合に提案される、SANDIMMUNE(商標)の初回の経口用量は10〜18mg/kg/日である。
【0047】
以下の例は本発明を例示するために提示する。しかしながら、本発明はこれらの例に記載されている具体的な条件又は詳細に限定されるべきではないと考えられるはずである。明細書を通じて、公然と入手可能な文書、例えば米国特許に対する任意の、かつ全ての引用文献が、引用によって本特許出願に具体的に組み入れられる。
【実施例】
【0048】
例1
この例の目的は、ナノ粒状の、主に非晶質のシクロスポリン製剤を調製することにあった。
【0049】
表1に記載のナノ粒状非晶質シクロスポリン製剤は、高エネルギー媒体ミル粉砕技術を用いて得られた。全てのミル粉砕実験が、0.15Lの試験槽を備え付けたDYNO−MILL(商標)KDL型(Willy Bachofen AG, Basel, Switzerland)を利用した。シクロスポリンはNorth China Pharmaceutical Corporation (Shijiazhuang, China)によって製造された。粒度分布は、Horiba LA−910光散乱粒度解析機(Horiba Instruments, Irviae, CA)を用いて決定した。
【0050】
(1)10%シクロスポリン、6%F108、0.1%SLS
ナノ粒状組成物(1)は、5.1gのPluronic(商標)F108及び0.085gのラウリル硫酸ナトリウム(SLS)を71.32gの脱イオン水に溶解させることによって調製した。安定剤溶液は、8.5gのシクロスポリン薬物物質及び500μmのポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填された。製剤を6時間処理し、続いて回収し、そして濾過した。最終的な粒度分布は平均=275nm、90%<420nmであった。
【0051】
(2)5%シクロスポリン、1.5%HPC−SL、0.15%SLS
ナノ粒状組成物(2)は、1.28gのHPC−SL(Nippon Soda)及び0.085gのラウリル硫酸ナトリウム(SLS)を、79.38gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を4時間処理した。続いて、SLSの濃度を0.15%に高めた。
分散液を更に0.5時間ミル粉砕し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=268nm、90%<380nmであった。
【0052】
(3)5%シクロスポリン、1%チロキサポール
ナノ粒状組成物(3)は、0.85gのチロキサポール(Nycomed)を、79.9gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を3時間処理し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=213nm、90%<304nmであった。
【0053】
(4)5%シクロスポリン、2%B20−5000
ナノ粒状組成物(4)は、0.85gのB20−5000(Dow Chemical)を、79.9gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を4.5時間処理した。そのとき、更に0.85gのB20−5000を加えた。分散液を更に2.25時間ミル粉砕し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=292nm、90%<411nmであった。
【0054】
(5)5%シクロスポリン、2%F108、1%チロキサポール
ナノ粒状組成物(5)は、1.7gのPluronic(商標)F108(BASF)及び0.85gのチロキサポール(Nycomed)を、78.2gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を7時間処理し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=192nm、90%<300nm(Horiba LA-910による)であった。
【0055】
(6)5%シクロスポリン、0.5%SLS
ナノ粒状組成物(6)は、0.425gのラウリル硫酸ナトリウム(Spectrum)を、80.33gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を3時間処理し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=182nm、90%<265nmであった。
【0056】
これらの例において使用される薬物物質の出発材料は、X線粉末回折によって決定した場合主に結晶であり、この結果を図1に示す。2つの代表的な実験の後、ミル粉砕したコロイド分散液もX線粉末回折によって解析した。ミル粉砕の完了により、各分散液の一部を遠心し、そして上清の液体をデカントした。固形を水で洗浄し、そして複数回再遠心してから乾燥させた。ミル粉砕した材料のX線粉末回折は、はっきりとした吸収線の不在を示しており、これは当該材料が、図2及び3に示す様に非晶質であることを示唆した。図2は、表面安定剤としてPluronic(商標)F108を有する、ミル粉砕したシクロスポリンのX線粉末回折の結果を示し、そして図3は、表面安定剤としてHPC−SLを有するミル粉砕したシクロスポリンのX線粉末回折の結果を示す。前記コロイド分散液は、非晶質の薬物物質の出発材料から調製され得る。
【表1】

【0057】
前記結果は、ナノ粒状非晶質シクロスポリン製剤が、種々の表面安定剤を用いて、種々の安定剤の濃度を用いて、そして種々のシクロスポリンの濃度を用いて、結晶性シクロスポリンの出発材料から製造され得ることを示している。
【0058】
例2
この例の目的は、本発明に従うナノ粒状シクロスポリン製剤と、常用のシクロスポリン製剤、NEORAL(商標)の薬理動態を比較することにあった。NEORAL(商標)に存在するシクロスポリンは、アルコール及び複数の追加の賦形剤に溶解する。
【0059】
比較研究は、ナノ粒状非晶質シクロスポリンA組成物とNEORAL(商標)の間で行った。前記ナノ粒状組成物は、10%w/wシクロスポリン、6%w/w Pluronic(商標)F108、及び0.1%w/wラウリル硫酸ナトリウム(SLS)から構成した。当該組成物は、90gのPluronic(商標)F108及び1.5gのSLSを1258.5gの、USPの注射用滅菌水に溶解し、そして次に150gのシクロスポリンを加えてプレミックスを形成させて調製した。DYNO−MILL(商標)KDL型に、500μmのポリマーアトリション媒体を充填した600cc(600ml)の再循環槽を取り付けた。スラリーを12.5時間処理し、そして次に20μmのカプセルフィルターを介して濾過して、165nmの平均粒度を有し、そして90%<229nmのシクロスポリンのナノ粒状コロイド分散液を生成せしめた。粒度分布は、Horiba LA−910の粒度解析器で決定した。
【0060】
表2及び3は、24時間に及んで2つの群の3匹のイヌ(群1及び2)にそれぞれ投与された、単回の100mg量のナノ粒状非晶質シクロスポリンA組成物及びNEORAL(商標)に関する濃度曲線下面積(AUC)の要約を示す。より大きなAUCはより大きな生物学的利用能に対応する。
【0061】
個々の動物の異なる吸収速度に起因する、観察されたAUC値の何らかの差異を最小化するために、ナノ粒状非晶質シクロスポリンA組成物及びNEORAL(商標)についてのAUC測定値は、同一の動物に対する投与から8日後に測定された。従って、ナノ粒状非晶質シクロスポリンA組成物についてのAUC値は、表2に示した様に群1のイヌの場合、1日目から定期的増大が、そして群2のイヌの場合、8日目から定期的増大が測定された。更に、NEORAL(商標)の投与についてのAUC値は、表3に示す様に群2のイヌの場合、1日目からの定期的増大が、そして群1のイヌの場合、8日目から定期的増大が測定された。
【表2】

【表3】

【0062】
前記結果は、群1のイヌのナノ粒状非晶質シクロスポリンAの吸収が、AUC値4964.2、4593.2、そして4473.3と劇的に一致していたことを示す。対照的に、同一のイヌの群である、群1の場合のNEORAL(商標)の吸収は、AUC値6307.0、3355.3、そして5177.1ng/mL/時間と広く変化した。群2のイヌの場合の結果は、比較的一致しているナノ粒状非晶質シクロスポリンAのAUC値4155.9、2833.8、そして6387.9ng/mL/時間と同様であった。対照的に、NEORAL(商標)の投与についての群2のイヌの場合のAUC値は6457.2、8982.8、そして12600.6ng/mL/時間であった。吸収の幅広い変化が非常に不所望であるのは、そのことが投与製剤を難しくし、そして前記薬物の適切な血液レベルを保証するために、患者の一定の監視を必要とすることをもたらし得るためである。各剤形についてのAUC値の相対標準偏差(RSD)は、対象者間の吸収変化性の定量的測定値である。ナノ粒状シクロスポリンを受けたイヌの間の、AUC値のRSDは25.4%であり、一方、NEORAL(商標)を投与した場合のAUC値のRSDは45.4%であった。従って、対象者間の変化性は、NEORAL(商標)の剤形の場合、ナノ粒状製剤の場合よりも1.8倍大きかった。
【表4】

【0063】
ナノ粒状非晶質シクロスポリン製剤と比較した場合のNEORAL(商標)についての吸収の変化性も、以下の表5に示す様に、同じ単回の100mgの用量についての各製剤の吸収範囲の比較によって示される。NEORAL(商標)は、9245ng/mL/時間に及ぶAUCにおける対象者間の吸収の変化性を有するが、ナノ粒状のAUCの変化性(最小から最大まで)はわずかに3354ng/mL/時間である。吸収の変化性は、治療量以下の薬物の血漿濃度、又は反対に、当該薬物物質が毒性の効果を発揮する、過剰に高い血漿濃度を導くことがある。その様な変化性は非常に不所望なことであり、特に、狭い有効量範囲を有する薬物、例えばシクロスポリンの場合に望ましくない。
【表5】

【0064】
更に、NEORAL(商標)とナノ粒状非晶質シクロスポリン製剤の間の吸収の不一致は、投薬後の最初の0.50時間における劇的な差異によって証明される。ナノ粒状シクロスポリンを受けたイヌの間で、6匹全ての対象者が、投与から15分後に検出可能な血漿濃度(405.27〜623.23ng/mL/時間に及ぶ)を有していた(表2)。NEORAL(商標)を与えた場合、6匹のうち5匹の対象者が、投与から15分後に検出可能な血漿濃度(66.50〜393.04ng/mL/時間に及ぶ)を有していたが、1匹のイヌ(番号408/f/1)が、前記薬物を受けてから30分経過しても検出可能な血液レベルを有していなかった(表3)。
【0065】
前記結果はまた、前記ナノ粒状非晶質シクロスポリン製剤が、従来のNEORAL(商標)製剤よりも更に素速く吸収されることを示している。表2に見られる様に、イヌがナノ粒状シクロスポリンを投与されると、ピークの血漿濃度に約1時間ないしそれ以下で全て達した。NEORAL(商標)を与えると、ピークの血漿レベルに、6匹のうち5匹のイヌが約1.5時間で達し、そしてイヌ番号408/f/1の場合約2時間で達した(表3)。
【0066】
これらの結果は、異なる対象者間での、従来のシクロスポリン製剤、例えばNEORAL(商標)以上の本発明の組成物の生物学的利用能の優れた一貫性及び更に素速い吸収を示している。
【0067】
当業者にとって、種々の修飾及び変更が、本発明の精神又は範囲を逸脱することなく、本発明の方法及び組成物において行われ得ることは明らかである。従って、本発明は、特許請求の範囲及びそれらの同等物に含まれる様に提供される本発明の修飾及び変更を網羅することが意図されている。以下の例は更に本発明を例示しており、そして本明細書及び特許請求の範囲を限定するものとしてみなされるべきではない。
【技術分野】
【0001】
本発明の分野
本発明は非晶質シクロスポリン、又は非晶質シクロスポリンと結晶性シクロスポリンとの混合物を含んで成るナノ粒状組成物、並びに当該組成物の製造方法及び使用方法に関する。
【背景技術】
【0002】
本発明の背景
シクロスポリンは、免疫抑制、抗炎症、抗菌、及び抗寄生虫活性を発揮する疎水性の、環状ウンデカペプチドである。免疫抑制剤の投薬は、多くの小児科の疾患の管理において大きな役割を果たす。シクロスポリンは、中実の器官及び骨髄移植後の拒絶を予防するために使用される主要な手段であって;移植片の生存を向上させ、入院を減少させ、そして患者の罹患率を低下させることによって、移植の大変革をもたらした薬物である。シクロスポリンは、米国において腎臓移植を受けた子供の90%以上に与えられていると推定されている。シクロスポリンはまた、種々の他の自己免疫症状、例えばブドウ膜炎、乾癬、I型糖尿病、リウマチ様関節炎、炎症性腸疾患、ある種の腎症、難治性のクローン病、潰瘍性大腸炎、胆汁性肝硬変、再生不良性貧血、リウマチ様関節炎、重症筋無力症、及び皮膚筋炎において有効とされている。
【0003】
シクロスポリンは、商標名SANDIMMUNE(商標)(Novartis)、NEORAL(商標)(Novartis)、及びSANGCYA(商標)(SangStat)のもと、世界中で臨床的に使用されている。1983年に発表されたSANDIMMUNE(商標)は、乏しく、かつ広範に変化する吸収率に苦しんでいた。このことは、量及び一貫性、その両方においてSANDIMMUNE(商標)よりも優れた吸収を有するマイクロエマルジョン製剤である、第二世代のシクロスポリン製剤の開発を促した。NEORAL(商標)が発表された1995年から、約70%の患者がSANDIMMUNE(商標)からNEORAL(商標)に切り換えられ、このことはシクロスポリンの乏しく、かつ一貫性のない吸収の重大性を示している。NEORAL(商標)と生物学的に同等な、改良された経口溶液であるSANGCYA(商標)は1998年に発表された。
【0004】
シクロスポリンは経口及び静脈(IV)から投与される。経口投与後、およそ20〜50%が吸収されるが、吸収は大きく変化し得る。初回通過代謝、投与形態、及び薬物間相互作用の全てがシクロスポリンの吸収に影響を及ぼす。食品は、NEORAL(商標)及びSANGCYA(商標)の吸収を低下させる。
【0005】
シクロスポリンは極度に疎水性である。IV製剤は、当該薬物を溶解するために33%のアルコール及びオリーブ油を含んでおり、このことは時折起こる深刻な超過敏反応の原因となると考えられている。経口調製物は、低濃度であるが、トウモロコシ油、ヒマシ油又はオリーブ油及びエタノールを含むことがある。投与量で標準化した濃度曲線下面積(AUC)は、NEORAL(商標)又はSANGCYA(商標)の場合、SANDIMMUNE(商標)と比較して、腎移植、リウマチ様関節、及び乾癬の患者において23%大きく、そして肝臓移植の患者において50%大きい。心臓移植の患者に関するデータは制限されるが、同様の増大が認められている。ピークの血液シクロスポリン濃度における増大(SANDIMMUNE(商標)と比較されたNEORAL(商標)及びSANGCYA(商標))は、腎移植の患者の場合40〜106%に及び、そして肝臓移植の患者の場合90%に及んだ。
【0006】
NEORAL(商標)及びSANGCYA(商標)はSANDIMMUNE(商標)以上に改良されたものであるが、常用のシクロスポリン製剤が乏しい生物学的利用能に苦しんでいるのは、特に、シクロスポリンがほとんど水溶性ではないためである。更に、現在注目されているシクロスポリン製剤は、不都合な「対象者間の変化性」を有することが知られており、すなわち、同じ投与量が与えることで、シクロスポリンの実際の血液レベルが患者間で有意に変化することが明らかとなっている。Physicians' Desk Reference (1998) at 1882(非特許文献1)を参照のこと。このことはこれらの薬物重大な欠点を代表している。具体的には、シクロスポリンが狭い治療指数(有効量と有害量との間の範囲が狭い)を有するので、薬物吸収を予測出来ないということは、医者が近くで各患者をモニタリングし、基準線の吸収レベルを確立することを必要とする。その様なモニタリングは高価であり、かつ時間がかかる。更に、既知のシクロスポリン製剤の乏しい吸収及び患者の変化性は、投与製剤を困難にし得る。シクロスポリンについての適切な投与製剤が重要であるのは、当該薬物が一般的な免疫抑制剤であるためである。従って、当該薬物は感染に対する感受性の増大をもたらし得る。多過ぎる薬物は非制御型感染をもたらすことがあり、一方、少なすぎると臓器拒絶が起こり得る。
【0007】
前記薬物の生物学的利用能を増大せしめ、吸収率、量及び一貫性を増大せしめ、毒性を低下せしめ得る1つの薬物送達法は、前記薬物をナノ粒状組成物に調製することである。米国特許第5,145,684号(「 '684号特許」)(特許文献1)において最初に記載されたナノ粒状組成物は、非架橋型表面安定剤が吸着した、ほとんど可溶性でない結晶性の治療又は診断剤から成る粒子である。シクロスポリンを含んで成るナノ粒状組成物は、 '684号特許(特許文献1)には記載されていない。結晶性であるが、非晶質ではないシクロスポリンを含むナノ粒状組成物は、米国特許第5,494,683号(特許文献2)及び第5,399,363号(特許文献3)に開示されている。
【0008】
常用の巨大な粒径の非晶質シクロスポリン組成物は、米国特許第5,389,382号(「 '382号特許」)(特許文献4)及び第5,827,822号(「 '822号特許」)(特許文献5)に記載されている。これらの開示は、種々の欠如に苦しんでいる。例えば、 '382号特許(特許文献4)は懸濁されているか、又は乾燥している、静脈から適用可能な、安定化された医薬として許容される形態の、シクロスポリンのヒドロゾルを記載している。当該ヒドロゾル製剤は、制御型沈澱法によって得られる。この様な方法は、それらが表面安定剤に対して薬物の比が低い、固形の投与製剤及び固形分が少ない液体分散製剤をもたらすという欠点がある。このことは、制御型沈澱法が、小さいサイズの沈澱粒子を生成するために、過剰量の表面安定剤及び水を必要とするためである。過剰な表面安定剤は、大量の安定剤及び少量の薬物を有する固形の投与組成物を生成し、そして過剰な水は、固形分が少ない、その結果として薬物含量が少ない液体分散製剤を生成する。
【0009】
固形の投与製剤又は液体分散製剤の場合に高い薬物含量が好ましいのは、それが更に濃縮された投与製剤を生成するためである。シクロスポリンの濃縮された剤形が特に望ましいのは、この薬物の投与量が比較的多く、すなわち約100mg/日又はそれ以上であるためである。薬物含量が少ないが、多くの一日量を必要とする投与製剤は、患者に投与するためにより大きな丸薬、カプセル、又は液体の量、又はその様な製剤の複数回投与のいずれかを引き起こす。対照的に、濃縮型の剤形は、経口投与される丸薬又はカプセルのサイズ、あるいは1日の投与回数の最小化を可能にする。
【0010】
'822号特許(特許文献5)は、溶解剤として低級アルカノール及びポリオキシアルキレン界面活性剤を含む非晶質シクロスポリンAの水性分散製剤に関する。アルコール溶解剤の添加がしばしば不所望であるのは、それらが患者のアレルギー反応を引き起こし得るためである。その様な溶解剤は、シクロスポリンの溶解性を増大させるために、従来技術のシクロスポリン組成物にしばしば必要とされる。薬物は、効力を発揮する前に患者に吸収されなければならない。従って、しばしば高度に不溶性の薬物の医薬製剤は、投与後の薬物の吸収を助けるために、更に溶解剤を含む。
【0011】
当業界において、高用量の製剤として送達されることができ、一定かつ有効な吸収を示し、既知のシクロスポリン製剤と比較して低下した毒性を有し、そしてアルコール溶解剤の存在を必要としないシクロスポリン製剤に関する必要性が残されている。本発明はこれらの必要性を満たしている。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】米国特許第5,145,684号
【特許文献2】米国特許第5,494,683号
【特許文献3】米国特許第5,399,363号
【特許文献4】米国特許第5,389,382号
【特許文献5】米国特許第5,827,822号
【非特許文献】
【0013】
【非特許文献1】Physicians' Desk Reference (1998) at 1882
【発明の概要】
【0014】
本発明の要約
本発明は、非晶質シクロスポリン及び、当該シクロスポリンの表面に吸着された、少なくとも1つの非架橋型表面安定剤のナノ粒状組成物に関する。ナノ粒状組成物のシクロスポリン粒子は、約2000nm未満の有効平均粒度を有する。
【0015】
別の態様において、本発明は非晶質シクロスポリン及び結晶性シクロスポリンの混合物並びに、当該シクロスポリンの表面に吸着された、少なくとも1つの非架橋型表面安定剤のナノ粒状組成物を包含する。ナノ粒状組成物のシクロスポリン粒子は、約2000nm未満の有効平均粒度を有する。
【0016】
本発明の別の観点は、本発明の1又は複数のナノ粒状組成物を含んで成る医薬組成物に関する。当該医薬組成物は、好ましくは上述のナノ粒状組成物及び医薬として許容される担体、並びに任意の所望の賦形剤を含んで成る。高用量の製剤として送達され得る当該組成物は、常用のシクロスポリン製剤と比較して低下した毒性を示し、そして増大した吸収を示す、所定の用量に関して患者間で向上したシクロスポリン吸収の一貫性を提供する。
【0017】
本発明は更に、本発明に従いナノ粒状組成物を作製する方法を開示する。最初の方法は、安定なナノ粒状組成物を提供するのに十分な時間及び条件で、非晶質シクロスポリン、又は非晶質シクロスポリン及び結晶性シクロスポリンの混合物を、少なくとも1つの表面安定剤と接触させることを含んで成る。前記表面安定剤は、シクロスポリン粒子の粉砕の前、間、又は後のいずれかに、シクロスポリン粒子と接触され得る。当該ナノ粒状組成物のシクロスポリン粒子は、約2000nm未満の有効平均粒度を有する。
【0018】
本発明は更に、治療に有効な量の本発明に従うナノ粒状組成物を、必要としている哺乳類に投与することを含んで成る処置方法に関する。当該ナノ粒状シクロスポリン組成物は、任意な常用の経路を介して投与され得る。
【0019】
前述の一般的な説明及び後述の詳細な説明は共に例示及び説明的なものであり、そして特許請求の範囲にある様に本発明の更なる説明を提供することが意図されている。他の目的、利点及び新規な特徴は、以下の本発明の詳細な説明から、当業者にとって容易に理解されるだろう。
【図面の簡単な説明】
【0020】
【図1】図1は、未加工のシクロスポリン薬物物質のX線粉末回折の結果を示す。
【図2】図2は、表面安定剤としてPluronic(商標)F108を有する、ミル粉砕したシクロスポリン製剤のX線粉末回折の結果を示す。
【図3】図3は、表面安定剤としてHPC−SLを有する、ミル粉砕したシクロスポリン製剤のX線粉末回折の結果を示す。
【発明を実施するための形態】
【0021】
本発明の詳細な説明
本発明はナノ粒状非晶質シクロスポリン、又は非晶質シクロスポリン及び結晶性シクロスポリンの混合物を含んで成る組成物、並びに当該ナノ粒状組成物の製造方法及び使用方法に関する。本明細書で使用する場合、表現を単純にするためだけに単一の用語が使用されており、そして本発明又は本発明の観点を単一の態様に限定することは意図されていない。従って、例えば「表面安定剤」の記載は、特に明示しない限り、「1又は複数の」表面安定剤を説明することを意味する。
【0022】
本発明以前は、 '684号によって教示されていた様に、結晶性薬物がナノ粒状組成物へと調製され得ることが知られていた。当該組成物において、表面安定剤は前記薬物の結晶表面に吸着し、そして他の薬物粒子に対して立体的な障壁として働き、凝集を防ぐ。このことは、粒度が溶解及び再結晶又は凝集を介して、時間の経過によって有意に増大しない、安定なナノ粒状組成物をもたらす。表面安定剤が結晶性薬物の表面に吸着し、そして薬物と化学反応しないので、非晶質薬物が '684号特許に記載のナノ粒状組成物に利用され得ないと考えられていた。非晶質薬物は、結晶性の固形の状態の特徴である、分子間格子構造を持たない。驚いたことに、非晶質シクロスポリンがナノ粒状組成物に組み込まれ得ることが発見された。
【0023】
非晶質化合物は結晶性化合物よりも高度なエネルギーレベルを有している。このために、非晶質化合物は一般的に不安定であり、その結果、天然において当該化合物はより低エネルギーの結晶状態に変換されやすい。非晶質化合物が結晶性化合物よりも高度なエネルギーレベルを有するので、薬物は非晶状態にあることが好ましい。非晶状態は結晶状態ほど安定ではなく;それ故に、固形は結晶状態よりも非晶状態においてより可溶性であるだろう。向上した溶解性は素速い、かつ更に完全な溶解をもたらし、そして溶解性が乏しい薬物物質の場合には、向上した生物学的利用能をもたらすだろう。
【0024】
本発明の組成物は、シクロスポリンの表面上に吸着する1又は複数の表面安定剤を有する、ナノ粒状非晶質シクロスポリン、又は非晶質シクロスポリン及び結晶性シクロスポリンの混合物を含んで成る。本明細書で有用な表面安定剤は、ナノ粒状シクロスポリンの表面に物理的に吸着するが、シクロスポリン自身とは化学反応しない。個々に吸着した表面安定剤の分子は、本質的に分子間架橋を欠いている。
【0025】
本発明はまた、非経口注射、経口投与、直腸又は局所投与等のための、集合的に担体と称される、1又は複数の無毒の生理学的に許容される担体、アジュバント、又は媒体と一緒に組成物へと調製されるナノ粒状組成物を含む。本発明は更に、固形の投与製剤及び液体の分散製剤におけるナノ粒状組成物を含む。
【0026】
1.シクロスポリン
当該シクロスポリンは、有用な免疫抑制、抗炎症、及び抗寄生虫活性を有する、環状の非極性オリゴペプチドのクラスを含んで成る。単離された最初のシクロスポリン及び前記クラスの「親」化合物と称されているものは、単純に「シクロスポリン」又は「シクロスポリンA」として引用される天然の菌類代謝物である。
【0027】
シクロスポリンAの発見から、広範な天然シクロスポリンが単離され、そして同定され、そして他の非天然シクロスポリンが合成手段によって、又は改良された培養技術を介して調製されてきた。その様な化合物は当業界で知られており、そして例えば米国特許第5,389,382号及びThe Merck Index (12th ed, 1996)の464−465に記載されている。本明細書で使用する場合、用語シクロスポリンはシクロスポリンA及び他のシクロスポリン、例えばシクロスポリンB〜I及びそれらの合成類似体を含むことを意味する。本明細書で使用する好ましいシクロスポリンはシクロスポリンAである。
【0028】
本発明のシクロスポリン組成物は、天然で部分的に又は主に非晶質である。このことは、前記ナノ粒状組成物を得るために使用される出発シクロスポリン化合物が天然で主に結晶性であっても同様である。用語「非晶質」は、化学業界で認識されている意味を有する用語であり、そして非結晶性の構造、すなわち分子間格子構造を欠いている構造を説明している。前記ナノ粒状組成物が結晶又は非晶状態にあるか否かは、例えばX線粉末回折パターン又は当業者に知られている他の方法によって決定され得る。
【0029】
2.表面安定剤
適当な表面安定剤は、好ましくは既知の有機性及び無機性医薬賦形剤から選択され得る。その様な賦形剤は種々のポリマー、低分子量オリゴマー、天然生成物、及び界面活性剤を含む。好ましい表面安定剤は、非イオン性及びイオン性界面活性剤を含む。2又はそれ以上の表面安定剤が組み合わせて使用され得る。
【0030】
表面安定剤の代表例は、塩化セチルピリジニウム、ゼラチン、カゼイン、レシチン(ホスファチド)、デキストラン、グリセロール、アカシアゴム、コレステロール、トラガカント、ステアリン酸、塩化ベンズアルコニウム、ステアリン酸カルシウム、モノステアリン酸グリセロール、セトステアリルアルコール、セトマクロゴール乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル(例えばマクロゴールエーテル、例えばセトマクロゴール1000)、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル(例えば市販のTween(商標)、例えばTween 20(商標)及びTween 80(商標)(ICI Speciality Chemicals));ポリエチレングリコール(例えば、Carbowax 3350(商標)及び1450(商標)、並びにCarbopol 934(商標)(Union Carbide))、ドデシルトリメチル臭化アンモニウム、ステアリン酸ポリオキシエチレン、コロイド性二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、ヒドロキシプロピルセルロース(例えばHPC,HPC−SL、及びHPC−L)、ヒドロキシプロピルメチルセルロース(HPMC)、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、フタル酸ヒドロキシプロピルメチル−セルロース、非結晶性セルロース、アルミニウムケイ酸マグネシウム、トリエタノールアミン、ポリビニルアルコール(PVA)、ポリビニルピロリドン(PVP)、エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー(チロキサポールとしても知られている)、ポロキサマー(例えば、エチレンオキシド及びプロピレンオキシドのブロックコポリマーである、Pluronic F68(商標)及びF108(商標));ポロキサミン(例えば、エチレンジアミンに対するプロピレンオキシド及びエチレンオキシドの逐次添加から誘導された四官能性ブロックコポリマーである、Poloxamine 908(商標)としても知られているTetronic 908(商標)(BASF Corporation, Parsippany, N.J.));荷電リン脂質、例えばジミリストイルホスファチジルグリセロール、ジオクチルスルホコハク酸塩(DOSS);Tetronic 1508(商標)(T−1508)(BASF Corporation)、スルホコハク酸ナトリウムのジアルキルエステル(例えば、スルホコハク酸ナトリウムのジオクチルエステルである、Acrosol OT(商標)(American Cyanamid));ラウリル硫酸ナトリウムである、Duponol P(商標);スルホン酸アルキルアリールポリエーテルである、Triton X−200(商標)(Rohmand Haas);ステアリン酸スクロースとジステアリン酸スクロースの混合物である、Crodesta F−110(商標)(Croda Inc.);Olin−10G(商標)又はSurfactant 10−G(商標)としても知られている、p−イソノニルフェノキシポリ−(グリシドール)(Olin Chemicals, Stanford, CT);Crodesta SL−40(商標)(Croda, Inc.);C18H37CH2 (CON(CH3 )−CH2 (CHOCH)4(CH2 OH)2 である、SA9OHCO(Eastman Kodak Co.)、構造−(−PEO)−−(−PBO−)−−(−PEO−)−のトリブロックコポリマー(B20−5000として知られている)等を含む。
【0031】
これらの表面安定剤の多くが既知の医薬賦形剤であり、そして具体的に引用によって組み入れられる、the American Pharmaceutical Association及びThe Pharmaceutical Society of Great Britainによって一緒に出版された、Hand book of Excipients(The Pharmaceutical Press, 1986)に詳細に記載されている。当該表面安定剤は市販されており、そして/あるいは当業界で知られている技術によって調製され得る。
【0032】
本発明は、上記安定剤又は本明細書に記載され、若しくは本明細書で引用した文献に記載された他の安定剤が、単独で、互いに組み合わせて、又は他の表面安定剤と一緒に、そのいずれかで使用され得る。
【0033】
3.ナノ粒子の粒度
好ましくは、本発明の組成物は光散乱法又は当業界で認められている他の方法によって測定された、約2000nm未満、約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、又は約50nm未満の有効平均粒度を有するナノ粒子を含む。「約2000nm未満の有効平均粒度」によって、少なくとも50%の薬物粒子が、光散乱法又は他の常用の技術によって測定された場合に、約2000nm未満の重量平均粒度を有することが意味される。好ましくは、少なくとも70%の薬物粒子が約2000nm未満の平均粒度を有し、更に好ましくは少なくとも90%の薬物粒子が約2000nm未満の平均粒度を有し、そして更に好ましくは少なくとも約95%の粒子が約2000nm未満の重量平均粒度を有する。
【0034】
4.シクロスポリン及び表面安定剤の濃度
表面安定剤に対するシクロスポリンの好ましい重量比は約10:1〜約1.5:1である。液体分散により、好ましい薬物含量は重量当たり約50%〜約2%である。
【0035】
B.ナノ粒状製剤の製造方法
ナノ粒状組成物を製造する例示的な方法は、 '684号特許に記載されている。本発明の最適な有効平均粒度は粒度の低下過程を制御することによって、例えばミル粉砕の時間及び加えられる表面安定剤の量を制御することによって得られ得る。粒子の成長及び粒子の凝集も、より冷たい温度のもとで前記組成物をミル粉砕し、そしてより冷たい温度で最終組成物を保存することによっても最小化され得る。
【0036】
ナノ粒状組成物を得るためのミル粉砕は、シクロスポリン粒子を液体分散媒中で分散し、続いて、シクロスポリンの粒度を所望の有効平均粒度に縮小させるための粉砕媒体の存在下で機械的手段を適用することを含んで成る。シクロスポリン粒子は、1又は複数の表面安定剤の存在下でサイズが縮小され得る。あるいは、シクロスポリン粒子は磨砕後に1又は複数の表面安定剤と接触され得る。他の化合物、例えば希釈剤が、サイズの縮小過程の間にシクロスポリン/表面安定剤組成物に加えられ得る。分散液は連続的に又はバッチモードで製造され得る。生じたナノ粒状シクロスポリン分散液は、固形又は液体の投与製剤において利用され得る。例示的な有用なミルは、低エネルギーミル、例えばローラーミル又はボールミル、並びに高エネルギーミル、例えばDynoミル、Netzschミル、DCミル及びPlanetaryミルを含む。
【0037】
出発材料のシクロスポリン組成物は主に結晶であっても、主に非晶質であっても、又はそれらの混合物であってもよい。生じたシクロスポリン組成物は主に非晶質である。
【0038】
固形の投与製剤は、粉砕後に、ナノ粒状非晶質シクロスポリン、又は非晶質シクロスポリン及び結晶性シクロスポリンの混合物を乾燥させることによって調製され得る。好ましい乾燥方法はスプレー乾燥である。スプレー乾燥工程は、シクロスポリンをナノ粒子に変換するために使用されるミル粉砕工程後に、ナノ粒状粉末を得るために使用される。その様なナノ粒状粉末は経口投与のための錠剤へと調製され得る。
【0039】
C.本発明のナノ粒状組成物の使用方法
本発明のナノ粒状組成物は経口、経直腸、非経口(静脈内、筋肉内、又は皮下)、大槽内、腔内、腹腔内から、局所的に(粉末、軟膏又は点滴薬)、又は口腔内若しくは鼻内スプレーとして、そのいずれかでヒト及び動物に投与され得る。
【0040】
非経口注射に適した組成物は、生理学的に許容される滅菌水溶液又は非水溶液、分散液、懸濁液又は乳濁液及び滅菌注射溶液又は分散液への再構成のための滅菌粉末を含んで成ることがある。適当な水性及び非水性担体、希釈剤、溶媒、又は媒体の例は、水、エタノール、ポリオール(プロピレングリコール、ポリエチレングリコール、グリセロール等)、適当なそれらの混合物、植物油(例えばオリーブ油)及び注射用有機エステル、例えばオレイン酸エチルを含む。適切な流度が、例えばコーティング、例えばレシチンの使用によって、分散液の場合には必要な粒度の維持によって、そして界面活性剤の使用によって維持され得る。
【0041】
当該ナノ粒状組成物は更に、アジュバント、例えば防腐剤、湿潤剤、乳化剤、及び分散剤を含むことがある。微生物の増殖の予防は、種々の抗菌剤及び抗真菌剤、例えばパラベン、クロロブタノール、フェノール、ソルビン酸等によって保証され得る。等張性の物質、例えば糖類、塩化ナトリウム等を含むことが望ましいこともある。注射用医薬形態の吸収の延長は、吸収を遅らせる物質、例えばモノステアリン酸アルミニウム及びゼラチンの使用によってもたらされることがある。
【0042】
経口投与のための固形の剤形は、カプセル、錠剤、丸薬、粉末、及び顆粒を含む。その様な固形の剤形において、活性化合物は少なくとも1つの以下のもの:(a)1又は複数の不活性な賦形剤(又は担体)、例えばリン酸二カルシウム;(b)充填剤又は増量剤、例えばデンプン、ラクトース、スクロース、グルコース、マンニトール、及びケイ酸;(c)結合剤、例えばカルボキシメチルセルロース、アルギン酸塩(alignate)、ゼラチン、ポリビニルピロリドン、スクロース及びアカシア;(d)湿潤剤、例えばグリセロール;(e)崩壊剤、例えば寒天、炭酸カルシウム、ジャガイモ又はタピオカデンプン、アルギン酸、ある複合体のケイ酸塩、及び炭酸ナトリウム;(f)溶液凝固遅延剤、例えばパラフィン;(g)吸収促進剤、例えば第4級アンモニウム化合物;(h)加湿剤、例えばセチルアルコール及びモノステアリン酸グリセロール;(i)吸着剤、例えばカオリン及びベントナイト;並びに(j)潤滑剤、例えばタルク、ステアリン酸カルシウム、ステアリン酸マグネシウム、固形のポリエチレングリコール、ラウリル硫酸ナトリウム、又はそれらの混合物と混合される。カプセル、錠剤、及び丸剤に関して、当該剤形は更に緩衝剤を含んで成ることもある。
【0043】
経口投与のための液体の剤形は、医薬として許容される乳濁液、溶液、懸濁液、シロップ、及びエリキシルを含む。活性化合物に加えて、当該液体剤形は、当業界で一般的に使用される不活性な希釈剤、例えば水又は他の溶媒、溶解剤、及び乳化剤を含んで成ることもある。例示的な乳化剤はエチルアルコール、イソプロピルアルコール、炭酸エチル、酢酸エチル、ベンジルアルコール、安息香酸ベンジル、プロピレングリコール、1,3−ブチレングリコール、ジメチルホルムアミド、油、例えば綿実油、落花生油、トウモロコシ胚油、オリーブ油、ヒマシ油、及びゴマ油、グリセロール、テトラヒドロフラニルアルコール、ポリエチレングリコール、ソルビタン脂肪酸エステル、又はこれらの物質の混合物等を含んで成ることもある。
【0044】
この様な不活性な希釈剤の他に、当該組成物はアジュバント、例えば加湿剤、乳化剤及び懸濁剤、甘味剤、香料添加剤、及び香料を含むこともある。
【0045】
本発明のナノ粒状組成物における活性成分の正味の用量レベルは、特定の組成物及び投与方法にとって所望の治療的応答を得るために有効な活性成分の量を得るために変更され得る。従って、選択される用量レベルは所望の治療効果、投与経路、所望の治療期間、及び他の要因に依存する。
【0046】
単回又は分割量で宿主に投与される本発明の化合物の合計の一日量は、様々な要因、例えば体重、身体全体の健康、性別、食生活、投与の時間及び経路、吸収及び排出の速度、他の薬物との組み合わせ、並びに処置される特定の症状の重症度に依存して変更し得る。例えば、推奨されるNEORAL(商標)の一日量は、腎移植の患者の場合の9±3mg/kg/日から乾癬及びリウマチ様関節炎の場合の2.5mg/kg/日に及び、一方、移植患者の場合に提案される、SANDIMMUNE(商標)の初回の経口用量は10〜18mg/kg/日である。
【0047】
以下の例は本発明を例示するために提示する。しかしながら、本発明はこれらの例に記載されている具体的な条件又は詳細に限定されるべきではないと考えられるはずである。明細書を通じて、公然と入手可能な文書、例えば米国特許に対する任意の、かつ全ての引用文献が、引用によって本特許出願に具体的に組み入れられる。
【実施例】
【0048】
例1
この例の目的は、ナノ粒状の、主に非晶質のシクロスポリン製剤を調製することにあった。
【0049】
表1に記載のナノ粒状非晶質シクロスポリン製剤は、高エネルギー媒体ミル粉砕技術を用いて得られた。全てのミル粉砕実験が、0.15Lの試験槽を備え付けたDYNO−MILL(商標)KDL型(Willy Bachofen AG, Basel, Switzerland)を利用した。シクロスポリンはNorth China Pharmaceutical Corporation (Shijiazhuang, China)によって製造された。粒度分布は、Horiba LA−910光散乱粒度解析機(Horiba Instruments, Irviae, CA)を用いて決定した。
【0050】
(1)10%シクロスポリン、6%F108、0.1%SLS
ナノ粒状組成物(1)は、5.1gのPluronic(商標)F108及び0.085gのラウリル硫酸ナトリウム(SLS)を71.32gの脱イオン水に溶解させることによって調製した。安定剤溶液は、8.5gのシクロスポリン薬物物質及び500μmのポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填された。製剤を6時間処理し、続いて回収し、そして濾過した。最終的な粒度分布は平均=275nm、90%<420nmであった。
【0051】
(2)5%シクロスポリン、1.5%HPC−SL、0.15%SLS
ナノ粒状組成物(2)は、1.28gのHPC−SL(Nippon Soda)及び0.085gのラウリル硫酸ナトリウム(SLS)を、79.38gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を4時間処理した。続いて、SLSの濃度を0.15%に高めた。
分散液を更に0.5時間ミル粉砕し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=268nm、90%<380nmであった。
【0052】
(3)5%シクロスポリン、1%チロキサポール
ナノ粒状組成物(3)は、0.85gのチロキサポール(Nycomed)を、79.9gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を3時間処理し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=213nm、90%<304nmであった。
【0053】
(4)5%シクロスポリン、2%B20−5000
ナノ粒状組成物(4)は、0.85gのB20−5000(Dow Chemical)を、79.9gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を4.5時間処理した。そのとき、更に0.85gのB20−5000を加えた。分散液を更に2.25時間ミル粉砕し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=292nm、90%<411nmであった。
【0054】
(5)5%シクロスポリン、2%F108、1%チロキサポール
ナノ粒状組成物(5)は、1.7gのPluronic(商標)F108(BASF)及び0.85gのチロキサポール(Nycomed)を、78.2gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を7時間処理し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=192nm、90%<300nm(Horiba LA-910による)であった。
【0055】
(6)5%シクロスポリン、0.5%SLS
ナノ粒状組成物(6)は、0.425gのラウリル硫酸ナトリウム(Spectrum)を、80.33gの脱イオン水に溶解することによって調製した。安定剤溶液は、4.25gのシクロスポリン薬物物質及び500μmポリマーアトリション媒体と一緒に、ミル粉砕試験槽に充填した。製剤を3時間処理し、そして次に濾過によってアトリション媒体から単離した。最終的な粒度分布は、平均=182nm、90%<265nmであった。
【0056】
これらの例において使用される薬物物質の出発材料は、X線粉末回折によって決定した場合主に結晶であり、この結果を図1に示す。2つの代表的な実験の後、ミル粉砕したコロイド分散液もX線粉末回折によって解析した。ミル粉砕の完了により、各分散液の一部を遠心し、そして上清の液体をデカントした。固形を水で洗浄し、そして複数回再遠心してから乾燥させた。ミル粉砕した材料のX線粉末回折は、はっきりとした吸収線の不在を示しており、これは当該材料が、図2及び3に示す様に非晶質であることを示唆した。図2は、表面安定剤としてPluronic(商標)F108を有する、ミル粉砕したシクロスポリンのX線粉末回折の結果を示し、そして図3は、表面安定剤としてHPC−SLを有するミル粉砕したシクロスポリンのX線粉末回折の結果を示す。前記コロイド分散液は、非晶質の薬物物質の出発材料から調製され得る。
【表1】

【0057】
前記結果は、ナノ粒状非晶質シクロスポリン製剤が、種々の表面安定剤を用いて、種々の安定剤の濃度を用いて、そして種々のシクロスポリンの濃度を用いて、結晶性シクロスポリンの出発材料から製造され得ることを示している。
【0058】
例2
この例の目的は、本発明に従うナノ粒状シクロスポリン製剤と、常用のシクロスポリン製剤、NEORAL(商標)の薬理動態を比較することにあった。NEORAL(商標)に存在するシクロスポリンは、アルコール及び複数の追加の賦形剤に溶解する。
【0059】
比較研究は、ナノ粒状非晶質シクロスポリンA組成物とNEORAL(商標)の間で行った。前記ナノ粒状組成物は、10%w/wシクロスポリン、6%w/w Pluronic(商標)F108、及び0.1%w/wラウリル硫酸ナトリウム(SLS)から構成した。当該組成物は、90gのPluronic(商標)F108及び1.5gのSLSを1258.5gの、USPの注射用滅菌水に溶解し、そして次に150gのシクロスポリンを加えてプレミックスを形成させて調製した。DYNO−MILL(商標)KDL型に、500μmのポリマーアトリション媒体を充填した600cc(600ml)の再循環槽を取り付けた。スラリーを12.5時間処理し、そして次に20μmのカプセルフィルターを介して濾過して、165nmの平均粒度を有し、そして90%<229nmのシクロスポリンのナノ粒状コロイド分散液を生成せしめた。粒度分布は、Horiba LA−910の粒度解析器で決定した。
【0060】
表2及び3は、24時間に及んで2つの群の3匹のイヌ(群1及び2)にそれぞれ投与された、単回の100mg量のナノ粒状非晶質シクロスポリンA組成物及びNEORAL(商標)に関する濃度曲線下面積(AUC)の要約を示す。より大きなAUCはより大きな生物学的利用能に対応する。
【0061】
個々の動物の異なる吸収速度に起因する、観察されたAUC値の何らかの差異を最小化するために、ナノ粒状非晶質シクロスポリンA組成物及びNEORAL(商標)についてのAUC測定値は、同一の動物に対する投与から8日後に測定された。従って、ナノ粒状非晶質シクロスポリンA組成物についてのAUC値は、表2に示した様に群1のイヌの場合、1日目から定期的増大が、そして群2のイヌの場合、8日目から定期的増大が測定された。更に、NEORAL(商標)の投与についてのAUC値は、表3に示す様に群2のイヌの場合、1日目からの定期的増大が、そして群1のイヌの場合、8日目から定期的増大が測定された。
【表2】

【表3】

【0062】
前記結果は、群1のイヌのナノ粒状非晶質シクロスポリンAの吸収が、AUC値4964.2、4593.2、そして4473.3と劇的に一致していたことを示す。対照的に、同一のイヌの群である、群1の場合のNEORAL(商標)の吸収は、AUC値6307.0、3355.3、そして5177.1ng/mL/時間と広く変化した。群2のイヌの場合の結果は、比較的一致しているナノ粒状非晶質シクロスポリンAのAUC値4155.9、2833.8、そして6387.9ng/mL/時間と同様であった。対照的に、NEORAL(商標)の投与についての群2のイヌの場合のAUC値は6457.2、8982.8、そして12600.6ng/mL/時間であった。吸収の幅広い変化が非常に不所望であるのは、そのことが投与製剤を難しくし、そして前記薬物の適切な血液レベルを保証するために、患者の一定の監視を必要とすることをもたらし得るためである。各剤形についてのAUC値の相対標準偏差(RSD)は、対象者間の吸収変化性の定量的測定値である。ナノ粒状シクロスポリンを受けたイヌの間の、AUC値のRSDは25.4%であり、一方、NEORAL(商標)を投与した場合のAUC値のRSDは45.4%であった。従って、対象者間の変化性は、NEORAL(商標)の剤形の場合、ナノ粒状製剤の場合よりも1.8倍大きかった。
【表4】

【0063】
ナノ粒状非晶質シクロスポリン製剤と比較した場合のNEORAL(商標)についての吸収の変化性も、以下の表5に示す様に、同じ単回の100mgの用量についての各製剤の吸収範囲の比較によって示される。NEORAL(商標)は、9245ng/mL/時間に及ぶAUCにおける対象者間の吸収の変化性を有するが、ナノ粒状のAUCの変化性(最小から最大まで)はわずかに3354ng/mL/時間である。吸収の変化性は、治療量以下の薬物の血漿濃度、又は反対に、当該薬物物質が毒性の効果を発揮する、過剰に高い血漿濃度を導くことがある。その様な変化性は非常に不所望なことであり、特に、狭い有効量範囲を有する薬物、例えばシクロスポリンの場合に望ましくない。
【表5】

【0064】
更に、NEORAL(商標)とナノ粒状非晶質シクロスポリン製剤の間の吸収の不一致は、投薬後の最初の0.50時間における劇的な差異によって証明される。ナノ粒状シクロスポリンを受けたイヌの間で、6匹全ての対象者が、投与から15分後に検出可能な血漿濃度(405.27〜623.23ng/mL/時間に及ぶ)を有していた(表2)。NEORAL(商標)を与えた場合、6匹のうち5匹の対象者が、投与から15分後に検出可能な血漿濃度(66.50〜393.04ng/mL/時間に及ぶ)を有していたが、1匹のイヌ(番号408/f/1)が、前記薬物を受けてから30分経過しても検出可能な血液レベルを有していなかった(表3)。
【0065】
前記結果はまた、前記ナノ粒状非晶質シクロスポリン製剤が、従来のNEORAL(商標)製剤よりも更に素速く吸収されることを示している。表2に見られる様に、イヌがナノ粒状シクロスポリンを投与されると、ピークの血漿濃度に約1時間ないしそれ以下で全て達した。NEORAL(商標)を与えると、ピークの血漿レベルに、6匹のうち5匹のイヌが約1.5時間で達し、そしてイヌ番号408/f/1の場合約2時間で達した(表3)。
【0066】
これらの結果は、異なる対象者間での、従来のシクロスポリン製剤、例えばNEORAL(商標)以上の本発明の組成物の生物学的利用能の優れた一貫性及び更に素速い吸収を示している。
【0067】
当業者にとって、種々の修飾及び変更が、本発明の精神又は範囲を逸脱することなく、本発明の方法及び組成物において行われ得ることは明らかである。従って、本発明は、特許請求の範囲及びそれらの同等物に含まれる様に提供される本発明の修飾及び変更を網羅することが意図されている。以下の例は更に本発明を例示しており、そして本明細書及び特許請求の範囲を限定するものとしてみなされるべきではない。
【特許請求の範囲】
【請求項1】
(a)非晶質シクロスポリン粒子;及び
(b)前記シクロスポリン粒子の表面上に吸着された、少なくとも1つの非架橋型表面安定剤、
を含んで成り、約2000nm未満の有効平均粒度を有するナノ粒状組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が、約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物。
【請求項2】
前記ナノ粒状組成物の有効平均粒度が約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、そして約50nm未満から成る群から選択される、請求項1に記載の組成物。
【請求項3】
固形の投与製剤である、請求項1に記載の組成物。
【請求項4】
表面安定剤に対して、少なくとも2:1の比で薬物を有する、請求項3に記載の組成物。
【請求項5】
液体分散製剤である、請求項1に記載の組成物。
【請求項6】
液体分散の固形分が約40%〜約5%(w/w)である、請求項5に記載の液体分散。
【請求項7】
注射製剤である、請求項5に記載の組成物。
【請求項8】
前記表面安定剤が塩化セチルピリジニウム、ゼラチン、カゼイン、ホスファチド、デキストラン、グリセロール、アカシアゴム、コレステロール、トラガカント、ステアリン酸、塩化ベンズアルコニウム、ステアリン酸カルシウム、モノステアリン酸グリセロール、セトステアリルアルコール、セトマクロゴール乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル、ポリエチレングリコール、ドデシルトリメチル臭化アンモニウム、ステアリン酸ポリオキシエチレン、コロイド性二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、フタル酸ヒドロキシプロピルメチル−セルロース、非結晶性セルロース、アルミニウムケイ酸マグネシウム、トリエタノールアミン、ポリビニルアルコール、ポリビニルピロリドン、エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー、ポロキサマー、ポロキサミン、ジミリストイルホスファチジルグリセロール、ジオクチルスルホコハク酸塩、スルホコハク酸ナトリウムのジアルキルエステル、ラウリル硫酸ナトリウム、スルホン酸アルキルアリールポリエーテル、ステアリン酸スクロースとジステアリン酸スクロースの混合物、p−イソノニルフェノキシポリ−(グリシドール)、並びに構造−(−PEO)−−(−PBO−)−−(−PEO−)−のトリブロックコポリマーから成る群から選択される、請求項1に記載の組成物。
【請求項9】
前記表面安定剤がエチレンオキシド及びプロピレンオキシドのブロックコポリマー、(2)構造−(−PEO)−−(−PBO−)−−(−PEO−)を有し、そして約5000の分子量を有するトリブロックコポリマー、(3)エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー、(4)ヒドロキシプロピルセルロース、及び(5)ラウリル硫酸ナトリウム、から成る群から選択される、請求項8に記載の組成物。
【請求項10】
請求項1に記載の非晶質シクロスポリン組成物及び医薬として許容される賦形剤を含んで成る医薬組成物。
【請求項11】
(a)非晶質シクロスポリン粒子と結晶性シクロスポリン粒子の混合物;並びに
(b)前記シクロスポリン粒子の表面上に吸収された、少なくとも1つの非架橋型表面安定剤、
を含んで成り、約2000nm未満の有効平均粒度を有するナノ粒状組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が、約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物。
【請求項12】
前記ナノ粒状組成物の有効平均粒度が約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、そして約50nm未満から成る群から選択される、請求項11に記載の組成物。
【請求項13】
固形の投与製剤である、請求項11に記載の組成物。
【請求項14】
表面安定剤に対して、少なくとも2:1の比で薬物を有する、請求項13に記載の組成物。
【請求項15】
液体分散製剤である、請求項11に記載の組成物。
【請求項16】
液体分散の固形分が約40%〜約5%(w/w)である、請求項15に記載の液体分散。
【請求項17】
注射製剤である、請求項11に記載の組成物。
【請求項18】
前記表面安定剤が塩化セチルピリジニウム、ゼラチン、カゼイン、ホスファチド、デキストラン、グリセロール、アカシアゴム、コレステロール、トラガカント、ステアリン酸、塩化ベンズアルコニウム、ステアリン酸カルシウム、モノステアリン酸グリセロール、セトステアリルアルコール、セトマクロゴール乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル、ポリエチレングリコール、ドデシルトリメチル臭化アンモニウム、ステアリン酸ポリオキシエチレン、コロイド性二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、フタル酸ヒドロキシプロピルメチル−セルロース、非結晶性セルロース、アルミニウムケイ酸マグネシウム、トリエタノールアミン、ポリビニルアルコール、ポリビニルピロリドン、エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー、ポロキサマー、ポロキサミン、ジミリストイルホスファチジルグリセロール、ジオクチルスルホコハク酸塩、スルホコハク酸ナトリウムのジアルキルエステル、ラウリル硫酸ナトリウム、スルホン酸アルキルアリールポリエーテル、ステアリン酸スクロースとジステアリン酸スクロースの混合物、p−イソノニルフェノキシポリ−(グリシドール)、並びに構造−(−PEO)−−(−PBO−)−−(−PEO−)−のトリブロックコポリマーから成る群から選択される、請求項1に記載の組成物。
【請求項19】
前記表面安定剤が(1)エチレンオキシド及びプロピレンオキシドのブロックコポリマー、(2)構造−(−PEO)−−(−PBO−)−−(−PEO−)を有し、そして約5000の分子量を有するトリブロックコポリマー、(3)エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー、(4)ヒドロキシプロピルセルロース、及び(5)ラウリル硫酸ナトリウム、から成る群から選択される、請求項18に記載の組成物。
【請求項20】
請求項11に記載の非晶質シクロスポリン組成物及び医薬として許容される賦形剤を含んで成る医薬組成物。
【請求項21】
(a)非晶質シクロスポリン粒子;及び
(b)前記シクロスポリン粒子の表面上に吸収された、少なくとも1つの非架橋型表面安定剤を含んで成り、約1000nm未満の有効平均粒度を有するナノ粒状組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物を製造する方法であって、約2000nm未満の有効平均粒度を有し、そして約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の薬物:表面安定剤の比を有するナノ粒状非晶質シクロスポリン組成物を提供するのに十分な時間及び条件のもとで、シクロスポリンを少なくとも1つの非架橋型安定剤と接触させることを含んで成る方法。
【請求項22】
前記ナノ粒状組成物の有効平均粒度が約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、そして約50nm未満から成る群から選択される請求項21に記載の方法。
【請求項23】
前記組成物がミル粉砕によって得られる、請求項21に記載の方法。
【請求項24】
前記ミル粉砕が高エネルギーミル粉砕である、請求項23に記載の方法。
【請求項25】
(a)非晶質シクロスポリン粒子;及び
(b)前記シクロスポリン粒子の表面上に吸収された、少なくとも1つの非架橋型表面安定剤、
を含んで成り、約2000nm未満の有効平均粒度を有するナノ粒状非晶質シクロスポリン組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物の使用方法であって、治療に有効な量のナノ粒状組成物を、必要としている哺乳類に投与することを含んで成る方法。
【請求項26】
前記ナノ粒状組成物の有効平均粒度が、約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、そして約50nm未満から成る群から選択される、請求項25に記載の方法。
【請求項1】
(a)非晶質シクロスポリン粒子;及び
(b)前記シクロスポリン粒子の表面上に吸着された、少なくとも1つの非架橋型表面安定剤、
を含んで成り、約2000nm未満の有効平均粒度を有するナノ粒状組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が、約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物。
【請求項2】
前記ナノ粒状組成物の有効平均粒度が約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、そして約50nm未満から成る群から選択される、請求項1に記載の組成物。
【請求項3】
固形の投与製剤である、請求項1に記載の組成物。
【請求項4】
表面安定剤に対して、少なくとも2:1の比で薬物を有する、請求項3に記載の組成物。
【請求項5】
液体分散製剤である、請求項1に記載の組成物。
【請求項6】
液体分散の固形分が約40%〜約5%(w/w)である、請求項5に記載の液体分散。
【請求項7】
注射製剤である、請求項5に記載の組成物。
【請求項8】
前記表面安定剤が塩化セチルピリジニウム、ゼラチン、カゼイン、ホスファチド、デキストラン、グリセロール、アカシアゴム、コレステロール、トラガカント、ステアリン酸、塩化ベンズアルコニウム、ステアリン酸カルシウム、モノステアリン酸グリセロール、セトステアリルアルコール、セトマクロゴール乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル、ポリエチレングリコール、ドデシルトリメチル臭化アンモニウム、ステアリン酸ポリオキシエチレン、コロイド性二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、フタル酸ヒドロキシプロピルメチル−セルロース、非結晶性セルロース、アルミニウムケイ酸マグネシウム、トリエタノールアミン、ポリビニルアルコール、ポリビニルピロリドン、エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー、ポロキサマー、ポロキサミン、ジミリストイルホスファチジルグリセロール、ジオクチルスルホコハク酸塩、スルホコハク酸ナトリウムのジアルキルエステル、ラウリル硫酸ナトリウム、スルホン酸アルキルアリールポリエーテル、ステアリン酸スクロースとジステアリン酸スクロースの混合物、p−イソノニルフェノキシポリ−(グリシドール)、並びに構造−(−PEO)−−(−PBO−)−−(−PEO−)−のトリブロックコポリマーから成る群から選択される、請求項1に記載の組成物。
【請求項9】
前記表面安定剤がエチレンオキシド及びプロピレンオキシドのブロックコポリマー、(2)構造−(−PEO)−−(−PBO−)−−(−PEO−)を有し、そして約5000の分子量を有するトリブロックコポリマー、(3)エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー、(4)ヒドロキシプロピルセルロース、及び(5)ラウリル硫酸ナトリウム、から成る群から選択される、請求項8に記載の組成物。
【請求項10】
請求項1に記載の非晶質シクロスポリン組成物及び医薬として許容される賦形剤を含んで成る医薬組成物。
【請求項11】
(a)非晶質シクロスポリン粒子と結晶性シクロスポリン粒子の混合物;並びに
(b)前記シクロスポリン粒子の表面上に吸収された、少なくとも1つの非架橋型表面安定剤、
を含んで成り、約2000nm未満の有効平均粒度を有するナノ粒状組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が、約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物。
【請求項12】
前記ナノ粒状組成物の有効平均粒度が約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、そして約50nm未満から成る群から選択される、請求項11に記載の組成物。
【請求項13】
固形の投与製剤である、請求項11に記載の組成物。
【請求項14】
表面安定剤に対して、少なくとも2:1の比で薬物を有する、請求項13に記載の組成物。
【請求項15】
液体分散製剤である、請求項11に記載の組成物。
【請求項16】
液体分散の固形分が約40%〜約5%(w/w)である、請求項15に記載の液体分散。
【請求項17】
注射製剤である、請求項11に記載の組成物。
【請求項18】
前記表面安定剤が塩化セチルピリジニウム、ゼラチン、カゼイン、ホスファチド、デキストラン、グリセロール、アカシアゴム、コレステロール、トラガカント、ステアリン酸、塩化ベンズアルコニウム、ステアリン酸カルシウム、モノステアリン酸グリセロール、セトステアリルアルコール、セトマクロゴール乳化ワックス、ソルビタンエステル、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンヒマシ油誘導体、ポリオキシエチレンソルビタン脂肪酸エステル、ポリエチレングリコール、ドデシルトリメチル臭化アンモニウム、ステアリン酸ポリオキシエチレン、コロイド性二酸化ケイ素、リン酸塩、ドデシル硫酸ナトリウム、カルボキシメチルセルロースカルシウム、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシプロピルセルロース、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシエチルセルロース、フタル酸ヒドロキシプロピルメチル−セルロース、非結晶性セルロース、アルミニウムケイ酸マグネシウム、トリエタノールアミン、ポリビニルアルコール、ポリビニルピロリドン、エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー、ポロキサマー、ポロキサミン、ジミリストイルホスファチジルグリセロール、ジオクチルスルホコハク酸塩、スルホコハク酸ナトリウムのジアルキルエステル、ラウリル硫酸ナトリウム、スルホン酸アルキルアリールポリエーテル、ステアリン酸スクロースとジステアリン酸スクロースの混合物、p−イソノニルフェノキシポリ−(グリシドール)、並びに構造−(−PEO)−−(−PBO−)−−(−PEO−)−のトリブロックコポリマーから成る群から選択される、請求項1に記載の組成物。
【請求項19】
前記表面安定剤が(1)エチレンオキシド及びプロピレンオキシドのブロックコポリマー、(2)構造−(−PEO)−−(−PBO−)−−(−PEO−)を有し、そして約5000の分子量を有するトリブロックコポリマー、(3)エチレンオキシド及びホルムアルデヒドを有する4−(1,1,3,3−テトラメチルブチル)−フェノールポリマー、(4)ヒドロキシプロピルセルロース、及び(5)ラウリル硫酸ナトリウム、から成る群から選択される、請求項18に記載の組成物。
【請求項20】
請求項11に記載の非晶質シクロスポリン組成物及び医薬として許容される賦形剤を含んで成る医薬組成物。
【請求項21】
(a)非晶質シクロスポリン粒子;及び
(b)前記シクロスポリン粒子の表面上に吸収された、少なくとも1つの非架橋型表面安定剤を含んで成り、約1000nm未満の有効平均粒度を有するナノ粒状組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物を製造する方法であって、約2000nm未満の有効平均粒度を有し、そして約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の薬物:表面安定剤の比を有するナノ粒状非晶質シクロスポリン組成物を提供するのに十分な時間及び条件のもとで、シクロスポリンを少なくとも1つの非架橋型安定剤と接触させることを含んで成る方法。
【請求項22】
前記ナノ粒状組成物の有効平均粒度が約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、そして約50nm未満から成る群から選択される請求項21に記載の方法。
【請求項23】
前記組成物がミル粉砕によって得られる、請求項21に記載の方法。
【請求項24】
前記ミル粉砕が高エネルギーミル粉砕である、請求項23に記載の方法。
【請求項25】
(a)非晶質シクロスポリン粒子;及び
(b)前記シクロスポリン粒子の表面上に吸収された、少なくとも1つの非架橋型表面安定剤、
を含んで成り、約2000nm未満の有効平均粒度を有するナノ粒状非晶質シクロスポリン組成物であって、シクロスポリン及び少なくとも1つの表面安定剤が約10:1〜約1.5:1(w/w)(シクロスポリン:表面安定剤)の比で存在する組成物の使用方法であって、治療に有効な量のナノ粒状組成物を、必要としている哺乳類に投与することを含んで成る方法。
【請求項26】
前記ナノ粒状組成物の有効平均粒度が、約1500nm未満、約1000nm未満、約800nm未満、約700nm未満、約600nm未満、約500nm未満、約400nm未満、約300nm未満、約200nm未満、約100nm未満、そして約50nm未満から成る群から選択される、請求項25に記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2011−6450(P2011−6450A)
【公開日】平成23年1月13日(2011.1.13)
【国際特許分類】
【出願番号】特願2010−186933(P2010−186933)
【出願日】平成22年8月24日(2010.8.24)
【分割の表示】特願2001−521335(P2001−521335)の分割
【原出願日】平成12年9月7日(2000.9.7)
【出願人】(500370883)エラン ファーマ インターナショナル,リミティド (45)
【Fターム(参考)】
【公開日】平成23年1月13日(2011.1.13)
【国際特許分類】
【出願日】平成22年8月24日(2010.8.24)
【分割の表示】特願2001−521335(P2001−521335)の分割
【原出願日】平成12年9月7日(2000.9.7)
【出願人】(500370883)エラン ファーマ インターナショナル,リミティド (45)
【Fターム(参考)】
[ Back to top ]

