非水電解液
【課題】リチウムイオン電池に適用した際、繰り返しの充電/放電サイクルに供した際にも、該リチウムイオン電池の寿命を、より長期化することができる非水電解液を提供する。
【解決手段】非水溶媒と、上記式(1)で表されるリチウム塩と、上記式(2)で表される化合物のうち少なくとも一つの第1の添加剤と、上記式(3)で表される化合物のうち少なくとも一つの第2の添加剤とを組み合わせて、非水電解液を作成する。
【解決手段】非水溶媒と、上記式(1)で表されるリチウム塩と、上記式(2)で表される化合物のうち少なくとも一つの第1の添加剤と、上記式(3)で表される化合物のうち少なくとも一つの第2の添加剤とを組み合わせて、非水電解液を作成する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、非水電解液に関する。本発明の非水電解液は、リチウム二次電池に、特に好適に使用可能である。
【背景技術】
【0002】
一次電池および二次電池は、1つまたは複数の電気化学セルを含む。多くの電池は、リチウムの高い還元電位、リチウム元素の低い分子量および高い出力密度のためリチウムセルを含む。二次電池では、リチウムカチオンの小ささおよび高い移動度が、迅速な再充電の可能性を与える。これらの利点により、リチウム二次電池は、携帯電話およびラップトップコンピュータなどの携帯エレクトロニクス装置に理想的である。最近、ハイブリッド電気自動車市場に使用するための用途を有する、より大型なリチウム電池が開発されている。
【0003】
リチウム二次電池は、リチウム元素の高い還元電位および低分子量のため、既存の一次および二次電池技術に優って、出力密度の劇的な向上をもたらす。リチウム二次電池は、金属リチウムを負極として含む電池であり、リチウムイオン電池としても知られているリチウムイオンホスト材料を負極として含む電池もある。二次電池とは、充放電の複数のサイクルを考慮した電池である。リチウムカチオンは小さく移動度が高いので、急速な再充電が可能となる。これらの利点により、リチウムイオン電池は、例えば携帯電話およびラップトップコンピュータなどの携帯型エレクトロニクス装置に理想的である。最近、より大型のリチウムイオン電池が開発され、ハイブリット車市場での利用に用途がある。
セルの充放電の可逆性に対する主な問題は、変化する条件下での電解質溶液成分(塩および溶媒)へのそれらの反応性であった。従来、電解質塩および溶媒は全て、少なくとも最初の充電工程の間負極でいくらか還元されることが観察されてきた。この還元は、安定で伝導性の不活性化層または固体電解質インターフェースすなわちSEI層とも呼ばれるフィルムを形成することがあるが、あるいは還元が充電/放電サイクルとともに継続し、最終的に負極での可逆容量が無くなることもある。
【0004】
更に、上記したハイブリッド電気自動車への応用においては、リチウムイオン電池の寿命を出来る限り長期化することが、特に問題であった。これには、該電池内における、「望ましくない」反応を抑制することが重要であった。
【0005】
上述したように、従来のリチウムイオン電池においては、充電/放電サイクルを繰り返した際に、その寿命が短くなる傾向があった。
【0006】
【特許文献1】特開2007−87938号公報
【特許文献2】特開2007−202745号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明の目的は、上記した従来技術の欠点を解消し、リチウムイオン電池に適用した際、繰り返しの充電/放電サイクルに供した際にも、該リチウムイオン電池の寿命を、より長期化することができる非水電解液を提供することにある。
本発明の他の目的は、繰り返しの充電/放電サイクルに供した際にも、より長い寿命を実現することができるリチウムイオン電池を提供することにある。
【課題を解決するための手段】
【0008】
本発明者は鋭意研究の結果、特定構造を有するリチウム塩に、更に特定構造を有する2種の添加剤を組み合わせることが、上記目的の達成のために極めて効果的なことを見出した。
【0009】
本発明の非水電解液は上記知見に基づくものであり、より詳しくは、非水溶媒と、
下記式(1)
【0010】
【化1】

(式中、xは0から3の整数を示す)
【0011】
で表されるリチウム塩と、
【0012】
下記式(2)
【0013】
【化2】

(式中、XおよびYは、独立に、H、CH3、ビニル基またはFを示す)
【0014】
で表される化合物のうち少なくとも一つの第1の添加剤と、
下記式(3)
【0015】
【化3】

(式中、YはOを示し、XはHまたはOHを示し、nは0〜5の整数を示す)
【0016】
で表される化合物のうち少なくとも一つの第2の添加剤とを含むことを特徴とするものである。
【発明の効果】
【0017】
上述したように本発明によれば、リチウムイオン電池に適用した際、繰り返しの充電/放電サイクルに供した際にも、該リチウムイオン電池の寿命を、より長期化することができる非水電解液が提供される。
【0018】
更に、本発明によれば、繰り返しの充電/放電サイクルに供した際にも、より長い寿命を実現することができるリチウムイオン電池が提供される。
【0019】
更に、本発明によれば、繰り返しの充電/放電サイクルに供した際にも、より大きい放電容量を維持できるリチウムイオン電池が提供される。
【発明を実施するための最良の形態】
【0020】
以下、必要に応じて図面を参照しつつ本発明を更に具体的に説明する。以下の記載において量比を表す「部」および「%」は、特に断らない限り質量基準とする(ただし、溶媒の組成に関しては、特に断らない限り「容積」基準とする)。
【0021】
(電解液)
本発明の電解液は、非水溶媒と、特定構造を有するリチウム塩と、特定構造を有する2種の添加剤とを、少なくとも含む。
【0022】
(リチウム塩)
本発明において使用可能なリチウム塩は、本発明の電解質塩を構成するリチウム塩の例は、以下の式(1)により表されるリチウムフルオロボレートである。
【0023】
【化4】

(式中、xは0から3の整数を示す)
【0024】
(好ましいリチウム塩の例示)
より詳しくは、上式(1)で表される化合物のうち、x=0であるものが、耐酸化性が高い(すなわち、寿命が長くなる)点から特に好ましい。
【0025】
(第1の添加剤)
本発明において、第1の添加剤は、下記式(2):
【化5】

(式中、XおよびYは、独立に、H、CH3、ビニル基またはFを示す)
【0026】
で表される化合物のうち少なくとも一つの添加剤である。
【0027】
(好適な第1の添加剤)
上記した第1の添加剤の中でも、電池性能(例えば、出力)の点からは、下記の化合物が特に好適に使用可能である。
例えば、ビニレンカーボネート(VC)、ビニルエチレンカーボネート(VEC)、ジメチルビニレンカーボネート(DMVC)、フッ素化エチレンカーボネート(FEC)から選ばれる少なくとも一つの添加剤。
【0028】
内部抵抗が高くならない点からは、上記の中でも、特にVCが好ましい。
【0029】
(第2の添加剤)
本発明において、第2の添加剤は、下記式(3):
【化6】

(式中、YはOを示し、XはHまたはOHを示し、nは0〜5の整数を示す)
で表される化合物のうち少なくとも一つの添加剤である。
【0030】
(好適な第2の添加剤)
上記した第2の添加剤の中でも、高温安定性の点からは、下記の化合物が特に好適に使用可能である。
【0031】
例えば、プロパンサルトン(PS)およびヒドロキシプロパンスルトン(HOPS)選ばれる少なくとも一つの添加剤。
【0032】
上記した中でも、ガス発生を良好に抑制可能な点からは、PSが特に好ましい。
【0033】
(好適な第1および第2の添加剤の組合せ)
電池性能と寿命とのバランスの点から、本発明において、好適な第1および第2の添加剤の組合せとしては、下記の例が挙げられる。
<第1の添加剤> <第2の添加剤>
ビニレンカーボネート(VC) プロパンサルトン(PS)
フッ素化エチレンカーボネート(FEC) PS
(VC+ビニルエチレンカーボネート(VEC) PS
【0034】
(好適なリチウム塩、第1・第2の添加剤の組合せ)
電池性能と寿命とのバランスの点から、本発明において、好適なリチウム塩、第1および第2の添加剤の組合せとしては、下記の例が挙げられる。
<リチウム塩> <第1の添加剤> <第2の添加剤>
Li2B12F12 VC PS
Li2B12F12 VC ヒドロキシプロパンスルトン(HOPS)
Li2B12F12 (VC+VEC) PS
Li2B12F12 VC (PS+HOPS)
【0035】
(非水溶媒)
本発明に使用可能な非水溶媒(「キャリア」と称される場合もある)は、特に制限されない。
【0036】
(非水溶媒の具体例)
電解質溶液を形成する非プロトン性溶媒またはキャリアの例は、エチレンカーボネート(EC)、プロピレンカーボネート(PC)、ジメチルカーボネート(DMC)、エチルメチルカーボネート(EMC)、ジエチルカーボネート(DEC)、メチルプロピルカーボネート(MPC)、エチルプロピルカーボネート(EPC)、ジプロピルカーボネート(DPC)、ビス(トリフルオロエチル)カーボネート、ビス(ペンタフルオロプロピル)カーボネート、トリフルオロエチルメチルカーボネート、ペンタフルオロエチルメチルカーボネート、へプタフルオロプロピルメチルカーボネート、パーフルオロブチルメチルカーボネート、トリフルオロエチルエチルカーボネート、ペンタフルオロエチルエチルカーボネート、へプタフルオロプロピルエチルカーボネート、パーフルオロブチルエチルカーボネートなど、フッ化オリゴマー、ジメトキシエタン、トリグライム、テトラエチレングリコール、ジメチルエーテル(DME)、ポリエチレングリコール、スルホンおよびガンマブチロラクトン(GBL)からなる群から選択される少なくとも1つのメンバーを含む。溶媒またはキャリアは少なくとも1種のイオン性液体を含んでもよい。イオン性液体とは、どのような常温溶融塩も意味する。好適なイオン性液体の例は、とりわけ、液体のカチオン中に活性水素または還元可能な水素を含まない、弱配位アニオンの非対称テトラアルキルアンモニウム塩、例えば、ブチルトリメチルアンモニウムテトラフルオロボレート、ヘキシルトリメチルアンモニウムトリフルオロメタンスルホンイミドなど、弱配位アニオンのN−アルキルピペリジウム塩、例えばN−メチルピペリジニウムテトラフルオロボレート、N−エチルピペリジニウムトリフルオロメタンスルホネート、N−ブチルピペリジニウムトリフルオロメタンスルホンイミドからなる群から選択される少なくとも1つのメンバーを含む。
【0037】
(好適なリチウム塩、第1・第2の添加剤の組合せ)
電池性能と寿命とのバランスの点から、本発明において、好適な非水溶媒、リチウム塩、第1および第2の添加剤の組合せとしては、下記の例が挙げられる(組成比は、容積比(部、parts)である)。
【0038】
(1)EC/PC=30/5と、DMC/EMC/DEC=65/10/40
(2)EC/PC=30/10と、DMC/GBC=40/20
またはEC/PC=30/10と、EMC/GBC=40/20
またはEC/PC=30/10と、DEC/GBC=40/20
(3)PC/EC=(5〜20)/(20〜40)と、
(DMCまたはEMCまたはDEC)/GBC=(20〜65)/(5〜25)
【0039】
(好適な電池の寿命)
本発明の非水電解液を用いたリチウムイオン電池は、その100回の充電/放電サイクル後のキャパシティをCap(100)とし、その200回の充電/放電サイクル後のキャパシティをCap(200)とした場合に、これらの比たるR(Cap)=Cap(200)/Cap(100)の値が、 以上であることが好ましい。この比R(Cap)は、更には 以上(特に 以上)であることが好ましい。
【0040】
(電池寿命の内挿)
上記したCap(100)および/又はCap(200)の値は、その前後の充電/放電サイクル後のキャパシティ(例えば、(100−a)回および(100+b)回;(200−c)回および(200+d)回のキャパシティから、下記の式により「内挿」で求めることができる。
【0041】
(キャパシティの測定方法)
上記したCap(100)およびCap(200)の値は、後述する実施例1の条件を使用して、好適に測定することができる。
【0042】
(他の例)
他の態様において、本発明の電解質は非プロトン性ゲルポリマーキャリア/溶媒を含んでよい。好適なゲルポリマーキャリア/溶媒は、とりわけ、ポリエーテル、ポリエチレンオキシド、ポリイミド、ポリホスファジン、ポリアクリロニトリル、ポリシロキサン、ポリエーテルグラフト化ポリシロキサン、上記のものの誘導体、上記のもののコポリマー、上記のものの架橋および網目構造、上記のもののブレンドからなる群から選択される少なくとも1つのメンバーを含んでよく、適切なイオン性電解質塩が加えられる。他のゲル−ポリマーキャリア/溶媒は、ポリプロピレンオキシド、ポリシロキサン、スルホン化ポリイミド、過フッ化メンブレン(Nafion(商標)樹脂)、ジビニルポリエチレングリコール、ポリエチレングリコール−ビス−(メチルアクリレート)、ポリエチレングリコール−ビス(メチルメタクリレート)、上記のものの誘導体、上記のもののコポリマー、上記のものの架橋および網目構造からなる群から選択される少なくとも1つのメンバーから誘導されるポリマーマトリックスから製造されるものを含んでよい。非プロトン性ゲルポリマーキャリアは、上記の段落に記載した非プロトン性液体キャリアのいずれを含んでもよい。
【0043】
電解質が溶液中に電解質を含む場合、塩の濃度は典型的には約0.05から約2モル、または約0.1から約1.2モル、または約0.2から約0.5モルであろう。濃度が高くなると粘度が高くなりすぎる傾向があり、電解質を利用するセルのバルク伝導特性が悪影響を受ける場合がある。
【0044】
(負極/正極)
本発明の電池またはセルは、負極および正極ならびに本発明の電解質を含む。ある態様において、電池の正極および負極は、どのような利用中のリチウム含有物質でもよく、あるいは還元形態または酸化形態でイオンを「ホスト」できる、リチウムなどの物質である。「ホスト」とは、イオン、例えばリチウムイオンを可逆的に隔離できる物質を意味する。本発明の電池の負極は、金属リチウム、炭素質物質、例えばアモルファスカーボンまたはグラファイト(天然および人造)、スズおよびその合金、ケイ素およびその合金、ゲルマニウムおよびその合金、金属酸化物またはこれらの物質の誘導体(例えばリチウムチタネート)からなる群から選択される、少なくとも1つのメンバーを含んでよい。
【0045】
本発明の電池に使用する正極は、とりわけ、コバルト、ニッケル、マンガン、これらの混合物などの遷移金属と組み合わせたリチウム複合酸化物またはリチウム部位または遷移金属部位の一部がコバルト、ニッケル、マンガン、アルミニウム、ホウ素、マグネシウム、鉄、銅などからなる群から選択される少なくとも1つのメンバーにより置換されているリチウム複合酸化物に基づいてよい。このようなリチウム複合酸化物を例示すれば、例えば、LiMOx(式中、Mは金属を示す;M=Cu、Mn、Ni・・・・Mn+Ni、等)の式を有するものが挙げられる。また、LiMPO4(式中、Mは金属を示す;M=Fe、Mn、Co、Ni・・・・、等)の式を有する、いわゆる「オリビン型」のリン酸化合物も挙げられる。
【0046】
正極として使用するためのリチウム複合体の具体例は、リチウム鉄リン酸塩、LiFePO4、LiNi1-xCOxO2およびリチウムマンガンスピネル、LiMn2O4の少なくとも1つを含む。
【0047】
(セパレータ)
本発明において、リチウム電池のセパレータは微孔質ポリマーフィルムを含んでよい。フィルムを形成するポリマーの例は、とりわけ、ナイロン、セルロース、ニトロセルロース、ポリスルホン、ポリアクリロニトリル、ポリビニリデンフルオライド、ポリプロピレン、ポリエチレン、ポリブテン、その混合物からなる群から選択される少なくとも1つのメンバーを含む。セラミックセパレータ、とりわけシリケート、アルミノシリケートおよびそれらの誘導体に基づくものも使用できる。界面活性剤をセパレータまたは電解質に加えて、セパレータの電解質濡れ(electrolyte wetting)を改善することができる。電解質またはセル中で有用であると知られている他の成分または化合物を加えてもよい。
【0048】
ある態様において、電池は、炭素質リチウムイオンホスティング負極、正極、セパレータおよび非プロトン性溶媒、ゲルポリマーまたはポリマーマトリックス中に保持されているリチウム系電解質塩から構成されている。炭素質負極の例には、グラファイトおよび硬質炭素(hard carbon)がある。
【0049】
以下の例は本発明の種々の態様を説明するものであり、本願に添付する特許請求の範囲を限定しない。
【0050】
以下、実施例により本発明を更に具体的に説明する。
【実施例】
【0051】
製造例1
[Li2B12HxF12−x(x=0〜3)の調製]
平均ハメット酸度Ho=−2〜−4でギ酸6ml中にK2B12H12CH3OH2.96g(11.8mmol)を含有する無色のスラリーを0〜20℃でフッ素化した。所望の100%F2(142mmol)を、10%F2/10%O2/80%N2の混合ガスとして添加し、無色の溶液が残った。30℃での更なるフッ素化(3%)によって、溶液から固体が沈殿した。溶媒を一晩排気して無色の脆い固体5.1gを得た。この粗生成物を19F NMRによって分析し、主としてB12F10H22−(60%)、B12F11H2−(35%)及びB12F122−(5%)であることがわかった。粗反応生成物を水に溶解して、溶液のpHをトリエチルアミン及びトリエチルアミン塩酸塩で4〜6に調整した。沈殿した生成物を濾過して乾燥させ、水に再度懸濁させた。2当量の水酸化リチウム一水和物をこのスラリーに添加し、得られたトリエチルアミンを排気した。全てのトリエチルアミンを蒸留した後、さらに水酸化リチウムを添加して最終的な溶液のpHを9〜10にした。蒸留により水を除去し、最終生成物を200℃で4〜8時間真空乾燥した。Li2B12FxH12−x(x=10、11、12)の典型的な収率は約75%であった。
【0052】
製造例2
[Li2B12FxH12-x(x=10〜12)の調製]
平均ハメット酸度Ho=−2〜−4でギ酸6ml中にK2B12H12CH3OH2.96g(11.8mmol)を含有する無色のスラリーを0〜20℃でフッ素化した。所望の100%F2(142mmol)を、10%F2/10%O2/80%N2の混合ガスとして添加し、無色の溶液が残った。30℃での更なるフッ素化(3%)によって、溶液から固体が沈殿した。溶媒を一晩排気して無色の脆い固体5.1gを得た。この粗生成物を19F NMRによって分析し、主としてB12F10H22-(60%)、B12F11H2-(35%)及びB12F122-(5%)であることがわかった。粗反応生成物を水に溶解して、溶液のpHをトリエチルアミン及びトリエチルアミン塩酸塩で4〜6に調整した。沈殿した生成物を濾過して乾燥させ、水に再度懸濁させた。2当量の水酸化リチウム一水和物をこのスラリーに添加し、得られたトリエチルアミンを排気した。全てのトリエチルアミンを蒸留した後、さらに水酸化リチウムを添加して最終的な溶液のpHを9〜10にした。蒸留により水を除去し、最終生成物を200℃で4〜8時間真空乾燥した。Li2B12FxH12-x(x=10、11、12)の典型的な収率は約75%であった。
【0053】
製造例3
[Li2B12FxBr12-x(x≧10、平均x=11)の調製]
平均組成Li2B12F11HのLi2B12FxH12-x(x≧10)3g(0.008mol)を1M HCl(aq)160mLに溶解した。Br21.4mL(0.027mol)を添加し、この混合物を100℃で4時間還流した。NMR分析のために試料を採取した。
【0054】
上記試料の一部を還流に戻し、塩素を6時間にわたり添加して、より強力な臭素化剤BrClを形成した。塩素の添加が完了した時点で、アリコートを採取して、NMR分析によりそのアリコートの組成が最初のアリコートの組成と同一であることが示された。HClと水を蒸留し、生成物を150℃で真空乾燥した。合計2.55gの白色固体生成物を単離した。Li2B12FxBr12-x(x≧10、平均x=11)の理論量は3.66gである。
【0055】
製造例4
[ナトリウムとカリウムからのLi2B12F12の精製]
約200ppmのナトリウムを含有するLi2B12F12の水溶液を、Li+形態のカチオン交換樹脂DOWEX 50WX8−200を有するカラムを介して溶離した。この溶離液から水を蒸留除去し、残留物を150℃で真空乾燥した。精製した塩Li2B12F12は、ICPにより測定した場合に約60ppmのナトリウムを含有していた。
【0056】
製造例5
[Li2B12F12の熱重量分析(TGA)/IR]
TGA/IR分析は、試料をTA 2960 SDTにおいてランピング(ramping)してN2、H2O、飽和N2又は空気100cc/分中、室温から800℃まで10℃/分で加熱することにより実施した。放出されたガスを10cmのIR気体セルに通した。IRスペクトルは、AVATAR IRにより分解能4cm-1、ゲイン1で収集した。スペクトルは、1分間隔で一連のスペクトルとして収集した。放出ガスのプロファイルを、IRスペクトルにおけるバンド最大値で種々の化合物に関する吸光度を測定することにより作成した。定量的な情報は、プロファイル曲線より下の面積に校正係数を掛け、試料質量で割ることにより導き出した。図6に示されるIRプロファイルは、N2パージにより、大部分の水が約190℃でこの試料からとれ、225℃でさらに除去されることを示している。180℃以下での最終的な水の除去は比較的ゆっくりと進むであろう。
【0057】
製造例6
[Li2B12FxZ12-x塩の真空乾燥]
製造例2に従って調製した約200gのLi2B12F12塩を粉砕し、30mTorrの動的真空下において250℃で8時間乾燥した。アルゴンで充満した不活性雰囲気の乾燥ボックスに試料を移した。この塩の水分分析をOrion AF7 Coulometeric Karl-Fischer Titratorによって実施した。Riedel-deHaen製のHydranal(商標)Karl-Fischer試薬及び標準物質を用いた。Li2B12F12約0.60gを乾燥したアセトニトリル3mlに溶解し、水分析のために3〜1mLを採取した。この乾燥手順の後、塩質量ベースで約100ppmの水の値を得た。この方法における真空乾燥では、100〜500ppmの水の指示値が典型的に得られた。
【0058】
製造例7
[流動床でのLi2B12FxZ12-xの乾燥]
製造例2に従って調製した約100gのLi2B12F12塩を粉砕し、100mTorrの動的真空下において150〜200℃で4時間乾燥した。試料をさらに粉砕して、垂直なガラス管中の石英フリット上に充填した。この管を260℃に外部加熱し、乾燥した窒素を塩の床を流動化するのに十分な速度で塩を通してパージした。12時間後、試料を冷却し、水含有量の分析のためにアルゴンで充満した不活性雰囲気のボックスに移した。例7と同様に実施したKarl-Fischer分析において、塩が塩質量ベースで10〜20ppmの水を含有していることが示された。
【0059】
実施例1
(リチウム塩)
リチウム塩であるLi2B12F12(純度99.5%以上)は、製造例2に従って原料化合物をフッ素化し、不純物を除去、乾燥して得たのち、露点−80℃以下に保ったアルゴングローブボックス中で保管し、電解液の調合に供した。
得られたLi2B12F12のリキッドクロマトグラム(LC)法で評価した純度は99.5%であった。また、カールフィシャー(KF))法で評価した水分値は20ppmであった。電解液に用いた溶媒は水分含有量を10ppm以下に精製したものを使用した。
【0060】
(電解液)
実施例1の電解液1としてLi2B12F12塩14.96gを秤量し、ビニレンカーボネート(VC)2wt%,プロパンスルトン(PS)1wt%を含む、PC:EC:DEC=5:30:65vol%(但し、PC:プロピレンカーボネート、EC:エチレンカーボネート、DEC:ジエチルカーボネート)で混合した溶媒に溶解して100mlの溶液とし、Li2B12F12塩が0.4モル/lの電解液1を作製した。
この電解液1の1kHzで計測した導電率は4.75mS/cm、粘度は6.8cPであった。
【0061】
(ラミネート型電池)
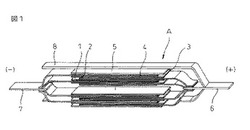
次に、電池特性を評価するために、以下の手順に従いラミネート型の電池を作製した。先ず、LiMn2O4を80wt%とLiNi0.8Co0.18Al0.02O2を20Wt%の割合で混合したものを正極活物質Aとして、これに導電材として10wt%のアセチレンブラックと90wt%のグラファイトを混合したものB、および、結着材としてポリビニリデンフロライドCとを乾燥重量比でA:B:C=85:8:7wt%となるように、N−メルチピロリドン(NMP)に溶解して正極材ペーストを作製し、アルミ箔からなる正極集電体1に塗布、乾燥、プレスして正極層2を正極集電体1の両面に形成し、正極電極を作製した。また、人造グラファイトDとCとを乾燥重量でD:C=92:8wt%になるようにNMPに溶解して負極材ペーストを作製し、銅箔からなる負極集電体3に塗布、乾燥、プレスして負極層4を負極集電体3の両面に形成し、負極電極を作製した。
【0062】
これら作製した電極をタブ端子部分を逆向き、交互に負極16枚、正極15枚をセパレータ5を介して積層し、正極にはアルミから成る正極端子6、負極にはニッケルからなる負極端子7を正極、負極のタブ端子にそれずれ超音波溶接して接続し、アルミラミネートシートからなる外装体に挿入し、底辺および正負極端子辺を熱溶着して封止し、上記で作製した電解液1を上辺より注液し、真空脱気した後、上辺を熱溶着して仮封止して、設計容量約4Ahの電池評価用ラミネート電池Aを作製した(図1、図5)。
【0063】
(繰り返し充放電テスト)
作製した電池1は、電解液が電極に馴染むまで注液後8h放置した後、0.1C(400mA)で3.2Vまで充電し、さらに8h放置した。次に、0.2C(800mA)で4.2Vまで充電し、4.2Vにて電流値が40mAになるまで定電圧で充電した。この状態でさらに8h放置後、0.2Cで2.7Vまで定電流で放電し、放電容量を計測した後、上辺のシール部分を切除し、ガス抜きを行い、再度、上辺を熱溶着して封止した。初回のラミネート電池1の放電容量は3.97Ahであった。
【0064】
次に、この電池の寿命を評価するために、電池1を0.5Cで定電流−定電圧4.2Vで3.5h充電し、その状態で60℃の恒温槽で保管した。一定期間後、保管した電池を恒温槽から取り出し、25℃にて0.2Cでの残存容量、0.5Cで充電後、0.2Cでの回復放電容量を評価した。このような試験を、保存時の電圧を3.95V,4.1Vと変えて実施し、図2に示す60℃サイクル試験での容量推移のグラフを得た。
【0065】
図2における試験条件は、以下の通りである。
SOC 100%サイクル試験
充電: 電流値 1C(4A)、4.2V、CC−CV(定電流−定電圧)
3.5hrカット
放電: 電流値 1C(4A)、
2.7Vカット
【0066】
更に、60℃保存試験により、図3のグラフを得た。
【0067】
図3における試験条件は、以下の通りである。
保存電圧:4.2、4.1、3.9 V
【0068】
比較例
条件を図2〜図4の図中に示すように変更した以外は、実施例1と同様にして実験を行った。得られた結果を、図2〜図4のグラフに示す。
【0069】
(過充電保護添加物としての1,2−ジメトキシ−4−ブロモベンゼンに対する溶媒の誘電率の影響)
過充電保護酸化還元シャトルとしての1,2−ジメトキシ−4−ブロモベンゼンの使用が、米国特許第5,763,119号明細書に開示されていた。0.1Mの4−ブロモ−1,2−ジメトキシベンゼンをEC:DEC(3:7)(誘電率=28)溶液中の1.0M LiPF6とPC溶液(誘電率〜65)中の1.0M LiPF6に加えた。例2〜6に記載のものと同様の電気化学電池でサイクリックボルタンメトリー試験を行った。スキャン速度は20mV/秒であった。EC/DECとPC含有溶媒中の酸化閾値電位は、4,18Vであった。溶媒の誘電率は、酸化閾値電位に影響が無かった。
【0070】
結果は、LiPF6電解質中の0.2M Li2B12F12を使用すると、電池は5.5ボルトの設定電圧まで過充電されず、過充電保護塩の酸化のために約4.6ボルトで平坦なプラトーが観察された。この電池設計により、LiPF6塩を有するリチウム2次電池中のLi2B12F12塩の使用は、過充電保護を与え、過充電条件中の酸化還元シャトルをするのに充分な量で存在した。
【0071】
得られた結果を、図4のグラフに示す。図4における試験条件は、以下の通りである。
【0072】
25℃ 過充電試験
SOC 100%(4.2V)からの過充電
電流値 1C(4A)
グラフ中、曲線1は、実施例1の電圧を示す。
曲線1’は、実施例1の表面温度を示す。
曲線2は、比較例の電圧を示す。
曲線2’は、比較例の表面温度を示す。
【図面の簡単な説明】
【0073】
【図1】本発明のリチウムイオン電池の構成の一例を示す模式斜視図である。
【図2】実施例で得られた測定結果を示すグラフである。
【図3】実施例で得られた測定結果を示すグラフである。
【図4】実施例で得られた測定結果を示すグラフである。
【図5】本発明のリチウムイオン電池の構成の一例を示す模式断面図である。
【図6】製造例5で得られたIRプロファイルを示すグラフである。
【技術分野】
【0001】
本発明は、非水電解液に関する。本発明の非水電解液は、リチウム二次電池に、特に好適に使用可能である。
【背景技術】
【0002】
一次電池および二次電池は、1つまたは複数の電気化学セルを含む。多くの電池は、リチウムの高い還元電位、リチウム元素の低い分子量および高い出力密度のためリチウムセルを含む。二次電池では、リチウムカチオンの小ささおよび高い移動度が、迅速な再充電の可能性を与える。これらの利点により、リチウム二次電池は、携帯電話およびラップトップコンピュータなどの携帯エレクトロニクス装置に理想的である。最近、ハイブリッド電気自動車市場に使用するための用途を有する、より大型なリチウム電池が開発されている。
【0003】
リチウム二次電池は、リチウム元素の高い還元電位および低分子量のため、既存の一次および二次電池技術に優って、出力密度の劇的な向上をもたらす。リチウム二次電池は、金属リチウムを負極として含む電池であり、リチウムイオン電池としても知られているリチウムイオンホスト材料を負極として含む電池もある。二次電池とは、充放電の複数のサイクルを考慮した電池である。リチウムカチオンは小さく移動度が高いので、急速な再充電が可能となる。これらの利点により、リチウムイオン電池は、例えば携帯電話およびラップトップコンピュータなどの携帯型エレクトロニクス装置に理想的である。最近、より大型のリチウムイオン電池が開発され、ハイブリット車市場での利用に用途がある。
セルの充放電の可逆性に対する主な問題は、変化する条件下での電解質溶液成分(塩および溶媒)へのそれらの反応性であった。従来、電解質塩および溶媒は全て、少なくとも最初の充電工程の間負極でいくらか還元されることが観察されてきた。この還元は、安定で伝導性の不活性化層または固体電解質インターフェースすなわちSEI層とも呼ばれるフィルムを形成することがあるが、あるいは還元が充電/放電サイクルとともに継続し、最終的に負極での可逆容量が無くなることもある。
【0004】
更に、上記したハイブリッド電気自動車への応用においては、リチウムイオン電池の寿命を出来る限り長期化することが、特に問題であった。これには、該電池内における、「望ましくない」反応を抑制することが重要であった。
【0005】
上述したように、従来のリチウムイオン電池においては、充電/放電サイクルを繰り返した際に、その寿命が短くなる傾向があった。
【0006】
【特許文献1】特開2007−87938号公報
【特許文献2】特開2007−202745号公報
【発明の開示】
【発明が解決しようとする課題】
【0007】
本発明の目的は、上記した従来技術の欠点を解消し、リチウムイオン電池に適用した際、繰り返しの充電/放電サイクルに供した際にも、該リチウムイオン電池の寿命を、より長期化することができる非水電解液を提供することにある。
本発明の他の目的は、繰り返しの充電/放電サイクルに供した際にも、より長い寿命を実現することができるリチウムイオン電池を提供することにある。
【課題を解決するための手段】
【0008】
本発明者は鋭意研究の結果、特定構造を有するリチウム塩に、更に特定構造を有する2種の添加剤を組み合わせることが、上記目的の達成のために極めて効果的なことを見出した。
【0009】
本発明の非水電解液は上記知見に基づくものであり、より詳しくは、非水溶媒と、
下記式(1)
【0010】
【化1】

(式中、xは0から3の整数を示す)
【0011】
で表されるリチウム塩と、
【0012】
下記式(2)
【0013】
【化2】

(式中、XおよびYは、独立に、H、CH3、ビニル基またはFを示す)
【0014】
で表される化合物のうち少なくとも一つの第1の添加剤と、
下記式(3)
【0015】
【化3】

(式中、YはOを示し、XはHまたはOHを示し、nは0〜5の整数を示す)
【0016】
で表される化合物のうち少なくとも一つの第2の添加剤とを含むことを特徴とするものである。
【発明の効果】
【0017】
上述したように本発明によれば、リチウムイオン電池に適用した際、繰り返しの充電/放電サイクルに供した際にも、該リチウムイオン電池の寿命を、より長期化することができる非水電解液が提供される。
【0018】
更に、本発明によれば、繰り返しの充電/放電サイクルに供した際にも、より長い寿命を実現することができるリチウムイオン電池が提供される。
【0019】
更に、本発明によれば、繰り返しの充電/放電サイクルに供した際にも、より大きい放電容量を維持できるリチウムイオン電池が提供される。
【発明を実施するための最良の形態】
【0020】
以下、必要に応じて図面を参照しつつ本発明を更に具体的に説明する。以下の記載において量比を表す「部」および「%」は、特に断らない限り質量基準とする(ただし、溶媒の組成に関しては、特に断らない限り「容積」基準とする)。
【0021】
(電解液)
本発明の電解液は、非水溶媒と、特定構造を有するリチウム塩と、特定構造を有する2種の添加剤とを、少なくとも含む。
【0022】
(リチウム塩)
本発明において使用可能なリチウム塩は、本発明の電解質塩を構成するリチウム塩の例は、以下の式(1)により表されるリチウムフルオロボレートである。
【0023】
【化4】

(式中、xは0から3の整数を示す)
【0024】
(好ましいリチウム塩の例示)
より詳しくは、上式(1)で表される化合物のうち、x=0であるものが、耐酸化性が高い(すなわち、寿命が長くなる)点から特に好ましい。
【0025】
(第1の添加剤)
本発明において、第1の添加剤は、下記式(2):
【化5】

(式中、XおよびYは、独立に、H、CH3、ビニル基またはFを示す)
【0026】
で表される化合物のうち少なくとも一つの添加剤である。
【0027】
(好適な第1の添加剤)
上記した第1の添加剤の中でも、電池性能(例えば、出力)の点からは、下記の化合物が特に好適に使用可能である。
例えば、ビニレンカーボネート(VC)、ビニルエチレンカーボネート(VEC)、ジメチルビニレンカーボネート(DMVC)、フッ素化エチレンカーボネート(FEC)から選ばれる少なくとも一つの添加剤。
【0028】
内部抵抗が高くならない点からは、上記の中でも、特にVCが好ましい。
【0029】
(第2の添加剤)
本発明において、第2の添加剤は、下記式(3):
【化6】

(式中、YはOを示し、XはHまたはOHを示し、nは0〜5の整数を示す)
で表される化合物のうち少なくとも一つの添加剤である。
【0030】
(好適な第2の添加剤)
上記した第2の添加剤の中でも、高温安定性の点からは、下記の化合物が特に好適に使用可能である。
【0031】
例えば、プロパンサルトン(PS)およびヒドロキシプロパンスルトン(HOPS)選ばれる少なくとも一つの添加剤。
【0032】
上記した中でも、ガス発生を良好に抑制可能な点からは、PSが特に好ましい。
【0033】
(好適な第1および第2の添加剤の組合せ)
電池性能と寿命とのバランスの点から、本発明において、好適な第1および第2の添加剤の組合せとしては、下記の例が挙げられる。
<第1の添加剤> <第2の添加剤>
ビニレンカーボネート(VC) プロパンサルトン(PS)
フッ素化エチレンカーボネート(FEC) PS
(VC+ビニルエチレンカーボネート(VEC) PS
【0034】
(好適なリチウム塩、第1・第2の添加剤の組合せ)
電池性能と寿命とのバランスの点から、本発明において、好適なリチウム塩、第1および第2の添加剤の組合せとしては、下記の例が挙げられる。
<リチウム塩> <第1の添加剤> <第2の添加剤>
Li2B12F12 VC PS
Li2B12F12 VC ヒドロキシプロパンスルトン(HOPS)
Li2B12F12 (VC+VEC) PS
Li2B12F12 VC (PS+HOPS)
【0035】
(非水溶媒)
本発明に使用可能な非水溶媒(「キャリア」と称される場合もある)は、特に制限されない。
【0036】
(非水溶媒の具体例)
電解質溶液を形成する非プロトン性溶媒またはキャリアの例は、エチレンカーボネート(EC)、プロピレンカーボネート(PC)、ジメチルカーボネート(DMC)、エチルメチルカーボネート(EMC)、ジエチルカーボネート(DEC)、メチルプロピルカーボネート(MPC)、エチルプロピルカーボネート(EPC)、ジプロピルカーボネート(DPC)、ビス(トリフルオロエチル)カーボネート、ビス(ペンタフルオロプロピル)カーボネート、トリフルオロエチルメチルカーボネート、ペンタフルオロエチルメチルカーボネート、へプタフルオロプロピルメチルカーボネート、パーフルオロブチルメチルカーボネート、トリフルオロエチルエチルカーボネート、ペンタフルオロエチルエチルカーボネート、へプタフルオロプロピルエチルカーボネート、パーフルオロブチルエチルカーボネートなど、フッ化オリゴマー、ジメトキシエタン、トリグライム、テトラエチレングリコール、ジメチルエーテル(DME)、ポリエチレングリコール、スルホンおよびガンマブチロラクトン(GBL)からなる群から選択される少なくとも1つのメンバーを含む。溶媒またはキャリアは少なくとも1種のイオン性液体を含んでもよい。イオン性液体とは、どのような常温溶融塩も意味する。好適なイオン性液体の例は、とりわけ、液体のカチオン中に活性水素または還元可能な水素を含まない、弱配位アニオンの非対称テトラアルキルアンモニウム塩、例えば、ブチルトリメチルアンモニウムテトラフルオロボレート、ヘキシルトリメチルアンモニウムトリフルオロメタンスルホンイミドなど、弱配位アニオンのN−アルキルピペリジウム塩、例えばN−メチルピペリジニウムテトラフルオロボレート、N−エチルピペリジニウムトリフルオロメタンスルホネート、N−ブチルピペリジニウムトリフルオロメタンスルホンイミドからなる群から選択される少なくとも1つのメンバーを含む。
【0037】
(好適なリチウム塩、第1・第2の添加剤の組合せ)
電池性能と寿命とのバランスの点から、本発明において、好適な非水溶媒、リチウム塩、第1および第2の添加剤の組合せとしては、下記の例が挙げられる(組成比は、容積比(部、parts)である)。
【0038】
(1)EC/PC=30/5と、DMC/EMC/DEC=65/10/40
(2)EC/PC=30/10と、DMC/GBC=40/20
またはEC/PC=30/10と、EMC/GBC=40/20
またはEC/PC=30/10と、DEC/GBC=40/20
(3)PC/EC=(5〜20)/(20〜40)と、
(DMCまたはEMCまたはDEC)/GBC=(20〜65)/(5〜25)
【0039】
(好適な電池の寿命)
本発明の非水電解液を用いたリチウムイオン電池は、その100回の充電/放電サイクル後のキャパシティをCap(100)とし、その200回の充電/放電サイクル後のキャパシティをCap(200)とした場合に、これらの比たるR(Cap)=Cap(200)/Cap(100)の値が、 以上であることが好ましい。この比R(Cap)は、更には 以上(特に 以上)であることが好ましい。
【0040】
(電池寿命の内挿)
上記したCap(100)および/又はCap(200)の値は、その前後の充電/放電サイクル後のキャパシティ(例えば、(100−a)回および(100+b)回;(200−c)回および(200+d)回のキャパシティから、下記の式により「内挿」で求めることができる。
【0041】
(キャパシティの測定方法)
上記したCap(100)およびCap(200)の値は、後述する実施例1の条件を使用して、好適に測定することができる。
【0042】
(他の例)
他の態様において、本発明の電解質は非プロトン性ゲルポリマーキャリア/溶媒を含んでよい。好適なゲルポリマーキャリア/溶媒は、とりわけ、ポリエーテル、ポリエチレンオキシド、ポリイミド、ポリホスファジン、ポリアクリロニトリル、ポリシロキサン、ポリエーテルグラフト化ポリシロキサン、上記のものの誘導体、上記のもののコポリマー、上記のものの架橋および網目構造、上記のもののブレンドからなる群から選択される少なくとも1つのメンバーを含んでよく、適切なイオン性電解質塩が加えられる。他のゲル−ポリマーキャリア/溶媒は、ポリプロピレンオキシド、ポリシロキサン、スルホン化ポリイミド、過フッ化メンブレン(Nafion(商標)樹脂)、ジビニルポリエチレングリコール、ポリエチレングリコール−ビス−(メチルアクリレート)、ポリエチレングリコール−ビス(メチルメタクリレート)、上記のものの誘導体、上記のもののコポリマー、上記のものの架橋および網目構造からなる群から選択される少なくとも1つのメンバーから誘導されるポリマーマトリックスから製造されるものを含んでよい。非プロトン性ゲルポリマーキャリアは、上記の段落に記載した非プロトン性液体キャリアのいずれを含んでもよい。
【0043】
電解質が溶液中に電解質を含む場合、塩の濃度は典型的には約0.05から約2モル、または約0.1から約1.2モル、または約0.2から約0.5モルであろう。濃度が高くなると粘度が高くなりすぎる傾向があり、電解質を利用するセルのバルク伝導特性が悪影響を受ける場合がある。
【0044】
(負極/正極)
本発明の電池またはセルは、負極および正極ならびに本発明の電解質を含む。ある態様において、電池の正極および負極は、どのような利用中のリチウム含有物質でもよく、あるいは還元形態または酸化形態でイオンを「ホスト」できる、リチウムなどの物質である。「ホスト」とは、イオン、例えばリチウムイオンを可逆的に隔離できる物質を意味する。本発明の電池の負極は、金属リチウム、炭素質物質、例えばアモルファスカーボンまたはグラファイト(天然および人造)、スズおよびその合金、ケイ素およびその合金、ゲルマニウムおよびその合金、金属酸化物またはこれらの物質の誘導体(例えばリチウムチタネート)からなる群から選択される、少なくとも1つのメンバーを含んでよい。
【0045】
本発明の電池に使用する正極は、とりわけ、コバルト、ニッケル、マンガン、これらの混合物などの遷移金属と組み合わせたリチウム複合酸化物またはリチウム部位または遷移金属部位の一部がコバルト、ニッケル、マンガン、アルミニウム、ホウ素、マグネシウム、鉄、銅などからなる群から選択される少なくとも1つのメンバーにより置換されているリチウム複合酸化物に基づいてよい。このようなリチウム複合酸化物を例示すれば、例えば、LiMOx(式中、Mは金属を示す;M=Cu、Mn、Ni・・・・Mn+Ni、等)の式を有するものが挙げられる。また、LiMPO4(式中、Mは金属を示す;M=Fe、Mn、Co、Ni・・・・、等)の式を有する、いわゆる「オリビン型」のリン酸化合物も挙げられる。
【0046】
正極として使用するためのリチウム複合体の具体例は、リチウム鉄リン酸塩、LiFePO4、LiNi1-xCOxO2およびリチウムマンガンスピネル、LiMn2O4の少なくとも1つを含む。
【0047】
(セパレータ)
本発明において、リチウム電池のセパレータは微孔質ポリマーフィルムを含んでよい。フィルムを形成するポリマーの例は、とりわけ、ナイロン、セルロース、ニトロセルロース、ポリスルホン、ポリアクリロニトリル、ポリビニリデンフルオライド、ポリプロピレン、ポリエチレン、ポリブテン、その混合物からなる群から選択される少なくとも1つのメンバーを含む。セラミックセパレータ、とりわけシリケート、アルミノシリケートおよびそれらの誘導体に基づくものも使用できる。界面活性剤をセパレータまたは電解質に加えて、セパレータの電解質濡れ(electrolyte wetting)を改善することができる。電解質またはセル中で有用であると知られている他の成分または化合物を加えてもよい。
【0048】
ある態様において、電池は、炭素質リチウムイオンホスティング負極、正極、セパレータおよび非プロトン性溶媒、ゲルポリマーまたはポリマーマトリックス中に保持されているリチウム系電解質塩から構成されている。炭素質負極の例には、グラファイトおよび硬質炭素(hard carbon)がある。
【0049】
以下の例は本発明の種々の態様を説明するものであり、本願に添付する特許請求の範囲を限定しない。
【0050】
以下、実施例により本発明を更に具体的に説明する。
【実施例】
【0051】
製造例1
[Li2B12HxF12−x(x=0〜3)の調製]
平均ハメット酸度Ho=−2〜−4でギ酸6ml中にK2B12H12CH3OH2.96g(11.8mmol)を含有する無色のスラリーを0〜20℃でフッ素化した。所望の100%F2(142mmol)を、10%F2/10%O2/80%N2の混合ガスとして添加し、無色の溶液が残った。30℃での更なるフッ素化(3%)によって、溶液から固体が沈殿した。溶媒を一晩排気して無色の脆い固体5.1gを得た。この粗生成物を19F NMRによって分析し、主としてB12F10H22−(60%)、B12F11H2−(35%)及びB12F122−(5%)であることがわかった。粗反応生成物を水に溶解して、溶液のpHをトリエチルアミン及びトリエチルアミン塩酸塩で4〜6に調整した。沈殿した生成物を濾過して乾燥させ、水に再度懸濁させた。2当量の水酸化リチウム一水和物をこのスラリーに添加し、得られたトリエチルアミンを排気した。全てのトリエチルアミンを蒸留した後、さらに水酸化リチウムを添加して最終的な溶液のpHを9〜10にした。蒸留により水を除去し、最終生成物を200℃で4〜8時間真空乾燥した。Li2B12FxH12−x(x=10、11、12)の典型的な収率は約75%であった。
【0052】
製造例2
[Li2B12FxH12-x(x=10〜12)の調製]
平均ハメット酸度Ho=−2〜−4でギ酸6ml中にK2B12H12CH3OH2.96g(11.8mmol)を含有する無色のスラリーを0〜20℃でフッ素化した。所望の100%F2(142mmol)を、10%F2/10%O2/80%N2の混合ガスとして添加し、無色の溶液が残った。30℃での更なるフッ素化(3%)によって、溶液から固体が沈殿した。溶媒を一晩排気して無色の脆い固体5.1gを得た。この粗生成物を19F NMRによって分析し、主としてB12F10H22-(60%)、B12F11H2-(35%)及びB12F122-(5%)であることがわかった。粗反応生成物を水に溶解して、溶液のpHをトリエチルアミン及びトリエチルアミン塩酸塩で4〜6に調整した。沈殿した生成物を濾過して乾燥させ、水に再度懸濁させた。2当量の水酸化リチウム一水和物をこのスラリーに添加し、得られたトリエチルアミンを排気した。全てのトリエチルアミンを蒸留した後、さらに水酸化リチウムを添加して最終的な溶液のpHを9〜10にした。蒸留により水を除去し、最終生成物を200℃で4〜8時間真空乾燥した。Li2B12FxH12-x(x=10、11、12)の典型的な収率は約75%であった。
【0053】
製造例3
[Li2B12FxBr12-x(x≧10、平均x=11)の調製]
平均組成Li2B12F11HのLi2B12FxH12-x(x≧10)3g(0.008mol)を1M HCl(aq)160mLに溶解した。Br21.4mL(0.027mol)を添加し、この混合物を100℃で4時間還流した。NMR分析のために試料を採取した。
【0054】
上記試料の一部を還流に戻し、塩素を6時間にわたり添加して、より強力な臭素化剤BrClを形成した。塩素の添加が完了した時点で、アリコートを採取して、NMR分析によりそのアリコートの組成が最初のアリコートの組成と同一であることが示された。HClと水を蒸留し、生成物を150℃で真空乾燥した。合計2.55gの白色固体生成物を単離した。Li2B12FxBr12-x(x≧10、平均x=11)の理論量は3.66gである。
【0055】
製造例4
[ナトリウムとカリウムからのLi2B12F12の精製]
約200ppmのナトリウムを含有するLi2B12F12の水溶液を、Li+形態のカチオン交換樹脂DOWEX 50WX8−200を有するカラムを介して溶離した。この溶離液から水を蒸留除去し、残留物を150℃で真空乾燥した。精製した塩Li2B12F12は、ICPにより測定した場合に約60ppmのナトリウムを含有していた。
【0056】
製造例5
[Li2B12F12の熱重量分析(TGA)/IR]
TGA/IR分析は、試料をTA 2960 SDTにおいてランピング(ramping)してN2、H2O、飽和N2又は空気100cc/分中、室温から800℃まで10℃/分で加熱することにより実施した。放出されたガスを10cmのIR気体セルに通した。IRスペクトルは、AVATAR IRにより分解能4cm-1、ゲイン1で収集した。スペクトルは、1分間隔で一連のスペクトルとして収集した。放出ガスのプロファイルを、IRスペクトルにおけるバンド最大値で種々の化合物に関する吸光度を測定することにより作成した。定量的な情報は、プロファイル曲線より下の面積に校正係数を掛け、試料質量で割ることにより導き出した。図6に示されるIRプロファイルは、N2パージにより、大部分の水が約190℃でこの試料からとれ、225℃でさらに除去されることを示している。180℃以下での最終的な水の除去は比較的ゆっくりと進むであろう。
【0057】
製造例6
[Li2B12FxZ12-x塩の真空乾燥]
製造例2に従って調製した約200gのLi2B12F12塩を粉砕し、30mTorrの動的真空下において250℃で8時間乾燥した。アルゴンで充満した不活性雰囲気の乾燥ボックスに試料を移した。この塩の水分分析をOrion AF7 Coulometeric Karl-Fischer Titratorによって実施した。Riedel-deHaen製のHydranal(商標)Karl-Fischer試薬及び標準物質を用いた。Li2B12F12約0.60gを乾燥したアセトニトリル3mlに溶解し、水分析のために3〜1mLを採取した。この乾燥手順の後、塩質量ベースで約100ppmの水の値を得た。この方法における真空乾燥では、100〜500ppmの水の指示値が典型的に得られた。
【0058】
製造例7
[流動床でのLi2B12FxZ12-xの乾燥]
製造例2に従って調製した約100gのLi2B12F12塩を粉砕し、100mTorrの動的真空下において150〜200℃で4時間乾燥した。試料をさらに粉砕して、垂直なガラス管中の石英フリット上に充填した。この管を260℃に外部加熱し、乾燥した窒素を塩の床を流動化するのに十分な速度で塩を通してパージした。12時間後、試料を冷却し、水含有量の分析のためにアルゴンで充満した不活性雰囲気のボックスに移した。例7と同様に実施したKarl-Fischer分析において、塩が塩質量ベースで10〜20ppmの水を含有していることが示された。
【0059】
実施例1
(リチウム塩)
リチウム塩であるLi2B12F12(純度99.5%以上)は、製造例2に従って原料化合物をフッ素化し、不純物を除去、乾燥して得たのち、露点−80℃以下に保ったアルゴングローブボックス中で保管し、電解液の調合に供した。
得られたLi2B12F12のリキッドクロマトグラム(LC)法で評価した純度は99.5%であった。また、カールフィシャー(KF))法で評価した水分値は20ppmであった。電解液に用いた溶媒は水分含有量を10ppm以下に精製したものを使用した。
【0060】
(電解液)
実施例1の電解液1としてLi2B12F12塩14.96gを秤量し、ビニレンカーボネート(VC)2wt%,プロパンスルトン(PS)1wt%を含む、PC:EC:DEC=5:30:65vol%(但し、PC:プロピレンカーボネート、EC:エチレンカーボネート、DEC:ジエチルカーボネート)で混合した溶媒に溶解して100mlの溶液とし、Li2B12F12塩が0.4モル/lの電解液1を作製した。
この電解液1の1kHzで計測した導電率は4.75mS/cm、粘度は6.8cPであった。
【0061】
(ラミネート型電池)
次に、電池特性を評価するために、以下の手順に従いラミネート型の電池を作製した。先ず、LiMn2O4を80wt%とLiNi0.8Co0.18Al0.02O2を20Wt%の割合で混合したものを正極活物質Aとして、これに導電材として10wt%のアセチレンブラックと90wt%のグラファイトを混合したものB、および、結着材としてポリビニリデンフロライドCとを乾燥重量比でA:B:C=85:8:7wt%となるように、N−メルチピロリドン(NMP)に溶解して正極材ペーストを作製し、アルミ箔からなる正極集電体1に塗布、乾燥、プレスして正極層2を正極集電体1の両面に形成し、正極電極を作製した。また、人造グラファイトDとCとを乾燥重量でD:C=92:8wt%になるようにNMPに溶解して負極材ペーストを作製し、銅箔からなる負極集電体3に塗布、乾燥、プレスして負極層4を負極集電体3の両面に形成し、負極電極を作製した。
【0062】
これら作製した電極をタブ端子部分を逆向き、交互に負極16枚、正極15枚をセパレータ5を介して積層し、正極にはアルミから成る正極端子6、負極にはニッケルからなる負極端子7を正極、負極のタブ端子にそれずれ超音波溶接して接続し、アルミラミネートシートからなる外装体に挿入し、底辺および正負極端子辺を熱溶着して封止し、上記で作製した電解液1を上辺より注液し、真空脱気した後、上辺を熱溶着して仮封止して、設計容量約4Ahの電池評価用ラミネート電池Aを作製した(図1、図5)。
【0063】
(繰り返し充放電テスト)
作製した電池1は、電解液が電極に馴染むまで注液後8h放置した後、0.1C(400mA)で3.2Vまで充電し、さらに8h放置した。次に、0.2C(800mA)で4.2Vまで充電し、4.2Vにて電流値が40mAになるまで定電圧で充電した。この状態でさらに8h放置後、0.2Cで2.7Vまで定電流で放電し、放電容量を計測した後、上辺のシール部分を切除し、ガス抜きを行い、再度、上辺を熱溶着して封止した。初回のラミネート電池1の放電容量は3.97Ahであった。
【0064】
次に、この電池の寿命を評価するために、電池1を0.5Cで定電流−定電圧4.2Vで3.5h充電し、その状態で60℃の恒温槽で保管した。一定期間後、保管した電池を恒温槽から取り出し、25℃にて0.2Cでの残存容量、0.5Cで充電後、0.2Cでの回復放電容量を評価した。このような試験を、保存時の電圧を3.95V,4.1Vと変えて実施し、図2に示す60℃サイクル試験での容量推移のグラフを得た。
【0065】
図2における試験条件は、以下の通りである。
SOC 100%サイクル試験
充電: 電流値 1C(4A)、4.2V、CC−CV(定電流−定電圧)
3.5hrカット
放電: 電流値 1C(4A)、
2.7Vカット
【0066】
更に、60℃保存試験により、図3のグラフを得た。
【0067】
図3における試験条件は、以下の通りである。
保存電圧:4.2、4.1、3.9 V
【0068】
比較例
条件を図2〜図4の図中に示すように変更した以外は、実施例1と同様にして実験を行った。得られた結果を、図2〜図4のグラフに示す。
【0069】
(過充電保護添加物としての1,2−ジメトキシ−4−ブロモベンゼンに対する溶媒の誘電率の影響)
過充電保護酸化還元シャトルとしての1,2−ジメトキシ−4−ブロモベンゼンの使用が、米国特許第5,763,119号明細書に開示されていた。0.1Mの4−ブロモ−1,2−ジメトキシベンゼンをEC:DEC(3:7)(誘電率=28)溶液中の1.0M LiPF6とPC溶液(誘電率〜65)中の1.0M LiPF6に加えた。例2〜6に記載のものと同様の電気化学電池でサイクリックボルタンメトリー試験を行った。スキャン速度は20mV/秒であった。EC/DECとPC含有溶媒中の酸化閾値電位は、4,18Vであった。溶媒の誘電率は、酸化閾値電位に影響が無かった。
【0070】
結果は、LiPF6電解質中の0.2M Li2B12F12を使用すると、電池は5.5ボルトの設定電圧まで過充電されず、過充電保護塩の酸化のために約4.6ボルトで平坦なプラトーが観察された。この電池設計により、LiPF6塩を有するリチウム2次電池中のLi2B12F12塩の使用は、過充電保護を与え、過充電条件中の酸化還元シャトルをするのに充分な量で存在した。
【0071】
得られた結果を、図4のグラフに示す。図4における試験条件は、以下の通りである。
【0072】
25℃ 過充電試験
SOC 100%(4.2V)からの過充電
電流値 1C(4A)
グラフ中、曲線1は、実施例1の電圧を示す。
曲線1’は、実施例1の表面温度を示す。
曲線2は、比較例の電圧を示す。
曲線2’は、比較例の表面温度を示す。
【図面の簡単な説明】
【0073】
【図1】本発明のリチウムイオン電池の構成の一例を示す模式斜視図である。
【図2】実施例で得られた測定結果を示すグラフである。
【図3】実施例で得られた測定結果を示すグラフである。
【図4】実施例で得られた測定結果を示すグラフである。
【図5】本発明のリチウムイオン電池の構成の一例を示す模式断面図である。
【図6】製造例5で得られたIRプロファイルを示すグラフである。
【特許請求の範囲】
【請求項1】
非水溶媒と、
下記式(1)
【化1】

(式中、xは0から3の整数を示す)
で表されるリチウム塩と、
下記式(2)
【化2】

(式中、XおよびYは、独立に、H、CH3、ビニル基またはFを示す)
で表される化合物のうち少なくとも一つの第1の添加剤と、
下記式(3)
【化3】

(式中、YはOを示し、XはHまたはOHを示し、nは0〜5の整数を示す)
で表される化合物のうち少なくとも一つの第2の添加剤とを含むことを特徴とする非水電解液。
【請求項2】
前記第1の添加剤が、ビニレンカーボネート(VC)、ビニルエチレンカーボネート(VEC)、ジメチルビニレンカーボネート(DMVC)、フッ素化エチレンカーボネート(FEC)から選ばれる少なくとも一つの添加剤である請求項1に記載の非水電解液。
【請求項3】
前記第2の添加剤が、プロパンサルトン(PS)およびヒドロキシプロパンスルトン(HOPS)から選ばれる少なくとも一つの添加剤である請求項1または2に記載の非水電解液。
【請求項4】
前記第1の添加剤がVCであり、第2の添加剤がプロパンサルトン(PS)である請求項3に記載の非水電解液。
【請求項5】
前記第1の添加剤がFECであり、第2の添加剤がPSである請求項3に記載の非水電解液。
【請求項6】
前記第1の添加剤がVCおよびVECであり、第2の添加剤がPSである請求項3に記載の非水電解液。
【請求項7】
前記リチウム塩がLi2B12F12であり、第1の添加剤がVCであり、第2の添加剤がPSである請求項3に記載の非水電解液。
【請求項8】
前記リチウム塩がLi2B12F12であり、第1の添加剤がVCであり、第2の添加剤がヒドロキシプロパンスルトン(HOPS)である請求項3に記載の非水電解液。
【請求項9】
前記リチウム塩がLi2B12F12であり、第1の添加剤がVCおよびVECであり、第2の添加剤がPSである請求項3に記載の非水電解液。
【請求項10】
前記リチウム塩がLi2B12F12であり、第1の添加剤がVCであり、第2の添加剤がPSおよびHOPSである請求項3に記載の非水電解液。
【請求項11】
前記リチウムを吸蔵放出可能な負極と、
リチウムを吸蔵放出可能な正極と、
前記負極と正極との間に配置されたセパレータと、
前記負極と正極との間に配置された非水電解液とを少なくとも含むリチウム二次電池であって;
前記非水電解液が、請求項1記載の非水電解液であることを特徴とするリチウム二次電池。
【請求項12】
前記非水電解液が第1の添加剤としてVCを、第2の添加剤としてプロパンサルトン(PS)を含む請求項11記載のリチウム二次電池。
【請求項13】
前記非水電解液が第1の添加剤としてFECを、第2の添加剤としてPSを含む請求項11記載のリチウム二次電池。
【請求項14】
前記非水電解液が第1の添加剤としてVCおよびVECを、第2の添加剤としてPSを含む請求項11記載のリチウム二次電池。
【請求項15】
前記非水電解液がリチウム塩としてLi2B12F12を、第1の添加剤としてVCを、第2の添加剤としてPSを含む請求項11記載のリチウム二次電池。
【請求項16】
前記非水電解液がリチウム塩としてLi2B12F12を、第1の添加剤としてVCを、第2の添加剤としてHOPSを含む請求項11記載のリチウム二次電池。
【請求項17】
前記非水電解液がリチウム塩としてLi2B12F12を、第1の添加剤としてVCを、第2の添加剤としてPSおよびHOPSを含む請求項11記載のリチウム二次電池。
【請求項18】
複数個直列または並列に接続されたリチウム二次電池を含むリチウム電池電源であって;
該リチウム二次電池が請求項11〜17のいずれかに記載のリチウム二次電池であることを特徴とするリチウム電池電源。
【請求項19】
前記負極が、リチウム金属、炭素質材料、スズとその合金、シリコンとその合金、ゲルマニウムとその合金、およびそのような材料の誘導体を含む、請求項11に記載のリチウム二次電池。
【請求項20】
前記炭素質材料が、アモルファス炭素、グラファイト(天然および人造)から選ばれる請求項19に記載のリチウム二次電池。
【請求項21】
前記誘導体が、リチウムチタネートである請求項19または20に記載のリチウム二次電池。
【請求項22】
前記負極が、炭素質材料を含む請求項19〜21のいずれかに記載のリチウム二次電池。
【請求項23】
前記炭素質材料が、硬質炭素またはグラファイトである請求項22に記載のリチウム二次電池。
【請求項24】
前記炭素質材料が、グラファイトである請求項23に記載のリチウム二次電池。
【請求項25】
前記正極が、リチウム鉄リン酸塩、LiFePO4、LiNi1−xCoxO2およびリチウム・マンガン尖晶石(スピネル)LiMn2O4のうちの少なくとも1つを含む請求項11に記載のリチウム二次電池。
【請求項26】
前記正極が、リチウム・マンガン尖晶石(スピネル)LiMn2O4を含む請求項25に記載のリチウム二次電池。
【請求項1】
非水溶媒と、
下記式(1)
【化1】

(式中、xは0から3の整数を示す)
で表されるリチウム塩と、
下記式(2)
【化2】

(式中、XおよびYは、独立に、H、CH3、ビニル基またはFを示す)
で表される化合物のうち少なくとも一つの第1の添加剤と、
下記式(3)
【化3】

(式中、YはOを示し、XはHまたはOHを示し、nは0〜5の整数を示す)
で表される化合物のうち少なくとも一つの第2の添加剤とを含むことを特徴とする非水電解液。
【請求項2】
前記第1の添加剤が、ビニレンカーボネート(VC)、ビニルエチレンカーボネート(VEC)、ジメチルビニレンカーボネート(DMVC)、フッ素化エチレンカーボネート(FEC)から選ばれる少なくとも一つの添加剤である請求項1に記載の非水電解液。
【請求項3】
前記第2の添加剤が、プロパンサルトン(PS)およびヒドロキシプロパンスルトン(HOPS)から選ばれる少なくとも一つの添加剤である請求項1または2に記載の非水電解液。
【請求項4】
前記第1の添加剤がVCであり、第2の添加剤がプロパンサルトン(PS)である請求項3に記載の非水電解液。
【請求項5】
前記第1の添加剤がFECであり、第2の添加剤がPSである請求項3に記載の非水電解液。
【請求項6】
前記第1の添加剤がVCおよびVECであり、第2の添加剤がPSである請求項3に記載の非水電解液。
【請求項7】
前記リチウム塩がLi2B12F12であり、第1の添加剤がVCであり、第2の添加剤がPSである請求項3に記載の非水電解液。
【請求項8】
前記リチウム塩がLi2B12F12であり、第1の添加剤がVCであり、第2の添加剤がヒドロキシプロパンスルトン(HOPS)である請求項3に記載の非水電解液。
【請求項9】
前記リチウム塩がLi2B12F12であり、第1の添加剤がVCおよびVECであり、第2の添加剤がPSである請求項3に記載の非水電解液。
【請求項10】
前記リチウム塩がLi2B12F12であり、第1の添加剤がVCであり、第2の添加剤がPSおよびHOPSである請求項3に記載の非水電解液。
【請求項11】
前記リチウムを吸蔵放出可能な負極と、
リチウムを吸蔵放出可能な正極と、
前記負極と正極との間に配置されたセパレータと、
前記負極と正極との間に配置された非水電解液とを少なくとも含むリチウム二次電池であって;
前記非水電解液が、請求項1記載の非水電解液であることを特徴とするリチウム二次電池。
【請求項12】
前記非水電解液が第1の添加剤としてVCを、第2の添加剤としてプロパンサルトン(PS)を含む請求項11記載のリチウム二次電池。
【請求項13】
前記非水電解液が第1の添加剤としてFECを、第2の添加剤としてPSを含む請求項11記載のリチウム二次電池。
【請求項14】
前記非水電解液が第1の添加剤としてVCおよびVECを、第2の添加剤としてPSを含む請求項11記載のリチウム二次電池。
【請求項15】
前記非水電解液がリチウム塩としてLi2B12F12を、第1の添加剤としてVCを、第2の添加剤としてPSを含む請求項11記載のリチウム二次電池。
【請求項16】
前記非水電解液がリチウム塩としてLi2B12F12を、第1の添加剤としてVCを、第2の添加剤としてHOPSを含む請求項11記載のリチウム二次電池。
【請求項17】
前記非水電解液がリチウム塩としてLi2B12F12を、第1の添加剤としてVCを、第2の添加剤としてPSおよびHOPSを含む請求項11記載のリチウム二次電池。
【請求項18】
複数個直列または並列に接続されたリチウム二次電池を含むリチウム電池電源であって;
該リチウム二次電池が請求項11〜17のいずれかに記載のリチウム二次電池であることを特徴とするリチウム電池電源。
【請求項19】
前記負極が、リチウム金属、炭素質材料、スズとその合金、シリコンとその合金、ゲルマニウムとその合金、およびそのような材料の誘導体を含む、請求項11に記載のリチウム二次電池。
【請求項20】
前記炭素質材料が、アモルファス炭素、グラファイト(天然および人造)から選ばれる請求項19に記載のリチウム二次電池。
【請求項21】
前記誘導体が、リチウムチタネートである請求項19または20に記載のリチウム二次電池。
【請求項22】
前記負極が、炭素質材料を含む請求項19〜21のいずれかに記載のリチウム二次電池。
【請求項23】
前記炭素質材料が、硬質炭素またはグラファイトである請求項22に記載のリチウム二次電池。
【請求項24】
前記炭素質材料が、グラファイトである請求項23に記載のリチウム二次電池。
【請求項25】
前記正極が、リチウム鉄リン酸塩、LiFePO4、LiNi1−xCoxO2およびリチウム・マンガン尖晶石(スピネル)LiMn2O4のうちの少なくとも1つを含む請求項11に記載のリチウム二次電池。
【請求項26】
前記正極が、リチウム・マンガン尖晶石(スピネル)LiMn2O4を含む請求項25に記載のリチウム二次電池。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−157437(P2010−157437A)
【公開日】平成22年7月15日(2010.7.15)
【国際特許分類】
【出願番号】特願2008−335160(P2008−335160)
【出願日】平成20年12月26日(2008.12.26)
【出願人】(506224034)エアープロダクツジャパン株式会社 (1)
【Fターム(参考)】
【公開日】平成22年7月15日(2010.7.15)
【国際特許分類】
【出願日】平成20年12月26日(2008.12.26)
【出願人】(506224034)エアープロダクツジャパン株式会社 (1)
【Fターム(参考)】
[ Back to top ]

