非水電解質二次電池およびその製造方法
【課題】電池の内部抵抗増加を抑制しつつ、優れたサイクル特性と高い信頼性を有する非水電解質二次電池を提供する。
【解決手段】本発明の非水電解質二次電池は、正極1と、負極2と、正極1と負極2との間に配置されたセパレータ3と、非水電解質15と、を備える。負極2は、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含んでいる。励起X線源として単結晶分光Al−Kα線を用いた、半充電状態の負極2のX線光電子分光スペクトルが、次式(1)を満たす:6<(IF/IC)≦21・・・(1)(式(1)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。)
【解決手段】本発明の非水電解質二次電池は、正極1と、負極2と、正極1と負極2との間に配置されたセパレータ3と、非水電解質15と、を備える。負極2は、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含んでいる。励起X線源として単結晶分光Al−Kα線を用いた、半充電状態の負極2のX線光電子分光スペクトルが、次式(1)を満たす:6<(IF/IC)≦21・・・(1)(式(1)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、非水電解質二次電池およびその製造方法に関し、特に非水電解質リチウムイオン二次電池およびその製造方法に関する。
【背景技術】
【0002】
近年、高エネルギー密度の蓄電デバイスとして、リチウム一次電池、リチウムイオン二次電池、リチウムポリマー二次電池などが実用化されている。
【0003】
中でも、リチウムイオン二次電池は、モバイル機器の電源としてだけでなく、ハイブリッド自動車および電気自動車、また家庭用蓄電などの用途での蓄電池としても注目され、開発が進められている。これらの用途では、低温や高温などの過酷な環境下で使用される場合もあり、そのような状況での急速充放電特性や長期にわたる信頼性が要求される。
【0004】
リチウムイオン二次電池は、正極および負極にリチウムイオンを吸蔵放出可能な材料を用い、電気的な接触を防ぐためのセパレータとリチウムイオン伝導性の電解質とを介して、正極および負極を互いに対向させた構成を有している。電池内では電解質を通して、充電時には正極からリチウムイオンを放出し負極で吸蔵、逆に放電時には正極が負極から放出されたリチウムイオンを吸蔵する反応が起こっている。この時、外部回路を通して電池内部でのリチウムイオンの移動に相当する電子の受け渡しを行って、充放電が行われている。
【0005】
従来、リチウムイオンの吸蔵放出が可能な負極活物質として、炭素系の材料が一般に用いられている。しかしながら、炭素材料を用いた負極では、リチウムイオンの吸蔵放出の反応電位が0.1V(vs.Li/Li+)以下と低く、リチウムの溶解析出電位に近いため、特に反応性の低下する低温環境下での急速充電時において負極表面への金属リチウムの析出が起こりやすい。負極上への金属リチウムの析出は、内部短絡の原因となるだけでなく、不働体化することで容量低下の原因ともなり、電池の動作不良や性能劣化を引き起こす可能性がある。
【0006】
そこで、炭素材料に代わる負極活物質としてチタン酸リチウムをはじめとする酸化物系材料の検討が行われている。チタン酸リチウムは、正極活物質として用いられるマンガン酸リチウムと同様のスピネル型の結晶構造を有する複合酸化物であり、可逆的にリチウムイオンの吸蔵放出をさせることができる。チタン酸リチウムは、マンガン酸リチウムとは異なり、約1.5V(vs.Li/Li+)と低い電位で可逆的にリチウムと反応するので、負極活物質として用いることができる。また、この電位での充放電反応時の体積変化が非常に小さいので、チタン酸リチウムは、充放電を繰り返す二次電池用の電極材料として優れた特性を有することが期待できる。
【0007】
このチタン酸リチウムをリチウムイオン二次電池の負極活物質として用いることが、既に提案されている。具体的には、一般式LiaTi3-aO4(式中、aは0<a<3の数を示す)で表されるチタン酸リチウム化合物を負極に用い、一般式:LiCobNi1-bO2(0≦b≦1)、LiAlcCodNia-c-dO2(0≦c≦1、0≦d≦1、0≦c+d≦1)、で表される化合物を正極に用いた非水二次電池が提案されている。
【0008】
同時に、チタン酸リチウムは、リチウムとの反応電位が約1.5V(vs.Li/Li+)と、リチウムの溶解析出電位よりも十分に貴である。このことから、チタン酸リチウムは、上述の炭素材料の様な金属リチウムの析出を抑制することができ、電池の信頼性をより高めることができる。
【0009】
また、炭素材料を用いた負極では、その反応電位の低さから非水電解質を還元分解して表面に反応生成物から成る被膜を形成する。この被膜は、初期充放電時に形成されると、その後の非水電解質との過剰な反応などの副反応を抑制する効果があり、炭素材料を用いる上で必要な反応である。しかし、その抑制効果は完全なものではなく、微量ではあるが副反応は継続的に起こる。そのため、充放電を繰り返し長期にわたって電池を使用する場合には、たとえ微少量であっても継続的に起こる反応の影響が大きく現れ、電池の可逆容量の低下や内部抵抗の増加による出力特性の劣化を招く。
【0010】
ところが、チタン酸リチウムを負極活物質に用いた場合には、反応電位が高いため非水電解質の還元分解が起こり難く、上述のような劣化の抑制にも効果がある。
【0011】
しかしながら、チタン酸リチウムを負極活物質として用いた場合でも、すべての副反応が完全に抑制できるわけではなく、例えば高温環境下で放置した場合には副反応による電池の内部抵抗増加は無視できない水準となってしまう。
【0012】
この課題を解決するため、特許文献1ではフッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を用いることを提案している。特許文献1ではチタン酸リチウム粒子表面のフッ化物層の量を、X線光電子分光スペクトルでの特定のピーク強度を用いて下記式(1)で規定している。
3.2≦(F1/C1)≦6 ・・・(1)
但し、F1は、680〜687eVに現れる第1のピークの強度であり、C1は、280〜290eVに現れる第2のピークの強度である。
【0013】
フッ化リチウムは、チタン酸リチウムのリチウムとの反応電位において安定であるだけでなく、フッ化リチウム以外の酸化物などの化合物よりもリチウムイオン伝導性が良好である。そのため、上述のような負極を用いることで、チタン酸リチウム表面に存在する、フッ化リチウムを含むフッ化物層により、高温貯蔵時の副反応を抑制し電池抵抗の増加を抑制することができるとしている。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】特開2010−231960号公報
【発明の概要】
【発明が解決しようとする課題】
【0015】
しかし、特許文献1の方法では実施例に開示されているような55℃の環境下で1ヶ月放置した後の電池内部抵抗の抑制効果は得られるが、例えば充放電サイクルを繰り返した際の容量劣化を抑制することができない。
【0016】
本発明はこのような従来技術の課題を改善し、サイクル特性にも優れた非水電解質二次電池およびその製造方法を提供することを目的とする。
【課題を解決するための手段】
【0017】
本発明の非水電解質二次電池は、
正極と、
負極と、
前記正極と前記負極との間に配置されたセパレータと、
非水電解質と、
を備え、
前記負極は、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含んでおり、
励起X線源として単結晶分光Al−Kα線を用いた、半充電状態の前記負極のX線光電子分光スペクトルが、下記式(2)を満たす。
6<(IF/IC)≦21 ・・・(2)
式(2)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。
【0018】
本発明は、また、
(I)チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を形成する工程と、
(II)正極と、セパレータと、前記工程(I)で得られた前記負極とを用いて、前記セパレータが前記負極と前記正極との間に配置された電極群を作製し、前記電極群に非水電解質を含浸させる工程と、
を含む、非水電解質二次電池の製造方法も提供する。
【発明の効果】
【0019】
本発明の非水電解質二次電池は、X線光電子分光スペクトルにおいて上記式(2)を満たすような、フッ化リチウムを含むフッ化物層を粒子表面に有するチタン酸リチウムを含む負極を用いている。これにより、充放電サイクルを繰り返した場合の副反応の発生を抑制し、サイクル劣化を低減することができる。このように、本発明の非水電解質二次電池は、電池の内部抵抗増加を抑制しつつも、優れたサイクル特性と高い信頼性を有する。
【図面の簡単な説明】
【0020】
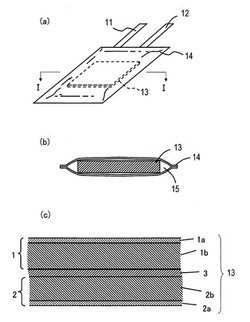
【図1】(a)は、本発明の非水電解質二次電池の一実施形態であるリチウムイオン二次電池を示す斜視図であり、(b)は、図1(a)のI−I線に沿った断面図であり、(c)は、図1(a)および(b)に示す電極群13を拡大して示す断面図である。
【図2】実施例1で作製した正極1の寸法を示す図である。
【図3】実施例1で作製した負極2の寸法を示す図である。
【図4】実施例4で作製した電池A4の負極を測定したX線光電子分光スペクトルであり、680〜687eVの範囲を示す図である。
【図5】実施例4で作製した電池A4の負極を測定したX線光電子分光スペクトルであり、280〜290eVの範囲を示す図である。
【発明を実施するための形態】
【0021】
X線光電子分光スペクトルにおいて下記式(2)を満たすような、フッ化リチウムを含むフッ化物層を粒子表面に有するチタン酸リチウムを負極活物質として用いることによって、電池のサイクル劣化を抑制することが可能である。
6<(IF/IC)≦21 ・・・(2)
式(2)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。
【0022】
この観点で、チタン酸リチウムの粒子表面のフッ化物層に関する検討を行い、本発明に至った。以下、本発明の実施形態を詳細に説明する。なお、以下の実施形態は本発明の一例であり、本発明は以下の実施形態に限定されない。
【0023】
まず、本発明の非水電解質二次電池の一実施形態であるリチウムイオン二次電池について、その一構成例を説明する。
【0024】
図1(a)は、本実施形態のリチウムイオン二次電池の斜視図である。図1(b)は、図1(a)におけるI−I線に沿った断面を示している。
【0025】
図1(a)および(b)に示すように、本実施形態のリチウムイオン二次電池は、電極群13と、電極群13を収納する電池ケース14と、電池ケース14内に充填された非水電解液(非水電解質)15とを備える。電極群13における正極は、正極リード11に接続されている。電極群13における負極は、負極リード12に接続されている。正極リード11および負極リード12は、電池ケース14の外部に引き出されている。
【0026】
非水電解液15は、一般にリチウムイオン二次電池に用いられるものであればよい。例えば、エチレンカーボネート(EC)(市販バッテリーグレード)とエチルメチルカーボネート(EMC)(市販バッテリーグレード)とが、25:75の比率で混合された非水溶媒を、非水電解液15に用いることができる。この非水溶媒に、支持電解質塩として、例え1mol/Lの濃度でLiPF6(市販バッテリーグレード)が溶解されている溶液を、非水電解液15として用いることができる。本実施形態では、非水電解液15の一例として、上記非水溶媒および上記支持電解質塩の組み合わせを用いたが、一般にリチウムイオン二次電池に用いられる組み合わせであれば、他の組み合わせを用いてもよい。例えば、プロピレンカーボネートおよびフルオロエチレンカーボネートなどの環状カーボネート、および、ジメチルカーボネートおよびジエチルカーボネートなどの鎖状カーボネートが、非水溶媒として使用可能である。また、ガンマブチロラクトンなどの環状エステル、および、メチルプロピオネートなどの鎖状エステルを、非水溶媒として用いてもよい。支持電解質塩としても、四フッ化ホウ酸リチウムなど、リチウムイオン電池用電解液の支持電解質塩として用いることができるリチウム塩であれば、他のリチウム塩を用いてもよい。もちろん、これらの非水溶媒および支持電解質塩に限定されない。
【0027】
図1(c)は電極群13の断面を拡大して示している。図1(c)に示すように、電極群13は、正極1と、負極2と、正極2と負極2との間に設けられたセパレータ3とを備えている。正極1は、例えば、アルミニウム箔からなる正極集電体1aと、正極集電体1aの表面に配置されたコバルト酸リチウム(LiCoO2)を含有する正極合剤層1bとを有している。一方、負極2は、例えば、アルミニウム箔からなる負極集電体2aと、負極集電体2aの表面に配置されたチタン酸リチウム(Li4Ti5O12)を含有する負極合剤層2bとを有している。セパレータ3は、例えばポリエチレン製の微多孔質シートからなる。
【0028】
正極合剤層1bの正極活物質としては、LiCoO2以外のリチウム含有遷移金属酸化物を用いてもよい。例えば、LixCoO2、LixNiO2、LixMnO2、LixCoyNi1-yO2、LixCoyM1-yOz、LixNi1-yMyOz、LixMn2O4、LixMn2-yMyO4(Mは、Na、Mg、Sc、Y、Mn、Fe、Co、Ni、Cu、Zn、Al、Cr、Pb、SbおよびBから選択される少なくとも一種である。x、yおよびzは、x=0〜1.2、y=0〜0.9、z=1.7〜2.3を満たす。)が挙げられる。これらの材料以外でも、充電時の正極1の電位がリチウム基準で4Vを超えるような材料であれば、正極活物質として使用できる。また、正極活物質として、複数の異なった材料を混合して用いてもよい。正極活物質が粉末である場合には、平均粒径は特に限定はされないが、例えば0.1〜30μmの平均粒径を有する粉末が好ましい。正極合剤層1bは、通常50〜200μm程度の厚さを有するが、特に厚さに制約はない。正極合剤層1bは、0.1〜50μmの厚さを有していてもよい。なお、ここでいう平均粒径とは、レーザー回折・散乱法を用いた粒度分布測定装置で測定された値である。
【0029】
正極合剤層1bは、前記酸化物以外の導電剤および結着剤の両方を含んでいてもよいし、いずれか一方のみを含んでいてもよい。または、正極合剤層1bは、導電剤および結着剤のいずれも含んでおらず、正極活物質のみから構成されていてもよい。
【0030】
正極合剤層1b用の導電剤は、正極1の充放電電位において、化学変化を起こさない電子伝導性材料であれば何でもよい。例えば、黒鉛類、カ−ボンブラック類、炭素繊維および金属繊維などの導電性繊維類、金属粉末類、導電性ウィスカー類、導電性金属酸化物、または、有機導電性材料などを単独で用いてもよいし、これらの混合物として用いてもよい。導電剤の添加量は、特に限定されないが、正極活物質に対して1〜50重量%が好ましく、特に1〜30重量%が好ましい。
【0031】
正極合剤層1bに用いられる結着剤には、熱可塑性樹脂および熱硬化性樹脂を用いることができる。好ましい結着剤としては、例えば、ポリエチレンおよびポリプロピレンなどのポリオレフィン樹脂、ポリテトラフルオロエチレン(PTFE)、ポリフッ化ビニリデン(PVdF)およびヘキサフルオロプロピレン(HFP)などのフッ素系樹脂およびその共重合体樹脂、ポリアクリル酸およびその共重合体樹脂などである。
【0032】
導電剤および結着剤の他にも、フィラー、分散剤、イオン伝導体、圧力増強剤およびその他の各種添加剤を用いることができる。フィラーは、リチウムイオン二次電池内で化学変化を起こさない繊維状材料であれば何でもよい。
【0033】
正極集電体1aの材料は、正極1の充放電電位において化学変化を起こさない電子伝導体であれば何でもよい。例えば、ステンレス鋼、アルミニウム、チタン、炭素および導電性樹脂などを用いることができる。また、正極集電体1aの表面には、表面処理により凹凸を付けることが望ましい。形状は、フォイルの他、フィルム、シート、ネット、パンチングメタル、エキスパンドメタル、多孔質体、発泡体、繊維群、不織布体、およびそれらの成形体などのいずれであってもよい。正極集電体1aの厚さは、特に限定されないが、一般には1〜500μmである。
【0034】
負極合剤層2bに含まれる負極活物質は、本発明において負極活物質として特定された、フッ化リチウムを含むフッ化物層を粒子表面に有するチタン酸リチウムを含有する。負極活物質の詳細は、後述する。
【0035】
負極集電体2aとしては、アルミニウム箔が好ましいが、例えば、銅箔やニッケル箔、ステンレス箔などを用いてもよい。また、前記の正極集電体1aと同様の形状であってもよい。
【0036】
セパレータ3としては、ポリエチレン製の微多孔質シートだけでなく、ポリプロピレン製の微多孔質シート、不織布シート、セルロース繊維を用いて抄紙したシート、およびこれらを複合化させたシートを用いることができる。もちろん、これら以外にも、リチウムイオン二次電池のセパレータとして用いることが可能な材料を使用することができる。
【0037】
なお、本実施形態では、シート型のリチウムイオン二次電池を一例として説明したが、本実施形態のリチウムイオン二次電池は、他の形状を有していてもよい。例えば、本実施形態のリチウムイオン二次電池は、円筒形および角形形状を有していてもよい。また、電気自動車等に用いる大型の形状を有していてもよい。
【0038】
本実施形態のリチウムイオン二次電池は、携帯情報端末、携帯電子機器、家庭用小型電力貯蔵装置、自動二輪車、電気自動車、ハイブリッド電気自動車等に用いることができる。また、これら以外の機器にも用いることができる。
【0039】
次に、本実施形態のリチウムイオン二次電池において、負極活物質として使用されるチタン酸リチウムについて説明する。チタン酸リチウムは、リチウムとの反応電位が約1.5V(vs.Li/Li+)である。この反応電位は、リチウム金属および炭素材料のリチウムとの反応電位よりも高い。このため、チタン酸リチウムが用いられた負極では、電極表面にリチウム金属の析出が起こりにくいだけでなく、非水電解質の還元分解の反応が生じにくいといった特徴がある。しかしながら、チタン酸リチウムが用いられた負極は、副反応を完全に抑制できるものではなく、充放電サイクルの繰り返しに時には副反応の影響が顕著となって、サイクルに伴う容量劣化が生じる。充放電反応を繰り返す場合は、例えば充電状態で貯蔵する場合とは異なり、負極活物質表面と電解質との界面部分で、リチウムイオンの授受を伴う反応が起こる。この時、一般に広く用いられているカーボネート系溶媒を含む電解液中では、充電時にはリチウムイオンは溶媒分子で溶媒和された形態で負極活物質表面に到達し、負極活物質とのリチウムイオンの受け渡しが行われる。このような反応の際に、溶媒分子と負極活物質表面との間での副反応が起こりやすく、副反応生成物の蓄積がサイクル劣化の原因となると考えられる。
【0040】
負極活物質として含まれるチタン酸リチウム粒子の表面に、フッ化リチウムを含むフッ化物層を存在させることにより、溶媒分子とチタン酸リチウムとの直接的な接触が抑制される。その結果、上記の副反応の発生を低減させることが可能となる。フッ化リチウムは非常に安定な化合物であるため、チタン酸リチウムの反応電位において、それ自身が分解や副反応を起こすことがない。また、酸化物などのフッ化リチウム以外の化合物に比べてリチウムイオン伝導性が良好であるため、充放電反応に及ぼす影響も比較的小さい。
【0041】
ただし、フッ化リチウムを含むフッ化物層の存在量が多すぎる場合には、その影響が大きくなり、チタン酸リチウムの充放電反応を阻害してしまうため好ましくない。X線光電子分光スペクトルでのピーク強度で表される、フッ化リチウムを含むフッ化物層の存在量の適正な範囲は、以下式(2)で示される。
6<(IF/IC)≦21 ・・・(2)
式(2)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。
【0042】
IF/ICの値がこの範囲よりも小さい場合には、サイクル劣化の抑制効果が十分ではない。また、IF/ICの値がこの範囲よりも大きい場合には、フッ化物層による充放電反応の阻害が著しく、十分な充放電特性が得られない。特に、高率充放電において性能の低下が大きい。より詳しく説明すると、(IF/IC)が6以下の場合には、1ヶ月程度の高温環境下での貯蔵では電池抵抗の増加抑制効果が得られるが、副反応抑制の効果は十分ではなくサイクル劣化抑制の効果は小さい。しかしながら、(IF/IC)が21を超える場合には、粒子表面でのフッ化物の存在量が多すぎてしまい、反応抵抗が上昇するため十分な充放電特性が得られない。
【0043】
フッ化リチウムを含むフッ化物層の存在量は、上述のようにX線光電子分光スペクトルを用いて定量することができる。本実施形態では、作製した電池を1回充放電して動作容量を確認し、続いて再度充電した後に動作容量の半分まで0.05Cで放電した状態での負極用いて、X線光電子分光スペクトル測定を行った。この負極の状態を半充電状態とする。X線光電子分光スペクトルの測定装置には、ULVAC−PHI、Inc.製の「PHI Quantera SXM」を用いた。X線源には、単結晶分光Al−Kα線(1486.6eV)を用いた。出力は、15kV/25Wとした。光電子取り出し角は、45°とした。分析面積は、300μm×800μmとした。スキャンは、0.10eV/stepとした。ただし、測定装置および条件は、これらに限定されない。
【0044】
なお、680〜687eVに現れるピークは、Li−FのF1sに起因するピークである。また、280〜290eVに現れるピークは、C−O、C−CおよびC−HのC1sに起因するピークである。
【0045】
なお、半充電状態は、正確に動作容量の50%を満充電状態から放電した状態に限られるわけではなく、50%を中心に±20%程度の範囲で放電した状態であればよい。
【0046】
次に、本実施形態のリチウムイオン二次電池の製造方法、特に負極の製造方法について説明する。
【0047】
本実施形態のリチウムイオン二次電池は、
(I)チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を形成する工程と、
(II)正極と、セパレータと、前記工程(I)で得られた前記負極とを用いて、前記セパレータが前記負極と前記正極との間に配置された電極群を作製し、前記電極群に非水電解質(非水電解液)を含浸させる工程と、
を含む方法によって製造することができる。
【0048】
このように、本実施形態では、事前に形成された、フッ化物層を表面に有するチタン酸リチウム粒子を含む負極2を用い、これを正極1、セパレータ3および非水電解質(非水電解液15)と組み合わせることによって、形成される。負極2は、チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、形成される。具体的には、例えば、負極2に対して事前にフッ化リチウムを含むフッ化物層を形成するための処理を行った後、これを正極1およびセパレータ3と組み合わせて電極群13とし、電極群13を電池ケース14内に挿入して非水電解液15を注入して密封することによって、本実施形態のリチウムイオン二次電池が得られる。
【0049】
チタン酸リチウム粒子の表面にフッ化リチウムを含むフッ化物層を形成するための処理方法としては、上記のとおり、主としてチタン酸リチウムを含有する極板を、フッ酸および非水溶媒を含む処理液に浸漬する方法を用いることができる。この方法の一例として、チタン酸リチウムを含有する極板を、フッ素を含有するリチウム塩と非水溶媒とを含有する処理液に浸漬し、かつ加熱する方法が挙げられる。より具体的な例としては、例えば、六フッ化リン酸リチウムが溶解したカーボネート溶液中に極板を投入し、加熱処理を行う。六フッ化リン酸リチウムが溶解したカーボネート溶液を加熱することで、溶液中に不純物として含まれる微量の水分と六フッ化リン酸リチウムが反応し、フッ酸が生成する。このフッ酸が、チタン酸リチウム粒子表面に存在している酸化リチウム、水酸化リチウムおよび炭酸リチウムなどのリチウム含有の不純物成分と反応することによって、フッ化リチウムを含むフッ化物層が形成される。本実施形態では、電気化学的な反応ではなく、化学反応によってフッ化リチウムを含むフッ化物層が形成される。このため、フッ化物層の存在量は、処理に用いるカーボネート溶液の六フッ化リン酸リチウム濃度、この溶液における水分の添加量、加熱処理条件などにより、生成するフッ酸量を増減させることによって、容易に制御することができる。もちろん、直接フッ酸を添加してもよく、その添加量により反応量を制御することも可能である。
【0050】
また、チタン酸リチウム粒子表面に存在する、リチウム含有の不純物成分量を制御することにより、生成するフッ化リチウムを含むフッ化物層の量を増減させることも可能である。チタン酸リチウム粒子表面に存在するリチウム含有の不純物成分の量は、チタン酸リチウム合成時のリチウム原料投入比率により制御可能である。また、合成後の粉末に、メカニカルミリング等の方法により、粒子レベルでリチウム含有化合物を混合してもよいし、リチウム含有化合物の溶液もしくは分散液を用いたスプレードライ法や流動層造粒法により混合してもよい。
【0051】
処理後、負極を、六フッ化リン酸リチウムおよびフッ酸を含まない非水溶媒で洗浄して、六フッ化リン酸リチウムおよびフッ酸などを除去する。その後、乾燥させた負極を、電池作製に用いることができる。これにより、溶液中に残留しているフッ酸、水分およびフッ化物層形成時の反応副生成物などの不純物が、電池内で、負極活物質とだけでなく正極活物質などとも副反応を起こして、電池性能劣化の原因となることを抑制することができる。したがって、事前にチタン酸リチウム粒子の表面にフッ化リチウムを含むフッ化物層を形成した本実施形態の方法によれば、電池の電解液中にフッ酸および/または水分を添加することによりフッ化物層を形成する電池と比較して、電池性能の劣化を抑制しつつもフッ化物層の存在量を容易に制御することができる。本発明者らは、フッ化物層を形成するまでの工程が全く同じである極板を2つ準備し、一方の極板(A)には、予め準備された処理液を用いて事前に所定量のフッ化物層を形成する処理を行い、他方の極板(B)については、電池の電解液中にフッ酸および/または水分を添加して極板(B)にフッ化物層を電気化学的な反応により形成させる、という実験を行った。フッ化物層を形成する方法以外、例えば形成するフッ化物層の量などは、極板(A)および極板(B)で同じにした。このようにして得られた各負極を用いて同じ条件で電池を作製し、そのサイクル特性を評価したところ、極板(A)が用いられた電池は、極板(B)が用いられた電池よりも、150サイクル後容量維持率が20%程度高かった。なお、サイクル特性の評価には、後述する実施例でのサイクル特性と同じ評価方法が用いられた。
【0052】
なお、フッ化物層の形成のための処理液や、処理後の洗浄に用いる非水溶媒には、一般にリチウムイオン電池の電解液溶媒として用いられるプロピレンカーボネート、ジエチルカーボネート、エチルメチルカーボネートおよびジエチルカーボネートなどの溶媒を、単体および混合して用いることができるが、これらに限定されるものではない。
【0053】
また、本実施形態では、チタン酸リチウム粒子の表面にフッ化リチウムを含むフッ化物層を形成する手法の一例を示したが、これらの方法に限定されるものではない。しかし、上記に説明したように、チタン酸リチウム粒子の表面に存在するリチウム含有化合物から成る不純物成分を、非水溶媒中でフッ酸と反応させてフッ化リチウムを含むフッ化物層を形成させたチタン酸リチウムを負極活物質として用いることで、サイクル特性のより優れたリチウムイオン二次電池を得ることができる。
【0054】
本発明では、フッ化物層の定量を、平均的な状態である半充電状態での負極のX線光電子分光スペクトルを用いて行うこと定義している。しかし、本実施形態で示すような化学的な反応により形成されたフッ化物層であれば、充放電の状態には大きく影響を受けないので、半充電状態でない負極で測定を行っても同様の結果が得られる可能性が高い。
【実施例】
【0055】
以下に本発明の実施例を詳細に説明する。
【0056】
1.電池の作製
(実施例1)
<正極の作製>
まず、正極活物質としてLiCoO2(平均粒径10μm、BET法による比表面積0.38m2/g)を準備した。正極活物質として用いたLiCoO2の調製法は以下の通りである。
【0057】
硫酸コバルト飽和水溶液を低速で撹拌しながら水酸化ナトリウムを溶解したアルカリ溶液を滴下して、Co(OH)2の沈殿を得た。この沈殿物をろ過、水洗した後、空気中で80℃に加熱することにより乾燥した。得られた水酸化物の平均粒径は、約10μmであった。
【0058】
次に、得られた水酸化物に対して、空気中で380℃の熱処理を10時間行うことにより、酸化物Co3O4を得た。粉末X線回折により、得られた酸化物が単一相を有することを確認した。
【0059】
さらに、得られた酸化物に、Coのモル数とLiのモル数との比が1.00:1.00になるように炭酸リチウムの粉末を混合し、乾燥空気中で1000℃の熱処理を10時間行うことにより、目的とするLiCoO2を得た。得られたLiCoO2を用いて粉末X線回折(リガク製)を行い、六方晶層状構造からなる単一相の回折パターンであることを確認した。粉砕および分級の処理を行った後、走査型電子顕微鏡(日立ハイテクノロジーズ製)による観察から、粒径が10〜15μm程度であることを確認した。なお、平均粒径は、レーザー回折・散乱式粒度分布測定装置(HORIBA製)を用いて求めた。
【0060】
次に、得られたLiCoO2粉末を用いて正極を作製した。LiCoO2と、導電剤であるアセチレンブラック(AB)、および結着剤であるポリフッ化ビニリデン(PVdF)を重量比でLiCoO2:AB:PVdF=100:3:4となるように秤量し、適量のN−メチル−2−ピロリドンを加えて攪拌・混合し、スラリー状の正極合剤を得た。
【0061】
次に、図2に示すように、厚さ20μmのアルミニウム箔からなる集電体1aの片面に、前記スラリー状の正極合剤を塗布し、塗膜を乾燥し、ローラーで圧延することによって、正極合剤層1bを得た。
【0062】
得られた極板を、図2に示す寸法に打ち抜いて、リード取り付け部であるタブの部分の正極合剤層1bを剥離して、正極1を得た。正極合剤層1bが設けられた正極集電体1aは、30mm×40mmの長方形状を有していた。
【0063】
<電解液の調製>
まず、混合溶媒を調製した。エチレンカーボネート(EC)とエチルメチルカーボネート(EMC)とを、体積比でEC:EMC=1:3となるように混合した。この混合溶媒に、1.0Mの濃度となるように六フッ化リン酸リチウム(LiPF6)を加えて溶解し、電解液を得た。
【0064】
<負極の作製>
まず、負極活物質としてLi4Ti5O12(平均粒径≦1μm、BET法による比表面積4m2/g)を準備した。負極活物質として用いたLi4Ti5O12の調製法は以下の通りである。なお、ここでの平均粒径は、レーザー回折・散乱法を用いた粒度分布測定装置で測定した値である。
【0065】
市販試薬であるLiOH・H2OとTiO2の原料粉末を、Li/Tiのモル混合比が化学量論比よりもややLi過剰となるように秤量し、これらを乳鉢で混合した。原料のTiO2には、アナターゼ型の結晶構造を有し、平均粒径が約0.3μmのものを用いた。
【0066】
混合後の原料粉末をAl2O3製のるつぼに入れ、大気雰囲気中で850℃の熱処理を12時間行うことで、目的とするLi4Ti5O12を得た。
【0067】
熱処理後の材料をるつぼから取り出して乳鉢にて粉砕し、Li4Ti5O12の粗粉末を得た。得られたLi4Ti5O12粗粉末の粉末X線回折(リガク製)測定を行ったところ、スピネル型構造からなる単相の回折パターンが得られた。さらに、Li/Tiモル比率をICP発光分光分析法(Thermo Fisher Scientific製)により分析したところLi/Ti=4.2/5.0であった。
【0068】
続いて、得られたチタン酸リチウムを用いて、ジェットミル粉砕および分級の処理を行った。得られた粉末は、走査型電子顕微鏡(日立ハイテクノロジーズ製)による観察から、粒径が0.7μm程度の単粒子に粉砕されていることを確認した。
【0069】
次に、上記の方法により得られたLi4Ti5O12粉末を用いて負極を作製した。Li4Ti5O12と、導電剤である気相成長炭素繊維(VGCF)と、結着剤であるポリフッ化ビニリデンとを、重量比で、Li4Ti5O12:VGCF:PVdF=100:7:5となるように秤量し、適量のN−メチル−2−ピロリドンを加えて、攪拌・混合し、スラリー状の負極合剤を得た。
【0070】
次に、図3に示すように、厚さ20μmのアルミニウム箔からなる集電体2aの片面に、前記スラリー状の負極合剤を塗布し、塗膜を乾燥し、ローラーで圧延することによって、負極合剤層2bを得た。
【0071】
得られた極板を、図3に示す寸法に打ち抜いて、リード取り付け部であるタブの部分の負極合剤層2bを剥離して、負極2を得た。負極合剤層2bが設けられた負極集電体2aは、30mm×40mmの長方形状を有していた。
【0072】
<負極の処理>
上述の方法で作成した負極を用い、六フッ化リン酸リチウム(LiPF6)がプロピレンカーボネート(PC)に溶解した溶液(処理液)を用いて処理を行った。処理液は、LiPF6を1.0Mの濃度でPCに溶解させることによって調製された。作製した負極と調製した処理液3mLをポリプロピレン製の容器に入れて密閉し、85℃の環境下で15時間放置した。その後、容器を開封して取り出した負極を、エチルメチルカーボネートを用いて洗浄し、十分に乾燥した。
【0073】
<組み立て>
得られた正極1および負極2を、セパレータ3を介して積層し、図1(c)に示すような電極群13を作製した。セパレータとしては、厚さ20μmのポリエチレン製微多孔質シートを用いた。
【0074】
次に、図1(a)に示すように、電極群13の正極1にアルミニウム製正極リード11を、負極2にニッケル製負極リード12を溶接した。その後、電極群13を、3方向が開口している厚さ0.12mmのアルミラミネートフィルム製電池ケース14の内部に収容し、ポリプロピレン製のテープで電池ケース14の内面に固定した。正極リード11および負極リード12が出ている開口部を含む開口部を熱溶着し、1つの開口部のみを熱溶着せずに残して、電池ケース14を袋状とした。熱溶着していない開口部から、電解液15を注入し、減圧および脱気後、減圧状態で開口部を熱溶着することにより、電池内部を密封した。組み立てた電池を2.7Vで充電した時の設計容量は40mAhである。作製した電池を電池A1とする。
【0075】
(実施例2)
負極の処理方法が異なる以外は、実施例1と同様の方法で電池A2を作製した。負極の処理は、LiPF6がPCに溶解した溶液(処理液)を用いて行った。LiPF6を2.0Mの濃度でPCに溶解させて処理液を得た。作製した負極と調製した処理液3mLとをポリプロピレン製の容器に入れて密閉し、85℃の環境下で15時間放置した。その後、容器を開封して取り出した負極を、EMCを用いて洗浄し、十分に乾燥した。
【0076】
(実施例3)
負極の処理方法が異なる以外は、実施例1と同様の方法で電池A3を作製した。負極の処理は、LiPF6がPCに溶解した溶液(処理液)を用いて行った。LiPF6を1.0Mの濃度でPCに溶解させ、さらに重量比で500ppmの水を添加して、処理液を得た。作製した負極と調製した処理溶液3mLとをポリプロピレン製の容器に入れて密閉し、85℃の環境下で15時間放置した。その後、容器を開封して取り出した負極を、EMCを用いて洗浄し、十分に乾燥した。
【0077】
(実施例4)
負極の処理方法が異なる以外は、実施例1と同様の方法で電池A4を作製した。負極の処理は、LiPF6がPCに溶解した溶液(処理液)を用いて行った。LiPF6を2.0Mの濃度でPCに溶解させ、さらに重量比で500ppmの水を添加して、処理液を得た。作製した負極と調製した処理溶液3mLとをポリプロピレン製の容器に入れて密閉し、85℃の環境下で15時間放置した。その後、容器を開封して取り出した負極を、EMCを用いて洗浄し、十分に乾燥した。
【0078】
(比較例1)
負極の処理を行わなかった以外は、実施例1と同様の方法で電池B1を作製した。
【0079】
(比較例2)
負極の処理方法が異なる以外は、実施例1と同様の方法で電池B2を作製した。負極の処理は、LiPF6がPCに溶解した溶液(処理液)を用いて行った。LiPF6を2.0Mの濃度でPCに溶解させ、さらに重量比で500ppmの水を添加して、処理液を得た。作製した負極と調製した処理溶液3mLとをポリプロピレン製の容器に入れて密閉し、85℃の環境下で30時間放置した。その後、容器を開封して取り出した負極を、EMCを用いて洗浄し、十分に乾燥した。
【0080】
なお、実施例1、2、3および4と、比較例1および2での負極処理および電解液調製に用いた溶媒(EC、EMC、PC)、LiPF6は、いずれもリチウムバッテリーグレードの市販品を用いた。
【0081】
2.フッ化物層の定量
<X線光電子分光スペクトルの測定>
作製した各電池A1、A2、A3、A4、B1およびB2の負極を用いてX線光電子スペクトル測定を行った。
【0082】
25℃の環境下において、電流値2mAで2.7Vまで定電流充電を行った。その後、電流値2mAで1.5Vまで定電流放電を行い、設計容量で動作していることを確認した。
【0083】
次に、各電池を25℃の環境下で、電流値40mAで2.7Vまで定電流充電を行い、その後、電流値が2mAに減衰するまで、2.7Vで定電圧充電を行った。その後、電流値2mAで動作容量の50%の定容量放電を行って半充電状態とした。
【0084】
続いて、半充電状態の各電池を分解して負極を取り出し、EMCでよく洗浄した後、十分に乾燥させて、半充電状態の負極を得た。
【0085】
得られた各負極を用いて、X線光電子分光スペクトルの測定を行い、680〜687eVに現れるピークの強度IFと280〜290eVに現れるピークの強度IC、およびその強度比(IF/IC)の値を算出した結果を表1に示す。また、図4および図5に、電池A4の負極の測定で得られたX線光電子分光スペクトルを示す。
【0086】
3.電池の評価
<サイクル特性の評価>
作製した電池A1、A2、A3、A4、B1およびB2を用いて、サイクル特性の評価を行った。
【0087】
25℃の環境下において、電流値2mAで2.7Vまで定電流充電を行った。その後、電流値2mAで1.5Vまで定電流放電を行い、設計容量で動作していることを確認した。
【0088】
次に、各電池を、60℃の環境下で、電流値40mAで2.7Vまで定電流充電を行い、その後、電流値が2mAに減衰するまで、2.7Vで定電圧充電を行った。その後、電流値20mAで1.5Vまで定電流放電を行った。この条件で充放電を150回繰り返した後の容量から、150サイクル後容量維持率(150サイクル後容量維持率=150サイクル目放電容量/1サイクル目放電容量)を算出し、その百分率を表2に示す。なお、ここでは劣化をより加速させるため60℃の環境下での評価を行った。
【0089】
<高率放電特性の評価>
作製した各電池A1、A2、A3、A4、B1およびB2を用いて高率放電特性の評価を行った。
【0090】
25℃の環境下において、電流値2mAで2.7Vまで定電流充電を行った。その後、電流値2mAで1.5Vまで定電流放電を行い、設計容量で動作していることを確認した。このとき得られた放電容量を0.05C放電容量とした。
【0091】
次に、25℃の環境下で、電流値40mAで2.7Vまで定電流充電を行い、その後、電流値が2mAに減衰するまで、2.7Vで定電圧充電を行った。その後、電流値40mAで1.5Vまで定電流放電を行い、このとき得られた放電容量を1C高率放電容量とした。
【0092】
各電池の0.05C放電容量に対する1C高率放電容量の割合を1C高率放電特性(1C高率放電特性=1C高率放電容量/0.05C放電容量)とし、その百分率を表3に示す。
【0093】
表1、2、3で示すように、X線光電子分光スペクトル測定での(IF/IC)の値が6を超える場合には、150サイクル後容量維持率が95%以上となっており良好なサイクル特性が得られている。これは、フッ化リチウムを含むフッ化物層による副反応抑制の効果であると考えられる。(IF/IC)の値が6以下の比較例1では、150サイクル後容量維持率が90%未満であり、フッ化物層の量が少ないためにその効果が十分ではないと考えられる。しかしながら、(IF/IC)の値が21以上の比較例2では、1C高率放電特性の低下が著しく、フッ化物層の量が多すぎるために充放電反応が阻害されてしまっていると考えられる。
【0094】
【表1】

【0095】
【表2】

【0096】
【表3】

【産業上の利用可能性】
【0097】
本発明によれば、サイクル特性に優れ、良好な長期信頼性を示すリチウムイオン二次電池が実現できる。本発明は、特にチタン酸リチウムを負極活物質として用いるリチウムイオン二次電池に用いられる。
【符号の説明】
【0098】
1 正極
1a 正極集電体
1b 正極合剤層
2 負極
2a 負極集電体
2b 負極合剤層
3 セパレータ
11 正極リード
12 負極リード
13 電極群
14 電池ケース
15 電解液
【技術分野】
【0001】
本発明は、非水電解質二次電池およびその製造方法に関し、特に非水電解質リチウムイオン二次電池およびその製造方法に関する。
【背景技術】
【0002】
近年、高エネルギー密度の蓄電デバイスとして、リチウム一次電池、リチウムイオン二次電池、リチウムポリマー二次電池などが実用化されている。
【0003】
中でも、リチウムイオン二次電池は、モバイル機器の電源としてだけでなく、ハイブリッド自動車および電気自動車、また家庭用蓄電などの用途での蓄電池としても注目され、開発が進められている。これらの用途では、低温や高温などの過酷な環境下で使用される場合もあり、そのような状況での急速充放電特性や長期にわたる信頼性が要求される。
【0004】
リチウムイオン二次電池は、正極および負極にリチウムイオンを吸蔵放出可能な材料を用い、電気的な接触を防ぐためのセパレータとリチウムイオン伝導性の電解質とを介して、正極および負極を互いに対向させた構成を有している。電池内では電解質を通して、充電時には正極からリチウムイオンを放出し負極で吸蔵、逆に放電時には正極が負極から放出されたリチウムイオンを吸蔵する反応が起こっている。この時、外部回路を通して電池内部でのリチウムイオンの移動に相当する電子の受け渡しを行って、充放電が行われている。
【0005】
従来、リチウムイオンの吸蔵放出が可能な負極活物質として、炭素系の材料が一般に用いられている。しかしながら、炭素材料を用いた負極では、リチウムイオンの吸蔵放出の反応電位が0.1V(vs.Li/Li+)以下と低く、リチウムの溶解析出電位に近いため、特に反応性の低下する低温環境下での急速充電時において負極表面への金属リチウムの析出が起こりやすい。負極上への金属リチウムの析出は、内部短絡の原因となるだけでなく、不働体化することで容量低下の原因ともなり、電池の動作不良や性能劣化を引き起こす可能性がある。
【0006】
そこで、炭素材料に代わる負極活物質としてチタン酸リチウムをはじめとする酸化物系材料の検討が行われている。チタン酸リチウムは、正極活物質として用いられるマンガン酸リチウムと同様のスピネル型の結晶構造を有する複合酸化物であり、可逆的にリチウムイオンの吸蔵放出をさせることができる。チタン酸リチウムは、マンガン酸リチウムとは異なり、約1.5V(vs.Li/Li+)と低い電位で可逆的にリチウムと反応するので、負極活物質として用いることができる。また、この電位での充放電反応時の体積変化が非常に小さいので、チタン酸リチウムは、充放電を繰り返す二次電池用の電極材料として優れた特性を有することが期待できる。
【0007】
このチタン酸リチウムをリチウムイオン二次電池の負極活物質として用いることが、既に提案されている。具体的には、一般式LiaTi3-aO4(式中、aは0<a<3の数を示す)で表されるチタン酸リチウム化合物を負極に用い、一般式:LiCobNi1-bO2(0≦b≦1)、LiAlcCodNia-c-dO2(0≦c≦1、0≦d≦1、0≦c+d≦1)、で表される化合物を正極に用いた非水二次電池が提案されている。
【0008】
同時に、チタン酸リチウムは、リチウムとの反応電位が約1.5V(vs.Li/Li+)と、リチウムの溶解析出電位よりも十分に貴である。このことから、チタン酸リチウムは、上述の炭素材料の様な金属リチウムの析出を抑制することができ、電池の信頼性をより高めることができる。
【0009】
また、炭素材料を用いた負極では、その反応電位の低さから非水電解質を還元分解して表面に反応生成物から成る被膜を形成する。この被膜は、初期充放電時に形成されると、その後の非水電解質との過剰な反応などの副反応を抑制する効果があり、炭素材料を用いる上で必要な反応である。しかし、その抑制効果は完全なものではなく、微量ではあるが副反応は継続的に起こる。そのため、充放電を繰り返し長期にわたって電池を使用する場合には、たとえ微少量であっても継続的に起こる反応の影響が大きく現れ、電池の可逆容量の低下や内部抵抗の増加による出力特性の劣化を招く。
【0010】
ところが、チタン酸リチウムを負極活物質に用いた場合には、反応電位が高いため非水電解質の還元分解が起こり難く、上述のような劣化の抑制にも効果がある。
【0011】
しかしながら、チタン酸リチウムを負極活物質として用いた場合でも、すべての副反応が完全に抑制できるわけではなく、例えば高温環境下で放置した場合には副反応による電池の内部抵抗増加は無視できない水準となってしまう。
【0012】
この課題を解決するため、特許文献1ではフッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を用いることを提案している。特許文献1ではチタン酸リチウム粒子表面のフッ化物層の量を、X線光電子分光スペクトルでの特定のピーク強度を用いて下記式(1)で規定している。
3.2≦(F1/C1)≦6 ・・・(1)
但し、F1は、680〜687eVに現れる第1のピークの強度であり、C1は、280〜290eVに現れる第2のピークの強度である。
【0013】
フッ化リチウムは、チタン酸リチウムのリチウムとの反応電位において安定であるだけでなく、フッ化リチウム以外の酸化物などの化合物よりもリチウムイオン伝導性が良好である。そのため、上述のような負極を用いることで、チタン酸リチウム表面に存在する、フッ化リチウムを含むフッ化物層により、高温貯蔵時の副反応を抑制し電池抵抗の増加を抑制することができるとしている。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】特開2010−231960号公報
【発明の概要】
【発明が解決しようとする課題】
【0015】
しかし、特許文献1の方法では実施例に開示されているような55℃の環境下で1ヶ月放置した後の電池内部抵抗の抑制効果は得られるが、例えば充放電サイクルを繰り返した際の容量劣化を抑制することができない。
【0016】
本発明はこのような従来技術の課題を改善し、サイクル特性にも優れた非水電解質二次電池およびその製造方法を提供することを目的とする。
【課題を解決するための手段】
【0017】
本発明の非水電解質二次電池は、
正極と、
負極と、
前記正極と前記負極との間に配置されたセパレータと、
非水電解質と、
を備え、
前記負極は、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含んでおり、
励起X線源として単結晶分光Al−Kα線を用いた、半充電状態の前記負極のX線光電子分光スペクトルが、下記式(2)を満たす。
6<(IF/IC)≦21 ・・・(2)
式(2)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。
【0018】
本発明は、また、
(I)チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を形成する工程と、
(II)正極と、セパレータと、前記工程(I)で得られた前記負極とを用いて、前記セパレータが前記負極と前記正極との間に配置された電極群を作製し、前記電極群に非水電解質を含浸させる工程と、
を含む、非水電解質二次電池の製造方法も提供する。
【発明の効果】
【0019】
本発明の非水電解質二次電池は、X線光電子分光スペクトルにおいて上記式(2)を満たすような、フッ化リチウムを含むフッ化物層を粒子表面に有するチタン酸リチウムを含む負極を用いている。これにより、充放電サイクルを繰り返した場合の副反応の発生を抑制し、サイクル劣化を低減することができる。このように、本発明の非水電解質二次電池は、電池の内部抵抗増加を抑制しつつも、優れたサイクル特性と高い信頼性を有する。
【図面の簡単な説明】
【0020】
【図1】(a)は、本発明の非水電解質二次電池の一実施形態であるリチウムイオン二次電池を示す斜視図であり、(b)は、図1(a)のI−I線に沿った断面図であり、(c)は、図1(a)および(b)に示す電極群13を拡大して示す断面図である。
【図2】実施例1で作製した正極1の寸法を示す図である。
【図3】実施例1で作製した負極2の寸法を示す図である。
【図4】実施例4で作製した電池A4の負極を測定したX線光電子分光スペクトルであり、680〜687eVの範囲を示す図である。
【図5】実施例4で作製した電池A4の負極を測定したX線光電子分光スペクトルであり、280〜290eVの範囲を示す図である。
【発明を実施するための形態】
【0021】
X線光電子分光スペクトルにおいて下記式(2)を満たすような、フッ化リチウムを含むフッ化物層を粒子表面に有するチタン酸リチウムを負極活物質として用いることによって、電池のサイクル劣化を抑制することが可能である。
6<(IF/IC)≦21 ・・・(2)
式(2)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。
【0022】
この観点で、チタン酸リチウムの粒子表面のフッ化物層に関する検討を行い、本発明に至った。以下、本発明の実施形態を詳細に説明する。なお、以下の実施形態は本発明の一例であり、本発明は以下の実施形態に限定されない。
【0023】
まず、本発明の非水電解質二次電池の一実施形態であるリチウムイオン二次電池について、その一構成例を説明する。
【0024】
図1(a)は、本実施形態のリチウムイオン二次電池の斜視図である。図1(b)は、図1(a)におけるI−I線に沿った断面を示している。
【0025】
図1(a)および(b)に示すように、本実施形態のリチウムイオン二次電池は、電極群13と、電極群13を収納する電池ケース14と、電池ケース14内に充填された非水電解液(非水電解質)15とを備える。電極群13における正極は、正極リード11に接続されている。電極群13における負極は、負極リード12に接続されている。正極リード11および負極リード12は、電池ケース14の外部に引き出されている。
【0026】
非水電解液15は、一般にリチウムイオン二次電池に用いられるものであればよい。例えば、エチレンカーボネート(EC)(市販バッテリーグレード)とエチルメチルカーボネート(EMC)(市販バッテリーグレード)とが、25:75の比率で混合された非水溶媒を、非水電解液15に用いることができる。この非水溶媒に、支持電解質塩として、例え1mol/Lの濃度でLiPF6(市販バッテリーグレード)が溶解されている溶液を、非水電解液15として用いることができる。本実施形態では、非水電解液15の一例として、上記非水溶媒および上記支持電解質塩の組み合わせを用いたが、一般にリチウムイオン二次電池に用いられる組み合わせであれば、他の組み合わせを用いてもよい。例えば、プロピレンカーボネートおよびフルオロエチレンカーボネートなどの環状カーボネート、および、ジメチルカーボネートおよびジエチルカーボネートなどの鎖状カーボネートが、非水溶媒として使用可能である。また、ガンマブチロラクトンなどの環状エステル、および、メチルプロピオネートなどの鎖状エステルを、非水溶媒として用いてもよい。支持電解質塩としても、四フッ化ホウ酸リチウムなど、リチウムイオン電池用電解液の支持電解質塩として用いることができるリチウム塩であれば、他のリチウム塩を用いてもよい。もちろん、これらの非水溶媒および支持電解質塩に限定されない。
【0027】
図1(c)は電極群13の断面を拡大して示している。図1(c)に示すように、電極群13は、正極1と、負極2と、正極2と負極2との間に設けられたセパレータ3とを備えている。正極1は、例えば、アルミニウム箔からなる正極集電体1aと、正極集電体1aの表面に配置されたコバルト酸リチウム(LiCoO2)を含有する正極合剤層1bとを有している。一方、負極2は、例えば、アルミニウム箔からなる負極集電体2aと、負極集電体2aの表面に配置されたチタン酸リチウム(Li4Ti5O12)を含有する負極合剤層2bとを有している。セパレータ3は、例えばポリエチレン製の微多孔質シートからなる。
【0028】
正極合剤層1bの正極活物質としては、LiCoO2以外のリチウム含有遷移金属酸化物を用いてもよい。例えば、LixCoO2、LixNiO2、LixMnO2、LixCoyNi1-yO2、LixCoyM1-yOz、LixNi1-yMyOz、LixMn2O4、LixMn2-yMyO4(Mは、Na、Mg、Sc、Y、Mn、Fe、Co、Ni、Cu、Zn、Al、Cr、Pb、SbおよびBから選択される少なくとも一種である。x、yおよびzは、x=0〜1.2、y=0〜0.9、z=1.7〜2.3を満たす。)が挙げられる。これらの材料以外でも、充電時の正極1の電位がリチウム基準で4Vを超えるような材料であれば、正極活物質として使用できる。また、正極活物質として、複数の異なった材料を混合して用いてもよい。正極活物質が粉末である場合には、平均粒径は特に限定はされないが、例えば0.1〜30μmの平均粒径を有する粉末が好ましい。正極合剤層1bは、通常50〜200μm程度の厚さを有するが、特に厚さに制約はない。正極合剤層1bは、0.1〜50μmの厚さを有していてもよい。なお、ここでいう平均粒径とは、レーザー回折・散乱法を用いた粒度分布測定装置で測定された値である。
【0029】
正極合剤層1bは、前記酸化物以外の導電剤および結着剤の両方を含んでいてもよいし、いずれか一方のみを含んでいてもよい。または、正極合剤層1bは、導電剤および結着剤のいずれも含んでおらず、正極活物質のみから構成されていてもよい。
【0030】
正極合剤層1b用の導電剤は、正極1の充放電電位において、化学変化を起こさない電子伝導性材料であれば何でもよい。例えば、黒鉛類、カ−ボンブラック類、炭素繊維および金属繊維などの導電性繊維類、金属粉末類、導電性ウィスカー類、導電性金属酸化物、または、有機導電性材料などを単独で用いてもよいし、これらの混合物として用いてもよい。導電剤の添加量は、特に限定されないが、正極活物質に対して1〜50重量%が好ましく、特に1〜30重量%が好ましい。
【0031】
正極合剤層1bに用いられる結着剤には、熱可塑性樹脂および熱硬化性樹脂を用いることができる。好ましい結着剤としては、例えば、ポリエチレンおよびポリプロピレンなどのポリオレフィン樹脂、ポリテトラフルオロエチレン(PTFE)、ポリフッ化ビニリデン(PVdF)およびヘキサフルオロプロピレン(HFP)などのフッ素系樹脂およびその共重合体樹脂、ポリアクリル酸およびその共重合体樹脂などである。
【0032】
導電剤および結着剤の他にも、フィラー、分散剤、イオン伝導体、圧力増強剤およびその他の各種添加剤を用いることができる。フィラーは、リチウムイオン二次電池内で化学変化を起こさない繊維状材料であれば何でもよい。
【0033】
正極集電体1aの材料は、正極1の充放電電位において化学変化を起こさない電子伝導体であれば何でもよい。例えば、ステンレス鋼、アルミニウム、チタン、炭素および導電性樹脂などを用いることができる。また、正極集電体1aの表面には、表面処理により凹凸を付けることが望ましい。形状は、フォイルの他、フィルム、シート、ネット、パンチングメタル、エキスパンドメタル、多孔質体、発泡体、繊維群、不織布体、およびそれらの成形体などのいずれであってもよい。正極集電体1aの厚さは、特に限定されないが、一般には1〜500μmである。
【0034】
負極合剤層2bに含まれる負極活物質は、本発明において負極活物質として特定された、フッ化リチウムを含むフッ化物層を粒子表面に有するチタン酸リチウムを含有する。負極活物質の詳細は、後述する。
【0035】
負極集電体2aとしては、アルミニウム箔が好ましいが、例えば、銅箔やニッケル箔、ステンレス箔などを用いてもよい。また、前記の正極集電体1aと同様の形状であってもよい。
【0036】
セパレータ3としては、ポリエチレン製の微多孔質シートだけでなく、ポリプロピレン製の微多孔質シート、不織布シート、セルロース繊維を用いて抄紙したシート、およびこれらを複合化させたシートを用いることができる。もちろん、これら以外にも、リチウムイオン二次電池のセパレータとして用いることが可能な材料を使用することができる。
【0037】
なお、本実施形態では、シート型のリチウムイオン二次電池を一例として説明したが、本実施形態のリチウムイオン二次電池は、他の形状を有していてもよい。例えば、本実施形態のリチウムイオン二次電池は、円筒形および角形形状を有していてもよい。また、電気自動車等に用いる大型の形状を有していてもよい。
【0038】
本実施形態のリチウムイオン二次電池は、携帯情報端末、携帯電子機器、家庭用小型電力貯蔵装置、自動二輪車、電気自動車、ハイブリッド電気自動車等に用いることができる。また、これら以外の機器にも用いることができる。
【0039】
次に、本実施形態のリチウムイオン二次電池において、負極活物質として使用されるチタン酸リチウムについて説明する。チタン酸リチウムは、リチウムとの反応電位が約1.5V(vs.Li/Li+)である。この反応電位は、リチウム金属および炭素材料のリチウムとの反応電位よりも高い。このため、チタン酸リチウムが用いられた負極では、電極表面にリチウム金属の析出が起こりにくいだけでなく、非水電解質の還元分解の反応が生じにくいといった特徴がある。しかしながら、チタン酸リチウムが用いられた負極は、副反応を完全に抑制できるものではなく、充放電サイクルの繰り返しに時には副反応の影響が顕著となって、サイクルに伴う容量劣化が生じる。充放電反応を繰り返す場合は、例えば充電状態で貯蔵する場合とは異なり、負極活物質表面と電解質との界面部分で、リチウムイオンの授受を伴う反応が起こる。この時、一般に広く用いられているカーボネート系溶媒を含む電解液中では、充電時にはリチウムイオンは溶媒分子で溶媒和された形態で負極活物質表面に到達し、負極活物質とのリチウムイオンの受け渡しが行われる。このような反応の際に、溶媒分子と負極活物質表面との間での副反応が起こりやすく、副反応生成物の蓄積がサイクル劣化の原因となると考えられる。
【0040】
負極活物質として含まれるチタン酸リチウム粒子の表面に、フッ化リチウムを含むフッ化物層を存在させることにより、溶媒分子とチタン酸リチウムとの直接的な接触が抑制される。その結果、上記の副反応の発生を低減させることが可能となる。フッ化リチウムは非常に安定な化合物であるため、チタン酸リチウムの反応電位において、それ自身が分解や副反応を起こすことがない。また、酸化物などのフッ化リチウム以外の化合物に比べてリチウムイオン伝導性が良好であるため、充放電反応に及ぼす影響も比較的小さい。
【0041】
ただし、フッ化リチウムを含むフッ化物層の存在量が多すぎる場合には、その影響が大きくなり、チタン酸リチウムの充放電反応を阻害してしまうため好ましくない。X線光電子分光スペクトルでのピーク強度で表される、フッ化リチウムを含むフッ化物層の存在量の適正な範囲は、以下式(2)で示される。
6<(IF/IC)≦21 ・・・(2)
式(2)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。
【0042】
IF/ICの値がこの範囲よりも小さい場合には、サイクル劣化の抑制効果が十分ではない。また、IF/ICの値がこの範囲よりも大きい場合には、フッ化物層による充放電反応の阻害が著しく、十分な充放電特性が得られない。特に、高率充放電において性能の低下が大きい。より詳しく説明すると、(IF/IC)が6以下の場合には、1ヶ月程度の高温環境下での貯蔵では電池抵抗の増加抑制効果が得られるが、副反応抑制の効果は十分ではなくサイクル劣化抑制の効果は小さい。しかしながら、(IF/IC)が21を超える場合には、粒子表面でのフッ化物の存在量が多すぎてしまい、反応抵抗が上昇するため十分な充放電特性が得られない。
【0043】
フッ化リチウムを含むフッ化物層の存在量は、上述のようにX線光電子分光スペクトルを用いて定量することができる。本実施形態では、作製した電池を1回充放電して動作容量を確認し、続いて再度充電した後に動作容量の半分まで0.05Cで放電した状態での負極用いて、X線光電子分光スペクトル測定を行った。この負極の状態を半充電状態とする。X線光電子分光スペクトルの測定装置には、ULVAC−PHI、Inc.製の「PHI Quantera SXM」を用いた。X線源には、単結晶分光Al−Kα線(1486.6eV)を用いた。出力は、15kV/25Wとした。光電子取り出し角は、45°とした。分析面積は、300μm×800μmとした。スキャンは、0.10eV/stepとした。ただし、測定装置および条件は、これらに限定されない。
【0044】
なお、680〜687eVに現れるピークは、Li−FのF1sに起因するピークである。また、280〜290eVに現れるピークは、C−O、C−CおよびC−HのC1sに起因するピークである。
【0045】
なお、半充電状態は、正確に動作容量の50%を満充電状態から放電した状態に限られるわけではなく、50%を中心に±20%程度の範囲で放電した状態であればよい。
【0046】
次に、本実施形態のリチウムイオン二次電池の製造方法、特に負極の製造方法について説明する。
【0047】
本実施形態のリチウムイオン二次電池は、
(I)チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を形成する工程と、
(II)正極と、セパレータと、前記工程(I)で得られた前記負極とを用いて、前記セパレータが前記負極と前記正極との間に配置された電極群を作製し、前記電極群に非水電解質(非水電解液)を含浸させる工程と、
を含む方法によって製造することができる。
【0048】
このように、本実施形態では、事前に形成された、フッ化物層を表面に有するチタン酸リチウム粒子を含む負極2を用い、これを正極1、セパレータ3および非水電解質(非水電解液15)と組み合わせることによって、形成される。負極2は、チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、形成される。具体的には、例えば、負極2に対して事前にフッ化リチウムを含むフッ化物層を形成するための処理を行った後、これを正極1およびセパレータ3と組み合わせて電極群13とし、電極群13を電池ケース14内に挿入して非水電解液15を注入して密封することによって、本実施形態のリチウムイオン二次電池が得られる。
【0049】
チタン酸リチウム粒子の表面にフッ化リチウムを含むフッ化物層を形成するための処理方法としては、上記のとおり、主としてチタン酸リチウムを含有する極板を、フッ酸および非水溶媒を含む処理液に浸漬する方法を用いることができる。この方法の一例として、チタン酸リチウムを含有する極板を、フッ素を含有するリチウム塩と非水溶媒とを含有する処理液に浸漬し、かつ加熱する方法が挙げられる。より具体的な例としては、例えば、六フッ化リン酸リチウムが溶解したカーボネート溶液中に極板を投入し、加熱処理を行う。六フッ化リン酸リチウムが溶解したカーボネート溶液を加熱することで、溶液中に不純物として含まれる微量の水分と六フッ化リン酸リチウムが反応し、フッ酸が生成する。このフッ酸が、チタン酸リチウム粒子表面に存在している酸化リチウム、水酸化リチウムおよび炭酸リチウムなどのリチウム含有の不純物成分と反応することによって、フッ化リチウムを含むフッ化物層が形成される。本実施形態では、電気化学的な反応ではなく、化学反応によってフッ化リチウムを含むフッ化物層が形成される。このため、フッ化物層の存在量は、処理に用いるカーボネート溶液の六フッ化リン酸リチウム濃度、この溶液における水分の添加量、加熱処理条件などにより、生成するフッ酸量を増減させることによって、容易に制御することができる。もちろん、直接フッ酸を添加してもよく、その添加量により反応量を制御することも可能である。
【0050】
また、チタン酸リチウム粒子表面に存在する、リチウム含有の不純物成分量を制御することにより、生成するフッ化リチウムを含むフッ化物層の量を増減させることも可能である。チタン酸リチウム粒子表面に存在するリチウム含有の不純物成分の量は、チタン酸リチウム合成時のリチウム原料投入比率により制御可能である。また、合成後の粉末に、メカニカルミリング等の方法により、粒子レベルでリチウム含有化合物を混合してもよいし、リチウム含有化合物の溶液もしくは分散液を用いたスプレードライ法や流動層造粒法により混合してもよい。
【0051】
処理後、負極を、六フッ化リン酸リチウムおよびフッ酸を含まない非水溶媒で洗浄して、六フッ化リン酸リチウムおよびフッ酸などを除去する。その後、乾燥させた負極を、電池作製に用いることができる。これにより、溶液中に残留しているフッ酸、水分およびフッ化物層形成時の反応副生成物などの不純物が、電池内で、負極活物質とだけでなく正極活物質などとも副反応を起こして、電池性能劣化の原因となることを抑制することができる。したがって、事前にチタン酸リチウム粒子の表面にフッ化リチウムを含むフッ化物層を形成した本実施形態の方法によれば、電池の電解液中にフッ酸および/または水分を添加することによりフッ化物層を形成する電池と比較して、電池性能の劣化を抑制しつつもフッ化物層の存在量を容易に制御することができる。本発明者らは、フッ化物層を形成するまでの工程が全く同じである極板を2つ準備し、一方の極板(A)には、予め準備された処理液を用いて事前に所定量のフッ化物層を形成する処理を行い、他方の極板(B)については、電池の電解液中にフッ酸および/または水分を添加して極板(B)にフッ化物層を電気化学的な反応により形成させる、という実験を行った。フッ化物層を形成する方法以外、例えば形成するフッ化物層の量などは、極板(A)および極板(B)で同じにした。このようにして得られた各負極を用いて同じ条件で電池を作製し、そのサイクル特性を評価したところ、極板(A)が用いられた電池は、極板(B)が用いられた電池よりも、150サイクル後容量維持率が20%程度高かった。なお、サイクル特性の評価には、後述する実施例でのサイクル特性と同じ評価方法が用いられた。
【0052】
なお、フッ化物層の形成のための処理液や、処理後の洗浄に用いる非水溶媒には、一般にリチウムイオン電池の電解液溶媒として用いられるプロピレンカーボネート、ジエチルカーボネート、エチルメチルカーボネートおよびジエチルカーボネートなどの溶媒を、単体および混合して用いることができるが、これらに限定されるものではない。
【0053】
また、本実施形態では、チタン酸リチウム粒子の表面にフッ化リチウムを含むフッ化物層を形成する手法の一例を示したが、これらの方法に限定されるものではない。しかし、上記に説明したように、チタン酸リチウム粒子の表面に存在するリチウム含有化合物から成る不純物成分を、非水溶媒中でフッ酸と反応させてフッ化リチウムを含むフッ化物層を形成させたチタン酸リチウムを負極活物質として用いることで、サイクル特性のより優れたリチウムイオン二次電池を得ることができる。
【0054】
本発明では、フッ化物層の定量を、平均的な状態である半充電状態での負極のX線光電子分光スペクトルを用いて行うこと定義している。しかし、本実施形態で示すような化学的な反応により形成されたフッ化物層であれば、充放電の状態には大きく影響を受けないので、半充電状態でない負極で測定を行っても同様の結果が得られる可能性が高い。
【実施例】
【0055】
以下に本発明の実施例を詳細に説明する。
【0056】
1.電池の作製
(実施例1)
<正極の作製>
まず、正極活物質としてLiCoO2(平均粒径10μm、BET法による比表面積0.38m2/g)を準備した。正極活物質として用いたLiCoO2の調製法は以下の通りである。
【0057】
硫酸コバルト飽和水溶液を低速で撹拌しながら水酸化ナトリウムを溶解したアルカリ溶液を滴下して、Co(OH)2の沈殿を得た。この沈殿物をろ過、水洗した後、空気中で80℃に加熱することにより乾燥した。得られた水酸化物の平均粒径は、約10μmであった。
【0058】
次に、得られた水酸化物に対して、空気中で380℃の熱処理を10時間行うことにより、酸化物Co3O4を得た。粉末X線回折により、得られた酸化物が単一相を有することを確認した。
【0059】
さらに、得られた酸化物に、Coのモル数とLiのモル数との比が1.00:1.00になるように炭酸リチウムの粉末を混合し、乾燥空気中で1000℃の熱処理を10時間行うことにより、目的とするLiCoO2を得た。得られたLiCoO2を用いて粉末X線回折(リガク製)を行い、六方晶層状構造からなる単一相の回折パターンであることを確認した。粉砕および分級の処理を行った後、走査型電子顕微鏡(日立ハイテクノロジーズ製)による観察から、粒径が10〜15μm程度であることを確認した。なお、平均粒径は、レーザー回折・散乱式粒度分布測定装置(HORIBA製)を用いて求めた。
【0060】
次に、得られたLiCoO2粉末を用いて正極を作製した。LiCoO2と、導電剤であるアセチレンブラック(AB)、および結着剤であるポリフッ化ビニリデン(PVdF)を重量比でLiCoO2:AB:PVdF=100:3:4となるように秤量し、適量のN−メチル−2−ピロリドンを加えて攪拌・混合し、スラリー状の正極合剤を得た。
【0061】
次に、図2に示すように、厚さ20μmのアルミニウム箔からなる集電体1aの片面に、前記スラリー状の正極合剤を塗布し、塗膜を乾燥し、ローラーで圧延することによって、正極合剤層1bを得た。
【0062】
得られた極板を、図2に示す寸法に打ち抜いて、リード取り付け部であるタブの部分の正極合剤層1bを剥離して、正極1を得た。正極合剤層1bが設けられた正極集電体1aは、30mm×40mmの長方形状を有していた。
【0063】
<電解液の調製>
まず、混合溶媒を調製した。エチレンカーボネート(EC)とエチルメチルカーボネート(EMC)とを、体積比でEC:EMC=1:3となるように混合した。この混合溶媒に、1.0Mの濃度となるように六フッ化リン酸リチウム(LiPF6)を加えて溶解し、電解液を得た。
【0064】
<負極の作製>
まず、負極活物質としてLi4Ti5O12(平均粒径≦1μm、BET法による比表面積4m2/g)を準備した。負極活物質として用いたLi4Ti5O12の調製法は以下の通りである。なお、ここでの平均粒径は、レーザー回折・散乱法を用いた粒度分布測定装置で測定した値である。
【0065】
市販試薬であるLiOH・H2OとTiO2の原料粉末を、Li/Tiのモル混合比が化学量論比よりもややLi過剰となるように秤量し、これらを乳鉢で混合した。原料のTiO2には、アナターゼ型の結晶構造を有し、平均粒径が約0.3μmのものを用いた。
【0066】
混合後の原料粉末をAl2O3製のるつぼに入れ、大気雰囲気中で850℃の熱処理を12時間行うことで、目的とするLi4Ti5O12を得た。
【0067】
熱処理後の材料をるつぼから取り出して乳鉢にて粉砕し、Li4Ti5O12の粗粉末を得た。得られたLi4Ti5O12粗粉末の粉末X線回折(リガク製)測定を行ったところ、スピネル型構造からなる単相の回折パターンが得られた。さらに、Li/Tiモル比率をICP発光分光分析法(Thermo Fisher Scientific製)により分析したところLi/Ti=4.2/5.0であった。
【0068】
続いて、得られたチタン酸リチウムを用いて、ジェットミル粉砕および分級の処理を行った。得られた粉末は、走査型電子顕微鏡(日立ハイテクノロジーズ製)による観察から、粒径が0.7μm程度の単粒子に粉砕されていることを確認した。
【0069】
次に、上記の方法により得られたLi4Ti5O12粉末を用いて負極を作製した。Li4Ti5O12と、導電剤である気相成長炭素繊維(VGCF)と、結着剤であるポリフッ化ビニリデンとを、重量比で、Li4Ti5O12:VGCF:PVdF=100:7:5となるように秤量し、適量のN−メチル−2−ピロリドンを加えて、攪拌・混合し、スラリー状の負極合剤を得た。
【0070】
次に、図3に示すように、厚さ20μmのアルミニウム箔からなる集電体2aの片面に、前記スラリー状の負極合剤を塗布し、塗膜を乾燥し、ローラーで圧延することによって、負極合剤層2bを得た。
【0071】
得られた極板を、図3に示す寸法に打ち抜いて、リード取り付け部であるタブの部分の負極合剤層2bを剥離して、負極2を得た。負極合剤層2bが設けられた負極集電体2aは、30mm×40mmの長方形状を有していた。
【0072】
<負極の処理>
上述の方法で作成した負極を用い、六フッ化リン酸リチウム(LiPF6)がプロピレンカーボネート(PC)に溶解した溶液(処理液)を用いて処理を行った。処理液は、LiPF6を1.0Mの濃度でPCに溶解させることによって調製された。作製した負極と調製した処理液3mLをポリプロピレン製の容器に入れて密閉し、85℃の環境下で15時間放置した。その後、容器を開封して取り出した負極を、エチルメチルカーボネートを用いて洗浄し、十分に乾燥した。
【0073】
<組み立て>
得られた正極1および負極2を、セパレータ3を介して積層し、図1(c)に示すような電極群13を作製した。セパレータとしては、厚さ20μmのポリエチレン製微多孔質シートを用いた。
【0074】
次に、図1(a)に示すように、電極群13の正極1にアルミニウム製正極リード11を、負極2にニッケル製負極リード12を溶接した。その後、電極群13を、3方向が開口している厚さ0.12mmのアルミラミネートフィルム製電池ケース14の内部に収容し、ポリプロピレン製のテープで電池ケース14の内面に固定した。正極リード11および負極リード12が出ている開口部を含む開口部を熱溶着し、1つの開口部のみを熱溶着せずに残して、電池ケース14を袋状とした。熱溶着していない開口部から、電解液15を注入し、減圧および脱気後、減圧状態で開口部を熱溶着することにより、電池内部を密封した。組み立てた電池を2.7Vで充電した時の設計容量は40mAhである。作製した電池を電池A1とする。
【0075】
(実施例2)
負極の処理方法が異なる以外は、実施例1と同様の方法で電池A2を作製した。負極の処理は、LiPF6がPCに溶解した溶液(処理液)を用いて行った。LiPF6を2.0Mの濃度でPCに溶解させて処理液を得た。作製した負極と調製した処理液3mLとをポリプロピレン製の容器に入れて密閉し、85℃の環境下で15時間放置した。その後、容器を開封して取り出した負極を、EMCを用いて洗浄し、十分に乾燥した。
【0076】
(実施例3)
負極の処理方法が異なる以外は、実施例1と同様の方法で電池A3を作製した。負極の処理は、LiPF6がPCに溶解した溶液(処理液)を用いて行った。LiPF6を1.0Mの濃度でPCに溶解させ、さらに重量比で500ppmの水を添加して、処理液を得た。作製した負極と調製した処理溶液3mLとをポリプロピレン製の容器に入れて密閉し、85℃の環境下で15時間放置した。その後、容器を開封して取り出した負極を、EMCを用いて洗浄し、十分に乾燥した。
【0077】
(実施例4)
負極の処理方法が異なる以外は、実施例1と同様の方法で電池A4を作製した。負極の処理は、LiPF6がPCに溶解した溶液(処理液)を用いて行った。LiPF6を2.0Mの濃度でPCに溶解させ、さらに重量比で500ppmの水を添加して、処理液を得た。作製した負極と調製した処理溶液3mLとをポリプロピレン製の容器に入れて密閉し、85℃の環境下で15時間放置した。その後、容器を開封して取り出した負極を、EMCを用いて洗浄し、十分に乾燥した。
【0078】
(比較例1)
負極の処理を行わなかった以外は、実施例1と同様の方法で電池B1を作製した。
【0079】
(比較例2)
負極の処理方法が異なる以外は、実施例1と同様の方法で電池B2を作製した。負極の処理は、LiPF6がPCに溶解した溶液(処理液)を用いて行った。LiPF6を2.0Mの濃度でPCに溶解させ、さらに重量比で500ppmの水を添加して、処理液を得た。作製した負極と調製した処理溶液3mLとをポリプロピレン製の容器に入れて密閉し、85℃の環境下で30時間放置した。その後、容器を開封して取り出した負極を、EMCを用いて洗浄し、十分に乾燥した。
【0080】
なお、実施例1、2、3および4と、比較例1および2での負極処理および電解液調製に用いた溶媒(EC、EMC、PC)、LiPF6は、いずれもリチウムバッテリーグレードの市販品を用いた。
【0081】
2.フッ化物層の定量
<X線光電子分光スペクトルの測定>
作製した各電池A1、A2、A3、A4、B1およびB2の負極を用いてX線光電子スペクトル測定を行った。
【0082】
25℃の環境下において、電流値2mAで2.7Vまで定電流充電を行った。その後、電流値2mAで1.5Vまで定電流放電を行い、設計容量で動作していることを確認した。
【0083】
次に、各電池を25℃の環境下で、電流値40mAで2.7Vまで定電流充電を行い、その後、電流値が2mAに減衰するまで、2.7Vで定電圧充電を行った。その後、電流値2mAで動作容量の50%の定容量放電を行って半充電状態とした。
【0084】
続いて、半充電状態の各電池を分解して負極を取り出し、EMCでよく洗浄した後、十分に乾燥させて、半充電状態の負極を得た。
【0085】
得られた各負極を用いて、X線光電子分光スペクトルの測定を行い、680〜687eVに現れるピークの強度IFと280〜290eVに現れるピークの強度IC、およびその強度比(IF/IC)の値を算出した結果を表1に示す。また、図4および図5に、電池A4の負極の測定で得られたX線光電子分光スペクトルを示す。
【0086】
3.電池の評価
<サイクル特性の評価>
作製した電池A1、A2、A3、A4、B1およびB2を用いて、サイクル特性の評価を行った。
【0087】
25℃の環境下において、電流値2mAで2.7Vまで定電流充電を行った。その後、電流値2mAで1.5Vまで定電流放電を行い、設計容量で動作していることを確認した。
【0088】
次に、各電池を、60℃の環境下で、電流値40mAで2.7Vまで定電流充電を行い、その後、電流値が2mAに減衰するまで、2.7Vで定電圧充電を行った。その後、電流値20mAで1.5Vまで定電流放電を行った。この条件で充放電を150回繰り返した後の容量から、150サイクル後容量維持率(150サイクル後容量維持率=150サイクル目放電容量/1サイクル目放電容量)を算出し、その百分率を表2に示す。なお、ここでは劣化をより加速させるため60℃の環境下での評価を行った。
【0089】
<高率放電特性の評価>
作製した各電池A1、A2、A3、A4、B1およびB2を用いて高率放電特性の評価を行った。
【0090】
25℃の環境下において、電流値2mAで2.7Vまで定電流充電を行った。その後、電流値2mAで1.5Vまで定電流放電を行い、設計容量で動作していることを確認した。このとき得られた放電容量を0.05C放電容量とした。
【0091】
次に、25℃の環境下で、電流値40mAで2.7Vまで定電流充電を行い、その後、電流値が2mAに減衰するまで、2.7Vで定電圧充電を行った。その後、電流値40mAで1.5Vまで定電流放電を行い、このとき得られた放電容量を1C高率放電容量とした。
【0092】
各電池の0.05C放電容量に対する1C高率放電容量の割合を1C高率放電特性(1C高率放電特性=1C高率放電容量/0.05C放電容量)とし、その百分率を表3に示す。
【0093】
表1、2、3で示すように、X線光電子分光スペクトル測定での(IF/IC)の値が6を超える場合には、150サイクル後容量維持率が95%以上となっており良好なサイクル特性が得られている。これは、フッ化リチウムを含むフッ化物層による副反応抑制の効果であると考えられる。(IF/IC)の値が6以下の比較例1では、150サイクル後容量維持率が90%未満であり、フッ化物層の量が少ないためにその効果が十分ではないと考えられる。しかしながら、(IF/IC)の値が21以上の比較例2では、1C高率放電特性の低下が著しく、フッ化物層の量が多すぎるために充放電反応が阻害されてしまっていると考えられる。
【0094】
【表1】

【0095】
【表2】

【0096】
【表3】

【産業上の利用可能性】
【0097】
本発明によれば、サイクル特性に優れ、良好な長期信頼性を示すリチウムイオン二次電池が実現できる。本発明は、特にチタン酸リチウムを負極活物質として用いるリチウムイオン二次電池に用いられる。
【符号の説明】
【0098】
1 正極
1a 正極集電体
1b 正極合剤層
2 負極
2a 負極集電体
2b 負極合剤層
3 セパレータ
11 正極リード
12 負極リード
13 電極群
14 電池ケース
15 電解液
【特許請求の範囲】
【請求項1】
正極と、
負極と、
前記正極と前記負極との間に配置されたセパレータと、
非水電解質と、
を備え、
前記負極は、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含んでおり、
励起X線源として単結晶分光Al−Kα線を用いた、半充電状態の前記負極のX線光電子分光スペクトルが、下記式(1)を満たす、
非水電解質二次電池。
6<(IF/IC)≦21 ・・・(1)
式(1)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。
【請求項2】
前記非水電解質二次電池は、事前に形成された、前記フッ化物層を表面に有するチタン酸リチウム粒子を含む前記負極を、前記正極、前記セパレータおよび前記非水電解質と組み合わせることによって形成されており、
前記負極は、チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、形成されている、
請求項1に記載の非水電解質二次電池。
【請求項3】
前記負極は、チタン酸リチウム粒子を含む極板を、フッ素を含有するリチウム塩と非水溶媒とを含む処理液に浸漬し、かつ加熱することによって、形成されている、
請求項2に記載の非水電解質二次電池。
【請求項4】
(I)チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を形成する工程と、
(II)正極と、セパレータと、前記工程(I)で得られた前記負極とを用いて、前記セパレータが前記負極と前記正極との間に配置された電極群を作製し、前記電極群に非水電解質を含浸させる工程と、
を含む、非水電解質二次電池の製造方法。
【請求項5】
前記工程(I)において、チタン酸リチウム粒子を含む極板を、フッ素を含有するリチウム塩と非水溶媒とを含む処理液に浸漬し、かつ加熱することによって、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を形成する、
請求項4に記載の非水電解質二次電池の製造方法。
【請求項1】
正極と、
負極と、
前記正極と前記負極との間に配置されたセパレータと、
非水電解質と、
を備え、
前記負極は、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含んでおり、
励起X線源として単結晶分光Al−Kα線を用いた、半充電状態の前記負極のX線光電子分光スペクトルが、下記式(1)を満たす、
非水電解質二次電池。
6<(IF/IC)≦21 ・・・(1)
式(1)中、IFは、680〜687eVに現れるピークの最大強度であり、ICは、280〜290eVに現れるピークの最大強度である。
【請求項2】
前記非水電解質二次電池は、事前に形成された、前記フッ化物層を表面に有するチタン酸リチウム粒子を含む前記負極を、前記正極、前記セパレータおよび前記非水電解質と組み合わせることによって形成されており、
前記負極は、チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、形成されている、
請求項1に記載の非水電解質二次電池。
【請求項3】
前記負極は、チタン酸リチウム粒子を含む極板を、フッ素を含有するリチウム塩と非水溶媒とを含む処理液に浸漬し、かつ加熱することによって、形成されている、
請求項2に記載の非水電解質二次電池。
【請求項4】
(I)チタン酸リチウム粒子を含む極板を、フッ酸および非水溶媒を含む処理液に浸漬することによって、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を形成する工程と、
(II)正極と、セパレータと、前記工程(I)で得られた前記負極とを用いて、前記セパレータが前記負極と前記正極との間に配置された電極群を作製し、前記電極群に非水電解質を含浸させる工程と、
を含む、非水電解質二次電池の製造方法。
【請求項5】
前記工程(I)において、チタン酸リチウム粒子を含む極板を、フッ素を含有するリチウム塩と非水溶媒とを含む処理液に浸漬し、かつ加熱することによって、フッ化リチウムを含むフッ化物層を表面に有するチタン酸リチウム粒子を含む負極を形成する、
請求項4に記載の非水電解質二次電池の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−114809(P2013−114809A)
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2011−257823(P2011−257823)
【出願日】平成23年11月25日(2011.11.25)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年11月25日(2011.11.25)
【出願人】(000005821)パナソニック株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

