非水電解質二次電池用活物質、非水電解質二次電池用活物質の製造方法、非水電解質二次電池用電極及び非水電解質二次電池
【課題】リチウム過剰遷移金属複合酸化物を含有し、BET比表面積の値が小さく、放電容量が大きい非水電解質二次電池用活物質、及び、それを用いた非水電解質二次電池を提供する。
【解決手段】六方晶構造を有するリチウム遷移金属複合酸化物を含有する非水電解質二次電池用活物質であって、前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む遷移金属元素Me、Li、並びに、元素X(Xは、F、Cl、P及びSからなる群のうち1種又は2種以上)を含有し、前記遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40であり、前記遷移金属元素Me中のCoのモル比Co/Meが0.02〜0.23であり、前記遷移金属元素Me中のMnのモル比Mn/Meが0.63〜0.72であり、前記Liに対する前記元素Xのモル比X/Liが0.01〜0.1であることを特徴とする。
【解決手段】六方晶構造を有するリチウム遷移金属複合酸化物を含有する非水電解質二次電池用活物質であって、前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む遷移金属元素Me、Li、並びに、元素X(Xは、F、Cl、P及びSからなる群のうち1種又は2種以上)を含有し、前記遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40であり、前記遷移金属元素Me中のCoのモル比Co/Meが0.02〜0.23であり、前記遷移金属元素Me中のMnのモル比Mn/Meが0.63〜0.72であり、前記Liに対する前記元素Xのモル比X/Liが0.01〜0.1であることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、非水電解質二次電池用活物質及びそれを用いた非水電解質二次電池に関する。
【背景技術】
【0002】
従来、非水電解質二次電池には、正極活物質として主にLiCoO2が用いられている。しかし、放電容量は120〜130mAh/g程度であった。
【0003】
LiMeO2で表される活物質として、LiCo1−2xNixMnxO2(0<x<1)で表される化合物を含有する活物質等が知られている。
【0004】
非特許文献1には、LiCo0.8Ni0.1Mn0.1O2で表される活物質について記載されている。また、Co,Ni及びMnを含有する前駆体を中和法により調整し、Li塩(Li(OH)/H2O)と混合して900℃で焼成することにより、前記活物質を合成したことが記載され、BET比表面積は約6.2m2/gであり、放電容量は約165mAh/gであったことが記載されている。また、前記Li塩として、Li(OH)/H2Oと共にLiFを、合成される活物質の質量に対して3wt%混合して900℃で焼成することにより合成した活物質のBET比表面積は約3.6m2/gであり、放電容量は約130mAh/gであったことが記載されている。また、同文献には、各種活物質のエックス線回折図及びエックス線回折結果から算出された格子定数の値が記載され、用いたLiFの量に応じて格子定数が連続的に変化したことが示されている。
【0005】
特許文献1には、LiCo1−2xNixMnxO2(0<x<1)で表される活物質について記載されている。また、錯化剤であるヒドラジンの存在下で、温度、pH及び原料溶液の滴下速度を注意深く制御する反応晶析法を用いて、Co,Ni及びMnを均一に含有する共沈前駆体を調整し、Li塩と混合して1000℃前後で焼成することにより、前記活物質を合成したことが記載されている。
【0006】
上記したように、非特許文献1には、BET比表面積が著しく大きい活物質が報告されている。この原因は、前記前駆体を中和法により調整する場合に必要な、温度、pH及び原料溶液の滴下速度等の注意深い制御、あるいは、錯化剤の使用等についての検討が十分でないためであると本発明者は考えている。本発明者は、特許文献1に記載の合成条件を採用すれば、LiCo1−2xNixMnxO2(0<x<1)で表され、十分な放電容量を備え、BET比表面積が0.7m2/g程度である活物質が得られることを確認している。従って、LiMeO2で表される活物質については、BET比表面積が大きすぎるという課題は存在しない。
【0007】
遷移金属(Me)の比率に対するリチウムの組成比率Li/Meが1より大きく、例えばLi/Meが1.25〜1.6である活物質が知られている。このような材料は、Li1+αMe1−αO2(α>0)と表記することができる。例えば、α=0.2のとき、Li/Me=1.5である。
【0008】
特許文献2には、このような活物質の一種であり、Li[Li1/3Mn2/3]O2、LiNi1/2Mn1/2O2及びLiCoO2の3つの成分の固溶体として表すことのできる活物質が記載されている。また、前記活物質を用いた電池の製造方法として、4.3V(vs.Li/Li+)を超え4.8V以下(vs.Li/Li+)の正極電位範囲に出現する、電位変化が比較的平坦な領域に少なくとも至る充電を行う製造工程を設けることにより、充電時の正極の最大到達電位が4.3V(vs.Li/Li+)以下である充電方法が採用された場合であっても、177mAh/g以上の放電容量が得られる電池を製造できることが記載されている。
【0009】
非特許文献2には、Li[Li0.2Ni0.15+0.5ZCo0.10Mn0.55−0.5Z]O2−ZFZで表される組成式の通りに酸素サイトの一部がFで置換された構造の活物質について記載されている。Fig.1には、エックス線回折図が記載され、Fで置換しない(Z=0)活物質のエックス線回折ピークに比べて、Fで置換した活物質のエックス線回折ピーク位置がシフトしている様子が記載されている。Fig.2には、室温において、Z=0である活物質の放電容量は約230mAh/gであり、Z=0.02である活物質の放電容量は約225mAh/gであり、Z=0.05である活物質の放電容量は約220mAh/gであり、Z=0.10である活物質の放電容量は約160mAh/gであったことが示されている。また、ゾルゲル法によって前記活物質を合成したことが記載されている。しかしながら、酸素サイトの一部がFで置換された構造の活物質について、どのような原料を用い、どのような手順及び条件によりFを導入したかについては、非特許文献2及び同文献末尾に記載の参考文献を参照しても記載がない。
非特許文献2に記載された活物質は、全遷移金属元素に対するLiのモル比が1.50と大きいものであり、Fの置換量Z=0.10程度で放電容量が極端に低下するという問題がある。また、Fの置換が、活物質の比表面積にどのような影響を与えるかは示されていない。
【0010】
特許文献3には、「一般式LiwMxOyXz (I)
(ここで、MはCoあるいはNiあるいはMnあるいはVあるいはFeあるいはTiを示し、Xは少なくとも1種以上のハロゲン元素を示す。wは0.2≦w≦2.5、xは0.8≦x≦1.25、yは1≦y≦2、zは0<z<0.25である。)で表される含リチウム金属ハロゲン化酸化物。」の発明が記載されているが、MをCo、Ni及びMnとすること、LiをMに対して過剰にすることは、具体的に示されていない。また、この発明は、正極電位そしてその還元電位を高くすることを課題(段落[0005])として、含リチウム金属ハロゲン化酸化物を正極活物質として使用するものであり、ハロゲン元素を導入することにより、活物質の比表面積がどのように変化するかは示されていない。
【0011】
特許文献4には、「リチウムイオンの吸蔵・放出が可能な正極活物質と、リチウムイオンの吸蔵・放出が可能な負極活物質と、非水系電解質とを備えた非水電解質二次電池であって、前記正極活物質は(110)ベクトル方向の結晶子サイズが1000Å以上で、かつ合成時の焼成によりハロゲンが添加された六方晶系のリチウム含有コバルト複合酸化物であることを特徴とする非水電解質二次電池。」の発明が記載され、コバルトの一部をV,Cr,Fe,Mn,Ni,Al,Tiから選択される少なくとも一種の異種元素で置換することも示されている(請求項4)が、Liを全遷移金属元素に対して過剰にすることは示されていない。また、この発明は、濾液のpH値が上昇しないような正極活物質を得て、電池内でのガスの発生を抑制して、高温時のサイクル特性が向上するとともに、充電保存時の劣化を抑制した非水電解質二次電池を提供することを目的とするものであり(段落[0007])、ハロゲン元素を添加することにより、活物質の比表面積がどのように変化するかは示されていない。
【0012】
特許文献5には、「F原子を0.025〜2.5重量%含有するリチウムコバルト系複合酸化物であって、該リチウムコバルト系複合酸化物の粒子表面をXPS分析(X線光電子分光分析)したときに、F原子に起因するピーク強度の最大となるエネルギーの位置が685eV近傍で、且つ該リチウムコバルト系複合酸化物の粒子内部に存在するF原子の量がリチウムコバルト系複合酸化物粒子中に含有されたF原子全体量の10〜30重量%であることを特徴とするリチウムコバルト系複合酸化物。」の発明が記載されているが、コバルトの一部を他の遷移金属元素で置換すること、Liを全遷移金属元素に対して過剰にすることは示されていない。また、この発明は、リチウム二次電池の正極活物質として用いたときに、特に負荷特性、サイクル特性、高温保存特性、低温特性及び安全性に優れたリチウム二次電池の正極活物質として有用なリチウムコバルト系複合酸化物を提供することを目的とするものであり(段落[0007])、比表面積が示されているが、F原子を存在させることが、活物質の比表面積にどのような影響を与えるかは示されていない。
【0013】
特許文献6には、リチウム複合金属酸化物の焼成の際に、反応促進剤を含有させることが記載され、「反応促進剤として、より具体的には、NaCl、KCl、NH4Clなどの塩化物、LiF、NaF、KF、HN4Fなどのフッ化物、ホウ酸、好ましくは前記塩化物を挙げることができ、より好ましくはKClである。混合物が反応促進剤を含有することで、混合物の焼成時の反応性を向上させ、得られるリチウム複合金属酸化物のBET比表面積を調整することが可能な場合がある。通常、焼成の保持温度が同じ場合には、混合物における反応促進剤の含有量が多くなればなるほど、BET比表面積は小さくなる傾向にある。また、反応促進剤を2種以上併用することもできる。反応促進剤は、共沈物とリチウム化合物との混合時に、添加して混合すればよい。また、反応促進剤は、リチウム複合金属酸化物に残留していてもよいし、洗浄、蒸発等により除去されていてもよい。」(段落[0031])と記載されているが、KClを含有させた実施例としては、Ni:Mn:Feのモル比が0.45:0.45:0.10であり、BET比表面積が96m2/gである共沈物と水酸化リチウム一水和物とKCl(反応促進剤)とを乾式混合して800℃で焼成することにより、Li:Ni:Mn:Feのモル比が1.10:0.45:0.45:0.10であり、BET比表面積が7.6m2/gであるリチウム複合金属酸化物を製造することが記載されている(段落[0102]〜[0107])だけであり、Co、Ni及びMnを含み、Liを全遷移金属元素に対して過剰にしたリチウム複合金属酸化物は示されていない。
【0014】
特許文献7には、「リチウム複合酸化物の粒子表面近傍に硫黄(S)およびリン(P)の少なくとも1種を含み、上記リチウム複合酸化物の粒子表面近傍における硫黄(S)およびリン(P)の少なくとも1種の含有量が、上記リチウム複合酸化物の粒子内部よりも高いことを特徴とする正極活物質。」の発明が記載されているが、Co、Ni及びMnを含み、Liを全遷移金属元素に対して過剰にしたリチウム複合金属酸化物は示されていない。また、この発明は、高温保存特性に優れた正極活物質を提供することを目的とするものであり(段落[0007])、比表面積が示されているが、硫黄(S)およびリン(P)を含有させることが、活物質の比表面積にどのような影響を与えるかは示されていない。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】特許第4556377号公報
【特許文献2】特開2009−152114号公報
【特許文献3】特許第3112138号公報
【特許文献4】特開2002−298846号公報
【特許文献5】特開2003−221235号公報
【特許文献6】特開2010−21125号公報
【特許文献7】特開2007−335331号公報
【非特許文献】
【0016】
【非特許文献1】S.Jouanneau, J.R.Dahn,J. Electrochem.Soc., 151(10), A1749-1754, 2004.
【非特許文献2】S.-H.Kang, K.Amine, J.Power Sources, 146, (1-2), 654-657, 2005.
【発明の開示】
【発明が解決しようとする課題】
【0017】
非水電解質二次電池用活物質のBET比表面積が大きいと、種々の不都合が生じる。非水電解質二次電池用電極は、活物質粉体に、導電剤、結着剤及び溶剤を混合し、ペースト状にして集電体上に塗布し、前記溶剤を揮発させる乾燥工程、プレス工程を経て、集電体上に合剤層が形成されてなる。このとき、活物質のBET比表面積が大きいと、ペースト状にするために結着剤を多く必要とする。結着剤は電極反応に寄与しないので、結着剤の量が多いことは、合剤中の活物質の量が相対的に低下する。従って、活物質自体のリチウムイオンの吸蔵放出能力が十分であったとしても、このような電極を用いた非水電解質電池は、エネルギー密度が低いものとなる。また、結着剤の量が十分でない場合、プレス工程で合剤が脱落しやすい等の不具合を生じやすい。また、このような電極を湾曲した場合、前記合剤層にひび割れ等が生じるなど、可撓性に欠けるものとなりやすく、電極性能の低下を導く。さらに、BET比表面積が大きいと、これを用いた電池において、電解液との副反応が大きくなる傾向があり、充放電サイクル性能の低下、保存性能の低下を導く。なお、BET比表面積を小さくすることのできる合成条件が見いだされたとしても、十分な電極特性を兼ね備えるものでなければならないことはいうまでもない。
【0018】
本発明者は、Li1+αMe1−αO2(MeはCo,Mn及びNiを含む遷移金属、α>0)で表され、Li/Meが1.20〜1.50である活物質の組成及び焼成温度を種々変化させて検討を行った。これらの結果を本願明細書に比較例として後述する。これらの結果を整理した図1〜3からわかるように、Li/Me比の値が1.5の場合、焼成温度を1000℃とすることで、BET比表面積の値が1m2/g程度と十分に小さく、Li/Me比の値が1.4又は1.3の場合と比べて高い放電容量を備えた活物質を合成することができる。
【0019】
次に、本発明者は、Li/Me比の値を1.4又は1.3とし、焼成温度を1000℃未満とすることで、Li/Me比の値が1.5の場合に比べて、高い放電容量と高い初期充放電効率を兼ね備えた活物質を合成することができることを見いだした。しかしながら、このような活物質は、BET比表面積が大きなものとなってしまうという問題点があった。
【0020】
本発明の課題は、Co、Ni及びMnを含む遷移金属元素Me、並びに、Liを含有し、前記全遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40である(以下、「リチウム過剰」という。)リチウム遷移金属複合酸化物を含有し、BET比表面積の値が小さく、放電容量が大きい非水電解質二次電池用活物質、及び、それを用いた非水電解質二次電池を提供することにある。
【課題を解決するための手段】
【0021】
本発明においては、上記課題を解決するために、以下の手段を採用する。
(1)六方晶構造を有するリチウム遷移金属複合酸化物を含有する非水電解質二次電池用活物質であって、前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む遷移金属元素Me、Li、並びに、元素X(Xは、F、Cl、P及びSからなる群のうち1種又は2種以上)を含有し、前記遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40であり、前記遷移金属元素Me中のCoのモル比Co/Meが0.02〜0.23であり、前記遷移金属元素Me中のMnのモル比Mn/Meが0.63〜0.72であり、前記Liに対する前記元素Xのモル比X/Liが0.01〜0.1であることを特徴とする非水電解質二次電池用活物質。
(2)前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む化合物の共沈前駆体と前記元素Xを含むリチウム化合物を一部に用いたリチウム化合物とを混合して焼成したものである前記(1)の非水電解質二次電池用活物質。
(3)前記リチウム遷移金属複合酸化物は、前記元素Xを含有しないリチウム遷移金属複合酸化物と比較して格子定数に変化がない前記(1)又は(2)の非水電解質二次電池用活物質。
(4)前記元素XはSである前記(1)〜(3)のいずれか1項の非水電解質二次電池用活物質。
(5)前記(1)〜(4)のいずれか1項の非水電解質二次電池用活物質の製造方法であって、溶液中でCo、Ni及びMnを含む化合物を共沈させて共沈前駆体を製造する工程、前記共沈前駆体と前記元素Xを含むリチウム化合物を一部に用いたリチウム化合物とを混合し、焼成する工程を含むことを特徴とする非水電解質二次電池用活物質の製造方法。
(6)前記(1)〜(4)のいずれか1項の非水電解質二次電池用活物質を含有する非水電解質二次電池用電極。
(7)前記(6)の非水電解質二次電池用電極を備えた非水電解質二次電池。
【発明の効果】
【0022】
本発明によれば、新規なリチウム遷移金属複合酸化物を用いることにより、BET比表面積の値が小さく、また、元素Xを含有しないリチウム遷移金属複合酸化物を用いた場合と比較して放電容量の低下が小さい非水電解質二次電池用活物質が得られる。
【図面の簡単な説明】
【0023】
【図1】Li/Me比が1.3、1.4又は1.5である従来のリチウム遷移金属複合酸化物を含有する活物質について、焼成温度と放電容量の関係を示す図である。
【図2】Li/Me比が1.3、1.4又は1.5である従来のリチウム遷移金属複合酸化物を含有する活物質について、焼成温度と初期充放電効率の関係を示す図である。
【図3】Li/Me比が1.3、1.4又は1.5である従来のリチウム遷移金属複合酸化物を含有する活物質について、焼成温度とBET比表面積の関係を示す図である。
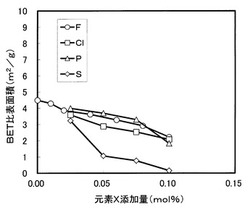
【図4】本発明のリチウム遷移金属複合酸化物を含有する活物質について、元素Xの添加量とBET比表面積の関係を示す図である。
【図5】本発明のリチウム遷移金属複合酸化物を含有する活物質について、元素Xの添加量と発熱開始温度の関係を示す図である。
【発明を実施するための最良の形態】
【0024】
本発明の非水電解質二次電池用活物質は、リチウム遷移金属複合酸化物を含むものであり、そのリチウム遷移金属複合酸化物は、Co、Ni及びMnを含む遷移金属元素Me、Li、並びに、元素X(Xは、F、Cl、P及びSからなる群のうち1種又は2種以上)を含有し、その遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40であり、モル比Co/Meが0.02〜0.23であり、モル比Mn/Meが0.63〜0.72であり、Liに対する元素Xのモル比X/Liが0.01〜0.1であることを特徴とする。
なお、非水電解質二次電池としては、リチウム二次電池が典型的なものであるから、以下においては、リチウム二次電池について説明する。
【0025】
本発明は、Li過剰活物質はBET比表面積が大きいものとなりすぎるという、LiCoO2系やLiNi1/2Mn1/2O2系あるいはそれらの固溶体に代表されるLiMeO2で表される正極活物質にはなかった、Li過剰活物質に特有の課題を解決するためのものである。即ち、Li過剰活物質において、BET比表面積を低いものとするために、元素Xを備える、あるいは、LiX(元素Xを含むリチウム化合物)を混合して焼成するというものである。また、Liに対する元素Xのモル比X/Liを0.01〜0.1(以下、「mol%」と省略する。)とすることを特徴とする。
後述するデータからわかるように、元素Xの0.025mol%の添加でBET比表面積を約3m2/gまで低減できる。0.1mol%の添加でBET比表面積を約2m2/gまで低減できる。添加量が0.1mol%を超えると、放電容量が低下する場合があることから、添加量は0.1mol%以下が好ましい。X=F,Cl,P,Sである。なかでも、X=Sを選択すれば、わずか0.05mol%を添加するだけでBET比表面積を約1m2/gまで低減でき、0.1mol%を添加すればBET比表面積を約0.2m2/gまで低減できる。しかも、ここまでBET比表面積を低減させた場合でも、放電容量の低下が小さい。
【0026】
非特許文献2は、Fを適用することで、0.1mol%相当量の場合で比較して、放電容量が約30%低下している。これに対し、本発明では、放電容量の低下はわずか8.6%(後述の表2の実施例6参照)である。この原因について推察するため、本発明者は、エックス線回折図及びそこから算出される格子定数について検討した。もし、O(酸素)サイトの一部がFに置換されたとすると、小さな原子を大きな原子で置換することを意味することから、置換量に応じて、a軸長及びc軸長が共に大きくなると考えられるところ、非特許文献2では実際にその通りのデータが示されている。これに対して、本願明細書に記載した実施例及び比較例について同様の検討を行ったところ、表1に示すように、a軸長については、LiFの添加量に伴って、逆に減少傾向が認められ、c軸長についてはLiFの添加量との相関が認められなかった。即ち、LiFの添加量に伴って、格子定数に連続的な変化は認められなかった。この事実は、本発明に係る活物質においては、原料に用いたF等の元素が、活物質材料中に固溶していないことを示唆している。
【0027】
【表1】

【0028】
本発明のリチウム遷移金属複合酸化物は便宜的に次の一般式で表される。
一般式LiaCoxNiyMnzO2Xb(a+x+y+z=2)
但し、a/(x+y+z)が1.25〜1.40、x/(x+y+z)が0.02〜0.23、z/(x+y+z)が0.63〜0.72、b/aが0.01〜0.1
上記のように、本発明においては、リチウム遷移金属複合酸化物は、元素X(F、Cl、P及びSからなる群のうち1種又は2種以上)を含有しないリチウム遷移金属複合酸化物と比較して格子定数に変化がないものであり、元素Xが固溶していないと考えられるから、Oの係数は2のままであり、b/aが0.01〜0.1の元素Xが付加されていると推定される。しかし、本発明においては、Xが一部固溶されている場合を排除するものではない。
【0029】
遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40(a/(x+y+z)が1.25〜1.40)、Meに対するCoのモル比Co/Meが0.02〜0.23(x/(x+y+z)が0.02〜0.23)、Meに対するMnのモル比Mn/Meが0.63〜0.72(z/(x+y+z)が0.63〜0.72)、Liに対する元素Xのモル比X/Liが0.01〜0.1(b/aが0.01〜0.1)という全ての要件を満たすリチウム遷移金属複合酸化物を活物質として用いることにより、BET比表面積の値が小さく、かつ、放電容量が大きい非水電解質二次電池用活物質を得ることができる。
【0030】
遷移金属元素Meに対するLiのモル比Li/Meが1.25よりも小さいと、放電容量が小さくなり、Li/Meが1.40よりも大きいと、1000℃未満で焼成する場合には、放電容量が小さくなるので、放電容量が大きいリチウム二次電池を得るために、Li/Meは1.25〜1.40(a/(x+y+z)は1.25〜1.40)とする。なかでも、Li/Me1.25〜1.35が好ましい。
【0031】
遷移金属元素Meに対するCoのモル比Co/Meが0.02よりも小さい、又はCo/Meが0.23よりも大きいと、放電容量が小さくなるので、放電容量が大きいリチウム二次電池を得るために、Co/Meは0.02〜0.23(x/(x+y+z)は0.02〜0.23)とする。Co/Meは0.04〜0.21が好ましく、0.06〜0.17がより好ましい。
【0032】
遷移金属元素Meに対するMnのモル比Mn/Meが0.63よりも小さい、又はMn/Meが0.72よりも大きいと、放電容量が小さくなるので、放電容量が大きいリチウム二次電池を得るために、Mn/Meは0.63〜0.72(z/(x+y+z)は0.63〜0.72)とする。Mn/Meは0.65〜0.71が好ましい。
【0033】
本発明のリチウム遷移金属複合酸化物は、上記のような一般式で表されるものであり、本質的に、Li、Co、Ni及びMnからなる複合酸化物に元素Xを含有するものであるが、本発明の効果を損なわない範囲で、少量のNa,Ca等のアルカリ金属やアルカリ土類金属、Fe,Zn等の3d遷移金属に代表される遷移金属など他の金属を含有することを排除するものではない。
【0034】
また、本発明のリチウム遷移金属複合酸化物は、本質的に、結晶構造が六方晶に帰属される。空間群としてはP3112又はR3−mに帰属可能である。ここで、P3112は、R3−mにおける3a、3b、6cサイトの原子位置を細分化した結晶構造モデルであり、R3−mにおける原子配置に秩序性が認められるときに該P3112モデルが採用される。なお、「R3−m」は本来「R3m」の「3」の上にバー「−」を施して表記すべきものである。
【0035】
次に、本発明のリチウム二次電池用活物質を製造する方法について説明する。
本発明の非水電解質二次電池用活物質は、基本的に、活物質を構成する金属元素(Li,Mn,Co,Ni)及び元素Xを、目的とする活物質(リチウム遷移金属複合酸化物)の組成通りに含有するように原料を調整し、最終的にこの原料を焼成すること、によって得ることができる。但し、Li原料の量については、焼成中にLi原料の一部が消失することを見込んで、1〜5%程度過剰に仕込むことが好ましい。
目的とする組成を有するリチウム遷移金属複合酸化物を作製するための方法として、Li,Co,Ni,Mnのそれぞれの塩を混合・焼成するいわゆる「固相法」や、あらかじめCo,Ni,Mnを一粒子中に存在させた共沈前駆体を作製しておき、これにLi塩を混合・焼成する「共沈法」が知られている。「固相法」による合成過程では、特にMnはCo,Niに対して均一に固溶しにくい。このため、各元素が一粒子中に均一に分布した試料を得ることは困難である。本発明に係る非水電解質二次電池用活物質を製造するにあたり、前記「固相法」と前記「共沈法」のいずれを選択するかについては限定されるものではない。しかしながら、「固相法」を選択した場合には、本発明に係る正極活物質を製造することは極めて困難である。「共沈法」を選択する方が原子レベルで均一相を得ることが容易である点で好ましい。
【0036】
共沈前駆体を作製するにあたって、Co,Ni,MnのうちMnは酸化されやすく、Co,Ni,Mnが2価の状態で均一に分布した共沈前駆体を作製することが容易ではないため、Co,Ni,Mnの原子レベルでの均一な混合は不十分なものとなりやすい。特に本発明の組成範囲においては、Mn比率がCo,Ni比率に比べて高いので、水溶液中の溶存酸素を除去することが重要である。溶存酸素を除去する方法としては、酸素を含まないガスをバブリングする方法が挙げられる。酸素を含まないガスとしては、限定されるものではないが、窒素ガス、アルゴンガス、二酸化炭素(CO2)等を用いることができる。なかでも、後述する実施例のように、共沈炭酸塩前駆体を作製する場合には、酸素を含まないガスとして二酸化炭素を採用すると、炭酸塩がより生成しやすい環境が与えられるため、好ましい。
【0037】
溶液中でCo、Ni及びMnを含有する化合物を共沈させて前駆体を製造する工程におけるpHは限定されるものではないが、前記共沈前駆体を共沈炭酸塩前駆体として作製しようとする場合には、8.5〜11とすることができる。タップ密度を大きくするためには、pHを制御することが好ましい。pHを9.4以下とすることにより、タップ密度を1.25g/cc以上とすることができ、高率放電特性を向上させることができる。
【0038】
前記共沈前駆体の作製は、MnとNiとCoとが均一に混合された化合物であることが好ましい。ただし前駆体は水酸化物に限定されるものではなく、他にも炭酸塩、クエン酸塩などの元素が原子レベルで均一に存在した難溶性塩であれば水酸化物と同様に使用することができる。また、錯化剤を用いた晶析反応等を用いることによって、より嵩密度の大きな前駆体を作製することもできる。その際、Li源と混合・焼成することでより高密度の活物質を得ることができるので電極面積あたりのエネルギー密度を向上させることができる。
【0039】
前記共沈前駆体の原料は、Mn化合物としては酸化マンガン、炭酸マンガン、硫酸マンガン、硝酸マンガン、酢酸マンガン等を、Ni化合物としては、水酸化ニッケル、炭酸ニッケル、硫酸ニッケル、硝酸ニッケル、酢酸ニッケル等を、Co化合物としては、硫酸コバルト、硝酸コバルト、酢酸コバルト等を一例として挙げることができる。
【0040】
前記共沈前駆体の作製に用いる原料としては、アルカリ水溶液と沈殿反応を形成するものであればどのような形態のものでも使用することができるが、好ましくは溶解度の高い金属塩を用いるとよい。
【0041】
本発明におけるリチウム二次電池用活物質は前記共沈前駆体とLi化合物とを混合した後、熱処理することで好適に作製することができる。Li化合物としては、水酸化リチウム、炭酸リチウム、硝酸リチウム、酢酸リチウム等を用いることができるが、本発明においては、リチウム遷移金属複合酸化物中にXを含有させるために、炭酸リチウム(Li2CO3)等のLi化合物の一部に元素Xを含むリチウム化合物を用いることが好ましい。
具体的には、元素Xを含むリチウム化合物としてLiF、LiCl、Li2SO4、Li3PO4等を用いることができ、Co、Ni及びMnを含む化合物の共沈前駆体と上記のような元素Xを含むリチウム化合物を混合し、焼成することによって、本発明のリチウム遷移金属複合酸化物が得られる。
【0042】
可逆容量の大きな活物質を得るにあたって、焼成温度の選択は極めて重要である。
焼成温度が高すぎると、得られた活物質が酸素放出反応を伴って崩壊すると共に、主相の六方晶に加えて単斜晶のLi[Li1/3Mn2/3]O2型に規定される相が、固溶相としてではなく、分相して観察される傾向があり、このような材料は、活物質の可逆容量が大きく減少するので好ましくない。このような材料では、X線回折図上35°付近及び45°付近に不純物ピークが観察される。従って、焼成温度は、活物質の酸素放出反応の影響する温度未満とすることが重要である。活物質の酸素放出温度は、本発明に係る組成範囲においては、概ね1000℃以上であるが、活物質の組成によって酸素放出温度に若干の差があるので、あらかじめ活物質の酸素放出温度を確認しておくことが好ましい。特に試料に含まれるCo量が多いほど前駆体の酸素放出温度は低温側にシフトすることが確認されているので注意が必要である。活物質の酸素放出温度を確認する方法としては、焼成反応過程をシミュレートするために、共沈前駆体とリチウム化合物を混合したものを熱重量分析(DTA−TG測定)に供してもよいが、この方法では測定機器の試料室に用いている白金が揮発したLi成分により腐食されて機器を痛めるおそれがあるので、あらかじめ500℃程度の焼成温度を採用してある程度結晶化を進行させた組成物を熱重量分析に供するのが良い。
【0043】
一方、焼成温度が低すぎると、結晶化が十分に進まず、電極特性も大きく低下するので好ましくない。焼成温度は少なくとも800℃以上とすることが必要である。十分に結晶化させることは結晶粒界の抵抗を軽減し、円滑なリチウムイオン輸送を促すために重要である。結晶化の度合いの見極め方として走査型電子顕微鏡を用いた視覚的な観察が挙げられる。本発明の正極活物質について走査型電子顕微鏡観察を行ったところ、試料合成温度が800℃以下ではナノオーダーの一次粒子から形成されているものであったが、さらに試料合成温度を上昇させることでサブミクロン程度まで結晶化するものであり、電極特性向上につながる大きな一次粒子を得られるものであった。
また、発明者らは、本発明活物質の回折ピークの半値幅を詳細に解析することで800℃までの温度で合成した試料においては格子内にひずみが残存しており、それ以上の温度で合成することでほとんどひずみを除去することができることを確認した。また、結晶子のサイズは合成温度が上昇するに比例して大きくなるものであった。よって、本発明活物質の組成においても、系内に格子のひずみがほとんどなく、かつ結晶子サイズが十分成長した粒子を志向することで良好な放電容量を得られるものであった。具体的には、格子定数に及ぼすひずみ量が1%以下、かつ結晶子サイズが100nm以上に成長しているような合成温度(焼成温度)を採用することが好ましいことがわかった。これらを電極として成型して充放電をおこなうことで膨張収縮による変化も見られるが、充放電過程においても結晶子サイズは50nm以上を保っていることが得られる効果として好ましい。即ち、焼成温度を上記した活物質の酸素放出温度にできるだけ近付けるように選択することにより、はじめて、可逆容量が顕著に大きい活物質を得ることができる。
【0044】
上記のように、好ましい焼成温度は、活物質の酸素放出温度により異なるから、一概に焼成温度の好ましい範囲を設定することは難しいが、本発明においては、Li/Meが1.25〜1.40である場合に放電容量を充分なものとするために、焼成温度を800〜950℃とすることが好ましく、850〜900℃とすることがより好ましい。
【0045】
本発明に係るリチウム二次電池に用いる非水電解質は、限定されるものではなく、一般にリチウム電池等への使用が提案されているものが使用可能である。非水電解質に用いる非水溶媒としては、プロピレンカーボネート、エチレンカーボネート、ブチレンカーボネート、クロロエチレンカーボネート、ビニレンカーボネート等の環状炭酸エステル類;γ−ブチロラクトン、γ−バレロラクトン等の環状エステル類;ジメチルカーボネート、ジエチルカーボネート、エチルメチルカーボネート等の鎖状カーボネート類;ギ酸メチル、酢酸メチル、酪酸メチル等の鎖状エステル類;テトラヒドロフランまたはその誘導体;1,3−ジオキサン、1,4−ジオキサン、1,2−ジメトキシエタン、1,4−ジブトキシエタン、メチルジグライム等のエーテル類;アセトニトリル、ベンゾニトリル等のニトリル類;ジオキソランまたはその誘導体;エチレンスルフィド、スルホラン、スルトンまたはその誘導体等の単独またはそれら2種以上の混合物等を挙げることができるが、これらに限定されるものではない。
【0046】
非水電解質に用いる電解質塩としては、例えば、LiClO4,LiBF4,LiAsF6,LiPF6,LiSCN,LiBr,LiI,Li2SO4,Li2B10Cl10,NaClO4,NaI,NaSCN,NaBr,KClO4,KSCN等のリチウム(Li)、ナトリウム(Na)またはカリウム(K)の1種を含む無機イオン塩、LiCF3SO3,LiN(CF3SO2)2,LiN(C2F5SO2)2,LiN(CF3SO2)(C4F9SO2),LiC(CF3SO2)3,LiC(C2F5SO2)3,(CH3)4NBF4,(CH3)4NBr,(C2H5)4NClO4,(C2H5)4NI,(C3H7)4NBr,(n−C4H9)4NClO4,(n−C4H9)4NI,(C2H5)4N−maleate,(C2H5)4N−benzoate,(C2H5)4N−phtalate、ステアリルスルホン酸リチウム、オクチルスルホン酸リチウム、ドデシルベンゼンスルホン酸リチウム等の有機イオン塩等が挙げられ、これらのイオン性化合物を単独、あるいは2種類以上混合して用いることが可能である。
【0047】
さらに、LiBF4とLiN(C2F5SO2)2のようなパーフルオロアルキル基を有するリチウム塩とを混合して用いることにより、さらに電解質の粘度を下げることができるので、低温特性をさらに高めることができ、また、自己放電を抑制することができ、より望ましい。
【0048】
また、非水電解質として常温溶融塩やイオン液体を用いてもよい。
【0049】
非水電解質における電解質塩の濃度としては、高い電池特性を有する非水電解質電池を確実に得るために、0.1mol/l〜5mol/lが好ましく、さらに好ましくは、0.5mol/l〜2.5mol/lである。
【0050】
負極材料としては、限定されるものではなく、リチウムイオンを析出あるいは吸蔵することのできる形態のものであればどれを選択してもよい。例えば、Li[Li1/3Ti5/3]O4に代表されるスピネル型結晶構造を有するチタン酸リチウム等のチタン系材料、SiやSb,Sn系などの合金系材料リチウム金属、リチウム合金(リチウム−シリコン、リチウム−アルミニウム,リチウム−鉛,リチウム−スズ,リチウム−アルミニウム−スズ,リチウム−ガリウム,及びウッド合金等のリチウム金属含有合金)、リチウム複合酸化物(リチウム−チタン)、酸化珪素の他、リチウムを吸蔵・放出可能な合金、炭素材料(例えばグラファイト、ハードカーボン、低温焼成炭素、非晶質カーボン等)等が挙げられる。
【0051】
正極活物質の粉体および負極材料の粉体は、平均粒子サイズ100μm以下であることが望ましい。特に、正極活物質の粉体は、非水電解質電池の高出力特性を向上する目的で10μm以下であることが望ましい。粉体を所定の形状で得るためには粉砕機や分級機が用いられる。例えば乳鉢、ボールミル、サンドミル、振動ボールミル、遊星ボールミル、ジェットミル、カウンタージェトミル、旋回気流型ジェットミルや篩等が用いられる。粉砕時には水、あるいはヘキサン等の有機溶剤を共存させた湿式粉砕を用いることもできる。分級方法としては、特に限定はなく、篩や風力分級機などが、乾式、湿式ともに必要に応じて用いられる。
【0052】
以上、正極及び負極の主要構成成分である正極活物質及び負極材料について詳述したが、前記正極及び負極には、前記主要構成成分の他に、導電剤、結着剤、増粘剤、フィラー等が、他の構成成分として含有されてもよい。
【0053】
導電剤としては、電池性能に悪影響を及ぼさない電子伝導性材料であれば限定されないが、通常、天然黒鉛(鱗状黒鉛,鱗片状黒鉛,土状黒鉛等)、人造黒鉛、カーボンブラック、アセチレンブラック、ケッチェンブラック、カーボンウイスカー、炭素繊維、金属(銅,ニッケル,アルミニウム,銀,金等)粉、金属繊維、導電性セラミックス材料等の導電性材料を1種またはそれらの混合物として含ませることができる。
【0054】
これらの中で、導電剤としては、電子伝導性及び塗工性の観点よりアセチレンブラックが望ましい。導電剤の添加量は、正極または負極の総重量に対して0.1重量%〜50重量%が好ましく、特に0.5重量%〜30重量%が好ましい。特にアセチレンブラックを0.1〜0.5μmの超微粒子に粉砕して用いると必要炭素量を削減できるため望ましい。これらの混合方法は、物理的な混合であり、その理想とするところは均一混合である。そのため、V型混合機、S型混合機、擂かい機、ボールミル、遊星ボールミルといったような粉体混合機を乾式、あるいは湿式で混合することが可能である。
【0055】
前記結着剤としては、通常、ポリテトラフルオロエチレン(PTFE),ポリフッ化ビニリデン(PVDF),ポリエチレン,ポリプロピレン等の熱可塑性樹脂、エチレン−プロピレン−ジエンターポリマー(EPDM),スルホン化EPDM,スチレンブタジエンゴム(SBR)、フッ素ゴム等のゴム弾性を有するポリマーを1種または2種以上の混合物として用いることができる。結着剤の添加量は、正極または負極の総重量に対して1〜50重量%が好ましく、特に2〜30重量%が好ましい。
【0056】
フィラーとしては、電池性能に悪影響を及ぼさない材料であれば何でも良い。通常、ポリプロピレン,ポリエチレン等のオレフィン系ポリマー、無定形シリカ、アルミナ、ゼオライト、ガラス、炭素等が用いられる。フィラーの添加量は、正極または負極の総重量に対して添加量は30重量%以下が好ましい。
【0057】
正極及び負極は、前記主要構成成分(正極においては正極活物質、負極においては負極材料)、およびその他の材料を混練し合剤とし、N−メチルピロリドン,トルエン等の有機溶媒に混合させた後、得られた混合液を下記に詳述する集電体の上に塗布し、または圧着して50℃〜250℃程度の温度で、2時間程度加熱処理することにより好適に作製される。前記塗布方法については、例えば、アプリケーターロールなどのローラーコーティング、スクリーンコーティング、ドクターブレード方式、スピンコーティング、バーコータ等の手段を用いて任意の厚さ及び任意の形状に塗布することが望ましいが、これらに限定されるものではない。
【0058】
セパレータとしては、優れた高率放電性能を示す多孔膜や不織布等を、単独あるいは併用することが好ましい。非水電解質電池用セパレータを構成する材料としては、例えばポリエチレン,ポリプロピレン等に代表されるポリオレフィン系樹脂、ポリエチレンテレフタレート,ポリブチレンテレフタレート等に代表されるポリエステル系樹脂、ポリフッ化ビニリデン、フッ化ビニリデン−ヘキサフルオロプロピレン共重合体、フッ化ビニリデン−パーフルオロビニルエーテル共重合体、フッ化ビニリデン−テトラフルオロエチレン共重合体、フッ化ビニリデン−トリフルオロエチレン共重合体、フッ化ビニリデン−フルオロエチレン共重合体、フッ化ビニリデン−ヘキサフルオロアセトン共重合体、フッ化ビニリデン−エチレン共重合体、フッ化ビニリデン−プロピレン共重合体、フッ化ビニリデン−トリフルオロプロピレン共重合体、フッ化ビニリデン−テトラフルオロエチレン−ヘキサフルオロプロピレン共重合体、フッ化ビニリデン−エチレン−テトラフルオロエチレン共重合体等を挙げることができる。
【0059】
セパレータの空孔率は強度の観点から98体積%以下が好ましい。また、充放電特性の観点から空孔率は20体積%以上が好ましい。
【0060】
また、セパレータは、例えばアクリロニトリル、エチレンオキシド、プロピレンオキシド、メチルメタアクリレート、ビニルアセテート、ビニルピロリドン、ポリフッ化ビニリデン等のポリマーと電解質とで構成されるポリマーゲルを用いてもよい。非水電解質を上記のようにゲル状態で用いると、漏液を防止する効果がある点で好ましい。
【0061】
さらに、セパレータは、上述したような多孔膜や不織布等とポリマーゲルを併用して用いると、電解質の保液性が向上するため望ましい。即ち、ポリエチレン微孔膜の表面及び微孔壁面に厚さ数μm以下の親溶媒性ポリマーを被覆したフィルムを形成し、前記フィルムの微孔内に電解質を保持させることで、前記親溶媒性ポリマーがゲル化する。
【0062】
前記親溶媒性ポリマーとしては、ポリフッ化ビニリデンの他、エチレンオキシド基やエステル基等を有するアクリレートモノマー、エポキシモノマー、イソシアナート基を有するモノマー等が架橋したポリマー等が挙げられる。該モノマーは、ラジカル開始剤を併用して加熱や紫外線(UV)を用いたり、電子線(EB)等の活性光線等を用いて架橋反応を行わせることが可能である。
【0063】
リチウム二次電池の構成については特に限定されるものではなく、正極、負極及びロール状のセパレータを有する円筒型電池、角型電池、扁平型電池等が一例として挙げられる。
【0064】
従来のリチウム二次電池においては、正極の最大到達電位が4.5V(vs.Li/Li+)以上に至る充電をして使用することが一般的に行われているが、本発明の活物質も、正極電位が4.5V(vs.Li/Li+)付近に至って充放電が可能である。しかしながら、使用する非水電解質の種類によっては、充電時の正極電位が高すぎると、非水電解質が酸化分解され電池性能の低下を引き起こす虞がある。したがって、使用時において、充電時の正極の最大到達電位が4.3V(vs.Li/Li+)以下となるような充電方法を採用しても、充分な放電容量が得られるリチウム二次電池が求められる場合がある。本発明の活物質を用いると、使用時において、充電時の正極の最大到達電位が4.5V(vs.Li/Li+)より低くなるような、例えば、4.4V(vs.Li/Li+)以下や4.3V(vs.Li/Li+)以下となるような充電方法を採用しても、約200mAh/g以上という従来の正極活物質の容量を超える放電電気量を取り出すことが可能である。
【0065】
本発明に係る正極活物質が、高い放電容量を備えたものとするためには、リチウム遷移金属複合酸化物を構成する遷移金属元素が層状岩塩型結晶構造の遷移金属サイト以外の部分に存在する割合が小さいものであることが好ましい。これは、焼成工程に供する前駆体において、Co,Ni,Mnといった遷移金属元素が十分に均一に分布していること、及び、活物質試料の結晶化を促すための適切な焼成工程の条件を選択することによって達成できる。焼成工程に供する前駆体中の遷移金属の分布が均一でない場合、十分な放電容量が得られないものとなる。この理由については必ずしも明らかではないが、焼成工程に供する前駆体中の遷移金属の分布が均一でない場合、得られるリチウム遷移金属複合酸化物は、層状岩塩型結晶構造の遷移金属サイト以外の部分、即ちリチウムサイトに遷移金属元素の一部が存在するものとなる、いわゆるカチオンミキシングが起こることに由来するものと本発明者らは推察している。同様の推察は焼成工程における結晶化過程においても適用でき、活物質試料の結晶化が不十分であると層状岩塩型結晶構造におけるカチオンミキシングが起こりやすくなる。前記遷移金属元素の分布の均一性が高いものは、X線回折測定による(003)面と(104)面の回折ピークの強度比が大きいものとなる傾向がある。本発明において、X線回折測定による(003)面と(104)面の回折ピークの強度比は、I(003)/I(104)≧1.20であることが好ましく、I(003)/I(104)≧1.40であることがより好ましく、I(003)/I(104)≧1.50であることが特に好ましい。本願明細書の実施例に示した正極活物質は、比較例も含めて全て、正極活物質が合成によって得られた段階、即ち、未だ充放電に供していない状態において、I(103)/I(104)≧1.58であった。また、充放電を経た放電末の状態においてI(103)/I(104)>1であることが好ましい。前駆体の合成条件や合成手順が不適切である場合、前記ピーク強度比はより小さい値となり、しばしば1未満の値となる。
本願明細書に記載した合成条件及び合成手順を採用することにより、上記のような高性能の正極活物質を得ることができる。とりわけ、充電上限電位を4.5Vより低く設定した場合、例えば4.4Vや4.3Vといった充電上限電位を設定した場合でも高い放電容量を得ることができる非水電解質二次電池用正極活物質とすることができる。
【実施例】
【0066】
(比較例1)
(活物質の合成)
硫酸コバルト7水和物、硫酸ニッケル6水和物及び硫酸マンガン5水和物をCo、Ni及びMnのモル比が12.5:19.94:67.56となるよう秤量し、イオン交換水に溶解させることで2Mの硫酸塩水溶液を作製した。一方、15Lの反応槽を用意した。この反応層には、反応槽内部の液面が一定の高さを超えるとその排出口から溶液が排出されるように排出口が設けられている。また、反応槽内には、撹拌羽が備えられていると共に、攪拌時に上下方向の対流を生じさせるための円筒型の対流板が固定されている。前記反応槽に7Lのイオン交換水を入れ、CO2ガスを30minバブリングさせることにより、前記イオン交換水中に前記CO2ガスを十分溶解させた。なお、CO2ガスバブリングは、硫酸塩水溶液を滴下し終わるまで継続した。次に、前記反応層を50℃に設定し、前記撹拌羽を1000rpmの回転速度で作動させた。前記反応槽中に2Lの硫酸塩水溶液を徐々に滴下した。滴下中、前記攪拌を継続した。また、反応槽中のpHを常時監視し、pHが8.6±0.2の範囲となるように、2Mの炭酸ナトリウム及び0.2Mのアンモニアが溶解している水溶液を加えた。前記硫酸塩水溶液を滴下している間、前記排出口から反応生成物を含む溶液一部が反応槽の外へ排出されるが、2Lの硫酸塩水溶液の全量を滴下し終わるまでの排出溶液は、反応槽内に戻さず、廃棄した。滴下終了後、反応生成物を含む溶液をから、吸引ろ過により共沈生成物を濾別し、付着したナトリウムイオンを除去するために、イオン交換水を用いて洗浄した。次に、大気雰囲気中、常圧下、オーブンで100℃にて乾燥させた。乾燥後、粒径を揃えるように、乳鉢で数分間粉砕した。このようにして、共沈炭酸塩前駆体の粉末を得た。
【0067】
前記共沈炭酸塩前駆体に、炭酸リチウムを加え、Li:Me(Co,Ni,Mn)のモル比が1.3:1.0である混合粉体を調製した。ここで、炭酸リチウムは、Li量が前記化学量論比に対してさらに3%過剰になるようにした。前記混合粉体2gを全長約100mmのアルミナ製ボートに移し、箱型電気炉(型番:AMF20)に設置した。前記箱型電気炉の内部寸法は、縦10cm、幅20cm、奥行き30cmであり、幅方向20cm間隔に電熱線が入っている。空気雰囲気中、常圧下で、焼成炉の温度を室温から900℃まで4hかけて昇温し、900℃で10h焼成した。この後、ヒーターのスイッチを切り、アルミナ製ボートを炉内に置いたまま自然放冷した。この結果、炉の温度は5時間後には約200℃程度にまで低下するが、その後の降温速度はやや緩やかである。一昼夜経過後、焼成炉の温度が常温に戻ったことを確認してから、焼成物を取り出し、粒径を揃える程度に乳鉢で粉砕した。このようにしてLi[Li0.13Co0.109Ni0.173Mn0.588]O2(Li/Me比:1.30)を作製した。
【0068】
(実施例1〜6、比較例2〜4)
前記共沈炭酸塩前駆体に、炭酸リチウムの一部をフッ化リチウム(LiF)に変えて加え、Liに対するFのモル比F/Liが0.01〜0.25となるようにした以外は、比較例1と同様にして、実施例1〜5、比較例2〜4のリチウム遷移金属複合酸化物を作製した。
【0069】
(実施例7〜10、比較例5)
前記共沈炭酸塩前駆体に、炭酸リチウムの一部を塩化リチウム(LiCl)に変えて加え、Liに対するClのモル比Cl/Liが0.025〜0.15となるようにした以外は、比較例1と同様にして、実施例7〜10、比較例5のリチウム遷移金属複合酸化物を作製した。
【0070】
(実施例11〜14、比較例6)
前記共沈炭酸塩前駆体に、炭酸リチウムの一部をリン酸リチウム(Li3PO4)に変えて加え、Liに対するPのモル比P/Liが0.025〜0.15となるようにした以外は、比較例1と同様にして、実施例11〜14、比較例6のリチウム遷移金属複合酸化物を作製した。
【0071】
(実施例15〜18、比較例7)
前記共沈炭酸塩前駆体に、炭酸リチウムの一部を硫酸リチウム(Li2SO4)に変えて加え、Liに対するPのモル比P/Liが0.025〜0.15となるようにした以外は、比較例1と同様にして、実施例11〜14、比較例7のリチウム遷移金属複合酸化物を作製した。
【0072】
(比較例8、9)
焼成温度を800℃、700℃に変更した以外は、比較例1と同様にして、比較例8、9のリチウム遷移金属複合酸化物を作製した。
【0073】
(リチウム二次電池の作製及び評価)
実施例1〜18及び比較例1〜9に係るリチウム遷移金属複合酸化物をそれぞれリチウム二次電池用正極活物質として用いて、以下の手順でリチウム二次電池を作製し、電池特性を評価した。
【0074】
N−メチルピロリドンを分散媒とし、活物質、アセチレンブラック(AB)及びポリフッ化ビニリデン(PVdF)が質量比90:5:5の割合で混練分散されている塗布用ペーストを作製した。該塗布ペーストを厚さ20μmのアルミニウム箔集電体の片方の面に塗布し、正極板を作製した。なお、全ての実施例及び比較例に係るリチウム二次電池同士で試験条件が同一になるように、一定面積当たりに塗布されている活物質の質量及び塗布厚みを統一した。
【0075】
正極の単独挙動を正確に観察する目的のため、対極、即ち負極には金属リチウムをニッケル箔集電体に密着させて用いた。ここで、リチウム二次電池の容量が負極によって制限されないよう、負極には十分な量の金属リチウムを配置した。
【0076】
電解液として、エチレンカーボネート(EC)/エチルメチルカーボネート(EMC)/ジメチルカーボネート(DMC)が体積比6:7:7である混合溶媒に濃度が1mol/lとなるようにLiPF6を溶解させた溶液を用いた。セパレータとして、ポリアクリレートで表面改質したポリプロピレン製の微孔膜を用いた。さらに、参照電極として、ニッケル板にリチウム金属箔をはりつけた棒を設置した。外装体には、ポリエチレンテレフタレート(15μm)/アルミニウム箔(50μm)/金属接着性ポリプロピレンフィルム(50μm)からなる金属樹脂複合フィルムを用い、正極端子、負極端子および参照極端子の開放端部が外部露出するように電極を収納し、前記金属樹脂複合フィルムの内面同士が向かい合った融着代を注液孔となる部分を除いて気密封止し、前記電解液を注液後、注液孔を封止した。
【0077】
以上の手順にて作製されたリチウム二次電池は、25℃の下、初期充放電工程に供した。電圧制御は全て正極電位に対して行った。充電は、電流0.1CA、電圧4.6Vの定電流定電圧充電とし、充電終止条件は電流値が1/6に減衰した時点とした。放電は、電流0.1CA、終止電圧2.0Vの定電流放電とした。この充放電を2サイクル行った。ここで、充電後及び放電後にそれぞれ30分の休止過程を設けた。
【0078】
次に、充電電圧を変更して、1サイクルの充放電試験を行った。電圧制御は全て正極電位に対して行った。この充放電試験の条件は、充電電圧を4.3V(vs.Li/Li+)としたことを除いては、前記初期充放電工程の条件と同一である。このときの放電電気量を「放電容量(mAh/g)」として記録した。
続いて、以下の手順で高温保存試験を行った。充電条件を4.3V(vs.Li/Li+)として電流0.1CAでの定電流定電圧充電を行った。充電終止条件は電流値が1/6に減衰した時点とした。次に、全ての端子から回路を取り外した開回路状態にて、60℃の恒温槽中に2週間保存した。その後、25℃にて、1サイクル半の放電−充電−放電を行った。このときの充放電条件は保存の直前に行った充放電条件と同一であり、充電後及び放電後にそれぞれ30分の休止過程を設けた。このようにして最後に行った放電で得られた放電容量の、前記60℃保存前の「放電容量(mAh/g)」に対する百分率を「容量維持率」として表記した。
【0079】
(比表面積測定)
ユアサアイオニクス社製比表面積測定装置(商品名:MONOSORB)を用いて、一点法により、活物質に対する窒素吸着量[m2]を求めた。得られた吸着量(m2)を活物質質量(g)で除した値をBET比表面積とした。測定に当たって、液体窒素を用いた冷却によるガス吸着を行った。また、冷却前に120℃15minの予備加熱を行った。また、測定試料の投入量は、0.5g±0.01gとした。
【0080】
(発熱開始温度測定)
前記高温保存試験の後、再び、電流0.1CA,電圧4.3V (vs. Li/Li+)の定電流定電圧充電を行い、充電終止条件は電流値が1/6に減衰した時点とした。次にアルゴン雰囲気中のグローブボックス中で電池を解体し、正極板を取り出し、電解液を含んだ状態のままアルミニウム集電体ごと3mmφのポンスで打ち抜き、示差走査熱量測定(DSC)装置(Rigaku,DSC8230)専用のAl製のパンにカシメ封口により封入し、測定試料とした。前記示差走査熱量測定装置を用いて、昇温速度5℃/minにて400℃までのDSC測定を行った。得られたDSCカーブのうち、発熱方向に最も大きな熱量を示す発熱カーブの立ち上がり部分の温度を発熱開始温度とした。
【0081】
実施例1〜18及び比較例1〜9に係るリチウム遷移金属複合酸化物をそれぞれリチウム二次電池用正極活物質として用いたリチウム二次電池の試験結果を表2、図4及び図5に示す。
また、CuKα管球を用いた粉末エックス線回折測定の結果、いずれのリチウム遷移金属複合酸化物もα−NaFeO2型の六方晶構造が主相として確認された。
【0082】
【表2】

【0083】
表2より、Liに対する元素Xのモル比X/Liが0.01〜0.1の範囲で元素X(Xは、F、Cl、P又はS)を含有させたリチウム遷移金属複合酸化物を用いた正極活物質は、元素Xを含有しないリチウム遷移金属複合酸化物を用いた正極活物質と比較して、BET比表面積が小さくなり、発熱開始温度が高くなって熱安定性が向上していることがわかる。また、放電容量は、元素Xの含有量が増加するにしたがって低下するが、その低下は前記モル比X/Liが0.1までの範囲であれば小さく、逆に、容量維持率については、元素Xを含有しない場合と比較して大きくなっているから、高温保存特性は改善されているといえる。
【0084】
(比較例10)
硫酸コバルト7水和物4.6873g、硫酸ニッケル6水和物6.5743g及び硫酸マンガン5水和物22.110gを秤量し、これらの全量をイオン交換水200mlに溶解させ、Co;Ni:Mnのモル比が0.1250:0.1875:0.6875となる0.67Mの硫酸塩水溶液を作製した。一方、2dm3の反応槽に750mlのイオン交換水を注ぎ、CO2ガスを30minバブリングさせることにより、イオン交換水中にCO2を溶解させた。反応槽の温度を50℃(±2℃)に設定し、攪拌モーターを備えたパドル翼を用いて反応槽内を700rpmの回転速度で攪拌しながら、前記硫酸塩水溶液を3ml/minの速度で滴下した。ここで、滴下の開始から終了までの間、0.67Mの炭酸ナトリウム及び0.067Mのアンモニアを含有する水溶液を適宜滴下することにより、反応槽中のpHが常に8.6(±0.05)を保つように制御した。滴下終了後、反応槽内の攪拌をさらに1h継続した。攪拌の停止後、12h以上静置した。静置することにより、反応槽内に生成する共沈炭酸塩の粒子を十分に成長させることができる。
次に、吸引ろ過装置を用いて、反応槽内に生成した共沈炭酸塩の粒子を分離し、さらにイオン交換水を用いて粒子に付着しているナトリウムイオンを洗浄除去し、電気炉を用いて、空気雰囲気中、常圧下、100℃にて乾燥させた。その後、粒径を揃えるために、瑪瑙製自動乳鉢で数分間粉砕した。このようにして、共沈炭酸塩前駆体を作製した。
【0085】
前記共沈炭酸塩前駆体2.3305gに、炭酸リチウム0.9163gを加え、瑪瑙製自動乳鉢を用いてよく混合し、Li:(Co,Ni,Mn)のモル比が1.20:1.00である混合粉体を調製した。ペレット成型機を用いて、6MPaの圧力で成型し、直径25mmのペレットとした。ペレット成型に供した混合粉体の量は、想定する最終生成物の質量が2gとなるように換算して決定した。前記ペレット1個を全長約100mmのアルミナ製ボートに載置し、箱型電気炉(型番:AMF20)に設置し、空気雰囲気中、常圧下、900℃で10h焼成した。前記箱型電気炉の内部寸法は、縦10cm、幅20cm、奥行き30cmであり、幅方向20cm間隔に電熱線が入っている。焼成後、ヒーターのスイッチを切り、アルミナ製ボートを炉内に置いたまま自然放冷した。この結果、炉の温度は5時間後には約200℃程度にまで低下するが、その後の降温速度はやや緩やかである。一昼夜経過後、炉の温度が100℃以下となっていることを確認してから、ペレットを取り出し、粒径を揃えるために、瑪瑙製自動乳鉢で数分間粉砕した。このようにして、比較例10に係るリチウム遷移金属複合酸化物を作製した。
【0086】
共沈炭酸塩前駆体が含有する金属元素の組成、共沈炭酸塩前駆体と炭酸リチウムの混合量、焼成温度について、表2の比較例11〜84の記載に沿って変更した他は、比較例10と同様にして、比較例11〜80に係るリチウム遷移金属複合酸化物を合成した。
【0087】
比較例10〜84に係るリチウム遷移金属複合酸化物をそれぞれリチウム二次電池用正極活物質として用いて、実施例1〜18及び比較例1〜9と同様の手順でリチウム二次電池を作製し、試験を行って、電池特性を評価した。試験結果を表3及び表4に示す。
【0088】
【表3】

【0089】
【表4】

【0090】
表3及び表4より、リチウム遷移金属複合酸化物を正極活物質として用いる場合、1000℃未満の焼成により高い放電容量を得るためには、Li/Meを1.25〜1.40とし、Co/Me比を0.02〜0.23とし、Mn/Me比を0.63〜0.72とすることが必要であることがわかる。
また、全てのリチウム遷移金属複合酸化物は、CuKα線源を用いたエックス線回折装置(Rigaku社製、型名:MiniFlex II)を行いてエックス線回折測定を行った結果、表3及び表4に示されるように、(003)面と(104)面の回折ピークの強度比I(003)/I(104)が1.58以上であった。
【産業上の利用可能性】
【0091】
本発明の新規なリチウム遷移金属複合酸化物を含む正極活物質を用いることにより、比表面積が小さく、放電容量が大きい非水電解質二次電池を提供することができるので、この非水電解質二次電池は、ハイブリッド自動車用、電気自動車用のリチウム二次電池として有用である。
【技術分野】
【0001】
本発明は、非水電解質二次電池用活物質及びそれを用いた非水電解質二次電池に関する。
【背景技術】
【0002】
従来、非水電解質二次電池には、正極活物質として主にLiCoO2が用いられている。しかし、放電容量は120〜130mAh/g程度であった。
【0003】
LiMeO2で表される活物質として、LiCo1−2xNixMnxO2(0<x<1)で表される化合物を含有する活物質等が知られている。
【0004】
非特許文献1には、LiCo0.8Ni0.1Mn0.1O2で表される活物質について記載されている。また、Co,Ni及びMnを含有する前駆体を中和法により調整し、Li塩(Li(OH)/H2O)と混合して900℃で焼成することにより、前記活物質を合成したことが記載され、BET比表面積は約6.2m2/gであり、放電容量は約165mAh/gであったことが記載されている。また、前記Li塩として、Li(OH)/H2Oと共にLiFを、合成される活物質の質量に対して3wt%混合して900℃で焼成することにより合成した活物質のBET比表面積は約3.6m2/gであり、放電容量は約130mAh/gであったことが記載されている。また、同文献には、各種活物質のエックス線回折図及びエックス線回折結果から算出された格子定数の値が記載され、用いたLiFの量に応じて格子定数が連続的に変化したことが示されている。
【0005】
特許文献1には、LiCo1−2xNixMnxO2(0<x<1)で表される活物質について記載されている。また、錯化剤であるヒドラジンの存在下で、温度、pH及び原料溶液の滴下速度を注意深く制御する反応晶析法を用いて、Co,Ni及びMnを均一に含有する共沈前駆体を調整し、Li塩と混合して1000℃前後で焼成することにより、前記活物質を合成したことが記載されている。
【0006】
上記したように、非特許文献1には、BET比表面積が著しく大きい活物質が報告されている。この原因は、前記前駆体を中和法により調整する場合に必要な、温度、pH及び原料溶液の滴下速度等の注意深い制御、あるいは、錯化剤の使用等についての検討が十分でないためであると本発明者は考えている。本発明者は、特許文献1に記載の合成条件を採用すれば、LiCo1−2xNixMnxO2(0<x<1)で表され、十分な放電容量を備え、BET比表面積が0.7m2/g程度である活物質が得られることを確認している。従って、LiMeO2で表される活物質については、BET比表面積が大きすぎるという課題は存在しない。
【0007】
遷移金属(Me)の比率に対するリチウムの組成比率Li/Meが1より大きく、例えばLi/Meが1.25〜1.6である活物質が知られている。このような材料は、Li1+αMe1−αO2(α>0)と表記することができる。例えば、α=0.2のとき、Li/Me=1.5である。
【0008】
特許文献2には、このような活物質の一種であり、Li[Li1/3Mn2/3]O2、LiNi1/2Mn1/2O2及びLiCoO2の3つの成分の固溶体として表すことのできる活物質が記載されている。また、前記活物質を用いた電池の製造方法として、4.3V(vs.Li/Li+)を超え4.8V以下(vs.Li/Li+)の正極電位範囲に出現する、電位変化が比較的平坦な領域に少なくとも至る充電を行う製造工程を設けることにより、充電時の正極の最大到達電位が4.3V(vs.Li/Li+)以下である充電方法が採用された場合であっても、177mAh/g以上の放電容量が得られる電池を製造できることが記載されている。
【0009】
非特許文献2には、Li[Li0.2Ni0.15+0.5ZCo0.10Mn0.55−0.5Z]O2−ZFZで表される組成式の通りに酸素サイトの一部がFで置換された構造の活物質について記載されている。Fig.1には、エックス線回折図が記載され、Fで置換しない(Z=0)活物質のエックス線回折ピークに比べて、Fで置換した活物質のエックス線回折ピーク位置がシフトしている様子が記載されている。Fig.2には、室温において、Z=0である活物質の放電容量は約230mAh/gであり、Z=0.02である活物質の放電容量は約225mAh/gであり、Z=0.05である活物質の放電容量は約220mAh/gであり、Z=0.10である活物質の放電容量は約160mAh/gであったことが示されている。また、ゾルゲル法によって前記活物質を合成したことが記載されている。しかしながら、酸素サイトの一部がFで置換された構造の活物質について、どのような原料を用い、どのような手順及び条件によりFを導入したかについては、非特許文献2及び同文献末尾に記載の参考文献を参照しても記載がない。
非特許文献2に記載された活物質は、全遷移金属元素に対するLiのモル比が1.50と大きいものであり、Fの置換量Z=0.10程度で放電容量が極端に低下するという問題がある。また、Fの置換が、活物質の比表面積にどのような影響を与えるかは示されていない。
【0010】
特許文献3には、「一般式LiwMxOyXz (I)
(ここで、MはCoあるいはNiあるいはMnあるいはVあるいはFeあるいはTiを示し、Xは少なくとも1種以上のハロゲン元素を示す。wは0.2≦w≦2.5、xは0.8≦x≦1.25、yは1≦y≦2、zは0<z<0.25である。)で表される含リチウム金属ハロゲン化酸化物。」の発明が記載されているが、MをCo、Ni及びMnとすること、LiをMに対して過剰にすることは、具体的に示されていない。また、この発明は、正極電位そしてその還元電位を高くすることを課題(段落[0005])として、含リチウム金属ハロゲン化酸化物を正極活物質として使用するものであり、ハロゲン元素を導入することにより、活物質の比表面積がどのように変化するかは示されていない。
【0011】
特許文献4には、「リチウムイオンの吸蔵・放出が可能な正極活物質と、リチウムイオンの吸蔵・放出が可能な負極活物質と、非水系電解質とを備えた非水電解質二次電池であって、前記正極活物質は(110)ベクトル方向の結晶子サイズが1000Å以上で、かつ合成時の焼成によりハロゲンが添加された六方晶系のリチウム含有コバルト複合酸化物であることを特徴とする非水電解質二次電池。」の発明が記載され、コバルトの一部をV,Cr,Fe,Mn,Ni,Al,Tiから選択される少なくとも一種の異種元素で置換することも示されている(請求項4)が、Liを全遷移金属元素に対して過剰にすることは示されていない。また、この発明は、濾液のpH値が上昇しないような正極活物質を得て、電池内でのガスの発生を抑制して、高温時のサイクル特性が向上するとともに、充電保存時の劣化を抑制した非水電解質二次電池を提供することを目的とするものであり(段落[0007])、ハロゲン元素を添加することにより、活物質の比表面積がどのように変化するかは示されていない。
【0012】
特許文献5には、「F原子を0.025〜2.5重量%含有するリチウムコバルト系複合酸化物であって、該リチウムコバルト系複合酸化物の粒子表面をXPS分析(X線光電子分光分析)したときに、F原子に起因するピーク強度の最大となるエネルギーの位置が685eV近傍で、且つ該リチウムコバルト系複合酸化物の粒子内部に存在するF原子の量がリチウムコバルト系複合酸化物粒子中に含有されたF原子全体量の10〜30重量%であることを特徴とするリチウムコバルト系複合酸化物。」の発明が記載されているが、コバルトの一部を他の遷移金属元素で置換すること、Liを全遷移金属元素に対して過剰にすることは示されていない。また、この発明は、リチウム二次電池の正極活物質として用いたときに、特に負荷特性、サイクル特性、高温保存特性、低温特性及び安全性に優れたリチウム二次電池の正極活物質として有用なリチウムコバルト系複合酸化物を提供することを目的とするものであり(段落[0007])、比表面積が示されているが、F原子を存在させることが、活物質の比表面積にどのような影響を与えるかは示されていない。
【0013】
特許文献6には、リチウム複合金属酸化物の焼成の際に、反応促進剤を含有させることが記載され、「反応促進剤として、より具体的には、NaCl、KCl、NH4Clなどの塩化物、LiF、NaF、KF、HN4Fなどのフッ化物、ホウ酸、好ましくは前記塩化物を挙げることができ、より好ましくはKClである。混合物が反応促進剤を含有することで、混合物の焼成時の反応性を向上させ、得られるリチウム複合金属酸化物のBET比表面積を調整することが可能な場合がある。通常、焼成の保持温度が同じ場合には、混合物における反応促進剤の含有量が多くなればなるほど、BET比表面積は小さくなる傾向にある。また、反応促進剤を2種以上併用することもできる。反応促進剤は、共沈物とリチウム化合物との混合時に、添加して混合すればよい。また、反応促進剤は、リチウム複合金属酸化物に残留していてもよいし、洗浄、蒸発等により除去されていてもよい。」(段落[0031])と記載されているが、KClを含有させた実施例としては、Ni:Mn:Feのモル比が0.45:0.45:0.10であり、BET比表面積が96m2/gである共沈物と水酸化リチウム一水和物とKCl(反応促進剤)とを乾式混合して800℃で焼成することにより、Li:Ni:Mn:Feのモル比が1.10:0.45:0.45:0.10であり、BET比表面積が7.6m2/gであるリチウム複合金属酸化物を製造することが記載されている(段落[0102]〜[0107])だけであり、Co、Ni及びMnを含み、Liを全遷移金属元素に対して過剰にしたリチウム複合金属酸化物は示されていない。
【0014】
特許文献7には、「リチウム複合酸化物の粒子表面近傍に硫黄(S)およびリン(P)の少なくとも1種を含み、上記リチウム複合酸化物の粒子表面近傍における硫黄(S)およびリン(P)の少なくとも1種の含有量が、上記リチウム複合酸化物の粒子内部よりも高いことを特徴とする正極活物質。」の発明が記載されているが、Co、Ni及びMnを含み、Liを全遷移金属元素に対して過剰にしたリチウム複合金属酸化物は示されていない。また、この発明は、高温保存特性に優れた正極活物質を提供することを目的とするものであり(段落[0007])、比表面積が示されているが、硫黄(S)およびリン(P)を含有させることが、活物質の比表面積にどのような影響を与えるかは示されていない。
【先行技術文献】
【特許文献】
【0015】
【特許文献1】特許第4556377号公報
【特許文献2】特開2009−152114号公報
【特許文献3】特許第3112138号公報
【特許文献4】特開2002−298846号公報
【特許文献5】特開2003−221235号公報
【特許文献6】特開2010−21125号公報
【特許文献7】特開2007−335331号公報
【非特許文献】
【0016】
【非特許文献1】S.Jouanneau, J.R.Dahn,J. Electrochem.Soc., 151(10), A1749-1754, 2004.
【非特許文献2】S.-H.Kang, K.Amine, J.Power Sources, 146, (1-2), 654-657, 2005.
【発明の開示】
【発明が解決しようとする課題】
【0017】
非水電解質二次電池用活物質のBET比表面積が大きいと、種々の不都合が生じる。非水電解質二次電池用電極は、活物質粉体に、導電剤、結着剤及び溶剤を混合し、ペースト状にして集電体上に塗布し、前記溶剤を揮発させる乾燥工程、プレス工程を経て、集電体上に合剤層が形成されてなる。このとき、活物質のBET比表面積が大きいと、ペースト状にするために結着剤を多く必要とする。結着剤は電極反応に寄与しないので、結着剤の量が多いことは、合剤中の活物質の量が相対的に低下する。従って、活物質自体のリチウムイオンの吸蔵放出能力が十分であったとしても、このような電極を用いた非水電解質電池は、エネルギー密度が低いものとなる。また、結着剤の量が十分でない場合、プレス工程で合剤が脱落しやすい等の不具合を生じやすい。また、このような電極を湾曲した場合、前記合剤層にひび割れ等が生じるなど、可撓性に欠けるものとなりやすく、電極性能の低下を導く。さらに、BET比表面積が大きいと、これを用いた電池において、電解液との副反応が大きくなる傾向があり、充放電サイクル性能の低下、保存性能の低下を導く。なお、BET比表面積を小さくすることのできる合成条件が見いだされたとしても、十分な電極特性を兼ね備えるものでなければならないことはいうまでもない。
【0018】
本発明者は、Li1+αMe1−αO2(MeはCo,Mn及びNiを含む遷移金属、α>0)で表され、Li/Meが1.20〜1.50である活物質の組成及び焼成温度を種々変化させて検討を行った。これらの結果を本願明細書に比較例として後述する。これらの結果を整理した図1〜3からわかるように、Li/Me比の値が1.5の場合、焼成温度を1000℃とすることで、BET比表面積の値が1m2/g程度と十分に小さく、Li/Me比の値が1.4又は1.3の場合と比べて高い放電容量を備えた活物質を合成することができる。
【0019】
次に、本発明者は、Li/Me比の値を1.4又は1.3とし、焼成温度を1000℃未満とすることで、Li/Me比の値が1.5の場合に比べて、高い放電容量と高い初期充放電効率を兼ね備えた活物質を合成することができることを見いだした。しかしながら、このような活物質は、BET比表面積が大きなものとなってしまうという問題点があった。
【0020】
本発明の課題は、Co、Ni及びMnを含む遷移金属元素Me、並びに、Liを含有し、前記全遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40である(以下、「リチウム過剰」という。)リチウム遷移金属複合酸化物を含有し、BET比表面積の値が小さく、放電容量が大きい非水電解質二次電池用活物質、及び、それを用いた非水電解質二次電池を提供することにある。
【課題を解決するための手段】
【0021】
本発明においては、上記課題を解決するために、以下の手段を採用する。
(1)六方晶構造を有するリチウム遷移金属複合酸化物を含有する非水電解質二次電池用活物質であって、前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む遷移金属元素Me、Li、並びに、元素X(Xは、F、Cl、P及びSからなる群のうち1種又は2種以上)を含有し、前記遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40であり、前記遷移金属元素Me中のCoのモル比Co/Meが0.02〜0.23であり、前記遷移金属元素Me中のMnのモル比Mn/Meが0.63〜0.72であり、前記Liに対する前記元素Xのモル比X/Liが0.01〜0.1であることを特徴とする非水電解質二次電池用活物質。
(2)前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む化合物の共沈前駆体と前記元素Xを含むリチウム化合物を一部に用いたリチウム化合物とを混合して焼成したものである前記(1)の非水電解質二次電池用活物質。
(3)前記リチウム遷移金属複合酸化物は、前記元素Xを含有しないリチウム遷移金属複合酸化物と比較して格子定数に変化がない前記(1)又は(2)の非水電解質二次電池用活物質。
(4)前記元素XはSである前記(1)〜(3)のいずれか1項の非水電解質二次電池用活物質。
(5)前記(1)〜(4)のいずれか1項の非水電解質二次電池用活物質の製造方法であって、溶液中でCo、Ni及びMnを含む化合物を共沈させて共沈前駆体を製造する工程、前記共沈前駆体と前記元素Xを含むリチウム化合物を一部に用いたリチウム化合物とを混合し、焼成する工程を含むことを特徴とする非水電解質二次電池用活物質の製造方法。
(6)前記(1)〜(4)のいずれか1項の非水電解質二次電池用活物質を含有する非水電解質二次電池用電極。
(7)前記(6)の非水電解質二次電池用電極を備えた非水電解質二次電池。
【発明の効果】
【0022】
本発明によれば、新規なリチウム遷移金属複合酸化物を用いることにより、BET比表面積の値が小さく、また、元素Xを含有しないリチウム遷移金属複合酸化物を用いた場合と比較して放電容量の低下が小さい非水電解質二次電池用活物質が得られる。
【図面の簡単な説明】
【0023】
【図1】Li/Me比が1.3、1.4又は1.5である従来のリチウム遷移金属複合酸化物を含有する活物質について、焼成温度と放電容量の関係を示す図である。
【図2】Li/Me比が1.3、1.4又は1.5である従来のリチウム遷移金属複合酸化物を含有する活物質について、焼成温度と初期充放電効率の関係を示す図である。
【図3】Li/Me比が1.3、1.4又は1.5である従来のリチウム遷移金属複合酸化物を含有する活物質について、焼成温度とBET比表面積の関係を示す図である。
【図4】本発明のリチウム遷移金属複合酸化物を含有する活物質について、元素Xの添加量とBET比表面積の関係を示す図である。
【図5】本発明のリチウム遷移金属複合酸化物を含有する活物質について、元素Xの添加量と発熱開始温度の関係を示す図である。
【発明を実施するための最良の形態】
【0024】
本発明の非水電解質二次電池用活物質は、リチウム遷移金属複合酸化物を含むものであり、そのリチウム遷移金属複合酸化物は、Co、Ni及びMnを含む遷移金属元素Me、Li、並びに、元素X(Xは、F、Cl、P及びSからなる群のうち1種又は2種以上)を含有し、その遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40であり、モル比Co/Meが0.02〜0.23であり、モル比Mn/Meが0.63〜0.72であり、Liに対する元素Xのモル比X/Liが0.01〜0.1であることを特徴とする。
なお、非水電解質二次電池としては、リチウム二次電池が典型的なものであるから、以下においては、リチウム二次電池について説明する。
【0025】
本発明は、Li過剰活物質はBET比表面積が大きいものとなりすぎるという、LiCoO2系やLiNi1/2Mn1/2O2系あるいはそれらの固溶体に代表されるLiMeO2で表される正極活物質にはなかった、Li過剰活物質に特有の課題を解決するためのものである。即ち、Li過剰活物質において、BET比表面積を低いものとするために、元素Xを備える、あるいは、LiX(元素Xを含むリチウム化合物)を混合して焼成するというものである。また、Liに対する元素Xのモル比X/Liを0.01〜0.1(以下、「mol%」と省略する。)とすることを特徴とする。
後述するデータからわかるように、元素Xの0.025mol%の添加でBET比表面積を約3m2/gまで低減できる。0.1mol%の添加でBET比表面積を約2m2/gまで低減できる。添加量が0.1mol%を超えると、放電容量が低下する場合があることから、添加量は0.1mol%以下が好ましい。X=F,Cl,P,Sである。なかでも、X=Sを選択すれば、わずか0.05mol%を添加するだけでBET比表面積を約1m2/gまで低減でき、0.1mol%を添加すればBET比表面積を約0.2m2/gまで低減できる。しかも、ここまでBET比表面積を低減させた場合でも、放電容量の低下が小さい。
【0026】
非特許文献2は、Fを適用することで、0.1mol%相当量の場合で比較して、放電容量が約30%低下している。これに対し、本発明では、放電容量の低下はわずか8.6%(後述の表2の実施例6参照)である。この原因について推察するため、本発明者は、エックス線回折図及びそこから算出される格子定数について検討した。もし、O(酸素)サイトの一部がFに置換されたとすると、小さな原子を大きな原子で置換することを意味することから、置換量に応じて、a軸長及びc軸長が共に大きくなると考えられるところ、非特許文献2では実際にその通りのデータが示されている。これに対して、本願明細書に記載した実施例及び比較例について同様の検討を行ったところ、表1に示すように、a軸長については、LiFの添加量に伴って、逆に減少傾向が認められ、c軸長についてはLiFの添加量との相関が認められなかった。即ち、LiFの添加量に伴って、格子定数に連続的な変化は認められなかった。この事実は、本発明に係る活物質においては、原料に用いたF等の元素が、活物質材料中に固溶していないことを示唆している。
【0027】
【表1】

【0028】
本発明のリチウム遷移金属複合酸化物は便宜的に次の一般式で表される。
一般式LiaCoxNiyMnzO2Xb(a+x+y+z=2)
但し、a/(x+y+z)が1.25〜1.40、x/(x+y+z)が0.02〜0.23、z/(x+y+z)が0.63〜0.72、b/aが0.01〜0.1
上記のように、本発明においては、リチウム遷移金属複合酸化物は、元素X(F、Cl、P及びSからなる群のうち1種又は2種以上)を含有しないリチウム遷移金属複合酸化物と比較して格子定数に変化がないものであり、元素Xが固溶していないと考えられるから、Oの係数は2のままであり、b/aが0.01〜0.1の元素Xが付加されていると推定される。しかし、本発明においては、Xが一部固溶されている場合を排除するものではない。
【0029】
遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40(a/(x+y+z)が1.25〜1.40)、Meに対するCoのモル比Co/Meが0.02〜0.23(x/(x+y+z)が0.02〜0.23)、Meに対するMnのモル比Mn/Meが0.63〜0.72(z/(x+y+z)が0.63〜0.72)、Liに対する元素Xのモル比X/Liが0.01〜0.1(b/aが0.01〜0.1)という全ての要件を満たすリチウム遷移金属複合酸化物を活物質として用いることにより、BET比表面積の値が小さく、かつ、放電容量が大きい非水電解質二次電池用活物質を得ることができる。
【0030】
遷移金属元素Meに対するLiのモル比Li/Meが1.25よりも小さいと、放電容量が小さくなり、Li/Meが1.40よりも大きいと、1000℃未満で焼成する場合には、放電容量が小さくなるので、放電容量が大きいリチウム二次電池を得るために、Li/Meは1.25〜1.40(a/(x+y+z)は1.25〜1.40)とする。なかでも、Li/Me1.25〜1.35が好ましい。
【0031】
遷移金属元素Meに対するCoのモル比Co/Meが0.02よりも小さい、又はCo/Meが0.23よりも大きいと、放電容量が小さくなるので、放電容量が大きいリチウム二次電池を得るために、Co/Meは0.02〜0.23(x/(x+y+z)は0.02〜0.23)とする。Co/Meは0.04〜0.21が好ましく、0.06〜0.17がより好ましい。
【0032】
遷移金属元素Meに対するMnのモル比Mn/Meが0.63よりも小さい、又はMn/Meが0.72よりも大きいと、放電容量が小さくなるので、放電容量が大きいリチウム二次電池を得るために、Mn/Meは0.63〜0.72(z/(x+y+z)は0.63〜0.72)とする。Mn/Meは0.65〜0.71が好ましい。
【0033】
本発明のリチウム遷移金属複合酸化物は、上記のような一般式で表されるものであり、本質的に、Li、Co、Ni及びMnからなる複合酸化物に元素Xを含有するものであるが、本発明の効果を損なわない範囲で、少量のNa,Ca等のアルカリ金属やアルカリ土類金属、Fe,Zn等の3d遷移金属に代表される遷移金属など他の金属を含有することを排除するものではない。
【0034】
また、本発明のリチウム遷移金属複合酸化物は、本質的に、結晶構造が六方晶に帰属される。空間群としてはP3112又はR3−mに帰属可能である。ここで、P3112は、R3−mにおける3a、3b、6cサイトの原子位置を細分化した結晶構造モデルであり、R3−mにおける原子配置に秩序性が認められるときに該P3112モデルが採用される。なお、「R3−m」は本来「R3m」の「3」の上にバー「−」を施して表記すべきものである。
【0035】
次に、本発明のリチウム二次電池用活物質を製造する方法について説明する。
本発明の非水電解質二次電池用活物質は、基本的に、活物質を構成する金属元素(Li,Mn,Co,Ni)及び元素Xを、目的とする活物質(リチウム遷移金属複合酸化物)の組成通りに含有するように原料を調整し、最終的にこの原料を焼成すること、によって得ることができる。但し、Li原料の量については、焼成中にLi原料の一部が消失することを見込んで、1〜5%程度過剰に仕込むことが好ましい。
目的とする組成を有するリチウム遷移金属複合酸化物を作製するための方法として、Li,Co,Ni,Mnのそれぞれの塩を混合・焼成するいわゆる「固相法」や、あらかじめCo,Ni,Mnを一粒子中に存在させた共沈前駆体を作製しておき、これにLi塩を混合・焼成する「共沈法」が知られている。「固相法」による合成過程では、特にMnはCo,Niに対して均一に固溶しにくい。このため、各元素が一粒子中に均一に分布した試料を得ることは困難である。本発明に係る非水電解質二次電池用活物質を製造するにあたり、前記「固相法」と前記「共沈法」のいずれを選択するかについては限定されるものではない。しかしながら、「固相法」を選択した場合には、本発明に係る正極活物質を製造することは極めて困難である。「共沈法」を選択する方が原子レベルで均一相を得ることが容易である点で好ましい。
【0036】
共沈前駆体を作製するにあたって、Co,Ni,MnのうちMnは酸化されやすく、Co,Ni,Mnが2価の状態で均一に分布した共沈前駆体を作製することが容易ではないため、Co,Ni,Mnの原子レベルでの均一な混合は不十分なものとなりやすい。特に本発明の組成範囲においては、Mn比率がCo,Ni比率に比べて高いので、水溶液中の溶存酸素を除去することが重要である。溶存酸素を除去する方法としては、酸素を含まないガスをバブリングする方法が挙げられる。酸素を含まないガスとしては、限定されるものではないが、窒素ガス、アルゴンガス、二酸化炭素(CO2)等を用いることができる。なかでも、後述する実施例のように、共沈炭酸塩前駆体を作製する場合には、酸素を含まないガスとして二酸化炭素を採用すると、炭酸塩がより生成しやすい環境が与えられるため、好ましい。
【0037】
溶液中でCo、Ni及びMnを含有する化合物を共沈させて前駆体を製造する工程におけるpHは限定されるものではないが、前記共沈前駆体を共沈炭酸塩前駆体として作製しようとする場合には、8.5〜11とすることができる。タップ密度を大きくするためには、pHを制御することが好ましい。pHを9.4以下とすることにより、タップ密度を1.25g/cc以上とすることができ、高率放電特性を向上させることができる。
【0038】
前記共沈前駆体の作製は、MnとNiとCoとが均一に混合された化合物であることが好ましい。ただし前駆体は水酸化物に限定されるものではなく、他にも炭酸塩、クエン酸塩などの元素が原子レベルで均一に存在した難溶性塩であれば水酸化物と同様に使用することができる。また、錯化剤を用いた晶析反応等を用いることによって、より嵩密度の大きな前駆体を作製することもできる。その際、Li源と混合・焼成することでより高密度の活物質を得ることができるので電極面積あたりのエネルギー密度を向上させることができる。
【0039】
前記共沈前駆体の原料は、Mn化合物としては酸化マンガン、炭酸マンガン、硫酸マンガン、硝酸マンガン、酢酸マンガン等を、Ni化合物としては、水酸化ニッケル、炭酸ニッケル、硫酸ニッケル、硝酸ニッケル、酢酸ニッケル等を、Co化合物としては、硫酸コバルト、硝酸コバルト、酢酸コバルト等を一例として挙げることができる。
【0040】
前記共沈前駆体の作製に用いる原料としては、アルカリ水溶液と沈殿反応を形成するものであればどのような形態のものでも使用することができるが、好ましくは溶解度の高い金属塩を用いるとよい。
【0041】
本発明におけるリチウム二次電池用活物質は前記共沈前駆体とLi化合物とを混合した後、熱処理することで好適に作製することができる。Li化合物としては、水酸化リチウム、炭酸リチウム、硝酸リチウム、酢酸リチウム等を用いることができるが、本発明においては、リチウム遷移金属複合酸化物中にXを含有させるために、炭酸リチウム(Li2CO3)等のLi化合物の一部に元素Xを含むリチウム化合物を用いることが好ましい。
具体的には、元素Xを含むリチウム化合物としてLiF、LiCl、Li2SO4、Li3PO4等を用いることができ、Co、Ni及びMnを含む化合物の共沈前駆体と上記のような元素Xを含むリチウム化合物を混合し、焼成することによって、本発明のリチウム遷移金属複合酸化物が得られる。
【0042】
可逆容量の大きな活物質を得るにあたって、焼成温度の選択は極めて重要である。
焼成温度が高すぎると、得られた活物質が酸素放出反応を伴って崩壊すると共に、主相の六方晶に加えて単斜晶のLi[Li1/3Mn2/3]O2型に規定される相が、固溶相としてではなく、分相して観察される傾向があり、このような材料は、活物質の可逆容量が大きく減少するので好ましくない。このような材料では、X線回折図上35°付近及び45°付近に不純物ピークが観察される。従って、焼成温度は、活物質の酸素放出反応の影響する温度未満とすることが重要である。活物質の酸素放出温度は、本発明に係る組成範囲においては、概ね1000℃以上であるが、活物質の組成によって酸素放出温度に若干の差があるので、あらかじめ活物質の酸素放出温度を確認しておくことが好ましい。特に試料に含まれるCo量が多いほど前駆体の酸素放出温度は低温側にシフトすることが確認されているので注意が必要である。活物質の酸素放出温度を確認する方法としては、焼成反応過程をシミュレートするために、共沈前駆体とリチウム化合物を混合したものを熱重量分析(DTA−TG測定)に供してもよいが、この方法では測定機器の試料室に用いている白金が揮発したLi成分により腐食されて機器を痛めるおそれがあるので、あらかじめ500℃程度の焼成温度を採用してある程度結晶化を進行させた組成物を熱重量分析に供するのが良い。
【0043】
一方、焼成温度が低すぎると、結晶化が十分に進まず、電極特性も大きく低下するので好ましくない。焼成温度は少なくとも800℃以上とすることが必要である。十分に結晶化させることは結晶粒界の抵抗を軽減し、円滑なリチウムイオン輸送を促すために重要である。結晶化の度合いの見極め方として走査型電子顕微鏡を用いた視覚的な観察が挙げられる。本発明の正極活物質について走査型電子顕微鏡観察を行ったところ、試料合成温度が800℃以下ではナノオーダーの一次粒子から形成されているものであったが、さらに試料合成温度を上昇させることでサブミクロン程度まで結晶化するものであり、電極特性向上につながる大きな一次粒子を得られるものであった。
また、発明者らは、本発明活物質の回折ピークの半値幅を詳細に解析することで800℃までの温度で合成した試料においては格子内にひずみが残存しており、それ以上の温度で合成することでほとんどひずみを除去することができることを確認した。また、結晶子のサイズは合成温度が上昇するに比例して大きくなるものであった。よって、本発明活物質の組成においても、系内に格子のひずみがほとんどなく、かつ結晶子サイズが十分成長した粒子を志向することで良好な放電容量を得られるものであった。具体的には、格子定数に及ぼすひずみ量が1%以下、かつ結晶子サイズが100nm以上に成長しているような合成温度(焼成温度)を採用することが好ましいことがわかった。これらを電極として成型して充放電をおこなうことで膨張収縮による変化も見られるが、充放電過程においても結晶子サイズは50nm以上を保っていることが得られる効果として好ましい。即ち、焼成温度を上記した活物質の酸素放出温度にできるだけ近付けるように選択することにより、はじめて、可逆容量が顕著に大きい活物質を得ることができる。
【0044】
上記のように、好ましい焼成温度は、活物質の酸素放出温度により異なるから、一概に焼成温度の好ましい範囲を設定することは難しいが、本発明においては、Li/Meが1.25〜1.40である場合に放電容量を充分なものとするために、焼成温度を800〜950℃とすることが好ましく、850〜900℃とすることがより好ましい。
【0045】
本発明に係るリチウム二次電池に用いる非水電解質は、限定されるものではなく、一般にリチウム電池等への使用が提案されているものが使用可能である。非水電解質に用いる非水溶媒としては、プロピレンカーボネート、エチレンカーボネート、ブチレンカーボネート、クロロエチレンカーボネート、ビニレンカーボネート等の環状炭酸エステル類;γ−ブチロラクトン、γ−バレロラクトン等の環状エステル類;ジメチルカーボネート、ジエチルカーボネート、エチルメチルカーボネート等の鎖状カーボネート類;ギ酸メチル、酢酸メチル、酪酸メチル等の鎖状エステル類;テトラヒドロフランまたはその誘導体;1,3−ジオキサン、1,4−ジオキサン、1,2−ジメトキシエタン、1,4−ジブトキシエタン、メチルジグライム等のエーテル類;アセトニトリル、ベンゾニトリル等のニトリル類;ジオキソランまたはその誘導体;エチレンスルフィド、スルホラン、スルトンまたはその誘導体等の単独またはそれら2種以上の混合物等を挙げることができるが、これらに限定されるものではない。
【0046】
非水電解質に用いる電解質塩としては、例えば、LiClO4,LiBF4,LiAsF6,LiPF6,LiSCN,LiBr,LiI,Li2SO4,Li2B10Cl10,NaClO4,NaI,NaSCN,NaBr,KClO4,KSCN等のリチウム(Li)、ナトリウム(Na)またはカリウム(K)の1種を含む無機イオン塩、LiCF3SO3,LiN(CF3SO2)2,LiN(C2F5SO2)2,LiN(CF3SO2)(C4F9SO2),LiC(CF3SO2)3,LiC(C2F5SO2)3,(CH3)4NBF4,(CH3)4NBr,(C2H5)4NClO4,(C2H5)4NI,(C3H7)4NBr,(n−C4H9)4NClO4,(n−C4H9)4NI,(C2H5)4N−maleate,(C2H5)4N−benzoate,(C2H5)4N−phtalate、ステアリルスルホン酸リチウム、オクチルスルホン酸リチウム、ドデシルベンゼンスルホン酸リチウム等の有機イオン塩等が挙げられ、これらのイオン性化合物を単独、あるいは2種類以上混合して用いることが可能である。
【0047】
さらに、LiBF4とLiN(C2F5SO2)2のようなパーフルオロアルキル基を有するリチウム塩とを混合して用いることにより、さらに電解質の粘度を下げることができるので、低温特性をさらに高めることができ、また、自己放電を抑制することができ、より望ましい。
【0048】
また、非水電解質として常温溶融塩やイオン液体を用いてもよい。
【0049】
非水電解質における電解質塩の濃度としては、高い電池特性を有する非水電解質電池を確実に得るために、0.1mol/l〜5mol/lが好ましく、さらに好ましくは、0.5mol/l〜2.5mol/lである。
【0050】
負極材料としては、限定されるものではなく、リチウムイオンを析出あるいは吸蔵することのできる形態のものであればどれを選択してもよい。例えば、Li[Li1/3Ti5/3]O4に代表されるスピネル型結晶構造を有するチタン酸リチウム等のチタン系材料、SiやSb,Sn系などの合金系材料リチウム金属、リチウム合金(リチウム−シリコン、リチウム−アルミニウム,リチウム−鉛,リチウム−スズ,リチウム−アルミニウム−スズ,リチウム−ガリウム,及びウッド合金等のリチウム金属含有合金)、リチウム複合酸化物(リチウム−チタン)、酸化珪素の他、リチウムを吸蔵・放出可能な合金、炭素材料(例えばグラファイト、ハードカーボン、低温焼成炭素、非晶質カーボン等)等が挙げられる。
【0051】
正極活物質の粉体および負極材料の粉体は、平均粒子サイズ100μm以下であることが望ましい。特に、正極活物質の粉体は、非水電解質電池の高出力特性を向上する目的で10μm以下であることが望ましい。粉体を所定の形状で得るためには粉砕機や分級機が用いられる。例えば乳鉢、ボールミル、サンドミル、振動ボールミル、遊星ボールミル、ジェットミル、カウンタージェトミル、旋回気流型ジェットミルや篩等が用いられる。粉砕時には水、あるいはヘキサン等の有機溶剤を共存させた湿式粉砕を用いることもできる。分級方法としては、特に限定はなく、篩や風力分級機などが、乾式、湿式ともに必要に応じて用いられる。
【0052】
以上、正極及び負極の主要構成成分である正極活物質及び負極材料について詳述したが、前記正極及び負極には、前記主要構成成分の他に、導電剤、結着剤、増粘剤、フィラー等が、他の構成成分として含有されてもよい。
【0053】
導電剤としては、電池性能に悪影響を及ぼさない電子伝導性材料であれば限定されないが、通常、天然黒鉛(鱗状黒鉛,鱗片状黒鉛,土状黒鉛等)、人造黒鉛、カーボンブラック、アセチレンブラック、ケッチェンブラック、カーボンウイスカー、炭素繊維、金属(銅,ニッケル,アルミニウム,銀,金等)粉、金属繊維、導電性セラミックス材料等の導電性材料を1種またはそれらの混合物として含ませることができる。
【0054】
これらの中で、導電剤としては、電子伝導性及び塗工性の観点よりアセチレンブラックが望ましい。導電剤の添加量は、正極または負極の総重量に対して0.1重量%〜50重量%が好ましく、特に0.5重量%〜30重量%が好ましい。特にアセチレンブラックを0.1〜0.5μmの超微粒子に粉砕して用いると必要炭素量を削減できるため望ましい。これらの混合方法は、物理的な混合であり、その理想とするところは均一混合である。そのため、V型混合機、S型混合機、擂かい機、ボールミル、遊星ボールミルといったような粉体混合機を乾式、あるいは湿式で混合することが可能である。
【0055】
前記結着剤としては、通常、ポリテトラフルオロエチレン(PTFE),ポリフッ化ビニリデン(PVDF),ポリエチレン,ポリプロピレン等の熱可塑性樹脂、エチレン−プロピレン−ジエンターポリマー(EPDM),スルホン化EPDM,スチレンブタジエンゴム(SBR)、フッ素ゴム等のゴム弾性を有するポリマーを1種または2種以上の混合物として用いることができる。結着剤の添加量は、正極または負極の総重量に対して1〜50重量%が好ましく、特に2〜30重量%が好ましい。
【0056】
フィラーとしては、電池性能に悪影響を及ぼさない材料であれば何でも良い。通常、ポリプロピレン,ポリエチレン等のオレフィン系ポリマー、無定形シリカ、アルミナ、ゼオライト、ガラス、炭素等が用いられる。フィラーの添加量は、正極または負極の総重量に対して添加量は30重量%以下が好ましい。
【0057】
正極及び負極は、前記主要構成成分(正極においては正極活物質、負極においては負極材料)、およびその他の材料を混練し合剤とし、N−メチルピロリドン,トルエン等の有機溶媒に混合させた後、得られた混合液を下記に詳述する集電体の上に塗布し、または圧着して50℃〜250℃程度の温度で、2時間程度加熱処理することにより好適に作製される。前記塗布方法については、例えば、アプリケーターロールなどのローラーコーティング、スクリーンコーティング、ドクターブレード方式、スピンコーティング、バーコータ等の手段を用いて任意の厚さ及び任意の形状に塗布することが望ましいが、これらに限定されるものではない。
【0058】
セパレータとしては、優れた高率放電性能を示す多孔膜や不織布等を、単独あるいは併用することが好ましい。非水電解質電池用セパレータを構成する材料としては、例えばポリエチレン,ポリプロピレン等に代表されるポリオレフィン系樹脂、ポリエチレンテレフタレート,ポリブチレンテレフタレート等に代表されるポリエステル系樹脂、ポリフッ化ビニリデン、フッ化ビニリデン−ヘキサフルオロプロピレン共重合体、フッ化ビニリデン−パーフルオロビニルエーテル共重合体、フッ化ビニリデン−テトラフルオロエチレン共重合体、フッ化ビニリデン−トリフルオロエチレン共重合体、フッ化ビニリデン−フルオロエチレン共重合体、フッ化ビニリデン−ヘキサフルオロアセトン共重合体、フッ化ビニリデン−エチレン共重合体、フッ化ビニリデン−プロピレン共重合体、フッ化ビニリデン−トリフルオロプロピレン共重合体、フッ化ビニリデン−テトラフルオロエチレン−ヘキサフルオロプロピレン共重合体、フッ化ビニリデン−エチレン−テトラフルオロエチレン共重合体等を挙げることができる。
【0059】
セパレータの空孔率は強度の観点から98体積%以下が好ましい。また、充放電特性の観点から空孔率は20体積%以上が好ましい。
【0060】
また、セパレータは、例えばアクリロニトリル、エチレンオキシド、プロピレンオキシド、メチルメタアクリレート、ビニルアセテート、ビニルピロリドン、ポリフッ化ビニリデン等のポリマーと電解質とで構成されるポリマーゲルを用いてもよい。非水電解質を上記のようにゲル状態で用いると、漏液を防止する効果がある点で好ましい。
【0061】
さらに、セパレータは、上述したような多孔膜や不織布等とポリマーゲルを併用して用いると、電解質の保液性が向上するため望ましい。即ち、ポリエチレン微孔膜の表面及び微孔壁面に厚さ数μm以下の親溶媒性ポリマーを被覆したフィルムを形成し、前記フィルムの微孔内に電解質を保持させることで、前記親溶媒性ポリマーがゲル化する。
【0062】
前記親溶媒性ポリマーとしては、ポリフッ化ビニリデンの他、エチレンオキシド基やエステル基等を有するアクリレートモノマー、エポキシモノマー、イソシアナート基を有するモノマー等が架橋したポリマー等が挙げられる。該モノマーは、ラジカル開始剤を併用して加熱や紫外線(UV)を用いたり、電子線(EB)等の活性光線等を用いて架橋反応を行わせることが可能である。
【0063】
リチウム二次電池の構成については特に限定されるものではなく、正極、負極及びロール状のセパレータを有する円筒型電池、角型電池、扁平型電池等が一例として挙げられる。
【0064】
従来のリチウム二次電池においては、正極の最大到達電位が4.5V(vs.Li/Li+)以上に至る充電をして使用することが一般的に行われているが、本発明の活物質も、正極電位が4.5V(vs.Li/Li+)付近に至って充放電が可能である。しかしながら、使用する非水電解質の種類によっては、充電時の正極電位が高すぎると、非水電解質が酸化分解され電池性能の低下を引き起こす虞がある。したがって、使用時において、充電時の正極の最大到達電位が4.3V(vs.Li/Li+)以下となるような充電方法を採用しても、充分な放電容量が得られるリチウム二次電池が求められる場合がある。本発明の活物質を用いると、使用時において、充電時の正極の最大到達電位が4.5V(vs.Li/Li+)より低くなるような、例えば、4.4V(vs.Li/Li+)以下や4.3V(vs.Li/Li+)以下となるような充電方法を採用しても、約200mAh/g以上という従来の正極活物質の容量を超える放電電気量を取り出すことが可能である。
【0065】
本発明に係る正極活物質が、高い放電容量を備えたものとするためには、リチウム遷移金属複合酸化物を構成する遷移金属元素が層状岩塩型結晶構造の遷移金属サイト以外の部分に存在する割合が小さいものであることが好ましい。これは、焼成工程に供する前駆体において、Co,Ni,Mnといった遷移金属元素が十分に均一に分布していること、及び、活物質試料の結晶化を促すための適切な焼成工程の条件を選択することによって達成できる。焼成工程に供する前駆体中の遷移金属の分布が均一でない場合、十分な放電容量が得られないものとなる。この理由については必ずしも明らかではないが、焼成工程に供する前駆体中の遷移金属の分布が均一でない場合、得られるリチウム遷移金属複合酸化物は、層状岩塩型結晶構造の遷移金属サイト以外の部分、即ちリチウムサイトに遷移金属元素の一部が存在するものとなる、いわゆるカチオンミキシングが起こることに由来するものと本発明者らは推察している。同様の推察は焼成工程における結晶化過程においても適用でき、活物質試料の結晶化が不十分であると層状岩塩型結晶構造におけるカチオンミキシングが起こりやすくなる。前記遷移金属元素の分布の均一性が高いものは、X線回折測定による(003)面と(104)面の回折ピークの強度比が大きいものとなる傾向がある。本発明において、X線回折測定による(003)面と(104)面の回折ピークの強度比は、I(003)/I(104)≧1.20であることが好ましく、I(003)/I(104)≧1.40であることがより好ましく、I(003)/I(104)≧1.50であることが特に好ましい。本願明細書の実施例に示した正極活物質は、比較例も含めて全て、正極活物質が合成によって得られた段階、即ち、未だ充放電に供していない状態において、I(103)/I(104)≧1.58であった。また、充放電を経た放電末の状態においてI(103)/I(104)>1であることが好ましい。前駆体の合成条件や合成手順が不適切である場合、前記ピーク強度比はより小さい値となり、しばしば1未満の値となる。
本願明細書に記載した合成条件及び合成手順を採用することにより、上記のような高性能の正極活物質を得ることができる。とりわけ、充電上限電位を4.5Vより低く設定した場合、例えば4.4Vや4.3Vといった充電上限電位を設定した場合でも高い放電容量を得ることができる非水電解質二次電池用正極活物質とすることができる。
【実施例】
【0066】
(比較例1)
(活物質の合成)
硫酸コバルト7水和物、硫酸ニッケル6水和物及び硫酸マンガン5水和物をCo、Ni及びMnのモル比が12.5:19.94:67.56となるよう秤量し、イオン交換水に溶解させることで2Mの硫酸塩水溶液を作製した。一方、15Lの反応槽を用意した。この反応層には、反応槽内部の液面が一定の高さを超えるとその排出口から溶液が排出されるように排出口が設けられている。また、反応槽内には、撹拌羽が備えられていると共に、攪拌時に上下方向の対流を生じさせるための円筒型の対流板が固定されている。前記反応槽に7Lのイオン交換水を入れ、CO2ガスを30minバブリングさせることにより、前記イオン交換水中に前記CO2ガスを十分溶解させた。なお、CO2ガスバブリングは、硫酸塩水溶液を滴下し終わるまで継続した。次に、前記反応層を50℃に設定し、前記撹拌羽を1000rpmの回転速度で作動させた。前記反応槽中に2Lの硫酸塩水溶液を徐々に滴下した。滴下中、前記攪拌を継続した。また、反応槽中のpHを常時監視し、pHが8.6±0.2の範囲となるように、2Mの炭酸ナトリウム及び0.2Mのアンモニアが溶解している水溶液を加えた。前記硫酸塩水溶液を滴下している間、前記排出口から反応生成物を含む溶液一部が反応槽の外へ排出されるが、2Lの硫酸塩水溶液の全量を滴下し終わるまでの排出溶液は、反応槽内に戻さず、廃棄した。滴下終了後、反応生成物を含む溶液をから、吸引ろ過により共沈生成物を濾別し、付着したナトリウムイオンを除去するために、イオン交換水を用いて洗浄した。次に、大気雰囲気中、常圧下、オーブンで100℃にて乾燥させた。乾燥後、粒径を揃えるように、乳鉢で数分間粉砕した。このようにして、共沈炭酸塩前駆体の粉末を得た。
【0067】
前記共沈炭酸塩前駆体に、炭酸リチウムを加え、Li:Me(Co,Ni,Mn)のモル比が1.3:1.0である混合粉体を調製した。ここで、炭酸リチウムは、Li量が前記化学量論比に対してさらに3%過剰になるようにした。前記混合粉体2gを全長約100mmのアルミナ製ボートに移し、箱型電気炉(型番:AMF20)に設置した。前記箱型電気炉の内部寸法は、縦10cm、幅20cm、奥行き30cmであり、幅方向20cm間隔に電熱線が入っている。空気雰囲気中、常圧下で、焼成炉の温度を室温から900℃まで4hかけて昇温し、900℃で10h焼成した。この後、ヒーターのスイッチを切り、アルミナ製ボートを炉内に置いたまま自然放冷した。この結果、炉の温度は5時間後には約200℃程度にまで低下するが、その後の降温速度はやや緩やかである。一昼夜経過後、焼成炉の温度が常温に戻ったことを確認してから、焼成物を取り出し、粒径を揃える程度に乳鉢で粉砕した。このようにしてLi[Li0.13Co0.109Ni0.173Mn0.588]O2(Li/Me比:1.30)を作製した。
【0068】
(実施例1〜6、比較例2〜4)
前記共沈炭酸塩前駆体に、炭酸リチウムの一部をフッ化リチウム(LiF)に変えて加え、Liに対するFのモル比F/Liが0.01〜0.25となるようにした以外は、比較例1と同様にして、実施例1〜5、比較例2〜4のリチウム遷移金属複合酸化物を作製した。
【0069】
(実施例7〜10、比較例5)
前記共沈炭酸塩前駆体に、炭酸リチウムの一部を塩化リチウム(LiCl)に変えて加え、Liに対するClのモル比Cl/Liが0.025〜0.15となるようにした以外は、比較例1と同様にして、実施例7〜10、比較例5のリチウム遷移金属複合酸化物を作製した。
【0070】
(実施例11〜14、比較例6)
前記共沈炭酸塩前駆体に、炭酸リチウムの一部をリン酸リチウム(Li3PO4)に変えて加え、Liに対するPのモル比P/Liが0.025〜0.15となるようにした以外は、比較例1と同様にして、実施例11〜14、比較例6のリチウム遷移金属複合酸化物を作製した。
【0071】
(実施例15〜18、比較例7)
前記共沈炭酸塩前駆体に、炭酸リチウムの一部を硫酸リチウム(Li2SO4)に変えて加え、Liに対するPのモル比P/Liが0.025〜0.15となるようにした以外は、比較例1と同様にして、実施例11〜14、比較例7のリチウム遷移金属複合酸化物を作製した。
【0072】
(比較例8、9)
焼成温度を800℃、700℃に変更した以外は、比較例1と同様にして、比較例8、9のリチウム遷移金属複合酸化物を作製した。
【0073】
(リチウム二次電池の作製及び評価)
実施例1〜18及び比較例1〜9に係るリチウム遷移金属複合酸化物をそれぞれリチウム二次電池用正極活物質として用いて、以下の手順でリチウム二次電池を作製し、電池特性を評価した。
【0074】
N−メチルピロリドンを分散媒とし、活物質、アセチレンブラック(AB)及びポリフッ化ビニリデン(PVdF)が質量比90:5:5の割合で混練分散されている塗布用ペーストを作製した。該塗布ペーストを厚さ20μmのアルミニウム箔集電体の片方の面に塗布し、正極板を作製した。なお、全ての実施例及び比較例に係るリチウム二次電池同士で試験条件が同一になるように、一定面積当たりに塗布されている活物質の質量及び塗布厚みを統一した。
【0075】
正極の単独挙動を正確に観察する目的のため、対極、即ち負極には金属リチウムをニッケル箔集電体に密着させて用いた。ここで、リチウム二次電池の容量が負極によって制限されないよう、負極には十分な量の金属リチウムを配置した。
【0076】
電解液として、エチレンカーボネート(EC)/エチルメチルカーボネート(EMC)/ジメチルカーボネート(DMC)が体積比6:7:7である混合溶媒に濃度が1mol/lとなるようにLiPF6を溶解させた溶液を用いた。セパレータとして、ポリアクリレートで表面改質したポリプロピレン製の微孔膜を用いた。さらに、参照電極として、ニッケル板にリチウム金属箔をはりつけた棒を設置した。外装体には、ポリエチレンテレフタレート(15μm)/アルミニウム箔(50μm)/金属接着性ポリプロピレンフィルム(50μm)からなる金属樹脂複合フィルムを用い、正極端子、負極端子および参照極端子の開放端部が外部露出するように電極を収納し、前記金属樹脂複合フィルムの内面同士が向かい合った融着代を注液孔となる部分を除いて気密封止し、前記電解液を注液後、注液孔を封止した。
【0077】
以上の手順にて作製されたリチウム二次電池は、25℃の下、初期充放電工程に供した。電圧制御は全て正極電位に対して行った。充電は、電流0.1CA、電圧4.6Vの定電流定電圧充電とし、充電終止条件は電流値が1/6に減衰した時点とした。放電は、電流0.1CA、終止電圧2.0Vの定電流放電とした。この充放電を2サイクル行った。ここで、充電後及び放電後にそれぞれ30分の休止過程を設けた。
【0078】
次に、充電電圧を変更して、1サイクルの充放電試験を行った。電圧制御は全て正極電位に対して行った。この充放電試験の条件は、充電電圧を4.3V(vs.Li/Li+)としたことを除いては、前記初期充放電工程の条件と同一である。このときの放電電気量を「放電容量(mAh/g)」として記録した。
続いて、以下の手順で高温保存試験を行った。充電条件を4.3V(vs.Li/Li+)として電流0.1CAでの定電流定電圧充電を行った。充電終止条件は電流値が1/6に減衰した時点とした。次に、全ての端子から回路を取り外した開回路状態にて、60℃の恒温槽中に2週間保存した。その後、25℃にて、1サイクル半の放電−充電−放電を行った。このときの充放電条件は保存の直前に行った充放電条件と同一であり、充電後及び放電後にそれぞれ30分の休止過程を設けた。このようにして最後に行った放電で得られた放電容量の、前記60℃保存前の「放電容量(mAh/g)」に対する百分率を「容量維持率」として表記した。
【0079】
(比表面積測定)
ユアサアイオニクス社製比表面積測定装置(商品名:MONOSORB)を用いて、一点法により、活物質に対する窒素吸着量[m2]を求めた。得られた吸着量(m2)を活物質質量(g)で除した値をBET比表面積とした。測定に当たって、液体窒素を用いた冷却によるガス吸着を行った。また、冷却前に120℃15minの予備加熱を行った。また、測定試料の投入量は、0.5g±0.01gとした。
【0080】
(発熱開始温度測定)
前記高温保存試験の後、再び、電流0.1CA,電圧4.3V (vs. Li/Li+)の定電流定電圧充電を行い、充電終止条件は電流値が1/6に減衰した時点とした。次にアルゴン雰囲気中のグローブボックス中で電池を解体し、正極板を取り出し、電解液を含んだ状態のままアルミニウム集電体ごと3mmφのポンスで打ち抜き、示差走査熱量測定(DSC)装置(Rigaku,DSC8230)専用のAl製のパンにカシメ封口により封入し、測定試料とした。前記示差走査熱量測定装置を用いて、昇温速度5℃/minにて400℃までのDSC測定を行った。得られたDSCカーブのうち、発熱方向に最も大きな熱量を示す発熱カーブの立ち上がり部分の温度を発熱開始温度とした。
【0081】
実施例1〜18及び比較例1〜9に係るリチウム遷移金属複合酸化物をそれぞれリチウム二次電池用正極活物質として用いたリチウム二次電池の試験結果を表2、図4及び図5に示す。
また、CuKα管球を用いた粉末エックス線回折測定の結果、いずれのリチウム遷移金属複合酸化物もα−NaFeO2型の六方晶構造が主相として確認された。
【0082】
【表2】

【0083】
表2より、Liに対する元素Xのモル比X/Liが0.01〜0.1の範囲で元素X(Xは、F、Cl、P又はS)を含有させたリチウム遷移金属複合酸化物を用いた正極活物質は、元素Xを含有しないリチウム遷移金属複合酸化物を用いた正極活物質と比較して、BET比表面積が小さくなり、発熱開始温度が高くなって熱安定性が向上していることがわかる。また、放電容量は、元素Xの含有量が増加するにしたがって低下するが、その低下は前記モル比X/Liが0.1までの範囲であれば小さく、逆に、容量維持率については、元素Xを含有しない場合と比較して大きくなっているから、高温保存特性は改善されているといえる。
【0084】
(比較例10)
硫酸コバルト7水和物4.6873g、硫酸ニッケル6水和物6.5743g及び硫酸マンガン5水和物22.110gを秤量し、これらの全量をイオン交換水200mlに溶解させ、Co;Ni:Mnのモル比が0.1250:0.1875:0.6875となる0.67Mの硫酸塩水溶液を作製した。一方、2dm3の反応槽に750mlのイオン交換水を注ぎ、CO2ガスを30minバブリングさせることにより、イオン交換水中にCO2を溶解させた。反応槽の温度を50℃(±2℃)に設定し、攪拌モーターを備えたパドル翼を用いて反応槽内を700rpmの回転速度で攪拌しながら、前記硫酸塩水溶液を3ml/minの速度で滴下した。ここで、滴下の開始から終了までの間、0.67Mの炭酸ナトリウム及び0.067Mのアンモニアを含有する水溶液を適宜滴下することにより、反応槽中のpHが常に8.6(±0.05)を保つように制御した。滴下終了後、反応槽内の攪拌をさらに1h継続した。攪拌の停止後、12h以上静置した。静置することにより、反応槽内に生成する共沈炭酸塩の粒子を十分に成長させることができる。
次に、吸引ろ過装置を用いて、反応槽内に生成した共沈炭酸塩の粒子を分離し、さらにイオン交換水を用いて粒子に付着しているナトリウムイオンを洗浄除去し、電気炉を用いて、空気雰囲気中、常圧下、100℃にて乾燥させた。その後、粒径を揃えるために、瑪瑙製自動乳鉢で数分間粉砕した。このようにして、共沈炭酸塩前駆体を作製した。
【0085】
前記共沈炭酸塩前駆体2.3305gに、炭酸リチウム0.9163gを加え、瑪瑙製自動乳鉢を用いてよく混合し、Li:(Co,Ni,Mn)のモル比が1.20:1.00である混合粉体を調製した。ペレット成型機を用いて、6MPaの圧力で成型し、直径25mmのペレットとした。ペレット成型に供した混合粉体の量は、想定する最終生成物の質量が2gとなるように換算して決定した。前記ペレット1個を全長約100mmのアルミナ製ボートに載置し、箱型電気炉(型番:AMF20)に設置し、空気雰囲気中、常圧下、900℃で10h焼成した。前記箱型電気炉の内部寸法は、縦10cm、幅20cm、奥行き30cmであり、幅方向20cm間隔に電熱線が入っている。焼成後、ヒーターのスイッチを切り、アルミナ製ボートを炉内に置いたまま自然放冷した。この結果、炉の温度は5時間後には約200℃程度にまで低下するが、その後の降温速度はやや緩やかである。一昼夜経過後、炉の温度が100℃以下となっていることを確認してから、ペレットを取り出し、粒径を揃えるために、瑪瑙製自動乳鉢で数分間粉砕した。このようにして、比較例10に係るリチウム遷移金属複合酸化物を作製した。
【0086】
共沈炭酸塩前駆体が含有する金属元素の組成、共沈炭酸塩前駆体と炭酸リチウムの混合量、焼成温度について、表2の比較例11〜84の記載に沿って変更した他は、比較例10と同様にして、比較例11〜80に係るリチウム遷移金属複合酸化物を合成した。
【0087】
比較例10〜84に係るリチウム遷移金属複合酸化物をそれぞれリチウム二次電池用正極活物質として用いて、実施例1〜18及び比較例1〜9と同様の手順でリチウム二次電池を作製し、試験を行って、電池特性を評価した。試験結果を表3及び表4に示す。
【0088】
【表3】

【0089】
【表4】

【0090】
表3及び表4より、リチウム遷移金属複合酸化物を正極活物質として用いる場合、1000℃未満の焼成により高い放電容量を得るためには、Li/Meを1.25〜1.40とし、Co/Me比を0.02〜0.23とし、Mn/Me比を0.63〜0.72とすることが必要であることがわかる。
また、全てのリチウム遷移金属複合酸化物は、CuKα線源を用いたエックス線回折装置(Rigaku社製、型名:MiniFlex II)を行いてエックス線回折測定を行った結果、表3及び表4に示されるように、(003)面と(104)面の回折ピークの強度比I(003)/I(104)が1.58以上であった。
【産業上の利用可能性】
【0091】
本発明の新規なリチウム遷移金属複合酸化物を含む正極活物質を用いることにより、比表面積が小さく、放電容量が大きい非水電解質二次電池を提供することができるので、この非水電解質二次電池は、ハイブリッド自動車用、電気自動車用のリチウム二次電池として有用である。
【特許請求の範囲】
【請求項1】
六方晶構造を有するリチウム遷移金属複合酸化物を含有する非水電解質二次電池用活物質であって、前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む遷移金属元素Me、Li、並びに、元素X(Xは、F、Cl、P及びSからなる群のうち1種又は2種以上)を含有し、前記遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40であり、前記遷移金属元素Me中のCoのモル比Co/Meが0.02〜0.23であり、前記遷移金属元素Me中のMnのモル比Mn/Meが0.63〜0.72であり、前記Liに対する前記元素Xのモル比X/Liが0.01〜0.1であることを特徴とする非水電解質二次電池用活物質。
【請求項2】
前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む化合物の共沈前駆体と前記元素Xを含むリチウム化合物を一部に用いたリチウム化合物とを混合して焼成したものである請求項1に記載の非水電解質二次電池用活物質。
【請求項3】
前記リチウム遷移金属複合酸化物は、前記元素Xを含有しないリチウム遷移金属複合酸化物と比較して格子定数に変化がない請求項1又は2に記載の非水電解質二次電池用活物質。
【請求項4】
前記元素XはSである請求項1〜3のいずれか1項に記載の非水電解質二次電池用活物質。
【請求項5】
請求項1〜4のいずれか1項に記載の非水電解質二次電池用活物質の製造方法であって、溶液中でCo、Ni及びMnを含む化合物を共沈させて共沈前駆体を製造する工程、前記共沈前駆体と前記元素Xを含むリチウム化合物を一部に用いたリチウム化合物とを混合し、焼成する工程を含むことを特徴とする非水電解質二次電池用活物質の製造方法。
【請求項6】
請求項1〜4のいずれか1項に記載の非水電解質二次電池用活物質を含有する非水電解質二次電池用電極。
【請求項7】
請求項6に記載の非水電解質二次電池用電極を備えた非水電解質二次電池。
【請求項1】
六方晶構造を有するリチウム遷移金属複合酸化物を含有する非水電解質二次電池用活物質であって、前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む遷移金属元素Me、Li、並びに、元素X(Xは、F、Cl、P及びSからなる群のうち1種又は2種以上)を含有し、前記遷移金属元素Meに対するLiのモル比Li/Meが1.25〜1.40であり、前記遷移金属元素Me中のCoのモル比Co/Meが0.02〜0.23であり、前記遷移金属元素Me中のMnのモル比Mn/Meが0.63〜0.72であり、前記Liに対する前記元素Xのモル比X/Liが0.01〜0.1であることを特徴とする非水電解質二次電池用活物質。
【請求項2】
前記リチウム遷移金属複合酸化物は、Co、Ni及びMnを含む化合物の共沈前駆体と前記元素Xを含むリチウム化合物を一部に用いたリチウム化合物とを混合して焼成したものである請求項1に記載の非水電解質二次電池用活物質。
【請求項3】
前記リチウム遷移金属複合酸化物は、前記元素Xを含有しないリチウム遷移金属複合酸化物と比較して格子定数に変化がない請求項1又は2に記載の非水電解質二次電池用活物質。
【請求項4】
前記元素XはSである請求項1〜3のいずれか1項に記載の非水電解質二次電池用活物質。
【請求項5】
請求項1〜4のいずれか1項に記載の非水電解質二次電池用活物質の製造方法であって、溶液中でCo、Ni及びMnを含む化合物を共沈させて共沈前駆体を製造する工程、前記共沈前駆体と前記元素Xを含むリチウム化合物を一部に用いたリチウム化合物とを混合し、焼成する工程を含むことを特徴とする非水電解質二次電池用活物質の製造方法。
【請求項6】
請求項1〜4のいずれか1項に記載の非水電解質二次電池用活物質を含有する非水電解質二次電池用電極。
【請求項7】
請求項6に記載の非水電解質二次電池用電極を備えた非水電解質二次電池。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−65472(P2013−65472A)
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願番号】特願2011−203737(P2011−203737)
【出願日】平成23年9月16日(2011.9.16)
【出願人】(507151526)株式会社GSユアサ (375)
【Fターム(参考)】
【公開日】平成25年4月11日(2013.4.11)
【国際特許分類】
【出願日】平成23年9月16日(2011.9.16)
【出願人】(507151526)株式会社GSユアサ (375)
【Fターム(参考)】
[ Back to top ]

