非水電解質二次電池
【課題】 非水系二次電池において、負極活物質にリチウムの吸蔵・放出可能な合金を用いた場合、初期の放電容量は高いが、サイクル時に微粉化を起こし寿命特性が悪く、さらに高率放電特性にも課題を有している。
【解決手段】 Sn、Si、Al、Ga、In、Pb、Sb、Biから選択されるいずれか1種を主成分として有する電気化学的にリチウムイオンの吸蔵・放出が可能な元素(A相)とTi、Zrあるいは希土類元素から選択される1種以上の元素(B相)と酸素及び窒素を有する合金を用いたことを特徴とする非水電解質二次電池である。B相中に前記合金に含有する酸素と窒素の70重量%以上が存在し、合金中の酸素と窒素の含有率は各々0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%が有効である。
【解決手段】 Sn、Si、Al、Ga、In、Pb、Sb、Biから選択されるいずれか1種を主成分として有する電気化学的にリチウムイオンの吸蔵・放出が可能な元素(A相)とTi、Zrあるいは希土類元素から選択される1種以上の元素(B相)と酸素及び窒素を有する合金を用いたことを特徴とする非水電解質二次電池である。B相中に前記合金に含有する酸素と窒素の70重量%以上が存在し、合金中の酸素と窒素の含有率は各々0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%が有効である。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】本発明は非水電解質二次電池の負極の改良に関わり、高容量と長寿命さらには高率放電特性に優れた非水電解質二次電池を提供するものである。
【0002】
【従来の技術】非水電解液二次電池の負極としては金属リチウムまたはリチウム化合物が、高電圧で高エネルギー密度を実現できるため、多くの研究が行われてきた。
【0003】一方、正極としてはLiMn2O4、LiCoO2、LiNiO2、V2O5、Cr2O5、MnO2、TiS2、MoS2などの遷移金属の酸化物およびカルコゲン化合物が検討されてきた。これらは層状もしくはトンネル構造を有し、リチウムイオンが出入りできる結晶構造を持つことが知られている。
【0004】金属リチウムが当初多く検討されたが、充電時に負極リチウム表面に樹枝状のリチウムが析出し、充放電効率の低下や正極と接して内部短絡を生じるという問題を生じた。このため、現在は金属リチウムより容量は小さいがリチウムを可逆的に吸蔵、放出ができサイクル寿命特性、安全性に優れた黒鉛系の炭素材料を負極に用いたリチウムイオン電池が実用化されている。
【0005】しかしながら上述のように黒鉛系炭素材料を負極に使用した場合、その実用容量が350mAh/gと小さく、また理論密度も2.2g/ccと低く、負極シートとした場合、さらに密度が低下する。電池として高容量化を求めるためには、体積あたりでより高容量化が可能な金属系材料を負極として利用することが望まれる。
【0006】
【発明が解決しようとする課題】しかし、金属系材料を負極活物質として使用する際の課題として、リチウムイオンの挿入・脱離にともない、活物質が膨張・収縮を繰り返し、微粉化することがあげられる。微粉化した活物質は負極中で他の活物質あるいは導電剤との接点を失い、電子伝導性が低下することから見かけ上、不活性な活物質となり容量減少を生じる。
【0007】これらを解決する手段として、特開平11−86854号公報で一粒子内にリチウムを吸蔵できる相と吸蔵しない相を共存させることにより、充電状態(吸蔵状態)においてリチウムを吸収しない相が応力を緩和させ、活物質の膨張破壊の抑制を図っている。さらに特開平11−86853号公報では一粒子内にリチウムを吸蔵する相が2相以上存在させることによって、Li吸蔵時に各相での構造変化で膨張応力を緩和することで微粉化抑制を図っている。これは活物質粒子内に複数の微小な相が存在し、リチウム吸蔵時において隣接界面に膨張応力を逃がすことが出来るためと考えられる。
【0008】しかしながら、これらの条件を満たす負極材料であっても活物質の微粉化は完全に抑制できず、それに起因して充放電の繰り返しによるサイクル劣化を生じる。この原因としては前者のように各相の膨張率が大きく異なる場合、活物質粒子内での応力の不均一化により、強く膨張応力が働いた一部の相の応力をリチウム非吸収相が十分吸収できず、結果として微粉化が生じ、活物質粒子から遊離が起きると考えられる。また、リチウムを吸蔵しない相がリチウムの移動時の抵抗として働き、電池における高率放電特性の低下をもたらす。
【0009】一方、後者のように2相ともリチウムイオンを吸蔵する場合は、リチウムイオン吸蔵時の合金相間の膨張率差は小さくなるが、合金粒子全体としては体積膨張が大きくなり、合金粒子間及び集電材間でゆるみを生じ、集電不良を起こす。このため合金粒子は負極極板内で電気的に独立し、電池反応に寄与しないものが増加する。よって後者では膨張・収縮による合金粒子の微粉化抑制効果はあるが、充放電サイクルによる放電容量低下を十部抑えることはできない。
【0010】また負極活物質に金属酸化物を利用する技術も多く報告されている。例えばIdotaらはスズの酸化物を利用することで高容量かつ長寿命の負極を発表している(Science、276,5317,1395−1397(1997))。しかしながらこれらの場合、初回の充電過程において2価あるいは4価の価数を有する酸化物中のスズを0価(金属状態)まで還元する必要があり、大きな不可逆容量を持つことになる。このため、充放電サイクルに関与しないリチウムが多量に生じ、実際の電池系としては低容量のものしか設計することができない。
【0011】本発明は以上のような充放電時での合金粒子の膨張・収縮を抑制し、高容量かつ充放電サイクル寿命特性、高率放電特性に優れた非水電解質二次電池用負極を提供することを目的とするものである。
【0012】
【課題を解決するための手段】本発明は、合金系負極材料の課題である膨張・収縮にともなう微粉化に対して、酸素及び窒素を多く有するリチウム透過相を緩衝相として介在させることで抑制した。これにより高容量、長寿命かつ高率放電特性に優れた非水電解質二次電池を提供するものである。
【0013】鋭意検討した結果、リチウムイオンを吸蔵・放出する充放電可能な正極、負極およびリチウム塩を含む非水電解質からなる非水電解質二次電池において、負極活物質が少なくとも2種以上の金属元素あるいは/及び半金属元素とさらに酸素と窒素を含有する合金粒子でありことを特徴とする。
【0014】この合金粒子は、リチウムイオンの吸蔵・放出が可能なA相とリチウムイオンの透過性を有するB相の少なくとも2相が共存し、B相はA相を取り囲むように存在し、A相は少なくともSn、Si、Al、Ga、In、Pb、Sb、Biから選択されるいずれか1種を主成分として有し、B相は少なくともTi、Zrあるいは希土類元素から選択される1種以上を有している。但し、合金粒子中の酸素及び窒素の含有量はA相よりB相の方が多く、合金粒子中の酸素と窒素の全含有量の70重量%以上がB相に存在することが好ましい。
【0015】Sn、Si、Al、Ga、In、Pb、Sb、Biは電気化学的にリチウムと合金化しやすい元素であり、充分に高容量(大きなリチウム吸蔵量)を発揮する。含有量としてはA相において上記元素が50mol%以上存在することが望ましい。Ti、Zrあるいは希土類元素は酸素及び窒素との反応性が高く、A相への酸素及び窒素の反応を抑制し、B相への酸化反応及び窒化反応を優先的に起こす。これによってB相においては低結晶化あるいは非晶質化が進行し、結晶粒界面の増加あるいは原子配列の長距離秩序が消失する。その結果、リチウムイオンの透過性が向上するとともに塑性強度が増し、A相の微粉化を抑制する効果が大きくなる。リチウムイオンの透過性が向上することで電池特性としては高率放電特性が改善される。
【0016】A相自体も酸素及び窒素と反応するが、その反応性はTi、Zrあるいは希土類元素を有するB相に比べてはるかに小さく、リチウムイオンの吸蔵・放出量を低下させるレベルではない。
【0017】本発明の合金粒子は前記B相が前記A相を取り囲む組織構造をもつことにより、A相の膨張・収縮で発生する応力が分散され個々に吸収することが可能となり、効果的に微粉化を抑制できる。
【0018】B相にTi、Zrあるいは希土類元素を含まない場合は雰囲気中の酸素や窒素がB相だけでなくA相とも同様に反応し、A相にも酸化物及び窒化物が多く形成される。このためリチウムの吸蔵・放出量が減少し放電容量の低下を招く。Ti、Zrあるいは希土類元素の含有量は5重量%以上70重量%以下が容量の点から望ましい。より好ましくは5重量%以上30重量%以下の含有率とすることで容量と寿命さらに高率放電特性の点で優れる。
【0019】合金粒子中の酸素及び窒素含有率としては放電容量と寿命特性及び高率放電特性のバランスから各々0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%が望ましい。特に1重量%≦酸素+窒素≦5重量%が最適である。含有率が0.5重量%未満では本発明の効果は薄く、また10重量%より多く存在すると上述の酸化物負極と同様に初回充電時における不可逆容量が増加するため実効放電容量の低下を招き不適である。さらに、酸素、窒素の過度な混入は活物質の密度を低下させる要因であり、体積あたりの放電容量が減少するため不適である。
【0020】さらに合金粒子中に酸素及び窒素以外にフッ素、硫黄、リンから選択される少なくとも1種以上を含有し、酸素と窒素及びフッ素、硫黄、リンの含有率が0.5重量%以上10重量%以下の時も微粉化抑制効果が認められた。
【0021】この際、活性相である前記A相でのリチウム吸蔵・放出量の低下を防ぎつつ、B相においては酸化反応、窒化反応に加えてフッ化物・硫化物・リン化物形成による膨張・収縮での応力緩和効果を大きくするため合金粒子中の酸素と窒素及びフッ素、硫黄、リンの含有量の70重量%以上がB相に存在することが好ましかった。
【0022】リチウムイオンの吸蔵・放出能力が高く、かつ寿命への効果を確保するため酸素量、窒素量、さらにフッ素量、硫黄量、リン量を制御して、微粉化抑制を行い、高容量・長寿命化を図った。
【0023】本発明では酸素及び窒素、さらにフッ素、硫黄、リンのいずれか少なくとも1種以上をアトマイズ法やメカニカルアロイング等の手法を利用して制御しながら合金中に導入することで、放電容量を減少させず高率放電特性の低下を抑え、サイクル性を向上させることが可能となる。単に合金粒子を2相以上の相で構成しただけでは、高率放電特性が悪く、リチウム吸蔵・放出時の膨張応力を緩和する能力に乏しく、あまり長寿命の電池が得られなかった。
【0024】酸素、窒素さらにフッ素、硫黄、リンが前記B相に選択的に導入されることにより、B相の低結晶化あるいは非晶質化の進行に加え、フッ化物、硫化物、リン化物も生成することによって、さらにリチウムイオンが容易に通過でき、高率放電特性の低下を防ぐこともできた。
【0025】
【発明の実施の形態】以下に本発明の実施例を示す。負極合金粒子の製造法としてはガスアトマイズ法、水アトマイズ法やメカニカルアロイング法等の手法が合金粒子中に酸素、窒素さらにはフッ素、硫黄、リンを導入するのに有効であった。個々の製法については各実施例で詳細に述べる。
【0026】電池特性評価は放電容量については電気化学セル、高率放電特性及びサイクル寿命については円筒型電池を組んで行った。
【0027】(電気化学セルの作製法)図1に示す試験セルを作製した。負極合金粒子7.5gと導電剤としての黒鉛粉末2g、結着剤としてのポリエチレン粉末0.5gを混合して合剤とした。この合剤0.1gを直径17.5mmに加圧成型して試験電極1とし、ケース3の中に置いた。次に、微孔性ポリプロピレンセパレータ7を電極上に置いた。
【0028】1モル/lの過塩素酸リチウム(LiClO4)を溶解したエチレンカーボネート(EC)とジメトキシエタン(DME)の体積比で1:1の混合溶液を非水電解質として試験セルに注液した。この上に、内側に直径17.5mmの金属Li4を張り付け、外周部にポリプロピレンガスケット5を付けた封口板6を置いて、封口し試験セルとした。
【0029】この試験セルにおいて、0.5mA/cm2の一定電流で端子電圧が0Vになるまで充電(合金粒子にリチウムイオンが挿入される反応)を行い、次に端子電圧が1.5Vになるまで0.5mA/cm2の電流で放電(合金粒子からリチウムイオンが放出される反応)を行い、放電容量を測った。その際の充電容量と放電容量の比を求めた。この値が低いことは初回充電時に不可逆な反応が多く生じていることを示す。つまり電気化学的に不可逆容量が多いことが示せる。
【0030】(円筒型電池の作製法)正極活物質であるLiMn1.8Co0.2O4は、Li2CO3とMn3O4とCoCO3とを所定のモル比で混合し、900℃で加熱することによって合成した。さらに、これを100メッシュ以下に分級したものを正極活物質とした。
【0031】上記正極活物質100gに対して導電剤として炭素粉末を10g、結着剤としてポリ4フッ化エチレンディスパージョン8gと純水を加え、十分混合しペースト状にし、アルミニウムの芯材に塗布し、乾燥、圧延して正極11を得た。
【0032】負極としては各種方法で作製した合金粒子(活物質)と導電剤としての黒鉛粉末、結着剤としてのスチレンブタジエンゴム(SBR)を重量比で70:20:10の割合で混合し、水を分散溶媒に用いてペ−スト状としたものを銅の芯材に塗布後、140℃で乾燥し、負極12とした。
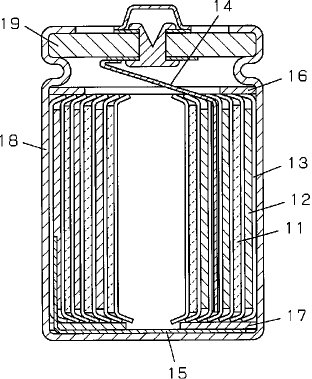
【0033】円筒型電池の作製手順を以下に図2を用いて説明する。超音波溶接で正極芯材のアルミニウムにアルミニウムからなる正極リード14を取り付けた。同様に負極芯材の銅に、同材質の負極リード15を超音波溶接で接合した。正極と負極間に両極板より幅の広い帯状の多孔性ポリプロピレン製のセパレータ13を配して全体を渦巻状に捲回して構成した。さらに、上記電極体の上下それぞれにポリプロピレン製の絶縁板16、17を配して電槽18に挿入し、電槽18の上部に段部を形成させた後、非水電解液として、1モル/lのLiClO4を溶解したECとDMEの等比体積混合溶液を注入し、封口板19で密閉して電池とした。
【0034】この様にして作製した円筒型電池は試験温度20℃、充電電流0.2C(1Cは1時間率電流)で、電池電圧が4.2Vまで定電流充電を行い、その後4.2Vで定電圧充電(定電流定電圧CCCV充電)を行った。1回目の放電は0.2Cの電流で電池電圧3.0Vまで行い、2回目は同一充電条件で、放電のみ2Cの電流で行った。2回目の2C放電容量を1回目の0.2C放電容量で割り100を掛けた値を高率放電比とした。
【0035】この比が100に近いほど高率放電に優れることになる。3回目以降は1回目と同一条件で充放電を繰り返した。1サイクル目に対する100サイクル目の放電容量比をサイクル維持率とした。当然、この比も100に近いほどサイクル特性が良好なことを示す。
【0036】以下に各種組成、各種合金作製方法及び各種条件で作製した合金を負極活物質とした電池について具体的に実施例を示す。
【0037】
【実施例】以下に本発明をその実施例によりさらに詳しく説明する。なお、本発明はこれらに限定されるものではない。
【0038】(実施例1―6)本実施例に用いた合金粒子は以下の方法で合成した。各種元素を塊状あるいは板状、あるいは粒状のまま任意の比率で混合し、アーク溶解炉で鋳造した。
【0039】得られた鋳造合金を原料としてガスアトマイズ法を用いて球状の合金粒子を得た。このとき、噴射ノズル径は1mmφであり、噴射ガスはAr+O2(1%、3%、5%)あるいはN2+O2(1%、3%、5%)を用いた。ガス噴射圧は100kgf/cm2で行った。この作製したガスアトマイズ合金粒子を45ミクロンメッシュのふるいを通すことで平均粒径28μmの粒子を得た。
【0040】上記粒子に対してX線回折分析及びEPMA分析(電子線マイクロ分析)による面分析を行ったところ、どれも複数の相を有していた。それらの相及び粒子中の酸素量、窒素量を透過型電子顕微鏡(TEM)および電子エネルギー損失分析(EELS)により分析した結果及び電池特性を表1に示す。酸素および窒素量は各粒子の断面の数点をTEMで観測し、EELSにより面分析を行うことで算出した。表1の値は合金相を1とした場合の酸素、窒素の存在比の平均値を記載している。
【0041】TiとSnを化学量論比で仕込み、Ti2Sn合金をAr+1%O2(実施例1)、Ar+3%O2(実施例2)、Ar+5%O2(実施例3)及びN2+1%O2(実施例4)、N2+3%O2(実施例5)、N2+5%O2(実施例6)のガスを用いてガスアトマイズした場合、作製した合金中のA相及びB相中の酸素量および窒素量は実施例1−6で、それぞれ表1に示すような値を示した。いずれにおいてもA相には酸素および窒素がほとんど含まれず、B相の方に多く含まれていることがわかった。これはTiが酸素及び窒素のゲッターとして働いたためと思われる。電池特性も表1に示すが、放電容量は高く、高率放電特性及びサイクル特性にも優れていた。
【0042】
【表1】

【0043】(実施例7―12)合金仕込み組成としてCuZrSi2を化学量論比でアーク溶解炉に投入し、合金を作製した。その後、実施例1−6と同様に各種ガスでガスアトマイズを行い、合金粒子を作製した。合金粒子のA相及びB相の組成分析の結果と電池特性を表2に示す。B相中の酸素及び窒素含有量の総量は0.5重量%以上10重量%で優れた特性を示した。
【0044】これに対して、Arガスのみによるガスアトマイズ法で合成したTiSn合金(比較例1)ではガス中に酸素及び窒素を含んでいないため合金粒子中の酸素量および窒素量がそれぞれ0.11重量%、0.25重量%と低く、サイクル特性が表1に示すように大幅に低下した。
【0045】一方、アーク溶解炉で作製したTiSn合金をAr+8%O2(比較例2)及びN2+8%O2(比較例3)のガスを用いてガスアトマイズした場合、作製した合金中のA相及びB相中の酸素量、窒素量はそれぞれ表1に示すように大幅に増加し、初回放電容量/充電容量比の低下をもたらした。これは、A相中の酸素量および窒素量が増加することで活性相(ここではSn)が酸化、窒化される。リチウムイオンを吸蔵するためにはSnを金属状態まで還元する必要があるため電気化学的には不可逆容量が増加する。
【0046】また、Ar+1%O2及びN2+1%O2のガスを用いてFeSi(それぞれ比較例4、比較例7)、FeSn2(比較例5、比較例8)及びNiAl合金(比較例6、比較例9)をガスアトマイズした場合では、作製した合金粒子中のA相及びB相中の酸素量、窒素量がそれぞれ表1に示すような値となり、いずれの合金粒子においてもB相(リチウム非吸蔵相)にTi、Zrあるいは希土類元素を含んでいないため、合金粒子中の酸素および窒素はA相にも多く含まれ、初回放電容量/充電容量の比が大幅に低下した。
【0047】比較例1のようにArガスのみでガスアトマイズを行ったものではB相中の酸素あるいは窒素量が低く、放電容量は高かったが高率放電特性及びサイクル寿命特性は現行リチウムイオン電池より劣っていた。一方、比較例2及び比較例3のようにガス中の酸素量が8%を越すような場合は、A相中の酸素量も増加し、不可逆容量の増加が顕著となった。
【0048】本発明の合金粒子を負極に用いた電池は、比較例に比べて高容量かつサイクル特性及び高率放電特性において格段に優れていた。
【0049】(実施例13−14)実施例1と同様にNiLaGa及びNiCeIn2となるよう原料を化学量論比で一旦アーク溶解炉を用いて合金を作製した後、水アトマイズ法で合金粒子を作製した。合成雰囲気はN2中である。水アトマイズでは噴出圧800kgf/cm2の水を溶湯にぶつけることで合金は急冷、微粉化される。この合金粒子を45ミクロンメッシュのふるいを通すことで平均粒径20μmの粒子を得た。
【0050】この合金を用いて水アトマイズ合金粒子を上記条件で作製した。これら合金粒子の各種分析(実施例1と同様)結果を表2に示す。EPMA分析の断面での組成分析より水アトマイズ法で合成した粒子では粒子表面に平均膜厚18nm程度の酸化物被膜が生成していることが判明した。本実施例においてもB相にほとんどの酸素と窒素が導入されていることがわかった。水アトマイズ法の場合、水に含まれる溶存酸素と窒素さらには冷却時の衝突で分解される水の影響で合金中に酸素及び窒素が導入される。
【0051】得られた合金粒子を用いて電池を作製し、充放電試験を行った時の電池特性も表2に示す。本発明の活物質を負極に用いた電池は従来例に比べて高容量かつ長寿命で高率放電特性に優れていた。
【0052】
【表2】

【0053】以上のような実施例合金の分析より酸素及び窒素を多く含んだB相は、TEM観察および観測点における電子線回折により低結晶あるいは非晶質の状態であることが判明した。このB相はリチウムを良く透すことができるため、高率放電特性に優れる。また、A相の膨張・収縮の応力の吸収にも適しており、サイクル特性においても優れていた。この際、合金粒子のB相に窒素が入ることで前記応力の緩和効果が酸素のみの場合に比べて向上した。
【0054】表2に各合金粒子を負極活物質とした時の放電容量、高率放電特性及びサイクル特性を示しているが、酸素量及び窒素量が0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%の範囲に置いて、高容量で高率放電特性に優れ、かつ長寿命の電池特性となることがわかった。
【0055】(実施例15−24)本実施例に用いた合金粒子は以下の方法で合成した。ステンレスボール(直径4.8cm)25個を入れたステンレス製ポットミル(容量500ml)中に各種金属あるいは半金属元素および添加元素の粉末(全て粒径45μm以下)を任意の比率で投入した。フッ素の添加についてはLiF(顆粒状)を加え、全混合粉末量は15gとした。仕込み組成はTiPb、ZrSb2、TiCoBi、Ti2Sn、TiSi2である。さらにTiPbには1.0重量%のフッ素(LiF)、ZrSb2には0.5重量%の硫黄、そしてTiCoBiには1.0重量%のリンをそれぞれ添加した。
【0056】前記ポットミルの雰囲気を 1)Ar+O2 (3%)雰囲気 (実施例15−19)
2)N2+O2(3%)雰囲気 (実施例20−24)
3)Ar雰囲気(Ar純度99.999%) (比較例10−14)
4)大気中 (比較例15−19)
の4つの条件とした。各種雰囲気下で封口後、その雰囲気下において60rpm一定回転で10日間ボールミリングを行った。合成操作後、合金粒子の平均粒径はいずれも約0.8μmと非常に微小な合金粒子が得られた。
【0057】上記合金粒子に対してX線回折分析を行ったところ、どの合金粒子もブロードなピーク形状を示す低結晶あるいは非晶質な粒子であることが判明した。また上記粒子に対してX線回折から判明するものに関してはそのピークから相構造を、また非晶質の粒子に対してはTEMを利用して相構造を解析した。その結果、全ての粒子において複数の金属間化合物相からなることが判明した。その分析結果及び電池特性を表3に示す。
【0058】
【表3】

【0059】比較例10−19に比べ、本実施例ではB相に酸素、窒素が多く含まれ、さらに上記添加物のほとんどがB相でのみ検出された。これらの合金粒子は高率放電特性及び寿命特性に優れることがわかった。
【0060】本実施例においては、B相の界面から相内部に向かって10nmまでの部分にで酸素と窒素の70重量%以上が存在していることがわかった。
【0061】比較例の合金を活物質とした場合の組成分析結果及び電池特性も表3に示すが、Arガスのみの雰囲気では寿命特性及び高率放電特性に劣っており、大気中の物ではA相の酸素量、窒素量が多くなりすぎ、不可逆容量の増加をもたらした。
【0062】本発明の合金粒子を負極活物質に用いた電池は比較例に比べて高容量かつサイクル特性に優れ、高率放電特性の点でも酸素及び窒素を含有していない合金に比べて格段に優れていた。
【0063】電池としての放電容量の点からは、リチウムイオンの吸蔵・放出量が大きいことが望まれ、A相にSn、Si、Al、Ga、In、Pb、Sb、Biから選択されるいずれか1種を主成分とするものが有効であった。
【0064】なお本実施例では正極としてLiMn1.8Co0.2O4を用いた場合について説明したが、LiMn2O4、LiCoO2、LiNiO2などの充放電に対して可逆性を有する正極と組み合わせた場合にも同様の効果があることはいうまでもない。
【0065】以上の結果より、酸素量及び窒素量が0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%の範囲において、高容量で高率放電特性に優れ、かつ長寿命の電池特性となることがわかった。
【0066】また、合金粒子中に含有される酸素と窒素は、その全含有量の70重量%以上がB相に含まれていることが望ましい。
【0067】
【発明の効果】以上述べたように高容量、長寿命かつ高率放電特性に優れた合金粒子を負極活物質に用いることで、より高エネルギー密度で樹枝状リチウムによる短絡のない高信頼性の非水電解質二次電池を得ることが可能となる。
【図面の簡単な説明】
【図1】本発明の負極材料の電極特性を評価するための試験セルの断面概略図
【図2】本発明の負極材料の電池特性を評価するための円筒型電池の断面概略図
【符号の説明】
1 試験電極
2 集電体
3 ケース
4 金属リチウム
5 ガスケット
6 封口板
7 セパレータ
11 正極
12 本発明負極
13 セパレータ
14 正極リード板
15 負極リード板
16 上部絶縁板
17 下部絶縁板
18 電槽
19 封口板
【0001】
【発明の属する技術分野】本発明は非水電解質二次電池の負極の改良に関わり、高容量と長寿命さらには高率放電特性に優れた非水電解質二次電池を提供するものである。
【0002】
【従来の技術】非水電解液二次電池の負極としては金属リチウムまたはリチウム化合物が、高電圧で高エネルギー密度を実現できるため、多くの研究が行われてきた。
【0003】一方、正極としてはLiMn2O4、LiCoO2、LiNiO2、V2O5、Cr2O5、MnO2、TiS2、MoS2などの遷移金属の酸化物およびカルコゲン化合物が検討されてきた。これらは層状もしくはトンネル構造を有し、リチウムイオンが出入りできる結晶構造を持つことが知られている。
【0004】金属リチウムが当初多く検討されたが、充電時に負極リチウム表面に樹枝状のリチウムが析出し、充放電効率の低下や正極と接して内部短絡を生じるという問題を生じた。このため、現在は金属リチウムより容量は小さいがリチウムを可逆的に吸蔵、放出ができサイクル寿命特性、安全性に優れた黒鉛系の炭素材料を負極に用いたリチウムイオン電池が実用化されている。
【0005】しかしながら上述のように黒鉛系炭素材料を負極に使用した場合、その実用容量が350mAh/gと小さく、また理論密度も2.2g/ccと低く、負極シートとした場合、さらに密度が低下する。電池として高容量化を求めるためには、体積あたりでより高容量化が可能な金属系材料を負極として利用することが望まれる。
【0006】
【発明が解決しようとする課題】しかし、金属系材料を負極活物質として使用する際の課題として、リチウムイオンの挿入・脱離にともない、活物質が膨張・収縮を繰り返し、微粉化することがあげられる。微粉化した活物質は負極中で他の活物質あるいは導電剤との接点を失い、電子伝導性が低下することから見かけ上、不活性な活物質となり容量減少を生じる。
【0007】これらを解決する手段として、特開平11−86854号公報で一粒子内にリチウムを吸蔵できる相と吸蔵しない相を共存させることにより、充電状態(吸蔵状態)においてリチウムを吸収しない相が応力を緩和させ、活物質の膨張破壊の抑制を図っている。さらに特開平11−86853号公報では一粒子内にリチウムを吸蔵する相が2相以上存在させることによって、Li吸蔵時に各相での構造変化で膨張応力を緩和することで微粉化抑制を図っている。これは活物質粒子内に複数の微小な相が存在し、リチウム吸蔵時において隣接界面に膨張応力を逃がすことが出来るためと考えられる。
【0008】しかしながら、これらの条件を満たす負極材料であっても活物質の微粉化は完全に抑制できず、それに起因して充放電の繰り返しによるサイクル劣化を生じる。この原因としては前者のように各相の膨張率が大きく異なる場合、活物質粒子内での応力の不均一化により、強く膨張応力が働いた一部の相の応力をリチウム非吸収相が十分吸収できず、結果として微粉化が生じ、活物質粒子から遊離が起きると考えられる。また、リチウムを吸蔵しない相がリチウムの移動時の抵抗として働き、電池における高率放電特性の低下をもたらす。
【0009】一方、後者のように2相ともリチウムイオンを吸蔵する場合は、リチウムイオン吸蔵時の合金相間の膨張率差は小さくなるが、合金粒子全体としては体積膨張が大きくなり、合金粒子間及び集電材間でゆるみを生じ、集電不良を起こす。このため合金粒子は負極極板内で電気的に独立し、電池反応に寄与しないものが増加する。よって後者では膨張・収縮による合金粒子の微粉化抑制効果はあるが、充放電サイクルによる放電容量低下を十部抑えることはできない。
【0010】また負極活物質に金属酸化物を利用する技術も多く報告されている。例えばIdotaらはスズの酸化物を利用することで高容量かつ長寿命の負極を発表している(Science、276,5317,1395−1397(1997))。しかしながらこれらの場合、初回の充電過程において2価あるいは4価の価数を有する酸化物中のスズを0価(金属状態)まで還元する必要があり、大きな不可逆容量を持つことになる。このため、充放電サイクルに関与しないリチウムが多量に生じ、実際の電池系としては低容量のものしか設計することができない。
【0011】本発明は以上のような充放電時での合金粒子の膨張・収縮を抑制し、高容量かつ充放電サイクル寿命特性、高率放電特性に優れた非水電解質二次電池用負極を提供することを目的とするものである。
【0012】
【課題を解決するための手段】本発明は、合金系負極材料の課題である膨張・収縮にともなう微粉化に対して、酸素及び窒素を多く有するリチウム透過相を緩衝相として介在させることで抑制した。これにより高容量、長寿命かつ高率放電特性に優れた非水電解質二次電池を提供するものである。
【0013】鋭意検討した結果、リチウムイオンを吸蔵・放出する充放電可能な正極、負極およびリチウム塩を含む非水電解質からなる非水電解質二次電池において、負極活物質が少なくとも2種以上の金属元素あるいは/及び半金属元素とさらに酸素と窒素を含有する合金粒子でありことを特徴とする。
【0014】この合金粒子は、リチウムイオンの吸蔵・放出が可能なA相とリチウムイオンの透過性を有するB相の少なくとも2相が共存し、B相はA相を取り囲むように存在し、A相は少なくともSn、Si、Al、Ga、In、Pb、Sb、Biから選択されるいずれか1種を主成分として有し、B相は少なくともTi、Zrあるいは希土類元素から選択される1種以上を有している。但し、合金粒子中の酸素及び窒素の含有量はA相よりB相の方が多く、合金粒子中の酸素と窒素の全含有量の70重量%以上がB相に存在することが好ましい。
【0015】Sn、Si、Al、Ga、In、Pb、Sb、Biは電気化学的にリチウムと合金化しやすい元素であり、充分に高容量(大きなリチウム吸蔵量)を発揮する。含有量としてはA相において上記元素が50mol%以上存在することが望ましい。Ti、Zrあるいは希土類元素は酸素及び窒素との反応性が高く、A相への酸素及び窒素の反応を抑制し、B相への酸化反応及び窒化反応を優先的に起こす。これによってB相においては低結晶化あるいは非晶質化が進行し、結晶粒界面の増加あるいは原子配列の長距離秩序が消失する。その結果、リチウムイオンの透過性が向上するとともに塑性強度が増し、A相の微粉化を抑制する効果が大きくなる。リチウムイオンの透過性が向上することで電池特性としては高率放電特性が改善される。
【0016】A相自体も酸素及び窒素と反応するが、その反応性はTi、Zrあるいは希土類元素を有するB相に比べてはるかに小さく、リチウムイオンの吸蔵・放出量を低下させるレベルではない。
【0017】本発明の合金粒子は前記B相が前記A相を取り囲む組織構造をもつことにより、A相の膨張・収縮で発生する応力が分散され個々に吸収することが可能となり、効果的に微粉化を抑制できる。
【0018】B相にTi、Zrあるいは希土類元素を含まない場合は雰囲気中の酸素や窒素がB相だけでなくA相とも同様に反応し、A相にも酸化物及び窒化物が多く形成される。このためリチウムの吸蔵・放出量が減少し放電容量の低下を招く。Ti、Zrあるいは希土類元素の含有量は5重量%以上70重量%以下が容量の点から望ましい。より好ましくは5重量%以上30重量%以下の含有率とすることで容量と寿命さらに高率放電特性の点で優れる。
【0019】合金粒子中の酸素及び窒素含有率としては放電容量と寿命特性及び高率放電特性のバランスから各々0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%が望ましい。特に1重量%≦酸素+窒素≦5重量%が最適である。含有率が0.5重量%未満では本発明の効果は薄く、また10重量%より多く存在すると上述の酸化物負極と同様に初回充電時における不可逆容量が増加するため実効放電容量の低下を招き不適である。さらに、酸素、窒素の過度な混入は活物質の密度を低下させる要因であり、体積あたりの放電容量が減少するため不適である。
【0020】さらに合金粒子中に酸素及び窒素以外にフッ素、硫黄、リンから選択される少なくとも1種以上を含有し、酸素と窒素及びフッ素、硫黄、リンの含有率が0.5重量%以上10重量%以下の時も微粉化抑制効果が認められた。
【0021】この際、活性相である前記A相でのリチウム吸蔵・放出量の低下を防ぎつつ、B相においては酸化反応、窒化反応に加えてフッ化物・硫化物・リン化物形成による膨張・収縮での応力緩和効果を大きくするため合金粒子中の酸素と窒素及びフッ素、硫黄、リンの含有量の70重量%以上がB相に存在することが好ましかった。
【0022】リチウムイオンの吸蔵・放出能力が高く、かつ寿命への効果を確保するため酸素量、窒素量、さらにフッ素量、硫黄量、リン量を制御して、微粉化抑制を行い、高容量・長寿命化を図った。
【0023】本発明では酸素及び窒素、さらにフッ素、硫黄、リンのいずれか少なくとも1種以上をアトマイズ法やメカニカルアロイング等の手法を利用して制御しながら合金中に導入することで、放電容量を減少させず高率放電特性の低下を抑え、サイクル性を向上させることが可能となる。単に合金粒子を2相以上の相で構成しただけでは、高率放電特性が悪く、リチウム吸蔵・放出時の膨張応力を緩和する能力に乏しく、あまり長寿命の電池が得られなかった。
【0024】酸素、窒素さらにフッ素、硫黄、リンが前記B相に選択的に導入されることにより、B相の低結晶化あるいは非晶質化の進行に加え、フッ化物、硫化物、リン化物も生成することによって、さらにリチウムイオンが容易に通過でき、高率放電特性の低下を防ぐこともできた。
【0025】
【発明の実施の形態】以下に本発明の実施例を示す。負極合金粒子の製造法としてはガスアトマイズ法、水アトマイズ法やメカニカルアロイング法等の手法が合金粒子中に酸素、窒素さらにはフッ素、硫黄、リンを導入するのに有効であった。個々の製法については各実施例で詳細に述べる。
【0026】電池特性評価は放電容量については電気化学セル、高率放電特性及びサイクル寿命については円筒型電池を組んで行った。
【0027】(電気化学セルの作製法)図1に示す試験セルを作製した。負極合金粒子7.5gと導電剤としての黒鉛粉末2g、結着剤としてのポリエチレン粉末0.5gを混合して合剤とした。この合剤0.1gを直径17.5mmに加圧成型して試験電極1とし、ケース3の中に置いた。次に、微孔性ポリプロピレンセパレータ7を電極上に置いた。
【0028】1モル/lの過塩素酸リチウム(LiClO4)を溶解したエチレンカーボネート(EC)とジメトキシエタン(DME)の体積比で1:1の混合溶液を非水電解質として試験セルに注液した。この上に、内側に直径17.5mmの金属Li4を張り付け、外周部にポリプロピレンガスケット5を付けた封口板6を置いて、封口し試験セルとした。
【0029】この試験セルにおいて、0.5mA/cm2の一定電流で端子電圧が0Vになるまで充電(合金粒子にリチウムイオンが挿入される反応)を行い、次に端子電圧が1.5Vになるまで0.5mA/cm2の電流で放電(合金粒子からリチウムイオンが放出される反応)を行い、放電容量を測った。その際の充電容量と放電容量の比を求めた。この値が低いことは初回充電時に不可逆な反応が多く生じていることを示す。つまり電気化学的に不可逆容量が多いことが示せる。
【0030】(円筒型電池の作製法)正極活物質であるLiMn1.8Co0.2O4は、Li2CO3とMn3O4とCoCO3とを所定のモル比で混合し、900℃で加熱することによって合成した。さらに、これを100メッシュ以下に分級したものを正極活物質とした。
【0031】上記正極活物質100gに対して導電剤として炭素粉末を10g、結着剤としてポリ4フッ化エチレンディスパージョン8gと純水を加え、十分混合しペースト状にし、アルミニウムの芯材に塗布し、乾燥、圧延して正極11を得た。
【0032】負極としては各種方法で作製した合金粒子(活物質)と導電剤としての黒鉛粉末、結着剤としてのスチレンブタジエンゴム(SBR)を重量比で70:20:10の割合で混合し、水を分散溶媒に用いてペ−スト状としたものを銅の芯材に塗布後、140℃で乾燥し、負極12とした。
【0033】円筒型電池の作製手順を以下に図2を用いて説明する。超音波溶接で正極芯材のアルミニウムにアルミニウムからなる正極リード14を取り付けた。同様に負極芯材の銅に、同材質の負極リード15を超音波溶接で接合した。正極と負極間に両極板より幅の広い帯状の多孔性ポリプロピレン製のセパレータ13を配して全体を渦巻状に捲回して構成した。さらに、上記電極体の上下それぞれにポリプロピレン製の絶縁板16、17を配して電槽18に挿入し、電槽18の上部に段部を形成させた後、非水電解液として、1モル/lのLiClO4を溶解したECとDMEの等比体積混合溶液を注入し、封口板19で密閉して電池とした。
【0034】この様にして作製した円筒型電池は試験温度20℃、充電電流0.2C(1Cは1時間率電流)で、電池電圧が4.2Vまで定電流充電を行い、その後4.2Vで定電圧充電(定電流定電圧CCCV充電)を行った。1回目の放電は0.2Cの電流で電池電圧3.0Vまで行い、2回目は同一充電条件で、放電のみ2Cの電流で行った。2回目の2C放電容量を1回目の0.2C放電容量で割り100を掛けた値を高率放電比とした。
【0035】この比が100に近いほど高率放電に優れることになる。3回目以降は1回目と同一条件で充放電を繰り返した。1サイクル目に対する100サイクル目の放電容量比をサイクル維持率とした。当然、この比も100に近いほどサイクル特性が良好なことを示す。
【0036】以下に各種組成、各種合金作製方法及び各種条件で作製した合金を負極活物質とした電池について具体的に実施例を示す。
【0037】
【実施例】以下に本発明をその実施例によりさらに詳しく説明する。なお、本発明はこれらに限定されるものではない。
【0038】(実施例1―6)本実施例に用いた合金粒子は以下の方法で合成した。各種元素を塊状あるいは板状、あるいは粒状のまま任意の比率で混合し、アーク溶解炉で鋳造した。
【0039】得られた鋳造合金を原料としてガスアトマイズ法を用いて球状の合金粒子を得た。このとき、噴射ノズル径は1mmφであり、噴射ガスはAr+O2(1%、3%、5%)あるいはN2+O2(1%、3%、5%)を用いた。ガス噴射圧は100kgf/cm2で行った。この作製したガスアトマイズ合金粒子を45ミクロンメッシュのふるいを通すことで平均粒径28μmの粒子を得た。
【0040】上記粒子に対してX線回折分析及びEPMA分析(電子線マイクロ分析)による面分析を行ったところ、どれも複数の相を有していた。それらの相及び粒子中の酸素量、窒素量を透過型電子顕微鏡(TEM)および電子エネルギー損失分析(EELS)により分析した結果及び電池特性を表1に示す。酸素および窒素量は各粒子の断面の数点をTEMで観測し、EELSにより面分析を行うことで算出した。表1の値は合金相を1とした場合の酸素、窒素の存在比の平均値を記載している。
【0041】TiとSnを化学量論比で仕込み、Ti2Sn合金をAr+1%O2(実施例1)、Ar+3%O2(実施例2)、Ar+5%O2(実施例3)及びN2+1%O2(実施例4)、N2+3%O2(実施例5)、N2+5%O2(実施例6)のガスを用いてガスアトマイズした場合、作製した合金中のA相及びB相中の酸素量および窒素量は実施例1−6で、それぞれ表1に示すような値を示した。いずれにおいてもA相には酸素および窒素がほとんど含まれず、B相の方に多く含まれていることがわかった。これはTiが酸素及び窒素のゲッターとして働いたためと思われる。電池特性も表1に示すが、放電容量は高く、高率放電特性及びサイクル特性にも優れていた。
【0042】
【表1】

【0043】(実施例7―12)合金仕込み組成としてCuZrSi2を化学量論比でアーク溶解炉に投入し、合金を作製した。その後、実施例1−6と同様に各種ガスでガスアトマイズを行い、合金粒子を作製した。合金粒子のA相及びB相の組成分析の結果と電池特性を表2に示す。B相中の酸素及び窒素含有量の総量は0.5重量%以上10重量%で優れた特性を示した。
【0044】これに対して、Arガスのみによるガスアトマイズ法で合成したTiSn合金(比較例1)ではガス中に酸素及び窒素を含んでいないため合金粒子中の酸素量および窒素量がそれぞれ0.11重量%、0.25重量%と低く、サイクル特性が表1に示すように大幅に低下した。
【0045】一方、アーク溶解炉で作製したTiSn合金をAr+8%O2(比較例2)及びN2+8%O2(比較例3)のガスを用いてガスアトマイズした場合、作製した合金中のA相及びB相中の酸素量、窒素量はそれぞれ表1に示すように大幅に増加し、初回放電容量/充電容量比の低下をもたらした。これは、A相中の酸素量および窒素量が増加することで活性相(ここではSn)が酸化、窒化される。リチウムイオンを吸蔵するためにはSnを金属状態まで還元する必要があるため電気化学的には不可逆容量が増加する。
【0046】また、Ar+1%O2及びN2+1%O2のガスを用いてFeSi(それぞれ比較例4、比較例7)、FeSn2(比較例5、比較例8)及びNiAl合金(比較例6、比較例9)をガスアトマイズした場合では、作製した合金粒子中のA相及びB相中の酸素量、窒素量がそれぞれ表1に示すような値となり、いずれの合金粒子においてもB相(リチウム非吸蔵相)にTi、Zrあるいは希土類元素を含んでいないため、合金粒子中の酸素および窒素はA相にも多く含まれ、初回放電容量/充電容量の比が大幅に低下した。
【0047】比較例1のようにArガスのみでガスアトマイズを行ったものではB相中の酸素あるいは窒素量が低く、放電容量は高かったが高率放電特性及びサイクル寿命特性は現行リチウムイオン電池より劣っていた。一方、比較例2及び比較例3のようにガス中の酸素量が8%を越すような場合は、A相中の酸素量も増加し、不可逆容量の増加が顕著となった。
【0048】本発明の合金粒子を負極に用いた電池は、比較例に比べて高容量かつサイクル特性及び高率放電特性において格段に優れていた。
【0049】(実施例13−14)実施例1と同様にNiLaGa及びNiCeIn2となるよう原料を化学量論比で一旦アーク溶解炉を用いて合金を作製した後、水アトマイズ法で合金粒子を作製した。合成雰囲気はN2中である。水アトマイズでは噴出圧800kgf/cm2の水を溶湯にぶつけることで合金は急冷、微粉化される。この合金粒子を45ミクロンメッシュのふるいを通すことで平均粒径20μmの粒子を得た。
【0050】この合金を用いて水アトマイズ合金粒子を上記条件で作製した。これら合金粒子の各種分析(実施例1と同様)結果を表2に示す。EPMA分析の断面での組成分析より水アトマイズ法で合成した粒子では粒子表面に平均膜厚18nm程度の酸化物被膜が生成していることが判明した。本実施例においてもB相にほとんどの酸素と窒素が導入されていることがわかった。水アトマイズ法の場合、水に含まれる溶存酸素と窒素さらには冷却時の衝突で分解される水の影響で合金中に酸素及び窒素が導入される。
【0051】得られた合金粒子を用いて電池を作製し、充放電試験を行った時の電池特性も表2に示す。本発明の活物質を負極に用いた電池は従来例に比べて高容量かつ長寿命で高率放電特性に優れていた。
【0052】
【表2】

【0053】以上のような実施例合金の分析より酸素及び窒素を多く含んだB相は、TEM観察および観測点における電子線回折により低結晶あるいは非晶質の状態であることが判明した。このB相はリチウムを良く透すことができるため、高率放電特性に優れる。また、A相の膨張・収縮の応力の吸収にも適しており、サイクル特性においても優れていた。この際、合金粒子のB相に窒素が入ることで前記応力の緩和効果が酸素のみの場合に比べて向上した。
【0054】表2に各合金粒子を負極活物質とした時の放電容量、高率放電特性及びサイクル特性を示しているが、酸素量及び窒素量が0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%の範囲に置いて、高容量で高率放電特性に優れ、かつ長寿命の電池特性となることがわかった。
【0055】(実施例15−24)本実施例に用いた合金粒子は以下の方法で合成した。ステンレスボール(直径4.8cm)25個を入れたステンレス製ポットミル(容量500ml)中に各種金属あるいは半金属元素および添加元素の粉末(全て粒径45μm以下)を任意の比率で投入した。フッ素の添加についてはLiF(顆粒状)を加え、全混合粉末量は15gとした。仕込み組成はTiPb、ZrSb2、TiCoBi、Ti2Sn、TiSi2である。さらにTiPbには1.0重量%のフッ素(LiF)、ZrSb2には0.5重量%の硫黄、そしてTiCoBiには1.0重量%のリンをそれぞれ添加した。
【0056】前記ポットミルの雰囲気を 1)Ar+O2 (3%)雰囲気 (実施例15−19)
2)N2+O2(3%)雰囲気 (実施例20−24)
3)Ar雰囲気(Ar純度99.999%) (比較例10−14)
4)大気中 (比較例15−19)
の4つの条件とした。各種雰囲気下で封口後、その雰囲気下において60rpm一定回転で10日間ボールミリングを行った。合成操作後、合金粒子の平均粒径はいずれも約0.8μmと非常に微小な合金粒子が得られた。
【0057】上記合金粒子に対してX線回折分析を行ったところ、どの合金粒子もブロードなピーク形状を示す低結晶あるいは非晶質な粒子であることが判明した。また上記粒子に対してX線回折から判明するものに関してはそのピークから相構造を、また非晶質の粒子に対してはTEMを利用して相構造を解析した。その結果、全ての粒子において複数の金属間化合物相からなることが判明した。その分析結果及び電池特性を表3に示す。
【0058】
【表3】

【0059】比較例10−19に比べ、本実施例ではB相に酸素、窒素が多く含まれ、さらに上記添加物のほとんどがB相でのみ検出された。これらの合金粒子は高率放電特性及び寿命特性に優れることがわかった。
【0060】本実施例においては、B相の界面から相内部に向かって10nmまでの部分にで酸素と窒素の70重量%以上が存在していることがわかった。
【0061】比較例の合金を活物質とした場合の組成分析結果及び電池特性も表3に示すが、Arガスのみの雰囲気では寿命特性及び高率放電特性に劣っており、大気中の物ではA相の酸素量、窒素量が多くなりすぎ、不可逆容量の増加をもたらした。
【0062】本発明の合金粒子を負極活物質に用いた電池は比較例に比べて高容量かつサイクル特性に優れ、高率放電特性の点でも酸素及び窒素を含有していない合金に比べて格段に優れていた。
【0063】電池としての放電容量の点からは、リチウムイオンの吸蔵・放出量が大きいことが望まれ、A相にSn、Si、Al、Ga、In、Pb、Sb、Biから選択されるいずれか1種を主成分とするものが有効であった。
【0064】なお本実施例では正極としてLiMn1.8Co0.2O4を用いた場合について説明したが、LiMn2O4、LiCoO2、LiNiO2などの充放電に対して可逆性を有する正極と組み合わせた場合にも同様の効果があることはいうまでもない。
【0065】以上の結果より、酸素量及び窒素量が0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%の範囲において、高容量で高率放電特性に優れ、かつ長寿命の電池特性となることがわかった。
【0066】また、合金粒子中に含有される酸素と窒素は、その全含有量の70重量%以上がB相に含まれていることが望ましい。
【0067】
【発明の効果】以上述べたように高容量、長寿命かつ高率放電特性に優れた合金粒子を負極活物質に用いることで、より高エネルギー密度で樹枝状リチウムによる短絡のない高信頼性の非水電解質二次電池を得ることが可能となる。
【図面の簡単な説明】
【図1】本発明の負極材料の電極特性を評価するための試験セルの断面概略図
【図2】本発明の負極材料の電池特性を評価するための円筒型電池の断面概略図
【符号の説明】
1 試験電極
2 集電体
3 ケース
4 金属リチウム
5 ガスケット
6 封口板
7 セパレータ
11 正極
12 本発明負極
13 セパレータ
14 正極リード板
15 負極リード板
16 上部絶縁板
17 下部絶縁板
18 電槽
19 封口板
【特許請求の範囲】
【請求項1】 充放電によってリチウムイオンの吸蔵・放出が可能な正極、負極およびリチウム塩を含む非水電解質からなる非水電解質二次電池において、前記負極活物質が少なくとも2種以上の金属元素あるいは/及び半金属元素及び酸素と窒素で構成される合金粒子であることを特徴とする非水電解質二次電池。
【請求項2】 充放電によってリチウムイオンの吸蔵・放出が可能な正極、負極およびリチウム塩を含む非水電解質からなり、負極活物質が少なくとも2種以上の金属元素あるいは半金属元素からなる合金粒子であって、その合金粒子は、電気化学的にリチウムイオンの吸蔵・放出が可能なA相とリチウムイオンの透過性を有するB相の少なくとも2相が存在し、さらに前記B相の方がA相より多くの酸素および窒素を含有していることを特徴とする非水電解質二次電池。
【請求項3】 請求項2記載のA相は少なくともSn、Si、Al、Ga、In、Pb、Sb、Biから選択されるいずれか1種以上を成分として有し、B相がTi、Zrあるいは希土類元素から選択される1種以上を有していることを特徴とする非水電解質二次電池。
【請求項4】 請求項2記載のB相がA相を取り囲むように存在していることを特徴とする非水電解質二次電池。
【請求項5】 請求項2記載のB相中に含有する酸素と窒素の含有量が合金粒子全体での酸素と窒素の全含有量に対して70重量%以上存在することを特徴とする非水電解質二次電池。
【請求項6】 請求項1記載の合金中の酸素と窒素の含有率が各々0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%であることを特徴とする非水電解質二次電池。
【請求項7】 請求項3記載のTi、Zrあるいは希土類元素の含有量が5重量%以上70重量%以下であることを特徴とする非水電解質二次電池。
【請求項8】 請求項1記載の合金粒子中に酸素及び窒素以外にフッ素、硫黄、リンから選択される少なくとも1種以上を含有し、酸素と窒素及びフッ素、硫黄、リンの含有率が0.5重量%以上10重量%以下であることを特徴とする非水電解質二次電池。
【請求項9】 請求項2記載の合金粒子中に酸素及び窒素以外にフッ素、硫黄、リンから選択される少なくとも1種以上を含有し、酸素と窒素及びフッ素、硫黄、リンの含有率が0.5重量%以上10重量%以下であることを特徴とする非水電解質二次電池。
【請求項10】 請求項9記載の合金粒子中の酸素と窒素及びフッ素、硫黄、リンの含有量の70重量%以上がB相に存在することを特徴とする非水電解質二次電池。
【請求項1】 充放電によってリチウムイオンの吸蔵・放出が可能な正極、負極およびリチウム塩を含む非水電解質からなる非水電解質二次電池において、前記負極活物質が少なくとも2種以上の金属元素あるいは/及び半金属元素及び酸素と窒素で構成される合金粒子であることを特徴とする非水電解質二次電池。
【請求項2】 充放電によってリチウムイオンの吸蔵・放出が可能な正極、負極およびリチウム塩を含む非水電解質からなり、負極活物質が少なくとも2種以上の金属元素あるいは半金属元素からなる合金粒子であって、その合金粒子は、電気化学的にリチウムイオンの吸蔵・放出が可能なA相とリチウムイオンの透過性を有するB相の少なくとも2相が存在し、さらに前記B相の方がA相より多くの酸素および窒素を含有していることを特徴とする非水電解質二次電池。
【請求項3】 請求項2記載のA相は少なくともSn、Si、Al、Ga、In、Pb、Sb、Biから選択されるいずれか1種以上を成分として有し、B相がTi、Zrあるいは希土類元素から選択される1種以上を有していることを特徴とする非水電解質二次電池。
【請求項4】 請求項2記載のB相がA相を取り囲むように存在していることを特徴とする非水電解質二次電池。
【請求項5】 請求項2記載のB相中に含有する酸素と窒素の含有量が合金粒子全体での酸素と窒素の全含有量に対して70重量%以上存在することを特徴とする非水電解質二次電池。
【請求項6】 請求項1記載の合金中の酸素と窒素の含有率が各々0<酸素<10重量%、0<窒素<10重量%、0.5重量%≦酸素+窒素≦10重量%であることを特徴とする非水電解質二次電池。
【請求項7】 請求項3記載のTi、Zrあるいは希土類元素の含有量が5重量%以上70重量%以下であることを特徴とする非水電解質二次電池。
【請求項8】 請求項1記載の合金粒子中に酸素及び窒素以外にフッ素、硫黄、リンから選択される少なくとも1種以上を含有し、酸素と窒素及びフッ素、硫黄、リンの含有率が0.5重量%以上10重量%以下であることを特徴とする非水電解質二次電池。
【請求項9】 請求項2記載の合金粒子中に酸素及び窒素以外にフッ素、硫黄、リンから選択される少なくとも1種以上を含有し、酸素と窒素及びフッ素、硫黄、リンの含有率が0.5重量%以上10重量%以下であることを特徴とする非水電解質二次電池。
【請求項10】 請求項9記載の合金粒子中の酸素と窒素及びフッ素、硫黄、リンの含有量の70重量%以上がB相に存在することを特徴とする非水電解質二次電池。
【図1】


【図2】




【図2】


【公開番号】特開2002−42805(P2002−42805A)
【公開日】平成14年2月8日(2002.2.8)
【国際特許分類】
【出願番号】特願2000−218528(P2000−218528)
【出願日】平成12年7月19日(2000.7.19)
【出願人】(000005821)松下電器産業株式会社 (73,050)
【Fターム(参考)】
【公開日】平成14年2月8日(2002.2.8)
【国際特許分類】
【出願日】平成12年7月19日(2000.7.19)
【出願人】(000005821)松下電器産業株式会社 (73,050)
【Fターム(参考)】
[ Back to top ]

