非水電解質二次電池
【課題】エネルギー密度が高く、かつ充放電サイクル特性に優れた非水電解質二次電池を提供する。
【解決手段】非水電解質二次電池は、正極活物質を含む正極と、負極と、非水電解質とを備える非水電解質二次電池であって、上記正極活物質が、Lix1Nay1CoαMnβOγ(0.66<x1<1.1、0<y1≦0.02、0.75≦α<1、0<β≦0.25、1.9≦γ≦2.1)で表されるリチウム含有酸化物であることを特徴としている。
【解決手段】非水電解質二次電池は、正極活物質を含む正極と、負極と、非水電解質とを備える非水電解質二次電池であって、上記正極活物質が、Lix1Nay1CoαMnβOγ(0.66<x1<1.1、0<y1≦0.02、0.75≦α<1、0<β≦0.25、1.9≦γ≦2.1)で表されるリチウム含有酸化物であることを特徴としている。
【発明の詳細な説明】
【技術分野】
【0001】
本願発明は、非水電解質二次電池に関するものである。
【背景技術】
【0002】
近年、非水電解質二次電池の一種であるリチウムイオン二次電池が様々な携帯機器の電源等として使用されているが、携帯機器の多機能化による消費電力の増加に伴って、さらに高いエネルギー密度のリチウムイオン二次電池が要望されている。
【0003】
そこで、次世代の高容量正極活物質のひとつとして、ナトリウム含有酸化物をイオン交換して作製されるリチウム含有酸化物が研究されている。
【0004】
現在実用化されている正極活物質のLiCoO2が空間群R−3mのO3構造で規定されるのに対し、イオン交換することによって作製されたLiCoO2はO2構造で規定され、属する代表的な空間群としてはP63mcがある。O3構造とは、リチウムが酸素八面体の中心に存在し、かつ酸素と遷移金属酸化物MO6との重なり方が単位格子あたり3種類存在する構造である。一方、O2構造とはリチウムが酸素八面体の中心に存在しているのは同じであるが、酸素と遷移金属酸化物MO6との重なり方が単位格子あたり2種類存在する構造である。
【0005】
O3構造のLiCoO2は、4.6V(vs. Li/Li+)まで充電すると、LiCoO2中のリチウムが約50%引き抜かれ、結晶構造が崩れてリチウムの挿入・脱離の可逆性が低下する。一方、O2構造のLiCoO2は、LiCoO2中のリチウムが約80%引き抜かれても充放電が可能であり(非特許文献1参照)、次世代の高容量正極活物質の有力な候補の一つである。
【0006】
しかしながら、O2構造のLiCoO2は作製することが困難である。O2構造のLiCoO2はP2構造のNa0.7CoO2を作製し、ナトリウムをリチウムでイオン交換することによって得られるが、イオン交換する際の温度が150℃を超えるとO3構造のLiCoO2になり、温度が低すぎるとイオン交換前の原料が残る。
【0007】
さらに、O2構造のLiCoO2やO3構造のLiCoO2は、充電終止電位を4.6V(vs. Li/Li+)以上とした充放電サイクル特性に問題があった。この原因としては、リチウムが結晶中から脱離する過程で不可逆な結晶構造の変化が起こり、初期の構造を維持することができなくなるためと考えられる。
【0008】
特許文献1では出発原料として利用するナトリウム酸化物にリチウムを添加することが提案されている。ここでは、主構造以外にLi2MnO3の補構造が正極活物質に含まれることにより高容量化することが示されている。すなわち主構造と補構造の相互作用が正極活物質の容量密度増加に貢献していると考えられる。
【0009】
しかしながら、この正極活物質では、2.0−5.0V(vs. Li/Li+)の範囲では平均放電電位が3.6V程度と高くなく、次世代高容量正極材料としては課題があった。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Solid State Ionics 144 (2001) 263
【特許文献】
【0011】
【特許文献1】特開2009−32681
【発明の概要】
【発明が解決しようとする課題】
【0012】
本願発明の目的は、エネルギー密度が高く、かつ充放電サイクル特性に優れた非水電解質二次電池を提供することにある。
【課題を解決するための手段】
【0013】
本願発明の非水電解質二次電池は、正極活物質を含む正極と、負極と、非水電解質とを備える非水電解質二次電池であって、上記正極活物質が、Lix1Nay1CoαMnβOγ(0.66<x1<1.1、0<y1≦0.02、0.75≦α<1、0<β≦0.25、1.9≦γ≦2.1)で表されるリチウム含有酸化物であることを特徴としている。
【0014】
上記リチウム含有酸化物はO2構造の酸化物を含んでいる。空間群C2/m又はC2/mに属する酸化物を含んでいてもよい。また、Li2MnO3やO3構造のLiCoO2が20%未満含まれていてもよい。
【0015】
上記リチウム含有酸化物は、ナトリウム、ナトリウムのモル量を超えないリチウム、コバルト、及びマンガンを含むナトリウム含有酸化物のナトリウムをリチウムにイオン交換することによって作製することができるが、Lix2Nay2CoαMnβOγ(0<x2≦0.1、0.66<y2<0.75、0.75≦α<1、0<β≦0.25、1.9≦γ≦2.1)で表されるナトリウム含有酸化物に含まれるナトリウムの一部をリチウムでイオン交換することによって作製することがより好ましい。
【0016】
上記正極活物質は、コバルト及びマンガンを含み、かつコバルト含有量が高いO2構造を多く含むため、平均放電電位が高く、かつ高電位でも結晶構造が安定している。そのため、上記正極活物質を含む正極と、負極と、非水電解質とを備える非水電解質二次電池は、エネルギー密度が高く、かつ充放電サイクル特性に優れる。
【0017】
特に、放電終止電位2.0V(vs. Li/Li+)以上充電終止電位5.0V(vs. Li/Li+)以下の電位範囲において優れた充放電サイクル特性を示す。放電終止電位3.2V(vs. Li/Li+)以上充電終止電位5.0V(vs. Li/Li+)以下の電位範囲、さらに放電終止電位3.2V(vs. Li/Li+)以上充電終止電位4.8V(vs. Li/Li+)以下の電位範囲であれば、より優れた充放電サイクル特性を示す。尚、放電終止電位を高くすると充放電サイクル特性が良くなるのは、結晶構造が安定化するからである。また、充電終止電位を低くするほど充放電サイクル特性が良くなるのは、電解質の分解が抑えられるからである。
【0018】
上記正極活物質のリチウム含有量x1が上記範囲より少ないと充放電に関与できるリチウムが少なくなるため、理論容量が減少する。また、リチウム含有量x1が上記範囲より多いと遷移金属サイトにリチウムが入り、容量密度が減少する。
【0019】
ここで、上記正極活物質のコバルト量が増加するにつれて、イオン交換後のリチウム量が増加する。これは、コバルトはイオン交換前のナトリウム酸化物中では3価以上の状態でも安定であるのに対し、イオン交換後のリチウム含有酸化物中では3価が安定な状態となり、イオン交換時にコバルトが還元され、リチウムイオンが構造中に吸蔵されるためと推測される。
【0020】
上記正極活物質のナトリウム含有量y1が上記範囲より多いと、ナトリウムが挿入・脱離するときに結晶構造の破壊が起こりやすくなる。一方でy1≦0.02の範囲では、構造が安定化すると考えられる。尚、y1≦0.02の場合、XRD測定では、ナトリウムを検出できない場合がある。
【0021】
上記正極活物質のコバルト含有量αが上記範囲より少ないと放電電位が低くなる。また、コバルト含有量αが上記範囲より多いと4.6V(vs. Li/Li+)以上の充電過程で安定な結晶構造が得られない。尚、コバルト含有量αは0.80〜0.95の範囲であると、エネルギー密度がさらに高くなるためより好ましい。
【0022】
上記正極活物質のマンガン含有量βが上記範囲より多くなると、3.2V以下の放電容量密度が増し、結果的に平均放電電位の低下を招く。
【0023】
尚、上記正極活物質に、マグネシウム、ニッケル、ジルコニウム、モリブデン、タングステン、アルミニウム、クロム、バナジウム、セリウム、チタン、鉄、カリウム、ガリウム、インジウムから選ばれる元素のうち少なくとも一つの元素を添加してもよい。添加量がコバルトとマンガンの総mol量に対して10mol%以下である場合、充電時の熱安定性が改善されることが予想される。
【0024】
本願発明で用いられる負極の例としては、リチウム、珪素、炭素、錫、ゲルマニウム、アルミニウム、鉛、インジウム、ガリウム、リチウム合金、予めリチウムを吸蔵させた炭素並びに珪素、及びこれらの合金並びに混合物が挙げられる。
【0025】
電極の導電性が優れている場合は、導電剤を添加しなくても電極として機能するが、電極の導電性が低い場合は、導電剤を電極に添加することが望ましい。導電剤としては、導電性を有する材料であればよく、特に導電性が優れている酸化物、炭化物、窒化物、炭素材料の少なくとも一種を用いることができる。酸化物としては、酸化スズ、酸化インジウム等が挙げられる。炭化物としては、炭化タングステン、炭化ジルコニウムが挙げられる。窒化物としては、窒化チタン、窒化タンタル等が挙げられる。
【0026】
尚、導電剤を添加させる場合、その添加量が少ないと、正極における導電性を充分に向上させることができない。一方、その添加量が多くなり過ぎると、正極における活物質の割合が少なくなって高いエネルギー密度が得られなくなる。このため、導電剤の量が活物質の総量に対し0質量%より多く30質量%以下であることが好ましく、さらに1質量%以上20質量%以下、さらに2質量%以上10質量%以下の範囲がより好ましい。
【0027】
電極に添加するバインダーは、ポリテトラフルオロエチレン、ポリフッ化ビニリデン、ポリエチレンオキサイド、ポリビニルアセテート、ポリメタクリレート、ポリアクリレート、ポリアクリロニトリル、ポリビニルアルコール、スチレン−ブタジエンラバー、カルボキシメチルセルロースから選択される少なくとも一種を用いることができる。
【0028】
本願発明で用いられるバインダーの量が多いと、正極に含まれる活物質の割合が小さくなるため、高いエネルギー密度が得られなくなる。そのため、バインダーの量は活物質の総量に対し0質量%以上30質量%以下であることが好ましく、さらに1質量%以上20質量%以下、さらに2質量%以上10質量%以下の範囲がより好ましい。
【0029】
本願発明で用いる非水溶媒の例としては、環状炭酸エステル、鎖状炭酸エステル、エステル類、環状エーテル類、鎖状エーテル類、二トリル類、アミド類、及びこれらの混合溶媒等が挙げられる。
【0030】
環状炭酸エステルの例としては、エチレンカーボネート、プロピレンカーボネート、ブチレンカーボネート、又はこれらの水素基の一部若しくは全部がフッ素化されたものを用いることができる。環状炭酸エステルの例としては、トリフルオロプロピレンカーボネートやフルオロエチレンカーボネートなどが挙げられる。
【0031】
鎖状炭酸エステルの例としては、ジメチルカーボネート、エチルメチルカーボネート、ジエチルカーボネート、メチルプロピルカーボネート、エチルプロピルカーボネート、メチルイソプロピルカーボネート、又はこれらの水素の一部若しくは全部がフッ素化されたものを用いることができる。
【0032】
エステル類の例としては、酢酸メチル、酢酸エチル、酢酸プロピル、プロピオン酸メチル、プロピオン酸エチル、γ−ブチロラクトンなどが挙げられる。
【0033】
環状エーテル類の例としては、1,3−ジオキソラン、4−メチル−1、3−ジオキソラン、テトラヒドロフラン、2−メチルテトラヒドロフラン、プロピレンオキシド、1,2−ブチレンオキシド、1,4−ジオキサン、1,3,5−トリオキサン、フラン、2−メチルフラン、1,8−シネオール、クラウンエーテルなどが挙げられる。
【0034】
鎖状エーテル類の例としては、1,2−ジメトキシエタン、ジエチルエーテル、ジプロピルエーテル、ジイソプロピルエーテル、ジブチルエーテル、ジヘキシルエーテル、エチルビニルエーテル、ブチルビニルエーテル、メチルフェニルエーテル、エチルフェニルエーテル、ブチルフェニルエーテル、ペンチルフェニルエーテル、メトキシトルエン、ベンジルエチルエーテル、ジフェニルエーテル、ジベンジルエーテル、o-ジメトキシベンゼン、1,2−ジエトキシエタン、1,2−ジブトキシエタン、ジエチレングリコールジメチルエーテル、ジエチレングリコールジエチルエーテル、ジエチレングリコールジブチルエーテル、1,1−ジメトキシメタン、1,1−ジエトキシエタン、トリエチレングリコールジメチルエーテル、テトラエチレングリコールジメチルなどが挙げられる。
【0035】
二トリル類の例としては、アセトニトリル等が、アミド類の例としては、ジメチルホルムアミド等が挙げられる。
【0036】
本願発明で用いるリチウム塩の例としては、従来のリチウムイオン二次電池において電解質として一般に使用されているものを用いることができ、例えば、LiBF4、LiPF6、LiCF3SO3、LiC4F9SO3、LiN(CF3SO2)2、LiN(C2F5SO2)2、LiAsF6、ジフルオロ(オキサラト)ホウ酸リチウム、から選択される少なくとも1種を用いることができる。
【発明の効果】
【0037】
本願発明によれば、エネルギー密度が高く、かつ充放電サイクル特性に優れた非水電解質二次電池を提供することができる。
【図面の簡単な説明】
【0038】
【図1】本願発明で使用した試験セルの模式図
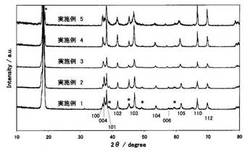
【図2】実施例1〜5で作製した正極活物質のXRDパターン
【図3】比較例1〜3で作製した正極活物質のXRDパターン
【図4】比較例4〜5で作製した正極活物質のXRDパターン
【発明を実施するための形態】
【0039】
以下、本願発明の実施の形態について図面を参照しつつ詳細に説明するが、本願発明はこれらの実施例により限定されるものではない。
【0040】
(実施例1)
Na0.7Co11/12Mn1/12O2(仕込み組成)が得られるように原料として、硝酸ナトリウム(NaNO3)、酸化コバルト(II III)(Co3O4)、及び酸化マンガン(III)(Mn2O3)を混合し、900℃で10時間保持することによって、ナトリウム含有酸化物を得た。尚、他の実施例及び比較例において、仕込み組成にリチウムが含まれる場合は、炭酸リチウム(Li2CO3)を上記原料に加えて混合した。
【0041】
硝酸リチウム(LiNO3)と水酸化リチウム(LiOH)をmol%で61:39の割合になるように混合した溶融塩床を、得られたナトリウム含有酸化物5gに対し5倍当量加え、200℃で10時間保持させることによって、ナトリウム含有酸化物のナトリウムの一部をリチウムにイオン交換した。イオン交換後の物質を水洗して得られたリチウム含有酸化物を正極活物質として利用した。
【0042】
得られた正極活物質を80質量%、導電剤としてのアセチレンブラックを10質量%、結着剤としてのポリフッ化ビニリデンが10質量%となるように混合し、N−メチル−2−ピロリドンを用いてスラリー化した後、アルミ箔集電体上に塗布した。その後、110℃で真空乾燥し作用極1を用意した。
【0043】
不活性雰囲気下で、作用極1、対極2、セパレータ3、参照極4を用いて図1に示すような試験セル5を作製した。尚、対極2及び参照極4にはリチウム金属を用いた。また、エチレンカーボネートとジエチルカーボネートを体積%で30:70の割合になるように混合した非水溶媒に、六フッ化リン酸リチウム(LiPF6)を1.0 mol/lの濃度になるように添加したものを電解液として用いた。
【0044】
得られた試験セルを用いて2.0−5.0V(vs. Li/Li+)の範囲で10回充放電を繰り返した。尚、このときの電流密度は0.1mA/cm2とした。
【0045】
(実施例2)
Li0.1Na0.7Co11/12Mn1/12O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0046】
(実施例3)
Na0.7Co10/12Mn2/12O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0047】
(実施例4)
Li0.1Na0.7Co10/12Mn2/12O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0048】
(実施例5)
Li0.1Na0.7Co9/12Mn3/12O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0049】
(比較例1)
Na0.7CoO2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0050】
(比較例2)
Na0.7Co17/24Mn7/24O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0051】
(比較例3)
Li0.1Na0.7Co17/24Mn7/24O2(仕込み組成)で表されるナトリウ
ム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0052】
表1に、実施例1〜5及び比較例1〜3のナトリウム含有酸化物の仕込み組成及び、リチウム含有酸化物の組成分析の結果を示す。リチウム含有酸化物の組成比は、リチウム及びナトリウムを原子発光分析で、コバルト及びマンガンをICP発光分析で求めた。尚、組成比はコバルトとマンガンの和を1、酸素を2として示されている。
【0053】
【表1】

【0054】
実施例1〜5のリチウム含有酸化物のXRD測定結果を図2に示す。尚、XRD測定には線源としてCuKαを用いた。図中下方に示した3桁の数字は、O2構造に帰属されるピークの指数である。また、*は不純物相のピークを示す。
【0055】
図2より実施例1〜5の主構造は空間群P63mcのO2構造であることが分かる。不純物相はO3構造のLiCoO2などが考えられる。コバルト組成比の高い試料ではLi2MnO3に対応するピークは観察されず、O3構造のLiCoO2に対応するピークプロファイルが観察された。この結果から、ナトリウム酸化物に添加されたリチウムは主にO3−LiCoO2の生成に利用され、Li2MnO3の生成量は多くとも5%程度の極微量である。
【0056】
比較例1〜3のリチウム含有酸化物のXRD回折測定結果及び、Powder Diffraction Fileより、LiCoO2(PDF#75−0532)、Li0.62CoO2(PDF#77−1868)、Na0.74CoO2(PDF#87−0274)のパターンを図3に示す。
【0057】
比較例1〜3に含まれるO3構造のLiCoO2や、比較例1で観察されたイオン交換されていないナトリウム含有酸化物を不純物相とし、不純物相に帰属するピークには*を付した。
【0058】
図3に示した3桁の数字はO2構造に帰属されるピークの指数である。また、▽はO6構造(空間群R−3m)に帰属できるピークである。O6構造とはリチウムが酸素八面体の中心に存在し、かつ酸素と遷移金属酸化物MO6との重なり方が単位格子あたり6種類存在する構造である。
【0059】
図3より、比較例1の主構造はO3構造、比較例2の主構造はO6構造であることが分かる。比較例3では、ピーク強度は小さいが、O2構造に対応するピークが見られる。表2に、実施例1〜5及び比較例1〜3について上記充放電を繰り返した際の1サイクル目の放電容量密度、平均放電電位、及びエネルギー密度を示す。
【0060】
【表2】

【0061】
表2より、実施例1〜5の放電容量密度が比較例1〜2と比較して向上していることが分かる。これは、実施例1〜5の正極活物質がコバルト及びマンガンを含みかつコバルト含有量が多く含まれるO2構造の結晶構造を持つため、高電位において結晶構造が安定であるためと考えられる。尚、3.2−4.8V(vs. Li/Li+)の範囲の実施例1〜4の放電容量密度と平均放電電位は、実施例1で222mAh/g、4.09V、実施例2で228mAh/g、4.10V、実施例3で224mAh/g、4.14V、実施例4で217mAh/g、4.16Vとなり、平均放電電位が高くなるので、上記電位範囲で充放電することがより好ましい。
【0062】
実施例1〜5の平均放電電位は比較例3と比較して高くなっている。これは、実施例1〜5の正極活物質では、コバルト及びマンガンを含むO2構造中にコバルトが比較例3より多く含まれているためと考えられる。ここで、O2構造の材料にLi2MnO3が含まれることで放電容量密度が増加することは特許文献1で開示されている。しかしながら、コバルト及びマンガンを含むO2構造中のコバルト量を多くすることによって、平均放電電位が高くなることについては、特許文献1から予測できない。また、コバルト及びマンガンを含むO2構造中のコバルト量を多くすることは、相対的にLi2MnO3量を減らすことになり、特許文献1の発明思想と逆行するものである。
実施例1〜5のエネルギー密度は比較例1〜3と比較して大きくなっている。エネルギー密度は初期放電容量密度と平均放電電位を乗じた値として簡易的に見積もった。高エネルギー密度化を目的とした電池では、放電容量密度や平均放電電位の単独の値より、エネルギー密度の値が重要である。
【0063】
実施例2、4及び5の中では、実施例2及び4がより高いエネルギー密度を有している。これは、実施例2及び4の正極活物質が実施例5の正極活物質と比較してコバルト含有量が多く、平均放電電位が高くなっているためである。
【0064】
実施例2が実施例1よりも、又は実施例4が実施例3よりも放電容量密度が高くなっているのは、イオン交換前の物質であるナトリウム含有酸化物にリチウムが添加されることにより、主構造以外に微量のLi2MnO3等が補構造としてイオン交換後の正極活物質に含まれることが要因であると考えられる。このLi2MnO3の補構造は、O2構造の主構造と相互作用することにより、放電容量密度の増加に貢献していると考えられる。
【0065】
比較例2及び3の組成は類似しているが、図3より微細構造が異なることが分かる。この差異が表2で示す放電容量の違いに現れており、組成比が類似していても電池特性が異なり得ることが分かる。尚、微細構造の違いは、ナトリウム含有酸化物に含まれるリチウム量に起因すると考えられる。
【0066】
(比較例4)
炭酸リチウム(Li2CO3)及び酸化コバルト(II III)(Co3O4)を混合し、900℃で10時間保持することによって、リチウム含有酸化物を得た。これを正極活物質として上記と同様に試験セルを作製した。得られた試験セルを用いて2.0−4.6V(vs. Li/Li+)の範囲で10回充放電を繰り返した。尚、このときの電流密度は2mA/cm2とした。
【0067】
ここで、電流密度を2mA/cm2として充放電を繰り返したが、電流密度を0.1mA/cm2として充放電を繰り返した後の容量維持率と同様の結果が得られると予想される。また、充電終止電位を5.0Vとしなかった理由は、高い電位でO3構造のLiCoO2の結晶構造が不安定であることが知られているからである。尚、充電終止電位が低い場合、充電終止電位が高い場合と比較して、充放電を繰り返した後の容量維持率は一般的に高くなる。
【0068】
(比較例5)
硝酸ナトリウム(NaNO3)、炭酸リチウム(Li2CO3)及び酸化コバルト(II III)(Co3O4)を混合し、900℃で10時間保持することによって、ナトリウム含有酸化物を得た。得られたナトリウム含有酸化物5gを、臭化リチウム(LiBr)濃度5mol/lのヘキサノール溶液150mlに浸漬させ、120℃で16時間還流することによってイオン交換を行い、リチウム含有酸化物を得た。得られたリチウム含有酸化物を正極活物質として、上記と同様に試験セルを作製した。得られた試験セルを用いて2.0−4.6V(vs. Li/Li+)の範囲で10回充放電を繰り返した。尚、このときの電流密度は2mA/cm2とした。
【0069】
表3に、比較例4及び5のリチウム含有酸化物の組成分析の結果を示す。リチウム含有酸化物の組成比は、リチウム及びナトリウムを原子発光分析で、コバルト及びマンガンをICP発光分析で求めた。尚、組成比はコバルトとマンガンの和を1、酸素を2として示されている。
【0070】
【表3】

【0071】
比較例4及び比較例5のリチウム含有酸化物のXRD測定結果を図4に示す。各ピークには対応する面指数を示した。図4より、比較例4はO3構造のLiCoO2の単相に帰属されることが分かる。また、比較例5の主構造はO2構造に帰属され、前駆体のP2構造のナトリウム含有酸化物がイオン交換されずに残っていることが分かる。空間群P63/mmcのP2構造のナトリウム含有酸化物に対応するピークに*を付した。
【0072】
実施例1〜5、比較例4及び比較例5の初期容量密度及び10サイクル後の容量維持率を表4に示す。
【0073】
【表4】

【0074】
比較例5の10サイクル後の容量維持率は、実施例1〜5と比較して低くなっている。これは、比較例5の正極活物質に含まれるO2構造にマンガンが含まれていないため、4.6V(vs. Li/Li+)付近でのリチウムが結晶中から脱離する過程で、不可逆な結晶構造の変化が起こり、初期の結晶構造を維持することができなくなったためと考えられる。
【0075】
尚、実施例1〜5には不純物としてO3構造のLiCoO2が含まれていることから、これらを除去すると更にサイクルに伴う劣化が抑制されると期待される。
【符号の説明】
【0076】
1・・・作用極
2・・・対極
3・・・セパレータ
4・・・参照極
5・・・試験セル
【技術分野】
【0001】
本願発明は、非水電解質二次電池に関するものである。
【背景技術】
【0002】
近年、非水電解質二次電池の一種であるリチウムイオン二次電池が様々な携帯機器の電源等として使用されているが、携帯機器の多機能化による消費電力の増加に伴って、さらに高いエネルギー密度のリチウムイオン二次電池が要望されている。
【0003】
そこで、次世代の高容量正極活物質のひとつとして、ナトリウム含有酸化物をイオン交換して作製されるリチウム含有酸化物が研究されている。
【0004】
現在実用化されている正極活物質のLiCoO2が空間群R−3mのO3構造で規定されるのに対し、イオン交換することによって作製されたLiCoO2はO2構造で規定され、属する代表的な空間群としてはP63mcがある。O3構造とは、リチウムが酸素八面体の中心に存在し、かつ酸素と遷移金属酸化物MO6との重なり方が単位格子あたり3種類存在する構造である。一方、O2構造とはリチウムが酸素八面体の中心に存在しているのは同じであるが、酸素と遷移金属酸化物MO6との重なり方が単位格子あたり2種類存在する構造である。
【0005】
O3構造のLiCoO2は、4.6V(vs. Li/Li+)まで充電すると、LiCoO2中のリチウムが約50%引き抜かれ、結晶構造が崩れてリチウムの挿入・脱離の可逆性が低下する。一方、O2構造のLiCoO2は、LiCoO2中のリチウムが約80%引き抜かれても充放電が可能であり(非特許文献1参照)、次世代の高容量正極活物質の有力な候補の一つである。
【0006】
しかしながら、O2構造のLiCoO2は作製することが困難である。O2構造のLiCoO2はP2構造のNa0.7CoO2を作製し、ナトリウムをリチウムでイオン交換することによって得られるが、イオン交換する際の温度が150℃を超えるとO3構造のLiCoO2になり、温度が低すぎるとイオン交換前の原料が残る。
【0007】
さらに、O2構造のLiCoO2やO3構造のLiCoO2は、充電終止電位を4.6V(vs. Li/Li+)以上とした充放電サイクル特性に問題があった。この原因としては、リチウムが結晶中から脱離する過程で不可逆な結晶構造の変化が起こり、初期の構造を維持することができなくなるためと考えられる。
【0008】
特許文献1では出発原料として利用するナトリウム酸化物にリチウムを添加することが提案されている。ここでは、主構造以外にLi2MnO3の補構造が正極活物質に含まれることにより高容量化することが示されている。すなわち主構造と補構造の相互作用が正極活物質の容量密度増加に貢献していると考えられる。
【0009】
しかしながら、この正極活物質では、2.0−5.0V(vs. Li/Li+)の範囲では平均放電電位が3.6V程度と高くなく、次世代高容量正極材料としては課題があった。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Solid State Ionics 144 (2001) 263
【特許文献】
【0011】
【特許文献1】特開2009−32681
【発明の概要】
【発明が解決しようとする課題】
【0012】
本願発明の目的は、エネルギー密度が高く、かつ充放電サイクル特性に優れた非水電解質二次電池を提供することにある。
【課題を解決するための手段】
【0013】
本願発明の非水電解質二次電池は、正極活物質を含む正極と、負極と、非水電解質とを備える非水電解質二次電池であって、上記正極活物質が、Lix1Nay1CoαMnβOγ(0.66<x1<1.1、0<y1≦0.02、0.75≦α<1、0<β≦0.25、1.9≦γ≦2.1)で表されるリチウム含有酸化物であることを特徴としている。
【0014】
上記リチウム含有酸化物はO2構造の酸化物を含んでいる。空間群C2/m又はC2/mに属する酸化物を含んでいてもよい。また、Li2MnO3やO3構造のLiCoO2が20%未満含まれていてもよい。
【0015】
上記リチウム含有酸化物は、ナトリウム、ナトリウムのモル量を超えないリチウム、コバルト、及びマンガンを含むナトリウム含有酸化物のナトリウムをリチウムにイオン交換することによって作製することができるが、Lix2Nay2CoαMnβOγ(0<x2≦0.1、0.66<y2<0.75、0.75≦α<1、0<β≦0.25、1.9≦γ≦2.1)で表されるナトリウム含有酸化物に含まれるナトリウムの一部をリチウムでイオン交換することによって作製することがより好ましい。
【0016】
上記正極活物質は、コバルト及びマンガンを含み、かつコバルト含有量が高いO2構造を多く含むため、平均放電電位が高く、かつ高電位でも結晶構造が安定している。そのため、上記正極活物質を含む正極と、負極と、非水電解質とを備える非水電解質二次電池は、エネルギー密度が高く、かつ充放電サイクル特性に優れる。
【0017】
特に、放電終止電位2.0V(vs. Li/Li+)以上充電終止電位5.0V(vs. Li/Li+)以下の電位範囲において優れた充放電サイクル特性を示す。放電終止電位3.2V(vs. Li/Li+)以上充電終止電位5.0V(vs. Li/Li+)以下の電位範囲、さらに放電終止電位3.2V(vs. Li/Li+)以上充電終止電位4.8V(vs. Li/Li+)以下の電位範囲であれば、より優れた充放電サイクル特性を示す。尚、放電終止電位を高くすると充放電サイクル特性が良くなるのは、結晶構造が安定化するからである。また、充電終止電位を低くするほど充放電サイクル特性が良くなるのは、電解質の分解が抑えられるからである。
【0018】
上記正極活物質のリチウム含有量x1が上記範囲より少ないと充放電に関与できるリチウムが少なくなるため、理論容量が減少する。また、リチウム含有量x1が上記範囲より多いと遷移金属サイトにリチウムが入り、容量密度が減少する。
【0019】
ここで、上記正極活物質のコバルト量が増加するにつれて、イオン交換後のリチウム量が増加する。これは、コバルトはイオン交換前のナトリウム酸化物中では3価以上の状態でも安定であるのに対し、イオン交換後のリチウム含有酸化物中では3価が安定な状態となり、イオン交換時にコバルトが還元され、リチウムイオンが構造中に吸蔵されるためと推測される。
【0020】
上記正極活物質のナトリウム含有量y1が上記範囲より多いと、ナトリウムが挿入・脱離するときに結晶構造の破壊が起こりやすくなる。一方でy1≦0.02の範囲では、構造が安定化すると考えられる。尚、y1≦0.02の場合、XRD測定では、ナトリウムを検出できない場合がある。
【0021】
上記正極活物質のコバルト含有量αが上記範囲より少ないと放電電位が低くなる。また、コバルト含有量αが上記範囲より多いと4.6V(vs. Li/Li+)以上の充電過程で安定な結晶構造が得られない。尚、コバルト含有量αは0.80〜0.95の範囲であると、エネルギー密度がさらに高くなるためより好ましい。
【0022】
上記正極活物質のマンガン含有量βが上記範囲より多くなると、3.2V以下の放電容量密度が増し、結果的に平均放電電位の低下を招く。
【0023】
尚、上記正極活物質に、マグネシウム、ニッケル、ジルコニウム、モリブデン、タングステン、アルミニウム、クロム、バナジウム、セリウム、チタン、鉄、カリウム、ガリウム、インジウムから選ばれる元素のうち少なくとも一つの元素を添加してもよい。添加量がコバルトとマンガンの総mol量に対して10mol%以下である場合、充電時の熱安定性が改善されることが予想される。
【0024】
本願発明で用いられる負極の例としては、リチウム、珪素、炭素、錫、ゲルマニウム、アルミニウム、鉛、インジウム、ガリウム、リチウム合金、予めリチウムを吸蔵させた炭素並びに珪素、及びこれらの合金並びに混合物が挙げられる。
【0025】
電極の導電性が優れている場合は、導電剤を添加しなくても電極として機能するが、電極の導電性が低い場合は、導電剤を電極に添加することが望ましい。導電剤としては、導電性を有する材料であればよく、特に導電性が優れている酸化物、炭化物、窒化物、炭素材料の少なくとも一種を用いることができる。酸化物としては、酸化スズ、酸化インジウム等が挙げられる。炭化物としては、炭化タングステン、炭化ジルコニウムが挙げられる。窒化物としては、窒化チタン、窒化タンタル等が挙げられる。
【0026】
尚、導電剤を添加させる場合、その添加量が少ないと、正極における導電性を充分に向上させることができない。一方、その添加量が多くなり過ぎると、正極における活物質の割合が少なくなって高いエネルギー密度が得られなくなる。このため、導電剤の量が活物質の総量に対し0質量%より多く30質量%以下であることが好ましく、さらに1質量%以上20質量%以下、さらに2質量%以上10質量%以下の範囲がより好ましい。
【0027】
電極に添加するバインダーは、ポリテトラフルオロエチレン、ポリフッ化ビニリデン、ポリエチレンオキサイド、ポリビニルアセテート、ポリメタクリレート、ポリアクリレート、ポリアクリロニトリル、ポリビニルアルコール、スチレン−ブタジエンラバー、カルボキシメチルセルロースから選択される少なくとも一種を用いることができる。
【0028】
本願発明で用いられるバインダーの量が多いと、正極に含まれる活物質の割合が小さくなるため、高いエネルギー密度が得られなくなる。そのため、バインダーの量は活物質の総量に対し0質量%以上30質量%以下であることが好ましく、さらに1質量%以上20質量%以下、さらに2質量%以上10質量%以下の範囲がより好ましい。
【0029】
本願発明で用いる非水溶媒の例としては、環状炭酸エステル、鎖状炭酸エステル、エステル類、環状エーテル類、鎖状エーテル類、二トリル類、アミド類、及びこれらの混合溶媒等が挙げられる。
【0030】
環状炭酸エステルの例としては、エチレンカーボネート、プロピレンカーボネート、ブチレンカーボネート、又はこれらの水素基の一部若しくは全部がフッ素化されたものを用いることができる。環状炭酸エステルの例としては、トリフルオロプロピレンカーボネートやフルオロエチレンカーボネートなどが挙げられる。
【0031】
鎖状炭酸エステルの例としては、ジメチルカーボネート、エチルメチルカーボネート、ジエチルカーボネート、メチルプロピルカーボネート、エチルプロピルカーボネート、メチルイソプロピルカーボネート、又はこれらの水素の一部若しくは全部がフッ素化されたものを用いることができる。
【0032】
エステル類の例としては、酢酸メチル、酢酸エチル、酢酸プロピル、プロピオン酸メチル、プロピオン酸エチル、γ−ブチロラクトンなどが挙げられる。
【0033】
環状エーテル類の例としては、1,3−ジオキソラン、4−メチル−1、3−ジオキソラン、テトラヒドロフラン、2−メチルテトラヒドロフラン、プロピレンオキシド、1,2−ブチレンオキシド、1,4−ジオキサン、1,3,5−トリオキサン、フラン、2−メチルフラン、1,8−シネオール、クラウンエーテルなどが挙げられる。
【0034】
鎖状エーテル類の例としては、1,2−ジメトキシエタン、ジエチルエーテル、ジプロピルエーテル、ジイソプロピルエーテル、ジブチルエーテル、ジヘキシルエーテル、エチルビニルエーテル、ブチルビニルエーテル、メチルフェニルエーテル、エチルフェニルエーテル、ブチルフェニルエーテル、ペンチルフェニルエーテル、メトキシトルエン、ベンジルエチルエーテル、ジフェニルエーテル、ジベンジルエーテル、o-ジメトキシベンゼン、1,2−ジエトキシエタン、1,2−ジブトキシエタン、ジエチレングリコールジメチルエーテル、ジエチレングリコールジエチルエーテル、ジエチレングリコールジブチルエーテル、1,1−ジメトキシメタン、1,1−ジエトキシエタン、トリエチレングリコールジメチルエーテル、テトラエチレングリコールジメチルなどが挙げられる。
【0035】
二トリル類の例としては、アセトニトリル等が、アミド類の例としては、ジメチルホルムアミド等が挙げられる。
【0036】
本願発明で用いるリチウム塩の例としては、従来のリチウムイオン二次電池において電解質として一般に使用されているものを用いることができ、例えば、LiBF4、LiPF6、LiCF3SO3、LiC4F9SO3、LiN(CF3SO2)2、LiN(C2F5SO2)2、LiAsF6、ジフルオロ(オキサラト)ホウ酸リチウム、から選択される少なくとも1種を用いることができる。
【発明の効果】
【0037】
本願発明によれば、エネルギー密度が高く、かつ充放電サイクル特性に優れた非水電解質二次電池を提供することができる。
【図面の簡単な説明】
【0038】
【図1】本願発明で使用した試験セルの模式図
【図2】実施例1〜5で作製した正極活物質のXRDパターン
【図3】比較例1〜3で作製した正極活物質のXRDパターン
【図4】比較例4〜5で作製した正極活物質のXRDパターン
【発明を実施するための形態】
【0039】
以下、本願発明の実施の形態について図面を参照しつつ詳細に説明するが、本願発明はこれらの実施例により限定されるものではない。
【0040】
(実施例1)
Na0.7Co11/12Mn1/12O2(仕込み組成)が得られるように原料として、硝酸ナトリウム(NaNO3)、酸化コバルト(II III)(Co3O4)、及び酸化マンガン(III)(Mn2O3)を混合し、900℃で10時間保持することによって、ナトリウム含有酸化物を得た。尚、他の実施例及び比較例において、仕込み組成にリチウムが含まれる場合は、炭酸リチウム(Li2CO3)を上記原料に加えて混合した。
【0041】
硝酸リチウム(LiNO3)と水酸化リチウム(LiOH)をmol%で61:39の割合になるように混合した溶融塩床を、得られたナトリウム含有酸化物5gに対し5倍当量加え、200℃で10時間保持させることによって、ナトリウム含有酸化物のナトリウムの一部をリチウムにイオン交換した。イオン交換後の物質を水洗して得られたリチウム含有酸化物を正極活物質として利用した。
【0042】
得られた正極活物質を80質量%、導電剤としてのアセチレンブラックを10質量%、結着剤としてのポリフッ化ビニリデンが10質量%となるように混合し、N−メチル−2−ピロリドンを用いてスラリー化した後、アルミ箔集電体上に塗布した。その後、110℃で真空乾燥し作用極1を用意した。
【0043】
不活性雰囲気下で、作用極1、対極2、セパレータ3、参照極4を用いて図1に示すような試験セル5を作製した。尚、対極2及び参照極4にはリチウム金属を用いた。また、エチレンカーボネートとジエチルカーボネートを体積%で30:70の割合になるように混合した非水溶媒に、六フッ化リン酸リチウム(LiPF6)を1.0 mol/lの濃度になるように添加したものを電解液として用いた。
【0044】
得られた試験セルを用いて2.0−5.0V(vs. Li/Li+)の範囲で10回充放電を繰り返した。尚、このときの電流密度は0.1mA/cm2とした。
【0045】
(実施例2)
Li0.1Na0.7Co11/12Mn1/12O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0046】
(実施例3)
Na0.7Co10/12Mn2/12O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0047】
(実施例4)
Li0.1Na0.7Co10/12Mn2/12O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0048】
(実施例5)
Li0.1Na0.7Co9/12Mn3/12O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0049】
(比較例1)
Na0.7CoO2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0050】
(比較例2)
Na0.7Co17/24Mn7/24O2(仕込み組成)で表されるナトリウム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0051】
(比較例3)
Li0.1Na0.7Co17/24Mn7/24O2(仕込み組成)で表されるナトリウ
ム含有酸化物を用いたこと以外は実施例1と同様にして実験を行った。
【0052】
表1に、実施例1〜5及び比較例1〜3のナトリウム含有酸化物の仕込み組成及び、リチウム含有酸化物の組成分析の結果を示す。リチウム含有酸化物の組成比は、リチウム及びナトリウムを原子発光分析で、コバルト及びマンガンをICP発光分析で求めた。尚、組成比はコバルトとマンガンの和を1、酸素を2として示されている。
【0053】
【表1】

【0054】
実施例1〜5のリチウム含有酸化物のXRD測定結果を図2に示す。尚、XRD測定には線源としてCuKαを用いた。図中下方に示した3桁の数字は、O2構造に帰属されるピークの指数である。また、*は不純物相のピークを示す。
【0055】
図2より実施例1〜5の主構造は空間群P63mcのO2構造であることが分かる。不純物相はO3構造のLiCoO2などが考えられる。コバルト組成比の高い試料ではLi2MnO3に対応するピークは観察されず、O3構造のLiCoO2に対応するピークプロファイルが観察された。この結果から、ナトリウム酸化物に添加されたリチウムは主にO3−LiCoO2の生成に利用され、Li2MnO3の生成量は多くとも5%程度の極微量である。
【0056】
比較例1〜3のリチウム含有酸化物のXRD回折測定結果及び、Powder Diffraction Fileより、LiCoO2(PDF#75−0532)、Li0.62CoO2(PDF#77−1868)、Na0.74CoO2(PDF#87−0274)のパターンを図3に示す。
【0057】
比較例1〜3に含まれるO3構造のLiCoO2や、比較例1で観察されたイオン交換されていないナトリウム含有酸化物を不純物相とし、不純物相に帰属するピークには*を付した。
【0058】
図3に示した3桁の数字はO2構造に帰属されるピークの指数である。また、▽はO6構造(空間群R−3m)に帰属できるピークである。O6構造とはリチウムが酸素八面体の中心に存在し、かつ酸素と遷移金属酸化物MO6との重なり方が単位格子あたり6種類存在する構造である。
【0059】
図3より、比較例1の主構造はO3構造、比較例2の主構造はO6構造であることが分かる。比較例3では、ピーク強度は小さいが、O2構造に対応するピークが見られる。表2に、実施例1〜5及び比較例1〜3について上記充放電を繰り返した際の1サイクル目の放電容量密度、平均放電電位、及びエネルギー密度を示す。
【0060】
【表2】

【0061】
表2より、実施例1〜5の放電容量密度が比較例1〜2と比較して向上していることが分かる。これは、実施例1〜5の正極活物質がコバルト及びマンガンを含みかつコバルト含有量が多く含まれるO2構造の結晶構造を持つため、高電位において結晶構造が安定であるためと考えられる。尚、3.2−4.8V(vs. Li/Li+)の範囲の実施例1〜4の放電容量密度と平均放電電位は、実施例1で222mAh/g、4.09V、実施例2で228mAh/g、4.10V、実施例3で224mAh/g、4.14V、実施例4で217mAh/g、4.16Vとなり、平均放電電位が高くなるので、上記電位範囲で充放電することがより好ましい。
【0062】
実施例1〜5の平均放電電位は比較例3と比較して高くなっている。これは、実施例1〜5の正極活物質では、コバルト及びマンガンを含むO2構造中にコバルトが比較例3より多く含まれているためと考えられる。ここで、O2構造の材料にLi2MnO3が含まれることで放電容量密度が増加することは特許文献1で開示されている。しかしながら、コバルト及びマンガンを含むO2構造中のコバルト量を多くすることによって、平均放電電位が高くなることについては、特許文献1から予測できない。また、コバルト及びマンガンを含むO2構造中のコバルト量を多くすることは、相対的にLi2MnO3量を減らすことになり、特許文献1の発明思想と逆行するものである。
実施例1〜5のエネルギー密度は比較例1〜3と比較して大きくなっている。エネルギー密度は初期放電容量密度と平均放電電位を乗じた値として簡易的に見積もった。高エネルギー密度化を目的とした電池では、放電容量密度や平均放電電位の単独の値より、エネルギー密度の値が重要である。
【0063】
実施例2、4及び5の中では、実施例2及び4がより高いエネルギー密度を有している。これは、実施例2及び4の正極活物質が実施例5の正極活物質と比較してコバルト含有量が多く、平均放電電位が高くなっているためである。
【0064】
実施例2が実施例1よりも、又は実施例4が実施例3よりも放電容量密度が高くなっているのは、イオン交換前の物質であるナトリウム含有酸化物にリチウムが添加されることにより、主構造以外に微量のLi2MnO3等が補構造としてイオン交換後の正極活物質に含まれることが要因であると考えられる。このLi2MnO3の補構造は、O2構造の主構造と相互作用することにより、放電容量密度の増加に貢献していると考えられる。
【0065】
比較例2及び3の組成は類似しているが、図3より微細構造が異なることが分かる。この差異が表2で示す放電容量の違いに現れており、組成比が類似していても電池特性が異なり得ることが分かる。尚、微細構造の違いは、ナトリウム含有酸化物に含まれるリチウム量に起因すると考えられる。
【0066】
(比較例4)
炭酸リチウム(Li2CO3)及び酸化コバルト(II III)(Co3O4)を混合し、900℃で10時間保持することによって、リチウム含有酸化物を得た。これを正極活物質として上記と同様に試験セルを作製した。得られた試験セルを用いて2.0−4.6V(vs. Li/Li+)の範囲で10回充放電を繰り返した。尚、このときの電流密度は2mA/cm2とした。
【0067】
ここで、電流密度を2mA/cm2として充放電を繰り返したが、電流密度を0.1mA/cm2として充放電を繰り返した後の容量維持率と同様の結果が得られると予想される。また、充電終止電位を5.0Vとしなかった理由は、高い電位でO3構造のLiCoO2の結晶構造が不安定であることが知られているからである。尚、充電終止電位が低い場合、充電終止電位が高い場合と比較して、充放電を繰り返した後の容量維持率は一般的に高くなる。
【0068】
(比較例5)
硝酸ナトリウム(NaNO3)、炭酸リチウム(Li2CO3)及び酸化コバルト(II III)(Co3O4)を混合し、900℃で10時間保持することによって、ナトリウム含有酸化物を得た。得られたナトリウム含有酸化物5gを、臭化リチウム(LiBr)濃度5mol/lのヘキサノール溶液150mlに浸漬させ、120℃で16時間還流することによってイオン交換を行い、リチウム含有酸化物を得た。得られたリチウム含有酸化物を正極活物質として、上記と同様に試験セルを作製した。得られた試験セルを用いて2.0−4.6V(vs. Li/Li+)の範囲で10回充放電を繰り返した。尚、このときの電流密度は2mA/cm2とした。
【0069】
表3に、比較例4及び5のリチウム含有酸化物の組成分析の結果を示す。リチウム含有酸化物の組成比は、リチウム及びナトリウムを原子発光分析で、コバルト及びマンガンをICP発光分析で求めた。尚、組成比はコバルトとマンガンの和を1、酸素を2として示されている。
【0070】
【表3】

【0071】
比較例4及び比較例5のリチウム含有酸化物のXRD測定結果を図4に示す。各ピークには対応する面指数を示した。図4より、比較例4はO3構造のLiCoO2の単相に帰属されることが分かる。また、比較例5の主構造はO2構造に帰属され、前駆体のP2構造のナトリウム含有酸化物がイオン交換されずに残っていることが分かる。空間群P63/mmcのP2構造のナトリウム含有酸化物に対応するピークに*を付した。
【0072】
実施例1〜5、比較例4及び比較例5の初期容量密度及び10サイクル後の容量維持率を表4に示す。
【0073】
【表4】

【0074】
比較例5の10サイクル後の容量維持率は、実施例1〜5と比較して低くなっている。これは、比較例5の正極活物質に含まれるO2構造にマンガンが含まれていないため、4.6V(vs. Li/Li+)付近でのリチウムが結晶中から脱離する過程で、不可逆な結晶構造の変化が起こり、初期の結晶構造を維持することができなくなったためと考えられる。
【0075】
尚、実施例1〜5には不純物としてO3構造のLiCoO2が含まれていることから、これらを除去すると更にサイクルに伴う劣化が抑制されると期待される。
【符号の説明】
【0076】
1・・・作用極
2・・・対極
3・・・セパレータ
4・・・参照極
5・・・試験セル
【特許請求の範囲】
【請求項1】
正極活物質を含む正極と、負極と、非水電解質とを備える非水電解質二次電池であって、
上記正極活物質が、Lix1Nay1CoαMnβOγ(0.66<x1<1.1、0<y1≦0.02、0.75≦α<1、0<β≦0.25、1.9≦γ≦2.1)で表されるリチウム含有酸化物であることを特徴とする非水電解質二次電池。
【請求項2】
請求項1に記載のリチウム含有酸化物がO2構造の酸化物を含んでいることを特徴とする非水電解質二次電池。
【請求項3】
請求項1又は2に記載のリチウム含有酸化物が、Lix2Nay2CoαMnβOγ(0≦x2≦0.1、0.66<y2<0.75、0.75≦α<1、 0<β≦0.25、1.9≦γ≦2.1)で表されるナトリウム含有酸化物に含まれるナトリウムの一部をリチウムでイオン交換することによって得られるリチウム含有酸化物であることを特徴とする非水電解質二次電池。
【請求項1】
正極活物質を含む正極と、負極と、非水電解質とを備える非水電解質二次電池であって、
上記正極活物質が、Lix1Nay1CoαMnβOγ(0.66<x1<1.1、0<y1≦0.02、0.75≦α<1、0<β≦0.25、1.9≦γ≦2.1)で表されるリチウム含有酸化物であることを特徴とする非水電解質二次電池。
【請求項2】
請求項1に記載のリチウム含有酸化物がO2構造の酸化物を含んでいることを特徴とする非水電解質二次電池。
【請求項3】
請求項1又は2に記載のリチウム含有酸化物が、Lix2Nay2CoαMnβOγ(0≦x2≦0.1、0.66<y2<0.75、0.75≦α<1、 0<β≦0.25、1.9≦γ≦2.1)で表されるナトリウム含有酸化物に含まれるナトリウムの一部をリチウムでイオン交換することによって得られるリチウム含有酸化物であることを特徴とする非水電解質二次電池。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−228273(P2011−228273A)
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願番号】特願2011−51935(P2011−51935)
【出願日】平成23年3月9日(2011.3.9)
【出願人】(000001889)三洋電機株式会社 (18,308)
【Fターム(参考)】
【公開日】平成23年11月10日(2011.11.10)
【国際特許分類】
【出願日】平成23年3月9日(2011.3.9)
【出願人】(000001889)三洋電機株式会社 (18,308)
【Fターム(参考)】
[ Back to top ]

