非蛍光性蛍光蛋白質を用いた遺伝毒性を判定するための方法
本発明は、(a)変異がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で魚類を形質転換させる工程、(b)形質転換された魚類を試験物質で処理する工程、及び(c)試験物質で処理された魚類内の蛍光を測定する工程であって、蛍光が、試験物質で処理された魚類において、導入されたヌクレオチド配列の復帰変異により非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されることにより発生する工程を含む試験物質の遺伝毒性を判定するための方法に関する。本発明によれば、本発明の蛍光蛋白質変異体は、試験物質処理により蛍光蛋白質変異体の復帰が誘発された蛍光稚魚を生産して試験物質の遺伝毒性を測定できる非常に優れる動物システムを提供する。したがって、本発明のMutaFishシステムは、真核生物で試験物質の遺伝毒性を非常に簡単でかつ速かに判定することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は非蛍光性蛍光蛋白質を用いた遺伝毒性を判定するための方法に関する。
【背景技術】
【0002】
周辺環境への化学物質の流入は環境及び人間健康に甚大な危険をもたらす。したがって、ヨーロッパ及び他の産業国家の最近の法律は、化学物質、殺虫剤、殺生物剤、及び医薬品の登録のために危険性評価データを要求している(Commission of the European Communities、1967、1991、1992、1993a、b、1994;CVMP/VICH、2000;EMEA/CHMP、2006;VICH、2004)。化学物質の毒性を評価するために開発された多様な遺伝毒性アッセイのうちからエームスアッセイ(Ames assay)が最も頻繁に用いられている(非特許文献1及び2)。この方法は、ヒスチジンが欠乏された培養で成長を定量することで、サルモネラティフィムリウム(Salmonella typhimurium)の欠損突然変異体(defective mutant)のhis遺伝子で点突然変異の回復(reversal)を検出することに基づく。しかしながら、エームスアッセイは次のような重大な欠点を持っている:サルモネラは発癌前駆物質(procarcinogens)を活性代謝物質(reactive metabolites)に転換させることに必要な脊椎動物の細胞内の機能を有しない。したがって、MutaMouse(非特許文献3)、BigBlue mouse(非特許文献4)、gpt−Δトランスジェニックマウスシステム(非特許文献5)、及びrpsLトランスジェニックゼブラフィッシュ(非特許文献6)のような多様なトランスジェニック動物システムが開発された。しかしながら、前述した全てのシステムにおいて、トランスジェニックレポーター遺伝子は全て原核細胞起源で動物器官からDNAを抽出した後、適切なテストバクテリア(E.coli)に導入されて評価されなければならなかった。
【0003】
本明細書の全体に亘って多数の論文及び特許文献が参照され、その引用が表示されている。引用された論文及び特許文献の開示内容は、その全体として本明細書に参照にして挿入されて本発明が属する技術分野の水準及び本発明の内容がより明確に説明される。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Ames、Durston et al.,1973
【非特許文献2】Maron and Ames、1983
【非特許文献3】Gossen、de Leeuw et al.,1989
【非特許文献4】Kohler、Provost et al.,1991
【非特許文献5】Nohmi、Katoh et al.,1996
【非特許文献6】Amanuma、Takeda et al.,2000
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明者らは、試験物質の遺伝毒性を判定するための新規な方法を開発しようと努力した。その結果、本発明者らは蛍光蛋白質変異体、好ましくはEGFP(enhanced green fluorescent protein)変異体(EGFPmut)に形質転換された細胞、又はゼブラフィッシュを用いた遺伝毒性を判定するための方法(例えば、MutaFishモデル)を開発し、これを用いて試験物質の遺伝毒性をEGFP復帰突然変異体の蛍光により視覚化することができ、以前のモデルと比較して、より敏感で、かつ容易に遺伝毒性をテストすることができるということを見出し、本発明の完成に至った。
【0006】
本発明の目的は、遺伝毒性を判定するための方法を提供することにある。
【0007】
本発明の他の目的は、遺伝毒性を判定するための組成物を提供することにある。
【0008】
本発明の更に他の目的は、野生型EGFP変異体(EGFPmut)を提供することにある。
【0009】
本発明の他の目的及び利点は、以下の発明の詳細な説明、請求範囲、及び図面により、一層明らかになる。
【図面の簡単な説明】
【0010】
【図1】図1は、pEGFPmut::CATのベクターマップを示す。cat遺伝子はpEGFP(Clonetech)のstuI位置にクローニングされた。
【図2】図2は、変異体EGFPmutのDNA配列が表示された野生型EGFPのDNA(A)及びアミノ酸配列(B)を示すものである。EGFPmut1の場合、137番目のロイシンがプロリンに置換された突然変異[L137P(CTG to CCC)]を含み、EGFPmut2の場合、51番目Glyの次に、もう1つのGlyが追加された突然変異(TG51GKLPVPWPT)であり、EGFPmut3の場合、51番目Glyの次に2つのGlyが追加された−1フレームシフト突然変異である。EGFPmut2の蛋白質翻訳は、51番目Glyの以後、10番目アミノ酸である62番目のアミノ酸で中断される。EGFPmut3の配列は、次の通りである:NH2−MVSKGEELFTGVVPILVELDGDVNGHKFSVSGEGEGDATYGKLTLKFICTTGGSCPCPGPPS−OH。
【図3】図3は、pCMV−Mut−EGFP::pCMLC2−mCherryのベクターマップを示す。EGFPmutはto12キット内の2つのatt位置の間にクローニングされた。
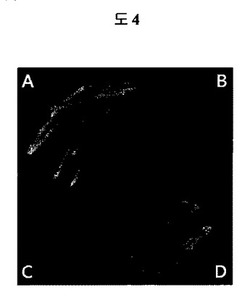
【図4】図4は、UV光の下でEGFP変異体プラスミドを保有するサルモネラLT2株を観察した結果である。使用したプラスミドは以下の通りである:A、pEGFP::cat;B、pEGFPmut1::cat;C、pEGFPmut3::cat;D、pEGFPmut2::cat。
【発明を実施するための形態】
【0011】
本発明の一態様によれば、本発明は下記工程を含む試験物質の遺伝毒性を判定するための方法を提供する:(a)変異(mutation)がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で魚類を形質転換させる工程;(b)上記形質転換された魚類を試験物質で処理する工程;及び(c)で処理された魚類内の蛍光を測定する工程であって、前記蛍光が、前記試験物質で処理された魚類において、前記導入されたヌクレオチド配列の復帰変異(back mutation)により前記非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されることにより発生する工程。
【0012】
本発明の他の態様によれば、本発明は変異がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で形質転換された魚類を含み、上記形質転換された魚類を試験物質で処理して復帰変異(back mutation)の発生を観察することを特徴とする遺伝毒性を判定するための組成物を提供する。
【0013】
本発明の更に他の態様によれば、本発明はEGFP変異体(EGFPmut)をコードする配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列を提供する。
【0014】
本発明者らは、試験物質に対する新規な遺伝毒性を判定するための方法を開発しようと努力した。その結果、本発明者らは、蛍光蛋白質変異体、好ましくはEGFP(enhanced green fluorescent protein)変異体(EGFPmut)に形質転換された細胞又はゼブラフィッシュを用いた遺伝毒性を判定するための方法(例えば、MutaFishモデル)を開発し、これを用いて試験物質の遺伝毒性をEGFP復帰突然変異体の蛍光で視覚化することができ、以前のモデルと比較して、より敏感で、かつ容易に遺伝毒性をテストすることができることを見出した。
【0015】
化学物質がDNAと反応する程度又はDNAを修飾させる程度を測定するための短期試験(short−term test)方法が開発されてきたものであり、このような方法を用いて得られた陽性結果は、化学物質の発癌性を十分に立証することはできないが、可能性を提示し、たびたび動物生体定量のための化学物質選択に利用されてきた。このような短期試験方法で、突然変異原性試験(例:エームステスト)、染色体効果試験(例:染色体の数又は構造変化を測定)、哺乳動物細胞形質転換試験(例:細胞の変化を測定)などがある。
【0016】
これら短期試験方法のうち、エームステストは化学物質が発癌物質か否かを評価するために用いられる最も一般的な方法である。エームステストによれば、化学物質のサルモネラティフィムリウム株の特定遺伝因子に対する復帰突然変異(back mutation又はrevertants)誘発程度を測定する。エームステストで陽性結果を表す化学物質は、約90%以上の場合、動物実験で発癌性を示す。エームステストは、次のような長所を有する:(a)低廉な費用;(b)容易性;及び(c)迅速性。しかしながら、エームステストは次のような致命的な欠点を有する。エームステストで用いられるサルモネラは原核生物であるので、真核生物(例えば、人間)の細胞内の機能を正常に反映できない。例えば、サルモネラは発癌前駆物質(procarcinogens)を活性代謝物質(reactive metabolites)に転換させることに必要な脊椎動物の細胞内の機能を遂行することができない。したがって、本発明者らは前述した短所を克服するために変異がある非蛍光性蛍光蛋白質を用いて試験物質の遺伝毒性を判定するための新規な方法を開発した。
【0017】
本発明は野生型EGFP変異体(EGFPmut)に形質転換された細胞(例:サルモネラティフィムリウム;CH4001及びCH4003株)又は魚類(例:MutaFish)を用いた試験物質の遺伝毒性を判定するための方法を提供する。
【0018】
本発明によれば、本発明は下記工程を含む遺伝毒性を判定するための方法を提供する:
(a)変異(mutation)がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列に細胞又は魚類を形質転換させる工程;
(b)上記形質転換された細胞又は魚類を試験物質で処理する工程;及び
(c)上記試験物質が処理された細胞又は魚類内の蛍光を測定する工程であって、前記蛍光が、前記試験物質で処理された魚類において、上記導入されたヌクレオチド配列の復帰変異(back mutation)により上記非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されることにより発生する工程。
【0019】
前述したように、試験物質が突然変異誘発因子として機能しているか否かを調べる最も簡単な方法は、細菌の栄養性突然変異体を使用して復帰(reversion)実験を実施する方法(例えば、エームステスト)である。最も簡単な復帰実験は一定数の突然変異体の細菌を突然変異誘発物質が入っている培地で培養しながら、そこで生じる復帰突然変異体(revertants)の数をカウンティングするものである。試験物質が突然変異誘発因子の場合、復帰突然変異体の数は試験物質で処理されない培地より増加する。
【0020】
本発明者らは、非蛍光性蛍光蛋白質を細胞又は魚類に形質転換させて得た形質転換体を用いて試験物質の遺伝毒性をより効率的に判定する方法を開発し、本発明の方法は、上記非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されて発生する蛍光を通じた視覚化により、一層容易で、かつ速かに遺伝毒性を判定することができる。したがって、本発明の方法は従来技術(エームステスト)の限界点である原核細胞を利用し、したがって、真核生物に適用できないという限界点を克服できる非常に優れる方法である。
【0021】
本明細書で、用語“変異(mutation)”又は“突然変異(mutation)”は、本発明で利用できる非蛍光性蛍光蛋白質をコードするヌクレオチド配列で発生する変異を意味し、好ましくは、形質転換された細胞又は魚類で上記非蛍光性蛍光蛋白質が蛍光性蛋白質に復帰される変異(back mutation又はrevertant)を意味する。
【0022】
一般に、DNA変異は多様な因子(例えば、紫外線、ウイルス、トランスポゾン、突然変異誘発物質など)により誘発され、生物体自体(例えば、細胞内に発生する超突然変異(hyper mutation))により誘発できる。また、突然変異は多様な形態にDNA配列の変化をもたらすことができる。例えば、ナンセンス突然変異、フレームシフト突然変異、ミスセンス突然変異などがある。ミスセンス突然変異は、DNA配列で1つのヌクレオチドが他のヌクレオチドに交換又は置換される点突然変異により変異されたヌクレオチドにより形成されたコドンによって発現される蛋白質が決まる。フレームシフト突然変異は、多数のヌクレオチドの挿入又は欠失により誘発される突然変異であって、挿入又は欠失されたヌクレオチドの数によって発現される蛋白質が決まる。ナンセンス突然変異は、1つのヌクレオチドが変化されて他のアミノ酸をコードするコドンへの変異を誘発する点突然変異であって、発現された変異蛋白質が元の活性を無くす場合が発生する。
【0023】
本発明の好ましい具現例によれば、本発明の変異がある非蛍光性蛍光蛋白質は野生型(wild type)蛍光蛋白質のヌクレオチド配列において(i)フレームシフト変異,又は(ii)ミスセンス変異を誘発する置換変異により変異される。本発明によれば、本発明の非蛍光性蛍光蛋白質をコードするヌクレオチド配列で生じる変異は前述した突然変異を含む。即ち、本発明で誘発された変異は試験物質により非蛍光性蛍光蛋白質をコードするヌクレオチド配列の上に多様な形態の突然変異が発生して非蛍光性蛍光蛋白質(変異体)が蛍光蛋白質に復帰されて蛍光を引き起こす。試験物質の処理により非蛍光性蛍光蛋白質(変異体)が蛍光蛋白質に復帰されて蛍光を示す場合、試験物質が形質転換された細胞又は魚類で遺伝毒性を示すことと判定され、これは試験物質が発癌物質(carcinogen)の候補物質として判断される。
【0024】
本発明の好ましい具現例によれば、本発明の復帰変異はフレームシフト変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させ、又は置換変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる。より好ましくは、本発明の復帰変異はEGFP変異体(EGFPmut)をコードする配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列がコードする非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる。本明細書の用語“置換変異(substitution mutation)”は本発明の非蛍光性蛍光蛋白質をコードするヌクレオチド配列を変異させて非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させることを意味し、これは点突然変異、挿入、又は欠失などを含み、より好ましくはミスセンス突然変異により誘発される変異を意味する。
【0025】
本発明の好ましい具現例によれば、本発明の判定方法で利用できる蛍光性蛋白質は、GFP(green fluorescent protein)、RFP(red fluorescent protein)、CFP(cyan fluorescent protein)、YFP(yellow fluorescent protein)、BFP(blue fluorescent protein)、EGFP(enhanced green fluorescent protein)、ECFP(enhanced cyan fluorescent protein)、EYFP(enhanced yellow fluorescent protein)、ERFP(enhanced red fluorescent protein)、mCherry、mTomato、又はEBFP(enhanced blue fluorescent protein)を含むが、これに限定されるものではない。最も好ましくは、本発明の蛍光性蛋白質はEGFPである。
【0026】
本発明の好ましい具現例によれば、本発明のEGFP変異体(EGFPmut)は蛍光を示さない。
【0027】
本発明の好ましい具現例によれば、本発明の方法が適用できる魚類はゼブラフィッシュを含むが、これに限定されるものではない。
【0028】
本発明の好ましい具現例によれば、本発明の方法は前述した工程(b)以後、試験物質で処理された形質転換魚類の胚を培養して孵化させて仔稚魚(flylarvae)を得る工程をさらに含む。
【0029】
本発明の好ましい具現例によれば、本発明の工程(c)で、蛍光測定は当業界に公知された多様な方法を用いて実施することができ、最も好ましくはフローサイトメトリーを用いて実施される。
【0030】
本発明のより好ましい具現例によれば、本発明は(a)前述した形質転換された細胞又は魚類に試験物質を処理する工程;及び(b)上記EGFP変異体の蛍光を測定する工程を含む突然変異誘発物質(mutagens)のスクリーニング方法であって、上記試験物質が配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列からなる野生型EGFP変異体蛋白質の蛍光を誘導すれば、突然変異誘発物質であると判断される。
【0031】
本発明の方法は、前述した本発明のEGFP変異体を有効性分として含むため、両方に重複した内容は重複記載に従う本明細書の過度な複雑性を避けるために、その記載を省略する。
【0032】
本発明のスクリーニング方法を言及しながら使われる用語“試験物質”は、多様な非蛍光性蛍光蛋白質をコードするヌクレオチド配列又はそれらの相補的なヌクレオチド配列、又は前述したヌクレオチド配列がコードするアミノ酸配列からなる非蛍光性蛍光蛋白質で変異を誘発して復帰突然変異体を発生させる未知の物質を意味し、より好ましくは、図2の配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列、又は配列番号3又は配列番号4のアミノ酸配列からなる野生型EGFP変異体(EGFPmut)蛋白質で変異を誘発して蛍光蛋白質を発生させる物質を意味する。
【0033】
次に、試験物質で処理された細胞又は魚類において、非蛍光性蛍光蛋白質の蛍光蛋白質への変異を蛍光で検出する。より好ましくは、前述した野生型EGFP変異体(EGFPmut)蛋白質において、非蛍光の蛍光への復帰変異を蛍光で検出する。
【0034】
上記試験物質は合成又は天然化合物のライブラリー又は天然材料から得ることができる。合成又は天然化合物のライブラリーを得る方法は当業界に公知されている。合成化合物ライブラリーは、Maybridge Chemical Co.(UK)、Comgenex(USA)、Brandon Associates(USA)、Microsource(USA)、及びSigma−Aldrich(USA)から商業的に購入可能であり、天然化合物のライブラリーはPan Laboratories(USA)、及びMycoSearch(USA)から商業的に購入可能である。
【0035】
試験物質は当業界に公知された多様な組合ライブラリー方法により得ることができ、例えば、生物学的ライブラリー、空間アドレッサブルパラレル固相又は液相ライブラリー(spatially addressable parallel solid phase or solution phase libraries)、デコンボリューションが求められる合成ライブラリー方法、“1−ビード1−化合物”ライブラリー方法、そして親和性クロマトグラフィー選別を用いる合成ライブラリー方法により得ることができる。分子ライブラリーの合成方法は、DeWitt et al.,Proc.Natl.Acad.Sci.U.S.A.90,6909,1993;Erb et al.Proc.Natl.Acad.Sci.U.S.A.91,11422,1994;Zuckermann et al.,J.Med.Chem.37,2678,1994;Cho et al.,Science 261,1303,1993;Carell et al.,Angew.Chem.Int.Ed.Engl.33,2059,1994;Carell et al.,Angew.Chem.Int.Ed.Engl.33,2061;Gallop et al.,J.Med.Chem.37,1233,1994等に提示されている。
【0036】
一方、本発明は前述したEGFP変異体を含む組み換えベクター又はその転写物により形質転換された細胞及び遺伝子導入による形質転換された細胞又は形質転換体を提供する。
【0037】
本発明の形質転換された細胞又は形質転換体は、前述した本発明のEGFP変異体を有効成分として含むため、両方に重複した内容は重複記載に従う本明細書の過度な複雑性を避けるためにその記載を省略する。
【0038】
本発明の組み換えベクターは、配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列を含む。本発明の組み換えベクターは典型的にクローニングのためのベクター又は発現のためのベクターとして構築できる。また、本発明の組み換えベクターは原核細胞又は真核細胞を宿主にして構築できる。
【0039】
好ましくは、本発明の組み換えベクターは、(i)前述した本発明の発現対象物質をコードするヌクレオチド配列;(ii)上記(i)のヌクレオチド配列に動作可能なように連結され、動物細胞で作用してRNA分子を形成させるプロモーターを含み、より好ましくは、(i)前述した本発明の配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列をコードするヌクレオチド配列;(ii)上記(i)のヌクレオチド配列に動作可能なように連結され、動物細胞で作用してRNA分子を形成させるプロモーター;及び(iii)動物細胞で作用して上記RNA分子の3’−末端のポリアデニル化を引き起こす3’−非翻訳部位を含む組み換え発現ベクターを含む。
【0040】
好ましくは、前述した発現対象物質は蛍光蛋白質が変異された非蛍光性蛍光蛋白質であり、上記蛍光蛋白質は、GFP、RFP、CFP、YFP、BFP、EGFP、ECFP、EYFP、ERFP、及びEBFPを含むが、これに限定されるものではない。最も好ましくは、EGFPである。
【0041】
本明細書において、用語“プロモーター”はコード配列(CDS)又は機能的RNAの発現を調節するDNA配列を意味する。本発明の組み換え発現ベクターにおける発現対象物質コードヌクレオチド配列は、上記プロモーターに動作可能なように連結される。本明細書において、用語“動作可能なように結合された(operatively linked)”は、核酸発現調節配列(例:プロモーター配列、シグナル配列、又は転写調節因子結合位置のアレイ)と他の核酸配列との間の機能的な結合を意味し、これによって上記調節配列は上記他の核酸配列の転写及び/又は翻訳を調節するようになる。
【0042】
本発明のベクターが原核細胞を宿主にする場合には、転写を進行させることができる強力なプロモーター(例えば、tacプロモーター、lacプロモーター、lac UV5プロモーター、lppプロモーター、pLλプロモーター、pRλプロモーター、rac5プロモーター、ampプロモーター、recAプロモーター、SP6プロモーター、trpプロモーター、T7プロモーターなど)、翻訳のためのリボゾーム結合部位及び転写/翻訳終結配列を含むことが一般的である。より好ましくは、本発明で用いられる宿主細胞はサルモネラであり、最も好ましくはサルモネラティフィムリウムLT2株である。この際、本発明で用いられるプロモーターには、lacプロモーターが好ましい。また、宿主細胞としてE.coliが用いられる場合、E.coliトリプトファン生合成経路のプロモーター及びオペレーター部位(Yanofsky,C.,J.Bacteriol.,158:1018−1024(1984))、そしてファージλの左向プロモーター(pLλプロモーター、Herskowitz,I.and Hagen,D.,Ann.Rev.Genet.,14:399−445(1980))が調節部位として利用できる。一方、本発明に利用できるベクターは当業界でたびたび使われるプラスミド(例:pSC101、ColE1、pBR322、pUC8/9、pHC79、pUC19、pETなど)、ファージ(例:λgt4λB、λ−Charon、λΔz1、及びM13など)、又はウイルス(例:SV40など)を操作して製作できる。
【0043】
本発明のベクターを宿主細胞内に保有する方法は、宿主細胞が原核細胞の場合、CaCl2方法(Cohen,S.N.et al.,Proc.Natl.Acac.Sci.USA,9:2110−2114(1973))、ハナハン方法(Cohen,S.N.et al.,Proc.Natl.Acac. Sci.USA,9:2110−2114(1973);及びHanahan,D.,J.Mol.Biol.,166:557−580(1983))及び電気穿孔方法(Dower,W.J.et al.,Nucleic.Acids Res.,16:6127−6145(1988))などにより実施できる。
【0044】
一方、本発明の組み換えベクターが魚類のような哺乳動物で適用される場合、利用できるプロモーターは、好ましくは動物細胞、より好ましくは哺乳動物細胞で作動して本発明の発現対象物質の転写を調節できるものであって、哺乳動物ウイルスから由来したプロモーター及び哺乳動物細胞のゲノムから由来したプロモーターを含み、例えば、CMV(cytomegalo virus)プロモーター、アデノウイルス後期プロモーター、ワクシニアウイルス7.5Kプロモーター、SV40プロモーター、HSVのtkプロモーター、RSVプロモーター、ヒト伸長因子アルファ(hEF1α)プロモーター、メタロチオネインプロモーター、β−アクチンプロモーター、ヒトIL−2遺伝子のプロモーター、ヒトIFN遺伝子のプロモーター、ヒトIL−4遺伝子のプロモーター、ヒトリンホトキシン遺伝子のプロモーター、及びヒトGM−CSF遺伝子のプロモーターを含むが、これに限定されるものではない。最も好ましくは、CMVプロモーター又はhEF1αプロモーターである。好ましくは、本発明に用いられる発現コンストラクトはポリアデニル化配列を含む(例:ウシ成長ホルモンターミネーター及びSV40由来ポリアデニル化配列)。
【0045】
より詳しくは、本発明の形質転換用組み換えベクターは“プロモーター−発現対象物質コードヌクレオチド配列−ポリアデニル化配列”の構造を有し、より好ましくは、“CMVプロモーター−非蛍光性蛍光蛋白質−SV40由来ポリアデニル化配列”から構成される。また、上記形質転換用組み換えベクターは、上記コンストラクトの両方にトランスポゾンエレメントを含むことができるように多位置ゲートウェイ−基盤コンストラクトキット(Fisher,et al.,2006;Kwan,et al.,2007)を用いて製造する。構築された組み換えベクターをゼブラフィッシュ系列で得られた受精卵(fertilization eggs)、より好ましくは単一細胞段階の受精卵にマイクロインジェクションさせる(Xu,Q.(1999).Microinjection into zebrafish embryos. In “Molecular Methods in Developmental Biology”(M.Guille,Ed.),Vol.127,pp.125−132.Humana Press,Inc.,Totowa,NJ.)。前述した受精卵は受精後20分間が超えない受精卵を用いて、マイクロインジェクション後、生成された胚(F1 embryos)で性成熟を誘導し、互いに交配させて形質転換された発現対象物質に対する同型接合体(homozygote)を含むF2胚を得る。以後、F2胚ゼブラフィッシュ間の交雑(in−cross)を通じてF3胚を得る。
【0046】
本発明のベクターシステムは当業界に公知された多様な方法により構築されることができ、これに対する具体的な方法は、Sambrook et al.,Molecular Cloning,A Laboratory Manual,Cold Spring Harbor Laboratory Press(2001)に開示されており、この文献は本明細書に参照として挿入される。
【0047】
本発明の組み換え発現ベクターを用いて形質転換された動物細胞の製造は、当業界に通常的に公知された遺伝子転移方法により実施できる。例えば、電気穿孔法(工法)(electroporation)、リポゾーム−媒介転移方法(Wong等、1980)、レトロウイルス−媒介転移方法(Chen,H.Y.,et al.,(1990),J.Reprod.Fert.41:173−182;Kopchick,J.J.et al.,(1991)Methods for the introduction of recombinant DNA into chicken embryos. In Transgenic Animals,ed.N.L.First&F.P.Haseltine,pp.275−293,Boston;Butterworth−Heinemann;Lee,M.−R.and Shuman,R.(1990)Proc.4th World Congr.Genet.Appl.Livestock Prod.16,107−110)及びマイクロインジェクション(Zebrafish Course,Mullins,August,2005;Xu,Q.(1999).Microinjection into zebrafish embryos. In “Molecular Methods in Developmental Biology”(M.Guille,Ed.),Vol.127,pp.125−132.Humana Press, Inc.,Totowa,NJ.)があり、より好ましくはマイクロインジェクションにより実施される。
【0048】
本発明の特徴及び利点を要約すれば、次の通りである:
(a)本発明は、蛍光蛋白質変異体、好ましくは野生型EGFP変異体(EGFPmut)を用いた遺伝毒性を判定するための方法に関する。
(b)本発明によれば、本発明の蛍光蛋白質変異体、好ましくは野生型EGFP変異体が形質転換されたゼブラフィッシュ(Danio rerio)系統であるMutaFishシステムは試験物質処理により蛍光蛋白質変異体の復帰(reversion)が誘発された蛍光仔稚魚を生産して試験物質の遺伝毒性を測定できる非常に優れる動物システムを提供する。
(c)本発明のMutaFishシステムは、従来技術(例えば、エームステスト)の限界点であった真核生物で試験物質の遺伝毒性を非常に簡単で、かつ速かに判定することができる。
【実施例】
【0049】
以下、実施形態を通じて本発明をより詳細に説明する。これら実施形態は本発明をより具体的に説明するためのものであって、本発明の要旨に従って本発明の範囲がこれら実施形態により制限されないということは当業界で通常の知識を有する者において自明である。
【0050】
(実施例)
実験材料及び実験方法
サルモネラ株
エームステスト用S.チフィムリウム株であるTA98及びTAを購入して製造者の指示によって培養した(Xenometrix AG、Switzerland)。染色体の上にEGFPmut DNAを保有するCH4001及びCH4003株(表1)を実験結果に記載した通り製造した。
【0051】
【表1】

【0052】
EGFPmutの製造
突然変異を誘発するプライマーを用いた位置指定突然変異誘発法(site directed mutagenesis)により非蛍光突然変異されたEGFPを得た。次のような4セットのプライマーを用いた:lacプロモーターの上流にpEGFP(Clontech Laboratories,Palo Alto,CA)(Yang,Cheng et al.,1996)のBamHI位置を含む正方向プライマー(プライマー1)及び停止コドンの下流にEcoRI位置を含む逆方向プライマー(プライマー4)(表2)。好ましい突然変異を含む第2セットのプライマー(プライマー2−x及びプライマー3−x)は必要な変異(change)を生産するためにデザインされた(Joseph Sambrook、2001)。EGFPmut1を製作するために、プライマー1及び3dを用いて最初のPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施し、プライマー2d及び4を用いて第2セットのPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施した。EGFPmut2を製作するために、プライマー1及び3aを用いて最初のPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施し、プライマー2a及び4を用いて第2セットのPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施した。EGFPmut3を製作するために、プライマー1及び3bを用いて最初のPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施し、プライマー2b及び4を用いて第2セットのPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施した。2つ反応のPCR産物を混合し、最適化してアニーリングさせ、以後、プライマー1及び4を用いた最終PCRのテンプルレートとして用いた。最終PCR産物をEcoR1及びBamH1で切断してpEGFP空ベクターに再ライゲーションさせた。前述したプラスミドはlacプロモーターの調節の下で非蛍光EGFP遺伝子を含んでいる。サルモネラ染色体にEGFPmut遺伝子を位置させるために、クロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子をプラスミドのStuI位置に挿入させてpEGFPmut::CATプラスミドを作った(図1)。EGFPmutの配列変更は図2に記載されている。
【0053】
【表2】

【0054】
EGFPmut DNAのサルモネラ染色体への挿入
EGFPmut DNAが染色体の終結(ter)部位から約5min位離れたputA位置を用いてサルモネラティフィムリウムLT2株の染色体に挿入された(Elliott、1992)。サルモネラエンテリカ血清型ティフィムリウムのputA位置の配列を含む次のプライマーを用いてlacP−EGFPmut::CAT DNAを増幅した:5’プライマー、5’−GAAATCGCCTGTTAATGGTA CCAATAGCCTTGACGCAATAGAGTAATGACTCACTCACTCATTAGGCACCCCAGGCTTT−3’及び3’プライマー、5’−CGTCATTGTCAGTCTCTTACAGAAAGATTACACGATTATTTCA TCGGCAGGAGACGCGTAGCACCAGGCGTTTAAG−3’。前述したプライマーは、pEGFPmut::CATプラスミドをテンプレートでlacP−nonEGFP::catに隣接した50−nt又は55−ntのputA(アンダーラインした配列)、及び25−nt配列又は22−nt配列で各々構成された。1.4−kbpのPCR産物を精製してレッドヘルパープラスミド(pKD46)を有するバクテリアに電気穿孔法により形質転換した(Datsenko and Wanner、2000)。線形DNAはエームステストのサルモネラティフィムリウム株であるTA100及びTA98でp22形質導入するためのマーカーとしてクロラムフェニコール遺伝子を含み、結果的にCH4001及びCH4003を各々製造した(Davis, et al.,1980)。
【0055】
エームステスト(Ames test)
プレート−挿入アッセイ(plate−incorporation assay)を以前の記述したように実施した(OECD、1997)。簡略には、ストック溶液からバクテリア細胞を液体培地で12時間の間37℃で培養した。0.1mLのバクテリア懸濁液を0.6%アガー、0.6%NaCl、20.96μgのl−ヒスチジン及びd−バイオチン(Sigma)を含む2mLのトップアガー(Difco)培地に添加した。また、テスト溶液(又は、溶媒照合群、又は製剤陽性照合群)、及びS9−混合物(S9−mix;0.5mL/プレート;10v/v%S9;Sigma)、又はカリウムリン酸緩衝液(0.5mL/プレート;0.2M、pH7.4)(Sigma)をトップアガーに添加して混合した後、Vogel−Bonner最小培地アガープレートの塗抹した(処理実験群の場合、投与当たり独立的な3個の複製群及び溶媒照合群の場合、投与当たり独立的な6個の複製群)。コロニーを37℃で48時間の間培養した後、カウントした。プレートに添加されたテスト溶液の最も大きい容量は最初実験の場合100μLに制限し、再確認実験では200μLまで増加させた。
【0056】
S9−混合物
組成:1mLのS9−混合物は0.1mLのS9、0.01mLの0.4M MgCl2(Sigma)、0.01mLの1.65M KCl(Sigma)、0.5mLの0.2M phosphate buffer(pH7.4;Sigma)、0.04mLの0.1M NADP(Sigma)、0.005mLの1M glucose−6−phosphate(Sigma)及び0.335mLの蒸溜水を含んでいる。全ての補助因子(co−factor)は使用前に0.45−μmの滅菌膜(Millipore)を通して濾過した。
【0057】
突然変異誘発因子の製造
5mM 2−(N−モルフォリノ)エテインスルホン酸(pH6.0)(Sigma)で緩衝化した0.008% Instant Ocean salts(Senju Pharmaceutical,Hyogo,Japan)105.5mLにENU(isopack N−3385;Sigma Chemical Co.,St.Louis,MO,USA)1gを溶解させて81mM ENUのストック溶液を製造し、−80℃に格納した。2mg/mL ICR−191(Polyscience Inc.,Warrington、PA、USA)のストック溶液は10mLの滅菌蒸溜水に20mgのICR−191を溶解させて製作した。
【0058】
EGFPmutを保有するゼブラフィッシュ発現ベクターの構築
pEGFPmut::CATプラスミド内のEGFPmut遺伝子を正方向プライマー(attB1)及び逆方向プライマー(attB2)を用いてPCR増幅した。プライマー配列は、次の通りである:5’−GGGGACAAGTTTGTACAAAAAAGCAGGCTCCACCATGGTGAGCAAGGGCGAG−3’(正方向);5’−GGGGACCACTTTGTACAAGAAAGCTGGGTTGGCTGATTATGATCTAGAG−3’(逆方向)。増幅されたPCR産物をTo12プラスミドでゲートウェイクローニングしたが、EGFPmut遺伝子はCMVプロモーターにより発現された(To12キット:To12トランスポゾン形質転換コンストラクトのための多位置ゲートウェイ−基盤構築キット(Fisher,et al.,2006;Kwan,et al.,2007))。To12プラスミドは心臓−特異的CMLC2プロモーターにより調節されるmCherry遺伝子を保有するが、これは生殖系列伝逹の指示子として用いられる。最終的なコンストラクトであるpCMV−Mut−EGFP::pCMLC2−mCherry(図3)は、制限酵素切断及びDNAシーケンシングにより確認した。
【0059】
トランスジェニックゼブラフィッシュの製作
前述した通り製作されたEGFPmutプラスミドはトランスポサーゼmRNAを有するAB*ゼブラフィッシュ系列(Oregon University、Corvallis、OR、USA)で作られた単一細胞段階受精卵にマイクロインジェクションされた。マイクロインジェクションされた受精卵は、性成熟(sexual maturity)が誘発され、野生型AB*ゼブラフィッシュと交配(mate)した。以後、生成された胚(embryos)の心臓でmCherry蛍光の存否に対してスクリーニングした。突然変異されたEGFPのゲノム組込み(挿入)を確認するために、スクリーンされた胚(F1)でRT−PCR、ウェスタンブロッティング及びサザンブロッティングを実施した。F1胚にまた性成熟が誘発され、互いに交配(mate)してEGFPmutに対して同型接合であるF2胚を発生させた。F2ゼブラフィッシュ間の交配を通じて発生したF3胚で再び性成熟を誘発した。
【0060】
突然変異誘発因子の処理
受精卵を、トランスジェニックF3雌及び非トランスジェニック雄フィッシュを交配して得た。本発明者らは相変らずコリオンで囲まれた24時間胚を3グループ(266胚/グループ)に分類した後、0.1% Instant Ocean salts(Senja Pharmaceutical,Hyogo,Japan)に含まれた0、2mM、又は5mM ENU 10mLで処理して30分間26℃で反応した。以後、突然変異誘発された胚をリンスし、28.5℃培養器で3日間維持した。ほとんど全ての胚が培養期間の間に孵化した。合わせられた生存稚魚を形態的な非正常稚魚とEGFP+稚魚をカウントした。
【0061】
統計分析
全ての分析をウィンドウ統計パッケージ用 SPSS version 11.0を用いて実施した。エームステストで得られた実験的な値に対する統計的分析は、母数的方法、即ちDunnett’s t−検定(Dunnett、1955;Dunnett、1964)、及び投与量に従う反応を観察した線形回帰分析(Kirkland、1994)により実施した。SCEテストの場合、一元変量分析(ANOVA)を実施した後、Student’s t−検定及びpost−hoc Dunnett’s t−検定を遂行した。TF分析はχ2−テストを用いて実施した。実施された全てのテストで≦0.05のp−値が統計的に留意性を有することと見なした。
【0062】
実験結果
非蛍光EGFPの製造
エームステストと遺伝的に類似のEGFPを用いた視覚的遺伝毒性テストシステムを作るための試みとして、本発明者らはエームステストで採択された2つの突然変異、hisG46(TA100)及びhisD6610(TA97)に注目した。hisG46突然変異はLeu(CTC)がPro(CCC)に置換された塩基対を有し、hisD6610突然変異はC1フレームシフト突然変異により6個のシトシン(−C−C−C−C−C−C−)をもたらす。これら突然変異は、反復的なC−G−C−G−C−G−C−G−配列のリーディングフレームに影響を及ぼすhisD3052(TA98)の−1フレームシフト突然変異を復帰させる幾つかの突然変異誘発因子に感受性がある(Isono and Yourno,1974;Levin,Yamasaki et al.,1982)。本発明者らはEGFPで類似の突然変異を誘発させて非蛍光蛋白質を作るために位置指定突然変異誘発法を用いた。まず、本発明者らはhisG46突然変異と類似するようにLeu137をProに置換した。このような置換は、突然変異EGFPを非蛍光蛋白質に変化させた(図4)。これをEGFPmut1と命名し、hisG46突然変異のように突然変異誘発因子により塩基対置換を検出できることと期待した。以後、本発明者らはGFPのコア構造で空のシリンダーを形成するβ−バレルに連結されたα−ヘリックスの部位(reviewed in Tsien、1998)に位置したGly51(GGG)の次にGly(GGG)が追加された更に他の突然変異EGFPを作った。これは、Gly51(GGG)の次に追加的なグリシンがEGFP分子にほとんど影響を及ぼさないので、蛍光蛋白質を生産する。図4は、追加的なGlyを持つEGFP蛋白質(EGFPmut2)が蛍光を発することを示す結果である。一方、フレームシフト突然変異のための6個のグアノシンを有する頻発部位(hot spot)DNA配列を製作した。したがって、5個のグアノシンを有するEGFPmut2から−1Gフレームシフト突然変異が誘発されてEGFPmut3が製作された。この場合、EGFP蛋白質翻訳がGly51以後の10番目のアミノ酸である62番目のアミノ酸で中断される。この蛋白質は非蛍光性を有するものと分かった(図4)。5個のグアノシンを保有するEGFPmut3はフレームシフト突然変異の検出に用いられる株であるhisD6610と類似するものと予想された。
【0063】
EGFPmutを保有するサルモネラティフィムリウムテスト株を用いた遺伝毒性テスト
次に、エームステストと類似の突然変異テスト株を確立するためにEGFPmut遺伝子を関連サルモネラティフィムリウムの染色体に移した。EGFPmut遺伝子が野生型サルモネラ(LT2)染色体の上のputAP位置(Elliott、1992)に入るようにλレッドシステムを用いた線形DNA形質転換方法(Datsenko and Wanner、2000)を実施した。一般的な形質導入ファージであるP22を用いてEGFPmut1及びEGFPmut3遺伝子を各々TA100及びTA98に挿入させてCH4001及びCH4003を製作した。
【0064】
本発明者らは突然変異誘発因子(ENU及びICR191)の存在下で従来のエームステスト株であるTA100及びTA98と一緒にCH4001及びCH4003の突然変異頻度をテストした。ENUは塩基−対の置換を誘発するものと知られている一方、ICR191はフレームシフト突然変異を誘発するものと知られている(OECD、1997)。最小培地プレートの下でHis+復帰突然変異体(revertants)を選択し、約106コロニーを個別的に視覚化できるNAプレートでEGFP+復帰突然変異体をスクリーニングした。突然変異誘発因子の不在下で、His+及びEGFP+復帰突然変異体は全てTA及びCH株で1.1〜1.8×10−6の頻度で発生した(表3)。ENU(0.1mg/プレート)の存在下で、塩基置換用テスト株であるTA100及びCH4001でHis+復帰突然変異体の頻度は各々5.6×10−6及び5.2×10−6に増加した。このような復帰頻度は、以前の報告(Lang、1984)で報告された範囲内にあるものである。非常に興味深くても、本発明者らはENUの存在下でEGFP+復帰突然変異体も7.1×10−6の頻度で類似するように増加した。TA98及びフレームシフト突然変異用テスト株であるCH1003をICR191(1mg/プレート)と反応させた。His+復帰突然変異体は以前の報告(Hera and Pueyo、1988)と類似するように420.8×10−6の突然変異頻度で増加した。また、TA98でHis+復帰突然変異体が327.6×10−6の突然変異頻度で増加した。ICR191の存在下で、EGFP+復帰突然変異体は456.3×10−6の突然変異頻度で類似するように増加した。総合して見ると、前述した結果はHis+復帰突然変異においてCH4001及びCH4003がTA100及びTA98と機能的類似体ということを表した。したがって、CH株等のEGFP+復帰突然変異システムはエームステストのHis+復帰突然変異システムを置換することができる。
【0065】
【表3】

【0066】
遺伝子を保有するトランスジェニックゼブラフィッシュを用いた細胞毒性テスト
本発明者らはEGFPmutをコードするTo12プラスミド及びトランスポサーゼmRNAを単一細胞段階ゼブラフィッシュ受精卵に注入した。実験プロトコルに記載されたように、生殖系列伝達によるF1子孫をPCR及びサダンブロット分析により選択した。1つの高い導入遺伝子(transgene)−陽性系列を同定した。この系列のF3子孫をF2ゼブラフィッシュと非トランスジェニックゼブラフィッシュとを交配させて得た場合、F2ゼブラフィッシュはF3子孫ゼブラフィッシュの約50%に導入遺伝子を伝達したが、これは導入遺伝子が安定的にゼブラフィッシュ染色体のうちの1つに統合されることを表す。結果的に、本発明者らはEGFPmut1を保有するMutaFish1及びEGFPmut3を保有するMutaFish3を確立した。
【0067】
これらトランスジェニックゼブラフィッシュを用いてインビボで突然変異を検出できるか否かを調べるために、トランスジェニックゼブラフィッシュと非トランスジェニックゼブラフィッシュとを交尾させて得た24時間胚に突然変異誘発因子を30分間処理した:5mM ENUで処理されたMutaFish1及び10mM ICR191で処理されたMutaFish3。3日後、EGFP+稚魚の数を測定した(表4)。突然変異誘発因子の不在下で発生する突然変異体の頻度のバックグラウンドは約2〜3×10−5であった。この値はマウスシステム(Gondo,Shioyama,et al.,1996)及びrplSを保有するトランスジェニックゼブラフィッシュ(Amanuma,Takeda,et al.,2000)で観察される値と類似しており、処理された胚のゲノムDNAで突然変異を検出するには非常に低い値である。ENUで処理されたMutaFish1は6.3×10−4の頻度でEGFP+ラルヴァの数を増加させたが、これは形態学的異常の増加(20.9%)と関連していた。これはrplSを保有するトランスジェニックゼブラフィッシュでの結果と類似している(Amanuma,Takeda,et al.,2000)。ICR191で処理されたMutaFish3は2.32×10−3の頻度でEGFP+稚魚の数を増加させたが、これは形態学的異常の増加(24.2%)と関連していた。総合して見ると、前述したデータはMutaFishシステムがアルキル化剤及び塩基性付加物を含む突然変異−誘発性化合物(mutagenic compounds)の遺伝毒性を調べることに利用できることを表した。
【0068】
【表4】

【0069】
ディスカッション
EGFP復帰突然変異システムを用いるMutaFishシステムは遺伝毒性テストのための選択的動物テストを提供する。MutaFishシステムの最も大きい長所は遺伝毒性の視覚化ということができる:UV光の下でEGFP+稚魚の定量化は化学物質の遺伝毒性の反映であり、稚魚に対するいかなる追加的な操作も必要としない。医薬品を登録するための調節システムは遺伝毒性テストを実施する必要があるが(Billinton,Hastwell,et al.,2008;CPM/ICH 1995)、このようなテストはゲノムを損傷させたり、又は他の方法を通じてゲノムを修飾させて癌発病率(carcinogenicity)及び/又は遺伝性突然変異の危険を増加させる化合物を同定するために考案された。例え化学物質の環境的な危険を予測する多様な選択的接近方法が用いられるが、本発明者らは本研究でMutaFishが最も便利な動物アッセイシステムということを証明した。ゼブラフィッシュは利用可能な研究内容、技法、及び接近方法的な面で独特である。しかしながら、本発明でゼブラフィッシュに適用されたEGFPmutシステムを用いた本発明の視覚的技法はメダカ(medaka;Oryzias latipes)及びファットヘッドミノー(fathead Minnow;Pimephales promelas)のような他の実験モデルフィッシュ種にも適用できる。また、これら種の稚魚が稚魚/成魚に対する急性毒性テストを置換することができる方法として提案できる(Braunbeck,Boettcher,et al.,2005;Scholz,Fischer,et al.,2008)。
【0070】
MutaFishシステムの感度(sensitivity)を向上させるために、今後DNA復旧酵素に欠陥を有するフィッシュが考慮されなければならない。多くのインビボマウスモデルで、次の株が開発されてより効果的に多くの毒性化学物質を検出することに利用されてきた:XPA−/−、XPC−/−、Msh2+/−、Msh2−/−、及びp53+/−突然変異マウス、Apc(ApcΔ716、Apc1638N、Apcmin)突然変異マウス、A33Δ_β−catノックイン(knock−in)マウス(Dashwood、2003)。これらのうち、いろいろなモデルが腫瘍形成(tumorigenesis)のターゲット及び非ターゲット器官で化学物質によりインビボで誘発された突然変異スペクトラムに対する考察を提供した。また、DNA復旧システムに含まれるが、まだ同定されない他の遺伝子等も検出感度のさらなる向上のためにMutaFishでテストできる。
【0071】
本研究で、本発明者らが蛍光GFPの利点を利用したとしても、本発明の技法は一連のGFP変異体(Shaner,Steinbach,et al.,2005)及びホタルルシフェラーゼ及びレニラルシフェラーゼを含む光発生蛋白質のような他の蛍光蛋白質に拡張できる。また、本研究で記載されない蛍光を無くすことができるGFPの更に他の突然変異が本発明より化学物質への曝露に対し、より高い復帰率(reversionrate)を有することも可能である。
【0072】
去る数年間、ゼブラフィッシュは発生を研究するモデルとして生物学者にその重要性が非常に大きい手段となったが、その理由はゼブラフィッシュの胚が透明で、かつ早く発生し、ゼブラフィッシュの遺伝子がヒトと非常に類似(約75%)し、脊椎動物であるためである(Bradbury,2004;Scholz,Fischer,et al.,2008)。発生する胚が毒性損傷に非常に敏感であるという事実を考慮する時、化学物質の遺伝毒性を視覚化するに当たってゼブラフィッシュシステムは魅力的なインビボモデルである。最近に実験及び他の科学的目的として用いられる動物の保護のためのヨーロッパ連合法律によれば、脊椎動物の胚段階での利用は規制されなかった(Commission of the European Communities、1986)。したがって、胚を用いた実験は動物実験に対する代替手段として考慮されている(Fleming、2007)。したがって、修飾されたフローサイトメトリー法を用いて小規模(small−scale)、高速(high−throughput)分析を実施できるという点でMutaFishシステムは化学物質の環境的危険評価のための卓越なモデルである。
【0073】
以上、本発明の特定の部分を詳細に記述したところ、当業界の通常の知識を有する者に当たってこのような具体的な技術は単に好ましい具現例であるだけであり、これに本発明の範囲が制限されるものでないことは明白である。したがって、本発明の実質的な範囲は添付された請求項とその等価物により定義されるべきである。
【0074】
参考文献
Amanuma,K.,H.Takeda,et al.(2000).“Transgenic zebrafish for detecting mutations caused by compounds in aquatic environments.”Nat Biotechnol,18(1):62−5.
Ames,B.N.,W.E.Durston,et al.(1973).“Carcinogens are mutagens: a simple test system combining liver homogenates for activation and bacteria for detection.”Proc Natl Acad Sci USA,70(8):2281−5.
Billinton,N.,P.W.Hastwell,et al.(2008).“Interlaboratory assessment of the GreenScreen HC GADD45a−GFP genotoxicity screening assay: an enabling study for independent validation as an alternative method.”Mutat Res,653(1−2):23−33.
Bradbury,J.(2004).“Small fish, big science.”PLoS Biol,2(5):E148.
Braunbeck,T.,M.Boettcher,et al.(2005).“Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi−species −− an update.”ALTEX,22(2):87−102.
Commission of the European Communities(1967).“Council Directive 67/548/EEC of 18 August 1967 on the approximation of the laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances.”Official Journal of the European Communities,L96/1.
Commission of the European Communities (1986).“Council Directive 86/609/EEC of 24 November 1986 on the approximation of the laws, regulations and administrative provisions of the Member States regarding the protection of animals used for experimental and other scientific purposes.”Official Journal,L358,18/12/1986 P.0001−0028.
Commission of the European Communities(1991).“Council Directive 91/414/EEC of 15 July 1991 concerning the placing of plant protection products on the market.”Official Journal of the European Communities,L230/1.
Commission of the European Communities(1992).“Council Directive 92/32/EEC of 30 April 1992 amending for the seventh thime Directive 67/548/EEC on the laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances.”
Commission of the European Communities(1993a).“Council Regulation 793/93/EEC of 23 March 1993 on the evaluation and control of risks of existing substances.”Official Journal of the European Communities,L84/1.
Commission of the European Communities (1993b).“Commision Directive 93/67/EEC of 20 July 1993, laying down the principles for assessment of risks to man and the environment of substances notified in accordance with Council Directive 67/548/EEC.”Official Journal of the European Communities,L227/9.
Commission of the European Communities(1994).“Regulation 1488/94/EEC of 28 June 1994, laying down the principles for assessment of risks to man and the environment of substances notified in accordance with Council Directive 793/93/EEC.”Official Journal of the European Communities,L161/3.
CVMP/VICH (2000).Guideline on environmental impact assessment (EIAS) for veterinary medicinal products−phase I. VICH Topic GL6 (Ecotoxicity Phase I) Step 7(CVMP/VICH/592/98).
Dashwood,R.H.(2003).“Use of transgenic and mutant animal models in the study of heterocyclic amine−induced mutagenesis and carcinogenesis.”J Biochem Mol Biol,36(1):35−42.
Datsenko,K.A.and B.L.Wanner(2000).“One−step inactivation of chromosomal genes in Escherichia coli K−12 using PCR products.”Proc Natl Acad Sci USA,97(12):6640−5.
Davis,R.W.,D.Botstein,J.R.Roth(1980).Advanced Bacterial Genetics: A manual for genetic Engineering.New York,Cold Spring Harbor Laboratory Press.
Dunnett,C.W.(1955).“A Multiple Comparison Procedure for Comparing Several Treatments with a Control.”Journal of the American Statistical Association,50(272):1096−1121.
Dunnett,C.W.(1964).“New Tables for Multiple Comparisons with a Control.”Biometrics,20(3):482−491.
Elliott,T.(1992).“A method for constructing single−copy lac fusions in Salmonella typhimurium and its application to the hemA−prfA operon.”J Bacteriol,174(1):245−53.
EMEA/CHMP(2006).Guideline on environmental impact assessment of medicinal products for human use.Doc.ref.EMEA/CHMP/SWP/4447/00.
Fisher,S.,E.A.Grice,et al.(2006).“Evaluating the biological relevance of putative enhancers using Tol2 transposon−mediated transgenesis in zebrafish.”Nat Protoc,1(3):1297−305.
Fleming,A.(2007).“Zebrafish as an alternative model organism for disease modelling and drug discovery: implications for the 3Rs.”NC3Rs www.nc3rs.org.uk(10).
Gondo,Y.,Y.Shioyama,et al.(1996).“A novel positive detection system of in vivo mutations in rpsL (strA) transgenic mice.”Mutat Res,360(1):1−14.
Gossen,J.A.,W.J.de Leeuw,et al.(1989).“Efficient rescue of integrated shuttle vectors from transgenic mice: a model for studying mutations in vivo.”Proc Natl Acad Sci USA,86(20):7971−5.
Hera,C.and C.Pueyo(1988).“Response of the L−arabinose forward mutation assay of Salmonella typhimurium to frameshift−type mutagens.”Mutat Res,203(1):39−45.
Isono,K.and J.Yourno(1974).“Chemical carcinogens as frameshift mutagens: Salmonella DNA sequence sensitive to mutagenesis by polycyclic carcinogens.”Proc Natl Acad Sci USA,71(5):1612−7.
Joseph Sambrook,D.W.R.(2001).Molecular Cloning a laboratory manual.New York,Cold Spring Harbor laboratory Press.3.
Kirkland,D.J.(1994).“Statistical evaluation of mutagenicity test data: recommendations of the U.K. Environmental Mutagen Society.”Environ Health Perspect,102 Suppl1:43−7.
Kohler,S.W.,G.S.Provost,et al.(1991).“Spectra of spontaneous and mutagen−induced mutations in the lacI gene in transgenic mice.”Proc Natl Acad Sci USA,88(18):7958−62.
Kwan,K.M.,E.Fujimoto,et al.(2007).“The Tol2kit: a multisite gateway−based construction kit for Tol2 transposon transgenesis constructs.”Dev Dyn,236(11):3088−99.
Lang,R.(1984).“The mammalian spot test and its use for testing of mutagenic and carcinogenic potential: experience with the pesticide chlordimeform, its principal metabolites and the drug lisuride hydrogen maleate.”Mutat Res,135(3):219−24.
Levin,D.E.,E.Yamasaki,et al.(1982).“A new Salmonella tester strain, TA97, for the detection of frameshift mutagens. A run of cytosines as a mutational hot−spot.”Mutat Res,94(2):315−30.
Maron,D.M.and B.N.Ames(1983).“Revised methods for the Salmonella mutagenicity test.”Mutat Res,113(3−4):173−215.
Nohmi,T.,M.Katoh,et al.(1996).“A new transgenic mouse mutagenesis test system using Spi− and 6−thioguanine selections.”Environ Mol Mutagen,28(4):465−70.
OECD(1997).OECD Guidelines for Testing of Chemicals.,Test 471,Bacterial Reverse Mutation Test.
Scholz,S.,S.Fischer,et al.(2008).“The zebrafish embryo model in environmental risk assessment−−applications beyond acute toxicity testing.”Environ Sci Pollut Res Int,15(5):394−404.
Shaner,N.C.,P.A.Steinbach,et al.(2005).“A guide to choosing fluorescent proteins.”Nat Methods,2(12):905−9.
Tsien,R.Y.(1998).“The green fluorescent protein.”Annu Rev Biochem,67:509−44.
VICH(2004).The European Agency for the Evaluation of Medicinal Products:environmental impact assessment for veterinary medicinal products.Phase II guidance.VICH Topic GL38(Ecotoxicity Phase II)Step7(CVMP/VICH/790/03−final).
W.Barnes,E.T.,E.Eisenstadt(1982).“Base−sequence analysis of His+ revertants of the hiG46 missense mutation in Salmonella typhimurium.”Environ Mutagen,4(3):297(abstr.Aa−1).
Yang,T.T.,L.Cheng,et al.(1996).“Optimized codon usage and chromophore mutations provide enhanced sensitivity with the green fluorescent protein.”Nucleic Acids Res,24(22):4592−3.
【技術分野】
【0001】
本発明は非蛍光性蛍光蛋白質を用いた遺伝毒性を判定するための方法に関する。
【背景技術】
【0002】
周辺環境への化学物質の流入は環境及び人間健康に甚大な危険をもたらす。したがって、ヨーロッパ及び他の産業国家の最近の法律は、化学物質、殺虫剤、殺生物剤、及び医薬品の登録のために危険性評価データを要求している(Commission of the European Communities、1967、1991、1992、1993a、b、1994;CVMP/VICH、2000;EMEA/CHMP、2006;VICH、2004)。化学物質の毒性を評価するために開発された多様な遺伝毒性アッセイのうちからエームスアッセイ(Ames assay)が最も頻繁に用いられている(非特許文献1及び2)。この方法は、ヒスチジンが欠乏された培養で成長を定量することで、サルモネラティフィムリウム(Salmonella typhimurium)の欠損突然変異体(defective mutant)のhis遺伝子で点突然変異の回復(reversal)を検出することに基づく。しかしながら、エームスアッセイは次のような重大な欠点を持っている:サルモネラは発癌前駆物質(procarcinogens)を活性代謝物質(reactive metabolites)に転換させることに必要な脊椎動物の細胞内の機能を有しない。したがって、MutaMouse(非特許文献3)、BigBlue mouse(非特許文献4)、gpt−Δトランスジェニックマウスシステム(非特許文献5)、及びrpsLトランスジェニックゼブラフィッシュ(非特許文献6)のような多様なトランスジェニック動物システムが開発された。しかしながら、前述した全てのシステムにおいて、トランスジェニックレポーター遺伝子は全て原核細胞起源で動物器官からDNAを抽出した後、適切なテストバクテリア(E.coli)に導入されて評価されなければならなかった。
【0003】
本明細書の全体に亘って多数の論文及び特許文献が参照され、その引用が表示されている。引用された論文及び特許文献の開示内容は、その全体として本明細書に参照にして挿入されて本発明が属する技術分野の水準及び本発明の内容がより明確に説明される。
【先行技術文献】
【非特許文献】
【0004】
【非特許文献1】Ames、Durston et al.,1973
【非特許文献2】Maron and Ames、1983
【非特許文献3】Gossen、de Leeuw et al.,1989
【非特許文献4】Kohler、Provost et al.,1991
【非特許文献5】Nohmi、Katoh et al.,1996
【非特許文献6】Amanuma、Takeda et al.,2000
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明者らは、試験物質の遺伝毒性を判定するための新規な方法を開発しようと努力した。その結果、本発明者らは蛍光蛋白質変異体、好ましくはEGFP(enhanced green fluorescent protein)変異体(EGFPmut)に形質転換された細胞、又はゼブラフィッシュを用いた遺伝毒性を判定するための方法(例えば、MutaFishモデル)を開発し、これを用いて試験物質の遺伝毒性をEGFP復帰突然変異体の蛍光により視覚化することができ、以前のモデルと比較して、より敏感で、かつ容易に遺伝毒性をテストすることができるということを見出し、本発明の完成に至った。
【0006】
本発明の目的は、遺伝毒性を判定するための方法を提供することにある。
【0007】
本発明の他の目的は、遺伝毒性を判定するための組成物を提供することにある。
【0008】
本発明の更に他の目的は、野生型EGFP変異体(EGFPmut)を提供することにある。
【0009】
本発明の他の目的及び利点は、以下の発明の詳細な説明、請求範囲、及び図面により、一層明らかになる。
【図面の簡単な説明】
【0010】
【図1】図1は、pEGFPmut::CATのベクターマップを示す。cat遺伝子はpEGFP(Clonetech)のstuI位置にクローニングされた。
【図2】図2は、変異体EGFPmutのDNA配列が表示された野生型EGFPのDNA(A)及びアミノ酸配列(B)を示すものである。EGFPmut1の場合、137番目のロイシンがプロリンに置換された突然変異[L137P(CTG to CCC)]を含み、EGFPmut2の場合、51番目Glyの次に、もう1つのGlyが追加された突然変異(TG51GKLPVPWPT)であり、EGFPmut3の場合、51番目Glyの次に2つのGlyが追加された−1フレームシフト突然変異である。EGFPmut2の蛋白質翻訳は、51番目Glyの以後、10番目アミノ酸である62番目のアミノ酸で中断される。EGFPmut3の配列は、次の通りである:NH2−MVSKGEELFTGVVPILVELDGDVNGHKFSVSGEGEGDATYGKLTLKFICTTGGSCPCPGPPS−OH。
【図3】図3は、pCMV−Mut−EGFP::pCMLC2−mCherryのベクターマップを示す。EGFPmutはto12キット内の2つのatt位置の間にクローニングされた。
【図4】図4は、UV光の下でEGFP変異体プラスミドを保有するサルモネラLT2株を観察した結果である。使用したプラスミドは以下の通りである:A、pEGFP::cat;B、pEGFPmut1::cat;C、pEGFPmut3::cat;D、pEGFPmut2::cat。
【発明を実施するための形態】
【0011】
本発明の一態様によれば、本発明は下記工程を含む試験物質の遺伝毒性を判定するための方法を提供する:(a)変異(mutation)がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で魚類を形質転換させる工程;(b)上記形質転換された魚類を試験物質で処理する工程;及び(c)で処理された魚類内の蛍光を測定する工程であって、前記蛍光が、前記試験物質で処理された魚類において、前記導入されたヌクレオチド配列の復帰変異(back mutation)により前記非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されることにより発生する工程。
【0012】
本発明の他の態様によれば、本発明は変異がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で形質転換された魚類を含み、上記形質転換された魚類を試験物質で処理して復帰変異(back mutation)の発生を観察することを特徴とする遺伝毒性を判定するための組成物を提供する。
【0013】
本発明の更に他の態様によれば、本発明はEGFP変異体(EGFPmut)をコードする配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列を提供する。
【0014】
本発明者らは、試験物質に対する新規な遺伝毒性を判定するための方法を開発しようと努力した。その結果、本発明者らは、蛍光蛋白質変異体、好ましくはEGFP(enhanced green fluorescent protein)変異体(EGFPmut)に形質転換された細胞又はゼブラフィッシュを用いた遺伝毒性を判定するための方法(例えば、MutaFishモデル)を開発し、これを用いて試験物質の遺伝毒性をEGFP復帰突然変異体の蛍光で視覚化することができ、以前のモデルと比較して、より敏感で、かつ容易に遺伝毒性をテストすることができることを見出した。
【0015】
化学物質がDNAと反応する程度又はDNAを修飾させる程度を測定するための短期試験(short−term test)方法が開発されてきたものであり、このような方法を用いて得られた陽性結果は、化学物質の発癌性を十分に立証することはできないが、可能性を提示し、たびたび動物生体定量のための化学物質選択に利用されてきた。このような短期試験方法で、突然変異原性試験(例:エームステスト)、染色体効果試験(例:染色体の数又は構造変化を測定)、哺乳動物細胞形質転換試験(例:細胞の変化を測定)などがある。
【0016】
これら短期試験方法のうち、エームステストは化学物質が発癌物質か否かを評価するために用いられる最も一般的な方法である。エームステストによれば、化学物質のサルモネラティフィムリウム株の特定遺伝因子に対する復帰突然変異(back mutation又はrevertants)誘発程度を測定する。エームステストで陽性結果を表す化学物質は、約90%以上の場合、動物実験で発癌性を示す。エームステストは、次のような長所を有する:(a)低廉な費用;(b)容易性;及び(c)迅速性。しかしながら、エームステストは次のような致命的な欠点を有する。エームステストで用いられるサルモネラは原核生物であるので、真核生物(例えば、人間)の細胞内の機能を正常に反映できない。例えば、サルモネラは発癌前駆物質(procarcinogens)を活性代謝物質(reactive metabolites)に転換させることに必要な脊椎動物の細胞内の機能を遂行することができない。したがって、本発明者らは前述した短所を克服するために変異がある非蛍光性蛍光蛋白質を用いて試験物質の遺伝毒性を判定するための新規な方法を開発した。
【0017】
本発明は野生型EGFP変異体(EGFPmut)に形質転換された細胞(例:サルモネラティフィムリウム;CH4001及びCH4003株)又は魚類(例:MutaFish)を用いた試験物質の遺伝毒性を判定するための方法を提供する。
【0018】
本発明によれば、本発明は下記工程を含む遺伝毒性を判定するための方法を提供する:
(a)変異(mutation)がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列に細胞又は魚類を形質転換させる工程;
(b)上記形質転換された細胞又は魚類を試験物質で処理する工程;及び
(c)上記試験物質が処理された細胞又は魚類内の蛍光を測定する工程であって、前記蛍光が、前記試験物質で処理された魚類において、上記導入されたヌクレオチド配列の復帰変異(back mutation)により上記非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されることにより発生する工程。
【0019】
前述したように、試験物質が突然変異誘発因子として機能しているか否かを調べる最も簡単な方法は、細菌の栄養性突然変異体を使用して復帰(reversion)実験を実施する方法(例えば、エームステスト)である。最も簡単な復帰実験は一定数の突然変異体の細菌を突然変異誘発物質が入っている培地で培養しながら、そこで生じる復帰突然変異体(revertants)の数をカウンティングするものである。試験物質が突然変異誘発因子の場合、復帰突然変異体の数は試験物質で処理されない培地より増加する。
【0020】
本発明者らは、非蛍光性蛍光蛋白質を細胞又は魚類に形質転換させて得た形質転換体を用いて試験物質の遺伝毒性をより効率的に判定する方法を開発し、本発明の方法は、上記非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されて発生する蛍光を通じた視覚化により、一層容易で、かつ速かに遺伝毒性を判定することができる。したがって、本発明の方法は従来技術(エームステスト)の限界点である原核細胞を利用し、したがって、真核生物に適用できないという限界点を克服できる非常に優れる方法である。
【0021】
本明細書で、用語“変異(mutation)”又は“突然変異(mutation)”は、本発明で利用できる非蛍光性蛍光蛋白質をコードするヌクレオチド配列で発生する変異を意味し、好ましくは、形質転換された細胞又は魚類で上記非蛍光性蛍光蛋白質が蛍光性蛋白質に復帰される変異(back mutation又はrevertant)を意味する。
【0022】
一般に、DNA変異は多様な因子(例えば、紫外線、ウイルス、トランスポゾン、突然変異誘発物質など)により誘発され、生物体自体(例えば、細胞内に発生する超突然変異(hyper mutation))により誘発できる。また、突然変異は多様な形態にDNA配列の変化をもたらすことができる。例えば、ナンセンス突然変異、フレームシフト突然変異、ミスセンス突然変異などがある。ミスセンス突然変異は、DNA配列で1つのヌクレオチドが他のヌクレオチドに交換又は置換される点突然変異により変異されたヌクレオチドにより形成されたコドンによって発現される蛋白質が決まる。フレームシフト突然変異は、多数のヌクレオチドの挿入又は欠失により誘発される突然変異であって、挿入又は欠失されたヌクレオチドの数によって発現される蛋白質が決まる。ナンセンス突然変異は、1つのヌクレオチドが変化されて他のアミノ酸をコードするコドンへの変異を誘発する点突然変異であって、発現された変異蛋白質が元の活性を無くす場合が発生する。
【0023】
本発明の好ましい具現例によれば、本発明の変異がある非蛍光性蛍光蛋白質は野生型(wild type)蛍光蛋白質のヌクレオチド配列において(i)フレームシフト変異,又は(ii)ミスセンス変異を誘発する置換変異により変異される。本発明によれば、本発明の非蛍光性蛍光蛋白質をコードするヌクレオチド配列で生じる変異は前述した突然変異を含む。即ち、本発明で誘発された変異は試験物質により非蛍光性蛍光蛋白質をコードするヌクレオチド配列の上に多様な形態の突然変異が発生して非蛍光性蛍光蛋白質(変異体)が蛍光蛋白質に復帰されて蛍光を引き起こす。試験物質の処理により非蛍光性蛍光蛋白質(変異体)が蛍光蛋白質に復帰されて蛍光を示す場合、試験物質が形質転換された細胞又は魚類で遺伝毒性を示すことと判定され、これは試験物質が発癌物質(carcinogen)の候補物質として判断される。
【0024】
本発明の好ましい具現例によれば、本発明の復帰変異はフレームシフト変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させ、又は置換変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる。より好ましくは、本発明の復帰変異はEGFP変異体(EGFPmut)をコードする配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列がコードする非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる。本明細書の用語“置換変異(substitution mutation)”は本発明の非蛍光性蛍光蛋白質をコードするヌクレオチド配列を変異させて非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させることを意味し、これは点突然変異、挿入、又は欠失などを含み、より好ましくはミスセンス突然変異により誘発される変異を意味する。
【0025】
本発明の好ましい具現例によれば、本発明の判定方法で利用できる蛍光性蛋白質は、GFP(green fluorescent protein)、RFP(red fluorescent protein)、CFP(cyan fluorescent protein)、YFP(yellow fluorescent protein)、BFP(blue fluorescent protein)、EGFP(enhanced green fluorescent protein)、ECFP(enhanced cyan fluorescent protein)、EYFP(enhanced yellow fluorescent protein)、ERFP(enhanced red fluorescent protein)、mCherry、mTomato、又はEBFP(enhanced blue fluorescent protein)を含むが、これに限定されるものではない。最も好ましくは、本発明の蛍光性蛋白質はEGFPである。
【0026】
本発明の好ましい具現例によれば、本発明のEGFP変異体(EGFPmut)は蛍光を示さない。
【0027】
本発明の好ましい具現例によれば、本発明の方法が適用できる魚類はゼブラフィッシュを含むが、これに限定されるものではない。
【0028】
本発明の好ましい具現例によれば、本発明の方法は前述した工程(b)以後、試験物質で処理された形質転換魚類の胚を培養して孵化させて仔稚魚(flylarvae)を得る工程をさらに含む。
【0029】
本発明の好ましい具現例によれば、本発明の工程(c)で、蛍光測定は当業界に公知された多様な方法を用いて実施することができ、最も好ましくはフローサイトメトリーを用いて実施される。
【0030】
本発明のより好ましい具現例によれば、本発明は(a)前述した形質転換された細胞又は魚類に試験物質を処理する工程;及び(b)上記EGFP変異体の蛍光を測定する工程を含む突然変異誘発物質(mutagens)のスクリーニング方法であって、上記試験物質が配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列からなる野生型EGFP変異体蛋白質の蛍光を誘導すれば、突然変異誘発物質であると判断される。
【0031】
本発明の方法は、前述した本発明のEGFP変異体を有効性分として含むため、両方に重複した内容は重複記載に従う本明細書の過度な複雑性を避けるために、その記載を省略する。
【0032】
本発明のスクリーニング方法を言及しながら使われる用語“試験物質”は、多様な非蛍光性蛍光蛋白質をコードするヌクレオチド配列又はそれらの相補的なヌクレオチド配列、又は前述したヌクレオチド配列がコードするアミノ酸配列からなる非蛍光性蛍光蛋白質で変異を誘発して復帰突然変異体を発生させる未知の物質を意味し、より好ましくは、図2の配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列、又は配列番号3又は配列番号4のアミノ酸配列からなる野生型EGFP変異体(EGFPmut)蛋白質で変異を誘発して蛍光蛋白質を発生させる物質を意味する。
【0033】
次に、試験物質で処理された細胞又は魚類において、非蛍光性蛍光蛋白質の蛍光蛋白質への変異を蛍光で検出する。より好ましくは、前述した野生型EGFP変異体(EGFPmut)蛋白質において、非蛍光の蛍光への復帰変異を蛍光で検出する。
【0034】
上記試験物質は合成又は天然化合物のライブラリー又は天然材料から得ることができる。合成又は天然化合物のライブラリーを得る方法は当業界に公知されている。合成化合物ライブラリーは、Maybridge Chemical Co.(UK)、Comgenex(USA)、Brandon Associates(USA)、Microsource(USA)、及びSigma−Aldrich(USA)から商業的に購入可能であり、天然化合物のライブラリーはPan Laboratories(USA)、及びMycoSearch(USA)から商業的に購入可能である。
【0035】
試験物質は当業界に公知された多様な組合ライブラリー方法により得ることができ、例えば、生物学的ライブラリー、空間アドレッサブルパラレル固相又は液相ライブラリー(spatially addressable parallel solid phase or solution phase libraries)、デコンボリューションが求められる合成ライブラリー方法、“1−ビード1−化合物”ライブラリー方法、そして親和性クロマトグラフィー選別を用いる合成ライブラリー方法により得ることができる。分子ライブラリーの合成方法は、DeWitt et al.,Proc.Natl.Acad.Sci.U.S.A.90,6909,1993;Erb et al.Proc.Natl.Acad.Sci.U.S.A.91,11422,1994;Zuckermann et al.,J.Med.Chem.37,2678,1994;Cho et al.,Science 261,1303,1993;Carell et al.,Angew.Chem.Int.Ed.Engl.33,2059,1994;Carell et al.,Angew.Chem.Int.Ed.Engl.33,2061;Gallop et al.,J.Med.Chem.37,1233,1994等に提示されている。
【0036】
一方、本発明は前述したEGFP変異体を含む組み換えベクター又はその転写物により形質転換された細胞及び遺伝子導入による形質転換された細胞又は形質転換体を提供する。
【0037】
本発明の形質転換された細胞又は形質転換体は、前述した本発明のEGFP変異体を有効成分として含むため、両方に重複した内容は重複記載に従う本明細書の過度な複雑性を避けるためにその記載を省略する。
【0038】
本発明の組み換えベクターは、配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列を含む。本発明の組み換えベクターは典型的にクローニングのためのベクター又は発現のためのベクターとして構築できる。また、本発明の組み換えベクターは原核細胞又は真核細胞を宿主にして構築できる。
【0039】
好ましくは、本発明の組み換えベクターは、(i)前述した本発明の発現対象物質をコードするヌクレオチド配列;(ii)上記(i)のヌクレオチド配列に動作可能なように連結され、動物細胞で作用してRNA分子を形成させるプロモーターを含み、より好ましくは、(i)前述した本発明の配列番号1又は配列番号2のヌクレオチド配列又はそれらの相補的なヌクレオチド配列をコードするヌクレオチド配列;(ii)上記(i)のヌクレオチド配列に動作可能なように連結され、動物細胞で作用してRNA分子を形成させるプロモーター;及び(iii)動物細胞で作用して上記RNA分子の3’−末端のポリアデニル化を引き起こす3’−非翻訳部位を含む組み換え発現ベクターを含む。
【0040】
好ましくは、前述した発現対象物質は蛍光蛋白質が変異された非蛍光性蛍光蛋白質であり、上記蛍光蛋白質は、GFP、RFP、CFP、YFP、BFP、EGFP、ECFP、EYFP、ERFP、及びEBFPを含むが、これに限定されるものではない。最も好ましくは、EGFPである。
【0041】
本明細書において、用語“プロモーター”はコード配列(CDS)又は機能的RNAの発現を調節するDNA配列を意味する。本発明の組み換え発現ベクターにおける発現対象物質コードヌクレオチド配列は、上記プロモーターに動作可能なように連結される。本明細書において、用語“動作可能なように結合された(operatively linked)”は、核酸発現調節配列(例:プロモーター配列、シグナル配列、又は転写調節因子結合位置のアレイ)と他の核酸配列との間の機能的な結合を意味し、これによって上記調節配列は上記他の核酸配列の転写及び/又は翻訳を調節するようになる。
【0042】
本発明のベクターが原核細胞を宿主にする場合には、転写を進行させることができる強力なプロモーター(例えば、tacプロモーター、lacプロモーター、lac UV5プロモーター、lppプロモーター、pLλプロモーター、pRλプロモーター、rac5プロモーター、ampプロモーター、recAプロモーター、SP6プロモーター、trpプロモーター、T7プロモーターなど)、翻訳のためのリボゾーム結合部位及び転写/翻訳終結配列を含むことが一般的である。より好ましくは、本発明で用いられる宿主細胞はサルモネラであり、最も好ましくはサルモネラティフィムリウムLT2株である。この際、本発明で用いられるプロモーターには、lacプロモーターが好ましい。また、宿主細胞としてE.coliが用いられる場合、E.coliトリプトファン生合成経路のプロモーター及びオペレーター部位(Yanofsky,C.,J.Bacteriol.,158:1018−1024(1984))、そしてファージλの左向プロモーター(pLλプロモーター、Herskowitz,I.and Hagen,D.,Ann.Rev.Genet.,14:399−445(1980))が調節部位として利用できる。一方、本発明に利用できるベクターは当業界でたびたび使われるプラスミド(例:pSC101、ColE1、pBR322、pUC8/9、pHC79、pUC19、pETなど)、ファージ(例:λgt4λB、λ−Charon、λΔz1、及びM13など)、又はウイルス(例:SV40など)を操作して製作できる。
【0043】
本発明のベクターを宿主細胞内に保有する方法は、宿主細胞が原核細胞の場合、CaCl2方法(Cohen,S.N.et al.,Proc.Natl.Acac.Sci.USA,9:2110−2114(1973))、ハナハン方法(Cohen,S.N.et al.,Proc.Natl.Acac. Sci.USA,9:2110−2114(1973);及びHanahan,D.,J.Mol.Biol.,166:557−580(1983))及び電気穿孔方法(Dower,W.J.et al.,Nucleic.Acids Res.,16:6127−6145(1988))などにより実施できる。
【0044】
一方、本発明の組み換えベクターが魚類のような哺乳動物で適用される場合、利用できるプロモーターは、好ましくは動物細胞、より好ましくは哺乳動物細胞で作動して本発明の発現対象物質の転写を調節できるものであって、哺乳動物ウイルスから由来したプロモーター及び哺乳動物細胞のゲノムから由来したプロモーターを含み、例えば、CMV(cytomegalo virus)プロモーター、アデノウイルス後期プロモーター、ワクシニアウイルス7.5Kプロモーター、SV40プロモーター、HSVのtkプロモーター、RSVプロモーター、ヒト伸長因子アルファ(hEF1α)プロモーター、メタロチオネインプロモーター、β−アクチンプロモーター、ヒトIL−2遺伝子のプロモーター、ヒトIFN遺伝子のプロモーター、ヒトIL−4遺伝子のプロモーター、ヒトリンホトキシン遺伝子のプロモーター、及びヒトGM−CSF遺伝子のプロモーターを含むが、これに限定されるものではない。最も好ましくは、CMVプロモーター又はhEF1αプロモーターである。好ましくは、本発明に用いられる発現コンストラクトはポリアデニル化配列を含む(例:ウシ成長ホルモンターミネーター及びSV40由来ポリアデニル化配列)。
【0045】
より詳しくは、本発明の形質転換用組み換えベクターは“プロモーター−発現対象物質コードヌクレオチド配列−ポリアデニル化配列”の構造を有し、より好ましくは、“CMVプロモーター−非蛍光性蛍光蛋白質−SV40由来ポリアデニル化配列”から構成される。また、上記形質転換用組み換えベクターは、上記コンストラクトの両方にトランスポゾンエレメントを含むことができるように多位置ゲートウェイ−基盤コンストラクトキット(Fisher,et al.,2006;Kwan,et al.,2007)を用いて製造する。構築された組み換えベクターをゼブラフィッシュ系列で得られた受精卵(fertilization eggs)、より好ましくは単一細胞段階の受精卵にマイクロインジェクションさせる(Xu,Q.(1999).Microinjection into zebrafish embryos. In “Molecular Methods in Developmental Biology”(M.Guille,Ed.),Vol.127,pp.125−132.Humana Press,Inc.,Totowa,NJ.)。前述した受精卵は受精後20分間が超えない受精卵を用いて、マイクロインジェクション後、生成された胚(F1 embryos)で性成熟を誘導し、互いに交配させて形質転換された発現対象物質に対する同型接合体(homozygote)を含むF2胚を得る。以後、F2胚ゼブラフィッシュ間の交雑(in−cross)を通じてF3胚を得る。
【0046】
本発明のベクターシステムは当業界に公知された多様な方法により構築されることができ、これに対する具体的な方法は、Sambrook et al.,Molecular Cloning,A Laboratory Manual,Cold Spring Harbor Laboratory Press(2001)に開示されており、この文献は本明細書に参照として挿入される。
【0047】
本発明の組み換え発現ベクターを用いて形質転換された動物細胞の製造は、当業界に通常的に公知された遺伝子転移方法により実施できる。例えば、電気穿孔法(工法)(electroporation)、リポゾーム−媒介転移方法(Wong等、1980)、レトロウイルス−媒介転移方法(Chen,H.Y.,et al.,(1990),J.Reprod.Fert.41:173−182;Kopchick,J.J.et al.,(1991)Methods for the introduction of recombinant DNA into chicken embryos. In Transgenic Animals,ed.N.L.First&F.P.Haseltine,pp.275−293,Boston;Butterworth−Heinemann;Lee,M.−R.and Shuman,R.(1990)Proc.4th World Congr.Genet.Appl.Livestock Prod.16,107−110)及びマイクロインジェクション(Zebrafish Course,Mullins,August,2005;Xu,Q.(1999).Microinjection into zebrafish embryos. In “Molecular Methods in Developmental Biology”(M.Guille,Ed.),Vol.127,pp.125−132.Humana Press, Inc.,Totowa,NJ.)があり、より好ましくはマイクロインジェクションにより実施される。
【0048】
本発明の特徴及び利点を要約すれば、次の通りである:
(a)本発明は、蛍光蛋白質変異体、好ましくは野生型EGFP変異体(EGFPmut)を用いた遺伝毒性を判定するための方法に関する。
(b)本発明によれば、本発明の蛍光蛋白質変異体、好ましくは野生型EGFP変異体が形質転換されたゼブラフィッシュ(Danio rerio)系統であるMutaFishシステムは試験物質処理により蛍光蛋白質変異体の復帰(reversion)が誘発された蛍光仔稚魚を生産して試験物質の遺伝毒性を測定できる非常に優れる動物システムを提供する。
(c)本発明のMutaFishシステムは、従来技術(例えば、エームステスト)の限界点であった真核生物で試験物質の遺伝毒性を非常に簡単で、かつ速かに判定することができる。
【実施例】
【0049】
以下、実施形態を通じて本発明をより詳細に説明する。これら実施形態は本発明をより具体的に説明するためのものであって、本発明の要旨に従って本発明の範囲がこれら実施形態により制限されないということは当業界で通常の知識を有する者において自明である。
【0050】
(実施例)
実験材料及び実験方法
サルモネラ株
エームステスト用S.チフィムリウム株であるTA98及びTAを購入して製造者の指示によって培養した(Xenometrix AG、Switzerland)。染色体の上にEGFPmut DNAを保有するCH4001及びCH4003株(表1)を実験結果に記載した通り製造した。
【0051】
【表1】

【0052】
EGFPmutの製造
突然変異を誘発するプライマーを用いた位置指定突然変異誘発法(site directed mutagenesis)により非蛍光突然変異されたEGFPを得た。次のような4セットのプライマーを用いた:lacプロモーターの上流にpEGFP(Clontech Laboratories,Palo Alto,CA)(Yang,Cheng et al.,1996)のBamHI位置を含む正方向プライマー(プライマー1)及び停止コドンの下流にEcoRI位置を含む逆方向プライマー(プライマー4)(表2)。好ましい突然変異を含む第2セットのプライマー(プライマー2−x及びプライマー3−x)は必要な変異(change)を生産するためにデザインされた(Joseph Sambrook、2001)。EGFPmut1を製作するために、プライマー1及び3dを用いて最初のPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施し、プライマー2d及び4を用いて第2セットのPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施した。EGFPmut2を製作するために、プライマー1及び3aを用いて最初のPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施し、プライマー2a及び4を用いて第2セットのPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施した。EGFPmut3を製作するために、プライマー1及び3bを用いて最初のPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施し、プライマー2b及び4を用いて第2セットのPCR(95℃、30秒間;55℃、30秒間;72℃、1分間)を実施した。2つ反応のPCR産物を混合し、最適化してアニーリングさせ、以後、プライマー1及び4を用いた最終PCRのテンプルレートとして用いた。最終PCR産物をEcoR1及びBamH1で切断してpEGFP空ベクターに再ライゲーションさせた。前述したプラスミドはlacプロモーターの調節の下で非蛍光EGFP遺伝子を含んでいる。サルモネラ染色体にEGFPmut遺伝子を位置させるために、クロラムフェニコールアセチルトランスフェラーゼ(CAT)遺伝子をプラスミドのStuI位置に挿入させてpEGFPmut::CATプラスミドを作った(図1)。EGFPmutの配列変更は図2に記載されている。
【0053】
【表2】

【0054】
EGFPmut DNAのサルモネラ染色体への挿入
EGFPmut DNAが染色体の終結(ter)部位から約5min位離れたputA位置を用いてサルモネラティフィムリウムLT2株の染色体に挿入された(Elliott、1992)。サルモネラエンテリカ血清型ティフィムリウムのputA位置の配列を含む次のプライマーを用いてlacP−EGFPmut::CAT DNAを増幅した:5’プライマー、5’−GAAATCGCCTGTTAATGGTA CCAATAGCCTTGACGCAATAGAGTAATGACTCACTCACTCATTAGGCACCCCAGGCTTT−3’及び3’プライマー、5’−CGTCATTGTCAGTCTCTTACAGAAAGATTACACGATTATTTCA TCGGCAGGAGACGCGTAGCACCAGGCGTTTAAG−3’。前述したプライマーは、pEGFPmut::CATプラスミドをテンプレートでlacP−nonEGFP::catに隣接した50−nt又は55−ntのputA(アンダーラインした配列)、及び25−nt配列又は22−nt配列で各々構成された。1.4−kbpのPCR産物を精製してレッドヘルパープラスミド(pKD46)を有するバクテリアに電気穿孔法により形質転換した(Datsenko and Wanner、2000)。線形DNAはエームステストのサルモネラティフィムリウム株であるTA100及びTA98でp22形質導入するためのマーカーとしてクロラムフェニコール遺伝子を含み、結果的にCH4001及びCH4003を各々製造した(Davis, et al.,1980)。
【0055】
エームステスト(Ames test)
プレート−挿入アッセイ(plate−incorporation assay)を以前の記述したように実施した(OECD、1997)。簡略には、ストック溶液からバクテリア細胞を液体培地で12時間の間37℃で培養した。0.1mLのバクテリア懸濁液を0.6%アガー、0.6%NaCl、20.96μgのl−ヒスチジン及びd−バイオチン(Sigma)を含む2mLのトップアガー(Difco)培地に添加した。また、テスト溶液(又は、溶媒照合群、又は製剤陽性照合群)、及びS9−混合物(S9−mix;0.5mL/プレート;10v/v%S9;Sigma)、又はカリウムリン酸緩衝液(0.5mL/プレート;0.2M、pH7.4)(Sigma)をトップアガーに添加して混合した後、Vogel−Bonner最小培地アガープレートの塗抹した(処理実験群の場合、投与当たり独立的な3個の複製群及び溶媒照合群の場合、投与当たり独立的な6個の複製群)。コロニーを37℃で48時間の間培養した後、カウントした。プレートに添加されたテスト溶液の最も大きい容量は最初実験の場合100μLに制限し、再確認実験では200μLまで増加させた。
【0056】
S9−混合物
組成:1mLのS9−混合物は0.1mLのS9、0.01mLの0.4M MgCl2(Sigma)、0.01mLの1.65M KCl(Sigma)、0.5mLの0.2M phosphate buffer(pH7.4;Sigma)、0.04mLの0.1M NADP(Sigma)、0.005mLの1M glucose−6−phosphate(Sigma)及び0.335mLの蒸溜水を含んでいる。全ての補助因子(co−factor)は使用前に0.45−μmの滅菌膜(Millipore)を通して濾過した。
【0057】
突然変異誘発因子の製造
5mM 2−(N−モルフォリノ)エテインスルホン酸(pH6.0)(Sigma)で緩衝化した0.008% Instant Ocean salts(Senju Pharmaceutical,Hyogo,Japan)105.5mLにENU(isopack N−3385;Sigma Chemical Co.,St.Louis,MO,USA)1gを溶解させて81mM ENUのストック溶液を製造し、−80℃に格納した。2mg/mL ICR−191(Polyscience Inc.,Warrington、PA、USA)のストック溶液は10mLの滅菌蒸溜水に20mgのICR−191を溶解させて製作した。
【0058】
EGFPmutを保有するゼブラフィッシュ発現ベクターの構築
pEGFPmut::CATプラスミド内のEGFPmut遺伝子を正方向プライマー(attB1)及び逆方向プライマー(attB2)を用いてPCR増幅した。プライマー配列は、次の通りである:5’−GGGGACAAGTTTGTACAAAAAAGCAGGCTCCACCATGGTGAGCAAGGGCGAG−3’(正方向);5’−GGGGACCACTTTGTACAAGAAAGCTGGGTTGGCTGATTATGATCTAGAG−3’(逆方向)。増幅されたPCR産物をTo12プラスミドでゲートウェイクローニングしたが、EGFPmut遺伝子はCMVプロモーターにより発現された(To12キット:To12トランスポゾン形質転換コンストラクトのための多位置ゲートウェイ−基盤構築キット(Fisher,et al.,2006;Kwan,et al.,2007))。To12プラスミドは心臓−特異的CMLC2プロモーターにより調節されるmCherry遺伝子を保有するが、これは生殖系列伝逹の指示子として用いられる。最終的なコンストラクトであるpCMV−Mut−EGFP::pCMLC2−mCherry(図3)は、制限酵素切断及びDNAシーケンシングにより確認した。
【0059】
トランスジェニックゼブラフィッシュの製作
前述した通り製作されたEGFPmutプラスミドはトランスポサーゼmRNAを有するAB*ゼブラフィッシュ系列(Oregon University、Corvallis、OR、USA)で作られた単一細胞段階受精卵にマイクロインジェクションされた。マイクロインジェクションされた受精卵は、性成熟(sexual maturity)が誘発され、野生型AB*ゼブラフィッシュと交配(mate)した。以後、生成された胚(embryos)の心臓でmCherry蛍光の存否に対してスクリーニングした。突然変異されたEGFPのゲノム組込み(挿入)を確認するために、スクリーンされた胚(F1)でRT−PCR、ウェスタンブロッティング及びサザンブロッティングを実施した。F1胚にまた性成熟が誘発され、互いに交配(mate)してEGFPmutに対して同型接合であるF2胚を発生させた。F2ゼブラフィッシュ間の交配を通じて発生したF3胚で再び性成熟を誘発した。
【0060】
突然変異誘発因子の処理
受精卵を、トランスジェニックF3雌及び非トランスジェニック雄フィッシュを交配して得た。本発明者らは相変らずコリオンで囲まれた24時間胚を3グループ(266胚/グループ)に分類した後、0.1% Instant Ocean salts(Senja Pharmaceutical,Hyogo,Japan)に含まれた0、2mM、又は5mM ENU 10mLで処理して30分間26℃で反応した。以後、突然変異誘発された胚をリンスし、28.5℃培養器で3日間維持した。ほとんど全ての胚が培養期間の間に孵化した。合わせられた生存稚魚を形態的な非正常稚魚とEGFP+稚魚をカウントした。
【0061】
統計分析
全ての分析をウィンドウ統計パッケージ用 SPSS version 11.0を用いて実施した。エームステストで得られた実験的な値に対する統計的分析は、母数的方法、即ちDunnett’s t−検定(Dunnett、1955;Dunnett、1964)、及び投与量に従う反応を観察した線形回帰分析(Kirkland、1994)により実施した。SCEテストの場合、一元変量分析(ANOVA)を実施した後、Student’s t−検定及びpost−hoc Dunnett’s t−検定を遂行した。TF分析はχ2−テストを用いて実施した。実施された全てのテストで≦0.05のp−値が統計的に留意性を有することと見なした。
【0062】
実験結果
非蛍光EGFPの製造
エームステストと遺伝的に類似のEGFPを用いた視覚的遺伝毒性テストシステムを作るための試みとして、本発明者らはエームステストで採択された2つの突然変異、hisG46(TA100)及びhisD6610(TA97)に注目した。hisG46突然変異はLeu(CTC)がPro(CCC)に置換された塩基対を有し、hisD6610突然変異はC1フレームシフト突然変異により6個のシトシン(−C−C−C−C−C−C−)をもたらす。これら突然変異は、反復的なC−G−C−G−C−G−C−G−配列のリーディングフレームに影響を及ぼすhisD3052(TA98)の−1フレームシフト突然変異を復帰させる幾つかの突然変異誘発因子に感受性がある(Isono and Yourno,1974;Levin,Yamasaki et al.,1982)。本発明者らはEGFPで類似の突然変異を誘発させて非蛍光蛋白質を作るために位置指定突然変異誘発法を用いた。まず、本発明者らはhisG46突然変異と類似するようにLeu137をProに置換した。このような置換は、突然変異EGFPを非蛍光蛋白質に変化させた(図4)。これをEGFPmut1と命名し、hisG46突然変異のように突然変異誘発因子により塩基対置換を検出できることと期待した。以後、本発明者らはGFPのコア構造で空のシリンダーを形成するβ−バレルに連結されたα−ヘリックスの部位(reviewed in Tsien、1998)に位置したGly51(GGG)の次にGly(GGG)が追加された更に他の突然変異EGFPを作った。これは、Gly51(GGG)の次に追加的なグリシンがEGFP分子にほとんど影響を及ぼさないので、蛍光蛋白質を生産する。図4は、追加的なGlyを持つEGFP蛋白質(EGFPmut2)が蛍光を発することを示す結果である。一方、フレームシフト突然変異のための6個のグアノシンを有する頻発部位(hot spot)DNA配列を製作した。したがって、5個のグアノシンを有するEGFPmut2から−1Gフレームシフト突然変異が誘発されてEGFPmut3が製作された。この場合、EGFP蛋白質翻訳がGly51以後の10番目のアミノ酸である62番目のアミノ酸で中断される。この蛋白質は非蛍光性を有するものと分かった(図4)。5個のグアノシンを保有するEGFPmut3はフレームシフト突然変異の検出に用いられる株であるhisD6610と類似するものと予想された。
【0063】
EGFPmutを保有するサルモネラティフィムリウムテスト株を用いた遺伝毒性テスト
次に、エームステストと類似の突然変異テスト株を確立するためにEGFPmut遺伝子を関連サルモネラティフィムリウムの染色体に移した。EGFPmut遺伝子が野生型サルモネラ(LT2)染色体の上のputAP位置(Elliott、1992)に入るようにλレッドシステムを用いた線形DNA形質転換方法(Datsenko and Wanner、2000)を実施した。一般的な形質導入ファージであるP22を用いてEGFPmut1及びEGFPmut3遺伝子を各々TA100及びTA98に挿入させてCH4001及びCH4003を製作した。
【0064】
本発明者らは突然変異誘発因子(ENU及びICR191)の存在下で従来のエームステスト株であるTA100及びTA98と一緒にCH4001及びCH4003の突然変異頻度をテストした。ENUは塩基−対の置換を誘発するものと知られている一方、ICR191はフレームシフト突然変異を誘発するものと知られている(OECD、1997)。最小培地プレートの下でHis+復帰突然変異体(revertants)を選択し、約106コロニーを個別的に視覚化できるNAプレートでEGFP+復帰突然変異体をスクリーニングした。突然変異誘発因子の不在下で、His+及びEGFP+復帰突然変異体は全てTA及びCH株で1.1〜1.8×10−6の頻度で発生した(表3)。ENU(0.1mg/プレート)の存在下で、塩基置換用テスト株であるTA100及びCH4001でHis+復帰突然変異体の頻度は各々5.6×10−6及び5.2×10−6に増加した。このような復帰頻度は、以前の報告(Lang、1984)で報告された範囲内にあるものである。非常に興味深くても、本発明者らはENUの存在下でEGFP+復帰突然変異体も7.1×10−6の頻度で類似するように増加した。TA98及びフレームシフト突然変異用テスト株であるCH1003をICR191(1mg/プレート)と反応させた。His+復帰突然変異体は以前の報告(Hera and Pueyo、1988)と類似するように420.8×10−6の突然変異頻度で増加した。また、TA98でHis+復帰突然変異体が327.6×10−6の突然変異頻度で増加した。ICR191の存在下で、EGFP+復帰突然変異体は456.3×10−6の突然変異頻度で類似するように増加した。総合して見ると、前述した結果はHis+復帰突然変異においてCH4001及びCH4003がTA100及びTA98と機能的類似体ということを表した。したがって、CH株等のEGFP+復帰突然変異システムはエームステストのHis+復帰突然変異システムを置換することができる。
【0065】
【表3】

【0066】
遺伝子を保有するトランスジェニックゼブラフィッシュを用いた細胞毒性テスト
本発明者らはEGFPmutをコードするTo12プラスミド及びトランスポサーゼmRNAを単一細胞段階ゼブラフィッシュ受精卵に注入した。実験プロトコルに記載されたように、生殖系列伝達によるF1子孫をPCR及びサダンブロット分析により選択した。1つの高い導入遺伝子(transgene)−陽性系列を同定した。この系列のF3子孫をF2ゼブラフィッシュと非トランスジェニックゼブラフィッシュとを交配させて得た場合、F2ゼブラフィッシュはF3子孫ゼブラフィッシュの約50%に導入遺伝子を伝達したが、これは導入遺伝子が安定的にゼブラフィッシュ染色体のうちの1つに統合されることを表す。結果的に、本発明者らはEGFPmut1を保有するMutaFish1及びEGFPmut3を保有するMutaFish3を確立した。
【0067】
これらトランスジェニックゼブラフィッシュを用いてインビボで突然変異を検出できるか否かを調べるために、トランスジェニックゼブラフィッシュと非トランスジェニックゼブラフィッシュとを交尾させて得た24時間胚に突然変異誘発因子を30分間処理した:5mM ENUで処理されたMutaFish1及び10mM ICR191で処理されたMutaFish3。3日後、EGFP+稚魚の数を測定した(表4)。突然変異誘発因子の不在下で発生する突然変異体の頻度のバックグラウンドは約2〜3×10−5であった。この値はマウスシステム(Gondo,Shioyama,et al.,1996)及びrplSを保有するトランスジェニックゼブラフィッシュ(Amanuma,Takeda,et al.,2000)で観察される値と類似しており、処理された胚のゲノムDNAで突然変異を検出するには非常に低い値である。ENUで処理されたMutaFish1は6.3×10−4の頻度でEGFP+ラルヴァの数を増加させたが、これは形態学的異常の増加(20.9%)と関連していた。これはrplSを保有するトランスジェニックゼブラフィッシュでの結果と類似している(Amanuma,Takeda,et al.,2000)。ICR191で処理されたMutaFish3は2.32×10−3の頻度でEGFP+稚魚の数を増加させたが、これは形態学的異常の増加(24.2%)と関連していた。総合して見ると、前述したデータはMutaFishシステムがアルキル化剤及び塩基性付加物を含む突然変異−誘発性化合物(mutagenic compounds)の遺伝毒性を調べることに利用できることを表した。
【0068】
【表4】

【0069】
ディスカッション
EGFP復帰突然変異システムを用いるMutaFishシステムは遺伝毒性テストのための選択的動物テストを提供する。MutaFishシステムの最も大きい長所は遺伝毒性の視覚化ということができる:UV光の下でEGFP+稚魚の定量化は化学物質の遺伝毒性の反映であり、稚魚に対するいかなる追加的な操作も必要としない。医薬品を登録するための調節システムは遺伝毒性テストを実施する必要があるが(Billinton,Hastwell,et al.,2008;CPM/ICH 1995)、このようなテストはゲノムを損傷させたり、又は他の方法を通じてゲノムを修飾させて癌発病率(carcinogenicity)及び/又は遺伝性突然変異の危険を増加させる化合物を同定するために考案された。例え化学物質の環境的な危険を予測する多様な選択的接近方法が用いられるが、本発明者らは本研究でMutaFishが最も便利な動物アッセイシステムということを証明した。ゼブラフィッシュは利用可能な研究内容、技法、及び接近方法的な面で独特である。しかしながら、本発明でゼブラフィッシュに適用されたEGFPmutシステムを用いた本発明の視覚的技法はメダカ(medaka;Oryzias latipes)及びファットヘッドミノー(fathead Minnow;Pimephales promelas)のような他の実験モデルフィッシュ種にも適用できる。また、これら種の稚魚が稚魚/成魚に対する急性毒性テストを置換することができる方法として提案できる(Braunbeck,Boettcher,et al.,2005;Scholz,Fischer,et al.,2008)。
【0070】
MutaFishシステムの感度(sensitivity)を向上させるために、今後DNA復旧酵素に欠陥を有するフィッシュが考慮されなければならない。多くのインビボマウスモデルで、次の株が開発されてより効果的に多くの毒性化学物質を検出することに利用されてきた:XPA−/−、XPC−/−、Msh2+/−、Msh2−/−、及びp53+/−突然変異マウス、Apc(ApcΔ716、Apc1638N、Apcmin)突然変異マウス、A33Δ_β−catノックイン(knock−in)マウス(Dashwood、2003)。これらのうち、いろいろなモデルが腫瘍形成(tumorigenesis)のターゲット及び非ターゲット器官で化学物質によりインビボで誘発された突然変異スペクトラムに対する考察を提供した。また、DNA復旧システムに含まれるが、まだ同定されない他の遺伝子等も検出感度のさらなる向上のためにMutaFishでテストできる。
【0071】
本研究で、本発明者らが蛍光GFPの利点を利用したとしても、本発明の技法は一連のGFP変異体(Shaner,Steinbach,et al.,2005)及びホタルルシフェラーゼ及びレニラルシフェラーゼを含む光発生蛋白質のような他の蛍光蛋白質に拡張できる。また、本研究で記載されない蛍光を無くすことができるGFPの更に他の突然変異が本発明より化学物質への曝露に対し、より高い復帰率(reversionrate)を有することも可能である。
【0072】
去る数年間、ゼブラフィッシュは発生を研究するモデルとして生物学者にその重要性が非常に大きい手段となったが、その理由はゼブラフィッシュの胚が透明で、かつ早く発生し、ゼブラフィッシュの遺伝子がヒトと非常に類似(約75%)し、脊椎動物であるためである(Bradbury,2004;Scholz,Fischer,et al.,2008)。発生する胚が毒性損傷に非常に敏感であるという事実を考慮する時、化学物質の遺伝毒性を視覚化するに当たってゼブラフィッシュシステムは魅力的なインビボモデルである。最近に実験及び他の科学的目的として用いられる動物の保護のためのヨーロッパ連合法律によれば、脊椎動物の胚段階での利用は規制されなかった(Commission of the European Communities、1986)。したがって、胚を用いた実験は動物実験に対する代替手段として考慮されている(Fleming、2007)。したがって、修飾されたフローサイトメトリー法を用いて小規模(small−scale)、高速(high−throughput)分析を実施できるという点でMutaFishシステムは化学物質の環境的危険評価のための卓越なモデルである。
【0073】
以上、本発明の特定の部分を詳細に記述したところ、当業界の通常の知識を有する者に当たってこのような具体的な技術は単に好ましい具現例であるだけであり、これに本発明の範囲が制限されるものでないことは明白である。したがって、本発明の実質的な範囲は添付された請求項とその等価物により定義されるべきである。
【0074】
参考文献
Amanuma,K.,H.Takeda,et al.(2000).“Transgenic zebrafish for detecting mutations caused by compounds in aquatic environments.”Nat Biotechnol,18(1):62−5.
Ames,B.N.,W.E.Durston,et al.(1973).“Carcinogens are mutagens: a simple test system combining liver homogenates for activation and bacteria for detection.”Proc Natl Acad Sci USA,70(8):2281−5.
Billinton,N.,P.W.Hastwell,et al.(2008).“Interlaboratory assessment of the GreenScreen HC GADD45a−GFP genotoxicity screening assay: an enabling study for independent validation as an alternative method.”Mutat Res,653(1−2):23−33.
Bradbury,J.(2004).“Small fish, big science.”PLoS Biol,2(5):E148.
Braunbeck,T.,M.Boettcher,et al.(2005).“Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi−species −− an update.”ALTEX,22(2):87−102.
Commission of the European Communities(1967).“Council Directive 67/548/EEC of 18 August 1967 on the approximation of the laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances.”Official Journal of the European Communities,L96/1.
Commission of the European Communities (1986).“Council Directive 86/609/EEC of 24 November 1986 on the approximation of the laws, regulations and administrative provisions of the Member States regarding the protection of animals used for experimental and other scientific purposes.”Official Journal,L358,18/12/1986 P.0001−0028.
Commission of the European Communities(1991).“Council Directive 91/414/EEC of 15 July 1991 concerning the placing of plant protection products on the market.”Official Journal of the European Communities,L230/1.
Commission of the European Communities(1992).“Council Directive 92/32/EEC of 30 April 1992 amending for the seventh thime Directive 67/548/EEC on the laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances.”
Commission of the European Communities(1993a).“Council Regulation 793/93/EEC of 23 March 1993 on the evaluation and control of risks of existing substances.”Official Journal of the European Communities,L84/1.
Commission of the European Communities (1993b).“Commision Directive 93/67/EEC of 20 July 1993, laying down the principles for assessment of risks to man and the environment of substances notified in accordance with Council Directive 67/548/EEC.”Official Journal of the European Communities,L227/9.
Commission of the European Communities(1994).“Regulation 1488/94/EEC of 28 June 1994, laying down the principles for assessment of risks to man and the environment of substances notified in accordance with Council Directive 793/93/EEC.”Official Journal of the European Communities,L161/3.
CVMP/VICH (2000).Guideline on environmental impact assessment (EIAS) for veterinary medicinal products−phase I. VICH Topic GL6 (Ecotoxicity Phase I) Step 7(CVMP/VICH/592/98).
Dashwood,R.H.(2003).“Use of transgenic and mutant animal models in the study of heterocyclic amine−induced mutagenesis and carcinogenesis.”J Biochem Mol Biol,36(1):35−42.
Datsenko,K.A.and B.L.Wanner(2000).“One−step inactivation of chromosomal genes in Escherichia coli K−12 using PCR products.”Proc Natl Acad Sci USA,97(12):6640−5.
Davis,R.W.,D.Botstein,J.R.Roth(1980).Advanced Bacterial Genetics: A manual for genetic Engineering.New York,Cold Spring Harbor Laboratory Press.
Dunnett,C.W.(1955).“A Multiple Comparison Procedure for Comparing Several Treatments with a Control.”Journal of the American Statistical Association,50(272):1096−1121.
Dunnett,C.W.(1964).“New Tables for Multiple Comparisons with a Control.”Biometrics,20(3):482−491.
Elliott,T.(1992).“A method for constructing single−copy lac fusions in Salmonella typhimurium and its application to the hemA−prfA operon.”J Bacteriol,174(1):245−53.
EMEA/CHMP(2006).Guideline on environmental impact assessment of medicinal products for human use.Doc.ref.EMEA/CHMP/SWP/4447/00.
Fisher,S.,E.A.Grice,et al.(2006).“Evaluating the biological relevance of putative enhancers using Tol2 transposon−mediated transgenesis in zebrafish.”Nat Protoc,1(3):1297−305.
Fleming,A.(2007).“Zebrafish as an alternative model organism for disease modelling and drug discovery: implications for the 3Rs.”NC3Rs www.nc3rs.org.uk(10).
Gondo,Y.,Y.Shioyama,et al.(1996).“A novel positive detection system of in vivo mutations in rpsL (strA) transgenic mice.”Mutat Res,360(1):1−14.
Gossen,J.A.,W.J.de Leeuw,et al.(1989).“Efficient rescue of integrated shuttle vectors from transgenic mice: a model for studying mutations in vivo.”Proc Natl Acad Sci USA,86(20):7971−5.
Hera,C.and C.Pueyo(1988).“Response of the L−arabinose forward mutation assay of Salmonella typhimurium to frameshift−type mutagens.”Mutat Res,203(1):39−45.
Isono,K.and J.Yourno(1974).“Chemical carcinogens as frameshift mutagens: Salmonella DNA sequence sensitive to mutagenesis by polycyclic carcinogens.”Proc Natl Acad Sci USA,71(5):1612−7.
Joseph Sambrook,D.W.R.(2001).Molecular Cloning a laboratory manual.New York,Cold Spring Harbor laboratory Press.3.
Kirkland,D.J.(1994).“Statistical evaluation of mutagenicity test data: recommendations of the U.K. Environmental Mutagen Society.”Environ Health Perspect,102 Suppl1:43−7.
Kohler,S.W.,G.S.Provost,et al.(1991).“Spectra of spontaneous and mutagen−induced mutations in the lacI gene in transgenic mice.”Proc Natl Acad Sci USA,88(18):7958−62.
Kwan,K.M.,E.Fujimoto,et al.(2007).“The Tol2kit: a multisite gateway−based construction kit for Tol2 transposon transgenesis constructs.”Dev Dyn,236(11):3088−99.
Lang,R.(1984).“The mammalian spot test and its use for testing of mutagenic and carcinogenic potential: experience with the pesticide chlordimeform, its principal metabolites and the drug lisuride hydrogen maleate.”Mutat Res,135(3):219−24.
Levin,D.E.,E.Yamasaki,et al.(1982).“A new Salmonella tester strain, TA97, for the detection of frameshift mutagens. A run of cytosines as a mutational hot−spot.”Mutat Res,94(2):315−30.
Maron,D.M.and B.N.Ames(1983).“Revised methods for the Salmonella mutagenicity test.”Mutat Res,113(3−4):173−215.
Nohmi,T.,M.Katoh,et al.(1996).“A new transgenic mouse mutagenesis test system using Spi− and 6−thioguanine selections.”Environ Mol Mutagen,28(4):465−70.
OECD(1997).OECD Guidelines for Testing of Chemicals.,Test 471,Bacterial Reverse Mutation Test.
Scholz,S.,S.Fischer,et al.(2008).“The zebrafish embryo model in environmental risk assessment−−applications beyond acute toxicity testing.”Environ Sci Pollut Res Int,15(5):394−404.
Shaner,N.C.,P.A.Steinbach,et al.(2005).“A guide to choosing fluorescent proteins.”Nat Methods,2(12):905−9.
Tsien,R.Y.(1998).“The green fluorescent protein.”Annu Rev Biochem,67:509−44.
VICH(2004).The European Agency for the Evaluation of Medicinal Products:environmental impact assessment for veterinary medicinal products.Phase II guidance.VICH Topic GL38(Ecotoxicity Phase II)Step7(CVMP/VICH/790/03−final).
W.Barnes,E.T.,E.Eisenstadt(1982).“Base−sequence analysis of His+ revertants of the hiG46 missense mutation in Salmonella typhimurium.”Environ Mutagen,4(3):297(abstr.Aa−1).
Yang,T.T.,L.Cheng,et al.(1996).“Optimized codon usage and chromophore mutations provide enhanced sensitivity with the green fluorescent protein.”Nucleic Acids Res,24(22):4592−3.
【特許請求の範囲】
【請求項1】
下記工程を含むことを特徴とする試験物質の遺伝毒性を判定するための方法:
(a)変異がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で魚類を形質転換させる工程と、
(b)前記形質転換された魚類を試験物質で処理する工程と、
(c)前記試験物質で処理された魚類内の蛍光を測定する工程であって、前記蛍光が、前記試験物質で処理された魚類において、前記導入されたヌクレオチド配列の復帰変異(back mutation)により前記非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されることにより発生する工程。
【請求項2】
蛍光性蛋白質は、GFP(green fluorescent protein)、RFP(red fluorescent protein)、CFP(cyan fluorescent protein)、YFP(yellow fluorescent protein)、BFP(blue fluorescent protein)、EGFP(enhanced green fluorescent protein)、ECFP(enhanced cyan fluorescent protein)、EYFP(enhanced yellow fluorescent protein)、ERFP(enhanced red fluorescent protein)、mCherry、mTomato、又はEBFP(enhanced blue fluorescent protein)である請求項1に記載の方法。
【請求項3】
蛍光性蛋白質は、EGFPである請求項2に記載の方法。
【請求項4】
変異がある非蛍光性蛍光蛋白質は、野生型蛍光蛋白質のヌクレオチド配列において(i)フレームシフト変異、又は(ii)ミスセンス変異を誘発する置換変異により変異された請求項1に記載の方法。
【請求項5】
復帰変異は、フレームシフト変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる請求項4に記載の方法。
【請求項6】
復帰変異は、置換変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる請求項4に記載の方法。
【請求項7】
魚類は、ゼブラフィッシュである請求項1に記載の方法。
【請求項8】
試験物質で処理される形質転換された魚類は、胚(embryo)である請求項1に記載の方法。
【請求項9】
方法は、工程(b)以後、試験物質で処理された形質転換魚類の胚を培養して孵化させて仔稚魚(frylarvae)を得る工程をさらに含む請求項8に記載の方法。
【請求項10】
工程(c)は、試験物質で処理された魚類に対してフローサイトメトリーにより実施される請求項1に記載の方法。
【請求項11】
工程(c)は、試験物質で処理された胚を培養して孵化して得た仔稚魚に対してフローサイトメトリーにより実施される請求項9に記載の方法。
【請求項12】
変異がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で形質転換された魚類を含み、前記形質転換された魚類を試験物質で処理して復帰変異(back mutation)が生じることを観察することを特徴とする遺伝毒性を判定するための組成物。
【請求項13】
蛍光性蛋白質は、GFP、RFP、CFP、YFP、BFP、EGFP、ECFP、EYFP、ERFP、又はEBFPである請求項12に記載の組成物。
【請求項14】
蛍光性蛋白質は、EGFPである請求項13に記載の組成物。
【請求項15】
変異がある非蛍光性蛍光蛋白質は、野生型蛍光蛋白質のヌクレオチド配列において(i)フレームシフト変異、又は(ii)ミスセンス変異を誘発する置換変異により変異された請求項12に記載の組成物。
【請求項16】
変異があるEGFP蛋白質は、配列番号1又は配列番号2のヌクレオチド配列によりコードされる請求項14に記載の組成物。
【請求項17】
復帰変異は、フレームシフト変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる請求項15に記載の組成物。
【請求項18】
復帰変異は、置換変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる請求項15に記載の組成物。
【請求項19】
魚類は、ゼブラフィッシュである請求項12に記載の組成物。
【請求項20】
形質転換された魚類は、胚(embryo)である請求項19に記載の組成物。
【請求項21】
EGFP変異体(EGFPmut)をコードする配列番号1又は配列番号2のヌクレオチド配列、又はそれらの相補的なヌクレオチド配列であることを特徴とするヌクレオチド配列。
【請求項1】
下記工程を含むことを特徴とする試験物質の遺伝毒性を判定するための方法:
(a)変異がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で魚類を形質転換させる工程と、
(b)前記形質転換された魚類を試験物質で処理する工程と、
(c)前記試験物質で処理された魚類内の蛍光を測定する工程であって、前記蛍光が、前記試験物質で処理された魚類において、前記導入されたヌクレオチド配列の復帰変異(back mutation)により前記非蛍光性蛍光蛋白質が蛍光性蛋白質に変異されることにより発生する工程。
【請求項2】
蛍光性蛋白質は、GFP(green fluorescent protein)、RFP(red fluorescent protein)、CFP(cyan fluorescent protein)、YFP(yellow fluorescent protein)、BFP(blue fluorescent protein)、EGFP(enhanced green fluorescent protein)、ECFP(enhanced cyan fluorescent protein)、EYFP(enhanced yellow fluorescent protein)、ERFP(enhanced red fluorescent protein)、mCherry、mTomato、又はEBFP(enhanced blue fluorescent protein)である請求項1に記載の方法。
【請求項3】
蛍光性蛋白質は、EGFPである請求項2に記載の方法。
【請求項4】
変異がある非蛍光性蛍光蛋白質は、野生型蛍光蛋白質のヌクレオチド配列において(i)フレームシフト変異、又は(ii)ミスセンス変異を誘発する置換変異により変異された請求項1に記載の方法。
【請求項5】
復帰変異は、フレームシフト変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる請求項4に記載の方法。
【請求項6】
復帰変異は、置換変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる請求項4に記載の方法。
【請求項7】
魚類は、ゼブラフィッシュである請求項1に記載の方法。
【請求項8】
試験物質で処理される形質転換された魚類は、胚(embryo)である請求項1に記載の方法。
【請求項9】
方法は、工程(b)以後、試験物質で処理された形質転換魚類の胚を培養して孵化させて仔稚魚(frylarvae)を得る工程をさらに含む請求項8に記載の方法。
【請求項10】
工程(c)は、試験物質で処理された魚類に対してフローサイトメトリーにより実施される請求項1に記載の方法。
【請求項11】
工程(c)は、試験物質で処理された胚を培養して孵化して得た仔稚魚に対してフローサイトメトリーにより実施される請求項9に記載の方法。
【請求項12】
変異がある非蛍光性蛍光蛋白質をコードするヌクレオチド配列で形質転換された魚類を含み、前記形質転換された魚類を試験物質で処理して復帰変異(back mutation)が生じることを観察することを特徴とする遺伝毒性を判定するための組成物。
【請求項13】
蛍光性蛋白質は、GFP、RFP、CFP、YFP、BFP、EGFP、ECFP、EYFP、ERFP、又はEBFPである請求項12に記載の組成物。
【請求項14】
蛍光性蛋白質は、EGFPである請求項13に記載の組成物。
【請求項15】
変異がある非蛍光性蛍光蛋白質は、野生型蛍光蛋白質のヌクレオチド配列において(i)フレームシフト変異、又は(ii)ミスセンス変異を誘発する置換変異により変異された請求項12に記載の組成物。
【請求項16】
変異があるEGFP蛋白質は、配列番号1又は配列番号2のヌクレオチド配列によりコードされる請求項14に記載の組成物。
【請求項17】
復帰変異は、フレームシフト変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる請求項15に記載の組成物。
【請求項18】
復帰変異は、置換変異がある非蛍光性蛍光蛋白質を蛍光性蛋白質に変異させる請求項15に記載の組成物。
【請求項19】
魚類は、ゼブラフィッシュである請求項12に記載の組成物。
【請求項20】
形質転換された魚類は、胚(embryo)である請求項19に記載の組成物。
【請求項21】
EGFP変異体(EGFPmut)をコードする配列番号1又は配列番号2のヌクレオチド配列、又はそれらの相補的なヌクレオチド配列であることを特徴とするヌクレオチド配列。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2013−521491(P2013−521491A)
【公表日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2012−556031(P2012−556031)
【出願日】平成23年3月31日(2011.3.31)
【国際出願番号】PCT/KR2011/002210
【国際公開番号】WO2011/122864
【国際公開日】平成23年10月6日(2011.10.6)
【出願人】(308026861)インダストリー ファウンデーション オブ チョンナム ナショナル ユニバーシティー (9)
【Fターム(参考)】
【公表日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年3月31日(2011.3.31)
【国際出願番号】PCT/KR2011/002210
【国際公開番号】WO2011/122864
【国際公開日】平成23年10月6日(2011.10.6)
【出願人】(308026861)インダストリー ファウンデーション オブ チョンナム ナショナル ユニバーシティー (9)
【Fターム(参考)】
[ Back to top ]

