頭頸部癌の腫瘍マーカー
【課題】頭頸部癌の腫瘍マーカーの提供。
【解決手段】本発明の頭頸部癌の腫瘍マーカーは、CXCL13遺伝子、CXCL13mRNA、CXCL13タンパク質からなる群から選択される腫瘍マーカーである。本発明によれば、例えば、頭頸部癌の診断及びその予後の向上に大きく貢献でき、好ましくは、頭頸部扁平上皮癌の診断、より好ましくは、頭頸部癌の早期癌の診断の感度及び/又は精度を向上できる。
【解決手段】本発明の頭頸部癌の腫瘍マーカーは、CXCL13遺伝子、CXCL13mRNA、CXCL13タンパク質からなる群から選択される腫瘍マーカーである。本発明によれば、例えば、頭頸部癌の診断及びその予後の向上に大きく貢献でき、好ましくは、頭頸部扁平上皮癌の診断、より好ましくは、頭頸部癌の早期癌の診断の感度及び/又は精度を向上できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、頭頸部癌の腫瘍マーカーに関する。
【背景技術】
【0002】
腫瘍マーカーは一般的に癌の早期発見や治療経過のモニタリングの補助ツールとして広く用いられている。代表的な腫瘍マーカーとして、α−フェトプロテイン(AFP)、癌胎児性抗原(CEA)、cytokeratin fragment(CYFLA)、carbohydorate antigen(CA19−9)、ニューロン特異的エノラーゼ(NSE)、前立腺特異的抗原(PSA)などが挙げられる。
【0003】
一方、頭頸部領域に発生する悪性腫瘍、特に扁平上皮癌の診断補助に広く用いられる腫瘍マーカーは扁平上皮ガン抗原(SCC)であるが、感度が低く、特に早期癌では偽陰性となる症例も多い(例えば、非特許文献1〜2)。また、これまでに、頭頸部扁平上皮癌における腫瘍マーカーとして、例えばCEAなどの有用性についても様々な検討がされてきたが、早期癌では十分な感度が得られていないのが現状である(例えば、非特許文献2〜4)。
【非特許文献1】吉田英彦ら、「口腔癌診断に対する血清SCC抗原測定の意義.」 癌と化学療法 11:3595−3601,1989.
【非特許文献2】松友豊伸、「口腔扁平上皮癌におけるSCC抗原及びCEAの臨床的意義.」 日口外誌 39(3):207−214,1993.
【非特許文献3】小林 裕、「Glutathione S−transferase−π(GST−π)による口腔扁平上皮癌の診断に関する研究.」 口腔病会誌 66(1):45−56,1999.
【非特許文献4】Rosati Gら、「Use of tumor markers in the management of head and neck cancer.」 Int J Biol Markers 15(2):179−83,2000.
【発明の開示】
【発明が解決しようとする課題】
【0004】
従来の頭頸部癌の腫瘍マーカーは感度が低く、例えば、早期癌の診断ツールとして満足できるものではない。頭頸部癌の早期癌に対しても高い感度を有する腫瘍マーカーは、頭頸部癌の診断や予後の向上に極めて有用であり、その必要性は高い。
【0005】
そこで、本発明は、新規かつ有用な頭頸部癌の腫瘍マーカーを提供する。
【課題を解決するための手段】
【0006】
本発明の頭頸部癌の腫瘍マーカーは、CXCL13遺伝子、CXCL13mRNA、及びCXCL13タンパク質からなる群から選択される腫瘍マーカーである(以下、本発明の腫瘍マーカーともいう)。
【0007】
本発明の頭頸部癌の腫瘍マーカー検出用プローブは、CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含み、本発明の腫瘍マーカーの検出に使用するプローブである(以下、本発明のプローブともいう)。
【0008】
本発明の頭頸部癌の腫瘍マーカー検出用プライマーは、CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含み、本発明の腫瘍マーカーの検出に使用するプライマーである(以下、本発明のプライマーともいう)。
【0009】
本発明の頭頸部癌の腫瘍マーカー検出用マイクロアレイは、本発明のプローブが配置され、本発明の腫瘍マーカーの検出に使用するマイクロアレイである(以下、本発明のマイクロアレイともいう)。
【0010】
本発明の頭頸部癌の腫瘍マーカー検出用抗体は、CXCL13タンパク質を特異的に認識し、本発明の腫瘍マーカーの検出に使用する抗体である(以下、本発明の抗体ともいう)。
【0011】
本発明の頭頸部癌の腫瘍マーカー検出用プロテインチップは、本発明の抗体が配置され、本発明の腫瘍マーカーの検出に使用するプロテインチップである(以下、本発明のプロテインチップともいう)。
【0012】
本発明の頭頸部癌の腫瘍マーカー検出用キットは、本発明のプローブ、プライマー、マイクロアレイ、抗体、及びプロテインチップからなる群から選択される少なくとも一つを含み、本発明の腫瘍マーカーの検出に使用するキットである(以下、本発明のキットともいう)。
【0013】
本発明の頭頸部癌の腫瘍マーカーの使用方法は、被検試料を準備する準備工程、前記試料中における本発明の腫瘍マーカーを検出する検出工程、及び前記検出結果に基づいて腫瘍マーカーの陽性を判定する判定工程を含む(以下、本発明の使用方法ともいう)。
【0014】
本発明の頭頸部癌の腫瘍マーカーの発現を抑制する物質のスクリーニング方法は、被検物質と本発明の腫瘍マーカーを発現している細胞とを接触させる工程、及び前記腫瘍マーカーの発現量を減少させる被検物質を選択する工程を含む(以下、本発明のスクリーニング方法ともいう)。
【発明の効果】
【0015】
本発明によれば、例えば、頭頸部癌の診断及びその予後の向上に大きく貢献でき、好ましくは、頭頸部扁平上皮癌の診断、より好ましくは、頭頸部癌の早期癌の診断の感度及び/又は精度を向上できる。
【発明を実施するための最良の形態】
【0016】
本発明者らは、頭頸部癌の腫瘍マーカーについて鋭意研究を重ね、CXCL13が頭頸部癌の腫瘍マーカーとなり得ることを見出し、この発明に到達した。具体的には、本発明者らは、まず、正常組織と頭頸部癌の腫瘍組織において、マイクロアレイによる網羅的な遺伝子解析を行なった結果、頭頸部癌である扁平上皮癌においてのみ共通して3倍以上の発現亢進を示す遺伝子を278種類同定した。そして、それらのうち、CXCL13(chemokine(C−X−C motif)ligand 13)を新規の腫瘍マーカーとして同定した。CXCL13は、B細胞に特異的に細胞走化活性を示すケモカインとして1998年に同定され、リンパ濾胞やリンパ節形成に重要な役割を果たしていることが報告されている。しかし、固形腫瘍とりわけ頭頸部癌との関連については報告されておらず、頭頸部扁平上皮癌との関連も不明である。本発明は、頭頸部癌における新規な腫瘍マーカーとしてCXCL13を見出したことに基づくものであって、本発明によれば、頭頸部癌の診断及びその予後の向上に大きく貢献できる。
【0017】
本発明の頭頸部癌の腫瘍マーカーは、CXCL13遺伝子、CXCL13mRNA、及びCXCL13タンパク質からなる群から選択される腫瘍マーカーであり、好ましくは、頭頸部扁平上皮癌、より好ましくは、頭頸部癌の早期癌の腫瘍マーカーである。
【0018】
本発明において「頭頸部癌」とは、脳と眼を除いた首から上にできる癌をいい、一般的に、口腔癌、鼻副鼻腔癌、口唇癌、咽頭癌、喉頭癌、頭部腫瘍、耳の癌を含む。本発明において「腫瘍マーカー」とは、癌細胞の目印(マーカー)となる物質であって、癌の診断や治療の判断基準として役立つ物質の総称をいう。
【0019】
本発明において「CXCL13」は、Chemokine(C−X−C motif )ligand 13というケモカインであり、BLC(B−lymphocyto chemoattractant)又はBCA−1(B cell−atracting chemokine 1)ともいう。本発明において「CXCL13遺伝子」とは分泌性可溶性タンパク質であるCXCL13タンパク質をコードする遺伝子であり、「CXCL13mRNA」とは前記CXCL13遺伝子の転写産物であり、「CXCL13タンパク質」とは前記CXCL13mRNAの翻訳産物である。前記CXCL13遺伝子は、CXCL13タンパク質をコードするDNA及びその断片などを含み、例えば、クローニング、化学合成技術又はそれらを組み合わせて得られるようなcDNAやゲノムDNAなどが挙げられる。前記CXCL13mRNAは、NCBIの遺伝子データ−ベースにおいてAccession Number NM_006419(2007年7月10日付)として登録されており、具体的には、配列表の配列番号1の塩基配列からなるポリヌクレオチドである。前記CXCL13タンパク質は、NCBIのタンパク質データ−ベースにおいてAccession Number NP_006410として登録されており、具体的には、配列表の配列番号2のアミノ酸配列からなるポリペプチドである。前記塩基配列において、例えば、突然変異や遺伝子多型などに起因して1から数個の塩基の置換・欠失・付加などの相違があっても、本発明の腫瘍マーカーに含まれる。同じく、前記アミノ酸配列において、例えば、突然変異や遺伝子多型などに起因して1から数個のアミノ酸残基の置換・欠失・付加などの相違があっても本発明の腫瘍マーカーに含まれる。また、前記CXCL13mRNA及びCXCL13タンパク質の一部分、及び修飾されたCXCL13タンパク質、例えば、リン酸化CXCL13なども本発明の腫瘍マーカーに含まれる。
【0020】
本発明の腫瘍マーカーは、特に限定されないが、好ましくは頭頸部扁平上皮癌、さらに好ましくは頭頸部癌の早期癌の診断などに使用できる。
【0021】
本発明のプローブ及びプライマーは、CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含む。前記ポリヌクレオチドは、特に限定されないが、例えば、CXCL13遺伝子又はCXCL13mRNAの塩基配列の全体配列、部分配列、及びそれらの相補配列からなるポリヌクレオチド、並びに、前記ポリヌクレオチドにおいて1から数個の塩基が、欠失、置換若しくは付加されたポリヌクレオチドからなる群から選択されるポリヌクレオチドなどが挙げられる。(以下、本発明のプローブ用又はプライマー用ポリヌクレオチドという)。なお、前記ストリンジェントな条件は、特に限定されないが、例えば、0.3%SDSを含む5XSSC緩衝液中で熱変性し、65℃で4〜16時間ハイブリダイゼーションし、常温で0.1%SDSを含む2XSSC緩衝液及び2XSSC緩衝液で、それぞれ5分間洗浄し、0.05XSSCでリンスすることなどが挙げられる。本発明のプローブ及びプライマーは、特に限定されないが、例えば、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。
【0022】
本発明のプローブ用又はプライマー用ポリヌクレオチドは、特に限定されないが、例えば、DNA、RNA、又は、従来公知のこれらの誘導体や類縁体を使用できる。また、欠失、置換若しくは付加が可能な塩基数としては、特に限定されないが、例えば1〜10個以上であり、好ましくは1〜3個であり、より好ましくは1又は2個である。本発明のプローブ又はプライマー用ポリヌクレオチドの製造方法としては、特に限定されないが、従来公知の製造方法、例えば、化学合成や酵素合成などが挙げられる。本発明のプローブ又はプライマー用ポリヌクレオチドは、特に限定されないが、例えば、酵素標識、放射標識、及び蛍光標識などの従来公知の標識方法で標識されてもよい。
【0023】
本発明のプローブの使用方法は、特に限定されないが、例えば、後述するマイクロアレイのプローブ、又は、リアルタイムPCRのプローブとして使用することなどが挙げられる。マイクロアレイのプローブとして使用する場合、その長さとしては、特に限定されないが、例えば、10〜200ヌクレオチドであって、20〜100ヌクレオチドが好ましく、40〜80ヌクレオチドがより好ましい。また、マイクロアレイのプローブとして使用する場合は、マイクロアレイの基板に固定するための修飾がされていてもよい。前記修飾は、使用するマイクロアレイの基板の種類に応じて従来公知のものを選択できるが、例えば、プローブのポリヌクレオチドの5’又は3’側のC(3〜7)アミン化などが挙げられる。また、リアルタイムPCRのプローブとして使用する場合、本発明のプローブは、例えば、蛍光物質及びクエンチャーを結合してもよい。
【0024】
本発明のプライマーは、CXCL13遺伝子やCXCL13mRNAを特異的に増幅するためのプライマーである。本発明のプライマーを用いることにより、PCRなどの公知の方法に基づいて目的のCXCL13遺伝子やCXCL13mRNAを増幅できる。プライマーの設計は、特に制限されないが、従来公知の方法、例えば、プライマー設計用アルゴリズムやソフトウエアなどを利用して行なうことができる。プライマーの長さとしては、特に限定されないが、例えば、15〜30ヌクレオチドである。また、本発明のプライマーは、特に限定されないが、前述のとおり適当な標識によりラベル化されてもよく、ビオチン、リン酸、アミンなどにより修飾されてもよい。
【0025】
本発明のマイクロアレイは、本発明のプローブが基板上に配置されたマイクロアレイである。前記マイクロアレイにおいて、配置される前記本発明のプローブの種類と数は特に限定されない。前記マイクロアレイの製造方法としては、特に制限されないが、例えば、基板表面で直接プローブのポリヌクレオチドを合成する方法(オンチップ法)や、予め調製したプローブを基板表面に固定する方法などの従来公知の方法などが挙げられる。前記オンチップ法としては、光照射で選択的に除去される保護基の使用と、半導体製造に利用されるフォトリソグラフィー技術及び固相合成技術とを組み合わせて、微小なマトリックスの所定の領域で選択的に合成を行なう方法などが挙げられる。また、前記予め調製したプローブを用いる方法としては、プローブ溶解液をインクジェット法により基板に微小滴下して、化学的又は物理的に固定する方法などが挙げられる。前記基板としては、特に制限されないが、例えば、ガラス、金属、プラスチックなどが挙げられる。本発明のマイクロアレイは、特に限定されないが、例えば、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。
【0026】
本発明の抗体は、CXCL13タンパク質を特異的に認識する抗体である。CXCL13タンパク質のアミノ酸配列は、前述のとおり、例えば、NCBIのタンパク質データ−ベースにおいて、Accession Number NP_006410により入手できる。抗体の製造方法は、従来公知の方法により製造できる。例えば、抗体がポリクローナル抗体の場合は、従来公知の方法により大腸菌などで発現し精製されたCXCL13タンパク質を用いて、又は、従来公知の方法によりCXCL13タンパク質の部分アミノ酸配列を有するオリゴペプチドを合成して、ウサギなどの非人動物に免疫し、該免疫動物の血清から通常の方法により製造することができる。一方、モノクローナル抗体の場合は、従来公知の方法により大腸菌などで発現し精製されたCXCL13タンパク質を用いて、又は、従来公知の方法によりCXCL13タンパク質の部分アミノ酸配列を有するオリゴペプチドを合成し、マウスなどの非人動物に免疫し、得られた脾臓細胞と骨髄細胞とを融合させて調製したハイブリドーマ細胞の中から作製することができる。また、本発明の抗体は、特に限定されないが、例えば、酵素標識、放射標識、及び蛍光標識などの従来公知の標識方法で標識してもよく、ビオチンなどにより適宜に修飾されてもよい。本発明の抗体の作製に免疫抗原として使用されるCXCL13タンパク質は、例えば、CXCL13遺伝子の配列情報に基づいて、DNAのクローニング、プラスミドへの構築、宿主へのトランスフェクション、形質転換体の培養及び培養物からのタンパク質の回収などの操作により作製できる。本発明の抗体は、特に限定されないが、例えば、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。
【0027】
本発明のプロテインチップは、本発明の抗体が基板上に配置されたプロテインチップである。前記プロテインチップにおいて、配置される前記本発明の抗体の種類と数は特に限定されない。前記抗体の基板上の配置は、特に限定されないが、公知の方法、例えば、光架橋剤を用いる方法やレーザーアブレーションによる方法などにより行なうことができる。また、本発明のプロテインチップは、特に限定されないが、公知の方法、例えば、インクジェット方式など、マイクロアレイの作製と同様の方法により作製できる。また、前記基板としては、前記マイクロアレイの基板と同様のものを使用できる。本発明のプロテインチップは、特に限定されないが、例えば、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。
【0028】
本発明の腫瘍マーカーの検出用キットは、特に限定されないが、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。本発明のキットは、特に限定されないが、前述のとおり作製した本発明のプローブ、プライマー、マイクロアレイ、抗体、及びプロテインチップからなる群から選択される少なくとも一つを含ませることにより作製できる。また、本発明のキットは、取り扱い説明書を含んでもよい。さらに、本発明のキットは、例えば、その利用目的によって、酵素、緩衝液、試薬などを含むことができる。
【0029】
本発明のキットの第1の態様として、本発明のプローブを含むキットが挙げられる。前記キットは、例えば、リアルタイムPCR法により本発明の腫瘍マーカーを検出する場合や、本発明のマイクロアレイを作製する場合などに使用できる。本発明のキットの第2の態様として、本発明のマイクロアレイを含むキットが挙げられる。前記キットは、さらに、被検試料からトータルRNAを調製するためのプライマーや試薬、ターゲットを調製するための標識化された本発明のプライマーや試薬などを含んでもよい。前記試薬としては、特に限定されないが、従来公知の試薬が利用でき、例えば、ポリメラーゼ、標識化合物、及び緩衝液などが挙げられる。本発明のキットの第3の態様として、本発明の抗体を含むキットが挙げられる。前記キットは、さらに、前記抗体に対する標識化された二次抗体を含んでもよい。前記キットは、例えば、ウエスタンブロット法、ELISA法等により本発明の腫瘍マーカーを免疫学的に検出する場合や本発明のプロテインチップを作成する場合などに使用できる。本発明のキットの第4の態様として、本発明のプロテインチップを含むキットが挙げられる。前記キットは、さらに、酵素標識化された前記抗体に対する二次抗体や、発色試薬などを含んでもよい。
【0030】
本発明の腫瘍マーカーの使用方法は、特に限定されないが、従来公知の腫瘍マーカーの使用方法と同様の方法でよい。例えば、被検試料を準備する準備工程、前記試料中における腫瘍マーカーを検出する検出工程、及び前記検出結果に基づいて腫瘍マーカーの陽性を判定する判定工程を含む使用方法などが挙げられる。
【0031】
まず、準備工程として、特に限定されないが、例えば、被験者の組織や細胞などの生体試料や、血清などの血液試料を被検試料として準備する。
【0032】
次に、検出工程において、本発明の腫瘍マーカーの検出及び/又は定量を行う。CXCL13mRNAを検出/定量する場合は、前記の被検試料から通常の方法によりRNAを調製し、又は、該RNAから転写された相補的ポリヌクレオチドを調製し、下記の方法などで検出/定量する。前記CXCL13mRNAの定量は、絶対量として又は相対量として測定してもよい。測定操作の簡便性や正確性などの点から、内部標準や外部標準などを利用した相対量として測定することが好ましい。前記内部標準としては、βアクチン遺伝子やGAPDH遺伝子などが挙げられる。特定のmRNAを検出/定量する方法は、特に制限されないが、例えば、ノーザンブロッティング、in situハイブリダイゼーション、RNaseプロテクションアッセイ、PCR法,リアルタイムPCR法、マイクロアレイ法、及びmRNAを直接測定する方法などが挙げられる。CXCL13mRNAの検出/定量には、本発明のプローブ、プライマー、マイクロアレイ、及びそれらを含むキットなどを適宜利用することができる。前記リアルタイムPCR法としては、例えば、前記被検試料からmRNAを抽出し、逆転写酵素を用いてcDNAに逆転写し、そのcDNAを鋳型に目的領域をPCRで増幅し、リアルタイムモニタリング用試薬を用いて増幅産物の生成過程をリアルタイムでモニタリングして解析する方法などが挙げられる。前記マイクロアレイ法としては、例えば、本発明の腫瘍マーカーに対応するプローブが配置されたマイクロアレイを準備し、前記マイクロアレイに、前記被検試料中の本発明の腫瘍マーカーを鋳型として調製した標識化ターゲットをハイブリダイズさせ、前記プローブに結合した前記ターゲットの標識シグナルを測定して解析する方法などが挙げられる。前記mRNAを直接測定する方法としては、Invader(登録商標:Third Wave Technologies社)RNAアッセイなどが挙げられる。
【0033】
なお、検出工程において、CXCL13タンパク質を検出/定量する場合は、前記の被検試料から通常の方法によりタンパク質を調製し、下記の方法などで検出/定量する。特定のタンパク質を検出/定量する方法は、特に限定されないが、ウエスタンブロット法、ELISA法、蛍光抗体法、プロテインチップ法などが挙げられる。また、CXCL13タンパク質の検出/定量には、本発明の抗体、プロテインチップ、及びそれらを含むキットなどを適宜使用することができる。なお、CXCL13タンパク質は、特に限定されないが、例えば、被検試料中のタンパク質の濃度として検出/定量することができる。前記ELISA法としては、例えば、前記被検試料から調製したCXCL13タンパク質を含む溶液をマイクロプレートのウェルの固相表面に吸着させた後、CXCL13タンパク質に特異的な抗体を加え、酵素反応により検出/定量する方法などが挙げられる。前記プロテインチップ法としては、例えば、CXCL13タンパク質に特異的な抗体を配置したプロテインチップに、前記被検試料から調製したCXCL13タンパク質を加え、抗体抗原反応をさせた後、標的タンパク質のシグナルを検出し、解析する方法などが挙げられる。
【0034】
最後に、判定工程において、前記検出工程の検出結果に基づいて本発明の腫瘍マーカーが陽性か否かを判定する。本発明において、腫瘍マーカーが陽性であるとは、被験者の腫瘍マーカーの測定値が基準値より大きい場合をいう。
【0035】
前記の検出工程においてCXCL13mRNAを定量した場合の基準値は、特に限定されないが、当該技術分野の当業者であれば、健常者や頭頸部癌症例などにおける前記CXCL13mRNAの測定値を統計学的に処理した値に基づいて定めることができる。前記基準値としては、例えば、健常者における前記CXCL13mRNAの測定値の平均の2倍、3倍、4倍、5倍、及びそれ以上の値などが挙げられ、被験者のCXCL13mRNAの測定値が基準値以上である場合は、陽性と判断される。なお、前記CXCL13mRNAの測定値は、上述のとおり、絶対量として又は相対量としての測定値のいずれであってもよい。
【0036】
前記検出工程において、CXCL13タンパク質を定量した場合の基準値は、特に限定されないが、当該技術分野の当業者であれば、健常者や頭頸部癌症例などにおけるCXCL13タンパク質の測定値を統計学的に処理した値に基づいて定めることができる。前記基準値としては、例えば、ROC(Rceiver Operating Characteristic curve)曲線で決定するカットオフ値などが挙げられ、好ましくは、正診率が最大になる場合のカットオフ値などが挙げられる。
【0037】
本発明のスクリーニング方法は、特に限定されないが、従来公知の方法と同様の方法でよい。例えば、被検物質と本発明の腫瘍マーカーを発現している細胞とを接触させる工程、及び前記腫瘍マーカーの発現量を減少させる被検物質を選択する工程を含むスクリーニング方法などが挙げられる。前記スクリーニング方法は、さらに、被検物質と接触させた細胞における前記腫瘍マーカーの発現量を測定する工程、被検物質と接触させていない対照細胞における前記腫瘍マーカーの発現量を測定する工程、前記測定結果を比較する工程を含んでもよく、その場合、前記の比較結果に基づいて、前記腫瘍マーカーの発現量を減少させる被検物質を選択することができる。前記腫瘍マーカーの発現量は、具体的には、CXCL13mRNA又はCXCL13タンパク質を定量することにより測定することができる。
【0038】
本発明のスクリーニングに用いられる細胞としては、特に限定されないが、例えば、CXCL13遺伝子を発現する培養細胞全般が挙げられる。前記培養細胞としては、特に限定されないが、例えば癌患者より単離、調製した生体組織や血球由来の細胞、又はCXCL13遺伝子を導入した細胞などが挙げられる。また、培養細胞における前記CXCL13遺伝子の発現の有無は、公知の方法、例えば、ウエスタンブロット法などにより容易に確認することができる。前記細胞と被検物質とを接触させる条件は、特に制限されないが、該細胞が死滅せずかつ本発明の腫瘍マーカー遺伝子を発現できる培養条件(温度、pH、培地組成など)が好ましい。前記スクリーニング方法は、例えば、CXCL13遺伝子の発現量を低下させる物質を探索することによって頭頸部癌を抑制する候補物質を提供する。
【0039】
本発明は、例えば頭頸部癌、好ましくは頭頸部扁平上皮癌、さらに好ましくは頭頸部癌の早期癌の診断及び治療における本発明の腫瘍マーカーの使用を含む。前記本発明の腫瘍マーカーの使用は、特に限定されないが、例えば、頭頸部癌の早期発見や治療過程のモニタリングの補助ツールとしての使用などが挙げられる。さらに、本発明は、本発明の腫瘍マーカーを使用又は検出することを含む、例えば頭頸部癌、好ましくは頭頸部扁平上皮癌、さらに好ましくは頭頸部癌の早期癌の診断方法及び治療方法を含む。具体的には、本発明は、本発明の腫瘍マーカー、プローブ、プライマー、抗体、マイクロアレイ、プロテインチップ、キット、使用方法、及びスクリーニング方法などによる、例えば頭頸部癌、好ましくは頭頸部扁平上皮癌、さらに好ましくは頭頸部癌の早期癌の診断、治療、診断方法及び治療方法を含む。
【0040】
以下、実施例を用いて本発明を具体的に説明するが、本発明は、これに限定されない。
【実施例1】
【0041】
(頭頸部癌の腫瘍マーカーの同定)
頭頸部扁平上皮癌45症例を対象とし、比較対照例として正常粘膜組織3例を用いた。前記各症例の原発腫瘍及び正常粘膜組織を機械的にホモジナイズした後、Isogen(Nippon Gene社)を用いてトータルRNAを抽出し、精製した。前記トータルRNA1μgをケミルミネッセントRT−IVTラベリングキット(Applied Biosystems社製)を用いて増幅し、ジゴキシゲニン(Roche Molecular Biochemicals社製)標識cRNAを合成した。前記合成cRNAをヒトゲノムサーベイマイクロアレイ(Applied Biosystems社)にハイブリダイゼーションさせた。その後、ケミルミネッセントディテクションキット(Applied Biosystems社製)を用いて洗浄、発色させ、Applied Biosysytems 1700マイクロアレイアナライザー(Applied Biosystems社製)を用いて29908個のヒト全遺伝子の発現量を定量した。各症例及び対照例の遺伝子発現量の比較は、ソフトウエアGeneSpring(Sikicon Genetics社製)を用いて解析した。
【0042】
(結果)
まず、正常粘膜組織と比較して、頭頸部扁平上皮癌の腫瘍組織においてのみ共通して3倍以上の発現亢進を認める遺伝子を278種類同定し、その中より、分泌型の可溶性タンパク質であるCXCL13を新規腫瘍マーカーとして同定した。
【実施例2】
【0043】
本実験は愛媛大学医学部附属病院臨床研究倫理審査委員会での承認を受け、人権保護への配慮などを明記した同意書をもとに説明の上、同意の得られた患者及び健常者を被験者として行われた。前記被験者から血液を採取し室温で1時間放置した後、4℃で3000rpm、15分間遠心分離し血清を抽出した。
【0044】
(CXCL13の頭頸部癌の腫瘍マーカーとしての有用性)
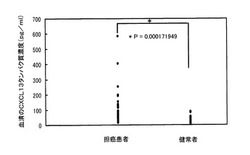
頭頸部扁平上皮癌におけるCXCL13の腫瘍マーカーとしての有用性を検討した。対象は未治療の頭頸部扁平上皮癌患者53名、健常者25名とした。CXCL13は、Quantikine Human CXCL13/BLC/BCA−1 ELISA Kit(R&D Systems社製)を用いて、血清100μlにおけるCXCL13タンパク質を測定した。その結果について、図1に示した。
【0045】
(結果)
図1に示したとおり、血清のCXCL13タンパク質の濃度は、担癌患者で 90.0±95.0 pg/mlであり、健常者では36.2±22.0 pg/mlであり、担癌患者では健常者と比較して有意に高値(P値は0.000171949である)を示した(図1)。以上の結果から、血清のCXCL13は、腫瘍マーカーとりわけ頭頸部癌の腫瘍マーカーとして有用であることが分った。
【0046】
(病期分類別比較検討)
担癌患者をUICC(Unio Internationalis Contra Cancrum,International Union against Cancer)の分類に従った病期分類別に分類し、血清のCXCL13タンパク質の濃度の検討を行なった。その結果を図2に示す。また、既存の腫瘍マーカーであるSCCについても、アーキテクト・SCC(アボットジャパン社製)を用いて、血清150μlにおけるそのタンパク質を測定し、口腔扁平上皮癌の診断を受けた患者132名及び健常者33名との比較検討を行った。その結果を図3に示す。
【0047】
(結果)
図2に示すとおり、血清のCXCL13タンパク質の濃度は、早期癌(ステージI、ステージII)では72.4±52.5pg/mlであり、進行癌(ステージIII、ステージIV)では104.7±118.4pg/mlであった。血清のCXCL13タンパク質の濃度は、早期癌と進行癌で共に健常者よりも有意に(P値は、それぞれ、0.00385968と0.00465328である)高値を示した(図2)。また、図3に示したとおり、血清のSCCタンパク質の濃度は、早期癌では1.12±0.51ng/mlであり、進行癌では1.92±1.78ng/mlであり、健常者では1.2±0.55ng/mlであった。血清のSCCタンパク質の濃度については、進行癌では健常者との有意差を認めるものの(P値は0.00675049である)、早期癌では有意差を認めることはできなかった。以上の結果により、血清のCXCL13は、腫瘍マーカーとりわけ頭頸部癌、特に、早期癌の腫瘍マーカーとして、極めて有用であることが分った。
【0048】
(頭頸部癌の腫瘍マーカーを用いた腫瘍の診断の比較検討)
腫瘍の診断とりわけ頭頸部癌の診断を行なう場合の、腫瘍マーカーとしてのCXCL13とSCCについて比較検討を行なった。具体的には、図4のとおり、まず、CXCL13のカットオフ値を決定するために縦軸に感度、横軸に1−特異度(偽陽性率)をとり、ROC(Receiver Operating Characteristic curve)曲線を設定した。次に、Youden指数(感度+特異度−1)が最大、すなわち正診率が最大となるようにCXCL13のカットオフ値を設定した結果、カットオフ値は50pg/mlとなった。CXCL13を腫瘍マーカーとして、前記カットオフ値に基づいて頭頸部癌の腫瘍の陽性を判断した場合、感度は71%、特異度は80%、正診率は74.3%であった。なお、SCCについては、通常の臨床診断に用いるのと同様に1.5ng/mlをカットオフ値とし、それ以上を陽性とした。この場合、SCCの頭頸部扁平上皮癌早期癌に対する感度は7%、特異度は87.9%、正診率は36.7%であり、進行癌に対する感度は34.7%、正診率は54.9%となった。以上の結果から、CXCL13を腫瘍マーカーとした場合、頭頸部癌とりわけ頭頸部扁平上皮癌に対する感度、特異度、及び正診率のすべてにおいて優れており、特に、早期癌に対しては、感度、特異度、及び正診率が共に非常に優れていることが分った。
【産業上の利用可能性】
【0049】
本発明は、頭頸部癌の腫瘍マーカーとして利用でき、例えば、頭頸部癌頭の診断及び治療の分野で有用である。
【図面の簡単な説明】
【0050】
【図1】頭頸部扁平上皮癌患者と健常者における血清のCXCL13タンパク質の濃度を比較した結果を示す図である。
【図2】頭頸部扁平上皮癌の早期癌患者、進行癌患者、及び健常者における血清のCXCL13タンパク質の濃度を比較した結果を示す図である。
【図3】頭頸部扁平上皮癌の早期癌患者、進行癌患者、及び健常者における血清のSCCタンパク質の濃度を比較した結果を示す図である。
【図4】血清のCXCL13タンパク質濃度のROC曲線を示す図である。
【技術分野】
【0001】
本発明は、頭頸部癌の腫瘍マーカーに関する。
【背景技術】
【0002】
腫瘍マーカーは一般的に癌の早期発見や治療経過のモニタリングの補助ツールとして広く用いられている。代表的な腫瘍マーカーとして、α−フェトプロテイン(AFP)、癌胎児性抗原(CEA)、cytokeratin fragment(CYFLA)、carbohydorate antigen(CA19−9)、ニューロン特異的エノラーゼ(NSE)、前立腺特異的抗原(PSA)などが挙げられる。
【0003】
一方、頭頸部領域に発生する悪性腫瘍、特に扁平上皮癌の診断補助に広く用いられる腫瘍マーカーは扁平上皮ガン抗原(SCC)であるが、感度が低く、特に早期癌では偽陰性となる症例も多い(例えば、非特許文献1〜2)。また、これまでに、頭頸部扁平上皮癌における腫瘍マーカーとして、例えばCEAなどの有用性についても様々な検討がされてきたが、早期癌では十分な感度が得られていないのが現状である(例えば、非特許文献2〜4)。
【非特許文献1】吉田英彦ら、「口腔癌診断に対する血清SCC抗原測定の意義.」 癌と化学療法 11:3595−3601,1989.
【非特許文献2】松友豊伸、「口腔扁平上皮癌におけるSCC抗原及びCEAの臨床的意義.」 日口外誌 39(3):207−214,1993.
【非特許文献3】小林 裕、「Glutathione S−transferase−π(GST−π)による口腔扁平上皮癌の診断に関する研究.」 口腔病会誌 66(1):45−56,1999.
【非特許文献4】Rosati Gら、「Use of tumor markers in the management of head and neck cancer.」 Int J Biol Markers 15(2):179−83,2000.
【発明の開示】
【発明が解決しようとする課題】
【0004】
従来の頭頸部癌の腫瘍マーカーは感度が低く、例えば、早期癌の診断ツールとして満足できるものではない。頭頸部癌の早期癌に対しても高い感度を有する腫瘍マーカーは、頭頸部癌の診断や予後の向上に極めて有用であり、その必要性は高い。
【0005】
そこで、本発明は、新規かつ有用な頭頸部癌の腫瘍マーカーを提供する。
【課題を解決するための手段】
【0006】
本発明の頭頸部癌の腫瘍マーカーは、CXCL13遺伝子、CXCL13mRNA、及びCXCL13タンパク質からなる群から選択される腫瘍マーカーである(以下、本発明の腫瘍マーカーともいう)。
【0007】
本発明の頭頸部癌の腫瘍マーカー検出用プローブは、CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含み、本発明の腫瘍マーカーの検出に使用するプローブである(以下、本発明のプローブともいう)。
【0008】
本発明の頭頸部癌の腫瘍マーカー検出用プライマーは、CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含み、本発明の腫瘍マーカーの検出に使用するプライマーである(以下、本発明のプライマーともいう)。
【0009】
本発明の頭頸部癌の腫瘍マーカー検出用マイクロアレイは、本発明のプローブが配置され、本発明の腫瘍マーカーの検出に使用するマイクロアレイである(以下、本発明のマイクロアレイともいう)。
【0010】
本発明の頭頸部癌の腫瘍マーカー検出用抗体は、CXCL13タンパク質を特異的に認識し、本発明の腫瘍マーカーの検出に使用する抗体である(以下、本発明の抗体ともいう)。
【0011】
本発明の頭頸部癌の腫瘍マーカー検出用プロテインチップは、本発明の抗体が配置され、本発明の腫瘍マーカーの検出に使用するプロテインチップである(以下、本発明のプロテインチップともいう)。
【0012】
本発明の頭頸部癌の腫瘍マーカー検出用キットは、本発明のプローブ、プライマー、マイクロアレイ、抗体、及びプロテインチップからなる群から選択される少なくとも一つを含み、本発明の腫瘍マーカーの検出に使用するキットである(以下、本発明のキットともいう)。
【0013】
本発明の頭頸部癌の腫瘍マーカーの使用方法は、被検試料を準備する準備工程、前記試料中における本発明の腫瘍マーカーを検出する検出工程、及び前記検出結果に基づいて腫瘍マーカーの陽性を判定する判定工程を含む(以下、本発明の使用方法ともいう)。
【0014】
本発明の頭頸部癌の腫瘍マーカーの発現を抑制する物質のスクリーニング方法は、被検物質と本発明の腫瘍マーカーを発現している細胞とを接触させる工程、及び前記腫瘍マーカーの発現量を減少させる被検物質を選択する工程を含む(以下、本発明のスクリーニング方法ともいう)。
【発明の効果】
【0015】
本発明によれば、例えば、頭頸部癌の診断及びその予後の向上に大きく貢献でき、好ましくは、頭頸部扁平上皮癌の診断、より好ましくは、頭頸部癌の早期癌の診断の感度及び/又は精度を向上できる。
【発明を実施するための最良の形態】
【0016】
本発明者らは、頭頸部癌の腫瘍マーカーについて鋭意研究を重ね、CXCL13が頭頸部癌の腫瘍マーカーとなり得ることを見出し、この発明に到達した。具体的には、本発明者らは、まず、正常組織と頭頸部癌の腫瘍組織において、マイクロアレイによる網羅的な遺伝子解析を行なった結果、頭頸部癌である扁平上皮癌においてのみ共通して3倍以上の発現亢進を示す遺伝子を278種類同定した。そして、それらのうち、CXCL13(chemokine(C−X−C motif)ligand 13)を新規の腫瘍マーカーとして同定した。CXCL13は、B細胞に特異的に細胞走化活性を示すケモカインとして1998年に同定され、リンパ濾胞やリンパ節形成に重要な役割を果たしていることが報告されている。しかし、固形腫瘍とりわけ頭頸部癌との関連については報告されておらず、頭頸部扁平上皮癌との関連も不明である。本発明は、頭頸部癌における新規な腫瘍マーカーとしてCXCL13を見出したことに基づくものであって、本発明によれば、頭頸部癌の診断及びその予後の向上に大きく貢献できる。
【0017】
本発明の頭頸部癌の腫瘍マーカーは、CXCL13遺伝子、CXCL13mRNA、及びCXCL13タンパク質からなる群から選択される腫瘍マーカーであり、好ましくは、頭頸部扁平上皮癌、より好ましくは、頭頸部癌の早期癌の腫瘍マーカーである。
【0018】
本発明において「頭頸部癌」とは、脳と眼を除いた首から上にできる癌をいい、一般的に、口腔癌、鼻副鼻腔癌、口唇癌、咽頭癌、喉頭癌、頭部腫瘍、耳の癌を含む。本発明において「腫瘍マーカー」とは、癌細胞の目印(マーカー)となる物質であって、癌の診断や治療の判断基準として役立つ物質の総称をいう。
【0019】
本発明において「CXCL13」は、Chemokine(C−X−C motif )ligand 13というケモカインであり、BLC(B−lymphocyto chemoattractant)又はBCA−1(B cell−atracting chemokine 1)ともいう。本発明において「CXCL13遺伝子」とは分泌性可溶性タンパク質であるCXCL13タンパク質をコードする遺伝子であり、「CXCL13mRNA」とは前記CXCL13遺伝子の転写産物であり、「CXCL13タンパク質」とは前記CXCL13mRNAの翻訳産物である。前記CXCL13遺伝子は、CXCL13タンパク質をコードするDNA及びその断片などを含み、例えば、クローニング、化学合成技術又はそれらを組み合わせて得られるようなcDNAやゲノムDNAなどが挙げられる。前記CXCL13mRNAは、NCBIの遺伝子データ−ベースにおいてAccession Number NM_006419(2007年7月10日付)として登録されており、具体的には、配列表の配列番号1の塩基配列からなるポリヌクレオチドである。前記CXCL13タンパク質は、NCBIのタンパク質データ−ベースにおいてAccession Number NP_006410として登録されており、具体的には、配列表の配列番号2のアミノ酸配列からなるポリペプチドである。前記塩基配列において、例えば、突然変異や遺伝子多型などに起因して1から数個の塩基の置換・欠失・付加などの相違があっても、本発明の腫瘍マーカーに含まれる。同じく、前記アミノ酸配列において、例えば、突然変異や遺伝子多型などに起因して1から数個のアミノ酸残基の置換・欠失・付加などの相違があっても本発明の腫瘍マーカーに含まれる。また、前記CXCL13mRNA及びCXCL13タンパク質の一部分、及び修飾されたCXCL13タンパク質、例えば、リン酸化CXCL13なども本発明の腫瘍マーカーに含まれる。
【0020】
本発明の腫瘍マーカーは、特に限定されないが、好ましくは頭頸部扁平上皮癌、さらに好ましくは頭頸部癌の早期癌の診断などに使用できる。
【0021】
本発明のプローブ及びプライマーは、CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含む。前記ポリヌクレオチドは、特に限定されないが、例えば、CXCL13遺伝子又はCXCL13mRNAの塩基配列の全体配列、部分配列、及びそれらの相補配列からなるポリヌクレオチド、並びに、前記ポリヌクレオチドにおいて1から数個の塩基が、欠失、置換若しくは付加されたポリヌクレオチドからなる群から選択されるポリヌクレオチドなどが挙げられる。(以下、本発明のプローブ用又はプライマー用ポリヌクレオチドという)。なお、前記ストリンジェントな条件は、特に限定されないが、例えば、0.3%SDSを含む5XSSC緩衝液中で熱変性し、65℃で4〜16時間ハイブリダイゼーションし、常温で0.1%SDSを含む2XSSC緩衝液及び2XSSC緩衝液で、それぞれ5分間洗浄し、0.05XSSCでリンスすることなどが挙げられる。本発明のプローブ及びプライマーは、特に限定されないが、例えば、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。
【0022】
本発明のプローブ用又はプライマー用ポリヌクレオチドは、特に限定されないが、例えば、DNA、RNA、又は、従来公知のこれらの誘導体や類縁体を使用できる。また、欠失、置換若しくは付加が可能な塩基数としては、特に限定されないが、例えば1〜10個以上であり、好ましくは1〜3個であり、より好ましくは1又は2個である。本発明のプローブ又はプライマー用ポリヌクレオチドの製造方法としては、特に限定されないが、従来公知の製造方法、例えば、化学合成や酵素合成などが挙げられる。本発明のプローブ又はプライマー用ポリヌクレオチドは、特に限定されないが、例えば、酵素標識、放射標識、及び蛍光標識などの従来公知の標識方法で標識されてもよい。
【0023】
本発明のプローブの使用方法は、特に限定されないが、例えば、後述するマイクロアレイのプローブ、又は、リアルタイムPCRのプローブとして使用することなどが挙げられる。マイクロアレイのプローブとして使用する場合、その長さとしては、特に限定されないが、例えば、10〜200ヌクレオチドであって、20〜100ヌクレオチドが好ましく、40〜80ヌクレオチドがより好ましい。また、マイクロアレイのプローブとして使用する場合は、マイクロアレイの基板に固定するための修飾がされていてもよい。前記修飾は、使用するマイクロアレイの基板の種類に応じて従来公知のものを選択できるが、例えば、プローブのポリヌクレオチドの5’又は3’側のC(3〜7)アミン化などが挙げられる。また、リアルタイムPCRのプローブとして使用する場合、本発明のプローブは、例えば、蛍光物質及びクエンチャーを結合してもよい。
【0024】
本発明のプライマーは、CXCL13遺伝子やCXCL13mRNAを特異的に増幅するためのプライマーである。本発明のプライマーを用いることにより、PCRなどの公知の方法に基づいて目的のCXCL13遺伝子やCXCL13mRNAを増幅できる。プライマーの設計は、特に制限されないが、従来公知の方法、例えば、プライマー設計用アルゴリズムやソフトウエアなどを利用して行なうことができる。プライマーの長さとしては、特に限定されないが、例えば、15〜30ヌクレオチドである。また、本発明のプライマーは、特に限定されないが、前述のとおり適当な標識によりラベル化されてもよく、ビオチン、リン酸、アミンなどにより修飾されてもよい。
【0025】
本発明のマイクロアレイは、本発明のプローブが基板上に配置されたマイクロアレイである。前記マイクロアレイにおいて、配置される前記本発明のプローブの種類と数は特に限定されない。前記マイクロアレイの製造方法としては、特に制限されないが、例えば、基板表面で直接プローブのポリヌクレオチドを合成する方法(オンチップ法)や、予め調製したプローブを基板表面に固定する方法などの従来公知の方法などが挙げられる。前記オンチップ法としては、光照射で選択的に除去される保護基の使用と、半導体製造に利用されるフォトリソグラフィー技術及び固相合成技術とを組み合わせて、微小なマトリックスの所定の領域で選択的に合成を行なう方法などが挙げられる。また、前記予め調製したプローブを用いる方法としては、プローブ溶解液をインクジェット法により基板に微小滴下して、化学的又は物理的に固定する方法などが挙げられる。前記基板としては、特に制限されないが、例えば、ガラス、金属、プラスチックなどが挙げられる。本発明のマイクロアレイは、特に限定されないが、例えば、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。
【0026】
本発明の抗体は、CXCL13タンパク質を特異的に認識する抗体である。CXCL13タンパク質のアミノ酸配列は、前述のとおり、例えば、NCBIのタンパク質データ−ベースにおいて、Accession Number NP_006410により入手できる。抗体の製造方法は、従来公知の方法により製造できる。例えば、抗体がポリクローナル抗体の場合は、従来公知の方法により大腸菌などで発現し精製されたCXCL13タンパク質を用いて、又は、従来公知の方法によりCXCL13タンパク質の部分アミノ酸配列を有するオリゴペプチドを合成して、ウサギなどの非人動物に免疫し、該免疫動物の血清から通常の方法により製造することができる。一方、モノクローナル抗体の場合は、従来公知の方法により大腸菌などで発現し精製されたCXCL13タンパク質を用いて、又は、従来公知の方法によりCXCL13タンパク質の部分アミノ酸配列を有するオリゴペプチドを合成し、マウスなどの非人動物に免疫し、得られた脾臓細胞と骨髄細胞とを融合させて調製したハイブリドーマ細胞の中から作製することができる。また、本発明の抗体は、特に限定されないが、例えば、酵素標識、放射標識、及び蛍光標識などの従来公知の標識方法で標識してもよく、ビオチンなどにより適宜に修飾されてもよい。本発明の抗体の作製に免疫抗原として使用されるCXCL13タンパク質は、例えば、CXCL13遺伝子の配列情報に基づいて、DNAのクローニング、プラスミドへの構築、宿主へのトランスフェクション、形質転換体の培養及び培養物からのタンパク質の回収などの操作により作製できる。本発明の抗体は、特に限定されないが、例えば、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。
【0027】
本発明のプロテインチップは、本発明の抗体が基板上に配置されたプロテインチップである。前記プロテインチップにおいて、配置される前記本発明の抗体の種類と数は特に限定されない。前記抗体の基板上の配置は、特に限定されないが、公知の方法、例えば、光架橋剤を用いる方法やレーザーアブレーションによる方法などにより行なうことができる。また、本発明のプロテインチップは、特に限定されないが、公知の方法、例えば、インクジェット方式など、マイクロアレイの作製と同様の方法により作製できる。また、前記基板としては、前記マイクロアレイの基板と同様のものを使用できる。本発明のプロテインチップは、特に限定されないが、例えば、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。
【0028】
本発明の腫瘍マーカーの検出用キットは、特に限定されないが、後述のとおり、本発明の腫瘍マーカーの検出に使用できる。本発明のキットは、特に限定されないが、前述のとおり作製した本発明のプローブ、プライマー、マイクロアレイ、抗体、及びプロテインチップからなる群から選択される少なくとも一つを含ませることにより作製できる。また、本発明のキットは、取り扱い説明書を含んでもよい。さらに、本発明のキットは、例えば、その利用目的によって、酵素、緩衝液、試薬などを含むことができる。
【0029】
本発明のキットの第1の態様として、本発明のプローブを含むキットが挙げられる。前記キットは、例えば、リアルタイムPCR法により本発明の腫瘍マーカーを検出する場合や、本発明のマイクロアレイを作製する場合などに使用できる。本発明のキットの第2の態様として、本発明のマイクロアレイを含むキットが挙げられる。前記キットは、さらに、被検試料からトータルRNAを調製するためのプライマーや試薬、ターゲットを調製するための標識化された本発明のプライマーや試薬などを含んでもよい。前記試薬としては、特に限定されないが、従来公知の試薬が利用でき、例えば、ポリメラーゼ、標識化合物、及び緩衝液などが挙げられる。本発明のキットの第3の態様として、本発明の抗体を含むキットが挙げられる。前記キットは、さらに、前記抗体に対する標識化された二次抗体を含んでもよい。前記キットは、例えば、ウエスタンブロット法、ELISA法等により本発明の腫瘍マーカーを免疫学的に検出する場合や本発明のプロテインチップを作成する場合などに使用できる。本発明のキットの第4の態様として、本発明のプロテインチップを含むキットが挙げられる。前記キットは、さらに、酵素標識化された前記抗体に対する二次抗体や、発色試薬などを含んでもよい。
【0030】
本発明の腫瘍マーカーの使用方法は、特に限定されないが、従来公知の腫瘍マーカーの使用方法と同様の方法でよい。例えば、被検試料を準備する準備工程、前記試料中における腫瘍マーカーを検出する検出工程、及び前記検出結果に基づいて腫瘍マーカーの陽性を判定する判定工程を含む使用方法などが挙げられる。
【0031】
まず、準備工程として、特に限定されないが、例えば、被験者の組織や細胞などの生体試料や、血清などの血液試料を被検試料として準備する。
【0032】
次に、検出工程において、本発明の腫瘍マーカーの検出及び/又は定量を行う。CXCL13mRNAを検出/定量する場合は、前記の被検試料から通常の方法によりRNAを調製し、又は、該RNAから転写された相補的ポリヌクレオチドを調製し、下記の方法などで検出/定量する。前記CXCL13mRNAの定量は、絶対量として又は相対量として測定してもよい。測定操作の簡便性や正確性などの点から、内部標準や外部標準などを利用した相対量として測定することが好ましい。前記内部標準としては、βアクチン遺伝子やGAPDH遺伝子などが挙げられる。特定のmRNAを検出/定量する方法は、特に制限されないが、例えば、ノーザンブロッティング、in situハイブリダイゼーション、RNaseプロテクションアッセイ、PCR法,リアルタイムPCR法、マイクロアレイ法、及びmRNAを直接測定する方法などが挙げられる。CXCL13mRNAの検出/定量には、本発明のプローブ、プライマー、マイクロアレイ、及びそれらを含むキットなどを適宜利用することができる。前記リアルタイムPCR法としては、例えば、前記被検試料からmRNAを抽出し、逆転写酵素を用いてcDNAに逆転写し、そのcDNAを鋳型に目的領域をPCRで増幅し、リアルタイムモニタリング用試薬を用いて増幅産物の生成過程をリアルタイムでモニタリングして解析する方法などが挙げられる。前記マイクロアレイ法としては、例えば、本発明の腫瘍マーカーに対応するプローブが配置されたマイクロアレイを準備し、前記マイクロアレイに、前記被検試料中の本発明の腫瘍マーカーを鋳型として調製した標識化ターゲットをハイブリダイズさせ、前記プローブに結合した前記ターゲットの標識シグナルを測定して解析する方法などが挙げられる。前記mRNAを直接測定する方法としては、Invader(登録商標:Third Wave Technologies社)RNAアッセイなどが挙げられる。
【0033】
なお、検出工程において、CXCL13タンパク質を検出/定量する場合は、前記の被検試料から通常の方法によりタンパク質を調製し、下記の方法などで検出/定量する。特定のタンパク質を検出/定量する方法は、特に限定されないが、ウエスタンブロット法、ELISA法、蛍光抗体法、プロテインチップ法などが挙げられる。また、CXCL13タンパク質の検出/定量には、本発明の抗体、プロテインチップ、及びそれらを含むキットなどを適宜使用することができる。なお、CXCL13タンパク質は、特に限定されないが、例えば、被検試料中のタンパク質の濃度として検出/定量することができる。前記ELISA法としては、例えば、前記被検試料から調製したCXCL13タンパク質を含む溶液をマイクロプレートのウェルの固相表面に吸着させた後、CXCL13タンパク質に特異的な抗体を加え、酵素反応により検出/定量する方法などが挙げられる。前記プロテインチップ法としては、例えば、CXCL13タンパク質に特異的な抗体を配置したプロテインチップに、前記被検試料から調製したCXCL13タンパク質を加え、抗体抗原反応をさせた後、標的タンパク質のシグナルを検出し、解析する方法などが挙げられる。
【0034】
最後に、判定工程において、前記検出工程の検出結果に基づいて本発明の腫瘍マーカーが陽性か否かを判定する。本発明において、腫瘍マーカーが陽性であるとは、被験者の腫瘍マーカーの測定値が基準値より大きい場合をいう。
【0035】
前記の検出工程においてCXCL13mRNAを定量した場合の基準値は、特に限定されないが、当該技術分野の当業者であれば、健常者や頭頸部癌症例などにおける前記CXCL13mRNAの測定値を統計学的に処理した値に基づいて定めることができる。前記基準値としては、例えば、健常者における前記CXCL13mRNAの測定値の平均の2倍、3倍、4倍、5倍、及びそれ以上の値などが挙げられ、被験者のCXCL13mRNAの測定値が基準値以上である場合は、陽性と判断される。なお、前記CXCL13mRNAの測定値は、上述のとおり、絶対量として又は相対量としての測定値のいずれであってもよい。
【0036】
前記検出工程において、CXCL13タンパク質を定量した場合の基準値は、特に限定されないが、当該技術分野の当業者であれば、健常者や頭頸部癌症例などにおけるCXCL13タンパク質の測定値を統計学的に処理した値に基づいて定めることができる。前記基準値としては、例えば、ROC(Rceiver Operating Characteristic curve)曲線で決定するカットオフ値などが挙げられ、好ましくは、正診率が最大になる場合のカットオフ値などが挙げられる。
【0037】
本発明のスクリーニング方法は、特に限定されないが、従来公知の方法と同様の方法でよい。例えば、被検物質と本発明の腫瘍マーカーを発現している細胞とを接触させる工程、及び前記腫瘍マーカーの発現量を減少させる被検物質を選択する工程を含むスクリーニング方法などが挙げられる。前記スクリーニング方法は、さらに、被検物質と接触させた細胞における前記腫瘍マーカーの発現量を測定する工程、被検物質と接触させていない対照細胞における前記腫瘍マーカーの発現量を測定する工程、前記測定結果を比較する工程を含んでもよく、その場合、前記の比較結果に基づいて、前記腫瘍マーカーの発現量を減少させる被検物質を選択することができる。前記腫瘍マーカーの発現量は、具体的には、CXCL13mRNA又はCXCL13タンパク質を定量することにより測定することができる。
【0038】
本発明のスクリーニングに用いられる細胞としては、特に限定されないが、例えば、CXCL13遺伝子を発現する培養細胞全般が挙げられる。前記培養細胞としては、特に限定されないが、例えば癌患者より単離、調製した生体組織や血球由来の細胞、又はCXCL13遺伝子を導入した細胞などが挙げられる。また、培養細胞における前記CXCL13遺伝子の発現の有無は、公知の方法、例えば、ウエスタンブロット法などにより容易に確認することができる。前記細胞と被検物質とを接触させる条件は、特に制限されないが、該細胞が死滅せずかつ本発明の腫瘍マーカー遺伝子を発現できる培養条件(温度、pH、培地組成など)が好ましい。前記スクリーニング方法は、例えば、CXCL13遺伝子の発現量を低下させる物質を探索することによって頭頸部癌を抑制する候補物質を提供する。
【0039】
本発明は、例えば頭頸部癌、好ましくは頭頸部扁平上皮癌、さらに好ましくは頭頸部癌の早期癌の診断及び治療における本発明の腫瘍マーカーの使用を含む。前記本発明の腫瘍マーカーの使用は、特に限定されないが、例えば、頭頸部癌の早期発見や治療過程のモニタリングの補助ツールとしての使用などが挙げられる。さらに、本発明は、本発明の腫瘍マーカーを使用又は検出することを含む、例えば頭頸部癌、好ましくは頭頸部扁平上皮癌、さらに好ましくは頭頸部癌の早期癌の診断方法及び治療方法を含む。具体的には、本発明は、本発明の腫瘍マーカー、プローブ、プライマー、抗体、マイクロアレイ、プロテインチップ、キット、使用方法、及びスクリーニング方法などによる、例えば頭頸部癌、好ましくは頭頸部扁平上皮癌、さらに好ましくは頭頸部癌の早期癌の診断、治療、診断方法及び治療方法を含む。
【0040】
以下、実施例を用いて本発明を具体的に説明するが、本発明は、これに限定されない。
【実施例1】
【0041】
(頭頸部癌の腫瘍マーカーの同定)
頭頸部扁平上皮癌45症例を対象とし、比較対照例として正常粘膜組織3例を用いた。前記各症例の原発腫瘍及び正常粘膜組織を機械的にホモジナイズした後、Isogen(Nippon Gene社)を用いてトータルRNAを抽出し、精製した。前記トータルRNA1μgをケミルミネッセントRT−IVTラベリングキット(Applied Biosystems社製)を用いて増幅し、ジゴキシゲニン(Roche Molecular Biochemicals社製)標識cRNAを合成した。前記合成cRNAをヒトゲノムサーベイマイクロアレイ(Applied Biosystems社)にハイブリダイゼーションさせた。その後、ケミルミネッセントディテクションキット(Applied Biosystems社製)を用いて洗浄、発色させ、Applied Biosysytems 1700マイクロアレイアナライザー(Applied Biosystems社製)を用いて29908個のヒト全遺伝子の発現量を定量した。各症例及び対照例の遺伝子発現量の比較は、ソフトウエアGeneSpring(Sikicon Genetics社製)を用いて解析した。
【0042】
(結果)
まず、正常粘膜組織と比較して、頭頸部扁平上皮癌の腫瘍組織においてのみ共通して3倍以上の発現亢進を認める遺伝子を278種類同定し、その中より、分泌型の可溶性タンパク質であるCXCL13を新規腫瘍マーカーとして同定した。
【実施例2】
【0043】
本実験は愛媛大学医学部附属病院臨床研究倫理審査委員会での承認を受け、人権保護への配慮などを明記した同意書をもとに説明の上、同意の得られた患者及び健常者を被験者として行われた。前記被験者から血液を採取し室温で1時間放置した後、4℃で3000rpm、15分間遠心分離し血清を抽出した。
【0044】
(CXCL13の頭頸部癌の腫瘍マーカーとしての有用性)
頭頸部扁平上皮癌におけるCXCL13の腫瘍マーカーとしての有用性を検討した。対象は未治療の頭頸部扁平上皮癌患者53名、健常者25名とした。CXCL13は、Quantikine Human CXCL13/BLC/BCA−1 ELISA Kit(R&D Systems社製)を用いて、血清100μlにおけるCXCL13タンパク質を測定した。その結果について、図1に示した。
【0045】
(結果)
図1に示したとおり、血清のCXCL13タンパク質の濃度は、担癌患者で 90.0±95.0 pg/mlであり、健常者では36.2±22.0 pg/mlであり、担癌患者では健常者と比較して有意に高値(P値は0.000171949である)を示した(図1)。以上の結果から、血清のCXCL13は、腫瘍マーカーとりわけ頭頸部癌の腫瘍マーカーとして有用であることが分った。
【0046】
(病期分類別比較検討)
担癌患者をUICC(Unio Internationalis Contra Cancrum,International Union against Cancer)の分類に従った病期分類別に分類し、血清のCXCL13タンパク質の濃度の検討を行なった。その結果を図2に示す。また、既存の腫瘍マーカーであるSCCについても、アーキテクト・SCC(アボットジャパン社製)を用いて、血清150μlにおけるそのタンパク質を測定し、口腔扁平上皮癌の診断を受けた患者132名及び健常者33名との比較検討を行った。その結果を図3に示す。
【0047】
(結果)
図2に示すとおり、血清のCXCL13タンパク質の濃度は、早期癌(ステージI、ステージII)では72.4±52.5pg/mlであり、進行癌(ステージIII、ステージIV)では104.7±118.4pg/mlであった。血清のCXCL13タンパク質の濃度は、早期癌と進行癌で共に健常者よりも有意に(P値は、それぞれ、0.00385968と0.00465328である)高値を示した(図2)。また、図3に示したとおり、血清のSCCタンパク質の濃度は、早期癌では1.12±0.51ng/mlであり、進行癌では1.92±1.78ng/mlであり、健常者では1.2±0.55ng/mlであった。血清のSCCタンパク質の濃度については、進行癌では健常者との有意差を認めるものの(P値は0.00675049である)、早期癌では有意差を認めることはできなかった。以上の結果により、血清のCXCL13は、腫瘍マーカーとりわけ頭頸部癌、特に、早期癌の腫瘍マーカーとして、極めて有用であることが分った。
【0048】
(頭頸部癌の腫瘍マーカーを用いた腫瘍の診断の比較検討)
腫瘍の診断とりわけ頭頸部癌の診断を行なう場合の、腫瘍マーカーとしてのCXCL13とSCCについて比較検討を行なった。具体的には、図4のとおり、まず、CXCL13のカットオフ値を決定するために縦軸に感度、横軸に1−特異度(偽陽性率)をとり、ROC(Receiver Operating Characteristic curve)曲線を設定した。次に、Youden指数(感度+特異度−1)が最大、すなわち正診率が最大となるようにCXCL13のカットオフ値を設定した結果、カットオフ値は50pg/mlとなった。CXCL13を腫瘍マーカーとして、前記カットオフ値に基づいて頭頸部癌の腫瘍の陽性を判断した場合、感度は71%、特異度は80%、正診率は74.3%であった。なお、SCCについては、通常の臨床診断に用いるのと同様に1.5ng/mlをカットオフ値とし、それ以上を陽性とした。この場合、SCCの頭頸部扁平上皮癌早期癌に対する感度は7%、特異度は87.9%、正診率は36.7%であり、進行癌に対する感度は34.7%、正診率は54.9%となった。以上の結果から、CXCL13を腫瘍マーカーとした場合、頭頸部癌とりわけ頭頸部扁平上皮癌に対する感度、特異度、及び正診率のすべてにおいて優れており、特に、早期癌に対しては、感度、特異度、及び正診率が共に非常に優れていることが分った。
【産業上の利用可能性】
【0049】
本発明は、頭頸部癌の腫瘍マーカーとして利用でき、例えば、頭頸部癌頭の診断及び治療の分野で有用である。
【図面の簡単な説明】
【0050】
【図1】頭頸部扁平上皮癌患者と健常者における血清のCXCL13タンパク質の濃度を比較した結果を示す図である。
【図2】頭頸部扁平上皮癌の早期癌患者、進行癌患者、及び健常者における血清のCXCL13タンパク質の濃度を比較した結果を示す図である。
【図3】頭頸部扁平上皮癌の早期癌患者、進行癌患者、及び健常者における血清のSCCタンパク質の濃度を比較した結果を示す図である。
【図4】血清のCXCL13タンパク質濃度のROC曲線を示す図である。
【特許請求の範囲】
【請求項1】
CXCL13遺伝子、CXCL13mRNA、及びCXCL13タンパク質からなる群から選択される頭頸部癌の腫瘍マーカー。
【請求項2】
前記頭頸部癌が頭頸部扁平上皮癌である、請求項1に記載の頭頸部癌の腫瘍マーカー。
【請求項3】
前記頭頸部癌が早期癌である、請求項1又は2に記載の頭頸部癌の腫瘍マーカー。
【請求項4】
CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含み、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するプローブ。
【請求項5】
CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含み、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するプライマー。
【請求項6】
請求項4に記載のプローブが配置されたマイクロアレイであって、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するマイクロアレイ。
【請求項7】
CXCL13タンパク質を特異的に認識する抗体であって、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用する抗体。
【請求項8】
請求項7に記載の抗体が配置されたプロテインチップであって、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するプロテインチップ。
【請求項9】
下記の(1)〜(5)からなる群から選択される少なくとも一つを含み、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するキット:
(1)請求項4に記載のプローブ、
(2)請求項5に記載のプライマー、
(3)請求項6に記載のマイクロアレイ、
(4)請求項7に記載の抗体、
(5)請求項8に記載のプロテインチップ。
【請求項10】
下記の工程(1)〜(3)を含む請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの使用方法:
(1)被検試料を準備する準備工程、
(2)前記被検試料中における請求項1〜3のいずれかに記載の腫瘍マーカーを検出する検出工程、
(3)前記検出結果に基づいて腫瘍マーカーの陽性を判定する判定工程。
【請求項11】
請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーを発現している細胞と被検物質とを接触させる工程、及び前記頭頸部癌の腫瘍マーカーの発現量を減少させる被検物質を選択する工程を含む請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの発現を抑制する物質のスクリーニング方法。
【請求項1】
CXCL13遺伝子、CXCL13mRNA、及びCXCL13タンパク質からなる群から選択される頭頸部癌の腫瘍マーカー。
【請求項2】
前記頭頸部癌が頭頸部扁平上皮癌である、請求項1に記載の頭頸部癌の腫瘍マーカー。
【請求項3】
前記頭頸部癌が早期癌である、請求項1又は2に記載の頭頸部癌の腫瘍マーカー。
【請求項4】
CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含み、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するプローブ。
【請求項5】
CXCL13遺伝子、CXCL13mRNA、及びそれらの相補配列からなる群から選択されるポリヌクレオチドとストリンジェントな条件化でハイブリダイズする塩基配列からなるポリヌクレオチドを含み、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するプライマー。
【請求項6】
請求項4に記載のプローブが配置されたマイクロアレイであって、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するマイクロアレイ。
【請求項7】
CXCL13タンパク質を特異的に認識する抗体であって、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用する抗体。
【請求項8】
請求項7に記載の抗体が配置されたプロテインチップであって、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するプロテインチップ。
【請求項9】
下記の(1)〜(5)からなる群から選択される少なくとも一つを含み、請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの検出に使用するキット:
(1)請求項4に記載のプローブ、
(2)請求項5に記載のプライマー、
(3)請求項6に記載のマイクロアレイ、
(4)請求項7に記載の抗体、
(5)請求項8に記載のプロテインチップ。
【請求項10】
下記の工程(1)〜(3)を含む請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの使用方法:
(1)被検試料を準備する準備工程、
(2)前記被検試料中における請求項1〜3のいずれかに記載の腫瘍マーカーを検出する検出工程、
(3)前記検出結果に基づいて腫瘍マーカーの陽性を判定する判定工程。
【請求項11】
請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーを発現している細胞と被検物質とを接触させる工程、及び前記頭頸部癌の腫瘍マーカーの発現量を減少させる被検物質を選択する工程を含む請求項1〜3のいずれかに記載の頭頸部癌の腫瘍マーカーの発現を抑制する物質のスクリーニング方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2009−34071(P2009−34071A)
【公開日】平成21年2月19日(2009.2.19)
【国際特許分類】
【出願番号】特願2007−203371(P2007−203371)
【出願日】平成19年8月3日(2007.8.3)
【出願人】(504147254)国立大学法人愛媛大学 (214)
【Fターム(参考)】
【公開日】平成21年2月19日(2009.2.19)
【国際特許分類】
【出願日】平成19年8月3日(2007.8.3)
【出願人】(504147254)国立大学法人愛媛大学 (214)
【Fターム(参考)】
[ Back to top ]

