顕微鏡用細胞収容器
【課題】培養した動物細胞を簡便に顕微鏡を用いて観察することができ状態にでき、かつ、かかる状態において、観察視野内に動物細胞を確保した状態で鮮明に動物細胞を観察することができる顕微鏡用細胞収容器を提供する。
【解決手段】顕微鏡を用いて細胞観察に使用される細胞収容器であって、収容ケース11と、収容ケース11に挿入される挿入部材15とを備えており、挿入部材15の下端部には、収容ケース11の内底部の両者間にチャンバを形成し得るチャンバ形成部が設けられている。挿入部材15の下端部と収容ケース11の内底部との間に空気層を有しないチャンバを形成することができるから、チャンバ内に水滴等が形成されるのを防止できる。挿入部材15を収容ケース11内に挿入するだけで、チャンバ内に確保した動物細胞Cを常に観察視野内に確保して観察できる。
【解決手段】顕微鏡を用いて細胞観察に使用される細胞収容器であって、収容ケース11と、収容ケース11に挿入される挿入部材15とを備えており、挿入部材15の下端部には、収容ケース11の内底部の両者間にチャンバを形成し得るチャンバ形成部が設けられている。挿入部材15の下端部と収容ケース11の内底部との間に空気層を有しないチャンバを形成することができるから、チャンバ内に水滴等が形成されるのを防止できる。挿入部材15を収容ケース11内に挿入するだけで、チャンバ内に確保した動物細胞Cを常に観察視野内に確保して観察できる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、顕微鏡用細胞収容器に関する。さらに詳しくは、顕微鏡を用いて細胞観察に使用される細胞収容器であって、培養した細胞を観察視野に確保しながら、鮮明な細胞観察をすることができ、しかも、細胞に対するストレス試験、薬剤耐性試験等を行うことができる顕微鏡用細胞収容器に関する。
【背景技術】
【0002】
近年の分子生物学等の発展に伴い、細胞の発生メカニズムや分化メカニズム、代謝メカニズム等の様々な細胞メカニズムが詳細に研究されている。とくに、動物細胞の細胞メカニズムの解明は、医学分野、薬学分野等において非常に重要なテーマとなっており、解明のための重要な手法の一つとして、動物細胞を培養した後、培養した動物細胞を顕微鏡を用いて観察する顕微鏡細胞観察がある。
【0003】
ここで、従来より行われている動物細胞の顕微鏡細胞観察について簡単に説明する。
一般に動物細胞の観察は、シャーレやディッシュ等の上部に開口部を有する中空な空間部を備えた円柱状の開放型培養器(以下、単に培養容器という)を用いて動物細胞を培養した後、汚染防止のために蓋をして、かかる培養器を顕微鏡のステージ上にセットした後、培養した動物細胞を所定の倍率で観察する。
【0004】
具体的には、ある程度まで培養した肉芽状の動物細胞を内底面にコラーゲン等の着床誘導材が設けられたディッシュに入れてディッシュ内底面に着床させた後、例えば、高湿度(湿度約90%)、温度約37度に調整可能な恒温槽等内で動物細胞をさらに培養する。すると、動物細胞は、支持体に着床して増殖するという性質を有するので、ディッシュ内底面にコラーゲン等の着床誘導部材が設けられていれば、動物細胞をディッシュ内底面に着床させて増殖させることができる。
ディッシュの直径が約35mm程度であれば、動物細胞を培養した培養容器ごと一般の顕微鏡のステージ上に配置することができるので、ディッシュ内底面に着床している動物細胞を、倒立顕微鏡を使用して、ディッシュ底面から観察することができる。つまり、培養容器として、一般に使用されている倒立顕微鏡のステージ上にセットできる大きさのディッシュを用いて動物細胞を培養すれば、培養容器を顕微鏡のステージ上にセットするだけで動物細胞を顕微鏡を用いて観察することも可能である。
【0005】
しかしながら、上記方法により動物細胞を観察することができるのは、ほんの短い時間のみであり、詳細な観察が必要となる動物細胞を観察するには不向きである。その理由は、以下の問題点を有するからである。
【0006】
まず、ディッシュ内に入れる培地は液体であり、この液体の培地はディッシュの開口部から約半分の深さになるようにその量が調整されている。これは、ディッシュを移動するときに、培地がディッシュ外部へこぼれることを防止するためである。例えば、かかる量に調整された培地を有するディッシュを顕微鏡のステージ上に配置しても、ディッシュ内の培地がステージ下方に位置する対物レンズ等にかかるのを防止できる。
しかし、上記の量しか培地を入れていないので、ディッシュに蓋をしたときには、培地界面と蓋との間に空気層が形成される。上述したように、動物細胞は、恒温槽等を用いて培養されているので、培地温度は室温よりもかなり高い状態を維持している。このディッシュを恒温槽等から取り出して室温環境下の顕微鏡のステージ上に配置すれば、培地温度は緩やかに低下するが、空気層温度は培地温度に比べて早く低下する。すると、両者間の温度差により蓋内面に水滴や曇り等を生じることとなる。蓋内面に水滴等が付着すると、動物細胞を観察するために照射した光が乱反射したりするので、動物細胞に焦点を合わせにくくなる。
【0007】
これらの問題点を解決する技術として、上記のごとき蓋内面に付着する水滴等を考慮した顕微鏡用細胞培養容器が開示されている(例えば、特許文献1)。
特許文献1の培養容器は、中空な空間部を有する本体部と、蓋部を備えており、この蓋部は、その中央部下端面が下方に向かって突出するように形成されている。このため、本体部内に培地を入れた状態において、下方に突出した中央部下端面が培地に浸漬するように蓋部を本体部に取り付ければ、培地界面と蓋部の中央部下端面との間に空気層が形成されないから、中央部下端面の内側に水滴等が生じるのを防止することができる。
【0008】
また、特許文献2には、ディッシュを収容する中空な収容空間を有する収容部を備えており、この収容部の上部と下部に、それぞれ加温プレートを備えた顕微鏡用培養容器収容装置が開示されている。すると、ディッシュ内に空気層を有する場合でも、培地温度と空気温度との間の温度差を解消することができるので、蓋内面に水滴等が付着するのを防止することができる。
【0009】
以上のごとく、特許文献1の培養容器および特許文献2の装置を使用すれば、培養容器で培養した動物細胞をそのまま培養容器を顕微鏡のステージ上に配置しても、培養細胞をある程度鮮明に観察することができる。
【0010】
しかるに、動物細胞は培養容器の底面を着床支持体として自由に移動することができるため、特許文献1および特許文献2の培養容器では、観察対象とする動物細胞を顕微鏡における観察視野内に保持しておくことができない。したがって、観察の目的の動物細胞が観察視野内から観察視野外へ移動すれば、目的の動物細胞を観察することができないという問題点を有している。
【0011】
現状では、培養した動物細胞を汚染することなく、簡便に顕微鏡のステージ上にセットして鮮明な動物細胞の観察をすることができ、しかも、顕微鏡観察下において、目的とする動物細胞を観察視野内に保持しておける顕微鏡用細胞収容器は開発されていない。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】実用新案登録第3104790号公報
【特許文献2】特開平10−28576号公報
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は上記事情に鑑み、培養した動物細胞を簡便に顕微鏡を用いて観察することができる状態にでき、かつ、かかる状態において、観察視野内に動物細胞を確保した状態で鮮明に動物細胞を観察することができる顕微鏡用細胞収容器を提供することを目的とする。
【課題を解決するための手段】
【0014】
第1発明の顕微鏡用細胞収容器は、顕微鏡を用いて細胞観察に使用される細胞収容器であって、上端に開口部を有する中空な空間部を備えた収容ケースと、該収容ケースの開口部から前記中空な空間部に挿入される挿入部材と、を備えており、前記挿入部材の下端部には、該下端部が前記収容ケース内の中空な空間部の内底部に接した状態において、該下端部と該内底部の両者間にチャンバを形成し得るチャンバ形成部が設けられていることを特徴とする。
第2発明の顕微鏡用細胞収容器は、第1発明において、前記挿入部材は、該挿入部材を前記中空な空間部に挿入した状態において、該挿入部材と該収容ケースとを連結して固定する固定手段を備えており、前記チャンバ形成部は、前記固定手段により両者が固定されたときに、前記チャンバの内部と外部とを液密に隔離するシール部材を備えていることを特徴とする。
第3発明の顕微鏡用細胞収容器は、第2発明において、前記挿入部材には、その内部に、前記チャンバ内部と外部とを連通する一対の連通通路が設けられており、該一対の連通通路は、前記チャンバの内面と前記挿入部材の上端部側面とをつなぐように形成されていることを特徴とする。
第4発明の顕微鏡用細胞収容器は、第2または第3発明において、前記収容ケースは、着脱可能な細胞培養部と、該細胞培養部を取り付けた状態で保持する保持ケース部と、から形成されており、前記保持ケース部は、その底部に、前記細胞培養部を保持した状態において、前記挿入部材を取り付けたときに、前記チャンバの底面を下方から観察し得る観察開口部が形成されており、該観察開口部は、その外縁部と前記チャンバ形成部との間に支持部を備えており、該支持部は、前記挿入部材を取り付けた状態において、前記シール部材との間に前記細胞培養部の内底面を挟んで支持するように形成されていることを特徴とする。
【発明の効果】
【0015】
第1発明によれば、収容ケース内の中空な空間部内で動物細胞を培養した状態において、収容ケースの開口部から挿入部材を培地内に挿入すれば、挿入部材の下端部と空間部の内底部との間に空気層を有しないチャンバを形成することができる。すると、チャンバ内に水滴等が形成されるのを防止できるので、顕微鏡を用いてチャンバ内に確保した動物細胞を鮮明に観察することができる。つまり、挿入部材を収容ケース内に挿入するだけで培養した動物細胞を顕微鏡を用いて観察することができる状態に調整できる。言い換えれば、培養した動物細胞を簡単かつ迅速に顕微鏡を用いて観察できる状態にできるから、煩雑な操作等を必要としないので操作ミス等による汚染を防止できる。とくに、培養した動物細胞を別の観察収容器等に移動するなどの操作をすることなく、培養した動物細胞を培養条件を維持したまま観察できるので、移動操作等によって生じるストレス等を培養した動物細胞に対して与えない。すると、所望の培養条件下で培養した動物細胞の状態を再現性よく観察できる。さらに、チャンバの内底面の面積が顕微鏡の観察視野の面積と略同程度になるように形成すれば、チャンバ内に確保した動物細胞が移動した場合でも常に目的の動物細胞を確実に観察できる。
第2発明によれば、挿入部材を収容ケース内の中空な空間部に挿入した状態において、挿入部材が固定手段により収容ケースに連結して固定すれば、挿入部材の下端部と中空な空間部の内底部との間に設けられたシール部材により、チャンバ内に培地および動物細胞を確実に保持しておくことができる。また、チャンバ内以外の培地を収容ケースから排出すれば、収容ケースを上下逆転にしても収容ケースから培地がこぼれないので、収容ケースの底面を上方にした状態で顕微鏡のステージ上に配置することができる。すると、倒立顕微鏡に比べて安価な正立顕微鏡を用いても動物細胞の観察ができる。
第3発明によれば、チャンバ内部には、チャンバ内面と挿入部の上端部側面とをつなぐように形成された一対の連通通路が設けられているので、一の連通通路から培地を供給をすれば、チャンバ内の培地を動物細胞に対して常に最適な状態に維持することができる。すると、長期間、動物細胞を顕微鏡を用いて観察できる。しかも、挿入部材を固定手段により収容ケース内に固定すれば、チャンバ内の培地が外部へ漏れ出すのを防止できるので、チャンバ内の培地圧を所望の圧力に調整することができる。さらに、連通通路の一端が、上端部側面に形成されているので、収容ケースの底面を上方にした状態で顕微鏡のステージ上に配置することができる。すると、倒立顕微鏡に比べて安価な正立顕微鏡を用いても培地圧を所望の圧力に調整した状態の動物細胞の観察ができる。
第4発明によれば、細胞培養部を一般のディッシュ等と同様の素材で形成すれば、細胞培養部の操作性を一般のディッシュ等と同等にすることができる。そして、細胞培養部を保持ケース部に保持させた状態で挿入部を取り付けると、保持ケースの底部には観察開口部が設けられているので、対物レンズをチャンバの底面に接近させた状態で、チャンバ内の培養した動物細胞を鮮明に観察できる。しかも、チャンバの底面をカバーグラスと同等の厚さの薄い板状のガラス製部材で形成すれば、培養した動物細胞を高倍率かつ鮮明に観察できる。また、チャンバの内部と外部を隔離するシール部材を細胞培養部の底部を介して保持するように観察開口部の外縁部が形成されている。このため、かかるガラス製部材に曲げるような力が加わらないから、チャンバの底面を薄い板状のガラス製部材で形成した場合でも、かかるガラスが割れて培地が漏れ出すのを防止できる。
【図面の簡単な説明】
【0016】
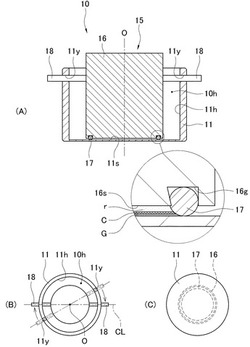
【図1】本実施形態の顕微鏡用細胞収容器10の概略説明図であって、(A)は顕微鏡用細胞収容器10の概略縦断面図であり、(B)は概略平面図であり、(C)は概略底面図である。
【図2】本実施形態の顕微鏡用細胞収容器10の概略説明図であって、(A)は斜視図であり、(B)は側面図であり、(C)は(B)図の固定用軸部18を(I)から(II)へ移動させたときにおける、チャンバ形成部に設けられたシール部材17の形状が変化を示した図である。
【図3】本実施形態の顕微鏡用細胞収容器10を使用する際の作業手順の概略縦断面説明図である。
【図4】本実施形態の顕微鏡用細胞収容器10の概略説明図であって、挿入部材15の本体部16の基端部に張出部16nを備えた構造の概略縦断面説明図である。
【図5】本実施形態の顕微鏡用細胞収容器10のチャンバ内を加圧する方法の概略縦断面説明図である。
【図6】他の実施形態の顕微鏡用細胞収容器10を使用して顕微鏡のステージ上にセットしたときの概略縦断面説明図である。
【図7】(X)は図6の他の実施形態の顕微鏡用細胞収容器10の(X)の拡大概略断面図であり、(X’)は他の実施形態の顕微鏡用細胞収容器10の(X)に相当する部分の拡大概略断面図である。
【図8】(X)は図6の他の実施形態の顕微鏡用細胞収容器10の(X)の拡大概略断面図であり、(X’)は他の実施形態の顕微鏡用細胞収容器10の(X)に相当する部分の拡大概略断面図である。
【図9】図6の他の実施形態の顕微鏡用細胞収容器10を使用する際の作業手順の概略縦断面説明図である。
【図10】他の実施形態の顕微鏡用細胞収容器10の概略縦断面図である。
【図11】図12の他の実施形態の顕微鏡用細胞収容器10の概略説明図であって、(A)は斜視図であり、(B)は側面図である。
【図12】他の実施形態の顕微鏡用細胞収容器10概略縦断面図である。
【図13】本実施形態の顕微鏡用細胞収容器10を保温するための温度制御手段40の概略説明図であり、(A)概略ブロック図と部分拡大図であり、(B)は保温部50の概略説明図である。
【図14】保温部50の概略説明図であり、(A)は他の実施形態の保持部材55の概略説明図であり、(B)は保持部材55の使用状況の概略図である。
【図15】倒立顕微鏡の概略説明図である。
【図16】実施例の実験結果(位相差顕微鏡写真)を示した図である。
【図17】実施例の実験結果(相対蛍光強度と経過時間との関係)を示した図である。
【図18】実施例の実験結果(蛍光顕微鏡写真)を示した図である。
【図19】伝熱プレートPを備えた保持部材55Aの概略説明図であり、(A)は概略平面図であり、(B)は概略側面図である。
【図20】伝熱プレートPを備えた他の保持部材52Aの概略説明図であり、(A)は概略平面図であり、(B)は概略側面図である。
【図21】実施例の実験結果(圧迫培養細胞の蛍光顕微鏡写真)を示した図である。
【発明を実施するための形態】
【0017】
つぎに、本発明の実施形態を図面に基づき説明する。
本発明の顕微鏡用細胞収容器は、培養した培養細胞を観察するために使用される容器であって、簡便かつ安全に作業ができ、しかも、培養した培養細胞を鮮明に顕微鏡を用いて観察することができることに特徴を有している。
なお、本願明細書の培養細胞とは、上記容器内で培養したときに、その内面に付着し得る細胞、例えば、動物細胞などを含む細胞を培養したものをいう。
【0018】
本実施形態の顕微鏡用細胞収容器10は、収容ケース11と挿入部材15を備えた容器であって、挿入部材15を収容ケース11内に挿入したときに、挿入部材15の下端部と収容ケース11の内底部との間に動物細胞等を保持することができるチャンバを形成することのできるものである。
【0019】
本実施形態の顕微鏡用細胞収容器10について詳細に説明する前に、まず、顕微鏡用細胞収容器10を使用して動物細胞等を顕微鏡によって観察する方法について簡単に説明する。
【0020】
顕微鏡としては、例えば、一般的な倒立顕微鏡を採用した場合について説明する。
図15に示すように、一般的な倒立顕微鏡は、本体部と、一端が本体部に連結しており開口部を有する観察窓上に観察対象物を配置するステージと、ステージ上方の本体部上端部に設けられた光源部と、ステージの観察窓の下方において光源から放射された光により観察対象物の照射された光により形成される透過光から中間実像を形成する対物レンズと、対物レンズにより形成された中間実像を所望の倍率で観察し得る接眼レンズとを備えた構造である。つまり、観察窓上のステージに観察対象物を配置して、その上方に設けられた光源から観察対象物に対して光を照射すれば、観察対象物の透過光等はステージ下方に設けられた対物レンズによって中間実像が結ばれる。そして、対物レンズが結んだ中間実像を接眼レンズにより拡大して観察対象物を観察するというものである。
【0021】
本実施形態の顕微鏡用細胞収容器10によって動物細胞Cを観察するときには、顕微鏡用細胞収容器10のチャンバに動物細胞を入れる。この顕微鏡用細胞収容器10を倒立顕微鏡のステージ上に配置して光源を点灯すれば、光は顕微鏡用細胞収容器10内に形成されたチャンバを透過する。光はチャンバを透過するときにチャンバ内に保持された動物細胞等の透過光を形成するので、対物レンズおよび接眼レンズを調整すれば、チャンバ内に保持された動物細胞等を所望の倍率で鮮明に観察することができる。
【0022】
(本実施形態の顕微鏡用細胞収容器10の説明)
つぎに、本実施形態の顕微鏡用細胞収容器10について詳細に説明する。
図1および図2に示すように、本実施形態の顕微鏡用細胞収容器10は、収容ケース11と、収容ケース11内に挿入される挿入部材15とを備えている。
【0023】
(収容ケース11の説明)
収容ケース11は、光を透過する光透過部材により形成された部材である。
図1に示すように、この収容ケース11は、その上端面から下方に向かって凹んだ中空な空間部11hを有する部材である。この収容ケース11は、中空な空間部11hの内部に液体を収容したときに液体が収容ケース11の外に漏れ出さないように形成されている。
【0024】
収容ケース11は、その底部は平坦な底面に形成されている。例えば、収容ケース11は、平板状の顕微鏡のステージ上に静置することができるように形成されている。一方、中空な空間部11hの内底面11sは、収容ケース11の平坦な底面と平行になるように形成されている。すると、本実施形態の顕微鏡用細胞収容器10を顕微鏡のステージに配置したときに、光源から放射された光は、内底面11sに対して均一に照射されるので、内底面11s下方に配設された対物レンズによってチャンバ内の物体の中間実像を鮮明に捉えることができる。
なお、収容ケース11の底部の厚さはとくに限定されないが、その厚さ、つまり、内底面11sと底面の距離を短くすれば、さらに鮮明な中間実像を形成することができる。
【0025】
また、収容ケース11の寸法は、本実施形態の顕微鏡用細胞収容器10を一般的な顕微鏡のステージにセットすることができる大きさに形成されており、ステージに設けられた観察窓(約20mm)以上となるように形成されている。具体的には、収容ケース11の形状として円柱状の形状を採用する場合、その寸法は、縦(図1(A)では上下方向)15〜25mm、直径(図1(A)では左右方向)40〜45mm程度となるように形成されている。
【0026】
なお、収容ケース11の寸法は、上述した寸法に限定されないが、本実施形態の顕微鏡用細胞収容器10を一般の顕微鏡のステージ上に配設して、細胞観察をし得る程度の大きさであればよい。
【0027】
また、収容ケース11の形状はとくに限定されない。例えば、図1に示すように、収容ケース11を、内部の中空な空間部11hが、円形断面となるように形成してもよい。この場合、後述するように、収容ケース11を構成する部材として、市販の円柱状のディッシュ(直径約35mm)を使用する場合、かかるディッシュをその内部に収容しやすくできるという利点が得られる。
また、収容ケース11の形状は、上述した円柱状の形状に限られないのはいうまでもなく、平面視矩形状などでもよい。
【0028】
(挿入部材15の説明)
挿入部材15は、光を透過する光透過部材により形成された部材である。
図1および図2に示すように、挿入部材15は、本体部16を備えており、この本体部16は、上記の収容ケース11の上端に形成された中空な空間部11hの開口部から挿入することができる部材である。例えば、本体部16は、円柱状のブロックのような形状を有する部材であり、光を透過する光透過部材により形成されている。この本体部16は、その下端に平端な下端面16sが形成されている。そして、本体部16は、上記収容ケース11内に取り付けられたときに、下端面16sが収容ケース11の底面および中空な空間部11hの内底面11sと平行になるように形成されているのである。
【0029】
本体部16の寸法は、上記の収容ケース11内の中空な空間部11hに挿入できる大きさに形成されている。具体的には、本体部16の形状が円柱状の形状の場合、収容ケース11の大きさが上述した寸法の場合には、本体部16の寸法は、縦15〜40mm、直径25〜30mm程度となるように形成されている。
とくに、図1および図2に示しように、本体部16の直径は、本体部16を上記収容ケース11内に取り付けた状態において、本体部16の外壁側面と中空な空間部11hの内側面間の間にある程度の隙間空間部10hを有する大きさに形成されているのが好適であるが、その理由は後述する。
【0030】
また、本体部16の高さ、つまり、軸方向の長さはとくに限定されないが、上記収容ケース11内に取り付けた状態において、収容ケース11の上端面から本体部16の上端部がやや突出するように本体部16の縦寸法が形成されていれば、本体部16を収容ケース11内に取り付けやすくなるので好適である。
【0031】
(チャンバの説明)
図1の拡大図に示すように、本体部16の下端部には、片アリ溝構造を有する保持溝16gが形成されている。この保持溝16gは、本体部16の中心軸を囲むように円形に形成されている。そして、この保持溝16gには、Oリングなどの弾性を有するシール部材17が設けられている(図1(A))。このため、収容ケース11内の中空な空間部11hに挿入部材15の本体部16を取り付けたときに、本体部16の下端部と、中空な空間部11hの内底部と、シール部材17とで囲まれた空間(以下、単にチャンバという)を形成することができる。
【0032】
なお、保持溝16gの構造は、片アリ溝構造に限定されないが、片アリ溝構造とすれば、シール部材17を本体部16の下端部に強固に保持させることができる。しかも、シール部材17は、かかる保持溝16gに対して着脱可能に装着することができるので、シール部材17に傷等が付いた場合には、すぐに交換することができる。よって、チャンバの内部と外部とをシール部材17により確実に隔離することができる。
【0033】
なお、保持溝16gの構造は、アリ溝構造を採用することが可能であるのはいうまでもない。この場合、保持溝16g内により強固にシール部材17を保持することができる。
【0034】
(固定手段の説明)
本実施形態の顕微鏡用細胞収容器10は、収容ケース11内の中空な空間部11hに挿入部材15の本体部16を取り付けた状態において、本体部16と、収容ケース11と連結して固定することができる固定手段を備えている。
以下、固定手段について説明する。
【0035】
図1および図2に示すように、本体部16の上端部側面には、一対の棒状の固定用軸部18が設けられている。この一対の固定用軸部18は、互いの中心軸が同軸であって、かつ本実施形態の顕微鏡用細胞収容器10の中心軸Oに直交する軸と同軸となるように、それぞれの基端部が本体部16の上端部側面に連結して配設されている。つまり、一対の固定用軸部18は、顕微鏡用細胞収容器10の中心軸Oに対して対向するように本体部16の上端部側面に連結して配設されているのである。
【0036】
一方、図2に示すように、収容ケース11の側壁上端部には、その上端に開口を有する、鍵形に屈曲した一対のスリット11yが形成されている。この一対のスリット11yは、各スリット11yに一対の固定用軸部18がそれぞれかつ同時に挿入できるように、顕微鏡用細胞収容器10の中心軸Oに対して対向する位置に設けられている。そして、このスリット11yは、その傾斜している部分に固定用軸部18を滑らせて挿入することができ、しかも、その内面と固定用軸部18との間の摩擦によって固定用軸部18の移動を固定できるように形成されている。
【0037】
上記のごとき構成であるので、挿入部材15の本体部16を収容ケース11の開口部からその内部に形成された中空な空間部11h内に挿入すれば、中空な空間部11hの内底部近傍に、本体部16の下端面16sと中空な空間部11hの内底面11sとシール部材17とで囲まれたチャンバを形成することができる。しかも、本体部16には、一対の固定用軸部18が本体部16の上端部側面に連結するように設けられており、この一対の固定用軸部18は、本体部16の中心軸、つまり、本実施形態の顕微鏡用細胞収容器10の中心軸Oに対して対向するように設けられている。すると、本体部16を収容ケース11内に挿入するときに、一対の固定用軸部18を収容ケース11の側壁上端部に形成された一対のスリット11yに挿入して、所定方向(図1(B)の矢印方向)に回転すれば、本体部16を収容ケース11内の所定の位置で固定することができる。
【0038】
しかも、本体部16を収容ケース11内に固定したとき、いずれの中心軸も本実施形態の顕微鏡用細胞収容器10の中心軸O上に位置するように配設することができる。そして、収容ケース11および挿入部材15の本体部16は、光を透過する光透過部材により形成された部材であるので、本体部16の上方、つまり中心軸O上から光を照射すれば、かかる光は本体部16からチャンバそして内底面11sを介して底部下方まで略直線的に透過させることができる。
【0039】
また、図2(B)および図2(C)に示すように、チャンバを形成するシール部材17がある程度の弾性を有している場合には、スリット11yとして、スリット11y内面と固定用軸部18表面との摩擦抵抗によりチャンバの高さを複数段階に調整し得る高さ調節機構を有するように形成していると好ましい。かかる高さ調節機構を有していれば、チャンバの内部と外部とを確実に液密に形成することができる。また、シール部材17の大きさを変えてチャンバの高さを調整するときに、同じ挿入部材15と収容ケース11を使用することが可能となる(図2(C))。
【0040】
なお、上記下端面16sと内底面11sとシール部材17とで囲まれた空間部が、特許請求の範囲にいうチャンバ形成部である。また、固定用軸部18とスリット11yが、特許請求の範囲にいう固定手段に相当する。
【0041】
また、シール部材17を設ける替わりに、本体部16の下端部に、本体部16の中心軸を囲むように下方に突出した円形凸部を設けてもよい。この場合、円形凸部を本体部16と一体的に形成できるので、加工の手間が少なくできるという利点がある。しかも、本体部16の素材が、後述するポリテトラフルオロエチレン(PTFE)であれば、チャンバの内部と外部との間を液密にシールすることができる。
【0042】
(張出部16nを有する本体部16の説明)
とくに、図4に示すように、挿入部材15の本体部16は、収容ケース11内に挿入する先端部16tと、この先端部16tよりも基端部が外方に向かって張り出した張出部16nを備えた構造とするのが好ましい。具体的には、空間部11hが中空な円柱状に形成された場合、張出部16nを備えた本体部16基端部の直径は、空間部11hの内径よりもやや小さくなるように形成されている。つまり、張出部16nは、本体部16を収容ケース11内に取り付けたときに、張出部16n外側面と収容ケース11内側面とが略接するように形成されている。
すると、本体部16の張出部16n外側面を収容ケース11内側面に滑らすようにして、本体部16を収容ケース11内に挿入するだけで、容易に本体部16を収容ケース11内に取り付けることができる。つまり、かかる構造とすれば、収容ケース11内側面は、本体部16の挿入案内部材としても機能するのである。しかも、本体部16を収容ケース11内に取り付けたときに、両者の中心軸を、確実に本実施形態の顕微鏡用細胞収容器10の中心軸O上に位置するように配設することができる。このため、顕微鏡の光源から放射される光を確実にチャンバ内を透過させることができるので、チャンバ内の動物細胞Cを鮮明に観察することができる。
【0043】
(本実施形態の顕微鏡用細胞収容器10を使用した動物細胞観察の説明)
本実施形態の顕微鏡用細胞収容器10を使用した動物細胞を観察する方法について以下説明する。
【0044】
(動物細胞Cの培養説明)
図1(A)に示すように、収容ケース11内の中空な空間部11hの底面に対して平行になるように形成した内底部のうち、チャンバの底面に相当する内底面11sに着床誘導部材Gを塗布する。この着床誘導部材Gは、動物細胞Cを培養する際の支持体として機能する部材であり、かかる着床誘導部材Gに動物細胞Cを着床さることにより、動物細胞Cを増殖等させることができる。ただし、動物細胞Cは、かかる着床誘導部材Gを支持体として移動する性質をも有するが、着床誘導部材Gを所望の範囲にだけ塗布すれば、動物細胞Cはかかる塗布範囲以外には移動しないので、動物細胞Cの移動範囲を限定することができる。
【0045】
なお、着床誘導部材Gとしては、動物細胞等が付着することができる部材であればとくに限定されず、例えば、コラーゲンやゼラチン等を挙げることができる。
また、内底面が平坦に形成されていれば、動物細胞を略均一な細胞膜層状に培養することができる。
【0046】
図3(A)に示すように、収容ケース11は、その内部に液密に形成された中空な空間部11hを備えているので、その内部に培地rを入れて動物細胞を培養することができる。例えば、湿度95%、温度37℃、5%二酸化炭素濃度に調整されたインキュベータ(以下、単にCO2インキュベータという)内において、動物細胞Cを内部に収容した収容ケース11を静置して行う。かかる操作は、培地等が汚染されないように所定の操作、例えば、収容ケース11の開口部を滅菌したシャーレ等で蓋をする等の操作を行うのは言うまでもない。
なお、培養装置としては、湿度、温度、二酸化炭素濃度を所定の値に調整し得ることができるものであればよい。
【0047】
(挿入部材15を収容ケース11内に取り付手順の説明)
以下では、収容ケース11内において、動物細胞Cが所定の培養期間を終了した後の挿入部材15を収容ケース11内に取り付ける手順を、図3に基づいて説明する。
【0048】
図3(A)に示すように、所定の培養が終了した後、CO2インキュベータから取り出した収容ケース11を滅菌された空間、例えばクリーンベンチ内に移動させた後、挿入部材15の本体部16を収容ケース11の開口部から内部に挿入する。このとき、本体部16の下端面16sに空気が溜まらないように挿入する。例えば、本体部16の中心軸を中空な空間部11hの内底面11sに対してやや傾けた状態で挿入する。そして、固定用軸部18と収容ケース11の側壁上端が接したときに、固定用軸部18を収容ケース11の側壁上端部に形成されたスリット11y内を滑らせて挿入する。すると、本体部16は、収容ケース11内の所定の位置で固定できる。
すると、本体部16の下端面16sと中空な空間部11hの内底面11sとの間に空気層を有しないチャンバ形成することができる。しかも、本体部16は、固定用軸部18により収容ケース11内に固定できるので、内部と外部とが確実に隔離されたチャンバを形成することができる。
【0049】
図3(B)に示すように、本体部16を収容ケース11内に固定したとき、培地r界面は、培地rに浸漬した本体部16の体積分だけ本体部16の外側面と収容ケース11の内側面との間に形成された隙間空間部10h内を上方に向かって上昇する。かかる培地rは、顕微鏡観察において不要であり、顕微鏡のステージ上で何らかの原因により収容ケース11の外部にこぼれた場合、ステージ下方に配設された大部レンズ等に対して甚大なダメージを与えるという問題を有する。そこで、図3(B)に示すように、隙間空間部10h上方からピペットP等により、かかる培地rを収容ケース11の外部へ排出すれば、上記の問題を解決することができる。
【0050】
そして、本体部16を収容ケース11内に取り付けた状態の本実施形態の顕微鏡用細胞収容器10を倒立顕微鏡のステージ上に配置すれば、動物細胞を観察できる。しかも、チャンバ内には空気層が形成されていないので、培地r温度と外気との間の温度差によるチャンバ内の水滴等が生じる現象を確実に防止できる。
【0051】
また、観察対象とする動物細胞Cの移動をチャンバという限られた空間内の範囲に限定することができるので、動物細胞Cが着床誘導部材G上を移動して観察視野範囲から逸脱することを防止できる。とくに、チャンバを形成する内底面11sの面積が、倒立顕微鏡の観察視野の面積と略同程度になるように形成されていれば、チャンバ内に確保した動物細胞Cが移動しても常に目的の動物細胞Cを観察視野の範囲に確実に確保することができる。すると、チャンバの内底面11sの面積が観察視野面積よりも大きい場合に比べて、目的とする動物細胞Cを簡単に見つけることができるので、観察ミス等をなくすことができる。
【0052】
以上のごとく、本実施形態の顕微鏡用細胞収容器10では、挿入部材15を収容ケース11内に挿入するという簡便な操作だけで、培養した動物細胞Cを確実かつ的確に観察視野内に確保することができる。つまり、培養した動物細胞Cを簡便かつ迅速に倒立顕微鏡を用いてかかる動物細胞Cを観察できる状態にできるから、煩雑な操作等を必要としないので、操作ミス等による汚染を防止できる。しかも、培養した動物細胞Cを別の観察収容器等に移動することなく、挿入部材15を収容ケース11内に挿入するという簡便な操作だけで、かかる培養条件を維持したまま動物細胞Cを観察できる。すると、移動操作等によって生じるストレス等を培養した動物細胞Cに対して与えないので、所望の培養条件下で培養した動物細胞Cの形態や動態などを再現性よく観察できる。
【0053】
また、チャンバ内に確保できない培地rを収容ケース11の外部へ排出できるので、かかる培地rが収容ケース11の外へこぼれた場合を想定する必要がなく、長時間の観察においても安心して動物細胞Cを観察できる。つまり、培地rが収容ケース11外へ漏れ出したりこぼれたりしないので、本実施形態の顕微鏡用細胞収容器10を倒立顕微鏡のステージに配置しても、対物レンズに対して培地rによる腐食被害等を生じさせないのである。
【0054】
さらに、本体部16は、固定用軸部18により確実に収容ケース11内に連結して固定されているので、かかる収容ケース11を上下逆転にしても外部へ培地がこぼれることはない。このため、かかる収容ケース11の底面を上方にした状態の本実施形態の顕微鏡用細胞収容器10を顕微鏡のステージ上に配置してすることができるので、ステージ上方に対物レンズを有する倒立顕微鏡に比べて安価な正立顕微鏡を用いても動物細胞Cの観察をすることができる。
【0055】
なお、所定の培養期間が終了した収容ケース11内の培地をクリーンベンチ内で所定の緩衝液に置換した後、上記の操作を行ってもよいのは、いうまでもなく、かかる場合においても、上述と同等の効果を奏する。
【0056】
(本実施形態の顕微鏡用細胞収容器10を使用した長期間の動物細胞観察の説明)
本実施形態の顕微鏡用細胞収容器10を使用した長期間の動物細胞を観察する方法について以下説明する。
なお、上述した本実施形態の顕微鏡用細胞収容器10とは、収容ケース11の構造は同じであるため、以下では異なる構成について説明する。
【0057】
(連通通路16a、16bの説明)
図5に示すように、挿入部材15の本体部16には、その内部に、上記チャンバ内と外部とを連通する一対の連通通路16a、16bが設けられている。一対の連通通路16a、16bは、その一端と他端との間において、チャンバ内の上面、つまり、本体部16の内底面16sと本体部16の上端部側面とをつなぐように形成されている。上端部側面に設けられた一対の連通通路16a、16bの他端には、外部からチャンバ内に培地rを供給するための培地供給チューブ16iと、チャンバ内の培地rを外部へ排出するための培地排出チューブ16eがそれぞれ連結されている。
【0058】
以上のごとき構成とすれば、チャンバ内部には、チャンバ内面と本体部16の上端部側面とをつなぐように形成された一対の連通通路16a、16bが設けられているので、一の連通通路16aからチャンバ内に培地rを供給して、他の連通通路16bからチャンバ内の動物細胞Cが排出した老廃物等を外部へ排出する。すると、チャンバ内の培地rを動物細胞Cに対して常に最適な状態に維持することができる。そうすると、本実施形態の顕微鏡用細胞収容器10を使用して、長期間、倒立顕微鏡を用いてチャンバ内の動物細胞Cを観察できる。
【0059】
とくに、図5の拡大図に示すように、チャンバ内の動物細胞Cが排出した老廃物等を外部へ排出するための連通通路16bは、チャンバ内に形成した一端がチャンバ内側でテーパ状に形成されているのが好適である。この場合、一の連通通路16aからチャンバ内に培地rを供給する際に、供給培地rが気泡を含んでいたとしても、かかる気泡は、培地r流動に乗って速やかにテーパ状に形成された他の連通通路16bへ導入することができる。すると、長期間の培養観察においても、常にチャンバ内は空気層を有しない構造とすることができるから、かかる場合においても動物細胞Cを鮮明に観察できる。
【0060】
また、培地供給チューブ16iの他端に所定の脈動を形成し得る脈動形成手段、例えば、脈動発生ポンプなどを連結すれば、チャンバ内を所望の脈圧条件となるように調整することができる。すると、チャンバ内の培地圧力を所望の圧力、例えば、生体内の血管内の脈圧と同等の脈圧になるように調整すれことができる。つまり、本実施形態の顕微鏡用細胞収容器10を使用すれば、血管内の動物細胞C(例えば、血管内皮細胞など)の動態等を倒立顕微鏡下で再現して観察することができる。言い換えれば、顕微鏡下において、動物細胞Cに対してストレス試験を行うことができる。
【0061】
さらに、一対の連通通路16a、16bの他端は、それぞれ本体部16の上端部側面に形成されているので、本体部16の上面をその中心軸と直交する平坦面に形成しておけば、収容ケース11の底面を上方にした状態で顕微鏡のステージ上に配置することができる。すると、上記の正立顕微鏡を用いても培地圧を所望の圧力に調整した状態の動物細胞Cの観察ができる。
【0062】
また、培地供給チューブ16iに、薬液等を供給培地に混入させることができる薬液供給手段、例えば、三方活栓等を設ければ、チャンバ内の動物細胞に対して様々な薬液や濃度の異なる薬液を与えることができる。つまり、顕微鏡下において、上述したように生体内と同様の条件を再現した状態で、薬剤耐性試験等をもすることができる。
【0063】
なお、上記例では、一対の連通通路16a、16bの他端が、それぞれ本体部16の上端部側面に形成された場合について説明したが、一対の連通通路16a、16bの他端を本体部16上端面に形成した構造を採用することもできる。
この場合、動物細胞Cの薬剤耐性試験等に用いられる薬剤を、上端面に形成された一対の連通通路16a、16bの他端開口のうちいずれかの他端開口から直接チャンバ内に添加することができる。例えば、ニードルの長さが約50mm程度の注射筒やシリンジ等を用いれば、ニードル先端で連通通路16a、16bの内壁を傷つけることなく、所望の薬剤を他端開口から直接チャンバ内へ添加することができる。すると、所望の濃度等に調整された薬剤等を確実にチャンバ内に所望の量だけ添加できる。そうすると、薬剤耐性試験等の再現性をさらに安定させることができ、しかも、高価な薬剤等を使用する場合には、その使用量を最小とすることができるので経済的であるという利点も得られる。
【0064】
(本実施形態の顕微鏡用細胞収容器10の収容ケース11の他の形態の説明)
図6に示すように、収容ケース11は、着脱可能な細胞培養部13と、この細胞培養部13を取り付けた状態で保持する保持ケース部12とから形成してもよい。
【0065】
(保持ケース部12の説明)
まず、保持ケース部12について説明する。
図6および図7に示すように、保持ケース部12は、その底部に、顕微鏡のステージに設けられた円形の観察窓の直径(約20mm)と同等もしくはやや大きめの直径、例えば22mm〜25mm程度となるように形成された観察開口部12qを備えており、その中心軸が保持ケース部12の中心軸に一致するように形成されている。
【0066】
(保持ケース部12の底部フランジ12fの説明)
また、保持ケース部12の底部には、側壁下端部に基端部が連接しており、底部の中心軸に向かった内方に観察開口部12qを有するドーナッツ状の底部フランジ12fが形成されている。図7(X)に示すように、この底部フランジ12fの先端部には、先端部近傍から上方に向かって凸状に形成された支持部12pが設けられている。言い換えれば、支持部12pと側壁下端部との間には、断面視凹み状の凹溝12gが側壁下端部に沿って形成されている。この支持部12pは、その高さが、後述する細胞培養部13の底面に設けられた凸状部13rの高さよりも高くなるように形成されている。
【0067】
(細胞培養部13の説明)
つぎに、細胞培養部13について説明する。
図6および図7に示すように、細胞培養部13は、その上端面から下方に向かって凹んだ中空な空間部13hを有する部材である。この細胞培養部13は、中空な空間部13hの内部に液体を収容したときに液体が細胞培養部13の外に漏れ出さないように形成されている。また、細胞培養部13は、保持ケース部12内に収容し得る大きさであれば、とくに限定されない。例えば、細胞培養部13は、有底筒状の容器であって、その外径が約35mm程度のものを使用できる。
【0068】
また、図6および図7に示すように、細胞培養部13の底部は、厚肉部13fと細胞保持部14とから形成されている。
【0069】
厚肉部13fは、側壁下端部に外周縁が連接された、細胞培養部13の底部の中心軸上に位置するドーナッツ状に形成されている。
細胞保持部14は、厚肉部13fよりも肉厚が薄く形成されており、チャンバを形成したときに、その上面において動物細胞Cを保持するように形成されている。この細胞保持部14は、その厚さ、つまり、細胞保持部14の上面14sと底面との距離が、チャンバを形成したときのチャンバ内の圧力に耐えうる程度の厚さになるように形成されている。例えば、細胞保持部14は、その中心が細胞培養部13の底部の中心軸上に位置するような円形状であって、その厚さは0.1mm〜0.3mmとなるように形成することができる。
そして、図7(X)に示すように、この細胞保持部14は、細胞培養部13を保持ケース部12に取り付けた状態において、本体部16を細胞培養部13内に取り付けたときに、本体部16の底部に設けられた上記シール部材17と上記支持部12pの上端面との間に挟まれるように形成する。逆にいえば、支持部12pは、細胞培養部13を保持ケース部12に取り付けた状態において、本体部16を細胞培養部13内に取り付けたときに、シール部材17と支持部12pとの両者間に細胞保持部14を挟み込む位置になるように形成されている。
【0070】
また、細胞培養部13には、細胞培養部13を水平な実験机等に置いたときに、底面に水等が付着しても、底面の密着性を低下させるための高台状の凸状部13rが、厚肉部13fの下端面に下方に設けられている。
【0071】
とくに、細胞保持部14の厚さを0.1mm程度に形成した場合であって、上述したようにチャンバ内の培地に所望の圧力を加える場合、かかる圧力によって細胞保持部14がたわまない程度に形成する。例えば、細胞保持部14の面積が保持ケース部12の底部に形成された観察開口部12qの面積よりも若干小さくなるように形成する。すると、チャンバ内の動物細胞Cを観察できる視野を確保しつつ、チャンバ内の動物細胞Cに対するストレス試験の状態を高感度で観察することができる。なお、細胞保持部14は、ガラス製部材で形成されていれば、より高感度に動物細胞Cを観察できるという利点が得られる。
【0072】
(リフタLの説明)
図9に示すように、細胞培養部13を保持ケース部12内取り付けるときに、リフタLにより、保持ケース部12内に取り付ける。このリフタLは、細胞培養部13を保持ケース部12内に取り付けた状態において、保持ケース部12の底部に形成された観察開口部12qから取り外すことができるように形成されている。例えば、リフタLは、棒状の把持部と、把持部の端部に連結した保持ケース部12を支持する円形状の支持部と、把持部の他端部に連結した台座部とから形成された部材であり、円形状の支持部は観察開口部12qの直径よりもやや小さくなるように形成する。
【0073】
このため細胞培養部13は、リフタLを使用すれば、以下の方法で保持ケース部12内に取り付けることができる。
まず、リフタLの支持部を保持ケース部12の観察開口部12qから挿入して、この支持部が、保持ケース部12の上端面よりもやや低い位置に配置する。そして、この支持部に細胞培養部13を配置して、保持ケース部12をリフタLの把持部の軸線方向に沿って持ち上げる(図9(A))。すると、保持ケース部12の上端内側面を細胞培養部13の導入案内部とすることができる。その後、細胞培養部13の底部が支持部12pの上端面に接した状態において、リフタLの支持部を保持ケース部12の観察開口部12qから取り外せば、細胞培養部13を簡易にかつ安全に保持ケース部12内に取り付けることができる。
【0074】
なお、このリフタLの形状は、細胞培養部13を保持ケース部12内に取り付けた状態で観察開口部12qから取り外すことができる形状であれば、とくに限定されない。
【0075】
以上のごとき構成であるので、細胞培養部13は、保持ケース部12から着脱可能であるので、一般のディッシュ等と同様の操作で動物細胞Cの培養操作をすることができるから、初めて使用する場合でも容易に操作することができる。
そして、リフタLを用いれば、培養した動物細胞Cを内部に収容した状態で、培地をこぼすことなく容易に細胞培養部13を保持ケース部12内に取り付けることができる(図9(A)および(B))。
そして、図9(B)および(C)に示すように、挿入部材15の本体部16を取り付けて、倒立顕微鏡のステージに配置すれば、保持ケース12の底部には観察開口部12qが設けられているので、対物レンズをチャンバの底面14sを形成する薄い板状の細胞保持部14の底面に接近させることができる。すると、対物レンズと動物細胞Cとの距離を短くできるので、チャンバ内の培養した動物細胞Cをより鮮明に観察できる。
しかも、保持ケース部12の底部には、凹み溝12gが側壁下端部に沿って形成されているので、細胞培養部13内から培地rがこぼれたとしても、かかる培地rを凹み溝12gで保持できるから、対物レンズ等へ培地rがかかるのを防止できる。
また、支持部12pは、本体部16の底部に設けられたシール部材17との間に細胞保持部14を挟み込むようにして、細胞保持部14をその上端部で保持しているので、細胞保持部14に曲げ等の力が加わることを防ぐことができる。すると、チャンバの底面、つまり、細胞保持部材14が薄い板状のガラス製部材、例えば、上述したカバーグラスと同等の厚さとなるように形成した場合でも、かかるガラス製部材が割れないので、チャンバ内の培地が漏れ出等といったトラブルを防止できる。
【0076】
なお、図7(X’)に示すように、細胞培養部13の底面に高台状の凸状部13rを有しない場合、保持ケース部12のフランジ12f上端部が平坦な構造を採用することも可能である。かかる場合、細胞培養部13および保持ケース部12の構造が上述した構造に比べて簡単となるので、安価に製造することができる。
【0077】
また、細胞培養部13は、上述した機能を備えているものであって、保持ケース部12に取り付けることができるものであればよく、市販のディッシュ等を採用することも可能である。
【0078】
なお、上記例では、細胞保持部14が、細胞培養部13を保持ケース部12に取り付けた状態において、本体部16を細胞培養部13内に取り付けたときに、本体部16の底部に設けられたシール部材17と支持部12pの上端面との間に挟まれるように形成された場合、つまり、シール部材17と支持部12pの両者間に細胞保持部14を挟む場合について説明した。しかし、図8に示すように、この両者間に、肉厚部13fを挟み込むようにした構造を採用することもできる。
この場合、細胞保持部14に力が加わらない。すると、チャンバの底面、つまり、細胞保持部材14を薄い板状のガラス製部材、例えば、上述したカバーグラスと同等の厚さ(例えば、0.1mm程度)部材によって形成した場合、本体部16を強く締め付けてもガラス製部材が割れないので、チャンバの内部と外部とをさらに液密にすることができる。なお、上記の例では、細胞保持部14がガラス製部材によって形成された場合について説明したが、細胞保持部14の材質は、ガラス製部材に限定されず、例えば、光を透過する光透過性を有する合成樹脂部材(例えば、ポリエチレン製部材、ポリプロピレン製部材等)を採用してもよい。
【0079】
(他の実施形態の顕微鏡用細胞収容器10Bの説明)
上述した挿入部材の構造は、同一の材質により形成された場合について説明したが、以下では、挿入部材が異なる材質で形成された構造を採用した場合について説明する。
【0080】
図10に示すように、挿入部材35は、収容ケース11に挿入する本体部36を備えており、この本体部36は、その内部に上端から下端に連通した円柱状の貫通孔部35hが形成されている。この円柱状の貫通孔部35hの下端部には、内方に突出した凸状部36pが形成されている。
【0081】
図10に示すように、円柱状の貫通孔部35hには、本体部36と材質の異なる材質で形成された円柱状の光を透過する円柱部材31と、この円柱部材31の上方に配設した円柱状の光を透過する保護部材32が、貫通孔部35h下端面から上方に向かって着脱可能に積層して取り付けられている。つまり、円柱部材31は、貫通孔部35hに挿入したときに、貫通孔部35hの下端部に形成された凸状部36pに係止し得るように取り付けられるのである。
【0082】
すると、本体部36は、例えば、光を透過する部材(ガラスや石英等)よりも異なる材質、例えば、フッ素樹脂系の材質で形成すれば、割れにくくかつ容易に加工することができる。しかも、円柱部材31と保護部材32は着脱可能であるので、円柱部材31に傷等が付いた場合、かかる部品だけを交換することができるので、経済的に好ましい。
【0083】
なお、保護部材32は、その側壁が貫通孔部35hの内壁面との間で螺合し得るように形成されているのが好適である。例えば、保護部材32の側壁に雄ネジ、貫通孔部35hの内壁面に雌ネジを形成する。すると、保護部材32を回転させることによって円柱部材31を固定することができるので、チャンバ内の培地rが円柱部材31の係止部分から漏れ出すのを防止できる。
また、保護部材32の下端面と円柱部材31の上端面との間に干渉部材33を備えていれば、両者間の摩擦による円柱部材31上端面に傷等が形成されるのを防止できる。
【0084】
また、保護部材32が、本体部材32aと、この本体部材32aを内方で保持する本体保持部32bとから構成されていれば、本体部材32aを光が透過できる部材で形成し、本体保持部32bを本体部材32aよりも硬い材質で形成することができる。すると、より強固に円柱部材31を固定することができる。
【0085】
さらになお、円柱部材31と保護部材32を貫通孔部35h内に取り付けた状態において、円柱部材31の下端面と凸状部36p下端面が略面一の状態、つまり、本体部36の下端面が略面一とになるように形成されているのが好ましい。この場合、かかる挿入部材35を収納ケース11内に取り付けた状態において、一の連通通路36aからチャンバ内に培地rを供給しても、チャンバ上面、つまり、本体部36の下端面近傍に段差に起因する渦流が形成されることを防止できる。
【0086】
(他の固定手段を備えた他の実施形態の顕微鏡用細胞収容器10Cの説明)
上述した挿入部を収容ケース11に挿入して、挿入部材を収容ケース11に取り付けた状態において、収容ケース11と連結して固定する固定手段として、棒状の固定用軸部18を採用した場合について説明したが、以下では、他の固定手段を採用した場合について説明する。
【0087】
図12に示すように、挿入部材35の本体部36は、本体部36を収容ケース11に固定するための固定部36sと、この固定部36sの先端面に基端が連結された先端部36tとを有する構造を採用することができる。なお、先端部36tは、上述した先端部16tと同等の構造を有するものである。
【0088】
図12に示すように、固定部36sは、本体部36を収容ケース11内に取り付けたときに、収容ケース11の保持ケース12の内側面と略接するように形成された張出部36nと、この張出部36nの基端部に、張出部36nよりも外方に向かって張り出してフランジとして機能する基端フランジ36fとから形成されている。この張出部36nの外側面には、雄ネジが形成されている。具体的には、張出部36nにおいて、基端フランジ36fの連結部から先端面の間の外側面に雄ネジが形成されている。すると、保持ケース12の内側面に雌ネジが形成されていれば、本体部36を回転させることによって保持ケース12内に本体部36を所定の位置で固定することができる。しかも、図12に示すように、本体部36の基端部には基端フランジ36fが設けられているので、本体部36を回転させながら保持ケース12内に挿入したときに、基端フランジ36fと保持ケース12の側壁上端面とが当接した位置で回転を停止させることができる。すると、本体部36を強く締めすぎてもチャンバの高さを所望の高さよりも低くなるのを防止できる。しかも、強い締め付けによって細胞保持部14が破損等するのを防止できる。
さらに、図11に示すように、基端フランジ36fの側壁面と保持ケース12の側壁面とが、略面一となるように形成されていれば、略凹凸のない構造とすることができるので、塵や埃等が外部に付着しにくい構造とすることができる。すると。凹凸形状を有する場合に比べて汚染の危険性を少なくすることができる。
【0089】
なお、張出部36nと保持ケース12の両者間にシール性を有する部材を設ければ、顕微鏡用細胞収容器10Cが転倒した場合であっても、培地rが両者間を介して外部に漏洩するのを防止できる。例えば、張出部36nの外周にOリングを設ける。具体的には、張出部36nの外側面に形成された雄ネジの基端と基端フランジ36fとの間にOリングが配置されるように設ければ、Oリングによって両者間をシールすることができる。
【0090】
(温度制御手段40の説明)
また、以下に説明するように、顕微鏡用細胞収容器10がチャンバ内の温度を制御する温度制御手段40を備えていてもよい。この場合には、長期間、顕微鏡用細胞収容器10を顕微鏡のステージに配置した場合であっても、チャンバ内の温度を常に一定の温度に保つことができ、チャンバ内の動物細胞Cに対する培地温度の影響を排除できる。すると、動物細胞Cの動態等をより再現性よく顕微鏡を用いて観察できるから、好適である。
【0091】
例えば、この温度制御手段40は、内部に顕微鏡用細胞収容器10を取り付けた状態において、顕微鏡用細胞収容器10の温度を測定し得る温度センサ62と、この温度センサ62の測定した温度データ等に基づいて顕微鏡用細胞収容器10内のチャンバ内温度が所望の値となるように、顕微鏡用細胞収容器10に所定の熱量を供給する保温部50と、を備えている。
以下、個々の部材について詳細に説明する。
【0092】
(保温部50の説明)
図13に示すように、保温部50は、固定ベース51と保持部材52とから形成されている。
【0093】
(固定ベース51の説明)
固定ベース51は、底面が平坦かつ上面が底面に対して平行な板状の部材であり、この板状部材には、円柱状の顕微鏡用細胞収容器10の直径、具体的には、収容ケース11の底面の直径よりやや大きな貫通孔50hが形成されている。そして、この固定ベース51は、後述するように、貫通孔50h内に顕微鏡用細胞収容器10を取り付けて顕微鏡のステージに配置した状態において、顕微鏡用細胞収容器10と貫通孔50hの両者の中心軸がステージに設けられた観察窓の中心軸と一致するように調整した状態を維持し得るように安定した形状に形成されている。
【0094】
(保持部材52の説明)
図13に示すように、この固定ベース51の上面には、保持部材52が設けられている。この保持部材52は、上端面および下端面にそれぞれ開口を有する内部に中空な空間部が形成された円筒状の部材であり、円筒状の内部空間部の直径が固定ベース51の貫通孔50hの直径と略同じ大きさに形成されている。そして、この保持部材52は、その中心軸が固定ベース51の貫通孔50hの中心軸と一致するように、貫通孔50hの外縁を囲むように配設されている。
すると、固定ベース52の貫通孔50hの外縁を囲むように保持部材52を配設した保温部50を顕微鏡のステージに配置した状態において、保持部材52の中空な空間部の上方から顕微鏡用細胞収容器10を挿入すれば、顕微鏡用細胞収容器10の中心軸Oがステージに設けられた観察窓の中心軸と略一致させて顕微鏡用細胞収容器10をステージに配置できる。
【0095】
(ヒータ部材61の説明)
また、図13に示すように、保持部材52には、保持部材52に熱を供給するヒータ部材61が設けられている。このヒータ部材61は、保持部材52の側壁に形成された切欠部52gに配設されている。この切欠部52gは、保持部材52の側壁の上端面から下端面に向かって形成されている。
【0096】
図13(A)に示すように、保温部50を顕微鏡のステージに配置した状態において、顕微鏡用細胞収容器10を保持部材52の上端面の開口から挿入して取り付ける。すると、図13(A)の拡大図に示すように、保温部50の貫通孔50hの直径が顕微鏡用細胞収容器10の底面の直径よりやや大きく形成されているので、顕微鏡用細胞収容器10は、その外側面と保持部材52の内側面との間に僅かな隙間を有するように保温部50の貫通孔50h内に配置できる。保持部材52は、ヒータ部材61から供給された熱を、その内側面から内方に向かって放出できるので、この放出された熱は、保持部材52の内側面と顕微鏡用細胞収容器10の外側面との間に形成された隙間を介して顕微鏡用細胞収容器10に供給できる。このため、保温部50により顕微鏡用細胞収容器10を保温することができる。
【0097】
なお、図13に示すように、保持部材52は、その中心に対して対向するように一対の切欠部52g、52gが形成されていれば、この一対の切欠部52g、52gにそれぞれヒータ部材61、61を取り付けることができるので、効率よくヒータ部材61から保持部材52に熱を供給できる。
また、ヒータ部材61を切欠部52gに取り付ける方法は、保持部材52に熱を供給できれば、とくに限定されず、例えば、ヒータ部材61は、切欠部52gにネジで固定してもよい。また、保持部材52に切欠部52gを設けずに、ヒータ部材61を差し込むための差し込み溝等を形成して、この差し込み溝にヒータ部材61を差し込んで固定するようにしてもよい。この場合、ヒータ部材61を差し込み溝に差し込む方向は、保持部材52の上方から下方に向かって差し込むように取り付けてもよいし、保持部材52の横方向から差し込むように取り付けてもよい。
【0098】
(切欠部52gの他の形状の説明)
なお、切欠部52gは、上述したヒータ部材61を取り付けることができる形状であればとくに限定されない。例えば、保持部材52の平面視(保持部材52の軸線方向からみたとき、つまり、図13(B)となるように紙面に対して垂直方向からみたとき)において、クサビ状(図13(B)の点線参照)に形成された形状としてもよい。この場合、クサビ状に形成した切欠部52gにヒータ部材61を取り付けておけば、このヒータ部材61に電気を通すケーブル等を保持部材52の周方向から接続することができる。すると、顕微鏡のステージ上に保温部50を配置したときに、かかるケーブル等が邪魔にならないので、好ましい。
【0099】
(制御部60の説明)
とくに、図13(A)に示すように、温度制御手段40は、ヒータ部材61の作動を制御する機能を有する制御部60を備えていれば、保温部50を顕微鏡のステージに配置した状態において、保温部50に形成された貫通孔50hに顕微鏡用細胞収容器10を配置することによって、顕微鏡用細胞収容器10内の温度を常に略一定の温度に維持することができる。
【0100】
具体的には、図13(A)に示すように、ヒータ部材61は、制御部60に電気的に接続されている。この制御部60には、ヒータ部材61の他、顕微鏡用細胞収容器10内の温度を測定する温度センサ62が電気的に接続されている。この温度センサ62は、顕微鏡用細胞収容器10内のチャンバ近傍の温度を測定するように配設されている。そして、この制御部60は、温度センサ62の測定値に基づいて、ヒータ部材61の作動を制御することにより、保持部材52から顕微鏡用細胞収容器10に供給する熱量を制御する機能を有している。例えば、制御部60にチャンバ内の培地温度とチャンバ近傍の温度から作成した検量線等を記憶させておけば、制御部60は、温度センサ62により得られた温度データに基づいてチャンバ内の推定温度値を算出できる。この算出された推定温度値に基づいて、制御部60がヒータ部材61の作動を制御すれば、保持部材52から顕微鏡用細胞収容器10に供給する熱量を制御することができる。
【0101】
上記のごとき温度制御手段40を備えていれば、温度センサ62によってチャンバ内温度が推定できるので、チャンバ内温度が所望の温度から変動すれば、制御部60によって、保持部材52の作動が制御され、顕微鏡用細胞収容器10内の温度が調整される。すると、チャンバ内を一定の温度に維持できるのから、動物細胞Cの動態等をさらに再現性よく顕微鏡を用いて観察できる。しかも、チャンバ内の温度を変動させれば、動物細胞Cに与える温度の影響をも顕微鏡を用いて観察できる。
【0102】
(他の保持部材55の例)
固定ベース51の貫通孔50hの外縁を囲むように配設した保持部材の構造は、その内部に顕微鏡用細胞収容器10を配置した状態において、その内側面から顕微鏡用細胞収容器10に対して熱を供給できる構造であれば、上述した構造に限定されない。
【0103】
例えば、以下に説明するように、保持部材55の内部に顕微鏡用細胞収容器10に配置したときに、保持部材55の内側面が顕微鏡用細胞収容器10の外側面に面接触し得る構造とすれば、保持部材55は、顕微鏡用細胞収容器10に効率よく熱量を供給することができるので、好適である。しかも、保持部材55の内側面と顕微鏡用細胞収容器10の外側面の間には、隙間が形成されないから、チャンバ内の温度をより正確に一定の温度に維持できる。
【0104】
図14に示すように、保持部材55は、上端面および下端面にそれぞれ開口を有する内部に中空な空間部が形成された円筒状の部材であり、その側壁に切欠き状の開口部55sが形成された略C字状の部材である。この略C字状の保持部材55は、固定ベース51に固定された固定部55aと、可動部55bとから形成されている。
【0105】
図14(A)に示すように、この固定部55aと可動部55bは、それぞれの基端部が連続するように連結部で連結して形成されている。具体的には、略C字状の保持部材55の中心を通り、欠き状の開口部55sに対して対向する部位に連結部を有するように形成されている。
可動部55bは、上記の連結部を支点として固定ベース51の上面を摺動し得るように固定部55aに対して揺動可能に連結されている。そして、この保持部材55は、可動部55bをその先端面が固定部55aの先端面に接するように揺動させたとき、つまり、切欠き状の開口部55sが閉塞した状況において、保持部材55内の中空な空間部の断面形状が、保持部材55の中心軸に対して直交する円形な断面形状となるように形成されている。また、かかる円形な断面形状となるように可動部55bを揺動して切欠き状の開口部55sを閉塞させた状態において、保持部材55は、その内部の中空な空間部の円形な断面形状の半径が、顕微鏡用細胞収容器10の中心軸Oに対して直交する円形な断面形状の半径と同一となるように形成されている。言い換えれば、かかる状態において、両者の曲率半径が同一となるように形成されている。
【0106】
このため、固定ベース51に保持部材55を上記のごとく取り付けた保温部50を顕微鏡のステージに配置した状態では、保持部材55は、その側壁に切欠き状の開口部55sが形成されているので、上端面の開口から顕微鏡用細胞収容器10を容易に貫通孔50h内に挿入して取り付けることができる。そして、保持部材55の切欠き状の開口部55sを閉塞すれば、保持部材55と顕微鏡用細胞収容器10の両者の中心軸を一致させることができる。しかも、この中心軸に対して直交する保持部材55内の中空な空間部の円形な断面形状と、この中心軸に対して直交する顕微鏡用細胞収容器10の円形な断面形状の両者の曲率半径が同一であるので、保持部材55は、その内側面が顕微鏡用細胞収容器10の外側面に面接触して顕微鏡用細胞収容器10をその内部に保持することができる。
【0107】
なお、上記連結部の内側面に上端面から下端面に向かった切欠きが形成されていれば、切欠き状の開口部55sを閉塞しやすくなるという利点が得られる(図19(A)参照))。
【0108】
(開口閉塞手段56の説明)
とくに、保持部材55は、可動部55bを連結部を支点として固定部55aに対して揺動させたときに、両者の先端面を密着して保持する開口閉塞手段56を備えていれば、保持部材55の内側面と顕微鏡用細胞収容器10の外側面を確実に面接触させておくことができる。
【0109】
例えば、図14に示すように、開口閉塞手段56は、一対の板状部材57a、57bと、この一対の板状部材57a、57bを接近離間するように調整する隙間調整部材58とから形成されている。この一対の板状部材57a、57bは、互いに略平行になるようにそれぞれ、その基端部が固定部55aと可動部55bの両端部の外側縁部に連結されている。具体的には、この一対の板状部材57a、57bは、それぞれの内端面が密着するように接近すれば、固定部55aと可動部55bの両端部の端面が密着するように形成されている。言い換えれば、開口閉塞手段56を備えた保持部材55は、クランプ状に形成された部材である。
【0110】
この隙間調整部材58は、一対の板状部材57a、57b間に形成された隙間を調整する部材である。
図14に示すように、一対の板状部材57a、57bは、対向する位置に貫通孔が形成されている。この貫通孔のうち一の板状部材57b(図14の左側の板状部材)に形成された貫通孔内面には、雌ネジが形成されている。そして、隙間調整部材58は、雄ネジが形成されたボルト状に形成されている。
すると、他の板状部材57aの貫通孔から一の板状部材57bの貫通孔に向かって隙間調整部材58を挿入し、隙間調整部材58の雄ネジを板状部材57bに形成した貫通孔内の雌ネジに螺合すれば、一対の板状部材57a、57bの内端面を接触した状態で保持することができる。つまり、かかる状態は、固定部55aと可動部55bの両端面が密着した状態で保持されているのである(図14(B))。
【0111】
このため、固定ベース51に保持部材55を上述したように取り付けた保温部50を顕微鏡のステージに配置した状態において、保持部材55の上端面の開口から顕微鏡用細胞収容器10を貫通孔50h内に挿入して、開口閉塞手段56により固定部55aと可動部55bの両先端面を密着して保持できるので(図14(B))、保持部材55の内側面と顕微鏡用細胞収容器10の外側面を密着させた状態で顕微鏡用細胞収容器10を保温部50内に取り付けることができる。
【0112】
したがって、保持部材55の内側面と顕微鏡用細胞収容器10の外側面を確実に面接触させておくこができるので、保持部材55は、顕微鏡用細胞収容器10に効率よく熱量を供給することができる。しかも、保持部材55の内側面と顕微鏡用細胞収容器10の外側面の間には、隙間が形成されないから、保持部材55の内側面から直接、顕微鏡用細胞収容器10に熱を供給できる。すると、保持部材55から顕微鏡用細胞収容器10に供給する熱量と、この供給された熱量により変動するチャンバ内の温度とをよりタイムロスがない状況で両者の関係を把握することができる。すると、温度制御手段40が上述した制御部60を備えていれば、チャンバ内の温度をより変動が少ない状態に維持することができるので、より正確にチャンバ内の温度を一定の温度に維持することができる。よって、さらに再現性のよい動物細胞Cの動態等を顕微鏡を用いて観察できる。
【0113】
さらに、開口閉塞手段56により保持部材55内部に顕微鏡用細胞収容器10を固定して保持することができるから、顕微鏡用細胞収容器10を顕微鏡のステージ以外の場所で保温部50の貫通孔50hに取り付けることができる。この場合、ステージ上で顕微鏡用細胞収容器10を保温部50に取り付ける場合に比べて取り付ける際の視野が広くなるので、より簡便に顕微鏡用細胞収容器10を保温部50に取り付けることができる。
例えば、保温部50を上面が平坦な実験台等に配置して、顕微鏡用細胞収容器10を保温部50の貫通孔50hに挿入する。そして、顕微鏡用細胞収容器10の底面が実験台等の上面に当接した状況で開口閉塞手段56により保持部材55内部に顕微鏡用細胞収容器10を固定して、かかる保温部50を顕微鏡のステージに配置することができる。
【0114】
なお、保温部50は、固定ベース51を備えていないものを採用することも可能であるというのは、いうまでもない。この場合、開口閉塞手段56により保持部材55内部に顕微鏡用細胞収容器10を固定して保持することができるから、かかる状態において、上下を逆転させても、保持部材55から顕微鏡用細胞収容器10に熱量を供給することができる。このため、正立顕微鏡を使用してチャンバ内の動物細胞Cを観察する場合であっても、上述した場合と同様の効果を奏する。
また、開口閉塞手段56により保持部材55内部に顕微鏡用細胞収容器10を固定して保持することができるから、保持部材55を形成する固定部55aが固定ベース51にビス等により着脱可能に形成されているのが、好ましい。この場合、倒立顕微鏡を使用する場合には、この保持部材55は、固定部55aを固定ベース51に固定した状態で用いればよく、正立顕微鏡を使用する場合には、固定部55aを固定ベース51からはずした状態で用いることができる。
【0115】
なお、保持部材52、55の素材は、熱伝導性を有するものであればとくに限定されず、たとえば、アルミニウムを採用することができる。
また、温度センサ62は、顕微鏡用細胞収容器10内のチャンバ内温度を計算できるデータを測定することができれば、とくに限定されない。例えば、チャンバ上方に配置された保護部材32のうち、本体保持部32b内に軸方向に一端が開口した一対の温度センサ挿入穴を、保護部材32の中心軸に対して対向するように形成し、この温度センサ挿入穴に温度センサ62を挿入すれば、チャンバ内温度を計算できるデータを測定することができる。
【0116】
(その他)
(構成部材の材質の説明)
金属イオン等がチャンバ内で培養した細胞に対してその動態等に影響を与える場合、本実施形態の顕微鏡用細胞収容器10を構成する部材は、金属イオン等が培地rにより溶出しない素材、例えば、フッ素樹脂のポリテトラフルオロエチレン(PTFE)や二酸化ケイ素(石英)を素材として形成するのが好ましい。例えば、PTFEを素材とした形成した部材は、加工が容易であり、しかも、オートクレーブ等を用いた高温滅菌処理をしても形状が変化しないので好適である。なお、本実施形態の顕微鏡用細胞収容器10を顕微鏡のステージ上に配置したときに、光源から放出された光がチャンバ内を透過するように形成するように本実施形態の顕微鏡用細胞収容器10の部材は構成されている、というのはいうまでもない。
【0117】
なお、上述した顕微鏡として、光源にハロゲンランプ等を有する光学顕微鏡(倒立顕微鏡および正立顕微鏡)を使用する場合について説明したが、使用される顕微鏡は光学顕微鏡に限定されない。例えば、光源として紫外線等を放射可能な蛍光顕微鏡を使用すれば、蛍光タンパク質を取り込ませた動物細胞Cにおいて、所望のタンパク質の細胞内局在を観察することができる。また、これらの顕微鏡にカメラやビデオ等の記録媒体を設けておけば、動物細胞Cの動態等を記録できるので好ましい。
【0118】
(伝熱プレートPの説明)
また、上述したように本実施形態の顕微鏡用細胞収容器10を使用して、長期間、顕微鏡を用いてチャンバ内の動物細胞Cを観察する場合、チャンバ内に供給する培地がチャンバ内の培地温度と略同じ温度になるように調整されていれば、動物細胞Cの長期間観察を再現性よく観察できるので好適である。
とくに、保持部材の外周面に培地供給チューブ16i、36iを収容し得るチューブ収容溝hが形成されていれば、培地供給チューブ16i、36iを保持部材の外周面に固定することができる。つまり、確実に培地供給チューブ16i、36iを保持部材の外周面に接した状態にしておくことができる。そうすると、培地供給チューブ16i、36iの内部に流れる培地を確実に加温できる。
【0119】
例えば、図19に示すように、保持部材55Aは、外側壁(外周面)に半径方向に沿って外方に延びた複数枚の伝熱プレート55Pを設けて、この複数枚の伝熱プレート55Pのうち隣接する伝熱プレート55P、55p間に培地供給チューブ16i、36iを収容し得るチューブ収容溝55hを形成した構成を採用してもよい。この場合、培地供給チューブ16i、36iをチューブ収容溝55h、55h内に取り付ければ、保持部材55Aをヒータ部材61により加温した状態において、伝熱プレート55Pから培地供給チューブ16i、36iに対して熱を供給することができる。そうすると、培地供給チューブ16i、36i内に流れる培地をチャンバ内に到達するまでに確実にチャンバ内の培地温度と略同等にすることができる。
【0120】
とくに、伝熱プレート55Pは、隣接する伝熱プレート55P、55Pの対向する面間の距離、つまり、チューブ収容溝55hの内壁間距離が培地供給チューブ16i、36iの外径よりも若干短くなるように設けるのが好ましい。この場合、培地供給チューブ16i、36iをチューブ収容溝55h、55h内壁面に密着して取り付けることができる。すると、培地供給チューブ16i、36iと収容溝55hの内壁の接触面積をより大きくできるので、伝熱プレート55P、55Pから供給チューブ16i、36iに対して供給する熱量を大きくできる。このため、供給チューブ16i、36i内に流れる培地をチャンバ内に到達するまでにより確実にチャンバ内の培地温度と略同等にすることができる。
【0121】
また、保持部材に形成するチューブ収容溝hは、その本数はとくに限定されないが、図19に示すように、2本のチューブ収容溝55h、55hを形成するのが好ましい。図19に示すように、複数の伝熱プレート55Pを保持部材55Aの外周面に沿って円弧状に設けた場合、隣接する円弧状の伝熱プレート55P間に形成したチューブ収容溝55h、55hの底(つまり、保持部材55Aの外周面)に沿わせて培地供給チューブ16i、36iを取り付けることができる。例えば、図19に示した保持部材55Aの場合、2本のチューブ収容溝55h、55hにおいて、培地供給チューブ16i、36iを下方のチューブ収容溝55h(図19(B)の側面図において紙面下方のチューブ収容溝55h)の底に沿って一の端部から他の端部まで取り付けたのち、他の端部で折り返して上方のチューブ収容溝55h(図19(B)の側面図において紙面上方のチューブ収容溝55h)の底に沿って他の端部から一の端部まで取り付けることができる。この場合、保持部材55Aの外周面において伝熱プレート55Pを設ける範囲を限定した場合であっても、培地供給チューブ16i、36iが伝熱プレート55Pに接する時間をより長くすることができるので、効率よく培地供給チューブ16i、36iに対して熱を供給することができ、培地供給チューブ16i、36iの内部に流れる培地をより確実にチャンバ内の培地温度と略同等にすることができる。
【0122】
また、チューブ収容溝55hは、その内底面が伝熱プレート55Pが設けられていない部分の外周面と一致するように形成するのが好ましい(図19(A)または図20(A)の点線参照)。具体的には、図19(A)に示すように、チューブ収容溝55hの内底面は、その曲率半径r2が伝熱プレート55Pを設けていない部分の外周面の曲率半径r1と同じ長さであり、かつその中心軸も一致するように形成している。つまり、保持部材55Aの中心軸に対して直交する面でチューブ収容溝55hの内底面を含むように保持部材55Aを切ったときに壁面の断面の厚さが略均一に形成しているのである。この場合、保持部材55A内部に顕微鏡用細胞収容器10を保持した状態において、保持部材55Aから略均一な熱量を顕微鏡用細胞収容器10の全周囲から供給することができる。すると、チャンバ内の培地温度をより安定して維持できる。
【0123】
なお、伝熱プレートPを保持部材に設ける範囲は、保持プレートPとヒータ部材61が干渉しないように設けられていれば、とくに限定されない。
例えば、図19に示すように、円弧状に設けられた複数枚の伝熱プレート55Pの両端が切欠部55g、55gの基端に一致するように形成していれば、供給チューブ16i、36iをチューブ収容溝55hに取り付けるときに、ヒータ部材61、61が邪魔にならないので好ましい。また、図20に示すように、保持部材52Aには、その外周面全体に沿って複数枚の伝熱プレート52Pが設けられており、保持部材52Aの内壁面には切欠部52g、52gが形成されている。そして。この切欠部52gには、上方から下方に向かってヒータ部材61が取り付けられている。この場合、地供給チューブ16i、36iをチューブ収容溝52h、52hに取り付ける際、ヒータ部材61、61が邪魔にならならない。
しかも、図20に示すように、チューブ収容溝52h、52hを保持部材52Aの外周面全体に沿って形成することができるので、地供給チューブ16i、36iをチューブ収容溝52h、52h内に保持しておく時間をより長くできる。すると、培地供給チューブ16i、36iの内部に流れる培地をさらにより確実にチャンバ内の培地温度と略同等にすることができる。
【0124】
また、チューブ収容溝hは、その内部に、例えば、アリ溝構造を有する形状を採用してもよい。この場合、培地供給チューブ16i、36iをチューブ収容溝hに取り付けた状態において、培地供給チューブ16i、36iがチューブ収容溝hから脱落等することを確実に防止することができるという利点が得られる。
【実施例1】
【0125】
本発明の顕微鏡用細胞収容器を用いて培養細胞を観察できることを確認した。
【0126】
実験では、(I)培養細胞の鮮明な顕微鏡写真が得られるか否か、(II)蛍光を用いた細胞の機能観察が可能か否か、(III)圧迫培養条件下における培養細胞の動態観察が可能か否か、を確認した。
実験(II)の蛍光観察は、細胞内遊離カルシウム濃度測定に使用されるカルシウム蛍光指示薬(以下、カルシウム蛍光プローブという)を導入された細胞に対して励起光を照射した場合における蛍光を蛍光顕微鏡により測定し観察した。
実験(III)の動態観察は、培養細胞の細胞骨格変化をアクチンフィラメント(以下、F−アクチンという)の形態変化に基づいてF−アクチンを蛍光染色することによって、その蛍光染色した細胞に対して励起光を照射した場合における蛍光を蛍光顕微鏡により測定し観察した。
【0127】
本実験に使用した顕微鏡用細胞収容器、細胞、培地(緩衝液含む)、カルシウム蛍光プローブ、顕微鏡、加圧機器等は、以下のとおりである。
【0128】
実験の顕微鏡用細胞収容器は、図10に示す構造を有するものを使用した。
保持ケース部は、外径が42mm、底面から上端面までの高さが16.5mmの円柱形状に形成されたものである。その内部には、内径が38mmの中空な空間部を有している。この保持ケース部の底部は、直径が21.5mmの観察開口部を備えており、その中心軸が保持ケース部の中心軸に一致するように形成されている。
細胞培養部として、直径35mmのディッシュ(松浪ガラス工業社製、型番:D111340)を使用した。このディッシュの底部は、その中心部に厚さが0.17mm、直径が14mmのガラス製の細胞保持部を備えており、この細胞保持部の外周に沿ってドーナッツ状に形成された厚さ0.9mmの厚肉部を備えたものを使用した。
【0129】
挿入部材の本体部は、底端面から上端面までの高さが21mm、直径が26mmの円柱状に形成されたものを使用した。本体部の下端部には、溝開口幅が1.25mm、溝深さが0.6mmの片アリ溝構造を有する保持溝が形成されている。この保持溝は、本体部の中心軸を囲むように内径が22mmの円形に形成されている。そして、この保持溝には、直径1.3mmのシリコン製のOリングが約半分埋まるように嵌め込められている。つまり、Oリングは、本体部の底面に、その底面から若干突出するように形成されている。なお、この突出部の高さは、約0.7mmである。
【0130】
上記のごとき構成を有する顕微鏡用細胞収容器では、保持ケース部内にディッシュを取り付けた状態において、本体部を取り付けると、本体部の下端面と、ディッシュの内底面と、シリコン製のOリングとで囲まれたチャンバが形成される(図8参照)。本実験に使用した顕微鏡用細胞収容器の場合、形成されるチャンバの容積は、約0.4mlである。
【0131】
実験(I)および(II)に用いた細胞は、牛副腎髄質細胞から単離した牛単離副腎髄質細胞を細胞密度5×105/mlに調整して、DMEM培地(Sigma社製)を使用して培養した。なお、細胞の調製方法および細胞の培養方法の詳細については、後述する。
実験(III)に用いた細胞は、ヒト臍帯静脈内皮細胞であるHUVEC細胞(タカラバイオ社製、型番:C2517A)を細胞密度1×105/mlに調整して、基本培地(タカラバイオ社製、型番:B3156)を使用して培養した。なお、細胞の培養方法の詳細については、後述する。
【0132】
実験(I)および(II)に用いた緩衝液は、HEPES(Sigma社製)を有するHEPES Buffer(以下、Standard ReleaseMedium(SRM)という)をpH7.35〜7.40に調整して使用した。緩衝液の組成およびその濃度は、表1のとおりである。なお、SRMのうち、カルシウムイオンを含有するものをSRM(+)、カルシウムイオンを含有しないものをSRM(−)とした。
【0133】
【表1】

【0134】
カルシウム蛍光プローブは、Fluo−4AM(Invitrogen社製)を使用した。Fluo−4AMは、ボルテックスミキサー(Scientific
Industries社製、型番:Vortex-2 genie)を用いてDMEM培地に溶解し、最終濃度5μMになるように調整した。そして、この培地をカルシウム蛍光プローブ導入培地として使用した。
【0135】
ここで、細胞に導入されたFluo−4AMについて簡単に説明する。
細胞に導入されたFluo−4AMは、細胞内のエステラーゼによりアセトメチル基(AM)が加水分解されてFluo−4となるものである。このFluo−4は、所定の励起光が照射されると、特徴的な波長の蛍光を発光する。しかも、Fluo−4は、カルシウムイオンと選択的に錯体を形成する。この錯体の蛍光強度は、錯体を形成する前のFluo−4だけの蛍光強度よりも約3倍程度強い蛍光を発光する。
そこで、本実験(II)では、細胞内にカルシウムを取り込ませる刺激剤により細胞を刺激したときに、Fluo−4のカルシウムイオン錯体が発光する蛍光強度の変化に基づいて、細胞内に取り込まれたカルシウムの濃度変化を測定した。この細胞内に取り込まれたカルシウムの動態は、後述する蛍光顕微鏡を使用することにより蛍光画像として捉えた。
【0136】
刺激剤は、アセチルコリン(Sigma社製、型番:塩化アセチルコリン粉末0.1g)をSRM(+)に溶解して最終濃度1.0×10-4Mとなるように調整したものを使用した。なお、対照刺激剤として、細胞内にカルシウムイオンを取り込ませる機能を殆ど有さない高麗人参抽出エッセンスを、SRM(+)に溶解して最終濃度25mg/mlになるように調整したものを使用した。
【0137】
実験(III)では、細胞骨格染色を行うために、以下の試薬等を使用した。
固定試薬:パラホルムアルデヒド(PFA)(和光純薬工業社製、型番:163-20145)を0.1mol/lりん酸緩衝液(pH7%)を用いて4%PFA溶液となるように調製したものを使用した。
PBS緩衝溶液:PBS(和光純薬工業社製、型番:045-29795)を0.01Mリン酸緩衝化生理食塩水を用いてpH7.2〜7.4に調製したものを使用した。
ブロッキング試薬:Triton X-100(和光純薬工業社製、型番:200221)が0.1%、Donkey血清(和光純薬工業社製、型番:017-000-121)が5%となるようにPBS緩衝溶液を用いて調製したものを使用した。
細胞骨格染色溶液:蛍光ファロイジン(Invitrogen社製、型番:Alexa Fluor 568)をブロッキング溶液を用いて200倍に希釈したものを使用した。
封入溶液:蛍光減衰防止剤(Thermo社製、型番:Perma Fluor Aquamous Mounting
Medium)を使用した。
また、DNA染色試薬として、DAPI(同仁化学研究所製、型番:28718-90-3)を1μg/mlに調製したものを使用した。
【0138】
ここで、F−アクチンの蛍光観察について簡単に説明する。
アクチンは球状のタンパク質であり、アクチンが繊維状に結合してアクチンフィラメント(F−アクチン)を形成する。この繊維状の結合したF−アクチンは細胞骨格を構成するものであり、細胞の変化に伴ってF−アクチンの形態も変化する。つまりF−アクチンの形態を観察することができれば、細胞骨格の変化、言い換えれば細胞の動態を観察することができるのである。F−アクチンを観察するためには、F−アクチンを形成するアクチンに対して特異的に結合する7分子のアミノ酸が環状に結合したファロイジンを用いることができる。そして、このファロイジンには、蛍光色素であるローダミンを結合させたものが一般的に用いられている。つまり、このローダミンを結合させたファロイジンをアクチンに作用(結合)させることによって、F−アクチンを蛍光染色することができる。この蛍光染色したF−アクチンに所定の励起光を照射することにより、ファロイジンに結合したローダミンが発光する蛍光を蛍光顕微鏡を用いて観察すれば、F−アクチンの形態を観察することができる。
そこで、本実験(III)では、チャンバ内において細胞に圧力をかけたときに、細胞の骨格を構成するF−アクチンに作用(結合)したファロイジンのローダミンが発光する蛍光を、後述する蛍光顕微鏡を使用することにより細胞骨格の変化つまり細胞の動態を蛍光画像として捉えた。
【0139】
顕微鏡は、透過光撮影モード、位相差撮影モードおよび蛍光撮影モードのそれぞれの機能を有する倒立蛍光顕微鏡(Nikon社製、型番:TE2000-U)を使用した。
光源は、高圧水銀ランプを使用した。
細胞の観察は、倍率を200倍(接眼レンズ10倍、対物レンズ20倍)に調整して観察した。観察した細胞は、顕微鏡に接続した顕微鏡用CCDデジタルカメラ(Nikon社製、型番:DS-L1)を使用して撮影した。
また、実験(II)では、蛍光撮影において、細胞に照射する励起光は495nmとし、照射された励起光により細胞内に導入したカルシウム蛍光プローブが発光する蛍光のうち、518nmの蛍光を測定した。
また、実験(III)では、蛍光撮影において、細胞に照射する励起光は540nmとし、照射された励起光によりF−アクチンに結合したファロイジンが発光する蛍光のうち、590nmの蛍光を測定した。
なお、観察した細胞に障害を与えないために、励起光は、Neutral Density filter(ND)フィルタNo4(Nikon社製)を透過させて細胞に照射した。
【0140】
実験(III)では、圧迫条件下で細胞を培養するために、ペリスタポンプ(EYELA社製、型番:MP-3)を使用した。以下では、2台のペリスタポンプ(A、B)を使用したときの配設方法について説明する。
本実験で用いた顕微鏡用細胞収容器の挿入部材の本体部の上部に設けられた連通通路(図10の36a)の端部にPBS緩衝溶液供給チューブ(図10の36iに相当)を連結した。連結したPBS緩衝溶液供給チューブの上流側にペリスタポンプAを連結し、空気クッションを行うために開口部をシリコン栓で閉じた三角フラスコを介してペリスタポンプBを連結した。そして、このペリスタポンプBにPBS緩衝溶液が入った三角フラスコを連結した。なお、ペリスタポンプ間等はシリコン製のチューブで連結した。また、ペリスタポンプA、B間に配設した三角フラスコのシリコン栓には、加圧計(エスコ社製、型番:EA729D-1)を取り付けた。また、本体部の上部に設けられた他方の連通通路(図10の36b)の端部には、PBS緩衝溶液排出チューブ(図10の36eに相当)を連結した。つまり、PBS緩衝溶液がPBS緩衝溶液が入った三角フラスコ→ペリスタポンプB→空気クッション用三角フラスコ→ペリスタポンプA→PBS緩衝溶液供給チューブ→本体部(チャンバ)→PBS緩衝溶液排出チューブといった流れになるように連結した。
【0141】
加圧条件:2台のペリスタポンプを作動させた状態において、ペリスタポンプBに供給されるPBS緩衝溶液の流量とペリスタポンプAから排出されるPBS緩衝溶液の流量の比が、2:1となるように、PBS緩衝溶液を送液した。このとき、送液するPBS緩衝溶液の液圧が0.02MPa(150mmHg)になるように加圧計を用いてペリスタポンプA、Bを調整した。つまり、本実験で用いた顕微鏡用細胞収容器のチャンバ内の液圧は、0.02MPa(150mmHg)となるように調整されているのである。
【0142】
(I)培養細胞の鮮明な顕微鏡写真が得られるか否か、および(II)蛍光を用いた細胞の機能観察が可能か否かの実験
顕微鏡を用いて観察対象細胞を観察する手順を説明する前に、まず、細胞の調整およびその培養について、以下、詳細に説明する。
【0143】
(細胞の調整)
まず、細胞として使用した牛副腎髄質細胞は、以下の(1)〜(7)の手順により調整した。
(1)副腎の周囲の脂肪を切り取った副腎を氷の上に置き、皮質表面に切れ目を入れて、副腎静脈口を露出させて、この副腎静脈口からSRM(−)を流し込んで、血液を除去した。
(2)血液を除去した副腎から、副腎髄質のみを切り取り、SRM(−)で満たした試験管に切り取った副腎髄質を約5分間、浸漬した。
(3)副腎髄質を試験管から取り出し、ハンドスライダー(NATUME社製、型番:KN-822)を使用して、厚さ約2.0mm程度に薄くスライスした後、スライスした副腎髄質をSRM(−)で満たした試験管に約5分間、浸漬した。
(4)スライスした副腎髄質を試験管から取り出し、カルシウムイオンを含有しないBSA培地(以下、単にBSA(−)という)(Sigma社製)を使用して、スライスした副腎髄質を3回洗浄した。この洗浄した副腎髄質をマイヤーフラスコ(容積300ml)に移した。この副腎髄質の細胞を分散させるために、コラーゲナーゼ処理を3回行った。このコラーゲナーゼ処理溶液は、コラーゲナーゼ(和光純薬株式会社製、型番:細胞分散用)を入れた培地(Digestion Medium)(日研生物医学研究所製、型番:EAGLE-MEM)を使用した。そして、このコラーゲナーゼ処理溶液を、洗浄した副腎髄質を入れたマイヤーフラスコに120ml入れて、水温37℃に調整したウォータバス(TAITEC社製、型番:XY-80)で60分間、振盪して攪拌した。
(5)コラーゲナーゼ処理をした溶液を200メッシュのナイロンメッシュ(セミテック社製、型番:NMG84)を使用して濾過した後、この濾過液を遠心分離機(KUBOTA社製、型番:KN-70)を用いて1000rpmで10分間、遠心分離した。この遠心分離後の上澄み液を試験管から除去した。この上澄み液を除去した後の試験管に、BSA(−)を30ml加えて、沈殿物を懸濁した後、1000rpmで10分間、遠心分離した。再度、上記の操作(遠心分離→沈殿物懸濁→遠心分離)を行った。
(6)(5)の工程後の試験管から上澄み液を除去した。試験管内に沈殿した沈殿物にDMEM培地を30ml加えて、懸濁した後、200メッシュのナイロンメッシュで濾過した。この濾過液を試験管に移して、1000rpmで10分間、遠心分離した。その後、試験管から上澄み液を除去した後の沈殿物に再度DMEM培地を30ml加えて、懸濁した後、1000rpmで10分間、遠心分離した。
(7)(6)の工程後の試験管から上澄み液を除去した後、DMEM培地を加えて、懸濁して、牛副腎髄質細胞の細胞密度が5×105/mlになるように調整した(以下、この細胞を牛単離副腎髄質細胞という)。
【0144】
(調整細胞の培養)
上述した手順により調整した牛単離副腎髄質細胞(以下、単に調整細胞という)を、上述したディッシュに播いた後、二酸化炭素濃度5%、室温37℃、湿度95%に調整したCO2インキュベータ(SANYO株式会社製、型番:MCO-5AC)内でディッシュ内の細胞が約70%コンフルエントとなるように4日間、静置培養した。
【0145】
(観察準備)
つぎに、観察対象細胞を顕微鏡を用いて観察するまでの手順について、以下詳細に説明する。
【0146】
(観察対象細胞の準備)
まず、観察対象細胞の準備について説明する。
4日間CO2インキュベータ内で調整細胞を静置培養したディッシュをクリーンベンチ内に移動して、DMEM培地を除去した。DMEM培地の除去は、アスピレータ(Markos Mefar社製、型番:SP30)に滅菌したピペットを装着して、このピペットによりDMEM培地を吸引して除去した。その後、上述したFluo−4AMを溶解したDMEM培地を1.5ml入れたディッシュを、アルミパッドに配置して、ディッシュ内の調整細胞に光が照射されないようにアルミホイルで遮光した。そして、アルミパッドを水温37℃に調整したウォータバスで30分間、軽く振盪した。この操作により、Fluo−4を導入した牛単離副腎髄質細胞を得ることができる。その後、上記と同様にディッシュからアスピレータで培地を除去した。その後、Fluo−4を導入した牛単離副腎髄質細胞をSRM(+)1mlで2回洗浄して、SRM(+)1mlをディッシュに入れた。この状態、つまりFluo−4が導入された牛単離副腎髄質細胞を観察対象細胞とした。
【0147】
(観察用装置の準備)
つぎに、観察用装置の準備について説明する。
観察用装置の準備は、以下の(1)〜(4)の手順により行った。なお、観察用装置は、事前にオートクレーブ(TOMY社製、型番:SX-700)にて滅菌処理をしたものを使用した。
(1)観察対象細胞が入ったディッシュを、保持ケース部内に取り付けた。取り付ける際には、SRM(+)がディッシュの外にこぼれないように注意した(図9(A)参照)。
(2)ディッシュを保持ケース部に取り付けた状態において、本体部を保持ケースの開口部から挿入した(図9(B)参照)。このとき、本体部の下端面に空気が溜まらないように本体部の中心軸をディッシュの底面に対してやや傾けた状態で挿入した。そして、本体部の固定用軸部と保持ケース部の側壁上端が接したときに、固定用軸部を保持ケース部の側壁上端部に形成されたスリット内を滑らせて挿入して、本体部を固定用軸部により保持ケース部内に固定した(図1、図2参照)。このとき、本体部の底面とディッシュの内底面との間に形成されたチャンバ内に観察対象細胞を確保した。
(3)保持ケース部に本体部を取り付けた状態において(図9(C)参照)、本体部とディッシュの内壁面との間に存在したSRM(+)を滅菌したピペットで吸引除去した(図3(B)参照)。
(4)かかる状態の顕微鏡用細胞収容器を、顕微鏡のステージに配置した保温部のクランプ状に形成された保持部材の上端面の開口から挿入した。そして、保持部材のボルトを回転して、顕微鏡用細胞収容器を保温部内に取り付けた(図14(B)参照)。
【0148】
(実験結果)
図16は、本発明の顕微鏡用細胞収容器を上述した倒立蛍光顕微鏡を位相差撮影モードにして撮影した位相差顕微鏡写真である。
図16に示すように、観察対象細胞である牛単離副腎髄質細胞が鮮明に観察できることを確認した。しかも、図16の位相差顕微鏡写真に示すように、観察視野内には、気泡は観察されなかった。
したがって、本発明の顕微鏡用細胞収容器を顕微鏡を使用して観察すれば、培養細胞を気泡がない状態で鮮明に観察できることが確認された。
【0149】
つぎに、蛍光を用いた細胞の機能観察の結果について説明する。
まず、倒立蛍光顕微鏡で観察対象細胞の透過光観察を行って、観察対象細胞が詳細に観察できることを確認した。その後、倒立蛍光顕微鏡の撮影モードを蛍光撮影モードに切り替えて、カルシウム蛍光プローブとして細胞内に導入したFluo−4が確実に細胞内に導入されていることを確認した。
つぎに、刺激剤を入れたビーカ内に一方の培地供給チューブの端部をいれて、他方の培地排出チューブを通してチャンバ内のSRM(+)を吸引して、チャンバ内のSRM(+)を刺激剤(アセチルコリンを溶解したSRM(+))に置換した。チャンバ内のSRM(+)を刺激剤に置換した状態における蛍光光度を倒立蛍光顕微鏡を用いて測定した。また併せて蛍光顕微鏡写真を撮影した。
【0150】
図17および図18に結果を示す。
図17は、チャンバ内のSRM(+)を刺激剤に置換したときの相対蛍光強度と、経過時間との関係を示したグラフであり、観察対象細胞とした牛単離副腎髄質細胞内の遊離カルシウムイオン濃度変化を示したものである。なお、上述と同様に、チャンバ内を対照刺激剤に置換したときの、相対蛍光強度と、経過時間との関係を図17に併せて示した。
また、図18は、チャンバ内を刺激剤に置換する前の蛍光顕微鏡写真と、チャンバ内を刺激剤に置換した後の蛍光顕微鏡写真である。
図17に示すように、チャンバ内を刺激剤に置換してから、蛍光強度が大きく変化していることが確認された。一方、チャンバ内を対照刺激剤に置換した場合、蛍光強度が変化しないことが確認された。
また、図18に示すように、チャンバ内を刺激剤に置換する前と後で、細胞内に取り込まれた遊離カルシウムイオン濃度が大きく変化していることを蛍光顕微鏡写真として確認できた。
【0151】
したがって、本発明の顕微鏡用細胞収容器を用いれば、従来と同様に生きた細胞の機能を観察するための一般的な試験の一種である細胞内遊離カルシウム濃度測定に使用されるカルシウム蛍光指示薬を導入された細胞に対して励起光を照射した場合における蛍光を蛍光顕微鏡により測定し観察することができたことを確認した。つまり、本発明の顕微鏡用細胞収容器を用いれば、観察対象細胞の機能観察ができることを確認した。しかも、刺激剤と対照刺激剤との違いを確実に測定できたことも確認できた。
【0152】
(III)圧迫培養条件下における培養細胞の動態観察が可能か否かの実験
顕微鏡を用いて観察対象細胞を観察する手順を説明する前に、まず、細胞の調整および培養について、以下、詳細に説明する。
【0153】
(HUVEC細胞の調整)
試験官に基本培地を加えて、HUVEC細胞を懸濁して、HUVEC細胞が1×105/mlになるように調整した。
【0154】
(調整HUVEC細胞の培養)
HUVEC細胞の細胞密度が1×105/mlになるように調整したHUVEC細胞(以下、調整HUVEC細胞という)を上述したディッシュに播いた後、二酸化炭素濃度5%、室温37℃、湿度95%に調整したCO2インキュベータ内でディッシュ内の細胞が約70%コンフルエントとなるように3日間、静置培養した。
【0155】
(観察準備)
つぎに、観察対象細胞を顕微鏡を用いて観察するまでの手順について、以下詳細に説明する。
【0156】
(観察対象細胞の準備)
まず、観察対象細胞の準備について説明する。
3日間CO2インキュベータ内で調整HUVEC細胞を静置培養したディッシュをクリーンベンチ内に移動して、基本培地を除去した。基本培地の除去は、アスピレータに滅菌したピペットを装着して、このピペットにより基本培地を吸引して除去した。そして、PBS緩衝溶液を、培養したHUVEC細胞(以下、単に培養HUVEC細胞という)が浸漬するまでディッシュに入れた。
【0157】
(圧迫培養細胞の調製)
まず、このPBS緩衝溶液で置換した培養HUVEC細胞が入ったディッシュを以下の(1)〜(5)の手順で圧迫培養装置に装着した。ついで、以下の(6)の操作により圧迫培養細胞を調製した。なお、圧迫培養装置は、事前にオートクレーブにて滅菌処理をしたものを使用した。
(1)培養HUVEC細胞が入ったディッシュを、保持ケース部内に取り付けた。取り付ける際には、PBS緩衝溶液がディッシュの外にこぼれないように注意した(図9(A)参照)。
(2)ディッシュを保持ケース部に取り付けた状態において、本体部を保持ケースの開口部から挿入した(図9(B)参照)。このとき、本体部の下端面に空気が溜まらないように本体部の中心軸をディッシュの底面に対してやや傾けた状態で挿入した。そして、本体部の固定用軸部と保持ケース部の側壁上端が接したときに、固定用軸部を保持ケース部の側壁上端部に形成されたスリット内を滑らせて挿入して、本体部を固定用軸部により保持ケース部内に固定した(図1、図2参照)。このとき、本体部の底面とディッシュの内底面との間に形成されたチャンバ内に培養HUVEC細胞を確保した。
(3)保持ケース部に本体部を取り付けた状態において(図9(C)参照)、本体部とディッシュの内壁面との間に存在したPBS緩衝溶液を滅菌したピペットで吸引除去した(図3(B)参照)。
(4)かかる状態の顕微鏡用細胞収容器を、顕微鏡のステージに配置した保温部のクランプ状に形成された保持部材の上端面の開口から挿入した。そして、保持部材のボルトを回転して、顕微鏡用細胞収容器を保温部内に取り付けた(図14(B)参照)。
(5)そして、顕微鏡用細胞収容器の挿入部材の本体部の上部に設けられた一の連通通路の端部にPBS緩衝溶液供給チューブを、他の連通通路の端部にPBS緩衝溶液排出チューブを連結した(図10参照)。なお、PBS緩衝溶液供給チューブの上流側には、上述したペリスタポンプ等を連結・配設した。
(6)つぎに、PBS緩衝溶液供給チューブの上流側に連結したペリスタポンプを作動させて、加圧計が所定の圧力(0.02MPa(150mmHg))になるようにPBS緩衝溶液の流量を調整した。そして、PBS緩衝溶液の流量が所定の圧力になった状態を30分間維持した。30分後のディッシュ内における圧迫条件下で培養された培養HUVEC細胞を以下、圧迫培養細胞という。
【0158】
(細胞骨格染色)
上記のごとく調製した圧迫培養細胞が入ったディッシュを圧迫培養装置から取り外し、以下の(1)〜(7)の手順で細胞骨格を染色した。なお、併せてDNAも染色した。
(1)(細胞固定)ディッシュからPBS緩衝溶液を除去したのち、固定試薬を圧迫培養細胞が浸漬するまでディッシュ内に入れ、室温で20分間静置した。かかる試薬によって、圧迫培養細胞が加圧された状態つまり細胞が加圧されたときの形態を維持するように細胞を固定することができる。
(2)(洗浄)室温に静置してから20分間が経過したのち、固定試薬をディッシュから除去した。このディッシュにPBS緩衝溶液を入れて5分間静置した。5分後PBS緩衝溶液をディッシュから除去したのち、再度PBS緩衝溶液を入れて5分間静置した。このPBS緩衝溶液による洗浄操作を3回繰り返した。
(3)(ブロッキング)洗浄に使用したPBS緩衝溶液をディッシュから除去したのち、ブロッキング試薬をディッシュ内に圧迫培養細胞を浸漬するまで入れて室温で1時間静置した。かかる試薬によって、ファロイジンが非特異的に細胞に結合するのを防止することができる。
(4)(洗浄)室温に静置してから1時間が経過したのち、ブロッキング試薬をディッシュから除去した。その後、上述した(2)と同様にPBS緩衝溶液を用いて洗浄操作を行った。
(5)(DNA染色)洗浄に使用したPBS緩衝溶液をディッシュから除去したのち、DNA染色試薬をディッシュ内に圧迫培養細胞を浸漬するまで入れて室温で1時間静置した。かかる試薬によって、F−アクチンの他に細胞内のDNAを染色することができる。
(6)(洗浄)室温に静置してから1時間が経過したのち、DNA染色試薬をディッシュから除去した。その後、上述した(2)と同様にPBS緩衝溶液を用いて洗浄操作を行った。
(7)(封入)洗浄に使用したPBS緩衝溶液をディッシュから除去したのち、封入溶液をディッシュ内の圧迫培養細胞に滴下して室温で約30分間静置した。かかる試薬によって、蛍光色素が拡散するのを防止することができる。
上記のごとき状態とした圧迫培養細胞を観察対象細胞とした。
【0159】
(観察用装置の準備)
つぎに、観察用装置の準備について説明する。
観察用装置の準備は、上述した圧迫培養装置の準備の(1)〜(4)の手順と同様に行った。
なお、観察用装置は、事前にオートクレーブにて滅菌処理をしたものを使用した。また、観察用装置の準備においては、PBS緩衝溶液に換わって封入溶液がディッシュの外にこぼれないように注意した。
【0160】
(実験結果)
まず、倒立蛍光顕微鏡で観察対象細胞の透過光観察を行って、観察対象細胞が詳細に観察できることを確認した。つぎに、倒立蛍光顕微鏡の撮影モードを蛍光撮影モードに切り替えて、F−アクチンが蛍光染色されていることを確認したのち、蛍光顕微鏡写真を撮影した。
【0161】
図21に結果を示す。
図21の(A)は、機械的加圧を30分間行った状態の圧迫培養細胞を固定し、固定化した圧迫培養細胞のF−アクチンを蛍光染色したものを蛍光顕微鏡写真で撮影したものである。図21(B)は、機械的加圧を行わない場合の対象細胞を上述と同様に固定化した圧迫培養細胞のF−アクチンを蛍光染色したものを蛍光顕微鏡写真で撮影したものである。
図21(A)に示すように、機械的加圧後の細胞骨格を構成するF−アクチンは、対照細胞に比べて繊維が太くなりかつ本数も増加していることが確認された。
【0162】
したがって、本発明の顕微鏡用細胞収容器を用いれば、圧迫培養条件下における培養細胞の動態を確実に観察することができたことを確認した。
一方、ヒトの高血圧とは、外来随時血圧を日を変えて数回測定し、おおむね最小血圧が90mmHg以上、あるいは最大血圧が140mmHg以上の場合とされている。とくに、高血圧のうち、軽症の高血圧(I度高血圧)は、おおむね最小血圧140mmHgから最大血圧160mmHg以下の場合とされている。すると、上述したように本実験では、機械的加圧つまり物理的圧迫下において、その圧力を150mmHgとした場合の圧迫培養条件下における培養細胞の動態を確実に観察できたのであるから、血管内皮細胞の圧迫病変における細胞傷害のメカニズムを本発明の顕微鏡用細胞収容器を用いることによって解明することが可能であることが示唆された。
【産業上の利用可能性】
【0163】
本発明の顕微鏡用細胞収容器は、医学、薬学、生物学などの分野において、培養した動物細胞などの培養細胞を簡便かつ鮮明に顕微鏡を用いて観察することができる器具として適している。
【符号の説明】
【0164】
10 顕微鏡用細胞収容器
11 収容ケース
11h 収容ケース11の中空な空間部
11y スリット
15 挿入部材
16 本体部
16a 連通通路
16b 連通通路
17 シール部材
18 固定用軸部
【技術分野】
【0001】
本発明は、顕微鏡用細胞収容器に関する。さらに詳しくは、顕微鏡を用いて細胞観察に使用される細胞収容器であって、培養した細胞を観察視野に確保しながら、鮮明な細胞観察をすることができ、しかも、細胞に対するストレス試験、薬剤耐性試験等を行うことができる顕微鏡用細胞収容器に関する。
【背景技術】
【0002】
近年の分子生物学等の発展に伴い、細胞の発生メカニズムや分化メカニズム、代謝メカニズム等の様々な細胞メカニズムが詳細に研究されている。とくに、動物細胞の細胞メカニズムの解明は、医学分野、薬学分野等において非常に重要なテーマとなっており、解明のための重要な手法の一つとして、動物細胞を培養した後、培養した動物細胞を顕微鏡を用いて観察する顕微鏡細胞観察がある。
【0003】
ここで、従来より行われている動物細胞の顕微鏡細胞観察について簡単に説明する。
一般に動物細胞の観察は、シャーレやディッシュ等の上部に開口部を有する中空な空間部を備えた円柱状の開放型培養器(以下、単に培養容器という)を用いて動物細胞を培養した後、汚染防止のために蓋をして、かかる培養器を顕微鏡のステージ上にセットした後、培養した動物細胞を所定の倍率で観察する。
【0004】
具体的には、ある程度まで培養した肉芽状の動物細胞を内底面にコラーゲン等の着床誘導材が設けられたディッシュに入れてディッシュ内底面に着床させた後、例えば、高湿度(湿度約90%)、温度約37度に調整可能な恒温槽等内で動物細胞をさらに培養する。すると、動物細胞は、支持体に着床して増殖するという性質を有するので、ディッシュ内底面にコラーゲン等の着床誘導部材が設けられていれば、動物細胞をディッシュ内底面に着床させて増殖させることができる。
ディッシュの直径が約35mm程度であれば、動物細胞を培養した培養容器ごと一般の顕微鏡のステージ上に配置することができるので、ディッシュ内底面に着床している動物細胞を、倒立顕微鏡を使用して、ディッシュ底面から観察することができる。つまり、培養容器として、一般に使用されている倒立顕微鏡のステージ上にセットできる大きさのディッシュを用いて動物細胞を培養すれば、培養容器を顕微鏡のステージ上にセットするだけで動物細胞を顕微鏡を用いて観察することも可能である。
【0005】
しかしながら、上記方法により動物細胞を観察することができるのは、ほんの短い時間のみであり、詳細な観察が必要となる動物細胞を観察するには不向きである。その理由は、以下の問題点を有するからである。
【0006】
まず、ディッシュ内に入れる培地は液体であり、この液体の培地はディッシュの開口部から約半分の深さになるようにその量が調整されている。これは、ディッシュを移動するときに、培地がディッシュ外部へこぼれることを防止するためである。例えば、かかる量に調整された培地を有するディッシュを顕微鏡のステージ上に配置しても、ディッシュ内の培地がステージ下方に位置する対物レンズ等にかかるのを防止できる。
しかし、上記の量しか培地を入れていないので、ディッシュに蓋をしたときには、培地界面と蓋との間に空気層が形成される。上述したように、動物細胞は、恒温槽等を用いて培養されているので、培地温度は室温よりもかなり高い状態を維持している。このディッシュを恒温槽等から取り出して室温環境下の顕微鏡のステージ上に配置すれば、培地温度は緩やかに低下するが、空気層温度は培地温度に比べて早く低下する。すると、両者間の温度差により蓋内面に水滴や曇り等を生じることとなる。蓋内面に水滴等が付着すると、動物細胞を観察するために照射した光が乱反射したりするので、動物細胞に焦点を合わせにくくなる。
【0007】
これらの問題点を解決する技術として、上記のごとき蓋内面に付着する水滴等を考慮した顕微鏡用細胞培養容器が開示されている(例えば、特許文献1)。
特許文献1の培養容器は、中空な空間部を有する本体部と、蓋部を備えており、この蓋部は、その中央部下端面が下方に向かって突出するように形成されている。このため、本体部内に培地を入れた状態において、下方に突出した中央部下端面が培地に浸漬するように蓋部を本体部に取り付ければ、培地界面と蓋部の中央部下端面との間に空気層が形成されないから、中央部下端面の内側に水滴等が生じるのを防止することができる。
【0008】
また、特許文献2には、ディッシュを収容する中空な収容空間を有する収容部を備えており、この収容部の上部と下部に、それぞれ加温プレートを備えた顕微鏡用培養容器収容装置が開示されている。すると、ディッシュ内に空気層を有する場合でも、培地温度と空気温度との間の温度差を解消することができるので、蓋内面に水滴等が付着するのを防止することができる。
【0009】
以上のごとく、特許文献1の培養容器および特許文献2の装置を使用すれば、培養容器で培養した動物細胞をそのまま培養容器を顕微鏡のステージ上に配置しても、培養細胞をある程度鮮明に観察することができる。
【0010】
しかるに、動物細胞は培養容器の底面を着床支持体として自由に移動することができるため、特許文献1および特許文献2の培養容器では、観察対象とする動物細胞を顕微鏡における観察視野内に保持しておくことができない。したがって、観察の目的の動物細胞が観察視野内から観察視野外へ移動すれば、目的の動物細胞を観察することができないという問題点を有している。
【0011】
現状では、培養した動物細胞を汚染することなく、簡便に顕微鏡のステージ上にセットして鮮明な動物細胞の観察をすることができ、しかも、顕微鏡観察下において、目的とする動物細胞を観察視野内に保持しておける顕微鏡用細胞収容器は開発されていない。
【先行技術文献】
【特許文献】
【0012】
【特許文献1】実用新案登録第3104790号公報
【特許文献2】特開平10−28576号公報
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は上記事情に鑑み、培養した動物細胞を簡便に顕微鏡を用いて観察することができる状態にでき、かつ、かかる状態において、観察視野内に動物細胞を確保した状態で鮮明に動物細胞を観察することができる顕微鏡用細胞収容器を提供することを目的とする。
【課題を解決するための手段】
【0014】
第1発明の顕微鏡用細胞収容器は、顕微鏡を用いて細胞観察に使用される細胞収容器であって、上端に開口部を有する中空な空間部を備えた収容ケースと、該収容ケースの開口部から前記中空な空間部に挿入される挿入部材と、を備えており、前記挿入部材の下端部には、該下端部が前記収容ケース内の中空な空間部の内底部に接した状態において、該下端部と該内底部の両者間にチャンバを形成し得るチャンバ形成部が設けられていることを特徴とする。
第2発明の顕微鏡用細胞収容器は、第1発明において、前記挿入部材は、該挿入部材を前記中空な空間部に挿入した状態において、該挿入部材と該収容ケースとを連結して固定する固定手段を備えており、前記チャンバ形成部は、前記固定手段により両者が固定されたときに、前記チャンバの内部と外部とを液密に隔離するシール部材を備えていることを特徴とする。
第3発明の顕微鏡用細胞収容器は、第2発明において、前記挿入部材には、その内部に、前記チャンバ内部と外部とを連通する一対の連通通路が設けられており、該一対の連通通路は、前記チャンバの内面と前記挿入部材の上端部側面とをつなぐように形成されていることを特徴とする。
第4発明の顕微鏡用細胞収容器は、第2または第3発明において、前記収容ケースは、着脱可能な細胞培養部と、該細胞培養部を取り付けた状態で保持する保持ケース部と、から形成されており、前記保持ケース部は、その底部に、前記細胞培養部を保持した状態において、前記挿入部材を取り付けたときに、前記チャンバの底面を下方から観察し得る観察開口部が形成されており、該観察開口部は、その外縁部と前記チャンバ形成部との間に支持部を備えており、該支持部は、前記挿入部材を取り付けた状態において、前記シール部材との間に前記細胞培養部の内底面を挟んで支持するように形成されていることを特徴とする。
【発明の効果】
【0015】
第1発明によれば、収容ケース内の中空な空間部内で動物細胞を培養した状態において、収容ケースの開口部から挿入部材を培地内に挿入すれば、挿入部材の下端部と空間部の内底部との間に空気層を有しないチャンバを形成することができる。すると、チャンバ内に水滴等が形成されるのを防止できるので、顕微鏡を用いてチャンバ内に確保した動物細胞を鮮明に観察することができる。つまり、挿入部材を収容ケース内に挿入するだけで培養した動物細胞を顕微鏡を用いて観察することができる状態に調整できる。言い換えれば、培養した動物細胞を簡単かつ迅速に顕微鏡を用いて観察できる状態にできるから、煩雑な操作等を必要としないので操作ミス等による汚染を防止できる。とくに、培養した動物細胞を別の観察収容器等に移動するなどの操作をすることなく、培養した動物細胞を培養条件を維持したまま観察できるので、移動操作等によって生じるストレス等を培養した動物細胞に対して与えない。すると、所望の培養条件下で培養した動物細胞の状態を再現性よく観察できる。さらに、チャンバの内底面の面積が顕微鏡の観察視野の面積と略同程度になるように形成すれば、チャンバ内に確保した動物細胞が移動した場合でも常に目的の動物細胞を確実に観察できる。
第2発明によれば、挿入部材を収容ケース内の中空な空間部に挿入した状態において、挿入部材が固定手段により収容ケースに連結して固定すれば、挿入部材の下端部と中空な空間部の内底部との間に設けられたシール部材により、チャンバ内に培地および動物細胞を確実に保持しておくことができる。また、チャンバ内以外の培地を収容ケースから排出すれば、収容ケースを上下逆転にしても収容ケースから培地がこぼれないので、収容ケースの底面を上方にした状態で顕微鏡のステージ上に配置することができる。すると、倒立顕微鏡に比べて安価な正立顕微鏡を用いても動物細胞の観察ができる。
第3発明によれば、チャンバ内部には、チャンバ内面と挿入部の上端部側面とをつなぐように形成された一対の連通通路が設けられているので、一の連通通路から培地を供給をすれば、チャンバ内の培地を動物細胞に対して常に最適な状態に維持することができる。すると、長期間、動物細胞を顕微鏡を用いて観察できる。しかも、挿入部材を固定手段により収容ケース内に固定すれば、チャンバ内の培地が外部へ漏れ出すのを防止できるので、チャンバ内の培地圧を所望の圧力に調整することができる。さらに、連通通路の一端が、上端部側面に形成されているので、収容ケースの底面を上方にした状態で顕微鏡のステージ上に配置することができる。すると、倒立顕微鏡に比べて安価な正立顕微鏡を用いても培地圧を所望の圧力に調整した状態の動物細胞の観察ができる。
第4発明によれば、細胞培養部を一般のディッシュ等と同様の素材で形成すれば、細胞培養部の操作性を一般のディッシュ等と同等にすることができる。そして、細胞培養部を保持ケース部に保持させた状態で挿入部を取り付けると、保持ケースの底部には観察開口部が設けられているので、対物レンズをチャンバの底面に接近させた状態で、チャンバ内の培養した動物細胞を鮮明に観察できる。しかも、チャンバの底面をカバーグラスと同等の厚さの薄い板状のガラス製部材で形成すれば、培養した動物細胞を高倍率かつ鮮明に観察できる。また、チャンバの内部と外部を隔離するシール部材を細胞培養部の底部を介して保持するように観察開口部の外縁部が形成されている。このため、かかるガラス製部材に曲げるような力が加わらないから、チャンバの底面を薄い板状のガラス製部材で形成した場合でも、かかるガラスが割れて培地が漏れ出すのを防止できる。
【図面の簡単な説明】
【0016】
【図1】本実施形態の顕微鏡用細胞収容器10の概略説明図であって、(A)は顕微鏡用細胞収容器10の概略縦断面図であり、(B)は概略平面図であり、(C)は概略底面図である。
【図2】本実施形態の顕微鏡用細胞収容器10の概略説明図であって、(A)は斜視図であり、(B)は側面図であり、(C)は(B)図の固定用軸部18を(I)から(II)へ移動させたときにおける、チャンバ形成部に設けられたシール部材17の形状が変化を示した図である。
【図3】本実施形態の顕微鏡用細胞収容器10を使用する際の作業手順の概略縦断面説明図である。
【図4】本実施形態の顕微鏡用細胞収容器10の概略説明図であって、挿入部材15の本体部16の基端部に張出部16nを備えた構造の概略縦断面説明図である。
【図5】本実施形態の顕微鏡用細胞収容器10のチャンバ内を加圧する方法の概略縦断面説明図である。
【図6】他の実施形態の顕微鏡用細胞収容器10を使用して顕微鏡のステージ上にセットしたときの概略縦断面説明図である。
【図7】(X)は図6の他の実施形態の顕微鏡用細胞収容器10の(X)の拡大概略断面図であり、(X’)は他の実施形態の顕微鏡用細胞収容器10の(X)に相当する部分の拡大概略断面図である。
【図8】(X)は図6の他の実施形態の顕微鏡用細胞収容器10の(X)の拡大概略断面図であり、(X’)は他の実施形態の顕微鏡用細胞収容器10の(X)に相当する部分の拡大概略断面図である。
【図9】図6の他の実施形態の顕微鏡用細胞収容器10を使用する際の作業手順の概略縦断面説明図である。
【図10】他の実施形態の顕微鏡用細胞収容器10の概略縦断面図である。
【図11】図12の他の実施形態の顕微鏡用細胞収容器10の概略説明図であって、(A)は斜視図であり、(B)は側面図である。
【図12】他の実施形態の顕微鏡用細胞収容器10概略縦断面図である。
【図13】本実施形態の顕微鏡用細胞収容器10を保温するための温度制御手段40の概略説明図であり、(A)概略ブロック図と部分拡大図であり、(B)は保温部50の概略説明図である。
【図14】保温部50の概略説明図であり、(A)は他の実施形態の保持部材55の概略説明図であり、(B)は保持部材55の使用状況の概略図である。
【図15】倒立顕微鏡の概略説明図である。
【図16】実施例の実験結果(位相差顕微鏡写真)を示した図である。
【図17】実施例の実験結果(相対蛍光強度と経過時間との関係)を示した図である。
【図18】実施例の実験結果(蛍光顕微鏡写真)を示した図である。
【図19】伝熱プレートPを備えた保持部材55Aの概略説明図であり、(A)は概略平面図であり、(B)は概略側面図である。
【図20】伝熱プレートPを備えた他の保持部材52Aの概略説明図であり、(A)は概略平面図であり、(B)は概略側面図である。
【図21】実施例の実験結果(圧迫培養細胞の蛍光顕微鏡写真)を示した図である。
【発明を実施するための形態】
【0017】
つぎに、本発明の実施形態を図面に基づき説明する。
本発明の顕微鏡用細胞収容器は、培養した培養細胞を観察するために使用される容器であって、簡便かつ安全に作業ができ、しかも、培養した培養細胞を鮮明に顕微鏡を用いて観察することができることに特徴を有している。
なお、本願明細書の培養細胞とは、上記容器内で培養したときに、その内面に付着し得る細胞、例えば、動物細胞などを含む細胞を培養したものをいう。
【0018】
本実施形態の顕微鏡用細胞収容器10は、収容ケース11と挿入部材15を備えた容器であって、挿入部材15を収容ケース11内に挿入したときに、挿入部材15の下端部と収容ケース11の内底部との間に動物細胞等を保持することができるチャンバを形成することのできるものである。
【0019】
本実施形態の顕微鏡用細胞収容器10について詳細に説明する前に、まず、顕微鏡用細胞収容器10を使用して動物細胞等を顕微鏡によって観察する方法について簡単に説明する。
【0020】
顕微鏡としては、例えば、一般的な倒立顕微鏡を採用した場合について説明する。
図15に示すように、一般的な倒立顕微鏡は、本体部と、一端が本体部に連結しており開口部を有する観察窓上に観察対象物を配置するステージと、ステージ上方の本体部上端部に設けられた光源部と、ステージの観察窓の下方において光源から放射された光により観察対象物の照射された光により形成される透過光から中間実像を形成する対物レンズと、対物レンズにより形成された中間実像を所望の倍率で観察し得る接眼レンズとを備えた構造である。つまり、観察窓上のステージに観察対象物を配置して、その上方に設けられた光源から観察対象物に対して光を照射すれば、観察対象物の透過光等はステージ下方に設けられた対物レンズによって中間実像が結ばれる。そして、対物レンズが結んだ中間実像を接眼レンズにより拡大して観察対象物を観察するというものである。
【0021】
本実施形態の顕微鏡用細胞収容器10によって動物細胞Cを観察するときには、顕微鏡用細胞収容器10のチャンバに動物細胞を入れる。この顕微鏡用細胞収容器10を倒立顕微鏡のステージ上に配置して光源を点灯すれば、光は顕微鏡用細胞収容器10内に形成されたチャンバを透過する。光はチャンバを透過するときにチャンバ内に保持された動物細胞等の透過光を形成するので、対物レンズおよび接眼レンズを調整すれば、チャンバ内に保持された動物細胞等を所望の倍率で鮮明に観察することができる。
【0022】
(本実施形態の顕微鏡用細胞収容器10の説明)
つぎに、本実施形態の顕微鏡用細胞収容器10について詳細に説明する。
図1および図2に示すように、本実施形態の顕微鏡用細胞収容器10は、収容ケース11と、収容ケース11内に挿入される挿入部材15とを備えている。
【0023】
(収容ケース11の説明)
収容ケース11は、光を透過する光透過部材により形成された部材である。
図1に示すように、この収容ケース11は、その上端面から下方に向かって凹んだ中空な空間部11hを有する部材である。この収容ケース11は、中空な空間部11hの内部に液体を収容したときに液体が収容ケース11の外に漏れ出さないように形成されている。
【0024】
収容ケース11は、その底部は平坦な底面に形成されている。例えば、収容ケース11は、平板状の顕微鏡のステージ上に静置することができるように形成されている。一方、中空な空間部11hの内底面11sは、収容ケース11の平坦な底面と平行になるように形成されている。すると、本実施形態の顕微鏡用細胞収容器10を顕微鏡のステージに配置したときに、光源から放射された光は、内底面11sに対して均一に照射されるので、内底面11s下方に配設された対物レンズによってチャンバ内の物体の中間実像を鮮明に捉えることができる。
なお、収容ケース11の底部の厚さはとくに限定されないが、その厚さ、つまり、内底面11sと底面の距離を短くすれば、さらに鮮明な中間実像を形成することができる。
【0025】
また、収容ケース11の寸法は、本実施形態の顕微鏡用細胞収容器10を一般的な顕微鏡のステージにセットすることができる大きさに形成されており、ステージに設けられた観察窓(約20mm)以上となるように形成されている。具体的には、収容ケース11の形状として円柱状の形状を採用する場合、その寸法は、縦(図1(A)では上下方向)15〜25mm、直径(図1(A)では左右方向)40〜45mm程度となるように形成されている。
【0026】
なお、収容ケース11の寸法は、上述した寸法に限定されないが、本実施形態の顕微鏡用細胞収容器10を一般の顕微鏡のステージ上に配設して、細胞観察をし得る程度の大きさであればよい。
【0027】
また、収容ケース11の形状はとくに限定されない。例えば、図1に示すように、収容ケース11を、内部の中空な空間部11hが、円形断面となるように形成してもよい。この場合、後述するように、収容ケース11を構成する部材として、市販の円柱状のディッシュ(直径約35mm)を使用する場合、かかるディッシュをその内部に収容しやすくできるという利点が得られる。
また、収容ケース11の形状は、上述した円柱状の形状に限られないのはいうまでもなく、平面視矩形状などでもよい。
【0028】
(挿入部材15の説明)
挿入部材15は、光を透過する光透過部材により形成された部材である。
図1および図2に示すように、挿入部材15は、本体部16を備えており、この本体部16は、上記の収容ケース11の上端に形成された中空な空間部11hの開口部から挿入することができる部材である。例えば、本体部16は、円柱状のブロックのような形状を有する部材であり、光を透過する光透過部材により形成されている。この本体部16は、その下端に平端な下端面16sが形成されている。そして、本体部16は、上記収容ケース11内に取り付けられたときに、下端面16sが収容ケース11の底面および中空な空間部11hの内底面11sと平行になるように形成されているのである。
【0029】
本体部16の寸法は、上記の収容ケース11内の中空な空間部11hに挿入できる大きさに形成されている。具体的には、本体部16の形状が円柱状の形状の場合、収容ケース11の大きさが上述した寸法の場合には、本体部16の寸法は、縦15〜40mm、直径25〜30mm程度となるように形成されている。
とくに、図1および図2に示しように、本体部16の直径は、本体部16を上記収容ケース11内に取り付けた状態において、本体部16の外壁側面と中空な空間部11hの内側面間の間にある程度の隙間空間部10hを有する大きさに形成されているのが好適であるが、その理由は後述する。
【0030】
また、本体部16の高さ、つまり、軸方向の長さはとくに限定されないが、上記収容ケース11内に取り付けた状態において、収容ケース11の上端面から本体部16の上端部がやや突出するように本体部16の縦寸法が形成されていれば、本体部16を収容ケース11内に取り付けやすくなるので好適である。
【0031】
(チャンバの説明)
図1の拡大図に示すように、本体部16の下端部には、片アリ溝構造を有する保持溝16gが形成されている。この保持溝16gは、本体部16の中心軸を囲むように円形に形成されている。そして、この保持溝16gには、Oリングなどの弾性を有するシール部材17が設けられている(図1(A))。このため、収容ケース11内の中空な空間部11hに挿入部材15の本体部16を取り付けたときに、本体部16の下端部と、中空な空間部11hの内底部と、シール部材17とで囲まれた空間(以下、単にチャンバという)を形成することができる。
【0032】
なお、保持溝16gの構造は、片アリ溝構造に限定されないが、片アリ溝構造とすれば、シール部材17を本体部16の下端部に強固に保持させることができる。しかも、シール部材17は、かかる保持溝16gに対して着脱可能に装着することができるので、シール部材17に傷等が付いた場合には、すぐに交換することができる。よって、チャンバの内部と外部とをシール部材17により確実に隔離することができる。
【0033】
なお、保持溝16gの構造は、アリ溝構造を採用することが可能であるのはいうまでもない。この場合、保持溝16g内により強固にシール部材17を保持することができる。
【0034】
(固定手段の説明)
本実施形態の顕微鏡用細胞収容器10は、収容ケース11内の中空な空間部11hに挿入部材15の本体部16を取り付けた状態において、本体部16と、収容ケース11と連結して固定することができる固定手段を備えている。
以下、固定手段について説明する。
【0035】
図1および図2に示すように、本体部16の上端部側面には、一対の棒状の固定用軸部18が設けられている。この一対の固定用軸部18は、互いの中心軸が同軸であって、かつ本実施形態の顕微鏡用細胞収容器10の中心軸Oに直交する軸と同軸となるように、それぞれの基端部が本体部16の上端部側面に連結して配設されている。つまり、一対の固定用軸部18は、顕微鏡用細胞収容器10の中心軸Oに対して対向するように本体部16の上端部側面に連結して配設されているのである。
【0036】
一方、図2に示すように、収容ケース11の側壁上端部には、その上端に開口を有する、鍵形に屈曲した一対のスリット11yが形成されている。この一対のスリット11yは、各スリット11yに一対の固定用軸部18がそれぞれかつ同時に挿入できるように、顕微鏡用細胞収容器10の中心軸Oに対して対向する位置に設けられている。そして、このスリット11yは、その傾斜している部分に固定用軸部18を滑らせて挿入することができ、しかも、その内面と固定用軸部18との間の摩擦によって固定用軸部18の移動を固定できるように形成されている。
【0037】
上記のごとき構成であるので、挿入部材15の本体部16を収容ケース11の開口部からその内部に形成された中空な空間部11h内に挿入すれば、中空な空間部11hの内底部近傍に、本体部16の下端面16sと中空な空間部11hの内底面11sとシール部材17とで囲まれたチャンバを形成することができる。しかも、本体部16には、一対の固定用軸部18が本体部16の上端部側面に連結するように設けられており、この一対の固定用軸部18は、本体部16の中心軸、つまり、本実施形態の顕微鏡用細胞収容器10の中心軸Oに対して対向するように設けられている。すると、本体部16を収容ケース11内に挿入するときに、一対の固定用軸部18を収容ケース11の側壁上端部に形成された一対のスリット11yに挿入して、所定方向(図1(B)の矢印方向)に回転すれば、本体部16を収容ケース11内の所定の位置で固定することができる。
【0038】
しかも、本体部16を収容ケース11内に固定したとき、いずれの中心軸も本実施形態の顕微鏡用細胞収容器10の中心軸O上に位置するように配設することができる。そして、収容ケース11および挿入部材15の本体部16は、光を透過する光透過部材により形成された部材であるので、本体部16の上方、つまり中心軸O上から光を照射すれば、かかる光は本体部16からチャンバそして内底面11sを介して底部下方まで略直線的に透過させることができる。
【0039】
また、図2(B)および図2(C)に示すように、チャンバを形成するシール部材17がある程度の弾性を有している場合には、スリット11yとして、スリット11y内面と固定用軸部18表面との摩擦抵抗によりチャンバの高さを複数段階に調整し得る高さ調節機構を有するように形成していると好ましい。かかる高さ調節機構を有していれば、チャンバの内部と外部とを確実に液密に形成することができる。また、シール部材17の大きさを変えてチャンバの高さを調整するときに、同じ挿入部材15と収容ケース11を使用することが可能となる(図2(C))。
【0040】
なお、上記下端面16sと内底面11sとシール部材17とで囲まれた空間部が、特許請求の範囲にいうチャンバ形成部である。また、固定用軸部18とスリット11yが、特許請求の範囲にいう固定手段に相当する。
【0041】
また、シール部材17を設ける替わりに、本体部16の下端部に、本体部16の中心軸を囲むように下方に突出した円形凸部を設けてもよい。この場合、円形凸部を本体部16と一体的に形成できるので、加工の手間が少なくできるという利点がある。しかも、本体部16の素材が、後述するポリテトラフルオロエチレン(PTFE)であれば、チャンバの内部と外部との間を液密にシールすることができる。
【0042】
(張出部16nを有する本体部16の説明)
とくに、図4に示すように、挿入部材15の本体部16は、収容ケース11内に挿入する先端部16tと、この先端部16tよりも基端部が外方に向かって張り出した張出部16nを備えた構造とするのが好ましい。具体的には、空間部11hが中空な円柱状に形成された場合、張出部16nを備えた本体部16基端部の直径は、空間部11hの内径よりもやや小さくなるように形成されている。つまり、張出部16nは、本体部16を収容ケース11内に取り付けたときに、張出部16n外側面と収容ケース11内側面とが略接するように形成されている。
すると、本体部16の張出部16n外側面を収容ケース11内側面に滑らすようにして、本体部16を収容ケース11内に挿入するだけで、容易に本体部16を収容ケース11内に取り付けることができる。つまり、かかる構造とすれば、収容ケース11内側面は、本体部16の挿入案内部材としても機能するのである。しかも、本体部16を収容ケース11内に取り付けたときに、両者の中心軸を、確実に本実施形態の顕微鏡用細胞収容器10の中心軸O上に位置するように配設することができる。このため、顕微鏡の光源から放射される光を確実にチャンバ内を透過させることができるので、チャンバ内の動物細胞Cを鮮明に観察することができる。
【0043】
(本実施形態の顕微鏡用細胞収容器10を使用した動物細胞観察の説明)
本実施形態の顕微鏡用細胞収容器10を使用した動物細胞を観察する方法について以下説明する。
【0044】
(動物細胞Cの培養説明)
図1(A)に示すように、収容ケース11内の中空な空間部11hの底面に対して平行になるように形成した内底部のうち、チャンバの底面に相当する内底面11sに着床誘導部材Gを塗布する。この着床誘導部材Gは、動物細胞Cを培養する際の支持体として機能する部材であり、かかる着床誘導部材Gに動物細胞Cを着床さることにより、動物細胞Cを増殖等させることができる。ただし、動物細胞Cは、かかる着床誘導部材Gを支持体として移動する性質をも有するが、着床誘導部材Gを所望の範囲にだけ塗布すれば、動物細胞Cはかかる塗布範囲以外には移動しないので、動物細胞Cの移動範囲を限定することができる。
【0045】
なお、着床誘導部材Gとしては、動物細胞等が付着することができる部材であればとくに限定されず、例えば、コラーゲンやゼラチン等を挙げることができる。
また、内底面が平坦に形成されていれば、動物細胞を略均一な細胞膜層状に培養することができる。
【0046】
図3(A)に示すように、収容ケース11は、その内部に液密に形成された中空な空間部11hを備えているので、その内部に培地rを入れて動物細胞を培養することができる。例えば、湿度95%、温度37℃、5%二酸化炭素濃度に調整されたインキュベータ(以下、単にCO2インキュベータという)内において、動物細胞Cを内部に収容した収容ケース11を静置して行う。かかる操作は、培地等が汚染されないように所定の操作、例えば、収容ケース11の開口部を滅菌したシャーレ等で蓋をする等の操作を行うのは言うまでもない。
なお、培養装置としては、湿度、温度、二酸化炭素濃度を所定の値に調整し得ることができるものであればよい。
【0047】
(挿入部材15を収容ケース11内に取り付手順の説明)
以下では、収容ケース11内において、動物細胞Cが所定の培養期間を終了した後の挿入部材15を収容ケース11内に取り付ける手順を、図3に基づいて説明する。
【0048】
図3(A)に示すように、所定の培養が終了した後、CO2インキュベータから取り出した収容ケース11を滅菌された空間、例えばクリーンベンチ内に移動させた後、挿入部材15の本体部16を収容ケース11の開口部から内部に挿入する。このとき、本体部16の下端面16sに空気が溜まらないように挿入する。例えば、本体部16の中心軸を中空な空間部11hの内底面11sに対してやや傾けた状態で挿入する。そして、固定用軸部18と収容ケース11の側壁上端が接したときに、固定用軸部18を収容ケース11の側壁上端部に形成されたスリット11y内を滑らせて挿入する。すると、本体部16は、収容ケース11内の所定の位置で固定できる。
すると、本体部16の下端面16sと中空な空間部11hの内底面11sとの間に空気層を有しないチャンバ形成することができる。しかも、本体部16は、固定用軸部18により収容ケース11内に固定できるので、内部と外部とが確実に隔離されたチャンバを形成することができる。
【0049】
図3(B)に示すように、本体部16を収容ケース11内に固定したとき、培地r界面は、培地rに浸漬した本体部16の体積分だけ本体部16の外側面と収容ケース11の内側面との間に形成された隙間空間部10h内を上方に向かって上昇する。かかる培地rは、顕微鏡観察において不要であり、顕微鏡のステージ上で何らかの原因により収容ケース11の外部にこぼれた場合、ステージ下方に配設された大部レンズ等に対して甚大なダメージを与えるという問題を有する。そこで、図3(B)に示すように、隙間空間部10h上方からピペットP等により、かかる培地rを収容ケース11の外部へ排出すれば、上記の問題を解決することができる。
【0050】
そして、本体部16を収容ケース11内に取り付けた状態の本実施形態の顕微鏡用細胞収容器10を倒立顕微鏡のステージ上に配置すれば、動物細胞を観察できる。しかも、チャンバ内には空気層が形成されていないので、培地r温度と外気との間の温度差によるチャンバ内の水滴等が生じる現象を確実に防止できる。
【0051】
また、観察対象とする動物細胞Cの移動をチャンバという限られた空間内の範囲に限定することができるので、動物細胞Cが着床誘導部材G上を移動して観察視野範囲から逸脱することを防止できる。とくに、チャンバを形成する内底面11sの面積が、倒立顕微鏡の観察視野の面積と略同程度になるように形成されていれば、チャンバ内に確保した動物細胞Cが移動しても常に目的の動物細胞Cを観察視野の範囲に確実に確保することができる。すると、チャンバの内底面11sの面積が観察視野面積よりも大きい場合に比べて、目的とする動物細胞Cを簡単に見つけることができるので、観察ミス等をなくすことができる。
【0052】
以上のごとく、本実施形態の顕微鏡用細胞収容器10では、挿入部材15を収容ケース11内に挿入するという簡便な操作だけで、培養した動物細胞Cを確実かつ的確に観察視野内に確保することができる。つまり、培養した動物細胞Cを簡便かつ迅速に倒立顕微鏡を用いてかかる動物細胞Cを観察できる状態にできるから、煩雑な操作等を必要としないので、操作ミス等による汚染を防止できる。しかも、培養した動物細胞Cを別の観察収容器等に移動することなく、挿入部材15を収容ケース11内に挿入するという簡便な操作だけで、かかる培養条件を維持したまま動物細胞Cを観察できる。すると、移動操作等によって生じるストレス等を培養した動物細胞Cに対して与えないので、所望の培養条件下で培養した動物細胞Cの形態や動態などを再現性よく観察できる。
【0053】
また、チャンバ内に確保できない培地rを収容ケース11の外部へ排出できるので、かかる培地rが収容ケース11の外へこぼれた場合を想定する必要がなく、長時間の観察においても安心して動物細胞Cを観察できる。つまり、培地rが収容ケース11外へ漏れ出したりこぼれたりしないので、本実施形態の顕微鏡用細胞収容器10を倒立顕微鏡のステージに配置しても、対物レンズに対して培地rによる腐食被害等を生じさせないのである。
【0054】
さらに、本体部16は、固定用軸部18により確実に収容ケース11内に連結して固定されているので、かかる収容ケース11を上下逆転にしても外部へ培地がこぼれることはない。このため、かかる収容ケース11の底面を上方にした状態の本実施形態の顕微鏡用細胞収容器10を顕微鏡のステージ上に配置してすることができるので、ステージ上方に対物レンズを有する倒立顕微鏡に比べて安価な正立顕微鏡を用いても動物細胞Cの観察をすることができる。
【0055】
なお、所定の培養期間が終了した収容ケース11内の培地をクリーンベンチ内で所定の緩衝液に置換した後、上記の操作を行ってもよいのは、いうまでもなく、かかる場合においても、上述と同等の効果を奏する。
【0056】
(本実施形態の顕微鏡用細胞収容器10を使用した長期間の動物細胞観察の説明)
本実施形態の顕微鏡用細胞収容器10を使用した長期間の動物細胞を観察する方法について以下説明する。
なお、上述した本実施形態の顕微鏡用細胞収容器10とは、収容ケース11の構造は同じであるため、以下では異なる構成について説明する。
【0057】
(連通通路16a、16bの説明)
図5に示すように、挿入部材15の本体部16には、その内部に、上記チャンバ内と外部とを連通する一対の連通通路16a、16bが設けられている。一対の連通通路16a、16bは、その一端と他端との間において、チャンバ内の上面、つまり、本体部16の内底面16sと本体部16の上端部側面とをつなぐように形成されている。上端部側面に設けられた一対の連通通路16a、16bの他端には、外部からチャンバ内に培地rを供給するための培地供給チューブ16iと、チャンバ内の培地rを外部へ排出するための培地排出チューブ16eがそれぞれ連結されている。
【0058】
以上のごとき構成とすれば、チャンバ内部には、チャンバ内面と本体部16の上端部側面とをつなぐように形成された一対の連通通路16a、16bが設けられているので、一の連通通路16aからチャンバ内に培地rを供給して、他の連通通路16bからチャンバ内の動物細胞Cが排出した老廃物等を外部へ排出する。すると、チャンバ内の培地rを動物細胞Cに対して常に最適な状態に維持することができる。そうすると、本実施形態の顕微鏡用細胞収容器10を使用して、長期間、倒立顕微鏡を用いてチャンバ内の動物細胞Cを観察できる。
【0059】
とくに、図5の拡大図に示すように、チャンバ内の動物細胞Cが排出した老廃物等を外部へ排出するための連通通路16bは、チャンバ内に形成した一端がチャンバ内側でテーパ状に形成されているのが好適である。この場合、一の連通通路16aからチャンバ内に培地rを供給する際に、供給培地rが気泡を含んでいたとしても、かかる気泡は、培地r流動に乗って速やかにテーパ状に形成された他の連通通路16bへ導入することができる。すると、長期間の培養観察においても、常にチャンバ内は空気層を有しない構造とすることができるから、かかる場合においても動物細胞Cを鮮明に観察できる。
【0060】
また、培地供給チューブ16iの他端に所定の脈動を形成し得る脈動形成手段、例えば、脈動発生ポンプなどを連結すれば、チャンバ内を所望の脈圧条件となるように調整することができる。すると、チャンバ内の培地圧力を所望の圧力、例えば、生体内の血管内の脈圧と同等の脈圧になるように調整すれことができる。つまり、本実施形態の顕微鏡用細胞収容器10を使用すれば、血管内の動物細胞C(例えば、血管内皮細胞など)の動態等を倒立顕微鏡下で再現して観察することができる。言い換えれば、顕微鏡下において、動物細胞Cに対してストレス試験を行うことができる。
【0061】
さらに、一対の連通通路16a、16bの他端は、それぞれ本体部16の上端部側面に形成されているので、本体部16の上面をその中心軸と直交する平坦面に形成しておけば、収容ケース11の底面を上方にした状態で顕微鏡のステージ上に配置することができる。すると、上記の正立顕微鏡を用いても培地圧を所望の圧力に調整した状態の動物細胞Cの観察ができる。
【0062】
また、培地供給チューブ16iに、薬液等を供給培地に混入させることができる薬液供給手段、例えば、三方活栓等を設ければ、チャンバ内の動物細胞に対して様々な薬液や濃度の異なる薬液を与えることができる。つまり、顕微鏡下において、上述したように生体内と同様の条件を再現した状態で、薬剤耐性試験等をもすることができる。
【0063】
なお、上記例では、一対の連通通路16a、16bの他端が、それぞれ本体部16の上端部側面に形成された場合について説明したが、一対の連通通路16a、16bの他端を本体部16上端面に形成した構造を採用することもできる。
この場合、動物細胞Cの薬剤耐性試験等に用いられる薬剤を、上端面に形成された一対の連通通路16a、16bの他端開口のうちいずれかの他端開口から直接チャンバ内に添加することができる。例えば、ニードルの長さが約50mm程度の注射筒やシリンジ等を用いれば、ニードル先端で連通通路16a、16bの内壁を傷つけることなく、所望の薬剤を他端開口から直接チャンバ内へ添加することができる。すると、所望の濃度等に調整された薬剤等を確実にチャンバ内に所望の量だけ添加できる。そうすると、薬剤耐性試験等の再現性をさらに安定させることができ、しかも、高価な薬剤等を使用する場合には、その使用量を最小とすることができるので経済的であるという利点も得られる。
【0064】
(本実施形態の顕微鏡用細胞収容器10の収容ケース11の他の形態の説明)
図6に示すように、収容ケース11は、着脱可能な細胞培養部13と、この細胞培養部13を取り付けた状態で保持する保持ケース部12とから形成してもよい。
【0065】
(保持ケース部12の説明)
まず、保持ケース部12について説明する。
図6および図7に示すように、保持ケース部12は、その底部に、顕微鏡のステージに設けられた円形の観察窓の直径(約20mm)と同等もしくはやや大きめの直径、例えば22mm〜25mm程度となるように形成された観察開口部12qを備えており、その中心軸が保持ケース部12の中心軸に一致するように形成されている。
【0066】
(保持ケース部12の底部フランジ12fの説明)
また、保持ケース部12の底部には、側壁下端部に基端部が連接しており、底部の中心軸に向かった内方に観察開口部12qを有するドーナッツ状の底部フランジ12fが形成されている。図7(X)に示すように、この底部フランジ12fの先端部には、先端部近傍から上方に向かって凸状に形成された支持部12pが設けられている。言い換えれば、支持部12pと側壁下端部との間には、断面視凹み状の凹溝12gが側壁下端部に沿って形成されている。この支持部12pは、その高さが、後述する細胞培養部13の底面に設けられた凸状部13rの高さよりも高くなるように形成されている。
【0067】
(細胞培養部13の説明)
つぎに、細胞培養部13について説明する。
図6および図7に示すように、細胞培養部13は、その上端面から下方に向かって凹んだ中空な空間部13hを有する部材である。この細胞培養部13は、中空な空間部13hの内部に液体を収容したときに液体が細胞培養部13の外に漏れ出さないように形成されている。また、細胞培養部13は、保持ケース部12内に収容し得る大きさであれば、とくに限定されない。例えば、細胞培養部13は、有底筒状の容器であって、その外径が約35mm程度のものを使用できる。
【0068】
また、図6および図7に示すように、細胞培養部13の底部は、厚肉部13fと細胞保持部14とから形成されている。
【0069】
厚肉部13fは、側壁下端部に外周縁が連接された、細胞培養部13の底部の中心軸上に位置するドーナッツ状に形成されている。
細胞保持部14は、厚肉部13fよりも肉厚が薄く形成されており、チャンバを形成したときに、その上面において動物細胞Cを保持するように形成されている。この細胞保持部14は、その厚さ、つまり、細胞保持部14の上面14sと底面との距離が、チャンバを形成したときのチャンバ内の圧力に耐えうる程度の厚さになるように形成されている。例えば、細胞保持部14は、その中心が細胞培養部13の底部の中心軸上に位置するような円形状であって、その厚さは0.1mm〜0.3mmとなるように形成することができる。
そして、図7(X)に示すように、この細胞保持部14は、細胞培養部13を保持ケース部12に取り付けた状態において、本体部16を細胞培養部13内に取り付けたときに、本体部16の底部に設けられた上記シール部材17と上記支持部12pの上端面との間に挟まれるように形成する。逆にいえば、支持部12pは、細胞培養部13を保持ケース部12に取り付けた状態において、本体部16を細胞培養部13内に取り付けたときに、シール部材17と支持部12pとの両者間に細胞保持部14を挟み込む位置になるように形成されている。
【0070】
また、細胞培養部13には、細胞培養部13を水平な実験机等に置いたときに、底面に水等が付着しても、底面の密着性を低下させるための高台状の凸状部13rが、厚肉部13fの下端面に下方に設けられている。
【0071】
とくに、細胞保持部14の厚さを0.1mm程度に形成した場合であって、上述したようにチャンバ内の培地に所望の圧力を加える場合、かかる圧力によって細胞保持部14がたわまない程度に形成する。例えば、細胞保持部14の面積が保持ケース部12の底部に形成された観察開口部12qの面積よりも若干小さくなるように形成する。すると、チャンバ内の動物細胞Cを観察できる視野を確保しつつ、チャンバ内の動物細胞Cに対するストレス試験の状態を高感度で観察することができる。なお、細胞保持部14は、ガラス製部材で形成されていれば、より高感度に動物細胞Cを観察できるという利点が得られる。
【0072】
(リフタLの説明)
図9に示すように、細胞培養部13を保持ケース部12内取り付けるときに、リフタLにより、保持ケース部12内に取り付ける。このリフタLは、細胞培養部13を保持ケース部12内に取り付けた状態において、保持ケース部12の底部に形成された観察開口部12qから取り外すことができるように形成されている。例えば、リフタLは、棒状の把持部と、把持部の端部に連結した保持ケース部12を支持する円形状の支持部と、把持部の他端部に連結した台座部とから形成された部材であり、円形状の支持部は観察開口部12qの直径よりもやや小さくなるように形成する。
【0073】
このため細胞培養部13は、リフタLを使用すれば、以下の方法で保持ケース部12内に取り付けることができる。
まず、リフタLの支持部を保持ケース部12の観察開口部12qから挿入して、この支持部が、保持ケース部12の上端面よりもやや低い位置に配置する。そして、この支持部に細胞培養部13を配置して、保持ケース部12をリフタLの把持部の軸線方向に沿って持ち上げる(図9(A))。すると、保持ケース部12の上端内側面を細胞培養部13の導入案内部とすることができる。その後、細胞培養部13の底部が支持部12pの上端面に接した状態において、リフタLの支持部を保持ケース部12の観察開口部12qから取り外せば、細胞培養部13を簡易にかつ安全に保持ケース部12内に取り付けることができる。
【0074】
なお、このリフタLの形状は、細胞培養部13を保持ケース部12内に取り付けた状態で観察開口部12qから取り外すことができる形状であれば、とくに限定されない。
【0075】
以上のごとき構成であるので、細胞培養部13は、保持ケース部12から着脱可能であるので、一般のディッシュ等と同様の操作で動物細胞Cの培養操作をすることができるから、初めて使用する場合でも容易に操作することができる。
そして、リフタLを用いれば、培養した動物細胞Cを内部に収容した状態で、培地をこぼすことなく容易に細胞培養部13を保持ケース部12内に取り付けることができる(図9(A)および(B))。
そして、図9(B)および(C)に示すように、挿入部材15の本体部16を取り付けて、倒立顕微鏡のステージに配置すれば、保持ケース12の底部には観察開口部12qが設けられているので、対物レンズをチャンバの底面14sを形成する薄い板状の細胞保持部14の底面に接近させることができる。すると、対物レンズと動物細胞Cとの距離を短くできるので、チャンバ内の培養した動物細胞Cをより鮮明に観察できる。
しかも、保持ケース部12の底部には、凹み溝12gが側壁下端部に沿って形成されているので、細胞培養部13内から培地rがこぼれたとしても、かかる培地rを凹み溝12gで保持できるから、対物レンズ等へ培地rがかかるのを防止できる。
また、支持部12pは、本体部16の底部に設けられたシール部材17との間に細胞保持部14を挟み込むようにして、細胞保持部14をその上端部で保持しているので、細胞保持部14に曲げ等の力が加わることを防ぐことができる。すると、チャンバの底面、つまり、細胞保持部材14が薄い板状のガラス製部材、例えば、上述したカバーグラスと同等の厚さとなるように形成した場合でも、かかるガラス製部材が割れないので、チャンバ内の培地が漏れ出等といったトラブルを防止できる。
【0076】
なお、図7(X’)に示すように、細胞培養部13の底面に高台状の凸状部13rを有しない場合、保持ケース部12のフランジ12f上端部が平坦な構造を採用することも可能である。かかる場合、細胞培養部13および保持ケース部12の構造が上述した構造に比べて簡単となるので、安価に製造することができる。
【0077】
また、細胞培養部13は、上述した機能を備えているものであって、保持ケース部12に取り付けることができるものであればよく、市販のディッシュ等を採用することも可能である。
【0078】
なお、上記例では、細胞保持部14が、細胞培養部13を保持ケース部12に取り付けた状態において、本体部16を細胞培養部13内に取り付けたときに、本体部16の底部に設けられたシール部材17と支持部12pの上端面との間に挟まれるように形成された場合、つまり、シール部材17と支持部12pの両者間に細胞保持部14を挟む場合について説明した。しかし、図8に示すように、この両者間に、肉厚部13fを挟み込むようにした構造を採用することもできる。
この場合、細胞保持部14に力が加わらない。すると、チャンバの底面、つまり、細胞保持部材14を薄い板状のガラス製部材、例えば、上述したカバーグラスと同等の厚さ(例えば、0.1mm程度)部材によって形成した場合、本体部16を強く締め付けてもガラス製部材が割れないので、チャンバの内部と外部とをさらに液密にすることができる。なお、上記の例では、細胞保持部14がガラス製部材によって形成された場合について説明したが、細胞保持部14の材質は、ガラス製部材に限定されず、例えば、光を透過する光透過性を有する合成樹脂部材(例えば、ポリエチレン製部材、ポリプロピレン製部材等)を採用してもよい。
【0079】
(他の実施形態の顕微鏡用細胞収容器10Bの説明)
上述した挿入部材の構造は、同一の材質により形成された場合について説明したが、以下では、挿入部材が異なる材質で形成された構造を採用した場合について説明する。
【0080】
図10に示すように、挿入部材35は、収容ケース11に挿入する本体部36を備えており、この本体部36は、その内部に上端から下端に連通した円柱状の貫通孔部35hが形成されている。この円柱状の貫通孔部35hの下端部には、内方に突出した凸状部36pが形成されている。
【0081】
図10に示すように、円柱状の貫通孔部35hには、本体部36と材質の異なる材質で形成された円柱状の光を透過する円柱部材31と、この円柱部材31の上方に配設した円柱状の光を透過する保護部材32が、貫通孔部35h下端面から上方に向かって着脱可能に積層して取り付けられている。つまり、円柱部材31は、貫通孔部35hに挿入したときに、貫通孔部35hの下端部に形成された凸状部36pに係止し得るように取り付けられるのである。
【0082】
すると、本体部36は、例えば、光を透過する部材(ガラスや石英等)よりも異なる材質、例えば、フッ素樹脂系の材質で形成すれば、割れにくくかつ容易に加工することができる。しかも、円柱部材31と保護部材32は着脱可能であるので、円柱部材31に傷等が付いた場合、かかる部品だけを交換することができるので、経済的に好ましい。
【0083】
なお、保護部材32は、その側壁が貫通孔部35hの内壁面との間で螺合し得るように形成されているのが好適である。例えば、保護部材32の側壁に雄ネジ、貫通孔部35hの内壁面に雌ネジを形成する。すると、保護部材32を回転させることによって円柱部材31を固定することができるので、チャンバ内の培地rが円柱部材31の係止部分から漏れ出すのを防止できる。
また、保護部材32の下端面と円柱部材31の上端面との間に干渉部材33を備えていれば、両者間の摩擦による円柱部材31上端面に傷等が形成されるのを防止できる。
【0084】
また、保護部材32が、本体部材32aと、この本体部材32aを内方で保持する本体保持部32bとから構成されていれば、本体部材32aを光が透過できる部材で形成し、本体保持部32bを本体部材32aよりも硬い材質で形成することができる。すると、より強固に円柱部材31を固定することができる。
【0085】
さらになお、円柱部材31と保護部材32を貫通孔部35h内に取り付けた状態において、円柱部材31の下端面と凸状部36p下端面が略面一の状態、つまり、本体部36の下端面が略面一とになるように形成されているのが好ましい。この場合、かかる挿入部材35を収納ケース11内に取り付けた状態において、一の連通通路36aからチャンバ内に培地rを供給しても、チャンバ上面、つまり、本体部36の下端面近傍に段差に起因する渦流が形成されることを防止できる。
【0086】
(他の固定手段を備えた他の実施形態の顕微鏡用細胞収容器10Cの説明)
上述した挿入部を収容ケース11に挿入して、挿入部材を収容ケース11に取り付けた状態において、収容ケース11と連結して固定する固定手段として、棒状の固定用軸部18を採用した場合について説明したが、以下では、他の固定手段を採用した場合について説明する。
【0087】
図12に示すように、挿入部材35の本体部36は、本体部36を収容ケース11に固定するための固定部36sと、この固定部36sの先端面に基端が連結された先端部36tとを有する構造を採用することができる。なお、先端部36tは、上述した先端部16tと同等の構造を有するものである。
【0088】
図12に示すように、固定部36sは、本体部36を収容ケース11内に取り付けたときに、収容ケース11の保持ケース12の内側面と略接するように形成された張出部36nと、この張出部36nの基端部に、張出部36nよりも外方に向かって張り出してフランジとして機能する基端フランジ36fとから形成されている。この張出部36nの外側面には、雄ネジが形成されている。具体的には、張出部36nにおいて、基端フランジ36fの連結部から先端面の間の外側面に雄ネジが形成されている。すると、保持ケース12の内側面に雌ネジが形成されていれば、本体部36を回転させることによって保持ケース12内に本体部36を所定の位置で固定することができる。しかも、図12に示すように、本体部36の基端部には基端フランジ36fが設けられているので、本体部36を回転させながら保持ケース12内に挿入したときに、基端フランジ36fと保持ケース12の側壁上端面とが当接した位置で回転を停止させることができる。すると、本体部36を強く締めすぎてもチャンバの高さを所望の高さよりも低くなるのを防止できる。しかも、強い締め付けによって細胞保持部14が破損等するのを防止できる。
さらに、図11に示すように、基端フランジ36fの側壁面と保持ケース12の側壁面とが、略面一となるように形成されていれば、略凹凸のない構造とすることができるので、塵や埃等が外部に付着しにくい構造とすることができる。すると。凹凸形状を有する場合に比べて汚染の危険性を少なくすることができる。
【0089】
なお、張出部36nと保持ケース12の両者間にシール性を有する部材を設ければ、顕微鏡用細胞収容器10Cが転倒した場合であっても、培地rが両者間を介して外部に漏洩するのを防止できる。例えば、張出部36nの外周にOリングを設ける。具体的には、張出部36nの外側面に形成された雄ネジの基端と基端フランジ36fとの間にOリングが配置されるように設ければ、Oリングによって両者間をシールすることができる。
【0090】
(温度制御手段40の説明)
また、以下に説明するように、顕微鏡用細胞収容器10がチャンバ内の温度を制御する温度制御手段40を備えていてもよい。この場合には、長期間、顕微鏡用細胞収容器10を顕微鏡のステージに配置した場合であっても、チャンバ内の温度を常に一定の温度に保つことができ、チャンバ内の動物細胞Cに対する培地温度の影響を排除できる。すると、動物細胞Cの動態等をより再現性よく顕微鏡を用いて観察できるから、好適である。
【0091】
例えば、この温度制御手段40は、内部に顕微鏡用細胞収容器10を取り付けた状態において、顕微鏡用細胞収容器10の温度を測定し得る温度センサ62と、この温度センサ62の測定した温度データ等に基づいて顕微鏡用細胞収容器10内のチャンバ内温度が所望の値となるように、顕微鏡用細胞収容器10に所定の熱量を供給する保温部50と、を備えている。
以下、個々の部材について詳細に説明する。
【0092】
(保温部50の説明)
図13に示すように、保温部50は、固定ベース51と保持部材52とから形成されている。
【0093】
(固定ベース51の説明)
固定ベース51は、底面が平坦かつ上面が底面に対して平行な板状の部材であり、この板状部材には、円柱状の顕微鏡用細胞収容器10の直径、具体的には、収容ケース11の底面の直径よりやや大きな貫通孔50hが形成されている。そして、この固定ベース51は、後述するように、貫通孔50h内に顕微鏡用細胞収容器10を取り付けて顕微鏡のステージに配置した状態において、顕微鏡用細胞収容器10と貫通孔50hの両者の中心軸がステージに設けられた観察窓の中心軸と一致するように調整した状態を維持し得るように安定した形状に形成されている。
【0094】
(保持部材52の説明)
図13に示すように、この固定ベース51の上面には、保持部材52が設けられている。この保持部材52は、上端面および下端面にそれぞれ開口を有する内部に中空な空間部が形成された円筒状の部材であり、円筒状の内部空間部の直径が固定ベース51の貫通孔50hの直径と略同じ大きさに形成されている。そして、この保持部材52は、その中心軸が固定ベース51の貫通孔50hの中心軸と一致するように、貫通孔50hの外縁を囲むように配設されている。
すると、固定ベース52の貫通孔50hの外縁を囲むように保持部材52を配設した保温部50を顕微鏡のステージに配置した状態において、保持部材52の中空な空間部の上方から顕微鏡用細胞収容器10を挿入すれば、顕微鏡用細胞収容器10の中心軸Oがステージに設けられた観察窓の中心軸と略一致させて顕微鏡用細胞収容器10をステージに配置できる。
【0095】
(ヒータ部材61の説明)
また、図13に示すように、保持部材52には、保持部材52に熱を供給するヒータ部材61が設けられている。このヒータ部材61は、保持部材52の側壁に形成された切欠部52gに配設されている。この切欠部52gは、保持部材52の側壁の上端面から下端面に向かって形成されている。
【0096】
図13(A)に示すように、保温部50を顕微鏡のステージに配置した状態において、顕微鏡用細胞収容器10を保持部材52の上端面の開口から挿入して取り付ける。すると、図13(A)の拡大図に示すように、保温部50の貫通孔50hの直径が顕微鏡用細胞収容器10の底面の直径よりやや大きく形成されているので、顕微鏡用細胞収容器10は、その外側面と保持部材52の内側面との間に僅かな隙間を有するように保温部50の貫通孔50h内に配置できる。保持部材52は、ヒータ部材61から供給された熱を、その内側面から内方に向かって放出できるので、この放出された熱は、保持部材52の内側面と顕微鏡用細胞収容器10の外側面との間に形成された隙間を介して顕微鏡用細胞収容器10に供給できる。このため、保温部50により顕微鏡用細胞収容器10を保温することができる。
【0097】
なお、図13に示すように、保持部材52は、その中心に対して対向するように一対の切欠部52g、52gが形成されていれば、この一対の切欠部52g、52gにそれぞれヒータ部材61、61を取り付けることができるので、効率よくヒータ部材61から保持部材52に熱を供給できる。
また、ヒータ部材61を切欠部52gに取り付ける方法は、保持部材52に熱を供給できれば、とくに限定されず、例えば、ヒータ部材61は、切欠部52gにネジで固定してもよい。また、保持部材52に切欠部52gを設けずに、ヒータ部材61を差し込むための差し込み溝等を形成して、この差し込み溝にヒータ部材61を差し込んで固定するようにしてもよい。この場合、ヒータ部材61を差し込み溝に差し込む方向は、保持部材52の上方から下方に向かって差し込むように取り付けてもよいし、保持部材52の横方向から差し込むように取り付けてもよい。
【0098】
(切欠部52gの他の形状の説明)
なお、切欠部52gは、上述したヒータ部材61を取り付けることができる形状であればとくに限定されない。例えば、保持部材52の平面視(保持部材52の軸線方向からみたとき、つまり、図13(B)となるように紙面に対して垂直方向からみたとき)において、クサビ状(図13(B)の点線参照)に形成された形状としてもよい。この場合、クサビ状に形成した切欠部52gにヒータ部材61を取り付けておけば、このヒータ部材61に電気を通すケーブル等を保持部材52の周方向から接続することができる。すると、顕微鏡のステージ上に保温部50を配置したときに、かかるケーブル等が邪魔にならないので、好ましい。
【0099】
(制御部60の説明)
とくに、図13(A)に示すように、温度制御手段40は、ヒータ部材61の作動を制御する機能を有する制御部60を備えていれば、保温部50を顕微鏡のステージに配置した状態において、保温部50に形成された貫通孔50hに顕微鏡用細胞収容器10を配置することによって、顕微鏡用細胞収容器10内の温度を常に略一定の温度に維持することができる。
【0100】
具体的には、図13(A)に示すように、ヒータ部材61は、制御部60に電気的に接続されている。この制御部60には、ヒータ部材61の他、顕微鏡用細胞収容器10内の温度を測定する温度センサ62が電気的に接続されている。この温度センサ62は、顕微鏡用細胞収容器10内のチャンバ近傍の温度を測定するように配設されている。そして、この制御部60は、温度センサ62の測定値に基づいて、ヒータ部材61の作動を制御することにより、保持部材52から顕微鏡用細胞収容器10に供給する熱量を制御する機能を有している。例えば、制御部60にチャンバ内の培地温度とチャンバ近傍の温度から作成した検量線等を記憶させておけば、制御部60は、温度センサ62により得られた温度データに基づいてチャンバ内の推定温度値を算出できる。この算出された推定温度値に基づいて、制御部60がヒータ部材61の作動を制御すれば、保持部材52から顕微鏡用細胞収容器10に供給する熱量を制御することができる。
【0101】
上記のごとき温度制御手段40を備えていれば、温度センサ62によってチャンバ内温度が推定できるので、チャンバ内温度が所望の温度から変動すれば、制御部60によって、保持部材52の作動が制御され、顕微鏡用細胞収容器10内の温度が調整される。すると、チャンバ内を一定の温度に維持できるのから、動物細胞Cの動態等をさらに再現性よく顕微鏡を用いて観察できる。しかも、チャンバ内の温度を変動させれば、動物細胞Cに与える温度の影響をも顕微鏡を用いて観察できる。
【0102】
(他の保持部材55の例)
固定ベース51の貫通孔50hの外縁を囲むように配設した保持部材の構造は、その内部に顕微鏡用細胞収容器10を配置した状態において、その内側面から顕微鏡用細胞収容器10に対して熱を供給できる構造であれば、上述した構造に限定されない。
【0103】
例えば、以下に説明するように、保持部材55の内部に顕微鏡用細胞収容器10に配置したときに、保持部材55の内側面が顕微鏡用細胞収容器10の外側面に面接触し得る構造とすれば、保持部材55は、顕微鏡用細胞収容器10に効率よく熱量を供給することができるので、好適である。しかも、保持部材55の内側面と顕微鏡用細胞収容器10の外側面の間には、隙間が形成されないから、チャンバ内の温度をより正確に一定の温度に維持できる。
【0104】
図14に示すように、保持部材55は、上端面および下端面にそれぞれ開口を有する内部に中空な空間部が形成された円筒状の部材であり、その側壁に切欠き状の開口部55sが形成された略C字状の部材である。この略C字状の保持部材55は、固定ベース51に固定された固定部55aと、可動部55bとから形成されている。
【0105】
図14(A)に示すように、この固定部55aと可動部55bは、それぞれの基端部が連続するように連結部で連結して形成されている。具体的には、略C字状の保持部材55の中心を通り、欠き状の開口部55sに対して対向する部位に連結部を有するように形成されている。
可動部55bは、上記の連結部を支点として固定ベース51の上面を摺動し得るように固定部55aに対して揺動可能に連結されている。そして、この保持部材55は、可動部55bをその先端面が固定部55aの先端面に接するように揺動させたとき、つまり、切欠き状の開口部55sが閉塞した状況において、保持部材55内の中空な空間部の断面形状が、保持部材55の中心軸に対して直交する円形な断面形状となるように形成されている。また、かかる円形な断面形状となるように可動部55bを揺動して切欠き状の開口部55sを閉塞させた状態において、保持部材55は、その内部の中空な空間部の円形な断面形状の半径が、顕微鏡用細胞収容器10の中心軸Oに対して直交する円形な断面形状の半径と同一となるように形成されている。言い換えれば、かかる状態において、両者の曲率半径が同一となるように形成されている。
【0106】
このため、固定ベース51に保持部材55を上記のごとく取り付けた保温部50を顕微鏡のステージに配置した状態では、保持部材55は、その側壁に切欠き状の開口部55sが形成されているので、上端面の開口から顕微鏡用細胞収容器10を容易に貫通孔50h内に挿入して取り付けることができる。そして、保持部材55の切欠き状の開口部55sを閉塞すれば、保持部材55と顕微鏡用細胞収容器10の両者の中心軸を一致させることができる。しかも、この中心軸に対して直交する保持部材55内の中空な空間部の円形な断面形状と、この中心軸に対して直交する顕微鏡用細胞収容器10の円形な断面形状の両者の曲率半径が同一であるので、保持部材55は、その内側面が顕微鏡用細胞収容器10の外側面に面接触して顕微鏡用細胞収容器10をその内部に保持することができる。
【0107】
なお、上記連結部の内側面に上端面から下端面に向かった切欠きが形成されていれば、切欠き状の開口部55sを閉塞しやすくなるという利点が得られる(図19(A)参照))。
【0108】
(開口閉塞手段56の説明)
とくに、保持部材55は、可動部55bを連結部を支点として固定部55aに対して揺動させたときに、両者の先端面を密着して保持する開口閉塞手段56を備えていれば、保持部材55の内側面と顕微鏡用細胞収容器10の外側面を確実に面接触させておくことができる。
【0109】
例えば、図14に示すように、開口閉塞手段56は、一対の板状部材57a、57bと、この一対の板状部材57a、57bを接近離間するように調整する隙間調整部材58とから形成されている。この一対の板状部材57a、57bは、互いに略平行になるようにそれぞれ、その基端部が固定部55aと可動部55bの両端部の外側縁部に連結されている。具体的には、この一対の板状部材57a、57bは、それぞれの内端面が密着するように接近すれば、固定部55aと可動部55bの両端部の端面が密着するように形成されている。言い換えれば、開口閉塞手段56を備えた保持部材55は、クランプ状に形成された部材である。
【0110】
この隙間調整部材58は、一対の板状部材57a、57b間に形成された隙間を調整する部材である。
図14に示すように、一対の板状部材57a、57bは、対向する位置に貫通孔が形成されている。この貫通孔のうち一の板状部材57b(図14の左側の板状部材)に形成された貫通孔内面には、雌ネジが形成されている。そして、隙間調整部材58は、雄ネジが形成されたボルト状に形成されている。
すると、他の板状部材57aの貫通孔から一の板状部材57bの貫通孔に向かって隙間調整部材58を挿入し、隙間調整部材58の雄ネジを板状部材57bに形成した貫通孔内の雌ネジに螺合すれば、一対の板状部材57a、57bの内端面を接触した状態で保持することができる。つまり、かかる状態は、固定部55aと可動部55bの両端面が密着した状態で保持されているのである(図14(B))。
【0111】
このため、固定ベース51に保持部材55を上述したように取り付けた保温部50を顕微鏡のステージに配置した状態において、保持部材55の上端面の開口から顕微鏡用細胞収容器10を貫通孔50h内に挿入して、開口閉塞手段56により固定部55aと可動部55bの両先端面を密着して保持できるので(図14(B))、保持部材55の内側面と顕微鏡用細胞収容器10の外側面を密着させた状態で顕微鏡用細胞収容器10を保温部50内に取り付けることができる。
【0112】
したがって、保持部材55の内側面と顕微鏡用細胞収容器10の外側面を確実に面接触させておくこができるので、保持部材55は、顕微鏡用細胞収容器10に効率よく熱量を供給することができる。しかも、保持部材55の内側面と顕微鏡用細胞収容器10の外側面の間には、隙間が形成されないから、保持部材55の内側面から直接、顕微鏡用細胞収容器10に熱を供給できる。すると、保持部材55から顕微鏡用細胞収容器10に供給する熱量と、この供給された熱量により変動するチャンバ内の温度とをよりタイムロスがない状況で両者の関係を把握することができる。すると、温度制御手段40が上述した制御部60を備えていれば、チャンバ内の温度をより変動が少ない状態に維持することができるので、より正確にチャンバ内の温度を一定の温度に維持することができる。よって、さらに再現性のよい動物細胞Cの動態等を顕微鏡を用いて観察できる。
【0113】
さらに、開口閉塞手段56により保持部材55内部に顕微鏡用細胞収容器10を固定して保持することができるから、顕微鏡用細胞収容器10を顕微鏡のステージ以外の場所で保温部50の貫通孔50hに取り付けることができる。この場合、ステージ上で顕微鏡用細胞収容器10を保温部50に取り付ける場合に比べて取り付ける際の視野が広くなるので、より簡便に顕微鏡用細胞収容器10を保温部50に取り付けることができる。
例えば、保温部50を上面が平坦な実験台等に配置して、顕微鏡用細胞収容器10を保温部50の貫通孔50hに挿入する。そして、顕微鏡用細胞収容器10の底面が実験台等の上面に当接した状況で開口閉塞手段56により保持部材55内部に顕微鏡用細胞収容器10を固定して、かかる保温部50を顕微鏡のステージに配置することができる。
【0114】
なお、保温部50は、固定ベース51を備えていないものを採用することも可能であるというのは、いうまでもない。この場合、開口閉塞手段56により保持部材55内部に顕微鏡用細胞収容器10を固定して保持することができるから、かかる状態において、上下を逆転させても、保持部材55から顕微鏡用細胞収容器10に熱量を供給することができる。このため、正立顕微鏡を使用してチャンバ内の動物細胞Cを観察する場合であっても、上述した場合と同様の効果を奏する。
また、開口閉塞手段56により保持部材55内部に顕微鏡用細胞収容器10を固定して保持することができるから、保持部材55を形成する固定部55aが固定ベース51にビス等により着脱可能に形成されているのが、好ましい。この場合、倒立顕微鏡を使用する場合には、この保持部材55は、固定部55aを固定ベース51に固定した状態で用いればよく、正立顕微鏡を使用する場合には、固定部55aを固定ベース51からはずした状態で用いることができる。
【0115】
なお、保持部材52、55の素材は、熱伝導性を有するものであればとくに限定されず、たとえば、アルミニウムを採用することができる。
また、温度センサ62は、顕微鏡用細胞収容器10内のチャンバ内温度を計算できるデータを測定することができれば、とくに限定されない。例えば、チャンバ上方に配置された保護部材32のうち、本体保持部32b内に軸方向に一端が開口した一対の温度センサ挿入穴を、保護部材32の中心軸に対して対向するように形成し、この温度センサ挿入穴に温度センサ62を挿入すれば、チャンバ内温度を計算できるデータを測定することができる。
【0116】
(その他)
(構成部材の材質の説明)
金属イオン等がチャンバ内で培養した細胞に対してその動態等に影響を与える場合、本実施形態の顕微鏡用細胞収容器10を構成する部材は、金属イオン等が培地rにより溶出しない素材、例えば、フッ素樹脂のポリテトラフルオロエチレン(PTFE)や二酸化ケイ素(石英)を素材として形成するのが好ましい。例えば、PTFEを素材とした形成した部材は、加工が容易であり、しかも、オートクレーブ等を用いた高温滅菌処理をしても形状が変化しないので好適である。なお、本実施形態の顕微鏡用細胞収容器10を顕微鏡のステージ上に配置したときに、光源から放出された光がチャンバ内を透過するように形成するように本実施形態の顕微鏡用細胞収容器10の部材は構成されている、というのはいうまでもない。
【0117】
なお、上述した顕微鏡として、光源にハロゲンランプ等を有する光学顕微鏡(倒立顕微鏡および正立顕微鏡)を使用する場合について説明したが、使用される顕微鏡は光学顕微鏡に限定されない。例えば、光源として紫外線等を放射可能な蛍光顕微鏡を使用すれば、蛍光タンパク質を取り込ませた動物細胞Cにおいて、所望のタンパク質の細胞内局在を観察することができる。また、これらの顕微鏡にカメラやビデオ等の記録媒体を設けておけば、動物細胞Cの動態等を記録できるので好ましい。
【0118】
(伝熱プレートPの説明)
また、上述したように本実施形態の顕微鏡用細胞収容器10を使用して、長期間、顕微鏡を用いてチャンバ内の動物細胞Cを観察する場合、チャンバ内に供給する培地がチャンバ内の培地温度と略同じ温度になるように調整されていれば、動物細胞Cの長期間観察を再現性よく観察できるので好適である。
とくに、保持部材の外周面に培地供給チューブ16i、36iを収容し得るチューブ収容溝hが形成されていれば、培地供給チューブ16i、36iを保持部材の外周面に固定することができる。つまり、確実に培地供給チューブ16i、36iを保持部材の外周面に接した状態にしておくことができる。そうすると、培地供給チューブ16i、36iの内部に流れる培地を確実に加温できる。
【0119】
例えば、図19に示すように、保持部材55Aは、外側壁(外周面)に半径方向に沿って外方に延びた複数枚の伝熱プレート55Pを設けて、この複数枚の伝熱プレート55Pのうち隣接する伝熱プレート55P、55p間に培地供給チューブ16i、36iを収容し得るチューブ収容溝55hを形成した構成を採用してもよい。この場合、培地供給チューブ16i、36iをチューブ収容溝55h、55h内に取り付ければ、保持部材55Aをヒータ部材61により加温した状態において、伝熱プレート55Pから培地供給チューブ16i、36iに対して熱を供給することができる。そうすると、培地供給チューブ16i、36i内に流れる培地をチャンバ内に到達するまでに確実にチャンバ内の培地温度と略同等にすることができる。
【0120】
とくに、伝熱プレート55Pは、隣接する伝熱プレート55P、55Pの対向する面間の距離、つまり、チューブ収容溝55hの内壁間距離が培地供給チューブ16i、36iの外径よりも若干短くなるように設けるのが好ましい。この場合、培地供給チューブ16i、36iをチューブ収容溝55h、55h内壁面に密着して取り付けることができる。すると、培地供給チューブ16i、36iと収容溝55hの内壁の接触面積をより大きくできるので、伝熱プレート55P、55Pから供給チューブ16i、36iに対して供給する熱量を大きくできる。このため、供給チューブ16i、36i内に流れる培地をチャンバ内に到達するまでにより確実にチャンバ内の培地温度と略同等にすることができる。
【0121】
また、保持部材に形成するチューブ収容溝hは、その本数はとくに限定されないが、図19に示すように、2本のチューブ収容溝55h、55hを形成するのが好ましい。図19に示すように、複数の伝熱プレート55Pを保持部材55Aの外周面に沿って円弧状に設けた場合、隣接する円弧状の伝熱プレート55P間に形成したチューブ収容溝55h、55hの底(つまり、保持部材55Aの外周面)に沿わせて培地供給チューブ16i、36iを取り付けることができる。例えば、図19に示した保持部材55Aの場合、2本のチューブ収容溝55h、55hにおいて、培地供給チューブ16i、36iを下方のチューブ収容溝55h(図19(B)の側面図において紙面下方のチューブ収容溝55h)の底に沿って一の端部から他の端部まで取り付けたのち、他の端部で折り返して上方のチューブ収容溝55h(図19(B)の側面図において紙面上方のチューブ収容溝55h)の底に沿って他の端部から一の端部まで取り付けることができる。この場合、保持部材55Aの外周面において伝熱プレート55Pを設ける範囲を限定した場合であっても、培地供給チューブ16i、36iが伝熱プレート55Pに接する時間をより長くすることができるので、効率よく培地供給チューブ16i、36iに対して熱を供給することができ、培地供給チューブ16i、36iの内部に流れる培地をより確実にチャンバ内の培地温度と略同等にすることができる。
【0122】
また、チューブ収容溝55hは、その内底面が伝熱プレート55Pが設けられていない部分の外周面と一致するように形成するのが好ましい(図19(A)または図20(A)の点線参照)。具体的には、図19(A)に示すように、チューブ収容溝55hの内底面は、その曲率半径r2が伝熱プレート55Pを設けていない部分の外周面の曲率半径r1と同じ長さであり、かつその中心軸も一致するように形成している。つまり、保持部材55Aの中心軸に対して直交する面でチューブ収容溝55hの内底面を含むように保持部材55Aを切ったときに壁面の断面の厚さが略均一に形成しているのである。この場合、保持部材55A内部に顕微鏡用細胞収容器10を保持した状態において、保持部材55Aから略均一な熱量を顕微鏡用細胞収容器10の全周囲から供給することができる。すると、チャンバ内の培地温度をより安定して維持できる。
【0123】
なお、伝熱プレートPを保持部材に設ける範囲は、保持プレートPとヒータ部材61が干渉しないように設けられていれば、とくに限定されない。
例えば、図19に示すように、円弧状に設けられた複数枚の伝熱プレート55Pの両端が切欠部55g、55gの基端に一致するように形成していれば、供給チューブ16i、36iをチューブ収容溝55hに取り付けるときに、ヒータ部材61、61が邪魔にならないので好ましい。また、図20に示すように、保持部材52Aには、その外周面全体に沿って複数枚の伝熱プレート52Pが設けられており、保持部材52Aの内壁面には切欠部52g、52gが形成されている。そして。この切欠部52gには、上方から下方に向かってヒータ部材61が取り付けられている。この場合、地供給チューブ16i、36iをチューブ収容溝52h、52hに取り付ける際、ヒータ部材61、61が邪魔にならならない。
しかも、図20に示すように、チューブ収容溝52h、52hを保持部材52Aの外周面全体に沿って形成することができるので、地供給チューブ16i、36iをチューブ収容溝52h、52h内に保持しておく時間をより長くできる。すると、培地供給チューブ16i、36iの内部に流れる培地をさらにより確実にチャンバ内の培地温度と略同等にすることができる。
【0124】
また、チューブ収容溝hは、その内部に、例えば、アリ溝構造を有する形状を採用してもよい。この場合、培地供給チューブ16i、36iをチューブ収容溝hに取り付けた状態において、培地供給チューブ16i、36iがチューブ収容溝hから脱落等することを確実に防止することができるという利点が得られる。
【実施例1】
【0125】
本発明の顕微鏡用細胞収容器を用いて培養細胞を観察できることを確認した。
【0126】
実験では、(I)培養細胞の鮮明な顕微鏡写真が得られるか否か、(II)蛍光を用いた細胞の機能観察が可能か否か、(III)圧迫培養条件下における培養細胞の動態観察が可能か否か、を確認した。
実験(II)の蛍光観察は、細胞内遊離カルシウム濃度測定に使用されるカルシウム蛍光指示薬(以下、カルシウム蛍光プローブという)を導入された細胞に対して励起光を照射した場合における蛍光を蛍光顕微鏡により測定し観察した。
実験(III)の動態観察は、培養細胞の細胞骨格変化をアクチンフィラメント(以下、F−アクチンという)の形態変化に基づいてF−アクチンを蛍光染色することによって、その蛍光染色した細胞に対して励起光を照射した場合における蛍光を蛍光顕微鏡により測定し観察した。
【0127】
本実験に使用した顕微鏡用細胞収容器、細胞、培地(緩衝液含む)、カルシウム蛍光プローブ、顕微鏡、加圧機器等は、以下のとおりである。
【0128】
実験の顕微鏡用細胞収容器は、図10に示す構造を有するものを使用した。
保持ケース部は、外径が42mm、底面から上端面までの高さが16.5mmの円柱形状に形成されたものである。その内部には、内径が38mmの中空な空間部を有している。この保持ケース部の底部は、直径が21.5mmの観察開口部を備えており、その中心軸が保持ケース部の中心軸に一致するように形成されている。
細胞培養部として、直径35mmのディッシュ(松浪ガラス工業社製、型番:D111340)を使用した。このディッシュの底部は、その中心部に厚さが0.17mm、直径が14mmのガラス製の細胞保持部を備えており、この細胞保持部の外周に沿ってドーナッツ状に形成された厚さ0.9mmの厚肉部を備えたものを使用した。
【0129】
挿入部材の本体部は、底端面から上端面までの高さが21mm、直径が26mmの円柱状に形成されたものを使用した。本体部の下端部には、溝開口幅が1.25mm、溝深さが0.6mmの片アリ溝構造を有する保持溝が形成されている。この保持溝は、本体部の中心軸を囲むように内径が22mmの円形に形成されている。そして、この保持溝には、直径1.3mmのシリコン製のOリングが約半分埋まるように嵌め込められている。つまり、Oリングは、本体部の底面に、その底面から若干突出するように形成されている。なお、この突出部の高さは、約0.7mmである。
【0130】
上記のごとき構成を有する顕微鏡用細胞収容器では、保持ケース部内にディッシュを取り付けた状態において、本体部を取り付けると、本体部の下端面と、ディッシュの内底面と、シリコン製のOリングとで囲まれたチャンバが形成される(図8参照)。本実験に使用した顕微鏡用細胞収容器の場合、形成されるチャンバの容積は、約0.4mlである。
【0131】
実験(I)および(II)に用いた細胞は、牛副腎髄質細胞から単離した牛単離副腎髄質細胞を細胞密度5×105/mlに調整して、DMEM培地(Sigma社製)を使用して培養した。なお、細胞の調製方法および細胞の培養方法の詳細については、後述する。
実験(III)に用いた細胞は、ヒト臍帯静脈内皮細胞であるHUVEC細胞(タカラバイオ社製、型番:C2517A)を細胞密度1×105/mlに調整して、基本培地(タカラバイオ社製、型番:B3156)を使用して培養した。なお、細胞の培養方法の詳細については、後述する。
【0132】
実験(I)および(II)に用いた緩衝液は、HEPES(Sigma社製)を有するHEPES Buffer(以下、Standard ReleaseMedium(SRM)という)をpH7.35〜7.40に調整して使用した。緩衝液の組成およびその濃度は、表1のとおりである。なお、SRMのうち、カルシウムイオンを含有するものをSRM(+)、カルシウムイオンを含有しないものをSRM(−)とした。
【0133】
【表1】

【0134】
カルシウム蛍光プローブは、Fluo−4AM(Invitrogen社製)を使用した。Fluo−4AMは、ボルテックスミキサー(Scientific
Industries社製、型番:Vortex-2 genie)を用いてDMEM培地に溶解し、最終濃度5μMになるように調整した。そして、この培地をカルシウム蛍光プローブ導入培地として使用した。
【0135】
ここで、細胞に導入されたFluo−4AMについて簡単に説明する。
細胞に導入されたFluo−4AMは、細胞内のエステラーゼによりアセトメチル基(AM)が加水分解されてFluo−4となるものである。このFluo−4は、所定の励起光が照射されると、特徴的な波長の蛍光を発光する。しかも、Fluo−4は、カルシウムイオンと選択的に錯体を形成する。この錯体の蛍光強度は、錯体を形成する前のFluo−4だけの蛍光強度よりも約3倍程度強い蛍光を発光する。
そこで、本実験(II)では、細胞内にカルシウムを取り込ませる刺激剤により細胞を刺激したときに、Fluo−4のカルシウムイオン錯体が発光する蛍光強度の変化に基づいて、細胞内に取り込まれたカルシウムの濃度変化を測定した。この細胞内に取り込まれたカルシウムの動態は、後述する蛍光顕微鏡を使用することにより蛍光画像として捉えた。
【0136】
刺激剤は、アセチルコリン(Sigma社製、型番:塩化アセチルコリン粉末0.1g)をSRM(+)に溶解して最終濃度1.0×10-4Mとなるように調整したものを使用した。なお、対照刺激剤として、細胞内にカルシウムイオンを取り込ませる機能を殆ど有さない高麗人参抽出エッセンスを、SRM(+)に溶解して最終濃度25mg/mlになるように調整したものを使用した。
【0137】
実験(III)では、細胞骨格染色を行うために、以下の試薬等を使用した。
固定試薬:パラホルムアルデヒド(PFA)(和光純薬工業社製、型番:163-20145)を0.1mol/lりん酸緩衝液(pH7%)を用いて4%PFA溶液となるように調製したものを使用した。
PBS緩衝溶液:PBS(和光純薬工業社製、型番:045-29795)を0.01Mリン酸緩衝化生理食塩水を用いてpH7.2〜7.4に調製したものを使用した。
ブロッキング試薬:Triton X-100(和光純薬工業社製、型番:200221)が0.1%、Donkey血清(和光純薬工業社製、型番:017-000-121)が5%となるようにPBS緩衝溶液を用いて調製したものを使用した。
細胞骨格染色溶液:蛍光ファロイジン(Invitrogen社製、型番:Alexa Fluor 568)をブロッキング溶液を用いて200倍に希釈したものを使用した。
封入溶液:蛍光減衰防止剤(Thermo社製、型番:Perma Fluor Aquamous Mounting
Medium)を使用した。
また、DNA染色試薬として、DAPI(同仁化学研究所製、型番:28718-90-3)を1μg/mlに調製したものを使用した。
【0138】
ここで、F−アクチンの蛍光観察について簡単に説明する。
アクチンは球状のタンパク質であり、アクチンが繊維状に結合してアクチンフィラメント(F−アクチン)を形成する。この繊維状の結合したF−アクチンは細胞骨格を構成するものであり、細胞の変化に伴ってF−アクチンの形態も変化する。つまりF−アクチンの形態を観察することができれば、細胞骨格の変化、言い換えれば細胞の動態を観察することができるのである。F−アクチンを観察するためには、F−アクチンを形成するアクチンに対して特異的に結合する7分子のアミノ酸が環状に結合したファロイジンを用いることができる。そして、このファロイジンには、蛍光色素であるローダミンを結合させたものが一般的に用いられている。つまり、このローダミンを結合させたファロイジンをアクチンに作用(結合)させることによって、F−アクチンを蛍光染色することができる。この蛍光染色したF−アクチンに所定の励起光を照射することにより、ファロイジンに結合したローダミンが発光する蛍光を蛍光顕微鏡を用いて観察すれば、F−アクチンの形態を観察することができる。
そこで、本実験(III)では、チャンバ内において細胞に圧力をかけたときに、細胞の骨格を構成するF−アクチンに作用(結合)したファロイジンのローダミンが発光する蛍光を、後述する蛍光顕微鏡を使用することにより細胞骨格の変化つまり細胞の動態を蛍光画像として捉えた。
【0139】
顕微鏡は、透過光撮影モード、位相差撮影モードおよび蛍光撮影モードのそれぞれの機能を有する倒立蛍光顕微鏡(Nikon社製、型番:TE2000-U)を使用した。
光源は、高圧水銀ランプを使用した。
細胞の観察は、倍率を200倍(接眼レンズ10倍、対物レンズ20倍)に調整して観察した。観察した細胞は、顕微鏡に接続した顕微鏡用CCDデジタルカメラ(Nikon社製、型番:DS-L1)を使用して撮影した。
また、実験(II)では、蛍光撮影において、細胞に照射する励起光は495nmとし、照射された励起光により細胞内に導入したカルシウム蛍光プローブが発光する蛍光のうち、518nmの蛍光を測定した。
また、実験(III)では、蛍光撮影において、細胞に照射する励起光は540nmとし、照射された励起光によりF−アクチンに結合したファロイジンが発光する蛍光のうち、590nmの蛍光を測定した。
なお、観察した細胞に障害を与えないために、励起光は、Neutral Density filter(ND)フィルタNo4(Nikon社製)を透過させて細胞に照射した。
【0140】
実験(III)では、圧迫条件下で細胞を培養するために、ペリスタポンプ(EYELA社製、型番:MP-3)を使用した。以下では、2台のペリスタポンプ(A、B)を使用したときの配設方法について説明する。
本実験で用いた顕微鏡用細胞収容器の挿入部材の本体部の上部に設けられた連通通路(図10の36a)の端部にPBS緩衝溶液供給チューブ(図10の36iに相当)を連結した。連結したPBS緩衝溶液供給チューブの上流側にペリスタポンプAを連結し、空気クッションを行うために開口部をシリコン栓で閉じた三角フラスコを介してペリスタポンプBを連結した。そして、このペリスタポンプBにPBS緩衝溶液が入った三角フラスコを連結した。なお、ペリスタポンプ間等はシリコン製のチューブで連結した。また、ペリスタポンプA、B間に配設した三角フラスコのシリコン栓には、加圧計(エスコ社製、型番:EA729D-1)を取り付けた。また、本体部の上部に設けられた他方の連通通路(図10の36b)の端部には、PBS緩衝溶液排出チューブ(図10の36eに相当)を連結した。つまり、PBS緩衝溶液がPBS緩衝溶液が入った三角フラスコ→ペリスタポンプB→空気クッション用三角フラスコ→ペリスタポンプA→PBS緩衝溶液供給チューブ→本体部(チャンバ)→PBS緩衝溶液排出チューブといった流れになるように連結した。
【0141】
加圧条件:2台のペリスタポンプを作動させた状態において、ペリスタポンプBに供給されるPBS緩衝溶液の流量とペリスタポンプAから排出されるPBS緩衝溶液の流量の比が、2:1となるように、PBS緩衝溶液を送液した。このとき、送液するPBS緩衝溶液の液圧が0.02MPa(150mmHg)になるように加圧計を用いてペリスタポンプA、Bを調整した。つまり、本実験で用いた顕微鏡用細胞収容器のチャンバ内の液圧は、0.02MPa(150mmHg)となるように調整されているのである。
【0142】
(I)培養細胞の鮮明な顕微鏡写真が得られるか否か、および(II)蛍光を用いた細胞の機能観察が可能か否かの実験
顕微鏡を用いて観察対象細胞を観察する手順を説明する前に、まず、細胞の調整およびその培養について、以下、詳細に説明する。
【0143】
(細胞の調整)
まず、細胞として使用した牛副腎髄質細胞は、以下の(1)〜(7)の手順により調整した。
(1)副腎の周囲の脂肪を切り取った副腎を氷の上に置き、皮質表面に切れ目を入れて、副腎静脈口を露出させて、この副腎静脈口からSRM(−)を流し込んで、血液を除去した。
(2)血液を除去した副腎から、副腎髄質のみを切り取り、SRM(−)で満たした試験管に切り取った副腎髄質を約5分間、浸漬した。
(3)副腎髄質を試験管から取り出し、ハンドスライダー(NATUME社製、型番:KN-822)を使用して、厚さ約2.0mm程度に薄くスライスした後、スライスした副腎髄質をSRM(−)で満たした試験管に約5分間、浸漬した。
(4)スライスした副腎髄質を試験管から取り出し、カルシウムイオンを含有しないBSA培地(以下、単にBSA(−)という)(Sigma社製)を使用して、スライスした副腎髄質を3回洗浄した。この洗浄した副腎髄質をマイヤーフラスコ(容積300ml)に移した。この副腎髄質の細胞を分散させるために、コラーゲナーゼ処理を3回行った。このコラーゲナーゼ処理溶液は、コラーゲナーゼ(和光純薬株式会社製、型番:細胞分散用)を入れた培地(Digestion Medium)(日研生物医学研究所製、型番:EAGLE-MEM)を使用した。そして、このコラーゲナーゼ処理溶液を、洗浄した副腎髄質を入れたマイヤーフラスコに120ml入れて、水温37℃に調整したウォータバス(TAITEC社製、型番:XY-80)で60分間、振盪して攪拌した。
(5)コラーゲナーゼ処理をした溶液を200メッシュのナイロンメッシュ(セミテック社製、型番:NMG84)を使用して濾過した後、この濾過液を遠心分離機(KUBOTA社製、型番:KN-70)を用いて1000rpmで10分間、遠心分離した。この遠心分離後の上澄み液を試験管から除去した。この上澄み液を除去した後の試験管に、BSA(−)を30ml加えて、沈殿物を懸濁した後、1000rpmで10分間、遠心分離した。再度、上記の操作(遠心分離→沈殿物懸濁→遠心分離)を行った。
(6)(5)の工程後の試験管から上澄み液を除去した。試験管内に沈殿した沈殿物にDMEM培地を30ml加えて、懸濁した後、200メッシュのナイロンメッシュで濾過した。この濾過液を試験管に移して、1000rpmで10分間、遠心分離した。その後、試験管から上澄み液を除去した後の沈殿物に再度DMEM培地を30ml加えて、懸濁した後、1000rpmで10分間、遠心分離した。
(7)(6)の工程後の試験管から上澄み液を除去した後、DMEM培地を加えて、懸濁して、牛副腎髄質細胞の細胞密度が5×105/mlになるように調整した(以下、この細胞を牛単離副腎髄質細胞という)。
【0144】
(調整細胞の培養)
上述した手順により調整した牛単離副腎髄質細胞(以下、単に調整細胞という)を、上述したディッシュに播いた後、二酸化炭素濃度5%、室温37℃、湿度95%に調整したCO2インキュベータ(SANYO株式会社製、型番:MCO-5AC)内でディッシュ内の細胞が約70%コンフルエントとなるように4日間、静置培養した。
【0145】
(観察準備)
つぎに、観察対象細胞を顕微鏡を用いて観察するまでの手順について、以下詳細に説明する。
【0146】
(観察対象細胞の準備)
まず、観察対象細胞の準備について説明する。
4日間CO2インキュベータ内で調整細胞を静置培養したディッシュをクリーンベンチ内に移動して、DMEM培地を除去した。DMEM培地の除去は、アスピレータ(Markos Mefar社製、型番:SP30)に滅菌したピペットを装着して、このピペットによりDMEM培地を吸引して除去した。その後、上述したFluo−4AMを溶解したDMEM培地を1.5ml入れたディッシュを、アルミパッドに配置して、ディッシュ内の調整細胞に光が照射されないようにアルミホイルで遮光した。そして、アルミパッドを水温37℃に調整したウォータバスで30分間、軽く振盪した。この操作により、Fluo−4を導入した牛単離副腎髄質細胞を得ることができる。その後、上記と同様にディッシュからアスピレータで培地を除去した。その後、Fluo−4を導入した牛単離副腎髄質細胞をSRM(+)1mlで2回洗浄して、SRM(+)1mlをディッシュに入れた。この状態、つまりFluo−4が導入された牛単離副腎髄質細胞を観察対象細胞とした。
【0147】
(観察用装置の準備)
つぎに、観察用装置の準備について説明する。
観察用装置の準備は、以下の(1)〜(4)の手順により行った。なお、観察用装置は、事前にオートクレーブ(TOMY社製、型番:SX-700)にて滅菌処理をしたものを使用した。
(1)観察対象細胞が入ったディッシュを、保持ケース部内に取り付けた。取り付ける際には、SRM(+)がディッシュの外にこぼれないように注意した(図9(A)参照)。
(2)ディッシュを保持ケース部に取り付けた状態において、本体部を保持ケースの開口部から挿入した(図9(B)参照)。このとき、本体部の下端面に空気が溜まらないように本体部の中心軸をディッシュの底面に対してやや傾けた状態で挿入した。そして、本体部の固定用軸部と保持ケース部の側壁上端が接したときに、固定用軸部を保持ケース部の側壁上端部に形成されたスリット内を滑らせて挿入して、本体部を固定用軸部により保持ケース部内に固定した(図1、図2参照)。このとき、本体部の底面とディッシュの内底面との間に形成されたチャンバ内に観察対象細胞を確保した。
(3)保持ケース部に本体部を取り付けた状態において(図9(C)参照)、本体部とディッシュの内壁面との間に存在したSRM(+)を滅菌したピペットで吸引除去した(図3(B)参照)。
(4)かかる状態の顕微鏡用細胞収容器を、顕微鏡のステージに配置した保温部のクランプ状に形成された保持部材の上端面の開口から挿入した。そして、保持部材のボルトを回転して、顕微鏡用細胞収容器を保温部内に取り付けた(図14(B)参照)。
【0148】
(実験結果)
図16は、本発明の顕微鏡用細胞収容器を上述した倒立蛍光顕微鏡を位相差撮影モードにして撮影した位相差顕微鏡写真である。
図16に示すように、観察対象細胞である牛単離副腎髄質細胞が鮮明に観察できることを確認した。しかも、図16の位相差顕微鏡写真に示すように、観察視野内には、気泡は観察されなかった。
したがって、本発明の顕微鏡用細胞収容器を顕微鏡を使用して観察すれば、培養細胞を気泡がない状態で鮮明に観察できることが確認された。
【0149】
つぎに、蛍光を用いた細胞の機能観察の結果について説明する。
まず、倒立蛍光顕微鏡で観察対象細胞の透過光観察を行って、観察対象細胞が詳細に観察できることを確認した。その後、倒立蛍光顕微鏡の撮影モードを蛍光撮影モードに切り替えて、カルシウム蛍光プローブとして細胞内に導入したFluo−4が確実に細胞内に導入されていることを確認した。
つぎに、刺激剤を入れたビーカ内に一方の培地供給チューブの端部をいれて、他方の培地排出チューブを通してチャンバ内のSRM(+)を吸引して、チャンバ内のSRM(+)を刺激剤(アセチルコリンを溶解したSRM(+))に置換した。チャンバ内のSRM(+)を刺激剤に置換した状態における蛍光光度を倒立蛍光顕微鏡を用いて測定した。また併せて蛍光顕微鏡写真を撮影した。
【0150】
図17および図18に結果を示す。
図17は、チャンバ内のSRM(+)を刺激剤に置換したときの相対蛍光強度と、経過時間との関係を示したグラフであり、観察対象細胞とした牛単離副腎髄質細胞内の遊離カルシウムイオン濃度変化を示したものである。なお、上述と同様に、チャンバ内を対照刺激剤に置換したときの、相対蛍光強度と、経過時間との関係を図17に併せて示した。
また、図18は、チャンバ内を刺激剤に置換する前の蛍光顕微鏡写真と、チャンバ内を刺激剤に置換した後の蛍光顕微鏡写真である。
図17に示すように、チャンバ内を刺激剤に置換してから、蛍光強度が大きく変化していることが確認された。一方、チャンバ内を対照刺激剤に置換した場合、蛍光強度が変化しないことが確認された。
また、図18に示すように、チャンバ内を刺激剤に置換する前と後で、細胞内に取り込まれた遊離カルシウムイオン濃度が大きく変化していることを蛍光顕微鏡写真として確認できた。
【0151】
したがって、本発明の顕微鏡用細胞収容器を用いれば、従来と同様に生きた細胞の機能を観察するための一般的な試験の一種である細胞内遊離カルシウム濃度測定に使用されるカルシウム蛍光指示薬を導入された細胞に対して励起光を照射した場合における蛍光を蛍光顕微鏡により測定し観察することができたことを確認した。つまり、本発明の顕微鏡用細胞収容器を用いれば、観察対象細胞の機能観察ができることを確認した。しかも、刺激剤と対照刺激剤との違いを確実に測定できたことも確認できた。
【0152】
(III)圧迫培養条件下における培養細胞の動態観察が可能か否かの実験
顕微鏡を用いて観察対象細胞を観察する手順を説明する前に、まず、細胞の調整および培養について、以下、詳細に説明する。
【0153】
(HUVEC細胞の調整)
試験官に基本培地を加えて、HUVEC細胞を懸濁して、HUVEC細胞が1×105/mlになるように調整した。
【0154】
(調整HUVEC細胞の培養)
HUVEC細胞の細胞密度が1×105/mlになるように調整したHUVEC細胞(以下、調整HUVEC細胞という)を上述したディッシュに播いた後、二酸化炭素濃度5%、室温37℃、湿度95%に調整したCO2インキュベータ内でディッシュ内の細胞が約70%コンフルエントとなるように3日間、静置培養した。
【0155】
(観察準備)
つぎに、観察対象細胞を顕微鏡を用いて観察するまでの手順について、以下詳細に説明する。
【0156】
(観察対象細胞の準備)
まず、観察対象細胞の準備について説明する。
3日間CO2インキュベータ内で調整HUVEC細胞を静置培養したディッシュをクリーンベンチ内に移動して、基本培地を除去した。基本培地の除去は、アスピレータに滅菌したピペットを装着して、このピペットにより基本培地を吸引して除去した。そして、PBS緩衝溶液を、培養したHUVEC細胞(以下、単に培養HUVEC細胞という)が浸漬するまでディッシュに入れた。
【0157】
(圧迫培養細胞の調製)
まず、このPBS緩衝溶液で置換した培養HUVEC細胞が入ったディッシュを以下の(1)〜(5)の手順で圧迫培養装置に装着した。ついで、以下の(6)の操作により圧迫培養細胞を調製した。なお、圧迫培養装置は、事前にオートクレーブにて滅菌処理をしたものを使用した。
(1)培養HUVEC細胞が入ったディッシュを、保持ケース部内に取り付けた。取り付ける際には、PBS緩衝溶液がディッシュの外にこぼれないように注意した(図9(A)参照)。
(2)ディッシュを保持ケース部に取り付けた状態において、本体部を保持ケースの開口部から挿入した(図9(B)参照)。このとき、本体部の下端面に空気が溜まらないように本体部の中心軸をディッシュの底面に対してやや傾けた状態で挿入した。そして、本体部の固定用軸部と保持ケース部の側壁上端が接したときに、固定用軸部を保持ケース部の側壁上端部に形成されたスリット内を滑らせて挿入して、本体部を固定用軸部により保持ケース部内に固定した(図1、図2参照)。このとき、本体部の底面とディッシュの内底面との間に形成されたチャンバ内に培養HUVEC細胞を確保した。
(3)保持ケース部に本体部を取り付けた状態において(図9(C)参照)、本体部とディッシュの内壁面との間に存在したPBS緩衝溶液を滅菌したピペットで吸引除去した(図3(B)参照)。
(4)かかる状態の顕微鏡用細胞収容器を、顕微鏡のステージに配置した保温部のクランプ状に形成された保持部材の上端面の開口から挿入した。そして、保持部材のボルトを回転して、顕微鏡用細胞収容器を保温部内に取り付けた(図14(B)参照)。
(5)そして、顕微鏡用細胞収容器の挿入部材の本体部の上部に設けられた一の連通通路の端部にPBS緩衝溶液供給チューブを、他の連通通路の端部にPBS緩衝溶液排出チューブを連結した(図10参照)。なお、PBS緩衝溶液供給チューブの上流側には、上述したペリスタポンプ等を連結・配設した。
(6)つぎに、PBS緩衝溶液供給チューブの上流側に連結したペリスタポンプを作動させて、加圧計が所定の圧力(0.02MPa(150mmHg))になるようにPBS緩衝溶液の流量を調整した。そして、PBS緩衝溶液の流量が所定の圧力になった状態を30分間維持した。30分後のディッシュ内における圧迫条件下で培養された培養HUVEC細胞を以下、圧迫培養細胞という。
【0158】
(細胞骨格染色)
上記のごとく調製した圧迫培養細胞が入ったディッシュを圧迫培養装置から取り外し、以下の(1)〜(7)の手順で細胞骨格を染色した。なお、併せてDNAも染色した。
(1)(細胞固定)ディッシュからPBS緩衝溶液を除去したのち、固定試薬を圧迫培養細胞が浸漬するまでディッシュ内に入れ、室温で20分間静置した。かかる試薬によって、圧迫培養細胞が加圧された状態つまり細胞が加圧されたときの形態を維持するように細胞を固定することができる。
(2)(洗浄)室温に静置してから20分間が経過したのち、固定試薬をディッシュから除去した。このディッシュにPBS緩衝溶液を入れて5分間静置した。5分後PBS緩衝溶液をディッシュから除去したのち、再度PBS緩衝溶液を入れて5分間静置した。このPBS緩衝溶液による洗浄操作を3回繰り返した。
(3)(ブロッキング)洗浄に使用したPBS緩衝溶液をディッシュから除去したのち、ブロッキング試薬をディッシュ内に圧迫培養細胞を浸漬するまで入れて室温で1時間静置した。かかる試薬によって、ファロイジンが非特異的に細胞に結合するのを防止することができる。
(4)(洗浄)室温に静置してから1時間が経過したのち、ブロッキング試薬をディッシュから除去した。その後、上述した(2)と同様にPBS緩衝溶液を用いて洗浄操作を行った。
(5)(DNA染色)洗浄に使用したPBS緩衝溶液をディッシュから除去したのち、DNA染色試薬をディッシュ内に圧迫培養細胞を浸漬するまで入れて室温で1時間静置した。かかる試薬によって、F−アクチンの他に細胞内のDNAを染色することができる。
(6)(洗浄)室温に静置してから1時間が経過したのち、DNA染色試薬をディッシュから除去した。その後、上述した(2)と同様にPBS緩衝溶液を用いて洗浄操作を行った。
(7)(封入)洗浄に使用したPBS緩衝溶液をディッシュから除去したのち、封入溶液をディッシュ内の圧迫培養細胞に滴下して室温で約30分間静置した。かかる試薬によって、蛍光色素が拡散するのを防止することができる。
上記のごとき状態とした圧迫培養細胞を観察対象細胞とした。
【0159】
(観察用装置の準備)
つぎに、観察用装置の準備について説明する。
観察用装置の準備は、上述した圧迫培養装置の準備の(1)〜(4)の手順と同様に行った。
なお、観察用装置は、事前にオートクレーブにて滅菌処理をしたものを使用した。また、観察用装置の準備においては、PBS緩衝溶液に換わって封入溶液がディッシュの外にこぼれないように注意した。
【0160】
(実験結果)
まず、倒立蛍光顕微鏡で観察対象細胞の透過光観察を行って、観察対象細胞が詳細に観察できることを確認した。つぎに、倒立蛍光顕微鏡の撮影モードを蛍光撮影モードに切り替えて、F−アクチンが蛍光染色されていることを確認したのち、蛍光顕微鏡写真を撮影した。
【0161】
図21に結果を示す。
図21の(A)は、機械的加圧を30分間行った状態の圧迫培養細胞を固定し、固定化した圧迫培養細胞のF−アクチンを蛍光染色したものを蛍光顕微鏡写真で撮影したものである。図21(B)は、機械的加圧を行わない場合の対象細胞を上述と同様に固定化した圧迫培養細胞のF−アクチンを蛍光染色したものを蛍光顕微鏡写真で撮影したものである。
図21(A)に示すように、機械的加圧後の細胞骨格を構成するF−アクチンは、対照細胞に比べて繊維が太くなりかつ本数も増加していることが確認された。
【0162】
したがって、本発明の顕微鏡用細胞収容器を用いれば、圧迫培養条件下における培養細胞の動態を確実に観察することができたことを確認した。
一方、ヒトの高血圧とは、外来随時血圧を日を変えて数回測定し、おおむね最小血圧が90mmHg以上、あるいは最大血圧が140mmHg以上の場合とされている。とくに、高血圧のうち、軽症の高血圧(I度高血圧)は、おおむね最小血圧140mmHgから最大血圧160mmHg以下の場合とされている。すると、上述したように本実験では、機械的加圧つまり物理的圧迫下において、その圧力を150mmHgとした場合の圧迫培養条件下における培養細胞の動態を確実に観察できたのであるから、血管内皮細胞の圧迫病変における細胞傷害のメカニズムを本発明の顕微鏡用細胞収容器を用いることによって解明することが可能であることが示唆された。
【産業上の利用可能性】
【0163】
本発明の顕微鏡用細胞収容器は、医学、薬学、生物学などの分野において、培養した動物細胞などの培養細胞を簡便かつ鮮明に顕微鏡を用いて観察することができる器具として適している。
【符号の説明】
【0164】
10 顕微鏡用細胞収容器
11 収容ケース
11h 収容ケース11の中空な空間部
11y スリット
15 挿入部材
16 本体部
16a 連通通路
16b 連通通路
17 シール部材
18 固定用軸部
【特許請求の範囲】
【請求項1】
顕微鏡を用いて細胞観察に使用される細胞収容器であって、
上端に開口部を有する中空な空間部を備えた収容ケースと、
該収容ケースの開口部から前記中空な空間部に挿入される挿入部材と、を備えており、
前記挿入部材の下端部には、
該下端部が前記収容ケース内の中空な空間部の内底部に接した状態において、該下端部と該内底部の両者間にチャンバを形成し得るチャンバ形成部が設けられている
ことを特徴とする顕微鏡用細胞収容器。
【請求項2】
前記挿入部材は、
該挿入部材を前記中空な空間部に挿入した状態において、該挿入部材と該収容ケースとを連結して固定する固定手段を備えており、
前記チャンバ形成部は、
前記固定手段により両者が固定されたときに、前記チャンバの内部と外部とを液密に隔離するシール部材を備えている
ことを特徴とする請求項1記載の顕微鏡用細胞収容器。
【請求項3】
前記挿入部材には、
その内部に、前記チャンバ内部と外部とを連通する一対の連通通路が設けられており、
該一対の連通通路は、
前記チャンバの内面と前記挿入部材の上端部側面とをつなぐように形成されている
ことを特徴とする請求項2記載の顕微鏡用細胞収容器。
【請求項4】
前記収容ケースは、
着脱可能な細胞培養部と、
該細胞培養部を取り付けた状態で保持する保持ケース部と、から形成されており、
前記保持ケース部は、
その底部に、前記細胞培養部を保持した状態において、前記挿入部材を取り付けたときに、前記チャンバの底面を下方から観察し得る観察開口部が形成されており、
該観察開口部は、
その外縁部と前記チャンバ形成部との間に支持部を備えており、
該支持部は、
前記挿入部を取り付けた状態において、前記シール部材との間に前記細胞培養部の内底面を挟んで支持するように形成されている
ことを特徴とする請求項2または3記載の顕微鏡用細胞収容器。
【請求項1】
顕微鏡を用いて細胞観察に使用される細胞収容器であって、
上端に開口部を有する中空な空間部を備えた収容ケースと、
該収容ケースの開口部から前記中空な空間部に挿入される挿入部材と、を備えており、
前記挿入部材の下端部には、
該下端部が前記収容ケース内の中空な空間部の内底部に接した状態において、該下端部と該内底部の両者間にチャンバを形成し得るチャンバ形成部が設けられている
ことを特徴とする顕微鏡用細胞収容器。
【請求項2】
前記挿入部材は、
該挿入部材を前記中空な空間部に挿入した状態において、該挿入部材と該収容ケースとを連結して固定する固定手段を備えており、
前記チャンバ形成部は、
前記固定手段により両者が固定されたときに、前記チャンバの内部と外部とを液密に隔離するシール部材を備えている
ことを特徴とする請求項1記載の顕微鏡用細胞収容器。
【請求項3】
前記挿入部材には、
その内部に、前記チャンバ内部と外部とを連通する一対の連通通路が設けられており、
該一対の連通通路は、
前記チャンバの内面と前記挿入部材の上端部側面とをつなぐように形成されている
ことを特徴とする請求項2記載の顕微鏡用細胞収容器。
【請求項4】
前記収容ケースは、
着脱可能な細胞培養部と、
該細胞培養部を取り付けた状態で保持する保持ケース部と、から形成されており、
前記保持ケース部は、
その底部に、前記細胞培養部を保持した状態において、前記挿入部材を取り付けたときに、前記チャンバの底面を下方から観察し得る観察開口部が形成されており、
該観察開口部は、
その外縁部と前記チャンバ形成部との間に支持部を備えており、
該支持部は、
前記挿入部を取り付けた状態において、前記シール部材との間に前記細胞培養部の内底面を挟んで支持するように形成されている
ことを特徴とする請求項2または3記載の顕微鏡用細胞収容器。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図19】


【図20】


【図16】


【図17】


【図18】


【図21】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図19】


【図20】


【図16】


【図17】


【図18】


【図21】


【公開番号】特開2013−27384(P2013−27384A)
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願番号】特願2012−12108(P2012−12108)
【出願日】平成24年1月24日(2012.1.24)
【出願人】(304020292)国立大学法人徳島大学 (307)
【出願人】(302015926)ネッパジーン株式会社 (5)
【Fターム(参考)】
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願日】平成24年1月24日(2012.1.24)
【出願人】(304020292)国立大学法人徳島大学 (307)
【出願人】(302015926)ネッパジーン株式会社 (5)
【Fターム(参考)】
[ Back to top ]

