食事介入による胃腸の健康、免疫および働きの改善
本発明は、グルカンおよび/またはフカンを含む組成物を使って直接食事介入することによる胃腸の健康、免疫および発育成績の改善に関し、特に、母親の食事のグルカンおよび/またはフカン補充を介した関連する健康上の利益の出生児への移行に関する。従って、本発明は、母動物に投与することにより母動物の子孫の胃腸の健康または機能の改善または維持に使用するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物、および母動物の子孫の胃腸の健康または機能の改善または維持のための方法で、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物を母動物に投与することを含む方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は、ラミナリンおよび/またはアルファフカンを使った直接的食事介入による胃腸の健康、免疫および働きの改善、ならびに母親の食事に対するラミナリンおよび/またはアルファフカン補充を介した関連する健康上の利益の出生児への移行に関する。
【0002】
特に、本発明は、母親の食事へのラミナリンおよび/またはアルファフカンの補充により授乳期および離乳期出生児の栄養学的、免疫学的および微生物学的状態を改善することを目的とする。別の態様では、本発明は、ラミナリンおよび/またはアルファフカン含有調理品または飼料を利用して、ブタ、家禽、ヒツジ、ウマ、ウサギ、魚、ネコ、イヌ、ヒトおよび他の単胃の対象における免疫状態および免疫応答を改善することに関する。他の態様は、このような化合物を使用して、母親の食事のラミナリンおよび/またはアルファフカンによる補充後に、有益な化合物の子宮内、または初乳および授乳中の母乳経由での母親からの移行を介して、離乳家畜の体重増および飼料要求率増加で示される家畜の発育成績を上げることに関する。
【0003】
別の態様では、本発明は、微生物集団を全体的に減らすこと、または選択的に有益な細菌を助長することにより新生児の腸の無菌条件を操作し、胃腸系内の病原体の成長を抑制することに関する。別の態様は、炭水化物基質からの発酵を増やし、タンパク質基質からの発酵を減少させることによる、腸内の直鎖揮発性脂肪酸の産生増加および分岐鎖揮発性脂肪酸の産生減少に関する。さらに別の態様は、腸管中の選択的刺激性ビフィズス菌による、共役リノール酸やオメガ3脂肪酸を含む長鎖多価不飽和脂肪酸の合成に関する。
【0004】
別の態様では、本発明は、ムチンおよび/またはトレフォイルファクター(TFF)の生体内産生の上方制御、およびそれによる侵襲、感染または傷害に対する胃腸粘膜の保護と安定性の強化に関する。
【背景技術】
【0005】
発明の背景
小児科医および獣医師は、身体、認知および神経の成長を達成するためには、妊娠中に最適栄養摂取を行うことが重要であることをよく知っている。いくつかの試験により、栄養素および他の化合物の欠乏または毒性に関連した胎児の成長の効果、およびその後の生物季節学的特徴が証明された。これにより、重大な段階および分娩後の健全な成長速度の間の最適成長を得るために、出生前および周産期の食事介入の重要性が強調された。
【0006】
確認コピー
これらの問題に対処するため、スワンレポート(1969)の出版により、抗生物質耐性に関連した、特に公衆衛生に対する脅威をもたらすリスクのために、動物の飼料における抗生物質使用法に関しより厳密な管理が推進された。これが2006年1月の動物の飼料の成長促進抗生物質に関するEU禁止に結びついた。これらの成長促進剤の禁止により、集約型農業生産者向け市場に空白を生じ、また、天然の安全な代替物の調達の機会がもたらされた。ブタ、家禽、ウマ、ヒツジ、ウサギ、魚、ヒトおよび他の単胃型の対象の妊娠授乳用食事へのラミナリンおよび/またはアルファフカンの含有により、出産時および出産直後の重要な免疫学的および微生物学的状態に大きな効果が得られ、従って、その後の健康、成長および成長速度に関し大きな効果が得られると思われる。
【0007】
ラミナリンと呼ばれる藻類ベータグルカンは、(1→6)結合分岐部を有する場合もある、ベータ(1→3)−Dグルコシルサブユニットから成る。ラミナリアディギタータ由来のラミナリンは、2つの同族列の分子、すなわち、少数の22〜28グリコシル残基を含むGシリーズ、およびより多くのマンニトール残基に結合した20〜30グリコシル残基から成るMシリーズ、として存在する。ラミナリアの多くの種(ラミナリアヒペルボレアを含む)由来のラミナリンは相対的に不溶性であり、主にベータ(1→3)鎖から成る。一方、ラミナリアディギタータ由来のラミナリンは可溶で、分岐部に結合したベータ(1→6)から成り、量的には少ないが有意水準量は存在する(Read et al、1996)。
【0008】
酵母ベータグルカンは、少量のベータ(1→6)鎖を有するベータ(1→3)結合により結合された長い直鎖の1300〜1500グルコース残基のある状態で発見されている。ラミナリンより遙かに短い鎖長(平均=24残基)を有する(種によってはベータ(1→6)分岐部を含む場合もある)。ラミナリアディギタータは、ベータ(1→6)分岐を有し、このためこれ由来のグルカンが水溶性になっている。他のラミナリア種、例えば、ラミナリアヒペルボレア、はこの分岐を持たず、直鎖凝集体を形成し、このため、これ由来のグルカンが不溶性になっている。
【0009】
基本的に硫酸化アルファ−L−フコース残基から構成される天然の多糖類は、フコイダン(またはアルファフカン)として知られている。これらは、褐藻類、一部の棘皮動物中に存在し、ワカメ、例えば、アスコフィラムノドサム(Ascophyllum nodosum)およびラミナリア種、中で2番目に多い多糖である。強力な抗凝固、抗腫瘍、および抗ウイルス試薬であるため、アルファフカンは、多様な生物活性に関して広範に研究されてきた。
【0010】
本発明は、アルファフカン、特に、海産植物、例えば、ナマコの体壁中に存在するフカン;特に、海洋性藻類の細胞壁中およびウニ卵子の卵ゼリーコート中に存在するアルファフカンの使用を包含する。理想的には、本発明は、大型藻類中に存在するフコイダン(アルファフカン)を使用する。
【0011】
発明の目的
母親による移行機構を介して、重要な成長段階での有益な化合物の早期送達を確実にすることにより、家畜、例えば、ブタ、家禽、ウマならびにウサギ、魚、ネコ、イヌ、およびヒトの新生児の生物学的、免疫学的および発育成績に関連する特質を制御する新規方法を提供することが本発明の1つの目的である。別の目的は、出生前の子宮内交換または出生後の初乳または母乳を介した移行による送達のための母親の食事の中のラミナリンおよび/またはアルファフカン含有調理品による食事介入を提供することである。別の目的は、家畜、例えば、ブタ、家禽、ウマ、ならびにウサギ、ネコ、イヌ、魚およびヒトの生物学的、免疫学的および発育成績関連特性を制御するためのラミナリンおよび/またはアルファフカン含有調理品用の投与計画を提供することである。
【0012】
プロリンおよび抗炎症性のサイトカイン、白血球集団の発現、ならびに免疫グロブリン、ムチンおよびトレフォイルファクターの発現を変えることにより、その組成物が免疫応答に有益な影響を与えるようにすることが、さらなる本発明の目的である。
【0013】
本発明のさらなる目的には、優先的に炭水化物を発酵基質として代謝するものに有利なように微生物学的プロファイルを変えることにより、揮発性直鎖脂肪酸の産生を増加させ、分岐鎖脂肪酸(例えば、吉草酸、イソ吉草酸およびイソ酪酸)の産生を減らすことが含まれる。
【発明の概要】
【0014】
本発明の第1の態様では、母動物への投与により母動物の子孫の胃腸の健康または機能の改善と維持に使用するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンと少なくともひとつのフカンを含む組成物が提供される。
【0015】
本発明の第2の態様では、母動物の子孫の胃腸の健康または機能の改善と維持の方法を提供し、この方法は、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンと少なくともひとつのフカンを含む組成物を母動物に投与することを含む。
【0016】
組成物は、少なくとも1つのグルカンを含んでもよい。組成物が2つ以上のグルカンを含む場合は、各グルカンは、同じであっても異なっていてもよい。任意選択、または追加として、組成物は、少なくとも1つのフカンを含んでもよい。組成物が2つ以上のフカンを含む場合は、各フカンは、同じであっても、異なっていてもよい。任意選択で、組成物は、少なくとも1つのグルカン、少なくとも1つのフカン、またはそれらの混合物または組み合わせを含んでもよい。
【0017】
任意選択として、組成物は、周産期に、出生前に、および/または出生後に母動物に投与してもよい。「出生前」は、全体妊娠期間の初期(受精)から50%までの期間を意味する。子孫の胃腸の健康または機能の出生前の改善もしくは維持は、出生前の投与の間に生じる可能性がある。「周産期」は、全体妊娠期間の50%から出産の時間までの期間を意味する。子孫の胃腸の健康または機能の周産期の改善または維持は、周産期の投与の間に起こる可能性がある。「出生後」は、出産以降の期間を意味し、離乳期(子孫による母親の初乳または母乳の摂食終了後の期間)まで及ぶことが意図されている。子孫の胃腸の健康または機能の出生後の改善または維持は、出生後の投与の間に起こる可能性がある。
【0018】
「子孫」は、母動物の出生児を意味し、出生前の期間に子宮内で成長している出生児、および出生後の期間に体外で成長している出生児を含むことが意図されている。
【0019】
「グルカン」は、少なくとも2つの糖類モノマーを含み、任意選択としてD−グルコースモノマーを含んでもよい多糖分子を意味し、各モノマーは隣接するモノマーとグリコシド結合により結合している。多糖分子は、直鎖であっても分岐であってもよく、すなわち、多糖分子は直鎖多糖であっても分岐鎖多糖であってもよい。任意選択で、グルカンは、分岐鎖グルカンでもよい。グルカンは、アルファグルカンであっても、ベータグルカンであってもよい。任意選択で、グルカンは、ベータグルカンでもよい。「ベータグルカン」は、少なくとも1つのベータグリコシド結合を含むグルカンを意味する。グリコシド結合は、第1のモノマーの炭素原子が、任意選択で一重結合により、隣接するモノマーの炭素原子と結合を形成するグリコシド結合を意味することが意図されている。ベータグリコシド結合は、第1のモノマーの炭素原子に結合した官能基、任意選択でヒドロキシル基、がモノマーの面より上(赤道面上)に伸びているグリコシド結合を意味することが意図されている。任意選択で、第1のモノマーのC1炭素原子が隣接モノマーのC6炭素原子と、任意選択で一重結合により、結合を形成する。さらなる任意選択で、グルカンは、ベータ(1→6)グリコシド結合、任意選択で、酸素含有ベータ(1→6)グリコシド結合、を含む。任意選択で、少なくとも1つのグルカンは、ベータ(1→3、1→6)グルカンである。またさらなる任意選択で、グルカンは、ラミナリンである。
【0020】
「フカン」は、多糖、少なくとも2つのフコース糖類モノマーを含む多糖、任意選択で硫酸化多糖、を意味し、各モノマーは、グリコシド結合により隣接モノマーと結合している。多糖分子は、直鎖であっても、分岐であってもよい。任意選択で、フカンは分岐フカンである。フカンは、アルファフカンであっても、ベータフカンであってもよい。任意選択で、フカンはアルファフカンである。「アルファフカン」は、少なくとも1つのアルファグリコシド結合を含むフカンを意味する。グリコシド結合は、第1のモノマーの炭素原子が、任意選択で一重結合により、隣接するモノマーの炭素原子と結合を形成するグリコシド結合を意味することが意図されている。アルファグリコシド結合は、第1のモノマーの炭素原子に結合した官能基、任意選択でヒドロキシル基、がモノマーの面より下(軸方向)に伸びているグリコシド結合を意味することが意図されている。任意選択で、第1のモノマーのC1炭素原子が隣接するモノマーのC3またはC4炭素原子と結合、任意選択で一重結合、を形成する。
【0021】
任意選択で、フカンはフコイダンである。
【0022】
任意選択で、グルカンおよび/またはフカンは、褐藻類、任意選択で、ワカメから単離される。任意選択で、褐藻類は大型褐藻類である。任意選択で、大型褐藻類、任意選択で、ワカメ、は褐藻類から選択され、任意選択で、褐藻類コンブ目および褐藻類ヒバマタ目から選択される。さらなる任意選択で、褐藻類、任意選択で、ワカメ、はコンブ科、ヒバマタ科、およびカジメ科から選択される。任意選択で、大型褐藻類、任意選択で、ワカメ、はアスコフィルム種、任意選択で、アスコフィラムノドサムおよびラミナリア種、任意選択で、ラミナリアディギタータ、ラミナリアヒペルボレア、カラフトコンブ、マコンブまたはホンダワラ種から選択される。
【0023】
あるいは、グルカンおよび/またはフカンは、紅藻類(red alga)、任意選択で、紅藻(red seaweed)から単離される。任意選択で、紅藻類は大型藻類である。任意選択で、大型紅藻類、任意選択で、紅藻、は真正紅藻綱から選択され、任意選択で、真正紅藻綱スギノリ目から選択され、任意選択で、スギノリ科から選択される。
【0024】
任意選択で、組成物を母動物に毎日投与する。
【0025】
任意選択で、1kgの体重当たり約3〜50ミリグラムのグルカンの投与に相当する組成物の量を、任意選択で毎日、母動物に投与する。さらなる任意選択で、1kgの体重当たり約2〜40ミリグラムのフカンの投与に相当する組成物の量を、任意選択で毎日、母動物に投与する。任意選択で、1kgの体重当たり約3〜50ミリグラムのグルカンの投与に相当する組成物の量を、任意選択で毎日、動物に投与する。さらなる任意選択で、1kgの体重当たり約2〜40ミリグラムのフカンの投与に相当する組成物の量を、任意選択で毎日、動物に投与する。任意選択で、動物は単胃の動物である。さらなる任意選択では、動物は、ブタ、家禽、ウマ、ヒツジ、ウサギ、魚、ネコ、イヌ、およびヒトである。
【0026】
「胃腸の健康または機能の改善と維持」は、生理的な機能または胃腸管の組織像改善および/または胃腸管の微生物学的集団の改善を意味する。さらに、宿主の免疫学的状態を改善することにより分子レベルで胃腸の改善または維持が可能である。胃腸の健康または機能の改善または維持は、不十分な胃腸の健康または機能に関連した障害、例えば、クローン病、過敏性腸症候群、および他の同類の慢性状態を防ぐこと、または予防的に治療することが意図されている。不十分な胃腸の健康に関係した他の障害は、重篤さは少なく、下痢症を生ずることが多い食品媒介病原菌およびある種の細菌やウイルス、悪い糞便の質、低出産体重または体重増加、または不十分な胃腸の健康による他の症状、を含みうる。
【0027】
任意選択で、胃腸の健康または機能は、母動物の初乳または母乳中の免疫グロブリンの濃度、任意選択で、免疫グロブリンGの濃度、を増やすことにより改善または維持される。
【0028】
任意選択で、胃腸の健康または機能は、母動物の初乳または母乳中の粗タンパク質濃度を増やすことにより改善または維持される。
【0029】
任意選択で、胃腸の健康または機能は、子孫の細菌性、任意選択で病原菌性、感染を減らすことにより改善または維持される。さらなる任意選択で、細菌性、任意選択で病原菌性、感染は腸内細菌感染であり、任意選択でサルモネラおよび大腸菌から選択される。
【0030】
任意選択で、胃腸の健康または機能は、サイトカインの発現を増やすことにより改善または維持される。サイトカインは、任意選択で、腫瘍壊死因子アルファ、インターロイキン−1アルファ、インターロイキン−6、およびトレフォイルファクター3から選択される。
【0031】
任意選択で、胃腸の健康または機能は、揮発性分岐鎖脂肪酸の濃度を減らすことにより改善または維持される。分岐鎖脂肪酸は、任意選択で、イソ酪酸、吉草酸、およびイソ吉草酸から選択される。
【0032】
任意選択で、胃腸の健康または機能は、貪食細胞、任意選択で白血球、好中球、好酸球、単球、またはリンパ球、さらなる任意選択で、白血球、好酸球またはリンパ球、の濃度または活性を変えることにより改善または維持される。さらなる任意選択で、白血球の濃度または活性を上げ、および/またはリンパ球の濃度または活性を下げ、および/または好酸球の濃度または活性を減らす。
【0033】
本発明のさらなる態様では、1キログラムの体重あたり約3〜50ミリグラムのグルカンの投与に相当する組成物の量を、任意選択で毎日、動物に投与すること;または1キログラムの体重あたり約2〜40ミリグラムのフカンの投与に相当する組成物の量を、任意選択で毎日、動物に投与することにより、動物の胃腸の健康または機能を改善または維持するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンと少なくとも1つのフカンを含む組成物が提供される。
【0034】
またさらなる本発明の態様では、動物の胃腸の健康または機能の改善または維持する方法を提供し、この方法は、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンと少なくとも1つのフカンを含む組成物を、1キログラムの体重あたり約3〜50ミリグラムのグルカンの投与に相当する量で、任意選択で毎日、動物に投与すること;または1キログラムの体重あたり約2〜40ミリグラムのフカンの投与に相当する該組成物の量を、任意選択で毎日、動物に投与することを含む。
【0035】
任意選択で、組成物がさらに糖、任意選択で、二糖を含み、任意選択でラクトース、ショ糖、ラクツロース、およびマルトースから選択される。さらなる任意選択で、組成物は、さらに糖、任意選択で、二糖を含み、任意選択でラクトース、ショ糖、ラクツロース、およびマルトースから選択される。
【0036】
任意選択で、胃腸の健康または機能が細菌感染、任意選択で、大腸菌感染を減らすことにより改善または維持される。任意選択で、胃腸の健康または機能が改善または維持され、下痢症が防がれ、または予防的に治療される。
【0037】
任意選択で、胃腸の健康または機能は、任意選択で抗原の存在下、サイトカインの発現を増加させることにより改善または維持される。さらなる任意選択で、抗原は、細菌性抗原、任意選択で、細菌性リポ多糖類である。任意選択で、サイトカインはインターロイキン−6およびインターロイキン−8から選択される。
【0038】
任意選択で、胃腸の健康または機能は、ムチン、任意選択で、ムチン−2および/またはムチン−4、の発現を増加させることにより改善または維持される。
【0039】
任意選択で、胃腸の健康または機能は、サーコウイルスまたはパルボウイルス、任意選択で、ブタサーコウイルスまたはブタパルボウイルスの濃度を減らすことにより改善または維持される。さらなる任意選択で、ブタサーコウイルスは2型ブタサーコウイルスである。
【0040】
任意選択で、胃腸の健康または機能は、直鎖揮発性脂肪酸の濃度を増やすことにより改善または維持される。
【0041】
本発明者等は、(I)腸の組織像、(II)腸の微生物学、(III)プロリン−および抗−炎症性サイトカインの発現、(III)新生児血清免疫グロブリンレベル、(IV)ムチン産生、(V)トレフォイルファクター産生、(VI)初乳および母乳の栄養学的および免疫学的組成および(VII)性能指数、に与える効果を変えるラミナリンおよび/またはアルファフカン製剤を含む組成物を開発した。さらに、感染と炎症の減少に由来する罹患率と死亡率の減少という利益に関連する腸内細菌集団に対する明らかに有害な作用が認められた。
【0042】
従って、本発明は、出生前および出生後の母親の食事の補充によって、新生児および離乳児の胃腸の健康および免疫を改善する方法においてベータグルカンおよび/またはアルファフカンを含む組成物の使用を提供する。好ましい実施形態では、ベータグルカンおよびアルファフカンは、海藻および一部の棘皮動物を含む2つ以上のソース由来であってもよい。海藻は、コンブ科、ヒバマタ科、スギノリ科またはカジメ科からなる群由来であってもよい。
【0043】
本発明はまた、下記の方法において、ベータグルカンおよび/またはアルファフカンを含む組成物の使用を提供する:
−新生児および離乳児の胃腸の細菌性集団を減らすために、母親の栄養学的補助食品または飼料を作成する方法において;
−新生児および離乳児の罹患率および死亡率を減らすために、母親の栄養学的補助食品または飼料を作成する方法において;
−新生児および離乳児の絨毛高を増やす、陰窩深を減らす、または全体絨毛高/陰窩深比率を増やすことにより消化組織像を改善するために、母親の栄養学的補助食品または飼料を作成する方法において;
−平均1日増体量の増加、平均1日飼料摂取量の増加、および増体/飼料比の改善を含む、家畜、例えば、ブタ、家禽、ウマ、ならびにウサギ、魚、ネコ、イヌおよびヒト、等の家畜の子孫の発育成績を改善するために、母親の栄養学的補助食品または飼料を作成する方法において;
−母親の食事を補助して、有益なミクロフローラを助長し、病原性ミクロフローラを減らし、また、新生児および離乳児の能力を改善することにより胃腸の健康を改善する方法において;
−胃腸の上皮の物理的保護を強化する手段として、上皮細胞によるムチンおよびトレフォイルファクターの産生を上方制御する方法において;
【0044】
さらなる態様では、本発明は、ベータグルカンおよび/またはアルファフカンを含む組成物をヒト、非ヒト動物または家禽に摂食させることにより上記の効果を達成する方法を提供する。
【0045】
またさらなる態様では、本発明は、下記を提供する:
−直接に食事を、または出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、家畜、例えば、ブタ、家禽、ウマ、ヒツジならびにウサギ、魚、ネコ、イヌおよびヒト、の細菌性またはウイルス感染および炎症を防止するための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、栄養学的質を改善し初乳および母乳の免疫グロブリンレベルを増やすための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補って、有益な免疫賦活性化合物を胎盤膜を通って子宮内移行することにより新生児の血清免疫グロブリンレベルを増やすための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、初乳または母乳の摂取増加により新生児血清免疫グロブリンレベルを増やすための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、新生児ブタ、家禽、ウマ、ならびにウサギ、魚、ネコ、イヌ、ヒトおよび他の単胃の対象の胃腸中の大腸菌を含む腸内細菌集団を減らすための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、離乳関連軽減機能性胃腸障害のための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補って、出生直後の腸の細菌性コロニー形成の期間に、支配的比率の有益な細菌の選択的助長および病原菌の成長の選択的抑制をすることにより新生児および離乳児の健全な腸微生物学的プロファイルを促進するための投与計画;
【0046】
ラミナリンの投与計画は、1キログラム体重あたり、3ミリグラム超/日〜最大50ミリグラム/日のラミナリンの毎日の投与量であってもよい。
【0047】
アルファフカンの投与計画は、1キログラム体重あたり、2ミリグラム超/日〜最大40ミリグラム/日の毎日の投与量であってもよい。
【0048】
ラミナリンとアルファフカンの組み合わせの投与計画は、1キログラム体重あたり、3ミリグラム超/日〜最大50ミリグラム/日のラミナリンの毎日の投与量を、1キログラム体重あたり、2ミリグラム超/日〜最大50ミリグラム/日のアルファフカンの毎日の投与量と組み合わせて投与してもよい。
【0049】
また、本発明は、ベータグルカンおよび/またはアルファフカンを含む組成物の下記の目的の方法に関しての使用を提供する:
−体内での直鎖揮発性脂肪酸産生を増やすための;
−体内での分岐鎖揮発性脂肪酸産生およびそれらの排出を減らすための;
−体内での長鎖多価不飽和脂肪酸産生を増やすための;
−免疫攻撃された家畜、例えば、ブタ、家禽、ウマ、ならびにウサギ、魚、ヒトおよび他の単胃の対象、の免疫状態および応答を改善するための;
−プロリン−および抗−炎症性のサイトカイン、ムチンおよびトレフォイルファクターの発現を増やすことにより免疫状態を改善するための。
【図面の簡単な説明】
【0050】
以降で、本発明の実施形態について、非制限的実施例、およびこれに付随する下記の図に対する参照を使用して説明する。
【図1】は、基礎食摂取子ブタのPCV2特異的抗体力価を示す。
【図2】は、LAM+FUCを補充した基礎食事摂取子ブタのPCV2特異的抗体力価を示す。
【図3】は、LAM+FUCおよびWPIを補充した基礎食事摂取子ブタのPCV2特異的抗体力価を示す。
【図4】は、異なる食事に慣らし、その後PCV2およびPPVの攻撃を受けた子ブタのリンパ球集団割合を示す。
【図5】は、異なる食事を給餌され、その後PCV2およびPPV(Day14PI)で攻撃を受けた子ブタの平均好酸球集団パーセンテージを示す。
【図6】は、異なる食事に慣らし、その後PCV2およびPPVの攻撃を受けた子ブタの平均末期体重(Kg)を示す。
【図7】は、異なる食事に慣らし、その後PCV2およびPPVの攻撃を受けた子ブタの糞便中で検出された平均PCV2DNAコピー数を示す。
【図8】は、異なる食事に慣らした子ブタのPCV2DNAコピー数を示す。
【発明を実施するための形態】
【0051】
実施例
実施例では、ヒト、動物および家禽を含む全ての単胃生物のモデルとして、ブタの研究対象に対するラミナリンおよび/またはフコイダン補充の効果に関する調査研究の結果が示される。実施例には、ラミナリンおよびフコイダンを組み合わせて(以降、SWEと呼ぶ)、または各化合物を別々にラミナリン(以降、LAMと呼び)またはフコイダン(以降、FUCと呼び)として含む海藻抽出物を使って行った試験が含まれる。
【0052】
実施例1
材料および方法
動物および処置
40匹の妊娠ブタを4つの食事療法の内の1つに割り当てた(n=10匹雌ブタ/処置):(T1)基礎授乳;(T2)基礎授乳+100g/日魚油(F.O.);(T3)基礎授乳+1.8g/日SWE;および(T4)基礎授乳+100g/日F.O.+1.8g/日SWE(妊娠の109日目から26日での離乳まで)。SWEは、一日量のラミナリン(1g)およびフコイダン(0.8g)を含有。被験動物に対し、食事に実験栄養補助剤を毎日追加した。出生時に体重を記録し、3匹の子ブタを選別して、同腹仔の平均出生時体重の代表値とした。これらは離乳まで毎週秤量した。離乳時に、120匹の雄雌混合ブタ(1匹の同腹仔当たり3匹のブタ;平均体重=8.05±0.46Kg)を選択し、スターター飼料を21日間与えた。飼料と水は実験中自由に入手できるようにした。ブタは、離乳(day0)の日に別々に秤量し、その後は離乳後、7、14および21日目に秤量した。飼料摂取量を毎日記録した。
【0053】
標本採取
30mlの初乳および母乳を分娩後、day0および12に雌ブタから採取した。血液サンプルを、授乳のday5および12に2匹の子ブタ/同腹仔の頸静脈から免疫グロブリン分析用として採取した。Association of Official Analytical Chemists(AOAC、1995)に従って、粗タンパク質を測定した。
【0054】
免疫グロブリンの定量
免疫グロブリンアッセイを、特異的ブタELISA定量キット(Bethyl Laboratories、Inc.、Montgomery、Texas、USA)を使って実施した。雌ブタの初乳および母乳および子ブタ血清を使って、Ilsley and Miller(2005)により記述されているようにして、ブタアッセイを行った。
【0055】
選択した微生物集団の分析
胃腸内容物標本を無菌的に屠殺後の各ブタの盲腸および結腸から取り出した。ビフィズス菌、大腸菌および乳酸桿菌種集団をPierce et al.(2006)に従って選択的に単離し、列挙した。
【0056】
揮発性脂肪酸(VFA)分析
Pierce et al.(2006)の手続きに従ったガスクロマトグラフィーによる方法により、盲腸および結腸からの胃腸内容物標本をVFA分析用に回収した。
【0057】
組織学的分析
十二指腸、空腸および回腸の切片を、10%リン酸塩緩衝ホルマリン中で無菌的に取りはずし、摘出および固定した。各腸セグメントの5μm厚さの断面をヘマトキシリンおよびエオシンで染色した。絨毛高および陰窩深をイメージアナライザー(Image Pro Plus;Media Cybernetics、Bethesda、MD、USA)付き光顕微鏡を使って測定した。
【0058】
フローサイトメトリーによる血球細胞の食作用評価
非オプソニン化、FITC標識大腸菌の摂食を測定する、PHAGOTEST(登録商標)キット(Orpegen Pharma、Heidelberg、Germany)を全血球細胞の貪食活性測定に使用した。標本をDakoCyan−ADPフローサイトメーター(Dako、Glostrup、Denmark)を使って解析した。
【0059】
回腸および結腸遺伝子発現−RNA抽出およびcDNA合成
組織標本を回腸および結腸から採取し、氷冷PBSで洗浄後直ちにRNAlater(登録商標)(Ambion Inc、Austin、TX)を含むチューブに入れた。全RNAをGene Elute Mammalian Total RNA Miniprepキット(Sigma−Aldrich)を使って抽出し、NanoDropND1000分光光度計(Thermo Fisher Scientific Inc.MA、USA)を使って定量した。260および280nmでの吸光度比を測定し純度を評価した。全体RNAを、First Strand cDNA Synthesisキット(Fermentas)とオリゴdTプライマーを使って逆転写(RT)した。
【0060】
定量的リアルタイムPCR(qPCR)
定量的リアルタイム(qPCR)アッセイを、7900HT ABI Prism Sequence Detection System(PE Applied Biosystems、Foster City、CA)上で、SYBR Green PCR Master Mix(Applied Biosystems)を使ってcDNA標本で実施した。RT−PCR(IL−1α、IL−6、IL−10、TNF−α、MUC2、TFF3、GAPDH、B2M、ACTS、PPIAおよびYWHAZ)に使った全プライマーは、Primer Express(登録商標)ソフトウェアを使って設計した。増幅を、10μlのSYBR PCR Mastermix、1μlの順方向および逆方向プライマー、8μlのDPEC処理水および1μlのテンプレートcDNA中で実施した。PCR産物の解離分析を行い、得られたPCR産物の特異性を確認した。
【0061】
結果
初乳および母乳組成物
初乳IgGレベルは、SWEを補充した雌ブタで有意に高かった(p<0.01)。補充により雌ブタの母乳中のタンパク質濃度が12日目に増加した(p<0.05)。
【表1】

【0062】
哺乳子豚の免疫グロブリン
SWE補充雌ブタから授乳した小ブタは、授乳の5日目(p<0.01)と12日目(p<0.05)に有意に高い血清中IgG濃度を示し、授乳5日目に高い血清IgA濃度を示した(p>0.05)。
【表2】

【0063】
哺乳子豚の発育成績
SWE補充雌ブタから授乳した小ブタは、授乳の第1週目の間、有意に低い平均1日増体量を示した(p<0.05)。出生と離乳の間の1日増体量に有意差はなかった。同腹仔サイズ、同腹仔体重、子ブタ出産体重および離乳時体重は、雌ブタの食事療法の影響を受けなかった。
【表3】

【0064】
離乳後の子ブタの発育成績
SWE補充雌ブタから授乳した小ブタは、離乳後7〜14日目(p<0.05)、離乳後0〜21日目(p=0.063)に有意に高いADGを示し、また離乳後7〜14日目に有意に高い食事摂取量を示した(p<0.05)。
【表4】

【0065】
微生物学
結腸では、母親のSWE補充により、ビフィズス菌集団の有意な減少が生じた(p<0.01)。さらに、SWE補充により、対象と比べて結腸中の大腸菌および乳酸桿菌集団を減少させる傾向が認められた(p=0.09)。
【表5】

【0066】
サイトカイン遺伝子発現
離乳後ブタの回腸では、母親へのSWE補充がプロリン炎症性サイトカインTNF−α発現の有意な増加を誘導した(p<0.01)。また、結腸でのTFF3遺伝子発現の有意な増加も認められた(p<0.05)。
【表6】

【0067】
揮発性脂肪酸(VFA)分析およびpH測定
【表7】

【0068】
組織像
回腸では、SWE補充が絨毛高および絨毛高の陰窩深に対する比率に与える有意な効果があった(p<0.05)。また、十二指腸での結果も、陰窩深に対するSWE補充と同様の有益な効果を示した(p>0.10)。
【表8】

【0069】
食作用能力
SWE補充は、授乳子ブタの全好酸球数に対し抑制効果を発揮した(p<0.01)。SWE補充食事は、SWE非補充食事に比較して、高い割合の大腸菌貪食白血球(p<0.05)および低い割合の大腸菌貪食リンパ球(p<0.01)を生成した。
【表9】

【0070】
実施例2 実験1
材料および方法
実験計画および食事
実験1を下記の5つの食事療法を含む完全な無作為化方式として計画した:(T1)0g/Kg SWE(対照)、(T2)0.7g/Kg SWE、(T3)1.4g/Kg SWE抽出物、(T4)2.8g/Kg SWE抽出物および(T5)5.6g/Kg SWE抽出物。SWEは、LAM+FUCを含む。全食事を同じ濃度の正味エネルギーおよび合計リシンを有するように処方した。アミノ酸要求をリシンに対して合わせた(Close、1994)。灰分消化率の測定を行うために、150ppmの速度で粉砕するときに酸化クロムを全食事に添加した。
【0071】
動物および管理
51±3.4Kgの初期生体重を有する30匹の仕上げ成熟雄ブタを実験に使用した。ブタを生体重に基づいて区分けし、無作為に5つの食事療法の1つに割り付けた。ブタを14日間の食事適応期間を与え、その後、秤量し別々の代謝クレートに移した。動物に5日間の順化を行わせ、5日間の採取期間で見かけ消化率を促進し、さらに窒素バランス調査を行った。1日摂取許容量(DE摂取量=3.44x(生体重)0.54(Close、1994))を2回の食事に分けた。水を食事と一緒に1:1の比率で与えた。食事の間に、新しい水を自由に与えた。代謝クレートを環境制御室で割り付け、22℃(±1.5℃)の定温で維持した。
【0072】
全消化管見かけ消化率係数(CTTAD)および窒素バランス調査
採取中、クレート下部の漏斗経由で尿を20mlの硫酸(25%H2SO4)を含むプラスチック容器に採取した。窒素の揮発を避けるため、漏斗に毎日4回、弱塩酸(2%H2SO4)溶液を吹き付けた。尿容量を毎日記録し、50mlの標本を採取し、研究室分析用に冷凍した。総糞便重量を毎日記録し、100℃でオーブン乾燥した。新しく排泄された糞便の標本を毎日集め、窒素分析とpH測定用として冷凍した。採取期間の最後で、糞便標本をプールし、副標本を研究室分析用に保管した。飼料標本を毎日集め化学分析用に保管した。全30匹のブタを屠殺までそのそれぞれの食事療法のまま保持した。
【0073】
実施例2 実験2
材料および方法
実験計画および食事
この実験を下記4つの食事療法を含む2x2要因配置として計画した:(T1)対照食事、(T2)対照+300ppm LAM、(T3)対照+238ppm FUC、(T4)対照+300ppm LAM+238ppm FUC。全食事を正味エネルギー(9.8MJ/Kg)と全リシン(10g/Kg)で規格化した。アミノ酸要求をリシンに対して合わせた(Close、1994)。
【表10】

【0074】
動物および管理
55Kgの初期生体重を有する28匹の仕上げ成熟雄ブタを使用した。ブタを生体重に基づいて区分けし、無作為に4つの食事療法の1つに割り付けた。ブタに28日間の食事適応期間を与え、その後秤量し、屠殺した。
【0075】
近接する盲腸と結腸中の灰分の微生物学および見かけ消化率
屠殺後各動物の近接した盲腸および結腸から胃腸内容物を取り出した。マーカーとして酸化クロムを使って盲腸および結腸中の消化率を測定した。ビフィズス菌種、乳酸桿菌種および腸内細菌を、O’Connell et al.、(2005)により記載された方法に従って単離、計数した。
【0076】
揮発性脂肪酸標本採取および分析
それぞれのブタの盲腸由来の胃腸内容物および近接したおよび遠位の結腸の検体をVFA分析用に採取した。O’Connell et al.(2005)に従って改良したPorterとMurray(2001)の方法を使って、胃腸内容物中のVFA濃度を測定した。
【0077】
結果
実験1−微生物学的調査
【表11】

【0078】
実験1−CFAsc:産生的に見かけ灰分消化率を増加する、その胃腸表面の発酵基質の合計リシン(10.0)分析
【表12】

【0079】
実験1−揮発性脂肪酸調査
【表13】

【0080】
実験2−微生物学調査
【表14】

【0081】
実験2−揮発性脂肪酸調査
【表15】

【0082】
実施例3
実験計画および食事
この実験は、25日間を2回連続して行った。240匹の子ブタを離乳後24日目に選別し、4つの食事療法の1つに割り当てた。期間1と2のブタはそれぞれ7.2Kgおよび7.8Kg(±0.9Kg)の生体重であった。この実験を2x2要因計画で行った。実験(0〜25日)の間、子ブタに次の食事を与えた:(T1)150g/Kgラクトース;(T2)150g/Kgラクトース+SWE;(T3)250g/Kgラクトース(T4)250g/Kgラクトース+SWE。SWEは、2.8g/Kgとし、これはラミナリアディギタータ由来であり、ラミナリン(112g/Kg)、フコイダン(89g/Kg)および灰分(799g/Kg)が含まれている。
【0083】
動物および管理
ブタを4つのグループ(n=15匹/処置)に分けて収容し、離乳(0日目)、7、14および25日目に秤量した。ブタは自由に摂食させた。新しい糞便検体を10〜15日目に採取し、栄養消化率測定およびVFA分析用とした。新しい糞便を10日目に採取し大腸菌と乳酸桿菌の計数用とした(O’Connell et al.、2005)。
【0084】
微生物学
1gの糞便検体をマキシマムリカバリー希釈液(MRD;Oxoid、Basingstoke、UK)で系列希釈し、選んだ寒天に蒔いた。乳酸桿菌種をde Man Rogosa Sharp寒天(MRS、Oxoid)に単離した。API50CHL(BioMerieux、France)キットを使って、疑わしい乳酸桿菌spp.を確認した。大腸菌種をMacConkey寒天(Oxoid)に単離した。疑わしいコロニーをAPI20E(BioMerieux、France)で確認した。
【0085】
結果
発育成績
【表16】

【0086】
全消化管見かけ消化率係数(CTTAD)
【表17】

【0087】
微生物学およびVFA
【表18】

【0088】
実施例4
実験計画および食事
初期生体重6.4±0.785Kgの192匹の24日齢離乳子ブタを4つの食事療法の1つまたは21日の離乳に割り当てた。食事療法は、(T1)基礎食事、(T2)基礎食事+300ppm LAM、(T3)基礎食事+236ppm FUC、(T4)基礎食事+300ppm LAM+236ppm FUC、から構成されている。食事を同じ濃度の消化可能エネルギー(DE)(16MJ/Kg)および回腸消化可能リシン(14g/Kg)となるよう処方した。総アミノ酸要求をリシンに対して合わせた(Close、1994)。栄養消化率測定のために酸化クロム(III)を食事に添加した。LAMおよびFUCをラミナリアヒペルボレア由来とした。
【0089】
管理
子ブタをグループ4に収納し毎日2回摂食させた。水は自由に与えた。病気の症状を呈する全てのブタを適切に処置し、記録した。ブタを0(離乳の日)、7、14および21日目に秤量した。飼料摂取量を毎週モニターした。新しい糞便検体を10日目に採取し大腸菌および乳酸桿菌濃度測定に供した。糞便献体を各家畜から12〜17日目に採取し化学分析用に保管した。新しい糞便検体を14日目に取り出し、冷凍して揮発性脂肪酸分析用に保管した。新しい糞便検体を17日目に採取しpH測定に供した。
【0090】
糞便スコアリングおよび罹患率
0〜21日目にブタの下痢症の臨床的兆候を観察した。スコアリングシステムを適用し兆候の存在と重症度を示した。次のスコアリングシステムを使った:1=固い、2=やや柔らかい、3=柔らかい、部分形成、4=緩い、半液状および5=水様、粘液様。
【0091】
微生物学
献体を9.0mlのマキシマムリカバリー希釈液(MRD、Oxoid、Basingstoke、UK)を使って系列希釈(1:10)し、選択した寒天に拡散播種した(0.1ml分量)。乳酸桿菌をdeMan、Rogosa、Sharp寒天(MRS、Oxoid)を用い、5%CO2中37℃で一晩インキュベーションして単離した。API50CHL(BioMerieux、France)キットを使って疑わしい乳酸桿菌sppを確認した。大腸菌種を、37℃で18〜24時間の好気性インキュベーションの後、MacConkey寒天(Oxoid)に単離した。疑わしいコロニーをAPI20E(BioMerieux、France)を使って確認した。
【0092】
結果
発育成績
LAM補充食を摂食したブタは、LAM無補充食を受けたブタに比べ、7〜14日目の間に(0.344 v 0.266、p<0.01)、および全実験期間の間に(0.324 v 0.232、p<0.01)ADGが増加した。LAM補充食摂食ブタは、栄養補助されないLAM食に比べ、7〜14日目の間に(0.763 vs.0.569、p<0.001)および全実験期間の間に(0.703 v 0.646、p<0.05)増体/飼料比が改善した。14〜21日目の間に、ADGに関しLAMおよびFUC補充間で有意な相互作用(p<0.05)が認められた。FUC食を受けたブタは、基礎食事を受けたブタより有意に高いADGを示したが、LAM食事にFUCを追加した場合には、効果は認められなかった。平均1日飼料摂取量にLAMまたはFUCを入れた場合には、効果は認められなかった。
【表19】

【0093】
糞便pH、DM、糞便スコア
LAM補充食を摂食したブタは、非栄養補助LAM食に比べ糞便DM含量が増加した(28.64 v 26.24;p<0.05)。LAM補充食を摂食したブタは、7〜14日目の間に糞便スコアが減少した(2.05 v 2.57;p<0.05)。糞便スコアに関し、全実験期間の間(0〜21日目)LAMおよびFUC含有間に有意な相互作用が認められた(P<0.05)。LAMとFUCの組み合わせを摂食したブタは、FUC単独食を受けたブタに比べ、糞便スコアが減少した。しかし、基礎食事に比較して、LAM添加の糞便スコアに対する効果は認められなかった。
【表20】

【0094】
微生物学および揮発性脂肪酸(VFA)
LAM食を摂食したブタは、LAM非補充食を摂食したブタに比較して糞便大腸菌集団が減少した(7.22 vs.7.84;p<0.05)。糞便乳酸桿菌集団に関して、LAMおよびFUC間に有意な相互作用(P<0.01)が認められた。FUC食を受けたブタは、基礎食事を受けたブタに比べ乳酸桿菌数が増加した(9.22 v 8.93)が、LAMと一緒に入れた場合には、糞便乳酸桿菌集団に対するFUCの効果は認められなかった。揮発性脂肪酸濃度に対する有意な処置効果は認められなかった。
【表21】

【0095】
LAM補充食を摂食したブタは、非栄養補助食を摂食したブタに比較して、平均1日増体量(ADG)および増体/飼料比(GFR)が改善された。LAMに対するこの陽性の応答は、これらのブタの腸中大腸菌集団の減少に起因する可能性がある。LAM補充食では、LAM非補助食を摂取したブタに比べ、7〜14日目の間に糞便大腸菌集団の減少を生じ、これは糞便DMの減少および下痢症の減少(より低い糞便スコア)を生じた。食事へのLAMの含有によりブタの腸内に腸内細菌集団の減少が生じた。このように、ラミナリン食摂食ブタに発育成績の改善が認められ、これはLAMの抗菌特性と関連し、この結果、ブタの腸内の健康状態の改善および大腸菌型負荷の減少が生ずると思われる。免疫細胞の特異的受容体へのLAMの結合による粘膜免疫の調節が、細菌のコロニー形成および増殖を防ぎ、その結果、その後の腸壁の損傷を防ぐことによりブタの健康に有益な効果を与える可能性がある。FUC補充食中の乳酸桿菌spp.の増殖は、ある割合の補充FUCが前腸での加水分解を避けて結腸に入り細菌性発酵を起こすことを示唆していると思われる。糖分解種の細菌、例えば、乳酸桿菌spp.、は複合体炭水化物の分解に寄与する。FUCは水に可溶で、それを急速に発酵性炭水化物源にする。乳酸桿菌種は、L−フコースを含む多くの単糖類を発酵させると報告されている。細菌の研究で、結腸中の乳酸桿菌spp.の濃度がFUC含有により増加することが明らかになった。乳酸桿菌集団の増加に拘わらず、VFA濃度またはプロファイルに対し食事効果が認められなかった。大腸で作られるVFA量は、基質の組成と量、および存在するミクロフローラに依存する(MacFarlane and MacFarlane、2003)。しかし、糞便VFA濃度は、大腸中での発酵強度を示すには、全体としては正しくない可能性がある。
【0096】
FUC+LAMの組み合わせ食事は、離乳後の下痢症を減らすには、最も有効であった。これには多くの理由が考えられる。第1に、組み合わせ食摂食からくる免疫応答である可能性がある。第2に、組み合わせ処置に伴う糞便大腸菌数の減少があった。下痢症を呈するブタは大量の溶血性大腸菌を住まわせている。従って、腸中の大腸菌の数の減少により、下痢症の重症度が低下し、最終的には離乳後子ブタ罹患率が減少するのであろう。
【0097】
全体として、糞便大腸菌集団の減少ならびにADGおよびGFRの増加により、LAMが離乳後の腸の健康を改善するための食事手段を提供する可能性があることが示唆される。しかし、LAMとFUCの組み合わせは、下痢症を減らすのにより有効である。
【0098】
実施例5
実験計画および動物の食事
初期体重17.9±2.2Kgの21匹のブタを3つの食事療法の1つに割り当てた:(T1)対照;(T2)基礎食事+300ppm LAM;(T3)基礎食事+600ppm LAM。自由摂取実験を21日間続けた。食事は、類似の消化可能エネルギー(DE)(14.4MJ/Kg)および回腸消化可能リシン(12.5g/Kg)を有するように処方した。
【0099】
微生物および揮発性脂肪酸(VFA)分析
屠殺後、胃腸を解剖で取り出し胃腸内容物を回腸から取り出した。各胃腸内容物献体をマキシマムリカバリー希釈液(MRD、Oxoid、Basingstoke、UK)で系列希釈し、選択寒天に拡散播種した。ビフィズス菌、乳酸桿菌および腸内細菌種をPierce et al.(2005)により記載された方法に従って単離した。VFA濃度測定に使う胃腸内容物献体を盲腸、ならびに回腸および結腸の同じ位置からから採取した。VFA分析は、Pierce et al.、(2005)により記載された方法に従いガス液体クロマトグラフィー(GLC)を使って行った。
【0100】
組織検体採取および組織攻撃手続き
回腸および結腸組織を胃腸内容物検体と同じ位置から摘出した。切除組織を腸間膜に沿って解剖して組織を空にし、無菌の燐酸塩緩衝食塩水(PBS)(Oxoid)で洗浄した。覆っている平滑筋を取り除いて、1cm3の組織断面を各組織から切り取った。各組織の2つの断面を1mlのダルベッコのModified Eagle’s Medium(DMEM)(Gibco)中に入れ、1つは10μg/mlの濃度の細菌性リポ多糖類(LPS)(Sigma Aldrich)の存在下のものに入れた。他の組織標本は対照として使用し、LPSが無い場合には無菌のDMEM中でインキュベートした。攻撃を受けたおよび未処置組織の両方を37℃で90分間インキュベートした後、取り出して吸い取り乾燥して秤量した。約1〜2gのブタの回腸および結腸組織を切断して小片とし、15mlのRNAlater(登録商標)(Applied Biosystems、Foster City、CA)中に入れた。RNAlater(登録商標)を除去した後、検体をRNA抽出で使用するまで−80℃で保存した。
【0101】
定量的リアルタイムPCR(qRT−PCR)用の未処置組織の調製
回腸および結腸組織をRNAlater(登録商標)溶液中で安定化させ、4℃で一晩貯蔵した。翌日、RNAlater(登録商標)を除去し検体を−86℃でRNA抽出まで貯蔵した。
【0102】
RNA抽出およびcDNA合成
RNA抽出用の組織標本を−86℃から取りだし、ホモジナイズした。500μ1の溶菌液/2−MEを各検体に添加し、これらを検体毎に1つの5mmステンレス鋼ビーズを使って機械的に粉砕した。次に組織破砕機(Qiagen)に入れ、ライセートを3分間ホモジナイズした後、GenElute Filtration Column(Sigma Aldrich)に移してRNAを抽出した。1μgの総RNA、oligo(dT)20プライマーを用い、逆転写ポリメラーゼ連鎖反応(RT−PCR)(Invitrogen Life Technologies、Carlsbad、CA)用のSuperscript(登録商標)III First−Strand synthesis systemを使って20μlの最終反応容量でcDNA合成を行った。cDNA合成の最終ステップで、大腸菌RNase H(Invitrogen Corp.)を用いて処置を行い、残っているRNA/mRNAテンプレートを消化して、次のqRT−PCR反応用の一本鎖cDNAテンプレートを産生した。
【0103】
定量的リアルタイムPCR(qPCR)およびqPCRデータの正規化
サイトカイン遺伝子インターフェロンガンマ(IFN−γ)、インターロイキン−1α(IL−1a)、IL−6、IL−8、IL−10、IL−17、腫瘍壊死因子(TNF−α)、ムチン遺伝子(MUC1、2、4、5AC、12、13および20)および3つのリファレンス遺伝子、β−アクチン(ACTB)、グリセルアルデヒド−3−リン酸脱水素酵素(GAPDH)およびペプチジルプロリン異性化酵素A(PPIA)、のための全ブタプライマーを、PrimerExpress(登録商標)(PE Applied Biosystems、Foster City、CA)を使ってデザインし、MWG Biotech(Milton Keynes、UK)で合成した。これらのリファレンス遺伝子がブタ組織での使用に対し前もって検証され、次に96−ウエルプレート(Applied Biosystems、Foster City、CA)用ABI PRISM 7900HT Fast sequence detection systemを使ってcDNAでqPCRを行った。全検体をSYBR Green Fast PCR Master Mix(Applied Biosystems、Foster City、CA)を使い、cDNAをテンプレートおよび選択遺伝子用の特異的プライマーとして使用して二通り調製した。核反応で、5μlcDNA、1.2μl(順方向および逆方向プライマーミックス、5μM)、10μl Fast SYBR Green PCR Master Mix(PE Applied Biosystems、Foster City、CA)を添加し、20μlの最終容量にした。2ステップPCRプログラムは次の通り:95℃、10分1サイクル、次に95℃、15秒、そして60℃、1分40サイクル。レファレンス遺伝子用の未加工Ct値は、式Q=E ΔCtを使って相対量に変換される;ここでEはアッセイのPCR効率、ΔCtは各遺伝子に対する最低Ct値と対象検体のCt値の差の計算値である。次に、内在性対照の相対量をgeNorm(Vandesompele et al.、2002)を使って安定性の観点から解析した。選択した内在性対照(ACTB、GAPDHおよびPPIA)へのgeNorm適用により得られた安定性「M」値は、これら腸検体用内在性対照としての適合性を示した。次に、ACTB、GAPDHおよびPPIAのための相対量の幾何学的手段(正規化因子)をgeNormを使って計算した。各標的遺伝子の相対量をその検体用正規化因子(geNormにより得た)で割って最終的な正規化相対発現量を得た。
【0104】
結果
この調査で、ラミナリアディギタータ由来LAMは、発育成績、栄養消化率または選択回腸内細菌に影響を与えなかったが、回腸と結腸中の腸内細菌は減少させた。特に関心があるのは、リポ多糖類(LPS)によるインビトロ攻撃後の回腸と結腸中のサイトカイン遺伝子発現に対するLAMの影響であった。
【0105】
動物発育成績および栄養消化率
LAM増加による発育成績(食物摂取量、1日増体量または飼料要求率)または栄養消化率係数(DM、OM、灰分、NまたはGE)に与える効果は認められなかった。
【0106】
微生物学および揮発性脂肪酸(VFA)
LAMレベルを0〜600ppmの範囲で増やしたことよる、回腸中のビフィズス菌、乳酸桿菌または腸内細菌集団に与える効果は認められなかった(p>0.05)。LAMの増加に伴う腸内細菌集団の減少は認められた。ビフィズス菌や乳酸桿菌数に影響しないで、有害腸内細菌株を減らせる可能性があることは、病原菌が死亡率を増加させていることから、非常に意義が大きい。これらの結果から、最適LAM含有割合は300ppmであることが示される。
【表22】

【0107】
回腸または結腸中の総VFAに与えるLAM食事含有レベル増加の有意な効果は認められなかった。VFA産生の主要部位である盲腸中のLAMレベルの増加に伴う総VFAの有意な増加が認められた(p<0.05)。いずれの腸領域から記録された胃腸内容物pHにも有意な変化は認められなかった。
【0108】
サイトカイン遺伝子発現
解析したいずれのサイトカインに対しても未処理回腸または結腸組織に与えるLAMの効果は認められなかった。このこれら炎症性マーカーに対する効果の全体的な欠如により、食事中のLAMの存在がどのような負の効果も誘発しなかったことが示唆されている。微生物の攻撃に対するLAMに曝された動物の回腸および結腸組織の応答を模倣するために、これらの組織を、その後、LPSと共に体外でインキュベートした。回腸では効果が観察されなかったが、LPS攻撃組織の結腸中でのIL−6およびIL−8遺伝子発現に対する有意な攻撃効果が観察された。300ppmのLAM含有レベルにより、IL−6発現の増加がもたらされ(p<0.05)、一方、IL−8遺伝子発現の直線的増加が観察された(p<0.05)。これらのデータから、食事LAMは、微生物の攻撃に対しプロリン炎症反応を高める可能性があることが示唆される。IL−6が、初期免疫応答における急性炎症で重要な役割を演ずるプロリン炎症性サイトカインであることから、LPS攻撃後のIL−6およびIL−8サイトカインの遺伝子上方制御強化の潜在的利益は、宿主にとって意義深いことである。同様に、ケモカインIL−8もまた、炎症に関し重要な役割を演じ、感染の初期部位に対する好中球補充および活性化の役割をする。LAM単独への暴露は、胃粘膜中のプロリン炎症性サイトカイン産生を刺激しなかったが、LPS誘導プロリン炎症性サイトカイン産生を強化した。
【表23】

【表24】

【0109】
ムチン遺伝子発現
食事因子、例えば、線維、タンパク質および非栄養因子が杯細胞からのムチンの合成と分泌および胃腸内容物中のムチンの回収に直接影響を与えることが知られている(Montagne et al.、2004)。全7ムチン遺伝子転写物がブタ結腸中で検出されたのは確かであるが、回腸中では7つの内の5つが実際に定量可能であったにすぎない。LAMを300ppm補充したブタの回腸で対照動物に比べMUC2の増加が認められた(p=0.05)。このMUC2発現の増加は、より高い食事中含有レベル(600ppm)では認められなかった。残りの回腸中検出可能ムチン(MUC4、MUC12、MUC13およびMUC20)に対してはLAM補充は効果がなかった。結腸中では、600ppmの含有レベルのLAMによる食事補助によりMUC2(2次;P<0.05)およびMUC4(2次;P<0.05)発現が有意に増加したが、この部位の残りのムチン遺伝子のいずれの発現に対しても効果が認められなかった。ベータグルカン含有食はまた、マウスモデルの空腸、回腸、盲腸および結腸のムチン産生の質と量に影響を与える(Deville et al.、2007)。
【表25】

【0110】
最適含有レベル
体外LPS攻撃で免疫系を「刺激」するには300ppmLAMで十分である。
【0111】
実施例6
免疫能力は、LAMおよび/またはFUCを用いた栄養学的介入により調節可能であり、これにより実験的感染出産ブタ中のブタサーコウイルス2型(PCV2)ウイルス量の減少およびブタの離乳後多臓器発育不良症候群(PMWS)の影響の改善につながる。
【0112】
結果
組織中のPCV2抗原の免疫蛍光検出
PCV2特異的モノクローナル抗体を使った免疫蛍光法によって、PCV2抗原が検死解剖動物(肝臓、肺、腎臓、脾臓、ILN、MLN)由来の組織断面中で検出された。
・基礎食事では、6匹の動物中の5匹を安楽死させた。
・基礎食事+LAMおよびFUC処置では、6匹の内1匹の動物を安楽死させた。
・基礎食事+LAM、FUC、WPIでは、実験の間に6匹の内1匹のブタを安楽死させた。この動物由来の組織には、高レベルのPCV2抗原を含んでいた。残りの5匹は実験の終わり時点で健康に見えた。これらは抗体陽転し体重が増えた。
【0113】
PCV2特異的抗体力価の測定
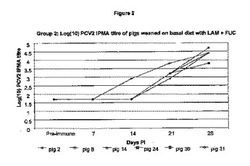
図1に、IPMAで測定した血清のPCV2特異的抗体力価を示す。
【0114】
グループ内分析
・基礎食事:6匹の子ブタの内の5匹は弱いPCV2抗体応答を示し、全て分析組織断面中に疾患を示すPCV2抗原を有していた。残りの動物(Tag10)は、妥当なPCV2特異的抗体力価に抗体陽転した。この残りの動物は実験の継続期間中健康を維持した。
・基礎食事+LAMおよびFUC処置:6匹のブタ中1匹は実験の終わりの前に抗体陽転した(Tag30)。この動物は、このグループの全動物の中でより低いPCV2特異的抗体力価を示し、組織中のPCV2抗原レベルは、PCV2関連疾患を示した。しかし、この動物の抗体力価はグループ1の疾患発症子ブタよりも高かった。
・基礎食事+LAMおよびFUC+WPI:6匹のブタの内1匹が実験の終わりの前に抗体陽転した(Tag26)。残りの全5匹の動物は実験の終わり時点で健康で、抗体陽転し体重が増えた。2匹の動物(Tag22および25)が組織中に高レベルのPCV2抗原を有していた。
【0115】
グループ間分析
感染後(PI)、21および28日目に、処置2(+LAMおよびFUC;図2参照)ならびに処置4(+LAMおよびFUC+WPI、図3参照)における動物の平均PCV2特異的抗体力価は、基礎食事を摂食した動物および基礎+WPIを摂食した子ブタよりも有意に高かった(p<0.05)。これらの結果から、ブタの食事にLAMとFUC単独、またはWPIと組み合わせ多補充がPCV2感染ブタの体液性応答を強化することが示唆される。
【0116】
リンパ球数
図4で、感染後(PI)28日目までに、基礎食事摂食グループは、3つの補充食よりも有意に低い割合のリンパ球細胞集団を有したことが認められる。いずれの補充剤も相互に有意な差がなかった。図5に示すように、PI14日目に、LAM+FUCを補充した食事を摂取した子ブタは、他のグループよりも有意に大きな好酸球割合を示した(p<0.05)。この時間以降、有意差は検出されなかった。
【0117】
動物の体重の分析
ブタの体重を毎週記録した。図6から、グループ2(+LAMおよびFUC)、3(+乳清タンパク単離物)および4(+LAMおよびFUC+乳清タンパク)の子ブタの実験終了時点での平均体重は基礎食事摂食のものよりも大きいことがわかる。グループ2および4の動物は、基礎食事摂食子ブタよりも有意により重かった。
【0118】
動物体温の分析
体温もまた全調査期間にわたりモニターした。PI17日目に、グループ3(+乳清タンパク単離物)およびグループ4(+LAMおよびFUCおよび乳清タンパク単離物)の動物は、基礎食事を摂食した子ブタ(39.82℃、p<0.05)よりも有意に低い平均体温(それぞれ38.33および38.02℃)であった。PI24日後のそれぞれの摂食グループ間での平均体温の有意差は認められなかった。
【0119】
ウイルス排出の分析
全糞便検体の定量PCRを行い、ウイルス量および排出を評価した。図7に示すように、PI10日目までにグループ3(+乳清タンパク単離物)の動物中で検出された平均PCV2 DNAコピー数は、他の3つの摂食グループよりも有意に少なかった(p<0.05)。PI20と24日目に、LAMおよびFUC補充食を摂食した子ブタはグループ1と3の子ブタよりも有意に少ないPCV2 DNAコピー数であった。LAMおよびFUCならびに乳清タンパク単離物を摂食した動物は、基礎食事のものに比べ有意に少ないPCV2 DNAコピー数であった(p<0.05)。PI27日目までに、全補充食事は基礎食事のものに比べ有意に少ないPCV2 DNAコピー数であった(p<0.05)。図8からわかるように、最も少ない平均PCV2 DNAコピー数がLAM+FUC摂食子ブタの糞便検体中で検出された。これらの結果は、これらの実験条件下、LAM+FUC、WPI、または両方の組み合わせによるブタ栄養補助食事がPCV2ウイルス排出の有意な減少につながったことを示している。
【表26】

【0120】
サイトカインPCR結果
IL−2、TNF−αおよびIL−4のためのサイトカインmRNAを、確立された2ステップ逆転写PCR(rtPCR)アッセイを使って定量化した。結果は、これらのサイトカインのプロファイルに関し異なる摂食処置間に有意差がないことを示した。
【0121】
組織ホモジネート中のPCV2 DNAの定量化
組織ホモジネートプール(10%w/v)を各動物の肝臓、肺、脾臓、腎臓、腸間膜および鼠径部リンパ節から調製した。PCV2 DNAを確立された定量化PCR方法(qPCR)を使って定量化した。最多量のPCV2 DNAが基礎食事(グループ1)を摂取した動物で検出された。また、WPI(グループ3)を補充した食事を摂食したブタは、LAM+FUC(グループ2)またはLAM+FUCとWPIの組み合わせ(グループ4)を補充した基礎食事を摂食したグループより高い量のPCV2 DNAであった。これら結果は、免疫蛍光法に基づく動物組織中のPCV2抗原の検出レベルと比べても遜色がない。他の2つのグループ(すなわち基礎/基礎+WPI)に比べ、LAM+FUC単独またはこれにWPIを組み合わせて補充した食事を摂食した動物で最小量のPCV2抗原が検出された。
【0122】
本発明は、実験的に感染した出産ブタのブタサーコウイルス2型(PCV2)ウイルス量を減少させ、ブタの離乳後多臓器発育不良症候群(PMWS)の影響を改善する。
【0123】
参考文献
Association of Analytical Chemicals (1995). 公定分析法, 第16版, Association of Official Chemists, Washington DC, USA.
Close, W.H. (1994).新遺伝子型物質の摂食:アミノ酸/エネルギー要求の確立。ブタ科学の基本(ed. D.J.A. Cole, J. Wiseman and M.A. Varley): 123-140. Nottingham University Press.
Deville, C; Damas, J., Forget, P; Dandrifosse, G. and Peulen, O (2004).食物繊維としてのラミナリン。Journal of the Science of Food and Agriculture. 84; 1030-1038.
Deville, C; Gharbi, M.; Dandrifosse, G. and Peulen, O (2007).ラミナリン:海藻由来の多糖が腸特性に与える効果の研究。Journal of the Science of Food and Agriculture 87: 1717-1725.
Gardiner, G. E., Campbell, A. J., O’Doherty, J. V., Pierce, E., Lynch, P. B., Leonard, F. C., Stanton, C., Ross, R. P. and Lawlor, P.G. (2008).アスコフィルムノドサム抽出物が生育期‐仕上げ期ブタの成長力、消化力、枝肉特性および選択腸ミクロフローラ集団に与える効果。Anim. Feed. Sci. Technol. 141:259-273.
Hojberg, O., Canibe, N., Knudsen, B and Jensen, B.B., 2003.ブタの胃腸由来胃腸内容物の潜在的発酵速度:発酵液体飼料摂食の効果. Appl. Environ. Micro. 69, 408-418.
Huber, R. E. & Hurlburt, K. L. (1984).ラクトース上の大腸菌増殖には、βガラクトシダーゼ産物の培地への循環が必要。Canadian Journal of Microbiology, 30, 411-415.
Ilsley, S.E.; Miller, H.M. and Kamel, C. (2005).離乳子ブタの発育成績と免疫状態に与える食事性キラヤ属サポニンおよびクルクミンの効果。Journal of Animal Science 83: 82-88.
Klasing K. C. and Barnes D. M.(1988). 免疫学的ストレスによる成長期ヒヨコのアミノ酸要求の低下。Journal of Nutrition 118:1158-1164.
Kogan G and Kocher A 2007.ブタの栄養学的および健康保護における酵母細胞壁多糖類の役割。Livestock Science, 10th Int. Sym. Dig. Phy. in Pigs, Denmark 2006, Part 2 109, 161-165
Krakowskia, L.; Krzyanowskia, J.; Wronaa, Z. and Siwickib, A. K. (1999).初乳の免疫グロブリンレベル,子ウマの新生児および出生後の期間の非特異的細胞性および体液性免疫指数に与える1,3/1,6グルカンおよびレバミソールによる妊馬の非特異的免疫刺激の効果。Veterinary Immunology and Immunopathology. 68 (1), 1-11.
Lynch, M.B.; Sweeney, T.; Callan, J.J. and O’Doherty, J.V. (2007).仕上げブタの栄養消化率, 窒素排泄, 腸ミクロフローラ, 揮発性脂肪酸濃度および堆肥アンモニア排泄に与えるコムギをオオムギと交換することによる食事性β-グルカンの摂取量の増加の効果。Animal 1(6): 812 - 819.
Lynch, M. B., Sweeney, T.,Callan, J. J., O’Sullivan, J. T. and O’Doherty, J. V.(2009).ブタの栄養消化率、窒素利用、腸ミクロフローラおよび揮発性脂肪酸濃度に与える食事性ラミナリア由来ラミナリンおよびフコイダンの効果。 J. Sci. Food. Agric.
90:430-437.
Macfarlane, G. T., Hay, S., Macfarlane, S. & Gibson, G. R. (1990). バッチおよび連続培養におけるバクテロイデス-オバータスによる増殖、多糖およびグリコシダーゼ産生に与える異なる炭水化物の効果。Journal of Applied Bacteriology, 68, 179-187.
Macfarlane, S. and Macfarlane, G.T. (2003). SCFA産生の調節. Proc. Nutr. Soc. 2003 62,67-72.
Mackie, R.I., Stroot, P.G. and Varel, V.H.(1998). 家畜排泄物の主要臭気化合物の生物学的特定と生物学的起源。Journal of Animal Science. 76: 1331-1342. 76: 1331-1342.
Mackie R I; Sghir A; Gaskins H R (1999). 新生児の胃腸の発生微生物生態学。 The American Journal of Clinical Nutrition 69 (5):1035S-1045S.
Mortensen, P.B., Holtug, K. And Rasmussen, H.S. 1987.糞便インキュベートシステムでの単および二糖類からの短鎖脂肪酸産生:食物繊維のヒトの結腸での発酵の推測。 Nutrition Journal 118: 321 - 324.
O’Connell, M., Callan, J.J., Byrne, C., Sweeney, T and O’Doherty, J.V. 2005.ブタの栄養消化率、腸ミクロフローラ、揮発性脂肪酸濃度および堆肥アンモニア排泄に与えるブタの食事への穀物型および外因性酵素補充の効果。 Animal Science 81: 357-364.
O’ Doherty, J. V., S, N. C., Callan, J. J. & McCarthy, P. (2004).離乳ブタの成長成績に対する乳飼料レベルと大豆食の間の相互作用。Anim. Sci. 78, 419-427.
O’ Doherty, J. V., Nolan. C. S., Mccarthy, P. C. (2005a).離乳ブタの発育成績に対するラクトースレベルと抗菌増殖成長プロモータの相互作用。J. Sci. Food Agricult. 85, 371-380.
O’ Doherty, J. V., Pierce, K. M.& Kenny, D. A. (2005b). 反芻しない、および反芻前の発酵性繊維および腸健康。IN GARNSWORTHY, P. C. & WISEMAN, J. (Eds.) Recent Adv. Anim. Nutr. Partridge, G.G and Gill, B.P., 1993.ブタ離乳食の新しい取り組み。Wiseman, J. and Garnsworthy, P.C. (Eds),動物栄養学的における最近の進歩。Nottingham University Press, U.K, pp. 221-248.
Pie S., Lalles J. P., Blazy F., Laffitte J., Seve B., Oswald I. P. (2004): 離乳は子ブタの腸の炎症性サイトカイン発現の上方制御と関連がある。Journal of Nutrition. 134: 641-647.
Pierce, K. M., Callan, J. J., Mccarthy, P. & O’ Doherty, J. V. (2005a).アビラマイシンまたはイヌリンを補充した低または高ラクトース食事を摂食した離乳ブタの発育成績。Anim. Sci. 80, 313-318.
Pierce, K. M.; Sweeney, T.; Brophy, P. O.; Callan, J. J.; Fitzpatrick, E.; McCarthy, P. and O’Doherty, J. V. (2006a).離乳ブタの胃腸中の腸形態、選択微生物集団および揮発性脂肪酸濃度に与えるラクトースおよびイヌリンの効果。Animal Science 82, 311-318.
Pierce, K. M.; Sweeney, T.; Callan, J. J.; Byrne, C.; McCarthy, P. and O’Doherty, J. V. (2006b).成熟雄ブタの栄養消化率、窒素排泄、揮発性脂肪酸濃度およびアンモニア放出に与える仕上げ食事中への高ラクトース補充剤含有効果。Animal Feed Science and Technology 125, 45-60.
Pollmann, D.S., Danielson, D.M. and Peo, E.R., (1980).ラクトース補充食を摂食したスターターブタに与えるアシドフィルス菌の効果。J. Anim. Sci. 51, 638-644.
Porter, M.G. and Murray, R.S. (2001). オーブン乾燥時の牧草サイレージ構成成分揮発性および異なる分析方法で評価された乾燥物成分間の相互関係。Grass and Forage Science 56: 405-411.
Rasmussen., H.S.; Holtug, K. and Mortensen, P.B. (1988).ヒトにおけるアミノ酸の短鎖脂肪酸への分解:1つのインビトロ調査。Scandinavian Journal of Gastroenterology.23: 178-182. Read, S.M.; Currie, G. and Bacic, A. (1996).エレクトロスプレーイオン化質量分析によるラミナリンの構造的不均質性分析。Carbohydrate Research 281: 187 - 201.
Reilly, P., J. V. O’Doherty, K. M. Pierce, J. J. Callan, J. T. O’Sullivan, and T. Sweeney (2008).離乳ブタの腸形態学、選択腸微生物叢、栄養消化率、揮発性脂肪酸濃度および免疫状態に与える海藻抽出物含有の効果。Animal 2:1465-1473.
Rooke, J A; Carranca, C; Bland, I M; Sinclair, A G; Ewen, M; Bland, V C (2003).子ブタの免疫グロブリンG受動吸収と免疫グロブリンGの離乳時血漿中濃度の間の関係。Livestock Production Science 81, 223-234.
Swann Report (1969). Joint Committee on the Use of Antibiotics in Animal Husbandry and Veterinary Medicine. Report. HMSO, London.
SAS (1985). 統計分析システム。SAS Institute Inc., North Carolina, USA.
Topping, D.L. and Clifton, P.M., (2001). 短鎖脂肪酸およびヒト結腸機能:耐性デンプンおよび非デンプン多糖類の役割。Physiological Reviews 81: 1031-1064.
【技術分野】
【0001】
発明の分野
本発明は、ラミナリンおよび/またはアルファフカンを使った直接的食事介入による胃腸の健康、免疫および働きの改善、ならびに母親の食事に対するラミナリンおよび/またはアルファフカン補充を介した関連する健康上の利益の出生児への移行に関する。
【0002】
特に、本発明は、母親の食事へのラミナリンおよび/またはアルファフカンの補充により授乳期および離乳期出生児の栄養学的、免疫学的および微生物学的状態を改善することを目的とする。別の態様では、本発明は、ラミナリンおよび/またはアルファフカン含有調理品または飼料を利用して、ブタ、家禽、ヒツジ、ウマ、ウサギ、魚、ネコ、イヌ、ヒトおよび他の単胃の対象における免疫状態および免疫応答を改善することに関する。他の態様は、このような化合物を使用して、母親の食事のラミナリンおよび/またはアルファフカンによる補充後に、有益な化合物の子宮内、または初乳および授乳中の母乳経由での母親からの移行を介して、離乳家畜の体重増および飼料要求率増加で示される家畜の発育成績を上げることに関する。
【0003】
別の態様では、本発明は、微生物集団を全体的に減らすこと、または選択的に有益な細菌を助長することにより新生児の腸の無菌条件を操作し、胃腸系内の病原体の成長を抑制することに関する。別の態様は、炭水化物基質からの発酵を増やし、タンパク質基質からの発酵を減少させることによる、腸内の直鎖揮発性脂肪酸の産生増加および分岐鎖揮発性脂肪酸の産生減少に関する。さらに別の態様は、腸管中の選択的刺激性ビフィズス菌による、共役リノール酸やオメガ3脂肪酸を含む長鎖多価不飽和脂肪酸の合成に関する。
【0004】
別の態様では、本発明は、ムチンおよび/またはトレフォイルファクター(TFF)の生体内産生の上方制御、およびそれによる侵襲、感染または傷害に対する胃腸粘膜の保護と安定性の強化に関する。
【背景技術】
【0005】
発明の背景
小児科医および獣医師は、身体、認知および神経の成長を達成するためには、妊娠中に最適栄養摂取を行うことが重要であることをよく知っている。いくつかの試験により、栄養素および他の化合物の欠乏または毒性に関連した胎児の成長の効果、およびその後の生物季節学的特徴が証明された。これにより、重大な段階および分娩後の健全な成長速度の間の最適成長を得るために、出生前および周産期の食事介入の重要性が強調された。
【0006】
確認コピー
これらの問題に対処するため、スワンレポート(1969)の出版により、抗生物質耐性に関連した、特に公衆衛生に対する脅威をもたらすリスクのために、動物の飼料における抗生物質使用法に関しより厳密な管理が推進された。これが2006年1月の動物の飼料の成長促進抗生物質に関するEU禁止に結びついた。これらの成長促進剤の禁止により、集約型農業生産者向け市場に空白を生じ、また、天然の安全な代替物の調達の機会がもたらされた。ブタ、家禽、ウマ、ヒツジ、ウサギ、魚、ヒトおよび他の単胃型の対象の妊娠授乳用食事へのラミナリンおよび/またはアルファフカンの含有により、出産時および出産直後の重要な免疫学的および微生物学的状態に大きな効果が得られ、従って、その後の健康、成長および成長速度に関し大きな効果が得られると思われる。
【0007】
ラミナリンと呼ばれる藻類ベータグルカンは、(1→6)結合分岐部を有する場合もある、ベータ(1→3)−Dグルコシルサブユニットから成る。ラミナリアディギタータ由来のラミナリンは、2つの同族列の分子、すなわち、少数の22〜28グリコシル残基を含むGシリーズ、およびより多くのマンニトール残基に結合した20〜30グリコシル残基から成るMシリーズ、として存在する。ラミナリアの多くの種(ラミナリアヒペルボレアを含む)由来のラミナリンは相対的に不溶性であり、主にベータ(1→3)鎖から成る。一方、ラミナリアディギタータ由来のラミナリンは可溶で、分岐部に結合したベータ(1→6)から成り、量的には少ないが有意水準量は存在する(Read et al、1996)。
【0008】
酵母ベータグルカンは、少量のベータ(1→6)鎖を有するベータ(1→3)結合により結合された長い直鎖の1300〜1500グルコース残基のある状態で発見されている。ラミナリンより遙かに短い鎖長(平均=24残基)を有する(種によってはベータ(1→6)分岐部を含む場合もある)。ラミナリアディギタータは、ベータ(1→6)分岐を有し、このためこれ由来のグルカンが水溶性になっている。他のラミナリア種、例えば、ラミナリアヒペルボレア、はこの分岐を持たず、直鎖凝集体を形成し、このため、これ由来のグルカンが不溶性になっている。
【0009】
基本的に硫酸化アルファ−L−フコース残基から構成される天然の多糖類は、フコイダン(またはアルファフカン)として知られている。これらは、褐藻類、一部の棘皮動物中に存在し、ワカメ、例えば、アスコフィラムノドサム(Ascophyllum nodosum)およびラミナリア種、中で2番目に多い多糖である。強力な抗凝固、抗腫瘍、および抗ウイルス試薬であるため、アルファフカンは、多様な生物活性に関して広範に研究されてきた。
【0010】
本発明は、アルファフカン、特に、海産植物、例えば、ナマコの体壁中に存在するフカン;特に、海洋性藻類の細胞壁中およびウニ卵子の卵ゼリーコート中に存在するアルファフカンの使用を包含する。理想的には、本発明は、大型藻類中に存在するフコイダン(アルファフカン)を使用する。
【0011】
発明の目的
母親による移行機構を介して、重要な成長段階での有益な化合物の早期送達を確実にすることにより、家畜、例えば、ブタ、家禽、ウマならびにウサギ、魚、ネコ、イヌ、およびヒトの新生児の生物学的、免疫学的および発育成績に関連する特質を制御する新規方法を提供することが本発明の1つの目的である。別の目的は、出生前の子宮内交換または出生後の初乳または母乳を介した移行による送達のための母親の食事の中のラミナリンおよび/またはアルファフカン含有調理品による食事介入を提供することである。別の目的は、家畜、例えば、ブタ、家禽、ウマ、ならびにウサギ、ネコ、イヌ、魚およびヒトの生物学的、免疫学的および発育成績関連特性を制御するためのラミナリンおよび/またはアルファフカン含有調理品用の投与計画を提供することである。
【0012】
プロリンおよび抗炎症性のサイトカイン、白血球集団の発現、ならびに免疫グロブリン、ムチンおよびトレフォイルファクターの発現を変えることにより、その組成物が免疫応答に有益な影響を与えるようにすることが、さらなる本発明の目的である。
【0013】
本発明のさらなる目的には、優先的に炭水化物を発酵基質として代謝するものに有利なように微生物学的プロファイルを変えることにより、揮発性直鎖脂肪酸の産生を増加させ、分岐鎖脂肪酸(例えば、吉草酸、イソ吉草酸およびイソ酪酸)の産生を減らすことが含まれる。
【発明の概要】
【0014】
本発明の第1の態様では、母動物への投与により母動物の子孫の胃腸の健康または機能の改善と維持に使用するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンと少なくともひとつのフカンを含む組成物が提供される。
【0015】
本発明の第2の態様では、母動物の子孫の胃腸の健康または機能の改善と維持の方法を提供し、この方法は、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンと少なくともひとつのフカンを含む組成物を母動物に投与することを含む。
【0016】
組成物は、少なくとも1つのグルカンを含んでもよい。組成物が2つ以上のグルカンを含む場合は、各グルカンは、同じであっても異なっていてもよい。任意選択、または追加として、組成物は、少なくとも1つのフカンを含んでもよい。組成物が2つ以上のフカンを含む場合は、各フカンは、同じであっても、異なっていてもよい。任意選択で、組成物は、少なくとも1つのグルカン、少なくとも1つのフカン、またはそれらの混合物または組み合わせを含んでもよい。
【0017】
任意選択として、組成物は、周産期に、出生前に、および/または出生後に母動物に投与してもよい。「出生前」は、全体妊娠期間の初期(受精)から50%までの期間を意味する。子孫の胃腸の健康または機能の出生前の改善もしくは維持は、出生前の投与の間に生じる可能性がある。「周産期」は、全体妊娠期間の50%から出産の時間までの期間を意味する。子孫の胃腸の健康または機能の周産期の改善または維持は、周産期の投与の間に起こる可能性がある。「出生後」は、出産以降の期間を意味し、離乳期(子孫による母親の初乳または母乳の摂食終了後の期間)まで及ぶことが意図されている。子孫の胃腸の健康または機能の出生後の改善または維持は、出生後の投与の間に起こる可能性がある。
【0018】
「子孫」は、母動物の出生児を意味し、出生前の期間に子宮内で成長している出生児、および出生後の期間に体外で成長している出生児を含むことが意図されている。
【0019】
「グルカン」は、少なくとも2つの糖類モノマーを含み、任意選択としてD−グルコースモノマーを含んでもよい多糖分子を意味し、各モノマーは隣接するモノマーとグリコシド結合により結合している。多糖分子は、直鎖であっても分岐であってもよく、すなわち、多糖分子は直鎖多糖であっても分岐鎖多糖であってもよい。任意選択で、グルカンは、分岐鎖グルカンでもよい。グルカンは、アルファグルカンであっても、ベータグルカンであってもよい。任意選択で、グルカンは、ベータグルカンでもよい。「ベータグルカン」は、少なくとも1つのベータグリコシド結合を含むグルカンを意味する。グリコシド結合は、第1のモノマーの炭素原子が、任意選択で一重結合により、隣接するモノマーの炭素原子と結合を形成するグリコシド結合を意味することが意図されている。ベータグリコシド結合は、第1のモノマーの炭素原子に結合した官能基、任意選択でヒドロキシル基、がモノマーの面より上(赤道面上)に伸びているグリコシド結合を意味することが意図されている。任意選択で、第1のモノマーのC1炭素原子が隣接モノマーのC6炭素原子と、任意選択で一重結合により、結合を形成する。さらなる任意選択で、グルカンは、ベータ(1→6)グリコシド結合、任意選択で、酸素含有ベータ(1→6)グリコシド結合、を含む。任意選択で、少なくとも1つのグルカンは、ベータ(1→3、1→6)グルカンである。またさらなる任意選択で、グルカンは、ラミナリンである。
【0020】
「フカン」は、多糖、少なくとも2つのフコース糖類モノマーを含む多糖、任意選択で硫酸化多糖、を意味し、各モノマーは、グリコシド結合により隣接モノマーと結合している。多糖分子は、直鎖であっても、分岐であってもよい。任意選択で、フカンは分岐フカンである。フカンは、アルファフカンであっても、ベータフカンであってもよい。任意選択で、フカンはアルファフカンである。「アルファフカン」は、少なくとも1つのアルファグリコシド結合を含むフカンを意味する。グリコシド結合は、第1のモノマーの炭素原子が、任意選択で一重結合により、隣接するモノマーの炭素原子と結合を形成するグリコシド結合を意味することが意図されている。アルファグリコシド結合は、第1のモノマーの炭素原子に結合した官能基、任意選択でヒドロキシル基、がモノマーの面より下(軸方向)に伸びているグリコシド結合を意味することが意図されている。任意選択で、第1のモノマーのC1炭素原子が隣接するモノマーのC3またはC4炭素原子と結合、任意選択で一重結合、を形成する。
【0021】
任意選択で、フカンはフコイダンである。
【0022】
任意選択で、グルカンおよび/またはフカンは、褐藻類、任意選択で、ワカメから単離される。任意選択で、褐藻類は大型褐藻類である。任意選択で、大型褐藻類、任意選択で、ワカメ、は褐藻類から選択され、任意選択で、褐藻類コンブ目および褐藻類ヒバマタ目から選択される。さらなる任意選択で、褐藻類、任意選択で、ワカメ、はコンブ科、ヒバマタ科、およびカジメ科から選択される。任意選択で、大型褐藻類、任意選択で、ワカメ、はアスコフィルム種、任意選択で、アスコフィラムノドサムおよびラミナリア種、任意選択で、ラミナリアディギタータ、ラミナリアヒペルボレア、カラフトコンブ、マコンブまたはホンダワラ種から選択される。
【0023】
あるいは、グルカンおよび/またはフカンは、紅藻類(red alga)、任意選択で、紅藻(red seaweed)から単離される。任意選択で、紅藻類は大型藻類である。任意選択で、大型紅藻類、任意選択で、紅藻、は真正紅藻綱から選択され、任意選択で、真正紅藻綱スギノリ目から選択され、任意選択で、スギノリ科から選択される。
【0024】
任意選択で、組成物を母動物に毎日投与する。
【0025】
任意選択で、1kgの体重当たり約3〜50ミリグラムのグルカンの投与に相当する組成物の量を、任意選択で毎日、母動物に投与する。さらなる任意選択で、1kgの体重当たり約2〜40ミリグラムのフカンの投与に相当する組成物の量を、任意選択で毎日、母動物に投与する。任意選択で、1kgの体重当たり約3〜50ミリグラムのグルカンの投与に相当する組成物の量を、任意選択で毎日、動物に投与する。さらなる任意選択で、1kgの体重当たり約2〜40ミリグラムのフカンの投与に相当する組成物の量を、任意選択で毎日、動物に投与する。任意選択で、動物は単胃の動物である。さらなる任意選択では、動物は、ブタ、家禽、ウマ、ヒツジ、ウサギ、魚、ネコ、イヌ、およびヒトである。
【0026】
「胃腸の健康または機能の改善と維持」は、生理的な機能または胃腸管の組織像改善および/または胃腸管の微生物学的集団の改善を意味する。さらに、宿主の免疫学的状態を改善することにより分子レベルで胃腸の改善または維持が可能である。胃腸の健康または機能の改善または維持は、不十分な胃腸の健康または機能に関連した障害、例えば、クローン病、過敏性腸症候群、および他の同類の慢性状態を防ぐこと、または予防的に治療することが意図されている。不十分な胃腸の健康に関係した他の障害は、重篤さは少なく、下痢症を生ずることが多い食品媒介病原菌およびある種の細菌やウイルス、悪い糞便の質、低出産体重または体重増加、または不十分な胃腸の健康による他の症状、を含みうる。
【0027】
任意選択で、胃腸の健康または機能は、母動物の初乳または母乳中の免疫グロブリンの濃度、任意選択で、免疫グロブリンGの濃度、を増やすことにより改善または維持される。
【0028】
任意選択で、胃腸の健康または機能は、母動物の初乳または母乳中の粗タンパク質濃度を増やすことにより改善または維持される。
【0029】
任意選択で、胃腸の健康または機能は、子孫の細菌性、任意選択で病原菌性、感染を減らすことにより改善または維持される。さらなる任意選択で、細菌性、任意選択で病原菌性、感染は腸内細菌感染であり、任意選択でサルモネラおよび大腸菌から選択される。
【0030】
任意選択で、胃腸の健康または機能は、サイトカインの発現を増やすことにより改善または維持される。サイトカインは、任意選択で、腫瘍壊死因子アルファ、インターロイキン−1アルファ、インターロイキン−6、およびトレフォイルファクター3から選択される。
【0031】
任意選択で、胃腸の健康または機能は、揮発性分岐鎖脂肪酸の濃度を減らすことにより改善または維持される。分岐鎖脂肪酸は、任意選択で、イソ酪酸、吉草酸、およびイソ吉草酸から選択される。
【0032】
任意選択で、胃腸の健康または機能は、貪食細胞、任意選択で白血球、好中球、好酸球、単球、またはリンパ球、さらなる任意選択で、白血球、好酸球またはリンパ球、の濃度または活性を変えることにより改善または維持される。さらなる任意選択で、白血球の濃度または活性を上げ、および/またはリンパ球の濃度または活性を下げ、および/または好酸球の濃度または活性を減らす。
【0033】
本発明のさらなる態様では、1キログラムの体重あたり約3〜50ミリグラムのグルカンの投与に相当する組成物の量を、任意選択で毎日、動物に投与すること;または1キログラムの体重あたり約2〜40ミリグラムのフカンの投与に相当する組成物の量を、任意選択で毎日、動物に投与することにより、動物の胃腸の健康または機能を改善または維持するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンと少なくとも1つのフカンを含む組成物が提供される。
【0034】
またさらなる本発明の態様では、動物の胃腸の健康または機能の改善または維持する方法を提供し、この方法は、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンと少なくとも1つのフカンを含む組成物を、1キログラムの体重あたり約3〜50ミリグラムのグルカンの投与に相当する量で、任意選択で毎日、動物に投与すること;または1キログラムの体重あたり約2〜40ミリグラムのフカンの投与に相当する該組成物の量を、任意選択で毎日、動物に投与することを含む。
【0035】
任意選択で、組成物がさらに糖、任意選択で、二糖を含み、任意選択でラクトース、ショ糖、ラクツロース、およびマルトースから選択される。さらなる任意選択で、組成物は、さらに糖、任意選択で、二糖を含み、任意選択でラクトース、ショ糖、ラクツロース、およびマルトースから選択される。
【0036】
任意選択で、胃腸の健康または機能が細菌感染、任意選択で、大腸菌感染を減らすことにより改善または維持される。任意選択で、胃腸の健康または機能が改善または維持され、下痢症が防がれ、または予防的に治療される。
【0037】
任意選択で、胃腸の健康または機能は、任意選択で抗原の存在下、サイトカインの発現を増加させることにより改善または維持される。さらなる任意選択で、抗原は、細菌性抗原、任意選択で、細菌性リポ多糖類である。任意選択で、サイトカインはインターロイキン−6およびインターロイキン−8から選択される。
【0038】
任意選択で、胃腸の健康または機能は、ムチン、任意選択で、ムチン−2および/またはムチン−4、の発現を増加させることにより改善または維持される。
【0039】
任意選択で、胃腸の健康または機能は、サーコウイルスまたはパルボウイルス、任意選択で、ブタサーコウイルスまたはブタパルボウイルスの濃度を減らすことにより改善または維持される。さらなる任意選択で、ブタサーコウイルスは2型ブタサーコウイルスである。
【0040】
任意選択で、胃腸の健康または機能は、直鎖揮発性脂肪酸の濃度を増やすことにより改善または維持される。
【0041】
本発明者等は、(I)腸の組織像、(II)腸の微生物学、(III)プロリン−および抗−炎症性サイトカインの発現、(III)新生児血清免疫グロブリンレベル、(IV)ムチン産生、(V)トレフォイルファクター産生、(VI)初乳および母乳の栄養学的および免疫学的組成および(VII)性能指数、に与える効果を変えるラミナリンおよび/またはアルファフカン製剤を含む組成物を開発した。さらに、感染と炎症の減少に由来する罹患率と死亡率の減少という利益に関連する腸内細菌集団に対する明らかに有害な作用が認められた。
【0042】
従って、本発明は、出生前および出生後の母親の食事の補充によって、新生児および離乳児の胃腸の健康および免疫を改善する方法においてベータグルカンおよび/またはアルファフカンを含む組成物の使用を提供する。好ましい実施形態では、ベータグルカンおよびアルファフカンは、海藻および一部の棘皮動物を含む2つ以上のソース由来であってもよい。海藻は、コンブ科、ヒバマタ科、スギノリ科またはカジメ科からなる群由来であってもよい。
【0043】
本発明はまた、下記の方法において、ベータグルカンおよび/またはアルファフカンを含む組成物の使用を提供する:
−新生児および離乳児の胃腸の細菌性集団を減らすために、母親の栄養学的補助食品または飼料を作成する方法において;
−新生児および離乳児の罹患率および死亡率を減らすために、母親の栄養学的補助食品または飼料を作成する方法において;
−新生児および離乳児の絨毛高を増やす、陰窩深を減らす、または全体絨毛高/陰窩深比率を増やすことにより消化組織像を改善するために、母親の栄養学的補助食品または飼料を作成する方法において;
−平均1日増体量の増加、平均1日飼料摂取量の増加、および増体/飼料比の改善を含む、家畜、例えば、ブタ、家禽、ウマ、ならびにウサギ、魚、ネコ、イヌおよびヒト、等の家畜の子孫の発育成績を改善するために、母親の栄養学的補助食品または飼料を作成する方法において;
−母親の食事を補助して、有益なミクロフローラを助長し、病原性ミクロフローラを減らし、また、新生児および離乳児の能力を改善することにより胃腸の健康を改善する方法において;
−胃腸の上皮の物理的保護を強化する手段として、上皮細胞によるムチンおよびトレフォイルファクターの産生を上方制御する方法において;
【0044】
さらなる態様では、本発明は、ベータグルカンおよび/またはアルファフカンを含む組成物をヒト、非ヒト動物または家禽に摂食させることにより上記の効果を達成する方法を提供する。
【0045】
またさらなる態様では、本発明は、下記を提供する:
−直接に食事を、または出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、家畜、例えば、ブタ、家禽、ウマ、ヒツジならびにウサギ、魚、ネコ、イヌおよびヒト、の細菌性またはウイルス感染および炎症を防止するための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、栄養学的質を改善し初乳および母乳の免疫グロブリンレベルを増やすための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補って、有益な免疫賦活性化合物を胎盤膜を通って子宮内移行することにより新生児の血清免疫グロブリンレベルを増やすための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、初乳または母乳の摂取増加により新生児血清免疫グロブリンレベルを増やすための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、新生児ブタ、家禽、ウマ、ならびにウサギ、魚、ネコ、イヌ、ヒトおよび他の単胃の対象の胃腸中の大腸菌を含む腸内細菌集団を減らすための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補うことによる、離乳関連軽減機能性胃腸障害のための投与計画;
−出生前後の期間の母親の食事を、ベータグルカンおよびアルファフカンを含む組成物で補って、出生直後の腸の細菌性コロニー形成の期間に、支配的比率の有益な細菌の選択的助長および病原菌の成長の選択的抑制をすることにより新生児および離乳児の健全な腸微生物学的プロファイルを促進するための投与計画;
【0046】
ラミナリンの投与計画は、1キログラム体重あたり、3ミリグラム超/日〜最大50ミリグラム/日のラミナリンの毎日の投与量であってもよい。
【0047】
アルファフカンの投与計画は、1キログラム体重あたり、2ミリグラム超/日〜最大40ミリグラム/日の毎日の投与量であってもよい。
【0048】
ラミナリンとアルファフカンの組み合わせの投与計画は、1キログラム体重あたり、3ミリグラム超/日〜最大50ミリグラム/日のラミナリンの毎日の投与量を、1キログラム体重あたり、2ミリグラム超/日〜最大50ミリグラム/日のアルファフカンの毎日の投与量と組み合わせて投与してもよい。
【0049】
また、本発明は、ベータグルカンおよび/またはアルファフカンを含む組成物の下記の目的の方法に関しての使用を提供する:
−体内での直鎖揮発性脂肪酸産生を増やすための;
−体内での分岐鎖揮発性脂肪酸産生およびそれらの排出を減らすための;
−体内での長鎖多価不飽和脂肪酸産生を増やすための;
−免疫攻撃された家畜、例えば、ブタ、家禽、ウマ、ならびにウサギ、魚、ヒトおよび他の単胃の対象、の免疫状態および応答を改善するための;
−プロリン−および抗−炎症性のサイトカイン、ムチンおよびトレフォイルファクターの発現を増やすことにより免疫状態を改善するための。
【図面の簡単な説明】
【0050】
以降で、本発明の実施形態について、非制限的実施例、およびこれに付随する下記の図に対する参照を使用して説明する。
【図1】は、基礎食摂取子ブタのPCV2特異的抗体力価を示す。
【図2】は、LAM+FUCを補充した基礎食事摂取子ブタのPCV2特異的抗体力価を示す。
【図3】は、LAM+FUCおよびWPIを補充した基礎食事摂取子ブタのPCV2特異的抗体力価を示す。
【図4】は、異なる食事に慣らし、その後PCV2およびPPVの攻撃を受けた子ブタのリンパ球集団割合を示す。
【図5】は、異なる食事を給餌され、その後PCV2およびPPV(Day14PI)で攻撃を受けた子ブタの平均好酸球集団パーセンテージを示す。
【図6】は、異なる食事に慣らし、その後PCV2およびPPVの攻撃を受けた子ブタの平均末期体重(Kg)を示す。
【図7】は、異なる食事に慣らし、その後PCV2およびPPVの攻撃を受けた子ブタの糞便中で検出された平均PCV2DNAコピー数を示す。
【図8】は、異なる食事に慣らした子ブタのPCV2DNAコピー数を示す。
【発明を実施するための形態】
【0051】
実施例
実施例では、ヒト、動物および家禽を含む全ての単胃生物のモデルとして、ブタの研究対象に対するラミナリンおよび/またはフコイダン補充の効果に関する調査研究の結果が示される。実施例には、ラミナリンおよびフコイダンを組み合わせて(以降、SWEと呼ぶ)、または各化合物を別々にラミナリン(以降、LAMと呼び)またはフコイダン(以降、FUCと呼び)として含む海藻抽出物を使って行った試験が含まれる。
【0052】
実施例1
材料および方法
動物および処置
40匹の妊娠ブタを4つの食事療法の内の1つに割り当てた(n=10匹雌ブタ/処置):(T1)基礎授乳;(T2)基礎授乳+100g/日魚油(F.O.);(T3)基礎授乳+1.8g/日SWE;および(T4)基礎授乳+100g/日F.O.+1.8g/日SWE(妊娠の109日目から26日での離乳まで)。SWEは、一日量のラミナリン(1g)およびフコイダン(0.8g)を含有。被験動物に対し、食事に実験栄養補助剤を毎日追加した。出生時に体重を記録し、3匹の子ブタを選別して、同腹仔の平均出生時体重の代表値とした。これらは離乳まで毎週秤量した。離乳時に、120匹の雄雌混合ブタ(1匹の同腹仔当たり3匹のブタ;平均体重=8.05±0.46Kg)を選択し、スターター飼料を21日間与えた。飼料と水は実験中自由に入手できるようにした。ブタは、離乳(day0)の日に別々に秤量し、その後は離乳後、7、14および21日目に秤量した。飼料摂取量を毎日記録した。
【0053】
標本採取
30mlの初乳および母乳を分娩後、day0および12に雌ブタから採取した。血液サンプルを、授乳のday5および12に2匹の子ブタ/同腹仔の頸静脈から免疫グロブリン分析用として採取した。Association of Official Analytical Chemists(AOAC、1995)に従って、粗タンパク質を測定した。
【0054】
免疫グロブリンの定量
免疫グロブリンアッセイを、特異的ブタELISA定量キット(Bethyl Laboratories、Inc.、Montgomery、Texas、USA)を使って実施した。雌ブタの初乳および母乳および子ブタ血清を使って、Ilsley and Miller(2005)により記述されているようにして、ブタアッセイを行った。
【0055】
選択した微生物集団の分析
胃腸内容物標本を無菌的に屠殺後の各ブタの盲腸および結腸から取り出した。ビフィズス菌、大腸菌および乳酸桿菌種集団をPierce et al.(2006)に従って選択的に単離し、列挙した。
【0056】
揮発性脂肪酸(VFA)分析
Pierce et al.(2006)の手続きに従ったガスクロマトグラフィーによる方法により、盲腸および結腸からの胃腸内容物標本をVFA分析用に回収した。
【0057】
組織学的分析
十二指腸、空腸および回腸の切片を、10%リン酸塩緩衝ホルマリン中で無菌的に取りはずし、摘出および固定した。各腸セグメントの5μm厚さの断面をヘマトキシリンおよびエオシンで染色した。絨毛高および陰窩深をイメージアナライザー(Image Pro Plus;Media Cybernetics、Bethesda、MD、USA)付き光顕微鏡を使って測定した。
【0058】
フローサイトメトリーによる血球細胞の食作用評価
非オプソニン化、FITC標識大腸菌の摂食を測定する、PHAGOTEST(登録商標)キット(Orpegen Pharma、Heidelberg、Germany)を全血球細胞の貪食活性測定に使用した。標本をDakoCyan−ADPフローサイトメーター(Dako、Glostrup、Denmark)を使って解析した。
【0059】
回腸および結腸遺伝子発現−RNA抽出およびcDNA合成
組織標本を回腸および結腸から採取し、氷冷PBSで洗浄後直ちにRNAlater(登録商標)(Ambion Inc、Austin、TX)を含むチューブに入れた。全RNAをGene Elute Mammalian Total RNA Miniprepキット(Sigma−Aldrich)を使って抽出し、NanoDropND1000分光光度計(Thermo Fisher Scientific Inc.MA、USA)を使って定量した。260および280nmでの吸光度比を測定し純度を評価した。全体RNAを、First Strand cDNA Synthesisキット(Fermentas)とオリゴdTプライマーを使って逆転写(RT)した。
【0060】
定量的リアルタイムPCR(qPCR)
定量的リアルタイム(qPCR)アッセイを、7900HT ABI Prism Sequence Detection System(PE Applied Biosystems、Foster City、CA)上で、SYBR Green PCR Master Mix(Applied Biosystems)を使ってcDNA標本で実施した。RT−PCR(IL−1α、IL−6、IL−10、TNF−α、MUC2、TFF3、GAPDH、B2M、ACTS、PPIAおよびYWHAZ)に使った全プライマーは、Primer Express(登録商標)ソフトウェアを使って設計した。増幅を、10μlのSYBR PCR Mastermix、1μlの順方向および逆方向プライマー、8μlのDPEC処理水および1μlのテンプレートcDNA中で実施した。PCR産物の解離分析を行い、得られたPCR産物の特異性を確認した。
【0061】
結果
初乳および母乳組成物
初乳IgGレベルは、SWEを補充した雌ブタで有意に高かった(p<0.01)。補充により雌ブタの母乳中のタンパク質濃度が12日目に増加した(p<0.05)。
【表1】

【0062】
哺乳子豚の免疫グロブリン
SWE補充雌ブタから授乳した小ブタは、授乳の5日目(p<0.01)と12日目(p<0.05)に有意に高い血清中IgG濃度を示し、授乳5日目に高い血清IgA濃度を示した(p>0.05)。
【表2】

【0063】
哺乳子豚の発育成績
SWE補充雌ブタから授乳した小ブタは、授乳の第1週目の間、有意に低い平均1日増体量を示した(p<0.05)。出生と離乳の間の1日増体量に有意差はなかった。同腹仔サイズ、同腹仔体重、子ブタ出産体重および離乳時体重は、雌ブタの食事療法の影響を受けなかった。
【表3】

【0064】
離乳後の子ブタの発育成績
SWE補充雌ブタから授乳した小ブタは、離乳後7〜14日目(p<0.05)、離乳後0〜21日目(p=0.063)に有意に高いADGを示し、また離乳後7〜14日目に有意に高い食事摂取量を示した(p<0.05)。
【表4】

【0065】
微生物学
結腸では、母親のSWE補充により、ビフィズス菌集団の有意な減少が生じた(p<0.01)。さらに、SWE補充により、対象と比べて結腸中の大腸菌および乳酸桿菌集団を減少させる傾向が認められた(p=0.09)。
【表5】

【0066】
サイトカイン遺伝子発現
離乳後ブタの回腸では、母親へのSWE補充がプロリン炎症性サイトカインTNF−α発現の有意な増加を誘導した(p<0.01)。また、結腸でのTFF3遺伝子発現の有意な増加も認められた(p<0.05)。
【表6】

【0067】
揮発性脂肪酸(VFA)分析およびpH測定
【表7】

【0068】
組織像
回腸では、SWE補充が絨毛高および絨毛高の陰窩深に対する比率に与える有意な効果があった(p<0.05)。また、十二指腸での結果も、陰窩深に対するSWE補充と同様の有益な効果を示した(p>0.10)。
【表8】

【0069】
食作用能力
SWE補充は、授乳子ブタの全好酸球数に対し抑制効果を発揮した(p<0.01)。SWE補充食事は、SWE非補充食事に比較して、高い割合の大腸菌貪食白血球(p<0.05)および低い割合の大腸菌貪食リンパ球(p<0.01)を生成した。
【表9】

【0070】
実施例2 実験1
材料および方法
実験計画および食事
実験1を下記の5つの食事療法を含む完全な無作為化方式として計画した:(T1)0g/Kg SWE(対照)、(T2)0.7g/Kg SWE、(T3)1.4g/Kg SWE抽出物、(T4)2.8g/Kg SWE抽出物および(T5)5.6g/Kg SWE抽出物。SWEは、LAM+FUCを含む。全食事を同じ濃度の正味エネルギーおよび合計リシンを有するように処方した。アミノ酸要求をリシンに対して合わせた(Close、1994)。灰分消化率の測定を行うために、150ppmの速度で粉砕するときに酸化クロムを全食事に添加した。
【0071】
動物および管理
51±3.4Kgの初期生体重を有する30匹の仕上げ成熟雄ブタを実験に使用した。ブタを生体重に基づいて区分けし、無作為に5つの食事療法の1つに割り付けた。ブタを14日間の食事適応期間を与え、その後、秤量し別々の代謝クレートに移した。動物に5日間の順化を行わせ、5日間の採取期間で見かけ消化率を促進し、さらに窒素バランス調査を行った。1日摂取許容量(DE摂取量=3.44x(生体重)0.54(Close、1994))を2回の食事に分けた。水を食事と一緒に1:1の比率で与えた。食事の間に、新しい水を自由に与えた。代謝クレートを環境制御室で割り付け、22℃(±1.5℃)の定温で維持した。
【0072】
全消化管見かけ消化率係数(CTTAD)および窒素バランス調査
採取中、クレート下部の漏斗経由で尿を20mlの硫酸(25%H2SO4)を含むプラスチック容器に採取した。窒素の揮発を避けるため、漏斗に毎日4回、弱塩酸(2%H2SO4)溶液を吹き付けた。尿容量を毎日記録し、50mlの標本を採取し、研究室分析用に冷凍した。総糞便重量を毎日記録し、100℃でオーブン乾燥した。新しく排泄された糞便の標本を毎日集め、窒素分析とpH測定用として冷凍した。採取期間の最後で、糞便標本をプールし、副標本を研究室分析用に保管した。飼料標本を毎日集め化学分析用に保管した。全30匹のブタを屠殺までそのそれぞれの食事療法のまま保持した。
【0073】
実施例2 実験2
材料および方法
実験計画および食事
この実験を下記4つの食事療法を含む2x2要因配置として計画した:(T1)対照食事、(T2)対照+300ppm LAM、(T3)対照+238ppm FUC、(T4)対照+300ppm LAM+238ppm FUC。全食事を正味エネルギー(9.8MJ/Kg)と全リシン(10g/Kg)で規格化した。アミノ酸要求をリシンに対して合わせた(Close、1994)。
【表10】

【0074】
動物および管理
55Kgの初期生体重を有する28匹の仕上げ成熟雄ブタを使用した。ブタを生体重に基づいて区分けし、無作為に4つの食事療法の1つに割り付けた。ブタに28日間の食事適応期間を与え、その後秤量し、屠殺した。
【0075】
近接する盲腸と結腸中の灰分の微生物学および見かけ消化率
屠殺後各動物の近接した盲腸および結腸から胃腸内容物を取り出した。マーカーとして酸化クロムを使って盲腸および結腸中の消化率を測定した。ビフィズス菌種、乳酸桿菌種および腸内細菌を、O’Connell et al.、(2005)により記載された方法に従って単離、計数した。
【0076】
揮発性脂肪酸標本採取および分析
それぞれのブタの盲腸由来の胃腸内容物および近接したおよび遠位の結腸の検体をVFA分析用に採取した。O’Connell et al.(2005)に従って改良したPorterとMurray(2001)の方法を使って、胃腸内容物中のVFA濃度を測定した。
【0077】
結果
実験1−微生物学的調査
【表11】

【0078】
実験1−CFAsc:産生的に見かけ灰分消化率を増加する、その胃腸表面の発酵基質の合計リシン(10.0)分析
【表12】

【0079】
実験1−揮発性脂肪酸調査
【表13】

【0080】
実験2−微生物学調査
【表14】

【0081】
実験2−揮発性脂肪酸調査
【表15】

【0082】
実施例3
実験計画および食事
この実験は、25日間を2回連続して行った。240匹の子ブタを離乳後24日目に選別し、4つの食事療法の1つに割り当てた。期間1と2のブタはそれぞれ7.2Kgおよび7.8Kg(±0.9Kg)の生体重であった。この実験を2x2要因計画で行った。実験(0〜25日)の間、子ブタに次の食事を与えた:(T1)150g/Kgラクトース;(T2)150g/Kgラクトース+SWE;(T3)250g/Kgラクトース(T4)250g/Kgラクトース+SWE。SWEは、2.8g/Kgとし、これはラミナリアディギタータ由来であり、ラミナリン(112g/Kg)、フコイダン(89g/Kg)および灰分(799g/Kg)が含まれている。
【0083】
動物および管理
ブタを4つのグループ(n=15匹/処置)に分けて収容し、離乳(0日目)、7、14および25日目に秤量した。ブタは自由に摂食させた。新しい糞便検体を10〜15日目に採取し、栄養消化率測定およびVFA分析用とした。新しい糞便を10日目に採取し大腸菌と乳酸桿菌の計数用とした(O’Connell et al.、2005)。
【0084】
微生物学
1gの糞便検体をマキシマムリカバリー希釈液(MRD;Oxoid、Basingstoke、UK)で系列希釈し、選んだ寒天に蒔いた。乳酸桿菌種をde Man Rogosa Sharp寒天(MRS、Oxoid)に単離した。API50CHL(BioMerieux、France)キットを使って、疑わしい乳酸桿菌spp.を確認した。大腸菌種をMacConkey寒天(Oxoid)に単離した。疑わしいコロニーをAPI20E(BioMerieux、France)で確認した。
【0085】
結果
発育成績
【表16】

【0086】
全消化管見かけ消化率係数(CTTAD)
【表17】

【0087】
微生物学およびVFA
【表18】

【0088】
実施例4
実験計画および食事
初期生体重6.4±0.785Kgの192匹の24日齢離乳子ブタを4つの食事療法の1つまたは21日の離乳に割り当てた。食事療法は、(T1)基礎食事、(T2)基礎食事+300ppm LAM、(T3)基礎食事+236ppm FUC、(T4)基礎食事+300ppm LAM+236ppm FUC、から構成されている。食事を同じ濃度の消化可能エネルギー(DE)(16MJ/Kg)および回腸消化可能リシン(14g/Kg)となるよう処方した。総アミノ酸要求をリシンに対して合わせた(Close、1994)。栄養消化率測定のために酸化クロム(III)を食事に添加した。LAMおよびFUCをラミナリアヒペルボレア由来とした。
【0089】
管理
子ブタをグループ4に収納し毎日2回摂食させた。水は自由に与えた。病気の症状を呈する全てのブタを適切に処置し、記録した。ブタを0(離乳の日)、7、14および21日目に秤量した。飼料摂取量を毎週モニターした。新しい糞便検体を10日目に採取し大腸菌および乳酸桿菌濃度測定に供した。糞便献体を各家畜から12〜17日目に採取し化学分析用に保管した。新しい糞便検体を14日目に取り出し、冷凍して揮発性脂肪酸分析用に保管した。新しい糞便検体を17日目に採取しpH測定に供した。
【0090】
糞便スコアリングおよび罹患率
0〜21日目にブタの下痢症の臨床的兆候を観察した。スコアリングシステムを適用し兆候の存在と重症度を示した。次のスコアリングシステムを使った:1=固い、2=やや柔らかい、3=柔らかい、部分形成、4=緩い、半液状および5=水様、粘液様。
【0091】
微生物学
献体を9.0mlのマキシマムリカバリー希釈液(MRD、Oxoid、Basingstoke、UK)を使って系列希釈(1:10)し、選択した寒天に拡散播種した(0.1ml分量)。乳酸桿菌をdeMan、Rogosa、Sharp寒天(MRS、Oxoid)を用い、5%CO2中37℃で一晩インキュベーションして単離した。API50CHL(BioMerieux、France)キットを使って疑わしい乳酸桿菌sppを確認した。大腸菌種を、37℃で18〜24時間の好気性インキュベーションの後、MacConkey寒天(Oxoid)に単離した。疑わしいコロニーをAPI20E(BioMerieux、France)を使って確認した。
【0092】
結果
発育成績
LAM補充食を摂食したブタは、LAM無補充食を受けたブタに比べ、7〜14日目の間に(0.344 v 0.266、p<0.01)、および全実験期間の間に(0.324 v 0.232、p<0.01)ADGが増加した。LAM補充食摂食ブタは、栄養補助されないLAM食に比べ、7〜14日目の間に(0.763 vs.0.569、p<0.001)および全実験期間の間に(0.703 v 0.646、p<0.05)増体/飼料比が改善した。14〜21日目の間に、ADGに関しLAMおよびFUC補充間で有意な相互作用(p<0.05)が認められた。FUC食を受けたブタは、基礎食事を受けたブタより有意に高いADGを示したが、LAM食事にFUCを追加した場合には、効果は認められなかった。平均1日飼料摂取量にLAMまたはFUCを入れた場合には、効果は認められなかった。
【表19】

【0093】
糞便pH、DM、糞便スコア
LAM補充食を摂食したブタは、非栄養補助LAM食に比べ糞便DM含量が増加した(28.64 v 26.24;p<0.05)。LAM補充食を摂食したブタは、7〜14日目の間に糞便スコアが減少した(2.05 v 2.57;p<0.05)。糞便スコアに関し、全実験期間の間(0〜21日目)LAMおよびFUC含有間に有意な相互作用が認められた(P<0.05)。LAMとFUCの組み合わせを摂食したブタは、FUC単独食を受けたブタに比べ、糞便スコアが減少した。しかし、基礎食事に比較して、LAM添加の糞便スコアに対する効果は認められなかった。
【表20】

【0094】
微生物学および揮発性脂肪酸(VFA)
LAM食を摂食したブタは、LAM非補充食を摂食したブタに比較して糞便大腸菌集団が減少した(7.22 vs.7.84;p<0.05)。糞便乳酸桿菌集団に関して、LAMおよびFUC間に有意な相互作用(P<0.01)が認められた。FUC食を受けたブタは、基礎食事を受けたブタに比べ乳酸桿菌数が増加した(9.22 v 8.93)が、LAMと一緒に入れた場合には、糞便乳酸桿菌集団に対するFUCの効果は認められなかった。揮発性脂肪酸濃度に対する有意な処置効果は認められなかった。
【表21】

【0095】
LAM補充食を摂食したブタは、非栄養補助食を摂食したブタに比較して、平均1日増体量(ADG)および増体/飼料比(GFR)が改善された。LAMに対するこの陽性の応答は、これらのブタの腸中大腸菌集団の減少に起因する可能性がある。LAM補充食では、LAM非補助食を摂取したブタに比べ、7〜14日目の間に糞便大腸菌集団の減少を生じ、これは糞便DMの減少および下痢症の減少(より低い糞便スコア)を生じた。食事へのLAMの含有によりブタの腸内に腸内細菌集団の減少が生じた。このように、ラミナリン食摂食ブタに発育成績の改善が認められ、これはLAMの抗菌特性と関連し、この結果、ブタの腸内の健康状態の改善および大腸菌型負荷の減少が生ずると思われる。免疫細胞の特異的受容体へのLAMの結合による粘膜免疫の調節が、細菌のコロニー形成および増殖を防ぎ、その結果、その後の腸壁の損傷を防ぐことによりブタの健康に有益な効果を与える可能性がある。FUC補充食中の乳酸桿菌spp.の増殖は、ある割合の補充FUCが前腸での加水分解を避けて結腸に入り細菌性発酵を起こすことを示唆していると思われる。糖分解種の細菌、例えば、乳酸桿菌spp.、は複合体炭水化物の分解に寄与する。FUCは水に可溶で、それを急速に発酵性炭水化物源にする。乳酸桿菌種は、L−フコースを含む多くの単糖類を発酵させると報告されている。細菌の研究で、結腸中の乳酸桿菌spp.の濃度がFUC含有により増加することが明らかになった。乳酸桿菌集団の増加に拘わらず、VFA濃度またはプロファイルに対し食事効果が認められなかった。大腸で作られるVFA量は、基質の組成と量、および存在するミクロフローラに依存する(MacFarlane and MacFarlane、2003)。しかし、糞便VFA濃度は、大腸中での発酵強度を示すには、全体としては正しくない可能性がある。
【0096】
FUC+LAMの組み合わせ食事は、離乳後の下痢症を減らすには、最も有効であった。これには多くの理由が考えられる。第1に、組み合わせ食摂食からくる免疫応答である可能性がある。第2に、組み合わせ処置に伴う糞便大腸菌数の減少があった。下痢症を呈するブタは大量の溶血性大腸菌を住まわせている。従って、腸中の大腸菌の数の減少により、下痢症の重症度が低下し、最終的には離乳後子ブタ罹患率が減少するのであろう。
【0097】
全体として、糞便大腸菌集団の減少ならびにADGおよびGFRの増加により、LAMが離乳後の腸の健康を改善するための食事手段を提供する可能性があることが示唆される。しかし、LAMとFUCの組み合わせは、下痢症を減らすのにより有効である。
【0098】
実施例5
実験計画および動物の食事
初期体重17.9±2.2Kgの21匹のブタを3つの食事療法の1つに割り当てた:(T1)対照;(T2)基礎食事+300ppm LAM;(T3)基礎食事+600ppm LAM。自由摂取実験を21日間続けた。食事は、類似の消化可能エネルギー(DE)(14.4MJ/Kg)および回腸消化可能リシン(12.5g/Kg)を有するように処方した。
【0099】
微生物および揮発性脂肪酸(VFA)分析
屠殺後、胃腸を解剖で取り出し胃腸内容物を回腸から取り出した。各胃腸内容物献体をマキシマムリカバリー希釈液(MRD、Oxoid、Basingstoke、UK)で系列希釈し、選択寒天に拡散播種した。ビフィズス菌、乳酸桿菌および腸内細菌種をPierce et al.(2005)により記載された方法に従って単離した。VFA濃度測定に使う胃腸内容物献体を盲腸、ならびに回腸および結腸の同じ位置からから採取した。VFA分析は、Pierce et al.、(2005)により記載された方法に従いガス液体クロマトグラフィー(GLC)を使って行った。
【0100】
組織検体採取および組織攻撃手続き
回腸および結腸組織を胃腸内容物検体と同じ位置から摘出した。切除組織を腸間膜に沿って解剖して組織を空にし、無菌の燐酸塩緩衝食塩水(PBS)(Oxoid)で洗浄した。覆っている平滑筋を取り除いて、1cm3の組織断面を各組織から切り取った。各組織の2つの断面を1mlのダルベッコのModified Eagle’s Medium(DMEM)(Gibco)中に入れ、1つは10μg/mlの濃度の細菌性リポ多糖類(LPS)(Sigma Aldrich)の存在下のものに入れた。他の組織標本は対照として使用し、LPSが無い場合には無菌のDMEM中でインキュベートした。攻撃を受けたおよび未処置組織の両方を37℃で90分間インキュベートした後、取り出して吸い取り乾燥して秤量した。約1〜2gのブタの回腸および結腸組織を切断して小片とし、15mlのRNAlater(登録商標)(Applied Biosystems、Foster City、CA)中に入れた。RNAlater(登録商標)を除去した後、検体をRNA抽出で使用するまで−80℃で保存した。
【0101】
定量的リアルタイムPCR(qRT−PCR)用の未処置組織の調製
回腸および結腸組織をRNAlater(登録商標)溶液中で安定化させ、4℃で一晩貯蔵した。翌日、RNAlater(登録商標)を除去し検体を−86℃でRNA抽出まで貯蔵した。
【0102】
RNA抽出およびcDNA合成
RNA抽出用の組織標本を−86℃から取りだし、ホモジナイズした。500μ1の溶菌液/2−MEを各検体に添加し、これらを検体毎に1つの5mmステンレス鋼ビーズを使って機械的に粉砕した。次に組織破砕機(Qiagen)に入れ、ライセートを3分間ホモジナイズした後、GenElute Filtration Column(Sigma Aldrich)に移してRNAを抽出した。1μgの総RNA、oligo(dT)20プライマーを用い、逆転写ポリメラーゼ連鎖反応(RT−PCR)(Invitrogen Life Technologies、Carlsbad、CA)用のSuperscript(登録商標)III First−Strand synthesis systemを使って20μlの最終反応容量でcDNA合成を行った。cDNA合成の最終ステップで、大腸菌RNase H(Invitrogen Corp.)を用いて処置を行い、残っているRNA/mRNAテンプレートを消化して、次のqRT−PCR反応用の一本鎖cDNAテンプレートを産生した。
【0103】
定量的リアルタイムPCR(qPCR)およびqPCRデータの正規化
サイトカイン遺伝子インターフェロンガンマ(IFN−γ)、インターロイキン−1α(IL−1a)、IL−6、IL−8、IL−10、IL−17、腫瘍壊死因子(TNF−α)、ムチン遺伝子(MUC1、2、4、5AC、12、13および20)および3つのリファレンス遺伝子、β−アクチン(ACTB)、グリセルアルデヒド−3−リン酸脱水素酵素(GAPDH)およびペプチジルプロリン異性化酵素A(PPIA)、のための全ブタプライマーを、PrimerExpress(登録商標)(PE Applied Biosystems、Foster City、CA)を使ってデザインし、MWG Biotech(Milton Keynes、UK)で合成した。これらのリファレンス遺伝子がブタ組織での使用に対し前もって検証され、次に96−ウエルプレート(Applied Biosystems、Foster City、CA)用ABI PRISM 7900HT Fast sequence detection systemを使ってcDNAでqPCRを行った。全検体をSYBR Green Fast PCR Master Mix(Applied Biosystems、Foster City、CA)を使い、cDNAをテンプレートおよび選択遺伝子用の特異的プライマーとして使用して二通り調製した。核反応で、5μlcDNA、1.2μl(順方向および逆方向プライマーミックス、5μM)、10μl Fast SYBR Green PCR Master Mix(PE Applied Biosystems、Foster City、CA)を添加し、20μlの最終容量にした。2ステップPCRプログラムは次の通り:95℃、10分1サイクル、次に95℃、15秒、そして60℃、1分40サイクル。レファレンス遺伝子用の未加工Ct値は、式Q=E ΔCtを使って相対量に変換される;ここでEはアッセイのPCR効率、ΔCtは各遺伝子に対する最低Ct値と対象検体のCt値の差の計算値である。次に、内在性対照の相対量をgeNorm(Vandesompele et al.、2002)を使って安定性の観点から解析した。選択した内在性対照(ACTB、GAPDHおよびPPIA)へのgeNorm適用により得られた安定性「M」値は、これら腸検体用内在性対照としての適合性を示した。次に、ACTB、GAPDHおよびPPIAのための相対量の幾何学的手段(正規化因子)をgeNormを使って計算した。各標的遺伝子の相対量をその検体用正規化因子(geNormにより得た)で割って最終的な正規化相対発現量を得た。
【0104】
結果
この調査で、ラミナリアディギタータ由来LAMは、発育成績、栄養消化率または選択回腸内細菌に影響を与えなかったが、回腸と結腸中の腸内細菌は減少させた。特に関心があるのは、リポ多糖類(LPS)によるインビトロ攻撃後の回腸と結腸中のサイトカイン遺伝子発現に対するLAMの影響であった。
【0105】
動物発育成績および栄養消化率
LAM増加による発育成績(食物摂取量、1日増体量または飼料要求率)または栄養消化率係数(DM、OM、灰分、NまたはGE)に与える効果は認められなかった。
【0106】
微生物学および揮発性脂肪酸(VFA)
LAMレベルを0〜600ppmの範囲で増やしたことよる、回腸中のビフィズス菌、乳酸桿菌または腸内細菌集団に与える効果は認められなかった(p>0.05)。LAMの増加に伴う腸内細菌集団の減少は認められた。ビフィズス菌や乳酸桿菌数に影響しないで、有害腸内細菌株を減らせる可能性があることは、病原菌が死亡率を増加させていることから、非常に意義が大きい。これらの結果から、最適LAM含有割合は300ppmであることが示される。
【表22】

【0107】
回腸または結腸中の総VFAに与えるLAM食事含有レベル増加の有意な効果は認められなかった。VFA産生の主要部位である盲腸中のLAMレベルの増加に伴う総VFAの有意な増加が認められた(p<0.05)。いずれの腸領域から記録された胃腸内容物pHにも有意な変化は認められなかった。
【0108】
サイトカイン遺伝子発現
解析したいずれのサイトカインに対しても未処理回腸または結腸組織に与えるLAMの効果は認められなかった。このこれら炎症性マーカーに対する効果の全体的な欠如により、食事中のLAMの存在がどのような負の効果も誘発しなかったことが示唆されている。微生物の攻撃に対するLAMに曝された動物の回腸および結腸組織の応答を模倣するために、これらの組織を、その後、LPSと共に体外でインキュベートした。回腸では効果が観察されなかったが、LPS攻撃組織の結腸中でのIL−6およびIL−8遺伝子発現に対する有意な攻撃効果が観察された。300ppmのLAM含有レベルにより、IL−6発現の増加がもたらされ(p<0.05)、一方、IL−8遺伝子発現の直線的増加が観察された(p<0.05)。これらのデータから、食事LAMは、微生物の攻撃に対しプロリン炎症反応を高める可能性があることが示唆される。IL−6が、初期免疫応答における急性炎症で重要な役割を演ずるプロリン炎症性サイトカインであることから、LPS攻撃後のIL−6およびIL−8サイトカインの遺伝子上方制御強化の潜在的利益は、宿主にとって意義深いことである。同様に、ケモカインIL−8もまた、炎症に関し重要な役割を演じ、感染の初期部位に対する好中球補充および活性化の役割をする。LAM単独への暴露は、胃粘膜中のプロリン炎症性サイトカイン産生を刺激しなかったが、LPS誘導プロリン炎症性サイトカイン産生を強化した。
【表23】

【表24】

【0109】
ムチン遺伝子発現
食事因子、例えば、線維、タンパク質および非栄養因子が杯細胞からのムチンの合成と分泌および胃腸内容物中のムチンの回収に直接影響を与えることが知られている(Montagne et al.、2004)。全7ムチン遺伝子転写物がブタ結腸中で検出されたのは確かであるが、回腸中では7つの内の5つが実際に定量可能であったにすぎない。LAMを300ppm補充したブタの回腸で対照動物に比べMUC2の増加が認められた(p=0.05)。このMUC2発現の増加は、より高い食事中含有レベル(600ppm)では認められなかった。残りの回腸中検出可能ムチン(MUC4、MUC12、MUC13およびMUC20)に対してはLAM補充は効果がなかった。結腸中では、600ppmの含有レベルのLAMによる食事補助によりMUC2(2次;P<0.05)およびMUC4(2次;P<0.05)発現が有意に増加したが、この部位の残りのムチン遺伝子のいずれの発現に対しても効果が認められなかった。ベータグルカン含有食はまた、マウスモデルの空腸、回腸、盲腸および結腸のムチン産生の質と量に影響を与える(Deville et al.、2007)。
【表25】

【0110】
最適含有レベル
体外LPS攻撃で免疫系を「刺激」するには300ppmLAMで十分である。
【0111】
実施例6
免疫能力は、LAMおよび/またはFUCを用いた栄養学的介入により調節可能であり、これにより実験的感染出産ブタ中のブタサーコウイルス2型(PCV2)ウイルス量の減少およびブタの離乳後多臓器発育不良症候群(PMWS)の影響の改善につながる。
【0112】
結果
組織中のPCV2抗原の免疫蛍光検出
PCV2特異的モノクローナル抗体を使った免疫蛍光法によって、PCV2抗原が検死解剖動物(肝臓、肺、腎臓、脾臓、ILN、MLN)由来の組織断面中で検出された。
・基礎食事では、6匹の動物中の5匹を安楽死させた。
・基礎食事+LAMおよびFUC処置では、6匹の内1匹の動物を安楽死させた。
・基礎食事+LAM、FUC、WPIでは、実験の間に6匹の内1匹のブタを安楽死させた。この動物由来の組織には、高レベルのPCV2抗原を含んでいた。残りの5匹は実験の終わり時点で健康に見えた。これらは抗体陽転し体重が増えた。
【0113】
PCV2特異的抗体力価の測定
図1に、IPMAで測定した血清のPCV2特異的抗体力価を示す。
【0114】
グループ内分析
・基礎食事:6匹の子ブタの内の5匹は弱いPCV2抗体応答を示し、全て分析組織断面中に疾患を示すPCV2抗原を有していた。残りの動物(Tag10)は、妥当なPCV2特異的抗体力価に抗体陽転した。この残りの動物は実験の継続期間中健康を維持した。
・基礎食事+LAMおよびFUC処置:6匹のブタ中1匹は実験の終わりの前に抗体陽転した(Tag30)。この動物は、このグループの全動物の中でより低いPCV2特異的抗体力価を示し、組織中のPCV2抗原レベルは、PCV2関連疾患を示した。しかし、この動物の抗体力価はグループ1の疾患発症子ブタよりも高かった。
・基礎食事+LAMおよびFUC+WPI:6匹のブタの内1匹が実験の終わりの前に抗体陽転した(Tag26)。残りの全5匹の動物は実験の終わり時点で健康で、抗体陽転し体重が増えた。2匹の動物(Tag22および25)が組織中に高レベルのPCV2抗原を有していた。
【0115】
グループ間分析
感染後(PI)、21および28日目に、処置2(+LAMおよびFUC;図2参照)ならびに処置4(+LAMおよびFUC+WPI、図3参照)における動物の平均PCV2特異的抗体力価は、基礎食事を摂食した動物および基礎+WPIを摂食した子ブタよりも有意に高かった(p<0.05)。これらの結果から、ブタの食事にLAMとFUC単独、またはWPIと組み合わせ多補充がPCV2感染ブタの体液性応答を強化することが示唆される。
【0116】
リンパ球数
図4で、感染後(PI)28日目までに、基礎食事摂食グループは、3つの補充食よりも有意に低い割合のリンパ球細胞集団を有したことが認められる。いずれの補充剤も相互に有意な差がなかった。図5に示すように、PI14日目に、LAM+FUCを補充した食事を摂取した子ブタは、他のグループよりも有意に大きな好酸球割合を示した(p<0.05)。この時間以降、有意差は検出されなかった。
【0117】
動物の体重の分析
ブタの体重を毎週記録した。図6から、グループ2(+LAMおよびFUC)、3(+乳清タンパク単離物)および4(+LAMおよびFUC+乳清タンパク)の子ブタの実験終了時点での平均体重は基礎食事摂食のものよりも大きいことがわかる。グループ2および4の動物は、基礎食事摂食子ブタよりも有意により重かった。
【0118】
動物体温の分析
体温もまた全調査期間にわたりモニターした。PI17日目に、グループ3(+乳清タンパク単離物)およびグループ4(+LAMおよびFUCおよび乳清タンパク単離物)の動物は、基礎食事を摂食した子ブタ(39.82℃、p<0.05)よりも有意に低い平均体温(それぞれ38.33および38.02℃)であった。PI24日後のそれぞれの摂食グループ間での平均体温の有意差は認められなかった。
【0119】
ウイルス排出の分析
全糞便検体の定量PCRを行い、ウイルス量および排出を評価した。図7に示すように、PI10日目までにグループ3(+乳清タンパク単離物)の動物中で検出された平均PCV2 DNAコピー数は、他の3つの摂食グループよりも有意に少なかった(p<0.05)。PI20と24日目に、LAMおよびFUC補充食を摂食した子ブタはグループ1と3の子ブタよりも有意に少ないPCV2 DNAコピー数であった。LAMおよびFUCならびに乳清タンパク単離物を摂食した動物は、基礎食事のものに比べ有意に少ないPCV2 DNAコピー数であった(p<0.05)。PI27日目までに、全補充食事は基礎食事のものに比べ有意に少ないPCV2 DNAコピー数であった(p<0.05)。図8からわかるように、最も少ない平均PCV2 DNAコピー数がLAM+FUC摂食子ブタの糞便検体中で検出された。これらの結果は、これらの実験条件下、LAM+FUC、WPI、または両方の組み合わせによるブタ栄養補助食事がPCV2ウイルス排出の有意な減少につながったことを示している。
【表26】

【0120】
サイトカインPCR結果
IL−2、TNF−αおよびIL−4のためのサイトカインmRNAを、確立された2ステップ逆転写PCR(rtPCR)アッセイを使って定量化した。結果は、これらのサイトカインのプロファイルに関し異なる摂食処置間に有意差がないことを示した。
【0121】
組織ホモジネート中のPCV2 DNAの定量化
組織ホモジネートプール(10%w/v)を各動物の肝臓、肺、脾臓、腎臓、腸間膜および鼠径部リンパ節から調製した。PCV2 DNAを確立された定量化PCR方法(qPCR)を使って定量化した。最多量のPCV2 DNAが基礎食事(グループ1)を摂取した動物で検出された。また、WPI(グループ3)を補充した食事を摂食したブタは、LAM+FUC(グループ2)またはLAM+FUCとWPIの組み合わせ(グループ4)を補充した基礎食事を摂食したグループより高い量のPCV2 DNAであった。これら結果は、免疫蛍光法に基づく動物組織中のPCV2抗原の検出レベルと比べても遜色がない。他の2つのグループ(すなわち基礎/基礎+WPI)に比べ、LAM+FUC単独またはこれにWPIを組み合わせて補充した食事を摂食した動物で最小量のPCV2抗原が検出された。
【0122】
本発明は、実験的に感染した出産ブタのブタサーコウイルス2型(PCV2)ウイルス量を減少させ、ブタの離乳後多臓器発育不良症候群(PMWS)の影響を改善する。
【0123】
参考文献
Association of Analytical Chemicals (1995). 公定分析法, 第16版, Association of Official Chemists, Washington DC, USA.
Close, W.H. (1994).新遺伝子型物質の摂食:アミノ酸/エネルギー要求の確立。ブタ科学の基本(ed. D.J.A. Cole, J. Wiseman and M.A. Varley): 123-140. Nottingham University Press.
Deville, C; Damas, J., Forget, P; Dandrifosse, G. and Peulen, O (2004).食物繊維としてのラミナリン。Journal of the Science of Food and Agriculture. 84; 1030-1038.
Deville, C; Gharbi, M.; Dandrifosse, G. and Peulen, O (2007).ラミナリン:海藻由来の多糖が腸特性に与える効果の研究。Journal of the Science of Food and Agriculture 87: 1717-1725.
Gardiner, G. E., Campbell, A. J., O’Doherty, J. V., Pierce, E., Lynch, P. B., Leonard, F. C., Stanton, C., Ross, R. P. and Lawlor, P.G. (2008).アスコフィルムノドサム抽出物が生育期‐仕上げ期ブタの成長力、消化力、枝肉特性および選択腸ミクロフローラ集団に与える効果。Anim. Feed. Sci. Technol. 141:259-273.
Hojberg, O., Canibe, N., Knudsen, B and Jensen, B.B., 2003.ブタの胃腸由来胃腸内容物の潜在的発酵速度:発酵液体飼料摂食の効果. Appl. Environ. Micro. 69, 408-418.
Huber, R. E. & Hurlburt, K. L. (1984).ラクトース上の大腸菌増殖には、βガラクトシダーゼ産物の培地への循環が必要。Canadian Journal of Microbiology, 30, 411-415.
Ilsley, S.E.; Miller, H.M. and Kamel, C. (2005).離乳子ブタの発育成績と免疫状態に与える食事性キラヤ属サポニンおよびクルクミンの効果。Journal of Animal Science 83: 82-88.
Klasing K. C. and Barnes D. M.(1988). 免疫学的ストレスによる成長期ヒヨコのアミノ酸要求の低下。Journal of Nutrition 118:1158-1164.
Kogan G and Kocher A 2007.ブタの栄養学的および健康保護における酵母細胞壁多糖類の役割。Livestock Science, 10th Int. Sym. Dig. Phy. in Pigs, Denmark 2006, Part 2 109, 161-165
Krakowskia, L.; Krzyanowskia, J.; Wronaa, Z. and Siwickib, A. K. (1999).初乳の免疫グロブリンレベル,子ウマの新生児および出生後の期間の非特異的細胞性および体液性免疫指数に与える1,3/1,6グルカンおよびレバミソールによる妊馬の非特異的免疫刺激の効果。Veterinary Immunology and Immunopathology. 68 (1), 1-11.
Lynch, M.B.; Sweeney, T.; Callan, J.J. and O’Doherty, J.V. (2007).仕上げブタの栄養消化率, 窒素排泄, 腸ミクロフローラ, 揮発性脂肪酸濃度および堆肥アンモニア排泄に与えるコムギをオオムギと交換することによる食事性β-グルカンの摂取量の増加の効果。Animal 1(6): 812 - 819.
Lynch, M. B., Sweeney, T.,Callan, J. J., O’Sullivan, J. T. and O’Doherty, J. V.(2009).ブタの栄養消化率、窒素利用、腸ミクロフローラおよび揮発性脂肪酸濃度に与える食事性ラミナリア由来ラミナリンおよびフコイダンの効果。 J. Sci. Food. Agric.
90:430-437.
Macfarlane, G. T., Hay, S., Macfarlane, S. & Gibson, G. R. (1990). バッチおよび連続培養におけるバクテロイデス-オバータスによる増殖、多糖およびグリコシダーゼ産生に与える異なる炭水化物の効果。Journal of Applied Bacteriology, 68, 179-187.
Macfarlane, S. and Macfarlane, G.T. (2003). SCFA産生の調節. Proc. Nutr. Soc. 2003 62,67-72.
Mackie, R.I., Stroot, P.G. and Varel, V.H.(1998). 家畜排泄物の主要臭気化合物の生物学的特定と生物学的起源。Journal of Animal Science. 76: 1331-1342. 76: 1331-1342.
Mackie R I; Sghir A; Gaskins H R (1999). 新生児の胃腸の発生微生物生態学。 The American Journal of Clinical Nutrition 69 (5):1035S-1045S.
Mortensen, P.B., Holtug, K. And Rasmussen, H.S. 1987.糞便インキュベートシステムでの単および二糖類からの短鎖脂肪酸産生:食物繊維のヒトの結腸での発酵の推測。 Nutrition Journal 118: 321 - 324.
O’Connell, M., Callan, J.J., Byrne, C., Sweeney, T and O’Doherty, J.V. 2005.ブタの栄養消化率、腸ミクロフローラ、揮発性脂肪酸濃度および堆肥アンモニア排泄に与えるブタの食事への穀物型および外因性酵素補充の効果。 Animal Science 81: 357-364.
O’ Doherty, J. V., S, N. C., Callan, J. J. & McCarthy, P. (2004).離乳ブタの成長成績に対する乳飼料レベルと大豆食の間の相互作用。Anim. Sci. 78, 419-427.
O’ Doherty, J. V., Nolan. C. S., Mccarthy, P. C. (2005a).離乳ブタの発育成績に対するラクトースレベルと抗菌増殖成長プロモータの相互作用。J. Sci. Food Agricult. 85, 371-380.
O’ Doherty, J. V., Pierce, K. M.& Kenny, D. A. (2005b). 反芻しない、および反芻前の発酵性繊維および腸健康。IN GARNSWORTHY, P. C. & WISEMAN, J. (Eds.) Recent Adv. Anim. Nutr. Partridge, G.G and Gill, B.P., 1993.ブタ離乳食の新しい取り組み。Wiseman, J. and Garnsworthy, P.C. (Eds),動物栄養学的における最近の進歩。Nottingham University Press, U.K, pp. 221-248.
Pie S., Lalles J. P., Blazy F., Laffitte J., Seve B., Oswald I. P. (2004): 離乳は子ブタの腸の炎症性サイトカイン発現の上方制御と関連がある。Journal of Nutrition. 134: 641-647.
Pierce, K. M., Callan, J. J., Mccarthy, P. & O’ Doherty, J. V. (2005a).アビラマイシンまたはイヌリンを補充した低または高ラクトース食事を摂食した離乳ブタの発育成績。Anim. Sci. 80, 313-318.
Pierce, K. M.; Sweeney, T.; Brophy, P. O.; Callan, J. J.; Fitzpatrick, E.; McCarthy, P. and O’Doherty, J. V. (2006a).離乳ブタの胃腸中の腸形態、選択微生物集団および揮発性脂肪酸濃度に与えるラクトースおよびイヌリンの効果。Animal Science 82, 311-318.
Pierce, K. M.; Sweeney, T.; Callan, J. J.; Byrne, C.; McCarthy, P. and O’Doherty, J. V. (2006b).成熟雄ブタの栄養消化率、窒素排泄、揮発性脂肪酸濃度およびアンモニア放出に与える仕上げ食事中への高ラクトース補充剤含有効果。Animal Feed Science and Technology 125, 45-60.
Pollmann, D.S., Danielson, D.M. and Peo, E.R., (1980).ラクトース補充食を摂食したスターターブタに与えるアシドフィルス菌の効果。J. Anim. Sci. 51, 638-644.
Porter, M.G. and Murray, R.S. (2001). オーブン乾燥時の牧草サイレージ構成成分揮発性および異なる分析方法で評価された乾燥物成分間の相互関係。Grass and Forage Science 56: 405-411.
Rasmussen., H.S.; Holtug, K. and Mortensen, P.B. (1988).ヒトにおけるアミノ酸の短鎖脂肪酸への分解:1つのインビトロ調査。Scandinavian Journal of Gastroenterology.23: 178-182. Read, S.M.; Currie, G. and Bacic, A. (1996).エレクトロスプレーイオン化質量分析によるラミナリンの構造的不均質性分析。Carbohydrate Research 281: 187 - 201.
Reilly, P., J. V. O’Doherty, K. M. Pierce, J. J. Callan, J. T. O’Sullivan, and T. Sweeney (2008).離乳ブタの腸形態学、選択腸微生物叢、栄養消化率、揮発性脂肪酸濃度および免疫状態に与える海藻抽出物含有の効果。Animal 2:1465-1473.
Rooke, J A; Carranca, C; Bland, I M; Sinclair, A G; Ewen, M; Bland, V C (2003).子ブタの免疫グロブリンG受動吸収と免疫グロブリンGの離乳時血漿中濃度の間の関係。Livestock Production Science 81, 223-234.
Swann Report (1969). Joint Committee on the Use of Antibiotics in Animal Husbandry and Veterinary Medicine. Report. HMSO, London.
SAS (1985). 統計分析システム。SAS Institute Inc., North Carolina, USA.
Topping, D.L. and Clifton, P.M., (2001). 短鎖脂肪酸およびヒト結腸機能:耐性デンプンおよび非デンプン多糖類の役割。Physiological Reviews 81: 1031-1064.
【特許請求の範囲】
【請求項1】
母動物に投与することにより母動物の子孫の胃腸の健康または機能の改善もしくは維持に使用するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物。
【請求項2】
母動物の子孫の胃腸の健康または機能を改善もしくは維持する方法であって、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物を母動物に投与することを含む方法。
【請求項3】
少なくとも1つのグルカンがベータグルカン、任意選択で、分岐鎖ベータグルカンである請求項1に記載の使用のための組成物、または請求項2に記載の方法。
【請求項4】
少なくとも1つのグルカンがベータ(1→6)グリコシド結合、任意選択で、酸素含有ベータ(1→6)グリコシド結合を含む請求項1もしくは3に記載の使用のための組成物、または請求項2もしくは3に記載の方法。
【請求項5】
少なくとも1つのグルカンがベータ(1→3、1→6)グルカン、任意選択で、ラミナリンである請求項1もしくは3〜4のいずれか1項に記載の使用のための組成物、または請求項2もしくは3〜4のいずれか1項に記載の方法。
【請求項6】
少なくとも1つのフカンがアルファ フカン、任意選択で、フコイダンである請求項1もしくは3〜5のいずれか1項に記載の使用のための組成物、または請求項2もしくは3〜5のいずれか1項に記載の方法。
【請求項7】
少なくとも1つのグルカンおよび/または少なくとも1つのフカンが大型褐藻類、任意選択で、ワカメから単離される請求項1もしくは3〜6のいずれか1項に記載の使用のための組成物、または請求項2もしくは3〜6のいずれか1項に記載の方法。
【請求項8】
大型褐藻類、任意選択で、ワカメ、が褐藻鋼から選択され、任意選択で、褐藻鋼コンブ目および褐藻鋼ヒバマタ目から選択される請求項7記載の使用のための組成物または方法。
【請求項9】
大型褐藻類、任意選択で、ワカメ、がコンブ科、ヒバマタ科、およびカジメ科から選択される請求項7または8記載の使用のための組成物または方法。
【請求項10】
大型褐藻類が、アスコフィルム種、任意選択で、アスコフィルムノッドサム(Ascophyllum nodosum);ラミナリア種、任意選択で、ラミナリアディギタータ、ラミナリアヒペルボレア、カラフトコンブもしくはマコンブ;またはホンダワラ種から選択される請求項7、8または9記載の使用のための組成物または方法。
【請求項11】
少なくとも1つのグルカンおよび/または少なくとも1つのフカンが紅藻類(red alga)、任意選択で、紅藻(red seaweed)から単離される請求項1もしくは3〜6のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜6のいずれか1項に記載の方法。
【請求項12】
紅藻類、任意選択で、 紅藻、が真正紅藻綱、任意選択で、真正紅藻綱スギノリ目から選択され、任意選択で、スギノリ科、から選択される請求項11に記載の使用のための組成物または方法。
【請求項13】
組成物が周産期、出生前、および/または出生後、母動物に投与される請求項1もしくは3〜12のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜12のいずれか1項に記載の方法。
【請求項14】
組成物が毎日母動物に投与される請求項1もしくは3〜13のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜13のいずれか1項に記載の方法。
【請求項15】
体重1kg当たり約3〜50ミリグラムのグルカンが母動物に、任意選択で、毎日、投与されるのに相当する量の組成物が母動物に、任意選択で、毎日、投与される請求項1もしくは3〜14のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜14のいずれか1項に記載の方法。
【請求項16】
体重1kg当たり約2〜40ミリグラムのフカンが母動物に、任意選択で、毎日、投与されるのに相当する量の組成物が母動物に、任意選択で、毎日、投与される請求項1もしくは3〜15のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜15のいずれか1項に記載の方法。
【請求項17】
動物が単胃の動物で、さらに任意選択で、ブタ、家禽、ウマ、ヒツジ、ウサギ、魚、ネコ、イヌおよびヒトから選択される請求項1もしくは3〜16のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜16のいずれか1項に記載の方法。
【請求項18】
母動物の初乳または母乳中の免疫グロブリン、任意選択で、免疫グロブリンG、の濃度を増加させることにより、胃腸の健康または機能が改善または維持される請求項1もしくは14〜17のいずれか1項に記載の使用のための組成物または請求項2もしくは14〜17のいずれか1項に記載の方法。
【請求項19】
母動物の初乳または母乳中の粗タンパク質の濃度を増加させることにより、胃腸の健康または機能が改善または維持される請求項1もしくは3〜18のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜18のいずれか1項に記載の方法。
【請求項20】
細菌性、任意選択で、病原菌の、子孫への感染を減らすことにより、胃腸の健康または機能が改善または維持される請求項1もしくは3〜19のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜19のいずれか1項に記載の方法。
【請求項21】
細菌性、任意選択で、病原菌の、感染が腸内細菌感染、任意選択で、サルモネラおよび大腸菌から選択される請求項20に記載の使用のための組成物または方法。
【請求項22】
子孫の胃腸の健康に関連した障害が、サイトカイン、任意選択で、腫瘍壊死因子アルファ、インターロイキン−1アルファ、インターロイキン−6、およびトレフォイルファクター3から選択されるサイトカイン、の発現を増加させることにより防止または治療される請求項1もしくは3〜22のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜22のいずれか1項に記載の方法。
【請求項23】
分岐鎖揮発性脂肪酸、任意選択で、イソ酪酸、吉草酸、およびイソ吉草酸から選択される脂肪酸、の産生を減らすことにより、胃腸の健康または機能が改善または維持される請求項1もしくは3〜22のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜22のいずれか1項に記載の方法。
【請求項24】
貪食細胞、任意選択で、好中球、好酸球、単球、もしくはリンパ球を含む白血球、の濃度または活性を変えることにより、胃腸の健康または機能が改善または維持される請求項1もしくは3〜23のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜23のいずれか1項に記載の方法。
【請求項25】
白血球の濃度または活性が高められおよび/またはリンパ球の濃度または活性が減らされおよび/または好酸球の濃度または活性が減らされる請求項24に記載の使用のための組成物または方法。
【請求項26】
体重1kg当たり約3〜50ミリグラムのグルカンが動物に、任意選択で、毎日、投与されるのに相当する量を動物に投与、または体重1kg当たり約2〜40ミリグラムのフカンが動物に、任意選択で、毎日、投与されるのに相当する量を動物に投与することにより、動物の胃腸の健康または機能の改善または維持に使用するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物。
【請求項27】
動物の胃腸の健康または機能の改善または維持のための方法であって、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物を、体重1kg当たり約3〜50ミリグラムのグルカンが動物に、任意選択で、毎日、投与されるのに相当する量で動物に投与、または体重1kg当たり約2〜40ミリグラムのフカンが動物に、任意選択で、毎日、投与されるのに相当する量で動物に投与することを含む方法。
【請求項28】
細菌感染、任意選択で、大腸菌感染、を減らすことにより胃腸の健康または機能が改善または維持される請求項26に記載の使用のための組成物または方法。
【請求項29】
任意選択で、抗原の存在下、サイトカインの発現を増やすことにより胃腸の健康または機能が改善または維持される請求項26もしくは28のいずれか1項に記載の使用のための組成物または請求項27もしくは28のいずれか1項に記載の方法。
【請求項30】
抗原が細菌性抗原、任意選択で、細菌性リポ多糖類、である請求項29に記載の使用のための組成物または方法。
【請求項31】
サイトカインが、任意選択で、インターロイキン−6およびインターロイキン−8から選択される請求項29または30に記載の使用のための組成物または方法。
【請求項32】
ムチン、任意選択で、ムチン−2および/またはムチン−4、の発現を増加させることにより胃腸の健康または機能が改善または維持される請求項26もしくは28〜31のいずれか1項に記載の使用のための組成物または請求項27〜31のいずれか1項に記載の方法。
【請求項33】
サーコウイルスまたはパルボウイルス、任意選択で、ブタサーコウイルスまたはブタパルボウイルス、の濃度を減らすことにより胃腸の健康または機能が改善または維持される請求項26もしくは28〜32のいずれか1項に記載の使用のための組成物または請求項27〜32のいずれか1項に記載の方法。
【請求項34】
ブタサーコウイルスが2型サーコウイルスである請求項33に記載の使用のための組成物または方法。
【請求項35】
直鎖揮発性脂肪酸の産生を増やすことにより胃腸の健康または機能が改善または維持される請求項26もしくは28〜34のいずれか1項に記載の使用のための組成物または請求項27〜34のいずれか1項に記載の方法。
【請求項1】
母動物に投与することにより母動物の子孫の胃腸の健康または機能の改善もしくは維持に使用するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物。
【請求項2】
母動物の子孫の胃腸の健康または機能を改善もしくは維持する方法であって、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物を母動物に投与することを含む方法。
【請求項3】
少なくとも1つのグルカンがベータグルカン、任意選択で、分岐鎖ベータグルカンである請求項1に記載の使用のための組成物、または請求項2に記載の方法。
【請求項4】
少なくとも1つのグルカンがベータ(1→6)グリコシド結合、任意選択で、酸素含有ベータ(1→6)グリコシド結合を含む請求項1もしくは3に記載の使用のための組成物、または請求項2もしくは3に記載の方法。
【請求項5】
少なくとも1つのグルカンがベータ(1→3、1→6)グルカン、任意選択で、ラミナリンである請求項1もしくは3〜4のいずれか1項に記載の使用のための組成物、または請求項2もしくは3〜4のいずれか1項に記載の方法。
【請求項6】
少なくとも1つのフカンがアルファ フカン、任意選択で、フコイダンである請求項1もしくは3〜5のいずれか1項に記載の使用のための組成物、または請求項2もしくは3〜5のいずれか1項に記載の方法。
【請求項7】
少なくとも1つのグルカンおよび/または少なくとも1つのフカンが大型褐藻類、任意選択で、ワカメから単離される請求項1もしくは3〜6のいずれか1項に記載の使用のための組成物、または請求項2もしくは3〜6のいずれか1項に記載の方法。
【請求項8】
大型褐藻類、任意選択で、ワカメ、が褐藻鋼から選択され、任意選択で、褐藻鋼コンブ目および褐藻鋼ヒバマタ目から選択される請求項7記載の使用のための組成物または方法。
【請求項9】
大型褐藻類、任意選択で、ワカメ、がコンブ科、ヒバマタ科、およびカジメ科から選択される請求項7または8記載の使用のための組成物または方法。
【請求項10】
大型褐藻類が、アスコフィルム種、任意選択で、アスコフィルムノッドサム(Ascophyllum nodosum);ラミナリア種、任意選択で、ラミナリアディギタータ、ラミナリアヒペルボレア、カラフトコンブもしくはマコンブ;またはホンダワラ種から選択される請求項7、8または9記載の使用のための組成物または方法。
【請求項11】
少なくとも1つのグルカンおよび/または少なくとも1つのフカンが紅藻類(red alga)、任意選択で、紅藻(red seaweed)から単離される請求項1もしくは3〜6のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜6のいずれか1項に記載の方法。
【請求項12】
紅藻類、任意選択で、 紅藻、が真正紅藻綱、任意選択で、真正紅藻綱スギノリ目から選択され、任意選択で、スギノリ科、から選択される請求項11に記載の使用のための組成物または方法。
【請求項13】
組成物が周産期、出生前、および/または出生後、母動物に投与される請求項1もしくは3〜12のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜12のいずれか1項に記載の方法。
【請求項14】
組成物が毎日母動物に投与される請求項1もしくは3〜13のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜13のいずれか1項に記載の方法。
【請求項15】
体重1kg当たり約3〜50ミリグラムのグルカンが母動物に、任意選択で、毎日、投与されるのに相当する量の組成物が母動物に、任意選択で、毎日、投与される請求項1もしくは3〜14のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜14のいずれか1項に記載の方法。
【請求項16】
体重1kg当たり約2〜40ミリグラムのフカンが母動物に、任意選択で、毎日、投与されるのに相当する量の組成物が母動物に、任意選択で、毎日、投与される請求項1もしくは3〜15のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜15のいずれか1項に記載の方法。
【請求項17】
動物が単胃の動物で、さらに任意選択で、ブタ、家禽、ウマ、ヒツジ、ウサギ、魚、ネコ、イヌおよびヒトから選択される請求項1もしくは3〜16のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜16のいずれか1項に記載の方法。
【請求項18】
母動物の初乳または母乳中の免疫グロブリン、任意選択で、免疫グロブリンG、の濃度を増加させることにより、胃腸の健康または機能が改善または維持される請求項1もしくは14〜17のいずれか1項に記載の使用のための組成物または請求項2もしくは14〜17のいずれか1項に記載の方法。
【請求項19】
母動物の初乳または母乳中の粗タンパク質の濃度を増加させることにより、胃腸の健康または機能が改善または維持される請求項1もしくは3〜18のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜18のいずれか1項に記載の方法。
【請求項20】
細菌性、任意選択で、病原菌の、子孫への感染を減らすことにより、胃腸の健康または機能が改善または維持される請求項1もしくは3〜19のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜19のいずれか1項に記載の方法。
【請求項21】
細菌性、任意選択で、病原菌の、感染が腸内細菌感染、任意選択で、サルモネラおよび大腸菌から選択される請求項20に記載の使用のための組成物または方法。
【請求項22】
子孫の胃腸の健康に関連した障害が、サイトカイン、任意選択で、腫瘍壊死因子アルファ、インターロイキン−1アルファ、インターロイキン−6、およびトレフォイルファクター3から選択されるサイトカイン、の発現を増加させることにより防止または治療される請求項1もしくは3〜22のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜22のいずれか1項に記載の方法。
【請求項23】
分岐鎖揮発性脂肪酸、任意選択で、イソ酪酸、吉草酸、およびイソ吉草酸から選択される脂肪酸、の産生を減らすことにより、胃腸の健康または機能が改善または維持される請求項1もしくは3〜22のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜22のいずれか1項に記載の方法。
【請求項24】
貪食細胞、任意選択で、好中球、好酸球、単球、もしくはリンパ球を含む白血球、の濃度または活性を変えることにより、胃腸の健康または機能が改善または維持される請求項1もしくは3〜23のいずれか1項に記載の使用のための組成物または請求項2もしくは3〜23のいずれか1項に記載の方法。
【請求項25】
白血球の濃度または活性が高められおよび/またはリンパ球の濃度または活性が減らされおよび/または好酸球の濃度または活性が減らされる請求項24に記載の使用のための組成物または方法。
【請求項26】
体重1kg当たり約3〜50ミリグラムのグルカンが動物に、任意選択で、毎日、投与されるのに相当する量を動物に投与、または体重1kg当たり約2〜40ミリグラムのフカンが動物に、任意選択で、毎日、投与されるのに相当する量を動物に投与することにより、動物の胃腸の健康または機能の改善または維持に使用するための、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物。
【請求項27】
動物の胃腸の健康または機能の改善または維持のための方法であって、少なくとも1つのグルカン、少なくとも1つのフカン、または少なくとも1つのグルカンおよび少なくとも1つのフカンを含む組成物を、体重1kg当たり約3〜50ミリグラムのグルカンが動物に、任意選択で、毎日、投与されるのに相当する量で動物に投与、または体重1kg当たり約2〜40ミリグラムのフカンが動物に、任意選択で、毎日、投与されるのに相当する量で動物に投与することを含む方法。
【請求項28】
細菌感染、任意選択で、大腸菌感染、を減らすことにより胃腸の健康または機能が改善または維持される請求項26に記載の使用のための組成物または方法。
【請求項29】
任意選択で、抗原の存在下、サイトカインの発現を増やすことにより胃腸の健康または機能が改善または維持される請求項26もしくは28のいずれか1項に記載の使用のための組成物または請求項27もしくは28のいずれか1項に記載の方法。
【請求項30】
抗原が細菌性抗原、任意選択で、細菌性リポ多糖類、である請求項29に記載の使用のための組成物または方法。
【請求項31】
サイトカインが、任意選択で、インターロイキン−6およびインターロイキン−8から選択される請求項29または30に記載の使用のための組成物または方法。
【請求項32】
ムチン、任意選択で、ムチン−2および/またはムチン−4、の発現を増加させることにより胃腸の健康または機能が改善または維持される請求項26もしくは28〜31のいずれか1項に記載の使用のための組成物または請求項27〜31のいずれか1項に記載の方法。
【請求項33】
サーコウイルスまたはパルボウイルス、任意選択で、ブタサーコウイルスまたはブタパルボウイルス、の濃度を減らすことにより胃腸の健康または機能が改善または維持される請求項26もしくは28〜32のいずれか1項に記載の使用のための組成物または請求項27〜32のいずれか1項に記載の方法。
【請求項34】
ブタサーコウイルスが2型サーコウイルスである請求項33に記載の使用のための組成物または方法。
【請求項35】
直鎖揮発性脂肪酸の産生を増やすことにより胃腸の健康または機能が改善または維持される請求項26もしくは28〜34のいずれか1項に記載の使用のための組成物または請求項27〜34のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2012−527416(P2012−527416A)
【公表日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願番号】特願2012−511193(P2012−511193)
【出願日】平成22年5月21日(2010.5.21)
【国際出願番号】PCT/EP2010/003088
【国際公開番号】WO2010/133359
【国際公開日】平成22年11月25日(2010.11.25)
【出願人】(511277272)バイオアトランティス リミテッド (1)
【Fターム(参考)】
【公表日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願日】平成22年5月21日(2010.5.21)
【国際出願番号】PCT/EP2010/003088
【国際公開番号】WO2010/133359
【国際公開日】平成22年11月25日(2010.11.25)
【出願人】(511277272)バイオアトランティス リミテッド (1)
【Fターム(参考)】
[ Back to top ]

