骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材
【課題】短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料形成用キット、ペースト状骨再生材料、骨再生材料及び骨接合材を提供する。
【解決手段】リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とからなる骨再生材料形成用キット。
【解決手段】リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とからなる骨再生材料形成用キット。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材に関する。
【背景技術】
【0002】
骨の欠損部又は損傷部の治療には人工骨が用いられている。
従来の人工骨としては、リン酸カルシウムからなる緻密体と多孔体の人工骨が知られていた。このような人工骨は、治療の対象となる骨の状態に合わせて、形状等を整える必要がある。しかし、手術現場において人工骨を切断加工したり、切削加工したりすることは困難であり、使いにくいという問題があった。
【0003】
これに対して、リン酸カルシウム顆粒を水系媒体中に懸濁させたペースト状骨補填材料が提案されている(例えば、特許文献1〜3)。ペースト状骨補填材料は、インジェクター等を用いて骨の欠損部又は損傷部に充填させることができる。ペースト状骨補填材料は、充填後に硬化して骨の欠損部又は損傷部に固定される。ペースト状骨補填材料を用いれば、複雑な欠損部又は損傷部であっても容易に治療を行うことができる。
【0004】
しかしながら、特許文献1〜3に記載されたペースト状骨補填材料を用いても、単に骨の欠損部又は損傷部を補うだけで、骨の再生を促進するわけではない。実際に、骨の再生は、充填した骨補填材料の表面に限られている。また、この骨補填材料は、力学強度はきわめて高いものの、骨組織の有するコラーゲン繊維等の有機成分を含有しないことから、弾性率と靭性に劣るという決定的な欠点もあった。従って、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すような骨再生材料が求められていた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2000−262609号公報
【特許文献2】特許第4134299号
【特許文献3】特許第3322231号
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明は、リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とからなる骨再生材料キットである。
以下に本発明を詳述する。
【0008】
本発明者は、鋭意検討の結果、リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子と水系媒体とを混合するとペースト状骨再生材料が得られること、該ペースト状骨再生材料はインジェクターにより骨の欠損部又は損傷部に容易に充填でき体内で硬化させることができること、及び、該ペースト状骨再生材料の硬化物によって短期的には骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができることを見出し、本発明を完成した。
【0009】
従来のリン酸カルシウム系化合物からなる微粒子と水系媒体とからなるペースト状骨補填材料は、充填して硬化させることにより、骨の力学的強度を確保することができる。しかしながら、硬化した骨補填材料を構成するリン酸カルシウム系化合物はほとんど生体内に吸収されない(生体内に吸収されるとしても、極めてゆっくりとした速度でしか吸収されない)ことから、骨芽細胞が侵入することができない。患者自身の骨を再生するためには、骨芽細胞等が人工骨内に侵入して増殖する必要がある。
これに対して本発明では、生体吸収性高分子からなる微粒子を配合することにより、該生体吸収性高分子からなる微粒子が生体吸収されることにより充填部に連続孔が生じる。このことから、該連続孔に骨芽細胞が侵入して増殖することができる。即ち、本発明の骨再生材料キットを用いて調製したペースト状骨再生材料は、骨の欠損部を補う役割と同時に、骨芽細胞の増殖のための足場材料としての役割も果たすことができる。更に、骨の欠損部の再生にとどまらず、軟骨欠損に対する修復(軟骨下骨の修復)や靱帯・腱の付着部の骨修復に関して組織工学的担体としての役割も果たすことができる。
【0010】
本発明の骨再生材料キットは、リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とからなる。
上記リン酸カルシウム系化合物からなる粒子は、水系媒体と混合するとペースト状となり、体内で硬化して、骨の力学強度を補う役割を有する。
【0011】
上記リン酸カルシウム系化合物は特に限定されず、例えば、リン酸三カルシウム、リン酸四カルシウム、リン酸水素カルシウム、水酸アパタイト、炭素含有アパタイト、フッ素アパタイト等が挙げられる。これらのリン酸カルシウム系化合物は単独で用いてもよく、2種以上を併用してもよい。
【0012】
上記リン酸カルシウム系化合物からなる微粒子の平均粒子径の好ましい下限は5μm、好ましい上限は100μmである。上記リン酸カルシウム系化合物からなる微粒子の平均粒子径が5μm未満であると、上記水系媒体と混合してペースト状にしたときに粘度が上昇してインジェクトが難しくなることがある。100μmを超えると、硬化物の強度が低く充分に骨の力学強度を補えないことがある。上記リン酸カルシウム系化合物からなる微粒子の平均粒子径のより好ましい上限は50μmである。
【0013】
上記生体吸収性高分子からなる微粒子は、施術後に徐々に生体内で吸収されて、充填部に骨芽細胞が侵入可能な連続孔を生じさせる役割を有する。また、上記生体吸収性高分子からなる微粒子が生体内で膨潤することで、充填部分への密着性が向上するという効果も得られる。
上記生体吸収性高分子は特に限定されず、例えば、ポリ乳酸、ポリグリコール酸、乳酸−グリコール酸共重合体、グリコール酸−ε−カプロラクトン共重合体、乳酸−ε−カプロラクトン共重合体、ポリリンゴ酸、ポリ−α−シアノアクリレート、ポリ−β−ヒドロキシ酸、ポリトリメチレンオキサレート、ポリテトラメチレンオキサレート、ポリオルソエステル、ポリオルソカーボネート、ポリエチレンカーボネート、ポリ−γ−ベンジル−L−グルタメート、ポリ−L−グルタミン酸、ポリ−γ−メチル−L−グルタメート、ポリ−L−リジン、ポリ−L−アラニン等の合成高分子;デンプン、アルギン酸、ヒアルロン酸、キチン、ペクチン酸及びその誘導体等の多糖類や、ゼラチン、コラーゲン、アルブミン、フィブリン等のタンパク質等の天然高分子等が挙げられる。これらの生体吸収性高分子は単独で用いてもよく、2種以上を併用してもよい。なかでも、生体親和性に優れ、架橋等の程度により生体吸収性を制御可能であることから、ゼラチン、コラーゲン又はヒアルロン酸が好適であり、ゼラチンがより好適である。
【0014】
ゼラチン等の親水性の高い高分子は、水分を含むことで膨潤する。このため、骨孔内に移植した後、周囲の水分を吸い、体積を増し、骨孔に密着することが期待される。親水性の高い生体吸収性高分子を含む本発明の骨再生材料キットは、止血効果があり、出血のある部位にも用いることができる。従来の無機材料のみを含むペースト状骨補填材料を用いても出血が止まらず、ペースト状骨補填材料が大量の血液を吸収して強度が低下してしまう、又は、崩壊して欠損部に流れ出てしまうということがあった。また、ゼラチンからなる生体吸収性高分子を含有することにより、本発明の骨再生材料キットを混合してから硬化するまでの時間のバラツキが小さくなるという効果も発揮される。
【0015】
上記生体吸収性高分子からなる微粒子がゼラチン、コラーゲン又はヒアルロン酸からなる場合、上記ゼラチン、コラーゲン又はヒアルロン酸は架橋されていることが好ましい。未架橋のゼラチン、コラーゲン又はヒアルロン酸からなる微粒子を用いると、上記水系媒体に懸濁させたときに溶解してしまい、充填部に骨芽細胞が侵入可能な連続孔を生じさせることができないことがある。また、溶解まではしないとしても、吸水して、必要以上の粒子径にまで膨潤してしまうことがある。
【0016】
上記架橋の方法は特に限定されず、熱脱水架橋、紫外線架橋、化学架橋、イオン架橋等の従来公知の架橋方法を用いることができる。
上記架橋の方法や程度により、吸水性や生体吸収性を制御することができる。好ましくは、上記生体吸収性高分子からなる微粒子を上記リン酸カルシウム系化合物と水系媒体と混合してペースト状骨再生材料としたときに、該ペースト状骨再生材料で吸水して膨潤した上記生体吸収性高分子からなる微粒子の平均粒子径が30〜500μm程度になるように架橋を施すことが好ましい。
例えば、上記ゼラチン微粒子を熱架橋する場合、真空下で110〜170℃、5分〜48時間程度の熱処理を行うことが考えられる。
【0017】
上記生体吸収性高分子からなる微粒子の平均粒子径の好ましい下限は10μm、好ましい上限は400μmである。上記生体吸収性高分子からなる微粒子の平均粒子径が10μm未満であると、骨芽細胞が侵入可能な連続孔を形成できないことがあり、400μmを超えると、硬化物の強度が低く充分に骨の力学強度を補えないことがある。上記生体吸収性高分子からなる微粒子の平均粒子径のより好ましい下限は20μm、より好ましい上限は200μmである。
【0018】
上記水系媒体は、ペースト状骨再生材料の媒体となるものである。
上記水系媒体は、注射用水等が挙げられる。上記水系媒体は、pHを調整する目的で、バッファー成分を含有してもよい。また、上記水系媒体として、骨髄液や細胞懸濁液も使用することができる。
更に、上記水系媒体は、粘度を調整する目的で少量の水溶性高分子を含有したり、感染を予防する目的で抗菌剤を含有したり、骨再生を促進する目的で各種の成長因子等を含有してもよい。
上記水溶性高分子は、例えば、乳酸、グリコール酸、コハク酸、マレイン酸、フマル酸、リンゴ酸等の重合体、コンドロイチン硫酸、ヒアルロン酸、デキストラン硫酸、ヘパラン硫酸等が挙げられる。
【0019】
本発明の骨再生材料キットは、更に各種細胞増殖因子、抗菌剤、抗生物質等の薬剤を有してもよい。これらを有する骨再生材料キットを用いれば、骨の欠損部又は損傷部に充填して硬化させた後、該硬化物が分解するとともに該薬剤が徐々に放出されることから、長期にわたって薬理効果を発揮することができる。例えば、細胞増殖因子の徐放により早期の骨再生が期待される。また、抗菌剤、抗生物質等の除放により、骨欠損部近傍に細菌等が多く存在する環境下(例えば、骨感染例や口腔内)での使用も可能となる。更に、細胞増殖因子と骨髄間葉系細胞を含む骨髄細胞とを併用した場合には、骨粗鬆症に伴う難治性骨折や脊椎圧迫骨折等の、骨修復部周囲に骨形成に必要な細胞が乏しいと考えられる場合や、骨修復部中心部まで骨形成に有効な細胞侵入が期待できない場合等にも、高い治癒効果の発揮を期待できる。なお、上記薬剤は、骨再生関連の薬剤のみに限定されない。
【0020】
本発明の骨再生材料キットを用いて、ペースト状骨再生材料を調製することができる。
ここでペースト状骨再生材料とは、使用時にはペースト状であってインジェクターにより骨の欠損部又は損傷部に容易に充填することができ、充填後に体内で硬化させることができる骨再生材料を意味する。
本発明の骨再生材料キットを構成するリン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とを混合してペースト状としたペースト状骨再生材料もまた、本発明の1つである。
【0021】
上記リン酸カルシウム系化合物からなる微粒子は、水系媒体と混合するとゾル化し、室温下でも時間の経過とともにゲル化し、最終的には硬化する。また、上記生体吸収性高分子からなる微粒子は、水系媒体と混合すると、室温下でも時間の経過とともに溶解したり、膨潤したりする。従って、ペースト状骨再生材料は、できる限り手術現場において施術の直前に調製することが好ましい。
【0022】
本発明のペースト状骨再生材料を調製するにあたって、上記リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とを配合する比率は特に限定されず、混練操作のしやすさ、インジェクターを用いたインジェクトのしやすさ、硬化までの時間、硬化物の強度等を考慮して決定する。
【0023】
上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子との配合比率を調整することによって、硬化物の空隙率を調整することができ、これにより硬化物の強度と骨の再生速度とを制御することができる。
上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子との配合比率は、重量比で97:3〜76:24の範囲であることが好ましい。この範囲内であると、短期的な骨の力学的強度を確保と、長期的な骨の再生とを両立することができる。この範囲よりも上記生体吸収性高分子からなる微粒子が少ない場合には、充分な連続孔が形成されずに骨の再生が進まないことがあり、この範囲よりも上記生体吸収性高分子からなる微粒子が多い場合には、硬化物の強度が低いことがある。より好ましくは重量比で95:5〜80:20の範囲であり、更に好ましくは重量比で90:10〜85:15の範囲である。
【0024】
骨再生材料に必要とされる強度は適用する部位によって異なる。従って、上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子との好ましい配合比率の範囲内において、その適用部位を考慮して配合比率を決定すればよい。
例えば、踵骨、大腿骨、脛骨、椎体等は、大きな荷重がかかる部位であることから、これらの部位に適用する場合には、骨の再生速度よりも強度を優先させるべきである。即ち、生体吸収性高分子からなる微粒子の配合比率を低めに設定する。
例えば、上腕骨、前腕(橈尺)骨、指骨等は、大きな荷重はかからない部位であることから、これらの部位に適用する場合には、強度よりも骨の再生速度を優先させるべきである。即ち、生体吸収性高分子からなる微粒子の配合比率を高めに設定する。
【0025】
上記水系媒体の含有量は、上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子との合計100重量部に対する好ましい下限が5重量部、好ましい上限が65重量部である。上記水系媒体の含有量が5重量部未満であると、ペースト状骨再生材料の粘度が高くインジェクトが困難となることがあり、65重量部を超えると、硬化させたときに、収縮することがある。上記水系媒体の含有量のより好ましい下限は15重量部、より好ましい上限は45重量部である。
【0026】
上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子と水系媒体とを混合する方法は特に限定されないが、リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子と水系媒体とシリンジ中に入れ、練和混合する方法や
板状でリン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子と水系媒体を練和混合する方法が好適である。
【0027】
本発明のペースト状骨再生材料を調製するにあたって、上記リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とを配合する手順については特に限定されず、上記リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体との全量を同時に混合してもかまわない。
しかしながら、上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子とを混合した後、この混合物に上記水系媒体を加えていく方法や、上記リン酸カルシウム系化合物からなる微粒子に上記水系媒体の一部量を加え練和混合した後、上記生体吸収性高分子からなる微粒子、上記水系媒体の残部量を加えて混合する方法が好ましい。このような方法でペースト状骨再生材料を調製することにより、より均一に調整することができ、強度の高い骨再生材料が得られる。
【0028】
本発明のペースト状骨再生材料は、注射器等のインジェクターを用いて、容易に骨の欠損部又は損傷部に充填することができる。充填したペースト状骨再生材料は室温下でも硬化して骨再生材料となり、骨の力学的強度を補完する。更に、時間の経過に従って上記生体吸収性高分子からなる微粒子が吸収されることにより連続孔が形成され、該連続孔に骨芽細胞が侵入することにより患者自身の骨が再生される。
また、本発明のペースト状骨再生材料をいったん外部で硬化させて骨再生材料を形成した後、該骨再生材料を骨の欠損部又は損傷部に充填したり、骨接合材として使用してもよい。
本発明のペースト状骨再生材料を硬化してなる骨再生材料、骨接合材もまた、本発明の1つである。
【発明の効果】
【0029】
本発明によれば、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材を提供することができる。
【図面の簡単な説明】
【0030】
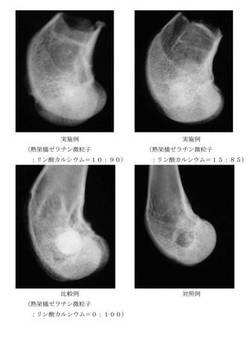
【図1】実施例及び比較例のペースト状骨再生材料を用いて海綿骨の欠損の再生を行った場合の組織の移植12週後の単純X線像と、対照例として欠損を生じさせなかった場合の組織の単純X線像である。
【図2】実施例及び比較例のペースト状骨再生材料を用いて海綿骨の欠損の再生を行った場合の組織の移植12週後のマイクロCT像である。
【図3】実施例及び比較例のペースト状骨再生材料を用いて海綿骨の欠損の再生を行った場合の移植12週後の組織のVillanueva Bone染色像である。
【図4】実施例及び比較例のペースト状骨再生材料を用いて皮質骨(緻密骨)の欠損の再生を行った場合の組織の移植12週後のマイクロCT像である。
【発明を実施するための形態】
【0031】
以下に実施例を挙げて本発明の態様を更に詳しく説明するが、本発明はこれら実施例にのみ限定されるものではない。
【0032】
(実施例1)
平均粒子径が200μmのゼラチン粒子を真空下で140℃で14時間熱処理し、熱架橋ゼラチン微粒子を得た。得られた熱架橋ゼラチン微粒子と、平均粒子径が10μmのリン酸カルシウム系微粒子(α型リン酸三カルシウム74.9体積%、リン酸四カルシウム17体積%、リン酸水素カルシウム二水和物5体積%及び水酸アパタイト2体積%、リン酸マグネシウム0.1体積%含有)とを、5:95、10:90、15:85及び20:80の重量比となるように混合した。次いで、これらの微粒子の総重量100重量部に対して45重量部の水系媒体(5.4%コンドロイチン硫酸ナトリウム、13%コハク酸二ナトリウム無水物含有水溶液、0.3%亜硫酸水素ナトリウム)を加えて、1分間混合して、ペースト状骨再生材料を得た。
【0033】
(比較例1)
平均粒子径が10μmのリン酸カルシウム系微粒子(α型リン酸三カルシウム74.9体積%、リン酸四カルシウム17体積%、リン酸水素カルシウム二水和物5体積%及び水酸アパタイト2体積%、リン酸マグネシウム0.1体積%含有)100重量部に対して、45重量部の水系媒体(5.4%コンドロイチン硫酸ナトリウム、13%コハク酸二ナトリウム無水物含有水溶液、0.3%亜硫酸水素ナトリウム)を加えて、1分間混合して、ペースト状骨再生材料を得た。
【0034】
(評価)
(1)海綿骨の欠損の再生
骨の内部を構成する海綿骨の欠損に対して、以下の方法により本発明のペースト状骨再生材料の適用の有効性について検討を行った。
ウサギ大腿骨骨頭遠位部に直径4mmの骨孔を作製した。この骨孔に、実施例及び比較例で調製したペースト状骨再生材料を、16G、2.5ccの注射器を用いて注入した。
【0035】
このとき実施例で調製したペースト状骨再生材料は、調製してから硬化するまでの時間のバラツキが小さく、使用感が良好であった。また、実施例で調製したペースト状骨再生材料は、骨孔に注入した後すぐに骨孔に密着して、硬化した骨再生材料が崩落したり、剥離したりする心配がなかった。一方、比較例で調製したペースト状骨再生材料は、調製してから硬化するまでの時間のバラツキが大きく、ごく短時間で硬化が開始して注射器による注入が困難になることがあった。また、比較例で調製したペースト状骨再生材料は、骨孔に対する密着性に乏しく、硬化した骨再生材料が崩落したり、剥離したりする恐れがあった。
【0036】
図1に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織の単純X線像と、対照例として欠損を生じさせなかった場合の組織の単純X線像を示した。
図1より、実施例のペースト状骨再生材料を用いた例では、注入した骨再生材料と周囲の骨組織の辺縁が不明瞭となっており、透過性は周囲の骨組織と近い程度にまで亢進していた。一方、比較例のペースト状骨再生材料を注入した骨孔については、注入した骨再生材料と周囲の骨組織の辺縁は明瞭なままであり、透過性も周囲の骨組織に比べ低いままであった。
【0037】
図2に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織のマイクロCT像を示した。
図2より、実施例のペースト状骨再生材料を用いた例では、骨再生材料注入部分は、より多孔質な像が観察され、周囲の骨組織との境界が不明瞭となっていた。特に熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を15:85とした骨再生材料では、周囲の骨梁と類似した像が観察された。
【0038】
図3に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織のVillanueva Bone染色像を示した。
図3より、実施例のペースト状骨再生材料を用いた例では、注入した骨再生材料が周囲から吸収され、周囲を取り囲むように中心へ向かって青く濃染される小球形単核細胞が多数観察された。比較例のペースト状骨再生材料を注入した骨孔については、骨再生材料と骨の境界に沿ってのみ骨形成が見られ、骨再生材料はほとんど吸収されていなかった。
【0039】
更に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織の蛍光像も作成して検討した。蛍光像より、実施例のペースト状骨再生材料を用いた例では、残存した骨再生材料と浸潤した細胞群との境界に沿って、緑色に染まる石灰化骨と赤色に染まる類骨の形成が全周性に観察された。特に熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を15:85とした骨再生材料では、骨再生材料の吸収が更に進み、周囲から骨梁が伸びるように中心に向かって骨形成が見られ、再生した骨梁には血管も観察された。中心部でも、周囲の骨髄腔全域を占める繊維組織と骨芽細胞とともに骨梁の形成が見られた。偏光像では、中心部付近においても再生骨梁に層板骨が確認された。蛍光像では、周囲から中心部付近まで再生骨梁に類骨形成が見られ、幅広い石灰化骨領域が確認された。
【0040】
(2)皮質骨(緻密骨)の欠損の再生−1
骨の表面近くの構成成分である皮質骨(緻密骨)の欠損に対して、以下の方法により本発明のペースト状骨再生材料の適用の有効性について検討を行った。
ウサギ下腿近位前内側、膝関節面から30mmの部位(皮質骨が比較的厚い部位)に直径5.0mmの骨孔を作製した。この骨孔に、実施例及び比較例で調製したペースト状骨再生材料を、16G、2.5ccの注射器を用いて注入した。
皮質骨(緻密骨)の欠損の再生においても、海綿骨の欠損の再生の場合と同様に、実施例で調製したペースト状骨再生材料の方が使用感や骨孔に対する密着性が良好であった。
【0041】
実施例のペースト状骨再生材料を注入した骨孔について、経時的に標本を取り出し、骨再生材料注入部分を肉眼的に観察した。
2週後ではいずれの骨再生材料も大きな相違なく、骨形成は見られなかった。しかし4週後になると、熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を10:90としたペースト状骨再生材料を用いた例ではすでに辺縁から皮質骨様骨組織による修復が認められていた。更に8週後になると、熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を15:85としたペースト状骨再生材料を用いた例でも同程度の皮質骨様骨組織の形成が認められ、12週後になると、熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を5:95及び20:80としたペースト状骨再生材料を用いた例においても同様の皮質骨様骨組織形成が認められた。
【0042】
図4に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織のマイクロCT像を示した。
図4より、実施例のペースト状骨再生材料を用いた例では、周囲の皮質骨のCT値と同等の緻密体である皮質骨様構造が認められた。なかでも、熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比が10:90、15:85のペースト状骨再生材料を用いた例では、周囲の皮質骨との連続性が明らかに認められた。髄腔内に注入された骨再生材料は同部位で経時的に吸収される傾向を示し、骨孔作製部の本来の骨組織構造である皮質骨と骨髄腔の再生が認められた。
【0043】
(3)皮質骨の欠損(緻密骨)の再生−2
皮質骨(緻密骨)の欠損に対するブロック状の骨再生材料の適用の有効性について、以下の方法により検討を行った。
実施例及び比較例で調製したペースト状骨再生材料を、直径5mm、長さ10mmの型枠中に充填し、空気中で1日硬化させ、直径5mm、長さ10mmの形状のブロック状の骨再生材料を得た。
ウサギ下腿近位前内側、膝関節面から30mmの部位(皮質骨が比較的厚い部位)に直径5.0mmの骨孔を作製した。この骨孔にブロック状の骨再生材料を周囲の皮質骨の面に合わせた深さまで挿入した。
【0044】
実施例のブロック状の骨再生材料を注入した骨孔について、12週後に標本を取り出し、骨再生材料注入部分を肉眼的に観察した。5:95、10:90、15:85、20:80のいずれの骨再生材料を用いた場合にも大きな相違なく、辺縁から皮質骨様骨組織による修復が認められた。単純X線像を観察したところ、周囲の皮質骨と同等の透過性もった皮質骨様骨組織がみられた。また、マイクロCT像では、周囲の皮質骨のCT値と同等の緻密体である皮質骨様構造がみられた。
【産業上の利用可能性】
【0045】
本発明によれば、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材を提供することができる。
【技術分野】
【0001】
本発明は、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材に関する。
【背景技術】
【0002】
骨の欠損部又は損傷部の治療には人工骨が用いられている。
従来の人工骨としては、リン酸カルシウムからなる緻密体と多孔体の人工骨が知られていた。このような人工骨は、治療の対象となる骨の状態に合わせて、形状等を整える必要がある。しかし、手術現場において人工骨を切断加工したり、切削加工したりすることは困難であり、使いにくいという問題があった。
【0003】
これに対して、リン酸カルシウム顆粒を水系媒体中に懸濁させたペースト状骨補填材料が提案されている(例えば、特許文献1〜3)。ペースト状骨補填材料は、インジェクター等を用いて骨の欠損部又は損傷部に充填させることができる。ペースト状骨補填材料は、充填後に硬化して骨の欠損部又は損傷部に固定される。ペースト状骨補填材料を用いれば、複雑な欠損部又は損傷部であっても容易に治療を行うことができる。
【0004】
しかしながら、特許文献1〜3に記載されたペースト状骨補填材料を用いても、単に骨の欠損部又は損傷部を補うだけで、骨の再生を促進するわけではない。実際に、骨の再生は、充填した骨補填材料の表面に限られている。また、この骨補填材料は、力学強度はきわめて高いものの、骨組織の有するコラーゲン繊維等の有機成分を含有しないことから、弾性率と靭性に劣るという決定的な欠点もあった。従って、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すような骨再生材料が求められていた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2000−262609号公報
【特許文献2】特許第4134299号
【特許文献3】特許第3322231号
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明は、リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とからなる骨再生材料キットである。
以下に本発明を詳述する。
【0008】
本発明者は、鋭意検討の結果、リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子と水系媒体とを混合するとペースト状骨再生材料が得られること、該ペースト状骨再生材料はインジェクターにより骨の欠損部又は損傷部に容易に充填でき体内で硬化させることができること、及び、該ペースト状骨再生材料の硬化物によって短期的には骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができることを見出し、本発明を完成した。
【0009】
従来のリン酸カルシウム系化合物からなる微粒子と水系媒体とからなるペースト状骨補填材料は、充填して硬化させることにより、骨の力学的強度を確保することができる。しかしながら、硬化した骨補填材料を構成するリン酸カルシウム系化合物はほとんど生体内に吸収されない(生体内に吸収されるとしても、極めてゆっくりとした速度でしか吸収されない)ことから、骨芽細胞が侵入することができない。患者自身の骨を再生するためには、骨芽細胞等が人工骨内に侵入して増殖する必要がある。
これに対して本発明では、生体吸収性高分子からなる微粒子を配合することにより、該生体吸収性高分子からなる微粒子が生体吸収されることにより充填部に連続孔が生じる。このことから、該連続孔に骨芽細胞が侵入して増殖することができる。即ち、本発明の骨再生材料キットを用いて調製したペースト状骨再生材料は、骨の欠損部を補う役割と同時に、骨芽細胞の増殖のための足場材料としての役割も果たすことができる。更に、骨の欠損部の再生にとどまらず、軟骨欠損に対する修復(軟骨下骨の修復)や靱帯・腱の付着部の骨修復に関して組織工学的担体としての役割も果たすことができる。
【0010】
本発明の骨再生材料キットは、リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とからなる。
上記リン酸カルシウム系化合物からなる粒子は、水系媒体と混合するとペースト状となり、体内で硬化して、骨の力学強度を補う役割を有する。
【0011】
上記リン酸カルシウム系化合物は特に限定されず、例えば、リン酸三カルシウム、リン酸四カルシウム、リン酸水素カルシウム、水酸アパタイト、炭素含有アパタイト、フッ素アパタイト等が挙げられる。これらのリン酸カルシウム系化合物は単独で用いてもよく、2種以上を併用してもよい。
【0012】
上記リン酸カルシウム系化合物からなる微粒子の平均粒子径の好ましい下限は5μm、好ましい上限は100μmである。上記リン酸カルシウム系化合物からなる微粒子の平均粒子径が5μm未満であると、上記水系媒体と混合してペースト状にしたときに粘度が上昇してインジェクトが難しくなることがある。100μmを超えると、硬化物の強度が低く充分に骨の力学強度を補えないことがある。上記リン酸カルシウム系化合物からなる微粒子の平均粒子径のより好ましい上限は50μmである。
【0013】
上記生体吸収性高分子からなる微粒子は、施術後に徐々に生体内で吸収されて、充填部に骨芽細胞が侵入可能な連続孔を生じさせる役割を有する。また、上記生体吸収性高分子からなる微粒子が生体内で膨潤することで、充填部分への密着性が向上するという効果も得られる。
上記生体吸収性高分子は特に限定されず、例えば、ポリ乳酸、ポリグリコール酸、乳酸−グリコール酸共重合体、グリコール酸−ε−カプロラクトン共重合体、乳酸−ε−カプロラクトン共重合体、ポリリンゴ酸、ポリ−α−シアノアクリレート、ポリ−β−ヒドロキシ酸、ポリトリメチレンオキサレート、ポリテトラメチレンオキサレート、ポリオルソエステル、ポリオルソカーボネート、ポリエチレンカーボネート、ポリ−γ−ベンジル−L−グルタメート、ポリ−L−グルタミン酸、ポリ−γ−メチル−L−グルタメート、ポリ−L−リジン、ポリ−L−アラニン等の合成高分子;デンプン、アルギン酸、ヒアルロン酸、キチン、ペクチン酸及びその誘導体等の多糖類や、ゼラチン、コラーゲン、アルブミン、フィブリン等のタンパク質等の天然高分子等が挙げられる。これらの生体吸収性高分子は単独で用いてもよく、2種以上を併用してもよい。なかでも、生体親和性に優れ、架橋等の程度により生体吸収性を制御可能であることから、ゼラチン、コラーゲン又はヒアルロン酸が好適であり、ゼラチンがより好適である。
【0014】
ゼラチン等の親水性の高い高分子は、水分を含むことで膨潤する。このため、骨孔内に移植した後、周囲の水分を吸い、体積を増し、骨孔に密着することが期待される。親水性の高い生体吸収性高分子を含む本発明の骨再生材料キットは、止血効果があり、出血のある部位にも用いることができる。従来の無機材料のみを含むペースト状骨補填材料を用いても出血が止まらず、ペースト状骨補填材料が大量の血液を吸収して強度が低下してしまう、又は、崩壊して欠損部に流れ出てしまうということがあった。また、ゼラチンからなる生体吸収性高分子を含有することにより、本発明の骨再生材料キットを混合してから硬化するまでの時間のバラツキが小さくなるという効果も発揮される。
【0015】
上記生体吸収性高分子からなる微粒子がゼラチン、コラーゲン又はヒアルロン酸からなる場合、上記ゼラチン、コラーゲン又はヒアルロン酸は架橋されていることが好ましい。未架橋のゼラチン、コラーゲン又はヒアルロン酸からなる微粒子を用いると、上記水系媒体に懸濁させたときに溶解してしまい、充填部に骨芽細胞が侵入可能な連続孔を生じさせることができないことがある。また、溶解まではしないとしても、吸水して、必要以上の粒子径にまで膨潤してしまうことがある。
【0016】
上記架橋の方法は特に限定されず、熱脱水架橋、紫外線架橋、化学架橋、イオン架橋等の従来公知の架橋方法を用いることができる。
上記架橋の方法や程度により、吸水性や生体吸収性を制御することができる。好ましくは、上記生体吸収性高分子からなる微粒子を上記リン酸カルシウム系化合物と水系媒体と混合してペースト状骨再生材料としたときに、該ペースト状骨再生材料で吸水して膨潤した上記生体吸収性高分子からなる微粒子の平均粒子径が30〜500μm程度になるように架橋を施すことが好ましい。
例えば、上記ゼラチン微粒子を熱架橋する場合、真空下で110〜170℃、5分〜48時間程度の熱処理を行うことが考えられる。
【0017】
上記生体吸収性高分子からなる微粒子の平均粒子径の好ましい下限は10μm、好ましい上限は400μmである。上記生体吸収性高分子からなる微粒子の平均粒子径が10μm未満であると、骨芽細胞が侵入可能な連続孔を形成できないことがあり、400μmを超えると、硬化物の強度が低く充分に骨の力学強度を補えないことがある。上記生体吸収性高分子からなる微粒子の平均粒子径のより好ましい下限は20μm、より好ましい上限は200μmである。
【0018】
上記水系媒体は、ペースト状骨再生材料の媒体となるものである。
上記水系媒体は、注射用水等が挙げられる。上記水系媒体は、pHを調整する目的で、バッファー成分を含有してもよい。また、上記水系媒体として、骨髄液や細胞懸濁液も使用することができる。
更に、上記水系媒体は、粘度を調整する目的で少量の水溶性高分子を含有したり、感染を予防する目的で抗菌剤を含有したり、骨再生を促進する目的で各種の成長因子等を含有してもよい。
上記水溶性高分子は、例えば、乳酸、グリコール酸、コハク酸、マレイン酸、フマル酸、リンゴ酸等の重合体、コンドロイチン硫酸、ヒアルロン酸、デキストラン硫酸、ヘパラン硫酸等が挙げられる。
【0019】
本発明の骨再生材料キットは、更に各種細胞増殖因子、抗菌剤、抗生物質等の薬剤を有してもよい。これらを有する骨再生材料キットを用いれば、骨の欠損部又は損傷部に充填して硬化させた後、該硬化物が分解するとともに該薬剤が徐々に放出されることから、長期にわたって薬理効果を発揮することができる。例えば、細胞増殖因子の徐放により早期の骨再生が期待される。また、抗菌剤、抗生物質等の除放により、骨欠損部近傍に細菌等が多く存在する環境下(例えば、骨感染例や口腔内)での使用も可能となる。更に、細胞増殖因子と骨髄間葉系細胞を含む骨髄細胞とを併用した場合には、骨粗鬆症に伴う難治性骨折や脊椎圧迫骨折等の、骨修復部周囲に骨形成に必要な細胞が乏しいと考えられる場合や、骨修復部中心部まで骨形成に有効な細胞侵入が期待できない場合等にも、高い治癒効果の発揮を期待できる。なお、上記薬剤は、骨再生関連の薬剤のみに限定されない。
【0020】
本発明の骨再生材料キットを用いて、ペースト状骨再生材料を調製することができる。
ここでペースト状骨再生材料とは、使用時にはペースト状であってインジェクターにより骨の欠損部又は損傷部に容易に充填することができ、充填後に体内で硬化させることができる骨再生材料を意味する。
本発明の骨再生材料キットを構成するリン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とを混合してペースト状としたペースト状骨再生材料もまた、本発明の1つである。
【0021】
上記リン酸カルシウム系化合物からなる微粒子は、水系媒体と混合するとゾル化し、室温下でも時間の経過とともにゲル化し、最終的には硬化する。また、上記生体吸収性高分子からなる微粒子は、水系媒体と混合すると、室温下でも時間の経過とともに溶解したり、膨潤したりする。従って、ペースト状骨再生材料は、できる限り手術現場において施術の直前に調製することが好ましい。
【0022】
本発明のペースト状骨再生材料を調製するにあたって、上記リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とを配合する比率は特に限定されず、混練操作のしやすさ、インジェクターを用いたインジェクトのしやすさ、硬化までの時間、硬化物の強度等を考慮して決定する。
【0023】
上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子との配合比率を調整することによって、硬化物の空隙率を調整することができ、これにより硬化物の強度と骨の再生速度とを制御することができる。
上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子との配合比率は、重量比で97:3〜76:24の範囲であることが好ましい。この範囲内であると、短期的な骨の力学的強度を確保と、長期的な骨の再生とを両立することができる。この範囲よりも上記生体吸収性高分子からなる微粒子が少ない場合には、充分な連続孔が形成されずに骨の再生が進まないことがあり、この範囲よりも上記生体吸収性高分子からなる微粒子が多い場合には、硬化物の強度が低いことがある。より好ましくは重量比で95:5〜80:20の範囲であり、更に好ましくは重量比で90:10〜85:15の範囲である。
【0024】
骨再生材料に必要とされる強度は適用する部位によって異なる。従って、上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子との好ましい配合比率の範囲内において、その適用部位を考慮して配合比率を決定すればよい。
例えば、踵骨、大腿骨、脛骨、椎体等は、大きな荷重がかかる部位であることから、これらの部位に適用する場合には、骨の再生速度よりも強度を優先させるべきである。即ち、生体吸収性高分子からなる微粒子の配合比率を低めに設定する。
例えば、上腕骨、前腕(橈尺)骨、指骨等は、大きな荷重はかからない部位であることから、これらの部位に適用する場合には、強度よりも骨の再生速度を優先させるべきである。即ち、生体吸収性高分子からなる微粒子の配合比率を高めに設定する。
【0025】
上記水系媒体の含有量は、上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子との合計100重量部に対する好ましい下限が5重量部、好ましい上限が65重量部である。上記水系媒体の含有量が5重量部未満であると、ペースト状骨再生材料の粘度が高くインジェクトが困難となることがあり、65重量部を超えると、硬化させたときに、収縮することがある。上記水系媒体の含有量のより好ましい下限は15重量部、より好ましい上限は45重量部である。
【0026】
上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子と水系媒体とを混合する方法は特に限定されないが、リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子と水系媒体とシリンジ中に入れ、練和混合する方法や
板状でリン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子と水系媒体を練和混合する方法が好適である。
【0027】
本発明のペースト状骨再生材料を調製するにあたって、上記リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とを配合する手順については特に限定されず、上記リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体との全量を同時に混合してもかまわない。
しかしながら、上記リン酸カルシウム系化合物からなる微粒子と生体吸収性高分子からなる微粒子とを混合した後、この混合物に上記水系媒体を加えていく方法や、上記リン酸カルシウム系化合物からなる微粒子に上記水系媒体の一部量を加え練和混合した後、上記生体吸収性高分子からなる微粒子、上記水系媒体の残部量を加えて混合する方法が好ましい。このような方法でペースト状骨再生材料を調製することにより、より均一に調整することができ、強度の高い骨再生材料が得られる。
【0028】
本発明のペースト状骨再生材料は、注射器等のインジェクターを用いて、容易に骨の欠損部又は損傷部に充填することができる。充填したペースト状骨再生材料は室温下でも硬化して骨再生材料となり、骨の力学的強度を補完する。更に、時間の経過に従って上記生体吸収性高分子からなる微粒子が吸収されることにより連続孔が形成され、該連続孔に骨芽細胞が侵入することにより患者自身の骨が再生される。
また、本発明のペースト状骨再生材料をいったん外部で硬化させて骨再生材料を形成した後、該骨再生材料を骨の欠損部又は損傷部に充填したり、骨接合材として使用してもよい。
本発明のペースト状骨再生材料を硬化してなる骨再生材料、骨接合材もまた、本発明の1つである。
【発明の効果】
【0029】
本発明によれば、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材を提供することができる。
【図面の簡単な説明】
【0030】
【図1】実施例及び比較例のペースト状骨再生材料を用いて海綿骨の欠損の再生を行った場合の組織の移植12週後の単純X線像と、対照例として欠損を生じさせなかった場合の組織の単純X線像である。
【図2】実施例及び比較例のペースト状骨再生材料を用いて海綿骨の欠損の再生を行った場合の組織の移植12週後のマイクロCT像である。
【図3】実施例及び比較例のペースト状骨再生材料を用いて海綿骨の欠損の再生を行った場合の移植12週後の組織のVillanueva Bone染色像である。
【図4】実施例及び比較例のペースト状骨再生材料を用いて皮質骨(緻密骨)の欠損の再生を行った場合の組織の移植12週後のマイクロCT像である。
【発明を実施するための形態】
【0031】
以下に実施例を挙げて本発明の態様を更に詳しく説明するが、本発明はこれら実施例にのみ限定されるものではない。
【0032】
(実施例1)
平均粒子径が200μmのゼラチン粒子を真空下で140℃で14時間熱処理し、熱架橋ゼラチン微粒子を得た。得られた熱架橋ゼラチン微粒子と、平均粒子径が10μmのリン酸カルシウム系微粒子(α型リン酸三カルシウム74.9体積%、リン酸四カルシウム17体積%、リン酸水素カルシウム二水和物5体積%及び水酸アパタイト2体積%、リン酸マグネシウム0.1体積%含有)とを、5:95、10:90、15:85及び20:80の重量比となるように混合した。次いで、これらの微粒子の総重量100重量部に対して45重量部の水系媒体(5.4%コンドロイチン硫酸ナトリウム、13%コハク酸二ナトリウム無水物含有水溶液、0.3%亜硫酸水素ナトリウム)を加えて、1分間混合して、ペースト状骨再生材料を得た。
【0033】
(比較例1)
平均粒子径が10μmのリン酸カルシウム系微粒子(α型リン酸三カルシウム74.9体積%、リン酸四カルシウム17体積%、リン酸水素カルシウム二水和物5体積%及び水酸アパタイト2体積%、リン酸マグネシウム0.1体積%含有)100重量部に対して、45重量部の水系媒体(5.4%コンドロイチン硫酸ナトリウム、13%コハク酸二ナトリウム無水物含有水溶液、0.3%亜硫酸水素ナトリウム)を加えて、1分間混合して、ペースト状骨再生材料を得た。
【0034】
(評価)
(1)海綿骨の欠損の再生
骨の内部を構成する海綿骨の欠損に対して、以下の方法により本発明のペースト状骨再生材料の適用の有効性について検討を行った。
ウサギ大腿骨骨頭遠位部に直径4mmの骨孔を作製した。この骨孔に、実施例及び比較例で調製したペースト状骨再生材料を、16G、2.5ccの注射器を用いて注入した。
【0035】
このとき実施例で調製したペースト状骨再生材料は、調製してから硬化するまでの時間のバラツキが小さく、使用感が良好であった。また、実施例で調製したペースト状骨再生材料は、骨孔に注入した後すぐに骨孔に密着して、硬化した骨再生材料が崩落したり、剥離したりする心配がなかった。一方、比較例で調製したペースト状骨再生材料は、調製してから硬化するまでの時間のバラツキが大きく、ごく短時間で硬化が開始して注射器による注入が困難になることがあった。また、比較例で調製したペースト状骨再生材料は、骨孔に対する密着性に乏しく、硬化した骨再生材料が崩落したり、剥離したりする恐れがあった。
【0036】
図1に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織の単純X線像と、対照例として欠損を生じさせなかった場合の組織の単純X線像を示した。
図1より、実施例のペースト状骨再生材料を用いた例では、注入した骨再生材料と周囲の骨組織の辺縁が不明瞭となっており、透過性は周囲の骨組織と近い程度にまで亢進していた。一方、比較例のペースト状骨再生材料を注入した骨孔については、注入した骨再生材料と周囲の骨組織の辺縁は明瞭なままであり、透過性も周囲の骨組織に比べ低いままであった。
【0037】
図2に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織のマイクロCT像を示した。
図2より、実施例のペースト状骨再生材料を用いた例では、骨再生材料注入部分は、より多孔質な像が観察され、周囲の骨組織との境界が不明瞭となっていた。特に熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を15:85とした骨再生材料では、周囲の骨梁と類似した像が観察された。
【0038】
図3に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織のVillanueva Bone染色像を示した。
図3より、実施例のペースト状骨再生材料を用いた例では、注入した骨再生材料が周囲から吸収され、周囲を取り囲むように中心へ向かって青く濃染される小球形単核細胞が多数観察された。比較例のペースト状骨再生材料を注入した骨孔については、骨再生材料と骨の境界に沿ってのみ骨形成が見られ、骨再生材料はほとんど吸収されていなかった。
【0039】
更に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織の蛍光像も作成して検討した。蛍光像より、実施例のペースト状骨再生材料を用いた例では、残存した骨再生材料と浸潤した細胞群との境界に沿って、緑色に染まる石灰化骨と赤色に染まる類骨の形成が全周性に観察された。特に熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を15:85とした骨再生材料では、骨再生材料の吸収が更に進み、周囲から骨梁が伸びるように中心に向かって骨形成が見られ、再生した骨梁には血管も観察された。中心部でも、周囲の骨髄腔全域を占める繊維組織と骨芽細胞とともに骨梁の形成が見られた。偏光像では、中心部付近においても再生骨梁に層板骨が確認された。蛍光像では、周囲から中心部付近まで再生骨梁に類骨形成が見られ、幅広い石灰化骨領域が確認された。
【0040】
(2)皮質骨(緻密骨)の欠損の再生−1
骨の表面近くの構成成分である皮質骨(緻密骨)の欠損に対して、以下の方法により本発明のペースト状骨再生材料の適用の有効性について検討を行った。
ウサギ下腿近位前内側、膝関節面から30mmの部位(皮質骨が比較的厚い部位)に直径5.0mmの骨孔を作製した。この骨孔に、実施例及び比較例で調製したペースト状骨再生材料を、16G、2.5ccの注射器を用いて注入した。
皮質骨(緻密骨)の欠損の再生においても、海綿骨の欠損の再生の場合と同様に、実施例で調製したペースト状骨再生材料の方が使用感や骨孔に対する密着性が良好であった。
【0041】
実施例のペースト状骨再生材料を注入した骨孔について、経時的に標本を取り出し、骨再生材料注入部分を肉眼的に観察した。
2週後ではいずれの骨再生材料も大きな相違なく、骨形成は見られなかった。しかし4週後になると、熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を10:90としたペースト状骨再生材料を用いた例ではすでに辺縁から皮質骨様骨組織による修復が認められていた。更に8週後になると、熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を15:85としたペースト状骨再生材料を用いた例でも同程度の皮質骨様骨組織の形成が認められ、12週後になると、熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比を5:95及び20:80としたペースト状骨再生材料を用いた例においても同様の皮質骨様骨組織形成が認められた。
【0042】
図4に、実施例及び比較例のペースト状骨再生材料を用いた例における12週後の組織のマイクロCT像を示した。
図4より、実施例のペースト状骨再生材料を用いた例では、周囲の皮質骨のCT値と同等の緻密体である皮質骨様構造が認められた。なかでも、熱架橋ゼラチン微粒子とリン酸カルシウム系微粒子との比が10:90、15:85のペースト状骨再生材料を用いた例では、周囲の皮質骨との連続性が明らかに認められた。髄腔内に注入された骨再生材料は同部位で経時的に吸収される傾向を示し、骨孔作製部の本来の骨組織構造である皮質骨と骨髄腔の再生が認められた。
【0043】
(3)皮質骨の欠損(緻密骨)の再生−2
皮質骨(緻密骨)の欠損に対するブロック状の骨再生材料の適用の有効性について、以下の方法により検討を行った。
実施例及び比較例で調製したペースト状骨再生材料を、直径5mm、長さ10mmの型枠中に充填し、空気中で1日硬化させ、直径5mm、長さ10mmの形状のブロック状の骨再生材料を得た。
ウサギ下腿近位前内側、膝関節面から30mmの部位(皮質骨が比較的厚い部位)に直径5.0mmの骨孔を作製した。この骨孔にブロック状の骨再生材料を周囲の皮質骨の面に合わせた深さまで挿入した。
【0044】
実施例のブロック状の骨再生材料を注入した骨孔について、12週後に標本を取り出し、骨再生材料注入部分を肉眼的に観察した。5:95、10:90、15:85、20:80のいずれの骨再生材料を用いた場合にも大きな相違なく、辺縁から皮質骨様骨組織による修復が認められた。単純X線像を観察したところ、周囲の皮質骨と同等の透過性もった皮質骨様骨組織がみられた。また、マイクロCT像では、周囲の皮質骨のCT値と同等の緻密体である皮質骨様構造がみられた。
【産業上の利用可能性】
【0045】
本発明によれば、短期的には骨の欠損部又は損傷部を補って骨の力学的強度を確保できるとともに、長期的には患者自身の骨の再生を促すことができる骨再生材料キット、ペースト状骨再生材料、骨再生材料及び骨接合材を提供することができる。
【特許請求の範囲】
【請求項1】
リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とからなることを特徴とする骨再生材料キット。
【請求項2】
生体吸収性高分子が、架橋ゼラチン、架橋コラーゲン又は架橋ヒアルロン酸であることを特徴とする請求項1記載の骨再生材料キット。
【請求項3】
リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子との配合比率が重量比で97:3〜76:24の範囲であることを特徴とする請求項1又は2記載の骨再生材料キット。
【請求項4】
リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子との合計100重量部に対して5〜65重量部の水系媒体を配合することを特徴とする請求項1、2又は3記載の骨再生材料キット。
【請求項5】
請求項1、2、3又は4記載の骨再生材料キットを用いてなるペースト状骨再生材料であって、リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とを混合してペースト状としたことを特徴とするペースト状骨再生材料。
【請求項6】
請求項5記載のペースト状骨再生材料を硬化してなることを特徴とする骨再生材料。
【請求項7】
請求項5記載のペースト状骨再生材料を硬化してなることを特徴とする骨接合材。
【請求項1】
リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とからなることを特徴とする骨再生材料キット。
【請求項2】
生体吸収性高分子が、架橋ゼラチン、架橋コラーゲン又は架橋ヒアルロン酸であることを特徴とする請求項1記載の骨再生材料キット。
【請求項3】
リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子との配合比率が重量比で97:3〜76:24の範囲であることを特徴とする請求項1又は2記載の骨再生材料キット。
【請求項4】
リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子との合計100重量部に対して5〜65重量部の水系媒体を配合することを特徴とする請求項1、2又は3記載の骨再生材料キット。
【請求項5】
請求項1、2、3又は4記載の骨再生材料キットを用いてなるペースト状骨再生材料であって、リン酸カルシウム系化合物からなる微粒子と、生体吸収性高分子からなる微粒子と、水系媒体とを混合してペースト状としたことを特徴とするペースト状骨再生材料。
【請求項6】
請求項5記載のペースト状骨再生材料を硬化してなることを特徴とする骨再生材料。
【請求項7】
請求項5記載のペースト状骨再生材料を硬化してなることを特徴とする骨接合材。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2011−15957(P2011−15957A)
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2010−131345(P2010−131345)
【出願日】平成22年6月8日(2010.6.8)
【出願人】(502437894)学校法人大阪医科大学 (8)
【出願人】(000001339)グンゼ株式会社 (919)
【Fターム(参考)】
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成22年6月8日(2010.6.8)
【出願人】(502437894)学校法人大阪医科大学 (8)
【出願人】(000001339)グンゼ株式会社 (919)
【Fターム(参考)】
[ Back to top ]

