骨吸収調節剤
【課題】副作用の少ない新規の骨吸収抑制剤・破骨細胞分化抑制剤・骨増成促進剤を提供すること、および、改善された破骨細胞の分化程度を検出するためのマーカーを提供することを、本発明の課題とする。
【解決手段】上記課題は、NHA2が優れた破骨細胞の分化程度を検出するためのマーカーであり、そして、NHA2の発現および/または機能を抑制することによって、破骨細胞の分化を抑制し、その結果、骨吸収活性が抑制されることを見出すことによって、解決された。
本発明に従って、骨吸収抑制剤および破骨細胞分化抑制剤が提供される。さらに、本発明に従って、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収抑制剤および/または骨増成促進剤をスクリーニングするためのキットおよび骨吸収抑制剤および/または骨増成促進剤をスクリーニングするための方法が提供される。
【解決手段】上記課題は、NHA2が優れた破骨細胞の分化程度を検出するためのマーカーであり、そして、NHA2の発現および/または機能を抑制することによって、破骨細胞の分化を抑制し、その結果、骨吸収活性が抑制されることを見出すことによって、解決された。
本発明に従って、骨吸収抑制剤および破骨細胞分化抑制剤が提供される。さらに、本発明に従って、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収抑制剤および/または骨増成促進剤をスクリーニングするためのキットおよび骨吸収抑制剤および/または骨増成促進剤をスクリーニングするための方法が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、骨吸収調節剤、破骨細胞分化調節剤および骨増成促進剤、ならびに、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収調節剤および/または骨増成促進剤をスクリーニングするためのキットおよび骨吸収調節剤および/または骨増成促進剤をスクリーニングするための方法に関する。
【背景技術】
【0002】
骨粗鬆症や、歯周病による歯槽骨吸収など骨吸収関連疾患の骨吸収を調節することは整形外科領域、歯科領域の治療を成功する上で非常に重要である。このような内因性による骨吸収や、外来刺激による骨吸収では、RANKL等の発現が促進され、破骨細胞が活性化され、その結果、骨吸収が促進されていると考えられている。この破骨細胞を主に活性化する因子がReceptorActivator of NF-kB Ligand (RANKL)である。RANKLは破骨細胞前駆体細胞膜上のRANK分子に結合し破骨細胞の分化を促進する。RANKL-RANKのシグナルはTNF-αAssociated Factor (TRAF)2, TRAF5, TRAF6などを介して核内に伝達される。なかでもTRAF6がその中心的役割を果たしていると言われている(非特許文献1)。RANKLシグナルは破骨細胞前駆体上のRANKに結合し、TRAF6などを介して核内に伝達される。RANKをコードする遺伝子が先天的に変異する場合があり、遺伝子の変異部位によって、広範性骨格性高ホスファターゼ症(ExpansileSkeletal Hyperphosphatasia,ESH)、家族性広汎性骨溶解症(Familial Expansile Osteolysis, FEO)、あるいは骨パジェット病(Paget'sDisease of Bone, PDB)と呼ばれる骨の疾患が見られる。その他にも難聴,歯の喪失,高カルシウム血症などが見られる。
【0003】
骨吸収調節剤として、カテプシKインヒビター、RANKL抗体(デノスマブ)、および破骨細胞に直接作用するビスフォスフォネートについて臨床研究が行われているが、これらの副作用が問題となっている。
【0004】
この出願の発明に関連する先行技術文献情報としては、次のものがある。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Boyle WJ, Simonet WS, Lacey DL., Osteoclast differentiation andactivation, Nature 423: 15, 337-342, 2003
【発明の概要】
【発明が解決しようとする課題】
【0006】
そこで副作用の少ない新規の骨吸収調節剤・破骨細胞分化調節剤が求められている。
【課題を解決するための手段】
【0007】
発明者らは、RAW264.7セルラインに対してDNAアレイ法を用いて可溶性RANKL刺激に対して応答する遺伝子AV251613を同定し、その遺伝子が破骨細胞の分化マーカーとして有用であること、さらに、驚くべきことに、siRNAで直接その遺伝子をサイレンシングすること、また、その遺伝子産物の機能を抗体で間接的に調節することによって骨吸収調節効果および破骨細胞分化調節効果が奏されることを見出し、本発明を完成した。
【0008】
従って、本発明は、以下を提供する。
(項目1) 骨増成を促進する物質のスクリーニング法であって、以下:
a)配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質をスクリーニングする工程;ならびに、
b)上記工程(a)のスクリーニングによって得られた物質から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
(項目2) 前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、項目1に記載の方法。
(項目3) 前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、項目1に記載の方法。
(項目4) 前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、項目1に記載の方法。
(項目5) 前記配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質が、抗体である、項目1に記載の方法。
(項目6) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質の集団から、骨増成を促進する物質をスクリーニングする法であって、以下:
物質の集団から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
(項目7) 前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、項目6に記載の方法。
(項目8) 前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、項目6に記載の方法。
(項目9) 前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、項目6に記載の方法。
(項目10) 前記配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質が、抗体である、項目6に記載の方法。
(項目11) 以下:
(1)配列番号2に記載のアミノ酸配列からなるタンパク質、または、これをコードする核酸;
(2)破骨細胞に分化する能力を有する細胞;および、
(3)骨芽細胞
を含む、骨増成を促進する物質をスクリーニングするためのキット。
(項目12) 骨増成を促進する物質のスクリーニング法であって、以下:
a)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAをスクリーニングする工程;ならびに、
b)上記工程(a)のスクリーニングによって得られたsiRNAから、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
(項目13) 前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、項目12に記載の方法。
(項目14) 前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、項目12に記載の方法。
(項目15) 前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、項目12に記載の方法。
(項目16) 配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAの集団から、骨増成を促進する物質をスクリーニングする法であって、以下:
物質の集団から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
(項目17) 前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、項目16に記載の方法。
(項目18) 前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、項目16に記載の方法。
(項目19) 前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、項目16に記載の方法。
(項目20) 以下:
(1)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸;
(2)破骨細胞に分化する能力を有する細胞;および、
(3)骨芽細胞
を含む、骨増成を促進する物質をスクリーニングするためのキット。
(項目21) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、骨吸収調節のための薬学的組成物。
(項目22) 前記骨吸収調節が、骨吸収抑制である、項目21に記載の薬学的組成物。
(項目23) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、破骨細胞の分化を調節するための薬学的組成物。
(項目24) 前記破骨細胞の分化の調節が、破骨細胞の分化の抑制である、項目23に記載の薬学的組成物。
(項目25) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、破骨細胞の分化程度を検出するための、薬学的組成物。
(項目26) 骨吸収調節剤をスクリーニングするためのキットであって、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、キット。
(項目27) 前記骨吸収調節剤が、骨吸収抑制剤である、項目26に記載のキット。
(項目28) 骨吸収調節剤をスクリーニングするための方法であって、以下:
a)候補化合物を、破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該破骨細胞由来のサンプルに対する、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体の結合量を検出する工程;および、
c)該サンプルに対する該抗体の結合量を変化させる候補化合物を、骨吸収調節剤として同定する工程、
を包含する、方法。
(項目29) 骨吸収抑制剤をスクリーニングするための方法であって、以下:
a)候補化合物を、破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該破骨細胞由来のサンプルに対する、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体の結合量を検出する工程;および、
c)該サンプルに対する該抗体の結合量を減少させる候補化合物を、骨吸収抑制剤として同定する工程、
を包含する、方法。
(項目30) 以下、
i)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、
ii)配列番号1に記載の核酸配列の相補鎖を含む核酸に1または数個の置換、付加、または、欠失を有する核酸に対するsiRNA、
からなる群から選択されるsiRNAを含有する、骨吸収調節のための薬学的組成物。
(項目31) 骨吸収抑制のための、項目30に記載の薬学的組成物。
(項目32) 前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、項目31に記載の薬学的組成物。
(項目33) 配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAを含有する、破骨細胞の分化を調節するための薬学的組成物。
(項目34) 破骨細胞の分化の抑制のための、項目33に記載の薬学的組成物。
(項目35) 前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、項目34に記載の薬学的組成物。
(項目36) 配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸を含有する、破骨細胞の分化程度を検出するための、薬学的組成物。
(項目37) 骨吸収調節剤をスクリーニングするためのキットであって、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸を含有する、キット。
(項目38) 前記骨吸収調節剤が骨吸収抑制剤である、項目37に記載のキット。
(項目39) 骨吸収調節剤をスクリーニングするための方法であって、以下:
a)候補化合物を破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該細胞由来のサンプルに対する、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸の結合量を検出する工程;および
c)該サンプルに対する該核酸の結合量を変化させる候補化合物を、骨吸収調節剤として同定する工程、
を包含する、方法。
(項目40) 骨吸収抑制剤をスクリーニングするための方法であって、以下:
a)候補化合物を破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該細胞由来のサンプルに対する、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸の結合量を検出する工程;および
c)該サンプルに対する該核酸の結合量を減少させる候補化合物を、骨吸収抑制剤として同定する工程、
を包含する、方法。
(項目41) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬学的組成物。
(項目42) 心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬剤をスクリーニングするためのキットであって、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、キット。
(項目43) 以下、
i)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、
ii)配列番号1に記載の核酸配列の相補鎖を含む核酸に1または数個の置換、付加、または、欠失を有する核酸に対するsiRNA、
からなる群から選択されるsiRNAを含有する、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬学的組成物。
(項目44) 前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、項目43に記載の薬学的組成物。
(項目45) 項目5または10に記載の方法によって得られた抗体。
(項目46) 平成21年(2009年)3月10日に、独立行政法人産業技術総合研究所特許生物寄託センターに寄託され、受託番号FERM AP-21780を割り当てられたハイブリドーマによって分泌される、モノクローナル抗体。
【発明の効果】
【0009】
本発明に従って、骨吸収調節剤、破骨細胞分化調節剤および骨再生誘導剤が提供される。さらに、本発明に従って、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収調節剤および/または骨再生誘導剤をスクリーニングするためのキットおよび骨吸収調節剤および/または骨再生誘導剤をスクリーニングするための方法が提供される。
【図面の簡単な説明】
【0010】
【図1】図1は、RANKL存在下(RANKL(+))および非存在下(RANKL(+))でのRAW264.7細胞における各遺伝子の発現量を、ログ比として示したグラフである。
【図2】図2(A)は、コントロールRAW264.7細胞、RANKL処理したRAW264.7細胞、RANKLおよびsiRNA(No.1および2)で処理したRAW264.7細胞におけるマウスNHA2の発現量を示すグラフである(値は、コントロールに対する相対値)。図2(B)は、コントロールRAW264.7細胞、RANKL処理したRAW264.7細胞、RANKLおよびsiRNA(No.1および2)で処理したRAW264.7細胞におけるカテプシンKの発現量を示すグラフである(値は、コントロールに対する相対値)。
【図3】図3は、ヒトNHA2およびマウスNHA2のアラインメントである。「1」は相同領域1(LDTARSHGEKQLEDY;配列番号9)を示し、「2」は相同領域2(LGPRVLQKSEHRTEEEVQGETS;配列番号10)を示す。
【図4】図4は、カテプシンK mRNAについてのリアルタイム定量的RT−PCRの結果である。「−」はRANKL非存在下、「+」はRANKL存在下での実験を表す。
【図5】図5は、種々のNa+/H+エクスチェンジャーのmRNA発現量に対する示された濃度のRANKLの影響を調べたPCRの結果である。
【図6】図6は、NHA2タンパク質の発現量に対する示された濃度のRANKLの影響を調べたウェスタンブロットの結果である。
【図7】図7は、RANKLによるNHA2発現誘導に対するpHの影響を調べた結果である。
【図8】図8は、RANKL非存在下(RANKL(−))およびRANKL存在下(RANKL(+))における、コントロールIgGおよび抗AK039655抗体(抗NHA2抗体)による細胞形態の影響を調べた結果である。
【図9】図9は、抗NHA2モノクローナル抗体により、破骨細胞への分化が抑制されたことを示す結果である。
【図10】図10は、抗NHA2モノクローナル抗体の中には、骨芽細胞の分化を促進するものがあることを示す結果である。
【発明を実施するための形態】
【0011】
以下、本発明を説明する。本明細書の全体にわたり、単数形の表現は、特に言及しない限り、その複数形の概念をも含むことが理解されるべきである。また、本明細書において使用される用語は、特に言及しない限り、当該分野で通常用いられる意味で用いられることが理解されるべきである。
【0012】
以下に本明細書において特に使用される用語の定義を列挙する。
【0013】
本明細書において使用する場合、用語「骨吸収」とは、破骨細胞によって、古い骨の細胞(通常、弾力や固さを失ってしまった細胞である)が分解され、壊されていく事象をいう。
【0014】
本明細書において使用する場合、用語「骨吸収調節」とは、骨吸収の速度および/または量を増減させることをいう。骨吸収は破骨細胞によって行われる事象であることから、「骨吸収抑制」は、破骨細胞の量および/または活性を低減させることによって達成されうる。破骨細胞の量の調節は、例えば、「破骨細胞に分化する能力を有する細胞」が破骨細胞に分化することを調節することによって達成され得るが、これに限定されない。破骨細胞の活性の低減は、例えば、破骨細胞の骨吸収活性の抑制によって達成され得る。破骨細胞の骨吸収活性の抑制は、例えば、破骨細胞によるプロトンの放出の抑制によって達成され得るが、これに限定されない。
【0015】
本明細書において使用する場合、用語「破骨細胞」とは、骨を壊す細胞である。破骨細胞は、細胞膜表面に存在する液胞性プロトンポンプの作用によって、プロトンを放出し、古い骨細胞を分解し、骨吸収を行う。
【0016】
本明細書において使用する場合、用語「破骨細胞に分化する能力を有する細胞」とは、一定の刺激を与えることによって、破骨細胞に分化する細胞をいう。例えば、マウス由来の破骨細胞前駆体培養細胞セルラインであるRAW264.7細胞(TIB-71、ATCC)は、可溶性RANKL存在下で培養することによって、破骨細胞の特徴を有するTRAP陽性多核巨細胞へと分化する最も確立されたマウス破骨細胞セルラインである。
【0017】
本明細書において使用する場合、用語「破骨細胞の分化程度」とは、破骨細胞に特有の指標を細胞が提示する程度をいう。そのような指標としては、例えば、破骨細胞の分化マーカー(例えば、カテプシンK、TRAP、MMP−9、カルボニックアンヒドラーゼ−II、カルシトニン−レセプター、β3−インテグリン、RANK、NFATc1、c−mycが挙げられるが、これに限定されない)が含まれる。
【0018】
本明細書において使用する場合、用語「骨芽細胞」とは、骨組織において骨形成を行う細胞をいう。骨芽細胞としては、例えば、MC3T3-E1細胞、HOS細胞、MG63細胞、UMR細胞、Saos2細胞が挙げられるが、これに限定されない。
【0019】
本明細書において使用する場合、用語「骨吸収調節剤」とは、破骨細胞による骨の吸収を調節(促進あるいは抑制または阻害)する因子をいう。
【0020】
本明細書において使用する場合、用語「骨吸収抑制剤」とは、破骨細胞による骨の吸収を抑制する因子をいう。
【0021】
本明細書において使用する場合、用語「骨増成促進剤」または「骨増成を促進する物質」とは、薬剤を投与しなければ骨の増成が充分に生じない条件下で、骨の増成を生じさせる薬剤、および/または、骨の増成速度を促進する薬剤をいう。骨吸収抑制を引き起こす物質は、間接的に骨増成を促進する(Kajiwaraら、Biomaterials, 2005 Feb;26(6):581-7)。従って、本発明の骨吸収抑制剤は、骨増成促進剤としても有用である。好ましくは、本発明の骨増成促進剤は、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質であるか、あるいは、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAであり、より好ましくは、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性の両方を有する物質である。本発明の本発明の骨増成促進剤としては、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質、低分子化合物、および、抗体、ならびに、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、配列番号1に記載の核酸配列からなる核酸に対するsiRNAであるが、これらに限定されない。
【0022】
本明細書において遺伝子(例えば、核酸配列、アミノ酸配列など)の「相同性」とは、2以上の遺伝子配列の、互いに対する同一性の程度をいう。また、本明細書において配列(核酸配列、アミノ酸配列など)の同一性とは、2以上の対比可能な配列の、互いに対する同一の配列(個々の核酸、アミノ酸など)の程度をいう。従って、ある2つの遺伝子の相同性が高いほど、それらの配列の同一性または類似性は高い。2種類の遺伝子が相同性を有するか否かは、配列の直接の比較、または核酸の場合ストリンジェントな条件下でのハイブリダイゼーション法によって調べられ得る。2つの遺伝子配列を直接比較する場合、その遺伝子配列間でDNA配列が、代表的には少なくとも50%同一である場合、好ましくは少なくとも70%同一である場合、より好ましくは少なくとも80%、90%、95%、96%、97%、98%または99%同一である場合、それらの遺伝子は相同性を有する。本明細書において、遺伝子(例えば、核酸配列、アミノ酸配列など)の「類似性」とは、上記相同性において、保存的置換をポジティブ(同一)とみなした場合の、2以上の遺伝子配列の、互いに対する同一性の程度をいう。従って、保存的置換がある場合は、その保存的置換の存在に応じて相同性と類似性とは異なる。また、保存的置換がない場合は、相同性と類似性とは同じ数値を示す。
【0023】
本明細書では、アミノ酸配列および塩基配列の類似性、同一性および相同性の比較は、配列分析用ツールであるFASTAを用い、デフォルトパラメータを用いて算出される。
【0024】
本明細書において「フラグメント」とは、全長のポリペプチドまたはポリヌクレオチド(長さがn)に対して、1〜n−1までの配列長さを有するポリペプチドまたはポリヌクレオチドをいう。フラグメントの長さは、その目的に応じて、適宜変更することができ、例えば、その長さの下限としては、ポリペプチドの場合、3、4、5、6、7、8、9、10、15,20、25、30、40、50およびそれ以上のアミノ酸が挙げられ、ここの具体的に列挙していない整数で表される長さ(例えば、11など)もまた、下限として適切であり得る。また、ポリヌクレオチドの場合、5、6、7、8、9、10、15,20、25、30、40、50、75、100およびそれ以上のヌクレオチドが挙げられ、ここの具体的に列挙していない整数で表される長さ(例えば、11など)もまた、下限として適切であり得る。本明細書において、ポリペプチドおよびポリヌクレオチドの長さは、上述のようにそれぞれアミノ酸または核酸の個数で表すことができるが、上述の個数は絶対的なものではなく、同じ機能を有する限り、上限または下限としての上述の個数は、その個数の上下数個(または例えば上下10%)のものも含むことが意図される。そのような意図を表現するために、本明細書では、個数の前に「約」を付けて表現することがある。しかし、本明細書では、「約」のあるなしはその数値の解釈に影響を与えないことが理解されるべきである。本明細書において有用なフラグメントの長さは、そのフラグメントの基準となる全長タンパク質の機能のうち少なくとも1つの機能が保持されているかどうかによって決定され得る。
【0025】
本明細書において「純化(された)」および「クローニング(された)」とは、互換可能に用いられる。「純化(された)」および「クローニング(された)」とは、ある物質または核酸の状態についていい、その核酸の存在頻度を高い状態にすることであって、好ましくは、その物質または核酸が、他の種類の物質または核酸が実質的に伴わない状態をいう。本明細書において「純化」および「クローニング」に関する文脈において使用される場合、他の種類の物質または核酸が「実質的に伴わない状態」とは、それら他の種類の物質または核酸が全く存在しない状態か、または存在するとしても、目的の物質または核酸に対して、何ら影響を与えない状態をいう。従って、より好ましい状態では、純化された核酸または核酸組成物は、ある特定の核酸のみを含む。
【0026】
本明細書で使用される場合、「遺伝子導入ベクター」および「遺伝子ベクター」は互換可能に使用される。「遺伝子導入ベクター」および「遺伝子ベクター」とは、目的のポリヌクレオチド配列を目的の細胞へと移入させることができるベクターをいう。
【0027】
本明細書において、「ストリンジェントな条件でハイブリダイズするポリヌクレオチド」とは、当該分野で慣用される周知の条件をいう。本発明のポリヌクレオチド中から選択されたポリヌクレオチドをプローブとして、コロニー・ハイブリダイゼーション法、プラーク・ハイブリダイゼーション法あるいはサザンブロットハイブリダイゼーション法等を用いることにより、そのようなポリヌクレオチドを得ることができる。具体的には、コロニーあるいはプラーク由来のDNAを固定化したフィルターを用いて、0.7〜1.0MのNaCl存在下、65℃でハイブリダイゼーションを行った後、0.1〜2倍濃度のSSC(saline−sodium citrate)溶液(1倍濃度のSSC溶液の組成は、150mM 塩化ナトリウム、15mM クエン酸ナトリウムである)を用い、65℃条件下でフィルターを洗浄することにより同定できるポリヌクレオチドを意味する。ハイブリダイゼーションは、Molecular Cloning 2nd ed.,Current Protocols in Molecular Biology,Supplement 1〜38、DNA Cloning 1:Core Techniques,A Practical Approach,Second Edition,Oxford University Press(1995)等の実験書に記載されている方法に準じて行うことができる。ここで、ストリンジェントな条件下でハイブリダイズする配列からは、好ましくは、A配列のみまたはT配列のみを含む配列が除外される。「ハイブリダイズ可能なポリヌクレオチド」とは、上記ハイブリダイズ条件下で別のポリヌクレオチドにハイブリダイズすることができるポリヌクレオチドをいう。ハイブリダイズ可能なポリヌクレオチドとして具体的には、本発明で具体的に示されるアミノ酸配列を有するポリペプチドをコードするDNAの塩基配列と少なくとも60%以上の相同性を有するポリヌクレオチド、好ましくは80%以上の相同性を有するポリヌクレオチド、さらに好ましくは95%以上の相同性を有するポリヌクレオチドを挙げることができる。
【0028】
本明細書において「高度にストリンジェントな条件」は、核酸配列において高度の相補性を有するDNA鎖のハイブリダイゼーションを可能にし、そしてミスマッチを有意に有するDNAのハイブリダイゼーションを除外するように設計された条件をいう。ハイブリダイゼーションのストリンジェンシーは、主に、温度、イオン強度、およびホルムアミドのような変性剤の条件によって決定される。このようなハイブリダイゼーションおよび洗浄に関する「高度にストリンジェントな条件」の例は、0.0015M塩化ナトリウム、0.0015Mクエン酸ナトリウム、65〜68℃、または0.015M塩化ナトリウム、0.0015Mクエン酸ナトリウム、および50%ホルムアミド、42℃である。このような高度にストリンジェントな条件については、Sambrooket al.,Molecular Cloning:A Laboratory Manual、第2版、Cold Spring Harbor Laboratory(ColdSpring Harbor,N,Y.1989);およびAnderson et al.、Nucleic Acid Hybridization:a Practical approach、IV、IRL Press Limited(Oxford,England).Limited,Oxford,Englandを参照のこと。必要により、よりストリンジェントな条件(例えば、より高い温度、より低いイオン強度、より高いホルムアミド、または他の変性剤)を、使用してもよい。他の薬剤が、非特異的なハイブリダイゼーションおよび/またはバックグラウンドのハイブリダイゼーションを減少する目的で、ハイブリダイゼーション緩衝液および洗浄緩衝液に含まれ得る。そのような他の薬剤の例としては、0.1%ウシ血清アルブミン、0.1%ポリビニルピロリドン、0.1%ピロリン酸ナトリウム、0.1%ドデシル硫酸ナトリウム(NaDodSO4またはSDS)、Ficoll、Denhardt溶液、超音波処理されたサケ精子DNA(または別の非相補的DNA)および硫酸デキストランであるが、他の適切な薬剤もまた、使用され得る。これらの添加物の濃度および型は、ハイブリダイゼーション条件のストリンジェンシーに実質的に影響を与えることなく変更され得る。ハイブリダイゼーション実験は、通常、pH6.8〜7.4で実施されるが;代表的なイオン強度条件において、ハイブリダイゼーションの速度は、ほとんどpH独立である。Anderson et al.、NucleicAcid Hybridization:a Practical Approach、第4章、IRL Press Limited(Oxford,England)を参照のこと。
【0029】
DNA二重鎖の安定性に影響を与える因子としては、塩基の組成、長さおよび塩基対不一致の程度が挙げられる。ハイブリダイゼーション条件は、当業者によって調整され得、これらの変数を適用させ、そして異なる配列関連性のDNAがハイブリッドを形成するのを可能にする。完全に一致したDNA二重鎖の融解温度は、以下の式によって概算され得る。
Tm(℃)=81.5+16.6(log[Na+])+0.41(%G+C)−600/N−0.72(%ホルムアミド)
ここで、Nは、形成される二重鎖の長さであり、[Na+]は、ハイブリダイゼーション溶液または洗浄溶液中のナトリウムイオンのモル濃度であり、%G+Cは、ハイブリッド中の(グアニン+シトシン)塩基のパーセンテージである。不完全に一致したハイブリッドに関して、融解温度は、各1%不一致(ミスマッチ)に対して約1℃ずつ減少する。
【0030】
本明細書において「中程度にストリンジェントな条件」とは、「高度にストリンジェントな条件」下で生じ得るよりも高い程度の塩基対不一致を有するDNA二重鎖が、形成し得る条件をいう。代表的な「中程度にストリンジェントな条件」の例は、0.015M塩化ナトリウム、0.0015M クエン酸ナトリウム、50〜65℃、または0.015M 塩化ナトリウム、0.0015M クエン酸ナトリウム、および20%ホルムアミド、37〜50℃である。例として、0.015Mナトリウムイオン中、50℃の「中程度にストリンジェントな」条件は、約21%の不一致を許容する。
【0031】
本明細書において「高度」にストリンジェントな条件と「中程度」にストリンジェントな条件との間に完全な区別は存在しないことがあり得ることが、当業者によって理解される。例えば、0.015Mナトリウムイオン(ホルムアミドなし)において、完全に一致した長いDNAの融解温度は、約71℃である。65℃(同じイオン強度)での洗浄において、これは、約6%不一致を許容にする。より離れた関連する配列を捕獲するために、当業者は、単に温度を低下させ得るか、またはイオン強度を上昇し得る。
【0032】
約20ヌクレオチドまでのオリゴヌクレオチドプローブについて、1MNaClにおける融解温度の適切な概算は、
Tm=(1つのA−T塩基につき2℃)+(1つのG−C塩基対につき4℃)
によって提供される。なお、6×クエン酸ナトリウム塩(SSC)におけるナトリウムイオン濃度は、1Mである(Suggsら、Developmental Biology Using Purified Genes、683頁、BrownおよびFox(編)(1981)を参照のこと)。
【0033】
本明細書において配列(アミノ酸または核酸など)の「同一性」、「相同性」および「類似性」のパーセンテージは、比較ウィンドウで最適な状態に整列された配列2つを比較することによって求められる。ここで、ポリヌクレオチド配列またはポリペプチド配列の比較ウィンドウ内の部分には、2つの配列の最適なアライメントについての基準配列(他の配列に付加が含まれていればギャップが生じることもあるが、ここでの基準配列は付加も欠失もないものとする)と比較したときに、付加または欠失(すなわちギャップ)が含まれる場合がある。同一の核酸塩基またはアミノ酸残基がどちらの配列にも認められる位置の数を求めることによって、マッチ位置の数を求め、マッチ位置の数を比較ウィンドウ内の総位置数で割り、得られた結果に100を掛けて同一性のパーセンテージを算出する。検索において使用される場合、相同性については、従来技術において周知のさまざまな配列比較アルゴリズムおよびプログラムの中から、適当なものを用いて評価する。このようなアルゴリズムおよびプログラムとしては、TBLASTN、BLASTP、FASTA、TFASTAおよびCLUSTALW(Pearson and Lipman,1988,Proc.Natl.Acad.Sci.USA 85(8):2444−2448、 Altschul et al.,1990,J.Mol.Biol.215(3):403−410、Thompson et al.,1994,Nucleic Acids Res.22(2):4673−4680、Higgins et al.,1996,Methods Enzymol.266:383−402、Altschul et al.,1990,J.Mol.Biol.215(3):403−410、Altschul et al.,1993,Nature Genetics 3:266−272)があげられるが、何らこれに限定されるものではない。特に好ましい実施形態では、従来技術において周知のBasic Local Alignment Search Tool(BLAST)(たとえば、Karlin and Altschul,1990,Proc.Natl.Acad.Sci.USA 87:2267−2268、Altschul et al.,1990,J.Mol.Biol.215:403−410、Altschul et al.,1993,Nature Genetics 3:266−272、Altschul et al.,1997,Nuc.Acids Res.25:3389−3402を参照のこと)を用いてタンパク質および核酸配列の相同性を評価する。特に、5つの専用BLASTプログラムを用いて以下の作業を実施することによって比較または検索が達成され得る。
【0034】
(1) BLASTPおよびBLAST3でアミノ酸のクエリー配列をタンパク質配列データベースと比較;
(2) BLASTNでヌクレオチドのクエリー配列をヌクレオチド配列データベースと比較;
(3) BLASTXでヌクレオチドのクエリー配列(両方の鎖)を6つの読み枠で変換した概念的翻訳産物をタンパク質配列データベースと比較;
(4) TBLASTNでタンパク質のクエリー配列を6つの読み枠(両方の鎖)すべてで変換したヌクレオチド配列データベースと比較;
(5) TBLASTXでヌクレオチドのクエリ配列を6つの読み枠で変換したものを、6つの読み枠で変換したヌクレオチド配列データベースと比較。
【0035】
BLASTプログラムは、アミノ酸のクエリ配列または核酸のクエリ配列と、好ましくはタンパク質配列データベースまたは核酸配列データベースから得られた被検配列との間で、「ハイスコアセグメント対」と呼ばれる類似のセグメントを特定することによって相同配列を同定するものである。ハイスコアセグメント対は、多くのものが従来技術において周知のスコアリングマトリックスによって同定(すなわち整列化)されると好ましい。好ましくは、スコアリングマトリックスとしてBLOSUM62マトリックス(Gonnet et al.,1992,Science 256:1443−1445、Henikoff and Henikoff,1993,Proteins 17:49−61)を使用する。このマトリックスほど好ましいものではないが、PAMまたはPAM250マトリックスも使用できる(たとえば、Schwartz and Dayhoff,eds.,1978,Matrices for Detecting Distance Relationships: Atlas of Protein Sequence and Structure,Washington: National Biomedical Research Foundationを参照のこと)。BLASTプログラムは、同定されたすべてのハイスコアセグメント対の統計的な有意性を評価し、好ましくはユーザー固有の相同率などのユーザーが独自に定める有意性の閾値レベルを満たすセグメントを選択する。統計的な有意性を求めるKarlinの式を用いてハイスコアセグメント対の統計的な有意性を評価すると好ましい(Karlin and Altschul,1990,Proc.Natl.Acad.Sci.USA 87:2267−2268参照のこと)。
【0036】
(遺伝子、タンパク質分子、核酸分子などの改変)
あるタンパク質分子において、配列に含まれるあるアミノ酸は、相互作用結合能力の明らかな低下または消失なしに、例えば、カチオン性領域または基質分子の結合部位のようなタンパク質構造において他のアミノ酸に置換され得る。あるタンパク質の生物学的機能を規定するのは、タンパク質の相互作用能力および性質である。従って、特定のアミノ酸の置換がアミノ酸配列において、またはそのDNAコード配列のレベルにおいて行われ得、置換後もなお、もとの性質を維持するタンパク質が生じ得る。従って、生物学的有用性の明らかな損失なしに、種々の改変が、本明細書において開示されたペプチドまたはこのペプチドをコードする対応するDNAにおいて行われ得る。
【0037】
上記のような改変を設計する際に、アミノ酸の疎水性指数が考慮され得る。タンパク質における相互作用的な生物学的機能を与える際の疎水性アミノ酸指数の重要性は、一般に当該分野で認められている(Kyte.JおよびDoolittle,R.F.J.Mol.Biol.157(1):105−132,1982)。アミノ酸の疎水的性質は、生成したタンパク質の二次構造に寄与し、次いでそのタンパク質と他の分子(例えば、酵素、基質、レセプター、DNA、抗体、抗原など)との相互作用を規定する。各アミノ酸は、それらの疎水性および電荷の性質に基づく疎水性指数を割り当てられる。それらは:イソロイシン(+4.5);バリン(+4.2);ロイシン(+3.8);フェニルアラニン(+2.8);システイン/シスチン(+2.5);メチオニン(+1.9);アラニン(+1.8);グリシン(−0.4);スレオニン(−0.7);セリン(−0.8);トリプトファン(−0.9);チロシン(−1.3);プロリン(−1.6);ヒスチジン(−3.2);グルタミン酸(−3.5);グルタミン(−3.5);アスパラギン酸(−3.5);アスパラギン(−3.5);リジン(−3.9);およびアルギニン(−4.5))である。
【0038】
あるアミノ酸を、同様の疎水性指数を有する他のアミノ酸により置換して、そして依然として同様の生物学的機能を有するタンパク質(例えば、酵素活性において等価なタンパク質)を生じさせ得ることが当該分野で周知である。このようなアミノ酸置換において、疎水性指数が±2以内であることが好ましく、±1以内であることがより好ましく、および±0.5以内であることがさらにより好ましい。疎水性に基づくこのようなアミノ酸の置換は効率的であることが当該分野において理解される。
【0039】
当該分野において、親水性指数もまた、改変設計において考慮され得る。米国特許第4,554,101号に記載されるように、以下の親水性指数がアミノ酸残基に割り当てられている:アルギニン(+3.0);リジン(+3.0);アスパラギン酸(+3.0±1);グルタミン酸(+3.0±1);セリン(+0.3);アスパラギン(+0.2);グルタミン(+0.2);グリシン(0);スレオニン(−0.4);プロリン(−0.5±1);アラニン(−0.5);ヒスチジン(−0.5);システイン(−1.0);メチオニン(−1.3);バリン(−1.5);ロイシン(−1.8);イソロイシン(−1.8);チロシン(−2.3);フェニルアラニン(−2.5);およびトリプトファン(−3.4)。アミノ酸が同様の親水性指数を有しかつ依然として生物学的等価体を与え得る別のものに置換され得ることが理解される。このようなアミノ酸置換において、親水性指数が±2以内であることが好ましく、±1以内であることがより好ましく、および±0.5以内であることがさらにより好ましい。
【0040】
本明細書において、「保存的置換」とは、アミノ酸置換において、元のアミノ酸と置換されるアミノ酸との親水性指数または/および疎水性指数が上記のように類似している置換をいう。保存的置換の例としては、例えば、親水性指数または疎水性指数が、±2以内のもの同士、好ましくは±1以内のもの同士、より好ましくは±0.5以内のもの同士のものが挙げられるがそれらに限定されない。従って、保存的置換の例は、当業者に周知であり、例えば、次の各グループ内での置換:アルギニンおよびリジン;グルタミン酸およびアスパラギン酸;セリンおよびスレオニン;グルタミンおよびアスパラギン;ならびにバリン、ロイシン、およびイソロイシン、などが挙げられるがこれらに限定されない。
【0041】
本明細書において、「改変体」とは、もとのポリペプチドまたはポリヌクレオチドなどの物質に対して、一部が変更されているものをいう。そのような改変体としては、置換改変体、付加改変体、欠失改変体、短縮(truncated)改変体、対立遺伝子変異体などが挙げられる。そのような改変体としては、基準となる核酸分子またはポリペプチドに対して、1または数個の置換、付加および/または欠失、あるいは1つ以上の置換、付加および/または欠失を含むものが挙げられるがそれらに限定されない。対立遺伝子(allele)とは、同一遺伝子座に属し、互いに区別される遺伝的改変体のことをいう。従って、「対立遺伝子変異体」とは、ある遺伝子に対して、対立遺伝子の関係にある改変体をいう。そのような対立遺伝子変異体は、通常その対応する対立遺伝子と同一または非常に類似性の高い配列を有し、通常はほぼ同一の生物学的活性を有するが、まれに異なる生物学的活性を有することもある。「種相同体またはホモログ(homolog)」とは、ある種の中で、ある遺伝子とアミノ酸レベルまたはヌクレオチドレベルで、相同性(好ましくは、60%以上の相同性、より好ましくは、80%以上、85%以上、90%以上、95%以上の相同性)を有するものをいう。そのような種相同体を取得する方法は、本明細書の記載から明らかである。「オルソログ(ortholog)」とは、オルソロガス遺伝子(orthologous gene)ともいい、二つの遺伝子がある共通祖先からの種分化に由来する遺伝子をいう。例えば、多重遺伝子構造をもつヘモグロビン遺伝子ファミリーを例にとると、ヒトおよびマウスのαヘモグロビン遺伝子はオルソログであるが,ヒトのαヘモグロビン遺伝子およびβヘモグロビン遺伝子はパラログ(遺伝子重複で生じた遺伝子)である。オルソログは、分子系統樹の推定に有用である。オルソログは、通常別の種において、もとの種と同様の機能を果たしていることがあり得ることから、本発明のオルソログもまた、本発明において有用であり得る。
【0042】
本明細書において「保存的(に改変された)改変体」は、アミノ酸配列および核酸配列の両方に適用される。特定の核酸配列に関して、保存的に改変された改変体とは、同一のまたは本質的に同一のアミノ酸配列をコードする核酸をいい、核酸がアミノ酸配列をコードしない場合には、本質的に同一な配列をいう。遺伝コードの縮重のため、多数の機能的に同一な核酸が任意の所定のタンパク質をコードする。例えば、コドンGCA、GCC、GCG、およびGCUはすべて、アミノ酸アラニンをコードする。したがって、アラニンがコドンにより特定される全ての位置で、そのコドンは、コードされたポリペプチドを変更することなく、記載された対応するコドンの任意のものに変更され得る。このような核酸の変動は、保存的に改変された変異の1つの種である「サイレント改変(変異)」である。ポリペプチドをコードする本明細書中のすべての核酸配列はまた、その核酸の可能なすべてのサイレント変異を記載する。当該分野において、核酸中の各コドン(通常メチオニンのための唯一のコドンであるAUG、および通常トリプトファンのための唯一のコドンであるTGGを除く)が、機能的に同一な分子を産生するために改変され得ることが理解される。したがって、ポリペプチドをコードする核酸の各サイレント変異は、記載された各配列において暗黙に含まれる。好ましくは、そのような改変は、ポリペプチドの高次構造に多大な影響を与えるアミノ酸であるシステインの置換を回避するようになされ得る。このような塩基配列の改変法としては、制限酵素などによる切断、DNAポリメラーゼ、Klenowフラグメント、DNAリガーゼなどによる処理等による連結等の処理、合成オリゴヌクレオチドなどを用いた部位特異的塩基置換法(特定部位指向突然変異法;Mark Zoller and Michael Smith,Methods in Enzymology,100,468−500(1983))が挙げられるが、この他にも通常分子生物学の分野で用いられる方法によって改変を行うこともできる。
【0043】
本明細書中において、機能的に等価なポリペプチドを作製するために、アミノ酸の置換のほかに、アミノ酸の付加、欠失、または修飾もまた行うことができる。アミノ酸の置換とは、もとのペプチドを1つ以上、例えば、1〜10個、好ましくは1〜5個、より好ましくは1〜3個のアミノ酸で置換することをいう。アミノ酸の付加とは、もとのペプチド鎖に1つ以上、例えば、1〜10個、好ましくは1〜5個、より好ましくは1〜3個のアミノ酸を付加することをいう。アミノ酸の欠失とは、もとのペプチドから1つ以上、例えば、1〜10個、好ましくは1〜5個、より好ましくは1〜3個のアミノ酸を欠失させることをいう。アミノ酸修飾は、アミド化、カルボキシル化、硫酸化、ハロゲン化、短縮化、脂質化(lipidation)、ホスホリル化、アルキル化、グリコシル化、リン酸化、水酸化、アシル化(例えば、アセチル化)などを含むが、これらに限定されない。置換、または付加されるアミノ酸は、天然のアミノ酸であってもよく、非天然のアミノ酸、またはアミノ酸アナログでもよい。天然のアミノ酸が好ましい。
【0044】
本明細書において使用される用語「ペプチドアナログ」または「ペプチド誘導体」とは、ペプチドとは異なる化合物であるが、ペプチドと少なくとも1つの化学的機能または生物学的機能が等価であるものをいう。したがって、ペプチドアナログには、もとのペプチドに対して、1つ以上のアミノ酸アナログまたはアミノ酸誘導体が付加または置換されているものが含まれる。ペプチドアナログは、その機能が、もとのペプチドの機能(例えば、pKa値が類似していること、官能基が類似していること、他の分子との結合様式が類似していること、水溶性が類似していることなど)と実質的に同様であるように、このような付加または置換がされている。そのようなペプチドアナログは、当該分野において周知の技術を用いて作製することができる。したがって、ペプチドアナログは、アミノ酸アナログを含むポリマーであり得る。
【0045】
同様に、「ポリヌクレオチドアナログ」、「核酸アナログ」は、ポリヌクレオチドまたは核酸とは異なる化合物であるが、ポリヌクレオチドまたは核酸と少なくとも1つの化学的機能または生物学的機能が等価であるものをいう。したがって、ポリヌクレオチドアナログまたは核酸アナログには、もとのペプチドに対して、1つ以上のヌクレオチドアナログまたはヌクレオチド誘導体が付加または置換されているものが含まれる。
【0046】
本明細書において使用される核酸分子は、発現されるポリペプチドが天然型のポリペプチドと実質的に同一の活性を有する限り、上述のようにその核酸の配列の一部が欠失または他の塩基により置換されていてもよく、あるいは他の核酸配列が一部挿入されていてもよい。あるいは、5’末端および/または3’末端に他の核酸が結合していてもよい。また、ポリペプチドをコードする遺伝子をストリンジェントな条件下でハイブリダイズし、そのポリペプチドと実質的に同一の機能を有するポリペプチドをコードする核酸分子でもよい。このような遺伝子は、当該分野において公知であり、本発明において利用することができる。
【0047】
このような核酸は、周知のPCR法により得ることができ、化学的に合成することもできる。これらの方法に、例えば、部位特異的変位誘発法、ハイブリダイゼーション法などを組み合わせてもよい。
【0048】
本明細書において、ポリペプチドまたはポリヌクレオチドの「置換、付加または欠失」とは、もとのポリペプチドまたはポリヌクレオチドに対して、それぞれアミノ酸もしくはその代替物、またはヌクレオチドもしくはその代替物が、置き換わること、付け加わることまたは取り除かれることをいう。このような置換、付加または欠失の技術は、当該分野において周知であり、そのような技術の例としては、部位特異的変異誘発技術などが挙げられる。置換、付加または欠失は、1つ以上であれば任意の数でよく、そのような数は、その置換、付加または欠失を有する改変体において目的とする機能(例えば、ホルモン、サイトカインの情報伝達機能など)が保持される限り、多くすることができる。例えば、そのような数は、1または数個であり得、そして好ましくは、全体の長さの20%以内、10%以内、または100個以下、50個以下、25個以下などであり得る。
【0049】
本明細書で用いる「抗体」という用語は、天然起源の抗体の他、例えば1本鎖抗体、キメラ2価ヒト化抗体、およびその抗体結合フラグメント(例えばFab’、F(ab’)2、Fab、FvおよびrIgG)を包含する。Pierce Catalog and Handbook 1994−1955(Pierce Chemical Co.、Rockford、IL)および例えばKuby、J.Immnol.3rdEd.、W.H.Freeman&Co,、New York(1998)参照。この様な非天然起源抗体を固相ペプチド合成を用いて構築するか、組み換えで製造するか、例えばHuseら、Science246:1275−1281(1989)に記載され、本明細書に引用して援用する可変重鎖および可変軽鎖でなるコンビナトリアルライブラリーをスクリーニ ングして得ることができる。例えばキメラ、ヒト化、CDRグラフト1本鎖2価抗体は当業者に公知である(Winterand Harris、Immunol.Today、14:243−246(1993);Ward et al.、Nature341:544−546(1989);Harlowand Lane,supra,1988;Hilyardら、Protein Engineering:A Practical Approach(IRL Press、1992);Borrabeck、AntibodyEngineering、2nd ed.(Oxford Universiry Press、1995);それぞれを本明細書に引用して援用する)。
【0050】
「抗体」という用語にはポリクローンおよびモノクローン抗体の双方が含まれる。この用語にはまた、キメラ抗体(例えばヒト化マウス抗体)およびヘテロ共役 付加抗体(例えば双特異性抗体)遺伝子操作型も含まれる。この用語は組み換え1本鎖Fvフラグメント(scFv)も指す。抗体という用語には2価または双特異性分子、2抗体、3抗体および4抗体も含まれる。2価および双特異性分子は例えばKostelny et al.、(1992)J Immunol 148:1547,Packand Pluckthun(1992)Biochemistry 31:1579,Hollinger et al.,1993,supra,Gruber et al.(1994)、J.Immunol:5368;Zhuet al.,(1997)、Protein Sci.6:781;Hu et al.,(1996)、Cancer Res.56:3055;Adams et al.,(1993)、CancerRes.53:4026;およびMcGartney et al.,(1995)、Protein Eng.8:301に記載されている。
【0051】
典型的には抗体は重鎖および軽鎖を有する。重鎖および軽鎖のそれぞれは不変領域および可変領域を有する(この領域は「ドメイン」としても知られている)。 軽鎖および重鎖可変領域は3個の超可変領域で隔てられた4個の「骨格」領域を有し、「相補性決定領域」または「CDR」とも呼ばれる。骨格領域とCDRの長さは定義されている。異なった重鎖または軽鎖の骨格領域の配列は一定の種内では相対的に保存されている。構成軽鎖および重鎖の組み合わせ骨格領域である 抗体の骨格領域は、CDRを3次元空間に位置し配列する役割を果たす。
【0052】
CDRは主として抗原のエピトープへの結合に関与する。各鎖のCDRは典型的にはN−末端から開始して番号が付けられるCDR1、CDR2およびCDR3と呼ばれ、特定のCDRが位置する鎖で同定される。従って、VHCDR3はそれが結合する抗体の重鎖の可変領域に位置し、一方、VLCDRはそれが見出される抗体の軽鎖の可変ドメイン由来のCDR1である。
【0053】
「VH」の例はFv、scFvまたなFabの重鎖を含む抗体の免疫グロブリン重鎖の可変領域である。「VL」の例はFv、scFvまたなFabの軽鎖を含む免疫グロブリン軽鎖の可変領域である。
【0054】
「1本鎖Fv」または「scFv」という語句は、伝統的な2本鎖抗体の重鎖および軽鎖の可変ドメインが結合して1本鎖を形成する抗体を指す。典型的には、リンカーペプチドが2本の鎖の間に挿入され、適切な折り畳みと活性結合部位の形成が可能になる。
【0055】
「キメラ抗体」とは(a)抗原結合部位(可変領域)が異なった、または変化したクラス、エフェクター機能および/または種の不変領域、またはキメラ抗体に 例えば酵素、毒素、ホルモン、成長因子、薬剤等の新しい性質を付与する全く異なった分子に結合する様に、不変領域またはその一部が変化した、または置換または交換された免疫グロブリン分子;または(b)可変領域またはその一部が変化した、または異なったまたは変化した抗原特異性を有する可変領域で置換また は交換された免疫グロブリン分子である。
【0056】
「ヒト化抗体」とは非ヒト免疫グロブリン由来の最少の配列を含む免疫グロブリン分子である。ヒト化抗体には受容者の相補性決定領域(CDR)由来の残基が 所望の特異性、親和性および容量を有するマウス、ラットまたはウサギ等の非ヒト種(供与者抗体)由来の残基で置換されたヒト免疫グロブリン(受容者抗体)が含まれる。ある場合は、ヒト免疫グロブリンのFv骨格領域が対応する非ヒト残基で置換されている。ヒト化抗体はまた、受容者抗体または導入CDRまたは 骨格配列内に見出されない残基を有してもよい。一般にヒト化抗体は少なくとも1個、典型的には2個の可変ドメインの実質的に全てを有するが、可変領域内では骨格領域(FR)の全て、または実質的に全てがヒト免疫グロブリンコンセンサス配列のものである。ヒト化抗体は免疫グロブリン不変領域(Fc)の少なく とも一部、典型的にはヒト免疫グロブリンの不変領域の一部を有することが最適である(Joneset al.,、Nature 321:522−525(1986);Riechman et al.,、Nature 332:323−329;およびPresta、Curr.Op.Struct.Biol.2:593−596(1992))。ヒト抗体に対しげっ歯類CDR配列(単数または複数)を置換することにより、ヒト化をWinterおよび共同研究者の方法(Jones et al.,、Nature 321:522−525(1986);Riechmanet al.,、Nature 332:323−327(1988);Verhoeyen et al.,、Science 239:1534−1536(1988))に従って基本的にあらかじめ生成することができる。従って、この様なヒト化抗体はキメラ抗体であり(米国特許第4,816,567号)、実質的に少なくとも無傷のヒト可変ドメインが非ヒト種由来の対応する配列で置換されている。
【0057】
「エピトープ」または「抗原決定基」とは、抗体が結合する抗原上の部位を指す。エピトープをタンパク質の3次元折り畳みで並置された隣接アミノ酸または非 隣接アミノ酸の双方から形成することができる。隣接アミノ酸で生成したエピトープは典型的には変性溶剤に晒しても保持されるが、3次元折り畳みで形成したエピトープは変性溶剤で処理すると典型的に失われる。エピトープには独自の空間配置中に少なくとも3個、通常は少なくとも5または8〜10個のアミノ酸が 含まれる。エピトープの空間配置の決定法には例えばX−線結晶学および2次元核磁気共鳴が含まれる。例えば「分子生物学の方法におけるエピトープマッピングプロトコール」、第66巻、Glenn E.Morris Ed(1996)参照。エピトープマッピングの好ましい方法は表面プラズモン共鳴である。
【0058】
(骨吸収抑制活性を有する抗体の調製)
上記の手法で調製した抗体の集団から、骨吸収抑制活性を有する抗体を容易に選択することができる。例えば、破骨細胞の分化の抑制を指標とする場合には、カテプシンK、TRAP、MMP−9、カルボニックアンヒドラーゼ−II、カルシトニン−レセプター、β3−インテグリン、RANK、NFATc1、およびc−mycからなる群から選択される遺伝子発現のRANKLによる促進を阻害する抗体を選択することによって、骨吸収抑制活性を有する抗体を容易に選択することができる。
【0059】
(薬学的組成物)
本発明のポリヌクレオチド、ポリヌクレオチドを含む発現ベクターおよび遺伝子導入ベクター、アンチセンス核酸、siRNA、ポリペプチド、ならびにポリペプチドに対する抗体は、骨吸収調節(促進あるいは抑制または阻害)のため、破骨細胞の分化調節(促進あるいは抑制または阻害)のため、および、破骨細胞の活性調節(促進あるいは抑制または阻害)のための成分としても使用することが可能である。さらに、本発明のポリヌクレオチドの改変体、ポリヌクレオチド改変体を含む発現ベクターおよび遺伝子導入ベクター、これら改変体に対するアンチセンス核酸、siRNA、そして、ポリペプチド改変体、ならびにポリペプチド改変体に対する抗体は、骨吸収調節のため、破骨細胞の分化調節のため、および、破骨細胞の活性調節のための成分としても使用することが可能である。
【0060】
また、本発明のポリヌクレオチド、ポリヌクレオチドを含む発現ベクターおよび遺伝子導入ベクター、アンチセンス核酸、siRNA、ポリペプチド、ならびにポリペプチドに対する抗体は、歯周病による歯槽骨吸収抑制、骨粗鬆症、骨腫瘍、溶骨性骨転移、リュウマチ性関節炎、歯周病、インプラント周囲炎、顎堤骨吸収などの骨破壊性疾患の処置、予防、診断または予後のための薬学的組成物の成分としても使用することが可能である。さらに、本発明のポリヌクレオチドの改変体、ポリヌクレオチド改変体を含む発現ベクターおよび遺伝子導入ベクター、これら改変体に対するアンチセンス核酸、siRNA、そして、本発明のポリペプチド改変体、ならびにポリペプチド改変体に対する抗体は、歯周病による歯槽骨吸収抑制、骨粗鬆症、骨腫瘍、溶骨性骨転移、リュウマチ性関節炎、歯周病、インプラント周囲炎、顎堤骨吸収などの骨破壊性疾患の処置、予防、診断または予後のための薬学的組成物の成分としても使用することが可能である。また、本発明のポリヌクレオチド、タンパク質、および抗体は、骨吸収調節剤のスクリーニングのため、および、これら疾患の治療薬の探索のためのツールとしても利用可能である。本発明のポリヌクレオチド改変体、タンパク質改変体、およびタンパク質改変体に対する抗体もまた、骨吸収調節剤のスクリーニングのため、および、これら疾患の治療薬の探索のためのツールとしても利用可能である。
【0061】
さらに、骨吸収抑制を引き起こす物質は、間接的に骨増成を促進することから、本発明の骨吸収抑制剤は、骨増成促進剤としても有用である。
【0062】
本発明のNHA2は、Na+/H+アンチポーターとして同定されている(Xiang Mら、A human Na+/H+ antiporter sharing evolutionary origins withbacterial NhaA may be a candidate gene for essential hypertension. PNAS, 2007Nov 20;104(47):18677-81. Epub 2007 Nov 13)。理論に拘束されることは望まないが、破骨細胞の細胞膜に発現し、プロトンの排出を担う液胞型H+−ATPaseは膜電位感受性であることから、NHA2は、液胞型H+−ATPaseがプロトン排出機能を発揮するために重要な役割を担い、その一方で、NHA2のアンチポーターとしての機能が損なわれると、結果として液胞型H+−ATPaseの機能が損なわれると考えられる。NHA2は、破骨細胞のみならず、他の細胞においても、細胞内のイオンおよび膜電位の恒常性に重要な役割を担い、そのため、NHA2の機能を調節(抑制および/または促進)することによって、プロトンのバランスが崩れたことによって引き起こされる種々の疾患(例えば、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態が挙げられるが、これに限定されない)を処置することが可能になる。
【0063】
ここで、「骨・カルシウム代謝異常疾患」としては、骨粗鬆症、変形性関節炎、関節リウマチ、小児リウマチ性疾患、若年性関節リウマチ、悪性関節リウマチ、脊椎関節症、強直性脊椎炎、Reiter症候群、反応性関節炎、膠原病に伴う関節炎、ベーチェット病、混合性結合組織病、リウマチ性多発性筋痛症、側頭動脈炎、シェグレーン症候群、再発性多発軟骨炎、掌蹠膿疱症性骨関節炎、結晶誘発性関節炎、代謝性骨疾患、骨軟化症、副甲状腺機能亢進症、骨壊死、全身性疾患に伴う関節炎、血液疾患における関節症、内分泌疾患における関節症、肺性肥大性骨関節症、反射性交感神経性異栄養症、感染性関節炎、頚椎部脊柱靭帯骨化症、頚椎症、肩関節障害、肘・手関節障害、神経病性関節症、椎間板変性疾患、腰部脊柱管狭窄症、脊柱側弯症、変形性股関節症、骨関節腫瘍、スポーツによる関節障害、O脚、X脚、Blount病、反張膝、膝内障、半月板損傷、タナ障害、大腿四頭筋損傷、頚骨粗面部断裂、Osgood−Schlatter病、有痛性分裂膝蓋骨、膝蓋軟骨軟化症、膝蓋骨脱臼・亜脱臼、膝靭帯損傷、前十字靭帯損傷、後十字靭帯損傷、内側側副靭帯損傷、大腿骨顆上、顆部骨折、頚骨顆部骨折、頚骨顆間隆起骨折、大腿骨遠位骨端離開、頚骨近位骨端離開、頚骨結節骨折、膝蓋骨骨折、関節ねずみ、離断性骨軟骨炎、関節内遊離体、骨軟骨腫症、膝のスポーツ外傷、急性化膿性膝関節炎、変形性膝関節症、関節水症、膝の骨壊死、滑液包炎、偽通風、特発性膝関節出血、高カルシウム血症、低カルシウム血症、副甲状腺機能亢進症、副甲状腺機能低下症、偽性副甲状腺機能低下症、カルシトニン産生腫瘍、腎性骨症、骨軟化症、サルコイドーシス、骨硬化症、骨転移が挙げられるが、これらに限定されない。
【0064】
また、本発明のポリヌクレオチド、ポリヌクレオチドを含む発現ベクターおよび遺伝子導入ベクター、アンチセンス核酸、siRNA、ポリペプチド、ならびにポリペプチドに対する抗体は、破骨細胞の分化程度のモニターのためのマーカーとしての薬学的組成物としても使用可能である。さらに、本発明のポリヌクレオチド改変体、ポリヌクレオチド改変体を含む発現ベクターおよび遺伝子導入ベクター、ならびに、これら改変体に対するアンチセンス核酸、siRNA、本発明のポリペプチド改変体、ならびにポリペプチド改変体に対する抗体は、破骨細胞の分化程度のモニターのためのマーカーとしての薬学的組成物としても使用可能である。
【0065】
本明細書において薬剤の「有効量」とは、その薬剤が目的とする薬効が発揮することができる量をいう。本明細書において、そのような有効量のうち、最小の濃度を最小有効量ということがある。そのような最小有効量は、当該分野において周知であり、通常、薬剤の最小有効量は当業者によって決定されているか、または当業者は適宜決定することができる。そのような有効量の決定には、実際の投与のほか、動物モデルなどを用いることも可能である。本発明はまた、このような有効量を決定する際に有用である。
【0066】
本明細書において「薬学的に受容可能なキャリア」は、医薬または動物薬のような農薬を製造するときに使用される物質であり、有効成分に有害な影響を与えないものをいう。そのような薬学的に受容可能なキャリアとしては、例えば、以下が挙げられるがそれらに限定されない:抗酸化剤、保存剤、着色料、風味料、および希釈剤、乳化剤、懸濁化剤、溶媒、フィラー、増量剤、緩衝剤、送達ビヒクル、賦形剤および/または農学的もしくは薬学的アジュバント。
【0067】
本発明の処置方法において使用される薬剤の種類および量は、本発明の方法によって得られた情報(例えば、疾患に関する情報)を元に、使用目的、対象疾患(種類、重篤度など)、患者の年齢、体重、性別、既往歴、投与される被検体の部位の形態または種類などを考慮して、当業者が容易に決定することができる。本発明のモニタリング方法を被検体(または患者)に対して施す頻度もまた、使用目的、対象疾患(種類、重篤度など)、患者の年齢、体重、性別、既往歴、および治療経過などを考慮して、当業者が容易に決定することができる。疾患状態をモニタリングする頻度としては、例えば、毎日−数ヶ月に1回(例えば、1週間に1回−1ヶ月に1回)のモニタリングが挙げられる。1週間−1ヶ月に1回のモニタリングを、経過を見ながら施すことが好ましい。
【0068】
必要に応じて、本発明の治療では、2種類以上の薬剤が使用され得る。2種類以上の薬剤を使用する場合、類似の性質または由来の物質を使用してもよく、異なる性質または由来の薬剤を使用してもよい。このような2種類以上の薬剤を投与する方法のための疾患レベルに関する情報も、本発明の方法によって入手することができる。
【0069】
本発明では、いったん類似の種類(例えば、ヒトに対するマウスなど)の生物、培養細胞、組織などに関し、ある特定の糖鎖構造の分析結果と、疾患レベルとが相関付けられた場合、対応する糖鎖構造の分析結果と、疾患レベルとが相関付けることができることは、当業者は容易に理解する。そのような事項は、例えば、動物培養細胞マニュアル、瀬野ら編著、共立出版、1993年などに記載され支持されており、本明細書においてこのすべての記載を援用する。
【0070】
(遺伝子治療)
遺伝子治療の方法の一般的な概説については、Goldspielら,Clinical Pharmacy 12:488−505(1993);WuおよびWu,Biotherapy 3:87−95(1991);Tolstoshev,Ann.Rev.Pharmacol.Toxicol.32:573−596(1993);Mulligan,Science 260:926−932(1993);ならびにMorganおよびAnderson,Ann.Rev.Biochem.62:191−217(1993);May,TIBTECH 11(5):155−215(1993)を参照のこと。遺伝子治療において使用される一般的に公知の組換えDNA技術は、Ausubelら(編),Current Protocols in Molecular Biology,John Wiley & Sons,NY(1993);およびKriegler,Gene Transfer and Expression,A Laboratory Manual,Stockton Press,NY(1990)に記載される。
【0071】
遺伝子治療に使用される核酸構築物は、周知の遺伝子導入ベクターを用いて局所的にまたは全身的にのいずれかで投与され得る。そのような核酸構築物がタンパク質のコード配列を包含する場合、そのタンパク質の発現は、内因性の哺乳類のプロモーターまたは異種のプロモーターの使用により誘導され得る。コード配列の発現は、構成的であり得るか、または調節され得る。
【0072】
種々の周知の遺伝子導入ベクターを遺伝子治療のための組成物として使用する場合、ベクターの投与は、PBS(リン酸緩衝化生理食塩水)または生理食塩水などに懸濁したベクター懸濁液の局所(例えば、癌組織内、肝臓内、筋肉内および脳内など)への直接注入か、または血管内(例えば、動脈内、静脈内および門脈内)への投与によりなされる。
【0073】
1つの実施態様において、遺伝子導入ベクターは、一般には、この遺伝子導入ベクターを単位用量注入可能な形態(溶液、懸濁液または乳濁液)で、薬学的に受容可能なキャリア(すなわち、使用された投薬量および濃度においてレシピエントに対して非毒性であり、そして処方物の他の成分と適合性であるもの)とを混合することによって処方され得る。例えば、処方物は、好ましくは、酸化剤および遺伝子導入ベクターにとって有害であることが公知である他の化合物を含まない。
【0074】
キャリアは、等張性および化学的安定性を増強する物質のような微量の添加物を適宜含む。このような物質は、使用された投薬量および濃度においてレシピエントに対して非毒性であり、そしてリン酸、クエン酸、コハク酸、酢酸、および他の有機酸またはそれらの塩のような緩衝剤;アスコルビン酸のような抗酸化剤;低分子量(約10残基未満の)ポリペプチド(例えば、ポリアルギニンまたはトリペプチド);タンパク質(例えば、血清アルブミン、ゼラチン、またはイムノグロブリン);親水性ポリマー(例えば、ポリビニルピロリドン);アミノ酸(例えば、グリシン、グルタミン酸、アスパラギン酸、またはアルギニン);単糖、二糖および他の炭水化物(セルロースまたはその誘導体、グルコース、マンノース、またはデキストリンを含む);キレート剤(例えば、EDTA);糖アルコール(例えば、マンニトールまたはソルビトール);対イオン(例えば、ナトリウム);および/または非イオン性界面活性剤(例えば、ポリソルベート、ポロキサマー)、またはPEGを含み得る。
【0075】
遺伝子導入ベクターを含む薬学的組成物は、代表的には、単位または多用量容器、例えば、密封アンプルまたはバイアルにおいて、水溶液として貯蔵され得る。
【0076】
遺伝子導入ベクターを含む薬学的組成物は医療実施基準(good medical practice)に一致した様式で、個々の患者の臨床状態(例えば、予防または処置されるべき状態)、遺伝子導入ベクターを含む組成物の送達部位、標的組織、投与方法、投与計画および当業者に公知の他の因子を考慮しつつ処方され、そして投与される。
【0077】
以下に、実施例に基づいて本発明を説明するが、以下の実施例は、例示の目的のみに提供される。従って、本発明の範囲は、上記発明の詳細な説明にも下記実施例にも限定されるものではなく、請求の範囲によってのみ限定される。
【実施例】
【0078】
(実施例1:本発明の遺伝子の同定)
マウス由来の破骨細胞前駆体培養細胞セルラインであるRAW264.7細胞 (TIB-71、ATCC)を本実施例において用いた。このセルラインは、可溶性Receptor Activatorof NF-kB Ligand (RANKL)存在下で培養することによって、TRAP陽性多核巨細胞へと分化する最も確立されたマウス破骨細胞セルラインである。RAW264.7細胞を、50ng/mlの可溶性RANKL(Peprotec社)存在下または非存在下で10%血清含有のDMEM(シグマ社)培地中で3日間培養しRNAを抽出した。cDNAを作成後、Affymetrix(Affymetrix社)を用いて可溶性RANKL刺激による遺伝子発現の比較検討を網羅的に行った。
【0079】
その結果、RANKL刺激による破骨細胞の分化過程においてこれまで述べられている破骨細胞の分化マーカー(cathepsinK, TRAP, MMP-9, carbonic anhydrase-II, calcitonin-receptor, beta3-integrin,RANK, NFATc1, c-Myc)と同様に、RANKL刺激によりAV251613(AK039655) mRNAが非常に増強することを発見した。内在性コントロールの遺伝子発現には、RANKL刺激は影響を与えなかった(図1)。
【0080】
AV251613遺伝子と相同性のある遺伝子配列をNCBIのホームページより検索したところ、マウスのAK039655(配列番号7)と一致し、さらに、NM178877.5と一致し、ヒトNM178833(配列番号1)と高い相同性があった。さらに、予想タンパク質のアミノ酸配列を、検討したところ、XiangMら(A human Na+/H+ antiporter sharing evolutionary origins with bacterial NhaAmay be a candidate gene for essential hypertension. PNAS, 2007 Nov20;104(47):18677-81. Epub 2007 Nov 13)が報告したNHA2(Na+/H+アンチポーター)と同一であることから、同定された遺伝子は、NHA2であることが判明した。
【0081】
(実施例2:NHA2のサイレンシング)
マウスNHA2の配列から、2組のsiRNAを調製した(シグマ社受託)。使用した配列は、センス鎖5'-GUGCUUAUACGAAUUCUGACU-3'(配列番号3)およびアンチセンス鎖5'-UCAGAAUUCGUAUAAGCACU-3'(配列番号4)の組合せ(siRNA No.1)、および、センス鎖5'-CACAAGUGGUCGUCAUCUUUG-3'(配列番号5)およびアンチセンス鎖5'-AAGAUGACGACCACUUGUGUU-3'(配列番号6)の組合せ(siRNA No.2)である。
【0082】
これら調製したsiRNAを用いてターゲット遺伝子のサイレンシングを行った。RAW264.7細胞を、AV251613(AK039655)-siRNA含有の無血清DMEMで前培養した。無血清DMEMで洗浄することによって余剰のAV251613(AK039655)-siRNAを取り除いた。10ng/mlの可溶性RANKL存在下または非存在下で10%血清含有のDMEM中で3日間培養しRNA抽出した。リアルタイム定量的RT−PCR(ABI社)を用いて、AV251613(AK039655)とカテプシンK遺伝子の発現を検討した。リアルタイムPCRでは、βアクチンを内在性コントロール遺伝子として、ターゲット遺伝子の発現量の検出を同時に行った。内在性コントロールとしてのβアクチンmRNAは、RANKL処理、siRNA処理、または/および抗体処理によって変化はなく、各ターゲットのmRNAの発現変化の相対的な解析には、このβアクチンの発現を基準として評価した(内在性コントロール遺伝子とは、図1の結果でも示されたハウスキーピング遺伝子として広く知られた遺伝子である。ハウスキーピング遺伝子のmRNAは、あらゆる細胞で恒常的に発現し、様々な環境変化でもそれらの発現量に著しい変化を生じないmRNAである。)。
【0083】
図2(A)に示すように、RANKL存在下では、NHA2の発現が上昇し、その上昇は、NHA2のsiRNAによって抑制された。一方、図2(B)に示すように、カテプシンKの発現もRANKL処理によって上昇した。また、RANKLによって上昇したカテプシンKの発現は、NHA2のsiRNAによって抑制された。カテプシンKは、破骨細胞への分化のマーカーであることから、この結果は、NHA2の発現を抑制することによって、破骨細胞への分化が抑制されたことを示す。したがって, NHA2のsiRNAは骨破壊性の病的な骨代謝状態を正常な方向へ調節することが示された。
【0084】
(実施例3:抗NHA2抗体の効果)
ヒトNHA2およびマウスNHA2のアラインメント(図3)に示される相同領域1(LDTARSHGEKQLEDY;配列番号9)および相同領域2(LGPRVLQKSEHRTEEEVQGETS;配列番号10)に基づき合成ペプチドを作製し、ウサギに免疫し抗体価を確認後、その血清を採取した(シグマ社受託)。実験には、ProteinAカラムで精製したものを0.2μmのフィルターで滅菌したものを、抗AK039655抗体(抗NHA2抗体)として使用した。
【0085】
3日間、可溶性RANKLによって刺激したRANW264.7細胞から、ラエムリ緩衝液を用いて細胞溶解物を抽出した。この細胞様怪物をSDS‐PAGE後、PDVF膜に転写した。PDVF膜上のタンパクに作製した抗NHA2抗体(抗AV251613(AK039655)抗体)を一次抗体として反応させ、洗浄後、HRP標識されたウサギIgGに対する抗体を2次抗体として反応させた。十分な洗浄後、HRP存在部位を検出するためにECLを用いた。反応したHRPとECLはバンドとして認識された。
【0086】
RAW264.7細胞を、可溶性RANKL存在下または非存在下で10%血清含有のDMEM中で4日間培養した。その培養を、20μg/mlのコントロールIgG、または上記のように作製した抗AK039655抗体(抗NHA2抗体)1、10、20μg/ml存在下で行った。各培養条件で培養した細胞よりRNAを抽出し、リアルタイム定量的RT-PCRを用いて、カテプシンK遺伝子の発現を検出した。リアルタイムPCRでは、βアクチンを内在性コントロール遺伝子として、ターゲット遺伝子の発現量の検出を同時に行った。内在性コントロールとしてのβアクチンmRNAは、RANKL処理、siRNA処理、または/および抗体処理によって変化はなく、各ターゲットのmRNAの発現変化の相対的な解析には、このβアクチンの発現を基準として評価した。その結果、図4に示されるように、抗NHA2抗体の添加量と、カテプシンK mRNAの発現抑制が相関することが明らかとなった。このことは、抗NHA2抗体によって、NHA2の機能の少なくとも一部が抑制され、その結果、破骨細胞への分化が抑制されたことを示すものである。
【0087】
(実施例4:RANKL刺激のNa+/H+エクスチェンジャー発現への影響)
NHA2は、Na+/H+エクスチェンジャーの一種であるが、RANKLの刺激がNHA2に特異的であるのかについて、検討した。0、10 、50、100 ng/mlの可溶性RANKL存在下でRAW264.7細胞を4-6日間培養し、RNAまたはタンパクを抽出した。タンパク抽出は、培養液のpHが6.2、7.0、7.4の条件下で培養した細胞からも抽出した。各RNAからcDNAを合成し、Na+/H+エクスチェンジャー(NHE)1、2、3、4、5、6およびNHA2(AK039655)の遺伝子をPCRで増幅した。増幅した遺伝子産物は、アガロース電気泳動後、エチジウムブロマイド染色し、紫外線下で写真撮影を行った。その結果、図5に示すように、NHA2(AV251613(AK039655))のmRNA発現量は、RANKLの添加量と比例していたが、それ以外のNa+/H+エクスチェンジャーの発現量は、RANKLの添加量と比例する応答を示さなかった。
【0088】
次に、培養細胞から抽出したタンパク質について、作製した抗AK039655抗体(抗NHA2抗体)を一次抗体としてウェスタンブロットを行い、発現強度を検討した。その結果、図6に示すように、NHA2(AV251613(AK039655))のタンパク質発現量もまた、RANKLの添加量と比例していた。また、図7に示すように、RANKLによるNHA2(AV251613(AK039655))の発現増強は、pH6.4に環境下よりも、pH7.4の環境下の方が大きかった。
【0089】
(実施例5:抗NHA2抗体の細胞への影響)
抗NHA2抗体が細胞に悪影響を与えないことを確認するために、抗NHA2抗体の細胞への影響を観察した。RAW264.7細胞を、10ng/mlの可溶性RANKL存在下または非存在下で10%血清含有のDMEM中で6日間培養した。この培養は、20μg/mlのコントロールIgGまたは実施例3で作製した抗NHA2抗体(抗AV251613(AK039655)抗体)存在下で行った。ホルマリン固定後、TRAP染色キット(Primarycell社)でTRAP染色を行い、細胞形態を写真撮影した。その結果、図8に示すように、抗NHA2抗体は細胞形態に悪影響を与えなかった。この結果から、抗NHA2抗体は、従来の骨吸収抑制剤と比較して格段に副作用の少ない、骨吸収抑制剤であると結論付けることができる。
【0090】
(実施例6:抗NHA2モノクローナル抗体による破骨細胞への分化抑制)
配列番号2に記載のアミノ酸配列からなるポリペプチドを抗原として、モノクローナル抗体を作製した(株式会社 ベックス、東京都板橋区)。調製されたモノクローナル抗体4種類について、その作用について検討した。具体的には、マウス由来の破骨細胞前駆体培養細胞セルラインであるRAW264.7細胞(TIB-71、ATCC)を、可溶性RANKL存在下で10%血清含有のDMEM中で4日間培養し、その培養を、10μg/mlのコントロールIgG、clodronate(クロドロネート)または新規に作製した抗NHA2モノクローナル抗体10μg/mlの存在下で行った。各培養条件で培養した細胞よりRNAを抽出し、リアルタイム定量的RT-PCRを用いて、カテプシンK遺伝子の発現を検出した。リアルタイムPCRでは、βアクチンを内在性コントロール遺伝子として、ターゲット遺伝子の発現量の検出を同時に行った。内在性コントロールとしてのβアクチンmRNAは、RANKL処理、siRNA処理、または/および抗体処理によって変化はなく、各ターゲットのmRNAの発現変化の相対的な解析には、このβアクチンの発現を基準として評価した。その結果、図9に示されるように、抗NHA2モノクローナル抗体の添加は、カテプシンK mRNAの発現を抑制することが明らかとなった。一方、25uMのclodronate添加した細胞のカテプシンK mRNAの発現量は、コントロールIgGを添加したカテプシンK mRNAの発現量と同等であった。これらのことから、抗NHA2モノクローナル抗体によって、NHA2の機能の少なくとも一部が抑制され、その結果、破骨細胞への分化が抑制されたことを示すものである。さらに、clodronateはビスフォスフォネートの一種であり、10μMのclodronateは骨吸収抑制効果があることが示されている (Selander ら、Characteristics ofclodronate-induced apoptosis in osteoclasts and macrophages. Mol. Pharmacol.50:1127-1138, 1996)。少なくとも本実施例で、10μg/mlの抗NHA2モノクローナル抗体は、25 uMのclodronateよりカテプシンK mRNAの発現を著しく抑制することが示された。
【0091】
(実施例7:抗NHA2モノクローナル抗体による骨芽細胞の分化促進)
実施例6で得られたモノクローナル抗体について、骨芽細胞の分化に対する影響を調べた。
【0092】
具体的には、マウス骨芽細胞セルラインであるMC3T3-E1細胞を、10%血清含有のDMEM中で7日間培養し、その培養を、10μg/mlのコントロールIgG、または実施例6で作製した抗NHA2モノクローナル抗体10μg/ml存在下で行った。各培養条件で培養した細胞よりRNAを抽出し、RT-PCRを用いて、骨芽細胞の分化マーカーであるオステリックス(Osterix)mRNAの発現を検出した。実施例6で調製した抗NHA2モノクローナル抗体のクローン3は、MC3T3-E1細胞におけるオステリックスmRNAの発現を著しく促進した。このモノクローナル抗体は、骨芽細胞の分化を促進するモノクローナル抗体である。このモノクローナル抗体を産生するハイブリドーマ細胞を、平成21年(2009年)3月10日に、独立行政法人産業技術総合研究所特許生物寄託センターに寄託し、受託番号FERMAP-21780が割り当てられた。
【0093】
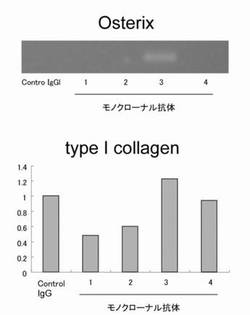
同様の実験を行ない、I型コラーゲンの発現について試験したところ、このクローン3は、I型コラーゲンmRNAの発現についても著明に促進した。これらの結果を図10に示す。
【0094】
このモノクローナル抗体は、破骨細胞の分化を抑制するのに加えて、骨芽細胞の分化を促進するモノクローナル抗体である。そのため、このモノクローナル抗体は、骨増成を促進する物質として非常に有用であることが明らかとなった。さらに、この結果は、NHA2への結合を指標とする一次スクリーニングを行ない、次に、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性の両方を有する物質をスクリーニングすることによって、骨増成を促進する物質として非常に有用な物質がスクリーニング可能であることが明らかとなった。
【0095】
以上のように、本発明の好ましい実施形態を用いて本発明を例示してきたが、本発明は、この実施形態に限定して解釈されるべきものではない。本発明は、特許請求の範囲によってのみその範囲が解釈されるべきであることが理解される。当業者は、本発明の具体的な好ましい実施形態の記載から、本発明の記載および技術常識に基づいて等価な範囲を実施することができることが理解される。本明細書において引用した特許、特許出願および文献は、その内容自体が具体的に本明細書に記載されているのと同様にその内容が本明細書に対する参考として援用されるべきであることが理解される。
【産業上の利用可能性】
【0096】
本発明に従って、骨吸収抑制剤および破骨細胞分化抑制剤が提供される。さらに、本発明に従って、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収抑制剤をスクリーニングするためのキットおよび骨吸収抑制剤をスクリーニングするための方法が提供される。
【受託番号】
【0097】
受託番号 FERMAP-21780
【配列表フリーテキスト】
【0098】
配列番号1は、ヒトNHA2(NM178833)の核酸配列である。
【0099】
配列番号2は、ヒトNHA2(NM178833)のアミノ酸配列である。
【0100】
配列番号3は、NHA2のsiRNA(センス鎖)の核酸配列である。
【0101】
配列番号4は、NHA2のsiRNA(アンチセンス鎖)の核酸配列である。
【0102】
配列番号5は、NHA2のsiRNA(センス鎖)の核酸配列である。
【0103】
配列番号6は、NHA2のsiRNA(アンチセンス鎖)の核酸配列である。
【0104】
配列番号7は、マウスNHA2(AK039655)の核酸配列である。
【0105】
配列番号8は、マウスNHA2(AK039655)のアミノ酸配列である。
【0106】
配列番号9は、抗NHA2抗体を惹起するために使用したペプチド配列である。
【0107】
配列番号10は、抗NHA2抗体を惹起するために使用したペプチド配列である。
【技術分野】
【0001】
本発明は、骨吸収調節剤、破骨細胞分化調節剤および骨増成促進剤、ならびに、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収調節剤および/または骨増成促進剤をスクリーニングするためのキットおよび骨吸収調節剤および/または骨増成促進剤をスクリーニングするための方法に関する。
【背景技術】
【0002】
骨粗鬆症や、歯周病による歯槽骨吸収など骨吸収関連疾患の骨吸収を調節することは整形外科領域、歯科領域の治療を成功する上で非常に重要である。このような内因性による骨吸収や、外来刺激による骨吸収では、RANKL等の発現が促進され、破骨細胞が活性化され、その結果、骨吸収が促進されていると考えられている。この破骨細胞を主に活性化する因子がReceptorActivator of NF-kB Ligand (RANKL)である。RANKLは破骨細胞前駆体細胞膜上のRANK分子に結合し破骨細胞の分化を促進する。RANKL-RANKのシグナルはTNF-αAssociated Factor (TRAF)2, TRAF5, TRAF6などを介して核内に伝達される。なかでもTRAF6がその中心的役割を果たしていると言われている(非特許文献1)。RANKLシグナルは破骨細胞前駆体上のRANKに結合し、TRAF6などを介して核内に伝達される。RANKをコードする遺伝子が先天的に変異する場合があり、遺伝子の変異部位によって、広範性骨格性高ホスファターゼ症(ExpansileSkeletal Hyperphosphatasia,ESH)、家族性広汎性骨溶解症(Familial Expansile Osteolysis, FEO)、あるいは骨パジェット病(Paget'sDisease of Bone, PDB)と呼ばれる骨の疾患が見られる。その他にも難聴,歯の喪失,高カルシウム血症などが見られる。
【0003】
骨吸収調節剤として、カテプシKインヒビター、RANKL抗体(デノスマブ)、および破骨細胞に直接作用するビスフォスフォネートについて臨床研究が行われているが、これらの副作用が問題となっている。
【0004】
この出願の発明に関連する先行技術文献情報としては、次のものがある。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Boyle WJ, Simonet WS, Lacey DL., Osteoclast differentiation andactivation, Nature 423: 15, 337-342, 2003
【発明の概要】
【発明が解決しようとする課題】
【0006】
そこで副作用の少ない新規の骨吸収調節剤・破骨細胞分化調節剤が求められている。
【課題を解決するための手段】
【0007】
発明者らは、RAW264.7セルラインに対してDNAアレイ法を用いて可溶性RANKL刺激に対して応答する遺伝子AV251613を同定し、その遺伝子が破骨細胞の分化マーカーとして有用であること、さらに、驚くべきことに、siRNAで直接その遺伝子をサイレンシングすること、また、その遺伝子産物の機能を抗体で間接的に調節することによって骨吸収調節効果および破骨細胞分化調節効果が奏されることを見出し、本発明を完成した。
【0008】
従って、本発明は、以下を提供する。
(項目1) 骨増成を促進する物質のスクリーニング法であって、以下:
a)配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質をスクリーニングする工程;ならびに、
b)上記工程(a)のスクリーニングによって得られた物質から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
(項目2) 前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、項目1に記載の方法。
(項目3) 前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、項目1に記載の方法。
(項目4) 前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、項目1に記載の方法。
(項目5) 前記配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質が、抗体である、項目1に記載の方法。
(項目6) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質の集団から、骨増成を促進する物質をスクリーニングする法であって、以下:
物質の集団から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
(項目7) 前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、項目6に記載の方法。
(項目8) 前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、項目6に記載の方法。
(項目9) 前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、項目6に記載の方法。
(項目10) 前記配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質が、抗体である、項目6に記載の方法。
(項目11) 以下:
(1)配列番号2に記載のアミノ酸配列からなるタンパク質、または、これをコードする核酸;
(2)破骨細胞に分化する能力を有する細胞;および、
(3)骨芽細胞
を含む、骨増成を促進する物質をスクリーニングするためのキット。
(項目12) 骨増成を促進する物質のスクリーニング法であって、以下:
a)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAをスクリーニングする工程;ならびに、
b)上記工程(a)のスクリーニングによって得られたsiRNAから、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
(項目13) 前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、項目12に記載の方法。
(項目14) 前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、項目12に記載の方法。
(項目15) 前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、項目12に記載の方法。
(項目16) 配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAの集団から、骨増成を促進する物質をスクリーニングする法であって、以下:
物質の集団から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
(項目17) 前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、項目16に記載の方法。
(項目18) 前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、項目16に記載の方法。
(項目19) 前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、項目16に記載の方法。
(項目20) 以下:
(1)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸;
(2)破骨細胞に分化する能力を有する細胞;および、
(3)骨芽細胞
を含む、骨増成を促進する物質をスクリーニングするためのキット。
(項目21) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、骨吸収調節のための薬学的組成物。
(項目22) 前記骨吸収調節が、骨吸収抑制である、項目21に記載の薬学的組成物。
(項目23) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、破骨細胞の分化を調節するための薬学的組成物。
(項目24) 前記破骨細胞の分化の調節が、破骨細胞の分化の抑制である、項目23に記載の薬学的組成物。
(項目25) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、破骨細胞の分化程度を検出するための、薬学的組成物。
(項目26) 骨吸収調節剤をスクリーニングするためのキットであって、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、キット。
(項目27) 前記骨吸収調節剤が、骨吸収抑制剤である、項目26に記載のキット。
(項目28) 骨吸収調節剤をスクリーニングするための方法であって、以下:
a)候補化合物を、破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該破骨細胞由来のサンプルに対する、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体の結合量を検出する工程;および、
c)該サンプルに対する該抗体の結合量を変化させる候補化合物を、骨吸収調節剤として同定する工程、
を包含する、方法。
(項目29) 骨吸収抑制剤をスクリーニングするための方法であって、以下:
a)候補化合物を、破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該破骨細胞由来のサンプルに対する、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体の結合量を検出する工程;および、
c)該サンプルに対する該抗体の結合量を減少させる候補化合物を、骨吸収抑制剤として同定する工程、
を包含する、方法。
(項目30) 以下、
i)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、
ii)配列番号1に記載の核酸配列の相補鎖を含む核酸に1または数個の置換、付加、または、欠失を有する核酸に対するsiRNA、
からなる群から選択されるsiRNAを含有する、骨吸収調節のための薬学的組成物。
(項目31) 骨吸収抑制のための、項目30に記載の薬学的組成物。
(項目32) 前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、項目31に記載の薬学的組成物。
(項目33) 配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAを含有する、破骨細胞の分化を調節するための薬学的組成物。
(項目34) 破骨細胞の分化の抑制のための、項目33に記載の薬学的組成物。
(項目35) 前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、項目34に記載の薬学的組成物。
(項目36) 配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸を含有する、破骨細胞の分化程度を検出するための、薬学的組成物。
(項目37) 骨吸収調節剤をスクリーニングするためのキットであって、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸を含有する、キット。
(項目38) 前記骨吸収調節剤が骨吸収抑制剤である、項目37に記載のキット。
(項目39) 骨吸収調節剤をスクリーニングするための方法であって、以下:
a)候補化合物を破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該細胞由来のサンプルに対する、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸の結合量を検出する工程;および
c)該サンプルに対する該核酸の結合量を変化させる候補化合物を、骨吸収調節剤として同定する工程、
を包含する、方法。
(項目40) 骨吸収抑制剤をスクリーニングするための方法であって、以下:
a)候補化合物を破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該細胞由来のサンプルに対する、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸の結合量を検出する工程;および
c)該サンプルに対する該核酸の結合量を減少させる候補化合物を、骨吸収抑制剤として同定する工程、
を包含する、方法。
(項目41) 配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬学的組成物。
(項目42) 心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬剤をスクリーニングするためのキットであって、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、キット。
(項目43) 以下、
i)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、
ii)配列番号1に記載の核酸配列の相補鎖を含む核酸に1または数個の置換、付加、または、欠失を有する核酸に対するsiRNA、
からなる群から選択されるsiRNAを含有する、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬学的組成物。
(項目44) 前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、項目43に記載の薬学的組成物。
(項目45) 項目5または10に記載の方法によって得られた抗体。
(項目46) 平成21年(2009年)3月10日に、独立行政法人産業技術総合研究所特許生物寄託センターに寄託され、受託番号FERM AP-21780を割り当てられたハイブリドーマによって分泌される、モノクローナル抗体。
【発明の効果】
【0009】
本発明に従って、骨吸収調節剤、破骨細胞分化調節剤および骨再生誘導剤が提供される。さらに、本発明に従って、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収調節剤および/または骨再生誘導剤をスクリーニングするためのキットおよび骨吸収調節剤および/または骨再生誘導剤をスクリーニングするための方法が提供される。
【図面の簡単な説明】
【0010】
【図1】図1は、RANKL存在下(RANKL(+))および非存在下(RANKL(+))でのRAW264.7細胞における各遺伝子の発現量を、ログ比として示したグラフである。
【図2】図2(A)は、コントロールRAW264.7細胞、RANKL処理したRAW264.7細胞、RANKLおよびsiRNA(No.1および2)で処理したRAW264.7細胞におけるマウスNHA2の発現量を示すグラフである(値は、コントロールに対する相対値)。図2(B)は、コントロールRAW264.7細胞、RANKL処理したRAW264.7細胞、RANKLおよびsiRNA(No.1および2)で処理したRAW264.7細胞におけるカテプシンKの発現量を示すグラフである(値は、コントロールに対する相対値)。
【図3】図3は、ヒトNHA2およびマウスNHA2のアラインメントである。「1」は相同領域1(LDTARSHGEKQLEDY;配列番号9)を示し、「2」は相同領域2(LGPRVLQKSEHRTEEEVQGETS;配列番号10)を示す。
【図4】図4は、カテプシンK mRNAについてのリアルタイム定量的RT−PCRの結果である。「−」はRANKL非存在下、「+」はRANKL存在下での実験を表す。
【図5】図5は、種々のNa+/H+エクスチェンジャーのmRNA発現量に対する示された濃度のRANKLの影響を調べたPCRの結果である。
【図6】図6は、NHA2タンパク質の発現量に対する示された濃度のRANKLの影響を調べたウェスタンブロットの結果である。
【図7】図7は、RANKLによるNHA2発現誘導に対するpHの影響を調べた結果である。
【図8】図8は、RANKL非存在下(RANKL(−))およびRANKL存在下(RANKL(+))における、コントロールIgGおよび抗AK039655抗体(抗NHA2抗体)による細胞形態の影響を調べた結果である。
【図9】図9は、抗NHA2モノクローナル抗体により、破骨細胞への分化が抑制されたことを示す結果である。
【図10】図10は、抗NHA2モノクローナル抗体の中には、骨芽細胞の分化を促進するものがあることを示す結果である。
【発明を実施するための形態】
【0011】
以下、本発明を説明する。本明細書の全体にわたり、単数形の表現は、特に言及しない限り、その複数形の概念をも含むことが理解されるべきである。また、本明細書において使用される用語は、特に言及しない限り、当該分野で通常用いられる意味で用いられることが理解されるべきである。
【0012】
以下に本明細書において特に使用される用語の定義を列挙する。
【0013】
本明細書において使用する場合、用語「骨吸収」とは、破骨細胞によって、古い骨の細胞(通常、弾力や固さを失ってしまった細胞である)が分解され、壊されていく事象をいう。
【0014】
本明細書において使用する場合、用語「骨吸収調節」とは、骨吸収の速度および/または量を増減させることをいう。骨吸収は破骨細胞によって行われる事象であることから、「骨吸収抑制」は、破骨細胞の量および/または活性を低減させることによって達成されうる。破骨細胞の量の調節は、例えば、「破骨細胞に分化する能力を有する細胞」が破骨細胞に分化することを調節することによって達成され得るが、これに限定されない。破骨細胞の活性の低減は、例えば、破骨細胞の骨吸収活性の抑制によって達成され得る。破骨細胞の骨吸収活性の抑制は、例えば、破骨細胞によるプロトンの放出の抑制によって達成され得るが、これに限定されない。
【0015】
本明細書において使用する場合、用語「破骨細胞」とは、骨を壊す細胞である。破骨細胞は、細胞膜表面に存在する液胞性プロトンポンプの作用によって、プロトンを放出し、古い骨細胞を分解し、骨吸収を行う。
【0016】
本明細書において使用する場合、用語「破骨細胞に分化する能力を有する細胞」とは、一定の刺激を与えることによって、破骨細胞に分化する細胞をいう。例えば、マウス由来の破骨細胞前駆体培養細胞セルラインであるRAW264.7細胞(TIB-71、ATCC)は、可溶性RANKL存在下で培養することによって、破骨細胞の特徴を有するTRAP陽性多核巨細胞へと分化する最も確立されたマウス破骨細胞セルラインである。
【0017】
本明細書において使用する場合、用語「破骨細胞の分化程度」とは、破骨細胞に特有の指標を細胞が提示する程度をいう。そのような指標としては、例えば、破骨細胞の分化マーカー(例えば、カテプシンK、TRAP、MMP−9、カルボニックアンヒドラーゼ−II、カルシトニン−レセプター、β3−インテグリン、RANK、NFATc1、c−mycが挙げられるが、これに限定されない)が含まれる。
【0018】
本明細書において使用する場合、用語「骨芽細胞」とは、骨組織において骨形成を行う細胞をいう。骨芽細胞としては、例えば、MC3T3-E1細胞、HOS細胞、MG63細胞、UMR細胞、Saos2細胞が挙げられるが、これに限定されない。
【0019】
本明細書において使用する場合、用語「骨吸収調節剤」とは、破骨細胞による骨の吸収を調節(促進あるいは抑制または阻害)する因子をいう。
【0020】
本明細書において使用する場合、用語「骨吸収抑制剤」とは、破骨細胞による骨の吸収を抑制する因子をいう。
【0021】
本明細書において使用する場合、用語「骨増成促進剤」または「骨増成を促進する物質」とは、薬剤を投与しなければ骨の増成が充分に生じない条件下で、骨の増成を生じさせる薬剤、および/または、骨の増成速度を促進する薬剤をいう。骨吸収抑制を引き起こす物質は、間接的に骨増成を促進する(Kajiwaraら、Biomaterials, 2005 Feb;26(6):581-7)。従って、本発明の骨吸収抑制剤は、骨増成促進剤としても有用である。好ましくは、本発明の骨増成促進剤は、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質であるか、あるいは、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAであり、より好ましくは、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性の両方を有する物質である。本発明の本発明の骨増成促進剤としては、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質、低分子化合物、および、抗体、ならびに、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、配列番号1に記載の核酸配列からなる核酸に対するsiRNAであるが、これらに限定されない。
【0022】
本明細書において遺伝子(例えば、核酸配列、アミノ酸配列など)の「相同性」とは、2以上の遺伝子配列の、互いに対する同一性の程度をいう。また、本明細書において配列(核酸配列、アミノ酸配列など)の同一性とは、2以上の対比可能な配列の、互いに対する同一の配列(個々の核酸、アミノ酸など)の程度をいう。従って、ある2つの遺伝子の相同性が高いほど、それらの配列の同一性または類似性は高い。2種類の遺伝子が相同性を有するか否かは、配列の直接の比較、または核酸の場合ストリンジェントな条件下でのハイブリダイゼーション法によって調べられ得る。2つの遺伝子配列を直接比較する場合、その遺伝子配列間でDNA配列が、代表的には少なくとも50%同一である場合、好ましくは少なくとも70%同一である場合、より好ましくは少なくとも80%、90%、95%、96%、97%、98%または99%同一である場合、それらの遺伝子は相同性を有する。本明細書において、遺伝子(例えば、核酸配列、アミノ酸配列など)の「類似性」とは、上記相同性において、保存的置換をポジティブ(同一)とみなした場合の、2以上の遺伝子配列の、互いに対する同一性の程度をいう。従って、保存的置換がある場合は、その保存的置換の存在に応じて相同性と類似性とは異なる。また、保存的置換がない場合は、相同性と類似性とは同じ数値を示す。
【0023】
本明細書では、アミノ酸配列および塩基配列の類似性、同一性および相同性の比較は、配列分析用ツールであるFASTAを用い、デフォルトパラメータを用いて算出される。
【0024】
本明細書において「フラグメント」とは、全長のポリペプチドまたはポリヌクレオチド(長さがn)に対して、1〜n−1までの配列長さを有するポリペプチドまたはポリヌクレオチドをいう。フラグメントの長さは、その目的に応じて、適宜変更することができ、例えば、その長さの下限としては、ポリペプチドの場合、3、4、5、6、7、8、9、10、15,20、25、30、40、50およびそれ以上のアミノ酸が挙げられ、ここの具体的に列挙していない整数で表される長さ(例えば、11など)もまた、下限として適切であり得る。また、ポリヌクレオチドの場合、5、6、7、8、9、10、15,20、25、30、40、50、75、100およびそれ以上のヌクレオチドが挙げられ、ここの具体的に列挙していない整数で表される長さ(例えば、11など)もまた、下限として適切であり得る。本明細書において、ポリペプチドおよびポリヌクレオチドの長さは、上述のようにそれぞれアミノ酸または核酸の個数で表すことができるが、上述の個数は絶対的なものではなく、同じ機能を有する限り、上限または下限としての上述の個数は、その個数の上下数個(または例えば上下10%)のものも含むことが意図される。そのような意図を表現するために、本明細書では、個数の前に「約」を付けて表現することがある。しかし、本明細書では、「約」のあるなしはその数値の解釈に影響を与えないことが理解されるべきである。本明細書において有用なフラグメントの長さは、そのフラグメントの基準となる全長タンパク質の機能のうち少なくとも1つの機能が保持されているかどうかによって決定され得る。
【0025】
本明細書において「純化(された)」および「クローニング(された)」とは、互換可能に用いられる。「純化(された)」および「クローニング(された)」とは、ある物質または核酸の状態についていい、その核酸の存在頻度を高い状態にすることであって、好ましくは、その物質または核酸が、他の種類の物質または核酸が実質的に伴わない状態をいう。本明細書において「純化」および「クローニング」に関する文脈において使用される場合、他の種類の物質または核酸が「実質的に伴わない状態」とは、それら他の種類の物質または核酸が全く存在しない状態か、または存在するとしても、目的の物質または核酸に対して、何ら影響を与えない状態をいう。従って、より好ましい状態では、純化された核酸または核酸組成物は、ある特定の核酸のみを含む。
【0026】
本明細書で使用される場合、「遺伝子導入ベクター」および「遺伝子ベクター」は互換可能に使用される。「遺伝子導入ベクター」および「遺伝子ベクター」とは、目的のポリヌクレオチド配列を目的の細胞へと移入させることができるベクターをいう。
【0027】
本明細書において、「ストリンジェントな条件でハイブリダイズするポリヌクレオチド」とは、当該分野で慣用される周知の条件をいう。本発明のポリヌクレオチド中から選択されたポリヌクレオチドをプローブとして、コロニー・ハイブリダイゼーション法、プラーク・ハイブリダイゼーション法あるいはサザンブロットハイブリダイゼーション法等を用いることにより、そのようなポリヌクレオチドを得ることができる。具体的には、コロニーあるいはプラーク由来のDNAを固定化したフィルターを用いて、0.7〜1.0MのNaCl存在下、65℃でハイブリダイゼーションを行った後、0.1〜2倍濃度のSSC(saline−sodium citrate)溶液(1倍濃度のSSC溶液の組成は、150mM 塩化ナトリウム、15mM クエン酸ナトリウムである)を用い、65℃条件下でフィルターを洗浄することにより同定できるポリヌクレオチドを意味する。ハイブリダイゼーションは、Molecular Cloning 2nd ed.,Current Protocols in Molecular Biology,Supplement 1〜38、DNA Cloning 1:Core Techniques,A Practical Approach,Second Edition,Oxford University Press(1995)等の実験書に記載されている方法に準じて行うことができる。ここで、ストリンジェントな条件下でハイブリダイズする配列からは、好ましくは、A配列のみまたはT配列のみを含む配列が除外される。「ハイブリダイズ可能なポリヌクレオチド」とは、上記ハイブリダイズ条件下で別のポリヌクレオチドにハイブリダイズすることができるポリヌクレオチドをいう。ハイブリダイズ可能なポリヌクレオチドとして具体的には、本発明で具体的に示されるアミノ酸配列を有するポリペプチドをコードするDNAの塩基配列と少なくとも60%以上の相同性を有するポリヌクレオチド、好ましくは80%以上の相同性を有するポリヌクレオチド、さらに好ましくは95%以上の相同性を有するポリヌクレオチドを挙げることができる。
【0028】
本明細書において「高度にストリンジェントな条件」は、核酸配列において高度の相補性を有するDNA鎖のハイブリダイゼーションを可能にし、そしてミスマッチを有意に有するDNAのハイブリダイゼーションを除外するように設計された条件をいう。ハイブリダイゼーションのストリンジェンシーは、主に、温度、イオン強度、およびホルムアミドのような変性剤の条件によって決定される。このようなハイブリダイゼーションおよび洗浄に関する「高度にストリンジェントな条件」の例は、0.0015M塩化ナトリウム、0.0015Mクエン酸ナトリウム、65〜68℃、または0.015M塩化ナトリウム、0.0015Mクエン酸ナトリウム、および50%ホルムアミド、42℃である。このような高度にストリンジェントな条件については、Sambrooket al.,Molecular Cloning:A Laboratory Manual、第2版、Cold Spring Harbor Laboratory(ColdSpring Harbor,N,Y.1989);およびAnderson et al.、Nucleic Acid Hybridization:a Practical approach、IV、IRL Press Limited(Oxford,England).Limited,Oxford,Englandを参照のこと。必要により、よりストリンジェントな条件(例えば、より高い温度、より低いイオン強度、より高いホルムアミド、または他の変性剤)を、使用してもよい。他の薬剤が、非特異的なハイブリダイゼーションおよび/またはバックグラウンドのハイブリダイゼーションを減少する目的で、ハイブリダイゼーション緩衝液および洗浄緩衝液に含まれ得る。そのような他の薬剤の例としては、0.1%ウシ血清アルブミン、0.1%ポリビニルピロリドン、0.1%ピロリン酸ナトリウム、0.1%ドデシル硫酸ナトリウム(NaDodSO4またはSDS)、Ficoll、Denhardt溶液、超音波処理されたサケ精子DNA(または別の非相補的DNA)および硫酸デキストランであるが、他の適切な薬剤もまた、使用され得る。これらの添加物の濃度および型は、ハイブリダイゼーション条件のストリンジェンシーに実質的に影響を与えることなく変更され得る。ハイブリダイゼーション実験は、通常、pH6.8〜7.4で実施されるが;代表的なイオン強度条件において、ハイブリダイゼーションの速度は、ほとんどpH独立である。Anderson et al.、NucleicAcid Hybridization:a Practical Approach、第4章、IRL Press Limited(Oxford,England)を参照のこと。
【0029】
DNA二重鎖の安定性に影響を与える因子としては、塩基の組成、長さおよび塩基対不一致の程度が挙げられる。ハイブリダイゼーション条件は、当業者によって調整され得、これらの変数を適用させ、そして異なる配列関連性のDNAがハイブリッドを形成するのを可能にする。完全に一致したDNA二重鎖の融解温度は、以下の式によって概算され得る。
Tm(℃)=81.5+16.6(log[Na+])+0.41(%G+C)−600/N−0.72(%ホルムアミド)
ここで、Nは、形成される二重鎖の長さであり、[Na+]は、ハイブリダイゼーション溶液または洗浄溶液中のナトリウムイオンのモル濃度であり、%G+Cは、ハイブリッド中の(グアニン+シトシン)塩基のパーセンテージである。不完全に一致したハイブリッドに関して、融解温度は、各1%不一致(ミスマッチ)に対して約1℃ずつ減少する。
【0030】
本明細書において「中程度にストリンジェントな条件」とは、「高度にストリンジェントな条件」下で生じ得るよりも高い程度の塩基対不一致を有するDNA二重鎖が、形成し得る条件をいう。代表的な「中程度にストリンジェントな条件」の例は、0.015M塩化ナトリウム、0.0015M クエン酸ナトリウム、50〜65℃、または0.015M 塩化ナトリウム、0.0015M クエン酸ナトリウム、および20%ホルムアミド、37〜50℃である。例として、0.015Mナトリウムイオン中、50℃の「中程度にストリンジェントな」条件は、約21%の不一致を許容する。
【0031】
本明細書において「高度」にストリンジェントな条件と「中程度」にストリンジェントな条件との間に完全な区別は存在しないことがあり得ることが、当業者によって理解される。例えば、0.015Mナトリウムイオン(ホルムアミドなし)において、完全に一致した長いDNAの融解温度は、約71℃である。65℃(同じイオン強度)での洗浄において、これは、約6%不一致を許容にする。より離れた関連する配列を捕獲するために、当業者は、単に温度を低下させ得るか、またはイオン強度を上昇し得る。
【0032】
約20ヌクレオチドまでのオリゴヌクレオチドプローブについて、1MNaClにおける融解温度の適切な概算は、
Tm=(1つのA−T塩基につき2℃)+(1つのG−C塩基対につき4℃)
によって提供される。なお、6×クエン酸ナトリウム塩(SSC)におけるナトリウムイオン濃度は、1Mである(Suggsら、Developmental Biology Using Purified Genes、683頁、BrownおよびFox(編)(1981)を参照のこと)。
【0033】
本明細書において配列(アミノ酸または核酸など)の「同一性」、「相同性」および「類似性」のパーセンテージは、比較ウィンドウで最適な状態に整列された配列2つを比較することによって求められる。ここで、ポリヌクレオチド配列またはポリペプチド配列の比較ウィンドウ内の部分には、2つの配列の最適なアライメントについての基準配列(他の配列に付加が含まれていればギャップが生じることもあるが、ここでの基準配列は付加も欠失もないものとする)と比較したときに、付加または欠失(すなわちギャップ)が含まれる場合がある。同一の核酸塩基またはアミノ酸残基がどちらの配列にも認められる位置の数を求めることによって、マッチ位置の数を求め、マッチ位置の数を比較ウィンドウ内の総位置数で割り、得られた結果に100を掛けて同一性のパーセンテージを算出する。検索において使用される場合、相同性については、従来技術において周知のさまざまな配列比較アルゴリズムおよびプログラムの中から、適当なものを用いて評価する。このようなアルゴリズムおよびプログラムとしては、TBLASTN、BLASTP、FASTA、TFASTAおよびCLUSTALW(Pearson and Lipman,1988,Proc.Natl.Acad.Sci.USA 85(8):2444−2448、 Altschul et al.,1990,J.Mol.Biol.215(3):403−410、Thompson et al.,1994,Nucleic Acids Res.22(2):4673−4680、Higgins et al.,1996,Methods Enzymol.266:383−402、Altschul et al.,1990,J.Mol.Biol.215(3):403−410、Altschul et al.,1993,Nature Genetics 3:266−272)があげられるが、何らこれに限定されるものではない。特に好ましい実施形態では、従来技術において周知のBasic Local Alignment Search Tool(BLAST)(たとえば、Karlin and Altschul,1990,Proc.Natl.Acad.Sci.USA 87:2267−2268、Altschul et al.,1990,J.Mol.Biol.215:403−410、Altschul et al.,1993,Nature Genetics 3:266−272、Altschul et al.,1997,Nuc.Acids Res.25:3389−3402を参照のこと)を用いてタンパク質および核酸配列の相同性を評価する。特に、5つの専用BLASTプログラムを用いて以下の作業を実施することによって比較または検索が達成され得る。
【0034】
(1) BLASTPおよびBLAST3でアミノ酸のクエリー配列をタンパク質配列データベースと比較;
(2) BLASTNでヌクレオチドのクエリー配列をヌクレオチド配列データベースと比較;
(3) BLASTXでヌクレオチドのクエリー配列(両方の鎖)を6つの読み枠で変換した概念的翻訳産物をタンパク質配列データベースと比較;
(4) TBLASTNでタンパク質のクエリー配列を6つの読み枠(両方の鎖)すべてで変換したヌクレオチド配列データベースと比較;
(5) TBLASTXでヌクレオチドのクエリ配列を6つの読み枠で変換したものを、6つの読み枠で変換したヌクレオチド配列データベースと比較。
【0035】
BLASTプログラムは、アミノ酸のクエリ配列または核酸のクエリ配列と、好ましくはタンパク質配列データベースまたは核酸配列データベースから得られた被検配列との間で、「ハイスコアセグメント対」と呼ばれる類似のセグメントを特定することによって相同配列を同定するものである。ハイスコアセグメント対は、多くのものが従来技術において周知のスコアリングマトリックスによって同定(すなわち整列化)されると好ましい。好ましくは、スコアリングマトリックスとしてBLOSUM62マトリックス(Gonnet et al.,1992,Science 256:1443−1445、Henikoff and Henikoff,1993,Proteins 17:49−61)を使用する。このマトリックスほど好ましいものではないが、PAMまたはPAM250マトリックスも使用できる(たとえば、Schwartz and Dayhoff,eds.,1978,Matrices for Detecting Distance Relationships: Atlas of Protein Sequence and Structure,Washington: National Biomedical Research Foundationを参照のこと)。BLASTプログラムは、同定されたすべてのハイスコアセグメント対の統計的な有意性を評価し、好ましくはユーザー固有の相同率などのユーザーが独自に定める有意性の閾値レベルを満たすセグメントを選択する。統計的な有意性を求めるKarlinの式を用いてハイスコアセグメント対の統計的な有意性を評価すると好ましい(Karlin and Altschul,1990,Proc.Natl.Acad.Sci.USA 87:2267−2268参照のこと)。
【0036】
(遺伝子、タンパク質分子、核酸分子などの改変)
あるタンパク質分子において、配列に含まれるあるアミノ酸は、相互作用結合能力の明らかな低下または消失なしに、例えば、カチオン性領域または基質分子の結合部位のようなタンパク質構造において他のアミノ酸に置換され得る。あるタンパク質の生物学的機能を規定するのは、タンパク質の相互作用能力および性質である。従って、特定のアミノ酸の置換がアミノ酸配列において、またはそのDNAコード配列のレベルにおいて行われ得、置換後もなお、もとの性質を維持するタンパク質が生じ得る。従って、生物学的有用性の明らかな損失なしに、種々の改変が、本明細書において開示されたペプチドまたはこのペプチドをコードする対応するDNAにおいて行われ得る。
【0037】
上記のような改変を設計する際に、アミノ酸の疎水性指数が考慮され得る。タンパク質における相互作用的な生物学的機能を与える際の疎水性アミノ酸指数の重要性は、一般に当該分野で認められている(Kyte.JおよびDoolittle,R.F.J.Mol.Biol.157(1):105−132,1982)。アミノ酸の疎水的性質は、生成したタンパク質の二次構造に寄与し、次いでそのタンパク質と他の分子(例えば、酵素、基質、レセプター、DNA、抗体、抗原など)との相互作用を規定する。各アミノ酸は、それらの疎水性および電荷の性質に基づく疎水性指数を割り当てられる。それらは:イソロイシン(+4.5);バリン(+4.2);ロイシン(+3.8);フェニルアラニン(+2.8);システイン/シスチン(+2.5);メチオニン(+1.9);アラニン(+1.8);グリシン(−0.4);スレオニン(−0.7);セリン(−0.8);トリプトファン(−0.9);チロシン(−1.3);プロリン(−1.6);ヒスチジン(−3.2);グルタミン酸(−3.5);グルタミン(−3.5);アスパラギン酸(−3.5);アスパラギン(−3.5);リジン(−3.9);およびアルギニン(−4.5))である。
【0038】
あるアミノ酸を、同様の疎水性指数を有する他のアミノ酸により置換して、そして依然として同様の生物学的機能を有するタンパク質(例えば、酵素活性において等価なタンパク質)を生じさせ得ることが当該分野で周知である。このようなアミノ酸置換において、疎水性指数が±2以内であることが好ましく、±1以内であることがより好ましく、および±0.5以内であることがさらにより好ましい。疎水性に基づくこのようなアミノ酸の置換は効率的であることが当該分野において理解される。
【0039】
当該分野において、親水性指数もまた、改変設計において考慮され得る。米国特許第4,554,101号に記載されるように、以下の親水性指数がアミノ酸残基に割り当てられている:アルギニン(+3.0);リジン(+3.0);アスパラギン酸(+3.0±1);グルタミン酸(+3.0±1);セリン(+0.3);アスパラギン(+0.2);グルタミン(+0.2);グリシン(0);スレオニン(−0.4);プロリン(−0.5±1);アラニン(−0.5);ヒスチジン(−0.5);システイン(−1.0);メチオニン(−1.3);バリン(−1.5);ロイシン(−1.8);イソロイシン(−1.8);チロシン(−2.3);フェニルアラニン(−2.5);およびトリプトファン(−3.4)。アミノ酸が同様の親水性指数を有しかつ依然として生物学的等価体を与え得る別のものに置換され得ることが理解される。このようなアミノ酸置換において、親水性指数が±2以内であることが好ましく、±1以内であることがより好ましく、および±0.5以内であることがさらにより好ましい。
【0040】
本明細書において、「保存的置換」とは、アミノ酸置換において、元のアミノ酸と置換されるアミノ酸との親水性指数または/および疎水性指数が上記のように類似している置換をいう。保存的置換の例としては、例えば、親水性指数または疎水性指数が、±2以内のもの同士、好ましくは±1以内のもの同士、より好ましくは±0.5以内のもの同士のものが挙げられるがそれらに限定されない。従って、保存的置換の例は、当業者に周知であり、例えば、次の各グループ内での置換:アルギニンおよびリジン;グルタミン酸およびアスパラギン酸;セリンおよびスレオニン;グルタミンおよびアスパラギン;ならびにバリン、ロイシン、およびイソロイシン、などが挙げられるがこれらに限定されない。
【0041】
本明細書において、「改変体」とは、もとのポリペプチドまたはポリヌクレオチドなどの物質に対して、一部が変更されているものをいう。そのような改変体としては、置換改変体、付加改変体、欠失改変体、短縮(truncated)改変体、対立遺伝子変異体などが挙げられる。そのような改変体としては、基準となる核酸分子またはポリペプチドに対して、1または数個の置換、付加および/または欠失、あるいは1つ以上の置換、付加および/または欠失を含むものが挙げられるがそれらに限定されない。対立遺伝子(allele)とは、同一遺伝子座に属し、互いに区別される遺伝的改変体のことをいう。従って、「対立遺伝子変異体」とは、ある遺伝子に対して、対立遺伝子の関係にある改変体をいう。そのような対立遺伝子変異体は、通常その対応する対立遺伝子と同一または非常に類似性の高い配列を有し、通常はほぼ同一の生物学的活性を有するが、まれに異なる生物学的活性を有することもある。「種相同体またはホモログ(homolog)」とは、ある種の中で、ある遺伝子とアミノ酸レベルまたはヌクレオチドレベルで、相同性(好ましくは、60%以上の相同性、より好ましくは、80%以上、85%以上、90%以上、95%以上の相同性)を有するものをいう。そのような種相同体を取得する方法は、本明細書の記載から明らかである。「オルソログ(ortholog)」とは、オルソロガス遺伝子(orthologous gene)ともいい、二つの遺伝子がある共通祖先からの種分化に由来する遺伝子をいう。例えば、多重遺伝子構造をもつヘモグロビン遺伝子ファミリーを例にとると、ヒトおよびマウスのαヘモグロビン遺伝子はオルソログであるが,ヒトのαヘモグロビン遺伝子およびβヘモグロビン遺伝子はパラログ(遺伝子重複で生じた遺伝子)である。オルソログは、分子系統樹の推定に有用である。オルソログは、通常別の種において、もとの種と同様の機能を果たしていることがあり得ることから、本発明のオルソログもまた、本発明において有用であり得る。
【0042】
本明細書において「保存的(に改変された)改変体」は、アミノ酸配列および核酸配列の両方に適用される。特定の核酸配列に関して、保存的に改変された改変体とは、同一のまたは本質的に同一のアミノ酸配列をコードする核酸をいい、核酸がアミノ酸配列をコードしない場合には、本質的に同一な配列をいう。遺伝コードの縮重のため、多数の機能的に同一な核酸が任意の所定のタンパク質をコードする。例えば、コドンGCA、GCC、GCG、およびGCUはすべて、アミノ酸アラニンをコードする。したがって、アラニンがコドンにより特定される全ての位置で、そのコドンは、コードされたポリペプチドを変更することなく、記載された対応するコドンの任意のものに変更され得る。このような核酸の変動は、保存的に改変された変異の1つの種である「サイレント改変(変異)」である。ポリペプチドをコードする本明細書中のすべての核酸配列はまた、その核酸の可能なすべてのサイレント変異を記載する。当該分野において、核酸中の各コドン(通常メチオニンのための唯一のコドンであるAUG、および通常トリプトファンのための唯一のコドンであるTGGを除く)が、機能的に同一な分子を産生するために改変され得ることが理解される。したがって、ポリペプチドをコードする核酸の各サイレント変異は、記載された各配列において暗黙に含まれる。好ましくは、そのような改変は、ポリペプチドの高次構造に多大な影響を与えるアミノ酸であるシステインの置換を回避するようになされ得る。このような塩基配列の改変法としては、制限酵素などによる切断、DNAポリメラーゼ、Klenowフラグメント、DNAリガーゼなどによる処理等による連結等の処理、合成オリゴヌクレオチドなどを用いた部位特異的塩基置換法(特定部位指向突然変異法;Mark Zoller and Michael Smith,Methods in Enzymology,100,468−500(1983))が挙げられるが、この他にも通常分子生物学の分野で用いられる方法によって改変を行うこともできる。
【0043】
本明細書中において、機能的に等価なポリペプチドを作製するために、アミノ酸の置換のほかに、アミノ酸の付加、欠失、または修飾もまた行うことができる。アミノ酸の置換とは、もとのペプチドを1つ以上、例えば、1〜10個、好ましくは1〜5個、より好ましくは1〜3個のアミノ酸で置換することをいう。アミノ酸の付加とは、もとのペプチド鎖に1つ以上、例えば、1〜10個、好ましくは1〜5個、より好ましくは1〜3個のアミノ酸を付加することをいう。アミノ酸の欠失とは、もとのペプチドから1つ以上、例えば、1〜10個、好ましくは1〜5個、より好ましくは1〜3個のアミノ酸を欠失させることをいう。アミノ酸修飾は、アミド化、カルボキシル化、硫酸化、ハロゲン化、短縮化、脂質化(lipidation)、ホスホリル化、アルキル化、グリコシル化、リン酸化、水酸化、アシル化(例えば、アセチル化)などを含むが、これらに限定されない。置換、または付加されるアミノ酸は、天然のアミノ酸であってもよく、非天然のアミノ酸、またはアミノ酸アナログでもよい。天然のアミノ酸が好ましい。
【0044】
本明細書において使用される用語「ペプチドアナログ」または「ペプチド誘導体」とは、ペプチドとは異なる化合物であるが、ペプチドと少なくとも1つの化学的機能または生物学的機能が等価であるものをいう。したがって、ペプチドアナログには、もとのペプチドに対して、1つ以上のアミノ酸アナログまたはアミノ酸誘導体が付加または置換されているものが含まれる。ペプチドアナログは、その機能が、もとのペプチドの機能(例えば、pKa値が類似していること、官能基が類似していること、他の分子との結合様式が類似していること、水溶性が類似していることなど)と実質的に同様であるように、このような付加または置換がされている。そのようなペプチドアナログは、当該分野において周知の技術を用いて作製することができる。したがって、ペプチドアナログは、アミノ酸アナログを含むポリマーであり得る。
【0045】
同様に、「ポリヌクレオチドアナログ」、「核酸アナログ」は、ポリヌクレオチドまたは核酸とは異なる化合物であるが、ポリヌクレオチドまたは核酸と少なくとも1つの化学的機能または生物学的機能が等価であるものをいう。したがって、ポリヌクレオチドアナログまたは核酸アナログには、もとのペプチドに対して、1つ以上のヌクレオチドアナログまたはヌクレオチド誘導体が付加または置換されているものが含まれる。
【0046】
本明細書において使用される核酸分子は、発現されるポリペプチドが天然型のポリペプチドと実質的に同一の活性を有する限り、上述のようにその核酸の配列の一部が欠失または他の塩基により置換されていてもよく、あるいは他の核酸配列が一部挿入されていてもよい。あるいは、5’末端および/または3’末端に他の核酸が結合していてもよい。また、ポリペプチドをコードする遺伝子をストリンジェントな条件下でハイブリダイズし、そのポリペプチドと実質的に同一の機能を有するポリペプチドをコードする核酸分子でもよい。このような遺伝子は、当該分野において公知であり、本発明において利用することができる。
【0047】
このような核酸は、周知のPCR法により得ることができ、化学的に合成することもできる。これらの方法に、例えば、部位特異的変位誘発法、ハイブリダイゼーション法などを組み合わせてもよい。
【0048】
本明細書において、ポリペプチドまたはポリヌクレオチドの「置換、付加または欠失」とは、もとのポリペプチドまたはポリヌクレオチドに対して、それぞれアミノ酸もしくはその代替物、またはヌクレオチドもしくはその代替物が、置き換わること、付け加わることまたは取り除かれることをいう。このような置換、付加または欠失の技術は、当該分野において周知であり、そのような技術の例としては、部位特異的変異誘発技術などが挙げられる。置換、付加または欠失は、1つ以上であれば任意の数でよく、そのような数は、その置換、付加または欠失を有する改変体において目的とする機能(例えば、ホルモン、サイトカインの情報伝達機能など)が保持される限り、多くすることができる。例えば、そのような数は、1または数個であり得、そして好ましくは、全体の長さの20%以内、10%以内、または100個以下、50個以下、25個以下などであり得る。
【0049】
本明細書で用いる「抗体」という用語は、天然起源の抗体の他、例えば1本鎖抗体、キメラ2価ヒト化抗体、およびその抗体結合フラグメント(例えばFab’、F(ab’)2、Fab、FvおよびrIgG)を包含する。Pierce Catalog and Handbook 1994−1955(Pierce Chemical Co.、Rockford、IL)および例えばKuby、J.Immnol.3rdEd.、W.H.Freeman&Co,、New York(1998)参照。この様な非天然起源抗体を固相ペプチド合成を用いて構築するか、組み換えで製造するか、例えばHuseら、Science246:1275−1281(1989)に記載され、本明細書に引用して援用する可変重鎖および可変軽鎖でなるコンビナトリアルライブラリーをスクリーニ ングして得ることができる。例えばキメラ、ヒト化、CDRグラフト1本鎖2価抗体は当業者に公知である(Winterand Harris、Immunol.Today、14:243−246(1993);Ward et al.、Nature341:544−546(1989);Harlowand Lane,supra,1988;Hilyardら、Protein Engineering:A Practical Approach(IRL Press、1992);Borrabeck、AntibodyEngineering、2nd ed.(Oxford Universiry Press、1995);それぞれを本明細書に引用して援用する)。
【0050】
「抗体」という用語にはポリクローンおよびモノクローン抗体の双方が含まれる。この用語にはまた、キメラ抗体(例えばヒト化マウス抗体)およびヘテロ共役 付加抗体(例えば双特異性抗体)遺伝子操作型も含まれる。この用語は組み換え1本鎖Fvフラグメント(scFv)も指す。抗体という用語には2価または双特異性分子、2抗体、3抗体および4抗体も含まれる。2価および双特異性分子は例えばKostelny et al.、(1992)J Immunol 148:1547,Packand Pluckthun(1992)Biochemistry 31:1579,Hollinger et al.,1993,supra,Gruber et al.(1994)、J.Immunol:5368;Zhuet al.,(1997)、Protein Sci.6:781;Hu et al.,(1996)、Cancer Res.56:3055;Adams et al.,(1993)、CancerRes.53:4026;およびMcGartney et al.,(1995)、Protein Eng.8:301に記載されている。
【0051】
典型的には抗体は重鎖および軽鎖を有する。重鎖および軽鎖のそれぞれは不変領域および可変領域を有する(この領域は「ドメイン」としても知られている)。 軽鎖および重鎖可変領域は3個の超可変領域で隔てられた4個の「骨格」領域を有し、「相補性決定領域」または「CDR」とも呼ばれる。骨格領域とCDRの長さは定義されている。異なった重鎖または軽鎖の骨格領域の配列は一定の種内では相対的に保存されている。構成軽鎖および重鎖の組み合わせ骨格領域である 抗体の骨格領域は、CDRを3次元空間に位置し配列する役割を果たす。
【0052】
CDRは主として抗原のエピトープへの結合に関与する。各鎖のCDRは典型的にはN−末端から開始して番号が付けられるCDR1、CDR2およびCDR3と呼ばれ、特定のCDRが位置する鎖で同定される。従って、VHCDR3はそれが結合する抗体の重鎖の可変領域に位置し、一方、VLCDRはそれが見出される抗体の軽鎖の可変ドメイン由来のCDR1である。
【0053】
「VH」の例はFv、scFvまたなFabの重鎖を含む抗体の免疫グロブリン重鎖の可変領域である。「VL」の例はFv、scFvまたなFabの軽鎖を含む免疫グロブリン軽鎖の可変領域である。
【0054】
「1本鎖Fv」または「scFv」という語句は、伝統的な2本鎖抗体の重鎖および軽鎖の可変ドメインが結合して1本鎖を形成する抗体を指す。典型的には、リンカーペプチドが2本の鎖の間に挿入され、適切な折り畳みと活性結合部位の形成が可能になる。
【0055】
「キメラ抗体」とは(a)抗原結合部位(可変領域)が異なった、または変化したクラス、エフェクター機能および/または種の不変領域、またはキメラ抗体に 例えば酵素、毒素、ホルモン、成長因子、薬剤等の新しい性質を付与する全く異なった分子に結合する様に、不変領域またはその一部が変化した、または置換または交換された免疫グロブリン分子;または(b)可変領域またはその一部が変化した、または異なったまたは変化した抗原特異性を有する可変領域で置換また は交換された免疫グロブリン分子である。
【0056】
「ヒト化抗体」とは非ヒト免疫グロブリン由来の最少の配列を含む免疫グロブリン分子である。ヒト化抗体には受容者の相補性決定領域(CDR)由来の残基が 所望の特異性、親和性および容量を有するマウス、ラットまたはウサギ等の非ヒト種(供与者抗体)由来の残基で置換されたヒト免疫グロブリン(受容者抗体)が含まれる。ある場合は、ヒト免疫グロブリンのFv骨格領域が対応する非ヒト残基で置換されている。ヒト化抗体はまた、受容者抗体または導入CDRまたは 骨格配列内に見出されない残基を有してもよい。一般にヒト化抗体は少なくとも1個、典型的には2個の可変ドメインの実質的に全てを有するが、可変領域内では骨格領域(FR)の全て、または実質的に全てがヒト免疫グロブリンコンセンサス配列のものである。ヒト化抗体は免疫グロブリン不変領域(Fc)の少なく とも一部、典型的にはヒト免疫グロブリンの不変領域の一部を有することが最適である(Joneset al.,、Nature 321:522−525(1986);Riechman et al.,、Nature 332:323−329;およびPresta、Curr.Op.Struct.Biol.2:593−596(1992))。ヒト抗体に対しげっ歯類CDR配列(単数または複数)を置換することにより、ヒト化をWinterおよび共同研究者の方法(Jones et al.,、Nature 321:522−525(1986);Riechmanet al.,、Nature 332:323−327(1988);Verhoeyen et al.,、Science 239:1534−1536(1988))に従って基本的にあらかじめ生成することができる。従って、この様なヒト化抗体はキメラ抗体であり(米国特許第4,816,567号)、実質的に少なくとも無傷のヒト可変ドメインが非ヒト種由来の対応する配列で置換されている。
【0057】
「エピトープ」または「抗原決定基」とは、抗体が結合する抗原上の部位を指す。エピトープをタンパク質の3次元折り畳みで並置された隣接アミノ酸または非 隣接アミノ酸の双方から形成することができる。隣接アミノ酸で生成したエピトープは典型的には変性溶剤に晒しても保持されるが、3次元折り畳みで形成したエピトープは変性溶剤で処理すると典型的に失われる。エピトープには独自の空間配置中に少なくとも3個、通常は少なくとも5または8〜10個のアミノ酸が 含まれる。エピトープの空間配置の決定法には例えばX−線結晶学および2次元核磁気共鳴が含まれる。例えば「分子生物学の方法におけるエピトープマッピングプロトコール」、第66巻、Glenn E.Morris Ed(1996)参照。エピトープマッピングの好ましい方法は表面プラズモン共鳴である。
【0058】
(骨吸収抑制活性を有する抗体の調製)
上記の手法で調製した抗体の集団から、骨吸収抑制活性を有する抗体を容易に選択することができる。例えば、破骨細胞の分化の抑制を指標とする場合には、カテプシンK、TRAP、MMP−9、カルボニックアンヒドラーゼ−II、カルシトニン−レセプター、β3−インテグリン、RANK、NFATc1、およびc−mycからなる群から選択される遺伝子発現のRANKLによる促進を阻害する抗体を選択することによって、骨吸収抑制活性を有する抗体を容易に選択することができる。
【0059】
(薬学的組成物)
本発明のポリヌクレオチド、ポリヌクレオチドを含む発現ベクターおよび遺伝子導入ベクター、アンチセンス核酸、siRNA、ポリペプチド、ならびにポリペプチドに対する抗体は、骨吸収調節(促進あるいは抑制または阻害)のため、破骨細胞の分化調節(促進あるいは抑制または阻害)のため、および、破骨細胞の活性調節(促進あるいは抑制または阻害)のための成分としても使用することが可能である。さらに、本発明のポリヌクレオチドの改変体、ポリヌクレオチド改変体を含む発現ベクターおよび遺伝子導入ベクター、これら改変体に対するアンチセンス核酸、siRNA、そして、ポリペプチド改変体、ならびにポリペプチド改変体に対する抗体は、骨吸収調節のため、破骨細胞の分化調節のため、および、破骨細胞の活性調節のための成分としても使用することが可能である。
【0060】
また、本発明のポリヌクレオチド、ポリヌクレオチドを含む発現ベクターおよび遺伝子導入ベクター、アンチセンス核酸、siRNA、ポリペプチド、ならびにポリペプチドに対する抗体は、歯周病による歯槽骨吸収抑制、骨粗鬆症、骨腫瘍、溶骨性骨転移、リュウマチ性関節炎、歯周病、インプラント周囲炎、顎堤骨吸収などの骨破壊性疾患の処置、予防、診断または予後のための薬学的組成物の成分としても使用することが可能である。さらに、本発明のポリヌクレオチドの改変体、ポリヌクレオチド改変体を含む発現ベクターおよび遺伝子導入ベクター、これら改変体に対するアンチセンス核酸、siRNA、そして、本発明のポリペプチド改変体、ならびにポリペプチド改変体に対する抗体は、歯周病による歯槽骨吸収抑制、骨粗鬆症、骨腫瘍、溶骨性骨転移、リュウマチ性関節炎、歯周病、インプラント周囲炎、顎堤骨吸収などの骨破壊性疾患の処置、予防、診断または予後のための薬学的組成物の成分としても使用することが可能である。また、本発明のポリヌクレオチド、タンパク質、および抗体は、骨吸収調節剤のスクリーニングのため、および、これら疾患の治療薬の探索のためのツールとしても利用可能である。本発明のポリヌクレオチド改変体、タンパク質改変体、およびタンパク質改変体に対する抗体もまた、骨吸収調節剤のスクリーニングのため、および、これら疾患の治療薬の探索のためのツールとしても利用可能である。
【0061】
さらに、骨吸収抑制を引き起こす物質は、間接的に骨増成を促進することから、本発明の骨吸収抑制剤は、骨増成促進剤としても有用である。
【0062】
本発明のNHA2は、Na+/H+アンチポーターとして同定されている(Xiang Mら、A human Na+/H+ antiporter sharing evolutionary origins withbacterial NhaA may be a candidate gene for essential hypertension. PNAS, 2007Nov 20;104(47):18677-81. Epub 2007 Nov 13)。理論に拘束されることは望まないが、破骨細胞の細胞膜に発現し、プロトンの排出を担う液胞型H+−ATPaseは膜電位感受性であることから、NHA2は、液胞型H+−ATPaseがプロトン排出機能を発揮するために重要な役割を担い、その一方で、NHA2のアンチポーターとしての機能が損なわれると、結果として液胞型H+−ATPaseの機能が損なわれると考えられる。NHA2は、破骨細胞のみならず、他の細胞においても、細胞内のイオンおよび膜電位の恒常性に重要な役割を担い、そのため、NHA2の機能を調節(抑制および/または促進)することによって、プロトンのバランスが崩れたことによって引き起こされる種々の疾患(例えば、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態が挙げられるが、これに限定されない)を処置することが可能になる。
【0063】
ここで、「骨・カルシウム代謝異常疾患」としては、骨粗鬆症、変形性関節炎、関節リウマチ、小児リウマチ性疾患、若年性関節リウマチ、悪性関節リウマチ、脊椎関節症、強直性脊椎炎、Reiter症候群、反応性関節炎、膠原病に伴う関節炎、ベーチェット病、混合性結合組織病、リウマチ性多発性筋痛症、側頭動脈炎、シェグレーン症候群、再発性多発軟骨炎、掌蹠膿疱症性骨関節炎、結晶誘発性関節炎、代謝性骨疾患、骨軟化症、副甲状腺機能亢進症、骨壊死、全身性疾患に伴う関節炎、血液疾患における関節症、内分泌疾患における関節症、肺性肥大性骨関節症、反射性交感神経性異栄養症、感染性関節炎、頚椎部脊柱靭帯骨化症、頚椎症、肩関節障害、肘・手関節障害、神経病性関節症、椎間板変性疾患、腰部脊柱管狭窄症、脊柱側弯症、変形性股関節症、骨関節腫瘍、スポーツによる関節障害、O脚、X脚、Blount病、反張膝、膝内障、半月板損傷、タナ障害、大腿四頭筋損傷、頚骨粗面部断裂、Osgood−Schlatter病、有痛性分裂膝蓋骨、膝蓋軟骨軟化症、膝蓋骨脱臼・亜脱臼、膝靭帯損傷、前十字靭帯損傷、後十字靭帯損傷、内側側副靭帯損傷、大腿骨顆上、顆部骨折、頚骨顆部骨折、頚骨顆間隆起骨折、大腿骨遠位骨端離開、頚骨近位骨端離開、頚骨結節骨折、膝蓋骨骨折、関節ねずみ、離断性骨軟骨炎、関節内遊離体、骨軟骨腫症、膝のスポーツ外傷、急性化膿性膝関節炎、変形性膝関節症、関節水症、膝の骨壊死、滑液包炎、偽通風、特発性膝関節出血、高カルシウム血症、低カルシウム血症、副甲状腺機能亢進症、副甲状腺機能低下症、偽性副甲状腺機能低下症、カルシトニン産生腫瘍、腎性骨症、骨軟化症、サルコイドーシス、骨硬化症、骨転移が挙げられるが、これらに限定されない。
【0064】
また、本発明のポリヌクレオチド、ポリヌクレオチドを含む発現ベクターおよび遺伝子導入ベクター、アンチセンス核酸、siRNA、ポリペプチド、ならびにポリペプチドに対する抗体は、破骨細胞の分化程度のモニターのためのマーカーとしての薬学的組成物としても使用可能である。さらに、本発明のポリヌクレオチド改変体、ポリヌクレオチド改変体を含む発現ベクターおよび遺伝子導入ベクター、ならびに、これら改変体に対するアンチセンス核酸、siRNA、本発明のポリペプチド改変体、ならびにポリペプチド改変体に対する抗体は、破骨細胞の分化程度のモニターのためのマーカーとしての薬学的組成物としても使用可能である。
【0065】
本明細書において薬剤の「有効量」とは、その薬剤が目的とする薬効が発揮することができる量をいう。本明細書において、そのような有効量のうち、最小の濃度を最小有効量ということがある。そのような最小有効量は、当該分野において周知であり、通常、薬剤の最小有効量は当業者によって決定されているか、または当業者は適宜決定することができる。そのような有効量の決定には、実際の投与のほか、動物モデルなどを用いることも可能である。本発明はまた、このような有効量を決定する際に有用である。
【0066】
本明細書において「薬学的に受容可能なキャリア」は、医薬または動物薬のような農薬を製造するときに使用される物質であり、有効成分に有害な影響を与えないものをいう。そのような薬学的に受容可能なキャリアとしては、例えば、以下が挙げられるがそれらに限定されない:抗酸化剤、保存剤、着色料、風味料、および希釈剤、乳化剤、懸濁化剤、溶媒、フィラー、増量剤、緩衝剤、送達ビヒクル、賦形剤および/または農学的もしくは薬学的アジュバント。
【0067】
本発明の処置方法において使用される薬剤の種類および量は、本発明の方法によって得られた情報(例えば、疾患に関する情報)を元に、使用目的、対象疾患(種類、重篤度など)、患者の年齢、体重、性別、既往歴、投与される被検体の部位の形態または種類などを考慮して、当業者が容易に決定することができる。本発明のモニタリング方法を被検体(または患者)に対して施す頻度もまた、使用目的、対象疾患(種類、重篤度など)、患者の年齢、体重、性別、既往歴、および治療経過などを考慮して、当業者が容易に決定することができる。疾患状態をモニタリングする頻度としては、例えば、毎日−数ヶ月に1回(例えば、1週間に1回−1ヶ月に1回)のモニタリングが挙げられる。1週間−1ヶ月に1回のモニタリングを、経過を見ながら施すことが好ましい。
【0068】
必要に応じて、本発明の治療では、2種類以上の薬剤が使用され得る。2種類以上の薬剤を使用する場合、類似の性質または由来の物質を使用してもよく、異なる性質または由来の薬剤を使用してもよい。このような2種類以上の薬剤を投与する方法のための疾患レベルに関する情報も、本発明の方法によって入手することができる。
【0069】
本発明では、いったん類似の種類(例えば、ヒトに対するマウスなど)の生物、培養細胞、組織などに関し、ある特定の糖鎖構造の分析結果と、疾患レベルとが相関付けられた場合、対応する糖鎖構造の分析結果と、疾患レベルとが相関付けることができることは、当業者は容易に理解する。そのような事項は、例えば、動物培養細胞マニュアル、瀬野ら編著、共立出版、1993年などに記載され支持されており、本明細書においてこのすべての記載を援用する。
【0070】
(遺伝子治療)
遺伝子治療の方法の一般的な概説については、Goldspielら,Clinical Pharmacy 12:488−505(1993);WuおよびWu,Biotherapy 3:87−95(1991);Tolstoshev,Ann.Rev.Pharmacol.Toxicol.32:573−596(1993);Mulligan,Science 260:926−932(1993);ならびにMorganおよびAnderson,Ann.Rev.Biochem.62:191−217(1993);May,TIBTECH 11(5):155−215(1993)を参照のこと。遺伝子治療において使用される一般的に公知の組換えDNA技術は、Ausubelら(編),Current Protocols in Molecular Biology,John Wiley & Sons,NY(1993);およびKriegler,Gene Transfer and Expression,A Laboratory Manual,Stockton Press,NY(1990)に記載される。
【0071】
遺伝子治療に使用される核酸構築物は、周知の遺伝子導入ベクターを用いて局所的にまたは全身的にのいずれかで投与され得る。そのような核酸構築物がタンパク質のコード配列を包含する場合、そのタンパク質の発現は、内因性の哺乳類のプロモーターまたは異種のプロモーターの使用により誘導され得る。コード配列の発現は、構成的であり得るか、または調節され得る。
【0072】
種々の周知の遺伝子導入ベクターを遺伝子治療のための組成物として使用する場合、ベクターの投与は、PBS(リン酸緩衝化生理食塩水)または生理食塩水などに懸濁したベクター懸濁液の局所(例えば、癌組織内、肝臓内、筋肉内および脳内など)への直接注入か、または血管内(例えば、動脈内、静脈内および門脈内)への投与によりなされる。
【0073】
1つの実施態様において、遺伝子導入ベクターは、一般には、この遺伝子導入ベクターを単位用量注入可能な形態(溶液、懸濁液または乳濁液)で、薬学的に受容可能なキャリア(すなわち、使用された投薬量および濃度においてレシピエントに対して非毒性であり、そして処方物の他の成分と適合性であるもの)とを混合することによって処方され得る。例えば、処方物は、好ましくは、酸化剤および遺伝子導入ベクターにとって有害であることが公知である他の化合物を含まない。
【0074】
キャリアは、等張性および化学的安定性を増強する物質のような微量の添加物を適宜含む。このような物質は、使用された投薬量および濃度においてレシピエントに対して非毒性であり、そしてリン酸、クエン酸、コハク酸、酢酸、および他の有機酸またはそれらの塩のような緩衝剤;アスコルビン酸のような抗酸化剤;低分子量(約10残基未満の)ポリペプチド(例えば、ポリアルギニンまたはトリペプチド);タンパク質(例えば、血清アルブミン、ゼラチン、またはイムノグロブリン);親水性ポリマー(例えば、ポリビニルピロリドン);アミノ酸(例えば、グリシン、グルタミン酸、アスパラギン酸、またはアルギニン);単糖、二糖および他の炭水化物(セルロースまたはその誘導体、グルコース、マンノース、またはデキストリンを含む);キレート剤(例えば、EDTA);糖アルコール(例えば、マンニトールまたはソルビトール);対イオン(例えば、ナトリウム);および/または非イオン性界面活性剤(例えば、ポリソルベート、ポロキサマー)、またはPEGを含み得る。
【0075】
遺伝子導入ベクターを含む薬学的組成物は、代表的には、単位または多用量容器、例えば、密封アンプルまたはバイアルにおいて、水溶液として貯蔵され得る。
【0076】
遺伝子導入ベクターを含む薬学的組成物は医療実施基準(good medical practice)に一致した様式で、個々の患者の臨床状態(例えば、予防または処置されるべき状態)、遺伝子導入ベクターを含む組成物の送達部位、標的組織、投与方法、投与計画および当業者に公知の他の因子を考慮しつつ処方され、そして投与される。
【0077】
以下に、実施例に基づいて本発明を説明するが、以下の実施例は、例示の目的のみに提供される。従って、本発明の範囲は、上記発明の詳細な説明にも下記実施例にも限定されるものではなく、請求の範囲によってのみ限定される。
【実施例】
【0078】
(実施例1:本発明の遺伝子の同定)
マウス由来の破骨細胞前駆体培養細胞セルラインであるRAW264.7細胞 (TIB-71、ATCC)を本実施例において用いた。このセルラインは、可溶性Receptor Activatorof NF-kB Ligand (RANKL)存在下で培養することによって、TRAP陽性多核巨細胞へと分化する最も確立されたマウス破骨細胞セルラインである。RAW264.7細胞を、50ng/mlの可溶性RANKL(Peprotec社)存在下または非存在下で10%血清含有のDMEM(シグマ社)培地中で3日間培養しRNAを抽出した。cDNAを作成後、Affymetrix(Affymetrix社)を用いて可溶性RANKL刺激による遺伝子発現の比較検討を網羅的に行った。
【0079】
その結果、RANKL刺激による破骨細胞の分化過程においてこれまで述べられている破骨細胞の分化マーカー(cathepsinK, TRAP, MMP-9, carbonic anhydrase-II, calcitonin-receptor, beta3-integrin,RANK, NFATc1, c-Myc)と同様に、RANKL刺激によりAV251613(AK039655) mRNAが非常に増強することを発見した。内在性コントロールの遺伝子発現には、RANKL刺激は影響を与えなかった(図1)。
【0080】
AV251613遺伝子と相同性のある遺伝子配列をNCBIのホームページより検索したところ、マウスのAK039655(配列番号7)と一致し、さらに、NM178877.5と一致し、ヒトNM178833(配列番号1)と高い相同性があった。さらに、予想タンパク質のアミノ酸配列を、検討したところ、XiangMら(A human Na+/H+ antiporter sharing evolutionary origins with bacterial NhaAmay be a candidate gene for essential hypertension. PNAS, 2007 Nov20;104(47):18677-81. Epub 2007 Nov 13)が報告したNHA2(Na+/H+アンチポーター)と同一であることから、同定された遺伝子は、NHA2であることが判明した。
【0081】
(実施例2:NHA2のサイレンシング)
マウスNHA2の配列から、2組のsiRNAを調製した(シグマ社受託)。使用した配列は、センス鎖5'-GUGCUUAUACGAAUUCUGACU-3'(配列番号3)およびアンチセンス鎖5'-UCAGAAUUCGUAUAAGCACU-3'(配列番号4)の組合せ(siRNA No.1)、および、センス鎖5'-CACAAGUGGUCGUCAUCUUUG-3'(配列番号5)およびアンチセンス鎖5'-AAGAUGACGACCACUUGUGUU-3'(配列番号6)の組合せ(siRNA No.2)である。
【0082】
これら調製したsiRNAを用いてターゲット遺伝子のサイレンシングを行った。RAW264.7細胞を、AV251613(AK039655)-siRNA含有の無血清DMEMで前培養した。無血清DMEMで洗浄することによって余剰のAV251613(AK039655)-siRNAを取り除いた。10ng/mlの可溶性RANKL存在下または非存在下で10%血清含有のDMEM中で3日間培養しRNA抽出した。リアルタイム定量的RT−PCR(ABI社)を用いて、AV251613(AK039655)とカテプシンK遺伝子の発現を検討した。リアルタイムPCRでは、βアクチンを内在性コントロール遺伝子として、ターゲット遺伝子の発現量の検出を同時に行った。内在性コントロールとしてのβアクチンmRNAは、RANKL処理、siRNA処理、または/および抗体処理によって変化はなく、各ターゲットのmRNAの発現変化の相対的な解析には、このβアクチンの発現を基準として評価した(内在性コントロール遺伝子とは、図1の結果でも示されたハウスキーピング遺伝子として広く知られた遺伝子である。ハウスキーピング遺伝子のmRNAは、あらゆる細胞で恒常的に発現し、様々な環境変化でもそれらの発現量に著しい変化を生じないmRNAである。)。
【0083】
図2(A)に示すように、RANKL存在下では、NHA2の発現が上昇し、その上昇は、NHA2のsiRNAによって抑制された。一方、図2(B)に示すように、カテプシンKの発現もRANKL処理によって上昇した。また、RANKLによって上昇したカテプシンKの発現は、NHA2のsiRNAによって抑制された。カテプシンKは、破骨細胞への分化のマーカーであることから、この結果は、NHA2の発現を抑制することによって、破骨細胞への分化が抑制されたことを示す。したがって, NHA2のsiRNAは骨破壊性の病的な骨代謝状態を正常な方向へ調節することが示された。
【0084】
(実施例3:抗NHA2抗体の効果)
ヒトNHA2およびマウスNHA2のアラインメント(図3)に示される相同領域1(LDTARSHGEKQLEDY;配列番号9)および相同領域2(LGPRVLQKSEHRTEEEVQGETS;配列番号10)に基づき合成ペプチドを作製し、ウサギに免疫し抗体価を確認後、その血清を採取した(シグマ社受託)。実験には、ProteinAカラムで精製したものを0.2μmのフィルターで滅菌したものを、抗AK039655抗体(抗NHA2抗体)として使用した。
【0085】
3日間、可溶性RANKLによって刺激したRANW264.7細胞から、ラエムリ緩衝液を用いて細胞溶解物を抽出した。この細胞様怪物をSDS‐PAGE後、PDVF膜に転写した。PDVF膜上のタンパクに作製した抗NHA2抗体(抗AV251613(AK039655)抗体)を一次抗体として反応させ、洗浄後、HRP標識されたウサギIgGに対する抗体を2次抗体として反応させた。十分な洗浄後、HRP存在部位を検出するためにECLを用いた。反応したHRPとECLはバンドとして認識された。
【0086】
RAW264.7細胞を、可溶性RANKL存在下または非存在下で10%血清含有のDMEM中で4日間培養した。その培養を、20μg/mlのコントロールIgG、または上記のように作製した抗AK039655抗体(抗NHA2抗体)1、10、20μg/ml存在下で行った。各培養条件で培養した細胞よりRNAを抽出し、リアルタイム定量的RT-PCRを用いて、カテプシンK遺伝子の発現を検出した。リアルタイムPCRでは、βアクチンを内在性コントロール遺伝子として、ターゲット遺伝子の発現量の検出を同時に行った。内在性コントロールとしてのβアクチンmRNAは、RANKL処理、siRNA処理、または/および抗体処理によって変化はなく、各ターゲットのmRNAの発現変化の相対的な解析には、このβアクチンの発現を基準として評価した。その結果、図4に示されるように、抗NHA2抗体の添加量と、カテプシンK mRNAの発現抑制が相関することが明らかとなった。このことは、抗NHA2抗体によって、NHA2の機能の少なくとも一部が抑制され、その結果、破骨細胞への分化が抑制されたことを示すものである。
【0087】
(実施例4:RANKL刺激のNa+/H+エクスチェンジャー発現への影響)
NHA2は、Na+/H+エクスチェンジャーの一種であるが、RANKLの刺激がNHA2に特異的であるのかについて、検討した。0、10 、50、100 ng/mlの可溶性RANKL存在下でRAW264.7細胞を4-6日間培養し、RNAまたはタンパクを抽出した。タンパク抽出は、培養液のpHが6.2、7.0、7.4の条件下で培養した細胞からも抽出した。各RNAからcDNAを合成し、Na+/H+エクスチェンジャー(NHE)1、2、3、4、5、6およびNHA2(AK039655)の遺伝子をPCRで増幅した。増幅した遺伝子産物は、アガロース電気泳動後、エチジウムブロマイド染色し、紫外線下で写真撮影を行った。その結果、図5に示すように、NHA2(AV251613(AK039655))のmRNA発現量は、RANKLの添加量と比例していたが、それ以外のNa+/H+エクスチェンジャーの発現量は、RANKLの添加量と比例する応答を示さなかった。
【0088】
次に、培養細胞から抽出したタンパク質について、作製した抗AK039655抗体(抗NHA2抗体)を一次抗体としてウェスタンブロットを行い、発現強度を検討した。その結果、図6に示すように、NHA2(AV251613(AK039655))のタンパク質発現量もまた、RANKLの添加量と比例していた。また、図7に示すように、RANKLによるNHA2(AV251613(AK039655))の発現増強は、pH6.4に環境下よりも、pH7.4の環境下の方が大きかった。
【0089】
(実施例5:抗NHA2抗体の細胞への影響)
抗NHA2抗体が細胞に悪影響を与えないことを確認するために、抗NHA2抗体の細胞への影響を観察した。RAW264.7細胞を、10ng/mlの可溶性RANKL存在下または非存在下で10%血清含有のDMEM中で6日間培養した。この培養は、20μg/mlのコントロールIgGまたは実施例3で作製した抗NHA2抗体(抗AV251613(AK039655)抗体)存在下で行った。ホルマリン固定後、TRAP染色キット(Primarycell社)でTRAP染色を行い、細胞形態を写真撮影した。その結果、図8に示すように、抗NHA2抗体は細胞形態に悪影響を与えなかった。この結果から、抗NHA2抗体は、従来の骨吸収抑制剤と比較して格段に副作用の少ない、骨吸収抑制剤であると結論付けることができる。
【0090】
(実施例6:抗NHA2モノクローナル抗体による破骨細胞への分化抑制)
配列番号2に記載のアミノ酸配列からなるポリペプチドを抗原として、モノクローナル抗体を作製した(株式会社 ベックス、東京都板橋区)。調製されたモノクローナル抗体4種類について、その作用について検討した。具体的には、マウス由来の破骨細胞前駆体培養細胞セルラインであるRAW264.7細胞(TIB-71、ATCC)を、可溶性RANKL存在下で10%血清含有のDMEM中で4日間培養し、その培養を、10μg/mlのコントロールIgG、clodronate(クロドロネート)または新規に作製した抗NHA2モノクローナル抗体10μg/mlの存在下で行った。各培養条件で培養した細胞よりRNAを抽出し、リアルタイム定量的RT-PCRを用いて、カテプシンK遺伝子の発現を検出した。リアルタイムPCRでは、βアクチンを内在性コントロール遺伝子として、ターゲット遺伝子の発現量の検出を同時に行った。内在性コントロールとしてのβアクチンmRNAは、RANKL処理、siRNA処理、または/および抗体処理によって変化はなく、各ターゲットのmRNAの発現変化の相対的な解析には、このβアクチンの発現を基準として評価した。その結果、図9に示されるように、抗NHA2モノクローナル抗体の添加は、カテプシンK mRNAの発現を抑制することが明らかとなった。一方、25uMのclodronate添加した細胞のカテプシンK mRNAの発現量は、コントロールIgGを添加したカテプシンK mRNAの発現量と同等であった。これらのことから、抗NHA2モノクローナル抗体によって、NHA2の機能の少なくとも一部が抑制され、その結果、破骨細胞への分化が抑制されたことを示すものである。さらに、clodronateはビスフォスフォネートの一種であり、10μMのclodronateは骨吸収抑制効果があることが示されている (Selander ら、Characteristics ofclodronate-induced apoptosis in osteoclasts and macrophages. Mol. Pharmacol.50:1127-1138, 1996)。少なくとも本実施例で、10μg/mlの抗NHA2モノクローナル抗体は、25 uMのclodronateよりカテプシンK mRNAの発現を著しく抑制することが示された。
【0091】
(実施例7:抗NHA2モノクローナル抗体による骨芽細胞の分化促進)
実施例6で得られたモノクローナル抗体について、骨芽細胞の分化に対する影響を調べた。
【0092】
具体的には、マウス骨芽細胞セルラインであるMC3T3-E1細胞を、10%血清含有のDMEM中で7日間培養し、その培養を、10μg/mlのコントロールIgG、または実施例6で作製した抗NHA2モノクローナル抗体10μg/ml存在下で行った。各培養条件で培養した細胞よりRNAを抽出し、RT-PCRを用いて、骨芽細胞の分化マーカーであるオステリックス(Osterix)mRNAの発現を検出した。実施例6で調製した抗NHA2モノクローナル抗体のクローン3は、MC3T3-E1細胞におけるオステリックスmRNAの発現を著しく促進した。このモノクローナル抗体は、骨芽細胞の分化を促進するモノクローナル抗体である。このモノクローナル抗体を産生するハイブリドーマ細胞を、平成21年(2009年)3月10日に、独立行政法人産業技術総合研究所特許生物寄託センターに寄託し、受託番号FERMAP-21780が割り当てられた。
【0093】
同様の実験を行ない、I型コラーゲンの発現について試験したところ、このクローン3は、I型コラーゲンmRNAの発現についても著明に促進した。これらの結果を図10に示す。
【0094】
このモノクローナル抗体は、破骨細胞の分化を抑制するのに加えて、骨芽細胞の分化を促進するモノクローナル抗体である。そのため、このモノクローナル抗体は、骨増成を促進する物質として非常に有用であることが明らかとなった。さらに、この結果は、NHA2への結合を指標とする一次スクリーニングを行ない、次に、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性の両方を有する物質をスクリーニングすることによって、骨増成を促進する物質として非常に有用な物質がスクリーニング可能であることが明らかとなった。
【0095】
以上のように、本発明の好ましい実施形態を用いて本発明を例示してきたが、本発明は、この実施形態に限定して解釈されるべきものではない。本発明は、特許請求の範囲によってのみその範囲が解釈されるべきであることが理解される。当業者は、本発明の具体的な好ましい実施形態の記載から、本発明の記載および技術常識に基づいて等価な範囲を実施することができることが理解される。本明細書において引用した特許、特許出願および文献は、その内容自体が具体的に本明細書に記載されているのと同様にその内容が本明細書に対する参考として援用されるべきであることが理解される。
【産業上の利用可能性】
【0096】
本発明に従って、骨吸収抑制剤および破骨細胞分化抑制剤が提供される。さらに、本発明に従って、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収抑制剤をスクリーニングするためのキットおよび骨吸収抑制剤をスクリーニングするための方法が提供される。
【受託番号】
【0097】
受託番号 FERMAP-21780
【配列表フリーテキスト】
【0098】
配列番号1は、ヒトNHA2(NM178833)の核酸配列である。
【0099】
配列番号2は、ヒトNHA2(NM178833)のアミノ酸配列である。
【0100】
配列番号3は、NHA2のsiRNA(センス鎖)の核酸配列である。
【0101】
配列番号4は、NHA2のsiRNA(アンチセンス鎖)の核酸配列である。
【0102】
配列番号5は、NHA2のsiRNA(センス鎖)の核酸配列である。
【0103】
配列番号6は、NHA2のsiRNA(アンチセンス鎖)の核酸配列である。
【0104】
配列番号7は、マウスNHA2(AK039655)の核酸配列である。
【0105】
配列番号8は、マウスNHA2(AK039655)のアミノ酸配列である。
【0106】
配列番号9は、抗NHA2抗体を惹起するために使用したペプチド配列である。
【0107】
配列番号10は、抗NHA2抗体を惹起するために使用したペプチド配列である。
【特許請求の範囲】
【請求項1】
骨増成を促進する物質のスクリーニング法であって、以下:
a)配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質をスクリーニングする工程;ならびに、
b)上記工程(a)のスクリーニングによって得られた物質から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
【請求項2】
前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、請求項1に記載の方法。
【請求項3】
前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、請求項1に記載の方法。
【請求項4】
前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、請求項1に記載の方法。
【請求項5】
前記配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質が、抗体である、請求項1に記載の方法。
【請求項6】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質の集団から、骨増成を促進する物質をスクリーニングする法であって、以下:
物質の集団から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
【請求項7】
前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、請求項6に記載の方法。
【請求項8】
前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、請求項6に記載の方法。
【請求項9】
前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、請求項6に記載の方法。
【請求項10】
前記配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質が、抗体である、請求項6に記載の方法。
【請求項11】
以下:
(1)配列番号2に記載のアミノ酸配列からなるタンパク質、または、これをコードする核酸;
(2)破骨細胞に分化する能力を有する細胞;および、
(3)骨芽細胞
を含む、骨増成を促進する物質をスクリーニングするためのキット。
【請求項12】
骨増成を促進する物質のスクリーニング法であって、以下:
a)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAをスクリーニングする工程;ならびに、
b)上記工程(a)のスクリーニングによって得られたsiRNAから、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
【請求項13】
前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、請求項12に記載の方法。
【請求項14】
前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、請求項12に記載の方法。
【請求項15】
前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、請求項12に記載の方法。
【請求項16】
配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAの集団から、骨増成を促進する物質をスクリーニングする法であって、以下:
物質の集団から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
【請求項17】
前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、請求項16に記載の方法。
【請求項18】
前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、請求項16に記載の方法。
【請求項19】
前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、請求項16に記載の方法。
【請求項20】
以下:
(1)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸;
(2)破骨細胞に分化する能力を有する細胞;および、
(3)骨芽細胞
を含む、骨増成を促進する物質をスクリーニングするためのキット。
【請求項21】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、骨吸収調節のための薬学的組成物。
【請求項22】
前記骨吸収調節が、骨吸収抑制である、請求項21に記載の薬学的組成物。
【請求項23】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、破骨細胞の分化を調節するための薬学的組成物。
【請求項24】
前記破骨細胞の分化の調節が、破骨細胞の分化の抑制である、請求項23に記載の薬学的組成物。
【請求項25】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、破骨細胞の分化程度を検出するための、薬学的組成物。
【請求項26】
骨吸収調節剤をスクリーニングするためのキットであって、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、キット。
【請求項27】
前記骨吸収調節剤が、骨吸収抑制剤である、請求項26に記載のキット。
【請求項28】
骨吸収調節剤をスクリーニングするための方法であって、以下:
a)候補化合物を、破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該破骨細胞由来のサンプルに対する、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体の結合量を検出する工程;および、
c)該サンプルに対する該抗体の結合量を変化させる候補化合物を、骨吸収調節剤として同定する工程、
を包含する、方法。
【請求項29】
骨吸収抑制剤をスクリーニングするための方法であって、以下:
a)候補化合物を、破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該破骨細胞由来のサンプルに対する、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体の結合量を検出する工程;および、
c)該サンプルに対する該抗体の結合量を減少させる候補化合物を、骨吸収抑制剤として同定する工程、
を包含する、方法。
【請求項30】
以下、
i)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、
ii)配列番号1に記載の核酸配列の相補鎖を含む核酸に1または数個の置換、付加、または、欠失を有する核酸に対するsiRNA、
からなる群から選択されるsiRNAを含有する、骨吸収調節のための薬学的組成物。
【請求項31】
骨吸収抑制のための、請求項30に記載の薬学的組成物。
【請求項32】
前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、請求項31に記載の薬学的組成物。
【請求項33】
配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAを含有する、破骨細胞の分化を調節するための薬学的組成物。
【請求項34】
破骨細胞の分化の抑制のための、請求項33に記載の薬学的組成物。
【請求項35】
前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、請求項34に記載の薬学的組成物。
【請求項36】
配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸を含有する、破骨細胞の分化程度を検出するための、薬学的組成物。
【請求項37】
骨吸収調節剤をスクリーニングするためのキットであって、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸を含有する、キット。
【請求項38】
前記骨吸収調節剤が骨吸収抑制剤である、請求項37に記載のキット。
【請求項39】
骨吸収調節剤をスクリーニングするための方法であって、以下:
a)候補化合物を破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該細胞由来のサンプルに対する、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸の結合量を検出する工程;および
c)該サンプルに対する該核酸の結合量を変化させる候補化合物を、骨吸収調節剤として同定する工程、
を包含する、方法。
【請求項40】
骨吸収抑制剤をスクリーニングするための方法であって、以下:
a)候補化合物を破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該細胞由来のサンプルに対する、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸の結合量を検出する工程;および
c)該サンプルに対する該核酸の結合量を減少させる候補化合物を、骨吸収抑制剤として同定する工程、
を包含する、方法。
【請求項41】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬学的組成物。
【請求項42】
心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬剤をスクリーニングするためのキットであって、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、キット。
【請求項43】
以下、
i)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、
ii)配列番号1に記載の核酸配列の相補鎖を含む核酸に1または数個の置換、付加、または、欠失を有する核酸に対するsiRNA、
からなる群から選択されるsiRNAを含有する、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬学的組成物。
【請求項44】
前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、請求項43に記載の薬学的組成物。
【請求項45】
請求項5または10に記載の方法によって得られた抗体。
【請求項46】
平成21年(2009年)3月10日に、独立行政法人産業技術総合研究所特許生物寄託センターに寄託され、受託番号FERM AP-21780を割り当てられたハイブリドーマによって分泌される、モノクローナル抗体。
【請求項1】
骨増成を促進する物質のスクリーニング法であって、以下:
a)配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質をスクリーニングする工程;ならびに、
b)上記工程(a)のスクリーニングによって得られた物質から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
【請求項2】
前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、請求項1に記載の方法。
【請求項3】
前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、請求項1に記載の方法。
【請求項4】
前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、請求項1に記載の方法。
【請求項5】
前記配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質が、抗体である、請求項1に記載の方法。
【請求項6】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質の集団から、骨増成を促進する物質をスクリーニングする法であって、以下:
物質の集団から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
【請求項7】
前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、請求項6に記載の方法。
【請求項8】
前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、請求項6に記載の方法。
【請求項9】
前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、請求項6に記載の方法。
【請求項10】
前記配列番号2に記載のアミノ酸配列からなるタンパク質に結合する物質が、抗体である、請求項6に記載の方法。
【請求項11】
以下:
(1)配列番号2に記載のアミノ酸配列からなるタンパク質、または、これをコードする核酸;
(2)破骨細胞に分化する能力を有する細胞;および、
(3)骨芽細胞
を含む、骨増成を促進する物質をスクリーニングするためのキット。
【請求項12】
骨増成を促進する物質のスクリーニング法であって、以下:
a)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAをスクリーニングする工程;ならびに、
b)上記工程(a)のスクリーニングによって得られたsiRNAから、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
【請求項13】
前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、請求項12に記載の方法。
【請求項14】
前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、請求項12に記載の方法。
【請求項15】
前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、請求項12に記載の方法。
【請求項16】
配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAの集団から、骨増成を促進する物質をスクリーニングする法であって、以下:
物質の集団から、破骨細胞に分化する能力を有する細胞の分化抑制活性、および、骨芽細胞の分化誘導活性を有する物質をスクリーニングする工程、
を包含する、方法。
【請求項17】
前記破骨細胞に分化する能力を有する細胞の分化抑制活性が、カテプシンKの発現量の減少によって決定される、請求項16に記載の方法。
【請求項18】
前記骨芽細胞の分化誘導活性が、オステリックスの発現量の増加によって決定される、請求項16に記載の方法。
【請求項19】
前記骨芽細胞の分化誘導活性が、I型コラーゲンの発現量の増加によって決定される、請求項16に記載の方法。
【請求項20】
以下:
(1)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸;
(2)破骨細胞に分化する能力を有する細胞;および、
(3)骨芽細胞
を含む、骨増成を促進する物質をスクリーニングするためのキット。
【請求項21】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、骨吸収調節のための薬学的組成物。
【請求項22】
前記骨吸収調節が、骨吸収抑制である、請求項21に記載の薬学的組成物。
【請求項23】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、破骨細胞の分化を調節するための薬学的組成物。
【請求項24】
前記破骨細胞の分化の調節が、破骨細胞の分化の抑制である、請求項23に記載の薬学的組成物。
【請求項25】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、破骨細胞の分化程度を検出するための、薬学的組成物。
【請求項26】
骨吸収調節剤をスクリーニングするためのキットであって、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、キット。
【請求項27】
前記骨吸収調節剤が、骨吸収抑制剤である、請求項26に記載のキット。
【請求項28】
骨吸収調節剤をスクリーニングするための方法であって、以下:
a)候補化合物を、破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該破骨細胞由来のサンプルに対する、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体の結合量を検出する工程;および、
c)該サンプルに対する該抗体の結合量を変化させる候補化合物を、骨吸収調節剤として同定する工程、
を包含する、方法。
【請求項29】
骨吸収抑制剤をスクリーニングするための方法であって、以下:
a)候補化合物を、破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該破骨細胞由来のサンプルに対する、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体の結合量を検出する工程;および、
c)該サンプルに対する該抗体の結合量を減少させる候補化合物を、骨吸収抑制剤として同定する工程、
を包含する、方法。
【請求項30】
以下、
i)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、
ii)配列番号1に記載の核酸配列の相補鎖を含む核酸に1または数個の置換、付加、または、欠失を有する核酸に対するsiRNA、
からなる群から選択されるsiRNAを含有する、骨吸収調節のための薬学的組成物。
【請求項31】
骨吸収抑制のための、請求項30に記載の薬学的組成物。
【請求項32】
前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、請求項31に記載の薬学的組成物。
【請求項33】
配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNAを含有する、破骨細胞の分化を調節するための薬学的組成物。
【請求項34】
破骨細胞の分化の抑制のための、請求項33に記載の薬学的組成物。
【請求項35】
前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、請求項34に記載の薬学的組成物。
【請求項36】
配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸を含有する、破骨細胞の分化程度を検出するための、薬学的組成物。
【請求項37】
骨吸収調節剤をスクリーニングするためのキットであって、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸を含有する、キット。
【請求項38】
前記骨吸収調節剤が骨吸収抑制剤である、請求項37に記載のキット。
【請求項39】
骨吸収調節剤をスクリーニングするための方法であって、以下:
a)候補化合物を破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該細胞由来のサンプルに対する、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸の結合量を検出する工程;および
c)該サンプルに対する該核酸の結合量を変化させる候補化合物を、骨吸収調節剤として同定する工程、
を包含する、方法。
【請求項40】
骨吸収抑制剤をスクリーニングするための方法であって、以下:
a)候補化合物を破骨細胞に分化する能力を有する細胞に接触させる工程;
b)該細胞由来のサンプルに対する、配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸の結合量を検出する工程;および
c)該サンプルに対する該核酸の結合量を減少させる候補化合物を、骨吸収抑制剤として同定する工程、
を包含する、方法。
【請求項41】
配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬学的組成物。
【請求項42】
心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬剤をスクリーニングするためのキットであって、配列番号2に記載のアミノ酸配列からなるタンパク質に結合する抗体を含有する、キット。
【請求項43】
以下、
i)配列番号1に記載の核酸配列の相補鎖を含む核酸にストリンジェントな条件でハイブリダイズする核酸に対するsiRNA、および、
ii)配列番号1に記載の核酸配列の相補鎖を含む核酸に1または数個の置換、付加、または、欠失を有する核酸に対するsiRNA、
からなる群から選択されるsiRNAを含有する、心疾患、高血圧、腎臓障害、腸管障害、骨吸収に伴う痛みまたは発熱、広範性骨格性高ホスファターゼ症、家族性広汎性骨溶解症、骨パジェット病、骨吸収と関連する骨・カルシウム代謝異常疾患、難聴,歯の喪失,および、高カルシウム血症からなる群から選択される疾患または状態の処置のための薬学的組成物。
【請求項44】
前記siRNAが、配列番号3の配列を含む核酸および配列番号4の配列を含む核酸との組合せ、ならびに、配列番号5の配列を含む核酸および配列番号6の配列を含む核酸との組合せからなる群から選択される、請求項43に記載の薬学的組成物。
【請求項45】
請求項5または10に記載の方法によって得られた抗体。
【請求項46】
平成21年(2009年)3月10日に、独立行政法人産業技術総合研究所特許生物寄託センターに寄託され、受託番号FERM AP-21780を割り当てられたハイブリドーマによって分泌される、モノクローナル抗体。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2009−254352(P2009−254352A)
【公開日】平成21年11月5日(2009.11.5)
【国際特許分類】
【出願番号】特願2009−60314(P2009−60314)
【出願日】平成21年3月12日(2009.3.12)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
【公開日】平成21年11月5日(2009.11.5)
【国際特許分類】
【出願日】平成21年3月12日(2009.3.12)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
[ Back to top ]

