骨造成のための注射用フィブリン組成物
【課題】椎体形成術および亀背形成術等における骨造成のための新規な注射用組成物を提供すること。
【解決手段】本発明は、フィブリン、造影剤、およびカルシウム塩含有粒子を含む骨造成のための生分解性注射用組成物、ならびに骨疾患を患う患者の骨造成法であって、当該骨の非石灰化部分または中空部分に当該組成物を注射する工程を包含する方法に関する。本発明は、注射が可能で、完全に再吸収可能な(すなわち、生物学的に分解可能な)細孔性のフィブリン基質に関する。本発明の材料は実質的に発熱性を有さず、エラストマーにおいて通常見られる機械的性質を示し、フィブリン単独よりも機械的に優れている。
【解決手段】本発明は、フィブリン、造影剤、およびカルシウム塩含有粒子を含む骨造成のための生分解性注射用組成物、ならびに骨疾患を患う患者の骨造成法であって、当該骨の非石灰化部分または中空部分に当該組成物を注射する工程を包含する方法に関する。本発明は、注射が可能で、完全に再吸収可能な(すなわち、生物学的に分解可能な)細孔性のフィブリン基質に関する。本発明の材料は実質的に発熱性を有さず、エラストマーにおいて通常見られる機械的性質を示し、フィブリン単独よりも機械的に優れている。
【発明の詳細な説明】
【技術分野】
【0001】
(発明の分野)
本発明は、フィブリン、造影剤、およびカルシウム塩含有粒子を含む骨造成のための生分解性注射用組成物、ならびに骨疾患を患う患者の骨造成法であって、当該骨の非石灰化部分または中空部分に当該組成物を注射する工程を包含する方法に関する。
【背景技術】
【0002】
(発明の背景)
例えば、経皮的骨造成は、下記の適応症に用いられてきた椎体形成技術および亀背形成技術を含む:有痛性血管腫、骨粗しょう症性圧迫骨折、外傷性圧迫骨折、および有痛性脊椎転移。一例としては、ポリメタクリル酸メチル(PMMA)骨セメントの経皮的送達による骨折した椎体の修復が挙げられる。この治療は、椎骨の鎮痛および高さの回復に有効である。蛍光透視法を用いて標的とする椎骨を特定し、椎体内に套管針を入れる。PMMAは、椎体の片側(一方向)または両側(双方向)に送達可能であり、蛍光透視法を用いてこの送達を監視し、セメントが漏出または移動することなく確実にボーラス形状を留めるようにする。
【0003】
この技術の問題点にはPMMAの漏出が含まれる。これは、傍脊椎漏出、静脈浸潤、硬膜外漏出、および椎間板内漏出となる可能性がある(Truckai C.,Shadduck J.H.,2006、特許文献1)。漏出の結果、(さらなる外科処置を必要とする)隣接臓器の圧迫および/または塞栓症を含む非常に重篤な合併症が生じる場合がある。最近の研究では、PMMAと自然骨間の不均衡な力によりPMMA処置部に隣接する椎骨の二次骨折が増加することも立証されている(非特許文献1)。
【0004】
この技術のさらなる問題点は、硬膜嚢、骨髄、および神経根に及ぶ熱壊死の潜在的な原因となり得るPMMAの高発熱性である。この発熱性はまた、PMMAが任意の薬理学的薬剤または化学療法剤を取り込む能力を制限する。PMMAはまた、再吸収不可能な物質であり、未反応、未重合、および低分子量化学物質の浸出が可能である。この技術については、PMMAセメントに蛍光造影剤(通常、硫酸バリウム)を取り込むことにより蛍光
透視鏡の送達を容易にしている。骨および接着特性に対する硫酸バリウムの長期効果は完全には知られていない。
【0005】
PMMAの粘度も重要なパラメータである。これは、注射を可能にする程度に十分に低く、かつ血管系内に押し込まれない程度に十分に高くなければならない。粘度は時間とともに高くなり、臨床医が施術を行うとともに針を取り除くために与えられる時間は10分程度である。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許出願公開第2006/089715号明細書
【非特許文献】
【0007】
【非特許文献1】Trout A.T.,Kallmes D.F.,Kaufmann T.J.,Journal of Neuroradiology,2006,27:217〜223
【発明の概要】
【発明が解決しようとする課題】
【0008】
(発明の要旨)
このため、上述した欠点を克服する注射用骨造成組成物に対する強い要望が存在する。
【0009】
従って、本発明の目的は、椎体形成術および亀背形成術等における骨造成のための新規な注射用組成物を提供することである。
【課題を解決するための手段】
【0010】
本発明は、注射が可能で、完全に再吸収可能な(すなわち、生物学的に分解可能な)細孔性のフィブリン基質に関する。本発明の材料は実質的に発熱性を有さず、エラストマーにおいて通常見られる機械的性質を示し、フィブリン単独よりも機械的に優れている。適切な造影剤を組み込むことにより適度な放射物不透性が得られ、粒子状物質を組み込むことにより粘度が得られるかまたは調節される。PMMAとは異なり、ある実施形態では、本発明の出発材料は急速にゲル化し、ごくわずかな待ち時間で送達を行うことができる。この技術の完了時間に上限はないが、材料の送達時間に余裕ができる。
本発明はまた、以下の項目を提供する。
(項目1)
注射用骨造成組成物の多成分系であって、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、多成分系。
(項目2)
上記成分(a)〜(d)は溶液中に存在しており、少なくとも成分(a)は、成分(b)と空間的に分離されている、項目1に記載の多成分系。
(項目3)
上記造影剤は、少なくとも1つのヨウ素含有有機化合物を含む、項目1に記載の多成分系。
(項目4)
上記造影剤は、ジアトリゾアート(メグルミン)、イオデコール、イオジキサノール、イオフラトール、イオグラミド、イオヘキソール、イオメプロール、イオパミドール、イオプロミド、イオトロール、イオベルソール、イオキサグレート、およびメトリザミド、ならびにそれらの混合物で構成される群から選択される、項目3に記載の多成分系。
(項目5)
上記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、リン酸カルシウム、リン酸カルシウムの多形、ヒドロキシアパタイト、炭酸カルシウム、硫酸カルシウム、およびそれらの任意の組み合わせで構成される群から選択される、項目1に記載の多成分系。
(項目6)
上記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、およびリン酸カルシウム、ならびにそれらの混合物で構成される群から選択され、かつ/または該カルシウム塩含有粒子は、Ca/P比が約1.5
〜約2の範囲である、項目5に記載の多成分系。
(項目7)
上記フィブリノゲン成分(a)中のフィブリノゲンの量は、約10〜約200mg/mlの範囲である、項目1に記載の多成分系。
(項目8)
上記トロンビン成分(b)中のトロンビンの量は、最終凝塊組成物において少なくとも約1IU/mlである、項目1に記載の多成分系。
(項目9)
上記成分(c)中の造影剤の量は、最終凝塊組成物において約100〜約800mg/mlの範囲である、項目1に記載の多成分系。
(項目10)
上記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、上記最終凝塊組成物に対して約1〜約50%w/wの範囲である、項目1に記載の多成分系。
(項目11)
上記成分(a)中のフィブリノゲンの量は、約10〜約200mg/mlの範囲であり、上記成分(b)中のトロンビンの量は、上記最終凝塊組成物において少なくとも約1IU/mlであり、上記成分(c)に含有される造影剤の量は、該最終凝塊組成物において約100〜約800mg/mlの範囲であり、上記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、該最終凝塊組成物に対して約1〜約50%w/wの範囲である、項目1に記載の多成分系。
(項目12)
上記カルシウム塩含有粒子は、直径が約100μm未満である、項目1に記載の多成分系。
(項目13)
上記カルシウム塩含有粒子は、直径が約50μm未満である、項目12に記載の多成分系。
(項目14)
注射用骨造成組成物の多成分系であって、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、を含み、
該成分(a)〜(d)の1つ以上または全ては、固体状で存在する、多成分系。
(項目15)
注射用骨造成組成物であって、
フィブリンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、組成物。
(項目16)
上記造影剤は、少なくとも1つのヨウ素含有有機化合物を含む、項目15に記載の注射用骨造成組成物。
(項目17)
上記適切な造影剤は、ジアトリゾアート(メグルミン)、イオデコール、イオジキサノール、イオフラトール、イオグラミド、イオヘキソール、イオメプロール、イオパミドール、イオプロミド、イオトロール、イオベルソール、イオキサグレート、およびメトリザミド、ならびにそれらの混合物で構成される群から選択される、項目15に記載の注射用骨造成組成物。
(項目18)
上記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、リン酸カルシウム、リン酸カルシウムの多形、ヒドロキシアパタイト、炭酸カルシウム、硫酸カルシウム、およびそれらの任意の組み合わせで構成される群から選択される、項目15に記載の注射用骨造成組成物。
(項目19)
上記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、およびリン酸カルシウム、ならびにそれらの混合物で構成される群から選択され、かつ/または該カルシウム塩含有粒子は、Ca/P比が約1.5
〜約2の範囲である、項目18に記載の注射用骨造成組成物。
(項目20)
上記成分(a)中のフィブリンの量は、上記最終凝塊組成物において約5〜約100mg/mlの範囲である、項目15に記載の注射用骨造成組成物。
(項目21)
上記成分(b)中のトロンビンの量は、上記最終凝塊組成物において少なくとも約1IU/mlである、項目15に記載の注射用骨造成組成物。
(項目22)
上記成分(c)中の造影剤の量は、上記最終凝塊組成物において約100〜約800mg/mlの範囲である、項目15に記載の注射用骨造成組成物。
(項目23)
上記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、上記最終凝塊組成物に対して約1〜約50%w/wの範囲である、項目15に記載の注射用骨造成組成物。
(項目24)
上記成分(a)中のフィブリンの量は、上記最終凝塊組成物において約5〜約100mg/mlの範囲であり、上記成分(b)中のトロンビンの量は、該最終凝塊組成物において少なくとも約1IU/mlであり、上記成分(c)に含有される造影剤の量は、該最終凝塊組成物において約100〜約800mg/mlの範囲であり、上記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、該最終凝塊組成物に対して約1〜約50%w/wの範囲である、項目15に記載の注射用骨造成組成物。
(項目25)
上記カルシウム塩含有粒子は、直径が約100μm未満である、項目15に記載の注射用骨造成組成物。
(項目26)
上記カルシウム塩含有粒子は、直径が約50μm未満である、項目25に記載の注射用骨造成組成物。
(項目27)
上記組成物はゲル化または凝塊した状態であり、骨の非石灰化部分または中空部分への注射に適した粘度を有する、項目15に記載の注入骨造成組成物。
(項目28)
骨疾患を患う患者の骨造成法であって、
フィブリンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む組成物を、該骨の非石灰化部分または中空部分に注射する工程を包含する、骨造成法。
(項目29)
上記骨疾患は、椎骨、臀部、および前腕の骨粗しょう症、ならびに良性および悪性病変からなる群から選択される、項目28に記載の骨造成法。
【図面の簡単な説明】
【0011】
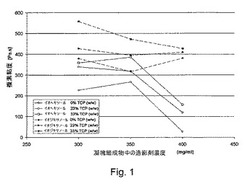
【図1】造影剤の濃度および/または粒子含有量の増加の結果生じた複素粘度の差。
【図2】椎骨(左)および大腿骨頭(右)における局所骨生成を増加するための骨粗しょう症の骨に対する注射用骨造成組成物の注射。
【発明を実施するための形態】
【0012】
(発明の詳細な説明)
本発明の1つの局面は、注射用骨造成組成物の多成分系であって、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、多成分系に関する。
【0013】
本発明の一実施形態によると、上記多成分系の成分(a)〜(d)は溶液中に存在しており、少なくとも成分(a)は、成分(b)と空間的に分離されている。
【0014】
上記注射用骨造成組成物の多成分系は、例えば、骨誘導剤、成長因子、化学療法剤もしくは薬理作用を有する薬剤、生理活性物質、硬化性化合物および/もしくは接着性化合物、ならびに鉱物添加剤等の骨の造成、強化、支持、修復、復元、治癒、または充填に適した任意の他の成分をさらに含んでもよい。これらの化合物は、本発明に係る多成分系の成分(a)〜(d)のいずれかに含有されるか、または特別な成分として含まれてもよい。
【0015】
本発明の一例によると、上記多成分系のフィブリノゲン成分(a)は、例えば、フィブロネクチン、細胞関連タンパク質、他の血漿由来タンパク質(例えば、血液凝固因子XIII(FXIII)およびプロテアーゼ)、およびプロテアーゼ阻害剤、ならびにそれらの混合物等、1つ以上の細胞外基質タンパク質をさらに含んでもよい。本発明に係るフィブリノゲン溶液はまた、例えば、市販のフィブリノゲン溶液等、科学的および/または市販のフィブリノゲン組成物の最新技術に含まれる任意の添加剤を含んでもよい。
【0016】
「フィブリノゲン」という用語は、フィブリノゲン自体だけでなく、フィブリノゲンの凝塊形成誘導体(例えば、「フィブリン1」)等の任意の凝塊形成物質も含む。
【0017】
上記多成分系のフィブリノゲン成分(a)中のフィブリノゲンの量は、例えば、約30〜約150mg/mlまたは約75〜約115mg/ml等、約10〜約200mg/mlの範囲である。
【0018】
本発明に係る多成分系のトロンビン成分(b)は、当該分野で公知の付加的な化合物、ならびに成分(c)および(d)の一方または両方、特に、造影剤成分(c)をさらに含んでもよい。トロンビンの使用量に関しては特に制限はない。本発明の一例では、上記トロンビン成分(b)中のトロンビンの量は、例えば、約30IU/mlの最終凝塊組成物において少なくとも約1IU/mlである。
【0019】
「トロンビン」という用語は、トロンビン自体だけでなく、例えば、生理学的に許容可能なアルカリ性緩衝系等、成分(a)のための任意のゲル化誘導剤または凝塊誘導剤も含む。
【0020】
本明細書で用いる「造影剤」という用語は、蛍光透視法等の分野で公知の撮影用途において本発明に従って使用可能な任意の適切な造影剤を含む。本発明の一実施形態では、上記多成分系の適切な造影剤は浸透圧が低く、フィブリン集合体を適切な程度で発生させることができる。
【0021】
さらに、「造影剤」という用語は、本発明に従って使用可能であるとともに、X線放射物、放射線、赤外線放射物、紫外線放射物、電子もしくは中性子放射物、または磁界もしくは超音波、またはそれらの任意の組み合わせ等の放射物の検出および/または照射により周囲組織と識別可能な全ての化合物を含む。
【0022】
本発明の一例では、本発明に係る多成分系の適切な造影剤は、少なくとも1つのヨウ素含有有機化合物を含む。本発明のさらなる例では、ガドリニウム等の希土類元素を含有する有機化合物を用いることができる。
【0023】
本明細書で用いる「ヨウ素含有有機化合物」という用語は、例えば、共有結合または配位結合等、物理的または化学的に結合した少なくとも1つのヨウ素原子および/またはヨウ素イオンを含有する全ての化合物を含む。同様の定義が上述した希土類元素を含有する有機化合物にも適用される。
【0024】
上記多成分系の適切な造影剤の例としては、ジアトリゾアート(メグルミン)、イオデコール(iodecol)、イオジキサノール、イオフラトール(iofratol)、イオグラミド(iogulamide)、イオヘキソール、イオメプロール、イオパミドール、イオプロミド、イオトロール(iotrol)、イオベルソール、イオキサグレート(ioxaglate)、およびメトリザミドで構成される群から選択されるものがある。
【0025】
本発明の一例によると、成分(c)中のイオジキサノールまたはイオヘキソール等の造影剤の量は、最終凝塊組成物において約150〜約600mg/mlまたは約200〜約400mg/ml等、約100〜約800mg/mlの範囲である。
【0026】
「粒子」という用語は、例えば、球状、角状、または中空状等の当該分野で公知の任意の種類の粒子形状または形態を含む。
【0027】
本発明の一実施形態では、本発明に係る多成分系のカルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、リン酸カルシウム、リン酸カルシウムの多形、ヒドロキシアパタイト、炭酸カルシウム、硫酸カルシウム、およびそれらの組み合わせで構成される群から選択される。例えば、上記カルシウム塩含有粒子は、Ca/P比が約1.5〜約2のリン酸三カルシウム、アルファ−リン酸
三カルシウム、ベータ−リン酸三カルシウム、およびリン酸カルシウムで構成される群から選択される。本発明のカルシウム塩含有粒子は、成分(d)が意味する範囲内で用いられる当該分野で公知の全ての市販化合物および/または混合物をさらに含む。他の例によると、本発明の多成分系のカルシウム塩含有粒子は、直径が約100μm未満(例えば、約50μm未満)である。本発明の1つの具体例では、成分(d)中の粒子の量は、最終凝塊組成物に対して約10〜約45%w/wまたは約30〜40%w/w等、約1〜約50%w/wの範囲である。
【0028】
本発明の一実施形態によると、上記多成分系の成分(a)中のフィブリノゲンの量は、約10〜約200mg/mlの範囲であり、成分(b)中のトロンビンの量は、最終凝塊組成物において少なくとも約1IU/mlであり、成分(c)に含有される造影剤の量は、最終凝塊組成物において約100〜約800mg/mlの範囲であり、成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、最終凝塊組成物に対して約1〜約50%w/wの範囲である。
【0029】
本発明の一具体例によると、上記多成分系の成分(a)中のフィブリノゲンの量は、約75〜約115mg/mlの範囲であり、成分(b)中のトロンビンの量は、最終凝塊組成物において約25IU/ml〜約50IU/mlの範囲であり、成分(c)に含有される造影剤の量は、最終凝塊組成物において約300〜約500mg/mlの範囲であり、成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、最終凝塊組成物に対して約30〜約40%w/wの範囲である。
【0030】
本発明の他の実施形態では、注射用骨造成組成物の多成分系は、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、を含み、
成分(a)〜(d)の1つ以上または全ては、固体状で存在する。
【0031】
本発明に係る多成分系は、例えば、リオフィリセート(lyophilisate)等の溶液もしくは分散液または固体の形態を有する成分またはそれらの任意の組み合わせを含有してもよい。さらに、上記多成分系中の成分は、上記多成分系の貯蔵、輸送、または使用に適した容器内に存在してもよい。本発明に係る多成分系で使用可能な容器は特に限定されておらず、例えば、バイアルまたは注射器等、任意のサイズ、材料、または形状の容器を含む。
【0032】
さらに、上記多成分系の成分は、例えば、異なる容器に入れられるか、または同じ容器内において任意の組み合わせで存在してもよい(例えば、成分(b)と成分(c)の組み合わせを1つの容器に入れる、成分(a)および成分(d)をそれぞれ異なる容器に入れる)。
【0033】
本発明によると、上記容器には、例えば、1つ以上の固体成分、および上記容器内において分離手段により当該成分から分離した溶媒を入れてもよく、上記1つ以上の成分のそれぞれの溶液は、上記分離手段を壊すかまたは取り外すことにより調製することができる。本発明の多成分系の成分(a)〜(d)はまた、すぐに使用可能な混合物として存在してもよい。
【0034】
さらに、上記1つ以上の容器に存在する成分(a)〜(d)はまた、上記多成分系を含むキットの一部であってもよい。このキットは、例えば、補助剤、緩衝塩、または緩衝液等、本発明の多成分系において使用可能な任意の付加的な化合物をさらに含んでもよい。上記キットはまた、例えば、注射器、ルアーアダプター、チューブ、予備の容器等、上記成分を混合する手段を含んでもよい。
【0035】
本発明の他の局面は、注射用骨造成組成物であって、
フィブリンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、注射用骨造成組成物に関する。
【0036】
本発明の一例によると、上記注射用骨造成組成物は、例えば、上記多成分系の成分を混合することおよび/またはそれらの成分を均質化することによって、上記多成分系から調製される。上記注射用骨造成組成物の調製は、例えば、約18〜約37℃の範囲の任意の適切な温度(例えば、25℃)で行うことができる。
【0037】
さらに、上記注射用骨造成組成物は、例えば、骨誘導剤、成長因子、化学療法剤もしくは薬理作用を有する薬剤、生理活性物質、硬化性化合物および/または接着性化合物、ならびに鉱物添加剤等、骨を造成、強化、支持、修復、復元、治癒、または充填するために適した任意の他の成分をさらに含んでもよい。これらの化合物および/または薬剤は、基質と化学的に結合させるか、例えば、カルシウム含有粒子等の粒子成分上に吸着させるか、フィブリン基質中に捕捉させるか、または自由分子/薬物粒子(例えば、粉末)内に含有することができる。
【0038】
本発明に係る注射用骨造成組成物の成分(b)〜(d)は、上記特徴を有する多成分系について定義したものと同じである。
【0039】
「フィブリン」という用語は、完全に凝固したフィブリノゲンを意味するだけでなく、トロンビンを用いたフィブリノゲンからのフィブリン形成時に発生し得るフィブリンとフィブリノゲンのあらゆる混合物をさらに含むため、骨の非石灰化部分または中空部分に注射される最終組成物に悪影響を与えない限り、考え得るあらゆる割合のフィブリノゲン/フィブリンならびにあらゆる度合いのゲルおよび/または凝塊を含む。本発明の注射用骨造成組成物のフィブリン成分(a)は、ごく少量のフィブリノゲンを有するフィブリン、またはフィブリノゲンが全く残っていない状態のフィブリンをさらに含む。また、「フィブリン」という用語は、上記成分(a)が部分的または完全にゲル化または凝塊した形態をさらに含む。
【0040】
本発明の一例によると、上記注射用骨造成組成物のフィブリン成分(a)中のフィブリンの量は、最終凝塊組成物において約15〜65mg/mlまたは約30〜65mg/ml等、約5〜約100mg/mlの範囲である。
【0041】
他の例によると、本発明の注射用骨造成組成物のフィブリン成分(a)中のフィブリンの量は、最終凝塊組成物において約5〜約100mg/mlの範囲であり、トロンビン成分(b)中のトロンビンの量は、最終凝塊組成物において少なくとも約1IU/mlであり、造影剤成分(c)に含有される造影剤の量は、最終凝塊組成物において約100〜約800mg/mlの範囲であり、成分(d)中の少なくとも1つのカルシウム塩含有粒子の量は、最終凝塊組成物に対して約1〜約50%w/wの範囲である。
【0042】
本発明によると、上記注射用骨造成組成物はゲル化または凝塊した状態であり、骨の非石灰化部分または中空部分への注射に適した粘度を有し、凝塊していない液体の状態、ゲル化した状態、または凝塊の状態で適用してもよい。
【0043】
本明細書で用いる「ゲル化」という用語は、初期状態と比較して粘度が上昇したあらゆる状態を意味する。これは、例えば、フィブリノゲンからのフィブリン形成において、または少なくとも1つの固相および少なくとも1つの液相の微細分散した系(例えば、コロイド)において見ることができる。さらに、「ゲル化」という用語は、当該分野で公知の全てのゲル化状態を含む。
【0044】
「凝塊」という用語は、例えば、フィブリンを含むゲルを意味し、当該分野で公知のあらゆる種類の凝固状態を含む。
【0045】
本発明によると、注射用組成物の粘度は、用途、すなわち、治療する骨疾患に依存し、当業者の常識の範囲内で調節される。例えば、骨嚢胞に充填する注射用組成物は、より少量のフィブリンおよび/またはより少量のカルシウム塩含有粒子を含有する。骨の非石灰化部分と置換するための注射用組成物は、より多量のフィブリンおよび/またはより多量のカルシウム塩含有粒子を含有する。
【0046】
本発明の他の局面は、骨疾患を患う患者の骨造成法であって、上記特徴を有する注射用骨造成組成物を上記骨の非石灰化部分または中空部分に注射する工程を包含する方法に関する。
【0047】
本明細書で用いる「患者」という用語は骨疾患を患う対象を意味し、哺乳類、特に、ヒトを含む。
【0048】
上記骨造成法は特定の治療法に限定されず、例えば、経皮注射等、あらゆる種類の注射技術を含む。本発明の一具体例によると、上記骨造成法は経皮的脊椎造成であり、椎体形成術および亀背形成術を含む。
【0049】
さらに、本発明に係る骨造成法は、骨(例えば、骨疾患を患うヒトの骨)の強化、支持、修復、復元、治癒、または充填に用いることができる。
【0050】
そのような骨疾患の例としては、例えば、椎骨、臀部、および前腕等の骨粗しょう症、または良性および悪性病変がある。
【0051】
本発明に係る注射用骨造成組成物は、骨の非石灰化部分または中空部分への注射を可能にする一方で、蛍光透視法等、各種の撮影法により施術を監視することができる点で極めて有利である。このことにより、外科医/医師は、注射した組成物が正しい位置にあることの確認を効果的に行うことができるため、患者の血流に対する組成物の漏出等の重大な問題が有利に回避される。さらに、フィブリン系組成物にカルシウム塩含有粒子を加えることにより、当該組成物に含有される造影剤により得られるコントラストが極めて高くなり、当該造影剤の含有量を有利に低減することができる。この組成物の他の有益な特徴は、最終凝塊組成物の非常に有利な生分解性、取扱の容易さを含み、特に、多成分系の形態では、長期的な貯蔵安定性および高い入手可能性を含む。
【0052】
下記の実施例において限定することなく本発明をさらに説明する。
【実施例】
【0053】
実施例1:ヨウ素化造影剤および粒子を含有する凝塊の調製
材料:
フィブリンシーラント溶液
凍結乾燥したフィブリノゲン粉末をアプロチニン溶液を用いて91mg/mlの全凝固性タンパク質濃度に還元したもの。
【0054】
イオジキサノール
5−[アセチル−[3−[アセチル−[3,5−ビス(2,3−ジヒドロキシプロピルカルバモイル)−2,4,6−トリヨード−フェニル]−アミノ]−2−ヒドロキシ−プロピル]−アミノ]−N,N’−ビス(2,3−ジヒドロキシプロピル)−2,4,6−トリヨード−ベンゼン−1,3−ジカルボキサミド
イオヘキソール
5−(アセチル−(2,3−ジヒドロキシプロピル)アミノ)−N,N’−ビス(2,3−ジヒドロキシプロピル)−2,4,6−トリヨード−ベンゼン−1,3−ジカルボキサミド
粒子
リン酸三カルシウム粒子(TCP)、35μm、球状(Plasma Biotal,Derby UK)
トロンビン500IU/ml
凍結乾燥したトロンビン粉末を5mlのトロンビン緩衝液を用いて500IU/mlの濃度に還元したもの。
【0055】
トロンビン緩衝液
40mMのCaCl2水溶液
80%または60%造影剤(イオジキサノールまたはイオヘキソール)および75IU
/mlトロンビン溶液をトロンビン希釈用緩衝液(40mMのCaCl2再蒸留水溶液)中で調製する。次いで、この溶液を均質化する。この溶液を遠心分離機にかけ泡を除去し、0.22μmフィルタで濾過して滅菌する。このフィブリノゲンをトロンビン/造影剤
(CA)と1:1の割合で混合する(このため、ゲル塊中のCA濃度は40または30%に半減する)。このため、2mlのトロンビン/造影剤溶液を5ml注射器に移す。2mlのフィブリノゲン(91mg/ml)を別の5ml注射器に移す。上記粒子(2μm程度)を最終的な凝塊の重量対容量百分率濃度(w/v)で取り込む。これらを重量測定し、別の5ml注射器に入れる。
【0056】
粒子およびトロンビンを入れた注射器をルアーアダプターを介して連結し、内容物を注射器から注射器に完全に移してトロンビン/CAおよび粒子を均質化する。
【0057】
トロンビン/CA/粒子およびフィブリノゲンを入れた注射器をルアーアダプターを介して連結し、その内容物を均質化する。
【0058】
この時、上記材料は、1分程度の間液体の状態で維持され、欠損部位に注射することができるか、または、代替的には、2、3分後に、既製のゲルとして送達することができる。
【0059】
異なる濃度の造影剤およびTCPのそれぞれの凝塊の粘度については、図1から読み取ることができる。
【0060】
実施例2:造影剤が存在する場合および存在しない場合のフィブリン塊の機械的性質
ヨウ素化造影剤および粒子を含有する凝塊を実施例1に記載のとおりに調製する。これらの凝塊をマルチウェルプレートのウェルに入れた後、それらをゲルにする。それらの凝塊をウェルから取り出した後、汎用機械試験システムを用いてそれらの機械的性質を圧迫状態で検査する。
【0061】
目視検査では、実施例1に従って調製した正常なフィブリン塊とCA塊間に大きな相違がある。造影剤を含有する凝塊は透明で透き通っているが、通常のフィブリン塊は白色で不透明である。通常のフィブリン塊と同様に、CA塊は、軽く混ぜ合わせた後モールドに注入してゲル状にすることができる。この処理中に通常の凝塊とCA塊の相違を観察することができる。通常の凝塊は、モールドから回収する際に傷がつき、崩壊して緩衝液を漏出し易い。CA塊は原形を維持し、より力を入れて扱うことができる。これらの材料はまた弾性を示すが、これは、密閉しない一軸圧縮試験を用いて実証されている。この試験では、通常の凝塊は、応力が増大し始める前に80%程度の歪みが生じる。応力が上昇する時点で、凝塊は、完全に押し潰される寸前の状態となり、緩衝液が押し出される。反対に、CA塊ははるかに固く、20%歪んだ後に応力の増大を示し始め(すなわち、これらを圧縮するためには、より大きな力が必要である)、この応力は塊が破断するまで上昇し続ける。破断前の任意の時点で応力がなくなると、この凝塊は、回復不能に損傷する通常の凝塊とは異なり、元の形状に戻る。「ゲル化」の時間を長くすることで、凝塊はさらに弾力性を有するようになり破断しなくなることも観察されている。このため、多くの場合には、蓄積エネルギーが増加して凝塊がインストロン(Instron)(機械試験機)から排出され、実験を停止しなければならなくなる。
【0062】
実施例3:注射用骨造成組成物の適用
骨粗しょう症および加齢による骨塩量の低下により椎骨および大腿骨頭が骨折する場合が多くある。これらの部位に本発明に係る注射用骨造成組成物を注射することは、そのような負傷の治療に役立つ。注射用骨造成組成物の製剤は、実施例1に概説するように調製される。
【0063】
蛍光透視法(Cアーム)において、経椎弓根アプローチを用いて椎体形成術用套管針(直径:3.2mm(10G)または1.8mm(15G)、長さ100または150mm)
をそれぞれヒト死体の椎骨および大腿骨頭に配置する。
【0064】
造影剤含有トロンビン溶液にTCPを加え、それら2つの成分を前後に往復(約20回)させて均質化する。
【0065】
TCPおよび造影剤を含有するトロンビン溶液とフィブリノゲン溶液を、連結した2つの注射器内で前後に6回程度往復させて混合する。ゲル化した後、その材料(9ml程度)を椎体形成術用銃(Optimed Cemento RE)の銃身に込める。
【0066】
この銃と套管針とを(間にチューブを介することなく)直接接続し、上記材料を銃から搾り出して椎骨および大腿骨頭のそれぞれに適用する。この手順を行う際
に写真を撮影した(図2参照)。
【0067】
実施例4:ヒツジにおける注射用骨造成組成物のインビボ検査
頸骨幹の内筋膜(medial fascia)を切除し、頸骨を露出させる。プレートを骨幹に合った形状にして、スクリューを用いて骨に固定する。このプレートを再度取り外し、規格化された1cm全層欠損部位を作る。この部分を除去し、プレートを再度配置して、スクリューを再度挿入する。その後、注射用骨造成組成物を欠損部位に充填し、縫合糸で傷を閉じる。
【0068】
それらの動物を4週間、8週間、および12週間継続して検査する(X線評価)。12週目の時点で、それらの動物を屠殺し、最終分析のために頸骨を摘出する(μCTおよび組織像)。
【0069】
造影剤は、骨内部の凝塊の医療効果に対して悪影響を及ぼさなかった。
【技術分野】
【0001】
(発明の分野)
本発明は、フィブリン、造影剤、およびカルシウム塩含有粒子を含む骨造成のための生分解性注射用組成物、ならびに骨疾患を患う患者の骨造成法であって、当該骨の非石灰化部分または中空部分に当該組成物を注射する工程を包含する方法に関する。
【背景技術】
【0002】
(発明の背景)
例えば、経皮的骨造成は、下記の適応症に用いられてきた椎体形成技術および亀背形成技術を含む:有痛性血管腫、骨粗しょう症性圧迫骨折、外傷性圧迫骨折、および有痛性脊椎転移。一例としては、ポリメタクリル酸メチル(PMMA)骨セメントの経皮的送達による骨折した椎体の修復が挙げられる。この治療は、椎骨の鎮痛および高さの回復に有効である。蛍光透視法を用いて標的とする椎骨を特定し、椎体内に套管針を入れる。PMMAは、椎体の片側(一方向)または両側(双方向)に送達可能であり、蛍光透視法を用いてこの送達を監視し、セメントが漏出または移動することなく確実にボーラス形状を留めるようにする。
【0003】
この技術の問題点にはPMMAの漏出が含まれる。これは、傍脊椎漏出、静脈浸潤、硬膜外漏出、および椎間板内漏出となる可能性がある(Truckai C.,Shadduck J.H.,2006、特許文献1)。漏出の結果、(さらなる外科処置を必要とする)隣接臓器の圧迫および/または塞栓症を含む非常に重篤な合併症が生じる場合がある。最近の研究では、PMMAと自然骨間の不均衡な力によりPMMA処置部に隣接する椎骨の二次骨折が増加することも立証されている(非特許文献1)。
【0004】
この技術のさらなる問題点は、硬膜嚢、骨髄、および神経根に及ぶ熱壊死の潜在的な原因となり得るPMMAの高発熱性である。この発熱性はまた、PMMAが任意の薬理学的薬剤または化学療法剤を取り込む能力を制限する。PMMAはまた、再吸収不可能な物質であり、未反応、未重合、および低分子量化学物質の浸出が可能である。この技術については、PMMAセメントに蛍光造影剤(通常、硫酸バリウム)を取り込むことにより蛍光
透視鏡の送達を容易にしている。骨および接着特性に対する硫酸バリウムの長期効果は完全には知られていない。
【0005】
PMMAの粘度も重要なパラメータである。これは、注射を可能にする程度に十分に低く、かつ血管系内に押し込まれない程度に十分に高くなければならない。粘度は時間とともに高くなり、臨床医が施術を行うとともに針を取り除くために与えられる時間は10分程度である。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】米国特許出願公開第2006/089715号明細書
【非特許文献】
【0007】
【非特許文献1】Trout A.T.,Kallmes D.F.,Kaufmann T.J.,Journal of Neuroradiology,2006,27:217〜223
【発明の概要】
【発明が解決しようとする課題】
【0008】
(発明の要旨)
このため、上述した欠点を克服する注射用骨造成組成物に対する強い要望が存在する。
【0009】
従って、本発明の目的は、椎体形成術および亀背形成術等における骨造成のための新規な注射用組成物を提供することである。
【課題を解決するための手段】
【0010】
本発明は、注射が可能で、完全に再吸収可能な(すなわち、生物学的に分解可能な)細孔性のフィブリン基質に関する。本発明の材料は実質的に発熱性を有さず、エラストマーにおいて通常見られる機械的性質を示し、フィブリン単独よりも機械的に優れている。適切な造影剤を組み込むことにより適度な放射物不透性が得られ、粒子状物質を組み込むことにより粘度が得られるかまたは調節される。PMMAとは異なり、ある実施形態では、本発明の出発材料は急速にゲル化し、ごくわずかな待ち時間で送達を行うことができる。この技術の完了時間に上限はないが、材料の送達時間に余裕ができる。
本発明はまた、以下の項目を提供する。
(項目1)
注射用骨造成組成物の多成分系であって、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、多成分系。
(項目2)
上記成分(a)〜(d)は溶液中に存在しており、少なくとも成分(a)は、成分(b)と空間的に分離されている、項目1に記載の多成分系。
(項目3)
上記造影剤は、少なくとも1つのヨウ素含有有機化合物を含む、項目1に記載の多成分系。
(項目4)
上記造影剤は、ジアトリゾアート(メグルミン)、イオデコール、イオジキサノール、イオフラトール、イオグラミド、イオヘキソール、イオメプロール、イオパミドール、イオプロミド、イオトロール、イオベルソール、イオキサグレート、およびメトリザミド、ならびにそれらの混合物で構成される群から選択される、項目3に記載の多成分系。
(項目5)
上記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、リン酸カルシウム、リン酸カルシウムの多形、ヒドロキシアパタイト、炭酸カルシウム、硫酸カルシウム、およびそれらの任意の組み合わせで構成される群から選択される、項目1に記載の多成分系。
(項目6)
上記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、およびリン酸カルシウム、ならびにそれらの混合物で構成される群から選択され、かつ/または該カルシウム塩含有粒子は、Ca/P比が約1.5
〜約2の範囲である、項目5に記載の多成分系。
(項目7)
上記フィブリノゲン成分(a)中のフィブリノゲンの量は、約10〜約200mg/mlの範囲である、項目1に記載の多成分系。
(項目8)
上記トロンビン成分(b)中のトロンビンの量は、最終凝塊組成物において少なくとも約1IU/mlである、項目1に記載の多成分系。
(項目9)
上記成分(c)中の造影剤の量は、最終凝塊組成物において約100〜約800mg/mlの範囲である、項目1に記載の多成分系。
(項目10)
上記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、上記最終凝塊組成物に対して約1〜約50%w/wの範囲である、項目1に記載の多成分系。
(項目11)
上記成分(a)中のフィブリノゲンの量は、約10〜約200mg/mlの範囲であり、上記成分(b)中のトロンビンの量は、上記最終凝塊組成物において少なくとも約1IU/mlであり、上記成分(c)に含有される造影剤の量は、該最終凝塊組成物において約100〜約800mg/mlの範囲であり、上記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、該最終凝塊組成物に対して約1〜約50%w/wの範囲である、項目1に記載の多成分系。
(項目12)
上記カルシウム塩含有粒子は、直径が約100μm未満である、項目1に記載の多成分系。
(項目13)
上記カルシウム塩含有粒子は、直径が約50μm未満である、項目12に記載の多成分系。
(項目14)
注射用骨造成組成物の多成分系であって、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、を含み、
該成分(a)〜(d)の1つ以上または全ては、固体状で存在する、多成分系。
(項目15)
注射用骨造成組成物であって、
フィブリンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、組成物。
(項目16)
上記造影剤は、少なくとも1つのヨウ素含有有機化合物を含む、項目15に記載の注射用骨造成組成物。
(項目17)
上記適切な造影剤は、ジアトリゾアート(メグルミン)、イオデコール、イオジキサノール、イオフラトール、イオグラミド、イオヘキソール、イオメプロール、イオパミドール、イオプロミド、イオトロール、イオベルソール、イオキサグレート、およびメトリザミド、ならびにそれらの混合物で構成される群から選択される、項目15に記載の注射用骨造成組成物。
(項目18)
上記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、リン酸カルシウム、リン酸カルシウムの多形、ヒドロキシアパタイト、炭酸カルシウム、硫酸カルシウム、およびそれらの任意の組み合わせで構成される群から選択される、項目15に記載の注射用骨造成組成物。
(項目19)
上記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、およびリン酸カルシウム、ならびにそれらの混合物で構成される群から選択され、かつ/または該カルシウム塩含有粒子は、Ca/P比が約1.5
〜約2の範囲である、項目18に記載の注射用骨造成組成物。
(項目20)
上記成分(a)中のフィブリンの量は、上記最終凝塊組成物において約5〜約100mg/mlの範囲である、項目15に記載の注射用骨造成組成物。
(項目21)
上記成分(b)中のトロンビンの量は、上記最終凝塊組成物において少なくとも約1IU/mlである、項目15に記載の注射用骨造成組成物。
(項目22)
上記成分(c)中の造影剤の量は、上記最終凝塊組成物において約100〜約800mg/mlの範囲である、項目15に記載の注射用骨造成組成物。
(項目23)
上記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、上記最終凝塊組成物に対して約1〜約50%w/wの範囲である、項目15に記載の注射用骨造成組成物。
(項目24)
上記成分(a)中のフィブリンの量は、上記最終凝塊組成物において約5〜約100mg/mlの範囲であり、上記成分(b)中のトロンビンの量は、該最終凝塊組成物において少なくとも約1IU/mlであり、上記成分(c)に含有される造影剤の量は、該最終凝塊組成物において約100〜約800mg/mlの範囲であり、上記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、該最終凝塊組成物に対して約1〜約50%w/wの範囲である、項目15に記載の注射用骨造成組成物。
(項目25)
上記カルシウム塩含有粒子は、直径が約100μm未満である、項目15に記載の注射用骨造成組成物。
(項目26)
上記カルシウム塩含有粒子は、直径が約50μm未満である、項目25に記載の注射用骨造成組成物。
(項目27)
上記組成物はゲル化または凝塊した状態であり、骨の非石灰化部分または中空部分への注射に適した粘度を有する、項目15に記載の注入骨造成組成物。
(項目28)
骨疾患を患う患者の骨造成法であって、
フィブリンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む組成物を、該骨の非石灰化部分または中空部分に注射する工程を包含する、骨造成法。
(項目29)
上記骨疾患は、椎骨、臀部、および前腕の骨粗しょう症、ならびに良性および悪性病変からなる群から選択される、項目28に記載の骨造成法。
【図面の簡単な説明】
【0011】
【図1】造影剤の濃度および/または粒子含有量の増加の結果生じた複素粘度の差。
【図2】椎骨(左)および大腿骨頭(右)における局所骨生成を増加するための骨粗しょう症の骨に対する注射用骨造成組成物の注射。
【発明を実施するための形態】
【0012】
(発明の詳細な説明)
本発明の1つの局面は、注射用骨造成組成物の多成分系であって、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、多成分系に関する。
【0013】
本発明の一実施形態によると、上記多成分系の成分(a)〜(d)は溶液中に存在しており、少なくとも成分(a)は、成分(b)と空間的に分離されている。
【0014】
上記注射用骨造成組成物の多成分系は、例えば、骨誘導剤、成長因子、化学療法剤もしくは薬理作用を有する薬剤、生理活性物質、硬化性化合物および/もしくは接着性化合物、ならびに鉱物添加剤等の骨の造成、強化、支持、修復、復元、治癒、または充填に適した任意の他の成分をさらに含んでもよい。これらの化合物は、本発明に係る多成分系の成分(a)〜(d)のいずれかに含有されるか、または特別な成分として含まれてもよい。
【0015】
本発明の一例によると、上記多成分系のフィブリノゲン成分(a)は、例えば、フィブロネクチン、細胞関連タンパク質、他の血漿由来タンパク質(例えば、血液凝固因子XIII(FXIII)およびプロテアーゼ)、およびプロテアーゼ阻害剤、ならびにそれらの混合物等、1つ以上の細胞外基質タンパク質をさらに含んでもよい。本発明に係るフィブリノゲン溶液はまた、例えば、市販のフィブリノゲン溶液等、科学的および/または市販のフィブリノゲン組成物の最新技術に含まれる任意の添加剤を含んでもよい。
【0016】
「フィブリノゲン」という用語は、フィブリノゲン自体だけでなく、フィブリノゲンの凝塊形成誘導体(例えば、「フィブリン1」)等の任意の凝塊形成物質も含む。
【0017】
上記多成分系のフィブリノゲン成分(a)中のフィブリノゲンの量は、例えば、約30〜約150mg/mlまたは約75〜約115mg/ml等、約10〜約200mg/mlの範囲である。
【0018】
本発明に係る多成分系のトロンビン成分(b)は、当該分野で公知の付加的な化合物、ならびに成分(c)および(d)の一方または両方、特に、造影剤成分(c)をさらに含んでもよい。トロンビンの使用量に関しては特に制限はない。本発明の一例では、上記トロンビン成分(b)中のトロンビンの量は、例えば、約30IU/mlの最終凝塊組成物において少なくとも約1IU/mlである。
【0019】
「トロンビン」という用語は、トロンビン自体だけでなく、例えば、生理学的に許容可能なアルカリ性緩衝系等、成分(a)のための任意のゲル化誘導剤または凝塊誘導剤も含む。
【0020】
本明細書で用いる「造影剤」という用語は、蛍光透視法等の分野で公知の撮影用途において本発明に従って使用可能な任意の適切な造影剤を含む。本発明の一実施形態では、上記多成分系の適切な造影剤は浸透圧が低く、フィブリン集合体を適切な程度で発生させることができる。
【0021】
さらに、「造影剤」という用語は、本発明に従って使用可能であるとともに、X線放射物、放射線、赤外線放射物、紫外線放射物、電子もしくは中性子放射物、または磁界もしくは超音波、またはそれらの任意の組み合わせ等の放射物の検出および/または照射により周囲組織と識別可能な全ての化合物を含む。
【0022】
本発明の一例では、本発明に係る多成分系の適切な造影剤は、少なくとも1つのヨウ素含有有機化合物を含む。本発明のさらなる例では、ガドリニウム等の希土類元素を含有する有機化合物を用いることができる。
【0023】
本明細書で用いる「ヨウ素含有有機化合物」という用語は、例えば、共有結合または配位結合等、物理的または化学的に結合した少なくとも1つのヨウ素原子および/またはヨウ素イオンを含有する全ての化合物を含む。同様の定義が上述した希土類元素を含有する有機化合物にも適用される。
【0024】
上記多成分系の適切な造影剤の例としては、ジアトリゾアート(メグルミン)、イオデコール(iodecol)、イオジキサノール、イオフラトール(iofratol)、イオグラミド(iogulamide)、イオヘキソール、イオメプロール、イオパミドール、イオプロミド、イオトロール(iotrol)、イオベルソール、イオキサグレート(ioxaglate)、およびメトリザミドで構成される群から選択されるものがある。
【0025】
本発明の一例によると、成分(c)中のイオジキサノールまたはイオヘキソール等の造影剤の量は、最終凝塊組成物において約150〜約600mg/mlまたは約200〜約400mg/ml等、約100〜約800mg/mlの範囲である。
【0026】
「粒子」という用語は、例えば、球状、角状、または中空状等の当該分野で公知の任意の種類の粒子形状または形態を含む。
【0027】
本発明の一実施形態では、本発明に係る多成分系のカルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、リン酸カルシウム、リン酸カルシウムの多形、ヒドロキシアパタイト、炭酸カルシウム、硫酸カルシウム、およびそれらの組み合わせで構成される群から選択される。例えば、上記カルシウム塩含有粒子は、Ca/P比が約1.5〜約2のリン酸三カルシウム、アルファ−リン酸
三カルシウム、ベータ−リン酸三カルシウム、およびリン酸カルシウムで構成される群から選択される。本発明のカルシウム塩含有粒子は、成分(d)が意味する範囲内で用いられる当該分野で公知の全ての市販化合物および/または混合物をさらに含む。他の例によると、本発明の多成分系のカルシウム塩含有粒子は、直径が約100μm未満(例えば、約50μm未満)である。本発明の1つの具体例では、成分(d)中の粒子の量は、最終凝塊組成物に対して約10〜約45%w/wまたは約30〜40%w/w等、約1〜約50%w/wの範囲である。
【0028】
本発明の一実施形態によると、上記多成分系の成分(a)中のフィブリノゲンの量は、約10〜約200mg/mlの範囲であり、成分(b)中のトロンビンの量は、最終凝塊組成物において少なくとも約1IU/mlであり、成分(c)に含有される造影剤の量は、最終凝塊組成物において約100〜約800mg/mlの範囲であり、成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、最終凝塊組成物に対して約1〜約50%w/wの範囲である。
【0029】
本発明の一具体例によると、上記多成分系の成分(a)中のフィブリノゲンの量は、約75〜約115mg/mlの範囲であり、成分(b)中のトロンビンの量は、最終凝塊組成物において約25IU/ml〜約50IU/mlの範囲であり、成分(c)に含有される造影剤の量は、最終凝塊組成物において約300〜約500mg/mlの範囲であり、成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、最終凝塊組成物に対して約30〜約40%w/wの範囲である。
【0030】
本発明の他の実施形態では、注射用骨造成組成物の多成分系は、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、を含み、
成分(a)〜(d)の1つ以上または全ては、固体状で存在する。
【0031】
本発明に係る多成分系は、例えば、リオフィリセート(lyophilisate)等の溶液もしくは分散液または固体の形態を有する成分またはそれらの任意の組み合わせを含有してもよい。さらに、上記多成分系中の成分は、上記多成分系の貯蔵、輸送、または使用に適した容器内に存在してもよい。本発明に係る多成分系で使用可能な容器は特に限定されておらず、例えば、バイアルまたは注射器等、任意のサイズ、材料、または形状の容器を含む。
【0032】
さらに、上記多成分系の成分は、例えば、異なる容器に入れられるか、または同じ容器内において任意の組み合わせで存在してもよい(例えば、成分(b)と成分(c)の組み合わせを1つの容器に入れる、成分(a)および成分(d)をそれぞれ異なる容器に入れる)。
【0033】
本発明によると、上記容器には、例えば、1つ以上の固体成分、および上記容器内において分離手段により当該成分から分離した溶媒を入れてもよく、上記1つ以上の成分のそれぞれの溶液は、上記分離手段を壊すかまたは取り外すことにより調製することができる。本発明の多成分系の成分(a)〜(d)はまた、すぐに使用可能な混合物として存在してもよい。
【0034】
さらに、上記1つ以上の容器に存在する成分(a)〜(d)はまた、上記多成分系を含むキットの一部であってもよい。このキットは、例えば、補助剤、緩衝塩、または緩衝液等、本発明の多成分系において使用可能な任意の付加的な化合物をさらに含んでもよい。上記キットはまた、例えば、注射器、ルアーアダプター、チューブ、予備の容器等、上記成分を混合する手段を含んでもよい。
【0035】
本発明の他の局面は、注射用骨造成組成物であって、
フィブリンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が約200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、注射用骨造成組成物に関する。
【0036】
本発明の一例によると、上記注射用骨造成組成物は、例えば、上記多成分系の成分を混合することおよび/またはそれらの成分を均質化することによって、上記多成分系から調製される。上記注射用骨造成組成物の調製は、例えば、約18〜約37℃の範囲の任意の適切な温度(例えば、25℃)で行うことができる。
【0037】
さらに、上記注射用骨造成組成物は、例えば、骨誘導剤、成長因子、化学療法剤もしくは薬理作用を有する薬剤、生理活性物質、硬化性化合物および/または接着性化合物、ならびに鉱物添加剤等、骨を造成、強化、支持、修復、復元、治癒、または充填するために適した任意の他の成分をさらに含んでもよい。これらの化合物および/または薬剤は、基質と化学的に結合させるか、例えば、カルシウム含有粒子等の粒子成分上に吸着させるか、フィブリン基質中に捕捉させるか、または自由分子/薬物粒子(例えば、粉末)内に含有することができる。
【0038】
本発明に係る注射用骨造成組成物の成分(b)〜(d)は、上記特徴を有する多成分系について定義したものと同じである。
【0039】
「フィブリン」という用語は、完全に凝固したフィブリノゲンを意味するだけでなく、トロンビンを用いたフィブリノゲンからのフィブリン形成時に発生し得るフィブリンとフィブリノゲンのあらゆる混合物をさらに含むため、骨の非石灰化部分または中空部分に注射される最終組成物に悪影響を与えない限り、考え得るあらゆる割合のフィブリノゲン/フィブリンならびにあらゆる度合いのゲルおよび/または凝塊を含む。本発明の注射用骨造成組成物のフィブリン成分(a)は、ごく少量のフィブリノゲンを有するフィブリン、またはフィブリノゲンが全く残っていない状態のフィブリンをさらに含む。また、「フィブリン」という用語は、上記成分(a)が部分的または完全にゲル化または凝塊した形態をさらに含む。
【0040】
本発明の一例によると、上記注射用骨造成組成物のフィブリン成分(a)中のフィブリンの量は、最終凝塊組成物において約15〜65mg/mlまたは約30〜65mg/ml等、約5〜約100mg/mlの範囲である。
【0041】
他の例によると、本発明の注射用骨造成組成物のフィブリン成分(a)中のフィブリンの量は、最終凝塊組成物において約5〜約100mg/mlの範囲であり、トロンビン成分(b)中のトロンビンの量は、最終凝塊組成物において少なくとも約1IU/mlであり、造影剤成分(c)に含有される造影剤の量は、最終凝塊組成物において約100〜約800mg/mlの範囲であり、成分(d)中の少なくとも1つのカルシウム塩含有粒子の量は、最終凝塊組成物に対して約1〜約50%w/wの範囲である。
【0042】
本発明によると、上記注射用骨造成組成物はゲル化または凝塊した状態であり、骨の非石灰化部分または中空部分への注射に適した粘度を有し、凝塊していない液体の状態、ゲル化した状態、または凝塊の状態で適用してもよい。
【0043】
本明細書で用いる「ゲル化」という用語は、初期状態と比較して粘度が上昇したあらゆる状態を意味する。これは、例えば、フィブリノゲンからのフィブリン形成において、または少なくとも1つの固相および少なくとも1つの液相の微細分散した系(例えば、コロイド)において見ることができる。さらに、「ゲル化」という用語は、当該分野で公知の全てのゲル化状態を含む。
【0044】
「凝塊」という用語は、例えば、フィブリンを含むゲルを意味し、当該分野で公知のあらゆる種類の凝固状態を含む。
【0045】
本発明によると、注射用組成物の粘度は、用途、すなわち、治療する骨疾患に依存し、当業者の常識の範囲内で調節される。例えば、骨嚢胞に充填する注射用組成物は、より少量のフィブリンおよび/またはより少量のカルシウム塩含有粒子を含有する。骨の非石灰化部分と置換するための注射用組成物は、より多量のフィブリンおよび/またはより多量のカルシウム塩含有粒子を含有する。
【0046】
本発明の他の局面は、骨疾患を患う患者の骨造成法であって、上記特徴を有する注射用骨造成組成物を上記骨の非石灰化部分または中空部分に注射する工程を包含する方法に関する。
【0047】
本明細書で用いる「患者」という用語は骨疾患を患う対象を意味し、哺乳類、特に、ヒトを含む。
【0048】
上記骨造成法は特定の治療法に限定されず、例えば、経皮注射等、あらゆる種類の注射技術を含む。本発明の一具体例によると、上記骨造成法は経皮的脊椎造成であり、椎体形成術および亀背形成術を含む。
【0049】
さらに、本発明に係る骨造成法は、骨(例えば、骨疾患を患うヒトの骨)の強化、支持、修復、復元、治癒、または充填に用いることができる。
【0050】
そのような骨疾患の例としては、例えば、椎骨、臀部、および前腕等の骨粗しょう症、または良性および悪性病変がある。
【0051】
本発明に係る注射用骨造成組成物は、骨の非石灰化部分または中空部分への注射を可能にする一方で、蛍光透視法等、各種の撮影法により施術を監視することができる点で極めて有利である。このことにより、外科医/医師は、注射した組成物が正しい位置にあることの確認を効果的に行うことができるため、患者の血流に対する組成物の漏出等の重大な問題が有利に回避される。さらに、フィブリン系組成物にカルシウム塩含有粒子を加えることにより、当該組成物に含有される造影剤により得られるコントラストが極めて高くなり、当該造影剤の含有量を有利に低減することができる。この組成物の他の有益な特徴は、最終凝塊組成物の非常に有利な生分解性、取扱の容易さを含み、特に、多成分系の形態では、長期的な貯蔵安定性および高い入手可能性を含む。
【0052】
下記の実施例において限定することなく本発明をさらに説明する。
【実施例】
【0053】
実施例1:ヨウ素化造影剤および粒子を含有する凝塊の調製
材料:
フィブリンシーラント溶液
凍結乾燥したフィブリノゲン粉末をアプロチニン溶液を用いて91mg/mlの全凝固性タンパク質濃度に還元したもの。
【0054】
イオジキサノール
5−[アセチル−[3−[アセチル−[3,5−ビス(2,3−ジヒドロキシプロピルカルバモイル)−2,4,6−トリヨード−フェニル]−アミノ]−2−ヒドロキシ−プロピル]−アミノ]−N,N’−ビス(2,3−ジヒドロキシプロピル)−2,4,6−トリヨード−ベンゼン−1,3−ジカルボキサミド
イオヘキソール
5−(アセチル−(2,3−ジヒドロキシプロピル)アミノ)−N,N’−ビス(2,3−ジヒドロキシプロピル)−2,4,6−トリヨード−ベンゼン−1,3−ジカルボキサミド
粒子
リン酸三カルシウム粒子(TCP)、35μm、球状(Plasma Biotal,Derby UK)
トロンビン500IU/ml
凍結乾燥したトロンビン粉末を5mlのトロンビン緩衝液を用いて500IU/mlの濃度に還元したもの。
【0055】
トロンビン緩衝液
40mMのCaCl2水溶液
80%または60%造影剤(イオジキサノールまたはイオヘキソール)および75IU
/mlトロンビン溶液をトロンビン希釈用緩衝液(40mMのCaCl2再蒸留水溶液)中で調製する。次いで、この溶液を均質化する。この溶液を遠心分離機にかけ泡を除去し、0.22μmフィルタで濾過して滅菌する。このフィブリノゲンをトロンビン/造影剤
(CA)と1:1の割合で混合する(このため、ゲル塊中のCA濃度は40または30%に半減する)。このため、2mlのトロンビン/造影剤溶液を5ml注射器に移す。2mlのフィブリノゲン(91mg/ml)を別の5ml注射器に移す。上記粒子(2μm程度)を最終的な凝塊の重量対容量百分率濃度(w/v)で取り込む。これらを重量測定し、別の5ml注射器に入れる。
【0056】
粒子およびトロンビンを入れた注射器をルアーアダプターを介して連結し、内容物を注射器から注射器に完全に移してトロンビン/CAおよび粒子を均質化する。
【0057】
トロンビン/CA/粒子およびフィブリノゲンを入れた注射器をルアーアダプターを介して連結し、その内容物を均質化する。
【0058】
この時、上記材料は、1分程度の間液体の状態で維持され、欠損部位に注射することができるか、または、代替的には、2、3分後に、既製のゲルとして送達することができる。
【0059】
異なる濃度の造影剤およびTCPのそれぞれの凝塊の粘度については、図1から読み取ることができる。
【0060】
実施例2:造影剤が存在する場合および存在しない場合のフィブリン塊の機械的性質
ヨウ素化造影剤および粒子を含有する凝塊を実施例1に記載のとおりに調製する。これらの凝塊をマルチウェルプレートのウェルに入れた後、それらをゲルにする。それらの凝塊をウェルから取り出した後、汎用機械試験システムを用いてそれらの機械的性質を圧迫状態で検査する。
【0061】
目視検査では、実施例1に従って調製した正常なフィブリン塊とCA塊間に大きな相違がある。造影剤を含有する凝塊は透明で透き通っているが、通常のフィブリン塊は白色で不透明である。通常のフィブリン塊と同様に、CA塊は、軽く混ぜ合わせた後モールドに注入してゲル状にすることができる。この処理中に通常の凝塊とCA塊の相違を観察することができる。通常の凝塊は、モールドから回収する際に傷がつき、崩壊して緩衝液を漏出し易い。CA塊は原形を維持し、より力を入れて扱うことができる。これらの材料はまた弾性を示すが、これは、密閉しない一軸圧縮試験を用いて実証されている。この試験では、通常の凝塊は、応力が増大し始める前に80%程度の歪みが生じる。応力が上昇する時点で、凝塊は、完全に押し潰される寸前の状態となり、緩衝液が押し出される。反対に、CA塊ははるかに固く、20%歪んだ後に応力の増大を示し始め(すなわち、これらを圧縮するためには、より大きな力が必要である)、この応力は塊が破断するまで上昇し続ける。破断前の任意の時点で応力がなくなると、この凝塊は、回復不能に損傷する通常の凝塊とは異なり、元の形状に戻る。「ゲル化」の時間を長くすることで、凝塊はさらに弾力性を有するようになり破断しなくなることも観察されている。このため、多くの場合には、蓄積エネルギーが増加して凝塊がインストロン(Instron)(機械試験機)から排出され、実験を停止しなければならなくなる。
【0062】
実施例3:注射用骨造成組成物の適用
骨粗しょう症および加齢による骨塩量の低下により椎骨および大腿骨頭が骨折する場合が多くある。これらの部位に本発明に係る注射用骨造成組成物を注射することは、そのような負傷の治療に役立つ。注射用骨造成組成物の製剤は、実施例1に概説するように調製される。
【0063】
蛍光透視法(Cアーム)において、経椎弓根アプローチを用いて椎体形成術用套管針(直径:3.2mm(10G)または1.8mm(15G)、長さ100または150mm)
をそれぞれヒト死体の椎骨および大腿骨頭に配置する。
【0064】
造影剤含有トロンビン溶液にTCPを加え、それら2つの成分を前後に往復(約20回)させて均質化する。
【0065】
TCPおよび造影剤を含有するトロンビン溶液とフィブリノゲン溶液を、連結した2つの注射器内で前後に6回程度往復させて混合する。ゲル化した後、その材料(9ml程度)を椎体形成術用銃(Optimed Cemento RE)の銃身に込める。
【0066】
この銃と套管針とを(間にチューブを介することなく)直接接続し、上記材料を銃から搾り出して椎骨および大腿骨頭のそれぞれに適用する。この手順を行う際
に写真を撮影した(図2参照)。
【0067】
実施例4:ヒツジにおける注射用骨造成組成物のインビボ検査
頸骨幹の内筋膜(medial fascia)を切除し、頸骨を露出させる。プレートを骨幹に合った形状にして、スクリューを用いて骨に固定する。このプレートを再度取り外し、規格化された1cm全層欠損部位を作る。この部分を除去し、プレートを再度配置して、スクリューを再度挿入する。その後、注射用骨造成組成物を欠損部位に充填し、縫合糸で傷を閉じる。
【0068】
それらの動物を4週間、8週間、および12週間継続して検査する(X線評価)。12週目の時点で、それらの動物を屠殺し、最終分析のために頸骨を摘出する(μCTおよび組織像)。
【0069】
造影剤は、骨内部の凝塊の医療効果に対して悪影響を及ぼさなかった。
【特許請求の範囲】
【請求項1】
注射用骨造成組成物のための多成分系であって、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、多成分系。
【請求項2】
注射用骨造成組成物であって、
フィブリンを含む成分(a’)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、組成物。
【請求項3】
前記成分(a)〜(d)は溶液中に存在しており、少なくとも成分(a)は、成分(b)と空間的に分離されている、請求項1に記載の多成分系。
【請求項4】
前記フィブリノゲン成分(a)中のフィブリノゲンの量は、10〜200mg/mlの範囲である、請求項1に記載の多成分系。
【請求項5】
前記トロンビン成分(b)中のトロンビンの量は、最終凝塊組成物において少なくとも1IU/mlである、請求項1に記載の多成分系。
【請求項6】
前記成分(c)中の造影剤の量は、最終凝塊組成物において100〜800mg/mlの範囲である、請求項1に記載の多成分系。
【請求項7】
前記成分(a)〜(d)の1つまたは複数または全ては、固体状で存在する、請求項1に記載の多成分系。
【請求項8】
前記造影剤は、少なくとも1つのヨウ素含有有機化合物を含む、請求項1に記載の多成分系または請求項2に記載の注射用骨造成組成物。
【請求項9】
前記造影剤は、ジアトリゾアート(メグルミン)、イオデコール、イオジキサノール、イオフラトール、イオグラミド、イオヘキソール、イオメプロール、イオパミドール、イオプロミド、イオトロール、イオベルソール、イオキサグレート、およびメトリザミド、ならびにそれらの混合物で構成される群から選択される、請求項8に記載の多成分系または注射用骨造成組成物。
【請求項10】
前記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、リン酸カルシウム、リン酸カルシウムの多形、ヒドロキシアパタイト、炭酸カルシウム、硫酸カルシウム、およびそれらの任意の組み合わせで構成される群から選択される、請求項1に記載の多成分系または請求項2に記載の注射用骨造成組成物。
【請求項11】
前記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、およびリン酸カルシウム、ならびにそれらの混合物で構成される群から選択され、かつ/または該カルシウム塩含有粒子は、Ca/P比が1.5〜2の範囲である、請求項10に記載の多成分系または注射用骨造成組成物。
【請求項12】
前記成分(a)中のフィブリンの量は、前記最終凝塊組成物において5〜100mg/mlの範囲である、請求項2に記載の注射用骨造成組成物。
【請求項13】
前記成分(b)中のトロンビンの量は、前記最終凝塊組成物において少なくとも1IU/mlである、請求項2に記載の注射用骨造成組成物。
【請求項14】
前記成分(c)中の造影剤の量は、前記最終凝塊組成物において100〜800mg/mlの範囲である、請求項2に記載の注射用骨造成組成物。
【請求項15】
前記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、前記最終凝塊組成物に対して1〜50%w/wの範囲である、請求項1に記載の多成分系または請求項2に記載の注射用骨造成組成物。
【請求項16】
前記カルシウム塩含有粒子は、直径が100μm未満である、請求項1に記載の多成分系または請求項2に記載の注射用骨造成組成物。
【請求項17】
前記カルシウム塩含有粒子は、直径が50μm未満である、請求項16に記載の多成分系または注射用骨造成組成物。
【請求項18】
前記組成物はゲル化または凝塊した状態であり、骨の非石灰化部分または中空部分への注射に適した粘度を有する、請求項2に記載の注入骨造成組成物。
【請求項19】
骨疾患を患う患者の骨造成用組成物であって、
フィブリンを含む成分(a’)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含み、該組成物は、該骨の非石灰化部分または中空部分に注射されるものであることを特徴とする、骨造成用組成物。
【請求項20】
前記骨疾患は、椎骨、臀部、および前腕の骨粗しょう症、ならびに良性および悪性病変からなる群から選択される、請求項19に記載の骨造成用組成物。
【請求項21】
明細書中に記載の発明。
【請求項1】
注射用骨造成組成物のための多成分系であって、
フィブリノゲンを含む成分(a)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、多成分系。
【請求項2】
注射用骨造成組成物であって、
フィブリンを含む成分(a’)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含む、組成物。
【請求項3】
前記成分(a)〜(d)は溶液中に存在しており、少なくとも成分(a)は、成分(b)と空間的に分離されている、請求項1に記載の多成分系。
【請求項4】
前記フィブリノゲン成分(a)中のフィブリノゲンの量は、10〜200mg/mlの範囲である、請求項1に記載の多成分系。
【請求項5】
前記トロンビン成分(b)中のトロンビンの量は、最終凝塊組成物において少なくとも1IU/mlである、請求項1に記載の多成分系。
【請求項6】
前記成分(c)中の造影剤の量は、最終凝塊組成物において100〜800mg/mlの範囲である、請求項1に記載の多成分系。
【請求項7】
前記成分(a)〜(d)の1つまたは複数または全ては、固体状で存在する、請求項1に記載の多成分系。
【請求項8】
前記造影剤は、少なくとも1つのヨウ素含有有機化合物を含む、請求項1に記載の多成分系または請求項2に記載の注射用骨造成組成物。
【請求項9】
前記造影剤は、ジアトリゾアート(メグルミン)、イオデコール、イオジキサノール、イオフラトール、イオグラミド、イオヘキソール、イオメプロール、イオパミドール、イオプロミド、イオトロール、イオベルソール、イオキサグレート、およびメトリザミド、ならびにそれらの混合物で構成される群から選択される、請求項8に記載の多成分系または注射用骨造成組成物。
【請求項10】
前記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、リン酸カルシウム、リン酸カルシウムの多形、ヒドロキシアパタイト、炭酸カルシウム、硫酸カルシウム、およびそれらの任意の組み合わせで構成される群から選択される、請求項1に記載の多成分系または請求項2に記載の注射用骨造成組成物。
【請求項11】
前記カルシウム塩含有粒子は、リン酸三カルシウム、アルファ−リン酸三カルシウム、ベータ−リン酸三カルシウム、およびリン酸カルシウム、ならびにそれらの混合物で構成される群から選択され、かつ/または該カルシウム塩含有粒子は、Ca/P比が1.5〜2の範囲である、請求項10に記載の多成分系または注射用骨造成組成物。
【請求項12】
前記成分(a)中のフィブリンの量は、前記最終凝塊組成物において5〜100mg/mlの範囲である、請求項2に記載の注射用骨造成組成物。
【請求項13】
前記成分(b)中のトロンビンの量は、前記最終凝塊組成物において少なくとも1IU/mlである、請求項2に記載の注射用骨造成組成物。
【請求項14】
前記成分(c)中の造影剤の量は、前記最終凝塊組成物において100〜800mg/mlの範囲である、請求項2に記載の注射用骨造成組成物。
【請求項15】
前記成分(d)中の少なくとも1種類のカルシウム塩含有粒子の量は、前記最終凝塊組成物に対して1〜50%w/wの範囲である、請求項1に記載の多成分系または請求項2に記載の注射用骨造成組成物。
【請求項16】
前記カルシウム塩含有粒子は、直径が100μm未満である、請求項1に記載の多成分系または請求項2に記載の注射用骨造成組成物。
【請求項17】
前記カルシウム塩含有粒子は、直径が50μm未満である、請求項16に記載の多成分系または注射用骨造成組成物。
【請求項18】
前記組成物はゲル化または凝塊した状態であり、骨の非石灰化部分または中空部分への注射に適した粘度を有する、請求項2に記載の注入骨造成組成物。
【請求項19】
骨疾患を患う患者の骨造成用組成物であって、
フィブリンを含む成分(a’)と;
トロンビンを含む成分(b)と;
少なくとも1つの造影剤を含む成分(c)と;
直径が200μm以下のカルシウム塩含有粒子を少なくとも1種類含む成分(d)と、
を含み、該組成物は、該骨の非石灰化部分または中空部分に注射されるものであることを特徴とする、骨造成用組成物。
【請求項20】
前記骨疾患は、椎骨、臀部、および前腕の骨粗しょう症、ならびに良性および悪性病変からなる群から選択される、請求項19に記載の骨造成用組成物。
【請求項21】
明細書中に記載の発明。
【図1】


【図2】




【図2】


【公開番号】特開2013−17842(P2013−17842A)
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−237629(P2012−237629)
【出願日】平成24年10月29日(2012.10.29)
【分割の表示】特願2009−511354(P2009−511354)の分割
【原出願日】平成19年4月17日(2007.4.17)
【出願人】(591013229)バクスター・インターナショナル・インコーポレイテッド (448)
【氏名又は名称原語表記】BAXTER INTERNATIONAL INCORP0RATED
【出願人】(501453189)バクスター・ヘルスケヤー・ソシエテ・アノニム (289)
【氏名又は名称原語表記】BAXTER HEALTHCARE S.A.
【Fターム(参考)】
【公開日】平成25年1月31日(2013.1.31)
【国際特許分類】
【出願番号】特願2012−237629(P2012−237629)
【出願日】平成24年10月29日(2012.10.29)
【分割の表示】特願2009−511354(P2009−511354)の分割
【原出願日】平成19年4月17日(2007.4.17)
【出願人】(591013229)バクスター・インターナショナル・インコーポレイテッド (448)
【氏名又は名称原語表記】BAXTER INTERNATIONAL INCORP0RATED
【出願人】(501453189)バクスター・ヘルスケヤー・ソシエテ・アノニム (289)
【氏名又は名称原語表記】BAXTER HEALTHCARE S.A.
【Fターム(参考)】
[ Back to top ]

