高光学純度L−乳酸の製造方法
【課題】生物学的手法を用いた高光学純度L−乳酸の生産であって、乳酸溶液中のD−乳酸を選択的あるいは優先的に資化する菌によって簡便で効率的な高光学純度L−乳酸の製造方法を提供することにある。
【解決手段】D−乳酸及びL−乳酸を含む乳酸溶液でD−乳酸資化性菌を培養し、該乳酸溶液中のD−乳酸を資化させる事によってL−乳酸の光学純度を高めるD−乳酸除去工程を有することを特徴とする高光学純度L−乳酸の製造方法によって解決する。
【解決手段】D−乳酸及びL−乳酸を含む乳酸溶液でD−乳酸資化性菌を培養し、該乳酸溶液中のD−乳酸を資化させる事によってL−乳酸の光学純度を高めるD−乳酸除去工程を有することを特徴とする高光学純度L−乳酸の製造方法によって解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、微生物を用いた高光学純度L−乳酸の製造方法に関し、詳しくは、L−乳酸及びD−乳酸を含む溶液からD−乳酸資化性菌によってD−乳酸を除去する高光学純度L−乳酸の製造方法に関する。
【背景技術】
【0002】
近年、化石資源の枯渇への危惧や地球環境保全の観点から、バイオマスを原料として生産が可能なバイオプラスチックに対する関心が高まっており、中でもポリ乳酸系バイオプラスチックが注目されている。
【0003】
ポリ乳酸のモノマーである乳酸は、光学活性が異なるL−乳酸とD−乳酸の2つのエナンチオマーが存在する。どちらかのエナンチオマーのみ、すなわち、L−乳酸又はD−乳酸のみを原料としてポリ乳酸を合成した場合、ラセミ体であるDL−乳酸を原料とした場合と比べて、結晶性や延伸性、耐熱性、成型加工性等が優れたポリマーができることはよく知られている。なお、L−乳酸で合成したポリ乳酸は、ポリ−L−乳酸といい、D−乳酸で合成した場合は、ポリ−D−乳酸という。
【0004】
ポリ−L−乳酸又はポリ−D−乳酸を合成する場合、その原料モノマーであるL−乳酸又はD−乳酸の光学純度がポリ乳酸の重合度やガラス転移点に大きく影響する。さらに、原料モノマーへの他方のエナンチオマーの混入が合成されたポリ乳酸の融点を下げることも知られている。そのため、バイオプラスチック素材としてポリ乳酸を使用するためには、ポリ乳酸製造のための原料乳酸の光学純度を高める必要がある。
【0005】
一般的な乳酸の生産方法は、合成法及び発酵法の2つが知られている。合成法では、アセトアルデヒドに青酸を作用させ、生成したシアンヒドリンを加水分解して乳酸を合成する場合と、アセトアルデヒドと一酸化炭素とを高圧下で反応させて合成する場合が知られている。一方、発酵法では、ショ糖、ブドウ糖、デンプン、ジャガイモ等のバイオマス原料を乳酸生産菌によって発酵させて得た発酵液を精製することで乳酸を生産する。
【0006】
合成法によって合成された乳酸の光学純度は、L−乳酸:D−乳酸比が1:1のラセミ体となる。
【0007】
一方、発酵法においては、発酵に用いる微生物を選択することによってL−乳酸又はD−乳酸の光学純度を高めることができる。例えば、L−乳酸生産菌を用いることによって、比較的光学純度の高いL−乳酸を生産することができる。
【0008】
例えば、特開平9−121844号公報には、高光学純度のL−乳酸を生産する新規バチルス(Bacillus)sp.SHO−1(FERM P−15234)を培養し、この培養物から光学純度95%以上のL−乳酸を採取することが開示されている(特許文献1)。また、特開2006−333847号公報には、耐熱性微生物Bacillus licheniformisTY7を好熱性L乳酸生産菌とし、これを用い、糖質とその他の栄養成分を高く含有するバイオマス原料を、50〜60℃、pH5.8〜6.5において殺菌することなく直接培養基として発酵するL−乳酸液製造方法が開示されている(特許文献2)。さらに、ラクトバチルス マニホチボランス(Lactobacillus manihotivorans)LMG18011株を用い、可溶性デンプンと残飯を原料とした直接発酵による光学純度99.2%のL−乳酸の生産が報告されている(非特許文献1)。
【0009】
ところで、L−乳酸及びD−乳酸のように光学活性の異なる物質を分割する方法には、(1)ラセミ体にキラル化合物(光学分割剤)を作用させてジアステレオマーを形成させ、ジアステレオマー間の物理的な性質、例えば溶解度などの差異を利用して、それぞれのジアステレオマーを分別結晶化した後、得られた単一のジアステレオマーから光学分割剤を取り除くことで目的のエナンチオマーを得る結晶化による光学分割法、(2)不斉要素をもつ固定相を用いたカラムクロマトグラフィーによって、その保持時間の差異を利用して分割する光学分割法、(3)酵素の高い不斉識別能によって一方のエナンチオマーを選択的に反応させる酵素法の3つが知られている。さらに、結晶化による光学分割方法には、優先晶出法、ジアステレオマー法、包接錯体法、優先富化法がある。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開平9−121844号公報
【特許文献2】特開2006−333847号公報
【非特許文献】
【0011】
【非特許文献1】Ohkouchi Y. and Inoue Y.,Bioresour.Technol.,2006,97(13),p.1554−1562
【発明の概要】
【発明が解決しようとする課題】
【0012】
合成法によって合成された乳酸の光学純度は、上記のようにL−乳酸:D−乳酸比が1:1のラセミ体となるため、L−乳酸を高光学純度で製造することができないという問題がある。
【0013】
乳酸菌を用いた発酵法で生産されるL−乳酸の光学純度は、高いもので97〜98%程度であり、バイオプラスチックに利用する際、数パーセント含まれる光学異性体の存在が、ポリ乳酸の結晶性や融点の低下とそれに伴うバイオプラスチック強度の低下や生産効率の悪化の一因となっている。
【0014】
また、遺伝子工学的手法による高光学純度乳酸生産菌の育種などに関する検討も現在進められているが、組み換え菌においても、その培養を繰り返すことで遺伝情報の欠落やそれに伴う形質の変化が生じることや、遺伝子組換え体の取り扱いが非常に難しいことなどの問題がある。
【0015】
さらに、物理化学的な光学分割法により、DL−混合乳酸から多量の高光学純度乳酸を製造することは必ずしも容易ではなく、コストも問題も発生する。
【0016】
従って、本発明の目的は、生物学的手法を用いた簡便な高光学純度L−乳酸の生産であって、乳酸溶液中のD−乳酸を選択的あるいは優先的に資化する菌によって、簡便、効率的かつ低コストで高光学純度L−乳酸の製造方法を提供することにある。
【課題を解決するための手段】
【0017】
上記課題を解決するため、本発明は、L−乳酸及びD−乳酸を含む乳酸溶液を調製する乳酸溶液調製工程と、該乳酸溶液中でD−乳酸資化性菌を培養し、該乳酸溶液中のD−乳酸を資化させることによってL−乳酸の光学純度を高めるD−乳酸除去工程と、を有する高光学純度L−乳酸の製造方法を提供するものである。
【発明の効果】
【0018】
本発明に係る高光学純度L−乳酸の製造方法によれば、D−乳酸を優先的に資化する能力が高いD−乳酸資化性菌を使用し、L−乳酸及びD−乳酸を含む乳酸溶液中のD−乳酸をこのD−乳酸資化性菌によって資化させることで、簡便、効率的かつ低コストでD−乳酸を除去し、高光学純度のL−乳酸を製造することが可能となる。また、所定の条件によって、光学純度が98%以上のL−乳酸を得ることができる。
【図面の簡単な説明】
【0019】
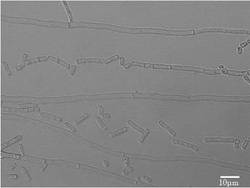
【図1】ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の顕微鏡写真である。
【図2】L−乳酸発酵液から調製した発酵乳酸培地を用いたD−乳酸資化性菌のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図3】各種培養温度におけるDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の増殖の様相を示す図である。
【図4】各種培養温度におけるDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図5】異なる初発pHのDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の増殖を示す図である。
【図6】異なる初発pHのDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図7】異なる窒素源とDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図8】異なるDL乳酸比の乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図9】異なる初発菌体濃度におけるL−乳酸発酵液から調製した発酵乳酸培地を用いたD−乳酸資化性菌のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【発明を実施するための形態】
【0020】
本発明の高光学純度乳酸の製造方法は、L−乳酸及びD−乳酸を含む乳酸溶液を含む乳酸溶液を調製する乳酸溶液調製工程と、該乳酸溶液中でD−乳酸資化性菌を培養し、該乳酸溶液中のD−乳酸を資化させることによってL−乳酸の光学純度を高めるD−乳酸除去工程を有する。
【0021】
本実施形態で使用されるL−乳酸及びD−乳酸を含む乳酸溶液は、公知の方法によって合成された合成乳酸又はショ糖、ブドウ糖、デンプン、ジャガイモなどを原料として乳酸生産菌による乳酸発酵によって生成された発酵乳酸を用いることができる。光学純度の高いL−乳酸を高い収量で生産する観点からは、乳酸溶液は、L−乳酸生産菌による乳酸発酵で生産された乳酸であることが好ましい。
【0022】
本実施形態で使用されるL−乳酸生産菌としては、D−乳酸よりもL−乳酸を多く生成する乳酸菌であればよく、例えば、ラクトバチルス(Lactobacillus)属、ラクトコッカス(Lactococcus)属、エンテロコッカス(Enterococcus)属、ストレプトコッカス(Streptococcus)属に属する微生物を挙げることができる。
【0023】
前記L−乳酸生産菌を培養するための条件として、使用培地は、乳酸菌が増殖し、L−乳酸を生産するためのものであればよく、乳酸菌の培養に一般的に用いられる様々な液体培地を用いることができる。好適な培地としては、GYP培地、MRS培地などを挙げることができる。また、培養温度は、15〜50℃の範囲で適宜決定することできるが、乳酸菌の培養至適温度を考慮すると25〜45℃に設定することが好ましい。乳酸発酵は嫌気的条件下で行われるため、静置培養又は嫌気的条件下での撹拌培養若しくはこれらの組み合わせで培養することが好ましい。
【0024】
本実施形態におけるD−乳酸除去工程は、L−乳酸及びD−乳酸を含む乳酸溶液からD−乳酸資化性菌によってD−乳酸を除去することにより、乳酸溶液中のL−乳酸の光学純度を高める工程である。
【0025】
上述のように、L−乳酸生産菌で乳酸発酵を実施した場合であっても、実際のL−乳酸の光学純度は高いもので97〜98%程度であり、D−乳酸が数%混在している。そのため、100%に近い光学純度が要求されるバイオプラスチック製造においては、数パーセント含まれるD−乳酸の存在が、ポリ乳酸の結晶性や融点の低下とそれに伴うバイオプラスチック強度の低下や生産効率の悪化の一因となっている。従って、本実施形態の高光学純度乳酸の製造方法においては、D−乳酸を特異的に資化し、L−乳酸を資化しない又はL−乳酸資化能の低いD−乳酸資化性菌を選択することが重要となる。
【0026】
本実施形態に使用されるD−乳酸資化性菌は、ゲオトリクム(Geotrichum)属に属する酵母であることが好ましく、D−乳酸資化性の観点から、ゲオトリクム ブルガレ(Geotrichum vulgare)、ゲオトリクム ブリンゼ(Geotrichum bryndzae)又はゲオトリクム シルビコラ(Geotrichum silvicola)であることがより好ましく、その中でもゲオトリクム ブルガレ(Geotrichum vulgare)と同種又は近縁種であるゲオトリクム エスピー(Geotrichum sp.)LAAM055株(受領番号:NITE AP1223)がD−乳酸の選択的資化能及び前記乳酸溶液からのL−乳酸生産収量の観点から特に好ましい。
【0027】
前記D−乳酸除去工程の条件は適宜設定し得るが、乳酸溶液中のL−乳酸の光学純度を向上させる観点から、温度30℃、初発pH3.0〜3.8で振とう培養(120oscillations/min)することが好ましい。
【0028】
前記D−乳酸除去工程における乳酸溶液のDL−乳酸量の比率は、特に制限はなく、例えば、乳酸溶液中のD−乳酸量が総乳酸量に対して50%以下の乳酸溶液を用いることができる。
【0029】
前記D−乳酸除去工程において、前記D−乳酸資化性菌を固定化した固定化D−乳酸資化性菌を添加することによって実施することもできる。
【0030】
前記D−乳酸資化性菌を固定化する方法としては、担体結合法(物理的吸着法、イオン結合法、共有結合法、生化学特異結合法)、架橋法、包括法(格子型、マイクロカプセル型)などの方法を挙げることができる。
【実施例】
【0031】
1.D−乳酸資化性菌の検索及び同定
(1)D−乳酸及び/又はL−乳酸資化性菌の分離
土壌、樹葉など60種の試料を分離源として、D−乳酸及び/又はL−乳酸資化性菌の検索を行った。すなわち、常法に従い、LYP液体培地を用いた集積培養及びLYP寒天培地を用いた純粋分離操作を繰り返し行い、乳酸資化性菌89株を得た。なお、LYP培地の組成は、DL−乳酸(純度85.0〜90.0%)(和光純薬株式会社製)2.5%、ペプトン(日本製薬株式会社製)0.25%、酵母エキス(日本ベクトン・ディッキンソン株式会社製)0.25%、KH2PO4 0.04%(pH3.8)である。
【0032】
(2)発酵乳酸培地の調製
L−乳酸生産菌であるラクトバチルス マリ(Lactobacillus mali)438株をMRS broth培地(Oxoid社製)50mlに1白金線接種し、30℃で24時間静置培養した。この前培養液3mlと乾熱滅菌(180℃、120分)した炭酸カルシウム6gとをオートクレーブ滅菌(121℃、10分)したGYP改変培地(グルコース2%、酵母エキス(日本ベクトン・ディッキンソン株式会社製)1%、ペプトン(日本製薬株式会社製)0.5%、CH3COONa・3H2O 0.1%、MgSO4・7H2O 0.02%、FeSO4・7H2O 0.001%、MnSO4・4H2O 0.001%、NaCl 0.001%、Tween80 0.05%)300mlに添加し、マグネティックスターラーによって液を穏やかに撹拌しながら、30℃で48時間培養して乳酸発酵液を調製した。また、この乳酸発酵液を遠心分離(4℃、10000G、30分)して得た上清をpH3.8に調整した後、オートクレーブ滅菌(121℃、10分)を行い、発酵乳酸培地(以下「L−LAB培地」という。)とした。
【0033】
(3)D−乳酸資化性菌の選抜
分離したD−乳酸及び/又はL−乳酸資化性菌89株からD−乳酸を選択的に資化する乳酸菌を選抜することを目的に、D−乳酸及び/又はL−乳酸資化性菌89株をYM培地を用いてそれぞれ培養し、これら菌株の培養液をL−LAB培地にそれぞれ添加して30℃で72時間振とう培養(120oscillations/min)を行った。また、この培養液中に残存するD−乳酸及びL−乳酸の濃度を以下の方法によって定量し、D−乳酸及び/又はL−乳酸資化性菌89株のD−乳酸資化特性を評価した。
【0034】
L−乳酸及びD−乳酸の分別定量は、酵素法(DL−乳酸測定用Fキット:ロシュ・ダイアグノスティックス社製)によって行った。なお、DL−乳酸の分別定量に供する培養液試料の調製は、以下の通りである。すなわち、マイクロチューブに、培養液の遠心分離(4℃、12000rpm、10分)上清を入れてキャップをロックした後、80〜90℃の温浴中で15分間加温することにより、培養液中に含まれる各種酵素を失活させた。これを水浴中で冷却した後、遠心分離(4℃、12000rpm、10分)し、回収した上清を定量試験に用いた。また、対照(Control)には試料液の代わりに同量の蒸留水を用いた。
【0035】
その結果、培養液中のD−乳酸をL−乳酸よりも選択的に消費してL−乳酸の光学純度を向上させる菌株として、LAAM018株、LAAM029株、LAAM042株、LAAM050株、LAAM055株及びLAAM065株の計6株を選抜した(図2)。
【0036】
図2に示したように、LAAM050株は、培養終了後の培養液中のD−乳酸とL−乳酸の比がD−乳酸:L−乳酸=0.57:99.43と、D−乳酸を優先的に資化し、最もL−乳酸の光学純度が高かった。しかしながら、他の5菌株と比べて培養液中に残存したL−乳酸量が最も低く、初発L−乳酸量に対するL−乳酸残存率は48.9%であった。
【0037】
一方、LAAM055株は、培養終了後の培養液中のD−乳酸とL−乳酸の比がD−乳酸:L−乳酸=0.86:99.14と、D−乳酸を優先的に資化し、L−乳酸の光学純度が高かった。また、初発L−乳酸量に対するL−乳酸残存率は約78%と、高光学純度L−乳酸を最も高い収率で得ることができた。
【0038】
(4)D−乳酸資化性菌の同定
上記で選抜したD−乳酸資化性菌6株のうち、LAAM055株、LAAM018株及びLAAM065株について、形態観察、炭素源資化性試験、26SrDNA−D1/D2塩基配列の解析を行い、これら菌の同定を行った。
【0039】
LAAM055株は、白色で粉状〜白亜状のコロニーを形成し、コロニーの周縁部は乱糸状であった。また、顕微鏡観察を行ったところ、出芽した細胞は確認されず、隔壁のある菌糸および分節型分生子が認められ、有性生殖器官の形成は認められなかった(図1)。
【0040】
また、LAAM055株の糖の発酵性、イノシトール資化性及び硝酸塩資化性がゲオトリクム(Geotrichum)
属の性質と一致していた(表1及び表2)。
【0041】
【表1】

【0042】
【表2】

【0043】
さらに、LAAM055株の26SrDNA−D1/D2塩基配列を調べたところ、本菌株の26SrDNA−D1/D2塩基配列は、子のう菌系アナモルフ酵母の一種であるゲオトリクム ブルガレ(Geotrichum vulgare)の基準株であるゲオトリクム ブルガレ(Geotrichum vulgare)CBS10073Tに対して99.6%の相同率を示した。このように、LAAM055株は、ゲオトリクム ブルガレ(Geotrichum vulgare)と同種又は近縁種であることが明らかとなった。
【0044】
一方、LAAM018株及びLAAM065株についても同様に調べた結果、LAAM018株及びLAAM065株とも、LAAM055株と同様、白色で粉状〜白亜状のコロニーを形成し、コロニーの周縁部は乱糸状であった。また、顕微鏡観察を行ったところ、出芽した細胞は確認されず、隔壁のある菌糸および分節型分生子が認められ、有性生殖器官の形成は認められなかった。
【0045】
また、LAAM018株及びLAAM065株の26SrDNA−D1/D2塩基配列は、子のう菌系アナモルフ酵母の一種であるゲオトリクム ブリンゼ(Geotrichum bryndzae)の基準株であるゲオトリクム ブリンゼ(Geotrichum bryndzae)NRRL Y−27641T及びゲオトリクム シルビコラ(Geotrichum silvicola)の基準株であるゲオトリクム シルビコラ(Geotrichum silvicola)CBS9194Tに対してともに99.4%の相同性を示した。このように、LAAM018株及びLAAM065株は、ゲオトリクム ブリンゼ(Geotrichum bryndzae)又はゲオトリクム シルビコラ(Geotrichum silvicola)と同種又は近縁種であることを明らかにした。
【0046】
さらに、LAAM055株、LAAM018及びLAAM065株の26SrDNA−D1/D2塩基配列について、マルチプルアライメントを行い、相互の遺伝学的関連性を調べた。その結果、LAAM018とLAAM065株とは、解読した545塩基のすべての配列が一致していた。一方、LAAM055株の塩基配列をこれら2株の塩基配列と比較したところ、545塩基のうち15塩基が異なっていた。このため、LAAM055株は、LAAM018及びLAAM065株と系統的にやや距離を有することが明らかとなった。
【0047】
以上の結果から、高光学純度L−乳酸を多量に調製するためのD−乳酸資化性菌として、分離菌ゲオトリクム エスピー(Geotrichum sp.)LAAM055株(受領番号:NITE AP−1223)を用いることとした。
【0048】
2.ゲオトリクム エスピー(Geotrichum sp.)LAAM055の培養特性
(1)培養温度の検討
ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の培養温度条件を検討した。すなわち、本菌株をYM培地を用いて30℃で24時間振とう培養(120oscillations/min)した(前培養)。この前培養液をLYP培地に1%(v/v)添加して、25℃、30℃、35℃又は40℃で72時間振とう培養(120oscillations/min)を行った(本培養)。また、本培養液中の菌体濃度、pH及びDL−乳酸量を経時的に測定した。なお、菌体濃度は、波長660nmにおける培養液の濁度(OD660nm)として示した。また、pHは、pHメーターを用いて測定した。さらに、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。これらの結果を図3及び4に示した。
【0049】
図3に示したように、培養温度が25又は30℃の場合では菌体の増殖が認められたが、培養温度が35℃以上では菌体の増殖が認められなかった。一方、本菌株の乳酸資化について、培養温度30℃の場合に最も乳酸資化速度が高かった。また、培養開始72時間後の培養液中のDL−乳酸濃度は11.16g/lであり、初発DL−乳酸濃度25.46g/lの約55%が資化された。さらに、図4に示したように、培養温度30℃における培養72時間後の培養液中に残存するDL−乳酸比は、D−乳酸:L−乳酸=6.91:93.09であった。
【0050】
他方、培養温度25℃の場合では菌体濃度が最も高い値を示したが、培養温度30℃の場合と比べて、乳酸資化速度及び乳酸資化量は低い値を示した(図3)。また、培養温度25℃における培養開始72時間後の培養液中のDL−乳酸比は、D−乳酸:L−乳酸=28.43:71.57であった(図4)。このように、L−乳酸の光学純度を向上させるためには、本菌株の培養温度を30℃程度とすることが有効であることが分かった。
【0051】
(2)初発pHの検討
ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の培養時における培地の初発pHについて検討した。すなわち、本菌株をYM培地を用いて30℃で24時間振とう培養(120oscillations/min)した(前培養)。この前培養液を6mol/lのHCl又は6mol/lのNaOHによって初発pHを2.6〜7.0に調整したLYP培地に1%(v/v)添加して、30℃で72時間振とう培養(120oscillations/min)を行った(本培養)。また、培養72時間後の本培養液中の菌体濃度、pH及びDL−乳酸量を測定した。なお、菌体濃度及びpHは上記2.(1)と同様に測定し、DL−乳酸は、上記1.(3)と同様に酵素法によって分別定量した。これら結果を図5及び6に示した。
【0052】
図5に示したように、培地の初発pHが3.0〜7.0の範囲で本菌株の増殖が認められた。また、培養72時間後の菌体濃度について、初発pHが5.4の場合、菌体濃度(OD660nm値)が5.59と最も高い値を示した。一方、初発pHが3.0又は3.8の場合、菌体濃度(OD660nm値)が2.63〜3.52と、初発pH4.6以上で培養した場合と比べて低い値を示した。
【0053】
他方、図6に示したように、初発pHが3.0又は3.8で培養した場合、培養液中のD−乳酸がそれぞれ0.42g/l又は0.77g/lと、初発pH4.6以上で培養した場合の3.74g/l〜4.92g/lと比べては低い値を示した。一方、L−乳酸は、初発pHが3.0では10.35g/l、初発pHが3.8では10.39g/lと、初発pH4.6以上で培養した場合の10.80g/l〜11.05g/lとほぼ同様の値であった。このように、培地の初発pHを3.0〜3.8で本菌株を培養すると培地中のD−乳酸が優先的に資化され、培養液中のL−乳酸の光学純度が向上することが分かった。
【0054】
(3)窒素源の検討
ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の培養時における培地の窒素源として添加する素材の種類について検討を行った。すなわち、本菌株をYM培地を用いて30℃で24時間振とう培養(120oscillations/min)した(前培養)。この前培養液を各種窒素源としたLYP培地に1%(v/v)添加して、30℃で72時間振とう培養(120oscillations/min)を行った(本培養)。
【0055】
なお、窒素源は、0.25%ペプトン及び0.25%酵母エキス(条件I)、0.4%ペプトン及び0.1%酵母エキス(条件II)、0.4%肉エキス及び0.1%酵母エキス(条件III)、0.4%硫酸アンモニウム及び0.1%酵母エキス(条件IV)、0.4%尿素及び0.1%酵母エキス(条件V)、0.4%硝酸ナトリウム及び0.1%酵母エキス(条件VI)又は0.4%リン酸水素二アンモニウム及び0.1%酵母エキス(条件VII)とした。
【0056】
また、培養72時間後の本培養液中のDL−乳酸量を測定した。なお、DL−乳酸は、上記1.(3)と同様に酵素法によって分別定量した。この結果を図7に示した。
【0057】
図7に示したように、すべての場合においてD−乳酸は資化され、培地中のL−乳酸の光学純度は向上したが、窒素源を0.25%ペプトン及び0.25%酵母エキスとした場合(条件I)が最もD−乳酸が資化され、L−乳酸の光学純度が向上した。このように、L−乳酸の光学純度を向上させるためには、培地の窒素源を0.25%ペプトン及び0.25%酵母エキスとすることが有効であることが分かった。
【0058】
(4)乳酸のDL比の検討
ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の培養時における培地の初発乳酸のDL比について検討を行った。すなわち、本菌株をYM培地を用いて30℃で24時間振とう培養(120oscillations/min)した(前培養)。この前培養液を初発乳酸のDL比をD−乳酸:L−乳酸=1:1、2:8又は1:9としたLYP培地(乳酸濃度2.5%)に1%(v/v)添加して、30℃で72時間振とう培養(120oscillations/min)を行った(本培養)。また、培養72時間後の本培養液中のDL−乳酸量を測定した。なお、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。この結果を図8に示した。
【0059】
図8に示したように、すべての場合でL−乳酸の光学純度は向上しており、培地中の初発乳酸のDL比がD−乳酸:L−乳酸=1:9(初発L−乳酸の光学純度90%)の場合、培養72時間後の培養液中のL−乳酸の光学純度が99.7%と最もL−乳酸の光学純度が高かった。一方、D−乳酸:L−乳酸=2:8(初発L−乳酸の光学純度80%)の場合ではL−乳酸の光学純度が94.8%であり、D−乳酸:L−乳酸=1:1の場合(初発L−乳酸の光学純度50%)ではL−乳酸の光学純度が96.1%であった。
【0060】
3.乳酸発酵液からの高光学純度L−乳酸の生産
L−乳酸生産菌を乳酸発酵させて得た乳酸発酵液から調製した発酵乳酸培地を用いて、ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株による高光学純度のL−乳酸生産について検討した。
【0061】
(1)D−乳酸資化菌の添加量
まず始めに、L−乳酸生産菌であるラクトバチルス マリ(Lactobacillus mali)438株の乳酸発酵液を用いて調製した発酵乳酸培地(L−LAB培地)に添加するゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の菌体濃度について検討した。
【0062】
すなわち、初発グルコース濃度を2.0%としたGYP改変培地でラクトバチルス マリ(Lactobacillus mali)438株を培養することで乳酸発酵液を調製した。この乳酸発酵液を用いて上記1.(2)と同様に調製した発酵乳酸培地(L−LAB培地)(pH3.0)にゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株を初発菌体濃度(OD660nm値)が0.093(条件I)、1.600(条件II)又は16.300(条件III)となるように添加して、30℃で72時間振とう培養(120oscillations/min)を行った。また、培養液中のDL−乳酸量を経時的に測定した。なお、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。この結果を図9に示した。
【0063】
図9に示したように、すべての場合において、培養72時間後の培養液中のL−乳酸の光学純度が高くなっており、菌体濃度(OD660nm値)が16.300の場合(条件IV)にL−乳酸の光学純度が98.36%、L−乳酸収率が80.22%と最も高い値を示した。
【0064】
(2)乳酸発酵液からの高光学純度L−乳酸の生産
上記3.(1)の結果から、乳酸発酵用GYP改変培地の初発グルコース濃度を2.0%とし、ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の菌体添加量を初発菌体濃度(OD660nm値)約16として、発酵乳酸培地(L−LAB培地)からの高光学純度L−乳酸生産の様相を調べた。
【0065】
すなわち、初発グルコース濃度を2.0%としたGYP改変培地でラクトバチルス マリ(Lactobacillus mali)438株を培養することで乳酸発酵液を調製した。この乳酸発酵液を用いて調製した発酵乳酸培地(L−LAB培地)(pH3.0)にゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株を初発菌体濃度(OD660nm値)が約16となるように添加して、30℃で72時間振とう培養(120oscillations/min)を行った。また、培養液中のDL−乳酸量を経時的に測定した。なお、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。この結果を表3に示した。
【0066】
【表3】

【0067】
表3に示したように、培養144時間後に培養液中のL−乳酸の光学純度が99.87%以上のL−乳酸が5.70g/l生成され、高光学純度のL−乳酸を得ることができた。
【0068】
4.固定化菌を用いた高光学純度L−乳酸の生産
固定化したゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株による発酵乳酸培地(L−LAB培地)からの高光学純度のL−乳酸生産について検討した。
【0069】
(1)固定化菌体の調製
ゲオトリクム エスピー(Geotrichum sp.)LAAM055株(受領番号:NITE AP−1223)株をYM培地600mlを用いて30℃で24時間振とう培養(120oscillations/min)した。この培養液を遠心分離(5000G、30分)し、回収した菌体をオートクレーブ滅菌した生理食塩水(0.9%NaCl溶液)15ml中に懸濁した。この菌体懸濁液15ml(OD660nm=約16)と5%アルギン酸ナトリウム溶液100mlとを混合し、これを5%塩化カルシウム溶液100ml中に滴下してゲルビーズを形成させた。この後、マグネティックスターラーで穏やかに撹拌しながら液中で該ゲルビーズを30分間保持することでゲルを硬化させ、これを固定化菌体とした。なお、調製した固定化菌体ビーズは、殺菌水で2度洗浄した後、以下の実験に供した。
【0070】
(2)固定化菌体を用いた高光学純度L−乳酸の生産
上記4.(1)で調製したゲオトリクム エスピー(Geotrichum sp.)LAAM055株の固定化菌体ビーズを初発グルコース濃度を2.0%として調製したL−LAB(pH3.0)に投入し、30℃で72時間振とう培養(120oscillations/min)を行った。また、培養液中のDL−乳酸量を経時的に測定した。なお、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。この結果を表4に示した。
【0071】
【表4】

【0072】
表4に示したように、培養48時間後に光学純度が91.29%のL−乳酸を12.3g/l(L−乳酸収率70.78%)生成した。また、培養72時間後の培養液中のL−乳酸の光学純度は94.09%と、培養48時間後の培養液と比べてL−乳酸の光学純度が向上したが、培養液中のL−乳酸が10.99g/l(L−乳酸収率63.23%)と乳酸収率が低下した。
【0073】
以上の結果から、ゲル包括固定化ゲオトリクム エスピー(Geotrichum sp.)LAAM055株を用いてもL−LAB培地から高光学純度のL−乳酸を生成することが可能であることが分かった。
【技術分野】
【0001】
本発明は、微生物を用いた高光学純度L−乳酸の製造方法に関し、詳しくは、L−乳酸及びD−乳酸を含む溶液からD−乳酸資化性菌によってD−乳酸を除去する高光学純度L−乳酸の製造方法に関する。
【背景技術】
【0002】
近年、化石資源の枯渇への危惧や地球環境保全の観点から、バイオマスを原料として生産が可能なバイオプラスチックに対する関心が高まっており、中でもポリ乳酸系バイオプラスチックが注目されている。
【0003】
ポリ乳酸のモノマーである乳酸は、光学活性が異なるL−乳酸とD−乳酸の2つのエナンチオマーが存在する。どちらかのエナンチオマーのみ、すなわち、L−乳酸又はD−乳酸のみを原料としてポリ乳酸を合成した場合、ラセミ体であるDL−乳酸を原料とした場合と比べて、結晶性や延伸性、耐熱性、成型加工性等が優れたポリマーができることはよく知られている。なお、L−乳酸で合成したポリ乳酸は、ポリ−L−乳酸といい、D−乳酸で合成した場合は、ポリ−D−乳酸という。
【0004】
ポリ−L−乳酸又はポリ−D−乳酸を合成する場合、その原料モノマーであるL−乳酸又はD−乳酸の光学純度がポリ乳酸の重合度やガラス転移点に大きく影響する。さらに、原料モノマーへの他方のエナンチオマーの混入が合成されたポリ乳酸の融点を下げることも知られている。そのため、バイオプラスチック素材としてポリ乳酸を使用するためには、ポリ乳酸製造のための原料乳酸の光学純度を高める必要がある。
【0005】
一般的な乳酸の生産方法は、合成法及び発酵法の2つが知られている。合成法では、アセトアルデヒドに青酸を作用させ、生成したシアンヒドリンを加水分解して乳酸を合成する場合と、アセトアルデヒドと一酸化炭素とを高圧下で反応させて合成する場合が知られている。一方、発酵法では、ショ糖、ブドウ糖、デンプン、ジャガイモ等のバイオマス原料を乳酸生産菌によって発酵させて得た発酵液を精製することで乳酸を生産する。
【0006】
合成法によって合成された乳酸の光学純度は、L−乳酸:D−乳酸比が1:1のラセミ体となる。
【0007】
一方、発酵法においては、発酵に用いる微生物を選択することによってL−乳酸又はD−乳酸の光学純度を高めることができる。例えば、L−乳酸生産菌を用いることによって、比較的光学純度の高いL−乳酸を生産することができる。
【0008】
例えば、特開平9−121844号公報には、高光学純度のL−乳酸を生産する新規バチルス(Bacillus)sp.SHO−1(FERM P−15234)を培養し、この培養物から光学純度95%以上のL−乳酸を採取することが開示されている(特許文献1)。また、特開2006−333847号公報には、耐熱性微生物Bacillus licheniformisTY7を好熱性L乳酸生産菌とし、これを用い、糖質とその他の栄養成分を高く含有するバイオマス原料を、50〜60℃、pH5.8〜6.5において殺菌することなく直接培養基として発酵するL−乳酸液製造方法が開示されている(特許文献2)。さらに、ラクトバチルス マニホチボランス(Lactobacillus manihotivorans)LMG18011株を用い、可溶性デンプンと残飯を原料とした直接発酵による光学純度99.2%のL−乳酸の生産が報告されている(非特許文献1)。
【0009】
ところで、L−乳酸及びD−乳酸のように光学活性の異なる物質を分割する方法には、(1)ラセミ体にキラル化合物(光学分割剤)を作用させてジアステレオマーを形成させ、ジアステレオマー間の物理的な性質、例えば溶解度などの差異を利用して、それぞれのジアステレオマーを分別結晶化した後、得られた単一のジアステレオマーから光学分割剤を取り除くことで目的のエナンチオマーを得る結晶化による光学分割法、(2)不斉要素をもつ固定相を用いたカラムクロマトグラフィーによって、その保持時間の差異を利用して分割する光学分割法、(3)酵素の高い不斉識別能によって一方のエナンチオマーを選択的に反応させる酵素法の3つが知られている。さらに、結晶化による光学分割方法には、優先晶出法、ジアステレオマー法、包接錯体法、優先富化法がある。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開平9−121844号公報
【特許文献2】特開2006−333847号公報
【非特許文献】
【0011】
【非特許文献1】Ohkouchi Y. and Inoue Y.,Bioresour.Technol.,2006,97(13),p.1554−1562
【発明の概要】
【発明が解決しようとする課題】
【0012】
合成法によって合成された乳酸の光学純度は、上記のようにL−乳酸:D−乳酸比が1:1のラセミ体となるため、L−乳酸を高光学純度で製造することができないという問題がある。
【0013】
乳酸菌を用いた発酵法で生産されるL−乳酸の光学純度は、高いもので97〜98%程度であり、バイオプラスチックに利用する際、数パーセント含まれる光学異性体の存在が、ポリ乳酸の結晶性や融点の低下とそれに伴うバイオプラスチック強度の低下や生産効率の悪化の一因となっている。
【0014】
また、遺伝子工学的手法による高光学純度乳酸生産菌の育種などに関する検討も現在進められているが、組み換え菌においても、その培養を繰り返すことで遺伝情報の欠落やそれに伴う形質の変化が生じることや、遺伝子組換え体の取り扱いが非常に難しいことなどの問題がある。
【0015】
さらに、物理化学的な光学分割法により、DL−混合乳酸から多量の高光学純度乳酸を製造することは必ずしも容易ではなく、コストも問題も発生する。
【0016】
従って、本発明の目的は、生物学的手法を用いた簡便な高光学純度L−乳酸の生産であって、乳酸溶液中のD−乳酸を選択的あるいは優先的に資化する菌によって、簡便、効率的かつ低コストで高光学純度L−乳酸の製造方法を提供することにある。
【課題を解決するための手段】
【0017】
上記課題を解決するため、本発明は、L−乳酸及びD−乳酸を含む乳酸溶液を調製する乳酸溶液調製工程と、該乳酸溶液中でD−乳酸資化性菌を培養し、該乳酸溶液中のD−乳酸を資化させることによってL−乳酸の光学純度を高めるD−乳酸除去工程と、を有する高光学純度L−乳酸の製造方法を提供するものである。
【発明の効果】
【0018】
本発明に係る高光学純度L−乳酸の製造方法によれば、D−乳酸を優先的に資化する能力が高いD−乳酸資化性菌を使用し、L−乳酸及びD−乳酸を含む乳酸溶液中のD−乳酸をこのD−乳酸資化性菌によって資化させることで、簡便、効率的かつ低コストでD−乳酸を除去し、高光学純度のL−乳酸を製造することが可能となる。また、所定の条件によって、光学純度が98%以上のL−乳酸を得ることができる。
【図面の簡単な説明】
【0019】
【図1】ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の顕微鏡写真である。
【図2】L−乳酸発酵液から調製した発酵乳酸培地を用いたD−乳酸資化性菌のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図3】各種培養温度におけるDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の増殖の様相を示す図である。
【図4】各種培養温度におけるDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図5】異なる初発pHのDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の増殖を示す図である。
【図6】異なる初発pHのDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図7】異なる窒素源とDL−乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図8】異なるDL乳酸比の乳酸を含むLYP培地でのゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【図9】異なる初発菌体濃度におけるL−乳酸発酵液から調製した発酵乳酸培地を用いたD−乳酸資化性菌のD−乳酸及びL−乳酸の選択的資化性を示す図である。
【発明を実施するための形態】
【0020】
本発明の高光学純度乳酸の製造方法は、L−乳酸及びD−乳酸を含む乳酸溶液を含む乳酸溶液を調製する乳酸溶液調製工程と、該乳酸溶液中でD−乳酸資化性菌を培養し、該乳酸溶液中のD−乳酸を資化させることによってL−乳酸の光学純度を高めるD−乳酸除去工程を有する。
【0021】
本実施形態で使用されるL−乳酸及びD−乳酸を含む乳酸溶液は、公知の方法によって合成された合成乳酸又はショ糖、ブドウ糖、デンプン、ジャガイモなどを原料として乳酸生産菌による乳酸発酵によって生成された発酵乳酸を用いることができる。光学純度の高いL−乳酸を高い収量で生産する観点からは、乳酸溶液は、L−乳酸生産菌による乳酸発酵で生産された乳酸であることが好ましい。
【0022】
本実施形態で使用されるL−乳酸生産菌としては、D−乳酸よりもL−乳酸を多く生成する乳酸菌であればよく、例えば、ラクトバチルス(Lactobacillus)属、ラクトコッカス(Lactococcus)属、エンテロコッカス(Enterococcus)属、ストレプトコッカス(Streptococcus)属に属する微生物を挙げることができる。
【0023】
前記L−乳酸生産菌を培養するための条件として、使用培地は、乳酸菌が増殖し、L−乳酸を生産するためのものであればよく、乳酸菌の培養に一般的に用いられる様々な液体培地を用いることができる。好適な培地としては、GYP培地、MRS培地などを挙げることができる。また、培養温度は、15〜50℃の範囲で適宜決定することできるが、乳酸菌の培養至適温度を考慮すると25〜45℃に設定することが好ましい。乳酸発酵は嫌気的条件下で行われるため、静置培養又は嫌気的条件下での撹拌培養若しくはこれらの組み合わせで培養することが好ましい。
【0024】
本実施形態におけるD−乳酸除去工程は、L−乳酸及びD−乳酸を含む乳酸溶液からD−乳酸資化性菌によってD−乳酸を除去することにより、乳酸溶液中のL−乳酸の光学純度を高める工程である。
【0025】
上述のように、L−乳酸生産菌で乳酸発酵を実施した場合であっても、実際のL−乳酸の光学純度は高いもので97〜98%程度であり、D−乳酸が数%混在している。そのため、100%に近い光学純度が要求されるバイオプラスチック製造においては、数パーセント含まれるD−乳酸の存在が、ポリ乳酸の結晶性や融点の低下とそれに伴うバイオプラスチック強度の低下や生産効率の悪化の一因となっている。従って、本実施形態の高光学純度乳酸の製造方法においては、D−乳酸を特異的に資化し、L−乳酸を資化しない又はL−乳酸資化能の低いD−乳酸資化性菌を選択することが重要となる。
【0026】
本実施形態に使用されるD−乳酸資化性菌は、ゲオトリクム(Geotrichum)属に属する酵母であることが好ましく、D−乳酸資化性の観点から、ゲオトリクム ブルガレ(Geotrichum vulgare)、ゲオトリクム ブリンゼ(Geotrichum bryndzae)又はゲオトリクム シルビコラ(Geotrichum silvicola)であることがより好ましく、その中でもゲオトリクム ブルガレ(Geotrichum vulgare)と同種又は近縁種であるゲオトリクム エスピー(Geotrichum sp.)LAAM055株(受領番号:NITE AP1223)がD−乳酸の選択的資化能及び前記乳酸溶液からのL−乳酸生産収量の観点から特に好ましい。
【0027】
前記D−乳酸除去工程の条件は適宜設定し得るが、乳酸溶液中のL−乳酸の光学純度を向上させる観点から、温度30℃、初発pH3.0〜3.8で振とう培養(120oscillations/min)することが好ましい。
【0028】
前記D−乳酸除去工程における乳酸溶液のDL−乳酸量の比率は、特に制限はなく、例えば、乳酸溶液中のD−乳酸量が総乳酸量に対して50%以下の乳酸溶液を用いることができる。
【0029】
前記D−乳酸除去工程において、前記D−乳酸資化性菌を固定化した固定化D−乳酸資化性菌を添加することによって実施することもできる。
【0030】
前記D−乳酸資化性菌を固定化する方法としては、担体結合法(物理的吸着法、イオン結合法、共有結合法、生化学特異結合法)、架橋法、包括法(格子型、マイクロカプセル型)などの方法を挙げることができる。
【実施例】
【0031】
1.D−乳酸資化性菌の検索及び同定
(1)D−乳酸及び/又はL−乳酸資化性菌の分離
土壌、樹葉など60種の試料を分離源として、D−乳酸及び/又はL−乳酸資化性菌の検索を行った。すなわち、常法に従い、LYP液体培地を用いた集積培養及びLYP寒天培地を用いた純粋分離操作を繰り返し行い、乳酸資化性菌89株を得た。なお、LYP培地の組成は、DL−乳酸(純度85.0〜90.0%)(和光純薬株式会社製)2.5%、ペプトン(日本製薬株式会社製)0.25%、酵母エキス(日本ベクトン・ディッキンソン株式会社製)0.25%、KH2PO4 0.04%(pH3.8)である。
【0032】
(2)発酵乳酸培地の調製
L−乳酸生産菌であるラクトバチルス マリ(Lactobacillus mali)438株をMRS broth培地(Oxoid社製)50mlに1白金線接種し、30℃で24時間静置培養した。この前培養液3mlと乾熱滅菌(180℃、120分)した炭酸カルシウム6gとをオートクレーブ滅菌(121℃、10分)したGYP改変培地(グルコース2%、酵母エキス(日本ベクトン・ディッキンソン株式会社製)1%、ペプトン(日本製薬株式会社製)0.5%、CH3COONa・3H2O 0.1%、MgSO4・7H2O 0.02%、FeSO4・7H2O 0.001%、MnSO4・4H2O 0.001%、NaCl 0.001%、Tween80 0.05%)300mlに添加し、マグネティックスターラーによって液を穏やかに撹拌しながら、30℃で48時間培養して乳酸発酵液を調製した。また、この乳酸発酵液を遠心分離(4℃、10000G、30分)して得た上清をpH3.8に調整した後、オートクレーブ滅菌(121℃、10分)を行い、発酵乳酸培地(以下「L−LAB培地」という。)とした。
【0033】
(3)D−乳酸資化性菌の選抜
分離したD−乳酸及び/又はL−乳酸資化性菌89株からD−乳酸を選択的に資化する乳酸菌を選抜することを目的に、D−乳酸及び/又はL−乳酸資化性菌89株をYM培地を用いてそれぞれ培養し、これら菌株の培養液をL−LAB培地にそれぞれ添加して30℃で72時間振とう培養(120oscillations/min)を行った。また、この培養液中に残存するD−乳酸及びL−乳酸の濃度を以下の方法によって定量し、D−乳酸及び/又はL−乳酸資化性菌89株のD−乳酸資化特性を評価した。
【0034】
L−乳酸及びD−乳酸の分別定量は、酵素法(DL−乳酸測定用Fキット:ロシュ・ダイアグノスティックス社製)によって行った。なお、DL−乳酸の分別定量に供する培養液試料の調製は、以下の通りである。すなわち、マイクロチューブに、培養液の遠心分離(4℃、12000rpm、10分)上清を入れてキャップをロックした後、80〜90℃の温浴中で15分間加温することにより、培養液中に含まれる各種酵素を失活させた。これを水浴中で冷却した後、遠心分離(4℃、12000rpm、10分)し、回収した上清を定量試験に用いた。また、対照(Control)には試料液の代わりに同量の蒸留水を用いた。
【0035】
その結果、培養液中のD−乳酸をL−乳酸よりも選択的に消費してL−乳酸の光学純度を向上させる菌株として、LAAM018株、LAAM029株、LAAM042株、LAAM050株、LAAM055株及びLAAM065株の計6株を選抜した(図2)。
【0036】
図2に示したように、LAAM050株は、培養終了後の培養液中のD−乳酸とL−乳酸の比がD−乳酸:L−乳酸=0.57:99.43と、D−乳酸を優先的に資化し、最もL−乳酸の光学純度が高かった。しかしながら、他の5菌株と比べて培養液中に残存したL−乳酸量が最も低く、初発L−乳酸量に対するL−乳酸残存率は48.9%であった。
【0037】
一方、LAAM055株は、培養終了後の培養液中のD−乳酸とL−乳酸の比がD−乳酸:L−乳酸=0.86:99.14と、D−乳酸を優先的に資化し、L−乳酸の光学純度が高かった。また、初発L−乳酸量に対するL−乳酸残存率は約78%と、高光学純度L−乳酸を最も高い収率で得ることができた。
【0038】
(4)D−乳酸資化性菌の同定
上記で選抜したD−乳酸資化性菌6株のうち、LAAM055株、LAAM018株及びLAAM065株について、形態観察、炭素源資化性試験、26SrDNA−D1/D2塩基配列の解析を行い、これら菌の同定を行った。
【0039】
LAAM055株は、白色で粉状〜白亜状のコロニーを形成し、コロニーの周縁部は乱糸状であった。また、顕微鏡観察を行ったところ、出芽した細胞は確認されず、隔壁のある菌糸および分節型分生子が認められ、有性生殖器官の形成は認められなかった(図1)。
【0040】
また、LAAM055株の糖の発酵性、イノシトール資化性及び硝酸塩資化性がゲオトリクム(Geotrichum)
属の性質と一致していた(表1及び表2)。
【0041】
【表1】

【0042】
【表2】

【0043】
さらに、LAAM055株の26SrDNA−D1/D2塩基配列を調べたところ、本菌株の26SrDNA−D1/D2塩基配列は、子のう菌系アナモルフ酵母の一種であるゲオトリクム ブルガレ(Geotrichum vulgare)の基準株であるゲオトリクム ブルガレ(Geotrichum vulgare)CBS10073Tに対して99.6%の相同率を示した。このように、LAAM055株は、ゲオトリクム ブルガレ(Geotrichum vulgare)と同種又は近縁種であることが明らかとなった。
【0044】
一方、LAAM018株及びLAAM065株についても同様に調べた結果、LAAM018株及びLAAM065株とも、LAAM055株と同様、白色で粉状〜白亜状のコロニーを形成し、コロニーの周縁部は乱糸状であった。また、顕微鏡観察を行ったところ、出芽した細胞は確認されず、隔壁のある菌糸および分節型分生子が認められ、有性生殖器官の形成は認められなかった。
【0045】
また、LAAM018株及びLAAM065株の26SrDNA−D1/D2塩基配列は、子のう菌系アナモルフ酵母の一種であるゲオトリクム ブリンゼ(Geotrichum bryndzae)の基準株であるゲオトリクム ブリンゼ(Geotrichum bryndzae)NRRL Y−27641T及びゲオトリクム シルビコラ(Geotrichum silvicola)の基準株であるゲオトリクム シルビコラ(Geotrichum silvicola)CBS9194Tに対してともに99.4%の相同性を示した。このように、LAAM018株及びLAAM065株は、ゲオトリクム ブリンゼ(Geotrichum bryndzae)又はゲオトリクム シルビコラ(Geotrichum silvicola)と同種又は近縁種であることを明らかにした。
【0046】
さらに、LAAM055株、LAAM018及びLAAM065株の26SrDNA−D1/D2塩基配列について、マルチプルアライメントを行い、相互の遺伝学的関連性を調べた。その結果、LAAM018とLAAM065株とは、解読した545塩基のすべての配列が一致していた。一方、LAAM055株の塩基配列をこれら2株の塩基配列と比較したところ、545塩基のうち15塩基が異なっていた。このため、LAAM055株は、LAAM018及びLAAM065株と系統的にやや距離を有することが明らかとなった。
【0047】
以上の結果から、高光学純度L−乳酸を多量に調製するためのD−乳酸資化性菌として、分離菌ゲオトリクム エスピー(Geotrichum sp.)LAAM055株(受領番号:NITE AP−1223)を用いることとした。
【0048】
2.ゲオトリクム エスピー(Geotrichum sp.)LAAM055の培養特性
(1)培養温度の検討
ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の培養温度条件を検討した。すなわち、本菌株をYM培地を用いて30℃で24時間振とう培養(120oscillations/min)した(前培養)。この前培養液をLYP培地に1%(v/v)添加して、25℃、30℃、35℃又は40℃で72時間振とう培養(120oscillations/min)を行った(本培養)。また、本培養液中の菌体濃度、pH及びDL−乳酸量を経時的に測定した。なお、菌体濃度は、波長660nmにおける培養液の濁度(OD660nm)として示した。また、pHは、pHメーターを用いて測定した。さらに、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。これらの結果を図3及び4に示した。
【0049】
図3に示したように、培養温度が25又は30℃の場合では菌体の増殖が認められたが、培養温度が35℃以上では菌体の増殖が認められなかった。一方、本菌株の乳酸資化について、培養温度30℃の場合に最も乳酸資化速度が高かった。また、培養開始72時間後の培養液中のDL−乳酸濃度は11.16g/lであり、初発DL−乳酸濃度25.46g/lの約55%が資化された。さらに、図4に示したように、培養温度30℃における培養72時間後の培養液中に残存するDL−乳酸比は、D−乳酸:L−乳酸=6.91:93.09であった。
【0050】
他方、培養温度25℃の場合では菌体濃度が最も高い値を示したが、培養温度30℃の場合と比べて、乳酸資化速度及び乳酸資化量は低い値を示した(図3)。また、培養温度25℃における培養開始72時間後の培養液中のDL−乳酸比は、D−乳酸:L−乳酸=28.43:71.57であった(図4)。このように、L−乳酸の光学純度を向上させるためには、本菌株の培養温度を30℃程度とすることが有効であることが分かった。
【0051】
(2)初発pHの検討
ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の培養時における培地の初発pHについて検討した。すなわち、本菌株をYM培地を用いて30℃で24時間振とう培養(120oscillations/min)した(前培養)。この前培養液を6mol/lのHCl又は6mol/lのNaOHによって初発pHを2.6〜7.0に調整したLYP培地に1%(v/v)添加して、30℃で72時間振とう培養(120oscillations/min)を行った(本培養)。また、培養72時間後の本培養液中の菌体濃度、pH及びDL−乳酸量を測定した。なお、菌体濃度及びpHは上記2.(1)と同様に測定し、DL−乳酸は、上記1.(3)と同様に酵素法によって分別定量した。これら結果を図5及び6に示した。
【0052】
図5に示したように、培地の初発pHが3.0〜7.0の範囲で本菌株の増殖が認められた。また、培養72時間後の菌体濃度について、初発pHが5.4の場合、菌体濃度(OD660nm値)が5.59と最も高い値を示した。一方、初発pHが3.0又は3.8の場合、菌体濃度(OD660nm値)が2.63〜3.52と、初発pH4.6以上で培養した場合と比べて低い値を示した。
【0053】
他方、図6に示したように、初発pHが3.0又は3.8で培養した場合、培養液中のD−乳酸がそれぞれ0.42g/l又は0.77g/lと、初発pH4.6以上で培養した場合の3.74g/l〜4.92g/lと比べては低い値を示した。一方、L−乳酸は、初発pHが3.0では10.35g/l、初発pHが3.8では10.39g/lと、初発pH4.6以上で培養した場合の10.80g/l〜11.05g/lとほぼ同様の値であった。このように、培地の初発pHを3.0〜3.8で本菌株を培養すると培地中のD−乳酸が優先的に資化され、培養液中のL−乳酸の光学純度が向上することが分かった。
【0054】
(3)窒素源の検討
ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の培養時における培地の窒素源として添加する素材の種類について検討を行った。すなわち、本菌株をYM培地を用いて30℃で24時間振とう培養(120oscillations/min)した(前培養)。この前培養液を各種窒素源としたLYP培地に1%(v/v)添加して、30℃で72時間振とう培養(120oscillations/min)を行った(本培養)。
【0055】
なお、窒素源は、0.25%ペプトン及び0.25%酵母エキス(条件I)、0.4%ペプトン及び0.1%酵母エキス(条件II)、0.4%肉エキス及び0.1%酵母エキス(条件III)、0.4%硫酸アンモニウム及び0.1%酵母エキス(条件IV)、0.4%尿素及び0.1%酵母エキス(条件V)、0.4%硝酸ナトリウム及び0.1%酵母エキス(条件VI)又は0.4%リン酸水素二アンモニウム及び0.1%酵母エキス(条件VII)とした。
【0056】
また、培養72時間後の本培養液中のDL−乳酸量を測定した。なお、DL−乳酸は、上記1.(3)と同様に酵素法によって分別定量した。この結果を図7に示した。
【0057】
図7に示したように、すべての場合においてD−乳酸は資化され、培地中のL−乳酸の光学純度は向上したが、窒素源を0.25%ペプトン及び0.25%酵母エキスとした場合(条件I)が最もD−乳酸が資化され、L−乳酸の光学純度が向上した。このように、L−乳酸の光学純度を向上させるためには、培地の窒素源を0.25%ペプトン及び0.25%酵母エキスとすることが有効であることが分かった。
【0058】
(4)乳酸のDL比の検討
ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の培養時における培地の初発乳酸のDL比について検討を行った。すなわち、本菌株をYM培地を用いて30℃で24時間振とう培養(120oscillations/min)した(前培養)。この前培養液を初発乳酸のDL比をD−乳酸:L−乳酸=1:1、2:8又は1:9としたLYP培地(乳酸濃度2.5%)に1%(v/v)添加して、30℃で72時間振とう培養(120oscillations/min)を行った(本培養)。また、培養72時間後の本培養液中のDL−乳酸量を測定した。なお、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。この結果を図8に示した。
【0059】
図8に示したように、すべての場合でL−乳酸の光学純度は向上しており、培地中の初発乳酸のDL比がD−乳酸:L−乳酸=1:9(初発L−乳酸の光学純度90%)の場合、培養72時間後の培養液中のL−乳酸の光学純度が99.7%と最もL−乳酸の光学純度が高かった。一方、D−乳酸:L−乳酸=2:8(初発L−乳酸の光学純度80%)の場合ではL−乳酸の光学純度が94.8%であり、D−乳酸:L−乳酸=1:1の場合(初発L−乳酸の光学純度50%)ではL−乳酸の光学純度が96.1%であった。
【0060】
3.乳酸発酵液からの高光学純度L−乳酸の生産
L−乳酸生産菌を乳酸発酵させて得た乳酸発酵液から調製した発酵乳酸培地を用いて、ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株による高光学純度のL−乳酸生産について検討した。
【0061】
(1)D−乳酸資化菌の添加量
まず始めに、L−乳酸生産菌であるラクトバチルス マリ(Lactobacillus mali)438株の乳酸発酵液を用いて調製した発酵乳酸培地(L−LAB培地)に添加するゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の菌体濃度について検討した。
【0062】
すなわち、初発グルコース濃度を2.0%としたGYP改変培地でラクトバチルス マリ(Lactobacillus mali)438株を培養することで乳酸発酵液を調製した。この乳酸発酵液を用いて上記1.(2)と同様に調製した発酵乳酸培地(L−LAB培地)(pH3.0)にゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株を初発菌体濃度(OD660nm値)が0.093(条件I)、1.600(条件II)又は16.300(条件III)となるように添加して、30℃で72時間振とう培養(120oscillations/min)を行った。また、培養液中のDL−乳酸量を経時的に測定した。なお、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。この結果を図9に示した。
【0063】
図9に示したように、すべての場合において、培養72時間後の培養液中のL−乳酸の光学純度が高くなっており、菌体濃度(OD660nm値)が16.300の場合(条件IV)にL−乳酸の光学純度が98.36%、L−乳酸収率が80.22%と最も高い値を示した。
【0064】
(2)乳酸発酵液からの高光学純度L−乳酸の生産
上記3.(1)の結果から、乳酸発酵用GYP改変培地の初発グルコース濃度を2.0%とし、ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株の菌体添加量を初発菌体濃度(OD660nm値)約16として、発酵乳酸培地(L−LAB培地)からの高光学純度L−乳酸生産の様相を調べた。
【0065】
すなわち、初発グルコース濃度を2.0%としたGYP改変培地でラクトバチルス マリ(Lactobacillus mali)438株を培養することで乳酸発酵液を調製した。この乳酸発酵液を用いて調製した発酵乳酸培地(L−LAB培地)(pH3.0)にゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株を初発菌体濃度(OD660nm値)が約16となるように添加して、30℃で72時間振とう培養(120oscillations/min)を行った。また、培養液中のDL−乳酸量を経時的に測定した。なお、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。この結果を表3に示した。
【0066】
【表3】

【0067】
表3に示したように、培養144時間後に培養液中のL−乳酸の光学純度が99.87%以上のL−乳酸が5.70g/l生成され、高光学純度のL−乳酸を得ることができた。
【0068】
4.固定化菌を用いた高光学純度L−乳酸の生産
固定化したゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株による発酵乳酸培地(L−LAB培地)からの高光学純度のL−乳酸生産について検討した。
【0069】
(1)固定化菌体の調製
ゲオトリクム エスピー(Geotrichum sp.)LAAM055株(受領番号:NITE AP−1223)株をYM培地600mlを用いて30℃で24時間振とう培養(120oscillations/min)した。この培養液を遠心分離(5000G、30分)し、回収した菌体をオートクレーブ滅菌した生理食塩水(0.9%NaCl溶液)15ml中に懸濁した。この菌体懸濁液15ml(OD660nm=約16)と5%アルギン酸ナトリウム溶液100mlとを混合し、これを5%塩化カルシウム溶液100ml中に滴下してゲルビーズを形成させた。この後、マグネティックスターラーで穏やかに撹拌しながら液中で該ゲルビーズを30分間保持することでゲルを硬化させ、これを固定化菌体とした。なお、調製した固定化菌体ビーズは、殺菌水で2度洗浄した後、以下の実験に供した。
【0070】
(2)固定化菌体を用いた高光学純度L−乳酸の生産
上記4.(1)で調製したゲオトリクム エスピー(Geotrichum sp.)LAAM055株の固定化菌体ビーズを初発グルコース濃度を2.0%として調製したL−LAB(pH3.0)に投入し、30℃で72時間振とう培養(120oscillations/min)を行った。また、培養液中のDL−乳酸量を経時的に測定した。なお、DL−乳酸量は、上記1.(3)と同様に酵素法によって分別定量した。この結果を表4に示した。
【0071】
【表4】

【0072】
表4に示したように、培養48時間後に光学純度が91.29%のL−乳酸を12.3g/l(L−乳酸収率70.78%)生成した。また、培養72時間後の培養液中のL−乳酸の光学純度は94.09%と、培養48時間後の培養液と比べてL−乳酸の光学純度が向上したが、培養液中のL−乳酸が10.99g/l(L−乳酸収率63.23%)と乳酸収率が低下した。
【0073】
以上の結果から、ゲル包括固定化ゲオトリクム エスピー(Geotrichum sp.)LAAM055株を用いてもL−LAB培地から高光学純度のL−乳酸を生成することが可能であることが分かった。
【特許請求の範囲】
【請求項1】
L−乳酸及びD−乳酸を含む乳酸溶液を調製する乳酸溶液調製工程と、
該乳酸溶液中でD−乳酸資化性菌を培養し、該乳酸溶液中のD−乳酸を資化させることによってL−乳酸の光学純度を高めるD−乳酸除去工程と、
を有する高光学純度L−乳酸の製造方法。
【請求項2】
前記乳酸溶液が、L−乳酸生産菌を培養して得られる乳酸発酵液である、
請求項1に記載の高光学純度L−乳酸の製造方法。
【請求項3】
前記D−乳酸資化性菌が、ゲオトリクム(Geotrichum)属に属する酵母である、
請求項1又は2に記載の高光学純度L−乳酸の製造方法。
【請求項4】
前記D−乳酸資化性菌が、ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株である、
請求項1〜3のいずれか1項に記載の高光学純度L−乳酸の製造方法。
【請求項5】
前記D−乳酸除去工程が、30℃、pH3.0〜3.8の好気的条件下で実施される、
請求項1〜4のいずれか1項に記載の高光学純度L−乳酸の製造方法。
【請求項6】
前記D−乳酸資化性菌が、固定化された固定化菌体である、
請求項1〜5のいずれか1項に記載の高光学純度L−乳酸の製造方法。
【請求項1】
L−乳酸及びD−乳酸を含む乳酸溶液を調製する乳酸溶液調製工程と、
該乳酸溶液中でD−乳酸資化性菌を培養し、該乳酸溶液中のD−乳酸を資化させることによってL−乳酸の光学純度を高めるD−乳酸除去工程と、
を有する高光学純度L−乳酸の製造方法。
【請求項2】
前記乳酸溶液が、L−乳酸生産菌を培養して得られる乳酸発酵液である、
請求項1に記載の高光学純度L−乳酸の製造方法。
【請求項3】
前記D−乳酸資化性菌が、ゲオトリクム(Geotrichum)属に属する酵母である、
請求項1又は2に記載の高光学純度L−乳酸の製造方法。
【請求項4】
前記D−乳酸資化性菌が、ゲオトリクム エスピー(Geotrichum sp.)LAAM055(受領番号:NITE AP−1223)株である、
請求項1〜3のいずれか1項に記載の高光学純度L−乳酸の製造方法。
【請求項5】
前記D−乳酸除去工程が、30℃、pH3.0〜3.8の好気的条件下で実施される、
請求項1〜4のいずれか1項に記載の高光学純度L−乳酸の製造方法。
【請求項6】
前記D−乳酸資化性菌が、固定化された固定化菌体である、
請求項1〜5のいずれか1項に記載の高光学純度L−乳酸の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−223192(P2012−223192A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【公開請求】
【出願番号】特願2012−98013(P2012−98013)
【出願日】平成24年4月23日(2012.4.23)
【新規性喪失の例外の表示】特許法第30条第2項適用申請有り 平成23年度醸造学専攻修士論文最終発表会要旨集 第37〜38頁 東京農業大学大学院醸造学専攻 2012年1月27日
【出願人】(598096991)学校法人東京農業大学 (85)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2012−98013(P2012−98013)
【出願日】平成24年4月23日(2012.4.23)
【新規性喪失の例外の表示】特許法第30条第2項適用申請有り 平成23年度醸造学専攻修士論文最終発表会要旨集 第37〜38頁 東京農業大学大学院醸造学専攻 2012年1月27日
【出願人】(598096991)学校法人東京農業大学 (85)
【Fターム(参考)】
[ Back to top ]

